КОМБИНИРОВАННЫЕ ВАКЦИНЫ ДЛЯ ПРОФИЛАКТИКИ ВИРУСНЫХ ИНФЕКЦИЙ СВИНЕЙ
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По данной заявке испрашивается приоритет по следующим трем патентным заявкам Китая: 201110140951.5, зарегистрированной 27 мая 2011 года, названной "Combination Vaccines for Porcine Reproductive and Respiratory Syndrome and Classical Swine Fever and Uses Thereof", 201110331206.9, зарегистрированной 27 октября 2011 года, названной "Combination Vaccines for Porcine Reproductive and Respiratory Syndrome and Porcine Pseudorabies Virus and Uses Thereof", 201110331159.8, зарегистрированной 27 октября 2011 года, названной "Triple Combination Vaccines for Porcine Reproductive and Respiratory Syndrome, Classical Swine Fever and Porcine Pseudorabies Virus and Preparation Methods Thereof", включенным в настоящее описание в качестве ссылки в полном объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к ветеринарным биологическим продуктам, конкретно к живой комбинированной вакцине для профилактики репродуктивного и респираторного синдрома свиней, классической чумы свиней и вируса псевдобешенства свиней и ее получению.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Репродуктивный и респираторный синдром свиней (PRRS) является одним из основных инфекционных заболеваний, угрожающих свиноводству во многих регионах мира. Со времен вспышки высокопатогенного репродуктивного и респираторного синдрома свиней (также называемого высокопатогенной "болезнью синих ушей") в Китае в 2006 году PRRS вызывал огромный экономический ущерб свиноводству в Китае и был внесен в список Министерства сельского хозяйства Китая как одно из заболеваний, для которых необходима обязательная вакцинация.
Помимо PRRS свиньи могут быть инфицированы другими инфекционными заболеваниями, такими как классическая чума свиней (CSF) и псевдобешенство. Однако, известно, что вирус PRRS (PRRSV) индуцирует иммуносупрессию после инфицирования своего хозяина и, таким образом, как правило, приводит к сниженному иммунному ответу на вторичные инфекции или даже к неудачной вакцинации. Исследования показали, что PRRSV повреждает иммунную систему хозяина, например, разрушая альвеолярные макрофаги, которые имеют важное значение для развития иммунного ответа, и/или подавляя экспрессию цитокинов, осуществляющих иммунологическую защиту от вторичных инфекций. Например, обнаруживали, что инфекция PRRSV значительно ингибирует иммунный ответ хозяина на вакцину против вируса классической чумы свиней (CSFV), даже приводя к неудачной вакцинации против CSFV (Suradhat, S. et al, Vaccine, 24: 2634-3642 (2006); Li, H. et al, Veterinary Microbiology, 95: 295-301 (2003)). Сообщают, что комбинированная вакцинация аттенуированным PRRSV и аттенуированным CSFV имеет сниженную степень иммунологической защиты приблизительно 60%, что не соответствует требованиям для вакцинации. Для вакцинирования против двух патогенов необходимы отдельные вакцинации, разделенные 14-дневными интервалами (см., например? Du, X.Z. et al, Zhejiang Journal Animal Science and Veterinary Medicine, 2: p5-6 (2011)). В качестве другого примера, обнаруживали, что PRRSV отрицательно влияет на эффекты вакцинации против вируса псевдобешенства (PRV) и значительно снижает или замедляет иммунный ответ хозяина против PRV (De Bruin, M.G.M. et al, Veterinary Immunology and Immunopathology, 76(1-2): p.125-135 (2000)).
Иммуноингибирование PRRSV, как правило, усложняет схему вакцинации свиней и снижает эффективность вакцинации. Когда свиней вакцинируют против PRRSV и других вирусов, часто необходимо использовать повторные инъекции и многократное введение доз, что делает процесс вакцинации длительным, трудоемким и затратным. Кроме того, в схеме многократной вакцинации пропущенная доза может оказывать непосредственное влияние на эффективность защиты вакцинами, в то время как частые и повторные вакцинации могут приводить к иммунопараличу и индуцировать иммунологический стресс.
Таким образом, существует потребность в комбинированной вакцинной композиции против PRRSV и других инфекционных заболеваний свиней без существенного иммуноингибирования.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном из аспектов настоящее изобретение относится к вакцинным композициям, содержащим вакцину против вируса репродуктивного и респираторного синдрома свиней (PRRSV) и вакцину против второго вируса свиней, где вакцина против PRRSV и вторая вакцина, по существу, не оказывают иммуноингибирования в отношении друг друга. В определенных вариантах осуществления вакцинная композиция дополнительно содержит вакцину против третьего вируса свиней, где вакцина против PRRSV, вторая вакцина и третья вакцина, по существу, не оказывают иммуноингибирования в отношении друг друга.
В определенных вариантах осуществления вакцина против второго вируса свиней выбрана из вакцины против вируса классической чумы свиней (CSFV) и вакцины против вируса псевдобешенства (PRV). В определенных вариантах осуществления вакцина против третьего вируса свиней выбрана из вакцины против вируса классической чумы свиней (CSFV) и вакцины против вируса псевдобешенства (PRV). Вторая вакцина отличается от третьей вакцины.
В определенных вариантах осуществления вакцинные композиции содержат вакцину против PRRSV, вакцину против CSFV и вакцину против PRV, где вакцина против PRRSV, вакцина против CSFV и вакцина против PRV, по существу, не оказывают иммуноингибирования в отношении друг друга.
В определенных вариантах осуществления вакцина против PRRSV содержит аттенуированный PRRSV. В определенных вариантах осуществления аттенуированный PRRSV содержит нуклеотид Nsp2, кодируемый последовательностью ДНК, в которой по сравнению с SEQ ID NO:4 отсутствует нуклеотидный фрагмент, содержащий по меньшей мере 50 смежных нуклеотидов, где фрагмент является по меньшей мере приблизительно на 80% гомологичным части SEQ ID NO:8 той же длины. В определенных вариантах осуществления фрагмент ДНК содержит по меньшей мере 100, по меньшей мере 120, по меньшей мере 150, по меньшей мере 180, по меньшей мере 200, по меньшей мере 210, по меньшей мере 220, по меньшей мере 230, по меньшей мере 240, по меньшей мере 250, по меньшей мере 260, по меньшей мере 270, по меньшей мере 280, по меньшей мере 290, по меньшей мере 300, по меньшей мере 310, по меньшей мере 320, по меньшей мере 330, по меньшей мере 340, по меньшей мере 350, или, по меньшей мере 360 смежных нуклеотидов. В определенных вариантах осуществления фрагмент ДНК является по меньшей мере приблизительно на 81%, приблизительно на 82%, приблизительно на 83%, приблизительно на 84%, приблизительно на 85%, приблизительно на 86%, приблизительно на 87%, приблизительно на 88%, приблизительно на 89%, приблизительно на 90%, приблизительно на 91%, приблизительно на 92%, приблизительно на 93%, приблизительно на 94%, приблизительно на 95%, приблизительно на 96%, приблизительно на 97%, приблизительно на 98%, приблизительно на 99% или на 100% гомологичным части SEQ ID NO: 8 той же длины. В определенных вариантах осуществления фрагмент ДНК содержит SEQ ID NO: 8.
В определенных вариантах осуществления аттенуированный PRRSV содержит нуклеотид Nsp2, кодирующий последовательность белка Nsp2, в котором по сравнению с SEQ ID NO:11 отсутствует пептидный фрагмент, содержащий по меньшей мере 20 смежных аминокислот, где фрагмент является по меньшей мере приблизительно на 80% гомологичным части SEQ ID NO:9 той же длины. В определенных вариантах осуществления пептидный фрагмент содержит, по меньшей мере 30, по меньшей мере 40, по меньшей мере 50, по меньшей мере 60, по меньшей мере 70, по меньшей мере 75, по меньшей мере 80, по меньшей мере 85, по меньшей мере 90, по меньшей мере 95, по меньшей мере 100, по меньшей мере 105, по меньшей мере 110, по меньшей мере 115 или по меньшей мере 120 смежных аминокислот. В определенных вариантах осуществления пептидный фрагмент является по меньшей мере приблизительно на 81%, приблизительно на 82%, приблизительно на 83%, приблизительно на 84%, приблизительно на 85%, приблизительно на 86%, приблизительно на 87%, приблизительно на 88%, приблизительно на 89%, приблизительно на 90%, приблизительно на 91%, приблизительно на 92%, приблизительно на 93%, приблизительно на 94%, приблизительно на 95%, приблизительно на 96%, приблизительно на 97%, приблизительно на 98%, приблизительно на 99% или на 100% гомологичным части SEQ ID NO: 9 той же длины. В определенных вариантах осуществления пептидный фрагмент содержит SEQ ID NO: 9.
В определенных вариантах осуществления аттенуированный PRRSV является аттенуированным относительно высокопатогенного PRRSV. В определенных вариантах осуществления аттенуированный PRRSV содержит нуклеотид Nsp2, кодируемый последовательностью ДНК, в которой по сравнению с SEQ ID NO:5 отсутствуют 90 несмежных нуклеотидов в SEQ ID NO:6. В определенных вариантах осуществления нуклеотид Nsp2 кодирует последовательность, имеющая по меньшей мере 90% гомологии с SEQ ID NO:2. В определенных вариантах осуществления нуклеотид Nsp2 кодирует последовательность, содержащая SEQ ID NO:2.
В определенных вариантах осуществления аттенуированный PRRSV дополнительно содержит нуклеотидную последовательность Nsp1, кодируемую последовательностью, имеющей по меньшей мере 90% гомологии с SEQ ID NO:1. В определенных вариантах осуществления аттенуированный PRRSV содержит нуклеотидную последовательность Nsp1, кодируемую SEQ ID NO:1, и нуклеотидную последовательность Nsp2, кодируемую SEQ ID NO:2.
В определенных вариантах осуществления аттенуированный PRRSV содержит нуклеотидную последовательность PRRSV, кодируемую последовательностью, имеющей по меньшей мере 90% гомологии с SEQ ID NO: 3. В определенных вариантах осуществления аттенуированный PRRSV содержит нуклеотидную последовательность PRRSV, кодируемую SEQ ID NO: 3. В определенных вариантах осуществления аттенуированный PRRSV имеет регистрационный номер в CGMCC 3121.
В определенных вариантах осуществления вакцина против CSFV содержит аттенуированный CSFV. В определенных вариантах осуществления аттенуированный CSFV кодирует последовательность, имеющая по меньшей мере 80% гомологии с SEQ ID NO: 10. В определенных вариантах осуществления аттенуированный CSFV кодирует SEQ ID NO: 10. В определенных вариантах осуществления аттенуированный CSFV имеет регистрационный номер в CGMCC 3891.
В определенных вариантах осуществления вакцина против PRV содержит аттенуированный PRV. В определенных вариантах осуществления аттенуированный PRV содержит последовательность, имеющую по меньшей мере 80% гомологии с последовательностью, имеющей в NCBI идентификационный номер NC_006151.
В определенных вариантах осуществления аттенуированный PRV имеет один или несколько инактивированных генов, выбранных из группы, состоящей из TK, PK, RR, дУТФазы, gG, gC, gE, gD и gI. В определенных вариантах осуществления аттенуированный PRV имеет инактивированный ген gE. В определенных вариантах осуществления аттенуированный PRV имеет регистрационный номер в CGMCC 5076.
В определенных вариантах осуществления вакцинная композиция, представленная в настоящем описании, содержит иммунологически эффективное количество вакцины против PRRSV, вакцины против CSFV и/или вакцины против PRV. В определенных вариантах осуществления иммунологически эффективное количество вакцины против PRRSV составляет по меньшей мере 104,5 TCID50, 105,0 TCID50 или 105,5 TCID50, иммунологически эффективное количество вакцины против CSFV составляет по меньшей мере 100,5 FA-TCID50 (TCID50, определяемая с помощью флуоресцентно-меченых антител), 101,0 FA-TCID50, 101,5 FA-TCID50, 102,0 FA-TCID50, 102,5 FA-TCID50, 103,0 TCID50, 103,5 FA-TCID50, 104,0 FA-TCID50, 104,5 FA-TCID50 или 105,0 FA-TCID50 или составляет по меньшей мере 2,5 RID (инфицирующая доза для кролика), 3 RID, 5 RID, 10 RID, 30 RID, 100 RID, 150 RID, 300 RID, 750 RID, 1000 RID, 3000 RID или 7500 RID, и/или иммунологически эффективное количество вакцины против PRV составляет по меньшей мере 103,0 TCID50, 103,5 TCID50, 104,0 TCID50, 104,5 TCID50, 105,0 TCID50, 105,5 TCID50 или 106,0 TCID50.
В определенных вариантах осуществления соотношение TCID50 вакцины против PRRSV и вакцины против CSFV в комбинированной вакцине находится в диапазоне от 10000:1 до 1:1. В определенных вариантах осуществления соотношение TCID50 вакцины против PRRSV и вакцины против PRV в комбинированной вакцине находится в диапазоне от 1:1 до 1:30. В определенных вариантах осуществления соотношение TCID50 вакцины против PRRSV: вакцины против CSFV: вакцины против PRV в комбинированной вакцине находится в диапазоне от приблизительно 104:1:105 до приблизительно 5:1:6.
В определенных вариантах осуществления вакцинные композиции дополнительно содержат адъювант. В определенных вариантах осуществления вакцинные композиции дополнительно содержат криопротектор. В определенных вариантах осуществления криопротектор содержит сахарозу, L-глутамат натрия и/или гидролизат лактальбумина.
В другом аспекте настоящее изобретение относится к способам получения вакцинных композиций, представленных в настоящем описании, включающим: (a) сбор вакцинного штамма PRRSV, вакцинного штамма CSFV и/или вакцинного штамма PRV, культивируемых в соответствующих им восприимчивых клетках, и (b) смешивание двух или более вирусных штаммов при подходящем соотношении TCID50.
В определенных вариантах осуществления восприимчивыми клетками для вакцинного штамма PRRSV является клеточная линия, выбранная из группы, состоящей из Marc-145, MA-104, Vero и CL-2621, или первичная культура клеток, являющаяся культурой клеток PAM. В определенных вариантах осуществления восприимчивыми клетками для вакцинного штамма CSFV является клеточная линия, выбранная из группы, состоящей из BT, Vero, MPK, SK6, PK2a, CPK, RKC, MDBK, MDCK, CRFK, ST и PT, или первичная культура клеток, являющаяся культурой клеток BT. В определенных вариантах осуществления восприимчивыми клетками для вакцинного штамма PRV является клеточная линия, выбранная из группы, состоящей из ST, PK-15, Marc-145, MDBK, BT, Vero, BHK-21, линия клеток почки свиньи (IBRS-2), линия клеток почки кролика (RK) и линия эмбриональных фибробластов курицы, или первичная культура клеток, являющаяся первичной культурой клеток почки свиньи.
В определенных вариантах осуществления культивирование включает инокуляцию каждым вакцинным штаммом восприимчивых клеток при плотности клеток в диапазоне от 1×106/мл - 5×106/мл при культивировании в роллерном флаконе или при плотности клеток в диапазоне от 5×106/мл - 1×107/мл в суспензионной культуре с встроенным адгезионным носителем в биореакторе.
В определенных вариантах осуществления инокулируют вакцинным штаммом PRRSV при множественности заражения (MOI) 0,01-0,5, вакцинным штаммом CSFV инокулируют при MOI 0,1-0,5 и/или инокулируют вакцинным штаммом PRV при MOI 0,005-0,5.
В определенных вариантах осуществления этап (b) включает смешивание собранного вакцинного штамма вируса PRRSV с вакцинным штаммом вируса CSFV при соотношении TCID50 от 10000:1 до 1:1. В определенных вариантах осуществления этап (b) включает смешивание собранного вакцинного штамма вируса PRRSV с вакцинным штаммом вируса PRV при соотношении TCID50 от 1:1 до 1:30. В определенных вариантах осуществления этап (b) включает смешивание собранного вакцинного штамма вируса PRRSV, вакцинного штамма вируса CSFV и вакцинного штамма вируса PRV при соотношении TCID50 от 104:1:105 до приблизительно 5:1:6.
В определенных вариантах осуществления этап (b) дополнительно включает смешивание смеси растворов, содержащих собранные вирусы, с криопротектором. В определенных вариантах осуществления смесь растворов, содержащих собранные вирусы, смешивают с криопротектором в объемном соотношении 75-80:25-20.
В другом аспекте настоящее изобретение относится к вакцинным композициям, получаемым с использованием способов, представленных в настоящем описании.
В другом аспекте настоящее изобретение относится к применению вакцинных композиций, представленных в настоящем описании, в производстве лекарственного средства для профилактики или лечения PRRS, CSF и/или PR.
В другом аспекте настоящее изобретение относится к способам иммунизации свиней, включающим введение свинье вакцинной композиции, представленной в настоящем описании.
В другом аспекте настоящее изобретение относится к вакцинным штаммам CSFV, культивируемым в клеточной линии, выбранной из группы, состоящей из ST, PK-15, Marc-145, MDBK, BT, Vero, BHK-21, линии клеток почки свиньи (IBRS-2), линии клеток почки кролика (RK) и линии эмбриональных фибробластов курицы, или первичной культуре клеток, являющейся первичной культурой клеток почки свиньи. В другом аспекте настоящее изобретение относится к применению этих клеточных линий в культивировании вакцинного штамма CSFV.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигуре 1 показаны 360 последовательных нуклеотидов, отсутствующих в кодирующей Nsp2 последовательности в штамме TJM PRRSV, но присутствующих в нуклеотидной последовательности Nsp2 штамма TJ PRRSV.
На фигуре 2 показана последовательность из 120 аминокислот, отсутствующих в белке Nsp2, кодируемом в штамме TJM PRRSV, но присутствующих в белке Nsp2 штамма TJ PRRSV.
Фигура 3 является схематическим изображением, на котором показана делеция 90 нуклеотидов в кодирующей Nsp2 последовательности высокопатогенного штамма PRRSV и делеция 90 нуклеотидов и делеция 360 нуклеотидов в аттенуированном штамме TJM PRRSV.
На фигуре 4 показана последовательность 90 несмежных нуклеотидов, отсутствующих в высокопатогенном штамме TJ PRRSV, но присутствующих в штамме VR-2332 PRRSV.
На фигуре 5 показана электрофореграмма вакцинного штамма TJM PRRSV (дорожка 2), высокопатогенного вирулентного штамма TJ PRRSV (дорожка 1) и воды (дорожка 3, в качестве отрицательного контроля), соответственно. M представляет собой маркер молекулярной массы.
На фигуре 6 показана электрофореграмма вакцинного штамма PRV (дорожка 1), вирулентного штамма (дорожка 2) и воды (дорожка 3, в качестве отрицательного контроля), соответственно. M представляет собой маркер молекулярной массы.
На фигуре 7 показаны изменения (%) CD3+ T-клеток у тестируемых свиней, вакцинированных отдельной вакциной на основе штамма TJM PRRSV, отдельной вакциной на основе штамма C (F16) CSFV и комбинированной вакциной или отрицательным контролем.
На фигуре 8 показаны изменения (%) CD4+ T-клеток у тестируемых свиней, вакцинированных отдельной вакциной на основе штамма TJM PRRSV, отдельной вакциной на основе штамма C (F16) CSFV и комбинированной вакциной или отрицательным контролем.
На фигуре 9 показаны изменения (%) CD8+ T-клеток у тестируемых свиней, вакцинированных отдельной вакциной на основе штамма TJM PRRSV, отдельной вакциной на основе штамма C (F16) CSFV и комбинированной вакциной или отрицательным контролем.
На фигуре 10 показаны изменения (%)CD4+CD8+ T-клеток у тестируемых свиней, вакцинированных отдельной вакциной на основе штамма TJM PRRSV, отдельной вакциной на основе штамма C (F16) CSFV, комбинированной вакциной PRRSV и CSFV или отрицательным контролем.
На фигуре 11 показаны титры антител против PRRSV (определяемые с помощью ELISA) у свиней, вакцинированных отдельной вакциной на основе штамма TJM PRRSV, комбинированной вакциной на основе штаммов TJM PRRSV и C (F16) CSFV или отрицательным контролем.
На фигуре 12 показаны титры антител против CSFV (определяемые с помощью ELISA) у свиней, вакцинированных отдельной вакциной на основе штамма C (F16) CSFV, комбинированной вакциной на основе штаммов TJM PRRSV и C (F16) CSFV или отрицательным контролем.
На фигуре 13 показаны ректальные температуры свиней после вакцинации отдельной вакциной на основе штамма TJM PRRSV, отдельной вакциной на основе штамма C (F16) CSFV, комбинированной вакциной на основе штаммов TJM PRRSV и C (F16) CSFV или отрицательными контролями.
На фигуре 14 показаны ректальные температуры свиней после заражения вирулентными штаммами PRRSV, свиней вакцинировали отдельной вакциной на основе штамма TJM PRRSV, комбинированной вакциной на основе штаммов TJM PRRSV и C (F16) CSFV или отрицательным контролем.
На фигуре 15 показаны ректальные температуры свиней после заражения вирулентными штаммами CSFV, свиней вакцинировали отдельной вакциной на основе штамма C (F16) CSFV, комбинированной вакциной на основе штаммов TJM PRRSV и C (F16) CSFV или отрицательным контролем.
На фигуре 16 показана балльная оценка клинических симптомов у свиней после заражения вирулентными штаммами PRRSV, свиней вакцинировали отдельной вакциной на основе штамма TJM PRRSV, комбинированной вакциной на основе штаммов TJM PRRSV и C (F16) CSFV или отрицательным контролем.
На фигуре 17 показана балльная оценка клинических симптомов у свиней после заражения вирулентными штаммами CSFV, свиней вакцинировали отдельной вакциной на основе штамма C (F16) CSFV, комбинированной вакциной на основе штаммов TJM PRRSV и C (F16) CSFV или отрицательным контролем.
На фигуре 18 показаны изменения (%)CD3+ T-клеток у свиней после заражения вирулентными штаммами PRRSV, свиней вакцинировали отдельной вакциной на основе штамма TJM PRRSV, комбинированной вакциной на основе штаммов TJM PRRSV и C (F16) CSFV или отрицательным контролем.
На фигуре 19 показаны изменения (%) CD4+ T-клеток после заражения вирулентными штаммами PRRSV.
На фигуре 20 показаны изменения (%) CD8+ T-клеток после заражения вирулентными штаммами PRRSV.
На фигуре 21 показаны изменения (%) CD4+ CD8+ T-клеток после заражения вирулентными штаммами PRRSV.
На фигуре 22 показаны изменения (%) CD3+ T-клеток после заражения вирулентными штаммами CSFV, свиней вакцинировали отдельной вакциной на основе штамма C (F16) CSFV, комбинированной вакциной против PRRSV и CSFV или отрицательным контролем.
На фигуре 23 показаны изменения (%) CD4+ T-клеток после заражения вирулентными штаммами CSFV.
На фигуре 24 показаны изменения (%) CD8+ T-клеток после заражения вирулентными штаммами CSFV.
На фигуре 25 показаны изменения (%) CD4+ CD8+ T-клеток после заражения вирулентными штаммами CSFV.
На фигуре 26 показан титр нейтрализующих антител против PRV после вакцинации PRRSV и PRV. Группу I последовательно инокулировали отдельной вакциной на основе штамма TJM PRRSV и отдельной вакциной на основе штамма Bartha K61 PRV, группу II инокулировали двойной комбинированной живой вакциной, группу III инокулировали отдельной вакциной на основе штамма Bartha K61 PRV, группу IV инокулировали только стерильным PBS.
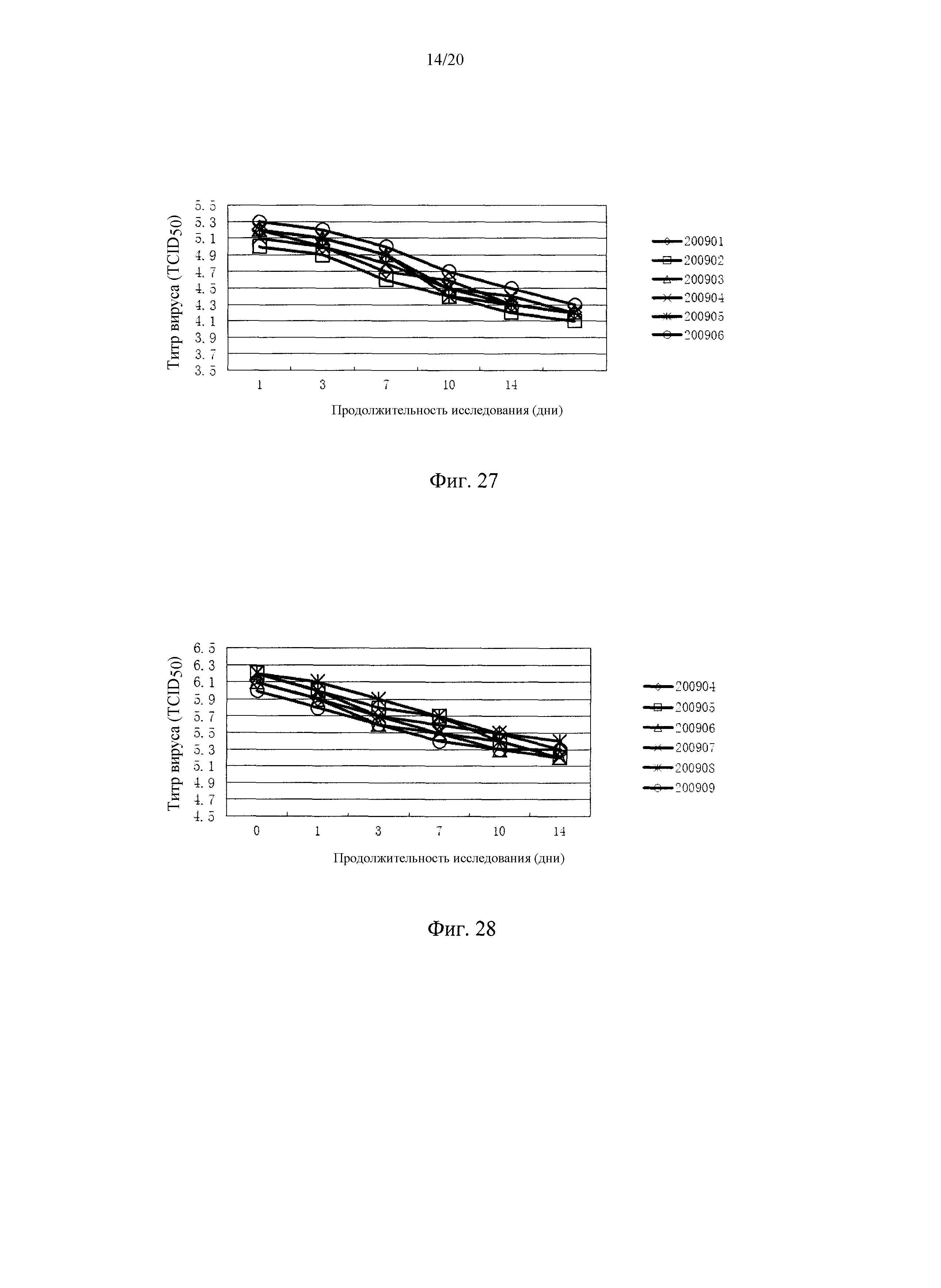
На фигуре 27 показаны титры штамма вируса C (F16) CSFV в отдельной вакцине против CSFV и в двойной комбинированной вакцине (PRRSV и CSFV) после хранения при 37°C в течение 14 дней. 200904, 200905 и 200906 представляют собой три партии двойной комбинированной вакцины, 200901 и 200902 и 200903 представляют собой три партии отдельной вакцины на основе штамма TJM PRRSV.
На фигуре 28 показаны титры штамма вируса TJM PRRSV в отдельной вакцине против PRRSV и в двойной комбинированной вакцине (PRRSV и CSFV) после хранения при 37°C в течение 14 дней. 200904, 200905 и 200906 представляют собой три партии двойной комбинированной вакцины, 200907 и 200908 и 200909 представляют собой три партии штамма C (F16) CSFV.
На фигуре 29 показаны титры штамма вируса C (F16) CSFV в отдельной вакцине против CSFV и в двойной комбинированной вакцине (PRRSV и CSFV) после хранения при 2-8°C в течение 18 месяцев. 200904, 200905 и 200906 представляют собой три партии двойной комбинированной вакцины, 200901 и 200902 и 200903 представляют собой три партии отдельной вакцины на основе штамма TJM PRRSV.
На фигуре 30 показаны титры штамма вируса TJM PRRSV в отдельной вакцине против PRRSV и в двойной комбинированной вакцине (PRRSV и CSFV) после хранения при 2-8°C в течение 18 месяцев. 200904, 200905 и 200906 представляют собой три партии двойной комбинированной вакцины, 200907 и 200908 и 200909 представляют собой три партии штамма C (F16) CSFV.
На фигуре 31 показаны титры штамма вируса TJM PRRSV в двойной комбинированной вакцине (PRRSV и PRV) после хранения при 2-8°C в течение 24 месяцев. SD001, SD002 и SD003 представляют собой три различные партии двойной живой комбинированной вакцины, соответственно.
На фигуре 32 показаны титры штамма вируса Bartha K61 PRV в двойной комбинированной вакцине (PRRSV и PRV) после хранения при 2-8°C в течение 24 месяцев. SD001, SD002 и SD003 представляют собой три различные партии двойной живой комбинированной вакцины, соответственно.
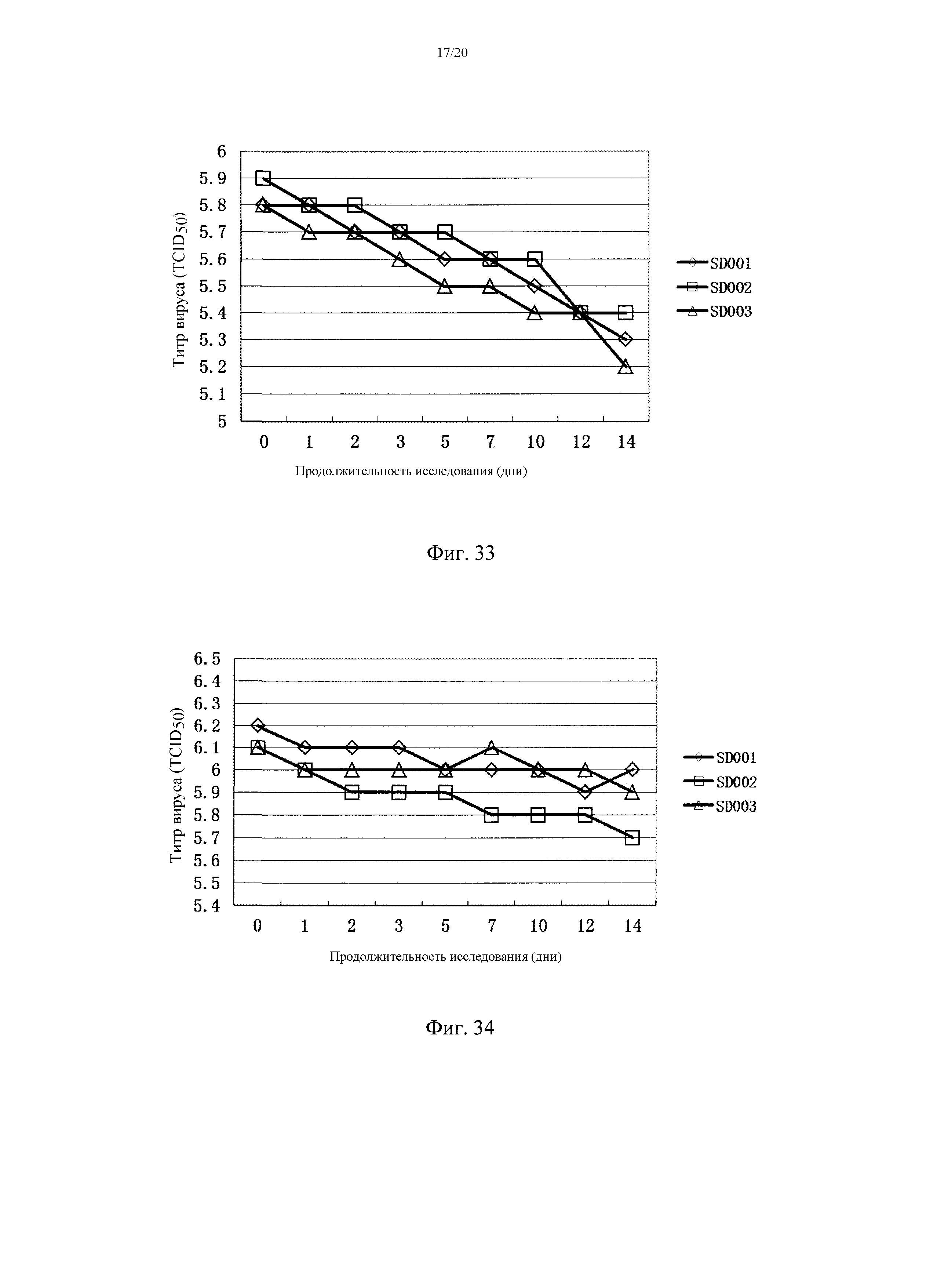
На фигуре 33 показаны титры штамма вируса TJM PRRSV в двойной комбинированной вакцине (PRRSV и PRV) после хранения при 37°C в течение 14 дней. SD001, SD002 и SD003 представляют собой три различные партии двойной живой комбинированной вакцины, соответственно.
На фигуре 34 показаны титры вируса штамма Bartha K61 PRV в двойной комбинированной вакцине (PRRSV и PRV) после хранения при 37°C в течение 14 дней. SD001, SD002 и SD003 представляют собой три различные партии двойной живой комбинированной вакцины, соответственно.
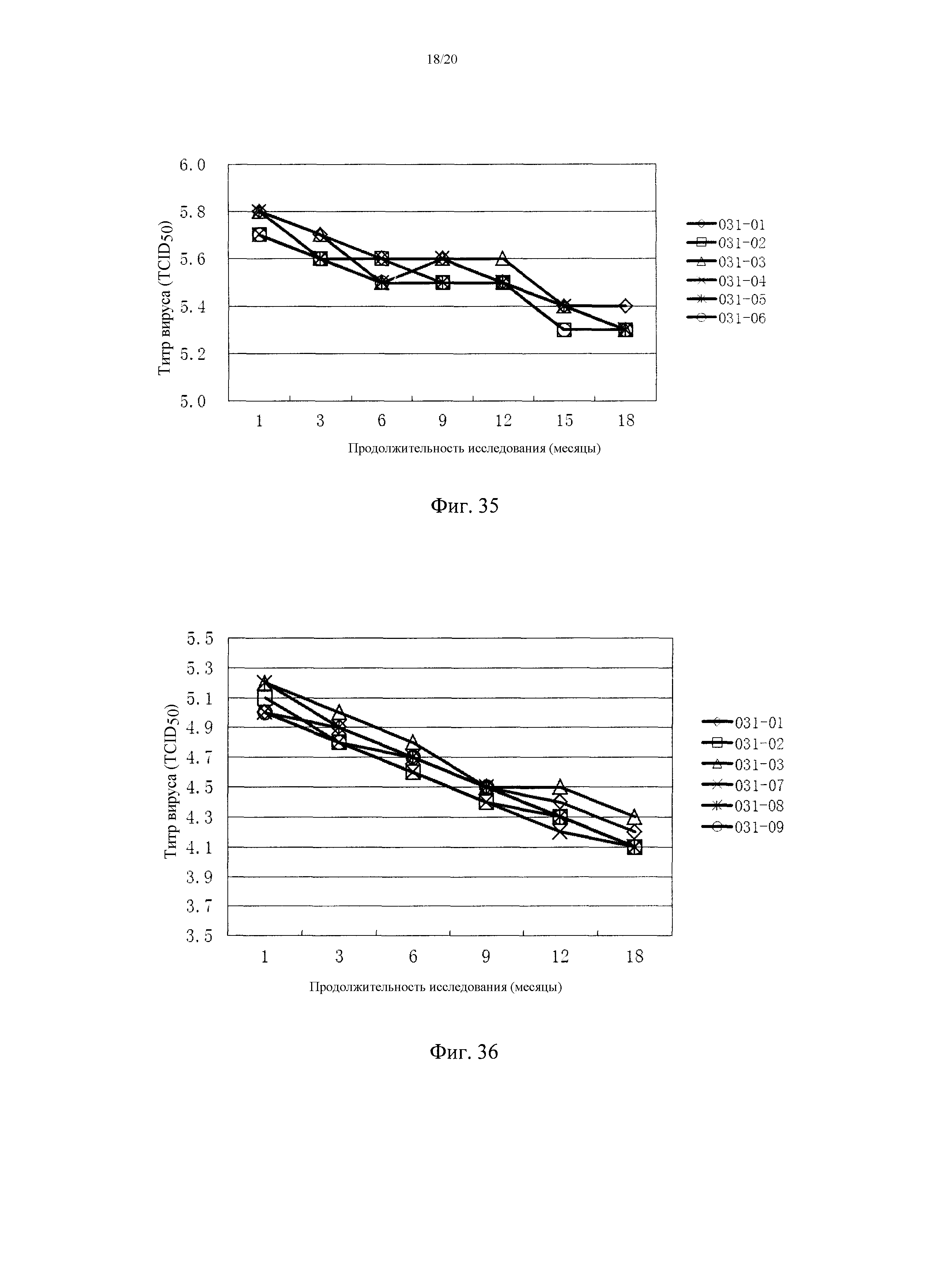
На фигуре 35 показаны титры штамма вируса TJM PRRSV в тройной живой комбинированной вакцине (TJM PRRSV + штамм C (F16) CSFV+ Bartha K61 PRV) после хранения 2-8°C в течение 18 месяцев. 031-01, 031-02 и 031-03 представляют собой три партии тройной живой комбинированной вакцины, и 031-04, 031-05 и 031-06 представляют собой три партии отдельной вакцины на основе штамма TJM PRRSV.
На фигуре 36 показаны титры штамма вируса C (F16) CSFV в тройной живой комбинированной вакцине (TJM PRRSV + штамм C (F16) CSFV+ Bartha K61 PRV) после хранения 2-8°C в течение 18 месяцев. 031-01, 031-02 и 031-03 представляют собой три партии тройной живой комбинированной вакцины, и 031-07, 031-08 и 031-09 представляют собой три партии отдельной вакцины на основе штамма C (F16) CSFV.
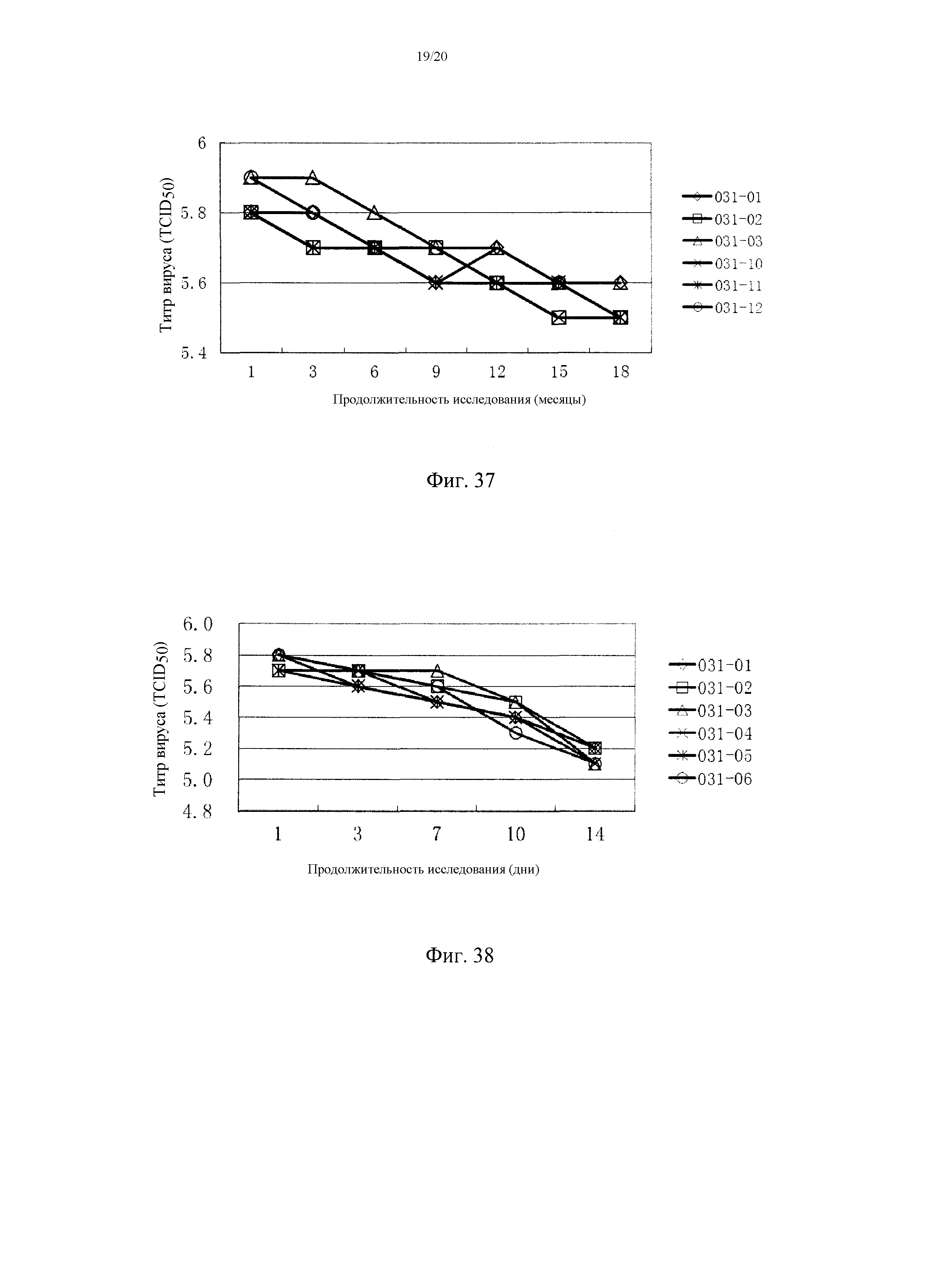
На фигуре 37 показаны титры штамма вируса Bartha K61 PRV в тройной живой комбинированной вакцине (TJM PRRSV + штамм C (F16) CSFV + Bartha K61 PRV) после хранения 2-8°C в течение 18 месяцев. 031-01, 031-02 и 031-03 представляют собой три партии тройной живой комбинированной вакцины, и 031-10, 031-11 и 031-12 представляют собой три партии отдельной вакцины на основе штамма Bartha K61 PRV.
На фигуре 38 показаны титры штамма вируса TJM PRRSV в тройной живой комбинированной вакцине (TJM PRRSV + штамм C (F16) CSFV+ Bartha K61 PRV) после хранения 37°C в течение 14 дней. 031-01, 031-02 и 031-03 представляют собой три партии тройной живой комбинированной вакцины, и 031-04, 031-05 и 031-06 представляют собой три партии отдельной вакцины на основе штамма TJM PRRSV.
На фигуре 39 показаны титры штамма вируса C (F16) CSFV в тройной живой комбинированной вакцине (TJM PRRSV + C CSFV штамм (F16)+ Bartha K61 PRV) после хранения 37°C в течение 14 дней. 031-01, 031-02 и 031-03 представляют собой три партии тройной живой комбинированной вакцины, и 031-07, 031-08 и 031-09 представляют собой три партии отдельной вакцины на основе штамма C (F16) CSFV.
На фигуре 40 показаны титры штамма вируса Bartha K61 PRV в тройной живой комбинированной вакцине (TJM PRRSV + C CSFV штамм (F16)+ Bartha K61 PRV) после хранения 37°C в течение 14 дней. 031-01, 031-02 и 031-03 представляют собой три партии тройной живой комбинированной вакцины, и 031-10, 031-11 и 031-12 представляют собой три партии отдельной вакцины на основе штамма Bartha K61 PRV.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Представленное ниже описание предназначено исключительно для иллюстрирования различных вариантов осуществления настоящего изобретения. В связи с этим, конкретные описываемые модификации не предназначены для ограничения изобретения. Для специалиста в этой области очевидно, что можно осуществлять различные эквиваленты, изменения и модификации без отклонения от сущности или объема объекта изобретения, представленного в настоящем описании, и следует понимать, что такие эквивалентные варианты осуществления подлежат включению в настоящее описание. Все публикации, патенты или патентные заявки, процитированные в настоящем описании, включены в качестве ссылки в полном объеме.
В одном из аспектов настоящее изобретение относится к вакцинным композициям, содержащим вакцину против вируса репродуктивного и респираторного синдрома свиней (PRRSV) и вакцину против второго вируса свиней, где вакцина против PRRSV и вторая вакцина, по существу, не оказывают иммуноингибирования в отношении друг друга.
PRRSV является РНК-вирусом с (+)-цепью, для которого к настоящему времени идентифицировали два генотипа: европейский генотип и американский генотип. Геном PRRSV содержит множественные открытые рамки считывания, в которых первая открытая рамка считывания (ORF1a и ORF1b) содержит 80% последовательности генома PRRSV и кодирует РНК-репликазу, необходимую для репликации PRRSV (Straw et al, Diseases of Swine, 9TH edition, chapter 24(2006)). ORF1a и ORF1b транслируются в полипротеин, расщепляемый содержащимся в нем протеазным доменом на несколько неструктурных белков, включая Nsp1-Nsp12 (см., например, Vries et al, Seminars in Virology, 8: 33-47 (1997); Allende et al, Journal of General Virology, 80: 307-315(1999)).
Вакцина против PRRSV и вакцина против второго вируса свиней, по существу, не оказывают иммуноингибирования в отношении друг друга.
Как применяют в настоящем описании, термин "по существу, не оказывают иммуноингибирования" означает, что комбинация двух или более отдельных вакцин не приводит к существенному снижению протективного иммунного ответа у хозяина на одну из отдельных вакцин или на все из отдельных вакцин. Как применяют в настоящем описании, термин "существенное снижение" относится к снижению на >20% (например, снижению на >30%, >40%, >50% или >60%).
В определенных вариантах осуществления комбинация двух или более отдельных вакцин способна вызывать протективный иммунный ответ на каждую из отдельных вакцин на уровне, сравнимом с иммунным ответом, вызываемым отдельной вакциной. Например, комбинация вакцины против PRRSV и вакцины против второго вируса свиней может вызывать иммунный ответ на PRRSV на уровне, сравнимом с иммунным ответом, вызываемым отдельной вакциной против PRRSV, и/или может вызывать иммунный ответ на вакцину против второго вируса свиней на уровне, сравнимом с иммунным ответом, вызываемым отдельной вакциной против второго вируса свиней.
Протективный иммунный ответ, как правило, включает гуморальный, клеточный и/или мукозальный иммунные ответы, и его можно охарактеризовывать с использованием известных в этой области способов. Гуморальный иммунный ответ развивается посредством продукции антител (например, IgG) против антигена в сыворотке. Титры антител легко можно измерять с использованием анализов, таких как ELISA (твердофазный иммуноферментный анализ). Например, вирусный антиген можно иммобилизовывать на твердой подложке и затем приводить в контакт с образцом, в котором, как предполагают, содержится антитело, затем определяя образование комплекса антиген-антитело. Клеточный иммунный ответ, как правило, является результатом возникновения цитотоксических T-лимфоцитов, и его можно охарактеризовывать посредством измерения конкретных субпопуляций T-клеток, таких как CD3+ T-клетки, CD4+ T-клетки, CD8+ T-клетки и CD4+CD8+ T-клетки, с использованием способов, таких как проточная цитометрия. В кратком изложении, T-клетки окрашивают с использованием антител против конкретных поверхностных маркеров, сортируют и подсчитывают как разные субпопуляции по наличию поверхностных маркеров. Мукозальный иммунный ответ, как правило, является результатом возникновения секреторных IgA на поверхностях слизистых оболочек.
В определенных вариантах осуществления вакцина PRRSV и вакцина против второго вируса свиней при введении в виде комбинированной вакцинной композиции не снижают существенно продукцию антител у хозяина в ответ на вакцину против PRRSV и/или вакцину против второго вируса свиней.
В определенных вариантах осуществления вакцина против PRRSV и вакцина против второго вируса свиней при введении в виде комбинированной вакцинной композиции не снижают существенно уровни CD3+ T-клеток, CD4+ T-клеток, CD8+ T-клеток и/или CD4+CD8+ T-клеток у хозяина в ответ на вакцину против PRRSV и/или вакцину против второго вируса свиней.
В определенных вариантах осуществления вакцина против PRRSV содержит аттенуированный PRRSV. Как применяют в настоящем описании, "аттенуированный PRRSV" относится к PRRSV, который может инфицировать хозяина, но не вызывает репродуктивный и респираторный синдром свиней или вызывает меньше симптомов и/или более слабые симптомы. Аттенуированный PRRSV включает живой аттенуированный PRRSV и его инактивированные продукты. Как применяют в настоящем описании, "репродуктивный и респираторный синдром свиней" (PRRS) относится к серии физиологических и патологических симптомов после инфекции природным PRRSV. Симптомы включают, в качестве неограничивающих примеров, помимо прочего, лихорадку, сонливость, потерю аппетита, утомляемость, одышку, кашель, репродуктивное нарушение у свиноматок и медленный рост или гибель поросят.
В определенных вариантах осуществления аттенуированный PRRSV содержит нуклеотид Nsp2, кодируемый последовательностью ДНК, в которой по сравнению с SEQ ID NO: 4 отсутствует нуклеотидный фрагмент, содержащий по меньшей мере 50 смежных нуклеотидов, где фрагмент является по меньшей мере приблизительно на 80% гомологичным части SEQ ID NO: 8 той же длины.
Как применяют в настоящем описании, термин "кодируемый последовательностью ДНК" относится к последовательности ДНК, которая может транскрибироваться в соответствующую последовательность РНК. Одноцепочечный РНК-вирус, такой как PRRSV и CSFV, имеет геном, состоящий из одной цепи молекулы РНК, который может кодироваться молекулой ДНК на основании уотсон-криковского спаривания оснований. При транскрипции из такой молекулы ДНК может продуцироваться молекула РНК с (+)-цепью, идентичная последовательности РНК в геноме вируса.
Хотя и не желая быть связанными какой-либо теорией, предполагают, что отсутствие такого фрагмента нуклеотида в последовательности Nsp2 в части, гомологичной SEQ ID NO: 8, может снижать вирулентность, а также потенциал иммуноингибирования PRRSV, например, посредством продукции нефункционального или менее функционального белка Nsp2, и/или отрицательно влияя на экспрессию или функцию других белков PRRSV и/или отрицательно влияя на жизненный цикл PRRSV.
Отсутствующий фрагмент может иметь любую подходящую длину, при условии, что он может снижать вирулентность, а также иммуноингибирование PRRSV, до степени, достаточной для устранения вирулентности PRRSV и для индукции протективного иммунитета против PRRSV без нарушения иммунитета против других коинфицирующих вирусов или вакцин. Например, отсутствующий фрагмент ДНК может содержать, по меньшей мере 100, по меньшей мере 120, по меньшей мере 150, по меньшей мере 180, по меньшей мере 200, по меньшей мере 210, по меньшей мере 220, по меньшей мере 230, по меньшей мере 240, по меньшей мере 250, по меньшей мере 260, по меньшей мере 270, по меньшей мере 280, по меньшей мере 290, по меньшей мере 300, по меньшей мере 310, по меньшей мере 320, по меньшей мере 330, по меньшей мере 340, по меньшей мере 350 или по меньшей мере 360 смежных нуклеотидов. Длина отсутствующего нуклеотидного фрагмента также может находиться в диапазоне, определяемом по любому из двух указанных выше значений, как если бы эти диапазоны точно указывали в настоящем описании. В определенных вариантах осуществления отсутствующий нуклеотидный фрагмент содержит приблизительно 300 смежных нуклеотидов, приблизительно 310, приблизительно 320, приблизительно 330, приблизительно 340, приблизительно 350 или приблизительно 360 смежных нуклеотидов.
Специалисты в этой области легко могут получать рекомбинантные вирусы, имеющие различные делеции в нуклеотидной последовательности Nsp2 в части, гомологичной SEQ ID NO: 8, и тестировать эти рекомбинантные вирусы на их жизнеспособность, вирулентность и потенциал иммуноингибирования с использованием способов, известных в этой области, и способов, представленных в настоящем описании. Например, что касается продукции и тестирования вирулентности рекомбинантного PRRSV, содержащего делеции в Nsp2, способы описывают в Kim, Dal-Young et al, Virus Genes, 38: 118-128 (2009). Что касается тестирования иммуноингибирования рекомбинантного PRRSV, способы описывают в Suradhat, S. et al, Vaccine, 24: 2634-3642 (2006), а также в примерах в настоящем описании. С помощью делеции фрагмента в части, гомологичной SEQ ID NO: 8 (например, делеции с 1-го нуклеотида по 50-й нуклеотид в этой части, со 2-го по 60-й нуклеотид, с 5-го по 100-й нуклеотид и т.д.), можно получать рекомбинантный PRRSV, содержащий интересующий нуклеотид Nsp2, и дополнительно тестировать жизнеспособные рекомбинантные штаммы PRRSV на их способность к образованию цитопатических бляшек, таким образом, что можно выбирать аттенуированные рекомбинантные штаммы PRRSV и дополнительно тестировать на свиньях их потенциал иммуноингибирования в отношении вакцины против второго вируса свиней.
В определенных вариантах осуществления отсутствующий фрагмент ДНК является по меньшей мере приблизительно на 81%, приблизительно на 82%, приблизительно на 83%, приблизительно на 84%, приблизительно на 85%, приблизительно на 86%, приблизительно на 87%, приблизительно на 88%, приблизительно на 89%, приблизительно на 90%, приблизительно на 91%, приблизительно на 92%, приблизительно на 93%, приблизительно на 94%, приблизительно на 95%, приблизительно на 96%, приблизительно на 97%, приблизительно на 98%, приблизительно на 99% или на 100% гомологичным части SEQ ID NO: 8 той же длины. В определенных вариантах осуществления отсутствующий фрагмент ДНК содержит SEQ ID NO: 8. В определенных вариантах осуществления отсутствующий фрагмент ДНК является SEQ ID NO: 8 (см. фигуру 1).
В определенных вариантах осуществления аттенуированный PRRSV содержит нуклеотидную последовательность Nsp2, кодирующую последовательность белка Nsp2, в которой, по сравнению с SEQ ID NO: 11, отсутствует пептидный фрагмент, содержащий по меньшей мере 20 смежных аминокислот, где пептидный фрагмент является по меньшей мере приблизительно на 80% гомологичным части SEQ ID NO: 9 той же длины.
Как применяют в настоящем описании термин "кодирующий" означает последовательность РНК, которая может транслироваться в соответствующую аминокислотную последовательность в соответствии со своим генетическим кодом.
Хотя и не желая быть связанными какой-либо теорией, предполагают, что белок Nsp2 без такого пептидного фрагмента является менее функциональным или нефункциональным, таким образом, нарушая вирулентность PRRSV, а также снижая иммуноингибирование вакцины против второго вируса свиней.
В определенных вариантах осуществления отсутствующий пептидный фрагмент содержит по меньшей мере 30, по меньшей мере 40, по меньшей мере 50, по меньшей мере 60, по меньшей мере 70, по меньшей мере 75, по меньшей мере 80, по меньшей мере 85, по меньшей мере 90, по меньшей мере 95, по меньшей мере 100, по меньшей мере 105, по меньшей мере 110, по меньшей мере 115 или по меньшей мере 120 смежных аминокислот. В определенных вариантах осуществления отсутствующий пептидный фрагмент является по меньшей мере приблизительно на 81%, приблизительно на 82%, приблизительно на 83%, приблизительно на 84%, приблизительно на 85%, приблизительно на 86%, приблизительно на 87%, приблизительно на 88%, приблизительно на 89%, приблизительно на 90%, приблизительно на 91%, приблизительно на 92%, приблизительно на 93%, приблизительно на 94%, приблизительно на 95%, приблизительно на 96%, приблизительно на 97%, приблизительно на 98%, приблизительно на 99% или на 100% гомологичным части SEQ ID NO: 9 той же длины. В определенных вариантах осуществления отсутствующий пептидный фрагмент содержит SEQ ID NO: 9. В определенных вариантах осуществления отсутствующий пептидный фрагмент является SEQ ID NO: 9 (см. фигура 2).
Отсутствие пептидного фрагмента в белке Nsp2 можно определять по нуклеотидной последовательности Nsp2. Например, нуклеотидную последовательность Nsp2 можно секвенировать и транслировать в аминокислотную последовательность, затем выравнивая ее с SEQ ID NO: 11 для идентификации отсутствующей пептидной последовательности.
Как применяют в настоящем описании, "гомология" или "гомологичный" относится к схожести двух аминокислотных последовательностей или двух нуклеотидных последовательностей. Гомологию между аминокислотными последовательностями или нуклеотидными последовательностями можно вычислять с использованием любых подходящих известных в этой области способов, например, кандидатную аминокислотную (нуклеотидную) последовательность можно выравнивать с референсной аминокислотной (нуклеотидной) последовательностью, при необходимости включая пропуски, для достижения максимального количества идентичных аминокислотных остатков (нуклеотидов) между выравниваемыми последовательностями, на основании чего можно вычислять процентную долю идентичных аминокислотных остатков (нуклеотидов) между двумя аминокислотными (нуклеотидными) последовательностями. Выравнивание аминокислотных (или нуклеотидных) последовательностей и вычисление их гомологии можно осуществлять с использованием программного обеспечения, известного в этой области, в качестве неограничивающих примеров, программного обеспечения BLAST (доступного на веб-сайте National Center of Biotechnology Information (NCBI): http://blast.ncbi.nlm.nih.gov/Blast.cgi, или см., например, Altschul S.F. et al, J. Mol. Biol.,215:403-410 (1990); Stephen F. et al, Nucleic Acids Res., 25:3389-3402 (1997)), программного обеспечения ClustalW2 (доступного на веб-сайте European Bioinformatics Institute: http://www.ebi. ac.uk/Tools/msa/clustalw2/, также см., например, Higgins D.G. et al, Methods in Enzymology, 266:383-402 (1996); Larkin M.A. et al, Bioinformatics (Oxford,England), 23(21): 2947-8 (2007)); и программного обеспечения TCoffee (доступного на веб-сайте Sweden Bioinformatics Institute: или см., например, Poirot O. et al, Nucleic Acids Res., 31(13): 3503-6 (2003); Notredame C.et al, J. Mol. Boil, 302(1): 205-17(2000)) и т.д. При использовании программного обеспечения для выравнивания последовательностей можно использовать параметры по умолчанию, представленные в программном обеспечении, или корректировать их в зависимости от конкретной ситуации, что входит в объем знаний специалиста в этой области.
В определенных вариантах осуществления аттенуированный PRRSV является аттенуированный относительно высокопатогенного PRRSV.
Термин "высокопатогенный PRRSV" относится к PRRSV, содержащую нуклеотидную последовательность Nsp2, кодируемую последовательностью ДНК, в которой, по сравнению с SEQ ID NO: 5, отсутствуют 90 несмежных нуклеотидов в части SEQ ID NO: 6 (т.е. фрагмент с 1440-го по 1680-ый нуклеотид SEQ ID NO: 5). Обнаруживают, что изоляты PRRSV без таких 90 несмежных нуклеотидов (см. фигуру 3) имеют более высокую патогенность, чем штамм VR-2332 PRRSV (см., например Tian et al., PLoS ONE 2(6): e526, (2007) doi:10.1371). В определенных вариантах осуществления 90 несмежных нуклеотидов включают "TTT" с 1440 по 1442 нуклеотид SEQ ID NO: 5 и последовательность, как представлено в SEQ ID NO: 7 (см., например, фигура 4).
В определенных вариантах осуществления высокопатогенный PRRSV содержит нуклеотидную последовательность Nsp2, кодируемую последовательностью, содержащей нуклеотидную последовательность SED ID NO: 4 (т.е. нуклеотидную последовательность Nsp2 штамма TJ PRRSV). В определенных вариантах осуществления высокопатогенный PRRSV является штаммом TJ PRRSV, чей геном кодируется последовательностью, имеющей регистрационный номер Genbank EU860248.
В определенных вариантах осуществления аттенуированный PRRSV является аттенуированным относительно высокопатогенного PRRSV, и содержит нуклеотидную последовательность Nsp2 без 90 несмежных нуклеотидов по сравнению с SEQ ID NO: 5, где 90 несмежных нуклеотидов находятся в SEQ ID NO: 6.
В определенных вариантах осуществления нуклеотидная последовательность Nsp2 аттенуированного PRRSV кодируется последовательностью, имеющей по меньшей мере 90% гомологии с SEQ ID NO: 2 (т.е. последовательностью, кодирующей нуклеотидную последовательность Nsp2 штамма TJM PRRSV). В определенных вариантах осуществления нуклеотидная последовательность Nsp2 кодируется последовательностью, содержащей SEQ ID NO: 2.
В определенных вариантах осуществления аттенуированный PRRSV дополнительно содержит нуклеотидную последовательность Nsp1, кодируемую последовательностью, имеющей по меньшей мере 90% гомологии с SEQ ID NO: 1 (т.е. последовательностью, кодирующей нуклеотидную последовательность Nsp1 штамма TJM PRRSV). В определенных вариантах осуществления аттенуированный PRRSV содержит нуклеотидную последовательность Nsp1, кодируемую SEQ ID NO: 1, и нуклеотидную последовательность Nsp2, кодируемую SEQ ID NO: 2.
В определенных вариантах осуществления аттенуированный PRRSV содержит нуклеотидную последовательность PRRSV, кодируемую последовательностью, имеющей по меньшей мере 90% гомологии с SEQ ID NO: 3 (т.е. последовательностью, кодирующей геном штамма TJM PRRSV). В определенных вариантах осуществления аттенуированный PRRSV содержит нуклеотидную последовательность PRRSV, кодируемую SEQ ID NO: 3. В определенных вариантах осуществления аттенуированный PRRSV имеет регистрационный номер в CGMCC 3121 (такой аттенуированный штамм PRRSV также обозначают в настоящем описании как штамм TJM PRRSV).
Вакцина против PRRSV, представленная в настоящем описании, по существу, не оказывает иммуноингибирования в отношении вакцины против второго вируса свиней. В определенных вариантах осуществления вакцина против второго вируса свиней выбрана из вакцины против вируса классической чумы свиней (CSFV) и вакцины против вируса псевдобешенства (PRV).
Классическая чума свиней (CSF) является высоко контагиозным и летальным инфекционным заболеванием свиней, вызываемым вирусом классической чумы свиней (CSFV). World Organization for Animal Health (OIE) включила заболевание в список заболеваний OIE как заболевание, случаи которого подлежат обязательной регистрации в ветеринарных органах. В Китае классическая чума свиней является одним из основных инфекционных заболеваний, и в "Category of Type I, II and III Animal diseases" ее указывают, как заболевание животного типа I. Вспышки и распространение CSF приводит к огромному экономическому ущербу для свиноводства в Китае и во всем мире.
Вирус классической чумы свиней (CSFV) классифицируют как представителя рода Pestivirus семейства вирусов Flaviviridae. CSFV является оболочечным РНК-вирусом с (+)-цепью. Вирус имеет геном 12,5 т.п.н. в своем полном размере, содержащий только одну большую открытую рамку считывания (ORF), кодирующую полипротеин, содержащий приблизительно 4000 аминокислот и имеющий молекулярную массу приблизительно 438 кДа. Далее полипротеин процессируется протеазами вируса и хозяина на 12 зрелых белков. Все структурные и неструктурные белки CSFV кодируются этой большой открытой рамкой считывания.
Важным инструментом для контроля классической чумы свиней являются вакцины, включая инактивированные вакцины и аттенуированные вакцины. Получение инактивированных вакцин против CSFV достигло своего пика в 1950-1960-х гг., когда широко использовали инактивированные формалином и кристалл-виолеттом вакцины против CSFV. Однако, по причине недостатков, проявляющихся в необходимости использования больших дозах, небольшой длительности сохранения иммунитета, медленного развития иммунных ответов и большой стоимости, постепенно их заменяли аттенуированными вакцинами против CSFV.
В определенных вариантах осуществления вакцина против CSFV является аттенуированной вакциной против CSFV. Аттенуированные вакцинные штаммы CSFV можно получать аттенуацией полевых штаммов CSFV. Отчеты в других странах, показали, что можно использовать различные способы лапинизации вирусов CSF и получения аттенуированных мутантных штаммов. Например, три аттенуированных вакцинных штамма широко используют как безопасные и эффективные даже без остаточной патогенности: 1) китайский лапинизированный вакцинный штамм (см., например Qiu, H.J. et al, Scientia Agricultura Sinica, 38(8): 1675-1685 (2005)); 2) японский GPE(-)-клеточный аттенуированный вакцинный штамм (см., например Liu, C. et al, Chinese Journal of Animal Husbandry and Veterinary Medicine, Vol. 10, pp. 50-51 (2004)); и 3) французский холодовой аттенуированный вакцинный штамм "Thiveosal" (см., например Zhu, L. Q. et al, Chinese Veterinary Journal, 39 (2): 33-37 (2005)).
В определенных вариантах осуществления аттенуированной вакциной против CSFV является китайский лапинизированный вакцинный штамм (штамм C). Последовательность гена штамма C CSFV приведена в SEQ ID NO: 10. Китайский лапинизированный вакцинный штамм CSF (также называемый штаммом C), разработанный китайскими учеными, широко используют в Китае с 1957 года, и его вводили в употребление во многих других странах, где классическая чума свиней находится под контролем или ликвидирована. Эту вакцину считают одной из наиболее применимых вакцинных штаммов CSFV по всем миру.
Лапинизированные вакцины против CSF (на основе штамма C) можно классифицировать по разным способам получения. Первый способ включает получение вакцин с использованием кроликов. Кролика инокулируют CSFV и собирают лимфоузел, селезенку или ткань кролика для получения вакцины против CSFV из селезенки и лимфоидной ткани или вакцины против CSFV из кролика. С помощью этого способа можно эффективно предотвращать контаминацию экзогенным вирусом и обеспечивать генетическую стабильность вируса. Однако, необходимо множество кроликов, трудно контролировать качество, и относительно высока стоимость производства. Второй способ включает использование первичных культур клеток крупного рогатого скота или овец или линии клеток свиньи для получения вакцины, т.е. вакцины против CSFV клеточного происхождения. Например, вакцину против CSFV клеточного происхождения можно получать, пропуская лапинизированный вирус CSF (из селезенки) через клетку и осуществляя два раунда очистки на уровне клона с помощью серийных разведений. Этот способ не требует использования множества животных. В определенных вариантах осуществления штамм C CSFV является штаммом C CSFV, происходящим из селезенки и лимфоидной ткани. В определенных вариантах осуществления штамм C CSFV является штаммом C CSFV клеточного происхождения, который можно получать из первичных культур клеток или клеточной линии.
В определенных вариантах осуществления аттенуированный CSFV кодируется последовательностью, имеющей по меньшей мере 80% гомологии с SEQ ID NO: 10 (т.е. последовательностью, кодирующей геном штамма C CSFV). В определенных вариантах осуществления аттенуированные CSFV кодирует SEQ ID NO: 10.
В определенных вариантах осуществления аттенуированный CSFV имеет регистрационный номер в CGMCC 3891 (такой аттенуированный штамм CSFV также обозначают в настоящем описании как штамм C CSFV, или F16 или штамм C (F16) CSFV). Штамм C (F16) CSFV является штаммом C CSFV клеточного происхождения.
В определенных вариантах осуществления вакцина против второго вируса свиней является вакциной против вируса псевдобешенства (PRV).
PRV принадлежит к семейству Herpesvirdae и подсемейству Alpherpesvirinae. В настоящее время идентифицировали только один серотип PRV. Геномом PRV является двухцепочечная ДНК, имеющая длину приблизительно 150 т.п.н. Геном вируса состоит из уникальной длинной области(UL), уникальной короткой области(US) и последовательности концевых повторов, фланкирующих область US и внутренние последовательности повторов. К настоящему моменту, в геноме PRV определена локализация 65 генов, и большинство из них функционально охарактеризовано. 56 генов локализованы в области UL, включая гены гликопротеинов, такие как gB, gC, gH, gK, gL, gM, gN, тимидинкиназы (TK), щелочной нуклеазы (AN), рибонуклеотидредуктазы (RR), ДНК-полимеразы (POL), ген DBP, ген MCP, ген ICP18.5 и ген раннего белка 0 (EP0) и т.д. Полностью секвенировали область US, в которой локализованы 7 генов, включая: гены гликопротеинов gD, gE, gG, gI и ген протеинкиназы (PK), ген белка 11kd и 28kd.
В определенных вариантах осуществления вакцина против PRV содержит аттенуированный PRV. Термин "аттенуированная вакцина против PRV" относится к PRV, способному инфицировать своего хозяина, но не вызывающему псевдобешенство или вызывающему сниженные или менее тяжелые симптомы. Аттенуированный PRV включает живой аттенуированный PRV и его инактивированный продукты. "Псевдобешенство" относится к серии физиологических и патологических симптомов, вызываемых инфекцией PRV дикого типа. Такие симптомы включают, в качестве неограничивающих примеров, невынашивание, мертворождение, недоразвитый плод, муммифицированный плод, лихорадку, низкий аппетит, неврологические симптомы, паралич, системную недостаточность и даже гибель.
В определенных вариантах осуществления аттенуированный PRV содержит последовательность, имеющую по меньшей мере 80% гомологии с последовательностью, имеющей идентификационный номер NCBI NC_006151, например, имеющую по меньшей мере 85%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% гомологии.
В определенных вариантах осуществления аттенуированный PRV имеет один или несколько инактивированных генов, влияющих на патогенность. "Инактивированный" ген относится к гену, функция которого снижается или отсутствует в результате его отсутствия или делеции полной последовательности или ее части или в результате инсерций или мутаций в гене. Примеры генов, влияющих на патогенность PRV, включают, в качестве неограничивающих примеров, TK (например, NCBI Gene ID: 2952559), PK (например, NCBI Gene ID: 2952530 или 2952561), RR (например, NCBI Gene ID: 2952535 или 2952536), дУТФазу (например, NCBI Gene ID: 2952537), gG (например, NCBI Gene ID: 2952520), gC (например, NCBI Gene ID: 2952505), gE (например, NCBI Gene ID: 2952517), gD (например, NCBI Gene ID: 2952521) и gI (например, NCBI Gene ID: 2952516).
В определенных вариантах осуществления аттенуированный PRV имеет один или несколько инактивированных генов, выбранных из группы, состоящей из TK, PK, RR, дУТФазы, gG, gC, gE, gD и gI. В определенных вариантах осуществления аттенуированный PRV имеет инактивированный ген gE. В определенных вариантах осуществления в аттенуированном PRV инактивируют только ген gE. В определенных вариантах осуществления аттенуированный PRV имеет инактивированный ген gE и дополнительно имеет один или несколько инактивированных генов, влияющих на патогенность, например, TK, PK, RR, дУТФазу, gG, gC, gD и/или gI.
Аттенуированную вакцину против PRV можно получать с использованием известных в этой области способов. Например, изолят штамма PRV дикого типа можно аттенуировать, осуществляя пассирование вируса в не принадлежащие свинье клетки или эмбрионы птиц или культивируя при повышенной температуре и/или в присутствие мутагена. В этой области известно множество аттенуированных вакцин против PRV, например, на основе штамма Bartha K61 (см., например, Bartha, A. Experiments to reduce the virulence of Aujeszky's virus. Magyar allatorvosok lapja 16, 42-45 (1961)), штамма BUK, штамма NIA4, штамма Alfort, штамма VGNKI и т.д. Эти аттенуированные вакцины против PRV можно использовать в настоящем описании. Например, штамм PRV дикого типа или аттенуированный штамм PRV можно дополнительно модифицировать, таким образом, что инактивируют один или несколько генов-мишеней, влияющих на патогенность, хотя вирус остается способным к репликации. В этой области известно множество аттенуированных вакцин против PRV, получаемых с помощью генетической инженерии, например, на основе штамма BUK-d13 PRV (см., например, Kit S. et al, Am. J. Vet. Res., 1985, 46 (6): 1359-1367), штамма d1gC /d1TK PRV (см., например, Kit S. et al, Am. J. Vet. Res., 1987, 48 (5): 780-793), S-PRV-002 (см., например, патент США № 4514497), штамма PRV783 (см., например, Van Oirschot J T et al, Am. J. Vet. Res., 1984, 45 (10): 2099-2103), EL-001, PRV376 и т.д.
В определенных вариантах осуществления в аттенуированном PRV отсутствует ген gE. В определенных вариантах осуществления аттенуированный PRV имеет регистрационный номер в CGMCC 5076 (такой аттенуированный штамм PRV также обозначают в настоящем описании как штамм Bartha K61 PRV).
В определенных вариантах осуществления аттенуированный PRV дополнительно содержит один или несколько инактивированных генов, не влияющих на репликацию вируса или инфицирования хозяина. В определенных вариантах осуществления аттенуированный PRV дополнительно содержит один или несколько гетерогенных генов, отсутствующих в геноме PRV. Встроенные гетерогенные гены применимы в определении и/или оценке вакцин.
В определенных вариантах осуществления вакцинная композиция дополнительно содержит третью вакцину против вируса свиней, где вакцина против PRRSV, вакцина против второго вируса свиней и вакцина против третьего вируса свиней, по существу, не оказывают иммуноингибирования в отношении друг друга. В определенных вариантах осуществления третью вакцину против вируса свиней можно выбирать из вакцины против CSFV и вакцины против PRV при условии, что вторая вакцина отличается от третьей вакцины.
В определенных вариантах осуществления вакцинные композиции содержат вакцину против PRRSV, вакцину против CSFV и вакцину против PRV, где вакцина против PRRSV, вакцина против CSFV и вакцина против PRV, по существу, не оказывают иммуноингибирования в отношении друг друга. При комбинировании в вакцинной композиции три вакцины, по существу, не снижают продукцию антител и/или уровни субпопуляций T-клеток у хозяина в ответ на вакцину против PRRSV, вакцину против CSFV и/или вакцину против PRV. В определенных вариантах осуществления вакцина против PRRSV содержит штамм TJM PRRSV. Вакцина против CSFV содержит любой из аттенуированных CSFV, представленных в настоящем описании, включая, в качестве неограничивающих примеров, штамм C CSFV. Вакцина против PRV содержит любой из аттенуированных штаммов PRV, представленных в настоящем описании, например в качестве неограничивающих примеров, штамм Bartha K61 PRV.
В определенных вариантах осуществления настоящее изобретение относится к вакцинной композиции, содержащей штамм TJM PRRSV, имеющий регистрационный номер CGMCC № 3121, и штамм C CSFV. В определенных вариантах осуществления штамм C CSFV является CSFV F16, имеющим регистрационный номер CGMCC № 3891. Штамм TJM PRRSV и штамм C (F16) CSFV не демонстрируют какого-либо иммуноингибирования или иммуносупрессии в отношении друг друга. Оба вакцинных штамма обладают хорошей безопасностью, иммуногенностью и специфичностью и могут обеспечивать эффективную защиту против высокопатогенного репродуктивного и респираторного синдрома свиней и классической чумы свиней, являющихся двумя основными эпидемическими заболеваниями в свиноводстве.
В определенных вариантах осуществления настоящее изобретение относится к вакцинной композиции, содержащей штамм TJM PRRSV, имеющий регистрационный номер CGMCC № 3121, и штамм Bartha K61 PRV с регистрационным номером CGMCC № 5076. Штамм TJM PRRSV и штамм Bartha K61 PRV не демонстрируют какого-либо иммуноингибирования или иммуносупрессии в отношении друг друга. Оба вакцинных штамма обладают хорошей безопасностью, иммуногенностью и специфичностью и могут обеспечивать эффективную защиту против высокопатогенного репродуктивного и респираторного синдрома свиней и псевдобешенства, являющихся двумя основными эпидемическими заболеваниями в свиноводстве.
В определенных вариантах осуществления настоящее изобретение относится к вакцинной композиции, содержащей штамм TJM PRRSV, штамм C (F16) CSFV и штамм Bartha K61 PRV. Штамм TJM PRRSV, штамм C CSFV (F16) и штамм Bartha K61 PRV не демонстрируют какого-либо иммуноингибирования или иммуносупрессии в отношении друг друга. Три вакцинных штамма обладают хорошей безопасностью, иммуногенностью и специфичностью и могут обеспечивать эффективную защиту против высокопатогенного репродуктивного и респираторного синдрома свиней, классической чумы свиней и псевдобешенства, являющихся тремя основными эпидемическими заболеваниями в свиноводстве.
Подробная регистрационная информация о штамме TJM PRRSV представлена ниже: Регистрационный номер: CGMCC № 3121; таксономическое название: вирус репродуктивного и респираторного синдрома свиней; адрес учреждения, осуществляющего хранение: Institute of Microbiology, Chinese Academy of Sciences, NO. 1 West Beichen Road, Chaoyang District, Beijing, China; учреждение, осуществляющее хранение: China General Microbiological Culture Collection Center; и дата регистрации: 15 июня 2009 года.
Подробная регистрационная информация о штамме C (F16) CSFV являлась следующей: регистрационный номер: CGMCC № 3891; таксономическое название: вирус классической чумы свиней; адрес учреждения, осуществляющего хранение: Institute of Microbiology, Chinese Academy of Sciences, NO. 1 West Beichen Road, Chaoyang District, Beijing, China; учреждение, осуществляющее хранение: China General Microbiological Culture Collection Center; и дата регистрации: 27 мая 2010 года.
Подробная регистрационная информация о штамме Bartha K61 PRV являлась следующей: регистрационный номер: CGMCC № 5076; таксономическое название: вирус псевдобешенства; адрес учреждения, осуществляющего хранение: Institute of Microbiology, Chinese Academy of Sciences, NO. 1 West Beichen Road, Chaoyang District, Beijing, China; учреждение, осуществляющее хранение: China General Microbiological Culture Collection Center; и дата регистрации: 21 июля 2011 года.
В определенных вариантах осуществления вакцинная композиция, представленная в настоящем описании, содержит иммунологически эффективное количество вакцины против PRRSV, вакцины против CSFV и/или вакцины против PRV. Как применяют в настоящем описании, термин "иммунологически эффективное количество" относится к количеству вакцины, достаточному для индуцирования протективного иммунного ответа у хозяина против предполагаемого антигена или патогена. Например, иммунологически эффективное количество может являться достаточным для снижения или замедления начала одного или нескольких симптомов инфекции, снижения заболеваемости и/или смертности инфицированного хозяина, индуцирования достаточного уровня антител против патогена, повышения уровней субпопуляций T-клеток и любой их комбинации. Характеризацию и/или количественный анализ протективного иммунного ответа можно осуществлять с использованием известных в этой области способов, например, измеряя титры антител против патогена и/или количество субпопуляций T-клеток, как описано выше, или наблюдая за клиническими проявлениями вакцинированных свиней после заражения вирулентным штаммом вируса.
Иммунологически эффективное количество вируса в вакцине можно охарактеризовывать по титру вируса, например, дозе, инфицирующей 50% культуры ткани (TCID50). В определенных вариантах осуществления иммунологически эффективное количество вакцины против PRRSV составляет по меньшей мере 103,0 TCID50, 103,5 TCID50, 104,0 TCID50, 104,5 TCID50, 105,0 TCID50 или 105,5 TCID50. В определенных вариантах осуществления иммунологически эффективное количество вакцины против PRRSV составляет по меньшей мере 104,5 TCID50, по меньшей мере 105,0 TCID50 или по меньшей мере 105,5 TCID50. В определенных вариантах осуществления вакцинные композиции, представленные в настоящем описании, содержат от приблизительно 104,5 TCID50 до приблизительно 106,0 TCID50 или от приблизительно 105,0 TCID50 до приблизительно 106,0 TCID50 вакцины против PRRSV.
В определенных вариантах осуществления иммунологически эффективное количество вакцины против CSFV составляет по меньшей мере 100,5 FA-TCID50 (TCID50, определяемая с помощью флуоресцентно-меченых антител), 101,0 FA-TCID50, 101,5 FA-TCID50, 102,0 FA-TCID50, 102,5 FA-TCID50, 103,0 FA-TCID50, 103,5 FA-TCID50, 104,0 FA-TCID50, 104,5 FA-TCID50 или 105,0 FA-TCID50. В определенных вариантах осуществления иммунологически эффективное количество вакцины против CSFV составляет по меньшей мере 104,0 FA-TCID50/мл. В определенных вариантах осуществления вакцинные композиции, представленные в настоящем описании, содержат от приблизительно 100,5 FA-TCID50 до приблизительно 105,0 FA-TCID50 или от приблизительно 104,0 FA-TCID50 до приблизительно 105,0 FA-TCID50 вакцины против CSFV. Термин "FA-TCID50" относится к значению TCID50, определяемому способом, основанным на использовании флуоресцентного антитела.
В определенных вариантах осуществления иммунологически эффективное количество вакцины против CSFV составляет по меньшей мере 2,5 RID, 3 RID, 5 RID, 10 RID, 30 RID, 100 RID, 150 RID, 300 RID, 750 RID, 1000 RID, 3000 RID или 7500 RID.
В определенных вариантах осуществления иммунологически эффективное количество вакцины против PRV составляет по меньшей мере 103,0 TCID50, 103,5 TCID50, 104,0 TCID50, 104,5 TCID50, 105,0 TCID50, 105,5 TCID50 или 106,0 TCID50. В определенных вариантах осуществления иммунологически эффективное количество вакцины против PRV составляет по меньшей мере 105,5 TCID50 или по меньшей мере 106,0 TCID50. В определенных вариантах осуществления вакцинные композиции, представленные в настоящем описании, содержат от приблизительно 105,0 TCID50 до приблизительно 106,5 TCID50 или от приблизительно 105,5 TCID50 до приблизительно 106,5 TCID50 вакцины против PRV.
TCID50 вирусной вакцины можно определять с использованием любых подходящих способов, известных в этой области. Например, вирусную вакцину (вакцину против PRRSV и/или вакцину против PRV) можно получать в виде вирус-содержащего раствора, и можно получать 10-кратные серийные разведения вирус-содержащего раствора и инокулировать 96-луночный планшет для культивирования, засеянный восприимчивыми клетками. Вирус-содержащие растворы каждого разведения можно инокулировать в 8 лунок при 100 мкл/лунку. Планшеты можно помещать в инкубатор при 37°C с 5% CO2 и инкубировать в течение 4-5 дней. Клетки исследуют на цитопатические эффекты и вычисляют TCID50 как концентрацию вируса, при которой 50% культуры ткани демонстрирует цитопатические эффекты. Подробное описание способа можно найти в Reed LJ, Muench H, A simple method of estimating fifty percent end points. Am J Hyg 1938; 27:493-97.
CSFV является вирусом, не вызывающим очевидные цитопатические эффекты, и, таким образом, TCID50 определяют иммунофлуоресцентным способом или с использованием исследования инфекции у кролика. В определенных вариантах осуществления FA-TCID50 вакцины против CSFV определяют иммунофлуоресцентным способом. В кратком изложении, вакцинный штамм CSFV получают как раствор, содержащий 1 дозу/мл, и получают 10-кратные серийные разведения со средой для культивирования DMEM, дополненной 3,5% сыворотки. Разведения, содержащие 10-1, 10-2, 10-3, 10-4 и 10-5 исходных образцов вируса, инокулируют, соответственно, в один слой клеток BT при 0,1 мл/лунку. После 3-4 дней культивирования клетки фиксируют и приводят в контакт с флуоресцентно-меченым моноклональным антителом против CSFV (в случае прямого иммунофлуоресцентного способа). После 45-60 минут реакции клетки исследуют на наличие флуоресценции, свидетельствующей о наличии вируса. Альтернативно, фиксированные клетки можно приводить в контакт с немеченым моноклональным антителом против CSFV (в случае непрямого иммунофлуоресцентного способа), и через 45-60 минут реакции клетки реагируют с флуоресцентно-меченым вторичным антителом в течение следующих 45-60 минут. Клетки исследуют на наличие флуоресценции, свидетельствующей о наличии вируса. FA-TCID50 вычисляют согласно способу Reed-Muench (см., например Reed LJ, Muench H, A simple method of estimating fifty percent end points. Am J Hyg 1938; 27:493-97).
В определенных вариантах осуществления количество вакцины против CSFV определяют по инфицирующей дозе для кролика. В кратком изложении, вакцинный штамм CSFV получают как раствор, содержащий 1 дозу, а затем разводят в 7500 раз для получения тестового образца. Каждому из 2 кроликов с массой тела 1,5-3 кг инъецируют 1 мл тестового образца и измеряют температуру тела дважды в сутки в течение первых 48 часов, а затем каждые 6 часов. Реакции температуры тела проверяют и классифицируют согласно следующим критериям: 1) типичная лихорадочная реакция (++): латентный период составляет приблизительно 48-96 часов, температура тела значительно повышается, при этом температура повышается по меньшей мере 3 раза относительно нормальной температуры по меньшей мере на 1°C, и повышение длится в течение 18-36 часов; 2) незначительная лихорадочная реакция (+): латентный период составляет приблизительно 48-96 часов, температура тела значительно повышается, при этом температура повышается по меньшей мере в 3 раза относительно нормальной температуры по меньшей мере на 0,5°C, и повышение длится 12-36 часов; 3) предполагаемая лихорадочная реакция (±): латентный период составляет приблизительно 48-96 часов, температура тела колеблется, повышение температуры длится в течение менее 12 часов, или латентный период составляет по меньшей мере 24 часов, и лихорадочная реакция происходит в пределах 48 часов, или через периода времени от 96 до 120 часов; и 4) отсутствие лихорадочной реакции (-): температура тела является нормальной. Вакцину определяют как имеющую количество 7500 RID, если у двух тестируемых кроликов наблюдают типичную лихорадочную реакцию (++), или у одного из кроликов наблюдают типичную лихорадочную реакцию (++), в то время как у другого наблюдают незначительную лихорадочную реакцию (+). В случае, когда у кроликов наблюдают другие реакции, которые трудно охарактеризовывать, тест можно повторять, но нельзя повторять его более 3 раз.
Отдельные вирусные вакцины можно смешивать в подходящем соотношении для получения вакцинных композиций, представленных в настоящем описании. Например, отдельную вирусную вакцину можно получать как вирус-содержащий раствор, содержащий вакцинный штамм при конкретном титре вируса (например, конкретном TCID50), и две или более отдельных вирусных вакцины смешивают в подходящем соотношении для получения комбинированной вакцины, содержащей каждую отдельную вакцину в заранее определенном количестве (например, TCID50) или соотношении.
В определенных вариантах осуществления в комбинированной вакцинной композиции, содержащей вакцину против PRRSV и вакцину против CSFV, соотношение TCID50 вакцины против PRRSV и вакцины против CSFV находится в диапазоне от 10000:1 до 1:1, от 1000:1 до 1:1, от 100:1 до 1:1, от 10:1 до 1:1 или от 5:1 до 1:1. Например, вакцинная композиция может содержать 104,5 TCID50 вакцины против PRRSV и 100,5 FA-TCID50 вакцины против CSFV, или 104,5 TCID50 вакцины против PRRSV и 103,5 FA-TCID50 вакцины против CSFV, или 105,0 TCID50 вакцины против PRRSV и 104,0 FA-TCID50 вакцины против CSFV.
В определенных вариантах осуществления в комбинированной вакцинной композиции, содержащей вакцину против PRRSV и вакцину против PRV, соотношение TCID50 вакцины против PRRSV и вакцины против PRV находится в диапазоне от 1:1 до 1:30, от 1:1 до 1:25, от 1:1 до 1:20, от 1:1 до 1:15, от 1:1 до 1:10, от 1:1 до 1:9, от 1:1 до 1:8, от 1:1 до 1:7, от 1:1 до 1:6, от 1:1 до 1:5, от 1:2 до 1:10, от 1:3 до 1:10, от 1:4 до 1:10 или от 1:5 до 1:10. Например, вакцинная композиция может содержать 104,5 TCID50 вакцины против PRRSV и 105,5 TCID50 вакцины против PRV, или 105,0 TCID50 вакцины против PRRSV и 105,5 TCID50 вакцины против PRV, или 105,0 TCID50 вакцины против PRRSV и 106,5 TCID50 вакцины против PRV.
В определенных вариантах осуществления в комбинированной вакцинной композиции, содержащей вакцину против PRRSV, вакцину против CSFV и вакцину против PRV, соотношение TCID50 вакцины против PRRSV:вакцины против CSFV:вакцины против PRV составляет от приблизительно 104:1:105 до приблизительно 5:1:6. Например, вакцинная композиция может содержать 104,5 TCID50 вакцины против PRRSV, 100,5 FA-TCID50 вакцины против CSFV и 105,5 TCID50 вакцины против PRV. В качестве другого примера, вакцинная композиция может содержать 104,5 TCID50 вакцины против PRRSV, 104,0 FA-TCID50 вакцины против CSFV и 105,5 TCID50 вакцины против PRV. В качестве другого примера, вакцинная композиция может содержать 105,7 TCID50 вакцины против PRRSV, 105,0 FA-TCID50 вакцины против CSFV и 105,8 TCID50 вакцины против PRV. В качестве другого примера, вакцинная композиция может содержать 106,0 TCID50 вакцины против PRRSV, 105,0 FA-TCID50 вакцины против CSFV и 106,5 TCID50 вакцины против PRV.
Вакцинные композиции, представленные в настоящем описании, могут дополнительно содержать адъювант. Адъювант может защищать вакцину от деградации in vivo и/или может неспецифически стимулировать иммунную систему и, таким образом, являться полезным в усилении иммунного ответа на вакцину. Примеры адъювантов включают, в качестве неограничивающих примеров, минеральные соли (например, гидроксид алюминия, фосфат алюминия, гидроксид кальция), эмульсии "вода-в-масле" (например, полный адъювант Фрейнда, неполный адъювант Фрейнда и т.д.), сапониновые адъюванты (например, Stimulon™ и т.д.), производные бактерий или микроорганизмов (например, производные LPS, липида A и т.д.) и микрочастицы (например, поли-α-гидроксикислоты и т.д.).
Вакцинная композиция, представленная в настоящем описании, может дополнительно содержать криопротектор. Криопротектор может поддерживать хорошую стабильность биологических продуктов и снижать ущерб биологической активности вакцины при лиофилизации. Примеры криопротектора включают сахарозу, L-глутамат натрия или гидролизат лактальбумина и т.д.
Способы получения
В другом аспекте настоящее изобретение относится к способам получения вакцинных композиций, представленных в настоящем описании, включающим: (a) сбор вакцинного штамма PRRSV, вакцинного штамма CSFV и/или вакцинного штамма PRV, культивируемых в соответствующих восприимчивых клетках, и (b) смешивание двух или более штаммов вирусов при подходящем соотношении TCID50.
В определенных вариантах осуществления этап (a) включает: инокуляцию вакцинным штаммом PRRSV, вакцинным штаммом CSFV и/или вакцинным штаммом PRV соответствующих восприимчивых клеток, культивирование клеток для получения посевных вирусов для получения вакцины, инокуляция посевными вирусами соответствующих восприимчивых клеток, выращивание клеток для получения антигенных растворов, содержащих соответствующие вирусы.
В определенных вариантах осуществления вакцинный штамм PRRSV является аттенуированным вакцинным штаммом высокопатогенного PRRSV. В определенных вариантах осуществления вакцинный штамм PRRSV является штаммом TJM PRRSV.
В определенных вариантах осуществления вакцинный штамм CSFV является аттенуированным CSFV. В определенных вариантах осуществления вакцинный штамм CSFV является штаммом C (F16) CSFV.
В определенных вариантах осуществления вакцинный штамм PRV является аттенуированным PRV. В определенных вариантах осуществления вакцинный штамм PRV является штаммом Bartha K61.
В определенных вариантах осуществления восприимчивые клетки для вакцинного штамма PRRSV включают, в качестве неограничивающих примеров, клеточные линии, такие как клеточная линия Marc-145, клеточная линия MA-104, клеточная линия Vero или клеточная линия CL-2621, или первичные культуры клеток, таких как клетки PAM.
В определенных вариантах осуществления восприимчивые клетки для вакцинного штамма CSFV включают, в качестве неограничивающих примеров, клеточные линии, такие как клеточная линия BT, клеточная линия Vero, клеточная линия MPK, клеточная линия SK6, клеточная линия PK2a, клеточная линия CPK, клеточная линия RKC, клеточная линия MDBK, клеточная линия MDCK, клеточная линия CRFK, клеточная линия PT и клеточная линия ST, или первичные культуры клеток, таких как клетки BT. И клеточная линия PT и клеточная линия ST являются линиями клеток яичка свиньи.
В определенных вариантах осуществления восприимчивые клетки для вакцинного штамма PRV включают, в качестве неограничивающих примеров, пассирование клеточных линий, таких как клеточная линия ST (ATCC № CRL-1746), клеточная линия PK-15 (ATCC № CCL-33), клеточная линия Marc-145 (ATCC № CRL-12219), линия клеток почки быка MDBK (ATCC № CCL-22), линия бычьих спиралевидных клеток BT (ATCC № CRL-1390), клеточная линия Vero (ATCC № CCL-81), клеточная линия BHK-21 (ATCC № CCL-10), линия клеток почки свиньи (см., IBRS-2, например, DECASTRO, M. P. 1964. Behavior of foot and mouth disease virus in cell culture: susceptibility of the IB-RS-2 swine cell line. Arquivos Instituto Biologica 31: 63-78) и линия клеток почки кролика RK (ATCC № CCL-106); или первичные культуры клеток, таких как эмбриональные фибробласты курицы и клетки почки свиньи. Первичные культуры клеток можно получать с использованием известных в этой области способов, например, выделяя ткани животного и получая клетки.
В определенных вариантах осуществления восприимчивые клетки культивировали предпочтительно при 33-37°C в присутствие 5% CO2. Способы культивирования восприимчивых клеток могут включать: пассирование клеточной линии после обработки раствором ЭДТА-трипсина, продолжение культивирования клеточной линии в среде для выращивания, когда клетки достигают 90-100% конфлуэнтности, их можно дополнительно пассировать или инокулировать посевным вирусом. Способ культивирования клеточной линии, предпочтительно, является любым из следующего: культивирование клеток в роллерной колбе и достижение плотности клеток 1×106/мл - 5×106/мл; или внесение адгезионного носителя в биореактор для культивирования в суспензии и достижения плотности клеток 5×106/мл - 1×107/мл, где адгезионный носитель предпочтительно является микроносителем или бумагой.
В определенных вариантах осуществления вакцинным штаммом PRRSV инокулируют восприимчивые клетки при множественности заражения (MOI) 0,01-0,5, вакцинным штаммом CSFV инокулируют в восприимчивые клетки при MOI 0,1-0,5, или посевным количеством является 3%-5% вируса клеточного происхождения, и/или вакцинным штаммом PRV инокулируют восприимчивые клетки при MOI 0,005-0,5.
В определенных вариантах осуществления клетки, инокулированные соответствующим вакцинным штаммом вируса, культивируют в течение 3-5 дней после инокуляции, после чего можно собирать посевные вирусы для получения вакцины. В случае штамма PRRSV посевной вирус собирают, когда цитопатический эффект достигает 70%. В случае штамма CSFV первый сбор осуществляют при смене среды на 5-й день после инокуляции, и последующие сборы осуществляют при смене среды через 4-дневные интервалы, при условии, что осуществляют не более пяти сборов. В случае штамма PRV среду для культивирования клеток, содержащую вирус, собирают через 2-3 дня после инокуляции.
В определенных вариантах осуществления посевной вирус для получения вакцины имеет подходящий титр вируса. Например, посевной вирус для штамма TJM PRRSV может содержать не менее 107,0 TCID50 вируса на мл, посевной вирус для штамма C (F16) CSFV может содержать >100000 инфицирующих доз для кролика на мл или не менее 106,0 FA-TCID50 вируса на мл, как измеряют с помощью иммунофлуоресцентного анализа и/или посевной вирус для PRV штамма Bartha K61 может иметь не менее 108,0 TCID50 вируса на мл.
В определенных вариантах осуществления посевными вирусами инокулируют соответствующие восприимчивые клетки и выращивают их для получения антигенных растворов, содержащих соответствующие вирусы. В определенных вариантах осуществления получаемые антигенные растворы имеют подходящее содержание вируса, например, не менее 107,0 TCID50 вируса на мл для штамма TJM PRRSV, >100000 RID на мл или не менее 106,0 FA-TCID50 вируса на мл, как измеряют с помощью иммунофлуоресцентного анализа, для штамма C (F16) CSFV и/или не менее 108,0 TCID50 вируса на мл для штамма Bartha K61 PRV.
В определенных вариантах осуществления этап (b) включает смешивание собранного вакцинного штамма PRRSV и вакцинного штамма CSFV при соотношении TCID50 от 10000:1 до 1:1. В определенных вариантах осуществления этап (b) включает смешивание собранного вакцинного штамма вируса PRRSV с вакцинным штаммом вируса PRV при соотношении TCID50 от 1:1 до 1:30. В определенных вариантах осуществления этап (b) включает смешивание собранного вакцинного штамма вируса PRRSV, вакцинного штамма вируса CSFV и вакцинного штамма вируса PRV при соотношении TCID50 приблизительно от 104:1:105 до приблизительно 5:1:6.
В определенных вариантах осуществления этап (b) дополнительно включает смешивание смеси растворов, содержащих собранные вирусы, с криопротектором. В определенных вариантах осуществления смесь растворов, содержащих собранные вирусы, смешивают с криопротектором в объемном соотношении 75-80:25-20.
В другом аспекте настоящее изобретение относится к вакцинным композициям, получаемым с использованием способов, представленных в настоящем описании.
В другом аспекте настоящее изобретение относится к применению вакцинных композиций, представленных в настоящем описании, в производстве лекарственного средства для профилактики или лечения PRRS, CSF и/или PR.
В другом аспекте настоящее изобретение относится к способам иммунизации свиней, включающим введение свинье вакцинной композиции, представленной в настоящем описании.
В другом аспекте настоящее изобретение относится к вакцинным штаммам CSFV, культивируемым в клеточной линии, выбранной из группы, состоящей из ST, PK-15, Marc-145, MDBK, BT, Vero, BHK-21, линии клеток почки свиньи (IBRS-2), линии клеток почки кролика (RK) и линии эмбриональных фибробластов курицы, или первичных культурах клеток, являющихся первичными культурами клеток почки свиньи. В другом аспекте настоящее изобретение относится к применению этих клеточных линий в культивировании вакцинного штамма CSFV.
Настоящее изобретение также относится к вакцинной композиции, получаемой с использованием описываемого выше способа получения, содержащей вакцину против PRRSV и вакцину против CSFV.
Настоящее изобретение также относится к применению вакцинной композиции в производстве биологического продукта для профилактики или лечения репродуктивного и респираторного синдрома свиней и классической чумы свиней.
Комбинированная вакцина, представленная в настоящем описании, демонстрирует значительную эффективность в профилактике высокопатогенного репродуктивного и респираторного синдрома свиней и классической чумы свиней. Высокопатогенные штаммы PRRSV и вакцинные штаммы CSFV, представленные в настоящем описании, не демонстрируют какой-либо иммуносупрессии, и получаемые, таким образом, комбинированные вакцины не демонстрируют отличий от каждой из соответствующих моновалентных вакцин относительно безопасности, иммуногенности, длительности сохранения иммунитета, иммунологической защиты и стабильности. Результаты исследования безопасности показали, что животные, которым вводили однократную дозу, повторные дозы, избыточную дозу вакцины, демонстрировали нормальную температуру тела и нормальное поведение без каких-либо клинических симптомов. Результаты исследования эффективности показали, что вакцина, представленная в настоящем описании, может обеспечивать значительную защиту животных от заражения вирулентными штаммами высокопатогенных PRRSV и CSFV и может эффективно предотвращать инфекцию высокопатогенными PRRSV и CSFV. Результаты исследования длительности сохранения иммунитета показали, что длительность сохранения иммунитета составляла 6 месяцев, что может обеспечивать эффективную защиту свиней в течение периода сохранения иммунитета. Результаты исследования стабильности показали, что вакцину можно хранить при 2-8°C в течение 18 месяцев, что свидетельствует о ее преимуществе при длительном сроке хранения и стабильности при хранении. Вакцины, представленные в настоящем описании, можно использовать для инокуляции животных и профилактики двух заболеваний посредством одной инъекции, что, таким образом, снижает трудоемкость вакцинации и частоту иммунизации, минимизируя нагрузку на свиноводство и предотвращая иммунологическую толерантность и неудачи при частых вакцинациях.
Настоящее изобретение также относится к способу иммунизации свиней, включающему введение свинье вакцинной композиции, представленной в настоящем описании. Свиней можно иммунизировать, например, посредством инъекции. Иммунизация может включать введение однократной дозы или повторное введение множества доз. Опытный ветеринар может корректировать способы иммунизации или дозирования в зависимости от конкретной ситуации.
ПРИМЕРЫ
Следующие примеры предназначены для дополнительного иллюстрирования настоящего изобретения. Преимущества и признаки настоящего изобретения будут понятны из описания. Однако эти примеры предназначены исключительно для иллюстративных целей, а не для ограничения объема настоящего изобретения.
Общие сведения
Инокуляцию вакцин осуществляли посредством инъекции в шейные мышцы свиней. Заражение вирусом осуществляли посредством закапывания вирус-содержащего материала в нос тестируемых свиней и/или посредством инъекции вирус-содержащего материала в мышцы тестируемых свиней. FA-TCID50 количества вируса CSFV измеряли с помощью иммунофлуоресцентного способа.
FACS-анализ T-клеток. T-клетки измеряли способом проточной цитометрии. В кратком изложении, образцы крови обрабатывали антикоагулянтом, затем лизируя эритроциты. Обработанные образцы окрашивали с использованием моноклонального антитела(mAb) FITC-CD8, mAb PE-CD4, mAb PECy5-CD3, соответственно (все антитела приобретали в 51AB Biotech, Beijing). После 45-минутной инкубации непрореагировавшие антитела удаляли, клетки суспендировали в PBS и анализировали с использованием проточного цитометра (BD FACS Aria).
Анализ ELISA. Антитела против антигенов PRRSV, антитела против антигенов CSFV измеряли с помощью ELISA с использованием соответствующих наборов для определения, приобретенных в Beijing IDEXX Yuanheng Laboratories Co., Ltd.
Часть I: Получение вакцин
Пример 1: Получение вакцин против PRRSV
Пассирование и культивирование клеток
Клетки Marc-145, используемые для культивирования вакцинного штамма TJM PRRSV, трипсинизировали и разводили 1:3. Клетки культивировали при 37°C в среде для культивирования. После образования клетками монослоя, их пассировали или инокулировали штаммом вируса.
Выращивание посевных вирусов в клетках
Вакцинным штаммом TJM высоковирулентного PRRSV инокулировали клетки Marc-145 при MOI 0,01-0,5. Инокулированные клетки культивировали в течение 3-5 дней и собирали вирус-содержащий раствор, когда цитопатические эффекты (CPE) достигали 70%. Собранный вирус-содержащий раствор использовали в качестве посевного вируса штамма TJM PRRSV.
Посевной вирус охарактеризовывали согласно Ветеринарной Фармакопее КНР. В растворе, содержащем посевной вирус, отсутствовали бактерии, плесень или микоплазма. Растворы, содержащие посевной вирус PRRSV, не оказывали неблагоприятных воздействий на свиней. Раствор, содержащий посевной вирус штамма TJM PRRSV, содержал не менее 107,0 TCID50 вируса на 1 мл.
Получение вирус-содержащего раствора для получения вакцины
Клетки Marc-145 культивировали до достижения 90-100% конфлюэнтного монослоя. Удаляли среду для культивирования клеток и дважды промывали клетки PBS. Раствор, содержащий посевной вирус штамма TJM PRRSV, инокулировали при MOI 0,01-0,5. Инокулированные клетки культивировали в течение 3-5 дней и собирали вирус-содержащий раствор при достижении CPE 70%. Собранный вирус-содержащий раствор использовали в качестве вирус-содержащего раствора для получения вакцины. Охарактеризовывали такой вирус-содержащий раствор, в нем отсутствовали бактерии, плесень или микоплазма, и вирус-содержащий раствор штамма TJM PRRSV содержал не менее 107,0 TCID50 вируса на 1 мл. Вирус-содержащий раствор разводили соответствующим образом для получения отдельной вакцины PRRSV, или смешивали с другими вакцинами для получения комбинированных вакцин.
Пример 2: Получение вакцин CSFV
Пассирование и культивирование клеток
Клетки BT, используемые для культивирования вакцинного штамма CSFV, трипсинизировали и разводили 1:5. Клетки культивировали при 37°C в среде для культивирования. После образования клетками монослоя, их пассировали или инокулировали штаммом вируса.
Штамм C (F16) CSFV получали в 0,3% вирус-содержащем растворе и инокулировали в монослой клеток BT. Инокулированные клетки культивировали в течение 5 дней и собирали вирус-содержащий раствор в качестве посевного вируса вакцинного штамма CSFV.
Характеристика посевных вирусов
Посевные вирусы охарактеризовывали согласно ветеринарной фармакопее КНР. В растворах, содержащих посевной вирус, бактерии, плесень или микоплазма. Штамм C (F16) CSFV тестировали как подходящий раствор, содержащий посевной вирус, и он не оказывал неблагоприятных воздействий на свиней. Раствор, содержащий посевной вирус штамма C (F16) CSFV, содержал >100000 инфицирующих доз для кролика (RID) или не менее 106,0 FA-TCID50 вируса на 1 мл вирус-содержащего раствора, как измеряли с помощью иммунофлуоресцентного способа.
Получение вирус-содержащего раствора для получения вакцины
Клетки BT культивировали до достижения 90-100% конфлюэнтного монослоя. Удаляли среду для культивирования клеток и дважды промывали клетки PBS. Раствор, содержащий посевной вирус штамма C (F16) CSFV, инокулировали при MOI 0,1-0,5 или в количестве 3%-5%. На 5-й день после инокуляции осуществляли первый сбор при смене среды и последующие сборы осуществляли через 4-дневные интервалы при условии, что осуществляли не более 5 сборов. После сбора вирус-содержащие растворы хранили при -20°C и использовали в качестве вирус-содержащего раствора для получения вакцины. Такой вирус-содержащий раствор охарактеризовывали, и раствор, содержащий посевной вирус штамма C (F16) CSFV, содержал >100000 RID или не менее 106,0 FA-TCID50 вируса на 1 мл вирус-содержащего раствора, как измеряли иммунофлуоресцентным способом. Вирус-содержащий раствор разводили соответствующим образом для получения отдельной вакцины CSFV или смешивали с другими вакцинами для получения комбинированных вакцин.
Пример 3: Получение вакцин PRV
Пассирование и культивирование клеток
Клетки Marc-145, клетки MDBK и клетки BT, используемые для культивирования вакцинного штамма Bartha K61 PRV, трипсинизировали и пассировали, соответственно, в среду для выращивания клеток. Клетки культивировали при 37°C в среде для культивирования. После образования клетками монослоя, их пассировали или инокулировали, соответственно, штаммом вируса.
Выращивание посевного вируса в клетках
Вакцинным штаммом Bartha K61 PRV инокулировали монослой клеток Marc-145, клеток MDBK или клеток BT в среде MEM, содержащей 2-4% бычью сыворотку. Инокулированные клетки культивировали, соответственно, в течение 2-3 дней, и собирали вирус-содержащие растворы в качестве посевного вируса вакцинного штамма PRV.
Характеристика посевных вирусов
Охарактеризовывали посевные вирусы. Посевные вирусы PRV тестировали в качестве подходящих посевных вирусов, и они не оказывали неблагоприятных воздействий на свиней. Раствор, содержащий посевной вирус штамма PRV, содержал не менее 108,0 TCID50 вируса на 1 мл.
Получение вирус-содержащего раствора вакцинного штамма PRV
Штаммом PRV инокулировали конфлюэнтный монослой клеток Marc-145, клеток MDBK или клеток BT при MOI 0,005-0,5 с добавлением поддерживающей среды. Инокулированный клетки культивировали при 36-37°C и собирали вирус-содержащий раствор при достижении CPE 70%.
Количество вирус-содержащего раствора измеряли после 2 циклов замораживания-оттаивания. Раствор, содержащий посевной вирус, содержал не менее 108,0 TCID50 вирус на 1 мл. Вирус-содержащий раствор охарактеризовывали согласно Ветеринарной фармакопее КНР, и в нем отсутствовали бактерии, плесень или микоплазма. Подходящие вирус-содержащие растворы хранили при -15°C и использовали в качестве вирус-содержащего раствора для получения вакцин. Вирус-содержащий раствор соответствующим образом разводили для получения отдельной вакцины PRV или смешивали с другими вакцинами для получения комбинированных вакцин.
Пример 4. Получение комбинированной вакцинной композиции против PRRSV и CSFV
Антигенный раствор получали комбинированием вирус-содержащего раствора штамма TJM PRRSV (полученного по примеру 1) и вирус-содержащего раствора штамма C (F16) CSFV (полученного по примеру 2).
Термостабильный криопротектор получали смешиванием сахарозы, L-глутамата натрия и гидролизата лактальбумина при подходящем соотношении, затем автоклавировали.
75-80 объемных долей антигенного раствора смешивали с 25-20 объемными долями криопротектора и смесью наполняли ампулы в заранее определенном количестве. Ампулы запаивали и подвергали лиофилизации для получения лиофилизированной вакцинной композиции. Вакцинную композицию тестировали на стерильность, безопасность и эффективность.
В каждой дозе получаемой комбинированной вакцины против PRRSV и CSFV количество штамма TJM PRRSV составляло >105,0 TCID50, и количество штамма C (F16) CSFV составляло >7500 RID (или >750 RID или >150 RID), или не менее 104,0 FA-TCID50 вируса, как измеряли иммунофлуоресцентным способом.
Комбинированную вакцину охарактеризовывали согласно стр. 15, 19 и 20 приложения к Ветеринарной фармакопее КНР. В комбинированной вакцине отсутствовали бактерии, плесень, микоплазма и экзогенные вирусы.
Пример 5. Получение комбинированной вакцинной композиции против PRRSV и PRV
Антигенный раствор получали комбинированием вирус-содержащего раствора штамма TJM PRRSV (полученного по примеру 1) и вирус-содержащего раствора штамма Bartha K61 PRV (полученного по примеру 3).
Термостабильный криопротектор получали смешиванием сахарозы, L-глутамата натрия и гидролизата лактальбумина при подходящем соотношении, затем автоклавировали.
6-8 объемных долей антигенного раствора смешивали с 2-4 объемными долями криопротектора и смесью наполняли ампулы в заранее определенном количестве. Ампулы запаивали и подвергали лиофилизации для получения лиофилизированной вакцинной композиции.
В каждой дозе получаемой комбинированной вакцины против PRRSV и PRV количество штамма TJM PRRSV составляло >105,0 TCID50, и количество штамма Bartha K61 PRV составляло >105,5 TCID50.
Комбинированную вакцину охарактеризовывали согласно стр. 15, 19 и 20 приложения к Ветеринарной фармакопее КНР. В комбинированной вакцине отсутствовали бактерии, плесень, микоплазма и экзогенные вирусы.
Пример 6. Получение комбинированной вакцинной композиции против PRRSV, CSFV и PRV
Антигенный раствор получали комбинированием вирус-содержащего раствора штамма TJM PRRSV (полученного по примеру 1), вирус-содержащего раствора штамма C (F16) CSFV (полученного по примеру 2) и вирус-содержащего раствора штамма Bartha K61 PRV (полученного по примеру 3).
Термостабильный криопротектор получали смешиванием сахарозы, L-глутамата натрия и гидролизата лактальбумина при подходящем соотношении, затем автоклавировали.
75-80 объемных долей антигенного раствора смешивали с 25-20 объемными долями криопротектора и наполняли смесью ампулы в заранее определенном количестве. Ампулы подвергали лиофилизации для получения вакцинной композиции. Вакцинную композицию тестировали на стерильность, безопасность и эффективность.
В каждой дозе полученной комбинированной вакцины против PRRSV, CSFV и PRV количество вируса штамма TJM PRRSV составляло >105,0 TCID50, количество вируса штамма C CSFV составляло >7500 RID (или >750 RID, >150 RID) или не менее 104,0 FA-TCID50 вируса, как измеряют с помощью иммунофлуоресцентного способа, и количество вируса штамма Bartha K61 PRV составляло >105,5 TCID50.
Комбинированную вакцину охарактеризовывали согласно стр. 15, 19 и 20 приложения к Ветеринарной фармакопее КНР. В комбинированной вакцине отсутствовали бактерии, плесень, микоплазма и экзогенные вирусы.
Пример 7. Генетическая характеристика штамма TJM PRRSV
Штамм TJM PRRSV, содержащийся в вирус-содержащем растворе, полученном по примеру 1, и в комбинированных вакцинах, полученных по примерам 4-6, охарактеризовывали с помощью ПЦР с использованием праймеров, специфичных для Nsp2 PRRSV (прямой праймер: 5'-GGCAAGAAGTTGAGGAAGT-3'; обратный праймер: 5'-TGGCAGGTTGGTCACAGA-3'). Штамм TJ PRRSV являлся положительным контролем, а вода являлась отрицательным контролем.
Результаты свидетельствовали о наличии специфической полосы, соответствующей 207 п.н., в образцах, содержащих штамм TJM PRRSV, по сравнению с полосой, соответствующей 567 п.н., в положительном контроле, содержащем штамм TJ PRRSV (фигура 5). Результаты подтверждали, что в штамме TJM PRRSV отсутствуют 360 нуклеотидов в гене Nsp2, и дополнительно подтверждали, что получаемые вакцины не контаминированы штаммом TJ PRRSV.
Пример 8. Генетическая характеристика штамма Bartha K61 PRV
Штамм Bartha K61 PRV, содержащийся в вирус-содержащем растворе, полученном по примеру 3, и в комбинированных вакцинных композициях, полученных по примерам 5-6, охарактеризовывали с помощью ПЦР с использованием праймеров, специфичных для gE PRV (прямой праймер: 5'-CGTCACGGTCACCAAGGAGC-3'; обратный праймер: 5'-GCACAGCACGCAGAGCCAG-3'). Вирулентный штамм PRV (штамм JL1) являлся положительным контролем, а вода являлась отрицательным контролем.
Согласно результатам, в образцах, содержащих штамм Bartha K61 PRV, не обнаруживали полос по сравнению с полосой, соответствующей 232 п.н., в вирулентном штамме PRV (фигура 6).
Результаты подтверждали, что штамм Bartha K61 PRV содержит делецию в гене gE, и дополнительно подтверждали, что получаемые вакцины не контаминированы вирулентным штаммом PRV.
Часть II: Исследования эффективности
Пример 9: Определение минимальной иммунологически эффективной дозы для штамма TJM PRRSV
В этом исследовании использовали 25 здоровых поросят-отъемышей. Свиньи являлись негативными по антигенам высокопатогенного PRRSV и по антителам против них. Свиней случайным образом разделяли на 5 групп. Группы I-VI инокулировали различными дозами штамма TJM PRRSV, в то время как группа V служила отрицательным контролем (таблица 1). Свиней заражали вирулентным штаммом TJ PRRSV и после исследования вычисляли степени защищенности. Согласно таблице 1, количество штамма TJM PRRSV 104,5 TCID50 или более являлось достаточным для индуцирования протективного иммунитета у свиней со степенью защищенности 4/5.
|
Пример 10: Определение минимальной иммунологически эффективной дозы штамма C (F16) CSFV
В исследовании использовали 28 здоровых поросят-отъемышей. Свиньи являлись негативными по антигенам CSFV и по антителам против них. Свиней случайным образом разделяли на 6 групп. Группы I-V инокулировали различными дозами штамма C (F16) CSFV, в то время как группа VI служила отрицательным контролем (таблица 2). Свиней заражали вирулентным штаммом Shimen CSFV и после исследования вычисляли степени защищенности. Согласно таблице 2, количество штамма C (F16) CSFV 100,5 TCID50 или более являлось достаточным для индуцирования протективного иммунитета у свиней со степенью защищенности 5/5.
|
Пример 11: Определение минимальной иммунологически эффективной дозы комбинированной вакцины на основе штамма TJM PRRSV и штамма C (F16) CSFV
В исследовании использовали 40 здоровых поросят. Свиньи являлись негативными по антигенам высокопатогенного PRRSV и CSFV относительно и по антителам против них. Свиней случайным образом разделяли на 4 группы. Группы I-III инокулировали различными дозами комбинированных вакцин на основе штамма TJM PRRSV и штамма C (F16) CSFV, в то время как группа IV служила отрицательным контролем. Половину свиней в каждой группе заражали штаммом TJ PRRSV, а другую половину заражали штаммом Shimen CSFV. После исследования вычисляли степени защищенности.
Согласно таблице 3, комбинированная вакцина, содержащая 104,5 TCID50 штамма TJM PRRSV и 103,5 FA-TCID50 штамма C (F16) CSFV, являлась достаточной для индуцирования протективного иммунитета у свиней (таблицы 3 и 4). В частности, штамм C (F16) CSFV демонстрировал 100% защиту при всех дозах при тестировании в комбинированной вакцине, свидетельствуя о том, что иммунный ответ на штамм C (F16) CSFV не подавлялся штаммом TJM PRRSV. Кроме того, учитывая крайне низкую иммунологически эффективную дозу штамма C (F16) CSFV, как показано в примере 10, в комбинированной вакцине можно использовать более низкие дозы штамма C (F16) CSFV без снижения степени защищенности.
|
|
Пример 12: В комбинированной вакцине на основе штамма TJM PRRSV и штамма C (F16) CSFV не наблюдали иммуноингибирования
В исследовании использовали 30 здоровых свиней возрастом 21-28 дней. Свиньи являлись негативными по антигенам высокопатогенного PRRSV и CSFV и по антителам против них. Свиней случайным образом разделяли на 7 групп по 5 свиней в каждой из групп I-V, 3 свиньи в группе VI и 2 свиньи в группе VII (таблица 5). Каждую свинью инокулировали 1 мл тестируемого образца или не инокулировали (группа VII) согласно дизайну исследования, представленному в таблице 5.
|
Измеряли ректальные температуры свиней каждый день с 3-го дня до вакцинации до 14-го дня после вакцинации. Массы тела измеряли каждые 7 дней. Также свиньи находились под тщательным клиническим наблюдением. Забирали образцы крови от каждой свиньи в исследовании за 3 дня до вакцинации, в 0 день, 3-ий день, 7-ой день, 10-ый день, 14-ый день, 21-ый день и 28-ой день после вакцинации, соответственно. Каждый образец крови разделяли на две части. Одну обрабатывали антикоагулянтом и использовали для определения CD3+, CD4+, CD8+ и CD4+CD8+ T-клеток. Другую обрабатывали коагулянтом и использовали для анализа титра антител.
Результаты показали, что изменения CD3+, CD4+, CD8+ и CD4+CD8+ T-клеток у вакцинированных свиней являлись аналогичными наблюдаемым у свиней контрольной группы (фигуры 7-10). После вакцинации комбинированными вакцинами у свиней в группах III и IV продуцировались антитела против обоих вирусов, и продукция таких антител не мешала друг другу (фигуры 11-12). Кинетика продукции антител против PRRSV у свиней в группах III и IV являлась аналогичной кинетике у свиней в группе I, и кинетика продукции антител CSFV у свиней в группах III и IV являлась аналогичной кинетике у свиней в группе II. Результаты показали, что, вакцинация штаммом TJM PRRSV не ингибирует иммунный ответ против штамма C (F16) CSFV и наоборот.
Ректальные температуры и массы тела свиней в каждой группе не демонстрировали значимых различий (фигура 13).
На 28-ой день после вакцинации свиней заражали вирулентными штаммами согласно дизайну исследования, представленному в таблице 6. После заражения вирусом ректальные температуры свиней измеряли каждый день и исследовали свиней на наличие клинических проявлений, включая аппетит, дыхание и поведение. Забирали образцы крови от каждой свиньи в 0 день, 3-ий день, 7-ой день, 10-ый день и 14-ый день, соответственно, после заражения вирусом и обрабатывали антикоагулянтом для определения CD3+, CD4+, CD8+ и CD4+CD8+ T-клеток. Образцы крови также забирали в день заражения вирусом и в каждый следующий день после заражения для выделения вируса PRRSV и вируса CSFV и определения наличия виремии. Через 14 дней после исследования заражения вирусом для каждой группы животных вычисляли клинические степени защищенности, заболеваемость (т.е. количество больных свиней/количество тестируемых свиней) и смертность (т.е. количество погибших свиней/количество тестируемых свиней), результаты представлены в таблице 6.
|
Результаты показали, что после заражения вирусом температуры тела повышались у невакцинированных свиней из группы V и VI, но не у вакцинированных свиней из групп I-IV (фигуры 14-15). Свиньи в группе V проявляли клинические симптомы высокопатогенного PRRS, такие как вялость, одышка, покраснение кожи и т.д. Свиньи в группе VI проявляли значительные симптомы классической чумы свиней, включая вялость, запор с последующей диареей, покраснение кожи и т.д. Свиньи в вакцинированных группах не проявляли таких клинических симптомов (фигуры 16-17).
После заражения вирусом, невакцинированные свиньи из групп V и VI демонстрировали значительное снижение CD3+, CD4+, CD8+ и CD4+CD8+ T-клеток и начинали умирать с 7-го дня после заражения вирусом. С другой стороны, свиньи, вакцинированные комбинированными вакцинами или отдельными вакцинами, не демонстрировали значительного снижения T-клеток, и профили T-клеток являлись сравнимыми со здоровыми свиньями в контрольной группе. Это свидетельствует о том, что вакцины являлись эффективными в индуцировании клеточных иммунных ответов. Кроме того, свиньи, вакцинированные комбинированными вакцинами, и свиньи, вакцинированные отдельными вакцинами, демонстрировали схожие изменения CD3+, CD4+, CD8+ и CD4+CD8+ T-клеток, что свидетельствует о том, что комбинированные вакцины не оказывали иммуноингибирования в отношении друг друга (фигуры 18-25).
После заражения высоковирулентным PRRSV у невакцинированных свиней группы V со 2 дня началось развитие виремии, длившейся до 11 дней. Однако, у свиней, вакцинированных комбинированными вакцинами или отдельной вакциной против PRRSV, до 4 дня не развивалась виремия, которая затем длилась до 5 дней. Это свидетельствует о том, что комбинированные вакцины и отдельная вакцина обеспечивали эффективную защиту против инфекции высокопатогенным PRRSV, и комбинированные вакцины не оказывали иммуноингибирования в отношении друг друга.
После заражения вирулентным CSFV у всех свиней в группе VI развивалась виремия, но у вакцинированных свиней виремия не развивалась. Это свидетельствует о том, что комбинированные вакцины и отдельная вакцина обеспечивали эффективную защиту против инфекции вирулентным CSFV, и комбинированные вакцины не оказывали иммуноингибирования в отношении друг друга.
Пример 13: Исследование эффективности двойной комбинированной вакцины против PRRSV и CSFV
Исследование эффективности осуществляли с использованием трех партий лабораторной двойной комбинированной вакцины против PRRSV и CSFV (партии №№ 200904, 200905 и 200906), полученной по примеру 4.
В исследовании использовали 28 здоровых свиней, негативных по антигенам высоковирулентного PRRSV и CSFV и по антителам против них, для каждой партии образца двойной комбинированной вакцины. Свиней случайным образом разделяли на 6 групп по 5 свиней в каждой из групп I-IV и группе VI и 3 свиньи в группе V. Каждую группу свиней инокулировали соответствующим тестируемым образцом и на 28-ой день после вакцинации свиней заражали вирулентным штаммом вируса согласно дизайну исследования, представленному в таблице 7.
|
Исследование заражения вирусом CSFV заканчивали на 16-ый день после заражения, а исследование заражения вирусом PRRSV заканчивали на 21-ый день после заражения. Вычисляли степени защищенности, результаты представлены в таблице 7. Все три партии двойных комбинированных вакцин против PRRSV и CSFV демонстрировали хорошую защиту против заражения высоковирулентным PRRSV или CSFV. Защита при использовании двойной комбинированной вакцины не отличалась значимо от отдельной контрольной вакцины. Все невакцинированные свиньи проявляли выраженные клинические симптомы инфекции.
Пример 14: Исследование длительности сохранения иммунитета при использовании двойной комбинированной вакцины против PRRSV и CSFV
Исследование длительности сохранения иммунитета осуществляли с использованием двойной комбинированной вакцины против PRRSV и CSFV (полученной по примеру 4). Отдельную вакцину против PRRSV (полученную по примеру 1) и отдельную вакцину против CSFV (полученную по примеру 2) использовали в качестве контролей.
В исследовании длительности сохранения иммунитета использовали 56 здоровых свиней. Все свиньи являлись негативными по антигенам PRRSV и CSFV и по антителам против них. Свиней случайным образом разделяли на 6 групп и инокулировали соответствующими тестируемыми образцами, как представлено в таблице 8. Собирали образцы крови для определения титров антител в 1-ый, 2-ой, 3-ий, 4-ый, 5-ый или 6-ой месяцы после вакцинации.
На 3-ий и 6-ой месяц после вакцинации, соответственно, брали половину животных из каждой исследуемой группы. Этих животных заражали соответствующим вирулентным штаммом вируса, как представлено в таблице 8.
Результаты показали (см. таблица 8), что двойные комбинированные вакцины обеспечивали эффективную защиту свиней против заражения вирусом через 6 месяцев после вакцинации и, таким образом, поддерживали 6-месячный период сохранения иммунитета. Обнаруживали, что длительность сохранения иммунитета для двойной комбинированной вакцины являлась сравнимой с таковой для отдельных вакцин.
|
Пример 15: Комбинированная вакцина на основе штамма TJM PRRSV и штамма Bartha K61 PRV не оказывает иммуноингибирование
В исследовании использовали двойную комбинированную вакцину на основе TJM PRRSV и Bartha K61 PRV (полученную по примеру 5). Свиней возрастом 4-5 недель случайным образом разделяли на 4 группы по 4 свиньи в каждой группе. Все свиньи являлись негативными по антигенам PRRSV и PRV и по антителам против них.
Свиней инокулировали соответствующим тестируемым образцом согласно дизайну исследования, представленному в таблице 9. Вторую вакцинацию осуществляли через одну неделю после первой вакцинации.
|
После вакцинации каждую неделю до 28-ого дня после вакцинации собирали образцы крови свиней. Обрабатывали образцы крови и определяли титры антител против PRV.
Результаты показали (фигура 26), что в группах I-III титр антител против PRV значимо не отличался. Это позволяет предполагать, что штамм TJM PRRSV не оказывает иммуноингибирования вакцины против PRV. Штамм TJM PRRSV не влиял на титр антител против PRV при введении раздельно или в виде комбинированной вакцины с PRV. Двойная комбинированная вакцина против PRRSV и PRV имела эффективность, сравнимую с таковой для отдельной вакцины против PRV.
Пример 16: Исследование эффективности комбинированной вакцины против PRRSV и PRV
Исследование эффективности осуществляли с использованием трех партий двойных комбинированных вакцин против PRRSV и PRV, полученных по примеру 5.
Свиней возрастом 4-5 недель случайным образом разделяли на 4 группы, по 10 свиней в каждой группе. Свиньям в группах I-III делали инъекции одной дозы соответствующей партии двойной комбинированной вакцины. Каждая доза вакцины содержала 105,0 TCID50/мл штамма TJM PRRSV и 105,5 TCID50/мл штамма Bartha K61 PRV. Группа IV являлась контрольной группой, и свиньям в этой группе делали инъекции 1 мл среды MEM.
После вакцинации исследовали свиней на наличие клинических проявлений и неблагоприятные воздействия. Каждую неделю собирали образцы крови свиней и выделяли сыворотку для определения титров антител. Каждую неделю измеряли массу тела свиней.
Через 4 недели после вакцинации 5 свиней в каждой группе заражали штаммом TJ PRRSV при дозе 2×104,0-2×104,5 TCID50, а других 5 свиней заражали вирулентным штаммом PRV (штаммом JL1) при дозе 103,0-103,5 TCID50. После заражения вирусом свиней исследовали на наличие клинических проявлений, включая аппетит и поведение. Каждый день измеряли ректальные температуры свиней. Собирали образцы крови и назальные мазки для определения вируса.
Результаты показали, что вакцинированные свиньи в группах I-III после вакцинации демонстрировали нормальную температуру, нормальное поведение и хороший аппетит. После заражения вирусом вакцинированные свиньи были защищены со степенью защиты более 4/5, в то время как у всех невакцинированных свиней в контрольной группе развивалась инфекция, и степень смертности составляла 2/5 для заражения вирулентным PRRSV и 3/5 для заражения вирулентным PRV. Результаты позволяют предполагать, что двойная комбинированная вакцина против PRRSV и PRV обладает хорошей эффективностью против заражения обоими вирусами и является эффективной в профилактике инфекции PRRSV и PRV.
Пример 17: Комбинированная вакцина на основе штамма TJM PRRSV, штамма C CSFV и штамма Bartha K61 PRV не оказывают иммуноингибирования
В исследовании использовали 46 здоровых свиней возрастом 21-28 дней. Свиньи являлись негативными по антигенам высоковирулентного PRRSV, CSFV и PRV и по антителам против них. Свиней случайным образом разделяли на 10 групп по 5 свиней в каждой из групп I-VII и группе IX и 3 свиньи в каждой из групп VIII и X. Свиней инокулировали 1 мл тестируемого образца, как указано, или не инокулировали (группа X), согласно дизайну исследования, представленному в таблице 10.
|
Каждый день измеряли ректальные температуры свиней с 3-го дня перед вакцинацией до 7-го дня после вакцинации. Также свиньи находились под тщательным клиническим наблюдением. От каждой исследуемой свиньи забирали образцы крови на 3-ий день перед вакцинацией, 0 день, 3-ий день, 7-ой день, 10-ый день, 14-ый день, 21-ый день, 28-ой день, 31-ый день, 35-ый день, 38-ой день и 42-ой день после вакцинации, соответственно. Каждый образец крови разделяли на две части. Одну обрабатывали антикоагулянтом и использовали для определения CD3+, CD4+ и CD8+ T-клеток. Другую обрабатывали коагулянтом и использовали для анализа титра антител.
На 28-ой день после вакцинации свиней заражали вирулентными штаммами согласно дизайну исследования, представленному в таблице 11. После заражения вирусом каждый день измеряли ректальные температуры свиней и исследовали свиней на наличие клинических проявлений, включая аппетит, дыхание и поведение. Исследование заражения PRRSV заканчивали на 21-ый день после заражения вирусом, и исследование заражения CSFV заканчивали на 16-ый день после заражения вирусом. Для каждой группы после исследования заражения вирусом вычисляли клинические степени защищенности, заболеваемость (т.е. количество больных свиней/количество тестируемых свиней) и смертность (т.е. количество погибших свиней/количество тестируемых свиней), результаты представлены в таблице 11.
|
Результаты показали, что штамм TJM PRRSV при комбинировании со штаммом C CSFV и штаммом Bartha K61 PRV обеспечивал эффективную защиту против заражения всеми тремя вирулентными штаммами. Комбинированные вакцины демонстрировали эффективность, сравнимую с таковой для каждой отдельной вакцины, позволяя предполагать, что комбинированные вакцины не оказывали иммуноингибирования в отношении друг друга.
Пример 18: Исследование эффективности комбинированной вакцины на основе штамма TJM PRRSV, штамма C CSFV и штамма Bartha K61 PRV
Исследование эффективности осуществляли с использованием трех партий лабораторной тройной комбинированной вакцины (партии №№ 031-01, 031-02, и 031-03), полученной по примеру 6.
В исследовании использовали 43 здоровые свиньи, негативные по антигенам высоковирулентного PRRSV, CSFV и PRV и по антителам против них. Свиней случайным образом разделяли на 9 групп по 5 свиней в каждой из групп I-VI, группе VIII и группе IX и 3 свиньи в группе VII. Каждую группу свиней инокулировали соответствующим тестируемым образцом и на 28-ой день после вакцинации свиней заражали соответствующим вирулентным штаммом вируса согласно дизайну исследования, представленному в таблице 12. Исследование заражения PRRSV заканчивали на 21-ый день после заражения вирусом, исследование заражения CSFV заканчивали на 16-ый день после заражения вирусом, и исследование заражения PRV заканчивали на 14-ый день после заражения вирусом. После исследования заражения вирусом для каждой группы животных вычисляли клиническую степень защиты, заболеваемость и смертность, результаты представлены в таблице 12.
|
Все три партии тройных комбинированных вакцин PRRSV, CSFV и PRV демонстрировали хорошую защиту против заражения высоковирулентным PRRSV, CSFV или PRV, в то время как все отрицательные контроли демонстрировали выраженные клинические симптомы инфекции. Защита при использовании тройной комбинированной вакцины не демонстрировала значимых отличий от контрольных отдельных вакцин.
Пример 19: Исследование длительности сохранения иммунитета для комбинированной вакцины на основе штамма TJM PRRSV, штамма C CSFV и штамма Bartha K61 PRV
Исследование длительности сохранения иммунитета осуществляли с использованием трех партий лабораторной тройной комбинированной вакцины (партии №№ 031-01, 031-02, и 031-03), полученной по примеру 6.
В исследовании длительности сохранения иммунитета использовали 86 здоровых свиней. Свиньи являлись негативными по антигенам высоковирулентного PRRSV, CSFV и PRV и по антителам против них. Свиней случайным образом разделяли на 9 групп по 6 свиней в группе VII, и 10 свиней в каждой из оставшихся групп. Свиньям проводили или не проводили вакцинацию согласно дизайну исследования, представленному в таблице 13. Образцы крови собирали для определения титров антител в 1-ый, 2-ой, 3-ий, 4-ый, 5-ый или 6-ой месяц после вакцинации.
На 3 и 6 месяцы после вакцинации, соответственно, брали половину животных из каждой исследуемой группы и заражали соответствующим вирулентным штаммом вируса, как представлено в таблице 13.
|
Результаты показали (см. таблицу 13), что тройные комбинированные вакцины обеспечивали эффективную защиту свиней против заражения вирусом через 6 месяцев после вакцинации, и, таким образом, поддерживали 6-месячный период сохранения иммунитета. Обнаруживали, что длительность сохранения иммунитета при использовании тройных комбинированных вакцин являлась сравнимой с каждой из отдельных вакцин.
Часть III: Исследования безопасности
Пример 20: Исследование безопасности комбинированной вакцины против PRRSV и CSFV
Исследование безопасности осуществляли с использованием трех партий лабораторной двойной комбинированной вакцины против PRRSV и CSFV (партии №№ 200904, 200905 и 200906), полученной по примеру 4.
Исследование включало исследование безопасности однократной дозы, исследование безопасности повторной дозы, исследование безопасности избыточной дозы на свиньях целевого возраста, исследование безопасности избыточной дозы на поросятах и исследование безопасности избыточной дозы на свиньях различных пород.
Результаты показали, что после вакцинации, свиньи в каждой исследуемой группе демонстрировали нормальную температуру, нормальное поведение и хороший аппетит. Не наблюдали системных или местных неблагоприятных воздействий. Показали, что введение избыточной дозы комбинированных вакцин является безопасным для поросят, а также свиней различных пород.
Пример 21: Исследование безопасности комбинированной вакцины против PRRSV и PRV
Исследование безопасности осуществляли с использованием трех партий двойной комбинированной вакцины против PRRSV и PRV, полученной по примеру 5.
Свиней возрастом 4-5 недели, негативных по антигенам PRRSV и PRV и по антителам против них, случайным образом разделяли на 3 группы по 15 свиней в каждой группе. Свиней в каждой группе инокулировали двойной комбинированной вакциной в однократной дозе (105,0-105,5 TCID50 вирус/мл), повторных дозах или 10-кратной избыточной дозе. 5 свиней использовали в качестве контрольной группы и не инокулировали.
Ректальные температуры свиней измеряли каждый день до 21-го дня после вакцинации. Также свиньи находились под тщательным клиническим наблюдением.
Результаты показали, что свиньи в каждой группе демонстрировали нормальную температуру и отсутствие патологических изменений после вакцинации. Двойная комбинированная вакцина являлась безопасной для свиней.
Пример 22: Исследование безопасности комбинированной вакцины против PRRSV, CSFV и PRV
Исследование безопасности осуществляли с использованием трех партий лабораторной тройной комбинированной вакцины против PRRSV, CSFV и PRV (партии №№ 031-01, 031-02 и 031-03), полученной по примеру 6. Исследование включало исследование безопасности однократной дозы, исследование безопасности повторной дозы, исследование безопасности избыточной дозы на свиньях целевого возраста, исследование безопасности избыточной дозы на поросятах и исследование безопасности избыточной дозы на свиньях различных пород.
Результаты показали, что после вакцинации свиньи в каждой исследуемой группе демонстрировали нормальную температуру, нормальное поведение и хороший аппетит. Не наблюдали системных или местных неблагоприятных воздействий. Показали, что введение избыточной дозы комбинированной вакцины является безопасным для поросят, а также свиней различных пород.
Часть IV: Исследования стабильности
Пример 23: Исследование стабильности двойной комбинированной вакцины против PRRSV и CSFV
Лабораторные комбинированные вакцины против PRRSV и CSFV (партии №№ 200904, 200905 и 200906) тестировали на стабильность и параллельно сравнивали с тремя партиями отдельной вакцины против PRRSV и отдельной вакцины против CSFV (партии №№ 200901, 200902, 200903, 200907, 200908 и 200909).
Три партии каждой из вакцинных композиций хранили при 2-8°C. Образцы собирали на 3, 6, 9, 12 и 18 месяц исследования, соответственно. Образцы тестировали на физико-химические свойства, степень вакуума в ампулах, остаточное содержание воды, активность и окисление при 37°C.
После 18-месячного хранения при 2-8°C три партии двойных комбинированных вакцинных композиций находились в белых рыхлых комках, быстро растворяющихся при добавлении буфера для разведения. При тестировании степени вакуума в ампулах вакцины демонстрировали белое или фиолетовое свечение. Среднее остаточное содержание воды в тестируемых вакцинах соответствует требованиям Ветеринарной фармакопеи КНР.
В вакцинных композициях определяли титры вируса, результаты представлены на фигурах 27-30. После хранения при 2-8°C в течение 18 месяцев титры вируса в двойной комбинированной вакцине не отличались значимо от каждой отдельной вакцины. После хранения при 37°C в течение 14 дней двойные комбинированные вакцины все еще имели высокий уровень титров вируса, не отличавшийся значимо от каждой из отдельных вакцин в параллельных исследованиях. Титры вируса в вакцинных композициях соответствуют требованиям для подходящих вакцин. Это показало, что термостабильный криопротектор при лиофилизации обеспечивал хорошую защиту для вакцинного штамма PRRSV и вакцинного штамма CSFV.
Как известно в этой области, общепринятые вакцины, как правило, хранят при 0°C (-20°C), что осложняет хранение вакцин. Результаты этого примера показали, что с использованием нового криопротектора вакцинные композиции можно транспортировать и хранить при более высокой температуре, таким образом, обеспечивая более высокую стабильность вакцин.
Пример 24: Исследование стабильности двойной комбинированной вакцины против PRRSV и PRV
Три партии лабораторных двойных комбинированных вакцин против PRRSV и PRV хранили при 2-8°C. Образцы собирали на 3-ий, 6-ой, 9-ый, 12-ый, 18-ый, 21-ый и 24-ый месяц исследования, соответственно. Образцы тестировали на физико-химические свойства, степень вакуума в ампулах, остаточное содержание воды, активность и окисление при 37°C.
После 24-месячного хранения при 2-8°C три партии вакцинных композиций находились в белых рыхлых комках, быстро растворяющихся при добавлении буфера для разведения. При тестировании степени вакуума в ампулах вакцины демонстрировали белое или фиолетовое свечение. Определяли титры вирусов в вакцинных композициях, результаты представлены на фигурах 31-34. Комбинированные вакцины являлись стабильными после хранения при 2-8°C в течение 24 месяцев, и титры вирусов не отличались значительно от таковых перед хранением.
Пример 25: Исследование стабильности тройной комбинированной вакцины против PRRSV, CSFV и PRV
Лабораторные тройные комбинированные вакцины против PRRSV, CSFV и PRV (партии №№ 031-01, 031-02 и 031-03) тестировали на стабильность и параллельно сравнивали с тремя партиями отдельной вакцины против PRRSV (партии №№ 031-04, 031-05, 031-06), отдельной вакцины против CSFV (партии №№ 031-07, 031-08, 031-09) и отдельной вакцины против PRV (партии №№ 031-10, 031-11 и 031-12).
Вакцинные композиции хранили при 2-8°C. Образцы собирали на 3-ий, 6-ой, 9-ый, 12-ый и 18-ый месяц исследования, соответственно. Образцы тестировали на физико-химические свойства, степень вакуума в ампулах, остаточное содержание воды, активность и окисление при 37°C.
После 18-месячного хранения при 2-8°C три партии вакцинных композиций находились в белых рыхлых комках, быстро растворяющихся при добавлении буфера для разведения. При тестировании степени вакуума в ампулах вакцины демонстрировали белое или фиолетовое свечение. Среднее остаточное содержание воды в тестируемых вакцинах соответствовало требованиям Ветеринарной фармакопеи КНР.
Определяли титры вирусов в вакцинных композициях, результаты представлены на фигурах 35-40. После хранения при 2-8°C в течение 18 месяцев титры вирусов в комбинированных вакцинах не отличались значительно от таковых в отдельных вакцинах. После хранения при 37°C в течение 14 дней комбинированные вакцины все еще демонстрировали высокий уровень титра вируса, не отличающийся значительно от такового в отдельных вакцинах в параллельных исследованиях. Это свидетельствует о том, что термостабильный криопротектор при лиофилизации обеспечивал хорошую защиту вакцинного штамма PRRSV, вакцинного штамма CSFV и вакцинного штамма PRV.