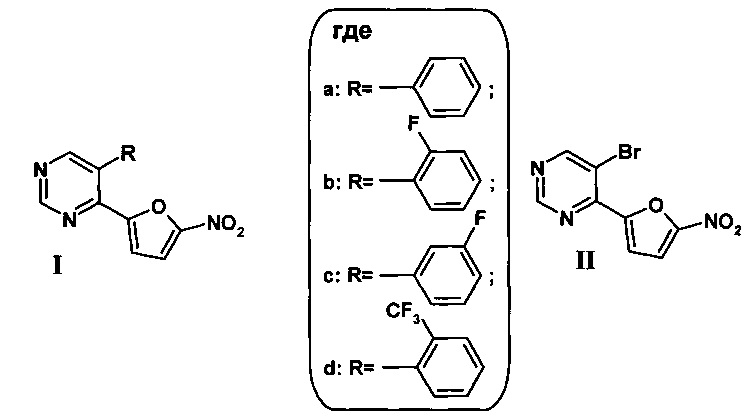
Результат интеллектуальной деятельности: 5-Арилзамещенный 4-(5-нитрофуран-2-ил)пиримидин, обладающий широким спектром антибактериальной активности, способ его получения и промежуточное соединение, обладающее широким спектром антибактериальной активности
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к 5-бром- и 5-арилзамещенным 4-(5-нитрофуран-2-ил)пиримидинам, которые обладают широким спектром антибактериальной активности в отношении кокковых инфекций. Указанные соединения могут быть использованы в качестве антибактериальных агентов, в первую очередь, для лечения больных с заболеваниями мочеполовой системы, вызванными золотистым стафилококком или гонококками. Уровень техники
В литературе описан способ получения наиболее близких по структуре 2,5,6-тризамещенных производных 4-(5-нитрофуран-2-ил)пиримидинов (4), основанный на конденсации гидрохлорида соответствующего 2-замещенного амидина (1) с 1,2-дизамещенным 3-(фуран-2-ил)-3-оксопропионовым альдегидом (2), с последующим нитрованием обращающегося 2,5,6-тризамещенного 4-(фуран-2-ил)пиримидина (3) дымящей азотной кислотой в смеси уксусного ангидрида и серной кислоты [Н. Berger, R. Gall, Н. Merdes, К. Stach, W. Voemel, W. Sauer. 4-(5-Nitrofuryl)pyrimidines. // Patent US 3704301 A, 1972].
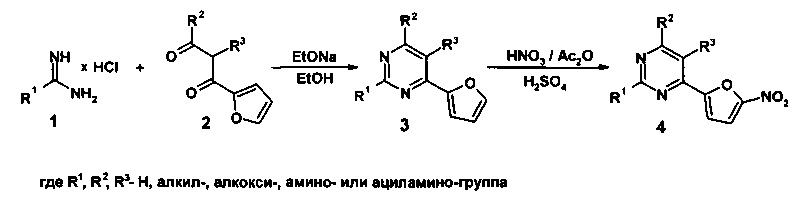
Недостатками данного способа являются: 1) малая доступность исходных 2-замещенных амидинов (1) и 1,2-дизамещенных 3-(фуран-2-ил)-3-оксопропионовых альдегидов (2), вследствие чего необходим их предварительный трудоемкий многостадийный синтез; 2) низкий общий выход промежуточных 2,5,6-тризамещенного 4-(фуран-2-ил)пиримидинов (3), составляющий в среднем 20-40%; 3) Необходимость проведения трудоемкой реакции нитрования, выход которой в среднем составляет 50-60%, каждый раз на стадии получения конечных 2,5,6-тризамещенных производных 4-(5-нитрофуран-2-ил)пиримидинов (4).
В литературе имеются сведения о наличии у 2,5,6-тризамещенных производных 4-(5-нитрофуран-2-ил)пиримидинов (4) антибактериальной активности в отношении шести штаммов бактерий, а именно: Staphylococcus aureus SG 511, Streptococcus pyogenes Aronson, Streptococcus faecalis, Escherichia coli, Proteus mirabilis, Pseudomonas aeruginosa [H. Berger, R. Gall, H. Merdes, K. Stach, W. Voemel, W. Sauer. 4-(5-Nitrofuryl)pyrimidines. // Patent US 3704301 A, 1972].
Таким образом, существующий метод является многостадийными, требует сложного предварительного синтеза исходных соединений и долгого времени протекания реакций.
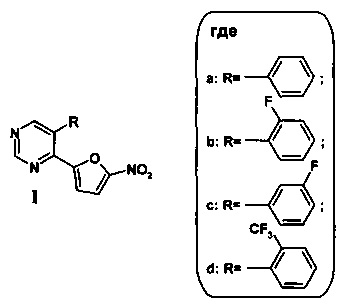
Еще одним близким по структуре к соединению общей формулы Ia-d являются соединения 5a-d - 5-арил-4-(фуран-2-ил)пиримидины, в структуре которого отсутствует нитрогруппа в положении С(5) фуранового кольца.
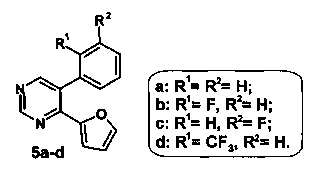
В литературе описан способ получения соединений 5a-d, который основан на использовании промотируемой микроволновым излучением реакции кросс-сочетания по Сузуки 5-бром-4-(фуран-2-ил)-пиримидина (0.5 ммоль) с фенилборной [2-фторфенилборной, 3-фторфенилборной или 2-(трифторметил)фенилборной] кислотой (0.6 ммоль) в 1,4-диоксане при 165°C в течение 20 минут [E.V. Verbitskiy, S.A. Baskakova, М.А. Kravchenko, S.N. Skornyakov, G.L. Rusinov, O.N. Chupakhin, V.N. Charushin. Synthesis and evaluation of antitubercular activity of fluorinated 5-aryl-4-(hetero)aryl substituted pyrimidines. // Bioorganic & Medicinal Chemistry, 2016, Vol. 24, Issue 16, P. 3771-3780.].
В литературе имеются сведения о наличии у 5-арил-4-(фуран-2-ил)пиримидинов (5a-d) антибактериальной активности в отношении штаммов микобактерий, а именно: Mycobacterium tuberculosis H37Rv, Mycobacterium avium, Mycobacterium terrae и микобактерий туберкулеза с множественной лекарственной устойчивостью.
Сведения о других свойствах и областях применения 5-замещенных 4-(5-нитрофуран-2-ил)пиримидинов общей формулы (Ia-d и II) в научно-технической и патентной литературе отсутствуют.
Задача изобретения: синтезировать соединения, обладающие высокой антибактериальной активностью, из доступного сырья, в мягких условиях, с высоким выходом.
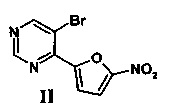
Поставленная задача решается тем, что на первой стадии получают 5-бром-4-(5-нитрофуран-2-ил)пиримидин(II) нитрованием 5-бром-4-(фуран-2-ил)пиримидина (6) смесью дымящейся азотной и концентрированной серной кислот в сухом дихлорметане при -10÷-15°C не менее 30 минут, а затем при комнатной температуре не менее 1 часа, выливают в воду со льдом, нейтрализуют водным раствором аммиака, экстрагируют этилацетатом, органическую фазу отделяют и отгоняют, а полученный остаток подвергают хроматографическому разделению на силикагеле при соотношении в элюенте этил ацетат - гексан = 1:3,
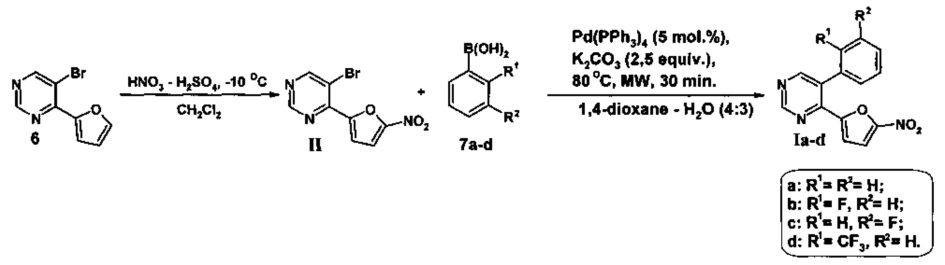
на второй стадии полученный 5-бром-4-(фуран-2-ил)пиримидин (6) смешивают с соответствующей арилборной кислотой (7a-d) и тетракис(трифенифосфин)палладием(0) в 1,4-диоксане, добавляют водный раствор карбоната калия и полученную смесь облучают микроволновым излучением при 80°C в течение 30 минут, растворитель отгоняют при пониженном давлении, полученный остаток подвергают хроматографическому разделению на силикагеле при соотношении в элюенте этилацетат - гексан = 1:3.
Проведение реакции нитрования 5-бром-4-(фуран-2-ил)пиримидина (6) осуществляют в температурном интервале -10÷-15°C в течение не менее 30 минут, поскольку увеличение температуры ведет к резкому осмолению и уменьшению выхода промежуточного продукта II, в свою очередь уменьшение температуры ниже -15°C приводит к значительному увеличению времени протекания реакции. Время реакции 30 минут при -10÷-15°C и не менее 1 часа при комнатной температуре достаточно для полного протекания реакции нитрования, тогда как его уменьшение при любой из температур также приводит к снижению выхода промежуточного 5-бром-4-(5-нитрофуран-2-ил)пиримидина (II).
Реакцию кросс-сочетания по Сузуки в условиях микроволновой активации проводят при температуре аналогично методике, описанной в литературе [E.V. Verbitskiy, S.A. Baskakova, М.А. Kravchenko, S.N. Skornyakov, G.L. Rusinov, O.N. Chupakhin, V.N. Charushin. Synthesis and evaluation of antitubercular activity of fluorinated 5-aryl-4-(hetero)aryl substituted pyrimidines. // Bioorganic & Medicinal Chemistry, 2016, Vol. 24, Issue 16, P. 3771-3780.], однако не выше 80°C, поскольку повышение температуры приводит к разложению реакционной смеси и резкому уменьшению выхода целевых продуктов Ia-d.
Выделение продуктов (Ia-d и II) осуществляют путем хроматографического разделения на силикагеле при соотношении в элюенте этилацетат : гексан = 1:3. Увеличение данного соотношения в пользу гексана приведет к необоснованному расходу растворителя, тогда как при увеличении доли этилацетата в элюенте не происходит селективного отделения целевого продукта (Ia-d и II) от побочных примесей.
Анализ промежуточных и целевых соединений проводят с использованием ЯМР-спектроскопии [Спектры ЯМР 1Н, 13С и 19F измерены на спектрометре Bruker AVANCEIII-500 (500, 126 и 470.5 МГц, соответственно) в растворе CDCl3, внутренний стандарт ТМС и С6F6] и элементного анализа на автоматическом анализаторе Perkin-Elmer РЕ-2400.
Пример 1.
Смесь дымящей азотной кислоты 1.1 мл (26 ммоль) и концентрированной серной кислоты 5 мл прикапывают при перемешивании к раствору 5-бром-4-(фуран-2-ил)-пиримидина (6) 1.95 г (8.67 ммоль) в 100 мл сухого CH2Cl2 при -10°C. Прикапывают в течение примерно 10 минут и оставляют при данной температуре на 30 минут. После этого охлаждение прекращают и оставляют реакционную смесь нагреваться до комнатной температуры, после чего продолжают промешивание еще 1 час. После этого реакционную смесь выливают в 200 мл воды со льдом, полученную смесь нейтрализуют водным раствором аммиака до рН=8, органический слой экстрагируют EtOAc (5×50 мл), промывают водой (2×100 мл) и сушат над безводным Na2SO4. После этого растворитель отгоняют на роторном испарителе при пониженном давлении, полученный остаток подвергают хроматографическому разделению на колонке с силикагелем (элюент: этилацетат - гексан, 1:3). В результате получают 5-бром-4-(5-нитрофуран-2-ил)пиримидин (II) в виде бежевого порошка. Выход 1.31 г (56%).
Т.пл. 200-201°C.
Спектр ЯМР 1Н (500 МГц, DMSO-d6) δ (м.д.): 9.30 (с, 1Н), 9.23 (с, 1Н), 7.90 (д, J=4.0 Гц, 1Н), 7.89 (d, J=4.0 Гц, 1Н).
Спектр ЯМР 13C NMR (126 MHz, DMSO-d6) δ (м.д.): 161.9, 156.7, 152.3, 150.2, 150.1, 118.7, 116.2, 113.6.
Элементный анализ для С8H4BrN3O3 (270.04):
Вычислено (%): С, 35.58; Н, 1.49; N 15.56.
Найдено (%): С, 35.39; Н, 1.54; N, 15.46.
ГЖХ: tR=21.11 мин. Масс-спектр: (ЭУ, 70 эВ), m/z (Iотн, %): 269 [М]+ (100) для 79Br, 271 [М]+ (100) для 81Br.
5-Бром-4-(5-нитрофуран-2-ил)пиримидин (II) 270 мг (1.0 ммоль) смешивают с фенилборной кислотой (7а) 146 мг (1.2 ммоль) и тетракис(трифенифосфин)палладием(0) 58 мг (0.05 ммоль). Полученную смесь растворяют в 4 мл дегазированного 1,4-диоксана. К образовавшемуся раствору добавляют раствор карбоната калия 346 мг (2.5 ммоль) в 3 мл дегазированной воды. Полученную смесь облучают микроволновым излучением при 80°C (250 Вт) в течение 30 минут. После этого растворитель отгоняют на роторном испарителе при пониженном давлении, полученный остаток подвергают хроматографическому разделению на колонке с силикагелем (элюент: этилацетат - гексан, 1:3). В результате получают 4-(5-нитрофуран-2-ил)-5-фенилпиримидин (Iа) в виде светло-коричневого порошка. Выход 185 мг (70%).
Т.пл. 152-153°C.
Спектр ЯМР 1Н (500 МГц, DMSO-d6) δ (м.д.): 9.35 (с, 1Н), 8.89 (с, 1Н), 7.68 (д, J=4.0 Гц, 1H), 7.54-7.52 (м, 3Н), 7.48 (д, J=1.9 Гц, 1Н), 7.47-7.46 (м, 1Н), 6.67 (d, J=4.0 Гц, 1Н).
Спектр ЯМР 13C NMR (126 MHz, DMSO-d6) δ (м.д.): 159.3, 157.4, 151.9, 151.7, 149.7, 134.5, 132.2, 129.0, 128.9, 117.0, 113.6.
Элементный анализ для C14H9N3O3 (267.25):
Вычислено (%): С, 62.92; Н, 3.39; N, 15.72.
Найдено (%): С, 62.76; Н, 3.23; N, 15.67.
ГЖХ: tR=24.12 мин. Масс-спектр: (ЭУ, 70 эВ), m/z (Iотн, %): 267 [М]+ (100).
Пример 2.
Смесь дымящей азотной кислоты 1.1 мл (26 ммоль) и концентрированной серной кислоты 5 мл прикапывают при перемешивании к раствору 5-бром-4-(фуран-2-ил)пиримидина (6) 1.95 г (8.67 ммоль) в 100 мл сухого CH2Cl2 при -10°C. Прикапывают в течение примерно 10 минут и оставляют при данной температуре на 30 минут. После этого охлаждение прекращают и оставляют реакционную смесь нагреваться до комнатной температуры, после чего продолжают промешивание еще 1 час. После этого реакционную смесь выливают в 200 мл воды со льдом, полученную смесь нейтрализуют водным раствором аммиака до рН=8, органический слой экстрагируют EtOAc (5×50 мл), промывают водой (2×100 мл) и сушат над безводным Na2SO4. После этого растворитель отгоняют на роторном испарителе при пониженном давлении, полученный остаток подвергают хроматографическому разделению на колонке с силикагелем (элюент: этилацетат - гексан, 1:3). В результате получают 5-бром-4-(5-нитрофуран-2-ил)пиримидин (II) в виде бежевого порошка. Выход 1.31 г (56%).
5-Бром-4-(5-нитрофуран-2-ил)пиримидин (II) 270 мг (1.0 ммоль) смешивают с 2-фторфенилборной кислотой (7с) 168 мг (1.2 ммоль) и тетракис(трифенифосфин)палладием(0) 58 мг (0.05 ммоль). Полученную смесь растворяют в 4 мл дегазированного 1,4-диоксана. К образовавшемуся раствору добавляют раствор карбоната калия 346 мг (2.5 ммоль) в 3 мл дегазированной воды. Полученную смесь облучают микроволновым излучением при 80°C (250 Вт) в течение 30 минут. После этого растворитель отгоняют на роторном испарителе при пониженном давлении, полученный остаток подвергают хроматографическому разделению на колонке с силикагелем (элюент: этилацетат - гексан, 1:3). В результате получают 5-(2-фторфенил)-4-(5-нитрофуран-2-ил)-пиримидин (Ib) в виде коричневого порошка. Выход 151 мг (53%).
Т.пл. 109-110°C.
Спектр ЯМР 1Н (500 МГц, DMSO-d6) δ (м.д.): 9.38 (с, 1Н), 8.96 (с, 1H), 7.73 (д, 3JC,F=4.0 Гц, 1H), 7.65-7.60 (м, 1H), 7.57 (тд, 3JC,F=7.7, 4JC,F =1.7 Гц, 1Н), 7.43-7.38 (м, 1Н), 7.35 (дд, 3JC,F=9.7, 4JC,F=1.2 Гц, 1Н), 7.11 (д, 4JC,F=4.0 Гц, 1Н).
Спектр ЯМР 19F (470.5 MHz, DMSO-d6) δ (м.д.): 46.65 (ддд, J=10.2, 7.6, 5.5 Гц, 1F).
Спектр ЯМР 13С (126 MHz, DMSO-d6) δ (м.д.): 160.1, 159.2 (д, 1JC,F=245.2 Гц), 158.0, 152.1, 151.9, 150.3, 131.6 (д, 3JC,F=8.2 Гц), 131.2 (д, 4JC,F=2.4 Гц), 125.5, 125.1 (д, 4JC,F=3.6 Гц), 122.2 (д, 2JC,F=15.9 Гц), 116.5, 115.7 (д, 2JC,F=21.3 Гц), 113.7.
Элементный анализ для C14H8FN3O3 (285.24):
Вычислено (%): С, 58.95; Н, 2.83; N, 14.73.
Найдено (%): С, 59.18; Н, 3.05; N, 14.57.
ГЖХ: tR=23.59 мин. Масс-спектр: (ЭУ, 70 эВ), m/z (Iотн, %): 285 [М]+ (100).
Пример 3.
Смесь дымящей азотной кислоты 1.1 мл (26 ммоль) и концентрированной серной кислоты 5 мл прикапывают при перемешивании к раствору 5-бром-4-(фуран-2-ил)-пиримидина (6) 1.95 г (8.67 ммоль) в 100 мл сухого CH2Cl2 при -10°C. Прикапывают в течение примерно 10 минут и оставляют при данной температуре на 30 минут. После этого охлаждение прекращают и оставляют реакционную смесь нагреваться до комнатной температуры, после чего продолжают промешивание еще 1 час. После этого реакционную смесь выливают в 200 мл воды со льдом, полученную смесь нейтрализуют водным раствором аммиака до рН=8, органический слой экстрагируют EtOAc (5×50 мл), промывают водой (2×100 мл) и сушат над безводным Na2SO4. После этого растворитель отгоняют на роторном испарителе при пониженном давлении, полученный остаток подвергают хроматографическому разделению на колонке с силикагелем (элюент: этилацетат - гексан, 1:3). В результате получают 5-бром-4-(5-нитрофуран-2-ил)пиримидин (II) в виде бежевого порошка. Выход 1.31 г (56%).
5-Бром-4-(5-нитрофуран-2-ил)пиримидин (II) 270 мг (1.0 ммоль) смешивают с 3-фторфенилборной кислотой (7с) 168 мг (1.2 ммоль) и тетракис(трифенифосфин)палладием(0) 58 мг (0.05 ммоль). Полученную смесь растворяют в 4 мл дегазированного 1,4-диоксана. К образовавшемуся раствору добавляют раствор карбоната калия 346 мг (2.5 ммоль) в 3 мл дегазированной воды. Полученную смесь облучают микроволновым излучением при 80°C (250 Вт) в течение 30 минут. После этого растворитель отгоняют на роторном испарителе при пониженном давлении, полученный остаток подвергают хроматографическому разделению на колонке с силикагелем (элюент: этилацетат - гексан, 1:3). В результате получают 5-(3-фторфенил)-4-(5-нитрофуран-2-ил)-пиримидин (1с) в виде светло-коричневого порошка. Выход 151 мг (53%).
Т. пл. 166-168°C.
Спектр ЯМР 1Н (500 МГц, DMSO-d6) δ (м.д.): 9.35 (с, 1Н), 8.91 (с, 1Н), 7.70 (д, J=4.0 Гц, 1Н), 7.56 (тд, J=7.9, 6.2 Гц, 1Н), 7.47-7.41 (м, 1H), 7.38 (тд, J=8.5,2.3 Гц, 1H), 7.30 (д, J=7.6 Гц, 1H), 6.92 (д, J=4.0 Гц, 1H).
Спектр ЯМР 19F (470.5 MHz, DMSO-d6) δ (м.д.): 49.88 (тд, J=9.4, 6.1 Гц, 1F).
Спектр ЯМР 13С (126 MHz, DMSO-d6) δ (м.д.): 162.1 (д, 1JC,F=244.3 Гц), 159.4, 157.7, 151.9, 151.7, 149.6, 136.8 (д, 3JC,F=8.3 Гц), 130.8 (д, 3JC,F=8.5 Гц), 130.7 (д, 4JC,F=1.9 Гц), 125.4 (д, 4JC,F=2.8 Гц), 117.07,116.2 (д, 2JC,F=22.7 Гц), 115.7 (д, 2JC,F=20.8 Гц), 113.7.
Элементный анализ для C14H8FN3O3 (285.24):
Вычислено (%): С, 58.95; Н, 2.83; N, 14.73.
Найдено (%): С, 59.08; Н, 3.08: N, 14.64.
ГЖХ: tR=23.81 мин. Масс-спектр: (ЭУ, 70 эВ), m/z (Iотн, %): 285 [М]+ (100).
Пример 4.
Смесь дымящей азотной кислоты 1.1 мл (26 ммоль) и концентрированной серной кислоты 5 мл прикапывают при перемешивании к раствору 5-бром-4-(фуран-2-ил)-пиримидина (6) 1.95 г (8.67 ммоль) в 100 мл сухого CH2Cl2 при -10°C. Прикапывают в течение примерно 10 минут и оставляют при данной температуре на 30 минут. После этого охлаждение прекращают и оставляют реакционную смесь нагреваться до комнатной температуры, после чего продолжают промешивание еще 1 час. После этого реакционную смесь выливают в 200 мл воды со льдом, полученную смесь нейтрализуют водным раствором аммиака до pH=8, органический слой экстрагируют EtOAc (5×50 мл), промывают водой (2×100 мл) и сушат над безводным Na2SO4. После этого растворитель отгоняют на роторном испарителе при пониженном давлении, полученный остаток подвергают хроматографическому разделению на колонке с силикагелем (элюент: этилацетат - гексан, 1:3). В результате получают 5-бром-4-(5-нитрофуран-2-ил)пиримидин (II) в виде бежевого порошка. Выход 1.31 г (56%).
5-Бром-4-(5-нитрофуран-2-ил)пиримидин (II) 270 мг (1.0 ммоль) смешивают с 2-(трифторметил)фенилборной кислотой (7d) 228 мг (1.2 ммоль) и тетракис(трифенифосфин)палладием(0) 58 мг (0.05 ммоль). Полученную смесь растворяют в 4 мл дегазированного 1,4-диоксана. К образовавшемуся раствору добавляют раствор карбоната калия 346 мг (2.5 ммоль) в 3 мл дегазированной воды. Полученную смесь облучают микроволновым излучением при 80°C (250 Вт) в течение 30 минут. После этого растворитель отгоняют на роторном испарителе при пониженном давлении, полученный остаток подвергают хроматографическому разделению на колонке с силикагелем (элюент: этилацетат - гексан, 1:3). В результате получают 4-(5-нитрофуран-2-ил)-5-[2-(трифторметил)фенил]-пиримидин (Id) в виде коричневого порошка. Выход 194 мг (58%).
Т.пл. 138-140°C.
Спектр ЯМР 1Н (500 МГц, DMSO-d6) δ (м.д.): 9.40 (с, 1Н), 8.90 (с, 1Н), 7.97 (д, J=7.4 Гц, 1H), 7.82 (дт, J=21.7, 7.2 Гц, 2Н), 7.67 (д, J=4.0 Гц, 1Н), 7.60 (д, J=7.3 Гц, 1Н), 6.91 (д, J=4.0 Гц, 1H).
Спектр ЯМР 19F (470.5 MHz, DMSO-d6) δ (м.д.): 104.86 (с, CF3).
Спектр ЯМР 13С (126 MHz, DMSO-d6) δ (м.д.): 161.9, 159.1, 158.2, 152.0, 151.6, 149.9, 132.9, 130.7 (д, 1JC,F=236.0 Гц), 128.6, 127.2 (к, 2JC,F=29.5 Гц), 126.4 (дд, 2JC,F=10.1, 3JC,F=5.1 Гц), 123.9 (д, 1JC,F=273.7 Гц), 118.7,116.8,113.5.
Элементный анализ для C15H8F3N3O3 (335.24):
Вычислено (%): С, 53.74; Н, 2.41; N, 12.53.
Найдено (%): С, 53.66; Н, 2.45; N, 12.57.
ГЖХ: tR=22.71 мин. Масс-спектр: (ЭУ, 70 эВ), m/z (Iотн, %): 335 [М]+ (100).
Сведения, подтверждающие возможность осуществления изобретения.
Список условных сокращений:
АТСС - American Type Culture Collection.
NCTC - National Collection of Type Cultures (Culture Collection of Public Health England).
SPEC - Спектиномицин (Spectinomycin), антибиотик класса аминоциклитолов. Механизм действия - ингибирует синтез белка в бактериальной клетке, путем связывания с 30S субъединицей рибосомы. Может нарушать функции и структуру цитоплазматических мембран.
МИК - минимальная ингибирующая концентрация
AZMR - клинический штамм, резистентный к Азитромицину (МИК AZM<0,25-0,5 мг/л). Контрольные штаммы Neisseria gonorrhoeae NCTC 12700/ АТСС 49226 и Neisseria gonorrhoeae NCTC 8375 / АТСС 19424, чувствительные к применяемым в лечении гонококковой инфекции антимикробным препаратам.
Изучение антибактериальной активности in vitro заявляемых соединений Ia-d и II.
Оценку чувствительности микроорганизмов к антимикробным препаратам проводят методом последовательных микроразведений - референсным методом, регламентированным международным стандартом ISO 20776-1:2006. В Российской Федерации действует Национальный Стандарт ГОСТ Р ИСО 20776-1-2010, идентичный международному стандарту: в стерильных 96-луночных планшетах готовят разведение препаратов в бульоне Мюллера-Хинтон (Mueller Hinton Broth (HiMedia, Индия). На втором этапе готовят инокулюмы контрольных штаммов, в соответствии со стандартом 0,5 Ед по МакФарланду (что соответствует 1,5×108 КОЕ/мл, затем разбавляют в 100 раз до концентрации 106 КОЕ/мл. В каждую лунку горизонтального ряда вносят по 50 мкл инокулюма соответствующего штамма (в т.ч. и в контрольную). Инкубация планшета в термостате при 35°C 18-24 часа. Учет результатов: Визуально или спектрофотометрически. Последняя лунка с задержкой роста (прозрачный бульон) соответствует минимальной подавляющей (бактериостатической) концентрации в отношении данного штамма.
В качестве соединения сравнения используют лекарственный препарат Спектиномицин формулы (SPEC)
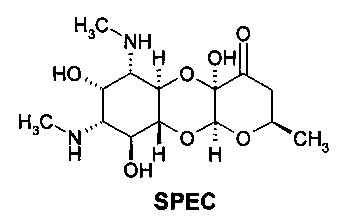
, который используют в медицинской практике для лечения острого гонорейного уретрита и простатита у мужчин, острого гонорейного цервицита и проктита у женщин, вызванных чувствительными штаммами Neisseria gonorrhoeae, при непереносимости или неэффективности бета - лактамных антибиотиков.
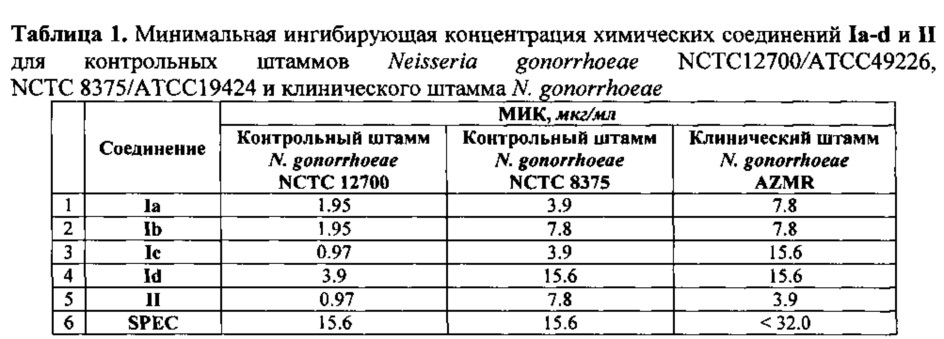
Для изучения антибактериальной активности соединений Ia-d и II проведено определение минимальные ингибирующие концентрации этих соединений по отношению к контрольным штаммам Neisseria gonorrhoeae NCTC 12700 / ATCC 49226, NCTC 8375 / АТСС 19424 и клиническому штамму N. gonorrhoeae AZMR (Таблица 1).
Кроме того, определены минимальные ингибирующие концентрации заявляемых соединений Ia-d в отношении эталонных штаммов условно-патогенных микроорганизмов из международных коллекций АТСС:
Грамотрицательные палочки (энтеробактерии):
Escherichia coli АТСС 8739
Citrobacter braakii АТСС 101/57
Shigella flexneri 1а8516
Proteus vulgaris 222
Serratia marcescens ATCC 13880
Klebsiella pneumoniae ATCC 13883
Неферментатирующие грамотрицательные палочки:
Pseudomonas aeruginosa ATCC 9027
Грамположительные кокки:
Staphylococcus aureus ATCC 25923
Результаты обобщены в Таблице 2.
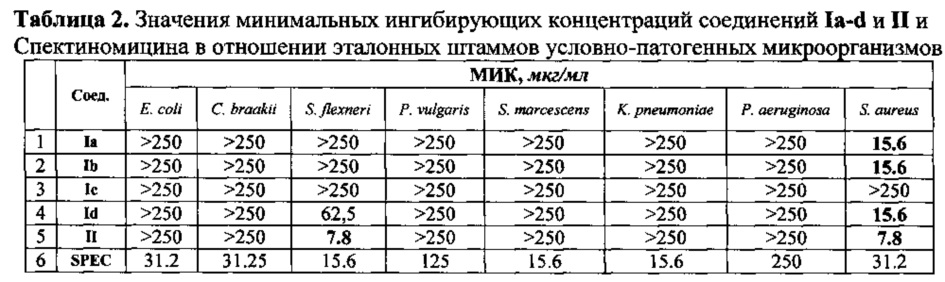
Таким образом, нами предложен новый эффективный способ получения 5-бром-4-(5-нитрофуран-2-ил)пиримидина и 5-арил-замещенным 4-(5-нитрофуран-2-ил)пиримидинов, которые проявили широкий спектр антибактериальной активности.
Преимуществами данного способа синтеза являются:
1. Легкость варьирования заместителей, благодаря высокой доступности коммерчески доступных арилборных кислот.
2. Мягкие условия проведения реакций и быстрота их проведения, в том числе, благодаря использованию микроволнового излучения.
3. Высокий выход целевых продуктов (53-70%), в отличие от многостадийных (не менее 3-х стадий), описанных в литературе способов получения аналогичных продуктов с выходом не более 50%.
Полученные соединения проявили активность в отношении контрольных штаммов бактерий Neisseria gonorrhoeae NCTC 12700 / ATCC 49226, NCTC 8375 / АТСС 19424 и клинического штамма N. gonorrhoeae превышающую аналогичную активность для Спектиномицина в ряде случаев от 8 до 16 раз. В отношении же Staphylococcus aureus АТСС 25923 заявляемые соединения с общими формулами Ia-d и II оказались более активными, чем препарат сравнения в 2-4 раза.
Заявляемые соединения по своим характеристикам превосходят аналоги по структуре и действию и могут быть использованы в практической медицине для лечения больных с заболеваниями мочеполовой системы, вызванными золотистым стафилококком или гонококками.