Результат интеллектуальной деятельности: СИСТЕМА ИНДИКАЦИИ НА ОСНОВЕ ПОЛНОРАЗМЕРНОГО АНТИТЕЛА ДЛЯ ЭУКАРИОТИЧЕСКИХ КЛЕТОК И ЕЕ ПРИМЕНЕНИЕ
Вид РИД
Изобретение
Данное изобретение относится к области моноклональных антител, в основном к нуклеиновым кислотам, кодирующим такие антитела. Изобретение относится к способам создания и отбора эукариотической клетки, экспрессирующей и представляющей на своей поверхности антитело, в основном полноразмерное моноклональное антитело, в основном биспецифическое моноклональное антитело, которое способно специфически связываться с одним или более чем одним антигеном, представляющим интерес.
Уровень техники
Известными способами выделения рекомбинантных антител являются фаговый дисплей (Hogenboom, Methods Mol. Biol. 178 (2002) 1-37), рибосомный/мРНК дисплей (Lipovsek and Plueckthun, J. Immunol. Method 290 (2004) 51-67) и дисплей микробных клеток (Boder and Wittrup, Nat. Biotechnol. 15 (1997) 553-557).
Система скрининга на основе опосредованной вирусом коровьей оспы экспрессии целых антител в клетках млекопитающих представлена в US 2002/0123057. Другая система скрининга основана на экспрессии антител на клеточной поверхности клеток млекопитающих (Но, et al., Proc. Natl. Acad. Sci. USA 103 (2006) 9637-9642).
Фаговый дисплей позволяет провести скрининг от 1012 до 1013 клонов в одном раунде пэннинга (Barbas III, et al., (eds.), Phage Display-Α Laboratory manual, Cold Spring Habour Press, (2001)), в то время как пропускная способность процедуры скрининга млекопитающих в формате «одно антитело на клетку» ограничивается сопутствующим анализом примерно от 106 до 107 клонов.
Клеточный дисплей описан в Higuchi et al. в клетках COS (J. Immunol. Meth. 202 (1997) 193-204). Beerli et al. сообщали о дисплейной библиотеке scFv на клеточной поверхности на основе вируса Синдбис, полученной из антигенспецифических В-клеток в ВНК-клетках (Proc. Natl. Acad. Sci. USA 105 (2008) 14336-14341). Но и Pastan сообщали о способах с клетками HEK293 (scFv) (Methods Mol. Biol. 562 (2009) 99-113). Лимфоцитарный дисплей описан в Alonso-Camino et al. (PLoS One. 4 (2009) e7174). Zhou et al. сообщают о способах, использующих клетки HEK293 (Acta Biochim. Biophys. Sin. 42 (2010) 575-584). Zhou et al. сообщают о системе Flp-ln (MAbs. 2 (2010) 508-518).
Taube, R., et al. сообщают (PLOS One 3 (2008) e3181) о стабильной экспрессии человеческих антител на поверхности человеческих клеток и лентивирусных частиц.
В WO 2007/047578 описан клеточный дисплей библиотек антител.
Сущность изобретения
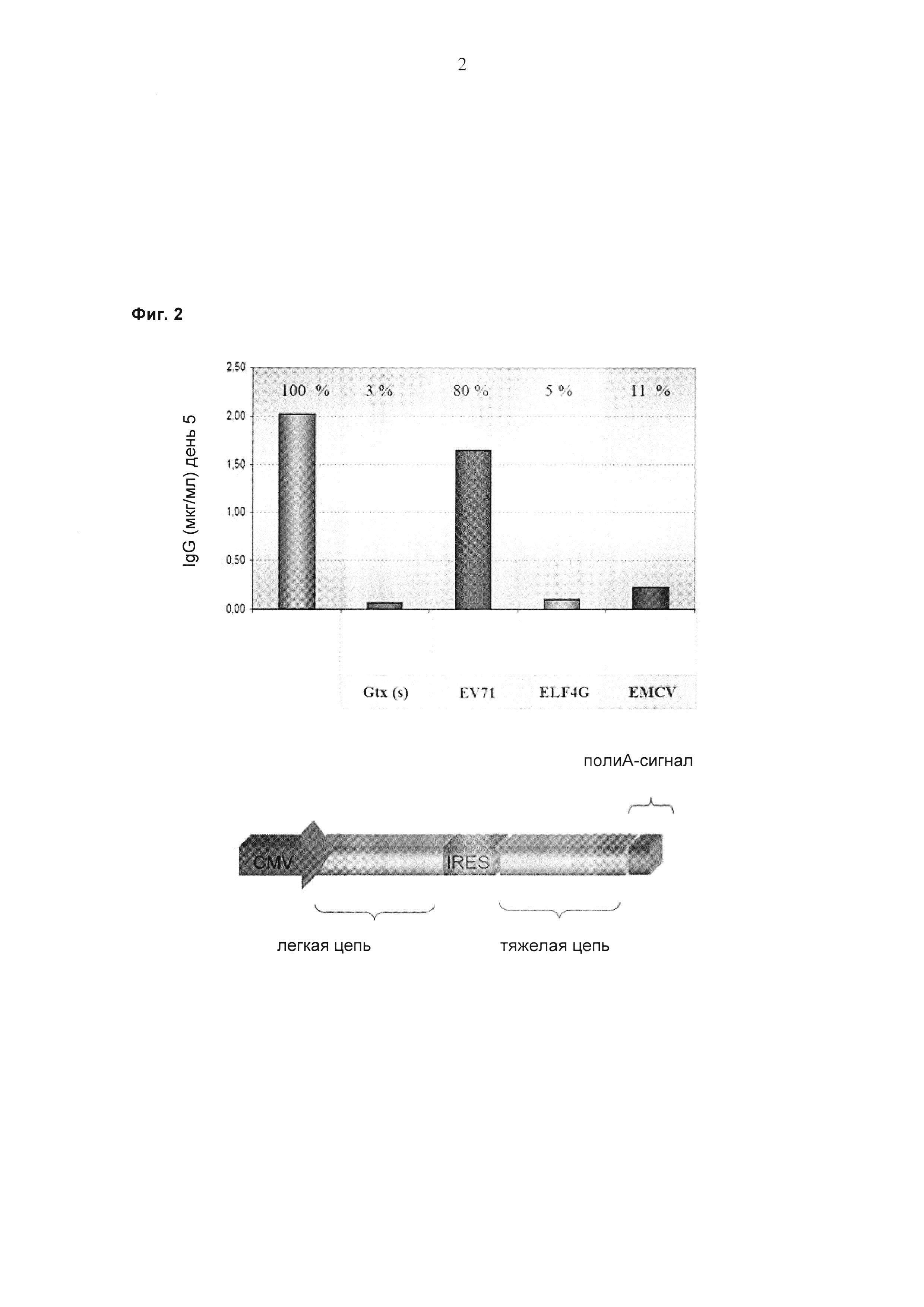
Обнаружили, что полноразмерные антитела могут быть экспрессированы и представлены на эукариотических клетках с использованием лентивирусной частицы, содержащей бицистронную экспрессионную кассету. Экспрессия полноразмерных антител на эукариотических клетках с использованием лентивирусной частицы, о которой сообщается в данном документе, возможна с помощью элемента IRES (внутреннего сайта посадки рибосомы) EV71, который связывает либо экспрессионные кассеты легкой цепи антитела и тяжелой цепи антитела, либо экспрессионные кассеты двух тяжелых цепей антитела.
В случае присутствия экспрессионной кассеты с легкой цепью антитела и экспрессионной кассеты с тяжелой цепью антитела в лентивирусном векторе экспрессионная кассета с тяжелой цепью антитела может содержать после экзона, кодирующего С-концевой домен антитела, неконститутивный сайт сплайсинга, обеспечивающий, помимо экспрессии растворимой тяжелой цепи антитела, также экспрессию мембраносвязанной тяжелой цепи антитела, приводя к презентации мембраносвязанного полноразмерного антитела.
В случае присутствия двух экспрессионных кассет с тяжелой цепью антитела в лентивирусном векторе либо обе, либо только вторая экспрессионная кассета с тяжелой цепью антитела может содержать после экзона, кодирующего С-концевой домен антитела, экзон, кодирующий трансмембранный домен, приводя к презентации мембраносвязанного полноразмерного антитела.
Кроме того, в данном описании приведены способы создания и отбора эукариотической клетки, экспрессирующей и представляющей на своей поверхности антитело, в основном моноклональное полноразмерное антитело.
Одним из аспектов, о которых сообщается в данном документе, является лентивирусный вектор, содержащий бицистронную экспрессионную кассету, которая включает в направлении от 5'- к 3'-
- промотор,
- первую нуклеиновую кислоту, кодирующую легкую цепь полноразмерного антитела,
- EV71-IRES,
- вторую нуклеиновую кислоту, кодирующую тяжелую цепь полноразмерного антитела,
- интрон с возможностью сплайсинга, и
- трансмембранный домен или GPI-якорь.
Этот лентивирусный вектор, о котором сообщается в данном документе, представляет собой экспрессионный вектор, который содержит бицистронную экспрессионную кассету для экспрессии легкой цепи полноразмерного антитела и тяжелой цепи полноразмерного антитела, где IRES, разделяющий две экспрессионные кассеты, представляет собой EV71-IRES.
Было обнаружено, что только EV71-IRES может быть использован для экспрессии полноразмерного антитела в бицистронной экспрессионной кассете в лентивирусной экспрессионной системе.
В связи с предоставлением интрона с возможностью слайсинга растворимая форма тяжелой цепи антитела, а также мембраносвязанная форма тяжелой цепи антитела может быть экспрессирована из экспрессионного вектора, о котором сообщается в данном документе.
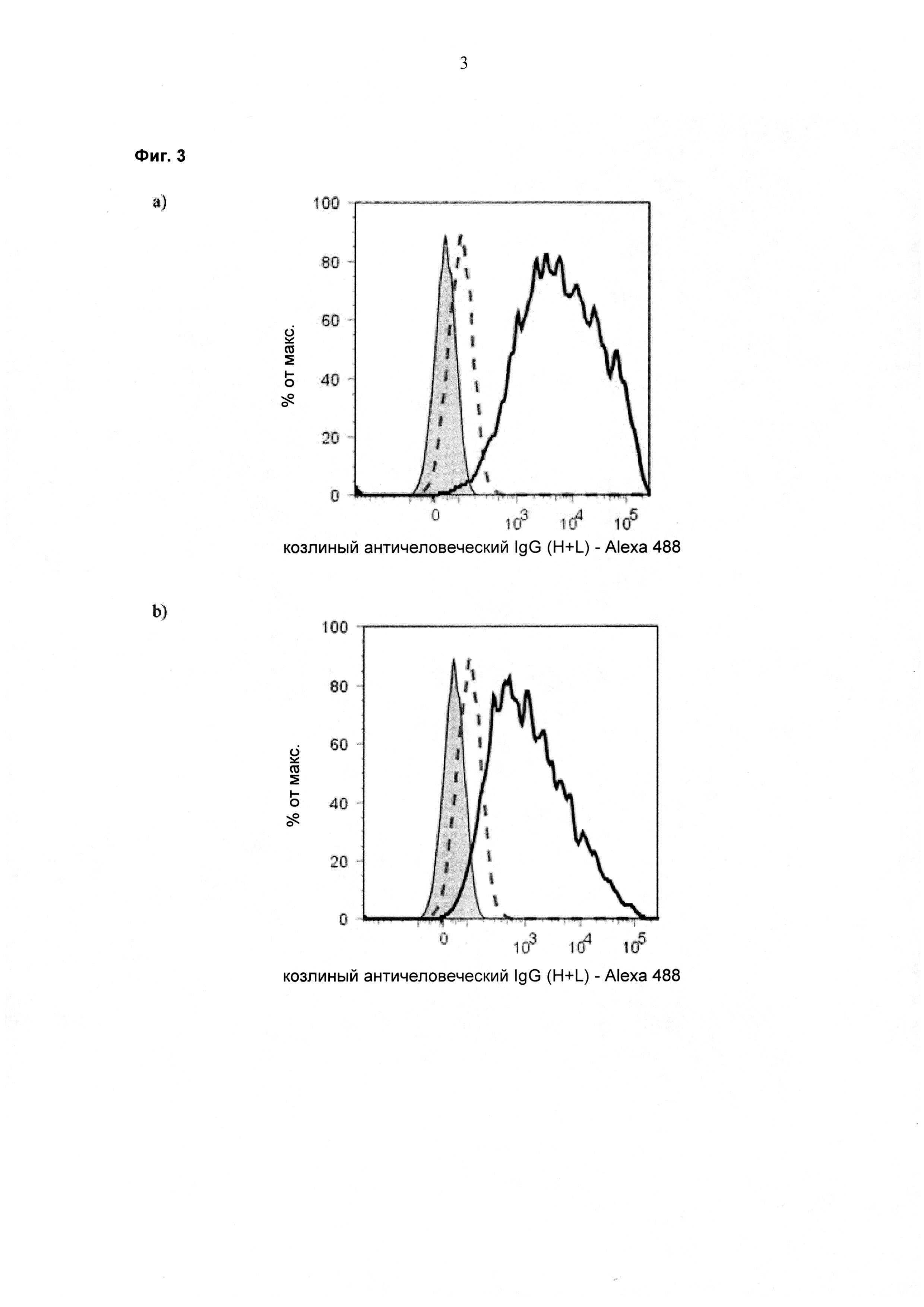
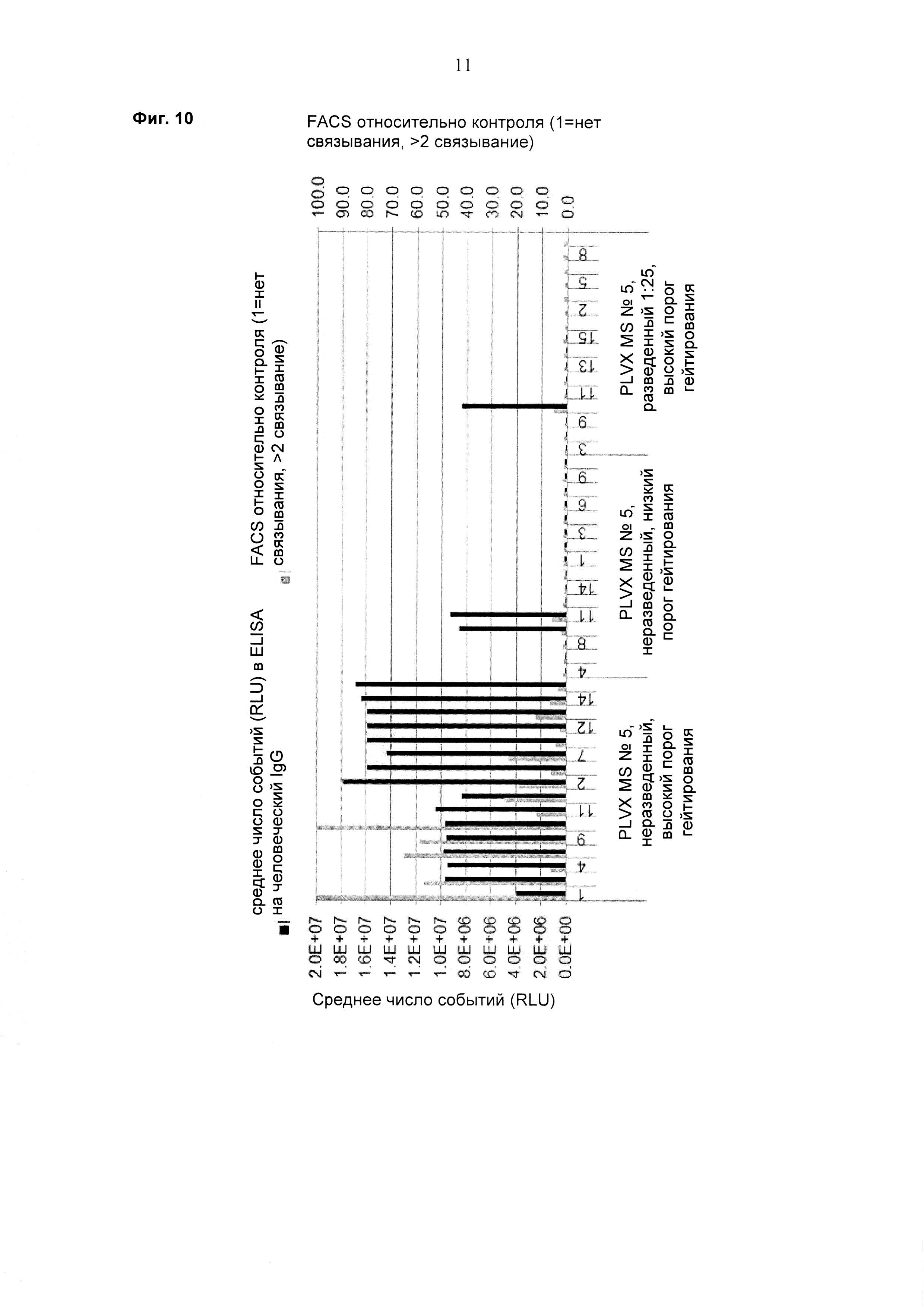
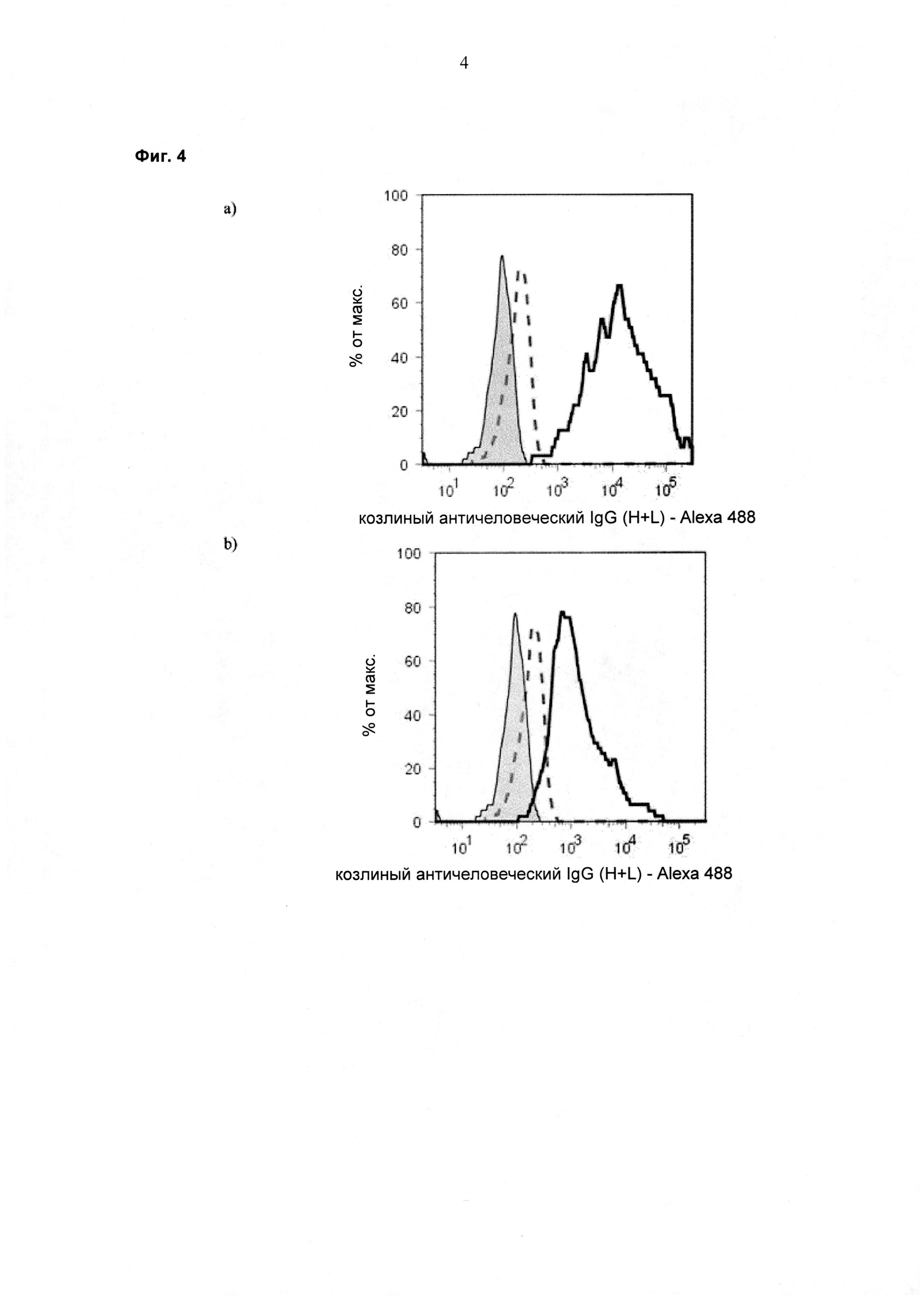
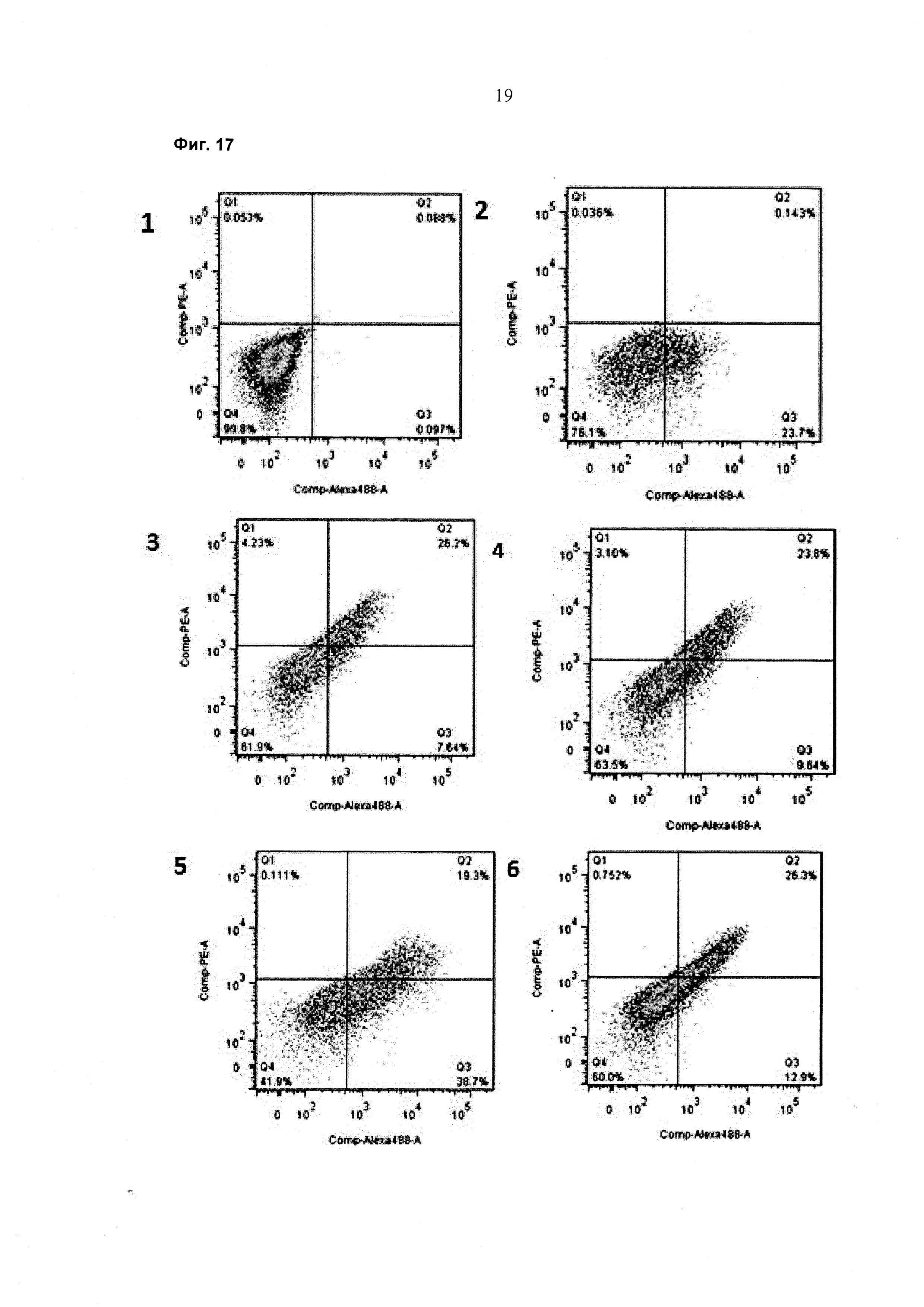
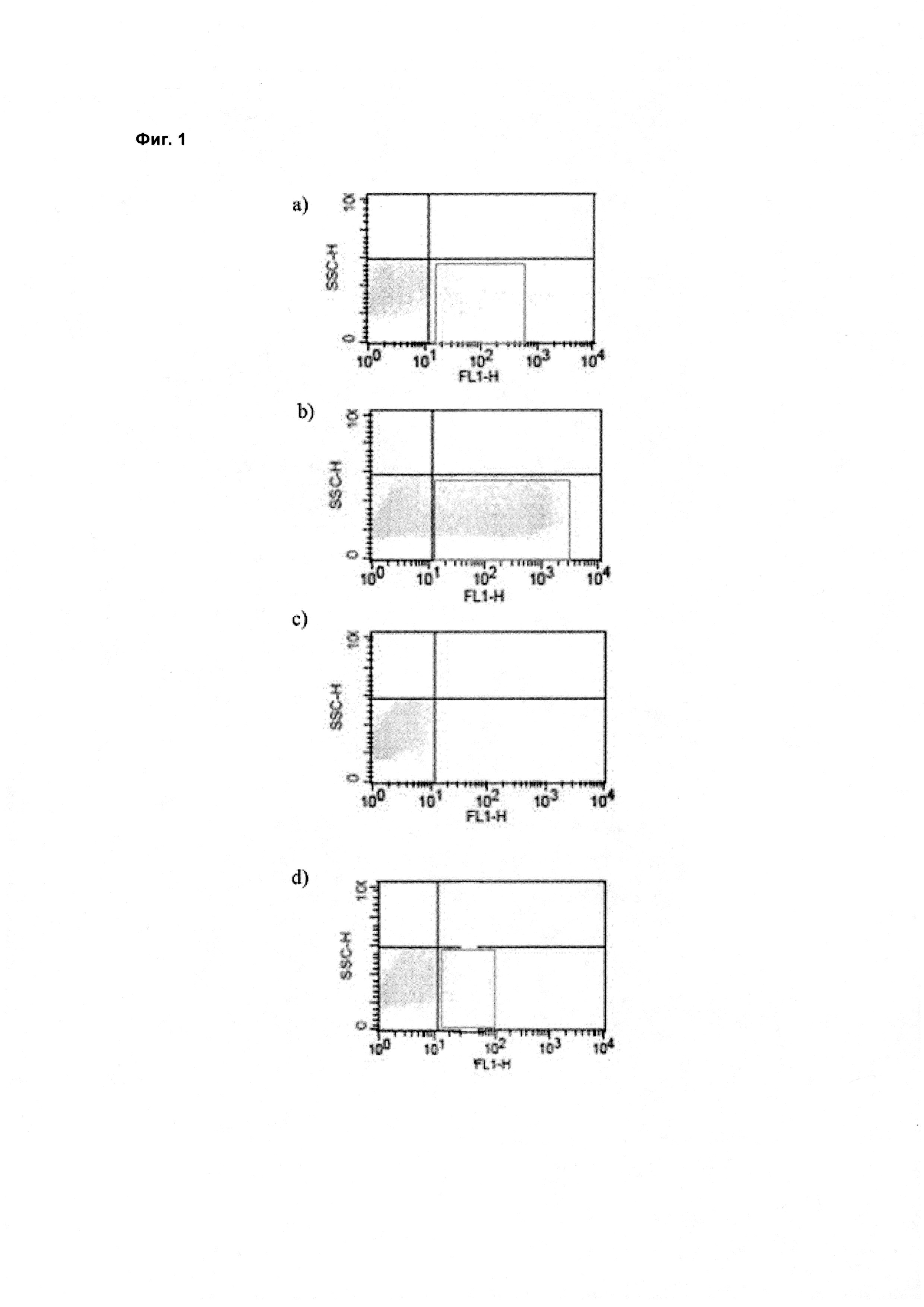
При экспрессии растворимой формы и мембраносвязанной формы тяжелой цепи антитела клетка, с одной стороны, секретирует полноразмерное антитело, которое может быть проверено, например, в ELISA, и в то же время представляет на своей поверхности мембраносвязанную форму полноразмерного антитела, которая может быть использована для селекции клеток, например, с помощью FACS, позволяющего выделять отдельный клон клеток.
Одним из аспектов, о котором сообщается в данном документе, является лентивирусный вектор, содержащий бицистронную экспрессионную кассету, которая включает в направлении от 5'- к 3'-
- промотор,
- первую нуклеиновую кислоту, кодирующую первую тяжелую цепь полноразмерного антитела,
- EV71-IRES,
- вторую нуклеиновую кислоту, кодирующую вторую тяжелую цепь полноразмерного антитела, и
- трансмембранный домен или GPI-якорь.
Этот лентивирусный вектор, о котором сообщается в данном документе, представляет собой экспрессионный вектор, который содержит бицистронную экспрессионную кассету для экспрессии двух различных тяжелых цепей полноразмерного антитела, где IRES, разделяющий две экспрессионные кассеты, представляет собой EV71-IRES.
При экспрессии мембраносвязанной формы тяжелой цепи антитела клетка представляет на своей поверхности связанную с мембраной форму полноразмерного антитела, которая может быть использована для отбора клетки, например, с помощью FACS, позволяющего выделять отдельный клон клеток.
В одном воплощении антитело представляет собой антитело, которое специфически связывается с антигеном. Таким образом, в одном воплощении антитело или кодирующая антитело нуклеиновая кислота, соответственно, получены из В-клетки, которая была выбрана по такому специфическому связыванию с антигеном.
В одном воплощении антитело представляет собой двухвалентное моноспецифическое антитело. В одном воплощении антитело специфически связывается с антигеном.
В одном воплощении антитело представляет собой двухвалентное биспецифическое антитело. В одном воплощении антитело специфически связывается с двумя различными антигенами или с двумя эпитопами на одном и том же антигене.
В одном воплощении антитело представляет собой четырехвалентное биспецифическое антитело. В одном воплощении антитело специфически связывается с двумя различными антигенами или с двумя эпитопами на одном и том же антигене.
В одном воплощении экспрессионный вектор представляет собой лентивирусный (экспрессионный) вектор.
Одним из аспектов, о котором сообщается в данном документе, является библиотека лентивирусного вектора, содержащая две или более двух лентивирусных частиц, каждая из которых содержит экспрессионный вектор, о котором сообщается в данном документе, где антитела, кодируемые каждым вектором, отличаются друг от друга по меньшей мере на одну аминокислоту.
В одном воплощении библиотека вектора содержит от 1000 до 1000000 различных экспрессионных векторов.
В одном воплощении антитела, кодируемые векторами из библиотеки вектора, различаются по меньшей мере на один аминокислотный остаток в вариабельных доменах антитела.
В одном воплощении антитела, кодируемые векторами из библиотеки вектора, различаются по меньшей мере на один аминокислотный остаток в одном из CDR антитела. В одном воплощении CDR представляет собой CDR3 тяжелой цепи.
Одним из аспектов, о котором сообщается в данном документе, является эукариотическая клетка, содержащая бицистронную экспрессионную кассету, о которой сообщается в данном документе. В одном воплощении бицистронная экспрессионная кассета была трансдуцирована в клетку.
Одним из аспектов, о котором сообщается в данном документе, является библиотека эукариотических клеток, содержащая две или более двух эукариотических клеток, каждая из которых содержит бицистронную экспрессионную кассету или вектор, о котором сообщается в данном документе, где антитела, экспрессированные каждой клеткой, отличаются друг от друга по меньшей мере на одну аминокислоту.
В одном воплощении библиотека эукариотических клеток содержит от 1000 до 1000000 отличающихся клеток млекопитающего.
В одном воплощении антитела, экспрессированные клетками из библиотеки эукариотических клеток, различаются по меньшей мере на один аминокислотный остаток в вариабельных доменах антитела.
В одном воплощении антитела, кодируемые эукариотическими клетками из библиотеки эукариотических клеток, различаются по меньшей мере на один аминокислотный остаток в одном из CDR антитела. В одном воплощении CDR представляет собой CDR3 тяжелой цепи.
Одним из аспектов, о котором сообщается в данном документе, является библиотека эукариотических клеток, содержащая библиотеку вектора, о которой сообщается в данном документе.
В одном воплощении эукариотические клетки из библиотеки эукариотических клеток экспрессируют и представляют одно антитело.
В одном воплощении эукариотические клетки из библиотеки эукариотических клеток представляют одно антитело.
В одном воплощении библиотека эукариотических клеток представляет собой популяцию эукариотических клеток, экспрессирующих библиотеку антител, где кодирующая нуклеиновая кислота получена из В-клеток иммунизированного животного. В одном воплощении В-клетки предварительно выбраны по их специфичности к представляющему интерес антигену.
В одном воплощении библиотека эукариотических клеток представляет собой популяцию эукариотических клеток, где каждая клетка содержит первую экспрессионную кассету, кодирующую полноразмерное антитело, которое специфически связывается с первым антигеном, и вторую экспрессионную кассету, кодирующую полноразмерное антитело, которое специфически связывается со вторым антигеном.
В одном воплощении библиотека эукариотических клеток представляет собой популяцию эукариотических клеток, где каждая клетка содержит первую экспрессионную кассету, кодирующую первую легкую цепь полноразмерного антитела и первую тяжелую цепь полноразмерного антитела, связывающего первый антиген, и вторую экспрессионную кассету, кодирующую вторую легкую цепь полноразмерного антитела и вторую тяжелую цепь полноразмерного антитела, специфически связывающего второй антиген.
В одном воплощении библиотека эукариотических клеток представляет собой популяцию эукариотических клеток, где каждая клетка содержит экспрессионную кассету, кодирующую первую тяжелую цепь полноразмерного антитела, специфически связывающего первый антиген, и вторую тяжелую цепь полноразмерного антитела, специфически связывающего второй антиген, где эукариотическая клетка экспрессирует общую легкую цепь.
В одном воплощении первая тяжелая цепь полноразмерного антитела содержит мутацию типа «замок», а вторая тяжелая цепь антитела содержит мутацию типа «ключ».
В одном воплощении первая легкая цепь полноразмерного антитела содержит в качестве константного домена СН1-домен, а первая тяжелая цепь полноразмерного антитела содержит в качестве первого константного домена CL-домен, или вторая легкая цепь полноразмерного антитела содержит в качестве константного домена СН1-домен, а вторая тяжелая цепь полноразмерного антитела содержит в качестве первого константного домена CL-домен.
В одном воплощении библиотеку экспрессионного вектора получают путем рандомизации одного или более аминокислотного остатка в одной или более CDR родительского экспрессионного вектора.
В одном воплощении библиотеку экспрессионного вектора получают путем комбинации двух различных полуантител.
Один из аспектов, о котором сообщается в данном описании, относится к способу выделения или отбора антитела, которое специфически связывается с одним или более, в основном с двумя антигенами, представляющими интерес.
Было обнаружено, что способ скрининга, о котором сообщается в данном документе, может быть выполнен в формате «одно антитело на клетку», который является предпочтительным, так как он позволяет завершать скрининг за один раунд отбора.
В данном документе сообщается о способе получения, выбора и/или выделения клетки, экспрессирующей антитело, которое специфически связывается с антигеном.
В одном воплощении антитело представляет собой моноклональное полноразмерное антитело. В одном воплощении антитело представляет собой биспецифическое моноклональное полноразмерное антитело.
Способы, о которых сообщается в данном документе, позволяют клонировать вариабельные области антитела или целое антитело из выбранной клетки.
Одним из аспектов, о котором сообщается в данном документе, является способ рекомбинантной продукции антител, отобранных с помощью способа, о котором сообщается в данном документе.
В одном воплощении полноразмерное антитело содержит константную область человеческого происхождения, в частности человеческого антитела класса IgG1, IgG2 или IgG4.
Способы, о которых сообщается в данном документе, позволяют рекомбинантно производить антитела с желаемой специфичностью в полностью видоспецифической форме, в основном полностью человеческие антитела.
Одним из аспектов, о котором сообщается в данном документе, является способ отбора клетки, экспрессирующей антитело, которое специфически связывается с представляющим интерес антигеном, включающий следующие этапы:
(a) возможно, отбор из популяции В-клеток субпопуляции В-клеток или отдельной В-клетки или клональной популяции В-клеток, секретирующих антитело, которое специфически связывается с одним или более чем одним антигеном,
(b) создание лентивирусной экспрессионной библиотеки, где каждый представитель лентивирусной экспрессионной библиотеки кодирует вариант антитела или антител, которые специфически связываются с одним или более чем одним антигеном, путем
(i) создания множества молекул ДНК, где создание включает этап амплификации пула молекул ДНК из субпопуляции В-клеток или этап получения библиотеки молекул ДНК из ДНК, кодирующей одно антитело, которое специфически связывается с одним или двумя антигенами, представляющими интерес, путем рандомизации кодирующей нуклеиновокислотной последовательности, и
(ii) клонирования множества молекул ДНК в лентивирусный экспрессионный вектор, содержащий EV71-IRES-связанную бицистронную экспрессионную кассету для экспрессии легкой цепи полноразмерного антитела и тяжелой цепи полноразмерного антитела как в растворимой, так и в мембраносвязанной форме;
(c) трансдукция популяции эукариотических клеток популяцией лентивирусных частиц, каждая из которых содержит представителя лентивирусной экспрессионной библиотеки;
(d) представление антител, кодируемых лентивирусной экспрессионной библиотекой, на поверхности эукариотических клеток млекопитающих; и
(e) выделение из популяции эукариотических клеток клетки, где клетка выбрана по способности антитела, представленного на ее поверхности, специфически связываться с антигеном или антигенами, представляющими интерес, или с их фрагментами или антигенными детерминантами.
Одним из аспектов, о котором сообщается в данном документе, является способ отбора клетки, экспрессирующей биспецифическое антитело (которое специфически связывается с двумя антигенами, представляющими интерес), включающий следующие этапы:
(a) создание лентивирусной экспрессионной библиотеки, где каждый представитель лентивирусной экспрессионной библиотеки кодирует вариант биспецифического антитела, путем
(i) создания множества молекул ДНК из ДНК, кодирующей одно биспецифическое антитело, путем рандомизации кодирующей нуклеиновокислотной последовательности, и
(ii) клонирования множества молекул ДНК в лентивирусный экспрессионный вектор, содержащий EV71-IRES-связанную бицистронную экспрессионную кассету для экспрессии полноразмерного биспецифического антитела в мембраносвязанной форме;
(b) трансдукция популяции эукариотических клеток популяцией лентивирусных частиц, каждая из которых содержит представителя лентивирусной экспрессионной библиотеки;
(c) представление антител, кодируемых лентивирусной экспрессионной библиотекой, на поверхности эукариотических клеток млекопитающего; и
(d) выделение из популяции эукариотических клеток клетки, где клетка выбрана по способности антитела, представленного на ее поверхности, специфически связываться с антигенами, представляющими интерес, или с их фрагментами или антигенными детерминантами.
Применение лентивирусной экспрессионной библиотеки в сочетании с лентивирусным экспрессионным вектором, содержащим EV71-IRES-связанную бицистронную экспрессионную кассету, для экспрессии легкой цепи полноразмерного антитела и тяжелой цепи полноразмерного антитела как в растворимой, так и в мембраносвязанной форме, позволяет достичь высокой эффективности скрининга.
В одном воплощении способ включает создание множества молекул ДНК, кодирующих антитела, которое включает следующие этапы:
(1) амплификация из субпопуляции В-клеток первого пула молекул ДНК, кодирующих вариабельные области тяжелой цепи (HCVR); и
(2) амплификация из субпопуляции В-клеток второго пула молекул ДНК, кодирующих вариабельные области легкой цепи (LCVR);
(3) клонирование комбинации множества молекул ДНК, кодирующих LCVR, и множества молекул ДНК, кодирующих HCVR, в лентивирусный экспрессионный вектор, содержащий EV71-IRES-связанную бицистронную экспрессионную кассету, для экспрессии легкой цепи полноразмерного антитела и тяжелой цепи полноразмерного антитела одновременно как в растворимой, так и в мембраносвязанной форме.
В одном воплощении способ включает создание множества молекул ДНК, кодирующих антитела, которые специфически связываются с одним или двумя антигенами, представляющими интерес, при этом создание множества молекул ДНК включает следующие этапы:
(1) амплификация из отдельной В-клетки или клональной популяции В-клеток молекулы ДНК, кодирующей HCVR, и молекулы ДНК, кодирующей LCVR, и
(2) рандомизация молекулы ДНК, кодирующей HCVR, и/или молекулы ДНК, кодирующей LCVR, путем рандомизации по меньшей мере одного кодона и тем самым создание множества молекул ДНК, кодирующих HCVR, и множества молекул ДНК, кодирующих LCVR;
(3) клонирование комбинации рандомизированного множества молекул ДНК, кодирующих LCVR, и множества молекул ДНК, кодирующих HCVR, в лентивирусный экспрессионный вектор, содержащий EV71-IRES-связанную бицистронную экспрессионную кассету, для экспрессии легкой цепи полноразмерного антитела и тяжелой цепи полноразмерного антитела одновременно как в растворимой, так и в мембраносвязанной форме.
В одном воплощении способ включает создание лентивирусной экспрессионной библиотеки, которое включает следующие этапы:
(i) создание множества молекул ДНК, кодирующих антитела, включающееэтапы:
(1) выделения мРНК из субпопуляции В-клеток;
(2) транскрипции мРНК в кДНК;
(3) амплификации из кДНК первого пула молекул ДНК с помощью первой смеси олигонуклеотидов, содержащей по меньшей мере два олигонуклеотида, способных амплифицировать кодирующие области HCVR; и
(4) амплификации из кДНК второго пула молекул ДНК с помощью второй смеси олигонуклеотидов, содержащей по меньшей мере два олигонуклеотида, способных амплифицировать кодирующие области LCVR;
(ii) клонирование пары молекул ДНК из первого и второго пула молекул ДНК в лентивирусный экспрессионный вектор, содержащий EV71-IRES-связанную бицистронную экспрессионную кассету, для экспрессии легкой цепи полноразмерного антитела и тяжелой цепи полноразмерного антитела одновременно как в растворимой, так и в мембраносвязанной форме.
В одном воплощении способ включает создание лентивирусной экспрессионной библиотеки, включающее следующие этапы:
(i) создание множества молекул ДНК, кодирующих антитела, которые специфически связываются с одним или двумя антигенами, при этом создание включает этапы:
(1) выделения мРНК из отдельной В-клетки или клональной популяции В-клеток;
(2) транскрипции мРНК в кДНК;
(3) амплификации из кДНК первой молекулы ДНК с помощью первой смеси олигонуклеотидов, содержащей по меньшей мере два олигонуклеотида, способных амплифицировать кодирующие области HCVR; и
(4) амплификации из кДНК второй молекулы ДНК с помощью второй смеси олигонуклеотидов, содержащей по меньшей мере два олигонуклеотида, способных амплифицировать кодирующие области LCVR;
(5) рандомизации первой и/или второй молекулы ДНК и тем самым создания первого пула молекул ДНК и второго пула молекул ДНК,
(ii) клонирование пары молекул ДНК первого и второго пулов молекул ДНК в лентивирусный экспрессионный вектор, содержащий EV71-IRES-связанную бицистронную экспрессионную кассету, для экспрессии легкой цепи полноразмерного антитела и тяжелой цепи полноразмерного антитела одновременно как в растворимой, так и в мембраносвязанной форме.
Одним из аспектов, о котором сообщается в данном документе, является способ отбора клетки, экспрессирующей биспецифическое антитело (которое специфически связывается с двумя антигенами, представляющими интерес), включающий следующие этапы:
(a) создание лентивирусной экспрессионной библиотеки, где каждый представитель лентивирусной экспрессионной библиотеки кодирует варианты тяжелых цепей биспецифического антитела, путем
(i) создания множества молекул ДНК из ДНК, кодирующей тяжелые цепи одного биспецифического антитела, путем рандомизации кодирующей нуклеиновокислотной последовательности, и
(ii) клонирования множества молекул ДНК в лентивирусный экспрессионный вектор, содержащий EV71-IRES-связанную бицистронную экспрессионную кассету, для экспрессии двух тяжелых цепей биспецифического антитела, где нуклеиновая кислота ниже EV71-IRES кодирует тяжелую цепь антитела с C-концевым трансмембранным доменом;
(b) трансдукция популяции эукариотических клеток, экспрессирующих легкую цепь антитела, которая может формировать антигенсвязывающий сайт с любой из тяжелых цепей антитела, популяцией лентивирусных частиц, каждая из которых содержит представителя лентивирусной экспрессионной библиотеки;
(c) представление антител, кодируемых лентивирусной экспрессионной библиотекой, на поверхности эукариотических клеток млекопитающего; и
(d) выделение из популяции эукариотических клеток клетки, где клетка выбрана по способности антитела, представленного на ее поверхности, специфически связываться с антигенами, представляющими интерес, или с их фрагментами или антигенными детерминантами.
Одним из аспектов, о котором сообщается в данном документе, является лентивирусный экспрессионный вектор для представления полноразмерного антитела на поверхности эукариотической клетки.
В одном воплощении экспрессионный вектор содержит элементы ДНК, кодирующие сигнальный пептид, EV71-IRES, трансмембранную область и, возможно, метку для обнаружения.
В одном воплощении экспрессионный вектор содержит сайт рестрикции, позволяющий клонирование, особенно клонирование в определенной ориентации, молекул ДНК, кодирующих тяжелую цепь полноразмерного антитела и легкую цепь полноразмерного антитела в экспрессионный вектор.
Одним из аспектов, о котором сообщается в данном документе, является экспрессионная библиотека, содержащая экспрессионный вектор, о котором сообщается в данном документе.
Одним из аспектов, о котором сообщается в данном документе, является эукариотическая клетка, содержащая экспрессионный вектор, о котором сообщается в данном документе, или содержащая по меньшей мере один представитель экспрессионной библиотеки, о которой сообщается в данном документе.
Моноклональные антитела, полученные способом, о котором сообщается в данном документе, могут быть использованы в исследовательских целях, диагностических целях или для лечения заболеваний.
В одном воплощении эукариотическая клетка является клеткой млекопитающего или дрожжевой клеткой. В одном воплощении клетка млекопитающего является клеткой CHO или клеткой HEK.
Одним из аспектов, о котором сообщается в данном документе, является способ отбора клетки, экспрессирующей антитело, включающий следующие этапы:
(a) получение популяции эукариотических клеток путем трансдукции популяцией лентивирусных вирусных частиц, в результате чего каждая клетка в популяции клеток представляет мембраносвязанное полноразмерное антитело, которое закодировано лентивирусной нуклеиновой кислотой и которое специфически связывается с одним или более антигеном или одним или более эпитопом на одном и том же антигене, и
(b) выбор из популяции эукариотических клеток клетки в зависимости от свойств представленного мембраносвязанного полноразмерного антитела,
при этом каждая лентивирусная частица из популяции лентивирусных частиц включает бицистронную экспрессионную кассету, содержащую EV71-IRES, для экспрессии мембраносвязанного антитела.
В одном воплощении каждая бицистронная экспрессионная кассета в лентивирусной частице из популяции лентивирусных частиц кодирует другой вариант родительского антитела, который специфически связывается с одним или более чем одним антигеном или одним или более чем одним эпитопом на одном и том же антигене.
В одном воплощении каждая бицистронная экспрессионная кассета включает в направлении от 5'- к 3'-
- промотор,
- первую нуклеиновую кислоту, кодирующую легкую цепь полноразмерного антитела,
- EV71-IRES,
- вторую нуклеиновую кислоту, кодирующую тяжелую цепь полноразмерного антитела,
- интрон с возможностью сплайсинга, и
- трансмембранный домен или GPI-якорь.
В одном воплощении каждая клетка из популяции эукариотических клеток представляет мембраносвязанное полноразмерное антитело и секретирует полноразмерное антитело.
В одном воплощении каждая клетка из популяции эукариотических клеток представляет и секретирует одно полноразмерное антитело.
В одном воплощении антитело представляет собой биспецифическое антитело.
Одним из аспектов, о котором сообщается в данном документе, является лентивирусный вектор, содержащий бицистронную экспрессионную кассету, которая включает в направлении от 5'- к 3'-
- промотор,
- первую нуклеиновую кислоту, кодирующую легкую цепь полноразмерного антитела,
- EV71-IRES,
- вторую нуклеиновую кислоту, кодирующую тяжелую цепь полноразмерного антитела,
- интрон с возможностью альтернативного сплайсинга для одновременной продукции мембраносвязанного антитела и секретируемого антитела, и
- трансмембранный домен или GPI-якорь.
Одним из аспектов, о котором сообщается в данном документе, является лентивирусный вектор, содержащий бицистронную экспрессионную кассету, которая включает в направлении от 5'- к 3'-
- промотор,
- первую нуклеиновую кислоту, кодирующую первую тяжелую цепь полноразмерного антитела,
- EV71-IRES,
- вторую нуклеиновую кислоту, кодирующую в направлении от 5'- к 3'-вторую тяжелую цепь полноразмерного антитела и трансмембранный домен или GPI-якорь.
Одним из аспектов, о котором сообщается в данном документе, является применение лентивирусного вектора в соответствии с предыдущими аспектами для создания популяции эукариотических клеток, представляющих и секретирующих или представляющих полноразмерное антитело.
Одним из аспектов, о котором сообщается в данном документе, является способ отбора клетки, экспрессирующей биспецифическое антитело, включающий следующие этапы:
(a) создание популяции эукариотических клеток путем трансдукции популяцией лентивирусных частиц, где каждая лентивирусная частица содержит бицистронную экспрессионную кассету, которая содержит первую нуклеиновую кислоту, кодирующую вариабельный домен тяжелой цепи в локусе «замок» или «ключ», которая располагается выше EV71-IRES, и вторую нуклеиновую кислоту, кодирующую вариабельный домен тяжелой цепи, в соответствующем другом локусе, который располагается ниже EV71-IRES, при этом первый вариабельный домен тяжелой цепи связывается с первым антигеном, а второй вариабельный домен связывается со вторым антигеном, где первый антиген и второй антиген могут быть одинаковыми или различными, где эукариотическая клетка экспрессирует общую легкую цепь, где одна или обе тяжелые цепи также содержат трансмембранный домен на их С-конце, и
(b) выбор из популяции эукариотических клеток клетки в зависимости от свойств представленного мембраносвязанного полноразмерного биспецифического антитела.
В одном воплощении только тяжелая цепь ниже EV71-IRES содержит трансмембранный домен на своем С-конце.
Одним из аспектов, о котором сообщается в данном документе, является способ отбора клетки, секретирующей биспецифическое антитело, включающий следующие этапы:
(а) создание популяции эукариотических клеток путем трансдукции популяцией лентивирусных частиц, где каждая лентивирусная частица содержит бицистронную экспрессионную кассету, кодирующую секретируемое биспецифическое антитело, которая содержит первую нуклеиновую кислоту, кодирующую вариабельный домен тяжелой цепи в локусе «замок» или «ключ» выше EV71-IRES, и вторую нуклеиновую кислоту, кодирующую вариабельный домен тяжелой цепи, в соответствующем другом локусе ниже EV71-IRES, при этом первый вариабельный домен тяжелой цепи связывается с первым антигеном, а второй вариабельный домен связывается со вторым антигеном, где первый антиген и второй антиген могут быть одинаковыми или различными, где эукариотическая клетка экспрессирует общую легкую цепь, и
(b) выбор из популяции эукариотических клеток клетки в зависимости от свойств секретируемого полноразмерного биспецифического антитела.
В одном воплощении способ включает в качестве первого этапа:
- иммунизацию трансгенного животного представляющим интерес антигеном, где В-клетки экспериментального животного экспрессируют одну и ту же легкую цепь.
В одном воплощении способ включает этап:
- отбора В-клеток иммунизированного экспериментального животного с помощью общей сортировки путем FACS.
В одном воплощении способ включает этап:
- получения нуклеиновой кислоты, кодирующей тяжелую цепь, из каждой В-клетки путем отдельной ПЦР-амплификации в двух отдельных/последовательных полимеразных цепных реакциях, внедряющих уникальные сайты рестрикции для направленного клонирования в шаттл-вектор/лентивирусный экспрессионный вектор.
В одном воплощении способ включает этап:
- выполнения ПЦР нуклеиновой кислоты, кодирующей полную первую тяжелую цепь, и нуклеиновой кислоты, кодирующей вариабельный домен второй тяжелой цепи (2,2 т.п.о.), включая EV71-IRES, и клонирования во второй шаттл-вектор без трансмембранного домена с удалением трансмембранного домена первой тяжелой цепи путем рестрикции и повторного лигирования вектора.
Все воплощения, о которых сообщалось в данном документе, относятся ко всем аспектам данного изобретения и могут быть объединены в любой возможной комбинации.
Подробное описание изобретения
В данном документе сообщается о способе отбора с помощью экспрессии полноразмерных антител в их естественной среде, т.е. секреторном пути клеток млекопитающих, который гарантирует, что все клеточные компоненты, обычно участвующие в синтезе и процессинге антител (сворачивании, формировании дисульфидных связей, гликозилировании и т.д.) доступны в физиологической форме и концентрации.
Общие аспекты
Как известно специалистам в данной области, для производства многочисленных производных нуклеиновой кислоты и/или полипептида можно использовать технологии рекомбинантной ДНК. Такие производные могут, например, быть изменены в одной отдельной или нескольких позициях путем замещения, изменения, замены, удаления или вставки. Такое изменение или образование производного может быть осуществлено, например, путем сайт-направленного мутагенеза. Такое изменение может быть легко проведено специалистом в данной области (смотри, например, Sambrook, J., et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York, USA (1999)). Применение рекомбинантной технологии позволяет специалисту в данной области трансформировать различные клетки-хозяева гетерологичной нуклеиновой кислотой (кислотами). Хотя в разных клетках в технике транскрипции и трансляции, т.е. экспрессии, используются одни и те же элементы, клетки, принадлежащие разным видам, могут помимо прочего иметь различную так называемую частоту использования кодонов. Таким образом, идентичные полипептиды (в отношении аминокислотной последовательности) могут быть закодированы различными нуклеиновыми кислотами. Кроме того, различные нуклеиновые кислоты могут кодировать один и тот же полипептид вследствие вырожденности генетического кода.
Применение технологии рекомбинантной ДНК позволяет получать многочисленные производные нуклеиновой кислоты и/или полипептида. Такие производные могут, например, быть изменены в одной отдельной или нескольких позициях путем замещения, изменения, замены, удаления или вставки. Такое изменение или образование производного может быть осуществлено, например, путем сайт-направленного мутагенеза. Такие изменения могут быть легко проведены специалистом в данной области (см., например, Sambrook, J., et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York, USA (1999); Hames, B.D., and Higgins, S.J., Nucleic acid hybridization - a practical approach, IRL Press, Oxford, England (1985)).
Применение рекомбинантной технологии позволяет специалисту в данной области трансформировать различные клетки-хозяева гетерологичной нуклеиновой кислотой (кислотами). Хотя в разных клетках в технике транскрипции и трансляции, т.е. экспрессии, используются одни и те же элементы, клетки, принадлежащие разным видам, могут помимо прочего иметь различную так называемую частоту использования кодонов. Таким образом, идентичные полипептиды (в отношении аминокислотной последовательности) могут быть закодированы различными нуклеиновыми кислотами. Кроме того, различные нуклеиновые кислоты могут кодировать один и тот же полипептид вследствие вырожденности генетического кода.
Определения
Понятие антитела с «созревшей аффинностью» относится к антителу с одним или более изменением в одной или более гипервариабельной области (hypervariable region, HVR) по сравнению с родительским антителом, которое не обладает такими изменениями, причем такие изменения приводят к повышению аффинности антитела к антигену.
Термин «антитело» в данном документе используется в самом широком его смысле и охватывает различные структуры антитела, в том числе, но не ограничиваясь ими, моноклональные антитела, поликлональные антитела и полиспецифические антитела (например, биспецифические антитела).
Термин «химерное антитело» относится к антителу, в котором часть тяжелой и/или легкой цепи получена из конкретного источника или вида, в то время как остальная часть тяжелой и/или легкой цепи получена из другого источника или вида.
Понятие «класса» антитела относится к типу константного домена или константной области, принадлежащей его тяжелой цепи. Существуют пять основных классов антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть дополнительно подразделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются α, δ, ε, γ и μ соответственно.
Термин «экспрессия», используемый в данном документе, относится к процессам транскрипции и/или трансляции, протекающим в клетке. Уровень транскрипции в клетке нуклеиновокислотной последовательности, представляющей интерес, может быть определен на основании количества соответствующей мРНК, присутствующей в клетке. Например, мРНК, транскрибированная из последовательности, представляющей интерес, может быть количественно оценена с помощью ОТ-ПЦР или нозерн-гибридизации (Sambrook et al., 1999, см. выше). Полипептиды, кодируемые нуклеиновой кислотой, представляющей интерес, могут быть количественно оценены с помощью различных способов, например, ELISA, с помощью анализа на биологическую активность полипептида или с помощью анализов, которые независимы от такой активности, например вестерн-блота или радиоиммунного анализа, с использованием иммуноглобулинов, которые распознают и связываются с полипептидом (Sambrook et al., 1999, см. выше).
Термин «экспрессионная кассета» относится к конструкции, содержащей необходимые регуляторные элементы, такие как промотор и сайт полиаденилирования, для экспрессии по меньшей мере содержащейся в клетке нуклеиновой кислоты.
«Экспрессионный вектор» представляет собой нуклеиновую кислоту, которая обеспечивает все необходимые элементы для экспрессии включенного структурного гена (генов) в клетке-хозяине. Как правило, экспрессионная плазмида содержит блок для размножения прокариотической плазмиды, например для Е. coli, содержащий сайт начала репликации и маркер для селекции, эукариотический маркер для селекции и одну или более экспрессионную кассету для экспрессии представляющего интерес структурного гена (генов), каждая из которых содержит промотор, структурный ген и терминатор транскрипции, включая сигнал полиаденилирования. Экспрессия гена, как правило, находится под контролем промотора, и такой структурный ген называется «функционально связанным» с промотором. Аналогичным образом, регуляторный элемент и основной промотор функционально связаны, если регуляторный элемент модулирует активность основного промотора.
Термин «Fc-область» в данном документе используется для определения С-концевой области тяжелой цепи иммуноглобулина, которая содержит по меньшей мере часть константной области. Этот термин включает Fc-области нативной последовательности и вариантные Fc-области. В одном воплощении Fc-область тяжелой цепи человеческого IgG простирается от Cys226 или от Pro230 до карбокси-конца тяжелой цепи. Тем не менее, С-концевой лизин (Lys447) Fc-области может присутствовать или отсутствовать. Если не указано иное, то нумерация аминокислотных остатков в Fc-области или константной области осуществляется в соответствии с системой нумерации ЕС, также называемой индексом ЕС, как описано в Kabat, Е.А., et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991), NIH Publication 91-3242.
Понятие «каркасного участка», или «FR», относится к остаткам вариабельного домена, отличным от остатков гипервариабельной области (HVR). FR вариабельного домена обычно состоит из четырех доменов FR: FR1, FR2, FR3 и FR4. Соответственно, последовательности HVR и FR обычно появляются в следующей последовательности в VH (или VL): FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
Термины «полноразмерное антитело», «интактное антитело» и «целое антитело» используются в данном документе взаимозаменяемо для обозначения антитела, имеющего структуру, по существу аналогичную структуре нативного антитела, или содержащего тяжелые цепи с Fc-областью, определенной в данном документе.
Термин «ген» означает нуклеиновую кислоту, которая представляет собой сегмент, например, на хромосоме или на плазмиде, который может влиять на экспрессию пептида, полипептида или белка. Кроме кодирующей области, т.е. структурного гена, ген содержит и другие функциональные элементы, например, сигнальную последовательность, промотор(ы), интроны и/или терминаторы.
Термины «клетка-хозяин», «клеточная линия-хозяин» и «клеточная культура-хозяин» используются взаимозаменяемо и относятся к клеткам, в которые может быть введена экзогенная нуклеиновая кислота, включая потомство таких клеток. Клетки-хозяева включают «трансформанты» и «трансформированные клетки», которые включают первичную трансформированную клетку и потомство, полученное из нее, независимо от числа пассажей. Потомство может не быть абсолютно идентичным родительской клетке по содержанию нуклеиновых кислот, а может содержать мутации. В данный документ включено мутантное потомство, которое имеет такую же функцию или биологическую активность, которая показана или выбрана для исходно трансформированной клетки.
«Человеческое антитело» является таким антителом, которое имеет аминокислотную последовательность, соответствующую антителу, полученному от человека или из клетки человека или полученному из нечеловеческого источника, который использует репертуар человеческих антител или другие последовательности, кодирующие человеческие антитела. Это определение человеческого антитела специально исключает гуманизированное антитело, содержащее нечеловеческие антигенсвязывающие остатки.
Понятие «гуманизированного» антитела относится к химерному антителу, содержащему аминокислотные остатки из нечеловеческих HVR и аминокислотные остатки из человеческих FR. В некоторых воплощениях гуманизированное антитело будет включать по существу все из по меньшей мере одного, а обычно двух вариабельных доменов, в которых все или по существу все HVR (например, CDR) соответствуют таковым из нечеловеческого антитела, и все или по существу все FR соответствуют таковым из человеческого антитела. Гуманизированное антитело, возможно, может содержать по меньшей мере часть константной области антитела, полученной из человеческого антитела. «Гуманизированная форма» антитела, например, нечеловеческого антитела, относится к антителу, которое подверглось гуманизации.
Термин «гипервариабельная область», или «HVR», используемый в данном документе, относится к каждой из областей вариабельного домена антитела, которые являются гипервариабельными в последовательности и/или образуют структурно определенные петли («гипервариабельные петли»). Как правило, нативные четырехцепочечные антитела содержат шесть HVR, три в VH (Н1, Н2, Н3) и три в VL (L1, L2, L3). HVR обычно содержат аминокислотные остатки из гипервариабельных петель и/или из областей, определяющих комплементарность (CDR), причем последние имеют наивысшую изменчивость последовательности и/или участвуют в распознавании антигена. Иллюстративные гипервариабельные петли возникают на аминокислотных остатках 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (Н1), 53-55 (Н2) и 96-101 (Н3) (Chothia, С.and Lesk, A.M., J. Mol. Biol. 196 (1987) 901-917). Иллюстративные CDR (CDR-L1, CDR-L2, CDR-L3, CDR-H1, CDR-H2 и CDR-H3) возникают на аминокислотных остатках 24-34 в L1, 50-56 в L2, 89-97 в L3, 31-35B в Н1, 50-65 в Н2 и 95-102 в Н3 (Kabat, Е.А., et al., Sequences of Proteins of Immunological Interest, 5th ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991), NIH Publication 91-3242). За исключением CDR1 в VH, CDR, как правило, содержат аминокислотные остатки, которые образуют гипервариабельные петли. CDR также включают «остатки, определяющие специфичность», или «SDR», которые являются остатками, контактирующими с антигеном. SDR содержатся в областях CDR, называемых сокращенно -CDR, или a-CDR. Типичные a-CDR (a-CDR-L1, а-CDR-L2, a-CDR-L3, a-CDR-H1, a-CDR-H2 и a-CDR-H3) возникают на аминокислотных остатках 31-34 в L1, 50-55 в L2, 89-96 в L3, 31-35В в Н1, 50-58 в Н2 и 95-102 в Н3. (см. Almagro, J.С. and Fransson, J., Front. Biosci. 13 (2008) 1619-1633). Если не указано иное, то HVR-остатки и другие остатки в вариабельном домене (например, FR-остатки) пронумерованы в данном документе в соответствии с Kabat et al., см. выше.
Понятие «внутренний сайт посадки рибосом», или «IRES», описывает последовательность, которая функционально способствует инициации трансляции независимо от гена, расположенного с 5'-конца от IRES, и позволяет двум цистронам (открытым рамкам считывания) транслироваться из одного транскрипта в клетке животного. IRES обеспечивает независимый сайт посадки рибосомы для трансляции открытой рамки считывания непосредственно ниже его («ниже» в данном документе используется взаимозаменяемо с «3' «). В отличие от бактериальной мРНК, которая может быть полицистронной, т.е. кодировать несколько различных полипептидов, которые будут транслироваться последовательно с мРНК, большинство мРНК в клетках животных являются моноцистронными и кодируют для синтеза только один белок. С полицистронным транскриптом в эукариотической клетке трансляция будет начинаться с наиболее близкого к 5'-концу сайта инициации трансляции, заканчиваться на первом стоп-кодоне, и транскрипт будет высвобождаться из рибосомы, что приведет к трансляции только первого закодированного в мРНК полипептида. В эукариотической клетке полицистронный транскрипт, имеющий IRES, функционально связанный со второй или последующими открытыми рамками считывания в транскрипте, позволяет последовательную трансляцию этой следующей ниже открытой рамки считывания, чтобы получить два или более двух полипептидов, закодированных с помощью одного и того же транскрипта. Применение элементов IRES в конструировании векторов было описано ранее, см, например, Pelletier, J., et al., Nature 334 (1988) 320-325; Jang, S.K., et al., J. Virol. 63 (1989) 1651-1660; Davies, M.V., et al., J. Virol. 66 (1992) 1924-1932; Adam, M.A., et al., J. Virol. 65 (1991) 4985-4990; Morgan, R.A., et al. Nucl. Acids Res. 20 (1992) 1293-1299; Sugimoto, Y., et al., Biotechnology 12 (1994) 694-698; Ramesh, Ν., et al., Nucl. Acids Res. 24 (1996) 2697-2700; и Mosser, D.D., et al., BioTechniques 22 (1997) 150-152).
Термин «моноклональное антитело», используемый в данном документе, относится к антителу, полученному из популяции по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, являются идентичными и/или связывают один и тот же эпитоп, за исключением возможных вариантных антител, например, содержащих природные мутации или возникающих в процессе производства препарата моноклональных антител, при этом такие варианты, как правило, присутствуют в незначительных количествах. В отличие от препаратов поликлональных антител, которые обычно включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело из препарата моноклонального антитела направлено против одной детерминанты на антигене. Таким образом, понятие «моноклональное» указывает на характер антитела, полученного по существу из гомогенной популяции антител, и не должно быть истолковано как требующее получения антитела каким-либо конкретным способом. Например, моноклональные антитела, которые будут использоваться в соответствии с данным изобретением, могут быть получены с помощью различных методик, включая, но не ограничиваясь ими, гибридомную методику, методики рекомбинантной ДНК, методики фагового дисплея, а также методики, использующие трансгенных животных, содержащих все или часть локусов человеческого иммуноглобулина, при этом такие методики и другие иллюстративные способы получения моноклональных антител описаны в данном документе.
Понятие «нуклеиновой кислоты», используемое в данном документе, относится к полимерной молекуле, состоящей из отдельных нуклеотидов (также называемых основаниями) А, С, G и Τ (или U в РНК), например к ДНК, РНК или к их модификациям. Эта полинуклеотидная молекула может быть или природной полинуклеотидной молекулой, или синтетической полинуклеотидной молекулой, или комбинацией одной или более природной полинуклеотидной молекулы с одной или более синтетической полинуклеотидной молекулой. Также под это определение подпадают природные полинуклеотидные молекулы, в которых один или более нуклеотид изменен (например, путем мутагенеза), удален или добавлен. Нуклеиновая кислота может быть либо выделена, либо встроена в другую нуклеиновую кислоту, например, в экспрессионную кассету, плазмиду или хромосому клетки-хозяина. Нуклеиновая кислота аналогично характеризуется ее нуклеиновокислотной последовательностью, состоящей из отдельных нуклеотидов.
Для специалиста в данной области хорошо известны процедуры и способы преобразования аминокислотной последовательности, например, полипептида, в соответствующую нуклеиновокислотную последовательность, кодирующую эту аминокислотную последовательность. Таким образом, нуклеиновая кислота характеризуется своей нуклеиновокислотной последовательностью, состоящей из отдельных нуклеотидов, и аналогично аминокислотной последовательностью полипептида, кодируемого ею.
Понятие «нуклеиновой кислоты», используемое в данном документе, относится также к природной или частично или полностью неприродной нуклеиновой кислоте, кодирующей полипептид, которая может быть получена рекомбинантно. Нуклеиновая кислота может быть построена из ДНК-фрагментов, которые либо выделены, либо синтезированы химическим путем. Нуклеиновая кислота может быть встроена в другую нуклеиновую кислоту, например в экспрессионную плазмиду или геном/хромосому эукариотической клетки-хозяина. Плазмида включает шаттл-плазмиды и экспрессионные плазмиды. Как правило, плазмида также будет содержать прокариотический блок размножения, содержащий сайт инициации репликации (например, сайт инициации репликации Со1Е1) и маркер для селекции (например, ген устойчивости к ампициллину или тетрациклину) для репликации и селекции, соответственно, плазмиды в прокариотах.
Понятие «функционально связанные» относится к сопоставлению двух или более компонентов, где компоненты, описанные таким образом, находятся во взаимосвязи, позволяющей им функционировать предназначенным им способом. Например, промотор и/или энхансер функционально связан с кодирующей последовательностью, если он действует так, чтобы контролировать или модулировать транскрипцию связанной последовательности. Как правило, но не обязательно, последовательности ДНК, которые «функционально связаны», являются смежными и, если необходимо соединить две области, кодирующие белки, такие как секреторный лидер и полипептид, являются смежными и находятся в рамке (считывания). Тем не менее, хотя функционально связанный промотор, как правило, расположен выше кодирующей последовательности, он не обязательно является смежным с ней. Энхансеры не должны быть смежными. Энхансер функционально связан с кодирующей последовательностью, если он усиливает транскрипцию кодирующей последовательности. Функционально связанные энхансеры могут быть расположены выше, в пределах или ниже кодирующих последовательностей и на значительном удалении от промотора. Сайт полиаденилирования функционально связан с кодирующей последовательностью, если он расположен на нижнем конце кодирующей последовательности таким образом, что транскрипция проходит через кодирующую последовательность в последовательность полиаденилирования. Стоп-кодон трансляции функционально связан с экзонной нуклеиновокислотной последовательностью, если он расположен на нижнем конце (3'-конце) кодирующей последовательности таким образом, что трансляция проходит через кодирующую последовательность до стоп-кодона и заканчивается там. Связывание осуществляют с помощью рекомбинантных способов, известных в данной области, например, с помощью методики ПЦР и/или лигирования по подходящим сайтам рестрикции. Если подходящих сайтов рестрикции нет, то в соответствии с обычной практикой используются синтетические олигонуклеотидные адаптеры или линкеры.
«Полицистронный блок транскрипции» представляет собой блок транскрипции, в котором более чем один структурный ген находится под контролем одного и того же промотора.
Термин «сигнал полиаденилирования» (полиА-сигнал), используемый в данной заявке, обозначает нуклеиновокислотную последовательность, используемую для индукции расщепления и полиаденилирования первичных транскриптов конкретного нуклеиновокислотного сегмента. 3'-нетранслируемая область, включающая сигнал полиаденилирования, может быть выбрана из группы, состоящей из 3'-нетранслируемой области, содержащей сигналы полиаденилирования, полученные из SV40, гена бычьего гормона роста (bGH), генов иммуноглобулинов и гена тимидинкиназы (tk, например, сигнал полиаденилирования гена тимидинкиназы вируса простого герпеса).
Понятие «промотора» относится к полинуклеотидной последовательности, контролирующей транскрипцию гена/структурного гена или нуклеиновокислотной последовательности, с которой он функционально связан. Промотор включает сигналы для связывания РНК-полимеразы и инициации транскрипции. Используемые промоторы будут функционировать в типе клеток-хозяев, в котором предусмотрена экспрессия выбранной последовательности. Большое число промоторов, в том числе конститутивных, индуцируемых и репрессируемых промоторов, из множества различных источников хорошо известны в данной области (и определены в базах данных, таких как GenBank) и доступны в виде и внутри клонированных полинуклеотидов (например, из таких депозитариев как АТСС, а также других коммерческих или индивидуальных источников).
«Промотор» включает нуклеотидную последовательность, которая направляет транскрипцию структурного гена. Как правило, промотор расположен в 5'-некодирующей или нетранслируемой области гена проксимальнее сайта начала транскрипции структурного гена. Элементы последовательности в промоторе, которые функционируют в инициации транскрипции, часто характеризуются консенсусными нуклеотидными последовательностями. Эти промоторные элементы включают сайты связывания РНК-полимеразы, последовательности TATA, последовательности СААТ, специфичные по дифференциации элементы (DSE; McGehee, R.E., et al., Mol. Endocrinol. 7 (1993) 551), элементы ответа на циклический АМФ (CRES), элементы сывороточного ответа (SRE; Treisman, R., Seminars in Cancer Biol. 1 (1990) 47), элементы глюкокортикоидного ответа (GRE) и сайты связывания других факторов транскрипции, например, CRE/ATF (OʹReilly, М.А., et al., J. Biol. Chem. 267 (1992) 19938), AP2 (Ye, J., et al., J. Biol. Chem. 269 (1994) 25728), SP1, белка, связывающего элементы ответа цАМФ (CREB; Loeken, M.R., Gene Expr. 3 (1993) 253) и октамерные факторы (основные положения см. в Watson et al., (eds.), Molecular Biology of the Gene, 4th ed. (The Benjamin/Cummings Publishing Company, Inc. (1987)), и Lemaigre, F.P. and Rousseau, G.G., Biochem. J. 303 (1994) 1-14). Если промотор является индуцибельным промотором, то скорость транскрипции повышается в ответ на индуцирующий агент.Напротив, скорость транскрипции не регулируется индуцирующим агентом, если промотор является конститутивным промотором. Также известны репрессирующие промоторы.
Например, промотор c-fos специфически активируется при связывании гормона роста с его рецептором на поверхности клетки. Регулируемая тетрациклином (tet) экспрессия может быть активирована искусственными гибридными промоторами, которые состоят, например, из CMV-промотора, сопровождаемого двумя сайтами Tet-оператора. Tet-penpeccop связывается с двумя сайтами Tet-оператора и блокирует транскрипцию. При добавлении индуктора тетрациклина Tet-репрессор высвобождается с сайтов Tet-оператора? и происходит транскрипция (Gossen M., Bujard H., Proc. Natl. Acad. Sci. USA 89, 1992, cc.5547-5551). О других индуцибельных промоторах, включая промотор металлотионеина и промоторы теплового шока, см., например, Sambrook et al. (выше), и Gossen et al., Curr. Opin. Biotech. 5 (1994) 516-520. Среди эукариотических промоторов, описанных в качестве сильных промоторов для высокого уровня экспрессии, имеются ранний промотор вируса SV40, главный поздний промотор аденовируса, промотор металлотионеина-1 мыши, длинный концевой повтор вируса саркомы Рауса, фактор элонгации 1 альфа китайского хомячка (CHEF-1, см., например, US 5888809), EF-1 альфа человека, убиквитин и прямой ранний промотор цитомегаловируса человека (CMV IE).
«Промотор» может быть конститутивным или индуцибельным. Энхансер (т.е., cis-действующий элемент ДНК, который воздействует на промотор для повышения транскрипции) может быть необходимым для функционирования в соединении с промотором для повышения уровня экспрессии, достигаемого с одним промотором, и может быть включен в качестве элемента регуляции транскрипции. Часто полинуклеотидный сегмент, содержащий промотор, может также включать энхансерные последовательности (например, CMV или SV40).
Термин «терминатор транскрипции» обозначает последовательность ДНК длиной 50-750 пар оснований, которая дает РНК-полимеразе сигнал для прекращения синтеза мРНК. Желательны очень эффективные (сильные) терминаторы на 3'-конце экспрессионной кассеты, чтобы предотвратить считывание РНК-полимеразой до конца, особенно при использовании сильных промоторов. Неэффективные терминаторы транскрипции могут привести к образованию оперон-подобной мРНК, которая может быть причиной экспрессии нежелательного, например, закодированного плазмидой, гена.
В рамках данного изобретения трансфицированные клетки могут быть получены практически любым известным в данной области способом трансфекции. Например, нуклеиновая кислота может быть введена в клетки путем электропорации или микроинъекции. Альтернативно, могут применяться реагенты для липофекции, например, FuGENE 6 (Roche Diagnostics GmbH, Германия), X-tremeGENE (Roche Diagnostics GmbH, Германия) и LipofectAmine (фирма Invitrogen Corp., США). Альтернативно, нуклеиновая кислота может быть введена в клетки с помощью соответствующих систем вирусных векторов, основанных на ретровирусах, лентивирусах, аденовирусах или адено-ассоциированных вирусах (Singer, О., Proc. Natl. Acad. Sci. USA 101 (2004) 5313-5314).
Термин «вариабельная область» или «вариабельный домен» относится к домену тяжелой или легкой цепи антитела, который участвует в связывании антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL соответственно) нативного антитела обычно имеют схожую структуру, при этом каждый домен содержит четыре консервативные каркасные области (FR, framework region) и три гипервариабельных участка (HVR, hypervariable region). См., например, Kindt et al., Kuby Immunology, 6th ed., W.H. Freeman and Co., (2007), c. 91). Один VH- или VL-домен может быть достаточным для придания специфичности связывания с антигеном. Кроме того, антитела, которые связываются с конкретным антигеном, могут быть выделены с помощью VH- или VL-домена из антитела, которое связывается с антигеном, для скрининга библиотеки комплементарных VL- или VH-доменов соответственно (см., например, Portolano, S., et al., J. Immunol. 150 (1993) 880-887; Clackson, T., et al., Nature 352 (1991) 624-628).
Термин «вектор» означает нуклеиновокислотную молекулу, способную размножать другую нуклеиновую кислоту, с которой она связана. Этот термин включает вектор как самореплицирующуюся нуклеиновокислотную структуру, а также вектор, включенный в геном клетки-хозяина, в которую он был внедрен. Некоторые векторы способны направлять экспрессию нуклеиновых кислот, с которыми они функционально связаны. Такие векторы называются в данном документе «экспрессионными векторами».
Термин «животное» означает организм, имеющий иммунную систему, способную продуцировать антитела. В одном воплощении животное выбрано среди рыб, амфибий, птиц, рептилий и млекопитающих, в основном парнокопытных, грызунов и приматов. В одном воплощении животное выбрано из группы, состоящей из овцы, лося, оленя, осла, мулового оленя, норки, лошади, крупного рогатого скота, свиньи, козы, собаки, кошки, крысы, хомяка, морской свинки и мыши. В одном воплощении животное представляет собой мышь, крысу или примата. В одном воплощении животное представляет собой примата или человека. В одном воплощении животное представляет собой трансгенное животное с человеческим иммуноглобулиновым локусом.
Вариабельная область легкой цепи (LCVR) кодируется перестроенными нуклеиновокислотными молекулами, полученными из зародышевых генов соответствующего животного. Вариабельная область легкой цепи представляет собой либо каппа LCVR, либо лямбда LCVR.
В одном воплощении вариабельная область легкой цепи представляет собой человеческие LCVR каппа. В одном воплощении вариабельная область легкой цепи представляет собой вариабельную область легкой цепи, которая кодируется нуклеиновой кислотой (ДНК), которая может быть амплифицирована из В-клеток человека или В-клеток трансгенного животного с человеческим иммуноглобулиновым локусом, с использованием комбинации праймеров одного или более среди SEQ ID №№12-18 и SEQ ID №19, и условий ПЦР, описанных в примере 11.
В одном воплощении вариабельная область легкой цепи представляет собой человеческую LCVR лямбда. В одном воплощении вариабельная область легкой цепи представляет собой вариабельную область, которая кодируется нуклеиновой кислотой (ДНК), которая может быть амплифицирована из В-клеток человека или В-клеток трансгенного животного с человеческим иммуноглобулиновым локусом, с использованием комбинации праймеров одного или более среди SEQ ID №№20-27 и SEQ ID №28 и условий ПЦР, описанных в примере 11.
Вариабельная область тяжелой цепи (HCVR) кодируется перестроенными нуклеиновокислотными молекулами, полученными из зародышевых генов соответствующего животного. В одном воплощении вариабельная область тяжелой цепи представляет собой человеческую вариабельную область тяжелой цепи. В одном воплощении вариабельная область тяжелой цепи представляет собой вариабельную область тяжелой цепи, которая кодируется нуклеиновой кислотой (ДНК), которая может быть амплифицирована из В-клеток человека или В-клеток трансгенного животного с человеческим иммуноглобулиновым локусом с использованием комбинации праймеров одного или более среди SEQ ID №№1-4 и SEQ ID №5 и условий ПЦР, описанных в примере 11.
Вариабельная область тяжелой цепи (HCVR) кодируется перестроенными нуклеиновокислотными молекулами, полученными из зародышевых генов соответствующего животного. В одном воплощении вариабельная область тяжелой цепи представляет собой человеческую вариабельную область тяжелой цепи. В одном воплощении вариабельная область тяжелой цепи представляет собой вариабельную область тяжелой цепи, которая кодируется нуклеиновой кислотой (ДНК), которая может быть амплифицирована из В-клеток человека или В-клеток трансгенного животного с человеческим иммуноглобулиновым локусом с использованием комбинации праймеров одного или более среди SEQ ID №№6-10 и SEQ ID №11 и условий ПЦР, описанных в примере 11.
Антитело
Способы, представленные в данном документе, предназначены для получения рекомбинантных моноклональных антител. Антитела могут быть различной конструкции, например, но не ограничиваясь ими, моноспецифические антитела, полиспецифические антитела (например, биспецифические антитела), моновалентные антитела и поливалентные антитела (например, двухвалентные антитела).
В некоторых воплощениях антитело представляет собой химерное антитело. Некоторые химерные антитела описаны, например, в US 4816567; и Morrison, S.L., et al., Proc. Natl. Acad. Sci. USA 81 (1984) 6851-6855. В одном примере химерное антитело содержит нечеловеческую вариабельную область (например, вариабельную область, полученную от мыши, крысы, хомяка, кролика или примата, например, обезьяны) и человеческую константную область. В другом примере химерное антитело представляет собой антитело «с переключенным классом», у которого класс или подкласс был изменен по сравнению с родительским антителом. Химерные антитела включают их антигенсвязывающие фрагменты.
В некоторых воплощениях химерное антитело представляет собой гуманизированное антитело. Как правило, нечеловеческое антитело гуманизируют, чтобы снизить иммуногенность для человека, сохраняя при этом специфичность и аффинность родительского нечеловеческого антитела. Как правило, гуманизированное антитело содержит один или более чем один вариабельный домен, в котором HVR, например CDR (или их части), получены из нечеловеческого антитела, a FR (или их части) получены из последовательностей человеческого антитела. Гуманизированное антитело, возможно, также будет содержать по меньшей мере часть человеческой константной области. В некоторых воплощениях некоторые FR-остатки в гуманизированном антителе замещены на соответствующие остатки из нечеловеческого антитела (например, антитела, из которого получены остатки HVR), например, для восстановления или улучшения специфичности или аффинности антитела.
Гуманизированные антитела и способы их получения приведены, например, в Almagro and Fransson, Front Biosci 13, 1619-1633 (2008), а также, например, в Riechmann, I., et al., Nature 332 (1988) 323-329; Queen, С, et al., Proc. Natl. Acad. Sci. USA 86 (1989) 10029-10033; US №№5821337, US 7527791, US 6982321 и US 7087409; Kashmiri, S.V., et al., Methods 36 (2005) 25-34 (описывает прививание SDR (a-CDR)); Padlan, E.A., Mol. Immunol. 28 (1991) 489-498 (описывает «перекладку»); Dall'Acqua, W.F., et al., Methods 36 (2005) 43-60 (описывает «перетасовку FR»); и Osbourn, J., et al., Methods 36 (2005) 61-68 и Klimka, Α., et al., Br. J. Cancer 83 (2000) 252-260 (описывает подход «направляемой селекции» к перетасовке FR).
Человеческие каркасные области, которые могут быть использованы для гуманизации, включают, но не ограничиваясь ими: каркасные области, выбранные с помощью способа «наилучшей подгонки» (см, например, Sims, M.J., et al., J. Immunol. 151 (1993) 2296-2308); каркасные области, полученные из консенсусной последовательности человеческих антител конкретной подгруппы вариабельных областей легкой или тяжелой цепи (см, например, Carter, P., et al., Proc. Natl. Acad. Sci. USA 89 (1992) 4285-4289; и Presta, L.G., et al., J. Immunol. 151 (1993) 2623-2632); человеческие зрелые (соматически мутированные) каркасные области или человеческие зародышевые каркасные области (см, например, Almagro, J.С. and Fransson, J., Front. Biosci. 13 (2008) 1619-1633); и каркасные области, полученные при скрининге FR-библиотек (см, например, Baca, M., et al., J. Biol. Chem. 272 (1997) 10678-10684 и Rosok, M.J., et al., J. Biol. Chem. 271 (1996) 22611-22618).
В некоторых воплощениях антитело представляет собой человеческое антитело. Человеческие антитела могут быть получены с использованием различных методик, известных в данной области. Человеческие антитела в целом описаны в van Dijk, М.А. and van de Winkel, J.G., Curr. Opin. Pharmacol. 5 (2001) 368-374 и Lonberg, N.. Curr. Opin. Immunol. 20 (2008) 450-459.
Человеческие антитела могут быть получены путем введения иммуногена трансгенному животному, которое было модифицировано для получения интактных человеческих антител или интактных антител с человеческими вариабельными областями в ответ на антигенную стимуляцию. Такие животные, как правило, содержат все или часть человеческих иммуноглобулиновых локусов, которые заменяют эндогенные иммуноглобулиновые локусы или присутствуют вне хромосомы или интегрированы в случайном порядке в хромосомы животного. У таких трансгенных мышей эндогенные иммуноглобулиновые локусы, как правило, инактивированы. Обзор способов получения человеческих антител из трансгенных животных см. в Lonberg, Ν., Nat. Biotech. 23 (2005) 1117-1125, a также, например, US 6075181 и US 6150584, описывающие технологию XENOMOUSETM; US 5770429, описывающий технологию HuMAB®; US 7041870, описывающий технологию K-M MOUSE®, и US 2007/0061900, описывающий технологию VelociMouse®. Человеческие вариабельные области из интактных антител, образуемые такими животными, могут быть дополнительно модифицированы, например, путем объединения с другой человеческой константной областью.
Человеческие антитела также могут быть получены с помощью способов на основе гибридом. Были описаны клеточные линии миеломы человека и гетеромиеломы мыши-человека для получения человеческих моноклональных антител (см, например, Kozbor, D., J. Immunol. 133 (1984) 3001-3005; Brodeur, B.R., et al., Monoclonal Antibody Production Techniques and Applications, Marcel Dekker, Inc., New York (1987), pp.51-63; и Boerner, P., et al., J. Immunol. 147 (1991) 86-95). Человеческие антитела, полученные с помощью технологии человеческой В-клеточной гибридомы, также описаны в Li, J., et al., Proc. Natl. Acad. Sci. USA 103 (2006) 3557-3562. Дополнительные способы включают те, которые описаны, например, в US 7189826 (описывающем получение моноклональных антител IgM человека из гибридомных клеточных линий) и в Ni, J., Xiandai Mianyixue 26 (2006) 265-268 (описывающем человек-человеческие гибридомы). Технология человеческой гибридомы (технология триомы) также описана в Vollmers, H.P. and Brandlein, S., Histology and Histopathology 20 (2005) 927-937, и в Vollmers, H.P. and Brandlein, S., Methods and Findings in Experimental and Clinical Pharmacology 27 (2005) 185-191.
Человеческие антитела также могут быть получены путем выделения последовательностей Fv-клональных вариабельных доменов, выбранных из библиотек фагового дисплея человеческого происхождения. Такие последовательности вариабельного домена затем могут быть объединены с нужным человеческим константным доменом. Методики отбора человеческих антител из библиотек антител описаны ниже.
Антитела могут быть выделены путем скрининга комбинаторных библиотек на антитела с желаемой активностью или активностями. Например, в данной области известны различные способы формирования библиотек фагового дисплея и скрининга таких библиотек на антитела, обладающие желаемыми характеристиками связывания. Такие способы приведены, например, в Hoogenboom, H.R., et al., Methods Mol. Biol. 178 (2002) 1-37, а также описаны, например, в the McCafferty, J., et al., Nature 348 (1990) 552-554; Clackson, T., et al., Nature 352 (1991) 624-628; Marks, J.D., et al., J. Mol. Biol. 222 (1992) 581-597; Marks, J.D. and Bradbury, Α., Methods in Molecular Biology 248 (2003) 161-175; Sidhu, S.S., et al., J. Mol. Biol. 338 (2004) 299-310; Lee, C.V., et al., J. Mol. Biol. 340 (2004) 1073-1093; Fellouse, F.A., Proc. Natl. Acad. Sci. USA 101 (2004) 12467-12472; и Lee, C.V., et al., J. Immunol. Methods 284 (2004) 119-132.
В некоторых способах фагового дисплея репертуары VH-и VL-генов отдельно клонируют с помощью полимеразной цепной реакции (ПЦР) и рекомбинируют в случайном порядке в фаговых библиотеках, которые затем могут быть подвергнуты скринингу на антигенсвязывающий фаг, как описано в Winter, G., et al., Ann. Rev. Immunol. 12 (1994) 433-455. Фаг обычно представляет фрагменты антител либо в виде одноцепочечных Fv-фрагментов (scFv), либо в виде Fab-фрагментов. Библиотеки из иммунизированных источников дают высокоаффинные антитела к иммуногену без необходимости конструирования гибридом. Альтернативно, можно клонировать наивный репертуар (например, от человека), чтобы обеспечить единый источник антител к широкому кругу не своих, а также своих антигенов без иммунизации, как описано в Griffiths, A.D., et al., EMBO J. 12 (1993) 725-734. Наконец, наивные библиотеки также могут быть получены синтетически путем клонирования неперестроенных сегментов V-гена из стволовых клеток, а также с помощью ПЦР-праймеров, содержащих случайную последовательность, для кодирования высоко вариабельных CDR3-областей и для выполнения перестановки in vitro, как описано в Hoogenboom, H.R. and Winter, G., J. Mol. Biol. 227 (1992) 381-388. Патентные публикации, описывающие фаговые библиотеки человеческих антител, включают, например, US 5750373 и US 2005/0079574, US 2005/0119455, US 2005/0266000, US 2007/0117126, US 2007/0160598, US 2007/0237764, US 2007/0292936 и US 2009/0002360.
Антитела или фрагменты антител, выделенные из библиотек человеческих антител, являются человеческими антителами или фрагментами человеческих антител, рассматриваемыми в данном документе.
В некоторых воплощениях антитело представляет собой полиспецифическое антитело, например, биспецифическое антитело. Полиспецифические антитела представляют собой моноклональные антитела, которые обладают специфичностью связывания по меньшей мере с двумя различными сайтами. В некоторых воплощениях одна из специфичностей связывания наблюдается для первого антигена, а другая наблюдается для отличающегося второго антигена. В некоторых воплощениях биспецифические антитела могут связываться с двумя различными эпитопами на одном и том же антигене. Биспецифические антитела также могут быть использованы для локализации цитотоксических агентов на клетках, которые экспрессируют антиген. Биспецифические антитела могут быть получены в виде полноразмерных антител или фрагментов антител.
Методики изготовления полиспецифических антител включают, но не ограничиваясь ими, рекомбинантную коэкспрессию двух пар тяжелых цепей и легких цепей иммуноглобулина, имеющих различные специфичности (см. Milstein, С. and Cuello, А.С., Nature 305 (1983) 537-540, WO 93/08829, и Traunecker, A. et al., EMBO J. 10 (1991) 3655-3659), и инженерию типа «ключ в замке» (см., например, US 5731168). Полиспецифические антитела также могут быть получены за счет использования инженерных электростатических перемешивающих влияний для изготовления Fc-гетеродимерных молекул антитела (WO 2009/089004); поперечного сшивания двух или более антител или фрагментов (см., например, US 4676980, и Brennan, M. et al., Science 229 (1985) 81-83); использования лейциновых застежек для получения биспецифических антител (см., например, Kostelny, S.A. et al., J. Immunol. 148 (1992) 1547-1553); использования методики «димерного антитела» для изготовления фрагментов биспецифических антител (см., например, Holliger, P. et al., Proc. Natl. Acad. Sci. USA 90 (1993) 6444-6448); и использования одноцепочечных Fv-димеров (sFv) (см., например, Gruber, M et al., J. Immunol. 152 (1994) 5368-5374); и получения триспецифических антител, как описано, например, в Tutt, A. et al., J. Immunol. 147 (1991) 60-69).
Инженерные антитела с тремя и более функциональными антигенсвязывающими сайтами, в том числе «антитела-осьминоги», также включены в данный документ (см., например, US 2006/0025576).
Антитело или фрагмент в данном документе также включает полиспецифические антитела, описанные в WO 2009/080251, WO 2009/080252, WO 2009/080253, WO 2009/080254, WO 2010/112193, WO 2010/115589, WO 2010/136172, WO 2010/145792 и WO 2010/145793.
Методы
В некоторых воплощениях способы, предложенные в данном документе, используются для изменения, т.е. для увеличения или уменьшения, степени, в которой гликозилировано антитело.
Если антитело содержит Fc-область, то углевод, прикрепленный к ней, может быть изменен. Природные антитела, продуцируемые клетками млекопитающих, обычно содержат разветвленный двухантенный олигосахарид, который, как правило, прикреплен с помощью N-связи к Asn297 СН2-домена Fc-области (см., например, Wright, A. and Morrison, S.L., TIBTECH 15 (1997) 26-32). Олигосахарид может включать различные углеводы, например, маннозу, N-ацетилглюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, прикрепленную к GlcNAc в «стволе» двухантенной олигосахаридной структуры. В некоторых воплощениях модификации олигосахаридов в антителе изобретения могут быть сделаны для того, чтобы создать варианты антитела с определенными улучшенными свойствами.
В одном воплощении предложенные способы приводят к продукции антител, имеющих углеводную структуру, в которой отсутствует фукоза, прикрепленная (прямо или косвенно) к Fc-области. Например, количество фукозы в таком антителе может составлять от 1% до 80%, от 1% до 65%, от 5% до 65% или от 20% до 40%. Количество фукозы определяется путем вычисления среднего количества фукозы в сахарной цепи на Asn297 по отношению к сумме всех гликоструктур, прикрепленных к Asn 297 (например, сложных, гибридных и высокоманнозных структур), измеренного путем масс-спектрометрии MALDI-TOF, как описано, например, в WO 2008/077546. Asn297 относится к остатку аспарагина, расположенному примерно в позиции 297 в Fc-области (нумерация ЕС остатков Fc-области по Кабату); тем не менее, Asn297 также может быть расположен в позиции примерно ±3 аминокислоты до или после позиции 297, т.е. между позициями 294 и 300, в связи с минорными изменениями последовательности в антителах. Такие варианты фукозилирования могут иметь улучшенные ADCC-функции (см., например, US 2003/0157108; US 2004/0093621). Примеры публикаций, связанных с «дефукозилированными» или «фукозодефицитными» вариантами антител, включают: US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO 2005/053742; WO 2005/031140; Okazaki, A. et al., J. Mol. Biol. 336 (2004) 1239-1249; Yamane-Ohnuki, N. et al., Biotech. Bioeng. 87 (2004) 614-622. Примеры клеточных линий, способных продуцировать дефукозилированные антитела, включают СНО-клетки Lec13, дефицитные по фукозилированию протеина (Ripka, J. et al., Arch. Biochem. Biophys. 249 (1986) 533-545; US 2003/0157108; и WO 2004/056312, особенно пример 11), и нокаутные клеточные линии, такие как СНО-клетки с нокаутом гена альфа-1,6-фукозилтрансферазы, FUT8 (см., например, Yamane-Ohnuki, N. et al., Biotech. Bioeng. 87 (2004) 614-622; Kanda, Y. et al., Biotechnol. Bioeng. 94 (2006) 680-688; и WO 2003/085107).
В некоторых воплощениях предложенные способы могут быть использованы для получения антител с олигосахаридами с симметричным разветвлением, например, в которых двухантенный олигосахарид, присоединенный к Fc-области антитела, разделен пополам посредством GlcNAc. Такие варианты антител могут обладать уменьшенным фукозилированием и/или улучшенной ADCC-функцией. Примеры таких вариантов антител описаны, например, в WO 2003/011878; US 6602684 и US 2005/0123546. Также могут быть получены варианты антител по меньшей мере с одним остатком галактозы в олигосахариде, прикрепленном к Fc-области. Такие варианты антител могут обладать улучшенной CDC-функцией. Такие варианты антител описаны, например, в WO 1997/30087, WO 1998/58964 и WO 1999/22764.
Антитела могут быть получены с использованием рекомбинантных способов и композиций, например, описанных в US 4816567. Нуклеиновая кислота может кодировать аминокислотную последовательность, содержащую VL, и/или аминокислотную последовательность, содержащую VH антитела (например, легкую и/или тяжелую цепи антитела). В другом воплощении предложен один или более чем один вектор (например, экспрессионный вектор), содержащий такую нуклеиновую кислоту. В другом воплощении предложена клетка-хозяин, содержащая такую нуклеиновую кислоту. В одном таком воплощении клетка-хозяин содержит (например, была трансформирована ими): (1) вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и аминокислотную последовательность, содержащую VH антитела, или (2) первый вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и второй вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VH антитела. В одном воплощении клетка-хозяин является эукариотической, например, клеткой яичника китайского хомячка (СНО) или лимфоидной клеткой (например, YO, NS0, Sp2/0) или человеческой эмбриональной клеткой почки (HEK293). В одном воплощении предложен способ получения антитела, который включает культивирование клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую антитело, описанное выше, в условиях, подходящих для экспрессии антитела, и, возможно, восстановление антитела из клетки-хозяина (или культуральной среды клетки-хозяина).
Для рекомбинантной продукции антитела нуклеиновую кислоту, кодирующую антитело, выделяют и встраивают в один или более чем один вектор для дальнейшего клонирования и/или экспрессии в клетке-хозяине. Такая нуклеиновая кислота может быть легко выделена и секвенирована с использованием обычных процедур (например, с использованием олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелые и легкие цепи антитела).
Подходящие клетки-хозяева для клонирования или экспрессии векторов, кодирующих антитела, включают прокариотические или эукариотические клетки, описанные в данном документе. Например, антитела могут быть получены в бактериях, в частности, когда не нужны гликозилирование и Fc-эффекторные функции. Для экспрессии фрагментов антитела и полипептидов в бактериях см., например, US 5648237, US 5789199 и US 5840523; см. также Charlton, KA, In: Methods in Molecular Biology, Vol.248, Lo, B.K.C. (ed.), Humana Press, Totowa, NJ (2003), pp.245-254, где описывается экспрессия фрагментов антител в Е. coli. После экспрессии антитело может быть выделено из массы бактериальных клеток в растворимой фракции и может быть далее очищено.
Кроме прокариотов для векторов, кодирующих антитела, подходящими клонирующими или экспрессирующими хозяевами являются эукариотические микроорганизмы, такие как нитчатые грибы или дрожжи, включая штаммы грибов и дрожжей, у которых пути гликозилирования являются «гуманизированными», что приводит к продукции антитела с частично или полностью человеческим характером гликозилирования (см. Gerngross, T.U., Nat. Biotech. 22 (2004) 1409-1414; и Li, H. et al., Nat. Biotech. 24 (2006) 210-215).
Подходящие клетки-хозяева для экспрессии гликозилированного антитела также получают из многоклеточных организмов (беспозвоночных и позвоночных). Примеры клеток беспозвоночных включают клетки растений и насекомых. Были идентифицированы многочисленные бакуловирусные штаммы, которые могут быть использованы в сочетании с клетками насекомых, в частности, для трансфекции клеток Spodoptera frugiperda.
Культуры растительных клеток также могут быть использованы в качестве хозяев (см., например, US 5959177, US 6040498, US 6420548, US 7125978 и US 6417429 (описывающие технологию PLANTIBODIES™ для получения антител в трансгенных растениях)).
Клетки позвоночных животных также могут быть использованы в качестве хозяев. Например, могут быть использованы клеточные линии млекопитающих, приспособленные к росту в суспензии. Другими примерами используемых клеточных линий-хозяев от млекопитающих являются линия почки обезьяны CV1, трансформированная SV40 (COS-7); человеческая эмбриональная почечная линия (293 или клетки 293, описанные, например, в Graham, F.L. et al., J. Gen Virol. 36 (1977) 59-74); клетки почек детенышей хомяка (ВНК); мышиные клетки Сертоли (ТМ4-клетки, описанные, например, в Mather, J.P., Biol. Reprod. 23 (1980) 243-252); клетки почки обезьяны (CV1); клетки почки африканской зеленой обезьяны (VERO-76); клетки шейки матки человеческой карциномы (HELA); клетки почки собаки (MDCK); клетки печени крысы buffalo (BRL 3А); клетки легких человека (W138); клетки печени человека (Hep G2); клетки опухоли молочной железы мыши (ММТ 060562); TRI-клетки, описанные, например, в Mather, J.P. et al., Annals Ν.Y. Acad. Sci. 383 (1982) 44-68; клетки MRC 5 и клетки FS4. Другие используемые линии клеток-хозяев от млекопитающих включают клетки яичника китайского хомячка (СНО), в том числе DHFR-CHO-клетки (Urlaub, G. et al., Proc. Natl. Acad. Sci. USA 77 (1980) 4216-4220); и клеточные линии миеломы, такие как YO, NS0 и Sp2/0. Обзор некоторых линий клеток-хозяев от млекопитающих, подходящих для продукции антител, см., например, в Yazaki, P. and Wu, A.M., Methods in Molecular Biology, Vol.248, Lo, B.K.C. (ed.), Humana Press, Totowa, NJ (2004), pp.255-268.
Конкретные воплощения изобретения
В данном документе предложены способы отбора клеток, экспрессирующих антитела с требуемой специфичностью, а также о способах получения таких антител.
Хотя можно определить антитела с помощью различных способов скрининга, последующее развитие в промышленном масштабе может быть затруднено ограничениями в экспрессии белка, неправильным сворачиванием и/или неправильными посттрансляционными модификациями, а также неправильной сборкой антител, например формированием гомодимеров.
В отличие от его антигенсвязывающего фрагмента полноразмерное антитело имеет несколько дополнительных функций, таких как длительное время полужизни в сыворотке (недели по сравнению с часами или днями), поддержка вторичных иммунных функций, таких как ADCC, CDC, FcRn-связывание.
В одном воплощении антитело специфически связывается с одним антигеном, представляющим интерес.
В одном воплощении антитело специфически связывается с двумя различными антигенами или с двумя различными неперекрывающимися эпитопами на одном и том же антигене.
Как правило, представляющий интерес антиген является белковым антигеном, небелковым антигеном или гаптеном. Представляющий интерес антиген в одном воплощении выбран из группы, состоящей из (а) антигена микроорганизма или патогена, (б) опухолевого антигена, (в) аутоантигена и (г) аллергена.
Опухолевый антиген представляет собой соединение, такое как пептид, которое ассоциировано с опухолью или раком и может связываться с антителом. Опухолевые антигены могут быть получены из раковых клеток путем получения неочищенных экстрактов раковых клеток, например, как описано в Cohen, et al., Cancer Research, 54 (1994) 1055, путем частичной очистки антигенов, путем рекомбинантной технологии или путем синтеза известных антигенов de novo. Опухолевые антигены включают антигены, которые являются целыми полипептидами опухоли или рака или их антигенными участками. Такие антигены могут быть выделены или получены рекомбинантно или с помощью любых других средств, известных в данной области. Раки или опухоли включают, но не ограничиваясь ими, рак желчных путей; рак мозга; рак молочной железы; рак шейки матки; хориокарциному; рак толстой кишки; рак эндометрия; рак пищевода; рак желудка; интраэпителиальные новообразования; лимфомы; рак печени; рак легкого (например, мелкоклеточный и немелкоклеточный); меланому; нейробластомы; рак полости рта; рак яичников; рак поджелудочной железы; рак предстательной железы; рак прямой кишки; саркомы; рак кожи; рак яичка; рак щитовидной железы; и рак почки, а также другие карциномы и саркомы.
Термин «антигенная детерминанта» обозначает часть антигена, которая специфически распознается В-лимфоцитами. В-лимфоциты отвечают на чужеродные антигенные детерминанты продукцией антител.
В отношении антитела, представленного на клетке млекопитающего, в одном из воплощений находится специфичность связывания антигена, определенная во флуоресцентном анализе, по существу как описано в данном документе в примере 12, где интенсивность сигнала флуоресценции коррелирует с количеством антигена, связанного клеткой, на которой представлено антитело. Антитела, представленные на клетках млекопитающих, считаются специфически связывающимися с антигеном, когда интенсивность сигнала флуоресценции выше, чем сигнал, зарегистрированный для контрольных клеток. В одном воплощении сигнал по меньшей мере в два раза выше, чем у контрольных клеток.
Термин «экспрессионная библиотека» обозначает множество экспрессионных векторов одного и того же типа, где отдельные экспрессионные векторы экспрессируют различные антитела. В одном воплощении экспрессионная библиотека является вирусной экспрессионной библиотекой. В одном воплощении экспрессионная библиотека является лентивирусной экспрессионной библиотекой.
Термин «множественность заражения» (MOI) обозначает соотношение между числом инфекционных вирусных частиц в вирусной, в частности, в лентивирусной, экспрессионной библиотеке, и числом клеток, подвергнутых воздействию вируса.
В данном документе сообщается о способе получения, отбора и/или выделения клетки, экспрессирующей антитело с желаемой специфичностью.
Более подробно, способ включает:
получение нуклеиновой кислоты, кодирующей полноразмерное антитело В одном воплощении нуклеиновая кислота получена путем выбора из популяции отдельных В-клеток субпопуляции В-клеток по их способности специфически связываться с антигеном, представляющим интерес.
В одном воплощении нуклеиновая кислота получена путем выбора из популяции выделенных В-клеток отдельной В-клетки по ее способности специфически связываться с одним или двумя антигенами, представляющими интерес.
В одном воплощении отдельная В-клетка представляет собой клональную В-клеточную популяцию.
В одном воплощении нуклеиновая кислота получена путем амплификации нуклеиновой кислоты, кодирующей вариабельный домен, из выделенной мРНК отдельной В-клетки или клональной В-клеточной популяции, и транскрипции амплифицированной мРНК в кДНК.
создание лентивирусной экспрессионной библиотеки
Лентивирусный экспрессионный вектор, о котором сообщается в данном документе и который используется в способах, описанных в данном документе, представляет собой вектор, содержащий бицистронную экспрессионную кассету для экспрессии полноразмерного антитела в растворимой и мембраносвязанной форме. Представляя растворимую и мембраносвязанную форму антитела в одно и то же время, клетка, экспрессирующая антитело, может быть выбрана на основании представленного на ее поверхности антитела, и антитело может быть проверено, например, на специфичность связывания с помощью секретируемого антитела.
Было обнаружено, что для экспрессии и представления полноразмерного антитела на клетке млекопитающего требуется использовать бицистронную экспрессионную конструкцию, которая также содержит нуклеиновую кислоту с возможностью сплайсинга для того, чтобы экспрессировать растворимую и мембраносвязанную форму с одной и той же экспрессионной кассеты.
В связи с тем, что размер лентивирусного экспрессионного вектора ограничивается для эффективной упаковки в вирусную частицу, и в связи с тем, что должно быть экспрессировано и представлено полноразмерное антитело, трансмембранная кодирующая нуклеиновая кислота также должна быть сокращена и уменьшена в размере.
Разнообразие лентивирусной экспрессионной библиотеки может быть получено следующим путем:
(i) В одном воплощении разнообразие лентивирусной экспрессионной библиотеки получают с помощью нуклеиновых кислот, кодирующих HCVR и LCVR и полученных из пула В-клеток, продуцирующих антитело, которое специфически связывается с одним антигеном или с двумя различными антигенами, или которое специфически связывается с двумя различными неперекрывающимися эпитопами одного и того же антигена.
(ii) В одном воплощении разнообразие лентивирусной экспрессионной библиотеки получают с помощью пары нуклеиновых кислот, кодирующих HCVR и LCVR, выбранных из пулов нуклеиновых кислот, кодирующих HCVR и LCVR, которые получают путем рандомизации по меньшей мере одного кодона нуклеиновой кислоты, кодирующей HCVR и LCVR и полученной из отдельной В-клетки, продуцирующей антитело, которое специфически связывается с одним антигеном или двумя различными антигенами, или которое специфически связывается с двумя различными неперекрывающимися эпитопами одного и того же антигена.
В одном воплощении отдельная В-клетка представляет собой клональную популяцию В-клеток.
В одном воплощении по меньшей мере один кодон находится в CDR HCVR или LCVR. В одном воплощении CDR представляет собой CDR3. В одном воплощении CDR3 представляет собой HCDR3.
(iii) В одном воплощении разнообразие лентивирусной экспрессионной библиотеки получают с помощью пар различных нуклеиновых кислот, кодирующих HCVR, и одной нуклеиновой кислоты, кодирующей LCVR, где различные нуклеиновые кислоты, кодирующие HCVR, получают путем рандомизации по меньшей мере одного кодона нуклеиновой кислоты, кодирующей HCVR и полученной из отдельной В-клетки, продуцирующей антитело, которое специфически связывается с одним антигеном или двумя различными антигенами, или которое специфически связывается с двумя различными неперекрывающимися эпитопами одного и того же антигена.
В одном воплощении отдельная В-клетка представляет собой клональную популяцию В-клеток.
В одном воплощении по меньшей мере один кодон находится в CDR HCVR. В одном воплощении CDR представляет собой CDR3.
(iv) В одном воплощении разнообразие лентивирусной экспрессионной библиотеки получают с помощью пар различных нуклеиновых кислот, кодирующих LCVR, и одной нуклеиновой кислоты, кодирующей HCVR, где различные нуклеиновые кислоты, кодирующие LCVR, получают путем рандомизации по меньшей мере одного кодона нуклеиновой кислоты, кодирующей LCVR и полученныой из отдельной В-клетки, продуцирующей антитело, которое специфически связывается с одним антигеном или двумя различными антигенами, или которое специфически связывается с двумя различными неперекрывающимися эпитопами одного и того же антигена.
В одном воплощении отдельная В-клетка представляет собой клональную популяцию В-клеток.
В одном воплощении по меньшей мере один кодон находится в CDR LCVR. В одном воплощении CDR представляет собой CDR3.
В одном воплощении получение разнообразия лентивирусной экспрессионной библиотеки включает следующие этапы:
(а):
(i) выделение РНК из субпопуляции В-клеток,
(ii) транскрипция РНК в кДНК;
(iii) амплификация с кДНК первого пула молекул ДНК с помощью первой смеси олигонуклеотидов, включающей по меньшей мере два олигонуклеотида, способных амплифицировать области, кодирующие HCVR;
(iv) амплификация с кДНК второго пула молекул ДНК с помощью второй смеси олигонуклеотидов, включающей по меньшей мере два олигонуклеотида, способных амплифицировать области, кодирующие LCVR; и
(v) получение пар одного представителя первого пула молекул ДНК и одного представителя второго пула молекул ДНК; или (b):
(i) выделение РНК из отдельной В-клетки или из клональной популяции В-клеток,
(ii) транскрипция РНК в кДНК;
(iii) амплификация с кДНК первой молекулы ДНК с помощью первой смеси олигонуклеотидов, включающей по меньшей мере два олигонуклеотида, способных амплифицировать области, кодирующие HCVR;
(iv) амплификация с кДНК второй молекулы ДНК с помощью второй смеси олигонуклеотидов, включающей по меньшей мере два олигонуклеотида, способных амплифицировать области, кодирующие LCVR; и
(v) получение первого пула молекул ДНК путем рандомизации по меньшей мере одного кодона первой молекулы ДНК,
(vi) получение второго пула молекул ДНК путем рандомизации по меньшей мере одного кодона второй молекулы ДНК, и
(vii) получение пар одного представителя первого пула молекул ДНК и одного представителя второго пула молекул ДНК
или (с):
(i) выделение РНК из отдельной В-клетки или из клональной популяции В-клеток,
(ii) транскрипция РНК в кДНК;
(iii) амплификация с кДНК первой молекулы ДНК с помощью первой смеси олигонуклеотидов, включающей по меньшей мере два олигонуклеотида, способных амплифицировать области, кодирующие HCVR;
(iv) амплификация с кДНК второй молекулы ДНК с помощью второй смеси олигонуклеотидов, включающей по меньшей мере два олигонуклеотида, способных амплифицировать области, кодирующие LCVR; и
(v) получение пула молекул ДНК путем рандомизации по меньшей мере одного кодона первой молекулы ДНК,
(vi) получение пар одного представителя пула молекул ДНК и второй молекулы ДНК; или (d):
(i) выделение РНК из отдельной В-клетки или из клональной популяции В-клеток,
(ii) транскрипция РНК в кДНК;
(iii) амплификация с кДНК первой молекулы ДНК с помощью первой смеси олигонуклеотидов, включающей по меньшей мере два олигонуклеотида, способных амплифицировать области, кодирующие HCVR;
(iv) амплификация с кДНК второй молекулы ДНК с помощью второй смеси олигонуклеотидов, включающей по меньшей мере два олигонуклеотида, способных амплифицировать области, кодирующие LCVR; и
(v получение пула молекул ДНК путем рандомизации по меньшей мере одного кодона второй молекулы ДНК,
(vi) получение пар одного представителя пула молекул ДНК и первой молекулы ДНК.
Для получения секретируемого полипептида структурный ген, представляющий интерес, включает сегмент ДНК, который кодирует «сигнальную последовательность» или «лидерный пептид». Сигнальная последовательность направляет вновь синтезированный полипептид в и через мембрану ER, где полипептид может быть направлен на секрецию. Сигнальная последовательность отщепляется с помощью сигнальных пептидаз, пока белок пересекает мембрану ER. Что касается функции сигнальной последовательности, существенным является распознавание секреторным механизмом клетки-хозяина. Поэтому используемая сигнальная последовательность должна распознаваться белками и ферментами секреторного механизма клетки-хозяина.
Лентивирусный экспрессионный вектор, используемый для получения лентивирусной экспрессионной библиотеки, позволяет экспрессировать секретируемую и мембраносвязанную форму антитела. Мембраносвязанная форма экспрессируется через связывание С-концевого константного домена тяжелой цепи антитела с альтернативно сплайсированной нуклеиновой кислоты (интроном) и далее экзоном, кодирующим трансмембранный или сигнальный пептид для GPI-якоря.
Термин «GPI-якорь», используемый в данной заявке, обозначает посттрансляционную модификацию, прикрепленную к С-концу полипептида или белка. «GPI-якорь» имеет осевую структуру, содержащую по меньшей мере один остаток этаноламинфосфата, триманнозид, остаток глюкозамин и инозитол фосфолипид. Несмотря на эту осевую структуру GPI-якорь обычно обладает некоторой микрогетерогенностью, и, следовательно, белок с GPI-якорем обычно представляет собой смесь белков с гомологичными GPI-якорями одной и той же основной конструкции с различными модификациями боковой цепи.
Термин «сигнальный пептид для GPI-якоря» обозначает С-концевую аминокислотную последовательность полипептида или белка, которая состоит из одной аминокислоты, к которой будет прикреплен GPI-якорь, возможно спейсерный пептид и гидрофобный пептид. Почти весь этот сигнальный пептид, т.е. необязательный спейсерный пептид и гидрофобный пептид, посттрансляционно удаляется ферментом GPI-трансаминазой, и между аминогруппой осевого этаноламинфосфата GPI-якоря и аминокислотой, к которой прикреплен GPI-якорь, формируется связь.
Термин «трансмембранный домен», используемый в данной заявке, обозначает полипептид или белок, который кодируется на уровне ДНК по меньшей мере одним экзоном, и который включает внеклеточную, трансмембранную и внутриклеточную области. Трансмембранный домен, как правило, содержит три отдельные структурные области: N-концевая внеклеточная область, центральный сохраненный трансмембранный участок и C-концевая цитоплазматическая область. В одном воплощении трансмембранный домен включает в направлении от N- к С-концу внеклеточную область и трансмембранную область. Трансмембранный домен может дополнительно содержать внутриклеточную или цитоплазматическую область.
Термин «нуклеиновая кислота с возможностью альтернативного сплайсинга» означает нуклеиновую кислоту, начинающуюся с 5'-донорного сайта сплайсинга и заканчивающуюся на 3'-акцепторном сайте сплайсинга. Эта нуклеиновая кислота с возможностью альтернативного сплайсинга содержит некодирующую область, которая не является конститутивно сплайсированной из соответствующей пре-мРНК, например, интрон после экзона, кодирующего домен CH3 или CH4 тяжелой цепи иммуноглобулина. «Событие альтернативного сплайсинга», которое проходит на 5'-донорном сайте сплайсинга нуклеиновой кислоты с возможностью альтернативного сплайсинга, представляет собой решающее событие, сплайсируется ли нуклеиновая кислота с возможностью альтернативного сплайсинга из пре-мРНК, или же она по меньшей мере частично сохраняется и включается в зрелую (процессированную) мРНК.
Термин «альтернативный сплайсинг» и его грамматические эквиваленты, используемые в данном документе, относятся к процессу в эукариотических клетках, во время которого из отдельной пре-мРНК в связи с различным процессингом одного или более интронов различных зрелых мРНК могут быть получены и, соответственно, могут быть экспрессированы различные изоформы полипептида. В одном воплощении данного изобретения отельный, т.е. только один, интрон предварительно полученной мРНК, может быть сплайсирован альтернативно. В другом воплощении вторая нуклеиновая кислота может быть сплайсирована альтернативо. В другом воплощении вторая нуклеиновая кислота включает интрон с возможностью альтернативного сплайсинга. Отличающийся процессинг является решением типа «да/нет», т.е. в процессе альтернативного сплайсинга интрон, подлежащий процессингу, т.е. «нуклеиновая кислота с возможностью альтернативного сплайсинга», либо по меньшей мере частично сохраняется, либо подвергается сплайсингу. Это не следует понимать как механизм точки ветвления, приводящий к различному следованию экзонов. Фактически это механизм, в котором нуклеиновая кислота с возможностью альтернативного сплайсинга либо подвергается сплайсингу, либо по меньшей мере частично сохраняется в зрелой мРНК. С помощью этого механизма нуклеиновая кислота с возможностью альтернативного сплайсинга и, таким образом, содержащийся в рамке стоп-кодон трансляции либо остаются, либо удаляются.
Альтернативный сплайсинг является регуляторным механизмом в эукариотических клетках. С помощью альтернативного сплайсинга могут быть получены различные комбинации экзонов в зрелой мРНК из одной и той же пре-мРНК, что приводит к множеству различных белков, кодируемых одной и той же ДНК.
Для того чтобы обеспечить альтернативный сплайсинг, последний экзон, кодирующий С-концевой домен тяжелой цепи антитела, должен быть без стоп-кодона трансляции в рамке считывания.
Термин «стоп-кодон трансляции в рамке считывания» обозначает стоп-кодон трансляции (ТАА, TAG или TGA), который следует за кодирующей областью нуклеиновой кислоты без сдвига рамки считывания по отношению к предшествующей кодирующей области нуклеиновой кислоты, т.е. который заканчивает кодирующую область во время трансляции. Стоп-кодон трансляции в рамке считывания функционально связан с предшествующей кодирующей областью нуклеиновой кислоты.
Термин «без стоп-кодона трансляции в рамке считывания» обозначает отсутствие стоп-кодона трансляции (ТАА, TAG или TGA) в указанной нуклеиновой кислоте и/или наличие стоп-кодона трансляции, который может находиться на протяжении или в конце кодирующей области нуклеиновой кислоты, но в связи с одним или двумя сдвигами пар оснований, которые не были распознаны при трансляции процессированной мРНК (т.е. не в рамке считывания, не связаны функционально), он не заканчивает кодирующую область в процессе трансляции.
«Нуклеиновая кислота с возможностью альтернативного сплайсинга» характеризуется по меньшей мере 5'-донорным сайта сплайсинга, 3'-акцепторным сайтом сплайсинга и так называемым бранч-сайтом (сайтом ветвления), который, как правило, расположен на 20-50 оснований выше акцепторного сайта. Эта архитектура влияет на распознавание и иссечение нуклеиновой кислоты от 5'-донорного сайта сплайсинга до 3'-акцепторного сайта сплайсинга из пре-мРНК во время сплайсинга РНК. На этапе сплайсинга образуется зрелая мРНК, из которой транслируется полипептид или белок. В одном воплощении данного изобретения по меньшей мере одна нуклеиновая кислота, предпочтительно вторая нуклеиновая кислота, является нуклеиновой кислотой с возможностью альтернативного сплайсинга, содержащей дополнительные регуляторные элементы, такие как стоп-кодон в рамке считывания.
Но процесс сплайсинга не является эксклюзивным. Например, может быть так, что во время процессинга пре-мРНК интрон не удаляется из пре-мРНК и, таким образом, по меньшей мере, частично встраивается в зрелую мРНК. Если в рамке присутствует стоп-кодон в этом «необязательно» включенном интроне, трансляция останавливается на этом стоп-кодоне, и образуется вариант кодируемого полипептида.
Распознавание и удаление интрона часто регулируется дополнительными цис-действующими элементами в пре-мРНК. Благодаря функции и положению эти элементы называются экзонными энхансерами сплайсинга (ESE), экзонными сайленсерами сплайсинга (ESS), интронными энхансерами сплайсинга (ISE) или интронными сайленсерами сплайсинга (ISS), соответственно (Black, D.L., Annu. Rev. Biochem. 72 (2003) 291-336).
Геномная ДНК из большинства эукариотических генов имеет интрон-экзонную организацию. Например, в экзоне, кодирующем С-концевой домен секретируемой формы иммуноглобулина, тяжелая цепь (т.е. CH3 или CH4, соответственно) является 5ʹ-донорным сайтом сплайсинга.
Если этот донорный сайт сплайсинга не эффективен в процессинге пре-мРНК тяжелой цепи, то интрон, следующий за этим экзоном, который содержит стоп-кодон, по меньшей мере частично сохраняется в зрелой мРНК. Затем мРНК транслируется в тяжелую цепь иммуноглобулина, которая заканчивается доменом CH3 или CH4 и представляет собой растворимый иммуноглобулин. Это основной путь процессинга для генов тяжелой цепи иммуноглобулина в клетках, секретирующих иммуноглобулин.
Если этот донорный сайт сплайсинга эффективен в процессинге пре-мРНК тяжелой цепи иммуноглобулина, то последующий интрон и, таким образом, стоп-кодон удаляются. Поэтому трансляция не останавливается после С-концевого домена тяжелой цепи иммуноглобулина. Кроме того, трансляция продолжается с последующим сплайсированием с экзонами, кодирующими трансмембранный домен. Этот путь незначительного процессинга для генов тяжелых цепей иммуноглобулина дает плазменную мембраносвязанную форму иммуноглобулина, представленную на клеточной поверхности клетки, продуцирующей иммуноглобулин.
Этот процесс называется «альтернативным сплайсингом», а нуклеиновая кислота (т.е. интрон), которая, возможно, удаляется в этом процессе, называется «нуклеиновой кислотой с возможностью альтернативного сплайсинга».
Если нуклеиновая кислота, кодирующая гетерологичный полипептид или белок, связана с нуклеиновой кислотой, кодирующей по меньшей мере фрагмент трансмембранного домена, или с нуклеиновой кислотой, кодирующей сигнальный пептид для GPI-якоря за счет/через нуклеиновую кислоту с возможностью альтернативного сплайсинга, т.е. нуклеиновая кислота с возможностью альтернативного сплайсинга находится между этими двумя нуклеиновыми кислотами, и при этом эти три нуклеиновые кислоты функционально связаны, то экспрессируются два варианта гетерологичного полипептида или белка: растворимый вариант, т.е. вариант, содержащий только полипептид или белок, и связанный с плазматической мембраной вариант, т.е. вариант, включающий и полипептид или белок, и трансмембранный домен или GPI-якорь.
Например, для рекомбинантной экспрессии тяжелых цепей иммуноглобулина в эукариотических клетках используют нуклеиновую кислоту либо с геномной интрон-экзонной организацией, либо содержащую только кодирующие области, т.е. кДНК. В обоих случаях нуклеиновая кислота заканчивается стоп-кодоном после экзона, кодирующего С-концевой домен тяжелой цепи иммуноглобулина. После этого в геномной организации последующие интроны и экзоны, содержащие нуклеиновую кислоту с возможностью альтернативного сплайсинга и трансмембранный домен, пропускаются. Поэтому с такой нуклеиновой кислотой получается только растворимая тяжелая цепь иммуноглобулина.
Если для рекомбинантной экспрессии иммуноглобулинов или их фрагментов геномная организация гена тяжелой цепи иммуноглобулина сохраняется по меньшей мере частично, т.е. если интрон после экзона, кодирующего С-концевой домен (т.е. нуклеиновая кислота с возможностью альтернативного сплайсинга), а также последующий экзон (экзоны), кодирующий трансмембранный домен, сохраняются, то альтернативный сплайсинг возможен. В случае альтернативного сплайсинга 3'-концевые кодоны и стоп-кодон экзона, кодирующего CH3- или CH4-домен, соответственно, будут удалены, в качестве/с интронной последовательностью, и вместо этого образуется другая, зрелая мРНК, в которой кодирующая область, т.е. рамка считывания, удлинена на 3'-конце дополнительно содержащимся экзоном (экзонами). Эта мРНК транслируется в удлиненную с С-конца тяжелую цепь иммуноглобулина, которая содержит дополнительный трансмембранный домен или его фрагмент, кодируемый дополнительным 3'-экзоном (экзонами). Эта удлиненная тяжелая цепь иммуноглобулина встраивается во время сборки иммуноглобулинов, образуя связанные с плазматической мембраной иммуноглобулины. В настоящее время неожиданно было обнаружено, что с такой нуклеиновой кислотой согласно изобретению могут быть выбраны трансфицированные клетки, продуцирующие гетерологичный полипептид. Эта методика широко применима и не ограничивается иммуноглобулинами. Для использования этой методики на практике нуклеиновая кислота для рекомбинантной экспрессии гетерологичного полипептида без стоп-кодона в рамке считывания должна быть функционально связана и находиться в рамке считывания с нуклеиновой кислотой с возможностью альтернативного сплайсинга, полученной из иммуноглобулина, содержащего в рамке считывания стоп-кодон трансляции и сайт полиаденилирования. Последующая третья нуклеиновая кислота также является переменной и может быть выбрана среди любых нуклеиновых кислот, кодирующих трансмембранный домен или его фрагмент, а также среди любых нуклеиновых кислот, кодирующих сигнальный пептид для GPI-якоря. Эти элементы, т.е. нуклеиновая кислота, кодирующая полипептид, нуклеиновая кислота с возможностью альтернативного сплайсинга и нуклеиновая кислота, кодирующая трансмембранный домен или сигнальный пептид для GPI-якоря, могут быть выбраны и объединены из различных генов, а также различных организмов. Единственным условием является то, что три нуклеиновые кислоты объединяются таким образом, что стоп-кодон трансляции в нуклеиновой кислоте с возможностью альтернативного сплайсинга находится в рамке считывания нуклеиновой кислоты, кодирующей полипептид, т.е. рибосома может его распознать, и трансляция прекращается.
Говоря в целом, при альтернативным сплайсинге, возможно, часть С-конца растворимой формы гетерологичного полипептида удалена/может быть удалена из пре-мРНК как часть интрона. Эта фракция включает, возможно, 3'-концевые кодоны, 3'-нетранслируемую область и стоп-кодон секретируемой формы. Таким образом, нуклеиновая кислота, начиная с 5'-донорного сайта сплайсинга и заканчивая 3'-акцепторным сайтом сплайсинга, которая удаляется, возможно, перекрывается/может перекрываться с С-концом не альтернативно процессированного варианта.
В одном воплощении, в котором первая нуклеиновая кислота кодирует тяжелую цепь иммуноглобулина, первая нуклеиновая кислота содержит все экзоны и все, кроме одного, интроны геномно-организованного гена тяжелой цепи иммуноглобулина. В одном воплощении третья нуклеиновая кислота кодирует либо фрагмент трансмембранного домена, либо сигнальный пептид для GPI-якоря, при этом фрагмент трансмембранного домена кодируется одним экзоном. В другом воплощении трансмембранный домен является трансмембранным доменом иммуноглобулина, закодированным слиянием М1-М2-экзонов, т.е. одним экзоном без геномного промежуточного интрона. В одном воплощении трансмембранный домен иммуноглобулина закодирован кДНК.
При введении нуклеиновой кислоты по меньшей мере с частично сохраненной общей геномной организацией гена тяжелой цепи иммуноглобулина в клетку-хозяина получается клетка, которая экспрессирует с одной стороны растворимый гетерологичный полипептид, а с другой стороны связанный с плазматической мембраной гетерологичный полипептид. Например, для получения двух вариантов иммуноглобулина, т.е. для альтернативного сплайсинга, нет необходимости оставлять всю геномную организацию гена тяжелой цепи иммуноглобулина, т.е. все интроны и экзоны. Необходимо только оставить сайт альтернативного сплайсинга в функциональной форме.
«Функциональный сайт сплайсинга» представляет собой нуклеиновокислотную последовательность, содержащую 5'-донорный сайт сплайсинга и 3'-акцепторный сайт сплайсинга, что позволяет удалять находящуюся между ними нуклеиновокислотную последовательность из пре-мРНК. Распознавание и удаление интрона часто регулируется дополнительными цис-действующими элементами на пре-мРНК. Благодаря функции и положению эти элементы называются экзонными энхансерами сплайсинга (ESE), экзонными сайленсерами сплайсинга (ESS), интронными энхансерами сплайсинга (ISE) или интронными сайленсерами сплайсинга (ISS), соответственно (Black, D.L., Annu. Rev. Biochem. 72 (2003) 291-336, включенный в данный документ посредством ссылки).
Связанный с плазматической мембраной вариант полипептида прочно связан с клеткой, экспрессирующей его. Поэтому связанный с плазматической мембраной вариант может быть использован в качестве маркера для выделения клеток, которые были успешно трансфицированы нуклеиновой кислотой для экспрессии гетерологичного полипептида или белка, например, иммуноглобулина. В одном воплощении полипептид представляет собой иммуноглобулин. В одном воплощении иммуноглобулин выбран из группы IgG, IgE и IgA.
На следующем этапе способа пары молекул ДНК клонируют в лентивирусный экспрессионный вектор.
После этого лентивирусную экспрессионную бибилиотеку вводят в первую популяцию клеток млекопитающих. Трансдуцированные клетки представляют антитела из лентивирусной экспрессионной библиотеки на их поверхности. Из библиотеки трансдуцированных клеток (т.е. из первой популяции клеток млекопитающих) одну или более чем одну клетку выбирают по способности антитела, представленного на ее/их поверхности, которое специфически связывается с антигеном, представляющим интерес, или его фрагментом или антигенной детерминантой.
В одном воплощении антитело, которое специфически связывается с антигеном, представляющим интерес, является гуманизированным или человеческим антителом, в основном человеческим антителом.
В одном воплощении антитело, которое специфически связывается с антигеном, представляющим интерес, является полноразмерным антителом.
Антитело, представленное на поверхности клетки млекопитающего, экспрессируется в виде полноразмерного антитела, содержащего трансмембранную область.
Антитело, секретируемое в культуральную среду клеткой млекопитающего, представляет собой полноразмерное антитело, т.е. антитело без трансмембранного домена.
В одном воплощении каждый представитель экспрессионной библиотеки, в основном лентивирусной экспрессионной библиотекой, кодирует полноразмерное антитело, где указанное антитело экспрессируется в виде секретируемого антитела и в виде связанного с плазматической мембраной антитела, содержащего трансмембранную область.
В одном воплощении изменчивость антиген-специфических антител увеличивается случайным образом за счет комбинации различных вариабельных областей легкой и тяжелой цепей.
Клонирование вариабельных областей является стандартной процедурой, хорошо известной в данной области и описанной для различных видов, включая человека, приматов, мышь, кролика и курицу. Обзор см. в Barbas III, et al., (eds.), Phage Display-Α Laboratory Manual, Cold Spring Habour Press (2001), в частности, в главе Andris-Widhopf et al., Generation of Antibody Libraries: PCR Amplification and Assembly of Light- and Heavy-chain Coding Sequences. Andris-Widhopf et al. раскрывает последовательности олигонуклеотидов, способных амплифицировать кодирующие вариабельные области (кодирующие области VR), в основном кодирующие области HCVR или кодирующие области LCVR, из упомянутых выше видов. Кроме того, олигонуклеотиды, способные к амплификации кодирующих областей HCVR или кодирующих областей LCVR, в основном человеческих кодирующих областей HCVR или кодирующих областей LCVR, могут быть разработаны специалистом в данной области путем сравнения известных последовательностей кодирующих областей антитела, которые доступны из баз данных, таких как, например, Immunogenetics (http://imgt.cines.fr/), Kabat (www.kabatdatabase.com) и Vbase (http://vbase.mrc-cpe.cam.ac.uk/), а также путем выявления консенсусных последовательностей, подходящих для дизайна праймеров. На основании общих знаний в молекулярной биологии, вышеуказанных руководств (Barbas III, et al., (eds.) Phage Display-A Laboratory Manual, Cold Spring Habour Press (2001)) и приведенных там ссылок, специалист в данной области может разработать олигонуклеотиды, способные амплифицировать кодирующие области HCVR или кодирующие области LCVR, где в одном воплощении праймер содержит подходящие сайты рестрикции для клонирования амплифицированных продуктов. Другие стратегии амплификации и клонирования VR описаны в Sblattero, D. and Bradbury, Α., Immunotechnology 3 (1998) 271-278 и Weitkamp et al., J. Immunol. Meth. 275 (2003) 223-237.
В одном воплощении нуклеиновая кислота вариабельной области содержит сайты рестрикции (restriction sites, RS), чтобы обеспечить клонирование собранных кодирующих областей в определенной ориентации в лентивирусный экспрессионный вектор. В одном воплощении сайты рестрикции отличаются друг от друга, и по меньшей мере один из них образует одноцепочечной выступ («липкий конец»), что обеспечивает направленное клонирование. В одном воплощении RS имеет восемь или больше пар оснований в длину и распознается «маскированными» рестрикционными ферментами, выбранными среди, но не ограничиваясь ими, AscI, Fsel, Notl, Pad, Pmel, Sfil и Swal.
Кодирующие области человеческой HCVR, человеческой LCVR каппа и человеческой LCVR лямбда амплифицировали путем ПЦР с отжигом смесей специфических смысловых и антисмысловых праймеров в каркасных областях 1 и 4, соответственно. Основной набор праймеров описан в данном документе: Sblattero, D. and Bradbury Α., Immunotechnology 3 (1998) 271-278. В качестве альтернативы использованию специфической смеси антисмысловых праймеров для амплификации кодирующих последовательностей HCVR, LCVR каппа и LCVR лямбда может быть использован отжиг одного антисмыслового праймера на константной области гамма, каппа и лямбда, соответственно.
Эффективность последующего клонирования специфических кодирующих областей вариабельной области (variable region, VR) может быть повышена путем предварительной амплификации транскриптома субпопуляции В-клеток, в частности с помощью протокола с переключением матрицы, описанного в Zhu, et al., BioTechniques 30 (2001) 892-897. Тем не менее, предварительная амплификация транскриптома должна быть сбалансирована, чтобы избежать возможной потери некоторых редких видов кДНК и возможного накопления ошибок в последовательности.
В одном воплощении транскрипция РНК в кДНК включает этапы предварительной амплификации транскриптома субпопуляции В-клеток или отдельной В-клетки или клональной популяции В-клеток, при этом предварительная амплификация включает этапы:
(a) селективной транскрипции полиаденилированной мРНК, содержащейся в РНК, в одноцепочечную кДНК; и
(b) амплификации двухцепочечной кДНК из одноцепочечной кДНК.
В одном воплощении амплификация двухцепочечной кДНК выполняется с использованием одного или более олигонуклеотида с SEQ ID №№1-11. В одном воплощении число циклов ПЦР менее 20, менее 15, от 10 до 14 или примерно 14.
В одном воплощении пул молекул ДНК, в основном первый и/или второй пул молекул ДНК, получают путем объединения молекул ДНК, полученных в независимых ПЦР-реакциях.
Смесь олигонуклеотидов, первая смесь олигонуклеотидов и/или вторая смесь олигонуклеотидов, содержит или состоит из точно одной пары олигонуклеотидов, способных амплифицировать кодирующие области VR, в основном кодирующие области HCVR или кодирующие области LCVR.
В одном воплощении получение пула молекул ДНК, в основном первого и/или второго пула молекул ДНК, осуществляется в отдельной реакции с применением более чем одной пары олигонуклеотидов в реакции.
В одном воплощении смесь олигонуклеотидов, в основном первая смесь олигонуклеотидов, содержит по меньшей мере два олигонуклеотида, способных амплифицировать человеческие кодирующие области HCVR.
В одном воплощении смесь олигонуклеотидов, в основном первая смесь олигонуклеотидов, содержит по меньшей мере два, в частности все олигонуклеотиды, выбранные из группы, состоящей из SEQ ID №№1-11.
В одном воплощении смесь олигонуклеотидов, в основном вторая смесь олигонуклеотидов, содержит по меньшей мере два олигонуклеотида, способных амплифицировать кодирующие области LCVR каппа, особенно человеческие кодирующие области LCVR.
В одном воплощении смесь олигонуклеотидов, в основном вторая смесь олигонуклеотидов, содержит по меньшей мере два олигонуклеотида, способных амплифицировать кодирующие области LCVR каппа, где особенно смесь олигонуклеотидов, особенно вторая смесь олигонуклеотидов, содержит по меньшей мере два, особенно все, олигонуклеотиды, выбранные из группы, состоящей из SEQ ID №№12-19.
В одном воплощении смесь олигонуклеотидов, в основном вторая смесь олигонуклеотидов, содержит по меньшей мере два олигонуклеотида, способных амплифицировать кодирующие области LCVR лямбда, особенно человеческие кодирующие области LCVR лямбда.
В одном воплощении смесь олигонуклеотидов, в основном вторая смесь олигонуклеотидов, содержит по меньшей мере два олигонуклеотида, способных амплифицировать кодирующие области LCVR лямбда, где более конкретно смесь олигонуклеотидов, в основном вторая смесь олигонуклеотидов, содержит по меньшей мере два, в основном все олигонуклеотиды, выбранные из группы, состоящей из SEQ ID №№20-28.
В одном воплощении смесь олигонуклеотидов, первая смесь олигонуклеотидов или вторая смесь олигонуклеотидов, включает общий объем праймеров, способных амплифицировать кодирующие области VR, где все прямые праймеры и все обратные праймеры, содержащиеся в общем объеме, находятся в эквимолярном соотношении.
В одном воплощении антитело, закодированное экспрессионной библиотекой, в основном лентивирусной экспрессионной библиотекой, включает ровно одну LCVR.
Чтобы обеспечить представление антитела на поверхности клетки, цепи антител экспрессируются с сигнальным пептидом, направляющим цепи антитела на секреторный путь через эндоплазматический ретикулум клетки, в основном клетки млекопитающего, где в основном сигнальный пептид расположен на N-конце каждой цепи антитела, и где также в основном сигнальный пептид отщепляется от цепей антитела в ходе процессинга и транспорта в клетке, в основном в клетке млекопитающего. Кроме того, тяжелая цепь антитела экспрессируется на определенной части с трансмембранной областью, закрепляющей антитело в клеточной мембране. Особо конкретно трансмембранная область расположена на С-конце тяжелой цепи антитела, что приводит к тому, что антитело остается прикрепленным к внешней поверхности клетки. Закрепление антитела в клеточной мембране также может быть достигнуто, например, путем GPI-связывания (Moran & Caras, The Journal Cell Biology 115 (1991) 1595-1600).
Сигнальные пептиды, направляющие белок на секреторный путь в эукариотических клетках, как правило, известны в данной области и описаны, например, в Nielsen, et al., Protein Engineering 10 (1997) 1-6.
В одном воплощении сигнальный пептид получен из секреторного белка или трансмембранного белка I типа.
В одном воплощении сигнальный пептид получен из секреторного белка, такого как член семейства сывороточных белков (альбумин, трансферрин, липопротеины, иммуноглобулины), внеклеточного матриксного белка (коллаген, фибронектин, протеогликаны), пептидного гормона (инсулин, глюкагон, эндорфины, энкефалины, АКТГ), пищеварительного фермента (трипсин, химотрипсин, амилаза, рибонуклеаза, дезоксирибонуклеаза) или молочного белка (казеин, лактальбумин).
В одном воплощении сигнальный пептид получен из иммуноглобулина, в основном из вариабельной области легкой цепи.
В одном воплощении сигнальный пептид является сигнальным пептидом легкой цепи мышиного Ig каппа.
В одном воплощении трансмембранная область получена из интегрального мембранного белка.
В одном воплощении трансмембранная область является внутренней заякоренной в мембране последовательностью остановки переноса, полученной из трансмембранного белка I типа (Do, et al., Cell 85 (1996) 369-78; Mothes, et al., Cell 89 (1997) 523-533), такой как молекула клеточной адгезии (интегрины, муцин, кадгерины), лектин (сиалоадгезин, CD22, CD33) или рецепторная тирозинкиназа (рецептор инсулина, рецептор EGF, рецептор FGF, рецептор PDGF).
В одном воплощении трансмембранная область является трансмембранной областью человеческого мембраносвязанного иммуноглобулина класса G.
В одном воплощении трансмембранная область получена из рецепторной тирозинкиназы, более конкретно из человеческого рецептора тромбоцитарного фактора роста (hPDGFR), наиболее конкретно из цепи В hPDGFR (регистрационный номер NP 002600).
В одном воплощении трансмембранная область получена из бета-цепи человеческого PDGFR.
Лентивирусы могут функционировать в широком диапазоне клеток-хозяев, в том числе в клетках млекопитающих, птиц, амфибий, рептилий и насекомых. Их геном содержит элементы, способные направлять экспрессию белков, в том числе гетерологичных белков, кодируемых нуклеиновыми кислотами вирусного генома в больших количествах.
Экспрессия структурных и неструктурных вирусных белков разделена, и структурные белки могут быть получены либо с помощью упаковочной клеточной линии, либо с помощью репликона вируса-помощника. В одном воплощении экспрессионная библиотека основана на отдельных репликонах лентивирусной РНК. В одном воплощении один репликон кодирует неструктурные белки, а другой кодирует структурные белки.
В одном воплощении популяция выделенных В-клеток получена от животного, обладающего повышенным титром антител, которые специфически связываются с антигеном, представляющим интерес. Титр антител, связывающихся в крови животного с антигеном, представляющим интерес, может быть определен способами, известными в данной области, например ELISA.
В одном воплощении животное подвергается или подверглось воздействию антигена, представляющего интерес, или его фрагмента или антигенной детерминанты, где в основном воздействие осуществляется путем природного воздействия, инфекции патогеном или иммунизации.
В одном воплощении животное инфицировано или было инфицировано патогеном, где патоген содержит антиген, представляющий интерес, или его фрагмент или антигенную детерминанту.
В одном воплощении популяция выделенных В-клеток получена от животного, иммунизированного иммуногенной композицией, где иммуногенная композиция содержит или, альтернативно, состоит из: (а) антигена, представляющего интерес; (b) фрагмента антигена, представляющего интерес; и (с) антигенной детерминанты антигена, представляющего интерес.
В контексте данного изобретения может быть использована любая иммуногенная композиция, известная в данной области, в частности композиция, вызывающая сильный иммунный ответ. Иллюстративные иммуногенные композиции представляют собой композиции, содержащие вирус-подобные частицы (virus-like particle, VLP), особенно VLP РНК-бактериофага. Используемые иммуногенные композиции приведены в WO 2006/097530, WO 2006/045796, WO 2006/032674, WO 2006/027300, WO 2005/117963, WO 2006/063974, WO 2004/084939, WO 2004/085635, WO 2005/068639, WO 2005/108425, WO 2005/117983, WO 2005/004907, WO 2004/096272, WO 2004/016282, WO 2004/009124, WO 2003/039225, WO 2004/007538, WO 2003/040164, WO 2003/031466, WO 2004/009116 и WO 2003/024481.
В одном воплощении иммунизация животного осуществляется с помощью иммуногенной композиции, где иммуногенность иммуногенной композиции усиливается иммуностимулирующим веществом, в частности иммуностимулирующим олигонуклеотидом, наиболее конкретно неметилированным CpG-содержащим олигонуклеотидом, описанным, например, в WO 2003/024481, WO 2005/004907 и WO 2004/084940.
В одном воплощении неметилированный CpG-содержащий олигонуклеотид представляет собой G10 (SEQ ID №54 из WO 2005/004907).
В одном воплощении иммунизация животного иммуногенной композицией выполняется путем введения иммуногенных композиций животному по меньшей мере три раза, особенно от трех до шести раз, с интервалами по меньшей мере в одну неделю, особенно с интервалами от двух недель до трех месяцев.
В одном воплощении иммунизация животного выполняется путем введения животному по меньшей мере 100 мкг, особенно от 200 мкг до 1000 мкг иммуногенной композиции в однократном введении.
В одном воплощении иммуногенная композиция содержит адъювант, в частности полный или неполный адъювант Фрейнда или квасцы.
В одном воплощении популяцию выделенных В-клеток или отдельных В-клеток или клональную популяцию В-клеток получают из источника, выбранного из: (а) крови; (b) вторичных лимфоидных органов, в частности селезенки или лимфатического узла; (с) костного мозга; и (d) ткани, содержащей В-клетки памяти. В одном воплощении источником является кровь. В одном воплощении популяция выделенных В-клеток включает или в основном состоит из мононуклеарных клеток периферической крови (peripheral blood mononuclear cells, PBMC).
В одном воплощении животное представляет собой млекопитающее или птицу.
В одном воплощении животное выбрано из группы, состоящей из: (а) человека; (b) мыши; (с) кролика; (d) курице; и (е) крысы.
В одном воплощении животное представляет собой млекопитающее, в частности крысу, мышь, кролика или человека.
В одном воплощении животное представляет собой трансгенную мышь, трансгенного кролика или человека.
Эффективность скрининга и клонирования антигенспецифических антител может быть значительно увеличена путем обогащения антигенспецифических В-клеток. Способы отбора из популяции выделенных В-клеток субпопуляции В-клеток по их способности специфически связываться с антигеном, представляющим интерес, хорошо известны в данной области. Эти способы основаны на взаимодействии антигенспецифических В-клеток, содержащихся в популяции выделенных В-клеток, с антигеном, представляющим интерес.
В одном воплощении выбор из популяции выделенных В-клеток субпопуляции В-клеток или отдельной В-клетки включает этапы:
(a) контактирования популяции выделенных В-клеток с представляющим интерес антигеном, его фрагментом или его антигенной детерминантой; и
(b) выбора В-клеток или отдельной В-клетки, которая специфически связывается с представляющим интерес антигеном, его фрагментом или его антигенной детерминантой.
Способы отбора из популяции выделенных В-клеток субпопуляции В-клеток, связывание В-клеток с покрытым антигеном носителем и FACS-сортировка описаны в WO 2004/102198.
В одном воплощении выбор из популяции выделенных В-клеток субпопуляции В-клеток или отдельной В-клетки включает этапы:
(a) нанесения на носитель представляющего интерес антигена, его фрагмента или его антигенной детерминанты;
(b) контактирования популяции выделенных В-клеток с носителем и связывание В-клеток с носителем через представляющий интерес антиген, его фрагмент или антигенную детерминанту;
(c) удаления несвязанных В-клеток, где в основном носитель содержит или также в основном состоит из шариков, где более конкретно шарики являются парамагнитными шариками; и
(d) удаление субпопуляции В-клеток или отдельной В-клетки с парамагнитных шариков.
В одном воплощении выбор из популяции выделенных В-клеток субпопуляции В-клеток или отдельной В-клетки выполняется путем FACS-сортировки.
В одном воплощении выбор из популяции выделенных В-клеток субпопуляции В-клеток или отдельной В-клетки включает следующие этапы:
(а) контактирование популяции выделенных В-клеток с представляющим интерес антигеном, его фрагментом или антигенной детерминантой, где представляющий интерес антиген, его фрагмент или антигенная детерминанта помечены флуоресцентным красителем; и
(b) разделение В-клеток, связанных с представляющим интерес антигеном, его фрагментом или его антигенной детерминантой, путем FACS-сортировки.
В одном воплощении флуоресцентный краситель выбран из группы, состоящей из (а) PerCP, аллофикоцианина (APC), (b) техасского красного, (с) родамина, (d) Cy3, (е) Cy5, (f) Cy5.5, (g) Cy7, (h) красителей Alexa Fluor, особенно Alexa 647 nm или Alexa 546 nm, (i) фикоэритрина (PE), Q) зеленого флуоресцентного белка (GFP), (k) тандемного красителя (например, РЕ-Су5), и (I) изотиоцианата флуоресцеина (FITC).
В одном воплощении флуоресцентный краситель представляет собой Alexa 647 nm или Alexa 546 nm.
В одном воплощении мечение флуоресцентным красителем соединения, особенно представляющего интерес антигена, его фрагмента или его антигенной детерминанты, выполняется любым способом, известным в данной области, в частности путем прямого мечения соединения путем связывания флуоресцентного красителя с соединением, где связывание может быть осуществлено с помощью ковалентной, а также нековалентной связи. Кроме того, мечение флуоресцентным красителем соединения, особенно представляющего интерес антигена, его фрагмента или его антигенной детерминанты, выполняется косвенно путем связывания со вторым соединением, в частности антителом, где второе соединение содержит флуоресценцтную метку.
Субпопуляция В-клеток, помимо способности клеток специфически связываться с представляющим интерес антигеном, может быть также выбрана по дополнительным маркерам, которые являются специфическими для этих типов В-клеток, экспрессирующих иммуноглобулины, которые предназначены для клонирования. Альтеранативно, могут быть исключены некоторые нежелательные типы В-клеток, преимущественно экспрессирующие нежелательные типы иммуноглобулинов. Кроме того, для отбора жизнеспособных клеток могут быть применены маркеры жизнеспособности, такие как, например, PI (пропидия йодид) или 7-AAD (7-аминоактиномицин). Кроме того, дополнительно или альтернативно, для отделения мертвых или апоптотических клеток могут быть применены маркеры клеточной гибели или апоптоза, такие как, например, YO-PRO-1 или аннексии V.
Кроме того, в выбор из популяции выделенных В-клеток субпопуляции В-клеток целесообразно включить положительную селекцию на наличие специфического маркера В-клеток, в частности CD19 или В220.
В одном воплощении отбор из популяции выделенных В-клеток субпопуляции В-клеток или отдельной В-клетки включает следующие этапы:
(a) контактирование популяции выделенных В-клеток с представляющим интерес антигеном, его фрагментом или антигенной детерминантой;
(b) отбор популяции В-клеток или отдельной В-клетки, которая специфически связывается с представляющим интерес антигеном, его фрагментом или антигенной детерминантой; и
(c) отбор В-клеток по меньшей мере по одному дополнительному параметру, где в основном отбор по меньшей мере по одному дополнительному параметру представляет собой
(i) положительную селекцию по параметру, выбранному среди присутствия специфического маркера В-клеток, в частности CD19 или В220, и жизнеспособности В-клеток; и/или
(ii) отрицательную селекцию по параметру, выбранному среди: присутствия антител IgM; присутствия антител IgD, присутствия маркеров клеточной гибели и присутствия маркеров апоптоза.
В одном воплощении отбор из популяции выделенных В-клеток субпопуляции В-клеток также включает этап отбора В-клеток с переключенным классом, особенно IgM- и/или IgD-отрицательных В-клеток, наиболее конкретно IgM- и IgD-отрицательных В-клеток.
В одном воплощении выбор из популяции выделенных В-клеток субпопуляции В-клеток или отдельной В-клетки включает следующие этапы:
(a) контактирование популяции выделенных В-клеток с представляющим интерес антигеном или его фрагментом или антигенной детерминантой, где представляющий интерес антиген или его фрагмент или антигенная детерминанта помечены первым флуоресцентным красителем, где в частности флуоресцентный краситель представляет собой Alexa 647 nm, Alexa 488 или Alexa 546 nm;
(b) контактирование клеток из популяции выделенных В-клеток с анти-IgM-и/или анти-IgD-антителами, где анти-IgM- и/или анти-1дй-антитела мечены вторым и/или третьим флуоресцентным красителем, где второй и/или третий флуоресцентный краситель излучает флуоресценцию при длине волны, отличной от длины волны флуоресценции, испускаемой первым флуоресцентным красителем; и
(с) отделение популяции В-клеток или отдельной В-клетки, связанной с представляющим интерес антигеном или его фрагментом или антигенной детерминантой, но не связанной с анти-IgM- и/или с анти-IgD-антителами, путем FACS-сортировки.
Для эффективности последующего процесса скрининга целесообразно, хотя и не абсолютно необходимо, чтобы каждая клетка, экспрессирующая и представляющая на своей поверхности антитело, содержала приблизительно один, в частности точно один, отдельный вид антитела, где каждая клетка в частности содержит различные виды антител. Это называется форматом «одно антитело на клетку».
Формат «одно антитело на клетку» может быть получен, например, с помощью вирусной экспрессионной библиотеки, особенно лентивирусной экспрессионной библиотеки, и путем выбора низкого соотношения числа вирусных частиц и числа эукариотических клеток, в частности клеток млекопитающих, при введении/трансдукции экспрессионной библиотеки, т.е. вирусных частиц, в популяцию клеток HEK293, используемых для представления.
В одном воплощении экспрессионная библиотека является вирусной экспрессионной библиотекой, особенно лентивирусной экспрессионной библиотекой, и введение экспрессионной библиотеки в первую популяцию эукариотических клеток, особенно клеток млекопитающих, осуществляется путем инфицирования эукариотических клеток, особенно клеток млекопитающих, лентивирусной экспрессионной библиотекой, особенно лентивирусной экспрессионной библиотекой, в которой более конкретно инфицирование проводят при множественности заражения не более 10, особенно не более 1, более конкретно не более 0,2, и наиболее конкретно не более 0,1. В одном воплощении множественность заражения составляет примерно 0,1.
В одном воплощении выделение клетки выполняется с помощью FACS-сортировки. В одном воплощении выделение клетки включает следующие этапы:
(a) мечение первой популяции эукариотических клеток, особенно клеток млекопитающих, представляющим интерес антигеном или его фрагментом или антигенной детерминантой, где представляющий интерес антиген или его фрагмент или антигенная детерминанта помечены флуоресцентным красителем; и
(b) отделение одной клетки, которая специфически связывается с представляющим интерес антигеном или его фрагментом или антигенной детерминантой, с помощью FACS-сортировки.
В одном воплощении отделение с помощью FACS-сортировки одной клетки, которая специфически связывается с представляющим интерес антигеном или его фрагментом или антигенной детерминантой, включает этап дальнейшего отбора клетки по меньшей мере по одному дополнительному параметру. В одном воплощении по меньшей мере один дополнительный параметр выбран среди
(i) положительной селекции по жизнеспособности клетки; и/или
(ii) отрицательной селекции по параметру, выбранному среди: присутствия IgM-антител; присутствия IgD-антител, присутствия маркеров клеточной гибели и присутствия маркеров апоптоза.
Отрицательная селекция также может включать отрицательную селекцию по связыванию одного или более, особенно одного нежелательного антигена(ов). Специалист в данной области, возможно, включит в скрининг нежелательный антиген(ы), особенно в немеченном формате, для того чтобы вытеснить клетки, экспрессирующие антитело, которое связывается с нежелательным антигеном(ами).
В одном воплощении способ также включает следующие этапы:
(a) культивирование по меньшей мере одной, в частности точно одной, отдельной клетки в присутствии второй популяции эукариотических клеток, особенности клеток млекопитающих;
(b) проверка возможности второй популяции эукариотических клеток, в частности клеток млекопитающих, специфически связываться с представляющим интерес антигеном или его фрагментом или антигенной детерминантой.
В одном воплощении первая популяция эукариотических клеток, в частности клеток млекопитающих и/или (в частности и) вторая популяция эукариотических клеток, в частности клеток млекопитающих, содержит (или в частности состоит из) клетки, выбранные среди: (а) клеток BHK 21, особенно АТСС CCL-10; (b) клеток Neuro-2a; (с) клеток HEK-293Т, особенно АТСС CRL-11268; (d) клеток CHO-K1, особенно АТСС CRL-62; и (е) клеток HEK293.
В одном воплощении первая популяция эукариотических клеток, в частности клеток млекопитающих, и/или вторая популяция эукариотических клеток, в частности клеток млекопитающих, содержит (или в частности состоит из) клетки CHO-K1, где более конкретно экспрессионная библиотека является лентивирусной экспрессионной библиотекой.
Отдельную клетку, представляющую интересующее антитело, можно использовать для клонирования и рекомбинантной экспрессии антител, содержащих вариабельные области антитела, представленного на клетке, с помощью способов, хорошо известных в данной области (см., например, Weitkamp, et al., J. Immunol. Meth. 275 (2003) 223-237). В принципе, можно экспрессировать антитела в любой известной форме (различные формы антител см. в Hollinger & Hudson, Nature Biotechnology 23 (2005)), особенно в виде IgG, наиболее конкретно в виде полностью человеческого IgG.
Таким образом, в данном документе предложен способ получения антитела, которое специфически связывается с антигеном, представляющим интерес, при этом способ включает следующие этапы:
(a) выделение клетки, экспрессирующей антитело, в соответствии со способом, о котором сообщается в данном документе;
(b) получение РНК из отдельной клетки;
(c) синтез кДНК, кодирующей антитело, из РНК;
(d) клонирование кДНК в экспрессионный вектор;
(e) экспрессия антитела в клетке; и
(f) очистка антитела.
В одном воплощении антитело содержит LCVR и HCVR, где в частности HCVR и LCVR получены из одной и той же отдельной клетки.
В одном воплощении синтез кДНК включает этап синтеза одноцепочечной кДНК из РНК.
В одном воплощении синтез кДНК также включает этап амплификации кДНК из одноцепочечной кДНК, где в частности амплификация выполняется с помощью
i) одного из олигонуклеотидов SEQ ID №№1-4 и олигонуклеотида SEQ ID №5 в качестве праймера, или
ii) одного из олигонуклеотидов SEQ ID №№6-10 и олигонуклеотида SEQ ID №11 в качестве праймера.
В одном воплощении экспрессия гибридного продукта осуществляется в клетках млекопитающих, особенно в клетках CHO-K1 и HEK293.
В данном документе сообщается о способе получения антитела, которое специфически связывается с представляющим интерес антигеном, путем экспрессии антитела в виде иммуноглобулина, особенно в виде специфического иммуноглобулина, наиболее конкретно в виде мышиного, крысиного, кроличьего, куриного или человеческого иммуноглобулина, наиболее конкретно в виде полностью человеческого иммуноглобулина.
В данном документе сообщается о способе получения антитела, которое специфически связывается с представляющим интерес антигеном, при этом способ включает следующие этапы:
(a) выделение клетки, экспрессирующей антитело? в соответствии со способом, о котором сообщается в данном документе;
(b) получение РНК из клетки;
(c) синтез кДНК из РНК;
(d) амплификация из кДНК ДНК, кодирующей вариабельные области (VR) антитела, экспрессируемого клеткой;
(e) создание экспрессионной конструкции, содержащей ДНК, где эта экспрессионная конструкция кодирует по меньшей мере одну VR антитела, экспрессируемого клеткой;
(f) экспрессия экспрессионной конструкции в клетке.
В одном воплощении способ включает следующие этапы:
(a) выделение клетки, экспрессирующей антитело, в соответствии со способом, описанным выше;
(b) получение РНК из клетки;
(c) синтез кДНК из РНК;
(d) амплификация из кДНК первой ДНК, кодирующей HCVR антитела, экспрессируемого клеткой;
(e) создание первой экспрессионной конструкции, содержащей первую ДНК, где первая экспрессионная конструкция кодирует тяжелую цепь иммуноглобулина, содержащую константную область тяжелой цепи (HCCR) и HCVR;
(f) амплификация из кДНК второй ДНК, кодирующей LCVR антитела, экспрессируемого клеткой;
(g) создание второй экспрессионной конструкции, содержащей вторую ДНК, где вторая экспрессионная конструкция кодирует легкую цепь иммуноглобулина, содержащую константную область легкой цепи (LCCR) и LCVR;
(h) экспрессия первой экспрессионной конструкции и второй экспрессионной конструкции в клетке.
В еще одном предпочтительном воплощении HCCR, HCVR, LCCR и LCVR имеют человеческое происхождение.
В одном воплощении экспрессионная конструкция, первая экспрессионная конструкция и/или вторая экспрессионная конструкция, также кодирует гидрофобную лидерную последовательность, в частности видоспецифическую гидрофобную лидерную последовательность, наиболее конкретно человеческую гидрофобную лидерную последовательность. В одном воплощении первая экспрессионная конструкция также кодирует человеческую гидрофобную лидерную последовательность тяжелой цепи. В одном воплощении вторая экспрессионная конструкция также кодирует человеческую гидрофобную лидерную последовательность легкой цепи, где человеческая гидрофобная лидерная последовательность легкой цепи выбрана из группы, состоящей из (а) человеческой гидрофобной лидерной последовательности легкой цепи каппа; и (b) человеческой гидрофобной лидерной последовательности легкой цепи лямбда.
В одном воплощении синтез кДНК включает этап синтеза одноцепочечной кДНК из РНК.
В одном воплощении синтез кДНК также включает этап амплификации кДНК из одноцепочечной кДНК.
В одном воплощении HCCR представляет собой человеческую HCCR, в частности человеческую HCCR, выбранную из группы, состоящей из: (а) человеческой HCCR гамма-1; (b) человеческой HCCR гамма 2; и (с) человеческой HCCR гамма 4.
В одном воплощении LCCR представляет собой человеческую LCCR, d особенности человеческую LCCR, выбранную из группы, состоящей из: (а) человеческой LCCR каппа; и (b) человеческой LCCR лямбда.
В одном воплощении амплификация первой ДНК осуществляется с помощью праймеров, специфических для HCVR.
В одном воплощении амплификация второй ДНК осуществляется с помощью праймеров, специфических для LCVR, причем в частности LCVR-специфические праймеры выбраны из каппа-LCVR-специфических праймеров и лямбда-LCVR-специфических праймеров. В одном воплощении LCVR-специфичные праймеры являются Kanna-LCVR-специфическими праймерами, где в частности каппа-LCVR-специфические праймеры являются комбинацией любого выбранного среди SEQ ID №№12-18 с SEQ ID №19. В одном воплощении LCVR-специфические праймеры являются лямбда-LCVR-специфическими праймерами, где в частности лямбда-LCVR-специфичные праймеры представляют собой комбинацию любого выбранного среди SEQ ID №№20-27 с SEQ ID №28.
В одном воплощении LCCR является человеческой каппа-LCCR, a LCVR является человеческой каппа-LCVR. В одном воплощении LCCR является человеческой лямбда-LCCR, a LCVR является человеческой лямбда-LCVR.
В принципе, иммуноглобулины, содержащие тяжелую и легкую цепь, могут быть рекомбинантно получены путем экспрессии двух различных экспрессионных векторов в одной и той же клетке. Альтеранативно, экспрессионные конструкции, кодирующие легкую цепь и тяжелую цепь, могут быть клонированы в один экспрессионный вектор. Таким образом, в одном воплощении экспрессия первой экспрессионной конструкции и второй экспрессионной конструкции включает экспрессию первой экспрессионной конструкции как части первого экспрессионного вектора, и экспрессию второй экспрессионной конструкции как части второго экспрессионного вектора, где первый экспрессионный вектор и второй экспрессионный вектор совместно трансфицируют в клетку. В одном воплощении экспрессия первой экспрессионной конструкции и второй экспрессионной конструкции включает экспрессию первой экспрессионной конструкции и второй экспрессионной конструкции как части одного и того же экспрессионного вектора.
Для экспрессии видоспецифических, в частности человеческих, антител получают экспрессионные кассеты, кодирующие HCCR или LCCR, от видов, в частности от человека, и соответствующие лидерные последовательности и содержащие сайт рестрикции, позволяющий вставить соответствующие кодирующие участки VR. В одном воплощении создание первой экспрессионной конструкции включает этап клонирования первой ДНК в первую экспрессионную кассету, где первая экспрессионная кассета кодирует HCCR и, в частности, гидрофобную лидерную последовательность HCCR. В одном воплощении создание второй экспрессионной конструкции включает этап клонирования второй ДНК во вторую экспрессионную кассету, где вторая экспрессионная кассета кодирует LCCR и, в частности, гидрофобную лидерную последовательность LCCR.
В одном воплощении антитело экспрессируется в форме, выбранной среди: (а) одноцепочечного антитела, в частности scFv; (b) димерного антитела; (с) Fab-фрагмента; (d) Р(abʹ)2-фрагмента; и (е) полноразмерного антитела, в частности выбранного среди IgG, IgA, IgE, IgM и IgD. В одном воплощении антитело представляет собой полностью человеческое антитело.
В одном воплощении антитело экспрессируется в виде целого антитела класса IgG, особенно IgG1, IgG2, IgG3 или IgG4; где в частности антитело представляет собой человеческое антитело, наиболее конкретно полностью человеческое антитело.
Экспрессия антитела может быть осуществлена в любой системе эукариотической экспрессии, известной в данной области. Как правило и в частности экспрессия антитела выполняется в эукариотических клетках, где более конкретно эукариотические клетки выбраны среди клеток дрожжей, клеток насекомых и клеток млекопитающих. В одном воплощении экспрессия антитела выполняется в клетках млекопитающих, где в частности клетки млекопитающих выбраны среди клеток НЕК, клеток СНО, клеток COS. Особо конкретно клетки млекопитающих представляют собой клетки СНО.
В данном документе сообщается об экспрессионном векторе для представления полноразмерных антител на поверхности эукариотической клетки, особенно клетки млекопитающего. Экспрессионный вектор в одном воплощении представляет собой вирусный экспрессионный вектор, в частности лентивирусный экспрессионный вектор. В одном воплощении экспрессионный вектор содержит элементы ДНК, кодирующие сигнальный пептид, трансмембранную область, где экспрессионный вектор содержит сайт рестрикции, позволяющий клонирование, особенно клонирование в определенной ориентации молекул ДНК, кодирующих вариабельные области антител в экспрессионный вектор. В еще одном предпочтительном воплощении экспрессионный вектор содержит элементы ДНК и сайт рестрикции в ориентации, позволяющей экспрессировать мембраносвязанное антитело, содержащее от N-к С-концу сигнальный пептид, тяжелую цепь антитела и трансмембранную область.
В данном документе сообщается об экспрессионной библиотеке, в частности об экспрессионной библиотеке, экспрессирующей полноразмерные антитела и содержащей экспрессионный вектор, о котором сообщается в данном документе.
В данном документе сообщается об эукариотической клетке, в частности клетке млекопитающего, содержащей экспрессионный вектор, о котором сообщается в данном документе, или содержащей по меньшей мере один образец из экспрессионной библиотеки, о которой сообщается в данном документе.
В данном документе сообщается о способе оптимизации/созревания антитела. Способ особенно подходит для скрининга разнообразия от малого до среднего размера, т.е. более 400 вариантов. Способ может быть осуществлен с помощью клеток млекопитающих, особенно HEK293.
Способы клеточного дисплея, о которых сообщается в данном документе:
- позволяют экспрессировать и представлять полноразмерные антитела в/на HEK293;
- делают возможным эффективный процесс, требующий ограниченных ресурсов;
- делают возможным экономичный процесс в одной пробирке, когда все варианты антитела получаются в одной пробирке;
- делают возможным созревание антител; и
- позволяют создавать недорогие библиотеки, которые не зависят от конкретного способа получения, например, с помощью ПЦР от людей-доноров или с помощью синтетических ДНК-олигомеров.
Способы создания и скрининга антител на основе В-клеток, развиваемые в последние годы, предусматривают новый способ создания и скрининга разработанных/инженерных/природных библиотек на основе IgG-антител в клетках млекопитающих.
В данном документе сообщается о способе, использующем разработанные/инженерные/природные разнообразные клеточные библиотеки млекопитающих полноразмерных антител с разнообразием от 103 до 106.
Размер библиотеки до 106 вариантов позволяет
- представлять 1000 легких и 1000 тяжелых цепей (что дает 106 различных антител);
- переставлять одну цепь и сохранять другую константную (что дает 106 возможных вариантов);
- для созревания отдельного CDR (106 вариантов предусматривает рандомизацию от 4 до 5 аминокислотных позиций (варианты длиной в 19 аминокислот на позицию, все аминокислоты без Cys: 130000 вариантов, если 4 аминокислотные позиции рандомизированы)).
В данном документе сообщается о способе, использующем полноразмерный IgG, экспрессированный в мембраносвязанной и секретируемой форме.
В данном документе сообщается о способе, позволяющем разработку последовательностей антитела на основе заказа/случайную.
В данном документе сообщается о способе, который использует пэннинг и/или скрининг вариантов антител на основе FACS.
Способы, о которых сообщается в данном документе, могут быть использованы для сборки предварительно отобранных человеческих донорных последовательностей легкой и тяжелой цепей антитела, например, последовательностей антитела из человеческих В-клеток, полученных с помощью ПЦР.
В одном воплощении В-клетки получены/выделены из крови.
Способы, о которых сообщается в данном документе, могут быть использованы для созревания антигенсвязывающих свойств (таких как аффинность, межвидовая перекрестная реактивность, рН-зависимое связывание антигена) антитела, например, путем перестановки легкой цепи или модификации/рандомизации одиночных (отдельных) CDR.
Способы, о которых сообщается в данном документе, могут быть использованы для сборки предварительно отобранных человеческих донорных последовательностей легкой и тяжелой цепей антитела (например, последовательностей антитела, полученного из человеческой опухолевой В-клетки, выделенных с помощью ПЦР).
Способы, о которых сообщается в данном документе, могут быть использованы для проверки и сборки рационально разработанных последовательностей антитела (например, каталитического антитела, проантител). Таким образом, способы, о которых сообщается в данном документе, могут быть использованы для инженерии антитела путем введения специфических особенностей последовательности.
Способы, о которых сообщается в данном документе, могут быть использованы для гуманизации антител, например, для идентификации обратных мутаций в случаях, если классический подход CDR-прививки терпит неудачу, и/или в случаях, когда требуется/намечается тестирование тысяч или десятков тысяч вариантов.
Способы, о которых сообщается в данном документе, могут быть использованы для оптимизации биофизических и/или биохимических свойств антитела (например, стабильности, тенденции к агрегации).
Способы, о которых сообщается в данном документе, могут быть использованы для оптимизации экспрессии и/или секреции антител.
Нуклеиновая кислота, кодирующая CDR, или нуклеиновая кислота, кодирующая вариабельный домен, или В-клетка, используемая в способах, о которых сообщается в данном документе, может быть получена от иммунизированного животного или от животного, которое перенесло заболевание, или от животного, которое в настоящее время имеет активное заболевание, или от трансгенного животного с человеческим IgG-локусом, или от наивного животного.
Кодирующие CDR нуклеиновые кислоты в вариабельных доменах могут быть все получены из природного вариабельного домена (в том числе получены от иммунизированного животного), либо могут быть смешаны с природными CDR и синтетическими CDR, или могут быть только синтетическими CDR.
Например, библиотека, содержащая рандомизированные нуклеиновые кислоты, кодирующие CDR3, может быть библиотекой, в которой отдельные члены разнообразны по длине кодируемого CDR3 (например, от 4 до 25 аминокислотных остатков в длину), где можно избежать применения стоп-кодонов, где можно избежать возникновения остатков цистеина, где можно избежать сайтов гликозилирования, где можно избежать нестабильных мотивов последовательности, и/или где четыре наиболее распространенных аминокислотных остатка для человеческих областей CDR3 для каждой из позиций рандомизированы.
Модуль, образующий разнообразие, может быть разнообразным в
- рандомизированных CDR, например, рандомизированном CDR3 (дизайн последовательности, отражающий длину человеческого CDR3, отсутствие стоп-кодонов, отсутствие цистеинов, отсутствие сайтов N-гликозилирования, отсутствие нестабильных мотивов); и/или
- разработанных CDR, например «рациональные» варианты последовательности на основании разработанных или существующих последовательностей; и/или
- донорных CDR или вариабельных доменах (полученных от человека-донора, иммунизированного животного).
Модуль разнообразия может быть получен с помощью ПЦР или генного синтеза, а клонирование в экспрессионный вектор может быть осуществлено с помощью классического лигирования или клонирования, независимого от последовательности и лигирования (sequence and ligation independent cloning, SLIC).
В экспрессионной системе антитело с одной специфичностью производится и представляется одной клеткой. Это может быть достигнуто с помощью вирусной инфекции с контролируемой MOI (лентивирусной или bacmam) во транзиентной системе или путем отдельных событий рекомбинации (LoxP, FLP) в стабильной системе. Экспрессионная система должна гарантировать высокий уровень экспрессии мембраносвязанного и/или секретируемого полноразмерного антитела.
Скрининг представителей библиотеки может быть выполнен путем выделения совпадений через пэннинг и/или FACS-селекцию. Скрининг секретируемого антитела может быть выполнен в супернатанте. Нуклеиновые кислоты, кодирующие вариабельный домен отобранных клонов, выделяют с помощью ПЦР.
Таким образом, в данном документе представлены способы управляемого антигеном обогащения (например, аффинно улучшенной) связывающей молекулы способами, основанными на FACS и/или использовании шариков.
Способы клеточного дисплея, приведенные в данном документе
Способ представления библиотек полноразмерных антител:
Модули, обеспечивающие разнообразие, такие как библиотека ДНК, содержащая рандомизированные кодирующие CDR3 нуклеиновокислотные последовательности антитела, вводят в лентивирусный дисплейный вектор, о котором сообщается в данном документе.
Обеспечивающий разнообразие модуль, содержащий лентивирусный дисплейный вектор и необходимые вспомогательные плазмиды, вводят в экспрессионную систему для создания инфекционных вирусных частиц.
После выделения содержащего вирус супернатанта и количественной оценки вирусной нагрузки (например, в экспериментах с трансдукцией или посредством ОТ-ПЦР) клетки млекопитающих, такие как HEK293, трансдуцируют для создания библиотеки с скорректированной MOI, чтобы получить клетки, которые представляют мембраносвязанных представителей библиотеки и в то же время секретируют растворимых представителей библиотеки.
Отдельных представителей библиотеки проверяют на основании мембраносвязанных представителей библиотеки для выявления и отбора клеток, представляющих варианты антител с заданными характеристиками, например в отношении аффинности, межвидовой перекрестной реактивности, рН-зависимого связывания антигена.
На следующем этапе отобранные клетки сохраняют в виде отдельных клеток для того, чтобы получить клональную клеточную популяцию, или сохраняют в виде пула клеток. После этого сохраненные клетки культивируют, получая вариант антитела. Секретируемый вариант антитела может быть использован для дальнейшей характеристики, такой как первичный скрининг.
Клоны или популяции, выбранные в первом скрининге, культивируют в течение длительного времени.
После этого выделяют нуклеиновые кислоты, кодирующие вариабельный домен.
Способ представления библиотек биспецисрических антител: Биспецифические антитела, как правило, представляют собой молекулы антител, которые специфически связываются с двумя различными неперекрывающимися эпитопами на одном и том же антигене или с двумя эпитопами на различных антигенах.
Известны различные форматы биспецифических антител.
Иллюстративные форматы биспецифических антител, которые можно использовать в способах, о которых сообщается в данном документе, представляют собой
- формат Crossmab: полноразмерное антитело IgG, содержащее первый сайт связывания, который специфически связывается с первым эпитопом или антигеном, и второй сайт связывания, который специфически связывается со вторым эпитопом или антигеном, где отдельные цепи являются такими
- легкая цепь 1 (вариабельный домен легкой цепи + константный домен легкой цепи каппа)
- легкая цепь 2 (вариабельный домен легкой цепи + СН1-домен тяжелой цепи)
- тяжелая цепь 1 (вариабельный домен тяжелой цепи + СН1 + петля + СН2 + СН3 с мутацией типа «замок»)
- тяжелая цепь 2 (вариабельный домен тяжелой цепи + константный домен легкой цепи каппа + петля + СН2 + CH3 с мутацией типа «ключ»);
- формат одной цепи с одной ветвью: антитело, содержащее первый сайт связывания, который специфически связывается с первым эпитопом или антигеном, и второй сайт связывания, который специфически связывается со вторым эпитопом или антигеном, где отдельные цепи являются такими
- легкая цепь (вариабельный домен легкой цепи+константный домен легкой цепи каппа)
- комбинированная легкая/тяжелая цепь (вариабельный домен легкой цепи + константный домен легкой цепи каппа + G4S-линкер + вариабельный домен тяжелой цепи + СН1 + петля + СН2 + СН3 с мутацией типа «ключ»)
- тяжелая цепь (вариабельный домен тяжелой цепи + СН1 + петля + СН2 + СН3 с мутацией типа «замок»);
- формат одной цепи с двумя ветвями: антитело, содержащее первый сайт связывания, который специфически связывается с первым эпитопом или антигеном, и второй сайт связывания, который специфически связывается со вторым эпитопом или антигеном, где отдельные цепи являются такими
- комбинированная легкая/тяжелая цепь 1 (вариабельный домен легкой цепи + константный домен легкой цепи каппа + G4S-линкер + вариабельный домен тяжелой цепи + СН1 + петля + СН2 + СН3 с мутацией типа «замок»)
- комбинированная легкая/тяжелая цепь 2 (вариабельный домен легкой цепи + константный домен легкой цепи каппа + G4S-линкер + вариабельный домен тяжелой цепи + СН1 + петля + СН2 + СН3 с мутацией типа «ключ»);
- биспецифический формат с общей легкой цепью: антитело, содержащее первый сайт связывания, который специфически связывается с первым эпитопом или антигеном, и второй сайт связывания, который специфически связывается со вторым эпитопом или антигеном, где отдельные цепи являются такими
- легкая цепь (вариабельный домен легкой цепи + константный домен легкой цепи каппа)
- тяжелая цепь 1 (вариабельный домен тяжелой цепи + СН1 + петля + СН2 + СН3 с мутацией типа «замок»)
- тяжелая цепь 2 (вариабельный домен тяжелой цепи + СН1 + петля + СН2 + СН3 с мутацией типа «ключ»).
- формат четырехвалентного scFv: биспецифическое четырехвалентное антитело, содержащее первый сайт связывания, который специфически связывается с первым эпитопом или антигеном, и второй сайт связывания (scFv), который специфически связывается со вторым эпитопом или антигеном, где отдельные цепи являются такими
- легкая цепь (вариабельный домен тяжелой цепи + константный домен легкой цепи каппа)
- комбинированная тяжелая цепь - scFv (вариабельный домен тяжелой цепи + СН1 + петля + СН2 + СН3 + G4S-линкер + scFv).
- формат четырехвалентного scFab: биспецифическое четырехвалентное антитело, содержащее первый сайт связывания, который специфически связывается с первым эпитопом или антигеном, и второй сайт связывания (scFv), который специфически связывается со вторым эпитопом или антигеном, где отдельные цепи являются такими
- легкая цепь (вариабельный домен легкой цепи + константный домен легкой цепи каппа)
- комбинированная тяжелая цепь - scFab (вариабельный домен тяжелой цепи + СН1 + петля + СН2 + СН3 + G4S-линкер + scFab).
Структура элементов экспрессионных кассет для описанных выше биспецифических форматов антител выглядит следующим образом (в направлении от 5ʹ к 3ʹ, см. также фиг. 7):
- формат Crossmab:
[5'-LTR + упаковочный элемент + RRE] - [hCMV-промотор] - [легкая цепь 1 или 2] - [IRES] - [тяжелая цепь 1 или 2] - [WPRE + 3'-LTR];
- формат одной цепи с одной ветвью:
1) [5-LTR + упаковочный элемент + RRE] - [hCMV-промотор] - [легкая цепь] - [IRES] - [тяжелая цепь] - [WPRE + 3'-LTR], и/или
2) [5-LTR + упаковочный элемент + RRE] - [hCMV-промотор] - [комбинированная легкая/тяжелая цепь] - [WPRE + 3'-LTR];
- формат одной цепи с двумя ветвями: [5'-LTR + упаковочный элемент + RRE] - [hCMV-промотор] - [комбинированная легкая/тяжелая цепь 1 или 2] - [WPRE + 3'-LTR];
- биспецифический формат с общей легкой цепью:
1) [5'-LTR + упаковочный элемент + RRE] - [hCMV-промотор] - [тяжелая цепь 1] - [IRES] - [тяжелая цепь 2] - [WPRE + 3'-LTR], и/или
2) [hCMV-промотор] - [легкая цепь] - [bGH полиА];
- формат четырехвалентного scFv:
1) [5'-LTR + упаковочный элемент + RRE] - [hCMV-промотор] - [тяжелая цепь] - [IRES] - [легкая цепь] - [WPRE + 3'-LTR];
- формат четырехвалентного scFab: 1) [5'-LTR + упаковочный элемент + RRE] - [hCMV-промотор] - [тяжелая цепь] - [IRES] - [легкая цепь] - [WPRE + 3'-LTR].
Технологический процесс представления полноразмерных антител на поверхности эукариотических клеток и отбора клеток описан далее:
На первом этапе необходимый экспрессионный вектор(ы), о котором сообщается в данном документе, конструируется на основе формата биспецифического антитела, которое должно быть представлено
После этого для каждой половины антитела получают две независимые вирусные частицы. Клетки трансфицируют шаттл-вектором и вспомогательными плазмидами, получая репликативно некомпетентные, но инфекционные вирусные частицы.
Для получения дисплейной библиотеки либо
- клетки млекопитающих инфицируют с низкой MOI (множественностью заражения) обеими вирусными частицами, кодирующими соответствующие части антител, либо
- клетки млекопитающих инфицируют с низкой MOI вирусными частицами, кодирующими первую половину антитела, а затем клетки инфицируют вирусными частицами со второй половиной антитела, либо
- клетки млекопитающих, стабильно экспрессирующие общую легкую цепь, инфицируют вирусной частицей, кодирующей две тяжелые цепи.
После этого отбирают/обогащают трансдуцированные клетки, экспрессирующие биспецифические моноклональные антитела.
Антигенсвязывающие клетки, экспрессирующие биспецифические антитела, сортируют (сохраняют) в виде отдельных клеток или в виде пула с использованием, например, FACS.
Отсортированные клетки культивируют и размножают.
После этого выполняют функциональный скрининг секретируемых антител в клеточном супернатанте FACS-отсортированных и культивируемых клеток, экспрессирующих биспецифические антитела.
Затем выполняется выбор клеток, экспрессирующих функциональные биспецифические антитела.
Наконец, экспрессионные кассеты с комбинацией легких и тяжелых цепей клонируют с помощью ПЦР и проводят ДНК-секвенирование.
Для создания экспрессионного вектора для биспецифических антител против одной мишени кроликов или мышей иммунизируют рекомбинантным белком-мишенью или клетками, рекомбинантно или природно экспрессирующими белок-мишень. Клетки селезенки или клетки периферической крови собирают после иммунизации и получают РНК. Антигенспецифические В-клетки могут быть обогащены путем общей FACS с помощью флуоресцентно меченого антигена в качестве селективного маркера. После этого получают кДНК, амплифицируют вариабельные домены тяжелой и легкой цепи с помощью ПЦР и лигируют в вектор для представления полноразмерных IgG, как описано в данном документе, или в экспрессионный вектор для экспрессии и продукции.
Для создания антител с общей легкой цепью трансгенных кроликов иммунизируют, как описано выше. Трансгенные кролики имеют нокаутный локус кроличьего IgM и Ig каппа. Нокаутный кроличий локус Ig заменяют на человеческий локус Ig, включающий человеческие гены легкой и тяжелой цепи. Ген легкой цепи уже полностью перестроен в трансгенном локусе Ig, что приводит к экспрессии отдельной легкой цепи во всех В-клетках, полученных из этих кроликов. Трансген тяжелой цепи не перестроен. Тяжелая цепь имеет высокое разнообразие в результате случайной перестановки вариабельного гена с J- и D-элементами и соматической гипермутации и генной конверсии (см, например, WO 2005/007696).
Для создания вирусных частиц шаттл-вектор (=лентивирусный дисплейный вектор, о котором сообщается в данном документе) совместно трансфицируют в HEK293 вместе с вспомогательными плазмидами (например, трансфекция с Cellfectin). Супернатант, содержащий вирусные частицы, собирают центрифугированием. Количество инфекционных вирусных частиц может быть проверено путем трансдукции клеток HEK293 аликвотами вирусного стока. Число экспрессирующих антитело клеток HEK293 подсчитывают с помощью FACS.
Для создания клеток HEK293, экспрессирующих и представляющих антитело, клетки инфицируют с низкой MOI шаттл-вектором, содержащим вирус. Клетки, экспрессирующие специфические антитела, отбирают и сортируют путем общей FACS после мечения флуоресцентно меченым антигеном. После отделения антигенспецифические комбинации легких и тяжелых цепей выделяют с помощью ПЦР как один фрагмент, включающий IRES, т.е. родственная комбинация вариабельных доменов легкой и тяжелой цепи сохраняется.
Для создания библиотек полуантител фрагменты ПЦР-ДНК (кодирующие легкую и тяжелую цепи антигенспецифических антител) лигируют в экспрессионные векторы с конструкциями типа «замок» и «ключ». Для обеих конструкций, «замка» и «ключа», вирусные частицы создают, как описано выше.
Для представления биспецифических антител получают клетки HEK293, экспрессирующие обе тяжелые цепи антитела на основе конструкций «замка» и «ключа» путем трансдукции различными вирусами. Для сортировки/отбора растворимый флуоресцентно меченый антиген добавляют к клеткам. Клетки промывают несколько раз, чтобы выбрать двухвалентные связывающие молекулы (более медленная диссоциация антигена, связанного двумя ветвями антитела). Связывающие молекулы с длительным периодом полужизни сортируются как отдельные клетки путем FACS.
Для скрининга функциональных биспецифических антител секретируемые антитела в супернатанте культивируемых клеток HEK293 проверяют в функциональном анализе на основе клеток или не на основе клеток (например, фосфорилирование рецептора, пролиферация, индукция апоптоза). Из отобранных клонов легкие и тяжелые цепи функционально активных антител клонируют с помощью ПЦР из клеток HEK293.
Одним из аспектов, о котором сообщается в данном документе, является технологический процесс/способ представления полноразмерных антител, содержащих общую легкую цепь, на поверхности эукариотических клеток и отбора клеток и тем самым отбора антитела, включающий следующие этапы:
- иммунизация экспериментального животного, такого как трансгенный кролик,
- отбор антигенспецифических В-клеток (путем FACS, общей сортировки),
- ПЦР-амплификация нуклеиновой кислоты, кодирующей тяжелую цепь: две отдельные полимеразные цепные реакции, встраивающие уникальные сайты рестрикции для направленного клонирования в шаттл-вектор, одна для цепи типа «ключ» с помощью одного или более или всех праймеров SEQ ID №№6-10 и праймера SEQ ID №11, и одна для цепи типа «замок» с помощью одного или более или всех праймеров SEQ ID №1-4 и праймера SEQ ID №5; лигирование: нуклеиновой кислоты, кодирующей вариабельный домен первой тяжелой цепи, в локус «замок» без трансмембранного домена, т.е. выше EV71-IRES, и нуклеиновой кислоты, кодирующей вариабельный домен второй тяжелой цепи в локус «ключ» с трансмембранным доменом, т.е. ниже EV71-IRES,
- получение вируса, инфицирование клетки млекопитающего, стабильно экспрессирующей общую легкую цепь, отбор биспецифических антител, представляемых на поверхности клетки млекопитающего (скрининг по диссоциации антигена, «off-rate»), общая сортировка ответов (клонов клеток млекопитающих) с помощью FACS,
- ПЦР нуклеиновой кислоты, кодирующей полную первую тяжелую цепь, и нуклеиновой кислоты, кодирующей вариабельный домен (который не имеет домена ТМ) второй тяжелой цепи, включая EV71-IRES, и клонирование во второй шаттл-вектор без трансмембранного домена с помощью, например, праймеров SEQ ID №29 и SEQ ID №30,
- получение вируса, инфицирование клетки млекопитающего, экспрессирующей общую легкую цепь, сортировка клеток по отдельным клеткам, скрининг биспецифического антитела в супернатанте и выбор биспецифического антитела.
Одним из аспектов, о котором сообщается в данном документе, является технологический процесс/способ представления полноразмерных антител, содержащих общую легкую цепь, на поверхности эукариотических клеток и отбора клеток и тем самым отбора антитела, включающий следующие этапы:
- иммунизация экспериментального животного, такого как трансгенный кролик,
- отбор антигенспецифических В-клеток (путем FACS, общей сортировки),
- ПЦР-амплификация нуклеиновой кислоты, кодирующей тяжелую цепь (две отдельные полимеразные цепные реакции, встраивающие уникальные сайты рестрикции для направленного клонирования в шаттл-вектор; лигирование: нуклеиновой кислоты, кодирующей вариабельный домен первой тяжелой цепи, в локус «замок» с трансмембранным доменом, т.е. выше EV71-IRES, и нуклеиновой кислоты, кодирующей вариабельный домен второй тяжелой цепи, в локус «ключ» с трансмембранным доменом, т.е. ниже EV71-IRES,
- получение вируса, инфицирование клетки млекопитающего, экспрессирующей общую легкую цепь, отбор биспецифических антител, представляемых на мембране клетки млекопитающего (скрининг «off-rate»), общая сортировка ответов (клонов клеток млекопитающих) с помощью FACS,
- ПЦР нуклеиновой кислоты, кодирующей полную первую тяжелую цепь, и нуклеиновой кислоты, кодирующей вариабельный домен второй тяжелой цепи (2,2 т.п.о.), включая EV71-IRES, и клонирование во второй шаттл-вектор без трансмембранного домена; удаление трансмембранного домена первой тяжелой цепи путем рестрикции и повторного лигирования вектора,
- получение вируса, инфицирование клетки млекопитающего, экспрессирующей общую легкую цепь, сортировка клеток по отдельным клеткам, скрининг биспецифического антитела в супернатанте и выбор биспецифического антитела.
Одним из аспектов, о котором сообщается в данном документе, является технологический процесс/способ представления полноразмерных антител, содержащих общую легкую цепь, на поверхности эукариотических клеток и отбора клеток и тем самым отбора антитела, включающий следующие этапы:
- иммунизация экспериментального животного, такого как трансгенный кролик,
- отбор антигенспецифических В-клеток (путем FACS, общей сортировки),
- ПЦР-амплификация нуклеиновой кислоты, кодирующей тяжелую цепь: две отдельные полимеразные цепные реакции, встраивающие уникальные сайты рестрикции для направленного клонирования в шаттл-вектор; лигирование: нуклеиновой кислоты, кодирующей вариабельный домен первой тяжелой цепи, в первый шаттл-веткор в локус «замок» с или без трансмембранного домена, и нуклеиновой кислоты, кодирующей вариабельный домен второй тяжелой цепи, во второй шаттл-вектор в локус «ключ» с или без трансмембранного домена, но по меньшей мере с одним трансмембранным доменом,
- получение вируса (одного для первого шаттл-вектора и одного для второго шаттл-вектора), последующее инфицирование клетки млекопитающего, экспрессирующей общую легкую цепь, первым вирусом и вторым вирусом, отбор биспецифических антител, представляемых на мембране клетки млекопитающего (скрининг «off-rate»), общая сортировка ответов (клонов клеток млекопитающих) с помощью FACS,
- ПЦР нуклеиновой кислоты, кодирующей вариабельные домены тяжелой цепи, и клонирование в третий шаттл-вектор в бицистронный экспрессионный блок без трансмембранного домена и EV71-IRES,
- получение вируса, инфицирование клетки млекопитающего, экспрессирующей общую легкую цепь, сортировка клеток по отдельным клеткам, скрининг биспецифического антитела в супернатанте и выбор биспецифического антитела.
Одним из аспектов, о котором сообщается в данном документе, является технологический процесс/способ представления полноразмерных биспецифических антител, содержащих общую легкую цепь, на поверхности эукариотических клеток и отбора таких эукариотических клеток и тем самым отбора биспецифического антитела, включающий следующие этапы:
- первое экспериментальное животное, в одном воплощении трансгенную мышь или трансгенного кролика, иммунизируют первым представляющим интерес антигеном, в одном воплощении внеклеточным доменом рецептора, где В-клетки экспериментального животного экспрессируют одну и ту же легкую цепь,
- второе экспериментальное животное, в одном воплощении трансгенную мышь или трансгенного кролика, иммунизируют вторым представляющим интерес антигеном, в одном воплощении внеклеточным доменом рецептора, где В-клетки экспериментального животного экспрессируют одну и ту же легкую цепь,
при этом первый антиген и второй антиген различны,
- выбор В-клеток первого и второго иммунизированного экспериментального животного, в одном воплощении путем общей FACS-сортировки,
- получение нуклеиновой кислоты, кодирующей тяжелую цепь, из каждой В-клетки путем отдельной ПЦР-амплификации в двух отдельных/последовательных полимеразных цепных реакциях, вводящих уникальные сайты рестрикции для направленного клонирования в шаттл-вектор/лентивирусный экспрессионный вектор,
- лигирование нуклеиновой кислоты, кодирующей первый вариабельный домен тяжелой цепи, в шаттл-вектор/лентивирусный экспрессионный вектор выше IRES (в одном воплощении IRES является EV71-IRES) в локус «замок» или «ключ» с трансмембранным доменом, и лигирование нуклеиновой кислоты, кодирующей второй вариабельный домен тяжелой цепи в тот же шаттл-вектор/лентивирусный экспрессионный вектор ниже IRES в соответствующий другой локус с трансмембранным доменом, т.е. если тяжелая цепь выше IRES имеет локус «замок», то тяжелая цепь ниже IRES имеет локус «ключ», и наоборот, при этом первый вариабельный домен тяжелой цепи связывается с первым антигеном, а второй вариабельный домен связывается со вторым антигеном, где первый антиген и второй антиген различны,
- получение вируса,
- инфицирование вирусом клетки млекопитающего, экспрессирующей общую легкую цепь,
- отбор клеток, представляющих биспецифические антитела на их поверхности, с помощью FACS дважды меченных трансдуцированных клеток,
- ПЦР нуклеиновой кислоты, кодирующей полную первую тяжелую цепь, и нуклеиновой кислоты, кодирующей вариабельный домен второй тяжелой цепи (2,2 т.п.о.), включая EV71-IRES, и клонирование во второй шаттл-вектор без трансмембранного домена; удаление трансмембранного домена первой тяжелой цепи путем рестрикции и повторного лигирования вектора,
- получение вируса, инфицирование клетки млекопитающего, экспрессирующей общую легкую цепь, сортировка клеток по отдельным клеткам, скрининг биспецифического антитела в супернатанте и выбор биспецифического антитела.
Одним из аспектов, о котором сообщается в данном документе, является технологический процесс/способ представления полноразмерных биспецифических антител, содержащих общую легкую цепь, на поверхности эукариотических клеток и отбора таких эукариотических клеток и тем самым отбора биспецифического антитела, включающий следующие этапы:
- экспериментальное животное, в одном воплощении трансгенную мышь или трансгенного кролика, иммунизируют представляющим интерес антигеном, в одном воплощении внеклеточным доменом рецептора, где В-клетки экспериментального животного экспрессируют одну и ту же легкую цепь,
- отбор В-клеток иммунизированного экспериментального животного, в одном воплощении путем общей FACS-сортировки,
- получение нуклеиновой кислоты, кодирующей тяжелую цепь, из каждой В-клетки путем отдельной ПЦР-амплификации в двух отдельных/последовательных полимеразных цепных реакциях, вводящих уникальные сайты рестрикции для направленного клонирования в шаттл-вектор/лентивирусный экспрессионный вектор,
- лигирование нуклеиновой кислоты, кодирующей вариабельный домен тяжелой цепи, в шаттл-вектор/лентивирусный экспрессионный вектор ниже IRES (в одном воплощении IRES является EV71-IRES) в локус тяжелой цепи с трансмембранным доменом, где шаттл-вектор/лентивирусный экспрессионный вектор содержит выше IRES нуклеиновую кислоту, кодирующую общую легкую цепь,
- получение вируса,
- инфицирование вирусом клетки млекопитающего, экспрессирующей общую легкую цепь,
- отбор клеток, представляющих антитела на их поверхности, с помощью FACS специфически меченных антигеном трансдуцированных клеток, в одном воплощении путем общей FACS-сортировки,
- получение нуклеиновой кислоты, кодирующей тяжелую цепь, из каждой выбранной клетки путем отдельной ПЦР-амплификации в двух отдельных/последовательных полимеразных цепных реакциях, вводящих уникальные сайты рестрикции для направленного клонирования в шаттл-вектор/лентивирусный экспрессионный вектор,
- лигирование нуклеиновой кислоты, кодирующей вариабельный домен первой тяжелой цепи, в шаттл-вектор/лентивирусный экспрессионный вектор выше IRES (в одном воплощении IRES является EV71-IRES) в локус «замок» или «ключ» без трансмембранного домена, и лигирование нуклеиновой кислоты, кодирующей вариабельный домен второй тяжелой цепи в тот же шаттл-вектор/лентивирусный экспрессионный вектор ниже IRES в соответствующий другой локус без трансмембранного домена, т.е. если тяжелая цепь выше IRES имеет локус «замок», то тяжелая цепь ниже IRES имеет локус «ключ», и наоборот, при этом первый вариабельный домен тяжелой цепи связывается с первым антигеном, а второй вариабельный домен связывается со вторым антигеном, где первый антиген и второй антиген могут быть одинаковыми или различными,
- получение вируса,
- инфицирование вирусом клетки млекопитающего, экспрессирующей общую легкую цепь,
- отбор клетки, секретирующей биспецифическое антитело.
В одном воплощении всех аспектов экспериментальное животное, чьи В-клетки экспрессируют одну и ту же легкую цепь, т.е. все В-клетки экспериментального животного экспрессируют только одну легкую цепь, является трансгенным экспериментальным животным. В одном воплощении трансгенное экспериментальное животное имеет нокаутный локус IgM и каппа Ig, который заменен на человеческий локус Ig, включающий человеческие гены легкой и тяжелой цепи, где ген легкой цепи полностью перестоен в трансгенном локусе Ig, а трансген тяжелой цепи не перестроен. В этом воплощении тяжелая цепь обладает высокой изменчивостью из-за случайной перестановки вариабельного гена с J-и D-элементами и соматической гипермутации и генной конверсии.
В одном воплощении всех аспектов общая легкая цепь биспецифического антитела содержит первый сайт связывания, который специфически связывается с первым антигеном, и второй сайт связывания, который специфически связывается со вторым антигеном, где отдельные цепи являются следующими:
- легкая цепь (вариабельный домен легкой цепи + константный домен легкой цепи каппа),
- первая тяжелая цепь (вариабельный домен тяжелой цепи + СН1 + петля + СН2 + СН3 с мутацией типа «замок»),
- вторая тяжелая цепь (вариабельный домен тяжелой цепи + СН1 + петля + СН2 + СН3 с мутацией типа «ключ»).
В одном воплощении всех аспектов, о которых сообщается в данном описании, праймер, используемый для амплификации вариабельной области тяжелой цепи из В-клеток представляет собой i) праймер SEQ ID №№1-4 в комбинации с праймером SEQ ID №5, и/или ii) праймер SEQ ID №№6-10 в комбинации с праймером SEQ ID №11.
В одном воплощении всех аспектов, о которых сообщается в данном описании, праймер, используемый для амплификации вариабельной области легкой цепи (каппа) из В-клеток представляет собой праймер SEQ ID №№12-18 в комбинации с праймером SEQ ID №19.
В одном воплощении всех аспектов, о которых сообщается в данном описании, праймер, используемый для амплификации вариабельной области (лямбда) из В-клеток представляет собой праймер SEQ ID №№20-27 в комбинации с праймером SEQ ID №28.
В одном воплощении всех аспектов, о которых сообщается в данном описании, праймер, используемый для амплификации вариабельной области тяжелой цепи из клеток НЕК представляет собой праймер SEQ ID №29 в комбинации с праймером SEQ ID №30.
Дисплейный вектор:
С базовым лентивирусным экспрессионным вектором можно получить только ограниченные возможности для нуклеиновой кислоты, кодирующей антитело, так как векторы более чем примерно 9 т.п.о. с 5-LTR до 3'-LTR не могут быть упакованы в лентивирусную частицу. Область от 5'-LTR до CMV-промотора (2,7 т.п.о.) и от элемента WPRE до 3'-LTR (1,5 т.п.о.) охватывает 4,2 т.п.о. (пример 1). Максимум 4,8 т.п.о. может быть вставлено без снижения эффективности получения вируса.
Если более подробно, максимум примерно 4800 п. о. может быть вставлено в основной вектор, если вирусный титр уменьшить в два раза для каждой 1000 п. о. по сравнению с пределом 4800 п. о.
Было обнаружено, что для укорочения вставки ДНК может быть использована экспрессионная кассета для комбинированной экспрессии легкой и тяжелой цепей, связанная через EV71-IRES. Нуклеиновая кислота, кодирующая легкую цепь, используется перед нуклеиновой кислотой, кодирующей тяжелую цепь.
В одном воплощении EV71-IRES имеет последовательность SEQ ID №31.
Было обнаружено, что для связанной экспрессии двух кодирующих нуклеиновых кислот особенно подходит IRES из энтеровируса 71 (EV71). Элементы IRES, полученные из вируса энцефаломиокардита (EMCV), мышиного Gtx, человеческого ELF4g, сохраняли менее 15% эффективности элемента EV71-IRES.
Экспрессия бицистронного экспрессионного элемента управляется человеческим CMV-промотором, включающим интрон А. Бицистронный экспрессионный элемент кодирует секретируемую (т.е. растворимую) и связанную с мембраной форму полноразмерного человеческого, или гуманизированного, или химерного антитела, или антитела животного происхождения.
Элементы интеграции имеют следующие размеры в зависимости от продуцируемого антитела:
i) только мембраносвязанное антитело:
|
ii) мембраносвязанное и секретируемое антитело (1):
|
iii) мембраносвязанное и секретируемое антитело (2):
|
iv) мембраносвязанное и секретируемое антитело без IRES (2):
|
В одном воплощении сигнальная полиА-последовательность bGH имеет последовательность SEQ ID №32. В одном воплощении hCMV-промотор имеет последовательность SEQ ID №33.
В одном воплощении интрон 6 + М1/М2-гибрид имеет последовательность SEQ ID №34.
v) мембраносвязанное с двумя тяжелыми цепями (KiH):
|
vi) одно мембраносвязанное с двумя тяжелыми цепями (KiH):
|
vii) мембраносвязанное формата scFv:
|
viii) мембраносвязанное формата scFab:
|
Было обнаружено, что EV71-IRES обеспечивает комбинированную экспрессию тяжелой и легкой цепей с помощью бицистронного экспрессионного элемента (сохраняя малый размер вектора).
Было установлено, что с помощью связывания экспрессионной кассеты легкой цепи с экспрессионной кассетой тяжелой цепи через элемент EV71 IRES может быть получена повышенная экспрессия (производительность):
|
Было обнаружено, что якорь, образующийся при альтернативном сплайсинге, может быть использован для одновременной экспрессии как мембраносвязанной формы, так и секретируемой формы антитела.
Уникальные сайты рестрикции были включены для обеспечения введения нуклеиновых кислот, кодирующих вариабельные легкую и тяжелую цепи при помощи ПЦР.
Вырожденные праймеры (с совместимыми сайтами рестрикции) были использованы для амплификации всех человеческих каркасных областей.
В способе, приведенном в данном документе, биспецифические антитела, которые являются комбинациями моноклональных антител, могут быть идентифицированы с помощью комбинации различных специфичностей связывания, полученных, например, из различных антител в ходе иммунизации, или при созревании аффинности, или путем гуманизации.
С помощью способа, приведенного в данном документе, большое число биспецифических антител может быть получено и проверено на идентификацию синергических комбинаций.
Иллюстративные пункты изобретения, приведенные в данном документе
1. Способ отбора клетки, экспрессирующей биспецифическое антитело, включающий следующие этапы
(a) создание популяции эукариотических клеток путем трансдукции популяцией лентивирусных частиц, где каждая лентивирусная частица содержит бицистронную экспрессионную кассету, которая содержит нуклеиновую кислоту, кодирующую первый вариабельный домен тяжелой цепи в локусе «замок» или «ключ» выше EV71-IRES, и нуклеиновую кислоту, кодирующую второй вариабельный домен тяжелой цепи в соответствующем другом локусе ниже EV71-IRES, где первый вариабельный домен тяжелой цепи связывается с первым антигеном, а второй вариабельный домен связывается со вторым антигеном, где первый антиген и второй антиген могут быть одинаковыми или разными, где эукариотическая клетка экспрессирует общую легкую цепь, где одна или обе тяжелые цепи также содержат трансмембранный домен на С-конце, и
(b) отбор из популяции эукариотических клеток клетки в зависимости от свойств представленного мембраносвязанного полноразмерного биспецифического антитела.
2. Способ по п. 1, где только тяжелая цепь ниже EV71-IRES содержит трансмембранный домен на своем С-конце.
3. Способ отбора клетки, секретирующей биспецифическое антитело, включающий следующие этапы:
(а) создание популяции эукариотических клеток путем трансдукции популяцией лентивирусных частиц, где каждая лентивирусная частица содержит бицистронную экспрессионную кассету, кодирующую секретируемое биспецифическое антитело, которая содержит нуклеиновую кислоту, кодирующую первый вариабельный домен тяжелой цепи в локусе «замок» или «ключ» выше EV71-IRES, и нуклеиновую кислоту, кодирующую второй вариабельный домен тяжелой цепи в соответствующем другом локусе ниже EV71-IRES, где первый вариабельный домен тяжелой цепи связывается с первым антигеном, а второй вариабельный домен связывается со вторым антигеном, где первый антиген и второй антиген могут быть одинаковыми или разными, где эукариотическая клетка экспрессирует общую легкую цепь, и
(b) отбор из популяции эукариотических клеток клетки в зависимости от свойств секретируемого полноразмерного биспецифического антитела.
4. Способ по любому из пп. 1-3, где каждая клетка популяции эукариотических клеток представляет или секретирует одно полноразмерное биспецифическое антитело.
5. Способ по любому из пп. 1-4, который включает в качестве первого этапа один или более чем один из следующих этапов:
- иммунизация трансгенного животного антигеном, представляющим интерес, где В-клетки экспериментального животного экспрессируют одну и ту же легкую цепь, и/или
- отбор В-клеток иммунизированного экспериментального животного путем общей сортировки с помощью FACS, и/или
- получение нуклеиновой кислоты, кодирующей тяжелую цепь каждой В-клетки путем отдельной ПЦР-амплификации в двух отдельных/последовательных полимеразных цепных реакциях, вводящих уникальные сайты рестрикции для направленного клонирования в шаттл-вектор/лентивирусный экспрессионный вектор.
6. Способ по любому из пп. 1-2 и 4-5, который включает этап:
- проведения ПЦР полной нуклеиновой кислоты, кодирующей первую тяжелую цепь, и нуклеиновой кислоты, кодирующей вариабельный домен второй тяжелой цепи (2,2 т.п.о.), включая EV71-IRES, и клонирование во второй шаттл-вектор без трансмембранного домена, возможно с удалением трансмембранного домена первой тяжелой цепи, если он присутствует, путем рестрикции и повторного лигирования вектора.
7. Способ по любому из пп. 1-2 и 4-6, где бицистронные экспрессионные кассеты содержат в направлении от 5'- к 3'-
- промотор,
- первую нуклеиновую кислоту, кодирующую первую тяжелую цепь полноразмерного антитела,
- возможно, нуклеиновую кислоту, кодирующую трансмембранный домен или GPI-якорь,
- EV71-IRES,
- вторую нуклеиновую кислоту, кодирующую вторую тяжелую цепь полноразмерного антитела, и
- нуклеиновую кислоту, кодирующую трансмембранный домен или GPI-якорь.
8. Способ по любому из пп. 3-6, где бицистронные экспрессионные кассеты содержат в направлении от 5'- к 3'-
- промотор,
- первую нуклеиновую кислоту, кодирующую первую тяжелую цепь полноразмерного антитела,
- EV71-IRES,
- вторую нуклеиновую кислоту, кодирующую вторую тяжелую цепь полноразмерного антитела.
9. Способ по любому одному из пп. 1-8, где антитело является бивалентным биспецифическим антителом.
10. Способ по любому из пп. 1-9, где антитело специфически связывается с двумя различными антигенами или двумя эпитопами на одном и том же антигене.
11. Способ по любому из пп. 1-10, где первая тяжелая цепь полноразмерного антитела содержит мутацию типа «замок», а вторая тяжелая цепь антитела содержит мутацию типа «ключ».
12. Способ по любому из пп. 1-11, где первая легкая цепь полноразмерного антитела содержит в качестве константного домена СН1-домен, а первая тяжелая цепь полноразмерного антитела содержит в качестве первого константного домена CL-домен, или вторая легкая цепь полноразмерного антитела содержит в качестве константного домена СН1-домен, а вторая тяжелая цепь полноразмерного антитела содержит в качестве первого константного домена CL-домен.
13. Способ по любому из пп. 1-12, где полноразмерное антитело содержит константную область человеческого происхождения, особенно из человеческого иммуноглобулина класса IgG1, IgG2 или IgG4.
14. Способ по любому из пп. 1-13, где эукариотическая клетка является клеткой млекопитающего или дрожжевой клеткой.
15. Способ по любому из пп. 1-13, где клетка млекопитающего является CHO-клеткой или HEK-клеткой.
16. Способ по любому из пп. 1-15, где нуклеиновая кислота, кодирующая тяжелую цепь иммуноглобулина, содержит все экзоны и все, кроме одного, интроны геномно-организованного гена тяжелой цепи иммуноглобулина.
17. Способ по любому из пп. 1-16, где трансмембранный домен является фрагментом трансмембранного домена или сигнальным пептидом для GPI-якоря, где фрагмент трансмембранного домена закодирован одним экзоном.
18. Способ по любому из пп. 1-17, где трансмембранный домен является трансмембранным доменом иммуноглобулина, закодированным М1-М2-экзон-гибридом одного экзона без геномного промежуточного интрона.
19. Способ по любому из пп. 1-18, где трансмембранный домен закодирован кДНК.
20. Способ по любому из пп. 1-19, где антитело является гуманизированным или человеческим антителом, особенно человеческим антителом.
21. Способ отбора клетки, экспрессирующей антитело, включающий следующие этапы:
(a) создание популяции эукариотических клеток путем трансдукции популяцией лентивирусных частиц, где каждая клетка популяции клеток представляет мембраносвязанное полноразмерное антитело, в котором по меньшей мере две цепи закодированы бицистронной экспрессионной кассетой, и которое специфически связывается с одним или более чем одним антигеном или с одним или более чем одним эпитопом на одном и том же антигене, и
(b) отбор из популяции эукариотических клеток клетки в зависимости от свойств представленного мембраносвязанного полноразмерного антитела,
где каждая лентивирусная частица популяции лентивирусных частиц содержит бицистронную экспрессионную кассету, содержащую EV71-IRES, для экспрессии мембраносвязанного антитела.
22. Способ по п. 21, где каждая бицистронная экспрессионная кассета лентивирусной частицы из популяции лентивирусных частиц кодирует различные варианты родительского антитела, которое специфически связывается с одним или более чем одним антигеном или одним или более чем одним эпитопом на одном и том же антигене.
23. Способ по любому из пп. 21-22, где бицистронные экспрессионные кассеты содержат в направлении от 5'- к 3'-
- промотор,
- первую нуклеиновую кислоту, кодирующую легкую цепь полноразмерного антитела,
- EV71-IRES,
- вторую нуклеиновую кислоту, кодирующую тяжелую цепь полноразмерного антитела,
- интрон с возможностью сплайсинга, и
- нуклеиновую кислоту, кодирующую трансмембранный домен или GPI-якорь.
24. Способ по любому из пп. 21-22, где бицистронные экспрессионные кассеты содержат в направлении от 5'- к 3'-
- промотор,
- первую нуклеиновую кислоту, кодирующую первую тяжелую цепь полноразмерного антитела,
- возможно, нуклеиновую кислоту, кодирующую трансмембранный домен или GPI-якорь,
- EV71-IRES,
- вторую нуклеиновую кислоту, кодирующую вторую тяжелую цепь полноразмерного антитела, и
- нуклеиновую кислоту, кодирующую трансмембранный домен или GPI-якорь.
25. Способ по любому из пп. 21-22, где бицистронные экспрессионные кассеты содержат в направлении от 5'- к 3'-
- промотор,
- первую нуклеиновую кислоту, кодирующую легкую цепь полноразмерного антитела,
- EV71-IRES,
- вторую нуклеиновую кислоту, кодирующую тяжелую цепь полноразмерного антитела, связанную на ее С-конце с scFv,
- интрон с возможностью сплайсинга, и
- нуклеиновую кислоту, кодирующую трансмембранный домен или GPI-якорь.
26. Способ по любому из пп. 21-22, где бицистронные экспрессионные кассеты содержат в направлении от 5'- к 3'-
- промотор,
- первую нуклеиновую кислоту, кодирующую легкую цепь полноразмерного антитела,
- EV71-IRES,
- вторую нуклеиновую кислоту, кодирующую тяжелую цепь полноразмерного антитела, связанную на ее С-конце с scFab,
- интрон с возможностью сплайсинга, и
- нуклеиновую кислоту, кодирующую трансмембранный домен или GPI-якорь.
27. Способ по любому одному из пп. 21-26, где каждая клетка из популяции эукариотических клеток представляет мембраносвязанное полноразмерное антитело и секретирует полноразмерное антитело.
28. Способ по любому из пп. 21-26, где каждая клетка из популяции эукариотических клеток представляет и секретирует одно полноразмерное антитело.
29. Способ по любому одному из пп. 21-28, где антитело специфически связывается с антигеном.
30. Способ по любому одному из пп. 21-23, где антитело является бивалентным моноспецифическим антителом.
31. Способ по любому одному из пп. 21-22 и 24, где антитело является бивалентным биспецифическим антителом.
32. Способ по любому одному из пп. 21-22 и 25-26, где антитело является тетравалентным биспецифическим антителом.
33. Способ по любому одному из пп. 21-28 и 31-32, где антитело специфически связывается с двумя различными антигенами или двумя эпитопами на одном и том же антигене.
34. Способ по любому одному из пп. 31-33, где первая тяжелая цепь полноразмерного антитела содержит мутацию типа «замок», а вторая тяжелая цепь антитела содержит мутацию типа «ключ».
35. Способ по любому одному из пп. 31-34, где первая легкая цепь полноразмерного антитела содержит в качестве константного домена СН1-домен, а первая тяжелая цепь полноразмерного антитела содержит в качестве первого константного домена CL-домен, или вторая легкая цепь полноразмерного антитела содержит в качестве константного домена СН1-домен, а вторая тяжелая цепь полноразмерного антитела содержит в качестве первого константного домена CL-домен.
36. Способ по любому из пп. 21-35, где полноразмерное антитело содержит константную область человеческого происхождения, особенно из человеческого иммуноглобулина класса IgG1, IgG2 или IgG4.
37. Способ по любому из пп. 21-36, где эукариотическая клетка является клеткой млекопитающего или дрожжевой клеткой.
38. Способ по любому из пп. 21-36, где клетка млекопитающего является CHO-клеткой или HEK-клеткой.
39. Способ по любому из пп. 21-38, где нуклеиновая кислота, кодирующая тяжелую цепь иммуноглобулина, содержит все экзоны и все, кроме одного, интроны геномно-организованного гена тяжелой цепи иммуноглобулина.
40. Способ по любому из пп. 21-39, где трансмембранный домен является фрагментом трансмембранного домена или сигнальным пептидом для GPI-якоря, где фрагмент трансмембранного домена закодирован одним экзоном.
41. Способ по любому из пп. 21-40, где трансмембранный домен является трансмембранным доменом иммуноглобулина, закодированным М1-М2-экзон-гибридом одного экзона без геномного промежуточного интрона.
42. Способ по любому из пп. 21-41, где трансмембранный домен закодирован кДНК.
43. Способ по любому из пп. 21-42, где антитело является гуманизированным или человеческим антителом, особенно человеческим антителом.
44. Бицистронная экспрессионная кассета, которая содержит в направлении от 5'- к 3'-
- омотор,
- рвую нуклеиновую кислоту, кодирующую легкую цепь полноразмерного антитела,
- EV71-IRES,
- вторую нуклеиновую кислоту, кодирующую тяжелую цепь полноразмерного антитела,
- интрон с возможностью сплайсинга, и
- нуклеиновую кислоту, кодирующую трансмембранный домен или GPI-якорь.
45. Бицистронная экспрессионная кассета, которая содержит в направлении от 5'- к 3'-
- промотор,
- первую нуклеиновую кислоту, кодирующую первую тяжелую цепь полноразмерного антитела,
- EV71-IRES,
- вторую нуклеиновую кислоту, кодирующую вторую тяжелую цепь полноразмерного антитела, и
- нуклеиновую кислоту, кодирующую трансмембранный домен или GPI-якорь.
46. Бицистронная экспрессионная кассета по любому одному из пп. 44-45, где первая тяжелая цепь полноразмерного антитела содержит мутацию типа «замок», а вторая тяжелая цепь антитела содержит мутацию типа «ключ».
47. Бицистронная экспрессионная кассета по любому одному из пп. 44-46, где первая легкая цепь полноразмерного антитела содержит в качестве константного домена СН1-домен, а первая тяжелая цепь полноразмерного антитела содержит в качестве первого константного домена CL-домен, или вторая легкая цепь полноразмерного антитела содержит в качестве константного домена СН1-домен, а вторая тяжелая цепь полноразмерного антитела содержит в качестве первого константного домена CL-домен.
48. Бицистронная экспрессионная кассета по любому одному из пп. 44-47, где полноразмерное антитело содержит константную область человеческого происхождения, особенно из человеческого иммуноглобулина класса IgG1, IgG2 или IgG4.
49. Бицистронная экспрессионная кассета по любому одному из пп. 44-48, где эукариотическая клетка является клеткой млекопитающего или дрожжевой клеткой.
50. Бицистронная экспрессионная кассета по любому одному из пп. 44-49, где клетка млекопитающего является CHO-клеткой или HEK-клеткой.
51. Бицистронная экспрессионная кассета по любому одному из пп. 44-50, где нуклеиновая кислота, кодирующая тяжелую цепь иммуноглобулина, содержит все экзоны и все, кроме одного, интроны геномно-организованного гена тяжелой цепи иммуноглобулина.
52. Бицистронная экспрессионная кассета по любому одному из пп. 44-51, где трансмембранный домен является фрагментом трансмембранного домена или сигнальным пептидом для GPI-якоря, где фрагмент трансмембранного домена закодирован одним экзоном.
53. Бицистронная экспрессионная кассета по любому одному из пп. 44-52, где трансмембранный домен является трансмембранным доменом иммуноглобулина, закодированным М1-М2-экзон-гибридом одного экзона без геномного промежуточного интрона.
54. Бицистронная экспрессионная кассета по любому одному из пп. 44-53, где трансмембранный домен закодирован кДНК.
55. Бицистронная экспрессионная кассета по любому одному из пп. 44-54, где антитело является гуманизированным или человеческим антителом, особенно человеческим антителом.
56. Эукариотическая клетка, содержащая бицистронную экспрессионную кассету по любому одному из пп. 44-55.
57. Эукариотическая клетка по п. 56, где бицистронная экспрессионная кассета была трансдуцирована в клетку.
58. Эукариотическая клетка по любому одному из пп. 56-57, где эукариотическая клетка является клеткой млекопитающего или дрожжевой клеткой.
59. Эукариотическая клетка по п. 58, где клетка млекопитающего является CHO-клеткой или HEK-клеткой.
60. Лентивирусный вектор, содержащий бицистронную экспрессионную кассету, которая содержит в направлении от 5'- к 3'-
- промотор,
- первую нуклеиновую кислоту, кодирующую легкую цепь полноразмерного антитела,
- EV71-IRES,
- вторую нуклеиновую кислоту, кодирующую тяжелую цепь полноразмерного антитела,
- интрон с возможностью сплайсинга, и
- нуклеиновую кислоту, кодирующую трансмембранный домен или GPI-якорь.
61. Лентивирусный вектор, содержащий бицистронную экспрессионную кассету, которая содержит в направлении от 5'- к 3'-
- промотор,
- первую нуклеиновую кислоту, кодирующую первую тяжелую цепь полноразмерного антитела,
- EV71-IRES,
- вторую нуклеиновую кислоту, кодирующую вторую тяжелую цепь полноразмерного антитела, и
- нуклеиновую кислоту, кодирующую трансмембранный домен или GPI-якорь.
62. Лентивирусный вектор по любому одному из пп. 60-61, где полноразмерное антитело содержит константную область человеческого происхождения, особенно из человеческого иммуноглобулина класса IgG1, IgG2 или IgG4.
63. Лентивирусный вектор по любому одному из пп. 60-62, где эукариотическая клетка является клеткой млекопитающего или дрожжевой клеткой.
64. Лентивирусный вектор по любому одному из пп. 60-63, где клетка млекопитающего является CHO-клеткой или HEK-клеткой.
65. Лентивирусный вектор по любому одному из пп. 60-64, где нуклеиновая кислота, кодирующая тяжелую цепь иммуноглобулина, содержит все экзоны и все, кроме одного, интроны геномно-организованного гена тяжелой цепи иммуноглобулина.
66. Лентивирусный вектор по любому одному из пп. 60-65, где трансмембранный домен является фрагментом трансмембранного домена или сигнальным пептидом для GPI-якоря, где фрагмент трансмембранного домена закодирован одним экзоном.
67. Лентивирусный вектор по любому одному из пп. 60-66, где трансмембранный домен является трансмембранным доменом иммуноглобулина, закодированным М1-М2-экзон-гибридом одного экзона без геномного промежуточного интрона.
68. Лентивирусный вектор по любому одному из пп. 60-67, где трансмембранный домен закодирован кДНК.
69. Лентивирусный вектор по любому одному из пп. 60-68, где антитело является гуманизированным или человеческим антителом, особенно человеческим антителом.
70. Эукариотическая клетка, содержащая лентивирусный вектор по любому одному из пп. 60-69.
71. Эукариотическая клетка по п. 70, где лентивирусный вектор был трансдуцирован в клетку.
72. Эукариотическая клетка по любому одному из пп. 70-71, где эукариотическая клетка является клеткой млекопитающего или дрожжевой клеткой.
73. Эукариотическая клетка по п. 72, где клетка млекопитающего является CHO-клеткой или HEK-клеткой.
74. Применение лентивирусного вектора по любому одному из пп. 60-69 для создания популяции эукариотических клеток для представления или секреции (или и представления, и секреции) полноразмерного антитела.
75. Применение по п. 74, где эукариотическая клетка является клеткой млекопитающего или дрожжевой клеткой.
76. Применение по п. 75, где клетка млекопитающего является CHO-клеткой или HEK-клеткой.
77. Библиотека лентивирусного вектора, содержащая две или более двух лентивирусных частиц, каждая из которых содержит экспрессионный вектор по любому одному из пп. 60-69, где антитела, закодированные каждым вектором, отличаются по меньшей мере на одну аминокислоту друг от друга.
78. Библиотека лентивирусного вектора по п. 77, которая содержит от 1000 до 1000000 различных экспрессионных векторов.
79. Библиотека лентивирусного вектора по любому одному из пп. 77-78, где антитела, закодированные векторами из библиотеки векторов, отличаются по меньшей мере на один аминокислотный остаток в одном из CDR антитела.
80. Библиотека лентивирусного вектора по п. 79, где CDR представляет собой CDR3 тяжелой цепи.
81. Библиотека лентивирусного вектора по любому одному из пп. 77-80, где библиотека экспрессионного вектора получена путем рандомизации одного или более чем одного аминокислотного остатка в одном или более чем одном CDR родительского экспрессионного вектора.
82. Библиотека лентивирусного вектора по любому одному из пп. 77-81, где библиотека лентивирусного экспрессионного вектора получена путем комбинации нуклеиновых кислот, кодирующих два разных полуантитела.
83. Библиотека лентивирусного вектора по любому одному из пп. 77-82, где разнообразие библиотеки лентивирусного вектора получено с помощью нуклеиновых кислот, кодирующих HCVR и LCVR и полученных из пула В-клеток продуцирующих антитело, которое специфически связывается с одним антигеном или с двумя разными антигенами, или которое специфически связывается с различными неперекрывающимися эпитопами одного и того же антигена.
84. Библиотека лентивирусного вектора по любому одному из пп. 77-82, где разнообразие библиотеки лентивирусного вектора получено с помощью пары нуклеиновых кислот, кодирующих HCVR и LCVR и выбранных из пулов нуклеиновых кислот, кодирующих HCVR и LCVR и полученных путем рандомизации по меньшей мере одного кодона HCVR, и нуклеиновой кислоты, кодирующей LCVR и полученной из отдельной В-клетки, продуцирующей антитело, которое специфически связывается с одним антигеном или с двумя разными антигенами, или которое специфически связывается с различными неперекрывающимися эпитопами одного и того же антигена.
85. Библиотека лентивирусного вектора по любому одному из пп. 77-82, где разнообразие библиотеки лентивирусного вектора получено с помощью пары различных нуклеиновых кислот, кодирующих HCVR, и одной нуклеиновой кислоты, кодирующей LCVR, где различные нуклеиновые кислоты, кодирующие HCVR, получены путем рандомизации по меньшей мере одного кодона нуклеиновой кислоты, кодирующей HCVR и полученной из отдельной В-клетки, продуцирующей антитело, которое специфически связывается с одним антигеном или с двумя разными антигенами, или которое специфически связывается с различными неперекрывающимися эпитопами одного и того же антигена.
86. Библиотека лентивирусного вектора по любому одному из пп. 77-82, где разнообразие библиотеки лентивирусного вектора получено с помощью пары различных нуклеиновых кислот, кодирующих LCVR, и одной нуклеиновой кислоты, кодирующей HCVR, где различные нуклеиновые кислоты, кодирующие LCVR, получены путем рандомизации по меньшей мере одного кодона нуклеиновой кислоты, кодирующей LCVR и полученной из отдельной В-клетки, продуцирующей антитело, которое специфически связывается с одним антигеном или с двумя разными антигенами, или которое специфически связывается с различными неперекрывающимися эпитопами одного и того же антигена.
87. Библиотека лентивирусного вектора по любому одному из пп. 77-86, где отдельная В-клетка является клональной популяцией В-клеток.
88. Библиотека лентивирусного вектора по любому одному из пп. 77-87, где создание разнообразия лентивирусной экспрессионной библиотеки включает следующие этапы:
(а):
(i) выделение РНК из субпопуляции В-клеток, (¡i) транскрипция РНК в кДНК;
(iii) амплификация из кДНК первого пула молекул ДНК с помощью первой смеси олигонуклеотидов, содержащей по меньшей мере два олигонуклеотида, способных амплифицировать кодирующие области HCVR;
(iv) амплификация из кДНК второго пула молекул ДНК с помощью второй смеси олигонуклеотидов, содержащей по меньшей мере два олигонуклеотида, способных амплифицировать кодирующие области LCVR; и
(v) получение пар одного представителя первого пула молекул ДНК и одного представителя второго пула молекул ДНК;
или (b):
(i) выделение РНК из отдельной В-клетки или из клональной популяции В-клеток,
(ii) транскрипция РНК в кДНК;
(iii) амплификация из кДНК первой молекулы ДНК с помощью первой смеси олигонуклеотидов, содержащей по меньшей мере два олигонуклеотида, способных амплифицировать кодирующие области HCVR;
(iv) амплификация из кДНК второй молекулы ДНК с помощью второй смеси олигонуклеотидов, содержащей по меньшей мере два олигонуклеотида, способных амплифицировать кодирующие области LCVR;
(v) создание первого пула молекул ДНК путем рандомизации по меньшей мере одного кодона первой молекулы ДНК,
(vi) создание второго пула молекул ДНК путем рандомизации по меньшей мере одного кодона второй молекулы ДНК, и
(vii) получение пар одного представителя первого пула молекул ДНК и одного представителя второго пула молекул ДНК;
или (с):
(i) выделение РНК из отдельной В-клетки или из клональной популяции В-клеток,
(ii) транскрипция РНК в кДНК;
(iii) амплификация из кДНК первой молекулы ДНК с помощью первой смеси олигонуклеотидов, содержащей по меньшей мере два олигонуклеотида, способных амплифицировать кодирующие области HCVR;
(iv) амплификация из кДНК второй молекулы ДНК с помощью второй смеси олигонуклеотидов, содержащей по меньшей мере два олигонуклеотида, способных амплифицировать кодирующие области LCVR;
(v) создание пула молекул ДНК путем рандомизации по меньшей мере одного кодона первой молекулы ДНК, и
(vi) получение пар одного представителя пула молекул ДНК и второй молекулы ДНК;
или (d):
(i) выделение РНК из отдельной В-клетки или из клональной популяции В-клеток,
(ii) транскрипция РНК в кДНК;
(iii) амплификация из кДНК первой молекулы ДНК с помощью первой смеси олигонуклеотидов, содержащей по меньшей мере два олигонуклеотида, способных амплифицировать кодирующие области HCVR;
(iv) амплификация из кДНК второй молекулы ДНК с помощью второй смеси олигонуклеотидов, содержащей по меньшей мере два олигонуклеотида, способных амплифицировать кодирующие области LCVR;
(v) создание пула молекул ДНК путем рандомизации по меньшей мере одного кодона второй молекулы ДНК, и
(vi) получение пар одного представителя пула молекул ДНК и первой молекулы ДНК.
89. Библиотека лентивирусного вектора по любому одному из пп. 77-88, где нуклеиновая кислота, кодирующая тяжелую цепь иммуноглобулина, содержит все экзоны и все, кроме одного, интроны геномно-организованного гена тяжелой цепи иммуноглобулина.
90. Библиотека лентивирусного вектора по любому одному из пп. 77-89, где трансмембранный домен является фрагментом трансмембранного домена или сигнальным пептидом для GPI-якоря, где фрагмент трансмембранного домена закодирован одним экзоном.
91. Библиотека лентивирусного вектора по любому одному из пп. 77-90, где трансмембранный домен является трансмембранным доменом иммуноглобулина, закодированным М1-М2-экзон-гибридом одного экзона без геномного промежуточного интрона.
92. Библиотека лентивирусного вектора по любому одному из пп. 77-91, где трансмембранный домен закодирован кДНК.
93. Эукариотическая клеточная библиотека, содержащая две или более двух эукариотических клеток, каждая из которых содержит бицистронную экспрессионную кассету по любому одному из пп. 44-55 или лентивирусный вектор по любому одному из пп. 60-69, где антитела, экспрессируемые каждой клеткой, отличаются друг от друга по меньшей мере на одну аминокислоту.
94. Эукариотическая клеточная библиотека, содержащая библиотеку лентивирусного вектора по пп. 77-92.
95. Эукариотическая клеточная библиотека по п. 94, где каждая эукариотическая клетка из эукариотической клеточной библиотеки экспрессирует одно антитело.
96. Эукариотическая клеточная библиотека по любому одному из пп. 94-95, где каждая эукариотическая клетка эукариотической клеточной библиотеки представляет одно антитело.
97. Эукариотическая клеточная библиотека по любому одному из пп. 94-96, где эукариотическая клеточная библиотека является популяцией эукариотических клеток, экспрессирующих библиотеку антитела, где кодирующие нуклеиновые кислоты получены из популяции В-клеток иммунизированного животного.
98. Эукариотическая клеточная библиотека по п. 97, где В-клетки предварительно отбирают по их специфичности к одному или более чем одному антигену, представляющему интерес.
99. Эукариотическая клеточная библиотека по любому одному из пп. 94-98, которая является популяцией эукариотических клеток, где каждая клетка содержит первую экспрессионную кассету, кодирующую полноразмерное антитело, которое специфически связывается с первым антигеном, и вторую экспрессионную кассету, кодирующую полноразмерное антитело, которое специфически связывается со вторым антигеном.
100. Эукариотическая клеточная библиотека по любому одному из пп. 94-99, которая является популяцией эукариотических клеток, где каждая клетка содержит первую экспрессионную кассету, кодирующую первую легкую цепь полноразмерного антитела и первую тяжелую цепь полноразмерного антитела, связывающегося с первым антигеном, и вторую экспрессионную кассету, кодирующую вторую легкую цепь полноразмерного антитела и вторую тяжелую цепь полноразмерного антитела, которое специфически связывается со вторым антигеном.
101. Эукариотическая клеточная библиотека по любому одному из пп. 94-100, которая является популяцией эукариотических клеток, где каждая клетка содержит экспрессионную кассету, кодирующую первую тяжелую цепь полноразмерного антитела, которое специфически связывается с первым антигеном, и вторую тяжелую цепь полноразмерного антитела, которое специфически связывается со вторым антигеном, где эукариотическая клетка экспрессирует общую легкую цепь.
102. Эукариотическая клеточная библиотека по любому одному из пп. 94-102, где первая тяжелая цепь полноразмерного антитела содержит мутацию типа «замок», а вторая тяжелая цепь антитела содержит мутацию типа «ключ».
103. Эукариотическая клеточная библиотека по любому одному из пп. 94-101, где первая легкая цепь полноразмерного антитела содержит в качестве константного домена СН1-домен, а первая тяжелая цепь полноразмерного антитела содержит в качестве первого константного домена CL-домен, или вторая легкая цепь полноразмерного антитела содержит в качестве константного домена СН1-домен, а вторая тяжелая цепь полноразмерного антитела содержит в качестве первого константного домена CL-домен.
104. Эукариотическая клеточная библиотека по любому одному из пп. 94-103, где полноразмерное антитело содержит константную область человеческого происхождения, особенно из человеческого иммуноглобулина класса IgG1, IgG2 или IgG4.
105. Эукариотическая клеточная библиотека по любому одному из пп. 94-104, где эукариотическая клетка является клеткой млекопитающего или дрожжевой клеткой.
106. Эукариотическая клеточная библиотека по любому одному из пп. 94-105, где клетка млекопитающего является CHO-клеткой или HEK-клеткой.
107. Эукариотическая клеточная библиотека по любому одному из пп. 94-106, где популяция выделенных В-клеток или отдельная В-клетка или клональная популяция В-клеток получена из источника, выбранного среди: (а) крови; (b) вторичных лимфоидных органов, особенно селезенки и лимфатических узлов; (с) костного мозга; и (d) ткани, содержащей В-клетки памяти.
108. Эукариотическая клеточная библиотека по п. 107, где популяция выделенных В-клеток содержит или в частности состоит из мононуклеарных клеток периферической крови (РВМС).
109. Эукариотическая клеточная библиотека по любому одному из пп. 94-108, где животное является млекопитающим, особенно крысой, мышью, кроликом или человеком.
110 Эукариотическая клеточная библиотека по п. 109, где животное является трансгенной мышью или трансгенным кроликом или человеком.
111. Эукариотическая клеточная библиотека по любому одному из пп. 94-110, где отбор из популяции выделенных В-клеток субпопуляции В-клеток или отдельной В-клетки включает следующие этапы:
(a) контакт популяции выделенных В-клеток с антигеном, представляющим интерес, или его фрагментом или антигенной детерминантой; и
(b) отбор В-клеток или отдельной В-клетки, которая специфически связывается с антигеном, представляющим интерес, или его фрагментом или антигенной детерминантой.
112. Эукариотическая клеточная библиотека по любому одному из пп. 94-111, где отбор из популяции выделенных В-клеток субпопуляции В-клеток или отдельной В-клетки включает следующие этапы:
(a) нанесение на носитель антигена, представляющего интерес, или его фрагмента или антигенной детерминанты;
(b) контакт популяции выделенных В-клеток с носителем и связывание В-клетки с носителем через антиген, представляющий интерес, или его фрагмент или антигенную детерминанту;
(c) удаление несвязанных В-клеток, где в частности носитель содержит или более конкретно состоит из шариков, где более конкретно шарики являются парамагнитными; и
(d) удаление субпопуляций В-клеток или отдельной В-клетки с парамагнитных шариков.
113. Эукариотическая клеточная библиотека по любому одному из пп. 94-112, где отбор из популяции выделенных В-клеток субпопуляции В-клеток или отдельной В-клетки проводится с помощью FACS-сортировки.
114. Эукариотическая клеточная библиотека по любому одному из пп. 94-113, где отбор из популяции выделенных В-клеток субпопуляции В-клеток или отдельной В-клетки включает следующие этапы:
(a) контакт популяции выделенных В-клеток с антигеном, представляющим интерес, или его фрагментом или антигенной детерминантой, где антиген, представляющий интерес, или его фрагмент или антигенную детерминанту метят флуоресцентным красителем; и
(b) отделение В-клетки, связанной с антигеном, представляющим интерес, или его фрагментом или антигенной детерминантой, с помощью FACS-сортировки.
115. Эукариотическая клеточная библиотека по любому одному из пп. 94-114, где отбор из популяции выделенных В-клеток субпопуляции В-клеток или отдельной В-клетки включает следующие этапы:
(a) контакт популяции выделенных В-клеток с антигеном, представляющим интерес, или его фрагментом или антигенной детерминантой;
(b) отбор популяции В-клеток или отдельной В-клетки, которая специфически связывается с антигеном, представляющим интерес, или его фрагментом или антигенной детерминантой; и
(c) отбор В-клеток по меньшей мере по одному дополнительному параметру, где в частности отбор по меньшей мере по одному дополнительному параметру представляет собой
(i) положительную селекцию по параметру, выбранному среди присутствия B-клеточного специфического маркера, особенно CD19 или В220, и жизнеспособности В-клеток; и/или
(ii) отрицательную селекцию по параметру, выбранному среди: присутствия IgM-антитела; присутствия IgD-антитела, присутствия маркеров клеточной гибели и присутствия маркеров апоптоза.
116. Эукариотическая клеточная библиотека по любому одному из пп. 94-115, где отбор из популяции выделенных В-клеток субпопуляции В-клеток также включает этап отбора В-клеток с переключенным классом, особенно IgM-и/или IgD-отрицательных В-клеток, наиболее конкретно IgM- и/или IgD-отрицательных В-клеток.
117. Эукариотическая клеточная библиотека по любому одному из пп. 94-116, где отбор из популяции выделенных В-клеток субпопуляции В-клеток или отдельной В-клетки включает следующие этапы:
(a) контакт популяции выделенных В-клеток с антигеном, представляющим интерес, или его фрагментом или антигенной детерминантой, где антиген, представляющий интерес, или его фрагмент или антигенная детерминанта мечены первым флуоресцентным красителем, где в частности флуоресцентный краситель представляет собой Alexa 647 nm, Alexa 488 или Alexa 546 nm;
(b) контакт клеток из популяции выделенных В-клеток с анти-IgM- и/или анти-IgD-антителом, где анти-IgM- и/или анти-IgD-антитела мечены вторым и/или третьим флуоресцентным красителем, где второй и/или третий флуоресцентный краситель испускает флуоресценцию при длине волны, отличной от длины волны флуоресценции, испускаемой первым флуоресцентным красителем; и
(c) отделение популяции В-клеток или отдельной В-клетки, связанной с представляющим интерес антигеном или его фрагментом или антигенной детерминантой, но не связанной с анти-IgM- и/или с анти-IgD-антителами, путем FACS-сортировки.
118. Эукариотическая клеточная библиотека по любому одному из пп. 94-117, где библиотека является вирусной библиотекой, особенно лентивирусной библиотекой, и введение библиотеки в первую популяцию эукариотической клетки, в частности клетки млекопитающего, проводится путем инфицирования эукариотической клетки, в частности клетки млекопитающего, вирусной библиотекой, в частности лентивирусной библиотекой, где более конкретно инфицирование проводится с множественностью заражения не более 10, особенно не более 1, более конкретно не более 0,2, и наиболее конкретно не более 0,1.
119. Эукариотическая клеточная библиотека по п. 118, где множественность заражения составляет примерно 0,1.
120. Эукариотическая клеточная библиотека по любому одному из пп. 94-119, где выделение клетки проводится с помощью FACS-сортировки. В одном воплощении выделение клетки включает следующие этапы:
(а) окрашивание первой популяции эукариотических клеток, в частности клеток млекопитающего, представляющим интерес антигеном или его фрагментом или антигенной детерминантой, где представляющий интерес антиген или его фрагмент или антигенную детерминанту метят флуоресцентным красителем; и
(b) выделение отдельной клетки, которая специфически связывается с антигеном, представляющим интерес, или его фрагментом или антигенной детерминантой, с помощью FACS-сортировки.
121. Эукариотическая клеточная библиотека по любому одному из пп. 94-120, где выделение отдельной клетки, которая специфически связывается с представляющим интерес антигеном или его фрагментом или антигенной детерминантой, с помощью FACS-сортировки включает этап дальнейшего отбора клетки по меньшей мере по одному дополнительному параметру.
122. Эукариотическая клеточная библиотека по любому одному из пп. 94-122, где способ также включает следующие этапы:
(a) культивирование по меньшей мере одной, в частности точно одной, отдельной клетки в присутствии второй популяции эукариотических клеток, в частности клеток млекопитающего;
(b) определение способности второй популяции эукариотических клеток, в частности клеток млекопитающего, специфически связываться с антигеном, представляющим интерес, или его фрагментом или антигенной детерминантой.
123. Эукариотическая клеточная библиотека по любому одному из пп. 94-122, где первая популяция эукариотических клеток, в частности клеток млекопитающего, и/или (в частности и) вторая популяция эукариотических клеток, в частности клеток млекопитающего, содержит или в частности состоит из клеток, выбранных среди: (а) клеток BHK 21, особенно ТСС CCL-10; (b) клеток Neuro-2a; (с) клеток HEK-293Т, особенно ТСС CRL-11268; (d) клеток CHO-K1, особенно ТСС CRL-62; и (е) клеток HEK293.
124. Эукариотическая клеточная библиотека по любому одному из пп. 94-123, где первая популяция эукариотических клеток, в частности клеток млекопитающего, и/или вторая популяция эукариотических клеток, в частности клеток млекопитающего, содержит или в частности состоит из клеток CHO-K1, где более конкретно экспрессионная библиотека является лентивирусной экспрессионной библиотекой.
125. Способ отбора клетки, экспрессирующей антитело, которое специфически связывается с антигеном, представляющим интерес, включающий следующие этапы:
(a) возможно, отбор из популяции В-клеток субпопуляции В-клеток или отдельной В-клетки или клональной популяции В-клеток, секретирующих антитело, которое специфически связывается с одним или более чем одним антигеном,
(b) создание лентивирусной экспрессионной библиотеки, где каждый представитель лентивирусной экспрессионной библиотеки кодирует вариантное антитело или антитело, которое специфически связывается с одним или более чем одним антигеном, путем
(i) создания множества молекул ДНК, где создание включает этап амплификации пула молекул ДНК из субпопуляции В-клеток или этап создания библиотеки молекул ДНК из ДНК, кодирующей одно антитело, которое специфически связывается с одним или двумя антигенами, представляющими интерес, путем рандомизации нуклеиновой кислоты, кодирующей последовательность, и
(ii) клонирование множества молекул ДНК в лентивирусный экспрессионный вектор, содержащий EV71-IRES-связанную бицистронную экспрессионную кассету, для экспрессии легкой цепи полноразмерного антитела и тяжелой цепи полноразмерного антитела в растворимой, а также в мембраносвязанной форме;
(c) трансдукция популяции эукариотических клеток популяцией лентивирусных частиц, каждая из которых содержит представителя лентивирусной экспрессионной библиотеки;
(d) представление антитела, закодированного лентивирусной экспрессионной библиотекой, на поверхности эукариотической клетки млекопитающего; и
(e) выделение из популяции эукариотических клеток клетки, где клетка выбрана по способности антитела, представленного на ее поверхности, специфически связывать антиген или антигены, представляющие интерес, или их фрагменты или антигенные детерминанты.
126. Способ отбора клетки, экспрессирующей биспецифическое антитело (которое специфически связывается с двумя антигенами, представляющими интерес), включающий следующие этапы:
(а) создание лентивирусной экспрессионной библиотеки, где каждый представитель лентивирусной экспрессионной библиотеки кодирует вариант биспецифического антитела, путем
(i) создания множества молекул ДНК из ДНК, кодирующей отдельное биспецифическое антитело, путем рандомизации нуклеиновой кислоты, кодирующей последовательность, и
(ii) клонирования множества молекул ДНК в лентивирусный экспрессионный вектор, содержащий EV71-IRES-связанную бицистронную экспрессионную кассету, для экспрессии полноразмерного биспецифического антитела в мембраносвязанной форме;
(b) трансдукция популяции эукариотических клеток популяцией лентивирусных частиц, каждая из которых содержит представителя лентивирусной экспрессионной библиотеки;
(c) представление антитела, закодированного лентивирусной экспрессионной библиотекой, на поверхности эукариотической клетки млекопитающего; и
(d) выделение из популяции эукариотических клеток клетки, где клетка выбрана по способности антитела, представленного на ее поверхности, специфически связывать антигены, представляющие интерес, или его фрагменты или антигенные детерминанты.
127. Способ по любому из пп. 125-126, который включает создание множества молекул ДНК, кодирующих антитела, при этом создание включает следующие этапы:
(1) амплификация из субпопуляции В-клеток первого пула молекул ДНК, кодирующих вариабельные области тяжелой цепи (HCVR); и
(2) амплификация из субпопуляции В-клеток второго пула молекул ДНК, кодирующих вариабельные области легкой цепи (LCVR);
(3) клонирование комбинации множества молекул ДНК, кодирующих LCVR, и множества молекул ДНК, кодирующих HCVR, в лентивирусный экспрессионный вектор, содержащий EV71-IRES-связанную бицистронную экспрессионную кассету, для экспрессии легкой цепи полноразмерного антитела и тяжелой цепи полноразмерного антитела в растворимой, а также в мембраносвязанной форме.
128. Способ по любому из пп. 125-127, который включает создание множества молекул ДНК, кодирующих антитела, которые специфически связываются с одним или двумя антигенами, представляющими интерес, при этом создание множества молекул ДНК включает следующие этапы:
(1) амплификация из отдельной В-клетки или клональной популяции В-клеток молекулы ДНК, кодирующей HCVR, и молекулы ДНК, кодирующей LCVR, и
(2) рандомизация молекулы ДНК, кодирующей HCVR, и/или молекулы ДНК, кодирующей LCVR, путем рандомизации по меньшей мере одного кодона, и, таким образом, создание множества молекул ДНК, кодирующих HCVR, и множества молекул ДНК, кодирующих LCVR;
(3) клонирование комбинации рандомизированного множества молекул ДНК, кодирующих LCVR, и множества молекул ДНК, кодирующих HCVR, в лентивирусный экспрессионный вектор, содержащий EV71-IRES-связанную бицистронную экспрессионную кассету, для экспрессии легкой цепи полноразмерного антитела и тяжелой цепи полноразмерного антитела в растворимой, а также в мембраносвязанной форме.
129. Способ по любому из пп. 125-128, который включает создание лентивирусной экспрессионной библиотеки, при этом создание включает следующие этапы:
(i) создание множества молекул ДНК, кодирующих антитела, включающее следующие этапы:
(1) выделение мРНК из субпопуляции В-клеток;
(2) траснкрипция мРНК в кДНК;
(3) амплификация из кДНК первого пула молекул ДНК с помощью первой смеси олигонуклеотидов, содержащей по меньшей мере два олигонуклеотида, способных амплифицировать кодирующие области HCVR; и
(4) амплификация из кДНК второго пула молекул ДНК с помощью второй смеси олигонуклеотидов, содержащей по меньшей мере два олигонуклеотида, способных амплифицировать кодирующие области LCVR;
(ii) клонирование пары молекул ДНК из первого и второго пула молекул ДНК в лентивирусный экспрессионный вектор, содержащий EV71-IRES-связанную бицистронную экспрессионную кассету, для экспрессии легкой цепи полноразмерного антитела и тяжелой цепи полноразмерного антитела в растворимой, а также в мембраносвязанной форме.
130. Способ по любому из пп. 135-129, который включает создание лентивирусной экспрессионной библиотеки, при этом создание включает следующие этапы:
(i) создание множества молекул ДНК, кодирующих антитела, которые специфически связываются с одним или двумя антигенами, при этом создание включает следующие этапы:
(1) выделение мРНК из отдельной В-клетки или клональной популяции В-клеток;
(2) траснкрипция мРНК в кДНК;
(3) амплификация из кДНК первой молекулы ДНК с помощью первой смеси олигонуклеотидов, содержащей по меньшей мере два олигонуклеотида, способных амплифицировать кодирующую область HCVR; и
(4) амплификация из кДНК второй молекулы ДНК с помощью второй смеси олигонуклеотидов, содержащей по меньшей мере два олигонуклеотида, способных амплифицировать кодирующую область LCVR;
(5) рандомизация первой и/или второй молекулы ДНК и, таким образом, создание первого пула молекул ДНК и второго пула молекул ДНК,
(ii) клонирование пары молекул ДНК из первого и второго пула молекул ДНК в лентивирусный экспрессионный вектор, содержащий EV71-IRES-связанную бицистронную экспрессионную кассету, для экспрессии легкой цепи полноразмерного антитела и тяжелой цепи полноразмерного антитела в растворимой, а также в мембраносвязанной форме.
131. Способ по любому из пп. 125-130, где эукариотическая клетка является клеткой млекопитающего или дрожжевой клеткой.
132. Способ по п. 131, где клетка млекопитающего является CHO-клеткой или HEK-клеткой.
133. Способ по любому из пп. 125-132, где животное выбрано из группы, состоящей из овцы, лося, оленя, осла, мулового оленя, норки, лошади, крупного рогатого скота, свиньи, козы, собаки, кошки, крысы, хомяка, морской свинки и мыши. В одном воплощении животное представляет собой мышь, крысу или примата.
134. Способ по любому из пп. 125-133, где животное является приматом или человеком.
135. Способ по любому из пп. 125-134, где животное представляет собой трансгенное животное с человеческим иммуноглобулиновым локусом.
136. Способ по любому из пп. 125-135, где нуклеиновая кислота получена путем отбора из популяции выделенных В-клеток субпопуляции В-клеток по их способности специфически связываться с антигеном, представляющим интерес.
137. Способ по любому из пп. 125-136, где нуклеиновая кислота получена путем отбора из популяции выделенных В-клеток отдельной В-клетки по ее способности специфически связываться с одним или двумя антигенами, представляющими интерес.
138. Способ по любому из пп. 125-137, где отдельная В-клетка является клональной B-клеточной популяцией.
139. Способ по любому из пп. 125-138, где нуклеиновая кислота получена путем амплификации нуклеиновой кислоты, кодирующей вариабельный домен, из выделенной мРНК отдельной В-клетки или клональной B-клеточной популяции, и траснкрипция амплифицированной мРНК в кДНК.
140. Способ по любому из пп. 125-139, где разнообразие библиотеки лентивирусного вектора получено с помощью нуклеиновых кислот, кодирующих HCVR и LCVR и полученных из пула В-клеток, продуцирующих антитело, которое специфически связывается с одним антигеном или с двумя разными антигенами, или которое специфически связывается с различными неперекрывающимися эпитопами одного и того же антигена.
141. Способ по любому из пп. 125-140, где разнообразие библиотеки лентивирусного вектора получено с помощью пары нуклеиновых кислот, кодирующих HCVR и LCVR и выбранных из пулов нуклеиновых кислот, кодирующих HCVR и LCVR и полученных путем рандомизации по меньшей мере одного кодона HCVR, и нуклеиновой кислоты, кодирующей LCVR и полученной из отдельной В-клетки, продуцирующей антитело, которое специфически связывается с одним антигеном или с двумя разными антигенами, или которое специфически связывается с различными неперекрывающимися эпитопами одного и того же антигена.
142. Способ по любому из пп. 125-140, где разнообразие библиотеки лентивирусного вектора получено с помощью пары различных нуклеиновых кислот, кодирующих HCVR, и одной нуклеиновой кислоты, кодирующей LCVR, где различные нуклеиновые кислоты, кодирующие HCVR, получены путем рандомизации по меньшей мере одного кодона нуклеиновой кислоты, кодирующей HCVR и полученной из отдельной B-клетки, продуцирующей антитело, которое специфически связывается с одним антигеном или с двумя разными антигенами, или которое специфически связывается с различными неперекрывающимися эпитопами одного и того же антигена.
143. Способ по любому из пп. 125-142, где разнообразие библиотеки лентивирусного вектора получено с помощью пары различных нуклеиновых кислот, кодирующих LCVR, и одной нуклеиновой кислоты, кодирующей HCVR, где различные нуклеиновые кислоты, кодирующие LCVR, получены путем рандомизации по меньшей мере одного кодона нуклеиновой кислоты, кодирующей LCVR и полученной из отдельной В-клетки, продуцирующей антитело, которое специфически связывается с одним антигеном или с двумя разными антигенами, или которое специфически связывается с различными неперекрывающимися эпитопами одного и того же антигена.
144. Способ по любому из пп. 125-143, где отдельная В-клетка является клональной популяцией В-клетки.
145. Способ по любому из пп. 125-144, где создание разнообразия лентивирусной экспрессионной библиотеки включает следующие этапы:
(а):
(i) выделение РНК из субпопуляции В-клеток,
(ii) транскрипция РНК в кДНК;
(iii) амплификация из кДНК первого пула молекул ДНК с помощью первой смеси олигонуклеотидов, содержащей по меньшей мере два олигонуклеотида, способных амплифицировать кодирующие области HCVR;
(iv) амплификация из кДНК второго пула молекул ДНК с помощью второй смеси олигонуклеотидов, содержащей по меньшей мере два олигонуклеотида, способных амплифицировать кодирующие области LCVR; и
(v) получение пар одного представителя первого пула молекул ДНК и одного представителя второго пула молекул ДНК;
или (b):
(i) выделение РНК из отдельной В-клетки или из клональной популяции В-клеток,
(ii) транскрипция РНК в кДНК;
(iii) амплификация из кДНК первой молекулы ДНК с помощью первой смеси олигонуклеотидов, содержащей по меньшей мере два олигонуклеотида, способных амплифицировать кодирующие области HCVR;
(iv) амплификация из кДНК второй молекулы ДНК с помощью второй смеси олигонуклеотидов, содержащей по меньшей мере два олигонуклеотида, способных амплифицировать кодирующие области LCVR;
(v) создание первого пула молекул ДНК путем рандомизации по меньшей мере одного кодона первой молекулы ДНК,
(vi) создание второго пула молекул ДНК путем рандомизации по меньшей мере одного кодона второй молекулы ДНК, и
(vii) получение пар одного представителя первого пула молекул ДНК и одного представителя второго пула молекул ДНК;
или (с):
(i) выделение РНК из отдельной В-клетки или из клональной популяции В-клеток,
(ii) транскрипция РНК в кДНК;
(iii) амплификация из кДНК первой молекулы ДНК с помощью первой смеси олигонуклеотидов, содержащей по меньшей мере два олигонуклеотида, способных амплифицировать кодирующие области HCVR;
(iv) амплификация из кДНК второй молекулы ДНК с помощью второй смеси олигонуклеотидов, содержащей по меньшей мере два олигонуклеотида, способных амплифицировать кодирующие области LCVR;
(v) создание пула молекул ДНК путем рандомизации по меньшей мере одного кодона первой молекулы ДНК, и
(vi) получение пар одного представителя пула молекул ДНК и второй молекулы ДНК;
или (d):
(i) выделение РНК из отдельной В-клетки или из клональной популяции В-клеток,
(ii) транскрипция РНК в кДНК;
(iii) амплификация из кДНК первой молекулы ДНК с помощью первой смеси олигонуклеотидов, содержащей по меньшей мере два олигонуклеотида, способных амплифицировать кодирующие области HCVR;
(iv) амплификация из кДНК второй молекулы ДНК с помощью второй смеси олигонуклеотидов, содержащей по меньшей мере два олигонуклеотида, способных амплифицировать кодирующие области LCVR;
(v) создание пула молекул ДНК путем рандомизации по меньшей мере одного кодона второй молекулы ДНК, и
(vi) получение пар одного представителя пула молекул ДНК и первой молекулы ДНК.
146. Способ по любому из пп. 125-145, где жизнеспособность антигенспецифического антитела увеличена путем случайной комбинации различных вариабельных областей легкой и тяжелой цепей.
147. Эукариотическая клеточная библиотека по любому одному из пп. 125-146, где популяция выделенных В-клеток или отдельные В-клетки или клональная популяция В-клеток получена из источника, выбранного среди: (а) крови; (b) вторичных лимфоидных органов, особенно селезенки и лимфатических узлов; (с) костного мозга; и (d) ткани, содержащей В-клетки памяти.
148. Эукариотическая клеточная библиотека по п. 147, где популяция выделенных В-клеток содержит или в частности состоит из мононуклеарных клеток периферической крови (РВМС).
149. Эукариотическая клеточная библиотека по любому одному из пп. 125-148, где животное является млекопитающим, особенно крысой, мышью, кроликом или человеком.
150 Эукариотическая клеточная библиотека по п. 149, где животное является трансгенной мышью или трансгенным кроликом или человеком.
151. Эукариотическая клеточная библиотека по любому одному из пп. 125-150, где отбор из популяции выделенных В-клеток субпопуляции В-клеток или отдельной В-клетки включает следующие этапы:
(a) контакт популяции выделенных В-клеток с антигеном, представляющим интерес, или его фрагментом или антигенной детерминантой; и
(b) отбор В-клетки или отдельной В-клетки, которая специфически связывается с антигеном, представляющим интерес, или его фрагментом или антигенной детерминантой.
152. Эукариотическая клеточная библиотека по любому одному из пп. 125-151, где отбор из популяции выделенных В-клеток субпопуляции В-клеток или отдельной В-клетки включает следующие этапы:
(a) нанесение на носитель антигена, представляющего интерес, или его фрагмента или антигенной детерминанты;
(b) контакт популяции выделенных В-клеток с носителем и связывание В-клетки с носителем через антиген, представляющий интерес, или его фрагмент или антигенную детерминанту;
(c) удаление несвязанных В-клеток, где в частности носитель содержит или более конкретно состоит из шариков, где более конкретно шарики являются парамагнитными; и
(d) удаление субпопуляций В-клеток или отдельной В-клетки с парамагнитных шариков.
153. Эукариотическая клеточная библиотека по любому одному из пп. 125-152, где отбор из популяции выделенных В-клеток субпопуляции В-клеток или отдельной В-клетки проводится с помощью FACS-сортировки.
154. Эукариотическая клеточная библиотека по любому одному из пп. 125-153, где отбор из популяции выделенных В-клеток субпопуляции В-клеток или отдельной В-клетки включает следующие этапы:
(a) контакт популяции выделенных В-клеток с антигеном, представляющим интерес, или его фрагментом или антигенной детерминантой, где антиген, представляющий интерес, или его фрагмент или антигенную детерминанту метят флуоресцентным красителем; и
(b) отделение В-клетки, связанной с антигеном, представляющим интерес, или его фрагментом или антигенной детерминантой с помощью FACS-сортировки.
155. Эукариотическая клеточная библиотека по любому одному из пп. 125-154, где отбор из популяции выделенных В-клеток субпопуляции В-клеток или отдельной В-клетки включает следующие этапы:
(a) контакт популяции выделенных В-клеток с антигеном, представляющим интерес, или его фрагментом или антигенной детерминантой;
(b) отбор популяции В-клеток или отдельной В-клетки, которая специфически связывается с антигеном, представляющим интерес, или его фрагментом или антигенной детерминантой; и
(c) отбор В-клеток по меньшей мере по одному дополнительному параметру, где в частности отбор по меньшей мере по одному дополнительному параметру представляет собой
(i) положительную селекцию по параметру, выбранному среди присутствия В-клеточного специфического маркера, особенно CD19 или В220, и жизнеспособности В-клеток; и/или
(ii) отрицательную селекцию по параметру, выбранному среди: присутствия IgM-антитела; присутствия IgD-антитела, присутствия маркеров клеточной гибели и присутствия маркеров апоптоза.
156. Эукариотическая клеточная библиотека по любому одному из пп. 125-155, где отбор из популяции выделенных В-клеток субпопуляции В-клеток также включает этап отбора В-клеток с переключенным классом, особенно IgM-и/или IgD-отрицательных В-клеток, наиболее конкретно IgM- и/или IgD-отрицательных В-клеток.
157. Эукариотическая клеточная библиотека по любому одному из пп. 125-156, где отбор из популяции выделенных В-клеток субпопуляции В-клеток или отдельной В-клетки включает следующие этапы:
(a) контакт популяции выделенных В-клеток с антигеном, представляющим интерес, или его фрагментом или антигенной детерминантой, где антиген, представляющий интерес, или его фрагмент или антигенная детерминанта мечены первым флуоресцентным красителем, где в частности флуоресцентный краситель представляет собой Alexa 647 nm, Alexa 488 или Alexa 546 nm;
(b) контакт клеток из популяции выделенных В-клеток с анти-IgM- и/или анти-IgD-антителом, где анти-IgM- и/или анти-IgD-антитела мечены вторым и/или третьим флуоресцентным красителем, где второй и/или третий флуоресцентный краситель испускает флуоресценцию при длине волны, отличной от длины волны флуоресценции, испускаемой первым флуоресцентным красителем; и
(c) отделение популяции В-клеток или отдельной В-клетки, связанной с представляющим интерес антигеном или его фрагментом или антигенной детерминантой, но не связанной с анти-IgM- и/или с анти-IgD-антителами, путем FACS-сортировки.
158. Эукариотическая клеточная библиотека по любому одному из пп. 125-157, где библиотека является вирусной библиотекой, в частности лентивирусной библиотекой, и введение библиотеки в первую популяцию эукариотической клетки, в частности клетки млекопитающего, проводится путем инфицирования эукариотической клетки, в частности клетки млекопитающего, вирусной библиотекой, в частности лентивирусной библиотекой, где более конкретно инфицирование проводится с множественностью заражения не более 10, особенно не более 1, более конкретно не более 0,2, и наиболее конкретно не более 0,1.
159. Эукариотическая клеточная библиотека по п. 158, где множественность заражения составляет примерно 0,1.
160. Эукариотическая клеточная библиотека по любому одному из пп. 125-159, где выделение клетки проводится с помощью FACS-сортировки. В одном воплощении выделение клетки включает следующие этапы:
(а) окрашивание первой популяции эукариотических клеток, в частности клеток млекопитающего, представляющим интерес антигеном или его фрагментом или антигенной детерминантой, где представляющий интерес антиген или его фрагмент или антигенную детерминанту метят флуоресцентным красителем; и
(b) выделение отдельной клетки, которая специфически связывается с антигеном, представляющим интерес, или его фрагментом или антигенной детерминантой, с помощью FACS-сортировки.
161. Эукариотическая клеточная библиотека по любому одному из пп. 125-160, где выделение отдельной клетки, которая специфически связывается с антигеном, представляющим интерес, или его фрагментом или антигенной детерминантой, с помощью FACS-сортировки включает этап дальнейшего отбора клетки по меньшей мере по одному дополнительному параметру.
162. Эукариотическая клеточная библиотека по п. 161, где по меньшей мере один дополнительный параметр выбран среди
(i) положительной селекции по жизнеспособности клетки; и/или
(ii) отрицательной селекции по параметру, выбранному среди: присутствия IgM-антитела; присутствия IgD-антитела, присутствия маркеров клеточной гибели и присутствия маркеров апоптоза.
163. Эукариотическая клеточная библиотека по любому одному из пп. 125-162, где способ также включает следующие этапы:
(a) культивирование по меньшей мере одной, в частности точно одной, отдельной клетки в присутствии второй популяции эукариотических клеток, в частности клеток млекопитающего;
(b) определение способности второй популяции эукариотических клеток, в частности клеток млекопитающего, специфически связываться с антигеном, представляющим интерес, или его фрагментом или антигенной детерминантой.
164. Эукариотическая клеточная библиотека по любому одному из пп. 125-163, где первая популяция эукариотических клеток, в частности клеток млекопитающего, и/или (в частности и) вторая популяция эукариотических клеток, в частности клеток млекопитающего, содержит или в частности состоит из клеток, выбранных среди: (а) клеток BHK 21, особенно ТСС CCL-10; (b) клеток Neuro-2a; (с) клеток HEK-293Т, особенно ТСС CRL-11268; (d) клеток CHO-K1, особенно ТСС CRL-62; и (е) клеток HEK293.
165. Эукариотическая клеточная библиотека по любому одному из пп. 125-164, где первая популяция эукариотических клеток, в частности клеток млекопитающего, и/или вторая популяция эукариотических клеток, в частности клеток млекопитающего, содержит или в частности состоит из клеток CHO-K1, где более конкретно экспрессионная библиотека является лентивирусной экспрессионной библиотекой.
166. Технологический процесс/способ представления полноразмерных антител, содержащих общую легкую цепь, на поверхности эукариотических клеток и отбора клеток и тем самым отбора антитела, включающий следующие этапы:
- иммунизация экспериментального животного, такого как трансгенный кролик,
- отбор антигенспецифических В-клеток (путем FACS, общей сортировки),
- ПЦР-амплификация нуклеиновой кислоты, кодирующей тяжелую цепь: две отдельные полимеразные цепные реакции, встраивающие уникальные сайты рестрикции для направленного клонирования в шаттл-вектор, одна для цепи типа «ключ» с помощью одного или более или всех праймеров SEQ ID №№6-10 и праймера SEQ ID №11, и одна для цепи типа «замок» с помощью одного или более или всех праймеров SEQ ID №1-4 и праймера SEQ ID №5; лигирование: нуклеиновой кислоты, кодирующей вариабельный домен первой тяжелой цепи, в локус «замок» без трансмембранного домена, т.е. выше EV71-IRES, и нуклеиновой кислоты, кодирующей вариабельный домен второй тяжелой цепи, в локус «ключ» с трансмембранным доменом, т.е. ниже EV71-IRES,
- получение вируса, инфицирование клетки млекопитающего, стабильно экспрессирующей общую легкую цепь, отбор биспецифических антител, представляемых на поверхности клетки млекопитающего (скрининг по диссоциации антигена, «off-rate»), общая сортировка ответов (клонов клеток млекопитающих) с помощью FACS,
- ПЦР нуклеиновой кислоты, кодирующей полную первую тяжелую цепь, и нуклеиновой кислоты, кодирующей вариабельный домен (который не имеет домена ТМ) второй тяжелой цепи, включая EV71-IRES, и клонирование во второй шаттл-вектор без трансмембранного домена с помощью, например, праймеров SEQ ID №29 и SEQ ID №30,
- получение вируса, инфицирование клетки млекопитающего, экспрессирующей общую легкую цепь, сортировка клеток по отдельным клеткам, скрининг биспецифического антитела в супернатанте и выбор биспецифического антитела.
167. Технологический процесс/способ представления полноразмерных антител, содержащих общую легкую цепь, на поверхности эукариотических клеток и отбора клеток и тем самым отбора антитела, включающий следующие этапы:
- иммунизация экспериментального животного, такого как трансгенный кролик,
- отбор антигенспецифических В-клеток (путем FACS, общей сортировки),
- ПЦР-амплификация нуклеиновой кислоты, кодирующей тяжелую цепь (две отдельные полимеразные цепные реакции, встраивающие уникальные сайты рестрикции для направленного клонирования в шаттл-вектор; лигирование: нуклеиновой кислоты, кодирующей вариабельный домен первой тяжелой цепи, в локус «замок» с трансмембранным доменом, т.е. выше EV71-IRES, и нуклеиновой кислоты, кодирующей вариабельный домен второй тяжелой цепи, в локус «ключ» с трансмембранным доменом, т.е. ниже EV71-IRES,
- получение вируса, инфицирование клетки млекопитающего, экспрессирующей общую легкую цепь, отбор биспецифических антител, представляемых на мембране клетки млекопитающего (скрининг «off-rate»), общая сортировка ответов (клонов клеток млекопитающих) с помощью FACS,
- ПЦР нуклеиновой кислоты, кодирующей полную первую тяжелую цепь, и нуклеиновой кислоты, кодирующей вариабельный домен второй тяжелой цепи (2,2 т.п.о.), включая EV71-IRES, и клонирование во второй шаттл-вектор без трансмембранного домена; удаление трансмембранного домена первой тяжелой цепи путем рестрикции и повторного лигирования вектора,
- получение вируса, инфицирование клетки млекопитающего, экспрессирующей общую легкую цепь, сортировка клеток по отдельным клеткам, скрининг биспецифического антитела в супернатанте и выбор биспецифического антитела.
168. Технологический процесс/способ представления полноразмерных антител, содержащих общую легкую цепь, на поверхности эукариотических клеток и отбора клеток и тем самым отбора антитела, включающий следующие этапы:
- иммунизация экспериментального животного, такого как трансгенный кролик,
- отбор антигенспецифических В-клеток (путем FACS, общей сортировки),
- ПЦР-амплификация нуклеиновой кислоты, кодирующей тяжелую цепь: две отдельные полимеразные цепные реакции, встраивающие уникальные сайты рестрикции для направленного клонирования в шаттл-вектор; лигирование: нуклеиновой кислоты, кодирующей вариабельный домен первой тяжелой цепи, в первый шаттл-веткор в локус «замок» с или без трансмембранного домена, и нуклеиновой кислоты, кодирующей вариабельный домен второй тяжелой цепи, во второй шаттл-вектор в локус «ключ» с или без трансмембранного домена, но по меньшей мере с одним трансмембранным доменом,
- получение вируса (одного для первого шаттл-вектора и одного для второго шаттл-вектора), последующее инфицирование клетки млекопитающего, экспрессирующей общую легкую цепь, первым вирусом и вторым вирусом, отбор биспецифических антител, представляемых на мембране клетки млекопитающего (скрининг «off-rate»), общая сортировка ответов (клонов клеток млекопитающих) с помощью FACS,
- ПЦР нуклеиновой кислоты, кодирующей вариабельные домены тяжелой цепи, и клонирование в третий шаттл-вектор в бицистронный экспрессионный блок без трансмембранного домена и EV71-IRES,
- получение вируса, инфицирование клетки млекопитающего, экспрессирующей общую легкую цепь, сортировка клеток по отдельным клеткам, скрининг биспецифического антитела в супернатанте и выбор биспецифического антитела.
169. Технологический процесс/способ представления полноразмерных биспецифических антител, содержащих общую легкую цепь, на поверхности эукариотических клеток и отбора таких эукариотических клеток и тем самым отбора биспецифического антитела, включающий следующие этапы:
- первое экспериментальное животное, в одном воплощении трансгенную мышь или трансгенного кролика, иммунизируют первым представляющим интерес антигеном, в одном воплощении внеклеточным доменом рецептора, где В-клетки экспериментального животного экспрессируют одну и ту же легкую цепь,
- второе экспериментальное животное, в одном воплощении трансгенную мышь или трансгенного кролика, иммунизируют вторым представляющим интерес антигеном, в одном воплощении внеклеточным доменом рецептора, где В-клетки экспериментального животного экспрессируют одну и ту же легкую цепь,
при этом первый антиген и второй антиген различны,
- выбор В-клеток первого и второго иммунизированного экспериментального животного, в одном воплощении путем общей FACS-сортировки,
- получение нуклеиновой кислоты, кодирующей тяжелую цепь, из каждой В-клетки путем отдельной ПЦР-амплификации в двух отдельных/последовательных полимеразных цепных реакциях, встраивающих уникальные сайты рестрикции для направленного клонирования в шаттл-вектор/лентивирусный экспрессионный вектор,
- лигирование нуклеиновой кислоты, кодирующей вариабельный домен первой тяжелой цепи, в шаттл-вектор/лентивирусный экспрессионный вектор выше IRES (в одном воплощении IRES является EV71-IRES) в локус «замок» или «ключ» с трансмембранным доменом, и лигирование нуклеиновой кислоты, кодирующей вариабельный домен второй тяжелой цепи в тот же шаттл-вектор/лентивирусный экспрессионный вектор ниже IRES в соответствующий другой локус с трансмембранным доменом, т.е. если тяжелая цепь выше IRES имеет локус «замок», то тяжелая цепь ниже IRES имеет локус «ключ», и наоборот, при этом вариабельный домен первой тяжелой цепи связывается с первым антигеном, а второй вариабельный домен связывается со вторым антигеном, где первый антиген и второй антиген различны,
- получение вируса,
- инфицирование вирусом клетки млекопитающего, экспрессирующей общую легкую цепь,
- отбор клеток, представляющих биспецифические антитела на их поверхности, с помощью FACS дважды меченных трансдуцированных клеток,
- ПЦР нуклеиновой кислоты, кодирующей полную первую тяжелую цепь, и нуклеиновой кислоты, кодирующей вариабельный домен второй тяжелой цепи (2,2 т.п.о.), включая EV71-IRES, и клонирование во второй шаттл-вектор без трансмембранного домена; удаление трансмембранного домена первой тяжелой цепи путем рестрикции и повторного лигирования вектора,
- получение вируса, инфицирование клетки млекопитающего, экспрессирующей общую легкую цепь, сортировка клеток по отдельным клеткам, скрининг биспецифического антитела в супернатанте и выбор биспецифического антитела.
170. Технологический процесс/способ представления полноразмерных биспецифических антител, содержащих общую легкую цепь, на поверхности эукариотических клеток и отбора таких эукариотических клеток и тем самым отбора биспецифического антитела, включающий следующие этапы:
- экспериментальное животное, в одном воплощении трансгенную мышь или трансгенного кролика, иммунизируют представляющим интерес антигеном, в одном воплощении внеклеточным доменом рецептора, где В-клетки экспериментального животного экспрессируют одну и ту же легкую цепь,
- отбор В-клеток иммунизированного экспериментального животного, в одном воплощении путем общей FACS-сортировки,
- получение нуклеиновой кислоты, кодирующей тяжелую цепь, из каждой В-клетки путем отдельной ПЦР-амплификации в двух отдельных/последовательных полимеразных цепных реакциях, встраивающих уникальные сайты рестрикции для направленного клонирования в шаттл-вектор/лентивирусный экспрессионный вектор,
- лигирование нуклеиновой кислоты, кодирующей вариабельный домен тяжелой цепи, в шаттл-вектор/лентивирусный экспрессионный вектор ниже IRES (в одном воплощении IRES является EV71-IRES) в локус тяжелой цепи с трансмембранным доменом, где шаттл-вектор/лентивирусный экспрессионный вектор содержит выше IRES нуклеиновую кислоту, кодирующую общую легкую цепь,
- получение вируса,
- инфицирование вирусом клетки млекопитающего, экспрессирующей общую легкую цепь,
- отбор клеток, представляющих антитела на их поверхности, с помощью FACS специфически меченных антигеном трансдуцированных клеток, в одном воплощении путем общей FACS-сортировки,
- получение нуклеиновой кислоты, кодирующей тяжелую цепь, из каждой выбранной клетки путем отдельной ПЦР-амплификации в двух отдельных/последовательных полимеразных цепных реакциях, встраивающих уникальные сайты рестрикции для направленного клонирования в шаттл-вектор/лентивирусный экспрессионный вектор,
- лигирование нуклеиновой кислоты, кодирующей вариабельный домен первой тяжелой цепи, в шаттл-вектор/лентивирусный экспрессионный вектор выше IRES (в одном воплощении IRES является EV71-IRES) в локус «замок» или «ключ» без трансмембранного домена, и лигирование нуклеиновой кислоты, кодирующей вариабельный домен второй тяжелой цепи в тот же шаттл-вектор/лентивирусный экспрессионный вектор ниже IRES в соответствующий другой локус без трансмембранного домена, т.е. если тяжелая цепь выше IRES имеет локус «замок», то тяжелая цепь ниже IRES имеет локус «ключ», и наоборот, при этом вариабельный домен первой тяжелой цепи связывается с первым антигеном, а второй вариабельный домен связывается со вторым антигеном, где первый антиген и второй антиген могут быть одинаковыми или различными,
- получение вируса,
- инфицирование вирусом клетки млекопитающего, экспрессирующей общую легкую цепь,
- отбор клетки, секретирующей биспецифическое антитело.
171. Применение клетки, отобранной в соответствии со способом по любому одному из пп. 1-170, для получения антитела.
Следующие примеры, последовательности и графические материалы приведены, чтобы помочь пониманию данного изобретения, истинный объем которого изложен в прилагаемой формуле изобретения. Следует понимать, что в, изложенных процедурах могут быть сделаны модификации без отхода от сущности данного изобретения.
Последовательности
|
Графические материалы
Фиг. 1. Точечный FACS-график IRES-связанной экспрессии GFP; a) gtx-IRES, b) EV71-IRES, с) ELF4G-IRES, d) EMCV-IRES.
Фиг. 2. Сравнение IRES-связанной экспрессии LC и НС антитела; a) gtx-IRES, b) EV71-IRES, с) ELF4G-IRES, d) EMCV-IRES; нижняя фигура: схема экспрессионной конструкции.
Фиг. 3. FACS-гистограммы временно трансфицированных клеток HEK293, полученные через 24 ч после трансфекции;
а) временная трансфекция pLVX M №2 (мембраносвязанный IgG): серая заштрихованная гистограмма: аутофлуоресцентный контроль fectin, гистограмма с пунктирной линией: клетки, окрашенные противочеловеческим антителом IgG (H+L)-Alexa 488, гистограмма со сплошной линией: клетки, окрашенные противочеловеческим антителом IgG (H+L)-Alexa 488 после трансфекции pLVX M №2;
б) временная трансфекция pLVX MS №5 (мембраносвязанный и секретируемый): серая заштрихованная гистограмма: аутофлуоресцентный контроль fectin, гистограмма с пунктирной линией: клетки, окрашенные противочеловеческим антителом IgG (H+L)-Alexa 488, гистограмма со сплошной линией: клетки, окрашенные противочеловеческим антителом IgG (H+L)-Alexa 488 после трансфекции pLVX MS №5.
Фиг. 4. FACS-гистограммы вирусно трансдуцированных клеток HEK293, полученные через 96 часов после трансдукции;
а) вирусная трансдукция вирусом pLVX MS №5: серая заштрихованная гистограмма: аутофлуоресцентный контроль с полибреном, гистограмма с пунктирной линией: клетки, окрашенные противочеловеческим антителом IgG (H+L)-Alexa 488, гистограмма со сплошной линией: клетки, окрашенные противочеловеческим антителом IgG (Н+L)-Alexa 488 после трансдукции вирусом pLVX MS №2.
б) вирусная трансдукция вирусом pLVX MS №5: серая заштрихованная гистограмма: аутофлуоресцентный контроль fectin, гистограмма с пунктирной линией: клетки, окрашенные противочеловеческим антителом IgG (H+L)-Alexa 488, гистограмма со сплошной линией: клетки, окрашенные противочеловеческим антителом IgG (Н+L)-Alexa 488 после трансдукции вирусом pLVX MS №5.
Фиг. 5. Определение титра лентивируса путем тирования лентивирусных стоковых растворов с помощью анализа проточной цитометрии через 96 часов после трансдукции свежесобранными лентивирусными супернатантами.
Фиг. 6. FACS-гистограммы вирусно трансдуцированных клеток HEK293 непосредственно после трансдукции и через 14 или 28 дней, соответственно;
a) сортировка (площадь черного столбца) клеток HEK293, положительных на конъюгат противочеловеческого антитела IgG (H+L) и Alexa 488, через 96 часов после вирусной трансдукции вирусом pLVX M №2: серая заштрихованная гистограмма: контроль с полибреном; гистограмма со сплошной линией: трансдуцированная клеточная линия;
b) повторный анализ отсортированных клеток путем FACS, окрашенных через 14 и 28 дней после первоначальной сортировки после трансдукции вирусом pLVX M №2: серая заштрихованная гистограмма: контроль с полибреном; гистограмма с пунктирной линией: трансдуцированная клеточная линия, анализируемая во второй раз через 14 дней после первой сортировки; гистограмма со сплошной линией: трансдуцированная клеточная линия, анализируемая во второй раз через 28 дней после первой сортировки;
c) сортировка (черный столбец) клеток HEK293, положительных на конъюгат противочеловеческого антитела IgG (H+L) и Alexa 488, через 96 часов после инфицирования вирусом pLVX MS №5: серая заштрихованная гистограмма: контроль с полибреном; гистограмма со сплошной линией: трансдуцированная линия клеток;
d) повторный анализ отсортированных клеток путем FACS, окрашенных через 14 и 28 дней после первоначальной сортировки после трансдукции вирусом pLVX MS №5: серая заштрихованная гистограмма: контроль с полибреном; гистограмма с пунктирной линией: трансдуцированная клеточная линия, анализируемая во второй раз через 14 дней после первой сортировки; гистограмма со сплошной линией: трансдуцированная клеточная линия, анализируемая во второй раз через 28 дней после первой сортировки.
Фиг. 7. Экспрессионные кассеты биспецифического антитела.
Фиг. 8. Получение представленного клетками HEK293A мембраносвязанного антитела путем FACS-сортировки клеток, меченных конъюгатом Alexa-488-антиген.
Фиг. 9. Результаты ELISA супернатанатов от клеток, положительно отсортированных на pLVX M №2 или MS №5 (пул-сортировка).
Фиг. 10. Результаты сравнительного анализа путем FACS, ELISA отдельных сохраненных FACS-положительных клеток.
Фиг. 11. Результаты окрашивания клеток, инфицированных в присутствии двух вирусов, несущих плазмиды для мембраносвязанной экспрессии IgG, направленных против двух различных антигенов:
(A) левый столбец - уровень отдельной клетки: антиген 1-положительные клетки; правый столбец - антиген 2-положительные клетки; для MOI 100 нет обнаружено двойной инфекции при высоком пороге сортировки; ось y: жизнеспособные (рассеивающие)/синглетные - частота родительских;
(B) левый столбец - уровень пула: антиген 1-положительные клетки; средний столбец: антиген 2-положительные клетки; правый столбец: антиген 1-положительные клетки и антиген 2-положительные клетки.
Фиг. 12. FACS-анализ клеток, трансдуцированных различными лентивирусными частицами: слева - pLVX MS без IRES, две содержащие hCMV-промотор разделенные экспрессионные кассеты для экспрессии мембраносвязанного и секретируемого полноразмерного антитела; посередине - pLVX MS с IRES, одна бицистронная экспрессионная кассета с одним hCMV-промотором для экспрессии мембраносвязанного и секретируемого полноразмерного антитела; справа - pLVX M с IRES, одна бицистронная экспрессионная кассета с одним hCMV-промотором для экспрессии мембраносвязанного полноразмерного антитела.
Фиг. 13. FACS-анализ TU/мл в зависимости от размера (п.о.) лентивирусного экспрессионного вектора; левый столбец - TU/мл; правый столбец - размер лентивирусного экспрессионного вектора в п. о.
Фиг. 14. Векторная карта pLVX-Puro.
Фиг. 15. Векторная карта pLVX M №2.
Фиг. 16. Векторная карта pLVX MS №5.
Фиг. 17. FACS-анализ клеток HEK293, трансфицированных биспецифическими дисплейными векторами, кодирующими антитела без или с одним трансмембранным доменом; V1.1: М-В(«ключ»)-IRES-М-В(«замок») (мембранный якорь на обеих связывающих тяжелых цепях), V1.2: М-В(«ключ»)-IRES-M-N(«замок») (мембранный якорь на обеих тяжелых цепях, связывающей и несвязывающей), V1.3: M-N(«ключ»)-IRES-B(«замок») (мембранный якорь только 5 на несвязывающей), V1.4: B(«ключ»)-IRES-M-N(«замок») (мембранный якорь только на несвязывающей), V1.5: M-N(«ключ»)-IRES-M-N(«замок») (только несвязывающая, мембранный якорь на обеих тяжелых цепях), V1.6 В(«замок»)-IRES-M-N(«ключ») (мембранный якорь на несвязывающей, «ключ» и «замок» поменяны); 1: контроль 1 - только fectin, 2: контроль 2 - только общая LC, 3: V1.1 10 M-B-IRES-M-B + общая LC, 4: V1.2 M-B-IRES-M-N + общая LC, 5: V1.3 M-N-IRES-B + общая LC, 6: V1.4 B-IRES-M-N + общая LC, 7: V1.5 M-N-IRES-M-N + общая LC, 8: V1.6 B-(«замок»)-IRES-M-N(«ключ») + общая LC.
Пример 1
15 Конструирование векторов pLVX M №2 и pLVX MS №5
Шаттл-вектор: Удаление MCS, промотора PPGK и гена устойчивости к пуромицину. Вставка легкой цепи - EV71-IRES - тяжелой цепи - элемента альтернативного сплайсинга с трансмембранным доменом в плазмиду.
Исходный шаттл-вектор включает следующие элементы:
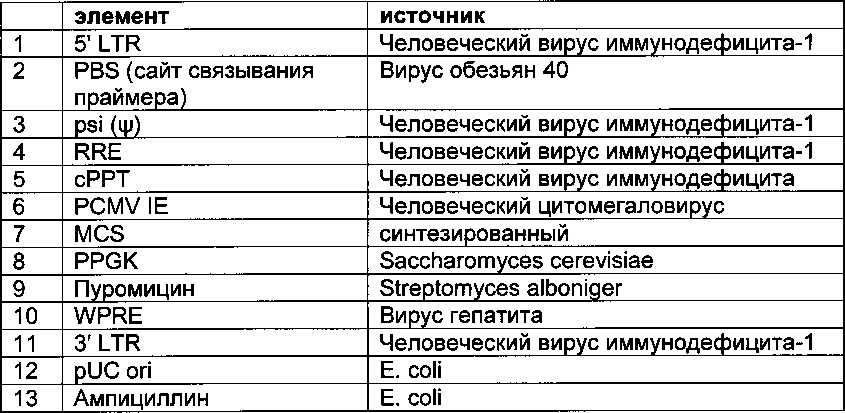
Плазмида pLVX М#2 содержит следующие элементы:

Пример 2
Создание инфекционных вирусов
3,75⋅105 клеток Lenti-XTM 293Т высевали в каждую лунку 6-луночного планшета и инкубировали в течение ночи. На следующий день клетки совместно трансфицировали 2,5 мкг pLVX M №2 или pLVX MS №5 и 12,75 мкл смеси Lenti-X НТХ Packaging Mix (Clontech 631248) с использованием 20 мкл реагента для трансфекции Lipofectamine™ 2000 (Invitrogen кат. № Ρ/Ν 52887) для каждой лунки. Среду меняли через 24 часа инкубации. Содержащие вирус супернатанты собирали через 48 часов после трансфекции.
Пример 3
Временная трансфекция клеток HEK293
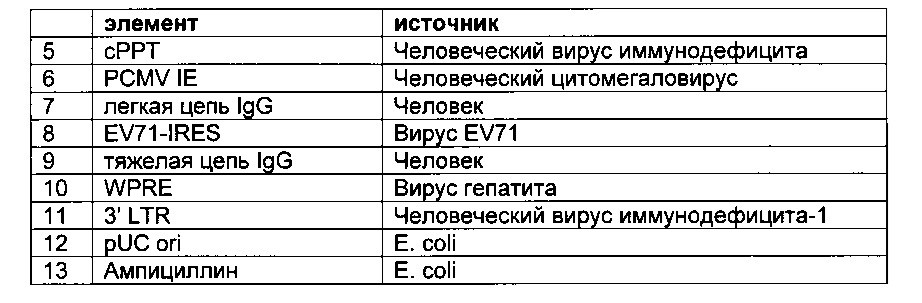
Плазмида pLVX MS №5 содержит следующие элементы:
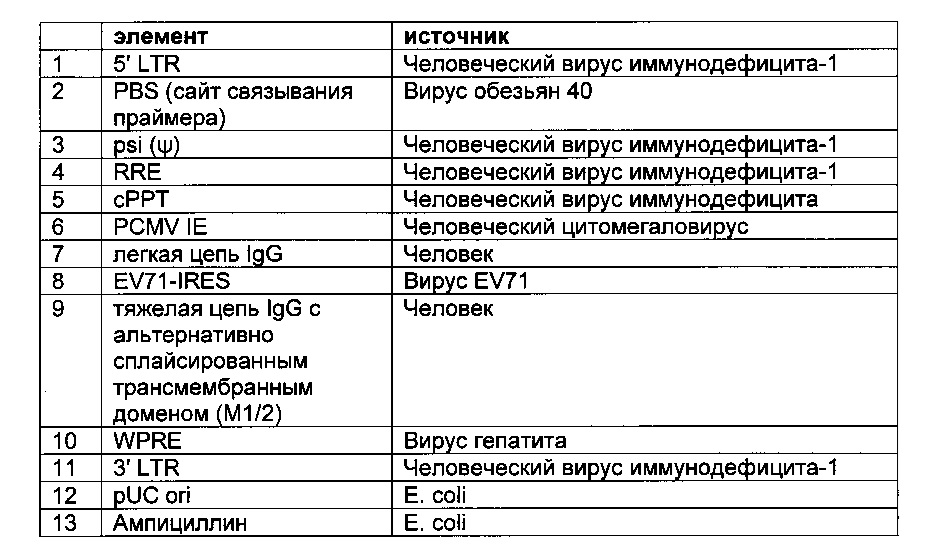
1⋅105 клеток Lenti-XTM 293Т высевали в 24-луночные и инкубировали в течение ночи. На следующий день клетки трансфицировали 0,9 мкг pLVX M №2 или pLVX MS №5 и 2,7 мкл реагента для трансфекции LipofectamineTM 2000 (Invitrogen кат. № Ρ/Ν 52887) для каждой лунки. Проводили мечение конъюгатом козлиного противочеловеческого IgG (H+L)-Alexa 488 (Invitrogen кат. № A11013) и выполняли FACS-анализ через 24 часа после трансфекции.
Результаты показаны на фиг. 3.
Пример 4
Вирусная трансдукция клеток HEK293
Вирусное инфицирование/трансдукция
1,5⋅104 клеток HEK293A высевали в лунки 48-луночного планшета и инкубировали в течение ночи. На следующий день полную среду удаляли и клетки инфицировали 300 мкл неразбавленных содержащих вирус супернатантов в присутствии 8 мкг/мл полибрена. Среду меняли через 24 часа инкубации. Клетки метили конъюгатом козлиного противочеловеческого IgG (H+L) - Alexa 488 (Invitrogen кат. № A11013) и выполняли FACS-анализ через 96 часов после трансфекции.
Результаты показаны на фиг. 4.
Определение лентивирусного титра
Лентивирусные титры определяли путем измерения лентивирусных стоковых растворов с использованием проточной цитометрии через 96 часов после трансдукции свежесобранными лентивирусными супернатантами.
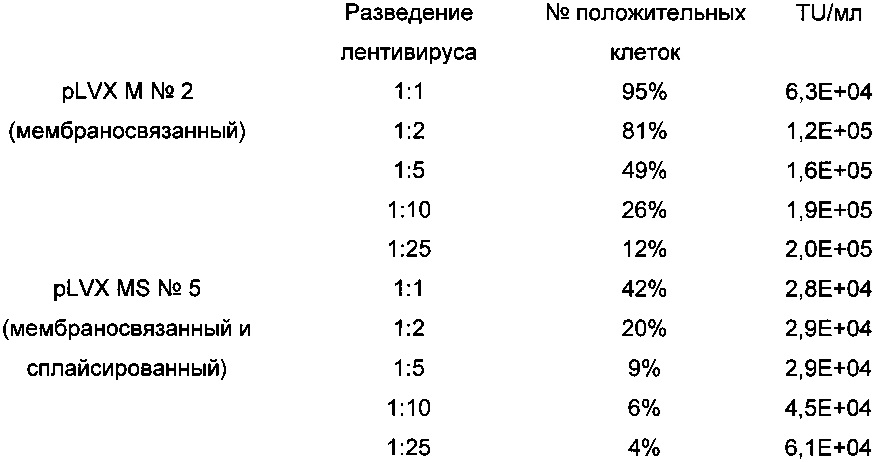
Титр рассчитывали по следующей формуле:
TU/мл=F*c*D/V,
где
F = частота положительных клеток
С = общее число клеток в лунке в момент трансдукции (например, 200000 клеток)
V = объем посевного материала в мл (0,3 мл)
D = разведение лентивируса
TU = единицы трансдукции Результаты показаны на фиг. 5.
Пример 5
Стабильность трансдуцированной вирусом клеточной линии HEK293
Создание вируса и вирусное инфицирование/трансдукцию проводили так, как описано в предыдущих примерах 2 и 4.
Отсортированные клетки размножали в 6-луночных планшетах или встряхиваемых колбах Т75. Пересев клеток проводили при 80% конфлюэнтности. Для FACS-окрашивания 1⋅105 клеток инкубировали с 10 мкг/мл конъюгата козлиного противочеловеческого IgG (H+L) - Alexa 488 (Invitrogen кат. № A11013) и выполняли FACS-анализ через 24 часа после трансфекции в общем объеме 100 мкл.
Определение долгосрочной стабильности проводили без селекционного давления. Соответствующие FACS-гистограммы приведены на фиг. 6.
Пример 6
Сортировка смеси клеток, представляющих мембраносвязанное антитело, и клеток дикого типа
Клетки HEK293A дикого типа смешивали с клетками HEK293A, стабильно трансдуцированными вектором pLVX M №2 (28 день), окрашивали 250 мкл 10 мкг/мл антигена, коъюгированного с Alexa 488, проводили FACS-анализ и сортировку Alexa 488-положительных клеток в 24-луночных микротитровальных планшетах.
Через четыре дня после сортировки все клетки в лунках 24-луночного микротитровального планшета, т.е. примерно 1⋅105 клеток, метили 50 мкл 10 мкг/мл антигена, коъюгированного с Alexa 488, с последующим анализом FACS.
Полученные результаты приведены на фиг. 8.
Пример 7
Секреция IgG отсортированными клетками (положительными на мембраносвязанный IgG) в культуральный супернатант
Отсортированные клетки размножали в 6-луночных микротитровальных планшетах или колбах Т75. Пересев клеток проводили при 80% конфлюэнтности. Супернатант от клеток с 95% конфлюэнтностью использовали для ELISA на IgG. Результаты представлены в таблице и на фиг. 9.
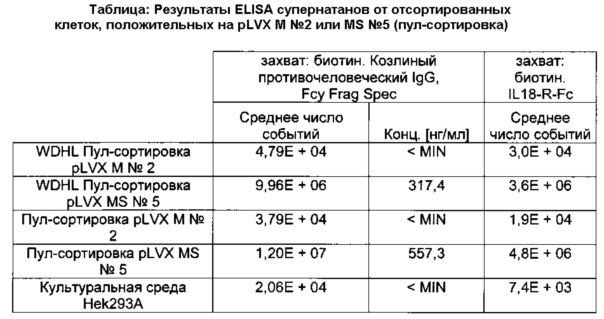
Пример 8
Корреляция мембраносвязанного антитела и секретируемого антитела
Создание вируса
3,75⋅105 клеток Lenti-XTM 293Т высевали в 6-луночный планшет и инкубировали в течение ночи. На следующий день клетки совместно трансфицировали 2,5 мкг pLVX MS №5 и 12,75 мкл смеси Lenti-X НТХ Packaging Mix (Clontech 631248) с использованием 20 мкл реагента для трансфекции LipofectamineTM 2000 (Invitrogen кат. № Ρ/Ν 52887) для каждой лунки. Среду меняли через 24 часа инкубации. Содержащие вирус супернатанты собирали через 48 часов после трансфекции.
Вирусное инфицирование/трансдукция
3⋅104 клеток HEK293A высевали в лунки 24-луночного планшета и инкубировали в течение ночи. На следующий день полную среду удаляли и клетки инфицировали 600 мкл неразведенных или разведенных 1:25 супернатантов, содержащих вирус, в присутствии 8 мкг/мл полибрена. Среду меняли через 24 часа инкубации. Проводили мечение клеток конъюгатом козлиного противочеловеческого IgG (H+L) - Alexa 488 (Invitrogen кат. № A11013), выполняли FACS-анализ через 96 часов после трансфекции и отдельные клетки отсортировывали в лунки 96-луночного планшета.
Три популяции клеток были отсортированы по отдельности:
- клетки, инфицированные неразведенным вирусом PLVX MS №5, с высоким порогом гейтирования
- клетки, инфицированные неразведенным вирусом PLVX MS №5, с низким порогом гейтирования
- клетки, инфицированные разведенным 1:25 вирусом PLVX MS №5, с низким порогом гейтирования.
Отсортированные клетки выращивали до конфлюэнтности 95% в 96-луночных планшетах и размножали в 24-луночных планшетах. Для FACS-окрашивания 5⋅104 клеток инкубировали с 10 мкг/мл конъюгата козлиного противочеловеческого IgG (H+L) - Alexa 488 в общем объеме 100 мкл. Из отсортированных клеток выделяли РНК для ПЦР-анализа на LC (ступенчатая ПЦР).
На фиг. 10 показаны результаты.
Из сравнительного анализа видно, что и FACS-анализ отдельных клеточных клонов, меченных конъюгатом противочеловеческого IgG (H+L) антитела с Alexa 488, и ELISA на человеческий IgG в культуральных супернатантах из одного отдельного клеточного клона через каждый гейт сортировки могут быть использованы для отбора клеток, при этом для FACS в качестве порога используется коэффициент более 2 по отношению к контрольному образцу (результаты также показаны в следующей таблице).
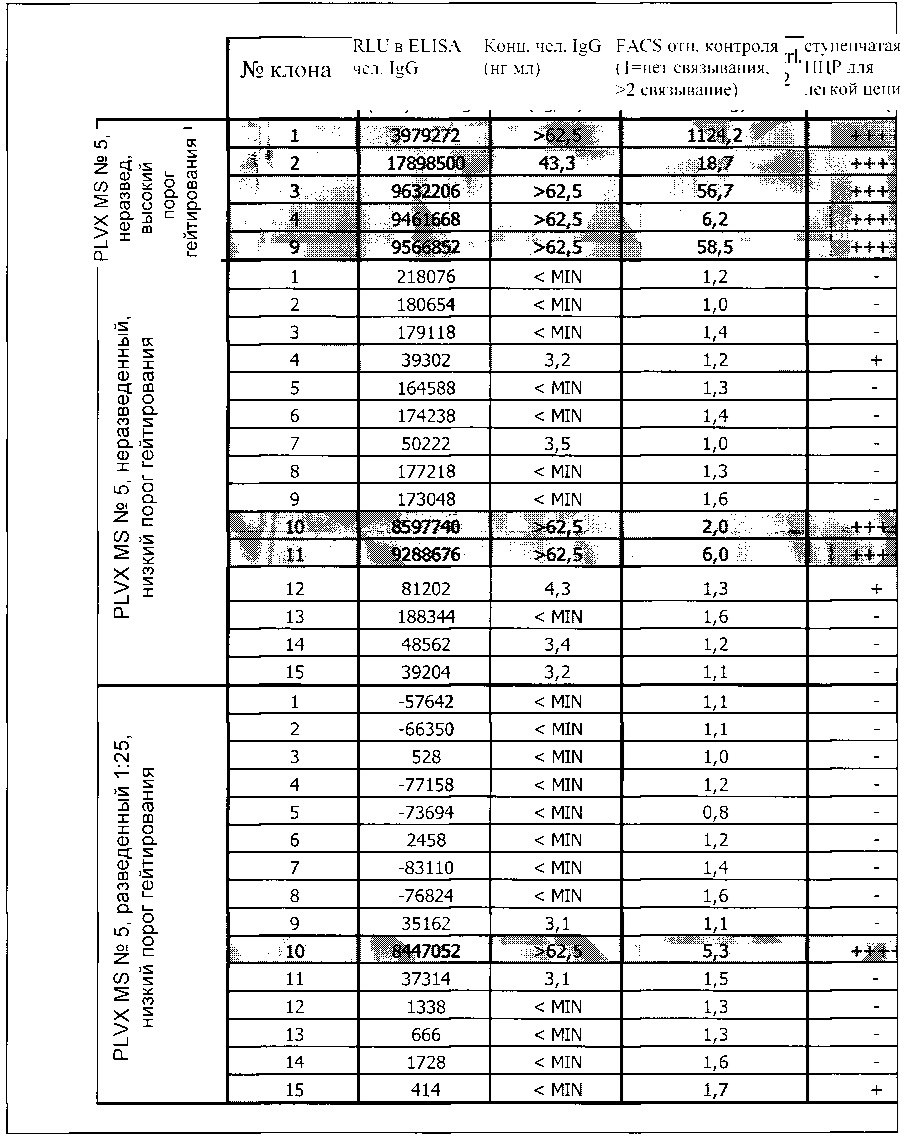
Пример 9
Инфицирование в присутствии двух вирусов с плазмидами различных антител
Клетки трансдуцировали в присутствии смеси пулов pLVX pLVX mAb1-М и pLVX mAb2-М. Клетки трансдуцировали различными MOI, рассчитанным с помощью ПЦР (1000, 100 и 40). После трансдукции отдельные отсортированные клеточные клоны (IgG+) метили путем инкубации с конъюгатом mAb1-антиген-Alexa 488 и конъюгатом mAb2-антиген-Су5.
Результат показан на фиг. 11.
Пример 10
Инфицирование клеток различными лентивирусными векторами с полноразмерным IgG
Вирусы были получены, как описано в примере 2, со следующими лентивирусными экспрессионными векторами:
- pLVX MS без IRES, две содержащие HCMV-промотор разделенные кассеты экспрессии для экспрессии мембраносвязанного и секретируемого полноразмерного антитела;
- pLVX MS с IRES, одна бицистронная экспрессионная кассета с одним HCMV-промотором для экспрессии мембраносвязанного и секретируемого полноразмерного антитела;
- pLVX M с IRES, одна бицистронная экспрессионная кассета с одним HCMV-промотором для экспрессии мембраносвязанного полноразмерного антитела.
Клетки трансдуцировали разведенными вирусами, содержащими три эти вектора, как описано в примере 4. Трансдуцированные клетки анализировали с помощью FACS после мечения конъюгатом противочеловеческого IgG (H+L) антитела с Alexa 488. Полученные результаты приведены на фиг. 12 и 13.
Пример 11
Амплификация нуклеиновых кислот из В-клеток
Общую РНК выделяли из антигенспецифических В-клеток. Одноцепочечную кДНК получали с помощью обратной транскриптазы PowerScriptTM (Clontech) с использованием протокола с переключением матрицы (Zhu, et al., BioTechniques 30 (2001) 892-897), с олигонуклеотидом для CDS (5'-AAG CAG TGG TAA CAA CGC AGA GTA CTT TTT TTT TTT TTT TTT TTT TTT TTT TTT TVN-3', SEQ ID №36) в качестве праймера и олигонуклеотидом SMART II (5'-d[AAG CAG TGG TAA CAA CGC AGA GTA CGC] r[GGG]-3', SEQ ID №37) в качестве переключаемой матрицы. Проводили общую амплификацию кДНК в 14 циклах ПЦР с использованием полимеразной смеси Advantage2 (Clontech) и праймера-якоря (5'-AAG CAG TGG TAT CAA CGC AGA GT-3', SEQ ID №38) в общем объеме 200 мкл. Двухцепочечную кДНК очищали с помощью набора для очистки QIAquick PCR (Qiagen).
Кодирующие последовательности вариабельной области тяжелой цепи амплифицировали с эквимолярной смесью одного смыслового праймера (SEQ ID №5), а также четырех антисмысловых праймеров (SEQ ID №№1-4) для конструкции «замок», и одного смыслового праймера (SEQ ID №11) и пяти антисмысловых праймеров (SED ID №№6-10) для конструкции «ключ»; кодирующие последовательности вариабельной области легкой каппа-цепи амплифицировали с эквимолярной смесью семи смысловых праймеров (SEQ ID №№12-18) и эквимолярной смесью одного антисмыслового праймера (SEQ ID №19); а кодирующие последовательности вариабельной области легкой лямбда-цепи амплифицировали с эквимолярной смесью восьми смысловых праймеров (SEQ ID №№20-27) и эквимолярной смесью одного антисмыслового праймера (SEQ ID №28).
Кодирующие области тяжелой цепи «замок» и «ключ», связанные через IRES, могут быть амплифицированы с использованием праймеров SEQ ID №29 и SEQ ID №30.
Пример 12
Обогащение клеток, представляющих специфически связывающиеся антитела, с помощью флуоресцентно активированной сортировки клеток
Субконфлюэнтные (80%) HEK-клетки инфицировали библиотекой полноразмерного антитела или пустым вирусным вектором в качестве отрицательного контроля с множественностью заражения (MOI) 0,2. Через 5 часов клетки отделяли с помощью буфера для клеточной диссоциации (Sigma), промывали и окрашивали. Половину клеток окрашивали антигеном, меченным Alexa 647 nm (4 мкг/мл), в течение 30 мин. Остальные клетки окрашивали антигеном, меченным Alexa 546 nm (4 мкг/мл), и антилентивирусной кроличьей сывороткой (разведенной 1:6000) в течение 30 мин, с последующим окрашиванием Су5-меченным ослиным противокроличьим IgG (1 мкг/мл) (Jackson ImmunoResearch Laboratories) в течение 20 мин. Затем все клетки промывали, фильтровали и окрашивали пропидия йодидом (PI), чтобы исключить мертвые клетки. Сортировку отдельных клеток проводили на проточном цитометре FACS Vantage SE (Becton Dickinson), соответственно, на Alexa 647 nm-положительные, PI-отрицательные и Alexa 546 nm-положительные лентивирус-положительные PI-отрицательные клетки.
Каждую клетку отсортировывали в лунку 24-луночного планшета, содержащего 50% конфлюэнтные фидерные клетки HEK. После распространения вируса (2-3 дня после сортировки) инфицированные клетки проверяли путем FACS-анализа на связывание антигена.
Пример 13
Влияние мембранного якоря на экспрессию биспецифических антител на клеточной поверхности
1⋅105 клеток HEK293A высевали в лунки 24-луночного планшета и инкубировали в течение ночи. На следующий день клетки совместно трансфицировали 0,5 мкг вектора с общей легкой цепью и 0,5 мкг шаттл-вектора V1.1-V1.5, обеспечивающего экспрессию двух разных тяжелых цепей. Тяжелая цепь В в комбинации с общей легкой цепью связывается с антигеном, в то время как тяжелая цепь Η в комбинации с общей легкой цепью не связывается с антигеном.
Двойное окрашивание проводили конъюгатом козлиного противочеловеческого IgG (H+L) с Alexa 488 (Invitrogen кат. № А11013) и биотинилированным антигеном и стрептавидином-РЕ (SA-PE). Анализ FACS выполняли через 48 часов после трансфекции.
Использовали следующие шаттл-веторы:
V1.1: М-В(«ключ»)-IRES-М-В(«замок») (мембранный якорь на обеих связывающих тяжелых цепях)
V1.2: M-B(«ключ»)-IRES-M-N(«замок») (мембранный якорь на обеих тяжелых цепях, связывающей и несвязывающей)
V1.3: M-N(«ключ»)-IRES-B(«замок») (мембранный якорь только на несвязывающей)
V1.4: B(«ключ)4»)-IRES-M-N(«замок») (мембранный якорь только на несвязывающей),
V1.5: M-N(«ключ»)-IRES-M-N(«замок») (только несвязывающая, мембранный якорь на обеих тяжелых цепях),
V1.6 B(«замок»)-IRES-M-N(«ключ») (мембранный якорь на несвязывающей, «ключ» и «замок» поменяны). Трансмембранный якорь на несвязывающей части антитела (N) является достаточным для представления связывающей части В антитела на клеточной поверхности, когда обе тяжелые цепи формируют гетеродимеры с технологией «ключ в замке» (V1.4 на фиг.17), указывая, что один трансмембранный якорь является достаточным для представления на поверхности клетки полноразмерного IgG, состоящего из двух разных тяжелых цепей и общей легкой цепи.