Результат интеллектуальной деятельности: Инъекционная лекарственная форма гидрофильного конъюгата гидроксиэтилкрахмала и 2,6-диизоборнил-4-метилфенола, способ ее получения и применения для лечения сердечно-сосудистых заболеваний
Вид РИД
Изобретение
Изобретение относится к медицине, конкретно к фармакологии, и может быть использовано при создании и применении инъекционных лекарственных форм, обладающих антиоксидантной, гемореологической активностью.
Корригирующая терапия реологических свойств крови должна быть многокомпонентной и направленной на различные звенья патологического процесса, приводящего к повышению вязкости. Препараты, которым свойственна гемореологическая активность (пентоксифиллин, ацетилсалициловая кислота, тиклопедин, танакан), оказывают влияние лишь на отдельные компоненты синдрома повышенной вязкости крови либо недостаточно снижают тяжесть проявления синдрома повышенной вязкости крови (СПВК) в целом [М.Д. Машковский. Лекарственные средства. 15-е изд., М., ООО «Новая волна». 2005. 1200 с.]. Эти препараты относятся к разным фармакологическим группам; а в различных классификациях отсутствует само понятие «гемореологическое средство». Вместе с тем на современном этапе принципиально новые методы фармакотерапии внутрисосудистых нарушений крови связаны с перспективами применения лекарственных средств, способных предотвращать или существенно уменьшать патологические сдвиги гемореологических параметров.
Эффективная терапия ишемических повреждений должна предусматривать и адекватную патогенетически обоснованную профилактику нарушений реологических свойств крови и расстройств микроциркуляции. В этой связи патогенетически обоснованным является применение в острейший период нарушений мозгового кровообращения и при реперфузионном синдроме препаратов, обладающих антиоксидантной и гемореологической активностью. Однако в настоящее время отсутствуют препараты с подобным спектром фармакологической активности и предназначенные для профилактики и лечения реперфузионных осложнений [Федеральное руководство по использованию лекарственных средств (формулярная система). М. 2013. Вып. 14]. Существующий аналог для парентерального введения, улучшающий деформируемость эритроцитов - пентоксифиллин в настоящее время не включен в стандарт специализированной медицинской помощи при инфаркте мозга.
Гидрофильный конъюгат гидроксиэтилкрахмала и 2,6-диизоборнил-4-метилфенола -O-(4-гидрокси-3,5-ди(1,7,7-триметилбицикло[2.2.1]гепт-экзо-2-ил)бензил)окси)этил)-O-(2-гидроксиэтил)-(1→4)-α-D-глюкан (Диборнол-ГЭК) [П.С. Власов, О.Ю. Сергеева, Н.С. Домнина, И.Ю. Чукичева, Е.В. Буравлёв, А.В. Кучин. Химия природных соединений. 2012. №4. С. 481-484; 7; Торлопов М.А., Чукичева И.Ю., Буравлев Е.В., Кучин А.В., П.С. Власов, Сергеева О.Ю., Домнина Н.С. Патент РФ №2497828, опубл. 10.11.2013. Бюл. №31] предложен в качестве средства, улучшающего реологические свойства крови и обладающего антиоксидантной активностью [Плотников М.Б., Алиев О.А., Сидехменова А.В., Кучин А.В., Чукичева И.Ю., Торлопов М.А., Буравлёв Е.В. Патент РФ №2546297. 10.04.2015. Бюл. №10; М.Б. Плотников, О.И. Алиев, А.В. Сидехменова, Е.В. Попова, О.И. Острикова, А.В. Кучин, И.Ю. Чукичева, М.А. Торлопов. Химико-фармацевтический журнал. 2016].
Полного аналога лекарственного средства, разрабатываемого на основе Диборнол-ГЭК, в России и за рубежом нет.
Ближайшими аналогами можно считать мексидол и пентоксифиллин. Мексидол является аналогом по показанию к применению в острый период нарушений мозгового кровообращения, обладает антигипоксическим, стресс-протективным, ноотропным, противосудорожным и анксиолитическим действием, применяется при острых нарушениях мозгового кровообращения, дисциркуляторной энцефалопатии [WO 2013/137778 А1 19.09.2013; патент RU 2398583, опубл. 10.09.2010. Бюл. №25]. Аналогом по гемореологическому действию является пентоксифиллин, который улучшает деформируемость эритроцитов, однако не обладает антиоксидантными свойствами. Недостатками пентоксифиллина, как гемореологического средства, являются: снижение артериального давления, что ухудшает кровоснабжение ишемизированных областей головного мозга и сердца при острых нарушениях кровообращения органов; опасность кровотечения; короткий период полуэлиминации - Т1/2=1 ч. Противопоказаниями к применению пентоксифиллина являются атеросклероз сосудов головного мозга и сердца, инфаркт миокарда и нестабильная стенокардия, аритмии, кровоизлияния в мозг и сетчатку глаза.
Предложенная инъекционная лекарственная форма гидрофильного конъюгата гидроксиэтилкрахмала и 2,6-диизоборнил-4-метилфенола для профилактики и лечения сердечно-сосудистых заболеваний в доступной патентной и научно-технической литературе не описана.
Техническим результатом нового вещества является создание стабильной инъекционной лекарственной формы гидрофильного конъюгата О-(4-гидрокси-3,5-ди(1,7,7-триметилбицикло[2.2.1]гепт-экзо-2-ил)бензил)окси)этил)-О-(2-гидроксиэтил)-(1→4)-α-D-глюкана.
Техническим результатом способа является повышение стабильности инъекционной лекарственной формы с O-(4-гидрокси-3,5-ди(1,7,7-триметилбицикло[2.2.1]гепт-экзо-2-ил)бензил)окси)этил)-O-(2-гидроксиэтил)-(1→4)-α-D-глюканом в течение срока годности.
Технический результат достигается тем, что инъекционная лекарственная форма гидрофильного конъюгата гидроксиэтилкрахмала и 2,6-диизоборнил-4-метилфенола для лечения заболеваний сердечно-сосудистой системы содержит в качестве действующего вещества терапевтически эффективное количество O-(4-гидрокси-3,5-ди(1,7,7-триметилбицикло[2.2.1]гепт-экзо-2-ил)бензил)окси)этил)-O-(2-гидроксиэтил)-(1→4)-α-D-глюкана (Диборнол-ГЭК), в качестве вспомогательных компонентов используют натрия хлорид, Твин 80, аскорбиновую кислоту, воду для инъекций или физиологический раствор, при следующем соотношении компонентов, масс. %:
|
Технический результат способа достигается тем, что субстанцию Диборнол-ГЭК добавляют в водный раствор поверхностно-активного вещества Твин 80 и перемешивают до полного растворения субстанции и получения прозрачного раствора, отгоняют воду при пониженном давлении, к сухому остатку добавляют 0.01-0.2% аскорбиновой кислоты, физиологический раствор (воду для инъекций) и перемешивают, раствор доводят до концентрации 4.5-7.5% по действующему веществу Диборнол-ГЭК физиологическим раствором (водой для инъекций) и центрифугируют, при необходимости осуществляют фильтрацию раствора, полученный лекарственный раствор разливают в стеклянные флаконы или ампулы, которые запаивают и упаковывают.
Полученную лекарственную форму применяют для лечения сердечно-сосудистых заболеваний.
Способ получения инъекционной лекарственной формы Диборнол-ГЭК осуществляется специальным образом.
Для получения лекарственной формы в качестве вспомогательных компонентов используют фармакологически приемлемые вещества такие, как натрия хлорид (ФС 42-0323-4895-03, ФС 42-0474-4119-03), Твин 80, аскорбиновую кислоту (ФС 000575-13, ЛСР-006666/08), вода для инъекций (ФС 42-2620-97), физиологический раствор.
Субстанцию Диборнол-ГЭК добавляют в водный раствор с ПАВ Твин 80 и перемешивают до полного растворения субстанции (до получения прозрачного раствора). После этого воду отгоняют при пониженном давлении при температуре 40-45°С.
По окончании отгонки растворителя к сухому остатку добавляют 0.1% аскорбиновой кислоты, физиологический раствор и перемешивают до полного растворения вспомогательных компонентов. Раствор доводят до концентрации 5% по субстанции Диборнол-ГЭК физиологическим раствором (водой для инъекций) и центрифугируют в течение 30 мин при 4500 об/мин. После центрифугирования проводят двухстадийную фильтрацию раствора через фильтры 0.45 и 0.22 мкм, после измерения необходимых параметров препарат разливают в стеклянные флаконы или ампулы по 20 мл. Упакованный препарат хранят при 2-6°С.
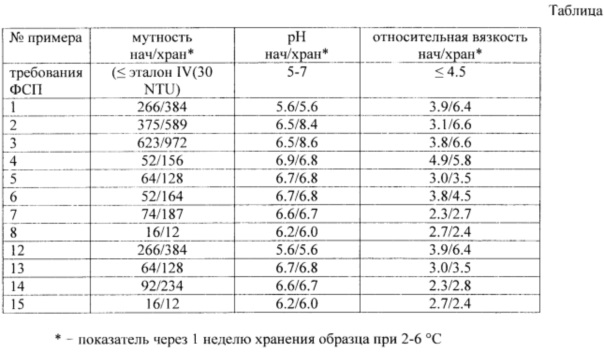
Для определения наиболее оптимального технического решения контролируют следующие параметры: pH раствора (5-7), мутность (≤ эталон IV (30 NTU), относительная вязкость (≤4.5).
Далее представлены примеры получения лекарственных форм О-(4-гидрокси-3,5-ди(1,7,7-триметилбицикло[2.2.1]гепт-экзо-2-ил)бензил)окси)этил)-О-(2-гидроксиэтил)-(1,4)-α-D-глюкана для инъекционного введения.
Пример 1.
Приведена рецептура лекарственной формы, содержащей 4.5% Диборнол-ГЭК в физиологическом растворе.
|
Проведенные исследования по стабильности лекарственной формы показывают, что по мере хранения при температуре, установленной в проекте ФСП (2-6°С), увеличивается мутность раствора, превышая эталон IV.
Пример 2.
Приведена рецептура лекарственной формы, содержащей 5.0% Диборнол-ГЭК в физиологическом растворе.
|
Проведенные исследования по стабильности лекарственной формы показывают, что по мере хранения при температуре, установленной в проекте ФСП, увеличивается мутность раствора, превышая эталон IV.
Пример 3.
Приведена рецептура лекарственной формы, содержащей 7.5% Диборнол-ГЭК в физиологическом растворе.
|
Показатели вязкости и мутности раствора препарата не соответствуют исходным требованиям; проведенные исследования по стабильности лекарственной формы показывают, что по мере хранения при температуре, установленной в проекте ФСП, мутность раствора увеличивается, превышая эталон IV.
Пример 4.
Приведена рецептура с содержанием Твин 80 0.01%.
|
После измерений получены данные по вязкости и мутности раствора препарата, которые не соответствуют исходным требованиям.
Пример 5.
Приведена рецептура с содержанием Твин 80 0.1%.
|
Проведенные исследования по стабильности лекарственной формы показывают, что по мере хранения при температуре, установленной в проекте ФСП, мутность раствора увеличивается, превышая эталон IV.
Пример 6.
Приведена рецептура с содержанием 0.01% Твин 80 и аскорбиновой кислоты 0.01%.
|
Изначально и в процессе хранения мутность раствора не удовлетворяет предъявленным требованиям.
Пример 7.
Приведена рецептура с содержанием 0.01% Твин 80 и аскорбиновой кислоты 0.1%.
|
Изначально и в процессе хранения мутность раствора не удовлетворяет предъявленным требованиям.
Пример 8.
Приведена рецептура с содержанием 0.1% Твин 80 и аскорбиновой кислоты 0.1%.
|
Показатели вязкости и мутности инъекционной лекарственной формы соответствуют исходным требованиям. Проведенные исследования по стабильности лекарственной формы показывают, что по мере хранения при температуре, установленной в проекте ФСП, все параметры инъекционной лекарственной формы соответствуют исходным требованиям.
Пример 9.
Приведена рецептура с содержанием Диборнол-ГЭК 7.5%.
|
Субстанция полностью растворяется, однако раствор препарата опалесцирует. В процессе хранения мутность раствора не удовлетворяет предъявленным требованиям.
Пример 10.
Приведены оптимальные соотношения и наиболее предпочтительные виды компонентов, масс. %:
|
Показатели вязкости и мутности инъекционной лекарственной формы соответствуют исходным требованиям. Проведенные исследования по стабильности лекарственной формы показывают, что по мере хранения при температуре, установленной в проекте ФСП, все параметры инъекционной лекарственной формы соответствуют исходным требованиям.
Пример 11.
Приведена рецептура с максимальным содержанием наиболее предпочтительных компонентов, масс. %:
|
Показатели вязкости и мутности инъекционной лекарственной формы соответствуют исходным требованиям. Проведенные исследования по стабильности лекарственной формы показывают, что по мере хранения при температуре, установленной в проекте ФСП, все параметры инъекционной лекарственной формы соответствуют исходным требованиям.
Пример 12.
В реактор загружают физиологический раствор в объеме, составляющем 80% от рассчитанного объема препарата, а затем осуществляют загрузку субстанции Диборнол-ГЭК воду и выдерживают на водяной бане при температуре 45-50°С в течение 4.5-5 часов. По истечении указанного времени основная часть субстанции растворяется, дальнейшее растворение проводят с использованием верхнеприводной лопастной мешалки в течение 2 часов при низкой скорости вращения и температуре 45-50°С. Добавляют оставшиеся 20% физиологического раствора, субстанция полностью растворяется, однако раствор препарата опалесцирует (мутный).
Полученные результаты свидетельствуют о том, что данный способ получения инъекционной лекарственной формы не подходит для дальнейшего использования, так как изначально и в процессе хранения показатели мутности раствора не удовлетворяют предъявленным требованиям.
Пример 13.
К навеске субстанции Диборнол-ГЭК добавляют воду для инъекций и выдерживают на водяной бане при температуре 45-50°С в течение 1-2 часов. По истечении указанного времени основная часть субстанции растворяется, и в емкость добавляют Твин 80. Дальнейшее растворение проводят с использованием верхнеприводной лопастной мешалки в течение 2 ч при скорости вращения 170-200 об/мин и температуре 45-50°С. Добавляют воду до прозрачного раствора.
Полученный раствор порционно упаривают на роторном испарителе. Полуфабрикат растворяют в физиологическом растворе, доводят объем до необходимой концентрации. Уровень pH до 6.7 доводят 5%-ным раствором NaOH, проводят фильтрацию раствора. После измерения необходимых параметров разливают в стеклянные флаконы по 20 мл. Начальное значение мутности составило 64 NTU, после хранения при температуре 5°С в течение недели показатель мутности составил 128 NTU.
Полученные результаты свидетельствуют о том, что данный способ получения инъекционной лекарственной формы не подходит для дальнейшего использования, так как изначально и в процессе хранения показатели мутности раствора не удовлетворяют предъявленным требованиям.
Пример 14.
Навеску субстанции Диборнол-ГЭК и этиловый спирт (96%) перемешивают в течение 1 часа, после чего добавляют 0.1% Твин 80. Проводят отгонку спирта при пониженном давлении до получения стекловидной пленки на внутренней поверхности колбы. Добавляют 0.1% аскорбиновой кислоты и физиологический раствор и проводят растворение с помощью верхнеприводной мешалки при температуре 40°С в течение 1-2 часов. Доводят объем полученной суспензии до необходимой концентрации физиологическим раствором. Центрифугируют раствор субстанции в течение 30 минут при скорости вращения 4000 об/мин. После центрифугирования проводят фильтрацию раствора, после измерения необходимых параметров разливают в стеклянные флаконы по 20 мл. Начальное значение мутности составило 92 NTU, после хранения при 5°С в течение недели показатель мутности составил 234 NTU.
Полученные результаты свидетельствуют о том, что данный способ получения инъекционной лекарственной формы не подходит для дальнейшего использования, так как изначально и в процессе хранения показатели мутности раствора не удовлетворяют предъявленным требованиям.
Пример 15.
Субстанцию Диборнол-ГЭК добавляют в водный раствор с ПАВ Твин 80 и перемешивают до полного растворения субстанции (до получения прозрачного раствора). После этого отгоняют растворитель и к сухому остатку добавляют 0.1% аскорбиновой кислоты, физиологический раствор и перемешивают до полного растворения вспомогательных компонентов. Раствор доводят до концентрации 5% по субстанции Диборнол-ГЭК физиологическим раствором и центрифугируют в течение 30 мин при 4500 об/мин. После центрифугирования проводят фильтрацию раствора, после измерения необходимых параметров разливают в стеклянные флаконы по 20 мл.
Мутность составила 16 NTU и 12 NTU при 25°С и при 2-6°С, соответственно, т.е. на уровне II-III эталонов.
Данная технология получения препарата взята за основу, так как изначально и в процессе хранения все параметры препарата удовлетворяют предъявленным требованиям.
В таблице приведено сравнение результатов исследований с требованиями ФСП.
Таким образом, разработана стабильная инъекционная лекарственная форма гидрофильного конъюгата гидроксиэтилкрахмала и 2,6-диизоборнил-4-метилфенола, которая может быть использована для лечения заболеваний сердечно-сосудистой системы.

