Результат интеллектуальной деятельности: Способ оценки эффективности фаготерапии при лечении инфекционных заболеваний
Вид РИД
Изобретение
Изобретение относится к медицине, а именно к хирургии, медицинской токсикологии, микробиологии, биологии.
В современной медицине резкий рост антибиотикорезистентности и прогрессирование инфекционных заболеваний населения, которые приводят к высокой инвалидизации, росту заболеваемости, смертности и экономическим затратам на лечение вызвал интерес к перспективам использования бактериофагов. Бактериофаги относят к иммунобиологическим препаратам. Их выпускают в жидком виде, в виде таблеток и спреев, а применяют аппликационно, введением в полости, ректально и перорально. Возможные области применения бактериофагов в медицинской отрасли более чем обширны. В настоящее время актуальной проблемой в медицине является оценка эффективности лечения бактериофагами.
Известен способ оценки эффективности применения биологических препаратов (пробиотики и бактериофаги) при лечении коров с острым течением эндометрита (Г.И. Григорьева, И.В. Гордеева, М.А. Кульчицкая, Т.А. Аникина «Эффективность применения биологических препаратов (пробиотики и бактериофаги) при лечении коров с острым течением эндометрита», журнал «Ветеринарная патология», 2006 - 1. Стр. 52-56). http://cyberleninka.ru/article/n/effektivnost-primeneniya-biologicheskih-preparatov-probiotiki-i-bakteriofagi-pri-lechenii-korov-s-ostrym-techeniem-endometrita. Способ заключается в том, что были использованы 24 дойных коровы, из которых 10 были клинически здоровыми (контрольная группа), а 14 имели клинические признаки острого эндометрита (опытная группа). Терапевтическую и профилактическую эффективность сочетанного применения препаратов пробиотиков и бактериофагов изучили на двух животных с острым течением эндометрита. Для оценки микробиологического эффекта - элиминации патогенных возбудителей и восстановления нормофлоры в маточно-цервикальном биотопе - микробиологическим исследованиям подвергали образцы маточно-цервикальной слизи. Установили, что до лечения микробиоценоз полости матки у опытных животных был представлен в основном патогенными бактериями. В сравнении с данными, полученными при исследовании образцов до начала лечения, установили, что после проведенного лечения состав маточно-цервикальной микрофлоры претерпел существенные изменения, так полностью отсутствовала патогенная микрофлора.
Недостатки данного способа заключаются в том, что оценка эффективности действия бактериофагов осуществляется опосредованно, путем оценки количества микроорганизмов в биоптатах, что не позволяет осуществить ни качественного, ни количественного контроля присутствия бактериофагов. Оценка эффективности действия бактериофагов проводилась между бактериофагами и традиционными способами лечения и их сочетанием. В силу известных из уровня техники свойств бактериофагов это приводит к неоднозначной трактовке полученных результатов и тем самым снижает оценку эффективности фаготерапии.
Известен способ оценки специфической активности бактериофагов (патент РФ №2296163, 2005), в стандартных условиях монослоя культуры клеток эмбриона человека проводят совместное культивирование в течение 2 ч тест-штамма микроорганизма с соответствующим лечебным бактериофагом или комбинированным (поливалентным) бактериофагом, в состав которого входит соответствующий используемой тест-культуре микроорганизма фаг, а результат оценивают по степени снижения адгезии тест-штамма микроорганизма по сравнению с контролем.
Недостатки данного способа заключаются в том, что используются эмбриональные клетки человека (что влечет этические и юридические сложности для выполнения способа). Данный способ представляет собой условный модельный аналог теста лизирования микроорганизма бактериофагом, как следствие, выполняется косвенная оценка эффективности фаготерапии.
Известен способ определения чувствительности микроорганизмов к жидкому комбинированному бактериофагу (патент РФ №2306563, 2006), принятый за прототип, путем взаимодействия раневой микрофлоры на питательной среде с жидким комбинированным бактериофагом, инкубации смеси и учета результатов по отсутствию роста бактерий, в качестве исследуемого материала берут цельное раневое отделяемое, разбавляют физиологическим раствором, гомогенизируют и центрифугируют для осаждения крупных частиц раневого детрита, после чего определяют чувствительность полученного супернатанта к жидкому комбинированному бактериофагу в течение 18-24 ч.
Недостатки данного способа заключаются в том, что отсутствует возможность отслеживать концентрацию бактериофагов в условиях in vitro (то есть до введения пациенту препарата), и в условиях in vivo (то есть после введения препарата бактериофагов пациенту), что приводит к снижению качества процесса лечения, возникновению рецидива инфекции, поскольку указанный способ представляет собой фактически косвенную оценку эффективности фаготерапии. Определение литической активности бактериофагов в условиях in vitro является, по сути, аналогом теста лизирования микроорганизмов бактериофагами в условиях in vivo. В данном способе не производят качественную оценку бактериофагов не только в условиях in vitro, но и в образце пациента, то есть в условиях in vivo после проведения фаготерапии. Помимо этого, указанный способ не предусматривает идентификацию этиологически значимого возбудителя раневого инфекционного процесса, что не позволяет сразу произвести подбор этиотропного штамма бактериофага. В данном способе при подготовке посевного материала существует высокая вероятность контаминации супернатанта другими микроорганизмами. Что также ведет к неверной интерпретации результатов при выборе препарата для фаготерапии.
Техническим результатом предлагаемого изобретения является создание способа, свободного от вышеуказанных недостатков.
Указанный технический результат достигается тем, что способ оценки эффективности фаготерапии при лечении инфекционных заболеваний, включающий забор исследуемого биологического материала, введение раствора коммерческого бактериофага в исследуемый биологический материал и определение эффективности взаимодействия коммерческого бактериофага с патогенными микроорганизмами в исследуемом биологическом материале, перед проведением хирургического вмешательства осуществляют идентификацию патогенных микроорганизмов в области планируемого хирургического вмешательства, определяют концентрацию (титр) бактериофага к патогенным микроорганизмам в исследуемом биологическом материале, вводят первую дозу раствора коммерческого бактериофага сразу после выполнения хирургического вмешательства, через 18-24 часов после введения первой дозы раствора коммерческого бактериофага производят забор исследуемого биологического материала и определяют концентрацию (титр) бактериофага в исследуемом биологическом материале, при установлении титра не менее 106 БОЕ/мл делают вывод об эффективном воздействии раствора коммерческого бактериофага на целевой патогенный микроорганизм, через 18-24 часов после введения первой дозы раствора коммерческого бактериофага вводят вторую дозу раствора коммерческого бактериофага, через 18-24 часов после введения второй дозы раствора коммерческого бактериофага вводят третью дозу раствора коммерческого бактериофага, на 4-5 сутки после хирургического вмешательства выполняют забор исследуемого биологического материала и производят оценку эффективности путем сравнения бактериофага, содержащегося в исследуемом биологическом материале с раствором коммерческого бактериофага, при установлении тождественности по литической активности не менее первых двух десятикратных разведений раствора коммерческого бактериофага, используемого для лечения пациента с бактериофагом, находящимся в исследуемом биологическом материале от пациента, делают вывод об эффективности фаготерапии и продолжают вводить раствор коммерческого бактериофага до полной элиминации патогенных микроорганизмов.
Вариант осуществления изобретения
1 этап - забор биологического материала и идентификация патогенных микроорганизмов
Производят забор биологического материала, например (пунктата, раневого отделяемого) от пациента объемом от 0,5 до 5,0 мл, и помещают во флакон, например «ВасТ/ALERT PF PLUS», с жидкой питательной средой, затем флакон, например «ВасТ/ALERT PF PLUS», загружают в бактериологический анализатор, например «ВасТ/ALERT 3D», и выращивают патогенные микроорганизмы до получения сигнала на бактериологическом анализаторе, например «ВасТ/ALERT 3D», о росте патогенного микроорганизма. Далее флакон, например «ВасТ/ALERT PF PLUS», достают из бактериологического анализатора, например «ВасТ/ALERT 3D», и с помощью изделий медицинского назначения, например шприца или модуля для посева, извлекают от 0,048 мл до 0,051 мл содержимого и делают высев каплями на специально подобранные питательные среды, например кровяной агар (Blood Agar Base), агар Сабуро и "шоколадный" агар (агар с гретой кровью), в чашках Петри. Капли растирают микробиологической петлей, используя метод истощающего штриха, для получения изолированных колоний. Питательные среды, например кровяной агар (Blood Agar Base), агар Сабуро и "шоколадный" агар (агар с гретой кровью) с посевами, инкубируют в термостате в течение 18-24 часов при температуре 35±2°С. Затем чашки Петри извлекают из термостата и просматривают под искусственным освещением на наличие видимого роста патогенных микроорганизмов. Далее проводят микроскопию патогенных микроорганизмов с помощью окраски по Грамму, идентифицируют выросшие патогенные микроорганизмы на анализаторе, например «VITEK 2 СОМРАСТ», или с помощью идентификационных карт, например API-стрипов, общепринятыми методами.
2 этап - определение концентрации жидких коммерческих бактериофагов к патогенным бактериям, выделенным от пациента.
Для определения концентрации (титра) бактериофагов используют метод агаровых слоев. Первоначально готовят десятикратные разведения анализируемого жидкого коммерческого препарата, содержащего бактериофаги, например секстафаг, пиобактериофаг, интести-бактериофаг, стафилококковый, стрептококковый, клебсифаг, бактериофаг протейный и другие жидкие коммерческие препараты в зависимости от выделенного вида микроорганизма из пациента. С этой целью готовят суспензию патогенных микроорганизмов в 0,85%-ном растворе хлорида натрия плотностью от 0,3 до 0,6 у.е. стандарта мутности по McFarland. Пробу бактериофагов в объеме 0,1 мл соответствующего разведения смешивают с 0,1 мл суспензии патогенных микроорганизмов. Полученную суспензию вносят в 10 мл расплавленного до 42°С 0,7%-ного агара и после быстрого перемешивания выливают на поверхность питательной среды с агаром, например 1,5%-ного мясо-пептонного агара, например Мюллер-Хинтон агар либо любая другая, пригодная для культивирования микроорганизмов среда в чашки Петри. После застывания верхнего слоя в течение 5-10 минут при температуре 21-23°С чашку Петри переворачивают и инкубируют в термостате при 35±2°С в течение 16-18 часов Для определения концентрации фаговых частиц в жидком коммерческом бактериофаге подсчитывают количество негативных колоний (прозрачные пятна на матовом фоне глубинного роста бактерий) на каждой чашке Петри. Количество фаговых частиц рассчитывают по формуле:
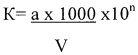 ,
,
где К - количество фаговых частиц в 1 мл препарата;
а - количество негативных колоний на чашке;
V - объем высеваемой пробы, на 1 мл;
10n - порядковый номер разведения препарата, по которому производится расчет фаговых частиц.
Результат интерпретируют следующим образом: достижение коммерческим бактериофагом концентрации (титра) не менее 106 БОЕ/мл (бляшкообразующие единицы на миллилитр) свидетельствует об эффективном воздействии раствора коммерческого бактериофага на целевой патогенный штамм микроорганизма(ов), тем самым подтверждает терапевтическую эффективность.
3 этап - применение коммерческих бактериофагов в условиях in vivo с последующим определением их литической активности
Пациентам проводят хирургическое лечение в объеме, соответствующем степени тяжести поражения и общему соматическому состоянию пациента. После завершения хирургического вмешательства и ушивания раны в дренажную трубку вводят первую дозу раствора коммерческого бактериофага, подобранного по результатам бактериологического исследования на 1- и 2-м этапах, в объеме до 6 мл. Через определенный интервал времени от 18 до 24 часов после введения первой дозы раствора коммерческого бактериофага производят забор из дренажной трубки биологического материала, например раневого отделяемого, в объеме от 5 до 10 мл. Биологический материал, например раневое отделяемое, помещают в изделие медицинского назначения, например в одноразовый стерильный полистирольный пластиковый контейнер, после чего охлаждают и отстаивают при комнатной температуре в течение 50-60 минут. Затем производят подсчет титра бактериофага в биологическом материале, например раневом отделяемом, с использованием метода двухслойного агара, как это описано на 2-м этапе. После определения титра бактериофага и подтверждения наличия эффективного титра бактериофага в биологическом материале, например раневом отделяемом, в дренажную трубку через определенный интервал времени от 18 до 24 часов после введения первой дозы раствора коммерческого бактериофага вводят вторую дозу раствора коммерческого бактериофага объемом до 6 мл. Третью дозу раствора коммерческого бактериофага объемом до 6 мл вводят также через определенный интервал времени от 18 до 24 часов на третьи сутки. На 4-5 сутки послеоперационного периода у пациента вновь производят забор из дренажной трубки биологического материала, например раневого отделяемого в объеме от 5 до 10 мл. Забор биологического материала, например раневого отделяемого и его пробоподготовку осуществляют аналогично тому, как описано выше. Далее используют методику Аппельмана. Способ осуществляется следующим образом. В первом изделии медицинского назначения, например стерильный 12-луночный планшет (Eppendorf «Cell Culture Plate»), осуществляют анализ наличия литической активности биологического материала, например раневого отделяемого, содержащего бактериофаги, к выделенному ранее патогенному микроорганизму, полученному при исследовании на 1- и 2-м этапах. Для этого в каждые двенадцать лунок первого планшета, например стерильный 12-луночный планшет (Eppendorf «Cell Culture Plate») наливают жидкую питательную среду, например LB бульон (Luria-Bertani), бульон с сердечно-мозговой вытяжкой для культивирования требовательных патогенных микроорганизмов (Brain Heart Broth) в объеме 4,5 мл. Затем в первую и одиннадцатую лунки планшета (Eppendorf «Cell Culture Plate») с помощью стерильных одноразовых пластиковых микропипеток вносят исследуемый биологический материал, например раневое отделяемое, в объеме 0,5 мл и тщательно перемешивают в обеих лунках. Содержимое первой лунки в объеме 0,5 мл переносят с помощью стерильной пластиковой микропипетки во вторую лунку и снова тщательно перемешивают. Из второй лунки содержимое в количестве 0,5 мл переносят в третью лунку с последующим перемешиванием и так далее перенос объема в 0,5 мл осуществляют до 10-ой лунки включительно. При этом одиннадцатая лунка планшета служит контролем стерильности исследуемого биологического материала, например раневого отделяемого, содержащего бактериофаги. Одновременно во втором стерильном 12-луночном планшете (Eppendorf «Cell Culture Plate») исследуют бактериальную активность жидкого коммерческого раствора бактериофага к ранее выделенному патогенному микроорганизму, полученному при исследовании на 1- и 2-м этапах от пациента. Для этого на втором планшете (Eppendorf «Cell Culture Plate»), так же как и в первом, в каждую лунку планшета (Eppendorf «Cell Culture Plate») наливают жидкую питательную среду, например LB бульон (Luria-Bertani), бульон с сердечно-мозговой вытяжкой для культивирования требовательных патогенных микроорганизмов (Brain Heart Broth) в объеме 4,5 мл. Затем в первую и в одиннадцатую лунки в объеме 0,5 мл вносят раствор того коммерческого бактериофага, который ранее был назначен для применения у пациента. Содержимое первой лунки в объеме 0,5 мл переносят с помощью стерильной пластиковой микропипетки во вторую лунку и снова тщательно перемешивают. Из второй лунки содержимое в объеме 0,5 мл переносят в третью лунку с последующим перемешиванием и так далее перенос объема в количестве 0,5 мл осуществляют до 10-й лунки включительно. При этом одиннадцатая лунка является контролем стерильности раствора коммерческого бактериофага. Далее готовят суспензию патогенных микроорганизмов, выделенных на 1-м этапе от пациента, например с помощью стерильного ватного тампона собирают несколько колоний исследуемого патогенного микроорганизма, предварительно выращенного на плотной питательной среде, например агар с добавлением 5% крови, в течение 18-24 часов при температуре 35±2°С, и переносят в стерильный изотонический раствор хлорида натрия, доводят до плотности 0,5 у.е. по стандарту мутности McFarland с помощью автоматического денситометра, например «DENSICHEK», путем добавления стерильного изотонического раствора. Подготовленную суспензию патогенных микроорганизмов, выделенных от пациента, вносят в объеме 0,1-0,2 мл в каждую лунку обоих планшетов, например (Eppendorf «Cell Culture Plate»), кроме одиннадцатой лунки. При этом двенадцатая лунка в обоих планшетах предназначена для контроля роста патогенных микроорганизмов в питательной среде. Оба планшета, например (Eppendorf «Cell Culture Plate»), слегка встряхивают и помещают в термостат для инкубации при температуре 35±2°С в течение 18-24 часов. Через сутки производят визуальную оценку результатов. При учете результатов опыта планшет, например (Eppendorf «Cell Culture Plate»), следует встряхнуть, так как литическая активность выражается максимальным разведением бактериофага, при котором произошел полный лизис исследуемой культуры патогенного штамма.
Трактовка результата исследования на первом планшете, например (Eppendorf «Cell Culture Plate»): в одиннадцатой лунке наблюдается отсутствие помутнения (наличие прозрачной среды), тем самым подтверждается отсутствие роста патогенных микроорганизмов в биологическом материале, например раневом отделяемом, и наличие литической активности бактериофагов в биологическом материале, например раневом отделяемом. В двенадцатой лунке отмечается помутнение среды, это свидетельствует о росте патогенных микроорганизмов в питательной среде.
Трактовка результата исследования на втором планшете, например (Eppendorf «Cell Culture Plate»): в одиннадцатой лунке наблюдается отсутствие помутнения (наличие прозрачной среды), это подтверждает литическую активность коммерческого бактериофага на ранее выделенные патогенные микроорганизмы от пациента. В двенадцатой лунке отмечается помутнение среды, это свидетельствует о росте патогенных микроорганизмов в питательной среде.
Таким образом, в результате сравнения количества лунок с первой по десятую, имеющих прозрачную среду, на первом и втором планшете, например (Eppendorf «Cell Culture Plate»), в условиях in vitro определили тождественность коммерческого бактериофага, используемого при лечении пациента с бактериофагом, находящегося в биологическом материале, например раневом отделяемом, и в успешном проведении эффективной фаготерапии. А по степени разведения (от 1- к 10-й лунке) имеется возможность суждения чувствительности к бактериофагу выделенных микроорганизмов. Далее продолжают вводить раствор коммерческого бактериофага в объеме до 6 мл через определенный интервал времени от 18 до 24 часов до 10 суток. На десятые сутки производят забор из дренажной трубки биологического материала, например раневого отделяемого, в объеме от 5 до 10 мл для установления элиминации патогенного микроорганизма в соответствии с 1-м этапом.
Пример клинического применения
Пациентка К., 67 лет, в 2015 г. была госпитализирована в отделение эндопротезирования ННИИТО с диагнозом: асептическая нестабильность эндопротеза правого тазобедренного сустава. В ходе обследования было выявлено увеличение маркеров системного воспаления (СОЭ, СРБ), что послужило показанием для проведения пункции области эндопротеза правого тазобедренного сустава. На основании этого производят забор биологического материала (пунктата) объемом до 3,0 мл и выполняют 1-й этап в соответствии с предложенным способом. Визуальный осмотр колоний патогенных микроорганизмов на питательной среде выявил их морфологическую однородность. Было установлено, что патогенным микроорганизмом является Staphylococcus epidermidis. После проведения оценки антибиотикочувствительности диско-диффузионным методом выявили, что данный микроорганизм устойчив к оксациллину и считается метициллинрезистентным штаммом Staphylococcus epidermidis (MRSE). Далее определяют концентрацию (титр) жидкого коммерческого стафилококкового бактериофага для патогенного штамма Staphylococcus epidermidis (MRSE), предусмотренного для 2-го этапа в соответствии с предложенным способом. Производят подсчет негативных колоний коммерческого стафилококкового бактериофага на газоне исследуемой бактериальной культуры. Подсчет показал, что титр жидкого коммерческого стафилококкового бактериофага составил 1,5×106 БОЕ/мл, что свидетельствует о хорошей чувствительности Staphylococcus epidermidis (MRSE) к данному коммерческому раствору бактериофага. На основании анамнеза, жалоб и данных обследования пациентке был выставлен уточненный диагноз: Гематогенная парапротезная инфекция эндопротеза правого тазобедренного сустава. Тотальная инфицированная нестабильность эндопротеза правого тазобедренного сустава. Нарушение функции сустава 2-й степени. Синдром правосторонней коксалгии. По результатам бактериологического исследования на 1- и 2-м этапах, в ходе которых был выявлен патогенный штамм Staphylococcus epidermidis (MRSE) в образцах биологического материала (пунктата) от пациентки и отражена его чувствительность к раствору коммерческого стафилококкового бактериофага, пациентке проводят хирургическое лечение в следующем объеме: удаляют эндопротез, санируют рану и устанавливают спейсер тазобедренного сустава с использованием бедренного и ацетабулярного компонентов стандартного эндопротеза тазобедренного сустава для цементной фиксации. Операцию завершают дренированием раны, дренаж был установлен субфасциально к шейке бедренного компонента и выведен через отдельный прокол на боковой поверхности бедра. Рану послойно ушивают с применением внутрикожных швов. После завершения операции в дренажную трубку вводят первую дозу раствора коммерческого стафилококкового бактериофага объемом до 6 мл, определенного по результатам бактериологического исследования на 1- и 2-й этапах. Через определенный интервал времени от 18 до 24 часов после введения первой дозы раствора коммерческого стафилококкового бактериофага производят забор из дренажной трубки раневого отделяемого в объеме от 5 до 10 мл и выполняют 2-й этап предложенного способа. После определения титра стафилококкового бактериофага и подтверждения наличия эффективного титра стафилококкового бактериофага в раневом отделяемом в дренажную трубку через определенный интервал времени от 18 до 24 часов после введения первой дозы раствора коммерческого стафилококкового бактериофага вводят вторую дозу раствора коммерческого стафилококкового бактериофага объемом до 6 мл. Третью дозу объемом до 6 мл раствора коммерческого стафилококкового бактериофага вводят также через определенный интервал времени от 18 до 24 часов на третьи сутки. На четвертые сутки послеоперационного периода у пациентки вновь производят забор из дренажной трубки раневого отделяемого в объеме от 5 до 10 мл. Забор раневого отделяемого и его пробоподготовку осуществляют аналогично тому, как описано в 3-м этапе. В результате на первом планшете в одиннадцатой лунке отсутствует помутнение (наличие прозрачной среды), и тем самым подтверждено отсутствие роста патогенного штамма Staphylococcus epidermidis (MRSE) в раневом отделяемом. В двенадцатой лунке отмечено помутнение жидкости, что свидетельствует о росте патогенного штамма Staphylococcus epidermidis (MRSE) в бульоне с сердечно-мозговой вытяжкой. В лунках с первой по пятую видимое помутнение отсутствует, что говорит о наличии активности бактериофагов в раневом отделяемом до пятикратного разведения. На втором планшете в одиннадцатой лунке помутнение отсутствует (наличие прозрачной среды), что говорит о литической активности коммерческого стафилококкового бактериофага. В двенадцатой лунке присутствует помутнение жидкости, что свидетельствует о росте патогенного штамма Staphylococcus epidermidis (MRSE) в бульоне с сердечно-мозговой вытяжкой. В лунках с первой по седьмую на втором планшете видимое помутнение отсутствует, что говорит о том, что коммерческий стафилококковый бактериофаг действует на ранее выделенный в биологическом материале пациента (пунктата) патогенного штамма Staphylococcus epidermidis (MRSE). В результате сравнения планшетных лунок с первой по десятую на каждом планшете было установлено, что литическая активность коммерческого стафилококкового бактериофага, использованного при лечении пациента и стафилококкового бактериофага, находившегося в раневом отделяемом, различались на два разведения, т.е. были тождественны (in vitro), что подтверждает высокую литическую активность стафилококкового бактериофага в раневом отделяемом и говорит об эффективности фаговой терапии. Данные литической активности и концентрации бактериофагов до и после лечения представлены в таблице 1.

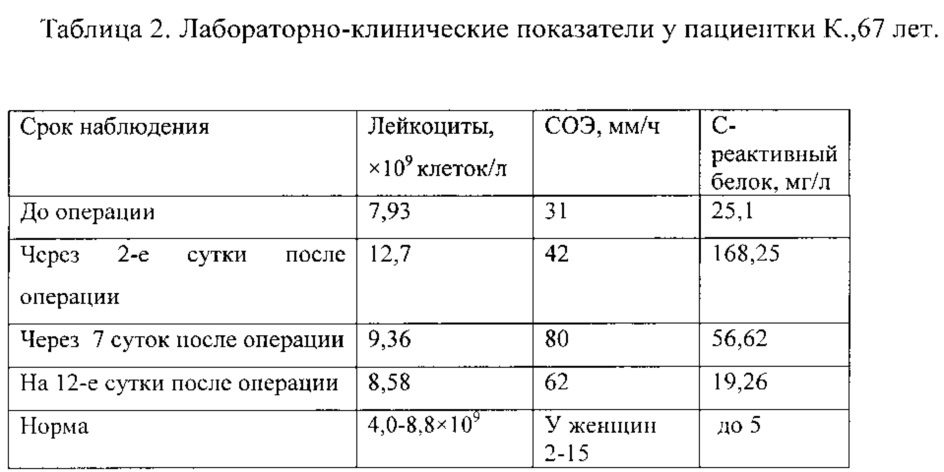
Из представленных в таблице 1 результатов следует, что через сутки после введения раствора коммерческого стафилококкового бактериофага в раневом отделяемом произошло нарастание концентрации бактериофага за счет массового лизиса большого количества патогенного штамма Staphylococcus epidermidis (MRSE). Увеличение титра стафилококкового бактериофага в раневом отделяемом свидетельствует о том, что бактерии в ране являются биодоступными для бактериофагов (способны производить потомство в условиях in vivo). После трехразового введения раствора коммерческого стафилококкового бактериофага титр бактериофага и его литическая активность на четвертые сутки понизились, но оставались достаточно высокими, что говорит о наличии патогенного штамма Staphylococcus epidermidis (MRSE) в ране, поэтому для полной элиминации микроорганизмов в ране в срок с 6- по 10-е сутки продолжают вводить этот же раствор коммерческого стафилококкового бактериофага через дренажную трубку. На десятые сутки производят забор из дренажной трубки раневого отделяемого в объеме от 5 до 10 мл. Микробиологический анализ раневого отделяемого на 10-е сутки проводят в соответствии с 1-м этапом, описанным в предложенном способе. Выполнение бактериологического посева раневого отделяемого показало отсутствие патогенного штамма Staphylococcus epidermidis (MRSE) в ране и последующей элиминации самих коммерческих стафилококковых бактериофагов из раны в отсутствие субстрата для размножения, т.е. Staphylococcus epidermidis (MRSE). После чего на 10-е сутки после введения раствора коммерческого стафилококкового бактериофага объемом до 6 мл дренажная система была удалена. Таким образом, было подтверждено, что коммерческий бактериофаг размножается и лизирует бактерии в ране (in vivo) подобно тому как размножается и лизирует бактериофаг на патогенном микроорганизме, выделенном из образца биологического материала от пациента в условиях (in vitro). Проведенный в ходе лечения пациента контроль лабораторных параметров содержания маркеров воспаления в сыворотке крови, а также контроль количества лейкоцитов и температуры тела пациента показал следующее: в послеоперационном периоде температура первые трое суток была субфебрильной. Одновременно отмечали постепенное уменьшение содержания маркеров острого воспаления, проявлявшегося в виде снижения величин СОЭ и С-реактивного белка, представленных в таблице 2. Рана зажила первичным натяжением. На 15-е сутки после операции пациентка была выписана на амбулаторное лечение в удовлетворительном состоянии.
Преимущество предложенного способа по сравнению с существующими заключается в том, что данный способ позволяет осуществлять качественный и количественный контроль присутствия бактериофагов, что приводит к более точной трактовке полученных результатов. Способ позволяет отслеживать концентрацию бактериофагов в условиях in vitro (то есть до введения пациенту препарата), и в условиях in vivo (то есть после введения препарата бактериофагов пациенту). Способ предусматривает идентификацию этиологически значимого возбудителя инфекционного процесса до проведения хирургического вмешательства, что позволяет сразу произвести подбор этиотропного штамма бактериофага. При подготовке посевного материала очень низка вероятность контаминации супернатанта другими микроорганизмами. Позволяет оценить эффективность фаготерапии в процессе ее проведения за счет измерения количества бактериофагов в биологическом материале пациента и сравнения полученной величины с величиной содержания бактериофагов в коммерческом растворе, это позволяет установить активность бактериофага в ране и тем самым повысить оценку эффективности фаготерапии. Как следствие, повышается качество процесса лечения, уменьшается риск возникновения рецидива инфекции.
Способ оценки эффективности фаготерапии при лечении инфекционных заболеваний реализуется на современном оборудовании, с использованием современных технологий и материалов.
Способ оценки эффективности фаготерапии при лечении инфекционных заболеваний, включающий забор исследуемого биологического материала, введение раствора коммерческого бактериофага в исследуемый биологический материал и определение эффективности взаимодействия коммерческого бактериофага с патогенными микроорганизмами в исследуемом биологическом материале, отличающийся тем, что перед проведением хирургического вмешательства осуществляют идентификацию патогенных микроорганизмов в области планируемого хирургического вмешательства, определяют концентрацию (титр) бактериофага к патогенным микроорганизмам в исследуемом биологическом материале, вводят первую дозу раствора коммерческого бактериофага сразу после выполнения хирургического вмешательства, через 18-24 часов после введения первой дозы раствора коммерческого бактериофага производят забор исследуемого биологического материала и определяют концентрацию (титр) бактериофага в исследуемом биологическом материале, при установлении титра не менее 10 БОЕ/мл делают вывод об эффективном воздействии раствора коммерческого бактериофага на целевой патогенный микроорганизм, через 18-24 часов после введения первой дозы раствора коммерческого бактериофага вводят вторую дозу раствора коммерческого бактериофага, через 18-24 часов после введения второй дозы раствора коммерческого бактериофага вводят третью дозу раствора коммерческого бактериофага, на 4-5 сутки после хирургического вмешательства выполняют забор исследуемого биологического материала и производят оценку эффективности путем сравнения бактериофага, содержащегося в исследуемом биологическом материале с раствором коммерческого бактериофага, при установлении тождественности литической активности не менее первых двух десятикратных разведений раствора коммерческого бактериофага, используемого для лечения пациента с бактериофагом, находящимся в исследуемом биологическом материале от пациента, делают вывод об эффективности фаготерапии и продолжают вводить раствор коммерческого бактериофага до полной элиминации патогенных микроорганизмов.
