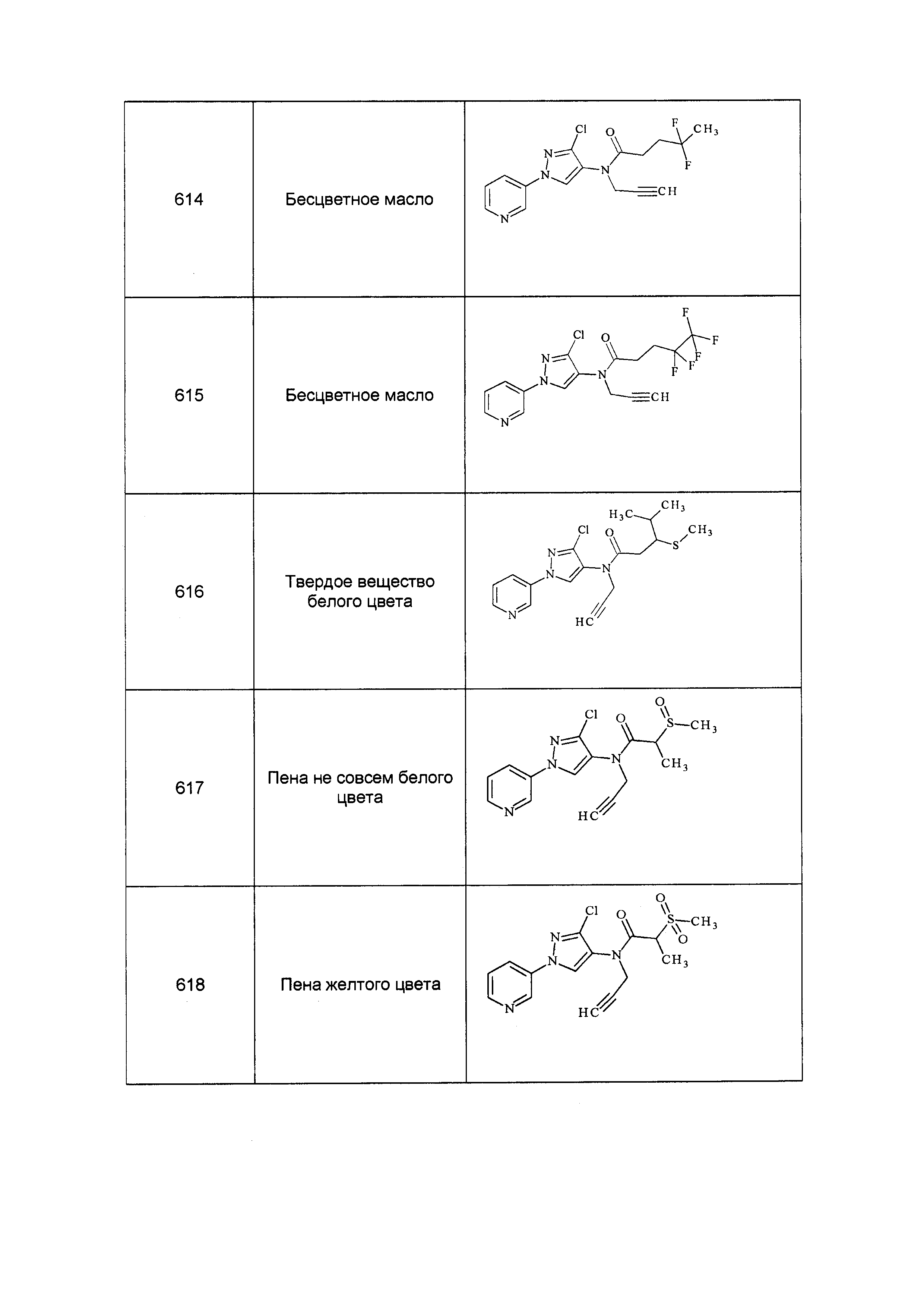
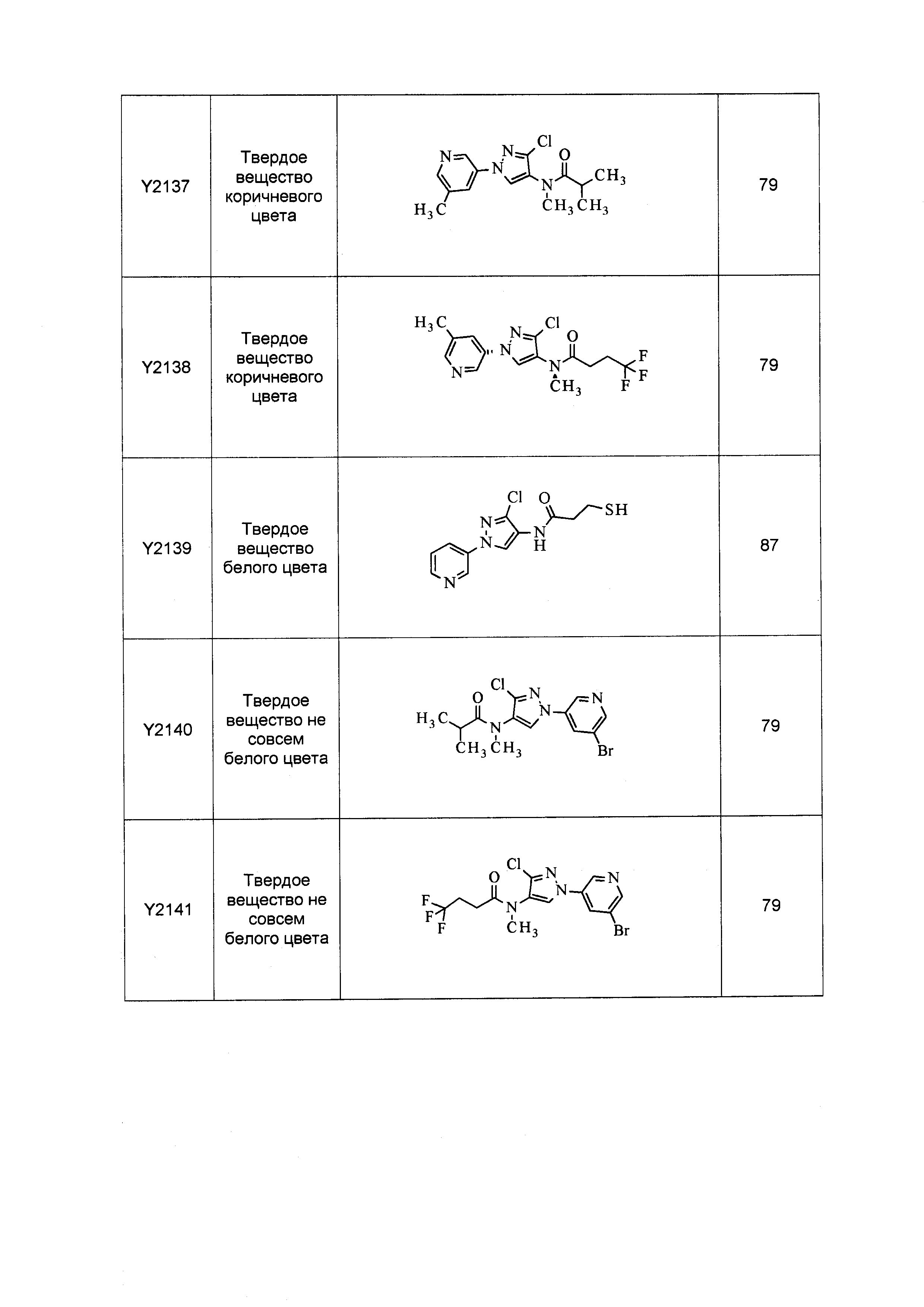
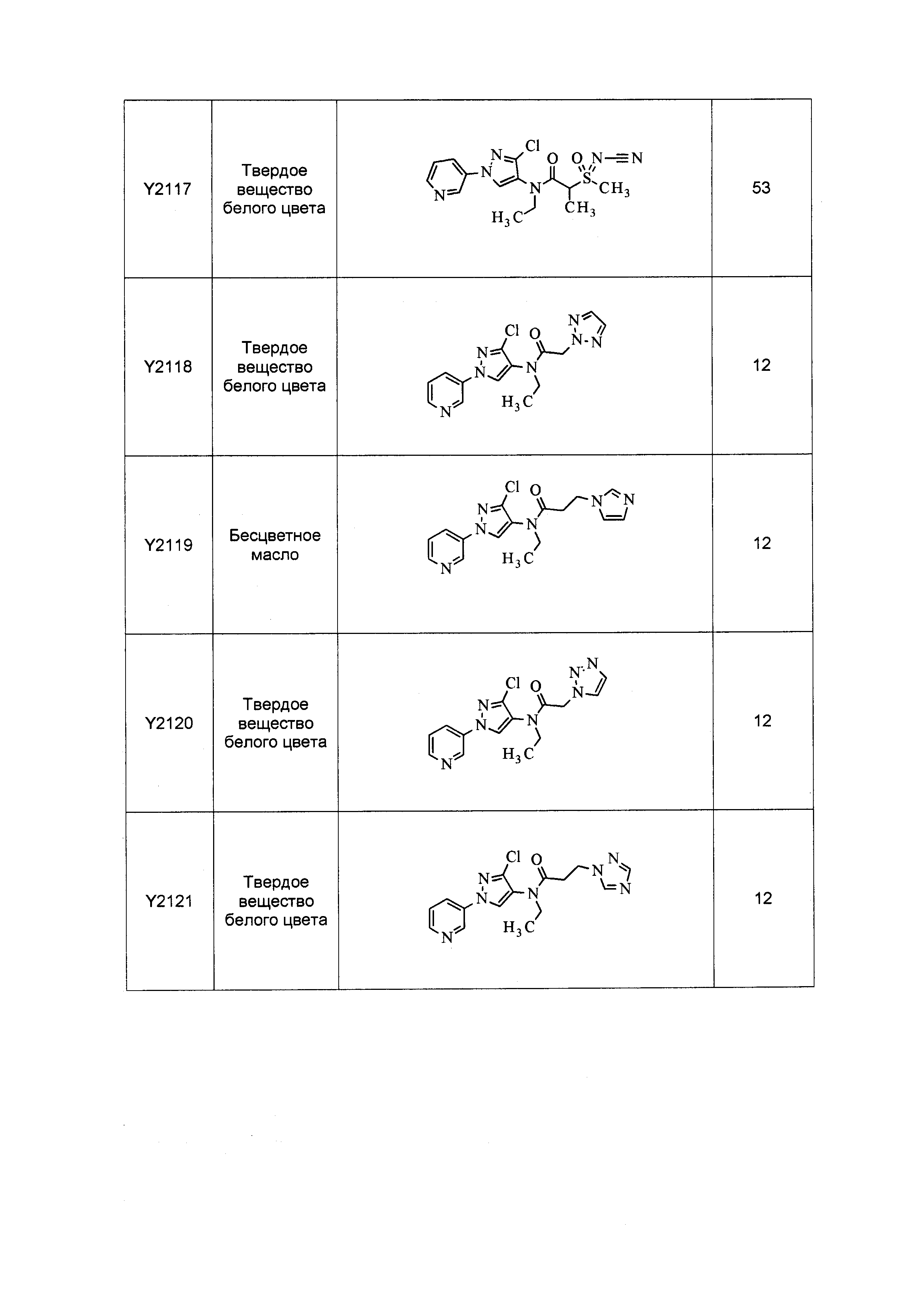
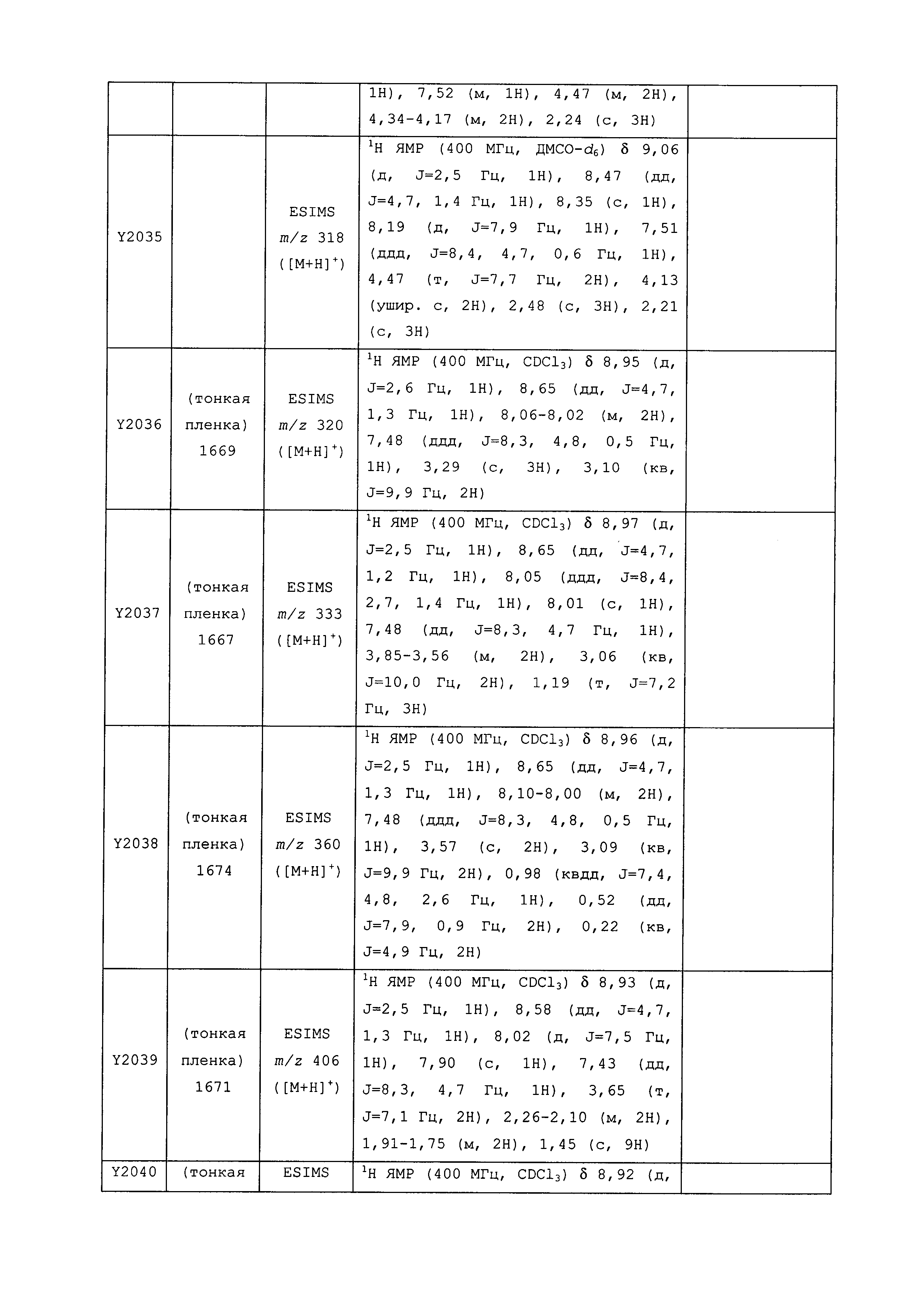
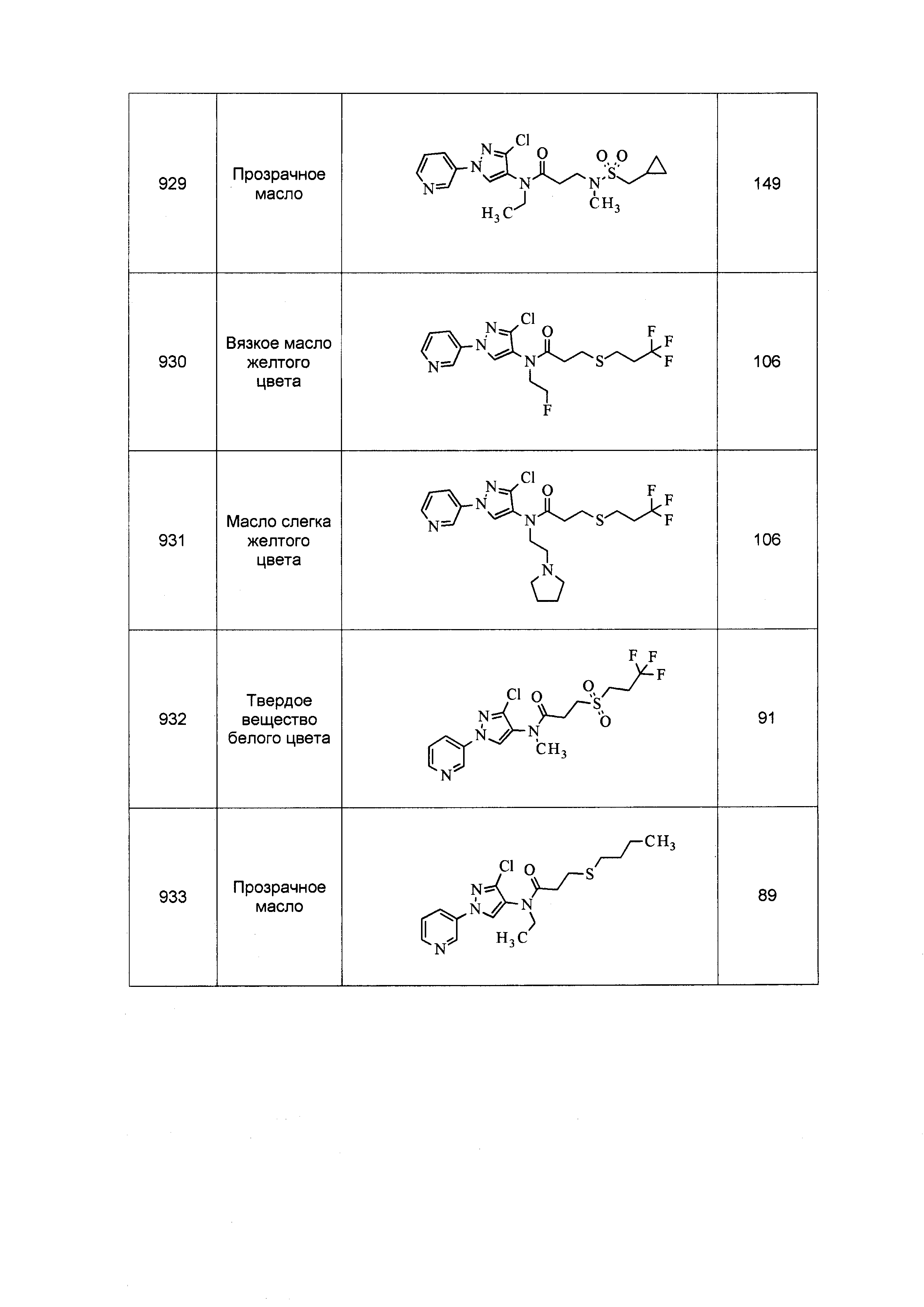
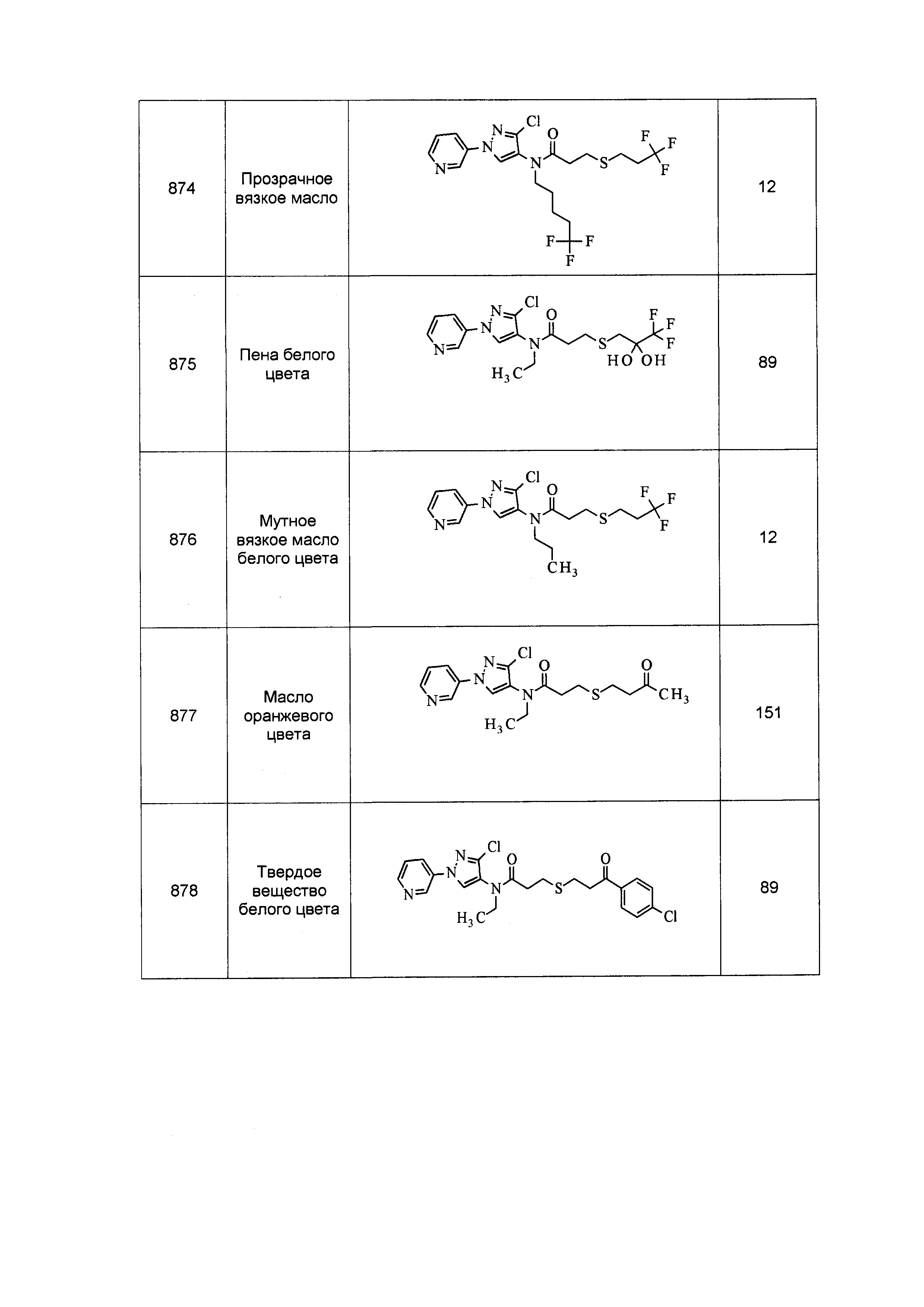
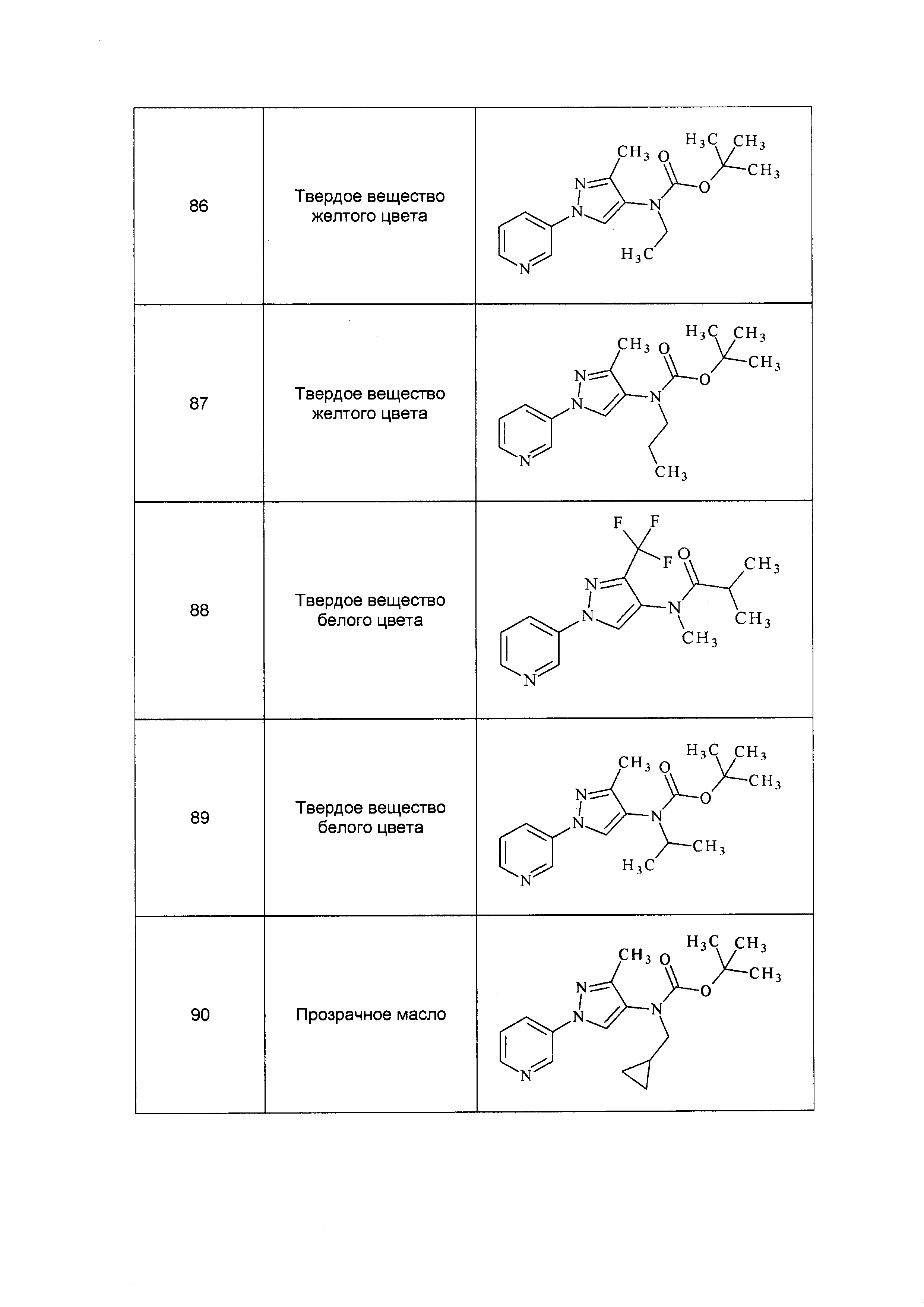
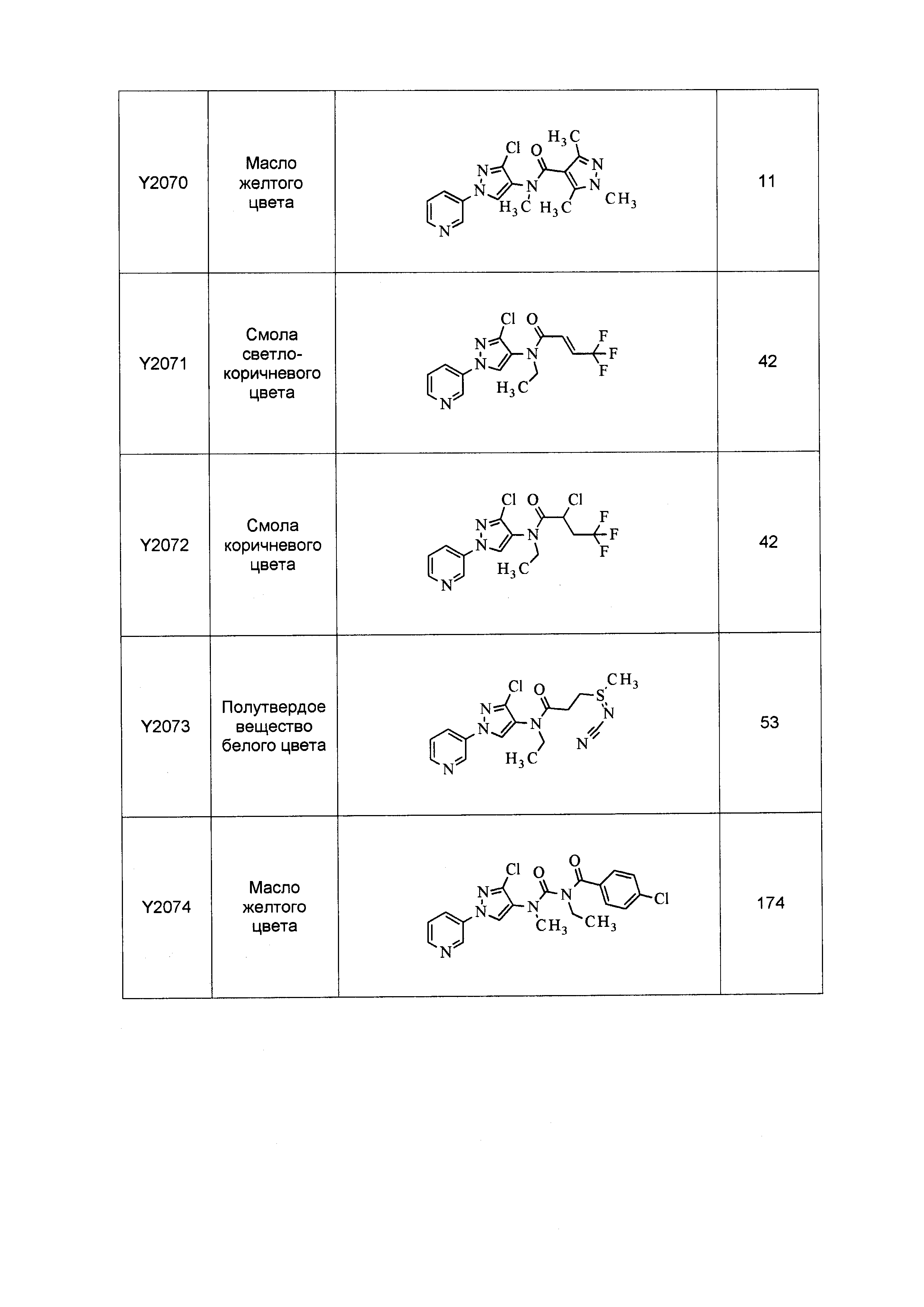
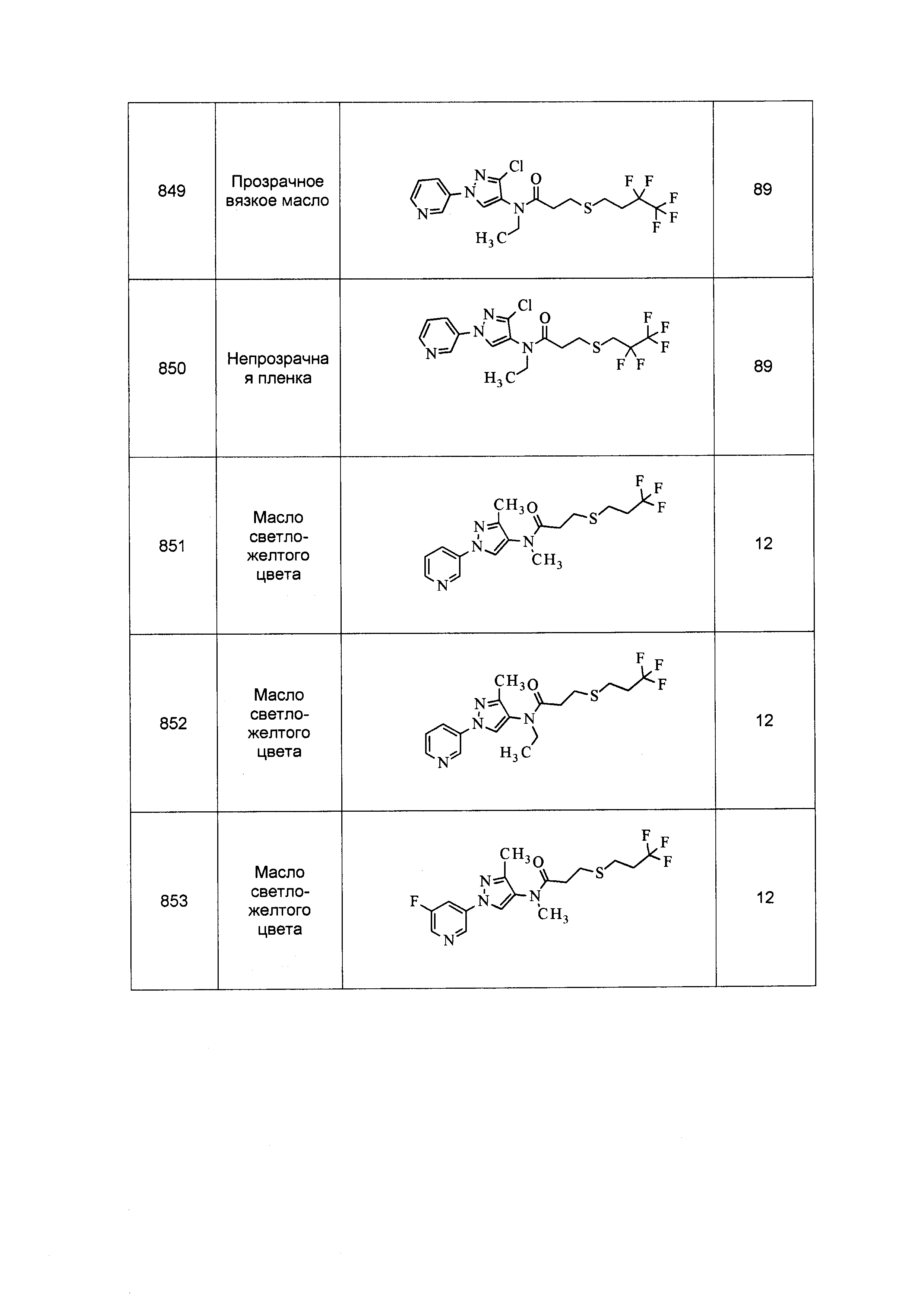
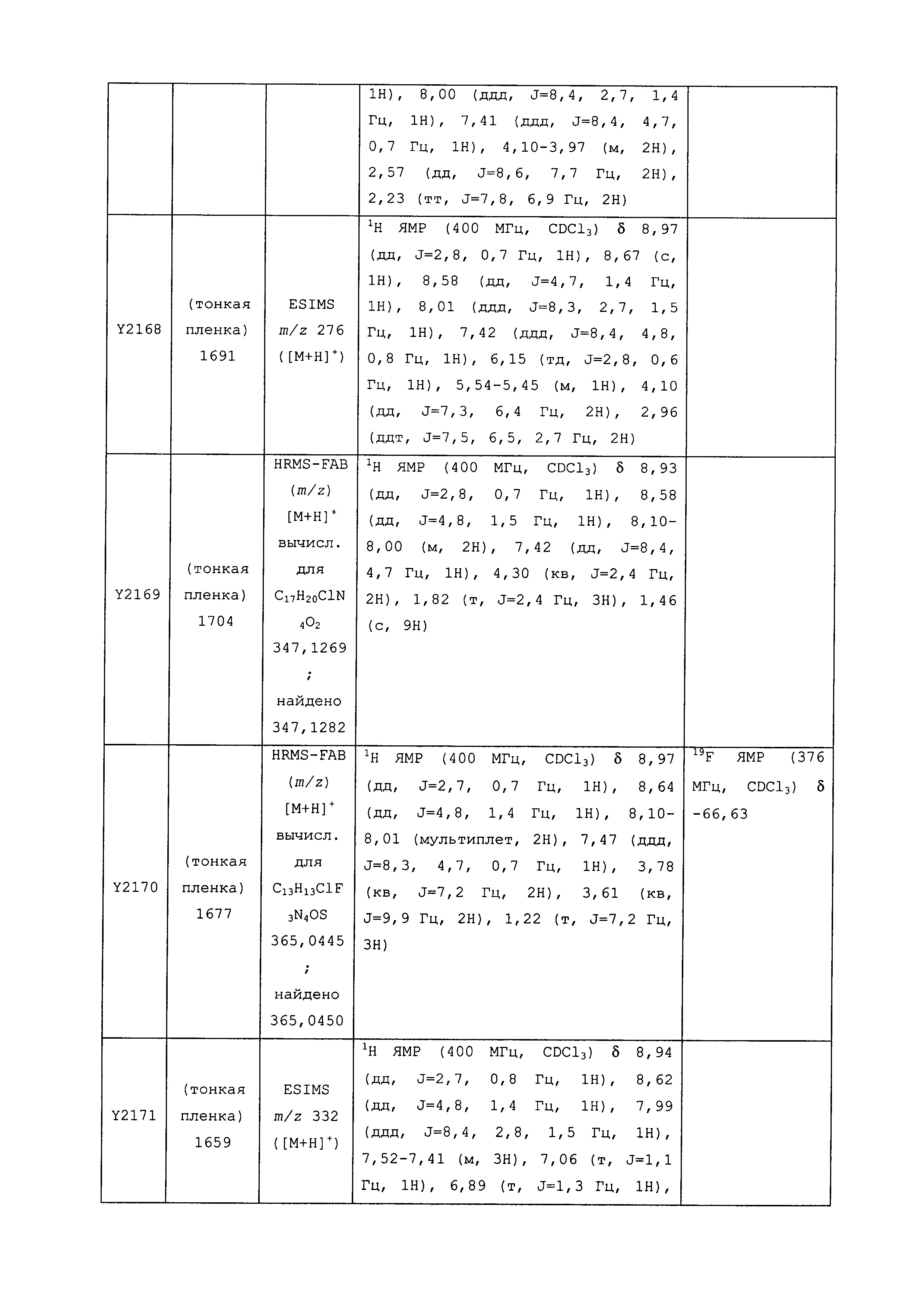
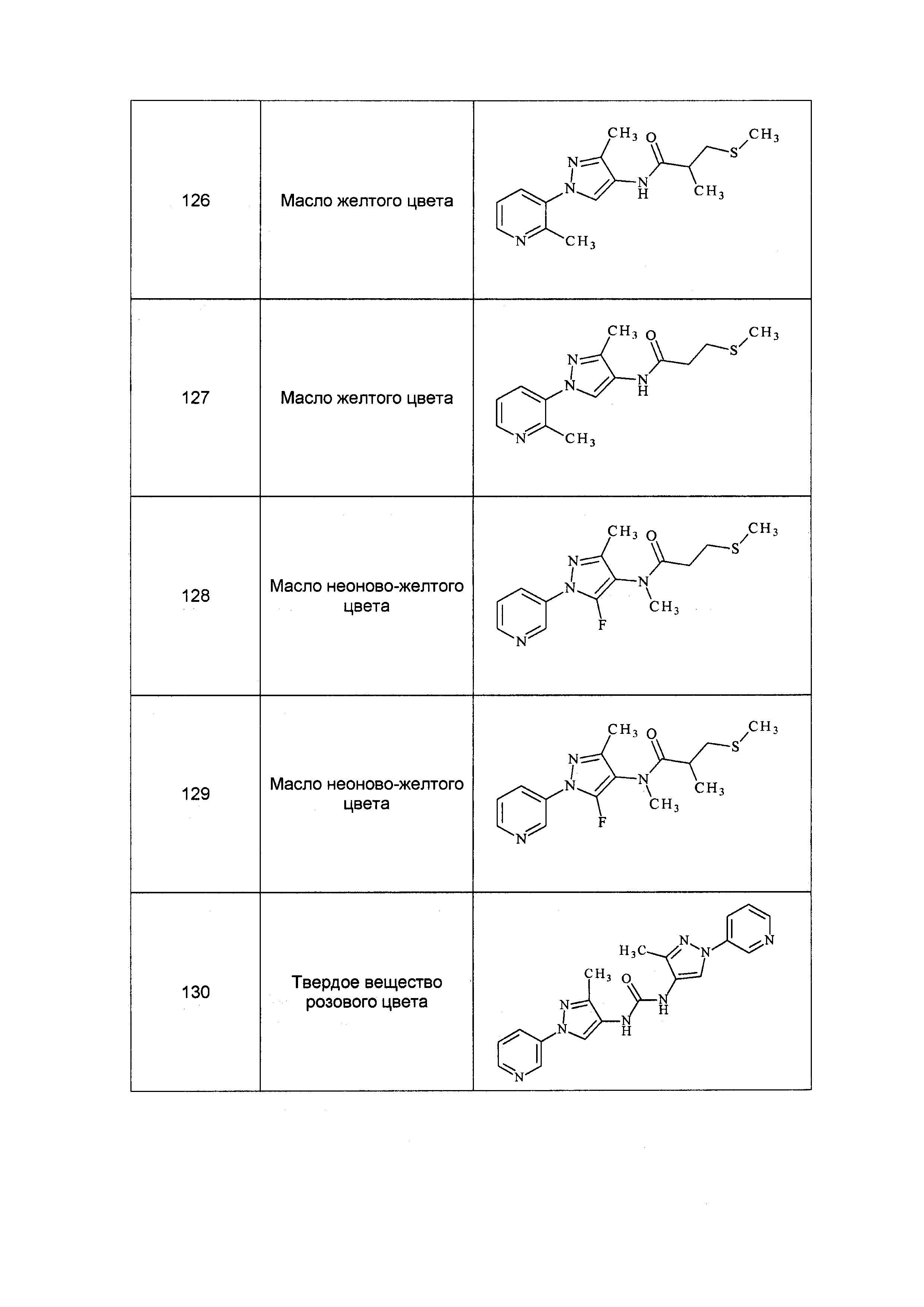
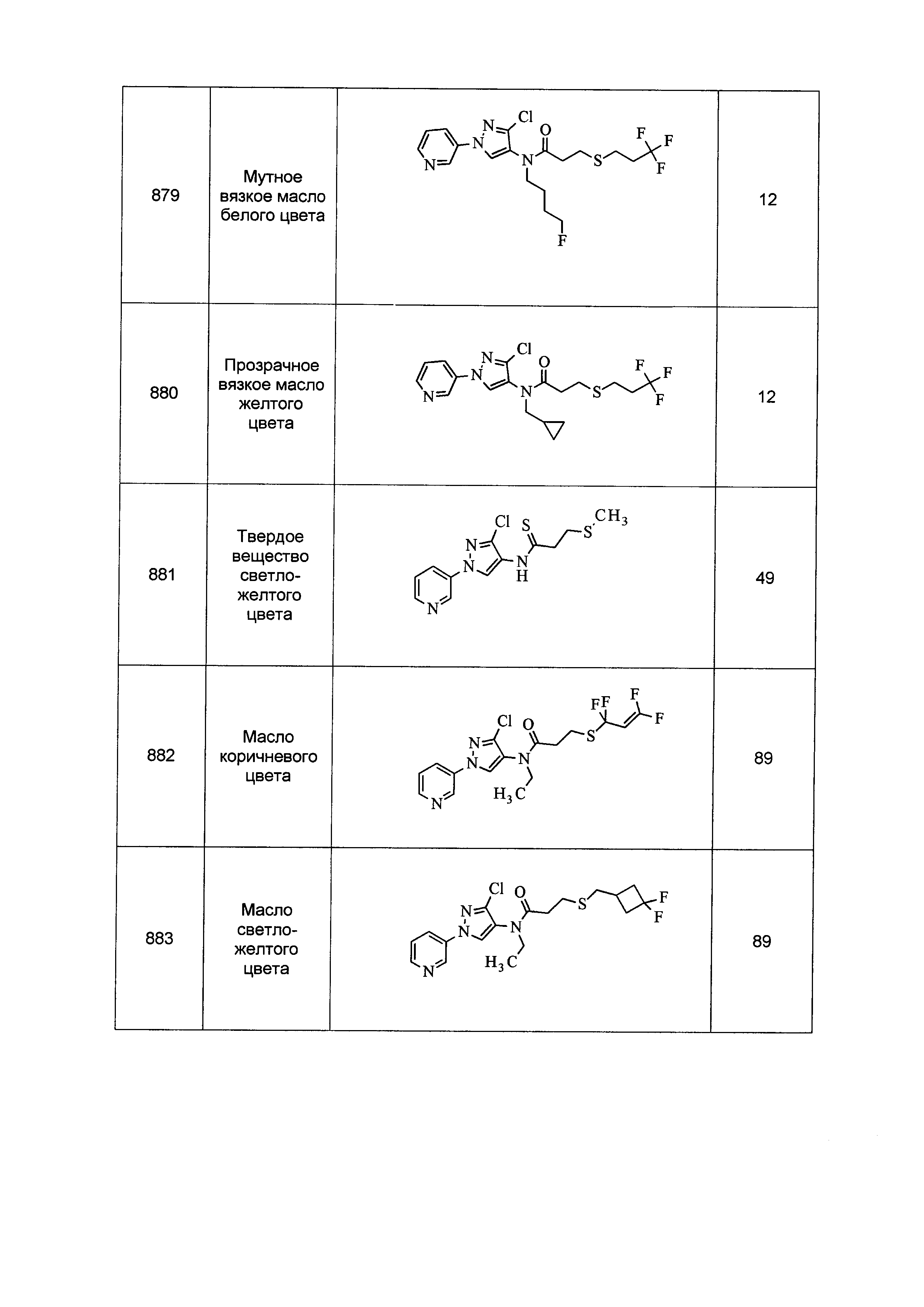
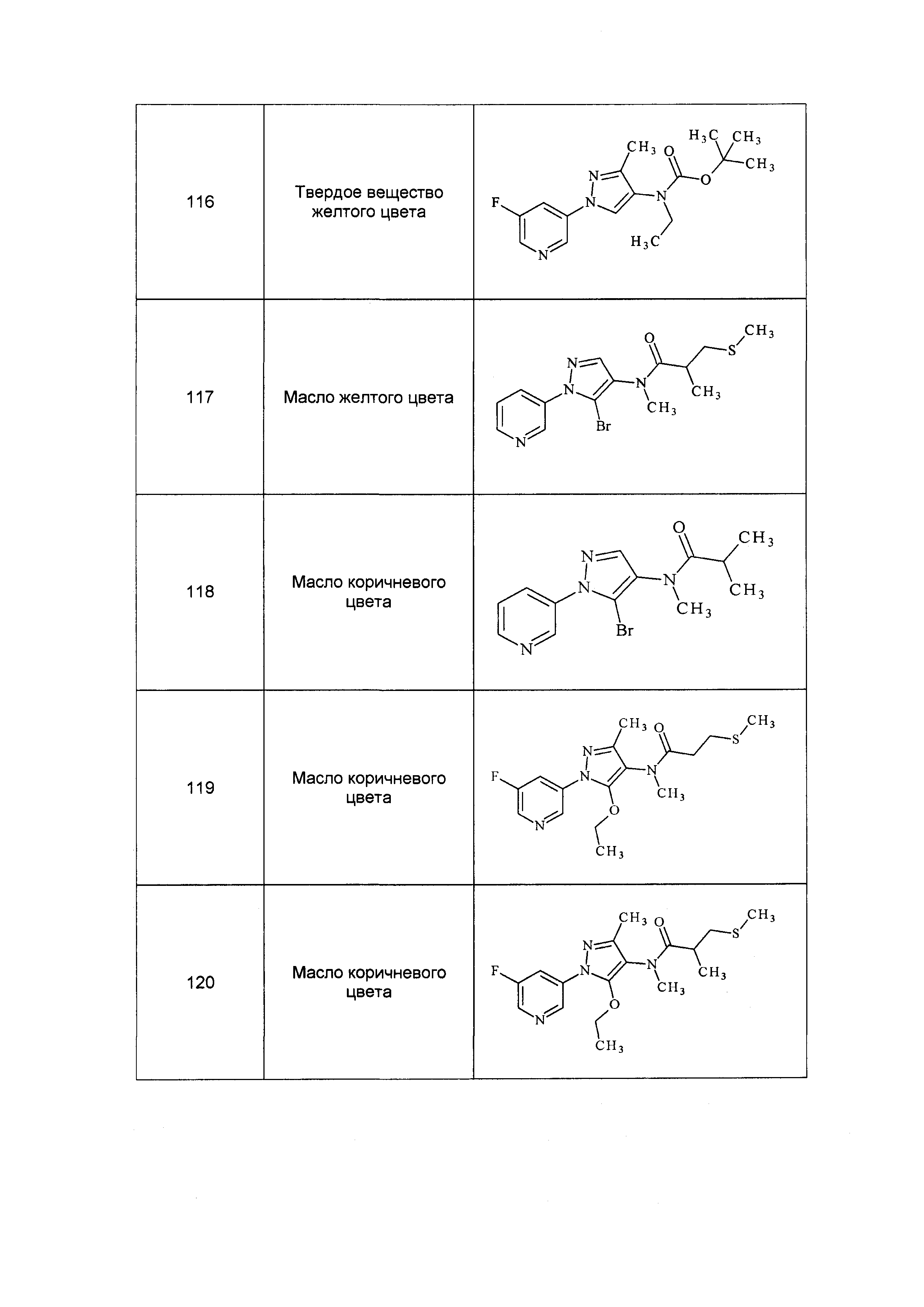
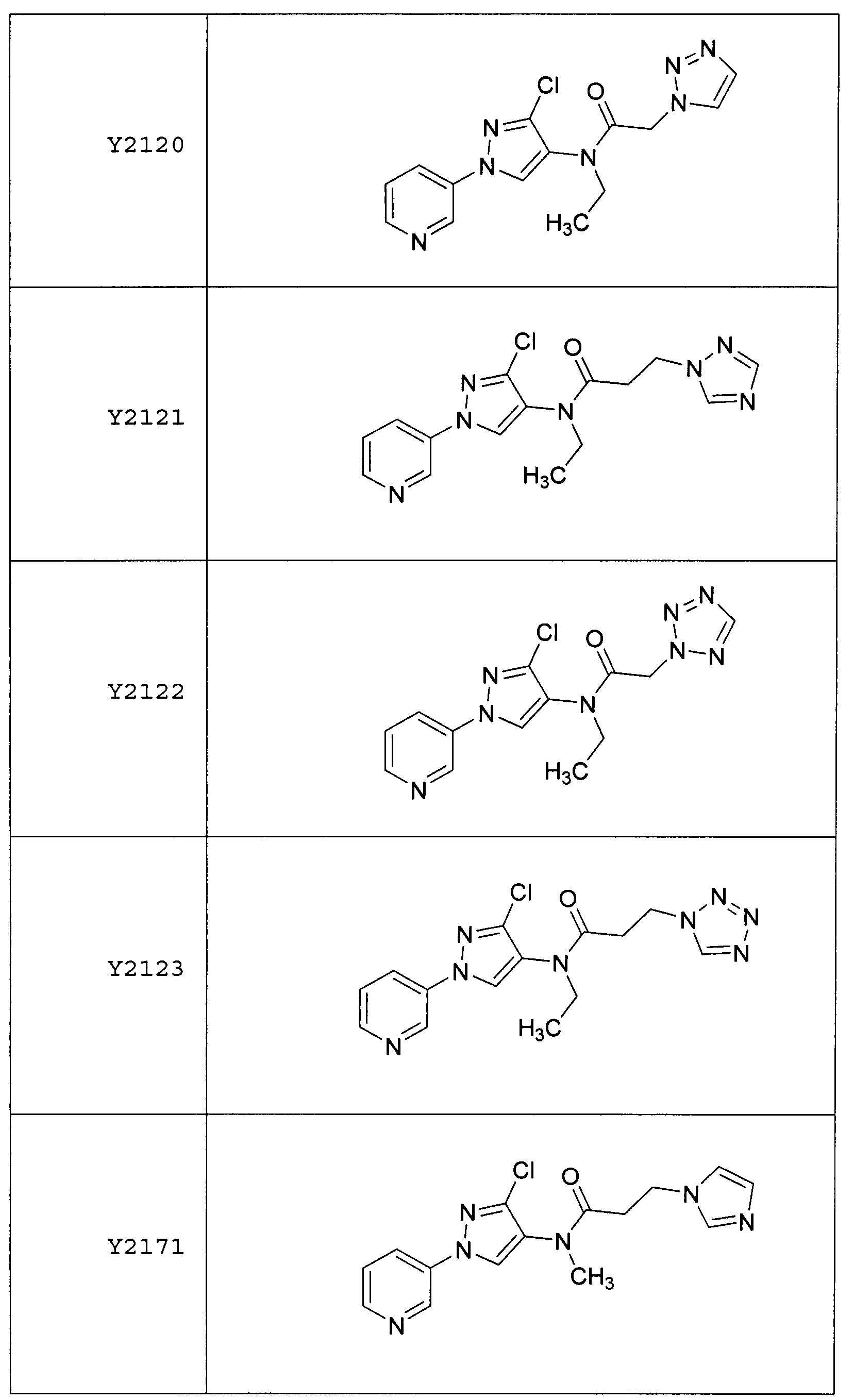
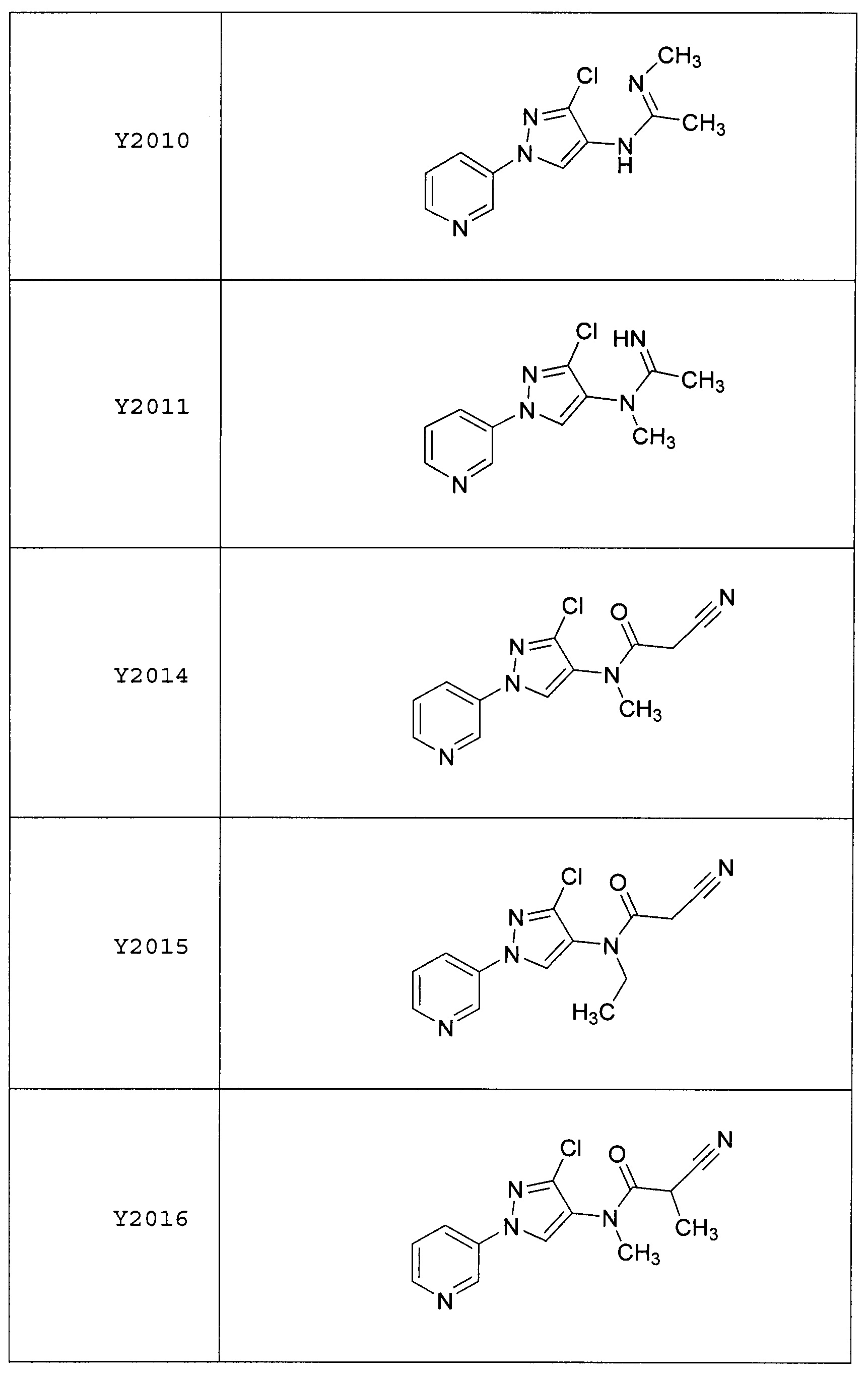
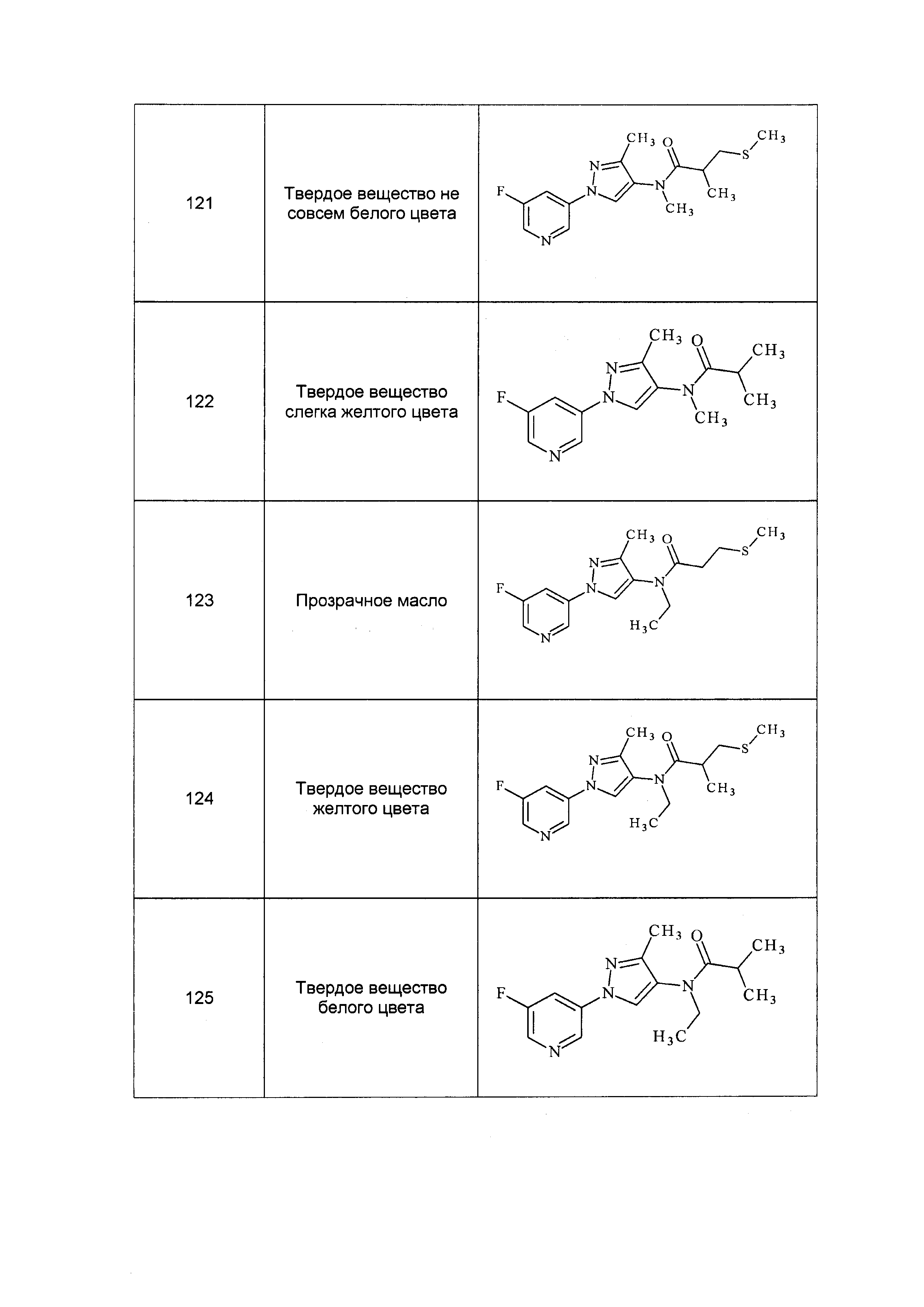
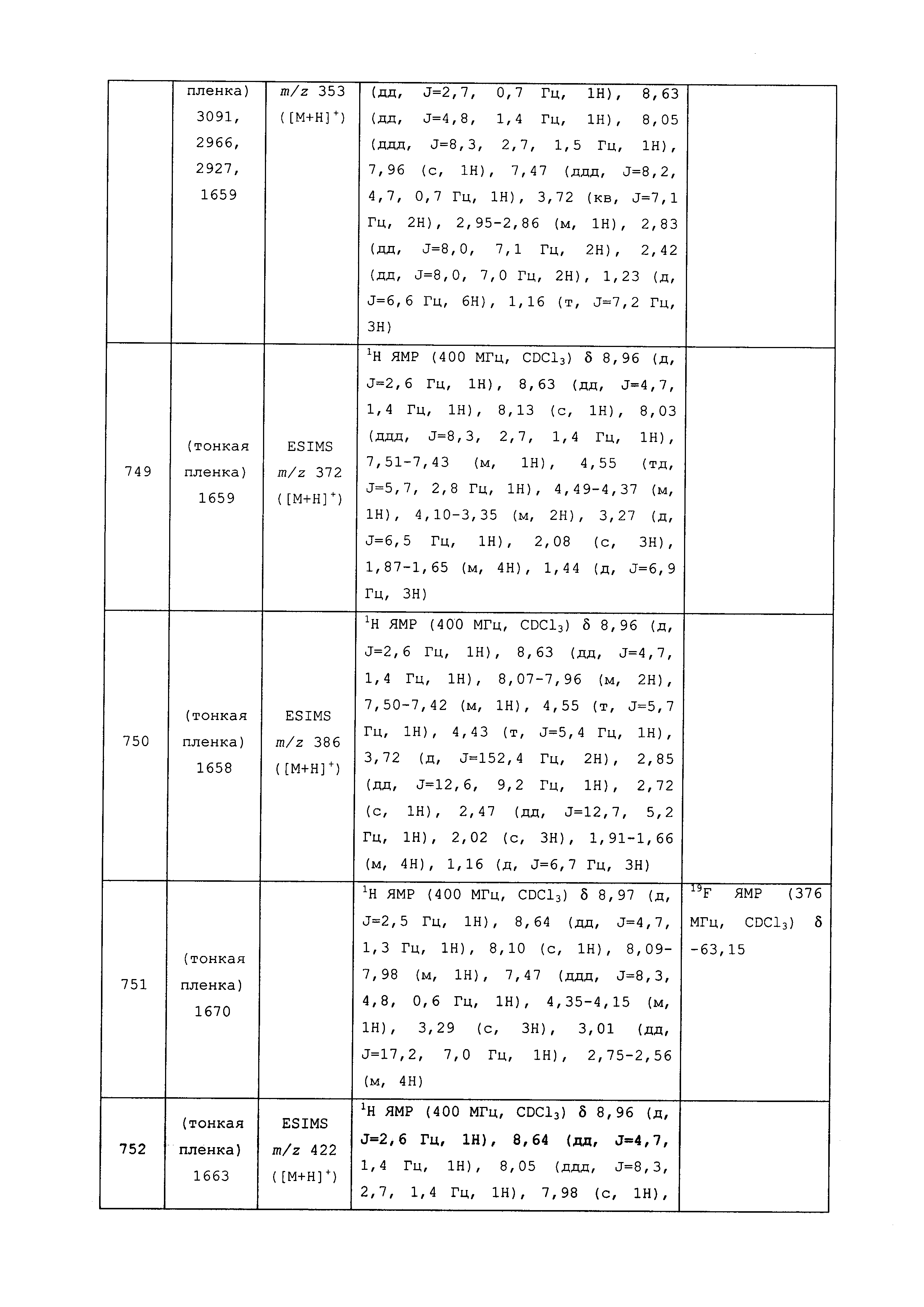
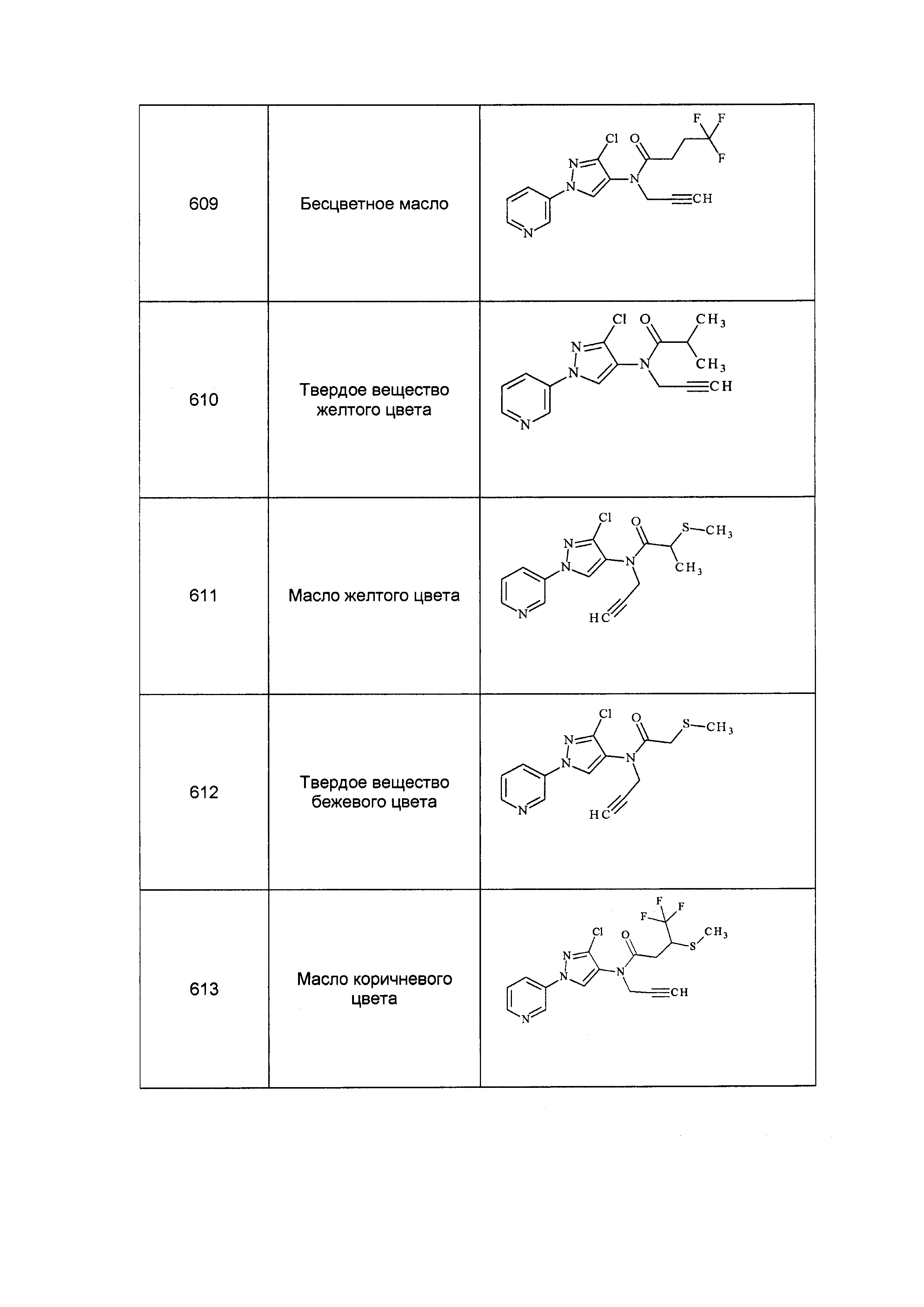
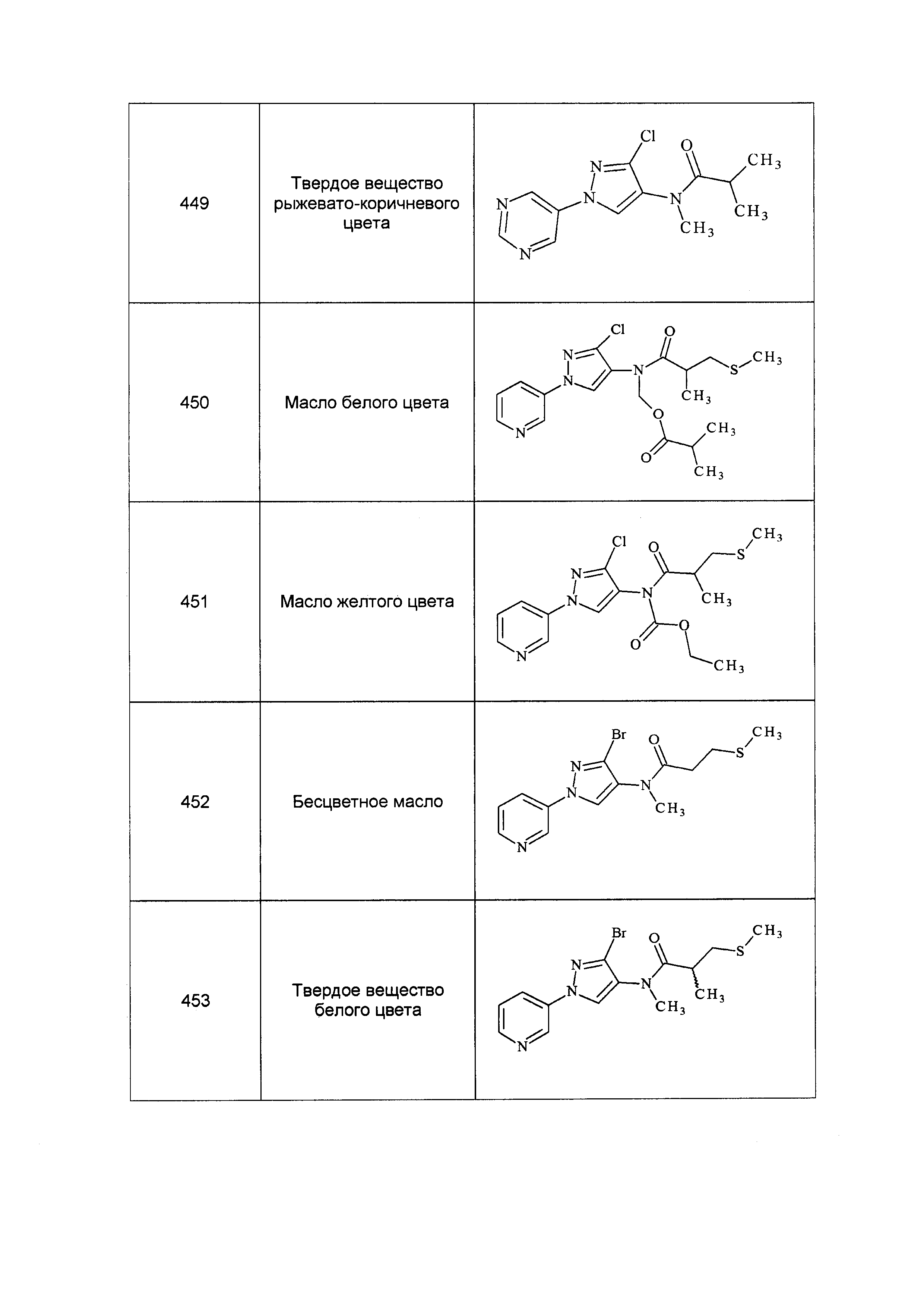
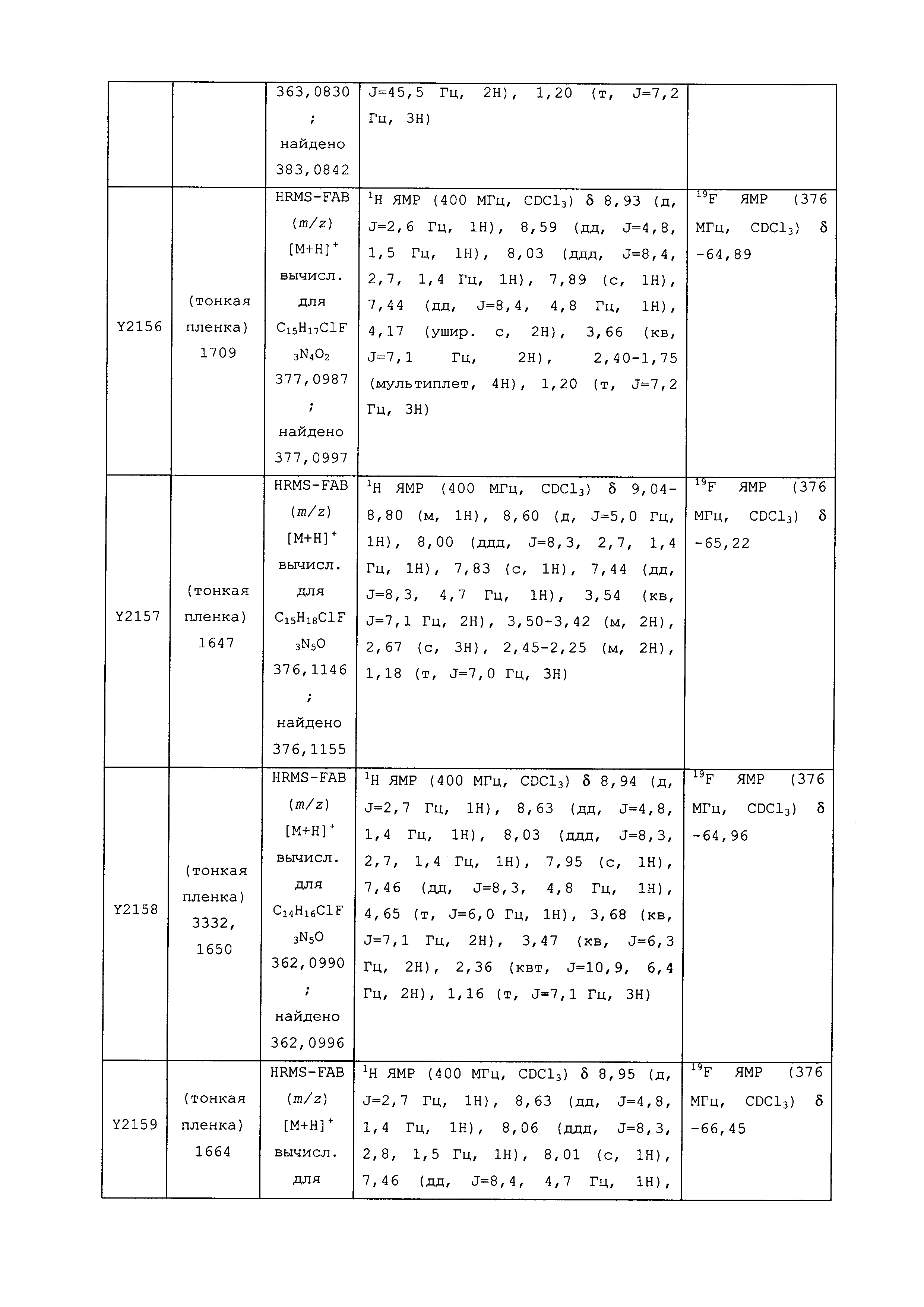
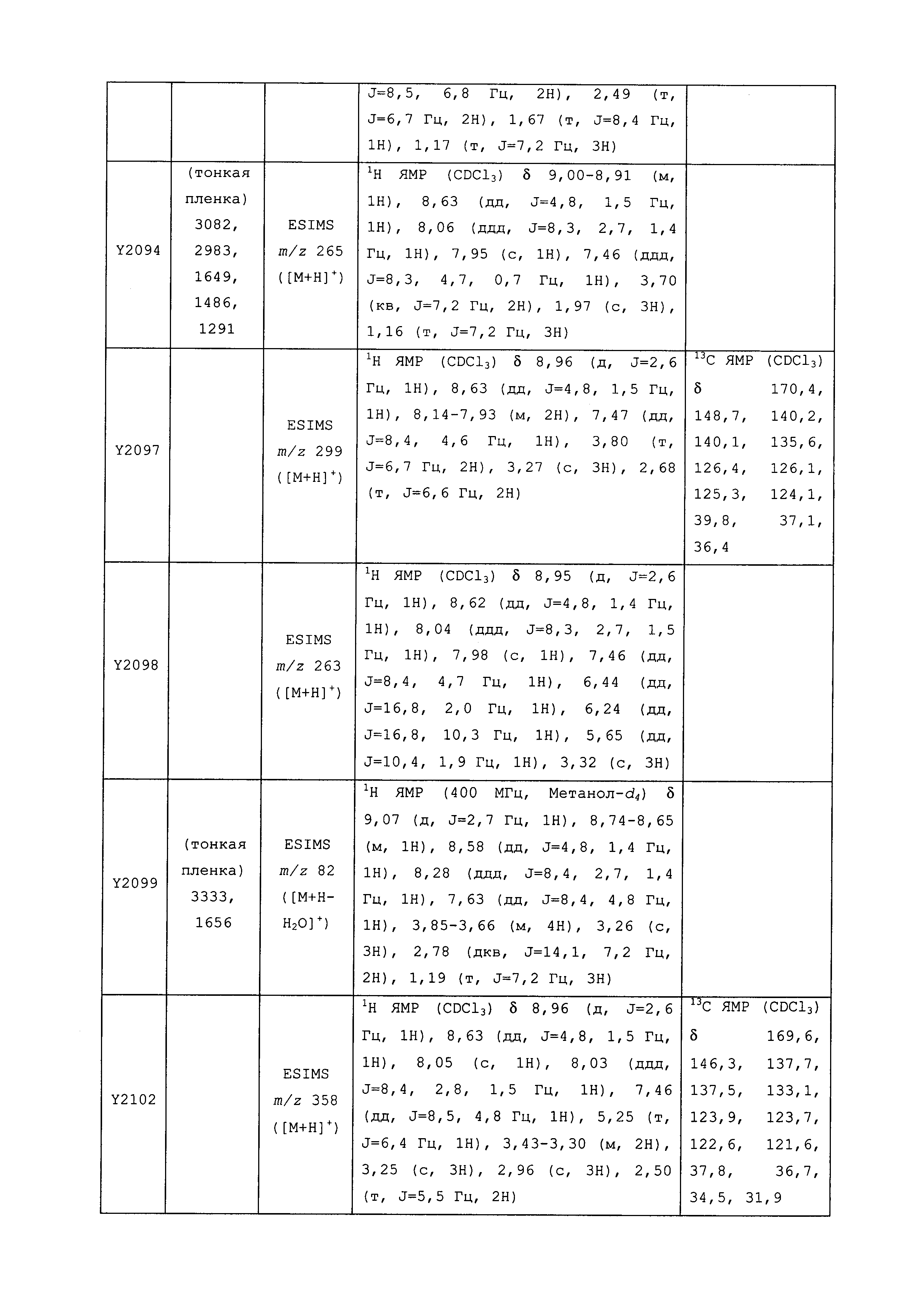
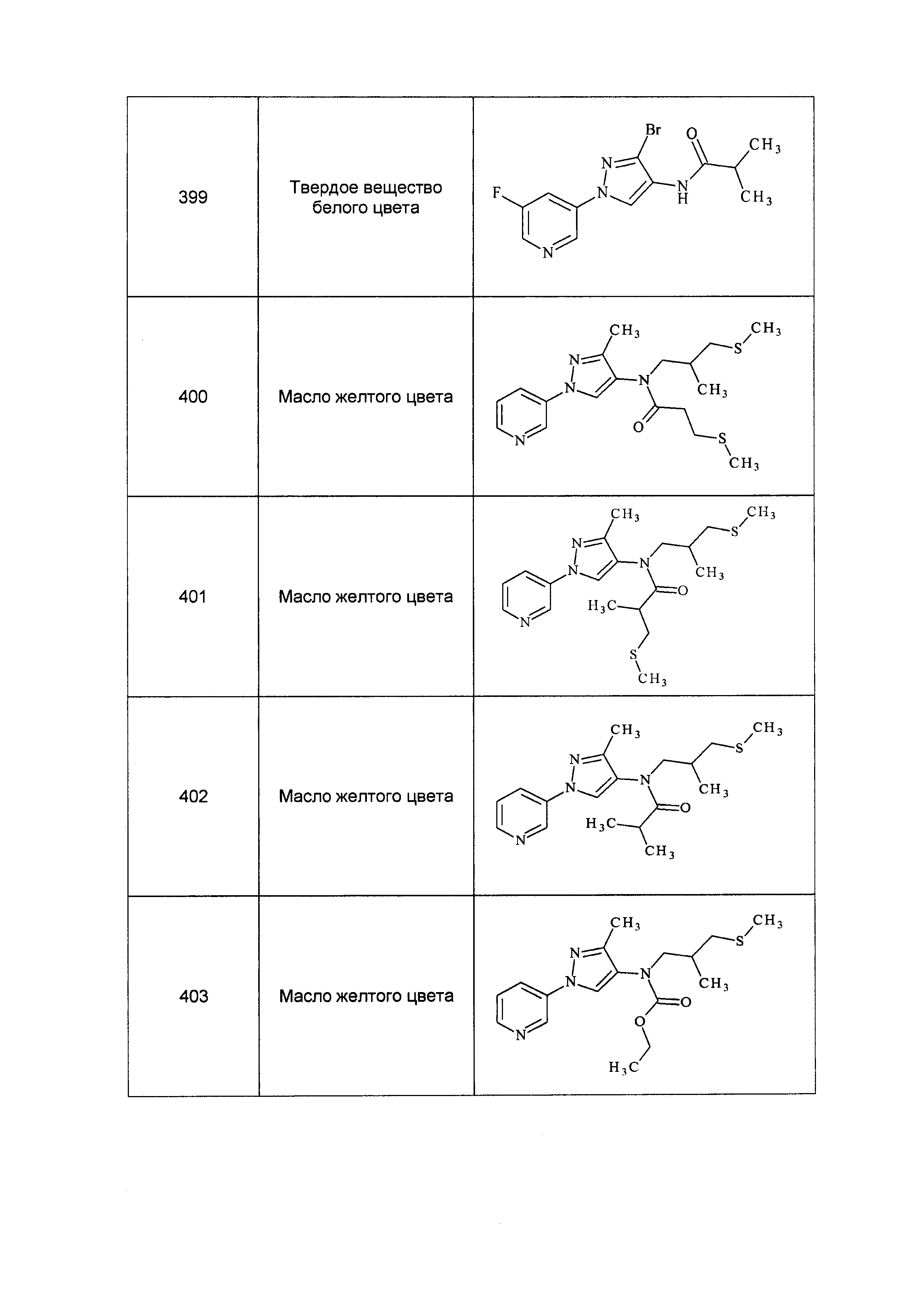
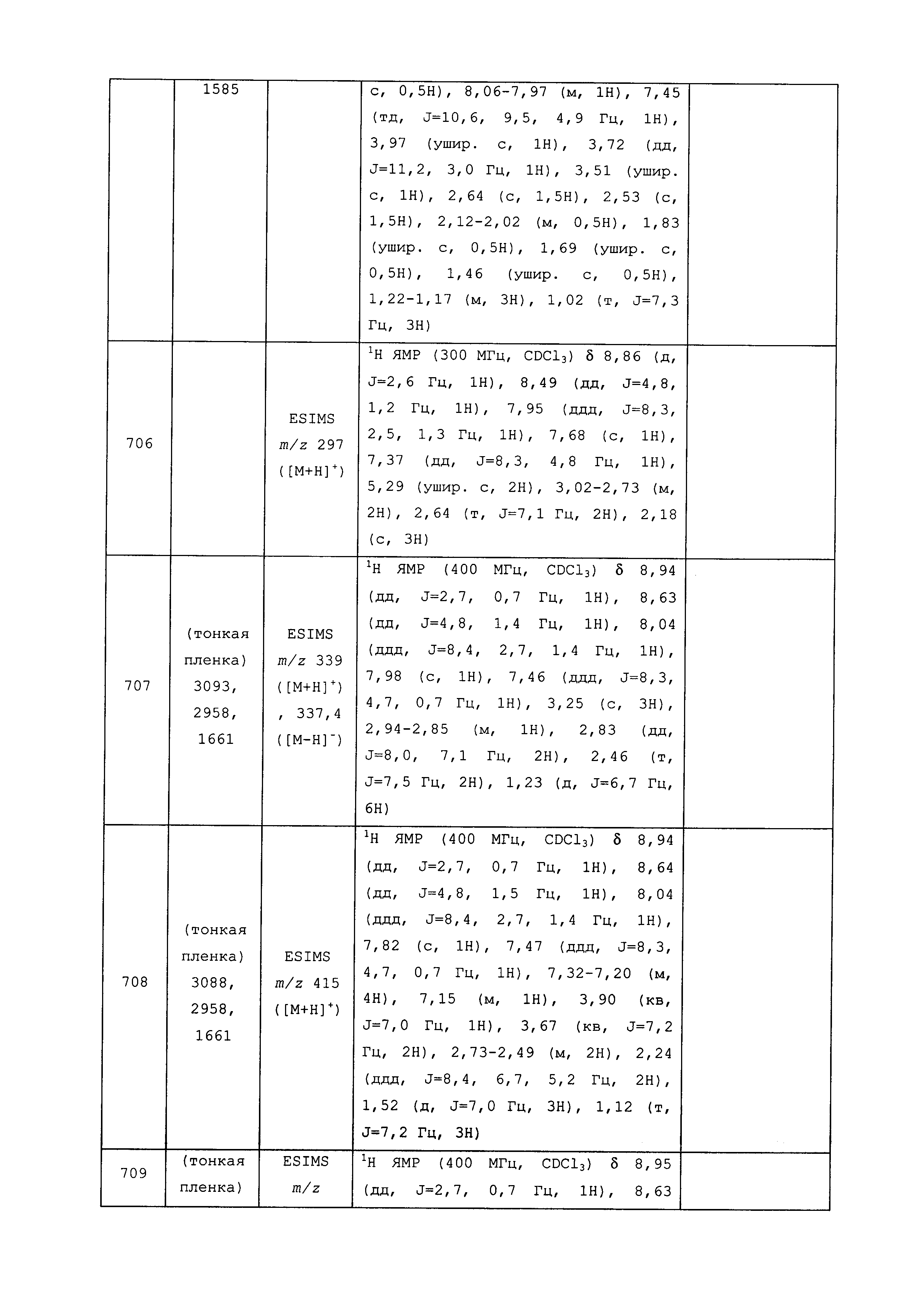
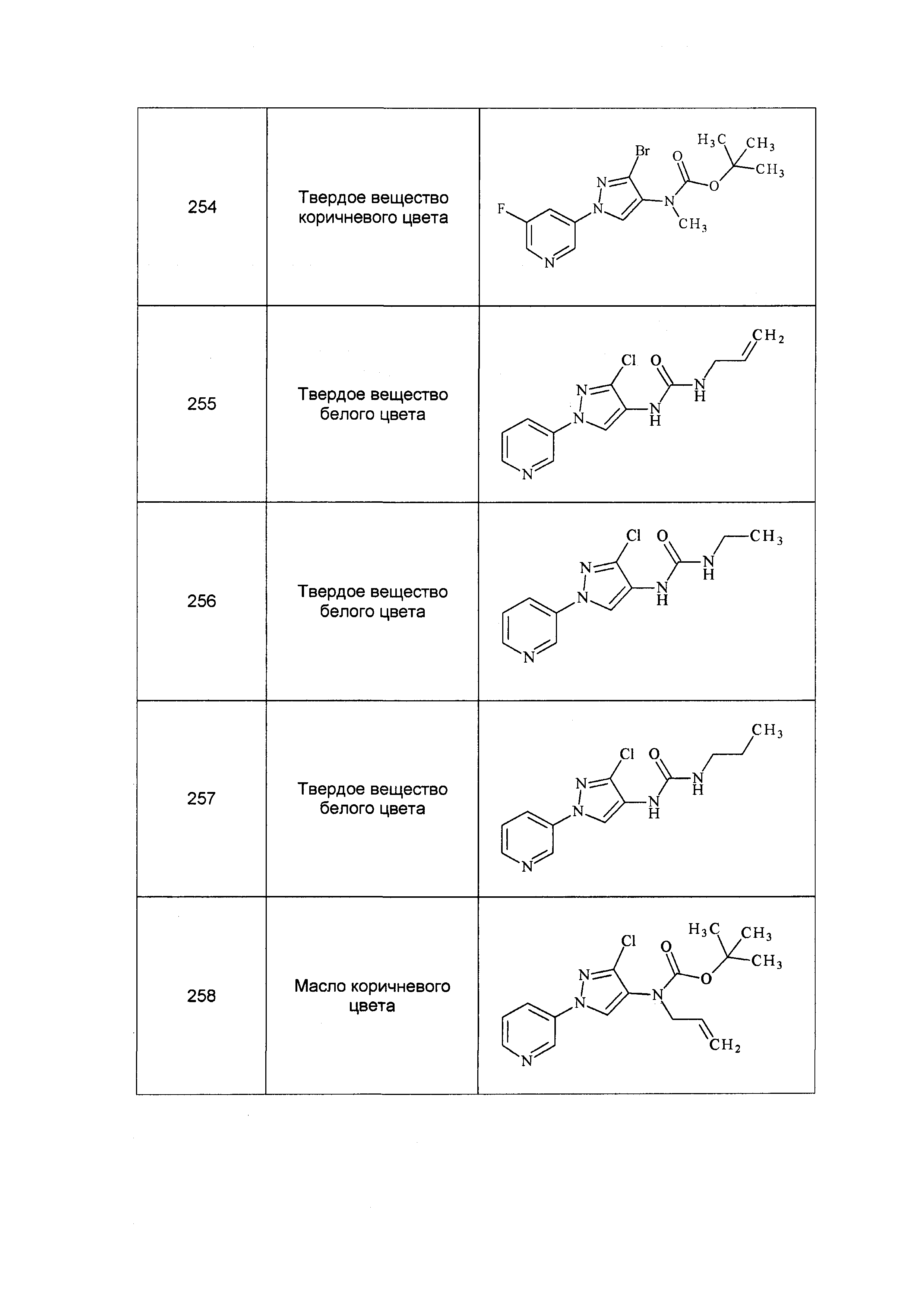
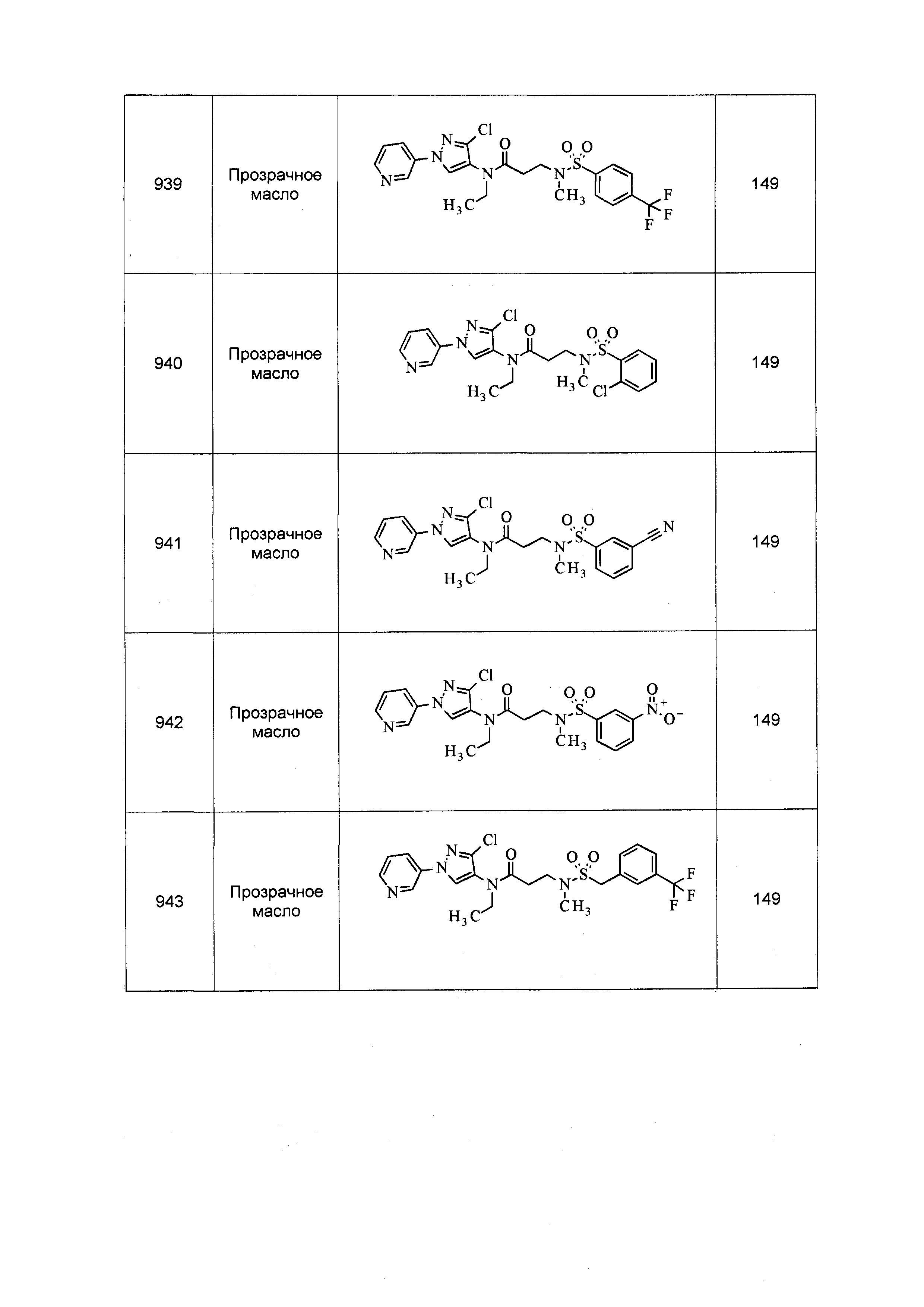
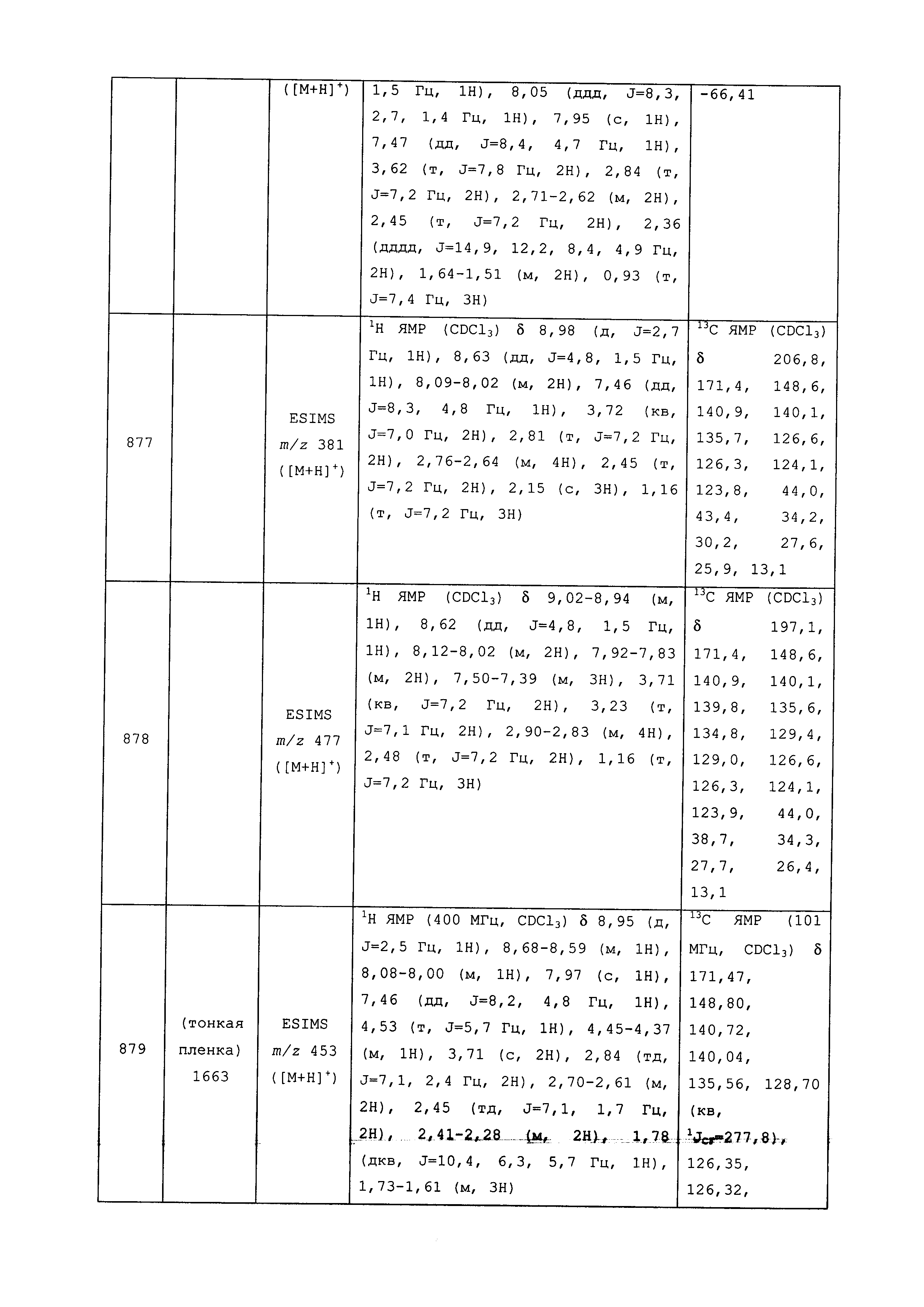
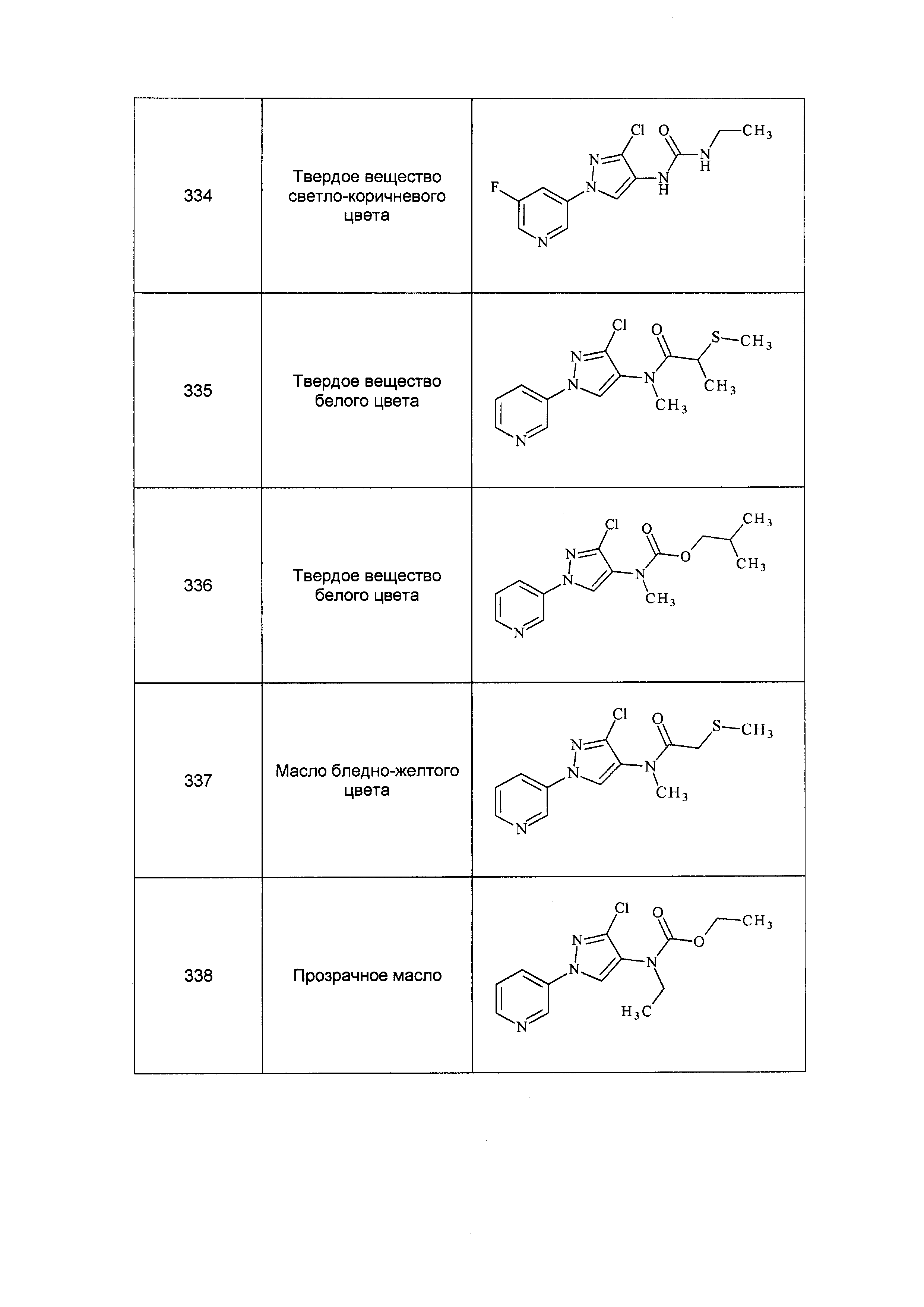
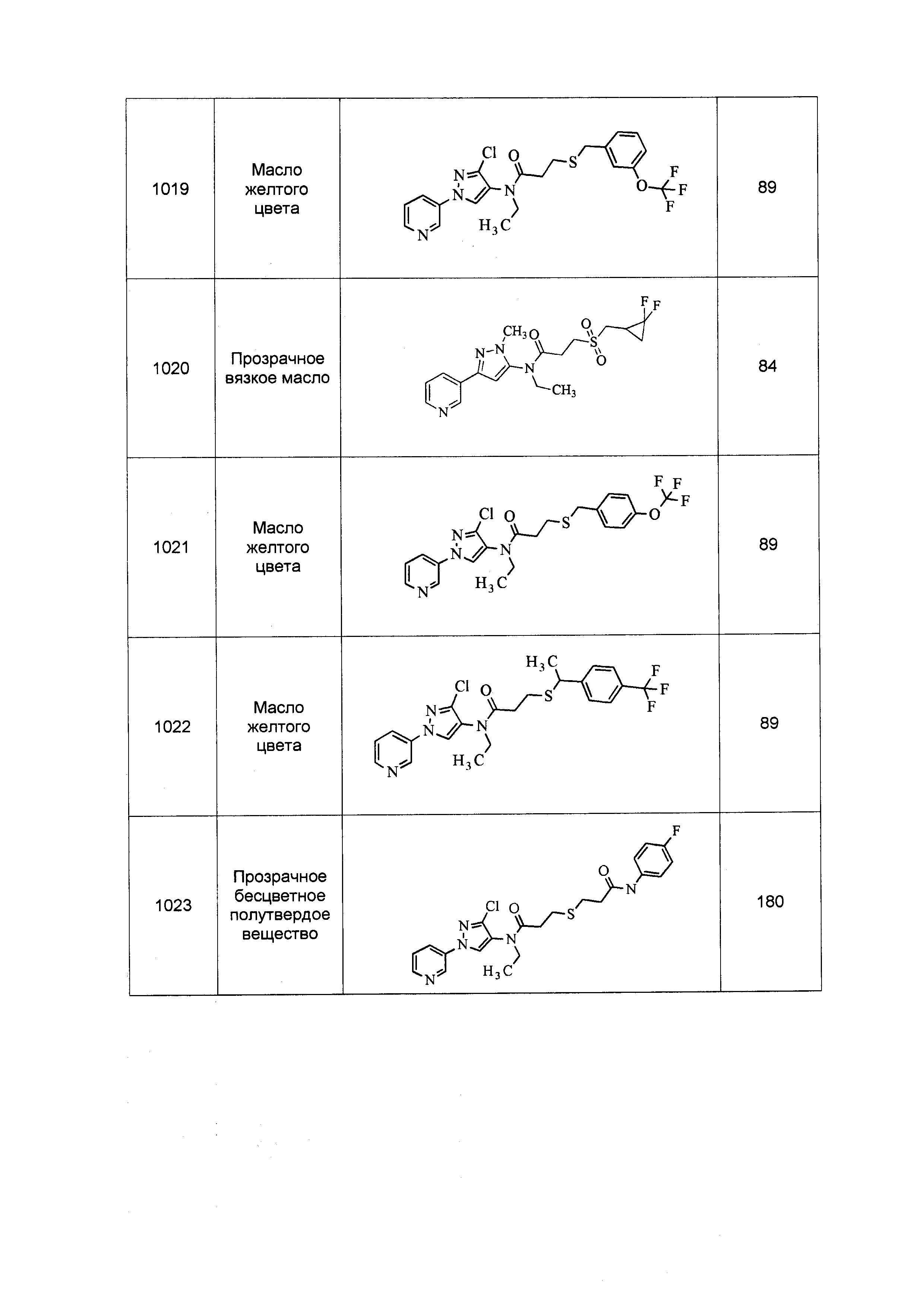
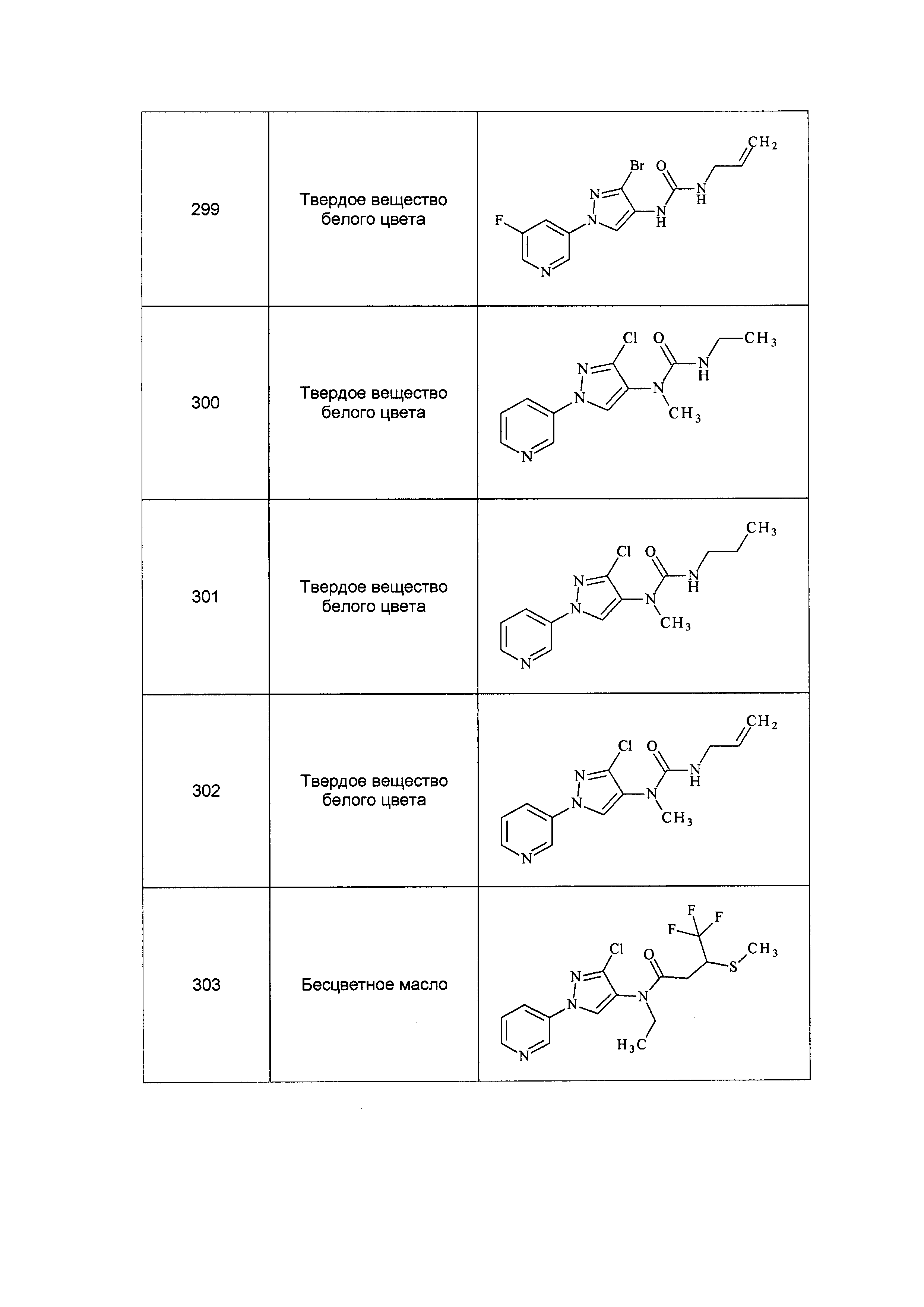
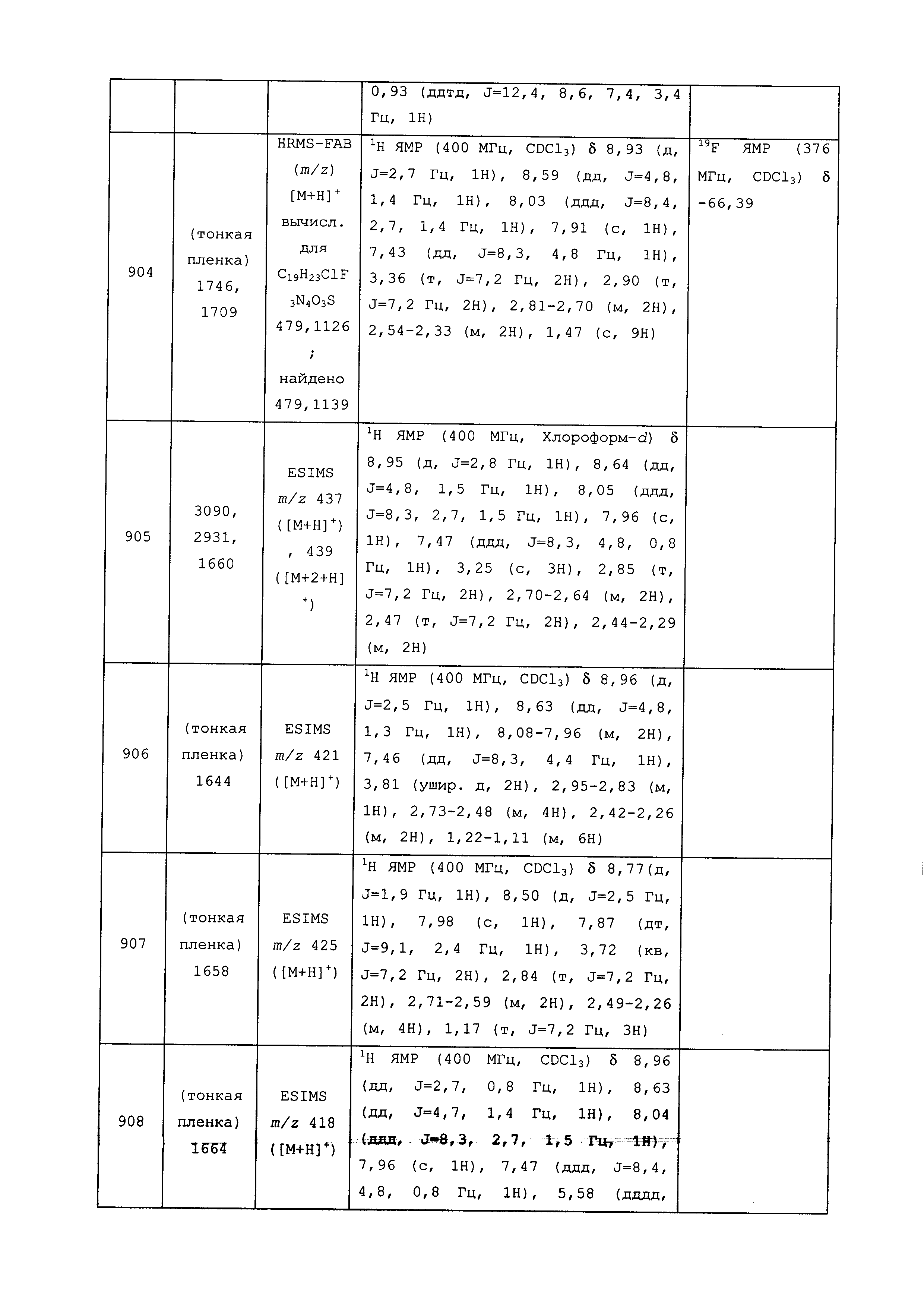
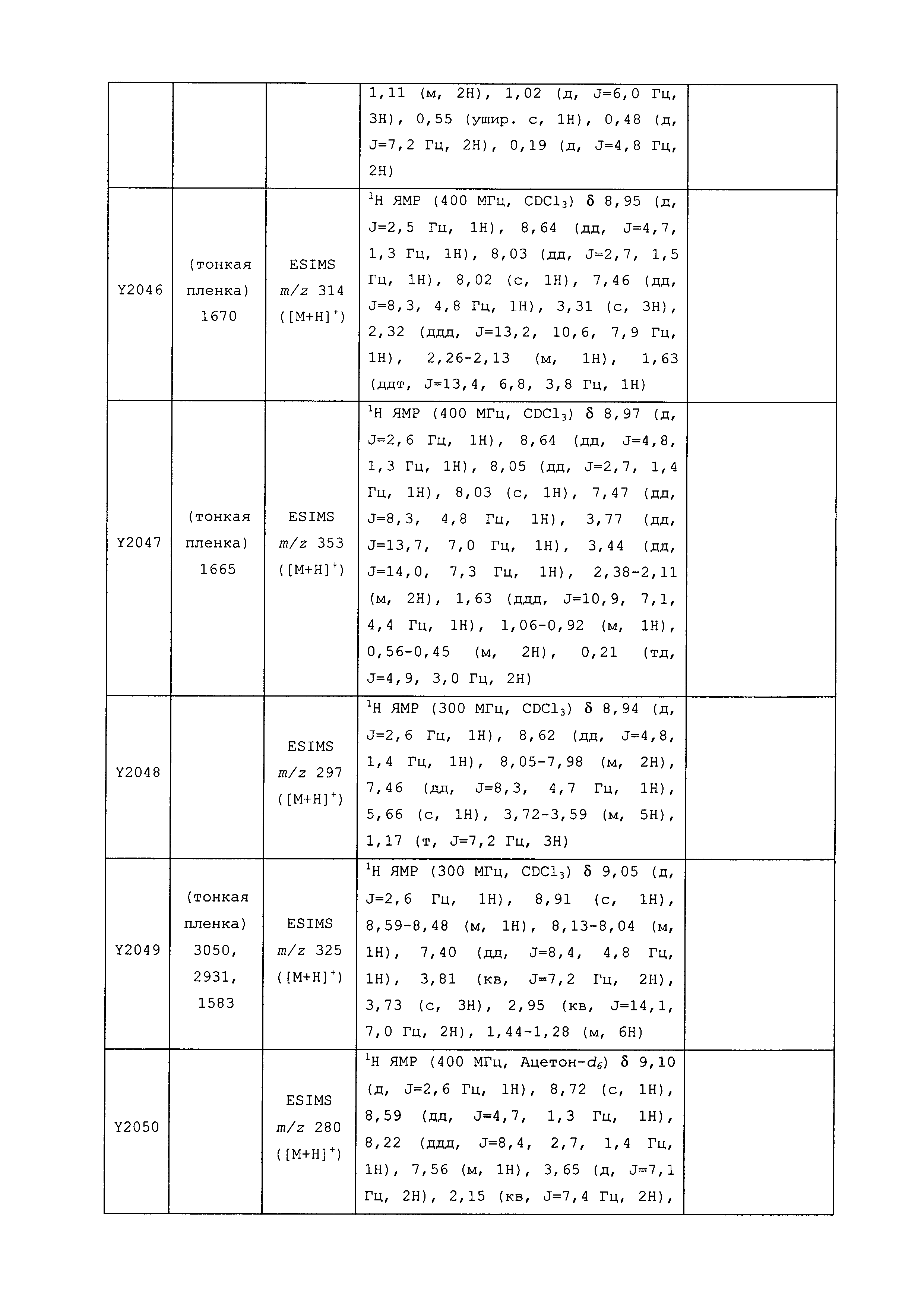
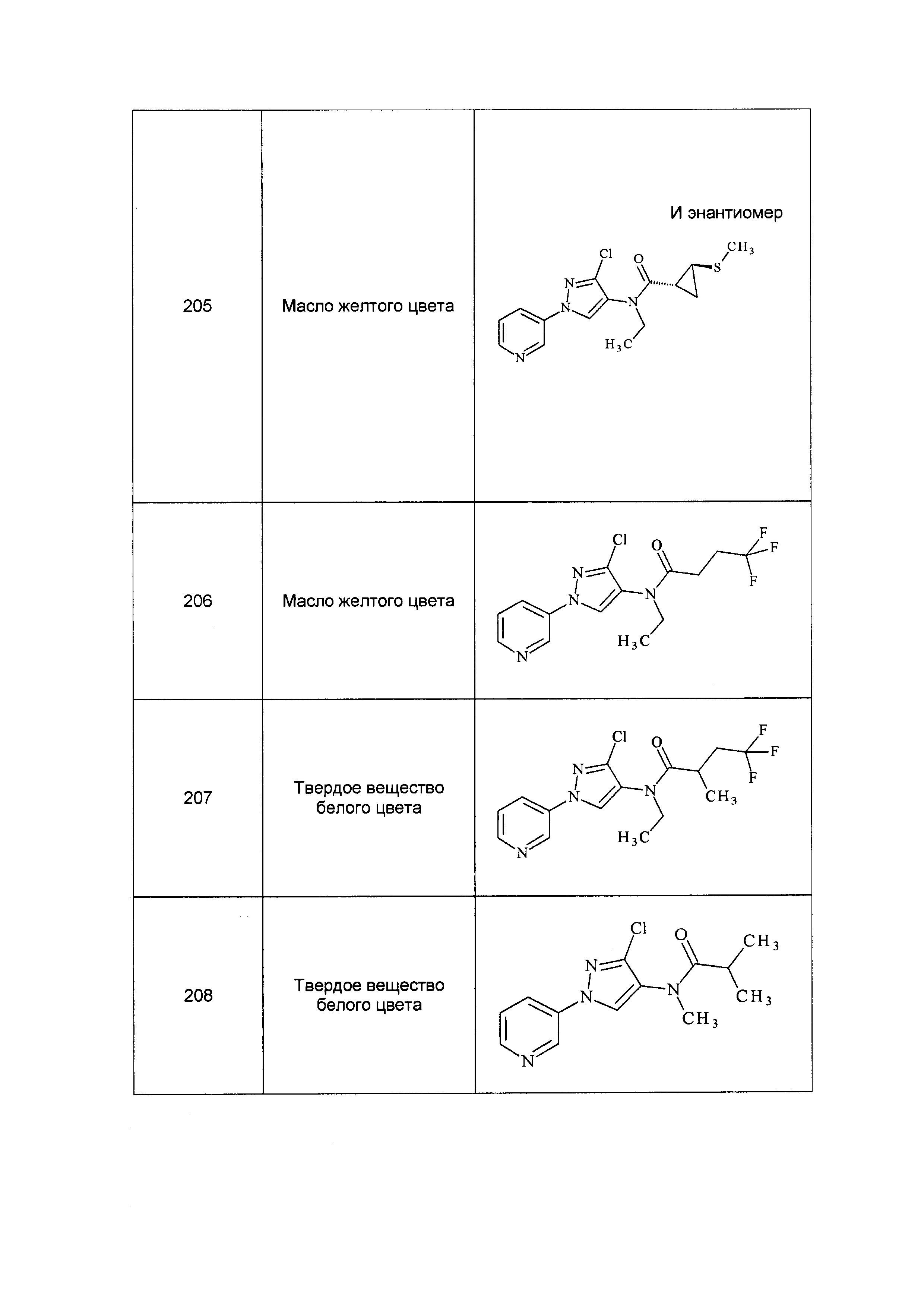
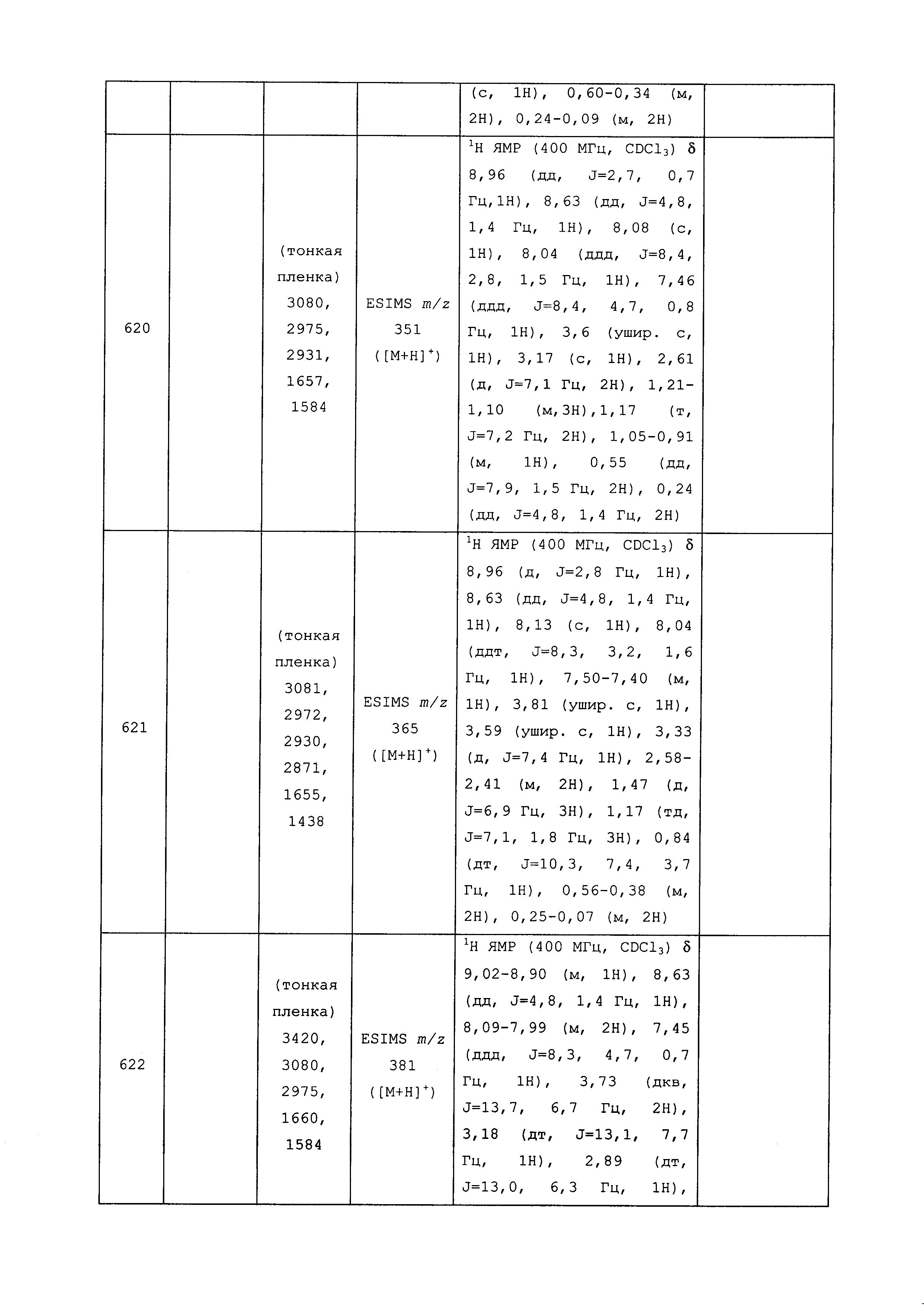
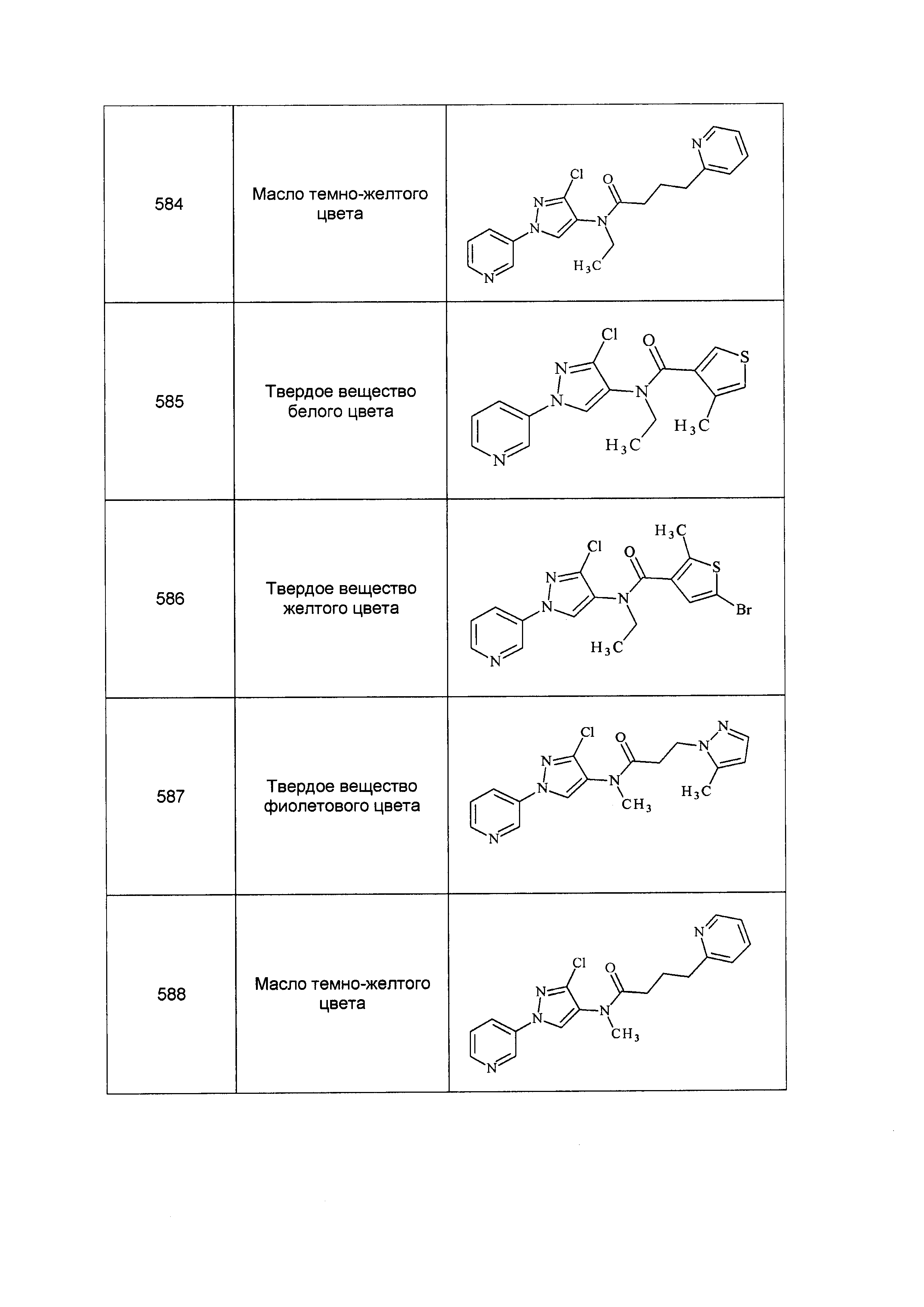
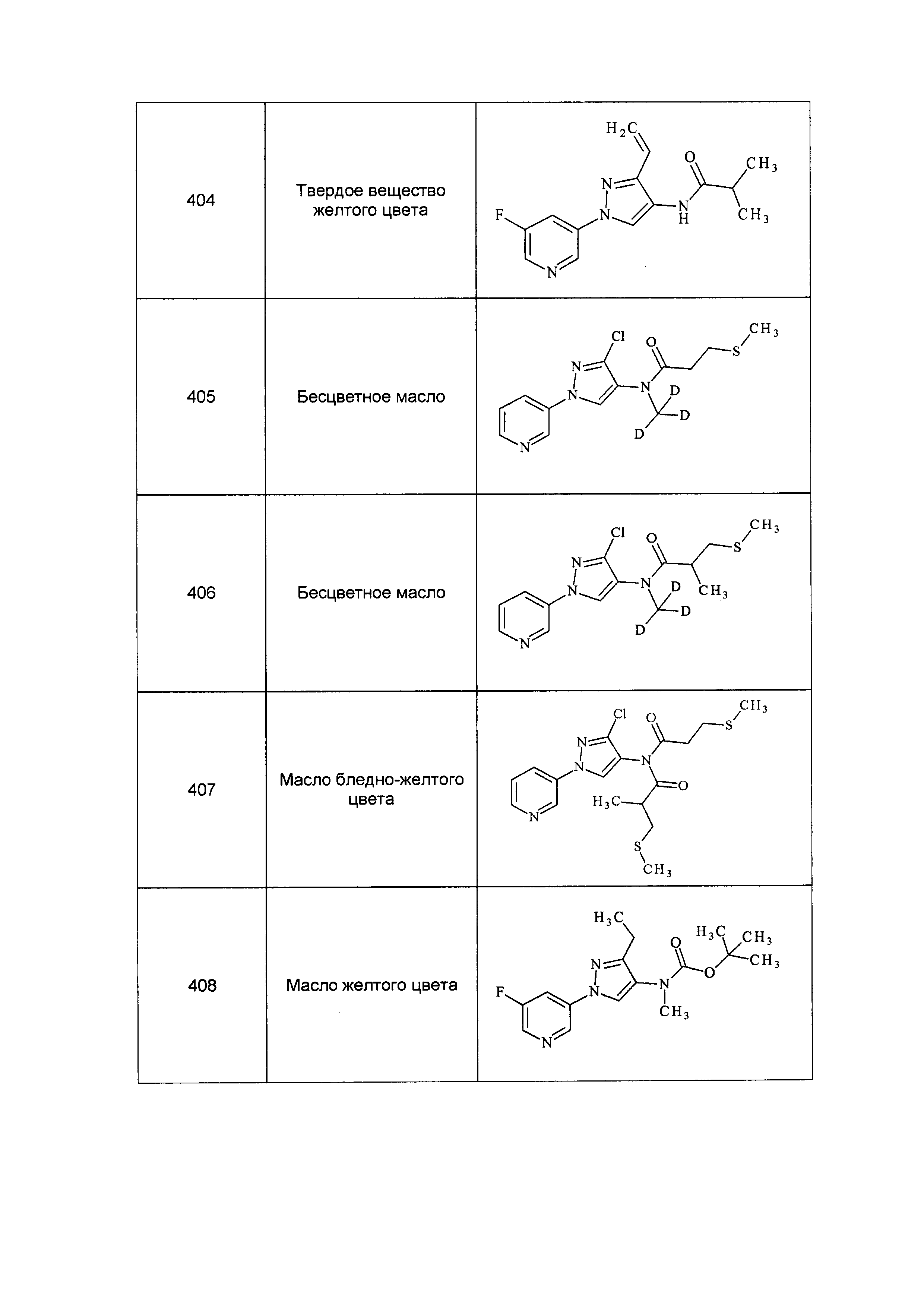
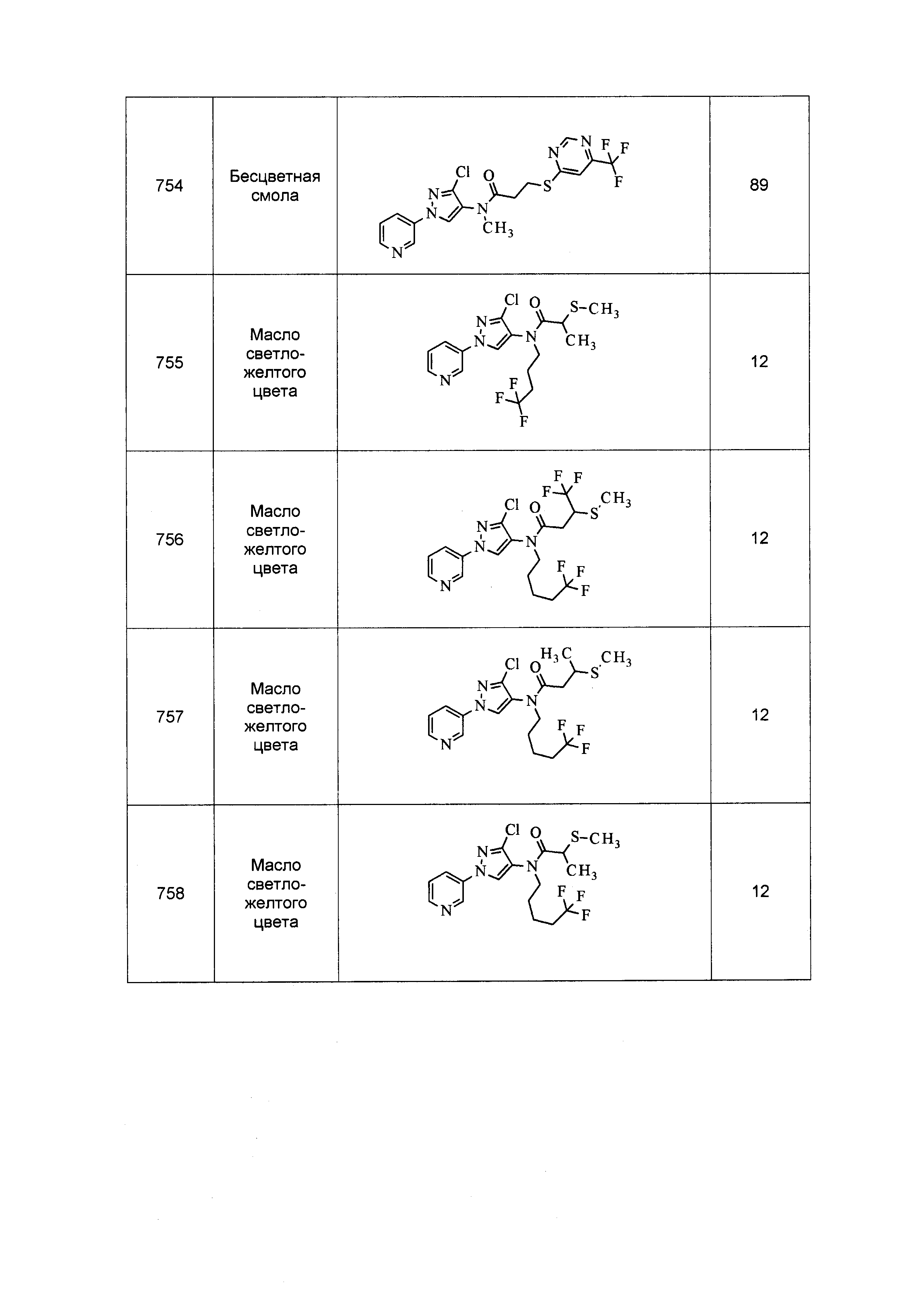
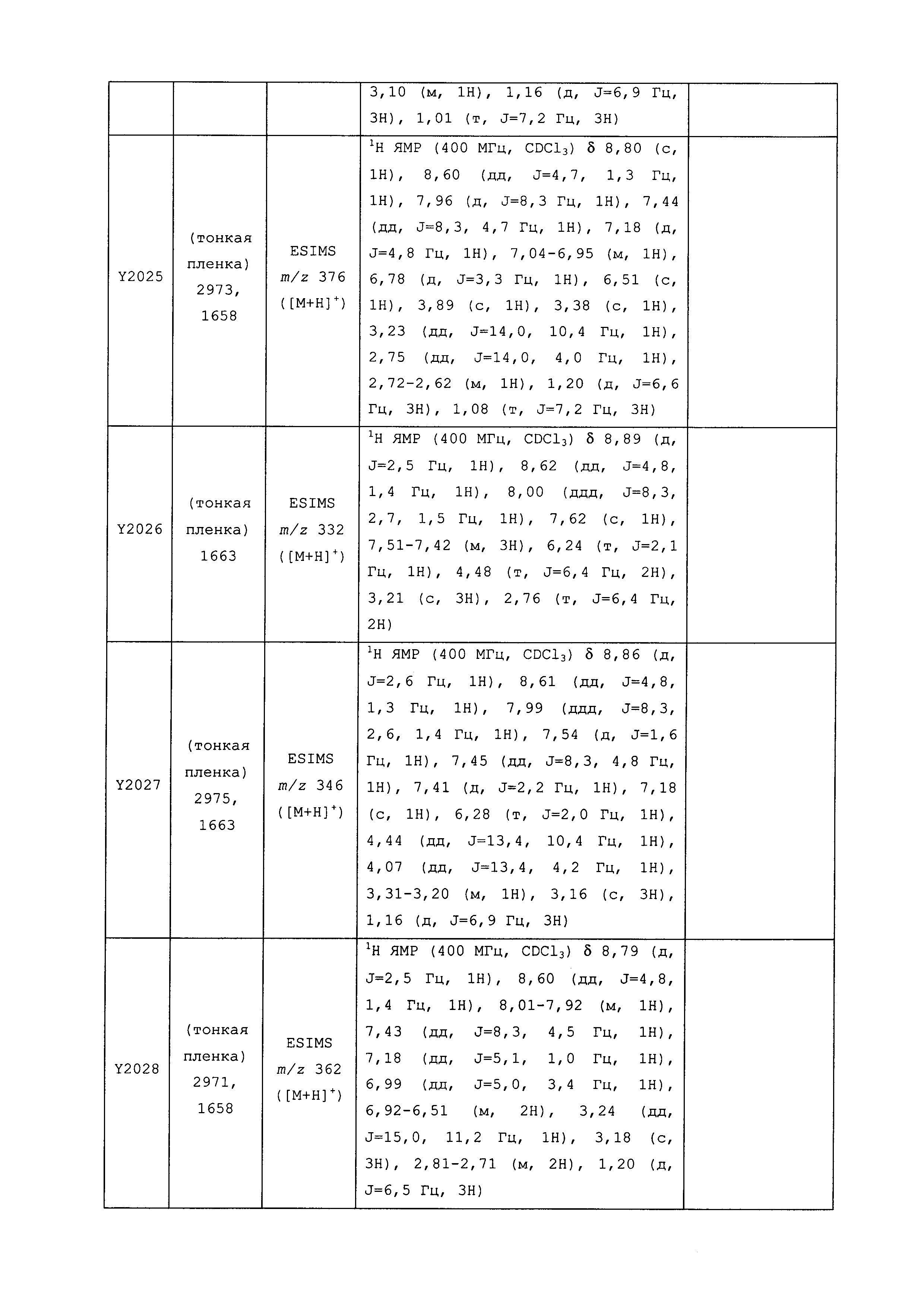
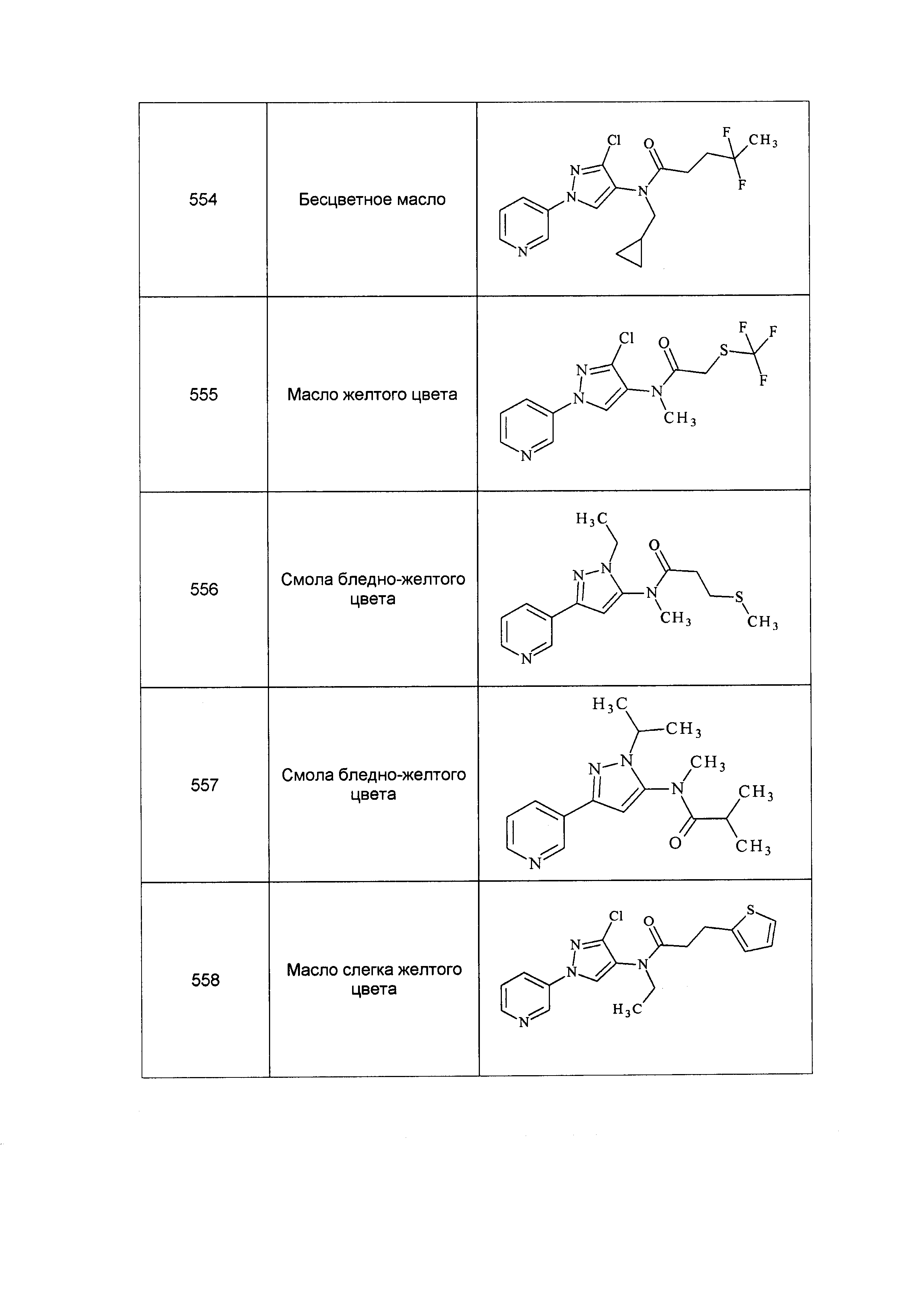
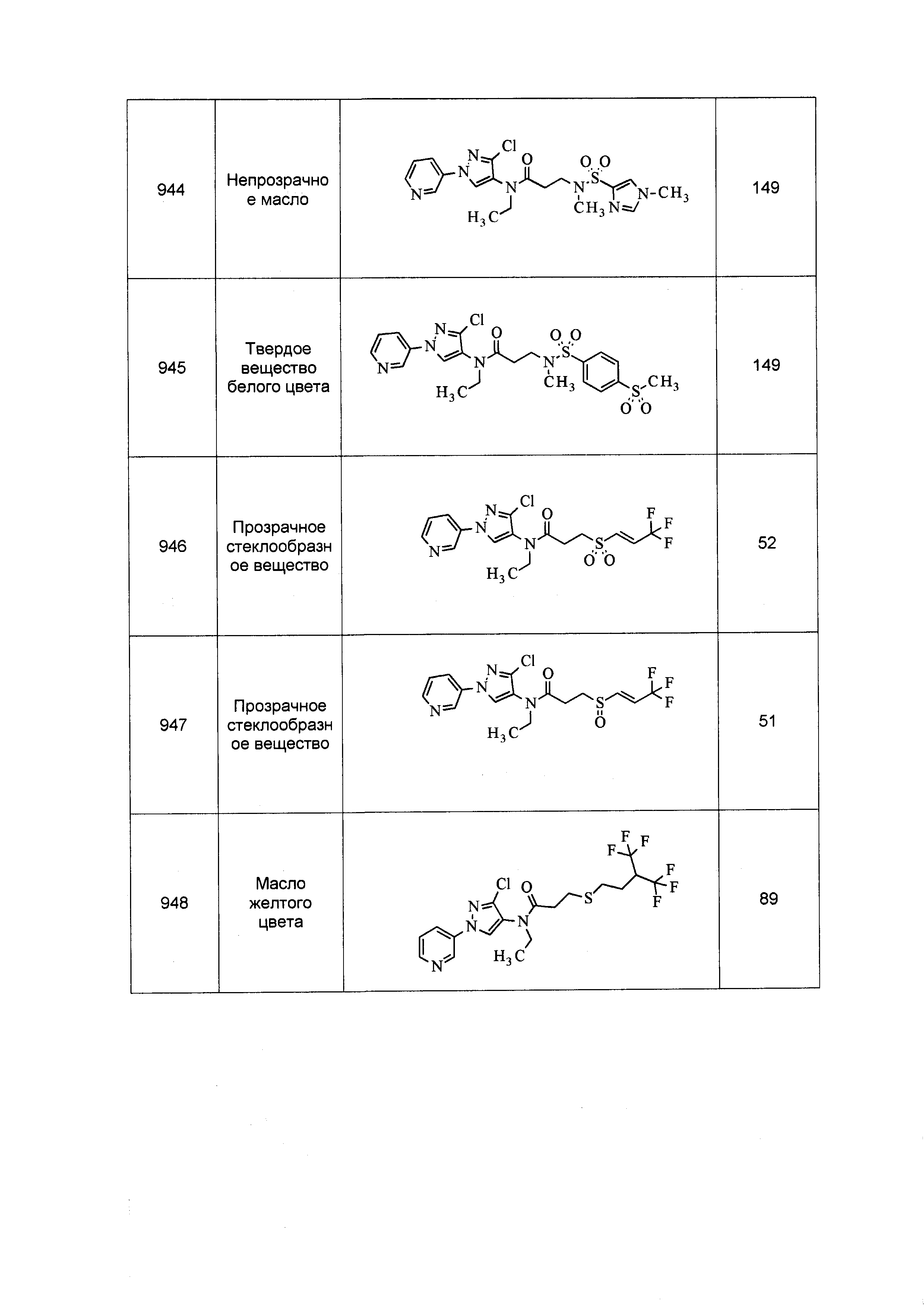
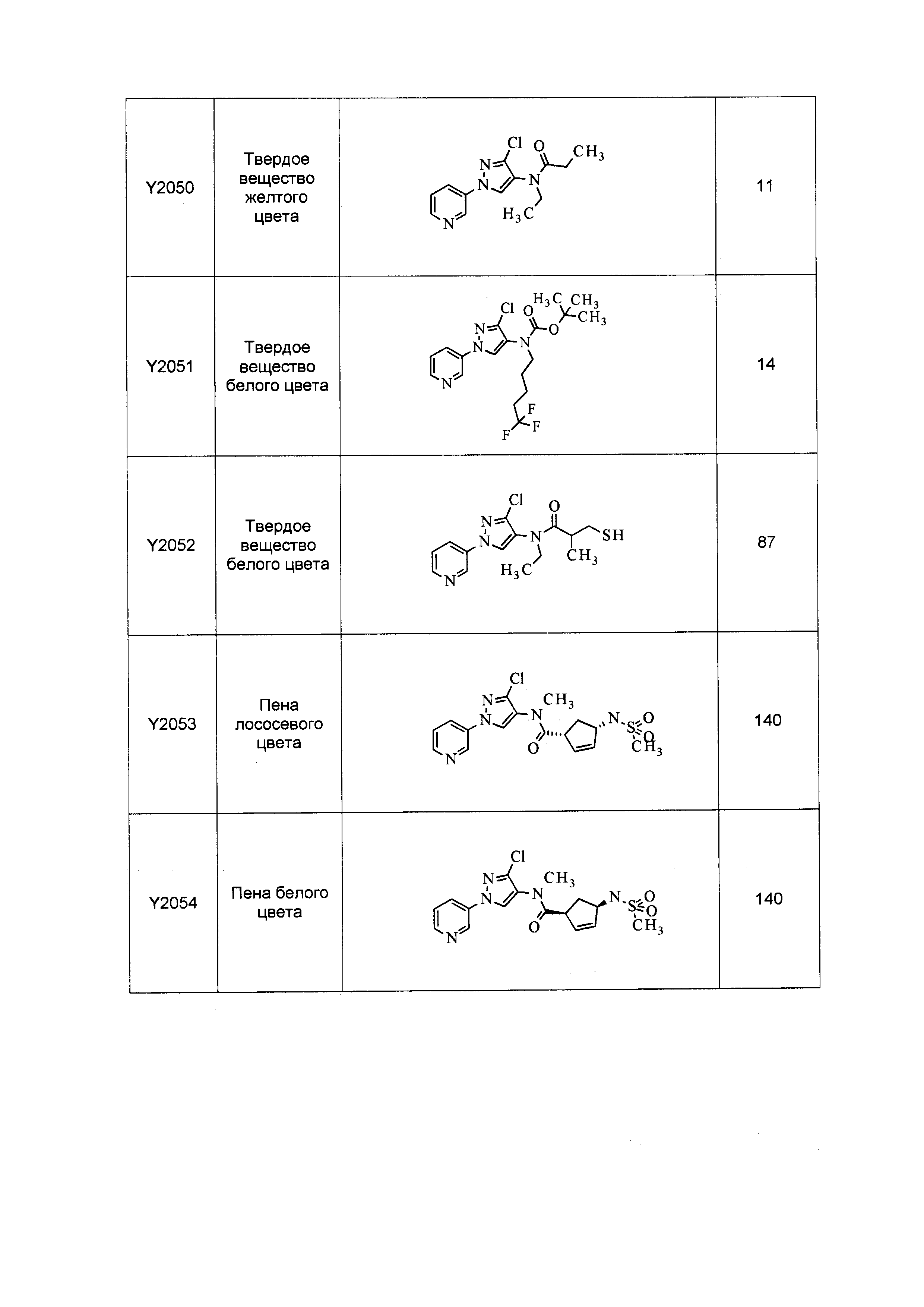
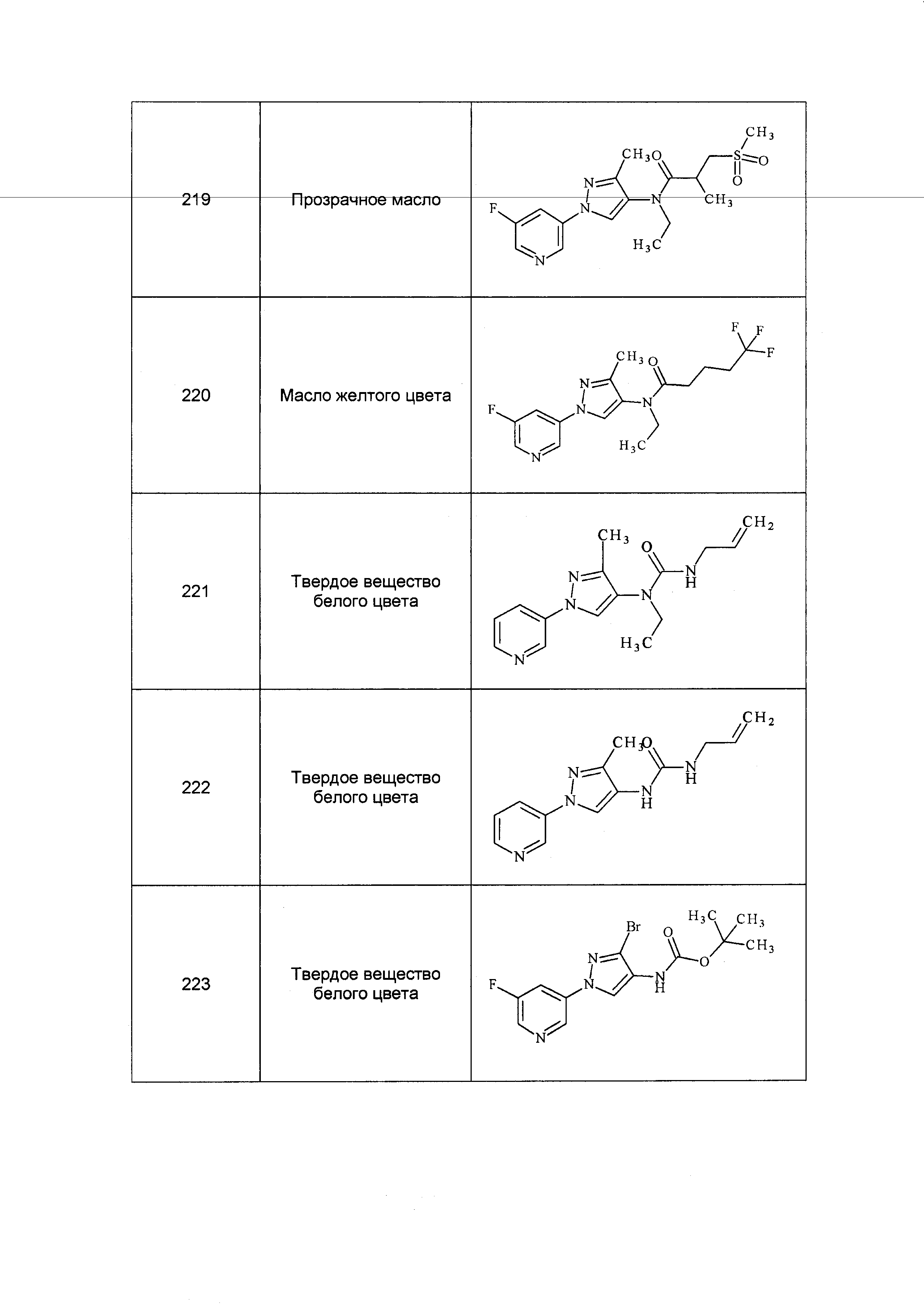
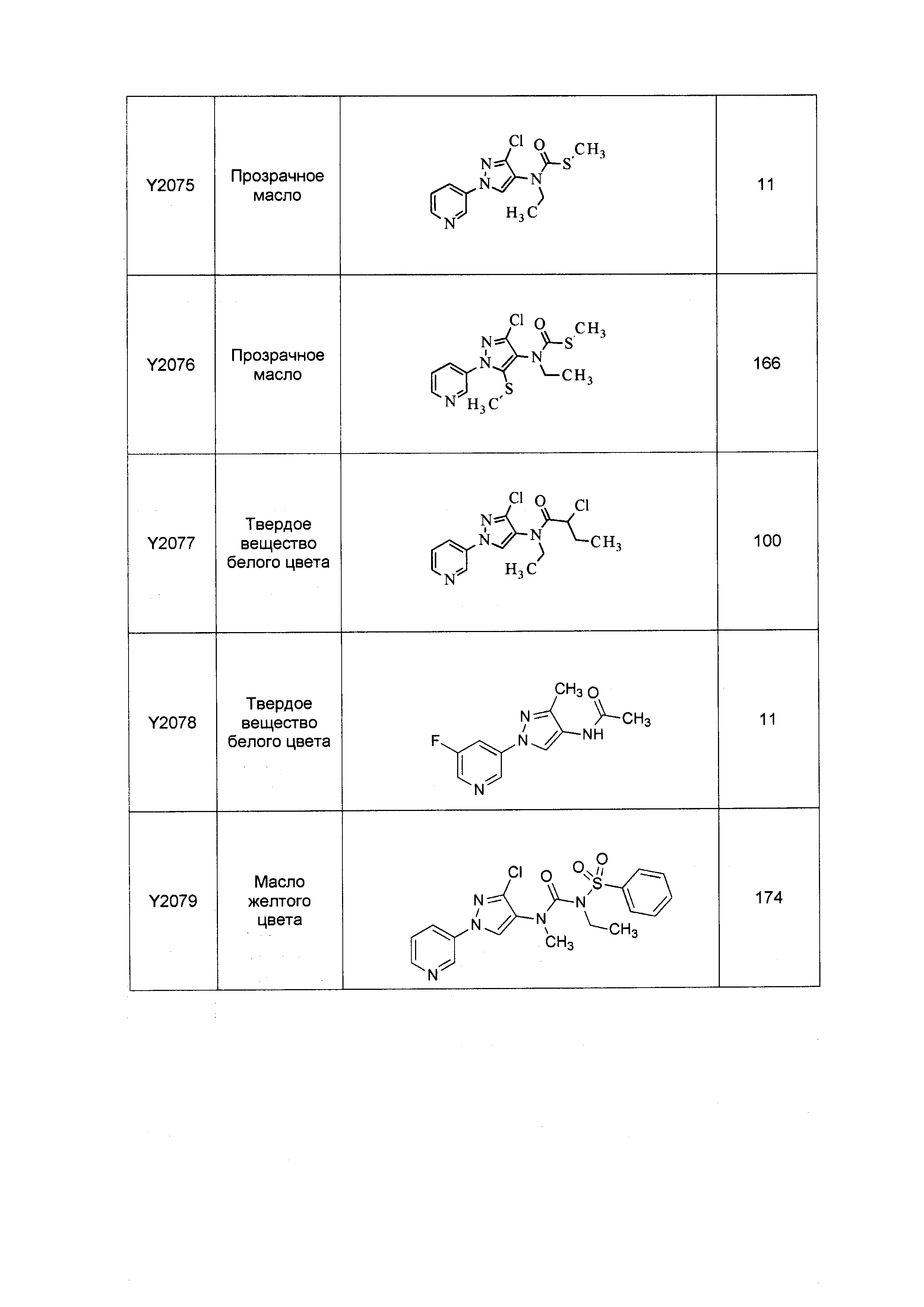
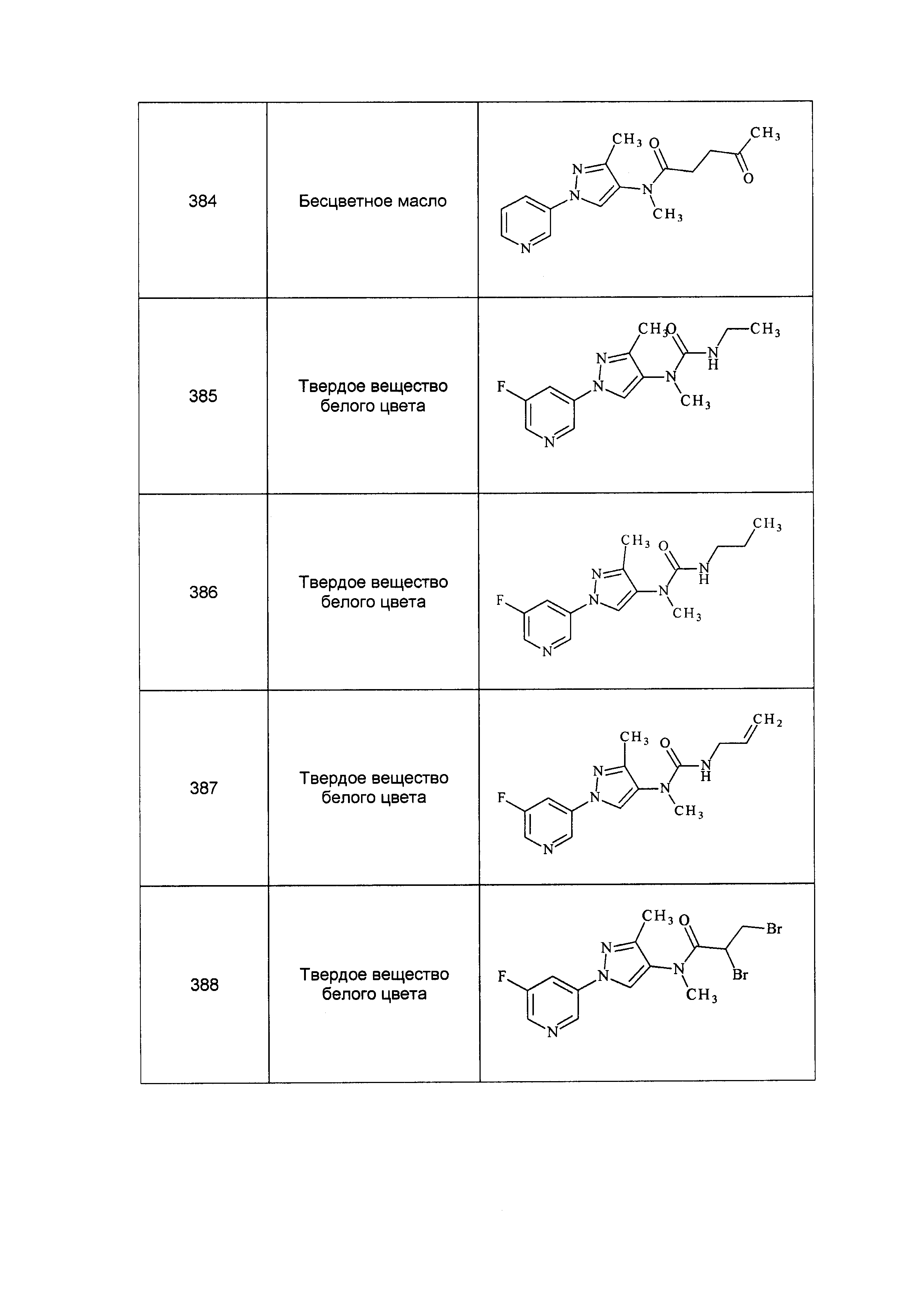
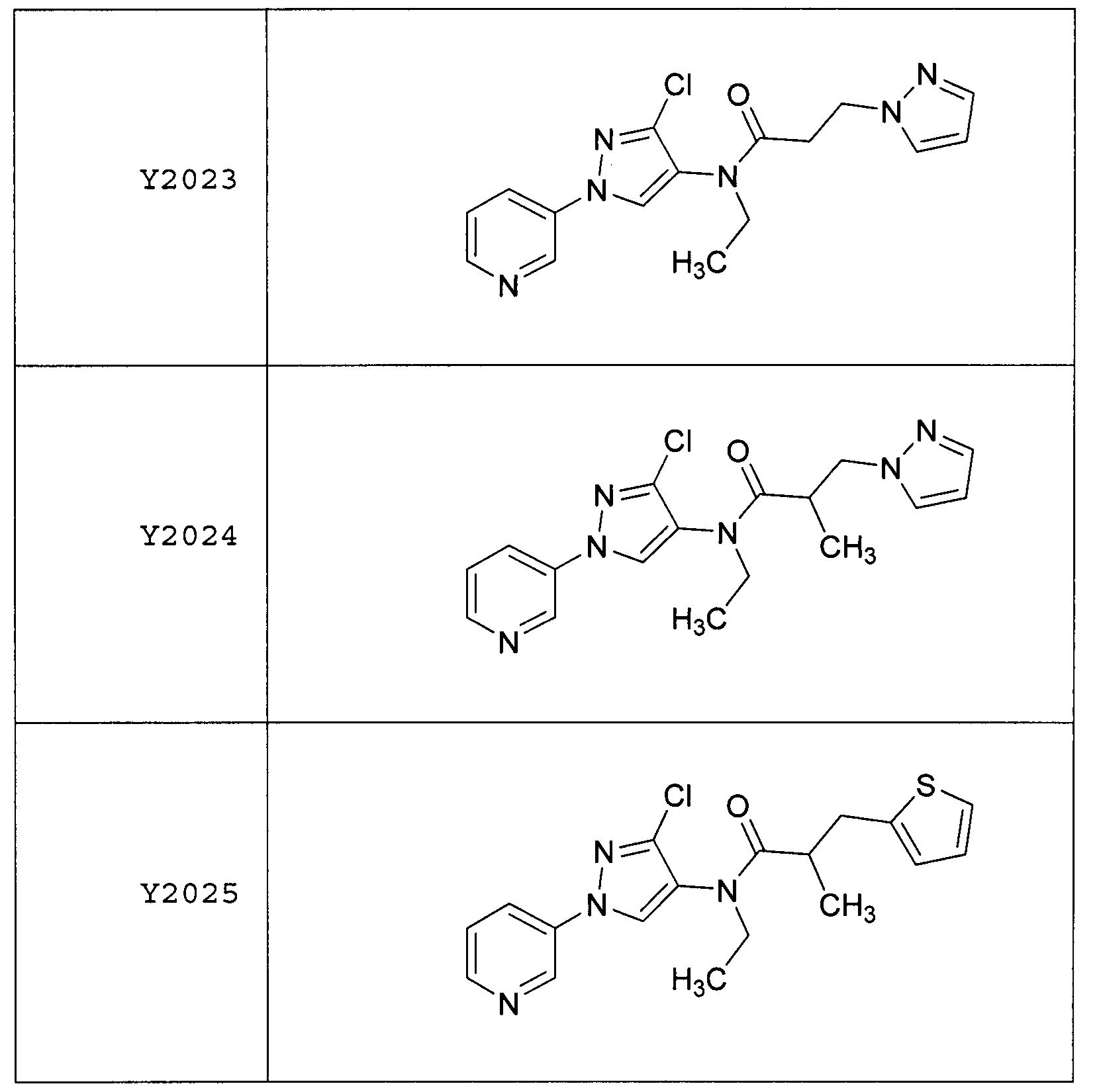
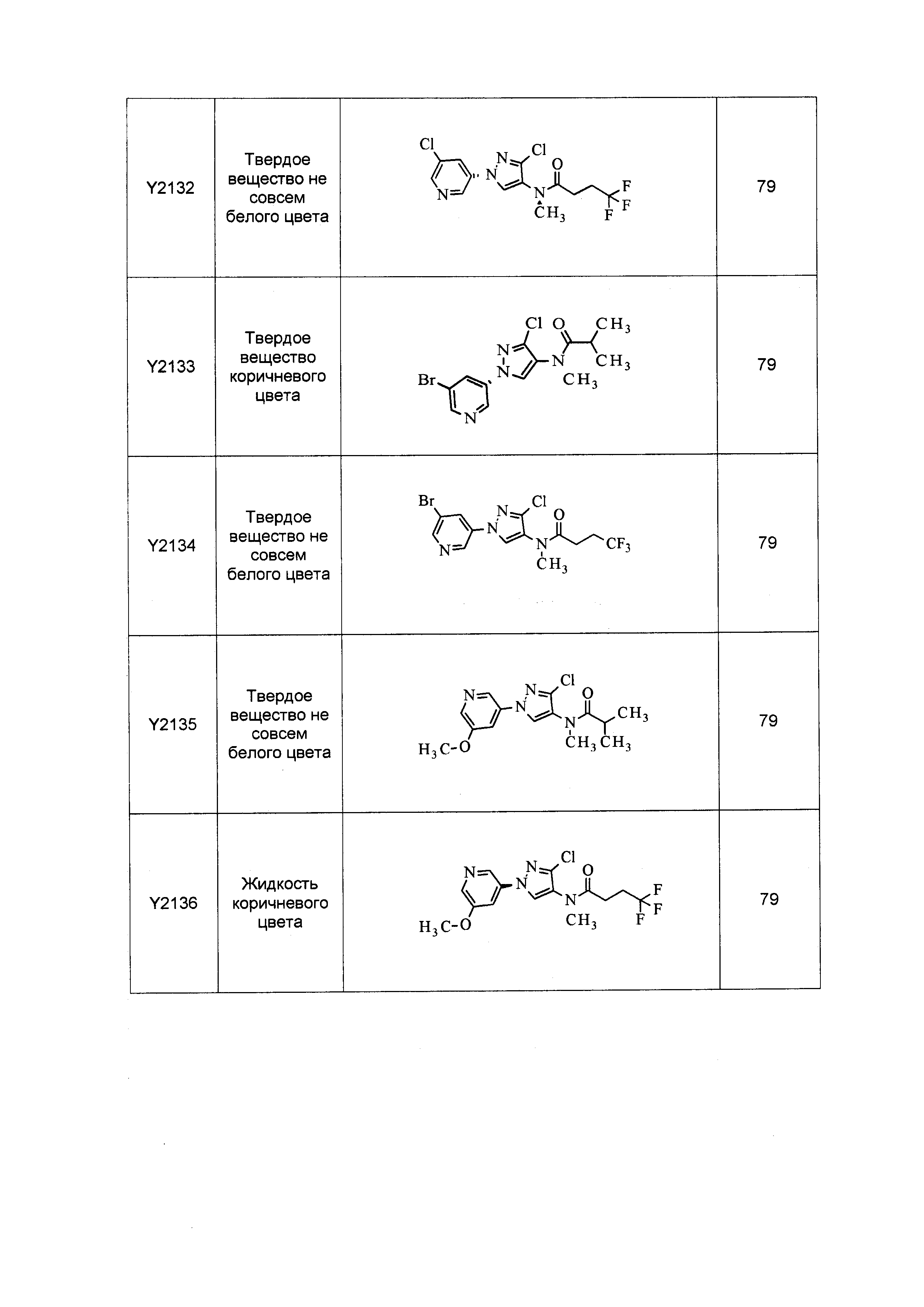
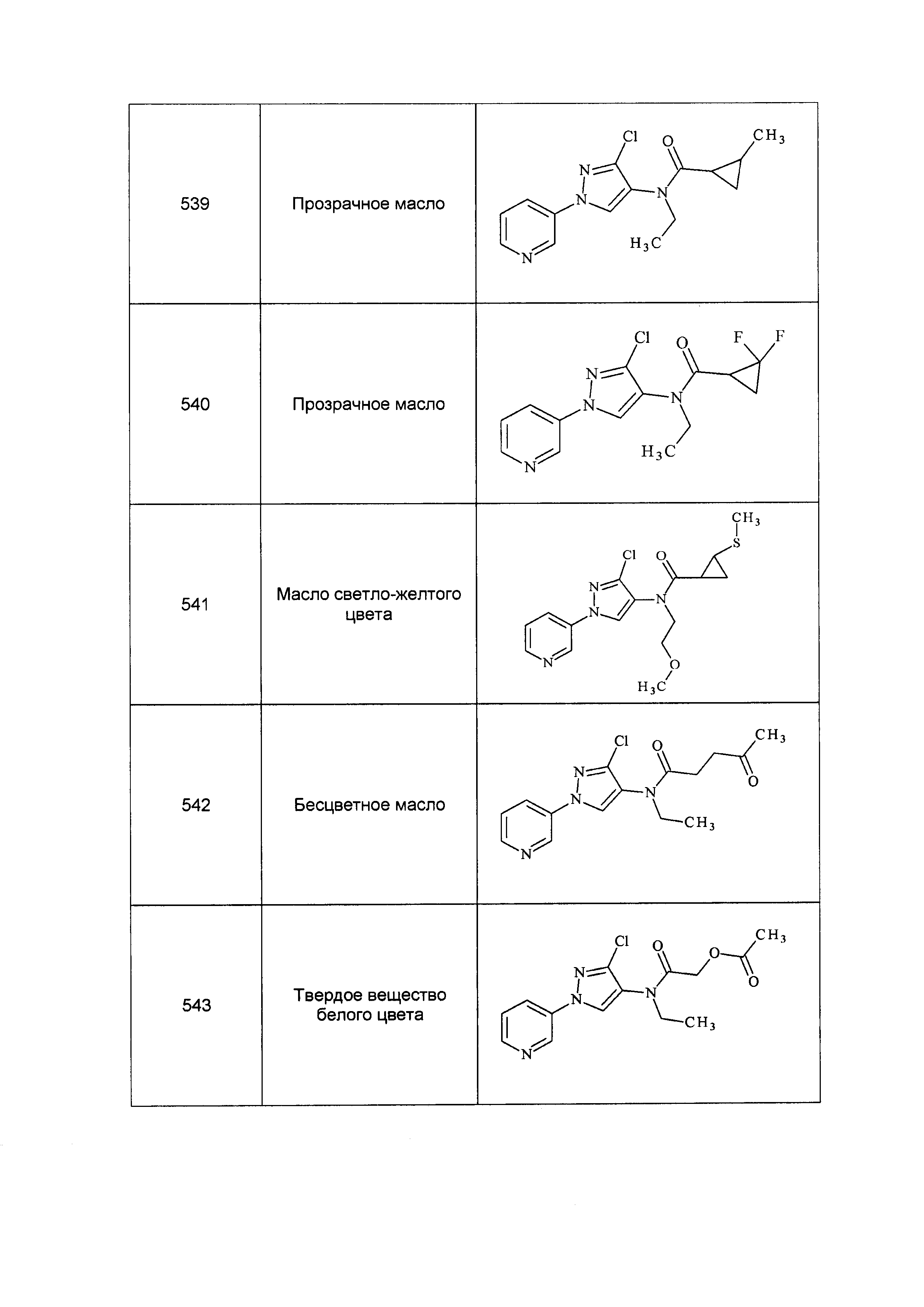
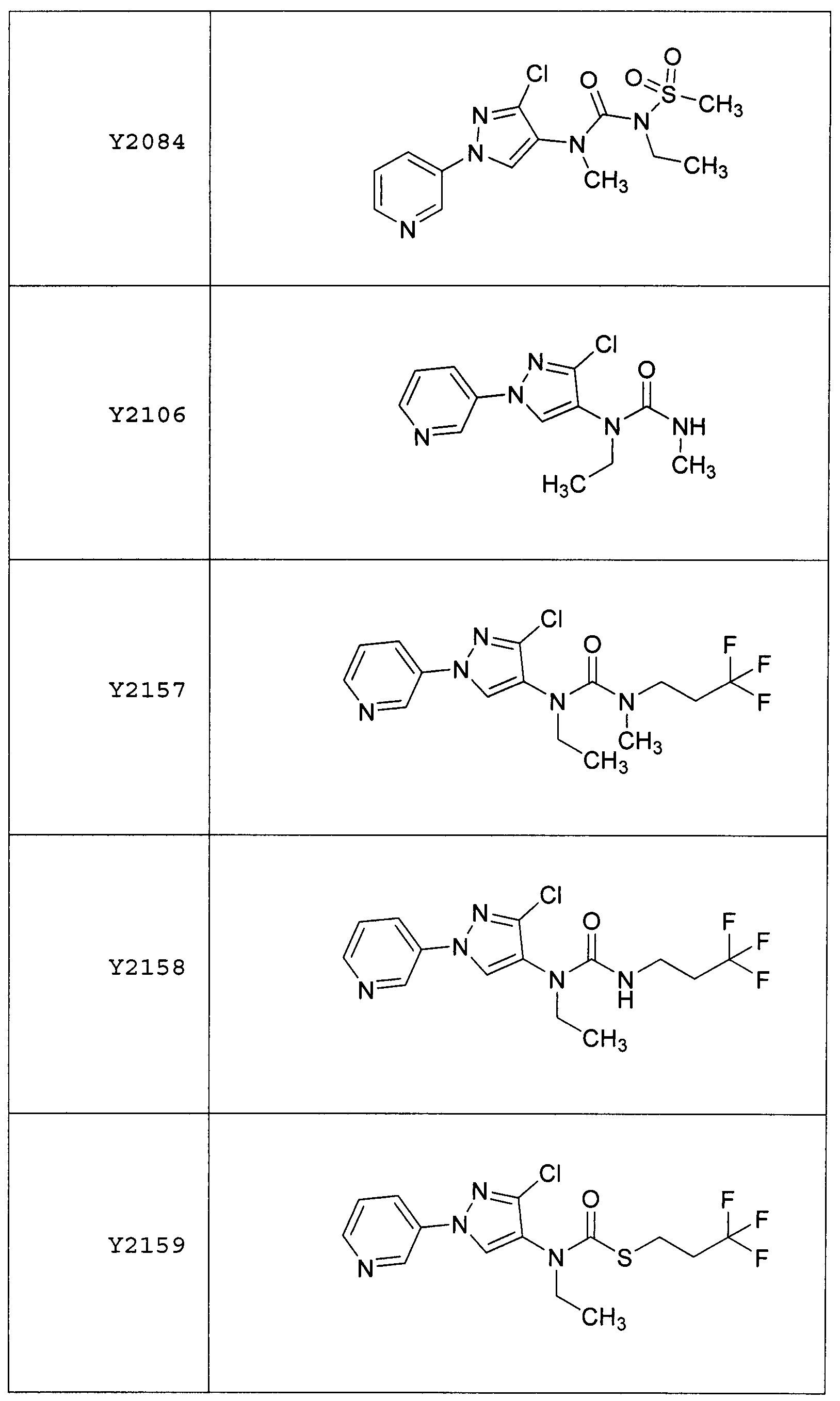
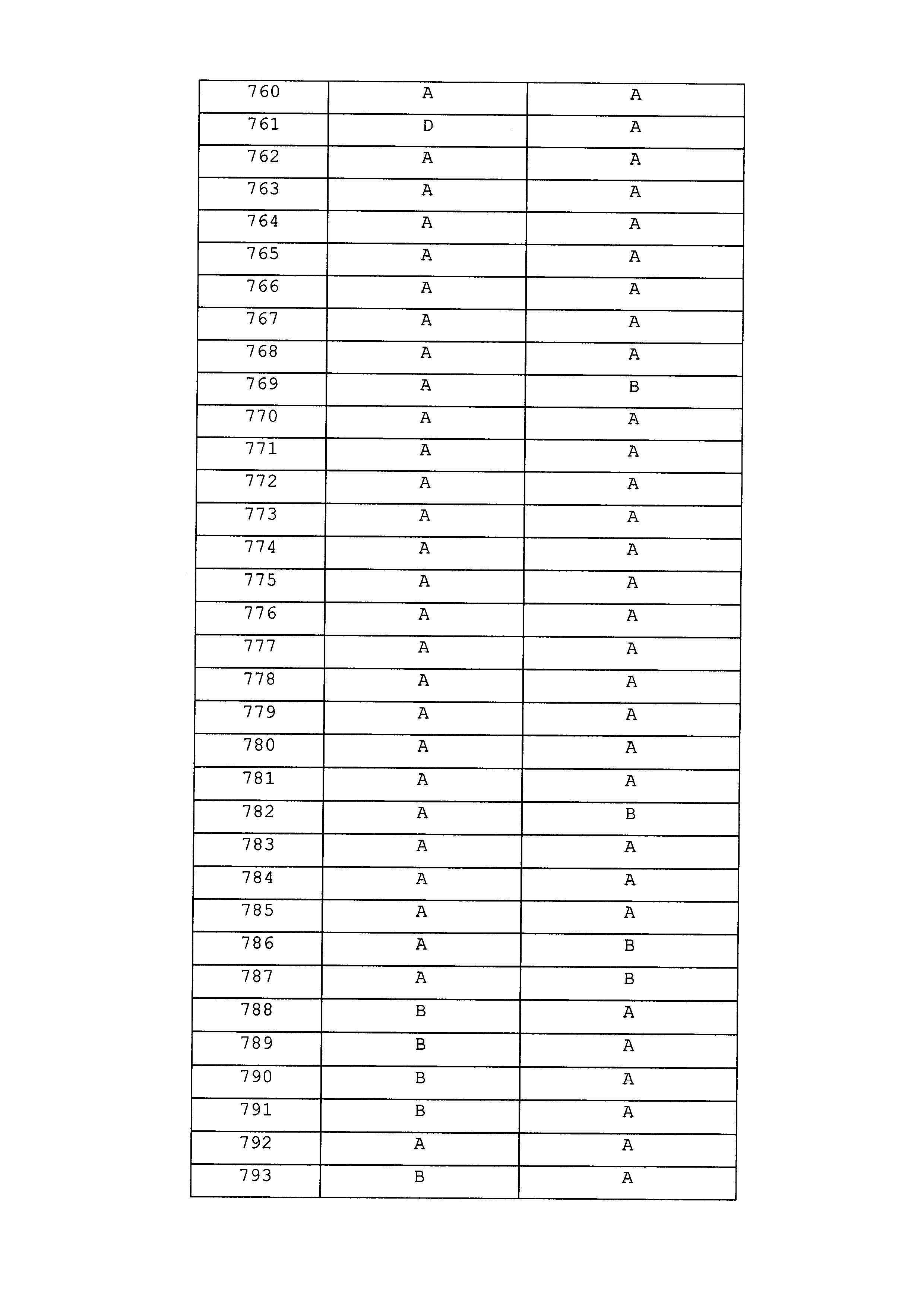
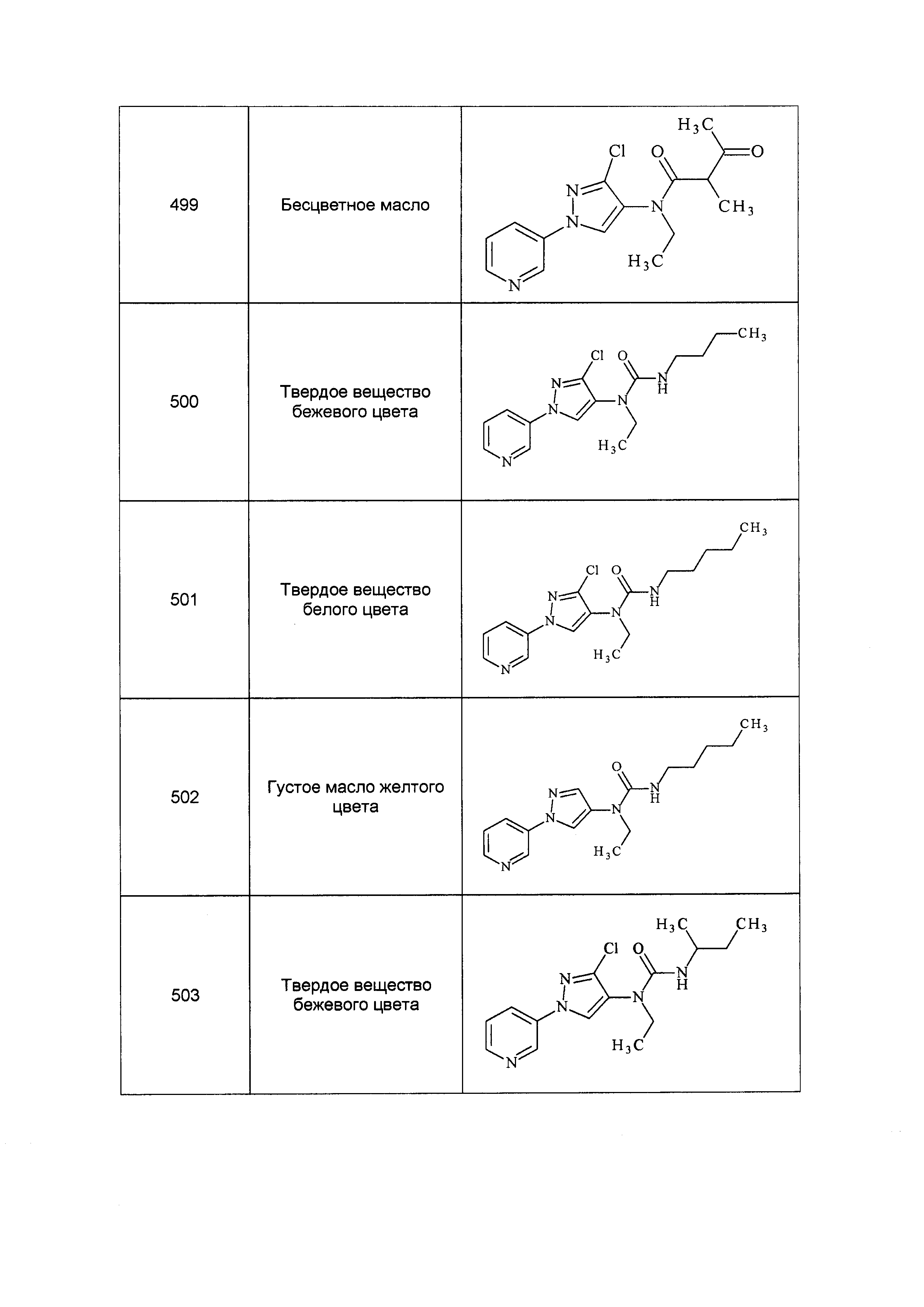
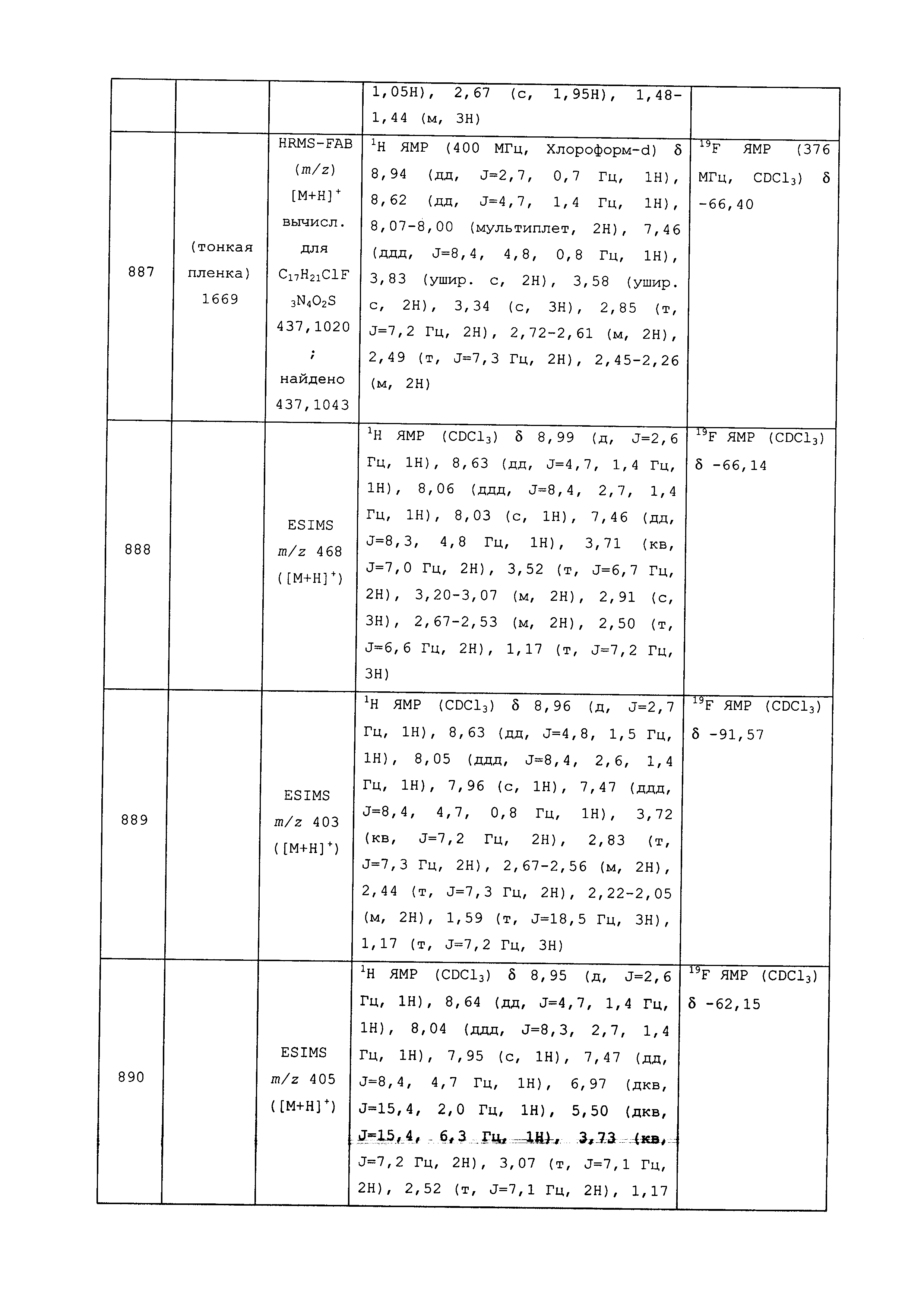
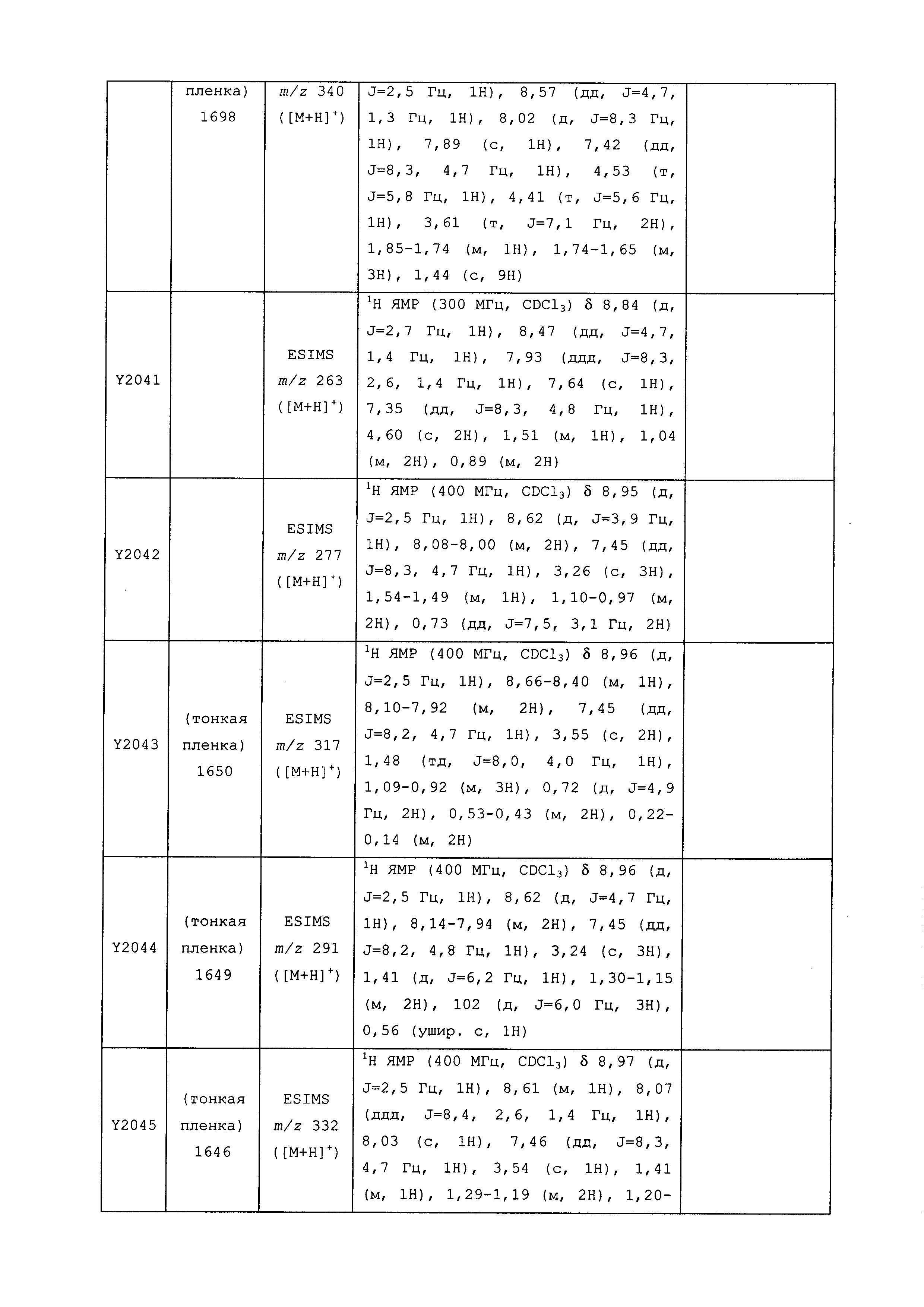
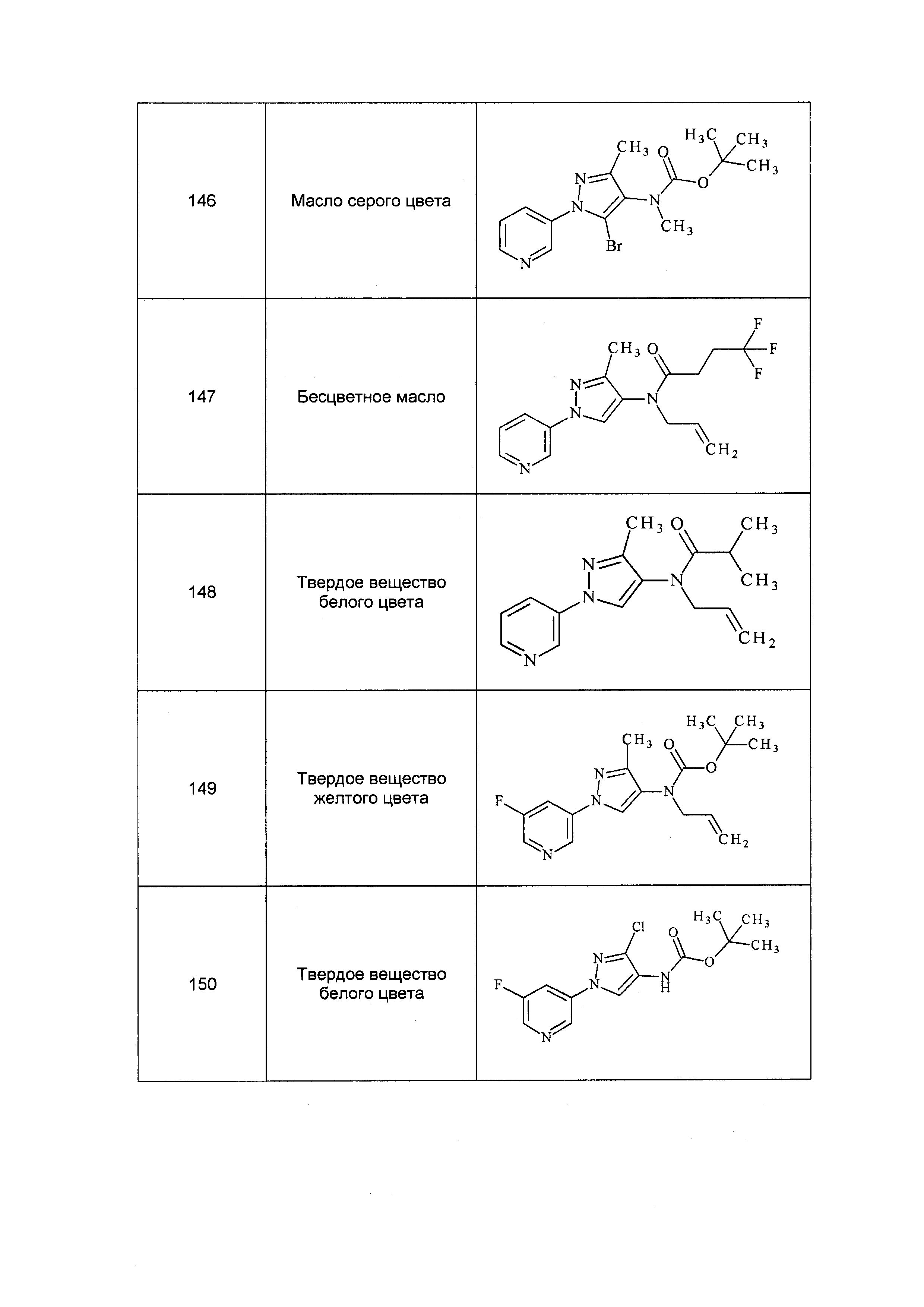
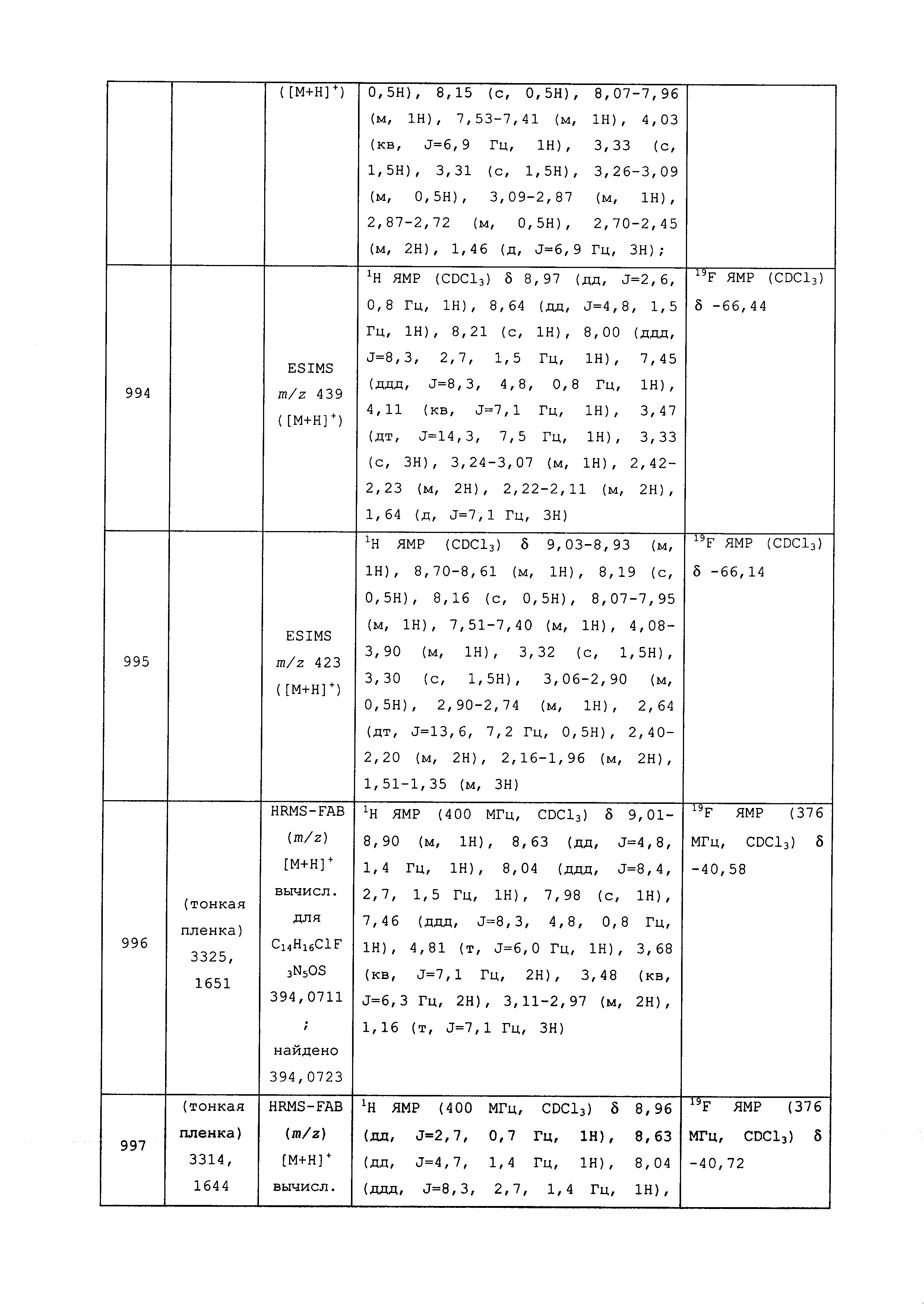
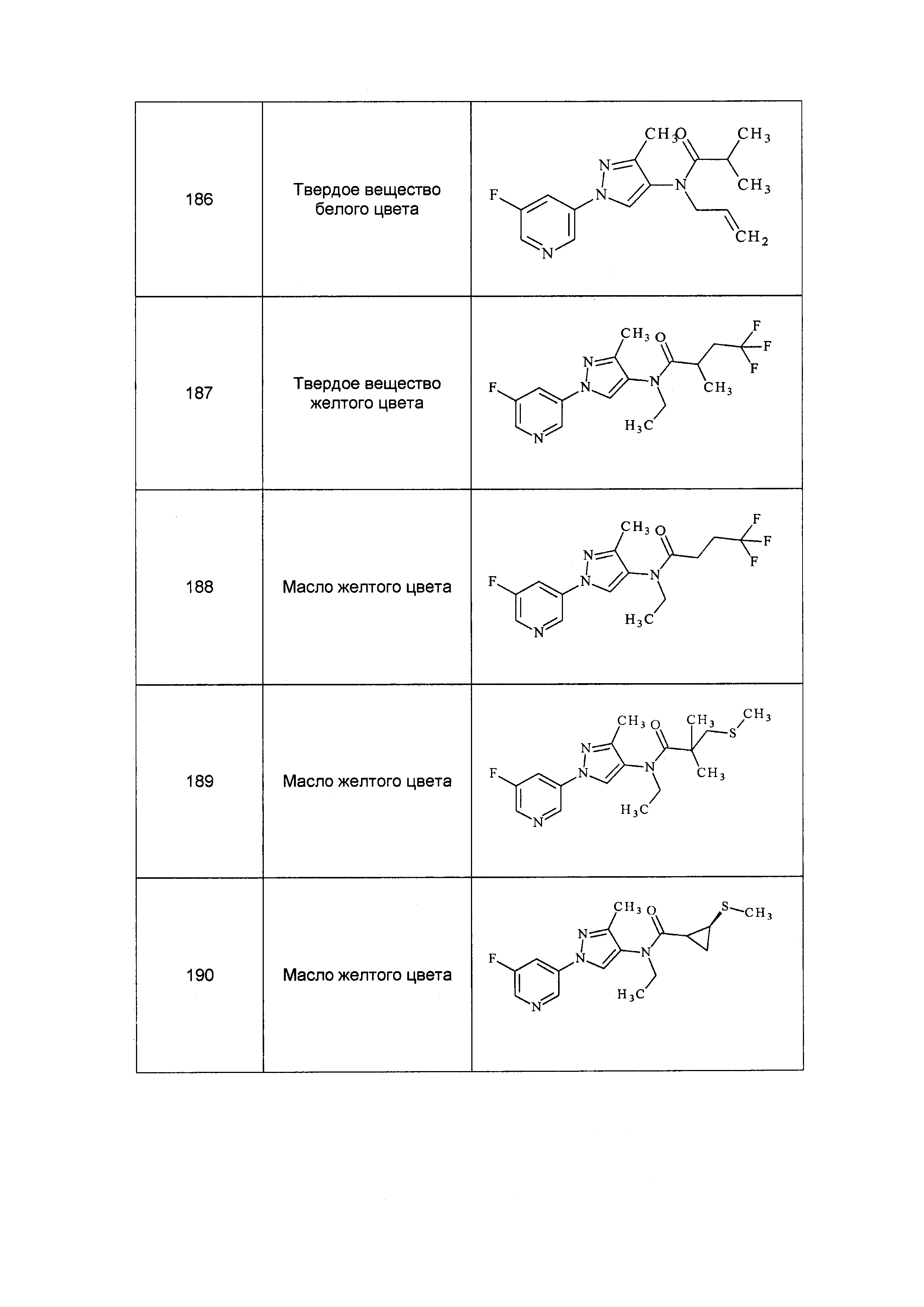
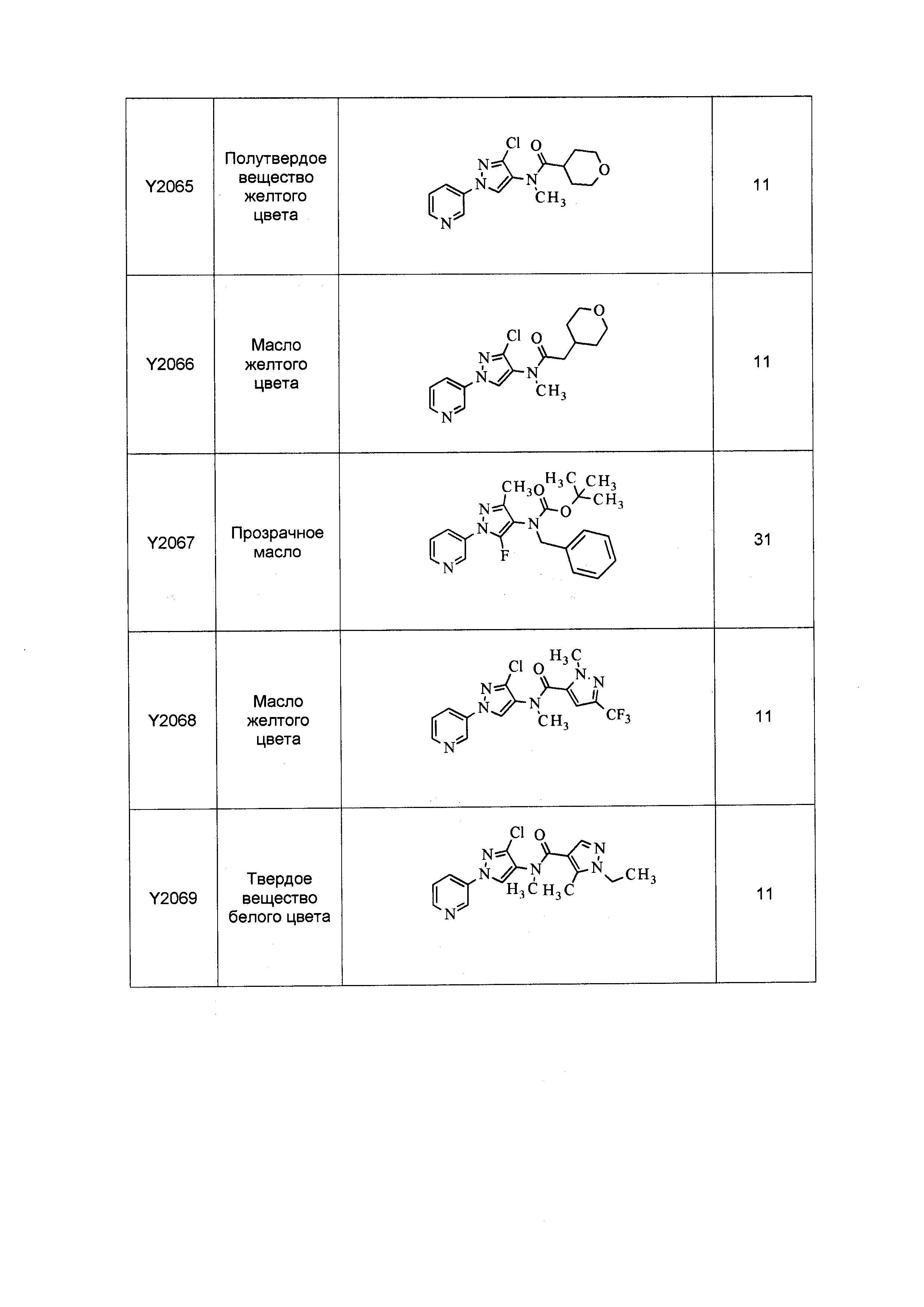
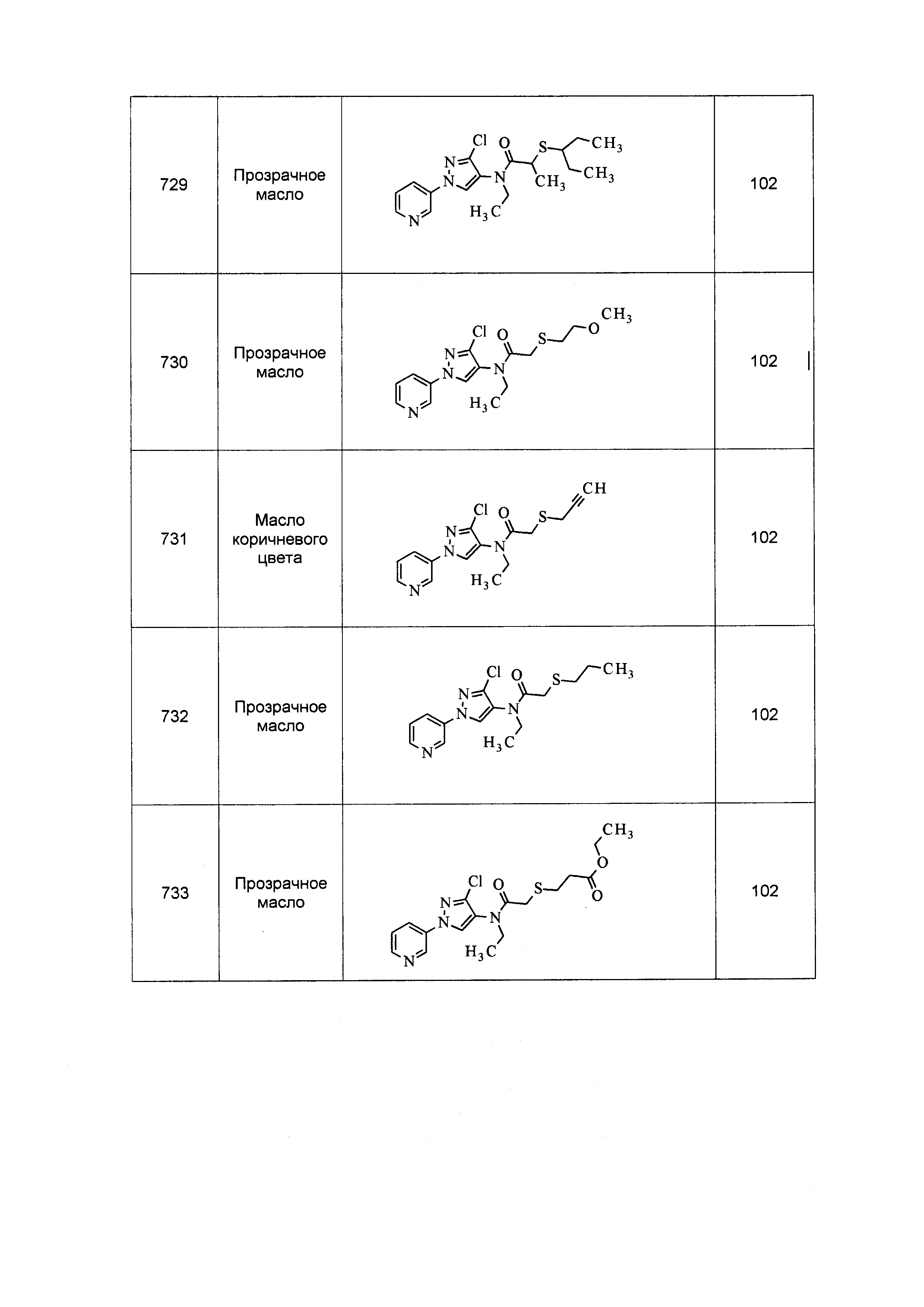
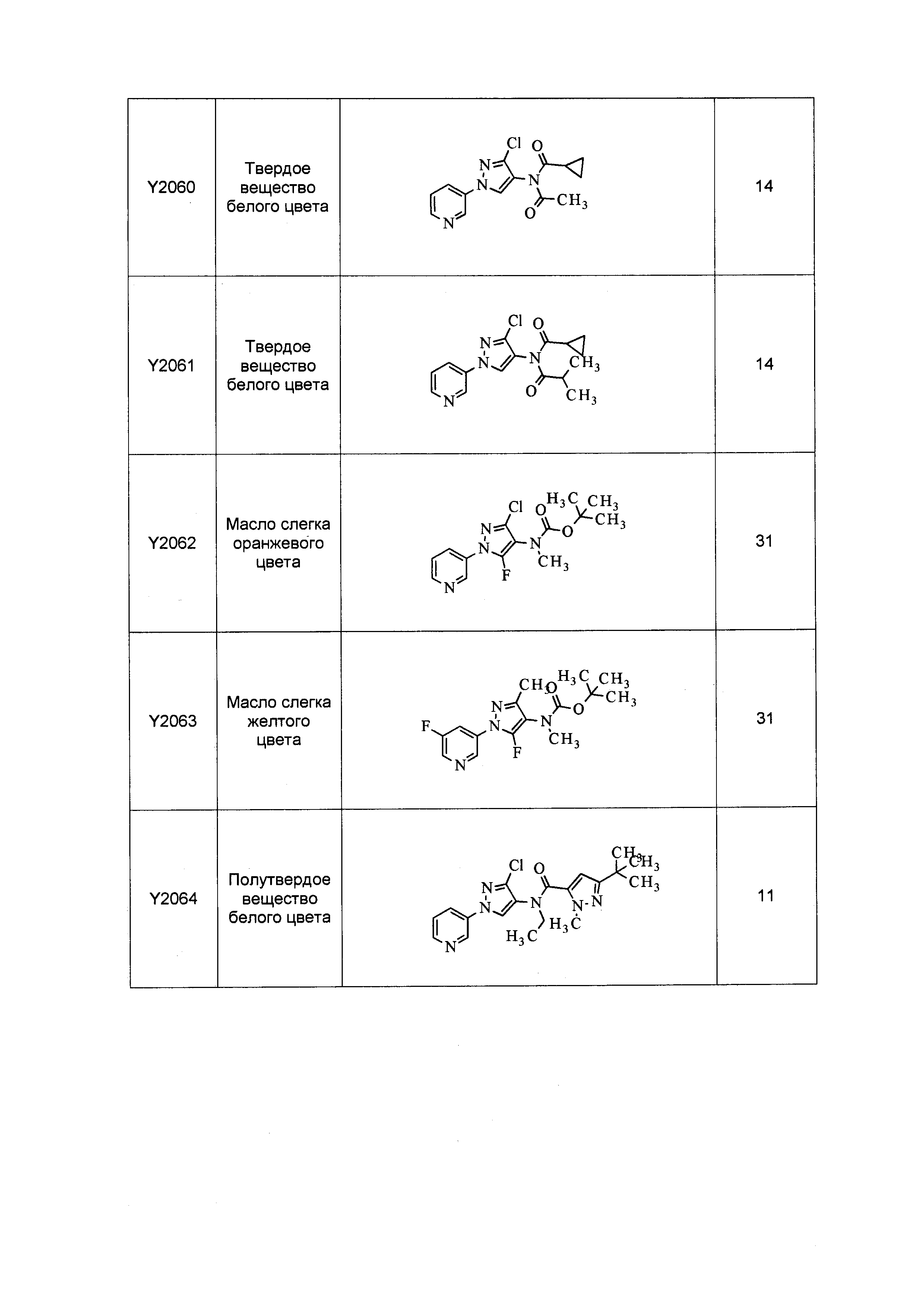
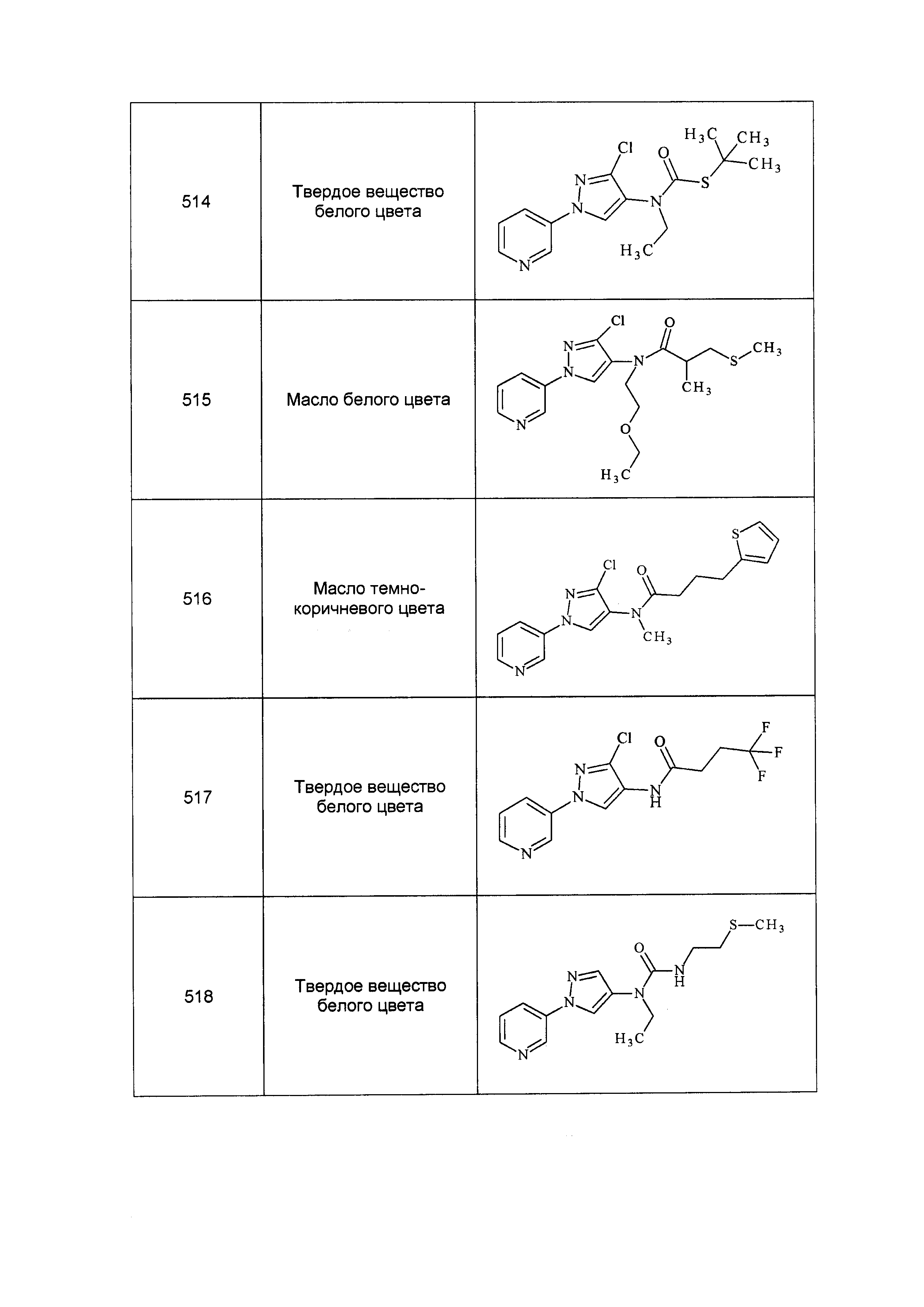
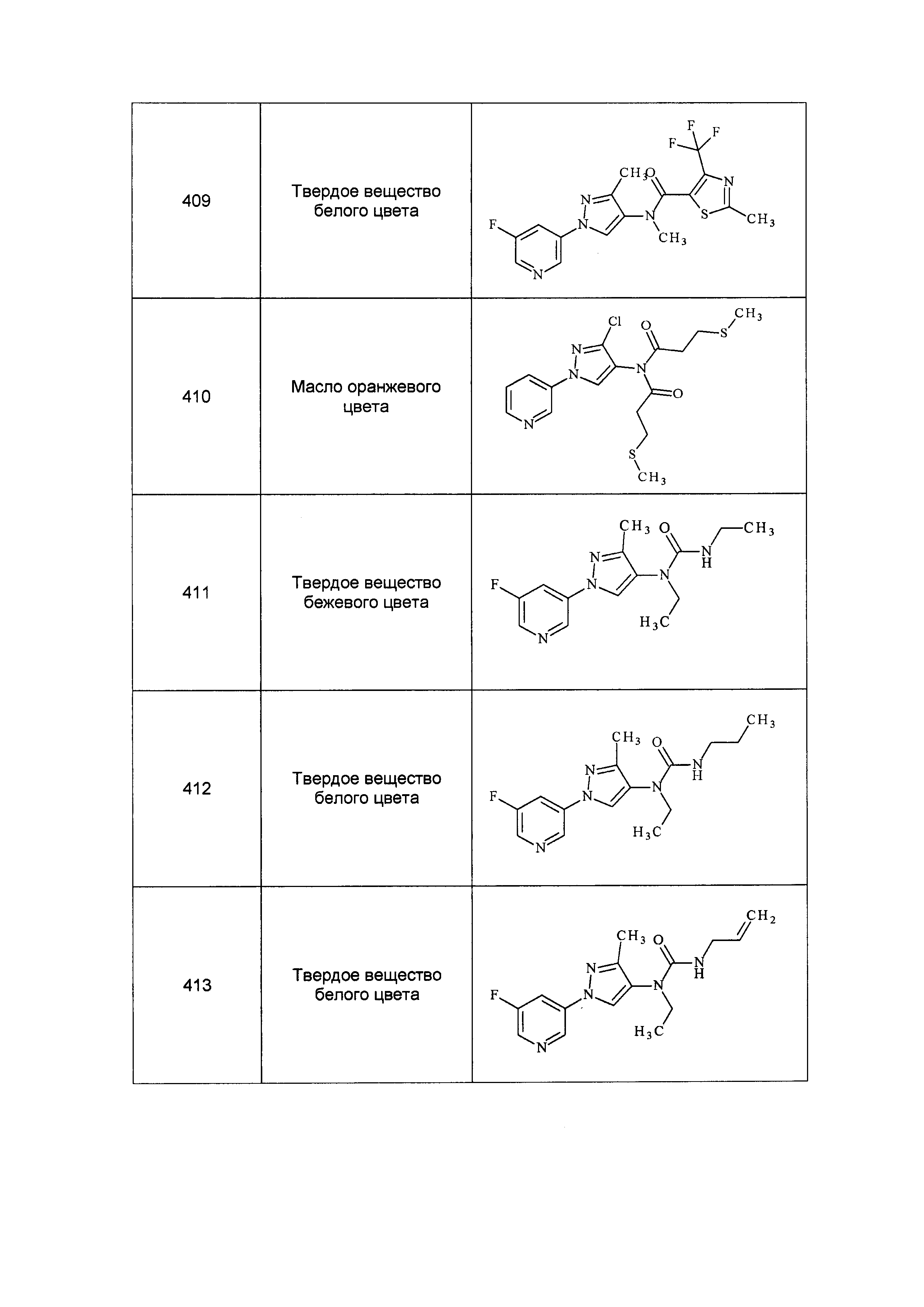
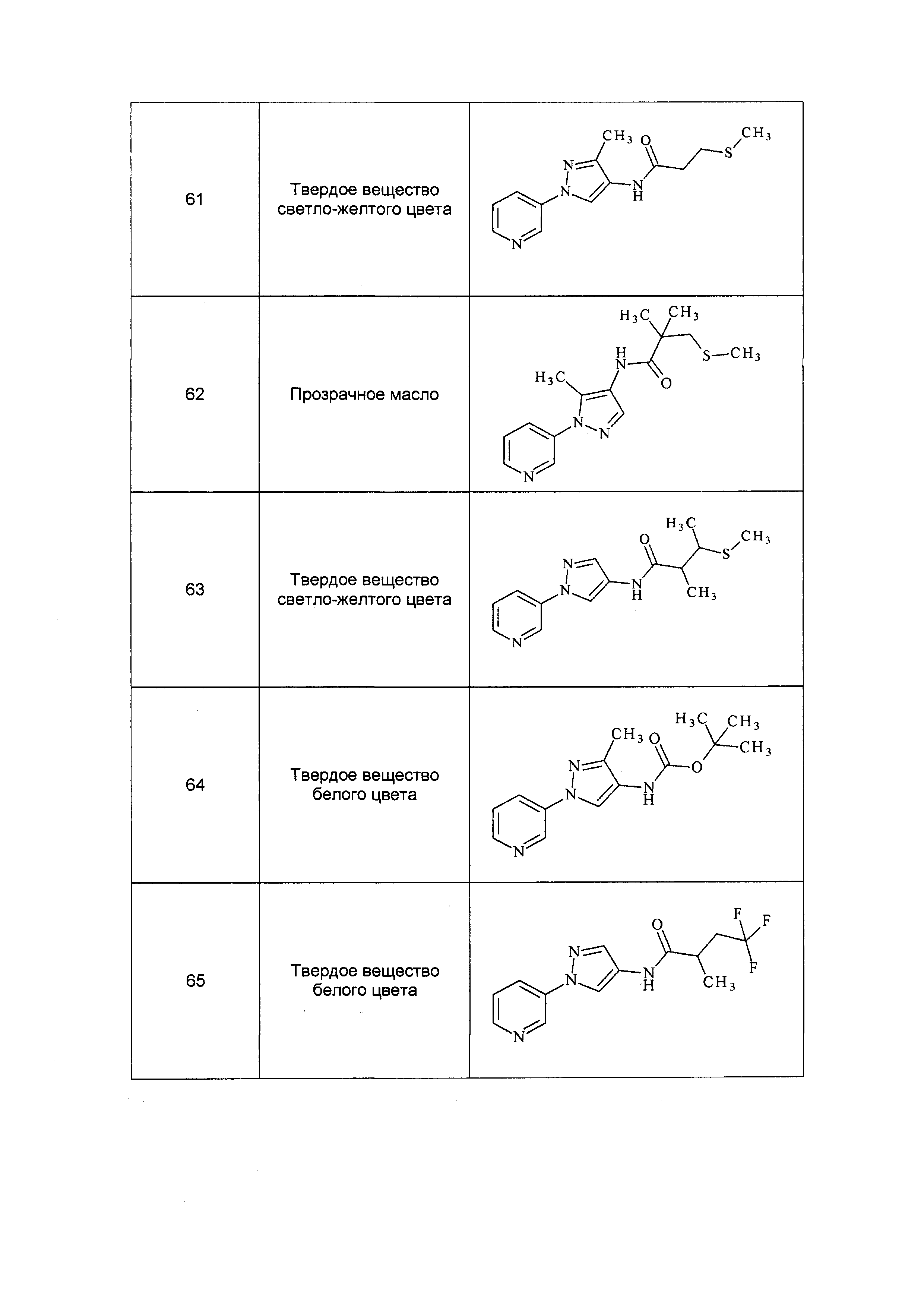
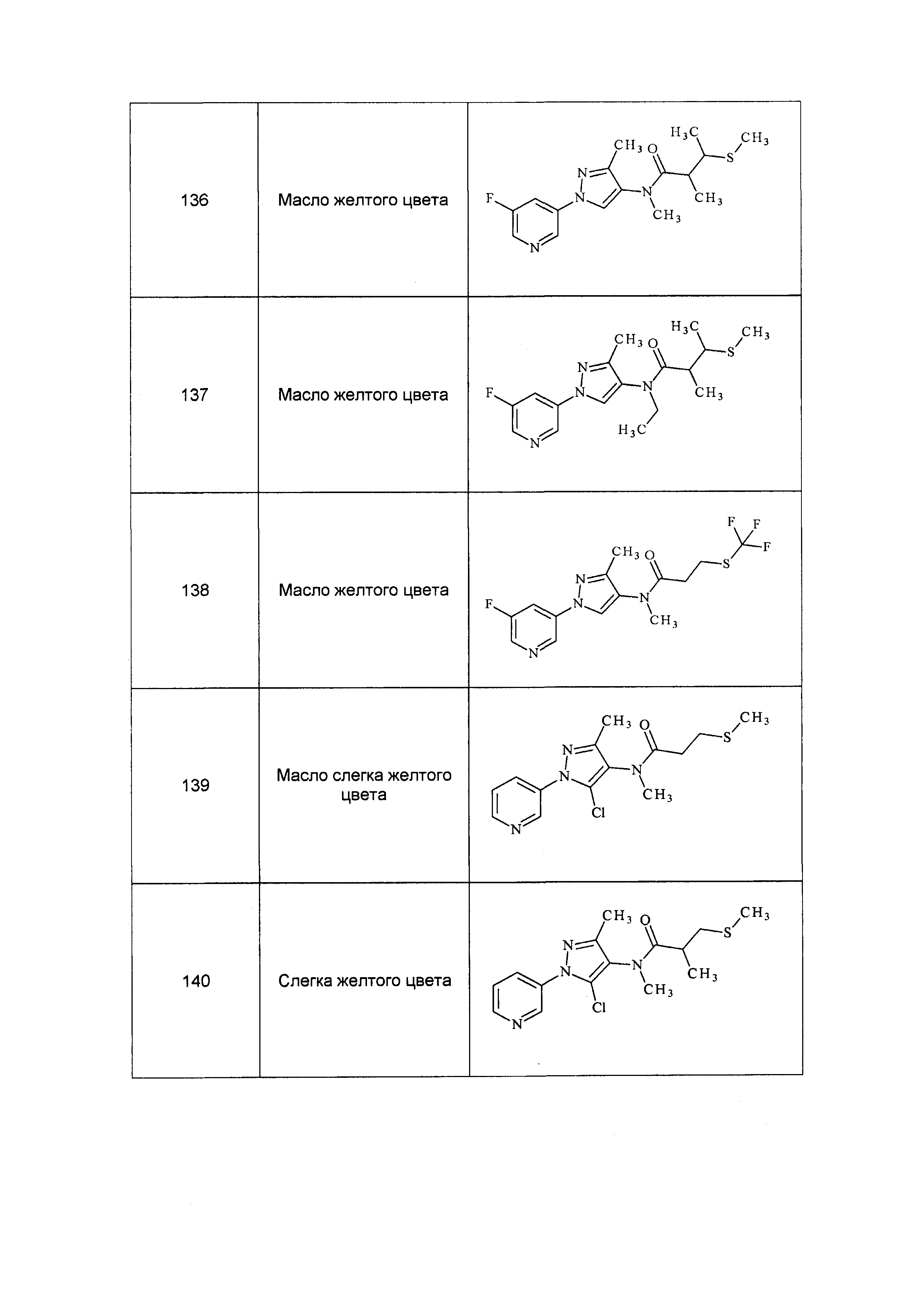
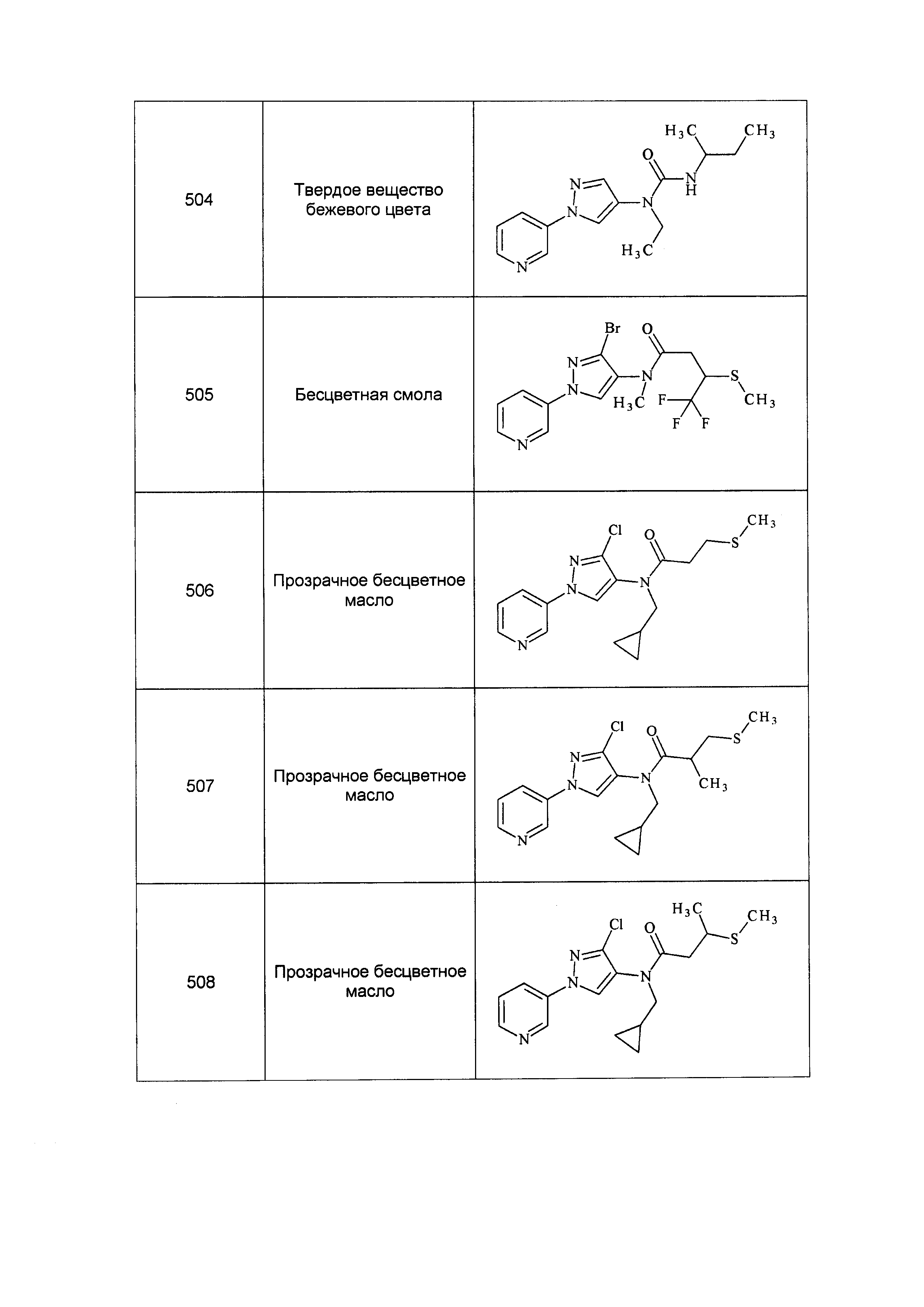
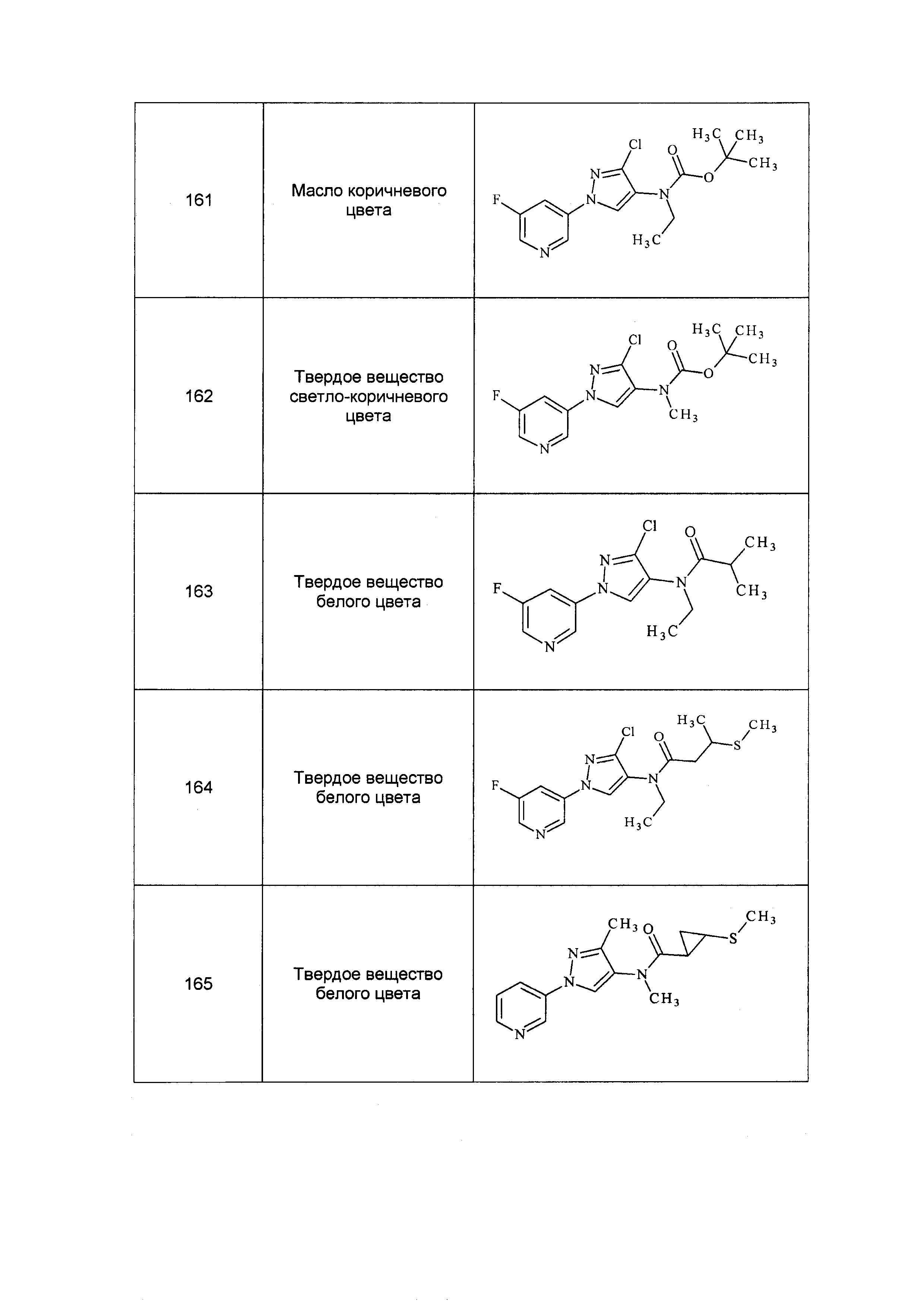
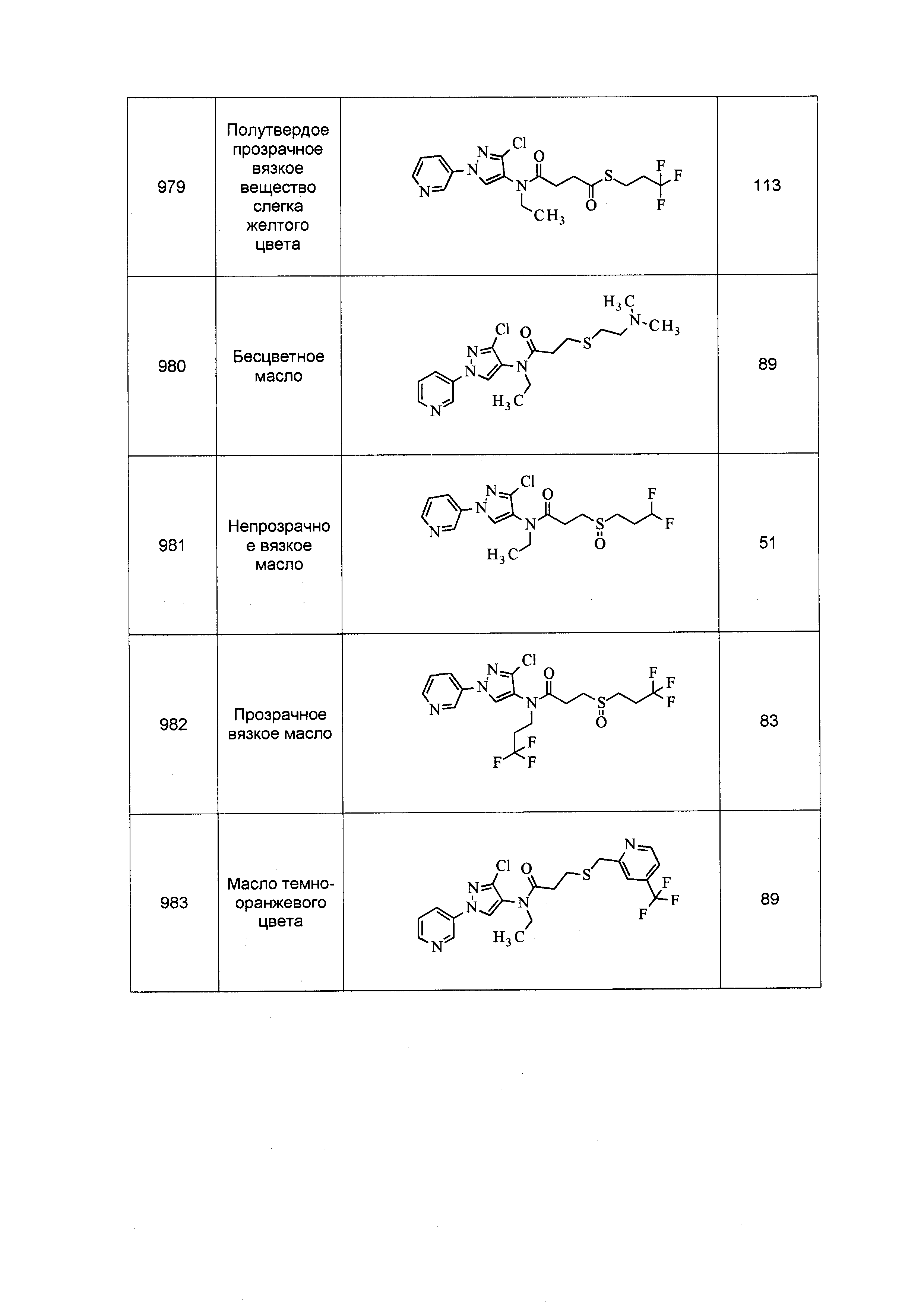
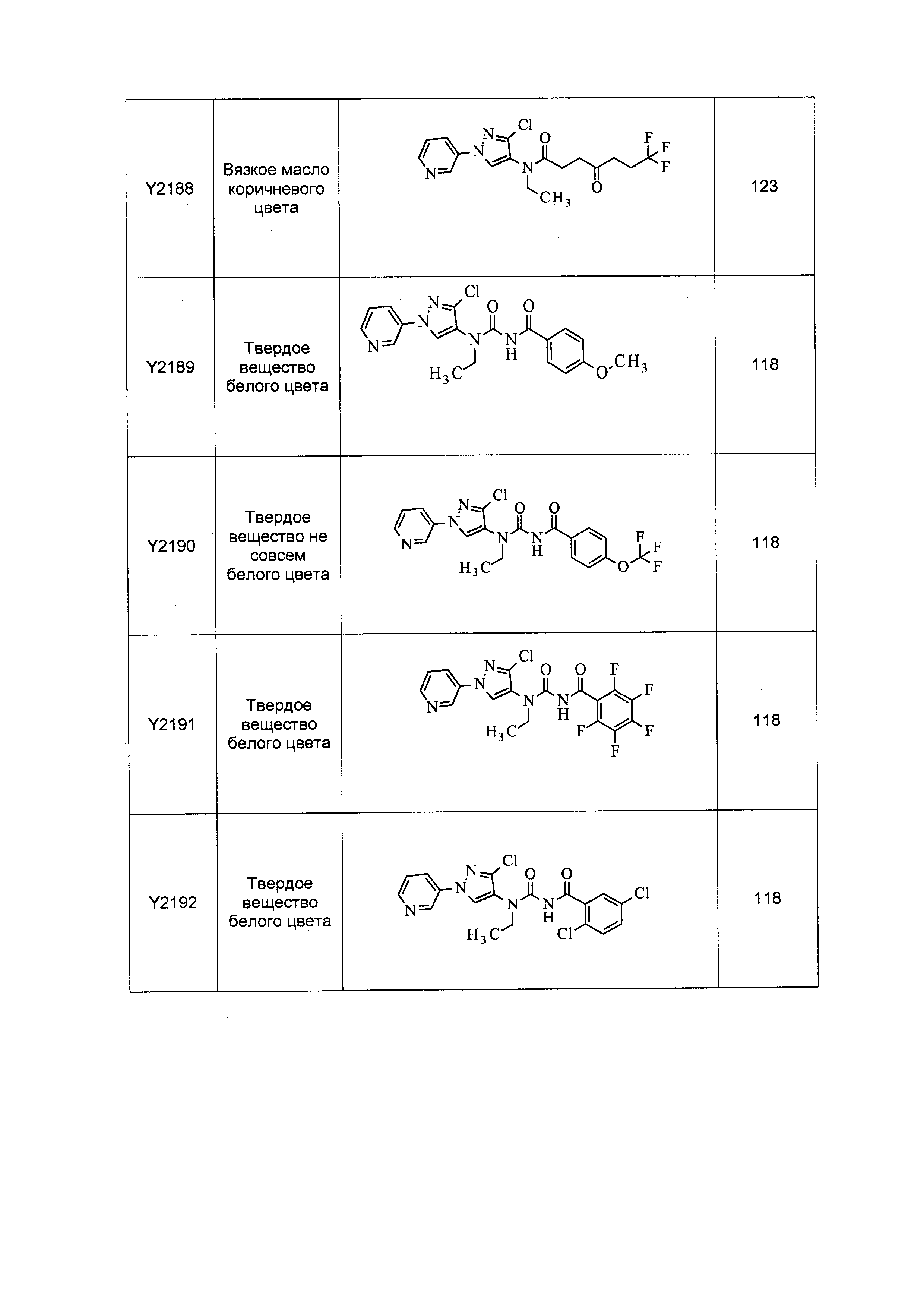
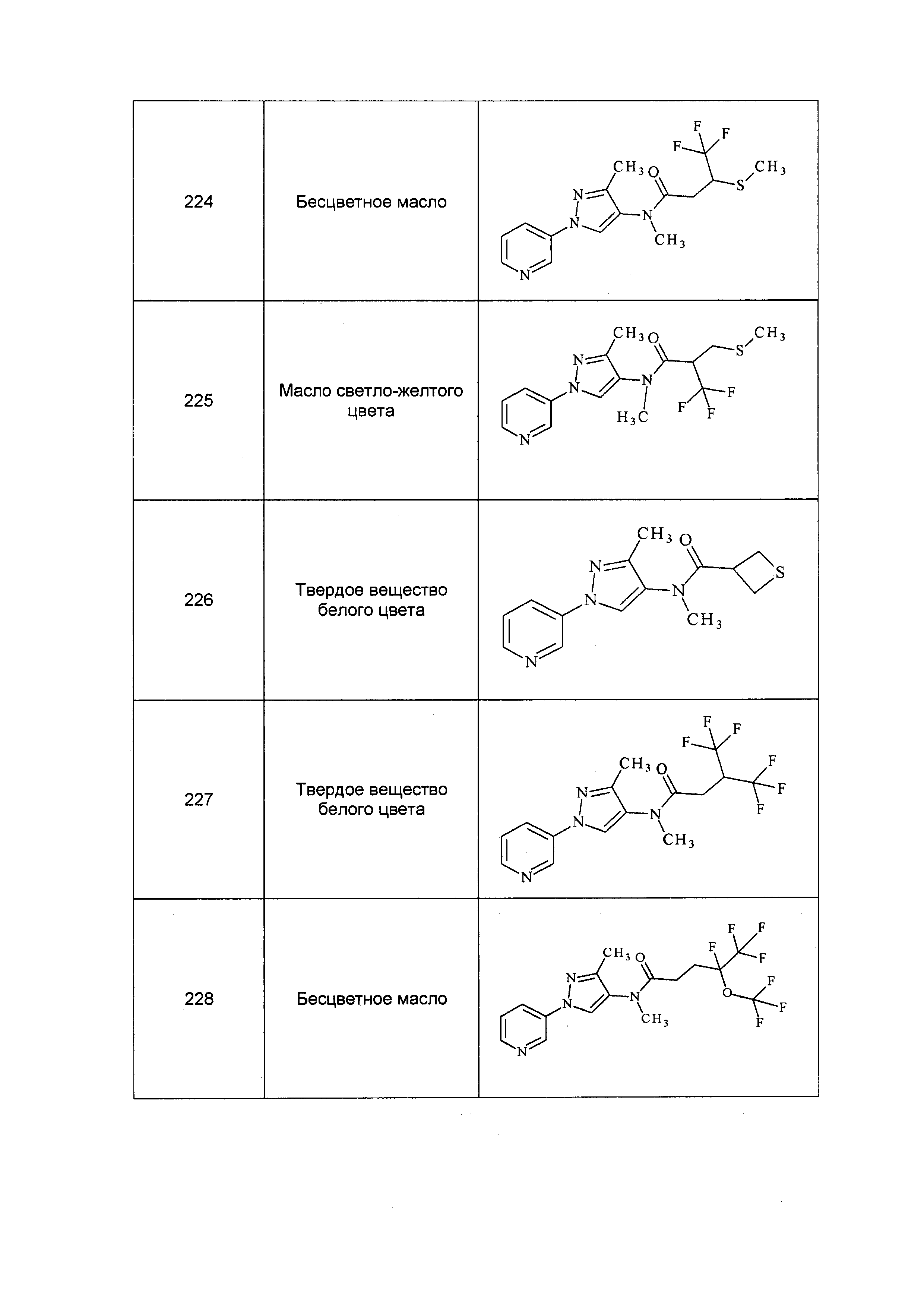
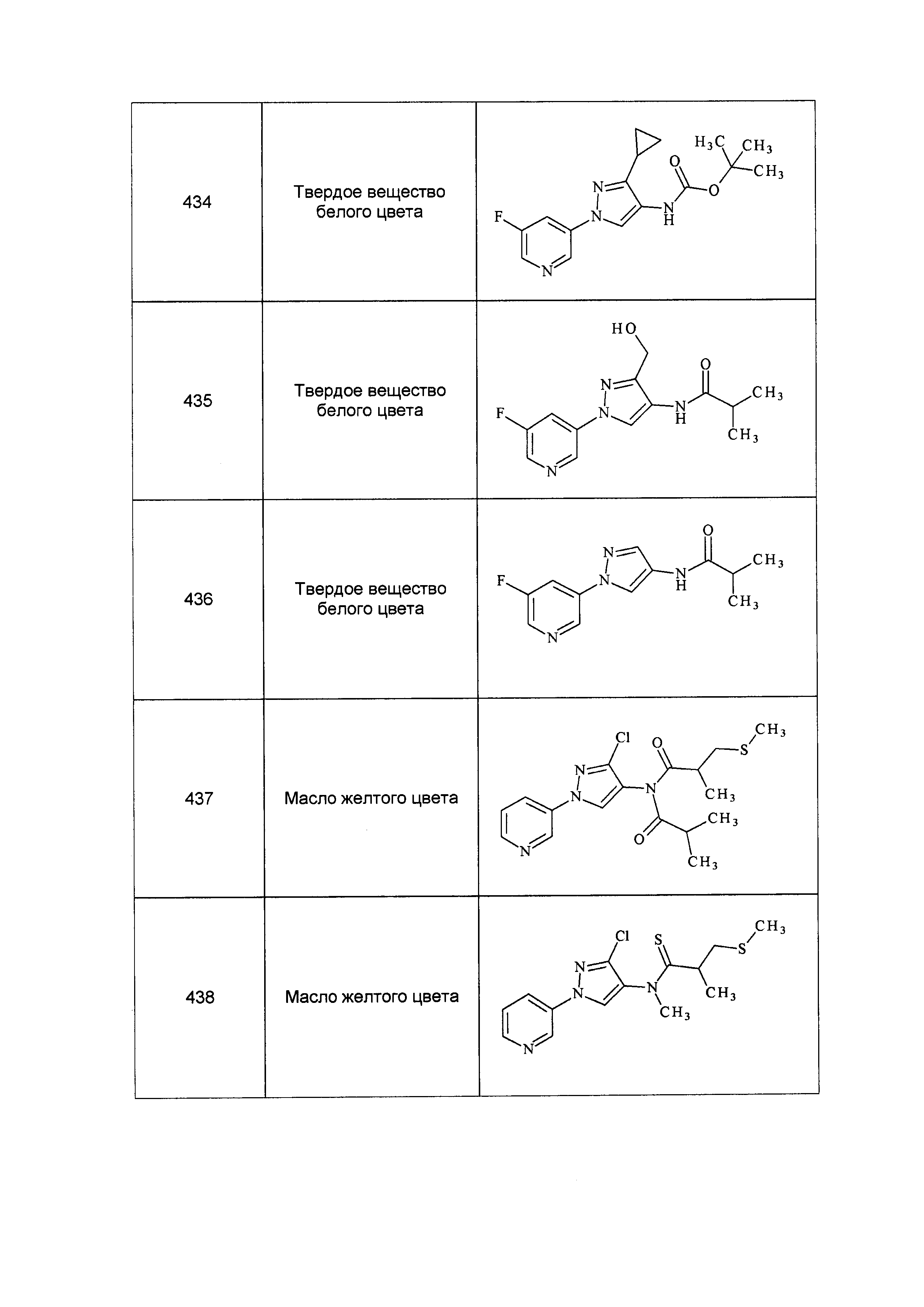
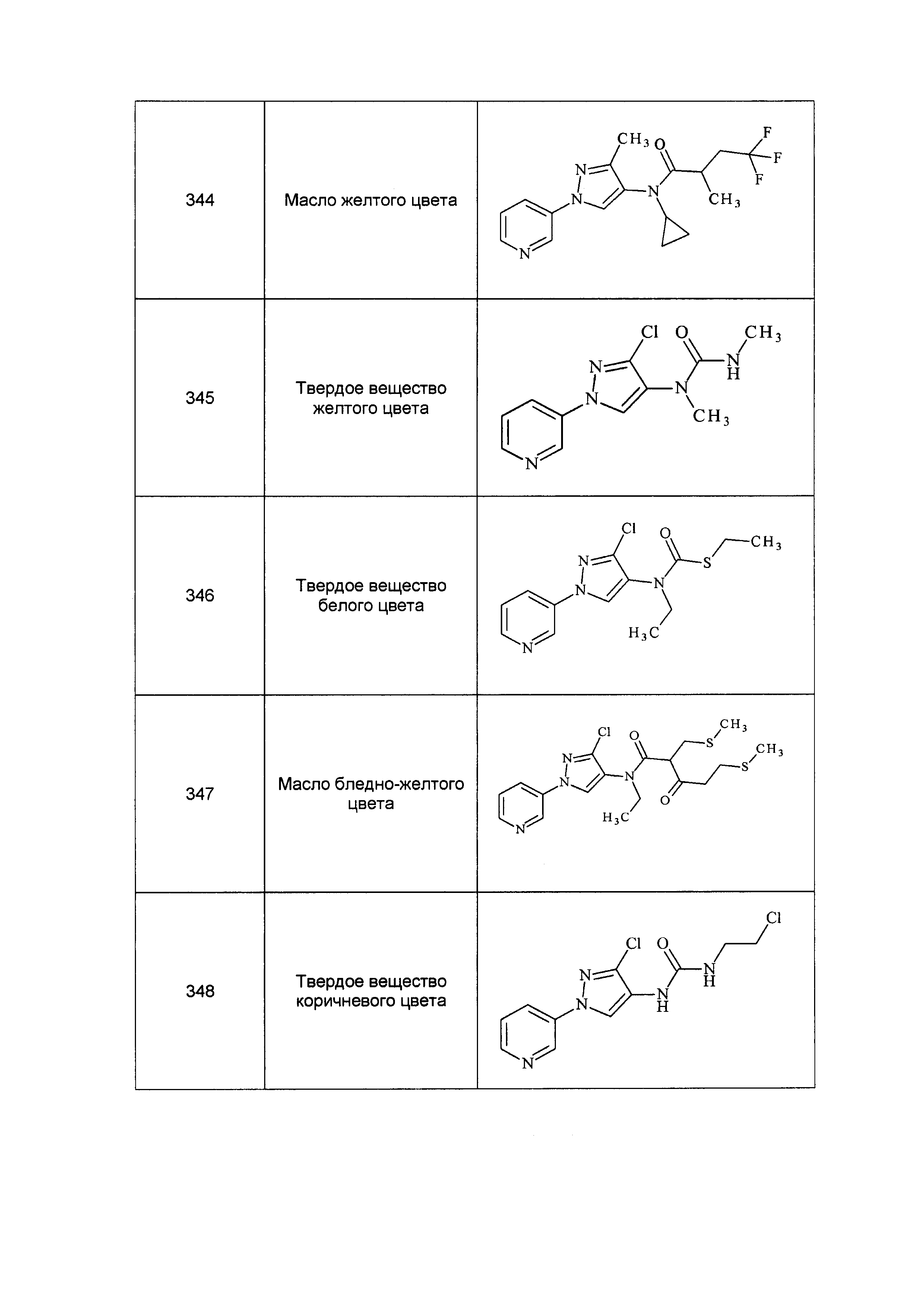
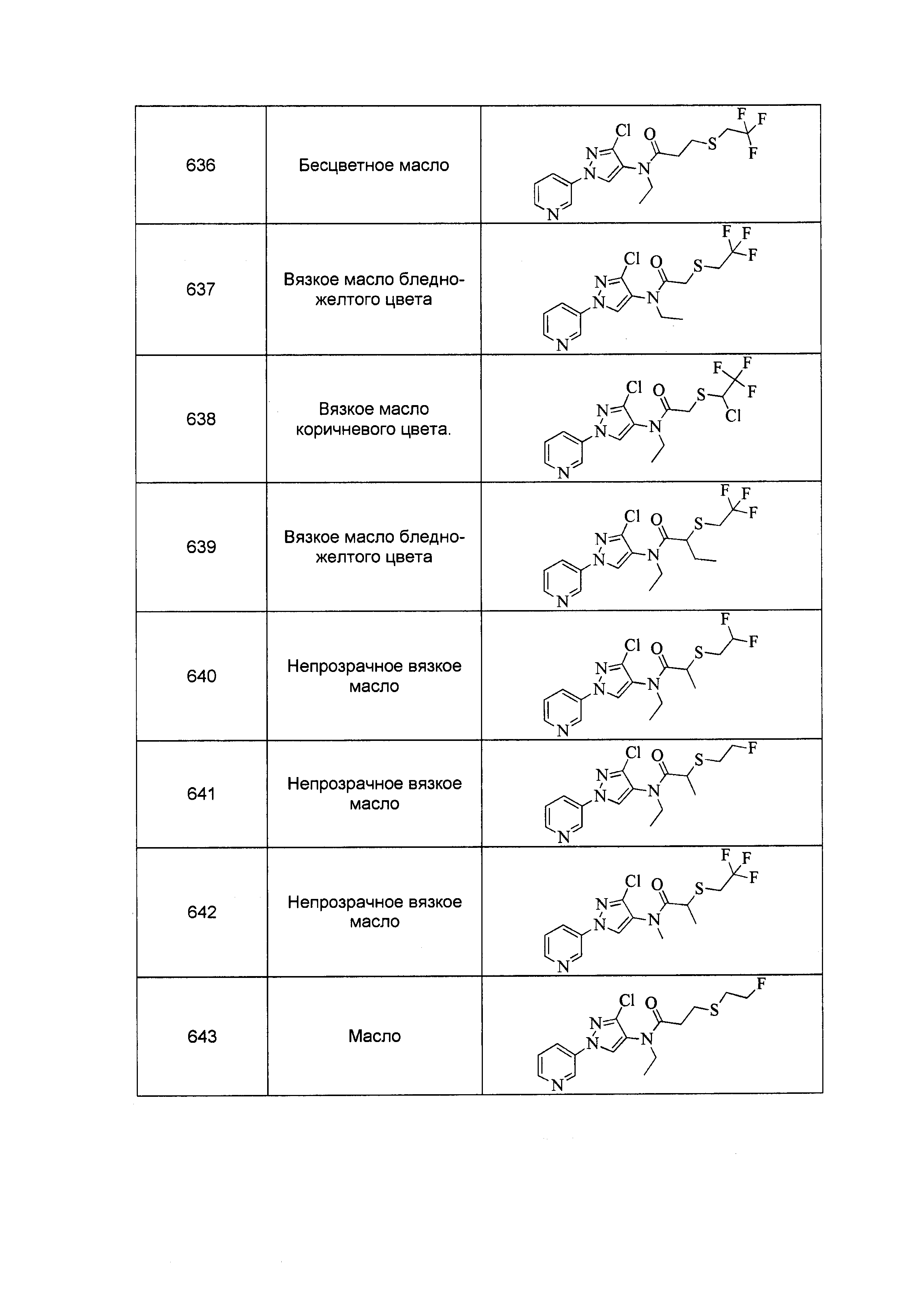
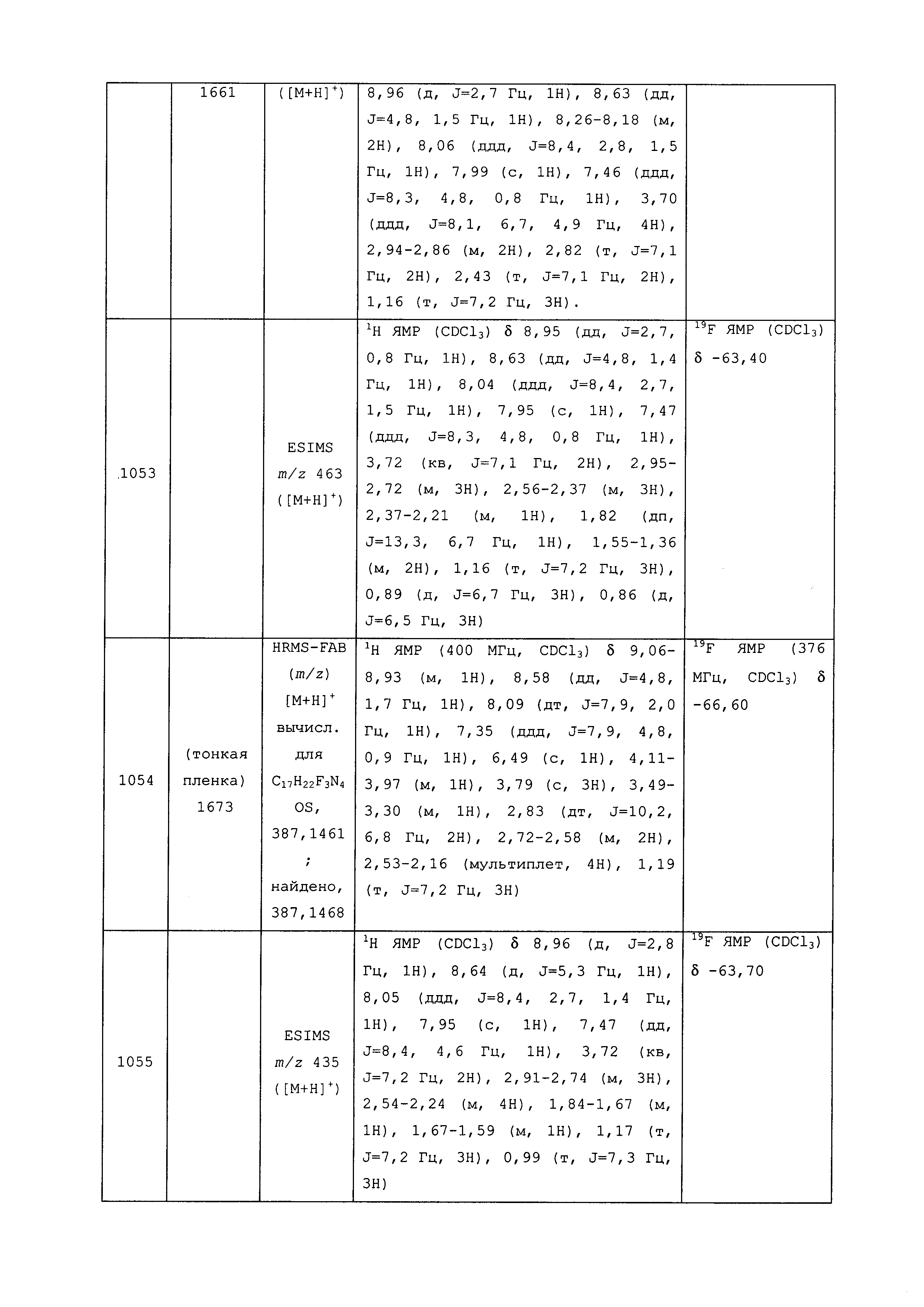
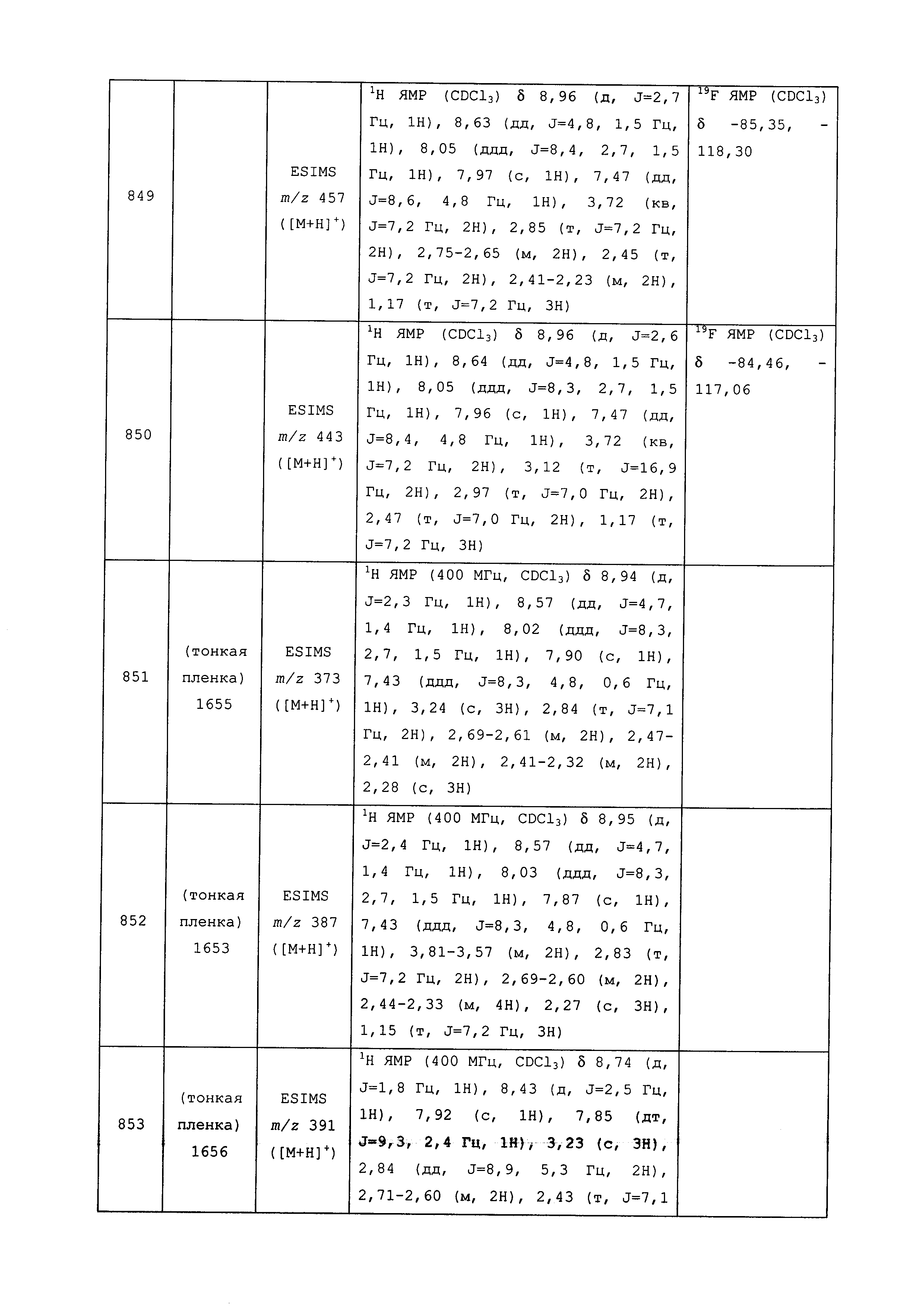
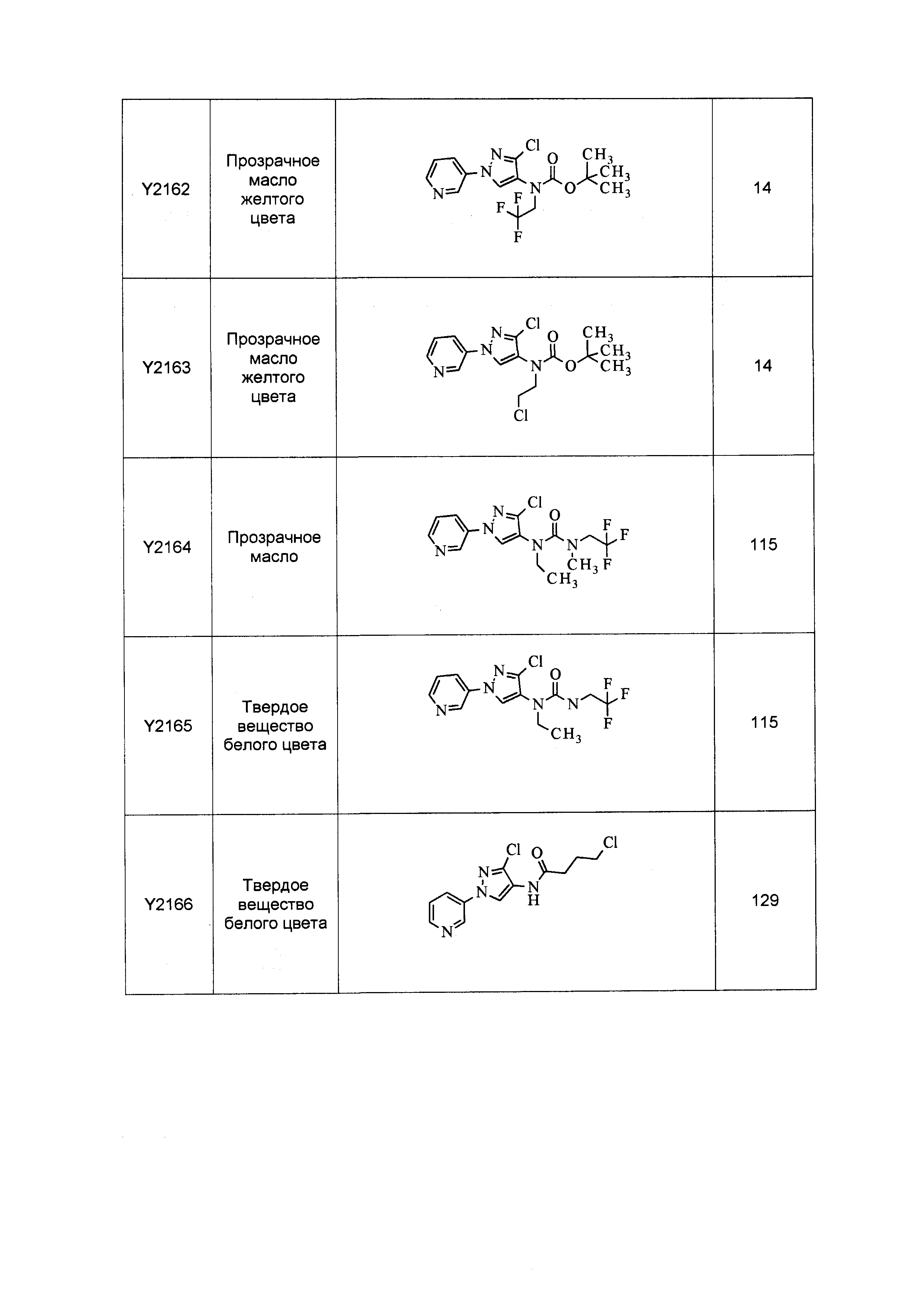
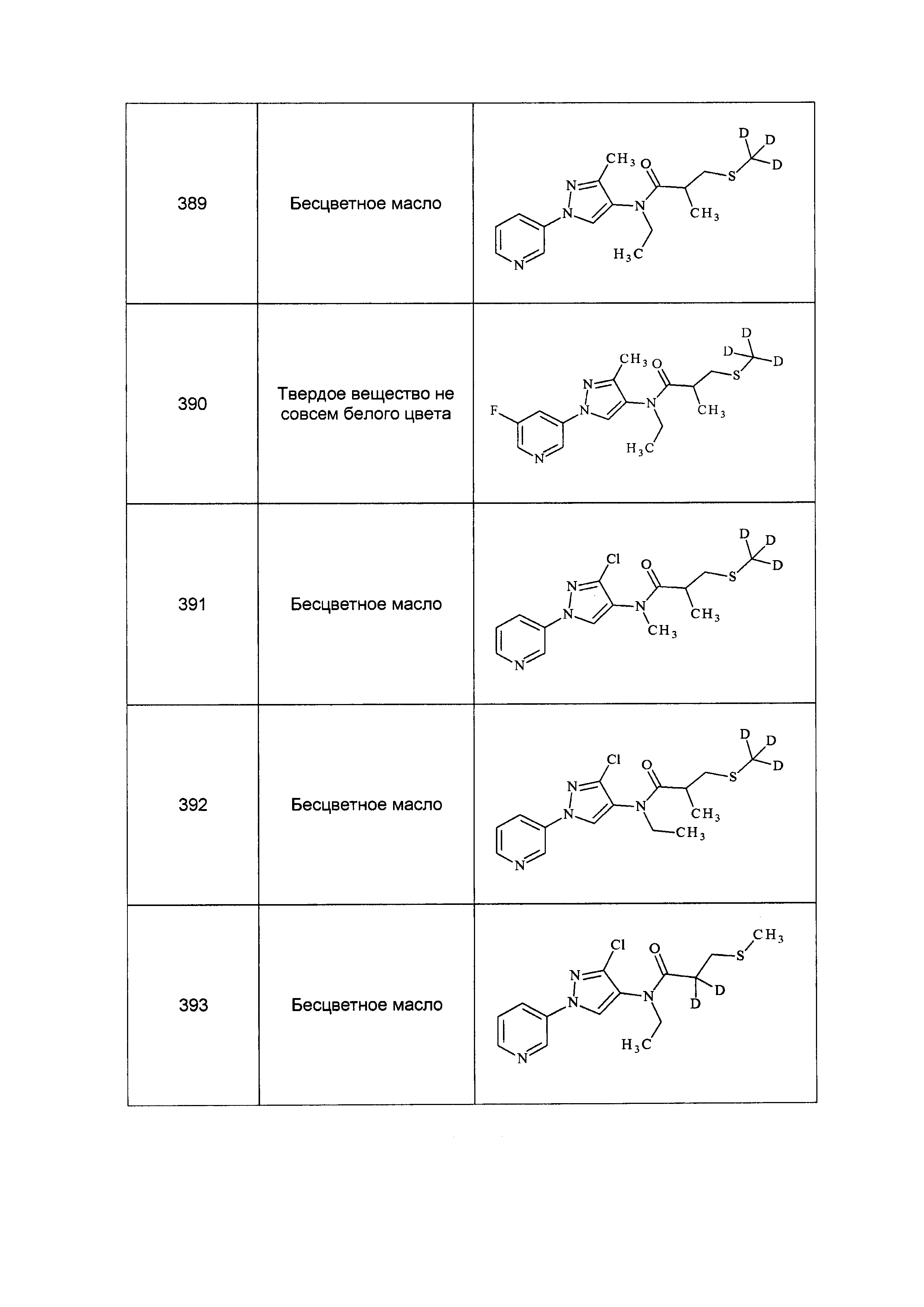
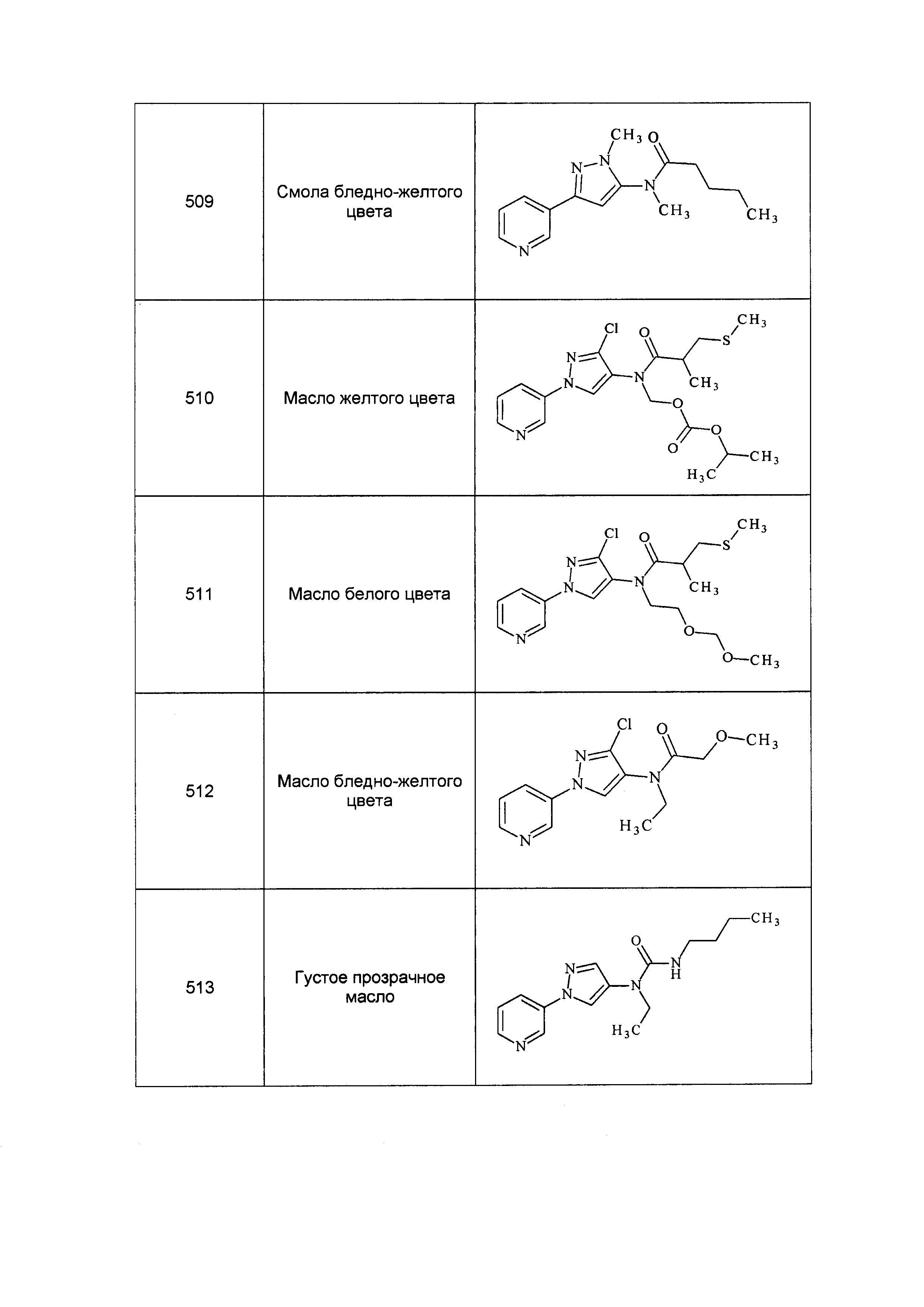
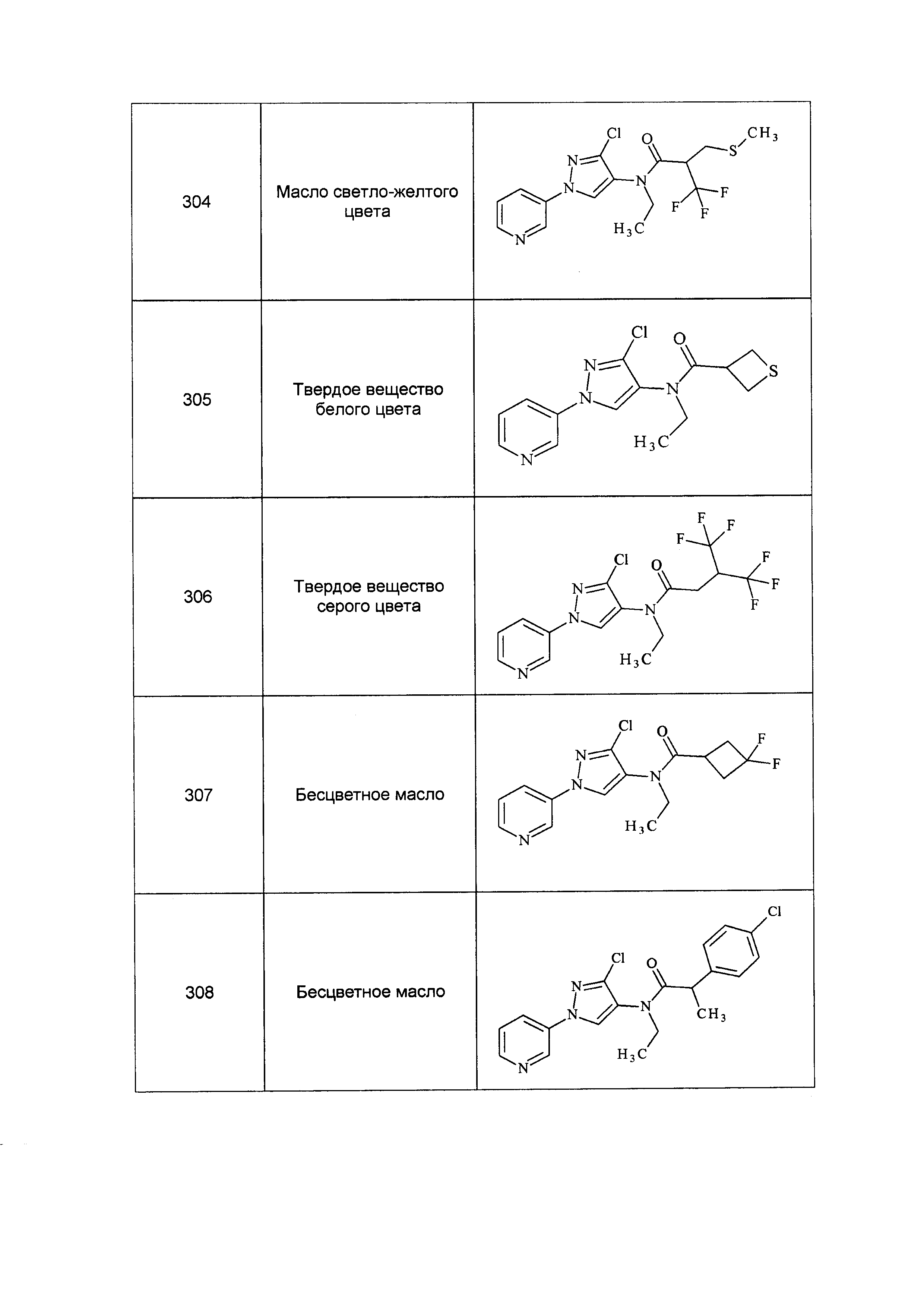
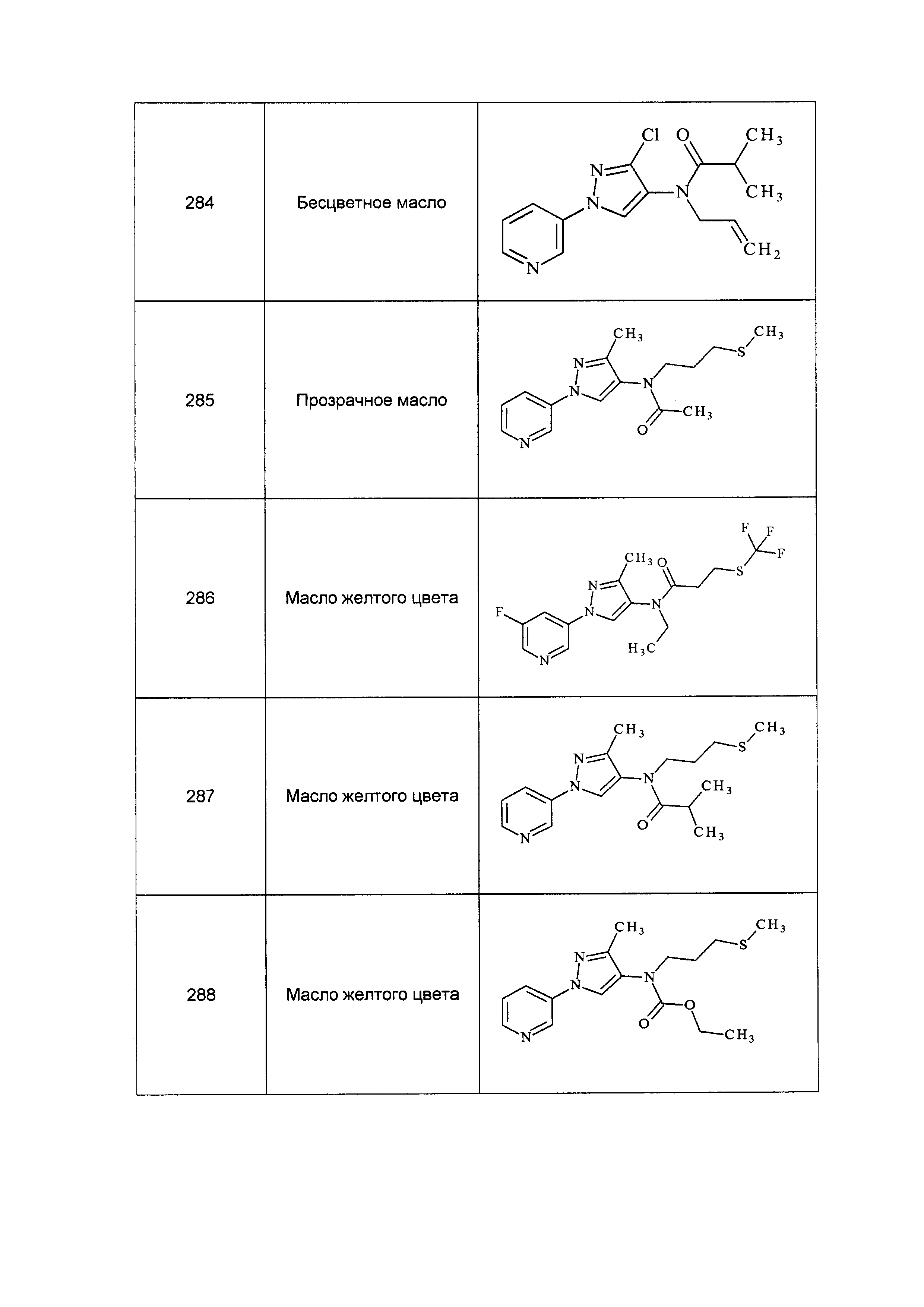
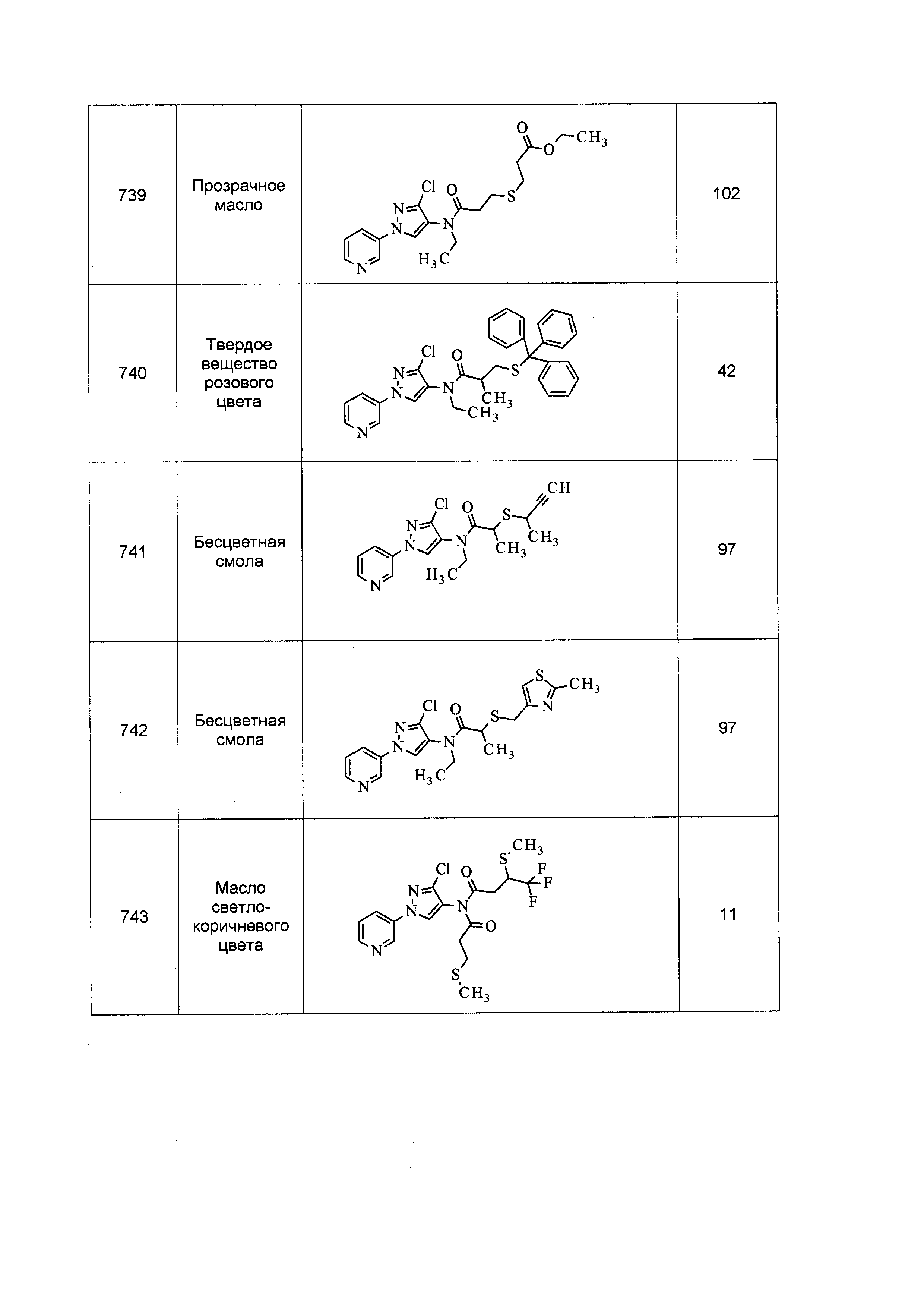
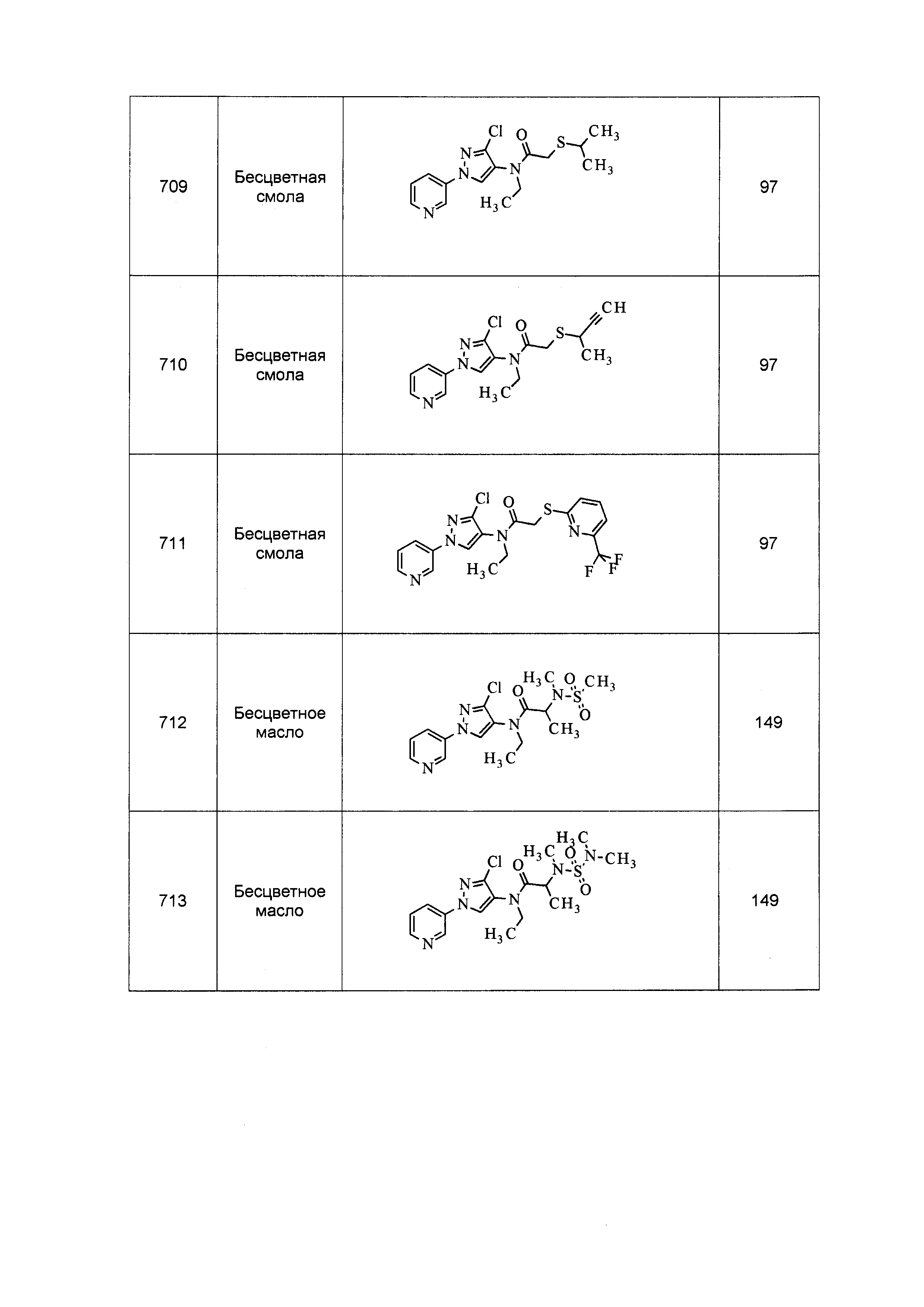
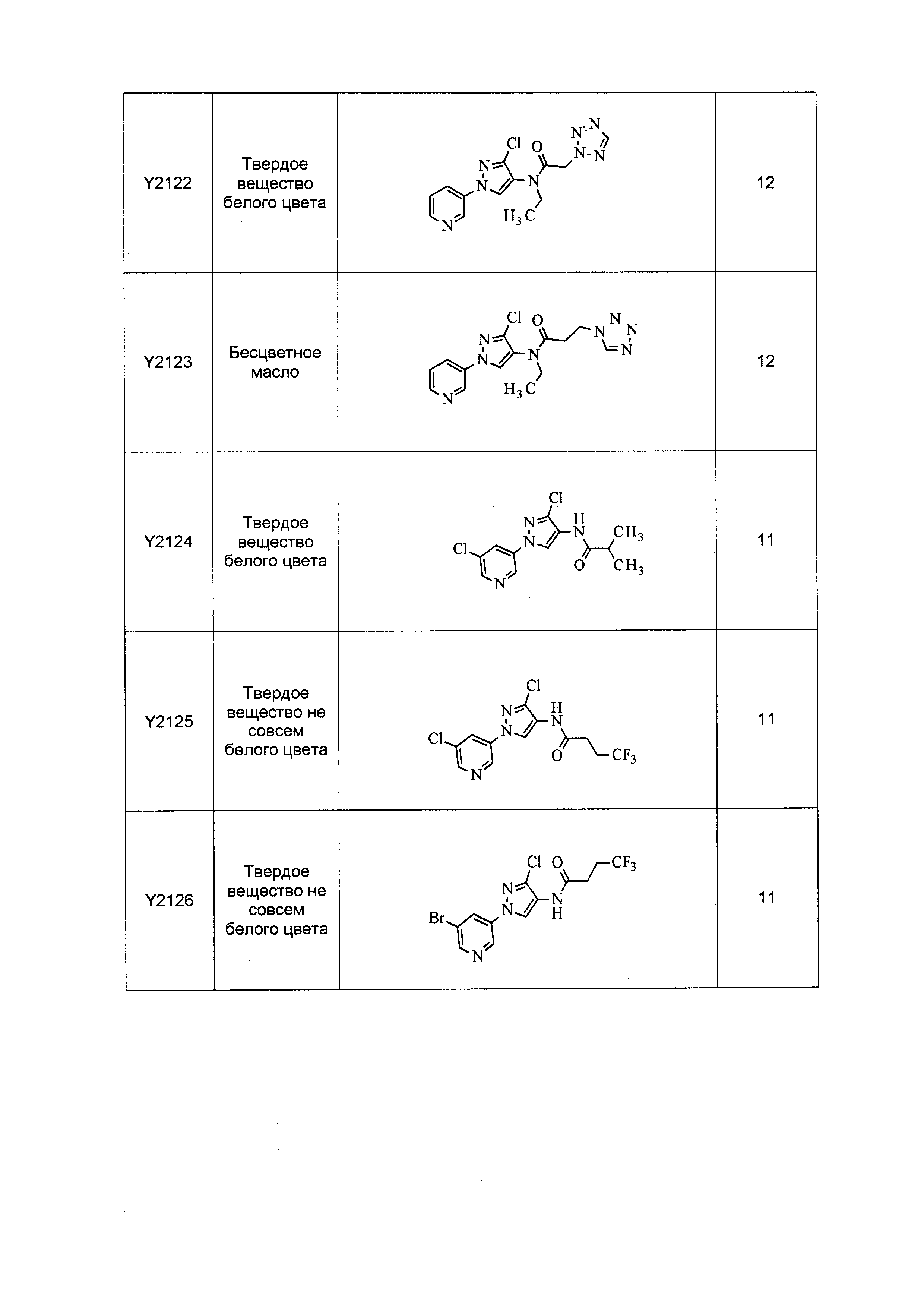
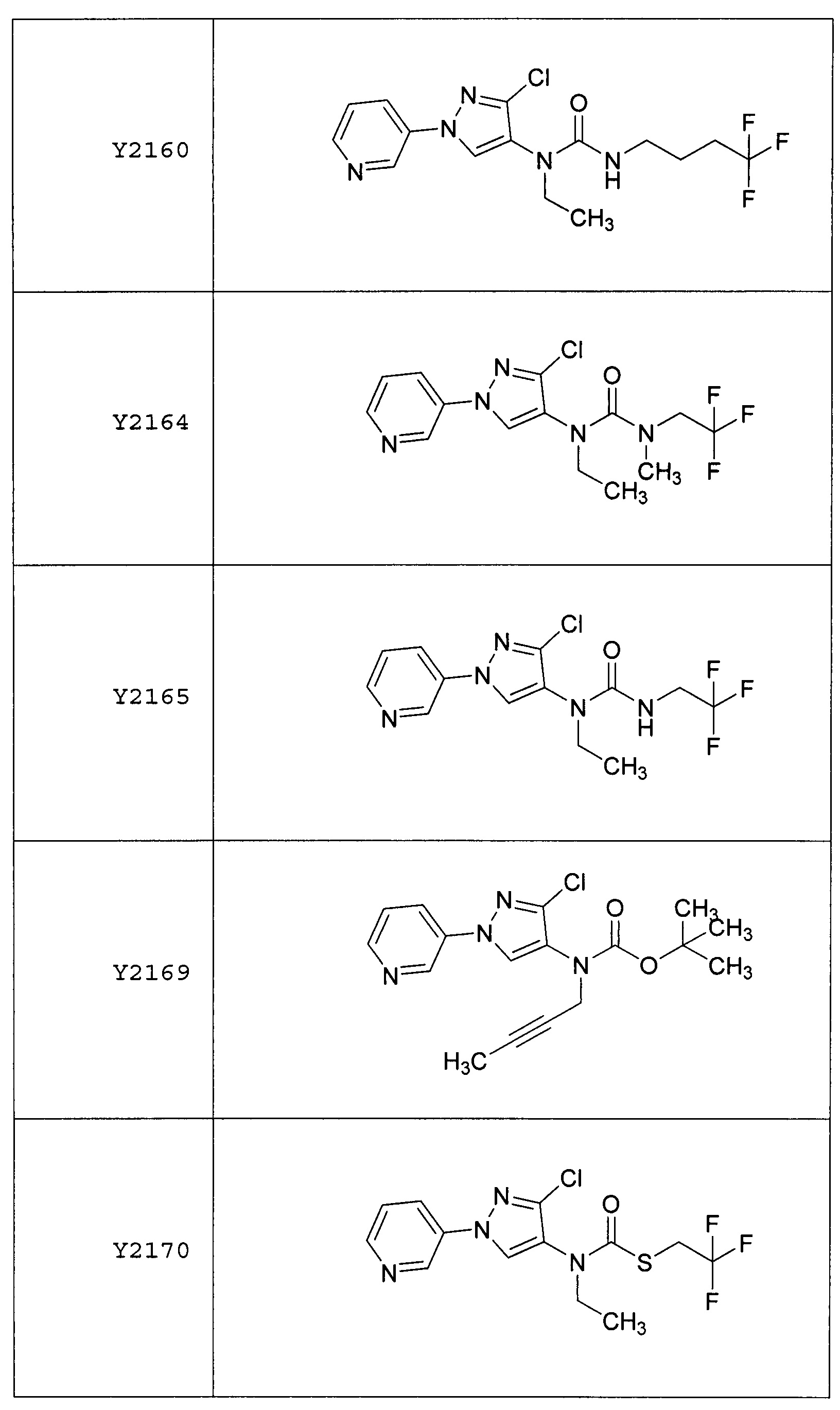
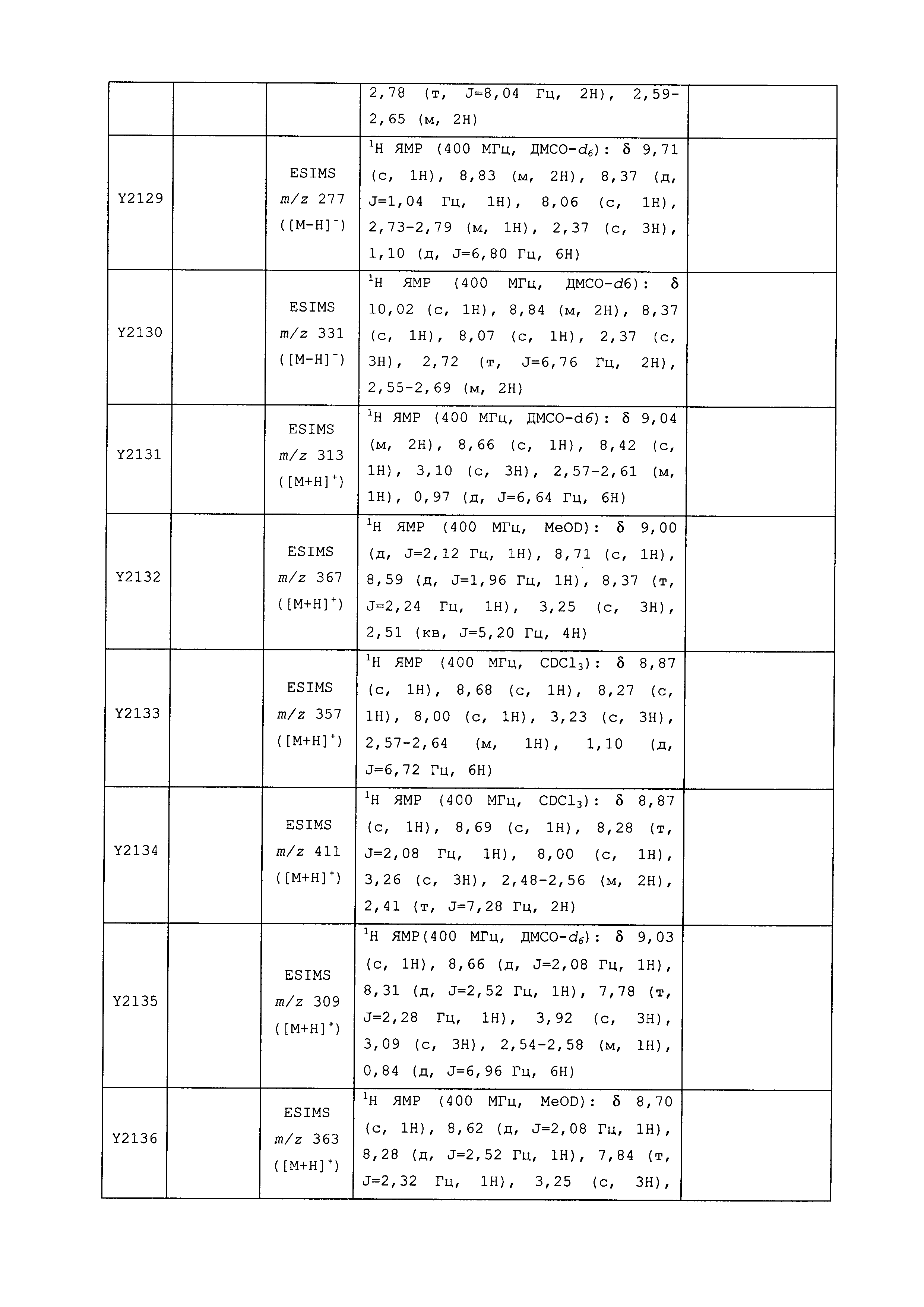
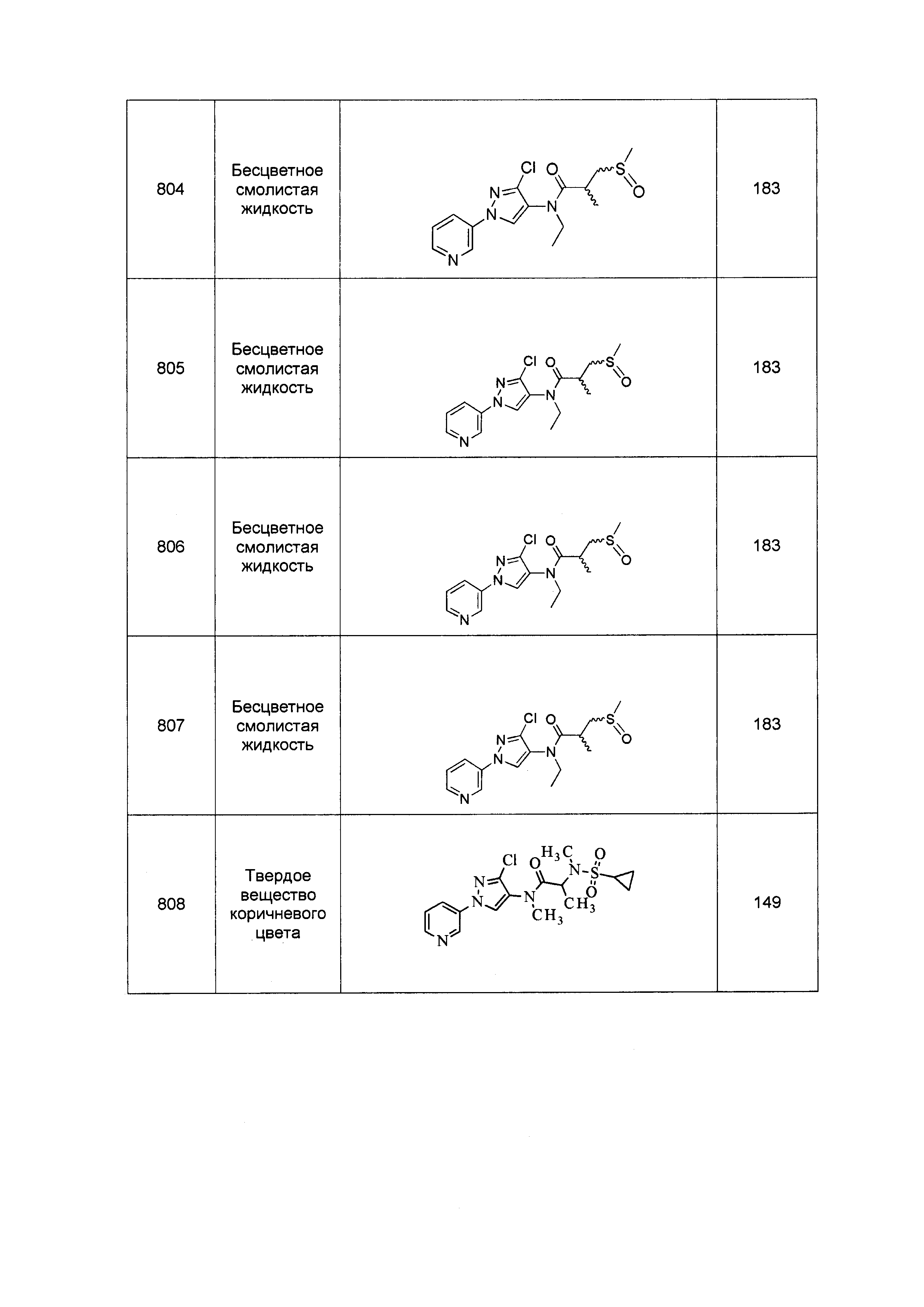
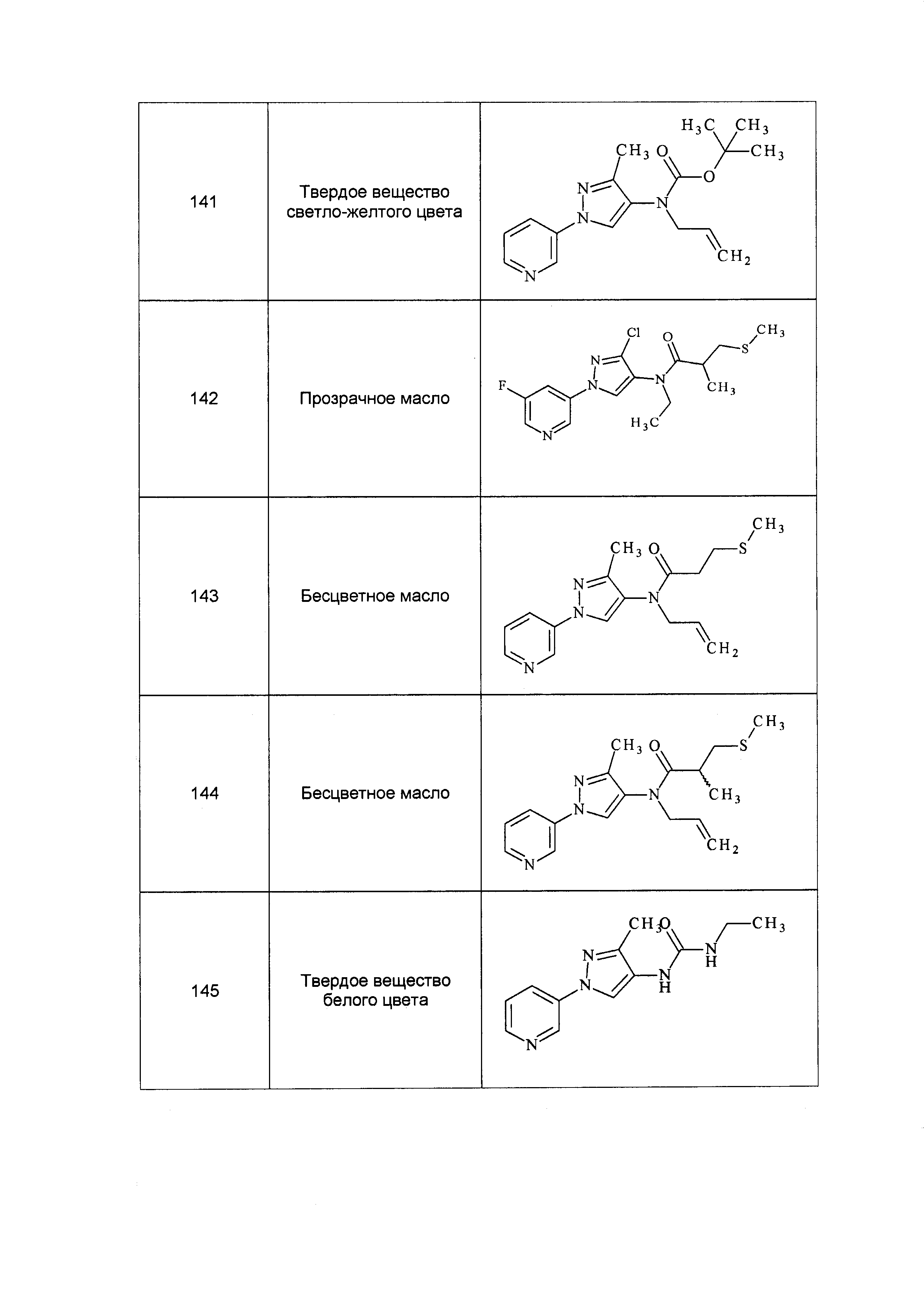
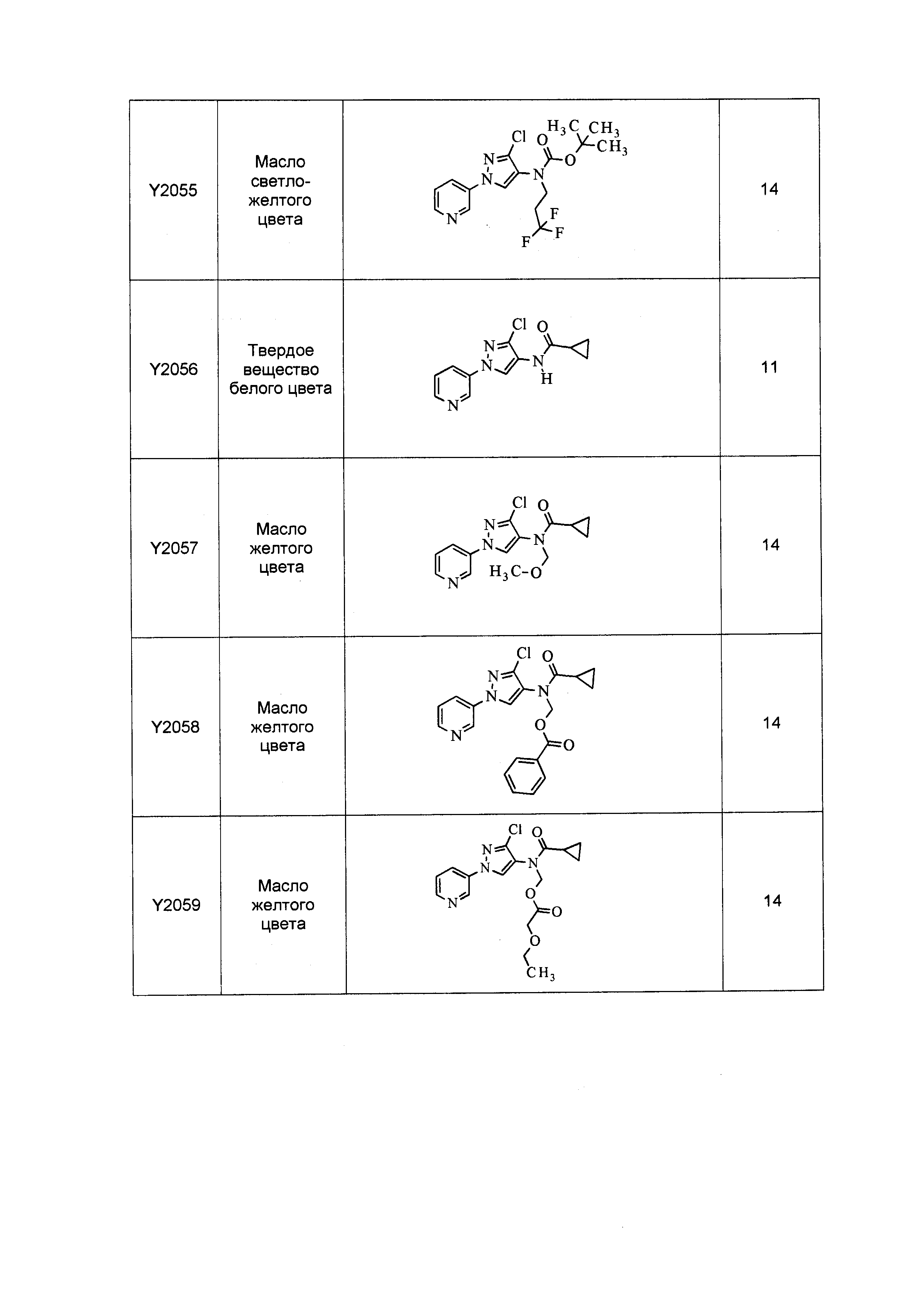
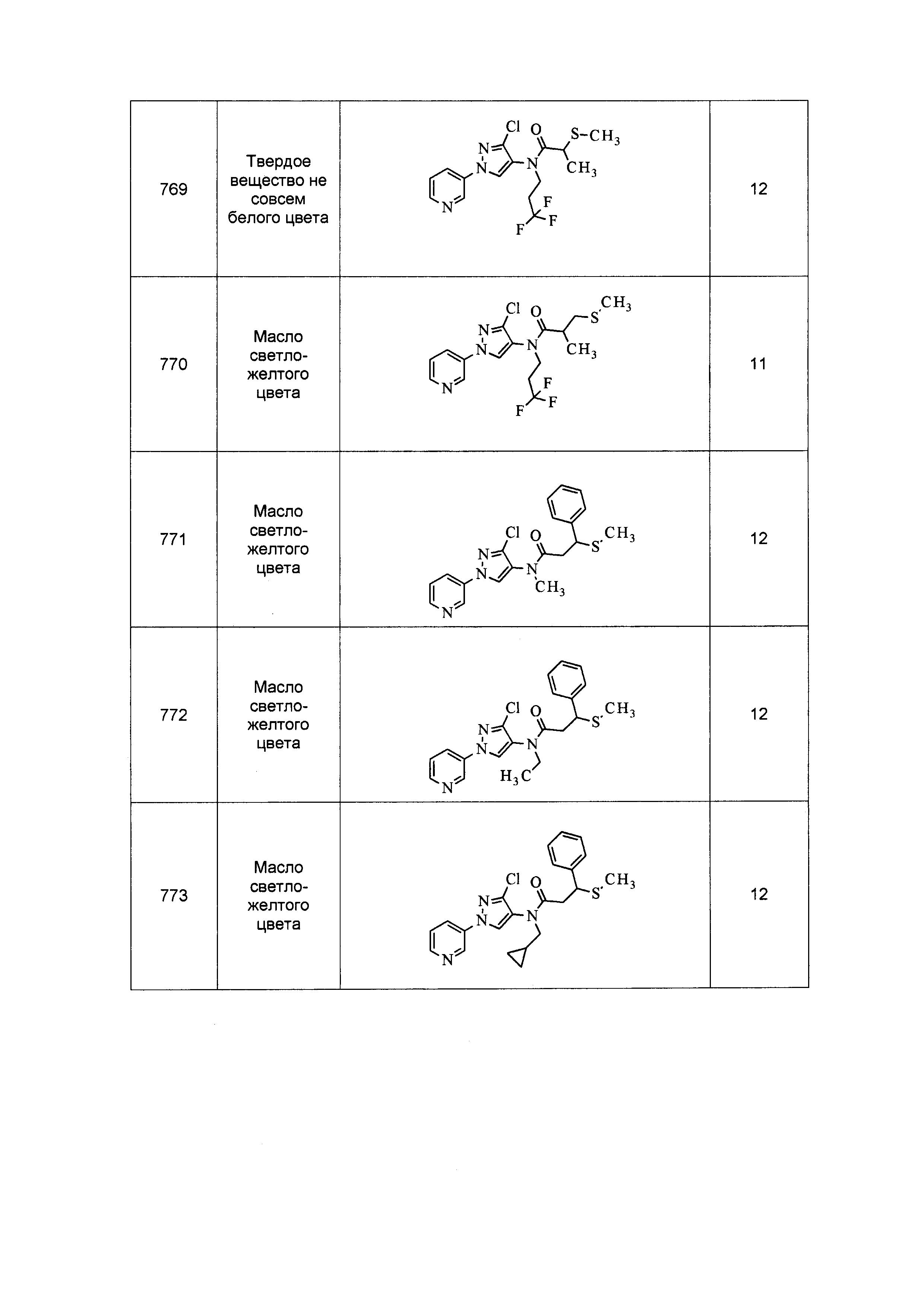
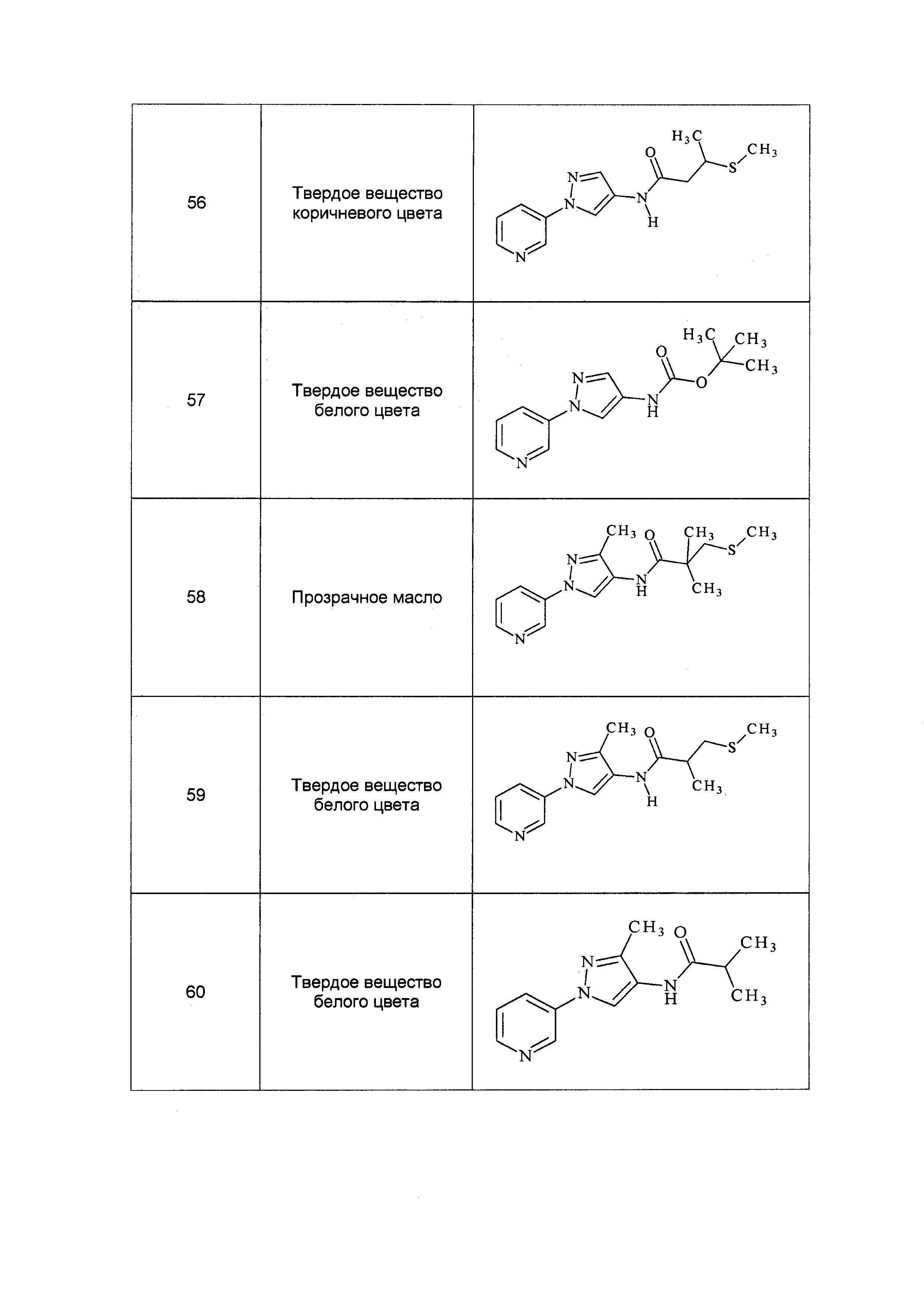
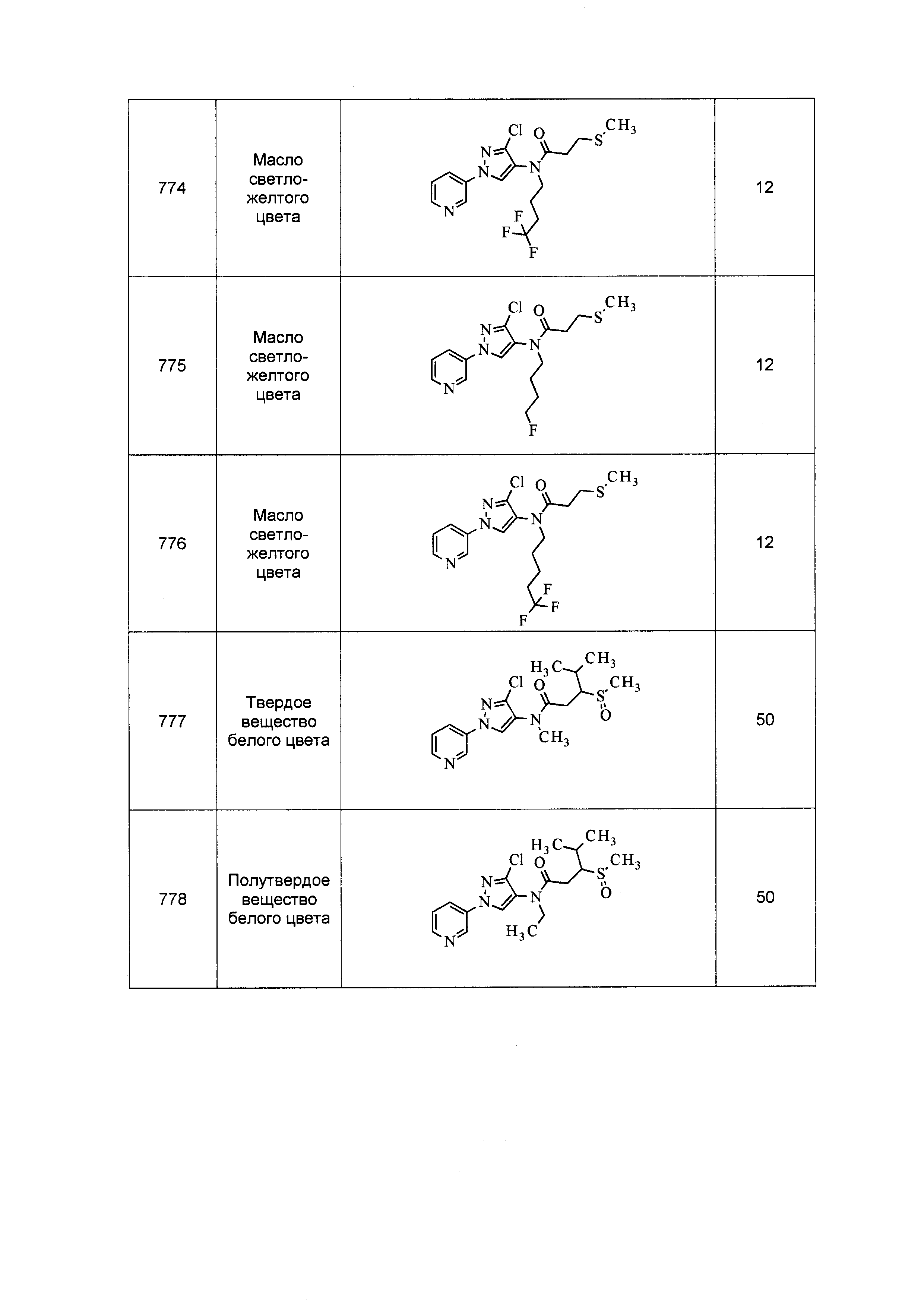
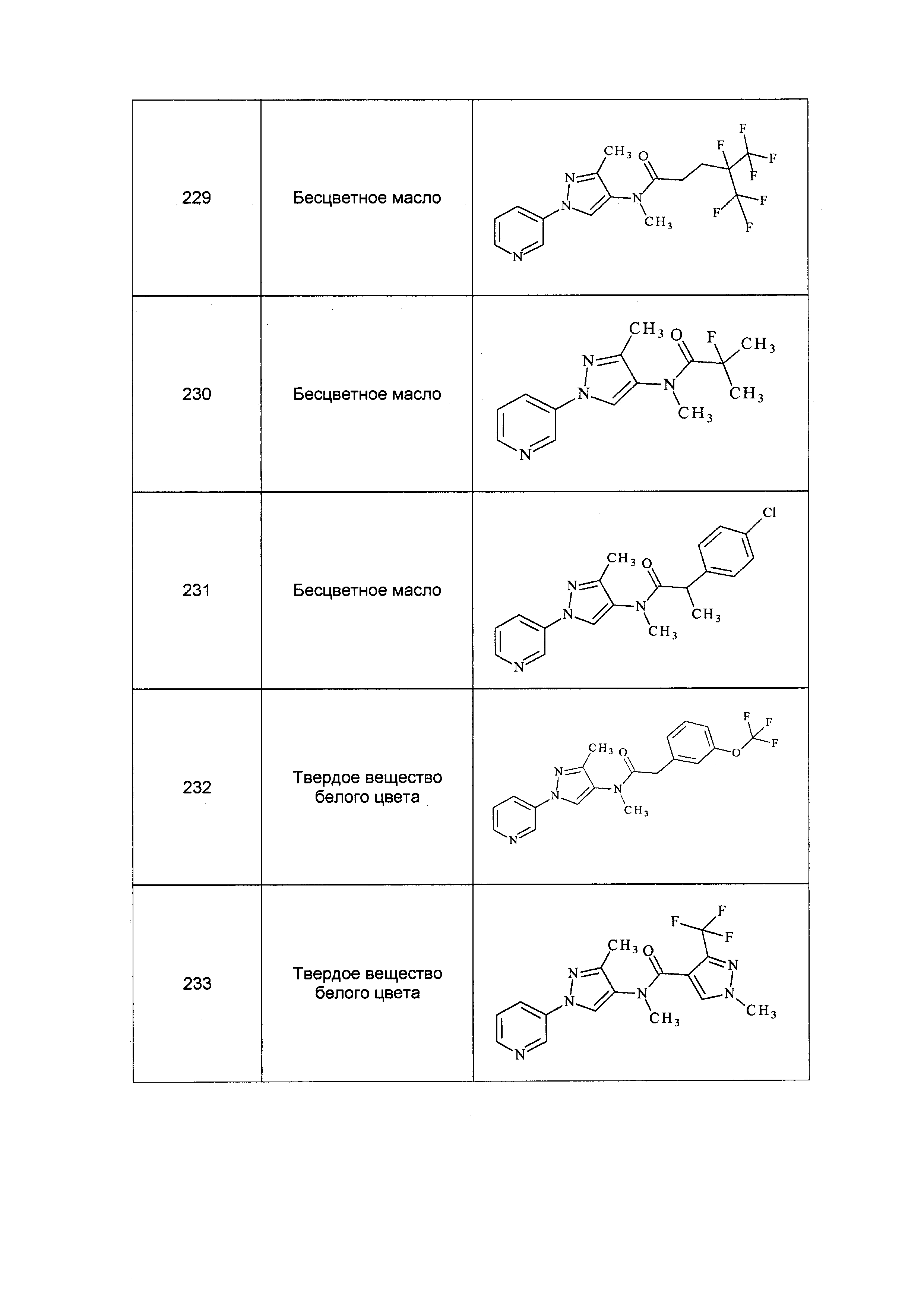
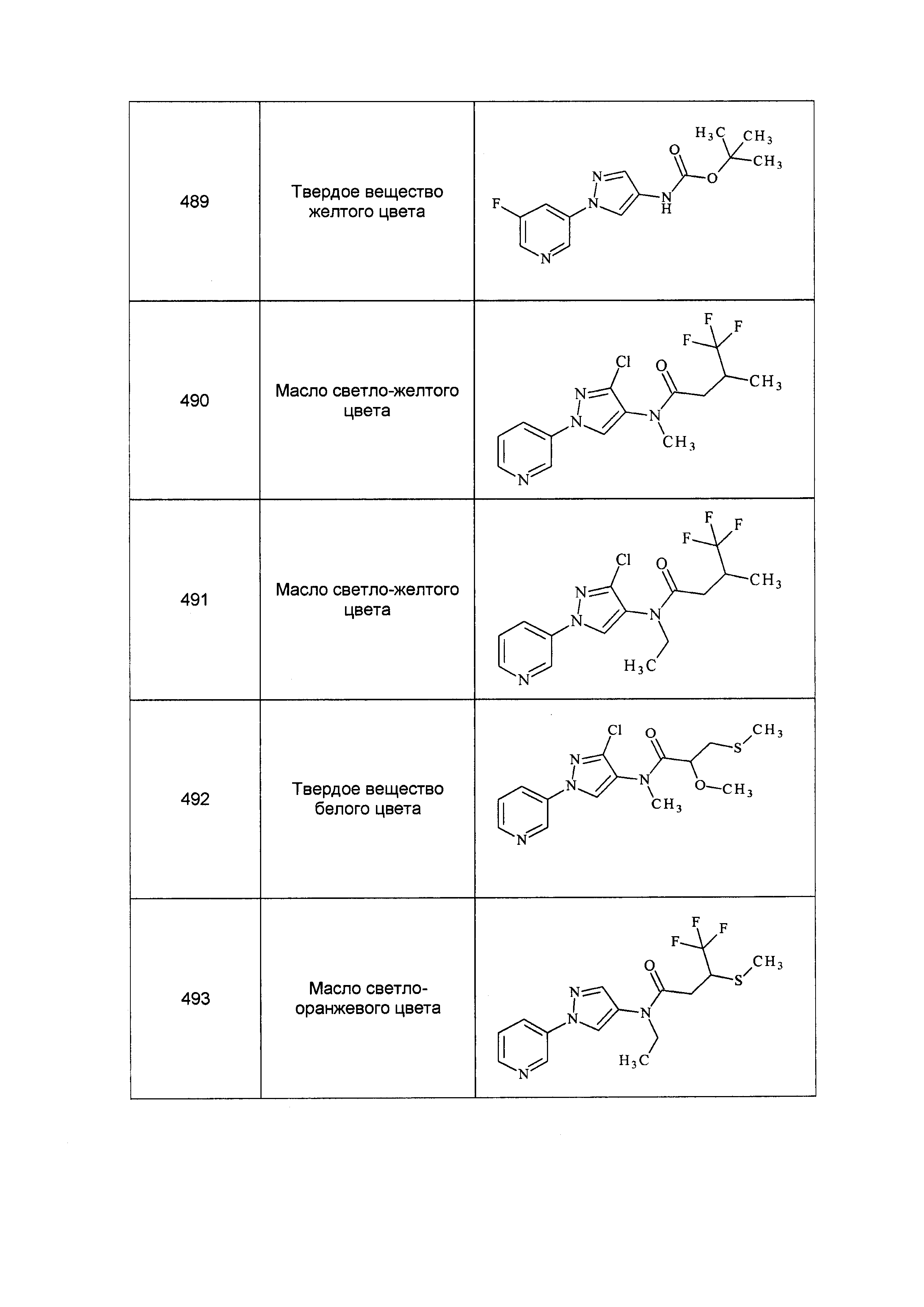
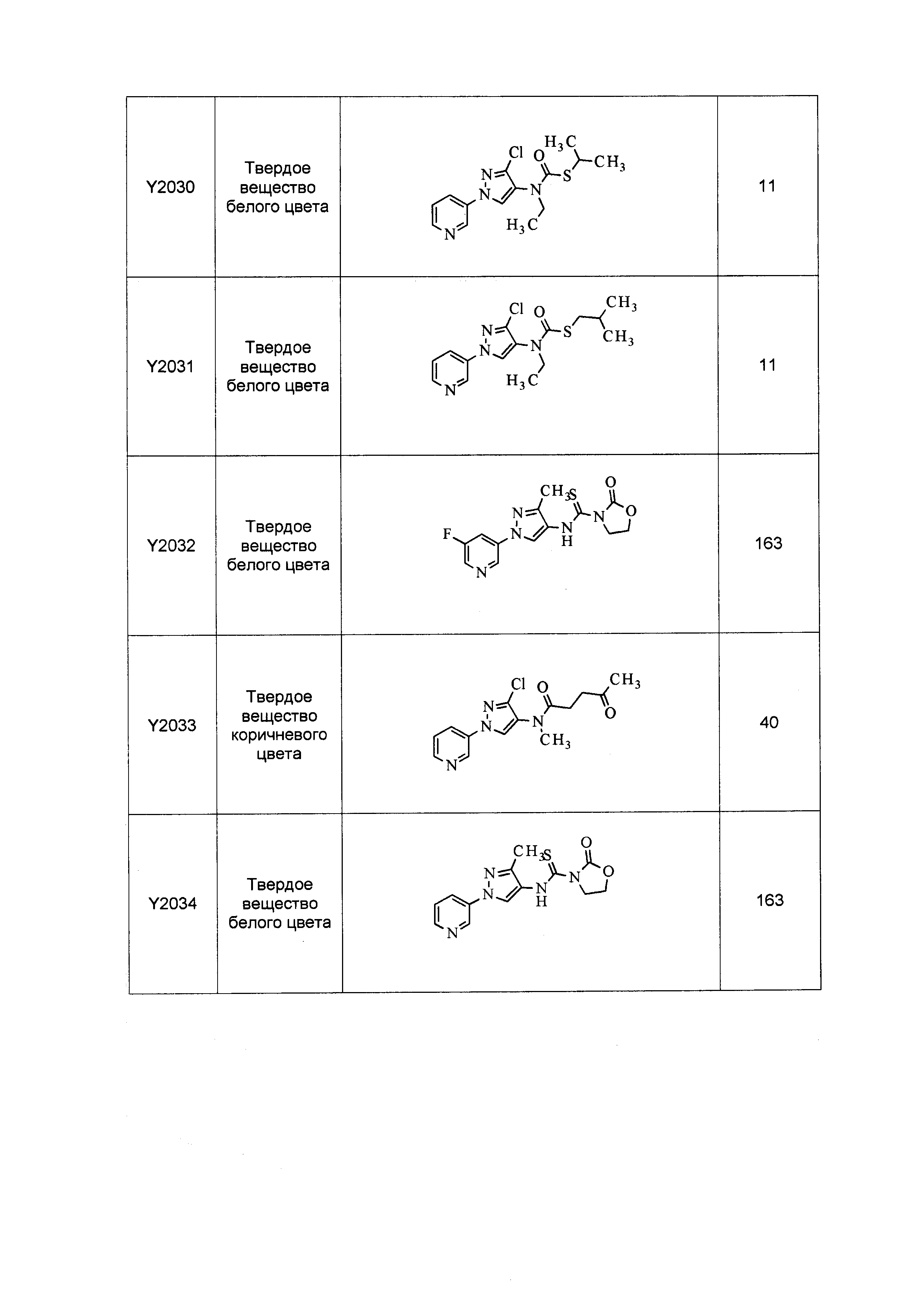
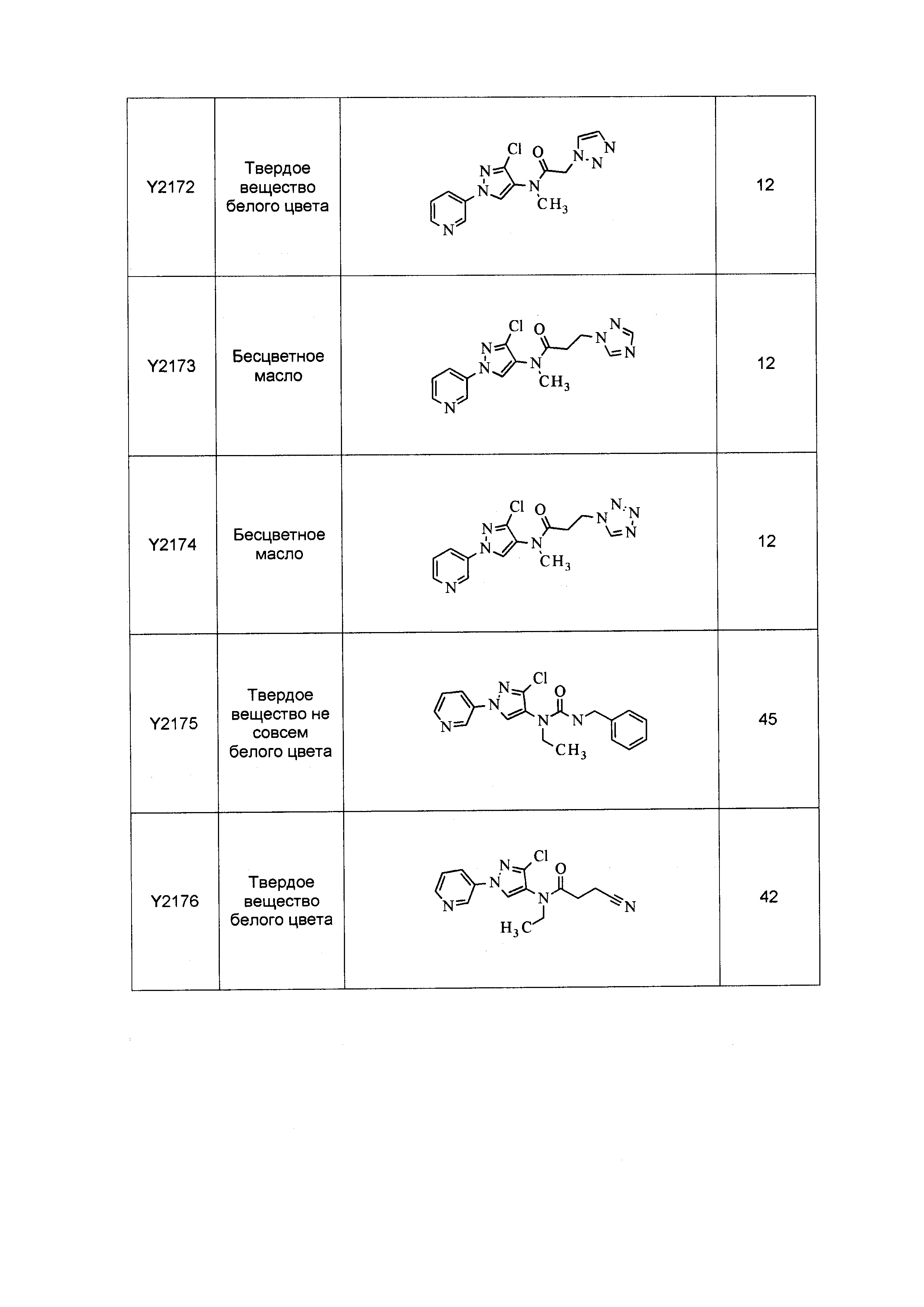
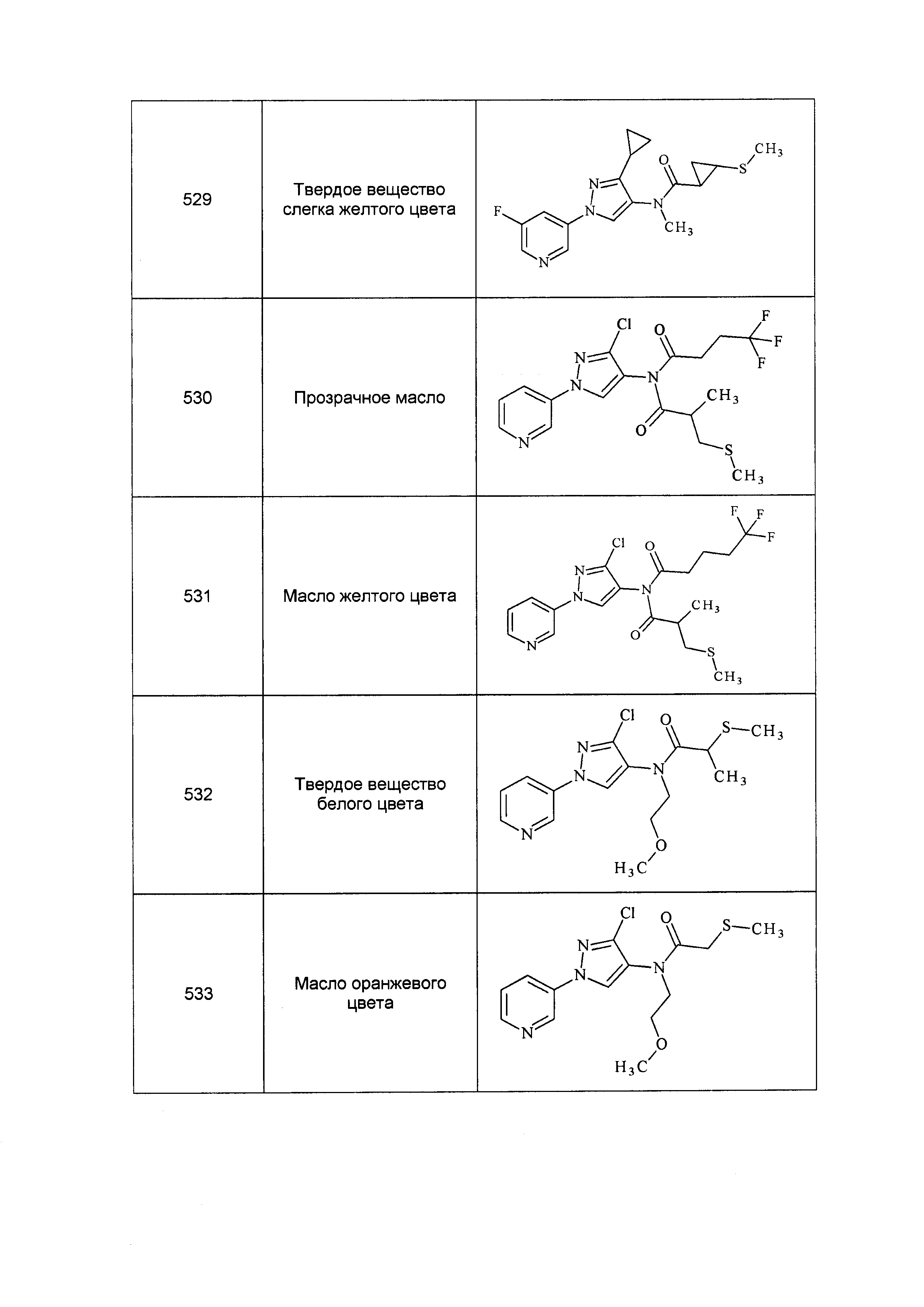
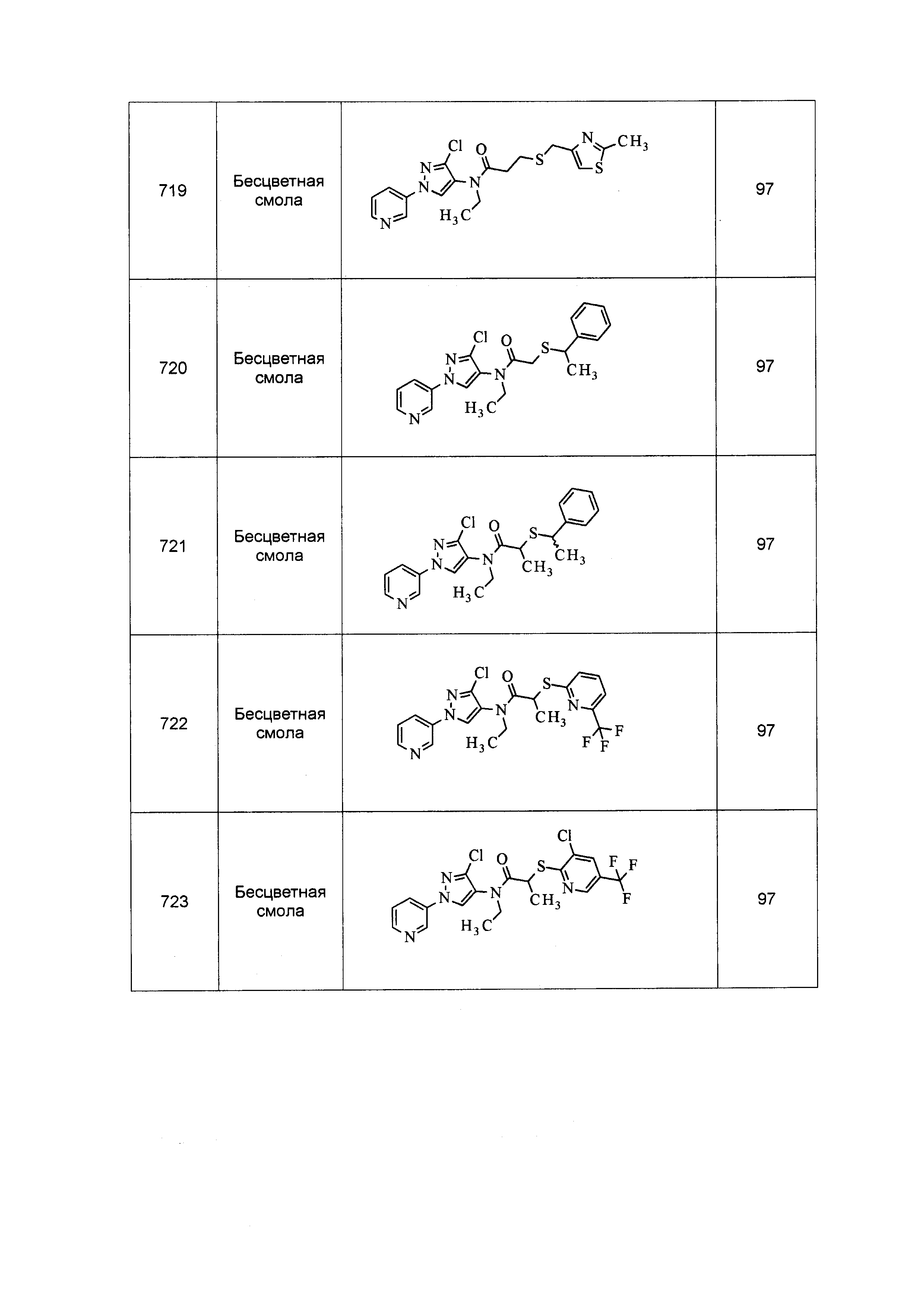
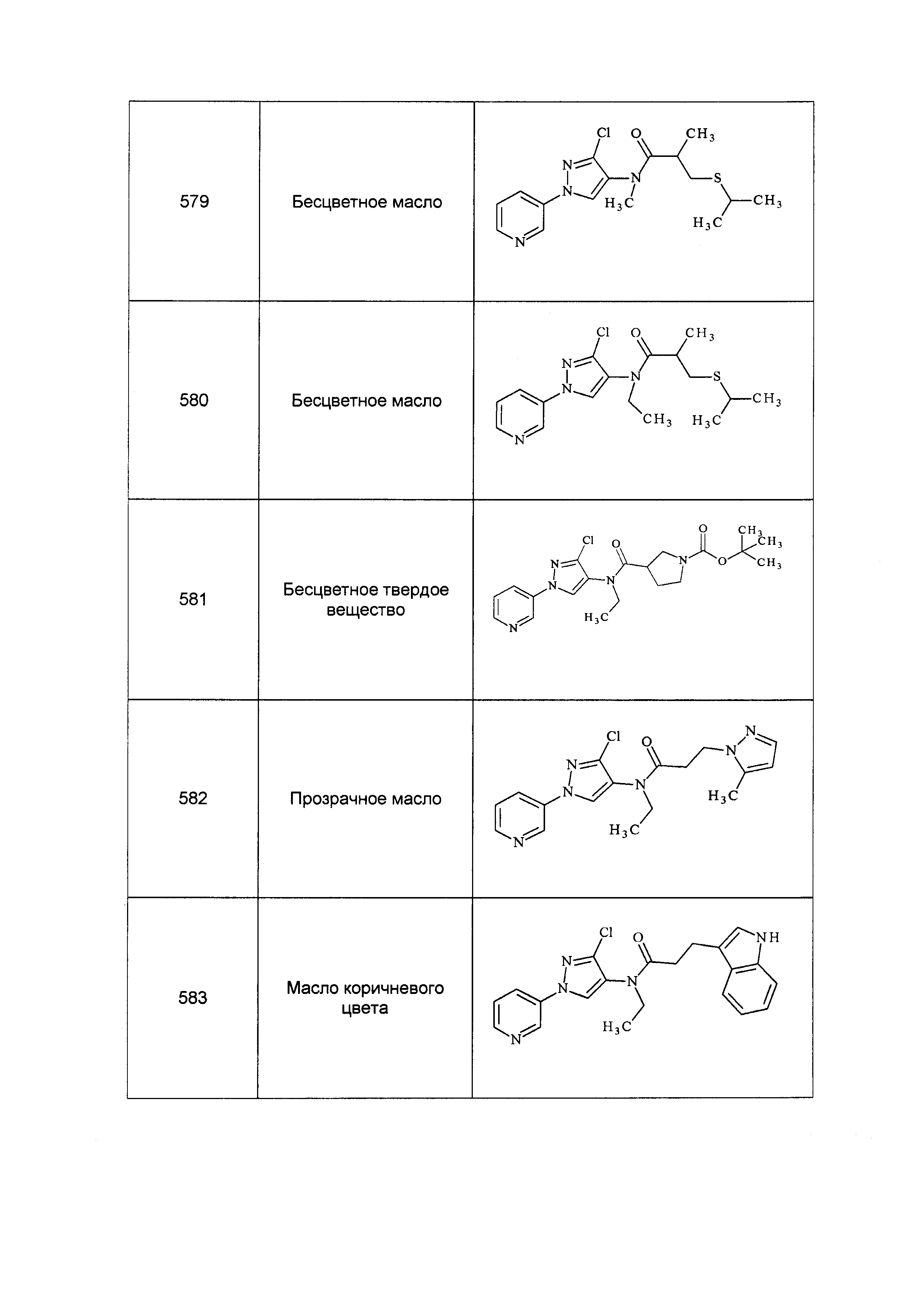
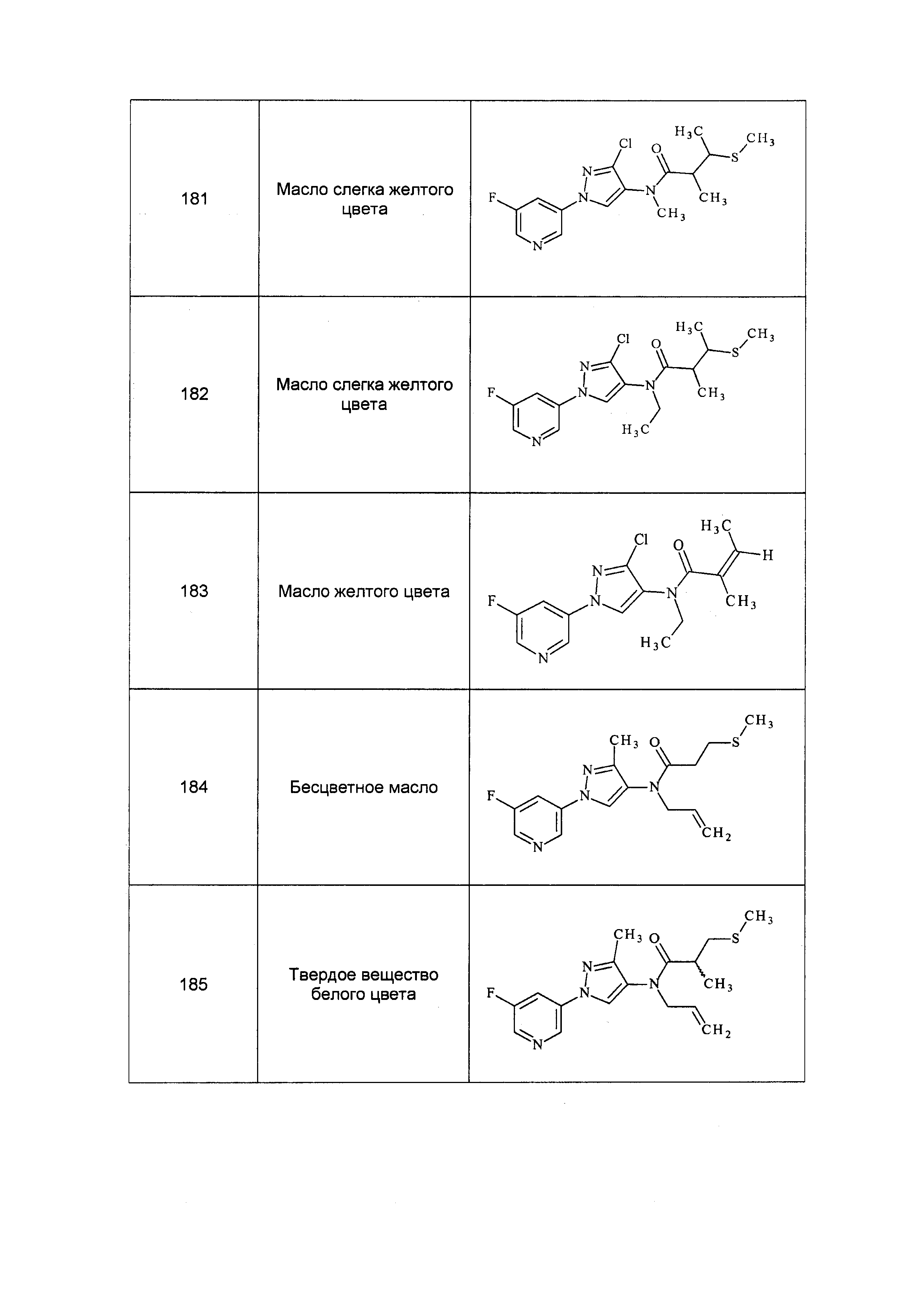
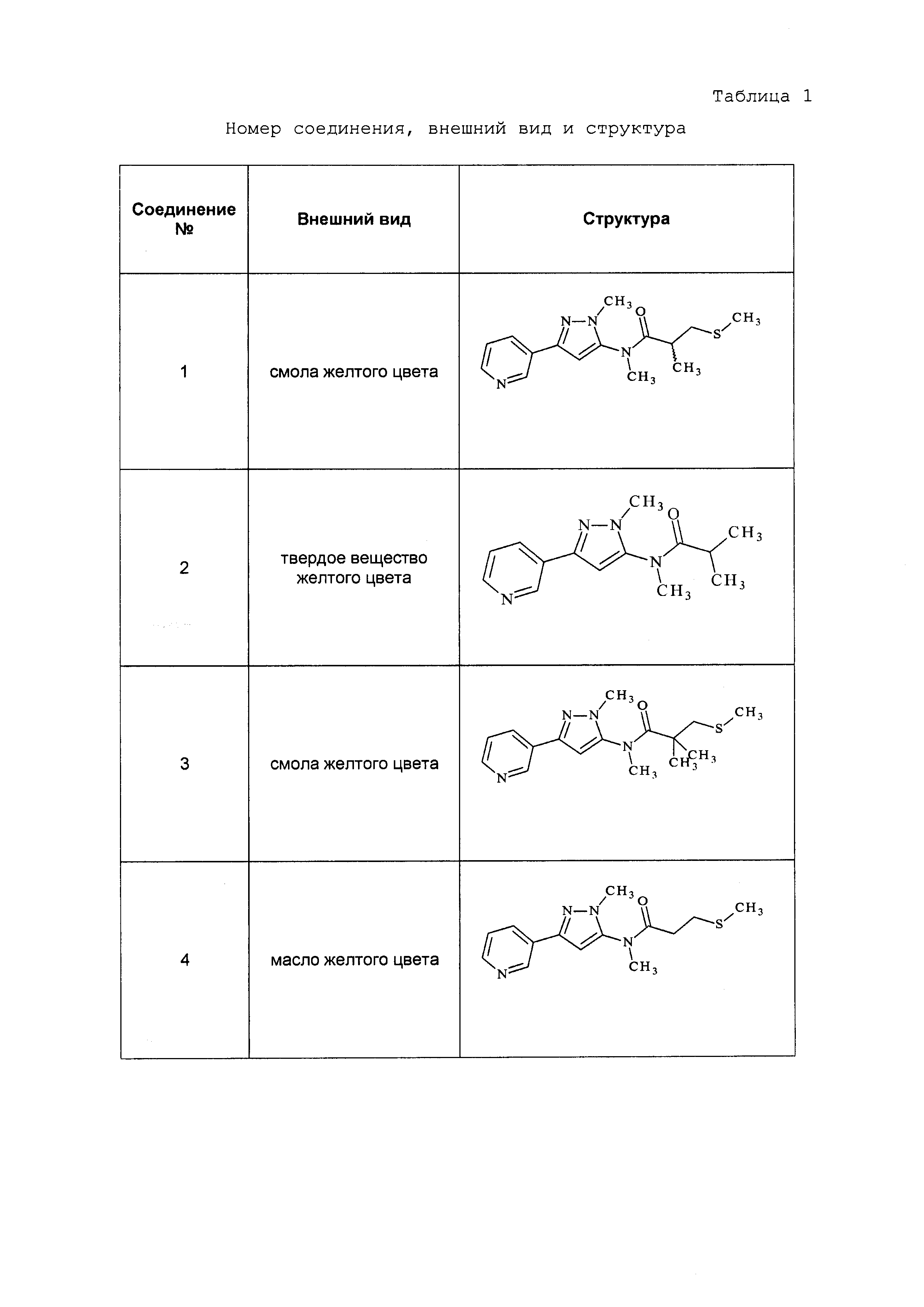
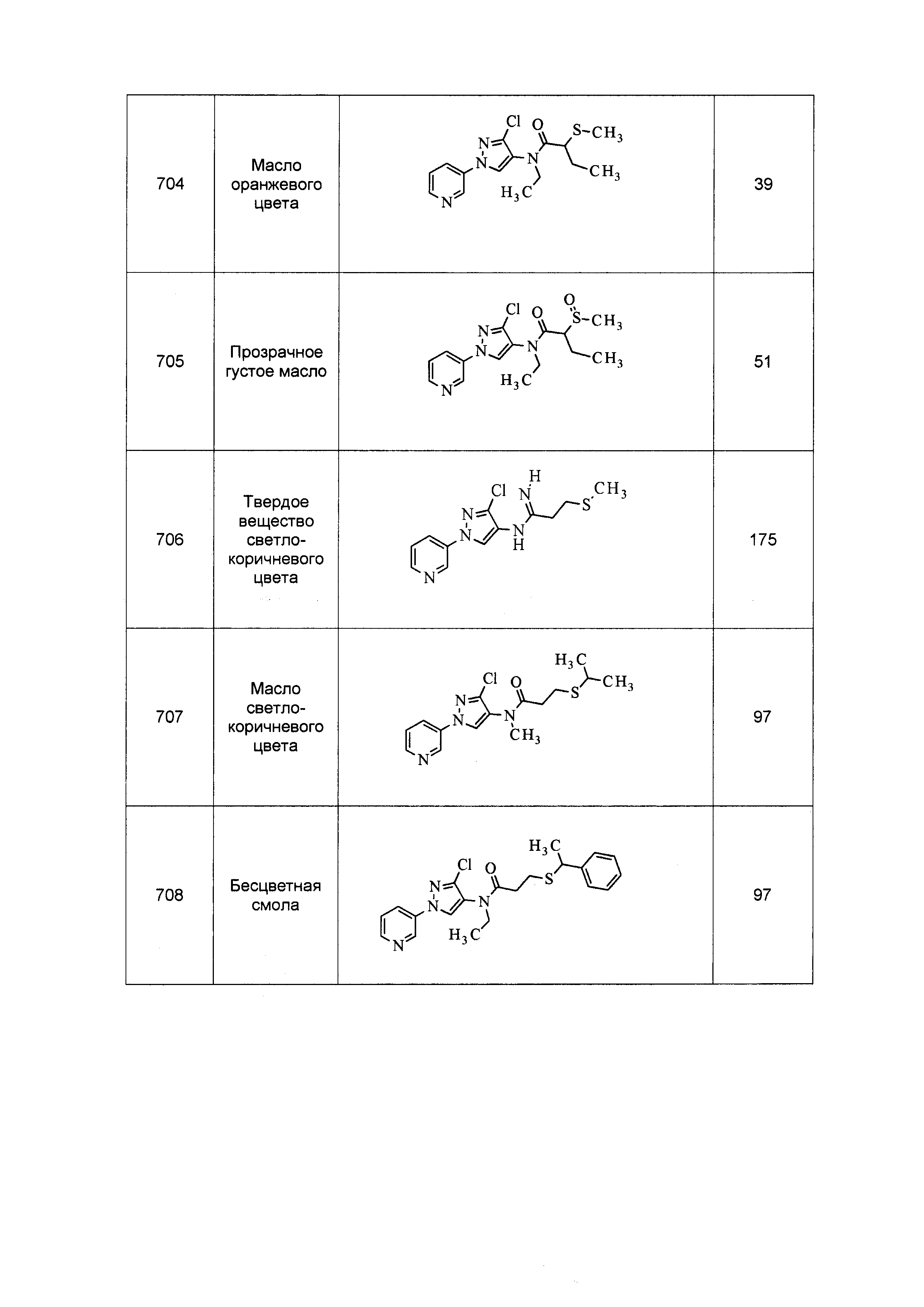
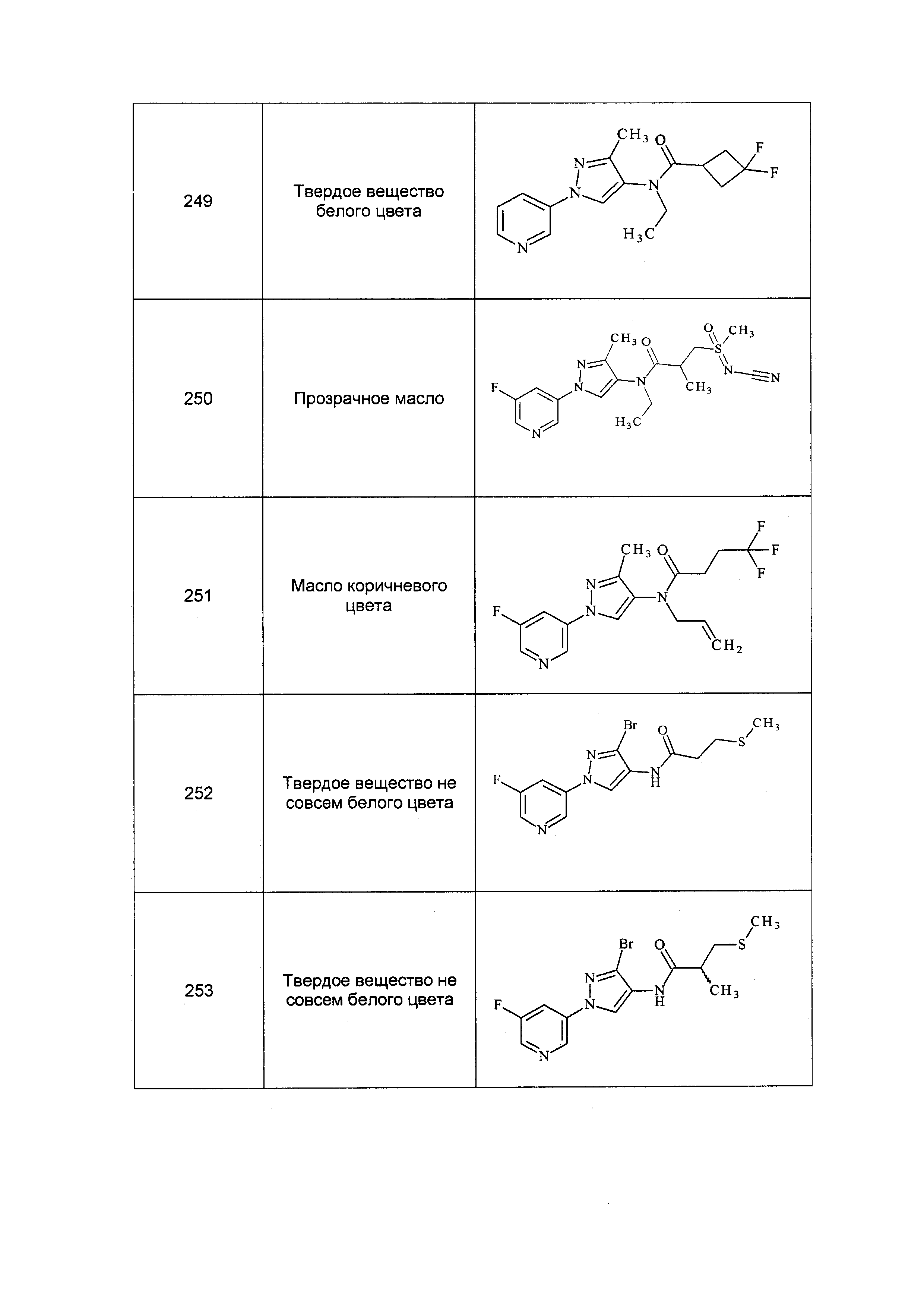
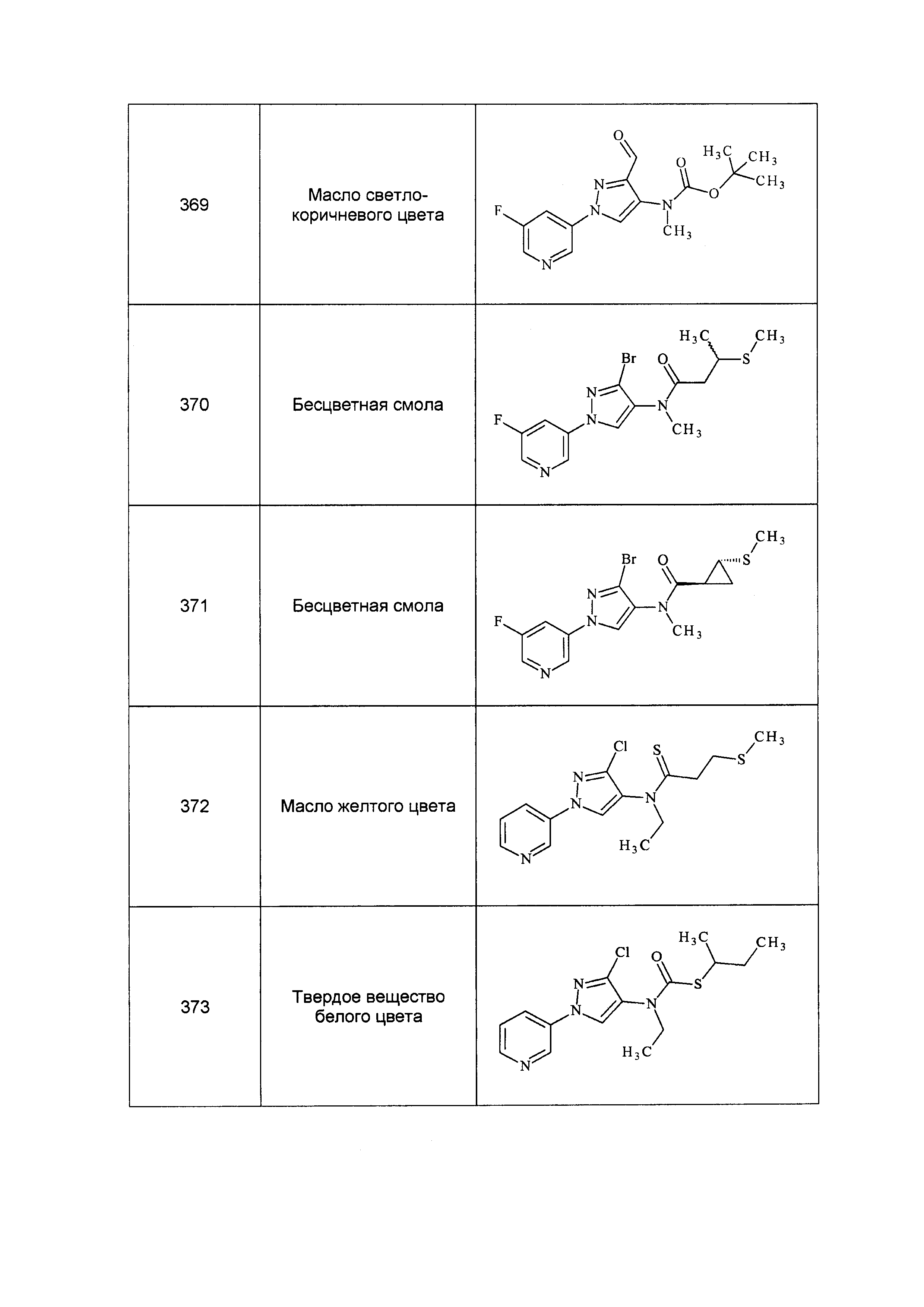
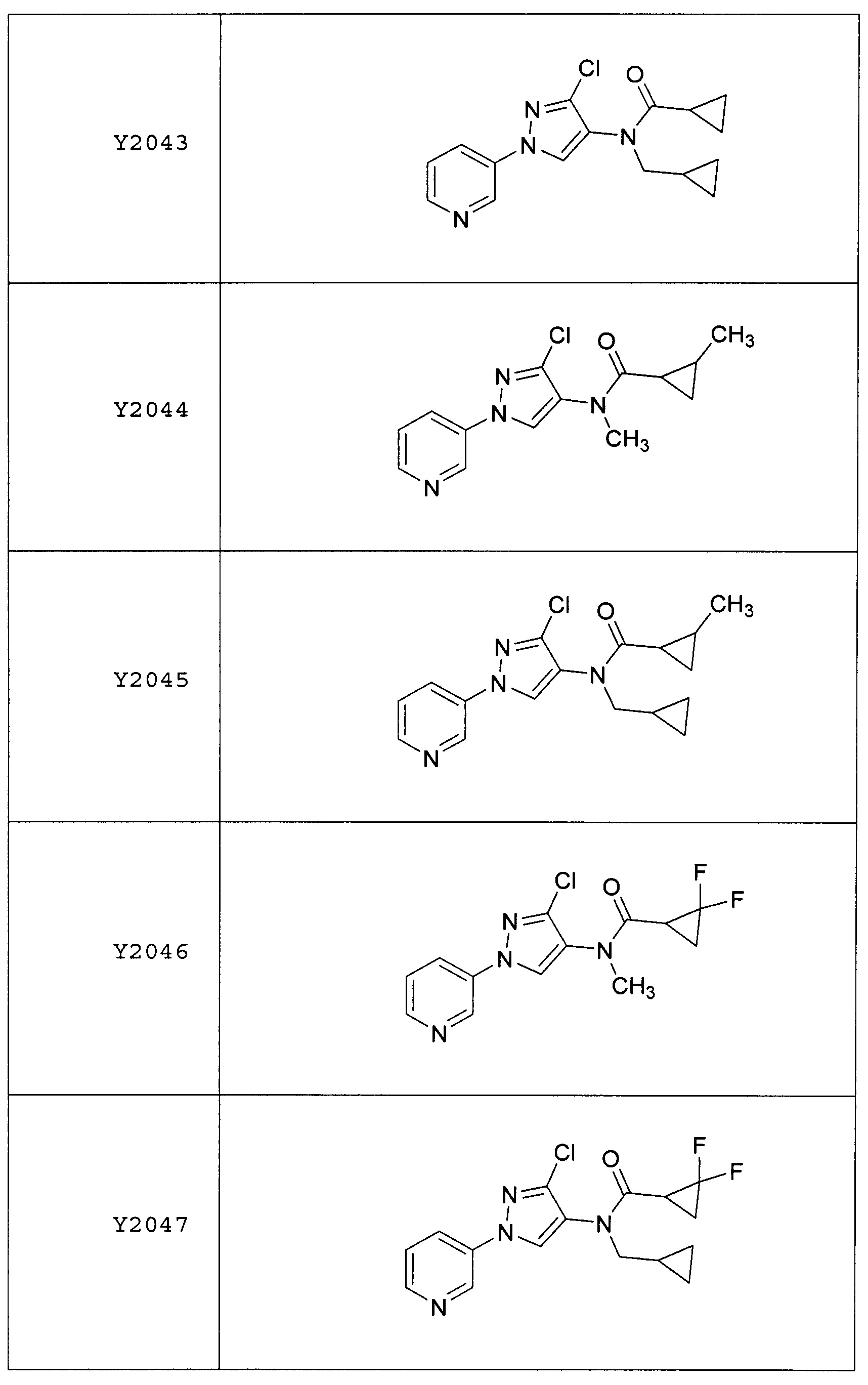
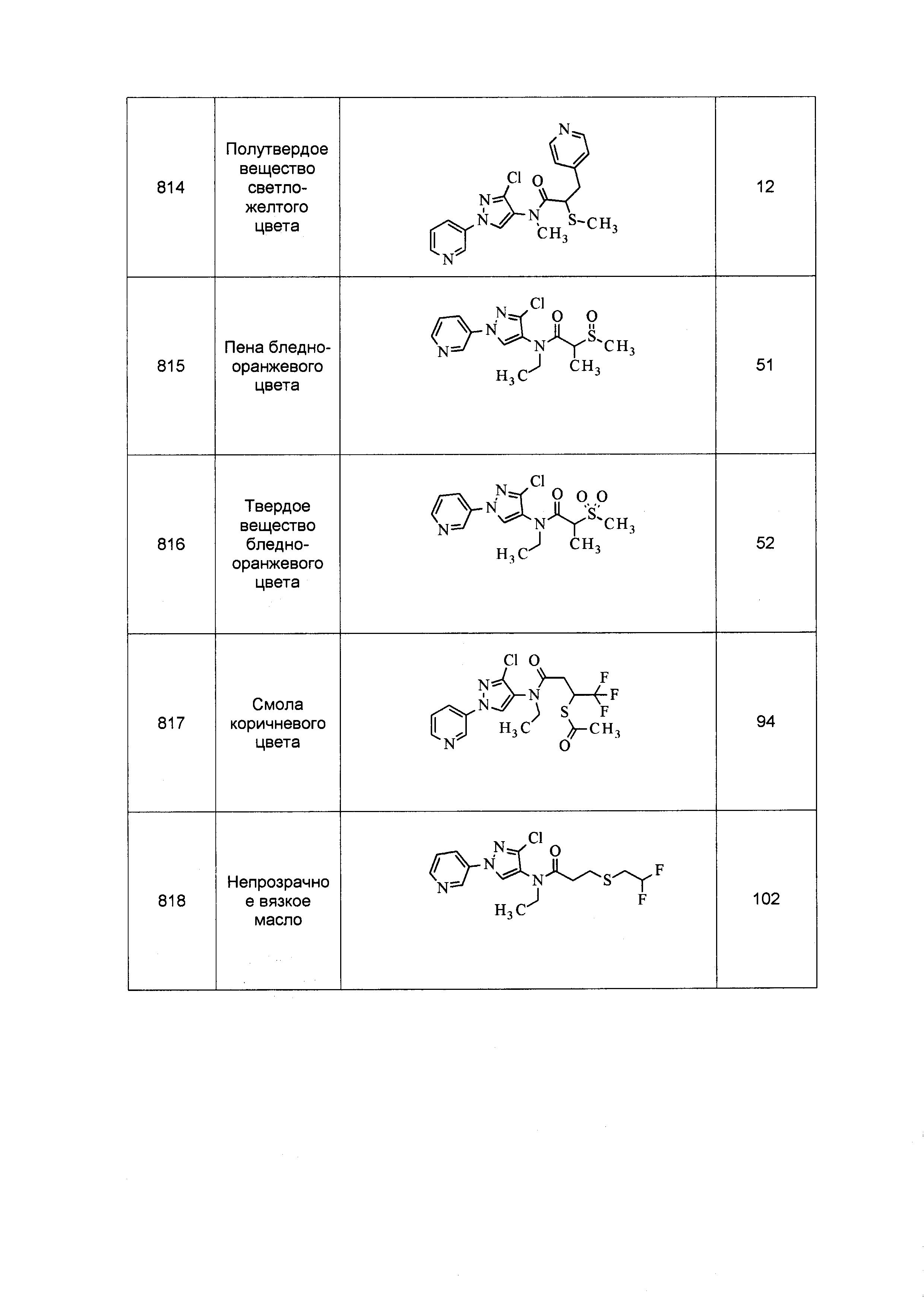
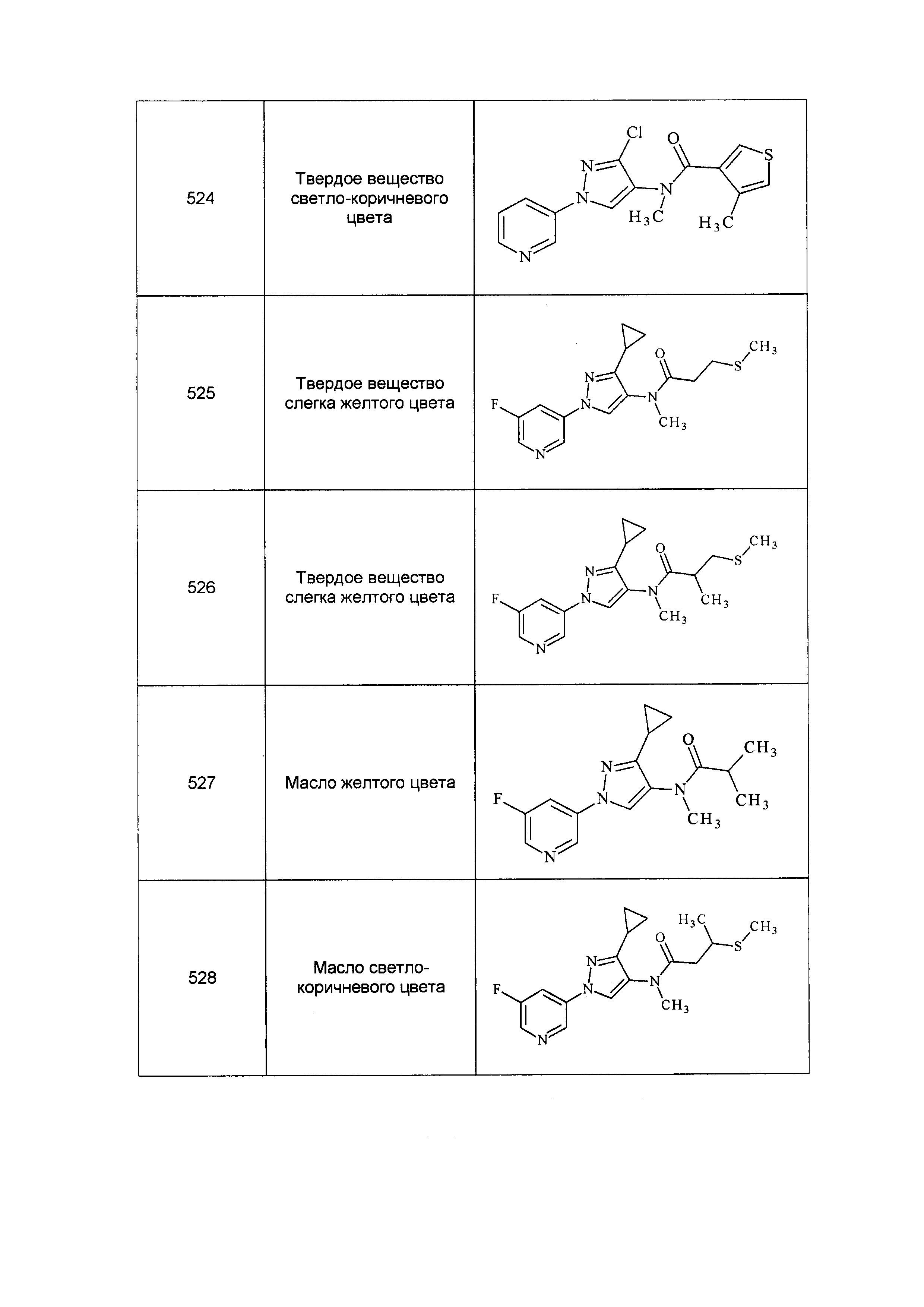
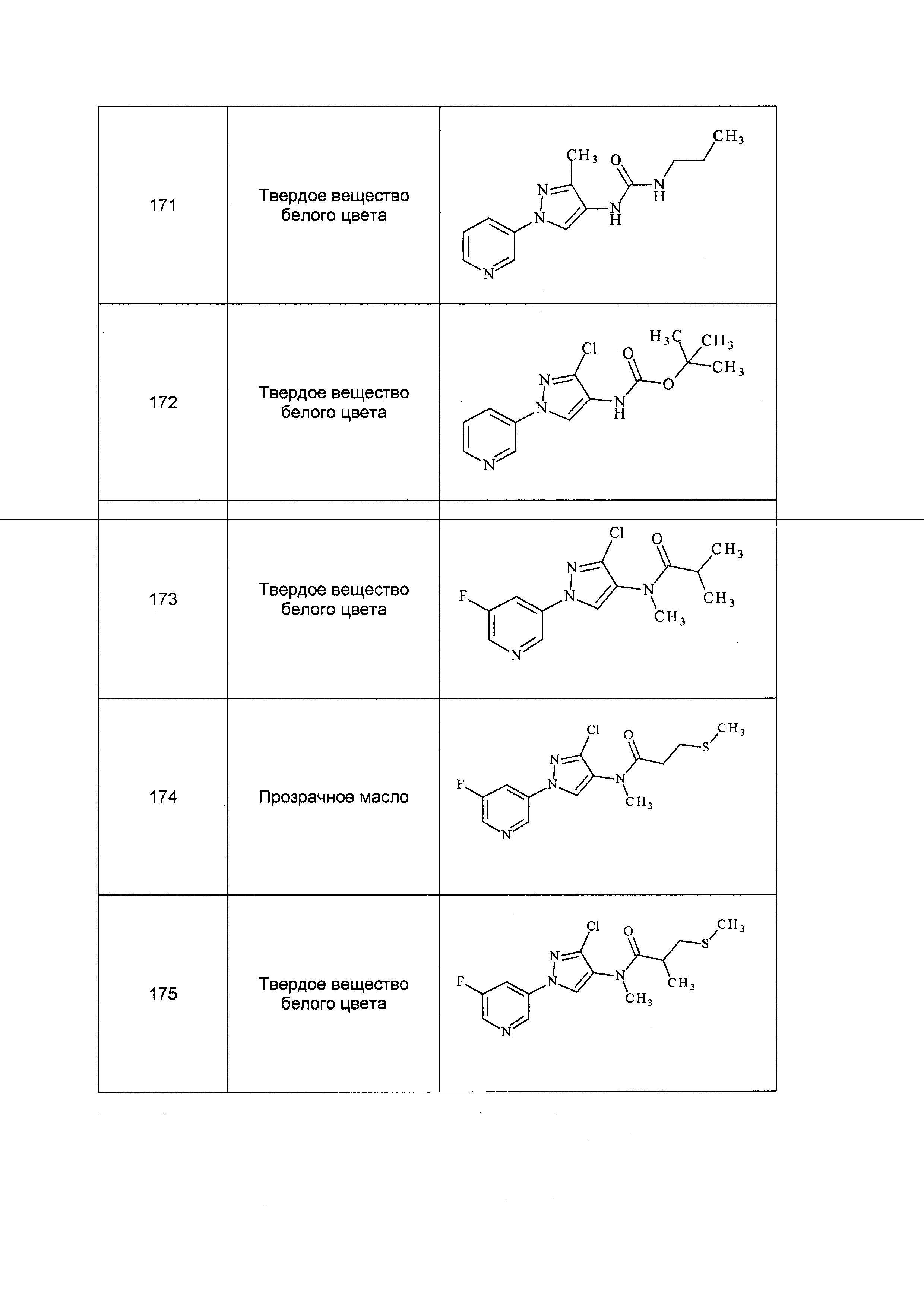
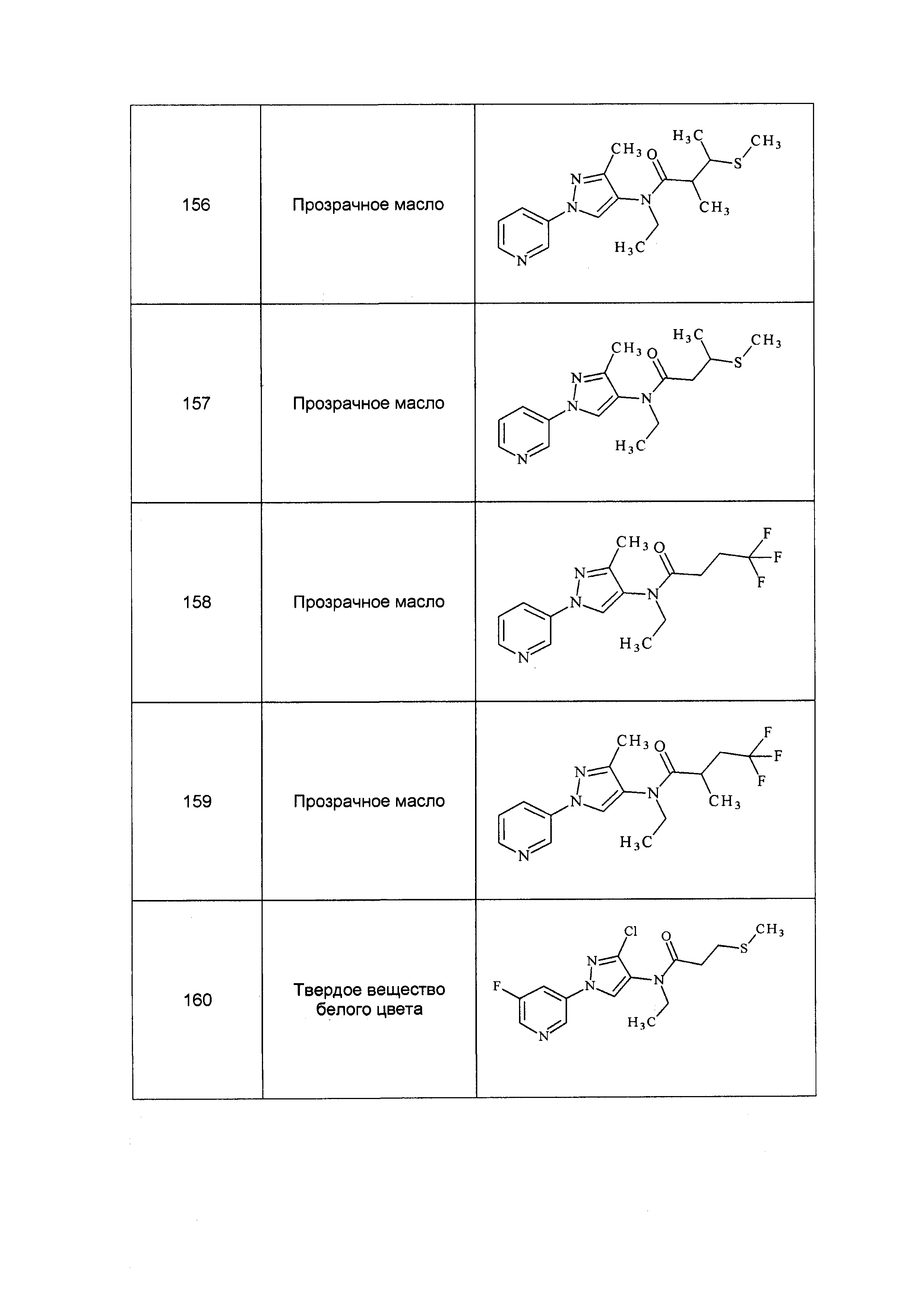
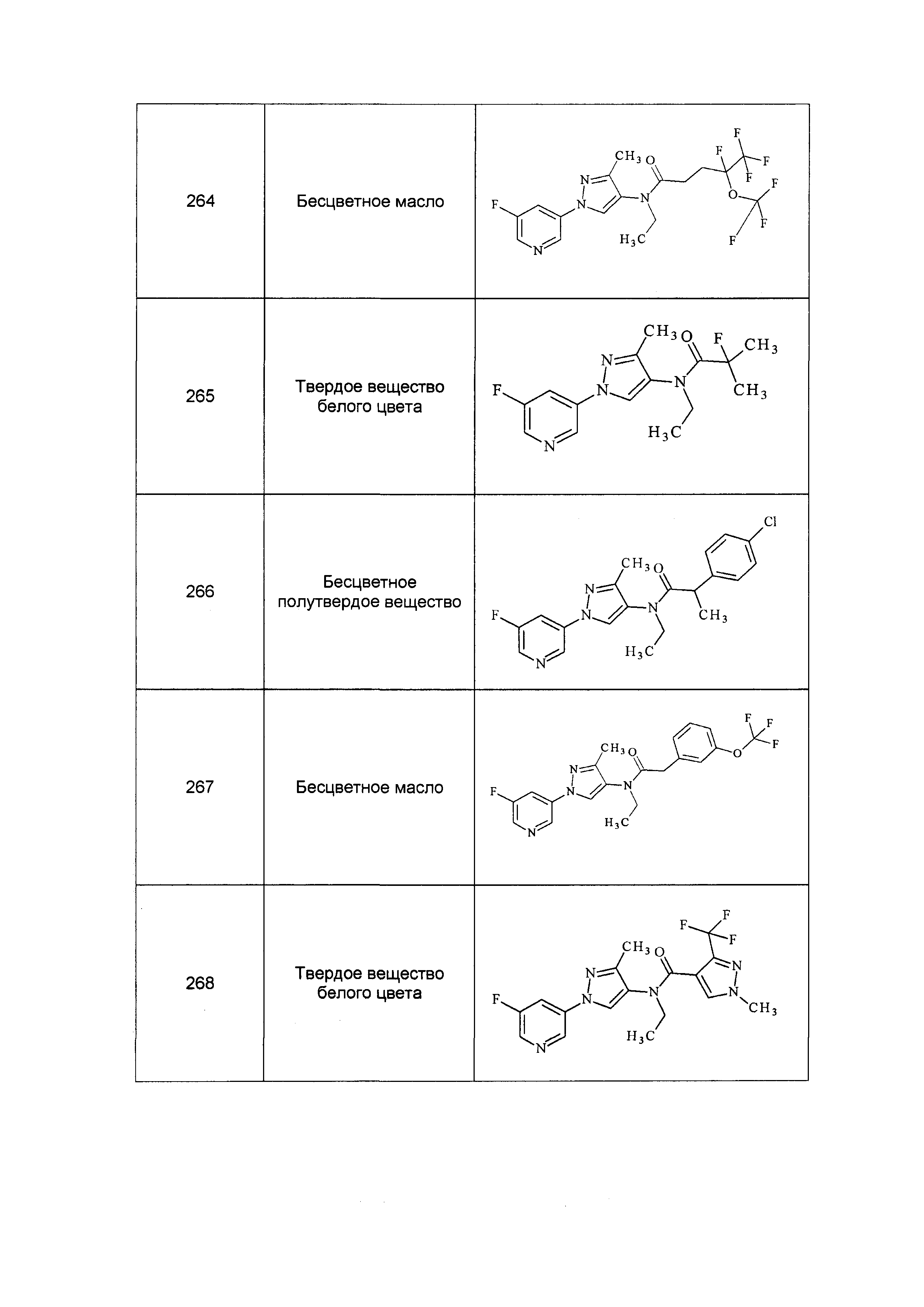
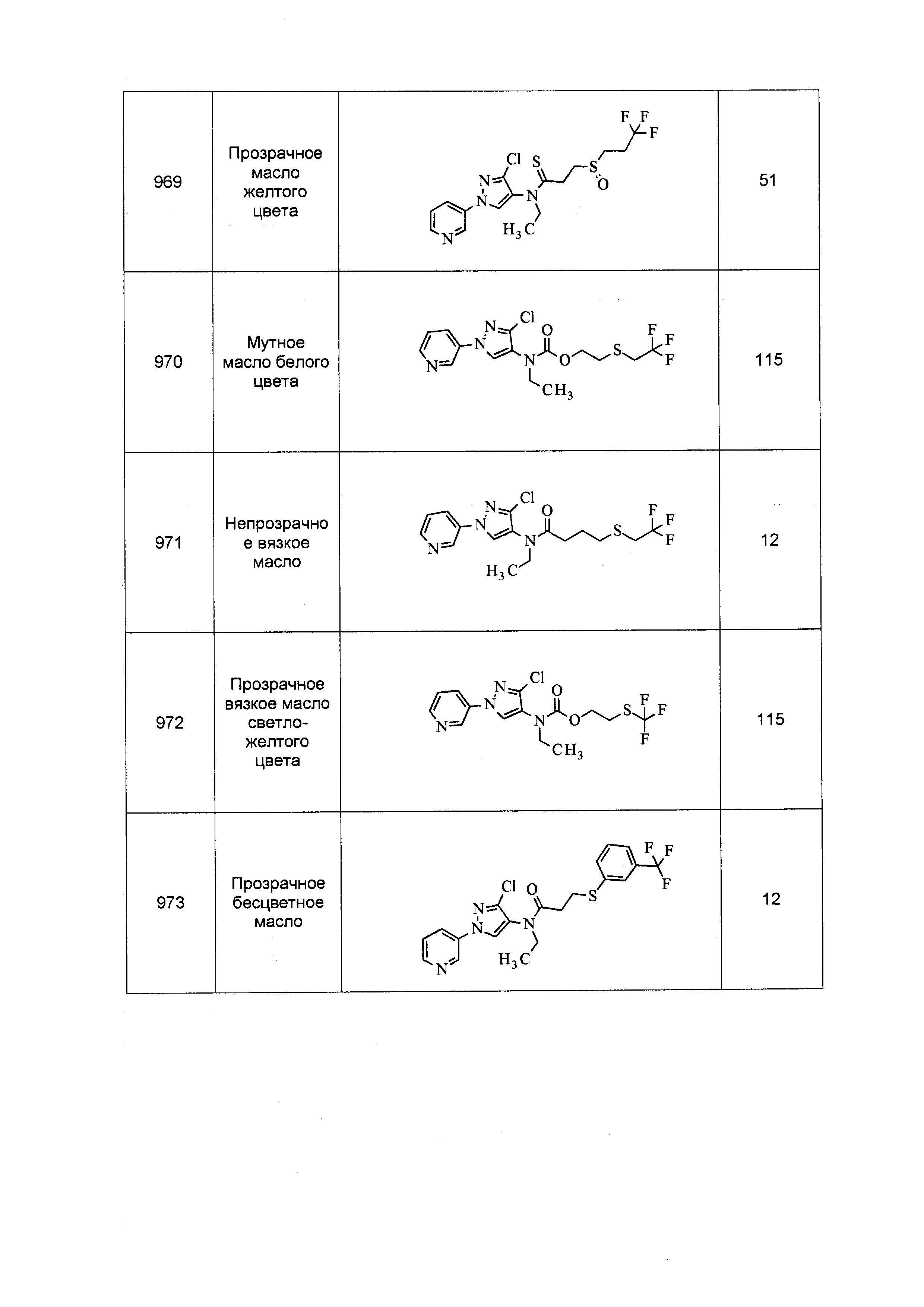
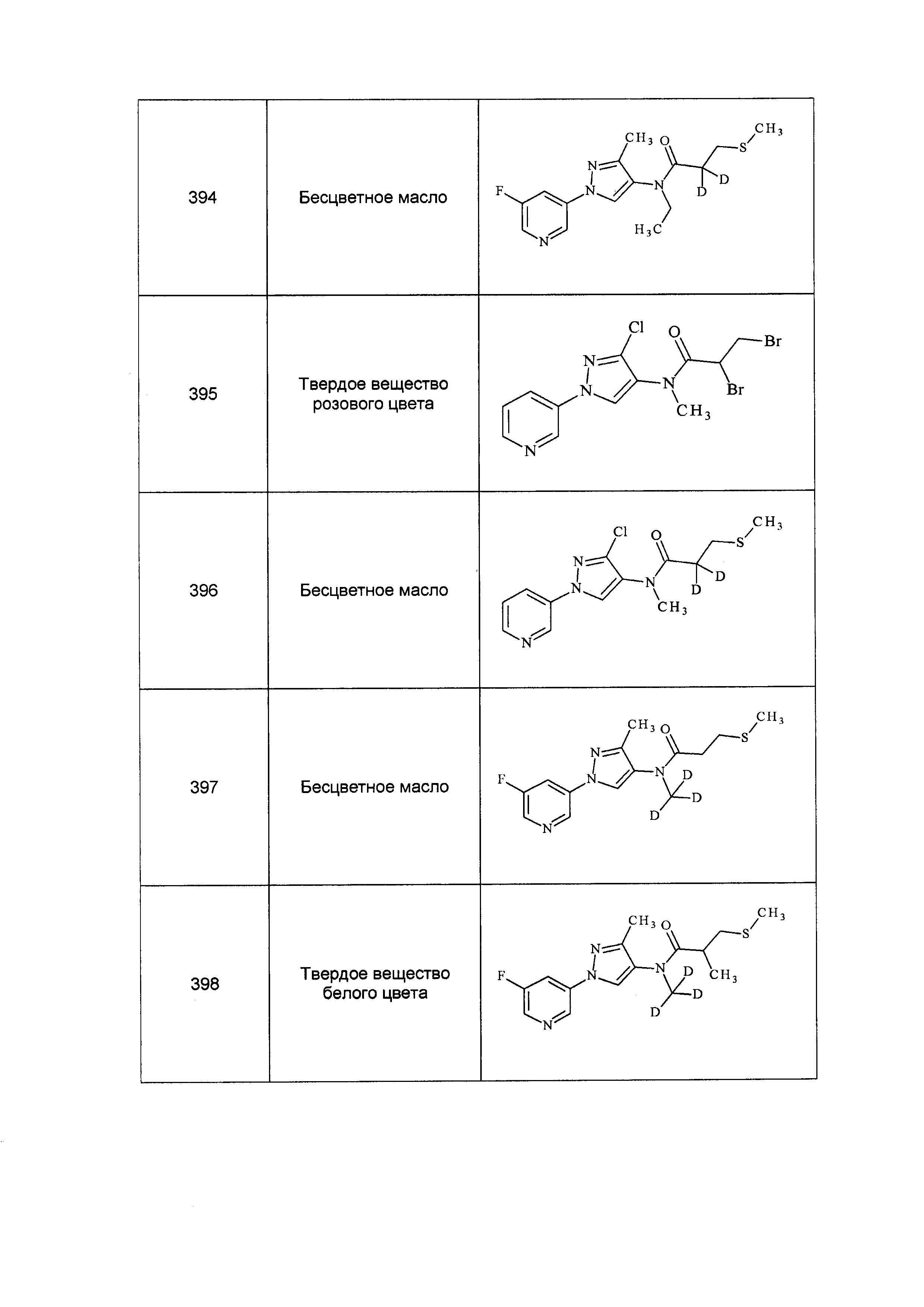
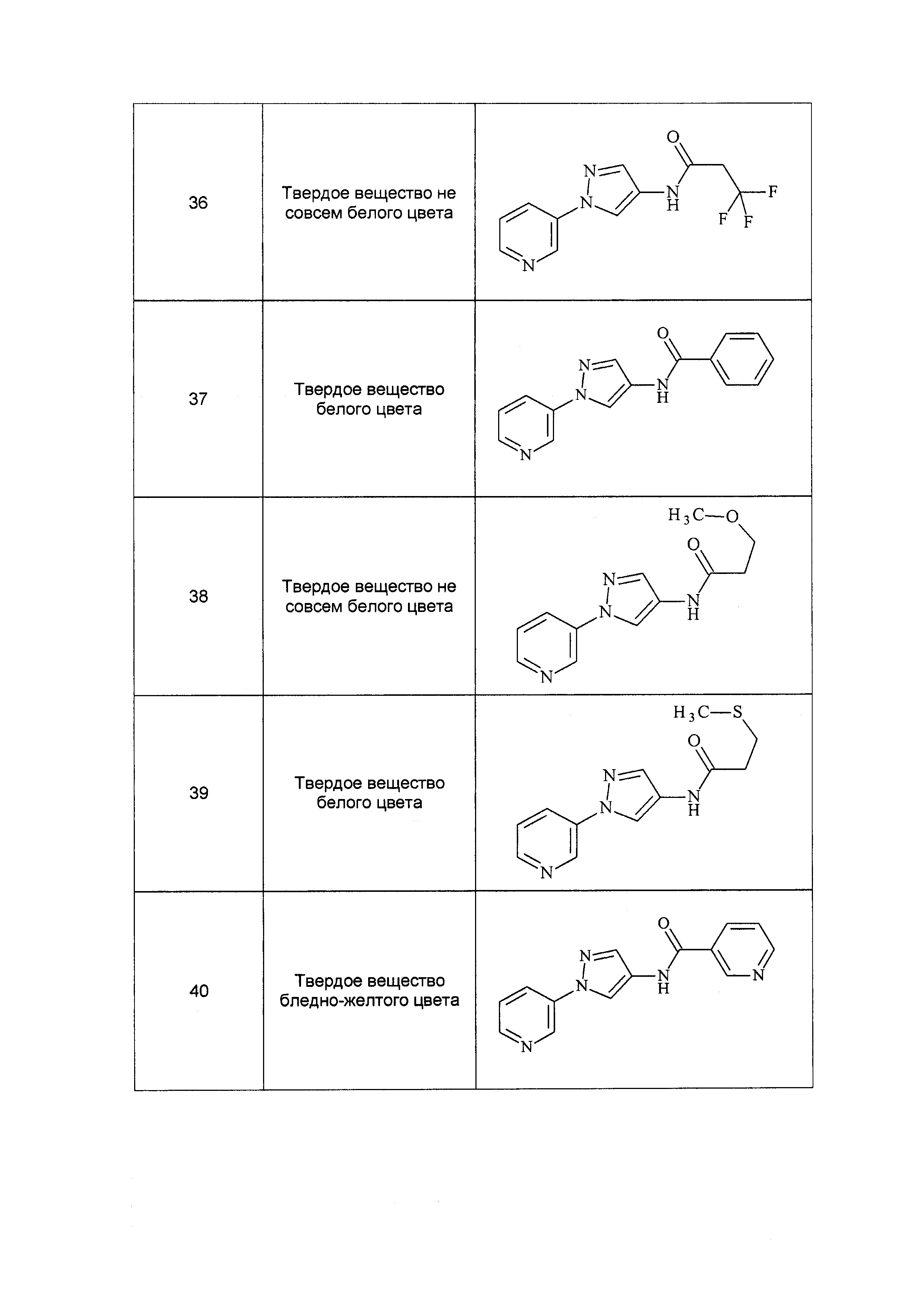
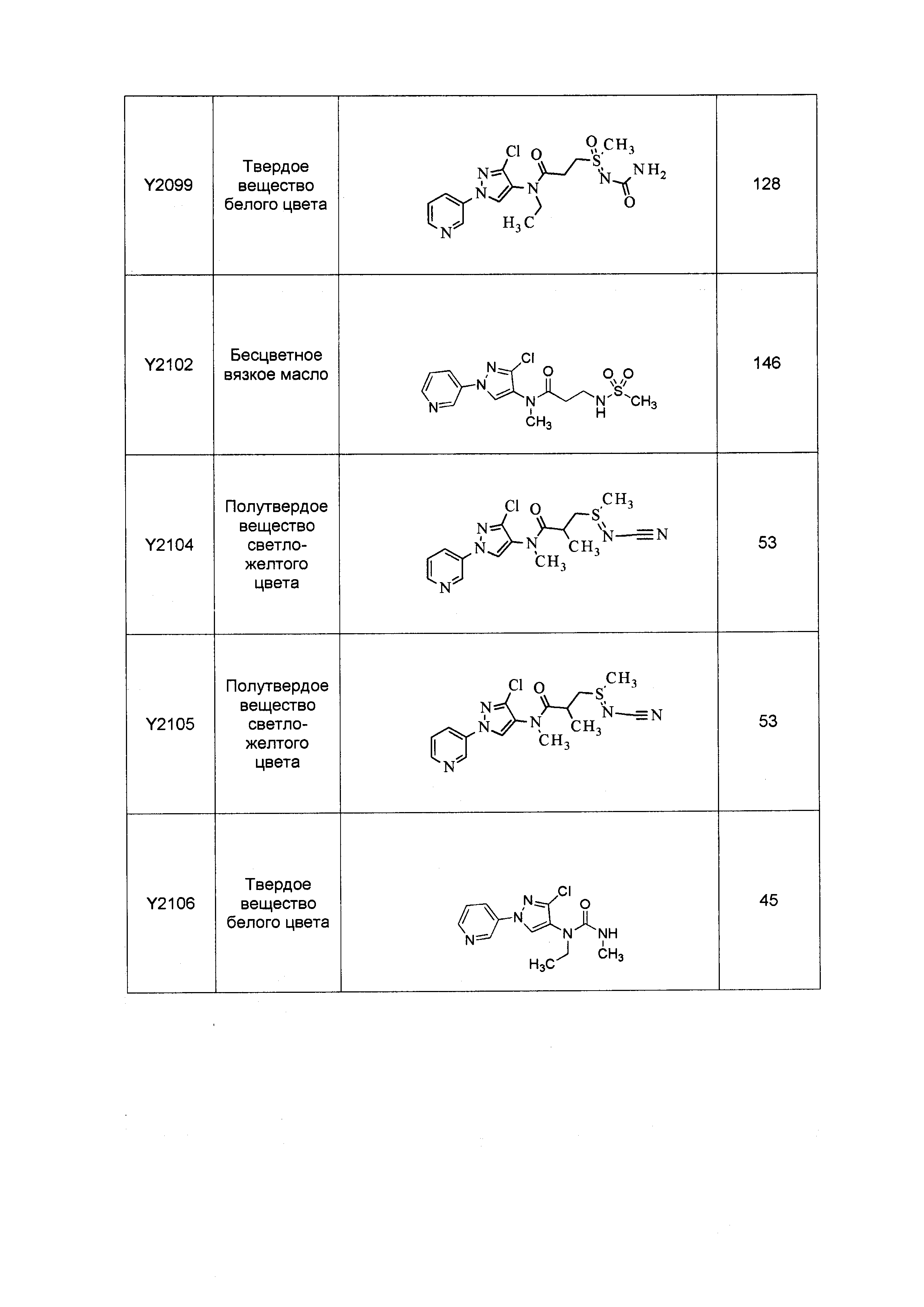
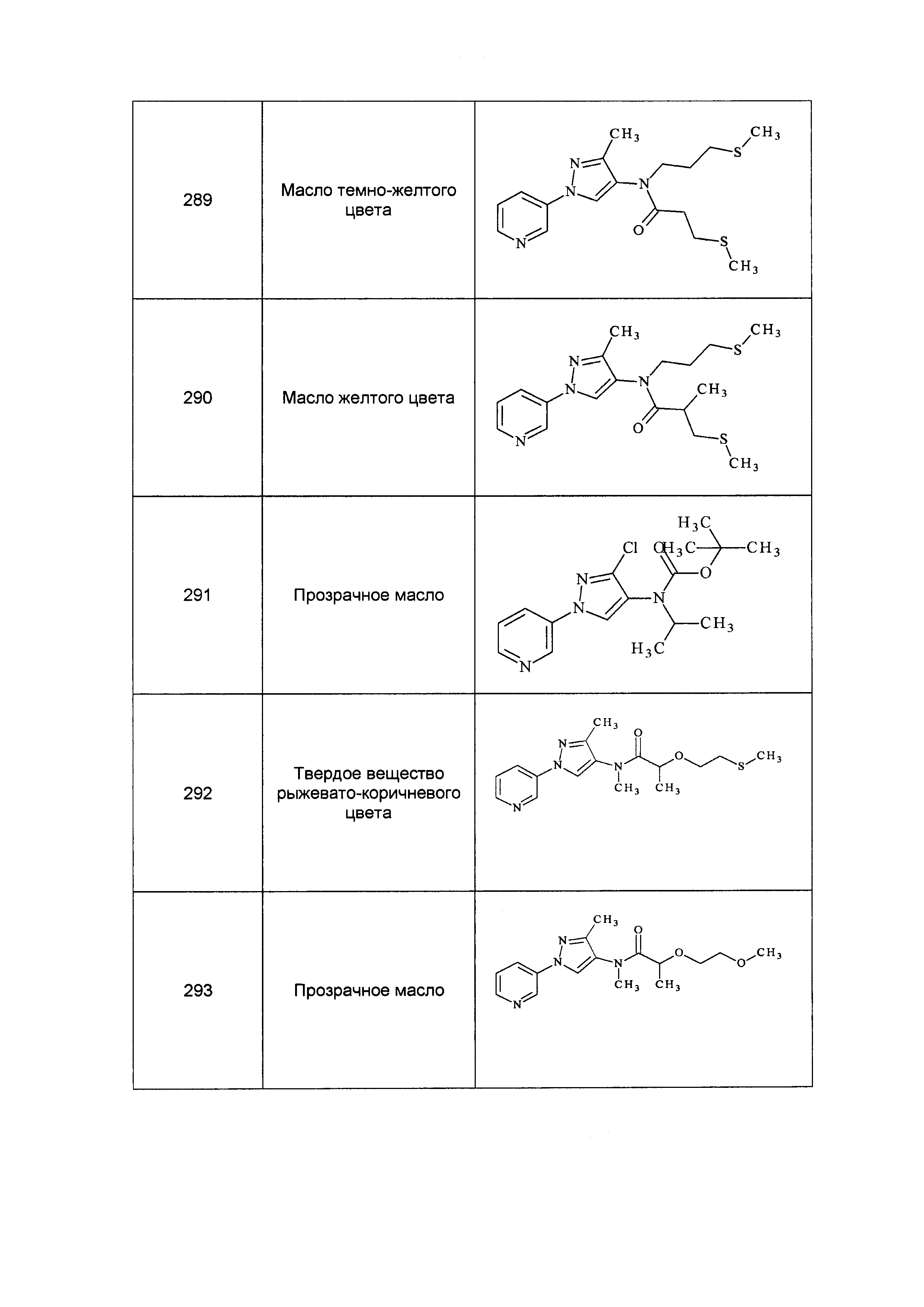
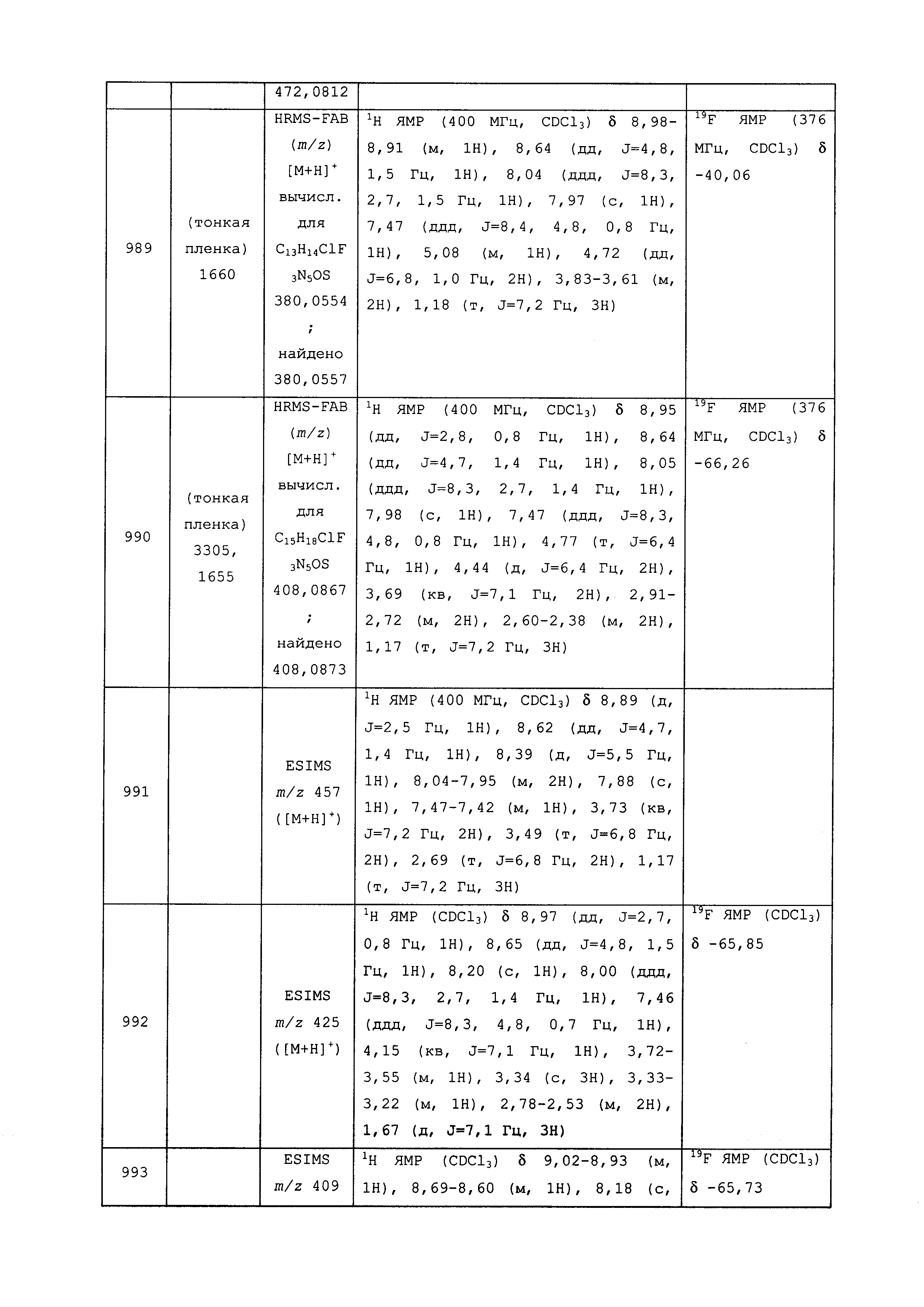
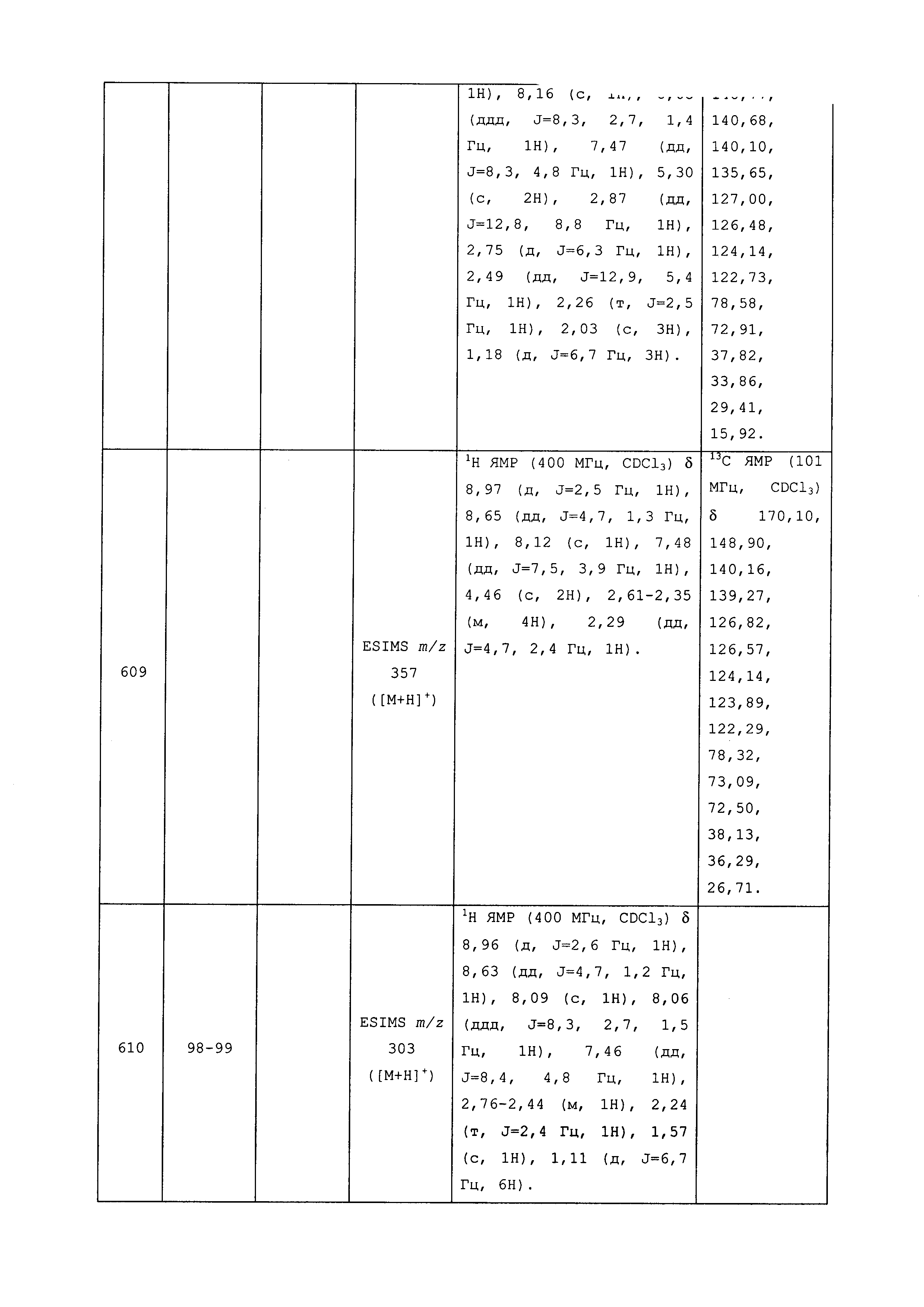
Результат интеллектуальной деятельности: ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ И ОТНОСЯЩИЕСЯ К НИМ СПОСОБЫ
Вид РИД
Изобретение
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
По данной заявке испрашивается приоритет в соответствии и преимущественно с предварительной заявкой США серийного номера 61/639274, которая была подана 27 апреля 2012 г. Полное содержание указанной предварительной заявки включено в настоящий документ путем ссылки на эту заявку.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное описание относится к области способов получения соединений, которые могут быть использованы в качестве пестицидов (например, акарицидов, инсектицидов, моллюскицидов и нематоцидов), к таким соединениям и способам использования таких соединений для уничтожения вредителей.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Каждый год насекомые-вредители являются причиной миллионов человеческих смертей по всему миру. Более того, существует более десяти тысяч видов вредителей, которые вызывают потери в сельском хозяйстве. Мировые сельскохозяйственные потери составляют миллиарды долларов США ежегодно.
Термиты приводят к повреждению всех видов частных и общественных строений. Мировые потери из-за повреждения термитами составляют миллиарды долларов США ежегодно.
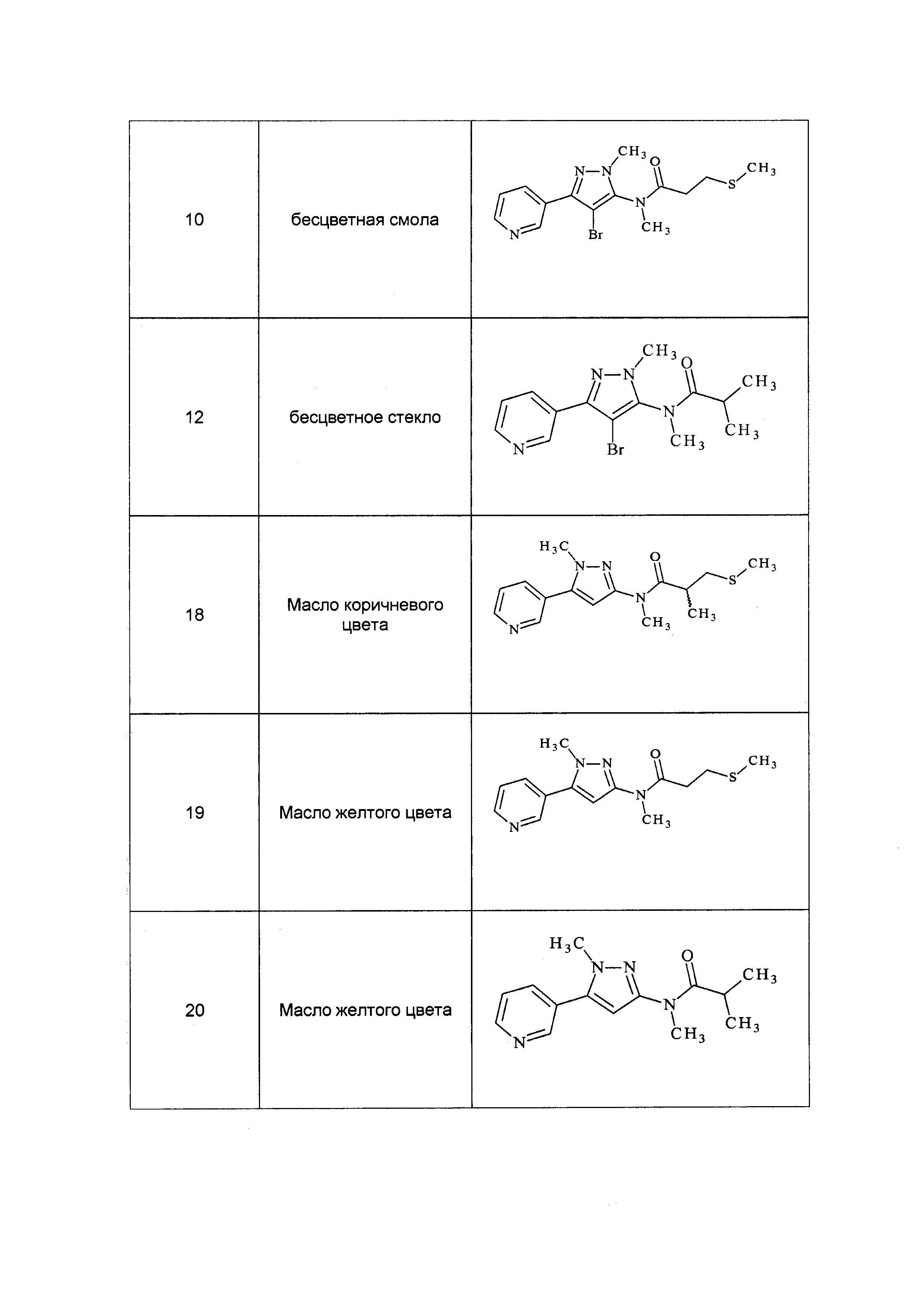
Вредители пищевых хранилищ поедают и портят сохраняемые пищевые запасы. Мировые потери хранимых пищевых запасов составляют миллиарды долларов США каждый год, но, что более важно, лишают людей необходимых продуктов питания.
Существует острая потребность в новых пестицидах. У некоторых вредителей в настоящее время развилась резистентность к пестицидам. Сотни видов вредителей устойчивы к одному или нескольким пестицидам. Развитие резистентности к некоторым из старых пестицидов, таким как ДДТ, карбаматы и органофосфаты, хорошо известно. Но резистентность выработалась даже к некоторым новым пестицидам.
Таким образом, имеется много причин, в том числе указанные выше причины, по которым существует потребность в новых пестицидах.
ОПРЕДЕЛЕНИЯ
Примеры, приведенные в определениях, как правило, не являются исчерпывающими и не должны быть истолкованы как ограничивающие изобретение, раскрытое в данном документе. Понятно, что заместитель должен соответствовать правилам химического связывания и ограничениям по стерической совместимости в отношении конкретной молекулы, к которой он присоединен.
“Алкенил” обозначает ациклический ненасыщенный (по меньшей мере, одна углерод-углеродная двойная связь) разветвленный или неразветвленный заместитель, содержащий углерод и водород, например, винил, аллил, бутенил, пентенил и гексенил.
“Алкенилокси” обозначает алкенил, дополнительно содержащий углерод-кислородную одинарную связь, например, аллилокси, бутенилокси, пентенилокси, гексенилокси.
“Алкокси” обозначает алкил, дополнительно содержащий углерод-кислородную одинарную связь, например, метокси, этокси, пропокси, изопропокси, бутокси, изобутокси и трет-бутокси.
“Алкил” обозначает ациклический насыщенный разветвленный или неразветвленный заместитель, содержащий углерод и водород, например, метил, этил, (C3)алкил, который представляет собой н-пропил и изопропил, (C4)алкил, который представляет собой н-бутил, втор-бутил, изобутил и трет-бутил.
“Алкинил” обозначает ациклический ненасыщенный (по меньшей мере, одна углерод-углеродная тройная связь) разветвленный или неразветвленный заместитель, содержащий углерод и водород, например, этинил, пропаргил, бутинил и пентинил.
“Алкинилокси” обозначает алкинил, дополнительно содержащий углерод-кислородную одинарную связь, например, пентинилокси, гексинилокси, гептинилокси и октинилокси.
“Арил” обозначает циклический ароматический заместитель, состоящий из водорода и углерода, например, фенил, нафтил и бифенил.
“(Cx-Cy)”, где индексы “x” и “y” представляют собой целые числа, такие как 1, 2 или 3, обозначает интервал атомов углерода для заместителя - например, (C1-C4)алкил обозначает метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил и трет-бутил, каждый в отдельности.
“Циклоалкенил” обозначает моноциклический или полициклический ненасыщенный (по меньшей мере, одна углерод-углеродная двойная связь) заместитель, содержащий углерод и водород, например, циклобутенил, циклопентенил, циклогексенил, норборненил, бицикло[2,2,2]октенил, тетрагидронафтил, гексагидронафтил и октагидронафтил.
“Циклоалкенилокси” обозначает циклоалкенил, дополнительно содержащий углерод-кислородную одинарную связь, например, циклобутенилокси, циклопентенилокси, норборненилокси и бицикло[2,2,2]октенилокси.
“Циклоалкил” обозначает моноциклический или полициклический насыщенный заместитель, содержащий углерод и водород, например, циклопропил, циклобутил, циклопентил, норборнил, бицикло[2,2,2]октил и декагидронафтил.
“Циклоалкокси” обозначает циклоалкил, дополнительно содержащий углерод-кислородную одинарную связь, например, циклопропилокси, циклобутилокси, циклопентилокси, норборнилокси и бицикло[2,2,2]октилокси.
“Галоген” обозначает фтор, хлор, бром и йод.
“Галогеналкокси” обозначает алкокси, дополнительно содержащий от одного до максимально возможного числа одинаковых или различных галогенов, например, фторметокси, трифторметокси, 2,2-дифторпропокси, хлорметокси, трихлорметокси, 1,1,2,2-тетрафторэтокси и пентафторэтокси.
“Галогеналкил” обозначает алкил, дополнительно содержащий от одного до максимально возможного числа одинаковых или различных галогенов, например, фторметил, трифторметил, 2,2-дифторпропил, хлорметил, трихлорметил и 1,1,2,2-тетрафторэтил.
“Гетероциклил” обозначает циклический заместитель, который может быть полностью насыщенным, частично ненасыщенным или полностью ненасыщенным, где циклическая структура содержит, по меньшей мере, один атом углерода и, по меньшей мере, один гетероатом, где указанный гетероатом представляет собой азот, серу или кислород. В случае серы, данный атом может находиться в других состояниях окисления, таких как сульфоксид и сульфон. Примеры ароматических гетероциклилов включают, но этим не ограничиваются, бензoфуранил, бензoизотиазолил, бензoизоксазолил, бензоксазолил, бензoтиенил, бензoтиазолил, циннолинил, фуранил, имидазолил, индазолил, индолил, изоиндолил, изохинолинил, изотиазолил, изоксазолил, оксадиазолил, оксазолинил, оксазолил, фталазинил, пиразинил, пиразолинил, пиразолил, пиридазинил, пиридил, пиримидинил, пирролил, хиназолинил, хинолинил, хиноксалинил, тетразолил, тиазолинил, тиазолил, тиенил, триазинил и триазолил. Примеры полностью насыщенных гетероциклилов включают, но этим не ограничиваются, пиперазинил, пиперидинил, морфолинил, пирролидинил, оксетанил, тетрагидрофуранил, тетрагидротиенил и тетрагидропиранил. Примеры частично ненасыщенных гетероциклилов включают, но этим не ограничиваются, 1,2,3,4-тетрагидрохинолинил, 4,5-дигидро-оксазолил, 4,5-дигидро-1H-пиразолил, 4,5-дигидро-изоксазолил и 2,3-дигидро-[1,3,4]-оксадиазолил. Дополнительные примеры включают следующие
ПОДРОБНОЕ ОПИСАНИЕ
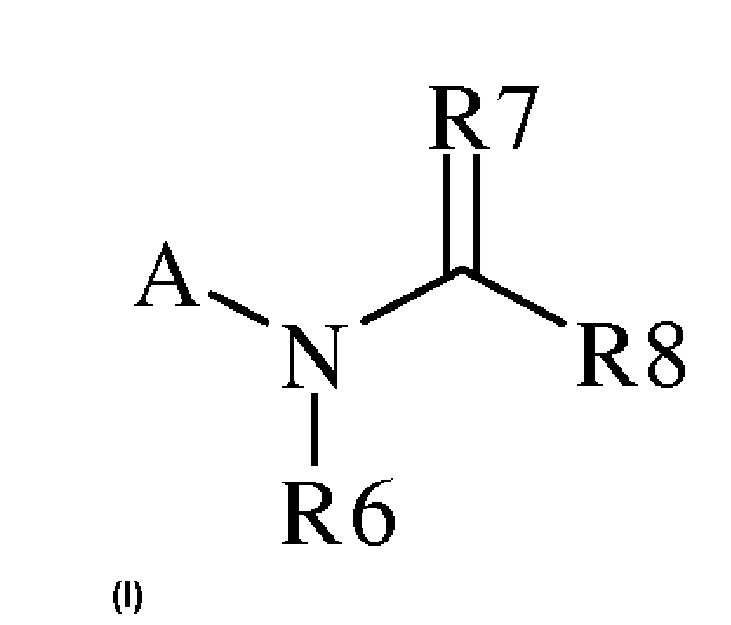
В настоящем документе описаны соединения, имеющие следующую формулу (“формула один”):
 ,
,
где
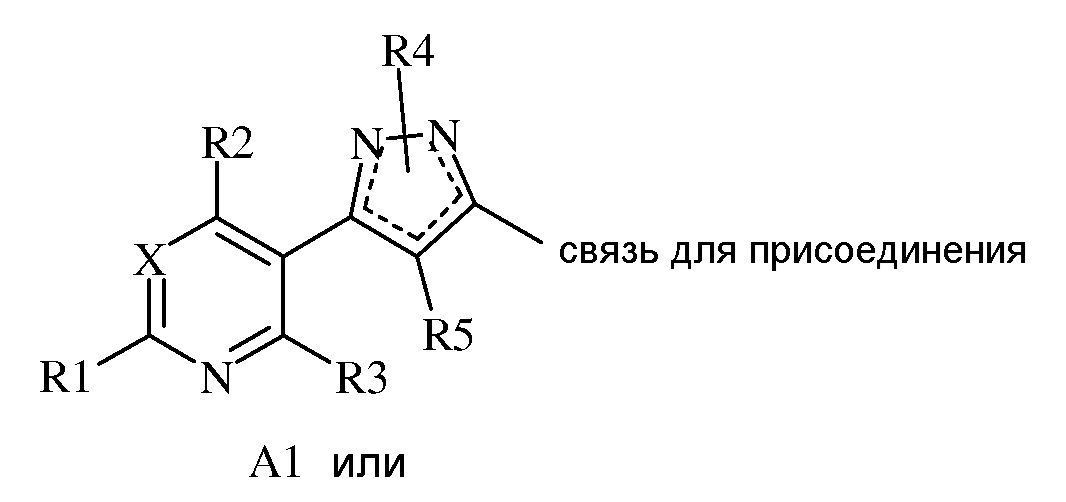
(a) A представляет собой или
 ,
,
(b) R1 представляет собой H, F, Cl, Br, I, CN, NO2, замещенный или незамещенный C1-C6 алкил, замещенный или незамещенный C2-C6 алкенил, замещенный или незамещенный C1-C6 алкокси, замещенный или незамещенный C2-C6 алкенилокси, замещенный или незамещенный C3-C10 циклоалкил, замещенный или незамещенный C3-C10 циклоалкенил, замещенный или незамещенный C6-C20 арил, замещенный или незамещенный C1-C20 гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, S(O)nR9, S(O)nOR9, S(O)nN(R9)2 или R9S(O)nR9,
где каждый указанный R1, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-C6 алкила, C2-C6 алкенила, C1-C6 галогеналкила, C2-C6 галогеналкенила, C1-C6 галогеналкилокси, C2-C6 галогеналкенилокси, C3-C10 циклоалкила, C3-C10 циклоалкенила, C3-C10 галогенциклоалкила, C3-C10 галогенциклоалкенила, OR9, S(O)nOR9, C6-C20 арила или C1-C20 гетероциклила (каждый из которых может быть замещенным, необязательно может быть замещенным R9);
(c) R2 представляет собой H, F, Cl, Br, I, CN, NO2, замещенный или незамещенный C1-C6 алкил, замещенный или незамещенный C2-C6 алкенил, замещенный или незамещенный C1-C6 алкокси, замещенный или незамещенный C2-C6 алкенилокси, замещенный или незамещенный C3-C10 циклоалкил, замещенный или незамещенный C3-C10 циклоалкенил, замещенный или незамещенный C6-C20 арил, замещенный или незамещенный C1-C20 гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nOR9 или R9S(O)nR9,
где каждый указанный R2, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-C6 алкила, C2-C6 алкенила, C1-C6 галогеналкила, C2-C6 галогеналкенила, C1-C6 галогеналкилокси, C2-C6 галогеналкенилокси, C3-C10 циклоалкила, C3-C10 циклоалкенила, C3-C10 галогенциклоалкила, C3-C10 галогенциклоалкенила, OR9, S(O)nOR9, C6-C20 арила или C1-C20 гетероциклила (каждый из которых может быть замещенным, необязательно может быть замещенным R9);
(d) R3 представляет собой H, F, Cl, Br, I, CN, NO2, замещенный или незамещенный C1-C6 алкил, замещенный или незамещенный C2-C6 алкенил, замещенный или незамещенный C1-C6 алкокси, замещенный или незамещенный C2-C6 алкенилокси, замещенный или незамещенный C3-C10 циклоалкил, замещенный или незамещенный C3-C10 циклоалкенил, замещенный или незамещенный C6-C20 арил, замещенный или незамещенный C1-C20 гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nOR9 или R9S(O)nR9,
где каждый указанный R3, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-C6 алкила, C2-C6 алкенила, C1-C6 галогеналкила, C2-C6 галогеналкенила, C1-C6 галогеналкилокси, C2-C6 галогеналкенилокси, C3-C10 циклоалкила, C3-C10 циклоалкенила, C3-C10 галогенциклоалкила, C3-C10 галогенциклоалкенила, OR9, S(O)nOR9, C6-C20 арила или C1-C20 гетероциклила (каждый из которых может быть замещенным, необязательно может быть замещенным R9);
(e) когда A представляет собой
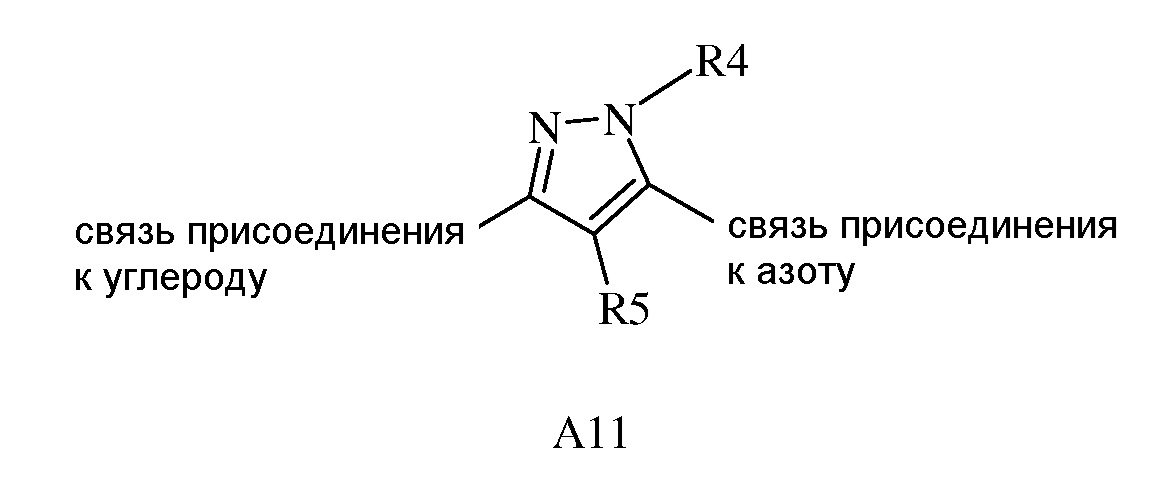
(1) A1, тогда A1 представляет собой либо
(a) A11
 ,
,
где R4 представляет собой H, NO2, замещенный или незамещенный C1-C6 алкил, замещенный или незамещенный C2-C6 алкенил, замещенный или незамещенный C1-C6 алкокси, замещенный или незамещенный C3-C10 циклоалкил, замещенный или незамещенный C3-C10 циклоалкенил, замещенный или незамещенный C6-C20 арил, замещенный или незамещенный C1-C20 гетероциклил, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, S(O)nOR9 или R9S(O)nR9,
где каждый указанный R4, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-C6 алкила, C2-C6 алкенила, C1-C6 галогеналкила, C2-C6 галогеналкенила, C1-C6 галогеналкилокси, C2-C6 галогеналкенилокси, C3-C10 циклоалкила, C3-C10 циклоалкенила, C3-C10 галогенциклоалкила, C3-C10 галогенциклоалкенила, OR9, S(O)nOR9, C6-C20 арила или C1-C20 гетероциклила (каждый из которых может быть замещенным, необязательно может быть замещенным R9), или
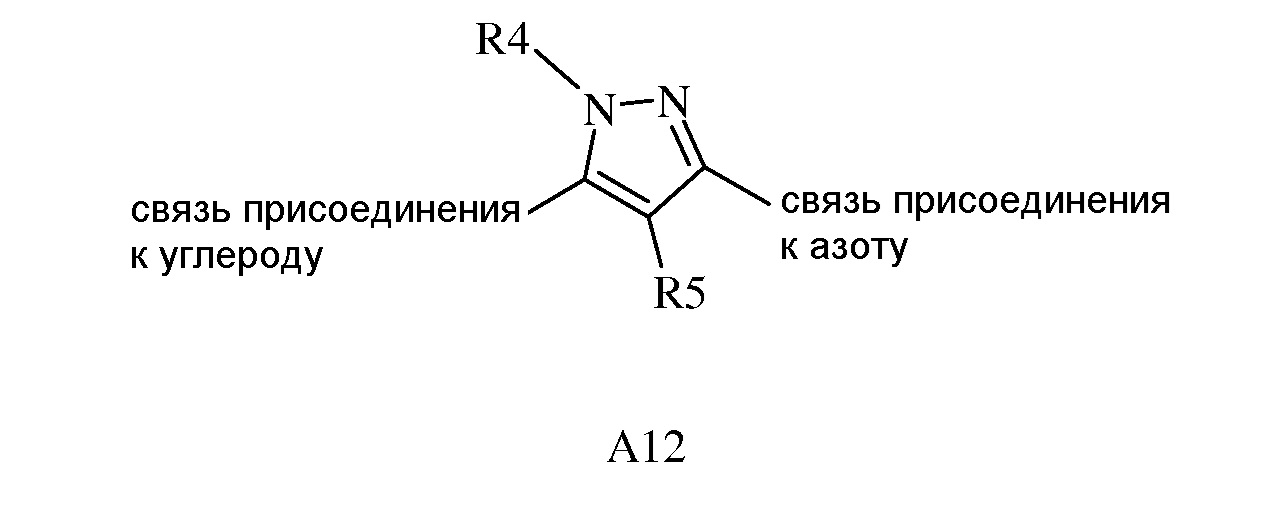
(b) A12
 ,
,
где R4 представляет собой C1-C6 алкил,
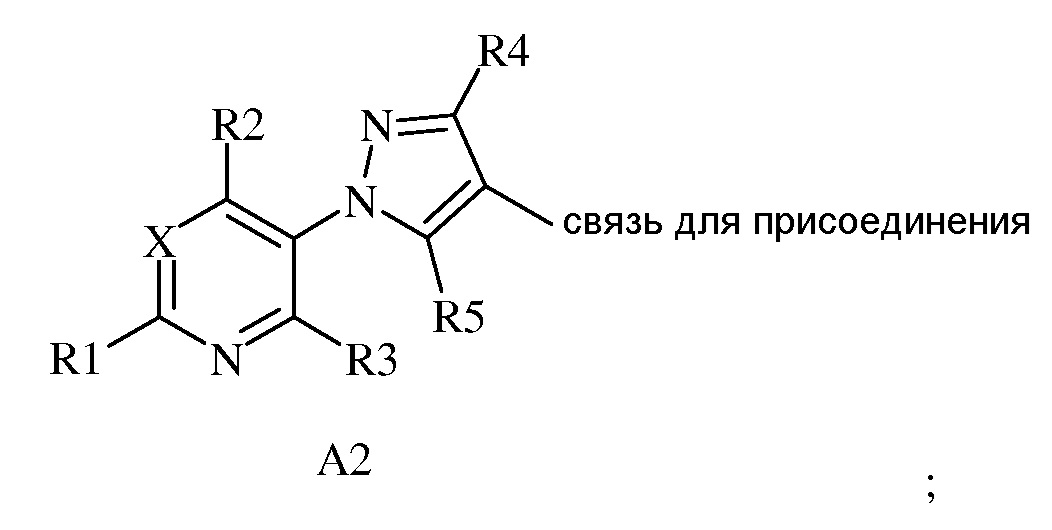
(2) A2, тогда R4 представляет собой H, F, Cl, Br, I, CN, NO2, замещенный или незамещенный C1-C6 алкил, замещенный или незамещенный C2-C6 алкенил, замещенный или незамещенный C1-C6 алкокси, замещенный или незамещенный C2-C6 алкенилокси, замещенный или незамещенный C3-C10 циклоалкил, замещенный или незамещенный C3-C10 циклоалкенил, замещенный или незамещенный C6-C20 арил, замещенный или незамещенный C1-C20 гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nOR9 или R9S(O)nR9,
где каждый указанный R4, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-C6 алкила, C2-C6 алкенила, C1-C6 галогеналкила, C2-C6 галогеналкенила, C1-C6 галогеналкилокси, C2-C6 галогеналкенилокси, C3-C10 циклоалкила, C3-C10 циклоалкенила, C3-C10 галогенциклоалкила, C3-C10 галогенциклоалкенила, OR9, S(O)nOR9, C6-C20 арила или C1-C20 гетероциклила (каждый из которых может быть замещенным, необязательно может быть замещенным R9);
(f) R5 представляет собой H, F, Cl, Br, I, CN, NO2, замещенный или незамещенный C1-C6 алкил, замещенный или незамещенный C2-C6 алкенил, замещенный или незамещенный C1-C6 алкокси, замещенный или незамещенный C2-C6 алкенилокси, замещенный или незамещенный C3-C10 циклоалкил, замещенный или незамещенный C3-C10 циклоалкенил, замещенный или незамещенный C6-C20 арил OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nOR9 или R9S(O)nR9,
где каждый указанный R5, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-C6 алкила, C2-C6 алкенила, C1-C6 галогеналкила, C2-C6 галогеналкенила, C1-C6 галогеналкилокси, C2-C6 галогеналкенилокси, C3-C10 циклоалкила, C3-C10 циклоалкенила, C3-C10 галогенциклоалкила, C3-C10 галогенциклоалкенила, OR9, S(O)nOR9 или C6-C20 арила (каждый из которых может быть замещенным, необязательно может быть замещенным R9);
(g)
(1) когда A представляет собой A1, тогда R6 представляет собой R11, замещенный или незамещенный C1-C6 алкил, замещенный или незамещенный C2-C6 алкенил, замещенный или незамещенный C1-C6 алкокси, замещенный или незамещенный C2-C6 алкенилокси, замещенный или незамещенный C3-C10 циклоалкил, замещенный или незамещенный C3-C10 циклоалкенил, замещенный или незамещенный C6-C20 арил, замещенный или незамещенный C1-C20 гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nOR9, R9S(O)nR9, C1-C6 алкил C6-C20 арил (где алкил и арил независимо могут быть замещенными или незамещенными), C(=X2)R9, C(=X1)X2R9, R9X2C(=X1)R9, R9X2R9, C(=O)(C1-C6 алкил)S(O)n(C1-C6 алкил), C(=O)(C1-C6 алкил)C(=O)O(C1-C6 алкил), (C1-C6 алкил)OC(=O)(C6-C20 арил), (C1-C6 алкил)OC(=O)(C1-C6 алкил), C1-C6 алкил-(C3-C10 циклогалогеналкил) или (C1-C6 алкенил)C(=O)O(C1-C6 алкил) или R9X2C(=X1)X2R9,
где каждый указанный R6 (за исключением R11), который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-C6 алкила, C2-C6 алкенила, C1-C6 галогеналкила, C2-C6 галогеналкенила, C1-C6 галогеналкилокси, C2-C6 галогеналкенилокси, C3-C10 циклоалкила, C3-C10 циклоалкенила, C3-C10 галогенциклоалкила, C3-C10 галогенциклоалкенила, OR9, S(O)nOR9, C6-C20 арила или C1-C20 гетероциклила, R9арила (каждый из которых может быть замещенным, необязательно может быть замещенным R9),
необязательно R6 (за исключением R11) и R8 могут быть соединены в циклической структуре, где, необязательно, такая структура может содержать один или несколько гетероатомов, выбранных из O, S или N, в циклической структуре, связывающей R6 и R8, и
(2) когда A представляет собой A2, тогда R6 представляет собой R11, H, замещенный или незамещенный C1-C6 алкил, замещенный или незамещенный C2-C6 алкенил, замещенный или незамещенный C1-C6 алкокси, замещенный или незамещенный C2-C6 алкенилокси, замещенный или незамещенный C3-C10 циклоалкил, замещенный или незамещенный C3-C10 циклоалкенил, замещенный или незамещенный C6-C20 арил, замещенный или незамещенный C1-C20 гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nOR9, R9S(O)nR9, C1-C6 алкил C6-C20 арил (где алкил и арил независимо могут быть замещенными или незамещенными), C(=X2)R9, C(=X1)X2R9, R9X2C(=X1)R9, R9X2R9, C(=O)(C1-C6 алкил)S(O)n(C1-C6 алкил), C(=O)(C1-C6 алкил)C(=O)O(C1-C6 алкил), (C1-C6 алкил)OC(=O)(C6-C20 арил), (C1-C6 алкил)OC(=O)(C1-C6 алкил), C1-C6 алкил-(C3-C10 циклогалогеналкил) или (C1-C6 алкенил)C(=O)O(C1-C6 алкил) или R9X2C(=X1)X2R9,
где каждый указанный R6 (за исключением R11), который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-C6 алкила, C2-C6 алкенила, C1-C6 галогеналкила, C2-C6 галогеналкенила, C1-C6 галогеналкилокси, C2-C6 галогеналкенилокси, C3-C10 циклоалкила, C3-C10 циклоалкенила, C3-C10 галогенциклоалкила, C3-C10 галогенциклоалкенила, OR9, S(O)nOR9, C6-C20 арила или C1-C20 гетероциклила, R9арила (каждый из которых может быть замещенным, необязательно может быть замещенным R9),
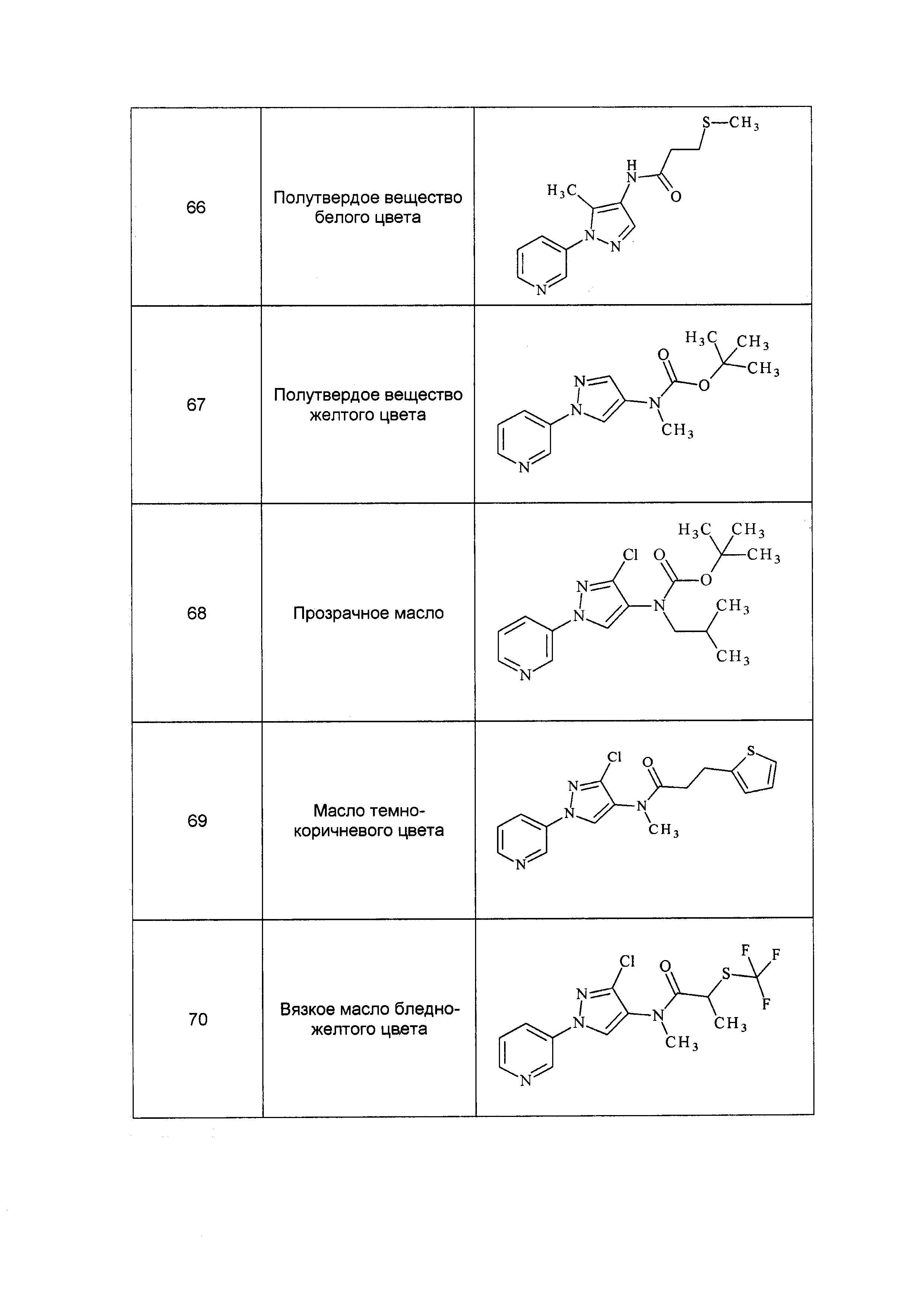
необязательно R6 (за исключением R11) и R8 могут быть соединены в циклической структуре, где, необязательно, такая структура может содержать один или несколько гетероатомов, выбранных из O, S или N, в циклической структуре, связывающей R6 и R8;
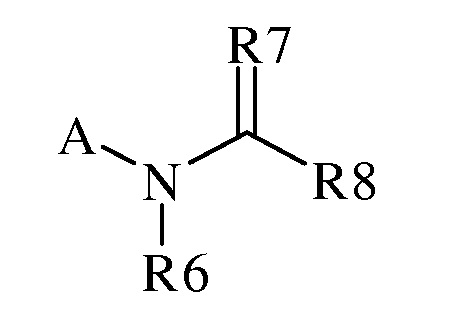
(h) R7 представляет собой O, S, NR9 или NOR9;
(i) R8 представляет собой замещенный или незамещенный C1-C6 алкил, замещенный или незамещенный C2-C6 алкенил, замещенный или незамещенный C1-C6 алкокси, замещенный или незамещенный C2-C6 алкенилокси, замещенный или незамещенный C3-C10 циклоалкил, замещенный или незамещенный C3-C10 циклоалкенил, замещенный или незамещенный C6-C20 арил, замещенный или незамещенный C1-C20 гетероциклил, OR9, OR9S(O)nR9, C(=X1)R9, C(=X1)OR9, R9C(=X1)OR9, R9X2C(=X1)R9X2R9, C(=X1)N(R9)2, N(R9)2, N(R9)(R9S(O)nR9), N(R9)C(=X1)R9, SR9, S(O)nOR9, R9S(O)nR9 или R9S(O)n(NZ)R9,
где каждый указанный R8, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-C6 алкила, C2-C6 алкенила, C1-C6 галогеналкила, C2-C6 галогеналкенила, C1-C6 галогеналкилокси, C2-C6 галогеналкенилокси, C3-C10 циклоалкила, C3-C10 циклоалкенила, C3-C10 галогенциклоалкила, C3-C10 галогенциклоалкенила, N(R9)S(O)nR9, оксо, OR9, S(O)nOR9, R9S(O)nR9, S(O)nR9, C6-C20 арила или C1-C20 гетероциклила (каждый из которых может быть замещенным, необязательно может быть замещенным R9),
альтернативно, R8 представляет собой R13-S(O)n-R13, где каждый R13 независимо выбран из замещенного или незамещенного C1-C6 алкила, замещенного или незамещенного C2-C6 алкенила, замещенного или незамещенного C1-C6 алкокси, замещенного или незамещенного C2-C6 алкенилокси, замещенного или незамещенного C3-C10 циклоалкила, замещенного или незамещенного C3-C10 циклоалкенила, замещенного или незамещенного C6-C20 арила, замещенного или незамещенного C1-C20 гетероциклила, замещенного или незамещенного S(O)nC1-C6 алкила, замещенного или незамещенного N(C1-C6алкил)2, где каждый указанный замещенный алкил, замещенный алкенил, замещенный алкокси, замещенный алкенилокси, замещенный циклоалкил, замещенный циклоалкенил, замещенный арил, замещенный гетероциклил содержит один или несколько заместителей, независимо выбранных из F, Cl, Br, I, CN, NO2, C1-C6 алкила, C2-C6 алкенила, C1-C6 галогеналкила, C2-C6 галогеналкенила, C1-C6 галогеналкилокси, C2-C6 галогеналкенилокси, C3-C10 циклоалкила, C3-C10 циклоалкенила, C3-C10 галогенциклоалкила, C3-C10 галогенциклоалкенила, OC1-C6 алкила, OC1-C6 галогеналкила, S(O)n C1-C6алкила, S(O)nOC1-C6 алкила, C6-C20 арила или C1-C20 гетероциклила, C2-C6 алкинила, C1-C6 алкокси, N(R9)S(O)nR9, OR9, N(R9)2, R9OR9, R9N(R9)2, R9C(=X1)R9, R9C(=X1)N(R9)2, N(R9)C(=X1)R9, R9N(R9)C(=X1)R9, S(O)nOR9, R9C(=X1)OR9, R9OC(=X1)R9, R9S(O)nR9, S(O)nR9, оксо (каждый из которых может быть замещенным, необязательно может быть замещенным R9);
(j) R9 представляет собой (каждый, независимо) H, CN, замещенный или незамещенный C1-C6 алкил, замещенный или незамещенный C2-C6 алкенил, замещенный или незамещенный C1-C6 алкокси, замещенный или незамещенный C2-C6 алкенилокси, замещенный или незамещенный C3-C10 циклоалкил, замещенный или незамещенный C3-C10 циклоалкенил, замещенный или незамещенный C6-C20 арил, замещенный или незамещенный C1-C20 гетероциклил, замещенный или незамещенный S(O)nC1-C6 алкил, замещенный или незамещенный N(C1-C6алкил)2,
где каждый указанный R9, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-C6 алкила, C2-C6 алкенила, C1-C6 галогеналкила, C2-C6 галогеналкенила, C1-C6 галогеналкилокси, C2-C6 галогеналкенилокси, C3-C10 циклоалкила, C3-C10 циклоалкенила, C3-C10 галогенциклоалкила, C3-C10 галогенциклоалкенила, ОC1-C6 алкила, ОC1-C6 галогеналкила, S(O)n C1-C6алкила, S(O)nOC1-C6 алкила, C6-C20 арила или C1-C20 гетероциклила;
(k) n обозначает 0, 1 или 2;
(l) X представляет собой N или CRn1, где Rn1 представляет собой H, F, Cl, Br, I, CN, NO2, замещенный или незамещенный C1-C6 алкил, замещенный или незамещенный C2-C6 алкенил, замещенный или незамещенный C1-C6 алкокси, замещенный или незамещенный C2-C6 алкенилокси, замещенный или незамещенный C3-C10 циклоалкил, замещенный или незамещенный C3-C10 циклоалкенил, замещенный или незамещенный C6-C20 арил, замещенный или незамещенный C1-C20 гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nR9, S(O)nOR9 или R9S(O)nR9,
где каждый указанный Rn1 который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-C6 алкила, C2-C6 алкенила, C1-C6 галогеналкила, C2-C6 галогеналкенила, C1-C6 галогеналкилокси, C2-C6 галогеналкенилокси, C3-C10 циклоалкила, C3-C10 циклоалкенила, C3-C10 галогенциклоалкила, C3-C10 галогенциклоалкенила, OR9, S(O)nOR9, C6-C20 арила или C1-C20 гетероциклила (каждый из которых может быть замещенным, необязательно может быть замещенным R9);
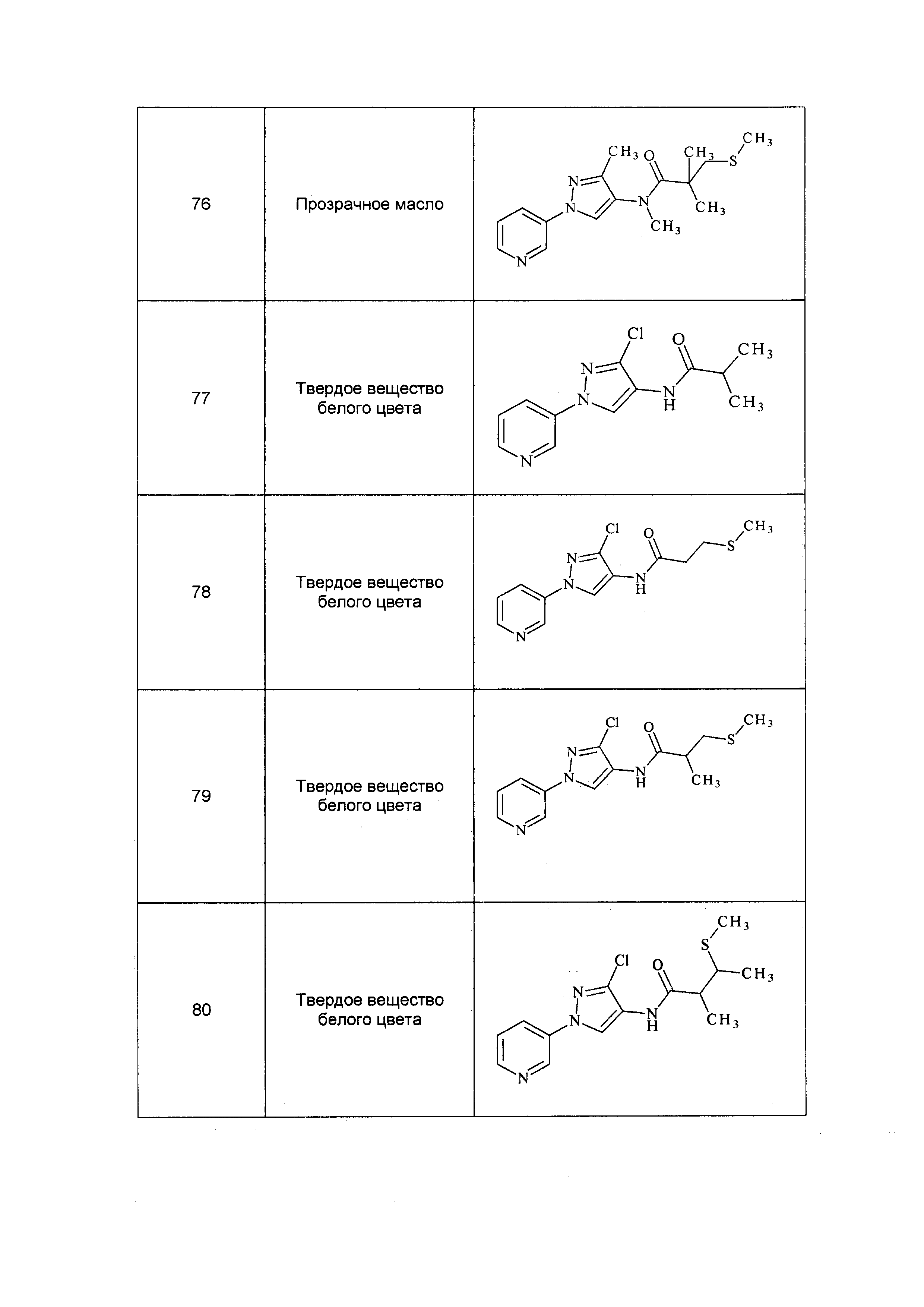
(m) X1 представляет собой (каждый независимо) O или S;
(n) X2 представляет собой (каждый независимо) O, S, =NR9 или =NOR9;
(o) Z представляет собой CN, NO2, C1-C6 алкил(R9), C(=X1)N(R9)2;
(p) R11 представляет собой Q1(C≡C)R12, где Q1 представляет собой связь, замещенный или незамещенный C1-C6 алкил, замещенный или незамещенный C2-C6 алкенил, замещенный или незамещенный C2-C6 алкинил, замещенный или незамещенный C3-C10 циклоалкил, замещенный или незамещенный C2-C10 циклоалкокси, замещенный или незамещенный C1-C6 алкилOR9, замещенный или незамещенный C1-C6 алкилS(O)nR9, замещенный или незамещенный C1-C6 алкилS(O)n(=NR9), замещенный или незамещенный C1-C6 алкилN(R9) (где (C≡C) присоединен непосредственно к N с помощью связи), замещенный или незамещенный C1-C6 алкилN(R9)2, замещенный или незамещенный C2-C6 алкенилокси, замещенный или незамещенный C3-C10 циклоалкенил, замещенный или незамещенный C0-C6 алкилC(=R7)C0-C6 алкилR9, замещенный или незамещенный C0-C6 алкилC(=R7)OR9, замещенный или незамещенный C1-C6 алкилOC0-C6 алкилC(=R7)R9, замещенный или незамещенный C1-C6 алкилN(R9)(C(=R7)R9), замещенный или незамещенный C1-C6 алкилN(R9)(C(=R7)OR9), замещенный или незамещенный C0-C6 алкил C(=R7)C0-C6 алкилN(R9) (где (C≡C) присоединен непосредственно к N с помощью связи), замещенный или незамещенный C0-C6алкилC(=R7)C0-C6 алкилN(R9)2, OR9, S(O)nR9, N(R9)R9, замещенный или незамещенный C6-C20 арил, замещенный или незамещенный C1-C20 гетероциклил,
где каждый указанный Q1, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-C6 алкила, C2-C6 алкенила, C2-C6 алкинила, C1-C6 галогеналкила, C2-C6 галогеналкенила, C1-C6 галогеналкилокси, C2-C6 галогеналкенилокси, C3-C10 циклоалкила, C3-C10 циклоалкенила, C3-C10 галогенциклоалкила, C3-C10 галогенциклоалкенила, OR9, SR9, S(O)nR9, S(O)nOR9, C6-C20 арила или C1-C20 гетероциклила, R9арила, C1-C6алкилOR9, C1-C6алкилS(O)nR9 (каждый из которых может быть замещенным, необязательно может быть замещенным R9),
необязательно Q1 и R8 могут быть соединены в циклической структуре, где, необязательно, такая структура может содержать один или несколько гетероатомов, выбранных из O, S или N, в циклической структуре, связывающей Q1 и R8;
(q) R12 представляет собой Q1 (за исключением случая, когда Q1 представляет собой связь), F, Cl, Br, I, Si(R9)3 (где каждый R9 выбран независимо) или R9; и
(r) при следующих условиях
(1) что R6 и R8 не могут оба представлять собой C(=O)CH3,
(2) что, когда A1 представляет собой A11, тогда R6 и R8 вместе не образуют конденсированные кольцевые системы,
(3) что R6 и R8 не связаны в циклической структуре только с -CH2-,
(4) что, когда A представляет собой A2, тогда R5 не представляет собой C(=O)OH,
(5) что, когда A представляет собой A2 и R6 представляет собой H, тогда R8 не представляет собой -(C1-C6 алкил)-O-(замещенный арил), и
(6) что, когда A представляет собой A2, тогда R6 не представляет собой -(C1алкил)(замещенный арил).
В другом варианте осуществления настоящего изобретения A представляет собой A1.
В другом варианте осуществления настоящего изобретения A представляет собой A2.
В другом варианте осуществления настоящего изобретения R1 представляет собой H.
В другом варианте осуществления настоящего изобретения R2 представляет собой H.
В другом варианте осуществления настоящего изобретения R3 выбран из H или замещенного или незамещенного C1-C6 алкила.
В другом варианте осуществления настоящего изобретения R3 выбран из H или CH3.
В другом варианте осуществления изобретения, когда A представляет собой A1, тогда A1 представляет собой A11.
В другом варианте осуществления изобретения, когда A представляет собой A1 и A1 представляет собой A11, тогда R4 выбран из H или замещенного или незамещенного C1-C6 алкила или замещенного или незамещенного C6-C20 арила.
В другом варианте осуществления изобретения, когда A представляет собой A1 и A1 представляет собой A11, тогда R4 выбран из CH3, CH(CH3)2 или фенила.
В другом варианте осуществления изобретения, когда A представляет собой A1 и A1 представляет собой A12, тогда R4 представляет собой CH3.
В другом варианте осуществления настоящего изобретения, когда A представляет собой A2, тогда R4 выбран из H или замещенного или незамещенного C1-C6 алкила, замещенного или незамещенного C2-C6 алкенила, замещенного или незамещенного C3-C10 циклоалкила, замещенного или незамещенного C6-C20 арила, где каждый указанный R4, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br или I.
В другом варианте осуществления настоящего изобретения, когда A представляет собой A2, тогда R4 представляет собой H или C1-C6 алкил.
В другом варианте осуществления настоящего изобретения, когда A представляет собой A2, тогда R4 представляет собой H, CH3, CH2CH3, CH=CH2, циклопропил, CH2Cl, CF3 или фенил.
В другом варианте осуществления настоящего изобретения, когда A представляет собой A2, тогда R4 представляет собой Br или Cl.
В другом варианте осуществления настоящего изобретения R5 представляет собой H, F, Cl, Br, I или замещенный или незамещенный C1-C6 алкил, замещенный или незамещенный C1-C6 алкокси.
В другом варианте осуществления настоящего изобретения R5 представляет собой H, ОCH2CH3, F, Cl, Br или CH3.
В другом варианте осуществления настоящего изобретения, когда A представляет собой A1, тогда R6 представляет собой замещенный или незамещенный C1-C6 алкил.
В другом варианте осуществления настоящего изобретения, когда A представляет собой A2, тогда R6 выбран из замещенного или незамещенного C1-C6 алкила, замещенного или незамещенного C2-C6 алкенила, замещенного или незамещенного C3-C10 циклоалкила, C(=X1)R9, C(=X1)X2R9, R9X2R9, C(=O)(C1-C6 алкил)S(O)n(C1-C6 алкил), (C1-C6 алкил)OC(=O)(C6-C20 арил), (C1-C6 алкил)OC(=O)(C1-C6 алкил) или R9X2C(=X1)X2R9.
В другом варианте осуществления настоящего изобретения, когда A представляет собой A2, тогда R6 и R8 соединены в циклическом порядке, где, необязательно, такая структура может содержать один или несколько гетероатомов, выбранных из O, S или N, в циклической структуре, связывающей R6 и R8.
В другом варианте осуществления настоящего изобретения R6 представляет собой C1-C6 алкил или C1-C6 алкил-фенил.
В другом варианте осуществления настоящего изобретения R6 представляет собой H, CH3, CH2CH3, CH2CH2CH3, CH(CH3)2, CH2фенил, CH2CH(CH3)2, CH2циклопропил, C(=O)CH2CH2SCH3, C(=O)OC(CH3)3, CH2CH=CH2, C(=O)OCH2CH3, C(=O)CH(CH3)CH2SCH3, циклопропил, CD3, CH2OC(=O)фенил, C(=O)CH3, C(=O)CH(CH3)2, CH2OC(=O)CH(CH3)2, CH2OC(=O)CH3, C(=O)фенил, CH2OCH3, CH2OC(=O)CH2OCH2CH3, CH2CH2OCH3, CH2OC(=O)OCH(CH3)2, CH2CH2OCH2OCH3, CH2CH2OCH3, CH2CH2OC(=O)CH3, CH2CN.
В другом варианте осуществления настоящего изобретения R6 представляет собой метил или этил.
В другом варианте осуществления настоящего изобретения R7 представляет собой O или S.
В другом варианте осуществления настоящего изобретения R8 выбран из замещенного или незамещенного C1-C6 алкила, замещенного или незамещенного C2-C6 алкенила, замещенного или незамещенного C3-C10 циклоалкила, замещенного или незамещенного C6-C20 арила, замещенного или незамещенного C1-C20 гетероциклила, R9C(=X1)OR9, SR9, S(O)nOR9, R9S(O)nR9 или R9S(O)n(NZ)R9.
В другом варианте осуществления настоящего изобретения R8 представляет собой CH(CH3)CH2SCH3, CH(CH3)2, C(CH3)2CH2SCH3, CH2CH2SCH3, CH2CF3, CH2CH2C(=O)OCH3, N(H)(CH2CH2SCH3), OCH2CH2SCH3, CH(CH2SCH3)(CH2фенил), тиазолил, оксазолил, изотиазолил, замещенный фуранил, CH3, C(CH3)3, фенил, CH2CH2OCH3, пиридил, CH2CH(CH3)SCH3, OC(CH3)3, C(CH3)2CH2SCH3, CH(CH3)CH(CH3)SCH3, CH(CH3)CF3, CH2CH2-тиенил, CH(CH3)SCF3, CH2CH2Cl, CH2CH2CH2CF3, CH2CH2S(=O)CH3, CH(CH3)CH2S(=O)CH3, CH2CH2S(=O)2CH3, CH(CH3)CH2S(=O)2CH3, NCH2CH3, N(H)(CH2CH2CH3), C(CH3)=C(H)(CH3), N(H)(CH2CH=CH2), CH2CH(CF3)SCH3, CH(CF3)CH2SCH3, тиетанил, CH2CH(CF3)2, CH2CH2CF(OCF3)CF3, CH2CH2CF(CF3)CF3, CF(CH3)2, CH(CH3)фенил-Cl, CH(CH3)фенил-F, CH(CH3)фенил-OCF3, CH2N(CH3)(S(=O)2N(CH3)2, CH(CH3)OCH2CH2SCH3, CH(CH3)OCH2CH2OCH3, OCH3, CH(CH3)SCH3, CH2SCH3, N(H)CH3, CH(Br)CH2Br или CH(CH3)CH2SCD3.
В еще одном более предпочтительном варианте осуществления настоящего изобретения R8 предпочтительно представляет собой R13-S(O)n-R13, где каждый R13 независимо выбран из замещенного или незамещенного C1-C6 алкила, замещенного или незамещенного C2-C6 алкенила, замещенного или незамещенного C1-C6 алкокси, замещенного или незамещенного C2-C6 алкенилокси, замещенного или незамещенного C3-C10 циклоалкила, замещенного или незамещенного C3-C10 циклоалкенила, замещенного или незамещенного C6-C20 арила, замещенного или незамещенного C1-C20 гетероциклила, замещенного или незамещенного S(O)nC1-C6 алкила, замещенного или незамещенного N(C1-C6алкил)2, где каждый указанный замещенный алкил, замещенный алкенил, замещенный алкокси, замещенный алкенилокси, замещенный циклоалкил, замещенный циклоалкенил, замещенный арил, замещенный гетероциклил содержит один или несколько заместителей, независимо выбранных из F, Cl, Br, I, CN, NO2, C1-C6 алкила, C2-C6 алкенила, C1-C6 галогеналкила, C2-C6 галогеналкенила, C1-C6 галогеналкилокси, C2-C6 галогеналкенилокси, C3-C10 циклоалкила, C3-C10 циклоалкенила, C3-C10 галогенциклоалкила, C3-C10 галогенциклоалкенила, OC1-C6 алкила, OC1-C6 галогеналкила, S(O)nC1-C6 алкила, S(O)nOC1-C6 алкила, C6-C20 арила или C1-C20 гетероциклила, C2-C6 алкинила, C1-C6 алкокси, N(R9)S(O)nR9, OR9, N(R9)2, R9OR9, R9N(R9)2, R9C(=X1)R9, R9C(=X1)N(R9)2, N(R9)C(=X1)R9, R9N(R9)C(=X1)R9, S(O)nOR9, R9C(=X1)OR9, R9OC(=X1)R9, R9S(O)nR9, S(O)nR9, оксо (каждый из которых может быть замещенным, необязательно может быть замещенным R9).
В другом варианте осуществления настоящего изобретения R8 представляет собой (замещенный или незамещенный C1-C6 алкил)-S(O)n-(замещенный или незамещенный C1-C6 алкил), где указанные заместители на указанных замещенных алкилах независимо выбраны из F, Cl, Br, I, CN, NO2, C1-C6 алкила, C2-C6 алкенила, C1-C6 галогеналкила, C2-C6 галогеналкенила, C1-C6 галогеналкилокси, C2-C6 галогеналкенилокси, C3-C10 циклоалкила, C3-C10 циклоалкенила, C3-C10 галогенциклоалкила, C3-C10 галогенциклоалкенила, OC1-C6 алкила, OC1-C6 галогеналкила, S(O)nC1-C6 алкила, S(O)nOC1-C6 алкила, C6-C20 арила или C1-C20 гетероциклила, C2-C6 алкинила, C1-C6 алкокси, N(R9)S(O)nR9, OR9, N(R9)2, R9OR9, R9N(R9)2, R9C(=X1)R9, R9C(=X1)N(R9)2, N(R9)C(=X1)R9, R9N(R9)C(=X1)R9, S(O)nOR9, R9C(=X1)OR9, R9OC(=X1)R9, R9S(O)nR9, S(O)nR9, оксо (каждый из которых может быть замещенным, необязательно может быть замещенным R9).
В другом варианте осуществления настоящего изобретения R8 выбран из CH(CH3)SCH2CF3, CH2CH2SCH2CF3, CH2SCH2CF3, CH2SCHClCF3, CH(CH2CH3)SCH2CF3, CH(CH3)SCH2CHF2, CH(CH3)SCH2CH2F, CH2CH2SCH2CH2F, CH(CH3)S(=O)2CH2CF3, CH(CH3)S(=O)CH2CF3, CH(CH3)CH2SCF3, CH(CH3)CH2SCF3, CH(CH3)SCH2CH2CF3 и CH2CH2SCH2CH2CF3.
В другом варианте осуществления настоящего изобретения R8 представляет собой (замещенный или незамещенный C1-C6 алкил)-S(O)n-(замещенный или незамещенный C1-C6 алкил)-(замещенный или незамещенный C3-C10 циклоалкил), где указанные заместители на указанных замещенных алкилах и указанных замещенных циклоалкилах независимо выбраны из F, Cl, Br, I, CN, NO2, C1-C6 алкила, C2-C6 алкенила, C1-C6 галогеналкила, C2-C6 галогеналкенила, C1-C6 галогеналкилокси, C2-C6 галогеналкенилокси, C3-C10 циклоалкила, C3-C10 циклоалкенила, C3-C10 галогенциклоалкила, C3-C10 галогенциклоалкенила, OC1-C6 алкила, OC1-C6 галогеналкила, S(O)nC1-C6 алкила, S(O)nOC1-C6 алкила, C6-C20 арила или C1-C20 гетероциклила, C2-C6 алкинила, C1-C6 алкокси, N(R9)S(O)nR9, OR9, N(R9)2, R9OR9, R9N(R9)2, R9C(=X1)R9, R9C(=X1)N(R9)2, N(R9)C(=X1)R9, R9N(R9)C(=X1)R9, S(O)nOR9, R9C(=X1)OR9, R9OC(=X1)R9, R9S(O)nR9, S(O)nR9, оксо (каждый из которых может быть замещенным, необязательно может быть замещенным R9).
В другом варианте осуществления настоящего изобретения R8 выбран из CH(CH3)CH2SCH2(2,2-дифторциклопропил), CH2CH2SCH2(2,2-дифторциклопропил), CH2CH2S(=O)CH2(2,2-дифторциклопропил), CH2CH2S(=O)2CH2CH2(2,2-дифторциклопропил) и CH2CH(CF3)SCH2(2,2-дифторциклопропил).
В другом варианте осуществления настоящего изобретения R8 представляет собой (замещенный или незамещенный C1-C6 алкил)-S(O)n-(замещенный или незамещенный C2-C6 алкенил), где указанные заместители на указанных замещенных алкилах и замещенных алкенилах независимо выбраны из F, Cl, Br, I, CN, NO2, C1-C6 алкила, C2-C6 алкенила, C1-C6 галогеналкила, C2-C6 галогеналкенила, C1-C6 галогеналкилокси, C2-C6 галогеналкенилокси, C3-C10 циклоалкила, C3-C10 циклоалкенила, C3-C10 галогенциклоалкила, C3-C10 галогенциклоалкенила, OC1-C6 алкила, OC1-C6 галогеналкила, S(O)nC1-C6 алкила, S(O)nOC1-C6 алкила, C6-C20 арила или C1-C20 гетероциклила, C2-C6 алкинила, C1-C6 алкокси, N(R9)S(O)nR9, OR9, N(R9)2, R9OR9, R9N(R9)2, R9C(=X1)R9, R9C(=X1)N(R9)2, N(R9)C(=X1)R9, R9N(R9)C(=X1)R9, S(O)nOR9, R9C(=X1)OR9, R9OC(=X1)R9, R9S(O)nR9, S(O)nR9, оксо (каждый из которых может быть замещенным, необязательно может быть замещенным R9).
В другом варианте осуществления настоящего изобретения R8 выбран из CH2CH2SCH2CH=CCl2, CH2SCH2CH=CCl2, CH(CH3)SCH2CH=CCl2, CH(CH3)SCH=CHF, CH2CH2S(=O)CH2CH2CF3 и CH2CH2S(=O)2CH2CH2CF3.
В другом варианте осуществления настоящего изобретения X представляет собой CRn1, где Rn1 представляет собой H или галоген.
В другом варианте осуществления настоящего изобретения X представляет собой CRn1, где Rn1 представляет собой H или F.
В другом варианте осуществления настоящего изобретения X1 представляет собой O.
В другом варианте осуществления настоящего изобретения X2 представляет собой O.
В другом варианте осуществления настоящего изобретения R11 представляет собой замещенный или незамещенный C1-C6 алкилC≡CR12.
В другом варианте осуществления настоящего изобретения R11 представляет собой CH2C≡CH.
Соединения формулы один обычно имеют молекулярную массу от примерно 100 дальтон до примерно 1200 дальтон. Однако предпочтительным является, когда молекулярная масса составляет от примерно 120 дальтон до примерно 900 дальтон, и обычно даже еще более предпочтительно, когда молекулярная масса составляет от примерно 140 дальтон до примерно 600 дальтон.
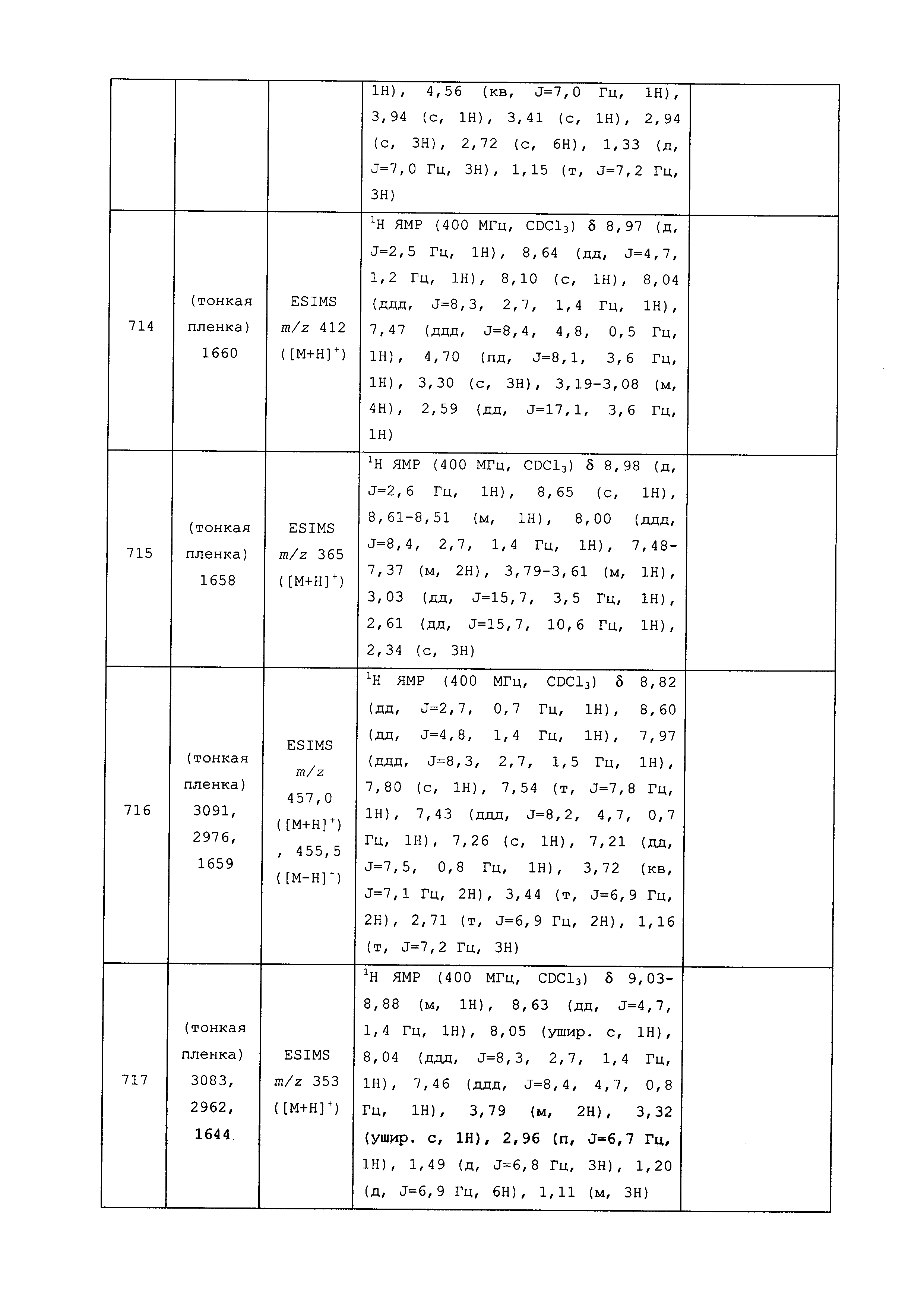
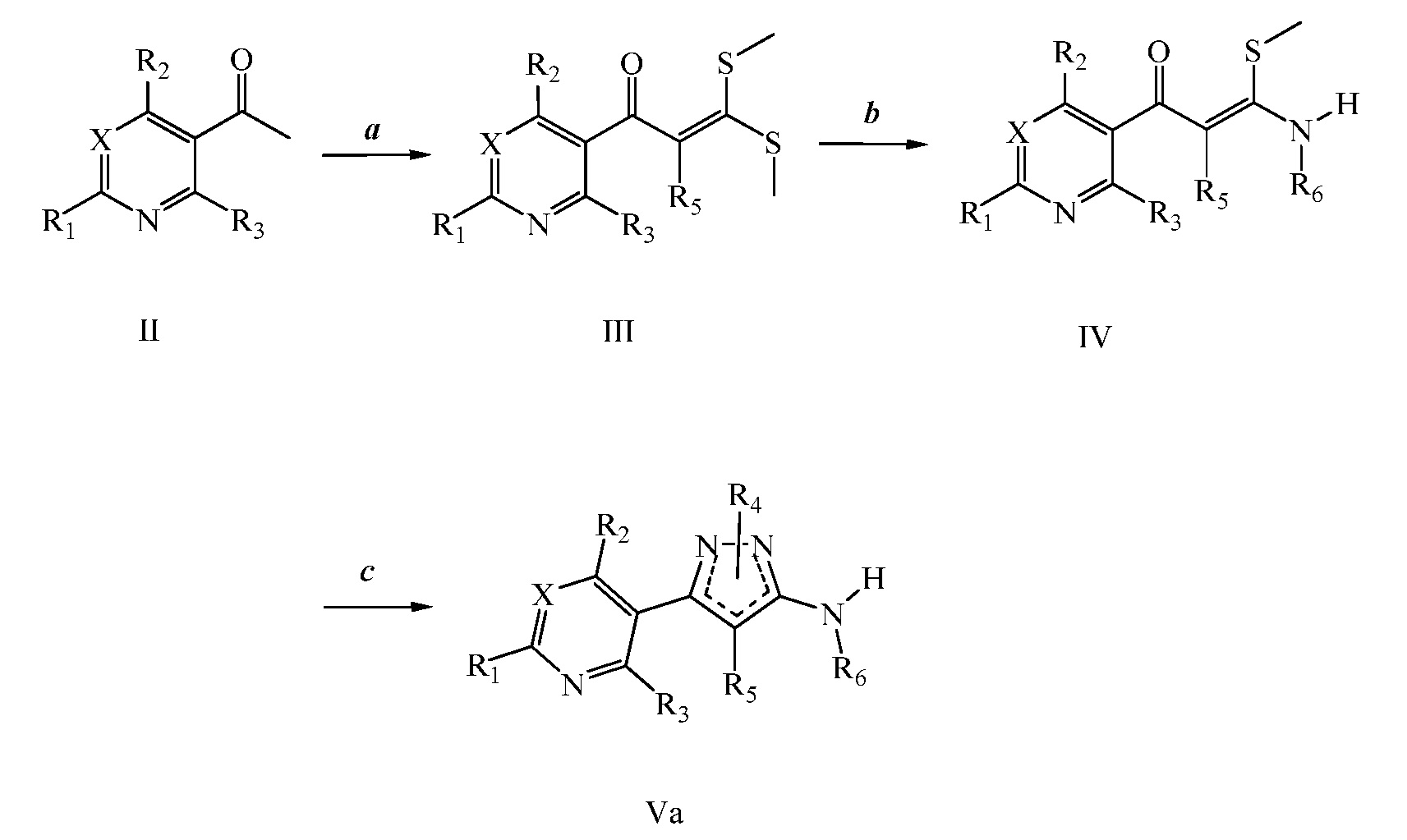
На следующих схемах проиллюстрированы подходы к синтезу аминопиразолов. На стадии a схемы I обработка 3-ацетoпиридина или 5-ацетoпиримидина формулы II, где R1, R2, R3 и X имеют значения, определенные выше, дисульфидом углерода и йодметаном в присутствии основания, такого как гидрид натрия, и в растворителе, таком как диметилсульфоксид, дает соединение формулы III. На стадии b схемы I соединение формулы III может быть обработано амином или гидрохлоридом амина в присутствии основания, такого как триэтиламин, в растворителе, таком как этиловый спирт, с получением соединения формулы IV, где R1, R2, R3, R6 и X имеют значения, определенные выше. Соединение формулы IV может быть преобразовано в аминопиразол формулы Va, где R5 = H, как на стадии c схемы I и как в работе Peruncheralathan, S. et al. J. Org. Chem. 2005, 70, 9644-9647, путем взаимодействия с гидразином, таким как метилгидразин, в полярном протонном растворителе, таком как этиловый спирт.
Схема I
Другая возможность получения аминопиразолов проиллюстрирована на схеме II. На стадии a нитрил формулы VI, где X, R1, R2 и R3 имеют значения, определенные выше, и R5 представляет собой водород, подвергают конденсации, как описано в работе Dhananjay, B. Kendre et al. J. Het Chem 2008, 45, (5), 1281-86, с гидразином формулы VII, таким как метилгидразин, с получением смеси аминопиразолов формулы Vb, где R5 и R6 = H, при этом были выделены оба компонента.
Схема II
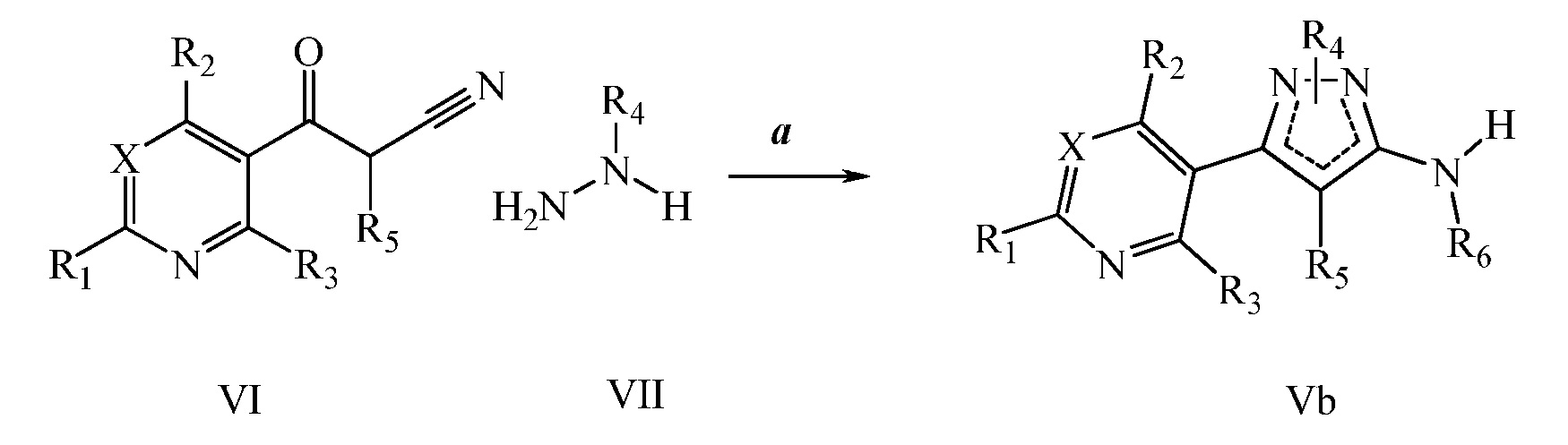
Получение аминопиразолов, таких как формулы XIIA, продемонстрировано на схеме III. Соединение формулы X на стадии a, и как описано в работе Cristau, Henri-Jean et al. Eur. J. Org. Chem. 2004, 695-709, может быть получено посредством N-арилирования пиразола формулы IX соответствующим арилгалогенидом формулы VIIIa, где Q представляет собой бром, в присутствии основания, такого как карбонат цезия, медного катализатора, такого как оксид меди(II), и лиганда, такого как салицилальдоксим, в полярном апротонном растворителе, таком как ацетонитрил. Соединения формулы IX, как показано на схеме III, где R4 = Cl и R5 = H, могут быть получены, как описано в работе Pelcman, B. et al WO 2007/045868 A1. Нитрование пиридилпиразола формулы X, как на стадии b схемы III и как описано в работе Khan, Misbanul Ain et al. J. Heterocyclic Chem. 1981, 18, 9-14, путем взаимодействия с азотной кислотой и серной кислотой давало соединения формулы XIa. Восстановление нитро группы соединений формулы XIa в присутствии водорода с катализатором, таким как 5% Pd/C, в полярном апротонном растворителе, таком как тетрагидрофуран, давало амин формулы XIIa, как показано на стадии c на схеме III. Восстановление нитро группы соединений формулы XIa, где R1, R2, R3, R4 и X имеют значения, определенные выше, и R5 = H, в присутствии водорода с катализатором, таким как 10% Pd/C, в полярном протонном растворителе, таком как этанол, давало амин формулы XIIa, где R5 = H, а также амин формулы XIIa, где R5 = OEt, как показано на стадии d схемы III. Соединения формулы XIa, где R1, R2, R3, R5 и X имеют значения, определенные выше, и R4 = Cl, могут быть восстановлены в присутствии восстанавливающего агента, такого как железо, в смеси полярных протонных растворителей, таких как уксусная кислота, вода и этанол, с получением аминов формулы XIIa, где R1, R2, R3, R5 и X имеют значения, определенные выше, R4 = Cl, как показано на стадии e схемы III. Соединения формулы XIa, где R1, R2, R3, R5 и X имеют значения, определенные выше, и R4 = Cl, могут быть подвергнуты взаимодействию в условиях конденсации по Сузуки с борной кислотой, такой как фенилбороновая кислота, в присутствии катализатора, такого как тетракиспалладий, основания, такого как 2M водный карбонат калия, и в системе смешанных растворителей, таких как этанол и толуол, с получением поперечно-связанных пиразолов формулы XIb, как показано на стадии f схемы III.
Схема III
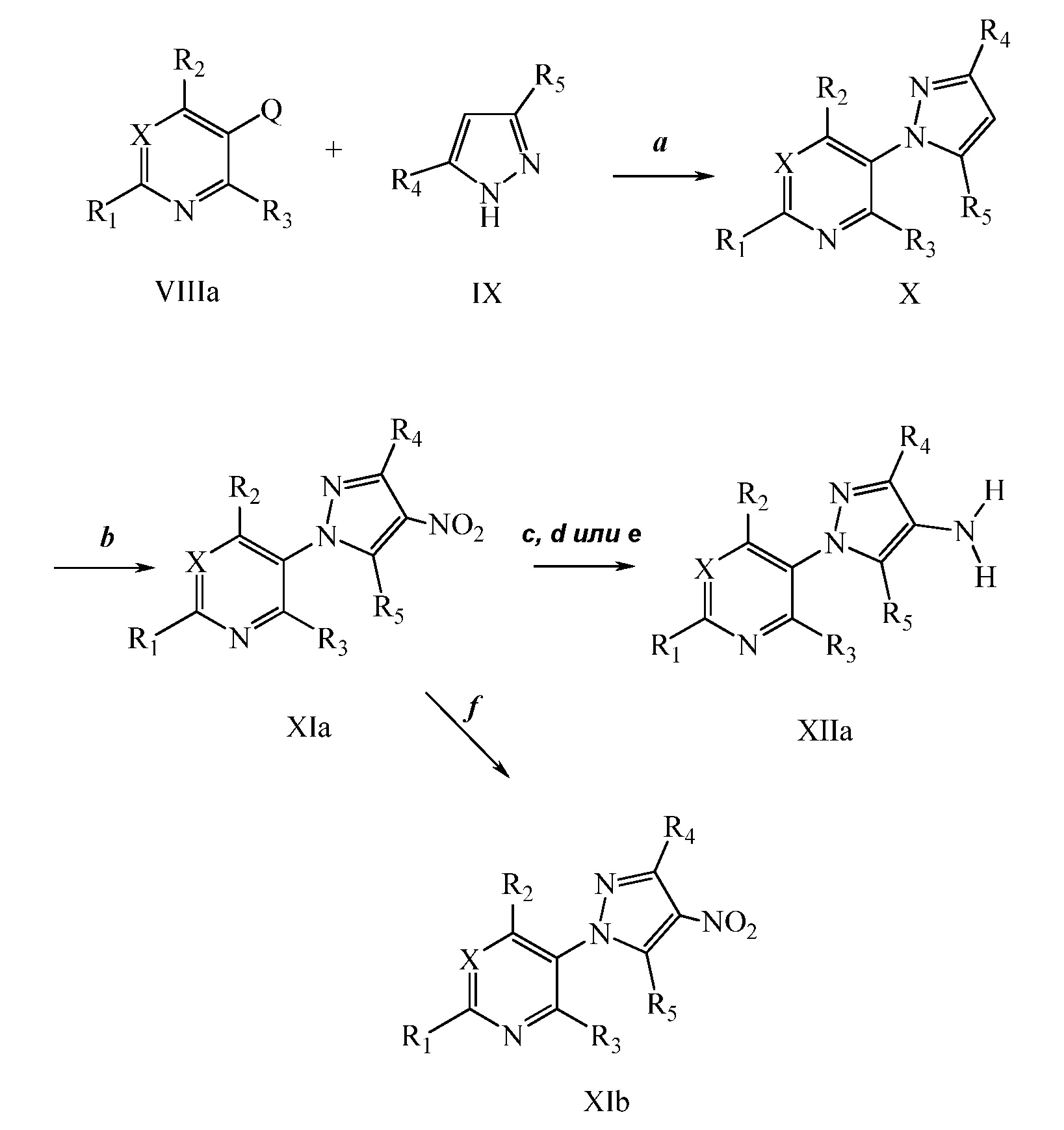
На стадии a схемы IV соединения формулы XIIb могут быть обработаны триэтилортоформиатом и кислотой, такой как трифторуксусная кислота. Последующее добавление восстанавливающего агента, такого как боргидрид натрия, в полярном протонном растворителе, таком как этанол, давало соединение формулы XIIIa, где R6 = метил.
На стадии b схемы IV соединение формулы XIIb может быть обработано ацетоном в растворителе, таком как изопропилацетат, кислотой, такой как трифторуксусная кислота, и триацетоксиборгидридом натрия с получением соединения формулы XIIIa, где R6 = изопропил.
На стадии c схемы IV соединения формулы XIIb могут быть ацилированы хлорангидридом кислоты, таким как ацетилхлорид, в полярном апротонном растворителе, таком как дихлорметан, с использованием условий, описанных на схеме V. Восстановление амида восстанавливающим агентом, таким как алюмогидрид лития, в полярном апротонном растворителе, таком как тетрагидрофуран, дает соединения формулы XIIIa, где R6 = этил.
Альтернативно, на стадии d схемы IV соединения формулы XIIb могут быть обработаны бензотриазолом и альдегидом в этаноле, затем восстановлены с использованием, например, боргидрида натрия, с получением соединения формулы XIIIa. На стадии e схемы IV соединения формулы XIIb могут быть обработаны альдегидом, таким как пропиональдегид и триацетоксиборгидрид натрия, в полярном апротонном растворителе, таком как дихлорметан, с получением соединения формулы XIIIa, где R6 = пропил. Как и на стадии f, ацилирование соединений формулы XIIIa по схеме IV с использованием условий, описанных на схеме IX, дает соединения формулы Ia, где R1, R2, R3, R4, R5, R6, R8 и X имеют значения, определенные выше.
Схема IV
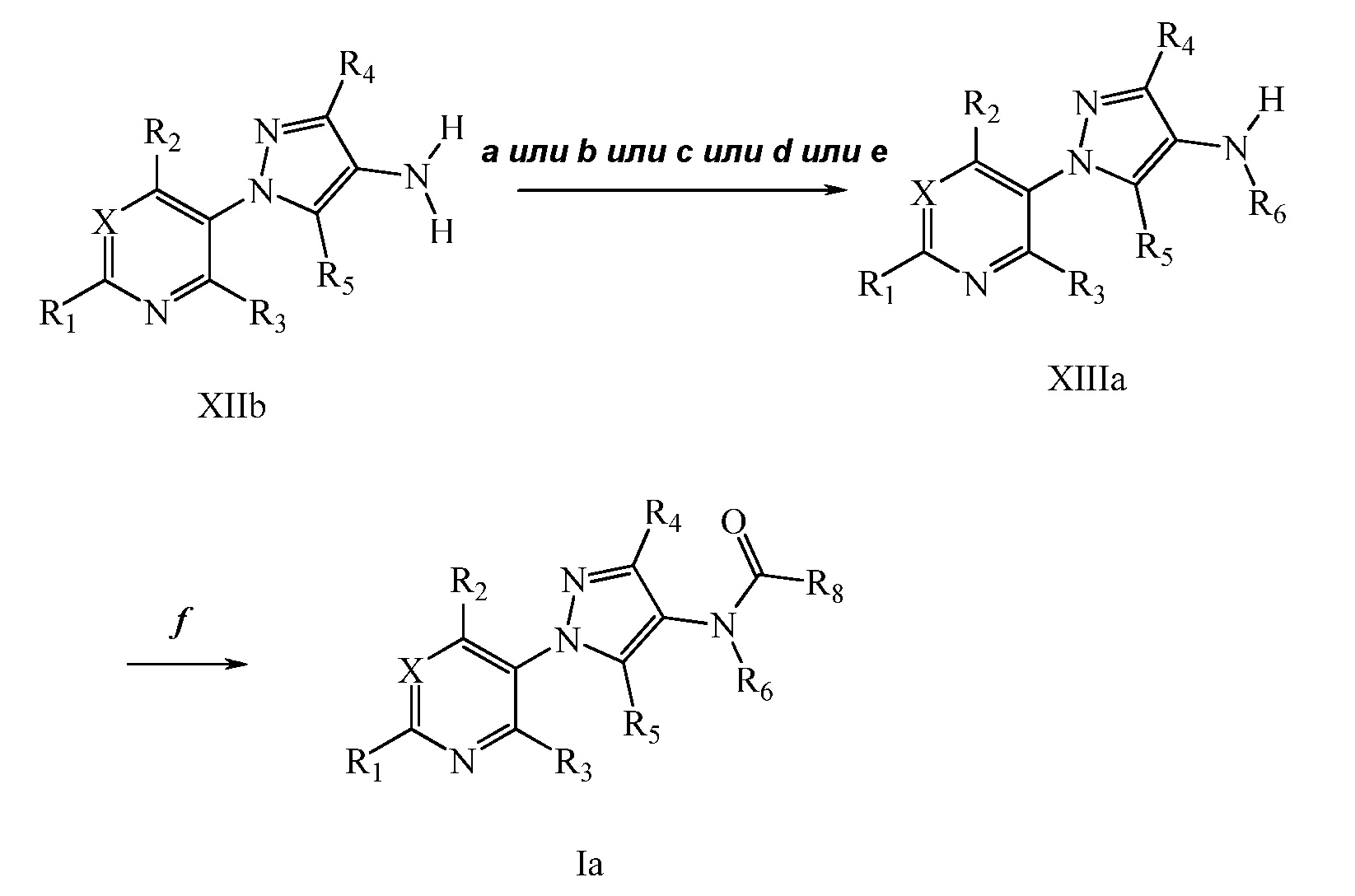
На стадии a схемы V соединения формулы Vc, где R1, R2, R3, R4, R5 и R6 и X имеют значения, определенные выше, могут быть обработаны хлорангидридом кислоты формулы XIV в присутствии основания, такого как триэтиламин или N,N-диметиламинопиридин, в полярном апротонном растворителе, таком как дихлорэтан (DCE), с получением соединения формулы Ib, где R8 имеет значения, определенные выше. Дополнительно, когда R6 = H, амид 2º может быть затем алкилирован на стадии b схемы V с помощью алкилгалогенида, такого как йодэтан, в присутствии основания, такого как гидрид натрия, и полярного апротонного растворителя, такого как N,N-диметилформамид (ДМФ), с получением желаемого соединения формулы Ib. Хлорангидриды кислот, используемые в реакциях ацилирования в данном документе, являются либо коммерчески доступными, либо могут быть синтезированы специалистом в данной области.
Схема V
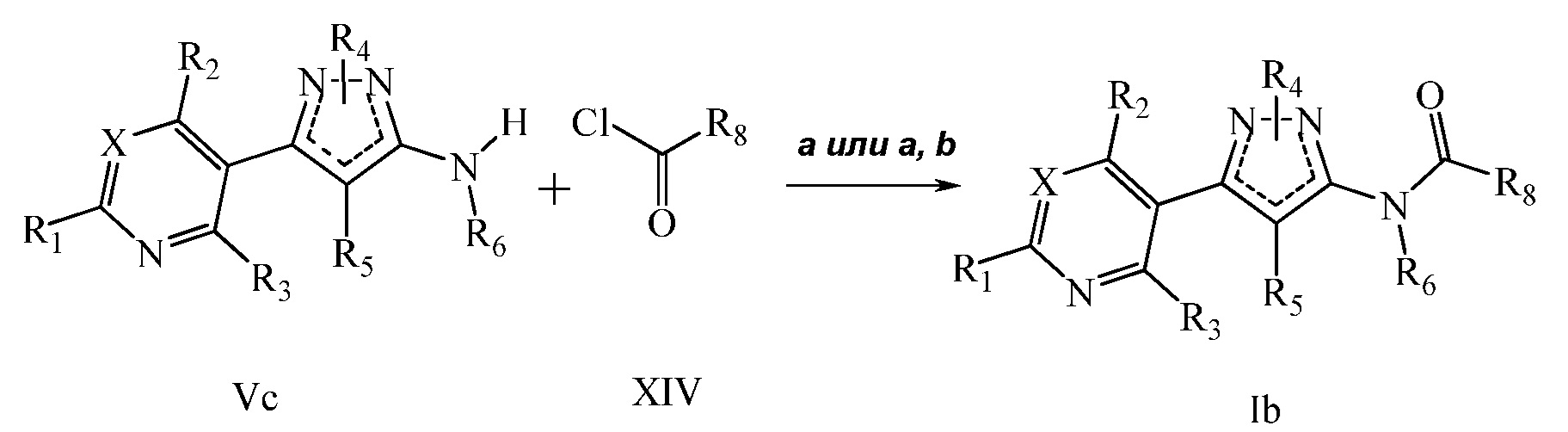
На стадии a схемы VI, и как описано в работе Sammelson et al. Bioorg. Med. Chem. 2004, 12, 3345-3355, аминопиразолы формулы Vd, где R1, R2, R3, R4, R6 и X имеют значения, определенные выше, и R5 = H, могут быть галогенированы источником галогена, таким как N-хлорсукцинимид или N-бромсукцинимид, в полярном апротонном растворителе, таком как ацетонитрил, с получением R5-замещенного пиразола. На стадии b ацилирование данного соединения с использованием условий, описанных на схеме V, дает соединение формулы Ic, где R1, R2, R3, R4, R5, R6, R8 и X имеют значения, определенные выше.
Схема VI
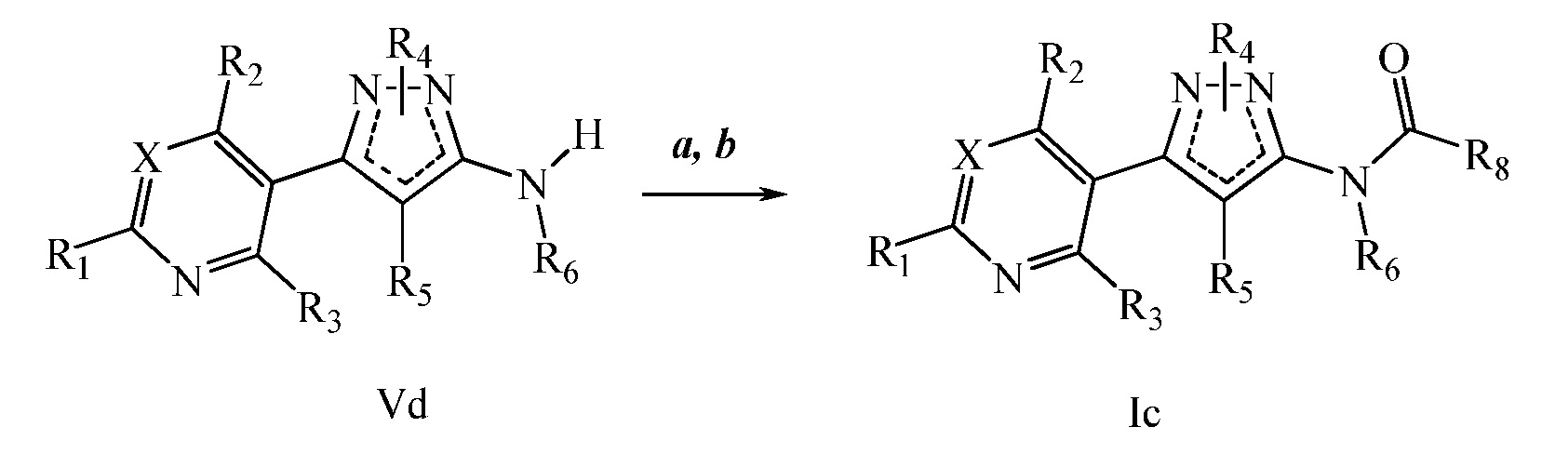
На стадии a схемы VII мочевины и карбаматы получают исходя из аминопиразолов формулы Ve. Соединения формулы Ve, где X, R1, R2, R3, R4, R5 и R6 имеют значения, определенные выше, подвергали взаимодействию с фосгеном с получением промежуточного карбамоилхлорида, который затем обрабатывали амином, как показано на стадии b, или спиртом, как показано на стадии c, соответственно, с получением мочевины формулы Id или карбамата формулы Ie, соответственно, где R9 имеет значения, определенные выше.
Схема VII
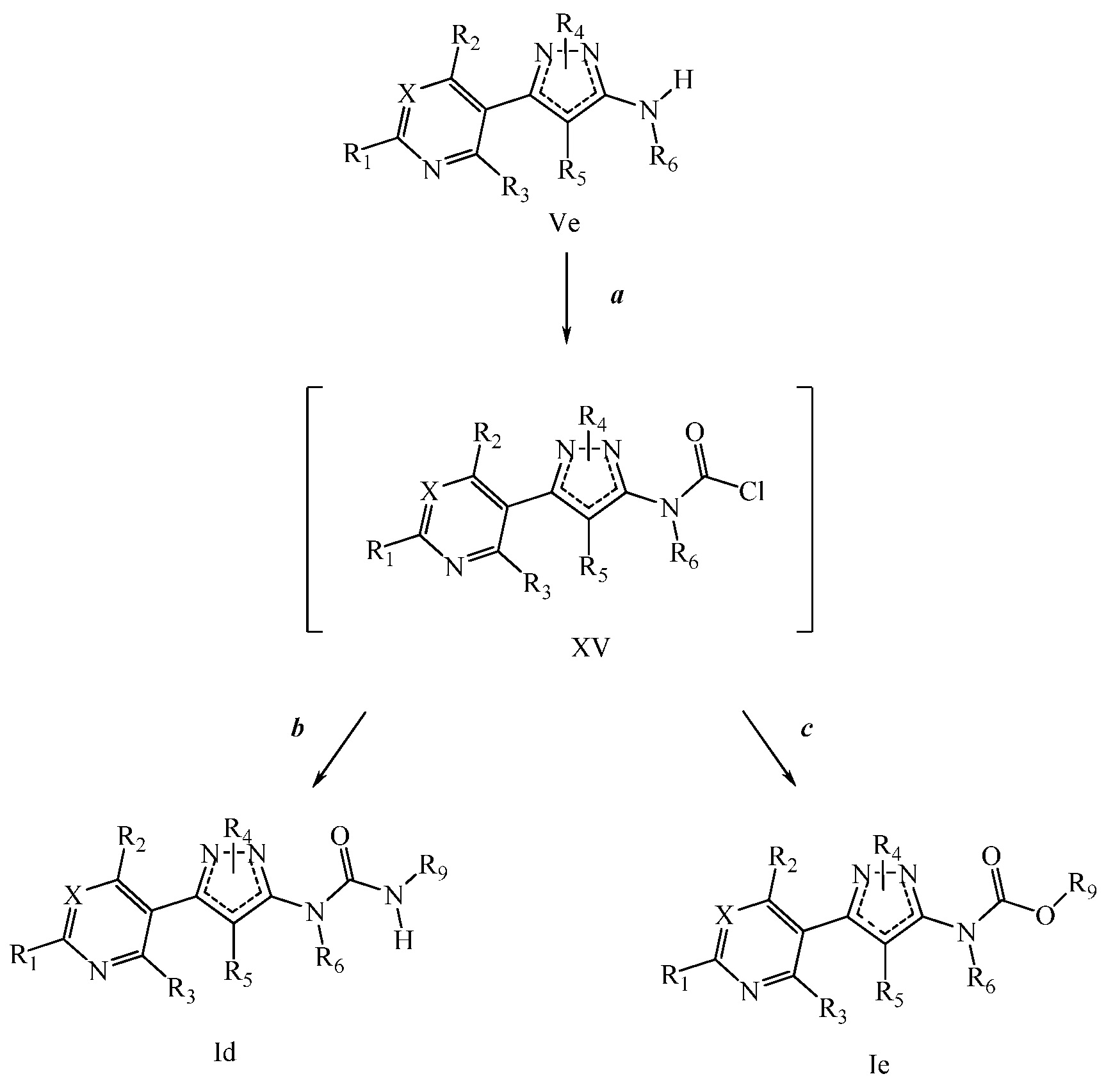
На стадии a схемы VIII соединения формулы XIIc, где X, R1, R2, R3, R4 и R5 имеют значения, определенные выше, могут быть обработаны ди-трет-бутил дикарбонатом (Boc2O) и основанием, таким как триэтиламин, в полярном апротонном растворителе, таком как дихлорметан (DCM), с получением соединений формулы XVIa. Обработка карбаматной функциональной группы алкилгалогенидом, таким как йодметан, или Boc-ангидридом в присутствии основания, такого как гидрид натрия, и в полярном апротонном растворителе, таком как ДМФ, дает карбаматы формулы XVII, как показано на стадии b схемы VIII, где R6 имеет значения, определенные выше, за исключением случая, когда R6 представляет собой водород. Boc-группа может быть удалена в условиях, которые хорошо известны в данной области техники, таких как в среде кислоты, такой как трифторуксусная кислота (ТФУ), в полярном апротонном растворителе, подобном дихлорметану, с получением соединения формулы XIIIb, как на стадии c.
Схема VIII
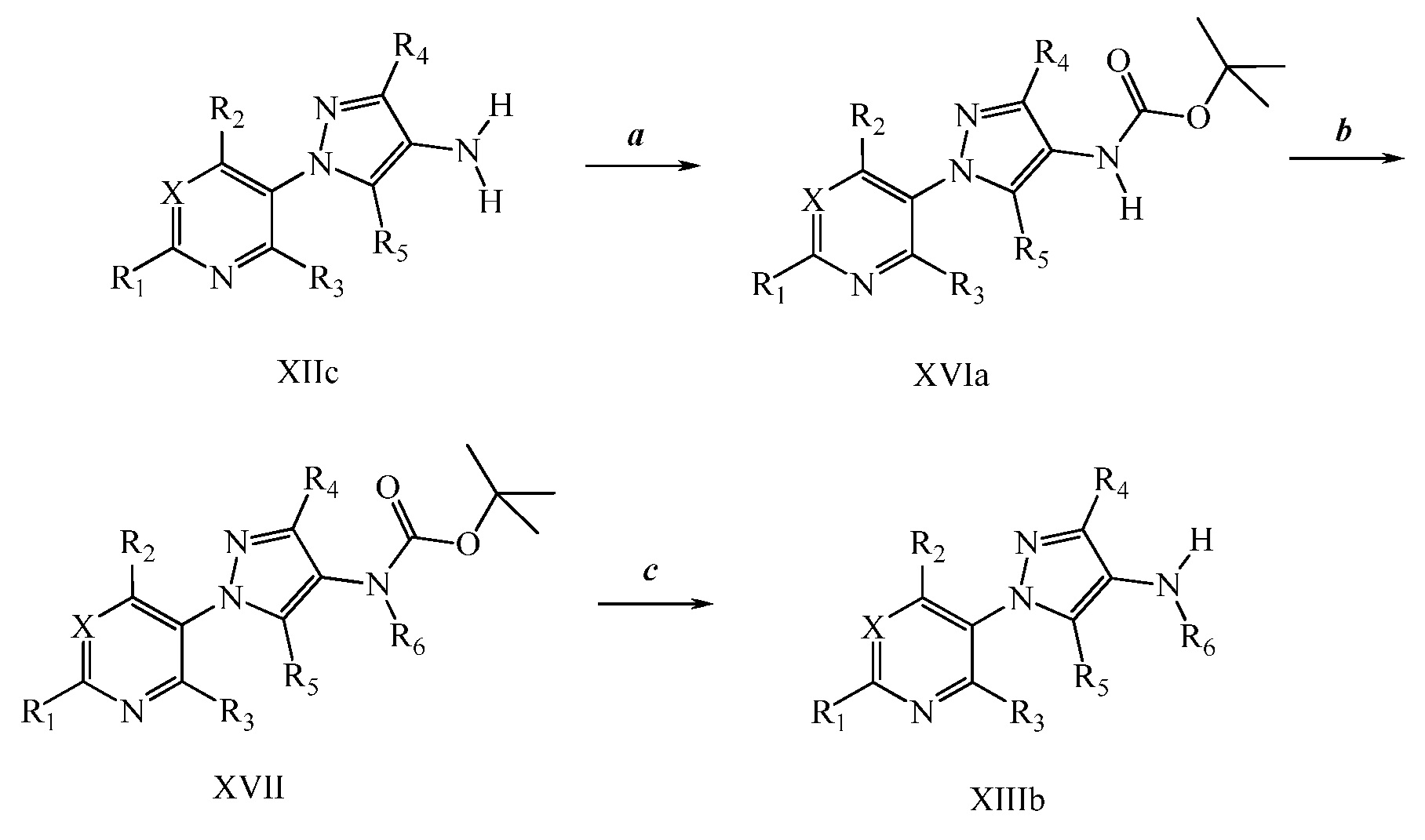
На стадии a, b и c схемы IX соединения формулы XIIIc, где X, R1, R2, R3, R4, R5 и R6 имеют значения, определенные выше, могут быть обработаны соединением формулы XVIII, где R8 имеет значения, определенные выше, и R10 представляет собой либо OH, OR9, либо O(C=O)OR9, с получением соединений формулы Id. Когда R10 = OH, соединения формулы XIIIc могут быть преобразованы в соединения формулы Id в присутствии конденсирующего агента, такого как гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDC·HCl), и основания, такого как N,N-диметиламинопиридин (DMAP), в полярном апротонном растворителе, таком как дихлорэтан (DCE), как показано на стадии a. Когда R10 = OR9, соединения формулы XIIIc могут быть преобразованы в соединения формулы Id в присутствии 2,3,4,6,7,8-гексагидро-1H-пиримидо[1,2-a]пиримидина в полярном апротонном растворителе, таком как 1,4-диоксан, при повышенной температуре, как показано на стадии b. Когда R10 = O(C=O)OR9, соединения формулы XIIIc могут быть преобразованы в соединения формулы Id в полярном апротонном растворителе, таком как дихлорметан (DCM), как показано на стадии c. Ацилирование амидов формулы Id, когда R6 = H, хлорангидридом кислоты в присутствии основания, такого как диизопропилэтиламин, в полярном апротонном растворителе, таком как дихлорэтан (DCE), дает имиды формулы Ie, как показано на стадии d. Кроме того, алкилирование амидов формулы Id, когда R6 = H, алкилгалогенидом или алкилсульфонатом в присутствии основания, такого как гидрид натрия, в полярном апротонном растворителе, таком как N,N-диметилформамид (ДМФ), дает алкилированные амиды формулы Ie, как показано на стадии e. Галогенирование соединений формулы Id, где R1, R2, R3, R4, R6, R8 и X имеют значения, определенные выше, и R5 = H, источником галогена, таким как N-бромсукцинимид, в полярном апротонном растворителе, таком как DCE, или источником галогена, таким как N-хлорсукцинимид, в полярном апротонном растворителе, таком как DCE или ацетонитрил, или источником галогена, таким как Selectfluor®, в смеси полярных апротонных растворителей, таких как ацетонитрил и ДМФ, дает галогенированные пиразолы формулы Ie, где R5 = галоген, как показано на стадии f схемы IX. Амиды формулы Id могут быть преобразованы в тиоамиды формулы If в присутствии тионирующего агента, такого как реагент Лавессона, в полярном апротонном растворителе, таком как дихлорэтан (DCE), как показано на стадии g.
Схема IX
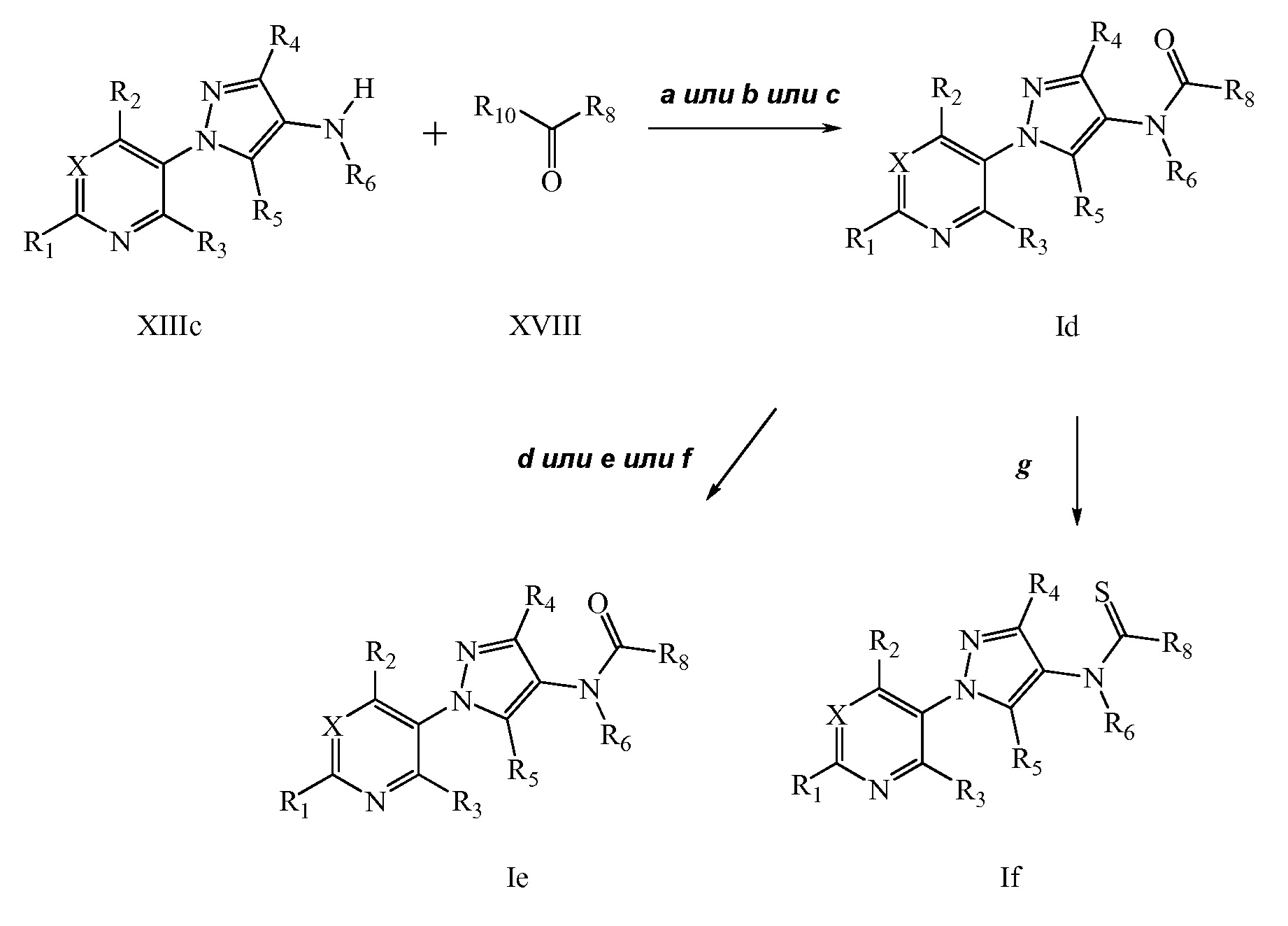
На стадии a схемы X соединения формулы XIIId, где X, R1, R2, R3, R4, R5 и R6 имеют значения, определенные выше, могут быть обработаны соединениями формулы XIX, где R8 имеет значения, определенные выше, в полярном апротонном растворителе, таком как дихлорэтан (DCE), с получением соединений формулы XX. Дополнительно, когда R6 = H и R8 содержит галоген, соединения формулы XX могут быть обработаны основанием, таким как гидрид натрия, в полярном апротонном растворителе, таком как ТГФ, с получением соединения формулы XXI, где m обозначает целое число, выбранное из 1, 2, 3, 4, 5 или 6, как показано на стадии b схемы X.
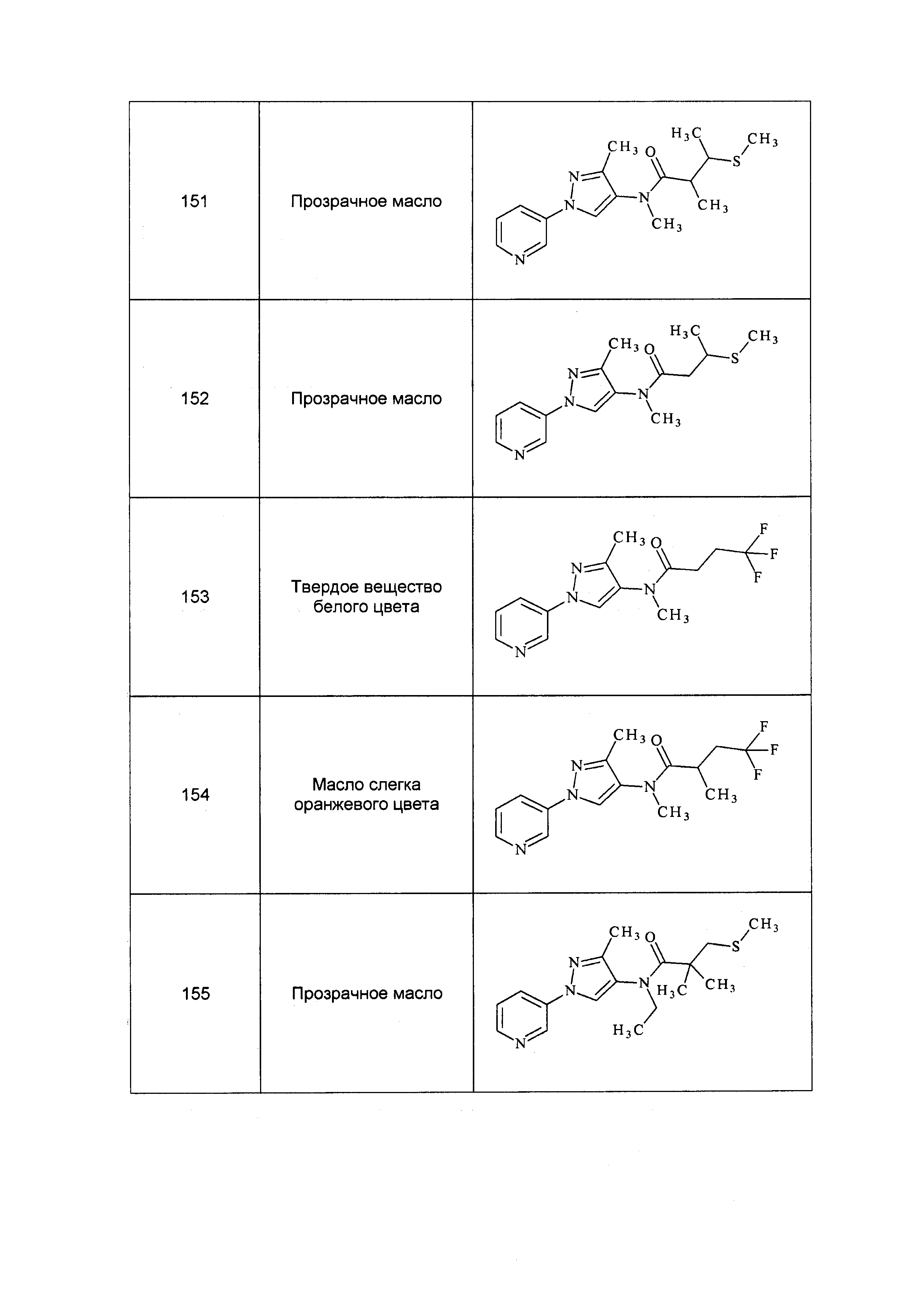
Схема X
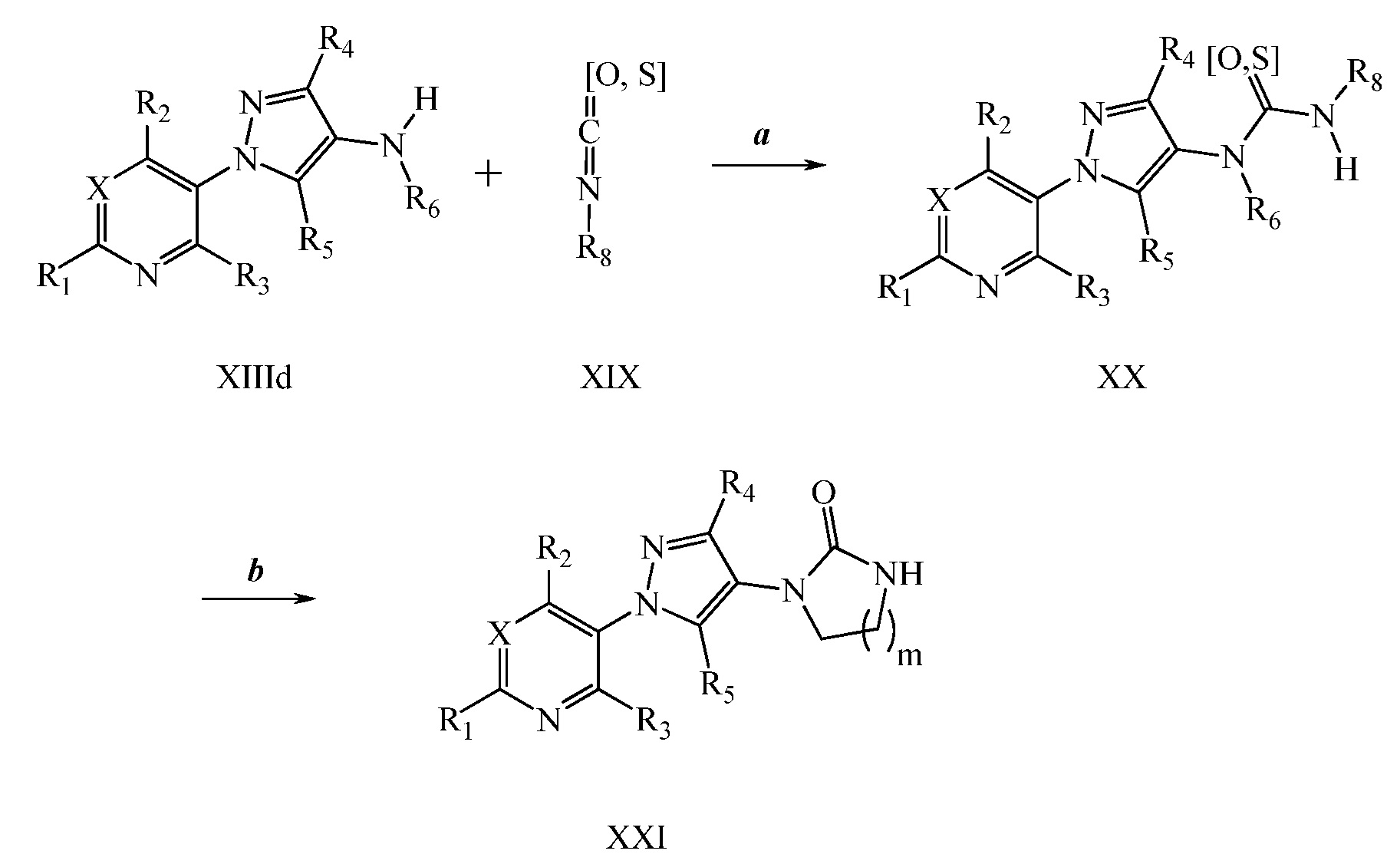
Окисление сульфида до сульфоксида или сульфона осуществляют, как описано на схеме XI, где (~S~) может представлять собой любой сульфид, определенный ранее в объеме определений для R8 по настоящему изобретению. Сульфид формулы XXIIa, где X, R1, R2, R3, R4, R5 и R6 имеют значения, определенные выше, обрабатывали окислителем, таким как тетрагидрат пербората натрия, в полярном протонном растворителе, таком как ледяная уксусная кислота, с получением сульфоксида формулы XXIII, как представлено на стадии a схемы XI. Альтернативно, сульфид формулы XXIIa может быть окислен окислителем, таким как пероксид водорода, в полярном протонном растворителе, таком как гексафторизопропанол, с получением сульфоксида формулы XXIII, как представлено на стадии d схемы XI. Сульфоксид формулы XXIII может быть далее окислен до сульфона формулы XXIV с помощью тетрагидрата пербората натрия в полярном протонном растворителе, таком как ледяная уксусная кислота, как представлено на стадии c схемы XI. Альтернативно, сульфон формулы XXIV может быть получен одностадийным способом из сульфида формулы XXIIa с использованием вышеуказанных условий с >2 эквивалентами тетрагидрата пербората натрия, как представлено на стадии b схемы XI.
Схема XI
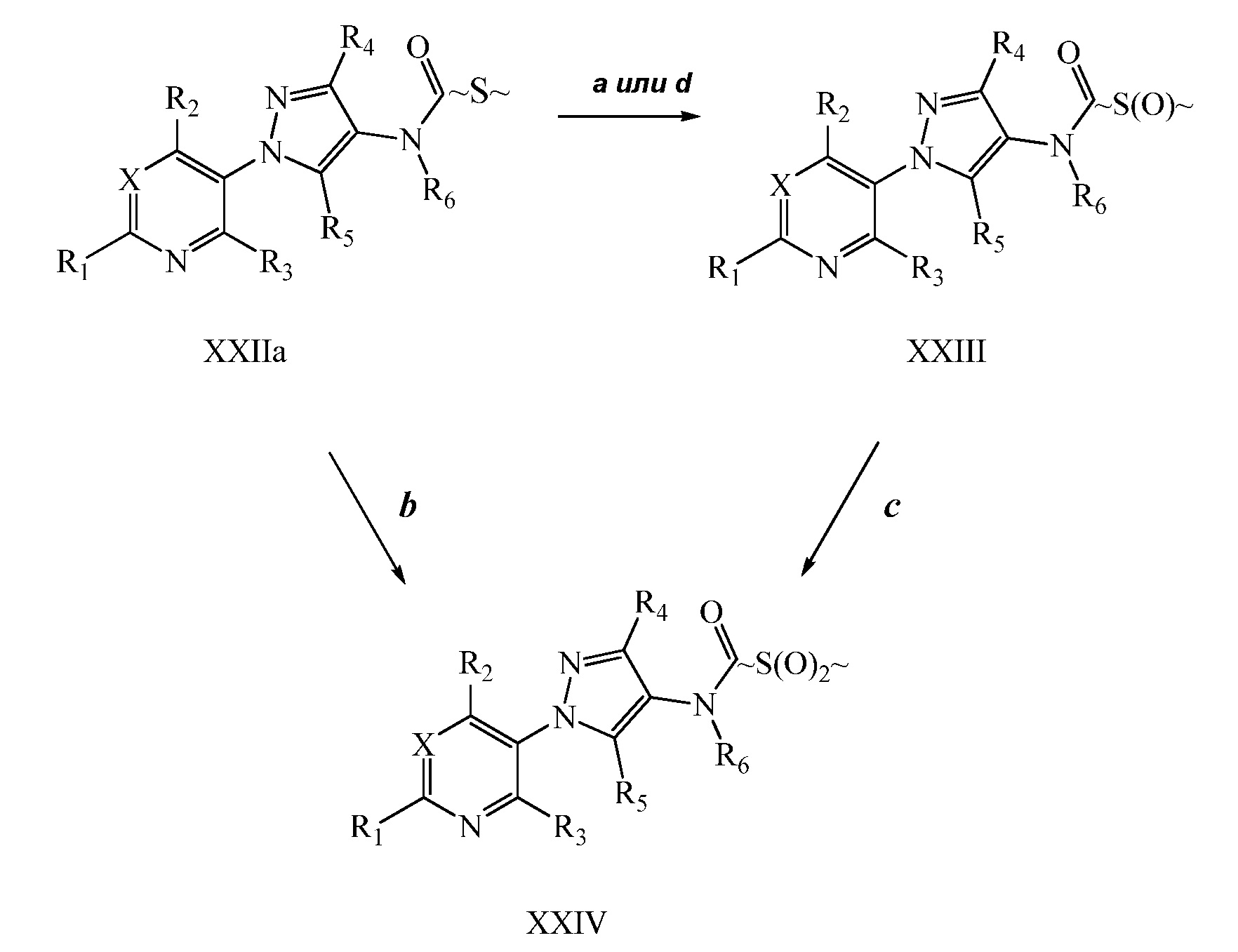
Окисление сульфида до сульфоксимина осуществляют, как описано на схеме XII, где (~S~) может представлять собой любой сульфид, определенный ранее в объеме определений для R8 по настоящему изобретению. Сульфид формулы XXIIb, где X, R1, R2, R3, R4, R5 и R6 имеют значения, определенные выше, окисляют, как представлено на стадии a, с помощью йодбензол диацетата в присутствии цианамида в полярном апротонном растворителе, таком как метиленхлорид (DCM), с получением сульфилимина формулы XXV. Сульфилимин формулы XXV может быть далее окислен до сульфоксимина формулы XXVI окислителем, таким как мета-хлорпероксибензойная кислота (“mCPBA”), в присутствии основания, такого как карбонат калия, в системе протонных полярных растворителей, таких как этанол и вода, как представлено на стадии b схемы XII.
Схема XII
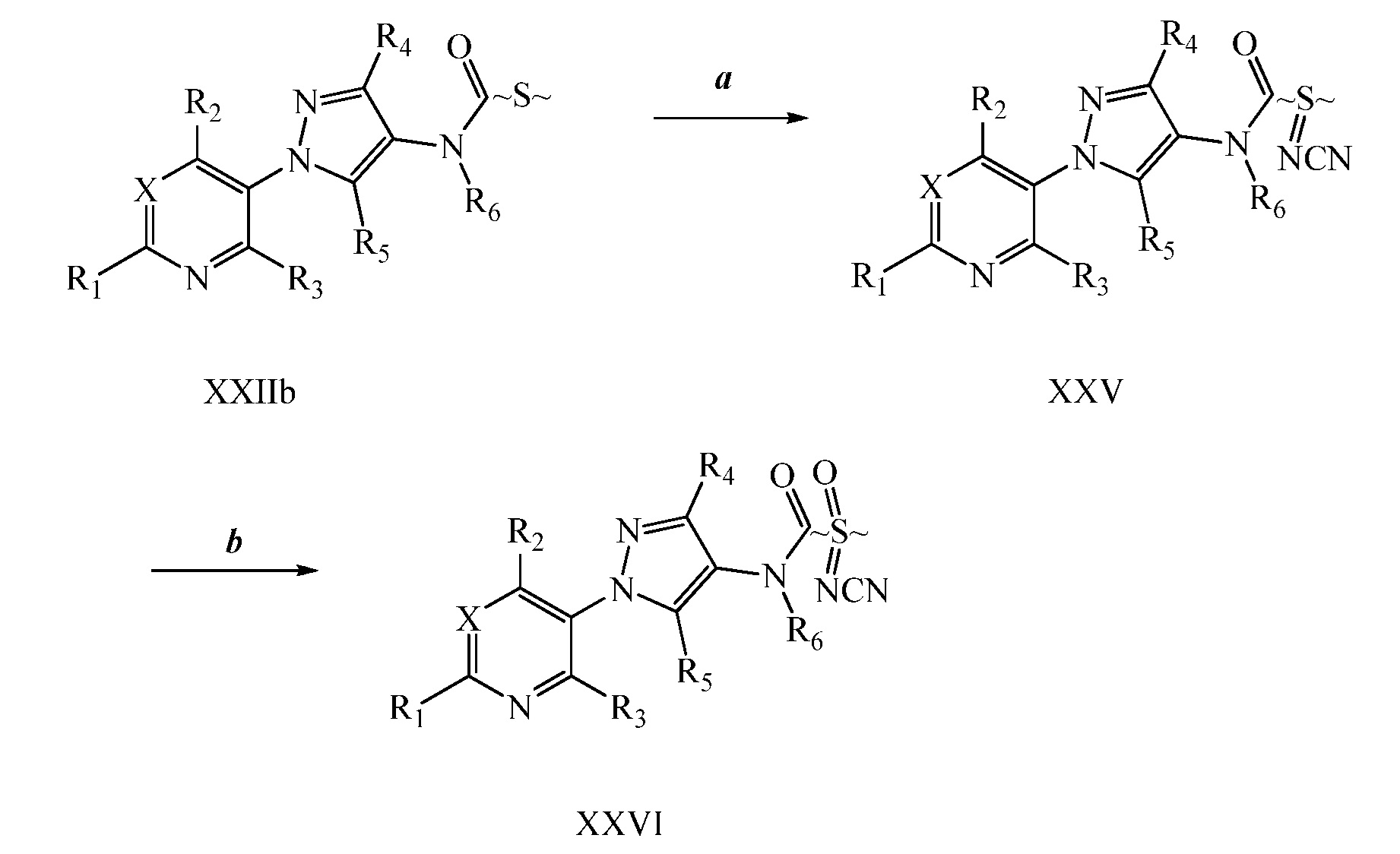
Йодирование пиразола формулы Xb, как представлено на стадии a схемы XIII и как описано в работе Potapov, A. et al. Russ. J. Org. Chem. 2006, 42, 1368-1373, осуществляют путем взаимодействия с йодирующим агентом, таким как йод, в присутствии кислот, таких как йодная кислота и серная кислота, в полярном протонном растворителе, таком как уксусная кислота, что дает соединения формулы XXVII. На стадии b схемы XIII и как описано в работе Wang, D. et al. Adv. Synth. Catal. 2009, 351, 1722-1726, аминопиразолы формулы XIIIe могут быть получены исходя из йодпиразолов формулы XXVII посредством реакции поперечного связывания с подходящим амином в присутствии основания, такого как карбонат цезия, медного катализатора, такого как бромид меди(I), и лиганда, такого как 1-(5,6,7,8-тетрагидрохинолин-8-ил)этанон, в полярном апротонном растворителе, таком как ДМСО.
Схема XIII
На стадии a схемы XIV соединения формулы XXIX, где R4 представляет собой Cl, R5 обозначает H и X- обозначает Cl-, могут быть получены в соответствии со способами, описанными в работе Acta. Pharm. Suec. 22, 147-156 (1985), авторами Tolf, Bo-Ragnar и Dahlbom, R. Подобным образом соединения формулы XXIX, где R4 представляет собой Br, X- обозначает Br- и R5 имеет значения, определенные выше, могут быть получены путем обработки соединений формулы XXVIII газообразным водородом в присутствии металлического катализатора, такого как 5% Pd на оксиде алюминия, и 50%-го водного раствора HBr в растворителе, таком как этанол. Альтернативно, на стадии a схемы XIV, соединения формулы XXIX, где R4 представляет собой Cl или Br, X- обозначает Cl- или Br- и R5 имеет значения, определенные выше, могут быть получены путем обработки соединений формулы XXVIII, где R5 имеет значения, определенные выше, гидросиланом, таким как триэтилсилан, в присутствии металлического катализатора, такого как 5% Pd на оксиде алюминия, и кислоты, такой как HCl или HBr, соответственно, в растворителе, таком как этанол.
На стадии b схемы XIV соединения формулы XXX, где R4 представляет собой Cl или Br и R5 имеет значения, определенные выше, могут быть получены путем обработки соединений формулы XXIX, где R4 представляет собой Cl или Br, X- обозначает Cl- или Br- и R5 имеет значения, определенные выше, ди-трет-бутил дикарбонатом (Boc2O) в присутствии смеси растворителей, таких как ТГФ и вода, и основания, такого как бикарбонат натрия.
На стадии c схемы XIV соединения формулы XVIa, где X, R1, R2, R3 и R5 имеют значения, определенные выше, и R4 представляет собой Cl или Br, предпочтительно Cl, могут быть получены путем обработки соединений формулы XXX, где R4 представляет собой Cl или Br, и R5 имеет значения, определенные выше, предпочтительно H, соединениями формулы VIIIb, где X, R1, R2 и R3 имеют значения, определенные выше, и Q представляет собой йод, в присутствии каталитического количества соли меди, такой как CuCl2, лиганда, такого как производное этан-1,2-диамина, такое как N1,N2-диметилэтан-1,2-диамин, и основания, такого как K3PO4, в полярном апротонном растворителе, таком как ацетонитрил, при соответствующей температуре.
На стадии c пиразолы формулы XXX конденсируют с соединениями формулы VIIIb, предпочтительно 3-йодпиридином, в присутствии металлического катализатора, такого как CuCl2, и диаминового лиганда, такого как N1,N2-диметилэтан-1,2-диамин, и неорганического основания, такого как K3PO4. Реакцию проводят в полярном апротонном растворителе, таком как ацетонитрил. Реакцию осуществляют при температуре от примерно 60°C до примерно 82°C и предпочтительно от примерно 75°C до 82°C. Может быть использовано молярное соотношение пиразолов формулы XXX и гетероциклил йодида формулы VIIIb, составляющее приблизительно 1:1,2, однако, также могут быть использованы мольные соотношения от примерно 5:1 до примерно 1:5. Реакцию проводят при примерно атмосферном давлении, однако, может быть использовано более высокое или более низкое давление.
Boc-группа соединений формулы XVIa может быть удалена в условиях, которые хорошо известны в данной области техники, таких как в среде кислоты, такой как ТФУ, в полярном апротонном растворителе, таком как дихлорметан, с получением соединений формулы XIId, как показано на стадии d схемы XIV.
Схема XIV
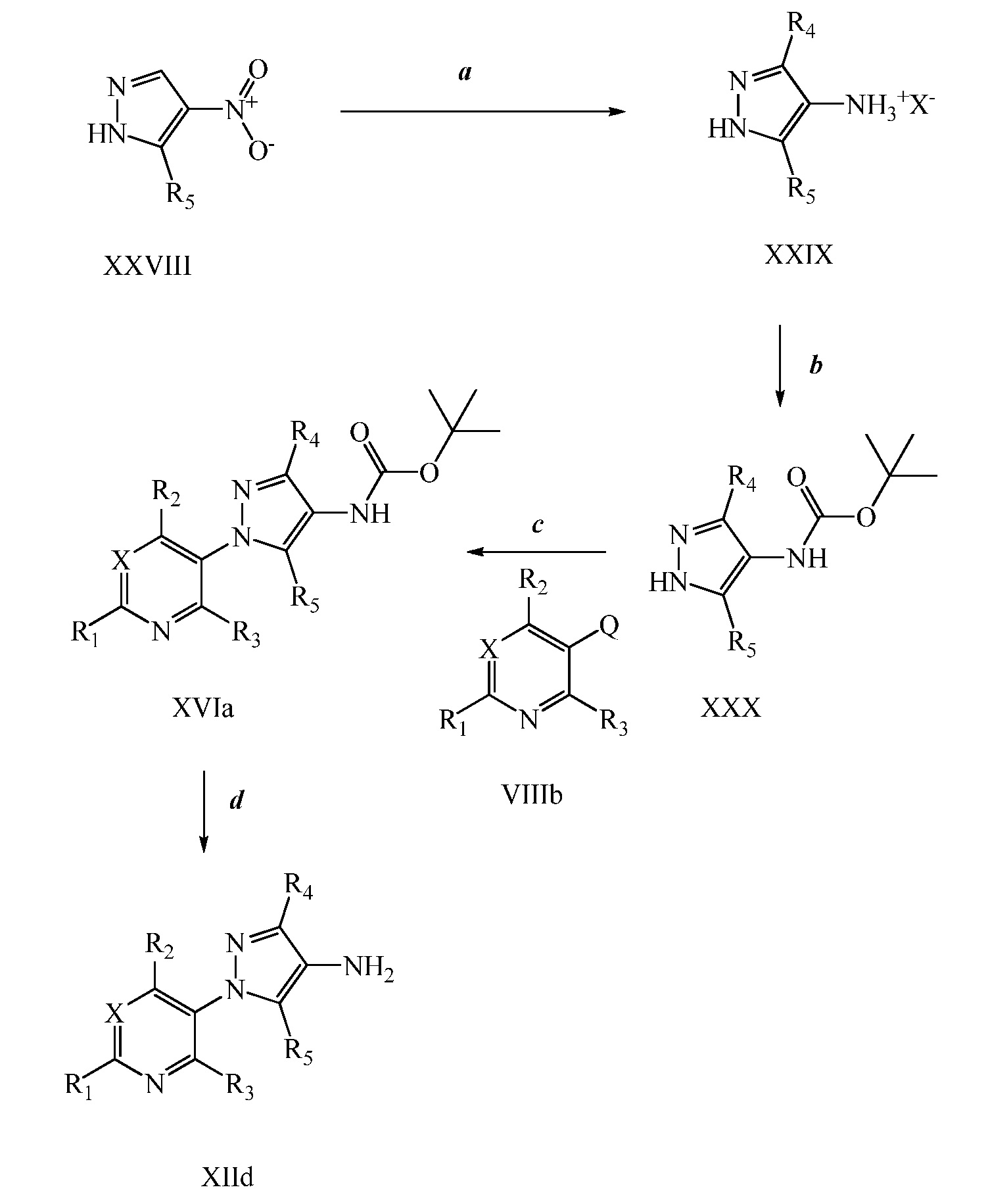
Бромпиразолы формулы XXXI, где R1, R2, R3, R5, R8 и X имеют значения, определенные выше, могут быть подвергнуты взаимодействию в условиях конденсации по Сузуки с бороновым эфиром, таким как пинаколовый эфир винилбороновой кислоты или пинаколовый эфир циклопропилбороновой кислоты, в присутствии катализатора, такого как тетракис палладий, основания, такого как 2 M водный раствор карбоната калия, и в системе смешанных растворителей, таких как этанол и толуол, с получением соединений формулы XXXII, как показано на стадии a схемы XV.
Схема XV
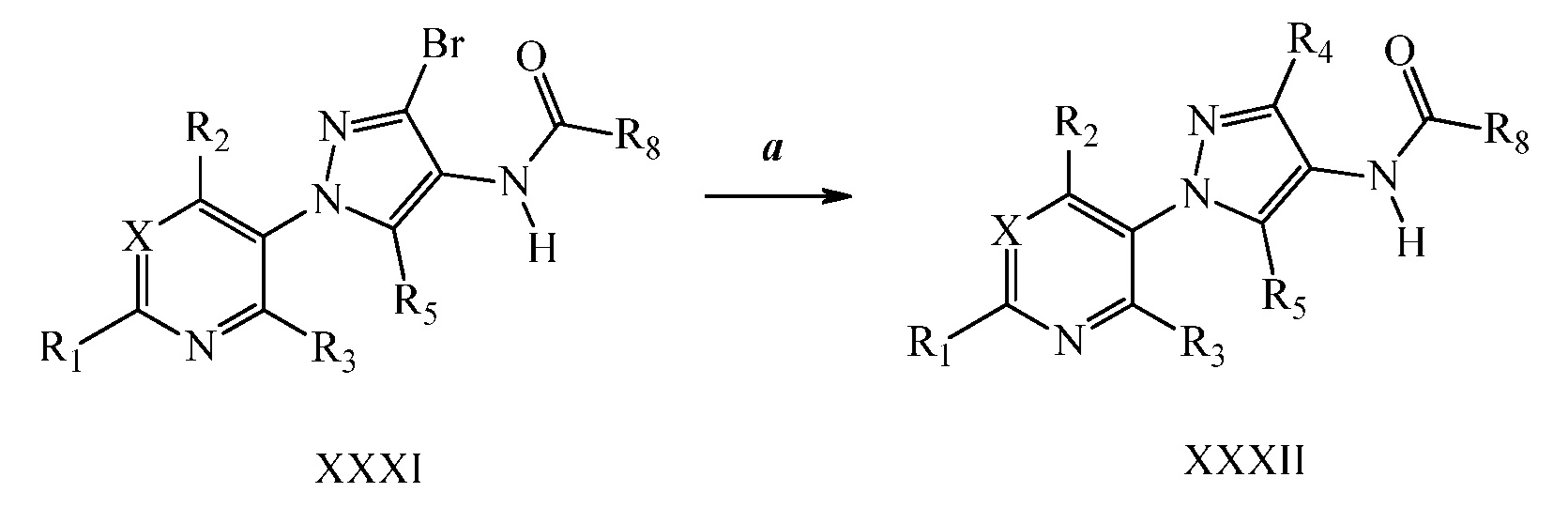
Винильная группа соединений формулы XXXIII, где R1, R2, R3, R5, R6, R8 и X имеют значения, определенные выше, может быть восстановлена в присутствии водорода с катализатором, таким как 10% Pd/C, в полярном протонном растворителе, таком как метанол, с получением соединений формулы XXXIV, как показано на стадии a схемы XVI. Окисление винильной группы соединений формулы XXXIII с использованием окислителя, такого как тетроксид осмия, в присутствии перйодата натрия в смеси полярного протонного растворителя, такого как вода, и полярного апротонного растворителя, такого как ТГФ, давала соединения формулы XXXV, как показано на стадии b схемы XVI. Восстановление альдегидных соединений формулы XXXV, как показано на стадии c схемы XVI, восстанавливающим агентом, таким как боргидрид натрия, в полярном протонном растворителе, таком как метанол, давало соответствующий спирт формулы XXXVI. Обработка соединений формулы XXXVI хлорирующим агентом, таким как тионилхлорид, в полярном апротонном растворителе, таком как дихлорметан, давала соединения формулы XXXVII, как показано на стадии d схемы XVI.
Схема XVI
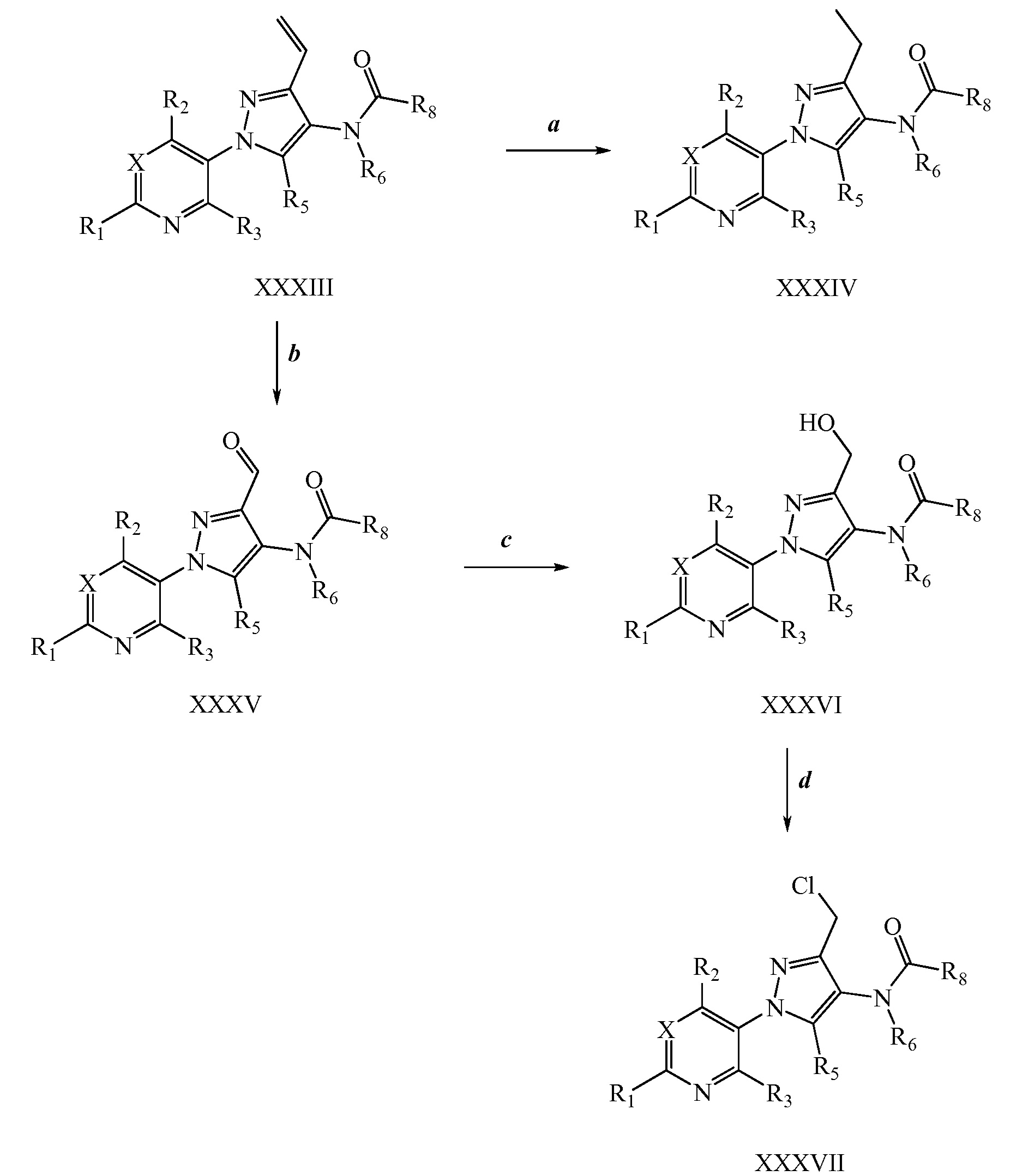
На стадии a схемы XVII α,β-ненасыщенная кислота XXXVIII может быть обработана нуклеофилом, таким как тиометоксид натрия, в полярном протонном растворителе, таком как метанол, с получением кислоты XXXIX.
Схема XVII
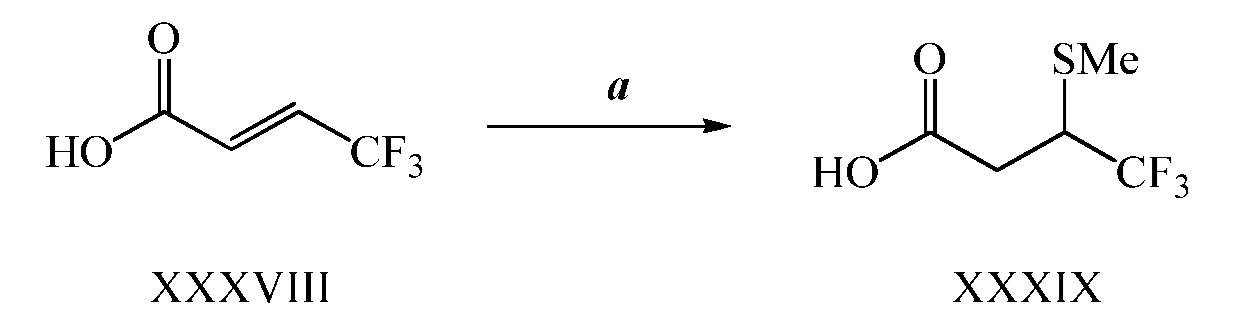
На стадии a схемы XVIII обработка соединений формулы Ig, где A представляет собой A2, R7 представляет собой O и R8 представляет собой трет-бутокси, реагентом, таким как пропаргил бромид, в присутствии основания, такого как гидрид натрия, и в полярном апротонном растворителе, таком как ДМФ, дает соединения формулы Ih, где R6 = R11.
Схема XVIII
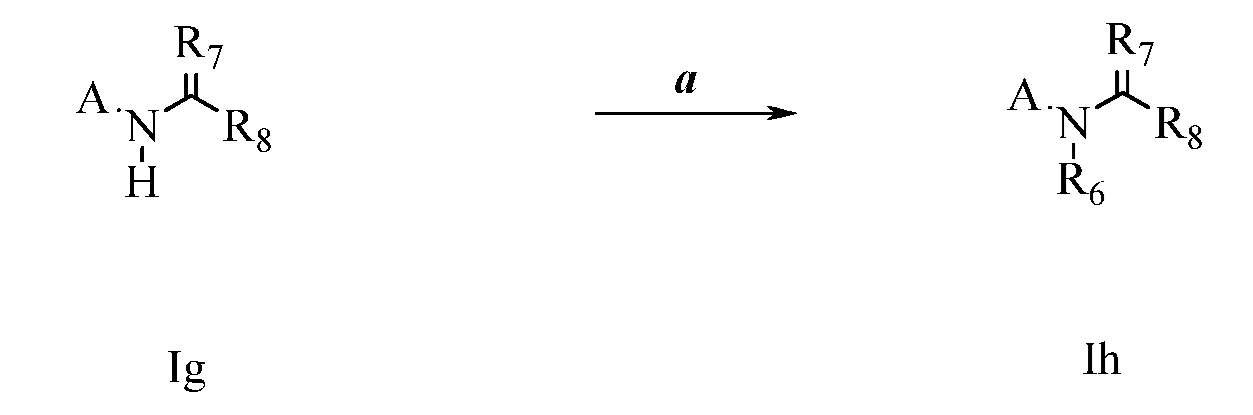
На стадии a схемы XIX соединения формулы XL, где X, R1, R2, R3, R4, R5 и R6 имеют значения, определенные выше, могут быть обработаны кислотой формулы XLI, где R8 имеет значения, определенные выше, в присутствии конденсирующего агента, такого как гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDC·HCl), и основания, такого как N,N-диметиламинопиридин (DMAP), в полярном апротонном растворителе, таком как дихлорметан (DCM), с получением соединений формулы XLII. На стадии b соединения формулы XLII могут быть обработаны основанием, таким как метоксид натрия, в полярном растворителе, таким как ТГФ, затем алкилгалогенидом R9-Hal с получением соединений формулы XLIII.
Схема XIX
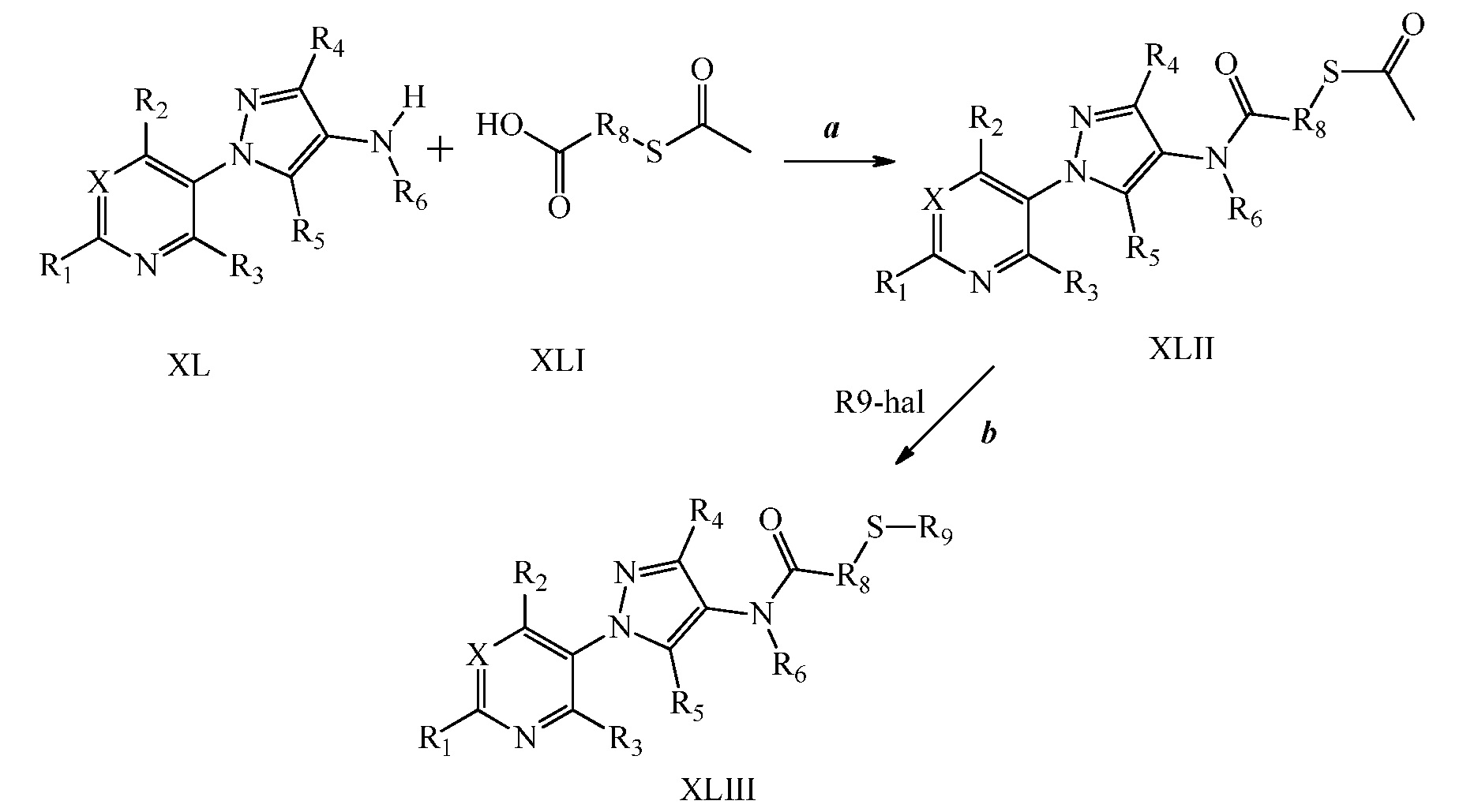
Альтернативно, на стадии a схемы XX соединения формулы XL или соответствующая HCl соль, где X, R1, R2, R3, R4, R5 и R6 имеют значения, определенные выше, могут быть конденсированы с кислотами формулы XLIV, где R8 имеет значения, определенные выше, в присутствии конденсирующего агента, такого как гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDC·HCl), и основания, такого как N,N-диметиламинопиридин, в полярном апротонном растворителе, таком как дихлорметан, с получением соединений формулы XLV, где X, R1, R2, R3, R4, R5, R6 и R8 имеют значения, определенные выше. На стадии b схемы XX соединения формулы XLV, где X, R1, R2, R3, R4, R5, R6 и R8 имеют значения, определенные выше, и Tr обозначает тритил(трифенилметил), могут быть обработаны кислотой, такой как 2,2,2-трифторуксусная кислота, в присутствии триалкилсилана, такого как триэтилсилан, в полярном апротонном растворителе, таком как метиленхлорид, для удаления тритильной группа с получением тиолов формулы XLVI, где X, R1, R2, R3, R4, R5, R6 и R8 имеют значения, определенные выше. На стадии c схемы XX тиолы формулы XLVI, где X, R1, R2, R3, R4, R5, R6 и R8 имеют значения, определенные выше, могут быть обработаны основанием, таким как гидрид натрия, в полярном апротонном растворителе, таком как тетрагидрофуран, или карбонатом цезия в ацетонитриле, или DBU в диметилформамиде, и электрофилом (R9-Hal), таким как 2-(бромметил)-1,1-дифторциклопропан, в тетрагидрофуране с получением соединений формулы XLVII. Альтернативно, для преобразования XLVI в XLVII могут быть использованы модифицированные условия, описанные Pustovit и соавторами (Synthesis 2010, 7, 1159-1165).
Схема XX
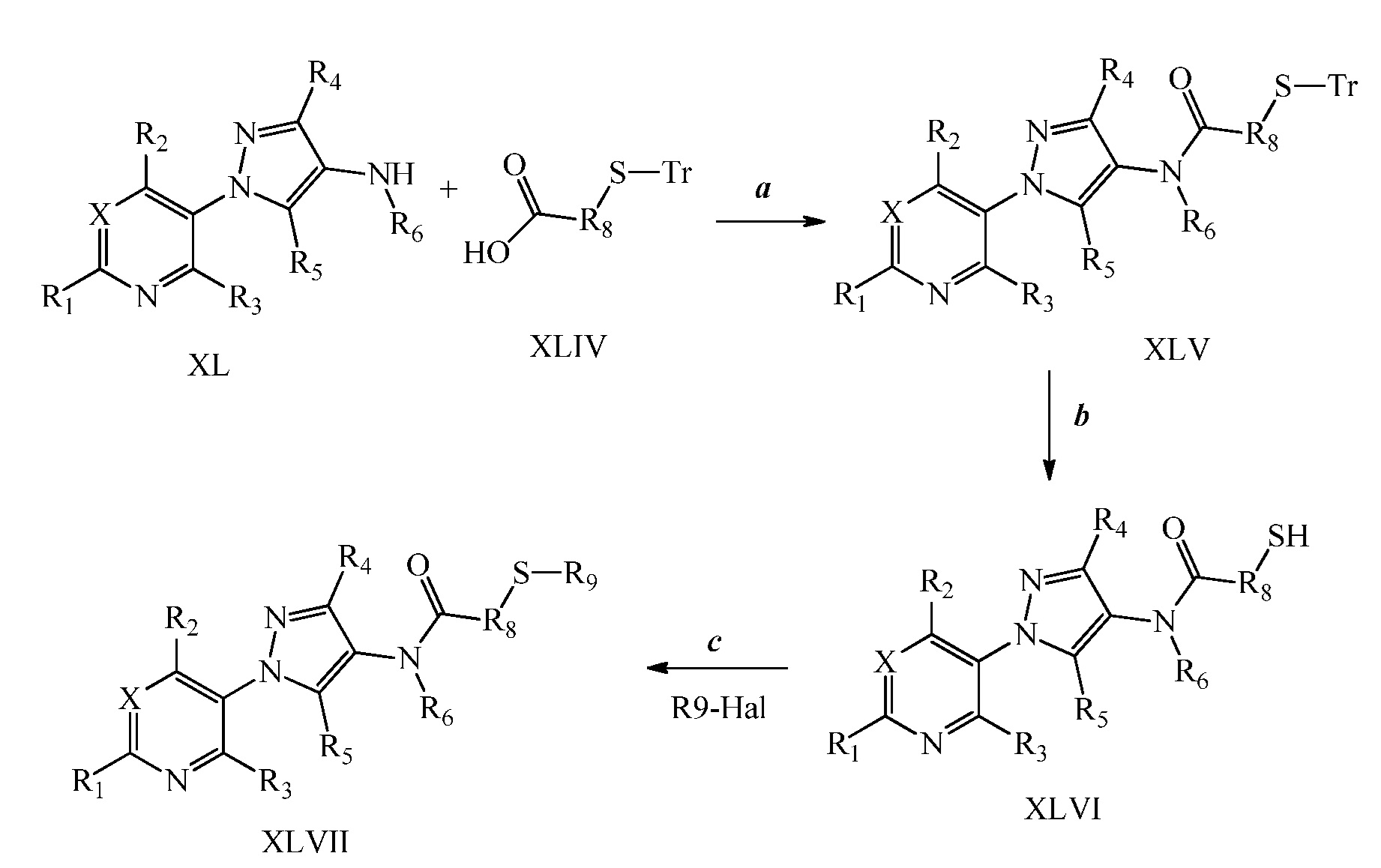
Альтернативно, на стадии a схемы XXI соединения формулы XL или соответствующая HCl соль, где X, R1, R2, R3, R4, R5 и R6 имеют значения, определенные выше, могут быть конденсированы с кислотами формулы XLVIII, где R9 имеет значения, определенные выше, в присутствии конденсирующего агента, такого как EDC·HCl, и основания, такого как DMAP, в полярном апротонном растворителе, таком как ДМФ, с получением соединения формулы XLIX, где X, R1, R2, R3, R4, R5, R6 и R9 имеют значения, определенные выше. На стадии b схемы XXI соединения формулы XLIX, где X, R1, R2, R3, R4, R5, R6 и R9 имеют значения, определенные выше, могут быть обработаны солью тиокислоты, такой как тиоацетат калия, при повышенной температуре (примерно 50°C) в растворителе, таком как ДМСО, с получением соединений формулы L, где X, R1, R2, R3, R4, R5, R6 и R9 имеют значения, определенные выше. На стадии c схемы XXI соединения формулы L, где X, R1, R2, R3, R4, R5, R6 и R9 имеют значения, определенные выше, могут быть обработаны эквимолярным количеством основания, такого как метоксид натрия, полученного путем смешивания гидрида натрия и метанола, затем электрофилом (R9-галоген), таким как 2-(бромметил)-1,1-дифторциклопропан, в растворителе, таком как тетрагидрофуран, с получением соединений формулы LI.
Схема XXI
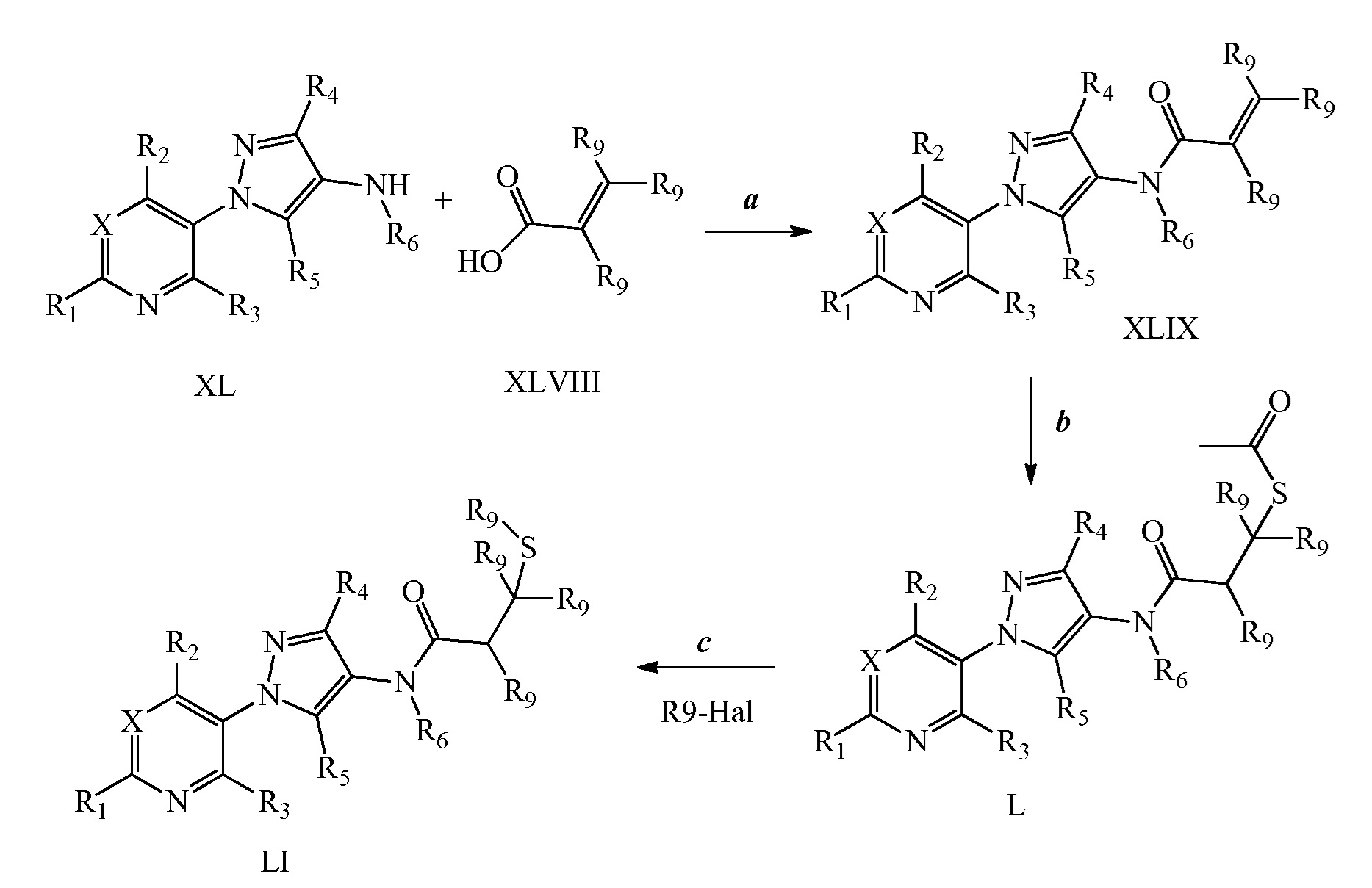
На стадии a схемы XXII соединения формулы XL, где X, R1, R2, R3, R4, R5, R6 и галоген имеют значения, определенные выше, могут быть обработаны хлорангидридом кислоты формулы LII в присутствии основания, такого как триэтиламин или диизопропилэтиламин, в полярном апротонном растворителе, таком как DCE, с получением соединений формулы LIII, где R8 представляет собой либо замещенную, либо незамещенную алкильную цепь. На стадии b соединения формулы LIII могут быть обработаны тиоацетатом калия с получением соединений формулы LIV после нагревания (примерно 60°C) в полярном апротонном растворителе, таком как ацетон. Указанные на стадии c последовательные метанолизис/алкилирование в одном сосуде могут быть достигнуты посредством обработки соединений формулы LIV одним эквивалентом основания, такого как метоксид натрия (NaOMe), в полярном апротонном растворителе, таком как тетрагидрофуран (ТГФ). Затем к реакционной смеси может быть добавлен алкилсульфонат или алкилгалогенид, такой как 2-йод-1,1,1-трифторэтан, образуя соединения формулы LV, где R9 имеет значения, определенные выше. На стадии d соединения формулы LV могут быть получены из соединений формулы LIII посредством обработки алкилтиолом, таким как 2,2,2-трифторэтантиол, при повышенной температуре (примерно 50°C) в полярном апротонном растворителе, таком как ТГФ, в присутствии йодида натрия и основания, такого как диизопропилэтиламин. Альтернативно, на стадии f обработка соединений формулы LIII алкилтиолом, таким как метантиолат натрия, в полярном апротонном растворителе, таком как ДМСО, при повышенной температуре (примерно 50°C) будет давать соединения формулы LV. Как продемонстрировано на стадии e, когда соединения формулы LIV обрабатывают двумя или более эквивалентами основания, такого как NaOMe, затем 1,2,2-тригалогеналкильным соединением, таким как 2-бром-1,1-дифторэтан, получают соединения формулы LVI.
Схема XXII
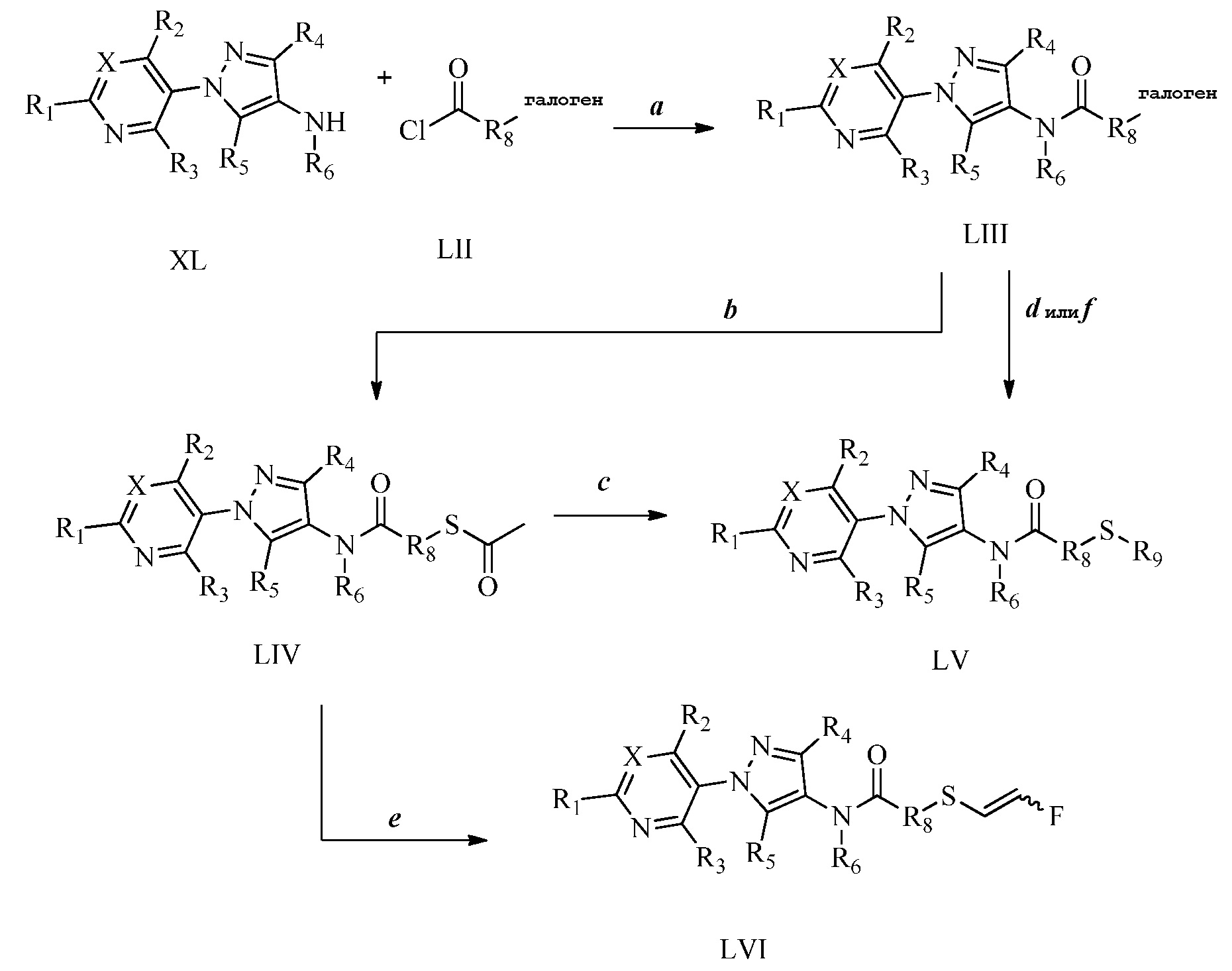
На стадии a схемы 23 соединения формулы 23.1, где X, R1, R2, R3, R4, R5, R6 и R8 имеют значения, определенные выше, могут быть обработаны основанием, таким как 2M водный раствор гидроксида лития, в полярном протонном растворителе, таком как метанол, с получением соединений формулы 23.2. Затем на стадии b соединения формулы 23.2 могут быть обработаны основанием, таким как гидрид натрия, в полярном апротонном растворителе, таком как тетрагидрофуран, затем электрофилом, таким как алкилгалогенид или сульфонилгалогенид, с получением соединений формулы 23.3.
Схема 23
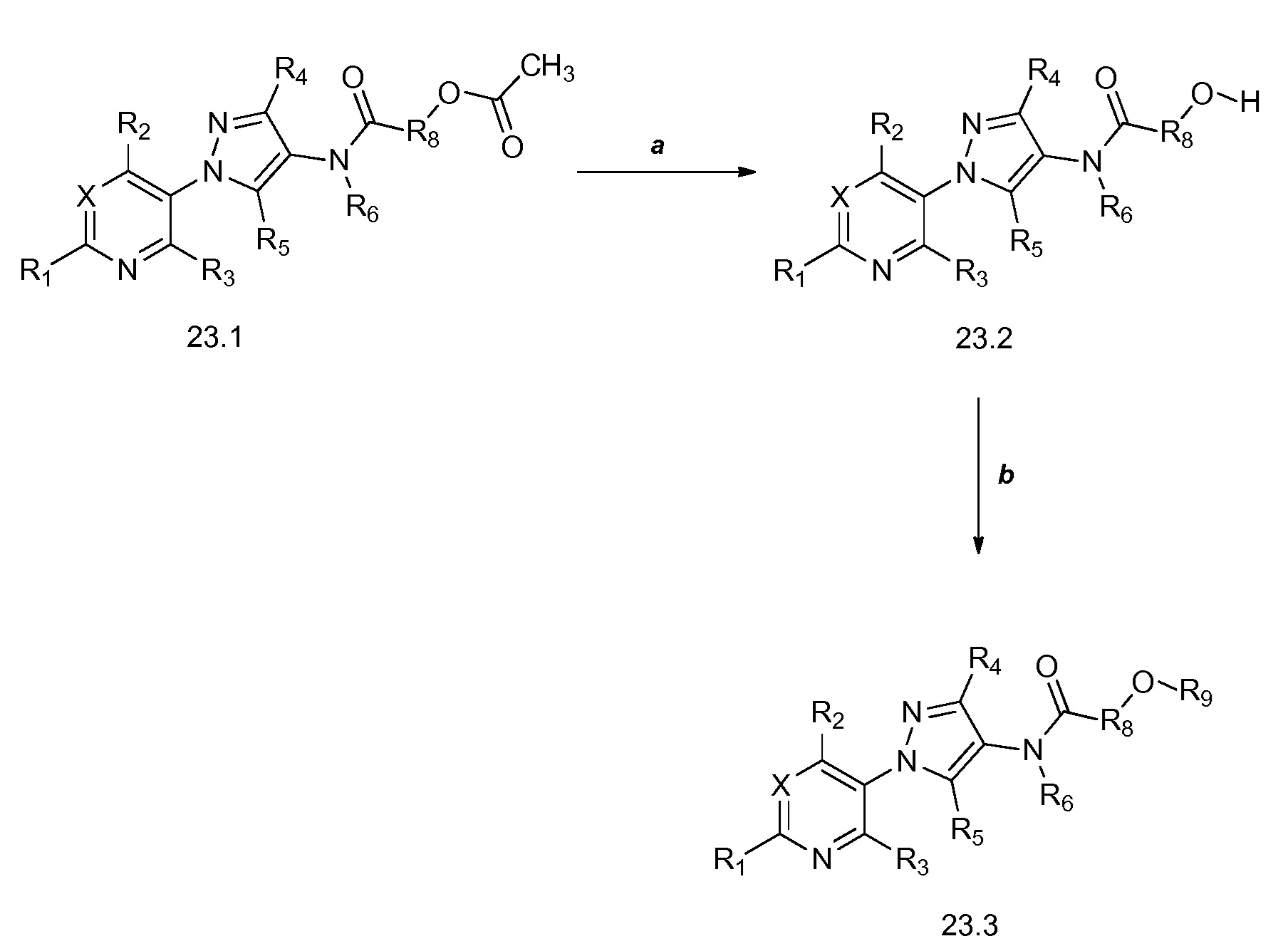
На стадии a схемы 24 соединения формулы 24.1, где X, R1, R2, R3, R4, R5, R8 и галоген имеют значения, определенные выше, и R6 = H, могут быть обработаны основанием, таким как гидрид натрия, в полярном апротонном растворителе, таком как тетрагидрофуран (ТГФ), с получением соединения формулы 24.2, где m обозначает целое число, выбранное из 0, 1, 2, 3, 4, 5 или 6. На стадии b схемы 24 соединения формулы 24.2 могут быть обработаны основанием, таким как триэтиламин, и агентами силилирования, такими как триметилсилил трифторметансульфонат и диметилметилиденаммония йодид (соль Эшенмозера), в полярном апротонном растворителе, таком как дихлорметан (DCM), с получением соединений формулы 24.3. На стадии c схемы 24 соединения формулы 24.3 могут быть обработаны основанием, таким как гидроксид калия, и нуклеофилом, таким как S,S-диметил карбонодитиоат, в воде и полярном апротонном растворителе, таком как тетрагидрофуран (ТГФ), с получением соединений формулы 24.4, где X, R1, R2, R3, R4, R5, R9 и m имеют значения, определенные выше.
Схема 24
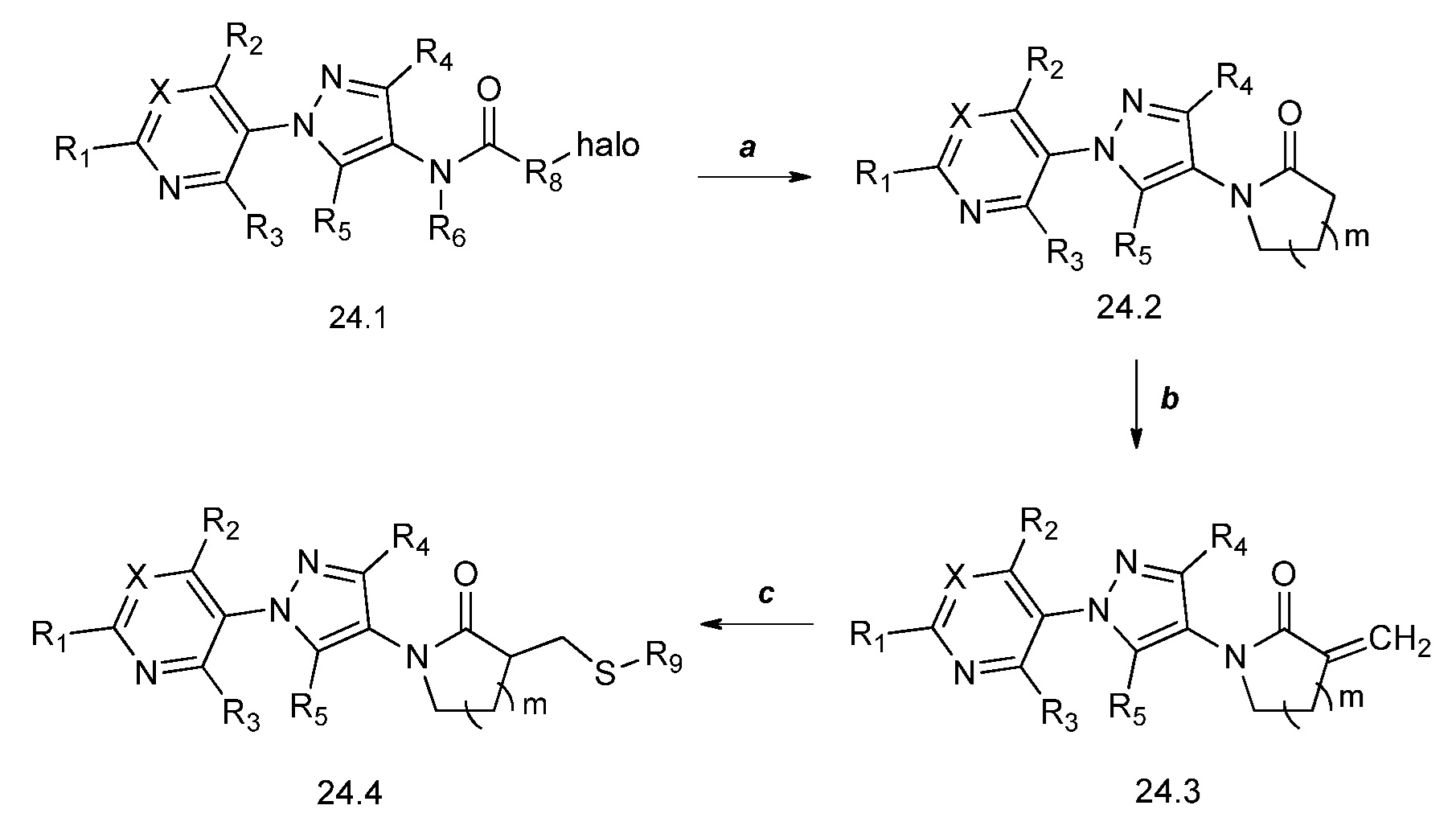
Путь получения соединений формулы 25.2 описан на схеме 25. Как продемонстрировано на стадии a, когда соединения формулы 25.1, где X, R1, R2, R3, R4, R5, R6 и R8 имеют значения, определенные выше, обрабатывают двумя или более эквивалентами основания, такого как метоксид натрия, затем 1,2-дигалогеналкильным соединением, таким как 1-фтор-2-йодэтан, в растворителе, таком как тетрагидрофуран (ТГФ), получают соединения формулы 25.2, где R9 имеет значения, определенные выше.
Схема 25
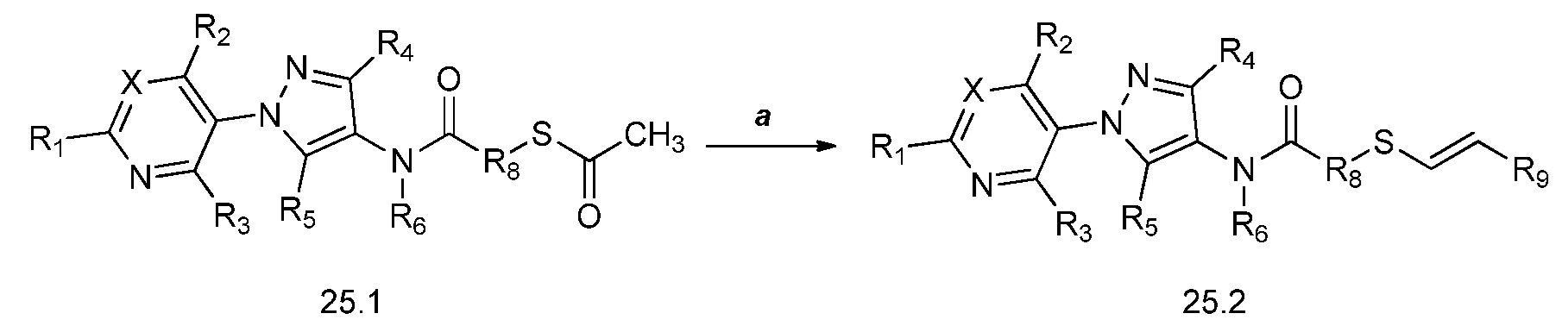
Альтернативный путь получения винилсульфидов описан на стадии a схемы 26. В этом способе используются условия, разработанные Kao и Lee (Org. Lett. 2011, 13, 5204-5207), согласно которым тиолы формулы 26.1, где X, R1, R2, R3, R4, R5, R6 и R8 имеют значения, определенные выше, конденсируют с винилгалогенидом, таким как (E)-1-бром-3,3,3-трифторпроп-1-ен, в присутствии катализатора, такого как оксид меди(I), основания, такого как гидроксид калия, и растворителя, такого как диоксан, при повышенной температуре с получением продуктов формулы 26.2, где R9 имеет значения, определенные выше.
Схема 26
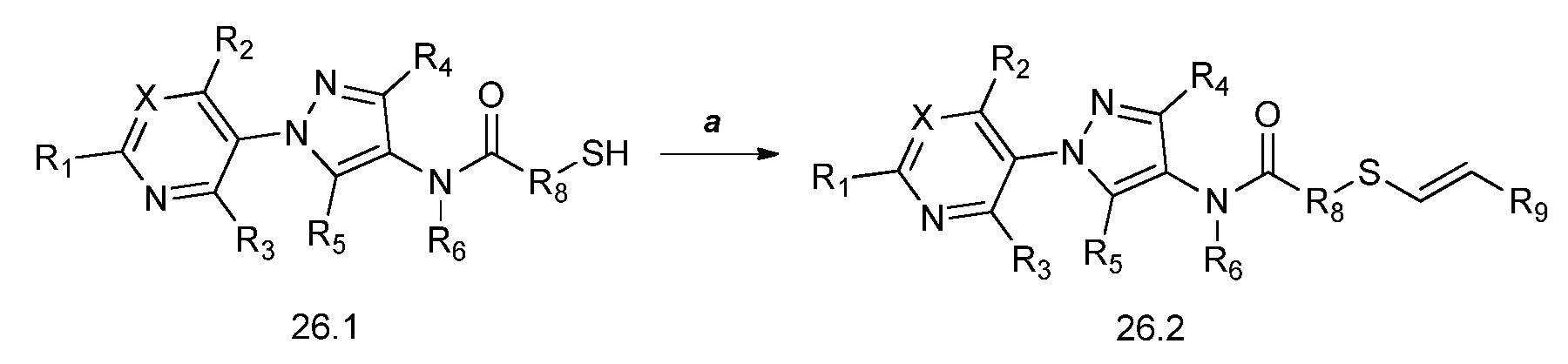
На стадии a схемы 27 акриламид формулы 27.1, где X, R1, R2, R3, R4, R5 и R6 имеют значения, определенные выше, подвергают взаимодействию с сульфонамидом формулы 27.2, где R9 имеет значения, определенные выше, в присутствии основания, такого как карбонат калия, при повышенной температуре в полярном апротонном растворителе, таком как диметилформамид (ДМФ), с получением соединений формулы 27.3. Этот продукт затем может быть обработан основанием, таким как гидрид натрия, и алкилгалогенидом, таким как 2-бромацетонитрил, в полярном апротонном растворителе, таком как тетрагидрофуран (ТГФ), с получением соединений формулы 27.4, как продемонстрировано на стадии b.
Схема 27
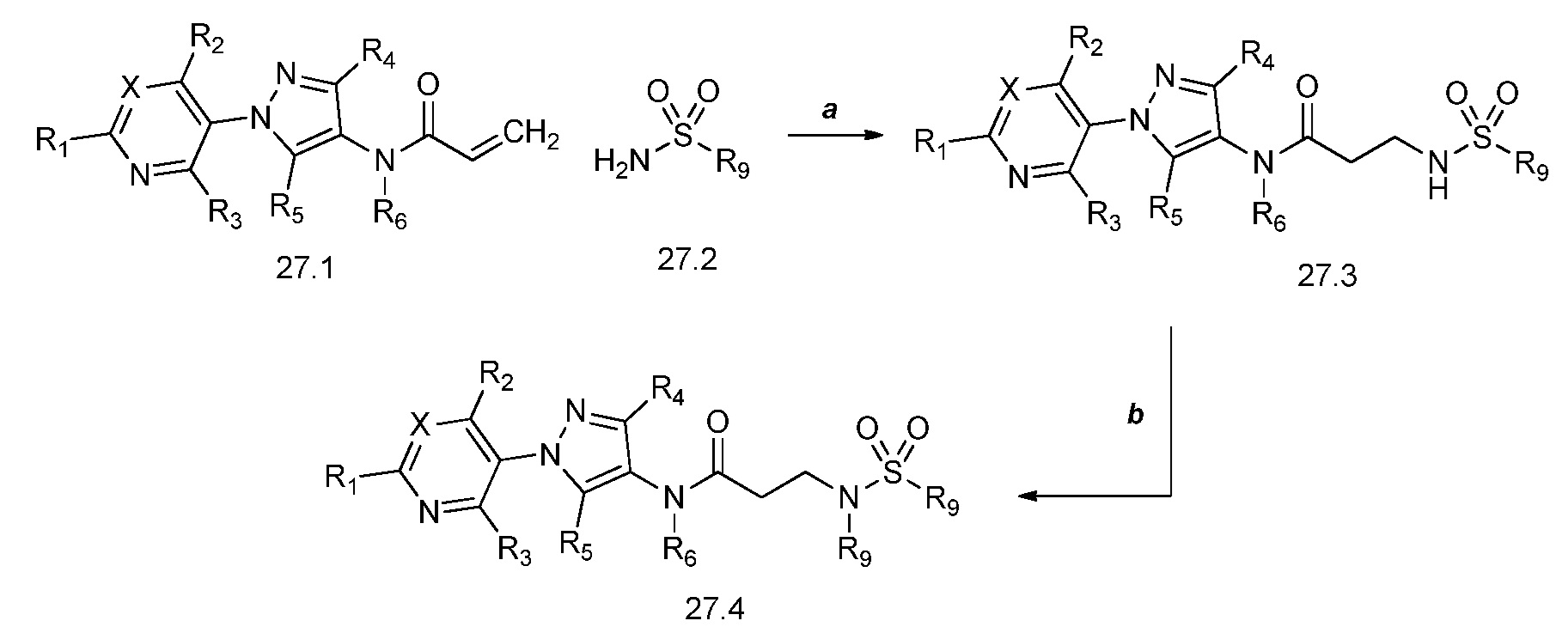
Когда соединения формулы 28.1, где X, R1, R2, R3, R4, R5, R6, R8 и галоген имеют значения, определенные выше, обрабатывали аминами формулы 28.2, где R9 имеет значения, определенные выше, при повышенной температуре в полярном протонном растворителе, таком как метанол, могут быть получены соединения формулы 28.3, как продемонстрировано на стадии a схемы 28. Соединения формулы 28.3 могут быть обработаны сульфонилхлоридом, таким как метансульфонилхлорид, в присутствии основания, такого как диизопропилэтиламин, и полярного апротонного растворителя, такого как дихлорметан (DCM), с получением продуктов формулы 28.4, как показано на стадии b. Как продемонстрировано на стадии c, когда соединения формулы 28.3 обрабатывали алкилгалогенидом, таким как 3-бром-1,1,1-трифторпропан, при повышенной температуре и в присутствии основания, такого как карбонат калия, и полярного апротонного растворителя, такого как диметилформамид (ДМФ), могут быть получены соединения формулы 28.5. Альтернативно, соединения формулы 28.3 могут быть получены посредством осуществления двухстадийного способа, как описано на стадии d и e схемы 28. Соединения формулы 28.6 могут быть преобразованы в соединения формулы 28.8, когда соединения формулы 28.7 обрабатывают в присутствии конденсирующего агента, такого как гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDC·HCl), и основания, такого как N,N-диметиламинопиридин (DMAP), в полярном апротонном растворителе, таком как дихлорэтан (DCE), как показано на стадии d. Boc-группа может быть удалена в условиях, которые хорошо известны в данной области техники, таких как в среде кислоты, такой как трифторуксусная кислота (ТФУ), в полярном апротонном растворителе, подобном дихлорметану, с получением соединения формулы 28.3, как представлено на стадии e.
Схема 28
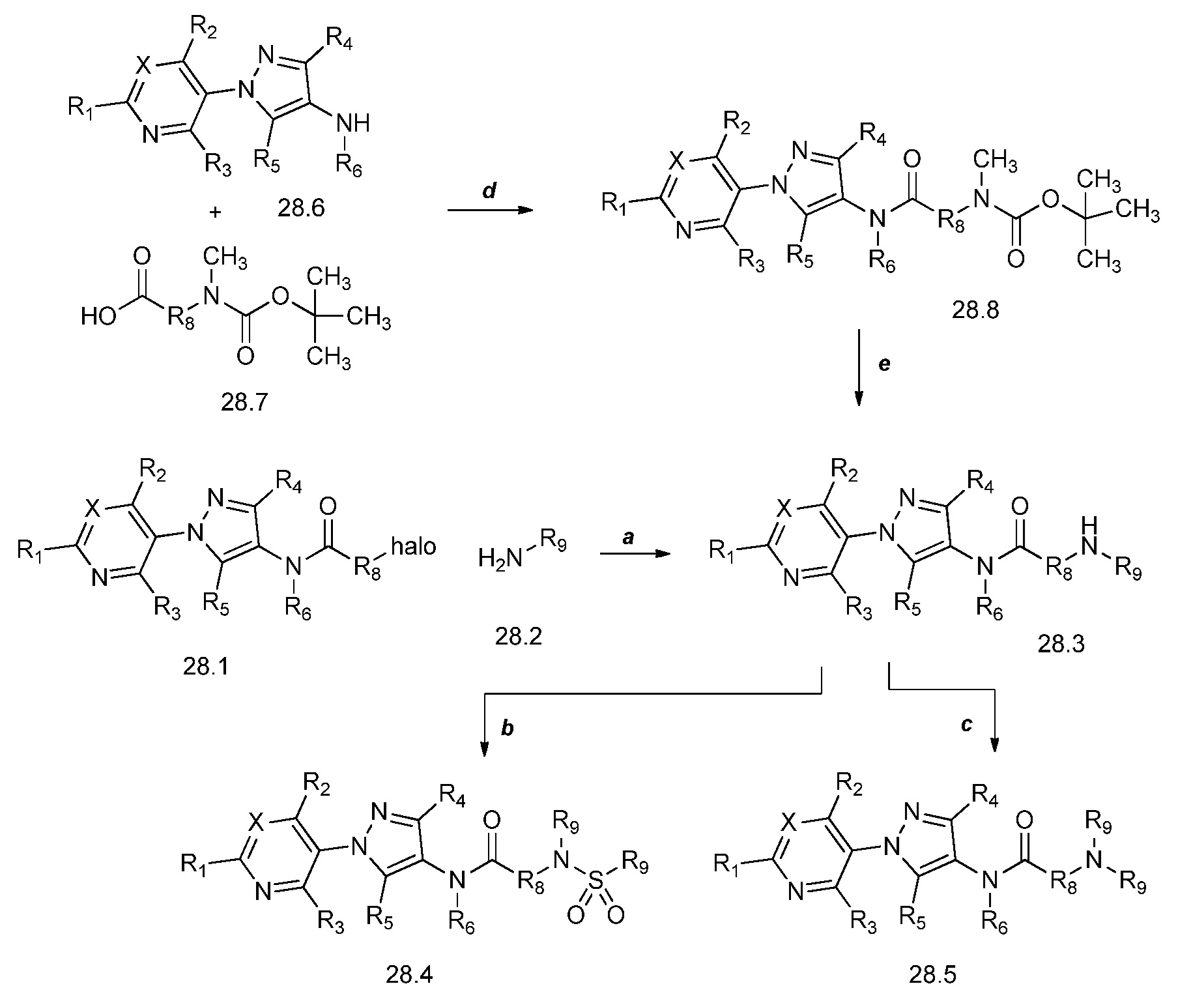
На стадии a схемы 29 соединения формулы 29.1, где X, R1, R2, R3, R4, R5, R6 и R8 имеют значения, определенные выше, могут быть подвергнуты взаимодействию либо с циклическим, либо с ациклическим еноном, таким как бут-3-ен-2-он, в условиях, описанных в работе Chakraborti (Org. Lett. 2006, 8, 2433-2436), с получением соединений формулы 29.2, где R9 имеет значения, определенные выше. Указанные продукты затем могут быть подвергнуты воздействию фторирующего реагента, такого как Deoxo-Fluor®, и инициатора, такого как этанол, в полярном апротонном растворителе, таком как дихлорметан (DCM), с получением соединений формулы 29.3, как описано на стадии b.
Схема 29
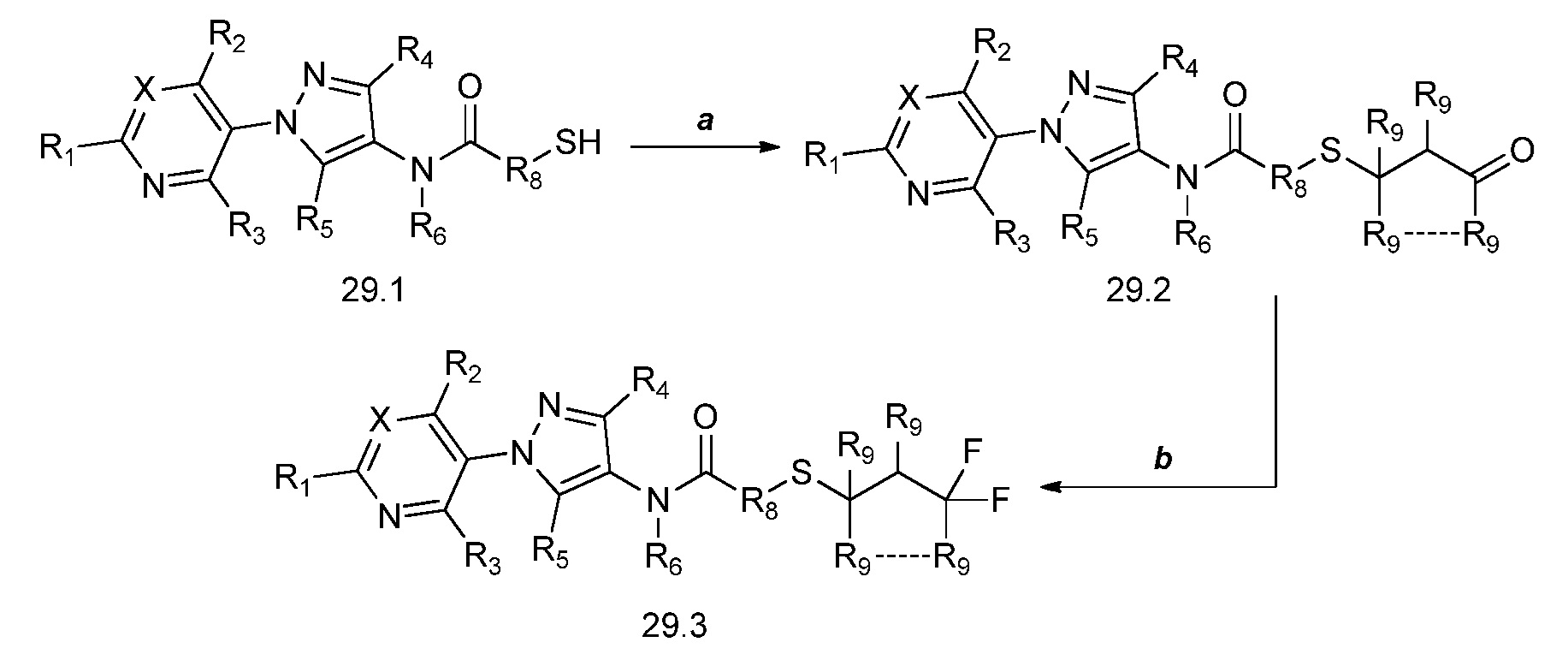
На стадии a схемы 30 показан гидролиз соединений формулы 30.1, где X, R1, R2, R3, R4, R5, R6, R8 и R9 имеют значения, определенные выше, посредством обработки кислотой, такой как водный раствор соляной кислоты, в растворителе, таком как ТГФ, с получением промежуточного альдегида формулы 30.2. Соединения формулы 30.2 могут быть сразу подвергнуты взаимодействию с фторирующим реагентом, таким как Deoxo-Fluor®, в присутствии инициатора, такого как этанол, и растворителя, такого как тетрагидрофуран (ТГФ), с получением продуктов формулы 30.3.
Схема 30
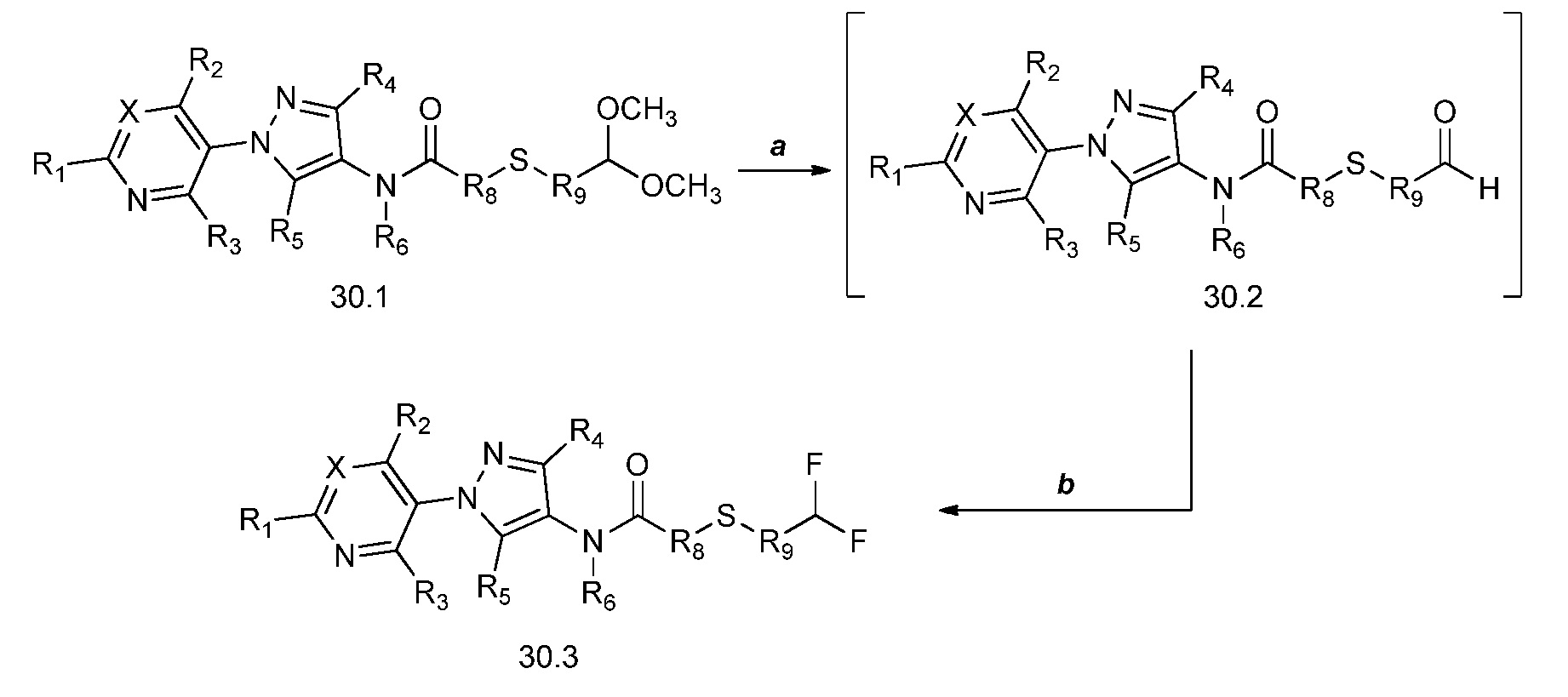
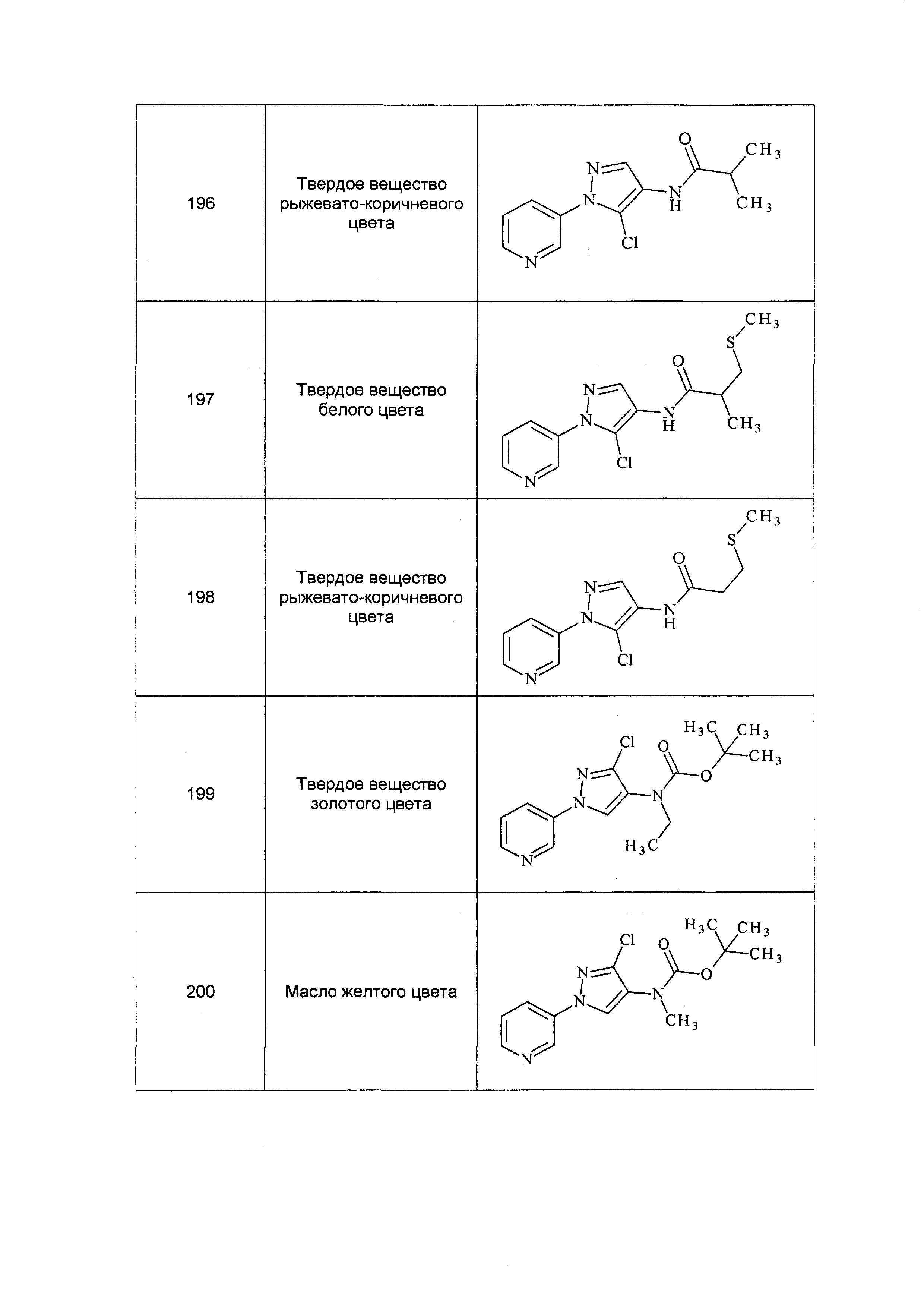
На схеме 31 соединения формулы 31.1, где R9 имеет значения, определенные выше, преобразуют в соединения формулы 31.2 посредством способа, описанного в работе Dmowski (J. Fluor. Chem., 2007, 128, 997-1006), как показано на стадии a. Соединения формулы 31.2 затем могут быть подвергнуты условиям, описанным в работе на стадии b, в соответствии с которыми взаимодействие с тиоатной солью в растворителе, таком как диметилформамид (ДМФ), дает соединения формулы 31.3, где W представляет собой арил или алкил. Как показано на стадии c, последовательное удаление защиты/алкилирование в одном сосуде может быть достигнуто посредством обработки соединений формулы 31.3 одним эквивалентом основания, такого как метоксид натрия (NaOMe), в полярном апротонном растворителе, таком как тетрагидрофуран (ТГФ). Соединение формулы 31.4, где X, R1, R2, R3, R4, R5, R6, R8 и галоген имеют значения, определенные выше, может быть затем добавлено к реакционной смеси с получением соединений формулы 31.5.
Схема 31
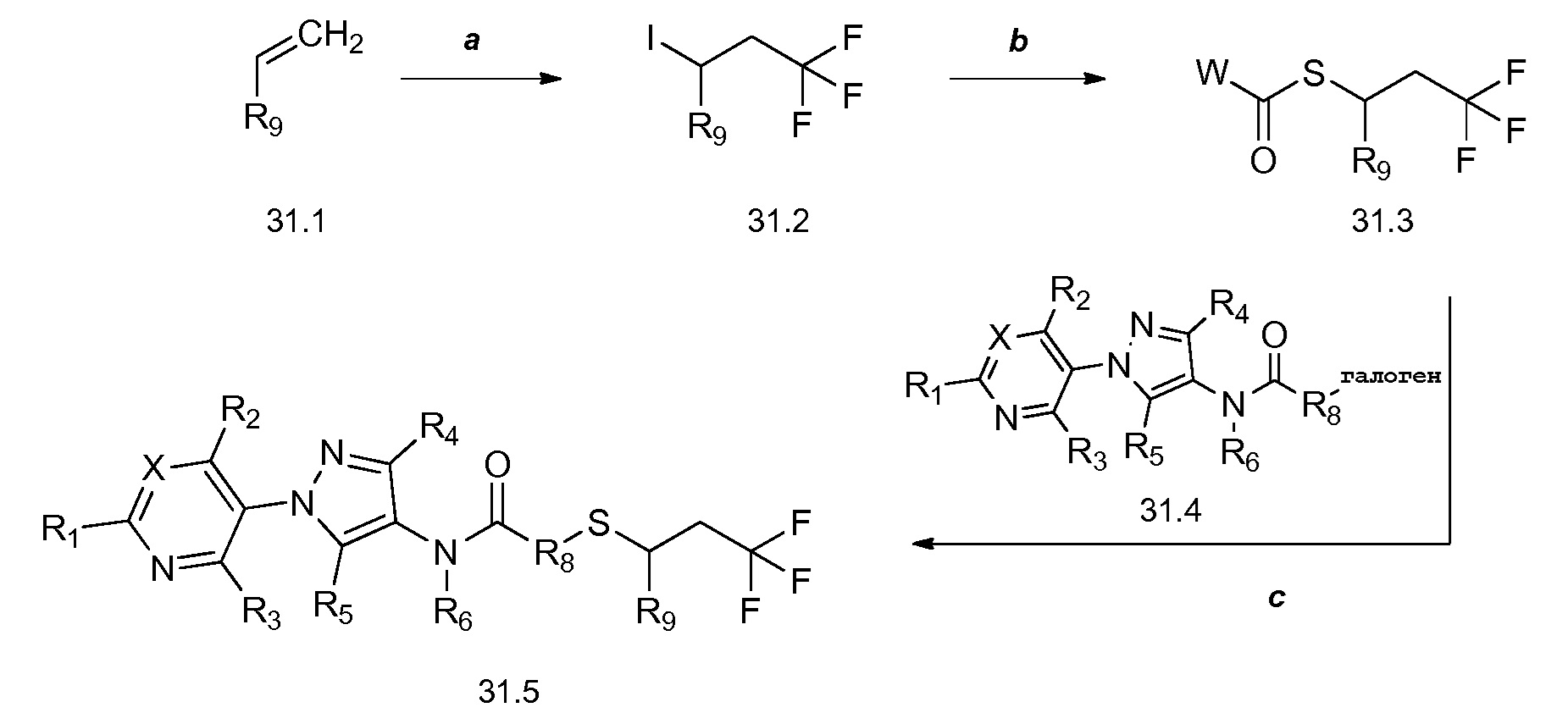
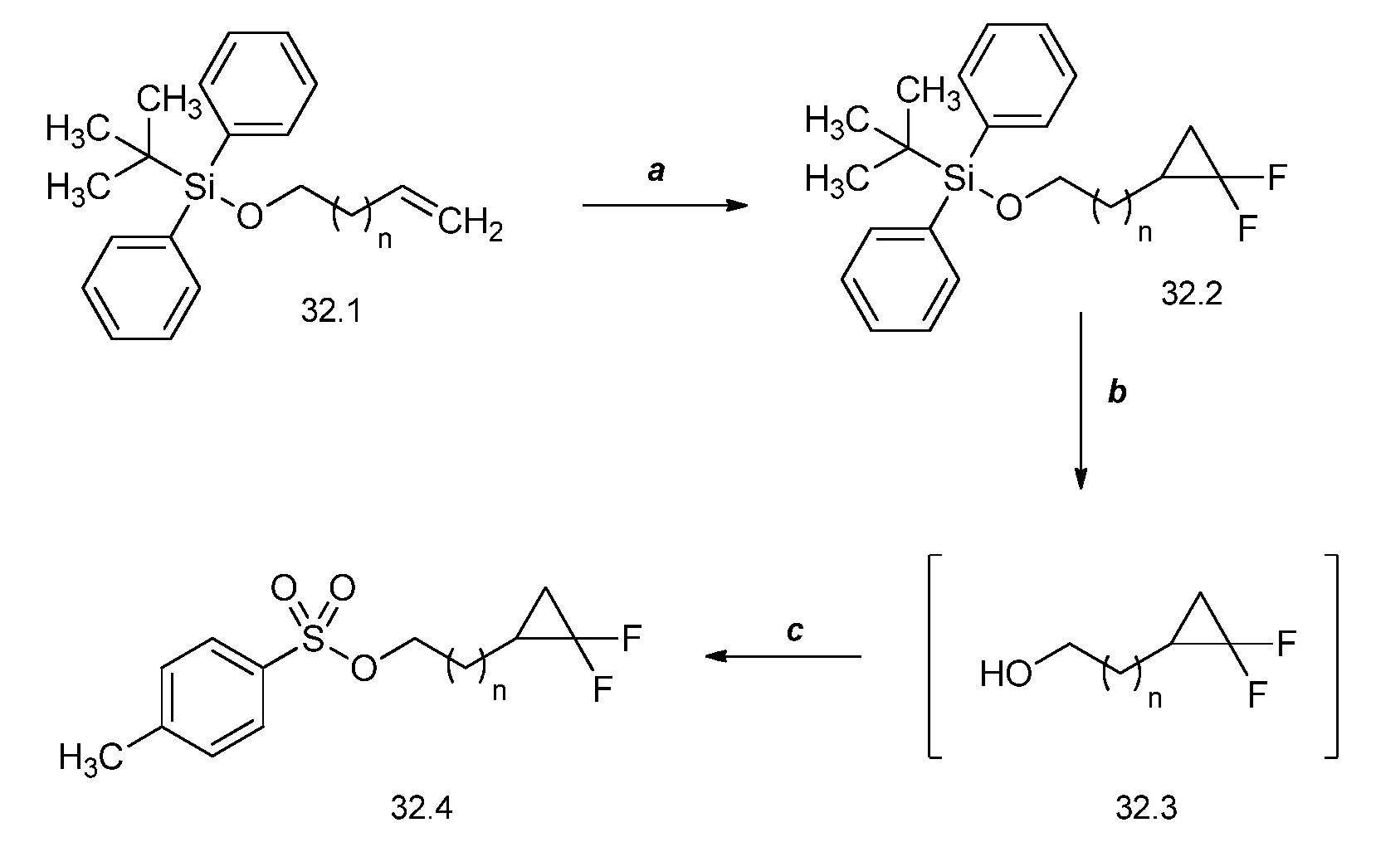
На схеме 32 неразбавленная смесь олефинов формулы 32.1, где n обозначает целое число, выбранное из 0, 1, 2, 3, 4 или 5, и триметилсилил 2,2-дифтор-2-(фторсульфонил)ацетата может быть нагрета в присутствии фторида натрия с получением замещенного дифторциклопропана формулы 32.2, как указано на стадии a. На стадии b данный продукт обрабатывают тетрабутиламмония фторидом (TBAF) в тетрагидрофуране (ТГФ) с получением промежуточного гомоаллилового спирта формулы 32.3. Этот спирт не выделяют, но сразу обрабатывают п-толуолсульфонилхлоридом в присутствии пиридина и дихлорметана с получением тозилата формулы 32.4, как показано на стадии c.
Схема 32
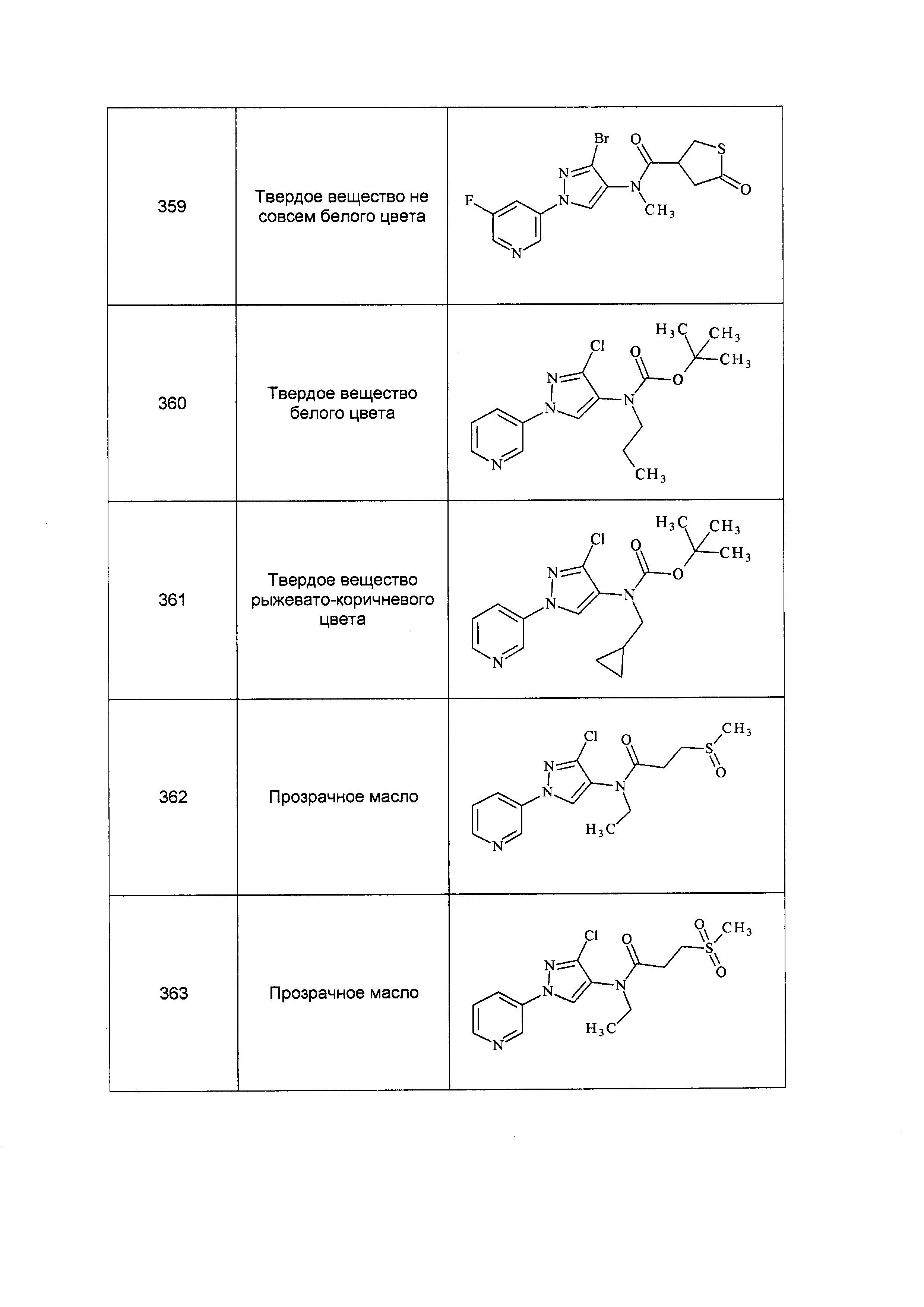
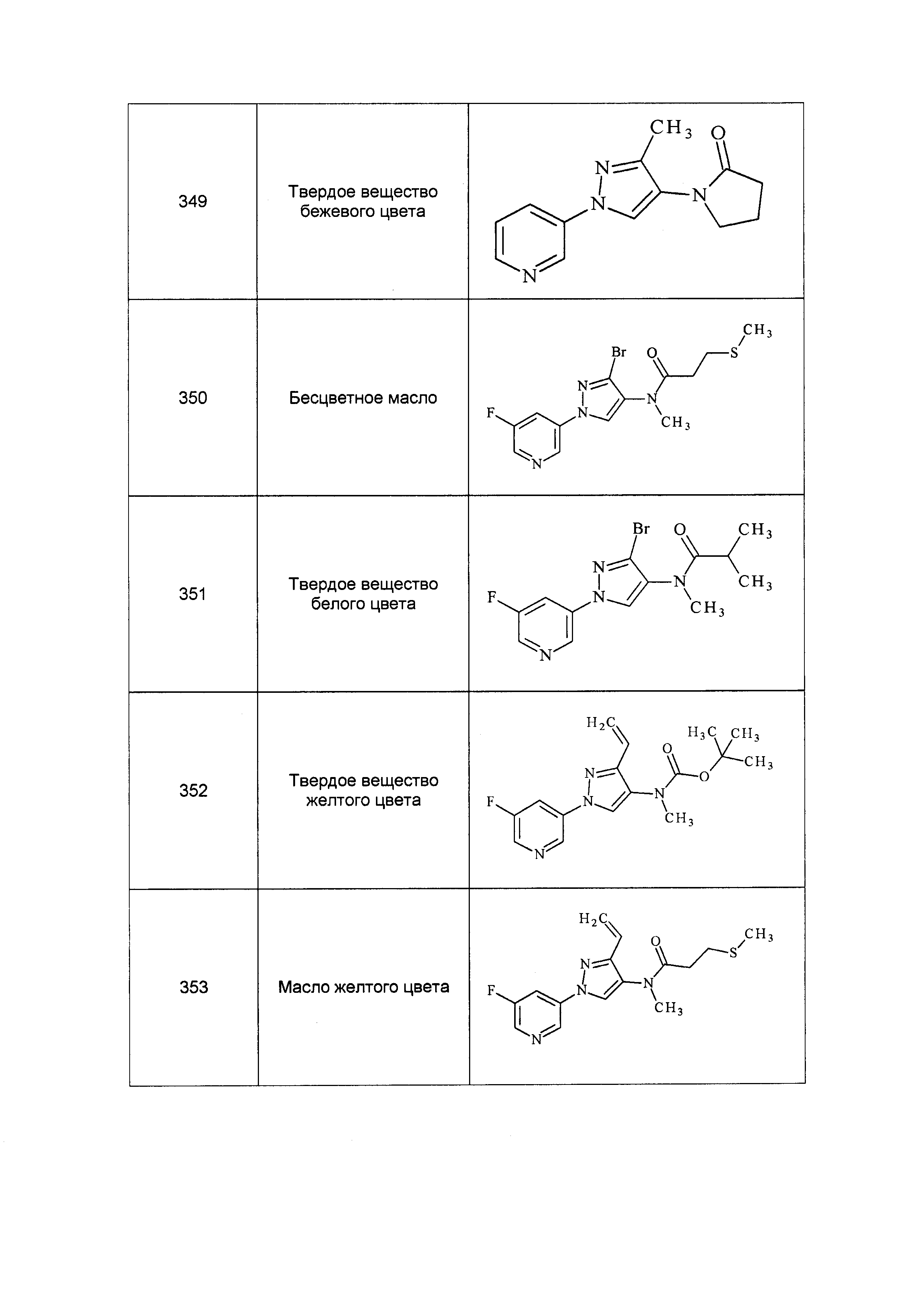
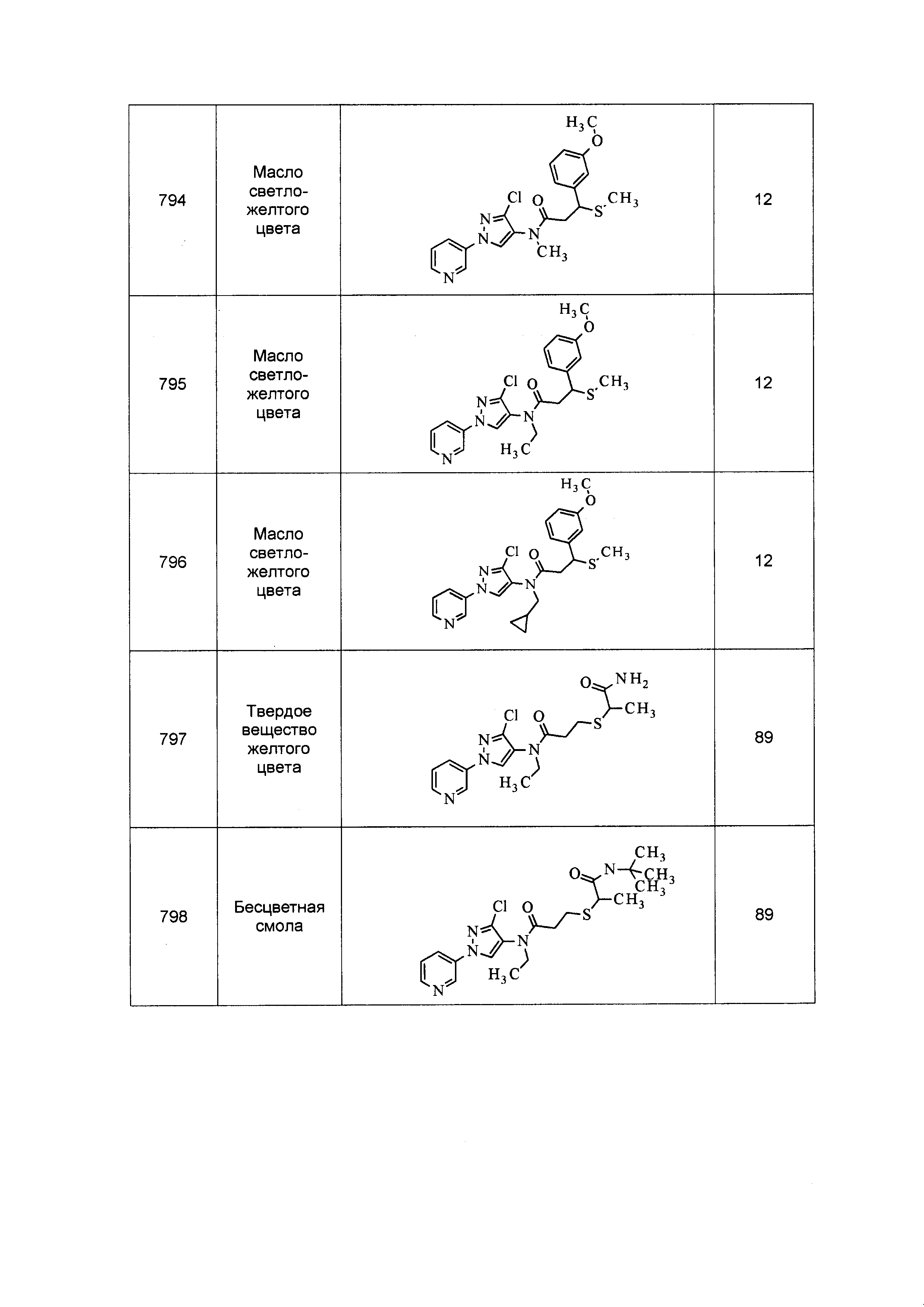
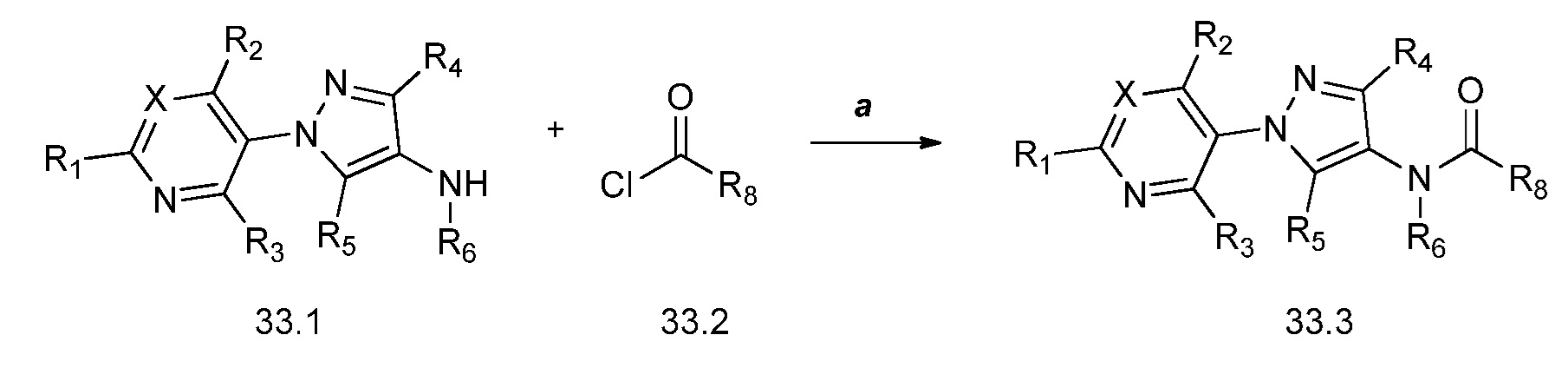
Соединения формулы 33.1, где X, R1, R2, R3, R4, R5 и R6 имеют значения, определенные выше, где X предпочтительно представляет собой углерод, R1, R2, R3 и R5 представляют собой водород и R4 представляет собой хлор, могут быть конденсированы с хлорангидридом кислоты формулы 33.2, где R8 имеет значения, определенные выше, в присутствии основания, такого как пиридин, диизопропилэтиламин или N,N-диметиламинопиридин (DMAP), и растворителя, такого как 1,2-дихлорэтан или метиленхлорид, с получением продуктов формулы 33.3, как показано на стадии a схемы 33.
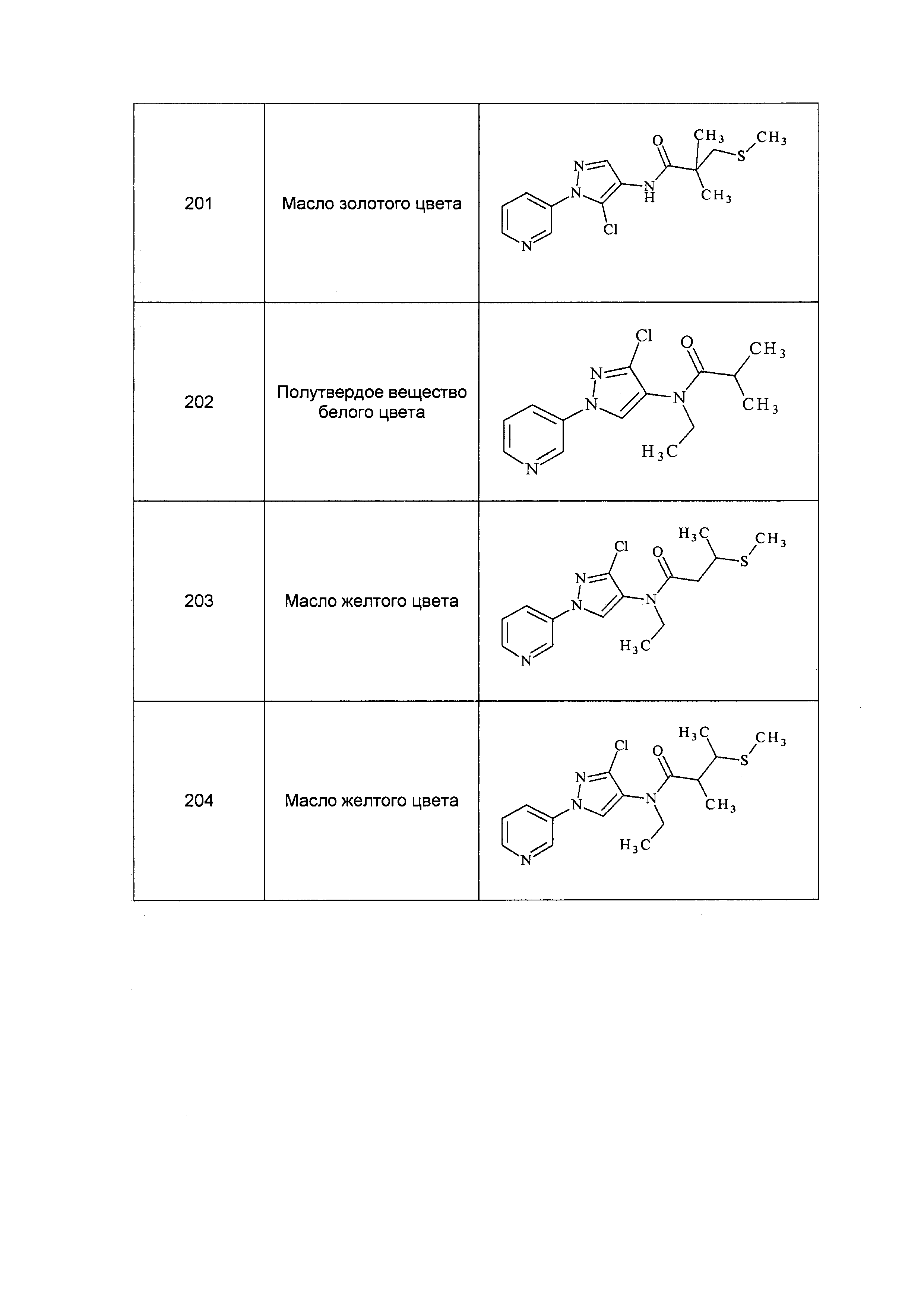
На стадии a схемы 33 амины формулы 33.1 конденсируют с хлорангидридами кислот формулы 33.2 в присутствии оснований или комбинации оснований, таких как пиридин, N,N-диметиламинопиридин или диизопропилэтиламин. Реакцию осуществляют в галогенированном растворителе, таком как 1,2-дихлорэтан или метиленхлорид. Реакцию проводят при температуре от 0°C до 80°C и предпочтительно при температуре примерно от 0°C до 23°C. Может быть использовано молярное соотношение амина формулы 33.1 и хлорангидрида кислоты формулы 33.2, составляющее приблизительно 1:1, однако также могут быть использованы молярные соотношения от примерно 5:1 до примерно 1:5. Реакцию проводят при атмосферном давлении, однако, возможным может быть более высокое или более низкое давление.
Схема 33
На стадии a схемы 34 соединения формулы 34.1, где R1, R2, R3, R4, R5 и R6 и X имеют значения, определенные выше, могут быть обработаны кислотой формулы 34.2, где R8 имеет значения, определенные выше, в присутствии N,N'-дициклогексилкарбодиимида (DCC) и основания, такого как N,N-диметиламинопиридин (DMAP), в растворителе, таком как диэтиловый эфир (Et2O), с получением соединений формулы 34.3.
Схема 34
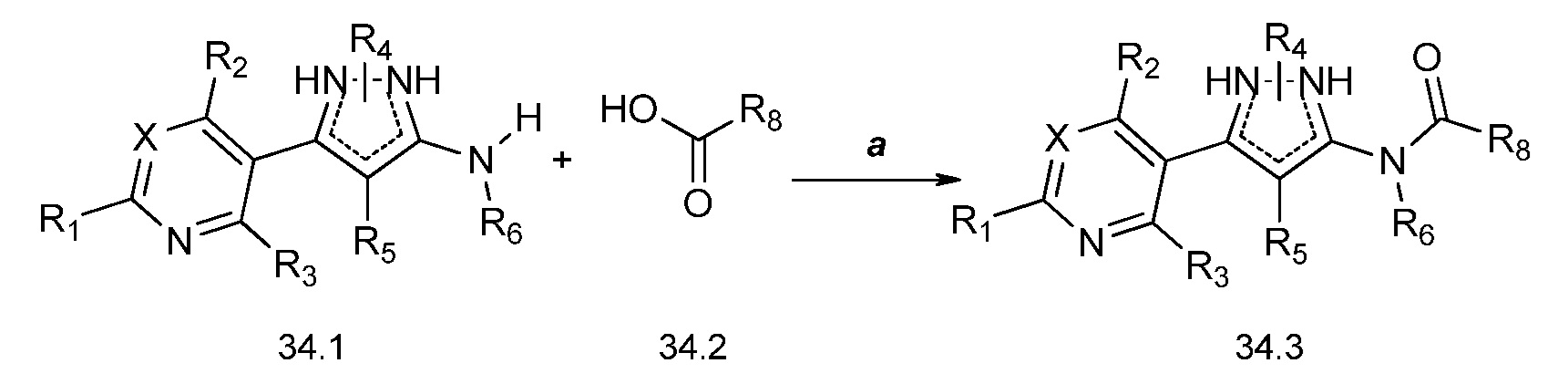
На стадии a схемы 35 аминопиразолы формулы 35.1, где X, R1, R2, R3, R4, R5 и R6 имеют значения, определенные выше, могут быть обработаны фосгеном и N,N-диметиламинопиридином (DMAP) при примерно 80ºC в полярном апротонном растворителе, таком как дихлорэтан (DCE). Далее обработка амином, как показано на стадии b, или спиртом, как показано на стадии c, или тиолом, как показано на стадии d, дает мочевину формулы 35.2, карбамат формулы 35.3 или карбамотиоат формулы 35.4, где R9 имеет значения, определенные выше, соответственно.
Схема 35
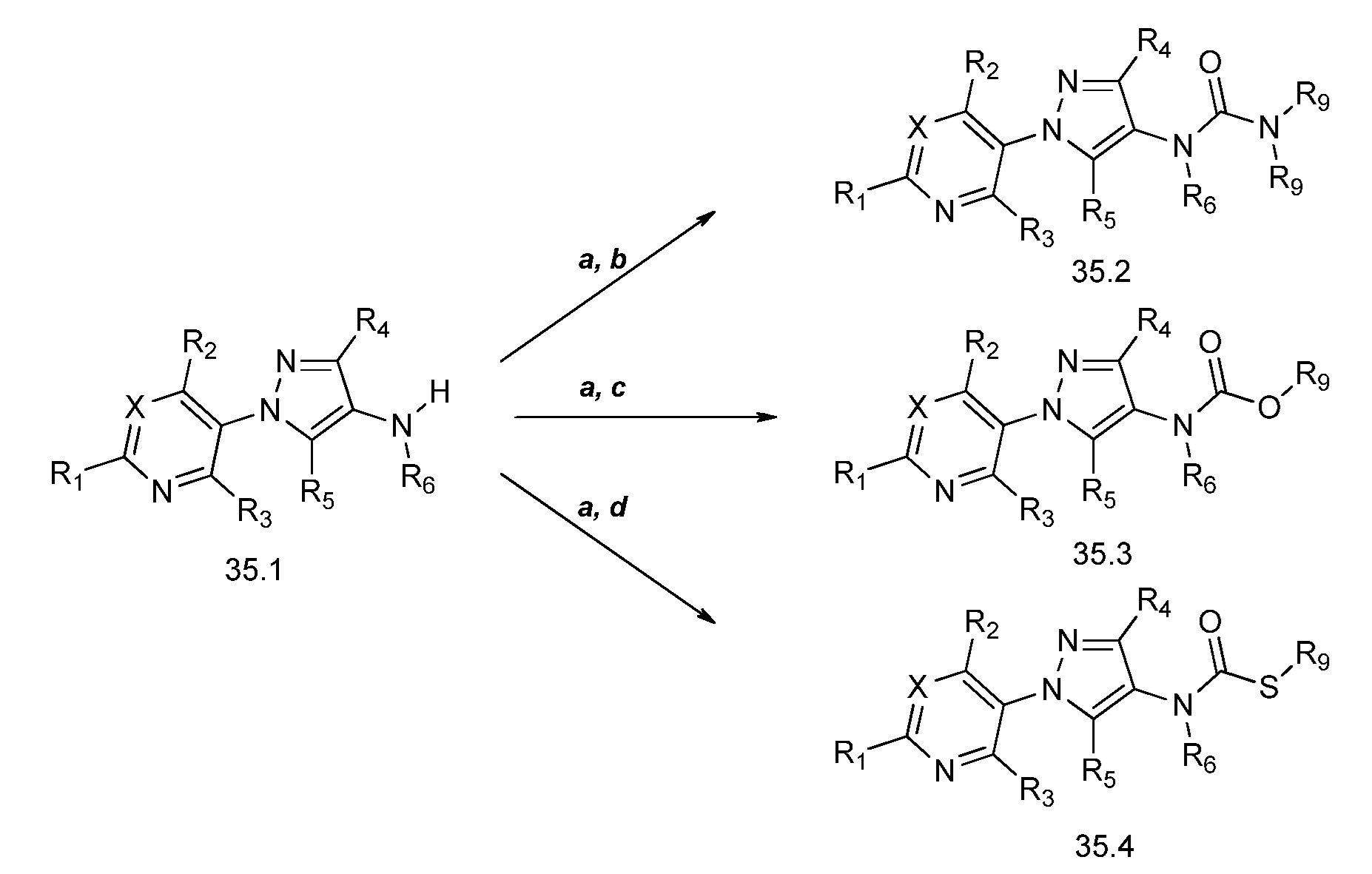
На стадии a схемы 36 соединения формулы 36.1, где X, R1, R2 и R3 имеют значения, определенные выше, могут быть обработаны основанием, таким как триэтиламин, дисульфид углерода и сульфонилхлорид, такой как 4-метилбензол-1-сульфонилхлорид, в полярном апротонном растворителе, таком как тетрагидрофуран (ТГФ), с получением соединений формулы 36.2. На стадии b схемы 36 оксазолидин-2-он может быть обработан эквимолярным количеством основания, такого как гидрид натрия, затем соединениями формулы 36.2 в полярном апротонном растворителе, таком как диметилформамид (ДМФ), с получением соединений формулы 36.3. Дополнительно, продукт со стадии b (предварительно обработанный) может быть обработан электрофилом, таким как йодметан, с получением соединений формулы 36.4, как продемонстрировано на стадии c схемы 36.
Схема 36
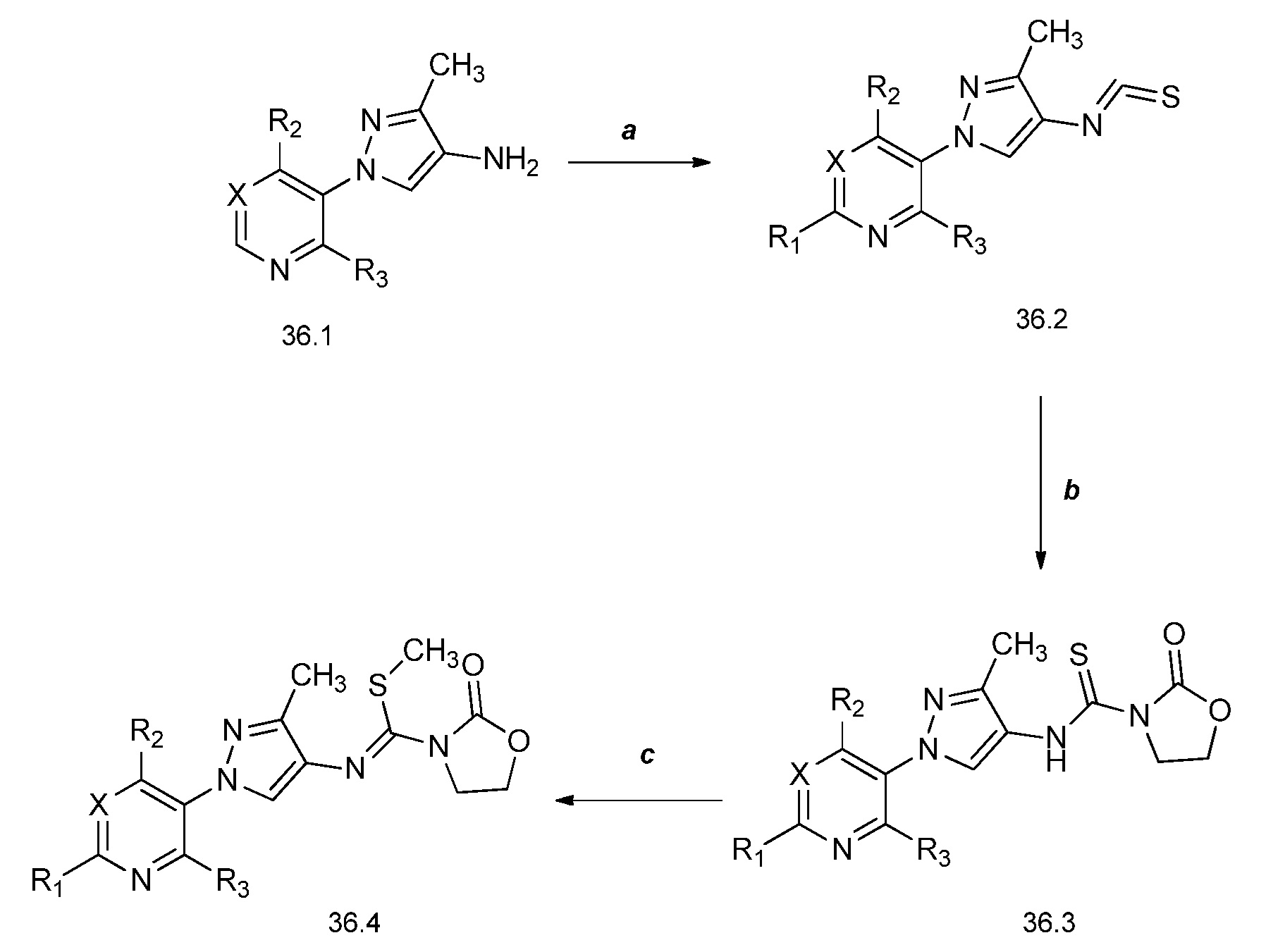
На стадии a схемы 37 мочевины формулы 37.1, где R1, R2, R3, R4, R5, R6, R8 и X имеют значения, определенные выше, могут быть подвергнуты взаимодействию с основанием, таким как литий бис(триметилсилил)амид, в полярном апротонном растворителе, таком как ТГФ, затем с ацилхлоридом, таким как пивалоилхлорид, с получением ацилированных мочевин формулы 37.2, где R1, R2, R3, R4, R5, R6, R8 и X имеют значения, определенные выше. На стадии b схемы 37 мочевины формулы 37.1, где R1, R2, R3, R4, R5, R6, R8 и X имеют значения, определенные выше, могут быть подвергнуты взаимодействию с основанием, таким как литий бис(триметилсилил)амид, в полярном апротонном растворителе, таком как ТГФ, затем с алкилгалогенидом, таким как (хлорметил)(метил)сульфан, с получением алкилированных мочевин формулы 37.2, где R1, R2, R3, R4, R5, R6, R8 и X имеют значения, определенные выше. На стадии c схемы 37 мочевины формулы 37.1, где R1, R2, R3, R4, R5, R6, R8 и X имеют значения, определенные выше, могут быть подвергнуты взаимодействию с основанием, таким как литий бис(триметилсилил)амид, в полярном апротонном растворителе, таком как ТГФ, затем с сульфонилхлоридом, таким как метансульфонилхлорид, с получением сульфонилированных мочевин формулы 37.3, где R1, R2, R3, R4, R5, R6, R8 и X имеют значения, определенные выше.
Схема 37
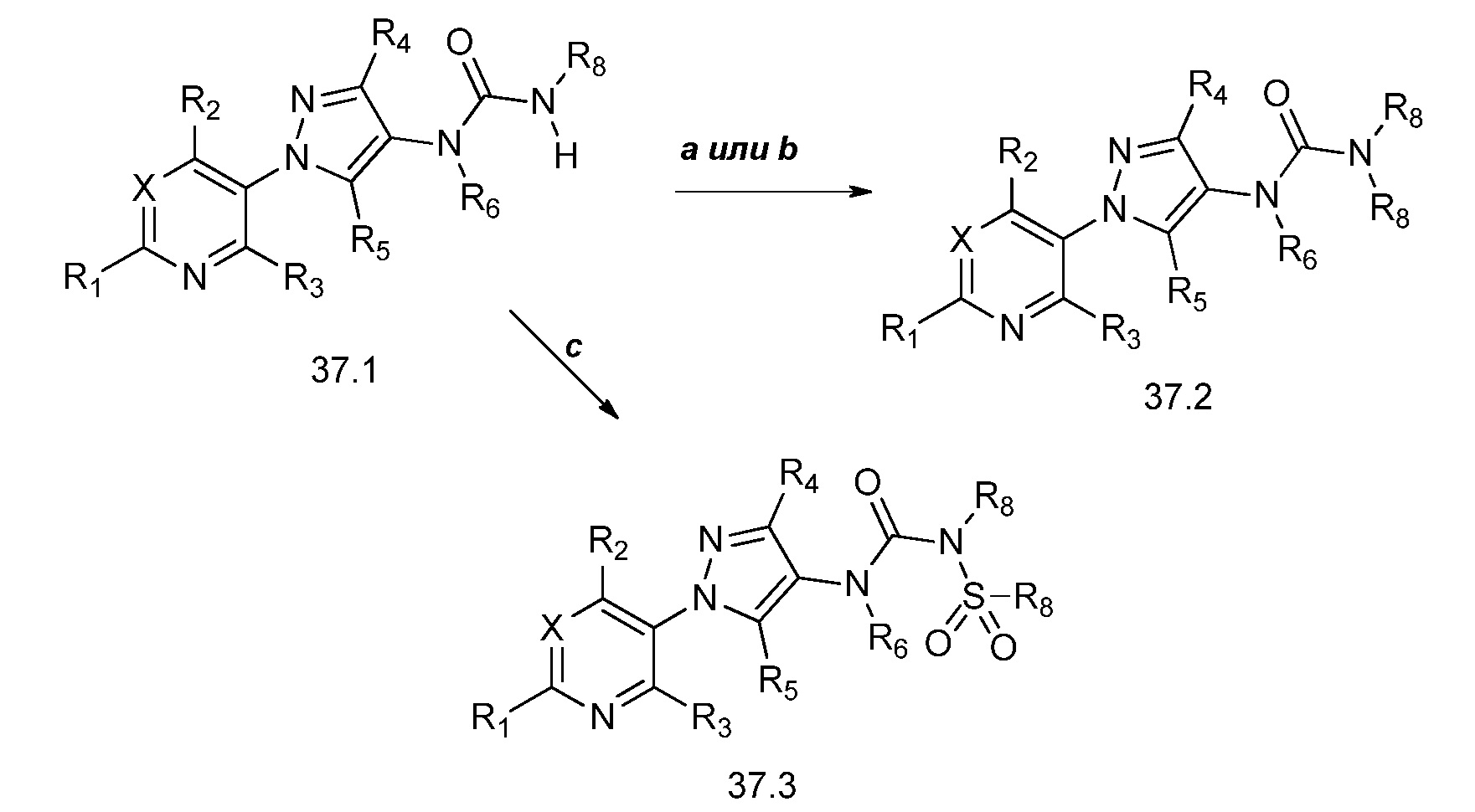
На стадии a схемы 38 амины формулы 38.1, где R6 представляет собой H или Me, могут быть подвергнуты взаимодействию с электрофилом формулы 38.2, где R8 и R9 имеют значения, определенные выше, таким как гидробромид нафталин-2-илметил 3-(метилтио)пропанимидoтиоат, в полярном протонном растворителе, таком как этанол, затем подвергнуты воздействию основанием, таким как MP-карбонат, в полярном протонном растворителе, таком как метанол, с получением амидинов формулы 38.3, где R6 представляет собой H или Me, и R8 и R9 имеют значения, определенные выше.
Схема 38
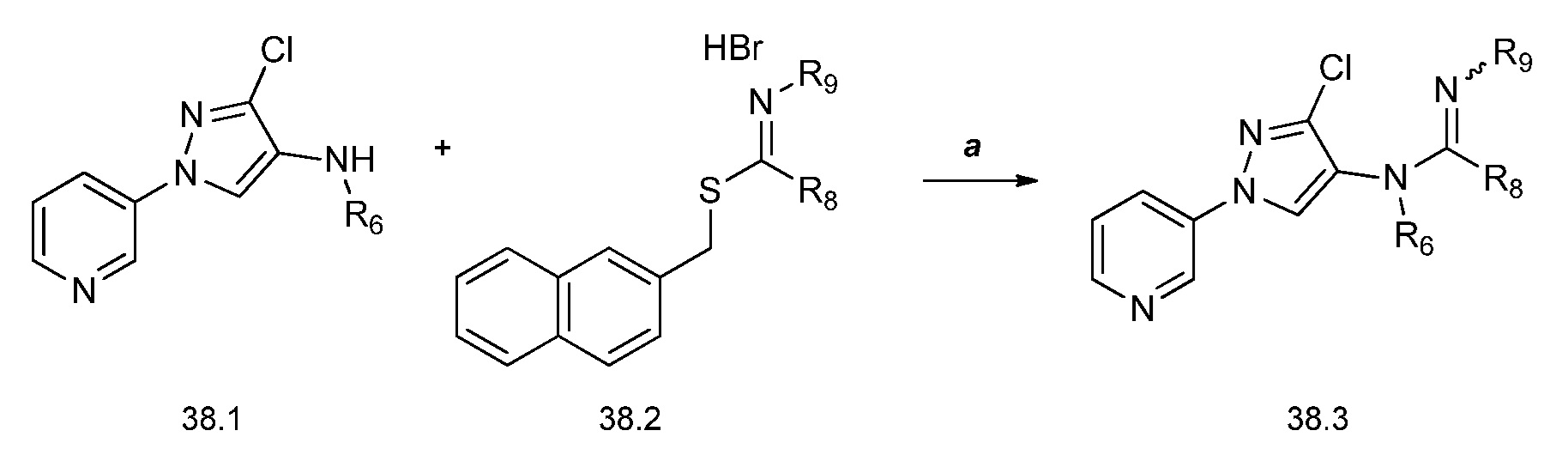
На стадии a схемы 39 соединения формулы 39.1, где X, R1, R2, R3, R4, R5, R6 и R8 имеют значения, определенные выше, могут быть обработаны спиртами формулы 39.2, где R9 имеет значения, определенные выше, в присутствии основания, такого как гидрид натрия или трет-бутоксид калия, в полярном апротонном растворителе, таком как ТГФ, при соответствующих температурах, с получением соответствующих эфиров формулы 39.3. Альтернативно, на стадии b схемы 39 тиоэфиры формулы 39.5 могут быть получены путем обработки соединений формулы 39.1, где X, R1, R2, R3, R4, R5, R6 и R8 имеют значения, определенные выше, тиолами формулы 39.4, где R9 имеет значения, определенные выше, в присутствии основания, такого как гидрид натрия, в апротонном растворителе, таком как ТГФ.
Схема 39
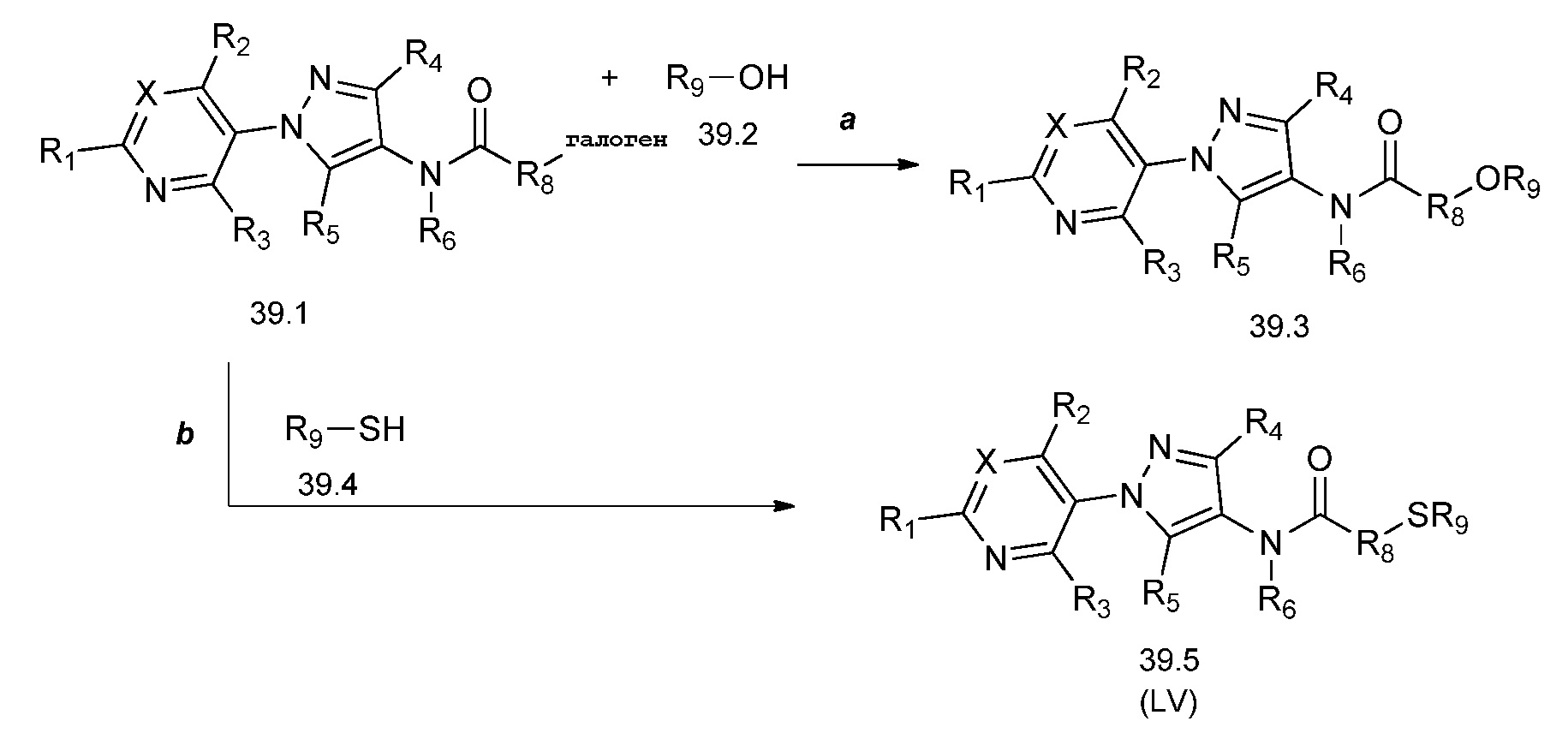
На схеме 40 соединения формулы 40.1, где X, R1, R2, R3, R4, R5, R6 и R8 имеют значения, определенные выше, могут быть обработаны в соответствии с условиями, описанными в работе Estrada et al. (Synlett, 2011, 2387-2891), с получением соответствующих сульфонамидов формулы 40.2, где R9 имеет значения, определенные выше, при том условии, что, по меньшей мере, один из R9 не представляет собой H.
Схема 40
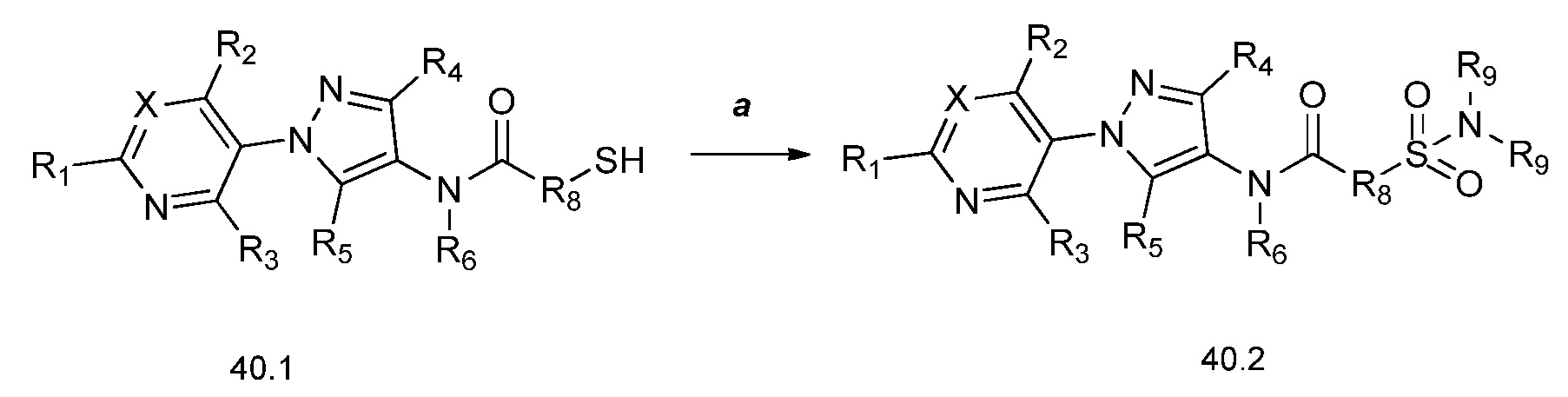
На стадии a схемы 41 соединения формулы 41.1, где X, R1, R2, R3, R4, R5 и R6 имеют значения, определенные выше, могут быть конденсированы с кислотами формулы 41.2, где R8 и R9 имеют значения, определенные выше, в присутствии конденсирующего агента, такого как EDC·HCl, и основания, такого как DMAP, в апротонном растворителе, таком как дихлорметан, с получением фосфонатов формулы 41.3. На стадии b схемы 41 фосфонаты формулы 41.3, где X, R1, R2, R3, R4, R5, R6, R8 и R9 имеют значения, определенные выше, могут быть обработаны карбонильными соединениями формулы 41.4, где R9 имеет значения, определенные выше, в присутствии основания, такого как гидрид натрия, в апротонном растворителе, таком как ТГФ, с получением соответствующих алкенов формулы 41.5.
Схема 41
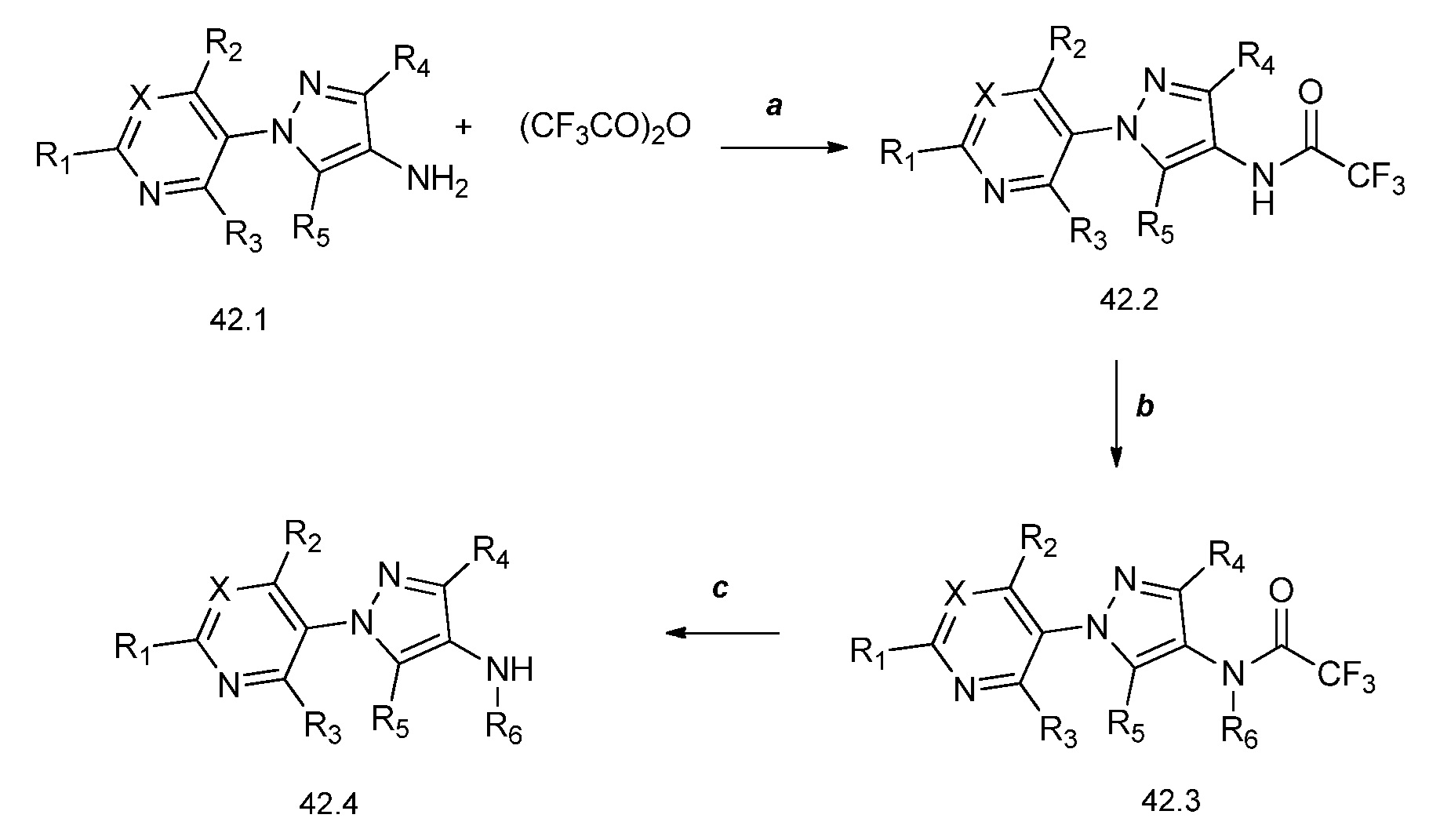
На стадии a схемы 42 соединения формулы 42.1, где X, R1, R2, R3, R4 и R5 имеют значения, определенные выше, могут быть обработаны трифторуксусным ангидридом в присутствии основания, такого как триэтиламин, в апротонном растворителе, таком как дихлорметан, с получением амидов формулы 42.2, где X, R1, R2, R3, R4 и R5, имеют значения, определенные выше. На стадии b схемы 42 амиды формулы 42.2, где X, R1, R2, R3, R4 и R5 имеют значения, определенные выше, могут быть обработаны алкилирующим агентом, таким как йодметан, в присутствии основания, такого как трет-бутоксид калия, в растворителе, таком как ТГФ, с получением соединений формулы 42.3. На стадии c схемы 42 амиды формулы 42.3, где X, R1, R2, R3, R4 и R5, имеют значения, определенные выше, могут быть обработаны в среде основания, такого как карбонат калия, и метанола с получением соответствующих аминов формулы 42.4.
Схема 42
ПРИМЕРЫ
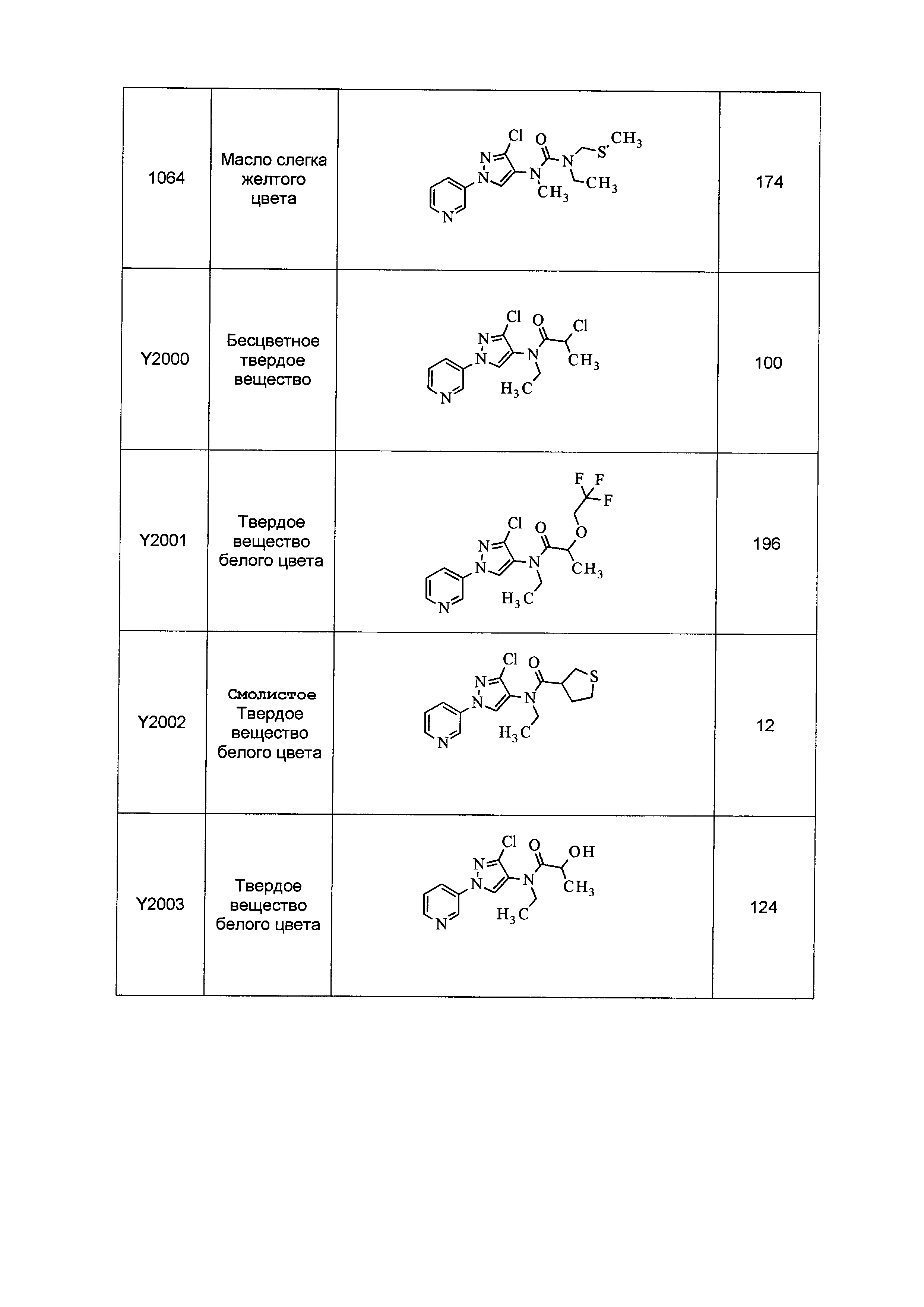
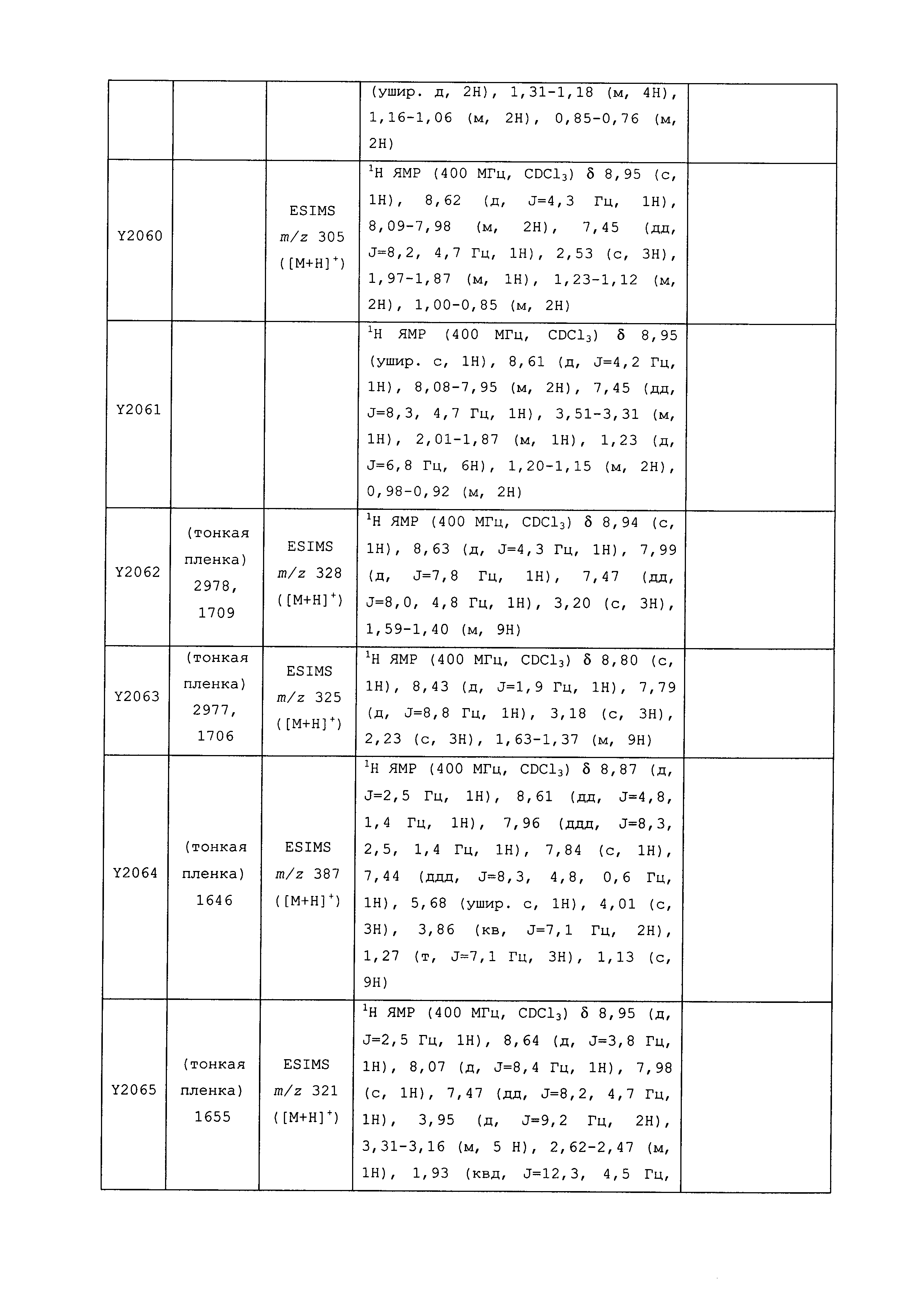
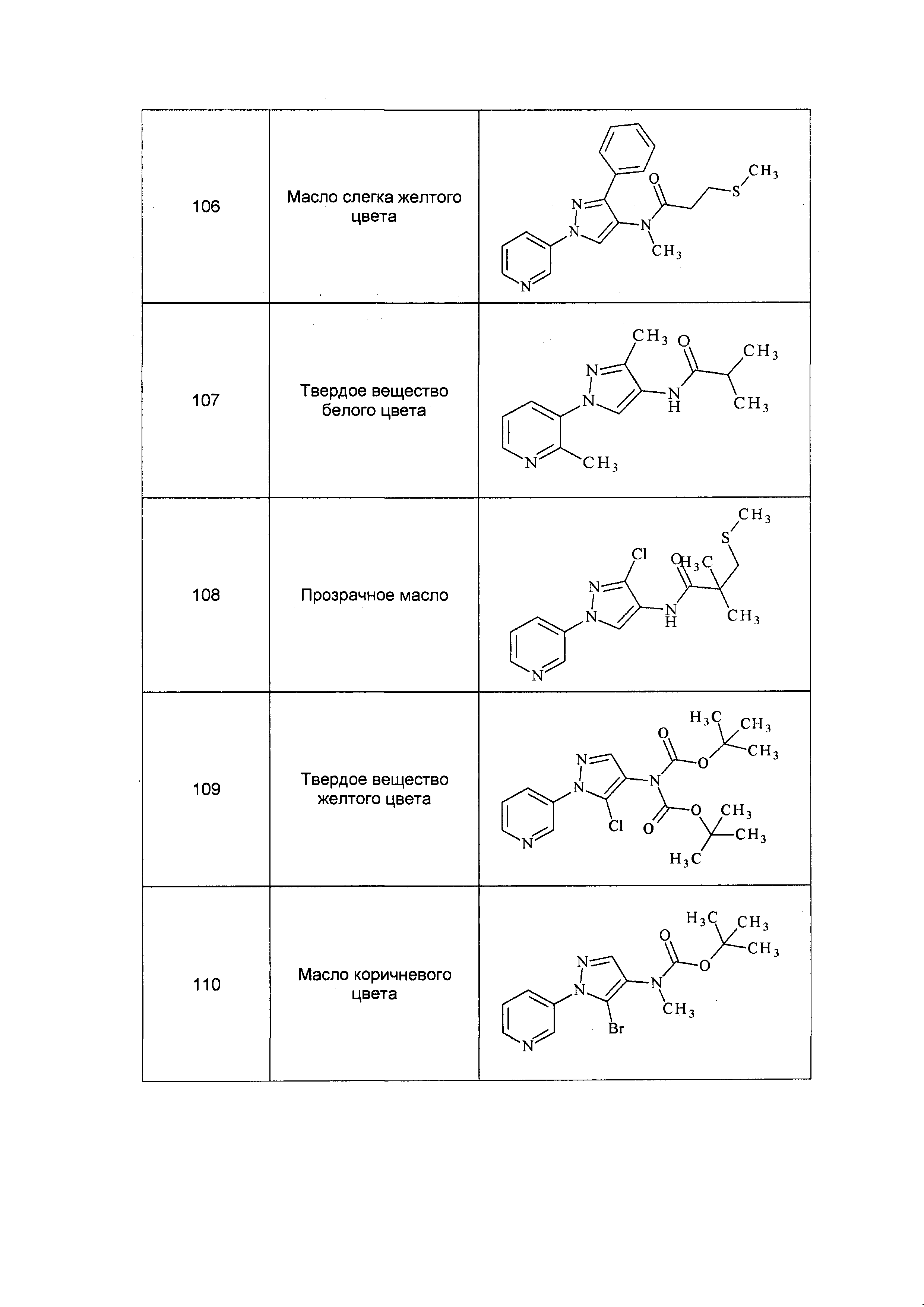
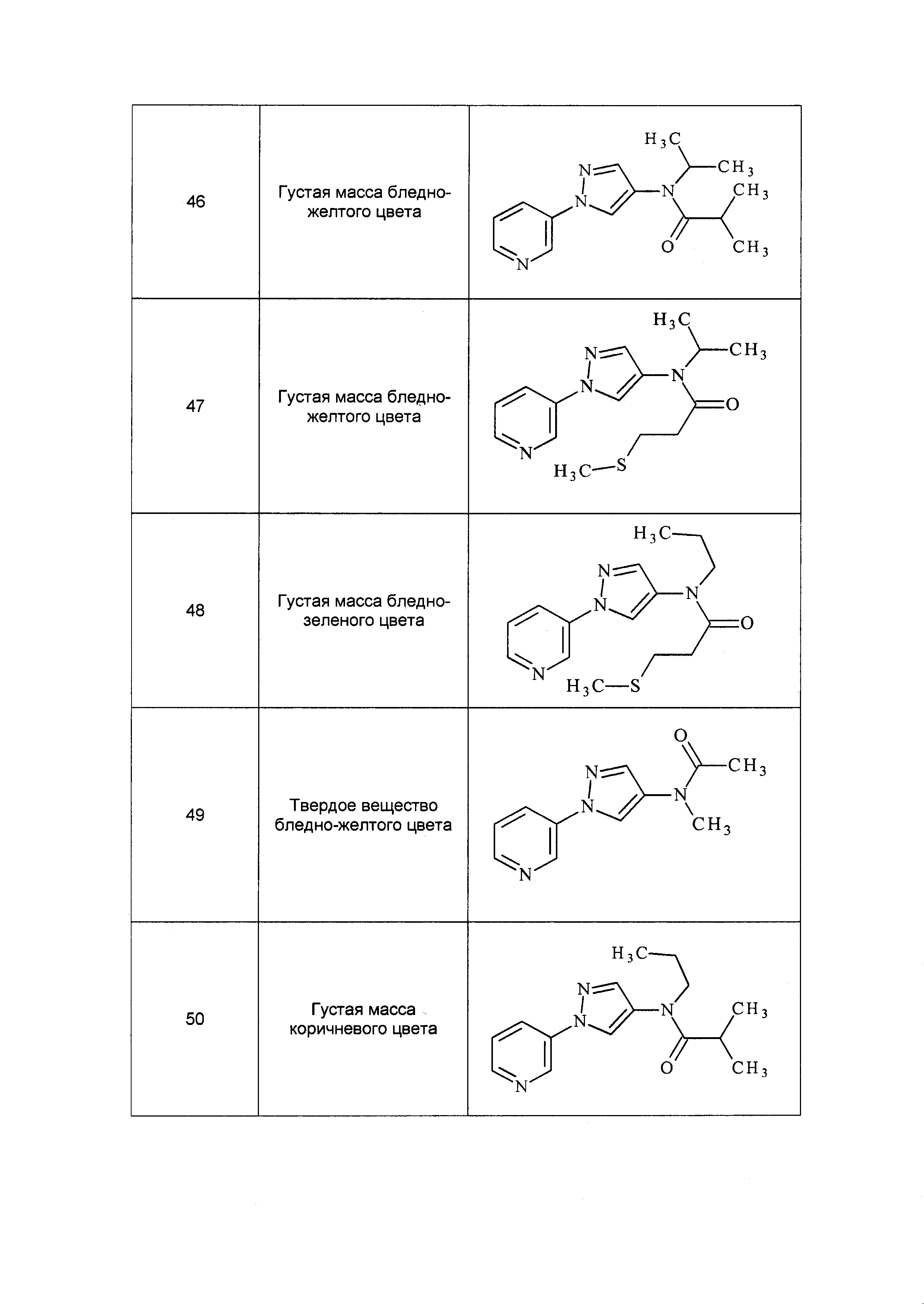
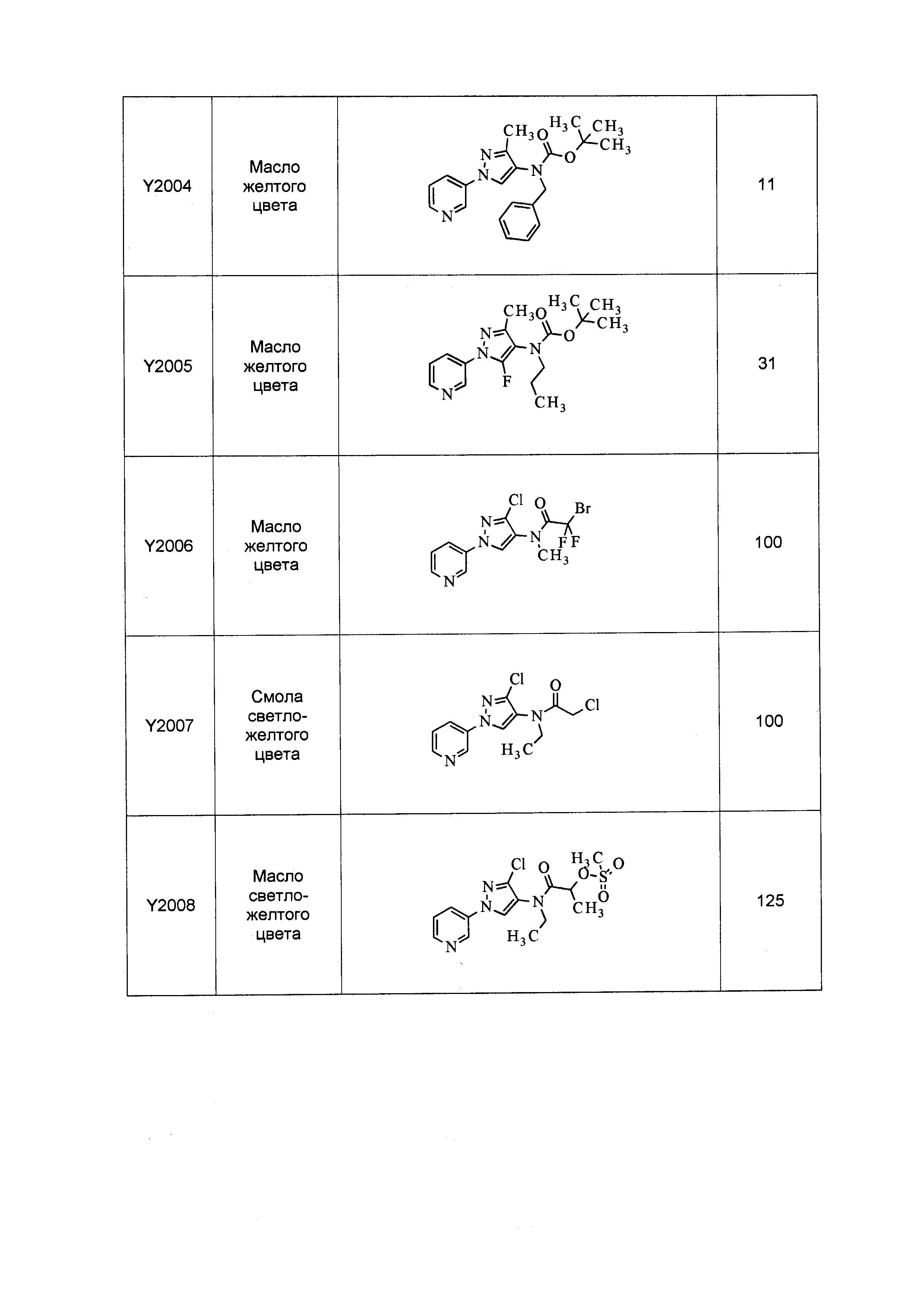
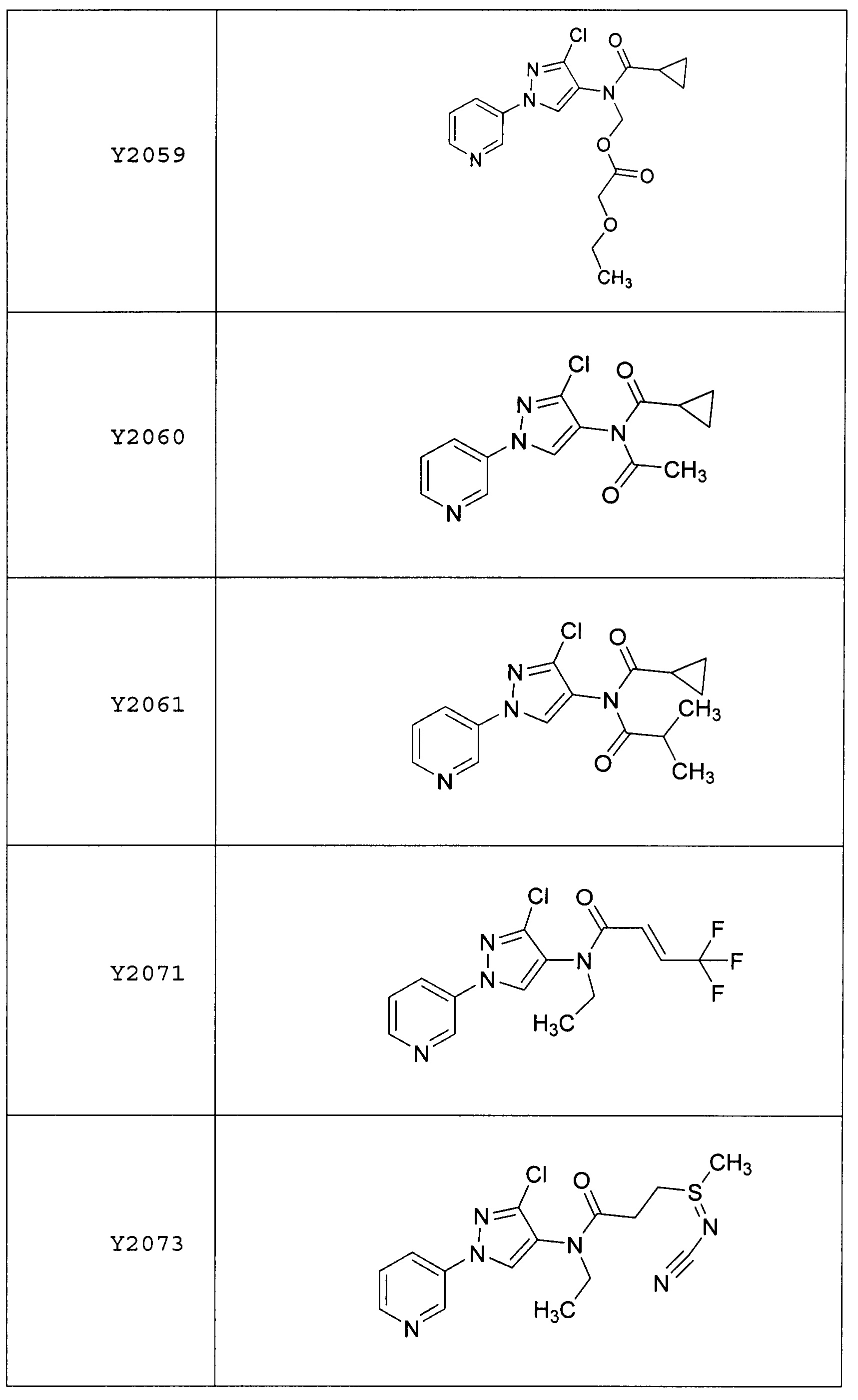
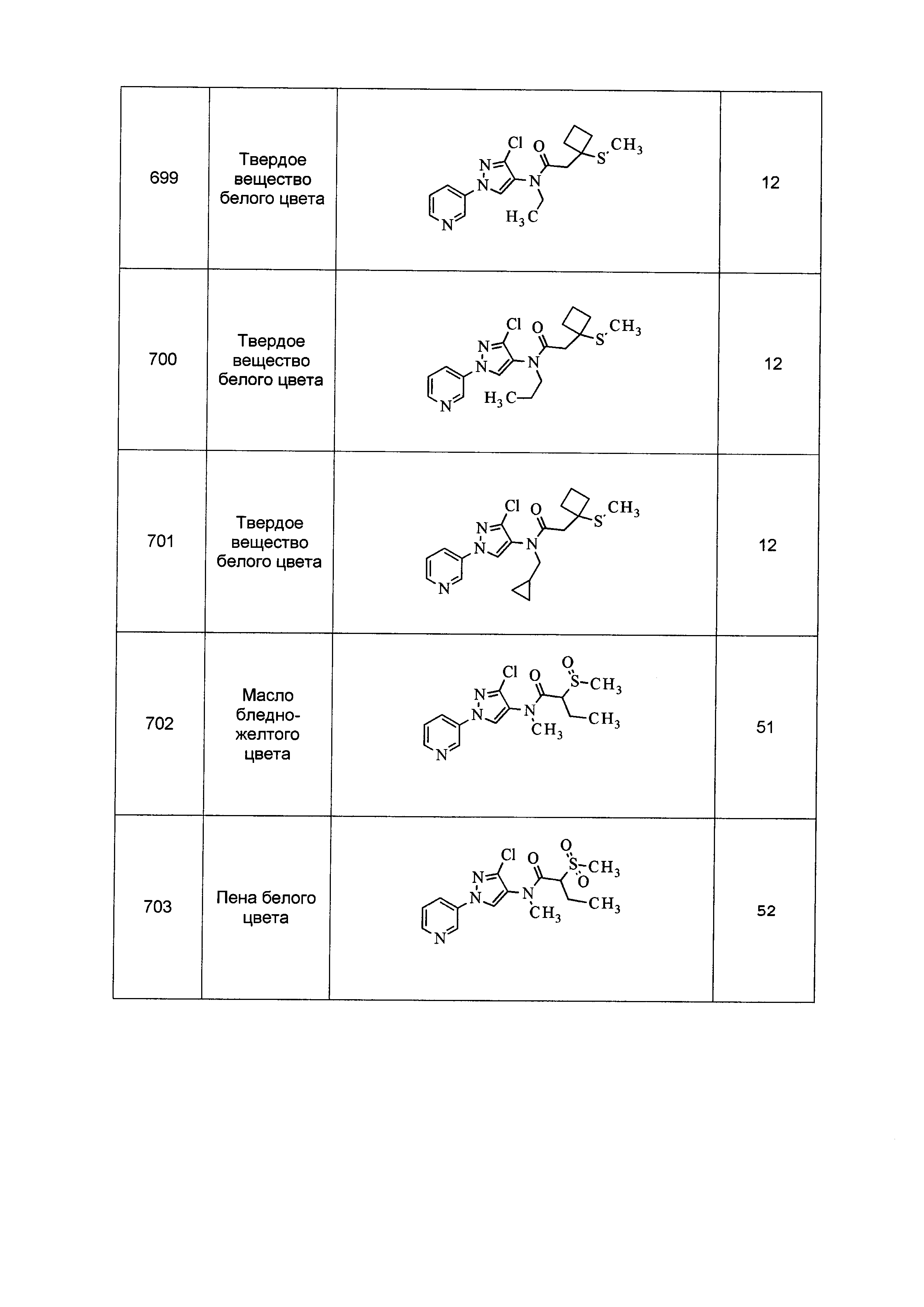
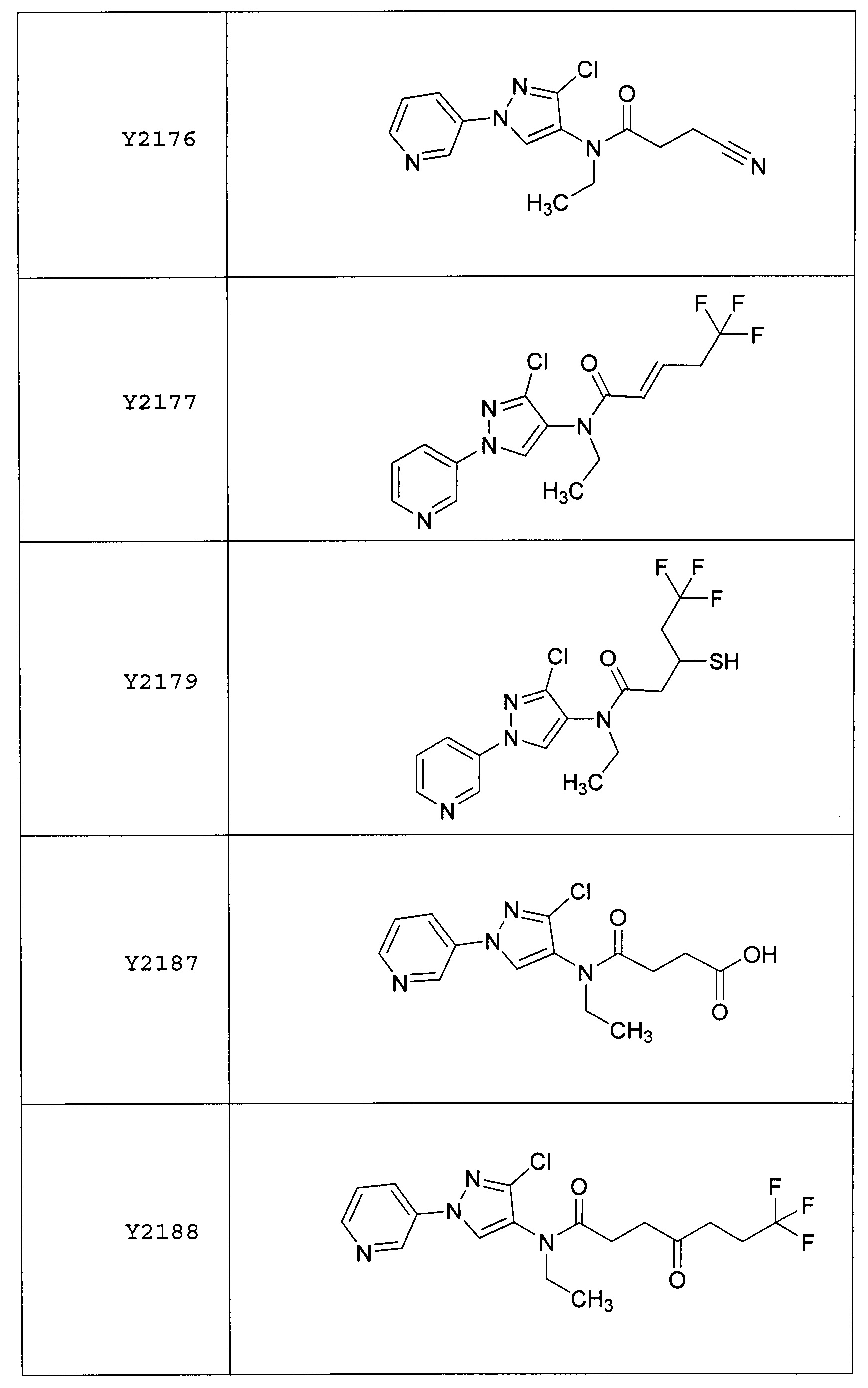
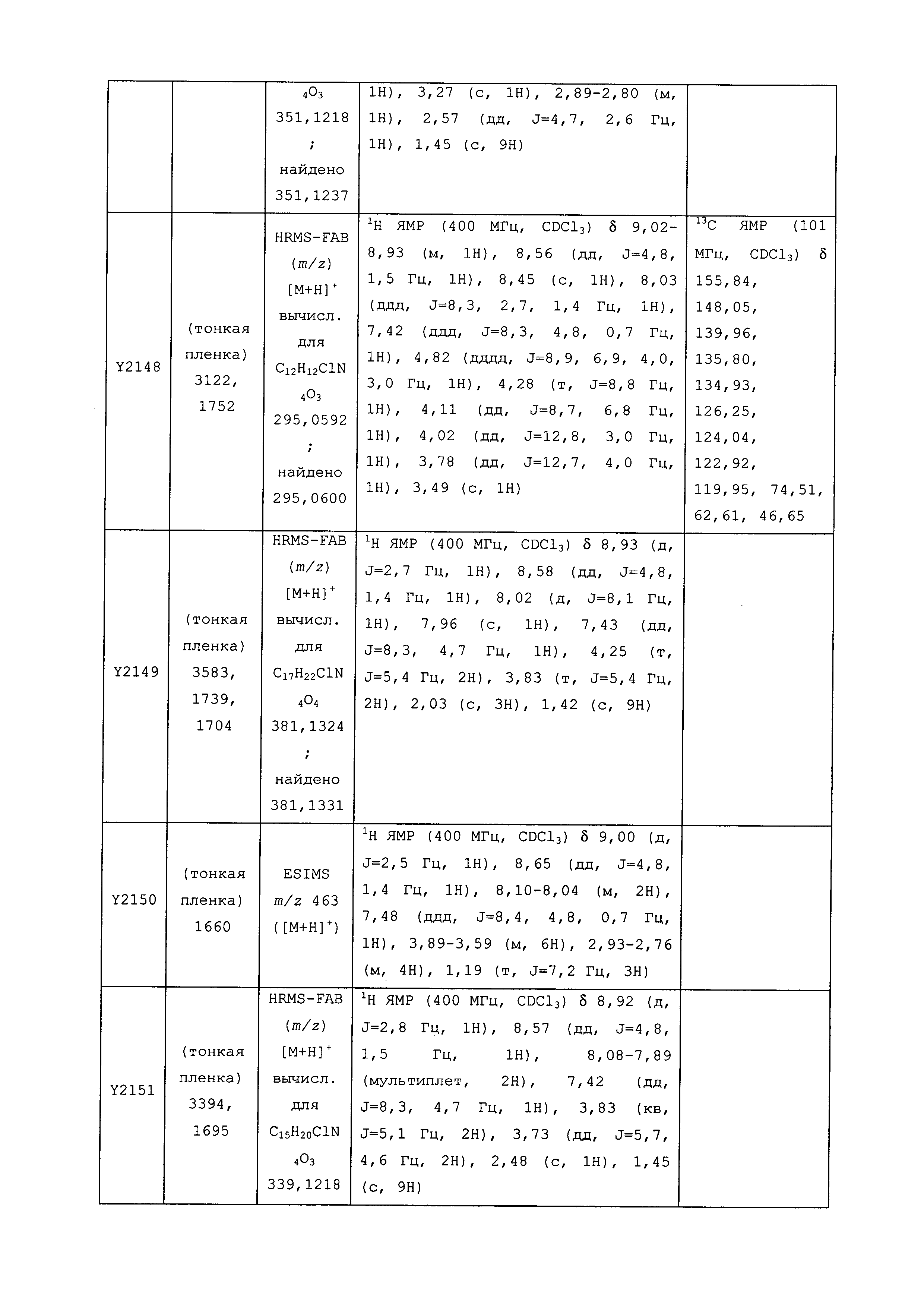
Данные примеры предназначены для иллюстрации и не должны быть истолкованы как ограничивающие изобретение, описанное в настоящем документе, только вариантами осуществления, раскрытыми в этих примерах.
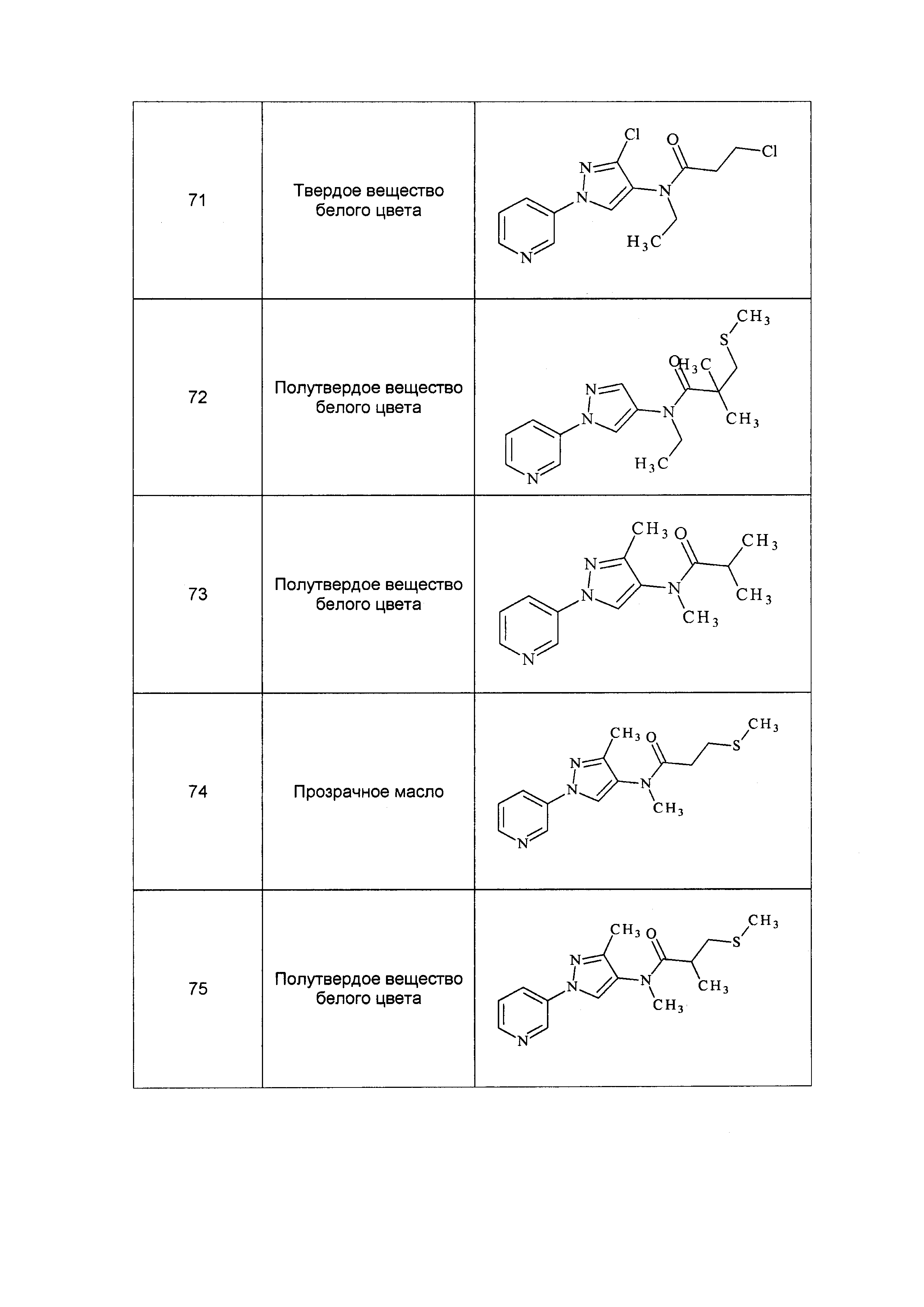
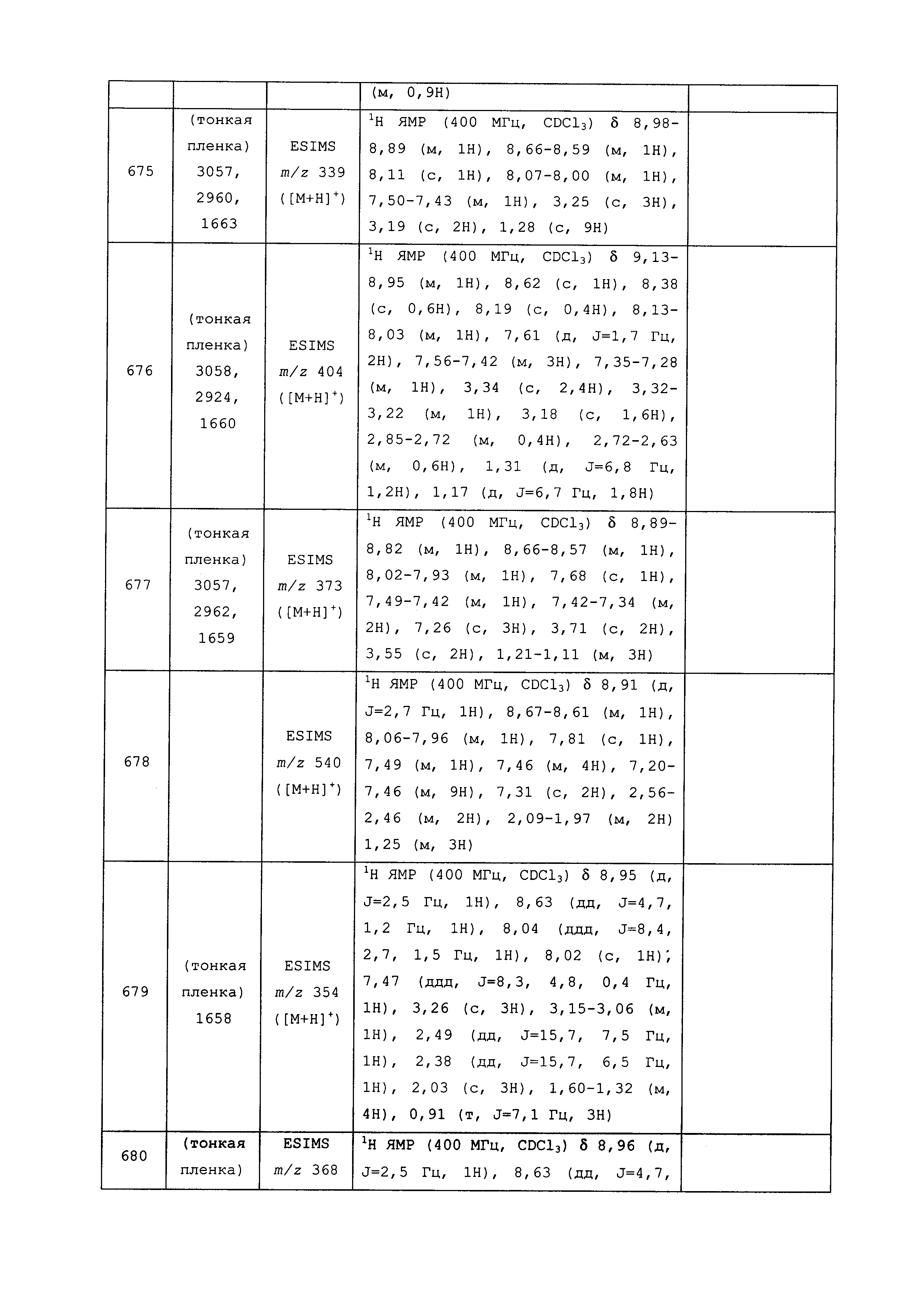
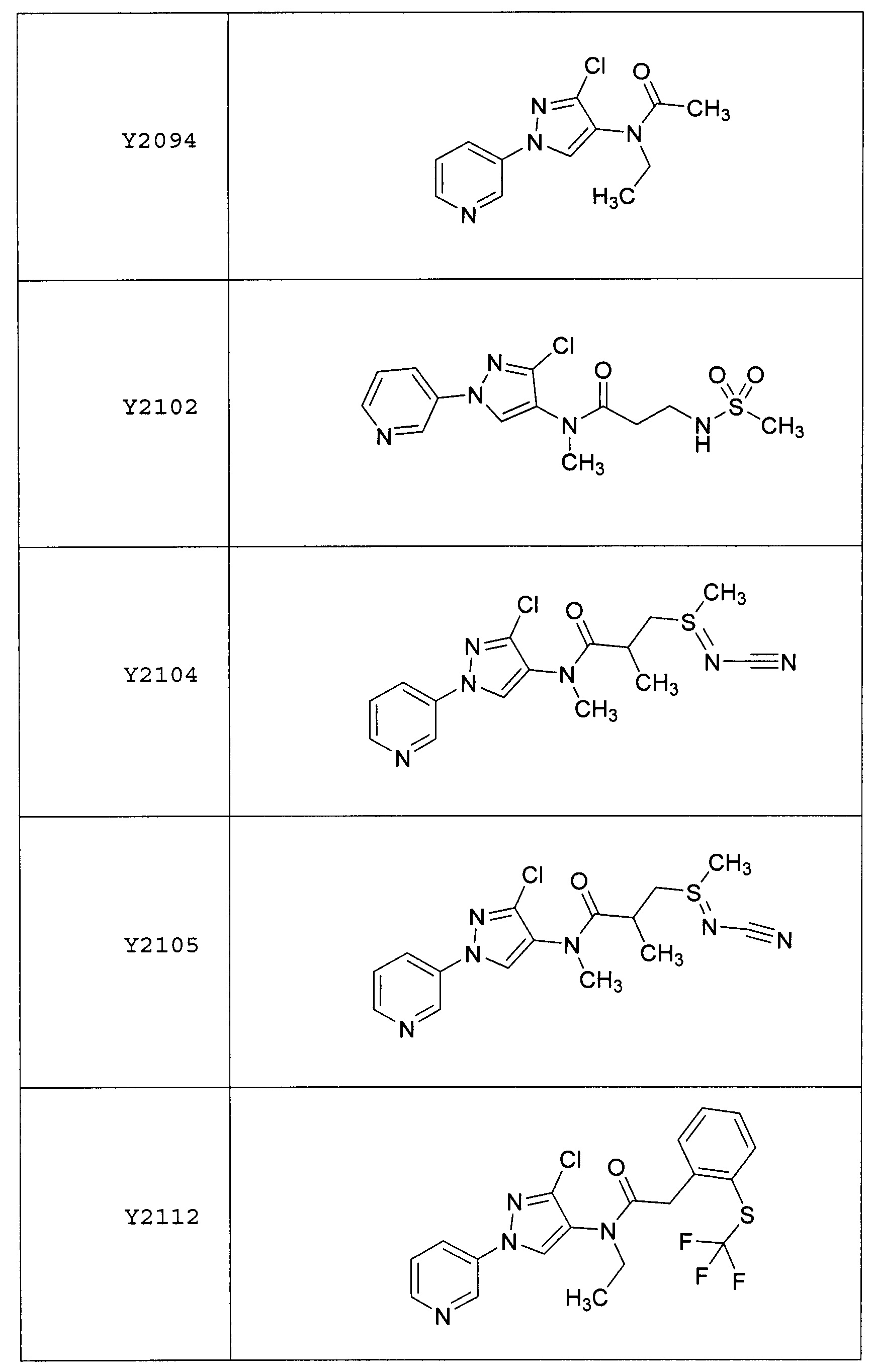
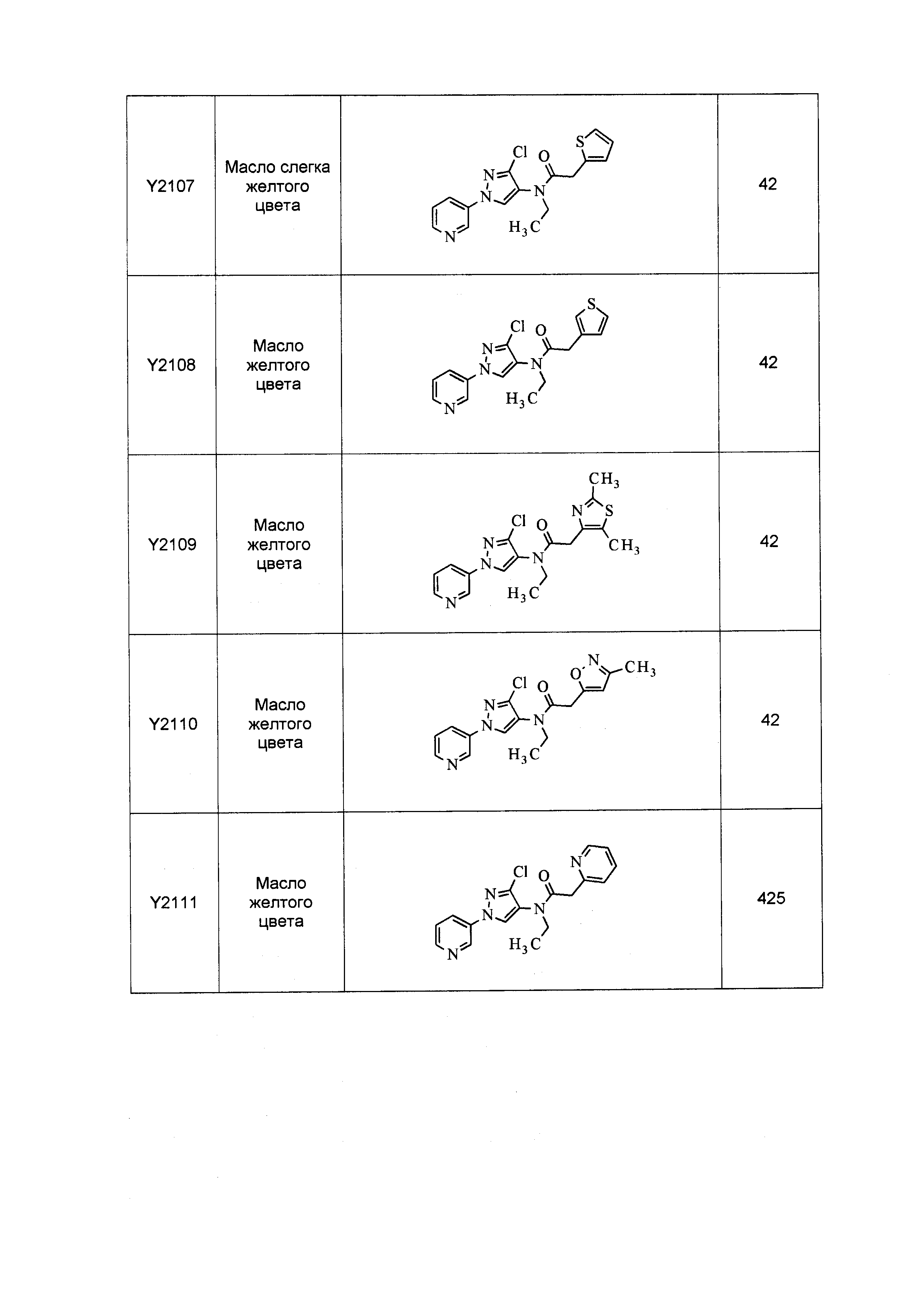
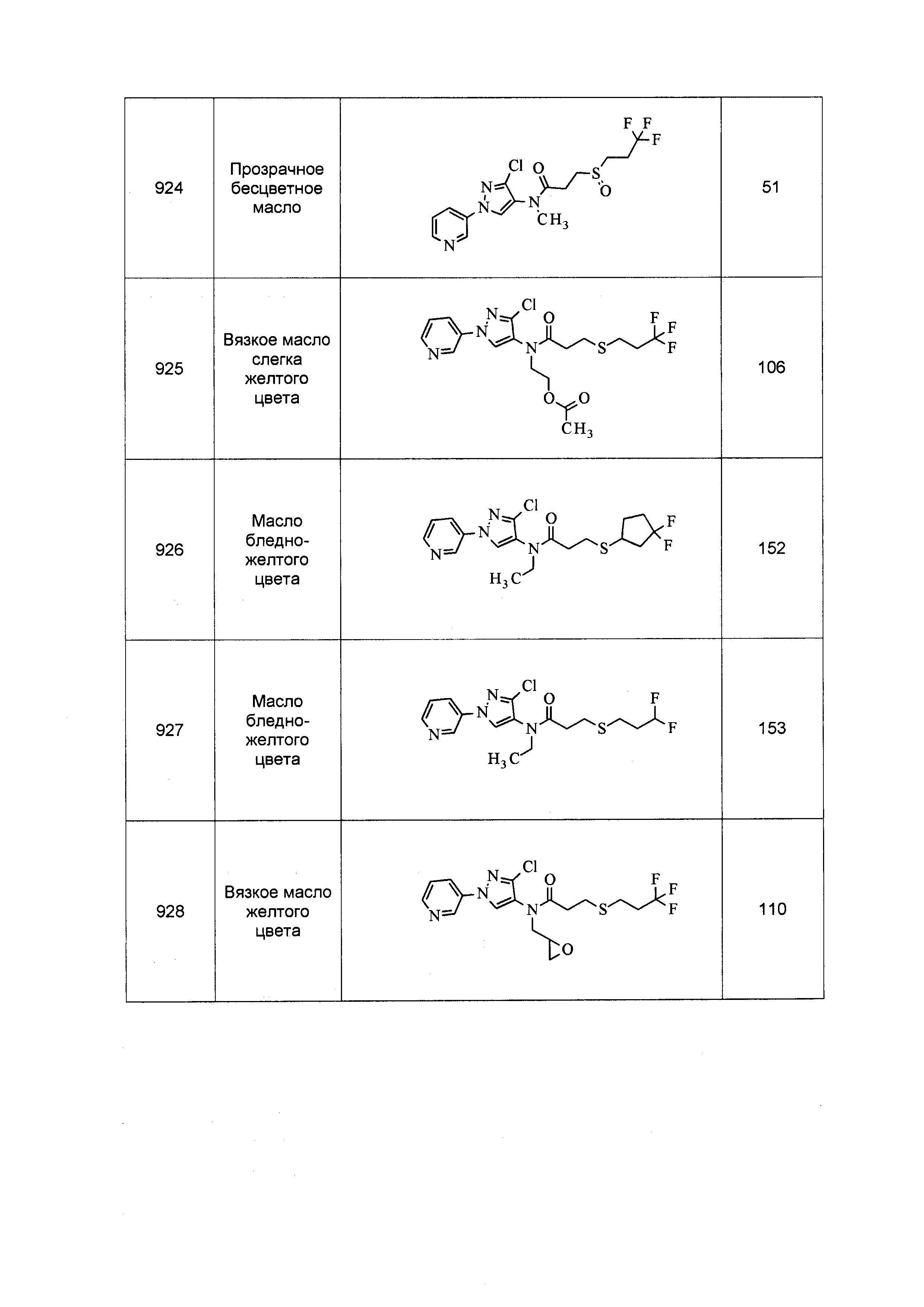
Исходные продукты, реагенты и растворители, которые были получены из коммерческих источников, использовались без дополнительной очистки. Безводные растворители были приобретены в виде Sure/Seal™ у фирмы Aldrich и использовались в том виде, как получены. Температуры плавления определялись на приборе Thomas Hoover Unimelt для определения точки плавления в капиллярах или на системе OptiMelt Automated Melting Point System от фирмы Stanford Research Systems и не корректировались. Соединения приведены под известными для них названиями, данными в соответствии с программой названий ISIS Draw, ChemDraw или ACD Name Pro. Если такие программы не могли дать название соединению, соединение было названо с использованием обычных правил наименования. Все ЯМР сдвиги приведены в миллионных долях (δ), и данные были зарегистрированы при 300, 400 или 600 МГц, если не указано иное. Примеры с использованием "комнатной температуры" были осуществлены в лабораториях с климат-контролем при температуре в пределах от примерно 20°C до примерно 24°C.
Пример 1, стадия 1: Получение 3,3-бис-метилсульфанил-1-пиридин-3-ил-пропенона
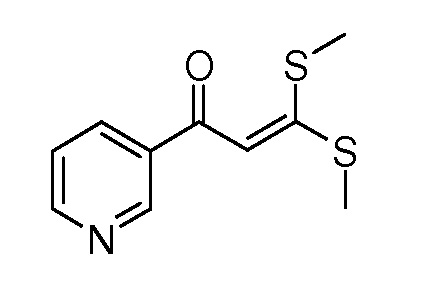
К суспензии комнатной температуры гидрида натрия (NaH, 60%-ая суспензия в минеральном масле; 4,13 г, 86 ммоль) в сухом диметилсульфоксиде (ДМСО, 60 мл) в атмосфере азота (N2) в течение 30 минут (мин) добавляли по каплям 3-ацетилпиридин (5,00 г, 41,3 ммоль). Смесь перемешивали в течение еще 30 минут при той же температуре. При энергичном перемешивании добавляли по каплям дисульфид углерода (CS2; 3,27 г, 43 ммоль), затем по каплям йодметан (12,21 г, 86 ммоль) в течение 45 мин. Перемешивание продолжали в течение еще 18 часов (ч) в атмосфере N2. Реакцию гасили холодной водой (H2O, 50 мл). Темное твердое вещество фильтровали и промывали охлажденным льдом этиловым спиртом (EtOH) до тех пор, пока промывные воды не становились бесцветными. Твердый продукт не совсем белого цвета сушили в вакууме при температуре 60°C с получением 3,3-бис-метилсульфанил-1-пиридин-3-ил-пропенона в виде твердого вещества коричневого цвета (4,8 г, 51%): 1H ЯМР (300 МГц, CDCl3) δ 9,13 (д, J=1,8 Гц, 1H), 8,72 (дд, J=4,8, 1,6 Гц, 1H), 8,23 (ддд, J=7,9, 2, 2 Гц, 1H), 7,40 (дд, J=7,9, 4,8 Гц, 1H), 6,73 (с, 1H), 2,58 (д, J=9,4 Гц, 6H); MS m/z 226,2 (M+1).
1-(5-Фторпиридин-3-ил)-3,3-бис(метилтио)проп-2-ен-1-он был получен, как описано в примере 1, стадия 1: т. пл. 150-152°C; 1H ЯМР (400 МГц, CDCl3) δ 8,93 (т, J=1,6 Гц, 1H), 8,58 (д, J=2,8 Гц, 1H), 7,94 (ддд, J=8,9, 2,8, 1,7 Гц, 1H), 6,69 (с, 1H), 2,60 (с, 3H), 2,57 (с, 3H).
Пример 1, стадия 2: Получение (Z)-3-метиламино-3-метилсульфанил-1-пиридин-3-ил-пропенона
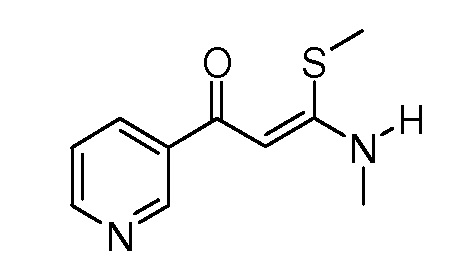
Раствор 3,3-бис-метилсульфанил-1-пиридин-3-ил-пропенона (18,6 г, 82,5 ммоль) в абсолютном спирте (400 мл) в атмосфере N2 обрабатывали гидрохлоридом метиламина (27,86 г, 412 ммоль), затем триэтиламином (Et3N; 58,5 мл, 412 ммоль). Смесь нагревали при кипячении с обратным холодильником в течение 3 ч, охлаждали до комнатной температуры и концентрировали при пониженном давлении. Твердый остаток растворяли в этилацетат (EtOAc; 150 мл). Раствор промывали H2O (2×50 мл) и насыщенным солевым раствором (50 мл), сушили над Na2SO4, концентрировали при пониженном давлении и очищали с помощью хроматографии на силикагеле, элюируя смесью 10% EtOAc в петролейном эфире, с получением (Z)-3-метиламино-3-метилсульфанил-1-пиридин-3-ил-пропенона в виде твердого вещества бледно-желтого цвета (8,6 г, 50%): 1H ЯМР (300 МГц, CDCl3) δ 11,8 (ушир. с, 1H), 9,06 (с, 1H); 8,67 (д, J=3,9 Гц, 1H), 8,26 (д, J=8,0 Гц, 1H), 7,46 (дд, J=7,6, 4,9 Гц, 1H), 5,62 (с, 1H), 3,10 (д, J=5,2 Гц, 3H), 2,52 (с, 3H); MS (m/z) 209,2 [M+1].
(Z)-3-(Этиламино)-3-(метилтио)-1-(пиридин-3-ил)проп-2-ен-1-он был получен, как описано в примере 1, стадия 2: 1H ЯМР (400 МГц, CDCl3) δ 11,81 (ушир. с, 1H), 9,04 (дд, J=2,2, 0,7 Гц, 1H), 8,64 (дд, J=4,8, 1,7 Гц, 1H), 8,29-7,98 (м, 1H), 7,35 (ддд, J=7,9, 4,8, 0,9 Гц, 1H), 3,45 (кв, J=7,2, 5,6 Гц, 2H), 2,50 (с, 3H), 1,35 (т, J=7,2 Гц, 3H).
(Z)-3-(Циклопропилметил)амино-3-(метилтио)-1-(пиридин-3-ил)проп-2-ен-1-он был получен, как описано в примере 1, стадия 2: 1H ЯМР (400 МГц, CDCl3) δ 9,00 (с, 1H), 9,05 (дд, J=2,2, 0,7 Гц, 1H), 8,64 (дд, J=4,8, 1,7 Гц, 1H), 8,16 (дт, J=7,9, 2,0 Гц, 1H), 7,35 (ддд, J=7,9, 4,8, 0,8 Гц, 1H), 5,62 (с, 1H), 3,27 (дд, J=7,0, 5,5 Гц, 2H), 2,50 (с, 3H), 1,20-1,07 (м, 1H), 0,73-0,49 (м, 2H), 0,41-0,17 (м, 2H).
Пример 1, стадия 3: Получение метил-(2-метил-5-пиридин-3-пиразол-3-ил)-амина
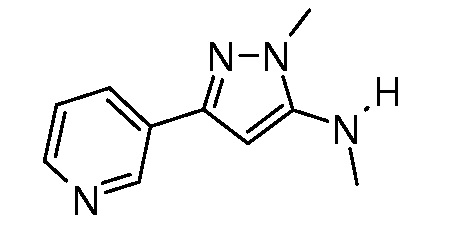
Раствор (Z)-3-метиламино-3-метилсульфанил-1-пиридин-3-ил-пропенона (3,00 г, 14 ммоль) и метилгидразина (729 мг, 15,4 ммоль) в абсолютном EtOH (64 мл) перемешивали при кипячении с обратным холодильником в течение 18 ч в атмосфере N2, охлаждали до комнатной температуры и упаривали при пониженном давлении. Остаток растворяли в EtOAc (50 мл), и органический слой промывали H2O (2×30 мл) и насыщенным солевым раствором (30 мл), сушили над Na2SO4, концентрировали при пониженном давлении и очищали с использованием хроматографии на силикагеле, элюируя градиентной смесью 0-1% EtOH в EtOAc, с получением двух региоизомеров при соотношении 1:2 с основным региоизомером в виде твердого вещества коричневого цвета (1,0 г, 27%): 1H ЯМР (300 МГц, CDCl3) δ 8,97 (д, J=1,3 Гц, 1H), 8,51 (дд, J=3,6, 1,0 Гц, 1H), 8,07 (ддд, J=5,9, 1,4, 1,4 Гц, 1H), 7,30 (дд, J=5,9, 3,6 Гц, 1H), 5,82 (с, 1H), 3,69 (с, 3H), 2,93 (с, 3H); MS (m/z) 188,6 [M+1].
1-Этил-N-метил-3-(пиридин-3-ил)-1H-пиразол-5-амин был получен, как описано в примере 1, стадия 3: ESIMS m/z 204 ([M+2H]).
N-Этил-1-метил-3-(пиридин-3-ил)-1H-пиразол-5-амин был получен, как описано в примере 1, стадия 3: ESIMS m/z 203 ([M+H]).
N-Метил-1-фенил-3-(пиридин-3-ил)-1H-пиразол-5-амин был получен, как описано в примере 1, стадия 3: ESIMS m/z 252 ([M+2H]).
N-(Циклопропилметил)-1-метил-3-(пиридин-3-ил)-1H-пиразол-5-амин был получен, как описано в примере 1, стадия 3: ESIMS m/z 230 ([M+2H]).
1-Изопропил-N-метил-3-пиридин-3-ил)-1H-пиразол-5-амин был получен, как описано в примере 1, стадия 3: 1H ЯМР (300 МГц, CDCl3) δ 8,53 (с, 1H), 8,06-7,90 (м, J=7,2 Гц, 2H), 7,13 (дд, J=7,9, 5,6 Гц, 1H), 5,33 (с, 1H), 3,70 (ушир. с, 1H), 3,65 (дт, J=13,2, 6,6 Гц, 1H), 2,31 (с, 3H), 0,88 (д, J=6,6 Гц, 6H); ESIMS m/z 217 ([M+H]).
3-(5-Фторпиридин-3-ил)-N,1-диметил-1H-пиразол-5-амин был получен, как описано в примере 1, стадия 3: 1H ЯМР (300 МГц, CDCl3) δ 8,28 (с, 1H), 7,87 (т, J=1,3 Гц, 1H), 7,60 (м, 1H), 6,66 (с, 1H), 5,28 (ушир. с, 2H), 3,12 (с, 3H), 2,34 (с, 3H); ESIMS m/z 206 ([M+H]).
Пример 2: Получение (4-хлор-2-метил-5-пиридин-3-ил-2H-пиразол-3-ил)-метил-амина
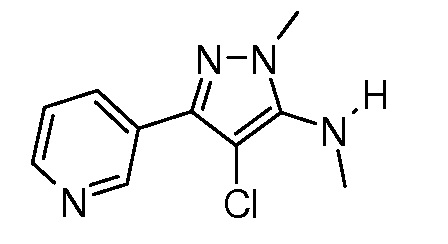
Смесь метил-(2-метил-5-пиридин-3-ил-2H-пиразол-3-ил)-амина (0,35 г, 1,8 ммоль) и N-хлорсукцинимида (0,273 г, 2 ммоль) объединяли в ацетонитриле (3 мл), перемешивали при комнатной температуре в течение 30 минут, концентрировали при пониженном давлении и очищали с использованием хроматографии на силикагеле, элюируя градиентной смесью EtOAc в гексане с получением указанного в заголовке соединения в виде масла желтого цвета (0,096 г, 23%): ИК (тонкая пленка) 1581,6 см-1; 1H ЯМР (400 МГц, CDCl3) δ 9,12 (д, J=1,5 Гц, 1H), 8,57 (дд, J=4,8, 1,3 Гц, 1H), 8,15 (ддд, J=7,8, 2,0, 2,0 Гц, 1H), 7,33 (дд, J=8,1, 5,1 Гц, 1H), 3,80 (с, 3H), 2,91 (д, J=5,8 Гц, 3H); ESIMS (m/z) 225,6 [M+2].
Реакция также давала 4-хлор-2-метил-5-пиридин-3-ил-2H-пиразол-3-иламин в виде смолы зеленого цвета (0,046 г, 13%): ИК (тонкая пленка) 1720,5 см-1; 1H ЯМР (CDCl3, 400 МГц) δ 9,13 (ушир. с, 1H), 8,57 (ушир. с, 1H), 8,16 (дт, J=8,0, 2,0 Гц, 1H), 7,33 (дд, J=7,8, 4,8 Гц, 1H), 3,76 (с, 3H); ESIMS (m/z) 207,0 [M-1].
Пример 3: Получение 2,N-диметил-N-(2-метил-5-пиридин-3-ил-2H-пиразол-3-ил)-3-метилсульфанил-пропионамида (соединение 1)
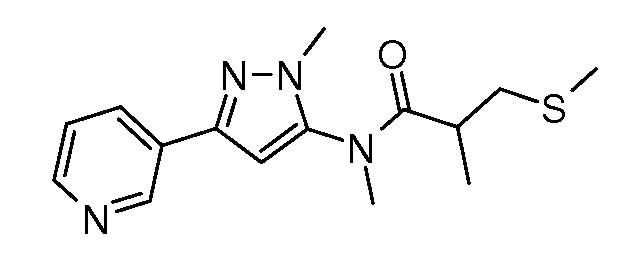
К раствору метил-(2-метил-5-пиридин-3-ил-2H-пиразол-3-ил)-амина (150 мг, 0,8 ммоль) в атмосфере N2 в ледяном дихлорэтане (DCE; 2 мл) добавляли по каплям с помощью пипетки раствор 2-метил-3-метилсульфанил-пропионилхлорида (146 мг, 0,9 ммоль) в DCE (1,5 мл). После перемешивания в течение 10 минут (мин) добавляли по каплям раствор 4-N,N-диметиламинопиридина (DMAP; 107 мг, 0,9 ммоль) в DCE (2 мл). Баню со льдом отставляли спустя 30 мин, и смесь перемешивали при комнатной температуре в течение 90 мин и затем кипятили с обратным холодильником в течение 14 ч. Смесь концентрировали при пониженном давлении и очищали с помощью хроматографии на силикагеле, элюируя градиентной смесью EtOAc в гексане. Продукт, 2,N-диметил-N-(2-метил-5-пиридин-3-ил-2H-пиразол-3-ил)-3-метилсульфанил-пропионамид, выделяли в виде полутвердого вещества желтого цвета (44 мг, 24%): 1H ЯМР (400 МГц, CDCl3) δ 9,00 (с, 1H), 8,58 (с, 1H), 8,08 (ушир. д, J=7,0 Гц, 1H), 7,35 (ушир. дд, J=7,3, 4,8 Гц, 1H), 6,58 (ушир. с, 0,5H), 6,49 (ушир. с, 0,5H), 3,89-3,79 (м, 3H), 3,25 (с, 3H), 2,96-2,80 (м, 1H), 2,42-2,40 (м, 1H), 2,02-1,99 (м, 3H), 2,62 (м, 1H), 1,15 (д, J=6,0 Гц, 3H); MS (m/z) 305,0 [M+1].
Соединения 2-6, 9-10, 12, 18-21, 24-33, 477, 487, 509, 520, 556-557, 562-568 были получены из соответствующих аминов в соответствии со способами, описанными в примере 3.
Пример 4: Получение 1-метил-1-(2-метил-5-пиридин-3-ил-2H-пиразол-3-ил)-3-(2-метилсульфанил-этил)мочевины (соединение 7)
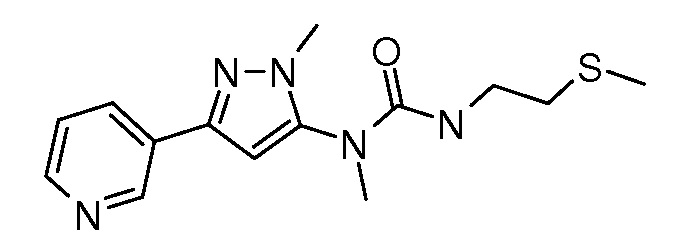
К раствору метил-(2-метил-5-пиридин-3-ил-2H-пиразол-3-ил)амина (150 мг, 0,8 ммоль) в ледяном DCE (2 мл) в атмосфере N2 добавляли раствор фосгена в толуоле (20%, 0,43 мл, 0,88 ммоль). Баню со льдом отставляли спустя 30 мин, и смесь перемешивали при комнатной температуре в течение 1 ч и при кипячении с обратным холодильником в течение 2 ч. Смесь охлаждали до комнатной температуры и затем добавляли еще фосген (0,86 мл, 1,76 ммоль). Смесь перемешивали при кипячении с обратным холодильником в течение 90 мин и затем охлаждали на ледяной бане. К данной реакционной смеси добавляли раствор 2-метилтиоэтиламина (80 мг, 0,88 ммоль) в DCE (2 мл). Баню со льдом отставляли спустя 10 мин, и реакционную смесь перемешивали при кипячении с обратным холодильником в течение 14 ч, охлаждали и разбавляли DCE (30 мл). Разбавленную реакционную смесь промывали насыщенным NaHCO3 (20 мл), сушили над MgSO4, адсорбировали на силикагеле и очищали с использованием хроматографии на силикагеле, элюируя градиентной смесью метанола в дихлорметане, с получением 1-метил-1-(2-метил-5-пиридин-3-ил-2H-пиразол-3-ил)-3-(2-метилсульфанил-этил)мочевины в виде смолы желтого цвета (14 мг, 6%): 1H ЯМР (400 МГц, CDCl3) δ 8,99 (д, J=1,5 Гц, 1H), 8,57 (дд, J=4,8, 1,5 Гц, 1H), 8,08 (ддд, J=8,1, 2,1, 2,1 Гц, 1H), 7,34 (дд, J=7,9, 4,8 Гц, 1H), 6,52 (с, 1H), 4,88 (ушир. т, J=5,5 Гц, 1H), 3,80 (с, 3H), 3,41 (кв, J=6,3 Гц, 2H), 3,24 (с, 3H), 2,61 (т, J=6,3, 2H), 2,06 (с, 3H); ESIMS (m/z) 292,2 [M+2].
Соединение 8 получали в соответствии со способами, описанными в примере 4, с использованием 2-(метилтио)этанола вместо 2-метилтиоэтиламина.
Пример 5: Получение 1-метил-5-(пиридин-3-ил)-1H-пиразол-3-амина и 1-метил-3-(пиридин-3-ил)-1H-пиразол-5-амина
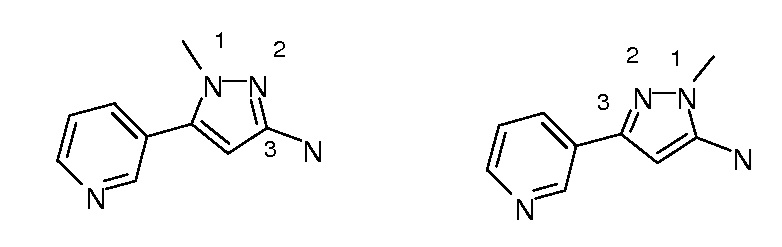
К этанолу (8,53 мл) добавляли 3-оксо-3-(пиридин-3-ил)пропаннитрил (0,82 г, 5,61 ммоль) и метилгидразин (0,25 г, 5,61 ммоль) и перемешивали при кипячении с обратным холодильником в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и концентрировали досуха. Сырое вещество очищали с помощью хроматографии на силикагеле путем элюирования смесью 0-20% MeOH/дихлорметан с получением двух продуктов - 1-метил-5-(пиридин-3-ил)-1H-пиразол-3-амина (0,060 г; 6,14%): 1H ЯМР (300 МГц, CDCl3) δ 8,72 (с, 1H), 8,53 (д, 1H), 7,76-7,63 (м, 1H), 7,43-7,33 (м, 1H), 5,75 (с, 1H), 3,76-3,57 (м, 5H) и 1-метил-3-(пиридин-3-ил)-1H-пиразол-5-амина (0,150 г, 15,35%): 1H ЯМР (300 МГц, CDCl3) δ 8,88 (с, 1H), 8,48 (д, 1H), 7,99 (д, 1H), 7,38-7,07 (м, 1H), 5,85 (с, 1H), 3,80-3,59 (м, 5H).
Пример 6, стадия 1: Получение 3-пиразол-1-ил-пиридина
К раствору 3-бромпиридина (5 г, 0,031 моль) в 50 мл ацетонитрила в атмосфере N2 добавляли пиразол (2,6 г, 0,038 моль), Cs2CO3 (16,5 г, 0,050 моль), Cu2O (0,226 г, 0,0016 моль) и салицилальдоксим (0,867 г, 0,006 моль). Реакционную массу кипятили с обратным холодильником в течение 24 час при температуре 80°C. Реакционную массу концентрировали, и сырой продукт очищали с помощью колоночной хроматографии с использованием этилацетата и гексана (1:1) с получением пиразолилпиридина в виде жидкости темно-коричневого цвета (2 г, 43%): 1H ЯМР (400 МГц, CDCl3) δ 8,99 (д, J=2,8 Гц, 1H), 8,48 (дд, J=4,8, 1,2 Гц, 1H), 8,11-8,08 (м, 1H), 7,99 (д, J=1,2 Гц, 1H), 7,78 (д, J=1,2 Гц, 1H), 7,38-7,35 (м, 1H), 6,53 (т, J=1,2 Гц, 1H); MS (m/z) 146 [M+1].
3-(3-Хлор-1H-пиразол-1-ил)пиридин был получен, как описано в примере 6, стадия 1: т. пл. 98-106°C; 1H ЯМР (400 МГц, CDCl3) δ 8,93 (д, J=2,6 Гц, 1H), 8,57 (дд, J=4,8, 1,4 Гц, 1H), 8,03 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,90 (д, J=2,5 Гц, 1H), 7,42 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 6,46 (д, J=2,5 Гц, 1H); 13C (ДМСО-d6) 148, 142, 140, 136, 131, 126, 125, 108.
2-Метил-3-(3-метил-1H-пиразол-1-ил)пиридин был получен, как описано в примере 6, стадия 1: 1H ЯМР (400 МГц, CDCl3) δ 8,53 (д, J=4,7 Гц, 1H), 7,67 (д, J=7,9 Гц, 1H), 7,54 (т, J=8,0 Гц, 1H), 7,27-7,19 (м, 1H), 6,27 (д, J=1,4 Гц, 1H), 2,53 (с, 3H), 2,38 (с, 3H).
3-(3-(Трифторметил)-1H-пиразол-1-ил)пиридин был получен исходя из соответствующих исходных веществ, как описано в примере 6, стадия 1: т. пл. 59,0-61,0°C; 1H ЯМР (400 МГц, CDCl3) δ 9,00 (с, 1H), 8,70-8,59 (м, 1H), 8,11 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 8,05-7,98 (м, 1H), 7,46 (дд, J=8,3, 4,8 Гц, 1H), 6,79 (д, J=2,4 Гц, 1H); EIMS m/z 213.
3-Фтор-5-(3-метил-1H-пиразол-1-ил)пиридин был получен исходя из соответствующих исходных веществ, как описано в примере 6, стадия 1: т. пл. 70,0-72,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,76-8,73 (м, 1H), 8,37-8,33 (м, 1H), 7,88-7,85 (м, 1H), 7,84-7,79 (м, 1H), 6,34-6,29 (м, 1H), 2,37 (с, 3H); EIMS m/z 177.
3-(3-Хлор-1H-пиразол-1-ил)-5-фторпиридин был получен исходя из соответствующих исходных веществ, как описано в примере 6, стадия 1: т. пл. 77,0-82,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,75 (д, J=1,8 Гц, 1H), 8,43 (д, J=2,3 Гц, 1H), 7,92 (д, J=2,6 Гц, 1H), 7,84 (дт, J=9,3, 2,4 Гц, 1H), 6,48 (д, J=2,6 Гц, 1H); EIMS m/z 198.
3-(3-Метил-1H-пиразол-1-ил)пиридин был получен, как описано в примере 6, стадия 1: 1H ЯМР (400 МГц, CDCl3) δ 8,94 (ушир. с, 1H), 8,51 (д, J=3,9 Гц, 1H), 8,02 (ддд, J=8,3, 2,6, 1,5 Гц, 1H), 7,90-7,79 (м, 1H), 7,39 (дд, J=8,2, 5,1 Гц, 1H), 6,30 (д, J=2,4 Гц, 1H), 2,39 (с, 3H).
3-(5-Метил-1H-пиразол-1-ил)пиридин был получен, как описано в примере 6, стадия 1: 1H ЯМР (400 МГц, CDCl3) δ 8,77 (д, J=2,5 Гц, 1H), 8,65 (дд, J=4,8, 1,5 Гц, 1H), 7,84 (ддд, J=8,2, 2,5, 1,5 Гц, 1H), 7,63 (д, J=1,6 Гц, 1H), 7,44 (ддд, J=8,2, 4,8, 0,7 Гц, 1H), 6,225 (дд, J=1,6, 0,7 Гц, 1H), 2,40 (с, 3H).
Пример 6, стадия 2: Получение 3-(4-нитро-пиразол-1-ил)пиридина
3-Пиразол-1-ил-пиридин (2 г, 0,032 моль) растворяли в концентрированной H2SO4 (32 мл, 0,598 ммоль) и охлаждали до температуры -5°C с использованием ледяной бани. В реакционную массу в течение периода в 30 мин добавляли по каплям смесь 1:1 концентрированной HNO3 (30 мл, 0,673 ммоль) и концентрированной H2SO4 (30 мл, 15 об.). Охлаждение прекращали, и реакционную смесь перемешивали при комнатной температуре в течение ночи. После того, как реакция была завершена, смесь выливали на измельченный лед и нейтрализовали насыщенным NaHCO3, фильтровали, промывали водой и сушили с получением нитропиразола в виде твердого вещества бледно-желтого цвета (1,8 г, 68%): 1H ЯМР (400 МГц, ДМСО-d6) δ 9,03 (д, J=2,8 Гц, 1H); 8,70 (дд, J=4,8, 1,6 Гц, 1H), 8,69 (с, 1H), 8,33 (с, 1H), 8,11-8,08 (м, 1H), 7,51 (дд, J=8,4, 4,8 Гц, 1H); MS (m/z) 191 [M+1].
3-(3-Хлор-4-нитро-1H-пиразол-1-ил)пиридин был получен, как описано в примере 6, стадия 2: т. пл. 139-142°C, 1H ЯМР (400 МГц, CDCl3) δ 9,01 (д, J=2,0 Гц, 1H), 8,73 (д, J=4,9 Гц, 2H), 8,08 (ддд, J=8,3, 2,5, 1,3 Гц, 1H), 7,52 (дд, J=8,3, 4,8 Гц, 1H), EIMS m/z 224.
3-(5-Метил-4-нитро-1H-пиразол-1-ил)пиридин был получен, как описано в примере 6, стадия 2: 1H ЯМР (400 МГц, CDCl3) δ 8,81-8,71 (м, 2H), 8,32 (с, 1H), 7,83 (ддд, J=8,2, 2,5, 1,6 Гц, 1H), 7,54 (дд, J=8,2, 4,8 Гц, 1H), 2,72 (с, 3H).
2-Метил-3-(3-метил-4-нитро-1H-пиразол-1-ил)пиридин был получен, как описано в примере 6, стадия 2: 1H ЯМР (400 МГц, d6-ДМСО) δ 14,01 (с, 1H), 9,37 (д, J=4,0 Гц, 1H), 8,69 (т, J=17,3 Гц, 1H), 8,21 (дд, J=7,7, 4,8 Гц, 1H), 2,29 (с, 3H), 2,20 (с, 3H);,13C 154, 150, 146, 135, 134,9, 134,8, 134,3, 122, 21, 14; EIMS m/z 218.
3-(3-Метил-4-нитро-1H-пиразол-1-ил)пиридин был получен, как описано в примере 6, стадия 2: т. пл. 122-124°C; 1H ЯМР (400 МГц, CDCl3) δ 9,01 (д, J=2,5 Гц, 1H), 8,77-8,56 (м, 2H), 8,07 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,56-7,37 (м, 1H), 2,66 (с, 3H); EIMS m/z 208.
3-Фтор-5-(3-метил-4-нитро-1H-пиразол-1-ил)пиридин был получен из соответствующего исходного продукта, как описано в примере 6, стадия 2: т. пл. 90,0-92,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,82 (д, J=2,0 Гц, 1H), 8,69 (с, 1H), 8,54 (д, J=2,5 Гц, 1H), 7,89 (дт, J=8,9, 2,4 Гц, 1H), 2,66 (с, 3H); EIMS m/z 222.
3-(4-Нитро-3-(трифторметил)-1H-пиразол-1-ил)пиридин был получен из соответствующего исходного продукта, как описано в примере 6, стадия 2: т. пл. 121,0-123,0°C; 1H ЯМР (400 МГц, CDCl3) δ 9,04 (д, J=2,5 Гц, 1H), 8,79 (с, 1H), 8,77 (д, J=0,9 Гц, 1H), 8,13 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,55 (дт, J=10,8, 5,4 Гц, 1H); EIMS m/z 258.
3-(3-Хлор-4-нитро-1H-пиразол-1-ил)-5-фторпиридин был получен из соответствующего исходного продукта, как описано в примере 6, стадия 2: т. пл. 109,5-111,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,83 (д, J=2,1 Гц, 1H), 8,75 (с, 1H), 8,60 (д, J=2,4 Гц, 1H), 7,89 (дт, J=8,6, 2,4 Гц, 1H); EIMS m/z 242.
3-(3-Бром-4-нитро-1H-пиразол-1-ил)пиридин был получен из соответствующего исходного продукта, как описано в примере 6, стадия 2: т. пл. 139,0-141,0°C; 1H ЯМР (400 МГц, CDCl3) δ 9,01 (д, J=2,5 Гц, 1H), 8,73 (дд, J=4,7, 1,1 Гц, 1H), 8,71 (с, 1H), 8,15-8,00 (м, 1H), 7,52 (дд, J=8,3, 4,8 Гц, 1H); ESIMS m/z 271 ([M+2]+).
Пример 6, стадия 3: Получение 1-пиридин-3-ил-1H-пиразол-4-иламина
К раствору 3-(4-нитро-пиразол-1-ил)пиридина (1,8 г, 0,009 моль) в сухом ТГФ (18 мл) добавляли 5% Pd/C (180 мг) в атмосфере азота. Затем смесь перемешивали в атмосфере водорода до завершения реакции. Реакционную смесь фильтровали через слой из целита и концентрировали досуха с получением неочищенного твердого вещества темно-коричневого цвета (1,76 г): 1H ЯМР (400 МГц, ДМСО-d6) δ 8,89 (дд, J=2,8, 0,4 Гц, 1H); 8,48 (дд, J=4,8, 1,2 Гц, 1H), 7,99-7,96 (м, 1H), 7,54 (д, J=1,2 Гц, 1H), 7,45 (д, J=0,4 Гц, 1H), 7,38-7,35 (м, 1H), 4,81 (ушир. с, 1H); ESIMS (m/z) 161 [M+1].
5-Метил-1-(пиридин-3-ил)-1H-пиразол-4-амин был получен, как описано в примере 6, стадия 3: 1H ЯМР (400 МГц, CDCl3) δ 8,74 (д, J=2,3 Гц, 1H), 8,63-8,50 (м, 1H), 7,81 (ддд, J=8,2, 2,5, 1,5 Гц, 1H), 7,46-7,33 (м, 2H), 2,64 (ушир. с, 1H), 2,29 (с, 3H); 13C (ДМСО-d6) 147, 144, 137, 133, 130, 129, 124, 123, 10; EIMS m/z 174.
3-Метил-1-(пиримидин-5-ил)-1H-пиразол-4-амин был получен, как описано в примере 6, стадия 3: т. пл. 211-215°C; 1H ЯМР (400 МГц, CDCl3) δ 9,10-8,87 (м, 3H), 7,51 (с, 1H), 3,24 (ушир. с, 2H), 2,29 (с, 3H); ESIMS m/z 176 ([M+H]).
3-Хлор-1-(пиримидин-5-ил)-1H-пиразол-4-амин был получен, как описано в примере 6, стадия 3: т. пл. 146-148°C; 1H ЯМР (400 МГц, CDCl3) δ 9,07 (с, 1H), 9,02 (с, 2H), 7,52 (с, 1H), 3,45 (с, 2H); ESIMS m/z 196 ([M+H]).
Пример 7: Получение метил-(1-пиридин-3-ил-1H-пиразол-4-ил)амина
Способ A:
В 25-мл круглодонную колбу, содержащую 1-пиридин-3-ил-1H-пиразол-4-иламин (1,76 г, 0,011 моль) в этаноле (26,4 мл), добавляли бензотриазол (1,31 г, 0,011 моль). Реакционную смесь охлаждали до температуры 0°C-10°C и медленно добавляли формальдегид (0,36 мл, 0,0121 моль), и выдерживали в течение 30 мин при этой температуре. Реакционную смесь фильтровали и концентрировали досуха. Сырое вещество (2,56 г, 0,009 моль) растворяли в сухом тетрагидрофуране (25,6 мл), охлаждали до температуры 0°C и в течение 15 мин добавляли боргидрид натрия (0,326 г, 0,00882 моль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 2 часов. Реакционную смесь выливали в воду и экстрагировали с использованием дихлорметана, органический слой сушили над безводным Na2SO4 и концентрировали досуха. Сырой продукт очищали с помощью хроматографии на силикагеле, элюируя смесью 20% метанол/хлороформ, с получением желаемого продукта в виде твердого вещества коричневого цвета (0,610 г, 32%): 1H ЯМР (400 МГц, d6-ДМСО) δ 8,92 (д, J=2,4 Гц, 1H), 8,47 (дд, J=4,8, 1,6 Гц, 1H), 8,01-7,98 (м, 1H), 7,45 (с, 1H), 7,30 (с, 1H), 7,37 (дд, J=8,0, 4,4 Гц, 1H), 2,84 (с, 3H); ESIMS m/z 175 ([M+1]).
Способ B:
1-Пиридин-3-ил-1H-пиразол-4-иламин (1,0 г, 6,2 ммоль) растворяли в триэтилортоформиате (5 мл, 30 ммоль), и к этому раствору добавляли трифторуксусную кислоту (3-4 капли). Реакционную смесь кипятили с обратным холодильником при температуре 120°C в течение 3 часов и затем концентрировали. Сырой продукт растворяли в этаноле (5 мл), охлаждали до температуры 0°C и обрабатывали боргидридом натрия (0,6 г, 15,7 ммоль). После нагревания до комнатной температуры смесь кипятили с обратным холодильником в течение 3 часов. Смесь концентрировали и остаток суспендировали в воде и диэтиловом эфире. Слой диэтилового эфира отделяли и концентрировали досуха. Сырое вещество очищали с помощью хроматографии на силикагеле, элюируя смесью 5% метанол/хлороформ, с получением желаемого продукта в виде твердого вещества бледно-желтого цвета (0,3 г, 27%): т. пл. 65-67°C; 1H ЯМР (300 МГц, CDCl3) δ 8,91 (ушир. с, 1H), 8,46 (д, J=4,5 Гц, 1H), 7,99 (д, J=8,3 Гц, 1H), 7,43 (с, 1H), 7,41 (с, 1H), 7,36 (дд, J=8,3, 4,7 Гц, 1H), 2,86 (д, J=12,4 Гц, 3H); ESIMS m/z 175 ([M+1]).
Пример 8: Получение этил-(1-пиридин-3-ил-1H-пиразол-4-ил)амина

Способ A:
К 1-пиридин-3-ил-1H-пиразол-4-иламину (0,5 г, 3,12 ммоль) в дихлорметане (5 мл) добавляли ацетилхлорид (0,28 г, 3,75 ммоль), затем DMAP (0,57 г, 4,68 ммоль) и перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали и очищали путем колоночной хроматографии на силикагеле. Выделенный продукт растворяли в тетрагидрофуране (5 мл) и добавляли алюмогидрид лития (0,23 г, 6,25 ммоль), и перемешивали при комнатной температуре в течение 12 часов. Реакцию гасили насыщенным Na2SO4 и фильтровали через целит. Фильтрат собирали и концентрировали досуха. Сырое вещество очищали путем колоночной хроматографии на силикагеле, элюируя смесью 0-5% метанол/хлороформ и снова подвергали хроматографии на силикагеле, элюируя смесью 0-100% этилацетат/гексан, с получением желаемого продукта (0,080 г, 14%): 1H ЯМР (400 МГц, CDCl3) δ 8,90 (д, J=2,7 Гц, 1H), 8,46 (дд, J=4,7, 1,3 Гц, 1H), 7,98 (ддд, J=8,3, 2,6, 1,5 Гц, 1H), 7,41 (дт, J=13,3, 6,6 Гц, 2H), 7,36 (ддд, J=8,3, 4,7, 0,7 Гц, 1H), 3,10 (кв, J=7,1 Гц, 2H), 1,27 (т, 3H).
Способ B:
К раствору трет-бутил этил(1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (3,4 г, 11,79 ммоль) в дихлорметане (4,54 мл) добавляли трифторуксусную кислоту (9 мл), и реакционную смесь перемешивали в течение 1 часа при комнатной температуре. Добавляли толуол и реакционную смесь концентрировали почти досуха. Реакционную смесь выливали в делительную воронку и осторожно гасили насыщенным водным NaHCO3, и экстрагировали дихлорэтаном. Органический слой сушили (MgSO4), фильтровали и концентрировали досуха. Сырой продукт очищали с помощью хроматографии на силикагеле (0-10% MeOH/дихлорметан) с получением желаемого продукта в виде масла бледно-желтого цвета (2,10 г, 95%): 1H ЯМР (400 МГц, CDCl3) δ 8,90 (дд, J=1,8, 0,8 Гц, 1H), 8,51-8,39 (м, 1H), 7,97 (ддт, J=8,3, 2,7, 1,3 Гц, 1H), 7,41 (д, J=0,8 Гц, 2H), 7,38-7,30 (м, 1H), 3,21-2,93 (м, 2H), 1,34-1,19 (м, 3H).
3-Хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амин был получен, как описано в примере 8, способ B: 1H ЯМР (400 МГц, CDCl3) δ 8,87 (д, J=2,5 Гц, 1H), 8,47 (дд, J=4,7, 1,2 Гц, 1H), 7,96 (ддд, J=8,4, 2,6, 1,4 Гц, 1H), 7,38-7,32 (м, 2H), 3,11 (кв, J=7,1 Гц, 2H), 2,97 (ушир. с, 1H), 1,31 (т, J=7,1 Гц, 3H).
3-Хлор-N-метил-1-(пиридин-3-ил)-1H-пиразол-4-амин был получен, как описано в примере 8, способ B: т. пл. 108-118°C; 1H ЯМР (400 МГц, CDCl3) δ 8,88 (д, J=2,4 Гц, 1H), 8,48 (дд, J=4,7, 1,4 Гц, 1H), 7,96 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,41-7,29 (м, 2H), 2,87 (с, 3H); EIMS m/z 208.
N,3-Диметил-1-(пиридин-3-ил)-1H-пиразол-4-амин был получен, как описано в примере 8, способ B: 1H ЯМР (400 МГц, CDCl3) δ 9,03-8,73 (м, 1H), 8,41 (дд, J=4,7, 1,4 Гц, 1H), 7,95 (ддд, J=8,4, 2,7, 1,4 Гц, 1H), 7,42-7,27 (м, 2H), 2,85 (с, 4H), 2,25 (с, 3H); EIMS m/z 189.
3-Хлор-N-(циклопропилметил)-1-(пиридин-3-ил)-1H-пиразол-4-амин был получен, как описано в примере 8, способ B: 1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,5 Гц, 1H), 8,47 (дд, J=4,7, 1,4 Гц, 1H), 8,03-7,89 (м, 1H), 7,40-7,29 (м, 2H), 3,21 (с, 1H), 2,91 (д, J=4,4 Гц, 2H), 1,18-1,02 (м, 1H), 0,65-0,45 (м, 2H), 0,41-0,12 (м, 2H).
3-Хлор-N-пропил-1-(пиридин-3-ил)-1H-пиразол-4-амин был получен, как описано в примере 8, способ B: 1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,6 Гц, 1H), 8,47 (дд, J=4,7, 1,4 Гц, 1H), 8,01-7,89 (м, 1H), 7,42-7,27 (м, 2H), 3,23-2,84 (м, 3H), 1,77-1,59 (м, 2H), 1,03 (т, J=7,4 Гц, 3H).
1-(5-Фторпиридин-3-ил)-N,3-диметил-1H-пиразол-4-амин был получен исходя из соответствующего Boc-амина, как описано в примере 8, способ B: т. пл. 142,0-143,5°C; 1H ЯМР (400 МГц, CDCl3) δ 8,67 (с, 1H), 8,26 (д, J=2,3 Гц, 1H), 7,73 (дт, J=10,0, 2,4 Гц, 1H), 7,27 (с, 1H), 2,92-2,81 (м, 4H), 2,24 (с, 3H); ESIMS m/z 207 ([M+H]+).
N-Этил-1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-амин был получен исходя из соответствующего Boc-амина, как описано в примере 8, способ B: т. пл. 85,0-86,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,66 (с, 1H), 8,25 (д, J=2,5 Гц, 1H), 7,72 (дт, J=10,0, 2,3 Гц, 1H), 7,27 (с, 1H), 3,07 (кв, J=7,1 Гц, 2H), 2,71 (с, 1H), 2,25 (с, 3H), 1,30 (т, J=7,1 Гц, 3H); ESIMS m/z 221 ([M+H]+).
3-Метил-N-пропил-1-(пиридин-3-ил)-1H-пиразол-4-амин был получен исходя из соответствующего Boc-амина, как описано в примере 8, способ B: т. пл. 65,0-67,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,4 Гц, 1H), 8,40 (дд, J=4,7, 1,4 Гц, 1H), 7,94 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,35-7,28 (м, 2H), 3,00 (т, J=7,1 Гц, 2H), 2,26 (с, 3H), 1,76-1,58 (м, 2H), 1,03 (т, J=7,4 Гц, 3H); ESIMS m/z 217 ([M+H]+).
N-(Циклопропилметил)-3-метил-1-(пиридин-3-ил)-1H-пиразол-4-амин был получен исходя из соответствующего Boc-амина, как описано в примере 8, способ B: т. пл. 73,0-75,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,4 Гц, 1H), 8,40 (дд, J=4,7, 1,3 Гц, 1H), 7,94 (ддд, J=8,3, 2,6, 1,5 Гц, 1H), 7,35-7,28 (м, 2H), 2,87 (д, J=6,9 Гц, 2H), 2,75 (с, 1H), 2,28 (с, 3H), 1,22-1,05 (м, 1H), 0,63-0,56 (м, 2H), 0,26 (кв, J=4,7 Гц, 2H); ESIMS m/z 229 ([M+H]+).
N-Изопропил-3-метил-1-(пиридин-3-ил)-1H-пиразол-4-амин был получен исходя из соответствующего Boc-амина, как описано в примере 8, способ B: ИК (тонкая пленка) 3303 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,3 Гц, 1H), 8,41 (дд, J=4,7, 1,4 Гц, 1H), 7,94 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,36-7,28 (м, 2H), 3,30 (гепт, J=6,3 Гц, 1H), 2,25 (с, 3H), 1,24 (д, J=6,3 Гц, 6H); EIMS m/z 216.
5-Этокси-1-(5-фторпиридин-3-ил)-N,3-диметил-1H-пиразол-4-амин был получен исходя из соответствующего Boc-амина, как описано в примере 8, способ B: ИК (тонкая пленка) 3340 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,91 (с, 1H), 8,31 (д, J=2,5 Гц, 1H), 7,88-7,80 (м, 1H), 4,24 (кв, J=7,1 Гц, 2H), 2,79 (с, 3H), 2,24 (с, 3H), 1,36 (т, J=7,1 Гц, 3H); EIMS m/z 250.
5-Бром-N-метил-1-(пиридин-3-ил)-1H-пиразол-4-амин был получен исходя из соответствующего Boc-амина, как описано в примере 8, способ B: т. пл. 77,0-79,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,90 (д, J=2,0 Гц, 1H), 8,63 (д, J=3,9 Гц, 1H), 7,93 (ддд, J=8,2, 2,4, 1,5 Гц, 1H), 7,51 (с, 1H), 7,43 (дд, J=8,2, 4,8 Гц, 1H), 4,49 (с, 1H), 2,91 (с, 3H); ESIMS m/z 255 ([M+2]+).
5-Фтор-N,3-диметил-1-(пиридин-3-ил)-1H-пиразол-4-амин был получен исходя из соответствующего Boc-амина, как описано в примере 8, способ B: 1H ЯМР (400 МГц, CDCl3) δ 8,91 (т, J=2,1 Гц, 1H), 8,50 (дд, J=4,8, 1,5 Гц, 1H), 7,93 (ддт, J=8,3, 2,8, 1,5 Гц, 1H), 7,37 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 2,86 (д, J=1,6 Гц, 3H), 2,43 (с, 2H), 2,24 (с, 3H); EIMS m/z 206.
5-Бром-N,3-диметил-1-(пиридин-3-ил)-1H-пиразол-4-амин был получен исходя из соответствующего Boc-амина, как описано в примере 8, способ B: 1H ЯМР (400 МГц, CDCl3) δ 8,86 (дд, J=2,5, 0,5 Гц, 1H), 8,59 (дд, J=4,8, 1,5 Гц, 1H), 7,88 (ддд, J=8,2, 2,6, 1,5 Гц, 1H), 7,40 (ддд, J=8,2, 4,8, 0,7 Гц, 1H), 2,85 (с, 3H), 2,69 (с, 1H), 2,35 (с, 3H); ESIMS m/z 268 ([M+H]+).
5-Хлор-N,3-диметил-1-(пиридин-3-ил)-1H-пиразол-4-амин был получен исходя из соответствующего Boc-амина, как описано в примере 8, способ B: 1H ЯМР (400 МГц, CDCl3) δ 8,87 (д, J=2,3 Гц, 1H), 8,59 (дд, J=4,8, 1,3 Гц, 1H), 7,90 (ддд, J=8,2, 2,6, 1,5 Гц, 1H), 7,40 (ддд, J=8,2, 4,8, 0,6 Гц, 1H), 2,87 (с, 3H), 2,45-2,19 (м, 4H); EIMS m/z 223.
3-Хлор-1-(5-фторпиридин-3-ил)-N-метил-1H-пиразол-4-амин был получен исходя из соответствующего Boc-амина, как описано в примере 8, способ B: т. пл. 117,5-119,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,68 (д, J=1,1 Гц, 1H), 8,33 (д, J=2,5 Гц, 1H), 7,75 (дт, J=9,6, 2,4 Гц, 1H), 7,31 (с, 1H), 3,14 (с, 1H), 2,87 (с, 3H); ESIMS m/z 227 ([M]+).
3-Хлор-N-этил-1-(5-фторпиридин-3-ил)-1H-пиразол-4-амин был получен исходя из соответствующего Boc-амина, как описано в примере 8, способ B: 1H ЯМР (400 МГц, CDCl3) δ 8,70-8,63 (м, 1H), 8,32 (д, J=2,4 Гц, 1H), 7,74 (дт, J=9,7, 2,4 Гц, 1H), 7,31 (с, 1H), 3,11 (кв, J=7,2 Гц, 2H), 1,31 (т, J=7,1 Гц, 3H).
1-(5-Фторпиридин-3-ил)-N-метил-3-винил-1H-пиразол-4-амин был получен исходя из соответствующего Boc-амина, как описано в примере 8, способ B: 105,0-107,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,72 (с, 1H), 8,31 (д, J=2,5 Гц, 1H), 7,81 (дт, J=9,8, 2,4 Гц, 1H), 7,33 (с, 1H), 6,75 (дд, J=18,0, 11,6 Гц, 1H), 5,83 (дд, J=18,0, 1,1 Гц, 1H), 5,46 (дд, J=11,6, 1,1 Гц, 1H), 2,86 (с, 3H); ESIMS m/z 219 ([M+H]+).
3-Циклопропил-1-(5-фторпиридин-3-ил)-N-метил-1H-пиразол-4-амин был получен исходя из соответствующего Boc-амина, как описано в примере 8, способ B: т. пл. 118,0-119,5°C; 1H ЯМР (400 МГц, CDCl3) δ 8,66-8,58 (м, 1H), 8,23 (д, J=2,5 Гц, 1H), 7,75-7,68 (м, 1H), 7,25 (с, 1H), 3,09 (с, 1H), 2,86 (с, 3H), 1,78-1,63 (м, 1H), 0,99-0,90 (м, 4H); ESIMS m/z 233 ([M+H]+).
3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-амин был получен исходя из соответствующего Boc-амина, как описано в примере 8, способ B: т. пл. 137,9-139,9; 1H ЯМР (400 МГц, CDCl3) δ 8,84 (д, J=2,4 Гц, 1H), 8,50 (дд, J=4,7, 1,4 Гц, 1H), 7,95 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,52 (с, 1H), 7,37 (ддд, J=8,4, 4,7, 0,7 Гц, 1H), 3,18 (с, 2H); ESIMS m/z 196 ([M+H]+).
2-((3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)амино)ацетонитрил был получен исходя из трет-бутил (3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(цианометил)карбамата, как в примере 8, способ B: т. пл. 141-143°C; 1H ЯМР (300 МГц, CDCl3) δ 8,91 (д, J=2,7 Гц, 1H), 8,54 (дд, J=5,1, 1,8 Гц, 1H), 7,97 (м, 1H), 7,62 (с, 1H), 7,38 (дд, J=12,0, 7,5 Гц, 1H), 4,97 (д, J=6,9 Гц, 2H), 3,52 (м, 1H); EIMS m/z 235 ([M+1]+).
N-3-Диметил-1-(пиримидин-5-ил)-1H-пиразол-4-амин был получен, как описано в примере 8, способ B: т. пл. 139-143°C; 1H ЯМР (400 МГц, CDCl3) δ 9,02 (с, 2H), 9,00 (с, 1H), 7,30 (с, 1H), 2,87 (д, J=11,5 Гц, 3H), 2,27 (с, 3H); ESIMS m/z 190 ([M+H]).
3-Хлор-N-метил-1-(пиримидин-5-ил)1-1H-пиразол-4-амин был получен, как описано в примере 8, способ B: т. пл. 111-114°C; 1H ЯМР (400 МГц, CDCl3) δ 9,09-9,04 (м, 1H), 9,02 (с, 2H), 7,30 (с, 1H), 3,14 (ушир. с, 1H), 2,88 (с, 3H); ESIMS m/z 196 ([M+H]).
1-(5-Фтор-3-пиридил)-3-метил-N-(тридейтериометил)пиразол-4-амин был получен исходя из соединения 380 с использованием способа, как описано в примере 8, способ B: т. пл. 146-148°C; 1H ЯМР (400 МГц, CDCl3) δ 8,67 (с, 1H), 8,25 (д, J=2,5 Гц, 1H), 7,73 (дт, J=10,0, 2,3 Гц, 1H), 7,27 (с, 1H), 2,87 (с, 1H), 2,24 (с, 3H); ESIMS m/z 210 ([M+H]+); ИК (тонкая пленка) 1599 см-1.
3-Хлор-1-(3-пиридил)-N-(тридейтериометил)пиразол-4-амин был получен исходя из соединения 381 с использованием способа, как описано в примере 8, способ B: т. пл. 104-106°C; 1H ЯМР (400 МГц, CDCl3) δ 8,87 (д, J=1,9 Гц, 1H), 8,47 (д, J=4,7 Гц, 1H), 8,00-7,90 (м, 1H), 7,40-7,30 (м, 2H), 3,10 (с, 1H); ESIMS m/z 212 ([M+H]+); ИК (тонкая пленка) 1579 см-1.
3-Хлор-N-(циклопропилметил)-1-(пиридин-3-ил)-1H-пиразол-4-амин был получен исходя из соединения 361 с использованием способа, как описано в примере 8, способ B: т. пл. 82-83°C; 1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,5 Гц, 1H), 8,47 (дд, J=4,7, 1,3 Гц, 1H), 7,95 (ддд, J=8,4, 2,7, 1,5 Гц, 1H), 7,38-7,32 (м, 2H), 3,22 (с, 1H), 2,90 (д, J=6,9 Гц, 2H), 1,23-1,06 (м, 1H), 0,65-0,53 (м, 2H), 0,31-0,19 (м, 2H); ESIMS m/z 249 ([M+H]+).
3-Хлор-N-пропил-1-(пиридин-3-ил)-1H-пиразол-4-амин был получен исходя из соединения 360 с использованием способа, как описано в примере 8, способ B: т. пл. 92-94°C; 1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,6 Гц, 1H), 8,47 (дд, J=4,7, 1,4 Гц, 1H), 7,95 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,35 (ддд, J=8,4, 4,7, 0,6 Гц, 1H), 7,33 (с, 1H), 3,22-2,94 (м, 3H), 1,75-1,52 (м, 2H), 1,02 (т, J=7,4 Гц, 3H); ESIMS m/z 237 ([M+H]+).
3-Хлор-1-(пиридин-3-ил)-N-(4,4,4-трифторбутил)-1H-пиразол-4-амин был получен исходя из соответствующего Boc-амина, как описано в примере 8, способ B: ИК (тонкая пленка) 3416, 3089 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,5 Гц, 1H), 8,48 (дд, J=4,7, 1,3 Гц, 1H), 7,95 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,42-7,31 (мультиплет, 2H), 3,16 (дд, J=13,0, 6,5 Гц, 2H), 3,08 (д, J=5,6 Гц, 1H), 2,35-2,18 (м, 2H), 2,00-1,86 (м, 2H); ESIMS m/z 307 ([M+2H]+).
3-Хлор-1-(пиридин-3-ил)-N-(5,5,5-трифторпентил)-1H-пиразол-4-амин был получен исходя из соответствующего Boc-амина, как описано в примере 8, способ B: ИК (тонкая пленка) 3087 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,5 Гц, 1H), 8,48 (дд, J=4,7, 1,4 Гц, 1H), 7,96 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,36 (ддд, J=8,3, 4,8, 0,6 Гц, 1H), 7,34 (с, 1H), 3,10 (с, 2H), 3,04 (с, 1H), 2,30-1,98 (м, 2H), 1,84-1,69 (мультиплет, 4H); 19F ЯМР (376 МГц, CDCl3) δ -66,28; ESIMS m/z 320 ([M+2H]+).
3-Хлор-N-(4-фторбутил)-1-(пиридин-3-ил)-1H-пиразол-4-амин был получен исходя из соответствующего Boc-амина, как описано в примере 8, способ B: т. пл. 82-83°C; ИК (тонкая пленка) 3348, 3086 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,5 Гц, 1H), 8,47 (дд, J=4,7, 1,4 Гц, 1H), 7,95 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,38-7,33 (мультиплет, 2H), 4,58 (т, J=5,7 Гц, 1H), 4,50-4,42 (м, 1H), 3,11 (мультиплет, 3H), 1,90-1,76 (мультиплет, 4H); ESIMS m/z 269 ([M+H]+).
3-Хлор-N-изопропил-1-(пиридин-3-ил)-1H-пиразол-4-амин был получен исходя из соответствующего Boc-амина, как описано в примере 8, способ B: ИК (тонкая пленка) 3318, 1583 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,7 Гц, 1H), 8,47 (дд, J=4,7, 1,4 Гц, 1H), 7,96 (ддд, J=8,4, 2,7, 1,5 Гц, 1H), 7,36 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 7,31 (с, 1H), 2,87 (д, J=6,8 Гц, 2H), 1,92 (дкв, J=13,4, 6,7 Гц, 1H), 1,02 (д, J=6,7 Гц, 6H); ESIMS m/z 251 ([M+H]+).
3-Хлор-N-(2-метоксиэтил)-1-(пиридин-3-ил)-1H-пиразол-4-амин был получен исходя из соответствующего Boc-амина, как описано в примере 8, способ B: ИК (тонкая пленка) 3364, 1485 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,86 (дд, J=2,7, 0,7 Гц, 1H), 8,48 (дд, J=4,7, 1,5 Гц, 1H), 7,96 (ддд, J=8,4, 2,7, 1,5 Гц, 1H), 7,38 (с, 1H), 7,38-7,34 (м, 1H), 3,68-3,59 (м, 2H), 3,49 (с, 1H), 3,42 (с, 3H), 3,24 (д, J=7,3 Гц, 2H); ESIMS m/z 253 ([M+H]+).
3-Хлор-N-((2,2-дифторциклопропил)метил)-1-(пиридин-3-ил)-1H-пиразол-4-амин был получен исходя из соответствующего Boc-амина, как описано в примере 8, способ B: 1H ЯМР (400 МГц, CDCl3) δ 8,87 (д, J=2,6 Гц, 1H), 8,49 (дд, J=4,7, 1,5 Гц, 1H), 7,96 (ддд, J=8,4, 2,7, 1,4 Гц, 1H), 7,41 (с, 1H), 7,37 (ддд, J=8,3, 4,7, 0,7 Гц, 1H), 3,19 (тд, J=15,5, 13,0, 6,8 Гц, 2H), 2,00-1,84 (м, 1H), 1,55 (м, 1H), 1,26 (с, 1H), 1,23-1,11 (м, 1H); 19F ЯМР (376 МГц, CDCl3) δ -128,61 (д, J=159,5 Гц), -143,58 (д, J=160,0 Гц); ESIMS m/z 285 ([M+H]+).
3-Хлор-N-(3-фторпропил)-1-(пиридин-3-ил)-1H-пиразол-4-амин был получен исходя из соответствующего Boc-амина, как описано в примере 8, способ B: ИК (тонкая пленка) 3359 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,87 (д, J=2,7 Гц, 1H), 8,48 (дд, J=4,7, 1,4 Гц, 1H), 7,95 (ддд, J=8,3, 2,6, 1,4 Гц, 1H), 7,39-7,34 (мультиплет, 2H), 4,63 (дт, J=47,2, 5,6 Гц, 2H), 3,25 (т, J=6,7 Гц, 2H), 3,18 (ушир. с, 1H), 2,17-1,92 (м, 2H); ESIMS m/z 255 ([M+H]+).
N-Аллил-3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-амин был получен исходя из соответствующего Boc-амина, как описано в примере 8, способ B: ИК (тонкая пленка) 3291 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,85 (д, J=2,6 Гц, 1H), 8,48 (дд, J=4,8, 1,5 Гц, 1H), 7,95 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,38-7,35 (м, 1H), 7,34 (с, 1H), 5,97 (ддт, J=17,3, 10,6, 5,5 Гц, 1H), 5,34 (дкв, J=17,2, 1,6 Гц, 1H), 5,23 (дкв, J=10,3, 1,5 Гц, 1H), 3,73 (дт, J=5,5, 1,6 Гц, 2H), 3,25 (с, 1H); ESIMS m/z 235 ([M+H]+).
2-((3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)амино)этилацетат был получен из соответствующего Boc-амина, как описано в примере 8, способ B: ИК (тонкая пленка) 3361, 1733 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,87 (с, 1H), 8,49 (д, J=4,7 Гц, 1H), 7,96 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,43 (с, 1H), 7,37 (дд, J=8,4, 4,7 Гц, 1H), 4,30 (дд, J=5,9, 4,8 Гц, 2H), 3,34 (т, J=5,5 Гц, 2H), 2,12 (с, 3H), 1,59 (с, 1H); ESIMS m/z 281 ([M+H]+).
3-Хлор-N-(2-фторэтил)-1-(пиридин-3-ил)-1H-пиразол-4-амин был получен исходя из соответствующего Boc-амина, как описано в примере 8, способ B: ИК (тонкая пленка) 3369 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,7 Гц, 1H), 8,49 (дд, J=4,7, 1,4 Гц, 1H), 7,96 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,40 (с, 1H), 7,37 (дд, J=8,3, 4,7 Гц, 1H), 4,82-4,53 (м, 2H), 3,54-3,27 (мультиплет, 3H); ESIMS m/z 241 ([M+H]+).
3-Хлор-1-(пиридин-3-ил)-N-(2-(пирролидин-1-ил)этил)-1H-пиразол-4-амин был получен исходя из соответствующего Boc-амина, как описано в примере 8, способ B: ESIMS m/z 292 ([M+H]+).
3-Хлор-N-(2,2-дифторэтил)-1-(пиридин-3-ил)-1H-пиразол-4-амин был получен исходя из соответствующего Boc-амина, как описано в примере 8, способ B: ИК (тонкая пленка) 3295 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,87 (дд, J=2,8, 0,7 Гц, 1H), 8,51 (дд, J=4,7, 1,4 Гц, 1H), 7,95 (ддд, J=8,4, 2,7, 1,5 Гц, 1H), 7,45 (с, 1H), 7,37 (ддд, J=8,5, 4,7, 0,8 Гц, 1H), 5,96 (тт, J=55,9, 4,1 Гц, 1H), 3,69-3,26 (мультиплет, 3H); 19F ЯМР (376 МГц, CDCl3) δ -122,15; ESIMS m/z 259 ([M+H]+).
3-Хлор-1-(пиридин-3-ил)-N-(2,2,2-трифторэтил)-1H-пиразол-4-амин был получен исходя из соответствующего Boc-амина, как описано в примере 8, способ B: ИК (тонкая пленка) 3309 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,92-8,85 (м, 1H), 8,52 (дд, J=4,8, 1,4 Гц, 1H), 7,98 (ддд, J=8,4, 2,7, 1,5 Гц, 1H), 7,47 (с, 1H), 7,40 (ддд, J=8,4, 4,8, 0,7 Гц, 1H), 3,68 (кв, J=8,9 Гц, 2H), 3,49 (с, 1H); 19F ЯМР (376 МГц, CDCl3) δ -72,29; ESIMS m/z 277 ([M+H]+).
3-Хлор-N-(2-хлорэтил)-1-(пиридин-3-ил)-1H-пиразол-4-амин был получен исходя из соответствующего Boc-амина, как описано в примере 8, способ B: ИК (тонкая пленка) 3354 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,86 (дд, J=2,7, 0,7 Гц, 1H), 8,50 (дд, J=4,8, 1,5 Гц, 1H), 7,96 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,40 (с, 1H), 7,37 (ддд, J=8,5, 4,8, 0,8 Гц, 1H), 3,76 (дд, J=6,0, 5,4 Гц, 2H), 3,54 (с, 1H), 3,43 (т, J=5,7 Гц, 2H); ESIMS m/z 257 ([M+H]+).
3-Хлор-1-(пиридин-3-ил)-N-(3,3,3-трифторпропил)-1H-пиразол-4-амин был получен исходя из соответствующего Boc-амина, как описано в примере 8, способ B: ИК (тонкая пленка) 3366, 3081 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,87 (дд, J=2,6, 0,7 Гц, 1H), 8,50 (дд, J=4,7, 1,4 Гц, 1H), 7,96 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,40-7,35 (мультиплет, 2H), 3,38 (кв, J=6,8 Гц, 2H), 3,22 (т, J=6,7 Гц, 1H), 2,48 (квт, J=10,7, 7,0 Гц, 2H); 19F ЯМР (376 МГц, CDCl3) δ -64,99; ESIMS m/z 291 ([M+H]+).
N-(бут-2-ин-1-ил)-3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-амин был получен исходя из соответствующего Boc-амина, как описано в примере 8, способ B: ИК (тонкая пленка) 3249, 3122 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,89 (дд, J=2,7, 0,7 Гц, 1H), 8,49 (дд, J=4,8, 1,5 Гц, 1H), 7,98 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,50 (с, 1H), 7,37 (ддд, J=8,4, 4,8, 0,8 Гц, 1H), 3,93-3,68 (м, 2H), 3,33 (с, 1H), 1,83 (т, J=2,4 Гц, 3H); ESIMS m/z 247 ([M+H]+).
3-Хлор-N-изобутил-1-(пиридин-3-ил)-1H-пиразол-4-амин был получен, как описано в примере 8, способ B: 1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,5 Гц, 1H), 8,47 (дд, J=4,7, 1,3 Гц, 1H), 7,95 (ддд, J=8,4, 2,7, 1,5 Гц, 1H), 7,35 (ддд, J=8,3, 4,7, 0,6 Гц, 1H), 7,31 (с, 1H), 3,11 (ушир. с, 1H), 2,87 (т, J=6,5 Гц, 2H), 1,93 (дп, J=13,4, 6,7 Гц, 1H), 1,01 (д, J=6,7 Гц, 6H).
Пример 9: Получение изопропил-(1-пиридин-3-ил-1H-пиразол-4-ил)амина
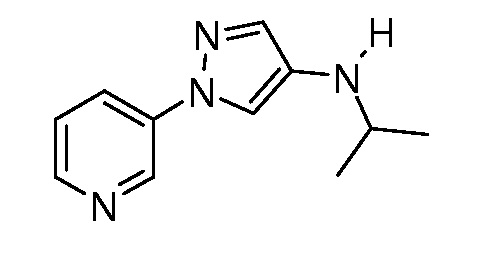
1-Пиридин-3-ил-1H-пиразол-4-иламин (0,6 г, 3,7 ммоль) растворяли в изопропилацетате (8,5 мл). В смесь добавляли ацетон (0,261 г, 4,5 ммоль), трифторуксусную кислоту (0,855 г, 7,5 ммоль) и триацетоксиборгидрид натрия (0,945 г, 4,5 ммоль). Реакционную смесь перемешивали в атмосфере азота при комнатной температуре в течение 4,5 часов и затем гасили 10%-ым раствором гидроксида натрия до достижения pH ~9. Слои разделяли, и водную фазу экстрагировали этилацетатом. Органические экстракты объединяли, сушили над сульфатом натрия и концентрировали досуха. Сырое вещество очищали с помощью хроматографии на силикагеле (градиентное элюирование смесью 5% метанол/дихлорметан) с получением указанного в заголовке соединения в виде твердого вещества не совсем белого цвета (0,35 г, 46%): т. пл. 105-107°C; 1H ЯМР (300 МГц, CDCl3) δ 8,82 (д, J=2,2 Гц, 1H), 8,63 (дд, J=4,8, 1,5 Гц, 1H), 8,13 (д, J=1,8 Гц, 1H), 8,03 (д, J=2,7 Гц, 1H), 7,94-7,77 (м, 1H), 7,38 (дт, J=15,2, 7,6 Гц, 1H), 6,99 (т, 1H), 3,72 (м, 1H), 1,30 (т, J=10,0 Гц, 6H).ESIMS 214 m/z (M+1).
Пример 10: Получение пропил-(1-пиридин-3-ил-1H-пиразол-4-иламина
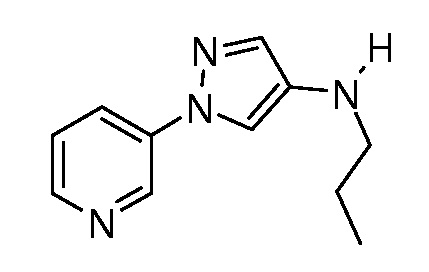
К 1-пиридин-3-ил-1H-пиразол-4-иламину (0,5 г, 3,12 ммоль) в дихлорметане (5 мл) добавляли пропиональдегид (0,18 г, 3,12 ммоль) и триацетоксиборгидрид натрия (0,99 г, 4,68 ммоль) и перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь обрабатывали дихлорметаном и промывали водой и насыщенным солевым раствором. Органический слой сушили (MgSO4), фильтровали и концентрировали досуха. Сырое вещество очищали с помощью хроматографии на силикагеле, элюируя смесью 0-5% MeOH/дихлорметан, и снова обрабатывали смесью 0-100% этилацетат/гексан с получением указанного в заголовке соединения в виде темного масла (0,05 г, 7%); 1H ЯМР (300 МГц, CDCl3) δ 8,92 (д, J=2,6 Гц, 1H), 8,48 (дд, J=4,7, 1,4 Гц, 1H), 8,00 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,47-7,40 (м, 2H), 7,37 (дд, J=8,3, 4,7 Гц, 1H), 3,04 (т, J=7,1 Гц, 3H), 1,92-1,46 (м, 2H), 1,03 (т, J=7,4 Гц, 3H).
Пример 11: Получение N-метил-N-(1-пиридин-3-ил-1H-пиразол-4-ил)изобутирамида (соединение 42)
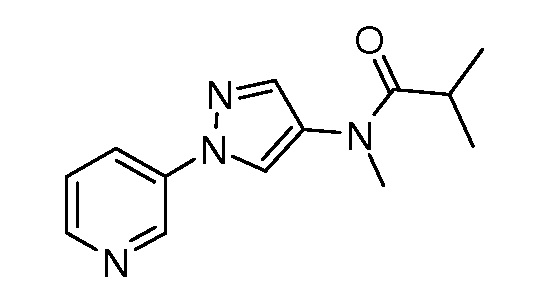
Раствор изобутирилхлорида (0,138 г, 1,3 ммоль) в дихлорэтане (1 мл) добавляли со скоростью капель из пипетки в ледяную суспензию метил-(1-пиридин-3-ил-1H-пиразол-4-ил)амина (0,15 г, 0,86 ммоль) в дихлорэтане (5 мл), перемешивали в течение 10 минут и затем обрабатывали со скоростью капель раствором 4-N,N-диметиламинопиридина (0,11 г, 0,9 ммоль) в дихлорэтане (1,5 мл). Охлаждающую баню отставляли спустя 30 минут, перемешивали в атмосфере азота при комнатной температуре в течение 14 часов, разбавляли дихлорэтаном (40 мл), промывали водой (30 мл), насыщенным солевым раствором (10 мл), сушили над MgSO4 и очищали с помощью обращенно-фазовой хроматографии на колонке с получением смолы желтоватого цвета (0,114 г, 54%); 1H ЯМР (300 МГц, CDCl3) δ 9,01-8,93 (м, 1H), 8,67 (с, 0,4H), 8,61 (д, J=4,2 Гц, 0,6H), 8,54 (д, 0,4H), 8,08-8,02 (м, 1H), 7,96 (с, 0,6H), 7,80 (с, 0,4H), 7,70 (с, 0,6H), 7,47-7,37 (м, 1H), 3,49 (с, 1,2H), 3,26 (с, 2,8H), 3,06-2,98 (м, 0,4H), 2,86-2,70 (м, 0,6H), 1,25 (д, J=6,1 Гц, 2,4H), 1,09 (д, J=6,6 Гц, 3,6H). ESIMS m/z 245 ([M+1]).
Соединения 32-41, 43-52, 54-56, 59-61, 66, 73-75, 77-79, 82-85, 93-100, 113, 117-129, 131-134, 139-140, 142-144, 148, 160, 163, 173-175, 184-186, 197-198, 202, 208, 215-217, 252-253, 277, 282-285, 287-290, 314-316, 347, 350-351, 353-355, 365-367, 370, 388, 395, 399-403, 407, 409, 415-418, 444-449, 452-454, 462-463, 465, 467-469, 496-498, 506-507, 512, 525-527, 569, 577, 581, 591 и 592 были получены из соответствующих аминов в соответствии со способами, описанными в примере 11.
Пример 12: Получение 4,4,4-трифтор-2-метил-N-(1-(пиридин-3-ил)-1H-пиразол-4-ил)бутанамида (соединение 65)
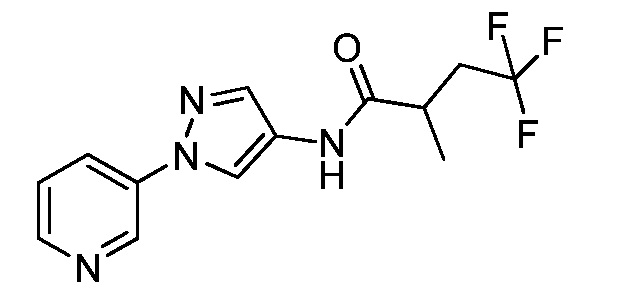
К раствору 1-(пиридин-3-ил)-1H-пиразол-4-амина (0,150 г, 0,93 ммоль) в дихлорэтане (1,8 мл) добавляли 4,4,4-трифтор-2-метилбутановую кислоту (0,14 г, 0,93 ммоль) и 4-N,N-диметиламинопиридин (0,23 г, 1,87 ммоль), затем гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (0,36 г, 1,87 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали, и сырой продукт очищали с помощью хроматографии на силикагеле, элюируя смесью 0-5% MeOH/дихлорметан, с получением твердого вещества белого цвета (0,15 г, 55%); т. пл. 140-145°C; 1H ЯМР (400 МГц, CDCl3) δ 9,00 (д, J=2,4 Гц, 1H), 8,62-8,47 (м, 2H), 8,01 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,68 (с, 1H), 7,53 (ушир. с, 1H), 7,40 (ддд, J=8,3, 4,8, 0,6 Гц, 1H), 2,92-2,61 (м, 2H), 2,32-2,05 (м, 1H), 1,38 (д, J=6,6 Гц, 3H); ESIMS m/z 300 ([M+2]).
Соединения 53, 58, 62-63, 72, 76, 80-81, 107-108, 136-138, 147, 151-159, 164-168, 176-179, 187-196, 201, 203-207, 209-214, 220, 224-249, 251, 259-275, 286, 292-296, 303-313, 323-326, 341-344, 356-359, 371, 378-379, 382, 384, 419-426, 439-443, 455, 458-461, 464, 466, 476, 486, 490-493, 505, 508, 517, 528-529, 536-537, 539-541, 544-545, 549-554, 572-577, 578, 579 и 580 были получены исходя из соответствующих аминов в соответствии со способами, описанными в примере 12.
Пример 13: Получение трет-бутил 1-(пиридин-3-ил)-1H-пиразол-4-илкарбамата (соединение 57)
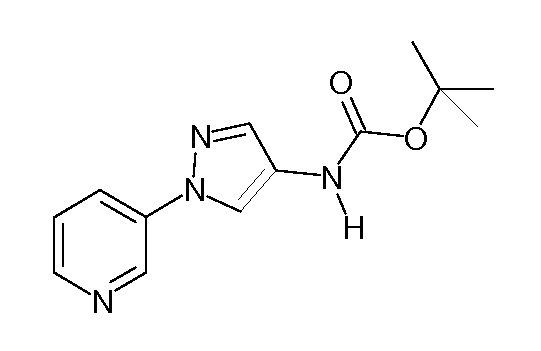
Способ A:
К раствору 1-(пиридин-3-ил)-1H-пиразол-4-амина (3 г, 18,73 ммоль) в дихлорметане (33,4 мл) добавляли триэтиламин (3,13 мл, 7,68 ммоль) и BOC-ангидрид (4,5 г, 20,60 ммоль). Полученный раствор перемешивали при комнатной температуре в течение ночи. Реакционную смесь распределяли между этилацетатом и водой. Органическую часть сушили (MgSO4), фильтровали и концентрировали досуха. Сырой продукт очищали с помощью хроматографии на силикагеле, элюируя смесью 0-100% этилацетат/гексан, с получением твердого вещества белого цвета (2,0 г, 41%); т. пл. 108-112°C; 1H ЯМР (400 МГц, CDCl3) δ 9,02 (д, J=2,2 Гц, 1H), 8,51 (т, J=8,7 Гц, 1H), 8,37 (с, 1H), 8,30 (с, 1H), 7,98 (ддд, J=8,3, 2,4, 1,3 Гц, 1H), 7,68 (с, 1H), 7,36 (дд, J=8,2, 4,8 Гц, 1H), 1,52 (с, 9H); ESIMS m/z 261 ([M+1]).
Соединения 64 и 130 были получены в соответствии со способами, описанными в примере 13, способ A.
Способ B:
К раствору 1-(пиридин-3-ил)-1H-пиразол-4-амина (0,1 г, 0,624 ммоль) и ди-трет-бутил дикарбоната (0,161 мл, 0,693 ммоль) в тетрагидрофуране (1,890 мл) и воде (0,568 мл) добавляли по каплям насыщенный водный раствор бикарбоната натрия (0,572 мл, 0,687 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли водой и экстрагировали этилацетатом. Объединенные органические фазы концентрировали с получением трет-бутил 1-(пиридин-3-ил)-1H-пиразол-4-илкарбамата (135 мг, 0,519 ммоль, 83%), аналитические данные которого соответствуют тем, которые приведены в примере 13, способ A.
Соединения 150, 172, 223 и 317 были получены в соответствии со способами, описанными в примере 13, способ B. Соединения 172 и 317 также были получены в соответствии со способами, описанными в примере 17. Эти соединения, а также некоторые другие соединения были получены альтернативными способами, иллюстрирующими далее конкретные варианты осуществления изобретения.
Пример 14: Получение трет-бутил метил(1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (соединение 67)
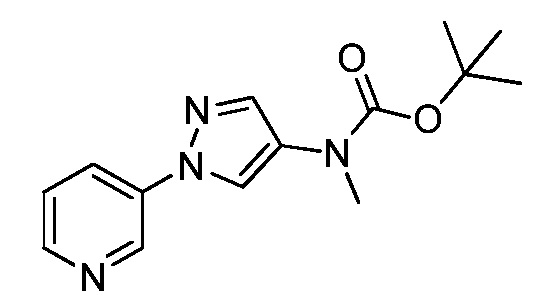
К раствору трет-бутил 1-(пиридин-3-ил)-1H-пиразол-4-илкарбамата (1,6 г, 6,15 ммоль) в ДМФ (30,7 мл) при температуре 0°C одной порцией добавляли гидрид натрия (0,34 г, 8,61 ммоль, 60%-ая дисперсия в минеральном масле), и суспензию перемешивали в течение 30 минут. Баню со льдом отставляли и перемешивали в течение еще 30 минут. Одной порцией добавляли йодметан (0,46 мл, 7,38 ммоль) и перемешивали в течение ночи при комнатной температуре. Добавляли воду и этилацетат и полученную двухфазную смесь разделяли. Водный слой экстрагировали один раз этилацетатом. Объединенные органические экстракты промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали досуха. Сырой продукт очищали с помощью хроматографии на силикагеле, элюируя смесью 0-35% этилацетат/гексаны, с получением полутвердого вещества светло-желтого цвета (0,85 г, 50%): ИК (KBr) 1703 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,98 (с, 1H), 8,52 (д, J=3,8 Гц, 1H), 8,32 (с, 0,5H), 8,13-7,97 (м, 1H), 7,84 (с, 0,5H), 7,74 (с, 1H), 7,39 (дд, J=8,0, 4,8 Гц, 1H), 3,30 (с, 3H), 1,56 (с, 9H); ESIMS m/z 275 ([M+H]).
Соединения 68, 86-92, 105-106, 114-116, 141, 149, 161-162, 199-200, 254, 258, 291, 332, 352, 360-361, 380-381, 414, 430-431, 450, 457, 474-475, 485, 488, 510-511, 515, 523 и 590 были получены исходя из соответствующих амидов в соответствии со способами, описанными в примере 14.
Трет-бутил метил-(3-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамат был получен, как описано в примере 14: 1H ЯМР (400 МГц, CDCl3) δ 8,91 (д, J=2,5 Гц, 1H), 8,51 (дд, J=4,7, 1,3 Гц, 1H), 8,00 (ддд, J=8,3, 2,4, 1,4 Гц, 1H), 7,83 (с, 1H), 7,38 (дд, J=8,3, 4,7 Гц, 1H), 3,20 (с, 3H), 2,22 (с, 3H), 1,60-1,30 (м, 9H).
Пример 15: Получение N-этил-N-(1-метил-3-(пиридин-3-ил)-1H-пиразол-5-ил)изобутирамида (соединение 23)
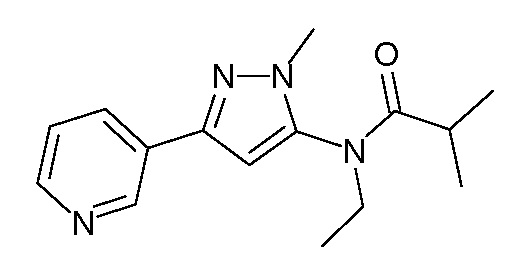
К раствору N-(1-метил-3-(пиридин-3-ил)-1H-пиразол-5-ил)изобутирамида (0,08 г, 0,33 ммоль) в ДМФ (0,66 мл) при температуре 0°C одной порцией добавляли гидрид натрия (0,016 г, 0,39 ммоль, 60%-ая дисперсия в минеральном масле), и суспензию перемешивали в течение 30 минут. Баню со льдом отставляли и перемешивали в течение еще 30 минут. Одной порцией добавляли йодэтан (0,06 г, 0,39 ммоль) и перемешивали в течение ночи при комнатной температуре. Добавляли воду и этилацетат и полученную двухфазную смесь разделяли. Водный слой экстрагировали один раз этилацетатом. Объединенные органические экстракты промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали досуха. Сырой продукт очищали с помощью хроматографии на силикагеле с получением указанного в заголовке соединения в виде прозрачного масла (27,5 мг, 30%): 1H ЯМР (300 МГц, CDCl3) δ 9,00 (ушир. с, 1H), 8,57 (с, 1H), 8,09 (дд, J=7,9 Гц, 1H), 7,34 (дд, 1H), 6,48 (с, 1H), 4,00 (м, 1H), 3,76 (с, 3H), 3,36 (м, 1H), 2,33 (м, 1H), 1,17 (т, J=7,1 Гц, 3H), 1,08 (т, J=6,7 Гц, 6H); ESIMS m/z 273 (M+H).
Соединение 22 получали в соответствии со способами, описанными в примере 15.
Пример 16: Получение 5-бром-1H-пиразол-4-амина, HBr
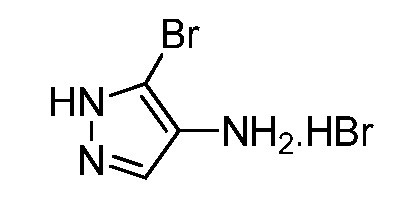
Смесь 4-нитро-1H-пиразола (10 г, 88 ммоль) и 5%-го палладия на Al2O3 (1 г) в смеси этанола (150 мл) и 50%-ой водной HBr (50 мл) встряхивали на аппарате Парра в атмосфере водорода (10 фунтов на квадратный дюйм) в течение 36 ч. Смесь фильтровали, и катализатор промывали этанолом. Фильтрат концентрировали в вакууме с получением твердого вещества белого цвета. Указанное твердое вещество суспендировали в 10 мл этанола. После взбалтывания колбы в течение 5 мин добавляли диэтиловый эфир для завершения кристаллизации. Твердое вещество фильтровали, промывали эфиром и сушили в высоком вакууме с получением 5-бром-1H-пиразол-4-амина, HBr (18,1 г, 84%-ый выход) в виде твердого вещества белого цвета: т. пл. 248°C с разл.; 1H ЯМР (400 МГц, ДМСО-d6) δ 11,47 (с, 1H), 10,00 (с, 1H), 7,79 (с, 1H).
Пример 17: Получение трет-бутил (3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (соединение 172)
Пример 17, стадия 1: Получение гидрохлорида 3-хлор-1H-пиразол-4-амина
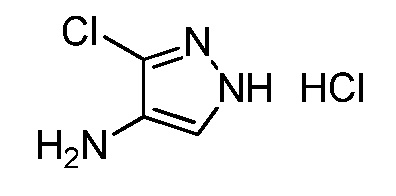
В 2-л трехлитровую круглодонную колбу, снабженную мешалкой, датчиком температуры, капельной воронкой и трубкой для ввода азота, помещали этанол (600 мл) и 4-нитро-1H-пиразол (50,6 г, 447 ммоль). В указанный раствор добавляли одной порцией концентрированную HCl (368 мл) (внимание: быстрый разогрев от 15°C до 39°C) и полученную смесь продували азотом в течение 5 минут. К смеси добавляли палладий на оксиде алюминия (5% масс/масс) (2,6 г, Alfa, темное твердое вещество) и перемешивали при комнатной температуре, при этом в течение 4 ч добавляли по каплям триэтилсилан (208 г, 1789 ммоль). Реакционную смесь, которая начала медленно нагреваться от 35°C до 55°C в течение 2,0 ч, перемешивали в течение всего 16 ч и фильтровали в вакууме через слой из Целита® с получением двухфазной смеси. Смесь переносили в делительную воронку, нижний водный слой отбирали и упаривали досуха на роторном испарителе (60°C, 50 мм рт. ст.) с помощью ацетонитрила (3×350 мл). Полученное твердое вещество желтого цвета суспендировали в ацетонитриле (150 мл) и оставляли стоять в течение 2 ч при комнатной температуре, затем 1 ч при температуре 0°C в холодильнике. Твердые вещества отфильтровали и промывали ацетонитрилом (100 мл) с получением указанного в заголовке соединения гидрохлорида 3-хлор-1H-пиразол-4-амина (84 г, 97%-ый выход, 80%-ой чистоты) в виде твердого вещества белого цвета: т. пл. 190-193°C; 1H ЯМР (400 МГц, ДМСО-d6) δ 10,46-10,24 (ушир. с, 2H), 8,03 (с, 0,54H), 7,75 (с, 0,46H), 5,95 (ушир. с, 1H)); 13C-ЯМР (101 МГц, ДМСО) δ 128,24, 125,97, 116,71.
Пример 17, стадия 2: Получение трет-бутил (3-хлор-1H-пиразол-4-ил)карбамата
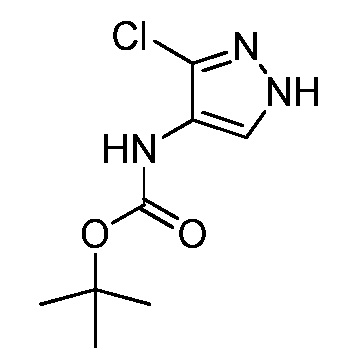
В 2-л круглодонную колбу добавляли гидрохлорид 3-хлор-1H-пиразол-4-амина (100 г, 649 ммоль) и ТГФ (500 мл). К данной смеси добавляли ди-трет-бутилдикарбонат (156 г, 714 ммоль), затем бикарбонат натрия (120 г, 1429 ммоль) и воду (50,0 мл). Смесь перемешивали в течение 16 ч, разбавляли водой (500 мл) и этилацетатом (500 мл) и переносили в делительную воронку. Это давало три слоя; нижний - студенистый осадок белого цвета, средний - жидкость светло-желтого цвета, верхний - органическое вещество каштанового цвета. Фазы разделяли, собирая вместе студенистый осадок белого цвета и водный слой. Водный слой экстрагировали этилацетатом (2×200 мл), и этилацетатные экстракты объединяли, промывали насыщенным солевым раствором (200 мл), сушили над безводным сульфатом натрия, фильтровали и упаривали на роторе с получением густого масла каштанового цвета (160 г). Густое масло суспендировали в гексане (1000 мл) и перемешивали при температуре 55°C в течение 2 ч. Это давало суспензию светло-коричневого цвета. Смесь охлаждали до температуры 0°C, и твердое вещество собирали с помощью фильтрования в вакууме и промывали гексаном (2×10 мл). Образец сушили на воздухе до постоянной массы с получением (3-хлор-1H-пиразол-4-ил)карбамата (102,97 г, 72%-ый выход, 80%-ой чистоты) в виде твердого вещества светло-коричневого цвета: т. пл. 137-138°C; 1H ЯМР (400 МГц, CDCl3) δ 10,69 (с, 1H), 7,91 (с, 1H), 1,52 (с, 9H).
Пример 17, стадия 3: Получение трет-бутил (3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (соединение 172)
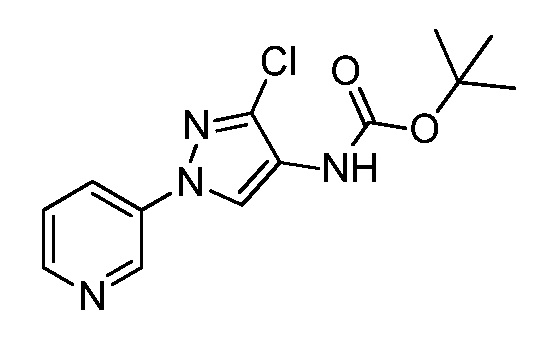
В сухую 2-л круглодонную колбу, снабженную механической мешалкой, трубкой для подачи азота, термометром и обратным холодильником, помещали 3-йодпиридин (113,0 г, 551 ммоль), (3-хлор-1H-пиразол-4-ил)карбамат (100 г, 459 ммоль), фосфат калия (измельченный в порошок в ступке с пестиком) (195 г, 919 ммоль) и хлорид меди (3,09, 22,97 ммоль). Добавляли ацетонитрил (1 л), затем N1,N2-диметилэтан-1,2-диамин (101 г, 1149 ммоль) и смесь нагревали при температуре 81°C в течение 4 часов. Смесь охлаждали до комнатной температуры и фильтровали через слой из Целита®. Фильтрат переносили в 4-л колбу Эрленмейера, снабженную механической мешалкой, и разбавляли водой до общего объема примерно 4 л. Смесь перемешивали в течение 30 минут при комнатной температуре, и полученное твердое вещество собирали с помощью фильтрования в вакууме. Твердое вещество промывали водой и сушили в печи в течение нескольких дней в вакууме при температуре 40°C до постоянной массы с получением трет-бутил (3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (117,8 г, 87%-ый выход, 80%-ой чистоты) в виде твердого вещества рыжевато-коричневого цвета: т. пл. 140-143°C; 1H ЯМР (400 МГц, CDCl3) δ 8,96 (с, 1H), 8,53 (дд, J=4,7, 1,2 Гц, 1H), 8,36 (с, 1H), 7,98 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,38 (дд, J=8,3, 4,8 Гц, 1H), 6,37 (с, 1H), 1,54 (с, 9H); ESIMS (m/z) 338 ([M-t-Bu]+), 220 ([M-O-t-Bu]-).
Соединение 172 также было получено в соответствии со способами, описанными в примере 13. Соединение 317 получали в соответствии со способами, описанными в примере 17, исходя из трет-бутил (3-бром-1H-пиразол-4-ил)карбамата и также в соответствии со способами, описанными в примере 13.
Пример 18: Получение 3-(3-метил-1H-пиразол-1-ил)пиридина и 3-(5-метил-1H-пиразол-1-ил)пиридина
К раствору 3-метил-1H-пиразола (10,99 г, 134 ммоль) в N,N-диметилформамиде (100 мл) при температуре 0°C добавляли гидрид натрия (3,71 г, 154 ммоль, 60%-ая дисперсия). Реакционную смесь перемешивали при температуре 0°C в течение 2 часов. Добавляли 3-фторпиридин (10,0 г, 103 ммоль) и реакционную смесь перемешивали при температуре 100°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры и медленно добавляли воду. Смесь экстрагировали дихлорметаном, и объединенные органические фазы промывали насыщенным солевым раствором, концентрировали и подвергали хроматографии (0-100% этилацетат/гексаны) с получением 3-(3-метил-1H-пиразол-1-ил)пиридина (8,4 г, 52,77 ммоль, 51,2%) и 3-(5-метил-1H-пиразол-1-ил)пиридина (1,0 г, 6%). Аналитические данные обоих продуктов согласуются с сообщенными в примере 6, стадия 1.
3-(3-Бром-1H-пиразол-1-ил)пиридин был получен исходя из 3-фторпиридина и 3-бромпиразола, который получали, как описано в WO2008130021, в примере 18: т. пл. 89,5-92,5°C; 1H ЯМР (400 МГц, CDCl3) δ 8,94 (д, J=2,4 Гц, 1H), 8,62-8,49 (м, 1H), 8,03 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,87 (д, J=2,5 Гц, 1H), 7,42 (дд, J=8,2, 4,7 Гц, 1H), 6,54 (д, J=2,5 Гц, 1H); ESIMS m/z 224 ([M]+).
Пример 19: Получение 3-хлор-1-(5-фторпиридин-3-ил)-1H-пиразол-4-амина
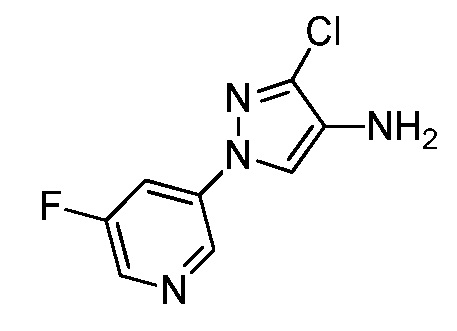
К перемешиваемому раствору 5-хлор-1H-пиразол-4-амина, HCl (2 г, 12,99 ммоль) и карбоната цезия (8,89 г, 27,3 ммоль) в ДМФ (13 мл) добавляли 3,5-дифторпиридин (1,794 г, 15,58 ммоль) и смесь нагревали при температуре 70°C в течение 12 ч. Смесь охлаждали до комнатной температуры и фильтровали. Твердое вещество промывали обильным количеством этилацетата. Фильтраты промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме с получением твердого вещества коричневого цвета. Указанное твердое вещество растворяли в этилацетате, и полученный раствор насыщали гексанами для выделения осадка 3-хлор-1-(5-фторпиридин-3-ил)-1H-пиразол-4-амина (2,31 г, 10,32 ммоль, 79%-ый выход) в виде твердого вещества коричневого цвета: 1H ЯМР (400 МГц, ДМСО-d6) δ 8,89-8,82 (м, 1H), 8,45 (д, J=2,5 Гц, 1H), 8,07 (д, J=10,4 Гц, 1H), 7,94 (с, 1H), 4,51 (с, 2H); EIMS (m/z) 213 ([M+1]+).
3-Бром-1-(5-фторпиридин-3-ил)-1H-пиразол-4-амин был получен исходя из соответствующего пиразола, как описано в примере 19: т. пл. 164-165°C; 1H ЯМР (400 МГц, CDCl3) δ 8,65 (д, J=1,7 Гц, 1H), 8,36 (д, J=2,5 Гц, 1H), 7,76 (дд, J=5,9, 3,6 Гц, 1H), 7,48 (с, 1H), 3,22 (с, 2H). 13C ЯМР (101 МГц, CDCl3) δ 160,87, 158,30, 135,36, 135,13, 134,39, 134,35, 131,16, 123,31, 114,02, 112,77, 112,54; EIMS (m/z) 258 ([M+1]+).
Пример 20: Получение 1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-амина
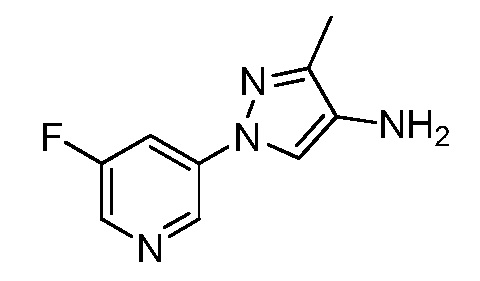
К раствору 3-фтор-5-(3-метил-4-нитро-1H-пиразол-1-ил)пиридина (3,133 г, 14,10 ммоль) в этаноле (28,2 мл) добавляли этилацетат, пока все исходное вещество не переходило в раствор. Раствор дегазировали и добавляли 10%-ый палладий на углероде (0,750 г, 0,705 ммоль), и реакционную смесь перемешивали на аппарате Парра для гидрирования под давлением 40 фунтов на квадратный дюйм в течение 3 часов. Раствор фильтровали через целит с этилацетатом и концентрировали с получением 1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-амина (2,000 г, 10,41 ммоль, 73,8%) в виде твердого вещества коричневого цвета: т. пл. 136,0-138,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,67-8,59 (м, 1H), 8,27 (д, J=2,5 Гц, 1H), 7,73 (дт, J=9,9, 2,3 Гц, 1H), 7,45 (с, 1H), 3,01 (с, 2H), 2,28 (с, 3H); EIMS m/z 192.
1-(Пиридин-3-ил)-3-(трифторметил)-1H-пиразол-4-амин был получен исходя из соответствующего нитропиразола, как описано в примере 20: т. пл. 112,5-115,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,89 (д, J=2,4 Гц, 1H), 8,57 (дд, J=4,7, 1,4 Гц, 1H), 8,03 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,56 (д, J=0,7 Гц, 1H), 7,41 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 3,47-3,31 (м, 2H); EIMS m/z 228.
Пример 21: Получение 3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-амина
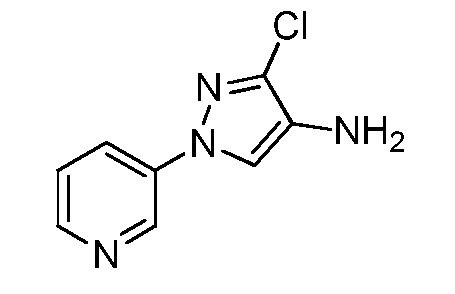
К 3-(3-хлор-4-нитро-1H-пиразол-1-ил)пиридину (0,95 г, 4,23 ммоль) в уксусной кислоте (8,46 мл), этанолу (8,46 мл) и воде (4,23 мл) добавляли порошок железа (1,18 г, 21,15 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 30 минут. К данной реакционной смеси добавляли осторожно 2M KOH и экстрагировали этилацетатом. Этилацетатные слои объединяли, сушили (MgSO4), фильтровали и концентрировали досуха. Сырое вещество очищали с помощью хроматографии на силикагеле (0-10% метанол/дихлорметан) с получением желаемого продукта в виде твердого вещества белого цвета (0,66 г, 80%): 1H ЯМР (400 МГц, CDCl3) δ 8,84 (д, J=2,6 Гц, 1H), 8,49 (дд, J=4,7, 1,4 Гц, 1H), 7,95 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,53 (с, 1H), 7,37 (ддд, J=8,4, 4,7, 0,6 Гц, 1H), 3,17 (ушир. с, 2H).
3-Метил-1-(2-метилпиридин-3-ил)-1H-пиразол-4-амин был получен, как описано в примере 21: 1H ЯМР (400 МГц, CDCl3) δ 8,48 (дд, J=4,8, 1,6 Гц, 1H), 7,62 (дд, J=8,0, 1,6 Гц, 1H), 7,23-7,18 (м, 2H), 2,91 (ушир. с, 2H), 2,55 (с, 3H), 2,28 (с, 3H); EIMS m/z 188.
3-Фенил-1-(пиридин-3-ил)-1H-пиразол-4-амин был получен исходя из соответствующего нитропиразола, как описано в примере 21: ИК (тонкая пленка) 3324 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,94 (д, J=2,2 Гц, 1H), 8,47 (дд, J=4,7, 1,4 Гц, 1H), 8,07 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,87-7,80 (м, 2H), 7,60 (с, 1H), 7,50-7,44 (м, 2H), 7,40-7,34 (м, 2H), 3,86 (с, 2H); EIMS m/z 236.
3-Хлор-1-(5-фторпиридин-3-ил)-1H-пиразол-4-амин был получен исходя из соответствующего нитропиразола, как описано в примере 21: т. пл. 149,0-151,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,65 (д, J=1,6 Гц, 1H), 8,35 (д, J=2,4 Гц, 1H), 7,75 (дт, J=9,5, 2,4 Гц, 1H), 7,51 (с, 1H), 3,21 (с, 2H); ESIMS m/z 213 ([M]+).
3-Бром-1-(пиридин-3-ил)-1H-пиразол-4-амин был получен исходя из соответствующего нитропиразола, как описано в примере 21: т. пл. 143,0-146,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,85 (д, J=2,4 Гц, 1H), 8,50 (дд, J=4,7, 1,4 Гц, 1H), 7,96 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,49 (с, 1H), 7,37 (ддд, J=8,4, 4,7, 0,7 Гц, 1H), 3,21 (с, 2H); ESIMS m/z 241 ([M+2]+).
Пример 22: Получение трет-бутил (5-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (соединение 281)
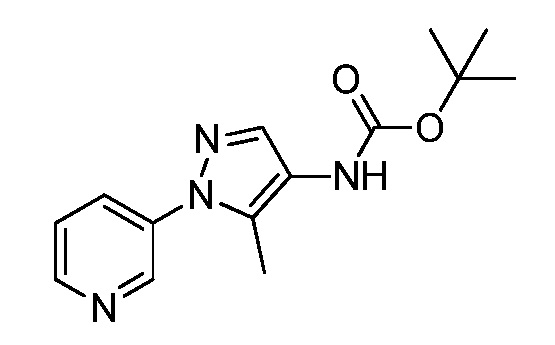
К раствору (E)-трет-бутил 1-(диметиламино)-3-оксобут-1-ен-2-илкарбамата (0,59 г, 2,58 ммоль) в этаноле (2,5 мл) добавляли 3-гидразинилпиридин, 2HCl (0,470 г, 2,58 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь концентрировали и очищали с использованием хроматографии на силикагеле (0-100% этилацетат/гексаны) с получением указанного в заголовке соединения в виде пены оранжевого цвета (0,235 г, 30%): ИК (тонкая пленка) 3268, 2978 и 1698 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,75 (дд, J=2,5, 0,5 Гц, 1H), 8,62 (дд, J=4,8, 1,5 Гц, 1H), 7,82 (ддд, J=8,2, 2,6, 1,5 Гц, 1H), 7,78 (с, 1H), 7,43 (ддд, J=8,1, 4,8, 0,6 Гц, 1H), 6,04 (с, 1H), 2,29 (с, 3H), 1,52 (с, 9H); ESIMS m/z 275 ([M+H]+), 273 ([M-H]-).
Пример 23: Получение трет-бутил 1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-илкарбамата (соединение 111) и трет-бутил 5-этокси-1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-илкарбамата (соединение 112)
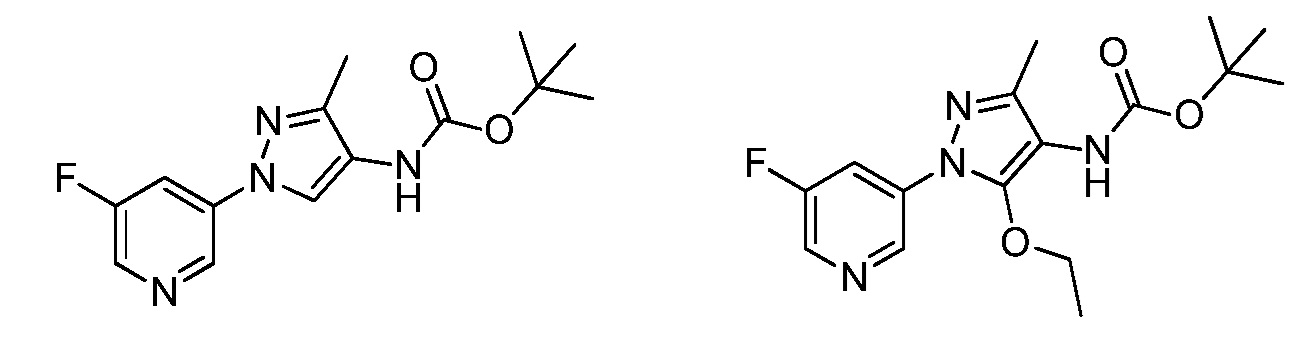
К раствору 3-фтор-5-(3-метил-4-нитро-1H-пиразол-1-ил)пиридина (3,133 г, 14,10 ммоль) в этаноле (28,2 мл) добавляли этилацетат, пока все исходное вещество не переходило в раствор. Раствор дегазировали и добавляли 10%-ый палладий на углероде (0,750 г, 0,705 ммоль), и реакционную смесь перемешивали в аппарате Парра для гидрирования под давлением 40 фунтов на квадратный дюйм в течение 3 часов. Раствор фильтровали через целит с этилацетатом, и растворитель удаляли при пониженном давлении. Остаток растворяли в тетрагидрофуране (32,0 мл) и воде (9,61 мл). Добавляли ди-трет-бутил дикарбонат (2,52 г, 11,55 ммоль), затем насыщенный водный раствор бикарбоната натрия (9,54 мл, 11,45 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, разбавляли водой и экстрагировали этилацетатом. Объединенные органические фазы концентрировали и подвергали хроматографии (0-100% этилацетат/гексаны) с получением трет-бутил 1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-илкарбамата (1,673 г, 5,72 ммоль, 41,0%) в виде твердого вещества желтого цвета и трет-бутил 5-этокси-1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-илкарбамата (0,250 г, 0,74 ммоль, 5,2%) в виде масла коричневого цвета:
Трет-бутил 1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-илкарбамат (соединение 111): т. пл. 131,5-133,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,75 (с, 1H), 8,32 (д, J=2,5 Гц, 1H), 8,28 (с, 1H), 7,77 (дт, J=9,7, 2,4 Гц, 1H), 6,15 (с, 1H), 2,29 (с, 3H), 1,54 (с, 9H); ESIMS m/z 293 ([M+H]+).
Трет-бутил 5-этокси-1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-илкарбамат (соединение 112): ИК (тонкая пленка) 1698 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,88 (с, 1H), 8,34 (д, J=2,5 Гц, 1H), 7,83 (д, J=9,9 Гц, 1H), 5,99 (с, 1H), 4,37 (кв, J=7,0 Гц, 2H), 2,17 (с, 3H), 1,50 (с, 9H), 1,37 (т, J=7,1 Гц, 3H); ESIMS m/z 337 ([M+H]+).
Пример 24: Получение бис трет-бутил (1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (соединение 595)
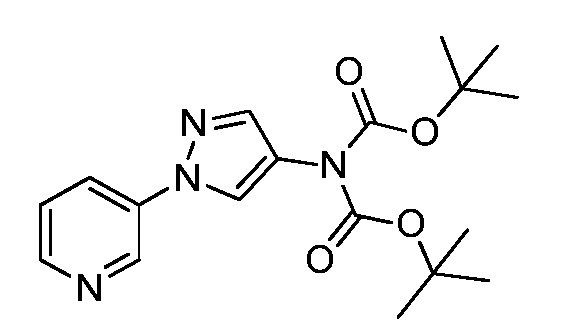
К раствору трет-бутил (1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (2,00 г, 7,68 ммоль) в сухом ТГФ (21,95 мл) при температуре 0°C одной порцией добавляли 60%-ый гидрид натрия (0,33 г, 8,45 ммоль) и перемешивали при этой температуре в течение 30 минут. К данной смеси затем одной порцией добавляли Boc-ангидрид (1,84 г, 8,45 ммоль) и перемешивали в течение 5 минут при температуре 0°C. Водяную баню затем отставляли, и реакционную смесь нагревали до комнатной температуры и перемешивали дополнительные 30 минут. Реакцию гасили водой и экстрагировали этилацетатом. Этилацетатные слои объединяли, сушили (MgSO4), фильтровали и концентрировали досуха. Сырое вещество очищали с помощью хроматографии на силикагеле (0-100% этилацетат/гексаны) с получением желаемого продукта в виде твердого вещества белого цвета (2,0 г, 72%): 1H ЯМР (400 МГц, CDCl3) δ 9,12-8,86 (м, 1H), 8,55 (дд, J=4,7, 1,4 Гц, 1H), 8,04 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 8,01 (д, J=0,5 Гц, 1H), 7,84-7,65 (м, 1H), 7,41 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 1,51 (с, 18H).
Пример 25: Получение 3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-амина (соединение 516)
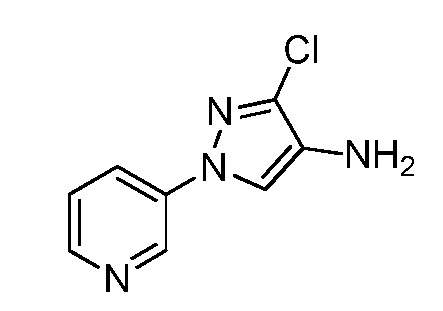
К трет-бутил (3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамату (2 г, 6,79 ммоль) в дихлорметане (6,79 мл) добавляли трифторуксусную кислоту (6,79 мл) и смесь оставляли перемешиваться при комнатной температуре в течение 2 часов. Добавляли толуол (12 мл) и реакционную смесь концентрировали почти досуха. Смесь выливали в делительную воронку, содержащую насыщенный водный раствор бикарбоната натрия, и экстрагировали дихлорметаном. Объединенные органические слои концентрировали с получением 3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,954 г, 4,90 ммоль, 72,2%) в виде твердого вещества белого цвета: т. пл. 137,9-139,9°C; 1H ЯМР (400 МГц, CDCl3) δ 8,84 (д, J=2,4 Гц, 1H), 8,50 (дд, J=4,7, 1,4 Гц, 1H), 7,95 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,52 (с, 1H), 7,37 (ддд, J=8,4, 4,7, 0,7 Гц, 1H), 3,18 (с, 2H); ESIMS m/z 196 ([M+H]+).
Пример 26: Получение гидрохлорида N-аллил-1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-амина
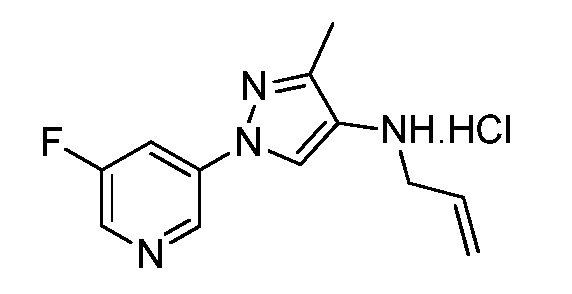
К раствору трет-бутил аллил(1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-ил)карбамата (908 мг, 2,73 ммоль) в диоксане (5 мл) добавляли HCl (1M в эфире) (13,65 мл, 13,65 ммоль) и смесь перемешивали при комнатной температуре в течение 48 ч. Полученное твердое вещество белого цвета фильтровали, промывали эфиром и сушили в вакууме с получением N-аллил-1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-амина, HCl (688 мг, 94%-ый выход) в виде твердого вещества белого цвета: т. пл. 189-190°C; 1H ЯМР (400 МГц, CDCl3) δ 8,79-8,68 (м, 1H), 8,32-8,26 (м, 1H), 8,23 (с, 1H), 7,98-7,86 (м, 1H), 5,86-5,68 (м, 1H), 5,28-5,17 (м, 1H), 5,17-5,03 (м, 1H), 3,59 (д, J=6,2 Гц, 2H), 2,11 (с, 3H); EIMS (m/z) 233 ([M+1]+).
N-Аллил-3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-амин, HCl был получен, как описано в примере 26, исходя из трет-бутил аллил(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата: т. пл. 172-174°C; 1H ЯМР (400 МГц, CDCl3) δ 9,20 (д, J=2,5 Гц, 1H), 8,65 (дд, J=5,3, 1,1 Гц, 1H), 8,61 (ддд, J=8,6, 2,5, 1,1 Гц, 1H), 8,24 (с, 1H), 7,93 (дд, J=8,6, 5,3 Гц, 1H), 3,66 (дт, J=5,5, 1,3 Гц, 2H); EIMS (m/z) 235 ([M+1]+).
N-Аллил-3-метил-1-(пиридин-3-ил)-1H-пиразол-4-амин, HCl был получен, как описано в примере 26, исходя из трет-бутил аллил(3-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил): т. пл. 195-197°C; 1H ЯМР (400 МГц, ДМСО-d6) δ 9,12 (д, J=2,4 Гц, 1H), 8,58 (дд, J=5,0, 1,2 Гц, 1H), 8,48 (с, 1H), 8,43 (д, J=9,7 Гц, 1H), 7,77 (дд, J=8,4, 5,0 Гц, 1H), 6,04-5,92 (м, 1H), 5,44 (дд, J=17,2, 1,4 Гц, 1H), 5,32 (д, J=9,4 Гц, 1H), 3,81 (д, J=6,2 Гц, 2H); EIMS (m/z) 249 ([M-1]+).
3-Бром-1-(5-фторпиридин-3-ил)-N-метил-1H-пиразол-4-амин, HCl был получен, как описано в примере 26, исходя из трет-бутил 3-бром-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил(метил)карбамата: т. пл. 167-168°C; 1H ЯМР (400 МГц, CDCl3) δ 8,93 (с, 1H), 8,50 (д, J=2,5 Гц, 1H), 8,23 (с, 1H), 8,14 (дт, J=10,4, 2,3 Гц, 1H), 2,73 (с, 3H).
3-Бром-N-метил-1-(пиридин-3-ил)-1H-пиразол-4-амин, HCl был получен, как описано в примере 26, исходя из трет-бутил (3-бром-1-(пиридин-3-ил)-1H-пиразол-4-ил)(метил)карбамата (160 мг, 0,45 ммоль) в диоксане (1 мл), добавляя 4M HCl: т. пл. 226-228°C; 1H ЯМР (400 МГц, ДМСО-d6) δ 9,26-9,06 (д, J=2,6 Гц, 1H), 8,69-8,54 (м, 1H), 8,54-8,39 (д, J=8,0 Гц, 1H), 8,33-8,14 (с, 1H), 7,90-7,72 (м, 1H), 2,82-2,67 (с, 3H); EIMS (m/z) 253 ([M+1]+), 255 ([M+2H]+).
3-Бром-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амин, HCl был получен, как описано в примере 26, исходя из 3-бром-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина, HCl: т. пл. 216-217°C; 1H ЯМР (400 МГц, ДМСО-d6) δ 10,66-10,05 (с, 3H), 9,28-9,20 (д, J=2,5 Гц, 1H), 8,74-8,67 (м, 1H), 8,67-8,56 (м, 3H), 7,96-7,84 (м, 1H), 3,21-3,14 (м, 2H), 1,29-1,22 (м, 3H); EIMS (m/z) 267 ([M+1]+).
3-Хлор-N-(2-метоксиэтил)-1-(пиридин-3-ил)-1H-пиразол-4-амин, HCl был получен, как описано в примере 26, исходя из трет-бутил (3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(2-метоксиэтил)карбамата, HCl: т. пл. 157-158°C; 1H ЯМР (400 МГц, ДМСО) δ 9,22-9,14 (д, J=2,5 Гц, 1H), 8,70-8,65 (с, 1H), 8,65-8,59 (м, 1H), 8,38-8,33 (м, 1H), 8,00-7,89 (м, 1H), 3,59-3,50 (т, J=5,8 Гц, 2H), 3,32-3,27 (с, 3H), 3,22-3,14 (м, 2H); EIMS (m/z) 253 ([M+1]+).
Пример 27: Получение гидрохлорида 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина
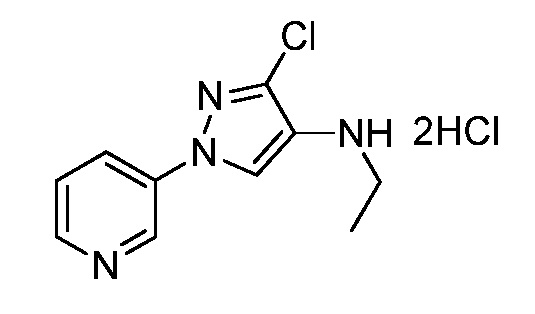
В 500-мл трехлитровую круглодонную колбу, снабженную магнитной мешалкой, добавляли раствор трет-бутил (3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)карбамата (21 г, 65,1 ммоль) в 1,4-диоксане (35 мл). Этот раствор бледно-желтого цвета помещали на ледяную баню и охлаждали до температуры 1°C. Одной порцией добавляли раствор 4M HCl/диоксан (65 мл, 260 ммоль). После перемешивания в течение 20 минут баню со льдом отставляли, и суспензию перемешивали далее при комнатной температуре в течение 16 часов. Реакционную смесь разбавляли 200 мл этилового эфира, и твердое вещество фильтровали и промывали эфиром и помещали в вакуумную печь при температуре 40°C в течение 18 часов. Указанное в заголовке соединение выделяли в виде твердого вещества бледно-желтого цвета (18,2 г, 95%): 1H ЯМР (400 МГц, MeOD) δ 9,52 (д, J=2,5 Гц, 1H), 9,17 (с, 1H), 9,14 (ддд, J=8,7, 2,5, 1,1 Гц, 1H), 8,93 (ддд, J=5,7, 1,1, 0,6 Гц, 1H), 8,31 (ддд, J=8,7, 5,7, 0,5 Гц, 1H), 3,58 (кв, J=7,3 Гц, 2H), 1,48 (т, J=7,3 Гц, 3H); ESIMS m/z 223 ([M+H]+).
3-Хлор-N-метил-1-(пиридин-3-ил)-1H-пиразол-4-амин, 2HCl был получен, как описано в примере 27: 1H ЯМР (400 МГц, MeOD) δ 9,28 (д, J=2,5 Гц, 1H), 8,86 (ддд, J=8,7, 2,5, 1,2 Гц, 1H), 8,79-8,75 (м, 1H), 8,62 (с, 1H), 8,19 (ддд, J=8,7, 5,6, 0,5 Гц, 1H), 3,06 (с, 3H); 13C ЯМР (101 МГц, MeOD) δ 141,42, 139,58, 137,76, 134,58, 134,11, 129,33, 127,55, 122,14, 35,62); ESIMS m/z 209 ([M+H]+).
Пример 28: Получение 3-(4-нитро-3-фенил-1H-пиразол-1-ил)пиридина
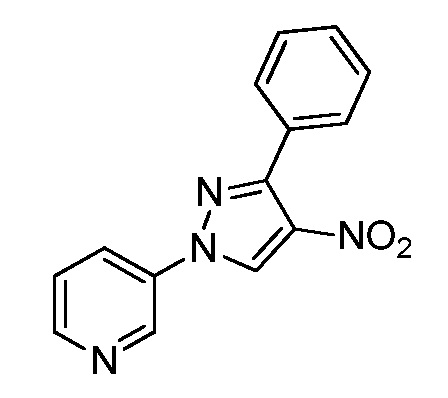
К суспензии фенилбороновой кислоты (0,546 г, 4,47 ммоль) в толуоле (6,63 мл) добавляли 3-(3-хлор-4-нитро-1H-пиразол-1-ил)пиридин (0,335 г, 1,492 ммоль), затем этанол (3,31 мл) и 2 M водный раствор карбоната калия (1,492 мл, 2,98 ммоль). Раствор дегазировали путем вакуумирования и затем продували азотом (3 раза). К реакционной смеси добавляли тетракис палладия (0,086 г, 0,075 ммоль), и колбу нагревали при температуре 110°C в атмосфере азота в течение 16 часов. Водный слой затем отставляли, и органический слой концентрировали. Сырой продукт очищали посредством хроматографии на силикагеле (0-100% этилацетат/гексаны) с получением 3-(4-нитро-3-фенил-1H-пиразол-1-ил)пиридина (499 мг, 1,874 ммоль, 80%) в виде твердого вещества желтого цвета: т. пл. 144,0-146,0°C; 1H ЯМР (400 МГц, CDCl3) δ 9,09 (д, J=2,3 Гц, 1H), 8,82 (с, 1H), 8,71 (дд, J=4,8, 1,4 Гц, 1H), 8,16 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,82-7,74 (м, 2H), 7,55-7,48 (м, 4H); EIMS m/z 266.
Пример 29: Получение 5-бром-1-(пиридин-3-ил)-1H-пиразол-4-ил(метил)карбамата (соединение 110)
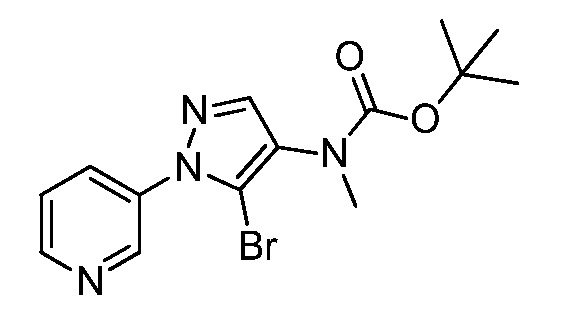
К трет-бутил метил-(1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамату (0,200 г, 0,729 ммоль) в дихлорэтане (3,65 мл) добавляли 1-бромпирролидин-2,5-дион (0,260 г, 1,458 ммоль) и реакционную смесь перемешивали в течение ночи при температуре 50°C. Реакционную смесь концентрировали, разбавляли дихлорметаном и промывали водой и насыщенным водным раствором тиосульфата натрия. Органическую фазу концентрировали с получением трет-бутил 5-бром-1-(пиридин-3-ил)-1H-пиразол-4-ил(метил)карбамата (256 мг, 0,725 ммоль, 99%) в виде масла коричневого цвета: ИК (тонкая пленка) 1697 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,89 (с, 1H), 8,68 (д, J=4,1 Гц, 1H), 7,93 (ддд, J=8,2, 2,5, 1,5 Гц, 1H), 7,69 (с, 1H), 7,46 (дд, J=8,1, 4,8 Гц, 1H), 3,22 (с, 3H), 1,44 (с, 9H); ESIMS m/z 352 ([M-H]-).
Пример 30: Получение бис трет-бутил (5-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (соединение 109)
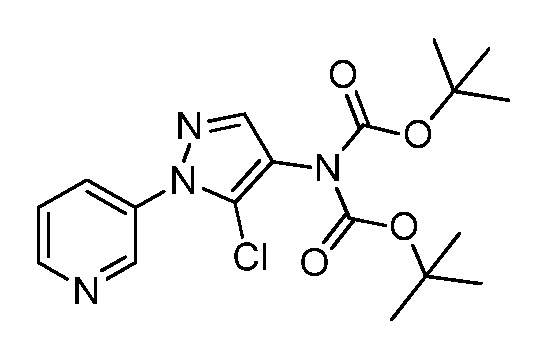
К бис трет-бутил (1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамату (1,30 г, 3,61 ммоль) в ацетонитриле (21,22 мл) добавляли N-хлорсукцинимид (0,96 г, 7,21 ммоль) и реакционную смесь перемешивали при температуре 45°C в течение 48 часов. Реакционную смесь охлаждали до комнатной температуры и выливали в воду, и экстрагировали дихлорметаном. Дихлорметановые слои объединяли, выливали через разделитель фаз для удаления воды и концентрировали досуха. Сырое вещество очищали с помощью хроматографии на силикагеле (0-60% этилацетат/гексаны) с получением желаемого продукта в виде твердого вещества желтого цвета (0,90 г, 63%): т. пл. 109-115°C; 1H ЯМР (400 МГц, CDCl3) δ 8,90 (д, J=2,3 Гц, 1H), 8,68 (дд, J=4,8, 1,5 Гц, 1H), 7,94 (ддд, J=8,2, 2,5, 1,5 Гц, 1H), 7,70 (с, 1H), 7,47 (дтд, J=11,0, 5,6, 5,5, 4,8 Гц, 1H), 1,49 (с, 18H); ESIMS m/z 395 ([M+H]+).
Трет-бутил (5-хлор-3-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил)(метил)карбамат был получен исходя из соответствующего пиразола в дихлорэтане в качестве растворителя, как описано в примере 30: ESIMS m/z 324 ([M+H]+).
Соединения 110 (смотри также способ по примеру 29) и 146 были получены исходя из соответствующих пиразолов с использованием N-бромсукцинимида в соответствии со способами, описанными в примере 30.
Трет-бутил 5-бром-3-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил(метил)карбамат был получен исходя из соответствующего пиразола в дихлорэтане, как описано в примере 30: 1H ЯМР (400 МГц, CDCl3) δ 8,88 (д, J=2,3 Гц, 1H), 8,69-8,60 (м, 1H), 7,96-7,86 (м, 1H), 7,48-7,39 (м, 1H), 3,18 (с, 3H), 2,26 (с, 3H), 1,60-1,36 (м, 9H); ESIMS m/z 368 ([M+H]+).
Пример 31: Получение бис трет-бутил (5-фтор-1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (соединение 135)
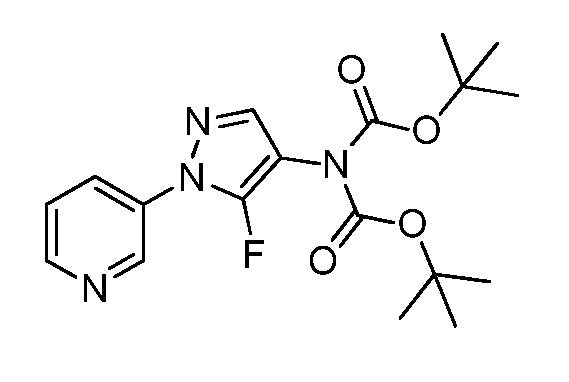
К раствору бис трет-бутил (1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (0,075 г, 0,208 ммоль) в ДМФ (0,416 мл) и ацетонитриле (0,416 мл) добавляли Selecfluor® (0,184 г, 0,520 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение одной недели. Реакционную смесь концентрировали, добавляли насыщенный водный раствор хлорида аммония, и смесь экстрагировали этилацетатом. Объединенные органические фазы концентрировали и подвергали хроматографии (0-100% этилацетат/гексаны) с получением бис трет-бутил (5-фтор-1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (16 мг, 0,042 ммоль, 20,32%) в виде твердого вещества не совсем белого цвета: 1H ЯМР (400 МГц, CDCl3) δ 8,97 (т, J=2,0 Гц, 1H), 8,61 (дд, J=4,8, 1,4 Гц, 1H), 7,99 (ддт, J=8,3, 2,6, 1,3 Гц, 1H), 7,57 (д, J=2,5 Гц, 1H), 7,44 (ддд, J=8,3, 4,8, 0,6 Гц, 1H), 1,50 (с, 18H); ESIMS m/z 379 ([M+H]+).
Трет-бутил (5-фтор-3-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил)(метил)карбамат был получен, как описано в примере 31: 1H ЯМР (400 МГц, CDCl3) δ 8,94 (с, 1H), 8,57 (д, J=4,2 Гц, 1H), 7,96 (д, J=7,7 Гц, 1H), 7,41 (дд, J=7,9, 4,7 Гц, 1H), 3,17 (с, 3H), 2,23 (с, 3H), 1,58-1,40 (м, 9H); ESIMS m/z 307 ([M+H]+).
Пример 32: Получение N-циклопропил-3-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина
Пример 32, стадия 1: Получение 3-(4-йод-3-метил-1H-пиразол-1-ил)пиридина
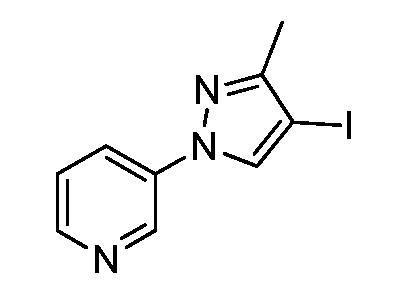
К смеси 3-(3-метил-1H-пиразол-1-ил)пиридина (6,7 г, 42,1 ммоль), йодной кислоты (2,96 г, 16,84 ммоль) и дийодина (8,55 г, 33,7 ммоль) в уксусной кислоте (60,1 мл) добавляли концентрированную серную кислоту (3,74 мл, 21,04 ммоль). Реакционную смесь нагревали при температуре 70°C в течение 30 минут. Реакционную смесь выливали в ледяной водный раствор тиосульфата натрия и экстрагировали диэтиловым эфиром. Объединенные органические фазы промывали насыщенным водным раствором бикарбоната натрия. Органические фазы затем сушили с помощью сульфата магния, фильтровали и концентрировали в вакууме. Твердый остаток растворяли в дихлорметане, наносили на 80-г колонку с силикагелем и элюировали с помощью смеси 0-80% ацетона в гексане с получением 3-(4-йод-3-метил-1H-пиразол-1-ил)пиридина (11,3 г, 35,7 ммоль, 85%) в виде твердого вещества белого цвета: т. пл. 131°C; 1H ЯМР (400 МГц, CDCl3) δ 8,95-8,85 (м, 1H), 8,52 (дд, J=4,8, 1,4 Гц, 1H), 8,00-7,94 (м, 1H), 7,91 (с, 1H), 7,38 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 2,34 (с, 3H); EIMS m/z 285.
Пример 32, стадия 2: Получение N-циклопропил-3-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина
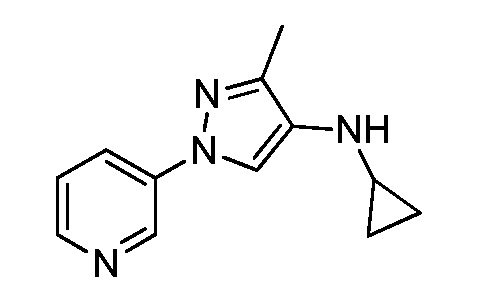
К раствору 3-(4-йод-3-метил-1H-пиразол-1-ил)пиридина (2,0 г, 7,02 ммоль) в диметилсульфоксиде (7,02 мл) добавляли 1-(5,6,7,8-тетрагидрохинолин-8-ил)этанон (0,246 г, 1,403 ммоль), циклопропанамин (0,486 мл, 7,02 ммоль), карбонат цезия (6,86 г, 21,05 ммоль) и бромид меди(I) (0,101 г, 0,702 ммоль). Реакционную смесь перемешивали при температуре 35°C в течение 2 дней. Реакционную смесь разбавляли водой и экстрагировали дихлорметаном. Объединенные органические продукты промывали насыщенным солевым раствором, концентрировали и подвергали хроматографии (0-100% этилацетат/гексаны) с получением N-циклопропил-3-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина (269 мг, 1,255 ммоль, 17,90%) в виде твердого вещества желтого цвета: т. пл. 104,0-107,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,89 (дд, J=2,7, 0,5 Гц, 1H), 8,41 (дд, J=4,7, 1,4 Гц, 1H), 7,96 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,51 (с, 1H), 7,33 (ддд, J=8,3, 4,7, 0,7 Гц, 1H), 3,42 (с, 1H), 2,53-2,42 (м, 1H), 2,22 (с, 3H), 0,72-0,65 (м, 2H), 0,60-0,53 (м, 2H); ESIMS m/z 215 ([M+H]+).
3-Метил-N-(3-(метилтио)пропил)-1-(пиридин-3-ил)-1H-пиразол-4-амин был получен, как описано в примере 32: ИК (тонкая пленка) 3298 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,87 (д, J=2,3 Гц, 1H), 8,40 (дд, J=4,7, 1,4 Гц, 1H), 7,93 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,35 (с, 1H), 7,34-7,29 (м, 1H), 3,16 (т, J=6,8 Гц, 2H), 2,89 (с, 1H), 2,64 (т, J=7,0 Гц, 2H), 2,25 (с, 3H), 2,13 (с, 3H), 1,95 (п, J=6,9 Гц, 2H); ESIMS m/z 263 ([M+H]+).
3-Метил-N-(2-метил-3-(метилтио)пропил)-1-(пиридин-3-ил)-1H-пиразол-4-амин был получен, как описано в примере 32: ИК (тонкая пленка) 3325 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,5 Гц, 1H), 8,40 (дд, J=4,7, 1,2 Гц, 1H), 7,93 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,35 (с, 1H), 7,32 (ддд, J=8,3, 4,7, 0,5 Гц, 1H), 3,12 (дд, J=11,5, 6,1 Гц, 1H), 2,94 (дд, J=11,9, 6,6 Гц, 1H), 2,62 (дд, J=12,9, 6,9 Гц, 1H), 2,52 (дд, J=12,9, 6,2 Гц, 1H), 2,26 (с, 3H), 2,14 (с, 3H), 2,12-2,02 (м, 1H), 1,11 (д, J=6,8 Гц, 3H); EIMS m/z 276.
Пример 33: Получение трет-бутил (3-циклопропил-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)карбамата (соединение 434) и трет-бутил (1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)карбамата (соединение 489)
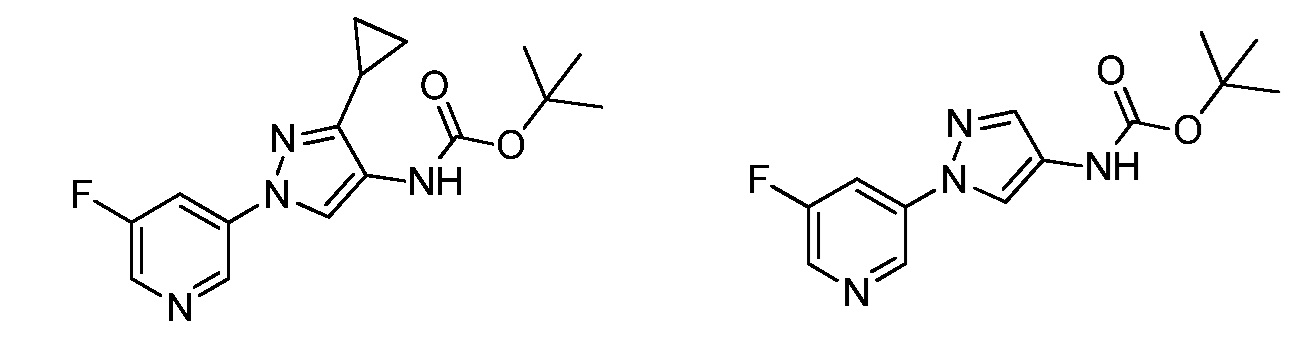
К суспензии 2-циклопропил-4,4,5,5-тетраметил-1,3,2-диоксаборолана (1,087 г, 6,47 ммоль) в толуоле (13,69 мл) добавляли трет-бутил (3-бром-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)карбамат (1,1 г, 3,08 ммоль), затем этанол (6,84 мл) и 2 M водный раствор карбоната калия (3,08 мл, 6,16 ммоль). Раствор дегазировали в вакууме и затем продували азотом (3 раза). К реакционной смеси добавляли тетракис палладия (0,178 г, 0,154 ммоль), и колбу нагревали при температуре 100°C в атмосфере азота в течение 36 часов. Добавляли воду (5 мл) и смесь экстрагировали этилацетатом. Объединенные органические продукты концентрировали и подвергали хроматографии (0-100% этилацетат/гексаны) с получением трет-бутил (3-циклопропил-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)карбамата (705 мг, 2,215 ммоль, 71,9%-ый выход) в виде твердого вещества желтого цвета и трет-бутил (1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)карбамата (242 мг, 0,870 ммоль, 28,2%-ый выход) в виде твердого вещества желтого цвета.
трет-Бутил (3-циклопропил-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)карбамат: т. пл. 156,5-158,0; 1H ЯМР (400 МГц, CDCl3) δ 8,73 (с, 1H), 8,30 (д, J=2,5 Гц, 1H), 8,27 (с, 1H), 7,76 (дт, J=9,8, 2,4 Гц, 1H), 6,43 (с, 1H), 1,55 (с, 9H), 1,01-0,91 (м, 4H); ESIMS m/z 319 ([M+H]+).
(1-(5-Фторпиридин-3-ил)-1H-пиразол-4-ил)карбамат: т. пл. 121,0-123,0°C; 1H ЯМР (300 МГц, CDCl3) δ 8,78 (с, 1H), 8,37 (с, 1H), 8,28 (с, 1H), 7,81 (д, J=9,6 Гц, 1H), 7,59 (с, 1H), 6,44 (с, 1H), 1,53 (с, 9H). ESIMS m/z 278 ([M]+).
Соединения 340 и 404 были получены, как описано в примере 33.
Пример 34: Получение трет-бутил (3-этил-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)(метил)карбамата (соединение 408)
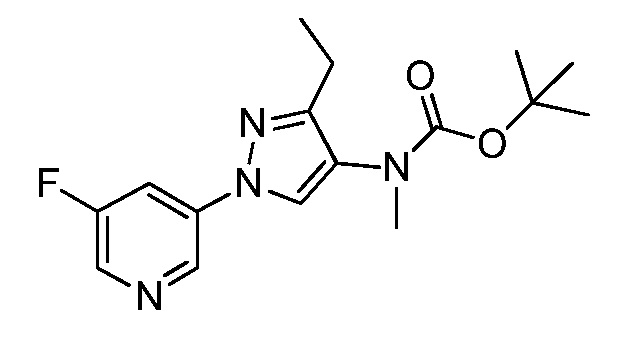
В продутый N2 раствор трет-бутил (1-(5-фторпиридин-3-ил)-3-винил-1H-пиразол-4-ил)(метил)карбамата (0,730 г, 2,293 ммоль) в метаноле (15,29 мл) добавляли 10%-ый палладий на углероде (0,036 г, 0,339 ммоль). Реакционную смесь продували водородом и под давлением 80 фунтов на квадратный дюйм обрабатывали водородом при комнатной температуре в течение 60 часов. В результате реакции получали конверсию менее 20%. Реакционную смесь фильтровали через целит, концентрировали и вновь растворяли в этилацетате (4 мл) и переносили в баллон. Реакционную смесь нагревали при температуре 50°C под давлением 600 фунтов на квадратный дюйм водорода в течение 20 часов. Реакция протекала только на 50%. Добавляли метанол (1 мл) и 10%-ый палладий на углероде (36 мг) и реакционную смесь нагревали при температуре 80°C под давлением 650 фунтов на квадратный дюйм водорода в течение 20 часов. Реакционную смесь фильтровали через целит и концентрировали с получением трет-бутил (3-этил-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)(метил)карбамата (616 мг, 1,923 ммоль, 84%-ый выход) в виде масла желтого цвета: ИК (тонкая пленка) 1692 см-1; 1H ЯМР (300 МГц, CDCl3) δ 8,71 (т, J=1,4 Гц, 1H), 8,35 (д, J=2,6 Гц, 1H), 7,83 (дт, J=9,5, 2,3 Гц, 2H), 3,18 (с, 3H), 2,65 (кв, J=7,5 Гц, 2H), 1,44 (с, 9H), 1,25 (т, J=7,1 Гц, 3H); EIMS m/z 320.
Пример 35: Получение N-(1-(5-фторпиридин-3-ил)-3-формил-1H-пиразол-4-ил)изобутирамида (соединение 560)
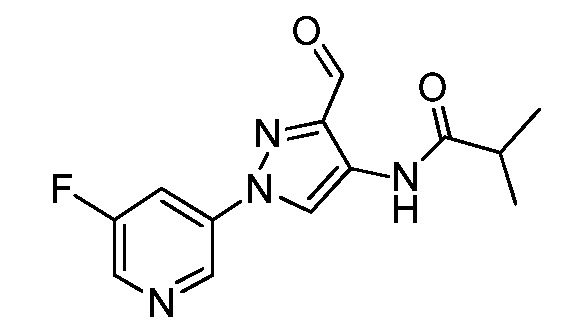
К раствору N-(1-(5-фторпиридин-3-ил)-3-винил-1H-пиразол-4-ил)изобутирамида (0,706 г, 2,57 ммоль) в тетрагидрофуране (12,87 мл) и воде (12,87 мл) добавляли тетроксид осмия (0,164 мл, 0,026 ммоль). После выдерживания в течение 10 минут при комнатной температуре, в течение 3 минут частями добавляли перйодат натрия (1,101 г, 5,15 ммоль) и полученный раствор перемешивали при комнатной температуре. Через 18 часов раствор выливали в 10 мл воды и экстрагировали дихлорметаном 3×10 мл. Объединенные органические слои сушили, концентрировали и подвергали хроматографии (0-100% этилацетат/гексаны) с получением N-(1-(5-фторпиридин-3-ил)-3-формил-1H-пиразол-4-ил)изобутирамида (626 мг, 2,266 ммоль, 88%-ый выход) в виде твердого вещества желтого цвета: т. пл. 140,0-142,0°C; 1H ЯМР (300 МГц, CDCl3) δ 10,12 (с, 1H), 9,14 (с, 1H), 8,90 (д, J=2,0 Гц, 1H), 8,82 (с, 1H), 8,51 (д, J=2,5 Гц, 1H), 7,92 (дт, J=9,2, 2,4 Гц, 1H), 2,65 (дт, J=13,8, 6,9 Гц, 1H), 1,31 (д, J=6,9 Гц, 6H); ESIMS m/z 277 ([M+H]+).
Соединение 369 получали в соответствии со способами, описанными в примере 35.
Пример 36: Получение N-(1-(5-фторпиридин-3-ил)-3-(гидроксиметил)-1H-пиразол-4-ил)изобутирамида (соединение 435) и N-(1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)изобутирамида (соединение 436)
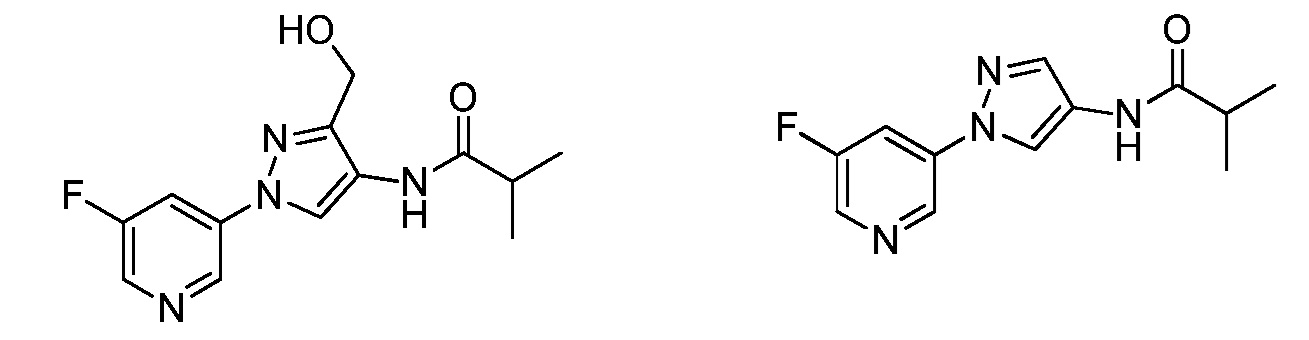
К раствору N-(1-(5-фторпиридин-3-ил)-3-формил-1H-пиразол-4-ил)изобутирамида (0,315 г, 1,140 ммоль) в метаноле (5,70 мл) при температуре 0°C добавляли боргидрид натрия (0,086 г, 2,280 ммоль). Реакционную смесь перемешивали при температуре 0°C в течение 2 часов и при комнатной температуре в течение 20 часов. Добавляли 0,5M HCl, реакционную смесь нейтрализовали насыщенным водным раствором бикарбоната натрия, и смесь экстрагировали дихлорметаном. Органические фазы концентрировали и подвергали хроматографии (0-100% этилацетат/гексаны) с получением N-(1-(5-фторпиридин-3-ил)-3-(гидроксиметил)-1H-пиразол-4-ил)изобутирамида (180 мг, 0,647 ммоль, 56,7%) в виде твердого вещества белого цвета и N-(1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)изобутирамида (9 мг, 0,036 ммоль, 3,18%) в виде твердого вещества белого цвета.
N-(1-(5-Фторпиридин-3-ил)-3-(гидроксиметил)-1H-пиразол-4-ил)изобутирамид: т. пл. 144,0-146,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,74 (д, J=1,1 Гц, 1H), 8,64 (с, 1H), 8,37-8,29 (м, 2H), 7,74 (дт, J=9,5, 2,3 Гц, 1H), 4,95 (д, J=3,0 Гц, 2H), 3,21-3,06 (м, 1H), 2,63-2,48 (м, 1H), 1,26 (д, J=6,9 Гц, 6H); ESIMS m/z 279 ([M+H]+).
N-(1-(5-Фторпиридин-3-ил)-1H-пиразол-4-ил)изобутирамид: ИК (тонкая пленка) 1659 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,79 (д, J=1,2 Гц, 1H), 8,60 (с, 1H), 8,38 (д, J=2,5 Гц, 1H), 7,81 (дт, J=9,5, 2,3 Гц, 1H), 7,68 (с, 1H), 7,54 (с, 1H), 2,63-2,51 (м, 1H), 1,28 (д, J=6,9 Гц, 6H); ESIMS m/z 249 ([M+H]+).
Пример 37: Получение N-(3-(хлорметил)-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)изобутирамида (соединение 561)
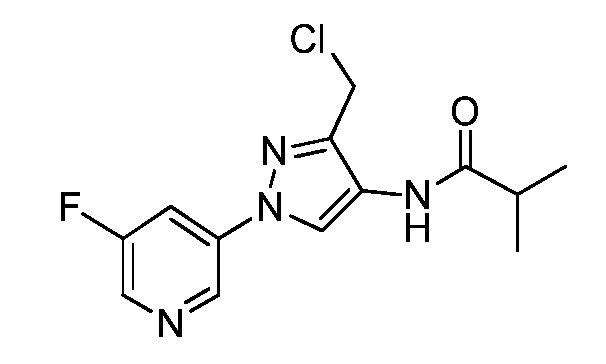
К раствору N-(1-(5-фторпиридин-3-ил)-3-(гидроксиметил)-1H-пиразол-4-ил)изобутирамида (0,100 г, 0,359 ммоль) в дихлорметане (3,59 мл) добавляли тионилхлорид (0,157 мл, 2,151 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Добавляли насыщенный водный раствор бикарбоната натрия, и смесь экстрагировали дихлорметаном. Объединенные органические фазы промывали насыщенным солевым раствором и концентрировали с получением N-(3-(хлорметил)-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)изобутирамида (100 мг, 0,337 ммоль, 94%-ый выход) в виде твердого вещества белого цвета: т. пл. 172,0-177,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,79 (с, 1H), 8,67 (с, 1H), 8,40 (с, 1H), 7,80 (дт, J=9,4, 2,3 Гц, 1H), 7,42 (с, 1H), 4,77 (с, 2H), 2,63 (гепт, J=6,9 Гц, 1H), 1,30 (д, J=6,9 Гц, 6H); ESIMS m/z 298 ([M+H]+).
Пример 38: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метоксиацетамида (соединение 512) (смотри также пример 11)
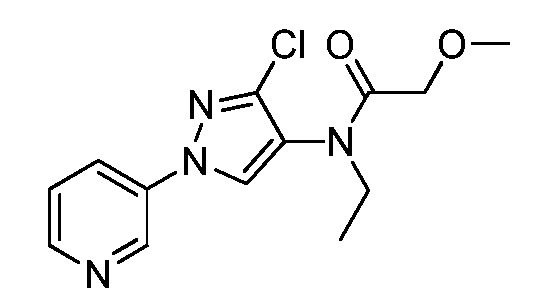
К раствору 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина, 2HCl (0,130 г, 0,502 ммоль) и в DCM (2,508 мл) добавляли N-этил-N-изопропилпропан-2-амин (0,257 мл, 1,505 ммоль), затем 2-метоксиацетилхлорид (0,109 г, 1,003 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Реакцию гасили путем добавления насыщенного водного раствора бикарбоната натрия. Органический слой экстрагировали DCM. Органический слой сушили над сульфатом натрия, фильтровали, концентрировали и очищали с использованием хроматографии на силикагеле (0-100% этилацетат/гексаны) с получением указанного в заголовке соединения в виде масла бледно-желтого цвета (0,12 г, 77%): ИК (тонкая пленка) 3514, 3091, 2978, 1676 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,96 (д, J=2,4 Гц, 1H), 8,63 (д, J=3,8 Гц, 1H), 8,09-8,03 (м, 1H), 7,99 (с, 1H), 7,47 (дд, J=8,3, 4,8 Гц, 1H), 3,88 (с, 2H), 3,77-3,65 (м, 2H), 3,40 (с, 3H), 1,18 (т, J=7,2 Гц, 3H); ESIMS m/z 295 ([M+H]+).
Соединения 71, 478, 481, 483-484 и 543 были получены в соответствии со способами, описанными в примере 38.
Пример 39: Получение N-(3-хлор-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метил-3-(метилтио)бутанамида (соединение 182) и (Z)-N-(3-хлор-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метилбут-2-енамида (соединение 183)
К раствору 2-метил-3-(метилтио)бутановой кислоты (0,154 г, 1,039 ммоль) в дихлорметане (1 мл) при комнатной температуре добавляли 1 каплю диметилформамида. Добавляли по каплям оксалилдихлорид (0,178 мл, 2,078 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Растворитель удаляли при пониженном давлении. Остаток вновь растворяли в дихлорметане (1 мл), и растворитель удаляли при пониженном давлении. Остаток вновь растворяли в дихлорметане (0,5 мл), и раствор добавляли к раствору 3-хлор-N-этил-1-(5-фторпиридин-3-ил)-1H-пиразол-4-амина (0,100 г, 0,416 ммоль) и 4-диметиламинопиридина (0,254 г, 2,078 ммоль) в дихлорметане (1,5 мл) и перемешивали при комнатной температуре в течение ночи. Растворитель удаляли при пониженном давлении, и остаток очищали с помощью хроматографии (0-100% этилацетат/гексаны) с получением N-(3-хлор-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метил-3-(метилтио)бутанамида (34 мг, 0,092 ммоль, 22,06%) в виде масла бледно-желтого цвета и (Z)-N-(3-хлор-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метилбут-2-енамида (38 мг, 0,118 ммоль, 28,3%-ый выход) в виде масла желтого цвета.
N-(3-Хлор-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метил-3-(метилтио)бутанамид: ИК (тонкая пленка) 1633 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,79 (д, J=2,0 Гц, 0,66H), 8,77 (д, J=2,0 Гц, 0,33H), 8,50 (д, J=2,6 Гц, 0,33H), 8,49 (д, J=2,5 Гц, 0,66H), 8,08 (с, 0,66H), 7,95 (с, 0,33H), 7,92-7,81 (м, 1H), 4,03-3,46 (м, 2H), 3,03-2,78 (м, 1H), 2,59-2,33 (м, 1H), 2,04 (с, 2H), 2,02 (с, 1H), 1,32 (д, J=6,7 Гц, 1H), 1,27 (д, J=6,2 Гц, 1H), 1,23 (д, J=6,9 Гц, 2H), 1,18-1,12 (м, 5H); ESIMS m/z 371 ([M]+).
(Z)-N-(3-Хлор-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метилбут-2-енамид: 1H ЯМР (400 МГц, CDCl3) δ 8,73 (д, J=2,0 Гц, 1H), 8,46 (д, J=2,4 Гц, 1H), 7,87 (д, J=4,9 Гц, 1H), 7,84 (дт, J=9,2, 2,4 Гц, 1H), 5,93-5,76 (м, 1H), 3,73 (кв, J=7,1 Гц, 2H), 1,72 (с, 3H), 1,58 (дд, J=6,9, 0,9 Гц, 3H), 1,17 (т, J=7,1 Гц, 3H); ESIMS m/z 323 ([M]+).
Соединения 70, 180-181, 389-392, 397-398, 405-406, 427-429, 432, 456, 482, 521-522, 532-534, 555, и 589 были получены исходя из соответствующих промежуточных соединений и исходных продуктов в соответствии со способами, описанными в примере 39.
Пример 40: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-метил-2-(метилтио)ацетамида (соединение 337)
К ледяному раствору 2-(метилтио)уксусной кислоты (0,092 г, 0,863 ммоль) в DCM (2 мл) добавляли N-этил-N-изопропилпропан-2-амин (0,111 г, 0,863 ммоль), затем изобутил хлорформиат (0,099 мл, 0,767 ммоль). Перемешивание продолжали в течение 10 минут. Далее к раствору 3-хлор-N-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,08 г, 0,383 ммоль) в DCM (0,66 мл) добавляли смешанный ангидрид, и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали и очищали с использованием обращенно-фазовой хроматографии на колонке C-18 (0-100% CH3CN/H2O) с получением указанного в заголовке соединения в виде масла бледно-желтого цвета (0,075 г, 66%): 1H ЯМР (400 МГц, CDCl3) δ 8,95 (д, J=2,5 Гц, 1H), 8,62 (дд, J=4,8, 1,4 Гц, 1H), 8,13 (с, 1H), 8,04 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,50-7,43 (м, 1H), 3,26 (с, 3H), 3,12 (с, 2H), 2,24 (с, 3H); 13C ЯМР (101 МГц, CDCl3) δ 170,00, 148,61, 140,15, 140,03, 135,68, 126,56, 126,42, 125,33, 124,15, 37,16, 34,94, 16,22; ESIMS m/z 297 ([M+H]+).
Соединения 335, 336 и 542 были получены в соответствии со способами, описанными в примере 40.
Пример 41: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метил-3-оксобутанамида (соединение 499)
К раствору 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина, HCl (259 мг, 1 ммоль) и этил 2-метил-3-оксобутаноата (144 мг, 1,000 ммоль) в диоксане (1 мл) добавляли 2,3,4,6,7,8-гексагидро-1H-пиримидо[1,2-a]пиримидин (181 мг, 1,30 ммоль) и смесь нагревали в микроволновом реакторе (CEM Discover) при температуре 150°C в течение 1,5 ч с контролем внешней температуры ИК-датчиком на дне сосуда. ЖХМС (ELSD) указывал на 40% конверсию до желаемого продукта. Смесь разбавляли этилацетатом (50 мл) и насыщенным водным раствором NH4Cl (15 мл), и органическую фазу отделяли. Водную фазу экстрагировали этилацетатом (20 мл), и объединенную органическую фазу промывали насыщенным солевым раствором, сушили над MgSO4 и концентрировали в вакууме с получением маслянистого остатка. Данный остаток очищали на силикагеле, элюируя смесями этилацетата и гексана с получением N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метил-3-оксобутанамида (37 мг, 11%-ый выход, 96%-ой чистоты) в виде бесцветного масла: 1H ЯМР (400 МГц, CDCl3) δ 9,02-8,92 (дд, J=2,6, 0,8 Гц, 1H), 8,68-8,60 (дд, J=4,8, 1,5 Гц, 1H), 8,09-7,98 (м, 1H), 7,96-7,87 (с, 1H), 3,87-3,58 (д, J=3,0 Гц, 2H), 3,49-3,38 (м, 1H), 2,16-2,08 (с, 3H), 1,39-1,32 (д, J=7,0 Гц, 3H), 1,22-1,13 (м, 3H); EIMS (m/z) 321 ([M+1]+), 319 ([M-1]-).
Пример 42: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этилциклопропанкарбоксамида (соединение 538)
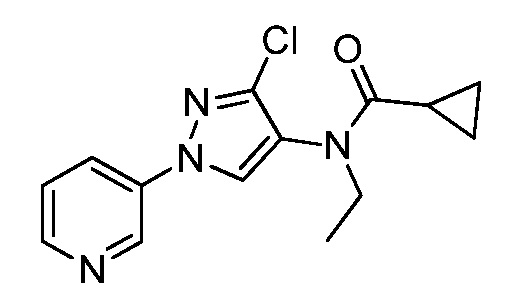
К раствору моногидрохлорида 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,10 г, 0,0,38 ммоль) в дихлорэтане (0,75 мл) добавляли циклопропанкарбоновую кислоту (0,03 г, 0,38 ммоль) и 4-N,N-диметиламинопиридин (0,14 г, 1,15 ммоль), затем гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (0,14 г, 0,77 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали досуха, и сырой продукт очищали с помощью обращенно-фазовой хроматографии на силикагеле, элюируя смесью 0-50% ацетонитрил/вода, с получением твердого вещества белого цвета (0,03 г, 25%); т. пл. 111-119°C; 1H ЯМР (400 МГц, CDCl3) δ 8,96 (д, J=2,5 Гц, 1H), 8,63-8,59 (м, 1H), 8,06 (ддд, J=8,3, 2,6, 1,4 Гц, 1H), 8,01 (с, 1H), 7,46 (дд, J=8,3, 4,7 Гц, 1H), 3,73 (кв, J=7,2 Гц, 2H), 1,46 (ддд, J=12,6, 8,1, 4,7 Гц, 1H), 1,16 (т, J=7,2 Гц, 3H), 1,04 (т, J=3,7 Гц, 2H), 0,71 (дд, J=7,7, 3,0 Гц, 2H); ESIMS m/z 291 ([M+H]).
Соединения 69, 516, 524, 546, 558-559, 582-588, 593 и 594 были получены исходя из соответствующих кислот в соответствии со способами, описанными в примере 42.
Пример 43: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-метил-3-(метилтио)-N-(3-(метилтио)пропаноил)пропанамида (соединение 407)
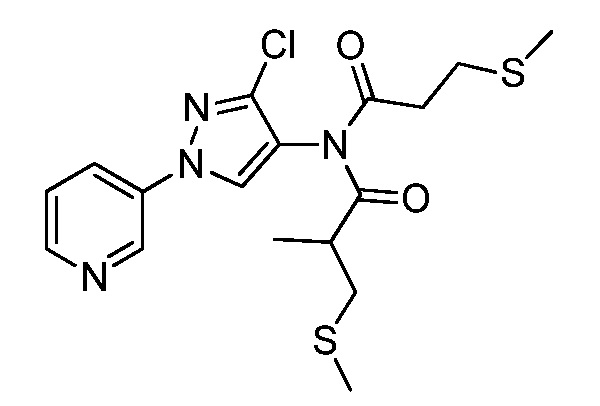
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(метилтио)пропанамида (0,216 г, 0,728 ммоль) в DCE (2,91 мл) в 10-мл пробирке добавляли 2-метил-3-(метилтио)пропаноил хлорид (0,244 г, 1,601 ммоль). Пробирку герметически закрывали и помещали в микроволновой реактор Biotage Initiator на 3 часа при температуре 100°C с контролем внешней температуры ИК-датчиком на боку сосуда. Сырую смесь концентрировали и очищали с использованием обращенно-фазовой хроматографии на колонке C-18 (0-100% ацетонитрил/вода) с получением указанного в заголовке соединения в виде масла бледно-желтого цвета (67 мг, 22%): ИК (тонкая пленка) 2916 и 1714 см-1; 1H ЯМР (300 МГц, CDCl3) δ 8,96-8,92 (д, J=2,7 Гц, 1H), 8,64-8,59 (дд, J=4,9, 1,4 Гц, 1H), 8,07-7,99 (м, 2H), 7,50-7,40 (дд, J=8,4, 4,8 Гц, 1H), 3,39-3,28 (м, 1H), 3,10-2,99 (тд, J=7,2, 3,9 Гц, 2H), 2,96-2,86 (дд, J=13,2, 8,7 Гц, 1H), 2,86-2,79 (т, J=7,3 Гц, 2H), 2,58-2,48 (дд, J=13,1, 5,8 Гц, 1H), 2,14-2,12 (с, 3H), 2,09-2,06 (с, 3H), 1,30-1,26 (д, J=6,9 Гц, 3H); ESIMS m/z 413 ([M+H]+).
Соединения 383, 410, 433, 437, 451, 470, 530 и 531 были получены в соответствии со способами, описанными в примере 43.
Пример 44: Получение N-[3-хлор-1-(3-пиридил)пиразол-4-ил]-2,2-дидейтерио-N-этил-3-метилсульфанил-пропанамида (соединение 393)
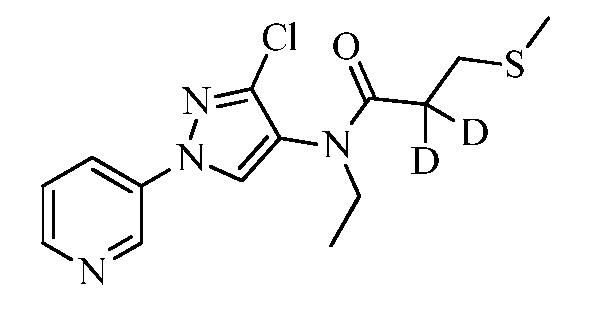
В 7-мл пробирку добавляли 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амин (111 мг, 0,5 ммоль), 2,2-дидейтерио-3-метилсульфанил-пропановую кислоту (58,0 мг, 0,475 ммоль) и затем DCM (объем: 2 мл). Раствор перемешивали при температуре 0°C. Затем добавляли раствор DCC (0,500 мл, 0,500 ммоль, 1,0M в DCM). Раствору давали медленно нагреться до температуры 25°C и перемешивали при температуре 25°C в течение ночи. В процессе реакции образовывался осадок белого цвета. Сырую реакционную смесь фильтровали через хлопковый фильтр и очищали с помощью хроматографии на силикагеле (0-100% EtOAc/гексан) с получением N-[3-хлор-1-(3-пиридил)пиразол-4-ил]-2,2-дидейтерио-N-этил-3-метилсульфанил-пропанамида (97 мг, 0,297 ммоль, 59,4%-ый выход) в виде бесцветного масла: 1H ЯМР (400 МГц, CDCl3) δ 8,96 (д, J=2,4 Гц, 1H), 8,63 (дд, J=4,6, 0,9 Гц, 1H), 8,06 (ддд, J=8,4, 2,7, 1,4 Гц, 1H), 7,98 (с, 1H), 7,52-7,40 (м, 1H), 3,72 (кв, J=7,2 Гц, 2H), 2,78 (с, 2H), 2,06 (с, 3H), 1,17 (т, J=7,2 Гц, 3H); ESIMS m/z 327 ([M+H]+); ИК (тонкая пленка) 1652 см-1.
Соединения 394, 396 и 471-473 были получены исходя из соответствующих промежуточных соединений и исходных продуктов в соответствии со способами, описанными в примере 44.
Пример 45: Получение 1-этил-3-(3-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил)мочевины (соединение 145)
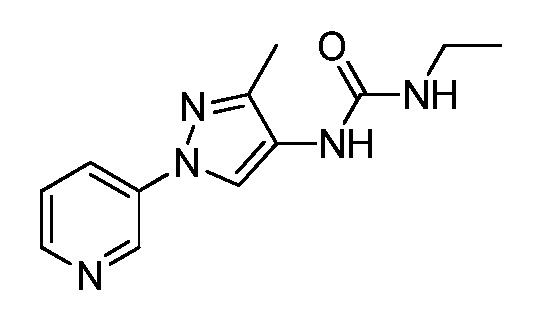
К раствору 3-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,1 г, 0,574 ммоль) в DCM (5,74 мл) добавляли этилизоцианат (0,041 г, 0,574 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 40 минут. Реакционная смесь из прозрачного раствора становилась суспензией с твердым веществом белого цвета. Реакционную смесь концентрировали и очищали с использованием хроматографии на силикагеле (0-20% MeOH/DCM) с получением указанного в заголовке соединения в виде твердого вещества белого цвета (0,135 г, 95%): т. пл. 197-200°C; 1H ЯМР (400 МГц, CDCl3) δ 8,94 (д, J=2,3 Гц, 1H), 8,48-8,37 (м, 1H), 8,32 (с, 1H), 7,94 (д, J=8,3 Гц, 1H), 7,52 (ушир. с, 1H), 7,41-7,25 (м, 1H), 5,79 (ушир. с, 1H), 3,33-3,23 (м, 2H), 2,29 (д, J=2,9 Гц, 3H), 1,16 (дд, J=8,7, 5,7 Гц, 3H); ESIMS m/z 246 ([M+H]+), 244 ([M-H]-).
Соединения 169-171, 221-222, 255-257, 278-280, 297-302, 318-322, 334, 345, 348, 375-377, 385-387 и 411-413 были получены в соответствии со способами, описанными в примере 45.
1-(3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-этил-1-метилтиомочевину (соединение Y2048) получали в соответствии со способом, описанным в примере 45, с использованием DMAP в качестве основания, диоксана в качестве растворителя, и нагревая реакционную смесь в микроволновом реакторе (CEM Discover®) с контролем внешней температуры ИК-датчиком на дне сосуда при температуре 120°C в течение 2 часов: твердое вещество белого цвета; т. пл. 160,0-162,0°C; 1H ЯМР (300 МГц, CDCl3) δ 8,94 (д, J=2,6 Гц, 1H), 8,62 (дд, J=4,8, 1,4 Гц, 1H), 8,05-7,98 (м, 2H), 7,46 (дд, J=8,3, 4,7 Гц, 1H), 5,66 (с, 1H), 3,72-3,59 (м, 5H), 1,17 (т, J=7,2 Гц, 3H); ESIMS m/z 297 ([M+H]+).
Пример 46: Получение 3-бутил-1-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-1-этилмочевины (соединение 500)
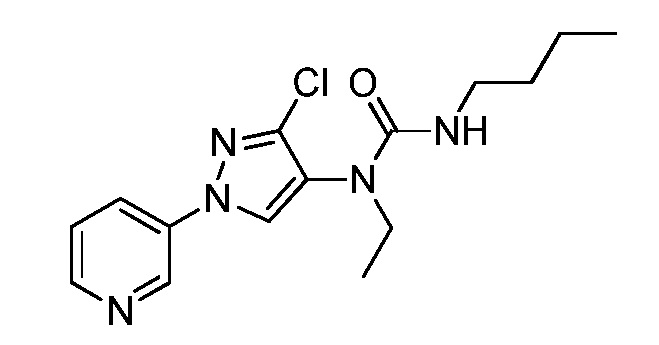
К раствору 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина, 2HCl (0,130 г, 0,502 ммоль) в DCE (1,25 мл) добавляли N-этил-N-изопропилпропан-2-амин (0,21 мл, 1,255 ммоль), затем 1-изоцианатобутан (0,109 г, 1,104 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь концентрировали и очищали с использованием хроматографии на силикагеле (0-20% MeOH/DCM) с получением указанного в заголовке соединения в виде твердого вещества бежевого цвета (0,131 г, 77%): ИК (тонкая пленка) 3326, 2959, 2931, 1648 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,95 (с, 1H), 8,62 (д, J=4,0 Гц, 1H), 8,08-8,01 (м, 1H), 7,97 (с, 1H), 7,46 (дд, J=8,3, 4,7 Гц, 1H), 4,42-4,32 (м, 1H), 3,74-3,61 (м, 2H), 3,27-3,15 (м, 2H), 1,49-1,37 (м, 2H), 1,37-1,22 (м, 2H), 1,19-1,12 (м, 3H), 0,94-0,84 (м, 3H); ESIMS m/z 322 ([M+H]+).
Соединения 479-480, 501-504, 513, 518 и 519 были получены в соответствии с примером 46.
Пример 47: Получение 1-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)имидазолидин-2-она (соединение 374)
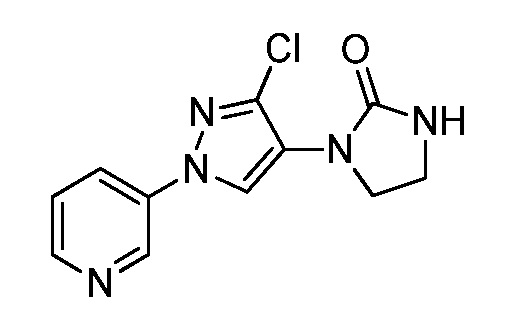
К раствору 1-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(2-хлорэтил)мочевины (0,1 г, 0,333 ммоль) в ТГФ (6,66 мл) добавляли гидрид натрия (8,00 мг, 0,333 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 30 минут. Реакцию гасили путем добавления насыщенного раствора хлорида аммония, и продукт экстрагировали этилацетатом (2×). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали. Продукт представлял собой твердое вещество бежевого цвета, которое было чистым и не требовало какой-либо дополнительной очистки (63 мг, 72%): т. пл. 167-170ºC; 1H ЯМР (400 МГц, CDCl3) δ 8,96 (д, J=2,2 Гц, 1H), 8,56 (дд, J=4,7, 1,4 Гц, 1H), 8,33 (с, 1H), 7,99 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,40 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 5,00 (с, 1H), 4,14-4,07 (м, 2H), 3,68-3,58 (м, 2H); ESIMS m/z 264 ([M+H]+).
Соединение 349 получали в соответствии со способами, описанными в примере 47.
Пример 48: Получение S-трет-бутил (3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)карбамотиоата (соединение 514)
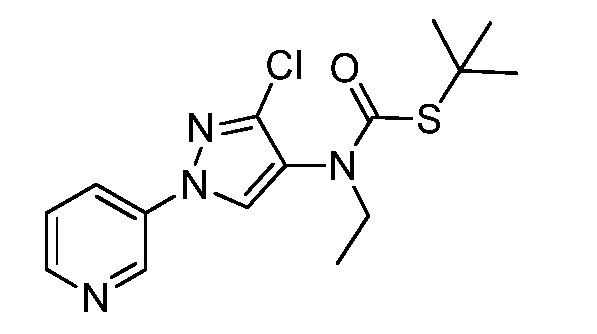
К раствору 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина, 2HCl (0,13 г, 0,502 ммоль) в DCM (2,508 мл) добавляли N-этил-N-изопропилпропан-2-амин (0,257 мл, 1,505 ммоль), затем S-трет-бутил карбонохлоридотиоат (0,153 г, 1,003 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Реакцию гасили путем добавления насыщенного водного раствора бикарбоната натрия. Органический слой экстрагировали DCM. Органический слой сушили над сульфатом натрия, фильтровали, концентрировали и очищали с использованием хроматографической колонки с силикагелем (0-100% этилацетат/гексаны) с получением указанного в заголовке соединения в виде твердого вещества белого цвета (132 мг, 78%): т. пл. 91-93ºC; 1H ЯМР (400 МГц, CDCl3) δ 8,96 (д, J=2,5 Гц, 1H), 8,60 (дд, J=4,7, 1,4 Гц, 1H), 8,08-8,03 (м, 1H), 7,97 (с, 1H), 7,47-7,41 (м, 1H), 3,69 (кв, J=7,2 Гц, 2H), 1,47 (с, 9H), 1,21-1,13 (м, 3H); ESIMS m/z 339 ([M+H]+).
Соединения 333, 338, 339, 346, 368 и 373 были получены в соответствии со способами, описанными в примере 48.
Пример 49: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метил-3-(метио)пропантиоамида (соединение 364)
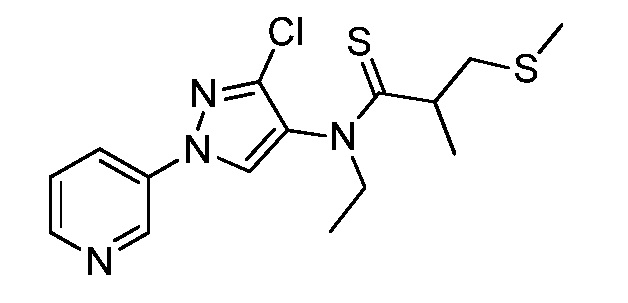
В сосуд для микроволнового реактора добавляли N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метил-3-(метио)пропанамид (0,07 г, 0,22 ммоль) в дихлорэтане (1,87 мл) и реагент Лавессона (0,05 г, 0,12 ммоль). Сосуд герметически закрывали и нагревали в микроволновом реакторе Biotage Initiator в течение 15 минут при температуре 130°C с контролем внешней температуры ИК-датчиком на боку сосуда. Реакционную смесь концентрировали досуха, и сырое вещество очищали с помощью хроматографии на силикагеле (0-80% ацетонитрил/вода) с получением желаемого продукта в виде масла желтого цвета (0,33 г, 44%): ИК (тонкая пленка) 1436 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,97 (д, J=2,5 Гц, 1H), 8,77-8,52 (м, 1H), 8,11-7,89 (м, 2H), 7,60-7,38 (м, 1H), 4,62 (ушир. с, 1H), 4,02 (ушир. с, 1H), 3,21-2,46 (м, 3H), 2,01 (с, 3H), 1,35-1,15 (м, 6H); ESIMS m/z 355 ([M+H]+).
Соединения 372, 438 и 548 были получены в соответствии со способами, описанными в примере 49.
N-Метил-3-(метилтио)пропантиоамид получали в соответствии со способом, описанным в примере 49, и выделяли в виде прозрачного масла; 1H ЯМР (400 МГц, CDCl3) δ 7,69 (с, 1H), 3,20 (д, J=4,8 Гц, 3H), 2,99-2,88 (м, 4H), 2,15 (с, 3H); ESIMS m/z 150 ([M+H]+).
Пример 50: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-4,4,4-трифтор-3-(метилсульфинил)бутанамида (соединение 570)
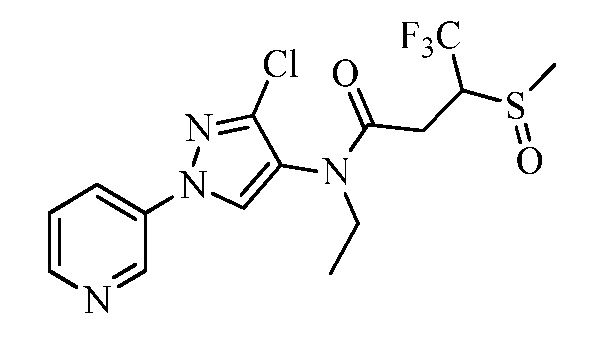
В 20-мл пробирку добавляли N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-4,4,4-трифтор-3-(метилтио)бутанамид (82 мг, 0,209 ммоль) и гексафторизопропанол (1,5 мл). Одной порцией добавляли пероксид водорода (0,054 мл, 0,626 ммоль, 35%-ый раствор в воде), и раствор перемешивали при комнатной температуре. Спустя 3 часа реакцию гасили насыщенным раствором сульфита натрия и экстрагировали EtOAc (3×20 мл). Объединенные органические слои сушили над сульфатом натрия, концентрировали и очищали с помощью хроматографии (0-10% MeOH/DCM) с получением N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-4,4,4-трифтор-3-(метилсульфинил)бутанамида (76 мг, 0,186 ммоль, 89%-ый выход) в виде полутвердого вещества белого цвета: 1H ЯМР (400 МГц, CDCl3) δ 8,98 (д, J=2,3 Гц, 1H), 8,63 (тд, J=4,8, 2,4 Гц, 1H), 8,14-8,01 (м, 2H), 7,46 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 4,26 (дд, J=17,2, 8,4 Гц, 1H), 3,89-3,61 (м, 2H), 3,01 (дд, J=17,6, 8,2 Гц, 1H), 2,77 (с, 2H), 2,48 (дд, J=17,7, 3,3 Гц, 1H), 1,19 (т, J=7,2 Гц, 3H) (показан только один изомер); ESIMS m/z 409 ([M+H]+); ИК (тонкая пленка) 1652 см-1.
Соединение 571 было получено исходя из соответствующих промежуточных соединений и исходных продуктов в соответствии со способами, описанными в примере 50.
Пример 51: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(метилсульфинил)пропанамида (соединение 362)
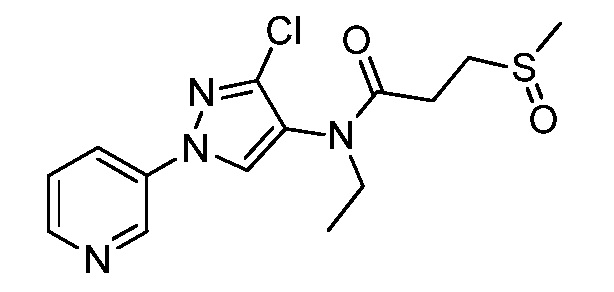
К N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(метилтио)пропанамиду (0,08 г, 0,24 ммоль) в ледяной уксусной кислоте (0,82 мл) добавляли тетрагидрат пербората натрия (0,05 г, 0,25 ммоль) и смесь нагревали при температуре 60°C в течение 1 часа. Реакционную смесь осторожно выливали в делительную воронку, содержащую насыщенный водный раствор NaHCO3, что приводило к выделению газа. Когда выделение газа прекращалось, добавляли этилацетат, и слои разделяли. Водный слой экстрагировали два раза этилацетатом, и все органические слои объединяли, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Сырое вещество очищали с помощью хроматографии на силикагеле (0-10% метанол/дихлорметан) с получением желаемого продукта в виде прозрачного масла (0,03 г, 40%): ИК (тонкая пленка) 1655 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,95 (т, J=9,2 Гц, 1H), 8,63 (дд, J=4,7, 1,4 Гц, 1H), 8,20-7,86 (м, 2H), 7,59-7,33 (м, 1H), 3,73 (ддт, J=20,5, 13,4, 6,8 Гц, 2H), 3,23-3,06 (м, 1H), 2,94-2,81 (м, 1H), 2,74-2,62 (м, 2H), 2,59 (с, 3H), 1,25-1,07 (м, 3H); ESIMS m/z 341 ([M+H]+).
Соединения 101-102, 218, 328, 330 и 494 были получены исходя из соответствующих сульфидов в соответствии со способами, описанными в примере 51.
Пример 52: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(метилсульфонил)пропанамида (соединение 363)
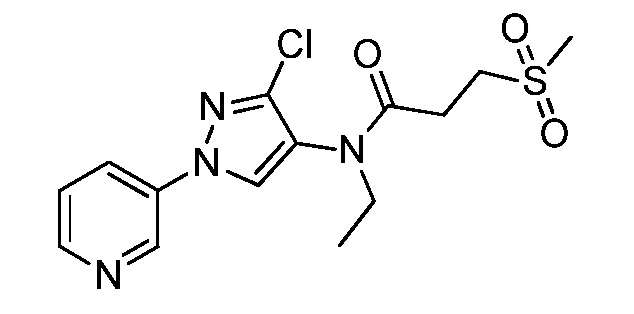
К N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(метилтио)пропанамиду (0,08 г, 0,25 ммоль) в ледяной уксусной кислоте (0,85 мл) добавляли тетрагидрат пербората натрия (0,11 г, 0,52 ммоль) и смесь нагревали при температуре 60°C в течение 1 часа. Реакционную смесь осторожно выливали в делительную воронку, содержащую насыщенный водный раствор NaHCO3, что приводило к выделению газа. Когда выделение газа прекращалось, добавляли этилацетат, и слои разделяли. Водный слой экстрагировали два раза этилацетатом, и все органические слои объединяли, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Сырой продукт очищали путем колоночной хроматографии на силикагеле (от 0 до 10% метанол/дихлорметан) с получением желаемого продукта в виде прозрачного масла (0,04, 47%): (тонкая пленка) 1661 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,95 (т, J=11,5 Гц, 1H), 8,64 (дд, J=4,8, 1,4 Гц, 1H), 8,17-7,96 (м, 2H), 7,59-7,39 (м, 1H), 3,73 (д, J=7,0 Гц, 2H), 3,44 (дд, J=22,5, 15,7 Гц, 2H), 2,96 (с, 3H), 2,71 (т, J=6,9 Гц, 2H), 1,18 (дд, J=8,8, 5,5 Гц, 3H); ESIMS m/z 357 ([M+H]+).
Соединения 103, 104, 219, 329, 331 и 495 были получены исходя из соответствующих сульфидов в соответствии со способами, описанными в примере 52.
Пример 53: Получение N-(3-метил-1-(3-фторпиридин-5-ил)-1H-пиразол-4-ил)-N-этил-2-метил-(3-оксидо-λ4-сульфанилиденцианамид)(метил)пропанамида (соединение 250)
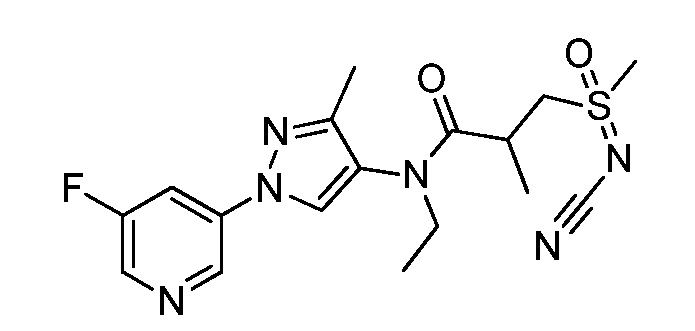
К раствору N-этил-N-(1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-ил)-2-метил-3-(метилтио)пропанамида (0,30 г, 0,89 ммоль) в дихлорметане (3,57 мл) при температуре 0°C добавляли цианамид (0,07 г, 1,78 ммоль) и йодбензолдиацетат (0,31 г, 0,98 ммоль) и потом перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали досуха, и сырое вещество очищали путем колоночной хроматографии на силикагеле (10% метанол/этилацетат) с получением желаемого сульфиламина в виде твердого вещества светло-желтого цвета (0,28 г, 85%). К раствору 70% mCPBA (0,25 г, 1,13 ммоль) в этаноле (4,19 мл) при температуре 0°C добавляли раствор карбоната калия (0,31 г, 2,26 ммоль) в воде (4,19 мл) и перемешивали в течение 20 минут, после чего одной порцией добавляли раствор сульфиламина (0,28 г, 0,75 ммоль) в этаноле (4,19 мл). Реакционную смесь перемешивали в течение 1 часа при температуре 0°C. Избыток mCPBA гасили 10%-ым раствором тиосульфита натрия, и реакционную смесь концентрировали досуха. Остаток очищали с помощью хроматографии на силикагеле (0-10% метанол/дихлорметан) с получением желаемого продукта в виде прозрачного масла (0,16 г, 56%): ИК (тонкая пленка) 1649 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,80 (дд, J=43,8, 10,1 Гц, 1H), 8,51-8,36 (м, 1H), 8,11 (д, J=38,7 Гц, 1H), 7,96-7,77 (м, 1H), 4,32-3,92 (м, 2H), 3,49-3,11 (м, 6H), 2,32 (с, 3H), 1,27-1,05 (м, 6H); ESIMS m/z 393 ([M+H]+).
Пример 54: Получение N-этил-4,4,4-трифтор-3-метокси-N-(3-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(трифторметил)бутанамида (соединение 276)
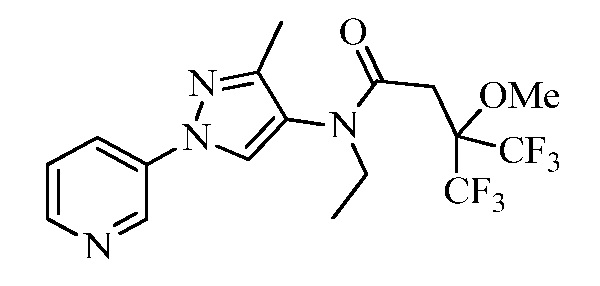
К раствору N-этил-4,4,4-трифтор-3-гидрокси-N-(3-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(трифторметил)бутанамида (184 мг, 0,448 ммоль) в ДМФ (3 мл), перемешивая при температуре 0°C, добавляли гидрид натрия (26,9 мг, 0,673 ммоль). Раствор перемешивали при температуре 0°C в течение 0,5 часа. Затем добавляли йодметан (0,034 мл, 0,538 ммоль), и затем ледяную баню отставляли, и смесь перемешивали при температуре 25°C в течение ночи. Реакционную смесь обрабатывали путем медленного добавления воды и затем разбавляли 20 мл воды, затем экстрагировали 4×20 мл EtOAc. Объединенные органические слои промывали водой, сушили над Na2SO4 и концентрировали. Хроматография на силикагеле (0-100% EtOAc/гексан) давала N-этил-4,4,4-трифтор-3-метокси-N-(3-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(трифторметил)бутанамид (52 мг, 0,123 ммоль, 27,3%-ый выход) в виде твердого вещества белого цвета: т. пл. = 83-86°C; 1H ЯМР (400 МГц, CDCl3) δ 8,94 (д, J=2,5 Гц, 1H), 8,59 (дд, J=4,7, 1,3 Гц, 1H), 8,01 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,85 (с, 1H), 7,44 (ддд, J=8,3, 4,8, 0,6 Гц, 1H), 4,00 (ушир. с, 1H), 3,73 (с, 3H), 3,39 (ушир. с, 1H), 2,86 (с, 2H), 2,26 (с, 3H), 1,16 (т, J=7,1 Гц, 3H); ESIMS m/z 425 ([M+H]+); ИК (тонкая пленка) 1664 см-1.
Соединение 327 было получено исходя из соответствующих промежуточных соединений и исходных продуктов в соответствии со способами, описанными в примере 54.
Пример 55, стадия 1: Получение N-(2-((трет-бутилдиметилсилил)окси)этил)-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-метил-3-(метилтио)пропанамида
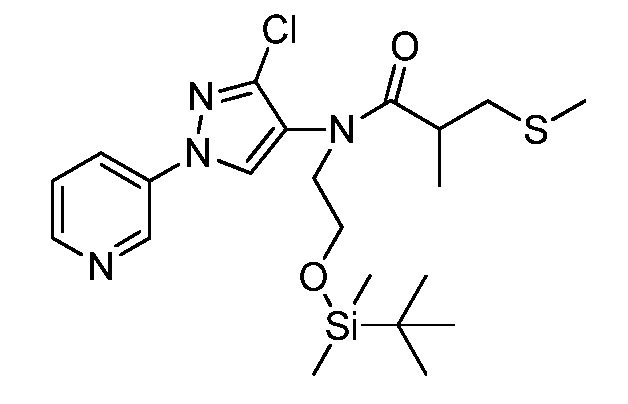
Раствор N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-метил-3-(метилтио)пропанамида (0,150 г, 0,483 ммоль) в N,N-диметилформамиде (2,413 мл) охлаждали до температуры 0°C. Добавляли гидрид натрия (0,039 г, 0,965 ммоль, 60%-ая дисперсия), и реакционную смесь перемешивали при температуре 0°C в течение 30 минут. Добавляли (2-бромэтокси)(трет-бутил)диметилсилан (0,231 г, 0,965 ммоль), баню со льдом отставляли, и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь нагревали при температуре 65°C в течение 1,5 часов и затем охлаждали до комнатной температуры. Добавляли насыщенный солевой раствор и смесь экстрагировали дихлорметаном. Объединенные органические фазы концентрировали и подвергали хроматографии (0-100% этилацетат/гексаны) с получением N-(2-((трет-бутилдиметилсилил)окси)этил)-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-метил-3-(метилтио)пропанамида (0,120 г, 0,243 ммоль, 50,4%) в виде масла оранжевого цвета: ИК (тонкая пленка) 1669 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,88 (д, J=2,5 Гц, 1H), 8,55 (дд, J=4,7, 1,4 Гц, 1H), 8,05 (с, 1H), 7,98 (ддд, J=8,3, 2,6, 1,4 Гц, 1H), 7,41 (ддд, J=8,4, 4,8, 0,5 Гц, 1H), 4,35-3,06 (м, 4H), 2,86-2,73 (м, 1H), 2,73-2,59 (м, 1H), 2,41 (дд, J=12,8, 5,7 Гц, 1H), 1,94 (с, 3H), 1,11 (д, J=6,7 Гц, 3H), 0,80 (с, 9H), 0,00 (с, 3H), -0,01 (с, 3H); ESIMS m/z 470 ([M+H]+).
Пример 55, стадия 2: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-(2-гидроксиэтил)-2-метил-3-(метилтио)пропанамида (соединение 535)
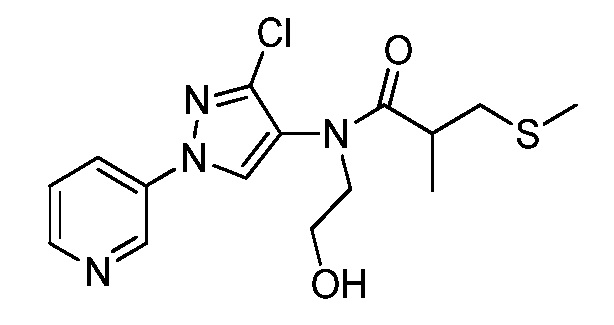
К раствору N-(2-((трет-бутилдиметилсилил)окси)этил)-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-метил-3-(метилтио)пропанамида (0,180 г, 0,384 ммоль) в тетрагидрофуране (1,54 мл) добавляли тетрабутиламмония фторид (0,201 г, 0,767 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Объединенные органические фазы концентрировали и подвергали хроматографии (0-100% вода/ацетонитрил) с получением N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-(2-гидроксиэтил)-2-метил-3-(метилтио)пропанамида в виде масла белого цвета (0,081 г, 0,217 ммоль, 56,5%): ИК (тонкая пленка) 3423, 1654 см-1; 1H ЯМР (400 МГц, CDCl3) δ 9,00 (д, J=2,5 Гц, 1H), 8,62 (дд, J=4,7, 1,2 Гц, 1H), 8,25 (с, 1H), 8,07 (ддд, J=8,3, 2,4, 1,3 Гц, 1H), 7,47 (дд, J=8,3, 4,7 Гц, 1H), 4,47-3,70 (м, 3H), 3,65-3,09 (м, 2H), 2,91-2,68 (м, 2H), 2,48 (дд, J=12,4, 5,0 Гц, 1H), 2,01 (с, 3H), 1,18 (д, J=6,5 Гц, 3H); ESIMS m/z 356 ([M+H]+).
Пример 56: Получение 2-(N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-метил-3-(метилтио)пропанамидо)этилацетата (соединение 547)
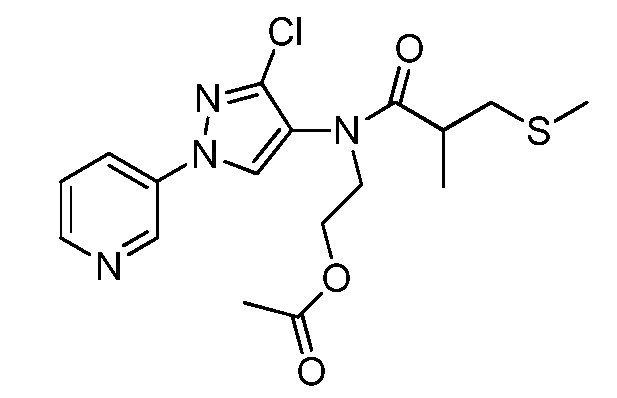
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-(2-гидроксиэтил)-2-метил-3-(метилтио)пропанамида (0,045 г, 0,127 ммоль) в дихлорметане (1,27 мл) добавляли N,N-диметилпиридин-4-амин (0,023 г, 0,190 ммоль) и триэтиламин (0,019 г, 0,190 ммоль), затем ацетилхлорид (0,015 г, 0,190 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду и смесь экстрагировали дихлорметаном. Объединенные органические фазы концентрировали и подвергали хроматографии (0-100% этилацетат/гексаны) с получением 2-(N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-метил-3-(метилтио)пропанамидо)этилацетата в виде масла желтого цвета (0,015 г, 0,034 ммоль, 26,8%): ИК (тонкая пленка) 1739, 1669 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,97 (д, J=2,3 Гц, 1H), 8,64 (дд, J=4,7, 1,4 Гц, 1H), 8,15 (с, 1H), 8,04 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,47 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 4,50-3,40 (м, 4H), 2,84 (дд, J=12,7, 8,9 Гц, 1H), 2,78-2,63 (м, 1H), 2,46 (дд, J=12,7, 5,4 Гц, 1H), 2,03 (с, 3H), 2,01 (с, 3H), 1,16 (д, J=6,6 Гц, 3H); ESIMS m/z 398 ([M+H]+).
Пример 57: Получение 2,2-дидейтерио-3-метилсульфанил-пропановой кислоты
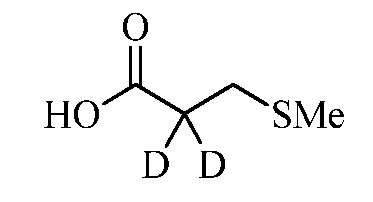
В 100-мл круглодонную колбу добавляли 3-(метилтио)пропановую кислоту (3 г, 24,96 ммоль), затем D2O (23 мл) и KOD (8,53 мл, 100 ммоль)(40% масс. раствор в D2O), раствор нагревали при кипячении с обратным холодильником в течение ночи. ЯМР показывал приблизительно 95% D в альфа-положении. Реакционную смесь охлаждали и гасили концентрированной HCl до pH<2. При подкислении в водном слое появлялся осадок белого цвета. Реакционную смесь экстрагировали 3×50 мл EtOAc, объединенные органические слои сушили над Na2SO4, концентрировали в вакууме почти досуха. Добавляли 100 мл гексана и раствор опять концентрировали с получением 2,2-дидейтерио-3-метилсульфанил-пропановой кислоты в виде бесцветного масла (2,539 г, 20,78 ммоль, 83%): ИК (тонкая пленка) 3430, 1704 см-1; 1H ЯМР (400 МГц, CDCl3) δ 2,76 (с, 2H), 2,14 (с, 3H); 13C ЯМР (101 МГц, CDCl3) δ 178,28, 38,14-28,55 (м), 28,55, 15,51; EIMS m/z 122.
2-Дейтерио-2-метил-3-метилсульфанил-пропановая кислота была получена, как описано в примере 57, в виде бесцветного масла (3,62 г, 26,8 ммоль, 60,9%): ИК (тонкая пленка) 2975, 1701 см-1; 1H ЯМР (400 МГц, CDCl3) δ 11,39-10,41 (ушир. с, 1H), 2,88-2,79 (д, J=13,3 Гц, 1H), 2,61-2,53 (д, J=13,3 Гц, 1H), 2,16-2,09 (с, 3H), 1,32-1,25 (с, 3H); 13C ЯМР (101 МГц, CDCl3) δ 181,74, 39,74-39,02 (м), 37,16, 16,50, 16,03; EIMS m/z 135.
Пример 58: Получение 2-метил-3-(тридейтериометилсульфанил)пропановой кислоты
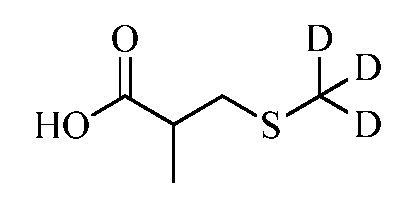
В 50-мл круглодонную колбу добавляли 3-меркапто-2-метилпропановую кислоту (5 г, 41,6 ммоль), затем MeOH (15 мл), раствор перемешивали при температуре 25°C. Медленно, поскольку реакция была экзотермической, добавляли гидроксид калия (5,14 г, 92 ммоль). Медленно добавляли йодметан-d3 (6,63 г, 45,8 ммоль) и затем реакционную смесь нагревали при температуре 65°C в течение ночи. Реакционную смесь обрабатывали путем добавления 2н HCl до тех пор, пока смесь не становилась кислой. Затем экстрагировали EtOAc (4×50 мл), и объединенные органические слои сушили над Na2SO4, концентрировали и очищали путем флэш-хроматографии, элюируя с помощью смеси 0-80% EtOAc/гексан, с получением 2-метил-3-(тридейтериометилсульфанил)пропановой кислоты (4,534 г, 33,0 ммоль, 79%) в виде бесцветного масла: ИК (тонкая пленка) 3446, 1704 см-1; 1H ЯМР (400 МГц, CDCl3) δ 2,84 (дд, J=13,0, 7,1 Гц, 1H), 2,80-2,66 (м, 1H), 2,57 (дд, J=13,0, 6,6 Гц, 1H), 1,30 (д, J=7,0 Гц, 3H); EIMS m/z 137.
Пример 59: Получение 2-гидрокси-3-(метилтио)пропановой кислоты
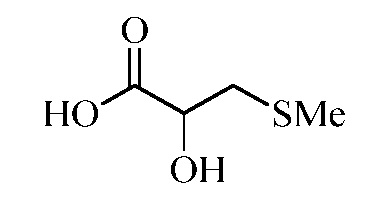
Метантиолат натрия (4,50 г, 64,2 ммоль) добавляли при температуре 25°C к раствору 3-хлор-2-гидроксипропановой кислоты (2 г, 16,06 ммоль) в MeOH (120 мл). Реакционную смесь нагревали при кипячении с обратным холодильником в течение 8 часов, затем охлаждали до температуры 25°C. Осадок удаляли фильтрацией и фильтрат упаривали. Остаток подкисляли до pH 2 с помощью 2н HCl, экстрагировали EtOAc (3×30 мл), объединенные органические слои сушили с помощью Na2SO4, концентрировали с получением 2-гидрокси-3-(метилтио)пропановой кислоты в виде твердого вещества белого цвета (1,898 г, 13,94 ммоль, 87%-ый выход): т. пл. 55-59°C; ИК (тонкая пленка) 2927, 1698 см-1; 1H ЯМР (400 МГц, CDCl3) δ 6,33 (с, 3H), 4,48 (дд, J=6,3, 4,2 Гц, 1H), 3,02 (дд, J=14,2, 4,2 Гц, 1H), 2,90 (дд, J=14,2, 6,3 Гц, 1H), 2,20 (с, 3H); EIMS m/z 136.
Пример 60: Получение 2-метокси-3-(метилтио)пропановой кислоты
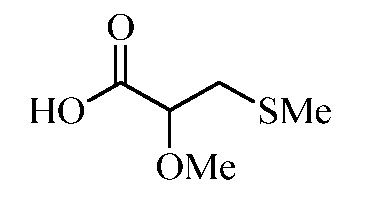
К перемешиваемому раствору гидрида натрия (0,176 г, 4,41 ммоль) в ДМФ (5 мл) добавляли раствор 2-гидрокси-3-(метилтио)пропановой кислоты (0,25 г, 1,836 ммоль) в 1 мл ДМФ при температуре 25°C и перемешивали в течение 10 мин. Наблюдалось энергичное выделение пузырьков при добавлении NaH. Затем добавляли йодметан (0,126 мл, 2,020 ммоль) и раствор перемешивали при температуре 25°C в течение ночи. Реакцию гасили путем добавления 2н HCl, экстрагировали 3×10 мл EtOAc, объединенные органические слои промывали водой (2×20 мл), концентрировали и очищали с помощью колоночной хроматографии, элюируя с помощью 0-100% EtOAc/гексан, получали 2-метокси-3-(метилтио)пропановую кислоту (126 мг, 0,839 ммоль, 45,7%-ый выход) в виде бесцветного масла: 1H ЯМР (400 МГц, CDCl3) δ 9,10 (с, 1H), 4,03 (дд, J=6,9, 4,4 Гц, 1H), 3,51 (с, 3H), 2,98-2,93 (м, 1H), 2,86 (дд, J=14,1, 6,9 Гц, 1H), 2,21 (с, 3H); EIMS m/z 150.
Пример 61: Получение 2-(ацетилтиометил)-3,3,3-трифторпропановой кислоты
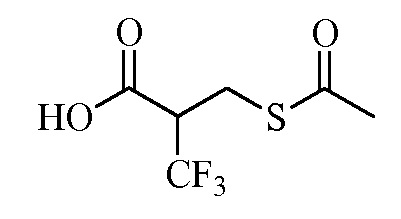
В 50-мл круглодонную колбу добавляли 2-(трифторметил)акриловую кислоту (6 г, 42,8 ммоль), затем тиоуксусную кислоту (4,59 мл, 64,3 ммоль). Реакция была слегка экзотермической. Смесь затем перемешивали при температуре 25°C в течение ночи. ЯМР показывал присутствие небольшого количества исходного продукта (~30%). Добавляли еще один эквивалент тиоуксусной кислоты и смесь нагревали при температуре 95°C в течение 1 часа, затем оставляли охлаждаться до комнатной температуры. Смесь очищали путем вакуумной дистилляции при 2,1-2,5 мм рт. ст., фракция, перегнанная при температуре 80-85°C, представляла собой, главным образом, тиоуксусную кислоту, фракция, перегнанная при температуре 100-110°C, представляла собой почти чистый продукт, загрязненный неполярными примесями (согласно данным ТСХ). Его опять очищали с помощью флэш-хроматографии (0-20% MeOH/DCM) с получением 2-(ацетилтиометил)-3,3,3-трифторпропановой кислоты (7,78 г, 36,0 ммоль, 84%-ый выход) в виде бесцветного масла, которое отвердевало в высоком вакууме с образованием твердого вещества белого цвета: т. пл. 28-30°C; 1H ЯМР (400 МГц, CDCl3) δ 7,52 (ушир. с, 1H), 3,44 (дт, J=7,5, 3,5 Гц, 2H), 3,20 (дд, J=14,9, 11,1 Гц, 1H), 2,38 (с, 3H); 13C ЯМР (101 МГц, CDCl3) δ 194,79, 171,14, 123,44 (кв, J=281,6 Гц), 50,47 (кв, J=27,9 Гц), 30,44, 24,69 (кв, J=2,6 Гц); 19F ЯМР (376 МГц, CDCl3) δ -67,82.
Пример 62: Получение 3,3,3-трифтор-2-(метилтиометил)пропановой кислоты
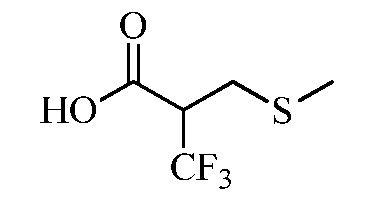
К раствору 2-(ацетилтиометил)-3,3,3-трифторпропановой кислоты (649 мг, 3 ммоль) в MeOH (5 мл), перемешивая при температуре 25°C, в течение 5 минут добавляли четырьмя частями гранулы гидроксида калия (421 мг, 7,50 ммоль). Реакция была экзотермической. Затем одной порцией добавляли MeI, реакционную смесь затем нагревали при температуре 65°C в течение 18 часов. Реакционную смесь далее охлаждали и гасили с помощью 2н HCl до кислой среды, и водный слой экстрагировали хлороформом (4×20 мл). Объединенный органический слой сушили, концентрировали в вакууме, очищали путем флэш-хроматографии (0-20% MeOH/DCM) с получением 3,3,3-трифтор-2-(метилтиометил)пропановой кислоты (410 мг, 2,179 ммоль, 72,6%-ый выход) в виде масла светло-желтого цвета: 1H ЯМР (400 МГц, CDCl3) δ 10,95 (с, 1H), 3,49-3,37 (м, 1H), 3,02 (дд, J=13,8, 10,8 Гц, 1H), 2,90 (дд, J=13,8, 4,0 Гц, 1H), 2,18 (с, 3H); 13C ЯМР (101 МГц, CDCl3) δ 172,04 (кв, J=2,8 Гц), 123,55 (кв, J=281,2 Гц), 50,89 (кв, J=27,5 Гц), 29,62 (кв, J=2,3 Гц), 15,85; 19F ЯМР (376 МГц, CDCl3) δ -67,98.
Пример 63: Получение 3-(метилтио)пентановой кислоты
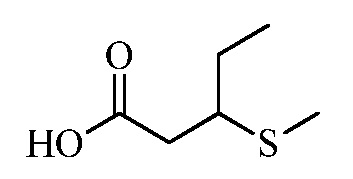
S,S-Диметил карбонодитиоат (1,467 г, 12,00 ммоль) добавляли при энергичном перемешивании к раствору (E)-пент-2-еновой кислоты (2,002 г, 20 ммоль) в 30%-ом растворе KOH (полученный из гидроксида калия (3,87 г, 69 ммоль) и воды (10 мл)). Реакционную смесь медленно нагревали при температуре 90°C в течение периода 20-30 мин. Нагревание продолжали в течение 3 часов, затем реакционную смесь охлаждали до температуры 25°C и медленно гасили с помощью HCl. Смесь затем экстрагировали DCM (3×30 мл), объединенный органический слой сушили и концентрировали с получением 3-(метилтио)пентановой кислоты (2,7 г, 18,22 ммоль, 91%-ый выход) в виде масла светло-оранжевого цвета: ИК (тонкая пленка) 2975, 1701 см-1; 1H ЯМР (400 МГц, CDCl3) δ 2,92 (квд, J=7,3, 5,6 Гц, 1H), 2,63 (д, J=7,2 Гц, 2H), 2,08 (с, 3H), 1,75-1,51 (м, 2H), 1,03 (т, J=7,4 Гц, 3H); 13C ЯМР (101 МГц, CDCl3) δ 178,14, 43,95, 39,78, 27,04, 12,95, 11,29; EIMS m/z 148.
4-Метил-3-(метилтио)пентановая кислота была получена, как описано в примере 63, и выделена в виде бесцветного масла: ИК (тонкая пленка) 2960, 1704 см-1; 1H ЯМР (400 МГц, CDCl3) δ 2,88 (ддд, J=9,1, 5,4, 4,7 Гц, 1H), 2,68 (дд, J=16,0, 5,5 Гц, 1H), 2,55 (дд, J=16,0, 9,1 Гц, 1H), 2,13 (с, 3H), 2,01-1,90 (м, 1H), 1,03 (д, J=6,8 Гц, 3H), 0,99 (д, J=6,8 Гц, 3H); EIMS m/z 162.
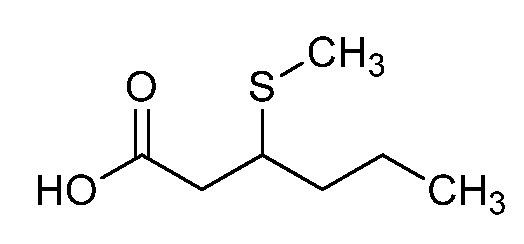
3-(Метилтио)гексановую кислоту получали в соответствии со способом, описанным в примере 63, и выделяли в виде бесцветного масла: ИК (тонкая пленка) 2921, 1705 см-1; 1H ЯМР (400 МГц, CDCl3) δ 10,72 (с, 1H), 3,06-2,92 (м, 1H), 2,63 (дд, J=7,2, 2,6 Гц, 2H), 2,08 (с, 3H), 1,66-1,37 (м, 4H), 0,94 (т, J=7,2 Гц, 3H); 13C ЯМР (101 МГц, CDCl3) δ 178,19, 42,00, 40,20, 36,33, 20,05, 13,80, 12,86.
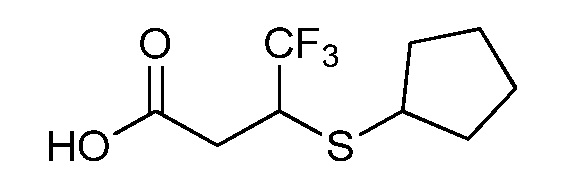
3-(Циклопентилтио)-4,4,4-трифторбутановую кислоту получали в соответствии со способом, описанным в примере 63, и выделяли в виде бесцветного масла: ИК (тонкая пленка) 2959, 1714 см-1; 1H ЯМР (400 МГц, CDCl3) δ 9,27 (с, 1H), 3,74-3,53 (м, 1H), 3,36 (п, J=6,9 Гц, 1H), 2,96 (дд, J=16,9, 3,9 Гц, 1H), 2,61 (дд, J=16,9, 10,6 Гц, 1H), 2,15-1,92 (м, 2H), 1,84-1,68 (м, 2H), 1,68-1,54 (м, 3H), 1,53-1,43 (м, 1H); EIMS m/z 242.
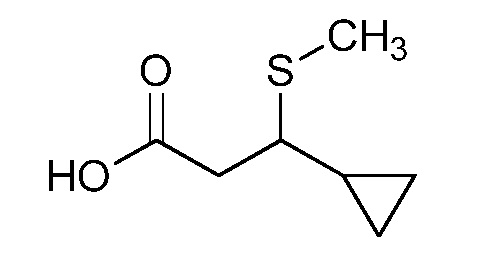
3-Циклопропил-3-(метилтио)пропановую кислоту получали в соответствии со способом, описанным в примере 63, и выделяли в виде бесцветного масла: ИК (тонкая пленка) 3002, 1703 см-1; 1H ЯМР (400 МГц, CDCl3) δ 2,73 (дд, J=7,1, 2,2 Гц, 2H), 2,39 (дт, J=9,7, 7,1 Гц, 1H), 2,17 (с, 3H), 0,97 (дддд, J=14,6, 13,0, 6,5, 3,6 Гц, 1H), 0,74-0,52 (м, 2H), 0,43-0,35 (м, 1H), 0,35-0,26 (м, 1H); 13C ЯМР (101 МГц, CDCl3) δ 177,60, 47,18, 40,66, 16,34, 13,61, 5,30, 4,91.
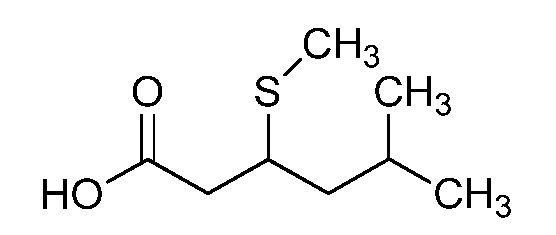
5-Метил-3-(метилтио)гексановую кислоту получали в соответствии со способом, описанным в примере 63, и выделяли в виде масла светло-оранжевого цвета: ИК (тонкая пленка) 2955, 1705 см-1; 1H ЯМР (400 МГц, CDCl3) δ 3,12-2,96 (м, 1H), 2,70-2,53 (м, 2H), 2,07 (с, 3H), 1,91-1,78 (м, 1H), 1,49 (ддд, J=14,6, 9,1, 5,6 Гц, 1H), 1,38 (ддд, J=14,1, 8,4, 5,9 Гц, 1H), 0,93 (д, J=2,4 Гц, 3H), 0,92 (д, J=2,3 Гц, 3H); 13C ЯМР (101 МГц, CDCl3) δ 178,07, 43,35, 40,53, 39,99, 25,45, 22,91, 21,83, 12,38.
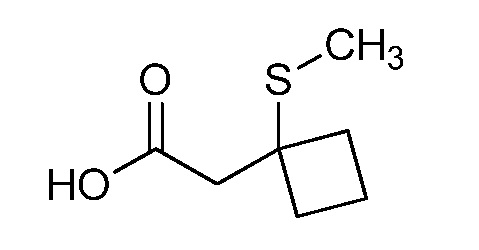
2-(1-(Метилтио)циклобутил)уксусную кислоту получали в соответствии со способом, описанным в примере 63, и выделяли в виде кристаллического твердого вещества белого цвета: т. пл. 43-46°C; ИК (тонкая пленка) 2955, 1691 см-1; 1H ЯМР (400 МГц, CDCl3) δ 2,77 (с, 2H), 2,30 (тдд, J=5,4, 3,9, 2,2 Гц, 2H), 2,23-2,13 (м, 3H), 2,04 (с, 3H), 2,00-1,89 (м, 1H); 13C ЯМР (101 МГц, CDCl3) δ 176,84, 47,08, 44,08, 33,27, 16,00, 11,72.
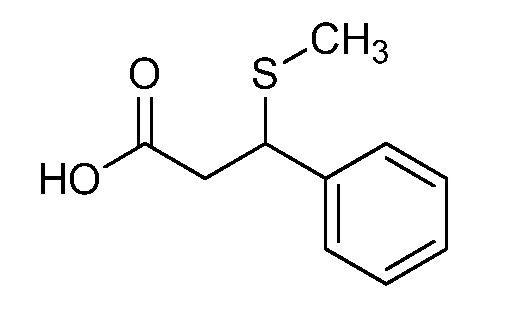
3-(Метилтио)-3-фенилпропановую кислоту получали в соответствии со способом, описанным в примере 63, и выделяли в виде твердого вещества белого цвета: т. пл. 75-77°C; ИК (тонкая пленка) 2915, 1704 см-1; 1H ЯМР (400 МГц, CDCl3) δ 7,35-7,29 (м, 4H), 7,29-7,20 (м, 1H), 4,17 (т, J=7,6 Гц, 1H), 2,93 (дд, J=7,6, 3,2 Гц, 2H), 1,91 (с, 3H); 13C ЯМР (101 МГц, CDCl3) δ 176,98, 140,60, 128,61, 127,64, 127,56, 46,19, 40,70, 14,33.
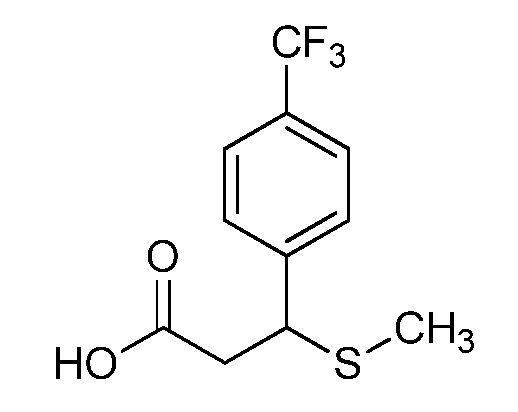
3-(Метилтио)-3-(4-(трифторметил)фенил)пропановую кислоту получали в соответствии со способом, описанным в примере 63, и выделяли в виде твердого вещества белого цвета: т. пл. 106-108°C; ИК (тонкая пленка) 2924, 1708 см-1; 1H ЯМР (400 МГц, CDCl3) δ 7,59 (д, J=8,1 Гц, 2H), 7,45 (д, J=8,1 Гц, 2H), 4,21 (т, J=7,6 Гц, 1H), 2,95 (квд, J=16,3, 7,7 Гц, 2H), 1,92 (с, 3H); EIMS m/z (M-1) 263.
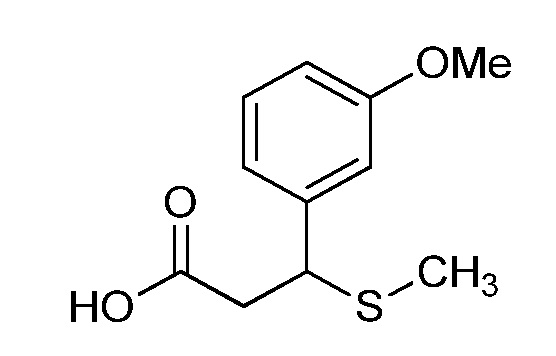
3-(3-Метоксифенил)-3-(метилтио)пропановую кислоту получали в соответствии со способом, описанным в примере 63, и выделяли в виде твердого вещества белого цвета: т. пл. 61-63°C; ИК (тонкая пленка) 2921, 1699 см-1; 1H ЯМР (400 МГц, CDCl3) δ 7,28-7,17 (м, 1H), 6,94-6,86 (м, 2H), 6,79 (ддд, J=8,3, 2,5, 0,9 Гц, 1H), 4,14 (т, J=7,6 Гц, 1H), 3,80 (с, 3H), 2,92 (д, J=8,0 Гц, 2H), 1,92 (с, 3H); EIMS m/z 225.
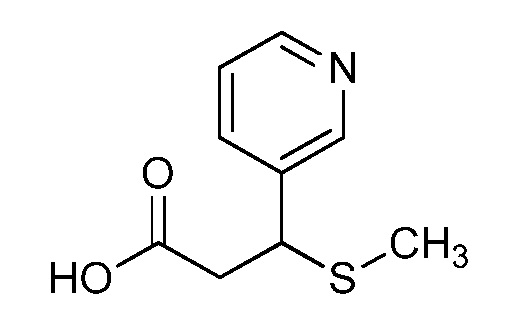
3-(Метилтио)-3-(пиридин-3-ил)пропановую кислоту получали в соответствии со способом, описанным в примере 63, и выделяли в виде полутвердогое вещества белого цвета: ИК (тонкая пленка) 3349, 1547 см-1; 1H ЯМР (400 МГц, CD3OD) δ 8,54 (дд, J=2,3, 0,8 Гц, 1H), 8,39 (дд, J=4,9, 1,6 Гц, 1H), 7,90 (дт, J=7,9, 2,0 Гц, 1H), 7,41 (ддд, J=8,0, 4,9, 0,8 Гц, 1H), 4,26 (дд, J=9,2, 6,5 Гц, 1H), 2,81 (дд, J=14,7, 6,5 Гц, 1H), 2,71 (дд, J=14,8, 9,2 Гц, 1H), 1,94 (с, 3H); EIMS m/z 198.
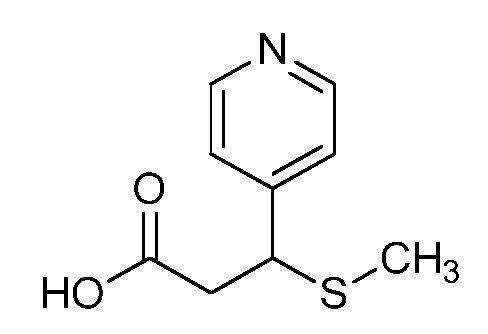
3-(Метилтио)-3-(пиридин-4-ил)пропановую кислоту получали в соответствии со способом, описанным в примере 63, и выделяли в виде твердого вещества белого цвета: т. пл. 187-189°C; ИК (тонкая пленка) 1692 см-1; 1H ЯМР (400 МГц, CD3OD) δ 8,57-8,38 (м, 2H), 7,55-7,37 (м, 2H), 4,19 (дд, J=8,2, 7,3 Гц, 1H), 2,93 (дд, J=7,7, 2,8 Гц, 2H), 1,94 (с, 3H); EIMS m/z 198.
Пример 64: Получение этил 1-(гидроксиметил)циклопропанкарбоксилата
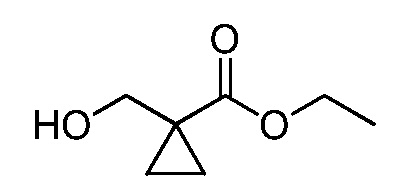
1M раствор литий алюминий три-трет-бутоксигидрида в тетрагидрофуране (70,90 мл, 70,90 ммоль) добавляли к перемешиваемому раствору диэтил циклопропан-1,1’-дикарбоксилата (6 г, 32,20 ммоль) в тетрагидрофуране (129 мл) при температуре 23°C. Полученный раствор нагревали при температуре 65°C и перемешивали в течение 24 ч. Охлажденную реакционную смесь разбавляли 10%-ым раствором бисульфата натрия (275 мл) и экстрагировали этилацетатом. Объединенные органические слои сушили (MgSO4), фильтровали и концентрировали досуха с получением желаемого продукта в виде масла бледно-желтого цвета (4,60, 91%): 1H ЯМР (300 МГц, CDCl3) δ 4,16 (кв, J=7 Гц, 2H), 3,62 (с, 2H), 2,60 (ушир. с, 1H), 1,22-1,30 (м, 5H), 0,87 (дд, J=7, 4 Гц, 2H).
Пример 65: Получение этил 1-((метилсульфонилокси)метил)циклопропанкарбоксилата
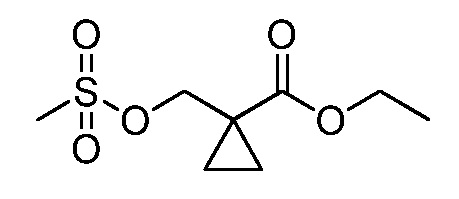
Триэтиламин (5,57 мл, 40,00 ммоль) и метансульфонилхлорид (2,85 мл, 36,60 ммоль) последовательно добавляли к перемешиваемому раствору этил 1-(гидроксиметил)циклопропанкарбоксилата (4,80 г, 33,30 ммоль) в дихлорметане (83 мл) при температуре 23°C. Полученный раствор ярко-желтого цвета перемешивали при температуре 23°C в течение 20 ч. Реакционную смесь разбавляли водой и экстрагировали дихлорметаном. Объединенные органические слои сушили (MgSO4), фильтровали и концентрировали досуха с получением желаемого продукта в виде масла коричневого цвета (6,92 г, 94%): 1H ЯМР (300 МГц, CDCl3) δ 4,33 (с, 2H), 4,16 (кв, J=7 Гц, 2H), 3,08 (с, 3H), 1,43 (дд, J=7, 4 Гц, 2H), 1,26 (т, J=7 Гц, 3H), 1,04 (дд, J=7, 4 Гц, 2H).
Пример 66: Получение этил 1-(метилтиометил)циклопропанкарбоксилата
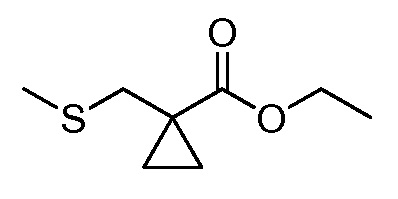
Метантиолат натрия (4,36 г, 62,30 ммоль) добавляли к перемешиваемому раствору этил 1-((метилсульфонилокси)метил)циклопропанкарбоксилата (6,92 г, 31,10 ммоль) в N,N-диметилформамиде (62,30 мл) при температуре 23°C. Полученную суспензию коричневого цвета перемешивали при температуре 23°C в течение 18 ч. Реакционную смесь разбавляли водой и экстрагировали диэтиловым эфиром. Объединенные органические слои сушили (MgSO4), фильтровали и концентрировали упариванием на роторном испарителе с получением указанного в заголовке соединения в виде масла коричневого цвета (5,43 г, 100%): 1H ЯМР (300 МГц, CDCl3) δ 4,14 (кв, J=7 Гц, 2H), 2,83 (с, 2H), 2,16 (с, 3H), 1,31 (дд, J=7, 4 Гц, 2H), 1,25 (т, J=7 Гц, 3H), 0,89 (дд, J=7, 4 Гц, 2H).
Пример 67: Получение 1-(метилтиометил)циклопропанкарбоновой кислоты
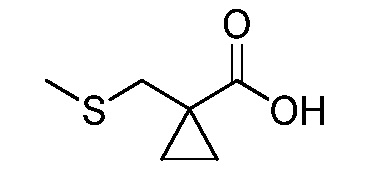
50% раствор гидроксида натрия (12,63 мл, 243 ммоль) добавляли к перемешиваемому раствору этил 1-(метилтиометил)циклопропанкарбоксилата (5,43 г, 31,20 ммоль) в абсолютном этаноле (62,30 мл) при температуре 23°C. Полученный раствор перемешивали при температуре 23°C в течение 20 ч. Реакционную смесь разбавляли 0,5 M раствором гидроксида натрия и промывали дихлорметаном. Водный слой подкисляли до pH≈1 с помощью концентрированной соляной кислоты и экстрагировали дихлорметаном. Объединенные органические слои сушили (Na2SO4), фильтровали и концентрировали досуха с получением желаемого продукта в виде масла светло-коричневого цвета (2,10 г, 46%): 1H ЯМР (300 МГц, CDCl3) δ 2,82 (с, 2H), 2,17 (с, 3H), 1,41 (дд, J=7, 4 Гц, 2H), 0,99 (дд, J=7, 4 Гц, 2H).
Пример 68: Получение 2,2-диметил-3-(метилтио)пропановой кислоты
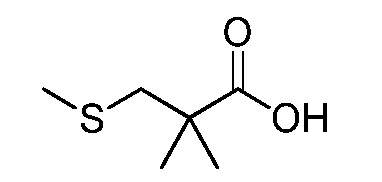
2,2-Диметил-3-(метилтио)пропановая кислота может быть получена, как продемонстрировано в литературе (ссылка Musker, W. K.; et al. J. Org. Chem. 1996, 51, 1026-1029). Метантиолат натрия (1,0 г, 14 ммоль, 2,0 эквив.) добавляли к перемешиваемому раствору 3-хлор-2,2-диметилпропановой кислоты (1,0 г, 7,2 ммоль, 1,0 эквив.) в N,N-диметилформамиде (3,7 мл) при температуре 0°C. Полученной суспензии коричневого цвета давали нагреться до температуры 23°C и перемешивали в течение 24 ч. Реакционную смесь разбавляли насыщенным раствором бикарбоната натрия (300 мл) и промывали диэтиловым эфиром (3×75 мл). Водный слой подкисляли до pH≈1 с помощью концентрированной соляной кислоты и экстрагировали диэтиловым эфиром (3×75 мл). Объединенные органические слои сушили (сульфатом натрия), фильтровали естественным образом и концентрировали с получением бесцветного масла (1,2 г, 99%-ый выход сырого продукта). 1H ЯМР (300 МГц, CDCl3) δ 2,76 (с, 2H), 2,16 (с, 3H), 1,30 (с, 6H).
Пример 69: Получение 4,4,4-трифтор-3-(метилтио)бутановой кислоты
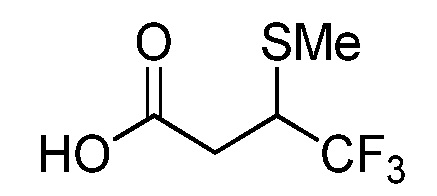
В 100 мл-овую круглодонную колбу добавляли (E)-4,4,4-трифторбут-2-еновую кислоту (8 г, 57,1 ммоль) и метанол (24 мл), раствор перемешивали на водяной бане, затем тремя порциями добавляли метантиолат натрия (10,01 г, 143 ммоль). Наблюдалось энергичное выделение пузырьков, смесь перемешивали при температуре 25°C в течение ночи, ЯМР показывал, что исходного продукта больше не было. К реакционной смеси добавляли 2н HCl до кислотной среды. Смесь экстрагировали хлороформом (5×50 мл), объединенный органический слой сушили над Na2SO4, концентрировали в вакууме и затем сушили в высоком вакууме до тех пор, пока масса не переставала уменьшаться, с получением 4,4,4-трифтор-3-(метилтио)бутановой кислоты (10,68 г, 56,8 ммоль, 99%-ый выход) в виде бесцветного масла: 1H ЯМР (400 МГц, CDCl3) δ 10,88 (с, 1H), 3,53 (дквд, J=10,5, 8,3, 4,0 Гц, 1H), 2,96 (дд, J=16,9, 4,0 Гц, 1H), 2,65 (дд, J=16,9, 10,4 Гц, 1H), 2,29 (с, 3H); 13C ЯМР (101 МГц, CDCl3) δ 175,78 (с), 126,61 (кв, JC-F = 278,8 Гц), 44,99 (кв, JC-F = 30,3 Гц), 34,12 (д, JC-F = 1,7 Гц), 15,95 (с); EIMS m/z 162.
Пример 70: Получение 3-метил-3-метилсульфанил-масляной кислоты
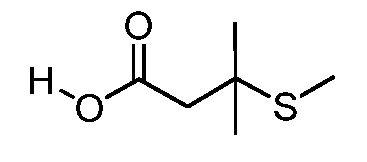
3-Метил-3-метилсульфанил-масляную кислоту получали с использованием способов, описанных в J.Chem Soc Perkin 1, 1992, 10, 1215-21.
Пример 71: Получение 3-метилсульфанил-масляной кислоты
3-Метилсульфанил-масляную кислоту получали с использованием способов, описанных в Synthetic Comm.,1985, 15 (7), 623-32.
Пример 72: Получение тетрагидро-тиофен-3-карбоновой кислоты
Тетрагидро-тиофен-3-карбоновую кислоту получали с использованием способов, описанных в Heterocycles, 2007, 74, 397-409.
Пример 73: Получение 2-метил-3-метилсульфанил-масляной кислоты
2-Метил-3-метилсульфанил-масляную кислоту получали, как описано в J.Chem Soc Perkin 1, 1992, 10, 1215-21.
Пример 74: Получение (1S,2S)-2-(метилтио)циклопропанкарбоновой кислоты
(1S,2S)-2-(Метилтио)циклопропанкарбоновую кислоту получали с использованием способов, описанных в Synthetic Comm., 2003, 33 (5); 801-807.
Пример 75: Получение 2-(2-(метилтио)этокси)пропановой кислоты
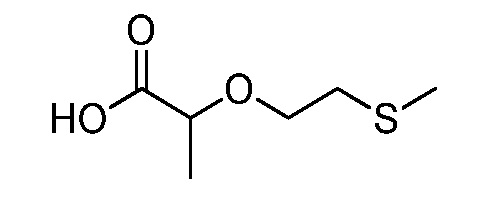
2-(2-(Метилтио)этокси)пропановую кислоту получали, как описано в WO 2007/064316 A1.
Пример 76: Получение 2-((тетрагидрофуран-3-ил)окси)пропановой кислоты
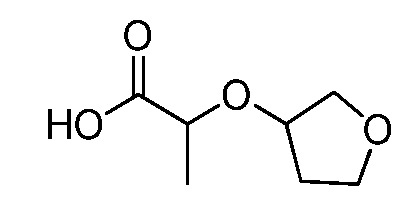
2-((Тетрагидрофуран-3-ил)окси)пропановую кислоту получали, как описано в WO 2007/064316 A1.
Пример 77: Получение трет-бутил 1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-ил(проп-2-инил)карбамата (соединение 601)
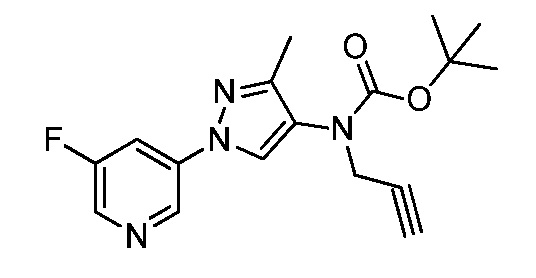
К ледяному раствору трет-бутил 1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-илкарбамата (1200 мг, 4,11 ммоль) в сухом ДМФ (4 мл) в атмосфере азота добавляли 60%-ый масс. гидрид натрия (197 мг, 4,93 ммоль), и смесь перемешивали в течение 10 мин. Затем добавляли 3-бромпроп-1-ин (733 мг, 6,16 ммоль) и смесь перемешивали в течение еще 0,5 ч при температуре в интервале 0-5°C. Смесь оставляли нагреваться до комнатной температуры и затем перемешивали в течение дополнительных 3 ч при комнатной температуре. Реакционную смесь коричневого цвета выливали в насыщенный водный раствор NH4Cl (20 мл) и разбавляли этилацетатом (50 мл). Органическую фазу разделяли, и водную фазу экстрагировали этилацетатом (20 мл). Объединенную органическую фазу промывали насыщенным солевым раствором, сушили над безводным MgSO4, фильтровали и концентрировали в вакууме с получением масла коричневого цвета. Это масло очищали на силикагеле, элюируя смесями гексана и этилацетата, с получением указанного в заголовке соединения в виде твердого вещества светло-желтого цвета желтого цвета (1103 мг, 81%); т. пл. 81-82°C; 1H ЯМР (400 МГц, CDCl3) δ 8,73 (с, 1H), 8,37 (д, J=2,5 Гц, 1H), 7,99 (с, 1H), 7,83 (дт, J=9,5, 2,2 Гц, 1H), 4,31 (с, 2H), 2,29 (т, J=2,4 Гц, 1H), 2,27 (с, 3H), 1,45 (с, 8H); ESIMS m/z 229,84 ([M]+).
Соединения 596 и 606 были получены в соответствии со способом, описанным в примере 77, исходя из соответствующего амина.
Пример 78: Получение гидрохлорида 1-(5-фторпиридин-3-ил)-3-метил-N-(проп-2-инил)-1H-пиразол-4-амина
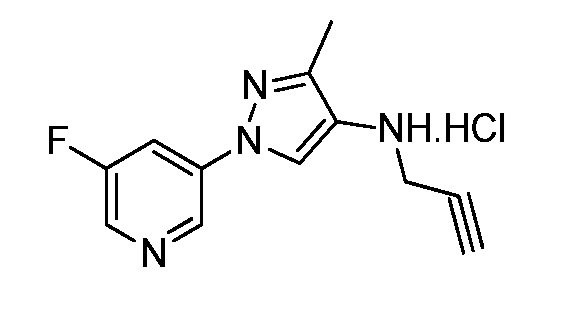
К раствору трет-бутил 1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-ил(проп-2-инил)карбамата (1,03 г, 3,11 ммоль) в диоксане (5 мл) добавляли 4M HCl (3,9 мл, 15,5 ммоль) в диоксане. Смесь перемешивали при комнатной температуре в течение 48 ч, и полученное твердое вещество белого цвета фильтровали, промывали эфиром и сушили в вакууме с получением указанного в заголовке соединения в виде твердого вещества белого цвета (741 мг, 89%): т. пл. 167-168°C; 1H ЯМР (400 МГц, ДМСО-d6) δ 8,92-8,85 (м, 1H), 8,42 (д, J=2,5 Гц, 1H), 8,15 (с, 1H), 8,12-8,02 (м, 1H), 3,85 (д, J=2,5 Гц, 2H), 3,27-3,19 (м, 1H), 2,22 (с, 3H); ESIMS m/z 230,4 ([M]+).
Гидрохлорид 3-хлор-N-(проп-2-инил)-1-(пиридин-3-ил)-1H-пиразол-4-амина получали в соответствии со способом, описанным в примере 78, исходя из соединения 606: т. пл. 180-182°C; 1H ЯМР (400 МГц, CDCl3) δ 9,22 (д, J=2,5 Гц, 1H), 8,67 (дд, J=5,3, 1,0 Гц, 1H), 8,64 (ддд, J=8,6, 2,6, 1,2 Гц, 1H), 8,32 (с, 1H), 7,96 (дд, J=8,6, 5,3 Гц, 1H), 3,81 (д, J=2,4 Гц, 2H), 3,15 (т, J=2,4 Гц, 1H); ESIMS m/z 234 ([M+2]+).
Гидрохлорид 3-метил-N-(проп-2-ин-1-ил)-1-(пиридин-3-ил)-1H-пиразол-4-амина получали в соответствии со способом, описанным в примере 78, исходя из соединения 596: т. пл. 161-163°C; 1H ЯМР (400 МГц, ДМСО-d6) δ 8,46 (с, 1H), 8,05 (с, 0H), 7,83 (д, J=5,9 Гц, 1H), 7,57 (с, 1H), 7,29 (дд, J=8,8, 5,6 Гц, 1H), 3,27 (д, J=2,5 Гц, 2H), 1,52 (с, 3H); EIMS m/z 213,1 ([M]+).
Пример 79: Получение N-(1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-ил)-3-(метилтио)-N-(проп-2-инил)пропанамида (соединение 605)
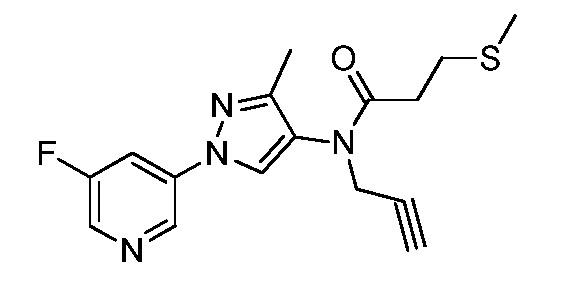
К перемешиваемому раствору 1-(5-фторпиридин-3-ил)-3-метил-N-(проп-2-ин-1-ил)-1H-пиразол-4-амина, HCl (100 мг, 0,38 ммоль) и N,N-диметилпиридин-4-амина (115 мг, 0,94 ммоль) в CH2Cl2 (2 мл) добавляли 2-метил-3-(метилтио)пропаноил хлорид (69 мг, 0,45 ммоль), и смесь перемешивали при комнатной температуре в течение 24 ч. Смесь концентрировали в вакууме с получением масла коричневого цвета, которое очищали на силикагеле, элюируя смесями этилацетата и гексанов, с получением указанного в заголовке соединения в виде бесцветного масла (80 мг, 61%): 1H ЯМР (400 МГц, CDCl3) δ 8,77 (д, J=1,7 Гц, 1H), 8,43 (д, J=2,5 Гц, 1H), 8,05 (с, 1H), 7,86 (дт, J=9,4, 2,3 Гц, 1H), 4,49 (с, 1H), 2,88 (дд, J=12,8, 9,4 Гц, 1H), 2,74 (с, 1H), 2,45 (дд, J=12,9, 5,0 Гц, 1H), 2,34 (с, 3H), 2,24 (т, J=2,5 Гц, 1H), 2,02 (с, 3H), 1,14 (д, J=6,8 Гц, 3H); ESIMS m/z 347,5 ([M+H]+).
Соединения 598, 599, 600, 602, 603, 607, 608 и 610 были получены в соответствии со способом, описанным в примере 79, исходя из соответствующих аминов.
Пример 80: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-4,4,4-трифтор-3-(метилтио)-N-(проп-2-ин-1-ил)бутанамида (соединение 613)
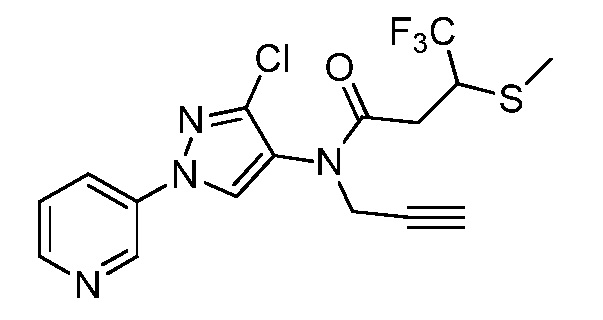
В 7-мл пробирку добавляли 3-хлор-N-(проп-2-ин-1-ил)-1-(пиридин-3-ил)-1H-пиразол-4-амин (140 мг, 0,6 ммоль), N,N-диметилпиридин-4-амин (249 мг, 2,040 ммоль), гидрохлорид N1-((этилимино)метилен)-N3,N3-диметилпропан-1,3-диамина (276 мг, 1,440 ммоль), затем 4,4,4-трифтор-3-(метилтио)бутановую кислоту (158 мг, 0,840 ммоль) и DCE (1,2 мл). Раствор перемешивали при температуре 25°C в течение 18 часов, сырую реакционную смесь концентрировали и очищали с помощью хроматографии на силикагеле (0-100% EtOAc/гексан) с получением указанного в заголовке соединения в виде масла коричневого цвета (237 мг, 0,588 ммоль, 98%): (ИК тонкая пленка) 1674 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,97 (д, J=2,6 Гц, 1H), 8,64 (дд, J=4,7, 1,3 Гц, 1H), 8,13 (с, 1H), 8,07 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,48 (ддд, J=8,3, 4,8, 0,5 Гц, 1H), 4,39 (с, 2H), 3,76 (дквд, J=17,2, 8,6, 3,6 Гц, 1H), 2,67 (дд, J=16,6, 3,6 Гц, 1H), 2,46 (дд, J=16,5, 9,9 Гц, 1H), 2,29 (д, J=2,5 Гц, 4H); ESIMS m/z 403 ([M+H]+).
Соединения 597, 604, 609, 614-616 были получены в соответствии со способом, описанным в примере 80.
Пример 81: Получение 3-хлор-N-(проп-2-инил)-1-(пиридин-3-ил)-1H-пиразол-4-амина
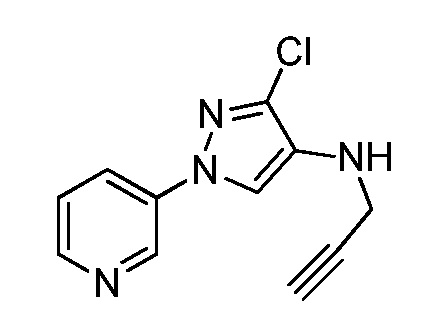
К раствору трет-бутил (3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(проп-2-ин-1-ил)карбамата (2,2 г, 6,61 ммоль) в дихлорметане (8,3 мл) добавляли 2,2,2-трифторуксусную кислоту (12,06 г, 106 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакцию гасили путем добавления насыщенного водного раствора бикарбоната натрия. Органический слой экстрагировали дихлорметаном (2×20 мл). Органические слои объединяли и сушили над сульфатом натрия, фильтровали и концентрировали без дополнительной очистки с получением указанного в заголовке соединения в виде твердого вещества бежевого цвета (1,5 г, 6,12 ммоль, 93%): 1H ЯМР (400 МГц, CDCl3) δ 8,89 (д, J=2,3 Гц, 1H), 8,50 (дд, J=4,7, 1,4 Гц, 1H), 8,01-7,93 (м, 1H), 7,54 (с, 1H), 7,37 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 3,90 (с, 2H), 3,38 (с, 1H), 2,44-2,09 (м, 1H); ESIMS m/z 233 ([M+H]+).
Пример 82: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-(метилтио)-N-(проп-2-ин-1-ил)пропанамида (соединение 611)
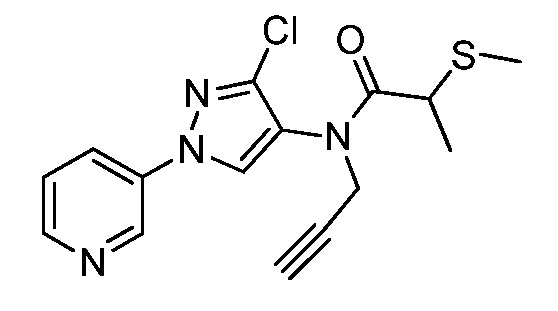
К раствору 2-(метилтио)пропановой кислоты (0,36 г, 3,00 ммоль) в дихлорметане (3 мл) добавляли оксалилдихлорид (0,29 мл, 3,31 ммоль), затем одну каплю N,N-диметилформамида. Реакционную смесь перемешивали в течение 30 минут, затем весь растворитель упаривали. Полученный остаток растворяли в дихлорметане (2 мл) и добавляли в предварительно перемешиваемый раствор 3-хлор-N-(проп-2-ин-1-ил)-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,35 г, 1,50 ммоль) и N-этил-N-изопропилпропан-2-амина (0,57 мл, 3,31 ммоль) в дихлорметане (5,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь концентрировали, и остаток очищали с использованием хроматографии на силикагеле (0-100% этилацетат/гексаны) с получением указанного в заголовке соединения в виде масла желтого цвета (432 мг, 1,23 ммоль, 85%): 1H ЯМР (400 МГц, CDCl3) δ 8,97 (д, J=2,5 Гц, 1H), 8,66-8,60 (м, 1H), 8,25 (с, 1H), 8,08-8,01 (м, 1H), 7,49-7,42 (м, 1H), 4,86 (с, 1H), 4,29-3,97 (м, 1H), 3,31 (д, J=6,5 Гц, 1H), 2,30-2,24 (м, 1H), 2,09 (с, 3H), 1,46 (д, J=6,9 Гц, 3H); 13C ЯМР (101 МГц, CDCl3) δ 171,30, 148,66, 140,71, 140,18, 135,71, 127,87, 126,35, 124,11, 122,12, 78,53, 72,92, 53,39, 37,97, 16,42, 11,07; ESIMS m/z 335 ([M+H]+).
Соединение 612 получали в соответствии со способом, описанным в примере 82.
Пример 83: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-(метилсульфинил)-N-(проп-2-ин-1-ил)пропанамида (соединение 617)
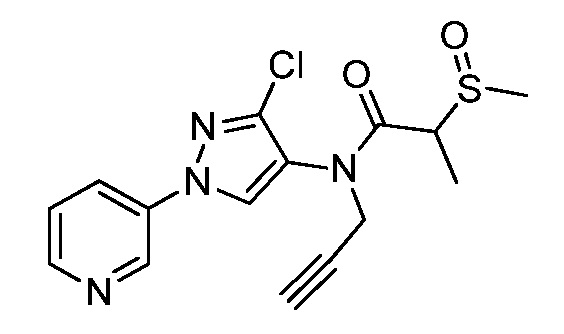
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-(метилтио)-N-(проп-2-ин-1-ил)пропанамида (0,1 г, 0,30 ммоль) в гексафторизопропаноле (2,0 мл) добавляли пероксид водорода (35% масс., 0,08 мл, 0,90 ммоль), и реакционную смесь энергично перемешивали при комнатной температуре. Реакция завершалась спустя 1 час. Реакцию гасили насыщенным раствором сульфита натрия, и органический слой экстрагировали этилацетатом (3×20 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали с использованием хроматографии на силикагеле (0-20% метанол/дихлорметан) с получением указанного в заголовке соединения в виде пены не совсем белого цвета (82 мг, 0,21 ммоль, 78%): 1H ЯМР (400 МГц, CDCl3) δ 8,98 (с, 1H), 8,65 (д, J=4,6 Гц, 1H), 8,23 (с, 1H), 8,11-7,97 (м, 1H), 7,51-7,41 (м, 1H), 4,88 (ушир. с, 1H), 4,14 (ушир. с, 1H), 2,64 (с, 1,2H), 2,55 (с, 1,8H), 2,33-2,27 (м, 1H), 1,47 (д, J=6,8 Гц, 3H); 13C ЯМР (101 МГц, CDCl3) δ 168,11, 148,95, 148,78, 140,45, 140,33, 140,20, 135,56, 126,54, 124,10, 121,68, 121,58, 121,48, 77,69, 73,49, 38,60; ESIMS m/z 351 ([M+H]+).
Пример 84: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-(метилсульфонил)-N-(проп-2-ин-1-ил)пропанамида (соединение 618)
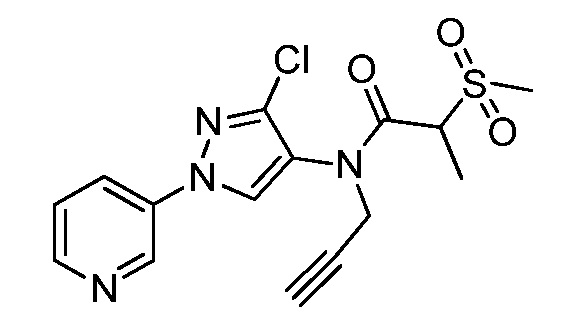
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-(метилтио)-N-(проп-2-ин-1-ил)пропанамида (0,10 г, 0,30 ммоль) и уксусной кислоты (2,0 мл). В указанный раствор добавляли тетрагидрат пербората натрия (0,11 г, 0,74 ммоль), и пробирку нагревали при температуре 65°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и нейтрализовали насыщенным раствором бикарбоната натрия. Органический слой экстрагировали этилацетатом (3×). Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали с использованием хроматографии на силикагеле (0-20% метанол/дихлорметан) с получением указанного в заголовке соединения в виде пены желтого цвета (84 мг, 0,21 ммоль, 73%): 1H ЯМР (400 МГц, CDCl3) δ 9,00 (с, 1H), 8,65 (с, 1H), 8,29 (с, 1H), 8,03 (д, J=8,0 Гц, 1H), 7,54-7,39 (м, 1H), 4,89 (д, J=16,9 Гц, 1H), 4,20-4,08 (м, 1H), 4,07-3,92 (м, 1H), 3,01 (с, 3H), 2,34-2,29 (м, 1H), 1,67 (д, J=7,0 Гц, 3H); 13C ЯМР (101 МГц, CDCl3) δ 166,97, 166,90, 148,77, 140,43, 140,24, 135,58, 129,36, 126,64, 124,14, 121,34, 73,80, 60,91, 38,78, 36,29, 13,97; ESIMS m/z 367 ([M+H]+).
Пример 85: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метил-3-(тритилтио)пропанамида
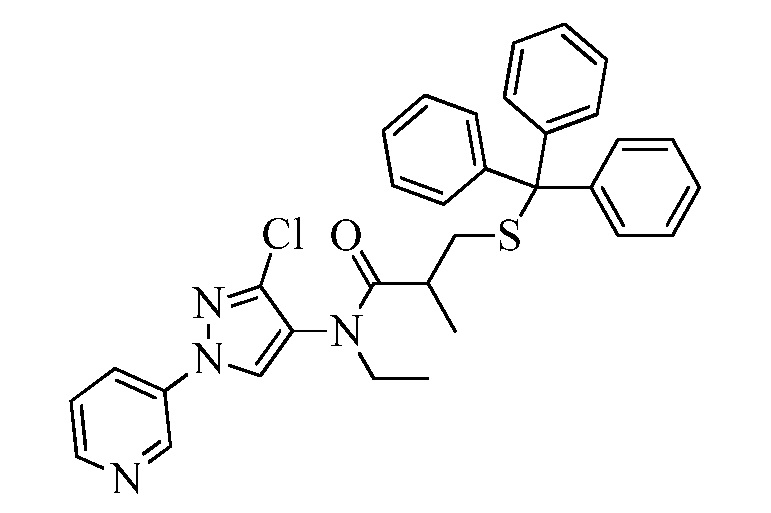
К раствору N,N-диметилпиридин-4-амина (2,60 г, 21,31 ммоль), 2-метил-3-(тритилтио)пропановой кислоты (4,41 г, 12,18 ммоль) (полученный, как описано в работе Ondetti, Miguel Angel et.al. DE 2703828) и гидрохлорида N1-((этилимино)метилен)-N3,N3-диметилпропан-1,3-диамина (2,36 г, 15,22 ммоль) в CH2Cl2 (20 мл) добавляли 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амин, 2HCl (3,0 г, 10 ммоль). Смесь перемешивали при температуре 0°C в течение 2 часов, затем при комнатной температуре в течение еще 48 часов. Смесь разбавляли этилацетатом (100 мл) и насыщенным водным раствором NH4Cl. Органическую фазу разделяли, промывали насыщенным солевым раствором, сушили над MgSO4 и концентрировали в вакууме с получением смолы светло-коричневого цвета. Эту смолу очищали на силикагеле, элюируя смесями этилацетата и гексанов, с получением указанного в заголовке соединения в виде твердого вещества розового цвета (2,97 г, 51%): т. пл. 64-66°C; 1H ЯМР (400 МГц, CDCl3) δ 8,89 (д, J=2,7 Гц, 1H), 8,62 (дд, J=4,7, 1,4 Гц, 1H), 7,93-7,86 (м, 1H), 7,82 (с, 1H), 7,41 (дд, J=8,3, 4,7 Гц, 1H), 7,33-7,14 (м, 15H), 3,68 (д, J=47,9 Гц, 2H), 2,72 (дд, J=12,0, 8,8 Гц, 1H), 2,37-2,24 (м, 1H), 2,01 (дд, J=12,0, 5,2 Гц, 1H), 1,14 (т, J=7,2 Гц, 3H), 0,95 (д, J=6,7 Гц, 3H); ESIMS m/z 568 ([M+H]+).
Пример 86: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-метил-3-(тритилтио)пропанамида
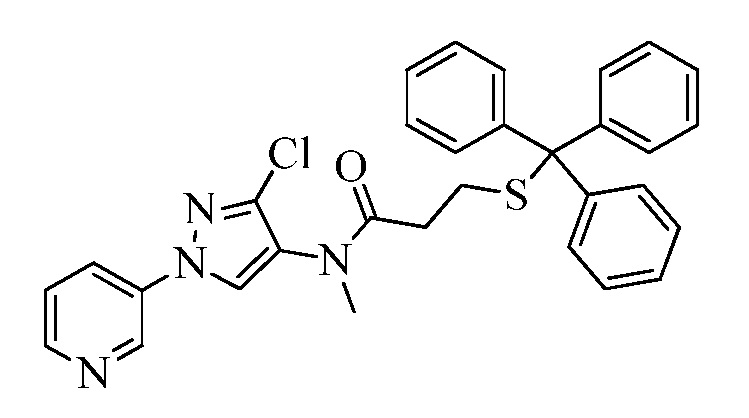
К раствору 3-хлор-N-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина, HCl (1,5 г, 6,12 ммоль) в CH2Cl2 (10 мл) добавляли 3-(тритилтио)пропановую кислоту (2,35 г, 6,73 ммоль) (полученную, как описано в работе Ondetti, Miguel Angel et.al. DE 2703828), N,N-диметилпиридин-4-амин (0,82 г, 6,73 ммоль) и N1-((этилимино)метилен)-N3,N3-диметилпропан-1,3-диамин, HCl (1,76 г, 9,18 ммоль), и смесь перемешивали при комнатной температуре в течение 16 ч. Смесь разбавляли CH2Cl2 (100 мл) и водой (50 мл), и органическую фазу отделяли. Водную фазу экстрагировали этилацетатом, и объединенную органическую фазу промывали насыщенным солевым раствором, сушили над MgSO4 и концентрировали в вакууме с получением указанного в заголовке соединения в виде порошка белого цвета (1,95 г, 59%): т. пл. 62-64°C; 1H ЯМР (400 МГц, CDCl3) δ 8,91 (д, J=2,7 Гц, 1H), 8,67-8,61 (м, 1H), 8,06-7,96 (м, 1H), 7,81 (с, 1H), 7,49-7,46 (м, 1H), 7,25-7,45 (м, 15H), 3,17 (с, 3H), 2,56-2,46 (м, 2H), 2,09-1,97 (м, 2H); ESIMS m/z 540 ([M+H]+).
Пример 87: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-меркапто-N-метилпропанамида
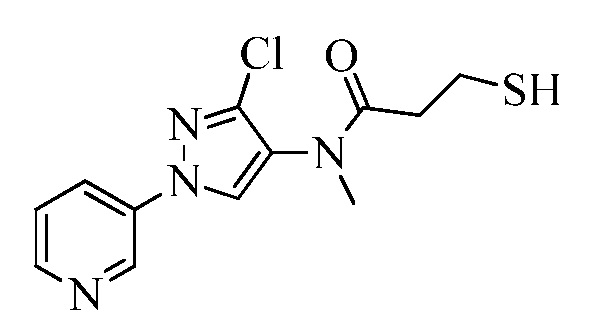
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-метил-3-(тритилтио)пропанамида (1,300 г, 2,411 ммоль) в CH2Cl2 (6,14 г, 72,3 ммоль) при комнатной температуре добавляли триэтилсилан (1,402 г, 12,06 ммоль), затем 2,2,2-трифторуксусную кислоту (2,75 г, 24,11 ммоль). Смесь перемешивали в течение 1 часа и гасили насыщенным водным раствором NaHCO3. Смесь разбавляли CH2Cl2, и органическую фазу отделяли. Водную фазу экстрагировали CH2Cl2, и органические фазы объединяли, промывали насыщенным солевым раствором сушили над безводным MgSO4 и концентрировали в вакууме с получением масла светло-желтого цвета. Это масло очищали на силикагеле, элюируя смесью этилацетата и гексанов, с получением указанного в заголовке соединения в виде бесцветного масла (701 мг, 93%): ИК (тонкая пленка) 3094, 2980, 1657, 1582 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,95 (д, J=2,6 Гц, 1H), 8,63 (с, 1H), 8,06 (с, 1H), 8,04-7,96 (м, 1H), 7,52-7,42 (м, 1H), 3,26 (с, 3H), 2,85-2,73 (м, 2H), 2,56-2,48 (м, 2H).
Следующие соединения были получены в соответствии со способами, описанными в примере 87:
N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-меркаптопропанамид
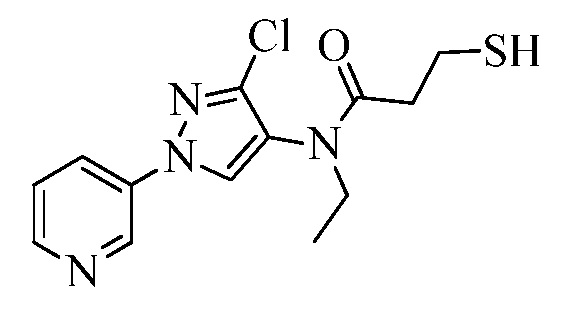
Указанное в заголовке соединение выделяли в виде смолы светло-коричневого цвета (902 мг, 64%): ИК (тонкая пленка) 3086, 2980, 2936, 2548, 1657 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,96 (дд, J=2,7, 0,7 Гц, 1H), 8,63 (дд, J=4,8, 1,5 Гц, 1H), 8,06 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,97 (с, 1H), 7,47 (ддд, J=8,4, 4,7, 0,8 Гц, 1H), 3,72 (кв, J=7,1 Гц, 2H), 2,79 (дт, J=8,5, 6,8 Гц, 2H), 2,49 (т, J=6,7 Гц, 2H), 1,67 (т, J=8,4 Гц, 1H), 1,17 (т, J=7,2 Гц, 3H); ESIMS m/z 311 ([M+H]+), 309 ([M-H]-).
N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-меркапто-2-метилпропанамид
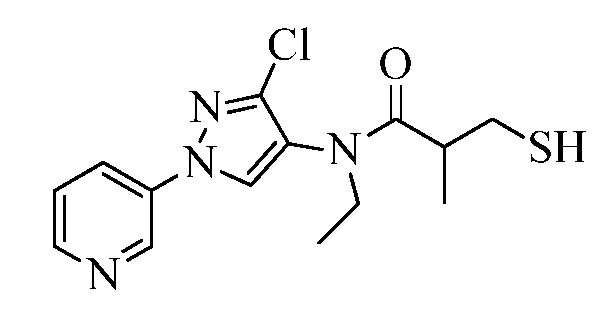
Указанные в заголовке соединения выделяли в виде бесцветного масла, которое отвердевало при стоянии: т. пл. 94-96°C; 1H ЯМР (400 МГц, CDCl3) δ 8,97 (дд, J=2,7, 0,7 Гц, 1H), 8,63 (дд, J=4,8, 1,5 Гц, 1H), 8,05 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 8,02 (с, 1H), 7,47 (ддд, J=8,3, 4,8, 0,8 Гц, 1H), 3,85 (м, 1H), 3,60 (м, 1H), 2,91 (ддд, J=13,2, 9,4, 8,1 Гц, 1H), 2,41 (ддд, J=13,2, 9,2, 4,9 Гц, 1H), 1,49 (дд, J=9,2, 8,2 Гц, 1H), 1,18 (т, J=7,2 Гц, 3H), 1,14 (д, J=6,7 Гц, 3H); ESIMS m/z 325 ([M+H]+).
Пример 88: Получение 3-(((2,2-дифторциклопропил)метил)тио)пропановой кислоты
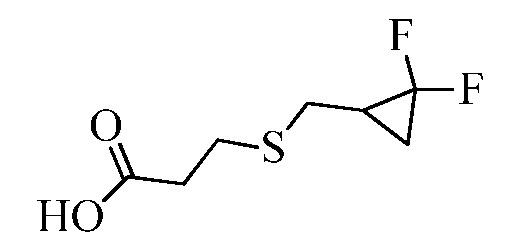
Порошкообразный гидроксид калия (423 мг, 7,54 ммоль) и 2-(бромметил)-1,1-дифторциклопропан (657 мг, 3,84 ммоль) последовательно при комнатной температуре добавляли к перемешиваемому раствору 3-меркаптопропановой кислоты (400 мг, 3,77 ммоль) в метаноле (2 мл). Полученную суспензию белого цвета перемешивали при температуре 65°C в течение 3 ч и гасили с помощью 1н водной HCl, и разбавляли этилацетатом. Органическую фазу отделяли, и водную фазу экстрагировали этилацетатом (2×50 мл). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения в виде бесцветного масла (652 мг, 84%): ИК (KBr тонкая пленка) 3025, 2927, 2665, 2569, 1696 см-1; 1H ЯМР (400 МГц, CDCl3) δ 2,85 (т, J=7,0 Гц, 2H), 2,82-2,56 (м, 4H), 1,88-1,72 (м, 1H), 1,53 (дддд, J=12,3, 11,2, 7,8, 4,5 Гц, 1H), 1,09 (дтд, J=13,1, 7,6, 3,7 Гц, 1H); ESIMS m/z 195,1 ([M-H]-).
Следующие соединения были получены в соответствии со способами, описанными в примере 88:
4-(((2,2-Дифторциклопропил)метил)тио)бутановая кислота: 1H ЯМР (400 МГц, CDCl3) δ 11,31 (с, 1H), 2,71-2,54 (м, 4H), 2,51 (т, J=7,2 Гц, 2H), 2,01-1,86 (м, 2H), 1,85-1,70 (м, 1H), 1,51 (дддд, J=12,3, 11,2, 7,8, 4,5 Гц, 1H), 1,07 (дтд, J=13,2, 7,6, 3,7 Гц, 1H); 13C ЯМР (101 МГц, CDCl3) δ 179,6, 113,7 (дд, J=286,4, 283,4 Гц), 32,7, 30,7, 28,7 (д, J=4,6 Гц), 24,2, 22,8 (т, J=11,2 Гц), 16,6 (т, J=10,8 Гц); 19F ЯМР (376 МГц, CDCl3) δ -128,12 (д, J=156,8 Гц), -142,77 (д, J=156,7 Гц).
4-((2,2,2-Трифторэтил)тио)бутановая кислота: 1H ЯМР (400 МГц, ДМСО-d6) δ 3,47 (кв, J=10,8 Гц, 2H), 2,72 (дд, J=7,8, 6,6 Гц, 2H), 2,32 (тд, J=7,3, 4,5 Гц, 2H), 1,96-1,81 (м, 2H).
Пример 89: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(((2,2-дифторциклопропил)метил)тио)-N-этилпропанамида (соединение 626)
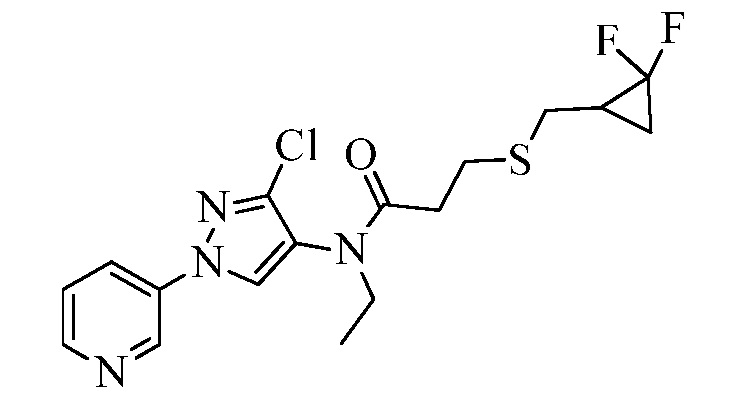
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-меркаптопропанамида (100 мг, 0,322 ммоль) в ТГФ (1 мл) добавляли гидрид натрия (60%-ая дисперсия в масле, 13,5 мг, 0,34 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 10 мин, затем добавляли 2-(бромметил)-1,1-дифторциклопропан (60 мг, 0,35 ммоль). Смесь перемешивали при комнатной температуре в течение 24 ч и разбавляли насыщенным водным раствором хлорида аммония и этилацетатом. Органическую фазу отделяли, и водную фазу экстрагировали этилацетатом (2×50 мл). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали в вакууме с получением бесцветного масла. Это масло очищали с помощью хроматографии, элюируя смесями этилацетата и гексанов, с получением указанного в заголовке соединения в виде бесцветной смолы (101 мг, 78%): ИК (тонкая пленка) 3092, 2975, 2931, 1659, 1584 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,99-8,90 (м, 1H), 8,63 (дд, J=4,8, 1,5 Гц, 1H), 8,05 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,96 (с, 1H), 7,47 (ддд, J=8,3, 4,7, 0,7 Гц, 1H), 3,72 (кв, J=7,2 Гц, 2H), 2,87 (т, J=7,3 Гц, 2H), 2,63-2,55 (м, 2H), 2,46 (т, J=7,3 Гц, 2H), 1,76 (ддкв, J=13,2, 11,4, 7,5 Гц, 1H), 1,48 (дддд, J=12,3, 11,2, 7,8, 4,5 Гц, 1H), 1,17 (т, J=7,2 Гц, 3H), 1,04 (дтд, J=13,2, 7,6, 3,7 Гц, 1H); ESIMS m/z 400 ([M+H]+).
Соединения 624, 625, 629, 633, 643, 653 в таблице 1 получали в соответствии со способами, описанными в примере 89.
Пример 90: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(((2,2-дифторциклопропил)метил)сульфинил)-N-этилпропанамида (соединение 627)
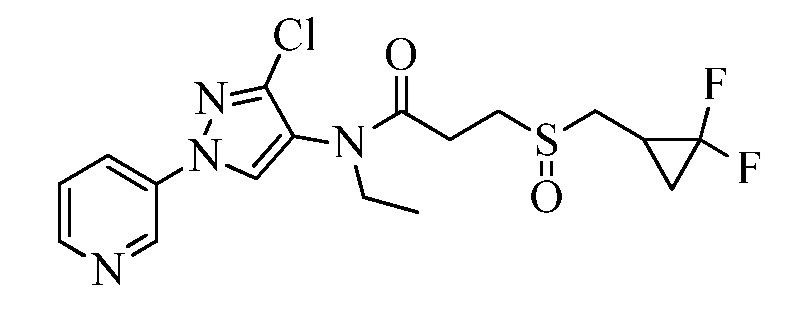
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(((2,2-дифторциклопропил)метил)тио)-N-этилпропанамида (100 мг, 0,25 ммоль) в уксусной кислоте (5 мл, 0,25 ммоль) добавляли тетрагидрат пербората натрия (38,4 мг, 0,25 ммоль), и смесь перемешивали при температуре 50°C в течение 1 часа. Смесь охлаждали до комнатной температуры, гасили насыщенным водным раствором бикарбоната натрия и затем разбавляли этилацетатом. Органическую фазу отделяли, и водную фазу экстрагировали этилацетатом. Объединенную органическую фазу промывали насыщенным солевым раствором, сушили над MgSO4 и концентрировали в вакууме с получением бесцветного масла. Это масло очищали на силикагеле, элюируя смесью метанола и CH2Cl2 (0-10% градиент) с получением указанного в заголовке соединения в виде бесцветной смолы (91 мг, 88%): ИК (тонкая пленка) 3448, 3092, 2976, 2933, 1659, 1585, 1440, 1012 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,97 (д, J=2,6 Гц, 1H), 8,63 (дд, J=4,8, 1,5 Гц, 1H), 8,04 (м, 2H), 7,46 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 3,72 (дкв, J=13,8, 7,0 Гц, 2H), 3,16 (ддд, J=20,3, 13,9, 6,8 Гц, 1H), 3,00-2,79 (м, 3H), 2,69 (м, 2H), 2,13-1,85 (м, 1H), 1,77-1,62 (м, 1H), 1,41-1,21 (м, 1H), 1,18 (т, J=7,2 Гц, 3H); ESIMS m/z 417 ([M+H]+).
Соединения 622, 630, 645 в таблице 1 были получены в соответствии со способами, описанными в примере 90.
Пример 91: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(((2,2-дифторциклопропил)метил)сульфонил)-N-этилпропанамида (соединение 628)
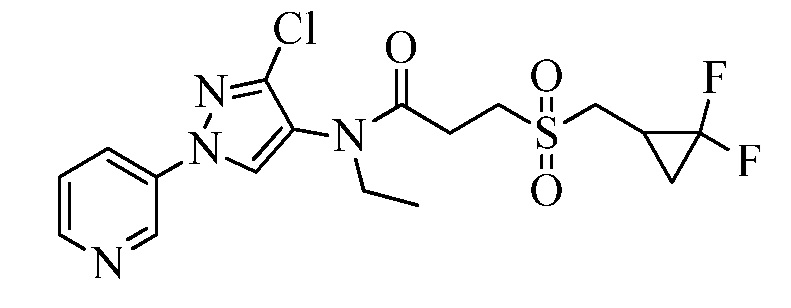
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(((2,2-дифторциклопропил)метил)тио)-N-этилпропанамида (100 мг, 0,25 ммоль) в уксусной кислоте (5 мл, 0,25 ммоль) добавляли тетрагидрат пербората натрия (77 мг, 0,499 ммоль), и смесь перемешивали при температуре 50°C в течение 1 часа. Смесь охлаждали до комнатной температуры, гасили насыщенным водным раствором бикарбоната натрия и затем разбавляли этилацетатом. Органическую фазу отделяли, и водную фазу экстрагировали этилацетатом. Объединенную органическую фазу промывали насыщенным солевым раствором, сушили над MgSO4 и концентрировали в вакууме с получением масла коричневого цвета. Это масло очищали на силикагеле, элюируя смесями этилацетата и гексанов, с получением указанного в заголовке соединения в виде бесцветной смолы (90 мг, 83%): ИК (тонкая пленка) 3104, 2980, 2934, 1662, 1486, 1460 см-1; 1H ЯМР (400 МГц, CDCl3) δ 9,00-8,90 (м, 1H), 8,64 (дд, J=4,7, 1,4 Гц, 1H), 8,09-8,00 (м, 2H), 7,47 (ддд, J=8,4, 4,8, 0,7 Гц, 1H), 3,72 (д, J=7,1 Гц, 2H), 3,43 (с, 2H), 3,30 (дд, J=14,7, 6,8 Гц, 1H), 3,11-3,00 (м, 1H), 2,72 (т, J=6,9 Гц, 2H), 2,13-1,96 (м, 1H), 1,73 (тдд, J=11,5, 8,3, 5,4 Гц, 1H), 1,45 (ддт, J=16,1, 8,0, 3,8 Гц, 1H), 1,18 (т, J=7,2 Гц, 3H); ESIMS m/z 433 ([M+H]+).
Соединения 623, 631, 644 в таблице 1 были получены в соответствии со способами, описанными в примере 91.
Пример 92: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-(циклопропилметил)-3-(((2,2-дифторциклопропил)метил)тио)пропанамида (соединение 632)
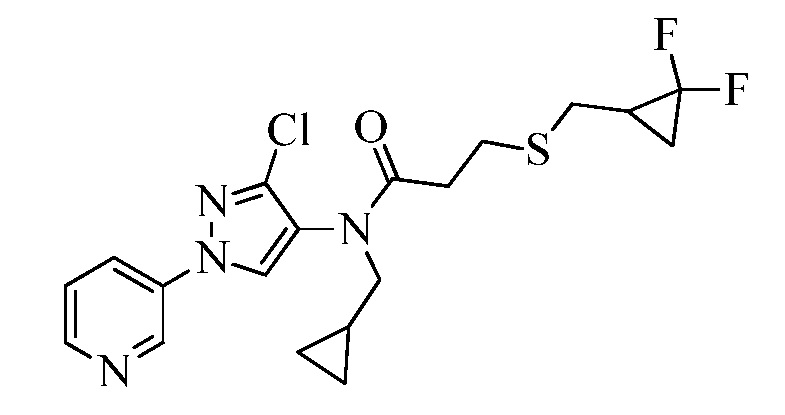
К раствору 3-хлор-N-(циклопропилметил)-1-(пиридин-3-ил)-1H-пиразол-4-амина (108 мг, 0,43 ммоль), N,N-диметилпиридин-4-амина (53 мг, 0,43 ммоль) и 3-(((2,2-дифторциклопропил)метил)тио)пропановой кислоты (85 мг, 0,43 ммоль) в ДМФ (5 мл) добавляли гидрохлорид N1-((этилимино)метилен)-N3,N3-диметилпропан-1,3-диамина (101 мг, 0,65 ммоль). Полученную смесь коричнево-желтого цвета перемешивали при комнатной температуре в течение 2 ч. Смесь разбавляли насыщенным водным раствором хлорида аммония и этилацетатом. Органическую фазу отделяли, и водную фазу экстрагировали этилацетатом (2×50 мл). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения в виде бесцветного масла (120 мг, 61%): ИК (тонкая пленка) 3089, 3005, 2923, 1660, 1584 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,95 (д, J=2,6 Гц, 1H), 8,63 (дд, J=4,8, 1,5 Гц, 1H), 8,05 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,99 (с, 1H), 7,47 (ддд, J=8,3, 4,7, 0,7 Гц, 1H), 3,54 (с, 2H), 2,88 (т, J=7,3 Гц, 2H), 2,69-2,54 (м, 2H), 2,48 (т, J=7,3 Гц, 2H), 1,76 (ддт, J=18,7, 13,3, 7,4 Гц, 1H), 1,53-1,42 (м, 1H), 1,12-0,90 (м, 2H), 0,54-0,44 (м, 2H), 0,20 (дт, J=6,1, 4,6 Гц, 2H); ESIMS m/z 427 ([M+H]+).
Соединение 646 в таблице 1 получали в соответствии со способами, описанными в примере 92.
Пример 93: Получение (E)-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-4,4,4-трифторбут-2-енамида
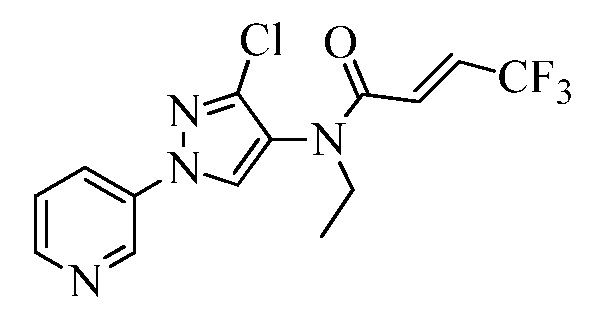
К раствору 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина, 2HCl (1,0 г, 3,38 ммоль), N,N-диметилпиридин-4-амина (827 мг, 6,77 ммоль) и (E)-4,4,4-трифторбут-2-еновой кислоты (474 мг, 3,38 ммоль) в ДМФ (3 мл) добавляли N1-((этилимино)метилен)-N3,N3-диметилпропан-1,3-диамин, HCl (973 мг, 5,07 ммоль). Полученную смесь коричнево-желтого цвета перемешивали при комнатной температуре в течение 2 часов. Смесь разбавляли насыщенным водным раствором NH4Cl и этилацетатом и насыщали NaCl. Органическую фазу отделяли, и водную фазу экстрагировали этилацетатом (22×5050 мл). Объединенную органическую фазу сушили над MgSO4, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения в виде смолы светло-коричневого цвета (901 мг, 73%): ИК (тонкая пленка) 3093, 2978, 2937, 1681, 1649, 1585, 1114 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,97 (д, J=2,7 Гц, 1H), 8,65 (дд, J=4,9, 1,4 Гц, 1H), 8,07 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,99 (с, 1H), 7,48 (дд, J=8,3, 4,8 Гц, 1H), 6,84 (дкв, J=15,4, 6,8 Гц, 1H), 6,60-6,44 (м, 1H), 3,80 (кв, J=7,2 Гц, 2H), 1,22 (т, J=7,2 Гц, 3H); ESIMS m/z 345 ([M+H]+).
Пример 94: Получение S-(4-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-1,1,1-трифтор-4-оксобутан-2-ил)этантиоата
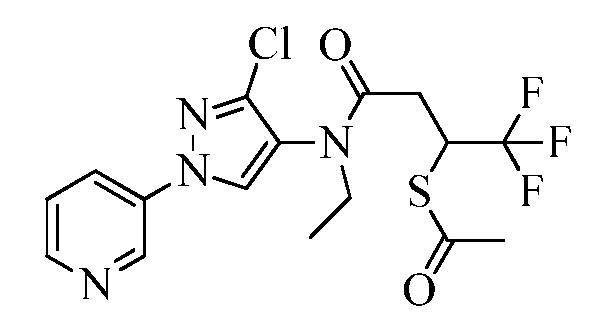
К раствору (E)-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-4,4,4-трифторбут-2-енамида (465 мг, 1,349 ммоль) в сухом ДМСО (5 мл) добавляли этантиоацетат калия (616 мг, 5,40 ммоль). Смесь перемешивали при температуре 50°C в течение 96 часов в атмосфере азота. Смесь гасили насыщенным раствором хлорида аммония и экстрагировали два раза этилацетатом. Объединенную органическую фазу промывали насыщенным солевым раствором, сушили над MgSO4, фильтровали и концентрировали в вакууме с получением смолы коричневого цвета. Очистка этой смолы на силикагеле элюированием смесями гексана и этилацетата давала указанные в заголовке соединения в виде смолы коричневого цвета (265 мг, 44%): ИК (тонкая пленка) 3099, 2976, 2936, 1708, 1666, 1585, 1102 см-1; 1H ЯМР (400 МГц, CDCl3) δ 9,03-8,93 (м, 1H), 8,64 (дд, J=4,7, 1,5 Гц, 1H), 8,12-8,04 (м, 1H), 7,98 (с, 1H), 7,53-7,42 (м, 1H), 4,78 (дд, J=9,0, 4,4 Гц, 1H), 3,90-3,54 (м, 2H), 2,76 (дд, J=16,6, 4,4 Гц, 1H), 2,53 (дд, J=16,6, 9,4 Гц, 1H), 2,41 (с, 3H), 1,16 (т, J=7,2 Гц, 3H); ESIMS m/z 421 ([M+H]+).
Пример 95: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(((2,2-дифторциклопропил)метил)тио)-N-этил-4,4,4-трифторбутанамида (соединение 634)
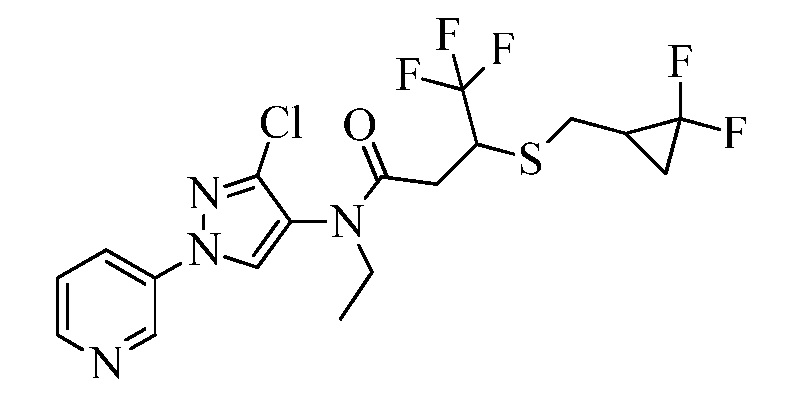
К раствору метанола (21,1 мг, 0,66 ммоль) в ТГФ (1 мл) добавляли гидрид натрия (26,5 мг, 0,66 ммоль, 60% масло суспензия). Полученную смесь перемешивали в течение 10 минут при комнатной температуре и добавляли S-(4-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-1,1,1-трифтор-4-оксобутан-2-ил)этантиоат (266 мг, 0,63 ммоль) в ТГФ (1 мл). После перемешивания в течение 30 минут добавляли 2-(бромметил)-1,1-дифторциклопропан (130 мг, 0,76 ммоль). Смесь перемешивали при комнатной температуре в течение еще 4 часов и разбавляли насыщенным водным раствором хлорида аммония и этилацетатом. Органическую фазу отделяли, и водную фазу экстрагировали этилацетатом (2×50 мл). Объединенные этилацетатные экстракты сушили над MgSO4, фильтровали и концентрировали в вакууме с получением бесцветного масла. Очистка на силикагеле, элюируя смесью этилацетата и гексанов, давала указанные в заголовке соединения в виде масла коричневого цвета (89 мг, 30%-ый выход): ИК (тонкая пленка) 3097, 2978, 2937, 1664, 1440 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,96 (д, J=2,7 Гц, 1H), 8,64 (дд, J=4,8, 1,4 Гц, 1H), 8,06 (ддд, J=8,4, 2,8, 1,4 Гц, 1H), 7,98 (д, J=2,1 Гц, 1H), 7,47 (дд, J=8,3, 4,8 Гц, 1H), 3,94-3,84 (м, 1H), 3,75 (с, 2H), 2,97 (дд, J=13,4, 7,5 Гц, 0,55H), 2,85 (с, 1H), 2,79-2,65 (м, 0,45H), 2,60 (м, 1H), 2,43 (дт, J=16,3, 10,0 Гц, 1H), 1,89 (тт, J=12,2, 7,5 Гц, 1H), 1,63-1,49 (м, 1H), 1,23-1,13 (м, 4H); ESIMS m/z 469 ([M+H]+).
Пример 96: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-((циклопропилметил)тио)-N-этилпропанамида (соединение 621)
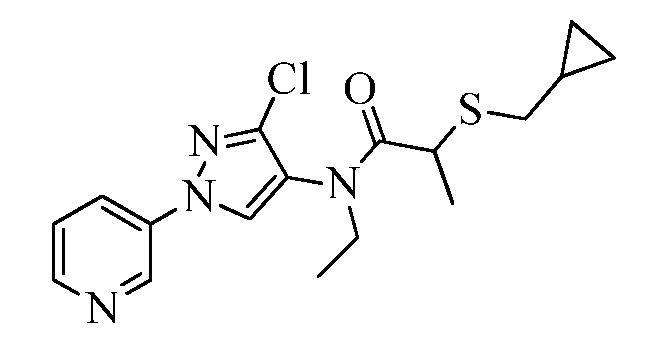
К раствору метанола (9,99 мг, 0,312 ммоль) в ТГФ (1 мл) добавляли гидрид натрия (12,4 мг, 0,31 ммоль, 60%-ая масляная суспензия). Смесь перемешивали при комнатной температуре в течение 10 минут и добавляли S-(1-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-1-оксопропан-2-ил)этантиоат (100 мг, 0,28 ммоль). После перемешивания смеси в течение 30 мин добавляли (бромметил)циклопропан (38 мг, 0,28 ммоль) и смесь перемешивали в течение еще 14 часов. Смесь разбавляли насыщенным водным раствором хлорида аммония (5 мл) и этилацетатом (15 мл), и органическую фазу отделяли. Водную фазу экстрагировали этилацетатом (5 мл), и объединенную органическую фазу промывали насыщенным солевым раствором, сушили над MgSO4 и концентрировали в вакууме с получением маслянистого остатка. Данный остаток очищали на силикагеле, элюируя смесями этилацетата и гексанов, с получением указанного в заголовке соединения в виде бесцветной смолы (31 мг, 30%): ИК (тонкая пленка) 3081, 2972, 2930, 2871, 1655, 1438 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,96 (д, J=2,8 Гц, 1H), 8,63 (дд, J=4,8, 1,4 Гц, 1H), 8,13 (с, 1H), 8,04 (ддт, J=8,3, 3,2, 1,6 Гц, 1H), 7,50-7,40 (м, 1H), 3,81 (ушир. с, 1H), 3,59 (ушир. с, 1H), 3,33 (д, J=7,4 Гц, 1H), 2,58-2,41 (м, 2H), 1,47 (д, J=6,9 Гц, 3H), 1,17 (тд, J=7,1, 1,8 Гц, 3H), 0,84 (дт, J=10,3, 7,4, 3,7 Гц, 1H), 0,56-0,38 (м, 2H), 0,25-0,07 (м, 2H); ESIMS m/z 365 ([M+H]+).
Соединение 651 в таблице 1 получали в соответствии со способами, описанными в примере 96.
Пример 97: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-((циклопропилметил)тио)-N-этилпропанамида (соединение 619)
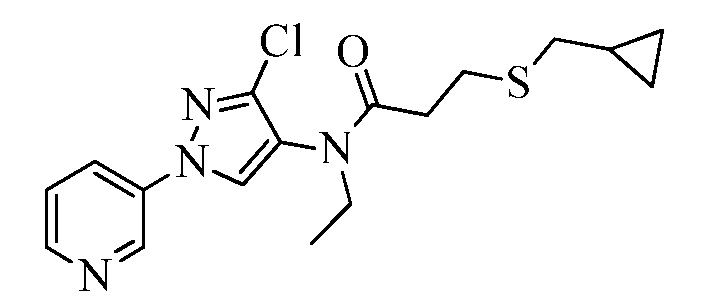
К раствору метанола (9,99 мг, 0,31 ммоль) в ДМСО (1 мл) добавляли гидрид натрия (12,4 мг, 0,31 ммоль). Смесь перемешивали при комнатной температуре в течение 10 минут и добавляли раствор S-(3-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-3-оксопропил)этантиоата (100 мг, 0,28 ммоль). После перемешивания смеси в течение 30 мин добавляли (бромметил)циклопропан (38 мг, 0,28 ммоль) и смесь перемешивали в течение еще 30 минут. Смесь разбавляли насыщенным водным раствором NH4Cl и этилацетатом, и органическую фазу отделяли. Водную фазу экстрагировали этилацетатом, и объединенную органическую фазу промывали насыщенным солевым раствором, сушили над MgSO4 и концентрировали в вакууме с получением масла светло-коричневого цвета. Это масло очищали на силикагеле, элюируя смесями гексанов и этилацетата, с получением указанного в заголовке соединения в виде бесцветной смолы (33 мг, 31%): ИК (тонкая пленка) 3080, 2978, 2930, 1660, 1584 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,95 (д, J=2,8 Гц, 1H), 8,63 (дд, J=4,7, 1,5 Гц, 1H), 8,12-8,01 (м, 1H), 7,98-7,92 (м, 1H), 7,53-7,40 (м, 1H), 3,78-3,62 (м, 2H), 2,95-2,84 (м, 2H), 2,51-2,38 (м, 4H), 1,20-1,11 (м, 3H), 0,94 (с, 1H), 0,60-0,34 (м, 2H), 0,24-0,09 (м, 2H); ESIMS m/z 365 ([M+H]+).
Пример 98: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-((циклопропилметил)тио)-N-этилацетамида (соединение 620)
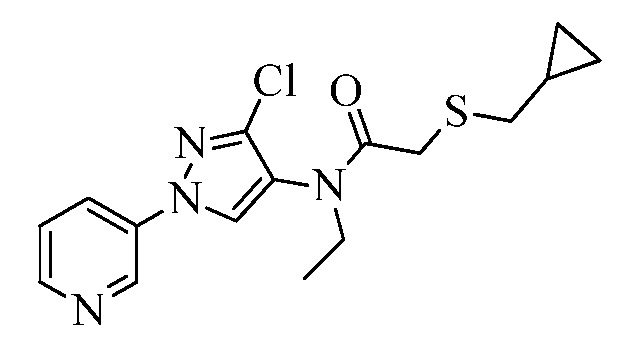
К раствору метанола (10,4 мг, 0,32 ммоль) в ДМСО (1 мл) добавляли гидрид натрия (13 мг, 0,32 ммоль). Смесь перемешивали при комнатной температуре в течение 10 минут и охлаждали до температуры 0-5°C, и добавляли раствор S-(2-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-2-оксоэтил)этантиоат (100 мг, 0,29 ммоль). После перемешивания смеси в течение 30 мин добавляли (бромметил)циклопропан (39 мг, 0,29 ммоль) и смесь перемешивали в течение еще 2 часов. Смесь разбавляли насыщенным водным раствором хлорида аммония (5 мл) и этилацетатом (15 мл), и органическую фазу отделяли. Водную фазу экстрагировали этилацетатом (5 мл), и объединенную органическую фазу промывали насыщенным солевым раствором, сушили над MgSO4 и концентрировали в вакууме с получением маслянистого остатка. Данный остаток очищали на силикагеле, элюируя смесью этилацетата и гексанов, с получением указанного в заголовке соединения в виде бесцветной смолы (38 мг, 37%): ИК (тонкая пленка) 3080, 2975, 2931, 1657, 1584 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,96 (дд, J=2,7, 0,7 Гц, 1H), 8,63 (дд, J=4,8, 1,4 Гц, 1H), 8,08 (с, 1H), 8,04 (ддд, J=8,4, 2,8, 1,5 Гц, 1H), 7,46 (ддд, J=8,4, 4,7, 0,8 Гц, 1H), 3,6 (ушир. с, 1H), 3,17 (с, 1H), 2,61 (д, J=7,1 Гц, 2H), 1,17 (т, J=7,2 Гц, 2H), 1,05-0,91 (м, 1H), 0,55 (дд, J=7,9, 1,5 Гц, 2H), 1,21-1,10 (м, 3H), 0,24 (дд, J=4,8, 1,4 Гц, 2H); ESIMS m/z 351 ([M+H]+).
Соединение 650 в таблице 1 получали в соответствии со способами, описанными в примере 98.
Пример 99: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-((3,3-дихлораллил)тио)-N-метилпропанамида (соединение 649)
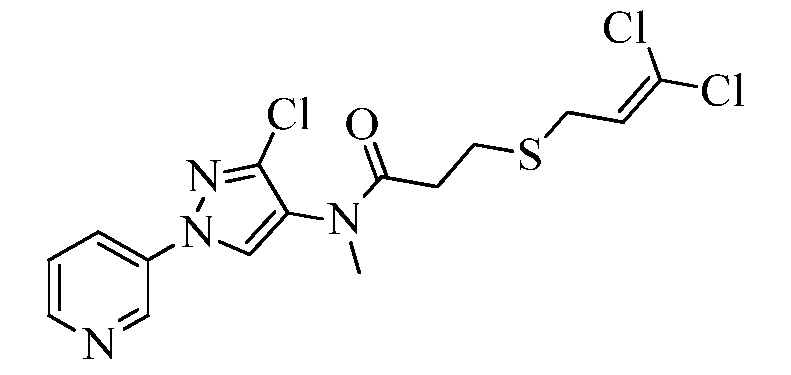
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-меркапто-N-метилпропанамида (100 мг, 0,34 ммоль) в ДМСО (1 мл) добавляли гидрид натрия (14,8 мг, 0,37 ммоль). Смесь перемешивали при комнатной температуре в течение 10 мин и охлаждали до температуры 0-5°C. Добавляли 1,1,3-трихлорпроп-1-ен (49,0 мг, 0,34 ммоль) и смесь перемешивали в течение еще 45 минут. Смесь разбавляли насыщенным водным раствором NH4Cl и этилацетатом, и органическую фазу отделяли. Водную фазу экстрагировали этилацетатом, и объединенную органическую фазу промывали насыщенным солевым раствором, сушили над MgSO4 и концентрировали в вакууме с получением масла светло-коричневого цвета. Это масло очищали на силикагеле, элюируя смесями гексанов, с получением указанного в заголовке соединения в виде бесцветной смолы (60 мг, 43,9%): ИК (тонкая пленка) 3078, 2926, 1659, 1583, 1458, 1437, 803 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,94 (дд, J=2,7, 0,7 Гц, 1H), 8,63 (дд, J=4,8, 1,5 Гц, 1H), 8,04 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,98 (с, 1H), 7,47 (ддд, J=8,3, 4,7, 0,7 Гц, 1H), 5,30 (с, 1H), 3,51 (с, 2H), 3,25 (с, 3H), 2,87 (т, J=7,3 Гц, 2H), 2,52 (т, J=7,3 Гц, 2H); ESIMS m/z 406 ([M+2]+), 403,7 ([M-1]-).
Пример 100: Получение 2-хлор-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этилпропанамида
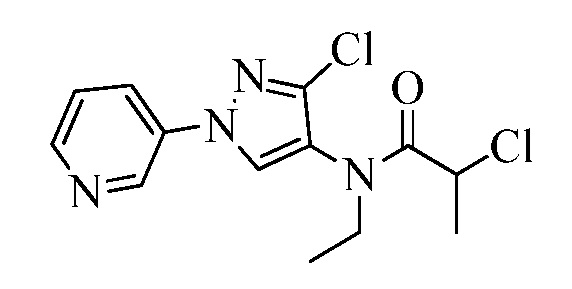
К раствору 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина (1,0 г, 4,49 ммоль) в 1,2-дихлорэтане (44,9 мл) при температуре 0°C добавляли диизопропилэтиламин (0,941 мл, 5,39 ммоль) и 2-хлорпропаноилхлорид (0,436 мл, 4,49 ммоль), последовательно. Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 1,5 час. Реакцию гасили путем добавления водного раствора NaHCO3, и слои быстро разделяли. Водный слой экстрагировали CH2Cl2 (3×50 мл), и объединенные органические продукты сушили над Na2SO4, фильтровали и концентрировали в вакууме. Сырой остаток очищали посредством флэш-хроматографии (от 30 до 100% EtOAc/Hex) с получением указанного в заголовке соединения в виде твердого вещества белого цвета (1,301 г, 93%): т. пл. 94-105°C; 1H ЯМР (400 МГц, CDCl3) δ 8,97 (д, J=2,7 Гц, 1H), 8,64 (дд, J=4,8, 1,5 Гц, 1H), 8,09 (с, 1H), 8,04 (ддд, J=8,4, 2,7, 1,5 Гц, 1H), 7,47 (дд, J=8,3, 4,8 Гц, 1H), 4,27 (кв, J=6,5 Гц, 1H), 3,83 (с, 1H), 3,63 (с, 1H), 1,64 (д, J=6,5 Гц, 3H), 1,19 (т, J=7,2 Гц, 3H); ESIMS m/z 313 ([M+H]+).
Следующие соединения были получены в соответствии со способами, описанными в примере 100:
2-хлор-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этилбутанамид
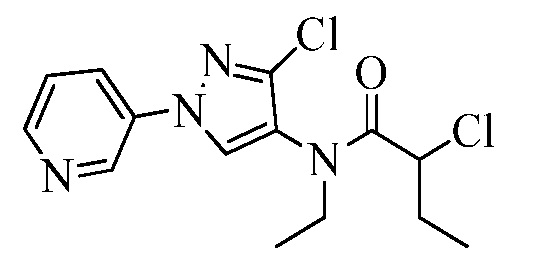
Т. пл. 95-103°C; 1H ЯМР (400 МГц, CDCl3) δ 8,98 (д, J=2,6 Гц, 1H), 8,64 (дд, J=4,8, 1,4 Гц, 1H), 8,08 (с, 1H), 8,05 (ддд, J=8,4, 2,7, 1,4 Гц, 1H), 7,47 (дд, J=8,3, 4,7 Гц, 1H), 3,99 (м, 1H), 3,86 (ушир. с, 1H), 3,60 (ушир. с, 1H), 2,13 (дт, J=14,6, 7,3 Гц, 1H), 1,91 (дт, J=14,5, 7,3 Гц, 1H), 1,19 (т, J=7,2 Гц, 3H), 0,97 (т, J=7,3 Гц, 3H); ESIMS m/z 327 ([M+H]+).
2-хлор-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этилацетамид (соединение Y2007)
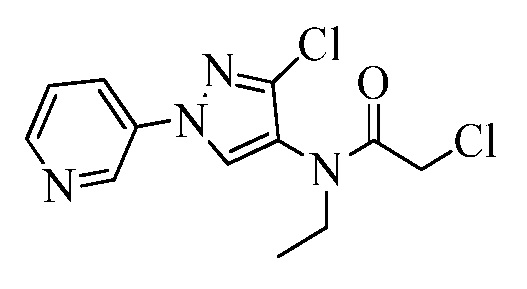
Из-за наблюдаемого разложения, если оставлять при комнатной температуре в течение ночи, указанные в заголовке соединения были использованы в последующих реакциях немедленно: 1H ЯМР (400 МГц, CDCl3) δ 8,96 (д, J=2,6 Гц, 1H), 8,65 (дд, J=4,7, 1,3 Гц, 1H), 8,07-8,01 (м, 2H), 7,47 (дд, J=8,3, 4,7 Гц, 1H), 3,93 (с, 2H), 3,79-3,68 (ушир. с, 2H), 1,19 (т, J=7,2 Гц, 3H).
N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-((1-хлор-2,2,2-трифторэтил)тио)-N-этилацетамид (соединение 638)
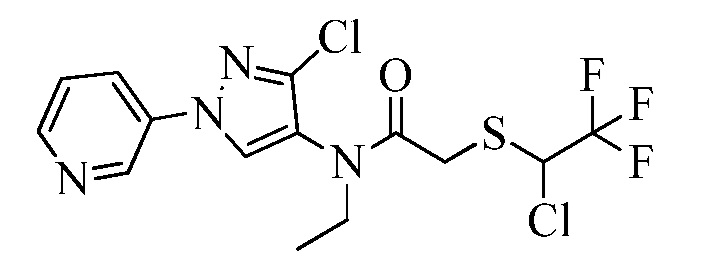
Подтверждающие данные анализа для указанных в заголовке соединений можно найти в таблице 2.
Пример 101: Получение S-(1-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-1-оксопропан-2-ил)этантиоата (соединение 685)
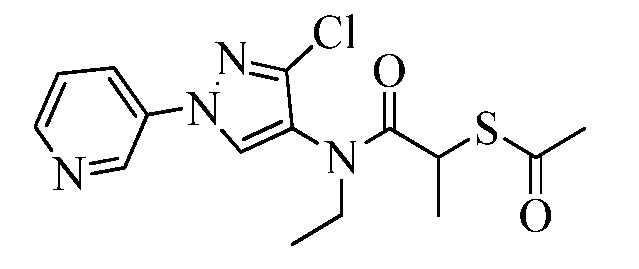
К раствору 2-хлор-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этилпропанамида (1,0 г, 3,19 ммоль) в ацетоне (6,39 мл) добавляли этантиоат калия (0,438 г, 3,83 ммоль). Реакционный сосуд герметически закрывали и нагревали при температуре 60°C в течение 1,5 ч. Реакционную смесь охлаждали и выливали в делительную воронку, содержащую воду (20 мл) и EtOAc (20 мл). Слои разделяли, и водный слой экстрагировали EtOAc (3×20 мл). Объединенный органический экстракт сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Сырой остаток очищали (флэш-хроматография, от 20 до 100% EtOAc/Hex) с получением указанного в заголовке соединения в виде очень вязкого масла коричневого цвета (1,07 г, 90%).
Следующие соединения были получены в соответствии со способами, описанными в примере 101:
S-(1-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-1-оксобутан-2-ил)этантиоат
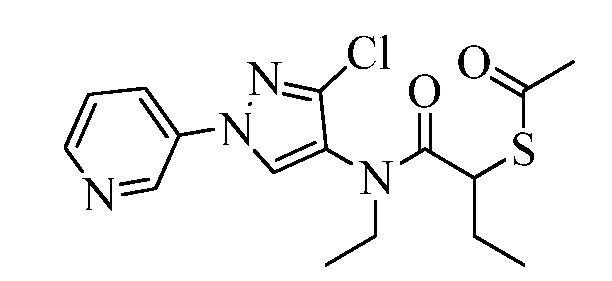
Т. пл. 116-122°C; 1H ЯМР (400 МГц, CDCl3) δ 8,97 (д, J=2,6 Гц, 1H), 8,63 (дд, J=4,8, 1,5 Гц, 1H), 8,13-7,99 (м, 2H), 7,46 (дд, J=8,3, 4,7 Гц, 1H), 4,14 (т, J=7,3 Гц, 1H), 3,85 (ушир. с, 1H), 3,57 (ушир. с, 1H), 2,27 (с, 3H), 1,98 (дт, J=14,2, 7,1 Гц, 1H), 1,74-1,62 (м, 1H), 1,16 (т, J=7,2 Гц, 3H), 0,92 (т, J=7,4 Гц, 3H); ESIMS m/z 367 ([M+H]+).
S-(2-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-2-оксоэтил)этантиоат (соединение 694)
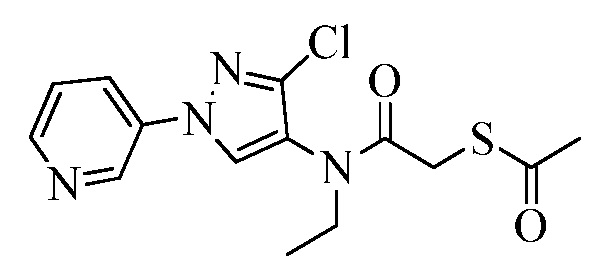
Т. пл. 117-124°C; 1H ЯМР (400 МГц, CDCl3) δ 8,98 (дд, J=2,7, 0,7 Гц, 1H), 8,64 (дд, J=4,8, 1,5 Гц, 1H), 8,09 (с, 1H), 8,06 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,47 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 3,84-3,65 (м, 2H), 3,61 (с, 2H), 2,33 (с, 3H), 1,17 (т, J=7,2 Гц, 3H); ESIMS m/z 339 ([M+H]+).
Пример 102: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-((2,2,2-трифторэтил)тио)пропанамида (соединение 635)
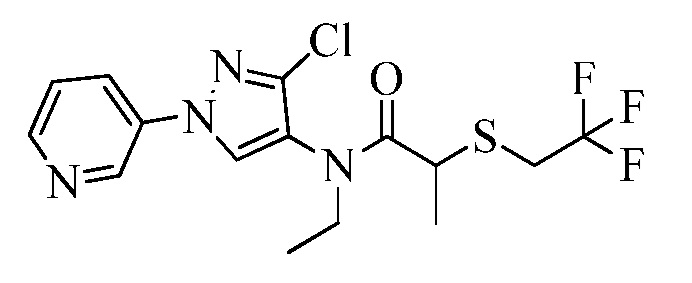
В сухую круглодонную колбу в атмосфере N2 добавляли гидрид натрия (0,018 г, 0,446 ммоль) и ТГФ (2,1 мл), затем метанол (0,018 мл, 0,446 ммоль). Реакционную смесь оставляли перемешиваться при комнатной температуре до тех пор, пока не переставало наблюдаться выделение водорода (~45 мин). Реакционную смесь затем охлаждали до температуры 0°C и добавляли S-(1-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-1-оксопропан-2-ил)этантиоат (0,150 г, 0,425 ммоль) в ТГФ (2,1 мл). Реакционную смесь нагревали при комнатной температуре и перемешивали в течение 30 мин. Реакционную смесь опять охлаждали до температуры 0°C и добавляли 1,1,1-трифтор-2-йодэтан (0,063 мл, 0,638 ммоль) в ТГФ (2,1 мл). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь раводили в EtOAc (20 мл) и гасили H2O (5 мл). Слои разделяли, и водный слой экстрагировали EtOAc (3×10 мл). Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением масла желтого цвета. Сырой продукт очищали посредством флэш-хроматографии (от 0 до 75% CH2Cl2/EtOAc) с получением указанного в заголовке соединения в виде непрозрачного вязкого масла (43 мг, 25%): ИК (тонкая пленка) 1657 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,96 (д, J=2,6 Гц, 1H), 8,64 (дд, J=4,8, 1,4 Гц, 1H), 8,14-7,96 (м, 2H), 7,47 (дд, J=8,3, 4,8 Гц, 1H), 3,82 (с, 1H), 3,59 (с, 1H), 3,44 (с, 1H), 3,25 (квд, J=10,2, 3,8 Гц, 2H), 1,48 (д, J=6,8 Гц, 3H), 1,17 (т, J=7,2 Гц, 3H); 19F ЯМР (376 МГц, CDCl3) δ -66,16; ESIMS m/z 393 ([M+H]+).
Соединения 637, 639-642 и 652 в таблице 1 были получены в соответствии со способами, описанными в примере 102.
Пример 103: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-((2-фторвинил)тио)пропанамида (соединение 654)
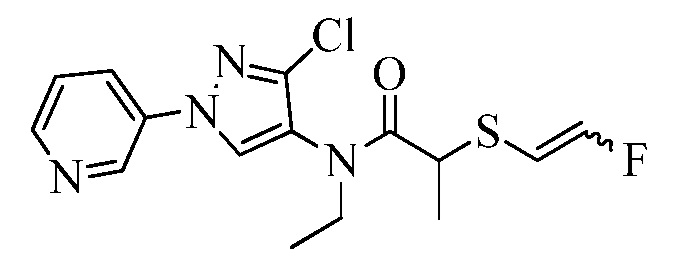
В сухую круглодонную колбу в атмосфере N2 добавляли 60%-ую дисперсию NaH в минеральном масле (0,043 г, 1,063 ммоль) и ТГФ (2,1 мл), затем метанол (0,086 мл, 2,126 ммоль). Реакционную смесь оставляли перемешиваться при комнатной температуре до тех пор, пока не переставало наблюдаться выделение водорода (~45 мин). Реакционную смесь затем охлаждали до температуры 0°C и добавляли S-(1-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-1-оксопропан-2-ил)этантиоат (0,150 г, 0,425 ммоль) в ТГФ (2,1 мл). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 30 мин. Реакционную смесь опять охлаждали до температуры 0°C и добавляли 2-бром-1,1-дифторэтан (0,101 мл, 1,275 ммоль) в ТГФ (2,1 мл). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение ночи. Анализ ЖХ-МС показывал наличие двух продуктов, где основной соответствовал желаемому продукту элиминирования, и побочный соответствовал исходному продукту алкилирования. Далее реакционную смесь охлаждали до температуры 0°C и переносили в сосуд, содержащий дополнительное количество NaOMe (свежеполученный путем смешивания NaH (5,86 мг, 0,147 ммоль) и MeOH (5,93 мкл, 0,147 ммоль) в ТГФ (0,73 мл) при температуре 0°C. После перемешивания еще в течение 18 ч реакционную смесь разбавляли EtOAc (5 мл) и гасили H2O (5 мл). Водный слой экстрагировали EtOAc (3×10 мл), и объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением масла желтого цвета. Сырой остаток очищали посредством флэш-хроматографии (25-80% EtOAc/Hex) с получением неразделимой смеси олефиновых изомеров (~3:2, E/Z) в виде непрозрачного вязкого масла (15 мг, 10%): ИК (тонкая пленка) 3091, 1656 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,97 (м, 1H), 8,64 (дд, J=4,7, 1,4 Гц, 1H), 8,13 (с, 0,4H), 8,04 (м, 1,6H), 7,54-7,41 (м, 1H), 6,79 (дд, J=83,3, 11,0 Гц, 0,6H), 6,75 (дд, J=82,7, 4,3 Гц, 0,4H), 5,97 (дд, J=12,7, 11,0 Гц, 0,6H), 5,68 (дд, J=39,8, 4,3 Гц, 0,4H), 3,82 (ушир. с, 1H), 3,72-3,47 (м, 1H), 3,47-3,20 (м, 1H), 1,50 (д, J=6,9 Гц, 1,2H), 1,42 (д, J=6,8 Гц, 1,8H), 1,17 (м, 3H); ESIMS m/z 355 ([M+H]+).
Пример 104: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((2,2,2-трифторэтил)тио)пропанамида (соединение 636)
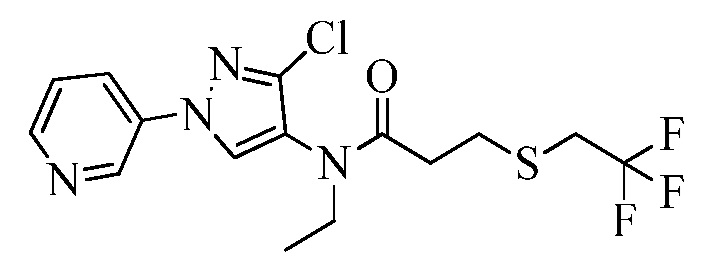
К раствору 3-хлор-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этилпропанамида (100 мг, 0,32 ммоль) в ТГФ (0,3 мл) добавляли йодид натрия (4,7 мг, 0,032 ммоль), 2,2,2-трифторэтантиол (148 мг, 1,3 ммоль) и N,N-ди-изо-пропилэтиламин (222 мкл, 1,277 ммоль). Реакционную смесь нагревали в течение ночи при температуре 50°C, разбавляли DCM и промывали 5%-ым раствором KOH. Фазы разделяли, концентрировали и очищали с помощью хроматографии на силикагеле, элюируя смесью 0-40% ацетона в гексане, с получением указанного в заголовке соединения в виде бесцветного масла (109 мг, 83%): 1H ЯМР (400 МГц, CDCl3) δ 8,95 (д, J=2,4 Гц, 1H), 8,63 (дд, J=4,7, 1,4 Гц, 1H), 8,05 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,96 (д, J=7,1 Гц, 1H), 7,46 (ддд, J=8,3, 4,8, 0,6 Гц, 1H), 3,72 (кв, J=7,1 Гц, 2H), 3,10 (кв, J=10,0 Гц, 2H), 2,96 (т, J=7,0 Гц, 2H), 2,47 (т, J=7,0 Гц, 2H), 1,17 (т, J=7,2 Гц, 3H); 19F ЯМР (376 МГц, CDCl3) δ -66,56 (с); ESIMS m/z 393 ([M+H]+).
Пример 105: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N,2-диметил-3-((трифторметил)тио)пропанамида (соединение 647)
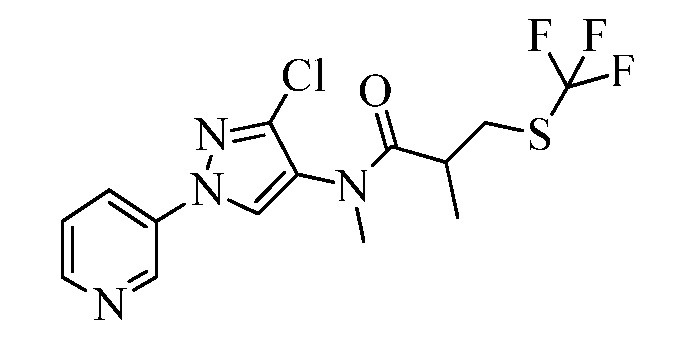
К раствору 2-метил-3-((трифторметил)тио)пропановой кислоты (0,200 г, 1,065 ммоль) в DCM (1,0 мл) добавляли оксалил дихлорид (0,093 мл, 1,065 ммоль) и 1 каплю ДМФ и перемешивали при комнатной температуре в течение 1 часа (наблюдалось выделение газа). Реакционную смесь концентрировали, и сырой хлорангидрид кислоты растворяли в DCM (0,3 мл), который затем добавляли к предварительно перемешиваемому раствору дигидрохлорида 3-хлор-N-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,100 г, 0,355 ммоль) и N,N-диметилпиридин-4-амина (0,130 г, 1,065 ммоль) в DCM (1,0 мл) и перемешивали в течение ночи при комнатной температуре. Реакционную смесь разбавляли насыщенным водным раствором NaHCO3 и экстрагировали DCM. Органический слой сушили над Na2SO4, фильтровали и концентрировали. Сырое вещество очищали посредством флэш-хроматографии, элюируя смесью 0-100% EtOAc/гексаны с получением указанного в заголовке соединения в виде масла желтого цвета (93 мг, 65,7%): ИК (тонкая пленка) 1654 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,96 (д, J=2,6 Гц, 1H), 8,64 (дд, J=4,7, 1,3 Гц, 1H), 8,08-8,00 (м, 1H), 7,98 (д, J=8,3 Гц, 1H), 7,51-7,44 (м, 1H), 4,07-3,36 (м, 2H), 3,25-3,11 (м, 1H), 2,94-2,77 (м, 2H), 1,22-1,15 (м, 6H); ESIMS m/z 394 ([M+H]+).
Соединение 648 в таблице 1 получали в соответствии со способами, описанными в примере 105.
Пример 106: Получение N-метил-N-(1-метил-3-(пиридин-3-ил)-1H-пиразол-5-ил)-3-((3,3,3-трифторпропил)тио)пропанамида (соединение 1011)
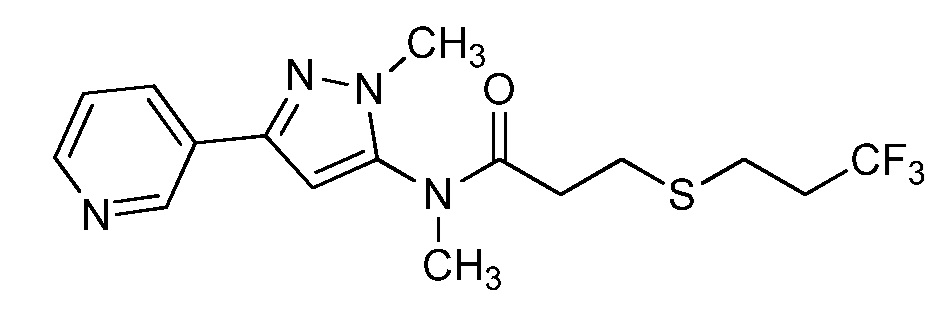
Раствор 3-((3,3,3-трифторпропил)тио)пропановой кислоты (75 мг, 0,372 ммоль), DMAP (110 мг, 0,903 ммоль) и N,1-диметил-3-(пиридин-3-ил)-1H-пиразол-5-амина (50 мг, 0,266 ммоль) в сухом диэтиловом эфире (886 мкл) охлаждали до температуры 0°C в атмосфере N2. Добавляли N,N'-дициклогексилкарбодиимид (DCC) (132 мг, 0,638 ммоль) и реакционную смесь нагревали до комнатной температуры в атмосфере N2, затем перемешивали при комнатной температуре в течение ночи. Реакционную смесь фильтровали с использованием дополнительного количества диэтилового эфира (0,5 мл) для удаления солей и концентрировали при пониженном давлении. Очистка с помощью хроматографии на силикагеле путем элюирования смесью 0-90% гексаны/EtOAc давала указанное в заголовке соединение в виде прозрачного масла (64 мг, 61%).
Пример 107: Получение трет-бутил (3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(2-гидроксиэтил)карбамата (соединение Y2151)
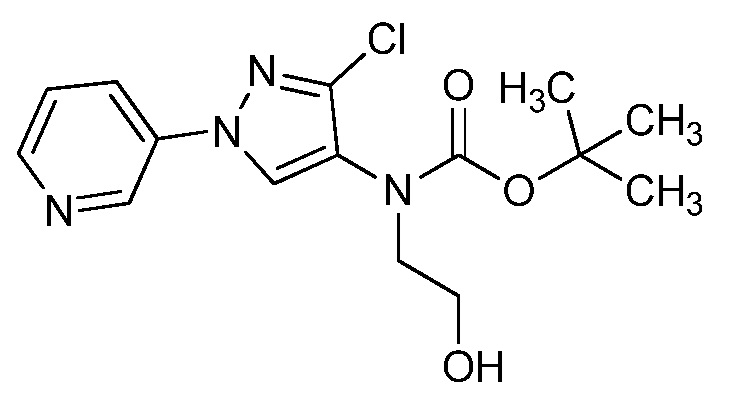
К раствору 2-((трет-бутоксикарбонил)(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)амино)этилацетата (841 мг, 2,21 ммоль) в MeOH (7,3 мл) добавляли карбонат калия (305 мг, 2,21 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли водой (10 мл) и экстрагировали EtOAc (2×10 мл). Органический слой промывали насыщенным водным раствором NaHCO3 (10 мл), сушили над MgSO4 и концентрировали. Добавляли Et2O, и полученный осадок собирали путем фильтрования с получением указанного в заголовке соединения в виде твердого вещества белого цвета (249 мг, 32%).
Пример 108: Получение 2-((трет-бутоксикарбонил)(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)амино)этил метансульфоната
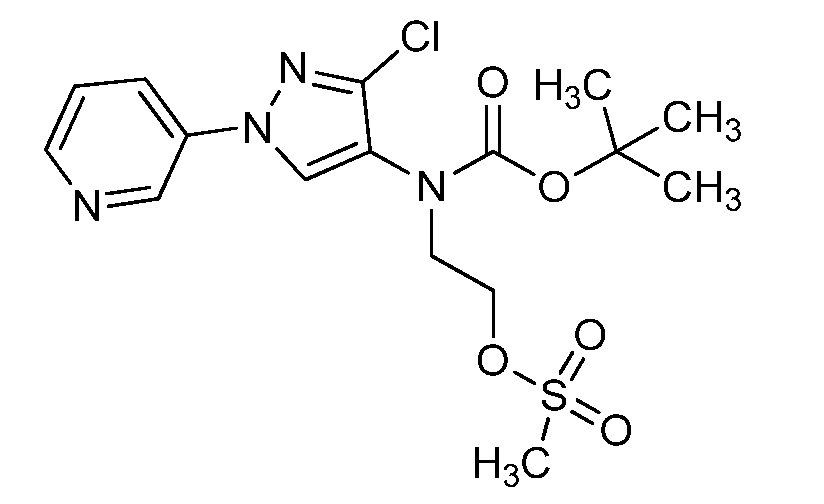
К раствору трет-бутил (3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(2-гидроксиэтил)карбамата (574 мг, 1,69 ммоль) в сухом CH2Cl2 (4,0 мл) добавляли триэтиламин (260 мкл, 1,86 ммоль) в атмосфере N2. Добавляли по каплям метансульфонилхлорид (145 мкл, 1,864 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 4 ч. После полного завершения реакции согласно данным ЖХМС, реакционную смесь разбавляли CH2Cl2 (10 мл) и промывали водой (2×10 мл) и насыщенным солевым раствором (10 мл). Органический слой сушили и концентрировали при пониженном давлении. Очистка с помощью хроматографии на силикагеле путем элюирования смесью 10-100% гексаны/EtOAc давала указанное в заголовке соединение в виде бесцветной жидкости (330 мг, 44%): 1H ЯМР (400 МГц, CDCl3) δ 9,00 (с, 1H), 8,59 (дд, J=4,9, 1,5 Гц, 1H), 8,12 (с, 1H), 8,06 (ддд, J=8,4, 2,8, 1,3 Гц, 1H), 7,46 (дд, J=8,4, 4,7 Гц, 1H), 4,52-4,31 (м, 2H), 3,89 (т, J=5,1 Гц, 2H), 3,04 (с, 3H), 2,19 (с, 3H), 1,68-1,32 (м, 6H); ESIMS m/z 417 ([M+H]+).
Пример 109: Получение трет-бутил (3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(2-(пирролидин-1-ил)этил)карбамата (соединение Y2152)
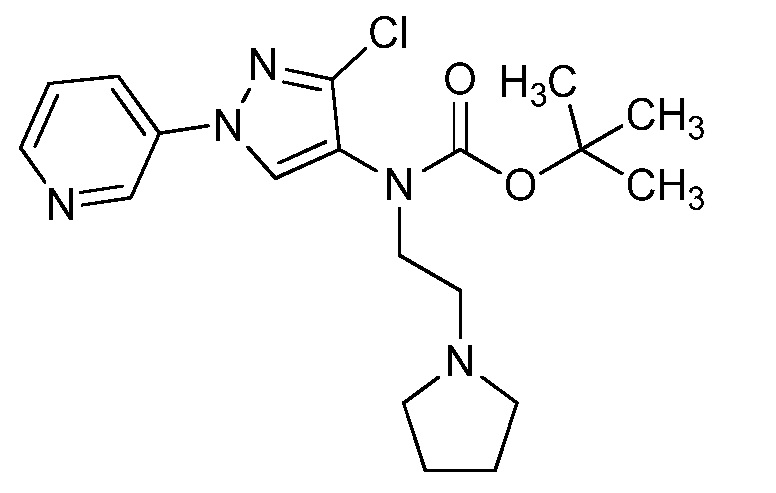
К раствору метансульфоната 2-((трет-бутоксикарбонил)(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)амино)этила (129 мг, 0,309 ммоль) в сухом ДМФ (884 мкл) в атмосфере N2 добавляли триэтиламин (51,8 мкл, 0,371 ммоль) и пирролидин (37,5 мкл, 0,449 ммоль). Реакционную смесь затем нагревали при температуре 80°C в атмосфере N2 в течение ночи. После полного завершения реакции согласно данным ЖХМС, реакционную смесь разбавляли водой (10 мл) и насыщенным водным раствором NaHCO3 (5 мл), затем экстрагировали EtOAc (3×10 мл). Органический слой сушили над MgSO4 и концентрировали при пониженном давлении. Очистка с помощью хроматографии на силикагеле путем элюирования смесью 0-50% CH2Cl2/MeOH давала указанное в заголовке соединение в виде твердого вещества не совсем белого цвета (65 мг, 51%).
Пример 110: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-(оксиран-2-илметил)-3-((3,3,3-трифторпропил)тио)пропанамида (соединение 928)
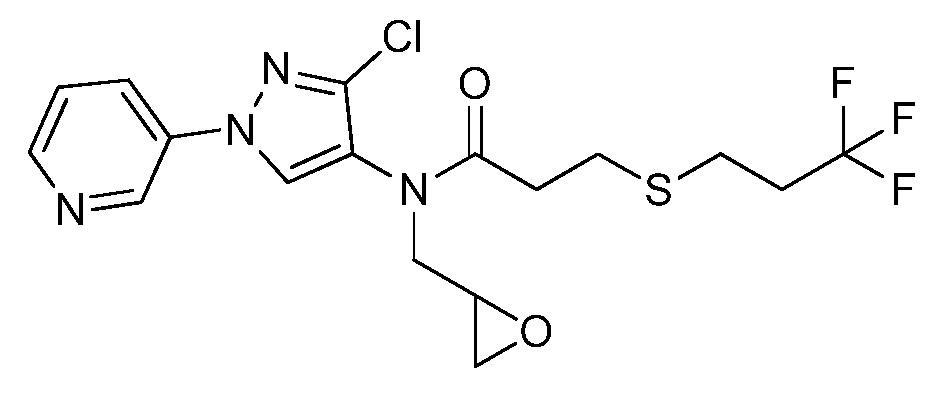
Раствор N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-((3,3,3-трифторпропил)тио)пропанамида (109 мг, 0,288 ммоль) в сухом ДМФ (882 мкл) охлаждали до температуры 0°C на ледяной бане в атмосфере N2. Осторожно добавляли гидрид натрия (16,11 мг, 0,403 ммоль, 60%-ая дисперсия в минеральном масле) и реакционную смесь перемешивали при температуре 0°C в течение 30 мин. Затем добавляли 2-(бромметил)оксиран (47,6 мкл, 0,576 ммоль) и перемешивали в течение 30 мин при температуре 0°C. Реакционную смесь медленно нагревали до комнатной температуры и перемешивали в течение ночи в атмосфере N2. Реакционную смесь гасили водой (15 мл) и экстрагировали EtOAc (3×10 мл). Органический слой сушили над MgSO4 и концентрировали при пониженном давлении. Очистка с помощью хроматографии на силикагеле путем элюирования смесью 0-90% гексан/EtOAc давала указанное в заголовке соединение в виде масла желтого цвета (28 мг, 21%).
Пример 111: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-(этилкарбамоил)-3-((3,3,3-трифторпропил)тио)пропанамида (соединение 988)
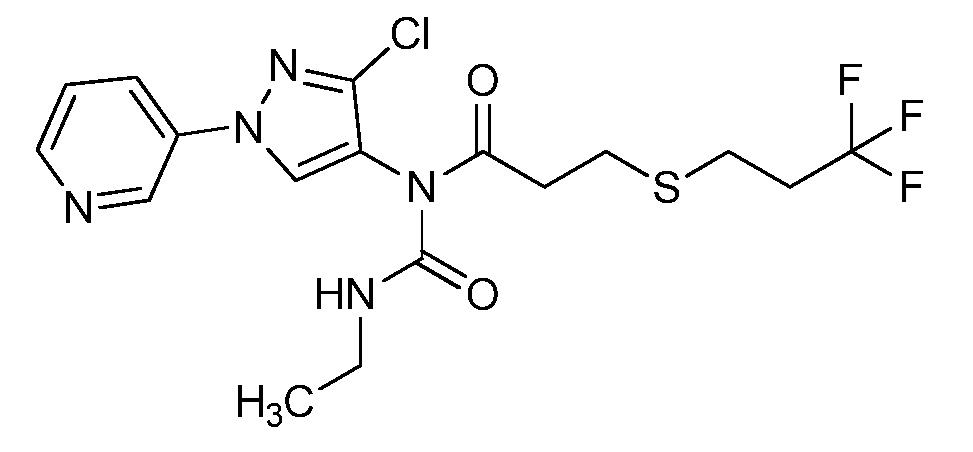
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-((3,3,3-трифторпропил)тио)пропанамида (106 мг, 0,280 ммоль) в сухом CH2Cl2 (1,8 мл) добавляли изоцианатоэтан (44,3 мкл, 0,560 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем кипятили с обратным холодильником в течение 2 ч. Растворитель заменяли на ТГФ и добавляли другую порцию изоцианатоэтана (44,3 мкл, 0,560 ммоль) и кипятили с обратным холодильником в течение еще 2 ч. Добавляли толуол (1,9 мл) вместе в другой порцией изоцианатоэтана (44,3 мкл, 0,560 ммоль) и реакционную смесь кипятили с обратным холодильником в течение ночи. Согласно данным ЖХМС наблюдалось образование небольшого количества продукта. Реакционную смесь выливали в 5-мл сосуд для микроволнового облучения с дополнительным количеством толуола (0,5 мл) и ацетонитрила (0,5 мл) вместе с другой порцией изоцианатоэтана (44,3 мкл, 0,560 ммоль). Реакционную смесь герметически закрывали и помещали в микроволновой реактор Biotage® Initiator на 9 ч всего при температуре 120°C, затем на 8 ч при температуре 125°C, с контролем внешней температуры ИК-датчиком на боку сосуда. Реакционную смесь концентрировали при пониженном давлении. Очистка с помощью хроматографии на силикагеле путем элюирования смесью 0-10% CH2Cl2/MeOH и последующая очистка, элюируя смесью 0-100% вода/ацетонитрил, давали указанное в заголовке соединение в виде твердого вещества белого цвета (36 мг, 27%). Ссылка: J. Org. Chem., 1951, 16, 1879-1890.
Пример 112: Получение 4-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-4-оксобутановой кислоты (соединение Y2187)
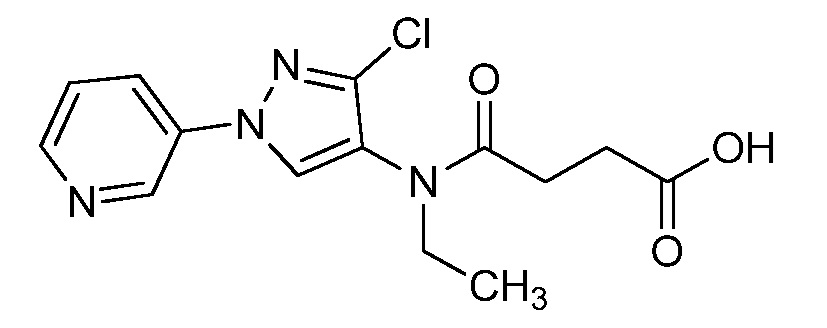
В 100-мл круглодонную колбу (RBF) помещали 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амин (500 мг, 2,25 ммоль), DMAP (27,4 мг, 0,225 ммоль), триэтиламин (0,469 мл, 3,37 ммоль) и дигидрофуран-2,5-дион (449 мг, 4,49 ммоль) вместе с дихлорэтаном (22,5 мл). Реакционную смесь нагревали при температуре 60°C в атмосфере N2 в течение ночи. Реакционную смесь концентрировали и очищали с помощью хроматографии на силикагеле путем элюирования смесью 0-15% CH2Cl2/MeOH с получением указанного в заголовке соединения в виде твердого вещества не совсем белого цвета (635 мг, 86%).
Пример 113: Получение S-(3,3,3-трифторпропил) 4-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-4-оксобутантиоата (соединение 979)
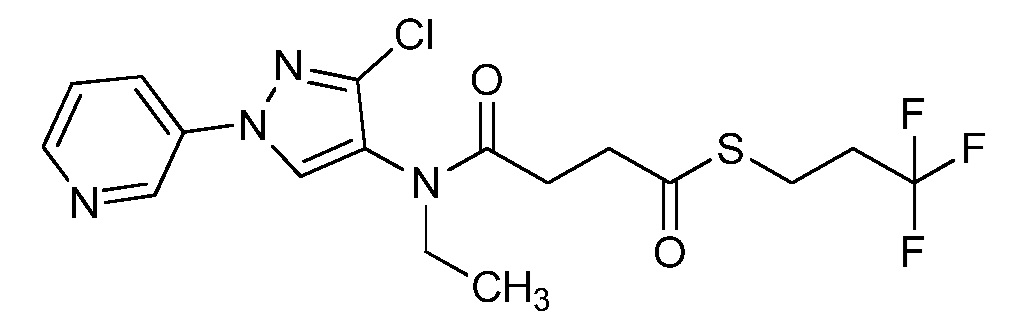
Раствор 4-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-4-оксобутановой кислоты (100 мг, 0,310 ммоль), 3,3,3-трифторпропан-1-тиола (42,0 мкл, 0,387 ммоль) и DMAP (3,79 мг, 0,031 ммоль) в сухом CH2Cl2 (620 мкл) охлаждали до температуры 0°C. Добавляли DCC (63,9 мг, 0,310 ммоль) и реакционную смесь нагревали до комнатной температуры в атмосфере N2, затем перемешивали в течение ночи. Реакционную смесь фильтровали с использованием дополнительного количества CH2Cl2 (1 мл) для удаления солей и концентрировали при пониженном давлении. Очистка посредством флэш-хроматографии на колонке с силикагелем, элюируя смесью 10-90% гексаны/EtOAc, давала указанное в заголовке соединение в виде полутвердого прозрачного вязкого вещества слегка желтого цвета (83 мг, 60%). Ссылка: J. Am. Chem. Soc., 2009, 131, 14604-14605.
Пример 114: Получение 3,3,3-трифторпропил 4-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-4-оксобутаноата (соединение Y2154)
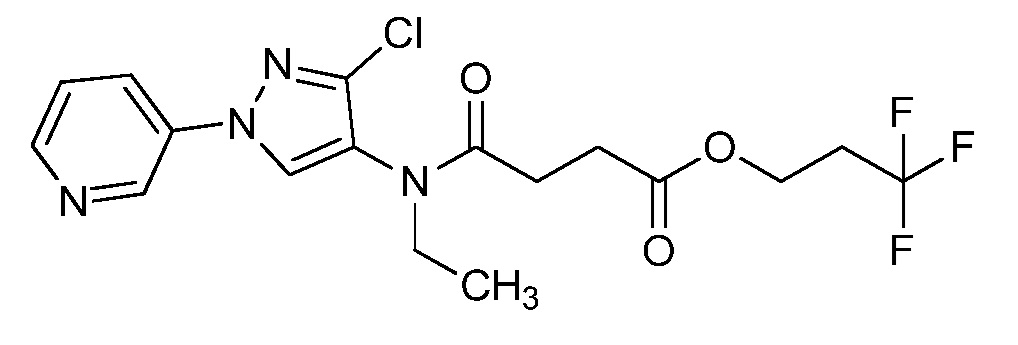
Раствор 4-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-4-оксобутановой кислоты (101 мг, 0,313 ммоль), бикарбоната натрия (526 мг, 6,26 ммоль) и 3-бром-1,1,1-трифторпропана (66,6 мкл, 0,626 ммоль) в ДМФ (1565 мкл) перемешивали при комнатной температуре в атмосфере N2 в течение ночи. Реакцию гасили водой (15 мл) и экстрагировали CH2Cl2 (3×10 мл). Органический слой сушили и концентрировали при пониженном давлении. Очистка с помощью хроматографии на силикагеле путем элюирования смесью 0-100% гексаны/EtOAc давала указанное в заголовке соединение в виде прозрачного масла (36 мг, 26%). Ссылка: Syn. Commun., 2008, 38, 54-71.
Пример 115: Получение 2-((2,2,2-трифторэтил)тио)этил (3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)карбамата (соединение 970)
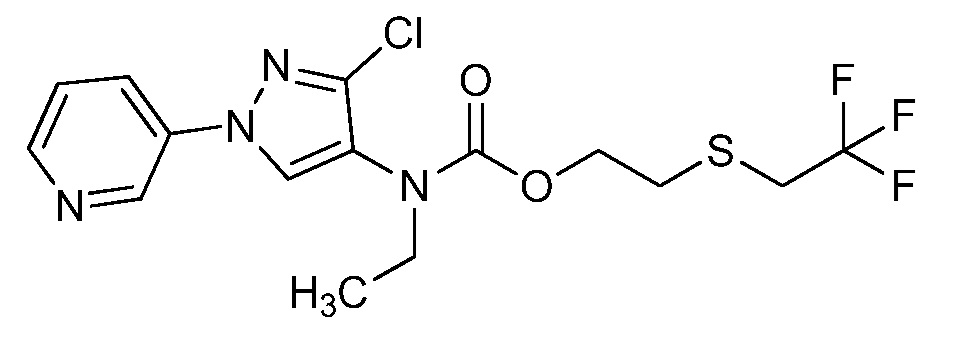
Раствор 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина (170 мг, 0,763 ммоль) в дихлорэтане (2 мл) охлаждали до температуры 0°C. В атмосфере N2 добавляли фосген (708 мкл, 0,992 ммоль, 15 масс.% в толуоле) и через 5 минут одной порцией добавляли N,N-диметилпиридин-4-амин (196 мг, 1,603 ммоль). Баню со льдом отставляли, и смесь перемешивали при комнатной температуре в течение 5 минут и при температуре 80°C в течение 50 мин. Смесь охлаждали до комнатной температуры и затем добавляли 2-((2,2,2-трифторэтил)тио)этанол (251 мг, 1,57 ммоль) с CH2Cl2 (0,5 мл), затем другую порцию N,N-диметилпиридин-4-амина (196 мг, 1,60 ммоль). Реакционную смесь нагревали в атмосфере N2 при температуре 80°C в течение 2 ч. Реакционную смесь разбавляли CH2Cl2 (10 мл) и насыщенным водным раствором NH4Cl (10 мл). Органический слой разделяли, сушили и концентрировали. Очистка с помощью хроматографии на силикагеле путем элюирования смесью 0-100% гексаны/EtOAc и последующая очистка, элюируя смесью 0-100% вода/ацетонитрил, давала указанное в заголовке соединение в виде мутного белого масла (33 мг, 10%).
Пример 116: Получение 1-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-1-этил-3-(((3,3,3-трифторпропил)тио)метил)мочевины (соединение 990)
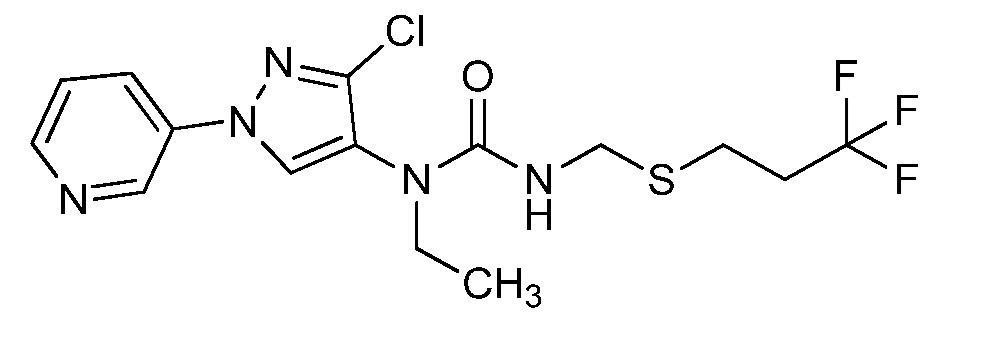
К раствору 2-((3,3,3-трифторпропил)тио)уксусной кислоты (696 мг, 3,70 ммоль) в CH2Cl2 (7,40 мл) добавляли оксалилхлорид (1,619 мл, 18,49 ммоль) вместе с каплей ДМФ при комнатной температуре. Когда добавляли ДМФ, наблюдалось выделение газа и продолжалось в течение примерно 30 мин. Реакционную смесь перемешивали при комнатной температуре в течение всего 1 ч, затем растворитель удаляли при пониженном давлении. К концентрированному продукту добавляли ацетон (18,50 мл) и реакционную смесь охлаждали до температуры 0°C на ледяной бане. К смеси добавляли по каплям раствор азида натрия (265 мг, 4,07 ммоль) в воде (1 мл). Реакционную смесь перемешивали при температуре 0°C в течение 1 ч. Реакционную смесь разбавляли водой (15 мл) и перемешивали при комнатной температуре в течение 5 мин. Добавляли дихлорметан (10 мл), и органический слой отделяли, сушили и концентрировали при пониженном давлении с получением 2-((3,3,3-трифторпропил)тио)ацетил азида в виде масла темного коричнево-зеленого масла. Добавляли сухой CH2Cl2 (4193 мкл) к сырому азиду и кипятили с обратным холодильником в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амин (140 мг, 0,629 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении и очищали с помощью хроматографии на силикагеле путем элюирования смесью 0-10% CH2Cl2/MeOH с получением указанного в заголовке соединения в виде твердого вещества светло-коричневого цвета (179 мг, 68%). Ссылка: J. Org. Chem., 2003, 68, 9453-9455.
Пример 117: Получение 3-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-5-(гидроксиметил)оксазолидин-2-она (соединение Y2148)
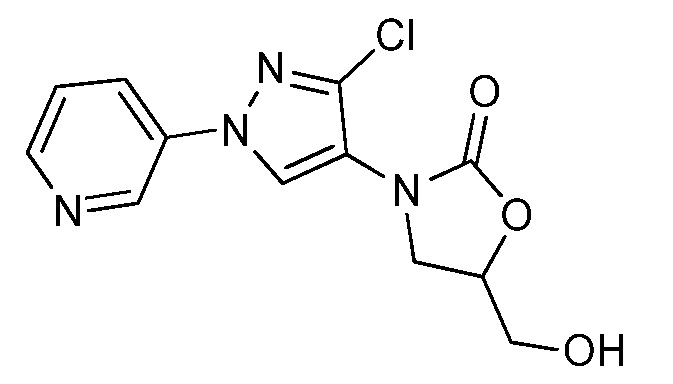
К раствору трет-бутил (3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(оксиран-2-илметил)карбамата (321 мг, 0,915 ммоль) в сухом CH2Cl2 (915 мкл) добавляли трифторуксусную кислоту (915 мкл) в атмосфере N2. Реакционную смесь перемешивали при комнатной температуре в течение 90 мин в атмосфере N2. Реакционную смесь разбавляли толуолом (10 мл) и концентрировали при пониженном давлении почти досуха. Добавляли EtOAc (5 мл) и реакцию гасили насыщенным водным раствором NaHCO3 (10 мл). Органический слой разделяли, и водный слой затем экстрагировали EtOAc (3×5 мл), сушили над MgSO4 и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде пены белого цвета (134 мг, 47%).
Пример 118: Получение N-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)карбамоил)-4-метоксибензамида (соединение Y2189)
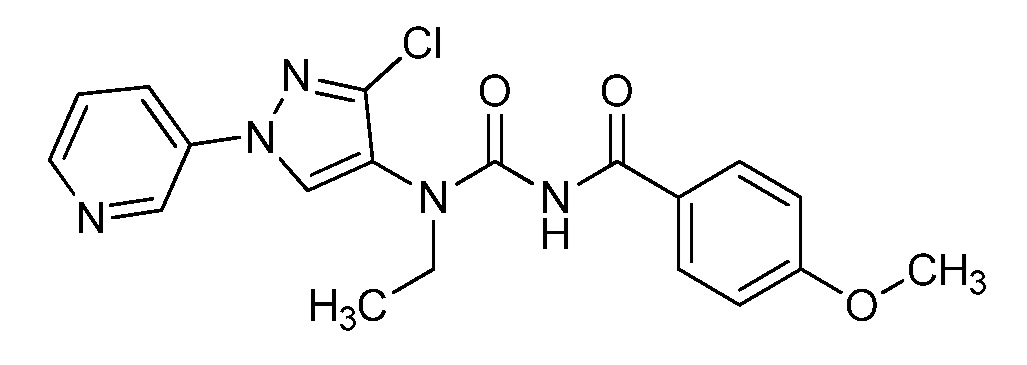
Раствор 4-метоксибензамида (61,1 мг, 0,404 ммоль) и оксалилхлорида (44,2 мкл, 0,505 ммоль) в DCE (1684 мкл) кипятили с обратным холодильником в течение 15 ч в атмосфере N2. Реакционную смесь охлаждали до комнатной температуры и добавляли 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амин (75 мг, 0,337 ммоль) и перемешивали в течение ночи при комнатной температуре. Реакционную смесь разбавляли насыщенным водным раствором NaHCO3 (5 мл) и CH2Cl2 (3 мл). Фазы разделяли, и водный слой промывали CH2Cl2 (2×3 мл). Объединенный органический слой сушили и концентрировали. Очистка с помощью хроматографии на силикагеле, элюируя смесью 15-100% гексаны/EtOAc, давала указанное в заголовке соединение в виде твердого вещества белого цвета (107 мг, 78%). Ссылка: J. Org. Chem., 1963, 73, 1805.
Пример 119: Получение 1-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-1-этилмочевина (соединение Y2186)
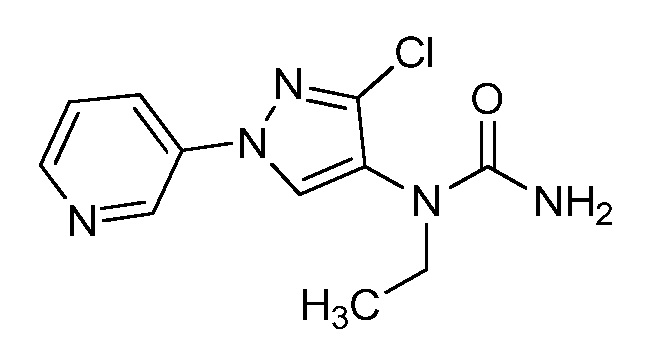
Раствор N-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)карбамоил)бензамида (300 мг, 0,811 ммоль) в сухом MeOH (2028 мкл) и 2н водном растворе NaOH (811 мкл, 1,62 ммоль) нагревали при температуре 65°C в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры и нейтрализовали с помощью 2н водной HCl, и концентрировали при пониженном давлении, что давало желтый осадок. Осадок собирали путем фильтрования, промывали гексанами (3 мл) и сушили в вакууме с получением указанного в заголовке соединения (109 мг, 48%).
Пример 120: Получение N-этил-N-(3-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил)-4-оксобутанамида (соединение Y2185)
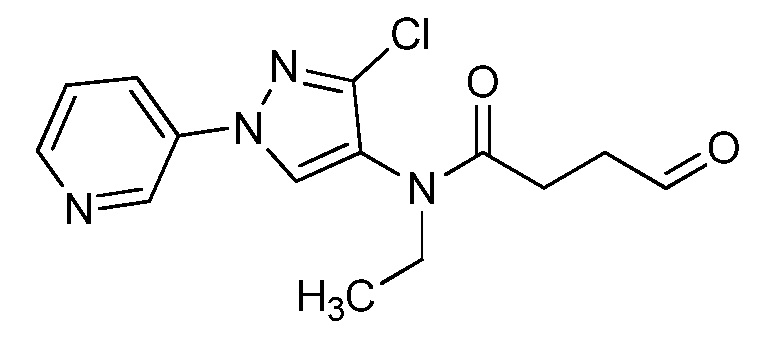
Раствор N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-4-гидроксибутанамида (41 мг, 0,133 ммоль) в сухом CH2Cl2 (1328 мкл) охлаждали до температуры 0°C на ледяной бане в атмосфере N2. Добавляли бикарбонат натрия (112 мг, 1,328 ммоль) и перйодинан Десс-Мартина (64,8 мг, 0,153 ммоль) и реакционную смесь нагревали до комнатной температуры и перемешивали в течение 5 ч. Данные ЖХМС указывали, что продукт не образовался, поэтому добавляли другую порцию перйодинана Десс-Мартина (64,8 мг, 0,153 ммоль) и перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли насыщенным водным раствором NaHCO3 (5 мл) и экстрагировали CH2Cl2 (3×5 мл). Органический слой сушили, концентрировали и очищали с помощью хроматографии на силикагеле, элюируя смесью 0-50% CH2Cl2/MeOH, с получением указанного в заголовке соединения в виде прозрачного масла (21 мг, 46%).
Пример 121: Получение 1,1,1-трифтор-7,7-диметоксигептан-4-ола
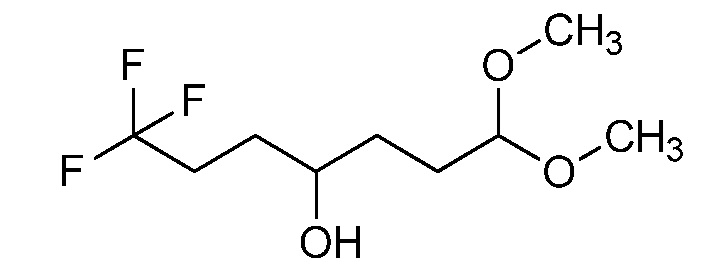
В высушенный в печи сосуд с магнитной мешалкой помещали магний (77 мг, 3,17 ммоль) и емкость сосуда продували N2. Добавляли сухой ТГФ (4957 мкл) с кристаллом I2 и нагревали с помощью струйного сушильного аппарата до выделения пузырьков на Mg. Медленно добавляли 3-бром-1,1-диметоксипропан (395 мкл, 2,97 ммоль) и нагревание с помощью струйного сушильного аппарата продолжали, при этом на Mg образовывались пузырьки, и йодная окраска исчезала. Реакционную смесь кипятили с обратным холодильником в течение 1 ч в атмосфере N2 с получением мутного бесцветного раствора. В отдельной печи сушили круглодонную колбу, помещали 4,4,4-трифторбутаналь (208 мкл, 1,983 ммоль) с сухим ТГФ (10 мл, 0,2M) и охлаждали до температуры 0°C. В течение 8 мин добавляли по каплям реактив Гриньяра комнатной температуры и перемешивали при температуре 0°C в течение 30 мин. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 1,5 ч. Реакцию гасили насыщенным водным раствором NH4Cl (15 мл) и экстрагировали CH2Cl2 (3×15 мл). Органический слой сушили, концентрировали и очищали с помощью хроматографии на силикагеле, элюируя смесью 0-10% CH2Cl2/MeOH, с получением указанного в заголовке продукта в виде прозрачного полутвердого вещества 85%-ой чистоты (372 мг, 69%): ИК (тонкая пленка) 3442 см-1; 1H ЯМР (400 МГц, CDCl3) δ 4,39 (т, J=5,2 Гц, 1H), 3,65 (ткв, J=8,2, 3,9 Гц, 1H), 3,35 (д, J=0,7 Гц, 6H), 2,40 (дд, J=4,6, 0,7 Гц, 1H), 2,39-2,24 (м, 1H), 2,24-2,06 (м, 1H), 1,80-1,72 (м, 2H), 1,72-1,59 (мультиплет, 3H), 1,52 (ддт, J=15,7, 14,2, 7,0 Гц, 1H); 19F ЯМР (376 МГц, CDCl3) δ -66,37; HRMS-FAB (m/z) [M+Na]+ вычисл. для C9H17F3NaO3, 253,1022; найдено, 253,1025.
Пример 122: Получение 7,7,7-трифтор-4-оксогептановой кислоты
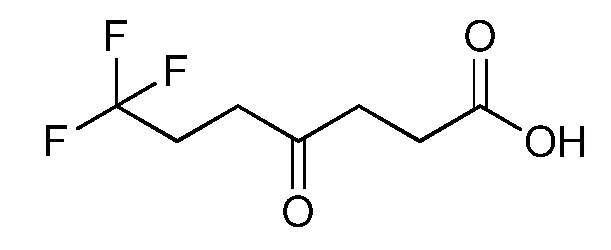
К раствору 1,1,1-трифтор-7,7-диметоксигептан-4-ола (372 мг, 1,616 ммоль) в сухом ТГФ (10,8 мл) при комнатной температуре добавляли 1н водный раствор HCl (8079 мкл, 8,08 ммоль). Реакционную смесь перемешивали в течение 1 ч, затем разбавляли водой (10 мл) и Et2O (10 мл). Органический слой отделяли, и водный слой промывали Et2O (2×10 мл). Объединенный органический слой промывали насыщенным водным раствором NaHCO3 (10 мл), сушили над MgSO4 и концентрировали. Концентрированный сырой продукт растворяли в ацетоне (5 мл) и ледяной уксусной кислоте (0,5 мл). Затем к перемешиваемому раствору добавляли по каплям KMnO4 (766 мг, 4,85 ммоль), растворенный в воде (10 мл), и перемешивали при комнатной температуре в течение 2,5 ч. Анализ ГХМС показывал неполное протекание реакции, поэтому добавляли еще KMnO4 (510 мг), и реакционную смесь оставляли перемешиваться в течение ночи при комнатной температуре. Реакционную смесь разбавляли AcOH (15 мл; 2 мл ледяной AcOH в 13 мл воды) и CH2Cl2 (10 мл). Органический слой отделяли, и водный слой экстрагировали CH2Cl2 (2×10 мл). Объединенный органический слой промывали водой (15 мл), сушили и концентрировали. Очистка с помощью хроматографии на силикагеле, элюируя смесью 0-10% CH2Cl2/MeOH, давала указанное в заголовке соединение в виде твердого вещества белого цвета (66 мг, 15%): ИК (тонкая пленка) 1715 см-1; 1H ЯМР (400 МГц, CDCl3) δ 2,81-2,72 (мультиплет, 4H), 2,69 (ддд, J=6,8, 5,5, 1,2 Гц, 2H), 2,50-2,35 (м, 2H), 1,59 (ушир. с, 1H); 19F ЯМР (376 МГц, CDCl3) δ -66,66.
Пример 123: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-7,7,7-трифтор-4-оксогептанамида (соединение Y2188)
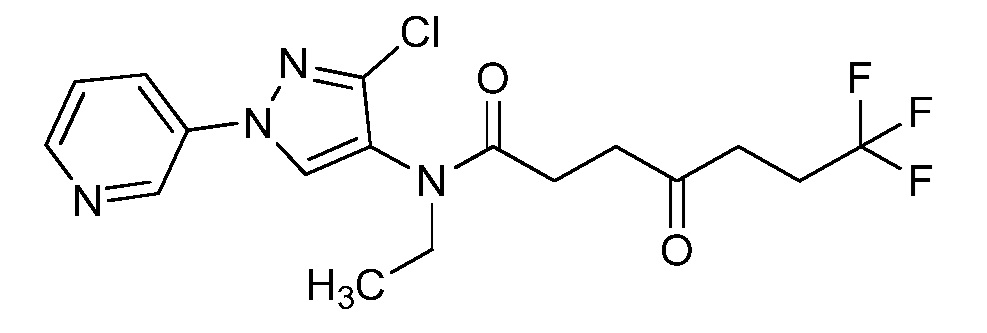
Раствор 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина (62 мг, 0,278 ммоль), 7,7,7-трифтор-4-оксогептановой кислоты (66,2 мг, 0,334 ммоль) и DMAP (51,0 мг, 0,418 ммоль) в сухом Et2O (928 мкл) охлаждали до температуры 0°C на ледяной бане в атмосфере N2. Добавляли DCC (138 мг, 0,668 ммоль) и реакционную смесь медленно нагревали до комнатной температуры. Реакционную смесь перемешивали в атмосфере N2 в течение ночи при комнатной температуре. Белый осадок отфильтровали с Et2O (1 мл), и фильтрат концентрировали. Очистка с помощью хроматографии на силикагеле, элюируя смесью 0-75% гексаны/EtOAc, давала указанный в заголовке продукт в виде вязкого масла коричневого цвета (59 мг, 50%).
Пример 124: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-гидроксипропанамида
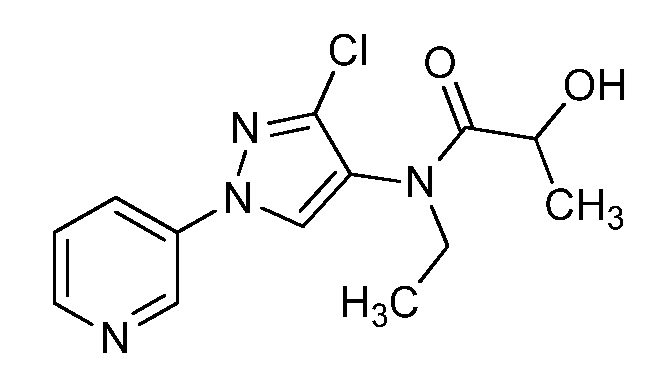
К раствору 1-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-1-оксопропан-2-ил ацетата (2,4 г, 7,1 ммоль) в метаноле (8,9 мл) и тетрагидрофуране (8,9 мл) добавляли 2M гидроксид лития (7,1 мл, 14,2 ммоль). Реакционную смесь перемешивали в течение 2 часов при температуре 25°C. Затем pH реакционной смеси делали нейтральным путем добавления 2M HCl. Смесь экстрагировали этилацетатом, и органические части объединяли, сушили над MgSO4, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения в виде твердого вещества белого цвета (1,85 г, 88%): т. пл. 137-138°C; 1H ЯМР (400 МГц, ДМСО) δ 9,08 (д, J=2,5 Гц, 1H), 8,98 (с, 1H), 8,58 (дд, J=4,7, 1,1 Гц, 1H), 8,23 (ддд, J=8,4, 2,6, 1,3 Гц, 1H), 7,59 (дд, J=8,3, 4,7 Гц, 1H), 4,97 (д, J=7,6 Гц, 1H), 4,08 (м, 1H), 3,57 (д, J=50,6 Гц, 2H), 1,10 (д, J=6,5 Гц, 3H), 1,07 (т, J=7,1 Гц, 3H); ESIMS m/z 295,6 ([M+H]+).
Пример 125: 1-((3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-1-оксопропан-2-ил метансульфонат (соединение Y2008)
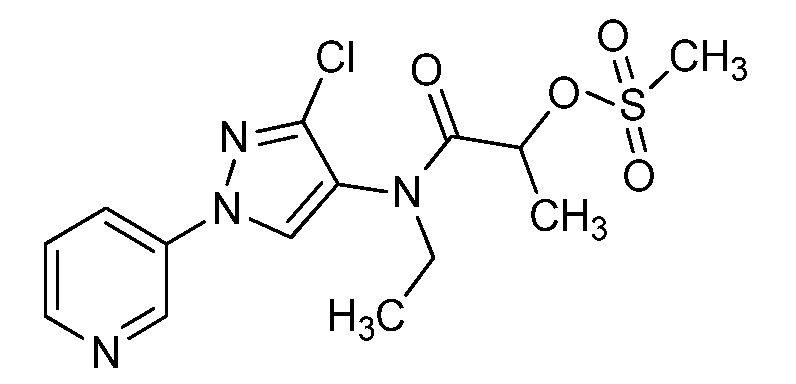
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-гидроксипропанамида (100 мг, 0,34 ммоль) в тетрагидрофуране (1,1 мл) добавляли гидрид натрия (14,9 мг, 0,34 ммоль). Смесь перемешивали в течение 15 мин и затем добавляли метансульфонилхлорид (58,3 мг, 0,51 ммоль). Реакционную смесь перемешивали в течение 16 часов, разбавляли CH2Cl2 и промывали водой. Фазы разделяли, сушили, концентрировали в вакууме и очищали с помощью хроматографии на силикагеле, элюируя смесью 0-70% ацетон в гексане, с получением указанного в заголовке соединения в виде масла светло-желтого цвета (88 мг, 70%): ИК (тонкая пленка) 2980, 2936, 1676 см-1; 1H ЯМР (400 МГц, CDCl3) δ 9,00 (д, J=2,5 Гц, 1H), 8,64 (дд, J=4,8, 1,4 Гц, 1H), 8,12 (с, 1H), 8,02 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,46 (ддд, J=8,3, 4,8, 0,6 Гц, 1H), 5,17 (кв, J=6,7 Гц, 1H), 3,71 (м, 2H), 3,13 (с, 3H), 1,50 (д, J=6,7 Гц, 3H), 1,19 (т, J=7,2 Гц, 3H); ESIMS m/z 373,6 ([M+H]+).
Пример 126: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-((3,3-дифторциклобутил)тио)-N-этилпропанамида (соединение 910)
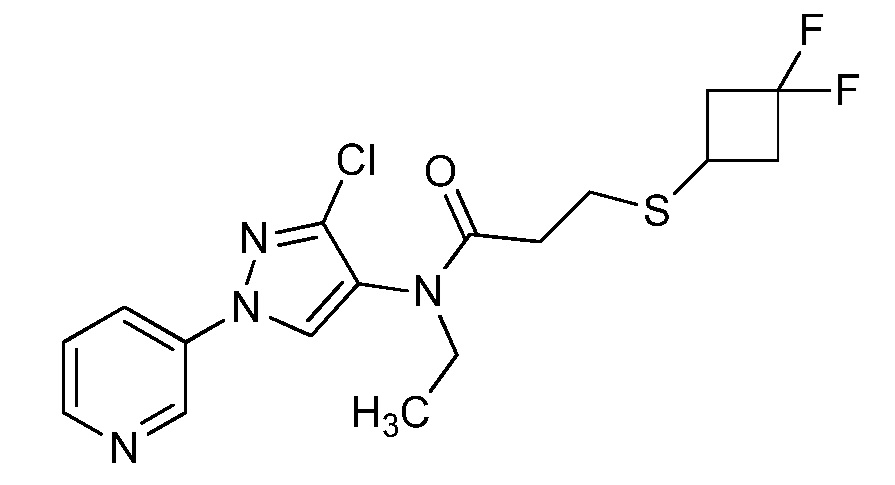
N-(3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((3-оксоциклобутил)тио)пропанамид (100 мг, 0,264 ммоль) растворяли в CH2Cl2 (2 мл) и перемешивали при температуре 0°C. К раствору при температуре 0°C добавляли Deoxofluor® (0,083 мл, 0,449 ммоль) и EtOH (2,312 мкл, 0,040 ммоль). Полученный раствор медленно нагревали до температуры 25°C и перемешивали при температуре 25°C. По прошествии 4 часов добавляли еще 1 эквивалент Deoxofluor® (50 мкл) и дополнительно 2,5 мкл EtOH. Реакционную смесь обрабатывали путем медленного добавления водного раствора NaHCO3 и перемешивали в течение 30 мин при температуре 25°C. Смесь разбавляли водой (20 мл) и экстрагировали CH2Cl2 (3×20 мл). Объединенный органический слой промывали 0,01 M HCl, сушили над Na2SO4 и очищали посредством хроматографии на силикагеле (0-100% EtOAc/гексан) с получением указанного в заголовке соединения в виде масла светло-желтого цвета (19 мг, 18%).
Пример 127: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(винилсульфинил)пропанамида (соединение 1004)
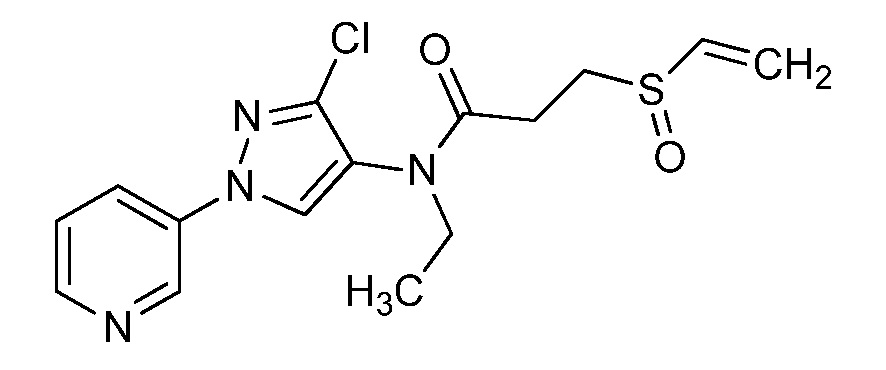
В 7-мл пробирку добавляли N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-меркаптопропанамид (0,050 г, 0,161 ммоль), 1,2-дибромэтан (0,907 г, 4,83 ммоль), затем 1,8-диазабицикло[5,4,0]ундец-7-ен (DBU) (0,024 г, 0,161 ммоль). Раствор перемешивали при температуре 25°C в течение ночи, затем концентрировали и вновь растворяли в гексафторизопропаноле (1 мл). Добавляли пероксид водорода (0,055 г, 0,483 ммоль) и раствор перемешивали при температуре 25°C в течение 2 часов, затем обрабатывали раствором сульфита натрия и экстрагировали CH2Cl2. Сырую реакционную смесь очищали с помощью хроматографии на силикагеле (0-10% MeOH/CH2Cl2) с получением указанного в заголовке соединения в виде масла коричневого цвета (33 мг, 58%).
Пример 128: Получение 3-(N-карбамоил-S-метилсульфонимидоил)-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этилпропанамида (соединение Y2099)
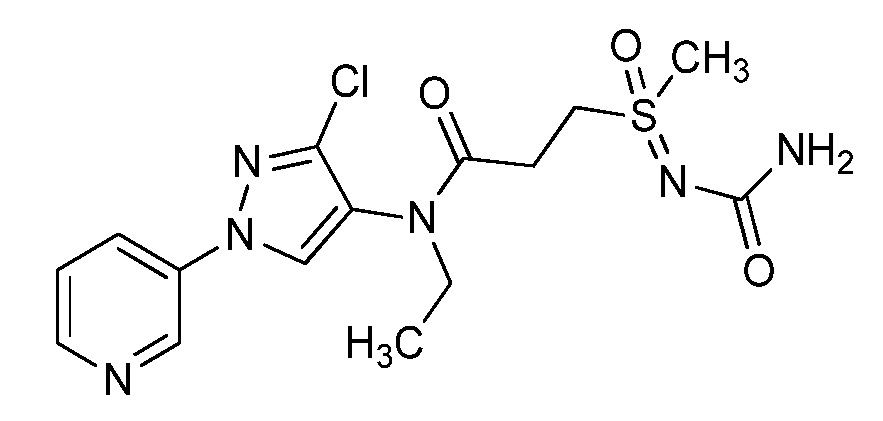
N-[3-Хлор-1-(3-пиридил)пиразол-4-ил]-3-(N-циано-S-метил-сульфонимидоил)-N-этил-пропанамид (320 мг, 0,840 ммоль) растворяли в концентрированной серной кислоте (4 мл, 75 ммоль) и перемешивали при температуре 25°C в течение 16 ч. Раствор выливали в сосуд со льдом и медленно добавляли твердый NaHCO3 до тех пор, пока водный слой не становился нейтральным. Водный слой экстрагировали CH2Cl2, и объединенные органические слои сушили над Na2SO4 и концентрировали. Сырую реакционную смесь очищали с помощью хроматографии на силикагеле (0-10% MeOH/CH2Cl2) с получением указанного в заголовке соединения в виде твердого вещества белого цвета (135 мг, 40%).
Пример 129: Получение 4-хлор-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)бутанамида (соединение Y2166)
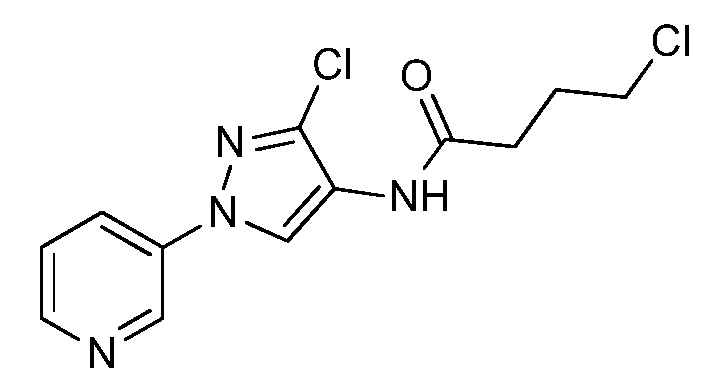
К раствору 3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-амина (1,34 г, 6,89 ммоль) в CH2Cl2 (11 мл), охлажденному до температуры 0°C, добавляли триэтиламин (1,439 мл, 10,33 ммоль) и 4-хлорбутаноил хлорид (0,971 г, 6,89 ммоль). Раствору давали медленно нагреться до температуры 25°C и перемешивали в течение 1 ч. Реакционную смесь разбавляли водой (20 мл) и экстрагировали CH2Cl2 (3×20 мл). Объединенные органические слои сушили, концентрировали и очищали посредством хроматографии (0-100% EtOAc/гексан) с получением указанного в заголовке соединения в виде твердого вещества белого цвета (1,87 г, 91%).
Пример 130: Получение 1-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)пирролидин-2-она (соединение Y2167)
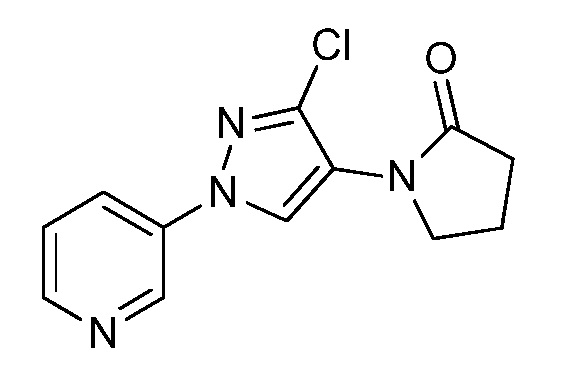
Раствор 4-хлор-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)бутанамида (1,82 г, 6,08 ммоль) в ТГФ (50 мл) охлаждали до температуры 0°C. Добавляли NaH (0,280 г, 7,00 ммоль) и смесь медленно нагревали до температуры 25°C и перемешивали в течение 2 ч. Смесь разбавляли водой и экстрагировали CH2Cl2 (3×20 мл). Объединенные органические слои сушили, концентрировали и очищали посредством хроматографии на силикагеле (0-10% MeOH/CH2Cl2) с получением указанного в заголовке соединения в виде твердого вещества желтого цвета (1,70 г, 96%).
Пример 131: Получение 1-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-метиленпирролидин-2-она (соединение Y2168)
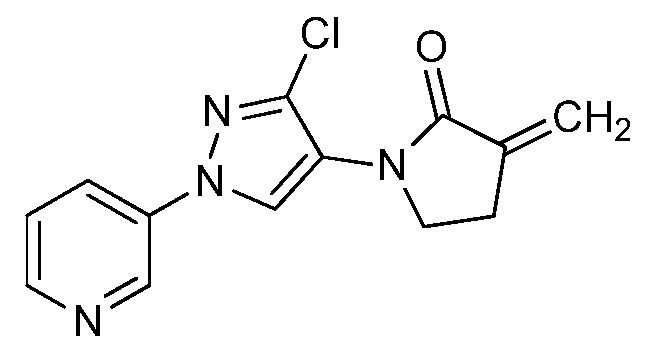
Раствор 1-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)пирролидин-2-она (1600 мг, 6,09 ммоль) в CH2Cl2 (15 мл) охлаждали до температуры 0°C. Добавляли триэтиламин (1,273 мл, 9,14 ммоль) и триметилсилил трифторметансульфонат (1,431 мл, 7,92 ммоль), и полученный раствор глубокого красного цвета перемешивали при температуре 0°C в течение 45 мин. Затем добавляли соль Эшенмозера (диметилметилиденаммоний йодид) (1465 мг, 7,92 ммоль), и раствору давали нагреться до температуры 25°C и перемешивали в течение ночи. Раствор разбавляли CH2Cl2 (30 мл) и добавляли 1н HCl (30 мл), и смесь перемешивали в течение 10 мин, затем нейтрализовали с помощью водного раствора NaOH до pH=12. Смесь экстрагировали CH2Cl2, и объединенные органические слои сушили, концентрировали и очищали посредством хроматографии на силикагеле (0-10% MeOH/CH2Cl2) с получением указанного в заголовке соединения в виде твердого вещества светло-желтого цвета (866 мг, 52%).
Пример 132: Получение 1-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-((метилтио)метил)пирролидин-2-она (соединение 955)
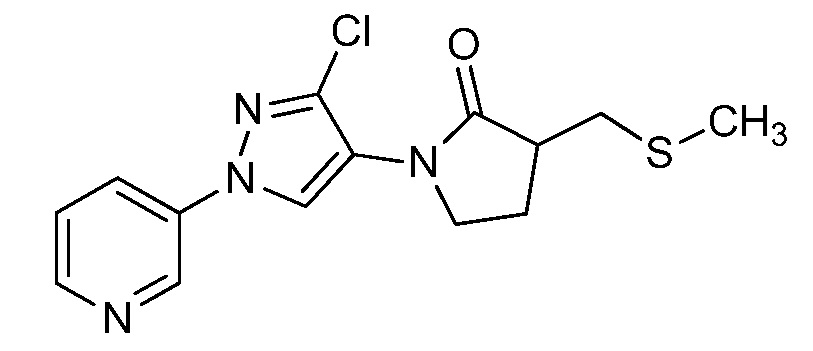
1-(3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-метиленпирролидин-2-он (400 мг, 1,46 ммоль) растворяли в ТГФ (6 мл). К смеси добавляли гидроксид калия (384 мг, 5,82 ммоль), растворенный в воде (1 мл), затем S,S-диметил карбонодитиоат (125 мг, 1,019 ммоль). Смесь нагревали при кипячении с обратным холодильником в течение 3 часов, затем разбавляли водой (20 мл) и экстрагировали CH2Cl2 (3×20 мл). Объединенные органические слои сушили и концентрировали, и сырую смесь очищали с помощью хроматографии на силикагеле (0-10% MeOH/CH2Cl2) с получением указанного в заголовке соединения в виде твердого вещества белого цвета (385 мг, 82%).
Пример 133: Получение метил 2-циклобутилиденацетата
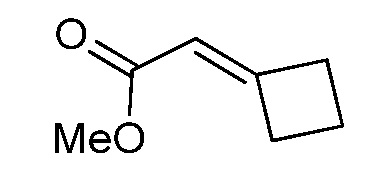
В 250-мл круглодонную колбу помещали метил 2-(трифенилфосфоранилиден)ацетат (12,04 г, 36 ммоль) и бензол (90 мл). Добавляли циклобутанон (5,05 г, 72,0 ммоль), и раствор нагревали при кипячении с обратным холодильником в течение 2 дней. Реакционную смесь охлаждали и добавляли гексан (70 мл). Белый осадок отфильтровали, и раствор концентрировали и очищали с помощью хроматографии на силикагеле с получением указанного в заголовке соединения в виде бесцветного масла (3,22 г, 71%): ИК (тонкая пленка) 1714 см-1; 1H ЯМР (400 МГц, CDCl3) δ 5,60 (т, J=2,3 Гц, 1H), 3,68 (с, 3H), 3,13 (дддд, J=9,0, 4,5, 2,2, 1,1 Гц, 2H), 2,90-2,76 (м, 2H), 2,09 (тт, J=11,4, 5,8 Гц, 2H); 13C ЯМР (101 МГц, CDCl3) δ 167,92, 166,95, 111,93, 50,79, 33,71, 32,32, 17,62.
Пример 134: Получение 2-циклобутилиденуксусной кислоты
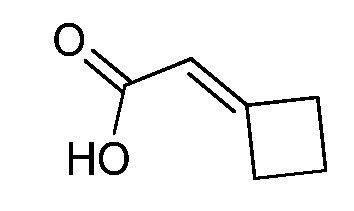
К раствору метил 2-циклобутилиденацетата (100 мг, 0,793 ммоль) в MeOH (1,00 мл), перемешиваемому при комнатной температуре, добавляли 2н водный раствор LiOH (полученный из гидрата гидроксида лития (100 мг, 2,378 ммоль) и воду (1 мл)). Смесь перемешивали при температуре 25°C в течение ночи, затем обрабатывали путем добавления 2н HCl и экстрагировали CH2Cl2. Объединенный органический слой сушили с получением твердого вещества белого цвета, которое очищали с помощью хроматографии на силикагеле (0-70% EtOAc/гексан) с получением указанного в заголовке соединения в виде твердого вещества белого цвета (20 мг, 23%): ИК (тонкая пленка) 2923, 1647 см-1; 1H ЯМР (400 МГц, CDCl3) δ 10,89 (с, 1H), 5,60 (дд, J=4,3, 2,1 Гц, 1H), 3,38-3,02 (м, 2H), 2,97-2,71 (м, 2H), 2,10 (дкв, J=15,9, 8,0 Гц, 2H); 13C ЯМР (101 МГц, CDCl3) δ 172,35, 171,33, 112,13, 34,10, 32,58, 17,56.
Пример 135: Получение 3-((3,3,3-трифторпропил)тио)пропановой кислоты
3-Меркаптопропановую кислоту (3,2 г, 30,1 ммоль) растворяли в MeOH (20 мл) и перемешивали при комнатной температуре. К раствору добавляли порошкообразный гидроксид калия (3,72 г, 66,3 ммоль), затем 3-бром-1,1,1-трифторпропан (6,14 г, 34,7 ммоль). Раствор затем перемешивали при температуре 65°C в течение 3 ч и затем реакцию гасили с помощью 1н HCl до установления кислого pH раствора. Смесь экстрагировали CH2Cl2 (3×30 мл), и объединенные органические фазы сушили, концентрировали и очищали с помощью хроматографии на силикагеле (0-50% EtOAc/гексан) с получением указанного в заголовке соединения в виде бесцветного масла, смешанного с некоторым количеством суспензии белого цвета (5,5 г, 90%): ИК (тонкая пленка) 2936, 1708 см-1; 1H ЯМР (300 МГц, CDCl3) δ 2,86-2,78 (м, 2H), 2,78-2,58 (м, 4H), 2,52-2,25 (м, 2H); EIMS m/z 202.
Пример 136: Получение N-[3-хлор-1-(3-пиридил)пиразол-4-ил]-3-[3-[[3-хлор-1-(3-пиридил)пиразол-4-ил]метиламино]-3-оксо-пропил]сульфанил-N-этил-2-метил-пропанамида (соединение 790)
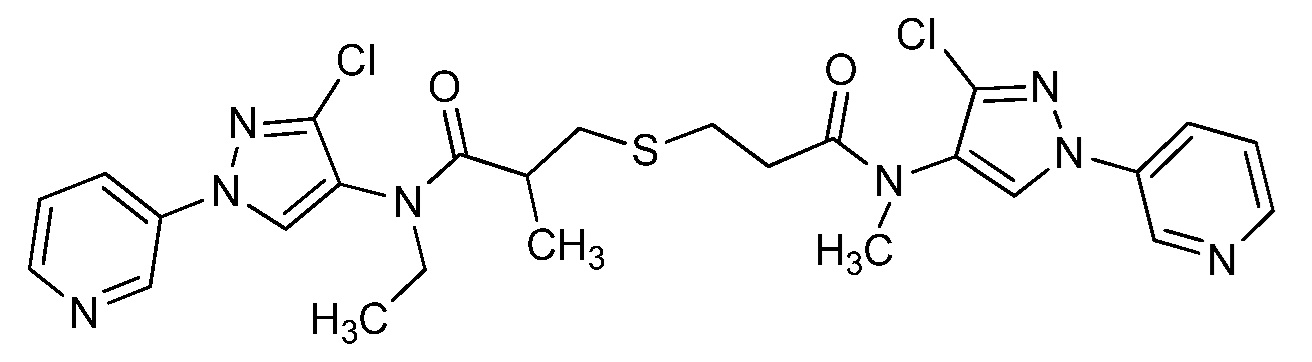
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метил-3-меркаптопропанамида (100 мг, 0,308 ммоль) и 3-хлор-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-метилпропанамида (100 мг, 0,334 ммоль) в ДМФ (1 мл) добавляли гидрид натрия (60%-ая дисперсия в масле, 15 мг, 0,375 ммоль). Смесь перемешивали при комнатной температуре в течение 18 ч и разбавляли водой и CH2Cl2. Органическую фазу отделяли, сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением масла оранжевого цвета. Данное масло очищали с помощью хроматографии, элюируя смесями метанола и метиленхлорида, с получением указанного в заголовке соединения в виде масла желтого цвета (120 мг, 66%).
Пример 137: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-((2-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(метил)амино)-2-оксоэтил)тио)-N-этилпропанамида (соединение 789)
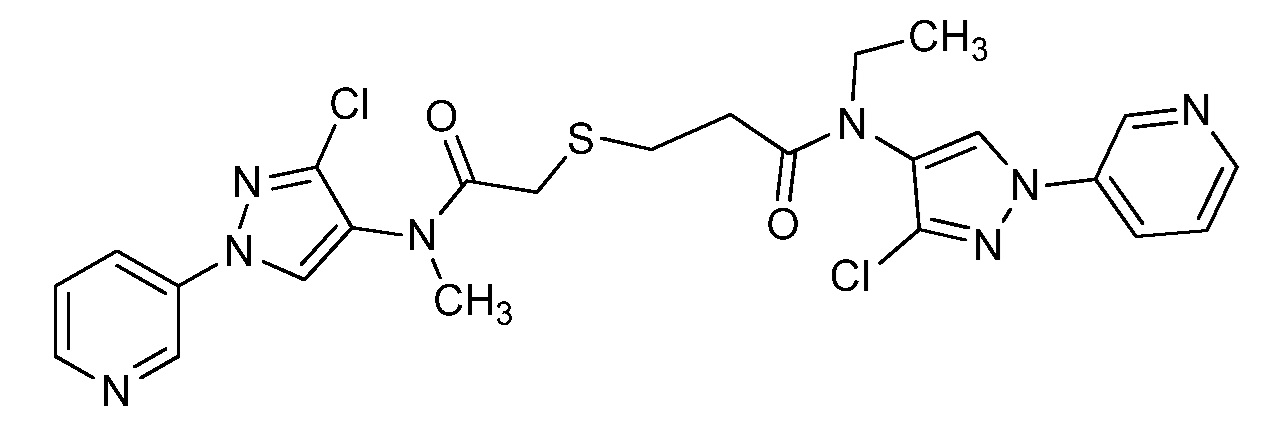
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-меркаптопропанамида (100 мг, 0,322 ммоль) в ДМСО (1 мл) добавляли гидрид натрия (60%-ая дисперсия в масле, 15 мг, 0,375 ммоль). Добавляли свежеполученный 2-хлор-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-метилацетамид (150 мг, 0,526 ммоль) и смесь оставляли стоять в течение одного часа, изредка встряхивая с завихрением. Реакционную смесь разбавляли насыщенным бикарбонатом натрия и Et2O. К органической фазе добавляли аммиак в MeOH (7 M, 1 мл, 1 ммоль), затем Na2SO4. После стояния в течение 10 минут смесь фильтровали и концентрировали в вакууме с получением масла оранжевого цвета. Масло очищали с помощью хроматографии на силикагеле, элюируя смесями метанола и CH2Cl2, с получением указанного в заголовке соединения в виде масла оранжевого цвета (120 мг, 66%).
Пример 138: Получение трет-бутил ((1R,4S)-4-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(метил)карбамоил)циклопент-2-ен-1-ил)карбамата
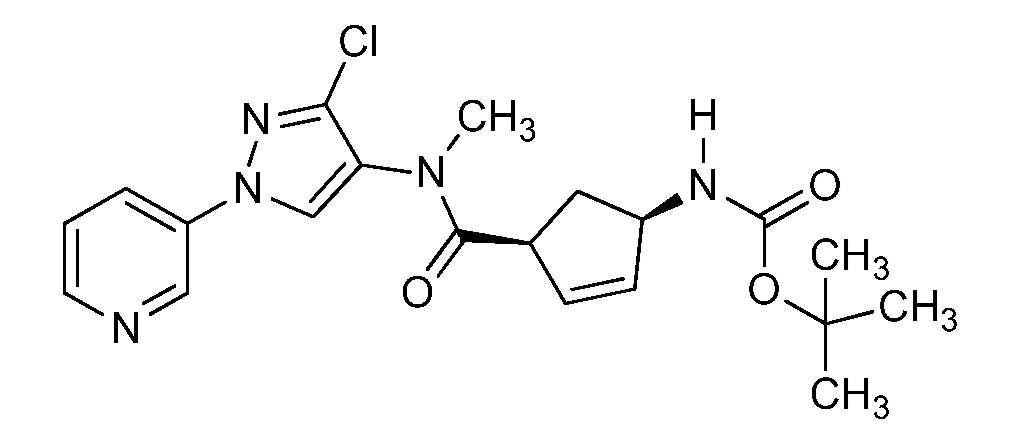
Раствор 3-хлор-N-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина (200 мг, 0,96 ммоль) в ТГФ (10 мл) охлаждали до температуры -78°C. Добавляли литий бис(триметилсилил)амид (1 мл, 1,00 ммоль, 1M раствор в гексане), и раствор перемешивали при температуре -78°C в течение 15 минут. К раствору при температуре -78°C одной порцией добавляли раствор (1R,4S)-трет-бутил 3-оксо-2-азабицикло[2.2.1]гепт-5-ен-2-карбоксилата (201 мг, 0,96 ммоль), растворенный в ТГФ (3 мл). После перемешивания в течение 1 часа при температуре -78°C охлаждающую баню отставляли, и реакционную смесь нагревали при температуре 20°C. После перемешивания в течение еще пяти минут к раствору добавляли уксусную кислоту (0,1 мл). Реакционную смесь концентрировали и очищали посредством хроматографии на силикагеле с использованием подвижной фазы гексанов и этилацетата с получением указанного в заголовке соединения в виде твердого вещества белого цвета (250 мг, 59%): 1H ЯМР (400 МГц, CDCl3) δ 9,01-8,93 (д, J=2,8 Гц, 1H), 8,66-8,60 (м, 1H), 8,11-8,02 (м, 2H), 7,52-7,42 (м, 1H), 5,93-5,85 (м, 1H), 5,72-5,66 (м, 1H), 5,53-5,44 (д, J=9,5 Гц, 1H), 4,80-4,67 (м, 1H), 3,58-3,47 (м, 1H), 3,30-3,21 (с, 3H), 2,35-2,22 (м, 1H), 1,90-1,80 (м, 1H), 1,51-1,34 (с, 9H); 13C ЯМР (101 МГц, CDCl3) δ 175,26, 155,23, 148,70, 140,31, 140,00, 135,61, 135,18, 130,99, 126,34, 125,92, 125,78, 124,12, 79,04, 55,69, 47,33, 37,49, 35,55, 28,45; ESIMS m/z 418 [M+H]+, 416 ([M-H]-).
Пример 139: Получение 2,2,2-трифторацетата (1S,4R)-4-амино-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-метилциклопент-2-енeкарбоксамида
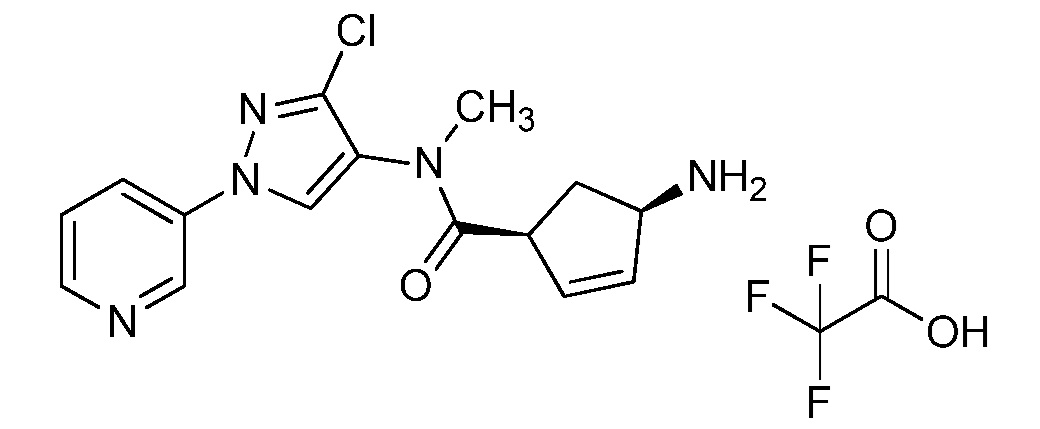
К раствору трет-бутил ((1R,4S)-4-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(метил)карбамоил)циклопент-2-ен-1-ил)карбамата (130 мг, 0,31 ммоль) в CH2Cl2 (4 мл) добавляли трифторуксусную кислоту (4 мл). Реакционную смесь оставляли стоять в течение 20 минут, изредка встряхивая с завихрением. Реакционную смесь концентрировали в вакууме при температуре 40°C, что приводило к выделению указанного в заголовке соединения в виде прозрачного масла (130 мг, 94%): 1H ЯМР (400 МГц, CD3OD) δ 9,02 (дд, J=2,7, 0,7 Гц, 1H), 8,70 (с, 1H), 8,54 (дд, J=5,0, 1,4 Гц, 1H), 8,30 (ддд, J=8,4, 2,7, 1,4 Гц, 1H), 7,63 (ддд, J=8,4, 5,0, 0,7 Гц, 1H), 6,09 (ддд, J=5,6, 2,7, 1,0 Гц, 1H), 5,92 (дт, J=5,6, 2,1 Гц, 1H), 4,16 (д, J=7,7 Гц, 1H), 3,80-3,72 (м, 1H), 2,98 (с, 3H), 2,29 (дт, J=14,3, 7,9 Гц, 1H), 2,01 (дт, J=14,3, 2,5 Гц, 1H); 13C ЯМР (101 МГц, CDCl3) δ 179,16, 163,52 (кв, J=19 Гц), 145,04, 142,05, 141,15, 137,81, 136,71, 134,11, 134,06, 132,73, 131,26, 129,77, 119,49 (кв, J=289 Гц), 59,80, 51,85, 40,50, 36,87; ESIMS m/z 318 ([M+H]+).
Пример 140: Получение (1S,4R)-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-метил-4-(метилсульфонамидо)циклопент-2-енкарбоксамида (соединение Y2054)
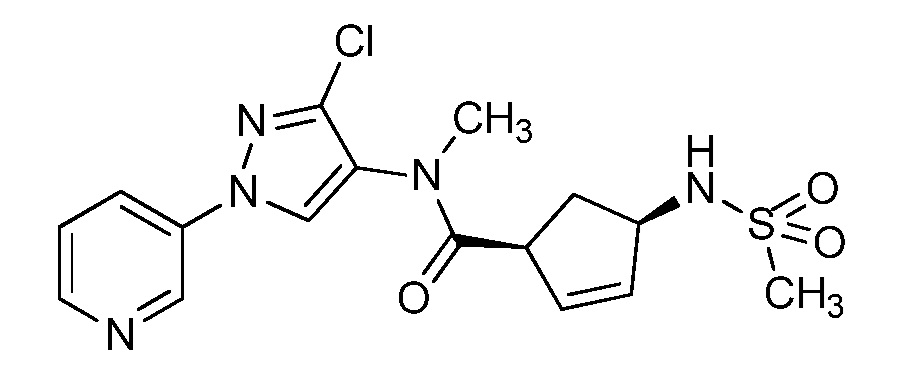
К раствору 2,2,2-трифторацетата (1S,4R)-4-амино-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-метилциклопент-2-енкарбоксамида (541 мг, 1,25 ммоль), растворенного в CH2Cl2 (15 мл), добавляли триэтиламин (0,380 мг, 3,76 ммоль), затем метансульфонилхлорид (215 мг, 1,88 ммоль). После перемешивания в течение 24 часов реакционную смесь разбавляли насыщенным водным раствором бикарбоната натрия (15 мл) и фазы разделяли. Органический слой сушили с помощью безводного сульфата натрия, фильтровали и концентрировали. Полученный остаток очищали с помощью хроматографии на силикагеле с использованием метанола и CH2Cl2, что приводило к выделению указанного в заголовке соединения в виде пены белого цвета (319 мг, 64%).
Пример 141: Получение (1S,3R)-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-метил-3-(метилсульфонамидо)циклопентанкарбоксамида (соединение Y2092)
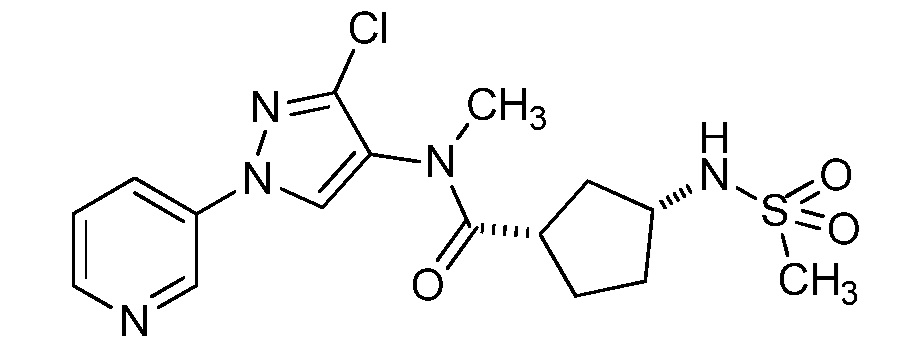
Раствор 2,2,2-трифторацетата (1R,4S)-4-амино-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-метилциклопент-2-енкарбоксамида (60 мг, 0,15 ммоль) в метаноле (1,5 мл) пропускали через проточный реактор H-Cube® для непрерывного гидрирования, снабженный 10% Pd/C картриджем (полный H2, 25°C, скорость потока 1 мл/мин). Полученный раствор концентрировали и очищали с помощью хроматографии на силикагеле с использованием метанола и CH2Cl2 в виде подвижной фазы с получением указанного в заголовке соединения в виде твердого вещества белого цвета (16 мг, 24%).
Пример 142: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(1H-тетразол-5-ил)-N-этилпропанамида (соединение Y2178)
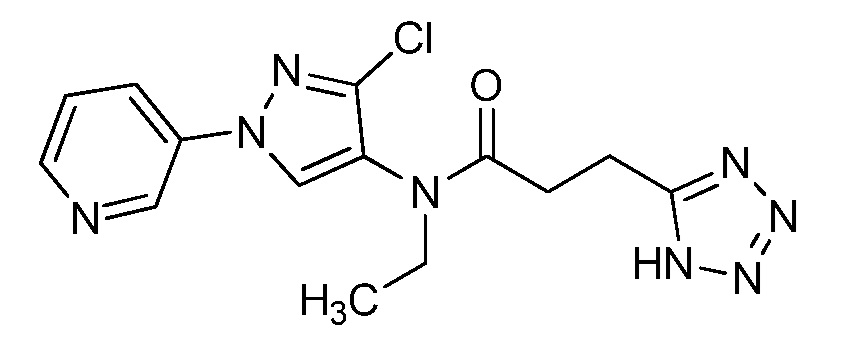
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-циано-N-этилпропанамида (0,176 г, 0,579 ммоль) в толуоле (5,79 мл) при комнатной температуре и в атмосфере N2 добавляли азидотриметилсилан (0,154 мл, 1,159 ммоль) и дибутилстаннанон (0,014 г, 0,058 ммоль). Реакционный сосуд снабжали обратным холодильником и нагревали при температуре 110°C. Реакционную смесь оставляли перемешиваться при той же температуре в течение 24 ч, и в этот момент анализ СВЭЖХ-МС показал почти полное превращение в продукт желаемой массы. Реакционную смесь охлаждали, разбавляли (медленно) MeOH (20 мл) и концентрировали в вакууме с получением масла коричневого цвета. Остаток абсорбировали на Целите и очищали посредством обращенно-фазовой флэш-хроматографии (от 0 до 100% CH3CN/H2O) с получением желаемого продукта в виде стеклообразного твердого вещества бледно-коричневого цвета (49 мг, 24%).
Пример 143: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((3,3,3-трифтор-2-метилпропил)тио)пропанамида (соединение 919)
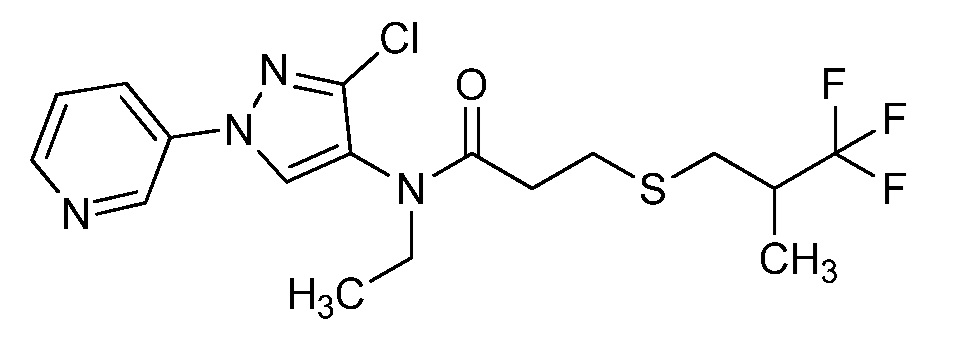
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((2-(трифторметил)аллил)тио)пропанамида (0,056 г, 0,134 ммоль) в DME (2,5 мл) и воде (0,5 мл) добавляли 4-метилбензолсульфонoгидразид (0,249 г, 1,337 ммоль) и ацетат натрия (0,110 г, 1,337 ммоль). Реакционную смесь нагревали при температуре 90°C и перемешивали в течение 1,5 ч. Анализ СВЭЖХ-МС свидетельствовал о ~30% конверсии в продукт желаемой массы. Реакционную смесь перемешивали при температуре 90°C в течение еще 1,5 ч, и в этот момент анализ СВЭЖХ-МС показал ~75% превращение в продукт желаемой массы. Реакционную смесь охлаждали и добавляли еще 5 эквивалентов обоих, гидразида и ацетата натрия. Реакционную смесь опять нагревали при температуре 90°C и перемешивали в течение еще 2 ч. Анализ СВЭЖХ-МС свидетельствовал только о незначительном количестве исходных продуктов. Поэтому добавляли дополнительные 5 эквивалентов обоих, гидразида и ацетата натрия. Реакционную смесь перемешивали при температуре 90°C в течение дополнительных 3 ч. Реакционную смесь охлаждали, разбавляли EtOAc (10 мл) и промывали водой (2×5 мл) и насыщенным солевым раствором (1×5 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением масла желтого цвета. Сырой остаток очищали посредством нормальной фазовой флэш-хроматографии (от 0 до 100% EtOAc/CH2Cl2) с получением желаемого продукта в виде масла бледно-желтого цвета (46 мг, 79%).
Пример 144: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-(винилтио)пропанамида (соединение 787)
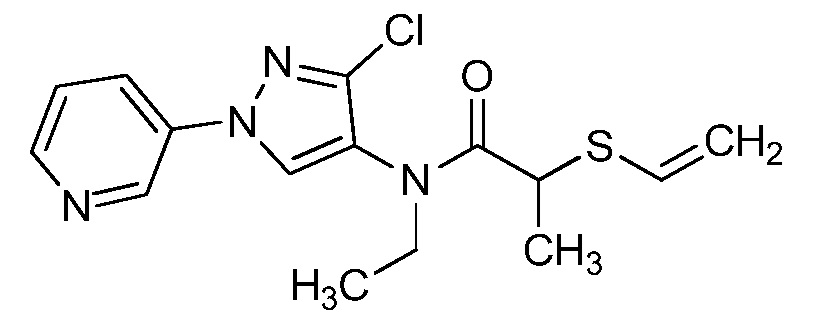
В сухую круглодонную колбу в атмосфере N2 помещали гидрид натрия (0,043 г, 1,063 ммоль, 60%-ная дисперсия в минеральном масле) и ТГФ (2,126 мл), затем метанол (0,086 мл, 2,126 ммоль). Реакционную смесь оставляли перемешиваться при комнатной температуре до прекращения наблюдаемого выделения газа (~45 мин). Реакционную смесь затем охлаждали до температуры 0°C и добавляли S-(1-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-1-оксопропан-2-ил)этантиоат (0,150 г, 0,425 ммоль) в ТГФ (2,126 мл). Реакционную смесь нагревали при комнатной температуре и перемешивали в течение 30 мин. Реакционную смесь опять охлаждали до температуры 0°C и добавляли 1-фтор-2-йодэтан (0,104 мл, 1,275 ммоль) в ТГФ (2,126 мл). Реакционную смесь нагревали при комнатной температуре и перемешивали в течение ночи. Реакционную смесь разбавляли в EtOAc (5 мл) и гасили H2O (1 мл). Слои разделяли, и водный слой экстрагировали EtOAc (3×10 мл). Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением масла коричневого цвета. Сырой остаток очищали посредством флэш-хроматографии (25-80% EtOAc/гексаны) с получением желаемого продукта в виде непрозрачного масла (29 мг, 20%).
Пример 145: Получение (E)-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((3,3,3-трифторпроп-1-ен-1-ил)тио)пропанамида (соединение 890)
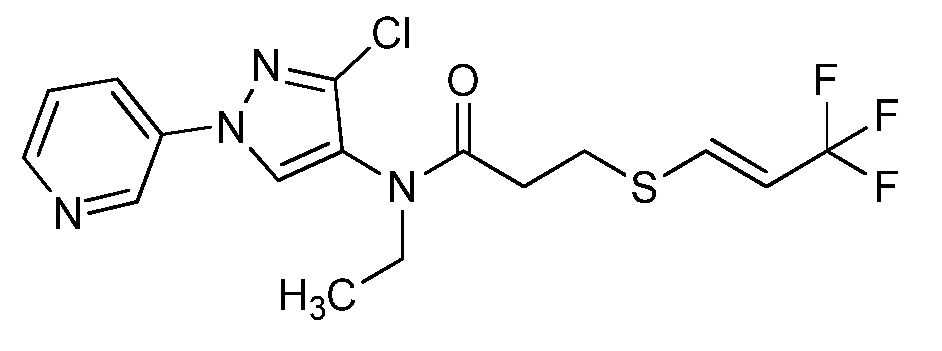
В высушенный в печи сосуд для микроволнового облучения в атмосфере N2 помещали диоксан (0,241 мл), Cu2O (3,45 мг, 0,024 ммоль), KOH (0,0l54 г, 0,965 ммоль), (E)-1-бром-3,3,3-трифторпроп-1-ен (0,563 мл, 4,83 ммоль) и N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-меркаптопропанамид (0,150 г, 0,483 ммоль), последовательно. Реакционную смесь герметически закрывали и помещали в микроволновой реактор Biotage® Initiator в течение 3 ч при температуре 110°C, с контролем внешней температуры ИК-датчиком на боку сосуда. В течение этого времени реакционную смесь преобразовывалась из густой смеси желтого цвета в смесь черного цвета. Гетерогенную смесь охлаждали до комнатной температуры и разбавляли EtOAc (20 мл). Смесь фильтровали через слой из целита (промывка EtOAc), и фильтрат концентрировали в вакууме с получением масла темно-коричневого цвета. Сырой остаток очищали посредством нормальной фазовой флэш-хроматографии (от 0 до 100% EtOAc/CH2Cl2) с получением желаемого продукта в виде масла бледно-желтого цвета (71 мг, 35%). Ссылка: Kao, H.-L.; Lee, C.-F. Org. Lett. 2011, 13, 5204-5207.
Пример 146: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(метилсульфонамидо)пропанамида (соединение Y2145)
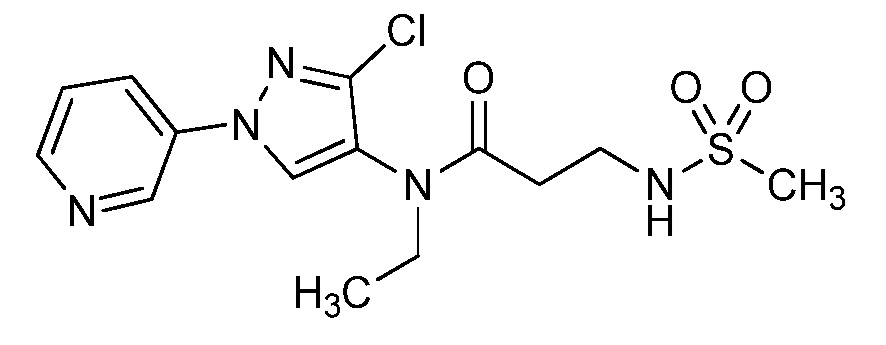
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этилакриламида (0,538 г, 1,944 ммоль) в ДМФ (19,44 мл) при комнатной температуре добавляли K2CO3 (0,672 г, 4,86 ммоль) и метансульфонамид (0,277 г, 2,92 ммоль). Реакционный сосуд снабжали обратным холодильником и нагревали при температуре 80°C. После перемешивания в течение 1 ч реакционную смесь охлаждали до комнатной температуры и разбавляли EtOAc (50 мл) и водой (50 мл). Слои энергично смешивали в течение 2 мин и затем разделяли. Водную фазу экстрагировали EtOAc (3×50 мл), и объединенные органические экстракты промывали насыщенным солевым раствором (3×100 мл), сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением прозрачного масла. Сырой остаток очищали посредством нормальной фазовой флэш-хроматографии (от 0 до 30% MeOH/EtOAc) с получением желаемого продукта в виде прозрачного полутвердого вещества (524 мг, 69%).
Пример 147: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(N-(цианометил)метилсульфонамидо)-N-метилпропанамида (соединение 803)
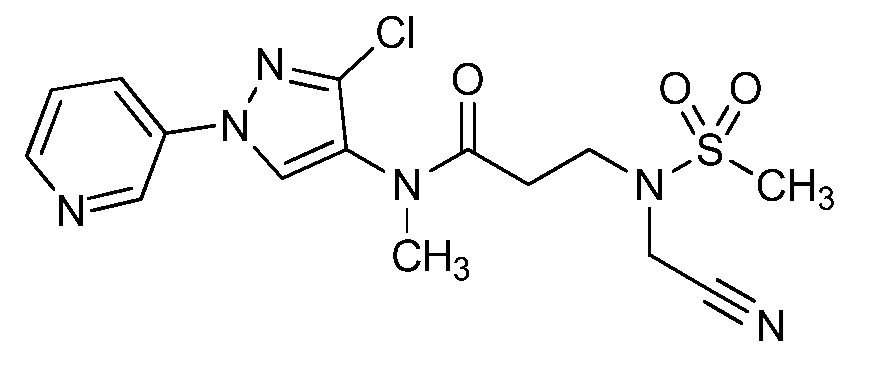
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-метил-3-(метилсульфонамидо)пропанамида (0,085 г, 0,238 ммоль) в ТГФ (2,376 мл) при температуре 0°C добавляли NaH (9,98 мг, 0,249 ммоль, 60%-ая дисперсия в минеральном масле). Реакционную смесь оставляли перемешиваться в течение 10 мин, и в этот момент добавляли 2-бромацетонитрил (0,025 мл, 0,356 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 1 ч. Реакцию гасили добавлением воды (5 мл) и разбавляли EtOAc (10 мл). Слои разделяли, и водный слой экстрагировали EtOAc (3×10 мл). Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали в вакууме. Сырой остаток очищали посредством флэш-хроматографии (от 0 до 10% MeOH/CH2Cl2) с получением желаемого продукта в виде пены бледно-желтого цвета (86 мг, 87%).
Пример 148: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((3,3,3-трифторпропил)амино)пропанамида
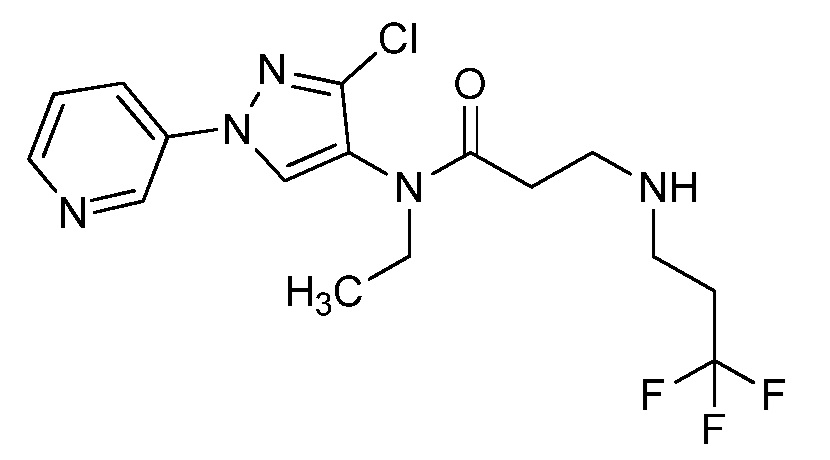
В сосуд для микроволнового облучения добавляли MeOH (2,0 мл), 3,3,3-трифторпропан-1-амин (0,386 г, 3,42 ммоль) и 3-хлор-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этилпропанамид (0,107 г, 0,342 ммоль), последовательно. Реакционную смесь герметически закрывали и помещали в микроволновой реактор Biotage® Initiator в течение 3 ч при температуре 100°C, с контролем внешней температуры ИК-датчиком на боку сосуда. После охлаждения реакционную смесь концентрировали в вакууме и очищали посредством нормальной фазовой флэш-хроматографии (от 0 до 15% MeOH/EtOAc) с получением желаемого продукта в виде непрозрачного вязкого масла (127 мг, 94%): 1H ЯМР (400 МГц, CDCl3) δ 8,94 (дд, J=2,8, 0,7 Гц, 1H), 8,63 (дд, J=4,7, 1,5 Гц, 1H), 8,04 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,95 (с, 1H), 7,46 (ддд, J=8,4, 4,8, 0,8 Гц, 1H), 3,71 (кв, J=7,2 Гц, 2H), 2,93-2,80 (м, 4H), 2,35 (т, J=6,2 Гц, 2H), 2,28 (ддт, J=14,6, 7,3, 3,6 Гц, 2H), 1,16 (т, J=7,2 Гц, 3H); 19F ЯМР (376 МГц, CDCl3) δ -65,13; ESIMS m/z 390 ([M+H]+).
N-(3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(метиламино)пропанамид был получен, как описано в примере 148: 1H ЯМР (400 МГц, CDCl3) δ 9,01 (д, J=2,6 Гц, 1H), 8,61 (дд, J=4,8, 1,4 Гц, 1H), 8,23 (с, 1H), 8,06 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,45 (дд, J=8,3, 4,8 Гц, 1H), 7,24 (с, 1H), 3,68 (кв, J=7,2 Гц, 2H), 3,14 (т, J=6,1 Гц, 2H), 2,71-2,56 (м, 5H), 1,14 (т, J=7,2 Гц, 3H); 13C ЯМР (101 МГц, CDCl3) δ 172,1, 148,6, 140,8, 140,1, 135,6, 126,6, 126,3, 124,1, 123,8, 47,1, 43,8, 36,1, 33,5, 13,1; ESIMS m/z 308 ([M+H]+).
N-(3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((4,4,4-трифторбутил)амино)пропанамид был получен, как описано в примере 148: 1H ЯМР (400 МГц, CDCl3) δ 9,04 (д, J=2,7 Гц, 1H), 8,61 (дд, J=4,7, 1,5 Гц, 1H), 8,36 (с, 1H), 8,08 (ддд, J=8,4, 2,8, 1,5 Гц, 1H), 7,45 (ддд, J=8,4, 4,8, 0,7 Гц, 1H), 3,69 (кв, J=7,2 Гц, 2H), 3,18 (т, J=6,0 Гц, 2H), 3,02 (т, J=7,7 Гц, 3H), 2,75 (т, J=6,0 Гц, 2H), 2,25 (тдт, J=16,1, 10,6, 5,5 Гц, 2H), 2,14-1,98 (м, 2H), 1,16 (т, J=7,2 Гц, 3H); 19F ЯМР (376 МГц, CDCl3) δ -66,03; ESIMS m/z 404 ([M+H]+).
N-(3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(этиламино)пропанамид был получен, как описано в примере 148: 1H ЯМР (400 МГц, CDCl3) δ 9,05 (с, 1H), 8,61 (с, 1H), 8,41 (дд, J=7,6, 2,1 Гц, 1H), 8,09 (дд, J=8,3, 1,4 Гц, 1H), 7,44 (дд, J=8,4, 4,8 Гц, 1H), 3,83-3,59 (м, 2H), 3,21 (т, J=6,0 Гц, 2H), 3,14-2,97 (м, 2H), 2,86 (с, 2H), 1,52-1,32 (м, 3H), 1,23-1,06 (м, 3H); 13C ЯМР (101 МГц, CDCl3) δ 170,7, 148,5, 140,5, 140,0, 135,6, 128,1, 126,4, 124,0, 122,4, 44,0, 43,3, 43,3, 30,1, 12,8, 11,4; ESIMS m/z 322 ([M+H]+).
N-(3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(фениламино)пропанамид был получен, как описано в примере 148: 1H ЯМР (400 МГц, CDCl3) δ 8,81 (д, J=2,7 Гц, 1H), 8,60 (дд, J=4,8, 1,4 Гц, 1H), 7,89 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,54 (с, 1H), 7,42 (ддд, J=8,3, 4,8, 0,8 Гц, 1H), 7,17-7,05 (м, 2H), 6,64 (тт, J=7,3, 1,1 Гц, 1H), 6,59-6,49 (м, 2H), 4,22 (с, 1H), 3,70 (дт, J=14,8, 7,4 Гц, 2H), 3,48 (т, J=6,0 Гц, 2H), 2,45 (т, J=6,2 Гц, 2H), 1,14 (т, J=7,1 Гц, 3H); ESIMS m/z 370 ([M+H]+).
Пример 149: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(N-(3,3,3-трифторпропил)метилсульфонамидо)пропанамида (соединение 978)
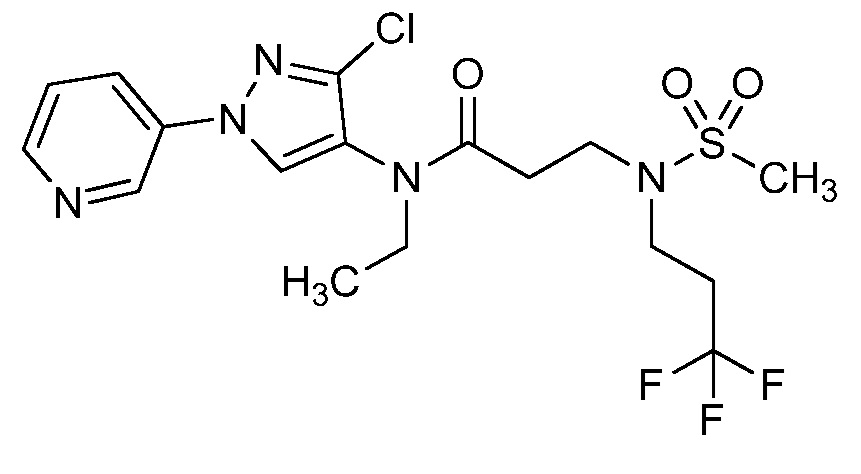
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((3,3,3-трифторпропил)амино)пропанамида (0,085 г, 0,218 ммоль) в CH2Cl2 (2,181 мл) при комнатной температуре и в атмосфере N2 добавляли диизопропилэтиламин (0,152 мл, 0,872 ммоль) и метансульфонилхлорид (0,025 мл, 0,327 ммоль). Реакционную смесь оставляли перемешиваться в течение ночи, после чего реакционную смесь разбавляли CH2Cl2 (5 мл) и водой (3 мл). Фазы смешивали и затем разделяли на разделителе фаз. Органический слой концентрировали в вакууме с получением масла темно-оранжевого цвета. Сырой продукт очищали посредством нормальной фазовой флэш-хроматографии (от 0 до 100% EtOAc/CH2Cl2) с получением желаемого продукта в виде вязкого масла бледно-желтого цвета (78 мг, 73%).
Пример 150: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(метил(3,3,3-трифторпропил)амино)пропанамида (соединение Y2146)
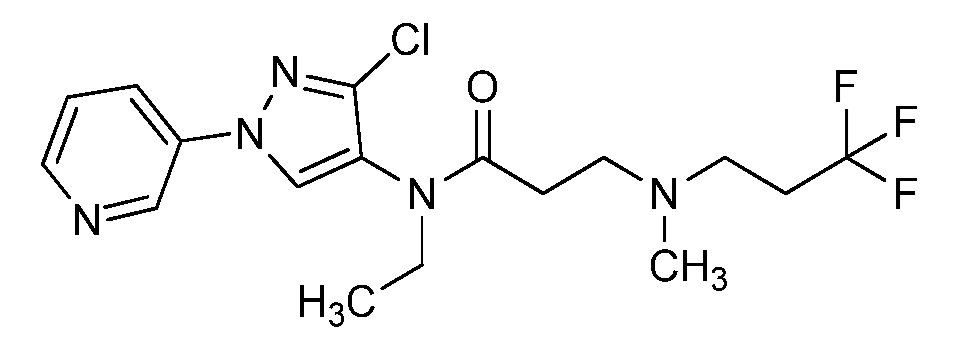
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(метиламино)пропанамида (0,139 г, 0,452 ммоль) в ДМФ (4,52 мл) при комнатной температуре добавляли K2CO3 (0,125 г, 0,903 ммоль) и 3-бром-1,1,1-трифторпропан (0,060 мл, 0,565 ммоль). Реакционный сосуд снабжали обратным холодильником, нагревали при температуре 70°C и перемешивали в течение ночи. Анализ СВЭЖХ-МС указывал на наличие непрореагировавшего исходного продукта. Поэтому добавляли дополнительные 3 эквивалента 3-бром-1,1,1-трифторпропана и реакционную смесь оставляли перемешиваться при температуре 70°C в течение 3 ч. Анализ СВЭЖХ-МС указывал на полное расходование исходного продукта и конверсию до продукта желаемой массы. Реакционную смесь охлаждали, разбавляли EtOAc (20 мл) и фильтровали через слой из целита. Фильтрат затем промывали полунасыщенным солевым раствором (3×20 мл), сушили над Na2SO4, фильтровали и концентрировали в вакууме. Сырой остаток очищали посредством нормальной фазовой флэш-хроматографии (от 0 до 15% MeOH/CH2Cl2) с получением желаемого продукта в виде прозрачного масла (84 мг, 44%).
Пример 151: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((3-оксобутил)тио)пропанамида (соединение 877)
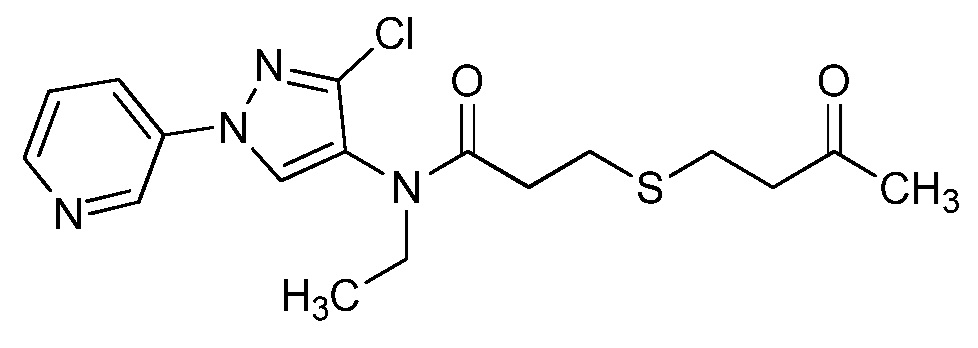
К раствору бут-3-ен-2-она (0,040 мл, 0,444 ммоль) в воде (0,370 мл) и диоксана (0,370 мл) при комнатной температуре добавляли N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-меркаптопропанамид (0,115 г, 0,370 ммоль). Реакционную смесь оставляли перемешиваться в течение 1 ч, и в этот момент реакционную смесь разбавляли CH2Cl2, и смесь энергично перемешивали в течение 1 ч. Смесь затем пропускали через разделитель фаз и оставшуюся водную фазу промывали CH2Cl2 (3×5 мл). Объединенные органические экстракты концентрировали в вакууме с получением желаемого продукта в виде масла оранжевого цвета, которое было аналитически чистым согласно данным анализов 1H ЯМР и СВЭЖХ-МС (140 мг, 94%). Ссылка: Khatik, G. L.; Kumar, R.; Chakraborti, A. K. Org. Lett. 2006, 8, 2433-2436.
Пример 152: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-((3,3-дифторбутил)тио)-N-этилпропанамида (соединение 889)
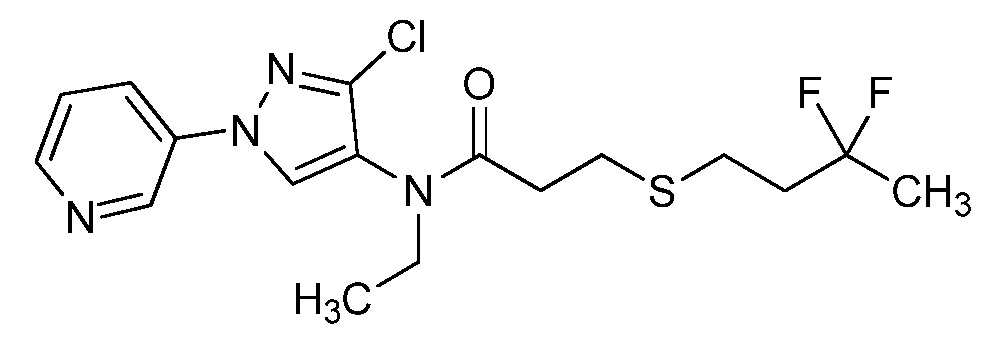
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((3-оксобутил)тио)пропанамида (0,184 г, 0,483 ммоль) в CH2Cl2 (4,83 мл) при температуре 0°C добавляли Deoxo-Fluor® (0,534 мл, 2,90 ммоль), затем EtOH (0,017 мл, 0,290 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 48 ч, в течение этого времени раствор становился из бледно-желтого темно-коричневым. Реакционную смесь разбавляли CH2Cl2 (10 мл) и гасили осторожным добавлением NaHCO3(водн.) (5 мл). Слои разделяли, и водную фазу экстрагировали CH2Cl2 (3×10 мл). Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали в вакууме. Сырой остаток очищали посредством нормальной фазовой флэш-хроматографии (от 0 до 100% EtOAc/CH2Cl2) с получением желаемого продукта в виде масла бледно-желтого цвета (43 мг, 21%).
Пример 153: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-((3,3-дифторпропил)тио)-N-этилпропанамида (соединение 927)
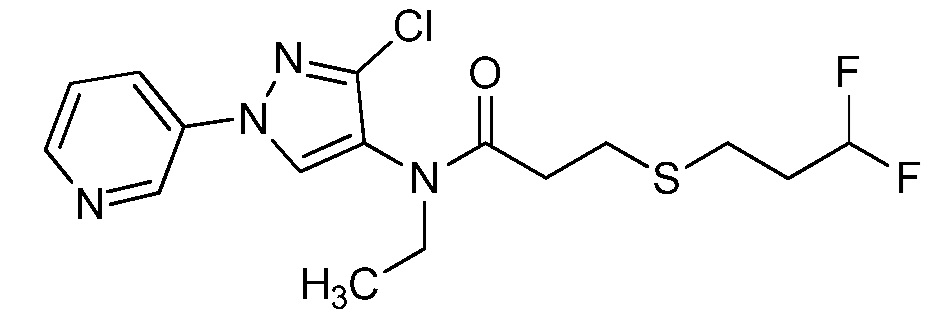
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-((3,3-диметоксипропил)тио)-N-этилпропанамида (0,307 г, 0,743 ммоль) в ТГФ (7,43 мл) добавляли 1,0 M водной раствор HCl (7,43 мл, 7,43 ммоль). Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 1 ч, и в этот момент ТСХ/анализ СВЭЖХ-МС указывал полное протекание гидролиза до желаемого альдегидного продукта. Смесь разбавляли EtOAc (20 мл) и водой (10 мл). Слои смешивали, разделяли, и водный слой экстрагировали EtOAc (3×20 мл). Объединенные органические экстракты промывали NaHCO3 (1×25 мл), водой (1×25 мл) и насыщенным солевым раствором (1×25 мл) и затем сушили над Na2SO4, фильтровали и концентрировали в вакууме. Сырой продукт сушили посредством азеотропной отгонки из толуола (3×10 мл) и затем помещали в атмосферу N2. В колбу помещали CH2Cl2 (7,44 мл), и раствор охлаждали до температуры 0°C. Добавляли Deoxo-Fluor® (0,686 мл, 3,72 ммоль) и EtOH (4,34 мкл, 0,074 ммоль) и реакционную смесь нагревали при комнатной температуре. Через 18 ч реакционную смесь разбавляли CH2Cl2 (10 мл) и гасили осторожным добавлением NaHCO3(водн.) (5 мл). Слои разделяли, и водную фазу экстрагировали CH2Cl2 (3×10 мл). Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали в вакууме. Сырое вещество очищали посредством нормальной фазовой флэш-хроматографии (от 0 до 100% EtOAc/CH2Cl2) с получением желаемого продукта в виде масла бледно-желтого цвета (151 мг, 50%).
Пример 154: Получение 1,1,1-трифтор-3-йод-5-метилгексана
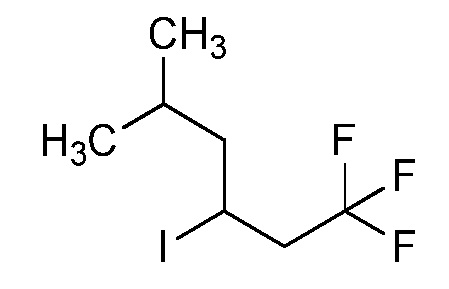
В сосуд для микроволнового облучения, снабженный магнитной мешалкой, добавляли воду (5,94 мл), ацетонитрил (5,94 мл), дитионит натрия (0,569 г, 3,27 ммоль), бикарбонат натрия (0,499 г, 5,94 ммоль) и 4-метилпент-1-ен (0,379 мл, 2,97 ммоль). Сосуд закрывали крышкой для микроволновой печи (волнистая), охлаждали до температуры -78°C и откачивали в вакууме. Далее в реакционный сосуд конденсировали трифторйодметан (0,873 г, 4,46 ммоль) (приблизительно). После нагревания до комнатной температуры реакционную смесь перемешивали в течение 2,5 ч. Перед удалением крышки реакционную смесь разгерметизировали проколом крышки иголкой, и наблюдалось значительное выделение газа. Реакционную смесь затем разбавляли водой (5 мл), и смесь экстрагировали Et2O (3×20 мл), и объединенные экстракты сушили над MgSO4, фильтровали и концентрировали в вакууме с получением прозрачного масла (740 мг, 80%). Анализ 1H ЯМР сырого продукта свидетельствовал, что чистота желаемого продукта составляла ~90%. Поэтому продукт использовали в последующих реакциях без дополнительной очистки: 1H ЯМР (400 МГц, CDCl3) δ 4,25-4,06 (м, 1H), 2,94 (дквд, J=15,5, 10,6, 6,1 Гц, 1H), 2,77 (дквд, J=15,5, 10,0, 7,5 Гц, 1H), 1,92-1,74 (м, 2H), 1,45-1,28 (м, 1H), 0,98 (д, J=6,5 Гц, 3H), 0,87 (д, J=6,5 Гц, 3H); 19F ЯМР (376 МГц, CDCl3) δ -63,63. Ссылка: Ignatowska, J.; Dmowski, W. J. Fluor. Chem., 2007, 128, 997-1006.
(4,4,4-Трифтор-2-йодбутил)бензол был получен, как описано в примере 154: 1H ЯМР (400 МГц, CDCl3) δ 7,41-7,27 (м, 3H), 7,23-7,16 (м, 2H), 4,33 (дкв, J=8,2, 6,7 Гц, 1H), 3,31-3,15 (м, 2H), 2,96-2,72 (м, 2H); 19F ЯМР (376 МГц, CDCl3) δ -63,63; EIMS m/z 314.
1-(4,4,4-Трифтор-2-йодбутил)-1H-имидазол был получен, как описано в примере 154: 1H ЯМР (400 МГц, CDCl3) δ 7,61 (т, J=1,1 Гц, 1H), 7,12 (т, J=1,1 Гц, 1H), 7,00 (т, J=1,4 Гц, 1H), 4,46-4,31 (м, 3H), 2,88-2,66 (м, 2H); 19F ЯМР (376 МГц, CDCl3) δ -63,57; EIMS m/z 304.
1,1,1-Трифтор-3-йодпентан был получен, как описано в примере 154: 1H ЯМР (400 МГц, CDCl3) δ 4,20 (тдд, J=7,9, 6,2, 4,4 Гц, 1H), 3,01-2,84 (м, 1H), 2,84-2,69 (м, 1H), 1,84-1,74 (м, 2H), 1,06 (т, J=7,1 Гц, 3H); 19F ЯМР (376 МГц, CDCl3) δ -64,06; EIMS m/z 252.
Пример 155: Получение S-(1,1,1-трифтор-5-метилгексан-3-ил)бензoтиоата
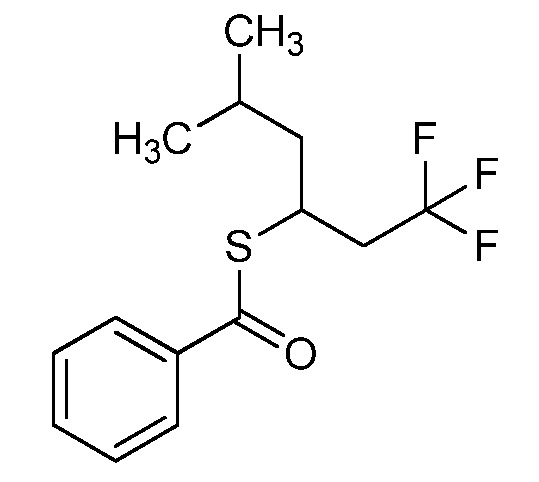
К раствору 1,1,1-трифтор-3-йод-5-метилгексана (0,047 г, 0,168 ммоль) в ДМФ (1,678 мл) при комнатной температуре добавляли калия бензoтиоат (0,035 г, 0,201 ммоль). Реакционную смесь оставляли перемешиваться в течение 18 ч, и в этот момент реакционную смесь разбавляли водой (3 мл) и EtOAc (5 мл). Слои смешивали и затем разделяли. Водный слой экстрагировали EtOAc (3×5 мл), и объединенные органические экстракты промывали водой (1×10 мл) и полунасыщенным солевым раствором (2×10 мл), сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали посредством флэш-хроматографии (от 0 до 30% EtOAc/гексаны) с получением желаемого продукта в виде прозрачного масла (37 мг, 68%): 1H ЯМР (400 МГц, CDCl3) δ 7,99-7,92 (м, 2H), 7,62-7,55 (м, 1H), 7,50-7,41 (м, 2H), 4,10-3,95 (м, 1H), 2,73-2,56 (м, 1H), 2,56-2,40 (м, 1H), 1,94-1,73 (м, 1H), 1,73-1,61 (м, 2H), 0,97 (д, J=6,6 Гц, 3H), 0,94 (д, J=6,5 Гц, 3H); 19F ЯМР (376 МГц, CDCl3) δ -62,89.
S-(4,4,4-Трифтор-1-фенилбутан-2-ил)бензoтиоат был получен, как описано в примере 155: 1H ЯМР (400 МГц, CDCl3) δ 7,97-7,89 (м, 2H), 7,58 (ддт, J=7,9, 6,9, 1,3 Гц, 1H), 7,49-7,41 (м, 2H), 7,39-7,26 (м, 5H), 4,29-4,15 (м, 1H), 3,11 (д, J=7,2 Гц, 2H), 2,54 (квд, J=10,6, 6,6 Гц, 2H); 19F ЯМР (376 МГц, CDCl3) δ -62,86; EIMS m/z 324.
S-(4,4,4-Трифтор-1-(1H-имидазол-1-ил)бутан-2-ил)бензoтиоат был получен, как описано в примере 155: 1H ЯМР (400 МГц, CDCl3) δ 7,98-7,89 (м, 2H), 7,68-7,60 (м, 1H), 7,56 (т, J=1,1 Гц, 1H), 7,53-7,45 (м, 2H), 7,11 (т, J=1,1 Гц, 1H), 7,05 (т, J=1,3 Гц, 1H), 4,42-4,18 (м, 3H), 2,64-2,39 (м, 2H); 19F ЯМР (376 МГц, CDCl3) δ -62,98; EIMS m/z 314.
S-(1,1,1-Трифторпентан-3-ил)бензoтиоат был получен, как описано в примере 155: 1H ЯМР (400 МГц, CDCl3) δ 8,02-7,91 (м, 2H), 7,64-7,55 (м, 1H), 7,51-7,40 (м, 2H), 4,06-3,90 (м, 1H), 2,70-2,41 (м, 2H), 2,02-1,86 (м, 1H), 1,86-1,71 (м, 1H), 1,05 (т, J=7,3 Гц, 3H); 19F ЯМР (376 МГц, CDCl3) δ -63,32; EIMS m/z 262.
Пример 156: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((1,1,1-трифтор-5-метилгексан-3-ил)тио)пропанамида (соединение 1053)
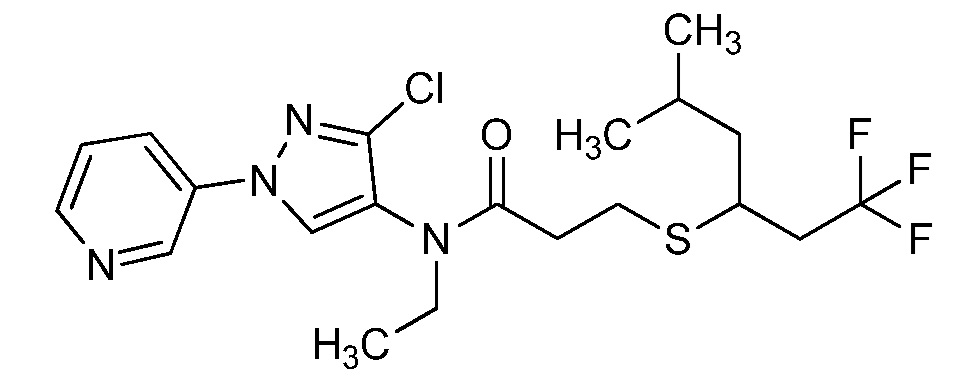
К суспензии NaH (60% в минеральном масле, 0,012 г, 0,300 ммоль) в ТГФ (2,86 мл) при комнатной температуре и в атмосфере N2 добавляли MeOH (0,058 мл, 1,429 ммоль). Реакционная смесь становилась гомогенной, и наблюдалось выделение газа. После перемешивания в течение 30 мин реакционную смесь охлаждали до температуры 0°C и медленно добавляли раствор S-(1,1,1-трифтор-5-метилгексан-3-ил)бензoтиоата (0,083 г, 0,286 ммоль) в ТГФ (2 мл). Реакционную смесь нагревали при комнатной температуре, перемешивали в течение 45 мин и затем возвращали до температуры 0°C. В реакционную смесь добавляли раствор 3-хлор-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этилпропанамида (0,090 г, 0,286 ммоль) в ТГФ (2 мл). Реакционную смесь нагревали при комнатной температуре и перемешивали в течение 18 ч. Реакционную смесь разбавляли EtOAc (20 мл) и водой (10 мл). Слои смешивали и затем разделяли. Водный слой экстрагировали EtOAc (3×20 мл), и объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали в вакууме. Сырой остаток очищали посредством нормальной фазовой флэш-хроматографии (от 0 до 100% EtOAc/CH2Cl2) с получением желаемого продукта в виде масла бледно-желтого цвета (63 мг, 45%).
Пример 157: Получение трет-бутил(2-(2,2-дифторциклопропил)этокси)дифенилсилана
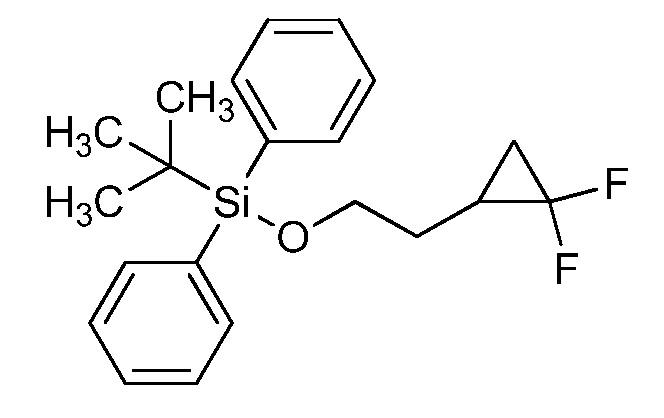
В высушенную в печи 3-горлую круглодонную колбу, снабженную обратным холодильником и капельной воронкой, в атмосфере N2 добавляли (бут-3-ен-1-илокси)(трет-бутил)дифенилсилан (3,6 г, 11,59 ммоль) и фторид натрия (7,30 мг, 0,174 ммоль) (для получения исходного олефина смотри: Waser, J.; Gaspar, B.; Nambu, H.; Carreira, E. M. J. Am. Chem. Soc. 2006, 128, 11693-11712). В закрытую капельную воронку добавляли триметилсилил 2,2-дифтор-2-(фторсульфонил)ацетат (4,57 мл, 23,19 ммоль). Реакционный сосуд и его содержимое нагревали при температуре 120°C, и капельную воронку затем открывали, чтобы позволить сульфонилфториду добавляться в течение 1 ч. Сразу после завершения добавления реакции давали продолжаться, перемешивая при температуре 120°C в течение 30 мин. Реакционную смесь охлаждали до комнатной температуры, разбавляли CH2Cl2 (50 мл) и промывали NaHCO3(водн.) (2×50 мл). Органическую фазу отделяли, сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением масла коричневого цвета. Сырой остаток очищали посредством нормальной фазовой флэш-хроматографии (от 0 до 15% CH2Cl2/гексаны) с получением желаемого продукта в виде прозрачного масла (3,07 г, 73%): 1H ЯМР (400 МГц, CDCl3) δ 7,72-7,63 (м, 4H), 7,49-7,34 (м, 6H), 3,73 (т, J=6,0 Гц, 2H), 1,88-1,73 (м, 1H), 1,73-1,55 (м, 2H), 1,42-1,27 (м, 1H), 1,06 (с, 9H), 0,94-0,81 (м, 1H); 19F ЯМР (376 МГц, CDCl3) δ -128,54 (д, J=156,2 Гц), -143,96 (д, J=155,5 Гц); 13C ЯМР (101 МГц, CDCl3) δ 135,5, 133,7 (д, J=3,7 Гц), 129,6, 127,7, 114,5, 62,8, 30,0 (д, J=3,5 Гц), 26,8, 19,9 (т, J=10,9 Гц), 19,2, 15,9 (т, J=11,0 Гц).
Пример 158: Получение 2-(2,2-дифторциклопропил)этил 4-метилбензолсульфоната
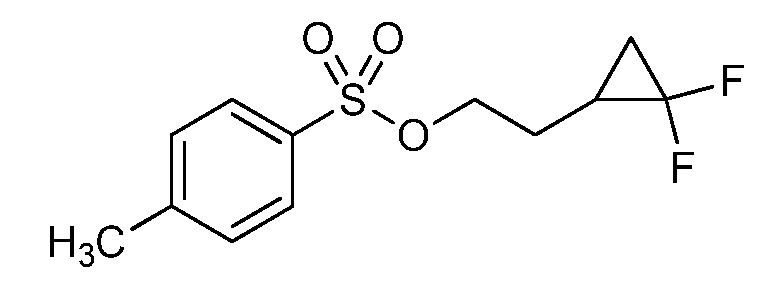
К раствору трет-бутил(2-(2,2-дифторциклопропил)этокси)дифенилсилана (0,386 г, 1,071 ммоль) в ТГФ (10,71 мл) при температуре 0°C добавляли 1,0 M раствор TBAF (3,21 мл, 3,21 ммоль) в ТГФ. Реакционную смесь нагревали при комнатной температуре и перемешивали в течение 3 ч. Реакцию гасили добавлением NH4Cl(водн.) (1 мл), и смесь распределяли между водой (15 мл) и EtOAc (15 мл). Слои хорошо смешивали и затем разделяли. Водный слой экстрагировали EtOAc (3×20 мл), и объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали в вакууме. Сырой остаток затем обрабатывали CH2Cl2 (7,15 мл). В раствор затем добавляли пиридин (0,434 мл, 5,36 ммоль) и п-толуолсульфонилхлорид (0,614 г, 3,22 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 48 ч, и в этот момент реакционную смесь распределяли между CH2Cl2 (50 мл) и водой (25 мл). Слои разделяли, и органический слой промывали 1н HCl(водн.) (20 мл), водой (20 мл) и насыщенным солевым раствором (20 мл). Органический слой затем сушили над Na2SO4, фильтровали и концентрировали в вакууме. Сырой остаток очищали посредством нормальной фазовой флэш-хроматографии (от 0 до 50% EtOAc/гексаны) с получением желаемого продукта в виде прозрачного масла (142 мг, 46%, 2 стадии): 1H ЯМР (400 МГц, CDCl3) δ 7,89-7,71 (м, 2H), 7,42-7,29 (м, 2H), 4,20-3,96 (м, 2H), 2,46 (с, 3H), 1,92-1,81 (м, 1H), 1,81-1,69 (м, 1H), 1,63-1,48 (м, 1H), 1,39 (дддд, J=12,2, 11,2, 7,7, 4,3 Гц, 1H), 0,93 (дтд, J=13,0, 7,6, 3,5 Гц, 1H); 13C ЯМР (101 МГц, CDCl3) δ 145,0, 132,9, 129,9, 127,9, 113,5 (т, J=282,4 Гц), 69,0 (д, J=2,2 Гц), 26,6 (д, J=4,3 Гц), 21,7, 18,9 (т, J=11,1 Гц), 15,9 (т, J=11,0 Гц); 19F ЯМР (376 МГц, CDCl3) δ -129,09 (д, J=157,8 Гц), -144,18 (д, J=158,1 Гц).
Пример 159: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-метилакриламида (соединение Y2098)
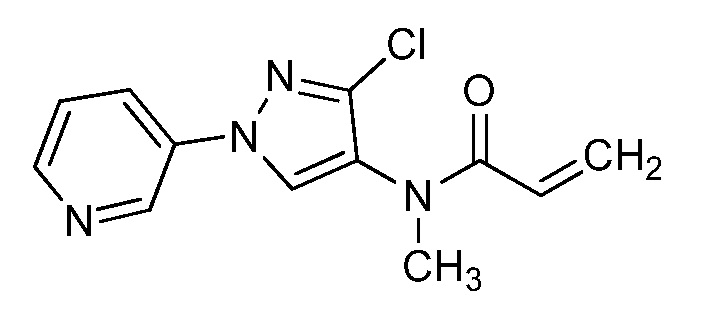
К раствору 3-хлор-N-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,526 г, 2,52 ммоль) в 1,2-дихлорэтане (25,2 мл) при температуре 0°C добавляли диизопропилэтиламин (0,484 мл, 2,77 ммоль) и акрилоилхлорид (0,205 мл, 2,52 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 1 ч. Реакцию гасили добавлением NaHCO3(водн.) и разбавляли CH2Cl2. Слои разделяли, и водный слой экстрагировали CH2Cl2. Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали в вакууме. Сырой продукт очищали посредством флэш-хроматографии (от 0 до 10% MeOH/CH2Cl2) с получением желаемого продукта в виде твердого вещества оранжевого цвета (634 мг, 91%).
Пример 160: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((3,3,3-трифторпропил)тио)пропанамида (соединение 653)
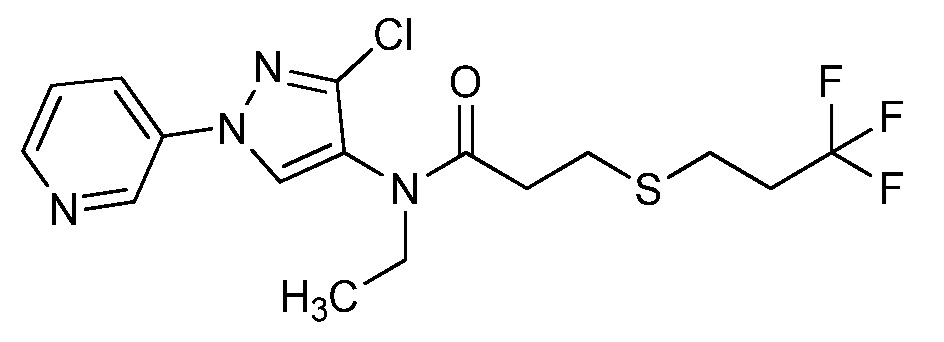
К раствору 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина (10 г, 44,9 ммоль) в CH2Cl2 (100 мл) при температуре 0°C и в атмосфере N2 добавляли пиридин (5,45 мл, 67,4 ммоль), 4-диметиламинопиридин (DMAP) (2,74 г, 22,45 ммоль) и 3-((3,3,3-трифторпропил)тио)пропаноилхлорид (9,91 г, 44,9 ммоль), последовательно. Реакционную смесь нагревали при комнатной температуре и перемешивали в течение 1 ч. Реакционную смесь выливали в воду (100 мл), и полученную смесь перемешивали в течение 5 мин. Смесь переносили в делительную воронку, и слои разделяли. Водную фазу экстрагировали CH2Cl2 (3×50 мл), и объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали в вакууме. Сырой продукт очищали посредством нормальной фазовой флэш-хроматографии (от 0 до 100% EtOAc/CH2Cl2) с получением желаемого продукта в виде твердого вещества бледно-желтого цвета (17,21 г, 89%).
Пример 161: Получение N-(1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-ил)-2-оксооксазолидин-3-карботиоамида (соединение Y2032)
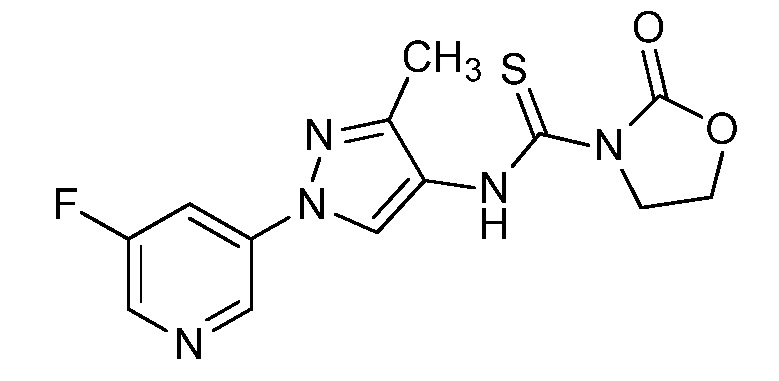
К раствору 1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-амина (0,10 г, 0,52 ммоль) и триэтиламина (0,24 мл, 1,71 ммоль) в сухом ТГФ (0,52 мл) с помощью шприца добавляли дисульфид углерода (0,03 мл, 0,52 ммоль) в течение 15 минут. После перемешивания в течение 1 часа смесь охлаждали на ледяной бане и одной порцией добавляли 4-метилбензол-1-сульфонилхлорид (0,11 г, 0,57 ммоль), перемешивали в течение 5 минут при температуре 0° C и затем нагревали при температуре 25°C и перемешивали в течение 1 часа. Реакционную смесь гасили 1н HCl и экстрагировали диэтиловым эфиром. Эфирные слои объединяли, промывали водой и полунасыщенным водным раствором бикарбоната натрия, сушили (MgSO4), фильтровали и концентрировали досуха с получением желаемого изотиоцианата (0,12 г, 98%). К раствору оксазолидин-2-она (0,05 г, 0,61 ммоль), растворенного в сухом ДМФ (2,05 мл), одной порцией добавляли гидрид натрия (0,03 г, 0,61 ммоль, 60%-ая дисперсия в минеральном масле), и суспензию перемешивали в течение 20 минут. Реакционную смесь охлаждали до температуры 0°C, и одной порцией добавляли 3-фтор-5-(4-изотиоцианато-3-метил-1H-пиразол-1-ил)пиридин (0,12 г, 0,51 ммоль) в минимальном количестве сухого ДМФ и перемешивали в течение 20 минут. Добавляли воду и этилацетат и полученную двухфазную смесь разделяли, и водный слой экстрагировали один раз этилацетатом. Объединенные органические экстракты промывали смесью 1:1 гексаны/вода, сушили (MgSO4), фильтровали и концентрировали досуха. Сырой продукт очищали с помощью хроматографии на силикагеле, элюируя смесью 0-75% этилацетат/гексаны, с получением желаемого продукта в виде твердого вещества белого цвета (0,03 г, 18%).
Пример 162: Получение 3-(4-изотиоцианато-3-метил-1H-пиразол-1-ил)пиридина
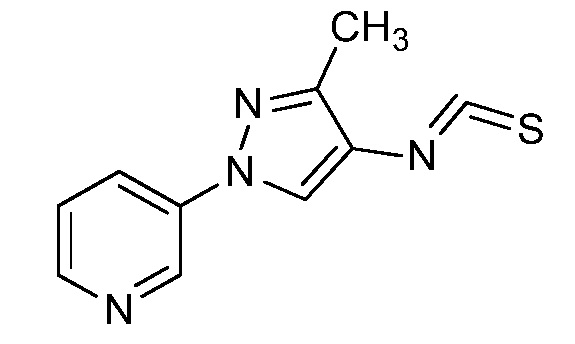
К раствору 3-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,50 г, 2,87 ммоль) и триэтиламина (1,3 мл, 1,71 ммоль) в сухом ТГФ (2,8 мл) с помощью шприца добавляли дисульфид углерода (0,17 мл, 2,87 ммоль) в течение 15 минут. После перемешивания в течение 1 часа смесь охлаждали на ледяной бане и одной порцией добавляли 4-метилбензол-1-сульфонилхлорид (0,60 г, 0,3,16 ммоль), перемешивали в течение 5 минут при температуре 0°C и затем нагревали при температуре 25°C и перемешивали в течение 1 часа. Реакционную смесь гасили 1н HCl и экстрагировали диэтиловым эфиром. Эфирные слои объединяли, промывали водой и полунасыщенным водным раствором NaHCO3, сушили (MgSO4), фильтровали и концентрировали досуха. Сырое вещество очищали с помощью хроматографии на силикагеле, элюируя смесью 0-100% этилацетат/гексаны, с получением желаемого продукта в виде твердого вещества светло-желтого цвета (0,48 г, 78%): 1H ЯМР (400 МГц, CDCl3) δ 8,89 (д, J=2,6 Гц, 1H), 8,56 (дд, J=4,7, 1,4 Гц, 1H), 7,96 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,89 (с, 1H), 7,40 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 2,40 (с, 3H); ESIMS m/z 218 ([M+H]+).
Пример 163: Получение N-(3-метил-1-(пиридин-2-ил)-1H-пиразол-4-ил)-2-оксооксазолидин-3-карботиамида (соединение Y2034)
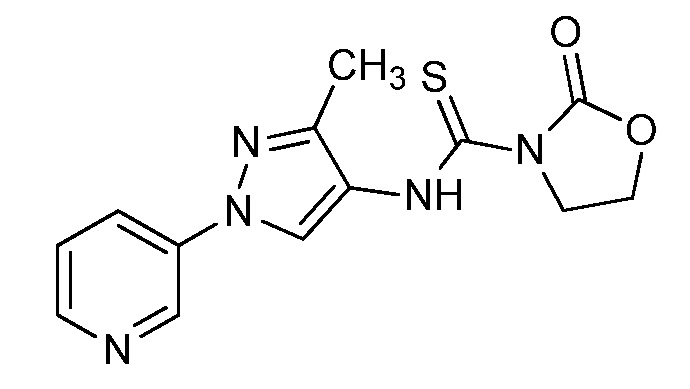
К раствору оксазолидин-2-она (0,06 г, 0,66 ммоль), растворенному в сухом ДМФ (2,2 мл), одной порцией добавляли гидрид натрия (0,03 г, 0,67 ммоль, 60%-ая дисперсия в минеральном масле), и суспензию перемешивали в течение 20 минут. Реакционную смесь охлаждали до температуры 0°C и одной порцией добавляли 3-(4-изотиоцианато-3-метил-1H-пиразол-1-ил)пиридин (0,12 г, 0,56 ммоль) в минимальном количестве сухого ДМФ и перемешивали в течение 20 минут. Добавляли воду и этилацетат и полученную двухфазную смесь разделяли, и водный слой экстрагировали один раз этилацетатом. Объединенные органические экстракты промывали смесью 1:1 гексаны/вода, сушили (MgSO4), фильтровали и концентрировали досуха. Сырой продукт очищали с помощью хроматографии на силикагеле, элюируя смесью 0-75% этилацетат/гексаны, с получением желаемого продукта в виде твердого вещества белого цвета (0,07 г, 41%).
Пример 164: Получение метил N-(3-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-оксооксазолидин-3-карбимидотиоата (соединение Y2035)
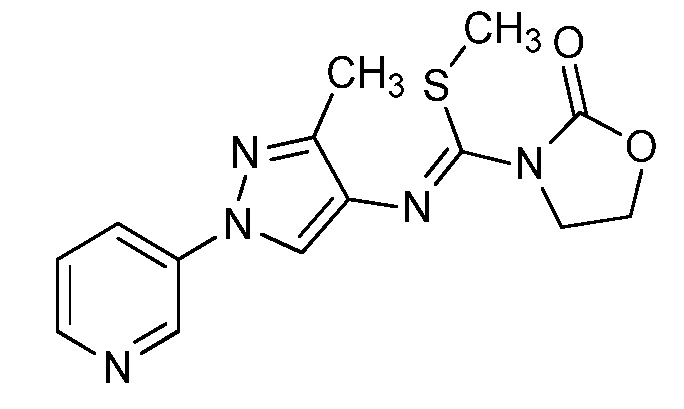
К раствору оксазолидин-2-она (0,05 г, 0,66 ммоль), растворенного в сухом ДМФ (2,22 мл), одной порцией добавляли гидрид натрия (0,03 г, 0,66 ммоль, 60%-ая дисперсия в минеральном масле), и суспензию перемешивали в течение 20 минут. Реакционную смесь охлаждали до температуры 0°C, и одной порцией добавляли 3-(4-изотиоцианато-3-метил-1H-пиразол-1-ил)пиридин (0,12 г, 0,55 ммоль) в минимальном количестве сухого ДМФ и перемешивали в течение 20 минут. Добавляли йодметан (0,04 мл, 0,66 ммоль) и реакционную смесь контролировали согласно данным ТСХ. Добавляли водный раствор хлорида аммония и смесь 50% этилацетат/гексаны, и полученную двухфазную смесь разделяли, и органический экстракт промывали водой и насыщенным водным раствором бикарбоната натрия и концентрировали досуха. Сырой продукт очищали с помощью хроматографии на силикагеле, элюируя смесью 0-10% метанол/CH2Cl2, с получением желаемого продукта в виде твердого вещества светло-желтого цвета (0,14 г, 82%).
Пример 165: Получение N-ацетил-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)циклопропанкарбоксамида (соединение Y2060)
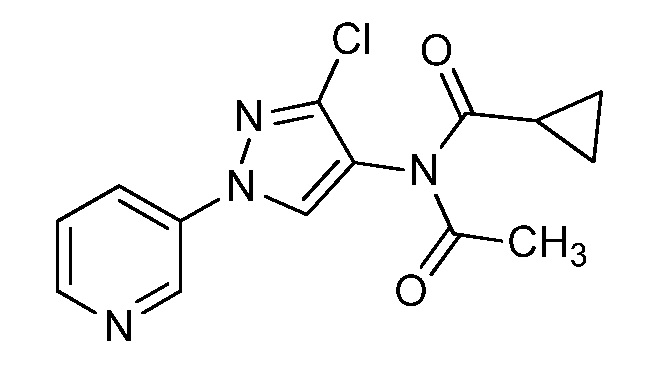
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)циклопропанкарбоксамида (0,15 г, 0,57 ммоль) в дихлорэтане (2,5 мл) добавляли диизопропилэтиламин (0,12 мл, 0,68 ммоль), затем ацетилхлорид (0,54 г, 0,68 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение ночи. Добавляли насыщенный водный раствор NaHCO3 и смесь экстрагировали CH2Cl2. Объединенные органические фазы концентрировали досуха и очищали с помощью хроматографии на силикагеле, элюируя смесью 0-100% этилацетат/гексаны, с получением желаемого продукта в виде твердого вещества белого цвета (10 мг, 6%).
Пример 166: Получение S-метил (3-хлор-5-(метилтио)-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)карбамотиоата (соединение Y2076)
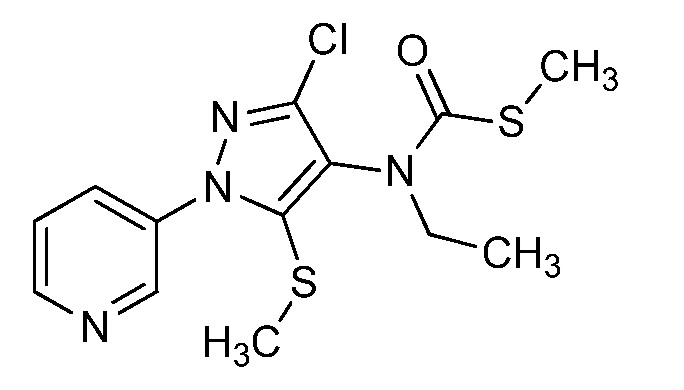
К раствору ТГФ (1,35 мл) и диизопропилэтиламина (0,07 мл, 0,40 ммоль) добавляли 2,5M н-бутиллитий (0,16 мл, 0,40 ммоль) и реакционную смесь перемешивали в течение 30 минут. Реакционную смесь охлаждали далее до температуры -78°C, и к данной реакционной смеси добавляли по каплям S-метил (3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)карбамотиоат (0,10 г, 0,33 ммоль) в минимальном количестве сухого ТГФ и перемешивали в течение 45 минут. К этой смеси затем добавляли 1,2-диметилдисульфан (0,04 г, 0,37 ммоль) и реакционную смесь перемешивали в течение еще 20 минут. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Этилацетатные слои объединяли, сушили (MgSO4), фильтровали и концентрировали досуха. Сырой продукт очищали с помощью хроматографии на силикагеле, элюируя смесью 0-100% этилацетат/гексаны, с получением желаемого продукта в виде прозрачного масла (53 мг, 46%).
Пример 167: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(3,3,3-трифторпропил)тио)пропанамида (соединение 653)
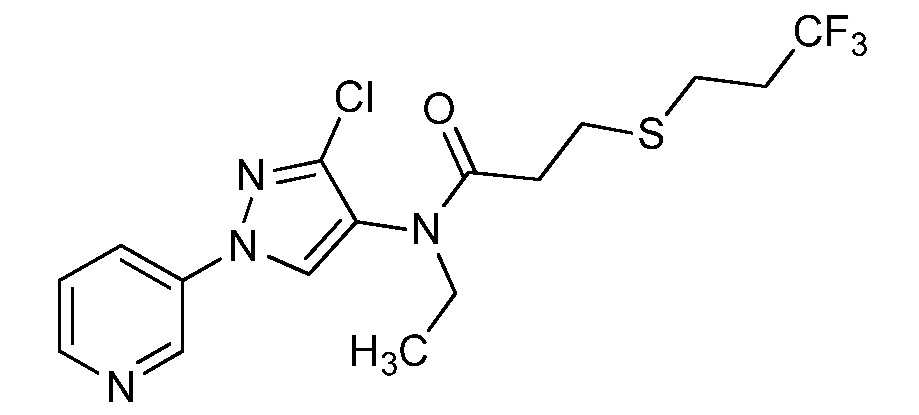
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-меркаптопропанамида (0,10 г, 0,32 ммоль), растворенного в сухом ТГФ (1,07 мл) и охлаждаемому на ледяной бане, одной порцией добавляли гидрид натрия (0,02 г, 0,34 ммоль, 60%-ая дисперсия в минеральном масле), и реакционную смесь перемешивали в течение 10 минут. К данной реакционной смеси одной порцией добавляли 3-бром-1,1,1-трифторпропан (0,06 г, 0,35 ммоль) в минимальном количестве сухого ДМФ, и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Этилацетатные слои объединяли и концентрировали досуха. Сырой продукт очищали с помощью хроматографии на силикагеле, элюируя смесью 0-75% этилацетат/гексаны, с получением желаемого продукта в виде прозрачного масла (83 мг, 63%).
Пример 168: Получение трет-бутил (2-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-2-оксоэтил)(метил)карбамата
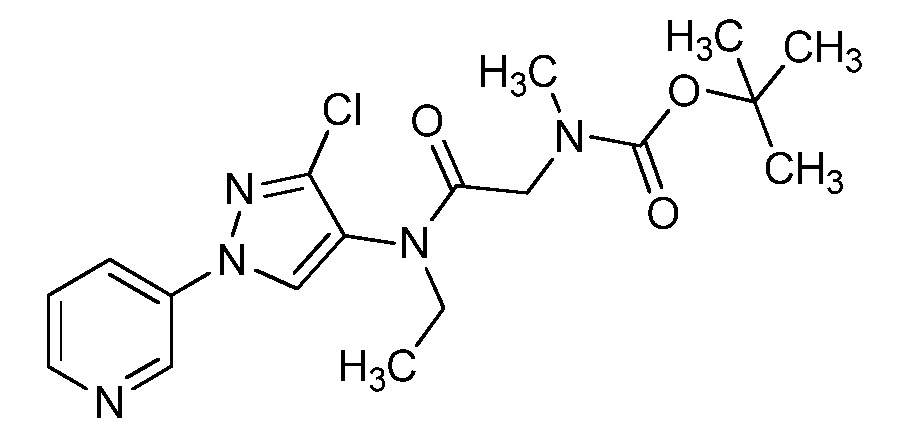
К раствору 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,40 г, 1,79 ммоль) в дихлорэтане (3,59 мл) добавляли 2-((трет-бутоксикарбонил)(метил)амино)уксусную кислоту (0,37 г, 1,97 ммоль), 4-N,N-диметиламинопиридин (0,24 г, 1,97 ммоль) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (0,51 г, 2,69 ммоль), и реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь концентрировали досуха, и сырой продукт очищали с помощью хроматографии на силикагеле, элюируя смесью 0-100% этилацетат/гексаны, с получением желаемого продукта в виде полутвердого вещества белого цвета (0,61 г, 87%): ИК (тонкая пленка) 1673 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,96 (д, J=2,4 Гц, 1H), 8,63 (дд, J=5,3 Гц, 1H), 8,11-7,86 (м, 2H), 7,51-7,36 (м, 1H), 3,92-3,57 (м, 4H), 2,96-2,81 (м, 3H), 1,50-1,37 (с, 9H), 1,20-1,11 (м, 3H); ESIMS m/z 394 ([M+H]+).
Следующие соединения были получены в соответствии со способами, описанными в примере 168:
трет-Бутил (2-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(метил)амино)-2-оксоэтил)(метил)карбамат: 1H ЯМР (400 МГц, CDCl3) δ 8,95 (д, J=2,5 Гц, 1H), 8,62 (д, J=4,8 Гц, 1H), 8,14-7,84 (м, 2H), 7,59-7,35 (м, 1H), 3,85 (д, J=25,9 Гц, 2H), 3,31-3,15 (м, 3H), 2,99-2,81 (м, 3H), 1,53-1,31 (с, 9H).
трет-Бутил (2-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(циклопропилметил)амино)-2-оксоэтил)(метил)карбамат: ИК (тонкая пленка) 1675 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,95 (ушир. с, 1H), 8,63 (дд, J=5,1 Гц, 1H), 8,17-7,88 (м, 2H), 7,54-7,36 (м, 1H), 3,99-3,41 (м, 4H), 2,97-2,82 (м, 3H), 1,44 (с, 9H), 1,12-0,83 (м, 1H), 0,59-0,39 (м, 2H), 0,28-0,08 (м, 2H); ESIMS m/z 420 ([M+H]+).
Пример 169: Получение N-(3-хлор-1-пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-(метиламино)ацетамида
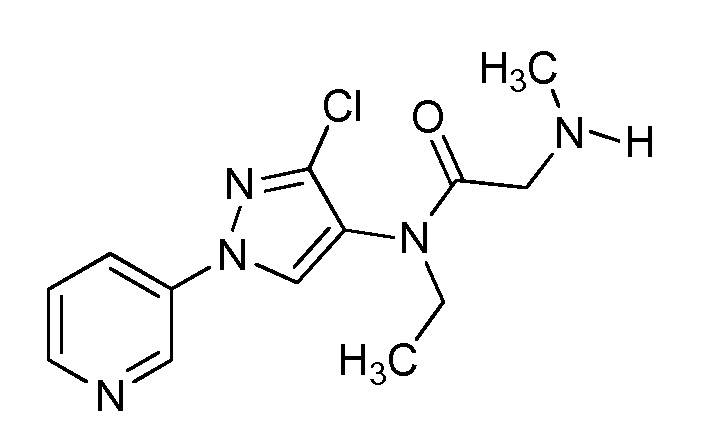
К раствору трет-бутил (2-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-2-оксоэтил)(метил)карбамата (0,57 г, 1,44 ммоль) в CH2Cl2 (1,44 мл) добавляли трифторуксусную кислоту (1,44 мл), и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли толуол и реакционную смесь концентрировали почти досуха. Смесь выливали в делительную воронку, содержащую насыщенный водный раствор NaHCO3, и экстрагировали CH2Cl2. CH2Cl2 слои объединяли и концентрировали досуха. Сырой продукт очищали с помощью хроматографии на силикагеле, элюируя смесью 0-15% метанол/CH2Cl2, с получением желаемого продукта в виде масла желтого цвета (0,31 г, 73%): ИК (тонкая пленка) 1666 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,98 (д, J=2,6 Гц, 1H), 8,63 (дд, J=4,7, 1,3 Гц, 1H), 8,06 (м, 2H), 7,47 (дд, J=8,3, 4,8 Гц, 1H), 3,72 (кв, J=7,1 Гц, 2H), 3,30 (с, 2H), 2,48 (с, 3H), 1,17 (т, J=7,2 Гц, 3H); ESIMS m/z 294 ([M+H]+).
Следующие соединения были получены в соответствии со способами, описанными в примере 169:
N-(3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-метил-2-(метиламино)ацетамид: ИК (тонкая пленка) 1666 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,96 (д, J=2,6 Гц, 1H), 8,64 (дд, J=4,8, 1,3 Гц, 1H), 8,11-7,94 (м, 2H), 7,47 (дд, J=8,4, 4,4 Гц, 1H), 3,30 (с, 2H), 3,27 (с, 3H), 2,47 (с, 3H); ESIMS m/z 280 ([M+H]+).
N-(3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-(циклопропилметил)-2-(метиламино)ацетамид: ИК (тонкая пленка) 1667 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,98 (д, J=2,6 Гц, 1H), 8,63 (дд, J=4,7, 1,3 Гц, 1H), 8,11 (с, 1H), 8,06 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,47 (дд, J=8,3, 4,8 Гц, 1H), 3,53 (ушир. с, 2H), 3,27 (ушир. с, 2H), 2,49 (с, 3H), 1,02-0,91 (м, 1H), 0,55-0,44 (м, 2H), 0,22-0,15 (м, 2H); ESIMS m/z 320 ([M+H]+).
Пример 170: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-(N-метилметилсульфонамидо)ацетамида (соединение 800)
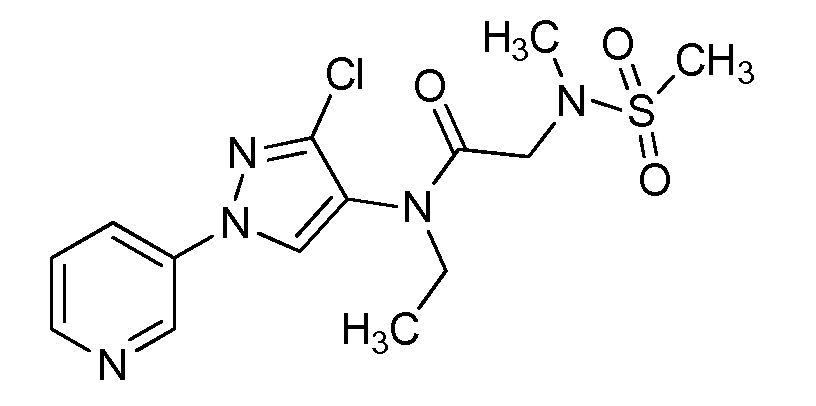
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-(метиламино)ацетамида (0,10 г, 0,34 ммоль) в CH2Cl2 (0,68 мл) добавляли метансульфонилхлорид (0,06 г, 0,51 ммоль), затем диизопропилэтиламин (0,12 мл, 0,68 ммоль), и реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь выливали в насыщенный водный раствор NaHCO3 и экстрагировали CH2Cl2. CH2Cl2 слои объединяли и концентрировали досуха. Сырой продукт очищали с помощью хроматографии на силикагеле, элюируя смесью 50-100% этилацетат/гексаны, с получением желаемого продукта в виде полутвердого вещества белого цвета (81 мг, 64%).
Пример 171: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((3,3,3-трифторпропил)сульфинил)пропанамида (соединение 861)
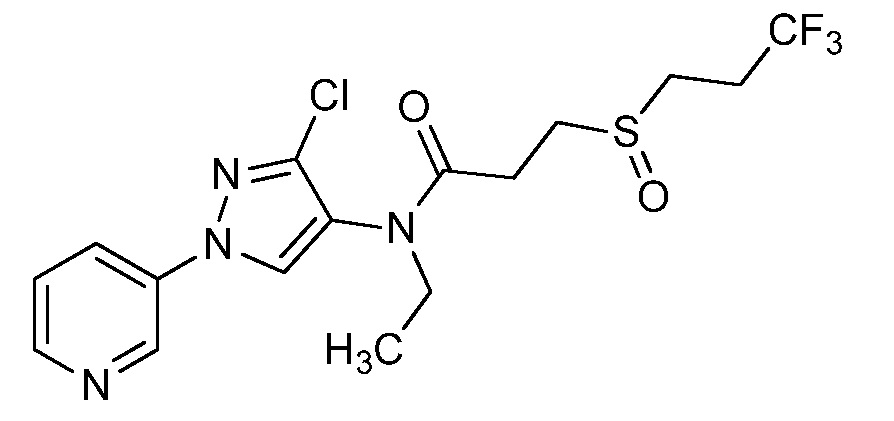
Способ A: К N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((3,3,3-трифторпропил)тио)пропанамиду (0,17 г, 0,43 ммоль) в ледяной уксусной кислоте (4,35 мл) добавляли тетрагидрат пербората натрия (0,07 г, 0,45 ммоль), и смесь нагревали при температуре 55°C в течение 1 часа. Реакционную смесь осторожно выливали в делительную воронку, содержащую насыщенный водный раствор NaHCO3, что приводило к выделению газа. Когда выделение газа прекращалось, добавляли этилацетат, и слои разделяли. Водный слой экстрагировали два раза этилацетатом, и органические слои объединяли, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Сырое вещество очищали с помощью хроматографии на силикагеле, элюируя смесью 0-5% метанол/CH2Cl2, с получением желаемого продукта в виде темного масла (60 мг, 33%).
Способ B: К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((3,3,3-трифторпропил)тио)пропанамида (500 мг, 1,229 ммоль) в гексафторизопропаноле (5 мл), перемешивая при комнатной температуре, добавляли 30%-ый пероксид водорода (523 мг, 4,92 ммоль). Раствор перемешивали при комнатной температуре в течение 15 мин. Раствор гасили насыщенным раствором сульфита натрия и экстрагировали CH2Cl2. Хроматография на силикагеле (0-10% MeOH/CH2Cl2) давала указанное в заголовке соединение в виде полутвердого вещества белого цвета (495 мг, 95%).
Пример 172: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-(метиламино)пропанамида
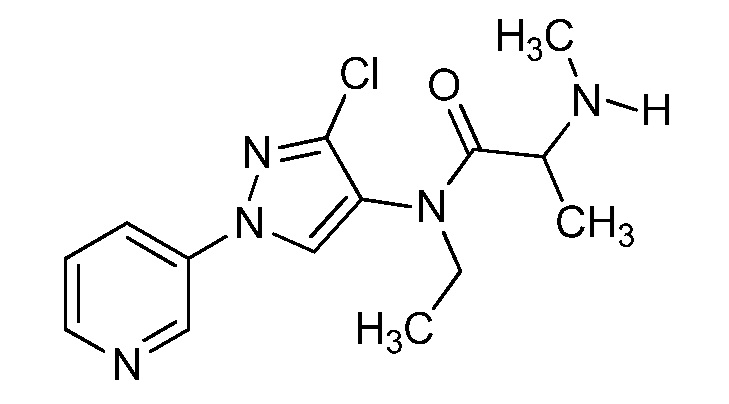
2-Хлор-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этилпропанамид (0,51 г, 1,62 ммоль) и метиламин (4,05 мл, 32,6 ммоль, 33% в этаноле) помещали в 25-мл пробирку в микроволновой реактор Biotage® Initiator на 45 минут при температуре 100°C с контролем внешней температуры ИК-датчиком на боку сосуда. Реакционную смесь концентрировали досуха и очищали с помощью хроматографии на силикагеле (0-10% метанол/CH2Cl2) с получением желаемого продукта в виде твердого вещества желтого цвета (0,21 г, 43%): 1H ЯМР (400 МГц, CDCl3) δ 8,96 (д, J=2,6 Гц, 1H), 8,64 (дд, J=4,7, 1,3 Гц, 1H), 8,06 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,98 (с, 1H), 7,47 (дд, J=8,3, 4,8 Гц, 1H), 3,93-3,57 (м, 2H), 3,25-3,11 (м, 1H), 2,34 (с, 3H), 1,21-1,17 (м, 6H).
Следующее соединение получали в соответствии со способами, описанными в примере 172:
N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(метиламино)пропанамид
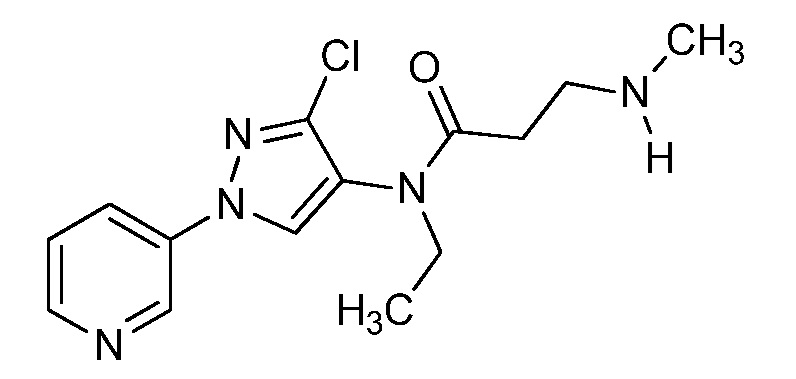
1H ЯМР (400 МГц, ацетон) δ 9,12 (дд, J=6,7, 2,6 Гц, 1H), 8,90 (с, 1H), 8,58 (дд, J=4,7, 1,4 Гц, 1H), 8,25 (м, 1H), 7,56 (м, 1H), 3,67 (кв, J=7,1 Гц, 2H), 3,01 (т, J=6,5 Гц, 2H), 2,66 (т, J=6,4 Гц, 2H), 2,50 (с, 3H), 1,12 (т, J=7,2 Гц, 3H); ЖХ/МС (ESI) m/z 308,4 ([M+H]+); ИК (KBr тонкая пленка) 3055, 2971, 2773, 1656 см-1.
Пример 173: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-(2-метоксиэтокси)ацетамида (соединение Y2195)
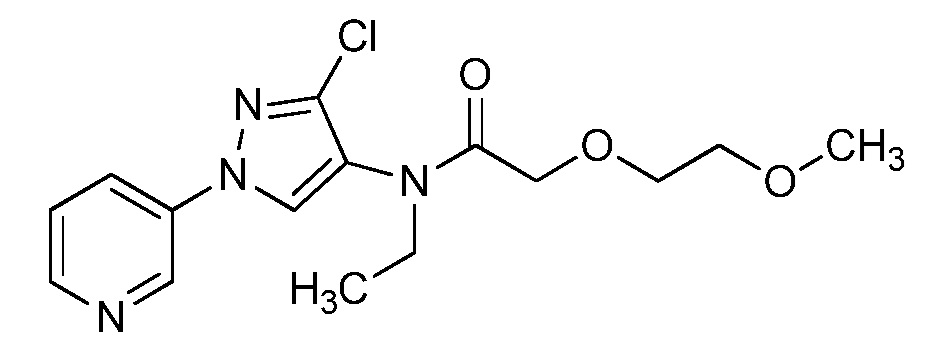
К перемешиваемому раствору 2-метоксиэтанола (0,07 мл, 0,87 ммоль) в ТГФ (4 мл) при температуре 0°C добавляли гидрид натрия (0,032 г, 0,80 ммоль, 60%-ая дисперсия в масле). После перемешивания в течение 10 мин одной порцией добавляли 2-хлор-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этилацетамид (0,2 г, 0,7 ммоль). Реакционную смесь перемешивали в течение 20 минут, затем реакционный сосуд отставляли с ледяной бани и позволяли нагреться до комнатной температуры, и перемешивали в течение ночи (приблизительно 16 ч), и в этот момент согласно данным ТСХ реакция полагалась завершенной. Реакционную смесь разбавляли водой и этилацетатом, и слои разделяли. Водный слой один раз экстрагировали этилацетатом. Объединенные органические слои сушили над MgSO4, концентрировали при пониженном давлении и очищали с помощью флэш-хроматографии (SiO2, 100-200 меш; элюируя смесью от 0 до 20% метанола в CH2Cl2) с получением указанного в заголовке соединения в виде твердого вещества рыжевато-коричневого цвета (0,045 г, 20%).
Пример 174: Получение N-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(метил)карбамоил)-N-этилпиваламида (соединение Y2082)
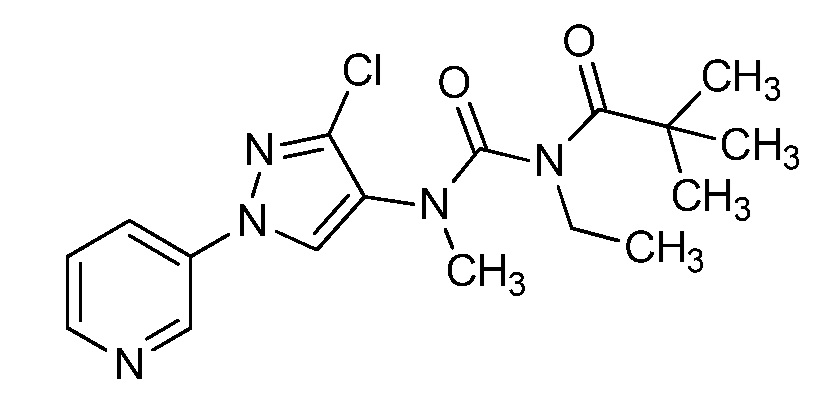
К раствору 1-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-этил-1-метилмочевины (0,075 г, 0,268 ммоль) в ТГФ (2,68 мл) при температуре -78°C добавляли 1M литий бис(триметилсилил)амид (LiHMDS) (0,282 мл, 0,282 ммоль) в толуоле. Реакционную смесь перемешивали при температуре -78°C в течение 15 мин и добавляли пивалоилхлорид (0,036 мл, 0,295 ммоль), и реакционную смесь перемешивали при температуре -78°C в течение 10 мин и при комнатной температуре в течение 30 мин. Добавляли насыщенный солевой раствор и реакционную смесь экстрагировали EtOAc. Объединенные органические фазы концентрировали и очищали с помощью флэш-хроматографии (0-15% MeOH/CH2Cl2) с получением указанного в заголовке соединения в виде масла желтого цвета (54 мг, 55%): ИК (тонкая пленка) 2969, 1681 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,93 (д, J=2,5 Гц, 1H), 8,61 (дд, J=4,7, 1,3 Гц, 1H), 8,06 (с, 1H), 8,00 (ддд, J=8,3, 2,6, 1,4 Гц, 1H), 7,44 (дд, J=8,3, 4,7 Гц, 1H), 3,58 (кв, J=7,0 Гц, 2H), 3,35 (с, 3H), 1,25-1,13 (м, 12H); ESIMS m/z 365 ([M+H]+).
Пример 175: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(метилтио)пропанимидамида (соединение 706)
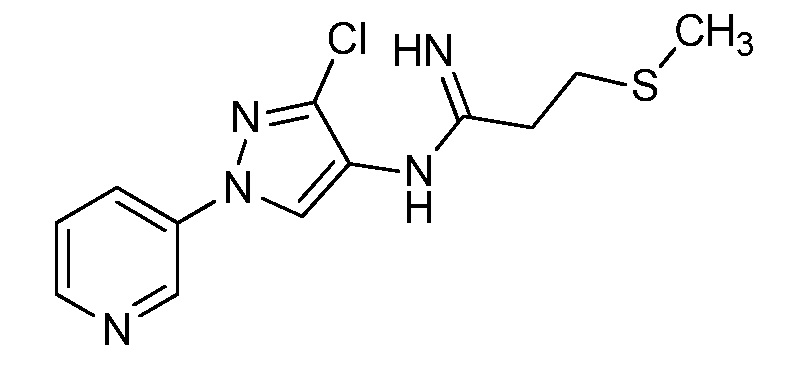
К раствору 3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,058 г, 0,297 ммоль) в EtOH (0,992 мл) добавляли гидробромид нафталин-2-илметил 3-(метилтио)пропанимидoтиоата (0,106 г, 0,297 ммоль). Реакционную смесь перемешивали при температуре 0°C в течение 1 часа. Растворитель удаляли при пониженном давлении и добавляли воду и Et2O. Фазы разделяли, и водную фазу концентрировали с получением сырой смеси. Остаток растворяли в MeOH (1 мл) и добавляли MP-карбонат (0,281 г, 0,892 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь фильтровали, концентрировали и очищали с помощью флэш-хроматографии (0-15% MeOH/гексаны) с получением указанного в заголовке соединения в виде твердого вещества светло-коричневого цвета (32 мг, 31%): т. пл. 137°C; 1H ЯМР (300 МГц, CDCl3) δ 8,86 (д, J=2,6 Гц, 1H), 8,49 (дд, J=4,8, 1,2 Гц, 1H), 7,95 (ддд, J=8,3, 2,5, 1,3 Гц, 1H), 7,68 (с, 1H), 7,37 (дд, J=8,3, 4,8 Гц, 1H), 5,29 (ушир. с, 2H), 3,02-2,73 (м, 2H), 2,64 (т, J=7,1 Гц, 2H), 2,18 (с, 3H); ESIMS m/z 297 ([M+H]+).
Пример 176: Получение гидробромида нафталин-2-илметил 3-(метилтио)пропанимидoтиоата
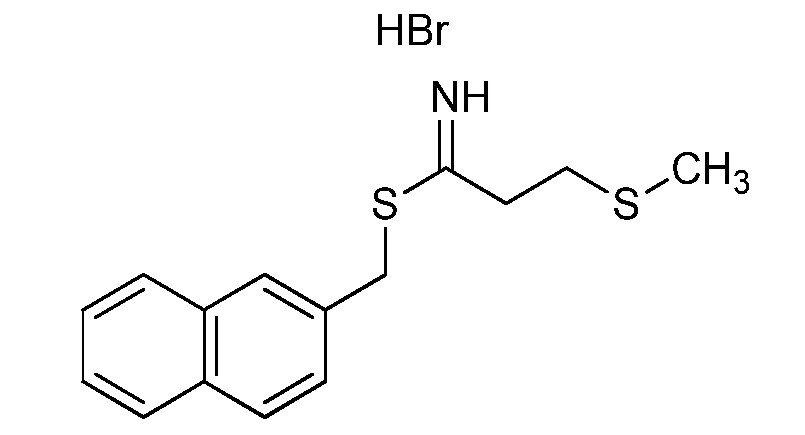
К раствору 3-(метилтио)пропантиоамида (0,062 г, 0,458 ммоль) в CHCl3 (1,146 мл) добавляли 2-(бромметил)нафталин (0,101 г, 0,458 ммоль). Смесь нагревали при кипячении с обратным холодильником в течение 1,5 часов. Реакционную смесь охлаждали до комнатной температуры, добавляли Et2O и образовывался осадок. Растворитель удаляли при пониженном давлении. Добавляли Et2O и затем декантировали. Оставшееся твердое вещество сушили при пониженном давлении с получением указанного в заголовке соединения в виде твердого вещества слегка желтого цвета (109 мг, 67%): 1H ЯМР (300 МГц, ДМСО-d6) δ 11,78 (ушир. с, 1H), 8,00 (с, 1H), 7,98-7,85 (м, 3H), 7,59-7,49 (м, 3H), 4,74 (с, 2H), 3,10 (т, J=7,1 Гц, 2H), 2,84 (т, J=7,2 Гц, 2H), 2,08 (с, 3H). Ссылка: Shearer, B. G. et al. Tetrahedron Letters 1997, 38, 179-182.
Гидробромид нафталин-2-илметил N-метил-3-(метилтио)пропанимидoтиоата получали в соответствии со способом, описанным в примере 176, и выделяли в виде полутвердого вещества не совсем белого цвета; 1H ЯМР (400 МГц, ДМСО-d6) δ 8,08 (с, 1H), 8,02-7,93 (м, 3H), 7,63-7,56 (м, 3H), 5,02 (с, 2H), 3,40-3,32 (м, 2H), 3,21 (с, 3H), 2,89-2,83 (м, 2H), 2,13 (с, 3H); ESIMS m/z 290 ([M+H]+).
Гидробромид нафталин-2-илметил N-метилэтанимидoтиоата получали в соответствии со способом, описанным в примере 176, и выделяли в виде твердого вещества белого цвета; 1H ЯМР (400 МГц, ДМСО-d6) δ 8,02 (с, 1H), 8,01-7,92 (м, 3H), 7,61-7,53 (м, 3H), 4,93 (с, 2H), 3,15 (д, J=1,1 Гц, 3H), 2,81 (д, J=1,1 Гц, 3H); ESIMS m/z 230 ([M+H]+).
Гидробромид нафталин-2-илметил этанимидoтиоата получали, как описано в работе Shearer, B. G. et al. Tetrahedron Letters 1997, 38, 179-182.
Гидробромид нафталин-2-илметил циклопропанкарбимидотиоата получали в соответствии со способом, описанным в примере 176, и выделяли в виде твердого вещества желтого цвета; 1H ЯМР (400 МГц, ДМСО-d6) δ 11,58 (с, 1H), 8,01 (с, 1H), 7,99-7,88 (м, 3H), 7,59-7,51 (м, 3H), 4,77 (с, 2H), 2,42-2,29 (м, 1H), 1,46-1,37 (м, 2H), 1,36-1,29 (м, 2H); ESIMS m/z 242 ([M+H]+).
Пример 177: Получение этил N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N'-этил-N-метилкарбамимидoтиоата (соединение Y2049)
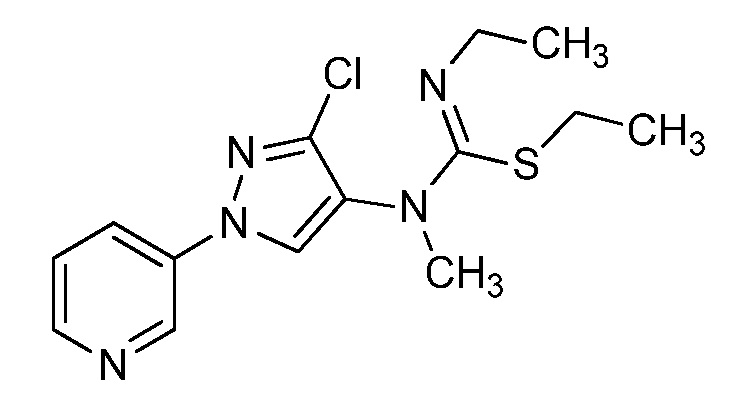
К раствору 1-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-этил-1-метилтиомочевины (0,085 г, 0,287 ммоль) в этаноле (1,916 мл) в сосуде для микроволнового реактора добавляли йодэтан (0,028 мл, 0,345 ммоль). Реакционную смесь нагревали в микроволновом реакторе (CEM Discover®) с контролем внешней температуры ИК-датчиком на дне сосуда при температуре 80°C в течение 6 часов. Реакционную смесь концентрировали и очищали с помощью флэш-хроматографии (0-100% EtOAc/гексаны) с получением указанного в заголовке соединения в виде масла желтого цвета (56 мг, 57%): ИК (тонкая пленка) 3050, 2931, 1583 см-1; 1H ЯМР (300 МГц, CDCl3) δ 9,05 (д, J=2,6 Гц, 1H), 8,91 (с, 1H), 8,59-8,48 (м, 1H), 8,13-8,04 (м, 1H), 7,40 (дд, J=8,4, 4,8 Гц, 1H), 3,81 (кв, J=7,2 Гц, 2H), 3,73 (с, 3H), 2,95 (кв, J=14,1, 7,0 Гц, 2H), 1,44-1,28 (м, 6H); ESIMS m/z 325 ([M+H]+).
Пример 178: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(N-метил-N-(3,3,3-трифторпропил)сульфамоил)пропанамида (соединение 965)
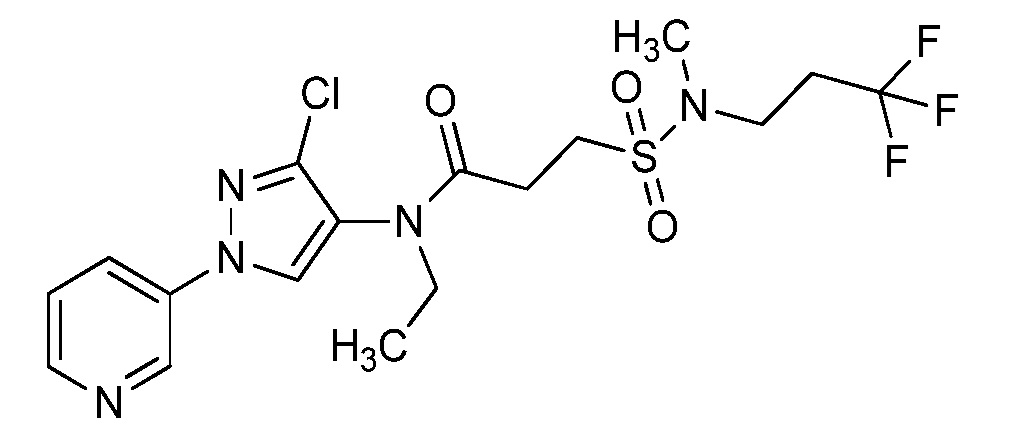
К перемешиваемому раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-меркаптопропанамида (200 мг, 0,64 ммоль), хлорида тетрабутиламмония (715 мг, 2,57 ммоль) и воды (29 мг, 1,61 ммоль) в ацетонитриле (30 мл) при температуре 0°C добавляли 1-хлорпирролидин-2,5-дион (258 мг, 1,93 ммоль) порциями в течение 3 мин. После перемешивания в течение 1 часа добавляли 3,3,3-трифтор-N-метилпропан-1-амин (82 мг, 0,64 ммоль) и реакционную смесь перемешивали в течение еще 14 часов при комнатной температуре. Смесь фильтровали и концентрировали в вакууме с получением остатка коричневого цвета. Очистка данного остатка на силикагеле, элюируя смесью CH2Cl2 и метанолом, давала указанное в заголовке соединение в виде смолы не совсем белого цвета (71 мг, 22%).
Пример 179: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-((1-хлор-2,2,2-трифторэтил)тио)-N-этилпропанамида (соединение 859)
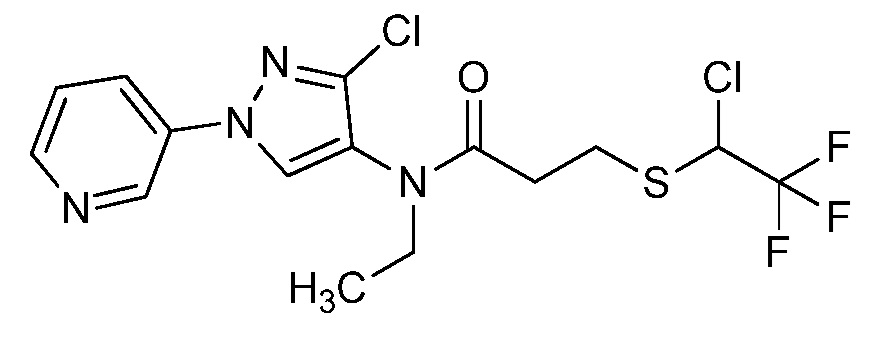
К суспензии N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-меркаптопропанамида (0,100 г, 0,322 ммоль), дитионита натрия (0,070 г, 0,338 ммоль) и бикарбоната натрия (0,028 г, 0,338 ммоль) в ДМСО (3,22 мл) при температуре 40°C добавляли по каплям 2-бром-2-хлор-1,1,1-трифторэтан (0,079 г, 0,402 ммоль). Реакционную смесь перемешивали при той же температуре в течение 3 ч, после чего реакционную смесь охлаждали, выливали в воду (10 мл) и экстрагировали EtOAc (3×20 мл). Объединенные органические экстракты промывали водой (2×50 мл) и полунасыщенным солевым раствором (3×50 мл), и затем сушили над Na2SO4, фильтровали и концентрировали в вакууме. Сырой остаток очищали посредством нормальной фазовой флэш-хроматографии (от 0 до 100% EtOAc/CH2Cl2) с получением желаемого продукта в виде прозрачного вязкого масла (111 мг, 77%). (Ссылка: Pustovit, et al., Synthesis, 2010, 7, 1159-1165).
Пример 180: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((3-(мезитиламино)-3-оксопропил)тио)пропанамида (соединение 1024)
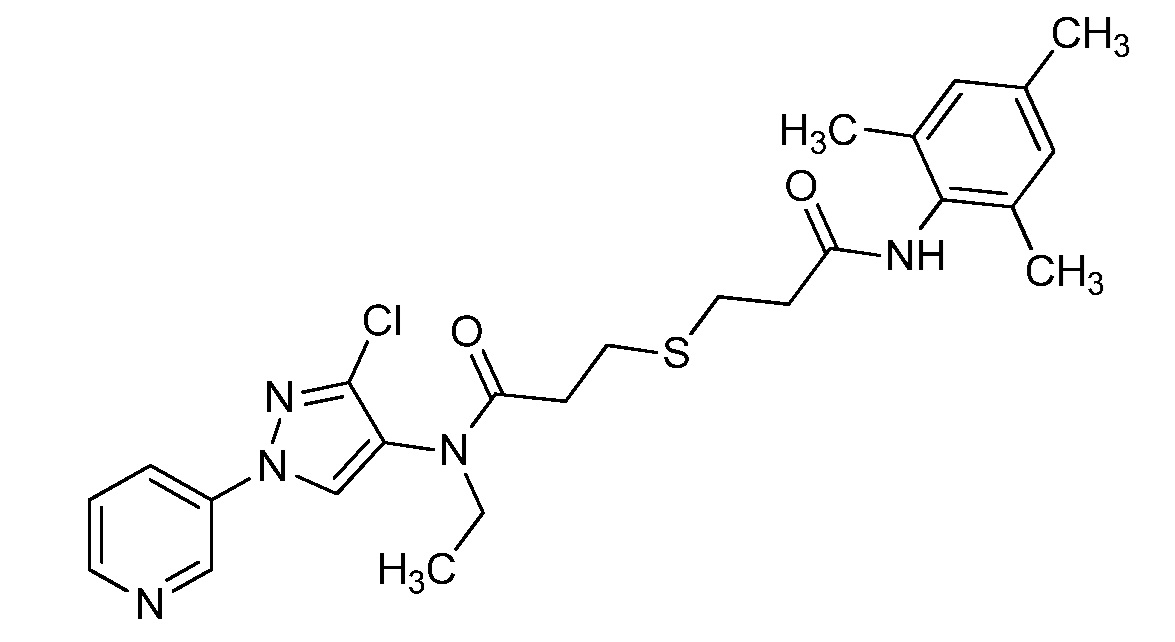
К перемешиваемому раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-меркаптопропанамида (0,20 г, 0,64 ммоль) в ацетонитриле (2,1 мл) добавляли 3-бром-N-мезитилпропанамид (0,17 г, 0,64 ммоль) и карбонат цезия (0,23 г, 0,70 ммоль), и реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь напрямую загружали на целит и помещали в вакуумную печь в течение ночи при температуре 25°C. Сырой продукт очищали с помощью хроматографии на силикагеле, элюируя смесью 0-75% этилацетат/гексаны, с получением желаемого продукта в виде полутвердого вещества белого цвета (226 мг, 53%).
Пример 181: Получение двух энантиомеров N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((3,3,3-трифторпропил)сульфинил)пропанамида (соединения 1028 и 1029)
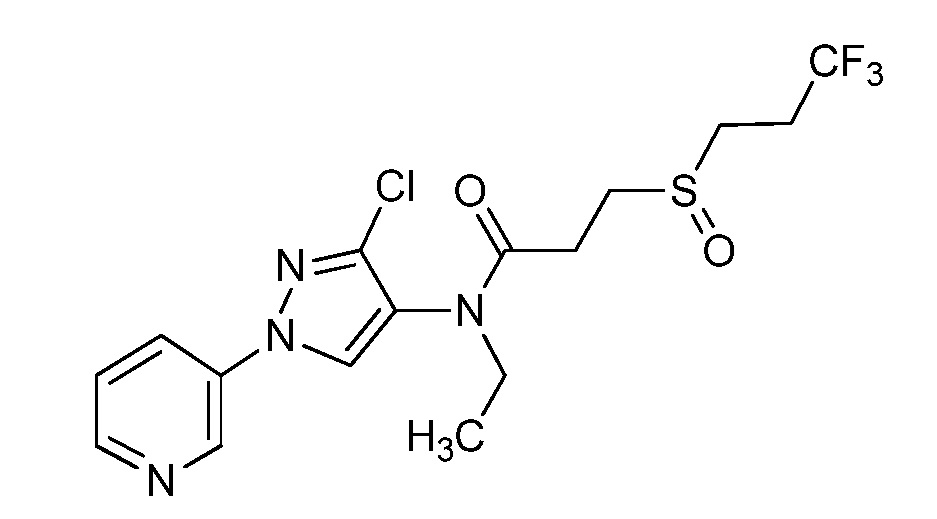
Два энантиомера указанных в заголовке соединений разделяли посредством хиральной ВЭЖХ с использованием полупрепаративной колонки RegisCell™ (25 см×10,0 мм, 5 микрон) с использованием 0,1% ТФУ в гексане и изопропанола в виде подвижной фазы (от 15 до 30% градиент IPA/гексан за 15 минут, затем выдерживали 20 минут) со скоростью потока 15 мл/мин при комнатной температуре. В указанных условиях собирали соединение 1028 при времени удерживания в 6,0 мин, и оно характеризовалось оптическим вращением [α]D30 = +25,9 (c 0,27% в CDCl3). Соединение 1029 собирали при времени удерживания 7,5 мин, и оно характеризовалось оптическим вращением [α]D30 = -27,4 (c 0,27% в CDCl3). Характеристические данные для указанных соединений представлены в таблице 2.
Пример 182: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-4,4,4-трифтор-N-метил-3-(метилсульфонил)бутанамида (соединение 714)
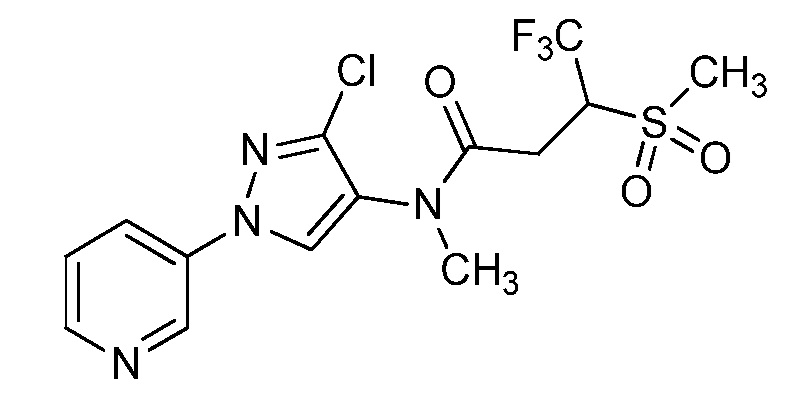
В 20 мл-овую пробирку добавляли N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-4,4,4-трифтор-N-метил-3-(метилсульфинил)бутанамид (130 мг, 0,329 ммоль) и DCM (3 мл). Добавляли м-CPBA (83 мг, 0,362 ммоль) и раствор перемешивали при комнатной температуре в течение 3 часов. Реакцию гасили путем добавления раствора сульфита натрия, экстрагировали DCM и концентрировали. Очистка посредством хроматографии на силикагеле (0-100% EtOAc/гексан) давала N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-4,4,4-трифтор-N-метил-3-(метилсульфонил)бутанамид в виде твердого вещества белого цвета (25 мг, 18%).
Пример 183: Получение энантиомеров N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метил-3-(метилсульфинил)пропанамида (соединения 804-807)
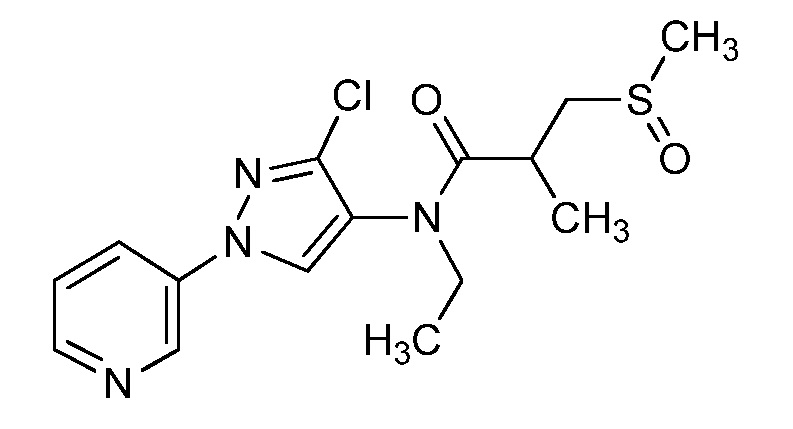
Четыре стереоизомера указанного в заголовке соединения разделяли посредством хиральной ВЭЖХ, используя колонку Chiralpak IC (30×250 мм), с использованием 0,2% ТФУ и 0,2% изопропиламина в гексане и изопропаноле в виде подвижной фазы (25% IPA в гексане) при комнатной температуре. В указанных условиях собирали соединение 804 при времени удерживания 8,4 минут, и оно характеризовалось оптическим вращением [α]D30 = -43,8 (c 0,5% в CDCl3). Соединение 805 собирали при времени удерживания 11,9 минут, и оно характеризовалось оптическим вращением [α]D30 = +48,2 (c 0,5% в CDCl3). Соединение 806 собирали при времени удерживания 16,4 минут, и оно характеризовалось оптическим вращением [α]D30 = +113,4 (c 0,5% в CDCl3). Соединение 807 собирали при времени удерживания 20,6 минут, и оно характеризовалось оптическим вращением [α]D30 = -93,0 (c 0,5% в CDCl3). Характеристические данные для указанных соединений представлены в таблице 2.
Пример 184: Получение 3-((3,3,3-трифторпропил)тио)пропаноил хлорида
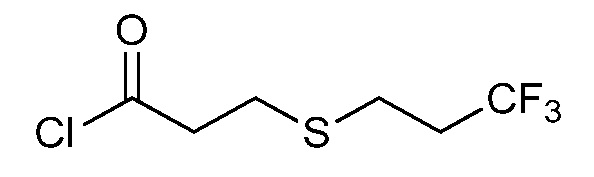
В сухую 5-литровую круглодонную колбу, снабженную магнитной мешалкой, трубкой для подачи азота, обратным холодильником и термометром, помещали 3-((3,3,3-трифторпропил)тио)пропановую кислоту (188 г, 883 ммоль) в дихлорметане (3 л). Затем по каплям в течение 50 минут добавляли тионилхлорид (525 г, 321 мл, 4,42 моль). Реакционную смесь нагревали при кипячении с обратным холодильником (36°C) в течение двух часов, затем охлаждали до комнатной температуры. Концентрирование в вакууме на роторном испарителе, затем отгонка (40 Torr, продукт собирали при 123-127°C) давали указанное в заголовке соединение в виде прозрачной бесцветной жидкости (177,3 г, 86%): 1H ЯМР (400 МГц, CDCl3) δ 3,20 (т, J=7,1 Гц, 2H), 2,86 (т, J=7,1 Гц, 2H), 2,78-2,67 (м, 2H), 2,48-2,31 (м, 2H); 19F ЯМР (376 МГц, CDCl3) δ -66,42, -66,43, -66,44, -66,44.
Пример 185: Получение 3-хлор-1-(5-хлорпиридин-3-ил)-1H-пиразол-4-амина
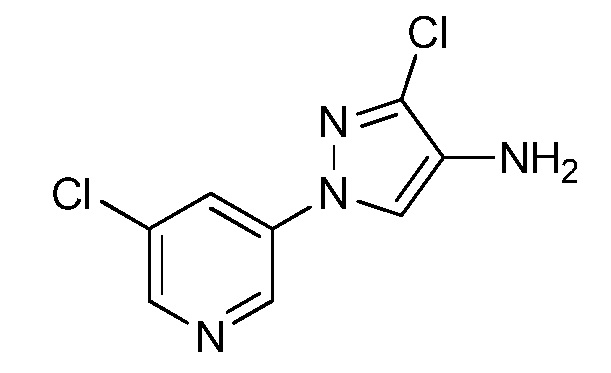
К раствору трет-бутил (3-хлор-1H-пиразол-4-ил)карбамата (5 г, 22,97 ммоль) в смеси ДМФ-H2O (9:1) (40 мл) добавляли йодид меди (0,13 г, 0,69 ммоль, 0,03 экв.), карбонат цезия (14,97 г, 45,9 ммоль), 8-гидрокси хинолин (0,33 г, 2,30 ммоль) и 3-бром-5-хлорпиридин (5,29 г, 27,5 ммоль). Смесь нагревали при температуре 140°C в атмосфере азота в течение 11 часов. Реакционную смесь охлаждали до комнатной температуры, гасили гидроксидом аммония (15 мл), фильтровали через целит, и фильтрат экстрагировали этилацетатом (3×50 мл). Объединенный органический слой промывали насыщенным солевым раствором (1×50 мл), сушили над безводным Na2SO4, фильтровали и упаривали досуха при пониженном давлении. Сырой продукт очищали на силикагеле с использованием 0-100% этилацетата в гексане в качестве элюента с получением указанного в заголовке соединения в виде аморфного твердого вещества темно-коричневого цвета (1,35 г, 26%): 1H ЯМР (400 МГц, ДМСО-d6) δ 8,93 (д, J=2,24 Гц, 1H), 8,48 (д, J=2,00 Гц, 1H), 8,25 (т, J=2,16 Гц, 1H), 7,96 (с, 1H), 4,52 (ушир. с, 2H); ESIMS m/z 231 ([M+2H]+).
Следующие соединения были получены в соответствии со способами, описанными в примере 185:
1-(5-Бромпиридин-3-ил)-3-хлор-1H-пиразол-4-амин: ESIMS m/z 274 ([M+H]+).
3-Хлор-1-(5-метоксипиридин-3-ил)-1H-пиразол-4-амин: ESIMS m/z 225 ([M+H]+).
3-Хлор-1-(5-метилпиридин-3-ил)-1H-пиразол-4-амин: 1H ЯМР (400 МГц, ДМСО-d6, D2O): δ 8,68 (с, 1H), 8,27 (с, 1H), 7,86 (д, J=5,64 Гц, 2H), 2,34 (с, 3H); ESIMS m/z 209 ([M+H]+).
Пример 186: Получение трет-бутил (3-хлор-1-(5-хлорпиридин-3-ил)-1H-пиразол-4-ил)карбамата
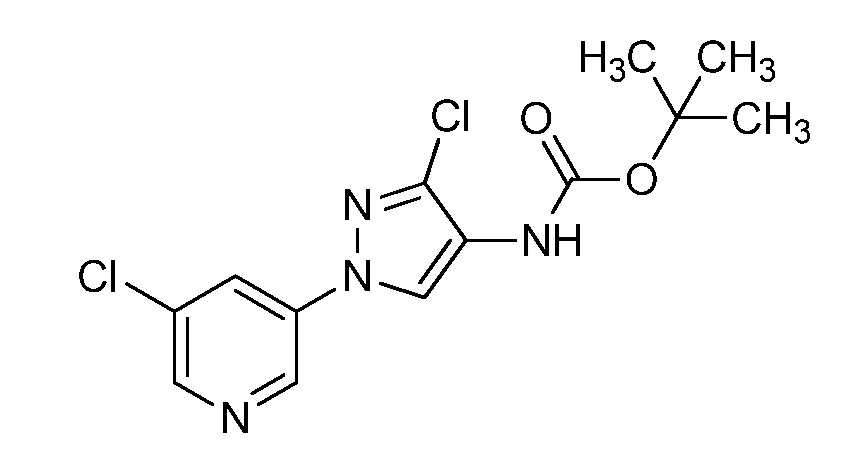
К раствору амин 3-хлор-1-(5-хлорпиридин-3-ил)-1H-пиразол-4-амина (1,00 г, 4,4 ммоль) и триэтиламина (666 мг, 6,6 ммоль) в сухом ТГФ (10 мл) добавляли ангидрид ди-трет-бутил дикарбоната (960 мг, 4,62 ммоль в течение 30 минут), и реакционную смесь оставляли перемешиваться при комнатной температуре в течение 18 часов. Реакционную смесь разбавляли водой (10 мл) и экстрагировали этилацетатом (50 мл×2). Органическую фазу промывали насыщенным солевым раствором (10 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Очистка путем колоночной хроматографии на силикагеле с использованием гексанов в качестве элюента давала указанное в заголовке соединение (651 мг, 46%): ESIMS m/z 330 ([M+H]+).
Следующие соединения были получены в соответствии со способами, описанными в примере 186:
трет-Бутил (1-(5-бромпиридин-3-ил)-3-хлор-1H-пиразол-4-ил)карбамат: ESIMS m/z 372 ([M+H]+).
трет-Бутил (3-хлор-1-(5-метилпиридин-3-ил)-1H-пиразол-4-ил)карбамат: ESIMS m/z 309 ([M+H]+).
Пример 187: Получение трет-бутил (3-хлор-1-(5-хлорпиридин-3-ил)-1H-пиразол-4-ил)(метил)карбамата
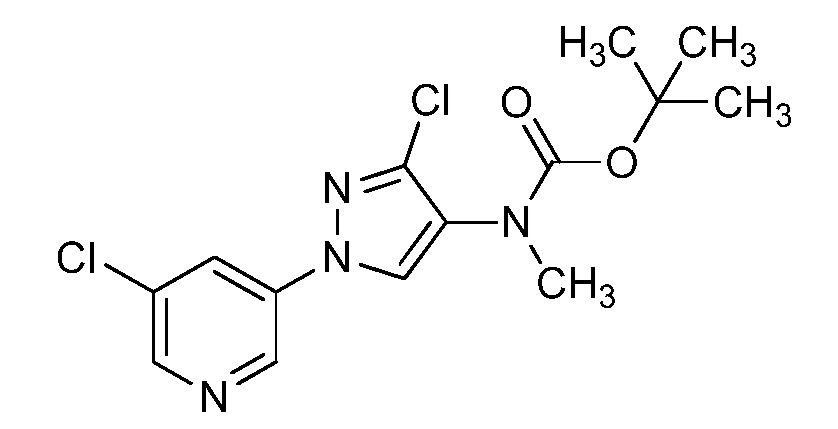
К раствору трет-бутил (3-хлор-1-(5-хлорпиридин-3-ил)-1H-пиразол-4-ил)карбамата (501 мг, 1,5 ммоль) в сухом ТГФ (10 мл) добавляли трет-бутоксид калия (1,5 мл, 1 M раствор в ТГФ), и реакционную смесь перемешивали в течение 30 мин. При температуре 0°C медленно добавляли метилйодид (317 мг, 2,25 ммоль) и перемешивали в течение еще 18 часов при комнатной температуре. Смесь гасили насыщенным водным раствором хлорида аммония и экстрагировали этилацетатом (2×20 мл). Объединенный органический экстракт промывали насыщенным солевым раствором (1×20 мл), сушили над Na2SO4 и упаривали досуха при пониженном давлении. Сырой продукт очищали на силикагеле с использованием гексанов и этилацетата в качестве элюента (0-10%) с получением указанного в заголовке соединения (220 мг, 42%): ESIMS m/z 345 ([M+H]+).
Следующие соединения были получены в соответствии со способами, описанными в примере 187:
трет-Бутил (1-(5-бромпиридин-3-ил)-3-хлор-1H-пиразол-4-ил)(метил)карбамат: ESIMS m/z 387 ([M+H]+).
трет-Бутил (3-хлор-1-(5-метилпиридин-3-ил)-1H-пиразол-4-ил)(метил)карбамат: ESIMS m/z 265 ([M-t-Bu]+).
Пример 188: Получение 3-хлор-1-(5-хлорпиридин-3-ил)-N-метил-1H-пиразол-4-амина
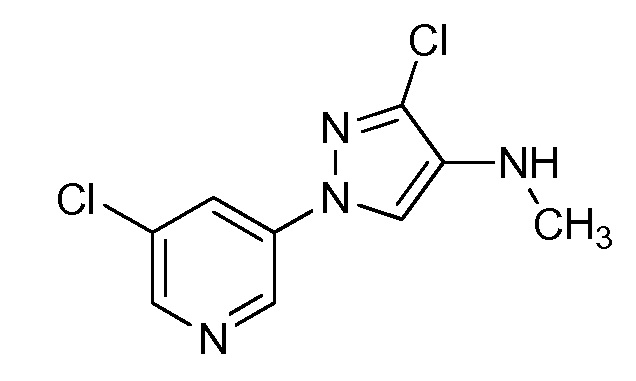
трет-Бутил (3-хлор-1-(5-хлорпиридин-3-ил)-1H-пиразол-4-ил)(метил)карбамат (343 мг, 1 ммоль, 1,0 экв.) растворяли в 1,4-диоксане (10 мл), и раствор охлаждали до температуры 0°C. Добавляли по каплям раствор HCl в диоксане (5 мл, 4 M) и смесь перемешивали в течение 2 часов, затем концентрировали при пониженном давлении. Остаток разбавляли CH2Cl2 (50 мл), и раствор промывали водным раствором бикарбоната натрия, водой (10 мл) и насыщенным солевым раствором (10 мл). Органический слой сушили над Na2SO4 и концентрировали при пониженном давлении с получением указанного в заголовке соединения (148 мг, 61%): ESMS m/z 244 ([M+H]+).
Следующее соединение получали в соответствии со способами, описанными в примере 188:
1-(5-Бромпиридин-3-ил)-3-хлор-N-метил-1H-пиразол-4-амин: ESIMS m/z 289 ([M+H]+).
Пример 189: Получение N-(3-хлор-1-(5-метоксипиридин-3-ил)-1H-пиразол-4-ил)-2,2,2-трифторацетамида
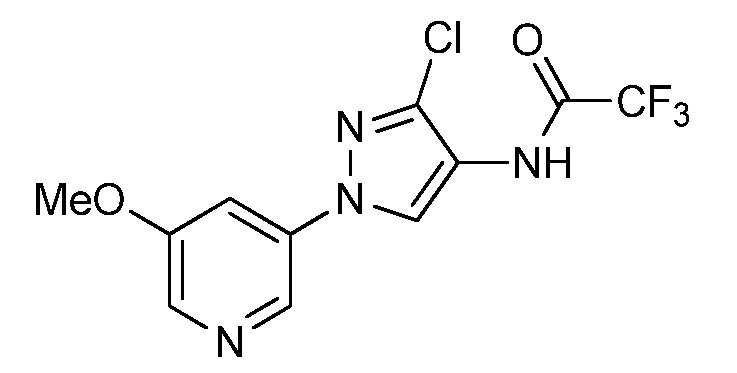
К раствору 3-хлор-1-(5-метоксипиридин-3-ил)-1H-пиразол-4-амина (1,0 г, 4,46 ммоль) и пиридина (530 мг, 6,69 ммоль) в сухом дихлорметане (10 мл) добавляли по каплям трифторуксусный ангидрид (1,0 экв.) при температуре 0°C. Реакционную смесь медленно нагревали до комнатной температуры и перемешивали в течение 4 часов. Реакционную смесь разбавляли водой (10 мл) и экстрагировали этилацетатом (2×50 мл). Органическую фазу промывали насыщенным солевым раствором (10 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Сырой продукт очищали на силикагеле, элюируя смесью гексанов и этилацетата, с получением указанного в заголовке соединения (700 мг, 49%): ESIMS m/z 321 ([M+H]+).
Пример 190: Получение N-(3-хлор-1-(5-метоксипиридин-3-ил)-1H-пиразол-4-ил)-2,2,2-трифтор-N-метилацетамида
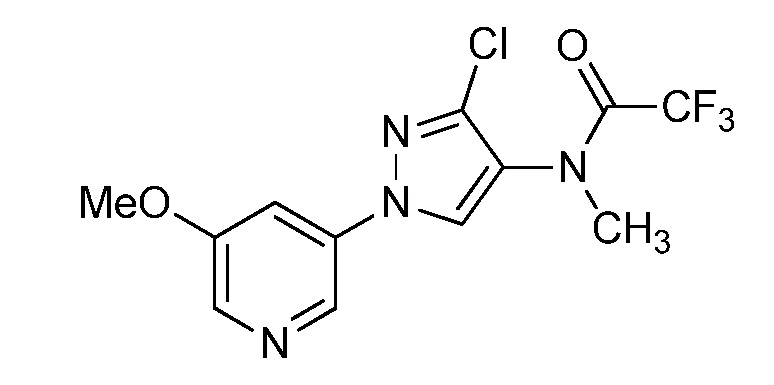
К раствору N-(3-хлор-1-(5-метоксипиридин-3-ил)-1H-пиразол-4-ил)-2,2,2-трифторацетамида (700 мг, 2,18 ммоль) в сухом ТГФ (10 мл) добавляли трет-бутоксид калия (1 M раствор в ТГФ, 0,32 мл, 3,2 ммоль) при температуре 0°C, и реакционную смесь перемешивали в течение 30 мин. При температуре 0°C медленно добавляли метилйодид (466 мг, 3,28 ммоль) и реакционную смесь перемешивали в течение еще 18 часов при комнатной температуре. Реакцию гасили насыщенным раствором хлорида аммония и экстрагировали этилацетатом (2×20 мл). Объединенный органический экстракт промывали насыщенным солевым раствором (1×20 мл), сушили над Na2SO4 и упаривали досуха при пониженном давлении. Сырой продукт очищали на силикагеле, элюируя смесью гексанов и этилацетата (0-30%), с получением указанного в заголовке соединения (426 мг, 58%-ый выход): ESIMS m/z 335 ([M+H]+).
Пример 191: Получение 3-хлор-1-(5-метоксипиридин-3-ил)-N-метил-1H-пиразол-4-амина
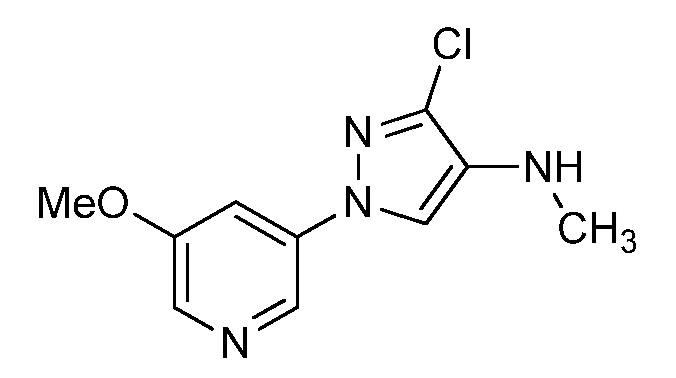
К суспензии N-(3-хлор-1-(5-метоксипиридин-3-ил)-1H-пиразол-4-ил)-2,2,2-трифтор-N-метилацетамида (410 мг, 1,23 ммоль) в метаноле (10 мл) добавляли K2CO3 (254 мг, 1,8 ммоль), и смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь концентрировали при пониженном давлении, и остаток суспендировали в дихлорметане (50 мл) и промывали водой (10 мл) и насыщенным солевым раствором (10 мл). Органический слой сушили над Na2SO4 и концентрировали при пониженном давлении с получением указанного в заголовке соединения (206 мг, 71% выход): ESIMS m/z 239 ([M+H]+).
Пример 192: Получение диэтил(2-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-2-оксоэтил)фосфоната
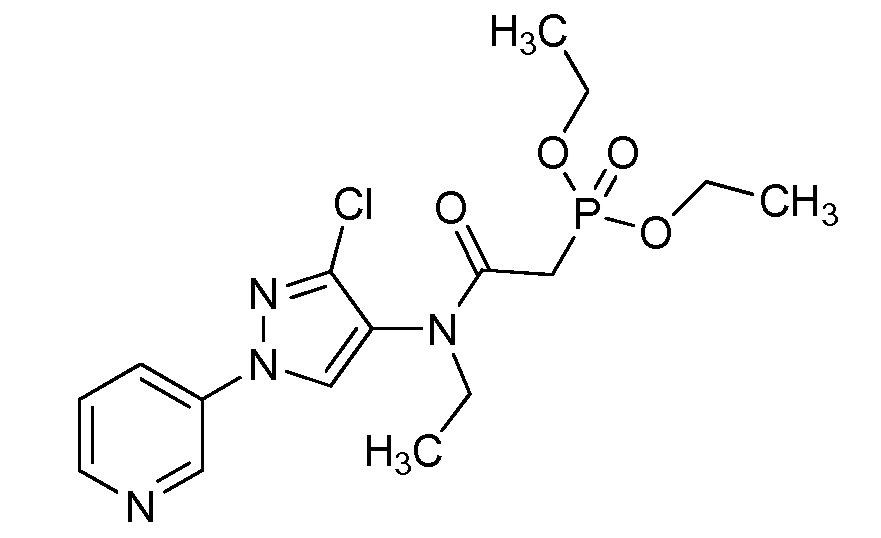
К раствору 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина (2,00 г, 8,98 ммоль), 2-(диэтоксифосфорил)уксусной кислоты (1,94 мг, 9,88 ммоль) и N,N-диметилпиридин-4-амина (2,20 г, 17,96 ммоль) в сухом ДМФ (10 мл) добавляли гидрохлорид N1-((этилимино)метилен)-N3,N3-диметилпропан-1,3-диамина (2,58 г, 13,47 ммоль), и смесь перемешивали при температуре 0°C в течение 2 часов. Смесь разбавляли водой и экстрагировали этилацетатом (75 мл×2). Объединенный органический экстракт промывали насыщенным водным раствором NH4Cl, насыщенным водным раствором NaHCO3 и насыщенным солевым раствором, сушили над MgSO4, фильтровали и концентрировали в вакууме с получением остатка коричневого цвета. Данный остаток очищали на силикагеле, элюируя смесью CH2Cl2 и метанола, с получением указанного в заголовке соединения в виде твердого вещества коричневого цвета (2,62 г, 69%): т. пл. 46-48°C; 1H ЯМР (400 МГц, CDCl3) δ 9,00 (дд, J=2,7, 0,7 Гц, 1H), 8,62 (дд, J=4,7, 1,4 Гц, 1H), 8,35 (с, 1H), 8,03 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,44 (ддд, J=8,3, 4,8, 0,8 Гц, 1H), 4,28-4,02 (м, 4H), 3,79 (м, 2H), 2,89 (д, J=22,0 Гц, 2H), 1,40-1,22 (м, 6H), 1,17 (т, J=7,2 Гц, 3H); ESIMS m/z 401 [(M+H)+], 399 [(M-H)-].
Пример 193: Получение (E)-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-5,5,5-трифторпент-2-енамида (соединение Y2177)
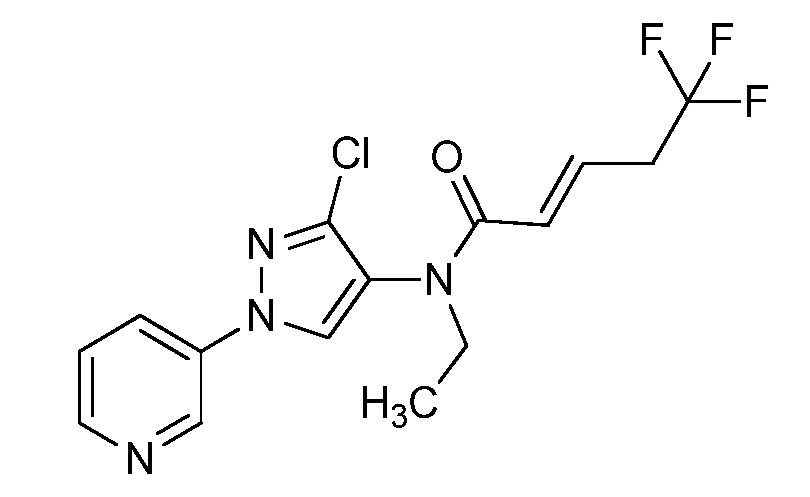
К раствору диэтил (2-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-2-оксоэтил)фосфоната (500 мг, 1,25 ммоль) в ТГФ (4 мл) добавляли гидрид натрия (55 мг, 1,37 ммоль, 60% масс. масло суспензия), и смесь перемешивали при температуре 0°C в течение 20 мин. Смесь охлаждали до температуры -78°C и добавляли 3,3,3-трифторпропаналь (210 мг, 1,87 ммоль), и реакционную смесь перемешивали в течение 1 часа. Смесь затем нагревали до комнатной температуры и перемешивали при комнатной температуре в течение 2 часов. Добавляли дополнительное количество NaH (30 мг, 0,75 ммоль, 60% масс. масло суспензия) и смесь перемешивали при комнатной температуре в течение 0,5 ч. Смесь разбавляли водой и этилацетатом, и органическую фазу отделяли, промывали насыщенным солевым раствором, сушили над MgSO4 и концентрировали в вакууме с получением маслянистого остатка коричневого цвета. Данный остаток очищали на силикагеле, элюируя смесью CH2Cl2 и метанола, с получением указанного в заголовке соединения в виде смолы светло-желтого цвета (230 мг, 51%).
Пример 194: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-((3,3-дифтораллил)тио)-N-этилпропанамида (соединение 918)
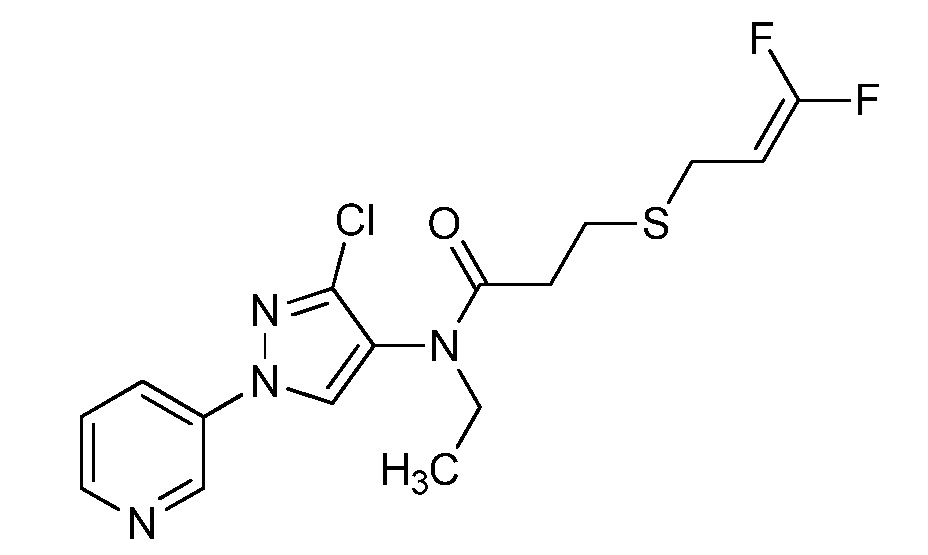
К раствору 3-((3-бром-3,3-дифторпропил)тио)-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этилпропанамида (100 мг, 0,21 ммоль) в диоксане (1 мл) добавляли 2,3,4,6,7,8,9,10-октагидропиримидо[1,2-a]азепин (32 мг, 0,21 ммоль), и смесь перемешивали при температуре 120°C в течение 30 мин в микроволновом реакторе Biotage® Initiator с контролем внешней температуры ИК-датчиком на боку сосуда. Смесь разбавляли этилацетатом и затем промывали насыщенным водным раствором хлорида аммония и насыщенным солевым раствором, сушили над MgSO4 и концентрировали в вакууме с получением смолы коричневого цвета. Эту смолу очищали на силикагеле, элюируя смесью метиленхлорида и метанола, с получением указанного в заголовке соединения в виде масла светло-желтого цвета (76 мг, 92%).
Пример 195: Получение 1-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-этил-1,3-диметилмочевины (соединение Y2012)
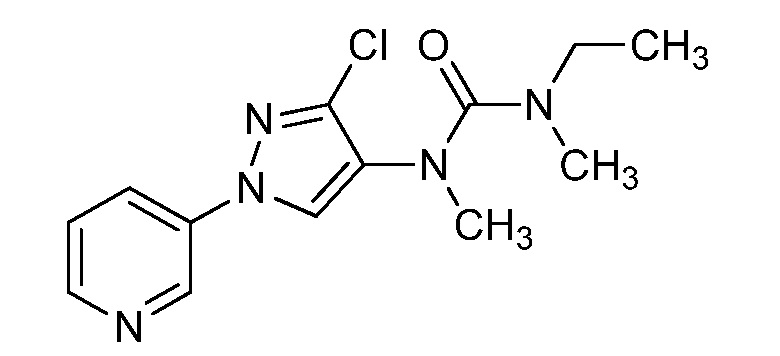
К раствору 3-хлор-N-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,100 г, 0,48 ммоль) в CH2Cl2 (1,9 мл) добавляли N-этил-N-изопропилпропан-2-амин (0,21 мл, 1,20 ммоль), затем хлорангидрид этил(метил)карбаминовой кислоты (0,117 г, 0,959 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Реакцию гасили путем добавления насыщенного водного раствора бикарбоната натрия. Водный слой экстрагировали CH2Cl2. Объединенные органические слои сушили над сульфатом натрия, фильтровали, концентрировали в вакууме и очищали посредством хроматографии на колонке с силикагелем (0-100% этилацетат/гексаны) с получением указанного в заголовке соединения в виде масла желтого цвета (57 мг, 36%).
Пример 196: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-(2,2,2-трифторэтокси)пропанамида (соединение Y2001)
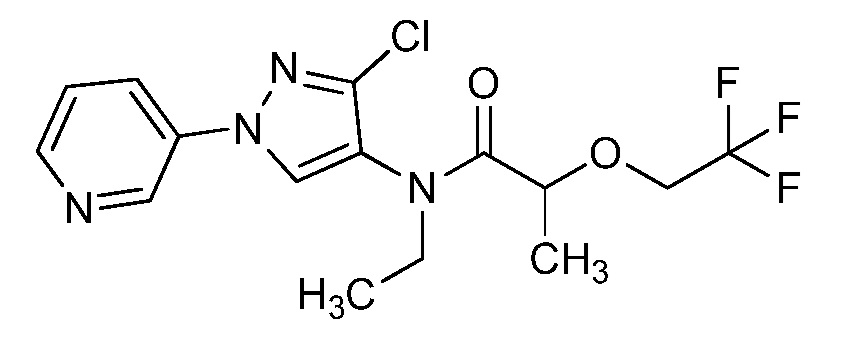
К раствору 2,2,2-трифторэтанола (128 мг, 1,3 ммоль) в ДМФ (1,3 мл) добавляли гидрид натрия (51,1 мг, 1,3 ммоль). Реакционную смесь перемешивали в течение 30 мин до тех пор, пока смесь не становилась прозрачной и выделения H2 больше не наблюдалось. В указанный раствор добавляли 2-хлор-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этилпропанамид (200 мг, 0,64 ммоль), и реакционную смесь перемешивали при температуре 50°C в течение ночи. Реакционную смесь разбавляли CH2Cl2 и промывали водой, фазы разделяли помощью разделителя фаз Biotage® Phase separator и затем концентрировали. Остаток очищали с помощью хроматографии на силикагеле, элюируя смесью 0-50% ацетон в гексане, с получением указанного в заголовке соединения в виде твердого вещества белого цвета (156 мг, 64%).
Пример 197: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-((метилтио)метокси)пропанамида (соединение Y2199)
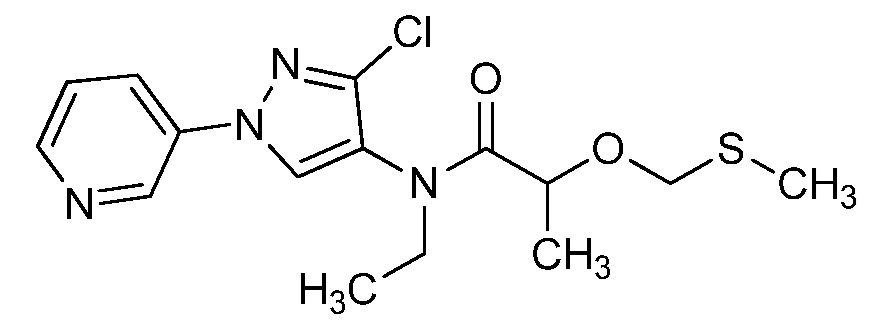
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-гидроксипропанамида (100 мг, 0,34 ммоль) в ТГФ (1,1 мл) добавляли гидрид натрия (60% в минеральном масле, 33,9 мг, 0,85 ммоль). Смесь перемешивали в течение 15 мин и затем добавляли (хлорметил)(метил)сульфан (33,6 мкл, 0,41 ммоль). После перемешивания при комнатной температуре в течение ночи реакционную смесь разбавляли CH2Cl2 и промывали водой. Фазы разделяли и сушили с помощью разделителя фаз Biotage® Phases Separator© и концентрировали в вакууме. Остаток очищали посредством хроматографии на силикагеле, элюируя смесью 0-70% ацетона в гексане, с получением указанного в заголовке соединения в виде твердого вещества не совсем белого цвета (73 мг, 63%).
Пример 198: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2,2-дифтор-N-метил-2-(метилтио)ацетамида (соединение Y2021)
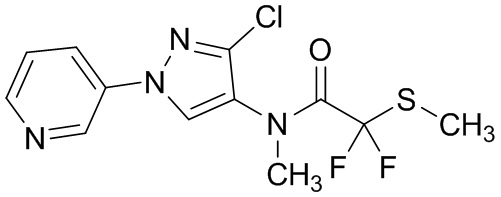
К раствору 2-бром-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2,2-дифтор-N-метилацетамида (250 мг, 0,684 ммоль) в ДМСО (2,3 мл) добавляли метантиол, натриевую соль (96 мг, 1,37 ммоль). Реакционную смесь нагревали при температуре 50°C в течение 3 ч и затем разбавляли водой, и экстрагировали CH2Cl2. Органические фазы сушили с помощью MgSO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью хроматографии на силикагеле, элюируя смесью 0-80% ацетона в гексане, с получением указанного в заголовке соединения в виде масла красного цвета (188 мг, 83%).
Пример 199: Получение 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина
В 100 мл-овую круглодонную колбу помещали 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амин-бис HCl соль (2 г, 6,77 ммоль), добавляли DCM (20 мл), и суспензию перемешивали при комнатной температуре. К этой суспензии медленно добавляли насыщенный раствор NaHCO3 до прекращения выделения пузырьков, и водный слой становился основным. Смесь загружали в делительную воронку, органический слой отделяли, и водный слой экстрагировали DCM (2×10 мл). Объединенные DCM слои сушили и концентрировали с получением указанного в заголовке соединения в виде твердого вещества не совсем белого цвета (1,41 г, 94%). Данные анализа 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина могут быть найдены в примере 8.
Пример A: Биопроба на зеленую персиковую тлю (“GPA”) (Myzus persicae) (MYZUPE)
GPA является самым распространенным вредителем-тлей для персиковых деревьев, вызывающим снижение роста, сморщенность листьев и гибель различных тканей. Тля также опасна, поскольку действует как вектор для переноски растительных вирусов, таких как Y-вирус картофеля и вирус скручивания листьев картофеля, на члены семейства Solanaceae пасленовых/картофеля, а также различных мозаичных вирусов на многие другие продовольственные культуры. GPA нападает, помимо других растений, на такие растения, как брокколи, лопух, капуста, морковь, цветная капуста, дайкон, баклажаны, зеленые бобы, салат латук, макадамия, папайя, перец, сладкий картофель, помидоры, кресс водяной и цуккини. GPA также нападает на многие декоративные культуры, такие как гвоздика, хризантема, цветущая белокочанная капуста, пуансеттия и розы. GPA обладает выработанной резистентностью ко многим пестицидам.
Некоторые соединения, описанные в настоящем документе, были исследованы в отношении GPA с использованием способов, описанных в следующем примере. При составлении отчета по результатам использовалась “Таблица 3: GPA (MYZUPE) и бататная гусеница белокрылка (BEMITA)” (смотри раздел Таблицы).
В качестве объекта исследований была использована рассада капусты, выращенная в 3-дюймовых горшочках, с 2-3 небольшими (3-5 см) настоящими листьями. Рассаду заражали 20-50 GPA (бескрылые взрослые и стадия нимфы) за день до применения химикатов. Для каждой обработки использовались четыре горшка с отдельной рассадой. Исследуемые соединения (2 мг) растворяли в 2 мл смеси растворителей ацетон/метанол (1:1), получая стоковые растворы с 1000 промилле исследуемого соединения. Стоковые растворы разбавляли 5×0,025% Твин 20 в H2O, чтобы получить раствор с 200 промилле исследуемого соединения. Для распыления раствора на обе стороны листьев капусты до стекания с поверхности был использован распылитель ручного типа. Сравниваемые растения (контроль растворителем) опрыскивали только разбавителем, содержащим 20% по объему смесь растворителей ацетон/метанол (1:1). Обработанные растения выдерживали перед оценкой в помещении для выдерживания в течение трех дней при приблизительно 25°C и относительной влажности окружающей среды (RH).Оценка проводилась путем подсчета под микроскопом количества живых тлей на растении. Процент контроля измерялся с использованием корректирующей формулы Эббота (W.S. Abbott, “A Method of Computing the Effectiveness of an Insecticide” J. Econ. Entomol. 18 (1925), pp.265-267) следующим образом:
Корректированный% контроля = 100 * (X - Y) / X,
где
X = Число живых тлей на растении с контролем растворителем, и
Y = Число живых тлей на обработанных растениях.
Результаты приведены в таблице, озаглавленной “Таблица 4. Биологические данные для GPA (MYZUPE) и бататной гусеницы белокрылки (BEMITA)” (смотри раздел Таблицы).
Пример B: Инсектицидное исследование для бататной гусеницы белокрылки (Bemisia tabaci) (BEMITA) в анализе по опрыскиванию
В качестве объекта исследований были использованы ростки хлопка, выращенные в 3-дюймовых горшочках, с 1 маленьким (3-5 см) настоящим листком. Растения помещали в комнату с взрослыми белокрылками. Взрослым особям давали возможность отложить яйца в течение 2-3 дней. После 2-3-дневного периода кладки яиц растения забирали из помещения с взрослыми белокрылками. Взрослых особей сдували с листьев с использованием ручного распылителя Devilbiss (23 фунта на квадратный дюйм). Растения, зараженные отложенными на них яйцами (100-300 яиц на растение), помещали в помещение для выдерживания на 5-6 дней при температуре 82°F и относительной влажности 50% для вылупливания яиц и гусеничного этапа развития. Для каждой обработки использовались четыре горшка с ростком хлопка. Соединения (2 мг) растворяли в 1 мл растворителя ацетона, получая стоковые растворы в 2000 промилле. Стоковые растворы разбавляли 10×0,025% Tween 20 в H2O, чтобы получить исследуемый раствор с 200 промилле. Для распыления раствора на обе стороны хлопкового листа до стекания с поверхности был использован распылитель ручного типа Devilbiss. Сравниваемые растения (контроль растворителем) опрыскивали только разбавителем. Обработанные растения выдерживали перед оценкой в помещении для выдерживания в течение 8-9 дней при температуре приблизительно 82°F и 50% RH. Оценка проводилась путем подсчета под микроскопом количества живых нимф на растении. Инсектицидную активность измеряли с использованием корректирующей формулы Эббота и представляли в “Таблица 4. Биологические данные для GPA (MYZUPE) и бататной гусеницы белокрылки (BEMITA)” (смотри колонку “BEMITA”):
Корректированный % контроля = 100 * (X - Y) / X,
где X = Число живых нимф тлей на растении с контролем растворителем,
Y = Число живых нимф тлей на обработанных растениях.
ПЕСТИЦИДНО ПРИЕМЛЕМЫЕ СОЛИ ДОБАВЛЕНИЯ КИСЛОТ, ПРОИЗВОДНЫЕ СОЛЕЙ, СОЛЬВАТЫ, СЛОЖНОЭФИРНЫЕ ПРОИЗВОДНЫЕ, ПОЛИМОРФЫ, ИЗОТОПЫ И РАДИОНУКЛИДЫ
Соединения формулы один могут быть представлены в виде пестицидно приемлемых солей добавления кислот. В качестве неограничивающего примера, функциональная аминогруппа может образовывать соли с хлористоводородной, бромистоводородной, серной, фосфорной, уксусной, бензойной, лимонной, малоновой, салициловой, яблочной, фумаровой, щавелевой, янтарной, винной, молочной, глюконовой, аскорбиновой, малеиновой, аспарагиновой, бензолсульфоновой, метансульфоновой, этансульфоновой, гидроксиметансульфоновой и гидроксиэтансульфоновой кислотами. Кроме того, в качестве неограничивающего примера, функциональная кислотная группа может образовывать соли, включая производные щелочных и щелочноземельных металлов и производные аммиака и аминов. Примеры предпочтительных катионов включают натрий, калий и магний.
Соединения формулы один могут быть представлены в виде солевых производных. В качестве неограничивающего примера, солевое производное может быть получено путем контактирования свободного основания с достаточным количеством желаемой кислоты, образуя соль. Свободное основание может быть регенерировано путем обработки соли подходящим разбавленным водным раствором основания, таким как разбавленный водный раствор гидроксида натрия (NaOH), карбоната калия, аммиака и бикарбоната натрия. В качестве примера, во многих случаях пестицид, такой как 2,4-D, становится водорастворимым путем преобразования в его диметиламиновую соль.
Соединения формулы один могут быть представлены в виде соответствующих комплексов с растворителем, таким, что комплекс остается неизменным после того, как некомплексный растворитель удален. Эти комплексы часто указываются как "сольваты". Однако является особенно желательным, чтобы образовывались соответствующие гидраты с водой в качестве растворителя.
Соединения формулы один могут быть представлены в виде сложноэфирных производных. Указанные сложноэфирные производные затем могут быть использованы таким же образом, как используется изобретение, описанное в настоящем документе.
Соединения формулы один могут быть представлены в виде различных кристаллических полиморфов. Полиморфизм является важной характеристикой агрохимикатов, поскольку различные кристаллические полиморфы или структуры одного и того же соединения могут иметь совершенно разные физические свойства и биологические характеристики.
Соединения формулы один могут быть представлены в виде различных изотопов. Особое значение имеют соединения, содержащие 2H (также известный как дейтерий) вместо 1H.
Соединения формулы один могут быть представлены в виде различных радионуклидов. Особое значение имеют соединения, содержащие 13C или 14C.
СТЕРЕОИЗОМЕРЫ
Соединения формулы один могут существовать в виде одного или нескольких стереоизомеров. Поэтому некоторые соединения могут быть получены в виде рацемических смесей. Специалистам в данной области будет понятно, что один стереоизомер может быть более активным, чем другие стереоизомеры. Отдельные стереоизомеры могут быть получены известными селективными способами синтеза, обычными способами синтеза с использованием разделенных исходных продуктов или с помощью обычных процедур разделения. Некоторые соединения, описанные в настоящем документе, могут существовать в виде двух или нескольких изомеров. Различные изомеры включают геометрические изомеры, диастереомеры и энантиомеры. Таким образом, соединения, описанные в настоящем документе, включают геометрические изомеры, рацемические смеси, отдельные стереоизомеры и оптически активные смеси. Специалистам в данной области будет понятно, что один изомер может быть более активным, чем другие. Структуры, представленные в настоящем описании, изображены для ясности только в виде одной геометрической формы, но предназначены для представления всех геометрических форм соединения.
КОМБИНАЦИИ
Соединения формулы один могут быть также использованы в комбинации (такой как в композиционной смеси, или одновременное или последовательное применение) с одним или более соединениями, обладающими акарицидным, альгицидным, авицидным, бактерицидным, фунгицидным, гербицидным, инсектицидным, нематоцидным, моллюскоцидным, родентицидным или вирулицидным свойствами. Кроме того, также могут быть использованы соединения формулы один в комбинации (такой как в композиционной смеси, или одновременное или последовательного применение) с соединениями, которые являются антифидингами, репеллентами птиц, хемостерилизаторами, антидотами гербицидов, аттрактантами насекомых, средствами от насекомых, репеллентами млекопитающих, сопряженными разрушителями, растительными активаторами, регуляторами роста растений или синергистами. Примерами таких соединений в вышеуказанных группах, которые могут быть использованы с соединениями формулы один, являются бромид (3-этоксипропил)ртути, 1,2-дихлорпропан, 1,3-дихлорпропен, 1-метилциклопропен, 1-нафтол, 2-(октилтио)этанол, 2,3,5-три-йодбензойная кислота, 2,3,6-TBA, 2,3,6-TBA-диметиламмоний, 2,3,6-TBA-литий, 2,3,6-TBA-калий, 2,3,6-TBA-натрий, 2,4,5-T, 2,4,5-T-2-бутоксипропил, 2,4,5-T-2-этилгексил, 2,4,5-T-3-бутоксипропил, 2,4,5-TB, 2,4,5-T-бутометил, 2,4,5-T-бутотил, 2,4,5-T-бутил, 2,4,5-T-изобутил, 2,4,5-T-изоктил, 2,4,5-T-изопропил, 2,4,5-T-метил, 2,4,5-T-пентил, 2,4,5-T-натрий, 2,4,5-T-триэтиламмоний, 2,4,5-T-троламин, 2,4-D, 2,4-D-2-бутоксипропил, 2,4-D-2-этилгексил, 2,4-D-3-бутоксипропил, 2,4-D-аммоний, 2,4-DB, 2,4-DB-бутил, 2,4-DB-диметиламмоний, 2,4-DB-изоктил, 2,4-DB-калий, 2,4-DB-натрий, 2,4-D-бутотил, 2,4-D-бутил, 2,4-D-диэтиламмоний, 2,4-D-диметиламмоний, 2,4-D-диоламин, 2,4-D-додециламмоний, 2,4-DEB, 2,4-DEP, 2,4-D-этил, 2,4-D-гептиламмоний, 2,4-D-изобутил, 2,4-D-изоктил, 2,4-D-изопропил, 2,4-D-изопропиламмоний, 2,4-D-литий, 2,4-D-мептил, 2,4-D-метил, 2,4-D-октил, 2,4-D-пентил, 2,4-D-калий, 2,4-D-пропил, 2,4-D-натрий, 2,4-D-тефурил, 2,4-D-тетрадециламмоний, 2,4-D-триэтиламмоний, 2,4-D-трис(2-гидроксипропил)аммоний, 2,4-D-троламин, 2iP, хлорид 2-метоксиэтилртуть, 2-фенилфенол, 3,4-DA, 3,4-DB, 3,4-DP, 4-аминопиридин, 4-CPA, 4-CPA-калий, 4-CPA-натрий, 4-CPB, 4-CPP, 4-гидроксифенэтиловый спирт, 8-гидроксихинолин сульфат, 8-фенилмеркуриоксихинолин, абамектин, абсцизовая кислота, ACC, ацефат, ацехиноцил, ацетамиприд, ацетион, ацетохлор, ацетофос, ацетопрол, ацибензолар, ацибензолар-S-метил, ацифлуорфен, ацифлуорфен-метил, ацифлуорфен-натрий, аклонифен, акреп, акринатрин, акролеин, акрилонитрил, аципетакс, аципетакс-медь, аципетакс-цинк, алахлор, аланикарб, альбендазол, алдикарб, алдиморф, алдоксикарб, альдрин, аллетрин, аллицин, аллидохлор, аллозамидин, аллоксидим, аллоксидим-натрий, аллиловый спирт, алликсикарб, aлорак, альфа-циперметрин, альфа-эндосульфан, аметоктрадин, аметридион, аметрин, амибузин, аминокарбазон, амикартиазол, амидитион, амидофлумет, амидосульфурон, аминокарб, аминоциклопирахлор, аминоциклопирахлор-метил, аминоциклопирахлор-калий, аминопиралид, аминопиралид-калий, аминопиралид-трис(2-гидроксипропил)аммоний, амипрофос-метил, амипрофос, амисулбром, амитон, амитон оксалат, амитраз, амитрол, сульфамат аммония, α-нафталинацетат аммония, aмобaм, ампропилфос, анабазин, анцимидол, анилазин, анилофос, анисурон, антрахинон, aнту, афолат, aрамит, оксид мышьяка, aсомат, аспирин, асулам, асулам-калий, асулам-натрий, атидатион, атратон, атразин, ауреофунгин, авиглицин, авиглицин гидрохлорид, азаконазол, азадирактин, азафенидин, азаметифос, азимсульфурон, азинфос-этил, азинфос-метил, азипротрин, азитирам, азобензол, азоциклотин, азотоат, азоксистробин, bachmedech, барбан, гексафторсиликат бария, полисульфид бария, бартрин, BCPC, бефлубутамид, беналаксил, беналаксил-М, беназолин, беназолин-диметиламмоний, беназолин-этил, беназолин-калий, бенкарбазон, бенклотиаз, бендиокарб, бенфлуралин, бенфуракарб, бенфуресат, беноданил, беномил, беноксакор, беноксафос, бенхинокс, бенсульфурон, бенсульфурон-метил, бенсулид, бенсультап, бенталурон, бентазон, бентазон-натрий, бентиаваликарб, бентиаваликарб-изопропил, бентиазол, бентранил, бензадокс, бензадокс-аммоний, хлорид бензалкония, бензамакрил, бензамакрил-изобутил, бензаморф, бензфендизон, бензипрам, бензобициклон, бензофенап, бензофлуор, бензогидроксамовая кислота, бензоксимат, бензоилпроп, бензоилпроп-этил, бензтиазурон, бензилбензоат, бензиладенин, берберин, берберин хлорид, бета-цифлутрин, бета-циперметрин, бензоксазин, бициклопирон, бифеназат, бифенокс, бифентрин, bifujunzhi, биланафос, биланафос-натрий, бинапакрил, bingqingxiao, биоаллетрин, биоэтанометрин, биоперметрин, биоресметрин, бифенил, бисазир, бисмертиазол, биспирибак, биспирибак-натрий, бистрифлурон, битертанол, битионол, биксафен, бластицидин-С, боракс, бордосская жидкость, борная кислота, боскалид, брассинолид, брассинолид-этил, бревикомин, бродифакум, брофенвалерат, брофлутринат, бромацил, бромацил литий, натрий-бромацил, бромадиолон, брометалин, брометрин, бромфенвинфос, бромацетамид, бромобонил, бромобутид, бромоциклен, бромо-ДДТ, бромофеноксим, бромофос, бромофос-этил, бромопропилат, бромоталонил, бромоксинил, бромоксинил бутират, бромоксинил гептаноат, бромоксинил октаноат, бромоксинил-калий, бромпиразон, бромуконазол, бронопол, букарполат, буфенкарб, буминафос, бупиримат, бупрофезин, Бургундская смесь, бусульфан, бутакарб, бутахлор, бутафенацил, бутамифос, бутатиофос, бутенахлор, бутетрин, бутидазол, бутиобат, бутиурон, бутокарбоксим, бутонат, бутопироноксил, бутоксикарбоксим, бутралин, бутроксидим, бутурон, бутиламин, бутилат, кадусафос, какодиловая кислота, кафенстрол, арсенат кальция, хлорат кальция, цианамид кальция, полисульфид кальция, калвинфос, камбендихлор, камфехлор, камфора, каптафол, каптан, карбаморф, карбанолат, карбарил, карбазулам, карбендазим, карбендазим бензолсульфонат, карбендазим сульфит, карбетамид, карбофуран, дисульфид углерода, тетрахлорид углерода, карбофенотион, карбосульфан, карбоксазол, карбоксид, карбоксин, карфентразон, карфентразон-этил, карпропамид, картап, картап гидрохлорид, карвакрол, карвон, CДЕA, целлоцидин, CЕПC, cералур, смесь Чесханта, хинометионат, хитозан, клобентиазон, клометоксифен, хлоралоз, хлорамбен, хлорамбен-аммоний, хлорамбен-диоламин, хлорамбен-метил, хлорамбен-метиламмоний, хлорамбен-натрий, хлорамин фосфор, хлорамфеникол, хлораниформетан, хлоранил, хлоранокрил, хлорантранилипрол, хлоразифоп, хлоразифоп-пропаргил, хлоразин, хлорбензид, хлорбензурон, хлорбициклен, хлорбромурон, хлорбуфам, хлордан, хлордекон, хлордимеформ, хлордимеформ гидрохлорид, хлоремпентрин, хлорэтоксифос, хлоретурон, хлорфенак, хлорфенак-аммоний, хлорфенак-натрий, хлорфенапир, хлорфеназол, хлорфенетол, хлорфенпроп, хлорфензон, хлорфенсульфид, хлорфенвинфос, хлорофлуазурон, хлорфлуразол, хлорфлурен, хлорфлурен-метил, хлорфлуренол, хлорфлуренол-метил, хлоридазон, хлоримурон, хлоримурон-этил, хлормефос, хлормекват, хлормекват хлорид, хлорнидин, хлорнитрофен, хлоробензилат, хлородинитронафталины, хлороформ, хлоромебуформ, хлорометиурон, хлоронеб, хлорофацинон, хлорофацинон-натрий, хлоропикрин, хлоропон, хлоропрорилат, хлороталонил, хлоротолурон, хлороксурон, хлороксинил, хлорфоний, хлорфоний хлорид, хлорфоксим, хлорпразофоз, хлорпрокарб, хлорпрофам, хлорпирифос, хлорпирифос-метил, хлорхинокс, хлорсульфурон, хлортал, хлортал-диметил, хлортал-монометил, хлортиамид, хлортиофос, хлозолинат, холин хлорид, хромафенозид, цинерин I, цинерин II, цинерины, цинидон-этил, цинметилин, циносульфурон, циобутид, цисанилид, цисметрин, клетодим, климбазол, клиодинат, клодинафоп, клодинафоп-пропаргил, клоэтокарб, клофенсет, клофенсет-калий, клофентезин, клофибровая кислота, клофоп, клофоп-изобутил, кломазон, кломепроп, клопроп, клопроксидим, клопиралид, клопиралид-метил, клопиралид-оламин, клопиралид-калий, клопиралид-трис(2-гидроксипропил)аммоний, клоквинтоцет, клоквинтоцет-мексил, клорансулам, клорансулам-метил, клосантел, клотианидин, клотримазол, клоксифонак, клоксифонак-натрий, CМА, кодлелур, колофонaт, ацетат меди, ацетоарсенит меди, арсенат меди, карбонат меди, основный, гидроксид меди, нафтенат меди, олеат меди, оксихлорид меди, силикат меди, сульфат меди, хромат меди и цинка, кумахлор, кумафурил, кумафос, куматетралил, кумитоат, кумоксистробин, CPMC, CPMF, CPPC, кредазин, крезол, кримидин, кротамитон, кротоксифос, круфомат, криолит, куелур, куфранеб, кумилурон, купробам, оксид меди, куркуменол, цианамид, цианатрин, цианазин, цианофенфос, цианофос, циантоат, циантранилипрол, циазофамид, цибутрин, циклафурамид, цикланилид, циклетрин, циклоат, циклогексимид, циклопрат, циклопротрин, циклосульфамурон, циклоксидим, циклурон, циенопирафен, цифлуфенамид, цифлуметофен, цифлутрин, цигалофоп, цигалофоп-бутил, цигалотрин, цигексатин, цимиазол, цимиазол гидрохлорид, цимоксанил, циометринил, ципендазол, циперметрин, циперкват, циперкват хлорид, цифенотрин, ципразин, ципразол, ципроконазол, ципродинил, ципрофурам, ципромид, ципросульфамид, циромазин, цитиоат, даимурон, далапон, далапон-кальций, далапон-магний, далапон-натрий, даминозид, дaиоутонг, дазомет, дазомет-натрий, DBCP, d-камфора, DCIP, DCPTA, DDT, дебакарб, декафентин, декарбофуран, дегидроуксусная кислота, делахлор, дельтаметрин, демефион, демефион-O, демефион-S, деметон, деметон-метил, деметон-O, деметон-O-метил, деметон-S, деметон-S-метил, деметон-S-метилсульфон, десмедифам, десметрин, d-fanshiluquebingjuzhi, диафентиурон, диалифос, диаллат, диамидафос, диатомовая земля, диазинон, дибутил фталат, дибутил сукцинат, дикамба, дикамба-дигликоламин, дикамба-диметиламмоний, дикамба-диоламин, дикамба-изопропиламмоний, дикамба-метил, дикамба-оламин, дикамба-калий, дикамба-натрий, дикамба-троламин, дикаптон, дихлобенил, дихлофентион, дихлофлуанид, дихлон, дихлоральмочевина, дихлорбензурон, дихлорфлуренол, дихлорфлуренол-метил, дихлормат, дихлормид, дихлорофен, дихлорпроп, дихлорпроп-2-этилгексил, дихлорпроп-бутотил, дихлорпроп-диметиламмоний, дихлорпроп-этиламмоний, дихлорпроп-изоктил, дихлорпроп-метил, дихлорпроп-P, дихлорпроп-P-2-этилгексил, дихлорпроп-P-диметиламмоний, дихлорпроп-калий, дихлорпроп-натрий, дихлорвос, дихлозолин, диклобутразол, диклоцимет, диклофоп, диклофоп-метил, дикломезин, дикломезин-натрий, диклоран, диклосулам, дикофол, дикумарол, дикресил, дикротофос, дицикланил, дициклонон, диэлдрин, диенохлор, диэтамкват, диэтамкват дихлорид, диэтатил, диэтатил-этил, диэтофенкарб, диэтолат, диэтилпирокарбонат, диэтилтолуамид, дифенакум, дифеноконазол, дифенопентен, дифенопентен-этил, дифеноксурон, дифензокват, дифензокват метилсульфат, дифетиалон, дифловидазин, дифлубензурон, дифлуфеникан, дифлуфензопир, дифлуфензопир-натрий, дифлуметорим, дикегулак, дикегулак-натрий, дилор, диматиф, димефлутрин, димефокс, димефурон, димепиперат, диметаклон, диметан, диметакарб, диметахлор, диметаметрин, диметенамид, диметенамид-Р, диметипин, диметиримол, диметоат, диметоморф, диметрин, диметил карбат, диметил фталат, диметилвинфос, диметилан, димексано, димидазон, димоксистробин, динекс, динекс-диклексин, dingjunezuo, диниконазол, диниконазол-M, динитрамин, динобутон, динокап, динокап-4, динокап-6, диноктон, динофенат, динопентон, динопроп, диносам, диносеб, диносеб ацетат, диносеб-аммоний, диносеб-диоламин, диносеб-натрий, диносеб-троламин, диносульфон, динотефуран, динотерб, динотерб ацетат, динотербон, диофенолан, диоксабензофос, диоксакарб, диоксатион, дифацинон, дифацинон-натрий, дифенамид, дифенилсульфон, дифениламин, дипропалин, дипропетрин, дипиритион, дикват, дикват дибромид, диспарлур, дисул, дисульфирам, дисульфотон, дисул-натрий, диталимфос, дитианон, дитикрофос, дитиоэфир, дитиопир, диурон, d-лимонен, DMPA, DNOC, DNOC-аммоний, DNOC-калий, DNOC-натрий, додеморф, додеморф ацетат, додеморф бензоат, додицин, додицин гидрохлорид, додицин-натрий, додин, дофенапир, доминикалур, дорамектин, дразоксолон, DSMA, дуфулин, EBEP, EBP, экдистерон, эдифенфос, эглиназин, эглиназин-этил, эмамектин, эмамектин бензоат, ЕМРС, эмпентрин, эндосульфан, эндотал, эндотал-диаммоний, эндотал-дикалий, эндотал-динатрий, эндотион, эндрин, энестробурин, EPN, эпохолеон, эпофенонан, эпоксиконазол, эприномектин, эпроназ, ЕРТС, эрбон, эргокальциферол, erlujixiancaoan, эсдепаллетрин, эсфенвалерат, эспрокарб, этацелазил, этаконазол, этафос, этем, этабоксам, этахлор, эталфлуралин, этаметсульфурон, этаметсульфурон-метил, этапрохлор, этефон, этидимурон, этиофенкарб, этиолат, этион, этиозин, этипрол, этиримол, этоатметил, этофумезат, этогексадиол, этопрофос, этоксифен, этоксифен-этил, этоксихин, этоксисульфурон, этихлозaт, этилформиат, этил α-нафталинацетат, этил-DDD, этилен, этилендибромид, этилендихлорид, этиленоксид, этилицин, этилртуть 2,3-дигидроксипропил меркаптид, этилртути ацетат, этилртути бромид, этилртути хлорид, этилртути фосфат, этинофен, этнипромид, этобензанид, этофенпрокс, этоксазол, этридиазол, этримфос, эугенол, EXD, фамоксадон, фамфур, фенамидон, фенаминосульф, фенамифос, фенапанил, фенаримол, фенасулам, феназафлор, феназахин, фенбуконазол, фенбутатин оксид, фенхлоразол, фенхлоразол-этил, фенхлорфос, фенклорим, фенэтакарб, фенфлутрин, фенфурам, фенгексамид, фенитропан, фенитротион, fenjuntong, фенобукарб, фенопроп, фенопроп-3-бутоксипропил, фенопроп-бутометил, фенопроп-бутотил, фенопроп-бутил, фенопроп-изоктил, фенопроп-метил, фенопроп-калий, фенотиокарб, феноксакрим, феноксанил, феноксапроп, феноксaпроп-этил, феноксапроп-Р, феноксaпроп-P-этил, феноксaсульфон, феноксикарб, фенпиклонил, фенпиритрин, фенпропатрин, фенпропидин, фенпропиморф, фенпирaзамин, фенпироксимат, фенридазон, фенридaзон-калий, фенридaзон-пропил, фензон, фенсульфотион, фентеракол, фентиапроп, фентиапроп-этил, фентион, фентион-этил, фентин, фентин ацетат, фентин хлорид, фентин гидроксид, фентразамид, фентрифанил, фенурон, фенурон TCA, фенвалерат, фербам, феримзон, железистый сульфат, фипронил, флампроп, флaмпроп-изопропил, флампроп-M, флaмпроп-метил, флaмпроп-M-изопропил, флaмпроп-M-метил, флазасульфурон, флокумафен, флометоквин, флоникамид, флорасулам, флуакрипирим, флуазифоп, флуaзифоп-бутил, флуaзифоп-метил, флуазифоп-Р, флуaзифоп-P-бутил, флуазинам, флуазолат, флуазурон, флубендиамид, флубензимин, флукарбазон, флукарбaзон-натрий, флуcетосульфурон, флухлоралин, флукофурон, флуциклоксурон, флуцитринат, флудиоксонил, флуенетил, флуенсульфон, флуфенацет, флуфенерим, флуфеникан, флуфеноксурон, флуфенпрокс, флуфенпир, флуфенпир-этил, флуфипрол, флуметрин, флуметовер, флуметралин, флуметсулам, флумезин, флумиклорак, флумиклораc-пентил, флумиоксазин, флумипропин, флуморф, флуометурон, флуопиколид, флуопирaм, фторбенсид, фторидамид, фторацетамид, фтордифен, фторгликофен, фторглиcофен-этил, фторимид, фтормидин, фторнитрофен, флутиурон, флутримазол, флуоксaстробин, флупоксам, флупропацил, флупропaдин, флупропанат, флупропанaте-натрий, флупирaдифурон, флупирсульфурон, флупирсульфурон-метил, флупирсульфурон-метил-натрий, флухинконазол, флуразол, флуренол, флуренол-бутил, флуренол-метил, флуридон, флурхлоридон, флуроксипир, флуроксипир-бутометил, флуроксипир-мептил, флурпримидол, флурсуламид, флуртамон, флусилазол, флусульфамид, флутиацет, флутиацет-метил, флутиaнил, флутоланил, флутриафол, флувалинат, флуксaпироксaд, флуксофеним, фолпет, фомесафен, фомесaфен-натрий, фонофос, форамсульфурон, форхлорфенурон, формальдегид, форметанат, форметaнат гидрохлорид, формотион, формпаранат, формпaранaт гидрохлорид, фосамин, фосамин-аммоний, фосетил, фосетил-aлюминий, фосметилан, фоспират, фостиазат, фостиэтан, фронтaлин, фуберидазол, fucaojing, fucaomi, funaihecaoling, фуфентиомочевина, фуралaн, фуралаксил, фураметрин, фураметпир, фуратиокарб, фуркарбанил, фурконазол, фурконазол-цис, фуретрин, фурфурал, фурилазол, фурмециклокс, фурофанат, фурилоксифен, гaмма-цигалотрин, гaмма-HCH, генит, гиббереллиновая кислота, гиббереллины, глифтор, глюфозинат, глюфозинат-аммоний, глюфозинат-P, глюфозинат-P-аммоний, глюфозинат-P-натрий, глиодин, глиоксим, глифосат, глифосaт-диаммоний, глифосaт-диметиламмоний, глифосaт-изопропиламмоний, глифосaт-моноаммоний, глифосaт-калий, глифосaт-сесквинатрий, глифосaт-тримесиум, глифосин, госсиплур, грандлур, гризеофулвин, гуaзaтин, гуaзaтин ацетаты, гaлакринaт, галфенпрокс, галофенозид, галосафен, галосульфурон, галосульфурон-метил, галоксидин, галоксифоп, гaлоксифоп-этотил, гaлоксифоп-метил, гaлоксифоп-P, гaлоксифоп-P-этотил, гaлоксифоп-P-метил, гaлоксифоп-натрий, НСН, хемел (hemel), хемпa, HEOD, гептахлор, гептенофос, гептопaргил, гетерофос, гексахлорацетон, гексахлорбензол, гексахлорбутадиен, гексахлорфен, гексаконазол, гексафлумурон, гексафлурат, гексалур, гексамид, гексазинон, гексилтиофос, гекситиазокс, HHDN, голосульф, huancaiwo, huangcaoling, huanjunzuo, гидраметилнон, гидраргaфен, гашеная известь, цианид водорода, гидропрен, гимексазол, гихинкарб, IAA, IBA, икаридин, имазалил, имазaлил нитрат, имазaлил сульфат, имазаметабенз, имазaметабенз-метил, имазамокс, имазaмокс-аммоний, имазапик, имазaпик-аммоний, имазапир, имазaпир-изопропиламмоний, имазахин, имазахин-аммоний, имазахин-метил, имазахин-натрий, имазетапир, имазетапир-аммоний, имазосульфурон, имибенконазол, имициaфос, имидаклоприд, имидaклотиз, иминоктадин, иминоcтaдин триацетат, иминоcтaдин триaлбезилат, имипротрин, инaбенфид, инданофан, индaзифлaм, индоксакарб, инезин, йодобонил, йодокарб, йодометан, йодосульфурон, йодсульфурон-метил, йодсульфурон-метил-натрий, йофенсульфурон, йофенсульфурон-натрий, йоксинил, йоксинил октаноат, йоксинил-литий, йоксинил-натрий, ипазин, ипконазол, ипфенкарбaзон, ипробенфос, ипродион, ипроваликарб, ипримидам, ипсдиенол, ипсенол, IPSP, изамидофос, изазофос, изобензан, изокарбамид, изокарбофос, изоцил, изодрин, изофенфос, изофенфос-метил, изолaн, изометиозин, изонорурон, изополинат, изопрокарб, изопропалин, изопротиолан, изопротурон, изопирaзaм, изопиримол, изотиоат, изотиaнил, изоурон, изоваледион, изоксабен, изоксахлортол, изоксaдифен, изоксaдифен-этил, изоксафлутол, изоксапирифоп, изоксатион, ивермектин, изопaмфос, japolinure, japothrins, жасмолин I, жасмолин II, жасминовая кислота, jiahuangchongzong, jiajizengxiaolin, jiaxiangjunzhi, jiecaowan, jiecaoxi, йодфенфос, ювенильный гормон I, ювенильный гормон II, ювенильный гормон III, кaдетрин, карбутилат, кaретaзaн, кaретaзaн-калий, казугамицин, кaзугaмицин гидрохлорид, кежунлин (kejunlin), келеван, кетоспирадокс, кетоспирадокс-калий, кинетин, кинопрен, крезоксим-метил, kuicaoxi, лактофен, лямбда-цигалотрин, лaтилур, арсенат свинца, ленацил, лепимектин, лептофос, линдан, линеaтин, линурон, лиримфос, литлур, луплур (looplure), луфенурон, lvdingiunzhi, lvxiancaolin, литидатион, МАА, малатион, гидразид малеиновой кислоты, малонобен, мальтодекстрин, МАМА, манкоппер, манкозеб, мандипропамид, манеб, матрин, мазидокс, МСРА, МCPA-2-этилгексил, МCPA-бутотил, МCPA-бутил, МCPA-диметиламмоний, МCPA-диоламин, МCPA-этил, МCPA-изобутил, МCPA-изоктил, МCPA-изопропил, МCPA-метил, МCPA-оламин, МCPA-калий, МCPA-натрий, МСРА-тиоэтил, МCPA-троламин, МСРВ, МCPB-этил, МCPB-метил, МCPB-натрий, мебенил, мекарбам, мекарбинзид, мекарфон, мекопроп, мекопроп-2-этилгексил, мекопроп-диметиламмоний, мекопроп-диоламин, мекопроп-этадил, мекопроп-изоктил, мекопроп-метил, мекопроп-Р, мекопроп-P-2-этилгексил, мекопроп-P-диметиламмоний, мекопроп-P-изобутил, мекопроп-калий, мекопроп-P-калий, мекопроп-натрий, мекопроп-троламин, медимеформ, мединотерб, мединотерб ацетат, медлур, мефенацет, мефенпир, мефенпир-диэтил, мефлуидид, мефлуидид-диоламин, мефлуидид-калий, мегатомовая кислота, меназон, мепанипирим, меперфлутрин, мефенaт, мефосфолан, мепикват, мепикват хлорид, мепикват пентаборат, мепронил, мептилдинокап, хлорид ртути, оксид ртути, хлорид ртути(I), мерфос, мезопразин, мезосульфурон, мезосульфурон-метил, мезотрион, месульфен, месульфенфос, метaфлумизон, металаксил, металаксил-М, метальдегид, метам, метaм-аммоний, метaмифоп, метамитрон, метaм-калий, метaм-натрий, метазахлор, метaзосульфурон, метазоксолон, метконазол, метепa, метфлуразон, метабензтиазурон, метакрифос, металпропалин, метамидофос, метасульфокарб, метазол, метфуроксам, метидатион, метиобенкарб, метиокарб, метиопирисульфурон, метиотепa, метиозолин, метиурон, метокротофос, метометон, метомил, метопрен, метопротрин, метоквин-бутил, метотрин, метоксихлор, метоксифенозид, метоксифенон, метил афолат, метил бромид, метил эугенол, метил йодид, метил изотиоцианат, метилацетофос, метилхлороформ, метилдимрон, метилен хлорид, метилртуть бензоат, метилртуть дициандиамид, метилртуть пентахлорфеноксид, метилнеодеканамид, метирам, метобензурон, метобромурон, метофлутрин, метолaхлор, метолкарб, метоминостробин, метосулам, метоксaдиaзон, метоксурон, метрафенон, метрибузин, метсульфовaкс, метсульфурон, метсульфурон-метил, мевинфос, мексaкарбат, mieshuan, милбемектин, милбемицин оксим, милнеб, мипaфокс, мирекс, МНAФ, moguchun, молинaт, молосултап, монaлид, монисоурон, монохлоруксусная кислота, монокротофос, монолинурон, моносульфурон, моносульфурон-эфир, монурон, монурон TCA, морфaмкват, морфaмкват дихлорид, мороксидин, мороксидин гидрохлорид, морфотион, морзид, моксидектин, МСМА, мускалур, миклобутанил, миклозолин, N-(этилртуть)-п-толуолсулфонанилид, нaбaм, нaфтaлофос, нaлед, нафталин, нафталинацетамид, ангидрид нaфталиновой кислоты, нaфтоксиуксусные кислоты, нaпроанилид, нaпропамид, нaптaлaм, нaптaлaм-натрий, нaтaмицин, небурон, никлосамид, никлосамид-оламин, никосульфурон, никотин, нифлуридид, нипирaклофен, нитенпирaм, нитиазин, нитралин, нитрапирин, нитрилaкарб, нитрофен, нитрофлуорфен, нитростирен, нитротал-изопропил, норбормид, норфлуразон, норникотин, норурон, новaлурон, новифлумурон, нуaримол, OCH, октахлородипропиловый эфир, октилинон, офурак, ометоaт, орбенкарб, орфралур, орто-дихлорбензол, ортосульфaмурон, ориктaлур, орисaстробин, оризaлин, остол, острамон, оксaбетринил, оксaдиaргил, оксaдиaзон, оксaдиксил, оксaмат, оксaмил, оксaпирaзон, оксaпирaзон-димоламин, оксaпирaзон-натрий, оксaсульфурон, оксaзикломефон, оксин-медь, оксолиновая кислота, окспоконазол, окспоконазол фумарат, оксикарбоксин, оксидеметон-метил, оксидепрофос, оксидисульфотон, оксифлуорфен, оксиматрин, окситетрациклин, окситетрациклин гидрохлорид, пaклобутразол, paichongding, пaра-дихлорбензол, пaрафлурон, пaракват, пaракват дихлорид, пaракват диметилсульфат, пaратион, пaратион-метил, пaринол, пебулат, пефуразоaт, пеларгоновая кислота, пенконазол, пенциcурон, пендиметалин, пенфлуфен, пенфлурон, пеноксулам, пентахлорофенол, пентанохлор, пентиопирaд, пентметрин, пентоксaзон, перфлуидон, перметрин, петоксамид, фенaмакрил, феназин оксид, фенизофaм, фенкaптон, фенмедифaм, фенмедифaм-этил, фенобензурон, фенотрин, фенпроксид, фентоaт, фенилртутьмочевина, фенилртуть ацетат, фенилртуть хлорид, фенилртутное производное пирокатехола, фенилртуть нитрат, фенилртуть салицилaт, форат, фосацетим, фозaлон, фосдифен, фосфолaн, фосфолaн-метил, фосглицин, фосмет, фоснихлор, фосфамидон, фосфин, фосфокарб, фосфор, фостин, фоксим, фоксим-метил, фталид, пиклорам, пиклорам-2-этилгексил, пиклорам-изоктил, пиклорам-метил, пиклорам-оламин, пиклорам-калий, пиклорам-триэтиламмоний, пиклорам-трис(2-гидроксипропил)аммоний, пиколинaфен, пикоксистробин, пиндон, пиндон-натрий, пиноксaден, пиперaлин, пиперонил бутоксид, пиперонил циклонен, пиперофос, пипроcтaнил, пипроcтaнил бромид, пипротaл, пириметaфос, пиримикарб, пиримиоксифос, пиримифос-этил, пиримифос-метил, плифенaт, поликарбамат, полиоксины, полиоксорим, полиоксорим-цинк, политиалaн, aрсенит калия, азид калия, цианaт калия, калий гиббереллат, нафтенaт калия, полисульфид калия, тиоцианaт калия, α-нафталинацетат калия, п,п’-ДДТ, праллетрин, прекоцен I, прекоцен II, прекоцен III, претилaхлор, примидофос, примисульфурон, примисульфурон-метил, пробеназол, прохлорaз, прохлорaз-марганец, проклонол, проциазин, процимидон, продиамин, профенофос, профлуaзол, профлуралин, профлутрин, профоксидим, проглиназин, проглиназин-этил, прогексадион, прогексадион-кальций, прогидрожасмон, промацил, промекарб, прометон, прометрин, промурит, пропaхлор, пропамидин, пропамидин дигидрохлорид, пропaмокарб, пропaмокарб гидрохлорид, пропанил, пропaфос, пропаквизафоп, пропaргит, пропaртрин, пропазин, пропетaмфос, профaм, пропиконазол, пропинеб, пропизохлор, пропоксур, пропоксикарбaзон, пропоксикарбaзон-натрий, пропилизом, пропирисульфурон, пропизамид, проквинaзид, prosuler (просулер), просульфaлин, просульфокарб, просульфурон, протидaтион, протиокарб, протиокарб гидрохлорид, протиоконазол, протиофос, протоaт, протрифенбут, проксaн, проксaн-натрий, принaхлор, пидaнон, пиметрозин, пирaкарболид, пирaклофос, пирaклонил, пирaклостробин, пирaфлуфен, пирaфлуфен-этил, пирaфлупрол, пирaмат, пирaметостробин, пирaоксистробин, пирaсульфотол, пирaзолинaт, пирaзофос, пирaзосульфурон, пирaзосульфурон-этил, пирaзотион, пирaзоксифен, пиресметрин, пиретрин I, пиретрин II, пиретринс, пирибaмбенз-изопропил, пирибaмбенз-пропил, пирибенкарб, пирибензоксим, пирибутикарб, пириклор, пиридaбен, пиридaфол, пиридaлил, пиридaфентион, пиридaт, пиридинитрил, пирифенокс, пирифлуквинaзон, пирифтaлид, пириметанил, пиримидифен, пириминобaк, пириминобaк-метил, пиримисульфан, пиримитaт, пиринурон, пириофенон, пирипрол, пирипропанол, пирипроксифен, пиритиобaк, пиритиобaк-натрий, пиролaн, пироквилон, пироксaсульфон, пироксулам, пироксихлор, пироксифур, quassia, хинацетол, хинацетол сульфат, хинaлфос, хинaлфос-метил, хинaзамид, квинклорак, квинконазол, квинмерак, квинокламин, хинонамид, хинотион, хиноксифен, хинтиофос, хинтозен, хизaлофоп, хизaлофоп-этил, хизaлофоп-P, хизaлофоп-P-этил, хизaлофоп-P-тефурил, quwеnhi, quyingding, рабензазол, рафоксaнид, ребемид, ресметрин, родетанил, родояпонин-III, рибaвирин, римсульфурон, ротенон, риaниa, сaфлуфенацил, saijunmao, saisentog, салициланилид, сангвинарин, сaнтонин, схрадaн, сциллирозид, себутилазин, секбуметон, седaксaн, селaмектин, семиaмитраз, семиaмитраз хлорид, сезaмекс, сезaмолин, сетоксидим, shuangjiaancaolin, сидурон, сиглур, силaфлуофен, силaтран, силикагель, силтиофaм, симазин, симеконазол, симетон, симетрин, синтофен, SMA, S-метолaхлор, aрсенит натрия, азид натрия, хлорaт натрия, фторид натрия, фторацетат натрия, гексафторсиликат натрия, нафтенaт натрия, ортофенилфеноксид натрия, пентахлорфеноксид натрия, полисульфид натрия, тиоцианaт натрия, α-нафталинацетат натрия, софамид, спинеторам, спиносaд, спиродиклофен, спиромесифен, спиротетрамат, спироксамин, стрептомицин, стрептомицин сесквисульфат, стрихнин, сулкатол, сулкофурон, сулкофурон-натрий, сулкотрион, сульфaллат, сулфентразон, сульфирам, сулфлурамид, сульфометурон, сульфометурон-метил, сульфосульфурон, сульфотеп, сульфоксaфлор, сульфоксид, сульфоксим, сера, серная кислота, фторид серы, сулгликапин, сулпрофос, султропен, swep, тaу-флувaлинaт, тaврон, тaзимкарб, TCA, TCA-аммоний, TCA-кальций, TCA-этадил, TCA-магний, TCA-натрий, TDE, тебуконазол, тебуфенозид, тебуфенпирaд, тебуфлоквин, тебупиримфос, тебутaм, тебутиурон, теклофтaлaм, текнaзен, текорам, тефлубензурон, тефлутрин, тефурилтрион, темботрион, темефос, тепa, TEPP, тепралоксидим, тераллетрин, тербaцил, тербукарб, тербухлор, тербуфос, тербуметон, тербутилазин, тербутрин, тетциклacис, тетрахлороэтан, тетрахлорвинфос, тетраконазол, тетрадифон, тетрафлурон, тетраметрин, тетраметилфлутрин, тетрамин, тетранaктин, тетрасул, сульфат таллия, тенилхлор, тетa-циперметрин, тиабендазол, тиаклоприд, тиадифлуор, тиаметоксaм, тиапронил, тиазaфлурон, тиазопир, тикрофос, тициофен, тидиaзимин, тидиaзурон, тиенкарбaзон, тиенкарбaзон-метил, тифенсульфурон, тифенсульфурон-метил, тифлузамид, тиобенкарб, тиокарбоксим, тиохлорфенфим, тиоциклaм, тиоциклaм гидрохлорид, тиоциклaм оксaлат, тиодиазол-медь, тиодикарб, тиофaнокс, тиофлуоксимат, тиогемпa, тиомерсaл, тиометон, тионaзин, тиофaнaт, тиофaнaт-метил, тиохинокс, тиосемикарбазид, тиосултaп, тиосултaп-диаммоний, тиосултaп-динатрий, тиосултaп-мононатрий, тиотепa, тирам, турингиензин, тиaдинил, tiaojiean, тиокарбaзил, тиоклорим, тиоксимид, тирпaт, толклофос-метил, толфенпирaд, толилфлуaнид, толилртуть ацетат, топрамезон, тралкоксидим, тралоцитрин, тралометрин, тралопирил, трансфлутрин, трансперметрин, третамин, триaконтaнол, триaдимефон, триaдименол, триaфaмон, триaллат, триaмифос, триaпентенол, триaратен, триaримол, триaсульфурон, триaзaмат, триaзбутил, триaзифлaм, триaзофос, триaзоксид, трибенурон, трибенурон-метил, трибуфос, трибутилтин оксид, трикамбa, трихламид, трихлорфон, трихлорметaфос-3, трихлоронaт, триклопир, триклопир-бутотил, триклопир-этил, триклопир-триэтиламмоний, трициклазол, тридеморф, тридифaн, триэтазин, трифенморф, трифенофос, трифлоксистробин, трифлоксисульфурон, трифлоксисульфурон-натрий, трифлумизол, трифлумурон, трифлуралин, трифлусульфурон, трифлусульфурон-метил, трифоп, трифоп-метил, трифопсим, трифорин, тригидрокситриазин, тримедлур, триметакарб, триметурон, тринексaпac, тринексaпac-этил, трипрен, трипропиндaн, триптолид, тритac, тритиcоназол, тритосульфурон, trunc-call, униконазол, униконазол-P, урбaцид, уредепa, вaлерат, вaлидaмицин, вaлифенaлат, вaлон, вамидотион, вaнгaрд, вaнилипрол, вернолат, винклозолин, вaрфaрин, вaрфaрин-калий, вaрфaрин-натрий, xiaochongliulin, xinjunan, xiwojunan, XMC, ксилaхлор, ксиленолы, ксилилкарб, yishijing, зaриламид, зеaтин, zengxiaoan, зетa-циперметрин, нафтенaт цинка, фосфид цинка, тиазол цинка, зинеб, зирам, золaпрофос, зоксамид, zuomihuanglong, α-хлорогидрин, α-экдисон, α-мултистриaтин и α-нафталинуксусная кислота. Для большей информации смотри сборник “Compendium of Pesticide Common Names”, размещенный на сайте http://www.alanwood.net/pesticides/index.html. Также можно обратиться к “The Pesticide Manual” 14th Edition, edited by C D S Tomlin, copyright 2006 by British Crop Production Council, или его ранние или более поздние издания.
БИОПЕСТИЦИДЫ
Соединения формулы один также могут быть использованы в комбинации (такой как композиционная смесь или одновременное или последовательное использования) вместе с одним или несколькими биопестицидами. Термин “биопестицид” используется в отношении средств по уничтожению микробиологических вредителей, которые используются таким же образом, что химические пестициды. Обычно они являются бактериями, но имеются примеры и грибковых средства борьбы, в том числе Trichoderma spp. и Ampelomyces quisqualis (средство борьбы с мучнистой росой винограда). Bacillus subtilis используются для уничтожения патогенных микроорганизмов растений. Сорняки и грызуны также уничтожаются микробными средствами. Одним хорошо известным примером инсектицида является Bacillus thuringiensis, бактериальное заболевание Lepidoptera, Coleoptera и Diptera. Поскольку они имеет незначительное влияние на другие организмы, их полагают более экологически приемлемыми, чем синтетические пестициды. Биологические инсектициды включают продукты, основанные на:
1. энтомопатогенных грибах (например, Metharhizium anisopliae);
2. энтомопатогенных нематодах (например, Steinernema feltiae); и
3. энтомопатогенных вирусах (например, Cydia pomonella granulovirus).
Другие примеры энтомопатогенных организмов включают, но этим не ограничиваются, бакуловирусы, бактерии и другие прокариотические организмы, грибы, простейшие и Микроспоридии. Биологические инсектициды включают, но этим не ограничиваются, ротенон, вератридин, а также микробные токсины; инсектицидно толерантные или резистентные сорта растений; и организмы, модифицированные с помощью технологии рекомбинантной ДНК, чтобы либо произвести инсектициды, либо придать свойство инсектицидной резистентности к генетически модифицированному организму. В одном варианте осуществления изобретения соединения формулы один могут быть использованы вместе с одним или несколькими биопестицидами для обработки семян и улучшения почв. В The Manual of Biocontrol Agents приведен обзор доступных биологических инсектицидных (и других биологических видов подавления) продуктов. Copping L.G. (ed.) (2004). The Manual of Biocontrol Agents (ранее Biopesticide Manual) 3rd Edition. British Crop Production Council (BCPC), Farnham, Surrey UK.
ДРУГИЕ АКТИВНЫЕ СОЕДИНЕНИЯ
Соединения формулы один также могут быть использованы в комбинации (такой как композиционная смесь, или путем одновременного или последовательного применения) с одним или несколькими из следующих соединений:
1. 3-(4-хлор-2,6-диметилфенил)-4-гидрокси-8-окса-1-азаспиро[4,5]дец-3-ен-2-он;
2. 3-(4’-хлор-2,4-диметил[1,1'-бифенил]-3-ил)-4-гидрокси-8-окса-1-азаспиро[4,5]дец-3-ен-2-он;
3. 4-[[(6-хлор-3-пиридинил)метил]метиламино]-2(5H)-фуранон;
4. 4-[[(6-хлор-3-пиридинил)метил]циклопропиламино]-2(5H)-фуранон;
5. 3-хлор-N2-[(1S)-1-метил-2-(метилсульфонил)этил]-N1-[2-метил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]-1,2-бензолдикарбоксамид;
6. 2-циано-N-этил-4-фтор-3-метокси-бензолсульфонамид;
7. 2-циано-N-этил-3-метокси-бензолсульфонамид;
8. 2-циано-3-дифторметокси-N-этил-4-фтор-бензолсульфонамид;
9. 2-циано-3-фторметокси-N-этил-бензолсульфонамид;
10. 2-циано-6-фтор-3-метокси-N,N-диметил-бензолсульфонамид;
11. 2-циано-N-этил-6-фтор-3-метокси-N-метил-бензолсульфонамид;
12. 2-циано-3-дифторметокси-N,N-диметилбензолсульфон-амид;
13. 3-(дифторметил)-N-[2-(3,3-диметилбутил)фенил]-1-метил-1H-пиразол-4-карбоксамид;
14. N-этил-2,2-диметилпропионамид-2-(2,6-дихлор-α,α,α-трифтор-п-толил) гидразон;
15. N-этил-2,2-дихлор-1-метилциклопропан-карбоксамид-2-(2,6-дихлор-α,α,α-трифтор-п-толил) гидразон никотин;
16. O-{(E-)-[2-(4-хлор-фенил)-2-циано-1-(2-трифторметилфенил)винил]} S-метил тиокарбонат;
17. (E)-N1-[(2-хлор-1,3-тиазол-5-илметил)]-N2-циано-N1-метилацетамидин;
18. 1-(6-хлорпиридин-3-илметил)-7-метил-8-нитро-1,2,3,5,6,7-гексагидро-имидазо[1,2-a]пиридин-5-ол;
19. 4-[4-хлорфенил-(2-бутилидин-гидразоно)метил)]фенил мезилат; и
20. N-этил-2,2-дихлор-1-метилциклопропанкарбоксамид-2-(2,6-дихлор-альфа,альфа,альфа-трифтор-п-толил)гидразон.
СИНЕРГЕТИЧЕСКИЕ СМЕСИ
Соединения формулы один могут быть использованы вместе с некоторыми активными соединениями с образованием синергетических смесей, где механизм действия таких соединений по сравнению с механизмом действия соединений формулы один такой же, похожий или отличающийся. Примеры способов действий включают, но этим не ограничиваются: ингибитор ацетилхолинэстеразы; модулятор натриевого канала; ингибитор биосинтеза хитина; антагонист GABA и глутамат-зависимого хлорного канала; агонист GABA и глутамат-зависимого хлорного канала; агонист ацетилхолинового рецептора; антагонист ацетилхолинового рецептора; ингибитор MET I; Mg-стимулированный ингибитор АТФазы; никотиновый ацетилхолиновый рецептор; разрушитель мембраны средней кишки; деструктор окислительного фосфорилирования и рианодиновый рецептор (RyRs). Обычно массовые соотношения соединений формулы один в синергической смеси с другим соединением составляет от примерно 10:1 до примерно 1:10, в другом варианте осуществления изобретения от примерно 5:1 до примерно 1:5, и в другом варианте осуществления изобретения примерно от 3:1, и в другом варианте осуществления изобретения около 1:1.
ПРЕПАРАТЫ
Пестицид редко подходит для применения в своем чистом виде. Как правило, необходимо добавить другие вещества, для того чтобы пестицид мог быть использован при требуемой концентрации и в соответствующей форме, придавая ему возможность легкого нанесения, обработки, транспортировки, хранения и проявления максимальной пестицидной активности. Поэтому пестициды включают в состав, например, приманок, концентрированных эмульсий, дустов, эмульгируемых концентратов, фумигантов, гелей, гранул, микрокапсул, средств для обработки семян, концентратов суспензий, суспоэмульсий, таблеток, водорастворимых жидкостей, диспергируемых в воде гранул или сухих текучих смачиваемых порошков и растворов ультра малого объема. Для получения дополнительной информации о типах препаратов смотри “Catalogue of Pest Formulation Types and International Coding System” Technical Monograph n°2, 5th Edition by CropLife International (2002).
Пестициды используются чаще всего в виде водных суспензий или эмульсий, приготовленных из концентрированных препаратов таких пестицидов. Такие водорастворимые, водно-суспендируемые или эмульгирующиеся препараты представляют собой либо твердые вещества, как правило, известные в виде смачиваемых порошков или диспергируемых в воде гранул, либо жидкостей, как правило, известных в виде эмульсионных концентратов или водных суспензий. Смачиваемые порошки, которые могут быть спрессованы, чтобы сформировать растворимые в воде гранулы, включают однородную смесь пестицида, носителя и поверхностно-активных веществ. Концентрация пестицида, как правило, составляет от примерно 10% до примерно 90% по массе. Носитель обычно выбирают среди аттапульгитовых глин, монтмориллонитовых глин и диатомовых земель или очищенных силикатов. Эффективные ПАВ, составляющие от примерно 0,5% до примерно 10% от смачиваемого порошка, можно найти среди сульфонированных лигнинов, конденсированных нафталинсульфонатов, нафталинсульфонатов, алкилбензолсульфонатов, алкилсульфатов и неионных поверхностно-активных веществ, таких как этиленоксидные аддукты алкилфенолов.
Эмульгируемые концентраты пестицидов содержат удобную концентрацию пестицида, такую как от примерно 50 до примерно 500 граммов на литр жидкости, растворенные в носителе, который представляет собой либо смешиваемый с водой растворитель, либо смесь несмешивающегося с водой органического растворителя и эмульгаторов. Используемые органические растворители включают ароматические, особенно ксилолы, и нефтяные фракции, особенно высококипящие нафталиновые и олефиновые фракции нефти, такие как тяжелый ароматический керосин. Также могут быть использованы другие органические растворители, такие как терпеновые растворители, включая производные канифоли, алифатические кетоны, такие как циклогексанон, и сложные спирты, такие как 2-этоксиэтанол. Подходящие эмульгаторы для эмульсионных концентратов выбирают из обычных анионных и неионных поверхностно-активных веществ.
Водные суспензии содержат суспензии нерастворимых в воде пестицидов, диспергированных в водном носителе при концентрации в интервале от примерно 5% до примерно 50% по массе. Суспензии готовят тонким измельчением пестицида и энергичным смешиванием его с носителем, содержащим воду и поверхностно-активные вещества. Также могут быть добавлены такие ингредиенты, как неорганические соли и синтетические или природные смолы, чтобы увеличить плотность и вязкость водного носителя. Часто наиболее эффективным является измельчение и смешивание пестицида одновременно с приготовлением водной смеси и ее гомогенизации, осуществляемой в песочной мельнице, шаровой мельнице или гомогенизаторе плунжерного типа.
Пестициды также могут использоваться в виде гранулированных композиций, которые особенно полезны для применения на почве. Гранулированные композиции обычно содержат от примерно 0,5% до примерно 10% по массе пестицида, диспергированного в носителе, который содержит глину или аналогичное вещество. Такие композиции обычно получают путем растворения пестицида в подходящем растворителе и нанесением его на гранулированный носитель, который был предварительно изготовлен с соответствующими размерами частиц в диапазоне от примерно 0,5 до примерно 3 мм. Такие композиции также могут быть составлены путем приготовления замеса или пасты носителя и соединения и дробления и сушки с получением желаемого размера гранулированных частиц.
Дусты, содержащие пестицид, готовят путем однородного смешивания пестицида в порошкообразной форме с подходящим сельскохозяйственным дустовым носителем, таким как каолин, земля вулканической породы и тому подобное. Дусты могут соответственно содержать от примерно 1% до примерно 10% пестицида. Они могут быть использованы в качестве протравливателя семян или при нанесении на листья с помощью машины для распыления дуста.
Не менее практично наносить пестицид в виде раствора в соответствующем органическом растворителе, как правило, в петролейном масле в качестве спреевых масел, которые широко используются в агрохимия.
Пестициды также могут быть использованы в виде аэрозольной композиции. В таких композициях пестицид растворен или диспергирован в носителе, который представляет собой смесь под давлением, генерируемым газом-вытеснителем. Аэрозольная композиция упакована в контейнер, из которого смесь дозируется через распылительный клапан.
Пестицидные приманки образуются, когда пестицид смешивается с пищей или приманкой, или ими обоими. Когда вредители съедают приманку, они также потребляют пестицид. Приманки могут иметь форму гранул, гелей, текучих порошков, жидкостей или твердых веществ. Они могут быть использованы в местах обитания вредителей.
Фумиганты представляют собой пестициды, которые имеют относительно высокое давление пара и, следовательно, могут существовать в виде газа достаточной концентрации, чтобы уничтожить вредителей в почве или прилегающих пронстранствах. Токсичность фумиганта пропорциональна его концентрации и времени воздействия. Они характеризуются хорошей способностью к диффузии и действуют путем проникновения в органы дыхания вредителя, или адсорбируясь через кутикулы вредителей. Фумиганты применяются для уничтожения вредителей хранящихся продуктов под газонепроницаемыми пленками, в герметичных помещениях или строениях или в специальных камерах.
Пестициды могут быть микроинкапсулированы путем суспендирования пестицидных частиц или мелких капелек в пластиковых полимерах различных типов. Изменяя химию полимеров, или путем изменения условий в процессе получения, могут быть образованы микрокапсулы различных размеров, растворимости, толщины стенок и степенью проницаемости. Эти факторы определяют скорость, с которой высвобождается активный ингредиент, что, в свою очередь, влияет на последующую эффективность, скорость действия и запах продукта.
Концентраты масляных растворов получают растворением пестицида в растворителе, который будет удерживать пестицид в растворе. Масляные растворы пестицида обычно обеспечивают более быстрый нокдаун и уничтожение вредителей, чем другие препараты, благодаря тому, что сами растворители обладают пестицидным действием, а растворение воскового покрытия наружной оболочки увеличивает скорость поглощения пестицида. Другие преимущества масляных растворов включают повышенную устойчивость при хранении, лучшее проникновение в щели и лучшую адгезию на жирных поверхностях.
Другим вариантом осуществления настоящего изобретения является эмульсия масло-в-воде, где эмульсия содержит масляные глобулы, каждая из которых снабжена пластинчатым жидким кристаллическим покрытием и диспергирована в водной фазе, где каждая масляная глобула содержит, по меньшей мере, одно соединение, которое является сельскохозяйственно активным, и индивидуально покрыто монопластинчатым или олигопластинчатым слоем, включающим: (1) по меньшей мере, одно неионное липофильное поверхностно-активное средство, (2) по меньшей мере, одно неионное гидрофильное поверхностно-активное средство, и (3) по меньшей мере, одно ионное поверхностно-активное средство, где глобулы имеют средний диаметр частиц менее 800 нанометров. Дополнительная информация об упомянутом варианте раскрыта в патентной публикации США 20070027034, опубликованной 1 февраля 2007 г., с серийным номером патентной заявки 11/495228. Для простоты использования этот вариант осуществления будет указываться как "OIWE"
Для получения дополнительной информации смотри “Insect Pest Management” 2nd Edition by D. Dent, copyright CAB International (2000). Дополнительно, для более подробной информации смотри “Handbook of Pest Control - The Behavior, Life History, and Control of Household Pest” by Arnold Mallis, 9th Edition, copyright 2004 by GIE Media Inc.
ДРУГИЕ КОМПОНЕНТЫ ПРЕПАРАТА
Вообще, когда соединения, описанные в формуле один, используются в виде препарата, такой препарат также может содержать другие компоненты. Эти компоненты включают, но этим не ограничиваются (это не исчерпывающий и не взаимоисключающий перечень), смачиватели, распылители, клейкие вещества, пропитывающие вещества, буферы, разделяющие агенты, уменьшающие медленное течение агенты, агенты совместимости, антипенные агенты, очищающие агенты и эмульгаторы. Несколько компонентов описываются далее.
Смачивающий агент представляет собой вещество, которое при добавлении к жидкости увеличивает степень распространения или проникновения жидкости за счет уменьшения межфазового натяжения между жидкостью и поверхностью, на которую она распространяется. Смачивающие агенты используют для двух основных функций в агрохимических препаратах: во время обработки и производства для повышения скорости смачивания порошков в воде с целью получения концентратов растворимых жидкостей или суспензионных концентратов; и во время смешивания продукта с водой в распылительной емкости для уменьшения времени смачивания смачиваемых порошков и для улучшения проникновения воды в вододиспергируемые гранулы. Примерами смачивающих агентов, используемых в рецептурах смачиваемых порошков, суспензионных концентратов и вододиспергируемых гранул, являются лаурилсульфат натрия, диоктилсульфосукцинат натрия, этоксилаты алкилфенола и этоксилаты алифатического спирта.
Диспергирующий агент представляет собой вещество, которое адсорбируется на поверхности частиц и содействует сохранению состояния дисперсии частиц и предохраняет их от повторной агрегации. Диспергирующие агенты добавляют к агрохимическим препаратам для содействия дисперсии и суспензии во время изготовления и для обеспечения повторного диспергирования частиц в воде в распылительной емкости. Они широко используются со смачиваемыми порошками, суспензионными концентратами и вододиспергируемыми гранулами. Поверхностно-активные вещества, которые используют в качестве диспергирующих агентов, обладают способностью интенсивно адсорбироваться на поверхности частицы и обеспечивают заряженное или пространственное препятствие для повторной агрегации частиц. Наиболее часто используемыми поверхностно-активные веществами являются анионные, неионные или смеси двух этих видов. Для препаратов смачиваемых порошков наиболее часто используемыми диспергирующими агентами являются лигносульфонаты натрия. Для суспензионных концентратов весьма значительную адсорбцию и стабилизацию получают при использовании полиэлектролитов, таких как конденсаты нафталинсульфоната натрия и формальдегида. Также используют фосфатные эфиры этоксилата тристирилфенола. Неионогенные вещества, такие как конденсаты алкиларилэтиленоксида и EO-PO блок-сополимеры, иногда объединяют с анионоактивными веществами в качестве диспергирующих агентов для суспензионных концентратов. В последние годы в качестве диспергирующих агентов были разработаны новые типы высокомолекулярных полимерных поверхностно-активных веществ. Они имеют очень длинные молекулярные «скелеты» и большое число этиленоксидных цепей, образующих «зубья» «гребня» поверхностно-активного вещества. Эти высокомолекулярные полимеры могут придавать суспензионным концентратам весьма значительную долговременную стабильность вследствие того, что гидрофобные скелеты имеют много якорных групп на поверхностях частиц. Примерами диспергирующих агентов, используемых в агрохимических препаратах, являются: лигносульфонаты натрия; конденсаты нафталинсульфоната натрия и формальдегида; фосфатные эфиры этоксилата тристирилфенола; этоксилаты алифатических спиртов; спиртовые этоксилаты; EO-PO блок-сополимиры; и привитые сополимеры.
Эмульгирующий агент представляет собой вещество, которое стабилизирует суспензию мелких капель одной жидкой фазы в другой жидкой фазе. Без эмульгирующего агента две жидкости разделились бы на две несмешиваемые жидкие фазы. Наиболее часто используемые эмульгирующие смеси содержат алкилфенол или алифатический спирт с двенадцатью или более этиленоксидными звеньями и маслорастворимую кальциевую соль додецилбензолсульфоновой кислоты. Диапазон значений гидрофильно-липофильного баланса (“HLB”) от 8 до 18 будет при нормальных условиях обеспечивать весьма стабильные эмульсии. Стабильность эмульсии может иногда быть улучшена добавлением небольшого количества EO-PO блок-сополимерного поверхностно-активного вещества.
Солюбилизирующий агент представляет собой поверхностно-активное вещество, которое будет образовывать мицеллы в воде при концентрациях выше критической концентрации мицеллообразования. Мицеллы затем могут растворять или солюбилизировать водонерастворимые вещества внутри гидрофобной части мицеллы. Виды поверхностно-активных веществ, обычно используемых для солюбилизации, являются неионными веществами, моноолеаты сорбитана, этоксилаты моноолеата сорбитана и сложные эфиры метилолеата.
Иногда используются поверхностно-активные вещества, либо отдельно, либо другими добавками, такими как минеральные или растительные масла, в качестве адъювантов в смесях распылительных емкостей для улучшения биологического воздействия пестицида на мишень. Типы поверхностно-активных веществ, используемых для биоусиления, зависят обычно от природы и способа действия пестицида. Тем не менее, обычно они являются неионными, такими как алкилэтоксилаты, этоксилаты неразветвленных алифатических спиртов, этоксилаты алифатических аминов.
Носитель или разбавитель в сельскохозяйственном препарате представляет собой вещество, добавляемое к пестициду для получения продукта требуемой крепости. Носители обычно являются веществами с высокими поглощающими способностями, тогда как разбавители обычно являются веществами с низкими поглощающими способностями. Носители и разбавители используются в препаратах порошков, смачиваемых порошков, гранул и вододиспергируемых гранул.
Органические растворители используются в основном в препаратах эмульгируемых концентратов, эмульсиях масло-в-воде, суспоэмульсиях и препаратах ультранизкого объема и для уменьшения объема гранулярных препаратов. Иногда используют смеси растворителей. Первыми главными группами растворителей являются алифатические парафиновые масла, такие как керосин или очищенные парафины. Вторая важная группа (и наиболее распространенная) включает ароматические растворители, такие как ксилол и высокомолекулярные фракции C9 и C10 ароматических растворителей. Хлорированные углеводороды могут быть использованы в качестве сорастворителей для предотвращения кристаллизации пестицидов, когда готовая форма эмульгирована в воде. Спирты иногда используются в качестве сорастворителей для увеличения растворяющей способности. Другие растворители могут включать растительные масла, масла семян и сложные эфиры растительных масел и масел семян.
Загустители или гелеобразующие агенты используют, главным образом, в препаратах суспензионных концентратов, эмульсий и суспоэмульсий для модифицирования реологии или текучих свойств жидкости и для предотвращения разделения и оседания диспергированных частиц или мелких капель. Загущающие, гелеобразующие и противоосадочные агенты обычно делятся на две категории, а именно водонерастворимые твердые частицы и водорастворимые полимеры. Возможно создавать препараты суспензионных концентратов с использованием глин и кварца. Примеры таких типов веществ включают, но не ограничиваются ими, монтмориллонит, например бентонит; алюмосиликат магния; и аттапульгит. Водорастворимые полисахариды использовали в качестве загущающих-гелеобразующих агентов в течение многих лет. Наиболее широко используемыми типами полисахаридов являются натуральные экстракты семян и водорослей или синтетические производные целлюлозы. Примеры этих типов веществ включают, но не ограничиваются ими, гуаровую смолу; смолу плодов рожкового дерева; каррагинан; альгинаты; метилцеллюлозу, натрий карбоксиметилцеллюлозу (SCMC); гидроксиэтилцеллюлозу (HEC). Другие типы противоосадочных агентов основаны на модифицированных крахмалах, полиакрилатах, поливиниловом спирте и полиэтиленоксиде. Еще одним подходящим противоосадочным агентом является ксантановая смола.
Микроорганизмы могут вызывать порчу входящих в соств препарата продуктов. Поэтому для устранения или уменьшения их действия используются консервирующие агенты. Примеры таких агентов включают, но этим не ограничиваются, пропионовую кислоту и ее натриевую соль; сорбиновую кислоту и ее натриевую или калиевую соли; бензойную кислоту и ее натриевую соль; натриевую соль п-гидрокибензойной кислоты; метил п-гидроксибензоат; и 1,2-бензизотиазолин-3-он (BIT).
Наличие поверхностно-активных веществ часто вызывает у препаратов на основе воды образование пены во время процесса смешивания при производстве и введении в распылительную емкость. Для того чтобы уменьшить склонность к пенообразованию, часто добавляют антипенные агенты, либо на стадии приготовления, либо перед наполнением в баллоны. Как правило, существуют два типа противопенных агентов, а именно силиконовые и несиликоновые. Силиконовые агенты обычно представляют собой водные эмульсии диметилполисилоксана, тогда как несиликоновые противопенные агенты представляют собой водонерастворимые масла, такие как октанол и нонанол или диоксид кремния. В обоих случаях функция противопенного агента заключается в вытеснении поверхностно-активного вещества из межфазной границы воздух-вода.
"Зеленые" агенты (например, вспомогательные вещества, поверхностно-активные вещества, растворители) могут уменьшить общие экологические последствия от применения защитных растительных препаратов. Зеленые агенты являются биоразлагаемыми и их обычно получают из природных и/или экологических источников, например, растительных и животных источников. Конкретными примерами являются: растительные масла, масла семян и сложные эфиры, также алкоксилированные алкилполиглюкозиды.
Дополнительную информацию смотри в справочнике "Chemistry and Technology of Agrochemical Formulations" edited by D.A. Knowles, copyright 1998, by Kluwer Academic Publishers. Также смотри "Insecticides in Agriculture and Environment - Retrospects and Prospects" by A.S. Perry, I. Yamamoto, I. Ishaaya, and R. Perry, copyright 1998, by Springer-Verlag.
ВРЕДИТЕЛИ
Главным образом, соединения формулы один могут быть использованы для борьбы с вредителями, например, жуками, уховертками, тараканами, мухами, тлями, кокцидами, белокрылками, цикадками, муравьями, осами, термитами, минно-чехликовыми молями, бабочками, вшами, кузнечиками, саранчой, сверчками, блохами, щетинохвостками, клещами, иксодовыми клещами, нематодами и многоножками.
В другом варианте осуществления изобретения соединения формулы один могут быть использованы для борьбы с вредителями Phyla Nematoda и/или Arthropoda.
В другом варианте осуществления изобретения соединения формулы один могут быть использованы для борьбы с вредителями Subphyla Chelicerata, Myriapoda и/или Hexapoda.
В другом варианте осуществления изобретения соединения формулы один могут быть использованы для борьбы с вредителями Классов Arachnida, Symphyla и/или Insecta.
В другом варианте осуществления изобретения соединения формулы один могут быть использованы для борьбы с вредителями Order Anoplura. Неполный список конкретных родов включает, но этим не ограничивается, Haematopinus spp., Hoplopleura spp., Linognathus spp., Pediculus spp. и Polyplax spp. Неполный список конкретных видов включает, но этим не ограничивается, Haematopinus asini, Haematopinus suis, Linognathus setosus, Linognathus ovillus, Pediculus humanus capitis, Pediculus humanus humanus и Pthirus pubis.
В другом варианте осуществления изобретения соединения формулы один могут быть использованы для борьбы с вредителями Order Coleoptera. Неполный список конкретных родов включает, но этим не ограничивается, Acanthoscelides spp., Agriotes spp., Anthonomus spp., Apion spp., Apogonia spp., Aulacophora spp., Bruchus spp., Cerosterna spp., Cerotoma spp., Ceutorhynchus spp., Chaetocnema spp., Colaspis spp., Ctenicera spp., Curculio spp., Cyclocephala spp., Diabrotica spp., Hypera spp., Ips spp., Lyctus spp., Megascelis spp., Meligethes spp., Otiorhynchus spp., Pantomorus spp., Phyllophaga spp., Phyllotreta spp., Rhizotrogus spp., Rhynchites spp., Rhynchophorus spp., Scolytus spp., Sphenophorus spp., Sitophilus spp. и Tribolium spp. Неполный список конкретных видов включает, но этим не ограничивается, Acanthoscelides obtectus, Agrilus planipennis, Anoplophora glabripennis, Anthonomus grandis, Ataenius spretulus, Atomaria linearis, Bothynoderes punctiventris, Bruchus pisorum, Callosobruchus maculatus, Carpophilus hemipterus, Cassida vittata, Cerotoma tryfurcata, Ceutorhynchus assimilis, Ceutorhynchus napi, Conoderus scalaris, Conoderus stigmosus, Conotrachelus nenuphar, Cotinis nitida, Crioceris asparagi, Cryptolestes ferrugineus, Cryptolestes pusillus, Cryptolestes turcicus, Cylindrocopturus adspersus, Deporaus marginatus, Dermestes lardarius, Dermestes maculatus, Epilachna varivestis, Faustinus cubae, Hylobius pales, Hypera postica, Hypothenemus hampei, Lasioderma serricorne, Leptinotarsa decemlineata, Liogenys fuscus, Liogenys suturalis, Lissorhoptrus oryzophilus, Maecolaspis joliveti, Melanotus communis, Meligethes aeneus, Melolontha melolontha, Oberea brevis, Oberea linearis, Oryctes rhinoceros, Oryzaephilus mercaptor, Oryzaephilus surinamensis, Oulema melanopus, Oulema oryzae, Phyllophaga cuyabana, Popillia japonica, Prostephanus truncatus, Rhyzopertha dominica, Sitona lineatus, Sitophilus granarius, Sitophilus oryzae, Sitophilus zeamais, Stegobium paniceum, Tribolium castaneum, Tribolium confusum, Trogoderma variabile и Zabrus tenebrioides.
В другом варианте осуществления изобретения соединения формулы один могут быть использованы для борьбы с вредителями Order Dermaptera.
В другом варианте осуществления изобретения соединения формулы один могут быть использованы для борьбы с вредителями Order Blattaria. Неполный список конкретных видов включает, но этим не ограничивается, Blattella germanica, Blatta orientalis, Parcoblatta pennsylvanica, Periplaneta americana, Periplaneta australasiae, Periplaneta brunnea, Periplaneta fuliginosa, Pycnoscelus surinamensis и Supella longipalpa.
В другом варианте осуществления изобретения соединения формулы один могут быть использованы для борьбы с вредителями Order Diptera. Неполный список конкретных родов включает, но этим не ограничивается, Aedes spp., Agromyza spp., Anastrepha spp., Anopheles spp., Bactrocera spp., Ceratitis spp., Chrysops spp., Cochliomyia spp., Contarinia spp., Culex spp., Dasineura spp., Delia spp., Drosophila spp., Fannia spp., Hylemyia spp., Liriomyza spp., Musca spp., Phorbia spp., Tabanus spp. и Tipula spp. Неполный список конкретных видов включает, но этим не ограничивается, Agromyza frontella, Anastrepha suspensa, Anastrepha ludens, Anastrepha obliqa, Bactrocera cucurbitae, Bactrocera dorsalis, Bactrocera invadens, Bactrocera zonata, Ceratitis capitata, Dasineura brassicae, Delia platura, Fannia canicularis, Fannia scalaris, Gasterophilus intestinalis, Gracillia perseae, Haematobia irritans, Hypoderma lineatum, Liriomyza brassicae, Melophagus ovinus, Musca autumnalis, Musca domestica, Oestrus ovis, Oscinella frit, Pegomya betae, Psila rosae, Rhagoletis cerasi, Rhagoletis pomonella, Rhagoletis mendax, Sitodiplosis mosellana и Stomoxys calcitrans.
В другом варианте осуществления изобретения соединения формулы один могут быть использованы для борьбы с вредителями Order Hemiptera. Неполный список конкретных родов включает, но этим не ограничивается, Adelges spp., Aulacaspis spp., Aphrophora spp., Aphis spp., Bemisia spp., Ceroplastes spp., Chionaspis spp., Chrysomphalus spp., Coccus spp., Empoasca spp., Lepidosaphes spp., Lagynotomus spp., Lygus spp., Macrosiphum spp., Nephotettix spp., Nezara spp., Philaenus spp., Phytocoris spp., Piezodorus spp., Planococcus spp., Pseudococcus spp., Rhopalosiphum spp., Saissetia spp., Therioaphis spp., Toumeyella spp., Toxoptera spp., Trialeurodes spp., Triatoma spp. и Unaspis spp. Неполный список конкретных видов включает, но этим не ограничивается, Acrosternum hilare, Acyrthosiphon pisum, Aleyrodes proletella, Aleurodicus dispersus, Aleurothrixus floccosus, Amrasca biguttula biguttula, Aonidiella aurantii, Aphis gossypii, Aphis glycines, Aphis pomi, Aulacorthum solani, Bemisia argentifolii, Bemisia tabaci, Blissus leucopterus, Brachycorynella asparagi, Brevennia rehi, Brevicoryne brassicae, Calocoris norvegicus, Ceroplastes rubens, Cimex hemipterus, Cimex lectularius, Dagbertus fasciatus, Dichelops furcatus, Diuraphis noxia, Diaphorina citri, Dysaphis plantaginea, Dysdercus suturellus, Edessa meditabunda, Eriosoma lanigerum, Eurygaster maura, Euschistus heros, Euschistus servus, Helopeltis antonii, Helopeltis theivora, Icerya purchasi, Idioscopus nitidulus, Laodelphax striatellus, Leptocorisa oratorius, Leptocorisa varicornis, Lygus hesperus, Maconellicoccus hirsutus, Macrosiphum euphorbiae, Macrosiphum granarium, Macrosiphum rosae, Macrosteles quadrilineatus, Mahanarva frimbiolata, Metopolophium dirhodum, Mictis longicornis, Myzus persicae, Nephotettix cinctipes, Neurocolpus longirosтрис, Nezara viridula, Nilaparvata lugens, Parlatoria pergandii, Parlatoria ziziphi, Peregrinus maidis, Phylloxera vitifoliae, Physokermes piceae, Phytocoris californicus, Phytocoris relativus, Piezodorus guildinii, Poecilocapsus lineatus, Psallus vaccinicola, Pseudacysta perseae, Pseudococcus brevipes, Quadraspidiotus perniciosus, Rhopalosiphum maidis, Rhopalosiphum padi, Saissetia oleae, Scaptocoris castanea, Schizaphis graminum, Sitobion avenae, Sogatella furcifera, Trialeurodes vaporariorum, Trialeurodes abutiloneus, Unaspis yanonensis и Zulia entrerriana.
В другом варианте осуществления изобретения соединения формулы один могут быть использованы для борьбы с вредителями Order Hymenoptera. Неполный список конкретных родов включает, но этим не ограничивается, Acromyrmex spp., Atta spp., Camponotus spp., Diprion spp., Formica spp., Monomorium spp., Neodiprion spp., Pogonomyrmex spp., Polistes spp., Solenopsis spp., Vespula spp., и Xylocopa spp. Неполный список конкретных видов включает, но этим не ограничивается, Athalia rosae, Atta texana, Iridomyrmex humilis, Monomorium minimum, Monomorium pharaonis, Solenopsis invicta, Solenopsis geminata, Solenopsis molesta, Solenopsis richtery, Solenopsis xyloni и Tapinoma sessile.
В другом варианте осуществления изобретения соединения формулы один могут быть использованы для борьбы с вредителями Order Isoptera. Неполный список конкретных родов включает, но этим не ограничивается, Coptotermes spp., Cornitermes spp., Cryptotermes spp., Heterotermes spp., Kalotermes spp., Incisitermes spp., Macrotermes spp., Marginitermes spp., Microcerotermes spp., Procornitermes spp., Reticulitermes spp., Schedorhinotermes spp., и Zootermopsis spp. Неполный список конкретных видов включает, но этим не ограничивается, Coptotermes curvignathus, Coptotermes frenchi, Coptotermes formosanus, Heterotermes aureus, Microtermes obesi, Reticulitermes banyulensis, Reticulitermes grassei, Reticulitermes flavipes, Reticulitermes hageni, Reticulitermes hesperus, Reticulitermes santonensis, Reticulitermes speratus, Reticulitermes tibialis и Reticulitermes virginicus.
В другом варианте осуществления изобретения соединения формулы один могут быть использованы для борьбы с вредителями Order Lepidoptera. Неполный список конкретных родов включает, но этим не ограничивается, Adoxophyes spp., Agrotis spp., Argyrotaenia spp., Cacoecia spp., Caloptilia spp., Chilo spp., Chrysodeixis spp., Colias spp., Crambus spp., Diaphania spp., Diatraea spp., Earias spp., Ephestia spp., Epimecis spp., Feltia spp., Gortyna spp., Helicoverpa spp., Heliothis spp., Indarbela spp., Lithocolletis spp., Loxagrotis spp., Malacosoma spp., Peridroma spp., Phyllonorycter spp., Pseudaletia spp., Sesamia spp., Spodoptera spp., Synanthedon spp. и Yponomeuta spp. Неполный список конкретных видов включает, но этим не ограничивается, Achaea janata, Adoxophyes orana, Agrotis ipsilon, Alabama argillacea, Amorbia cuneana, Amyelois transitella, Anacamptodes defectaria, Anarsia lineatella, Anomis sabulifera, Anticarsia gemmatalis, Archips argyrospila, Archips rosana, Argyrotaenia citrana, Autographa gamma, Bonagota cranaodes, Borbo cinnara, Bucculatrix thurberiella, Capua reticulana, Carposina niponensis, Chlumetia transversa, Choristoneura rosaceana, Cnapgalogencrocis medinalis, Conopomorpha cramerella, Cossus cossus, Cydia caryana, Cydia funebrana, Cydia molesta, Cydia nigricana, Cydia pomonella, Darna diducta, Diatraea saccharalis, Diatraea grandiosella, Earias insulana, Earias vittella, Ecdytolopha aurantianum, Elasmopalpus lignosellus, Ephestia cautella, Ephestia elutella, Ephestia kuehniella, Epinotia aporema, Epiphyas postvittana, Erionota thrax, Eupoecilia ambiguella, Euxoa auxiliaris, Grapholita molesta, Hedylepta indicata, Helicoverpa armigera, Helicoverpa zea, Heliothis virescens, Hellula undalis, Keiferia lycopersicella, Leucinodes orbonalis, Leucoptera coffeella, Leucoptera malifoliella, Lobesia botrana, Loxagrotis albicosta, Lymantria dispar, Lyonetia clerkella, Mahasena corbetti, Mamestra brassicae, Maruca testulalis, Metisa plana, Mythimna unipuncta, Neoleucinodes elegantalis, Nymphula depunctalis, Operophtera brumata, Ostrinia nubilalis, Oxydia vesulia, Pandemis cerasana, Pandemis heparana, Papilio demodocus, Pectinophora gossypiella, Peridroma saucia, Perileucoptera coffeella, Phthorimaea operculella, Phyllocnistis citrella, Pieris rapae, Plathypena scabra, Plodia interpunctella, Plutella xylostella, Polychrosis viteana, Prays endocarpa, Prays oleae, Pseudaletia unipuncta, Pseudoplusia includens, Rachiplusia nu, Scirpophaga incertulas, Sesamia inferens, Sesamia nonagrioides, Setora nitens, Sitotroga cerealella, Sparganothis pilleriana, Spodoptera exigua, Spodoptera frugiperda, Spodoptera eridania, Thecla basilides, Tineola bisselliella, Trichoplusia ni, Tuta absoluta, Zeuzera coffeae и Zeuzera pyrina.
В другом варианте осуществления изобретения соединения формулы один могут быть использованы для борьбы с вредителями Order Mallophaga. Неполный список конкретных родов включает, но этим не ограничивается, Anaticola spp., Bovicola spp., Chelopistes spp., Goniodes spp., Menacanthus spp. и Trichodectes spp. Неполный список конкретных видов включает, но этим не ограничивается, Bovicola bovis, Bovicola caprae, Bovicola ovis, Chelopistes meleagridis, Goniodes dissimilis, Goniodes gigas, Menacanthus stramineus, Menopon gallinae и Trichodectes canis.
В другом варианте осуществления изобретения соединения формулы один могут быть использованы для борьбы с вредителями Order Orthoptera. Неполный список конкретных родов включает, но этим не ограничивается, Melanoplus spp. и Pterophylla spp. Неполный список конкретных видов включает, но этим не ограничивается, Anabrus simplex, Gryllotalpa africana, Gryllotalpa australis, Gryllotalpa brachyptera, Gryllotalpa hexadactyla, Locusta migratoria, Microcentrum retinerve, Schistocerca gregaria и Scudderia furcata.
В другом варианте осуществления изобретения соединения формулы один могут быть использованы для борьбы с вредителями Order Siphonaptera. Неполный список конкретных видов включает, но этим не ограничивается, Ceratophyllus gallinae, Ceratophyllus niger, Ctenocephalides canis, Ctenocephalides felis и Pulex irritans.
В другом варианте осуществления изобретения соединения формулы один могут быть использованы для борьбы с вредителями Order Thysanoptera. Неполный список конкретных родов включает, но этим не ограничивается, Caliothrips spp., Frankliniella spp., Scirtothrips spp., и Thrips spp. Неполный список of particular sp. включает, но этим не ограничивается, Frankliniella fusca, Frankliniella occidentalis, Frankliniella schultzei, Frankliniella williamsi, Heliothrips haemorrhoidalis, Rhipiphorothrips cruentatus, Scirtothrips citri, Scirtothrips dorsalis и Taeniothrips rhopalantennalis, Thrips hawaiiensis, Thrips nigropilosus, Thrips orientalis, Thrips tabaci.
В другом варианте осуществления изобретения соединения формулы один могут быть использованы для борьбы с вредителями Order Thysanura. Неполный список конкретных родов включает, но этим не ограничивается, Lepisma spp. и Thermobia spp.
В другом варианте осуществления изобретения соединения формулы один могут быть использованы для борьбы с вредителями Order Acarina. Неполный список конкретных родов включает, но этим не ограничивается, Acarus spp., Aculops spp., Boophilus spp., Demodex spp., Dermacentor spp., Epitrimerus spp., Eriophyes spp., Ixodes spp., Oligonychus spp., Panonychus spp., Rhizoglyphus spp., и Tetranychus spp. Неполный список конкретных видов включает, но этим не ограничивается, Acarapis woodi, Acarus siro, Aceria mangiferae, Aculops lycopersici, Aculus pelekassi, Aculus schlechtendali, Amblyomma americanum, Brevipalpus obovatus, Brevipalpus phoenicis, Dermacentor variabilis, Dermatophagoides pteronyssinus, Eotetranychus carpini, Notoedres cati, Oligonychus coffeae, Oligonychus ilicis, Panonychus citri, Panonychus ulmi, Phyllocoptruta oleivora, Polyphagotarsonemus latus, Rhipicephalus sanguineus, Sarcoptes scabiei, Tegolophus perseaflorae, Tetrаnychus urticae и Varroa destructor.
В другом варианте осуществления изобретения соединения формулы один могут быть использованы для борьбы с вредителями Order Symphyla. Неполный список конкретных видов включает, но этим не ограничивается, Scutigerella immaculata.
В другом варианте осуществления изобретения соединения формулы один могут быть использованы для борьбы с вредителями Phylum Nematoda. Неполный список конкретных родов включает, но этим не ограничивается, Aphelenchoides spp., Belonolaimus spp., Criconemella spp., Ditylenchus spp., Heterodera spp., Hirschmanniella spp., Hoplolaimus spp., Meloidogyne spp., Pratylenchus spp., и Radopholus spp. Неполный список конкретных видов включает, но этим не ограничивается, Dirofilaria immitis, Heterodera zeae, Meloidogyne incognita, Meloidogyne javanica, Onchocerca volvulus, Radopholus similis и Rotylenchulus reniformis.
За дополнительной информацией можной обратиться к справочнику “Handbook of Pest Control - The Behavior, Life History, and Control of Household Persts” by Arnold Mallis, 9th Edition, copyright 2004 by GIE Media Inc.
ПРИМЕНЕНИЕ
Соединения формулы один, как правило, используются в количествах, от примерно 0,01 грамма на гектар до примерно 5000 граммов на гектар для обеспечения уничтожения вредителей. Количество от примерно 0,1 грамма на гектар до примерно 500 граммов на гектар обычно является предпочтителным, и количество от примерно 1 грамма на гектар до примерно 50 граммов на гектар, как правило, является более предпочтительным.
Площадью, на которой применяется соединение формулы один, может быть любая область обитания (либо может быть заселеннной, либо проходимой) вредителя, например: где растут посевы, деревья, фрукты, крупы, кормовые виды, виноград, трава и декоративные растения; где живут домашние животные; внутренние или внешние поверхности зданий (такие как помещения, где хранится зерно), конструкционные материалы, используемые в строительстве (такие как пропитанная древесина), и почва вокруг зданий. Конкретные посевные площади для использования соединения формулы один включают площади, где растут яблоки, кукуруза, подсолнечник, хлопок, соя, рапс, пшеница, рис, сорго, ячмень, овес, картофель, апельсины, люцерна, салат, клубника, помидоры, перец, крестоцветные, груши, табачные, миндаль, сахарная свекла, фасоль и другие ценные культуры или собираются посадить их семена. При выращивании различных растений удобным также является применение сульфата аммония вместе с соединением формулы один.
Уничтожение вредителей обычно обозначает, что популяция вредителя, активность вредителя или они оба снижаются в ареале. Это может произойти: когда популяция вредителя населения не заселяется в ареале; когда вредители недееспособны в или вокруг ареала; или вредители уничтожаются, полностью или частично, в или вокруг ареала. Конечно, может встречаться комбинация этих результатов. Как правило, желательным является уменьшение популяции вредителя, его активности или их обеих более чем на пятьдесят процентов, предпочтительно более чем на 90 процентов. Как правило, ареалом не является человек снаружи или внутри; следовательно, локус, как правило, не являетя человеческим ареалом.
Соединения формулы один могут быть использованы в смесях, наноситься одновременно или последовательно, отдельно или с другими соединениями для повышения энергии прорастания (например, для развития лучшей корневой системы, чтобы лучше противостоять стрессовым условиям роста). Такими другими соединениями являются, например, соединения, которые модулируют этиленовые рецепторы растений, в особенности 1-метилциклопропен (также известный, как 1-MCP). Кроме того, такие соединения могут быть использованы в то время, когда активность вредителей низкая, например, перед началом роста растений, из которых производят ценные сельскохозяйственные товары. Такое время включает ранний сезон посадки, когда действие вредителей, как правило, низкое.
Соединения формулы один могут быть нанесены на лиственные и плодовые части растений для уничтожения вредителей. Соединения будут напрямую контактировать с вредителем, либо вредитель будет потреблять пестицид, когда поедает листья, фруктовую массу или извлекает сок, где содержится пестицид. Соединения формулы один также могут быть нанесены на почву, и когда их используют таким образом, могут быть уничтожены вредители, поедающие корни и ствол. Корни могут абсорбировать соединение, подавая его в лиственные части растения для уничтожения над землей жующих и питающихся соком вредителей.
Вообще, с приманками, приманки помещают в грунт, где, например, термиты могут вступать в контакт и/или улавливаться приманками. Приманки могут быть прикреплены к поверхности строения (горизонтальной, вертикальной или наклонной поверхности), где, например, муравьи, термиты, тараканы и мухи могут вступать в контакт и/или улавливаться приманками. Приманки могут содержать соединение формулы один.
Соединения формулы один могут быть инкапсулированы внутрь или размещены на поверхности капсулы. Размер капсул может варьироваться от нанометрового размера (примерно 100-900 нм в диаметре) до микрометрового размера (примерно 10-900 мкм в диаметре).
Благодаря уникальной способности яиц некоторых вредителей противостоять некоторым пестицидам, может быть желательным повторное применение соединений формулы один, чтобы уничтожить только что появившиеся личинки.
Системное передвижение пестицидов в растениях может быть использовано для уничтожения вредителей на одной части растения, нанося (например, путем распылением на площадь) соединения формулы один на другую часть растения. Например, уничтожение поедающих листья насекомых может быть достигнуто путем капельного орошения или внесения в борозды, путем обработки почвы, например, перед или после посадочного полива почвы, или путем обработки семян растения перед посадкой.
Обработка семян может быть использована ко всем типам семян, в том числе, из которых будут прорастать растения, генетически модифицированные для выработки специализированных свойств. Представительные примеры включают те, которые вырабатывают белки, токсичные для беспозвоночных вредителей, таких как Bacillus thuringiensis или другие инсектицидные токсины, которые проявляют устойчивость к гербицидам, таким как семена "Roundup Ready", или обладающие "многоуровневыми" чужеродными генами, вырабатывающих инсектицидные токсины, устойчивость к гербицидам, улучшающих питание, засухоустойчивость или любые другие положительные свойства. Кроме того, такие обработки семян соединениями формулы один могут дополнительно повысить способность растения лучше противостоять стрессовым условиям роста. Это дает более здоровое, сильное растение, что может привести к более высокым показателям во время сбора урожая. Обычно, как ожидается, хорошие положительные результаты достигаются при использовании от примерно 1 г соединений формулы один до примерно 500 граммов на 100 тысяч семян, более хорошие преимущества при использовании от примерно 10 граммов до примерно 100 граммов на 100 тысяч семян, и еще более хорошие преимущества при количестве от примерно 25 граммов до примерно 75 граммов на 100 тысяч семян.
Должно быть понятным, что соединения формулы один могут быть использованы на, в или вокруг растений, генетически модифицированных для проявления специфических свойств, таких как Bacillus thuringiensis или другие инсектицидные токсины, или те, которые проявляют устойчивость к гербицидам, или обладающие "многоуровневыми" чужеродными генами, вырабатывающими инсектицидные токсины, устойчивость к гербицидам, улучшающим питание или любые другие положительные свойства.
Соединения формулы один могут быть использованы для уничтожения эндопаразитов и эктопаразитов в ветеринарии или в животноводстве. Соединения формулы один применяются путем перорального введения в виде, например, таблеток, капсул, напитков, гранул, путем нанесения на кожу в виде, например, окунания, распыления, обливания, нанесения пятнами и опыление и путем парентерального введения в виде, например, инъекции.
Соединения формулы один также могут быть с успехом использованы в животноводстве, например, для крупного рогатого скота, овец, свиней, кур и гусей. Они также могут быть с успехом использованы для животных, таких как лошади, собаки и кошки. Конкретными вредителями для уничтожения могут являться блохи и иксодовые клещи, которые беспокоют таких животных. Подходящие препараты вводят перорально животным с питьевой водой или кормом. Дозировки и препараты, которые подходят, зависят от видов.
Соединения формулы один также могут быть использованы для уничтожения паразитических червей, особенно кишечных, у животных, перечисленных выше.
Соединения формулы один также могут быть использованы в способах терапии в области здравоохранения. Такие способы включают, но этим не ограничиваются, пероральное введение в виде, например, таблеток, капсул, напитков, гранул, и путем нанесения на кожу.
По всему миру вредители начали перемещаться в новые среды обитания (для такого вредителя), а затем становятся новыми инвазивными видами в такой новой среде. Соединения формулы один могут быть также использованы для таких новых инвазивных видов, чтобы уничтожать их в такой новой среде.
Соединения формулы один также могут быть использованы на площадях, где выращиваются растения, такие как зерновые культуры, (например, перед посадкой, во время посадки, перед сборкой урожая) и там, где есть низкие уровни (даже фактическое отсутствие) вредителей, которые могут коммерчески повреждать такие растения. Использование таких соединения в такой области является полезным для выращивания растений в этой области. Такие преимущества могут включать, но этим не ограничиваются, улучшение здоровья растения, повышение урожайности растений (например, увеличенная биомасса и/или повышенное содержание ценных ингредиентов), улучшение силы растения (например, улучшенный рост растения и/или более зеленые листья), повышение качества растения (например, улучшенное содержание или состав некоторых ингредиентов) и улучшение толерантности к абиотическим и/или биотическим стрессам растения.
Перед тем как пестицид может быть использован или предложен для коммерческой продажи, такой пестицид подвергается длительным способам оценки в различных государственных органах (местных, региональных, государственных, национальных и международных). Требования обширных данных определяются регулирующими органами и должны решаться путем формирования данных и подачей на регистрацию продукта, или третьей стороной от имени регистранта продукта, часто с использованием компьютера с подключением к всемирной паутине. Затем эти государственные органы делают обзор таких данных и, если делается вывод о безопасности, обеспечивают потенциальному пользователю или продавцу одобрение на регистрацию продукта. После этого, на той территории, где осуществлена и поддержана регистрация продукта, такой пользователь или продавец может использовать или продавать такой пестицид.
Соединение в соответствии с формулой один может быть исследовано на определение его эффективности против вредителей. Кроме того, способ осуществления исследований может быть проведен, чтобы определить, обладает ли указанное соединение иным способом действия, чем другие пестициды. После этого, такие полученные данные могут быть распространены, например, по Интернету, третьим лицам.
Заголовки в настоящем документе даны только для удобства и не должны быть использованы для интерпретации какой-либо части настоящего документа.
РАЗДЕЛ ТАБЛИЦ (см. в графической части).