Результат интеллектуальной деятельности: ЗАМЕЩЕННЫЕ ПИРИМИДИНИЛПИРРОЛЫ, АКТИВНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ
Вид РИД
Изобретение
Настоящее изобретение относится к определенным замещенным пиримидинилпирролам, которые модулируют активность протеинкиназ. Соединения согласно настоящему изобретению, следовательно, пригодны при лечении заболеваний, связанных с дисрегулированной активностью киназ, как, например, рак, клеточно-пролиферативные нарушения, вирусные инфекции, связанные с иммунной системой нарушения, нейродегенеративные нарушения и сердечно-сосудистые заболевания.
Настоящее изобретение также относится к способам получения этих соединений, фармацевтическим композициям, содержащим эти соединения, и способам лечения заболеваний, используя фармацевтические композиции, содержащие эти соединения.
Протеинкиназы опосредуют внутриклеточную передачу сигнала посредством воздействия на перенос фосфорила от нуклеозидтрифосфата на белковый акцептор, то есть, вовлечены в путь передачи сигнала. Эти события фосфорилирования действуют как молекулярные «включено/выключено» переключатели, которые могут модулировать или регулировать биологическую функцию белков-мишеней и, в конечном счете, инициируют ответ на множество внеклеточных и других стимулов. Примеры таких стимулов включают признаки экологического и химического стресса (например, осмотический шок, тепловой шок, ультрафиолетовое облучение, бактериальный эндотоксин и Н2О2), цитокины (например, интерлейкин-3 (IL-3), интерлейкин-2 (IL-2)) и факторы роста (например, гранулоцит-макрофагиальный колониестимулирующий фактор (GM-CSF), фактор роста фибробластов (FGF)) и эритропоэтин (ЕРО). Внеклеточный стимул может воздействовать на один или более клеточных ответов, связанных с ростом клеток, миграцией, дифференцировкой, секрецией гормонов, активацией факторов транскрипции, сокращением мышц, метаболизмом глюкозы, контролированием синтеза белка и регуляцией клеточного цикла.
Нарушение функции протеинкиназ (PK) является критерием многочисленных заболеваний. Большая доля онкогенов и протоонкогенов, вовлекаемая в раковые заболевания человека, кодирует PK. Повышенные активности PK также вовлечены в множество незлокачественных заболеваний, которые включают, но не исчерпывающим образом, аутоиммунные заболевания, воспалительные заболевания, псориаз, костные заболевания, метаболические заболевания, неврологические и нейродегенеративные заболевания, сердечно-сосудистые заболевания, аллергии и астму, болезнь Альцгеймера и связанные с гормонами заболевания. Соответственно, были приложены существенные усилия в лекарственной химии для нахождения ингибиторов протеикиназы, которые являются эффективными в качестве терапевтических агентов. В отношении ссылочного материала по нарушению функции или дерегуляции PK см. Current Opinions in Chemical Biology, 3, 459-465 (1999); Nature Rev. Drug Discov., 1, 309-315 (2002); и Carcinogenesis, 29, 1087-1191 (2008).
JAK представляют собой семейство нерецепторных тирозинкиназ JAK1, JAK2, JAK3 и TYK2. В то время как JAK1, JAK2 и TYK2 экспрессируются повсеместно у млекопитающих, JAK3 экспрессируется главным образом в гемопоэтических клетках. JAK играют очень важную роль при передаче сигнала в случае гемопоэтического цитокина и факторов роста (Nature, 377, 591-594 (1995); Annu. Rev. Immunol., 16, 293-322 (1998)) и критически вовлекаются в рост клеток, выживание, развитие и дифференцировку миелоидных и иммунных клеток. Эффективные врожденные и адаптивные иммунные ответы требуют функциональной передачи сигнала JAK для защиты организма от инфекций или опухолей и мутаций, приводящих к утрате функции, компенсируя некоторые из наиболее обычных наследственных тяжелых иммунодефицитов. Как следствие, передача сигнала JAK/STAT вовлечена в посредничество многих патологических ответов, как, например, аллергии, астма, аутоиммунные заболевания, отторжение трансплантата, ревматоидный артрит, боковой амиотрофический склероз и рассеянный склероз, а также в случае солидных и гематологических злокачественностей, подобных лейкозам и лимфомам (Immunol. Rev., 228, 273-287 (2009)).
В особенности JAK2-киназа исключительно вовлечена в сигнальную трансдукцию, опосредуемую эритропоэтином (ЕРО), тромбопоэтином (ТРО), гормоном роста (GH), пролактином (PR) и цитокинами, которые передают сигнал через общий рецептор бета-цепи IL-3, гранулоцит-макрофагиального колониестимулирующего фактора (GM-CSF) и IL-5. В дополнение, JAK2 вместе с JAK1 и/или TYK2 являются важными для цитокинов, которые передают сигнал через gp130-рецепторы (например, IL-6, IL-11), рецепторы цитокина типа II, подобные IL-10, IL-19, IL-20 и IL-22, р40-содержащие рецепторы цитокина IL-12 и IL-23 и IFN-рецепторы для передачи сигнала типа I и типа II (Immunol. Rev., 228, 273-287 (2009)). JAK3-киназа главным образом экспрессируется в гемопоэтических клетках и селективно ассоциирована с общей γ-цепью (γс), которая является общим компонентом рецепторов IL-2, IL-4, IL-7, IL-9, IL-15 и IL-21, которые представляют собой цитокины, вовлекаемые в лимфоидное развитие и функцию и гомеостаз иммунной системы. TYK2 главным образом ассоциирован с передачей сигнала интерферонами, IL-12 и IL-23, однако, также с IL-10 и IL-6. Все эти факторы роста и цитокины вовлечены главным образом в пролиферацию и дифференцировку миелоидных клеток, воспалительный ответ и раковое заболевание (Blood, 114, 1289-1298 (2009); Clin. Cancer Res., 12, 6270s-6273s (2006); J. Leukoc. Biol., 88, 1145-1156 (2010); Eur. J. Cancer, 46, 1223 (2010)).
Связывание лиганда с конкретным рецептором позволяет индуцировать конформационное изменение в рецепторе, которое делает возможным транс- и/или автофосфорилирование двух связанных молекул JAK2. Активированный JAK2 затем фосфорилирует специфические тирозиновые остатки в цитоплазматических «хвостах» рецепторов, создавая стыковочные сайты для SH2-домена сигнальных трансдукторов и активаторов транскрипции белков (STAT). После связывания с рецепторами STAT сами фосфорилируются посредством JAK2 по тирозиновым остаткам. Фосфорилированные STAT димеризуются и транслокируются в ядра, где они регулируют транскрипцию гена. Таким образом, JAK2 является ответственным за трансдукцию сигнала от поверхности клетки к ядру через механизм передачи сигнала за счет фосфорилирования тирозина (J. Immun., 178, 2623-2629 (2007); Oncogene, 26, 6724-6737 (2007), и Cell Biochem. Biophys., 44, 213-222 (2006)).
JAK2, подобный другим JAK, характеризуется киназным доменом (JH1), непосредственно примыкающим к псевдокиназному домену (JH2), находящемуся внутри С-концевой части белка. Функцией псевдокиназного домена является регуляция негативно активности киназного домена (N. Engl. J. Med., 355, 2452-2466 (2006)). Активирующая точковая мутация JAK2 (замена валина на фенилаланин, JAK2-V617F) в псевдокиназном домене вместе с другими активирующими мутациями, в JAK2-экзон12 и в ТРО-рецепторе (MPLW515L/K), идентифицированы в гемопоэтических клетках пациентов с миелопролиферативными нарушениями или MPD (Nature, 434, 1144-8 (2005); N. Engl. J. Med., 352, 1779-90 (2005); Lancet, 365, 1054-61 (2005); Cancer Cell, 7, 387-97 (2005); Blood, 108, 1427-1428 (2006); и Leukemia, 22, 87-95 (2008)). Все эти данные подтверждают, что JAK2 является пригодной мишенью для разработки MPD-специфической терапии (Curr. Onc. Reports, 11, 117-124 (2009)). В дополнение показано, что JAK2 и вообще путь JAK/STAT активированы (например, мутация, амплификация, транслокация) в гематологических злокачественностях, подобных, но не исчерпывающим образом, AML, ALL, лимфоме Ходжкина, большой диффузной В-клеточной лимфоме и большой медиастинальной В-клеточной лимфоме (Science, 278, 1309-1312 (1997); Trends in Biochemical Sciences, 33, 122-131 (2007)) и в множестве солидных опухолей (например, мутация, фосфорилирование STAT, латентность JAK/STAT ингибиторов SOCS-белков, амплификация). Обзор в отношении фармацевтического вмешательства в JAK/STAT-путь представлен в AJP, 165, 1449-1460 (2004); Cancer Res., 66, 3162-3168 (2006); Clin. Cancer Res., 14, 3716-3721 (2008); и Immunol. Rev., 228, 273-287 (2009).
Производные пиримидинилпиррола для лечения заболеваний, ассоциированных с дисрегулированной активностью белка, как например рак, раскрыты в международной заявке WO-2007/110344 на имя заявителя настоящей заявки. Некоторые конкретные соединения вышеуказанной международной заявки на патент исключены из общей формулы согласно настоящему изобретению.
В настоящее время авторы настоящего изобретения обнаружили, что соединения формулы (I), описанные ниже, являются эффективными и селективными ингибиторами JAK и, таким образом, пригодны в терапии рака, клеточно-пролиферативных нарушений, вирусных инфекций, связанных с иммунной системой нарушений, нейродегенеративных нарушений и сердечно-сосудистых заболеваний.
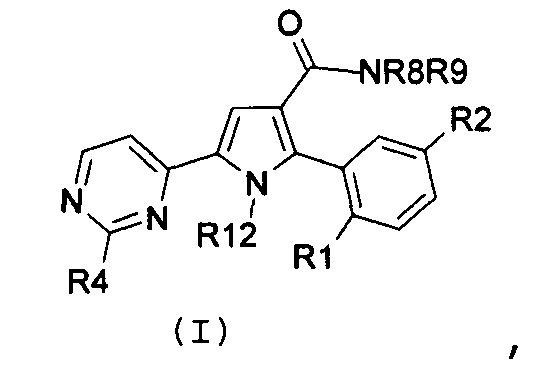
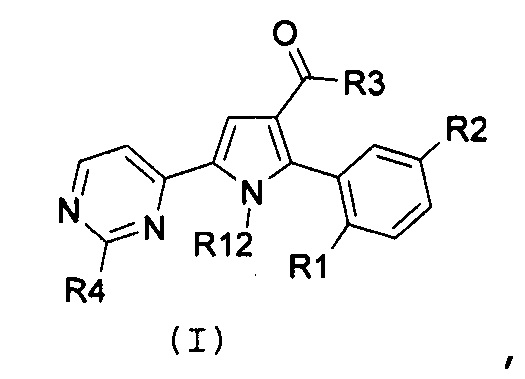
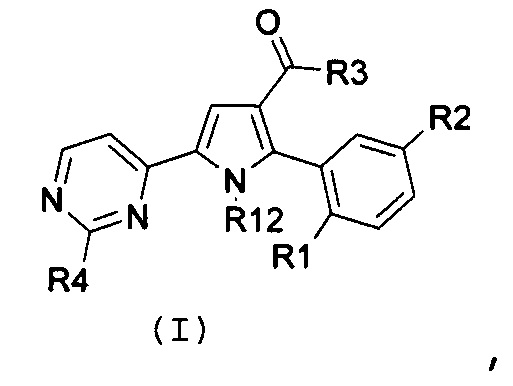
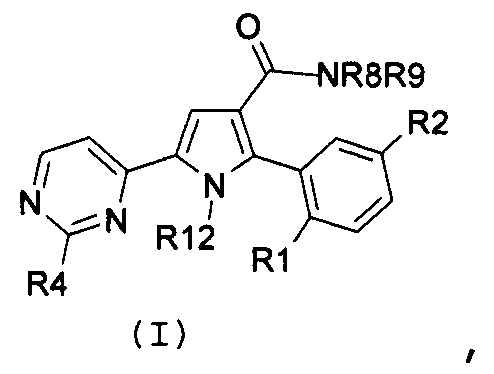
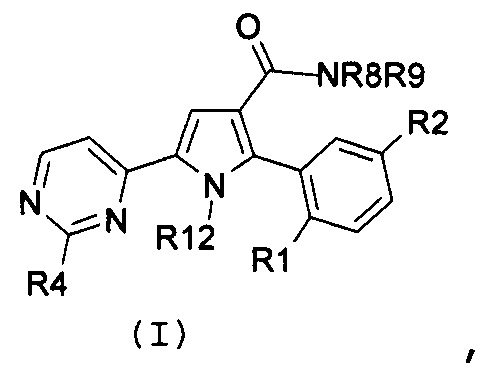
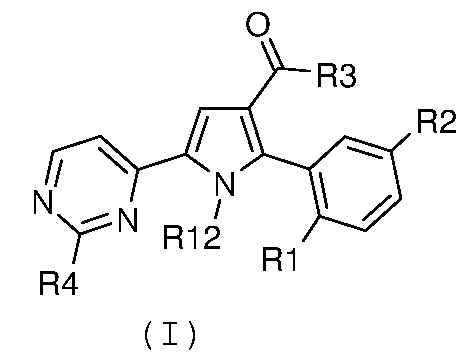
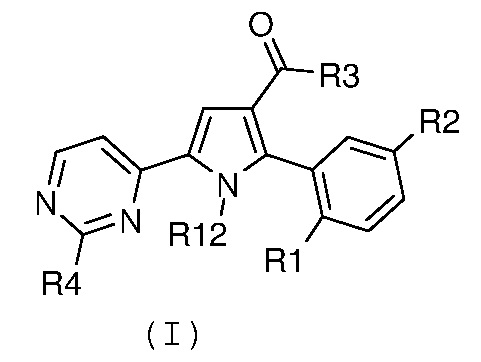
Соответственно, первый объект настоящего изобретения относится к замещенному пиримидинилпирролу, представленному формулой (I):
 ,
,
где:
R1 и R2, независимо, означают галоген, нитро, циано, OR5, NR6R7 или необязательно замещенную группу, выбираемую из группы, состоящей из С1-С6-алкила с линейной или разветвленной цепью, С2-С6-алкенила с линейной или разветвленной цепью, С2-С6-алкинила с линейной или разветвленной цепью, С3-С7-циклоалкила, циклоалкилалкила, арила, арилалкила, гетероциклила и гетероциклилалкила, где:
R5 означает водород или необязательно замещенную группу, выбираемую из группы, состоящей из С1-С6-алкила с линейной или разветвленной цепью, С2-С6-алкенила с линейной или разветвленной цепью, С2-С6-алкинила с линейной или разветвленной цепью, С3-С7-циклоалкила, циклоалкилалкила, арила, арилалкила, гетероциклила и гетероциклилалкила;
R6 и R7, независимо, означают водород или необязательно замещенную группу, выбираемую из группы, состоящей из С1-С6-алкила с линейной или разветвленной цепью, С2-С6-алкенила с линейной или разветвленной цепью, С2-С6-алкинила с линейной или разветвленной цепью, С3-С7-циклоалкила, циклоалкилалкила, арила, арилалкила, гетероциклила и гетероциклилалкила, или R6 и R7, вместе с атомом азота, с которым они связаны, могут образовывать необязательно замещенную 5-6-членную гетероарильную или гетероциклильную группу, необязательно содержащую один дополнительный гетероатом, выбираемый из N, O и S;
R3 означает NR8R9, где:
R8 и R9, независимо, означают водород или необязательно замещенную группу, выбираемую из группы, состоящей из С1-С6-алкила с линейной или разветвленной цепью, С2-С6-алкенила с линейной или разветвленной цепью, С2-С6-алкинила с линейной или разветвленной цепью, С3-С7-циклоалкила, циклоалкилалкила, арила, арилалкила, гетероциклила и гетероциклилалкила, или R8 и R9, вместе с атомом азота, с которым они связаны, могут образовывать необязательно замещенную 5-6-членную гетероарильную или гетероциклильную группу, необязательно содержащую один дополнительный гетероатом, выбираемый из N, O и S;
R4 означает водород, необязательно замещенный С1-С6-алкил с линейной или разветвленной цепью или NR10R11, где:
R10 и R11, независимо, означают водород или необязательно замещенную группу, выбираемую из группы, состоящей из С1-С6-алкила с линейной или разветвленной цепью, С2-С6-алкенила с линейной или разветвленной цепью, С2-С6-алкинила с линейной или разветвленной цепью, С3-С7-циклоалкила, циклоалкилалкила, арила, арилалкила, гетероциклила и гетероциклилалкила, или R10 и R11, вместе с атомом азота, с которым они связаны, могут образовывать необязательно замещенную 5-6-членную гетероарильную или гетероциклильную группу, необязательно содержащую один дополнительный гетероатом, выбираемый из N, O и S;
R12 означает водород или необязательно замещенный С1-С6-алкил с линейной или разветвленной цепью;
или к его фармацевтически приемлемой соли, при условии, что следующие соединения исключены:
5-(2-аминопиримидин-4-ил)-2-(5-фтор-2-метилфенил)-1Н-пиррол-3-карбоксамид,
5-(2-аминопиримидин-4-ил)-2-(2,5-дифторфенил)-1Н-пиррол-3-карбоксамид,
5-(2-аминопиримидин-4-ил)-2-(2,5-диметилфенил)-1Н-пиррол-3-карбоксамид,
5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-1Н-пиррол-3-карбоксамид,
5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-фторфенил)-1Н-пиррол-3-карбоксамид,
5-(2-аминопиримидин-4-ил)-2-(2-фтор-5-метилфенил)-1Н-пиррол-3-карбоксамид и
5-(2-аминопиримидин-4-ил)-2-(2-хлор-5-фторфенил)-1Н-пиррол-3-карбоксамид.
Настоящее изобретение также относится к способам получения замещенных пиримидинилпирролов, представленных формулой (I), получаемых посредством процесса, состоящего из стандартных синтетических превращений.
Настоящее изобретение также относится к способу лечения заболевания, вызванного и/или ассоциированного с дисрегулированной активностью протеинкиназы, в особенности, ABL, ACK1, AKT1, ALK, AUR1, AUR2, BRK, BUB1, CDC7/DBF4, CDK2/CYCA, CHK1, CK2, EEF2K, EGFR1, EphA2, EphB4, ERK2, FAK, FGFR1, FLT3, GSK3-бета, Хаспин, IGFR1, IKK2, IR, JAK1, JAK2, JAK3, KIT, LCK, LYN, MAPKAPK2, MELK, MET, MNK2, MPS1, MST4, NEK6, NIM1, P38-альфа, PAK4, PDGFR, PDK1, PERK, PIM1, PIM2, PKA-альфа, PKC-бета, PLK1, RET, ROS1, SULU1, Syk, TLK2, TRKA, TYK2, VEGFR2, VEGFR3, ZAP70, более конкретно, семейство JAK, который включает введение млекопитающему, нуждающемуся в таком лечении, эффективного количества замещенного пиримидинилпиррола, представленного формулой (I), как указано выше. Млекопитающим, нуждающимся в таком лечении, может быть, например, человек.
Предпочтительный способ согласно настоящему изобретению представляет собой лечение заболевания, вызванного и/или ассоциированного с дисрегулированной активностью протеинкиназы, выбираемого из группы, состоящей из ракового заболевания, клеточно-пролиферативных нарушений, вирусных инфекций, связанных с иммунной системой нарушений, нейродегенеративных нарушений и сердечно-сосудистых заболеваний.
Другой предпочтительный способ согласно настоящему изобретению представляет собой лечение конкретных типов ракового заболевания, включая, но не исчерпывающим образом: карциному, такую как карцинома мочевого пузыря, молочной железы, головного мозга, толстой кишки, почки, печени, легкого, включая мелкоклеточный рак легкого, головы и шеи, пищевода, желчного пузыря, яичника, матки, поджелудочной железы, желудка, шейки матки, щитовидной железы, предстательной железы и кожи, включая плоскоклеточную карциному; гемопоэтические опухоли лимфатического происхождения, включая лейкоз, Т- и В-клеточный острый лимфобластный лейкоз (ALL), включая DS-ALL, лимфому В-клеток, лимфому Т-клеток, лимфому Ходжкина, неходжкинскую лимфому, множественную миелому, волосяную клеточную лимфому, лимфому Беркитта и лимфому клеток мантийной зоны; гемопоэтические опухоли миелоидного происхождения, включая острый и хронический миелогенный лейкоз, острый мегакариобластный лейкоз, миелодиспластический синдром и промиелоцитарный лейкоз, миелопролиферативные нарушения, подобные истинной полицитемии (PV), эссенциальную тромбоцитемию (ЕТ), первичный миелофиброз и вторичный миелофиброз по отношению к PV и ЕТ, хронический миеломоноцитарный лейкоз; опухоли мезенхимного происхождения, включая саркому, фибросаркому и рабдомиосаркому; новообразования центральной и периферической нервной системы, включая астроцитому, нейробластому, глиому и шванному; другие новообразования, включая меланому, семиному, тератокарциному, остеосаркому, пигментную ксеродерму, кератоксантому, фолликулярный рак щитовидной железы, саркому Капоши, мезотелиому.
Другой предпочтительный способ согласно настоящему изобретению представляет собой лечение конкретных типов клеточно-пролиферативных нарушений, включая, но не исчерпывающим образом: доброкачественную гиперплазию предстательной железы, псориаз, пролиферацию гладкомышечных клеток, связанную с атеросклерозом; фиброз легких, артрит, гломерулонефрит и послеоперационный стеноз и рестеноз.
Другой предпочтительный способ согласно настоящему изобретению представляет собой лечение вирусных инфекций, включающий предупреждение развития СПИДа у ВИЧ-инфицированных индивидуумов.
Предпочтительный способ согласно настоящему изобретению представляет собой лечение связанных с иммунной системой нарушений, включая, но не исчерпывающим образом: отторжение трансплантата, кожные нарушения, подобные псориазу, аллергии, астму и опосредованные аутоиммунной системой заболевания, такие как ревматоидный артрит (RA), системная красная волчанка (SLE), болезнь Крона и боковой амиотрофический склероз.
Другой предпочтительный способ согласно настоящему изобретению представляет собой лечение нейродегенеративных нарушений, включая, но не исчерпывающим образом: болезнь Альцгеймера, дегенеративные нервные заболевания, энцефалит, инсульт, болезнь Паркинсона, рассеянный склероз, боковой амиотрофический склероз (ALS или болезнь Лу Герига), болезнь Хантингтона и болезнь Пика.
Другой предпочтительный способ согласно настоящему изобретению представляет собой лечение сердечно-сосудистых заболеваний, включая, но не исчерпывающим образом: первичный или вторичный атеросклероз вследствие диабета, сердечный приступ и инсульт.
В дополнение, способ согласно настоящему изобретению также относится к ангиогенезу опухоли и ингибированию метастаз, а также к лечению отторжения трансплантата органа и болезни «трансплантат против хозяина».
Кроме того, способ согласно настоящему изобретению, далее, включает подвергание млекопитающего, нуждающегося в этом, режиму лучевой терапии или химиотерапии, в комбинации по меньшей мере с одним цитостатическим или цитотоксическим агентом.
Настоящее изобретение также относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы (I), или его фармацевтически приемлемой соли, и по меньшей мере один фармацевтически приемлемый эксципиент, носитель и/или разбавитель.
В дополнение, настоящее изобретение относится к фармацевтической композиции, включающей соединение формулы (I), дополнительно содержащей один или более химиотерапевтических - например, цитостатических или цитотоксических - агентов, агенты типа антибиотика, алкилирующие агенты, антиметаболические агенты, гормональные агенты, иммунологические агенты, агенты типа интерферона, ингибиторы циклооксигеназы (например, ингибиторы СОХ-2), ингибиторы матриксметаллопротеазы, ингибиторы теломеразы, ингибиторы тирозинкиназы, рецепторные агенты против фактора роста, подобные агентам анти-HER, агенты анти-EGFR, анти-Abl, агенты против ангиогенеза (например, ингибиторы ангиогенеза), ингибиторы фарнезилтрансферазы, ингибиторы пути сигнальной трансдукции ras-raf-киназы, ингибиторы пути Akt, ингибиторы клеточного цикла, другие ингибиторы cdk, агенты, связывающие тубулин, ингибиторы топоизомеразы I, ингибиторы топоизомеразы II и т.п.
Настоящее изобретение дополнительно относится к способу in vitro ингибирования активности JAK1-, JAK2-, JAK3-протеинкиназы, который включает контактирование киназы с эффективным количеством соединения формулы (I), как представлено выше.
Настоящее изобретение также относится к анализу клеточной линии SET-2 в отношении JAK2-зависимого человеческого мегакариобластного лейкоза, который включает контактирование клеток с эффективным количеством соединения формулы (I), как представлено выше.
Кроме того, настоящее изобретение относится к модели in vivo, где клеточную линию SET-2 острого мегакариобластного лейкоза инокулировали подкожно самкам мышей в возрасте 5-6 недель с тяжелым комбинированным иммунодефицитом (SCID). Мышей с прощупываемой опухолью обрабатывали соединением формулы (I) в течение 10 суток, два раза в сутки. Размеры опухоли регулярно измеряли, используя штангенциркуль с нониусом, и рассчитывали ингибирование роста опухоли (TGI).
Дополнительно, данное изобретение относится к продукту, содержащему соединение формулы (I), или его фармацевтически приемлемую соль, как указано выше, и один или более химиотерапевтических агентов, в виде комбинированного лекарственного средства для одновременного, раздельного или последовательного применения в противораковой терапии.
Еще в другом аспекте данное изобретение относится к соединению формулы (I), или его фармацевтически приемлемой соли, как указано выше, для применения в качестве лекарственного средства.
Кроме того, данное изобретение относится к соединению формулы (I), или его фармацевтически приемлемой соли, как указано выше, для применения в способе лечения ракового заболевания.
В заключение, данное изобретение относится к применению соединения формулы (I), или его фармацевтически приемлемой соли, как указано выше, для получения лекарственного средства с противораковой активностью.
За исключением иначе указанного, когда ссылаются на сами соединения формулы (I), а также на включающую их любую фармацевтическую композицию или любое терапевтическое лечение, включающее данные соединения, настоящее изобретение включает все гидраты, сольваты, комплексы, метаболиты, фармацевтически приемлемые пролекарства, фармацевтически приемлемые биопредшественники, носители, N-оксиды и фармацевтически приемлемые соли соединений данного изобретения.
«Метаболит» соединения формулы (I) представляет собой любое соединение, в которое это же самое соединение формулы (I) превращено in vivo, например, после введения его млекопитающему, нуждающемуся в этом. Типично, однако, без представления ограничивающего примера, после введения соединения формулы (I) это же самое производное может быть превращено в множество соединений, например, включая более растворимые производные, подобные гидроксилированным производным, которые легко выделяются. Следовательно, в зависимости от таким образом встречающегося метаболического пути, любое из этих гидроксилированных производных может быть рассмотрено в качестве метаболита соединений формулы (I).
«Фармацевтически приемлемое пролекарство» и «фармацевтически приемлемые биопредшественники» представляют собой любые ковалентно связанные соединения, которые высвобождают in vivo активное исходное лекарственное средство согласно формуле (I).
Термины «фармацевтически приемлемое пролекарство» и «фармацевтически приемлемые биопредшественники», как используется в данном контексте, относятся к таким пролекарственным формам соединений согласно настоящему изобретению, которые, в рамках медицинского заключения, являются пригодными для применения в контакте с тканями людей и низших животных, без чрезмерной токсичности, раздражения, аллергического ответа и т.п., в соответствии с разумным соотношением польза/риск, и эффективными для их предназначенного применения, а также, где возможно, цвиттерионным формам соединений согласно данному изобретению. Термин «пролекарство» относится к соединениям, которые быстро превращаются in vivo с образованием активного исходного лекарственного средства в соответствии с формулой (I), например, путем гидролиза в крови. Подробное обсуждение представлено T. Higuchi и V. Stella, Pro-drugs as Novel Delivery Systems, том 14, A.C.S. Symposium Series, и Edward B. Roche, Bioreversible Carriers in Drug Design, American Pharmaceutical Association and Pergamon Press, 1987.
«N-оксиды» представляют собой соединения формулы (I), где азот и кислород связаны через донорно-акцепторную связь.
Фармацевтически приемлемые соли соединений формулы (I) включают аддитивные соли кислот с неорганическими или органическими кислотами, как например, азотная, соляная, бромистоводородная, серная, хлорная, фосфорная, уксусная, трифторуксусная, пропионовая, гликолевая, фумаровая, молочная, щавелевая, малоновая, яблочная, малеиновая, винная, лимонная, бензойная, коричная, миндальная, метансульфоновая, изэтионовая и салициловая кислота.
Фармацевтически приемлемые соли соединений формулы (I) также включают соли с неорганическими или органическими основаниями, как например, щелочные или щелочноземельные металлы, особенно гидроксиды, карбонаты или бикарбонаты натрия, калия, кальция, аммония или магния, ациклические или циклические амины.
Если в соединении согласно настоящему изобретению присутствует стереогенный центр или другая форма изомерного центра, то подразумевают, что все формы такого изомера или таких изомеров, включая энантиомеры и диастереомеры, входят в рамки данного контекста. Соединения, содержащие стереогенный центр, могут быть использованы в виде рацемической смеси, энантиомерно обогащенной смеси, или рацемическую смесь можно разделять, используя хорошо известные способы, и индивидуальный энантиомер может быть использован один. В случаях, в которых соединения имеют ненасыщенные двойные связи «углерод-углерод», как цис (Z)-, так и транс (Е)-изомеры входят в рамки данного изобретения.
В случаях, где соединения могут существовать в таутомерных формах, таких как кето-енольные таутомеры, предполагают, что каждая таутомерная форма входит в рамки данного изобретения, находится ли она в равновесии или преобладающе в одной форме.
В описании настоящего изобретения, за исключением иначе указанного, следующие термины имеют следующие значения.
Термин «арил» включает карбоциклические или гетероциклические углеводороды с 1-2 циклами, или конденсированными или связанными друг с другом ординарными связями, где по меньшей мере один из циклов является ароматическим; если присутствует, на любой ароматический гетероциклический углеводород также ссылаются как на гетероарильную группу, включающую 5-6-членный цикл с 1-3 гетероатомами, выбираемыми из N, O и S.
Примерами арильных групп, согласно данному изобретению, являются, например, фенил, бифенил, α- или β-нафтил, дигидронафтил, тиенил, бензотиенил, фурил, бензофуранил, пирролил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, изоксазолил, пиридил, пиразинил, пиримидинил, пиридазинил, индолил, изоиндолил, пуринил, хинолил, изохинолил, дигидрохинолинил, хиноксалинил, бензодиоксолил, инданил, инденил, триазолил и т.п.
Под термином «гетероциклил» (также известный как «гетероциклоалкил») авторы данного изобретения подразумевают 3-7-членный, насыщенный или частично ненасыщенный карбоцикл, где один или более атомов углерода заменены гетероатомами, такими как азот, кислород и сера. Неограничивающими примерами гетероциклильных групп являются, например, пиран, пирролидин, пирролин, имидазолин, имидазолидин, пиразолидин, пиразолин, тиазолин, тиазолидин, дигидрофуран, тетрагидрофуран, 1,3-диоксолан, пиперидин, пиперазин, морфолин и т.п.
Под термином «С1-С6-алкил с линейной или разветвленной цепью», следовательно, охватывающим С1-С4-алкил или С2-С6-алкил, авторы данного изобретения подразумевают любую из групп, такую как, например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, втор-бутил, н-пентил, н-гексил и т.п.
Под термином «С3-С7-циклоалкил», за исключением иначе указанного, авторы данного изобретения подразумевают 3-7-членный полностью углеродный моноцикл, который может содержать одну или более двойных связей, но не имеет полностью сопряженную π-электронную систему. Примерами циклоалкильных групп, без ограничения, являются циклопропан, циклобутан, циклопентан, циклопентен, циклогексан, циклогексен, циклогексадиен, циклогептан, циклогептен, циклогептадиен.
Под термином «С2-С6-алкенил с линейной или разветвленной цепью» авторы данного изобретения подразумевают любые группы, такие как, например, винил, аллил, 1-пропенил, изопропенил, 1-бутенил, 2-бутенил, 3-бутенил, 2-пентенил, 1-гексенил и т.п.
Под термином «С2-С6-алкинил с линейной или разветвленной цепью» авторы данного изобретения подразумевают любые группы, такие как, например, этинил, 2-пропинил, 4-пентинил и т.п.
В соответствии с настоящим изобретением и за исключением иначе предусмотренного, любая из вышеуказанных групп R1, R2, R3, R4, R12 может быть необязательно замещена, в любом из ее свободных положений, одной или более группами, например, 1-6 группами, независимо выбираемыми из группы, состоящей из: атома галогена, нитро, оксогрупп (=О), циано, С1-С6-алкила, полифторированного алкила, полифторированного алкокси, алкенила, алкинила, гидроксиалкила, арила, арилалкила, гетероциклила, С3-С7-циклоалкила, гидрокси, алкокси, арилокси, гетероциклилокси, метилендиокси, алкилкарбонилокси, арилкарбонилокси, циклоалкенилокси, гетероциклилкарбонилокси, алкилиденаминоокси, карбокси, алкоксикарбонила, арилоксикарбонила, циклоалкилоксикарбонила, гетероциклилоксикарбонила, амино, уреидо, алкиламино, диалкиламино, ариламино, диариламино, гетероциклиламино, формиламино, алкилкарбониламино, арилкарбониламино, гетероциклилкарбониламино, аминокарбонила, алкиламинокарбонила, диалкиламинокарбонила, ариламинокарбонила, гетероциклиламинокарбонила, алкоксикарбониламино, гидроксиаминокарбонилалкоксиимино, алкилсульфониламино, арилсульфониламино, гетероциклилсульфониламино, формила, алкилкарбонила, арилкарбонила, циклоалкилкарбонила, гетероциклилкарбонила, алкилсульфонила, арилсульфонила, аминосульфонила, алкиламиносульфонила, диалкиламиносульфонила, ариламиносульфонила, гетероциклиламиносульфонила, арилтио, алкилтио, фосфоната и алкилфосфоната.
В свою очередь, в случае необходимости, каждый вышеуказанный заместитель может быть далее замещен одной или более вышеуказанной(ыми) группой(ами).
В этом отношении, под термином «атом галогена» авторы данного изобретения подразумевают атом фтора, хлора, брома или иода.
Под термином «циано» авторы данного изобретения подразумевают остаток -CN.
Под термином «нитро» авторы данного изобретения подразумевают группу -NO2.
Под термином «полифторированный алкил или алкокси» авторы данного изобретения подразумевают любой вышеуказанный С1-С6-алкил или алкокси с линейной или разветвленной цепью, который замещен более чем одним атомом фтора, такой как, например, трифторметил, трифторэтил, 1,1,1,3,3,3-гексафторпропил, трифторметокси и т.п.
Под терминами «алкокси», «арилокси», «гетероциклилокси» и их производными авторы данного изобретения подразумевают любую из вышеуказанных С1-С6-алкильной, арильной или гетероциклильной групп, связанных с остатком молекулы через атом кислорода (-О-).
Из всего вышесказанного, квалифицированному специалисту ясно, что любая группа, название которой представляет собой составное название, такое как, например, «ариламино», подразумевают, что оно обычно сконструировано из частей, от которых оно происходит, например, от аминогруппы, которая далее замещена арилом, где арил имеет значение, как указано выше.
Также, любой из терминов, таких как, например, алкилтио, алкиламино, диалкиламино, алкоксикарбонил, алкоксикарбониламино, гетероциклилкарбонил, гетероциклилкарбониламино, циклоалкилоксикарбонил и т.п., включает группы, где алкил, алкокси, арил, С3-С7-циклоалкил и гетероциклил имеют значения, как указано выше.
Предпочтительно, соединение формулы (I) характеризуется тем, что R4 представляет собой NR10R11, где R10 и R11 независимо означают водород или необязательно замещенный С1-С6-алкил с линейной или разветвленной цепью; и R1, R2, R3 и R12 имеют значения, как указано выше.
Более предпочтительно, соединение формулы (I) характеризуется тем, что R3 представляет собой NR8R9, где R8 и R9 независимо означают водород или необязательно замещенный С1-С6-алкил с линейной или разветвленной цепью; и R1, R2, R4 и R12 имеют значения, как указано выше.
Еще более предпочтительно, соединение формулы (I) характеризуется тем, что R12 означает водород; и R1, R2, R3 и R4 имеют значения, как указано выше.
Конкретные, не исчерпывающие, предпочтительные соединения (cmpds) согласно данному изобретению, когда бы ни предназначались в форме фармацевтически приемлемых солей, являются следующими:
1. 5-(2-аминопиримидин-4-ил)-2-[2-хлор-5-(трифторметил)фенил]-1Н-пиррол-3-карбоксамид,
2. 5-(2-аминопиримидин-4-ил)-2-(2,5-дихлорфенил)-1Н-пиррол-3-карбоксамид,
3. 5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-метоксифенил)-1Н-пиррол-3-карбоксамид,
4. 5-(2-аминопиримидин-4-ил)-2-(2-хлор-5-этилфенил)-1Н-пиррол-3-карбоксамид,
5. 5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-этилфенил)-1Н-пиррол-3-карбоксамид,
6. 5-(2-аминопиримидин-4-ил)-2-(2-хлор-5-метилфенил)-1Н-пиррол-3-карбоксамид,
7. 5-(2-аминопиримидин-4-ил)-2-(2-хлор-5-цианофенил)-1Н-пиррол-3-карбоксамид,
8. 5-(2-аминопиримидин-4-ил)-2-(5-бром-2-метоксифенил)-1Н-пиррол-3-карбоксамид,
9. 5-(2-аминопиримидин-4-ил)-2-(5-бром-2-фторфенил)-1Н-пиррол-3-карбоксамид,
10. 5-(2-аминопиримидин-4-ил)-2-[2-хлор-5-(гидроксиметил)фенил]-1Н-пиррол-3-карбоксамид,
11. 5-(2-аминопиримидин-4-ил)-2-(2-хлор-5-метоксифенил)-1Н-пиррол-3-карбоксамид,
12. 5-(2-аминопиримидин-4-ил)-2-[2-хлор-5-(трифторметокси)фенил]-1Н-пиррол-3-карбоксамид,
13. 5-(2-аминопиримидин-4-ил)-2-[2-метил-5-(трифторметил)фенил]-1Н-пиррол-3-карбоксамид,
14. 5-(2-аминопиримидин-4-ил)-2-[5-хлор-2-(пропан-2-ил)фенил]-1Н-пиррол-3-карбоксамид,
15. 5-(2-аминопиримидин-4-ил)-2-[2,5-бис(трифторметил)фенил]-1Н-пиррол-3-карбоксамид,
16. 5-(2-аминопиримидин-4-ил)-2-[2-этил-5-(трифторметил)фенил]-1Н-пиррол-3-карбоксамид,
17. 5-(2-аминопиримидин-4-ил)-2-[5-хлор-2-(трифторметил)фенил]-1Н-пиррол-3-карбоксамид,
18. 5-(2-аминопиримидин-4-ил)-2-(5-циано-2-метилфенил)-1Н-пиррол-3-карбоксамид,
19. 5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-N-метил-1Н-пиррол-3-карбоксамид,
20. 5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-N-этил-1Н-пиррол-3-карбоксамид,
21. 5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-N-(2-гидроксиэтил)-1Н-пиррол-3-карбоксамид,
22. 5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-N-[2-(пиперидин-1-ил)этил]-1Н-пиррол-3-карбоксамид,
23. 5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-N-(1-метилпиперидин-4-ил)-1Н-пиррол-3-карбоксамид,
24. 5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-N-фенил-1Н-пиррол-3-карбоксамид,
25. 5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-N-(фуран-2-илметил)-1Н-пиррол-3-карбоксамид,
26. 5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-N-(3-гидроксипропил)-1Н-пиррол-3-карбоксамид,
27. 5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-N-(2-метоксиэтил)-1Н-пиррол-3-карбоксамид,
28. 5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-N-(2-фторэтил)-1Н-пиррол-3-карбоксамид,
29. 5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-N,N-диметил-1Н-пиррол-3-карбоксамид,
30. N-(2-аминоэтил)-5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-1Н-пиррол-3-карбоксамид,
31. 5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-N-[2-(метиламино)этил]-1Н-пиррол-3-карбоксамид,
32. 5-(2-аминопиримидин-4-ил)-N-бензил-2-(5-хлор-2-метилфенил)-1Н-пиррол-3-карбоксамид,
33. 5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-N-(2-метилпропил)-1Н-пиррол-3-карбоксамид,
34. 5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-N-(2,2-диметилпропил)-1Н-пиррол-3-карбоксамид,
35. 5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-этилфенил)-N-метил-1Н-пиррол-3-карбоксамид,
36. 5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-этилфенил)-N-этил-1Н-пиррол-3-карбоксамид,
37. 5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-этилфенил)-N-(2-гидроксиэтил)-1Н-пиррол-3-карбоксамид,
38. 5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-этилфенил)-N,N-диметил-1Н-пиррол-3-карбоксамид,
39. 5-(2-аминопиримидин-4-ил)-2-[2-хлор-5-(трифторметил)фенил]-N-метил-1Н-пиррол-3-карбоксамид,
40. 5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-гидроксифенил)-1Н-пиррол-3-карбоксамид,
41. 5-(2-аминопиримидин-4-ил)-2-(2-хлор-5-гидроксифенил)-1Н-пиррол-3-карбоксамид,
42. 2-(5-хлор-2-метилфенил)-5-[2-(метиламино)пиримидин-4-ил]-1Н-пиррол-3-карбоксамид,
43. 5-(пиримидин-4-ил)-2-(5-хлор-2-метилфенил)-1Н-пиррол-3-карбоксамид,
44. 2-(5-хлор-2-метилфенил)-5-(2-метилпиримидин-4-ил)-1Н-пиррол-3-карбоксамид,
45. 5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-этилфенил)-1-метил-1Н-пиррол-3-карбоксамид,
46. 5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-1-метил-1Н-пиррол-3-карбоксамид,
47. 5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-1-этил-1Н-пиррол-3-карбоксамид,
48. 5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-1-(2,2,2-трифторэтил)-1Н-пиррол-3-карбоксамид,
49. 5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-1-(2-гидроксиэтил)-1Н-пиррол-3-карбоксамид,
50. 5-(2-аминопиримидин-4-ил)-N-метил-2-[2-метил-5-(трифторметил)фенил]-1Н-пиррол-3-карбоксамид, и
51. 5-(2-аминопиримидин-4-ил)-2-[2-этил-5-(трифторметил)фенил]-N-метил-1Н-пиррол-3-карбоксамид.
Настоящее изобретение также относится к способу получения соединения формулы (I), как указано выше, посредством использования путей реакций и схем синтеза, описанных ниже, применения методик, доступных в данной области, и легкодоступных исходных веществ. Осуществление некоторых воплощений настоящего изобретения описано в примерах, которые следуют, но квалифицированному специалисту в данной области должно быть понятно, что описанные осуществления можно без труда адаптировать к осуществлению других воплощений настоящего изобретения. Например, синтез непроиллюстрированных соединений согласно данному изобретению может быть осуществлен путем модификаций, очевидных квалифицированному специалисту в данной области, например, с помощью соответствующих интерферирующих защитных групп, путем замены на другие подходящие реагенты, известные в данной области, или путем осуществления рутинных модификаций реакционных условий. Альтернативно, другие реакции, упоминаемые в данном контексте или известные в данной области, должны быть понятны как обладающие адаптивностью для получения других соединений согласно данному изобретению.
Соединения согласно данному изобретению можно получать из легкодоступных исходных веществ, используя следующие общие способы и методики. За исключением иначе указанного, исходные вещества представляют собой известные соединения или их можно получать из известных соединений, в соответствии с хорошо известными методиками. Должно быть понятно, что, где используют типичные или предпочтительные условия процесса (то есть, температуры реакций, времена, мольные соотношения реагентов, растворители, давления), также могут быть использованы другие условия процесса, за исключением иначе указанного. Оптимальные условия реакции можно варьировать с помощью используемых конкретных реагентов или растворителя, однако, такие условия могут быть определены только квалифицированным специалистом в данной области путем рутинных процедур оптимизации. Дополнительно, как должно быть очевидно квалифицированному специалисту в данной области, стандартные защитные группы могут быть необходимы для предохранения некоторых функциональных групп от подвергания нежелательным реакциям. Подходящие защитные группы для различных функциональных групп, а также подходящие условия для защиты и снятия защиты с конкретных функциональных групп, хорошо известны в данной области. Например, многочисленные защитные группы описаны в руководстве T.W. Greene и P.G.M. Wuts, Protecting Groups in Organic Synthesis, второе издание, Wiley, New York, 1991, и в ссылках, упоминаемых в данном контексте.
Соединение формулы (I) можно получать в соответствии с общими способами синтеза, описанными ниже на схемах А, В, С и D.
На описываемой схеме А представлено получение соединения формулы (I), где R1, R2 и R3 имеют значения, как указано выше, R4 означает NH2 и R12 означает водород.
Схема А
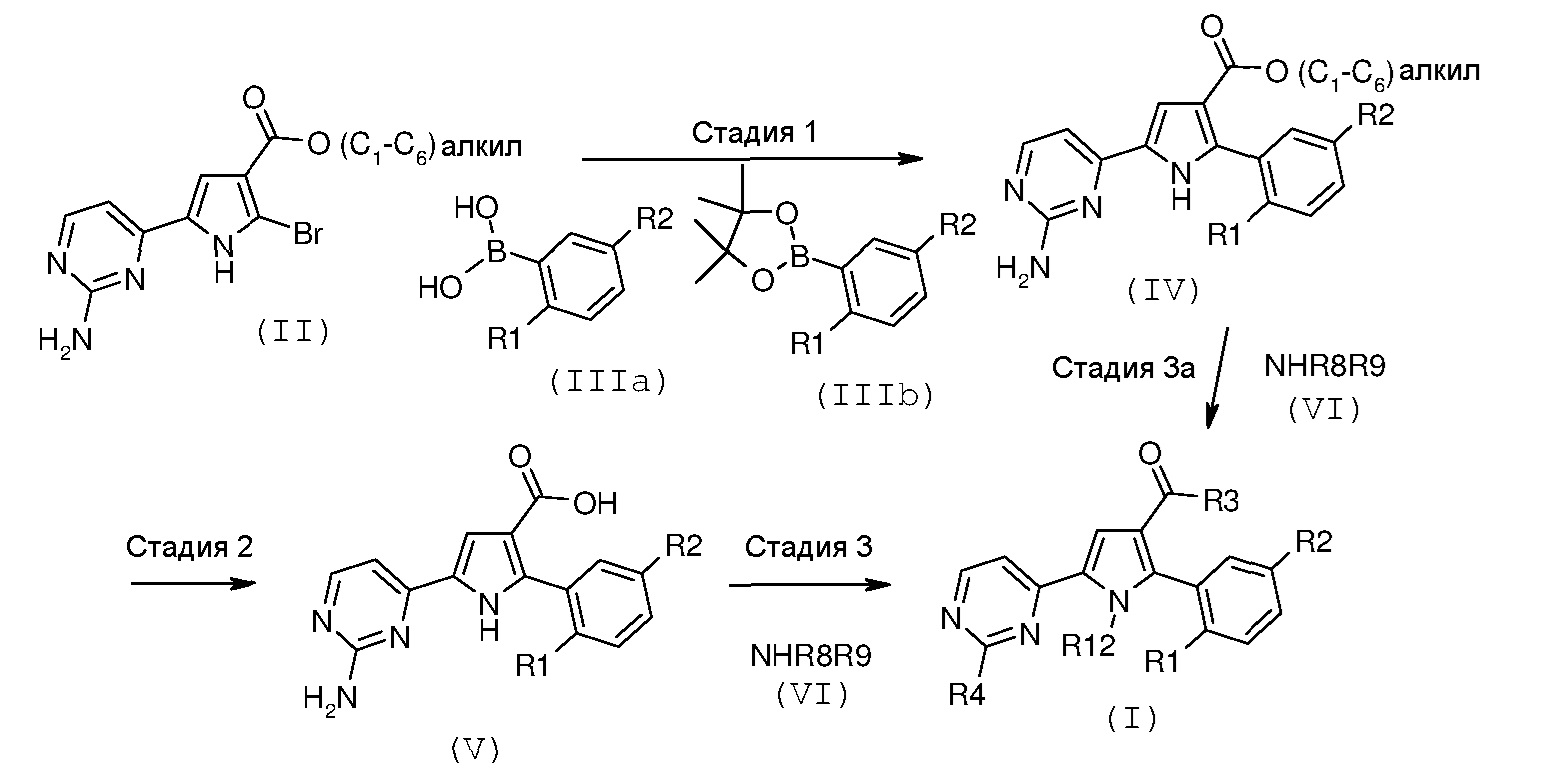
На вышеуказанной схеме R1, R2, R3, R8 и R9 имеют значения, как описано выше, R4 означает NH2 и R12 означает водород.
Всем квалифицированным специалистам в данной области должно быть понятно, что любое превращение, осуществляемое в соответствии с вышеуказанными способами, может требовать стандартных модификаций, таких как, например, защита вводимых групп, замена на другие подходящие реагенты, известные в данной области, или проведение рутинных модификаций условий реакции.
Соответственно, способ согласно настоящему изобретению включает следующие стадии:
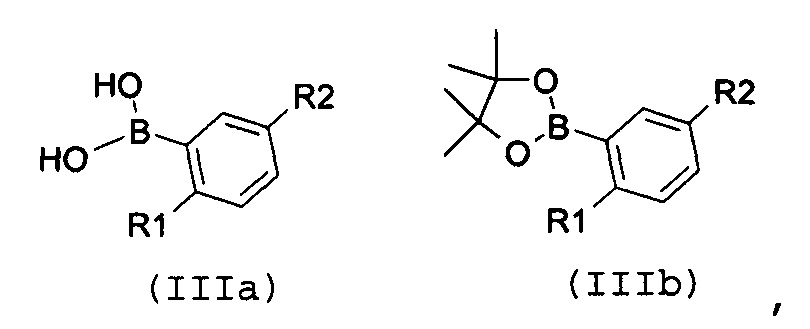
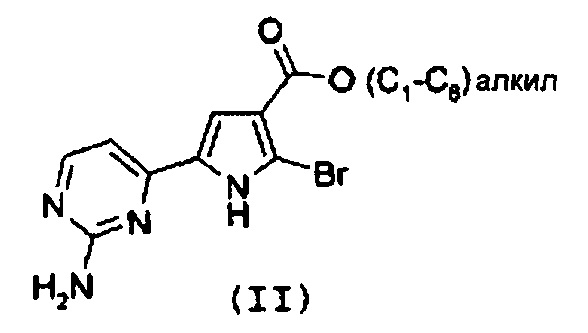
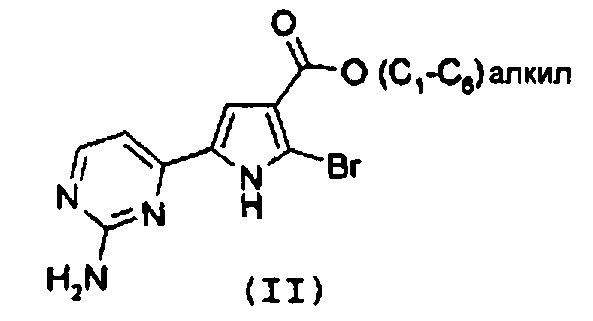
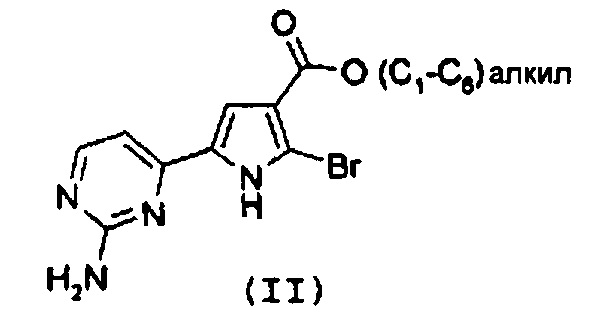
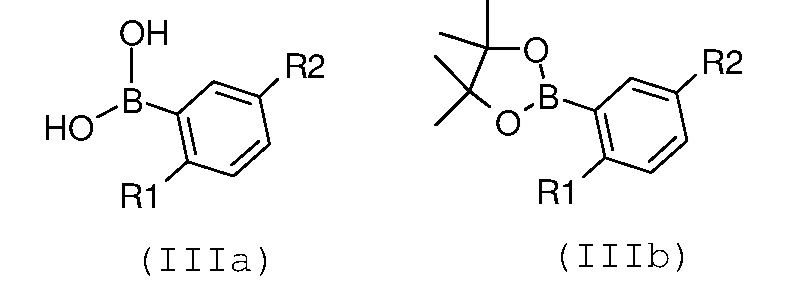
Стадия 1: катализируемая металлом реакция сочетания галогенпроизводного формулы (II):
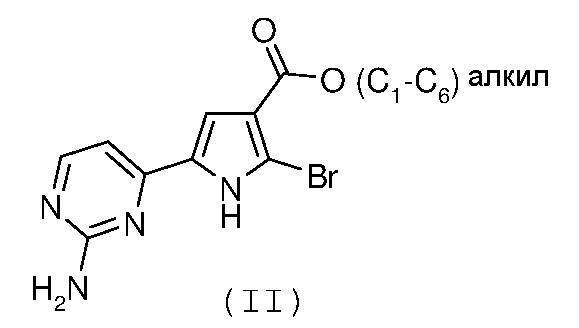
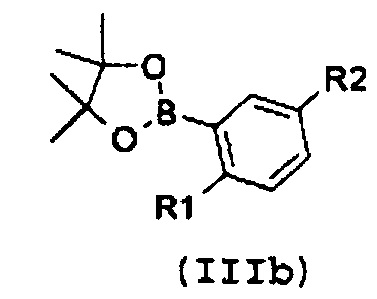
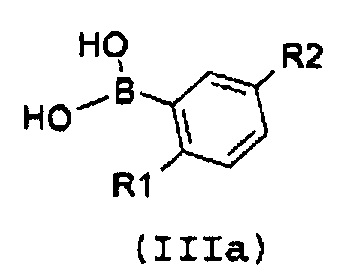
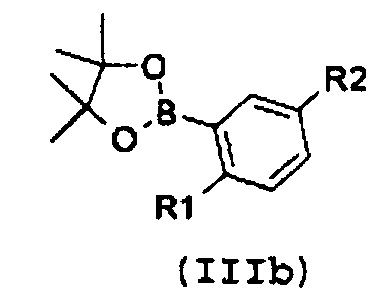
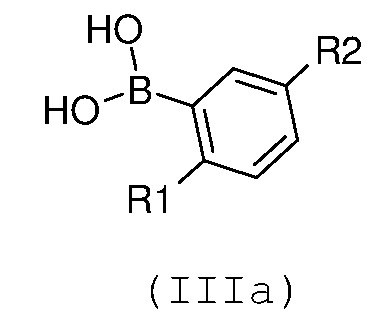
с замещенной арилбороновой кислотой формулы (IIIa) или эфиром арилбороновой кислоты формулы (IIIb):
 ,
,
где R1 и R2 имеют значения, как указано выше;
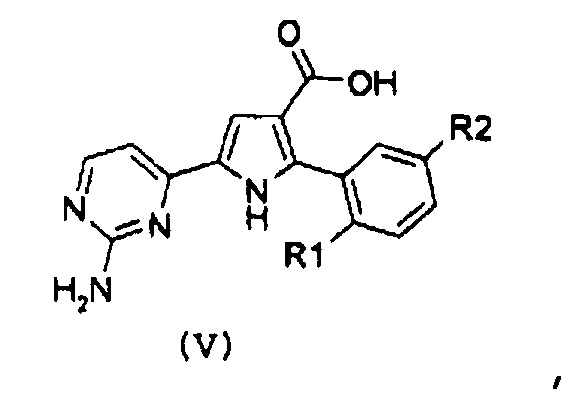
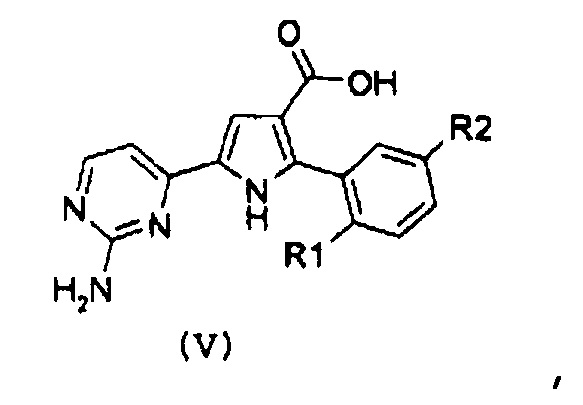
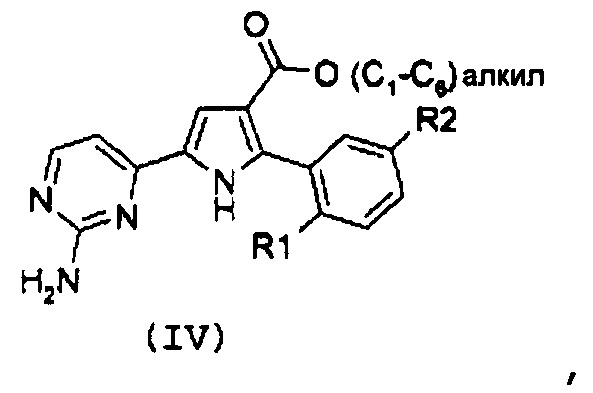
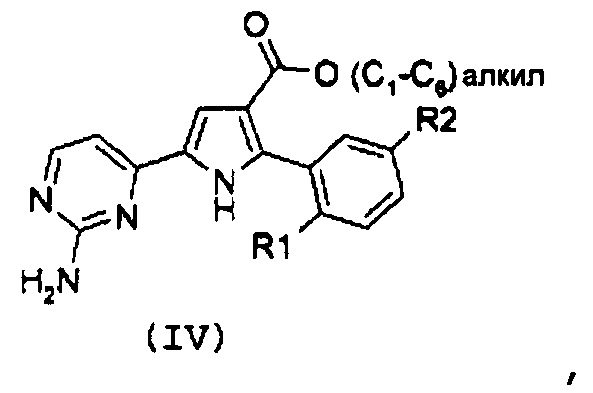
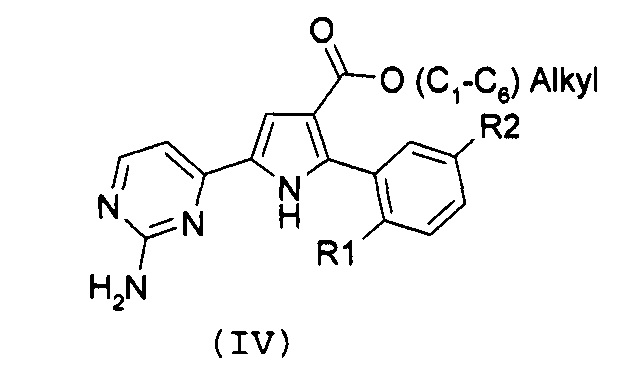
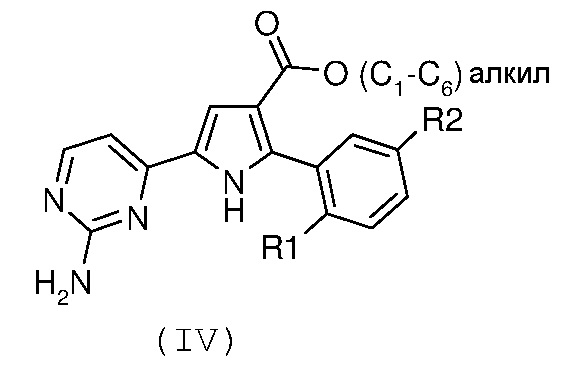
Стадия 2: гидролиз полученного эфира карбоновой кислоты формулы (IV):
 ,
,
где R1 и R2 имеют значения, как указано выше, за счет щелочного гидролиза;
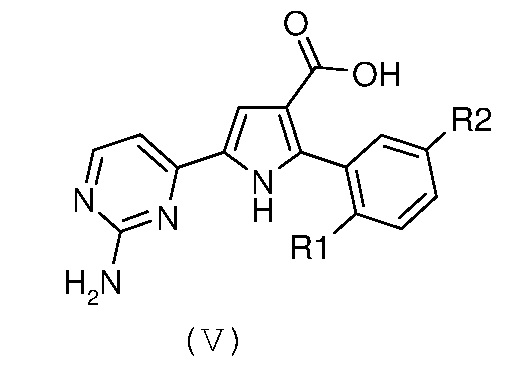
Стадия 3: амидирование полученной карбоновой кислоты формулы (V):
 ,
,
где R1 и R2 имеют значения, как указано выше, путем введения во взаимодействие с производным формулы (VI):
NHR8R9 (VI),
где R8 и R9 имеют значения, как указано выше, с получением соединения формулы (I):
 ,
,
где R1, R2 и R3 имеют значения, как указано выше, R4 означает NH2 и R12 означает водород;
или
Стадия 3а: прямое амидирование эфира карбоновой кислоты формулы (IV), как указано выше, путем введения во взаимодействие с производным формулы (VI), как указано выше, с получением соединения формулы (I):
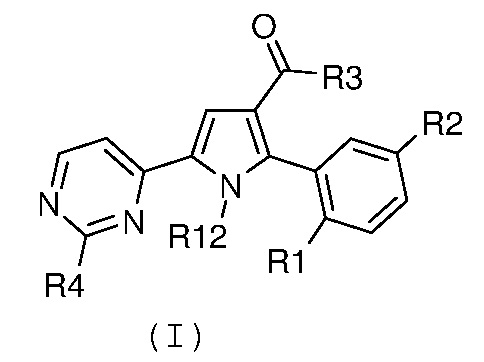 ,
,
где R1, R2 и R3 имеют значения, как указано выше, R4 означает NH2 и R12 означает водород;
необязательно, превращение соединения формулы (I) в другое, несходное, соединение формулы (I) и, если желательно, превращение соединения формулы (I) в его фармацевтически приемлемую соль или превращение соли в свободное соединение (I).
В соответствии со стадией 1 схемы А, превращение галогенпроизводного общей формулы (II) в соединение формулы (IV) может быть осуществлено множеством путей. Например, соединение формулы (II) может быть введено во взаимодействие путем катализируемых металлом реакций сочетания с замещенной арилбороновой кислотой формулы (IIIa) или эфиром арилбороновой кислоты формулы (IIIb). Предпочтительно, соединение формулы (IV) может быть получено из промежуточных соединений (II) путем катализируемой Pd реакции сочетания Suzuki-Miyaura с замещенной арилбороновой кислотой общей формулы (IIIa) или эфиром арилбороновой кислоты общей формулы (IIIb). Катализируемые переходным металлом реакции сочетания (гетеро)арилгалогенидов с арилбороновыми кислотами или эфирами бороновых кислот хорошо известны квалифицированному специалисту в данной области, см. ссылки: a) Miyaura, Norio; Suzuki, Akira (1979). “Palladium-Catalyzed Cross-Coupling Reactions of Organoboron Compounds”, Chemical reviews 95 (7): 2457-2483; b) Suzuki, A. In Metal-Catalyzed Cross-Coupling Reactions, Diederich F. and Stang P.J., изд. Wiley-VCH: New York, 1998, pp. 49-97. В случае так называемой реакции Suzuki-Miyaura, реакция сочетания арилбороновых кислот или эфира бороновой кислоты с (гетеро)арилгалогенидами обычно инициируется палладиевым комплексом. Для этой реакции используют фосфинпалладиевые комплексы, такие как тетракис(трифенилфосфин)палладий(0), но также можно использовать бис(трифенилфосфин)палладий(II)хлорид, [1,1’-бис(дифенилфосфино)ферроцен]дихлорпалладий(II). Добавляют основание, такое как фосфат калия, карбонат натрия, карбонат цезия, карбонат калия, трет-бутоксид калия, тетраэтиламмонийгидроксид, триэтиламин, и в качестве реакционных сред могут быть использованы тетрагидрофуран, диоксан, N,N-диметилформамид, этанол и толуол. Типично, диапазон температур составляет от комнатной температуры до температуры 150°С. Можно использовать стандартное нагревание вместе с микроволновым излучением. Продолжительность реакции составляет от примерно 30 минут до примерно 96 часов. Различные комбинации Pd-катализатор/основание/растворитель описаны в литературе, что позволяет точно регулировать условия реакции для того, чтобы можно было получить большое множество дополнительных функциональных групп у обоих компонентов сочетания.
В соответствии со стадией 2 схемы А, гидролиз производного формулы (IV) до карбоновой кислоты формулы (V) может быть осуществлен множеством путей. Типично, NaOH или KOH в спиртовом растворе используют в диапазоне температур от комнатной температуры до температуры 150°С, в диапазоне времени от примерно 30 минут до примерно 96 часов.
В соответствии со стадией 3 схемы А, превращение карбоновой кислоты формулы (V) в амид формулы (I) может быть осуществлено множеством путей и экспериментальных условий, которые широко известны в данной области для получения карбоксамидов. В качестве примера, соединение формулы (V) можно превращать в его соответствующий ацилхлорид в присутствии тионилхлорида или оксалилхлорида, в подходящем растворителе, таком как толуол, дихлорметан, хлороформ, диэтиловый эфир, тетрагидрофуран, диоксан, в диапазоне температур от примерно -10°С до температуры кипения с обратным холодильником, и в течение периода времени, изменяющегося от примерно 1 часа до примерно 96 часов. Ацилхлорид может быть выделен путем выпаривания растворителя и далее введен во взаимодействие с 33%-ным раствором гидроксида аммония или с амином NHR8R9 (VI), в подходящем растворителе, таком как толуол, дихлорметан, хлороформ, диэтиловый эфир, тетрагидрофуран, диоксан, в диапазоне температур от примерно -10°С до температуры кипения с обратным холодильником, и в течение периода времени, изменяющегося от примерно 1 часа до примерно 96 часов. Альтернативно, соединение формулы (V) может быть введено во взаимодействие с аммониевой солью 1-гидроксибензотриазола или с амином NHR8R9 (VI), в присутствии карбодиимида, такого как дициклогексилкарбодиимид, диизопропилкарбодиимид, 1-этил-3-(3’-диметиламино)карбодиимидгидрохлорид. Предпочтительно, эту реакцию осуществляют в подходящем растворителе, таком как, например, тетрагидрофуран, дихлорметан, толуол, диоксан, N,N-диметилформамид, и в присутствии акцептора протонов, такого как, например, триэтиламин, N,N-диизопропилэтиламин, в диапазоне температур от комнатной температуры до температуры кипения с обратным холодильником, в течение времени в диапазоне от примерно 30 минут до примерно 96 часов.
В соответствии со стадией 3а схемы А, прямое превращение сложного эфира (VI) в соединение формулы (I) осуществимо также путем синтеза и подразумевают, что это включено в рамки данного изобретения. Согласно последним литературным данным, предполагают, например, что такое превращение может быть без труда осуществлено путем использования нитрида магния (Mg3N2), в подходящем растворителе, таком как спирт, под воздействием микроволнового излучения (Gemma, E.; Veitch, G.E.; Bridgwood, K.L.; Ley, S.V. Org. Lett. 2008, 10, 3623).
Настоящее изобретение дополнительно относится к альтернативному способу получения соединения формулы (I), где R1, R2 и R3 имеют значения, как описано выше, R4 означает NH2 и R12 означает водород, который представлен на схеме В, приводимой ниже.
Схема В
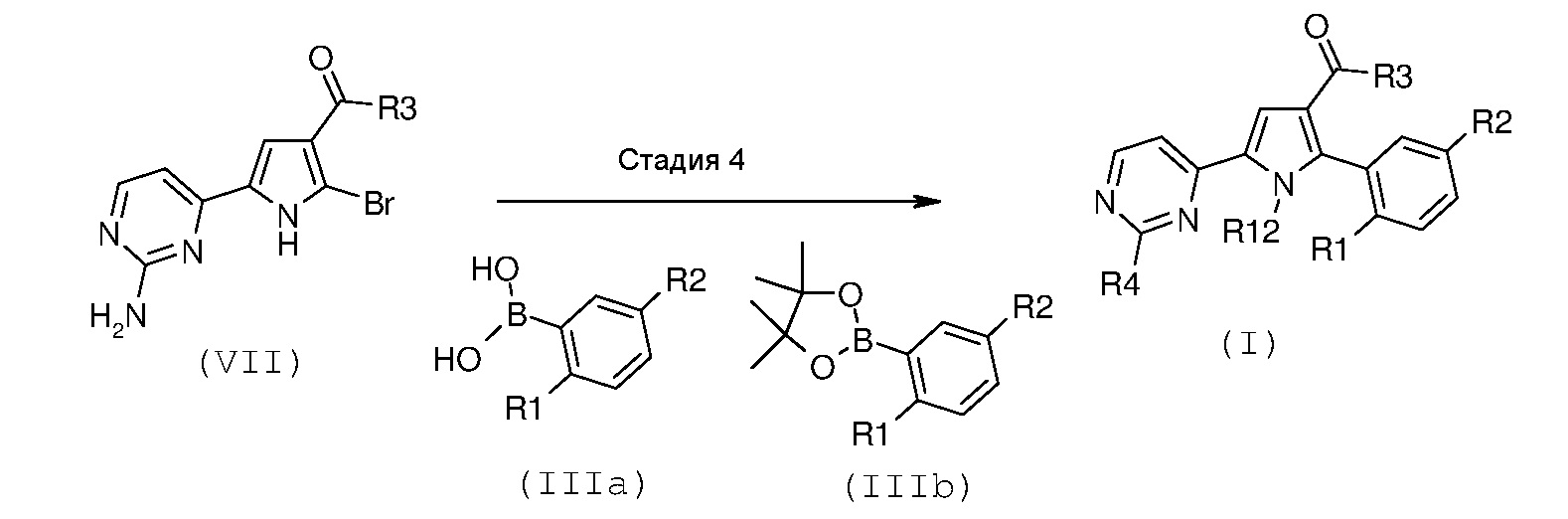
На вышеуказанной схеме R1, R2 и R3 имеют значения, как описано выше, R4 означает NH2 и R12 означает водород.
Соответственно, другой способ согласно настоящему изобретению включает следующую стадию:
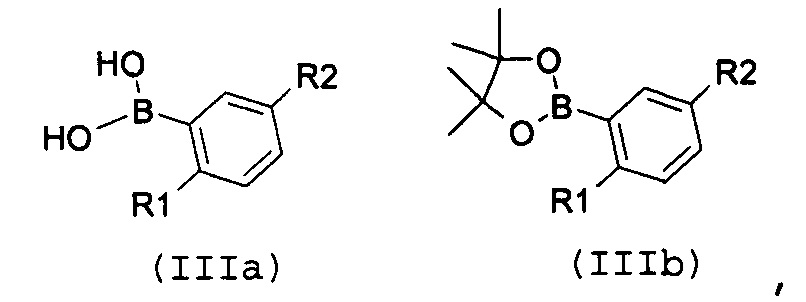
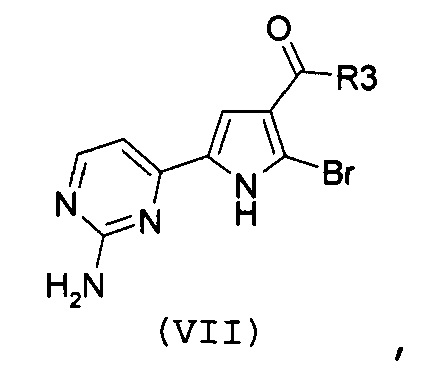
Стадия 4: катализируемая металлом реакция сочетания галогенпроизводного формулы (VII):
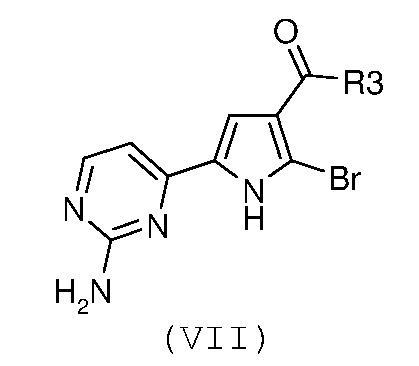 ,
,
где R3 имеет значение, как указано выше, с замещенной арилбороновой кислотой формулы (IIIa) или эфиром арилбороновой кислоты формулы (IIIb):
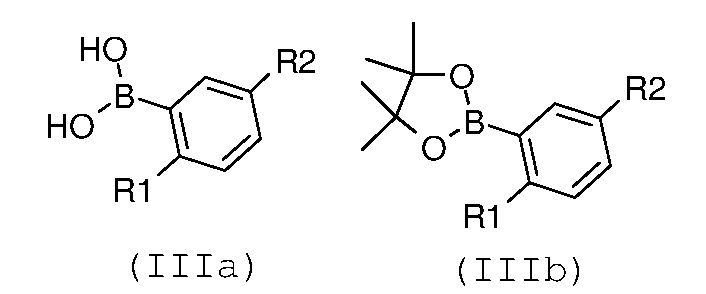 ,
,
где R1 и R2 имеют значения, как указано выше, с получением соединение формулы (I):
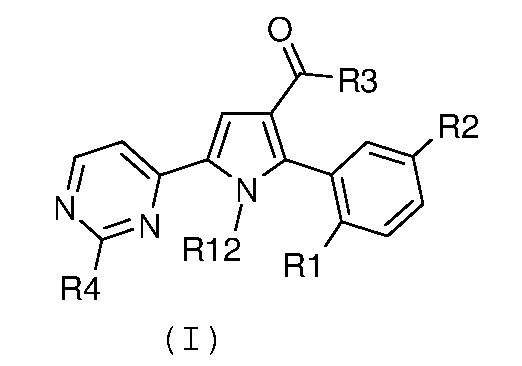 ,
,
где R1, R2 и R3 имеют значения, как указано выше, R4 означает NH2 и R12 означает водород; необязательно, превращение соединения формулы (I) в другое, несходное, соединение формулы (I) и, если желательно, превращение соединения формулы (I) в его фармацевтически приемлемую соль или превращение соли в свободное соединение (I).
В соответствии со стадией 4 схемы В, превращение галогенпроизводного общей формулы (VII) в соединение общей формулы (I) можно осуществлять в различных условиях, ранее описанных в случае стадии 1 схемы А.
Настоящее изобретение, далее, относится к альтернативному способу получения соединения формулы (I), где R1 и R2 имеют значения, как указано выше, R3 означает NH2, R4 означает NR10R11, где R10 и R11 имеют значения, как указано выше, и R12 означает водород, который представлен на схеме С, приводимой ниже.
Схема С
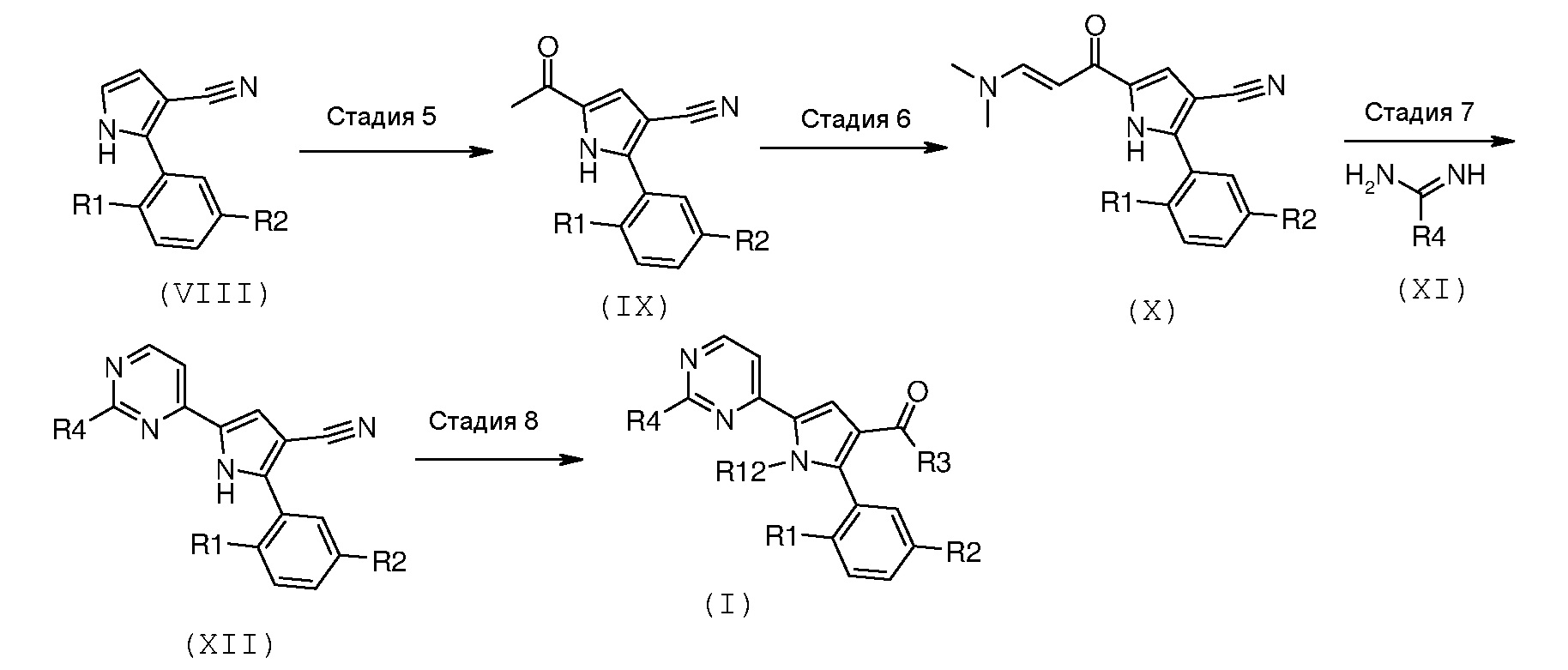
На вышеуказанной схеме R1 и R2 имеют значения, как указано выше, R3 означает NH2, R4 означает NR10R11, где R10 и R11 имеют значения, как указано выше, и R12 означает водород.
Соответственно, другой способ согласно настоящему изобретению включает следующие стадии:
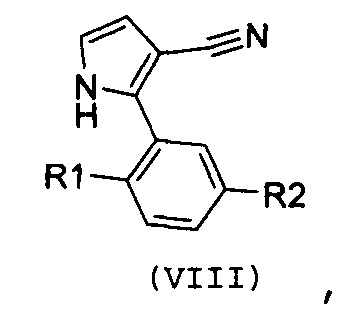
Стадия 5: введение во взаимодействие пиррола формулы (VIII):
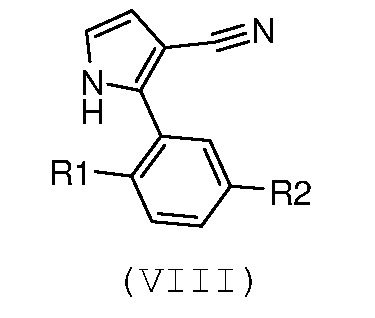 ,
,
где R1 и R2 имеют значения, как указано выше, с ацетилхлоридом в присутствии кислоты Льюиса или в присутствии металлического цинка;
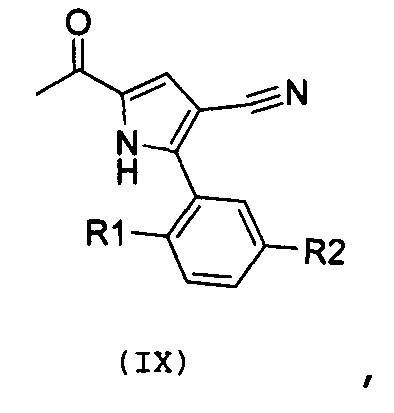
Стадия 6: введение во взаимодействие полученного соединения формулы (IX):
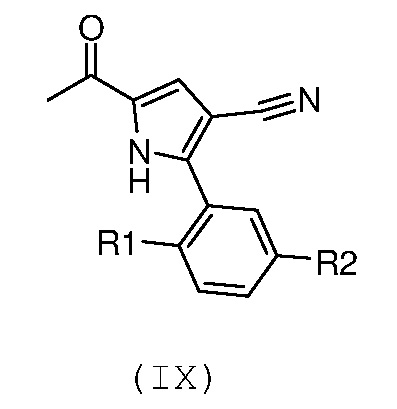 ,
,
где R1 и R2 имеют значения, как указано выше, с N,N-диметилформамиддиалкилацеталем;
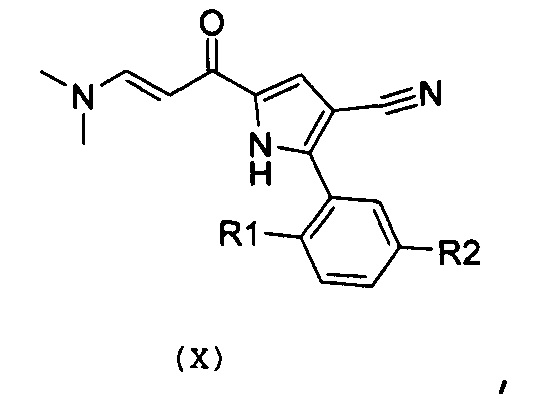
Стадия 7: введение во взаимодействие полученного енаминона формулы (Х):
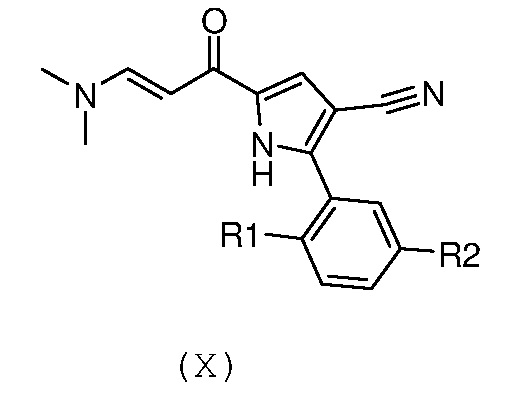 ,
,
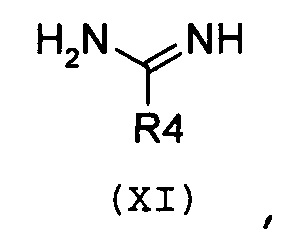
где R1 и R2 имеют значения, как указано выше, с необязательно замещенным гуанидином формулы (XI) или его солью:
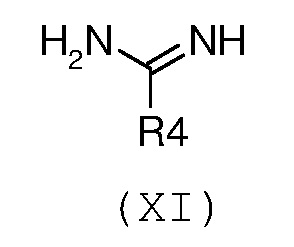 ,
,
где R4 означает NR10R11, и R10 и R11 имеют значения, как указано выше;
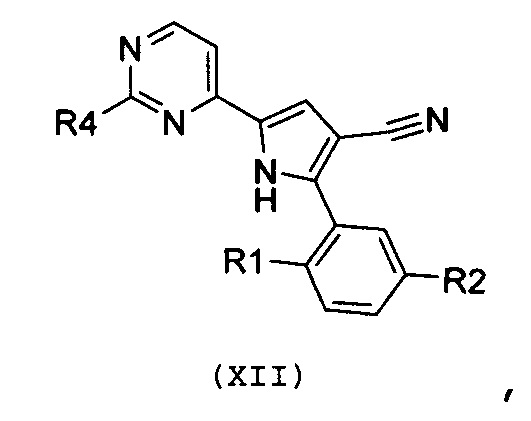
Стадия 8: гидролиз, в кислых условиях, цианогруппы полученного соединения формулы (XII):
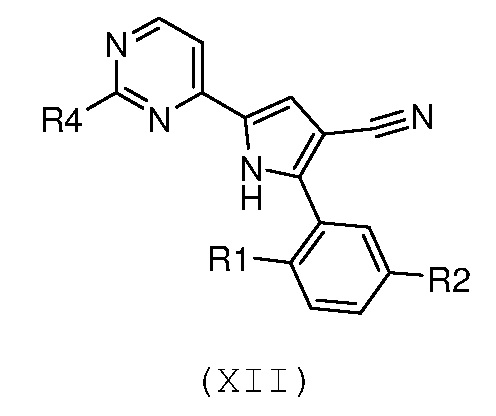 ,
,
где R4 означает NR10R11, где R10 и R11 имеют значения, как указано выше, и R1 и R2 имеют значения, как указано выше, для получения соединения формулы (I):
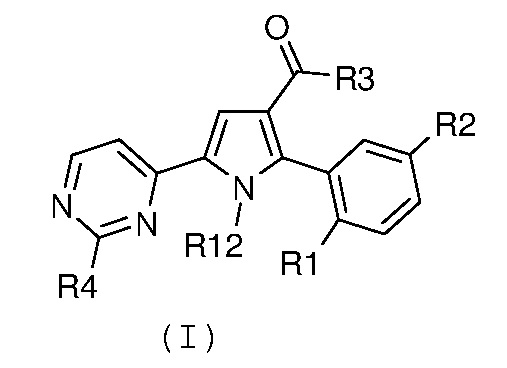 ,
,
где R1 и R2 имеют значения, как указано выше, R3 означает NH2, R4 означает NR10R11, где R10 и R11 имеют значения, как указано выше, и R12 означает водород; необязательно, превращение соединения формулы (I) в другое, несходное, соединение формулы (I) и, если желательно, превращение соединения формулы (I) в его фармацевтически приемлемую соль или превращение соли в свободное соединение (I).
В соответствии со стадией 5 схемы С, предпочтительно осуществляют ацилирование соединения формулы (VIII), для получения соединения формулы (IX), с помощью ацетилхлорида, в присутствии кислоты Льюиса, например, трихлорида алюминия или тетрахлорида титана, работая при охлаждении, например, при температуре от -5°С до 0°С, или при комнатной температуре, в безводном органическом растворителе, например, дихлорметане. Подобная реакция описана в J. Het. Chem., 1983, 20, 61. Иным образом, ацилирование соединения формулы (VIII), для получения соединения формулы (IX), осуществляют с помощью ацетилхлорида, в присутствии металлического цинка, при температуре от комнатной температуры до температуры кипения с обратным холодильником, в безводном органическом растворителе, например, толуоле. Подобная реакция описана в Te. Le. 2002, 43, 8133.
В соответствии со стадией 6 схемы С, превращение соединения формулы (IX) в енаминон формулы (Х) может быть осуществлено, используя диалкилацеталь, например, диметилацеталь или N,N-диметилформамиддиизопропилацеталь. Предпочтительно, введение во взаимодействие осуществляют при температуре между комнатной температурой и температурой кипения с обратным холодильником, предпочтительно, при температуре от 60°С до 90°С, в органическом растворителе, таком как, например, толуол, бензол, дихлорэтан или N,N-диметилформамид. Аналогичное превращение описано, например, в Heterocycles 1998, 47, 689.
В соответствии со стадией 7 схемы С, превращение соединения формулы (Х) в соединение формулы (XII) осуществляют путем введения во взаимодействие с гуанидином или замещенным гуанидином формулы (XI) или его солью. Предпочтительно, реакцию осуществляют при температуре от 80°С до 130°С, в органическом растворителе, таком как, например, ацетамид, N-метил-2-пирролидон, N,N-диметилформамид, в присутствии основания, такого как карбонат калия. Подобный вид превращения описан в научной литературе, например, в J. Het. Chem., 1989, 26, 1147.
В соответствии со стадией 8 схемы С, гидролиз, в кислых условиях, нитрилпроизводного формулы (XII), для получения карбоксамида формулы (I), предпочтительно, осуществляют в ледяной уксусной кислоте или трифторуксусной кислоте и концентрированной серной кислоте, более предпочтительно, при соотношениях между 1:1 и 5:1, необязательно в присутствии воды, при температуре между комнатной температурой и 120°С, в особенности, при температуре от 60°С до 90°С. Аналогичный гидролиз, например, описан в J. Org. Chem. 2005, 70, 1926. После подщелачивания с помощью концентрированного водного раствора аммония, гидроксида натрия или гидроксида калия, свободное основание отфильтровывают в виде осадка.
Настоящее изобретение, далее, относится к альтернативному способу получения соединения формулы (I), где R1 и R2 имеют значения, как указано выше, R3 означает NH2, R4 означает водород или необязательно замещенный (С1-С6)алкил с линейной или разветвленной цепью, и R12 означает водород, который представлен на схеме D, приводимой ниже.
Схема D
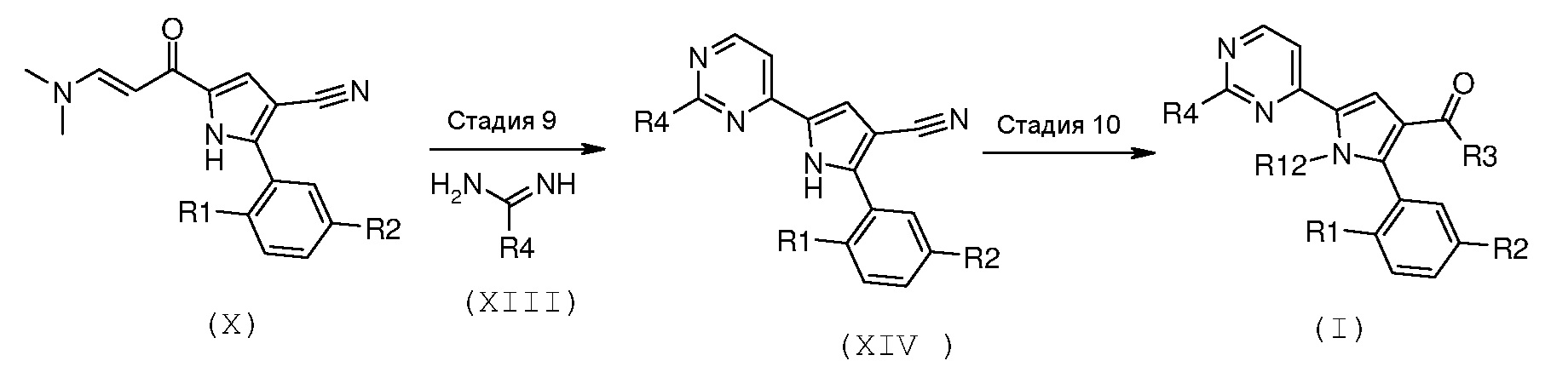
На вышеуказанной схеме R1 и R2 имеют значения, как указано выше, R3 означает NH2, R4 означает водород или необязательно замещенный (С1-С6)алкил с линейной или разветвленной цепью, и R12 означает водород.
Соответственно, другой способ согласно настоящему изобретению включает следующие стадии:
Стадия 9: введение во взаимодействие енаминона формулы (Х), как указано выше, с необязательно замещенным амидином формулы (XIII) или его солью:
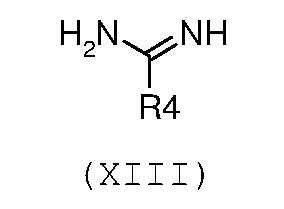 ,
,
где R4 означает водород или необязательно замещенный (С1-С6)алкил с линейной или разветвленной цепью;
Стадия 10: гидролиз цианогруппы полученного соединения формулы (XIV):
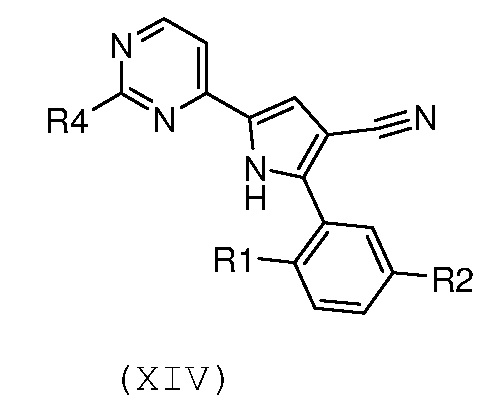 ,
,
где R1 и R2 имеют значения, как указано выше, и R4 означает водород или необязательно замещенный (С1-С6)алкил с линейной или разветвленной цепью, в кислых условиях, для получения соединения формулы (I):
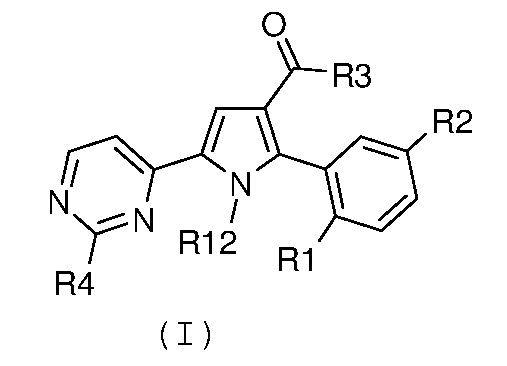 ,
,
где R1 и R2 имеют значения, как указано выше, R3 означает NH2, R4 означает водород или необязательно замещенный (С1-С6)алкил с линейной или разветвленной цепью, и R12 означает водород; необязательно, превращение соединения формулы (I) в другое, несходное, соединение формулы (I) и, если желательно, превращение соединения формулы (I) в его фармацевтически приемлемую соль или превращение соли в свободное соединение (I).
В соответствии со стадией 9 схемы D, превращение соединения формулы (Х) в соединение формулы (XIV) осуществляют путем введения во взаимодействие с формамидином или замещенным амидином формулы (XIII) или его солью. Предпочтительно, реакцию осуществляют при температуре от 80°С до 150°С, в органическом растворителе, таком как, например, ацетамид, N-метил-2-пирролидон, N,N-диметилформамид.
В соответствии со стадией 10 схемы D, гидролиз, в кислых условиях, нитрилпроизводного формулы (XIV), для получения соединения формулы (I), может быть осуществлен в различных условиях, ранее описанных на стадии 8 схемы С.
Как указано выше, соединение формулы (I), которое получают в соответствии со способами, объектом данного изобретения, может быть без труда превращено в другое соединение формулы (I), работая в соответствии с хорошо известными условиями синтеза, причем, ниже приводятся следующие примеры возможных превращений:
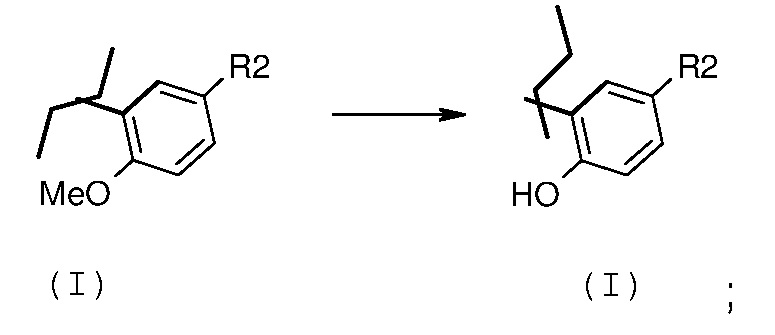
превращение 1) - превращение соединения формулы (I), где один из R1 или R2 означает OCH3, в соответствующее соединение формулы (I), где один из R1 или R2 означает ОН, путем обработки с помощью BCl3 или BBr3, в растворителе, таком как дихлорметан, хлороформ, дихлорэтан, ацетонитрил, при температуре в диапазоне от -20°С до температуры кипения с обратным холодильником, в течение периода времени от примерно 30 минут до примерно 96 часов;
превращение 2) - превращение соединения формулы (I), где R12 означает водород, в соответствующее соединение формулы (I), где R12 означает необязательно замещенный (С1-С6)алкил с линейной или разветвленной цепью,
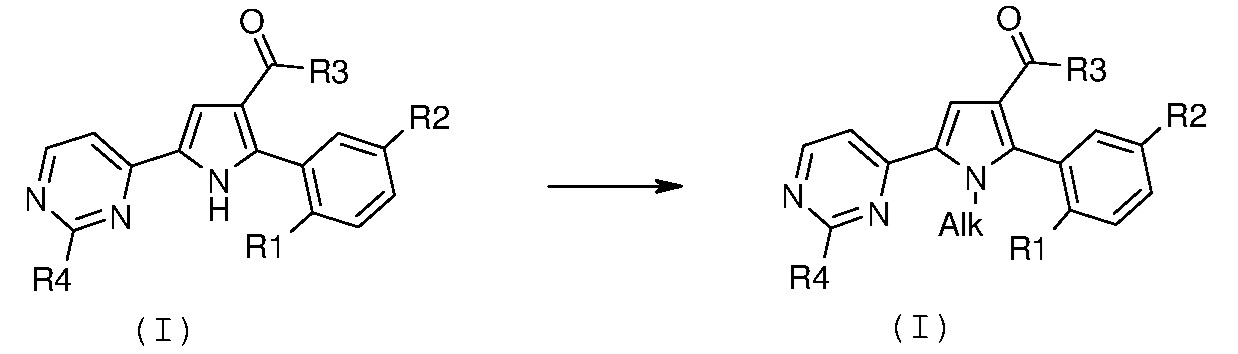
путем обработки необязательно замещенным алкилгалогенидом формулы R12’-X (XV), где R12’ означает необязательно замещенный (С1-С6)алкил с линейной или разветвленной цепью и Х означает галоген, в растворителе, таком как N,N-диметилформамид, и в присутствии основания, в диапазоне температур от комнатной температуры до температуры кипения с обратным холодильником, в течение времени от примерно 30 минут до примерно 96 часов.
Из всего вышеуказанного для квалифицированного специалиста ясно, что любое соединение формулы (I), имеющее функциональную группу, которая может быть далее превращена в другую функциональную группу, работая в соответствии со способами, хорошо известными в данной области, таким образом, приходя к получению других соединений формулы (I), подразумевают, что это входит в рамки настоящего изобретения.
Излишне говорить, также любые промежуточные соединения вышеописанных способов могут быть превращены в другие промежуточные соединения, если желательно и необходимо, действуя аналогичным путем, как в случае любой одной реакции превращения, описанной выше в данном контексте.
Из всего вышеуказанного квалифицированному специалисту ясно, что, когда получают соединения формулы (I), в соответствии с любым одним вариантом вышеуказанного способа, необязательные функциональные группы в исходных веществах или их промежуточных соединениях, которые могут вызывать нежелательные побочные реакции, необходимо должным образом защищать в соответствии со стандартными способами. Также, превращение этих последних в свободные, подвергнутые снятию защиты, соединения можно осуществлять в соответствии с известными способами.
Как легко должно быть понятно, если соединения формулы (I), полученные в соответствии со способом, описанным выше, существуют в виде смеси изомеров, их разделение с использованием стандартных способов на отдельные изомеры формулы (I) входит в рамки настоящего изобретения.
Конечные соединения могут быть выделены и очищены, используя стандартные методы, например, хроматографию и/или кристаллизацию и солеобразование.
Карбоксамиды формулы (I), как описано выше, могут быть превращены в фармацевтически приемлемые соли. Карбоксамиды формулы (I), как описано выше, или их фармацевтически приемлемые соли могут быть потом использованы вместе с фармацевтически приемлемым носителем или разбавителем для получения фармацевтической композиции.
Синтез соединения формулы (I), в соответствии со способом синтеза, описанным выше, можно проводить ступенчато, в соответствии с чем каждое промежуточное соединение выделяют и очищают стандартными способами очистки, подобными, например, колоночной хроматографии, перед осуществлением следующей реакции. Альтернативно, две или более стадии последовательности синтеза можно осуществлять по так называемому “one-pot” (однореакторному) способу, как известно в данной области, в соответствии с чем только соединение, получаемое в результате двух или более стадий, выделяют и очищают.
В случаях, где соединение формулы (I) содержит один или более асимметричных центров, вышеуказанное соединение может быть разделено на отдельные изомеры методами, известными квалифицированному специалисту в данной области. Такие методы включают стандартные хроматографические технологии, включая хроматографию с использованием хиральной стационарной фазы или кристаллизацию. Общие методы разделения соединений, содержащих один или более асимметричных центров, описаны, например, у Jacques, Jean; Collet, André; Wilen, Samuel H., - Enantiomers, Racemates, and Resolutions, John Wiley & Sons Inc., New York (NY), 1981.
В соответствии с любым вариантом способа получения соединений формулы (I), исходные вещества и любые другие реагенты известны или их легко получить в соответствии с известными способами.
Исходные вещества формул (II) и (VII) можно получать, как описано в заявке на патент WO 2007/110344.
Исходное вещество формулы (VIII) можно получать с помощью известных способов или как описано в экспериментальной части, представленной ниже (получения D и Е).
Соединения формул (IIIa), (IIIb), (VI), (XI), (XIII) и (XV) являются или коммерчески доступными, или их можно получать при использовании известных способов; соединения формулы (IIIa) также можно получать, как описано в экспериментальной части, представленной ниже (получения А, В и С).
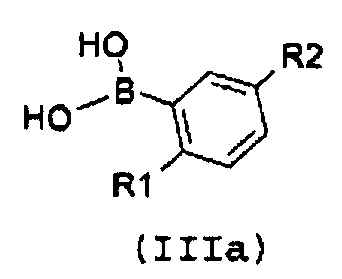
Настоящее изобретение также относится к промежуточному соединению формулы (IIIa):
 ,
,
где
R1 означает этил и R2 означает хлор или CF3, или
R1 означает изопропил и R2 означает хлор.
Соединения согласно настоящему изобретению можно вводить или в виде отдельных агентов, или, альтернативно, в комбинации с известными противораковыми терапиями, такими как режим радиационной терапии или химиотерапии, в комбинации с цитостатическими или цитотоксическими агентами, агентами типа антибиотиков, алкилирующими агентами, антиметаболическими агентами, гормональными агентами, иммунологическими агентами, агентами типа интерферона, ингибиторами циклооксигеназы (например, ингибиторы СОХ-2), ингибиторами матриксметаллопротеазы, ингибиторами теломеразы, ингибиторами тирозинкиназы, агентами против рецептора фактора роста, агентами анти-HER, агентами анти-EGFR, агентами антиангиогенеза (например, ингибиторы ангиогенеза), ингибиторами фарнезилтрансферазы, ингибиторами пути сигнальной трансдукции ras-raf-киназы, ингибиторами клеточного цикла, другими ингибиторами cdk, агентами, связывающими тубулин, ингибиторами топоизомеразы I, ингибиторами топоизомеразы II и т.п.
Если готовую лекарственную форму получают в виде фиксированной дозы, в таких комбинированных продуктах используют соединения согласно настоящему изобретению с диапазоном дозы, описанным ниже, и другой фармацевтически активный агент с соответствующим диапазоном дозы.
Соединения формулы (I) могут быть использованы последовательно с известными противораковыми агентами, когда комбинированная композиция является неподходящей.
Соединения формулы (I) согласно настоящему изобретению, пригодные для введения млекопитающему, например, людям, можно вводить обычными путями и уровень дозировки зависит от возраста, массы тела, состояний пациента и пути введения.
Например, подходящая дозировка, принятая для перорального введения соединения формулы (I), может находиться в диапазоне от примерно 10 мг до примерно 500 мг на дозу, 1-5 раз в сутки. Соединения согласно данному изобретению можно вводить в различных лекарственных формах, например, перорально, в виде таблеток, капсул, таблеток, покрытых сахаром или пленкой, жидких растворов или суспензий; ректально, в виде суппозиториев; парентерально, например, внутримышечно, или через внутривенную и/или интратекальную и/или интраспинальную инъекцию или инфузию.
Настоящее изобретение также включает фармацевтические композиции, содержащие соединение формулы (I), или его фармацевтически приемлемую соль, в сочетании с фармацевтически приемлемым эксципиентом, которым может быть носитель или разбавитель.
Фармацевтические композиции, содержащие соединения согласно данному изобретению, обычно получают при использовании следующих стандартных способов и вводят в подходящей фармацевтической форме. Например, твердые пероральные формы могут содержать, вместе с активным соединением, разбавители, как, например, лактоза, декстроза, сахароза, тростниковый сахар, целлюлоза, кукурузный крахмал или картофельный крахмал; смазочные вещества, как, например, диоксид кремния, тальк, стеариновая кислота, стеарат магния или кальция и/или полиэтиленгликоли; связующие агенты, как, например, крахмалы, гуммиарабик, желатин, метилцеллюлоза, карбоксиметилцеллюлоза или поливинилпирролидон; дезинтегрирующие агенты, как, например, крахмал, альгиновая кислота, альгинаты или натрийкрахмалгликолят; вспенивающиеся смеси; красители; подсластители; смачиватели, такие как лецитин, полисорбаты, лаурилсульфаты; и, вообще, нетоксичные и фармакологически неактивные вещества, используемые в фармацевтических композициях. Эти фармацевтические препараты могут быть получены известным образом, например, посредством способов смешивания, гранулирования, таблетирования, покрытия сахаром или покрытия пленкой.
Жидкие дисперсии для перорального введения могут быть, например, в виде сиропов, эмульсий и суспензий. В качестве примера, сиропы могут содержать в качестве носителя сахарозу или сахарозу с глицерином и/или маннит и сорбит.
Суспензии и эмульсии могут содержать, в качестве примеров носителей, природную камедь, агар-агар, альгинат натрия, пектин, метилцеллюлозу, карбоксиметилцеллюлозу или поливиниловый спирт. Суспензии или растворы для внутримышечных инъекций могут содержать, вместе с активным соединением, фармацевтически приемлемый носитель, например, стерильную воду, оливковое масло, этилолеат, гликоли, например, пропиленгликоль, и, если желательно, подходящее количество лидокаингидрохлорида.
Растворы для внутривенных инъекций или инфузий могут содержать в качестве носителя стерильную воду или, предпочтительно, они могут быть в форме стерильных, водных, изотонических, физиологических растворов, или они могут содержать пропиленгликоль в качестве носителя.
Суппозитории могут содержать, вместе с активным соединением, фармацевтически приемлемый носитель, например, масло какао, полиэтиленгликоль, полиоксиэтиленсорбитановый эфир жирной кислоты как поверхностно-активное вещество или лецитин.
В целях лучшего пояснения настоящего изобретения, без какого-либо его ограничения, теперь приводятся следующие примеры.
ЭКСПЕРИМЕНТАЛЬНЫЙ РАЗДЕЛ
Для ссылки на любое конкретное соединение формулы (I) согласно данному изобретению, необязательно в форме фармацевтически приемлемой соли, см. экспериментальный раздел и формулу изобретения. Ссылаясь на примеры, которые следуют, соединения согласно настоящему изобретению синтезируют, используя способы, описанные в данном контексте, или другие способы, хорошо известные в данной области.
Общая очистка и аналитические методы
Получение путем синтеза некоторых соединений формулы (I) согласно данному изобретению описано в следующих примерах. Соединения согласно настоящему изобретению, которые получают в соответствии со следующими примерами, также характеризуются данными 1Н-ЯМР и/или точной массой ESI(+).
1Н-ЯМР-спектрометрию осуществляли на приборе фирмы Mercury VX 400, работающем при 400,45 МГц, оснащенном дублирующим резонансным датчиком размером 5 мм [1H (15N-31P) ID_PFG Varian]. ESI(+), масс-спектр высокого разрешения (HRMS) получали при использовании прибора фирмы Waters Q-Tof Ultima, непосредственно связанного с прибором микро-ВЭЖХ 1100 Agilent, как ранее описано (M. Colombo, F. Riccardi-Sirtori, V. Rizzo, Rapid Commun. Mass Spectrom. 2004, 18, 511-517). Колоночную хроматографию проводили или при среднем давлении при использовании силикагеля (силикагель Merck, 40-63 мкм) или при использовании предварительно заполненных силикагелем картриджей (Biotage). Компоненты визуализировали в ультрафиолетовом свете (λ: 254 нм) и посредством паров иода. ВЭЖХ осуществляли на колонке Waters X Terra RP 18 (4,6×50 мм, 3,5 мкм), используя систему ВЭЖХ Waters 2790, оснащенную детектором 996 Waters PDA, и один квадрупольный масс-спектрометр Waters, мод. ZQ, оснащенный источником ионов с электрораспылением (ESI). Подвижная фаза А представляла собой 5 мМ аммонийацетатный буфер (рН=5,2, с уксусной кислотой)/ацетонитрил, 95/5, и подвижная фаза В представляла собой смесь вода/ацетонитрил, 5/95. Градиент представлял собой от 10% до 90% В, в течение 8 минут, удерживание 90% В течение 2 минут. УФ-детектирование осуществляли при длинах волн, равных 220 нм и 254 нм. Объемная скорость потока составляла 1 мл/мин. Объем вводимой пробы составлял 10 мкл. Полное сканирование, диапазон масс составлял 100-800 а.е.м. Капиллярное напряжение составляло 2,5 кВ; температура источника составляла 120°С; конус составлял 10 В. Времена удерживания (ВЭЖХ, комнатная температура) указывали в минутах при длине волны 220 нм или при 254 нм. Массы выражали в виде соотношения m/z. При необходимости, соединения очищали с помощью препаративной ВЭЖХ на колонке Waters Symmetry C18 (19×50 мм, 5 мкм) или на колонке Waters X Terra RP 18 (30×150 мм, 5 мкм), используя прибор для препаративной ВЭЖХ Waters 600, оснащенный детектором 996 Waters PDA, и один квадрупольный масс-спектрометр Waters, мод. ZMD, ионизацию электрораспылением, метод положительных ионов. Способ 1: подвижная фаза А представляла собой смесь вода - 0,1% трифторуксусной кислоты/ацетонитрил, 95/5, и подвижная фаза В представляла собой ацетонитрил; градиент представлял собой от 10% до 90% В, в течение 8 минут, удерживание 90% В в течение 2 минут; объемная скорость потока составляла 20 мл/мин. Способ 2: подвижная фаза А представляла собой смесь вода - 0,05% NH3/ацетонитрил, 95/5, и подвижная фаза В представляла собой ацетонитрил. Градиент представлял собой от 10% до 100% В, в течение 8 минут, удерживание 100% В в течение 2 минут. Объемная скорость потока составляла 20 мл/мин.
В нижеприводимых примерах, а также на всем протяжении заявки, следующие аббревиатуры имеют следующие значения. Если не определено, термины имеют их общепринятые значения.
|
|
Получение А
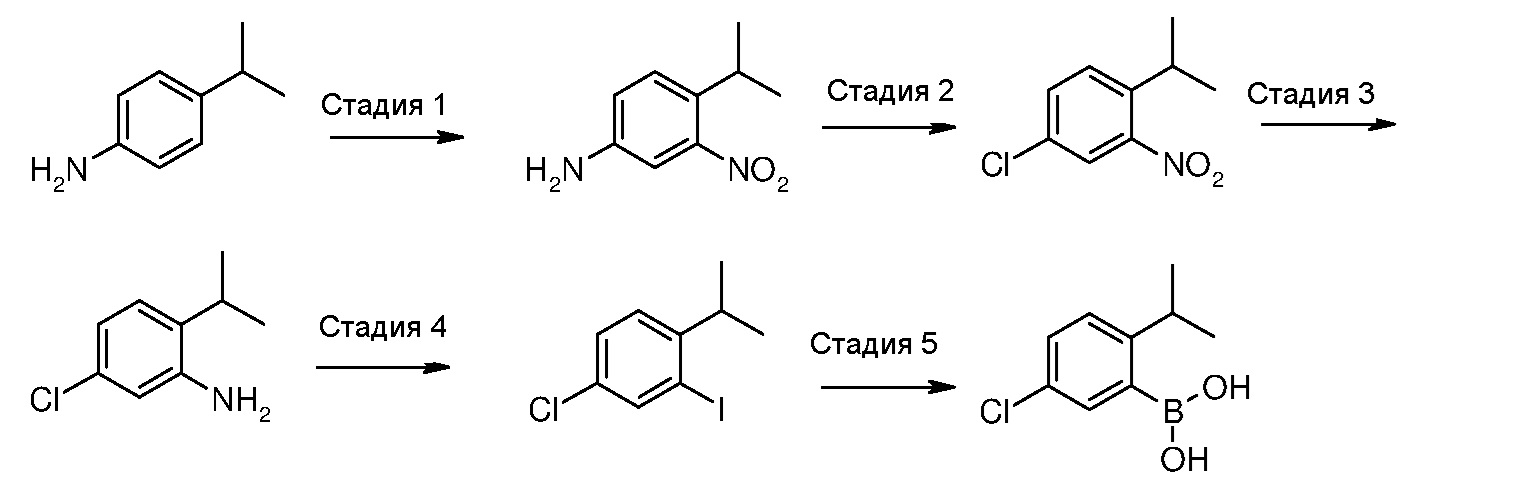
(5-Хлор-2-этилфенил)бороновая кислота (IIIa)
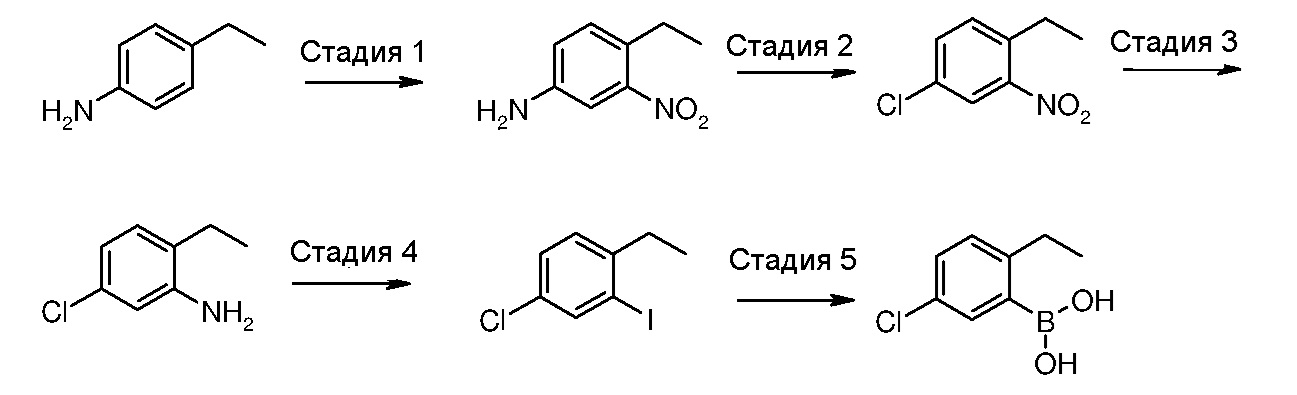
Стадия 1: 4-Этил-3-нитроанилин
4-Этиланилин (10,3 мл, 82,5 ммоль) по каплям добавляют к серной кислоте (96%, 63 мл), охлажденной до температуры 8°С, поддерживая температуру до значения ниже 10°С. После добавления реакционную смесь охлаждают до температуры -5°С, перед добавлением смеси из азотной кислоты (100%, 4 мл) и серной кислоты (96%, 10 мл), поддерживая температуру ниже 0°С. Реакционную смесь затем перемешивают при той же самой температуре в течение 1 часа. Реакционную смесь выливают на лед (200 мл) и осадок отфильтровывают и промывают водой. Твердое вещество суспендируют в воде (100 мл) и нейтрализуют с помощью раствора гидроксида аммония (35%). Осадок отфильтровывают и высушивают в сушильном шкафу, получая твердое вещество светло-коричневого цвета (10 г, 73%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,11 (т, J=7,45 Гц, 3H), 2,63 (кв, J=7,45 Гц, 2H), 5,53 (c, 2H), 6,81 (дд, J=8,30, 2,44 Гц, 1H), 7,04 (д, J=2,44 Гц, 1H), 7,11 (д, J=8,30 Гц, 1H).
Стадия 2: 4-Хлор-1-этил-2-нитробензол
Раствор нитрита натрия в воде (4,2 г, 60 ммоль, 5 М, 12 мл) по каплям добавляют к охлажденному (0°С) раствору 4-этил-3-нитроанилина (10 г, 60 ммоль) в концентрированной HCl (200 мл), и реакционную смесь перемешивают при той же самой температуре в течение 1,5 часов. Затем добавляют хлорид меди(I) (9,5 г, 96 ммоль) и раствор перемешивают при комнатной температуре в течение 1 часа и потом при температуре 80°С в течение дополнительного часа. После охлаждения реакционную смесь экстрагируют с помощью DCM (3×100 мл) и объединенные органические слои сушат над сульфатом натрия. Сырой продукт затем очищают с помощью флэш-хроматографии (гексан/EtOAc = 9/1), получая указанное в заголовке соединение в виде масла желтого цвета (6,28 г, выход 56%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,19 (т, J=7,45 Гц, 3H), 2,78 (кв, J=7,45 Гц, 2H), 7,57 (д, J=8,42 Гц, 1H), 7,74 (дд, J=8,36, 2,26 Гц, 1H), 8,03 (д, J=2,32 Гц, 1H).
Стадия 3: 5-Хлор-2-этиланилин
Раствор гидразингидрата (6,95 мл, 134,7 ммоль) в метаноле (50 мл) по каплям добавляют к раствору 4-хлор-1-этил-2-нитробензола (6,25 г, 33,7 ммоль) в метаноле (120 мл), в присутствии хлорида железа(III) (547 мг, 3,4 ммоль) и активированного угля (547 мг), и реакционную смесь перемешивают при кипячении с обратным холодильником в течение 13 часов. Твердые вещества отфильтровывают через целит, фильтрат концентрируют и очищают с помощью флэш-хроматографии (гексан/EtOAc = 9/1), получая указанное в заголовке соединение в виде масла светло-розового цвета (5,09 г, выход 97%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,09 (т, J=7,51 Гц, 3H), 2,39 (кв, J=7,49 Гц, 2H), 5,13 (c, 2H), 6,47 (дд, J=8,06, 2,20 Гц, 1H), 6,62 (д, J=2,20 Гц, 1H), 6,89 (д, J=8,06 Гц, 1H).
Стадия 4: 4-Хлор-1-этил-2-иодбензол
Смесь 5-хлор-2-этиланилина (3,35 г, 21,5 ммоль), п-толуолсульфоновой кислоты (12,29 г, 64,6 ммоль) и воды (2,15 мл) растирают в ступке в течение нескольких минут, получая гомогенную пасту, к которой добавляют твердый нитрит натрия (3,71 г, 53,8 ммоль), и пасту растирают в течение 10 минут. Добавляют твердый иодид калия (8,94 г, 53,8 ммоль) и пасту растирают в течение 20 минут. Пасту затем растворяют в воде (50 мл) и обрабатывают сульфитом натрия (10%-ный водный раствор), перед экстракцией с помощью EtOAc (3×100 мл). Объединенные органические слои сушат над сульфатом натрия и сырой продукт очищают с помощью флэш-хроматографии (гексан), получая указанное в заголовке соединение в виде масла светло-желтого цвета (4,35 г, выход 76%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,12 (т, J=7,51 Гц, 3H), 2,66 (кв, J=7,53 Гц, 2H), 7,29-7,35 (м, 1H), 7,42 (дд, J=8,30, 2,20 Гц, 1H), 7,87 (д, J=2,20 Гц, 1H).
Стадия 5: (5-Хлор-2-этилфенил)бороновая кислота
Изопропилмагнийхлорид (2 М раствор в ТГФ, 8,98 мл, 17,95 ммоль) по каплям добавляют к раствору 4-хлор-1-этил-2-иодбензола (4,35 г, 16,3 ммоль) в безводном ТГФ (40 мл), при температуре -30°С, и реакционную смесь перемешивают при той же самой температуре в течение 30 минут, в атмосфере аргона. По истечении этого времени по каплям добавляют триметилборат (3,63 мл, 32,6 ммоль) и реакционную смесь перемешивают при той же самой температуре в течение 1,5 часов. Добавляют HCl (1М, 16 мл) и реакционную смесь экстрагируют с помощью EtOAc (3×50 мл). Объединенные органические слои сушат над сульфатом натрия и, после удаления растворителя, получают твердое вещество, которое растирают в гексане, получая указанное в заголовке соединение в виде твердого вещества белого цвета (2,15 г, выход 72%).
1H ЯМР (400 МГц, ДМСО-d6) δ 1,12 м.д. (т, J=7,51 Гц, 3H), 2,72 (кв, J=7,69 Гц, 2H), 7,17 (д, J=8,18 Гц, 1H), 7,25-7,32 (м, 1H), 7,36 (д, J=2,32 Гц, 1H), 8,19 (c, 2H).
Получение В
[5-Хлор-2-(пропан-2-ил)фенил]бороновая кислота (IIIa)
Стадия 1: 3-Нитро-4-(пропан-2-ил)анилин
4-(Пропан-2-ил)анилин (10,12 мл, 74 ммоль) по каплям добавляют к серной кислоте (96%, 57 мл), охлажденной до температуры 8°С, поддерживая температуру ниже 10°С. После добавления реакционную смесь охлаждают до температуры -5°С, перед добавлением смеси из азотной кислоты (100%, 3,7 мл) и серной кислоты (96%, 9 мл), поддерживая температуру ниже 0°С. Реакционную смесь затем перемешивают при той же самой температуре в течение 1 часа. Реакционную смесь выливают на лед (200 мл) и осадок отфильтровывают и промывают водой. Твердое вещество суспендируют в воде (100 мл) и нейтрализуют с помощью раствора гидроксида аммония (35%). Осадок отфильтровывают и высушивают в сушильном шкафу, получая твердое вещество светло-коричневого цвета (9,49 г, 71%).
Стадия 2: 4-Хлор-2-нитро-1-(пропан-2-ил)бензол
Раствор нитрита натрия в воде (3,6 г, 52,2 ммоль, 5М, 10,4 мл) по каплям добавляют к раствору 3-нитро-4-(пропан-2-ил)анилина (9,4 г, 52,2 ммоль) в концентрированной HCl (175 мл) при температуре 0°С, и реакционную смесь перемешивают при той же самой температуре в течение 1,5 часов. Затем добавляют хлорид меди (I) (8,3 г, 83,5 ммоль) и раствор перемешивают при комнатной температуре в течение 1 часа и потом при температуре 80°С в течение дополнительного часа. После охлаждения реакционную смесь экстрагируют с помощью DCM (3×100 мл) и объединенные органические слои сушат над сульфатом натрия. Сырой продукт затем очищают с помощью флэш-хроматографии (гексан/EtOAc = 95/5), получая указанное в заголовке соединение в виде масла желтого цвета (1,8 г, выход 17%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,23 (д, J=6,84 Гц, 6H), 3,14 (септет, J=6,94 Гц, 1H), 7,67 (д, J=8,54 Гц, 1H), 7,74 (дд, J=8,54, 2,30 Гц, 1H), 7,95 (д, J=2,20 Гц, 1H).
Стадия 3: 5-Хлор-2-(пропан-2-ил)анилин
Раствор гидразингидрата (1,7 мл, 35,1 ммоль) в метаноле (12 мл) по каплям добавляют к раствору 4-хлор-2-нитро-1-(пропан-2-ил)бензола (1,75 г, 8,8 ммоль) в метаноле (40 мл) в присутствии хлорида железа (III) (146 мг, 0,9 ммоль) и активированного угля (146 мг), и реакционную смесь перемешивают при кипячении с обратным холодильником в течение 7 часов. Твердое вещество отфильтровывают через целит, фильтрат концентрируют и очищают с помощью флэш-хроматографии (гексан/EtOAc = 9/1), получая указанное в заголовке соединение в виде масла светло-розового цвета (1,4 г, выход 94%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,11 (д, J=6,84 Гц, 6H), 2,90 (септет, J=6,75 Гц, 1H), 5,15 (c, 2H), 6,50 (дд, J=8,18, 2,32 Гц, 1H), 6,62 (д, J=2,32 Гц, 1H), 6,96 (д, J=8,18 Гц, 1H).
Стадия 4: 4-Хлор-2-иод-1-(пропан-2-ил)бензол
Смесь 5-хлор-2-(пропан-2-ил)анилина (1,4 г, 8,3 ммоль), п-толуолсульфоновой кислоты (4,7 г, 24,8 ммоль) и воды (0,83 мл) растирают в ступке в течение нескольких минут, получая гомогенную пасту, к которой добавляют твердый нитрит натрия (1,42 г, 20,6 ммоль), и пасту растирают в течение 10 минут. Добавляют твердый иодид калия (3,42 г, 20,6 ммоль) и пасту растирают в течение 20 минут. Пасту затем растворяют в воде (20 мл) и обрабатывают сульфитом натрия (10%-ный водный раствор), перед экстракцией с помощью EtOAc (3×50 мл). Объединенные органические слои сушат над сульфатом натрия и сырой продукт очищают с помощью флэш-хроматографии (гексан), получая указанное в заголовке соединение в виде масла светло-желтого цвета (1,79 г, выход 77%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,17 (д, J=6,84 Гц, 6H), 3,08 (септет, J=6,88 Гц, 1H), 7,33 (д, J=8,42 Гц, 1H), 7,45 (ддд, J=8,42, 2,20, 0,37 Гц, 1H), 7,87 (д, J=2,20 Гц, 1H).
Стадия 5: [5-Хлор-2-(пропан-2-ил)фенил]бороновая кислота
Изопропилмагнийхлорид (2 М раствор в ТГФ, 3,34 мл, 6,7 ммоль) по каплям добавляют к раствору 4-хлор-2-иод-1-(пропан-2-ил)бензола (1,7 г, 6,7 ммоль) в безводном ТГФ (15 мл) при температуре -30°С, и реакционную смесь перемешивают при той же самой температуре в течение 30 минут в атмосфере аргона. По истечении этого времени по каплям добавляют триметилборат (1,35 мл, 12,1 ммоль), и реакционную смесь перемешивают при той же самой температуре в течение 1,5 часов. Добавляют HCl (1М, 6 мл) и реакционную смесь экстрагируют с помощью EtOAc (3×20 мл). Объединенные органические слои сушат над сульфатом натрия и, после удаления растворителя, получают твердое вещество, которое растирают в гексане, получая указанное в заголовке соединение в виде твердого вещества белого цвета (1,05 г, выход 87%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,16 (д, J=6,84 Гц, 6H), 3,17-3,25 (м, 1H), 7,24-7,29 (м, 2H), 7,29-7,33 (м, 1H), 8,22 (c, 2H).
Получение С
[2-Этил-5-(трифторметил)фенил]бороновая кислота (IIIa)
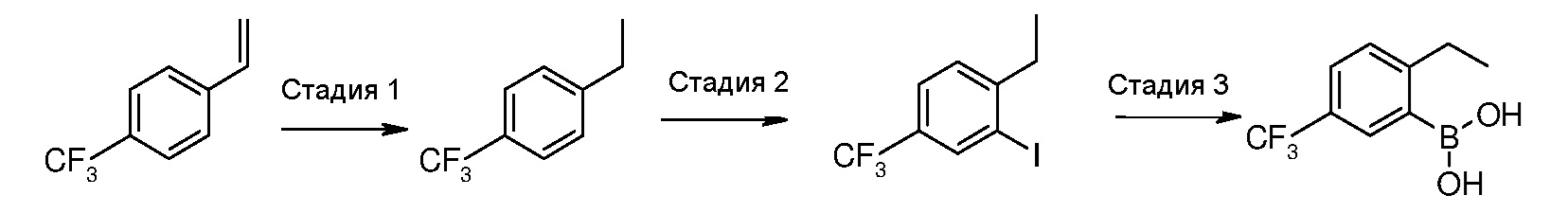
Стадия 1: 1-Этил-4-(трифторметил)бензол
Раствор 1-этенил-4-(трифторметил)бензола (1,72 мл, 11,6 ммоль) в ТГФ (60 мл) перемешивают в присутствии Pd/C (10%, 400 мг) в атмосфере водорода (45 фунт/кв.дюйм) в течение 7 часов. Твердое вещество отфильтровывают через целит (промытый DCM) и фильтрат осторожно концентрируют, поддерживая температуру бани ниже 20°С, при давлении, равном 200 мм рт.ст. Таким образом полученный концентрированный раствор используют на следующей стадии, без дальнейшей манипуляции с ним.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,20 (т, J=7,63 Гц, 3H), 2,70 (кв, J=7,16 Гц, 2H), 7,44 (д, J=7,93 Гц, 2H), 7,63 (д, J=7,93 Гц, 2H).
Стадия 2: 2-Иод-1-этил-4-(трифторметил)бензол
Серную кислоту (96%, 1,9 мл) по каплям добавляют к раствору периодата натрия (3,73 г, 17,4 ммоль) и иода (2,95 г, 11,6 ммоль) в смеси уксусной кислоты (8,45 мл), уксусного ангидрида (4,23 мл) при температуре 0°С, затем по каплям добавляют 1-этил-4-(трифторметил)бензол (2,0 г, 11,6 ммоль). Реакционную смесь оставляют нагреваться до комнатной температуры, все время перемешивая в течение 24 часов. Добавляют раствор метабисульфита натрия (10%), для гашения оставшегося иода, и затем добавляют гидроксид натрия (35%), для доведения рН до 7. Водный слой экстрагируют с помощью DCM (3×50 мл) и объединенные органические слои сушат над сульфатом натрия. После этого удаляют растворитель, сырой продукт используют без дальнейшей очистки на следующей стадии.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,16 (т, J=7,51 Гц, 3H), 2,75 (кв, J=7,49 Гц, 2H), 7,53 (д, J=8,06 Гц, 1H), 7,69-7,75 (м, 1H), 8,11 (дкв, J=1,95, 0,73 Гц, 1H).
Стадия 3: [2-Этил-5-(трифторметил)фенил]бороновая кислота
Изопропилмагнийхлорид (2М раствор в ТГФ, 5,81 мл, 11,6 ммоль) по каплям добавляют к охлажденному (-30°С) раствору 2-иод-1-этил-4-(трифторметил)бензола (3,48 г, 11,6 ммоль) в безводном ТГФ (30 мл), и реакционную смесь перемешивают при той же самой температуре в течение 30 минут в атмосфере аргона. По истечении этого времени по каплям добавляют триметилборат (2,6 мл, 23,2 ммоль), и реакционную смесь перемешивают при той же самой температуре в течение 1,5 часов. Добавляют HCl (1М, 10 мл) и реакционную смесь экстрагируют с помощью EtOAc (3×40 мл). Объединенные органические слои сушат над сульфатом натрия и растворитель выпаривают, получая указанное в заголовке соединение в виде твердого вещества белого цвета, кристаллизуемого из гексана (2,46 г, выход 97%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,16 (т, J=7,51 Гц, 3H), 2,82 (кв, J=7,45 Гц, 2H), 7,37 (д, J=8,06 Гц, 1H), 7,56-7,62 (м, 1H), 7,69 (дкв, J=1,80, 0,40 Гц, 1H), 8,27 (c, 2H).
Получение D
Метил-5-хлор-2-этилбензоат
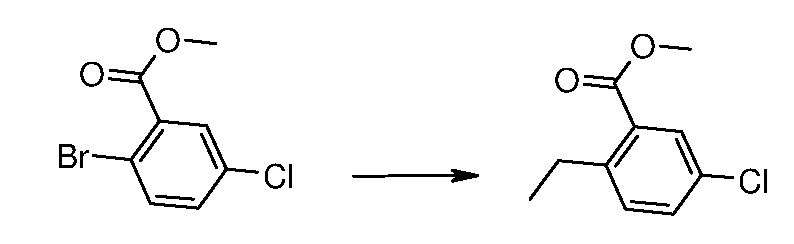
Метил-2-бром-5-хлорбензоат (1,0 г, 4 ммоль), хлорид лития (490 мг, 11,58 ммоль), тетраэтилолово (0,81 мл, 4,1 ммоль) и бис(трифенилфосфин)палладий(II)хлорид (100 мг, 0,13 ммоль) объединяют в ДМФА (20 мл) и нагревают при температуре 100°С в течение 5 часов. Растворитель удаляют при пониженном давлении и остаток разбавляют водой и EtOAc. Органический слой отделяют, промывают водой, сушат над сульфатом натрия и концентрируют. С помощью колоночной хроматографии на силикагеле (0-10% = EtOAc/гексан) получают указанное в заголовке соединение (435 мг, выход 55%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,15 (т, J=7,43 Гц, 3H) 2,86 (кв, J=7,45 Гц, 2H) 3,84 (c, 3H) 7,40 (д, J=8,30 Гц, 1H) 7,53-7,61 (м, 1H) 7,75 (д, J=2,32 Гц, 1H).
Вышеуказанную методику используют при синтезе следующего соединения:
Метил-2-этил-5-(трифторметил)бензоат
1H ЯМР (600 МГц, ДМСО-d6) δ 1,18 (т, J=7,6 Гц, 3H) 2,97 (кв, J = 7,6 Гц, 2H) 3,87 (c, 3H) 7,62 (д, J= 8,1 Гц, 1H) 7,88 (дд, J=1,5, 8,2 Гц, 1H) 8,04 (д, J=1,10 Гц, 1H).
Получение Е
2-[2-Хлор-5-(трифторметил)фенил]-1Н-пиррол-3-карбонитрил [(VIII), R1 = Cl, R2 = CF3]
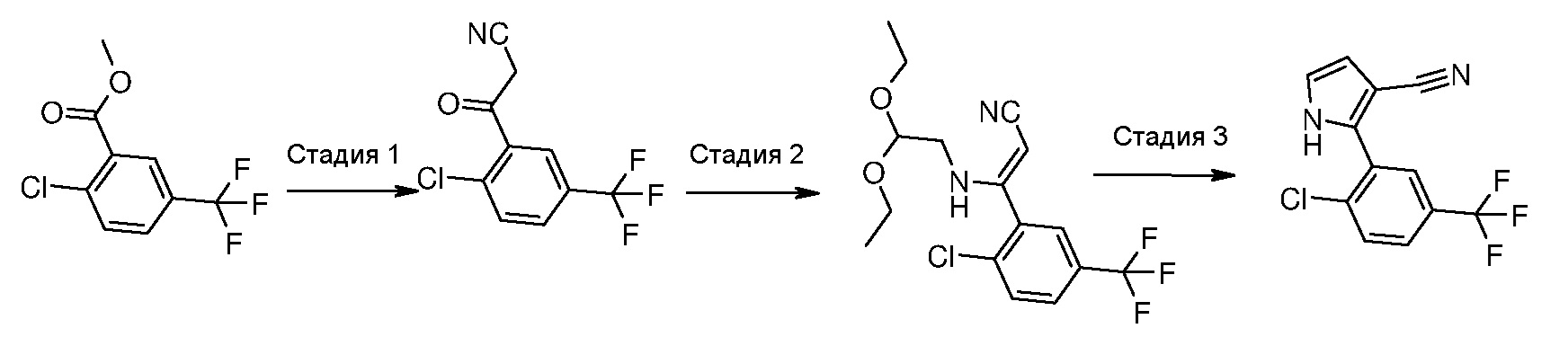
Стадия 1: 3-[2-Хлор-5-(трифторметил)фенил]-3-оксопропаннитрил
1,7М Раствор в толуоле трет-пентоксида калия (7,35 мл, 12,5 ммоль) по каплям добавляют к раствору метил-2-хлор-5-(трифторметил)бензоата (2,0 г, 8,38 ммоль) и ACN (1,32 мл, 25,15 ммоль) в безводном толуоле (30 мл). Смесь перемешивают при комнатной температуре в течение 20 минут, затем разбавляют 1н раствором HCl (20 мл), водой (75 мл) и EtOAc (100 мл). Органический слой отделяют, промывают водой (2×50 мл) и насыщенным солевым раствором (2×50 мл), сушат над сульфатом натрия и концентрируют. С помощью колоночной хроматографии на силикагеле (0-20% = EtOAc/гексан) получают указанное в заголовке соединение (1,73 г, выход 83%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 4,76 (c, 2H) 7,81-7,98 (м, 3H).
Стадия 2: 3-[2-Хлор-5-(трифторметил)фенил]-3-[(2,2-диэтоксиэтил)амино]проп-2-еннитрил
Смесь 3-[2-хлор-5-(трифторметил)фенил]-3-оксопропаннитрила (1,2 г, 4,8 ммоль), 2-аминоацетальдегиддиэтилацеталя (0,77 мл, 5,3 ммоль) и толуола (30 мл) перемешивают при температуре кипения с обратным холодильником в течение 5 часов в атмосфере азота в аппарате Дина-Старка. Смесь выпаривают в вакууме и используют на следующей стадии без дальнейшей очистки.
Стадия 3: 2-(2-Хлор-5-трифторметилфенил)-1Н-пиррол-3-карбонитрил
К ТФУК (4 мл) при температуре 5°С добавляют сырой 3-[2-хлор-5-(трифторметил)фенил]-3-[(2,2-диэтоксиэтил)амино]проп-2-еннитрил. После перемешивания при комнатной температуре в течение 30 минут, реакционную смесь концентрируют и затем разбавляют EtOAc и насыщенным раствором гидрокарбоната натрия. Органический слой отделяют, промывают водой и насыщенным солевым раствором, сушат над сульфатом натрия и концентрируют. С помощью колоночной хроматографии на силикагеле (0-20% = EtOAc/гексан) получают указанное в заголовке соединение (584 мг, выход 45% за 2 стадии).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,65 (т, J=2,62 Гц, 1H) 7,12 (т, J=2,81 Гц, 1H) 7,81-7,95 (м, 3H) 12,23 (уш.с, 1H).
Вышеуказанную методику используют для синтеза следующих соединений:
2-(5-Хлор-2-метилфенил)-1Н-пиррол-3-карбонитрил [(VIII), R1 = CH3, R2 = Cl]
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 2,26 (c, 3H) 6,59 (т, J=2,69 Гц, 1H) 7,04 (т, J=2,81 Гц, 1H) 7,38 (д, J=2,20 Гц, 1H) 7,39-7,42 (м, 1H) 7,42-7,47 (м, 1H) 11,99 (уш.с, 1H).
2-(2-Бром-5-хлорфенил)-1Н-пиррол-3-карбонитрил [(VIII), R1 = Br, R2 = Cl]
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,60 (т, J=2,62 Гц, 1H) 7,06 (т, J=2,81 Гц, 1H) 7,51 (дд, J=8,61, 2,62 Гц, 1H) 7,59 (д, J=2,56 Гц, 1H) 7,82 (д, J=8,54 Гц, 1H) 12,13 (уш.с, 1H).
2-(2,5-Дихлорфенил)-1Н-пиррол-3-карбонитрил [(VIII), R1 = Cl, R2 = Cl]
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,62 (т, J=2,62 Гц, 1H) 7,08 (т, J=2,81 Гц, 1H) 7,55-7,61 (м, 1H) 7,61-7,63 (м, 1H) 7,65-7,69 (м, 1H) 12,16 (уш.с, 1H).
2-(5-Хлор-2-этилфенил)-1Н-пиррол-3-карбонитрил [(VIII), R1 = CH2CH3, R2 = Cl]
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 0,99 (т, J=7,51 Гц, 3H) 2,58 (кв, J=7,53 Гц, 2H) 6,58 (т, J=2,65 Гц, 1H) 7,02 (т, J=2,81 Гц, 1H) 7,31-7,37 (м, 1H) 7,41-7,46 (м, 1H) 7,47-7,52 (м, 1H) 11,99 (уш.с, 1H).
2-[2-Метил-5-(трифторметил)фенил]-1Н-пиррол-3-карбонитрил [(VIII), R1 = CH3, R2 = CF3]
1H ЯМР (400 МГц, ДМСО-d6) δ 2,36-2,39 (м, 3H) 6,62 (т, J=2,61 Гц, 1H) 7,08 (т, J=2,75 Гц, 1H) 7,62 (д, J=8,24 Гц, 1H) 7,65 (c, 1H) 7,74 (д, J=7,96 Гц, 1H) 12,08 (уш.с, 1H).
2-[2-Этил-5-(трифторметил)фенил]-1Н-пиррол-3-карбонитрил [(VIII), R1 = CH2CH3, R2 = CF3]
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,04 (т, J=7,51 Гц, 3H) 1,11-1,52 (м, 1H) 2,07 (c, 1H) 2,69 (кв, J=7,51 Гц, 2H) 6,61 (т, J=2,75 Гц, 1H) 7,06 (т, J=2,75 Гц, 1H) 7,61 (c, 1H) 7,66 (д, J=8,24 Гц, 1H) 7,79 (дд, J= 1,46, 8,06 Гц, 1H) 12,05 (уш.с, 1H).
Пример 1
5-(2-Аминопиримидин-4-ил)-2-[2-хлор-5-(трифторметил)фенил]-1Н-пиррол-3-карбоксамид
[(I), R1 = Cl, R2 = CF3, R3 = R4 = NH2, R12 = H] (соединение 1)
Схема А, стадии 1, 2, 3
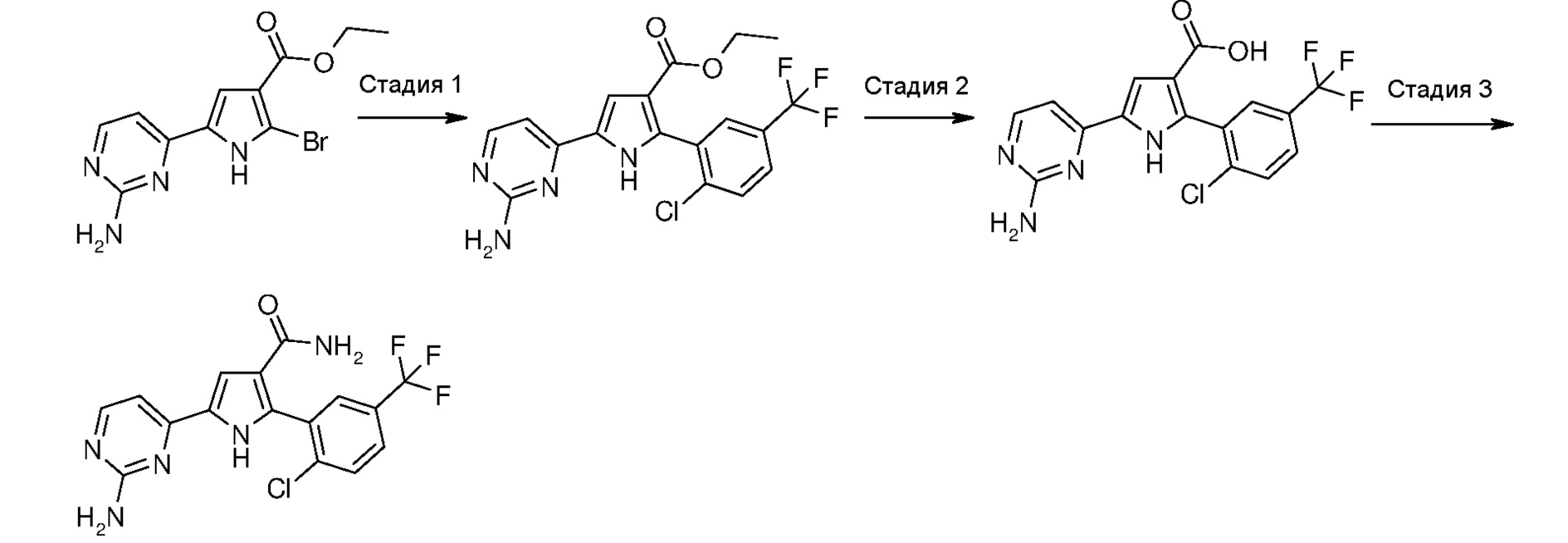
Стадия 1: Этил-5-(2-аминопиримидин-4-ил)-2-[2-хлор-5-(трифторметил)фенил]-1Н-пиррол-3-карбоксилат
К раствору этил-5-(2-аминопиримидин-4-ил)-2-бром-1Н-пиррол-3-карбоксилата (полученного в соответствии с международной заявкой на патент WO 2007/110344, 2,0 г, 6,43 ммоль), растворенного в EtOH (20 мл) и толуоле (20 мл), добавляют LiCl (408 мг, 9,64 ммоль), 1М водный раствор Na2CO3 (17 ммоль), 2-хлор-5-трифторметилфенилбороновую кислоту (1,875 г, 8,35 ммоль) и (Ph3P)2PdCl2 (470 мг, 0,67 ммоль) и реакционную смесь нагревают при температуре 100°С в течение 5 часов. После охлаждения до комнатной температуры осадок отфильтровывают, и фильтрат выпаривают при пониженном давлении, растворяют в DCM и промывают водой. Органический слой затем сушат над сульфатом натрия и концентрируют. Сырой продукт хроматографируют на силикагеле (DCM/EtOAc = 50/50), получая указанное в заголовке соединение (2,16 г, выход 82%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,01 (т, J=7,08 Гц, 3H) 4,00 (кв, J=7,08 Гц, 2H) 6,39 (уш.с, 2H) 6,99 (д, J=5,25 Гц, 1H) 7,29 (д, J=2,32 Гц, 3H) 7,82 (c, 4H) 8,20 (д, J=5,13 Гц, 3H) 12,36 (уш.с, 1H).
HRMS (ESI): рассчитано для C18H14ClF3N4O2 + H+ - 411,0830, найдено - 411,0827.
Вышеуказанную методику использовали для синтеза следующих соединений:
Этил-5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-1Н-пиррол-3-карбоксилат
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,09 (т, J=7,14 Гц, 3H) 2,11 (c, 3H) 4,04 (кв, J=7,12 Гц, 2H) 6,41 (c, 2H) 7,01 (д, J=5,25 Гц, 1H) 7,25-7,36 (м, 3H) 7,37-7,43 (м, 1H) 8,21 (д, J=5,13 Гц, 1H) 12,17 (уш.с, 1H).
Этил-5-(2-аминопиримидин-4-ил)-2-(2,5-дихлорфенил)-1Н-пиррол-3-карбоксилат
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,07 (т, J=7,08 Гц, 3H) 4,05 (кв, J=7,16 Гц, 2H) 6,42 (уш.с, 2H) 7,01 (д, J=5,25 Гц, 1H) 7,29 (c, 1H) 7,52-7,60 (м, 3H) 8,22 (д, J=5,25 Гц, 1H) 12,32 (уш.с, 1H).
Этил-5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-метоксифенил)-1Н-пиррол-3-карбоксилат
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,11 (т, J=7,08 Гц, 3H) 3,73 (c, 3H) 4,05 (кв, J=7,16 Гц, 2H) 6,43 (уш.с, 2H) 7,01 (д, J=5,25 Гц, 1H) 7,11 (д, J=8,91 Гц, 1H) 7,26 (д, J=2,69 Гц, 1H) 7,38 (д, J=2,69 Гц, 1H) 7,45 (дд, J=8,85, 2,75 Гц, 1H) 8,20 (д, J=5,25 Гц, 1H) 12,01 (уш.с, 1H).
Этил-5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-этилфенил)-1Н-пиррол-3-карбоксилат
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 0,97 (т, J=7,57 Гц, 3H) 1,06 (т, J=7,08 Гц, 3H) 2,44 (кв, J=7,57 Гц, 2H) 4,03 (кв, J=7,08 Гц, 2H) 7,21 (д, J=6,10 Гц, 1H) 7,32 (д, J=2,32 Гц, 1H) 7,38 (д, J=8,42 Гц, 1H) 7,47 (дд, J=8,30, 2,32 Гц, 1H) 7,50 (д, J=2,56 Гц, 1H) 8,25 (д, J=5,98 Гц, 1H) 12,52 (уш.с, 1H).
Этил-5-(2-аминопиримидин-4-ил)-2-(2-хлор-5-метилфенил)-1Н-пиррол-3-карбоксилат
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,06 (т, J=7,14 Гц, 3H) 2,34 (c, 3H) 4,03 (кв, J=7,16 Гц, 2H) 6,41 (c, 1H) 7,01 (д, J=5,25 Гц, 1H) 7,27-7,30 (м, 3H) 7,42 (д, J=8,06 Гц, 1H) 8,21 (д, J=5,25 Гц, 1H) 12,20 (уш.с, 1H).
Этил-5-(2-аминопиримидин-4-ил)-2-(5-бром-2-метоксифенил)-1Н-пиррол-3-карбоксилат
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,11 (т, J=7,08 Гц, 3H) 3,72 (c, 3H) 4,05 (кв, J=7,16 Гц, 2H) 6,41 (c, 2H) 7,01 (д, J=5,25 Гц, 1H) 7,06 (д, J=8,91 Гц, 1H) 7,25 (д, J=2,69 Гц, 1H) 7,49 (д, J=2,56 Гц, 1H) 7,57 (дд, J=8,85, 2,62 Гц, 1H) 8,20 (д, J=5,25 Гц, 1H) 12,01 (уш.с, 1H).
Этил-5-(2-аминопиримидин-4-ил)-2-(5-бром-2-фторфенил)-1Н-пиррол-3-карбоксилат
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,13 (т, J=7,08 Гц, 3H) 4,09 (кв, J=7,16 Гц, 2H) 6,44 (уш.с, 2H) 7,03 (д, J=5,13 Гц, 1H) 7,29 (дд, J=9,28, 8,91 Гц, 1H) 7,31 (д, J=2,32 Гц, 1H) 7,63-7,69 (м, 2H) 7,72 (дд, J=6,47, 2,56 Гц, 1H) 8,23 (д, J=5,25 Гц, 1H) 12,33 (уш.с, 1H).
Этил-5-(2-аминопиримидин-4-ил)-2-([2-хлор-5-(гидроксиметил)фенил]-1Н-пиррол-3-карбоксилат
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,07 (т, J=7,08 Гц, 3H) 4,04 (кв, J=7,08 Гц, 2H) 4,55 (c, 2H) 7,22 (д, J=5,98 Гц, 1H)) 7,38-7,55 (м, 4H) 8,26 (д, J=5,98 Гц, 1H) 12,55 (уш.с, 1H).
Этил-5-(2-аминопиримидин-4-ил)-2-(2-хлор-5-метоксифенил)-1Н-пиррол-3-карбоксилат
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,07 (т, J=7,14 Гц, 3H) 3,79 (c, 3H) 4,04 (кв, J=7,08 Гц, 2H) 6,41 (c, 2H) 7,02 (д, J=5,25 Гц, 1H) 7,03-7,06 (м, 2H) 7,28 (д, J=2,56 Гц, 1H) 7,41-7,46 (м, 1H) 8,21 (д, J=5,25 Гц, 1H) 12,22 (уш.с, 1H).
Этил-5-(2-аминопиримидин-4-ил)-2-[2-хлор-5-(трифторметокси)фенил]-1Н-пиррол-3-карбоксилат
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,04 (т, J=7,08 Гц, 3H) 4,03 (кв, J=7,08 Гц, 2H) 6,42 (уш.с, 2H) 7,01 (д, J=5,13 Гц, 1H) 7,30 (д, J=2,32 Гц, 1H) 7,46-7,54 (м, 2H) 7,68-7,72 (м, 1H) 8,22 (д, J=5,25 Гц, 1H) 12,37 (уш.с, 1H).
Этил-5-(2-аминопиримидин-4-ил)-2-[2-метил-5-(трифторметил)фенил]-1Н-пиррол-3-карбоксилат
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,04 (т, J=7,14 Гц, 3H) 2,21 (c, 3H) 4,02 (кв, J=7,04 Гц, 2H) 6,41 (c, 2H) 7,01 (д, J=5,25 Гц, 1H) 7,32 (д, J=2,44 Гц, 1H) 7,54 (д, J=8,06 Гц, 1H) 7,59 (д, J=1,46 Гц, 1H) 7,70 (дд, J=8,06, 1,46 Гц, 1H) 8,21 (д, J=5,25 Гц, 1H) 12,24 (уш.с, 1H).
Этил-5-(2-аминопиримидин-4-ил)-2-[5-хлор-2-(пропан-2-ил)фенил]-1Н-пиррол-3-карбоксилат
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,02 (т, J=7,08 Гц, 3H) 1,07 (д, J=6,96 Гц, 6H) 2,71 (септет, J=6,84 Гц, 1H) 4,00 (кв, J=7,08 Гц, 2H) 6,40 (уш.с, 2H) 7,00 (д, J=5,13 Гц, 1H) 7,25 (д, J=2,32 Гц, 1H) 7,28 (д, J=2,56 Гц, 1H) 7,42 (д, J=8,30 Гц, 1H) 7,48 (дд, J=8,30, 2,32 Гц, 1H) 8,20 (д, J=5,25 Гц, 1H) 12,23 (уш.с, 1H).
Этил-5-(2-аминопиримидин-4-ил)-2-[2-этил-5-(трифторметил)фенил]-1Н-пиррол-3-карбоксилат
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,01 (т, J=7,15 Гц, 6H) 2,54 (кв, J=7,60 Гц, 2H) 4,00 (кв, J=7,08 Гц, 2H) 6,41 (уш.с, 2H) 7,01 (д, J=5,25 Гц, 1H) 7,31 (д, J=2,56 Гц, 1H) 7,56 (д, J=1,60 Гц, 1H) 7,58 (д, J=8,20 Гц, 1H) 7,74 (дд, J=8,12, 1,53 Гц, 1H) 8,21 (д, J=5,13 Гц, 1H) 12,27 (уш.с, 1H).
Этил-5-(2-аминопиримидин-4-ил)-2-[5-хлор-2-(трифторметил)фенил]-1Н-пиррол-3-карбоксилат
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 0,97 (т, J=7,08 Гц, 3H) 3,97 (кв, J=7,08 Гц, 2H) 6,41 (уш.с, 2H) 6,99 (д, J=5,25 Гц, 1H) 7,27 (д, J=2,44 Гц, 1H) 7,66 (д, J=2,07 Гц, 1H) 7,74-7,79 (м, 1H) 7,86 (д, J=8,54 Гц, 1H) 8,21 (д, J=5,13 Гц, 1H) 12,37 (уш.с, 1H).
Этил-5-(2-аминопиримидин-4-ил)-2-(5-циано-2-метилфенил)-1Н-пиррол-3-карбоксилат
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,07 (т, J=7,14 Гц, 3H) 2,21 (c, 3H) 4,04 (кв, J=7,08 Гц, 2H) 6,41 (уш.с, 2H) 7,01 (д, J=5,25 Гц, 1H) 7,32 (д, J=2,32 Гц, 1H) 7,52 (д, J=8,06 Гц, 1H) 7,76 (д, J=1,83 Гц, 1H) 7,80 (дд, J=7,87, 1,77 Гц, 1H) 8,22 (д, J=5,25 Гц, 1H) 12,24 (уш.с, 1H).
Стадия 2: 5-(2-Аминопиримидин-4-ил)-2-[2-хлор-5-(трифторметил)фенил]-1Н-пиррол-3-карбоновая кислота
Этил-5-(2-аминопиримидин-4-ил)-2-[2-хлор-5-(трифторметил)фенил]-1Н-пиррол-3-карбоксилат (1,0 г, 2,43 ммоль) обрабатывают 1,5 М раствором гидроксида калия в 95%-ном EtOH (32,4 мл, 20 экв.) при кипячении с обратным холодильником в течение 20 часов. После охлаждения остаток концентрируют, растворяют в воде и промывают с помощью DCM. К охлажденной до температуры 5°С водной фазе добавляют 2н раствор HCl при перемешивании. Полученный осадок собирают путем фильтрации, получая указанное в заголовке соединение (0,88 г, выход 95%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,29 (д, J=6,35 Гц, 1H) 7,62 (уш.с, 2H) 7,58 (д, J=2,20 Гц, 1H) 7,79-7,92 (м, 3H) 8,29 (д, J=6,23 Гц, 1H) 12,67 (уш.с, 1H) 12,76 (уш.с, 1H).
HRMS (ESI): рассчитано для C16H10ClF3N4O2 + H+ - 383,0517, найдено - 383,0513.
Вышеуказанную методику использовали для синтеза следующих соединений:
5-(2-Аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-1Н-пиррол-3-карбоновая кислота
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 2,12 (c, 3H) 7,28-7,37 (м, 3H) 7,40-7,45 (м, 1H) 7,59 (д, J=2,56 Гц, 1H) 7,77 (уш.с, 1H) 8,28 (д, J=6,44 Гц, 1H) 12,06 (c, 1H) 12,54 (уш.с, 1H).
5-(2-Аминопиримидин-4-ил)-2-(5-хлор-2-этилфенил)-1Н-пиррол-3-карбоновая кислота
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 0,98 (т, J=7,57 Гц, 3H) 2,46 (кв, J=7,57 Гц, 2H) 6,79 (уш.с, 2H) 7,08 (д, J=5,49 Гц, 1H) 7,29 (д, J=2,32 Гц, 1H) 7,35 (д, J=8,30 Гц, 1H) 7,36 (д, J=2,81 Гц, 1H) 7,43 (дд, J=8,30, 2,32 Гц, 1H) 8,22 (д, J=5,62 Гц, 1H) 11,86 (уш.с, 1H) 12,23 (уш.с, 1H).
5-(2-Аминопиримидин-4-ил)-2-(2-хлор-5-метилфенил)-1Н-пиррол-3-карбоновая кислота
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 2,33 (c, 3H) 6,88 (уш.с, 1H) 7,11 (д, J=5,61 Гц, 1H) 7,24-7,30 (м, 2H) 7,29 (дкв, J=2,20, 0,60 Гц, 1H) 7,37 (д, J=2,20 Гц, 1H) 7,41 (д, J=8,06 Гц, 1H) 8,22 (д, J=5,62 Гц, 1H) 11,84 (уш.с, 1H) 12,26 (уш.с, 1H).
5-(2-Аминопиримидин-4-ил)-2-(5-бром-2-метоксифенил)-1Н-пиррол-3-карбоновая кислота
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 3,73 (c, 3H) 7,09 (д, J=8,91 Гц, 1H) 7,31 (д, J=6,59 Гц, 1H) 7,51 (д, J=2,56 Гц, 1H) 7,56 (д, J=2,32 Гц, 1H) 7,59 (дд, J=8,85, 2,62 Гц, 1H) 7,81 (уш.с, 2H) 8,27 (д, J=6,47 Гц, 1H) 12,41 (уш.с, 1H).
5-(2-Аминопиримидин-4-ил)-2-(5-бром-2-фторфенил)-1Н-пиррол-3-карбоновая кислота
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,27 (д, J=6,10 Гц, 1H) 7,30 (т, J=9,10 Гц, 1H) 7,53 (уш.с, 1H) 7,68 (ддд, J=8,88, 4,49, 2,62 Гц, 1H) 7,73 (дд, J=6,35, 2,56 Гц, 1H) 8,29 (д, J=6,10 Гц, 1H) 12,59 (уш.с, 1H).
5-(2-Аминопиримидин-4-ил)-2-[2-хлор-5-(трифторметокси)фенил]-1Н-пиррол-3-карбоновая кислота
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,27 (д, J=6,47 Гц, 1H) 7,47-7,57 (м, 3H) 7,71 (д, J=9,03 Гц, 1H) 8,29 (д, J=6,23 Гц, 1H) 12,06 (c, 1H) 12,65 (уш.с, 1H).
5-(2-Аминопиримидин-4-ил)-2-[2-метил-5-(трифторметил)фенил]-1Н-пиррол-3-карбоновая кислота
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 2,23 (c, 3H) 7,28 (д, J=6,10 Гц, 1H) 7,55 (д, J=8,30 Гц, 1H) 7,58 (д, J=1,80 Гц, 1H) 7,61 (д, J=1,34 Гц, 1H) 7,71 (дд, J=8,18, 1,60 Гц, 1H) 8,27 (д, J=6,22 Гц, 1H) 12,54 (уш.с, 1H).
5-(2-Аминопиримидин-4-ил)-2-[2-этил-5-(трифторметил)фенил]-1Н-пиррол-3-карбоновая кислота
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,02 (т, J=7,57 Гц, 3H) 2,56 (кв, J=7,65 Гц, 2H) 7,18 (д, J=5,86 Гц, 1H) 7,20 (уш.с, 2H) 7,48 (д, J=2,44 Гц, 1H) 7,57 (уш.с, 1H) 7,58 (д, J=8,00 Гц, 1H) 7,74 (дд, J=7,99, 1,65 Гц, 1H) 8,25 (д, J=5,98 Гц, 1H) 11,95 (уш.с, 1H) 12,43 (уш.с, 1H).
Стадия 3: 5-(2-Аминопиримидин-4-ил)-2-[2-хлор-5-(трифторметил)фенил]-1Н-пиррол-3-карбоксамид
[(I), R1 = Cl, R2 = CF3, R3 = R4 = NH2, R12 = H] (соединение 1)
Раствор 5-(2-аминопиримидин-4-ил)-2-(2-хлор-5-трифторметилфенил)-1Н-пиррол-3-карбоновой кислоты (581 мг, 1,52 ммоль) в ДМФА (5 мл) и DIPEA (1,06 мл, 6,08 ммоль) перемешивают при температуре 0°С. Добавляют EDCI (582 мг, 3,04 ммоль) и HOBT·NH3 (469 мг, 3,04 ммоль) и реакционную смесь перемешивают в течение 3 часов при комнатной температуре. Смесь разбавляют водой и полученный осадок собирают путем фильтрации, получая указанное в заголовке соединение (475 мг, выход 82%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,36 (уш.с, 2H) 6,77 (уш.с, 1H) 6,90 (д, J=5,25 Гц, 1H) 7,37 (д, J=2,56 Гц, 1H) 7,42 (уш.с, 1H) 7,69-7,84 (м, 3H) 8,22 (д, J=5,25 Гц, 1H) 12,07 (уш.с, 1H).
HRMS (ESI): рассчитано для C16H11ClF3N5O + H+ - 382,0677, найдено - 382,0675.
Вышеуказанную методику использовали для синтеза следующих соединений:
5-(2-Аминопиримидин-4-ил)-2-(2,5-дихлорфенил)-1Н-пиррол-3-карбоксамид
[(I), R1 = Cl, R2 = Cl, R3 = R4 = NH2, R12 = H] (соединение 2)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,87 (уш.с, 1H) 7,09 (д, J=6,10 Гц, 1H) 7,46 (уш.с, 1H) 7,48-7,56 (м, 3H) 8,26 (д, J=6,10 Гц, 1H) 12,35 (уш.с, 1H).
HRMS (ESI): рассчитано для C15H11Cl2N5O + H+ - 348,0414, найдено - 348,0419.
5-(2-Аминопиримидин-4-ил)-2-(5-хлор-2-метоксифенил)-1Н-пиррол-3-карбоксамид
[(I), R1 = ОСН3, R2 = Cl, R3 = R4 = NH2, R12 = H] (соединение 3)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 3,75 (c, 3H) 6,35 (уш.с, 2H) 6,74 (уш.с, 1H) 6,92 (д, J=5,25 Гц, 1H) 7,08-7,12 (м, 1H) 7,20 (уш.с, 1H) 7,25 (д, J=2,56 Гц, 1H) 7,36-7,41 (м, 2H) 8,19 (д, J=5,25 Гц, 1H) 11,63 (уш.с, 1H).
HRMS (ESI): рассчитано для C16H14ClN5O2 + H+ - 344,0909, найдено - 344,0912.
5-(2-Аминопиримидин-4-ил)-2-(2-хлор-5-этилфенил)-1Н-пиррол-3-карбоксамид
[(I), R1 = Cl, R2 = CH2CH3, R3 = R4 = NH2, R12 = H] (соединение 4)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,20 (т, J=7,57 Гц, 3H) 2,63 (кв, J=7,57 Гц, 2H) 6,33 (уш.с, 2H) 6,69 (уш.с, 1H) 6,93 (д, J=5,25 Гц, 1H) 7,14 (уш.с, 1H) 7,27 (д, J=2,20 Гц, 1H) 7,26 (дд, J=7,90, 2,20 Гц, 1H) 7,32 (д, J=2,56 Гц, 2H) 7,40 (дд, J=7,81, 0,49 Гц, 1H) 8,19 (д, J=5,25 Гц, 1H) 11,87 (уш.с, 1H).
HRMS (ESI): рассчитано для C17H16ClN5O + H+ - 342,1116, найдено - 342,1120.
5-(2-Аминопиримидин-4-ил)-2-(5-хлор-2-этилфенил)-1Н-пиррол-3-карбоксамид
[(I), R1 = CH2CH3, R2 = Cl, R3 = R4 = NH2, R12 = H] (соединение 5)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 0,97 (т, J=7,57 Гц, 3H) 2,41-2,49 (м, 2H) 6,32 (уш.с, 2H) 6,71 (уш.с, 1H) 6,92 (д, J=5,25 Гц, 1H) 7,16 (уш.с, 1H) 7,25 (д, J=2,20 Гц, 1H) 7,30-7,33 (м, 1H) 7,34 (д, J=2,69 Гц, 1H) 7,37-7,46 (м, 1H) 8,19 (д, J=5,25 Гц, 1H) 11,87 (уш.с, 1H).
HRMS (ESI): рассчитано для C17H16ClN5O + H+ - 342,1116, найдено - 342,1111.
5-(2-Аминопиримидин-4-ил)-2-(2-хлор-5-метилфенил)-1Н-пиррол-3-карбоксамид
[(I), R1 = Cl, R2 = CH3, R3 = R4 = NH2, R12 = H] (соединение 6)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 2,32 (c, 3H) 6,33 (уш.с, 2H) 6,68 (уш.с, 1H) 6,93 (д, J=5,25 Гц, 1H) 7,14 (уш.с, 1H) 7,20-7,24 (м, 1H) 7,25 (дкв, J=2,20, 0,60 Гц, 1H) 7,31 (д, J=2,56 Гц, 1H) 7,38 (д, J=8,18 Гц, 1H) 8,19 (д, J=5,25 Гц, 1H) 11,85 (уш.с, 1H).
HRMS (ESI): рассчитано для C16H14ClN5O + H+ - 328,0960, найдено - 328,0965.
5-(2-Аминопиримидин-4-ил)-2-(2-хлор-5-цианофенил)-1Н-пиррол-3-карбоксамид
[(I), R1 = Cl, R2 = CN, R3 = R4 = NH2, R12 = H] (соединение 7)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,42 (уш.с, 2H) 6,79 (уш.с, 1H) 6,90 (д, J=5,25 Гц, 1H) 7,38 (д, J=2,56 Гц, 1H) 7,44 (уш.с, 1H) 7,73 (д, J=8,42 Гц, 1H) 7,88 (дд, J=8,42, 2,07 Гц, 1H) 7,94 (д, J=2,07 Гц, 1H) 8,23 (д, J=5,37 Гц, 1H) 12,07 (уш.с, 1H).
HRMS (ESI): рассчитано для C16H11ClN6O + H+ - 339,0756, найдено - 339,0761.
5-(2-Аминопиримидин-4-ил)-2-(5-бром-2-метоксифенил)-1Н-пиррол-3-карбоксамид
[(I), R1 = ОСН3, R2 = Br, R3 = R4 = NH2, R12 = H] (соединение 8)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 3,74 (c, 3H) 6,36 (уш.с, 2H) 6,86 (уш.с, 1H) 7,07 (д, J=8,91 Гц, 1H) 7,14 (д, J=6,23 Гц, 1H) 7,29 (уш.с, 1H) 7,47 (д, J=2,44 Гц, 1H) 7,51 (д, J=2,56 Гц, 1H) 7,55 (дд, J=8,79, 2,56 Гц, 1H) 8,23 (д, J=6,23 Гц, 1H) 12,05 (уш.с, 1H).
HRMS (ESI): рассчитано для C16H14BrN5O2 + H+ - 388,0404, найдено - 388,0410.
5-(2-Аминопиримидин-4-ил)-2-(5-бром-2-фторфенил)-1Н-пиррол-3-карбоксамид
[(I), R1 = F, R2 = Br, R3 = R4 = NH2, R12 = H] (соединение 9)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,46 (уш.с, 2H) 6,91 (уш.с, 1H) 7,11 (д, J=6,10 Гц, 1H) 7,25 (дд, J=9,46, 8,97 Гц, 1H) 7,33 (уш.с, 1H) 7,51 (д, J=2,32 Гц, 2H) 7,63 (ддд, J=8,76, 4,49, 2,62 Гц, 1H) 7,69 (дд, J=6,47, 2,56 Гц, 1H) 8,27 (д, J=5,98 Гц, 1H) 12,31 (уш.с, 1H).
HRMS (ESI): рассчитано для C15H11BrFN5O + H+ - 376,0204, найдено - 376,0209.
5-(2-Аминопиримидин-4-ил)-2-[2-хлор-5-(гидроксиметил)фенил]-1Н-пиррол-3-карбоксамид
[(I), R1 = Cl, R2 = CH2OH, R3 = R4 = NH2, R12 = H] (соединение 10)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 4,53 (д, J=5,74 Гц, 2H) 5,33 (т, J=5,68 Гц, 1H) 6,33 (уш.с, 2H) 6,68 (уш.с, 1H) 6,93 (д, J=5,25 Гц, 1H) 7,15 (уш.с, 1H) 7,32 (д, J=2,56 Гц, 1H) 7,33-7,37 (м, 2H) 7,45 (д, J=8,80 Гц, 1H) 8,19 (д, J=5,25 Гц, 1H) 11,88 (уш.с, 1H).
HRMS (ESI): рассчитано для C16H14ClN5O2 + H+ - 344,0909, найдено - 344,0902.
5-(2-Аминопиримидин-4-ил)-2-(2-хлор-5-метоксифенил)-1Н-пиррол-3-карбоксамид
[(I), R1 = Cl, R2 = OCH3, R3 = R4 = NH2, R12 = H] (соединение 11)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 3,78 (c, 3H) 6,33 (c, 2H) 6,70 (уш.с, 1H) 6,93 (д, J=5,25 Гц, 1H) 6,97-7,02 (м, 2H) 7,15 (уш.с, 1H) 7,31 (д, J=2,56 Гц, 1H) 7,36-7,42 (м, 1H) 8,19 (д, J=5,25 Гц, 1H) 11,88 (уш.с, 1H).
HRMS (ESI): рассчитано для C16H14ClN5O2 + H+ - 344,0909, найдено - 344,0907.
5-(2-Аминопиримидин-4-ил)-2-[2-хлор-5-(трифторметокси)фенил]-1Н-пиррол-3-карбоксамид
[(I), R1 = Cl, R2 = OCF3, R3 = R4 = NH2, R12 = H] (соединение 12)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,35 (уш.с, 2H) 6,76 (уш.с, 1H) 6,90 (д, J=5,13 Гц, 1H) 7,35 (д, J=2,56 Гц, 1H) 7,39 (уш.с, 1H) 7,41-7,46 (м, 1H) 7,42 (дкв, J=1,74, 0,90 Гц, 1H) 7,64 (ддд, J=8,79, 1,46, 1,10 Гц, 1H) 8,21 (д, J=5,25 Гц, 1H) 12,04 (уш.с, 1H).
HRMS (ESI): рассчитано для C16H11ClF3N5O2 + H+ - 398,0626, найдено - 398,0624.
5-(2-Аминопиримидин-4-ил)-2-[2-метил-5-(трифторметил)фенил]-1Н-пиррол-3-карбоксамид
[(I), R1 = CH3, R2 = CF3, R3 = R4 = NH2, R12 = H] (соединение 13)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 2,23 (c, 3H) 6,32 (уш.с, 2H) 6,74 (уш.с, 1H) 6,92 (д, J=5,25 Гц, 1H) 7,32 (уш.с, 1H) 7,37 (д, J=2,44 Гц, 1H) 7,49 (д, J=8,06 Гц, 1H) 7,53 (д, J=1,46 Гц, 1H) 7,64 (дд, J=8,06, 1,46 Гц, 1H) 8,20 (д, J=5,25 Гц, 1H) 11,91 (уш.с, 1H).
HRMS (ESI): рассчитано для C17H14F3N5O + H+ - 362,1223, найдено - 362,1225.
5-(2-Аминопиримидин-4-ил)-2-[5-хлор-2-(пропан-2-ил)фенил]-1Н-пиррол-3-карбоксамид
[(I), R1 = CH(СН3)2, R2 = Cl, R3 = R4 = NH2, R12 = H] (соединение 14)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,06 (д, J=6,84 Гц, 6H) 2,79 (септет, J=6,90 Гц, 1H) 6,32 (уш.с, 2H) 6,71 (уш.с, 1H) 6,91 (д, J=5,25 Гц, 1H) 7,11 (уш.с, 1H) 7,21 (д, J=2,32 Гц, 1H) 7,34 (д, J=2,69 Гц, 1H) 7,38 (д, J=8,30 Гц, 1H) 7,44 (дд, J=8,30, 2,32 Гц, 1H) 8,18 (д, J=5,25 Гц, 1H) 11,89 (уш.с, 1H).
HRMS (ESI): рассчитано для C18H18ClN5O + H+ - 356,1273, найдено - 356,1271.
5-(2-Аминопиримидин-4-ил)-2-[2,5-бис(трифторметил)фенил]-1Н-пиррол-3-карбоксамид
[(I), R1 = CF3, R2 = CF3, R3 = R4 = NH2, R12 = H] (соединение 15)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,34 (уш.с, 2H) 6,69 (уш.с, 1H) 6,85 (д, J=5,25 Гц, 1H) 7,37 (д, J=2,44 Гц, 1H) 7,40 (уш.с, 1H) 7,79 (уш.с, 1H) 8,0-8,06 (м, 2H) 8,21 (д, J=5,25 Гц, 1H) 12,08 (уш.с, 1H).
HRMS (ESI): рассчитано для C17H11F6ClN5O + H+ - 416,0941, найдено - 416,0945.
5-(2-Аминопиримидин-4-ил)-2-[2-этил-5-(трифторметил)фенил]-1Н-пиррол-3-карбоксамид
[(I), R1 = CH2CH3, R2 = CF3, R3 = R4 = NH2, R12 = H] (соединение 16)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,02 (т, J=7,55 Гц, 3H) 2,57 (кв, J=7,60 Гц, 4H) 6,37 (уш.с, 2H) 6,76 (уш.с, 1H) 6,92 (д, J=5,49 Гц, 1H) 7,33 (уш.с, 1H) 7,38 (д, J=2,47 Гц, 1H) 7,47-7,57 (м, 2H) 7,70 (д, J=7,14 Гц, 1H) 8,21 (д, J=5,22 Гц, 1H) 11,97 (уш.с, 1H).
HRMS (ESI): рассчитано для C18H16F3N5O + H+ - 376,138, найдено - 376,1384.
5-(2-Аминопиримидин-4-ил)-2-[5-хлор-2-(трифторметил)фенил]-1Н-пиррол-3-карбоксамид
[(I), R1 = CF3, R2 = Cl, R3 = R4 = NH2, R12 = H] (соединение 17)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,36 (уш.с, 2H) 6,68 (уш.с, 1H) 6,86 (д, J=5,25 Гц, 1H) 7,34 (уш.с, 1H) 7,35 (д, J=2,56 Гц, 1H) 7,54 (д, J=1,95 Гц, 1H) 7,70 (дд, J=8,48, 1,40 Гц, 1H) 7,80 (д, J=8,54 Гц, 1H) 7,95 (c, 1H) 8,21 (д, J=5,37 Гц, 1H) 12,03 (уш.с, 1H).
HRMS (ESI): рассчитано для C16H11ClF3N5O + H+ - 382,0677, найдено - 382,0679.
5-(2-Аминопиримидин-4-ил)-2-(5-циано-2-метилфенил)-1Н-пиррол-3-карбоксамид
[(I), R1 = CH3, R2 = CN, R3 = R4 = NH2, R12 = H] (соединение 18)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 2,22 (c, 3H) 6,33 (уш.с, 2H) 6,76 (уш.с, 1H) 6,91 (д, J=5,25 Гц, 2H) 7,35 (уш.с, 1H) 7,37 (д, J=2,56 Гц, 1H) 7,47 (д, J=7,93 Гц, 2H) 7,69 (д, J=1,83 Гц, 2H) 7,74 (дд, J=7,93, 1,83 Гц, 2H) 8,21 (д, J=5,25 Гц, 2H) 11,90 (уш.с, 1H).
HRMS (ESI): рассчитано для C17H14N6O + H+ - 319,1302, найдено - 319,1314.
Пример 2
5-(2-Аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-N-метил-1Н-пиррол-3-карбоксамид
[(I), R1 = CH3, R2 = Cl, R3 = NHCH3, R4 = NH2, R12 = H] (соединение 19)
Схема А, стадия 3
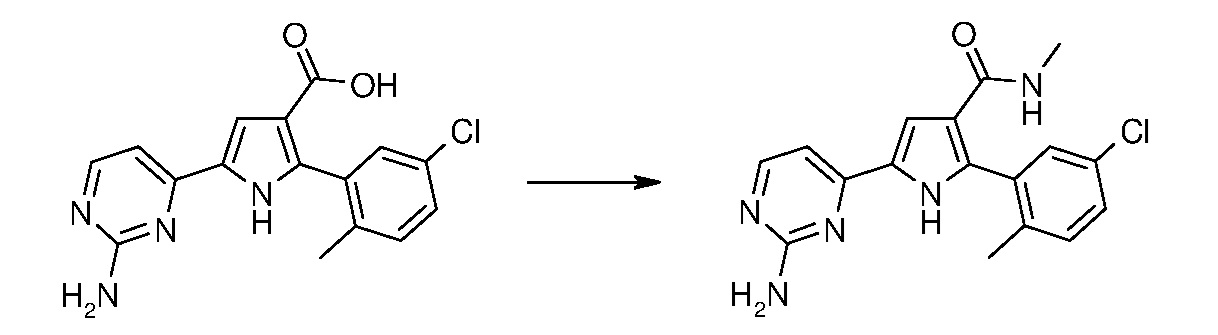
К раствору 5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-1Н-пиррол-3-карбоновой кислоты (142 мг, 0,43 ммоль) в смеси ДМФА/ТГФ (1/1, 4 мл) добавляют DIPEA (0,301 мл, 1,72 ммоль) и 2М раствор MeNH2 в ТГФ (0,432 мл, 0,86 ммоль) и раствор перемешивают при температуре 0°С. Добавляют EDCI (157 мг, 0,86 ммоль) и НОВТ (117 мг, 0,86 ммоль) и реакционную смесь перемешивают в течение 4 часов при комнатной температуре. Смесь разбавляют водой и экстрагируют с помощью DCM (4×10 мл). Органическую фазу промывают насыщенным солевым раствором, водой и затем сушат над сульфатом натрия и концентрируют. Сырой продукт хроматографируют на силикагеле (DCM/МеОН = 90/10), получая указанное в заголовке соединение (124 мг, выход 84%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 2,10 (c, 3H) 2,62 (д, J=4,52 Гц, 3H) 6,32 (уш.с, 1H) 6,93 (д, J=5,25 Гц, 1H) 7,27 (д, J=8,00 Гц, 1H) 7,29 (д, J=2,32 Гц, 1H) 7,31 (д, J=2,56 Гц, 1H) 7,35 (дд, J=8,30, 2,32 Гц, 1H) 7,80 (кв, J=4,76 Гц, 1H) 8,19 (д, J=5,37 Гц, 1H) 11,84 (уш.с, 1H).
HRMS (ESI): рассчитано для C17H16ClN5O + H+ - 342,1116, найдено - 342,1118.
Вышеуказанную методику использовали для синтеза следующих соединений:
5-(2-Аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-N-этил-1Н-пиррол-3-карбоксамид
[(I), R1 = CH3, R2 = Cl, R3 = NHCH2CH3, R4 = NH2, R12 = H] (соединение 20)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,02 (т, J=7,20 Гц, 3H) 2,11 (c, 3H) 3,12 (дкв, J=7,10, 5,92 Гц, 2H) 6,32 (уш.с, 2H) 6,94 (д, J=5,25 Гц, 1H) 7,28 (д, J=2,32 Гц, 1H) 7,28 (д, J=8,30 Гц, 1H) 7,33 (д, J=2,56 Гц, 1H) 7,35 (дд, J=8,30, 2,32 Гц, 1H) 7,80 (т, J=5,68 Гц, 1H) 8,19 (д, J=5,25 Гц, 1H) 11,83 (уш.с, 1H).
HRMS (ESI): рассчитано для C18H18ClN5O + H+ - 356,1273, найдено - 356,1277.
5-(2-Аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-N-(2-гидроксиэтил)-1Н-пиррол-3-карбоксамид
[(I), R1 = CH3, R2 = Cl, R3 = NHCH2CH2OH, R4 = NH2, R12 = H] (соединение 21)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 2,10 (c, 3H) 3,17 (кв, J=6,06 Гц, 2H) 3,38-3,44 (м, 2H) 4,61 (т, J=5,37 Гц, 1H) 6,34 (уш.с, 2H) 6,94 (д, J=5,25 Гц, 1H) 7,23-7,30 (м, 2H) 7,32-7,38 (м, 2H) 7,71 (т, J=5,80 Гц, 1H) 8,20 (д, J=5,37 Гц, 1H) 11,86 (уш.с, 1H).
HRMS (ESI): рассчитано для C18H18ClN5O2 + H+ - 372,1222, найдено - 372,1230.
5-(2-Аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-N-[2-(пиперидин-1-ил)этил]-1Н-пиррол-3-карбоксамид
[(I), R1 = CH3, R2 = Cl, R3 = NH-[2-(пиперидин-1-ил)]этил, R4 = NH2, R12 = H] (соединение 22)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,28-1,39 (м, 2H) 1,39-1,48 (м, 4H) 2,11 (c, 3H) 2,20-2,35 (м, 6H) 3,19 (дкв, J=6,80, 5,50 Гц, 2H) 6,33 (уш.с, 2H) 6,94 (д, J=5,25 Гц, 1H) 7,30 (д, J=7,95 Гц, 1H) 7,29 (д, J=2,20 Гц, 1H) 7,30 (д, J=2,00 Гц, 1H) 7,37 (дд, J=8,18, 2,20 Гц, 1H) 7,41 (т, J=5,37 Гц, 1H) 8,19 (д, J=5,25 Гц, 1H) 11,86 (уш.с, 1H).
HRMS (ESI): рассчитано для C23H27ClN6O + H+ - 439,2008, найдено - 439,2012.
5-(2-Аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-N-(1-метилпиперидин-4-ил)-1Н-пиррол-3-карбоксамид
[(I), R1 = CH3, R2 = Cl, R3 = NH-(1-метилпиперидин-4-ил), R4 = NH2, R12 = H] (соединение 23)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,45 (дкв, J=11,64, 3,91 Гц, 2H) 1,65 (дкв, J=12,66, 3,14 Гц, 2H) 1,88 (тд, J=11,41, 2,07 Гц, 2H) 2,10 (c, 3H) 2,12 (c, 3H) 2,63 (д, J=11,23 Гц, 2H) 3,49-3,62 (м, 1H) 6,32 (уш.с, 2H) 6,94 (д, J=5,25 Гц, 1H) 7,28 (д, J=8,67 Гц, 1H) 7,29 (д, J=2,00 Гц, 1H) 7,33-7,38 (м, 2H) 7,48 (д, J=8,18 Гц, 1H) 8,19 (д, J=5,25 Гц, 1H) 11,85 (уш.с, 1H).
HRMS (ESI): рассчитано для C22H25ClN6O + H+ - 425,1851, найдено - 425,1846.
5-(2-Аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-N-фенил-1Н-пиррол-3-карбоксамид
[(I), R1 = CH3, R2 = Cl, R3 = NHPh, R4 = NH2, R12 = H] (соединение 24)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 2,14 (c, 3H) 6,37 (уш.с, 2H) 6,99 (д, J=5,25 Гц, 1H) 7,00 (тт, J=7,40, 1,15 Гц, 1H) 7,26 (дд, J=8,36, 7,63 Гц, 2H) 7,30 (д, J=7,93 Гц, 1H) 7,34 (д, J=2,32 Гц, 1H) 7,37 (дд, J=7,93, 2,32 Гц, 1H) 7,57 (д, J=1,34 Гц, 1H) 7,65 (дд, J=8,61, 1,04 Гц, 2H) 8,23 (д, J=5,25 Гц, 1H) 9,74 (c, 1H) 12,05 (уш.с, 1H).
HRMS (ESI): рассчитано для C22H18ClN5O + H+ - 404,1273, найдено - 404,1274.
5-(2-Аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-N-(фуран-2-илметил)-1Н-пиррол-3-карбоксамид
[(I), R1 = CH3, R2 = Cl, R3 = NH-(фуран-2-илметил), R4 = NH2, R12 = H] (соединение 25)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 2,08 (c, 3H) 4,30 (д, J=5,86 Гц, 2H) 6,16 (дкв, J=3,22, 0,80 Гц, 1H) 6,32 (уш.с, 2H) 6,36 (дд, J=3,17, 1,83 Гц, 1H) 6,93 (д, J=5,25 Гц, 1H) 7,27 (д, J=7,93 Гц, 1H) 7,28 (д, J=2,20 Гц, 1H) 7,35 (дд, J=7,93, 2,20 Гц, 1H) 7,39 (д, J=2,56 Гц, 1H) 7,53 (дд, J=1,83, 0,85 Гц, 1H) 8,19 (д, J=5,37 Гц, 1H) 8,28 (т, J=5,86 Гц, 1H) 11,90 (уш.с, 1H).
HRMS (ESI): рассчитано для C21H18ClN5O2 + H+ - 408,1222, найдено - 408,1229.
5-(2-Аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-N-(3-гидроксипропил)-1Н-пиррол-3-карбоксамид
[(I), R1 = CH3, R2 = Cl, R3 = NHCH2CH2CH2OH, R4 = NH2, R12 = H] (соединение 26)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,57 (квинтет, J=6,65 Гц, 2H) 2,10 (c, 3H) 3,15 (кв, J=6,50 Гц, 2H) 4,40 (т, J=5,13 Гц, 1H) 6,33 (уш.с, 1H) 6,94 (д, J=5,13 Гц, 1H) 7,28 (д, J=8,18 Гц, 1H) 7,28 (д, J=2,32 Гц, 1H) 7,32 (c, 1H) 7,35 (дд, J=8,18, 2,20 Гц, 1H) 7,77 (т, J=5,55 Гц, 1H) 8,19 (д, J=5,25 Гц, 1H) 11,85 (уш.с, 1H).
HRMS (ESI): рассчитано для C19H20ClN5O2 + H+ - 386,1379, найдено - 386,1381.
5-(2-Аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-N-(2-метоксиэтил)-1Н-пиррол-3-карбоксамид
[(I), R1 = CH3, R2 = Cl, R3 = NHCH2CH2OCH3, R4 = NH2, R12 = H] (соединение 27)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 2,10 (c, 3H) 3,22 (c, 3H) 6,33 (уш.с, 2H) 6,94 (д, J=5,25 Гц, 1H) 7,28 (д, J=2,32 Гц, 1H) 7,29 (д, J=7,93 Гц, 1H) 7,34 (д, J=2,56 Гц, 1H) 7,36 (дд, J=8,18, 2,20 Гц, 1H) 7,69 (т, J=5,49 Гц, 1H) 8,19 (д, J=5,25 Гц, 1H) 11,87 (уш.с, 1H).
HRMS (ESI): рассчитано для C19H20ClN5O2 + H+ - 386,1379, найдено - 386,1385.
5-(2-Аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-N-(2-фторэтил)-1Н-пиррол-3-карбоксамид
[(I), R1 = CH3, R2 = Cl, R3 = NHCH2CH2F, R4 = NH2, R12 = H] (соединение 28)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 2,10 (c, 3H) 3,44 (кв, J=5,25 Гц, 2H) 4,43 (дт, J=47,48, 5,25 Гц, 2H) 6,33 (уш.с, 1H) 6,94 (д, J=5,25 Гц, 1H) 7,28 (д, J=8,30 Гц, 1H) 7,28 (д, J=2,32 Гц, 1H) 7,35 (дд, J=8,30, 2,32 Гц, 1H) 7,38 (д, J=1,95 Гц, 1H) 8,03 (т, J=5,55 Гц, 1H) 8,20 (д, J=5,25 Гц, 1H) 11,90 (уш.с, 1H).
HRMS (ESI): рассчитано для C18H17ClFN5O + H+ - 374,1179, найдено - 374,1185.
5-(2-Аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-N,N-диметил-1Н-пиррол-3-карбоксамид
[(I), R1 = CH3, R2 = Cl, R3 = N(СН3)2, R4 = NH2, R12 = H] (соединение 29)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 2,17 (c, 3H) 2,84 (c, 6H) 6,36 (c, 1H) 6,99 (д, J=5,25 Гц, 1H) 7,00 (c, 1H) 7,30 (д, J=8,06 Гц, 1H) 7,29 (д, J=2,20 Гц, 1H) 7,35 (дд, J=8,30, 2,32 Гц, 1H) 8,19 (д, J=5,25 Гц, 1H) 11,84 (уш.с, 1H).
HRMS (ESI): рассчитано для C18H18ClN5O + H+ - 356,1273, найдено - 356,1277.
N-(2-Аминоэтил)-5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-1Н-пиррол-3-карбоксамид
[(I), R1 = CH3, R2 = Cl, R3 = NHCH2CH2NH2, R4 = NH2, R12 = H] (соединение 30)
Получают из трет-бутил[3-({[5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-1Н-пиррол-3-ил]карбонил}амино)этил]карбамата, после обработки с помощью ТФУК в DCM.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 2,11 (c, 3H) 2,90 (секстет, 4H) 3,18 (кв, J=6,35 Гц, 2H) 7,09 (уш.с, 2H) 7,07 (д, J=5,86 Гц, 1H) 7,30 (д, J=8,30 Гц, 1H) 7,30 (д, J=2,32 Гц, 1H) 7,38 (дд, J=8,30, 2,32 Гц, 1H) 7,51 (д, J=2,20 Гц, 1H) 7,71 (уш.с, 3H) 8,15 (т, J=5,55 Гц, 1H) 8,25 (д, J=5,86 Гц, 1H) 12,23 (уш.с, 1H).
HRMS (ESI): рассчитано для C18H19ClN6O + H+ - 371,1382, найдено - 371,1381.
5-(2-Аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-N-[2-(метиламино)этил]-1Н-пиррол-3-карбоксамид
[(I), R1 = CH3, R2 = Cl, R3 = NHCH2CH2NHCH3, R4 = NH2, R12 = H] (соединение 31)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 2,11 (c, 3H) 2,26 (c, 3H) 2,54 (т, J=6,47 Гц, 2H) 3,18 (кв, J=6,35 Гц, 2H) 6,33 (уш.с, 2H) 6,94 (д, J=5,25 Гц, 1H) 7,29 (д, J=8,18 Гц, 1H) 7,29 (д, J=2,32 Гц, 1H) 7,33 (c, 1H) 7,36 (дд, J=8,18, 2,20 Гц, 1H) 7,66 (т, J=5,74 Гц, 1H) 8,19 (д, J=5,25 Гц, 1H) 11,86 (уш.с, 1H).
HRMS (ESI): рассчитано для C19H21ClN6O + H+ - 385,1538, найдено - 385,1541.
5-(2-Аминопиримидин-4-ил)-N-бензил-2-(5-хлор-2-метилфенил)-1Н-пиррол-3-карбоксамид
[(I), R1 = CH3, R2 = Cl, R3 = NHCH2Ph, R4 = NH2, R12 = H] (соединение 32)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 2,09 (c, 3H) 4,32 (д, J=6,10 Гц, 2H) 6,33 (уш.с, 2H) 6,94 (д, J=5,25 Гц, 1H) 7,17-7,32 (м, 7H) 7,32-7,37 (м, 1H) 7,40 (д, J=2,56 Гц, 1H) 8,20 (д, J=5,25 Гц, 1H) 8,38 (т, J=6,04 Гц, 1H) 11,89 (уш.с, 1H).
HRMS (ESI): рассчитано для C19H20ClN5O + H+ - 370,1429, найдено - 370,1431.
5-(2-Аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-N-(2-метилпропил)-1Н-пиррол-3-карбоксамид
[(I), R1 = CH3, R2 = Cl, R3 = NHCH2CH(СН3)2, R4 = NH2, R12 = H] (соединение 33)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 0,81 (д, J=6,71 Гц, 6H) 1,71 (септет, J=6,80 Гц, 1H) 2,11 (c, 3H) 2,92 (т, J=6,41 Гц, 2H) 6,33 (уш.с, 2H) 6,95 (д, J=5,25 Гц, 1H) 7,28 (д, J=8,30 Гц, 1H) 7,29 (д, J=2,20 Гц, 1H) 7,35 (д, J=2,50 Гц, 1H) 7,35 (дд, J=8,30, 2,30 Гц, 1H) 7,72 (т, J=5,92 Гц, 1H) 8,19 (д, J=5,25 Гц, 1H) 11,84 (уш.с, 1H).
HRMS (ESI): рассчитано для C18H18ClN5O + H+ - 356,1273, найдено - 356,1276.
5-(2-Аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-N-(2,2-диметилпропил)-1Н-пиррол-3-карбоксамид
[(I), R1 = CH3, R2 = Cl, R3 = NHCH2C(СН3)3, R4 = NH2, R12 = H] (соединение 34)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 0,78 (c, 9H) 2,11 (c, 3H) 2,94 (д, J=6,35 Гц, 2H) 6,33 (c, 2H) 6,96 (д, J=5,37 Гц, 1H) 7,30 (д, J=8,20 Гц, 1H) 7,32 (д, J=2,32 Гц, 1H) 7,33-7,40 (м, 3H) 8,19 (д, J=5,37 Гц, 1H) 11,86 (уш.с, 1H).
HRMS (ESI): рассчитано для C19H20ClN5O + H+ - 370,1429, найдено - 370,1433.
5-(2-Аминопиримидин-4-ил)-2-(5-хлор-2-этилфенил)-N-метил-1Н-пиррол-3-карбоксамид
[(I), R1 = CH2CH3, R2 = Cl, R3 = NHCH3, R4 = NH2, R12 = H] (соединение 35)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 0,95 (т, J=7,57 Гц, 3H) 2,44 (кв, J=7,61 Гц, 2H) 2,61 (д, J=4,64 Гц, 3H) 6,49 (уш.с, 2H) 6,94-6,96 (м, 1H) 7,24 (д, J=2,32 Гц, 1H) 7,30-7,33 (м, 1H) 7,34 (д, J=2,44 Гц, 1H) 7,39 (дд, J=8,30, 2,32 Гц, 1H) 7,75-7,83 (м, 1H) 8,19 (д, J=5,37 Гц, 1H) 11,94 (уш.с, 1H).
HRMS (ESI): рассчитано для C18H18ClN5O + H+ - 356,1273, найдено - 356,1281.
5-(2-Аминопиримидин-4-ил)-2-(5-хлор-2-этилфенил)-N-этил-1Н-пиррол-3-карбоксамид
[(I), R1 = CH2CH3, R2 = Cl, R3 = NHCH2CH3, R4 = NH2, R12 = H] (соединение 36)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 0,95 (т, J=7,57 Гц, 3H) 1,01 (т, J=7,20 Гц, 3H) 2,44 (кв, J=7,65 Гц, 2H) 3,03-3,16 (м, 2H) 6,32 (уш.с, 2H) 6,93 (д, J=5,25 Гц, 1H) 7,24 (д, J=2,32 Гц, 1H) 7,32 (д, J=12,08 Гц, 1H) 7,32 (c, 1H) 7,39 (дд, J=8,31, 2,30 Гц, 1H) 7,75 (т, J=5,68 Гц, 1H) 8,19 (д, J=5,25 Гц, 1H) 11,87 (уш.с, 1H).
HRMS (ESI): рассчитано для C19H20ClN5O + H+ - 370,1429, найдено - 370,1434.
5-(2-Аминопиримидин-4-ил)-2-(5-хлор-2-этилфенил)-N-(2-гидроксиэтил)-1Н-пиррол-3-карбоксамид
[(I), R1 = CH2CH3, R2 = Cl, R3 = NHCH2CH2OH, R4 = NH2, R12 = H] (соединение 37)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 0,96 (т, J=7,57 Гц, 3H) 2,44 (кв, J=7,61 Гц, 2H) 3,11-3,18 (м, 2H) 3,36-3,41 (м, 2H) 4,60 (уш.с, 1H) 6,35 (уш.с, 2H) 6,93 (д, J=5,37 Гц, 1H) 7,24 (д, J=2,32 Гц, 1H) 7,32 (д, J=12,08 Гц, 1H) 7,36 (д, J=2,56 Гц, 1H) 7,40 (дд, J=8,30, 2,30 Гц, 1H) 7,67 (т, J=5,55 Гц, 1H) 8,19 (д, J=5,25 Гц, 1H) 11,90 (уш.с, 1H).
HRMS (ESI): рассчитано для C19H20ClN5O2 + H+ - 386,1379, найдено - 386,1380.
5-(2-Аминопиримидин-4-ил)-2-(5-хлор-2-этилфенил)-N,N-диметил-1Н-пиррол-3-карбоксамид
[(I), R1 = CH2CH3, R2 = Cl, R3 = N(СН3)3, R4 = NH2, R12 = H] (соединение 38)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 0,99 (т, J=7,57 Гц, 3H) 2,86 (уш.с, 6H) 6,36 (c, 2H) 6,98 (д, J=5,25 Гц, 1H) 7,29 (д, J=2,32 Гц, 1H) 7,34 (д, J=8,30 Гц, 1H) 7,40 (дд, J=8,30, 2,32 Гц, 1H) 8,18 (д, J=5,37 Гц, 1H) 11,85 (уш.с, 1H).
HRMS (ESI): рассчитано для C21H24ClN5O + H+ - 398,1742, найдено - 398,1740.
5-(2-Аминопиримидин-4-ил)-2-[2-хлор-5-(трифторметил)фенил]-N-метил-1Н-пиррол-3-карбоксамид
[(I), R1 = Cl, R2 = CF3, R3 = NHCH3, R4 = NH2, R12 = H] (соединение 39)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 2,63 (д, J=4,64 Гц, 3H) 6,35 (уш.с, 2H) 6,90 (д, J=5,25 Гц, 1H) 7,33 (д, J=2,56 Гц, 1H) 7,72-7,80 (м, 3H) 7,90-7,94 (м, 1H) 8,22 (д, J=5,25 Гц, 1H) 12,07 (уш.с, 1H).
HRMS (ESI): рассчитано для C17H13ClF3N5O + H+ - 396,0834, найдено - 396,0828.
5-(2-Аминопиримидин-4-ил)-N-метил-2-[2-метил-5-(трифторметил)фенил]-1Н-пиррол-3-карбоксамид
[(I), R1 = СН3, R2 = CF3, R3 = NHCH3, R4 = NH2, R12 = H] (соединение 50)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 2,20 (c, 3H), 2,62 (д, J=4,64 Гц, 3H), 6,32 (уш.с, 2H), 6,92 (д, J=5,25 Гц, 1H), 7,34 (д, J=2,44 Гц, 1H), 7,53 (c, 1H), 7,47-7,51 (м, 1H), 7,53 (c, 1H), 7,64 (д, J=7,93 Гц, 1H), 7,86 (д, J=4,64 Гц, 1H), 8,20 (д, J=5,25 Гц, 1H), 11,92 (уш.с, 1H).
HRMS (ESI): рассчитано для C18H16F3N5O + H+ - 376,1380, найдено - 376,1380.
5-(2-Аминопиримидин-4-ил)-2-[2-этил-5-(трифторметил)фенил]-N-метил-1Н-пиррол-3-карбоксамид
[(I), R1 = СН2СН3, R2 = CF3, R3 = NHCH3, R4 = NH2, R12 = H] (соединение 51)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,00 (т, J=7,57 Гц, 3H), 2,52-2,57 (м, 2H), 2,61 (д, J=4,52 Гц, 3H), 6,32 (уш.с, 2H), 6,91 (д, J=5,25 Гц, 1H), 7,34 (д, J=2,32 Гц, 1H), 7,49 (c, 1H), 7,52 (д, J=8,2 Гц, 1H), 7,68 (д, J=8,18 Гц, 1H), 7,84 (кв, J=4,27 Гц, 1H), 8,19 (д, J=5,25 Гц, 1H), 11,94 (уш.с, 1H).
HRMS (ESI): рассчитано для C19H18F3N5O + H+ - 390,1536, найдено - 390,1535.
Пример 3
5-(2-Аминопиримидин-4-ил)-2-(5-хлор-2-гидроксифенил)-1Н-пиррол-3-карбоксамид
[(I), R1 = ОН, R2 = Cl, R3 = R4 = NH2, R12 = H] (соединение 40)
Превращение 1
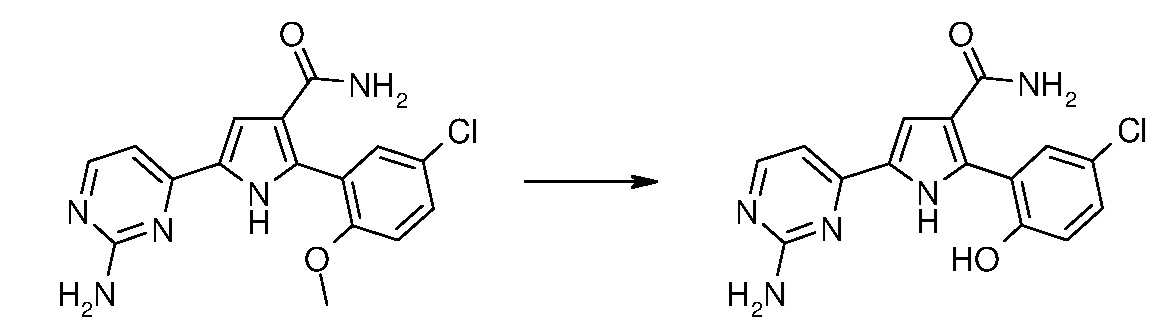
К хорошо перемешиваемому раствору 5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-метоксифенил)-1Н-пиррол-3-карбоксамида (50 мг, 0,15 ммоль) в DCM (1,5 мл) по каплям добавляют трибромид бора (1М раствор в DCM, 3 мл, 3 ммоль) при температуре 0°С. Смесь перемешивают при комнатной температуре в течение ночи. Смесь выливают в воду и органическую фазу отделяют. Водную фазу экстрагируют с помощью EtOAc. Органические фазы объединяют, сушат над сульфатом натрия и концентрируют. Сырой продукт очищают с помощью препаративной ВЭЖХ (способ 2), получая указанное в заголовке соединение (11 мг, выход 22%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,41 (c, 2H) 6,95 (д, J=8,67 Гц, 1H) 6,99 (д, J=5,25 Гц, 1H) 7,28 (дд, J=8,67, 2,69 Гц, 1H) 7,33 (уш.с, 2H) 7,42 (д, J=2,69 Гц, 1H) 7,77 (уш.с, 1H) 8,22 (д, J=5,25 Гц, 1H) 10,90 (уш.с, 1H) 11,71 (уш.с, 1H).
HRMS (ESI): рассчитано для C15H12ClN5O2 + H+ - 330,0753, найдено - 330,0758.
Вышеуказанную методику использовали для синтеза следующего соединения:
5-(2-Аминопиримидин-4-ил)-2-(2-хлор-5-гидроксифенил)-1Н-пиррол-3-карбоксамид
[(I), R1 = Cl, R2 = OH, R3 = R4 = NH2, R12 = H] (соединение 41)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,33 (c, 2H) 6,70 (уш.с, 1H) 6,77-6,85 (м, 2H) 6,93 (д, J=5,25 Гц, 1H) 7,08 (уш.с, 1H) 7,24-7,33 (м, 2H) 8,19 (д, J=5,25 Гц, 1H) 9,72 (c, 1H) 11,83 (уш.с, 1H).
HRMS (ESI): рассчитано для C15H12ClN5O2 + H+ - 330,0753, найдено - 330,0751.
Пример 4
5-(2-Аминопиримидин-4-ил)-2-(2-хлор-5-цианофенил)-1Н-пиррол-3-карбоксамид
[(I), R1 = Cl, R2 = CN, R3 = R4 = NH2, R12 = H] (соединение 7)
Схема В, стадия 4
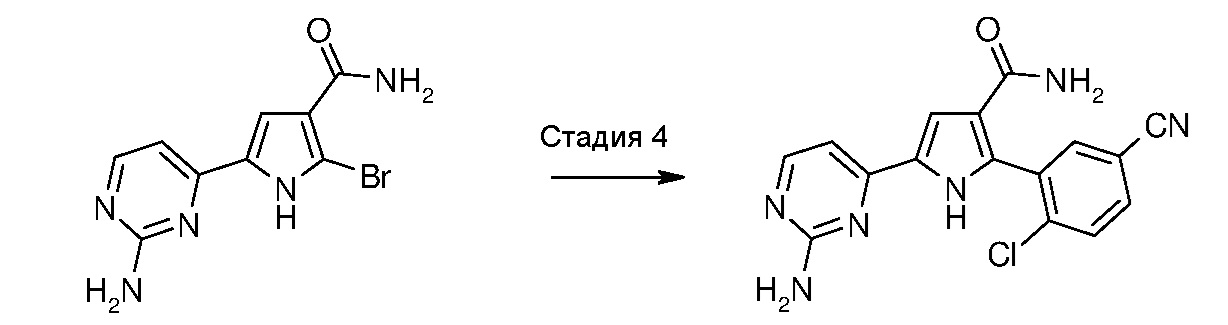
5-(2-Аминопиримидин-4-ил)-2-бром-1Н-пиррол-3-карбоксамид (полученный в соответствии с международной заявкой на патент WO 2007/110344, 0,1 г, 0,35 ммоль), 2-хлор-5-цианофенилбороновую кислоту (127 мг, 0,7 ммоль), Na2CO3 (111 мг, 1,05 ммоль) и PdCl2(dppf) (28 мг, 0,035 ммоль), в DME (2,5 мл) и воде (1 мл), нагревают при температуре 80°С в течение 12 часов в атмосфере аргона. После охлаждения до комнатной температуры осадок отфильтровывают и фильтрат выпаривают при пониженном давлении. Сырой продукт очищают с помощью препаративной ВЭЖХ (способ 1), получая указанное в заголовке соединение (15 мг, выход 13%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,42 (уш.с, 2H) 6,79 (уш.с, 1H) 6,90 (д, J=5,25 Гц, 1H) 7,38 (д, J=2,56 Гц, 1H) 7,44 (уш.с, 1H) 7,73 (д, J=8,42 Гц, 1H) 7,88 (дд, J=8,42, 2,07 Гц, 1H) 7,94 (д, J=2,07 Гц, 1H) 8,23 (д, J=5,37 Гц, 1H) 12,07 (уш.с, 1H).
HRMS (ESI): рассчитано для C16H11ClN6O + H+ - 339,0756, найдено - 339,0761.
Пример 5
2-(5-Хлор-2-метилфенил)-5-[2-(метиламино)пиримидин-4-ил]-1Н-пиррол-3-карбоксамид
[(I), R1 = CH3, R2 = Cl, R3 = NH2, R4 = NHCH3, R12 = H] (соединение 42)
Схема С, стадии 5, 6, 7, 8
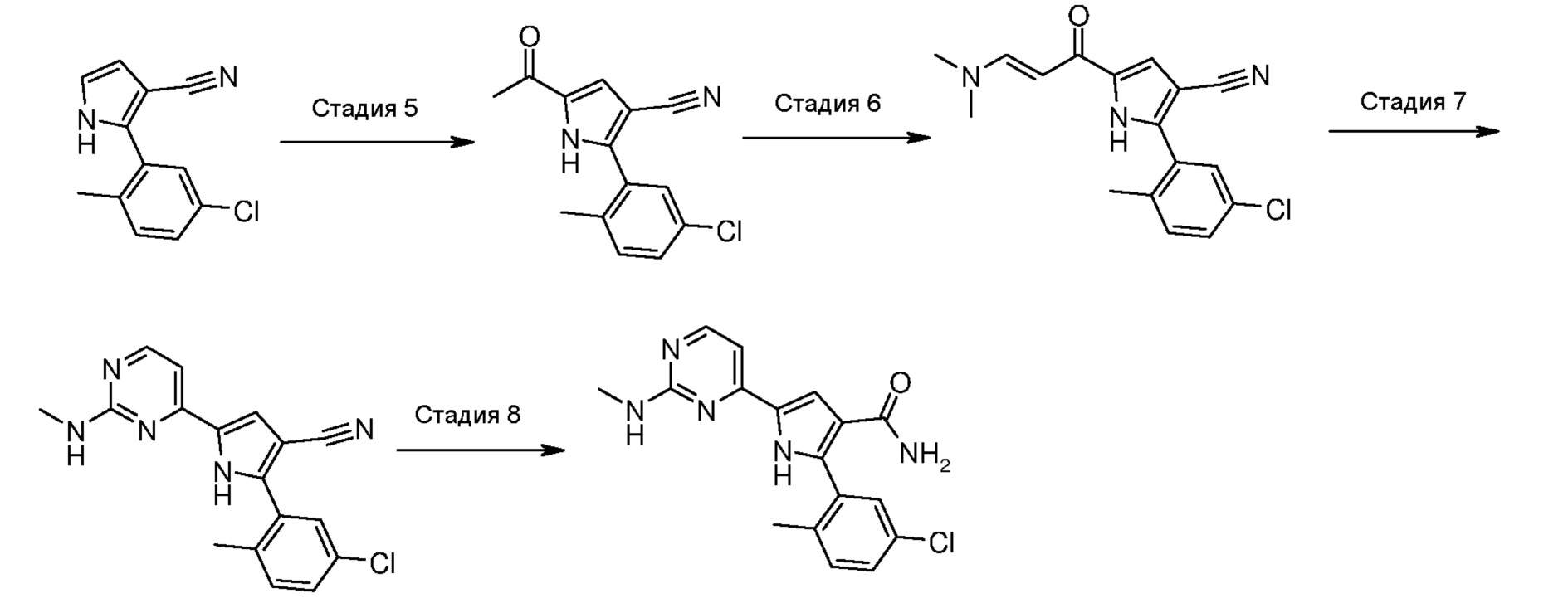
Стадия 5: 5-Ацетил-2-(5-хлор-2-метилфенил)-1Н-пиррол-3-карбонитрил
К смеси 2-(5-хлор-2-метилфенил)-1Н-пиррол-3-карбонитрила (900 мг, 4,14 ммоль) с DCM (20 мл) добавляют ацетилхлорид (0,468 мл, 6,57 ммоль), при комнатной температуре и в атмосфере азота. Полученную смесь охлаждают до температуры 0°С и добавляют безводный трихлорид алюминия (1,31 г, 9,9 ммоль) в виде маленьких порций в течение периода времени 10 минут, поддерживая внутреннюю температуру ниже 5°С. После завершения добавления смесь доводят до комнатной температуры и оставляют перемешиваться в течение 30 минут. Затем смесь медленно выливают в охлажденный льдом 1М водный раствор HCl (9 мл). Водный слой отделяют и дважды экстрагируют с помощью DCM (20 мл). Объединенные органические экстракты промывают насыщенным солевым раствором, сушат над Na2SO4 и концентрируют при пониженном давлении. Сырой продукт хроматографируют на силикагеле (10-20% = EtOAc/гексан), получая указанное в заголовке соединение (1,0 г, выход 86%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 2,24 (c, 3H) 2,43 (c, 3H) 7,38-7,42 (м, 1H) 7,43 (д, J=2,32 Гц, 1H) 7,46-7,50 (м, 1H) 7,60 (8, 1H) 12,89 (уш.с, 1H).
HRMS (ESI): рассчитано для C14H11ClN2O + H+ - 259,0633, найдено - 259,0638.
Стадия 6: 2-(5-Хлор-2-метилфенил)-5-(Е)-3-диметиламиноакрилоил)-1Н-пиррол-3-карбонитрил
К суспензии 5-ацетил-2-(5-хлор-2-метилфенил)-1Н-пиррол-3-карбонитрила (990 мг, 3,83 ммоль) в ДМФА (5 мл) добавляют N,N-диметилформамиддиизопропилацеталь (2,4 мл, 11,5 ммоль). Смесь оставляют перемешиваться в течение ночи при температуре 90°С. Смесь выпаривают в вакууме и используют на следующей стадии без дальнейшей очистки.
Стадия 7: 2-(5-Хлор-2-метилфенил)-5-(2-метиламинопиримидин-4-ил)-1Н-пиррол-3-карбонитрил
К суспензии 2-(5-хлор-2-метилфенил)-5-(Е)-3-диметиламиноакрилоил)-1Н-пиррол-3-карбонитрила (618 мг, 1,91 ммоль) в ДМФА (5 мл) добавляют метилгуанидингидрохлорид (230 мг, 2,1 ммоль) и К2СО3 (318 мг, 2,29 ммоль). Смесь нагревают при температуре 110°С в течение ночи при эффективном перемешивании. Полученную смесь концентрируют и хроматографируют на силикагеле (10-30% = EtOAc/гексан), получая указанное в заголовке соединение (300 мг, выход 48% за 2 стадии).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 2,28 (c, 3H) 2,88 (д, J=4,52 Гц, 3H) 6,83-6,95 (м, 1H) 6,95-7,03 (м, 1H) 7,36-7,41 (м, 1H) 7,41-7,46 (м, 1H) 7,46-7,53 (м, 3H) 8,27 (д, J=4,64 Гц, 1H) 12,53 (уш.с, 1H).
HRMS (ESI): рассчитано для C17H14ClN5 + H+ - 324,1011, найдено - 324,1013.
Стадия 8: 2-(5-Хлор-2-метилфенил)-5-(2-метиламинопиримидин-4-ил)-1Н-пиррол-3-карбоксамид
К раствору 2-(5-хлор-2-метилфенил)-5-(2-метиламинопиримидин-4-ил)-1Н-пиррол-3-карбонитрила (74 мг, 0,23 ммоль) в ТФУК (1,0 мл) последовательно добавляют воду (0,15 мл) и 98%-ную серную кислоту (0,30 мл) при эффективном перемешивании. Смесь оставляют перемешиваться в течение 8 часов при температуре 70°С и затем разбавляют путем добавления по каплям воды (3 мл). Реакционную смесь подщелачивают (рН=10-12) путем добавления 30%-ного водного раствора аммиака (1 мл) при перемешивании. Осажденное твердое вещество собирают путем фильтрации, промывают водой и, наконец, высушивают в вакуумном сушильном шкафу при температуре 50°С, получая указанное в заголовке соединение в виде твердого вещества не совсем белого цвета (66 мг, выход 88%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 2,12 (c, 3H) 2,88 (д, J=4,15 Гц, 3H) 6,67-6,83 (м, 1H) 6,88 (д, J=5,13 Гц, 1H) 7,19 (уш.с, 1H) 7,26-7,32 (м, 2H) 7,34-7,38 (м, 1H) 7,39 (c, 1H) 8,20 (д, J=5,37 Гц, 1H) 11,87 (уш.с, 1H).
HRMS (ESI): рассчитано для C17H16ClN5O + H+ - 342,1116, найдено - 342,1118.
Пример 6
5-(Пиримидин-4-ил)-2-(5-хлор-2-метилфенил)-1Н-пиррол-3-карбоксамид
[(I), R1 = CH3, R2 = Cl, R3 = NH2, R4 = H, R12 = H]
(соединение 43)
Схема D, стадии 9 и 10
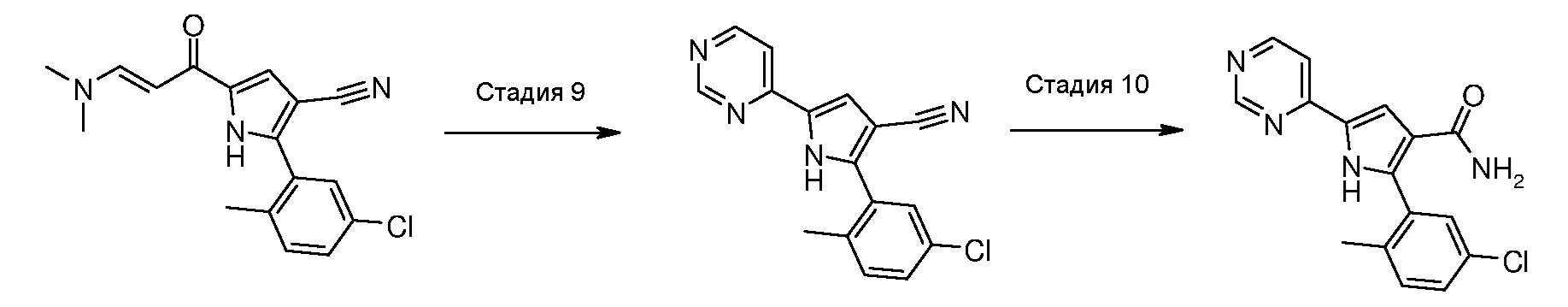
Стадия 9: 5-(Пиримидин-4-ил)-2-(5-хлор-2-метилфенил)-1Н-пиррол-3-карбонитрил
К суспензии 2-(5-хлор-2-метилфенил)-5-((Е)-3-диметиламиноакрилоил)-1Н-пиррол-3-карбонитрила (313 мг, 1,0 ммоль) в ДМФА (5 мл) добавляют формамидинацетат (208 мг, 2,0 ммоль). Смесь нагревают при температуре 150°С в течение 5 часов при эффективном перемешивании. Полученную смесь разбавляют путем добавления по каплям воды и экстрагируют с помощью EtOAc. Органическую фазу промывают насыщенным солевым раствором, водой и затем сушат над Na2SO4 и концентрируют. Сырой продукт хроматографируют на силикагеле (гексан/EtOAc = 90/10), получая указанное в заголовке соединение (90 мг, выход 30%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 2,30 (c, 3H) 7,40-7,45 (м, 1H) 7,46-7,53 (м, 2H) 7,61 (c, 1H) 7,90 (дд, J=5,43, 1,28 Гц, 1H) 8,79 (д, J=5,37 Гц, 1H) 9,13 (д, J=1,22 Гц, 1H) 12,98 (уш.с, 1H).
HRMS (ESI): рассчитано для C16H11ClN4 + H+ - 295,0745, найдено - 295,0750.
Стадия 10: 5-(Пиримидин-4-ил)-2-(5-хлор-2-метилфенил)-1Н-пиррол-3-карбоксамид
К раствору 5-(пиримидин-4-ил)-2-(5-хлор-2-метилфенил)-1Н-пиррол-3-карбонитрила (85 мг, 0,28 ммоль) в ТФУК (1,0 мл) последовательно добавляют воду (0,15 мл) и 98%-ную серную кислоту (0,30 мл) при эффективном перемешивании. Смесь оставляют перемешиваться в течение 5 часов при температуре 70°С и затем разбавляют путем добавления по каплям воды (1 мл). Реакционную смесь подщелачивают (рН=10-12) путем добавления 30%-ного водного раствора аммиака (3 мл) при перемешивании. Осажденное твердое вещество собирают путем фильтрации, промывают водой и, наконец, высушивают в вакуумном сушильном шкафу при температуре 50°С, получая указанное в заголовке соединение (72 мг, выход 83%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 2,13 (c, 3H) 6,81 (уш.с, 1H) 7,19-7,33 (м, 3H) 7,33-7,40 (м, 1H) 7,57 (д, J=2,69 Гц, 1H) 7,74 (дд, J=5,43, 1,40 Гц, 1H) 8,70 (д, J=5,49 Гц, 1H) 9,04 (д, J=1,10 Гц, 1H) 12,22 (уш.с, 1H).
HRMS (ESI): рассчитано для C16H13ClN4O + H+ - 313,0851, найдено - 313,0853.
Вышеуказанную методику использовали для синтеза следующего соединения:
2-(5-Хлор-2-метилфенил)-5-(2-метилпиримидин-4-ил)-1Н-пиррол-3-карбоксамид
[(I), R1 = CH3, R2 = Cl, R3 = NH2, R4 = CH3, R12 = H] (соединение 44)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 2,12 (c, 3H) 2,59 (c, 3H) 6,80 (уш.с, 1H) 7,24-7,31 (м, 2H) 7,33 (уш.с, 1H) 7,34-7,38 (м, 1H) 7,50-7,58 (м, 2H) 8,59 (д, J=5,34 Гц, 1H) 12,13 (уш.с, 1H).
HRMS (ESI): рассчитано для C17H15ClN4O + H+ - 327,1007, найдено - 327,1011.
Пример 7
5-(2-Аминопиримидин-4-ил)-2-[2-хлор-5-(трифторметил)фенил]-1Н-пиррол-3-карбоксамид
[(I), R1 = Cl, R2 = CF3, R3 = R4 = NH2, R12 = H]
(соединение 1)
Схема С, стадии 5, 6, 7, 8

Стадия 5: 5-Ацетил-2-[2-хлор-5-(трифторметил)фенил]-1Н-пиррол-3-карбонитрил
К смеси 2-[2-хлор-5-(трифторметил)фенил]-1Н-пиррол-3-карбонитрила (450 мг, 1,66 ммоль) с толуолом (3 мл) добавляют ацетилхлорид (0,176 мл, 2,49 ммоль), при комнатной температуре и в атмосфере азота, и цинк (217 мг, 3,32 ммоль). Смесь оставляют перемешиваться в течение 3 часов при температуре 80°С. Смесь охлаждают до комнатной температуры, разбавляют с помощью EtOAc и промывают водой. Водный слой отделяют и дважды экстрагируют с помощью EtOAc. Объединенные органические экстракты промывают насыщенным солевым раствором, сушат над Na2SO4 и концентрируют при пониженном давлении. Сырой продукт хроматографируют на силикагеле (0-10% = EtOAc/гексан), получая указанное в заголовке соединение (386 мг, выход 74%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 2,45 (с, 3H) 7,66 (с, 1H) 8,81-7,96 (м, 2H) 7,98 (c, 1H) 13,15 (уш.с, 1H).
Стадия 6: 2-[2-Хлор-5-(трифторметил)фенил]-5-(Е)-3-диметиламиноакрилоил)-1Н-пиррол-3-карбонитрил
К смеси 5-ацетил-2-[2-хлор-5-(трифторметил)фенил]-1Н-пиррол-3-карбонитрила (280 мг, 0,89 ммоль) с в толуолом (3 мл) добавляют N,N-диметилформамиддиизопропилацеталь (0,74 мл, 3,56 ммоль). Смесь оставляют перемешиваться в течение 2 часов при температуре 80°С. После охлаждения до комнатной температуры твердое вещество собирают путем отсасывания, промывают толуолом и высушивают на воздухе, получая указанное в заголовке соединение в виде твердого вещества белого цвета (170 мг, выход 52%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 2,91 (уш.с, 3H) 3,14 (уш.с, 3H) 5,74 (д, J=12,45 Гц, 1H) 7,40 (c, 1H) 7,69 (д, J=12,45 Гц, 1H) 7,81-7,99 (м, 3H) 12,74 (уш.с, 1H).
Стадия 7: 5-(2-Аминопиримидин-4-ил)-2-[2-хлор-5-(трифторметил)фенил]-1Н-пиррол-3-карбонитрил
К смеси 2-[2-хлор-5-(трифторметил)фенил]-5-(Е)-3-диметиламиноакрилоил)-1Н-пиррол-3-карбонитрила (167 мг, 0,46 ммоль) с ДМФА (2 мл) добавляют гуанидинкарбонат (388 мг, 2,15 ммоль). Смесь нагревают при температуре 110°С в течение 2 часов при эффективном перемешивании. Полученную смесь концентрируют и хроматографируют на силикагеле (20-50% = EtOAc/гексан), получая указанное в заголовке соединение (142 мг, выход 86%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,49 (уш.с, 2H) 7,02 (д, J=5,13 Гц, 1H) 7,39 (c, 1H) 7,85-8,03 (м, 3H) 8,28 (д, J=5,13 Гц, 1H) 12,81 (уш.с, 1H).
Стадия 8: 5-(2-Аминопиримидин-4-ил)-2-[2-хлор-5-(трифторметил)фенил]-1Н-пиррол-3-карбоксамид
Раствор ТФУК (2,0 мл), воду (0,480 мл) и 98%-ную серную кислоту (0,240 мл) добавляют к 5-(2-аминопиримидин-4-ил)-2-[2-хлор-5-(трифторметил)фенил]-1Н-пиррол-3-карбонитрилу (137 мг, 0,415 ммоль). Смесь оставляют перемешиваться в течение 8 часов при температуре 70°С и затем разбавляют путем добавления по каплям воды (6 мл). Реакционную смесь подщелачивают (рН=10-12) путем добавления 30%-ного водного раствора аммиака при перемешивании. Осажденное твердое вещество собирают путем фильтрации, промывают водой и, наконец, высушивают в вакуумном сушильном шкафу при температуре 50°С, получая указанное в заголовке соединение в виде твердого вещества белого цвета (133 мг, выход 92%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,36 (уш.с, 2H) 6,77 (уш.с, 1H) 6,90 (д, J=5,25 Гц, 1H) 7,37 (д, J=2,56 Гц, 1H) 7,42 (уш.с, 1H) 7,69-7,84 (м, 3H) 8,22 (д, J=5,25 Гц, 1H) 12,07 (уш.с, 1H).
HRMS (ESI): рассчитано для C16H11ClF3N5O + H+ - 382,0677, найдено - 382,0675.
Пример 8
5-(2-Аминопиримидин-4-ил)-2-(5-хлор-2-этилфенил)-1-метил-1Н-пиррол-3-карбоксамид
[(I), R1 = CH2CH3, R2 = Cl, R3 = R4 = NH2, R12 = CH3]
(соединение 45)
Превращение 2
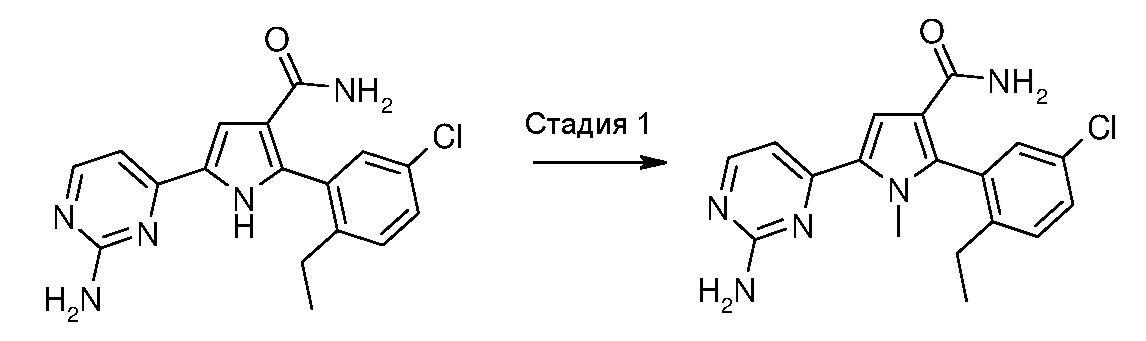
К раствору 5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-этилфенил)-1Н-пиррол-3-карбоксамида (101 мг, 0,295 ммоль) в ДМФА (1 мл) добавляют Cs2CO3 (101 мг, 0,31 ммоль) и MeI (28 мкл, 0,43 ммоль). Смесь перемешивают при комнатной температуре в течение 3 часов, затем растворитель удаляют. К остатку добавляют EtOAc и воду, слои разделяют, водный слой экстрагируют с помощью EtOAc и объединенные органические слои промывают водой, сушат над Na2SO4, отфильтровывают и концентрируют. Сырой продукт очищают с помощью флэш-хроматографии (DCM/MeOH/NH3 в МеОН = 95/5/0,5), получая указанное в заголовке соединение (36 мг, выход 34%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 0,96 (т, J=7,57 Гц, 3H) 2,18-2,45 (м, 2H) 3,61 (c, 3H) 6,58 (c, 2H) 6,71 (уш.с, 1H) 6,82 (д, J=5,37 Гц, 1H) 7,03 (уш.с, 1H) 7,21 (д, J=2,32 Гц, 1H) 7,35 (c, 1H) 7,36-7,40 (м, 1H) 7,41-7,48 (м, 1H) 8,21 (д, J=5,37 Гц, 1H).
Вышеуказанную методику использовали для синтеза следующих соединений:
5-(2-Аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-1-метил-1Н-пиррол-3-карбоксамид
[(I), R1 = СН3, R2 = Cl, R3 = R4 = NH2, R12 = CH3] (соединение 46)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 2,00 (c, 3H) 3,61 (c, 3H) 6,54 (c, 2H) 6,71 (уш.с, 1H) 6,81 (д, J=5,36 Гц, 1H) 7,04 (уш.с, 1H) 7,23 (д, J=2,19 Гц, 1H) 7,35 (д, J=8,30 Гц, 1H) 7,33 (c, 1H) 7,40 (дд, J=8,17, 2,19 Гц, 1H) 8,21 (д, J=5,36 Гц, 1H).
5-(2-Аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-1-этил-1Н-пиррол-3-карбоксамид
[(I), R1 = СН3, R2 = Cl, R3 = R4 = NH2, R12 = CH2CH3] (соединение 47)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 0,99 (т, J=7,20 Гц, 3H) 2,01 (c, 3H) 4,00 (дкв, J=13,66, 6,96 Гц, 1H) 4,43 (дкв, J=13,55, 6,92 Гц, 1H) 6,52 (c, 2H) 6,70 (уш.с, 1H) 6,81 (д, J=5,37 Гц, 1H) 7,03 (уш.с, 1H) 7,25 (д, J=2,32 Гц, 1H) 7,35 (д, J=8,18 Гц, 1H) 7,36 (c, 2H) 7,41 (дд, J=8,18, 2,20 Гц, 1H) 8,20 (д, J=5,25 Гц, 1H).
5-(2-Аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-1-(2,2,2-трифторэтил)-1Н-пиррол-3-карбоксамид
[(I), R1 = СН3, R2 = Cl, R3 = R4 = NH2, R12 = CH2CF3] (соединение 48)
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 2,02 (c, 3H) 5,46 (уш.с, 2H) 6,67 (c, 2H) 6,84 (д, J=5,24 Гц, 1H) 6,90 (уш.с, 1H) 7,24 (уш.с, 1H) 7,25 (д, J=2,07 Гц, 1H) 7,34-7,38 (м, 1H) 7,41-7,45 (м, 1H) 7,45 (c, 1H) 8,26 (д, J=5,24 Гц, 1H).
5-(2-Аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-1-(2-гидроксиэтил)-1Н-пиррол-3-карбоксамид
[(I), R1 = CH3, R2 = Cl, R3 = R4 = NH2, R12 = CH2CH2OH] (соединение 49)
Получают из 5-(2-аминопиримидин-4-ил)-2-(5-хлор-2-метилфенил)-1-[2-(тетрагидро-2Н-пиран-2-илокси)этил]-1Н-пиррол-3-карбоксамида после обработки концентрированным раствором HCl в этаноле.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 2,00 (c, 3H) 3,98 (дт, J=12,97, 7,00 Гц, 1H) 4,08 (кв, J=5,17 Гц, 2H) 4,46 (ддд, J=12,97, 7,11, 5,92 Гц, 1H) 4,67 (т, J=5,80 Гц, 1H) 6,54 (c, 2H) 6,70 (уш.с, 1H) 6,82 (д, J=5,37 Гц, 1H) 7,01 (уш.с, 1H) 7,26 (д, J=2,32 Гц, 1H) 7,33 (д, J=8,30 Гц, 1H) 7,38 (c, 1H) 7,39 (дд, J=8,30, 2,32 Гц, 1H) 8,20 (д, J=5,25 Гц, 1H).
ФАРМАКОЛОГИЯ
Биохимический анализ ингибиторов активности JAK-киназ
Общий принцип - Специфические JAK2-, JAK1- или JAK3-пептидные субстраты трансфосфорилировали с помощью JAK-киназ в присутствии АТФ, меченного с помощью 33Р-γ-АТФ. По окончании реакции фосфорилирования непрореагировавший АТФ, нерадиоактивный и радиоактивный, захватывали посредством избытка ионообменной смолы Dowex, которая со временем оседает под действием силы тяжести на дно реакционного планшета. Супернатант затем удаляли и переносили на планшет-ридер, который затем оценивали посредством β-подсчета.
Получение смолы Dowex - 500 г влажной смолы (SIGMA, обычно получаемая смола DOWEX 1×8 200-400 меш, 2,5 кг) взвешивали и разводили из расчета 2 к 1 в 150 мМ раствора формиата натрия, рН=3,00. Смолу оставляли отстаиваться в течение ночи и после этого супернатант отбрасывали. После трех промывок, как упомянуто выше, в течение пары дней смолу оставляли отстаиваться и добавляли два объема (что касается объема смолы) 150 мМ натрийформиатного буфера.
Буфер для киназы (KB) - Буфер для киназы состоял из 50 мМ HEPES, рН=7,5, содержащего 10 мМ MgCl2, 2,5 мМ DTT, 10 мкМ Na3VO4 и 0,2 мг/мл BSA.
Конкретные условия анализа JAK2
Фермент - Анализы осуществляли при использовании домена коммерчески доступной JAK2-киназы (Invitrogen, Eugene, OR), который показывает линейную кинетику без предварительного фосфорилирования.
Условия анализа - Анализ JAK2-киназы осуществляли при использовании конечной концентрации фермента 1 нМ в присутствии 60 мкМ АТФ, 3 нМ 33Р-γ-АТФ и 64 мкМ субстрата BiODBn*306 (аминокислотная последовательность: LPLDKDYYVVREPGQ – SEQ ID NO: 1). Пептидный субстрат получали от фирмы American Peptide Company (Sunnyvale, CA).
Конкретные условия анализа JAK1
Фермент - Анализы осуществляли при использовании домена JAK1-киназы (остатки 861-1152 от неукороченной последовательности длиной 1154 аминокислоты, номер доступа Р23458 базы данных UniProtKB/Swiss-Prot).
Домен JAK1-киназы предварительно активировали с помощью АТФ в течение 1 часа при температуре 28°С для получения линейной кинетики.
Условия анализа - Анализ JAK1-киназы осуществляли при использовании конечной концентрации предварительно активированного фермента 2,5 нМ в присутствии 100 мкМ АТФ, 2 нМ 33Р-γ-АТФ и 154 мкМ субстрата BioDBn*333 (аминокислотная последовательность: KKHTDDGYMPMSPGVA - SEQ ID NO: 2). Пептидный субстрат получали от фирмы American Peptide Company (Sunnyvale, CA).
Конкретные условия анализа JAK3
Фермент - Анализы осуществляли при использовании домена JAK3-киназы (остатки 781-1124 от неукороченной последовательности длиной 1124 аминокислоты, номер доступа Р52333 базы данных UniProtKB/Swiss-Prot), который показывает линейную кинетику без предварительного фосфорилирования.
Условия анализа - Анализ JAK3-киназы осуществляли при использовании конечной концентрации фермента 1 нМ в присутствии 22 мкМ АТФ, 1 нМ 33Р-γ-АТФ и 40 мкМ субстрата BiODBn*306 (аминокислотная последовательность: LPLDKDYYVVREPGQ - SEQ ID NO: 1). Пептидный субстрат получали от фирмы American Peptide Company (Sunnyvale, CA).
Разведение соединения - Для определения IC50, тестируемые соединения получали в виде 1 мМ раствора в 100% ДМСО, распределяли на 96-луночных планшетах: соединения затем вносили в первую колонку титрационного микропланшета (А1 - G1), 100 мкл на лунку. Автоматизированное устройство для последовательных разбавлений (Biomek FX, Beckman) использовали для получения 1:3 разведений в 100% ДМСО, от линии А1 до линии А10, и для всех соединений в колонке. Кроме того, получали 4-5 копий дочерних планшетов путем реформатизации 5 мкл из этого первого ряда планшетов с разведением в 100% ДМСО на 384-луночные планшеты с глубокими лунками: один из этих планшетов с последовательными разведениями тестируемых соединений должен быть «оттаян» в день экспериментов, восстановлен до концентрации 3Х с помощью воды и использован в анализах по определению IC50. В случае стандартного эксперимента, самая высокая концентрация (3Х) всех соединений составляет 30 мкМ, тогда как самая низкая концентрация составляет 1,5 нМ. Каждый 384-луночный планшет должен содержать по меньшей мере одну кривую стандартного ингибитора стауроспорина и справочные лунки (общая активность фермента против неферментативной активности) для Z’ и сигнала для оценки фона.
Схема анализа - 384-Луночные планшеты с V-дном (тест-планшеты) получали при использовании 5 мкл разведения (3Х) соединения и затем помещали на роботизированное устройство Plate Trak 12 (Perkin Elmer; робототехническое устройство имеет одну головку с 384 концами для пипетирования для начала анализа плюс одну головку с 96 концами для дозирования смолы) вместе с одним резервуаром для ферментной смеси (3Х) и одним резервуаром для АТФ-смеси (3Х). В начале осуществления робототехническое устройство аспирируют 5 мкл АТФ-смеси, делают воздушный зазор внутри концов (3 мкл) и аспирируют 5 мкл JAK2-смеси. Следующее дозирование на планшеты плюс 3 цикла смешения делает само робототехническое устройство, начинается реакция киназы. В этот момент корректные концентрации восстановлены для всех реагентов. Робототехническое устройство инкубирует планшеты в течение 60 минут при комнатной температуре, и затем реакция прекращается путем пипетирования 60 мкл суспензии смолы Dowex в реакционную смесь. Для того чтобы избежать засорения конца, использовали концы с широкими отверстиями для дозирования суспензии смолы. Три цикла смешения осуществляют немедленно после добавления смолы. Еще один цикл смешения осуществляют после прекращения работы всех планшетов - это время нормального использования концов: планшеты затем выдерживают в течение примерно одного часа для возможности протекания седиментации смолы. В этот момент 27 мкл супернатанта переносят в 384-луночные оптические планшеты-ридеры (Optiplates, Perkin-Elmer) с 50 мкл Microscint 40 (Perkin-Elmer); после орбитального встряхивания в течение 5 минут планшеты считывают при использовании счетчика радиактивности Top Count Perkin-Elmer.
Регрессионный анализ данных - Данные анализировали посредством встроенной версии программного обеспечения SW «Essay Explorer», которая обеспечивает сигмоидальный регрессионный анализ кривых десяти разведений для определения IC50 по программам вторичного квитирования анализы/совпадение при поиске.
Клеточная пролиферация
Клеточные линии: Клеточную линию JAK2-зависимого человеческого мегакариобластного лейкоза SET-2 (DSMZ, Брауншвейг, Германия) и клеточную линию JAK2-независимого человеческого хронического миелогенного лейкоза K562 (ECACC, Wiltshire, UK) культивировали в среде RPMI-1640 Glutamax (Gibco BRL, Gaithesburg, MD, USA), дополненной 10% фетальной телячьей сыворотки (FBS), при температуре 37°С и в присутствии 5% СО2.
Анализ клеточной пролиферации: Приблизительно 5×103 клеток помещали на 384-луночный титрационный микропланшет в лунки с 50 мкл культуральной среды с различными концентрациями ингибиторов. Клетки инкубировали при температуре 37°С и в присутствии 5% СО2 в течение 72 часов, затем планшеты обрабатывали при использовании анализа CellTiter-Glo (Promega, Madison, WI, USA), следуя инструкции изготовителей. Кратко, 25 мкл на лунку раствора реагента добавляли к каждую из лунок и после встряхивания в течение 5 минут титрационные микропланшеты считывали с помощью люминометра Envision (Perkin-Elmer, Waltham, MA, USA).
Регрессионный анализ данных: Данные анализировали посредством программного обеспечения Symix Assay Explorer (Symix Technologies Inc.), которое обеспечивает сигмоидальный алгоритм регрессионного анализа кривых разведений по 8 точкам для определения IC50.
Модель in vivo
Клеточную линию SET-2 острого мегакариобластного лейкоза (107 клеток) инокулировали подкожно самкам мышей (Charles River) в возрасте 5-6 недель с тяжелым комбинированным иммунодефицитом (SCID), предварительно подвергнутых гамма-облучению (200 рад гамма-облучения всего тела). Мышей с прощупываемой опухолью (100-200 мм3) обрабатывали наполнителем (0,5% Метоцель) или соединениями формулы (I) в течение 10 суток, два раза в сутки. Размеры опухоли регулярно измеряли, используя штангенциркуль с нониусом, и рассчитывали ингибирование роста опухоли (TGI).
Неожиданно, при биохимических анализах, соединения формулы (I), тестируемые как описано выше, показывают в высшей степени сильную JAK2-ингибирующую активность, типично ниже, чем 0,020 мкМ.
В качестве примера приведена следующая таблица А, где представлены экспериментальные данные (IC50) типичных соединений согласно данному изобретению формулы (I) по сравнению со справочным соединением.
Справочное соединение соответствует соединению F25 международной заявки на патент WO 2007/110344, цитированной выше, и является четвертым соединением, исключенным из соединений формулы (I) согласно настоящей заявке.
В случае клеточных анализов, соединения формулы (I) проявляют более высокую активность в отношении JAK2-зависимой клеточной линии SET-2 по сравнению с JAK2-независимой клеточной линией K562.
Кроме того, более высокая селективность в случае JAK2-зависимой клеточной линии соединений формулы (I) по сравнению со справочным соединением показана по соотношению между K-562 (IC50) и SET-2 (IC50), которое выше, чем 9, в случае соединений формулы (I) по сравнению с 4,65 в случае справочного соединения (см. последнюю колонку нижеприводимой таблицы А).
|
Следовательно, новые соединения согласно настоящему изобретению неожиданно обладают сильной и селективной JAK2-ингибирующей активностью, в значительно более высокой степени, чем активность структурно наиболее близких соединений известного уровня техники, и, таким образом, являются особенно полезными в терапии против рака, клеточных пролиферативных нарушений, вирусных инфекций, связанных с иммунной системой нарушений, нейродегенеративных нарушений и сердечно-сосудистых заболеваний.