Результат интеллектуальной деятельности: АНАЛИЗЫ И СПОСОБЫ ВЫБОРА РЕЖИМА ЛЕЧЕНИЯ ПАЦИЕНТА С ДЕПРЕССИЕЙ
Вид РИД
Изобретение
Перекрестная ссылка на связанные заявки
Данная заявка испрашивает приоритет согласно 35 U.S.C §119(е) по Предварительной Заявке на патент США No. 61/559,541, поданной 14 ноября 2011 года, содержание которой включено в данный документ ссылкой в полном объеме.
Область техники, к которой относится изобретение
Воплощения изобретения, в общем, относятся к анализам, способам и системам для выбора режима лечения субъекта с депрессией, например, с большим депрессивным расстройством. Изобретения также относятся к способам лечения субъекта с депрессией, например, с большим депрессивным расстройством.
Уровень техники
Согласно недавним оценкам более 19 миллионов американцев в возрасте старше 18 лет страдают от депрессивного расстройства каждый год. В общем, считается, что существует некоторая форма ассоциации между состояниями дефицита фолата и депрессией [1, 2 и 3], которая в свою очередь помогает объяснять предшествующие наблюдения на множестве психоневрологических описаний мегалобластной анемии [4]. В последнее время все больше и больше растет осознание важности фолата при других медицинских состояниях, в частности при дефекте нервной трубки [5] и сердечно-сосудистых заболеваниях [6], и потенциальной антидепрессантной эффективности агентов, продаваемых как диетические добавки или «нутрицевтики» [7 и 8], такие как S-аденозил-метионин (SAM), Hypericum perforatum (зверобой пронзеннолистный), и омега-3 жирные кислоты. Данная область постепенно двигалась по направлению к исследованию влияния дефицита фолата, замены и обогащения курса и тактики лечения депрессивных расстройств, в частности большого депрессивного расстройства [9], и предполагаемых ролей фолата в функции центральной нервной системы [10, 11 и 12]. Хотя в последнее десятилетие были сделаны значительные успехи при лечении депрессии, к лечению все еще частично или полностью устойчивы вплоть до 29-46% пациентов с депрессией, принимающих антидепрессант. Те, кто страдает от устойчивой к лечению депрессии, почти не имеют альтернатив. Поскольку не каждый режим лечения является эффективным для каждого из индивидуумов, существует большая потребность в идентификации маркеров, которые могут облегчить выбор соответствующего режима лечения для субъекта с депрессией.
Сущность изобретения
Значительная часть пациентов с депрессией, такой как большое депрессивное расстройство, демонстрирует только частичный ответ или отсутствие ответа на обычные антидепрессантные лекарственные средства, например, на селективные ингибиторы обратного захвата серотонина. Таким образом, существует острая потребность в разработке эффективных антидепрессантных терапий и/или в разделении пациентов с депрессией, так чтобы они могли получать соответствующие антидепрессантные терапии. Аспекты различных воплощений, описанных в данном документе, происходят из обнаружения однонуклеотидных полиморфизмов (SNP), периферических биомаркеров и/или клинических признаков, которые ассоциированы с эффективным ответом на применение фолат-содержащего соединения при лечении депрессии, например, большого депрессивного расстройства, в виде монотерапии или в виде дополнения к антидепрессантному лекарственному средству. В некоторых воплощениях авторы также показали, что эти маркеры или состояния, описанные в данном документе, также могут быть использованы для выбора более эффективного лечения субъектов с устойчивой к лечению депрессии (TRD), например устойчивой к, по меньшей мере, одному селективному ингибитору обратного захвата серотонина (SSRI).
В частности, один или комбинация биомаркеров, которые могут свидетельствовать о том, что пациент (например, с большим депрессивным расстройством и/или TRD) подходит для режима лечения, включающего фолат-содержащее соединение, включают, без ограничения перечисленным, по меньшей мере, один или несколько следующих SNP, идентифицируемых по номеру rs: rs1801133 присутствует в метилентетрагидрофолатредуктазе (MTHFR); rs2274976 присутствует в MTHFR; rs1805087 присутствует в метионинсинтетазе (MTR); rs1801394 присутствует в редуктазе метионинсинтетазы (MTRR); rs1006737 присутствует в альфа 1C-субъединице потенциалозависимого кальциевого канала L-типа (CACNA1C); rs1883729 присутствует в ДНК-(цитозин-5)-метилтрансферазе 3 бета (Dnmt3b); rs7163862 присутствует в белке-регуляторе обратной связи GTP-циклогидролазы 1 (GCHFR); rs12659 присутствует в белке-носителе восстановленного фолата 2 (RCF2); rs202676 присутствует в фолатгидролазе (простат-специфическом мембранном антигене) (FOLH1); rs2297291 присутствует в белке-носителе восстановленного фолата 1 (RCF1); rs1051266 присутствует в белке-носителе восстановленного фолата 1 (RCF1); rs8007267 присутствует в GTP-циклогидролазе 1 (GCH1); rs7639752 присутствует в холин-фосфат цитидилтрансферазе A (PCYT1A); rs6275 присутствует в допаминовом рецепторе D2 (DRD2); rs1079596 присутствует в DRD2; rs11240594 присутствует в DRD2; rs4633 присутствует в катехол-O-метилтрансферазе (СОМТ); rs4680 присутствует в СОМТ; rs250682 присутствует в активном транспортере допамина (DAT, или SLC6A3); rs2277820 присутствует в формиминотрансферазе циклодеаминазе (FTCD); rs2236225 присутствует в метилентетрагидрофолат дегидрогеназе (NADP+зависимой) 1 (MTHFD1); и любые их комбинации; и/или экспрессию, по меньшей мере, одного из числа S-аденозилметионина (SAM), S-аденозил гомоцистеина (SAH), 4-гидроксиноненаля (4-HNE), высокочувствительного с-реактивного белка (hsCRP), и любой их комбинации. Дополнительно или в качестве альтернативы, определение того, страдает ли человек ожирением или нет (например, путем измерения значения BMI) также может быть использовано в качестве биомаркера для выбора подходящего режима лечения (например, включающего или не включающего фолат-содержащее соединение) для пациента с депрессией или с риском депрессии. Любой индивидуальный биомаркер или комбинация таких биомаркеров, описанных в данном документе, могут быть использованы для идентификации пациентов, которые диагностированы как страдающие от депрессии или как имеющие риск развития депрессии, для получения режима лечения, включающего фолат-содержащее соединение. В некоторых воплощениях фолат-содержащее соединение может быть использовано в отсутствии антидепрессантного лекарственного средства для лечения депрессии (например, большого депрессивного расстройства) у субъектов выбранных как несущих, по меньшей мере, один или несколько биомаркеров, описанных в данном документе. В альтернативных воплощениях фолат-содержащее соединение может быть использовано индивидуально или в комбинации (например, в качестве вспомогательного вещества) с антидепрессантным лекарственным средством для лечения депрессии (например, больших депрессивных расстройств) у субъектов, выбранных как носителей, по меньшей мере, одного или нескольких биомаркеров, описанных в данном документе. В одном воплощении, антидепрессантное лекарственное средство включает селективный ингибитор обратного захвата серотонина (SSRI). Примеры SSRI включают в частности флуоксетин, питалопрам, пароксетин, эсциталопрам и любую их комбинацию.
Соответственно, предлагаемое в данном документе в основном относится к анализам, способам, системам и наборам реактивов для выбора режима лечения субъекта с депрессией или с риском развития депрессии, для лечения субъекта с депрессией или с риском развития депрессии, и/или для улучшения эффективности режима лечения, рекомендованного или вводимого субъекту с депрессией или с риском развития депрессии. Предлагаемое в данном документе также относится к фолат-содержащим композициям для применения при лечении депрессии у субъекта (например, у человека), выбранного так, чтобы он был носителем, по меньшей мере, одного (например, по меньшей мере, двух или более) или любой комбинации биомаркеров или состояний, описанных в данном документе.
В одном аспекте, предлагаемое в данном документе представляет собой анализ выбора режима лечения человека, страдающего от депрессии или имеющего риск развития депрессии. Анализ включает:
(а) осуществление на тестируемом образце человека, который диагностирован как страдающий от депрессии или имеющий риск развития депрессии, с помощью, по меньшей мере, одного анализа, для определения параметров, по меньшей мере, двух биомаркеров из следующих:
(i) генотип SNP-локуса в положении 677 в SEQ ID NO. 1 или в положении 27 в SEQ ID NO. 7 (идентифицированного с помощью rs1801133), где SEQ ID NO. 1 и SEQ ID NO. 7 каждая независимо представляют собой участок геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR);
(ii) генотип SNP-локуса в положении 1793 в SEQ ID NO. 1 или в положении 27 в SEQ ID NO. 8 (идентифицированного с помощью rs2274976), где SEQ ID NO. 1 и SEQ ID NO. 8 каждая независимо представляют собой участок геномной нуклеотидной последовательности MTHFR;
(iii) генотип SNP-локуса в положении 2756 в SEQ ID NO. 2 или положение 27 в SEQ ID NO. 9 (идентифицированного с помощью rs1805087), где SEQ ID NO. 2 и SEQ ID NO. 9 каждая независимо представляют собой участок геномной нуклеотидной последовательности метионинсинтазы (MTR);
(iv) генотип SNP-локуса в положении 66 в SEQ ID NO. 3 или в положении 27 в SEQ ID NO. 10 (идентифицированного с помощью rs1801394), где SEQ ID NO. 3 и SEQ ID NO. 10 каждая независимо представляют собой участок геномной нуклеотидной последовательности редуктазы метионинсинтазы (MTRR);
(v) генотип SNP-локуса в положении 27 в SEQ ID NO. 11 (идентифицированного с помощью rs1006737), где SEQ ID NO. 11 каждая независимо представляют собой участок геномной нуклеотидной последовательности альфа 1С-субъединицы потенциалозависимого кальциевого канала L-типа (CACNA1C);
(vi) генотип SNP-локуса в положении 27 в SEQ ID NO. 12 (идентифицированного с помощью rs18 83 729), где SEQ ID NO. 12 представляет собой геномную последовательность нуклеиновой кислоты ДНК (цитозин-5)-метилтрансферазы 3 бета (DNMT3B);
(vii) генотип SNP-локуса в положении 27 в SEQ ID NO. 13 (идентифицированного с помощью rs7163862), где SEQ ID NO. 13 представляет собой участок геномной нуклеотидной последовательности GTP циклогидролазы 1 регуляторного белка обратной связи (GCHFR);
(viii) генотип SNP-локуса в положении 27 в SEQ ID NO. 14 (идентифицированного с помощью rs12659), где SEQ ID NO. 14 представляет собой участок геномной нуклеотидной последовательности белка-носителя восстановленного фолата (RCF2);
(ix) генотип SNP-локуса в положении 27 в SEQ ID NO. 15 (идентифицированного с помощью rs202676), где SEQ ID NO. 15 представляет собой участок геномной нуклеотидной последовательности фолаттидролазы (простат-специфический мембранный антиген) 1 (FOLH1);
(х) генотип SNP-локуса в положении 27 в SEQ ID NO. 16 (идентифицированного с помощью rs2297291), где SEQ ID NO. 16 представляет собой участок геномной нуклеотидной последовательности белка-носителя восстановленного фолата (RCF1);
(xi) генотип SNP-локуса в положении 27 в SEQ ID NO. 17 (идентифицированного с помощью rs1051266), где SEQ ID NO. 17 представляет собой участок геномной нуклеотидной последовательности белка-носителя восстановленного фолата (RCF1);
(xii) генотип SNP-локуса в положении 27 в SEQ ID NO. 18 (идентифицированного с помощью rs8007267), где SEQ ID NO. 18 представляет собой участок геномной нуклеотидной последовательности GTP циклогидролазы 1 (GCH1);
(xiii) генотип SNP-локуса в положении 27 в SEQ ID NO. 19 (идентифицированного с помощью rs7639752), где SEQ ID NO. 19 представляет собой участок геномной нуклеотидной последовательности холин-фосфат цитидилтрансферазы A (PCYT1A);
(xiv) генотип SNP-локуса в положении 27 в SEQ ID NO. 20 (идентифицированного с помощью rs6275), где SEQ ID NO. 20 представляет собой участок геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
(xv) генотип SNP-локуса в положении 27 в SEQ ID NO. 21 (идентифицированного с помощью rs 1079596), где SEQ ID NO. 21 представляет собой участок геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
(xvi) генотип SNP-локуса в положении 27 в SEQ ID NO. 22 (идентифицированного с помощью rs11240594), где SEQ ID NO. 22 представляет собой участок геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
(xvii) генотип SNP-локуса в положении 27 в SEQ ID NO. 23 (идентифицированного с помощью rs4633), где SEQ ID NO. 23 представляет собой участок геномной нуклеотидной последовательности катехин-O-метилтрансферазы (СОМТ);
(xviii) генотип SNP-локуса в положении 27 в SEQ ID NO. 24 (идентифицированного с помощью rs4680), где SEQ ID NO. 24 представляет собой участок геномной нуклеотидной последовательности катехин-O-метилтрансферазы (СОМТ);
(xix) генотип SNP-локуса в положении 27 в SEQ ID NO. 25 (идентифицированного с помощью rs250682), где SEQ ID NO. 25 представляет собой участок геномной нуклеотидной последовательности 3 представителя 6 семейства переносчиков растворенных веществ (транспортер нейротрансмиттера допамина), (SLC6A3);
(хх) генотип SNP-локуса в положении 27 в SEQ ID NO. 26 (идентифицированного с помощью rs2277820), где SEQ ID NO. 26 представляет собой участок геномной нуклеотидной последовательности формиминотрансферазы циклодеаминазы (FTCD);
(xxi) генотип SNP-локуса в положении 27 в SEQ ID NO. 27 (идентифицированного с помощью rs2236225), где SEQ ID NO. 27 представляет собой участок геномной нуклеотидной последовательности метилентетрагидрофолат дегидрогеназы (NADP+зависимой) 1 (MTHFD1));
(xxii) уровень экспрессии SAM и SAH;
(xxiii) уровень экспрессии 4-HNE;
(xxiv) уровень экспрессии hsCRP; и любую их комбинацию; и
(b) детектирование необязательно с помощью искусственного устройства, на основе определенных параметров, по меньшей мере, двух биомаркеров, наличия, по меньшей мере, одного состояния, выбранного из следующих:
(A) SNP в положении 677 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 7 (идентифицированного с помощью rs1801133), включающего, по меньшей мере, один аллель с тимином «Т»;
(B) SNP в положении 1793 в SEQ ID NO. 1 или в положении 27 в SEQ ID NO. 8 (идентифицированного с помощью rs2274976), включающего, по меньшей мере, один аллель с аланином «А»;
(C) SNP в положении 2756 в SEQ ID NO. 2 или положение 27 в SEQ ID NO. 9 (идентифицированного с помощью rs 1805087), включающего, по меньшей мере, один аллель с гуанином «G»;
(D) SNP в положении 66 в SEQ ID NO. 3 или в положении 27 в SEQ ID NO. 10 (идентифицированного с помощью rs 18013 94), включающего, по меньшей мере, один аллель с гуанином «G»;
(Е) SNP в положении 27 в SEQ ID NO. 11 (идентифицированного с помощью rs1006737), включающего, по меньшей мере, один аллель с аланином «А»;
(F) SNP в положении 27 в SEQ ID NO. 12 (идентифицированного с помощью rs1883729), включающего, по меньшей мере, один аллель с аланином «А»;
(G) SNP в положении 27 в SEQ ID NO. 13 (идентифицированного с помощью rs7163862), включающего, по меньшей мере, один аллель с тимином «Т»;
(Н) SNP в положении 27 в SEQ ID NO. 14 (идентифицированного с помощью rs12659), включающего, по меньшей мере, один аллель с тимином «Т»;
(I) SNP в положении 27 в SEQ ID NO. 15 (идентифицированного с помощью rs202676), включающего, по меньшей мере, один аллель с гуанином «G»;
(G) SNP в положении 27 в SEQ ID NO. 16 (идентифицированного с помощью rs2297291), включающего, по меньшей мере, один аллель с аланином «А»;
(K) SNP в положении 27 в SEQ ID NO. 17 (идентифицированного с помощью rs1051266), включающего, по меньшей мере, один аллель с аланином «А»;
(L) SNP в положении 27 в SEQ ID NO. 18 (идентифицированного с помощью rs8007267), включающего, по меньшей мере, один аллель с тимином «Т»;
(М) SNP в положении 27 в SEQ ID NO. 19 (идентифицированного с помощью rs7639752), включающего, по меньшей мере, один аллель с аланином «А»;
(N) SNP в положении 27 в SEQ ID NO. 20 (идентифицированного с помощью rs6275), включающего, по меньшей мере, один аллель с тимином «Т»;
(О) SNP в положении 27 в SEQ ID NO. 21 (идентифицированного с помощью rs1 079596), включающего, по меньшей мере, один аллель с тимином «Т»;
(Р) SNP в положении 27 в SEQ ID NO. 22 (идентифицированного с помощью rs1 1240594), включающего, по меньшей мере, один аллель с аланином «А»;
(Q) SNP в положении 27 в SEQ ID NO. 23 (идентифицированного с помощью rs4633), включающего, по меньшей мере, один аллель с аланином «А»;
(R) SNP в положении 27 в SEQ ID NO. 24 (идентифицированного с помощью rs4680), включающего, по меньшей мере, один аллель с гуанином «G»;
(S) SNP в положении 27 в SEQ ID NO. 25 (идентифицированного с помощью rs250682), включающего, по меньшей мере, один аллель с цитозином «С»;
(Т) SNP в положении 27 в SEQ ID NO. 26 (идентифицированного с помощью rs2277820), включающего, по меньшей мере, один аллель с тимином «Т»;
(U) SNP в положении 1958 SEQ ID NO. 27 (идентифицированного с помощью rs2236225), включающего, по меньшей мере, один аллель с аланином «А»;
(V) соотношение уровня экспрессии SAM к SAH меньше, чем предварительно определенное соотношение;
(W) уровень экспрессии 4-HNE выше, чем предварительно определенное эталонное значение;
(X) экспрессия hsCRP выше чем около 2,3 мг на литр по измерению в образце плазмы; и
любая их комбинация.
На основе результатов анализа из стадии (b), если детектируется, по меньшей мере, одно из состояний, описанных выше, то анализ может дополнительно включать выбор человека и необязательно назначение человеку режима лечения, включающего эффективное количество фолат-содержащего соединения.
В некоторых воплощения данного аспекта и во всех других аспектах, описанных в данном документе, любой из SNP, описанных в данном документе, может включать один или два фолат-респонсивных аллеля. Исключительно в качестве примера, SNP в положении 677 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 7 (идентифицированного с помощью rs1801133), может включать один аллель с тимином «Т» или два аллеля с тимином «Т».
Любая комбинация, по меньшей мере, двух биомаркеров (i) - (xxiv), описанных в данном документе, может определяться в тестируемом образце для анализа, описанного в данном документе. Типичные комбинации, по меньшей мере, двух биомаркеров, описанных в данном документе, могут включать генотипы, по меньшей мере, двух SNP-локусов; или генотип, по меньшей мере, одного SNP-локуса и уровень экспрессии, по меньшей мере, одного указанного биомаркера (например, 4-HNE); или уровень экспрессии, по меньшей мере, двух указанных биомаркеров (например, SAM, SAH). В зависимости от выбранных комбинаций, по меньшей мере, двух биомаркеров, описанных в данном документе, причем тестируемый образец может быть подвергнут одному или нескольким анализам, например, включающим в частности, анализы генотипирования, анализы экспрессии (например, на уровне белка и/или транскрипта), или любую их комбинацию.
Соответственно, в некоторых воплощениях, анализ может включать осуществление на тестируемом образце человека, который диагностирован как страдающий от депрессии или имеющий риск развития депрессии, с помощью, по меньшей мере, одного анализа генотипирования, адаптированного для определения генотипов, по меньшей мере, двух локусов, где указанные, по меньшей мере, два локуса представляют собой: (i) положение 677 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 7 (идентифицированные с помощью rs1801133) и (ii) положение 2756 в SEQ ID NO. 2 или положение 27 в SEQ ID NO. 9 (идентифицированные с помощью rs1805087). В таком воплощении детектирование, по меньшей мере, одного SNP в каждом положении 677 в SEQ ID NO. 1 (или в положении 27 в SEQ ID NO. 7), включающем, по меньшей мере, один аллель с тимином «Т» или в положении 2756 в SEQ ED NO. 2 (или в положении 27 в SEQ ID NO. 9), включающем, по меньшей мере, один аллель с гуанином «G», или детектирование обоих вышеупомянутых SNP указывает на отбор человека и необязательное назначение ему режима лечения, включающего эффективное количество фолат-содержащего соединения.
В некоторых воплощениях, анализ генотипирования может включать стадию амплификации тестируемого образца с набором праймеров, фланкирующих любой из SNP, описанных в данном документе. В некоторых воплощениях, по меньшей мере, два (например, по меньшей мере, три, по меньшей мере, четыре, по меньшей мере, пять или более) набора праймеров, амплифицирующих, по меньшей мере, два (например, по меньшей мере, три, по меньшей мере, четыре, по меньшей мере, пять или более) SNP, могут использоваться в анализе мультиплексной амплификации.
В некоторых воплощениях, тестируемый образец может подвергаться воздействию для определения параметров, по меньшей мере, трех, по меньшей мере, четырех, по меньшей мере, пяти или более биомаркеров (i)-(xxiv), описанных в данном документе. Например, в некоторых воплощениях, анализ может включать: (а) воздействие на тестируемый образец с помощью одного или более чем одного анализа (например, анализы генотипирования и/или экспрессии) для определения наличия или отсутствия, по меньшей мере, одного из следующих состояний:
i. соотношение экспрессии s-аденозилметионина (SAM) к s-аденозилгомоцистеину (SAH) меньше, чем предварительно определенное эталонное соотношение;
ii. экспрессия 4-гидроксиноненаля (4-HNE) больше, чем предварительно определенное эталонное значение;
iii. однонуклеотидный полиморфизм (SNP) в положении 677 в SEQ ID NO: 1, включающий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO: 1 представляет собой участок геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR);
iv. (SNP) в положении 2756 в SEQ ID NO: 2, включающий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO: 2 представляет собой участок геномной нуклеотидной последовательности метионинсинтазы (MTR);
v. (SNP) в положении 66 в SEQ ID NO: 3, включающий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO: 3 представляет собой участок геномной нуклеотидной последовательности редуктазы метионинсинтазы (MTRR);
Если определяется, что присутствует, по меньшей мере, одно из этих состояний, то анализ может дополнительно включать отбор человека и необязательно назначение человеку режима лечения, включающего эффективное количество фолат-содержащего соединения.
В некоторых воплощениях данного аспекта и во всех других аспектах, описанных в данном документе, когда соотношение экспрессии SAM к SAH составляет менее, чем предварительно определенное эталонного соотношение, например, менее чем 3, или менее чем около 2,8 по измерениям в образце плазмы, то субъекту может быть рекомендовано и/или необязательно рекомендовано назначение режима лечения, включающего фолат-содержащее соединение. В одном воплощении соотношение экспрессии SAM к SAH, составляющее менее чем 2,71 по измерениям в образце плазмы, является показателем для того, чтобы рекомендовать и/или необязательно рекомендовать субъекту назначение режима лечения, включающего фолат-содержащее соединение. В некоторых воплощениях, если соотношение экспрессии SAM к SAH составляет, по меньшей мере, 2,71 или выше, чем 2,71 согласно измерениям в образце плазмы, то субъекту не рекомендуется назначать режим лечения, включающий фолат-содержащее соединение. В зависимости от источника тестируемого образца, например, образец крови по сравнению с буккальным образцом, предварительно определенное эталонное соотношение для образца крови может отличаться от значения, например, для буккального образца.
В некоторых воплощениях данного аспекта и во всех других аспектах, описанных в данном документе, когда экспрессия 4-HNE составляет более, чем предварительно определенное эталонное значение, например, больше чем 3 мг на литр, или больше чем около 3,2 мг на литр согласно измерениям в образце плазмы, то субъекту может быть рекомендовано и/или необязательно рекомендовано назначение режима лечения, включающего фолат-содержащее соединение. В одном воплощении, если экспрессия 4-HNE составляет, по меньшей мере, 3,28 мг на литр плазмы согласно измерениям в образце плазмы, то субъекту может быть рекомендовано и/или необязательно рекомендовано назначение режима лечения, включающего фолат-содержащее соединение. В некоторых воплощениях, если экспрессия 4-HNE составляет менее чем 3,28 мг на литр плазмы согласно измерениям в образце плазмы, то субъекту не рекомендуется назначать режим лечения, включающий фолат-содержащее соединение. В зависимости от источника тестируемого образца, например, образец крови по сравнению с буккальным образцом, предварительно определенное эталонное значение может отличаться от значения, например, для буккального образца.
В некоторых воплощениях данного аспекта и всех других аспектах, описанных в данном документе, анализ может дополнительно включать определение того страдает ли человек ожирением или нет. Если человек определен как страдающий ожирением, то затем следует выбор человека и необязательно назначение человеку режима лечения, включающего эффективное количество фолат-содержащего соединения. Способы определения ожирения у человека известны в данной области и могут включать в частности измерение индекса массы тела (BMI), измерение абдоминального жира (например, с помощью измерения обхвата талии или соотношения талии к бедрам), измерение жира тела, толщины кожных складок, подводное взвешивание (денситометрия), плетизмография с вытеснением воздухом, компьютерная томография (СТ) и магнитно-резонансная томография (MRI), и двухэнергетическая рентгеновская абсорбциометрия (DEXA), и любые их комбинации. Например, в одном воплощении анализ может дополнительно включать измерение индекса массы тела (BMI) человека для определения страдает ли человек ожирением или нет, и если значение BMI, измеряемое у субъекта, составляет, по меньшей мере, 30 кг/м2 или выше, то затем следует отбор субъекта и необязательно назначение человеку режима лечения, включающего эффективное количество фолат-содержащего соединения. В некоторых воплощениях, если человек имеет значение BMI менее чем 30 кг/м2, может быть не целесообразно рекомендовать или назначать человеку режима лечения, включающего фолат-содержащее соединение.
В некоторых воплощениях, анализ может включать определение наличия или отсутствия SNP в положении 1298 в SEQ ID NO. 1, включающем, по меньшей мере, аллель с цитозином «С», где присутствие SNP в положении 1298 в SEQ ID NO: 1, включающем, по меньшей мере, один аллель с цитозином «С», является показателем того, что субъекту рекомендовано назначить или необязательно рекомендовано назначить режим лечения, включающий фолат-содержащее соединение.
В некоторых воплощениях, анализ может дополнительно включать определение экспрессии высокочувствительного с-реактивного белка (hsCRP), где экспрессия hsCRP выше, чем около 2,3 мг на литр плазмы согласно измерениям в образце плазмы, является показателем того, что субъекту рекомендовано назначить или необязательно рекомендовано назначить режим лечения, включающий фолат-содержащее соединение. В некоторых воплощениях, если экспрессия hsCRP составляет менее чем 2,3 мг на литр плазмы согласно измерениям в образце плазмы, то субъекту не рекомендуется назначать режим лечения, включающий фолат-содержащее соединение. В зависимости от источника тестируемого образца, например, образец крови по сравнению с буккальным образцом, экспрессия hsCRP для образца плазмы может отличаться от значения, например,- для буккального образца.
В то время как присутствие, по меньшей мере, одного состояния (А)-(Х), описанного в данном документе в тестируемом образце человека с депрессией, как правило, достаточно для выявления человека, подлежащего режиму лечения, включающего эффективное количество фолат-содержащего соединения, в некоторых воплощениях, может быть целесообразно детектировать присутствие, по меньшей мере, двух состояний, трех состояний, четырех состояний или более, соответствующих выбранным биомаркерам, с целью отбора человека для введения или с целью назначения человеку режима лечения, включающего эффективное количество фолат-содержащего соединения. В некоторых воплощениях, если у человека не выявлено ни одно из данных состояний (А)-(X), описанных в данном документе, то человеку не рекомендуется режим лечения, включающий фолат-содержащее соединение.
Соответственно, в некоторых воплощениях данного аспекта или во всех других аспектах, описанных в данном документе, тестируемый образец может анализироваться для определения, по меньшей мере, одного или, по меньшей мере, двух, по меньшей мере, трех, по меньшей мере, четырех, по меньшей мере, пяти или шести из состояний (А)-(Х), предлагаемых в данном документе. Например, в некоторых воплощениях, тестируемый образец может анализироваться дл определения имеет ли субъект, по меньшей мере, SNP, локализованные в положениях 677 и 2756 локусов MTHFR и MTR, соответственно. В некоторых воплощениях, тестируемый образец может анализироваться для определения того, страдает ли человек ожирением (например, составляет ли значение BMI человека, по меньшей мере, 30 кг/м2), и определения, по меньшей мере, одного или обоих SNP, локализованных в положениях 2756 и 66 локусов MTR и MTRR, соответственно. В некоторых воплощениях, тестируемый образец может анализироваться для определения того, страдает ли человек ожирением (например, составляет ли, по меньше мере, значение BMI человека, по меньшей мере, 30 кг/м2), и определения, по меньшей мере, одного или обоих SNP, локализованных в положениях 677 и 2756 локусов MTHFR и MTR, соответственно. В некоторых воплощениях, тестируемый образец может анализироваться для определения того имеет ли субъект, по меньшей мере, значение BMI, по меньшей мере, 30 кг/м2, и определения SNP, локализованного в положении 2756 локуса MTR. В некоторых воплощениях, тестируемый образец может анализироваться для определения того имеет ли субъект, по меньшей мере, соотношение SAM/SAH менее, чем предварительно определенное эталонное соотношение, и определения SNP, локализованного в положении 2756 локуса MTR. В некоторых воплощениях, тестируемый образец может анализироваться для определения того имеет ли субъект, по меньшей мере, экспрессию 4-HNE выше чем предварительно определенное стандартное значение, и определения SNP, локализованных в положениях 2756 и 66 локусов MTR и MTRR, соответственно. Очевидно, что любые комбинации всех состояний (А)-(Х) могут анализироваться в анализе, описанном в данном документе.
В некоторых воплощениях, если определено, что, по меньшей мере, два, включая, по меньшей мере, три или более состояний (А)-(Х), предлагаемых в данном документе, присутствуют в тестируемом образце, то режим лечения, включающий фолат-содержащее соединение, рекомендован или выбран и необязательно назначается человеку.
В некоторых воплощениях, если человек удовлетворяет, по меньшей мере, двум, по меньшей мере, трем или более состояниям (А)-(Х), описанным в данном документе (и индикатор того, что у человека имеется ожирение, например значение BMI, составляет, по меньшей мере, 30 кг/м2 или выше), то субъекту можно вводить или предписать фолат-содержащее соединение.
Некоторые воплощения анализов, описанных в данном документе, могут быть включены как часть стратегии лечения, например, для выбора соответствующего режима лечения для человека, у которого диагностирована депрессия или риск развития депрессии. Соответственно, другой аспект, предлагаемый в данном документе, относится к способам лечения человека, у которого диагностирована депрессия или риск развития депрессии. В некоторых воплощениях, способ лечения человека с депрессией может включать осуществление одного или более воплощений анализа, предлагаемого в данном документе. В некоторых воплощениях, если субъект удовлетворяет, по меньшей мере, одному из состояний, описанных в анализе, предлагаемом в данном документе, способ лечения может дополнительно включать введение или предписание субъекту режима лечения, включающего эффективное количество фолат-содержащего соединения.
Соответственно, в одном воплощении, способ может включать определение в тестируемом образце человека параметров, по меньшей мере, из двух или более (включая, по меньшей мере, три, по меньшей мере, четыре, по меньшей мере, пять или более) биомаркеров (i)-(xxiv), описанных в данном документе; и назначение человеку режима лечения, включающего эффективное количество фолат-содержащего соединения, если присутствие, по меньшей мере, одного или более (включая, по меньшей мере, двух, по меньшей мере, трех, по меньшей мере, четырех, по меньшей мере, пяти или более), или любой комбинации состояний (А)-(Х), описанных в данном документе, детектируют в тестируемом образце.
В конкретном воплощении, способ может включать определение в тестируемом образце человека генотипов, по меньшей мере, двух локусов в положении 677 в SEQ ID NO. 1 (или в положении 27 в SEQ ID NO. 7) и в положении 2756 в SEQ ID NO. 2 (или в положении 27 в SEQ ID NO. 9); и назначение человеку режима лечения, включающего эффективное количество фолат-содержащего соединения, если детектируются либо, по меньшей мере, одно или оба из следующих состояний: (i) по меньшей мере, один аллель с тимином «Т» присутствует в положении 677 в SEQ ID NO. 1 (или в положении 27 в SEQ ID NO. 7); и (ii) по меньшей мере, один аллель с гуанином «G», присутствующим в положении 2756 в SEQ ID NO. 2 (или в положении 27 в SEQ ID NO. 9). В данных воплощениях способ может дополнительно включать определение наличия или отсутствия любого из состояний (А)-(Х), описанных в данном документе.
В некоторых воплощениях, способ лечения человека с депрессией может включать введение композиции, включающей эффективное количество фолат-содержащего соединения человеку, который диагностирован как страдающий от депрессии или с риском развития депрессии, и дополнительно определяется как носитель, по меньшей мере, одного или более (включая, по меньшей мере, два, по меньшей мере, три, по меньшей мере, четыре или более), или любую комбинацию состояний (А)-(Х), описанных в данном документе.
В некоторых воплощениях способ может включать введение композиции, включающей эффективное количество фолат-содержащего соединения человеку, который диагностирован как страдающий от депрессии или имеющий риск развития депрессии и дополнительно определен как носитель, по меньшей мере, одного из следующих SNP, или любую их комбинацию: (i) а SNP в положении 677 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 7 (идентифицированного с помощью rs1801133), включающий, по меньшей мере, один аллель с тимином «Т», и (ii) SNP в положении 2756 в SEQ ID NO. 2 или положение 27 в SEQ ID NO. 9, включающий, по меньшей мере, один аллель с гуанином «G»; В данных воплощениях способ может дополнительно включать определение наличия или отсутствия любого из состояний (А)-(Х), описанных в данном документе.
В некоторых воплощениях, субъект, которому вводят режим лечения, включающий фолат-содержащее соединение, может дополнительно определяться как имеющий ожирение (например, с помощью значения BMI, составляющего, по меньшей мере, около 30 кг/м2 или выше).
В некоторых воплощениях данного аспекта и всех других аспектов, описанных в данном документе, фолат-содержащее соединение может вводиться в количестве, эффективном для уменьшения, по меньшей мере, одного симптома (например, в частности, подавленное настроение, бессонница, возбуждение, беспокойство и/или потеря массы), ассоциированного с депрессией, например, с большим депрессивным расстройством. В некоторых воплощениях эффективное количество фолат-содержащего соединения может обеспечивать, по меньшей мере, введение от около 0,1 до около 1 мг/кг массы тела в день человеку. В некоторых воплощениях эффективное количество фолат-содержащего соединения может обеспечивать, по меньшей мере, введение от около 7,5 мг/день до около 50 мг/день человеку. В одном воплощении, эффективное количество фолат-содержащего соединения может обеспечивать, по меньшей мере, введение около 15 мг/день фолата человеку.
Эффективное количество фолат-содержащего соединения может вводиться выбранному человеку в виде однократной суточной дозы или в ином случае, в виде более чем одной суточной дозы, распределенной в течение дня посредством любого подходящего пути введения, например, с помощью перорального введения.
Эффективное количество фолата, вводимого выбранному человеку для лечения депрессии, как описано в данном документе, значительно выше, чем типичное количество, которое берут в виде диетической добавки (в интервале 50-600 μг/день). В некоторых воплощениях, эффективное количество фолата, вводимого выбранному человеку, составляет, по меньшей мере, около 2-кратного превышения, по меньшей мере, около 5-кратного превышения, по меньшей мере, около 10-кратного превышения, по меньшей мере, около 25-кратного превышения, по меньшей мере, около 50-кратного превышения, по меньшей мере, около 100-кратного превышения, по меньшей мере, около 250-кратного превышения, по меньшей мере, около 500-кратного превышения, по меньшей мере, около 1000-кратного превышения или более по отношению к типичному количеству, которое берут для диетической добавки. Соответственно, в некоторых воплощениях, фолат-содержащее соединение целесообразно включать в композицию с медленным высвобождением или с продолжительным высвобождением. Например, в одном воплощении, композиция, включающая фолат-содержащее соединение, может быть включена в состав для высвобождения эффективного количества фолат-содержащего соединения в течение периода 3-6 часов или 4-5 часов после введения.
Любое известное в данной области фолат-содержащее соединение может быть выбрано и/или необязательно может вводиться человеку, выбранному как носитель одного или более из следующих состояний (А)-(Х), описанных в данном документе. В некоторых воплощениях, фолат-содержащее соединение может включать соединение L-метилфолат. В одном воплощении, фолат-содержащее соединение может включать 6(S)-5-метилтетрагидрофолат или его производное.
В некоторых воплощениях данного аспекта и во всех других аспектах, описанных в данном документе, режим лечения может дополнительно включать выбор и необязательно введение антидепрессанта. В некоторых воплощениях, антидепрессант может включать селективный ингибитор обратного захвата серотонина, включающий в частности, флуоксетин, циталопрам, пароксетин, эсциталопрам, сертралин и любую их комбинацию.
В этих воплощениях, антидепрессант может вводиться в той же композиции, что и фолат-содержащее соединение. В альтернативных воплощениях, антидепрессант и фолат-содержащее соединение могут вводиться в отдельных композициях одновременно (например, параллельно) или последовательно (например, друг за другом), или в любом временном режиме введения, где адъювантный эффект фолат-содержащего соединения повышает эффективность антидепрессанта по сравнению с эффективностью без фолат-содержащего соединения. В некоторых воплощениях, антидепрессант и/или фолат-содержащее соединение могут вводиться в одной дозе или в раздельных дозах. Количество дозировок, вводимых в течение периода времени (например, в день) для антидепрессанта и фолат-содержащего соединения может быть одинаковым или различным. Антидепрессант и фолат-содержащее соединение могут вводиться посредством одного и того же или различных путей.
В некоторых воплощениях данного аспекта всех других аспектов, описанных в данном документе, адъювантный эффект фолат-содержащего соединения, вводимого в комбинации с антидепрессантом, может быть аддитивным.
В некоторых воплощениях данного аспекта всех других аспектов, описанных в данном документе, адъювантный эффект фолат-содержащего соединения, вводимого в комбинации с антидепрессантом, может быть синергическим.
Дополнительный аспект, предлагаемый в данном документе, представляет собой способ определения и/или улучшения эффективности антидепрессанта, вводимого человеку, например, путем определения того, восприимчив ли человек к фолату или к его производному в качестве адъюванта, например, с использованием анализа, описанного в данном документе. В некоторых воплощениях данного аспекта, способ может дополнительно включать введение или предписание субъекту соединения, содержащего эффективное количество фолата в качестве адъюванта к антидепрессанту, если субъект удовлетворяет одному из состояний (А)-(Х), предлагаемых в данном документе. Типичное эффективное количество фолата составляет от около 7,5 мг/день до около 50 мг/день, или в одном воплощении, эффективное количество составляет, по меньшей мере, около 15 мг/день. В одном воплощении, антидепрессант представляет собой селективный ингибитор обратного захвата серотонина, например, в частности, флуоксетин, питалопрам, пароксетин, эспиталопрам, сертралин и любую их комбинацию.
Еще один аспект, предлагаемый в данном документе, представляет собой способ улучшения эффективности или эффекта антидепрессанта, принимаемого субъектом, например, путем идентификации субъекта, имеющего, по меньшей мере, одно из состояний, определенных в анализе, описанном в данном документе. Соответственно, в некоторых воплощениях данного аспекта, способ может дополнительно включать введение или предписание субъекту соединения, содержащего эффективное количество фолата в качестве адъюванта к антидепрессанту, если субъект удовлетворяет одному из состояний, определенных в анализе, предлагаемом в данном документе. Типичное эффективное количество фолата составляет, по меньшей мере, около 15 мг/день. В одном воплощении, антидепрессант представляет собой селективный ингибитор обратного захвата серотонина, например в частности, флуоксетин, циталопрам, пароксетин, эсциталопрам, сертралин и любую их комбинацию.
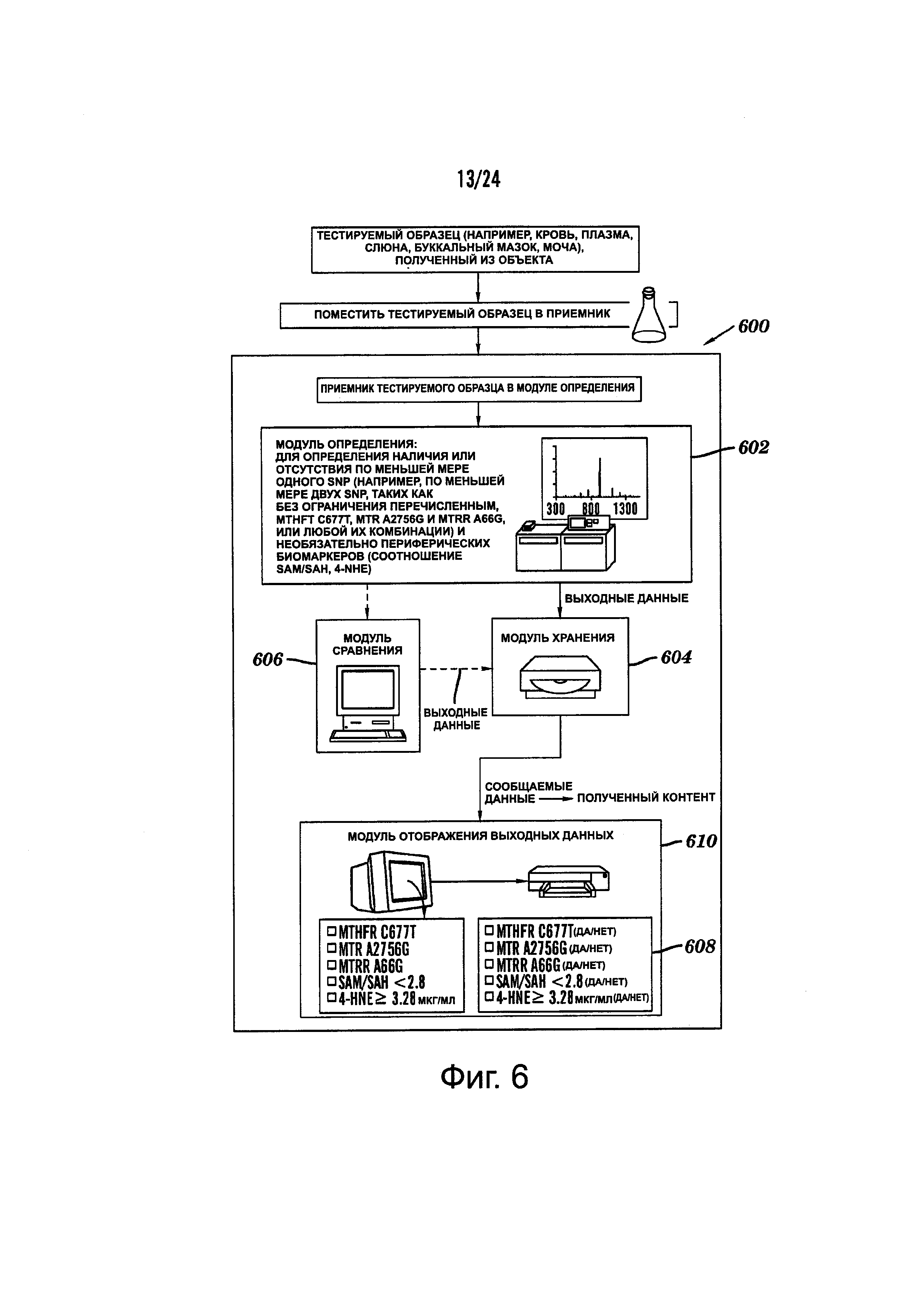
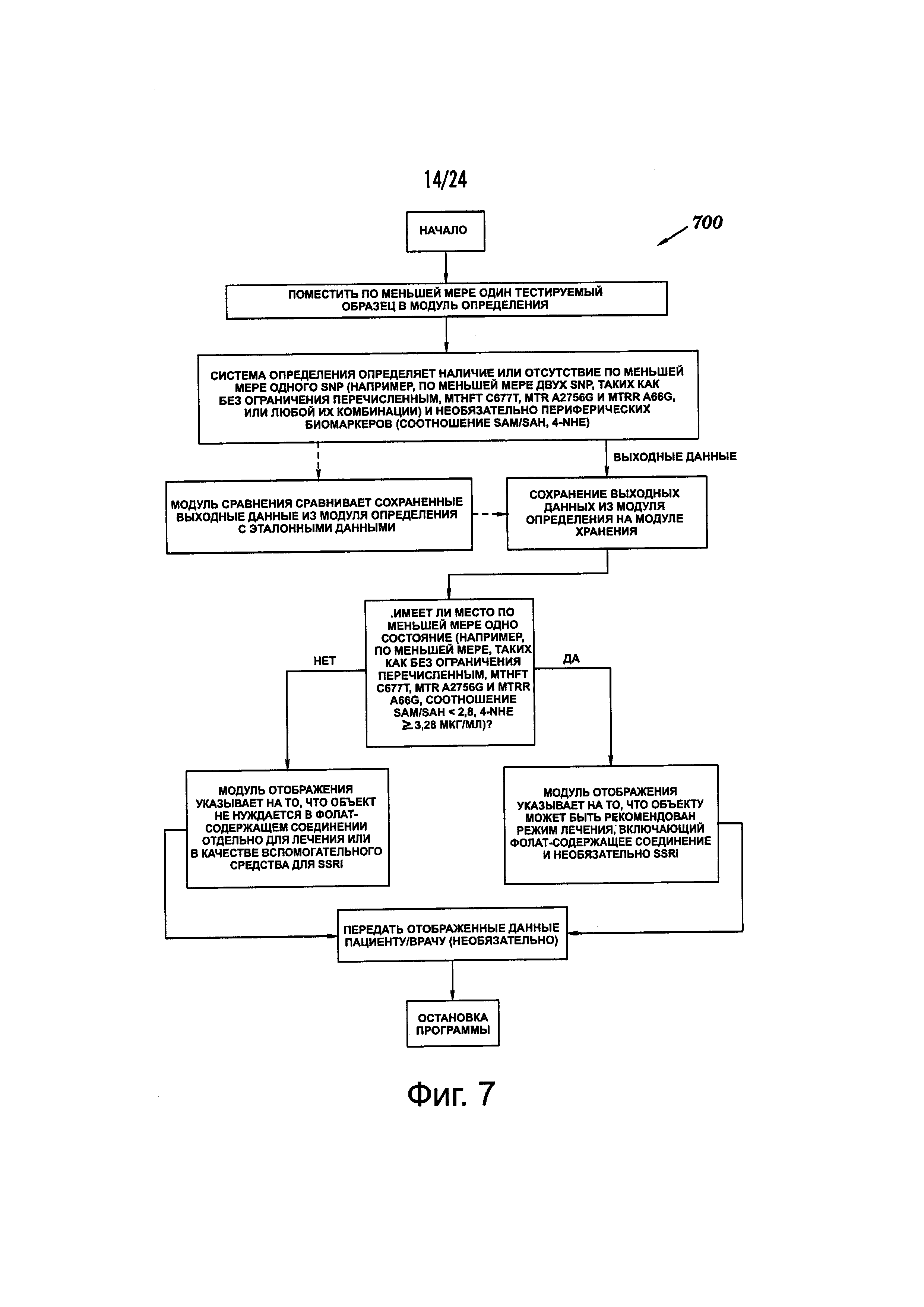
Также предлагаются компьютерные системы для применения в любых аспектах и/или способах, описанных в данном документе. Например, одно воплощение, предлагаемое в данном документе, представляет собой компьютерную систему для получения данных, по меньшей мере, из одного тестируемого образца, полученного, по меньшей мере, из одного субъекта. Система включает: (а) модуль определения, сконфигурированный для получения, по меньшей мере, одного тестируемого образца и осуществления, по меньшей мере, одного анализа, по меньшей мере, на одном тестируемом образце для определения параметров, по меньшей мере, двух биомаркеров (i)-(xxiv), описанных в данном документе; (b) устройство хранения, сконфигурированное для хранения выходных данных из модуля определения; (с) вычислительный модуль, например, искусственная машина, содержащая специфически запрограммированные инструкции для определения из выходных данных наличия, по меньшей мере, одного состояния (А)-(X), описанного в данном документе; и (d) модуль индикации для вывода содержания частично на основе выходных данных расчетного модуля, где содержание включает показательный сигнал наличия, по меньшей мере, одного состояния (А)-(X), описанного в данном документе, и необязательно, отсутствие любого из состояний (А)-(X), описанных в данном документе, или показательный сигнал отсутствия всех состояний (А)-(X), описанных в данном документе.
В некоторых воплощениях, модуль определения может конфигурироваться для осуществления, по меньшей мере, одного анализа генотипирования, по меньшей мере, на одном тестируемом образце для определения генотипов, по меньшей мере, двух локусов, включающих положение 677 в SEQ ID NO. 1 (или положение 27 в SEQ ID NO. 7) и положение 2756 в SEQ ID NO. 2 (или положение 27 в SEQ ID NO. 9). В этих воплощениях, компьютерный модуль может конфигурироваться для определения наличия, по меньшей мере, одного SNP, локализованного в положении 677 в SEQ ID NO. 1 (или в положении 27 в SEQ ID NO. 7), включающем, по меньшей мере, один аллель с тимином «Т» и/или в положении 2756 в SEQ ID NO. 2 (или в положении 27 в SEQ ID NO. 9), включающего, по меньшей мере, один аллель с гуанином «G».
В другом воплощении, модуль определения может конфигурироваться для осуществления, по меньшей мере, одного анализа, по меньшей мере, на одном тестируемом образце для определения наличия или отсутствия, по меньшей мере, одного из следующих состояний:
i. соотношение экспрессии s-аденозилметионина (SAM) к s-аденозилгомоцистеину (SAH) меньше, чем предварительно определенное эталонное соотношение;
ii. экспрессия 4-гидроксиноненаля (4-HNE) больше, чем предварительно определенное эталонное значение;
iii. однонуклеотидный полиморфизм (SNP) в положении 677 в SEQ ID NO. 1 (или в положении 27 в SEQ ID NO. 7), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 1 и SEQ ID NO. 7, каждая независимо представляет собой участок геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR);
iv. SNP в положении 2756 в SEQ ID NO. 2 (или в положении 27 в SEQ ID NO. 9), содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 2 и SEQ ID NO. 9 каждая независимо являются частью геномной нуклеотидной последовательности метионинсинтазы (MTR); и
v. SNP в положении 66 в SEQ ID NO. 3 (или в положении 27 в SEQ ID NO. 10), содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 3 и SEQ ID NO. 10, каждая независимо представляет собой участок геномной нуклеотидной последовательности редуктазы метионинсинтазы (MTRR);
В данных воплощениях модуль определения может дополнительно конфигурироваться для определения наличия или отсутствия, по меньшей мере, одного отличного состояния (А)-(Х), описанного в данном документе. Например, в некоторых воплощениях модуль определения может дополнительно конфигурироваться для определения экспрессии высокочувствительного с-реактивного белка (hsCRP). В некоторых воплощениях, модуль определения может дополнительно конфигурироваться для определение наличия или отсутствия SNP в положении 1298 в SEQ ID NO. 1, содержащего, по меньшей мере, один аллель с цитозином «С»;
В некоторых воплощениях, модуль определения может конфигурироваться для анализа, по меньшей мере, одного тестируемого образца для определения наличия или отсутствия, по меньшей мере, двух состояний, предлагаемых выше.
В некоторых воплощениях, модуль определения может дополнительно включать модуль сравнения, адаптированный для сравнения данных, выходных из модуля определения, с эталонными данными, которые хранятся на устройстве хранения.
В некоторых воплощениях, устройство хранения может дополнительно конфигурироваться для хранения физической информации, по меньшей мере, одного субъекта, например, включая индикаторы того имеется ли у тестируемого субъекта ожирение, например, BMI по меньшей мере, одного субъекта).
В некоторых воплощениях, содержание, выводимое на дисплейный модуль, может дополнительно включать значение BMI или показательный сигнал того, равно ли значение BMI, по меньшей мере, 30 кг/м2 или нет. В некоторых воплощениях, содержание, выводимое на дисплейный модуль, может дополнительно включать показательный сигнал того, что субъекту рекомендовано назначить режим лечения, включающий фолат-содержащее соединение, или показательный сигнал того, что субъекту рекомендовано назначить альтернативный режим лечения без фолат-содержащего соединения.
Также в данном документе предлагается материальный и энергонезависимый (например, энергонезависимые формы передачи сигналов) машиночитаемый носитель, имеющий машиночитаемые инструкции, записанные на нем, для определения программных модулей для обеспечения выполнения способа на компьютере. В одном воплощении, машиночитаемый носитель включает: (а) инструкции для сравнения данных, которые хранятся на устройстве хранения, с эталонными данными, с получением результата сравнения, где сравнение идентифицирует наличие или отсутствие, по меньшей мере, одного состояния (А)-(Х), описанного в данном документе; и (b) инструкции для вывода содержания частично на основе данных, выходных из модуля определения, где содержание включает показательный сигнал наличия, по меньшей мере, одного из состояний (А)-(Х), описанных в данном документе, и необязательно, отсутствия любого из этих состояний (А)-(Х), описанных в данном документе. В других воплощениях содержание может включать сигнал, выявляющий отсутствие всех состояний (А)-(Х), описанных в данном документе.
В некоторых воплощениях, инструкции могут конкретно программироваться для осуществления сравнения для идентификации наличия, по меньшей мере, одного SNP, локализованного в положении 677 в SEQ ID NO. 1 (или в положении 27 в SEQ ID NO. 7), включающем, по меньшей мере, один аллель с тимином «Т» и/или в положении 2756 в SEQ ID NO. 2 (или в положении 27 в SEQ ID NO. 9), включающего, по меньшей мере, один аллель с гуанином «G»;
В других воплощениях, инструкции могут конкретно программироваться для осуществления сравнения для идентификации одного из следующих состояний:
i. соотношение экспрессии s-аденозилметионина (SAM) к s-аденозилгомоцистеину (SAH) меньше, чем предварительно определенное эталонное соотношение;
ii. экспрессия 4-гидроксиноненаля (4-HNE) больше, чем предварительно определенное эталонное значение;
iii. однонуклеотидный полиморфизм (SNP) в положении 677 в SEQ ID NO: 1, включающий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO: 1 представляет собой участок геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR);
iv. (SNP) в положении 2756 в SEQ ID NO: 2, включающий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO: 2 представляет собой участок геномной нуклеотидной последовательности метионинсинтазы (MTR);
v. (SNP) в положении 66 в SEQ ID NO: 3, включающий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO: 3 представляет собой участок геномной нуклеотидной последовательности редуктазы метионинсинтазы (MTRR);
В данных воплощениях машиночитаемый носитель может дополнительно включать инструкции для идентификации наличия или отсутствия, по меньшей мере, одного другого состояния (А)-(Х), описанного в данном документе. Например, в одном воплощении, машиночитаемый носитель может дополнительно включать инструкции для идентификации наличия или отсутствия SNP в положении 1298 в SEQ ID NO: 1, включающий, по меньшей мере, один аллель с цитозином «С». В некоторых воплощениях, машиночитаемый носитель может дополнительно включать инструкции для сравнения экспрессии высокочувствительного с-реактивного белка (hsCRP) с эталонными данными.
В некоторых воплощениях, машиночитаемый носитель может дополнительно включать инструкции для определения или расчета того, имеется ли у субъекта ожирение (например, имеет ли субъект BMI, по меньшей мере, 30 кг/м2 или нет), на основе входных данных физических характеристик субъекта (например, вес и рост).
В некоторых воплощениях, машиночитаемый носитель может дополнительно включать инструкции для вывода измерений для определения того имеется ли у субъекта ожирение (например, значение BMI) или показательного сигнала того, имеется ли у субъекта ожирение (например, составляет ли значение BMI, по меньшей мере, 30 кг/м2 или нет).
В некоторых воплощениях, машиночитаемый носитель может дополнительно включать инструкции для вывода показательного сигнала того, что субъекту рекомендовано получать режим лечения, включающий фолат-содержащее соединение, или показательный сигнал того, что субъекту рекомендовано получать альтернативный режим лечения без фолат-содержащего соединения.
На основе идентификации SNP и/или периферических маркеров, ассоциированных с реакцией на применение фолат-содержащего соединения, также предлагается один аспект, описанный в данном документе, для дизайна и приготовления реактивов для детекции, необходимых для идентификации SNP и/или периферических маркеров, раскрытых в данном документе, в тестируемом образце субъекта. Например, реактивы для детекции могут быть разработаны и приготовлены для идентификации SNP в локусе MTHFR и в локусе MTR и необязательно в локусе MTRR, включенные в анализы и методы, описанные в данном документе, и/или для измерения уровня экспрессии SAM, SAH и 4-HNE в тестируемом образце. Примеры реактивов для детекции, которые могут использоваться для идентификации раскрытых SNP в тестируемом образце, могут включать праймер и зонд, где зонд может селективно гибридизоваться с SNP-содержащими молекулами нуклеиновых кислот, по сравнению с молекулой нуклеиновой кислоты, которая не содержит SNP в том же нуклеотидном положении. Примеры реактивов для детекции, которые могут использоваться для измерения уровня экспрессии белков в сыворотке или в плазме (например, SAM, SAH и/или 4-HNE) в тестируемом образце, могут включать антитела к таким белкам или праймер и зонд, где зонд специфично гибридизуется с молекулой нуклеиновой кислоты, соответствующей таким белкам.
В одном воплощении, набор реактивов может включать олигонуклеотидный чип, с множеством прикрепленных олигонуклеотидных зондов, которые исследуют, например, не более чем 30 SNP, где SNP включают, по меньшей мере, две или любые комбинации состояний (A)-(U), описанных в данном документе (например, в частности комбинация состояний (А) и (С)); и необязательный контейнер, содержащий детектируемую метку (например, включающую флуоресцентную молекулу), которая конъюгируется с нуклеотидной молекулой, выделенной из тестируемого образца человека; и, по меньшей мере, один реактив. Примеры реактива, который может быть включен в набор реактивов, могут включать в частности фермент рестрикции, универсальный адаптер, конъюгированный с нуклеотидной молекулой, праймер, комплементарный универсальному адаптеру, агент промывки и любые их комбинации.
В альтернативном воплощении набор реактивов включает множество олигонуклеотидных праймеров, которые связываются, по меньшей мере, с одним аллелем не более чем 30 SNP, где каждый набор олигонуклеотидных праймеров, которые связываются со специфичным аллелем SNP, метят с помощью отдельного репортера, и где указанные SNP включают, по меньшей мере, два или любую комбинацию SNP состояний (A)-(U), описанных в данном документе (например, в частности, комбинация состояний (А) и (С)); и, по меньшей мере, один реактив, например, в частности, свободные нуклеотидные основания, полимераза или и то и другое.
В некоторых воплощениях, набор реактивов может дополнительно включать, по меньшей мере, один реактив для определения экспрессии, по меньшей мере, одного биомаркера, описанного в данном документе (например, SAM, SAH, 4-HNE и hsCRP). Например, в одном воплощении набор реактивов может дополнительно включать твердую субстратную подложку с прикрепленным, по меньшей мере, одним связывающим компонентом на основе белка (например, антитело), которое специфично связывается с одним или более биомаркерами, описанными в данном документе. Типичная твердая субстратная подложка может включать в частности микропланшет для тИФА, щуп для измерения уровня, магнитные гранулы или любые их комбинации. В другом воплощении, набор реактивов может дополнительно включать, по меньшей мере, один праймер, сконструированный для гибридизации с одним или с несколькими биомаркерами, описанными в данном документе.
Анализы, способы, системы и/или наборы реактивов, описанные в данном документе, могут осуществляться и/или использоваться третьесторонним поставщиком услуг. Например, третьесторонний поставщик услуг может обеспечивать и изменять услугу, заказанную для определения наличия или отсутствия, по меньшей мере, одного состояния (А)-(Х) в тестируемом образце человека, например, для облегчения выбора режима лечения для человека с депрессией. Соответственно, также предлагаются способы выбора режима лечения для человека. Например, способ включает (а) получение тестируемого образца из человека, диагностированного как страдающего от депрессии или риск развития депрессии; (b) воздействие на тестируемый образец с помощью, по меньшей мере, одного анализа для определения параметров, по меньшей мере, двух биомаркеров (i)-(xxiv), описанных в данном документе (например, в частности, комбинации биомаркеров (i) и (iii)); (с) определение на основе параметров выбранных биомаркеров наличия, по меньшей мере, одного состояния (А)-(Х) (например, в частности, или одного или обоих состояний (А) и (С)); и (d) получение результата на выходе, демонстрирующего детектируется ли, по меньшей мере, одно из состояний (А)-(X) в тестируемом образце. Если присутствует, по меньшей мере, одно состояние, то способ может дополнительно включать выбор и необязательно назначение человеку режима лечения, включающего эффективное количество фолат-содержащего соединения.
В некоторых воплощениях, стадия (b) способа может дополнительно включать необязательно упаковку и доставку тестируемого образца в лабораторию, например, третья сторона CLIA-сертифицированного поставщика.
В некоторых воплощениях, стадия (d) способа осуществляется с помощью искусственного устройства.
Тестируемый образец для применения в анализах, способах, системах или в наборах реактивов, описанных в данном документе, может быть выделен из биологического образца субъекта, например, из образца крови или плазмы или образца сыворотки субъекта. В некоторых воплощениях, тестируемый образец может включать образец мочи. В некоторых воплощениях, тестируемый образец может включать буккальный образец. В некоторых воплощениях, тестируемый образец может включать образец слюны.
Если тестируемый образец представляет собой образец нуклеиновой кислоты, то тестируемый образец может быть подвергнут, по меньшей мере, одному анализу, выбранному из группы, состоящей из гибридизации аллель-специфичного зонда, удлинения аллель-специфичного праймера, аллель-специфичной амплификации, секвенирования, 5'-нуклезного гидролиза, анализа молекулярного маяка, анализ ДНК-чипов, анализ олигонуклеотидного лигирования, анализ размера, полиморфизм одноцепочечной конформации, полимеразная цепная реакция (ПЦР), качественный ПЦР в реальном времени, и любая их комбинация.
Если тестируемый образец представляет собой белковый образец, то тестируемый образец может быть подвергнут, по меньшей мере, одному анализу, выбранному из группы, состоящей из вестерн-блоттинга, твердофазного иммуноферментного анализа, масс-спектрометрии, иммуноанализа, проточной цитометрии, иммуногистохимического анализа и любой их комбинации.
Еще один следующий аспект, предлагаемый в данном документе, относится к применениям фолат-содержащей композиции в лечении депрессии у человека, который является носителем, по меньшей мере, одного из состояний (А)-(Х), описанных в данном документе (например, в частности, или одно или оба состояния (А) и (С)). Другой аспект, предлагаемый в данном документе, относится к применениям фолат-содержащей композиции в комбинации с антидепрессантом для применения при лечении депрессии у человека, который является носителем, по меньшей мере, одного из состояний (А)-(Х), описанных в данном документе (например, в частности, или одно или оба состояния (А) и (С)). В некоторых воплощениях данных аспектов, описанных в данном документе, фолат-содержащая композиция, которая может включать, по меньшей мере, около, 5 мг фолата (например, от около 7,5 мг до около 50 мг фолата). В некоторых воплощениях, фолат-содержащая композиция может быть включена в состав с профилем определенного высвобождения (например, продолжительное высвобождение). В некоторых воплощениях человек является взрослым человеком.
Воплощения различных аспектов, описанных в данном документе, могут применяться для применения у человека, диагностированного как страдающего от депрессии или с риском развития депрессию. В одном воплощения, различные аспекты, описанные в данном документе, могут использоваться для применения у человека, диагностированного как страдающего от большого депрессивного расстройства или с риском развития большого депрессивного расстройства. В некоторых воплощениях, человек может дополнительно определяться как устойчивый к антидепрессантной монотерапии. В некоторых воплощениях человек является взрослым человеком.
В некоторых воплощениях, различные аспекты, описанные в данном документе, могут применяться для применения у человека, который одновременно принимает антидепрессанты. В этих воплощениях, человек, который, как определено, удовлетворяет, по меньшей мере, одному (включая, например, по меньшей мере, три или более) из состояний (А)-(Х), может быть выбран для режима лечения, включающего фолат-содержащее соединение, и/или ему может вводиться это лечение. В некоторых воплощениях, режим лечения не включает антидепрессант. В некоторых воплощениях, режим лечения может включать тот же антидепрессант, который человек принимает в данный момент или другой антидепрессант.
Краткое описание чертежей
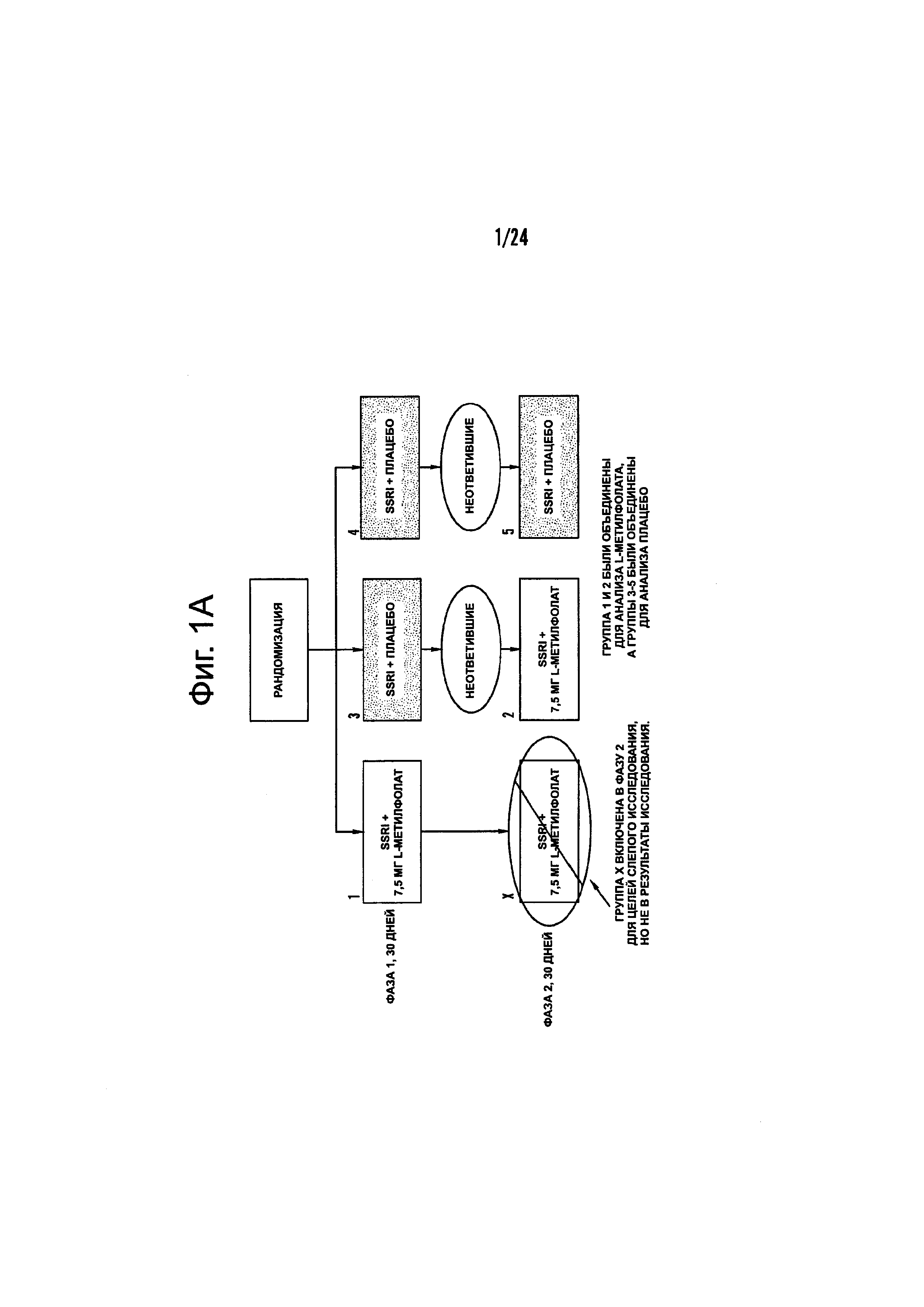
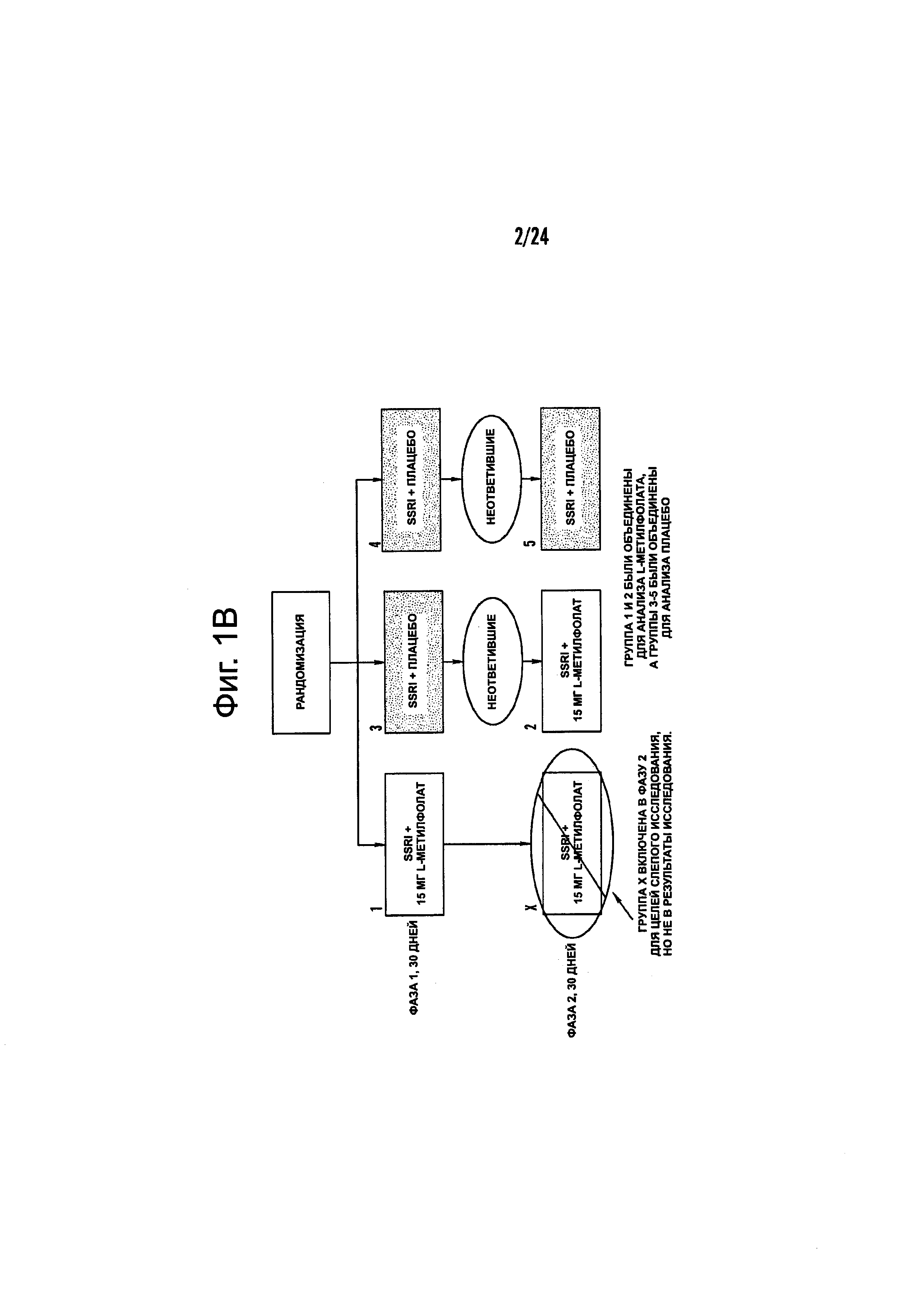
На Фиг. 1А-1В показаны схематические диаграммы типичных планов анализа эффективности фолат-содержащего соединения, например, в качестве вспомогательного вещества к селективному ингибитору обратного захвата серотонина (SSRI) для лечения субъекта с депрессией или для идентификации биомаркеров или состояний, которые являются показателями того, что субъекту с депрессией рекомендован режим лечения, включающий фолат-содержащее соединение и SSRI. На Фиг. 1А представлен типичный план исследования, в котором 7,5 мг/день L-метилфолата (например, 6(S)-5-метилтетрагидрофолат, сокращенно 6(S)-5-MTHF, как описано в данном документе) вводят в виде вспомогательного вещества к SSRI. На Фиг. 1В представлен типичный план исследования, в котором 15 мг/день L-метилфолата (например, 6(S)-5-MTHF) вводят в виде вспомогательного вещества к SSRI.
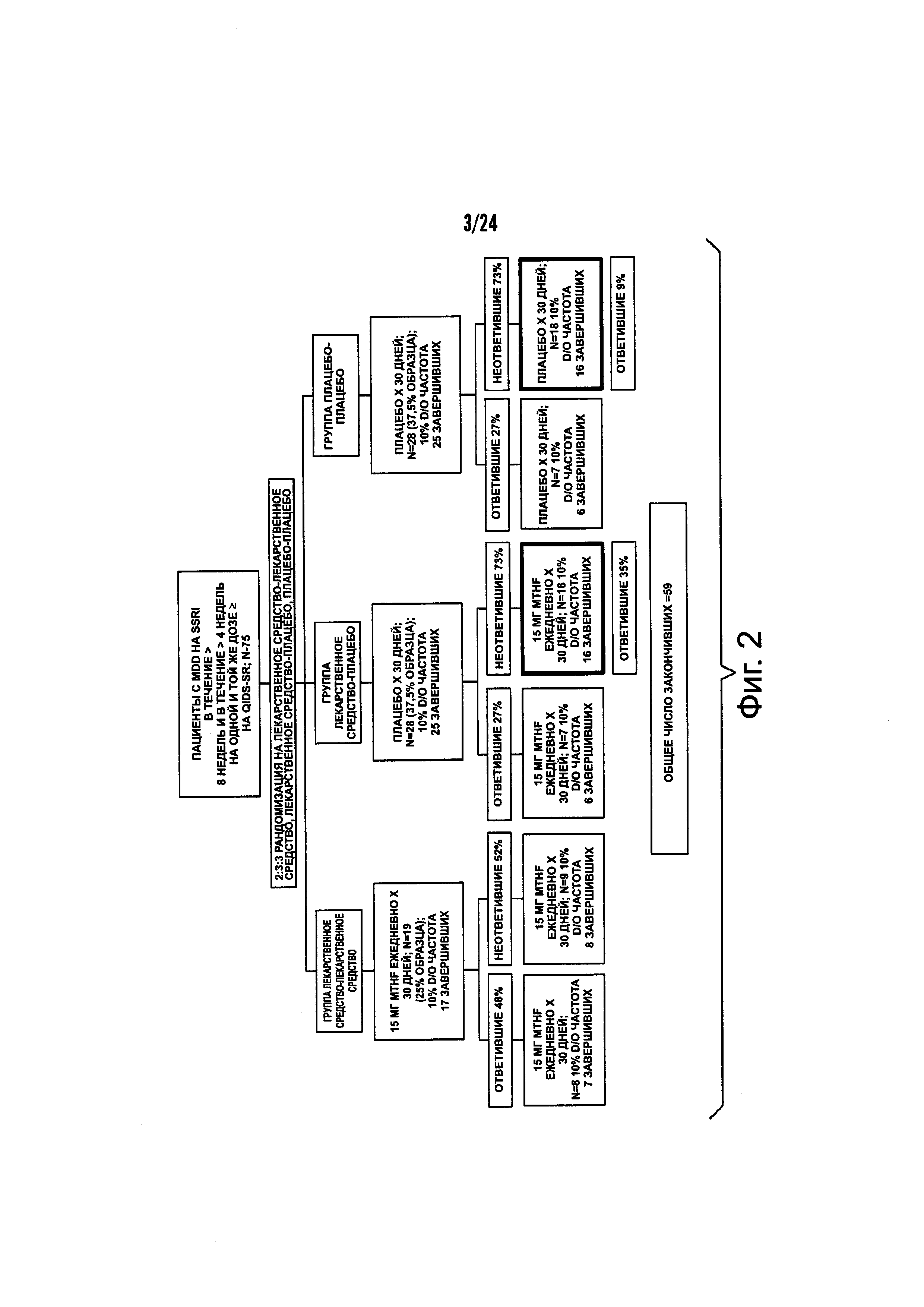
На Фиг. 2 представлена схематическая диаграмма типичного двойного слепого плацебо-контролируемого исследования 6(S)-5-MTHF среди SSRI-устойчивых амбулаторных пациентов с большим депрессивным расстройством (MDD) с использованием последовательного параллельного сравнения. В качестве примера, предполагается 10% частота выбывших из исследования. Процент частоты ответивших и не ответивших, представленный на данной фигуре, предназначен исключительно для указания относительной эффективности, и не предназначен для ограничения с помощью абсолютных значений указанных процентов.
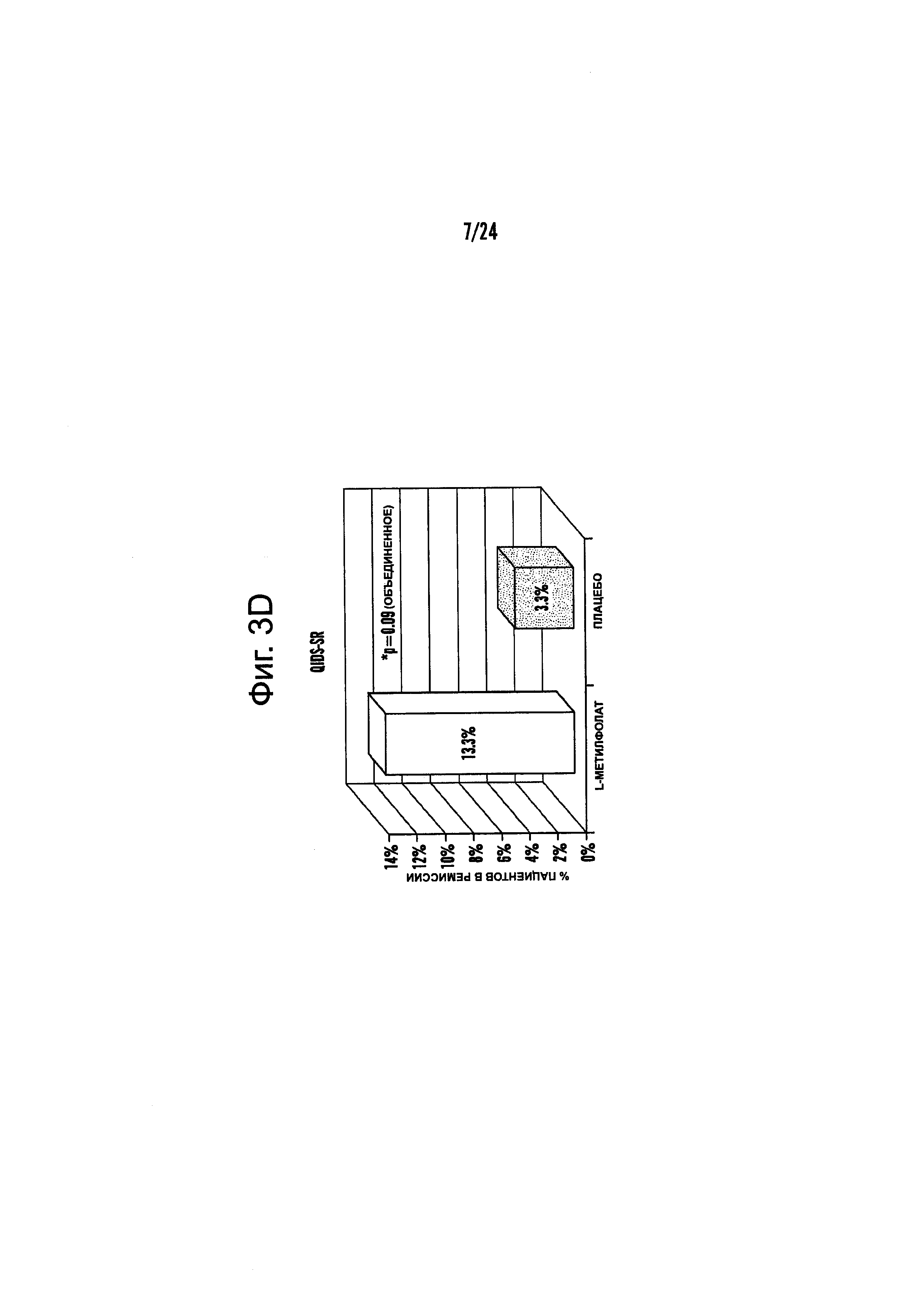
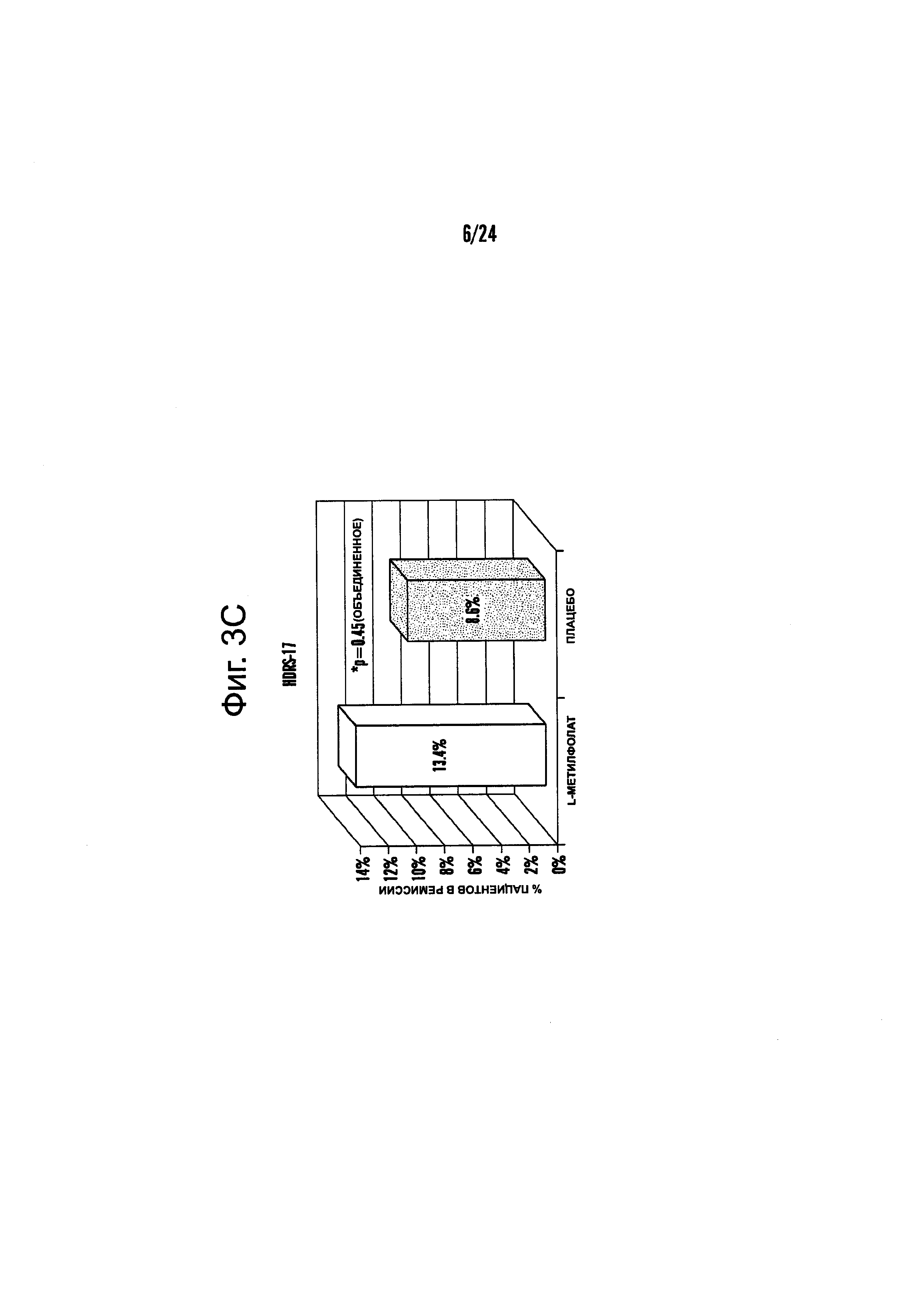
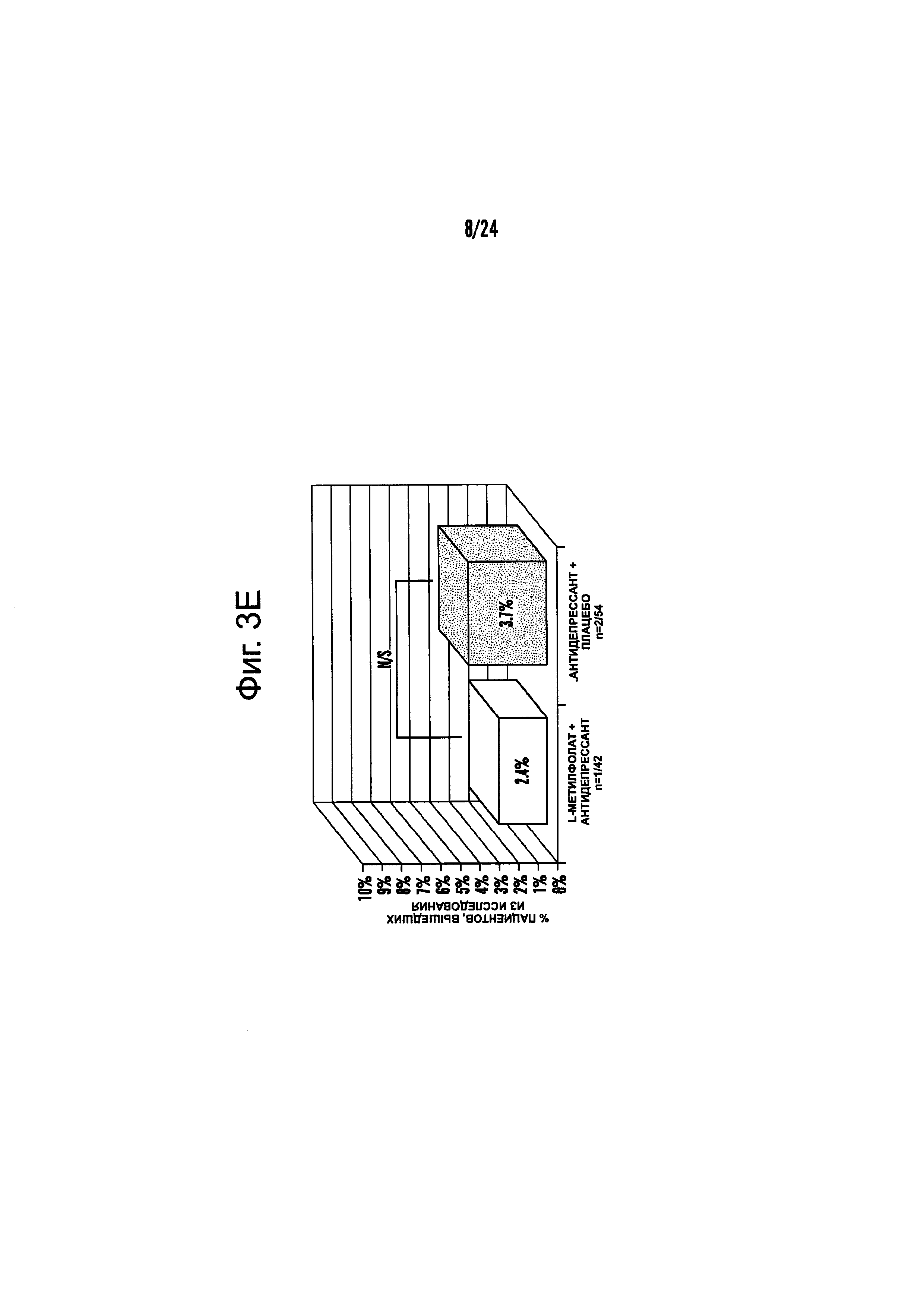
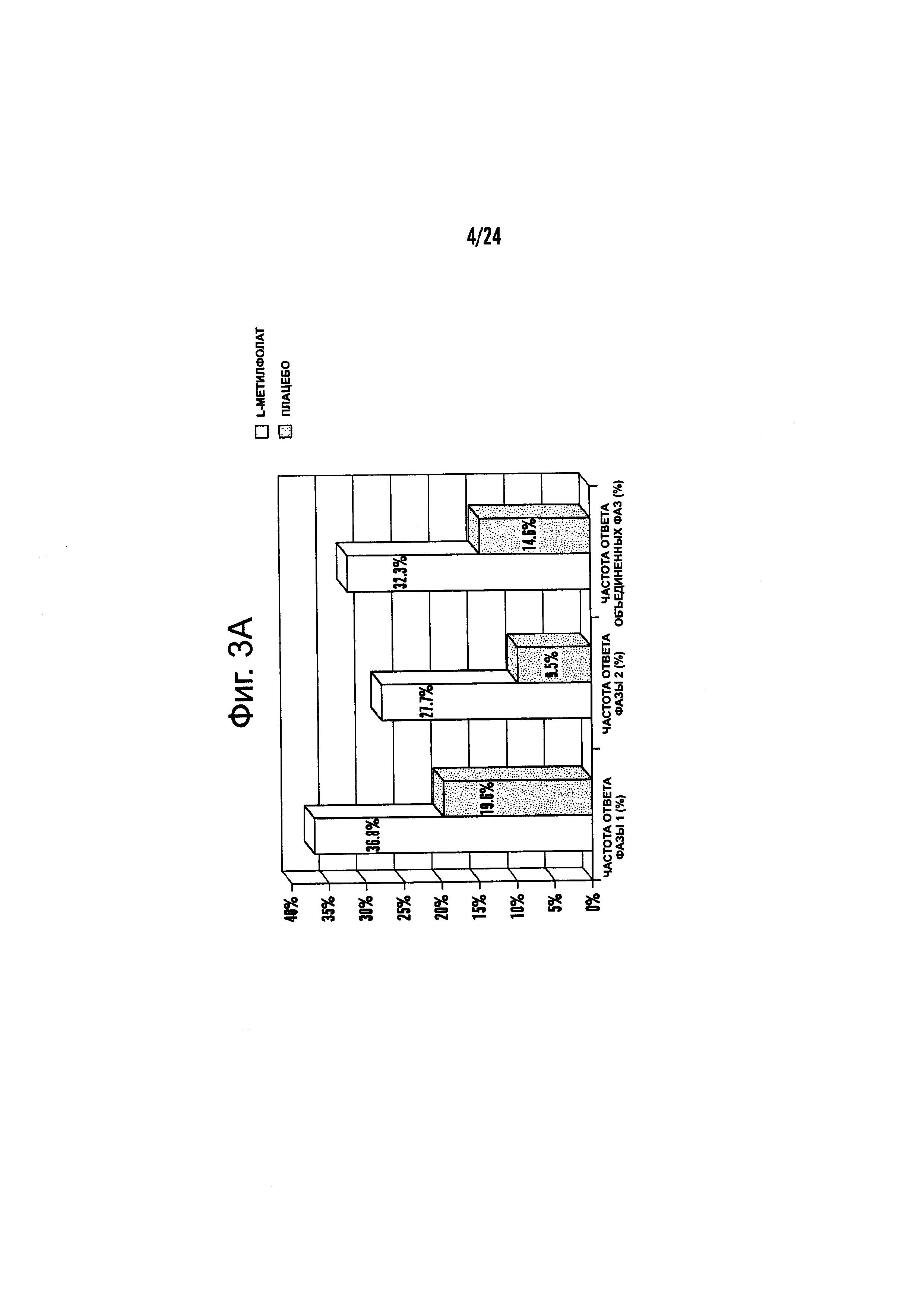
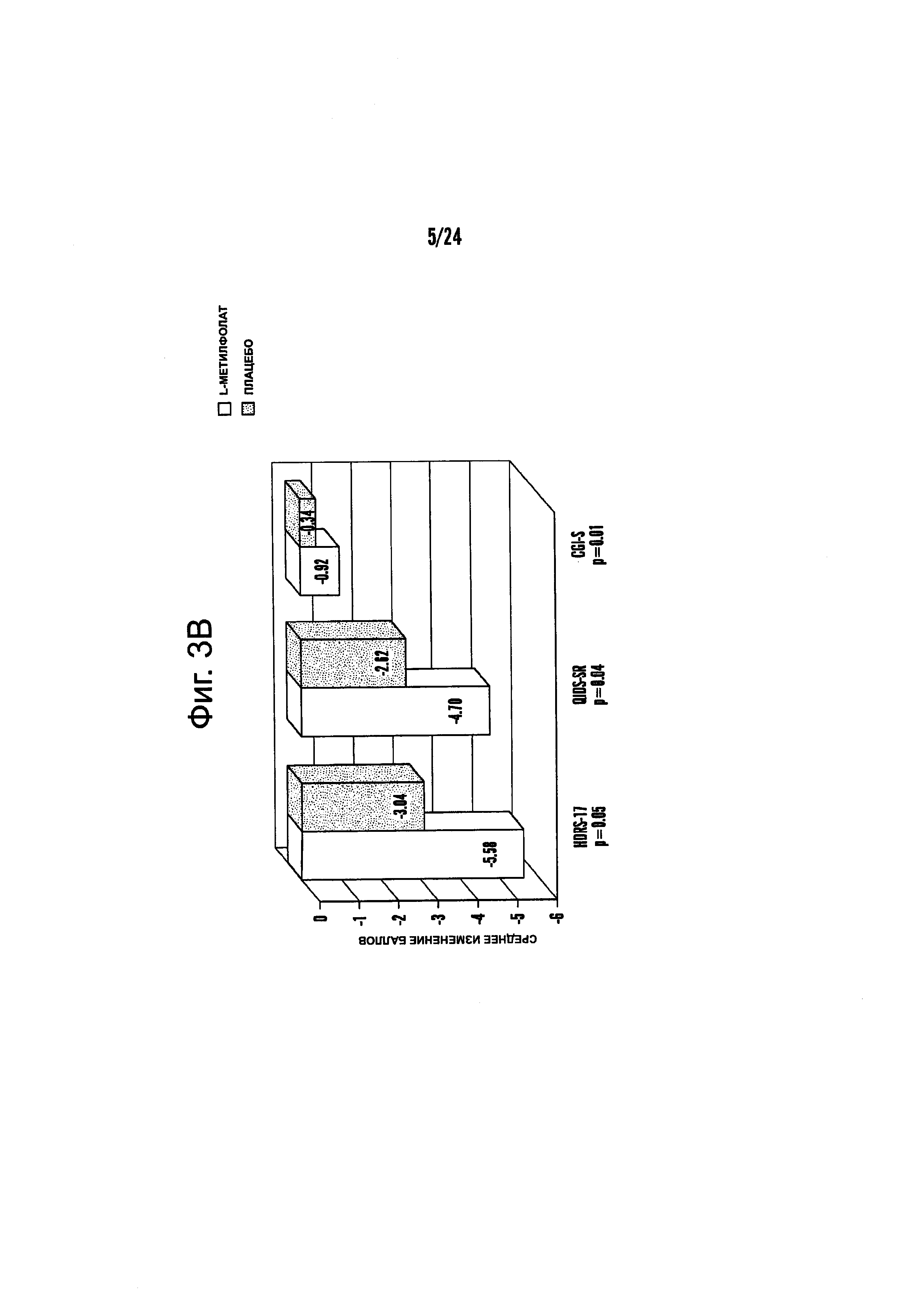
На Фиг. 3А-3Е представлены эффекты лечения пациентов с MDD с помощью фолат-содержащего соединения, например, в качестве вспомогательного вещества к SSRI в Испытании 2. На Фиг. 3А представлены показатели ответной реакции пациентов с MDD, подвергнутых лечению или с помощью фолат-содержащего соединения, или с помощью плацебо, совместно с SSRI, после 30-дневного курса лечения. Респондером является пациент с MDD, по меньшей мере, с 50% уменьшением HDAM-17 после лечения. На Фиг. 3В представлено среднее изменение баллов различных нейропсихологических тестов (например, HDAM-17, QIDS-SR, и CGI-S) для пациентов с MDD, подвергнутых лечению или с помощью фолат-содержащего соединения, или с помощью плацебо, совместно с SSRI, после 30-дневного курса лечения. На Фиг. 3С представлен процент пациентов с MDD в ремиссии согласно измерениям с помощью HDAM-17, после лечения или с помощью фолат-содержащего соединения, или с помощью плацебо совместно с SSRI, после 30-дневного курса лечения. На Фиг. 3D представлен процент пациентов с MDD в ремиссии согласно измерениям с помощью QIDS-SR, после лечения или с помощью фолат-содержащего соединения, или с помощью плацебо совместно с SSRI, после 30-дневного курса лечения. На Фиг. 3C-3D представлено, что показатели ремиссии после 30-дневного курса адъюванта 15 мг/день L-метилфолата и SSRI, по сравнению с плацебо и SSRI, не были значительными для депрессивных пациентов, которые неадекватно отвечали на монотерапию SSRL На Фиг. 3Е представлен процент пациентов с MDD, исключенных из Испытания 2, не выявивший значительного различия в частотах исключения из-за общих неблагоприятных явлений.
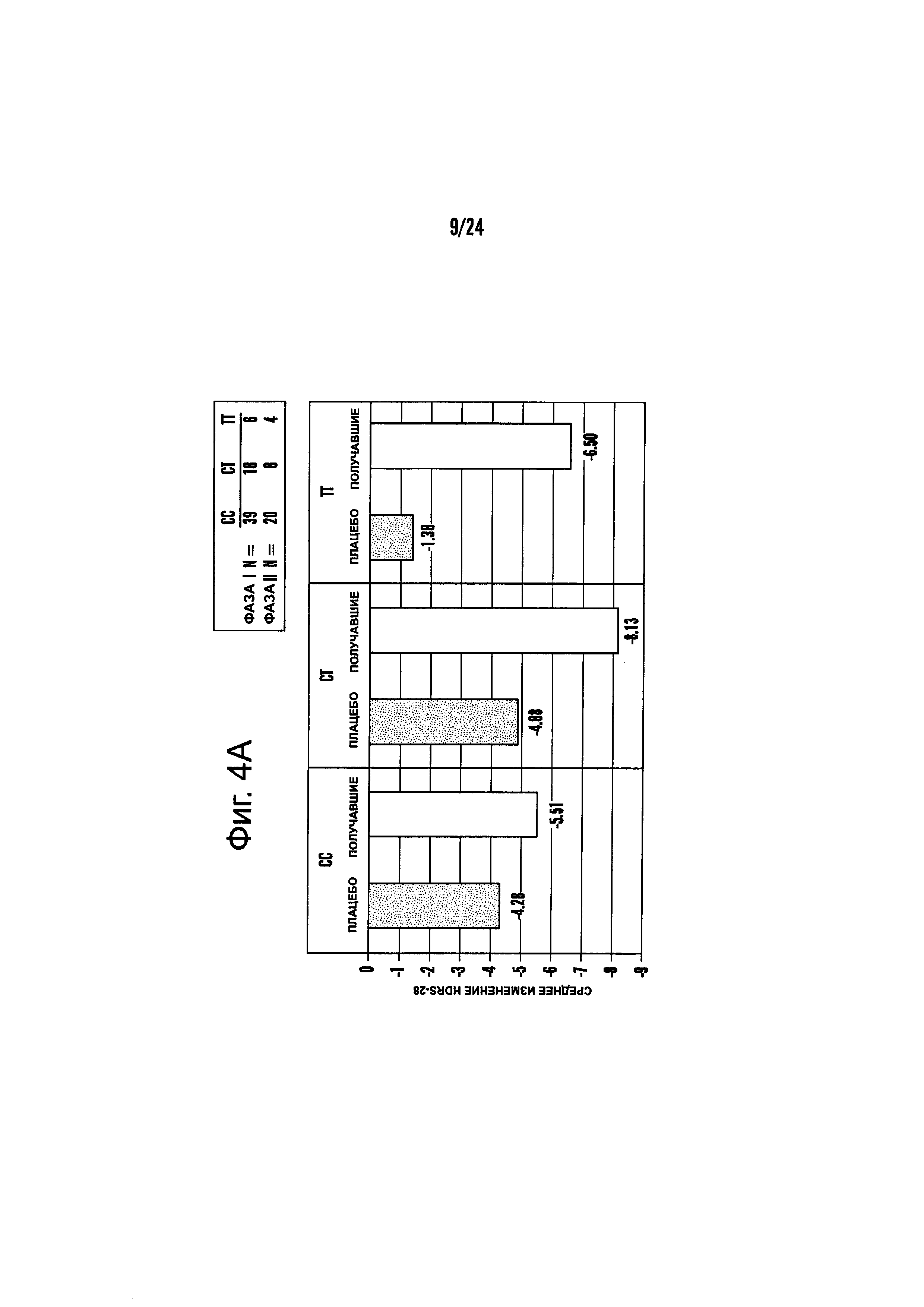
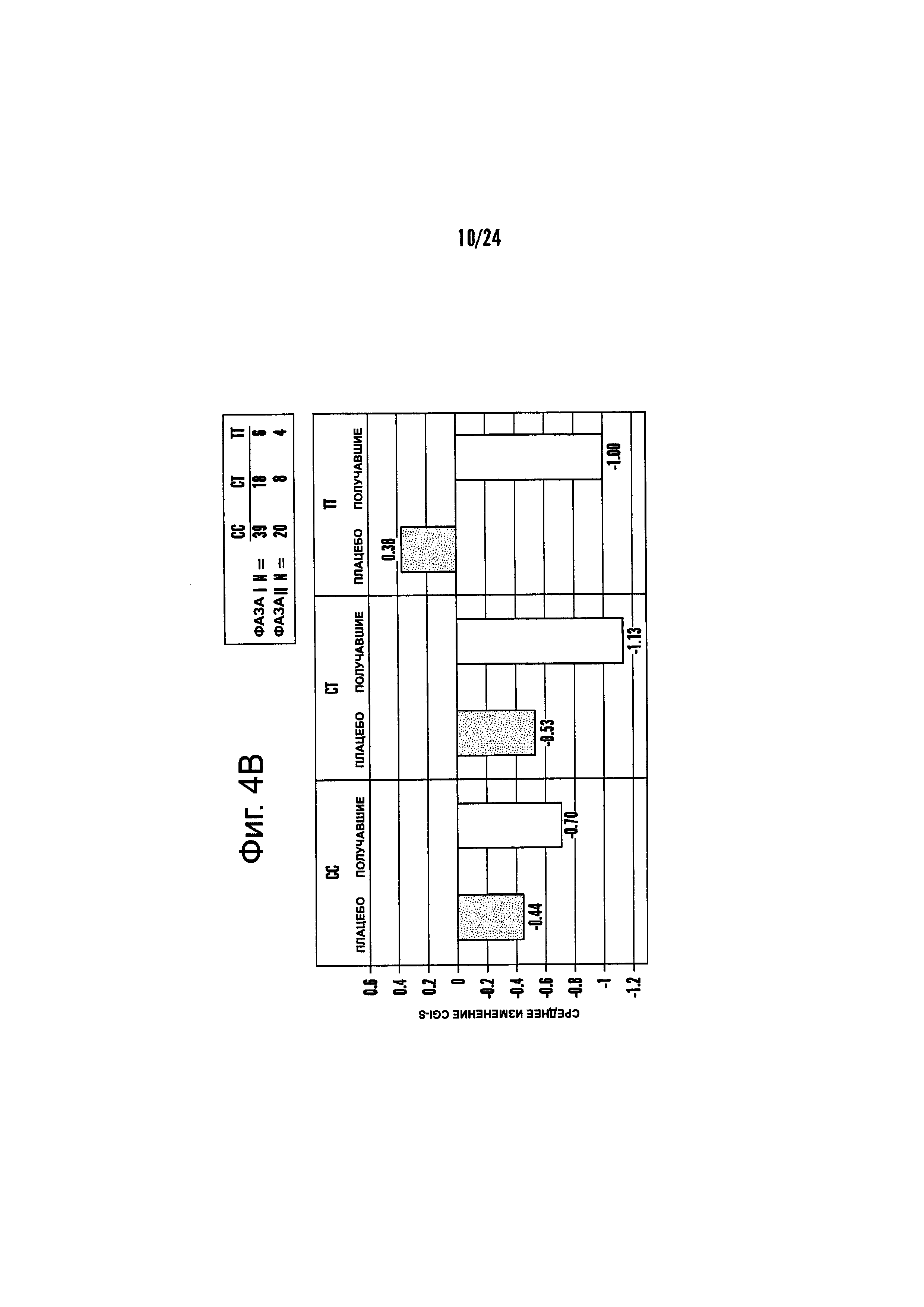
На Фиг. 4А-4В представлено влияние однонуклеотидного полиморфизма (SNP) в гене MTHFR (MTHFR C677T) в отношении эффективности лечения, включающего фолат-содержащее соединение (например, 6(S)-5-MTHF) и необязательно SSRI у пациента с депрессией. На Фиг. 4А представлены результаты эффективности согласно измерениям с помощью HDAM-28 (Шкала Гамильтона для оценки депрессии из 28 пунктов). На Фиг. 4В представлены результаты эффективности согласно измерениям с помощью CGI-S (общая клиническая оценка-тяжесть заболевания).
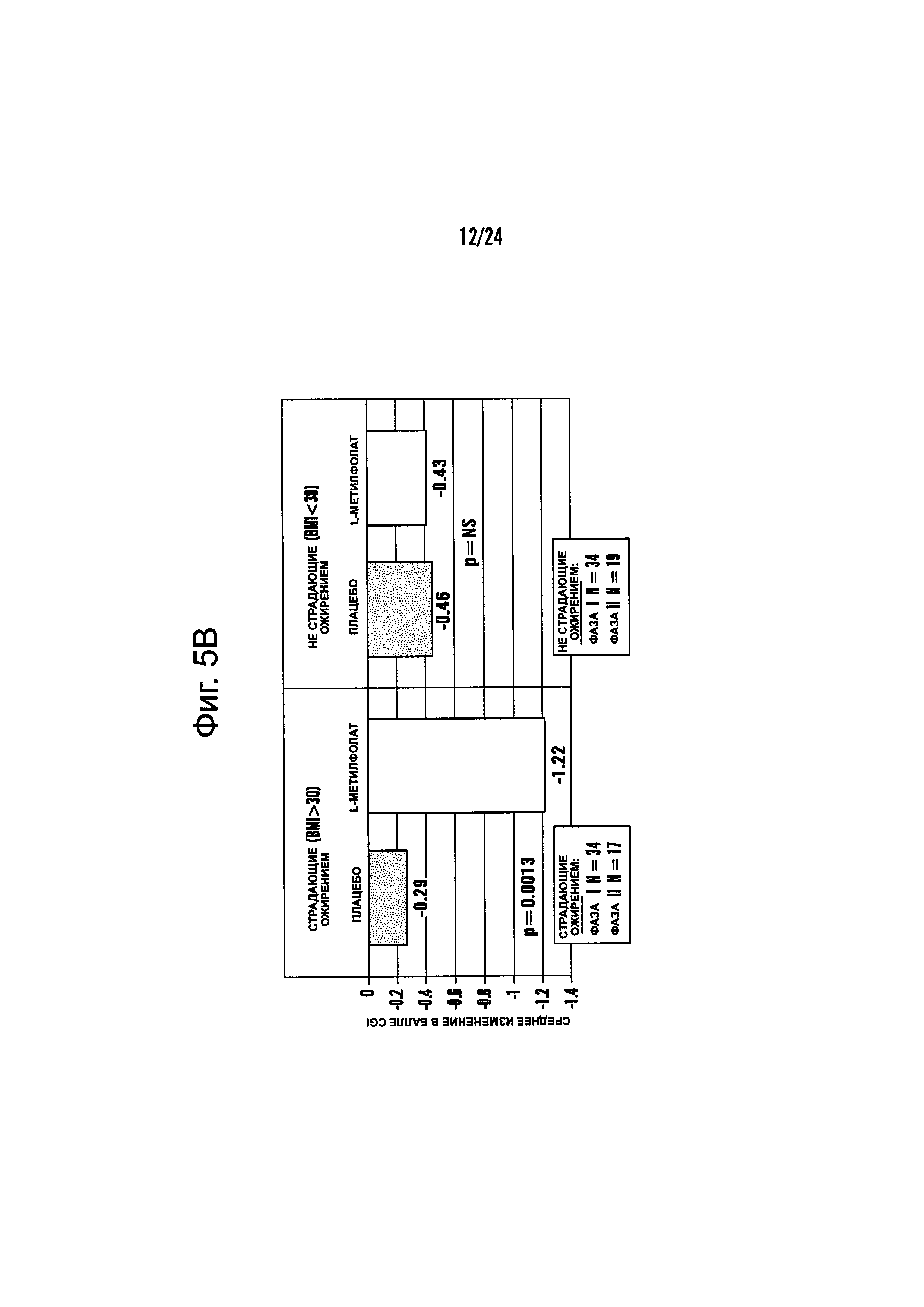
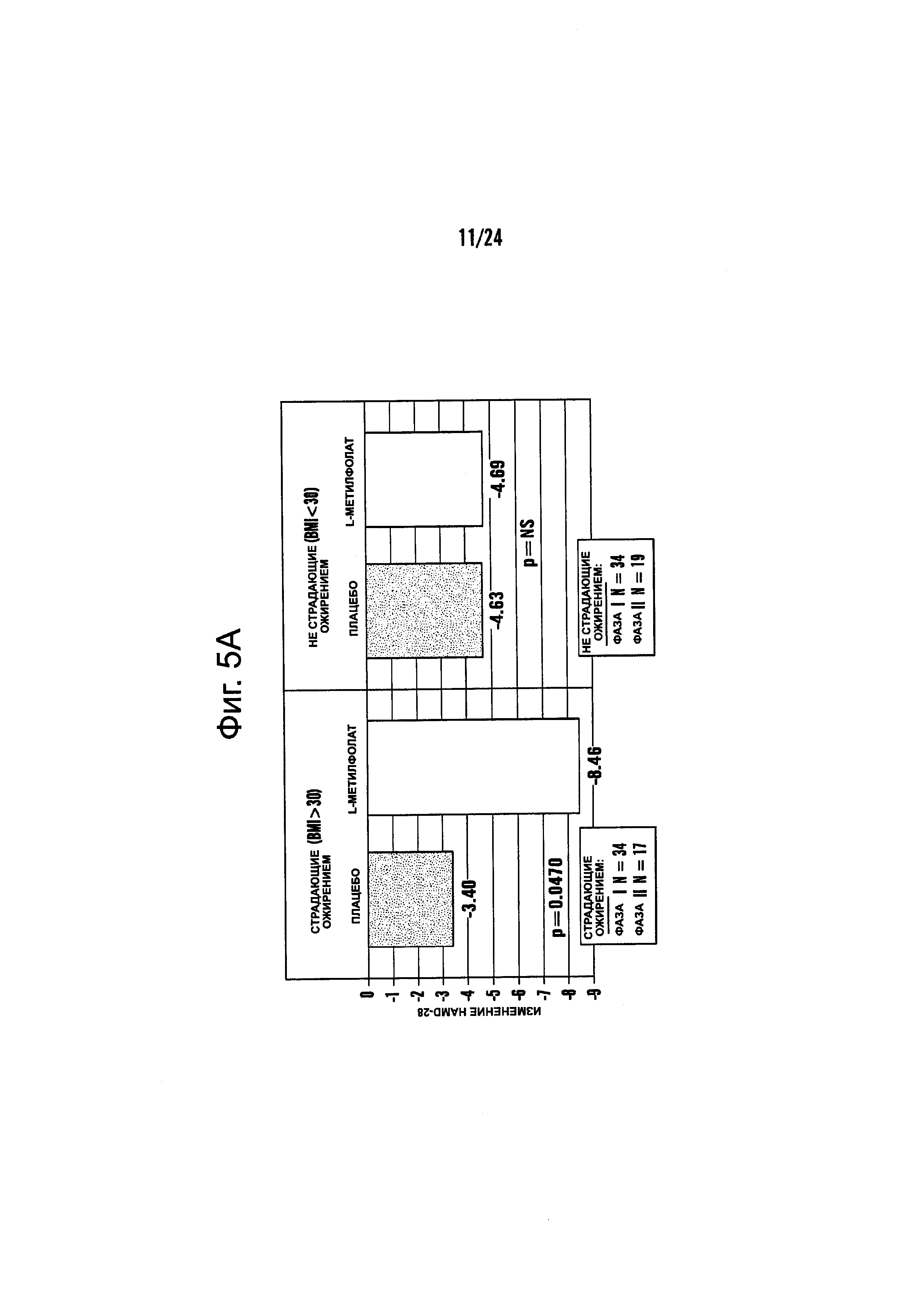
На Фиг. 5А-5В представлено влияние ожирения (т.е. BMI, составляет, по меньшей мере, 30 кг/м2 или выше) в отношении эффективности лечения, включающего фолат-содержащее соединение (например, 6(S)-5-MTHF) и необязательно SSRI у пациента с депрессией. На Фиг. 4А представлены результаты эффективности согласно измерениям с помощью HDAM-28 (Шкала Гамильтона для оценки депрессии из 28 пунктов) с критерием хи-квадрат 3,94 для лечебного эффекта. На Фиг. 4В представлена эффективность результатов согласно измерениям с помощью CGI-S (общая клиническая оценка-тяжесть заболевания) с критерием хи-квадрат 10,03 для эффекта лечения.
Фиг. 6 представляет собой блок-диаграмму, демонстрирующую типичную систему для применения в способах, описанных в данном документе, например, для выбора режима лечения субъекта с депрессией.
Фиг. 7 представляет собой типичный набор инструкций на машиночитаемом носителе для применения с системами, описанными в данном документе.
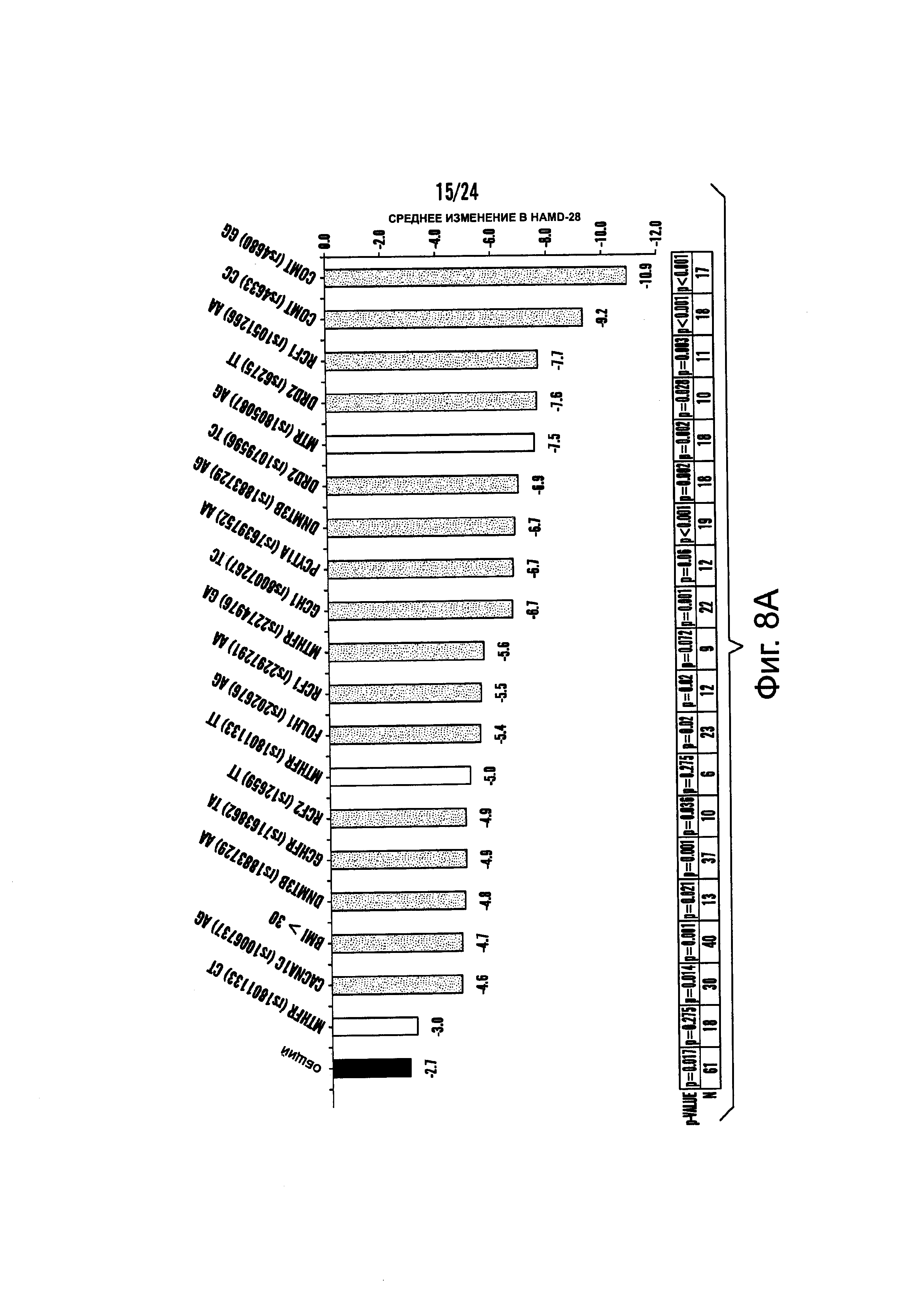
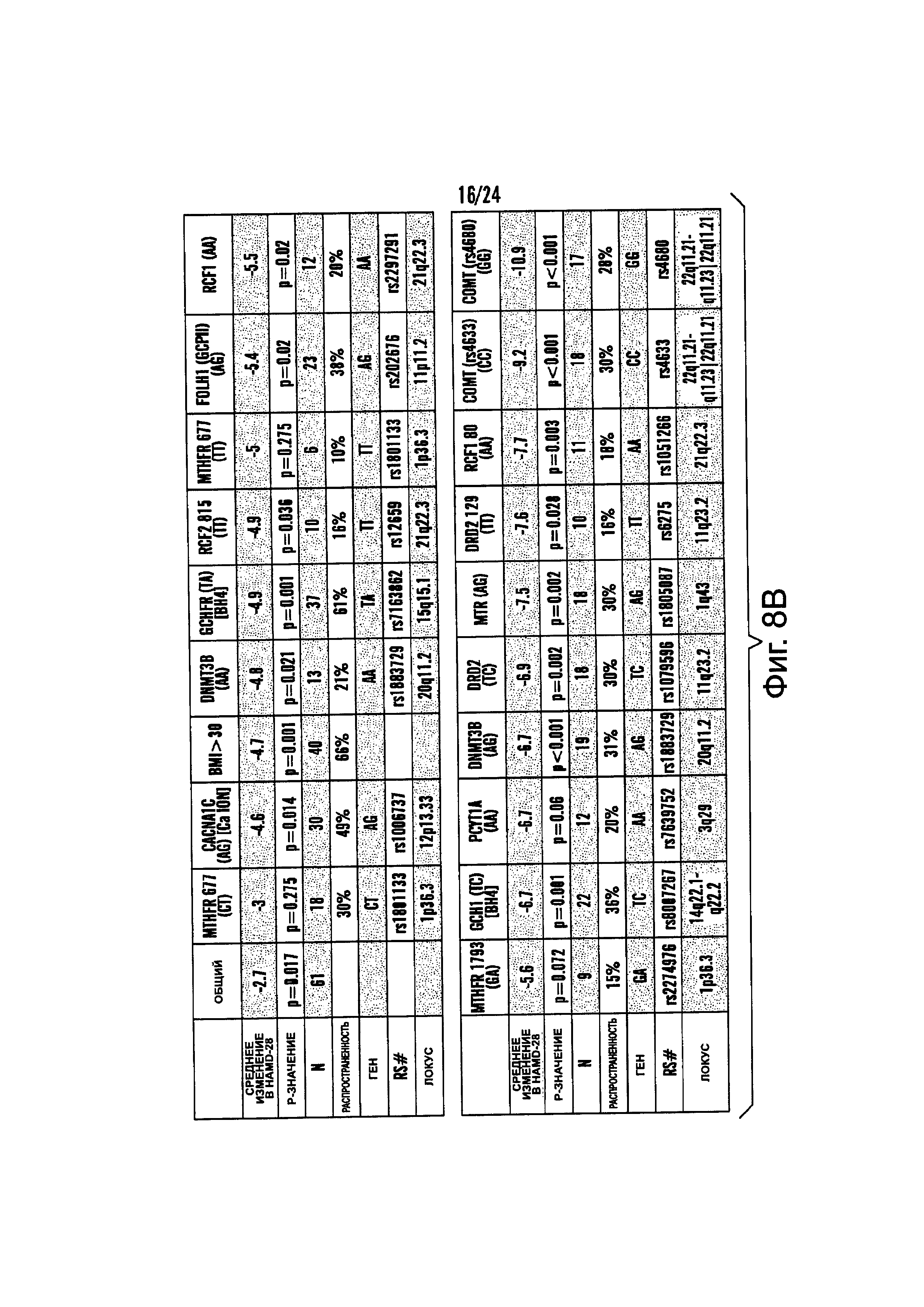
На Фиг. 8А-8В представлены средние изменения в HAMD-28 у пациентов с MDD, несущих, по меньшей мере, один редкий вариант на указанном гене, что противоположно полностью нормальному варианту соответствующего гена, когда пациенты подвергаются лечению с помощью фолат-содержащего соединения, например, в виде вспомогательного вещества к SSRI. На Фиг. 8А представлен график, демонстрирующий среднее изменение в HAMD-28 по отношению к различным указанным SNP-биомаркерам. На Фиг. 8В представлена таблица, демонстрирующая результаты, как представлено в Фиг. 8А; и соответствующие хромосомные локусы. Термин «преобладание», используемый на Фиг. 8В, относится к суммарному процентному содержанию пациентов с MDD, которые являются носителями SNP, как указано в данном конкретном исследовании.
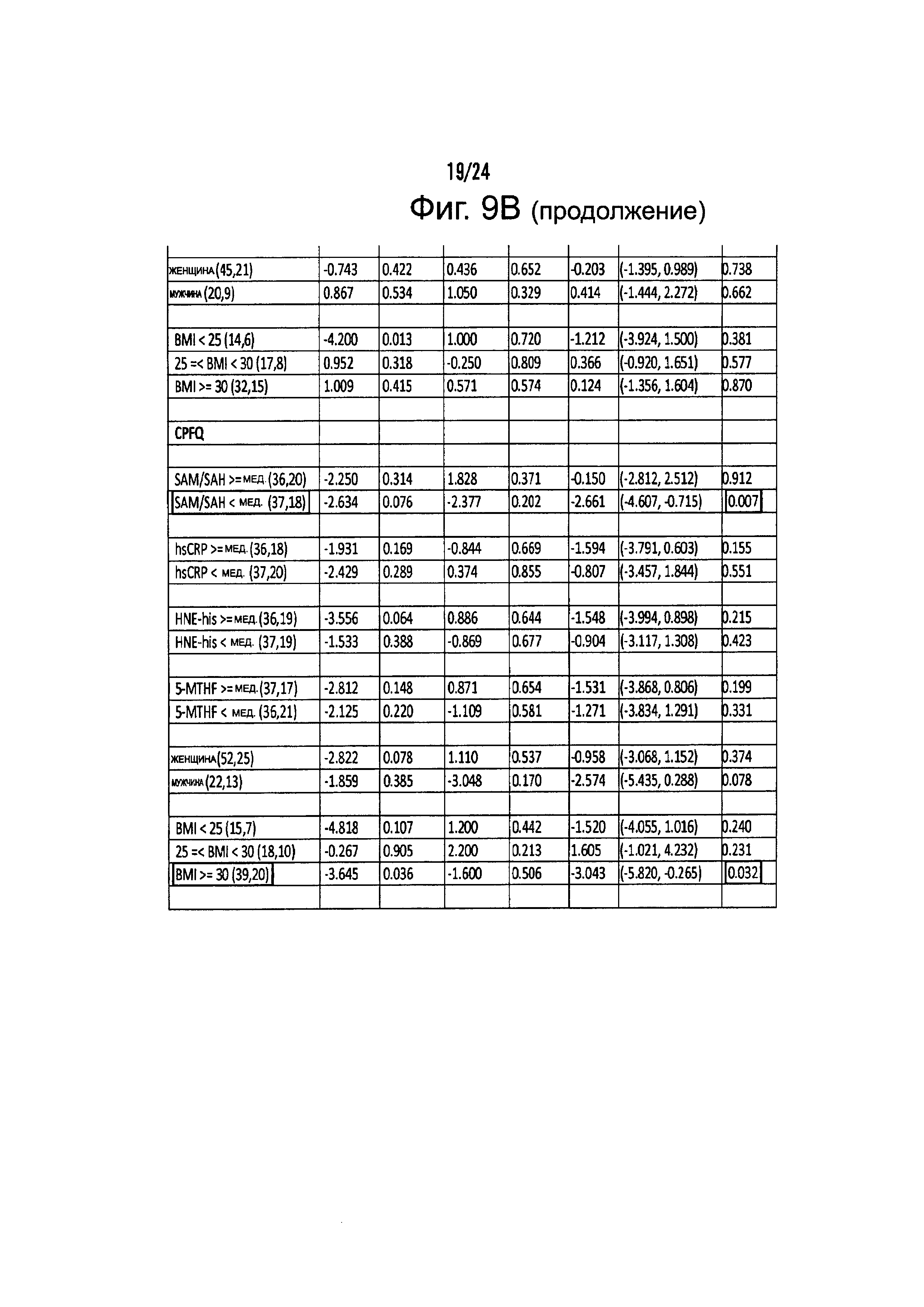
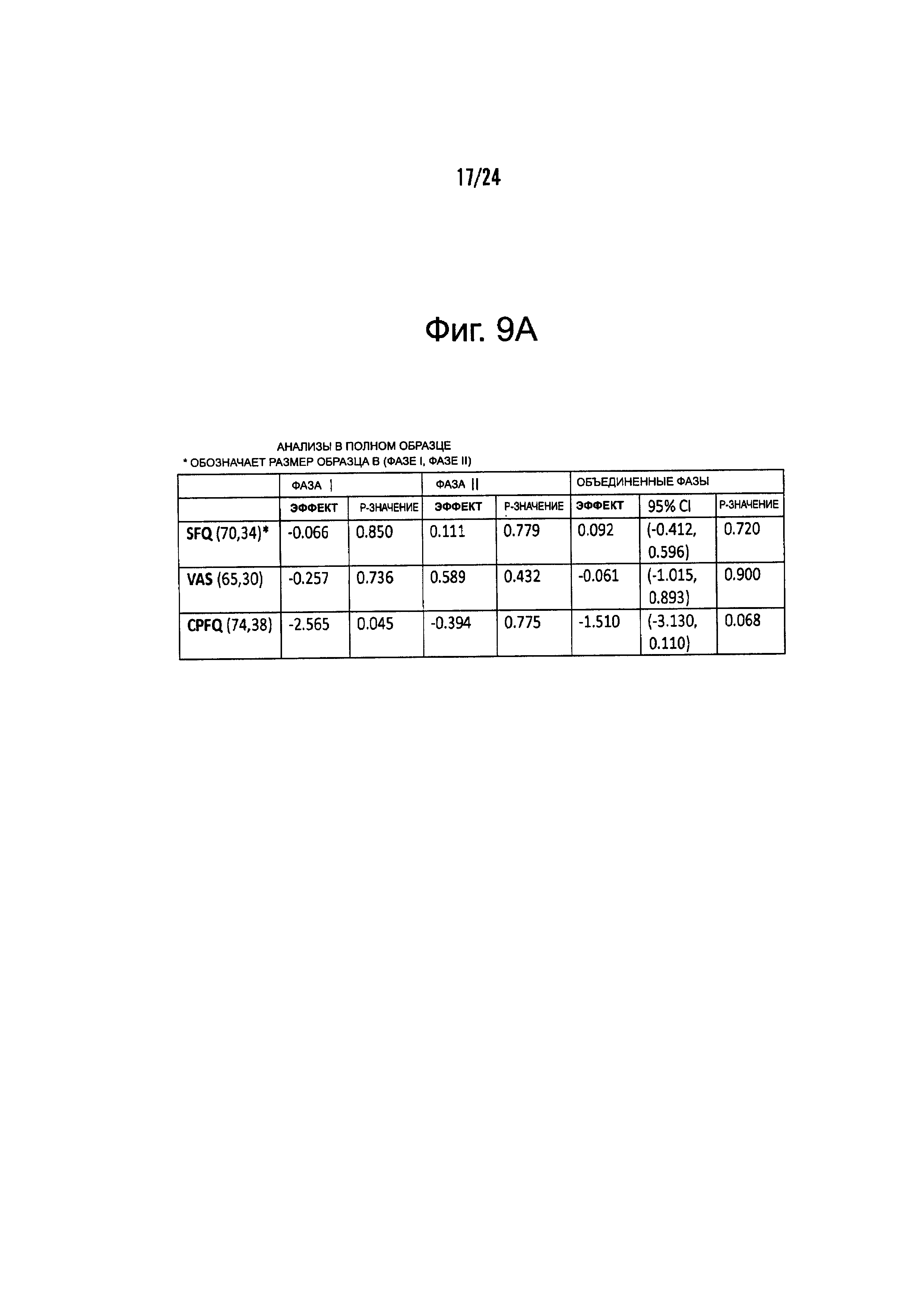
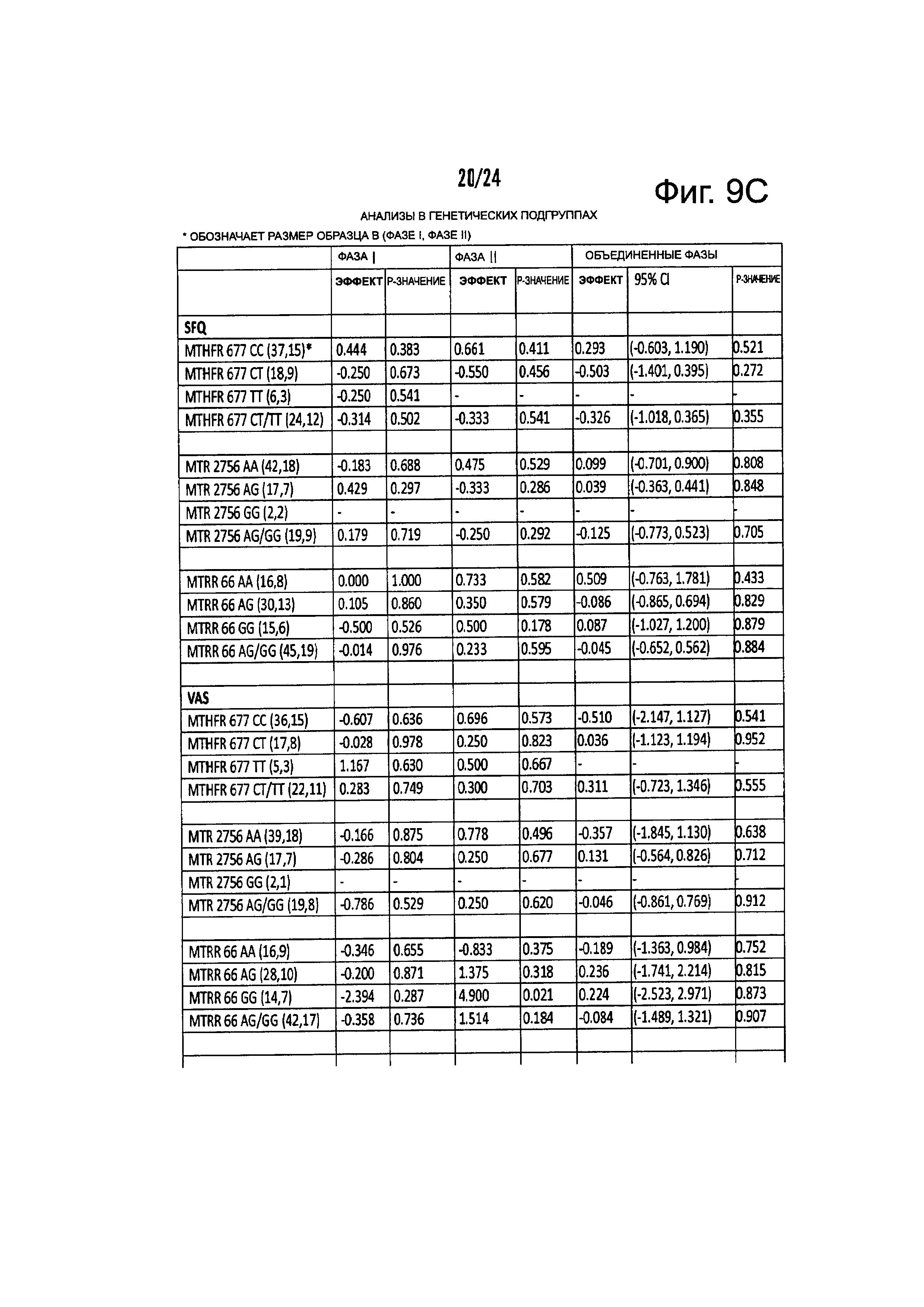
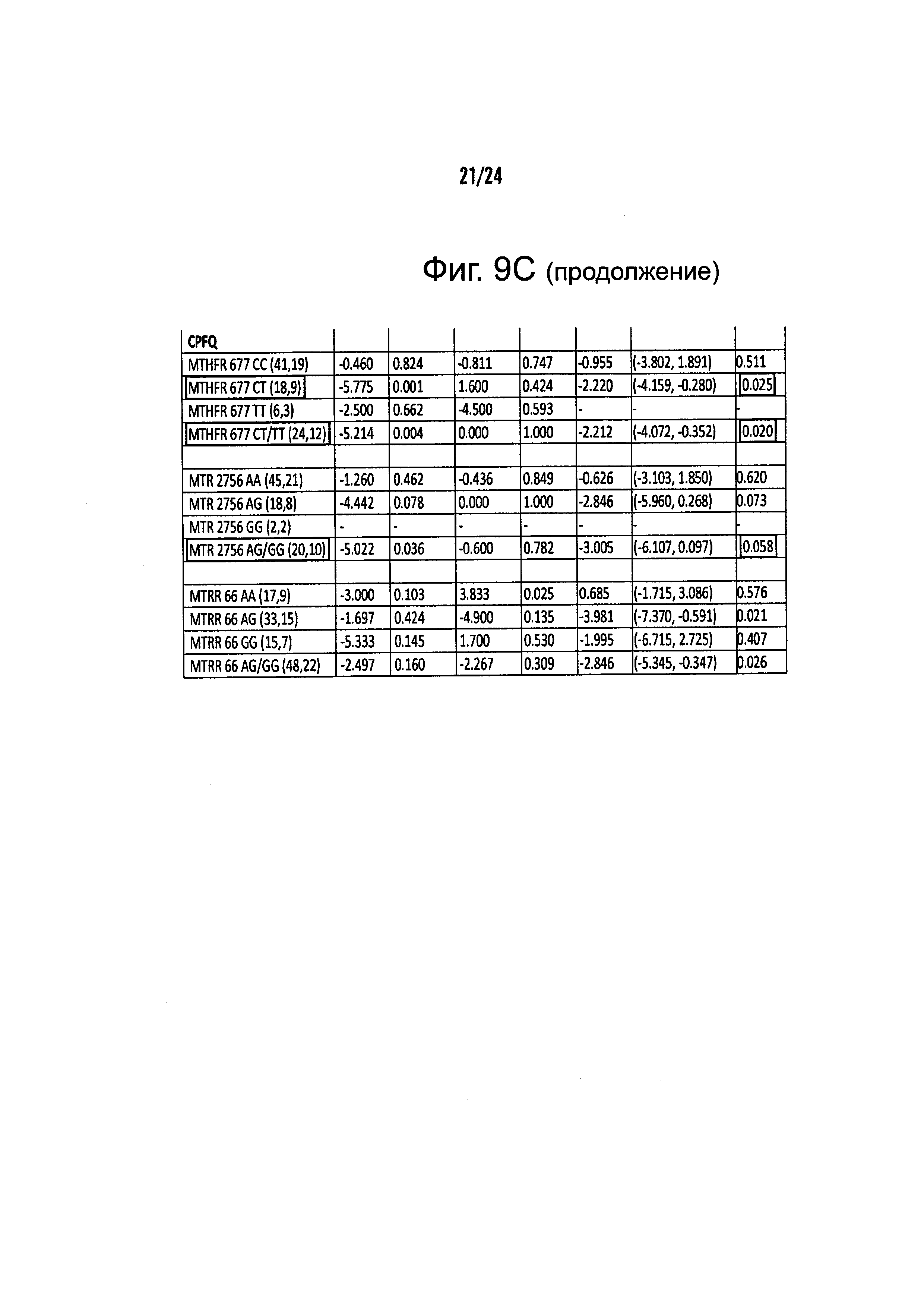
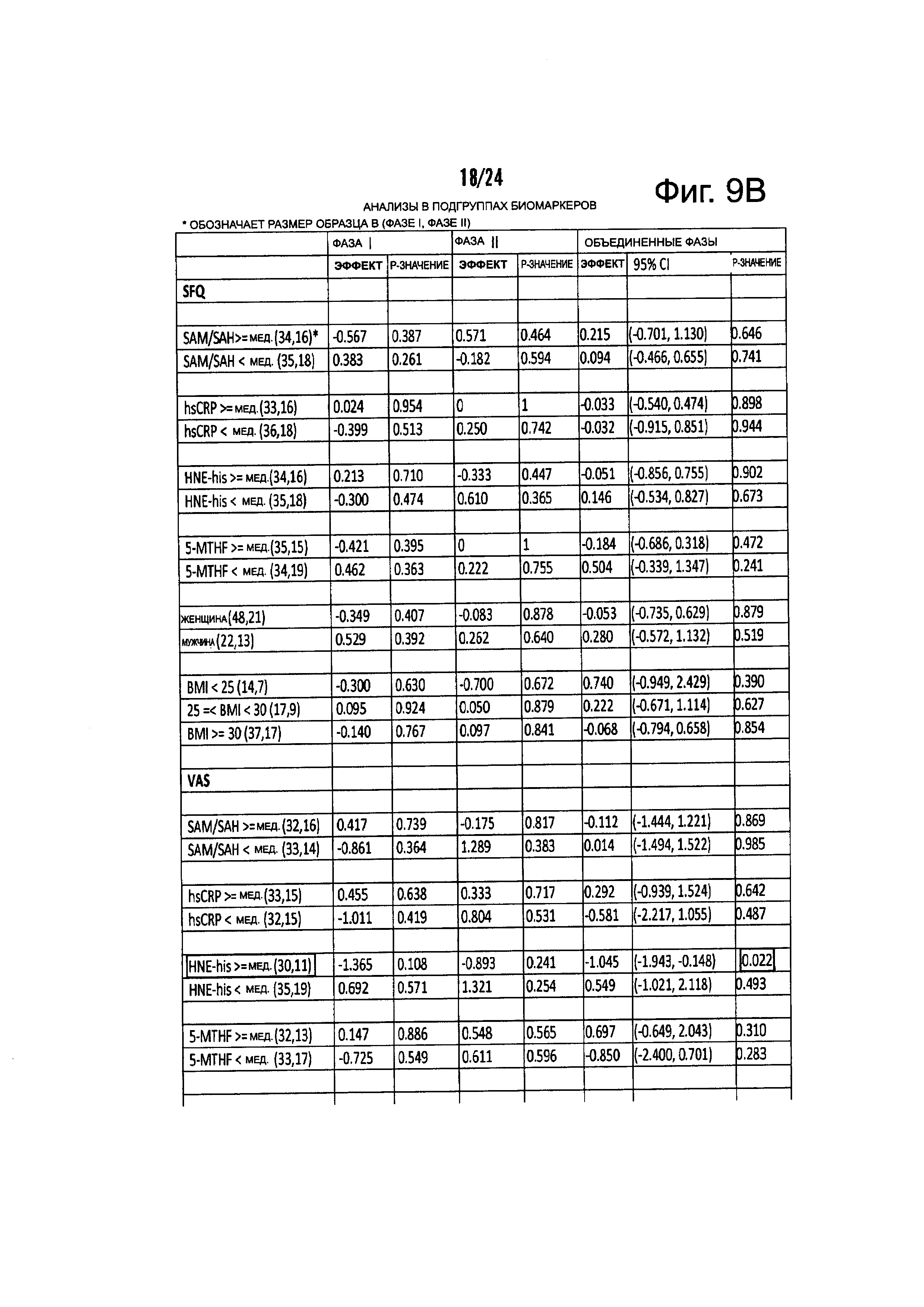
На Фиг. 9А-9С представлены результирующие таблицы, демонстрирующие эффекты наличия или отсутствия указанного состояния, у пациентов с MDD на степень депрессии, когда пациенты подвергались лечению с помощью режима лечения, включающего фолат-содержащее соединение. Степень депрессии измеряли с помощью Опросника Социального Функционирования (SFQ), Визуальной Аналоговой Шкалы (VAS), и Опросника Когнитивных и Физических Функций (CPFQ). Фиг. 9А демонстрирует анализы на всех образцах. Фиг. 9В демонстрирует анализы в подгруппах биомаркеров. Фиг. 9С демонстрирует анализы в генетических подгруппах.
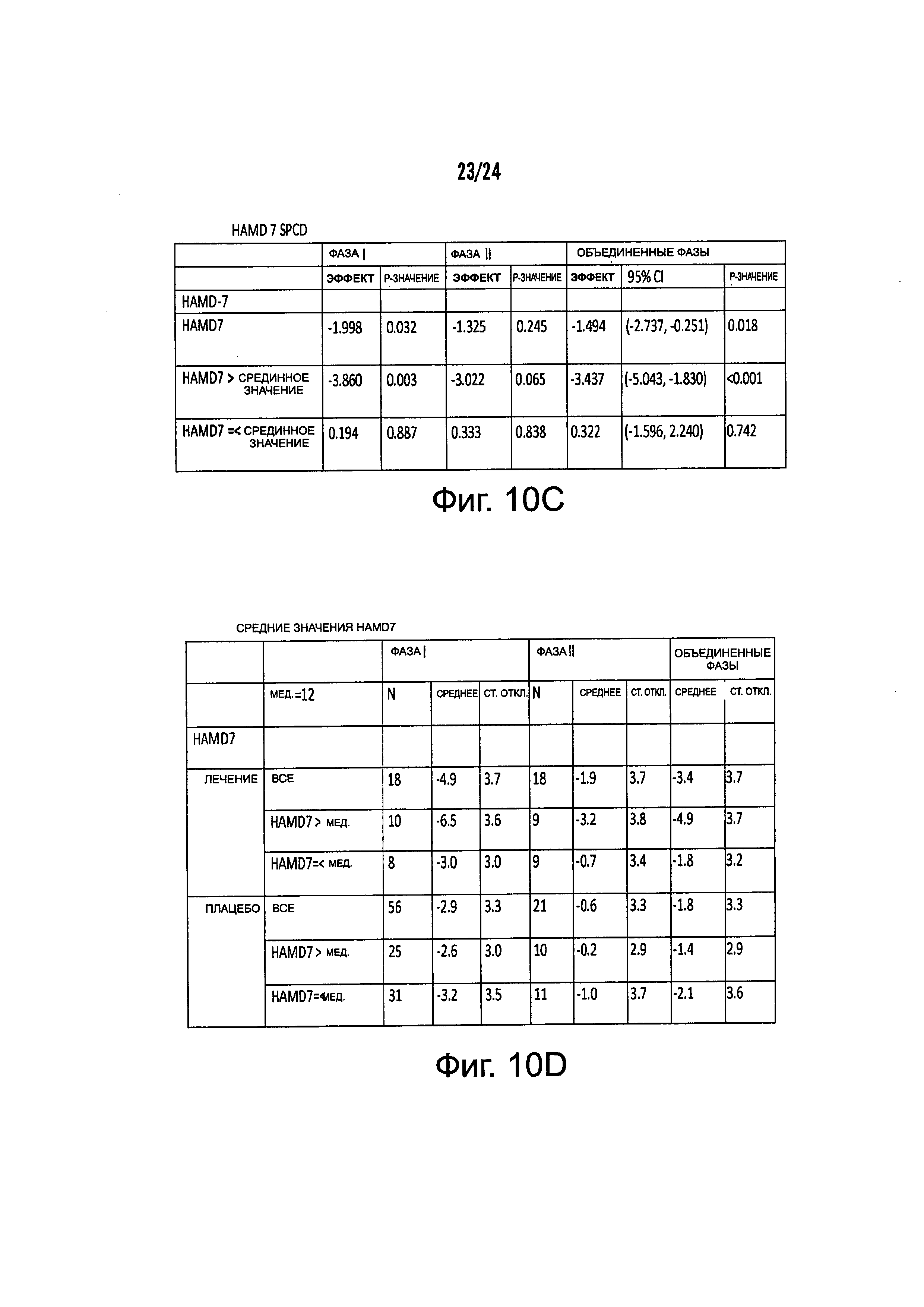
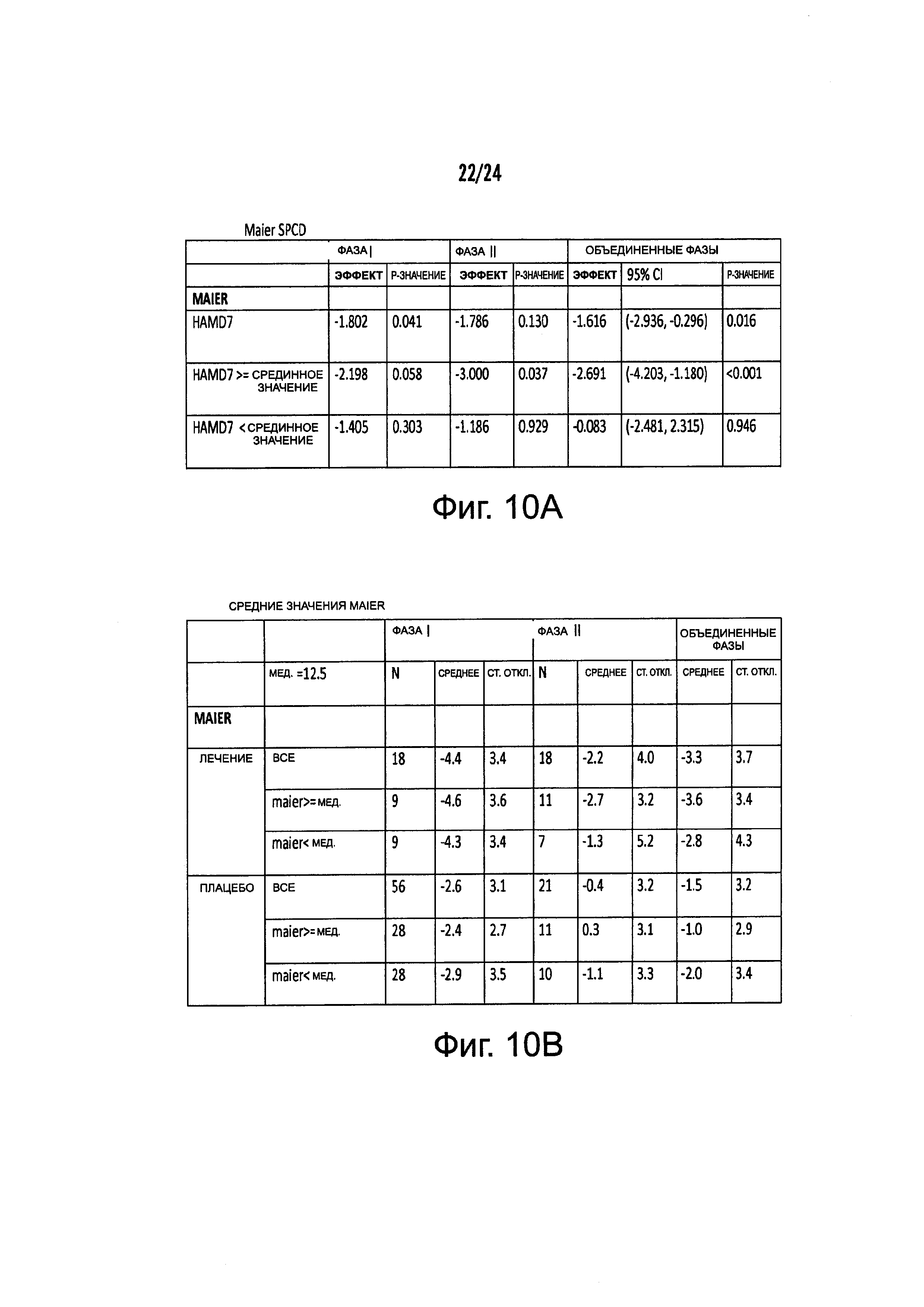
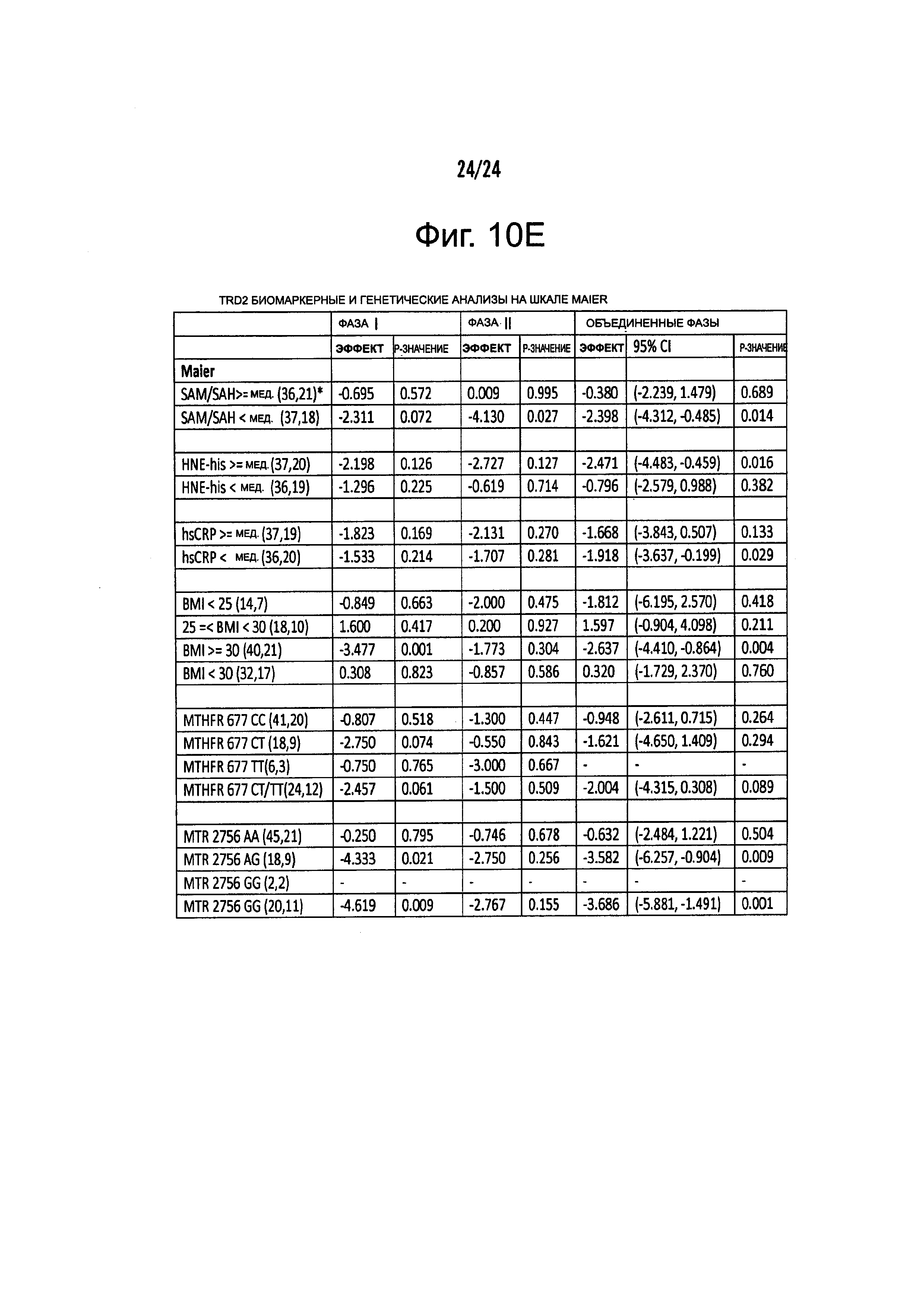
На Фиг. 10А-10С представлены результирующие таблицы, демонстрирующие эффекты наличия или отсутствия указанного состояния, у пациентов с MDD на степень депрессии, когда пациенты подвергались лечению с помощью фолат-содержащего соединения (группа лечения) или без фолат-содержащего соединения (группа плацебо). Степень депрессии измеряли с помощью шкалы Maier или дополнительной шкалы HAMD-7 на HAMD. Фиг. 10А демонстрирует результаты Maier SPCD. Фиг. 10В демонстрирует средние значения Maier. Фиг. 10С демонстрирует HAMD-7 SPCD. Фиг. 10D демонстрирует средние значения HAMD-7. Фиг. 10Е демонстрирует сводку биомаркерных и генетических анализов по шкале Maier.
Подробное описание изобретения
Согласно недавним оценкам более 19 миллионов американцев в возрасте старше 18 лет испытывают депрессивное расстройство каждый год. Хотя в последнее десятилетие были сделаны значительные успехи при лечении депрессии, вплоть до 29-46% пациентов с депрессией, принимающих антидепрессант, все еще частично или полностью устойчивы к лечению. Те, кто страдает от устойчивой к лечению депрессии, почти не имеют альтернатив. Поскольку не каждый режим лечения является эффективным для каждого из индивидуумов, существует большая потребность в идентификации маркеров, которые могут облегчить выбор соответствующего режима лечения для субъекта с депрессией.
Согласно аспектам различных воплощений, описанных в данном документе, по меньшей мере, 21 однонуклеотидный полиморфизм (SNP) и 4 периферических биомаркерных параметра были обнаружены для прогнозирования эффективности или эффекта режима лечения, включающего фолат-содержащее соединение. То есть эти SNP и параметры биомаркера в сыворотке/плазме могут использоваться для идентификации субъектов с депрессией, которые будут получать пользу или отвечать на режим лечения, включающий фолат-содержащее соединение, по сравнению с лечением без фолат-содержащего соединения. Конкретнее эти SNP и параметры биомаркеров в сыворотке/плазме могут использоваться для идентификации субъекта с устойчивой к лечению депрессией (например, субъект устойчив, по меньшей мере, к одному селективному ингибитору обратного захвата серотонина (SSRI)), который мог бы получать пользу или отвечать на режим лечения, включающего фолат-содержащее соединение, по сравнению с лечением без фолат-содержащего соединения. Фолат-содержащее соединение может вводиться в отсутствии антидепрессанта или оно может обеспечиваться в качестве адъюванта к антидепрессанту. В некоторых воплощениях, адъювантный эффект фолат-содержащего соединения, вводимого в комбинации с антидепрессантом, может быть аддитивным. В других воплощениях, адъювантный эффект фолат-содержащего соединения, вводимого в комбинации с антидепрессантом, может быть синергическим.
В частности, SNP, которые могут спрогнозировать эффективность введения человеку фолат-содержащего соединения (например, отдельно или в комбинированной терапии для повышения эффективности антидепрессанта), при лечении депрессии включают, по меньшей мере, один или несколько из следующих SNP, идентифицируемых по номеру rs: rs1801133, присутствует в метилентетрагидрофолатредуктазе (MTHFR); rs2274976 присутствует в MTHFR; rs 1805087 присутствует в метионинсинтетазе (MTR); rs 18013 94 присутствует в редуктазе метионинсинтетазы (MTRR); rs 100673 7 присутствует в альфа lC-субъединице потенциалозависимого кальциевого канала L-типа (CACNA1C); rs 1883729 присутствует в ДНК-(цитозин-5)-метилтрансферазе 3 бета (Dnmt3b); rs7163862 присутствует в белке-регуляторе обратной связи GTP-циклогидролазы 1 (GCHFR); rs12659 присутствует в белке-носителе восстановленного фолата 2 (RCF2); rs202676 присутствует в фолатгидролазе (простат-специфическом мембранном антигене) (FOLH1); rs2297291 присутствует в белке-носителе восстановленного фолата 1 (RCF1); rs 1051266 присутствует в белке-носителе восстановленного фолата 1 (RCF1); rs8007267 присутствует в GTP-циклогидролазе 1 (GCH1); rs7639752 присутствует в холин-фосфат цитидилтрансферазе A (PCYT1A); rs6275 присутствует в допаминовом рецепторе D2 (DRD2); rs1079596 присутствует в DRD2; rs11240594 присутствует в DRD2; rs4633 присутствует в катехол-O-метилтрансферазе (СОМТ); rs4680 присутствует в СОМТ; rs250682 присутствует в активном транспортере допамина (DAT, или SLC6A3); rs2277820 присутствует в формиминотрансферазе циклодеаминазе (FTCD); rs2236225 присутствует в метилентетрагидрофолатдегидрогеназе (NADP+зависимой) 1 (MTHFD1); и любые их комбинации.
Кроме того, параметры периферических биомаркеров, которые могут спрогнозировать эффективность введения человеческому субъекту фолат-содержащего соединения (например, отдельно или в комбинированной терапии для повышения эффективности антидепрессанта) для лечения депрессии включают относительные уровни экспрессии между s-аденозилметионином (SAM) и s-аденозил гомоцистеином (SAH), экспрессию 4-гидроксиноненаля (4-HNE), экспрессию высокочувствительного с-реактивного белка (hsCRP), или любых их комбинаций. Кроме того, также было обнаружено, что ожирение является предиктивным в отношении оценки эффективности режима лечения, включающего фолат-содержащее соединение (например, монотерапию или комбинационную терапию с антидепрессантом). Эти генетические полиморфизмы, периферические биомаркеры и клинические признаки оценивали на когорте людей, которые страдали большим депрессивным расстройством и которые были показаны как устойчивые к антидепрессантным монотерапиям, например, страдающие устойчивой к лечению депрессией (TRD), в частности депрессией, устойчивой к ингибиторам обратного захвата серотонина (SSRI).
Соответственно, некоторые воплощения, описанные в данном документе, в общем, относятся к анализам, способам, системам или наборам для выбора режима лечения для субъекта с депрессией или идентификации субъекта с депрессией поддающегося или респонсивного лечению, включающему фолат-содержащее соединение. В некоторых воплощениях лечение может включать комбинацию фолат-содержащего соединения и антидепрессантное лекарственное средство. В одном воплощении, анализы, способы, системы и наборы нацелены на определение в тестируемом образце из человека, например, человека, который диагностирован как страдающий или имеющий риск развития депрессии (например, без ограничения, большое депрессивное расстройство) наличия или отсутствия, по меньшей мере, одного из однонуклеотидных полиморфизмов (SNP) и/или параметров периферических биомаркеров для прогноза ответа субъекта на лечение, включающее фолат-содержащее соединение. Если, по меньшей мере, одно из состояний, описанных в данном документе определено как присутствующее в тестируемом образце из человека, режим лечения, включающий фолат-содержащее соединение может быть выбран и необязательно назначен человеку. В некоторых воплощениях режим лечения может дополнительно включать антидепрессантное лекарственное средство (например, SSRI) для введения, отдельно или одновременно, с фолат-содержащим соединением.
Анализы для выбора режима лечения человека с депрессией
Соответственно, представленное в данном документе в общем относится к анализам, способам, системам и наборам для выбора режима лечения для субъекта с депрессией или с риском развития депрессии; для лечения субъекта с депрессией или с риском развития депрессии и/или улучшения эффективности режима лечения, рекомендованного для и/или вводимого субъекту с депрессией или с риском развития депрессии. Предлагаемое в данном документе также относится к фолат-содержащим композициям для применения при лечении депрессии у субъекта (например, у человека), выбранного так, чтобы он был носителем, по меньшей мере, одного (например, по меньшей мере, двух или более) или любой комбинации биомаркеров или состояний, описанных в данном документе.
В одном аспекте, описанном в данном документе, предлагается анализ для выбора режима лечения субъекта с депрессией путем идентификации в тестируемом образце из субъекта генотипов, по меньшей мере, одного из SNP и/или экспрессии, по меньшей мере, одного периферического биомаркера, как описано в данном документе, в целях определения респонсивности человека на режим лечения, включающий фолат-содержащее соединение. Анализ включает:
(а) осуществление на тестируемом образце человека, который диагностирован как страдающий от депрессии или имеющий риск развития депрессии, с помощью, по меньшей мере, одного анализа, для определения параметров, по меньшей мере, двух (включая, например, по меньшей мере, три, по меньшей мере, четыре, по меньшей мере, пять и больше), из числа биомаркеров (i)-(xxiv):
(i) генотип SNP-локуса в положении 677 в SEQ ID NO.1 или в положении 27 в SEQ ID NO. 7 (идентифицированного с помощью rs1801133), где SEQ ID NO. 1 и SEQ ID NO. 7, каждая независимо представляет собой участок геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR);
(ii) генотип SNP-локуса в положении 1793 в SEQ ID NO. 1 или в положении 27 в SEQ ID NO. 8 (идентифицированного с помощью rs2274976), где SEQ ID NO. 1 и SEQ ID NO. 8, каждая независимо представляет собой участок геномной нуклеотидной последовательности MTHFR;
(iii) генотип SNP-локуса в положении 2756 в SEQ ID NO. 2 или положение 27 в SEQ ID NO. 9 (идентифицированного с помощью rs1805087), где SEQ ID NO. 2 и SEQ ID NO. 9, каждая независимо представляет собой участок геномной нуклеотидной последовательности метионинсинтазы (MTR);
(iv) генотип SNP-локуса в положении 66 в SEQ ID NO. 3 или в положении 27 в SEQ ID NO. 10 (идентифицированного с помощью rs1801394), где SEQ ID NO. 3 и SEQ ID NO. 10, каждая независимо представляет собой участок геномной нуклеотидной последовательности редуктазы метионинсинтазы (MTRR);
(v) генотип SNP-локуса в положении 27 в SEQ ID NO. 11 (идентифицированного с помощью rs100673 7), где SEQ ID NO. 11, каждая независимо представляет собой участок геномной нуклеотидной последовательности альфа 1С-субъединицы потенциалозависимого кальциевого канала L-типа (CACNA1C);
(vi) генотип SNP-локуса в положении 27 в SEQ ID NO. 12 (идентифицированного с помощью rs1883729), где SEQ ID NO. 12 представляет собой геномную последовательность нуклеиновой кислоты ДНК (цитозин-5)-метилтрансферазы 3 бета (DNMT3B);
(vii) генотип SNP-локуса в положении 27 в SEQ ID NO. 13 (идентифицированного с помощью rs7163862), где SEQ ID NO. 13 представляет собой участок геномной нуклеотидной последовательности GTP циклогидролазы 1 регуляторного белка обратной связи (GCHFR);
(viii) генотип SNP-локуса в положении 27 в SEQ ID NO. 14 (идентифицированного с помощью rs12659), где SEQ ID NO. 14 представляет собой участок геномной нуклеотидной последовательности белка-носителя восстановленного фолата (RCF2);
(ix) генотип SNP-локуса в положении 27 в SEQ ID NO. 15 (идентифицированного с помощью rs202676), где SEQ ID NO. 15 представляет собой участок геномной нуклеотидной последовательности фолатгидролазы (простат-специфический мембранный антиген) 1 (FOLH1);
(х) генотип SNP-локуса в положении 27 в SEQ ID NO. 16 (идентифицированного с помощью rs2297291), где SEQ ID NO. 16 представляет собой участок геномной нуклеотидной последовательности белка-носителя восстановленного фолата (RCF1);
(xi) генотип SNP-локуса в положении 27 в SEQ ID NO. 17 (идентифицированного с помощью rs 1051266), где SEQ ID NO. 17 представляет собой участок геномной нуклеотидной последовательности белка-носителя восстановленного фолата (RCF1);
(xii) генотип SNP-локуса в положении 27 в SEQ ID NO. 18 (идентифицированного с помощью rs8007267), где SEQ ID NO. 18 представляет собой участок геномной нуклеотидной последовательности GTP циклогидролазы 1 (GCH1);
(xiii) генотип SNP-локуса в положении 27 в SEQ ID NO. 19 (идентифицированного с помощью rs7639752), где SEQ ID NO. 19 представляет собой участок геномной нуклеотидной последовательности холин-фосфат цитидилтрансферазы A (PCYT1A);
(xiv) генотип SNP-локуса в положении 27 в SEQ ID NO. 20 (идентифицированного с помощью rs6275), где SEQ ID NO. 20 представляет собой участок геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
(xv) генотип SNP-локуса в положении 27 в SEQ ID NO. 21 (идентифицированного с помощью rs1079596), где SEQ ID NO. 21 представляет собой участок геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
(xvi) генотип SNP-локуса в положении 27 в SEQ ID NO. 22 (идентифицированного с помощью rs11240594), где SEQ ID NO. 22 представляет собой участок геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
(xvii) генотип SNP-локуса в положении 27 в SEQ ID NO. 23 (идентифицированного с помощью rs4633), где SEQ ID NO. 23 представляет собой участок геномной нуклеотидной последовательности катехин-O-метилтрансферазы (СОМТ);
(xviii) генотип SNP-локуса в положении 27 в SEQ ID NO. 24 (идентифицированного с помощью rs4680), где SEQ ID NO. 24 представляет собой участок геномной нуклеотидной последовательности катехин-O-метилтрансферазы (СОМТ);
(xix) генотип SNP-локуса в положении 27 в SEQ ID NO. 25 (идентифицированного с помощью rs250682), где SEQ ID NO. 25 представляет собой участок геномной нуклеотидной последовательности 3 представителя 6 семейства переносчиков растворенных веществ (транспортер нейротрансмиттера допамина), (SLC6A3);
(хх) генотип SNP-локуса в положении 27 в SEQ ID NO. 26 (идентифицированного с помощью rs2277820), где SEQ ID NO. 26 представляет собой участок геномной нуклеотидной последовательности формиминотрансферазы циклодеаминазы (FTCD);
(xxi) генотип SNP-локуса в положении 27 в SEQ ID NO. 27 (идентифицированного с помощью rs2236225), где SEQ ID NO. 27 представляет собой участок геномной нуклеотидной последовательности метилентетрагидрофолат дегидрогеназы (NADP+зависимой) 1 (MTHFD1));
(xxii) уровень экспрессии SAM и SAH;
(xxiii) уровень экспрессии 4-HNE;
(xxiv) уровень экспрессии hsCRP; и любую их комбинацию; и
(b) детектирование необязательно с помощью искусственного устройства, на основе определенных параметров, по меньшей мере, двух биомаркеров, наличия, по меньшей мере, одного состояния (включая, например, по меньшей мере, двух состояний, по меньшей мере, трех состояний, по меньшей мере, четырех состояний или больше), выбранного из следующих состояний (А)-(Х):
(A) SNP в положении 677 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 7 (идентифицированного с помощью rs1801133), включающего, по меньшей мере, один аллель с тимином «Т»;
(B) SNP в положении 1793 в SEQ ID NO. 1 или в положении 27 в SEQ ID NO. 8 (идентифицированного с помощью rs2274976), включающего, по меньшей мере, один аллель с аланином «А»;
(C) SNP в положении 2756 в SEQ ID NO. 2 или положение 27 в SEQ ID NO. 9 (идентифицированного с помощью rs1805087), включающего, по меньшей мере, один аллель с гуанином «G»;
(D) SNP в положении 66 в SEQ ID NO. 3 или в положении 27 в SEQ ID NO. 10 (идентифицированного с помощью rs1801394), включающего, по меньшей мере, один аллель с гуанином «G»;
(Е) SNP в положении 27 в SEQ ID NO. 11 (идентифицированного с помощью rs1006737), включающего, по меньшей мере, один аллель с аланином «А»;
(F) SNP в положении 27 в SEQ ID NO. 12 (идентифицированного с помощью rs1 883729), включающего, по меньшей мере, один аллель с аланином «А»;
(G) SNP в положении 27 в SEQ ID NO. 13 (идентифицированного с помощью rs7163862), включающего, по меньшей мере, один аллель с тимином «Т»;
(Н) SNP в положении 27 в SEQ ID NO. 14 (идентифицированного с помощью rs12659), включающего, по меньшей мере, один аллель с тимином «Т»;
(I) SNP в положении 27 в SEQ ID NO. 15 (идентифицированного с помощью rs202676), включающего, по меньшей мере, один аллель с гуанином «G»;
(J) SNP в положении 27 в SEQ ID NO. 16 (идентифицированного с помощью rs2297291), включающего, по меньшей мере, один аллель с аланином «А»;
(К) SNP в положении 27 в SEQ ID NO. 17 (идентифицированного с помощью rs1051266), включающего, по меньшей мере, один аллель с аланином «А»;
(L) SNP в положении 27 в SEQ ID NO. 18 (идентифицированного с помощью rs8007267), включающего, по меньшей мере, один аллель с тимином «Т»;
(М) SNP в положении 27 в SEQ ID NO. 19 (идентифицированного с помощью rs7639752), включающего, по меньшей мере, один аллель с аланином «А»;
(N) SNP в положении 27 в SEQ ID NO. 20 (идентифицированного с помощью rs6275), включающего, по меньшей мере, один аллель с тимином «Т»;
(О) SNP в положении 27 в SEQ ID NO. 21 (идентифицированного с помощью rs1 079596), включающего, по меньшей мере, один аллель с тимином «Т»;
(Р) SNP в положении 27 в SEQ ID NO. 22 (идентифицированного с помощью rs11240594), включающего, по меньшей мере, один аллель с аланином «А»;
(Q) SNP в положении 27 в SEQ ID NO. 23 (идентифицированного с помощью rs4633), включающего, по меньшей мере, один аллель с аланином «А»;
(R) SNP в положении 27 в SEQ ID NO. 24 (идентифицированного с помощью rs4680), включающего, по меньшей мере, один аллель с гуанином «G»;
(S) SNP в положении 27 в SEQ ID NO. 25 (идентифицированного с помощью rs250682), включающего, по меньшей мере, один аллель с цитозином «С»;
(Т) SNP в положении 27 в SEQ ID NO. 26 (идентифицированного с помощью rs2277820), включающего, по меньшей мере, один аллель с тимином «Т»;
(U) SNP в положении 1958 SEQ ID NO. 27 (идентифицированного с помощью rs2236225), включающего, по меньшей мере, один аллель с аланином «А»;
(V) соотношение уровня экспрессии SAM к SAH меньше, чем предварительно определенное соотношение;
(W) уровень экспрессии 4-HNE выше, чем предварительно определенное эталонное значение;
(X) экспрессия hsCRP выше, чем около 2,3 мг на литр по измерению в образце плазмы; и любая их комбинация.
В некоторых воплощения данного аспекта и во всех других аспектах, описанных в данном документе, любой из SNP, описанных в данном документе, может включать один или два фолат-респонсивных аллеля. Исключительно в качестве примера, SNP в положении 677 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 7 (идентифицированного с помощью rs1801133) может включать один аллель с тимином «Т» или два аллеля с тимином «Т». Не желая быть связанными теорией, хотим отметить, что человек, определенный как несущий два фолат-респонсивных аллеля в локусе SNP, описанном в данном документе, может показать больший ответ на режим лечения, включающий фолат-содержащее соединение, чем человек с одним фолат-респонсивным аллелем в том же SNP-локусе.
В зависимости от дизайна праймеров и зондов, состояния SNP (A)-(U) также могут быть представлены аллелями, комплементарными соответствующим фолат-респонсивным аллелям, описанным в данном документе. Например, вместо детектирования наличия SNP в положении 677 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 7 (идентифицированного с помощью rs1801133), содержащий, по меньшей мере, один аллель с тимином «Т», специалист в данной области может легко разработать праймеры и/или зонды для последовательности, комплементарной SEQ ID NO. 7 для поиска SNP в этом же расположении, содержащем, по меньшей мере, один аллель «А» вместо этого. Соответственно, в некоторых воплощениях данного аспекта и всех других аспектов, описанных в данном документе, наличие, по меньшей мере, одного состояния (включая, например, по меньшей мере, двух состояний, по меньшей мере, трех состояний, по меньшей мере, четырех состояний или больше), выбранного из состояний (A)-(U), может быть указано путем детекции наличия комплементарного аллеля фолат-респонсивного аллеля, как показано выше, а также в Таблице 42 ниже.
На основании анализа результатов из стадии (b) если детектируется, по меньшей мере, одно из состояний (А)-(Х), описанных выше, то анализ может дополнительно включать выбор человека и необязательно назначение человеку режима лечения, включающего эффективное количество фолат-содержащего соединения.
Любая комбинация, по меньшей мере, двух биомаркеров (i)-(xxiv), описанных в данном документе, может определяться в тестируемом образце для анализа, описанного в данном документе. Типичные комбинации, по меньшей мере, двух биомаркеров, описанных в данном документе, могут включать генотипы, по меньшей мере, двух или более SNP-локусов (например, по меньшей мере, трех SNP-локусов, по меньшей мере, четырех SNP-локусов, по меньшей мере, пяти SNP-локусов или больше); или генотип, по меньшей мере, одного или более SNP-локусов (например, включая, по меньшей мере, два SNP-локуса или больше) и уровень экспрессии, по меньшей мере, одного или более периферического биомаркера (например, 4-HNE, SAM, SAH); или уровень экспрессии, по меньшей мере, двух периферических биомаркеров (например, 4-HNE, SAM, SAH). В зависимости от выбранных комбинаций, по меньшей мере, двух биомаркеров, описанных в данном документе, тестируемый образец может быть подвергнут одному или нескольким анализам, например, включающим в частности, анализы генотипирования, анализы экспрессии (например, на уровне белка и/или транскрипта), или любую их комбинацию.
Соответственно, в некоторых воплощениях, анализ может включать осуществление на тестируемом образце человека, который диагностирован как страдающий от депрессии или имеющий риск развития депрессии, с помощью, по меньшей мере, одного анализа генотипирования, адаптированного для определения генотипов, по меньшей мере, двух локусов, где указанные, по меньшей мере, два локуса представляют собой: (i) положение 677 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 7 (идентифицированные с помощью rs1801133) и (ii) положение 2756 в SEQ ID NO. 2 или положение 27 в SEQ ID NO. 9 (идентифицированные с помощью rs1805087). В таком воплощении детектирование, по меньшей мере, одного SNP в каждом положении 677 в SEQ ID NO. 1 (или в положении 27 в SEQ ID NO. 7), включающем, по меньшей мере, один аллель с тимином «Т» или в положении 2756 в SEQ ID NO. 2 (или в положении 27 в SEQ ID NO. 9), включающем, по меньшей мере, один аллель с гуанином «G», или детектирование обоих вышеупомянутых SNP указывает на выбор человека и необязательное введение ему режима лечения, включающего эффективное количество фолат-содержащего соединения.
В некоторых воплощениях тестируемый образец может быть подвергнут, по меньшей мере, одному анализу генотипирования, адаптированному для определения генотипов, по меньшей мере, трех локусов, по меньшей мере, четырех локусов, по меньшей мере, пяти локусов, по меньшей мере, шести локусов, по меньшей мере, семи локусов, по меньшей мере, восьми локусов, по меньшей мере, девяти локусов, по меньшей мере, десяти локусов или больше. Дополнительные локусы для исследования могут быть выбраны из любых комбинаций биомаркеров (i)-(xxi).
В некоторых воплощениях, анализ генотипирования может включать стадию амплификации тестируемого образца с набором праймеров, фланкирующих любой из SNP, описанных в данном документе. В некоторых воплощениях, по меньшей мере, два (например, по меньшей мере, три, по меньшей мере, четыре, по меньшей мере, пять или более) набора праймеров, амплифицирующих, по меньшей мере, два (например, по меньшей мере, три, по меньшей мере, четыре, по меньшей мере, пять или более) SNP, могут использоваться в анализе мультиплексной амплификации.
В некоторых воплощениях, тестируемый образец может подвергаться воздействию для определения параметров, по меньшей мере, трех, по меньшей мере, четырех, по меньшей мере, пяти или более биомаркеров (i)-(xxiv), описанных в данном документе. Например, в некоторых воплощениях, анализ может включать: (а) воздействие на тестируемый образец с помощью одного или более чем одного анализа (например, анализы генотипирования и/или экспрессии) для определения наличия или отсутствия, по меньшей мере, одного из следующих состояний:
i. соотношение экспрессии s-аденозилметионина (SAM) к s-аденозилгомоцистеину (SAH) меньше, чем предварительно определенное эталонное соотношение;
ii. экспрессия 4-гидроксиноненаля (4-HNE) больше, чем предварительно определенное эталонное значение;
iii. однонуклеотидный полиморфизм (SNP) в положении 677 в SEQ ID NO. 1 (или в положении 27 в SEQ ID NO. 7), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO.1 и SEQ ID NO. 7, каждая независимо представляет собой участок геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR);
iv. SNP в положении 2756 в SEQ ID NO.2 (или положении 27 в SEQ ID NO. 9), содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 2 и SEQ ID NO. 9 каждая независимо являются частью геномной нуклеотидной последовательности метионинсинтазы (MTR); и
v. SNP в положении 66 в SEQ ID NO. 3 (или в положении 27 в SEQ ID NO. 10), содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 3 и SEQ ID NO. 10, каждая независимо представляет собой участок геномной нуклеотидной последовательности редуктазы метионинсинтазы (MTRR);
В этих воплощениях детекция наличия, по меньшей мере, одного из этих состояний свидетельствует о том, что субъекту рекомендуется режим лечения, включающий фолат-содержащее соединение. В некоторых воплощениях, если ни одно из состояний, описанных в данном документе, не наблюдается, субъекту не рекомендуется режим лечения, включающий фолат-содержащее соединение.
В некоторых воплощениях данного аспекта и всех других аспектах, описанных в данном документе, если соотношение экспрессии SAM к SAH составляет менее, чем предварительно определенное эталонное соотношение, например менее чем 3,0, или менее чем около 2,8 по измерениям в образце плазмы, то субъекту может быть рекомендовано и/или необязательно назначен режим лечения, включающего фолат-содержащее соединение. В одном воплощении соотношение экспрессии SAM к SAH, составляющее менее чем 2,71 (по измерениям в образце плазмы), является показателем для того, чтобы рекомендовать и/или необязательно назначить субъекту режим лечения, включающий фолат-содержащее соединение. В некоторых воплощениях, если соотношение экспрессии SAM к SAH составляет, по меньшей мере, 2,71 или выше, чем 2,71 согласно измерениям в образце плазмы, то субъекту не рекомендуется назначить режим лечения, включающий фолат-содержащее соединение. В зависимости от источника тестируемого образца, например, образец крови по сравнению с буккальным образцом, предварительно определенное эталонное соотношение для образца крови может отличаться от значения, например, для буккального образца.
В некоторых воплощениях любого из аспектов, описанных в данном документе, когда экспрессия 4-HNE составляет более, чем предварительно определенное эталонное значение, например, больше чем 3 мг на литр, или больше чем около 3,2 мг на литр (согласно измерениям в образце плазмы), то субъекту может быть рекомендован и/или необязательно назначен режим лечения, включающий фолат-содержащее соединение. В одном воплощении если экспрессия 4-HNE составляет, по меньшей мере, 3,28 мг на литр или больше (согласно измерениям в образце плазмы), то субъекту может быть рекомендован и/или необязательно назначен режим лечения, включающий фолат-содержащее соединение. В некоторых воплощениях, если экспрессия 4-HNE составляет менее чем 3,28 мг на литр плазмы согласно измерениям в образце плазмы, то субъекту не рекомендуется назначать режим лечения, включающий фолат-содержащее соединение. В зависимости от источника тестируемого образца, например образец крови по сравнению с буккальным образцом, предварительно определенное эталонное значение для образца плазмы может отличаться от значения, например, для буккального образца.
В некоторых воплощениях данного аспекта и всех других аспектах, описанных в данном документе, анализ может дополнительно включать определение того страдает ли человек ожирением или нет. Если человек определен как страдающий ожирением, то в таком случае человек отбирается для режима лечения и ему необязательно назначается режим лечения, включающий эффективное количество фолат-содержащего соединения. Способы определения ожирения у человека известны в данной области и могут включать в частности измерение индекса массы тела (BMI), измерение абдоминального жира (например, с помощью измерения обхвата талии или соотношения талии к бедрам), измерение жира тела, толщины кожных складок, подводное взвешивание (денситометрия), плетизмография с вытеснением воздухом, компьютерная томография (СТ) и магнитно-резонансная томография (MRI), и двухэнергетическая рентгеновская абсорбциометрия (DEXA), и любые их комбинации.
Ожирение может определяться клинически различными способами. Например, ожирение может быть определено по значению индекса массы тела (BMI), по меньшей мере, около 30 кг/м2 или выше. В другом воплощении ожирение может быть определено по избыточному абдоминальному жиру (например, с помощью измерения обхвата талии или соотношения талии к бедрам). Например, избыток абдоминального жира может быть клинически определен как обхват талии >40 дюймов (>102 см) у мужчин и >35 дюймов (>88 см) у женщин. В ином случае, абдоминальное ожирение может быть определено как соотношение талии к бедрам выше 0,95 для мужчин и выше 0,80 для женщин). В некоторых воплощениях ожирение может быть определено по проценту жира тела, например, ожирение определяется как процент жира тела, по меньшей мере, около 32% или больше у женщин и, по меньшей мере, около 255 или больше у мужчин.
В одном воплощении измерение BMI может быть использовано для определения, страдает ли человек ожирением. В таком воплощении анализ может дополнительно включать измерение индекса массы тела (BMI) человека для определения, страдает ли человек ожирением или нет, и если значение BMI, измеряемое у субъекта, составляет, по меньшей мере, 30 кг/м2 или выше, то в таком случае человек отбирается и ему необязательно назначается режим лечения, включающий эффективное количество фолат-содержащего соединения. В некоторых воплощениях, если человек имеет значение BMI менее чем 30 кг/м2, может быть не целесообразно рекомендовать или назначать человеку режима лечения, включающий фолат-содержащее соединение.
В некоторых воплощениях, анализ может дополнительно включать определение наличия или отсутствия SNP в положении 1298 в SEQ ID NO: 1, включающем, по меньшей мере, аллель с цитозином «С», где присутствие SNP в положении 1298 в SEQ ID NO: 1, включающем, по меньшей мере, один аллель с цитозином «С», является показателем того, что субъекту рекомендован и/или назначен режим лечения, включающий фолат-содержащее соединение.
В некоторых воплощениях, анализ может дополнительно включать определение экспрессии высокочувствительного с-реактивного белка (hsCRP), где экспрессия hsCRP выше, чем около 2,3 на литр плазмы (согласно измерениям в образце плазмы), является показателем того, что субъекту рекомендован режим лечения, включающий фолат-содержащее соединение. В некоторых воплощениях, если экспрессия hsCRP составляет менее чем 2,3 мг на литр плазмы согласно измерениям в образце плазмы, то субъекту не рекомендуется назначать режим лечения, включающий фолат-содержащее соединение. В зависимости от источника тестируемого образца, например, образец крови по сравнению с буккальным образцом, экспрессия hsCRP для образца плазмы может отличаться от значения, например, для буккального образца.
В некоторых воплощениях анализа, описанного в данном документе, тестируемый образец может анализироваться для определения, по меньшей мере, одного или, по меньшей мере, двух, по меньшей мере, трех, по меньшей мере, четырех, по меньшей мере, пяти или шести из числа состояний, предлагаемых в данном документе. Например, в некоторых воплощениях, тестируемый образец может анализироваться для определения, имеет ли субъект, по меньшей мере, SNP, локализованные в положениях 677 и 2756 локусов MTHFR и MTR, соответственно. В некоторых воплощениях, тестируемый образец может анализироваться для определения того, страдает ли человек ожирением (например, субъект имеет значение BMI равное, по меньшей мере, 30 кг/м2) и имеет ли SNP, расположенные в положениях 2756 и 66 локусов MTR и MTRR, соответственно. В некоторых воплощениях, тестируемый образец может анализироваться для определения того, имеет ли субъект, по меньшей мере, значение BMI, по меньшей мере, 30 кг/м2 и SNP, расположенный в положении 2756 локуса MTR. В некоторых воплощениях, тестируемый образец может анализироваться для определения того, имеет ли субъект, по меньшей мере, соотношение SAM/SAH менее, чем предварительно определенное эталонное соотношение, и определения SNP, локализованного в положении 2756 локуса MTR. В некоторых воплощениях, тестируемый образец может анализироваться для определения того, имеет ли субъект, по меньшей мере, экспрессию 4-HNE выше, чем предварительно определенное эталонное значение, и SNP, локализованные в положении 2756 и 66 локусов MTR и MTRR, соответственно. Как обсуждалось ранее, любые комбинации одного или большего количества из числа состояний (А)-(Х) могут быть проанализированы в одно и то же время или в разные периоды времени.
В некоторых воплощениях, если определено, что, по меньшей мере, два, включая, по меньшей мере, три или более, состояний, предлагаемых в данном документе, присутствуют в тестируемом образце из человека, то режим лечения, включающий фолат-содержащее соединение, отбирается или необязательно назначается человеку.
В некоторых воплощениях, если человек удовлетворяет, по меньшей мере, двум, по меньшей мере, трем или более состояниям (А)-(Х), описанным в данном документе (и ожирению, например, определенному значением BMI, составляющим, по меньшей мере, 30 кг/м2 или больше), то субъекту можно вводить или назначать фолат-содержащее соединение.
В некоторых воплощениях режим лечения может дополнительно включать антидепрессантное лекарственное средство (например, SSRI) для введения в комбинации (например, отдельно или одновременно), с фолат-содержащим соединением.
В некоторых воплощениях, фолат-содержащее соединение может включать соединение L-метилфолат. В одном воплощении, фолат-содержащее соединение может включать 6(8)-5-метилтетрагидрофолат или его производное.
Анализы, способы, системы и/или наборы реактивов, описанные в данном документе, могут осуществляться и/или использоваться третьесторонним поставщиком услуг. Например, третьесторонний поставщик услуг может обеспечивать и изменять услугу, заказанную для определения наличия или отсутствия, по меньшей мере, одного состояния (А)-(Х) в тестируемом образце человека, например, для облегчения выбора режима лечения для человека с депрессией. Соответственно, также предлагаются способы выбора режима лечения для человека. Например, способ включает (а) получение тестируемого образца из человека, диагностированного как страдающего от депрессии или имеющего риск развития депрессии; (b) осуществление на тестируемом образце, по меньшей мере, одного анализа для определения параметров, по меньшей мере, двух биомаркеров (i)-(xxiv), описанных в данном документе (например, в частности, комбинации биомаркеров (i) и (iii)); (с) определение на основе параметров выбранных биомаркеров наличия, по меньшей мере, одного состояния (А)-(Х) (например, в частности, или одного или обоих состояний (А) и (С)); и (d) получение результата на выходе, демонстрирующего детектируется ли, по меньшей мере, одно из состояний (А)-(X) в тестируемом образце. Если присутствует, по меньшей мере, одно состояние, то способ может дополнительно включать выбор и необязательно назначение человеку режима лечения, включающего эффективное количество фолат-содержащего соединения.
В некоторых воплощениях, стадия (b) способа может дополнительно включать необязательно упаковку и доставку тестируемого образца в лабораторию, например, третьестороннему, сертифицированному CLIA поставщику услуг.
В некоторых воплощениях, стадия (d) способа осуществляется с помощью искусственного устройства.
Фолат-респонсивные биомаркеры (i)-(xxiv) и соответствующие состояния (А)-(Х) указывают на режим лечения, включающий фолат-содержащее соединение.
Таблица 41А-41В ниже указывает на фолат-респонсивные биомаркеры (i)-(xxiv) и соответствующие состояния (А)-(Х), наличие, по меньшей мере, одного из которых в тестируемом образце из человека, диагностированного как страдающего, или имеющего риск развития депрессии, указывает на режим лечения, включающий фолат-содержащее соединение, который будет выбран для человека и необязательно назначен человеку.
Ниже представлена Таблица 41А: Фолат-респонсивные биомаркеры (i)-(xxi) используются в анализах, способах, системах и наборах, описанных в данном документе, и соответствуют фолат-респонсивным состояниям (A)-(U). Последовательности человеческого происхождения, показанные в Таблице 41А (включая их комплементарные последовательности), могут обеспечить основу для разработки праймеров и зондов для исследования SNP-биомаркеров, описанных в данном документе.
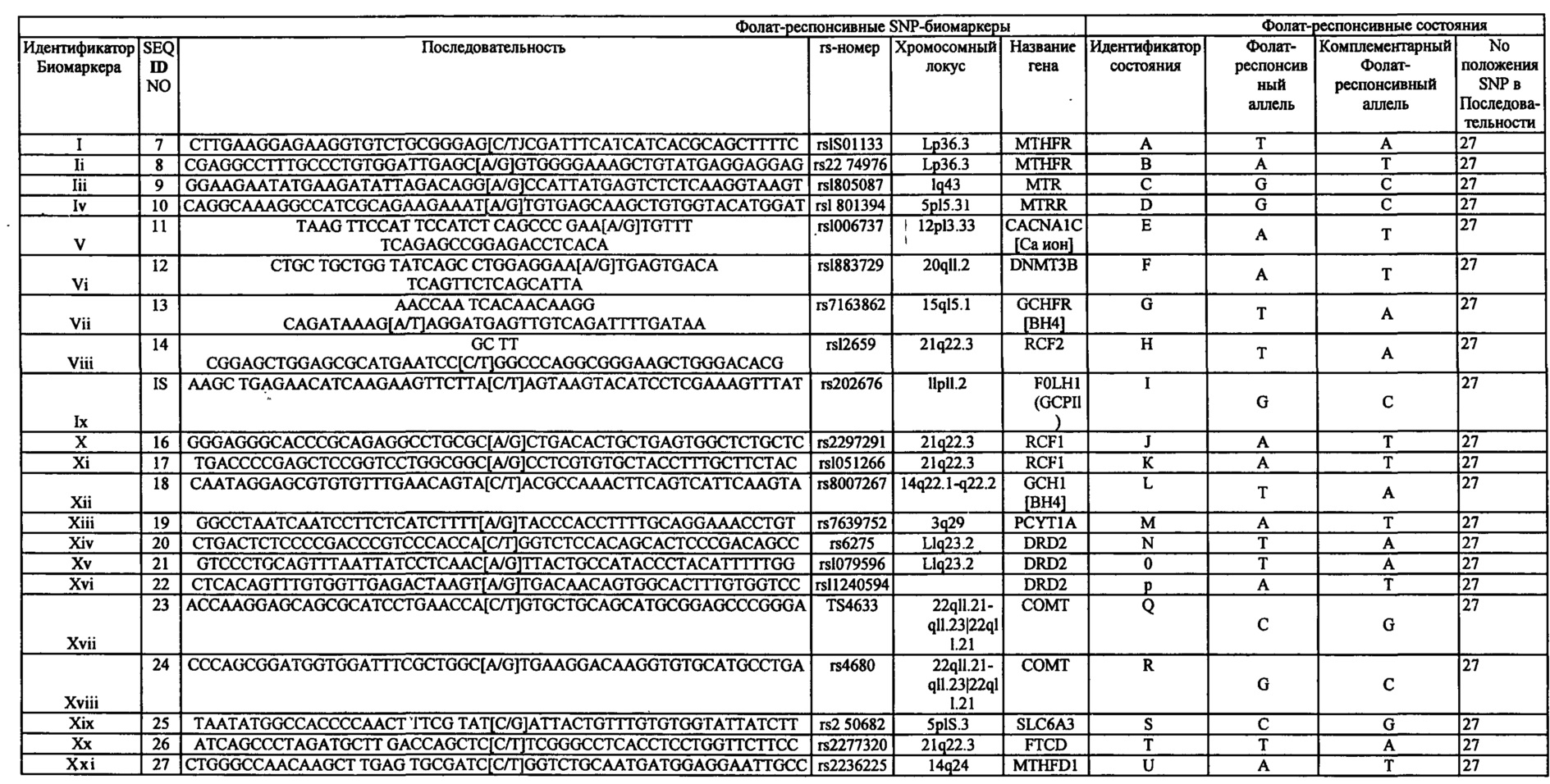
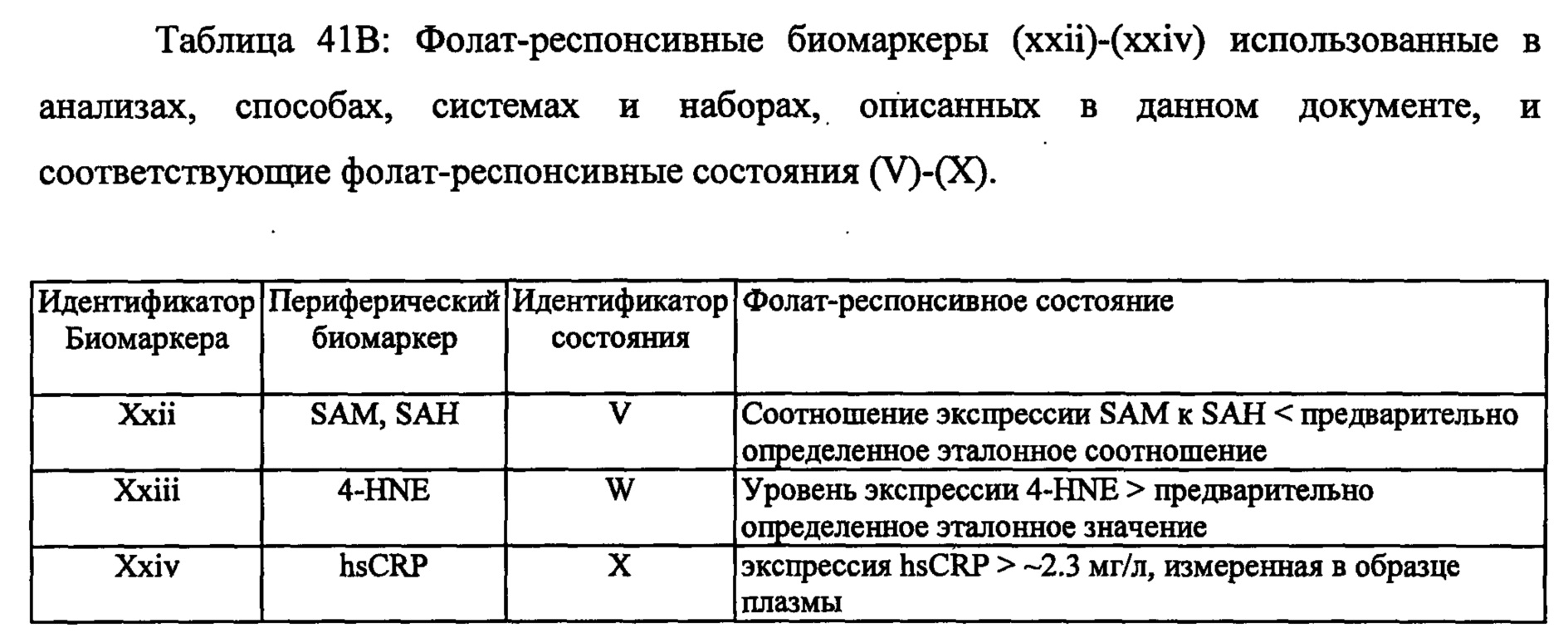

Воплощения различных аспектов, описанных в данном документе, относятся к определению соответствующих параметров (например, генотипов или уровня экспрессии), по меньшей мере, двух биомаркеров (i)-(xxiv) в тестируемом образце человека. В некоторых воплощениях также может быть измерен физический биомаркер (xxv) индикатора ожирения (например, BMI) как показано в Таблице 42, где ожирение (например, определенное по значению BMI, по меньшей мере, около 30 кг/м2 или больше) указывает на то, что режим лечения, включающий фолат-содержащее соединение, рекомендуется и/или назначается человеку. Как показано в Таблице 42, любой из фолат-респонсивных биомаркеров (выбранных из биомаркеров (i)-(xxiv)) может детектироваться в комбинации, по меньшей мере, с одним другим фолат-респонсивным биомаркером, на что указывает символ «х» в таблице, включая, например, по меньшей мере, два, по меньшей мере, три, по меньшей мере, четыре, по меньшей мере, пять, по меньшей мере, шесть, по меньшей мере, семь, по меньшей мере, восемь, по меньшей мере, девять, по меньшей мере, десять, по меньшей мере, одиннадцать, по меньшей мере, двенадцать, по меньшей мере, тринадцать, по меньшей мере, четырнадцать, по меньшей мере, пятнадцать, по меньшей мере, шестнадцать, по меньшей мере, семнадцать, по меньшей мере, восемнадцать, по меньшей мере, девятнадцать, по меньшей мере, двадцать, по меньшей мере, двадцать один, по меньшей мере, двадцать два, по меньшей мере, двадцать три, по меньшей мере, двадцать четыре других фолат-респонсивных биомаркера. Только для примера, учитывая колонку 1 Таблицы 42, фолат-респонсивный биомаркер (i) (соответствующий SNP в положении 27 в SEQ ID NO. 7 или в положении 677 в SEQ ID NO.1) может быть детектирован одним или любой комбинацией других фолат-респонсивных биомаркеров (ii)-(xxv). Например, оба фолат-респонсивных биомаркера (i) и (iii) могут быть отобраны для детекции в анализах, способах, системах и наборах, описанных в данном документе. В другом воплощении, комбинация трех фолат-респонсивных биомаркеров (i), (iii) и (xvii) может быть выбрана для детекции в анализах, способах, системах и наборах, описанных в данном документе. В другом воплощении комбинация трех фолат-респонсивных биомаркеров (i), (iii) и (xxv) может быть выбрана для детекции в анализах, способах, системах и наборах, описанных в данном документе.
Метилентетрагидрофолатредуктаза (MTHFR). Метилентетрагидрофолат редуктаза (MTHFR) является ферментом, который у человека кодируется геном MTHFR. SEQ ID NO: 1 соответствует части геномной нуклеотидной последовательности человеческого дикого типа или нормального гена MTHFR, полученной из базы данных NCBI (эталонная последовательность NCBI: NM_005957.4), где нуклеотиды в положении 677 и 1298 в SEQ ID NO: 1 являются нормальными (например, дикого типа) аллель «С» и аллель с «А», соответственно. Метилентетрагидрофолатредуктаза катализирует превращение 5,10-метилентетрагидрофолата в 5-метилтетрагидрофолат, косубстрата для реметилирования гомоцистеина в метионин. Ранее было показано, что генетическая вариация в данном гене влияет на восприимчивость к окклюзионному сосудистому заболеванию, дефектам нервной трубки, раку толстой кишки, острому лейкозу, болезни Альцгеймера или сосудистой деменции, а мутации в данном гене ассоциированы с дефицитом метилентетрагидрофолатредуктазы.
Мутация нуклеотида MTHFR в положении 677 в SEQ ID NO: 1 с аллеля с «С» на аллель с «Т» (С677Т) приводит к изменению аминокислотного остатка с аланина на валин в положении 222 соответствующей аминокислотной последовательности (SEQ ID NO: 4). Такая аминокислотная замена кодирует термолабильный фермент с пониженной активностью. Люди с термолабильной формой такого фермента, как правило, имеют повышенный уровень гомоцистеина в крови. Соответственно, в некоторых воплощениях, детекция повышения уровней гомоцистеина в образце крови пациента может указывать на SNP в положении 677 (например, С677Т) гена MTHFR (или SEQ ID NO: 1). В некоторых воплощениях детекция валина в положении 222 (например, A222V) соответствующей аминокислотной последовательности (SEQ ID NO: 4), например, масс-спектрометрией, может указывать на SNP в положении 677 (например, С677Т) гена MTHFR (или SEQ ID NO: 1).
В нуклеотиде 1298 в MTHFR, в общем, возможны два варианта: «А» или «С». MTHFR 1298А (приводящий к Glu в аминокислотном остатке 429) является наиболее распространенной, тогда как 1298С (приводящий к замене на А1а в аминокислотном остатке 429) является менее распространенной. В некоторых воплощениях детекция аланина в положении 429 (Е429А) соответствующей аминокислотной последовательности (SEQ ID NO: 4) может указывать на SNP в положении 1298 гена MTHFR (или SEQ ID NO: 1). Не желая быть связанными теорией, хотим отметить, что предыдущие исследования человеческой рекомбинантной MTHFR показали, что белок, кодируемый 1298С, не может быть отличен от 1298А по показателям активности, термолабильности, высвобождения FAD, или защитного эффекта 5-метил-ТНР (см., например, Yamada K. et al. (2001). Proc. Natl. Acad. Sci. U.S.A. 98 (26): 14853-8). Считается, что мутация С (например, А1298С) по всей видимости не влияет на белок MTHFR или не приводит к термолабильному MTHFR, или не влияет на уровни гомоцистеина.
Способы детекции SNP гена MTHFR, например, С677Т, А1298С или G1793A хорошо известны в данной области, например, включая способы и праймеры, использованные в Пат.No. US 6,833,243, который включен в настоящий документ ссылкой.
Метионинсинтаза (MTR). Метионинсинтаза, также известная как MS, MeSe, MetH, является ферментом, который у человека кодируется геном MTR (5-метилтетрагидрофолат-гомоцистеин метилтрансфераза). SEQ ID NO: 2 соответствует части геномной нуклеотидной последовательности человеческого дикого типа или нормального гена MTR, полученной из базы данных NCBI (эталонная последовательность NCBI: NM_000254.2), где нуклеотид в положении 2756 в SEQ ID NO: 2 является нормальным (например, дикого типа) аллелем с «А». Фермент отвечает за регенерацию метионина из гомоцистеина. Метионинсинтаза образует часть биосинтеза S-аденозилметионина (SAM) и цикла регенерации. Полиморфизм в гене MTR, транзиция А-G в положении 2756 (например, A2756G) в SEQ ID NO: 2 вызывает аминокислотную замену с аспарагиновой кислоты на глицин в кодоне 919 (D919G) соответствующей аминокислотной последовательности (SEQ ID NO: 5). Соответственно, в некоторых воплощениях, детекция глицина в положении 919 (например, D919G) соответствующей аминокислотной последовательности (SEQ ID NO: 5), например, масс-спектрометрией, может указывать на SNP в положении 2756 (например, A2756G) в гене MTR (или SEQ ID NO: 2).
Редуктаза метионинсинтазы (MTRR). Редуктаза метионинсинтазы, также известная как MSR, является ферментом, который у людей кодируется геном MTRR. SEQ ID NO: 3 соответствует части геномной нуклеотидной последовательности человеческого дикого типа или нормального гена MTRR, полученной из базы данных NCBI (эталонная последовательность NCBI: NM_002454.2), где нуклеотид в положении 66 в SEQ ID NO: 3 является нормальным (например, дикого типа) аллелем с «А». Метионин является незаменимой аминокислотой, необходимой для белкового синтеза и одноуглеродного метаболизма. Его синтез катализируется с помощью фермента метионинсинтазы. Метионинсинтаза в конечном счете становится неактивной из-за окисления ее кобаламинового кофактора. Редуктаза метионинсинтазы регенерирует функциональную метионинсинтазу через восстановительное метилирование и является представителем семейства ферредоксин-NADP(+) редуктаз (FNR) электрон-трансфераз. Полиморфизм MTRR, мутация аденина в гуанин в положении 66 (например, A66G) в SEQ ID NO: 3 превращает изолейцин в метионин (I22M) в положении 22 соответствующей аминокислотной последовательности (SEQ ID NO: 6). Соответственно, в некоторых воплощениях, детекция метионина в положении 22 (например, I22M) соответствующей аминокислотной последовательности (SEQ ID NO: 6), например, масс-спектрометрией, может указывать на SNP в положении 66 (например, A66G) в гене MTRR (или SEQ ID NO:3).
Катехол-O-метилтрансфераза (СОМТ). Катехол-O-метилтрансфераза является ферментом, ответственным за разложение допамина и норэпинефрина, например, в префронтальном кортексе. Объекты Met/Met являются более быстрыми метаболизаторами, чем объекты Val/Val, которые ассоциированы с когнитивной дисфункцией и патологией заболевания. В некоторых воплощениях гипометилированное состояние приводит к сверхэкспрессии СОМТ и большей дисфункции. Полиморфизм СОМТ (идентифицированный с помощью rs4680: SEQ ID NO. 24), мутация аденина в гуанин в положении 27 в SEQ ID NO. 24, преобразует валин (Val) в метионин (Met) (Val158Met) в соответствующем положении аминокислотной последовательности. Соответственно, в некоторых воплощениях, детекция метионина в положении 158 (например, V22M) соответствующей аминокислотной последовательности (SEQ ID NO. 28), например, масс-спектрометрией, может указать на SNP в положении 27 в SEQ ID NO. 24.
Переносчики восстановленного фолата 1 и 2 (RCF1 и RCF2). Переносчики восстановленного фолата 1 и 2 (при SLC19A1) являются рецепторами, которые транспортируют 5-MTHF через различные мембраны, включая хороидное сплетение и гемоэнцефалический барьер.
Допаминовый рецептор D2 (DRD2). TaqlB и Н313Н являются полиморфизмами допаминового рецептора, которые действуют на допаминовую передачу плотность рецепторов и антипсихотический ответ.
ДНК (цитозин-5)-метилтрансфераза 3 бета (DNMT3B). ДНК (цитозин-5)-метилтрансфераза 3 бета является геном кодирующим ДНК-метилтрансферазу, которая, как считается, выполняет функцию в de novo метилировании, а не в поддержании метилирования.
Холин-фосфат Цитидилтрансфераза A (PCYT1A). Холин-фосфат Цитидилтрансфераза А (PCYT1A) является ферментом, который способствует трансформации фосфатидилхолдина в холин.
GTP циклогидролаза I (GCH1). GTP циклогидролаза I является частью путей биосинтеза фолата и биоптерина. Она ответственна за гидролиз гуанозин трифосфата (GTP) с образованием 7,8-дигидронеоптерин 3'-трифосфата. GTPCH кодируется геном GCH1 и является скорость-ограничивающим ферментом в биосинтезе тетрабиоптерина (ТНВ, ВН4). GCH1 является незаменимым кофактором в синтезе моноамина и выработке NO.
Фолатгидролаза (простат-специфический мембранный антиген) (FOLHI). FOLH1 также известен как глутамат карбоксипептидаза II, которая является ферментом, который у человека кодируется геном FOLH1 (фолатгидролазы 1). GCPII является мембранным гликопротеином П класса. Он катализирует гидролиз N-ацетиласпартилглутамата (NAAG) в глутамат и N-ацетиласпартат (NAA).
Активный транспортер допамина (DAT). Транспортер допамина (также активный транспортер допамина, DAT,SLC6A3) является трансмембранным белком, который выкачивает нейротрансмиттер допамин снаружи синапса обратно в цитозоль, из которого другие транспортеры изолируют DA и NE в везикулы, для дальнейшего хранения и высвобождения.
Белок-регулятор обратной связи GTP-циклогидролазы 1 (GCHFR). Белок-регулятор обратной связи GTP-циклогидролазы 1 является ферментом, который у человека кодируется геном GCHFR. Белок-регулятор обратной связи GTP-циклогидролазы 1 связывается с и опосредует ингибирование тетрагидробиоптерином GTP-циклогидролазы 1, которая способствует de novo выработке ВН4.
Альфа 1C субъединица потенциалзависимого кальциевого канала L типа (CACNA1C). Ген CACNA1C кодирует альфа-1 субъединицу потенциалзависимого кальциевого канала. Кальциевые каналы опосредуют приток ионов кальция в клетку после поляризации мембраны.
Формиминотрансфераза циклодеаминаза (FTCD). Формиминотрансфераза циклодеаминаза является ферментом, который катализирует преобразование формиминоглутамата и тетрагидрофолата в формиминотетрагидрофолат и глутамат.
Метилентетрагидрофолат дегидрогеназа (NADP+зависимая) 1 (MTHFD 1). Метилентетрагидрофолат дегидрогеназа (NADP+зависимая) 1 является триаллельным геном, который кодирует белок, который обладает тремя различными ферментными активностями, Метилентетрагидрофолат дегидрогеназы, метенилтетрагидрофолат циклогидролазы и формат-тетрагидрофолат лигазы. Каждая из этих активностей катализирует одну из трех последовательных реакций в интерпреобразовании 1-углеродных производных тетрагидрофолата, который является субстратом для метионина, тимидилата, и de novo синтезов пурина. Распространенный однонуклеотидный полиморфизм (SNP) в нуклеотиде 1958 гена MTHFD1 (или в положении 27 в SEQ ID NO: 27) вызывает транзицию «G» в «А», которая приводит к замене аргинина в глутамат в положении аминокислоты 653 в синтетазном домене фермента (см., например, Hoi et al., (1998) «Molecular genetic analysis of the gene encoding the trifunctional enzyme MTHFD (methylenetetrahydrofolate-dehydrogenase, methenyltetrahydrofolate-cyclohydrolase, formyltetrahydrofolate synthetase) in patients with neural tube defects.» Clin Genet 53: 119-25). S-аденозилметионин (SAM) и S-аденозилгомоцистеин (SAH). S-аденозилметионин, широко известный как SAM, SAM-e или AdoMet, является естественным соединением, которое можно найти во всех живых клетках. Данное соединение является одним из наиболее используемых ферментных субстратов в биохимических реакциях, вторым после универсальной молекулы хранения и переноса энергии, аденозилтрифосфата (АТР).
S-аденозилметионин является распространенным косубстратом, вовлеченным в переносы метальных групп. Он образуется из аденозинтрифосфата (АТР) и метионина с помощью метионин-аденозилтрансферазы. Трансметилирование, транссульфурирование и аминопропилирование являются метаболическими путями, которые используют SAM. SAH образуется деметилированием S-аденозил-L-метионина (SAM). Дополнительные подробности о SAM и SAH, включая иммуноанализы для определения SAM, SAH и/или их соотношений, описаны в Пат. Заявка США No. 2009/0263879, которая включена в настоящий документ с помощью ссылки.
4-гидроксиноненаль (4-HNE). 4-Гидроксиноненаль, или 4-гидрокси-2-ноненаль или 4-HNE или HNE, (С9Н16О2), является α,β-ненасыщенным гидроксиалкеналем, который продуцируется перекисным окислением липидов в клетках. 4-HNE является первичным α,β-ненасыщенным гидроксиалкеналем, образованным в данном процессе. Он обнаруживается по всем животным тканям, и в более высоких количествах в ходе окислительного стресса из-за увеличения цепной реакции липидного перекисного окисления, из-за увеличения в стрессовых ситуациях. Считалось, что 4-HNE играет ключевую роль передаче клеточных сигналов во множестве путей от событий клеточного цикла до клеточной адгезии. 4-HNE также рассматривается как возможный причинный агент множества заболеваний, таких как хроническое воспаление, нейродегенеративные заболевания, синдром расстройства дыхания у взрослых, атерогенез, диабет и различные типы злокачественных заболеваний.
Аминокислотными остатками, реагирующими с 4HNE через 1,4-присоединение, являются Cys, His и Lys. Таким образом, в некоторых воплощениях, уровни экспрессии 4-HNE могут быть определены путем измерения уровней экспрессии аддуктов 4-HNE, например, 4-HNE-His. Коммерческие наборы тИФА для измерения аддуктов 4-HNE, например, набор «OxiSelect™ HNE-His Adduct ELISA Kit» доступны, например, в «CellBioLabs».
Тестируемый образец и его сбор и приготовление
Способы сбора тестируемых образцов, по меньшей мере, для одного анализа, осуществляемого в тестах и/или способах, описанных в данном документе, хорошо известны специалистам в данной области. В некоторых воплощениях тестируемый образец подвергаемый анализу, осуществляемому в тестах и способах, описанных в данном документе, получают из биологического образца субъекта. Термин «биологический образец» при использовании в данном документе, обозначает образец, взятый или выделенный из биологического организма, например, клеточного лизата, гомогената или тканевого образца из субъекта или жидкого образца из субъекта. Термин «биологический образец» также включает необработанные или предварительно обработанные (или предварительно процессированные) биологические образцы. В некоторых воплощениях биологический образец может быть биологической жидкостью, включая, без ограничения перечисленным, кровь (включая, цельную кровь, плазму, пуповинную кровь и сыворотку), продукты лактации (например, молоко), амниотические жидкости, мокроту, слюну, мочу, семенную жидкость, спинномозговую жидкость, бронхиальный аспират, пот, слизь, ожиженный кал, синовиальную жидкость, лимфатическую жидкость, слезы, трахеальный аспират и их фракции. В других воплощениях биологический образец может включать клеточный лизат и его фракции. Например, клетки (такие как красные кровяные клетки, тромбоциты, белые кровяные клетки и клетки, циркулирующие в биологической жидкости, описанной в данном документе) могут быть собраны и лизированы для получения клеточного лизата. В некоторых воплощениях, тестируемый образец или биологический образец представляет собой образец крови. В некоторых воплощениях, тестируемый образец или биологический образец представляет собой образец плазмы. В некоторых воплощениях, тестируемый образец или биологический образец представляет собой образец слюны. В некоторых воплощениях, тестируемый образец или биологический образец представляет собой буккальный образец. В некоторых воплощениях, тестируемый образец или биологический образец представляет собой образец мочи.
«Биологический образец» может содержать клетки из субъекта, но термин также относится к неклеточному биологическому материалу, такому как неклеточные фракции крови, слюны, мочи, которые могут быть использованы для измерения уровней экспрессии биомаркера плазмы/сыворотки или определения SNP. В некоторых воплощениях образец происходит из резекции, биопсии или толстоигольной биопсии. Кроме того, могут быть использованы образцы тонкоигольного пунктата. Образцы могут быть либо тканью, залитой в парафин, либо замороженной тканью.
Образец может быть получен удалением образца клеток из субъекта, но также может быть подготовлен с использованием ранее выделенных клеток (например, выделенных другим человеком). Кроме того, биологический образец может быть свежесобранным или ранее собранным образцом.
В некоторых воплощениях тестируемый образец или биологический образец может быть замороженным биологическим образцом, например, замороженной тканью или жидким образцом, таким как моча, кровь, сыворотка или плазма. Замороженный образец может быть разморожен перед использованием способов, тестов и систем, описанных в данном документе. После разморозки замороженный образец может быть отцентрифугирован перед использованием в способах, тестах или системах, описанных в данном документе.
В некоторых воплощениях тестируемый образец или биологический образец могут быть нуклеотидным продуктом, амплифицированным после полимеразной цепной реакции (PCR). Нуклеотидный продукт может включать ДНК, РНК и мРНК и может быть выделен из конкретного биологического образца с помощью любой из множества процедур, которые хорошо известны в данной области, конкретная выбранная процедура выделения является подходящей для конкретного биологического образца. Способы выделения и анализа вариантов нуклеиновых кислот, как описано выше, хорошо известны специалисту в данной области и могут быть обнаружены, например, в Molecular Cloning: A Laboratory Manual, 3rd Ed., Sambrook and Russel, Cold Spring Harbor Laboratory Press, 2001.
В некоторых воплощениях тестируемый образец или биологический образец могут быть обработаны химическими и/или биологическим реактивом. Химические и/или биологические реактивы могут быть использованы для защиты и/или поддержания стабильности образца, включая биомолекулы (например, нуклеиновую кислоту и белок) в них, в ходе обработки. Одним примерным реактивом является ингибитор протеаз, который, в общем, используется для защиты или поддержания стабильности белка в ходе обработки. Кроме того, или в ином случае, химические и/или биологические реактивы могут быть использованы для высвобождения нуклеиновой кислоты и/или белка из образца.
Специалист хорошо осведомлен о способах и процессах, подходящих для предварительной обработки тестируемых или биологических образцов, например, крови, требуемых для определения SNP или уровней экспрессии биомаркеров сыворотки/плазмы, как описано в данном документе.
В некоторых воплощениях, тестируемый образец или биологический образец является образцом крови, например цельной крови, плазмы или сыворотки. В некоторых воплощениях, тестируемый образец или биологический образец представляет собой образец цельной крови. В некоторых воплощениях, тестируемый образец или биологический образец представляет собой образец сыворотки. В некоторых воплощениях, тестируемый образец или биологический образец представляет собой образец плазмы. В некоторых воплощениях образец крови может быть оставлен высыхать при комнатной температуре от около 1 часа до утра, или в холодильнике (низкая влажность) в течение вплоть до нескольких месяцев перед осуществлением анализа, например, SNP-анализа. См., например, Ulvik A. and Ueland P.M. (2001) Clinical Chemistry 47: 2050, for methods of SNP genotyping in unprocessed whole blood and serum by real-time PCR.
К примеру, для сбора образца крови, кровь пациента может быть получена обученным медицинским персоналом прямо в антикоагулянты, такие как цитрат, EDTA PGE и теофиллин. Цельная кровь может быть разделена, на плазму, клетки, и тромбоциты, путем центрифугирования при 3500 g в течение 2 минут с охлаждением. После центрифугирования, надосадочная жидкость является плазмой, а осадок является RBC. Поскольку тромбоциты имеют тенденцию к прикреплению к стеклу, предпочтительно, чтобы пробирки для сбора были силиконизированы. Другой способ выделения красных кровяных клеток (RBC) описан в Best, CA et al., 2003, J. Lipid Research, 44: 612-620.
В ином случае из цельной крови может быть собрана сыворотка. К примеру, около 15 мл цельной крови может быть получено для около 6 мл сыворотки. Кровь может быть собрана в твердую пластиковую или стеклянную пробирку; кровь не будет свертываться в мягком пластике. Цельную кровь оставляют стоять при комнатной температуре в течение 30 минут - 2 часов до образования сгустка. Затем сгусток может быть осторожно отделен от сторон контейнера с помощью стеклянной палочки или деревянной лопатки, а оставшийся образец может быть оставлен в течение ночи при 4°С. После этого, образец может быть центрифугирован, а сыворотка может быть перенесена в чистую пробирку. Сыворотка может быть очищена центрифугированием при 1000 g в течение 10 минут при 4°С. Сыворотка может храниться при -80°С перед анализом. В таких воплощениях каротеноиды могут быть не стабильны в течение длительных периодов времени. Подробно описанное получение сыворотки с помощью пробирок для сбора может быть найдено в патенте США No. 3,837,376, включенном ссылкой. Пробирки для сбора крови также могут быть приобретены у «BD Diagnostic Systems», «Greiner Bio-One» и «Kendall Company».
Цельная кровь вначале может быть разделена на богатую тромбоцитами плазму и клетки (белые и красные клетки крови). Богатая тромбоцитами плазма (PRP) может быть выделена из крови центрифугированием цельной крови с цитратом при 200 g в течение 20 минут. Богатая тромбоцитами плазма затем переносится в новую полиэтиленовую пробирку. Этот PRP затем центрифугируется при 800 g для осаждения тромбоцитов и надосадочная жидкость (бедную тромбоцитами плазму [РРР]) м может быть сохранена для анализа, например, тИФА, на дальнейшей стадии. Тромбоциты затем могут быть осторожно ресуспендированы в буфере, таком как буфер «Tyrodes», содержащий 1 ед./мл PGE2, и осаждены центрифугированием снова. Отмывка может быть повторена дважды подобным образом, перед удалением мембранной фракции тромбоцитов центрифугированием с Triton X, и лизирование осадка тромбоцитов для анализа полученного из тромбоцитов PF4. Тромбоциты могут быть лизированы с помощью 50 мМ Tris HCL, 100-120 мМ Nad, 5 мМ EDTA, 1% таблетки с «Igepal» и ингибиторами протеаз (Complete TM mixture, «Boehringer Manheim», Индианаполис, Индиана).
В одном воплощении тромбоциты отделены от цельной крови и SNP или транскрипты hsCRP могут быть определены посредством этого. Когда цельную кровь центрифугируют как описано в данном документе, для отделения клеток крови от плазмы, в конце центрифугирования формируется осадок с плазмой над ним. Центрифугирование разделяет компоненты крови (RBC, WBC и тромбоциты) по их различным плотностям. RBC плотнее и будут первыми двигаться ко дну пробирки для сбора/центрифугирования, за ними следуют в меньшем количестве белые кровяные клети, и, наконец, тромбоциты. Фракция плазмы является наименее плотной и находится над тромбоцитами. «Лейкотромбоцитарный слой», который содержит основную часть тромбоцитов, будет содержаться между плазмой и над RBC. Центрифугирование цельной крови (с антикоагулянтом, PGE и теофиллином) может дать выделенный богатый тромбоцитами «Лейкотромбоцитарный слой», который лежит сразу над маркером. Лейкотромбоцитарный слой содержит концентрированные тромбоциты и белые кровяные клетки.
В другом воплощении тромбоциты могут быть отделены от крови согласно способам, описанных в пат. США No. 4,656,035 с использованием лектина для агглютинации тромбоцитов в цельной крови. В ином случае, могут быть использованы способы и устройство, описанные в пат. США No. 7,223,346, включающие устройство для сбора тромбоцитов, содержащее центрифужный спин-сепараторный контейнер с полостью, имеющей продольную внутреннюю поверхность для сбора «лейкотромбоцитарного слоя» обогащенного тромбоцитами после центрифугирования. В качестве другой альтернативы могут быть использованы способы и устройство, описанные в WO/2001/066172. Каждый из этих источников включен ссылкой в данный документ.
В другом воплощении, тромбоциты могут быть выделены двумя способами, описанными A.L. Copley and R.В. Houlihan, Blood, 1947, 2:170-181, которые включены в данный документ ссылкой. Оба способа основаны на принципе, по которому слой тромбоцитов может быть получен повторным фракционирующим центрифугированием.
В некоторых воплощениях для получения образца используются устройство и соответствующие способы, например механизмы, описанные в Пат. No. 4,120,448, 5,879,280 и 7,241,281, которые все включены в настоящий документ с помощью ссылки.
Способы для сбора различных типов тестируемого образца известны в данной области и могут быть использованы для получения тестируемого образца для анализов и способов, описанных в данном документе.
SNP, Полиморфизмы и Аллели
Геномы всех организмов подвергаются спонтанной мутации в направлении их продолжающейся эволюции, образующей вариантные формы генетических последовательностей-предшественников (Gusella, Ann. Rev. Biochem. 55, 831-854 (1986)). Сосуществование множества форм генетической последовательности является источником генетических полиморфизмов, включая SNP.
Примерно 90% всех полиморфизмов в человеческом геноме являются SNP. SNP являются однонуклеотидными положениями в ДНК, в которых различные аллели, или альтернативные нуклеотиды, существуют в популяции. Положению SNP (взаимозаменяемо упоминается в данном документе как SNP, сайт SNP, SNP-аллель или SNP-локус) как правило, предшествует или за ним следуют высококонсервативные последовательности аллеля (например, последовательности, которые варьируют менее чем у 1/100 или 1/1000 объектов в популяции). Индивидуум может быть гомозиготным или гетерозиготным по аллелю в каждом положении SNP. SNP может, в некоторых случаях, называться как «cSNP» для обозначения того, что нуклеотидная последовательность, содержащая SNP, является последовательностью, кодирующей аминокислоты.
SNP может возникнуть из-за замены одного нуклеотида на другой в полиморфном участке. Замены могут быть транзициями или трансверсиями. Транзиция является заменой одного пуринового нуклеотида на другой пуриновый нуклеотид, или одного пиримидина - на другой пиримидин. Трансверсия является заменой одного пурина на пиримидин или наоборот. SNP также может быть вариантом однонуклеотидной вставки или делеции, обозначаемым как «in/del» (Weber et al., «Human diallelic insertion/deletion polymorphisms». Am J Hum Genet October 2002; 71(4):854-62).
Тождественная кодоновая замена, или молчащая мутация/SNP (термины «SNP» и «мутация» используются в данном документе взаимозаменяемо), является заменой, которая не приводит к замене аминокислоты из-за вырожденности генетического кода. Замена, которая изменяет кодирование кодона для одной аминокислоты на кодирование кодона для другой аминокислоты (т.е. смысловая кодоновая замена) называется миссенс-мутацией. Бессмысленная мутация приводит к типу смысловой кодоновой замены, в которой образуется стоп-кодон, тем самым приводя к преждевременной терминации полипептидной цепи и к образованию укороченного белка. «Read-Through» мутация является другим типом смысловой кодоновой замены, которая вызывает разрушение стоп-кодона, тем самым приводя к появлению удлиненного полипептидного продукта. Хотя SNP могут быть би-, три- или тетра-аллельными, подавляющее большинство SNP являются биаллельными, и таким образом часто называются как «биаллельными маркерами» или «диаллельными маркерами».
Основная база данных человеческих SNP сохраняется в NCBI как dbSNP, и содержит данные уникальных человеческих SNP, состоящие из 1,78×108 депонированных SNP (идентифицируемых по «ss» номеру) и 5,2×107 эталонных SNP (идентифицируемых по «rs» номеру), по состоянию Build History 135: human_9606 основанной на сборке человеческого генома NCBI 37.3. Номера rs являются уникальными, не изменяются и позволяют проводить анализ индивидуально идентифицированных SNP в любом генетическом образце. По всему описанию, SNP, представленные в данном документе, также могут быть идентифицированы по «rs» номеру. Например, SNP в положении 677 в SEQ ID NO: 1 может быть идентифицирован по rs 1801133; SNP в положении 1298 в SEQ ID NO: 1 может быть идентифицирован по rs 1801131; SNP в положении 2756 в SEQ ID NO: 2 может быть идентифицирован по rs 1805087; SNP в положении 66 в SEQ ID NO: 2 может быть идентифицирован по rs 1801394. С «rs» номерами, известными для каждого SNP, специалист в данной области будет способен определить положение конкретного SNP в соответствующей хромосоме.
В то время как SNP могут предположительно иметь три или четыре аллеля, почти все SNP имеют только два аллеля. Анализ SNP, идентифицированных в данном документе, в общем, относится к двум аллелям, которые перечислены в связи с каждым SNP. Например, указано, что каждый SNP в локусе MTHFR, описанном в данном документе, имеет два аллеля, «С» или «Т» в положении 677 в SEQ ID NO. 1, и «А» или «С» в положении 1298 в SEQ ID NO. 1, где SEQ ID NO. 1 представляет собой участок геномной нуклеотидной последовательности MTHFR. Присутствие, по меньшей мере, одного аллеля с «Т» в положении 677 в SEQ ID NO. 1 и/или, по меньшей мере, один аллель с «С» в положении 1298 в SEQ ID NO. 1 указывает на то, что субъекту с депрессией рекомендован режим лечения, включающий фолат-содержащее соединение. SNP в локусе MTR, описанный в данном документе, является показателем наличия двух аллелей, «А» или «G». Присутствие, по меньшей мере, одного аллеля с «G» в положении 2756 в SEQ ID NO. 2, где SEQ ID NO: 2 является частью геномной нуклеотидной последовательности метионинсинтазы (MTR), указывает на то, что субъекту рекомендуется режим лечения, включающий фолат-содержащее соединение. SNP в локусе MTR, описанный в данном документе, является показателем наличия двух аллелей, «А» или «G». Присутствие, по меньшей мере, одного аллеля с «G» в положении 66 в SEQ ID NO. 3, где SEQ ID NO. 3 является частью геномной нуклеотидной последовательности редуктазы метионинсинтазы (MTRR), указывает на то, что субъекту рекомендуется режим лечения, включающий фолат-содержащее соединение.
Специалист в данной области легко распознает, что молекулы нуклеиновой кислоты могут быть двухцепочечными молекулами и что ссылка на конкретный участок на одной цепи означает также соответствующий участок на комплементарной цепи. В определенном SNP-положении, SNP-аллели, или нуклеотидной последовательности, ссылка на аденин «А», тимин «Т» (уридин «U»), цитозин «С», или гуанин «G» в конкретном участке на одной цепи молекулы нуклеиновой кислоты также определяет тимин «Т» (уридин «U»), аденин «А», гуанин «G» или цитозин «С» (соответственно) в соответствующем участке комплементарной цепи молекулы нуклеиновой кислоты. Таким образом, ссылка может быть дана на любую цепь в целях указания конкретной SNP-позиции, SNP-аллеля или нуклеотидной последовательности. Зонды и праймеры могут быть разработаны для гибридизации с любой цепью, а способы генотипирования SNP, описанные в данном документе могут, в общем, быть нацелены на любую цепь.
Соответственно, формула изобретения предназначена для покрытия анализа также и противоположной цепи. Для анализа противоположной цепи SNP в MTHFR -локусе являются аллелем «А» в положении 677 или аллелем с «G» в положении 1298 комплементарной последовательности SEQ ID NO. 1, где SEQ ID NO. 1 являются частью геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR); кроме того SNP в MTR-локусе является аллелем с «С» в положении 2756 комплементарной последовательности SEQ ID NO. 2, где SEQ ID NO. 2 являются частью геномной нуклеотидной последовательности метионинсинтазы (MTR); и SNP в MTRR-локусе является аллелем с «С» в положении 66 комплементарной последовательности SEQ ID NO. 3, где SEQ ID NO. 3 представляет собой участок геномной нуклеотидной последовательности редуктазы метионинсинтазы (MTRR).
Способ идентификации SNP может быть либо положительного типа (включение аллеля), либо отрицательного типа (исключение аллеля). Способы положительного типа определяют идентичность нуклеотида, содержащегося в полиморфном участке, тогда как способы отрицательного типа определяют идентичность нуклеотида, отсутствующего в полиморфном участке. Таким образом, участок дикого типа может быть определен либо как дикого типа, либо как не мутантный. Например, биаллельный полиморфный участок, в котором аллель дикого типа содержит тимин, а мутантный аллель содержит цитозин, участок может быть положительно определен как являющийся либо тимином, либо цитозином, или отрицательно определен как не являющийся тимином (и, таким образом, являющийся цитозином) или не являющийся цитозином (и, таким образом, являющийся тимином).
Способы детектирования SNP, раскрытых в данном документе
Согласно одному аспекту, описанному в данном документе, включен способ определения, является ли субъект гомозиготным по полиморфизму, гетерозиготным по полиморфизму или утратившим полиморфизм вообще (т.е. гомозиготным дикого типа). В качестве всего лишь примерного воплощения, предлагается способ детекции изменения С>Т в положении 677 в SEQ ID NO: 1, способ определения аллеля, гетерозиготного по С- и Т-аллелям, или гомозиготного по С-аллелю или Т-аллелю в SNP-локусах. По существу может быть использован любой способ определения любого аллеля в SNP, описанных в данном документе, такой как расщепление ферментами рестрикции, гибридизация аллель-специфичного зонда, удлинение аллель-специфичного праймера, аллель-специфичная амплификация, секвенирование, расщепление 5'-нуклеазой, анализ молекулярных маяков, анализ лигирования олигонуклеотидов, анализ размеров и одноцепочечный конформационный полиморфизм.
В одном воплощении может быть использован способ аллельной дискриминации для идентификации генотипов SNP человека, описанный в данном документе. Такой способ может включать применение различных олигонуклеотидных зондов, например, одного, комплементарного последовательности, имеющей основной аллель, и другого, комплементарного последовательности, имеющей минорный аллель. Способ аллельной дискриминации также включает применение, по меньшей мере, одного, а предпочтительно пары амплификационных праймеров для амплификации эталонного участка локуса MTHFR, MTR или MTRR субъекта. Эталонный участок включает, по меньшей мере, часть человеческого локуса MTHFR, MTR или MTRR.
Для полноразмерных генов целые белок-кодирующие последовательности, SNP-фланкирующие последовательности, могут составлять, например, вплоть до около 10 т.н., 9 т.н., 8 т.н., 7 т.н., 6 т.н., 5 т.н., 4 т.н., 3 т.н., 2 т.н., 1 т.н. на любой стороне SNP. Более того, в таких случаях, выделенная молекула нуклеиновой кислоты включает экзонные последовательности (включая кодирующие белок и/или некодирующие экзонные последовательности), но также может включать интронные последовательности. Таким образом, любая кодирующая белок последовательность может быть либо непрерывной, либо разделенной интронами. Важный момент заключается в том, что нуклеиновая кислота выделена из удаленных и неважных фланкирующих последовательностей и имеет соответствующую длину, так что она может быть подвергнута специфическим манипуляциям или применениям, описанным в данном документе, таким как рекомбинантная белковая экспрессия, приготовление зондов и праймеров для анализа SNP.
Зонд предпочтительно является ДНК-олигонуклеотидом, имеющим длину в диапазоне от около 20 до около 40 нуклеотидных остатков, предпочтительно от около 20 до около 30 нуклеотидных остатков, а более предпочтительно имеющий длину около 25 нуклеотидных остатков. В одном воплощении зонд оказывается неспособным к удлинению катализирующим ПЦР ферментом, таким как Taq-полимераза, например, имеющим флуоресцентный зонд, прикрепленный к одному или обоим его концам. Хотя немеченные олигонуклеотидные зонды могут быть использованы в наборах и способах, описанных в данном документе, зонды предпочтительно детектируемо помечены. Примерные метки включают радионуклиды, светоабсорбирующие химические компоненты (например, красители), флуоресцентные компоненты, и т.п. Предпочтительно, если метка является флуоресцентным компонентом, таким как 6-карбоксифлуоресцеин (FAM), 6-карбокси-4,7,2',7'-тетрахлорфлуоресцеин (ТЕТ), родамин, JOE (2,7-диметокси-4,5-дихлоро-6-карбоксифлуоресцеин), HEX (гексахлоро-6-карбоксифлуоресцеин) или VIC.
В некоторых воплощениях, зонд может содержать как флуоресцентную метку, так и компонент-тушитель флуоресценции, такой как 6-Карбокси-N,N,N',N'-тетраметилродамин (TAMRA) или 4-(4'-диметиламинофенилазо)бензойная кислота (DABCYL). Когда флуоресцентная метка и компонент-тушитель флуоресценции прикреплены к одному и тому же олигонуклеотиду и разделены не более чем около 40 нуклеотидными остатками, а предпочтительно не более чем около 30 нуклеотидными остатками, интенсивность флуоресценции флуоресцентной метки является ослабленной. Когда один или оба из числа флуоресцентной метки и компонента-тушителя флуоресценции отделены от нуклеотида, интенсивность флуоресцентной метки более не ослабляется. Предпочтительно, если зонд для применения в тестах, способах, системах и наборах, описанных в данном документе, имеет флуоресцентную метку, прикрепленную к или около (т.е. в пределах 10 нуклеотидных остатков) одного конца зонда, а компонент-тушитель флуоресценции прикреплен к или около другого конца. Деградация зонда ПЦР-катализирующим ферментом высвобождает, по меньшей мере, одну флуоресцентную метку и компонент-тушитель флуоресценции из зонда, тем самым прерывая тушение флуоресценции и увеличение детектируемой интенсивности флуоресцентных меток. Таким образом, расщепление зонда (который, как описано выше, коррелирует с полной комплементарностью зонда с целевой частью) может быть детектировано как увеличение флуоресценции тестовой смеси.
Если используются различные по детекции метки, то могут быть использованы более чем один меченный зонд. Например, тестовая смесь может содержать первый зонд, который полностью комплементарен целевой части полиморфизма гена MTHFR, MTR или MTRR, к которому прикреплена первая метка, и второй зонд, который полностью комплементарен целевой части основного аллеля или аллеля дикого типа. В некоторых воплощениях, к примеру, тестовая смесь содержит первый зонд, который полностью комплементарен целевой части полиморфизма гена MTHFR, к которому прикреплена первая метка, и второй зонд, который полностью комплементарен целевой части другого гена, например, MTR или MTRR. Когда используются два зонда, зонды являются различными друг другу по детекции, имеющие, например, различный по детекции размер, поглощение, возбуждение, или спектры эмиссии, свойства радиоактивной эмиссии, или т.п. Например, первый зонд может полностью комплементарным целевой части полиморфизма и имеет FAM и TAMRA прикрепленные к или около его противоположных концов. Первый зонд может быть использован в способах, анализах, системах и наборах, описанных в данном документе вместе со вторым зондом, который полностью комплементарен первой части аллеля дикого типа и имеет ТЕТ и TAMRA, прикрепленные к или около его противоположных концов. Усиление флуоресценции FAM (т.е. осуществляемое путем прекращения тушения флуоресценции при деградации первого зонда Taq-полимеразой) может детектироваться при одной длине волны (например, 518 нанометров), а усиление флуоресценции ТЕТ (т.е. осуществляемое путем прекращения тушения флуоресценции при деградации второго зонда Taq-полимеразой) может детектироваться при другой длине волны (например, 582 нанометра).
Любой подход, который детектирует мутации или полиморфизмы в гене, может быть использован для детекции наличия или отсутствия SNP-биомаркеров, описанных в данном документе, включая, без ограничения перечисленным, анализ однонуклеотидного конформационного полиморфизма (SSCP) (Orita et al. (1989) Proc. Natl. Acad. Sci. USA 86:2766-2770), гетеродуплексный анализ (Prior et al. (1995) Hum. Mutat. 5:263-268), лигирование олигонуклеотидов (Nickerson et al. (1990) Proc. Natl. Acad. Sci. USA 87:8923-8927) и гибридизационные анализы (Conner et al. (1983) Proc. Natl. Acad. Sci. USA 80:278-282). Традиционные стратегии на основе ПЦР с Taq-полимеразой, такие как ПЦР-ПДРФ, аллель-специфичная амплификация (ASA) (Ruano and Kidd (1989) Nucleic Acids Res. 17:8392), одномолекулярное разведение (SMD) (Ruano et al. (1990) Proc. Natl. Acad. Sci. USA 87:6296-6300), и комбинированные амплификация и секвенирование (CAS) (Ruano and Kidd (1991) Nucleic Acids Res. 19:6877-6882), являются легко осуществляемыми и высоко чувствительными способами определения гаплотипов (Michalatos-Beloin et al. (1996) Nucleic Acids Res. 24:4841-4843; Bames (1994) Proc. Natl. Acad. Sci. USA 91:5695-5699; Ruano and Kidd (1991) Nucleic Acids Res. 19:6877-6882).
Анализ Полиморфизма Длин Рестрикционных Фрагментов
В некоторых воплощениях рестрикционные ферменты могут быть использованы для идентификации вариаций или полимерного сайта с помощью анализа «полиморфизма длин рестрикционных фрагментов» (ПДРФ или RFLP) (Lentes et al. Nucleic Acids Res. 16:2359 (1988); и С.K. McQuitty et al. Hum. Genet. 93:225 (1994)). В RFLP, по меньшей мере, один целевой полинуклеотид расщепляется с помощью, по меньшей мере, одного рестрикционного фермента и полученные рестрикционные фрагменты разделяются на основании их мобильности в геле. Как правило, меньшие фрагменты мигрируют быстрее, чем большие фрагменты. Следовательно, целевой полинуклеотид, который содержит конкретный участок, распознаваемый рестрикционным ферментом, будет расщеплен на два или большее количество меньших фрагментов, которые будут мигрировать быстрее, чем больший фрагмент, утративший сайт, распознаваемый рестриктазой. Знание нуклеотидной последовательности целевого полинуклеотида, природа полиморфного участка, и знание последовательностей, распознаваемых рестрикционными ферментами, определяет дизайн таких тестов. В другом воплощении, анализ участков рестрикции конкретной нуклеотидной последовательности для идентификации нуклеотида в полиморфном сайте определяется по наличию или отсутствию участка для рестрикционного фермента. Большое количество ферментов рестрикции известно в данной области, и, в совокупности, они способны распознавание, по меньшей мере, одного аллеля из множества полиморфизмов. Однако такие однонуклеотидные полиморфизмы (SNP) редко приводят к изменениям в участке для рестрикционной эндонуклеазы. Таким образом, SNP редко являются детектируемыми анализом длин рестрикционных фрагментов.
Тесты На Основе Лигирования (например, Тест Лигирования Олигонуклеотидов)
Ряд подходов используют ДНК-лигазу, фермент, который может соединять два соседних олигонуклеотида, гибридизованных с ДНК-матрицей. В Тесте Лигирования Олигонуклеотидов (OLA) последовательность, окружающая сайт мутации, вначале амплифицируется и одна цепь служит в качестве матрицы для трех лигируемых зондов, два из которых являются ASO (аллель-специфичными олигонуклеотидами), а третий является общим зондом. Множество подходов может быть использовано для детекции лигированных продуктов, например, ASO с дифференциально меченными флуоресцентными гаптеновыми метками и лигированные продукты детектируемые флуорогенными или колориметрическими твердофазными иммуноферментными анализами (Tobe et al. Nucleic Acid Res, 1996; 24; 3728-32). Для систем на основе электрофореза, применение меток, модифицирующих подвижность, или вариаций в длине зонда в сочетании с детекцией флуоресценции позволяет осуществить мультиплексное генотипирование нескольких однонуклеотидных замен в одной пробирке (Baron et al., 1997; Clinical Chem., 43; 1984-6). При использовании на чипах, ASO могут быть напечатаны в конкретных местах или адресах на чипе, ПЦР-амплифицированная ДНК может быть затем добавлена и лигирование с меченными олигонуклеотидами в конкретных адресах на чипе может быть измерено (Zhong et al., Proc Nati Acad Sci 2003; 100; 11559-64).
Однонуклеотидное удлинение
Однонуклеотидное удлинение или минисиквенирование включает отжиг олигонуклеотидного праймера на одиночной цепи продукта ПЦР и добавление одиночного дидеоксинуклеотида термической ДНК-полимеразой. Олигонуклеотид разработан так, что быть на одно основание короче участка мутации. Включенный дидеоксинуклеотид комплементарен основанию в участке мутации. Подходы могут использовать различные флуоресцентные метки или гаптены для каждого из четырех различных дидеоксинуклеотидов (Pastinen et al., Clin Chem 1996, 42; 1391-7). Дидеоксинуклеотиды отличаются по молекулярной массе и это является основой для способов однонуклеотидного удлинения, с использованием масс-спектрометрии, и генотипирование, основанное на массе удлиненного олигонуклеотидного праймера, может использовать, например, масс-спектрометрию лазерной десорбции-ионизации в присутствии матрицы/время-пролетную или MALDI-TOF (Li et al., Electrophorosis, 1999, 20; 1258-65), которая является количественной и может быть использована для расчета относительного распространения аллеля, делая подход пригодным для других применений, таких как исследования дозы гена (например, для оценки частот аллелей в объединенных образцах ДНК).
Минисеквенирование или микросеквенирование с помощью MALDI-TOF может быть осуществлено средствами, известными специалистам в данной области. В варианте метода MALDI-TOF, некоторые воплощения могут быть использованы для технологии «Mass Array» от фирмы «Sequenom» (www.sequenom.com) (Sauser et al. Nucleic Acid Res, 2000, 28; E13 and Sauser et al. Nucleic Acid Res 2000, 28: E100). а также «GOOD Assay» (Sauer S et al. Nucleic Acid Res, 2000; 28, E13 and Sauer et al. Nucleic Acid Res, 2000; 28: E100).
В некоторых воплощениях варианты MALDI-TOF могут быть осуществлены для анализа вариаций в генах, ассоциированных с SNP, описанными в данном документе. Например, MALDI и электрораспылительная ионизация (ESI) (Sauer S. Clin Chem Acta, 2006; 363; 93-105) также могут быть использованы в различных аспектах, описанных в данном документе.
Генотипирование на основе гибридизации (например, Аллель-специфичная Амплификация (ASA))
Аллель-специфичная амплификация также известна как амплификационная система рефракторных мутаций (ARMS) использует в качестве праймеров ПЦР аллель-специфичные олигонуклеотиды (ASO) и является хорошо разработанным и известным способом генотипирования на основе ПЦР (Newton et al., J Med Genet, 1991; 28; 248-51). Как правило, один из двух олигонуклеотидных праймеров, используемых для ПЦР, связывается с участком мутации, и амплификация имеет место только тогда, когда присутствует нуклеотид мутации, а несовпадение не восприимчиво к амплификации. Полученные продукты ПЦР могут быть проанализированы любыми средствами, известными специалистам в данной области. В варианте данного подхода, названном мутагенно отделенная ПЦР (MS-PCR), используются два праймера ARMS различной длины, один специфичный для нормального гена, а второй - для мутации, для получения продуктов ПЦР различных длин для нормального и мутантного аллелей (Rust et al., Nucl Acids Res, 1993; 21; 3623-9). Последующий гель-электрофорез, например, покажет, по меньшей мере, один из двух аллельных продуктов, с нормальным, мутантными или обоими (гетерозигота) генами. Дополнительный вариант этого создан на основе системы «Masscode System™» (www.bioserve.com), в которой используются низкомолекулярные метки, ковалентно прикрепленные через фоторасщепляемый линкер с праймерами ARMS, при этом каждый праймер ARMS помечен меткой отличающейся массы (Kokoris et al., 2000, 5; 329-40). Каталог ряда меток позволяет одновременно проводить амплификацию/генотипирование (мультиплексирование) 24 различных мишеней в одной реакции ПЦР. Для любой одной мутации генотипирование основано на сравнении относительной распространенности двух релевантных массовых меток с помощью масс-спектрометрии.
Нормальный или мутантный аллели могут быть генотипированы измерением связывания аллель-специфичных олигонуклеотидных (ASO) зондов для гибридизации. В таких воплощениях, два зонда ASO, один комплементарный нормальному аллелю, а другой мутантному аллелю гибридизуются с ПЦР-амплифицированным участком мутации с окружающей ДНК. В некоторых воплощениях амплифицированные продукты могут быть иммобилизованы на твердой поверхности и гибридизованы с радиоактивно меченными олигонуклеотидами, что известно как дот-блот анализ. В альтернативных воплощениях может быть измерено связывание продуктов ПЦР, содержащих измеримую метку (например, биотиновую или флуоресцентную метки) с твердофазным аллель-специфичным олигонуклеотидом. В ином случае, для анализа обратной гибридизации, или «обратного дот-блота» может быть измерено связывание продуктов ПЦР, включающих измеримую метку (например, без ограничения перечисленным, биотиновую или флуоресцентную метки) с твердофазным аллель-специфичным олигонуклеотидом. В некоторых воплощениях применение микрочипов, содержащих сотни ASO, иммобилизованных на поверхностях твердой подложки, для образования массива ASO также может быть использованы для крупномасштабного генотипирования множества одиночных полиморфизмов одновременно, например, с помощью чипа «Affymetrix GENECHIP® Mapping 10K Array», который мог легко быть осуществлен специалистами в данной области.
Гомогенные тесты
В гомогенных анализах, также называемых эрреями в «закрытой пробирке», ДНК и все реактивы, требуемые для амплификации и генотипирования, добавляются одновременно. Генотипирование может быть проведено без какой-либо пост-амплификационной обработки. В некоторых воплощениях одним таким гомогенным тестом является 5'-флуорогенный нуклеазный тест, также известный как тест «TAQMAN®» (Livak et al. Genet Anal, 1999; 14: 143-9), а в альтернативных воплощениях используются анализы кривых плавления FRET-зондов. Такие способы осуществлялись с помощью амплификаторов «реального времени», и с использованием двух дважды меченных гибридизационных ASO-зондов, комплементарных нормальному и мутантных аллелям, где два зонда имеют различные репортерные метки, но общий краситель-тушитель, В таких воплощениях, изменения характеристик флуоресценции зондов при связывании с ПЦР-продуктами целевых генов в ходе амплификации, позволяет осуществлять отслеживание в «реальном времени» амплификации ПЦР, а различия аффинности флуорогенных зондов для продуктов ПЦР нормального и мутантного генов, позволяет осуществлять дифференциацию генотипов. Подход, использует дважды меченные гибридизационные ASO-зонды, комплементарные мутантному и нормальному аллелям. Два зонда имеют различные флуоресцентные репортерные красители, но общий краситель-тушитель. Будучи интактными, зонды не флуоресцируют из-за близости красителя-репортера и красителя-тушителя. В ходе фазы отжига в ПЦР, два зонда конкурируют за гибридизацию со своими целевыми последовательностями, ниже участка праймера и затем расщепляются 5' нуклеазной активностью полиферазы из Thermophilis aquaticus (Taq), при удлинении праймера, что приводит к отделению репортерных красителей от тушителя. Генотипирование определяется измерением интенсивности флуоресценции двух репортерных красителей после ПЦР-амплификации. Таким образом, когда интактные зонды не флуоресцируют из-за близости красителя-тушителя, тогда как в ходе фазы отжига ПЦР зонды конкурируют за гибридизацию целевых последовательностей и отделению одного из зондов от тушителя, что может детектироваться.
Кривая плавления FRET-гибридизации
Анализ кривой плавления FRET-гибридизации является другим подходом, который может быть использован для детекции наличия или отсутствия SNP-биомаркеров, описанных в данном документе. Вкратце, реакция включает два олигонуклеотидных зонда, которые затем в непосредственной близости образуют флуоресцентный комплекс, где один зонд часто называемый зонд-«мутантный сенсор» спроектирован для специфической гибридизации по всему участку мутации, а другой зонд (часто называемый «якорный зонд») гибридизуется в смежном участке. Флуоресцентный свет, излучаемый «донором», возбуждает «акцепторный» флуорофор, образуя уникальный флуорогенный комплекс, который формируется только тогда, когда зонды связываются со смежными участками на амплифицируемой ДНК. «Сенсорный» зонд является комплементарным либо нормальному, либо мутантному аллелям. После завершения ПЦР, нагревание образца при температурах плавления зонда дает кривую зависимости флуоресценции от температуры, которая отличается для мутантного и нормального аллелей.
Вариацией способа FRET-гибридизации является способ «LCGREEN™», который позволяет обойти требования для флуоресцентно меченных зондов вообще. «LCGREEN™» является чувствительным высоко флуорогенным красителем, связывающим двухцепочечную ДНК (дцДНК), который используется для детекции диссоциации немеченных зондов (Liew et al., Clin Chem, 2004; 50; 1156-64 and Zhou et al., Clin Chem, 2005; 51;1761 2). Способ использует немеченные аллель-специфичные олигонуклеотиды, которые предпочтительно являются комплементарными либо мутантному, либо нормальному аллелям, и несовпадение комплекса двухцепочечной ДНК ASO/матрицы приводит к понижению температуры плавления и к более раннему снижению флуоресцентного сигнала связывающего дцДНК красителя с увеличением температуры.
OLA может также быть осуществлен путем применения FRET-зондов (Chen et al., Genome Res, 1998; 8: 549-56). В таком воплощении, смесь ПЦР/лигирования содержит праймеры ПЦР, термостабильную ДНК-полимеразу без 5'-экзонуклеазной активности (для предотвращения расщепления лигированных зондов в ходе фазы лигирования, термостабильной ДНК-лигазы, а также олигонуклеотидов для реакции лигирования. Каждый из ASO лигирования имеет свой акцепторный флуорофор, а третий олигонуклеотид лигирования, который связывается рядом с ASO, имеет донорный флуорофор. Три олигонуклеотида лигирования спроектированы так, чтобы они имели более низкую температуру плавления, чем температура отжига для праймеров ПЦР в целях предотвращения их взаимодействия при амплификации ПЦР. После ПЦР температура понижают, чтобы прошло дотирование. Лигирование приводит к FRET между донорным и акцепторным красителями, и аллели могут быть различены путем сравнения флуоресцентного излучения двух красителей.
Тесты с молекулярными маяками
Кроме того, для детекции наличия или отсутствия SNP-биомаркеров, описанных в данном документе, также могут быть использованы вариации методов, основанных на гомогенной ПЦР и гибридизации для детекции полиморфизмов. Например, применение Молекулярных Маяков (Tyagi et al., Nat Biotech 1998; 16; 49-53) и зондов «SCORPION®» (Thelwell et al. Nucleic Acid Res 2000;28;3752-61). Молекулярные маяки содержат олигонуклеотиды, которые имеют флуоресцентный репортер и красители на их 5' и 3'-концах, при этом центральная часть олигонуклеотида гибридизуется по всей целевой последовательности, но 5' и 3' фланкирующие области комплементарны друг другу. Когда нет гибридизации со своей целевой последовательностью 5' и 3'-фланкирующие области гибридизуются с образованием структуры «петля-на-стебле», и имеется незначительная флуоресценция, из-за близкого расположения репортерного красителя и тушителя. Однако, при гибридизации с их целевой последовательностью, красители разделены и происходит большой рост флуоресценции. Несовпадающие гибриды зонд-мишень диссоциируют при существенно более низких температурах, чем точно совпадающие комплементарные гибриды. Существует ряд вариантов подхода «молекулярных маяков». В некоторых воплощениях такие варианты включают применение зондов «SCORPION®», которые похожи, но включают последовательность праймера ПЦР как часть зонда (Thelwell et al. Nucleic Acid Res 2000;28;3752 61). В другом варианте «дуплексный» формат дает улучшенный флуоресцентный сигнал (Solinas et al., Nucleic Acid Res, 2001,29; E96).
В другом воплощении полиморфизмы могут быть определены генотипированием с помощью гомогенного анализа или анализа в режиме реального времени на образцах цельной крови, без необходимости экстракции ДНК или ПЦР в реальном времени. Такой способ совместим с FRET и «TAQMAN®» (Castley et al., Clin Chem, 2005; 51; 2025-30) позволяя осуществить крайне быстрый скрининг конкретного представляющего интерес полиморфизма.
Флуоресцентная поляризация (FP)
В FP степень, с которой излучаемый свет остается поляризованным в определенной плоскости, является пропорциональной скорости, с которой молекулы вращаются и сталкиваются в растворе. При постоянном давлении, температуре и вязкости, FP непосредственно связана с молекулярной массой флуоресцентного соединения. Следовательно, если малая флуоресцентная молекула включена в более крупную молекулу, происходит рост FP. FP может быть использован при генотипировании представляющих интерес полиморфизмов (Chen et al., Genome Res, 1999; 9: 492-8 and Latif et al., Genome Res, 2001; 11;436-40). FP может быть использован в 5'-нуклеазном тесте (как описано выше), в котором олигонуклеотидный зонд расщепляется на соединения с меньшей молекулярной массой, например, поддающихся анализу с помощью FP, но с дополнительным преимуществом, которое заключается в отсутствие необходимости применения тушителя. Например, в качестве способа минисеквенирования с FP может быть использован набор «Perkin-Elmers AcycloPrime™-FP SNP Detection Kit». После амплификации ПЦР, невключенные праймеры и нуклеотиды деградируют ферментативно, ферменты инактивируются нагреванием, и осуществляется реакция минисеквенирования с использованием ДНК-полимеразы и флуоресцентно-меченных дидеоксинуклеотидов. Затем измеряют FP, как правило, в формате 96-386 луночного планшета на FP-ридере для планшетов.
Пиросеквенирование
В некоторых воплощениях реакция удлинения праймера и анализ осуществляются с помощью PYROSEQUENCING™ (Упсала, Швеция), которая по существу является секвенированием посредством синтеза. Праймер для секвенирования, разработанный так, чтобы он находился за нуклеиновой кислотой, отличающейся между вызывающей заболевание мутацией и нормальным аллелем или различными SNP аллелями, вначале гибридизуется с одноцепочечной, амплифицированной ПЦР ДНК-матрицей из индивидуума, и инкубируется с ферментами, ДНК-полимеразой. АТР-сульфурилазой, люциферазой и апиразой, и субстратами, аденозин 5' фосфосульфатом (APS) и люциферином. Один из четырех деоксинуклеотид трифосфатов (dNTP), например, соответствующий нуклеотиду, присутсвующему в мутации или полиморфизме, затем добавляется в реакцию. ДНК-полимераза катализирует включение dNTP в стандартную ДНК-цепь. Каждое событие включения сопровождается высвобождением пирофосфата (PPi) в количестве, эквимолярном количеству включенного нуклеотида. Затем АТР-сульфурилаза конвертирует PPi в АТР в присутствии аденозин 5' фосфосульфата. Этот АТР управляет опосредованным люциферазой преобразованием люциферина в оксилюциферин, который образует видимый свет в количествах, которые пропорциональны количеству АТР. Свет, вырабатываемый в катализируемой люциферазой реакции, детектируется CCD-камерой и наблюдается в виде пика в PYROGRAM™. Каждый световой сигнал пропорционален количеству включенных нуклеотидов и позволяет ясно определить наличие или отсутствие, например, мутации или полиморфизма. После этого апираза, нуклеотид-деградирующий фермент, непрерывно деградирует включенные dNTP и избыток АТР. Когда деградация заканчивается, добавляется другой dNTP, который соответствует dNTP, присутствующему, например, в выбранном SNP. Добавление dNTP осуществляется каждый в отдельности. Деоксиаденозин альфа-тиотрифосфат (dATPS) используется в качестве замены для естественного деоксиаденозинтрифосфата (dATP), поскольку эффективно используется ДНК-полимеразой, но не распознается люциферазой. Для подробной информации об условиях реакции для пиросеквенирования, см., например, Пат. США No. 6,210,891, включенный в настоящий документ ссылкой).
Анализ «INVADER®»
В ином случае может быть использован анализ «INVADER®» («Third Wave Technologies, Inc», Мэдисон, Висконсин). Этот анализ, в общем, основан на структурно-специфичной нуклеазной активности ряда ферментов, которые используются для расщепления мишень-зависимой расщепляемой структуры, тем самым указывая на присутствие специфических нуклеотидных последовательностей или их специфических вариаций в образце (см., например, Patent No. 6,458,535). Например, операционная (функциональная) система (ОС) «INVADER®» обеспечивает способ детекции и количественной оценки ДНК и РНК. ОС «INVADER®» основана на реакции фермент-субстрат «идеального совпадения». ОС «INVADER®» использует проприентарные ферменты «CLEAVASE®» («Third Wave Technologies, Inc», Мэдисон, Висконсин), которые распознают и разрезают только специфическую структуру, образованную в ходе процесса «INVADER®», где структура отличается между различными аллелями, выбранными для детекции, т.е. вызывающим заболевание аллелем и нормальным аллелем, а также между различными выбранными SNP. В отличие от способов на основе ПЦР, ОС «INVADER®» основана на линейной амплификации сигнала, полученного процессом «INVADER®», а не на экспоненциальной амплификации мишени.
В процессе «INVADER®» два коротких зонда гибридизуются с мишенью с образованием структуры, распознаваемой ферментом «CLEAVASE®». Затем фермент расщепляет зонды для высвобождения короткого ДНК «лоскута». Каждый высвобожденный лоскут связывается с флуоресцентно-меченным зондом и образует другую расщепляемую структуру. Когда фермент «CLEAVASE®» расщепляет меченный зонд, зонд испускает детектируемый флуоресцентный сигнал.
Мутации или полиморфизмы также могут быть детектироваться с помощью аллель-специфичной гибридизации с последующей детекцией различных продуктов гибридизации с помощью MALDI-TOF-MS. В предпочтительном воплощении, детекция усиленных или амплифицированных нуклеиновых кислот, представляющих различные аллели, осуществляется с помощью масс-спектрометрического (MS) анализа с лазерной десорбцией-ионизацией в присутствии матрицы/время-пролетного (MALDI-TOF), описанного в Примерах ниже. Этот способ отличает аллели, на основании их различных масс и может быть применен для анализа продуктов из различных вышеописанных способов удлинения праймеров или процесса «INVADER®».
Способы, основанные на миграции в геле (например, анализ конформационного полиморфизма однонитевой ДНК)
В других воплощениях изменения в электрофоретической подвижности используются для идентификации конкретного аллельного варианта. Например, анализ конформационного полиморфизма однонитевой ДНК (SSCP) может быть использован для обнаружения различий в электрофоретической подвижности между мутантной нуклеиновой кислотой и нуклеиновой кислотой дикого типа (Orita et al. (1989) Proc Natl. Acad. Sol USA 86:2766; Cotton (1993) Mutat. Res. 285: 125-144 и Hayashi (1992) Genet Anal Tech Appi 9: 73-79). Одноцепочечные ДНК фрагменты нуклеиновой кислоты образца и контрольной нуклеиновой кислоты денатурируют и позволяют ренатурировать. Вторичная структура одноцепочечных нуклеиновых кислот варьирует в соответствии с последовательностью, приводя к изменению в электрофоретической подвижности, позволяющей детектировать даже однонуклеотидное изменение. Изменения в подвижности полученных продуктов, таким образом, указывает на изменение основания.
Подходящие контроли и знание о паттернах «нормальной» миграции аллелей дикого типа могут быть использованы для идентификации полиморфных вариантов. Фрагменты ДНК могут быть помечены или детектированы с помощью меченных зондов. Чувствительность анализа может быть усилена с помощью РНК (а не ДНК), в которой вторичная структура является более чувствительной к изменению в последовательности. В другом предпочтительном воплощении целевой способ использует гетеродуплексный анализ для разделения двухцепочечных гетеродуплексных молекул на основании изменений в электрофоретической подвижности (Keen et al. (1991) Trends Genet. 7:5).
В еще одном воплощении идентичность аллельного варианта определяют анализом движения нуклеиновой кислоты, содержащей полиморфный участок в полиакриламидных гелях, содержащих градиент денатурирующего агента, которая тестируется с использованием денатурирующего градиентного гель-электрофореза (DGGE) (Myers et al. (1985) Nature 313: 495). Когда DGGE используется в качестве способа анализа, ДНК будет модифицироваться для того чтобы гарантировать, что она не полностью денатурирована, например, путем добавления с помощью ПЦР GC-блока примерно 40 п.о. тугоплавкой GC-богатой ДНК. В дополнительном воплощении, температурный градиент используется вместо градиента денатурирующего агента для идентификации различий в подвижности контрольной ДНК и ДНК образца (Rosenbaum and Reissner (1987) Biophys Chem 265:1275).
Другие анализы
Для детекции наличия или отсутствия любого из биомаркеров SNP, описанных в данном документе, например, для детекции мутаций в образцах геномной ДНК, кДНК и/или РНК могут быть использованы другие способы генетического скрининга. Широко используемые способы, или недавно разработанные способы, или еще неизвестные способы включены для применения для детекции наличия или отсутствия любого из SNP-биомаркеров, описанных в данном документе. Примеры недавно открытых способов, включают, например, без ограничения перечисленным: SNP-картирование (Davis et al., Methods Mol Biology, 2006; 351;75-92); наночип «Nanogen» (keen-Kim et al., 2006; Expert Rev Mol Diagnostic, 6; 287-294); амплификация по типу катящегося кольца (RCA) объединенная с циркуляционными олигонуклеотидными зондами (с-зондами) для детекции нуклеиновых кислот (Zhang et al., 2006: 363,61-70), система «luminex XMAP» для детекции множественных SNP в одном реакционном сосуде (Dunbar SA, Clin Chim Acta, 2006; 363;71-82; Dunbar et al. Methods Mol Med, 2005; 114: 147-1471) и ферментативные способы детекции мутаций (Yeung et al., Biotechniques, 2005; 38; 749-758).
В одном воплощении, один способ скрининга точечных мутаций основан на расщеплении рибонуклеазой несовпадений пар оснований в гетеродуплексах РНК/ДНК или РНК/РНК. При использовании в данном документе, термин «несовпадение» определяется как область одного или большего количества непарных или несовпадающих нуклеотидов в двухцепочечной РНК/РНК, РНК/ДНК или ДНК/ДНК молекуле. Определение, таким образом, включает несовпадения из-за мутаций вставки/делении, а также одно- или многонуклеотидные точечные мутации.
В таких воплощениях защита от расщепляющих агентов (таких как нуклеаза, гидроксиламин или осмий тетраоксид и с пиперидином) может быть использована для детекции несовпадающих оснований в РНК/РНК, ДНК/ДНК или РНК/ДНК гетеродуплексах (см., например, Myers et al. (1985) Science 230: 1242). В общем, метод «расщепления несовпадения» начинается с получения гетеродуплексов, образованных гибридизацией с контрольной нуклеиновой кислотой, которая необязательно метится, например, РНК или ДНК, содержащей нуклеотидную последовательность аллельного варианта представляющего интерес гена с нуклеиновой кислотой образца, например, РНК или ДНК полученных из образца ткани. Двухцепочечные дуплексы обрабатываются агентом, который расщепляет однонуклеотидные области дуплекса, так что образуются дуплексы, образованные на основании несовпадений пар оснований между цепями контроля и образца. Например, дуплексы РНК/ДНК могут быть обработаны рибонуклеазой, а ДНК/ДНК-гибриды обработаны S1-нуклеазой для ферментативного расщепления несовпадающих областей. В других воплощениях либо ДНК/ДНК-, либо РНК/ДНК-дуплексы могут быть обработаны гидроксиламином или осмий тетраоксидом и пиперидином в целях расщепления несовпадающих областей. После расщепления несовпадающих областей, полученный материал отделяется по размеру на денатурирующих полиакриламидных гелях для определения имеют ли идентичные нуклеотидные последовательности нуклеиновые кислоты контроля и образца или в каких нуклеотидах они отличаются. См., например, патент США No. 6,455,249, Cotton et al. (1988) Proc. Natl. Acad. Sci. USA 85:4397; Saleeba et al. (1992) Methods Enzy. 217:286-295. В другом воплощении нуклеиновая кислота контроля или образца метится для детекции.
В Пат. США 4,946,773 описан анализ расщепления рибонуклеазой А для детекции несовпадений, который включает отжиг тестируемых образцов с РНК-зондом и последующую обработку нуклеотидных дуплексов рибонуклеазой А. Для детекции несовпадений одноцепочечные продукты обработки рибонуклеазой электрофоретически разделяют по размеру и сравнивают с аналогичным образом обработанными контрольными дуплексами. Образцы, содержащие более мелкие фрагменты (продукты расщепления), не наблюдаемые в контрольных дуплексах, засчитываются как положительные. Применение рибонуклеазы I для обнаружения несовпадений также описано в литературе «Promega Biotech». «Promega» продает набор, содержащий рибонуклеазу I, которая, как сообщается, расщепляет три из четырех известных несовпадений.
В одном воплощении, ПЦР длинных фрагментов (LR-PCR) используется для детекции мутаций или полиморфизмов. Продукты LR-PCR генотипируются на предмет мутаций или полиморфизмов с использованием любых способов генотипирования, известных специалистам в данной области, и гаплотипы прогнозируются с помощью математических подходов (например, с помощью алгоритма Кларка (dark (1990) Mol. BioI. Evol. 7: 111-122).
Например, могут быть использованы способы, включая чипы с комплементарными ДНК (кДНК) (Shalon et al., Genome Research 6(7):639-45, 1996; Bernard et al. Nucleic Acids Research 24(8): 143 5-42, 1996), методом твердофазного минисеквенирования. Патент США No. 6,013,431, Suomalainen et al. Mol. Biotechnol. Jun; 15(2): 123-31, 2000), высокоэффективная жидкостная хроматография ионных пар (Doris et al. J. Chromatogr. A can 8; 806(1): 47-60, 1998), и метод с использованием 5'-нуклеаз или ОТ-ПЦР в реальном времени (Holland et al. Proc Nati Acad Sci USA 88: 7276-7280, 1991), или способы удлинения праймеров, описанные в Патенте США No. 6,355,433.
Другой способ детекции мутаций или полиморфизмов заключается в использовании флуоресцентно меченных dNTP/ddNTP. В дополнение к применению флуоресцентной метки в способе твердофазного минисеквенирования, стандартный гель для секвенирования нуклеиновых кислот может быть использован для детекции флуоресцентной метки, включенной в продукт амплификации ПЦР. Праймер для секвенирования разрабатывается для отжига за основанием, отличающим вызывающий заболевание и нормальный аллели или выбранные SNP-аллели. Реакция удлинения праймера осуществляется с помощью терминирующих рост цепи дидеоксирибонуклеозидтрифосфатов (ddNTP), меченных флуоресцентным красителем, одна метка прикреплена к ddNTP добавляемому к стандартной нуклеиновой кислоте, а другая - к ddNTP, добавляемому к целевой нуклеиновой кислоте.
Другие были описаны с помощью белка MutS или других ферментов репарации ДНК для детекции однонуклеотидных несовпадений. Альтернативные способы детекции мутаций делеции, вставки или замены, которые могут быть использованы на практике различными аспектами, описанными в данном документе, раскрыты в Пат. США 5,849,483, 5,851,770, 5,866,337, 5,925,525 и 5,928,870, каждый из которых включен в данный документ ссылкой.
В другом воплощении, процедуры мультиплексной ПЦР, с использованием аллель- специфичных праймеров, могут быть использованы для одновременной амплификации множества областей в целевой нуклеиновой кислоте (заявка РСТ W089/10414), позволяющие осуществить амплификацию, только если конкретный аллель присутствует в образце. Могут быть использованы другие воплощения с использованием процедур управляемого альтернативным праймером включения нуклеотида для анализа полиморфных участков в ДНК, и были описаны (Komher, J. S. et al., Nucl. Acids. Res. 17:7779-7784 (1989); Sokolov, В. P., Nucl. Acids Res. 18: 3671 (1990); Syvanen, A.-C., et al., Genomics 8:684-692 (1990); Kuppuswamy, M.N. et al., Proc. Nad. Acad. Sci. (U.S.A) 88:1143-1147 (1991); Bajaj et al. (No. 5846710); Prezant, T.R. et al. Hum Mutat. 1: 159-164 (1992); Ugozzoli, L. et al., GATA 9:107-112 47 (1992); Nyr6n, P. et al. Anal. Biochem. 208:171-175 (1993)).
Другие известные процедуры амплификации нуклеиновых кислот включают системы амплификации на основе транскрипции (Maiek, L.T. et al. Патент США 5,130,238; Davey, С.et al., европейская Патентная Заявка 329, 822; Schuster et al.) Патент США 5,169, 766; Miller, H.I. et al., РСТ-Заявка W089/06700; Kwoh, D. et al., Proc. Natl. Acad Sci. (U.S.A) 86:1173 Z1989); Gingeras, T.R. et al., РСТ Заявка W088/10315)), или также могут использоваться методы изотермической амплификации (Walker, G.T. et al., Proc. Natl. 4cad Sci. (U.S.A) 89:392-396 (1992)).
Другой способ определения генетической вариации представляет собой применение «генных чипов». Применение микрочипов, содержащих множество последовательностей, становится все более распространенным в данной области.
Зонды могут быть прикреплены к поверхностям для применения в качестве «генных чипов». Такие генные чипы могут быть использованы для детекции генетических вариаций множеством методов, известных специалистам в данной области. В одном методе, олигонуклеотиды располагаются не генном чипе для определения ДНК-последовательностей секвенированием с помощью гибридизационного подхода, таким как изложенный в Патентах США No. 6,025,136 и 6,018,041. Зонды также могут использоваться для флуоресцентного детектирования генетической последовательности. Такие методы описаны, например, в Патентах США No. 5,968,740 и 5,858,659. Зонд также может быть прикреплен к электродной поверхности для электрохимической детекции нуклеотидных последовательностей, таких как описанные Kayyem et al. Патент США No. 5.952,172 и Kelley, S.O. et al. (1999) Nucleic Acids Res. 27:4830-4837.
Примеры идентифицированных полиморфизмов и применения того, что информация в некотором смысле дающая полезную информацию о пациентах, могут быть найдены, например, в Патенте США No. 6,472,157; в Публикациях Патентных Заявок 20020016293, 20030099960, 20040203034; WO 0180896, содержания которых включено в настоящий документ с помощью ссылки.
Определение уровня экспрессии биомаркеров в сыворотке/плазме (например, SAM, SAH, 4-HNE, hsCRP)
По меньшей мере, один из биомаркеров сыворотки/плазмы, описанных в данном документе (например, SAM, SAH, 4-HNE и/или hsCRP) могут быть измерены согласно способам специалистом в данной области. В некоторых воплощениях уровни экспрессии биомаркеров в сыворотке/плазме (например, SAM, SAH, 4-HNE, hsCRP) могут быть определены путем измерения уровней белка. В некоторых воплощениях уровни экспрессии биомаркеров в сыворотке/плазме (например, hsCRP) может быть определено измерением уровней мРНК.
Определение уровня экспрессии путем измерения белка: Исключительно для примера, уровни биомаркеров в сыворотке/плазме (например, SAM, SAH, 4-HNE и/или hsCRP) может быть измерено при контакте тестируемого образца со связывающим компонентом на основе антитела, который специфически связывает, по меньшей мере, один из биомаркеров сыворотки/плазмы, описанных в данном документе, или их фрагмент. Образование комплекса антитело-белок затем детектируется множеством способов, известных в данной области.
Термин «связывающий компонент на основе антитела» или «антитело» может включать иммуноглобулиновые молекулы и иммунологически активные детерминанты иммуноглобулиновых молекул, например, молекул, которые содержат антигенсвязывающий участок, который специфически связывает (иммунореагирует с) белками сыворотки/плазмы (например, SAM, SAH, 4-HNE и/или hsCRP). Подразумевается, что термин «связывающий компонент на основе антитела» включает цельные антитела, например, любого изотипа (IgG, IgA, IgM, IgE, и т.п.), и включает их фрагменты, которые также специфически реагируют с белками сыворотки/плазмы (например, SAM, SAH, 4-HNE и/или hsCRP). Антитела могут быть фрагментированы с использованием подходящих методов. Таким образом, термин включает сегменты протеолитически расщепленных или рекомбинантно полученных частей молекулы антитела, которые способны селективно реагировать с определенным белком. Неограничивающие примеры таких протеолитических и/или рекомбинантных фрагментов включают Fab, F(ab')2, Fab' Fv, dAb и одноцепочечные антитела (scFv), содержащие VL и VH домены, объединенные пептидным линкером. scFv могут быть ковалентно или не ковалентно соединены с образованием антител, имеющих два или более сайтов связывания. Таким образом, «связывающий компонент на основе антитела» включает поликлональные, моноклональные или другие очищенные препараты антител и рекомбинантных антител. Также подразумевается, что термин «связывающий компонент на основе антитела» включает гуманизированные антитела, биспецифичные антитела, и химерные молекулы, имеющие, по меньшей мере, одну антиген-связывающую детерминанту, полученную из молекулы антитела. В некоторых воплощениях, связывающий компонент на основе антител может быть меченым детектируемой меткой.
«Меченное антитело», при использовании в данном документе, включает антитела, которые мечены детектируемыми средствами, и включает, без ограничения перечисленным, антитела, которые ферментативно, радиоактивно, флуоресцентно, и хемилюминесцентно мечены. Антитела также могут быть мечены с помощью детектируемой метки, такого как с-Мус, НА, VSV-G, HSV, FLAG, V5, или HIS. Детекция и количественная оценка белков сыворотки/плазмы (например, SAM, SAH, 4-HNE и/или hsCRP) в тестируемых образцах коррелирует с интенсивностью сигнала, испускаемого детектируемо меченным антителом.
В некоторых воплощениях, связывающий компонент на основе антител может быть меченым детектируемой меткой путем связывания антитела с ферментом. Фермент, в свою очередь, при экспонировании своему субстрату, будет реагировать с субстратом таким образом, чтобы продуцировать химический компонент, который может быть детектирован, например, спектрофотометрическими, флуорометрическими или визуальными средствами. Ферменты, которые могут быть использованы для детектируемого мечения антитела против белков сыворотки/плазмы (например, SAM, SAH, 4-HNE и/или hsCRP) могут включать, без ограничения перечисленным, малатдегидрогеназу, стафилококковую нуклеазу, дельта-V-стероид изомеразу, дрожжевую алкогольдегидрогеназу, альфа-глицеролфосфат дегидрогеназу, триозофосфатизомеразу, пероксидазу хрена, щелочную фосфатазу, аспарагиназу, глюкозооксидазу, бета-галактозидазу, рибонуклеазу, уреазу, каталазу, глюкозо-У1-фосфат дегидрогеназу, глюкоамилазу, и ацетилхолинэстеразу.
Детектирование также может осуществляться с использованием множества других иммуноанализов. Например, с помощью радиоактивно меченного антитела возможно детектировать антитело посредством использования радиоиммунных анализов. Радиоактивный изотоп может детектироваться с помощью таких способов, как использование гамма-счетчика или сцинтиллятора или с помощью радиоавтографии. Изотопы, которые в частности используются для детекции, представляют собой 3H, 131I, 35S, 14С, и 125I.
Также возможно метить антитело с помощью флуоресцентного соединения. Если флуоресцентно меченное антитело экспонируется свету соответствующей длины волны, его присутствие может быть определено по иммунофлуоресценции. Примеры наиболее широко используемых флуоресцентных метящих соединений включают, без ограничения перечисленным, CYE-красители, флуоресцеин изотиоцианат, родамин, фикоэритрин, фикоцианин, аллофикоцианин, о-фтальдегид и флуорескамин.
Антитело также может быть детектируемо мечено с помощью излучающих флуоресценцию металлов, таких как 125Eu, или другие из группы лантанидов. Эти металлы могут быть прикреплены к антителу с помощью таких металл-хелатирующих групп, как диэтилентриаминпентауксусная кислота (DPTA) или этилендиаминтетрауксусная кислота (EDTA).
Антитело также может метиться детектируемым образом путем соединения с хемилюминесцентными соединениями. Наличие хемилюминесцентного антитела затем определяется путем детекции наличия люминесценции, которая возникает в ходе химической реакции. Примеры хемилюминисцентно меченных соединений могут включать, без ограничения перечисленным, люминол, люциферин, изолюминол, тероматический сложный эфир акридиния, имидазол, соль акридиния и эфир щавелевой кислоты.
Без ограничений уровни белков в сыворотке/плазме (например, SAM, SAH, 4-HNE и/или hsCRP) могут быть определены с помощью иммуноанализов, таких как твердофазный иммуноферментный анализ (тИФА), радиоиммуноанализ (RIA), иммунорадиометрический анализ (IRMA), вестерн-блоттинг, иммуноцитохимия или иммуногистохимия, каждый из которых ниже описан более подробно. В некоторых воплощениях иммуноанализы, такие как тИФА или RIA могут быть использованы для определения уровней экспрессии белков сыворотки/плазмы (например, SAM, SAH, 4-HNE и/или hsCRP). Также могут применяться антительные эрреи или белковые чипы, см., например, Патентные Заявки США No: 2003/0013208А1; 2002/0155493А1; 2003/0017515 и Патенты США 6,329,209; 6,365,418, которые включены в данный документ ссылкой. Коммерчески доступные антитела и/или иммуноанализы (такие как тИФА) для детекции белков сыворотки/плазмы (например, SAM, SAH, 4-HNE и/или hsCRP), например, от «Cell BioLabs», «Abeam», «Novus Biologicals» и «Thermo Scientific Pierce Antibodies», могут быть использованы в анализах и/или способах, описанных в данном документе.
Иммуноанализы: Наиболее распространенный иммуноанализ представляет собой «Твердофазный иммуноферментный анализ (тИФА). тИФА представляет собой метод детекции и измерения концентрации антигена с использованием меченой формы (например, связанной с ферментом) антитела. Существуют различные формы тИФА, которые хорошо известны специалистам в данной области. Стандартные методы тИФА, известные в данной области, описаны в «Methods in Immunodiagnosis», 2nd Edition, Rose and Bigazzi, eds. John Wiley & Sons, 1980; Campbell et al., «Methods and Immunology», W.A. Benjamin, Inc., 1964; and Oellerich, M. 1984, J. Clin. Chem. din. Biochem., 22: 95-904.
В анализе «сэндвич-тИФА» антитело (например, анти-фермент) связывается с твердой подложкой (т.е. микропланшетом) и экспонируется биологическим образцом, содержащим антиген (например, фермент). Твердую подложку затем промывают для удаления несвязанного антигена. Меченое антитело (например, связанное с ферментом) затем связывается со связанным антигеном (если он есть) с образованием сэндвича антитело-антиген-антитело. Примеры ферментов, которые могут быть связаны с антителом, представляют собой щелочную фосфатазу, пероксидазу хрена, люциферазу, уреазу и бета-галактозидазу. Связанное с ферментом антитело реагирует с субстратом с генерацией окрашенного продукта реакции, который может быть измерен.
В «конкуретнтном тИФА» антитело инкубируется с содержащимся в образце антигеном (т.е. ферментом). Смесь антиген-антитело затем контактирует с твердой подложкой (т.е. с микропланшетом), который покрыт антигеном (например, ферментом). Чем больше антигена присутствует в образце, тем меньше свободного антитела, доступного для связывания с твердой фазой. Меченое (например, связанное с ферментом) вторичное антитело затем добавляется к твердой фазе для определения количества первичного антитела, связанного с твердой фазой.
В «Иммунохимическом анализе» тестируемый образец тестируется на предмет специфических белков путем экспонирования тестируемого образца антителам, которые являются специфическими для белка, который подвергается анализу. Антитела затем визуализируются любым из ряда способов для определения наличия и количества присутствующего белка. Примеры способов использованных для визуализации антител, например, через ферменты связанные антителами (например, люциферазу, щелочную фосфатазу, пероксидазу хрена или бета-галактозидазу) или химические способы (например, DAB/субстрат-хромоген). Образец затем анализируется микроскопически, например, световой микроскопией образца, окрашенного красителем, который детектируется в видимом спектре, с использованием любого из множества таких окрашивающих способов и реактивов, известных специалистам в данной области.
В ином случае, могут быть использованы «радиоиммуноанализы». Радиоиммуноанализ является способом детекции и измерения концентрации антигена, с помощью меченной (например, радиоактивно или флуоресцентно меченной) формы антигена. Примеры радиоактивно меченных антигенов включают 3H, 14C и 125I. Концентрация антигенного фермента в тестируемом образце или биологическом образце может быть измерена по конкуренции антигена в биологическом образце с меченным (например, радиоактивно) антигеном за связывание антитела с антигеном. Для обеспечения конкурентного связывания между меченным антигеном и немеченным антигеном, меченный антиген присутствует в концентрации достаточной для насыщения участков связывания антитела. Чем больше концентрация антигена в образце, тем меньше концентрация меченного антигена, который будет связываться с антителом.
В радиоиммуноанализе, для определения концентрации меченного антигена, связанного с антителом, комплекс антиген-антитело может быть отделен от свободного антигена. Один способ для отделения комплекса антиген-антитело от свободного антигена заключается в осаждении комплекса антиген-антитело с анти-изотипной антисывороткой. Другой способ отделения комплекса антиген-антитело от свободного антигена заключается в осуществлении «твердофазного радиоиммуноанализа», при котором антитело связано (например, ковалентно) с микросферами сефарозы, полистерольными лунками, поливинилхлоридными лунками, или микротитровальными лунками. Сравнением концентрации меченного антигена, связанного с антителом со стандартной кривой, основанной на образцах, имеющих известные концентрации антигена, может быть определена концентрация антигена в биологическом образце.
«Иммунорадиометрический анализ» (IRMA) является иммуноанализом, в котором антительный реактив радиоактивно мечен. IRMA требует получения мультивалентного антигенного конъюгата, такими методами, как конъюгация с белком, например, с кроличьим сывороточным альбумином (RSA). Мультивалентный антигенный конъюгат должен иметь, по меньшей мере, 2 антигенных остатка на молекулу и антигенные остатки должны быть на достаточной дистанции друг от друга, что бы позволить связаться с антигеном, по меньшей мере, двум антителам. Например, в IRMA мультивалентный антигенный конъюгат может быть прикреплен к твердой поверхности, такой как пластиковая сфера. Немеченный антиген «из образца» и антитело к антигену, которое является радиоактивно меченным, добавляются к тестовой пробирке, содержащей сферу, покрытую мультивалентным антигенным конъюгатом. Антиген в образце конкурирует с мультивалентным антигенным конъюгатом за участки связывания антигена с антителом. После соответствующего инкубационного периода несвязанные реактанты удаляются промывкой и определяется количество радиоактивности в твердой фазе. Количество связанного радиоактивного антитела обратно пропорционально концентрации антигена в образце.
В некоторых воплощениях для измерения уровней экспрессии белков сыворотки/плазмы (например, SAM, SAH, 4-HNE и/или hsCRP) может быть использован вестерн-блоттинг (Towbin et al., Proc. Nat. Acad. Sci. 76:4350 (1979)), где соответствующим образом обработанный образец прогоняется на геле SDS-PAGE перед переносом на твердую подложку, такую как нитроцеллюлозный фильтр. Детектируемо меченные антитела против фермента могут затем быть использованы для оценки уровней фермента, если интенсивность сигнала детектируемой метки соответствует количеству присутствующего фермента. Уровни могут быть количественно оценены, например, денситометрией.
В дополнение к иммуноанализам уровень экспрессии, по меньшей мере, одного из биомаркеров сыворотки/плазмы может быть определен масс-спектрометрией, такой как MALDI/TOF (время-пролетная), SELDI/TOF, жидкостная хроматография-масс-спектрометрия (LC-MS), газовая хроматография-масс-спектрометрия (GC-MS), высокоэффективная жидкостная хроматография - масс-спектрометрия (HPLC-MS), капиллярный электрофорез - масс-спектрометрия, спектрометрия ядерного магнитного резонанса, или тандемная масс-спектрометрия (например, MS/MS, MS/MS/MS, ESI-MS/MS, и т.п.). См., например, Патентные Заявки No: 20030199001, 20030134304, 20030077616, которые включены в данный документ ссылкой. Способы масс-спектрометрии хорошо известны в данной области и использовались для количественной оценки и/или идентификации молекул (см., например, Li et al. (2000) Tibtech 18:151-160; Rowley et al. (2000) Methods 20: 383-397; и Kuster and Mann (1998) Curr. Opin. Structural Biol. 8: 393-400).
В определенных воплощениях используется газофазный ионный спектрофотометр. В других воплощениях для анализа образца используется масс-спектрометрия с ионизацией лазерной десорбцией. Современная масс-спектрометрия с ионизацией лазерной десорбцией («LDI-MS») может быть осуществлена на практике в двух основных вариантах: масс-спектрометрия с ионизацией лазерной десорбцией с использованием матрицы («MALDI») и с ионизацией лазерной десорбцией с усиленной поверхностью («SELDI»), В MALDI аналит смешивают с раствором, содержащим матрицу, и каплю жидкости помещают на поверхность субстрата. Матричный раствор затем ко-кристаллизуют с биологическими молекулами. Субстрат вставляют в масс-спектрометр. Лазерную энергию направляют на поверхность субстрата, где она десорбируется и ионизирует биологические молекулы без значимой их фрагментации. См., например, Пат.No. 5,118,937 (Hillenkamp et al.), и Пат. No. 5,045,694 (Beavis & Chait).
В SELDI, субстратная поверхность модифицируется так, что она является активным участником в процессе десорбции. В одном варианте поверхность дериватизуется адсорбентом и/или захватывающими реактивами, которые селективно связывают представляющий интерес белок. В другом варианте, поверхность дериватизуется абсорбирующими энергию молекулами, которые не десорбируются при обработке лазером. В другом варианте, поверхность дериватизуется молекулами, которые связывают представляющий интерес белок и которые содержат фотолитическую связь, которая обрывается при применении лазера. В каждом из этих способов, дериватизующий агент в общем локализуется в конкретном месте на субстратной поверхности, на которую наносится образец. См., например, Пат. No. 5,719,060 и WO 98/59361. Два способа могут быть объединены, например, с помощью аффинной поверхности «SELDI» для захвата аналита и добавления матрикс-содержащей жидкости к захваченному аналиту для обеспечения адсорбирующего энергию материала.
Для дополнительной информации относительно масс-спектрометров, см., например, Principles of Instrumental Analysis, 3rd edition., Skoog, Saunders College Publishing, Philadelphia, 1985; and Kirk-Othmer Encyclopedia of Chemical Technology, 4.sup.th ed. Vol. 15 (John Wiley & Sons, New York 1995), pp. 1071-1094. Программное обеспечение, такое как программа «Biomarker Wizard» («Ciphergen Biosystems, Inc.», Фримонт, Калиф.) может быть использовано для помощи при анализе масс-спектров, например, сравнением силы сигнала значений пика из спектров образца тестируемого субъекта и контрольного образца (например, нормального здорового индивидуума). Масс-спектрометры и методы для них хорошо известны специалистам в данной области.
Определения уровня экспрессии гена или белка путем измерения мРНК: ПНР в реальном времени является методом амплификации, который может быть использован для определения уровней экспрессии мРНК, соответствующей представляющему интерес белку (например, hsCRP) (см., например, Gibson et al., Genome Research 6: 995-1001, 1996; Heid et al., Genome Research 6:986-994,1996). ПЦР в реальном времени оценивает уровень накопления продукта ПЦР в ходе амплификации. Этот метод позволяет осуществить количественную оценку уровней мРНК во множестве образцов. Для уровней мРНК, мРНК может быть экстрагирована из биологического образца, например, образца крови (такого как белые кровяные клетки и/или тромбоциты) и кДНК готовится с помощью стандартных методов. ПЦР в реальном времени может быть осуществлен, например, с помощью инструмента «7700 Prism» от «Perkin Elmer»/«Applied Biosystems» (Фостер-Сити, Калиф.). Совпадающие праймеры и флуоресцентные зонды могут быть разработаны для представляющих интерес генов с использованием, например, программы «Primer express», предоставляемой «Perkin Elmer»/«Applied Biosystems» (Фостер-Сити, Калиф.). Оптимальные концентрации праймеров и зондов могут быть изначально определены специалистами в данной области, а контрольные (например, бета-актиновые) праймеры и зонды могут быть получены на коммерческой основе, например, у «Perkin Elmer»/«Applied Biosystems» (Фостер-Сити, Калиф.). Для количественной оценки количества специфической представляющей интерес нуклеиновой кислоты в образце, с помощью контроля получают стандартную кривую. Стандартные кривые могут быть получены с помощью Ct-значений, определенных в ПЦР в реальном времени, которые связаны с исходной концентрацией представляющей интерес нуклеиновой кислоты, использованной в данном анализе. Стандартные разведения в диапазоне 101-106 копий представляющего интерес гена, как правило, являются достаточными. Кроме того, стандартная кривая формируется для контрольной последовательности. Это дает возможность стандартизации исходного содержимого представляющей интерес нуклеиновой кислоты в тестируемом образце к количеству контроля для целей сравнения.
Способы для количественной ПЦР в реальном времени с использованием зондов TaqMan хорошо известны в данной области. Подробные протоколы для количественной ПЦР в реальном времени, представлены например, для РНК в: Gibson et al., 1996, A novel method for real time quantitative RT-PCR. Genome Res., 10:995-1001; и для ДНК в: Heid et al., 1996, Real time quantitative PCR. Genome Res., 10:986-994.
Анализы на основе TaqMan используют флуорогенный олигонуклеотидный зонд, который содержит 5'-флуоресцентный краситель и 3'-гаситель. Зонд гибридизуется с ПЦР-продуктом, но не может сам удлиняться благодаря блокирующему агенту на 3'-конце. Когда ПЦР-продукт амплифицируется в последующих циклах, то 5'-нуклеазная активность полимеразы, например, AmpliTaq, приводит к расщеплению TaqMan-зонда. Это расщепление разделяет 5'-флуоресцентный краситель и 3'-гаситель, с получением таким образом усиления флуоресценции как функции амплификации (см., например, «Perkin-Elmer»).
В другом воплощении, детектирование РНК-транскрипта может достигаться с помощью Нозерн-блотинга, где получение РНК осуществляется на денатурирующем агарозном геле, с переносом на подходящую подложку, такую как активированная целлюлоза, нитроцеллюлоза или стекло или нейлоновая мембрана. Затем меченую (например, радиактивно меченую) кДНК или РНК гибридизуют с препаратом, промывают и анализируют с помощью методов, таких как радиоавтография.
Детектирование РНК-транскриптов может дополнительно осуществляться с использованием известных методов амплификации. Например, мРНК может обратно-транскрибироваться в кДНК с последующей полимеразной цепной реакцией (ОТ-ПЦР); или с использованием одного фермента для обеих стадий, как описано в Пат. США No. 5,322,770, или путем обратной транскрипции мРНК в кДНК с последующей лигазной цепной реакцией с симметричными пропусками (RT-AGLCR), как описано у R. L. Marshall, et al., PCR Methods and Applications 4: 80-84 (1994). Один подходящий метод детекции мРНК-транскриптов описан в публикации Pabic et. al. Hepatology, 37(5): 1056-1066, 2003, которая включена в данный документ ссылкой.
Также может использоваться визуализация in situ, когда радиоактивно меченый зонд антисмысловой РНК гибридизуют с биомаркерами-мишенями в тестируемом образце, промывают, расщепляют с помощью рибонуклеазы и подвергают обработке чувствительной эмульсией для радиоавтографии. Для демонстрации гистологического состава образца образцы можно окрашивать с помощью гематоксилина, а имеджинг методом темного поля с использованием подходящего светового фильтра, демонстрирует проявленную эмульсию. Также могут использоваться нерадиоактивные метки, такие как дигоксигенин.
В ином случае, экспрессию мРНК может определять на ДНК-эррее, чипе или на микроэррее. Олигонуклеотиды, соответствующие ферменту, иммобилизуют на чипе, который затем гибридизуют с мечеными нуклеиновыми кислотами тестируемого образца, полученного из пациента. Сигнал положительной гибридизации получают с помощью образца, содержащего транскрипты биомаркера. Способы получения ДНК-эрреев и их применение хорошо известны в данной области (см., например, Патенты США No: 6,618,6796; 6,379,897; 6,664,377; 6,451,536; 548,257; 20030157485 и Schena et al. 1995 Science 20:467-470; Gerhold et al. 1999 Trends in Biochem. Sci. 24, 168-173; и Lermon et al. 2000 Drug discovery Today 5: 59-65, которые включены в данный документ с помощью ссылки). Также может осуществляться Последовательный Анализ Генной Экспрессии (SAGE) (см., например, Патентную Заявку США 20030215858).
Способ лечения человека с депрессией
Согласно различным аспектам, описанным в данном документе, если детектируют, что у субъекта с депрессией присутствует, по меньшей мере, одно из состояний (А)-(Х), определенных в анализе, описанном в данном документе, то, субъекту рекомендуется и/или назначается режим лечения, включающий фолат-содержащее соединение. В таких воплощениях, субъекту может дополнительно вводиться или предписываться режим лечения, включающий антидепрессант и фолат-содержащее соединение. Соответственно, в данном документе представлены способы лечения субъекта с депрессией. В некоторых воплощениях, способ включает любые воплощения анализа для выбора режима лечения для субъекта с депрессией, описанного в данном документе. В некоторых воплощениях, способ может дополнительно включать предписание и/или назначение режима лечения, включающего фолат-содержащее соединение, выбранному человеку.
В некоторых воплощениях, способ лечения человека с депрессией может включать введение композиции, включающей эффективное количество фолат-содержащего соединения человеку, который диагностирован как страдающий от депрессии или с риском развития депрессии, и дополнительно определяется как носитель, по меньшей мере, одного или более (включая, по меньшей мере, два, по меньшей мере, три, по меньшей мере, четыре или более), или любую комбинацию состояний (А)-(Х), описанных в данном документе.
В некоторых воплощениях способ может включать введение композиции, включающей эффективное количество фолат-содержащего соединения человеку, который диагностирован как страдающий от депрессии или имеющий риск развития депрессии и дополнительно определен как носитель, по меньшей мере, одного из следующих SNP, или любую их комбинацию: (i) a SNP в положении 677 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 7 (идентифицированного с помощью rs1801133), включающий, по меньшей мере, один аллель с тимином «Т», и (ii) SNP в положении 2756 в SEQ ID NO. 2 или положение 27 в SEQ ID NO. 9, включающего, по меньшей мере, один аллель с гуанином «G». В данных воплощениях способ может дополнительно включать определение наличия или отсутствия любого из состояний (А)-(Х), описанных в данном документе.
В некоторых воплощениях, субъект, которому вводят режим лечения, включающий фолат-содержащее соединение, может дополнительно определяться как имеющий ожирение (например, с помощью значения BMI, составляющего, по меньшей мере, около 30 кг/м2 или выше).
Термины «лечение» и «лечить» при использовании в данном документе по отношению к лечению заболевания означают предотвращение прогрессии заболевания или изменение течения расстройства (например, в частности, замедление прогрессии расстройства), или реверсия симптомов расстройства или уменьшение одного или более симптомов и/или одного или более биохимических маркеров у субъекта, предотвращение одного или более симптомов от ухудшения или прогрессии, стимулирование восстановления или улучшение прогноза. Например, в случае лечения депрессии терапевтическое лечение относится к облегчению, по меньшей мере, одного симптома, ассоциированного с депрессией. Измеряемое уменьшение включает любое статистически значимое уменьшение измеряемого маркера или симптома, такое как измерение маркеров депрессии в крови, как описано позже, или оценка степени депрессии, например, с использованием критериев, перечисленных в DSM-IV, или эффективность измеряется, как описано в Примерах, например, HAMD-17, HAMD-28, CGI, Maier или HAMD-7, после лечения. В одном воплощении, по меньшей мере, один симптом депрессии ослабляется, по меньшей мере, на около 10%, по меньшей мере, на около 15%, по меньшей мере, на около 20%, по меньшей мере, на около 30%, по меньшей мере, на около 40%, или, по меньшей мере, на около 50%. В другом воплощении, по меньшей мере, один симптом ослабляется более чем на 50%, например, по меньшей мере, на около 60%, или, по меньшей мере, на около 70%. В одном воплощении, по меньшей мере, один симптом ослабляется, по меньшей мере, на около 80%, по меньшей мере, на около 90% или выше по сравнению с контролем (например, субъекту, имеющему такую же или сходную степень депрессии как у субъекта, подвергнутого лечению, вводится режим лечения без фолат-содержащего соединения, или субъекту, у кого нет ни одного из состояний, описанных в данном документе, вводится режим лечения, включающий фолат-содержащее соединение). В некоторых воплощениях улучшается, по меньшей мере, один нейропсихологический тест (например, снижается рейтинг HAMD-17), по меньшей мере, на около 10%, по меньшей мере, на около 15%, по меньшей мере, на около 20%, по меньшей мере, на около 30%, по меньшей мере, на около 40%, или, по меньшей мере, на около 50%. В другом воплощении улучшается, по меньшей мере, один нейропсихологический тест (например, снижается рейтинг HAMD-17), более чем на 50%, например, по меньшей мере, на около 60%, или, по меньшей мере, на около 70%. В одном воплощении улучшается, по меньшей мере, один нейропсихологический тест (например, снижается рейтинг HAMD-17), по меньшей мере, на около 80%, по меньшей мере, на около 90% или выше по сравнению с контролем (например, субъекту, имеющему такую же или сходную степень депрессии как у субъекта, подвергнутого лечению, вводится режим лечения без фолат-содержащего соединения, или субъекту, у кого нет ни одного из состояний, описанных в данном документе, вводится режим лечения, включающий фолат-содержащее соединение). В некоторых воплощениях, по меньшей мере, один симптом депрессии может ослабнуть, по меньшей мере, на около 10%, по меньшей мере, на около 15%, по меньшей мере, на около 20%, по меньшей мере, на около 30%, по меньшей мере, на около 40%, или, по меньшей мере, на около 50% или выше в течение периода, составляющего, по меньшей мере, около 10 дней, включая, например, по меньшей мере, около 20 дней, по меньшей мере, около 30 дней, по меньшей мере, около 40 дней или более. В некоторых воплощениях, по меньшей мере, один нейропсихологический тест (например, HAMD-17 уменьшается) улучшается, по меньшей мере, на около 10%, по меньшей мере, на около 15%, по меньшей мере, на около 20%, по меньшей мере, на около 30%, по меньшей мере, на около 40%, или, по меньшей мере, на около 50% или выше в течение периода, составляющего, по меньшей мере, около 10 дней, включая, например, по меньшей мере, около 20 дней, по меньшей мере, около 30 дней, по меньшей мере, около 40 дней или более.
В некоторых воплощениях данного аспекта и всех других аспектов, описанных в данном документе, фолат-содержащее соединение может вводиться в количестве, эффективном для уменьшения, по меньшей мере, одного симптома (например, в частности, подавленное настроение, ангедонию, упадок сил, бессонницу, возбуждение, беспокойство и/или потерю массы), ассоциированного с депрессией, например, с большим депрессивным расстройством. В некоторых воплощениях эффективное количество фолат-содержащего соединения может обеспечивать, по меньшей мере, введение от около 0,1 до около 1 мг/кг массы тела в день человеку. В некоторых воплощениях эффективное количество фолат-содержащего соединения может обеспечивать, по меньшей мере, введение от около 7,5 мг/день до около 50 мг/день человеку. В одном воплощении, эффективное количество фолат-содержащего соединения может обеспечивать, по меньшей мере, введение около 15 мг/день фолата человеку.
Эффективное количество фолат-содержащего соединения может вводиться выбранному человеку в виде однократной суточной дозы или в ином случае, в виде более чем одной суточной дозы, распределенной в течение дня посредством любого подходящего пути введения, например, с помощью перорального введения.
В некоторых воплощениях данного аспекта и во всех других аспектах, описанных в данном документе, режим лечения может дополнительно включать выбор и необязательно введение антидепрессанта. В некоторых воплощениях, антидепрессант может включать селективный ингибитор обратного захвата серотонина, включающий, в частности, флуоксетин, циталопрам, пароксетин, эсциталопрам, сертралин и любую их комбинацию.
Субъект с депрессией, подвергающийся лечению с использованием способов, описанных в данном документе, может представлять собой субъект, принимающий в настоящее время антидепрессант. Соответственно, способы лечения человека с депрессией, описанные в данном документе, также могут использоваться для выбора человека, которого следует подвергнуть лечению с использованием комбинации фолат-содержащего соединения и антидепрессанта для улучшения эффективности антидепрессанта, принимаемого, соответственно, субъектом в настоящее время. Соответственно, если человек, принимающий в настоящее время антидепрессант, определяется, как имеющий, по меньшей мере, одно (включая, например, по меньшей мере, два, по меньшей мере, три или более) из состояний (А)-(Х), описанных в данном документе, то субъекту может дополнительно вводиться или предписываться фолат-содержащее соединение в качестве адъюванта к антидепрессанту, который он/она принимает в настоящее время.
В других воплощениях, если субъект, принимающий в настоящее время антидепрессант, определяется как имеющий, по меньшей мере, одно (включая, например, по меньшей мере, два, по меньшей мере, три или более) из состояний (А)-(Х), описанных в данном документе, то субъекту может вводиться режим лечения, включающий фолат-содержащее соединение без антидепрессанта.
В некоторых воплощениях, способы, описанные в данном документе, могут использоваться для лечения, по меньшей мере, одного или более внутренних симптомов депрессии (например, в частности, в отношении плохого или депрессивного настроения, ангедонии (например, потери интереса или удовольствия от почти всех действий), низкий уровень энергетики) у субъекта, который определен как имеющий, по меньшей мере, одно (включая, например, по меньшей мере, два, по меньшей мере, три или более) из состояний (А)-(Х), описанных в данном документе.
Режим лечения, включающий фолат-содержащее соединение
Фолат-содержащее соединение, включенное в режим лечения, может вводиться совместно посредством одной дозированной лекарственной формы или посредством нескольких раздельных введений. В некоторых воплощениях, фолат-содержащее соединение может вводиться в одной дозированной лекарственной форме. Например, одна лекарственная форма может вводиться в виде одной таблетки, пилюли, капсулы для перорального введения или в виде раствора для парентерального введения. В ином случае, фолат-содержащее соединение может вводиться в виде отдельных композиций, например, в виде отдельных таблеток или растворов. Промежуток или время между введением субдозы фолат-содержащего соединения может регулироваться с достижением целевого терапевтического эффекта.
В некоторых воплощениях, режим лечения, включающий фолат-содержащее соединение, дополнительно включает, по меньшей мере, один антидепрессант (например, 1, 2, 3 или более антидепрессантов). Режим лечения, включающий фолат-содержащее соединение и, по меньшей мере, один антидепрессант, может вводиться вместе посредством одной лекарственной формы или посредством отдельных введений. В некоторых воплощениях, антидепрессант и фолат-содержащее соединение вводят вместе в одной лекарственной форме. Например, единая лекарственная форма может вводиться в виде одной таблетки, пилюли, капсулы для перорального введения или в виде раствора для парентерального введения. Альтернативно, антидепрессант и фолат-содержащее соединение могут вводиться в виде отдельных композиций, например в виде отдельных таблеток или растворов. Антидепрессант может вводиться одновременно с фолат- содержащим соединением, или антидепрессант и фолат-содержащее соединение вводиться с неким временным промежутком. Промежуток или время между введением антидепрессанта и фолат-содержащего соединения может регулироваться с достижением целевого терапевтического эффекта. Конкретно, фолат-содержащее соединение может вводиться с любой частотой или с протоколом введения для усиления эффективности антидепрессанта по сравнению с индивидуальным введением антидепрессанта (например, в отсутствии фолат-содержащего соединения).
В некоторых воплощениях фолат-содержащее соединение может вводиться всего за несколько минут (например, 1, 2, 5, 10, 30, или 60 мин) до или после введения антидепрессанта. Альтернативно, фолат-содержащее соединение может вводиться за несколько часов (например, 2, 4, 6, 10, 12, 24, или 36) до или после введения антидепрессанта. В зависимости от периода полужизни антидепрессанта и фолат-содержащего соединения в некоторых воплощениях может быть предпочтительным введение более чем одной дозировки фолат-содержащего соединения между введениями антидепрессанта. Например, фолат-содержащее соединение может вводиться через 3 часа и затем еще раз через 6 часов после введения антидепрессанта. В ином случае, может быть предпочтительным введение более чем одной дозировки антидепрессанта между введениями фолат-содержащего соединения. Важно, что в некоторых воплощениях терапевтический эффект каждого антидепрессанта и фолат-содержащего соединения могут перекрывать, по меньшей мере, часть периода продолжительности каждого терапевтического агента, чтобы терапевтический эффект в целом комбинированной терапии частично способствовал объединенной комбинированной терапии. В некоторых воплощениях, фолат-содержащее соединение и антидепрессант могут вводиться в периодическом введении. В других воплощениях, они могут вводиться в виде «пульс-чейз» введения, например, когда фолат-содержащее соединение вводят в течение краткого периода времени («пульс»), с последующим введением антидепрессанта в течение более продолжительного периода времени (например, «чейз»).
В некоторых воплощениях, где антидепрессант и фолат-содержащее соединение вводят в отдельных композициях, антидепрессант и фолат-содержащее соединение могут вводиться одним и тем же или различными путями. Например, антидепрессант может вводиться с помощью внутривенной инъекции, в то время как фолат-содержащее соединение может вводиться перорально или наоборот. Альтернативно, например, оба компонента: антидепрессант и фолат-содержащее соединение - могут вводиться вместе с помощью внутривенной инъекции или с помощью перорального введения.
В любых воплощениях способов, описанных в данном документе, адъювантный эффект фолат-содержащего соединения, вводимого в комбинации с антидепрессантом, может быть аддитивным. Термин «аддитивный» при использовании в данном документе в контексте одного агента имеет аддитивный эффект на второй агент, относится к повышению эффективности первого агента в присутствии второго агента по сравнению с применением первого агента индивидуально. Выражаясь иначе, второй агент может функционировать в качестве агента, который усиливает физиологический ответ органа или организма в присутствии первого агента. Таким образом, второй агент будет повышать эффективность первого агента путем повышения индивидуального ответа в присутствии первого агента.
В любых воплощениях способов, описанных в данном документе, адъювантный эффект фолат-содержащего соединения, вводимого в комбинации с антидепрессантом, может быть синергическим. Термин «синергизм» или «синергический» при использовании в данном документе относится к взаимодействию двух или более агентов, так чтобы их объединенный эффект был выше, чем каждый из их индивидуальных эффектов при одной и той же индивидуальной дозе.
В некоторых воплощениях, режим лечения может дополнительно включать совет по образу жизни, включая предписание занятий спортом, советов по питанию и/или введение другого фармацевтического агента, эффективного при лечении депрессии.
Фолат или фолат-содержащие соединения
Любое известное в данной области фолат-содержащее соединение может быть выбрано и/или необязательно может вводиться человеку, выбранному как носителя одного или более из следующих состояний (А)-(Х), описанных в данном документе. Термин «фолат-содержащее соединение» при использовании в данном документе относится к соединению, содержащему эффективное количество, по меньшей мере, одного фолата для применения в способах, описанных в данном документе. Фолат представляет собой водорастворимую форму витамина В9. Термин «фолат» при использовании в данном документе охватывает природные формы фолата, фолиевую кислоту (также известную как витамин В9 или фолацин) и их метаболиты или производные, такие как метилфолат, тетрагидрофолат и метилтетрагидрофолат. Термин «фолат» при использовании в данном документе также может относиться к моноглутамату птероевой кислоты (фолиевая кислота) и к восстановленным формам, таким как дигидрофолаты и тетрагидрофолаты, например 5-формилтетрагидрофолиевая кислота, 5-метилентетрагидрофолиевая кислота, 5,10-метилентетрагидрофолиевая кислота, 5,10-метенилтетрагидрофолиевая кислота, 10-формилтетрагидрофолиевая кислота и тетрагидрофолиевая кислота, их полиглутаматы, оптические изомеры (например, их оптически чистые натуральные изомеры, а также смеси оптических изомеров, такие как рацемические смеси), их производные, фармацевтически приемлемые соли и эфиры, их соли глюкозаминов и соли галактозаминов.
При использовании в данном документе термин «фармацевтически приемлемые соли и эфиры» относится к фармакологически приемлемым солям и эфирам. Фармакологически и фармацевтически приемлемые соли могут включать в частности соли щелочных и щелочноземельных металлов, например, соли натрия, калия, магния или кальция. Фармакологически и фармацевтически приемлемые эфиры могут включать в частности, С1-С4 алкиловый, С5-циклоалкиловый, С6-циклоалкиловый, фениловый, С1-С4 алкилфениловый, бензиловый или С1-С4-алкилбензиловый эфир. Эфиры могут быть моноэфирами или диэфирами. Диэфиры могут быть гомогенными или гетерогенными. В некоторых воплощениях фармакологически и фармацевтически приемлемые эфиры могут быть гомогенными диэфирами, такими как С1-С4 диалкилэфиры, например диметил- или диэтилэфиры.
В некоторых воплощениях, фолат-содержащее соединение может включать, по меньшей мере, одну (включая, по меньшей мере, две, по меньшей мере, три или более) соль щелочного металла или щелочноземельного металла фолата, например, в частности, кальциевую соль флата.
В некоторых воплощениях, фолат-содержащее соединение может включать, по меньшей мере, одну (включая, по меньшей мере, две, по меньшей мере, три или более) глюкозаминовую соль и/или галоактозаминовую соль фолата (включая, например, фолиевую кислоту и восстановленный фолат, например, в частности, тетрагидрофолат и их производные). Примеры глюкозамин-фолата и/или галактозаминфолата и их производные, например, раскрытые в Пат. США 7947662, могут вводиться человеку способами или могут быть включены в композиции, описанные в данном документе. В одном воплощении, «QUATREFOLIC®» (Gnosis S.p.A, Милан, Италия) или N-[4-[[[(6S)-2-амино-1,4,5,6,7,8-гексагидро-5-метил-4-оксо-6-птеридинил]метил]амино]бензоил]-L-глутаминовая кислота, глюкозаминовая соль может вводиться человеку способами или включена в композиции, описанные в данном документе.
Фолиевая кислота, фолат и их метаболиты или восстановленные фолаты, например, метилфолат, представляют собой вещества, которые характеризуются как витамины, необходимые питательные вещества, доступные в малых количествах в листовых овощах и в других продуктах. Фолиевая кислота сама по себе не является биологически активной, но она может биологически превращаться в тетрагидрофолат и в другие производные, после их превращения до дигидрофолиевой кислоты в печени в присутствии соответствующих ферментов.
В форме серии тетрогидрофолатных (THF) соединений, производные фолата представляют собой субстраты в ряде реакций переноса одного атома углерода, а также они вовлечены в синтез dTMP (2'-дезокситимидин-5'-фосфат) из dUMP (2'-дезоксиуридин-5'-фосфат).
Путь, приводящий к образованию метилфолата, такого как тетрагидрофолат (THF), запускается, когда фолиевая кислота (F), в виде фолата, восстанавливается до дигидрофолата (DHF), который затем восстанавливается до тетрагидрофолата (THF). Фермент дигидрофолат редуктаза катализирует последнюю стадию. Соответственно, в некоторых воплощениях для субъекта с депрессией, у которого имеется дефицит фермента дигидрофолат редуктазы, метилфолат, также известный как Me-THF, N5-Метил-THF, MTHF, 5-MTHF, L-метилфолат, и левомефолиевая кислота, или их фармацевтически приемлемая соль (например, натриевая соль, калиевая соль, магниевая соль, кальциевая соль, глюкозаминовая соль или галактозаминовая соль), более целесообразны в качестве фолат-содержащего соединения. Например, кальциевая соль метилфолата доступна по рецепту в США в виде DEPLIN® (L-метилфолата кальциевая соль). Кальциевая соль метилфолата также доступна за пределами Соединенных Штатов в виде METAFOLIN®, BODYFOLIN® и NUTRIFOLIN®.
Дополнительные примеры фолатов или фолат-содержащих соединений, которые могут вводиться субъекту в способах или могут быть включены в композиции, описанные в данном документе, могут включать в частности те, что описаны в Пат. No.: US 4,336,185; US 6,921,754; и US 7,947,662; и Пат. Заявке США No.: 2008/0064702 США, полное содержание которых включено в настоящий документ ссылкой.
Биологические эффекты фолата на центральную нервную систему: Роль фолата в функции центральной нервной системы ранее обсуждалась, включая существенную роль фолата в одноуглеродном цикле, который снабжает SAMe, основной донор метила для широкого спектра реакций, включающих синтез нейроактивных веществ, образование мембранных фосфолипидов и метаболизм нуклеиновых кислот [10]. Сообщалось, что при введении в парентеральных и в некоторых пероральных формах, SAM обладает антидепрессантной эффективностью, выше чем плацебо и сравнимой с трициклическими антидепрессантами [41]. Фолат также, по-видимому, влияет на скорость синтеза тетрагидробиоптерина [21], кофактора гидроксилирования фенилаланина и триптофана, лимитирующие стадии в биосинтезе допамина, норепинефрина и серотонина, нейромедиаторов, которые, как установлено, играют роль в патогенезе депрессии. Кроме того, было показано, что MTHF связывается с пресинаптическими рецепторами глутамата [42], где он потенциально может модулировать высвобождение других нейромедиаторов, включающих моноамины. Повышенный уровень гомоцистеина, полученный в результате дефицита фолата, может играть роль в опосредовании некоторых из его нейропсихиатрических осложнений путем генерации повышенного уровня S-аденозил-гомоцистеина, который ингибирует широкий спектр реакций метилирования [43], а также возможно вызывая непосредственные эксайтотоксические эффекты через активность N-метил-аспартат глутаматных рецепторов [44].
В цереброспинальной жидкости детектировали низкий уровень метаболита серотонина в виде 5-гидроксииндол уксусной кислоты и метаболита допамина в виде гомованилиновой кислоты, хотя не всегда [45], среди фолат-дефицитных пациентов с эпилепсией [46], другими нейропсихиатрическими расстройствами [47], и врожденными состояниями дефицита фолата [48]. Еще не установлено, действительно ли обеспечение фолатом усиливает синтез моноаминов или высвобождение или поставляет дополнительный SAMe. Испытания на человеке, оценивающие влияние сверхфизиологических доз фолата на метаболиты в цереброспинальной жидкости, отсутствуют. Фактически предыдущие испытания на крысах сделали парадоксальное открытие того, что добавка фолата и дефицит фолата снижали уровень серотонина в мозге. [47], что, в свою очередь, указывает на возможность аналогичного комплексного профиля у людей.
Фолат и депрессия: Нейропсихиатрические и депрессивные симптомы, включающие апатию, усталость, бессонницу, раздражительность и ослабленное внимание, обсуждались в клиническом описании фолат-дефицитных состояний, ассоциированных с малабсорбцией, [13] с эпилепсией, подвергнутой лечению с помощью противосудорожных средств, [14, 15] мегалобластной анемией, [16] и диетическим ограничением фолата [1]. В предыдущих исследованиях сообщалось, что одна треть пациентов среди психиатрического контингента, главным образом из Великобритании, демонстрировали низкие или дефицитные значения фолата в сыворотке, причем имеются по большей части сравнимые открытия в нескольких исследованиях, которые оценивали фолат в эритроцитах (RBC), как более точное отражение тканевых запасов фолата [12, 17, 18]. В ряде исследований, в которых пациентов с депрессией сравнивали с психиатрическими и не психиатрическими контрольными объектами, сообщалось, что пациенты с депрессией имеют уровень сывороточного фолата [2, 19], RBC фолата [21], или сывороточного метилтетрагидрофолата (MTHF) [22], который ниже, чем уровень во всех других группах за исключением пациентов с алкоголизмом, у кого имелось сходное превалирование низкого уровня фолата [20]. Кроме того, низкий уровень фолата в сыворотке или в RBC и низкий уровень MTHF в сыворотке часто ассоциирован с большей степенью тяжести симптомов у пациентов с депрессией [22, 23, 24, 25]. Среди испытаний, в которых не смогли продемонстрировать такую связь между низким уровнем фолата и тяжестью депрессии, наблюдали обратную связь между фолатом и продолжительностью эпизода депрессии [26] или продолжительностью госпитализации [27].
Уровень фолата и ответ на лечение антидепрессантами: Авторы изобретения ранее оценили уровень фолата в сыворотке и ответ на селективный ингибитор обратного захвата серотонина, флуоксетин, среди 213 взрослых с большим депрессивным расстройством [28]. Среди подвергнутых депрессии, но здоровых в других отношениях амбулаторных пациентов превалирование фактического дефицита фолата (определенного как <1,5 нг/мл) составило (2%), тогда как пограничные низкие значения (1,5-2,5 нг/мл) были более распространенными (17%). Индивидуумы с низким или дефицитным сывороточным фолатом демонстрировали 35% не отвечающих на адекватный курс флуоксетина по сравнению с 20% не отвечающих среди тех, у кого уровень сывороточного фолата находился в нормальном интервале. Об аналогичном результате сообщали среди 22 пациентов с депрессией старше 60 лет, подвергнутых лечению с помощью нортриптилина или сертралина, для кого имела место обратная связь между фолатом RBC и ответом на антидепрессант [29]. Согласно данному открытию в более раннем исследовании 101 пациентов с депрессией, получавших множество типов лечения, включая электрошоковую терапию, антидепрессанты или триптофан, результатом стало значительное ухудшение состояние пациентов с низким сывороточным фолатом [24]. Однако для небольшого количества пациентов, подвергающихся электрошоковой терапии, сывороточный MTHF, по-видимому, не коррелирует с ответом [22]. Таким образом, точные и чувствительные средства прогнозирования нечувствительности к лечению антидепрессантами, остаются неясными [30].
Добавка/увеличение уровня фолата и MTHF: Godfrey et al.[31] вводили MTHF (15 мг), пероральной формы фолата, активно переносимой через гематоэнцефалический барьер, 24 пациентам с большим депрессивным расстройством и низким или дефицитным фолатом (RBC фолат <200 мкг/л). В данном 6-месячном рандомизированном двойном слепом испытании тех 13 пациентов с депрессией, кто получали метилфолат, оценивали в целом как имеющих наилучшие симптомы улучшения и социальную приспособленность в моменты времени 3 и 6 месяцев по сравнению с 11 пациентами, кого оценивали с помощью плацебо. Однако данное сообщение было неокончательным, из-за относительно небольшого образца и необходимости повторения, несистемных сопутствующих терапий (например, с помощью антидепрессантов, лития или отсутствия лекарственных средств), улучшение симптомов при некоторых, но не всех измерениях и аналогичный, хотя менее значительный ответ на MTHF среди подвергнутых лечению сравнимыми способами пациентов с шизофренией, выявило, что положительные эффекты MTHF не могут быть специфичными для депрессии. Предыдущие сообщения расширили предыдущую работу по поводу замены фолата, сообщая об улучшенном продолжительном нейропсихиатрическом результате среди фолат-дефицитных пациентов с психиатрическими [32] и желудочно-кишечными [13] расстройствами и в некоторых, хотя не во всех исследованиях на пациентах с эпилепсией, подвергнутых лечению с помощью противосудорожных средств [14].
Фактическая клиническая актуальность этих предыдущих исследований, вероятно, существенно ограничена. В недавней работе сообщалось, что преобладание дефицита фолата или пограничных низких значений на самом деле ниже среди современных психиатрических когорт, чем исходно считалось [28], а также, что оценки с полученные на Западе могут быть не сравнимыми с другими частями мира, включая Азию [33]. Кроме того, большинство исследований по части фолата и депрессии основаны на данных, собранных перед применением программ обогащения фолиевой кислоты и распространения внимания общественности по поводу возможной пользы фолата для здоровья. В Соединенных Штатах мандат 1998 года Управления по контролю за продуктами и лекарствами, требующий обогащения фолиевой кислотой всех обогащенных зерновых продуктов, по видимому, оказал быстрое и существенное влияние на распространение низкого уровня и дефицитного фолата у населения, почти ликвидировав низкие значения сывороточного фолата (<3 нг/мл) среди 350 людей среднего и более старшего возраста в «Framingham Offspring Study Cohort» [34].
Необходимо провести сравнительное исследование по поводу распространения низкого содержания фолата среди тщательно диагностированных групп с депрессией в нашу эру обогащения пищи, особенно из-за того, что не установлена степень, в которой пищевой рацион вносит вклад в низкий уровень фолата у индивидуумов с депрессией [2, 24, 25, 28, 35, 36]. Тем не менее, считается, что распространение низкого уровня фолата среди образцов субъектов с депрессией уменьшается до значений ниже тех, что были перед осуществлением программ обогащения фолиевой кислоты. В таком случае, более значимое клиническое фокусирование для клиницистов, которые лечат депрессию, сдвигается от замены фолата к добавке фолата и к вопросу могут ли сверхфизиологические дозы фолата в качестве монотерапии или усиления подходящих агентов принести антидепрессантную пользу пациентам с депрессией с нормальным уровнем фолата.
Несмотря на огромные преимущества разработки безопасных и эффективных антидепрессантов, не менее 30-40% пациентов с депрессией продолжают быть симптоматически и функционально ослабленными, не смотря на адекватный курс лечения антидепрессантной терапии [30]. Таким образом, разработка новых стратегий лечения имеет существенное значение для общественного здравоохранения.
Корреляционные анализы выявили, что среди индивидуумов с большими аффективными расстройствами, большее значение уровня фолата предсказывало более сильный [25] и продолжительный результат [37]. В последнем исследовании уровень фолата индивидуумов с униполярной депрессией или с биполярным расстройством стимулировали с помощью ежедневной добавки низкой дозы фолата (200 мкг) вместе с фармакологической профилактикой аффективных симптомов. Дополнительная демонстрация потенциальной антидепрессантной пользы фолата происходит из двойного слепого исследования 96 пациентов без дефицита фолата со старческим слабоумием и депрессивными симптомами, в которых значительное улучшение депрессии было выявлено среди пациентов, рандомизированных по MTHF (50 мг), аналогично тому, что наблюдали с активным компаратором антидепрессантов, тразодоном (100 мг/д) [38]. Среди 16 пожилых субъектов без слабоумия с большим депрессивным расстройством открытое испытание MTHF (50 мг) также привело к существенному улучшению депрессивных симптомов даже среди 14 субъектов, у кого был нормальный исходный уровень сывороточного фолата [39].
Авторы изобретения также ранее оценивали эффективность метилфолата в качестве дополнительного лечения взрослых с MDD и неадекватным ответом на SSRI [40]. Двадцать два взрослых человека (59% женщин; средний возраст 45,2 ± 11 лет) с DSM-IV MDD, частично отвечающих или не отвечающих на SSRI через, по меньшей мере, 4 недели лечения и имеющих по Шкале Гамильтона для оценки депрессии из 17 пунктов (HAM-D-17) балльную оценку выше или равную 12, были вовлечены в данное 8-недельное проспективное открытое испытание. Критерий исключения включал текущее применение противосудорожных или психотропных средств, отличных от SSRI, или дефицит В12. Фолиновую кислоту выбирали в качестве пероральной, синтетической высоко биодоступной формы фолата, которая метаболизируется до MTHF после абсорбции, и в отличие от MTHF доступна для назначения в Соединенных Штатах. Таким образом, фолиновую кислоту добавляли к SSRI в количестве 15-30 мг/день. Уровень фолата повышался с 28 ± 19 нг/мл до 301 ± 203 нг/мл (р<0,001). Балльные оценки HAM-D-17 среди 16 завершивших испытание уменьшились с 19,1 ± 3,9 до 12,8 ±7 (р<0,01). 31% завершивших испытание и 27% прошедших рандомизацию (ITT) образцов достигали ответа (с, по меньшей мере, 50% снижением балльных оценок HAM-D-17), и 19% завершивших испытание и 18% ITT образцов достигали ремиссии (HAM-D-17 не выше чем 7). В данной работе фолиновая кислота, по-видимому, является умеренно эффективной в качестве вспомогательного средства для устойчивых к SSRI депрессивных индивидуумов с нормальным уровнем фолата, и удивительным фактом является то, что значительная часть депрессивных индивидуумов все равно не отвечали на фолиновую кислоту в качестве вспомогательного средства к антидепрессанту. Таким образом, добавка фолата при устойчивой к лечению депрессии не давала эффективного ответа у всех индивидуумов [49], и конкретно, не менее 29% - 46% пациентов с MDD продемонстрировали только частичный ответ или не ответили на адекватный курс лечения антидепрессантом [50]. Конкретно эти работы не идентифицируют, для каких пациентов добавка фолата была эффективной или тех пациентов, у которых эффективность антидепрессанта не усиливалась фолатом. Фактически, ни одна из этих работ не идентифицировала биомаркеров или метод скрининга для идентификации субъектов, у которых фолат может усилить эффективность антидепрессанта.
Анализы и/или способы, описанные в данном документе, могут использоваться в качестве скрининга для идентификации и отбора конкретных пациентов с депрессией, где режим лечения, включающий антидепрессант и фолат-содержащее соединение, будет полезен для усиления терапевтического эффекта антидепрессанта.
Согласно анализам и/или способам, описанным в данном документе, субъекты с депрессией, которые были определены как имеющие, по меньшей мере, одно из состояний, описанных в данном документе (например, SNP и/или уровень биомаркеров в плазме/в сыворотке, описанных в данном документе), могут получить пользу от терапевтического эффекта антидепрессанта, вводимого в комбинации с эффективным количеством фолат-содержащего соединения. В некоторых воплощениях, фолат-содержащее соединение может включать L-метилфолат. В некоторых воплощениях, фолат-содержащее соединение может включать 6(8)-5-метилтетрагидрофолат (также известный как 6(S)-5-MTHF) или DEPLIN®.
Эффективное количество фолата для применения в способах лечения, описанных в данном документе, может варьировать в зависимости от типов и/или дозировок антидепрессанта (если он есть), типов фолата, тяжести депрессии, физического состояния субъекта (например, возраста, пола, веса). При использовании в данном документе термин «эффективное количество» относится к количеству фолата или фолат-содержащего соединения, которое при введении выбранному субъекту может ослаблять, по меньшей мере, один симптом, ассоциированный с депрессией, как описано позже, например, по меньшей мере, на около 5%, по меньшей мере, на около 10%, по меньшей мере, на около 20%, по меньшей мере, на около 30%, по меньшей мере, на около 40%, по меньшей мере, на около 50%, по меньшей мере, на около 60%, по меньшей мере, на около 70%, по меньшей мере, на около 80%, по меньшей мере, на около 90% или более по сравнению с лечением в отсутствии фолат-содержащего соединения.
В некоторых воплощениях, при использовании в данном документе термин «эффективное количество» относится к количеству фолата или фолат-содержащего соединения, которое при введении выбранному субъекту в комбинации с антидепрессантом может повышать эффект (например, эффективность или терапевтический эффект) антидепрессанта, например, по меньшей мере, на около 5%, по меньшей мере, на около 10%, по меньшей мере, на около 20%, по меньшей мере, на около 30%, по меньшей мере, на около 40%, по меньшей мере, на около 50%, по меньшей мере, на около 60%, по меньшей мере, на около 70%, по меньшей мере, на около 80%, по меньшей мере, на около 90% или более по сравнению с лечением с использованием антидепрессанта индивидуально. Иначе говоря, при использовании в данном документе термин «эффективное количество» относится к количеству фолата или фолат-содержащего соединения, которое при введении выбранному субъекту в комбинации с антидепрессантом может ослаблять, по меньшей мере, один симптом, ассоциированный с депрессией, как описано далее, например, по меньшей мере, на около 5%, по меньшей мере, на около 10%, по меньшей мере, на около 20%, по меньшей мере, на около 30%, по меньшей мере, на около 40%, по меньшей мере, на около 50%, по меньшей мере, на около 60%, по меньшей мере, на около 70%, по меньшей мере, на около 80%, по меньшей мере, на около 90% или более по сравнению с лечением с использованием антидепрессанта индивидуально.
В некоторых воплощениях эффективное количество фолата в режиме лечения может колебаться от около 1 мг/в день до около 70 мг/в день, от около 1 мг/в день до около 50 мг/в день, от около 2,5 мг/в день до около 40 мг/в день, от около 5 мг/в день до около 40 мг/в день, от около 5 мг/в день до около 30 мг/в день или от около 7 мг/в день до около 15 мг/в день. В некоторых воплощениях эффективное количество фолата в режиме лечения, как описано в данном документе, может колебаться от около 7,5 мг/в день до около 50 мг/в день. В некоторых воплощениях эффективное количество фолата в режиме лечения, как описано в данном документе, может колебаться от около 7,5 мг/в день до около 40 мг/в день. В некоторых воплощениях эффективное количество фолата в режиме лечения может составлять около 15 мг/в день.
Антидепрессанты
При использовании в данном документе, если не указано иначе, термин «антидепрессант» или «антидепрессант» или «антидепрессантное средство» относится к любому фармацевтическому агенту, который лечит депрессию. В некоторых воплощениях антидепрессант, вводимый субъекту в соответствии со способами, описанными в данном документе, может представлять собой любой подходящий фармацевтический агент, который широко используется для лечения депрессии. Примеры антидепрессантов или антидепрессантных средств могут включать в частности ингибиторы моноаминоксидазы, такие как фенелзин, транилципромин, и моклобемид; трициклические соединения, такие как имипрамин, амитриптилин, десипрамин, нортриптилин, доксепин, протриптилин, тримипрамин, хломипрамин и амоксапин; тетрациклические соединения, такие как мапротилин; нециклические соединения, такие как номифензин; триазолпиридины, такие как тразодон; ингибиторы обратного захвата серотонина, такие как флуоксетин, сертралин, пароксетин, циталопрам и флувоксамин; антагонисты рецептора серотонина, такие как нефазадон; ингибиторы обратного захвата норадренергического серотонина, такие как венлафаксин и милнаципрам; норадренергические и специфические серотонергические агенты, такие как миртазапин; ингибиторы обратного захвата норадреналина, такие как ребоксетин. Дополнительные антидепрессанты, которые могут использоваться в способах, описанных в данном документе, включают, в частности, бупропион; натуральные продукты, такие как кава-кава и зверобой; пищевые добавки, такие как s-аденозилметионин; нейропептиды, такие как тиротропин-высвобождающий гормон; соединение с направленным воздействием на нейропептидные рецепторы, такие как антагонисты нейрокининового рецептора; и гормоны, такие как трииодотиронин.
В некоторых воплощениях антидепрессант или антидепрессантное средство может представлять собой ингибитор обратного захвата серотонина (SRI) или селективный ингибитор обратного захвата серотонина (SSRI). Примеры SRI и/или SSRI включают в частности циталопрам, эсциталопрам, флуоксетин, R-флуоксетин, сертралин, пароксетин, флувоксамин, венлафаксин, дулоксетин, дапоксетин, нефазодон, имипрамин, имипрамин N-оксид, десипрамин, пирандамин, дазепинил, нефопам, бефуралин, фезоламин, фемоксетин, кломипрамин, цианоимипрамин, литоксетин, церикламин, сепроксетин, WY 27587, WY 27866, имелдин, ифоксетин, тифлукарбин, викалин, милнаципран, базинаприн, YM 922, S 33005, F 98214ТА, OPC 14523, алапроклат, пианодотепин, тимипрамин, хинупрамин, дотиепин, амоксапин, нитроксазепин, McN 5652, McN 5707, 01 77, Org 6582, Org 6997, Org 6906, амитриптилин, амитриптилин N-оксид, нортриптилин, CL 255. 663, пирлиндол, индатралин, LY 113.821, LY 214.281, CGP 6085 A, RU 25.591, напамезол, диклофенсин, тразодон, EMD 68.843, BMY 42.569, NS 2389, серклоремин, нитрохипазин, адеметионин, сибутрамин и кловоксамин. SRI могут использоваться в форме основания или его фармацевтически приемлемой соли присоединения кислоты.
В некоторых воплощениях, другие терапевтические соединения, которые могут вызывать повышение внеклеточного уровня 5-НТ в синаптической щели, например, тианептин, могут использоваться в качестве антидепрессанта в способах, описанных в данном документе.
В некоторых воплощениях антидепрессант или антидепрессантное средство может представлять собой селективный ингибитор обратного захвата серотонина (SSRI). При использовании в данном документе, термин «селективный ингибитор обратного захвата серотонина (SSRI)» относится к ингибитору переносчиков моноамина, который обладает более сильным ингибирующим эффектом в отношении транспорта серотонина, чем допамина и норадреналина. Примеры селективных ингибиторов обратного захвата серотонина (SSRI) могут в частности включать флуоксетин, циталопрам, пароксетин, эсциталопрам, сертралин и любую их комбинацию.
Дополнительные SRI и/или SSRI, которые могут вводиться субъекту с депрессией в комбинации с фолат-содержащим соединением, могут включать, например, те, что описаны в Пат. Заявках США No.: US 2005/0054688, и US 2008/0138411; и Пат. США No.: 6,720,003; 6,787,560; 7,893,261; и 7148238.
Специалист в данной области будет способен легко определить рекомендуемый уровень дозы для известного и/или продаваемого антидепрессантного средства путем просмотра соответствующих ссылок, таких как листок-вкладыш, руководство FDA, и Настольное Руководство Врача. В некоторых воплощениях, доза антидепрессантного средства может колебаться от 0,1 мг/в день до около 1000 мг/в день, от около 0,5 мг/в день до около 500 мг/в день, от около 1 мг/в день до около 400 мг/в день, от около 5 мг/в день до около 300 мг/в день, или от около 10 мг/в день до около 200 мг/в день. Специалист в данной области может легко отрегулировать дозировку для каждого отличного антидепрессантного средства в зависимости от ряда факторов, таких как типы и/или эффективность антидепрессантов, тяжесть депрессии, физическое состояние субъекта (например, возраст, пол и вес), пути введения, другие лекарственные средства, принимаемые субъектом и их комбинация.
Фармацевтические композиции для лечения депрессии
В данном документе для in vivo введения субъектам, у кого имеется, по меньшей мере, одно (например, по меньшей мере, два, по меньшей мере, три или более) из состояний (А)-(Х), определенных в анализах, описанных в данном документе, представлены фармацевтические композиции, включающие терапевтически эффективное количество фолат-содержащего соединения и фармацевтически приемлемый носитель.
В различных воплощениях, терапевтически эффективное количество фолат-содержащего соединения или фолата, необязательно вводимого вместе с антидепрессантом или с его фармацевтически приемлемой солью, представляет собой количество, достаточное для повышения степени улучшения, по меньшей мере, одного нейропсихологического теста, например, по измерениям с помощью HAMD-17, HAMD-28 или с помощью других измерений эффективности, как описано в Примерах, по меньшей мере, на около 5%, по меньшей мере, на около 10%, по меньшей мере, на около 20%, по меньшей мере, на около 30%, по меньшей мере, на около 40%, по меньшей мере, на около 50%, по меньшей мере, на около 60%, по меньшей мере, на около 70%, по меньшей мере, на около 80%, или, по меньшей мере, на около 90%, по сравнению со степенью улучшения, полученной при отсутствии фолат-содержащего соединения (например, вместе с антидепрессантной монотерапией или без нее). В некоторых воплощениях, терапевтически эффективное количество фолат-содержащего соединения или фолата, необязательно вводимого вместе с антидепрессантом или с его фармацевтически приемлемой солью, представляет собой количество, достаточное для повышения степени улучшения, по меньшей мере, одного нейропсихологического теста, например, по измерениям с помощью HAMD-17, HAMD-28 или с помощью других измерений эффективности, как описано в Примерах, по меньшей мере, в 1 раз, по меньшей мере, примерно в 2 раза, по меньшей мере, примерно в 3 раза, по меньшей мере, примерно в 4 раза, по меньшей мере, примерно в 5 раз или выше, по сравнению со степенью улучшения, полученной при отсутствии фолат-содержащего соединения (например, вместе с антидепрессантной монотерапией или без нее).
В некоторых воплощениях, доза фолат-содержащего соединения или фолата для введения человеку может колебаться в интервале от около 0,01 до около 50 мг на килограмм массы тела реципиента в день, в интервале от около 0,05 до около 5 мг на килограмм массы тела реципиента в день, или в интервале от около 0,1 до около 1 мг на килограмм массы тела реципиента в день. В некоторых воплощениях целевая доза может присутствовать в виде одной дозированной лекарственной формы, например, содержащей от около 0,5 мг до около 500 мг, от около 5 мг до около 250 мг, от около 10 мг до около 100 мг, или от около 10 мг до около 50 мг. В некоторых воплощениях одна дозированная лекарственная форма может обеспечивать от около 1 мг до около 70 мг фолата, от около 5 Мг до около 60 мг фолата, или от около 7 мг до около 50 мг фолата. В некоторых воплощениях одна дозированная лекарственная форма может обеспечивать от около 7,5 мг до около 50 мг фолата. В других воплощениях, целевая доза может присутствовать в двух, трех, четырех, пяти или более субдозах, вводимых через подходящие интервалы в течение дня. Эти субдозы могут вводиться в дозированных лекарственных формах, например, содержащих от около 0,1 мг до около 250 мг, от около 1 мг до около 100 мг, от около 2 мг до около 20 мг, или от около 2 мг до около 10 мг.
В некоторых воплощениях, фармацевтическая композиция включает, по меньшей мере, один антидепрессант. Как правило, доза антидепрессанта или его фармацевтически приемлемой соли, подходящая для введения человеку, колеблется в интервале от около 0,01 до 50 мг на килограмм массы тела реципиента в день или в интервале от 0,1 до 5 мг на килограмм массы тела реципиента в день. В некоторых воплощениях целевая доза может присутствовать в виде одной дозированной лекарственной формы, например, содержащей от около 1 мг до около 500 мг, или от около 5 мг до около 300 мг. В других воплощениях, целевая доза может присутствовать в двух, трех, четырех, пяти или более субдозах, вводимых через подходящие интервалы в течение дня. Эти субдозы могут вводиться в дозированных лекарственных формах, например, содержащих от около 0,1 мг до около 100 мг, или от около 1 мг до около 50 мг.
При использовании в данном документе термин «фармацевтически приемлемый» относится к тем соединениям, материалам, композициям и/или дозированным формам, которые в рамках озвученного мнения врача подходят для использования в контакте с тканями людей и животных без избыточной токсичности, раздражения, аллергической реакции или других проблем или сложностей, в соответствии с оправданным соотношением пользы/риска.
При использовании в данном документе термин «фармацевтически приемлемый носитель» означает фармацевтически приемлемый материал, композицию или носитель, такие как жидкий или твердый наполнитель, эксципиент, вспомогательное вещество (например, смазочное вещество, тальк, стеарат магния, кальция или цинка, или стеариновая кислота), или материал, инкапсулирующий растворитель, вовлеченный в перенос или в транспорт целевого соединения из одного органа или области тела в другой орган или в другую область тела. Каждый носитель должен быть «совместимым» в смысле того, что он совместим с другими ингредиентами состава и не должен быть вредным по отношению к пациенту. Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают: (i) сахара, такие как лактоза, глюкоза и сахароза; (ii) крахмалы, такие как кукурузный крахмал и картофельный крахмал; (iii) целлюлозу и ее производные, такие как натрий карбоксиметилцеллюлоза, метилцеллюлоза, этилцеллюлоза, микрокристаллическая целлюлоза и ацетат целлюлозы; (iv) порошкообразный трагакант; (v) солод; (vi) желатин; (vii) смазывающие агенты, такие как стеарат магния, лаурил сульфат натрия и тальк; (viii) эксципиенты, такие как какао-масло и воски суппозиториев; (ix) масла, такие как арахисовое масло, хлопковое масло, подсолнечное масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (х) гликоли, такие как пропиленгликоль; (xi) полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль (PEG); (xii) эфиры, такие как этилолеат и этиллаурат; (xiii) агар; (xiv) буферные агенты, такие как гидроксид магния и гидроксид алюминия; (xv) альгиновая кислота; (xvi) пироген-свободная вода; (xvii) изотонический солевой раствор; (xviii) раствор Рингера; (xix) этиловый спирт; (хх) рН-буферные растворы; (xxi) полиэфиры, поликарбонаты и/или полиангидриды; (xxii) агенты-наполнители, такие как полипептиды и аминокислоты (xxiii) сывороточные компоненты, такие как сывороточный альбумин, HDL и LDL; (xxiv) C2-C12 спирты, такие как этанол; и (xxv) другие нетоксичные совместимые вещества, применяемые в фармацевтических составах. Увлажняющие агенты, красители, агенты высвобождения, агенты покрытия, подсластители, вкусовые агенты, отдушки, консерванты и антиоксиданты также могут присутствовать в составе.
Фармацевтически приемлемые носители могут варьировать в композиции, описанной в данном документе, в зависимости от пути введения и состава. Например, фармацевтически приемлемая композиция, описанная в данном документе, может быть доставлена посредством инъекции. Эти пути введения (доставки) включают в частности методы подкожного или парентерального введения, включающие методы внутривенного, внутриартериального, внутримышечного, внутрибрюшинного, внутримиокардиального и инфузионного введения. В одном воплощении, фармацевтически приемлемая композиция представлена в форме, которая подходит для инъекции. В другом воплощении фармацевтическая композиция представлена в виде состава для доставки посредством катетера.
При парентеральном введении фармацевтической композиции она, как правило, включена в состав в виде единой лекарственной формы (в виде раствора, суспензии, эмульсии). Фармацевтические композиции, подходящие для инъекции, включают стерильные водные растворы или дисперсии. Носитель может представлять собой растворитель или диспергирующую среду, содержащую, например, воду, клеточную культуральную среду, буферы (например, фосфатно-буферный солевой раствор), полиол (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль и тому подобное), и их подходящие смеси. В некоторых воплощениях, фармацевтический носитель может представлять собой буферный раствор (например, PBS).
В некоторых воплощениях, фармацевтическая композиция может быть представлена в составе в виде эмульсии или геля.
В некоторых воплощениях, фармацевтические композиции, описанные в данном документе, могут быть включены в состав для перорального введения или для ингаляции. Для перорального введения, подходящие лекарственные формы могут включать таблетки, пастилки, крахмальные капсулы, каплеты и капсулы, включающие твердые и мягкие желатиновые капсулы.
В некоторых воплощениях, и антидепрессант и фолат-содержащее соединение могут быть включены в состав в одной фармацевтической композиции. Например, и антидепрессант и фолат-содержащее соединение могут быть включены в состав одной таблетки для перорального введения.
В некоторых воплощениях, где антидепрессант и фолат-содержащее соединение включены в состав в одной композиции, они могут высвобождаться из композиции одновременно или в различные моменты времени. Исключительно в качестве примера, если фолат-содержащее соединение включено в состав во внешнем слое композиции (например, таблетки или частицы, доставляющей лекарственное средство), тогда как антидепрессант включен в состав во внутреннем слое композиции, то фолат-содержащее соединение могло бы высвобождаться из композиции позже с более медленной скоростью. С другой стороны, если антидепрессант и фолат-содержащее соединение смешаны гомогенно внутри композиции, то они оба могут высвобождаться одновременно из композиции.
В других воплощениях, антидепрессант и фолат-содержащее соединение могут быть включены в состав отдельных фармацевтических композиций для одинаковых или для различных путей введения в процессе курса терапии. Например, антидепрессант может быть включен в состав для ингаляции, в то время как фолат-содержащее соединение может быть включено в состав для перорального введения. В других воплощениях, и антидепрессант и фолат-содержащее соединение могут быть включены в состав для перорального введения, например, в отдельные таблетки.
Эффективное количество фолата, вводимого выбранному человеку для лечения депрессии, как описано в данном документе, значительно выше, чем типичное количество, которое берут в виде диетической добавки (в интервале 50-600 μг/день). В некоторых воплощениях, эффективное количество фолата, вводимого выбранному человеку, составляет, по меньшей мере, около 2-кратного превышения, по меньшей мере, около 5-кратного превышения, по меньшей мере, около 10-кратного превышения, по меньшей мере, около 25-кратного превышения, по меньшей мере, около 50-кратного превышения, по меньшей мере, около 100-кратного превышения, по меньшей мере, около 250-кратного превышения, по меньшей мере, около 500-кратного превышения, по меньшей мере, около 1000-кратного превышения или более по отношению к типичному количеству, которое берут для диетической добавки. Соответственно, в некоторых воплощениях, фолат-содержащее соединение целесообразно включать в композицию с медленным высвобождением или с продолжительным высвобождением.
Соответственно, в некоторых воплощениях, фармацевтические композиции, включающие фолат-содержащее соединение (вместе или без антидепрессанта), могут быть включены в состав для замедленной высвобождения или замедленной доставки. В некоторых воплощениях, фармацевтические композиции могут быть включены в состав в системы с контролируемым высвобождением, например, для обеспечения замедленного высвобождения фолат-содержащего соединения (и необязательно антидепрессанта). При использовании в данном документе термин «замедленное высвобождение» или «замедленная доставка» относится к продолжительной доставке терапевтического агента in vivo в течение некоторого периода времени после введения. Например, замедленное высвобождение может осуществляться в течение периода, составляющего, по меньшей мере, около 1 часа, по меньшей мере, около 2 часов, по меньшей мере, около 3 часов, по меньшей мере, около 4 часов, по меньшей мере, около 5 часов, по меньшей мере, около 6 часов, по меньшей мере, около 9 часов, по меньшей мере, около 12 часов, по меньшей мере, около 16 часов, по меньшей мере, около 24 часов после введения. В некоторых воплощениях, замедленное высвобождение может осуществляться в течение периода, составляющего, по меньшей мере, около 1 дня, по меньшей мере, около 2 дней, по меньшей мере, около 3 дней, по меньшей мере, около 4 дней, по меньшей мере, около 5 дней, по меньшей мере, около 6 дней, по меньшей мере, около 7 дней после введения. В некоторых воплощениях, высвобождение фолат-содержащего соединения из системы доставки лекарственного средства может представлять собой равновесное состояние (кинетика нулевого порядка) с высвобождением, по меньшей мере, около 30% (например, включая, по меньшей мере, около 40%, по меньшей мере, около 50%, по меньшей мере, около 60%, по меньшей мере, около 70%, по меньшей мере, около 80%, по меньшей мере, около 90%, по меньшей мере, около 95% или более) фолат-содержащего соединения (и необязательно антидепрессанта), которое высвобождается в течение периода около 3-6 часов после введения или в течение периода около 4-5 часов после введения. В одном воплощении, высвобождение фолат-содержащего соединения (и необязательно антидепрессанта) из системы доставки лекарственного средства может представлять собой равновесное состояние (кинетика нулевого порядка) по существу с полным высвобождением (например, ~100%) фолат-содержащего соединения, высвобождаемого в течение периода около 3-6 часов после введения или в течение периода около 4-5 часов после введения. В некоторых воплощениях, фолат-содержащее соединение может высвобождаться из системы доставки лекарственного средства со скоростью, которая достаточно медленная для того, чтобы не перегрузить способность кишечного всасывания двенадцатиперстной кишки пациента (первая 1/3 тонкого кишечника, где происходит ~90% всасывание фолат-содержащего соединения, например, L-MTHF). В некоторых воплощениях, фолат-содержащее соединение и антидепрессант (если он есть) могут высвобождаться из системы доставки лекарственного средства одновременно или по отдельности с одинаковой или с различными скоростями высвобождения.
Любая система доставки лекарственного средства (например, в частности, на основе полимера), которая обеспечивает высвобождение фолат-содержащего соединения (и необязательно антидепрессанта) в течение заранее определенного периода времени, может использоваться для введения фолат-содержащего соединения (и необязательно антидепрессанта). В одном воплощении, система доставки лекарственного средства может представлять собой тип каплеты с крупным размером, которого достаточно для блокирования пилорическим клапаном между желудком и двенадцатиперстной кишкой, что дает таким образом каплете медленно и частично растворяться в течение целевого периода времени, например, в течение периода около 2-3 часов, в течение которого фолат-содержащее соединение равновесно высвобождается из каплета. Так как каплет растворяется до размера, который может проникнуть через пилорический клапан, через какое-то время каплет завершает свое равновесное высвобождение (например, дополнительный период времени, например дополнительные 2 часа), и каплет может продолжить свой путь по тонкой кишке (вторая треть тонкого кишечника), где всасывание минимально.
В некоторых воплощениях, система доставки лекарственного средства может использовать смесь гидрофильных и гидрофобных полимеров для контроля высвобождения фолат-содержащего соединения (и необязательно антидепрессанта) посредством диффузии и эрозии полимерного матрикса.
В некоторых воплощениях, система доставки лекарственного средства может включать фолат-содержащее соединение (и необязательно антидепрессант), инкапсулированное в частицы на основе полимера. Эти фолат-содержащие частицы на основе полимера могут быть залиты в капсулы или в однодозовые саше для дополнительного контроля высвобождения.
Системы доставки лекарственного средства с контролируемым высвобождением (например, с замедленным высвобождением) для различных методов введения (например, пероральное введение, инъекция, имплантация, ингаляция), известные в данной области, могут быть выбраны для доставки фолат-содержащего соединения (и необязательно антидепрессанта) для способов лечения, описанных в данном документе. См., например, Пат. Заявки США No. WO 2012/111961 (пероральный состав), WO 2012/131678 (состав для инъекции); Пат. Заявку США No. US 2012/0258161 (состав для имплантации), US 2001/0038854, US 2001/0033866; и Пат. No. 8268347 (состав для ингаляции), содержание которых включено в данный документ ссылкой, для различных типов систем доставки лекарственных средств для доставки активного агента посредством различных путей введения.
Кроме того, могут быть добавлены различные добавки, которые повышают стабильность, стерильность и изотоничность композиций, включая противомикробные агенты, консерванты, антиоксиданты, хелатирующие агенты и буферы. Предотвращение действия микроорганизмов может быть предотвращено различными противобактериальными и противогрибковыми агентами, например, парабенами, хлоробутанолом, фенолом, сорбиновой кислотой и т.п. Во множестве случаев может быть целесообразным включить изотонические агенты, например, сахара, хлорид натрия и тому подобное.
Композиции также могут содержать вспомогательные вещества, такие как увлажнители или эмульгаторы, буферные агенты рН, добавки, усиливающие гелеобразование или вязкость, консерванты, красители, связующие агенты и т.п., в зависимости от пути введения и требуемого препарата. Стандартные тексты, такие как «REMINGTON'S PHARMACEUTICAL SCIENCE», 17th edition, 1985, включенные в данный документ ссылкой, могут быть использованы для справки и приготовления подходящих препаратов, без проведения излишних экспериментов. Однако по отношению к композициям, описанным в данном документе, любой используемый носитель, разбавитель или добавка, должны быть совместимы с антидепрессантом или с его фармацевтически приемлемой солью и/или с фолат-содержащим соединением.
Фармацевтические композиции могут быть изотоническими, т.е. они могут иметь такое же осмотическое давление, как кровь и лакримальная жидкость. Целевая изотоничность композиций, описанных в данном документе, может достигаться с использованием хлорида натрия или других фармацевтически приемлемых агентов, таких как декстроза, борная кислота, тартратнатрия, пропиленгликоль или другие неорганические или органические растворимые вещества. В одном воплощении, хлорид натрия используется в буферах, содержащих ионы натрия.
Вязкость композиций может поддерживаться на выбранном уровне с использованием фармацевтически приемлемых загустителей. В одном воплощении, используется метилцеллюлоза, так как она легкодоступна и экономически доступна, а также легка в применении. Другие подходящие загустители включают, например, ксантановую камедь, карбоксиметилцеллюлозу, гидроксипропилцеллюлозу, карбомер и тому подобное. Предпочтительная концентрация загустителя зависит от выбранного агента. Важный момент это применение количества, при котором будет достигаться выбранная вязкость. Вязкие композиции, как правило, получают из растворов путем добавления таких загустителей.
Как правило, любые добавки (дополнительно к антидепрессанту и/или фолат-содержащему соединению) могут присутствовать в количестве 0,001-50 масс.% раствора в фосфатно-буферном солевом растворе, и активный ингредиент присутствует в количестве порядка от миллиграммов до граммов, как например, от около 0,0001 до около 5 масс.%, от около 0,0001 до около 1 масс.%, от около 0,0001 до около 0,05 масс.% или от около 0,001 до около 20 масс.%, от около 0,01 до около 10 масс.%, и от около 0,05 до около 5 масс.%. Для любых терапевтических композиций, вводимых субъекту под давлением и для любого конкретного способа введения предпочтительно определить токсичность, как например, путем определения летальной дозы (LD) и LD50 на подходящей животной модели, например, на модели грызунов, таких как мышь; и дозировку композиции(й), концентрацию компонентов в композиции и расписание введения композиции(й), которые вызывают подходящий ответ. Такие определения не потребуют излишних экспериментов от специалиста в данной области.
Специалисту в данной области понятно, что компоненты композиций должны быть выбраны так, чтобы они были совместимы по отношению к активному агенту, например, к антидепрессанту, и/или к фолат-содержащему соединению. Это не принесет проблем специалистам в области химии и фармацевтики, или проблемы могут быть легко решены путем просмотра стандартной научной литературы или путем простых экспериментов (за исключением излишнего экспериментирования).
Композиции, описанные в данном документе, могут быть получены путем смешивания ингредиентов согласно общепринятым процедурам. Например, ингредиенты могут быть смешаны в соответствующем фармацевтически приемлемом носителе, и смесь может регулироваться до конечной концентрации и вязкости путем добавления воды и загустителя и возможно буфера для контроля рН, или дополнительного растворяемого вещества для контроля тоничности. Как правило, рН может варьироваться от около 3 до около 7,5. В некоторых воплощениях, рН композиции может составлять от около 6,5 до около 7,5. Композиции могут быть введены в дозировках и с помощью любых методов, хорошо известными специалистам в области медицины или ветеринарии, принимая во внимание такие факторы, как возраст, пол, вес и состояние конкретного пациента и формы композиции, используемой для введения (например, жидкая). Дозировки для людей или других млекопитающих могут определяться специалистом в данной области, не прибегая к излишнему экспериментированию.
Еще один следующий аспект, предлагаемый в данном документе, относится к применениям фолат-содержащей композиции при лечении депрессии у человека, который является носителем, по меньшей мере, одного из состояний (А)-(Х), описанных в данном документе (например, в частности, или одно или оба состояния (А) и (С)). Другой аспект, предлагаемый в данном документе, относится к применениям фолат-содержащей композиции в комбинации с антидепрессантом для применения при лечении депрессии у человека, который является носителем, по меньшей мере, одного из состояний (А)-(Х), описанных в данном документе (например, в частности, или одно или оба состояния (А) и (С)). В некоторых воплощениях данных аспектов, описанных в данном документе, фолат-содержащая композиция, которая может включать, по меньшей мере, около, 5 мг фолата (например, от около 7,5 мг до около 50 мг фолата). В некоторых воплощениях, фолат-содержащая композиция может включать в состав для профиля определенного высвобождения (например, продолжительное высвобождение). В некоторых воплощениях человек является взрослым человеком.
Отбор субъектов с депрессией
В некоторых воплощениях, субъекты, восприимчивые к анализам, способам и композициям, описанным в данном документе, могут представлять собой субъекты, у которых была диагностирована депрессия или предрасположенность к развитию депрессии. Соответственно, в некоторых воплощениях, субъекты, у которых была диагностирована депрессия или предрасположенность к развитию депрессии, выбирались перед тем, как подвергать их воздействию с помощью анализов, способов и/или композиций, описанных в данном документе. В некоторых воплощениях, выбирают субъект для режима лечения депрессии, включающего фолат-содержащее соединение. В некоторых воплощениях, субъекту специфически вводят фолат-содержащее соединение для усиления (или в качестве адъюванта) эффекта антидепрессантного средства, а не по какой-то другой причине. Например, женщина с депрессией, желающая забеременеть или которая уже беременна или в период лактации, может принимать пренатальные добавки, содержащие фолиевую кислоту в комбинации с антидепрессантным средством. В таких случаях, человек, восприимчивый к анализам, способам и/или композициям, описанным в данном документе, специфически выбирается для лечения депрессии перед осуществлением анализов и/или способов, описанных в данном документе и/или введения композиций, описанных в данном документе.
В некоторых воплощениях, субъекту специфично вводят фолат-содержащее соединение для лечения депрессии, и ни по какой-то другой причине. Например, человек, диагностированный как страдающий от депрессии или с риском развития депрессии, может принимать эффективное количество фолат-содержащего соединения (вместе с антидепрессантом или без него). В таких случаях, человек, восприимчивый к анализам, способам и/или композициям, описанным в данном документе, специфически выбирается для лечения депрессии перед осуществлением анализов и/или способов, описанных в данном документе, и/или введения композиций, описанных в данном документе.
Фраза «имеющий риск депрессии» или «предрасположенный к развитию депрессии» или «предрасположенный к развитию большого депрессивного расстройства» относится к субъекту, у которого присутствует один или более симптомов, выявляющих депрессию, включая большое депрессивное расстройство (например, необъяснимая бессонница, усталость, раздражительность, и т.д.), или который был скринирован на наличие депрессии, включая большое депрессивное расстройство (например, во время обычного медосмотра), например, согласно критериям, перечисленным в DSM-IV или ICD-10, как обсуждается ниже.
При использовании в данном документе термин «депрессия», как правило, относится к психическому состоянию депрессивного настроения, отличающегося чувством грусти, отчаяния и упадка духа. В некоторых случаях, депрессия представляет собой клинический симптом и может включать, в частности, большое депрессивное расстройство (включая единичный эпизод и рецидив), униполярную депрессию, невосприимчивую к лечению депрессию, стойкую депрессию, депрессию, сопровождающуюся тревожностью и дистимию (также относится к дистимическому расстройству). Кроме того, термин «депрессия» может охватывать любое большое депрессивное расстройство, дистимическое расстройство, расстройства настроения, связанные с заболеваниями с чертами депрессии, расстройства настроения, связанные с заболеваниями с эпизодами типа большого депрессивного расстройства, расстройства настроения с чертами депрессии и депрессивного расстройства, индуцированные препаратами, не определяемые никак иначе, кроме диагностических критериев, перечисленных в American Psychiatric Association's Diagnostic and Statistical Manual of Mental Disorders, 4th Edition, (DSM-IV) или любом его позднем издании, или в World Health Organization's International Statistical Classification of Diseases and Related Health Problems (ICD-10). В одном воплощении, депрессия представляет собой большое депрессивное расстройство.
DSM-IV и ICD-10 обеспечивают общепринятый язык и стандартные критерии для классификации психических расстройств и широко применяются специально обученными врачами общей практики или психиатрами для диагностики депрессии, включая большое депрессивное расстройство. Симптомы депрессии могут включать, в частности, проблемы концентрации, запоминания и/или принятия решений, изменений в привычках питания и/или сна, проблемы потери интереса к приятному времяпрепровождению, трудности походов на работу или осуществления ежедневных обязанностей, ощущения вины и/или безнадежности, замедленные мысли и/или речь и озабоченность мыслями о смерти или суициде. Специалист в данной области может определить балльную оценку степени депрессии на основе DSM-IV или ICD-10.
Также для определения степени депрессии могут использоваться другие шкалы или критерии классификации психических расстройств, известные в данной области, например, шкала Maier или HAMD-7, или Опросник социальных функций (SFQ), визуальная аналоговая шкала (VAS), и/или Опросник когнитивных и физических функций (CPFQ).
В процессе диагностики депрессии практикующий врач также может оценить историю болезни пациента, обсудить текущие способы регуляции настроения субъектом (здоровые или нет), такие как использование алкоголя и наркотиков, и/или осуществить оценку психического состояния, которая представляет собой оценку текущего настроения индивидуума, конкретно в отношении наличия тем безнадежности или пессимизма, членовредительства или суицида и отсутствия положительных мыслей или планов. Кроме того, практикующий врач, как правило, может осуществить медицинский осмотр для исключения других некогнитивных случаев симптомов депрессии. Например, для исключения гипотиреоза могут использоваться анализы крови, измеряющие TSH и тироксин; основные электролиты и сывороточный кальций для исключения метаболических нарушений; и полный анализ крови, включающий ESR для исключения системной инфекции или хронического заболевания. Уровень тестостерона также может оцениваться для диагностики гипогонадизма, причины депрессии у мужчин.
Для диагностики депрессии может использоваться любой генетический или биомаркерный способ, известный в данной области. Например, Пат. Заявка США № US 2010/0273153 дает описание того, что присутствие гаплотипа TG7AT может быть показателем предрасположенности к большому депрессивному расстройству. Дополнительный маркерный ген для депрессии, такой как АТР2А2, SCYA5, STIP1, EEF1A1, GRB10, CASP6, TSSC1, RAB9, NFATC3, TPR, и любые другие, перечисленные, например, в Пат. Заявке США № US 2005/0239110 также могут использоваться для диагностики депрессии.
В некоторых воплощениях, субъекты, восприимчивые к анализам, способам и композициям, описанным в данном документе, представляют собой субъекты, у которых было диагностировано большое депрессивное расстройство или предрасположенность к развитию большого депрессивного расстройства. Большое депрессивное расстройство характеризуется присутствием тяжело депрессивного настроения, которое длится в течение, по меньшей мере, двух недель. Эпизоды могут быть отдельными или могут повторяться и могут быть охарактеризованы практикующим врачом как умеренные (немного симптомов, превышающих минимальные критерии), средние или тяжелые (заметное влияние на социальное и профессиональное функционирование).
В некоторых воплощениях, субъекты, восприимчивые к анализам, методам и композициям, описанным в данном документе, представляют собой субъектов, которые были диагностированы как имеющие большое депрессивное расстройство (MDD) и которые устойчивы к антидепрессантной монотерапии, т.е. к лечению депрессии с использованием исключительно одного антидепрессанта. Фраза «устойчив к антидепрессантной монотерапии» используется в данном документе для обозначения субъекта с депрессией, который устойчив, по меньшей мере, к одному антидепрессанту одного или более классов. Это включает субъектов с депрессией, которые устойчивы, по меньшей мере, к двум, по меньшей мере, к трем, по меньшей мере, к четырем антидепрессантам или более, принадлежащим к одному или более классам. В некоторых воплощениях, субъекты, восприимчивые к анализам, методам и композициям, описанным в данном документе, представляют собой субъектов, которые были диагностированы как имеющие большое депрессивное расстройство (MDD) и которые устойчивы, по меньшей мере, к одному ингибитору обратного захвата серотонина (SRI), включая, по меньшей мере, один, по меньшей мере, два, по меньшей мере, три, по меньшей мере, четыре или более SRI. В некоторых воплощениях, субъекты, восприимчивые к анализам, методам и композициям, описанным в данном документе, представляют собой субъектов, которые были диагностированы как имеющие большое депрессивное расстройство (MDD) и которые устойчивы, по меньшей мере, к одному селективному ингибитору обратного захвата серотонина (SSRI), включая, по меньшей мере, два, по меньшей мере, три, по меньшей мере, четыре или более SSRI.
В некоторых воплощениях, субъект, выбранный для анализов, методов и композиций, описанных в данном документе, находился в состоянии ремиссии после депрессии и в данный момент диагностирован как имеющий рецидив или предрасположенность к рецидиву. В других воплощениях, субъект, выбранный для анализов, методов и композиций, описанных в данном документе, находится в состоянии депрессии и в данный момент принимает, по меньшей мере, один антидепрессант.
При использовании в данном документе, «субъект» может означать человека или животное. Примеры субъектов включают приматов (например, людей и обезьян). Как правило, животное представляет собой позвоночное, такое как примат, грызун, домашнее животное или охотничье-промысловое животное. Приматы включают шимпанзе, макак-крабоедов, паукообразных обезьян и макак, например Резус-макак. Грызуны включают мышей, крыс, сурков, хорьков, кроликов и хомяков. Пациент или субъект включает любую подгруппу из вышеупомянутых, например, все из вышеперечисленных, или включает одну или более групп или видов, таких как люди, приматы или грызуны. В некоторых воплощениях аспектов, описанных в данном документе, субъектом является млекопитающее, например, примат, например, человек. Термины «пациент», «индивидуум» и «субъект» используются в данном документе взаимозаменяемо. Субъект может быть мужского или женского пола. В некоторых воплощениях субъекты, восприимчивые к анализам, методам и/или композициям, описанным в данном документе, могут быть представлены женщинами.
В некоторых воплощениях, субъектом является человек. Субъекты-люди могут принадлежать к любому этносу или расе, например, включая в частности европейцев, афроамериканцев, азиатов и латиноамериканцев, африканцев, индийцев и алеутов, гавайцев и других народов тихоокеанских островов. В некоторых воплощениях человек, восприимчивый к анализам, способам и/или композициям, описанным в данном документе, может являться европейцем. При использовании в данном документе термин «Европеец» относится к представителю белой расы, состоящей из индивидуумов европейского, североафриканского или азиатского происхождения. В некоторых воплощениях субъекты-люди, восприимчивые к анализам, способам и/или композициям, описанным в данном документе, могут представлять собой афроамериканцев. В некоторых воплощениях субъекты-люди, восприимчивые к анализам, способам и/или композициям, описанным в данном документе, могут представлять собой азиатов. В некоторых воплощениях субъекты-люди, восприимчивые к анализам, способам и/или композициям, описанным в данном документе, могут представлять собой латиноамериканцев.
В некоторых воплощениях субъекты-люди, восприимчивые к анализам, способам и/или композициям, описанным в данном документе, могут быть любого возраста. В некоторых воплощениях субъекты-люди, восприимчивые к анализам, способам и/или композициям, описанным в данном документе, могут быть в возрасте, по меньшей мере, 18 лет. В других воплощениях, субъекты-люди, которым менее 18 лет, также могут подвергаться воздействию анализов, способов и/или композиций, описанных в данном документе.
Системы и машиночитаемые носители для применения в анализах и/или способах, описанных в данном документе
Воплощения следующего аспекта также обеспечивают системы (и машиночитаемые носители для работы компьютерных систем) для осуществления анализа выбора режима лечения субъекта с депрессией на основе, по меньшей мере, информации о последовательности SNP-биомаркеров (i)-(xxi), описанных в данном документе и/или на основе уровня экспрессии периферических биомаркеров (xxii)-(xxiv).
Представлена компьютерная система для получения данных, по меньшей мере, из одного тестируемого образца, полученного, по меньшей мере, из одного субъекта. Система включает: (а) модуль определения, сконфигурированный для получения, по меньшей мере, одного тестируемого образца и осуществления, по меньшей мере, одного анализа, по меньшей мере, на одном тестируемом образце для определения параметров, по меньшей мере, двух биомаркеров (i)-(xxiv), описанных в данном документе; (b) устройство хранения, сконфигурированное для хранения выходных данных из модуля определения; (с) расчетный модуль, например, искусственное устройство, включающее специфически запрограммированные инструкции для определения на основании выходных данных наличия, по меньшей мере, одного состояния (А)-(X), описанного в данном документе; и (d) модуль индикации для вывода содержания частично на основе выходных данных расчетного модуля, где содержание включает показательный сигнал наличия, по меньшей мере, одного состояния (А)-(X), описанного в данном документе, и необязательно, отсутствие любого из состояний (А)-(X), описанных в данном документе, или показательный сигнал отсутствия всех состояний (А)-(X), описанных в данном документе.
В некоторых воплощениях, модуль определения может быть сконфигурирован для осуществления, по меньшей мере, одного анализа генотипирования, по меньшей мере, на одном тестируемом образце для определения генотипов, по меньшей мере, двух локусов, включающих положение 677 в SEQ ID NO. 1 (или в положении 27 в SEQ ID NO. 7) и в положении 2756 в SEQ ID NO. 2 (или в положении 27 в SEQ ID NO. 9). В этих воплощениях, компьютерный модуль может конфигурироваться для определения наличия, по меньшей мере, одного SNP, локализованного в положении 677 в SEQ ID NO. 1 (или в положении 27 в SEQ ID NO. 7), включающем, по меньшей мере, один аллель с тимином «Т» и/или в положении 2756 в SEQ ID NO. 2 (или в положении 27 в SEQ ID NO. 9), включающего, по меньшей мере, один аллель с гуанином «G».
В другом воплощении, модуль определения может быть сконфигурирован для осуществления, по меньшей мере, одного анализа, по меньшей мере, на одном тестируемом образце для определения наличия или отсутствия, по меньшей мере, одного из следующих состояний:
i. соотношение экспрессии s-аденозилметионина (SAM) к s-аденозилгомоцистеину (SAH) меньше, чем предварительно определенное эталонное соотношение;
ii. экспрессия 4-гидроксиноненаля (4-HNE) больше, чем предварительно определенное эталонное значение;
iii. однонуклеотидный полиморфизм (SNP) в положении 677 в SEQ ID NO: 1, включающий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO: 1 представляет собой участок геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR);
iv. (SNP) в положении 2756 в SEQ ID NO: 2, включающий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO: 2 представляет собой участок геномной нуклеотидной последовательности метионинсинтазы (MTR);
v. (SNP) в положении 66 в SEQ ID NO: 3, включающий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO: 3 представляет собой участок геномной нуклеотидной последовательности редуктазы метионинсинтазы (MTRR).
В данных воплощениях модуль определения дополнительно может быть сконфигурирован для определения наличия или отсутствия, по меньшей мере, одного отличного состояния (А)-(Х), описанного в данном документе. Например, в некоторых воплощениях модуль определения может дополнительно может быть сконфигурирован для определения экспрессии высокочувствительного с-реактивного белка (hsCRP). В некоторых воплощениях, модуль определения может дополнительно может быть сконфигурирован для определение наличия или отсутствия SNP в положении 1298 в SEQ ID NO. 1, содержащего по меньшей мере, один аллель с цитозином «С».
В некоторых воплощениях, модуль определения компьютерной системы может быть сконфигурирован для анализа, по меньшей мере, одного тестируемого образца для определения наличия или отсутствия, по меньшей мере, двух из состояний (i)-(v), описанных выше, и экспрессии hsCRP.
В некоторых воплощениях, модуль определения компьютерной системы может дополнительно включать модуль сравнения, адаптированный для сравнения данных, выходных из модуля определения, с эталонными данными, которые хранятся на устройстве хранения. В некоторых воплощениях, эталонные данные могут включать в частности главные и/или редкие варианты аллелей, соответствующих SNP, описанным в данном документе, предварительно определенное эталонное значение 4-HNE (например, по меньшей мере, 3,2 мг/л или выше согласно измерениям в образце плазмы), предварительно определенное эталонное значение hsCRP (например, выше чем 2,3 мг/л согласно измерениям в образце плазмы), предварительно определенное эталонное соотношение SAM/SAH (например, менее чем 2,8 согласно измерениям в образце плазмы), и любые другие их комбинации.
Воплощения компьютерной системы, описанные в данном документе, также включают устройство хранения, сконфигурированное для хранения данных, выходящих из модуля определения; и дисплейный модуль для представления содержания, частично на основе данных, выходящих из модуля определения, где содержание включает сигнал, который является показателем наличия, по меньшей мере, одного из состояний (i)-(v), описанных выше, или сигнал, который является показателем отсутствия, по меньшей мере, одного из этих состояний. В некоторых воплощениях, содержание, выводимое на дисплейный модуль, может дополнительно включать сигнал, который является показателем того, что субъекту рекомендовано получать режим лечения, включающий фолат-содержащее соединение, или сигнал, который является показателем того, что субъекту рекомендовано получать альтернативный режим лечения.
В некоторых воплощениях, устройство хранения компьютерной системы дополнительно может быть сконфигурировано для хранения физикальной информации, по меньшей мере, одного тестируемого субъекта. Примеры физикальной информации могут включать показатель ожирения (например, BMI) и/или пол, по меньшей мере, одного тестируемого субъекта. В таких воплощениях, содержание, выводимое на дисплейный модуль компьютерной системы, может дополнительно включать показатель ожирения (например, значение BMI) или сигнал, который является показателем того, имеется ли у человека ожирение или нет (например, составляет ли значение BMI, по меньшей мере, 30 кг/м2 или нет).
Также в данном документе предлагается материальный и энергонезависимый (например, энергонезависимые формы передачи сигналов) машиночитаемый носитель, имеющий машиночитаемые инструкции, записанные на нем для определения программных модулей для обеспечения выполнения способа на компьютере. В одном воплощении, машиночитаемый носитель включает: (а) инструкции для сравнения данных, которые хранятся на устройстве хранения, с эталонными данными с получением результата сравнения, где сравнение идентифицирует наличие или отсутствие, по меньшей мере, одного состояния (А)-(Х), описанного в данном документе; и (b) инструкции для вывода содержания частично на основе данных, выходных из модуля определения, где содержание включает показательный сигнал наличия, по меньшей мере, одного из состояний (А)-(Х), описанных в данном документе, и необязательно, отсутствия любого из этих состояний (А)-(Х), описанных в данном документе. В других воплощениях содержание может включать сигнал, выявляющий отсутствие всех состояний (А)-(Х), описанных в данном документе.
В некоторых воплощениях, инструкции могут конкретно программироваться для осуществления сравнения для идентификации наличия, по меньшей мере, одного SNP, локализованного в положении 677 в SEQ ID NO. 1 (или в положении 27 в SEQ ID NO. 7), включающем, по меньшей мере, один аллель с тимином «Т» и/или в положении 2756 в SEQ ID NO. 2 (или в положении 27 в SEQ ID NO. 9), включающего, по меньшей мере, один аллель с гуанином «G».
В других воплощениях, инструкции могут конкретно программироваться для осуществления сравнения для идентификации одного из следующих состояний:
i. соотношение экспрессии s-аденозилметионина (SAM) к s-аденозилгомоцистеину (SAH) меньше, чем предварительно определенное эталонное соотношение;
ii. экспрессия 4-гидроксиноненаля (4 HNE) больше, чем предварительно определенное эталонное значение;
iii. однонуклеотидный полиморфизм (SNP) в положении 677 в SEQ ID NO: 1, включающий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO: 1 представляет собой участок геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR);
iv. (SNP) в положении 2756 в SEQ ID NO: 2, включающий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO: 2 представляет собой участок геномной нуклеотидной последовательности метионинсинтазы (MTR);
v. (SNP) в положении 66 в SEQ ID NO: 3, включающий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO: 3 представляет собой участок геномной нуклеотидной последовательности редуктазы метионинсинтазы (MTRR).
В данных воплощениях машиночитаемый носитель может дополнительно включать инструкции для идентификации наличия или отсутствия, по меньшей мере, одного отличного состояния (А)-(Х), описанного в данном документе. Например, в одном воплощении, машиночитаемый носитель может дополнительно включать инструкции для идентификации наличия или отсутствия SNP в положении 1298 в SEQ ID NO: 1, включающий, по меньшей мере, один аллель с цитозином «С». В некоторых воплощениях, машиночитаемый носитель может дополнительно включать инструкции для сравнения экспрессии высокочувствительного с-реактивного белка (hsCRP) с эталонными данными, например с предварительно определенным эталонным значением уровня экспрессии hsCRP выше чем 2,3 мг/л согласно измерениям в образце плазмы.
Воплощения дисплейного модуля машиночитаемого носителя, описанного в данном документе, также включают инструкции для вывода содержания, частично на основе выходных данных с модуля сравнения, где содержание включает сигнал, который является показателем наличия, по меньшей мере, одного из состояний, или сигнал, который является показателем отсутствия, по меньшей мере, одного из состояний. В некоторых воплощениях, дисплейный модуль может дополнительно включать инструкции для вывода сигнала, который является показателем того, что субъекту рекомендовано получать режим лечения, включающий фолат-содержащее соединение, или сигнал, который является показателем того, что субъекту рекомендовано получать альтернативный режим лечения.
В некоторых воплощениях сравнительный модуль машиночитаемого носителя может дополнительно включать инструкции для определения того, имеется ли у человека ожирение (например, составляет ли BMI, по меньшей мере, одного субъекта, по меньшей мере, 30 кг/м2 или нет). В таких воплощениях, дисплейный модуль может дополнительно включать инструкции для вывода показателя ожирения (например, значение BMI) или сигнала, который является показателем того, имеется ли у субъекта ожирение (например, составляет ли значение BMI, по меньшей мере, 30 кг/м2 или нет).
Воплощения систем, описанных в данном документе, были описаны посредством функциональных модулей, которые определяются с помощью инструкций, выполняемых компьютером, на машиночитаемом носителе и которые заставляют компьютер осуществлять стадии способа при приведении его в исполнение. Модули могут быть сегрегированы по функции ради ясности. Однако следует понимать, что модули не обязаны соответствовать дискретным блокам кода и описанные функции могут осуществляться посредством выполнения различных частей кода, сохраненных на различных носителях, и могут выполняться в различные моменты времени. Кроме того, следует понимать, что модули могут выполнять другие функции, поэтому модули не ограничены наличием конкретных функций или набором функций.
Машиночитаемый носитель может представлять собой любой доступный материальный носитель, к которому имеет доступ компьютер. Машиночитаемый носитель включает изменяемый и неизменяемый, удаляемый и неудаляемый материальный носитель, воплощенный любым способом или технологией хранения информации, такой как, например, машиночитаемые инструкции, структуры данных, программные модули или другие данные. Машиночитаемый носитель включает в частности RAM (оперативное запоминающее устройство), ROM (постоянное запоминающее устройство), EPROM электрически перепрограммируемое постоянное запоминающее устройство), EEPROM (электрическое стираемое программируемое постоянное запоминающее устройство), флэш-память или другую технологию памяти, CD-ROM (компакт-диск, доступный только для чтения), DVD (универсальный цифровой диск) или другие оптические носители, магнитные кассеты, магнитная пленка, магнитный диск хранения, другие типы изменяемой и неизменяемой памяти и любой другой материальный носитель, который может использоваться для хранения целевой информации и к которому имеется доступ с помощью компьютера, и любая подходящая комбинация вышеописанного.
В некоторых воплощениях, машиночитаемый носитель 700 может включать «облачную» систему, в которой пользователь может сохранять данные на удаленном сервере и позже имеет доступ к данным или может осуществлять дополнительный анализ данных с удаленного сервера.
Машиночитаемые данные, воплощенные на одном или нескольких машиночитаемых носителях, или машиночитаемый носитель 700, могут определять инструкции, например, в виде части одной или нескольких программ, которые, в результате выполнения компьютером, инструктируют компьютер для осуществления одной или нескольких функций, описанных в данном документе (например, в отношении системы 600, или машиночитаемого носителя 700), и/или их различные воплощения, вариации и комбинации. Такие инструкции могут быть написаны на любом из множества языков программирования, например Java, J#, Visual Basic, С, С#, C++, Fortran, Pascal, Eiffel, Basic, COBOL язык ассемблера, и так далее, или с помощью любой из множества их комбинаций. Машиночитаемый носитель, на котором воплощены такие инструкции, может хранить один или несколько компонентов каждого из системы 600, или машиночитаемого носителя 700, описанных в данном документе, и может распределяться на одном или нескольких из таких компонентов и может передаваться между ними.
Машиночитаемый носитель может быть переносимым так, чтобы инструкции, хранящиеся на нем, можно было загружать на любой компьютерный ресурс для выполнения анализов и/или способов, описанных в данном документе. Кроме того, следует понимать, что инструкции, хранящиеся на машиночитаемом носителе, или на машиночитаемом носителе 200, описанном выше, не ограничиваются инструкциями, воплощенными в виде части программного приложения, работающего на хост-компьютере. Скорее инструкции могут быть воплощены в виде любого типа компьютерного кода (например, программного или микрокода), который может применяться для программирования компьютера для выполнения анализов и/или способов, описанных в данном документе. Выполняемые компьютером инструкции могут быть записаны на подходящем компьютерном языке или на комбинации нескольких языков. Основные методы компьютерной биологии известны специалистам в данной области и описаны, например, в Setubal and Meidanis et al., Introduction to Computational Biology Methods (PWS Publishing Company, Boston, 1997); Salzberg, Searles, Kasif, (Ed.), Computational Methods in Molecular Biology, (Elsevier, Amsterdam, 1998); Rashidi and Buehler, Bioinformatics Basics: Application in Biological Science and Medicine (CRC Press, London, 2000) и в Ouelette and Bzevanis Bioinformatics: A Practical Guide for Analysis of Gene and Proteins (Wiley & Sons, Inc., 2nd ed., 2001).
Функциональные модули некоторых воплощений системы, описанной в данном документе, могут включать модуль определения, устройство хранения и дисплейный модуль. В некоторых воплощениях, система может дополнительно включать модуль сравнения. Функциональные модули могут выполняться на одном или на множестве компьютеров или путем применения одной или множеств компьютерных сетей. Модуль определения 602 имеет выполняемые компьютером инструкции для обеспечения информации о последовательности в машиночитаемой форме. При использовании в данном документе «информация о последовательности» относится к любой нуклеотидной и/или аминокислотной последовательности, включая в частности полноразмерные нуклеотидные и/или аминокислотные последовательности или мутантные последовательности. Кроме того, информация, «относящаяся к» информации о последовательности, включает детектирование наличия или отсутствия последовательности (например, детектирование мутации или делении), определение концентрации последовательности в образце (например, уровень экспрессии аминокислоты или уровень экспрессии нуклеотидной последовательности (РНК или ДНК)), и тому подобное. Подразумевается, что термин «информация о последовательности» включает наличие или отсутствие посттрансляционных модификаций (например, фосфорилирование, гликозилирование, сумоилирование, фарнесилирование и тому подобные).
В качестве примера, модуль определения 602 для определения информации о последовательности может включать известные системы для автоматического анализа последовательностей, включающие в частности флуоресцентные сканеры «Hitachi FMBIO®» и «Hitachi FMBIO® II» (доступны у «Hitachi Genetic Systems», Аламеда, Калифорния); полностью автоматизированные 96-капиллярные электрофорезные системы генетического анализа «Spectrumedix® SCE 9610» (доступны у «SpectruMedix LLC», Стейт-Колледж, Пенсильвания); ДНК-секвенатор «ABI PRISM® 377», ДНК-секвенатор «ABI PRISM ® 373», Генетический анализатор «ABI PRISM® 310», Генетический анализатор «ABI PRISM® 3100», и ДНК-анализатор «ABI PRISM® 3700» (доступны у «Applied Biosystems», Фостер-Сити, Калифорния); Флуоресцентные сканеры «Molecular Dynamics Fluorlmager™ 575, SI» и «Molecular Dynamics Fluorlmager™ 595» (доступны у «Amersham Biosciences UK Limited», Литл-Чалфонт, Бакингемшир, Англия); Система ДНК-секвенирования «GenomyxSC™» (доступна у «Genomyx Corporation» (Фостер-Сити, Калифорния); и ДНК-секвенаторы «Pharmacia ALF™» и «Pharmacia ALFexpress™» (доступен у «Amersham Biosciences UK Limited», Литл-Чалфонт, Бакингемшир, Англия).
Альтернативные методы определения информации о последовательности, т.е. модули определения 602, включают системы анализа белка и ДНК. Например, системы масс-спектрометрии, включающие времяпролетную масс-спектрометрию с лазерной ионизацией и десорбцией из жидкой матрицы (MALDI-TOF) и системы анализа на основе эррея «SELDI-TOF-MS ProteinChip»; системы анализа данных генной экспрессии (см., например, опубликованную Патентную Заявку США №2003/0194711); системы анализа экспрессии на основе эрреев: например, системы НТ-эррея, такие как «GeneChip® AutoLoader», «Complete GeneChip® Instrument System», «GeneChip® Fluidics Station 450», «GeneChip® Hybridization Oven 645», «GeneChip® QC Toolbox Software Kit», «GeneChip® Scanner 3000 7G plus Targeted Genotyping System», «GeneChip® Scanner 3000 7G Whole-Genome Association System», «GeneTitan™ Instrument», и «GeneChip® Array Station» (каждая доступна у «Afiymetrix», Санта-Клара, Калифорния); автоматизированные системы тИФА (например, «DSX®» или «DS2®» (доступны у «Dynax», Шантильи, Вирджиния) или Triturus® (доступен у «Grifols USA», Лос Анджелес, Калифорния), «Mago® Plus» (доступен у «Diamedix Corporation», Майями, Флорида); Денситометры (например, «X-Rite-508-Spectro Densitometer®» (доступен у «RP Imaging™», Тусон, Аризона), денситометр «HYRYS™ 2 HIT» (доступен у «Sebia Electrophoresis», Норкросс, Джорджия); автоматизированные системы флуоресцентной in situ гибридизации (см., например, Пат. США 6,136,540); системы гелевого 2D-имэджинга, соединенные программным обеспечением для 2-D имэджинга; микропланшетные ридеры; клеточные сортеры с активацией флуоресценции (FACS) (например, проточный цитометр «FACSVantage SE» (доступен у «Becton Dickinson», Франклин-Лэйкс, Нью-Джерси); и радиоизотопные анализаторы (например, сцинтилляторы).
Информация о последовательности SNP и/или информация об уровне экспрессии биомаркеров в плазме/сыворотке в модуле определения может считываться с помощью устройства хранения 604. Подразумевается, что при использовании в данном документе «устройство хранения» 604 включает любое подходящее вычислительный или обрабатывающий данные прибор или другое устройство, сконфигурированное или адаптированное для хранения данных или информации. Примеры электронного прибора, подходящего для использования с системой, описанной в данном документе, может включать вычислительный прибор, информационно-телекоммуникационные сети, включающие локальные сети (LAN), крупномасштабные сети (WAN), Интернет, Интранет и Экстранет и локальные и распределенные системы обработки компьютерных данных. Устройства хранения 604 также включают в частности: магнитные носители, такие как дискеты, носители на жестком диске, магнитная лента, оптические носители, такие как CD-ROM, DVD, электронные носители, такие как RAM, ROM, EPROM, EEPROM и тому подобное, обычные жесткие диски и гибриды этих категорий, такие как магнитные/оптические носители. Устройство хранения 604 адаптировано или сконфигурировано так, что оно имеет записанную на нем информацию о последовательности или об уровне экспрессии. Такая информация может обеспечиваться в цифровой форме, которая может передаваться и читаться в электронном виде, например, посредством Интернет, на дискете, через USB (универсальная последовательная шина) или посредством любого другого подходящего способа коммуникации, например «облако».
При использовании в данном документе «информация об уровне экспрессии» относится к любой информации об уровне экспрессии нуклеотидной и/или аминокислотной последовательности, включая, в частности, полноразмерные нуклеотидные и/или аминокислотные последовательности, частичные нуклеотидные и/или аминокислотные последовательности или мутантные последовательности. Кроме того, информация, которая «относится к» информации об уровне экспрессии, включает детектирование наличия или отсутствия последовательности (например, наличие или отсутствие аминокислотной последовательности, нуклеотидной последовательности или посттрансляционной модификации), определение концентрации последовательности в образце (например, уровень аминокислотной последовательности или уровень экспрессии нуклеотидной последовательности (РНК или ДНК), или уровень посттрансляционной модификации), и тому подобное. В некоторых воплощениях, информация об уровне экспрессии также включает арифметические манипуляции уровня экспрессии, по меньшей мере, двух или более биомаркеров (например, соотношение экспрессии SAM к SAH).
При использовании в данном документе термин «сохраняли» относится к процессу кодирования информации на устройстве хранения 604. Специалист в данной области может легко применить любой из настоящих способов для записи информации на известный носитель для создания продуктов, включающих информацию о последовательности или информацию об уровне экспрессии.
Множество программ и форматов могут использоваться для хранения информации о последовательности или информации об уровне экспрессии на устройстве для хранения. Любое количество форматов структурирования данных процессором (например, текстовый файл или база данных) могут применяться для получения или создания носителя, содержащего записанную на нем информацию о последовательности или информацию об уровне экспрессии.
Путем обеспечения информации о последовательности и/или информации об уровне экспрессии в машиночитаемой форме, специалист может использовать информацию о последовательности и/или информацию об уровне экспрессии в читаемой форме в модуле сравнения 606 для сравнения специфичной последовательности или профиля экспрессии с эталонными данными в устройстве хранения 604. Например, программы поиска могут использоваться для идентификации фрагментов или участков последовательностей, которые соответствуют конкретной последовательности (эталонные данные, например, информация о последовательности главного или редких аллелей, соответствующие SNP, описанным в данном документе), или прямое сравнение определенного уровня экспрессии может сравниваться с эталонными данными уровня экспрессии (например, информация о среднем уровне экспрессии из популяции объектов). Сравнение, осуществленное в машиночитаемой форме, обеспечивает результат машиночитаемого сравнения, который может обрабатываться различными средствами. Содержание 608 на основе результата сравнения может быть извлечено из модуля определения 600 или из модуля сравнения 606 для выявления наличия или отсутствия, по меньшей мере, одного SNP и биомаркеров сыворотки/плазмы, описанных в данном документе.
В одном воплощении эталонные данные, сохраненные на устройстве хранения 604 для считывания модулем определения 600 или модулем сравнения 606, представляют собой информационные данные из контрольного биологического образца того же типа, что и тестируемый биологический образец. В ином случае, эталонные данные представляют собой базу данных, например, часть последовательности цельного генома организма или последовательности семейства белков или профиль уровня экспрессии (РНК, белок или пептид). В одном воплощении, предпочтительными данными является информация о последовательности и/или о профиле уровня экспрессии, которые используются для облегчения определения того, следует ли рекомендовать субъекту с депрессией режим лечения, включающий фолат-содержащее соединение.
В одном воплощении эталонные данные представляют собой один или несколько эталонных полинуклеотидных или полипептидных последовательностей. В некоторых воплощениях эталонные полинуклеотидные последовательности могут быть выделены из нуклеотидных последовательностей, выбранных из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, и их участков, включающих нуклеотиды в положении, соответствующем SNP, и комплементарные им последовательности. В некоторых воплощениях эталонные полинуклеотидные последовательности могут быть выделены из аминокислотных последовательностей, выбранных из группы, состоящей из SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, и их участков, включающих аминокислотные остатки в положениях, соответствующих мутациям.
В одном воплощении, эталонные данные записаны в электронном или цифровом виде и снабжены примечаниями из баз данных, включающих, в частности, белковые и ДНК-базы данных GenBank (NCBI), такие как genome, EST, SNPS, Traces, Celara, Ventor Reads, Watson reads, HGTS, и тому подобные; Базы данных Швейцарского Института Биоинформатики, такие как ENZYME, PROSITE, SWISS-2DPAGE, Swiss-Prot и TrEMBL; пакет программ Melanie или ExPASy WWW-сервер, и тому подобное; SWISS-MODEL, Swiss-Shop и другие сетевые вычислительные средства; база данный Глобальный Ресурс по Микробам (доступная от Института Геномных Исследований). Полученная информация может храниться в связанной базе данных, которая может применяться для определения гомологии между эталонными данными или генами или белками внутри и между геномами.
«Модуль сравнения» 606 может использовать множество доступных программ и форматов для операции сравнения для того, чтобы сравнить информацию о последовательности, определенную в модуле определения 602, с эталонными данными. В одном воплощении модуль сравнения 606 конфигурируется для использования методов распознавания профиля для сравнения информации о последовательности из одного или более вводов данных с одни или более профилем эталонных данных. Модуль сравнения 606 может конфигурироваться с использованием существующих коммерчески доступных или находящихся в свободном доступе программ для сравнения образцов, и они могут быть оптимизированы для сравнения конкретных данных, которое проводится. Модуль сравнения 606 обеспечивает машиночитаемую информацию, связанную с информацией о последовательности, которая может включать, например, детектирование наличия или отсутствия последовательности (например, детектирование мутации или делеции (белок или ДНК), информацию, касающуюся различных аллелей, детектирование посттрансляционной модификации или пропусков или повторов последовательностей); определение концентрации последовательности в образце (например, уровень экспрессии аминокислотной последовательности/белка, или уровень экспрессии нуклеотидов (РНК или ДНК), или уровень посттрансляционной модификации), или определение профиля экспрессии.
В одном воплощении модуль сравнения 606 дает возможность предсказания белковых последовательностей на основании полинуклеотидных последовательностей, дает возможность предсказания открытых рамок считывания из полинуклеотидных последовательностей (ORF) или дает возможность предсказания информации о гомологичных последовательностях в сравнении с эталонными данными, т.е. гомологичные белковые домены, гомологичные ДНК или РНК последовательности или гомологичные экзоны и/или интроны.
В одном воплощении, модуль сравнения 606 использует информацию программ выравнивания последовательностей, таких программ как BLAST (Основное Средство Поиска Локального Выравнивания), или может применяться FAST (с использованием алгоритма Смита-Ватермана) индивидуально или в комбинации. Эти алгоритмы определяют выравнивание между похожими участками последовательностей и процент идентичности между последовательностями. Например, выравнивание может рассчитываться путем спаривания основания-за-основанием или аминокислоты-за аминокислотой.
Модуль сравнения 606 или любой другой модуль или система, описанная в данном документе, может включать операционную систему (например, UNIX), на которой работает родственная система управления базами данных. World Wide Web приложение, и World Wide Web сервер. World Wide Web приложение включает выполняемую программу, необходимую для генерации оператора языка базы данных (например, оператор Языка Структурированных Запросов (SQL)). Как правило, выполняемый модуль будет включать встроенные инструкции SQL. Кроме того, приложение World Wide Web может включать конфигурационный файл, который содержит указатели и адреса различных программных модулей, которые включает сервер, а также различных внешних и внутренних баз данных, к которым должен иметься доступ для сервиса запросов пользователя. Конфигурационный файл также направляет запросы серверных ресурсов для подходящего аппаратного обеспечения, поскольку может быть необходимо распределение сервера на два или более отдельных компьютера. В одном воплощении Интернет-сервер поддерживает протокол TCP/IP. Локальные сети, такие как эта, иногда обозначаются как «Интранет». Преимущество таких Интранет-сетей состоит в том, что они дают возможность упрощенной коммуникации с общедоступным доменом баз данных, хранящихся на World Wide Web (например, GenBank или Swiss Pro World Wide Web сайт). Таким образом, в конкретном воплощении, пользователи могут иметь непосредственный доступ к данным (через гипертекстовую ссылку, например), хранящимся в базах данных Интернет, с использованием интерфейса HTML, который обеспечивается Веб-браузером и Веб-серверами. В другом воплощении, пользователи могут иметь непосредственный доступ к данным, хранящимся на «облаке», предоставляемым провайдерами сервисов облачной обработки данных.
В одном воплощении модуль сравнения 606 осуществляет сравнение с спектрами масс-спектрометрии, например, сравнения информации о последовательности пептидного фрагмента могут проводиться с использованием спектров, обработанных в MATLAB с использованием макроса под названием «Qcealign» (см., например, WO 2007/022248, включен в данный документ ссылкой) и «Qpeaks» («Spectrum Square Associates», Итака, Нью-Йорк), или пакет программ «Ciphergen Peaks 2.1™». Обработанные спектры затем могут выравниваться с использованием алгоритмов выравнивания, которые выравнивают данные образца с контрольными данными с использованием алгоритма минимальной энтропии путем использования скорректированных данных базовой строки (см., например, Публикацию WIPO WO 2007/022248, включенную в данный документ ссылкой). Результат сравнения может дополнительно обрабатываться с помощью расчетных соотношений. Профили белковой экспрессии могут различаться.
В одном воплощении, вычислительные алгоритмы используются в модуле сравнения 606, такие как ожидание-доведение до максимума (ЕМ), вычитание и PHASE используются в методах статистической оценки гаплотипов (см., например, dark, A.G. Mol Biol Evol 7:111-22 (1990); Stephens, M., Smith, N.J. & Dormelly, P. Am J Hum Genet 68:978-89 (2001); Templeton, A.R., Sing, C.F., Kessling, A. & Humphries, Genetics 120: 1145-54(1988)).
Доступны различные алгоритмы, которые применяются для сравнения данных и идентификации предположительных характеристик генов. Например, алгоритмы, такие как те, что идентифицированы в Xu et al., Physiol. Genomics 11: 11-20 (2002). Существует множество пакетов программ, доступных для детектирования SNP и полиморфизмов, который могут использоваться в модуле сравнения, включающие в частности: HaploSNPer, web-программу детектирования SNP и аллелей в определенных пользователем введенных последовательностях из обоих видов - диплодного и полиплоидного (доступна по адресу bioinformatics.nl/tools/haplosnper/; см. также Tang et al., BMC Genetics 9: 23 (2008)); Polybayes, средство обнаружения SNP в избытке ДНК-последовательностей (Marth, GT., et al. Nature Genetics 23(4):452-6 (1999); SSAHA-SNP, средство детектирования полиморфизмов, которое использует алгоритм выравнивания SSAHA (доступно из Wellcome Trust Sanger Institute, Кембридж, Великобритания, см. также Ning Z., et al., Genome Research 11(10): 1725-9 (2001)); Polyphred, пакет обнаружения SNP, построенные на основе phred, phrap, и других средств (доступно в Интернете, см. Nickerson, DA et al. Nucleic Acids Research 25(14):2745-51 (1997)); NovoSNP, графическая программа на основе Java (PC/Mac/Linux) для идентификации SNP и вставок-делений (доступна в Интернете, см. Weckx, S. et al., Genome Research 15(3): 436-442 (2005)); SNPdetectorTM, для автоматизированной идентификации SNP и мутаций в считывании повторного секвенирования на основе флуоресценции (доступно у «Affymetrix», Санта-Клара, Калифорния), см. также Zhang et al. PLoS Comput Biol (5):e53 (2005). SNPdetector работает на платформе Unix/Linux и является общедоступной; Affymetrix (Санта-Клара, Калифорния) содержит пакет программ анализа множества данных, который может использоваться, например, в программах Genotyping Console™ Software, GeneChip® Sequence Analysis Software (GSEQ), GeneChip® Targeted Genotyping Analysis Software (GTGS) и Expression Console™ Software.
В одном воплощении, модуль сравнения 606 сравнивает профили генной экспрессии. Например, детектирование профилей генной экспрессии может определяться с использованием пакета программ «Affymetrix Microarray Suite version 5.0» (MAS 5.0) (доступна у «Affymetrix», Санта-Клара, Калифорния) для анализа относительной распространенности гена или генов на основе интенсивности сигнала из наборов зондов, файлы данных MAS 5.0 могут переноситься в базы данных и анализироваться с использованием пакета программ «Microsoft Excel» и «GeneSpring 6.0» (доступных у «Agilent Technologies», Санта-Клара, Калифорния). Алгоритм детектирования пакета программ «MAS 5.0» может использоваться для получения всеобъемлющего анализа того, сколько транскриптов детектировано, в данных образцах и дает возможность всеобъемлющего анализа двух или более наборов данных микроэрреев.
В одном воплощении, модуль сравнения 606 сравнивает профили белковой экспрессии. Может использоваться любая доступная программа сравнения, включая в частности «Ciphergen Express» (СЕ) и пакет «Biomarker Patterns Software» (BPS) (доступные у «Ciphergen Biosystems, Inc.», Фримонт, Калифорния). Сравнительный анализ может осуществляться с системным пакетом программ белковых чипов (например, «The Proteinchip Suite» (доступен у «Bio-Rad Laboratories», Геркулес, Калифорния). Алгоритмы идентификации профилей экспрессии могут включать применение алгоритмов оптимизации, такие как алгоритм средней дисперсии (например, алгоритм «JMP Genomics», доступный у «JMP Software Cary», Северная Каролина).
В одном воплощении пакет программ профиля сравнения может использоваться для определения того, является ли профиль экспрессии или мутаций показателем наличия или отсутствия состояний, детектированных в тестируемом образце субъекта.
Модуль сравнения 606 обеспечивает машиночитаемый результат сравнения, который может обрабатываться в машиночитаемой форме с помощью определенного заранее критерия или критерия, определенного пользователем, с получением содержания частично на основе результату сравнения, которое может храниться и выводиться по запросу пользователя с использованием дисплейного модуля 610. Дисплейный модуль 610 дает возможность вывода содержания 608 частично на основе результата сравнения для пользователя, где содержание 608 представляет собой сигнал, который является показателем наличия, по меньшей мере, одного из состояний, описанных в данном документе, или сигнал, который является показателем отсутствия, по меньшей мере, одного из состояний, описанных в данном документе. Такой сигнал может представлять собой, например, вывод содержания 608, которое является показателем наличия или отсутствия, по меньшей мере, одного из состояний, на монитор компьютера, распечатка страницы содержания 608, которое является показателем наличия или отсутствия, по меньшей мере, одного из состояний с принтера, или световой или звуковой показатель наличия или отсутствия, по меньшей мере, одного из состояний.
В различных воплощениях, компьютерная система, описанная в данном документе, модуль сравнения 606 может быть интегрирован в модуль определения 602.
Содержание 608 на основе результата сравнения также может включать профиль экспрессии одного или более биомаркеров, описанных в данном документе, в плазме/сыворотке. В одном воплощении содержание 608 на основе сравнения включает последовательность конкретного гена или белка и определение наличия одной или нескольких мутаций или специфической посттрансляционной модификации. В одном воплощении содержание 608 на основе результата сравнения представляет собой всего лишь сигнал, который является показателем наличия или отсутствия, по меньшей мере, одного из состояний, описанных в данном документе. В некоторых воплощениях, содержание 608 может представлять собой сигнал, который является показателем ожирения (например, значение BMI) или сигнала, который является показателем того, имеется ли у субъекта ожирение (например, составляет ли значение BMI, по меньшей мере, 30 кг/м2 или нет). В некоторых воплощениях, содержание 608 может представлять собой сигнал, который является показателем того, что субъекту рекомендовано получать режим лечения, включающий фолат-содержащее соединение, или сигнал, который является показателем того, что субъекту рекомендовано получать альтернативный режим лечения.
В одном воплощении содержание 608 на основе результата сравнения выводится на монитор компьютера. В одном воплощении содержание 608 на основе результата сравнения выводится с помощью печатающего устройства. Дисплейный модуль 610 может представлять собой любое подходящее устройство, сконфигурированное для получения пользователем с компьютера и дисплея компьютера читаемой информации. Частные примеры включают, например, универсальные компьютеры, такие как те, что основаны на процессоре типа PENTIUM, Motorola PowerPC, Sun UltraSPARC, Hewlett-Packard PA-RISC, любые из множества процессоров, доступных у «Advanced Micro Devices» (AMD) Саннивейл, Калифорния, или любой другой тип процессора, дисплейные устройства, такие как дисплей с плоским экраном, катодные трубки и тому подобные, а также компьютерные принтеры различных типов.
В одном воплощении, веб-браузер используется для обеспечения пользовательского интерфейса для вывода содержания 608 на основе результата сравнения. Следует понимать, что другие модули системы, описанной в данном документе, могут быть адаптированы так, что они будут иметь интерфейс веб-браузера. Посредством веб-браузера пользователь может конструировать запросы для поиска данных из модуля сравнения. Таким образом, пользователь, как правило, будет наводить и «кликать» на элементы пользовательского интерфейса, такие как командные кнопки, ниспадающее меню, линейка прокрутки и тому подобное, что используется подходящим образом в графических пользовательских интерфейсах. Запросы, сформулированные таким образом с использованием Web-браузера пользователя, передаются в Web-приложение, которое форматирует их с получением запроса, который может применяться для извлечения надлежащей информации, относящейся к информации о последовательности, например, вывод показателя наличия или отсутствия мутации или делении (ДНК или белка); вывод уровня экспрессии аминокислотной последовательности (белок); вывод уровня экспрессии нуклеотидной последовательности (РНК или ДНК); вывод профилей экспрессии, SNP, или мутаций, или гаплотипов, или вывод информации на основе этого. В одном воплощении также выводится информация о последовательности данных эталонного образца.
В любых воплощениях, модуль сравнения может выполняться посредством программ, выполняемых компьютером, как обсуждалось ранее. В таких воплощениях, результат, полученный из модуля сравнения, может выводиться на электронный дисплей. Результат может выводиться с помощью графиков, чисел, символов или слов. В дополнительных воплощениях, результаты, полученные из модуля сравнения, могут передаваться из одного места, по меньшей мере, в одно, другое место. Например, результаты сравнения могут передаваться посредством электронного носителя, например Интернета, факса, телефона, «облачной» системы и любой их комбинации. С использованием «облачной» системы пользователи могут сохранять и осуществлять доступ к личным файлам и данным или осуществлять дополнительный анализ на удаленном сервере, а не физически переносить везде носитель, такой как DVD или флеш-накопитель.
Система 600, и машиночитаемый носитель 700, представляют собой всего лишь иллюстративные воплощения для осуществления анализов для выбора режима лечения субъекта с депрессией на основе информации об уровне экспрессии или информации о последовательности, и они не предназначены для ограничения рамок изобретения, описанного в данном документе. Вариации системы 600, и машиночитаемого носителя 700, возможны и, как подразумевается, попадают в рамки изобретения, описанного в данном документе.
Модули машины или используемые машиночитаемые носители могут предполагать многочисленные конфигурации. Например, функция может обеспечиваться на одной машине или может распределяться по множеству машин.
Наборы реактивов
На основе идентификации SNP и/или периферических маркеров, ассоциированных с реакцией на применение фолат-содержащего соединения, также предлагается один аспект, описанный в данном документе, для дизайна и приготовления реактивов для детекции, необходимых для идентификации SNP и/или периферических маркеров, раскрытых в данном документе, в тестируемом образце субъекта. Например, реактивы для детекции могут быть разработаны и приготовлены для идентификации SNP в локусе MTHFR и в локусе MTR и необязательно в локусе MTRR, включенные в анализы и методы, описанные в данном документе, и/или для измерения уровня экспрессии SAM, SAH и 4-HNE в тестируемом образце. Примеры реактивов для детекции, которые могут использоваться для идентификации раскрытых SNP в тестируемом образце, могут включать праймер и зонд, где зонд может селективно гибридизоваться с SNP-содержащими молекулами нуклеиновых кислот, по сравнению с молекулой нуклеиновой кислоты, которая не содержит SNP в том же нуклеотидном положении. Примеры реактивов для детекции, которые могут использоваться для измерения уровня экспрессии периферических белков (например, SAM, SAH и/или 4-HNE) в тестируемом образце, могут включать антитела к таким белкам или праймер и зонд, где зонд специфично гибридизуется с молекулой нуклеиновой кислоты, соответствующей таким белкам.
Соответственно, в данном документе предлагаются наборы реактивов для выбора режима лечения субъекта с депрессией. В некоторых воплощениях, наборы реактивов могут использоваться для отслеживания эффективности ответа субъекта, подвергнутого лечению с помощью комбинированной терапии, включающей фолат-содержащее соединение, например, как представлено в Примере 5. Наборы реактивов включают, по меньшей мере, один реактив, специфичный для детектирования наличия или отсутствия SNP-маркеров (i)-(xxi), описанных в данном документе (например, MTHFR C677T, MTR A2756G, и/или MTRR A66G) и/или антитела, специфичные для детектирования периферических биомаркеров (xxii)-(xxiv) (например, SAM, SAH, и 4-HNE), и инструкции для определения того, что субъекту рекомендован режим лечения, включающий фолат-содержащее соединение, если в тестируемом образце субъекта детектировано наличие, по меньшей мере, одного из состояний, описанных в данном документе (например, в образце крови, слюны или в буккальном образце), например, с помощью процедур, представленных в Примере 5. Набор реактивов необязательно может включать нуклеиновую кислоту для детектирования представляющего интерес гена.
В одном воплощении, набор реактивов может включать олигонуклеотидный эррей с множеством фиксированных олигонуклеотидных зондов, которые используются для исследования, например, не более чем 30 SNP (включая не более чем 20 SNP, не более чем 15 SNP, не более чем 10 SNP, не более чем 5 SNP или менее), где SNP включают, по меньшей мере, две или любые комбинации состояний (А)-(U), описанных в данном документе (например, в частности комбинация состояний (А) и (С)); и необязательный контейнер, содержащий детектируемую метку (например, включающую флуоресцентную молекулу), которая конъюгируется с нуклеотидной молекулой, выделенной из тестируемого образца человека; и, по меньшей мере, один реактив. Примеры реактива, который может быть включен в набор реактивов, могут включать в частности фермент рестрикции, универсальный адаптер, конъюгированный с нуклеотидной молекулой, праймер, комплементарный универсальному адаптеру, агент промывки и любые их комбинации.
В некоторых воплощениях, множество олигонуклеотидных зондов, прикрепленных на олигонуклеотидном эррее, могут использоваться для исследования около 2-30 SNP, например, около 3-25 SNP, около 3-20 SNP, около 3-10 SNP, или около 3-5 SNP, где SNP включают, по меньшей мере, две или любые комбинации состояний (A)-(U), описанных в данном документе (например, в частности комбинация состояний (А) и (С)).
В альтернативном воплощении набор реактивов включает множество олигонуклеотидных праймеров, которые связываются, по меньшей мере, с одним аллелем не более чем 30 SNP (включая не более чем 20 SNP, не более чем 15 SNP, не более чем 10 SNP, не более чем 5 SNP или менее), где каждый набор олигонуклеотидных праймеров, которые связываются со специфичным аллелем SNP, метят с помощью отдельного репортера, и где указанные SNP включают, по меньшей мере, два или любую комбинацию SNP состояний (A)-(U), описанных в данном документе (например, в частности, комбинация состояний (А) и (С)); и, по меньшей мере, один реактив, например, в частности, свободные нуклеотидные основания, полимеразу или и то и другое.
В некоторых воплощениях, множество олигонуклеотидных зондов, прикрепленных на олигонуклеотидном эррее, могут использоваться для исследования около 2-30 SNP, например, около 3-25 SNP, около 3-20 SNP, около 3-10 SNP, или около 3-5 SNP, где SNP включают, по меньшей мере, две или любые комбинации состояний (A)-(U), описанных в данном документе (например, в частности комбинация состояний (А) и (С)).
Дополнительные реактивы, включенные в набор реактивов, могут варьироваться с выбором анализа генотипирования, например, в частности, гибридизация аллель-специфичного зонда, протяжка аллель-специфичного праймера, аллель-специфичная амплификация, секвенирование, 5'-нуклеазный гидролиз, анализ с помощью молекулярных маяков, анализ с помощью ДНК-чипа, анализ олигонуклеотидного лигирования, анализ определения размера, одноцепочечный конформационный полиморфизм, полимеразная цепная реакция (ПЦР), количественная ПЦР в реальном времени, и любая их комбинация.
В некоторых воплощениях, набор реактивов может дополнительно включать, по меньшей мере, один реактив для определения экспрессии, по меньшей мере, одного биомаркера, описанного в данном документе (например, SAM, SAH, 4-HNE и hsCRP). Например, в одном воплощении набор реактивов может дополнительно включать твердую субстратную подложку с прикрепленным, по меньшей мере, одним связывающим компонентом на основе белка (например, антитело), которое специфично связывается с одним или более биомаркерами, описанными в данном документе. Типичная твердая субстратная подложка может включать в частности микропланшет для тИФА, щуп для измерения уровня магнитные гранулы или любые их комбинации. Могут быть выбраны различные твердые подложки на основе различных типов анализов экспрессии, например, в частности, вестерн-блот, твердофазный иммуноферментный анализ, масс-спектрометрия, иммуноанализ, проточная цитометрия, иммуногистохимический анализ, и их комбинации.
В другом воплощении, набор реактивов может дополнительно включать, по меньшей мере, один праймер, сконструированный для гибридизации с одним или с несколькими биомаркерами, описанными в данном документе.
Воплощения различных аспектов, описанных в данном документе, также могут быть описаны любым из представленных ниже нумерованных абзацев.
1. Анализ для выбора режима лечения человека с депрессией, включающий:
(a) осуществление на тестируемом образце из человека, который диагностирован как страдающий депрессией или имеющий риск развития депрессии, по меньшей мере, одного анализа генотипирования, адаптированного для определения генотипов, по меньшей мере, двух локусов, где указанными, по меньшей мере, двумя локусами, являются:
i. положение 677 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 7 (идентифицированного по rs1801133), где SEQ ID NO. 1 и SEQ ID NO. 7 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолат-редуктазы (MTHFR);
ii. положение 2756 в SEQ ID NO. 2 или положение 27 в SEQ ID NO. 9 (идентифицированного по rs1805087), где SEQ ID NO. 2 и SEQ ID NO. 9 каждая независимо являются частью геномной нуклеотидной последовательности метионинсинтазы (MTR); и
(b) детекцию в генотипах указанных, по меньшей мере, двух локусов наличия однонуклеотидного полиморфизма (SNP) выбранного из следующих:
i. SNP677 в положении 677 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 7 содержащего, по меньшей мере, один аллель с тимином «Т»;
ii. SNP2756 в положении 2756 в SEQ ID NO. 2 или положении 27 в SEQ ID NO. 9, содержащем, по меньшей мере, один аллель с гуанином «G»; и in. комбинация, по меньшей мере, аллеля с тимином «Т» SNP677 и, по меньшей мере, аллеля с гуанином «G» SNP2756; и если, по меньшей мере, один Т аллель в положении SNP677 или, по меньшей мере, один G аллель в положении SNP2756 или оба, по меньшей мере, Т аллель в положении SNP677 и, по меньшей мере, один G аллель в положении SNP2756 детектирован, в таком случае выбор и необязательно назначение, режима лечения, содержащего эффективное количество фолат-содержащего соединения.
2. Анализ по абзацу 1, в котором если не обнаружен ни аллель SNP677 Т, ни аллель SNP2756 G, то выбирается режим лечения без фолат-содержащего соединения.
3. Анализ для выбора режима лечения человека, страдающего депрессией, включающий:
осуществление на тестируемом образце человека, который диагностирован, как страдающий от депрессии или имеющий риск развития депрессии, по меньшей мере, одного анализа для определения наличия или отсутствия, по меньшей мере, одного из представленных ниже состояний:
i. соотношение экспрессии s-аденозилметионина (SAM) к s-аденозилгомоцистеину (SAH) меньше, чем предварительно определенное эталонное соотношение;
ii. экспрессия 4-гидроксиноненаля (4-HNE) больше, чем предварительно определенное эталонное значение;
iii. однонуклеотидный полиморфизм (SNP) в положении 677 в SEQ ID NO. 1 или положении 27 в SEQ ID NO. 7 (идентифицированного по rs1801133), содержащий, по меньшей мере, один аллель с тимином «Т», в котором SEQ ID NO. 1 и SEQ ID NO. 7 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR);
iv. SNP в положении 2756 в SEQ ID NO. 2 или положение 27 в SEQ ID NO. 9, содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 2 и SEQ ID NO. 9 каждая независимо являются частью геномной нуклеотидной последовательности метионинсинтазы (MTR); и
v. SNP в положении 66 в SEQ ID NO. 3 или положении 27 в SEQ ID NO. 10 содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 3 и SEQ ID NO. 10 каждая независимо являются частью геномной нуклеотидной последовательности редуктазы метионинсинтазы (MTRR);
и если, по меньшей мере, обнаруживается наличие одного из указанных состояний, то рекомендуется выбор схемы лечения, включающей фолат-содержащее соединение; и если ни одно из этих состояний не обнаруживается, то рекомендуется режим лечения без фолат-содержащего соединения.
4. Анализ по любому из предшествующих абзацев, дополнительно включающий определение параметра, по меньшей мере, одного биомаркера из следующих:
i. генотип SNP-локуса в положении 1793 в SEQ ID NO. 1 или положения 27 в SEQ ID NO. 8 (идентифицированного по rs2274976), где SEQ ID NO. 1 и SEQ ID NO. 8 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR);
ii. генотип SNP-локуса в положении 66 в SEQ ID NO. 3 или в положении 27 в SEQ ID NO. 10 (идентифицированного по rs1801394), где SEQ ID NO. 3 и SEQ ID NO. 10 каждая независимо являются частью геномной нуклеотидной последовательности редуктазы метионинсинтазы (MTRR);
iii. генотип SNP-локуса в rs1006737 (положение 27 в SEQ ID NO. 11), где SEQ ID NO. 11 является частью геномной нуклеотидной последовательности альфа 1C субъединицы потенциалзависимого кальциевого канала L типа (CACNA1C);
iv. генотип SNP-локуса в rs1883729 (положение 27 в SEQ ID NO. 12), где SEQ ID NO. 12 является частью геномной нуклеотидной ДНК-последовательности (цитозин 5)-метилтрансферазы 3 бета (DNMT3B);
v. генотип SNP-локуса в rs7163862 (положение 27 в SEQ ID NO. 13), где SEQ ID NO. 13 является частью геномной нуклеотидной последовательности белка-регулятора обратной связи GTP-циклогидролазы 1 (GCHFR);
vi. генотип SNP-локуса в rs12659 (положение 27 в SEQ ID NO. 14), где SEQ ID NO. 14 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF2);
vii. генотип SNP-локуса в rs202676 (положение 27 в SEQ ID NO. 15), где SEQ ID NO. 15 является частью геномной нуклеотидной последовательности фолаттидролазы (простат-специфического мембранного антигена) 1 (FOLH1);
viii. генотип SNP-локуса в rs2297291 (положение 27 в SEQ ID NO. 16), где SEQ ID NO. 16 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF1);
ix. генотип SNP-локуса в rs1051266 (положение 27 в SEQ ID NO. 17), где SEQ ID NO. 17 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF1);
х. генотип SNP-локуса в rs8007267 (положение 27 в SEQ ID NO. 18), где SEQ ID NO. 18 является частью геномной нуклеотидной последовательности GTP циклогидролазы 1 (GCH1);
xi. генотип SNP-локуса в rs7639752 (положение 27 в SEQ ID NO. 19), где SEQ ID NO. 19 является частью геномной нуклеотидной последовательности холин-фосфат цитидилтрансферазы A (PCYT1A);
xii. генотип SNP-локуса в rs6275 (положение 27 в SEQ ID NO. 20), где SEQ ID NO. 20 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xiii. генотип SNP-локуса в rs1079596 (положение 27 в SEQ ID NO. 21), где SEQ ID NO. 21 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xiv. генотип SNP-локуса в rs11240594 (положение 27 в SEQ ID NO. 22), где SEQ ID NO. 22 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xv. генотип SNP-локуса в rs4633 (положение 27 в SEQ ID NO. 23), где SEQ ID NO. 23 является частью геномной нуклеотидной последовательности катехол-O-метилтрансферазы (СОМТ);
xvi. генотип SNP-локуса в rs4680 (положение 27 в SEQ ID NO. 24), где SEQ ID NO. 24 является частью геномной нуклеотидной последовательности катехол-O-метилтрансферазы (СОМТ);
xvii. генотип SNP-локуса в rs250682 (положение 27 в SEQ ID NO. 25, где SEQ ID NO. 25 является частью геномной нуклеотидной последовательности 3 представителя 6 семейства переносчиков растворенных веществ (транспортер нейротрансмиттера допамина) (SLC6A3);
xviii. генотип SNP-локуса в rs2277820 (положение 27 в SEQ ID NO. 26), где SEQ ID NO. 26 является частью геномной нуклеотидной последовательности формиминотрансферазы циклодеаминазы (FTCD);
xix. генотип SNP-локуса в rs2236225 (положение 27 в SEQ ID NO. 27), где SEQ ID NO. 27 является частью геномной нуклеотидной последовательности метилентетрагидрофолат дегидрогеназы (NADP+зависимой) 1 (MTHFD1);
хх. индикатор ожирения (например, значение BMI);
xxi. экспрессия SAM и SAH;
xxii. экспрессия 4-HNE;
xxiii. экспрессия hsCRP; и любые их комбинации.
5. Анализ по абзацу 4, дополнительно включающий определение из определенного параметра указанного, по меньшей мере, одного биомаркера, наличия, по меньшей мере, одного состояния из следующих:
i. SNP в положении 1793 в SEQ ID NO. 1 или положении 27 в SEQ ID NO. 8, содержащего, по меньшей мере, один аллель с аланином «А»;
ii. SNP в положении 66 в SEQ ID NO. 3 или положении 27 в SEQ ID NO. 10, содержащего, по меньшей мере, один аллель с гуанином «G»;
iii. SNP в rs1006737 (положение 27 в SEQ ID NO. 11), содержащего, по меньшей мере, один аллель с аланином «А»;
iv. SNP в rs1883 729 (положение 27 в SEQ ID NO. 12), содержащего, по меньшей мере, один аллель с аланином «А»;
v. SNP в rs7163862 (положение 27 в SEQ ID NO. 13 содержащего, по меньшей мере, один аллель с тимином «Т»;
vi. SNP в rs12659 (положение 27 в SEQ ID NO. 14), содержащего, по меньшей мере, один аллель с тимином «Т»;
vii. SNP в rs202676 (положение 27 в SEQ ID NO. 15), содержащего, по меньшей мере, один аллель с гуанином «G»;
viii. SNP в rs2297291 (положение 27 в SEQ ID NO. 16), содержащего, по меньшей мере, один аллель с аланином «А»;
ix. SNP в rs1051266 (положение 27 в SEQ ID NO. 17), содержащего, по меньшей мере, один аллель с аланином «А»;
х. SNP в rs8007267 (положение 27 в SEQ ID NO. 18), содержащего, по меньшей мере, один аллель с тимином «Т»;
xi. SNP в rs7639752 (положение 27 в SEQ ID NO. 19), содержащего, по меньшей мере, один аллель с аланином «А»;
xii. SNP в rs6275 (положение 27 в SEQ ID NO. 20), содержащего, по меньшей мере, один аллель с тимином «Т»;
xiii. SNP в rs1079596 (положение 27 в SEQ ID NO. 21), содержащего, по меньшей мере, один аллель с тимином «Т»;
xiv. SNP в rs11240594 (положение 27 в SEQ ID NO. 22), содержащего, по меньшей мере, один аллель с аланином «А»;
xv. SNP в rs4633 (положение 27 в SEQ ID NO. 23), содержащего, по меньшей мере, один аллель с цитозином «С»;
xvi. SNP в rs4680 (положение 27 в SEQ ID NO. 24), содержащего, по меньшей мере, один аллель с гуанином «G»;
xvii. SNP в rs250682 (положение 27 в SEQ ID NO. 25), содержащего, по меньшей мере, один аллель с цитозином «С»;
xviii. SNP в rs2277820 (положение 27 в SEQ ID NO. 26), содержащего, по меньшей мере, один аллель с тимином «Т»; и
xix. SNP в rs2236225 (положение 27 в SEQ ID NO. 27), содержащего, по меньшей мере, один аллель с аланином «А»;
хх. ожирение (например, определенное по значению BMI, равному 30 кг/м2 или больше);
xxi. соотношение экспрессии SAM к SAH меньше, чем предварительно определенное эталонное соотношение;
xxii. экспрессия 4-гидроксиноненаля (4-HNE) больше, чем предварительно определенное эталонное значение;
xxiii. xxv. экспрессия hsCRP больше, чем около 2,3 мг на литр плазмы, измеренное в образце плазмы; и их любые комбинации; и если, по меньшей мере, одно из состояний обнаруживается, то выбирается, и необязательно назначается, режим лечения, включающий эффективное количество фолат-содержащего соединения.
6. Анализ для выбора режима лечения человека, страдающего депрессией, включающий:
(а) осуществление на тестируемом образце из человека, который диагностирован как страдающий депрессией или имеющий риск развития депрессии, по меньшей мере, одного анализа для определения параметров, по меньшей мере, двух биомаркеров из:
i. генотип SNP-локуса в положении 677 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 7 (идентифицированного по rs 1801133), где SEQ ID NO. 1 и SEQ ID NO. 7 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR);
ii. генотип SNP-локуса в rs2274976 (положение 1793 в SEQ ID NO. 1 или положении 27 в SEQ ID NO. 8), где SEQ ID NO. 1 и SEQ ID NO. 8 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолат-редуктазы (MTHFR);
iii. генотип SNP-локуса в положении 2756 в SEQ ID NO. 2 или положение 27 в SEQ ID NO. 9 (идентифицированного по rs1805087), где SEQ ID NO. 2 и SEQ ID NO. 9 каждая независимо являются частью геномной нуклеотидной последовательности метионинсинтазы (MTR); и
iv. генотип SNP-локуса в положении 66 в SEQ ID NO. 3 или в положении 27 в SEQ ID NO. 10 (идентифицированного по rs1801394), где SEQ ID NO. 3 и SEQ ID NO. 10 каждая независимо являются частью геномной нуклеотидной последовательности редуктазы метионинсинтазы (MTRR);
v. генотип SNP-локуса в rs1006737 (положение 27 в SEQ ID NO. 11), где SEQ ID NO. 11 является частью геномной нуклеотидной последовательности альфа 1C субъединицы потенциалзависимого кальциевого канала L типа (CACNA1C);
vi. генотип SNP-локуса в rs1883729 (положение 27 в SEQ ID NO. 12), где SEQ ID NO. 12 является частью геномной нуклеотидной ДНК-последовательности (цитозин 5)-метилтрансферазы 3 бета (DNMT3B);
vii. генотип SNP-локуса в rs7163862 (положение 27 в SEQ ID NO. 13), где SEQ ID NO. 13 является частью геномной нуклеотидной последовательности белка-регулятора обратной связи GTP-циклогидролазы 1 (GCHFR);
viii. генотип SNP-локуса в rs12659 (положение 27 в SEQ ID NO. 14. где SEQ ID NO. 14 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF2);
ix. генотип SNP-локуса в rs202676 (положение 27 в SEQ ID NO. 15), где SEQ ID NO. 15 является частью геномной нуклеотидной последовательности фолатгидролазы (простат-специфического мембранного антигена) 1 (FOLH1);
х. генотип SNP-локуса в rs2297291 (положение 27 в SEQ ID NO. 16), где SEQ ID NO. 16 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF1);
xi. генотип SNP-локуса в rs1051266 (положение 27 в SEQ ID NO. 17), где SEQ ID NO. 17 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF1);
xii. генотип SNP-локуса в rs8007267 (положение 27 в SEQ ID NO. 18), где SEQ ID NO. 18 является частью геномной нуклеотидной последовательности GTP циклогидролазы 1 (GCH1);
xiii. генотип SNP-локуса в rs7639752 (положение 27 в SEQ ID NO. 19), где SEQ ID NO. 19 является частью геномной нуклеотидной последовательности холин-фосфат цитидилтрансферазы А (PCYT1A);
xiv. генотип SNP-локуса в rs6275 (положение 27 в SEQ ID NO. 20), где SEQ ID NO. 20 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xv. генотип SNP-локуса в rs1079596 (положение 27 в SEQ ID NO. 21), где SEQ ID NO. 21 представляет собой участок геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xvi. генотип SNP-локуса в rs11240594 (положение 27 в SEQ ID NO. 22), где SEQ ID NO. 22 представляет собой участок геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xvii. генотип SNP-локуса в rs4633 (положение 27 в SEQ ID NO. 23), где SEQ ID NO. 23 является частью геномной нуклеотидной последовательности катехол-O-метилтрансферазы (СОМТ);
xviii. генотип SNP-локуса в rs4680 (положение 27 в SEQ ID NO. 24), где SEQ ID NO. 24 представляет собой участок геномной нуклеотидной последовательности катехин-O-метилтрансферазы (СОМТ);
xix. генотип SNP-локуса в rs250682 (положение 27 в SEQ ID NO. 25), где SEQ ID NO. 25 является частью геномной нуклеотидной последовательности 3 представителя 6 семейства переносчиков растворенных веществ (транспортер нейротрансмиттера допамина) (SLC6A3);
хх. генотип SNP-локуса в rs2277820 (положение 27 в SEQ ID NO. 26. где SEQ ID NO. 26 является частью геномной нуклеотидной последовательности формиминотрансферазы циклодеаминазы (FTCD);
xxi. генотип SNP-локуса в rs2236225 (положение 27 в SEQ ID NO. 27, где SEQ ID NO. 27 является частью геномной нуклеотидной последовательности метилентетрагидрофолатдегидрогеназы (NADP+зависимой) 1 (MTHFD1);
xxii. индикатор ожирения (например, значение BMI);
xxiii. уровень экспрессии SAM и SAH;
xxiv. уровень экспрессии 4-HNE;
xxv. уровень экспрессии hsCRP; и их комбинации;
(b) обнаружение, необязательно с помощью искусственного устройства, из параметров указанных, по меньшей мере, двух биомаркеров, наличия, по меньшей мере, одного состояния, выбранного из следующих:
i. SNP в положении 677 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 7, содержащего, по меньшей мере, один аллель с тимином «Т»;
ii. SNP в rs2274976 (положение 27 в SEQ ID NO. 1 или положении 27 в SEQ ID NO. 8), содержащего, по меньшей мере, один аллель с аланином «А»;
iii. SNP в положении 2756 в SEQ ID NO. 2 или положение 27 в SEQ ID NO. 9, содержащего, по меньшей мере, один аллель с гуанином «G»;
iv. SNP в положении 66 в SEQ ID NO. 3 или в положении 27 в SEQ ID NO. 10, содержащего, по меньшей мере, один аллель с гуанином «G»;
v. SNP в rs1006737 (положение 27 в SEQ ID NO. 11), содержащего, по меньшей мере, один аллель с аланином «А»;
vi. SNP в rs1883729 (положение 27 в SEQ ID NO. 12), содержащего, по меньшей мере, один аллель с аланином «А»;
vii. SNP в rs7163862 (положение 27 в SEQ ID NO. 13), содержащего, по меньшей мере, один аллель с тимином «Т»;
viii. SNP в rs12659 (положение 27 в SEQ ID NO. 14), содержащего, по меньшей мере, один аллель с тимином «Т»;
ix. SNP в rs202676 (положение 27 в SEQ ID NO. 15), содержащего, по меньшей мере, один аллель с гуанином «G»;
х. SNP в rs2297291 (положение 27 в SEQ ID NO. 16), содержащего, по меньшей мере, один аллель с аланином «А»;
xi. SNP в rs1051266 (положение 27 в SEQ ID NO. 17), содержащего, по меньшей мере, один аллель с аланином «А»;
xii. SNP в rs8007267 (положение 27 в SEQ ID NO. 18), содержащего, по меньшей мере, один аллель с тимином «Т»;
xiii. SNP в rs7639752 (положение 27 в SEQ ID NO. 19), содержащего, по меньшей мере, один аллель с аланином «А»;
xiv. SNP в rs6275 (положение 27 в SEQ ID NO. 20), содержащего, по меньшей мере, один аллель с тимином «Т»;
xv. SNP в rs1079596 (положение 27 в SEQ ID NO. 21), содержащего, по меньшей мере, один аллель с тимином «Т»;
xvi. SNP в rs11240594 (положение 27 в SEQ ID NO. 22), содержащего, по меньшей мере, один аллель с аланином «А»;
xvii. SNP в rs4633 (положение 27 в SEQ ID NO. 23), содержащего, по меньшей мере, один аллель с цитозином «С»;
xviii. SNP в rs4680 (положение 27 в SEQ ID NO. 24), содержащего, по меньшей мере, один аллель с гуанином «G»;
xix. SNP в rs250682 (положение 27 в SEQ ID NO. 25), содержащего, по меньшей мере, один аллель с цитозином «С»;
хх. SNP в rs2277820 (положение 27 в SEQ ID NO. 26), содержащего, по меньшей мере, один аллель с тимином «Т»;
xxi. SNP в rs2236225 (положение 1958 SEQ ID NO.27), содержащего, по меньшей мере, один аллель с аланином «А»;
xxii. ожирение (например, определенное по значению BMI, равному 30 кг/м2 или больше);
xxiii. соотношение экспрессии SAM к SAH меньше, чем предварительно определенное эталонное соотношение;
xxiv. уровень экспрессии 4-HNE больше, чем предварительно определенное эталонное значение;
xxv. xxv. экспрессия hsCRP больше чем около 2,3 мг на литр плазмы, измеренная в образце плазмы; и их любые комбинации; и если, по меньшей мере, одно из состояний обнаруживается, то выбирается, и необязательно назначается, режим лечения, включающий эффективное количество фолат-содержащего соединения.
7. Анализ по любому из предшествующих абзацев, в котором предварительно определенное эталонное соотношение составляет около 2,8 при измерении в плазме крови.
8. Анализ по любому из предшествующих абзацев, в котором предварительно определенное эталонное соотношение составляет около 3,0 при измерении в плазме крови.
9. Анализ по любому из предшествующих абзацев, в котором предварительно определенное эталонное значение составляет около 3,0 мг на литр плазмы при измерении в образце плазмы.
10. Анализ по любому из предшествующих абзацев, в котором предварительно определенное эталонное значение составляет около 3,2 мг на литр плазмы при измерении в образце плазмы.
11. Анализ по любому из предшествующих абзацев, в котором тестируемый образец анализируется для определения, по меньшей мере, трех состояний.
12. Анализ по любому из предшествующих абзацев, в котором тестируемый образец анализируется для определения, по меньшей мере, трех состояний.
13. Анализ по любому из предшествующих абзацев, в котором тестируемый образец включает образец крови.
14. Анализ по любому из предшествующих абзацев, в котором тестируемый образец включает образец мочи.
15. Анализ по любому из предшествующих абзацев, в котором тестируемый образец включает буккальный образец.
16. Анализ по любому из предшествующих абзацев, в котором тестируемый образец включает образец слюны.
17. Анализ по любому из предшествующих абзацев, в котором генотипирование включает стадию амплификации тестируемого образца с набором праймеров, фланкирующих любой из SNP.
18. Анализ по абзацу 17, в котором, по меньшей мере, два набора праймеров, амплифицирующих, по меньшей мере, два SNP, используются в анализе мультиплексной амплификации.
19. Анализ по любому из предшествующих абзацев, в котором тестируемый образец содержит белковый образец, и тестируемый образец, содержащий белковый образец, подвергается, по меньшей мере, одному анализу, выбранному из группы, состоящей из вестерн-блоттинга, твердофазного иммуноферментного анализа, масс-спектрометрии, иммуноанализа, проточной цитометрии, иммуногистохимического анализа и любой их комбинации.
20. Анализ по любому из предшествующих абзацев, в котором режим лечения дополнительно включает выбор и необязательно введение антидепрессантного лекарственного средства.
21. Анализ по п.20, в котором антидепрессантное лекарственное средство включает селективный ингибитор обратного захвата серотонина.
22. Анализ по любому из предшествующих абзацев, в котором депрессия является большим депрессивным расстройством.
23. Способ лечения человека с депрессией, включающий введение композиции, содержащей эффективное количество фолат-содержащего соединения человеку, который диагностирован как страдающий депрессией или имеющий риск развития депрессии, и дополнительно определенный как несущий, по меньшей мере, один из следующих однонуклеотидных полиморфизмов (SNP) или их комбинацию:
i. SNP в положении 677 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 7 (идентифицированного по rs1801133), содержащий, по меньшей мере, один аллель с тимином «Т», в котором SEQ ID NO. 1 и SEQ ID NO. 7 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR); и
ii. SNP в положении 2756 в SEQ ID NO. 2 или положение 27 в SEQ ID NO. 9, содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 2 и SEQ ID NO. 9 каждая независимо являются частью геномной нуклеотидной последовательности метионинсинтазы (MTR).
24. Способ лечения человека с депрессией, включающий
а. определение генотипов, по меньшей мере, двух локусов в биологическом образце субъекта, который диагностирован как страдающий депрессией или имеющий риск развития депрессии, где указанные, по меньшей мере, два локуса являются:
i. SNP677, где SNP677 является положением 677 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 7 (идентифицированного по rs1801133), где SEQ ID NO. 1 и SEQ ID NO. 7 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR); и
ii. SNP2756, где SNP2756 является положением 2756 в SEQ ID NO. 2 или положением 27 в SEQ ID NO. 9 (идентифицированного по rs1805087), где SEQ ID NO. 2 и SEQ ID NO. 9 каждая независимо являются частью геномной нуклеотидной последовательности метионинсинтазы (MTR); и
b. назначение режима лечения, включающего композицию, содержащую эффективное количество фолат-содержащего соединения субъекту, если обнаружено, по меньшей мере, одно из следующих состояний:
i по меньшей мере, один аллель с тимином «Т» в SNP677;
ii. по меньшей мере, один аллель с гуанином «G» в SNP2756; или
iii. по меньшей мере, один аллель с тимином «Т» в SNP677 и, по меньшей мере, один аллель с гуанином «G» в SNP2756.
25. Способ повышения эффективности антидепрессантного лекарственного средства вводимого человеку, включающий введение композиции, содержащей эффективное количество фолат-содержащего соединения, в сочетании с антидепрессантным лекарственным средством, человеку, если человек определен как несущий, по меньшей мере, один из следующих однонуклеотидных полиморфизмов (SNP) или их комбинации:
i. SNP в положении 677 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 7 (идентифицированного по rs1801133), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 1 и SEQ ID NO. 7 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR); и
ii. SNP в положении 2756 в SEQ ID NO. 2 или положение 27 в SEQ ID NO. 9, содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 2 и SEQ ID NO. 9 каждая независимо являются частью геномной нуклеотидной последовательности метионинсинтазы (MTR).
26. Способ по любому из предшествующих абзацев, в котором субъект дополнительно определен как несущий, по меньшей мере, одно из следующих состояний или их комбинаций:
i. SNP в rs2274976 (положение 1793 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 8), содержащий, по меньшей мере, один аллель с аланином «А»;
ii. SNP в положении 66 в SEQ ID NO. 3 или в положении 27 в SEQ ID NO. 10, содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 3 и SEQ ID NO. 10 каждая независимо являются частью геномной нуклеотидной последовательности редуктазы метионинсинтазы (MTRR);
iii. SNP в rs1006737 (положение 27 в SEQ ID NO. 11), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 11 является частью геномной нуклеотидной последовательности альфа 1C субъединицы потенциалзависимого кальциевого канала L типа (CACNA1C);
iv. SNP в rs1883729 (положение 27 в SEQ ID NO. 12), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 12 является частью геномной нуклеотидной ДНК-последовательности (цитозин 5)-метилтрансферазы 3 бета (DNMT3B);
v. SNP в rs7163862 (положение 27 в SEQ ID NO. 13), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 13 является частью геномной нуклеотидной последовательности белка-регулятора обратной связи GTP-циклогидролазы 1 (GCHFR);
vi. SNP в rs12659 (положение 27 в SEQ ID NO. 14), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 14 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF2);
vii. SNP в rs202676 (положение 27 в SEQ ID NO. 15), содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 15 является частью геномной нуклеотидной последовательности фолатгидролазы (простата-специфического мембранного антигена) 1 (FOLH1);
viii. SNP в rs2297291 (положение 27 в SEQ ID NO. 16), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 16 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF1);
ix. SNP в rs1051266 (положение 27 в SEQ ID NO. 17), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 17 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF1);
х. SNP в rs8007267 (положение 27 в SEQ ID NO. 18), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 18 является частью геномной нуклеотидной последовательности GTP циклогидролазы 1 (GCH1);
xi. SNP в rs7639752 (положение 27 в SEQ ID NO. 19), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 19 является частью геномной нуклеотидной последовательности холин-фосфат цитидилтрансферазы A (PCYT1A);
xii. SNP в rs6275 (положение 27 в SEQ ID NO. 20), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 20 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xiii. SNP в rs1079596 (положение 27 в SEQ ID NO. 21), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 21 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xiv. SNP в rs11240594 (положение 27 в SEQ ID NO. 22), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 22 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xv. SNP в rs4633 (положение 27 в SEQ ID NO. 23), содержащий, по меньшей мере, один аллель с цитозином «С», где SEQ ID NO. 23 является частью геномной нуклеотидной последовательности катехол-O-метилтрансферазы (СОМТ);
xvi. SNP в rs4680 (положение 27 в SEQ ID NO. 15), содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 24 является частью геномной нуклеотидной последовательности катехол-O-метилтрансферазы (СОМТ);
xvii. SNP в rs250682 (положение 27 в SEQ ID NO. 25), содержащий, по меньшей мере, один аллель с цитозином «С», где SEQ ID NO. 25 является частью геномной нуклеотидной последовательности 3 представителя 6 семейства переносчиков растворенных веществ (транспортер нейротрансмиттера допамина) (SLC6A3);
xviii. SNP в rs2277820 (положение 27 в SEQ ID NO. 26), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 26 является частью геномной нуклеотидной последовательности формиминотрансферазы циклодеаминазы (FTCD); и
xix. SNP в rs2236225 (положение 27 в SEQ ID NO. 27), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 27 является частью геномной нуклеотидной последовательности метилентетрагидрофолат дегидрогеназы (NADP+зависимой) 1 (MTHFD1);
хх. ожирение (например, определенное по значению BMI, равному 30 кг/м2 или больше);
xxi. соотношение экспрессии SAM к SAH меньше, чем предварительно определенное соотношение;
xxii. экспрессия 4-гидроксиноненаля (4-HNE) больше, чем предварительно определенный стандарт; и
xxiii. экспрессия hsCRP больше чем около 2,3 мг на литр плазмы, измеренная в образце плазмы.
27. Способ лечения человека с депрессией, включающий введение композиции, содержащей эффективное количество фолат-содержащего соединения человеку, который диагностирован как страдающий депрессией или имеющий риск развития депрессии, и дополнительно определенный как несущий, по меньшей мере, одно из следующих состояний или любых их комбинаций:
i. SNP в положении 677 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 7 (идентифицированного по rs1801133), содержащий, по меньшей мере, один аллель с тимином «Т», в котором SEQ ID NO. 1 и SEQ ID NO. 7 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR);
ii. SNP в rs2274976 (положение 1793 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 8), содержащий, по меньшей мере, один аллель с аланином «А»; где SEQ ID NO. 1 и SEQ ID NO. 8 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолат-редуктазы (MTHFR);
iii. SNP в положении 2756 в SEQ ID NO. 2 или положение 27 в SEQ ID NO. 9, содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 2 и SEQ ID NO. 9 каждая независимо являются частью геномной нуклеотидной последовательности метионинсинтазы (MTR); и
iv. SNP в положении 66 в SEQ ID NO. 3 или в положении 27 в SEQ ID NO. 10, содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 3 и SEQ ID NO. 10 каждая независимо являются частью геномной нуклеотидной последовательности редуктазы метионинсинтазы (MTRR);
v. SNP в rs1006737 (положение 27 в SEQ ID NO. 11), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 11 является частью геномной нуклеотидной последовательности альфа 1C субъединицы потенциалзависимого кальциевого канала L типа (CACNA1C);
vi. SNP в rs1883729 (положение 27 в SEQ ID NO. 12), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 12 является частью геномной нуклеотидной ДНК-последовательности (цитозин 5)-метилтрансферазы 3 бета (DNMT3B);
vii. SNP в rs7163862 (положение 27 в SEQ ID NO. 13), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 13 является частью геномной нуклеотидной последовательности белка-регулятора обратной связи GTP-циклогидролазы 1 (GCHFR);
viii. SNP в rs12659 (положение 27 в SEQ ID NO. 14), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 14 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF2);
ix. SNP в rs202676 (положение 27 в SEQ ID NO. 15), содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 15 является частью геномной нуклеотидной последовательности фолатгидролазы (простата-специфического мембранного антигена) 1 (FOLH1);
х. SNP в rs2297291 (положение 27 в SEQ ID NO. 16), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 16 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF1);
xi. SNP в rs1051266 (положение 27 в SEQ ID NO. 17), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 17 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF1);
xii. SNP в rs8007267 (положение 27 в SEQ ID NO. 18), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 18 является частью геномной нуклеотидной последовательности GTP циклогидролазы 1 (GCH1);
xiii. SNP в rs7639752 (положение 27 в SEQ ID NO. 19), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 19 является частью геномной нуклеотидной последовательности холин-фосфат цитидилтрансферазы A (PCYT1A);
xiv. SNP в rs6275 (положение 27 в SEQ ID NO. 20), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 20 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xv. SNP в rs1079596 (положение 27 в SEQ ID NO. 21), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 21 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xvi. SNP в rs 11240594 (положение 27 в SEQ ID NO. 22), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 22 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xvii. SNP в rs4633 (положение 27 в SEQ ID NO. 23), содержащий, по меньшей мере, один аллель с цитозином «С», где SEQ ID NO. 23 является частью геномной нуклеотидной последовательности катехол-O-метилтрансферазы (СОМТ);
xviii. SNP в rs4680 (положение 27 в SEQ ID NO. 24), содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 24 является частью геномной нуклеотидной последовательности катехол-O-метилтрансферазы (СОМТ);
xix. SNP в rs250682 (положение 27 в SEQ ID NO. 25), содержащий, по меньшей мере, один аллель с цитозином «С», где SEQ ID NO. 25 является частью геномной нуклеотидной последовательности 3 представителя 6 семейства переносчиков растворенных веществ (транспортер нейротрансмиттера допамина) (SLC6A3);
хх. SNP в rs2277820 (положение 27 в SEQ ID NO. 26), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 26 является частью геномной нуклеотидной последовательности формиминотрансферазы циклодеаминазы (FTCD); и
xxi. SNP в rs2236225 (положение 27 в SEQ ID NO. 27), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 27 является частью геномной нуклеотидной последовательности метилентетрагидрофолат дегидрогеназы (NADP+зависимой) 1 (MTHFD1);
xxii. ожирение (например, определенное по значению BMI, равному 30 кг/м2 или больше);
xxiii. соотношение экспрессии SAM к SAH меньше, чем предварительно определенное соотношение;
xxiv. xxiv. экспрессия 4-гидроксиноненаля (4-HNE) больше, чем предварительно определенный стандарт; и
xxv. экспрессия hsCRP больше чем около 2,3 мг на литр плазмы, измеренная в образце плазмы.
28. Способ лечения депрессии у человека, включающий обнаружение, по меньшей мере, одного из следующих состояний в биологическом образце из человека, и если одно из них выполняется, то назначение человеку режима лечения, включающего эффективное количество фолат-содержащего соединения, где указанное, по меньшей мере, одно состояние выбирается из следующих:
i. SNP в положении 677 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 7 (определена rs1801133), содержащий, по меньшей мере, один аллель с тимином «Т»;
ii. SNP в rs2274976 (положение 27 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 8), содержащий, по меньшей мере, один аллель с аланином «А»;
iii. SNP в положении 2756 в SEQ ID NO.2 или положении 27 в SEQ ID NO. 9, содержащего, по меньшей мере, один аллель с гуанином «G»;
iv. SNP в положении 66 в SEQ ID NO. 3 или в положении 27 в SEQ ID NO. 10, содержащего, по меньшей мере, один аллель с гуанином «G»;
v. SNP в rs1006737 (положение 27 в SEQ ID NO. 11), содержащего, по меньшей мере, один аллель с аланином «А»;
vi. SNP в rs1883729 (положение 27 в SEQ ID NO. 12), содержащего, по меньшей мере, один аллель с аланином «А»;
vii. SNP в rs7163862 (положение 27 в SEQ ID NO. 13), содержащего, по меньшей мере, один аллель с тимином «Т»;
viii. SNP в rs12659 (положение 27 в SEQ ID NO. 14), содержащего, по меньшей мере, один аллель с тимином «Т»;
ix. SNP в rs202676 (положение 27 в SEQ ID NO. 15), содержащего, по меньшей мере, один аллель с гуанином «G»;
х. SNP в rs2297291 (положение 27 в SEQ ID NO. 16), содержащего, по меньшей мере, один аллель с аланином «А»;
xi. SNP в rs1051266 (положение 27 в SEQ ID NO. 17), содержащего, по меньшей мере, один аллель с аланином «А»;
xii. SNP в rs8007267 (положение 27 в SEQ ID NO. 18), содержащего, по меньшей мере, один аллель с тимином «Т»;
xiii. SNP в rs7639752 (положение 27 в SEQ ID NO. 19), содержащего, по меньшей мере, один аллель с аланином «А»;
xiv. SNP в rs6275 (положение 27 в SEQ ID NO. 20), содержащего, по меньшей мере, один аллель с тимином «Т»;
xv. SNP в rs1079596 (положение 27 в SEQ ID NO. 21), содержащего, по меньшей мере, один аллель с тимином «Т»;
xvi. SNP в rs11240594 (положение 27 в SEQ ID NO. 22), содержащего, по меньшей мере, один аллель с аланином «А»;
xvii. SNP в rs4633 (положение 27 в SEQ ID NO. 23), содержащего, по меньшей мере, один аллель с цитозином «С»;
xviii. SNP в rs4680 (положение 27 в SEQ ID NO. 24), содержащего, по меньшей мере, один аллель с гуанином «G»;
xix. SNP в rs250682 (положение 27 в SEQ ID NO. 25), содержащего, по меньшей мере, один аллель с цитозином «С»;
хх. SNP в rs2277820 (положение 27 в SEQ ID NO. 26), содержащего, по меньшей мере, один аллель с тимином «Т»;
xxi. SNP в rs2236225 (положение 1958 SEQ ID NO. 27), содержащего, по меньшей мере, один аллель с аланином «А»;
xxii. ожирение (например, определенное по значению BMI, равному 30 кг/м2 или больше);
xxiii. соотношение экспрессии SAM к SAH меньше, чем предварительно определенное эталонное соотношение;
xxiv. уровень экспрессии 4-HNE больше, чем предварительно определенное эталонное значение;
xxv. xxv. экспрессия hsCRP больше чем около 2,3 мг на литр плазмы, измеренная в образце плазмы; и их любые комбинации.
29. Способ по любому из предшествующих абзацев, в котором субъект дополнительно определяется как несущий, по меньшей мере, два из состояний или больше.
30. Способ по любому из предшествующих абзацев, в котором эффективное количество фолат-содержащего соединения находится в диапазоне от около 0,1 до около 1 мг/кг массы тела в день.
31. Способ по любому из предшествующих абзацев, в котором эффективное количество фолат-содержащего соединения составляет от около 7,5 мг/день до около 50 мг/день.
32. Способ по любому из предшествующих абзацев, в котором эффективное количество фолат-содержащего соединения составляет около 15 мг/день.
33. Способ по любому из предшествующих абзацев, в котором эффективное количество фолат-содержащего соединения вводится в виде однократной суточной дозировки.
34. Способ по любому из предшествующих абзацев, в котором эффективное количество фолат-содержащего соединения вводят в более чем одной дробной дозе в день.
35. Способ по любому из предшествующих абзацев, в котором введение является пероральным.
36. Способ по любому из предшествующих абзацев, в котором композиция составлена для высвобождения, по меньшей мере, части фолат-содержащего соединения в течение периода времени, по меньшей мере, около 3-6 часов, после введения композиции, где высвобождение необязательно является равновесным высвобождением.
37. Способ по любому из предшествующих пп., дополнительно включающий выбор и необязательно введение антидепрессантного лекарственного средства в сочетании с фолат-содержащим соединением.
38. Способ по абзацу 37, в котором антидепрессантное лекарственное средство включает селективный ингибитор обратного захвата серотонина.
39. Способ по абзацу 38, в котором селективный ингибитор обратного захвата серотонина выбирают из группы, состоящей из флуоксетина, циталопрама, пароксетина, эсциталопрама, сертралина, и любых их комбинаций.
40. Способ по любому из предшествующих абзацев, в котором субъект, который диагностирован как страдающий от депрессии является устойчивым, по меньшей мере, к одной антидепрессантной монотерапии.
41. Способ по любому из предшествующих абзацев, в котором депрессия является большим депрессивным расстройством.
42. Способ по любому из предшествующих абзацев, в котором тестируемый образец включает буккальный образец.
43. Способ по любому из предшествующих абзацев, в котором тестируемый образец включает образец слюны.
44. Способ по любому из предшествующих абзацев, в котором тестируемый образец включает образец крови.
45. Способ по любому из предшествующих абзацев, в котором тестируемый образец включает образец мочи.
46. Компьютерная система для получения данных, по меньшей мере, из одного тестируемого образца, полученного из одного субъекта, которая включает:
(а) по меньшей мере, один модуль определения, сконфигурированный для получения указанного одного тестируемого образца и осуществления, по меньшей мере, одного анализа на указанном, по меньшей мере, одном тестируемом образце для определения наличия или отсутствия, по меньшей мере, одного из следующих состояний или любых их комбинаций:
i. соотношение экспрессии s-аденозилметионина (SAM) к s-аденозилгомоцистеину (SAH) меньше, чем предварительно определенное эталонное соотношение;
ii. экспрессия 4-гидроксиноненаля (4-HNE) больше, чем предварительно определенное эталонное значение;
iii. однонуклеотидный полиморфизм (SNP) в положении 677 в SEQ ID NO. 1 или в положении 27 в SEQ ID NO. 7 (идентифицированного по rs1801133), содержащий, по меньшей мере, один аллель с тимином «Т», в котором SEQ ID NO. 7 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR);
iv. SNP в положении 2756 в SEQ ID NO. 2 или положении 27 в SEQ ID NO. 9, содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 2 и SEQ ID NO. 9 каждая независимо являются частью геномной нуклеотидной последовательности метионинсинтазы (MTR); и
v. SNP в положении 66 в SEQ ID NO. 3 или в положении 27 в SEQ ID NO. 10, содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 3 и SEQ ID NO. 10 каждая независимо являются частью геномной нуклеотидной последовательности редуктазы метионинсинтазы (MTRR);
(b) по меньшей мере, одно запоминающее устройство, сконфигурированное для хранения выходных данных из указанного модуля определения; и
(d) по меньшей мере, один модуль индикации для отображения содержимого на основе частично выходных данных указанного вычислительного модуля, в котором содержимое включает сигнал, указывающий на наличие, по меньшей мере, одного из состояний, и необязательно отсутствия любого из состояний, или сигнала, указывающего на отсутствие всех состояний.
47. Компьютерная система по абзацу 46, в которой указанный модуль определения сконфигурирован для анализа указанного, по меньшей мере, одного тестируемого образца для определения наличия или отсутствия, по меньшей мере, двух состояний.
48. Компьютерная система по абзацу 46 или 47, в которой указанный модуль определения дополнительно включает модуль сравнения, адаптированный для сравнения указанных выходных данных из указанного модуля определения с эталонными данными, сохраненными на указанном запоминающем устройстве.
49. Компьютерная система для получения данных, по меньшей мере, из одного тестируемого образца, полученного из одного субъекта, которая включает:
(a) по меньшей мере, один модуль определения, сконфигурированный для получения указанного одного тестируемого образца и осуществления, по меньшей мере, одного анализа генотипирования на указанном, по меньшей мере, одном тестируемом образце для определения генотипов, по меньшей мере, двух локусов, где указанные, по меньшей мере, два локуса включают:
(i) положение 677 в SEQ ID NO. 1 или в положении 27 в SEQ ID NO. 7 (идентифицированного по rs1801133), где SEQ ID NO. 1 и SEQ ID NO. 7 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR);
(ii) положение 2756 в SEQ ID NO. 2 или в положении 27 в SEQ ID NO. 9 (идентифицированного по rs1805087), где SEQ ID NO. 2 и SEQ ID NO. 9 каждая независимо являются частью геномной нуклеотидной последовательности метионинсинтазы (MTR); и
(iii) необязательно, положение 66 из SEQ ID NO. 3 или в положении 27 в SEQ ID NO. 10 (идентифицированного по rs1801394), где SEQ ID NO. 3 и SEQ ID NO. 10 каждая независимо являются частью геномной нуклеотидной последовательности редуктазы метионинсинтазы (MTRR);
(b) запоминающее устройство, сконфигурированное для хранения выходных данных из указанного модуля определения; и
(c) вычислительный модуль, включающий специально запрограммированные инструкции для определения из выходных данных наличия, по меньшей мере, одного однонуклеотидного полиморфизма (SNP) из следующего:
i. SNP в положении 677 в SEQ ID NO. 1 или в положении 27 в SEQ ID NO. 7 содержащего, по меньшей мере, один аллель с тимином «Т»;
ii. SNP в положении 2756 в SEQ ID NO. 2 или в положении 27 в SEQ ID NO. 9, содержащем, по меньшей мере, один аллель с гуанином «G»; и
iii. необязательно SNP в положении 66 в SEQ ID NO. 3 или в положении 27 в SEQ ID NO. 10, включающего, по меньшей мере, один аллель с гуанином «G»;
(d) модуль индикации для отображения содержимого на основе частично выходных данных указанного вычислительного модуля, в котором содержимое включает сигнал, указывающий на наличие, по меньшей мере, одного из данных SNP, и необязательно отсутствия любого из данных SNP, или сигнала, указывающего на отсутствие всех данных SNP.
50. Компьютерная система по любому из предшествующих абзацев, в которой указанный модуль определения дополнительно определяет параметр, по меньшей мере, одного из представленных ниже биомаркеров или любых их комбинаций:
i. генотип SNP-локуса в rs2274976 (положение 27 в SEQ ID NO. 1 или в положении 27 в SEQ ID NO. 8), где SEQ ID NO. 1 и SEQ ID NO. 8 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR);
ii. генотип SNP-локуса в rs1006737 (положение 27 в SEQ ID NO. 11), где SEQ ID NO. 11 является частью геномной нуклеотидной последовательности альфа 1C субъединицы потенциалзависимого кальциевого канала L типа (CACNA1C);
iii. генотип SNP-локуса в rs1883729 (положение 27 в SEQ ID NO. 12), где SEQ ID NO. 12 является частью геномной нуклеотидной ДНК-последовательности (цитозин 5)-метилтрансферазы 3 бета (DNMT3B);
iv. генотип SNP-локуса в rs7163862 (положение 27 в SEQ ID NO. 13), где SEQ ID NO. 13 является частью геномной нуклеотидной последовательности белка-регулятора обратной связи GTP-циклогидролазы 1 (GCHFR);
v. генотип SNP-локуса в rs12659 (положение 27 в SEQ ID NO. 14), где SEQ ID NO. 14 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF2);
vi. генотип SNP-локуса в rs202676 (положение 27 в SEQ ID NO. 15), где SEQ ID NO. 15 является частью геномной нуклеотидной последовательности фолатгидролазы (простата-специфического мембранного антигена) 1 (FOLH1);
vii. генотип SNP-локуса в rs2297291 (положение 27 в SEQ ID NO. 16), где SEQ ID NO. 16 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF1);
viii. генотип SNP-локуса в rs1051266 (положение 27 в SEQ ID NO. 17), где SEQ ID NO. 17 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF1);
ix. генотип SNP-локуса в rs8007267 (положение 27 в SEQ ID NO. 18), где SEQ ID NO. 18 является частью геномной нуклеотидной последовательности GTP циклогидролазы 1 (GCH1);
х. генотип SNP-локуса в rs7639752 (положение 27 в SEQ ID NO. 19), где SEQ ID NO. 19 является частью геномной нуклеотидной последовательности холин-фосфат цитидилтрансферазы A (PCYT1A);
xi. генотип SNP-локуса в rs6275 (положение 27 в SEQ ID NO. 20), где SEQ ID NO. 20 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xii. генотип SNP-локуса в rs1079596 (положение 27 в SEQ ID NO. 21), где SEQ ID NO. 21 представляет собой участок геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xiii. генотип SNP-локуса в rs11240594 (положение 27 в SEQ ID NO. 22), где SEQ ID NO. 22 представляет собой участок геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xiv. генотип SNP-локуса в rs4633 (положение 27 в SEQ ID NO. 23), где SEQ ID NO. 23 является частью геномной нуклеотидной последовательности катехол-O-метилтрансферазы (СОМТ);
xv. генотип SNP-локуса в rs4680 (положение 27 в SEQ ID NO. 24), где SEQ ID NO. 24 представляет собой участок геномной нуклеотидной последовательности катехин-O-метилтрансферазы (СОМТ);
xvi. генотип SNP-локуса в rs250682 (положение 27 в SEQ ID NO. 25), где SEQ ID NO. 25 является частью геномной нуклеотидной последовательности 3 представителя 6 семейства переносчиков растворенных веществ (транспортер нейротрансмиттера допамина) (SLC6A3);
xvii. генотип SNP-локуса в rs2277820 (положение 27 в SEQ ID NO. 26), где SEQ ID NO. 26 является частью геномной нуклеотидной последовательности формиминотрансферазы циклодеаминазы (FTCD);
xviii. генотип SNP-локуса в rs2236225 (положение 27 в SEQ ID NO. 27), где SEQ ID NO. 27 является частью геномной нуклеотидной последовательности метилентетрагидрофолат дегидрогеназы (NADP + зависимой) 1 (MTHFD1);
xix. индикатор ожирения (например, значение BMI);
хх. уровень экспрессии SAM и SAH;
xxi. уровень экспрессии 4-HNE;
xxii. уровень экспрессии hsCRP.
51. Компьютерная система по абзацу 50, в которой указанный компьютерный модуль дополнительно адаптирован для определения наличия, по меньшей мере, одного из следующих состояний или любых их комбинаций:
i. SNP в rs2274976 (положение 1793 в SEQ ID NO. 1 или в положении 27 в SEQ ID NO. 8), содержащего, по меньшей мере, один аллель с аланином «А»;
ii. SNP в rs1006737 (положение 27 в SEQ ID NO. 11), содержащего, по меньшей мере, один аллель с аланином «А»;
iii. SNP в rs1883729 (положение 27 в SEQ ID NO. 12), содержащего, по меньшей мере, один аллель с аланином «А»;
iv. SNP в rs7163862 (положение 27 в SEQ ID NO. 13), содержащего, по меньшей мере, один аллель с тимином «Т»;
v. SNP в rs12659 (положение 27 в SEQ ID NO. 14), содержащего, по меньшей мере, один аллель с тимином «Т»;
vi. SNP в rs202676 (положение 27 в SEQ ID NO. 15), содержащего, по меньшей мере, один аллель с гуанином «G»;
vii. SNP в rs2297291 (положение 27 в SEQ ID NO. 16), содержащего, по меньшей мере, один аллель с аланином «А»;
viii. SNP в rs1051266 (положение 27 в SEQ ID NO. 17), содержащего, по меньшей мере, один аллель с аланином «А»;
ix. SNP в rs8007267 (положение 27 в SEQ ID NO. 18), содержащего, по меньшей мере, один аллель с тимином «Т»;
х. SNP в rs7639752 (положение 27 в SEQ ID NO. 19), содержащего, по меньшей мере, один аллель с аланином «А»;
xi. SNP в rs6275 (положение 27 в SEQ ID NO. 20), содержащего, по меньшей мере, один аллель с тимином «Т»;
xii. SNP в rs1079596 (положение 27 в SEQ ID NO. 21), содержащего, по меньшей мере, один аллель с тимином «Т»;
xiii. SNP в rs11240594 (положение 27 в SEQ ID NO. 22), содержащего, по меньшей мере, один аллель с аланином «А»;
xiv. SNP в rs4633 (положение 27 в SEQ ID NO. 23), содержащего, по меньшей мере, один аллель с цитозином «С»;
xv. SNP в rs4680 (положение 27 в SEQ ID NO. 24), содержащего, по меньшей мере, один аллель с гуанином «G»;
xvi. SNP в rs250682 (положение 27 в SEQ ID NO. 25), содержащего, по меньшей мере, один аллель с цитозином «С»;
xvii. SNP в rs2277820 (положение 27 в SEQ ID NO. 26), содержащего, по меньшей мере, один аллель с тимином «Т»;
xviii. SNP в rs2236225 (положение 27 в SEQ ID NO. 27), содержащего, по меньшей мере, один аллель с аланином «А»;
xix. ожирение (например, определенное по значению BMI, равному 30 кг/м2 или больше);
хх. соотношение экспрессии SAM к SAH меньше, чем предварительно определенное эталонное соотношение;
xxi. уровень экспрессии 4-HNE больше, чем предварительно определенное эталонное значение;
xxii. экспрессия hsCRP больше чем около 2,3 мг на литр плазмы, измеренная в образце плазмы.
52. Компьютерная система для получения данных, по меньшей мере, из одного тестируемого образца, полученного из одного субъекта, которая включает:
(а) модуль определения, сконфигурированный для получения указанного одного тестируемого образца и осуществления, по меньшей мере, одного анализа на указанном, по меньшей мере, одном тестируемом образце для определения параметров, по меньшей мере, двух биомаркеров, где параметры указанных, по меньшей мере, двух биомаркеров выбирают из следующих:
i. генотип локуса однонуклеотидного полиморфизма (SNP) в положении 677 из SEQ ID NO. 1 или положение 27 в SEQ ID NO. 7 (идентифицированного по rs1801133), где SEQ ID NO. 1 и SEQ ID NO. 7 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолат-редуктазы (MTHFR);
ii. генотип SNP-локуса в rs2274976 (положение 1793 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 8), где SEQ ID NO. 1 и SEQ ID NO. 8 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR);
iii. генотип SNP-локуса в положении 2756 в SEQ ID NO. 2 или положение 27 в SEQ ID NO. 9 (идентифицированного по rs1805087), где SEQ ID NO. 2 и SEQ ID NO. 9 каждая независимо являются частью геномной нуклеотидной последовательности метионинсинтазы (MTR); и
iv. генотип SNP-локуса в положении 66 в SEQ ID NO. 3 или в положении 27 в SEQ ID NO. 10 (идентифицированного по rs1801394), где SEQ ID NO. 3 и SEQ ID NO. 10 каждая независимо являются частью геномной нуклеотидной последовательности редуктазы метионинсинтазы (MTRR);
v. генотип SNP-локуса в rs1006737 (положение 27 в SEQ ID NO. 11), где SEQ ID NO. 11 является частью геномной нуклеотидной последовательности альфа 1C субъединицы потенциалзависимого кальциевого канала L типа (CACNA1C);
vi. генотип SNP-локуса в rs1883729 (положение 27 в SEQ ID NO. 12), где SEQ ID NO. 12 является частью геномной нуклеотидной ДНК-последовательности (цитозин-5)-метилтрансферазы 3 бета (DNMT3B);
vii. генотип SNP-локуса в rs7163862 (положение 27 в SEQ ID NO. 13), где SEQ ID NO. 13 является частью геномной нуклеотидной последовательности белка-регулятора обратной связи GTP-циклогидролазы 1 (GCHFR);
viii. генотип SNP-локуса в rs12659 (положение 27 в SEQ ID NO. 14, где SEQ ID NO. 14 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF2);
ix. генотип SNP-локуса в rs202676 (положение 27 в SEQ ID NO. 15, где SEQ ID NO. 15 является частью геномной нуклеотидной последовательности фолатгидролазы (простата-специфического мембранного антигена) 1 (FOLH1);
х. генотип SNP-локуса в rs2297291 (положение 27 в SEQ ID NO. 16), где SEQ ID NO. 16 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF1);
xi. генотип SNP-локуса в rs1051266 (положение 27 в SEQ ID NO. 17), где SEQ ID NO. 17 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF1);
xii. генотип SNP-локуса в rs8007267 (положение 27 в SEQ ID NO. 18), где SEQ ID NO. 18 является частью геномной нуклеотидной последовательности GTP циклогидролазы 1 (GCH1);
xiii. генотип SNP-локуса в rs7639752 (положение 27 в SEQ ID NO. 19), где SEQ ID NO. 19 является частью геномной нуклеотидной последовательности холин-фосфат цитидилтрансферазы А (PCYT1A);
xiv. генотип SNP-локуса в rs6275 (положение 27 в SEQ ID NO. 20), где SEQ ID NO. 20 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xv. генотип SNP-локуса в rs1079596 (положение 27 в SEQ ID NO. 21), где SEQ ID NO. 21 представляет собой участок геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xvi. генотип SNP-локуса в rs11240594 (положение 27 в SEQ ID NO. 22), где SEQ ID NO. 22 представляет собой участок геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xvii. генотип SNP-локуса в rs4633 (положение 27 в SEQ ID NO. 23), где SEQ ID NO. 23 является частью геномной нуклеотидной последовательности катехол-O-метилтрансферазы (СОМТ);
xviii. генотип SNP-локуса в rs4680 (положение 27 в SEQ ID NO. 24), где SEQ ID NO. 24 представляет собой участок геномной нуклеотидной последовательности катехин-O-метилтрансферазы (СОМТ);
xix. генотип SNP-локуса в rs250682 (положение 27 в SEQ ID NO. 25), где SEQ ID NO. 25 является частью геномной нуклеотидной последовательности 3 представителя 6 семейства переносчиков растворенных веществ (транспортер нейротрансмиттера допамина) (SLC6A3);
хх. генотип SNP-локуса в rs2277820 (положение 27 в SEQ ID NO. 26), где SEQ ID NO. 26 является частью геномной нуклеотидной последовательности формиминотрансферазы циклодеаминазы (FTCD);
xxi. генотип SNP-локуса в rs2236225 (положение 27 в SEQ ID NO. 27), где SEQ ID NO. 27 является частью геномной нуклеотидной последовательности метилентетрагидрофолат дегидрогеназы (NADP+зависимой) 1 (MTHFD1);
xxii. экспрессия SAM и SAH;
xxiii. экспрессия 4-HNE;
xxiv. экспрессия hsCRP; и любые их комбинации.
(b) запоминающее устройство, сконфигурированное для хранения выходных данных из указанного модуля определения; и
(c) вычислительный модуль, включающий специально запрограммированные инструкции для определения из выходных данных наличия, по меньшей мере, одного состояния из следующих:
i. SNP в положении 677 в SEQ ID NO. 1 или положении 27 в SEQ ID NO. 7 содержащего, по меньшей мере, один аллель с тимином «Т»;
ii. SNP в rs2274976 (положение 1793 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 8), содержащего, по меньшей мере, один аллель с аланином «А»;
iii. SNP в положении 2756 в SEQ ID NO. 2 или положении 27 в SEQ ID NO. 9 содержащего, по меньшей мере, один аллель с гуанином «G»;
iv. SNP в положении 66 в SEQ ID NO. 3 или положении 27 в SEQ ID NO. 10 содержащего, по меньшей мере, один аллель с гуанином «G»;
v. SNP в rs1006737 (положение 27 в SEQ ID NO. 11), содержащего, по меньшей мере, один аллель с аланином «А»;
vi. SNP в rs1883729 (положение 27 в SEQ ID NO. 12), содержащего, по меньшей мере, один аллель с аланином «А»;
vii. SNP в rs7163862 (положение 27 в SEQ ID NO. 13), содержащего, по меньшей мере, один аллель с тимином «Т»;
viii. SNP в rs12659 (положение 27 в SEQ ID NO. 14), содержащего, по меньшей мере, один аллель с тимином «Т»;
ix. SNP в rs202676 (положение 27 в SEQ ID NO. 15), содержащего, по меньшей мере, один аллель с гуанином «G»;
х. SNP в rs2297291 (положение 27 в SEQ ID NO. 16), содержащего, по меньшей мере, один аллель с аланином «А»;
xi. SNP в rs1051266 (положение 27 в SEQ ID NO. 17), содержащего, по меньшей мере, один аллель с аланином «А»;
xii. SNP в rs8007267 (положение 27 в SEQ ID NO. 18), содержащего, по меньшей мере, один аллель с тимином «Т»;
xiii. SNP в rs7639752 (положение 27 в SEQ ID NO. 19), содержащего, по меньшей мере, один аллель с аланином «А»;
xiv. SNP в rs6275 (положение 27 в SEQ ID NO. 20), содержащего, по меньшей мере, один аллель с тимином «Т»;
xv. SNP в rs1079596 (положение 27 в SEQ ID NO. 21), содержащего, по меньшей мере, один аллель с тимином «Т»;
xvi. SNP в rs11240594 (положение 27 в SEQ ID NO. 22), содержащего, по меньшей мере, один аллель с аланином «А»;
xvii. SNP в rs4633 (положение 27 в SEQ ID NO. 23), содержащего, по меньшей мере, один аллель с цитозином «С»;
xviii. SNP в rs4680 (положение 27 в SEQ ID NO. 24), содержащего, по меньшей мере, один аллель с гуанином «G»;
xix. SNP в rs250682 (положение 27 в SEQ ID NO. 25), содержащего, по меньшей мере, один аллель с цитозином «С»;
хх. SNP в rs2277820 (положение 27 в SEQ ID NO. 26), содержащего, по меньшей мере, один аллель с тимином «Т»; и
xxi. SNP в rs2236225 (положение 27 в SEQ ID NO. 27), содержащего, по меньшей мере, один аллель с аланином «А»;
xxii. соотношение экспрессии SAM к SAH меньше, чем предварительно определенное эталонное соотношение;
xxiii. экспрессия 4-гидроксиноненаля (4-HNE) больше, чем предварительно определенное эталонное значение;
xxiv. xxv. экспрессия hsCRP больше чем около 2,3 мг на литр плазмы, измеренное в образце плазмы; и их любые комбинации.
(d) модуль индикации для отображения содержимого на основе частично выходных данных указанного вычислительного модуля, в котором содержимое включает сигнал, указывающий на наличие, по меньшей мере, одного из состояний, и необязательно отсутствия любого из состояний, или сигнала, указывающего на отсутствие всех состояний.
53. Компьютерная система по любому из предшествующих абзацев, в которой предварительно определенное эталонное соотношение составляет около 3,0 при измерении в образце плазмы.
54. Компьютерная система по любому из предшествующих абзацев, в которой предварительно определенное эталонное соотношение составляет около 2,8 при измерении в образце плазмы.
55. Компьютерная система по любому из предшествующих абзацев, в которой предварительно определенное эталонное значение составляет около 3,0 мг на литр, при измерении в образце плазмы.
56. Компьютерная система по любому из предшествующих абзацев, в которой предварительно определенное эталонное значение составляет около 3,2 мг на литр, при измерении в образце плазмы.
57. Компьютерная система по любому из предшествующих абзацев, в которой модуль определения сконфигурирован для определения параметров, по меньшей мере, трех биомаркеров или более.
58. Компьютерная система по любому из предшествующих абзацев, в которой вычислительный модуль сконфигурирован для определения наличия, по меньшей мере, двух состояний или более.
59. Компьютерная система по любому из предшествующих абзацев, в которой указанный вычислительный модуль дополнительно включает модуль сравнения, адаптированный для сравнения указанных выходных данных из указанного модуля определения с эталонными данными, сохраненными на указанном запоминающем устройстве.
60. Компьютерная система по любому из предшествующих абзацев, в которой запоминающее устройство дополнительно сконфигурировано для хранения информации медицинского осмотра указанного, по меньшей мере, одного субъекта.
61. Компьютерная система по абзацу 60, в которой информация медицинского осмотра включает индикатор ожирения (например, BMI) указанного, по меньшей мере, одного субъекта.
62. Компьютерная система по любому из предшествующих абзацев, в которой содержимое, отображаемое на указанном дисплейном модуле, дополнительно включает индикатор ожирения (например, значение BMI) или сигнал, указывающий страдает ли субъект ожирением (например, определяя равно значение BMI, по меньшей мере, 30 кг/м2 или нет).
63. Компьютерная система по любому из предшествующих абзацев, где содержание, выводимое на дисплейный модуль, может дополнительно включать сигнал, указывающий, что субъекту рекомендовано получать режим лечения, включающий фолат-содержащее соединение, или сигнал, указывающий, что субъекту рекомендовано получать альтернативный режим лечения без фолат-содержащего соединения.
64. Компьютерная система по любому из предшествующих абзацев, где депрессия является большим депрессивным расстройством.
65. Машиночитаемый носитель, имеющий машиночитаемые инструкции, записанные на нем, для определения программных модулей для реализации способа на компьютере, указанный машиночитаемый носитель включает:
(a) инструкции для сравнения данных, сохраненных на запоминающем устройстве с эталонными данными для обеспечения результата сравнения, где сравнение идентифицирует наличие или отсутствие, по меньшей мере, одного из следующих состояний или любых их комбинаций:
i. соотношение экспрессии s-аденозилметионина (SAM) к s-аденозилгомоцистеину (SAH) меньше, чем предварительно определенное эталонное соотношение;
ii. xxiv. экспрессия 4-гидроксиноненаля (4-HNE) больше, чем предварительно определенное эталонное значение;
iii. однонуклеотидный полиморфизм (SNP) в положении 677 в SEQ ID NO. 1 или положении 27 в SEQ ID NO. 7 (идентифицированного по rs 1801133), содержащий, по меньшей мере, один аллель с тимином «Т», в котором SEQ ID NO. 1 и SEQ ID NO. 7 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолат-редуктазы (MTHFR);
iv. SNP в положении 2756 в SEQ ID NO. 2 или положении 27 в SEQ ID NO. 9, содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 2 и SEQ ID NO. 9 каждая независимо являются частью геномной нуклеотидной последовательности метионинсинтазы (MTR); и
v. SNP в положении 66 в SEQ ID NO. 3 или положении 27 в SEQ ID NO. 10, содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 3 и SEQ ID NO. 10 каждая независимо являются частью геномной нуклеотидной последовательности редуктазы метионинсинтазы (MTRR);
(b) инструкции для отображения содержимого на основе частично выходных данных из указанного вычислительного модуля, в котором содержимое включает сигнал, указывающий на наличие, по меньшей мере, одного из состояний, и необязательно отсутствия любого из состояний, или сигнала, указывающего на отсутствие всех состояний.
66. Машиночитаемый носитель, имеющий машиночитаемые инструкции, записанные на нем, для определения программных модулей для реализации способа на компьютере, указанный машиночитаемый носитель включает:
(a) инструкции для сравнения данных, сохраненных на запоминающем устройстве с эталонными данными для обеспечения результата сравнения, где сравнение идентифицирует наличие или отсутствие, по меньшей мере, одного из следующих состояний:
i. однонуклеотидный полиморфизм (SNP) в положении 677 в SEQ ID NO. 1 или положении 27 в SEQ ID NO. 7 (идентифицированного по rs1801133), содержащий, по меньшей мере, один аллель с тимином «Т», в котором SEQ ID NO. 1 и SEQ ID NO. 7 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолат-редуктазы (MTHFR);
ii. SNP в положении 2756 в SEQ ID NO. 2 или положении 27 в SEQ ID NO. 9, содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 2 и SEQ ID NO. 9 каждая независимо являются частью геномной нуклеотидной последовательности метионинсинтазы (MTR); и
(b) инструкции для отображения содержимого на основе частично выходных данных из указанного вычислительного модуля, в котором содержимое включает сигнал, указывающий на наличие, по меньшей мере, одного из состояний, и необязательно отсутствия любого из состояний, или сигнала, указывающего на отсутствие всех состояний.
67. Машиночитаемый носитель по любому из предшествующих абзацев, дополнительно содержащий инструкции для идентификации наличия или отсутствия, по меньшей мере, одного из следующих состояний или любых их комбинаций:
i. SNP в rs2274976 (положение 1793 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 8), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 1 и SEQ ID NO. 8 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолат-редуктазы (MTHFR);
ii. SNP в положении 66 в SEQ ID NO. 3 или положении 27 в SEQ ID NO. 10, содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 3 и SEQ ID NO. 10 каждая независимо являются частью геномной нуклеотидной последовательности редуктазы метионинсинтазы (MTRR);
iii. SNP в rs1006737 (положение 27 в SEQ ID NO. 11), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 11 является частью геномной нуклеотидной последовательности альфа 1C субъединицы потенциалзависимого кальциевого канала L типа (CACNA1C);
iv. SNP в rs1883729 (положение 27 в SEQ ID NO. 12), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 12 является частью геномной нуклеотидной ДНК-последовательности (цитозин 5)-метилтрансферазы 3 бета (DNMT3B);
v. SNP в rs7163862 (положение 27 в SEQ ID NO. 13), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 13 является частью геномной нуклеотидной последовательности белка-регулятора обратной связи GTP-циклогидролазы 1 (GCHFR);
vi. SNP в rs12659 (положение 27 в SEQ ID NO. 14), содержащий, но меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 14 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF2);
vii. SNP в rs202676 (положение 27 в SEQ ID NO. 15), содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 15 является частью геномной нуклеотидной последовательности фолатгидролазы (простата-специфического мембранного антигена) 1 (FOLH1);
viii. SNP в rs2297291 (положение 27 в SEQ ID NO. 16), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 16 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF1);
ix. SNP в rs1051266 (положение 27 в SEQ ID NO. 17), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 17 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF1);
х. SNP в rs8007267 (положение 27 в SEQ ID NO. 18), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 18 является частью геномной нуклеотидной последовательности GTP циклогидролазы 1 (GCH1);
xi. SNP в rs7639752 (положение 27 в SEQ ID NO. 19), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 19 является частью геномной нуклеотидной последовательности холин-фосфат цитидилтрансферазы A (PCYT1A);
xii. SNP в rs6275 (положение 27 в SEQ ID NO. 20), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 20 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xiii. SNP в rs1079596 (положение 27 в SEQ ID NO. 21), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 21 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xiv. SNP в rs11240594 (положение 27 в SEQ ID NO. 22), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 22 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xv. SNP в rs4633 (положение 27 в SEQ ID NO. 23), содержащий, по меньшей мере, один аллель с цитозином «С», где SEQ ID NO. 23 является частью геномной нуклеотидной последовательности катехол-O-метилтрансферазы (СОМТ);
xvi. SNP в rs4680 (положение 27 в SEQ ID NO. 15), содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 24 является частью геномной нуклеотидной последовательности катехол-O-метилтрансферазы (СОМТ);
xvii. SNP в rs250682 (положение 27 в SEQ ID NO. 25), содержащий, по меньшей мере, один аллель с цитозином «С», где SEQ ID NO. 25 является частью геномной нуклеотидной последовательности 3 представителя 6 семейства переносчиков растворенных веществ (транспортер нейротрансмиттера допамина) (SLC6A3);
xviii. SNP в rs2277820 (положение 27 в SEQ ID NO. 26), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 26 является частью геномной нуклеотидной последовательности формиминотрансферазы циклодеаминазы (FTCD); и
xix. SNP в rs2236225 (положение 27 в SEQ ID NO. 27), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 27 является частью геномной нуклеотидной последовательности метилентетрагидрофолат дегидрогеназы (NADP+зависимой) 1 (MTHFD1);
хх. ожирение (например, определенное по значению BMI, равному 30 кг/м2 или больше);
xxi. соотношение экспрессии SAM к SAH меньше, чем предварительно определенное соотношение;
xxii. xxiv. экспрессия 4-гидроксиноненаля (4-HNE) больше, чем предварительно определенный стандарт; и
xxiii. экспрессия hsCRP больше чем около 2,3 мг на литр плазмы, измеренная в образце плазмы.
68. Машиночитаемый носитель, имеющий машиночитаемые инструкции, записанные на нем, для определения программных модулей для реализации способа на компьютере, указанная машиночитаемый носитель включает:
(а) инструкции для сравнения данных, сохраненных на запоминающем устройстве с эталонными данными для обеспечения результата сравнения, где сравнение идентифицирует наличие или отсутствие, по меньшей мере, одного из следующих состояний:
i. SNP в положении 677 в SEQ ID NO. 1 или положении 27 в SEQ ID NO. 7 (идентифицированного по rs1801133), содержащий, по меньшей мере, один аллель с тимином «Т», в котором SEQ ID NO. 1 и SEQ ID NO. 7 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR);
ii. SNP в rs2274976 (положение 1793 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 8), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 1 и SEQ ID NO. 8 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR);
iii. SNP в положении 2756 в SEQ ID NO. 2 или положении 27 в SEQ ID NO. 9, содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 2 и SEQ ID NO. 9 каждая независимо являются частью геномной нуклеотидной последовательности метионинсинтазы (MTR); и
iv. SNP в положении 66 в SEQ ID NO. 3 или положении 27 в SEQ ID NO. 10, содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 3 и SEQ ID NO. 10 каждая независимо являются частью геномной нуклеотидной последовательности редуктазы метионинсинтазы (MTRR);
v. SNP в rs100673 7 (положение 27 в SEQ ID NO. 11), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 11 является частью геномной нуклеотидной последовательности альфа 1C субъединицы потенциалзависимого кальциевого канала L типа (CACNA1C);
vi. SNP в rs1883729 (положение 27 в SEQ ID NO. 12), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 12 является частью геномной нуклеотидной ДНК-последовательности (цитозин-5)-метилтрансферазы 3 бета (DNMT3B);
vii. SNP в rs7163862 (положение 27 в SEQ ID NO. 13), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 13 является частью геномной нуклеотидной последовательности белка-регулятора обратной связи GTP-циклогидролазы 1 (GCHFR);
viii. SNP в rs12659 (положение 27 в SEQ ID NO. 14), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 14 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF2);
ix. SNP в rs202676 (положение 27 в SEQ ID NO. 15), содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 15 является частью геномной нуклеотидной последовательности фолатгидролазы (простата-специфического мембранного антигена) 1 (FOLH1);
х. SNP в rs2297291 (положение 27 в SEQ ID NO. 16), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 16 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF1);
xi. SNP в rs1051266 (положение 27 в SEQ ID NO. 17), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 17 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF1);
xii. SNP в rs8007267 (положение 27 в SEQ ID NO. 18), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 18 является частью геномной нуклеотидной последовательности GTP циклогидролазы 1 (GCH1);
xiii. SNP в rs7639752 (положение 27 в SEQ ID NO. 19), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 19 является частью геномной нуклеотидной последовательности холин-фосфат цитидилтрансферазы A (PCYT1A);
xiv. SNP в rs6275 (положение 27 в SEQ ID NO. 20), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 20 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xv. SNP в rs1079596 (положение 27 в SEQ ID NO. 21), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 20 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xvi. SNP в rs11240594 (положение 27 в SEQ ID NO. 22), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 22 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xvii. SNP в rs4633 (положение 27 в SEQ ID NO. 23), содержащий, по меньшей мере, один аллель с цитозином «С», где SEQ ID NO. 23 является частью геномной нуклеотидной последовательности катехол-O-метилтрансферазы (СОМТ);
xviii. SNP в rs4680 (положение 27 в SEQ ID NO. 24), содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 24 представляет собой участок геномной нуклеотидной последовательности катехин-O-метилтрансферазы (СОМТ);
xix. SNP в rs250682 (положение 27 в SEQ ID NO. 25), содержащий, по меньшей мере, один аллель с цитозином «С», где SEQ ID NO. 25 является частью геномной нуклеотидной последовательности 3 представителя 6 семейства переносчиков растворенных веществ (транспортер нейротрансмиттера допамина) (SLC6A3);
хх. SNP в rs2277820 (положение 27 в SEQ ID NO. 26), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 26 является частью геномной нуклеотидной последовательности формиминотрансферазы циклодеаминазы (FTCD); и
xxi. SNP в rs2236225 (положение 27 в SEQ ID NO. 27), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 27 является частью геномной нуклеотидной последовательности метилентетрагидрофолат дегидрогеназы (NADP + зависимой) 1 (MTHFD1);
xxii. ожирение (например, определенное по значению BMI, равному 30 кг/м2 или больше);
xxiii. соотношение экспрессии SAM к SAH меньше, чем предварительно определенное соотношение;
xxiv. экспрессия 4-HNE больше, чем предварительно определенный стандарт;
xxv. xxv. экспрессия hsCRP больше чем около 2,3 мг на литр плазмы, измеренная в образце плазмы; и их любые комбинации; и
(b) инструкции для отображения содержимого на основе частично выходных данных из указанного вычислительного модуля, в котором содержимое включает сигнал, указывающий на наличие, по меньшей мере, одного из состояний, и необязательно отсутствия любого из состояний, или сигнала, указывающего на отсутствие всех состояний.
69. Машиночитаемый носитель по абзацу 68, дополнительно включающий инструкции для отображения сигнала, указывающего указывающий что субъекту рекомендуется получение режима лечения, включающего фолат-содержащее соединение, или сигнал, указывающий что субъекту рекомендуется получение альтернативного режима лечения без фолат-содержащего соединения.
70. Машиночитаемый носитель по любому из предшествующих абзацев, где депрессия является большим депрессивным расстройством.
71. Набор, содержащий:
олигонуклеотидный чип, к которому прикреплено множество олигонуклеотидных зондов, которые проверяют не больше чем 30 однонуклеотидных полиморфизмов (SNP), где указанные SNP включают, по меньшей мере, два из следующих SNP или любых их комбинаций:
i. SNP в положении 677 в SEQ ID NO. 1 или положении 27 в SEQ ID NO. 7 (идентифицированного по rs1801133), содержащий, по меньшей мере, один аллель с тимином «Т», в котором SEQ ID NO. 1 и SEQ ID NO. 7 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR);
ii. SNP в rs2274976 (положение 1793 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 8), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 1 и SEQ ID NO. 8 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR);
iii. SNP в положении 2756 в SEQ ID NO. 2 или положении 27 в SEQ ID NO. 9, содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 2 и SEQ ID NO. 9 каждая независимо являются частью геномной нуклеотидной последовательности метионинсинтазы (MTR); и
iv. SNP в положении 66 в SEQ ID NO. 3 или положении 27 в SEQ ID NO. 10, содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 3 и SEQ ID NO. 10 каждая независимо являются частью геномной нуклеотидной последовательности редуктазы метионинсинтазы (MTRR);
v. SNP в rs100673 7 (положение 27 в SEQ ID NO. 11), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 11 является частью геномной нуклеотидной последовательности альфа 1C субъединицы потенциалзависимого кальциевого канала L типа (CACNA1C);
vi. SNP в rs1883729 (положение 27 в SEQ ID NO. 12), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 12 является частью геномной нуклеотидной ДНК-последовательности (цитозин 5)-метилтрансферазы 3 бета (DNMT3B);
vii. SNP в rs7163862 (положение 27 в SEQ ID NO. 13), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 13 является частью геномной нуклеотидной последовательности белка-регулятора обратной связи GTP-циклогидролазы 1 (GCHFR);
viii. SNP в rs12659 (положение 27 в SEQ ED NO. 14), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 14 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF2);
ix. SNP в rs202676 (положение 27 в SEQ ID NO. 15), содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 15 является частью геномной нуклеотидной последовательности фолатгидролазы (простата-специфического мембранного антигена) 1 (FOLH1);
х. SNP в rs2297291 (положение 27 в SEQ ID NO. 16), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 16 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF1);
xi. SNP в rs1051266 (положение 27 в SEQ ID NO. 17), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 17 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF1);
xii. SNP в rs8007267 (положение 27 в SEQ ID NO. 18), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 18 является частью геномной нуклеотидной последовательности GTP циклогидролазы 1 (GCH1);
xiii. SNP в rs7639752 (положение 27 в SEQ ID NO. 19), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 19 является частью геномной нуклеотидной последовательности холин-фосфат цитидилтрансферазы A (PCYT1A);
xiv. SNP в rs6275 (положение 27 в SEQ ID NO. 20), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 20 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xv. SNP в rs1079596 (положение 27 в SEQ ID NO. 21), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 21 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xvi. SNP в rs11240594 (положение 27 в SEQ ID NO. 22), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 22 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xvii. SNP в rs4633 (положение 27 в SEQ ID NO. 23), содержащий, по меньшей мере, один аллель с цитозином «С», где SEQ ID NO. 23 является частью геномной нуклеотидной последовательности катехол-O-метилтрансферазы (СОМТ);
xviii. SNP в rs4680 (положение 27 в SEQ ID NO. 24), содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 24 является частью геномной нуклеотидной последовательности катехол-O-метилтрансферазы (СОМТ);
xix. SNP в rs250682 (положение 27 в SEQ ID NO. 25), содержащий, по меньшей мере, один аллель с цитозином «С», где SEQ ID NO. 25 является частью геномной нуклеотидной последовательности 3 представителя 6 семейства переносчиков растворенных веществ (транспортер нейротрансмиттера допамина) (SLC6A3);
хх. SNP в rs2277820 (положение 27 в SEQ ID NO. 26), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 26 является частью геномной нуклеотидной последовательности формиминотрансферазы циклодеаминазы (FTCD); и
xxi. SNP в rs2236225 (положение 27 в SEQ ID NO. 27), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 27 является частью геномной нуклеотидной последовательности метилентетрагидрофолат дегидрогеназы (NADP + зависимой) 1 (MTHFD1); и
и необязательный контейнер, содержащий детектируемую метку, которая будет конъюгироваться с нуклеотидной молекулой, полученной из тестируемого образца субъекта; и
по меньшей мере, один реактив.
72. Набор, содержащий:
олигонуклеотидный чип, к которому прикреплено множество олигонуклеотидных зондов, которые проверяют не больше чем 5 однонуклеотидных полиморфизмов (SNP), указанные SNP включают:
(i) SNP в положении 677 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 7 (идентифицированного по rs 1801133), где SEQ ID NO. 1 и SEQ ID NO. 7 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR);
(ii) SNP в положении 2756 в SEQ ID NO. 2 или положении 27 в SEQ ID NO. 9 (идентифицированного по rs1805087), где SEQ ID NO. 2 и SEQ ID NO. 9 каждая независимо являются частью геномной нуклеотидной последовательности метионинсинтазы (MTR); и
и необязательный контейнер, содержащий детектируемую метку, которая будет конъюгироваться с нуклеотидной молекулой, полученной из тестируемого образца субъекта; и
по меньшей мере, один реактив.
73. Набор по абзацу 71 или 72, в котором, по меньшей мере, один реактив выбирают из группы, состоящей из фермента рестрикции, универсального адаптера, который будет конъюгироваться нуклеотидной молекулой, праймера, комплементарного универсальному адаптеру, промывочному агенту и любых их комбинаций.
74. Набор по любому из абзацев 71-73, в котором детектируемая метка включает флуоресцентную молекулу.
75. Набор, содержащий:
множество олигонуклеотидных праймеров, которое связывает, по меньшей мере, один аллель из не более чем 30 однонуклеотидных полиморфизмов (SNP), где каждое подмножество олигонуклеотидных праймеров, которое связывается со специфичным аллелем SNP метится отдельным репортером, и где указанные SNP включают, по меньшей мере, два из следующих SNP или любых их комбинаций:
i. однонуклеотидный полиморфизм (SNP) в положении 677 в SEQ ID NO. 1 или положении 27 в SEQ ID NO. 7 (идентифицированного по rs1801133), содержащий, по меньшей мере, один аллель с тимином «Т», в котором SEQ ID NO. 1 и SEQ ID NO. 7 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR);
ii. SNP в rs2274976 (положение 1793 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 8), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 1 и SEQ ID NO. 8 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR);
iii. SNP в положении 2756 в SEQ ID NO. 2 или положении 27 в SEQ ID NO. 9, содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 2 и SEQ ID NO. 9 каждая независимо являются частью геномной нуклеотидной последовательности метионинсинтазы (MTR); и
iv. SNP в положении 66 в SEQ ID NO. 3 или положении 27 в SEQ ID NO. 10, содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 3 и SEQ ID NO. 10 каждая независимо являются частью геномной нуклеотидной последовательности редуктазы метионинсинтазы (MTRR);
v. SNP в rs1006737 (положение 27 в SEQ ID NO. 11), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 11 является частью геномной нуклеотидной последовательности альфа 1C субъединицы потенциалзависимого кальциевого канала L типа (CACNA1C);
vi. SNP в rs1883729 (положение 27 в SEQ ID NO. 12), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 12 является частью геномной нуклеотидной ДНК-последовательности (цитозин 5)-метилтрансферазы 3 бета (DNMT3B);
vii. SNP в rs7163862 (положение 27 в SEQ ID NO. 13), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 13 является частью геномной нуклеотидной последовательности белка-регулятора обратной связи GTP-циклогидролазы 1 (GCHFR);
viii. SNP в rs12659 (положение 27 в SEQ ID NO. 14), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 14 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF2);
ix. SNP в rs202676 (положение 27 в SEQ ID NO. 15), содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 15 является частью геномной нуклеотидной последовательности фолатгидролазы (простата-специфического мембранного антигена) 1 (FOLH1);
х. SNP в rs2297291 (положение 27 в SEQ ID NO. 16), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 16 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF1);
xi. SNP в rs1051266 (положение 27 в SEQ ID NO. 17), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 17 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF1);
xii. SNP в rs8007267 (положение 27 в SEQ ID NO. 18), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 18 является частью геномной нуклеотидной последовательности GTP циклогидролазы 1 (GCH1);
xiii. SNP в rs7639752 (положение 27 в SEQ ID NO. 19), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 19 является частью геномной нуклеотидной последовательности холин-фосфат цитидилтрансферазы A (PCYT1A);
xiv. SNP в rs6275 (положение 27 в SEQ ID NO. 20), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 20 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xv. SNP в rs1079596 (положение 27 в SEQ ID NO. 21), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 21 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xvi. SNP в rs11240594 (положение 27 в SEQ ID NO. 22), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 22 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xvii. SNP в rs4633 (положение 27 в SEQ ID NO. 23), содержащий, по меньшей мере, один аллель с цитозином «С», где SEQ ID NO. 23 является частью геномной нуклеотидной последовательности катехол-O-метилтрансферазы (СОМТ);
xviii. SNP в rs4680 (положение 27 в SEQ ID NO. 24), содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 24 является частью геномной нуклеотидной последовательности катехол-O-метилтрансферазы (СОМТ);
xix. SNP в rs250682 (положение 27 в SEQ ID NO. 25), содержащий, по меньшей мере, один аллель с цитозином «С», где SEQ ID NO. 25 является частью геномной нуклеотидной последовательности 3 представителя 6 семейства переносчиков растворенных веществ (транспортер нейротрансмиттера допамина) (SLC6A3);
хх. SNP в rs2277820 (положение 27 в SEQ ID NO. 26), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 26 является частью геномной нуклеотидной последовательности формиминотрансферазы циклодеаминазы (FTCD); и
xxi. SNP в rs2236225 (положение 27 в SEQ ID NO. 27), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 27 является частью геномной нуклеотидной последовательности метилентетрагидрофолат дегидрогеназы (NADP + зависимой) 1 (MTHFD1); и
по меньшей мере, один реактив.
76. Набор, содержащий:
множество олигонуклеотидных праймеров, которые связывают, по меньшей мере, один аллель из не более чем 5 однонуклеотидных полиморфизмам (SNP), где каждое подмножество олигонуклеотидных праймеров, которые связывает специфичный аллель SNP помечено отдельным репортером, и где указанные SNP включают следующие SNP:
(i) SNP в положении 677 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 7 (идентифицированного по rs1801133), содержащий, по меньшей мере, один аллель с тимином «Т», в котором SEQ ID NO. 1 и SEQ ID NO. 7 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR);
(ii) SNP в положении 2756 в SEQ ID NO. 2 или положении 27 в SEQ ID NO. 9, содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 2 и SEQ ID NO. 9 каждая независимо являются частью геномной нуклеотидной последовательности метионинсинтазы (MTR); и
по меньшей мере, один реактив.
77. Набор по любому из абзацев 75-76, в котором, по меньшей мере, один реактив включает свободные нуклеотидные основания, полимеразу или и то, и другое.
78. Набор для выбора режима лечения для субъекта с депрессией, содержащий
по меньшей мере, один реактив для определения в тестируемом образце человеческого субъекта, который диагностирован как страдающий от депрессии или имеющий риск развития депрессии, наличия или отсутствия следующих SNP:
i. однонуклеотидный полиморфизм (SNP) в положении 677 в SEQ ID NO. 1 или положении 27 в SEQ ID NO. 7 (идентифицированного по rs1801133), содержащий, по меньшей мере, один аллель с тимином «Т», в котором SEQ ID NO. 1 и SEQ ID NO. 7 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR); и
ii. SNP в положении 2756 в SEQ ID NO. 2 или положении 27 в SEQ ID NO. 9, содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 2 и SEQ ID NO. 9 каждая независимо являются частью геномной нуклеотидной последовательности метионинсинтазы (MTR); и
инструкции для применения в анализе по любому из абзацев 1-69, в способе по любому из абзацев 7-129, или системе по любому из абзацев 130-171, или любой их комбинации.
79. Набор по абзацу 78, в котором указанные SNP дополнительно включают одно или любую комбинацию из следующего:
i. SNP в rs2274976 (положение 1793 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 8), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 1 и SEQ ID NO. 8 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR);
ii. SNP в положении 66 в SEQ ID NO. 3 или положении 27 в SEQ ID NO. 10, содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 3 и SEQ ID NO. 10 каждая независимо являются частью геномной нуклеотидной последовательности редуктазы метионинсинтазы (MTRR);
iii. SNP в rs1006737 (положение 27 в SEQ ID NO. 11), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 11 является частью геномной нуклеотидной последовательности альфа 1C субъединицы потенциалзависимого кальциевого канала L типа (CACNA1C);
iv. SNP в rs1883729 (положение 27 в SEQ ID NO. 12), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 12 является частью геномной нуклеотидной ДНК-последовательности (цитозин-5)-метилтрансферазы 3 бета (DNMT3B);
v. SNP в rs7163862 (положение 27 в SEQ ID NO. 13), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 13 является частью геномной нуклеотидной последовательности белка-регулятора обратной связи GTP-циклогидролазы 1 (GCHFR);
vi. SNP в rs12659 (положение 27 в SEQ ID NO. 14), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 14 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF2);
vii. SNP в rs202676 (положение 27 в SEQ ID NO.15), содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 15 является частью геномной нуклеотидной последовательности фолатгидролазы (простата-специфического мембранного антигена) 1 (FOLH1);
viii. SNP в rs2297291 (положение 27 в SEQ ID NO. 16), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 16 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF1);
ix. SNP в rs1051266 (положение 27 в SEQ ID NO. 17), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 17 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF1);
х. SNP в rs8007267 (положение 27 в SEQ ID NO. 18), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 18 является частью геномной нуклеотидной последовательности GTP циклогидролазы 1 (GCH1);
xi. SNP в rs7639752 (положение 27 в SEQ ID NO. 19), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 19 является частью геномной нуклеотидной последовательности холин-фосфат цитидилтрансферазы A (PCYT1A);
xii. SNP в rs6275 (положение 27 в SEQ ID NO. 20), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 20 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xiii. SNP в rs1079596 (положение 27 в SEQ ID NO. 21), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 21 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xiv. SNP в rs11240594 (положение 27 в SEQ ID NO. 22), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 22 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xv. SNP в rs4633 (положение 27 в SEQ ID NO. 23), содержащий, по меньшей мере, один аллель с цитозином «С», где SEQ ID NO. 23 является частью геномной нуклеотидной последовательности катехол-O-метилтрансферазы (СОМТ);
xvi. SNP в rs4680 (положение 27 в SEQ ID NO. 24), содержащий, по меньшей мере, один аллель с гуанином «G», где SEQ ID NO. 24 является частью геномной нуклеотидной последовательности катехол-O-метилтрансферазы (СОМТ);
xvii. SNP в rs250682 (положение 27 в SEQ ID NO. 25), содержащий, по меньшей мере, один аллель с цитозином «С», где SEQ ID NO. 25 является частью геномной нуклеотидной последовательности 3 представителя 6 семейства переносчиков растворенных веществ (транспортер нейротрансмиттера допамина) (SLC6A3);
xviii. SNP в rs2277820 (положение 27 в SEQ ID NO. 26), содержащий, по меньшей мере, один аллель с тимином «Т», где SEQ ID NO. 26 является частью геномной нуклеотидной последовательности формиминотрансферазы циклодеаминазы (FTCD); и
xix. SNP в rs2236225 (положение 27 в SEQ ID NO. 27), содержащий, по меньшей мере, один аллель с аланином «А», где SEQ ID NO. 27 является частью геномной нуклеотидной последовательности метилентетрагидрофолат дегидрогеназы (NADP + зависимой) 1 (MTHFD1).
80. Набор по любому из предшествующих абзацев, дополнительно включающий твердую субстратную подложку с прикрепленным, по меньшей мере, одним связывающим компонентом на основе белка, который специфически связывает биомаркер, выбранный из группы, состоящей из SAM, SAH, 4-HNE и hsCRP.
81. Набор по абзацу 80, в котором связывающий компонент на основе белка включает антитело.
82. Набор по абзацу 80 или 81, в котором указанная твердая субстратная подложка является микротитрационным планшетом для тИФА.
83. Набор по абзацу 80 или 81, в котором твердая субстратная подложка является индикаторной полоской.
84. Набор по абзацу 80 или 81, в котором твердая субстратная подложка включает магнитную микросферу.
85. Набор по любому из предшествующих абзацев, дополнительно включающий, по меньшей мере, один праймер, разработанный для исследования биомаркера, выбранного из группы, состоящей из SAM, SAH, 4-HNE и hsCRP.
86. Набор по любому из предшествующих абзацев, в котором депрессия является большим депрессивным расстройством.
87. Способ выбора режима лечения человека с депрессией, включающий:
а. получение тестируемого образца из человека, диагностированного как страдающий от депрессии;
b. осуществление на тестируемом образце, по меньшей мере, одного анализа для определения параметров, по меньшей мере, двух биомаркеров, где параметры указанных, по меньшей мере, двух биомаркеров выбирают из следующих:
i. генотип SNP-локуса в положении 677 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 7 (идентифицированного по rs1801133), где SEQ ID NO. 1 и SEQ ID NO. 7 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR);
ii. генотип локуса SNP при rs2274976 (положение 1793 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 8), где SEQ ID NO. 1 и SEQ ID NO. 8 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR);
iii. генотип SNP-локуса в положении 2756 в SEQ ID NO. 2 или положение 27 в SEQ ID NO. 9 (идентифицированного по rs1805087), где SEQ ID NO. 2 и SEQ ID NO. 9 каждая независимо являются частью геномной нуклеотидной последовательности метионинсинтазы (MTR); и
iv. генотип SNP-локуса в положении 66 в SEQ ID NO. 3 или в положении 27 в SEQ ID NO. 10 (идентифицированного по rs1801394), где SEQ ID NO. 3 и SEQ ID NO. 10 каждая независимо являются частью геномной нуклеотидной последовательности редуктазы метионинсинтазы (MTRR);
v. генотип SNP-локуса в rs100673 7 (положение 27 в SEQ ID NO. 11), где SEQ ID NO. 11 является частью геномной нуклеотидной последовательности альфа 1C субъединицы потенциалзависимого кальциевого канала L типа (CACNA1C);
vi. генотип SNP-локуса в rs1883729 (положение 27 в SEQ ID NO. 12), где SEQ ID NO. 12 является частью геномной нуклеотидной ДНК-последовательности (цитозин 5)-метилтрансферазы 3 бета (DNMT3B);
vii. генотип SNP-локуса в rs7163862 (положение 27 в SEQ ID NO. 13), где SEQ ID NO. 13 является частью геномной нуклеотидной последовательности белка-регулятора обратной связи GTP-циклогидролазы 1 (GCHFR);
viii. генотип SNP-локуса в rs12659 (положение 27 в SEQ ID NO. 14), где SEQ ID NO. 14 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF2);
ix. генотип SNP-локуса в rs202676 (положение 27 в SEQ ID NO. 15), где SEQ ID NO. 15 является частью геномной нуклеотидной последовательности фолатгидролазы (простата-специфического мембранного антигена) 1 (FOLH1);
х. генотип SNP-локуса в rs2297291 (положение 27 в SEQ ID NO. 16), где SEQ ID NO. 16 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF1);
xi. генотип SNP-локуса в rs1051266 (положение 27 в SEQ ID NO. 17), где SEQ ID NO. 17 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF1);
xii. генотип SNP-локуса в rs8007267 (положение 27 в SEQ ID NO. 18), где SEQ ID NO. 18 является частью геномной нуклеотидной последовательности GTP циклогидролазы 1 (GCH1);
xiii. генотип SNP-локуса в rs7639752 (положение 27 в SEQ ID NO. 19), где SEQ ID NO. 19 является частью геномной нуклеотидной последовательности холин-фосфат цитидилтрансферазы А (PCYT1A);
xiv. генотип SNP-локуса в rs6275 (положение 27 в SEQ ID NO. 20), где SEQ ID NO. 20 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xv. генотип SNP-локуса в rs1079596 (положение 27 в SEQ ID NO. 21), где SEQ ID NO. 21 представляет собой участок геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xvi. генотип SNP-локуса в rs11240594 (положение 27 в SEQ ID NO. 22), где SEQ ID NO. 22 представляет собой участок геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xvii. генотип SNP-локуса в rs4633 (положение 27 в SEQ ID NO. 23), где SEQ ID NO. 23 является частью геномной нуклеотидной последовательности катехол-O-метилтрансферазы (СОМТ);
xviii. генотип SNP-локуса в rs4680 (положение 27 в SEQ ID NO. 24), где SEQ ID NO. 24 представляет собой участок геномной нуклеотидной последовательности катехин-O-метилтрансферазы (СОМТ);
xix. генотип SNP-локуса в rs250682 (положение 27 в SEQ ID NO. 25), где SEQ ID NO. 25 является частью геномной нуклеотидной последовательности 3 представителя 6 семейства переносчиков растворенных веществ (транспортер нейротрансмиттера допамина) (SLC6A3);
хх. генотип SNP-локуса в rs2277820 (положение 27 в SEQ ID NO. 26), где SEQ ID NO. 26 является частью геномной нуклеотидной последовательности формиминотрансферазы циклодеаминазы (FTCD);
xxi. генотип SNP-локуса в rs2236225 (положение 27 в SEQ ID NO. 27), где SEQ ID NO. 27 является частью геномной нуклеотидной последовательности метилентетрагидрофолат дегидрогеназы (NADP+зависимой) 1 (MTHFD1);
xxii. экспрессия SAM и SAH;
xxiii. экспрессия 4-HNE;
xxiv. экспрессия hsCRP; и любой их комбинации; и
с. определение из параметров указанных, по меньшей мере, двух биомаркеров, наличия, по меньшей мере, одного состояния, выбранного из следующих:
i. SNP в положении 677 в SEQ ID NO. 1 или положении 27 в SEQ ID NO. 7 содержащего, по меньшей мере, один аллель с тимином «Т»;
ii. SNP в rs2274976 (положение 1793 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 8), содержащего, по меньшей мере, один аллель с аланином «А»;
iii. SNP в положении 2756 в SEQ ID NO. 2 или положении 27 в SEQ ID NO. 9, содержащего, по меньшей мере, один аллель с гуанином «G»;
iv. SNP в положении 66 в SEQ ID NO. 3 или положении 27 в SEQ ID NO. 10, содержащего, по меньшей мере, один аллель с гуанином «G»;
v. SNP в rs100673 7 (положение 27 в SEQ ID NO. 11), содержащего, по меньшей мере, один аллель с аланином «А»;
vi. SNP в rs1883729 (положение 27 в SEQ ID NO. 12), содержащего, по меньшей мере, один аллель с аланином «А»;
vii. SNP в rs7163862 (положение 27 в SEQ ID NO. 13), содержащего, по меньшей мере, один аллель с тимином «Т»;
viii. SNP в rs12659 (положение 27 в SEQ ID NO. 14), содержащего, по меньшей мере, один аллель с тимином «Т»;
ix. SNP в rs202676 (положение 27 в SEQ ID NO. 15), содержащего, по меньшей мере, один аллель с гуанином «G»;
х. SNP в rs2297291 (положение 27 в SEQ ID NO. 16), содержащего, по меньшей мере, один аллель с аланином «А»;
xi. SNP в rs1051266 (положение 27 в SEQ ID NO. 17), содержащего, по меньшей мере, один аллель с аланином «А»;
xii. SNP в rs8007267 (положение 27 в SEQ ID NO. 18), содержащего, по меньшей мере, один аллель с тимином «Т»;
xiii. SNP в rs7639752 (положение 27 в SEQ ID NO. 19), содержащего, по меньшей мере, один аллель с аланином «А»;
xiv. SNP в rs6275 (положение 27 в SEQ ID NO. 20), содержащего, по меньшей мере, один аллель с тимином «Т»;
xv. SNP в rs1079596 (положение 27 в SEQ ID NO. 21), содержащего, по меньшей мере, один аллель с тимином «Т»;
xvi. SNP в rs11240594 (положение 27 в SEQ ID NO. 22), содержащего, по меньшей мере, один аллель с аланином «А»;
xvii. SNP в rs4633 (положение 27 в SEQ ID NO. 23), содержащего, по меньшей мере, один аллель с цитозином «С»;
xviii. SNP в rs4680 (положение 27 в SEQ ID NO. 24), содержащего, по меньшей мере, один аллель с гуанином «G»;
xix. SNP в rs250682 (положение 27 в SEQ ID NO. 25), содержащего, по меньшей мере, один аллель с цитозином «С»;
хх. SNP в rs2277820 (положение 27 в SEQ ID NO. 26), содержащего, по меньшей мере, один аллель с тимином «Т»; и
xxi. SNP в rs2236225 (положение 27 в SEQ ID NO. 27), содержащего, по меньшей мере, один аллель с аланином «А»;
xxii. соотношение экспрессии SAM к SAH меньше, чем предварительно определенное эталонное соотношение;
xxiii. xxiv. экспрессия 4-гидроксиноненаля (4-HNE) больше, чем предварительно определенное эталонное значение;
xxiv. xxv. экспрессия hsCRP больше чем около 2,3 мг на литр плазмы, измеренное в образце плазмы; и их любые комбинации;
d. получение результата на выходе, излагающего, что если детектируется, по меньшей мере, одно состояние в тестируемом образце и если, по меньшей мере, одно состояние детектируется, то человеку-субъекту выбирается и необязательно назначается режим лечения, включающий эффективное количество фолат-содержащего соединения.
88. Способ выбора режима лечения для субъекта с депрессией, включающий:
а. получение тестируемого образца из человека, диагностированного как страдающего от депрессии;
b. осуществление на тестируемом образце, по меньшей мере, одного анализа для определения параметров, по меньшей мере, двух биомаркеров, где параметры указанных, по меньшей мере, двух биомаркеров, включают следующие:
i. генотип SNP-локуса в положении 677 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 7 (идентифицированного по rs1801133), где SEQ ID NO. 1 и SEQ ID NO. 7 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR);
ii. генотип SNP-локуса в положении 2756 в SEQ ID NO. 2 или положение 27 в SEQ ID NO. 9 (идентифицированного по rs1805087), где SEQ ID NO. 2 и SEQ ID NO. 9 каждая независимо являются частью геномной нуклеотидной последовательности метионинсинтазы (MTR); и
с. определение из определенных параметров указанных, по меньшей мере, двух биомаркеров, наличия, по меньшей мере, одного состояния из следующих или их комбинации:
i. SNP в положении 677 в SEQ ID NO. 1, содержащий, по меньшей мере, один аллель с тимином «Т»;
ii. SNP в положении 2756 в SEQ ID NO. 2, содержащий, по меньшей мере, один аллель с гуанином «G»;
d. получение результата на выходе, излагающего, что если детектируется, по меньшей мере, одно состояние в тестируемом образце, и если, по меньшей мере, одно состояние или оба детектируется, то человеку-субъекту выбирается и не обязательно назначается режим лечения, включающий эффективное количество фолат-содержащего соединения.
89. Способ по абзацу 88, в котором тестируемый образец дополнительно подвергается определению параметра, по меньшей мере, одного из следующих биомаркеров или любых их комбинаций:
i. генотип локуса SNP при rs2274976 (положение 1793 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 8), где SEQ ID NO. 1 и SEQ ID NO. 8 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR);
ii. генотип SNP-локуса в положении 66 в SEQ ID NO. 3 или в положении 27 в SEQ ID NO. 10 (идентифицированного по rs1801394), где SEQ ID NO. 3 и SEQ ID NO. 10 каждая независимо являются частью геномной нуклеотидной последовательности редуктазы метионинсинтазы (MTRR);
iii. генотип SNP-локуса в rs1006737 (положение 27 в SEQ ID NO. 11), где SEQ ID NO. 11 является частью геномной нуклеотидной последовательности альфа 1C субъединицы потенциалзависимого кальциевого канала L типа (CACNA1C);
iv. генотип SNP-локуса в rs1883729 (положение 27 в SEQ ID NO. 12), где SEQ ID NO. 12 является частью геномной нуклеотидной ДНК-последовательности (цитозин-5)-метилтрансферазы 3 бета (DNMT3B);
v. генотип SNP-локуса в rs7163862 (положение 27 в SEQ ID NO. 13), где SEQ ID NO. 13 является частью геномной нуклеотидной последовательности белка-регулятора обратной связи GTP-циклогидролазы 1 (GCHFR);
vi. генотип SNP-локуса в rs12659 (положение 27 в SEQ ID NO. 14), где SEQ ID NO. 14 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF2);
vii. генотип SNP-локуса в rs202676 (положение 27 в SEQ ID NO. 15), где SEQ ID NO. 15 является частью геномной нуклеотидной последовательности фолатгидролазы (простата-специфического мембранного антигена) 1 (FOLH1);
viii. генотип SNP-локуса в rs2297291 (положение 27 в SEQ ID NO. 16), где SEQ ID NO. 16 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF1);
ix. генотип SNP-локуса в rs1051266 (положение 27 в SEQ ID NO. 17), где SEQ ID NO. 17 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF1);
х. генотип SNP-локуса в rs8007267 (положение 27 в SEQ ID NO. 18), где SEQ ID NO. 18 является частью геномной нуклеотидной последовательности GTP циклогидролазы 1 (GCH1);
xi. генотип SNP-локуса в rs7639752 (положение 27 в SEQ ID NO. 19), где SEQ ID NO. 19 является частью геномной нуклеотидной последовательности холин-фосфат цитидилтрансферазы A (PCYT1A);
xii. генотип SNP-локуса в rs6275 (положение 27 в SEQ ID NO. 20), где SEQ ID NO. 20 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xiii. генотип SNP-локуса в rs1079596 (положение 27 в SEQ ID NO. 21), где SEQ ID NO. 21 представляет собой участок геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xiv. генотип SNP-локуса в rs11240594 (положение 27 в SEQ ID NO. 22), где SEQ ID NO. 22 представляет собой участок геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
xv. генотип SNP-локуса в rs4633 (положение 27 в SEQ ID NO. 23), где SEQ ID NO. 23 является частью геномной нуклеотидной последовательности катехол-O-метилтрансферазы (СОМТ);
xvi. генотип SNP-локуса в rs4680 (положение 27 в SEQ ID NO. 24), где SEQ ID NO. 24 представляет собой участок геномной нуклеотидной последовательности катехин-O-метилтрансферазы (СОМТ);
xvii. генотип SNP-локуса в rs250682 (положение 27 в SEQ ID.NO. 25), где SEQ ID NO. 25 является частью геномной нуклеотидной последовательности 3 представителя 6 семейства переносчиков растворенных веществ (транспортер нейротрансмиттера допамина) (SLC6A3);
xviii. генотип SNP-локуса в rs2277820 (положение 27 в SEQ ID NO. 26), где SEQ ID NO. 26 является частью геномной нуклеотидной последовательности формиминотрансферазы циклодеаминазы (FTCD);
xix. генотип SNP-локуса в rs2236225 (положение 27 в SEQ ID NO. 27), где SEQ ID NO. 27 является частью геномной нуклеотидной последовательности метилентетрагидрофолат дегидрогеназы (NADP + зависимой) 1 (MTHFD1);
хх. экспрессия SAM и SAH;
xxi. экспрессия 4-HNE; и
xxii. экспрессия hsCRP.
90. Способ абзаца 89 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
i. SNP в rs2274976 (положение 1793 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 8), содержащего, по меньшей мере, один аллель с аланином «А»;
ii. SNP в положении 66 в SEQ ID NO. 3 или положении 27 в SEQ ID NO. 10, содержащего, по меньшей мере, один аллель с гуанином «G»;
iii. SNP в rs1006737 (положение 27 в SEQ ID NO. 11), содержащего, по меньшей мере, один аллель с аланином «А»;
iv. SNP в rs1883729 (положение 27 в SEQ ID NO. 12), содержащего, по меньшей мере, один аллель с аланином «А»;
v. SNP в rs7163862 (положение 27 в SEQ ID NO. 13), содержащего, по меньшей мере, один аллель с тимином «Т»;
vi. SNP в rs12659 (положение 27 в SEQ ID NO. 14), содержащего, по меньшей мере, один аллель с тимином «Т»;
vii. SNP в rs202676 (положение 27 в SEQ ID NO. 15), содержащего, по меньшей мере, один аллель с гуанином «G»;
viii. SNP в rs2297291 (положение 27 в SEQ ID NO. 16), содержащего, по меньшей мере, один аллель с аланином «А»;
ix. SNP в rs1051266 (положение 27 в SEQ ID NO. 17), содержащего, по меньшей мере, один аллель с аланином «А»;
х. SNP в rs8007267 (положение 27 в SEQ ID NO. 18), содержащего, по меньшей мере, один аллель с тимином «Т»;
xi. SNP в rs7639752 (положение 27 в SEQ ID NO. 19), содержащего, по меньшей мере, один аллель с аланином «А»;
xii. SNP в rs6275 (положение 27 в SEQ ID NO. 20), содержащего, по меньшей мере, один аллель с тимином «Т»;
xiii. SNP в rs1079596 (положение 27 в SEQ ID NO. 21), содержащего, по меньшей мере, один аллель с тимином «Т»;
xiv. SNP в rs11240594 (положение 27 в SEQ ID NO. 22), содержащего, по меньшей мере, один аллель с аланином «А»;
xv. SNP в rs4633 (положение 27 в SEQ ID NO. 23), содержащего, по меньшей мере, один аллель с цитозином «С»;
xvi. SNP в rs4680 (положение 27 в SEQ ID NO. 24), содержащего, по меньшей мере, один аллель с гуанином «G»;
xvii. SNP в rs250682 (положение 27 в SEQ ID NO. 25), содержащего, по меньшей мере, один аллель с цитозином «С»;
xviii. SNP в rs2277820 (положение 27 в SEQ ID NO. 26), содержащего, по меньшей мере, один аллель с тимином «Т»; и
xix. SNP в rs2236225 (положение 27 в SEQ ID NO. 27), содержащего, по меньшей мере, один аллель с аланином «А»;
xx. соотношение экспрессии SAM к SAH меньше, чем предварительно определенное эталонное соотношение;
xxi. экспрессия 4-HNE больше, чем предварительно определенное эталонное значение; и
xxii. экспрессия hsCRP больше чем около 2,3 мг на литр плазмы, измеренная в образце плазмы.
91. Способ по любому из предшествующих абзацев, в котором предварительно определенное эталонное значение составляет около 3,0 мг на литр, измеренное в образце плазмы.
92. Способ по любому из предшествующих абзацев, в котором предварительно определенное эталонное значение составляет около 3,2 мг на литр, измеренное в образце плазмы.
93. Способ по любому из предшествующих абзацев, в котором стадия (b) дополнительно включает необязательную упаковку и доставку тестируемого образца в центр тестирования.
94. Способ по абзацу 93, в котором центр тестирования является третьесторонним сертифицированным CLIA поставщиком услуг.
95. Способ по любому из предшествующих абзацев, в котором стадия (d) осуществляется искусственным устройством.
96. Способ по любому из предшествующих абзацев, дополнительно включающий определение того, страдает ли субъект ожирением (например, путем измерения значения BMI субъекта).
97. Способ по любому из предшествующих абзацев, в котором определены, по меньшей мере, три из параметров вышеупомянутых биомаркеров.
98. Способ по любому из предшествующих абзацев, в котором депрессия является большим депрессивным расстройством.
99. Фолат-содержащая композиция для применения при лечении депрессии у человека, который несет, по меньшей мере, один из следующих однонуклеотидных полиморфизмов или их комбинацию:
а. по меньшей мере, один аллель с тимином «Т» в SNP677, где SNP677 находится в положении 677 в SEQ ID NO. 1 или положении 27 в SEQ ID NO. 7 (идентифицированного по rs1801133), где SEQ ID NO. 1 и SEQ ID NO. 7 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR); и
b. и, по меньшей мере, один аллель с гуанин «G» в SNP2756, где SNP2756 находится в положении 2756 в SEQ ID NO. 2 или положении 27 в SEQ ID NO. 9 (идентифицированного по rs1805087), где SEQ ID NO. 2 и SEQ ID NO. 9 каждая независимо являются частью геномной нуклеотидной последовательности метионинсинтазы (MTR).
100. Фолат-содержащая композиция для применения при лечении депрессии у человека, который несет, по меньшей мере, одно из следующих состояний или их комбинацию:
а. по меньшей мере, один аллель с тимином «Т» в локусе SNP в положении 677 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 7 (идентифицированного по rs1801133), где SEQ ID NO. 1 и SEQ ID NO. 7 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR);
b. по меньшей мере, один аллель с аланином «А» в локусе SNP в rs2274976 (положение 1793 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 8), где SEQ ID NO. 1 и SEQ ID NO. 8 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолат-редуктазы (MTHFR);
с. по меньшей мере, один аллель с гуанином «G» в локусе SNP в положении 2756 в SEQ ID NO. 2 или положении 27 в SEQ ID NO. 9 (идентифицированного по rs1805087), где SEQ ID NO. 2 и SEQ ID NO. 9 каждая независимо являются частью геномной нуклеотидной последовательности метионинсинтазы (MTR); и
d. по меньшей мере, один аллель с гуанином «G» в локусе SNP в положении 66 в SEQ ID NO. 3 или в положении 27 в SEQ ID NO. 10 (идентифицированного по rs1801394), где SEQ ID NO. 3 и SEQ ID NO. 10 каждая независимо являются частью геномной нуклеотидной последовательности редуктазы метионинсинтазы (MTRR);
е. по меньшей мере, один аллель с аланином «А» в локусе SNP в rs1006737 (положение 27 в SEQ ID NO. 11, где SEQ ID NO. 11 является частью геномной нуклеотидной последовательности альфа 1C субъединицы потенциалзависимого кальциевого канала L типа (CACNA1C));
f. по меньшей мере. один аллель с аланином «А» в локусе SNP в rs18 83 729 (положение 27 в SEQ ID NO. 12, где SEQ ID NO. 12 является частью геномной нуклеотидной ДНК-последовательности (цитозин-5)-метилтрансферазы 3 бета (DNMT3B));
g. по меньшей мере, один аллель с тимином «Т» в локусе SNP в rs7163862 (положение 27 в SEQ ID NO. 13, где SEQ ID NO. 13 является частью геномной нуклеотидной последовательности белка-регулятора обратной связи GTP-циклогидролазы 1 (GCHFR));
h. по меньшей мере, один аллель с тимином «Т» в локусе SNP в rs12659 (положение 27 в SEQ ID NO. 14, где SEQ ID NO. 14 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF2));
i. по меньшей мере, один аллель с гуанином «G» в локусе SNP в rs202676 (положение 27 в SEQ ID NO. 15, где SEQ ID NO. 15 является частью геномной нуклеотидной последовательности, фолатгидролазы (простат-специфического мембранного антигена) 1 (FOLH1));
j. по меньшей мере, один аллель с аланином «А» в локусе SNP в rs2297291 (положение 27 в SEQ ID NO. 16, где SEQ ID NO. 16 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF1));
k. по меньшей мере, один аллель с аланином «А» в локусе SNP в rs1051266 (положение 27 в SEQ ID NO. 17, где SEQ ID NO. 17 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF1));
l. по меньшей мере, один аллель с тимином «Т» в локусе SNP в rs8007267 (положение 27 в SEQ ID NO. 18, где SEQ ID NO. 18 является частью геномной нуклеотидной последовательности GTP циклогидролазы 1 (GCH1));
m. по меньшей мере, один аллель с аланином «А» в локусе SNP в rs7639752 (положение 27 в SEQ ID NO. 19, где SEQ ID NO. 19 является частью геномной нуклеотидной последовательности холин-фосфат цитидилтрансферазы A (PCYT1A));
n. по меньшей мере, один аллель с тимином «Т» в локусе SNP в rs6275 (положение 27 в SEQ ID NO. 20, где SEQ ID NO. 20 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2));
о. по меньшей мере, один аллель с тимином «Т» в локусе SNP в rs1079596 (положение 27 в SEQ ID NO. 21, где SEQ ID NO. 21 представляет собой участок геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2));
р. по меньшей мере, один аллель с аланином «А» в локусе SNP в rs11240594 (положение 27 в SEQ ID NO. 22, где SEQ ID NO. 22 представляет собой участок геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2));
q. по меньшей мере, один аллель с цитозином «С» в локусе SNP в rs4633 (положение 27 в SEQ ID NO. 23, где SEQ ID NO. 23 является частью геномной нуклеотидной последовательности катехол-O-метилтрансферазы (СОМТ));
r. по меньшей мере, один аллель с гуанином «G» в локусе SNP в rs4680 (положение 27 в SEQ ID NO. 24, где SEQ ID NO. 24 представляет собой участок геномной нуклеотидной последовательности катехин-O-метилтрансферазы (СОМТ));
s. по меньшей мере, один аллель с цитозином «С» в локусе SNP в rs250682 (положение 27 в SEQ ID NO. 25, где SEQ ID NO. 25 является частью геномной нуклеотидной последовательности 3 представителя 6 семейства переносчиков растворенных веществ (транспортер нейротрансмиттера допамина) (SLC6A3));
t. по меньшей мере, один аллель с тимином «Т» в локусе SNP в rs2277820 (положение 27 в SEQ ID NO. 26, где SEQ ID NO. 26 является частью геномной нуклеотидной последовательности формиминотрансферазы циклодеаминазы (FTCD)); и
u. по меньшей мере, один аллель с аланином «А» в локусе SNP в rs2236225 (положение 27 в SEQ ID NO. 27, где SEQ ID NO. 27 является частью геномной нуклеотидной последовательности метилентетрагидрофолат дегидрогеназы (NADP + зависимой) 1 (MTHFD1));
v. ожирение (например, определенное по значению BMI, равному 30 кг/м2 или больше));
w. соотношение экспрессии SAM к SAH меньше, чем предварительно определенное эталонное соотношение;
х. экспрессия 4-HNE больше, чем предварительно определенное эталонное значение; и
y. экспрессия hsCRP больше чем около 2,3 мг на литр плазмы, измеренная в образце плазмы.
101. Фолат-содержащая композиция в комбинации с антидепрессантом для применения при лечении депрессии у человека, который несет, по меньшей мере, один из следующих однонуклеотидных полиморфизмов или их комбинацию:
a. SNP677 в положении 677 в SEQ ID NO. 1 или в положении 27 в SEQ ID NO. 7 (идентифицированного по rs1801133), включающего, по меньшей мере, один аллель с тимином «Т»; и
b. SNP2756 в положении 2756 в SEQ ID NO. 2 или в положении 27 в SEQ ID NO. 9 содержащего, по меньшей мере, один аллель с гуанином «G».
102. Фолат-содержащая композиция в комбинации с антидепрессантом для применения при лечении депрессии у человека, который несет, по меньшей мере, одно из следующих состояний или любую их комбинацию:
а. по меньшей мере, один аллель с тимином «Т» в локусе SNP в положении 677 в SEQ ID NO. 1 или положение 27 в SEQ ID NO. 7 (идентифицированного по rs1801133), где SEQ ID NO. 1 и SEQ ID NO. 7 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR);
b. по меньшей мере, один аллель с аланином «А» в локусе SNP в rs2274976 (положение 1793 в SEQ ID NO. 1 или положении 27 в SEQ ID NO. 8), где SEQ ID NO. 1 и SEQ ID NO. 8 каждая независимо являются частью геномной нуклеотидной последовательности метилентетрагидрофолат-редуктазы (MTHFR);
с. по меньшей мере, один аллель с гуанином «G» в локусе SNP в положении 2756 в SEQ ID NO. 2 или в положении 27 в SEQ ID NO. 9 (идентифицированного по rs1805087), где SEQ ID NO. 2 и SEQ ID NO. 9 каждая независимо являются частью геномной нуклеотидной последовательности метионинсинтазы (MTR); и
d. по меньшей мере, один аллель с гуанином «G» в локусе SNP в положении 66 в SEQ ID NO. 3 или в положении 27 в SEQ ID NO. 10 (идентифицированного по rs1801394), где SEQ ID NO. 3 и SEQ ID NO. 10 каждая независимо являются частью геномной нуклеотидной последовательности редуктазы метионинсинтазы (MTRR);
е. по меньшей мере, один аллель с аланином «А» в локусе SNP в rs1006737 (положение 27 в SEQ ID NO. 11), где SEQ ID NO. 11 является частью геномной нуклеотидной последовательности альфа 1C субъединицы потенциалзависимого кальциевого канала L типа (CACNA1C);
f. по меньшей мере, один аллель с аланином «А» в локусе SNP в rs1883729 (положение 27 в SEQ ID NO. 12), где SEQ ID NO. 12 является частью геномной нуклеотидной ДНК-последовательности (цитозин 5)-метилтрансферазы 3 бета (DNMT3B);
g. по меньшей мере, один аллель с тимином «Т» в локусе SNP в rs7163862 (положение 27 в SEQ ID NO. 13), где SEQ ID NO. 13 является частью геномной нуклеотидной последовательности белка-регулятора обратной связи GTP-циклогидролазы 1 (GCHFR);
h. по меньшей мере, один аллель с тимином «Т» в локусе SNP в rs12659 (положение 27 в SEQ ID NO. 14), где SEQ ID NO. 14 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF2);
i. по меньшей мере, один аллель с гуанином «G» в локусе SNP в rs202676 (положение 27 в SEQ ID NO. 15), где SEQ ID NO. 15 является частью геномной нуклеотидной последовательности фолатгидролазы (простат-специфического мембранного антигена) 1 (FOLH1);
j. по меньшей мере, один аллель с аланином «А» в локусе SNP в rs2297291 (положение 27 в SEQ ID NO. 16), где SEQ ID NO. 16 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF1);
k. по меньшей мере, один аллель с аланином «А» в локусе SNP в rs1051266 (положение 27 в SEQ ID NO. 17), где SEQ ID NO. 17 является частью геномной нуклеотидной последовательности белка-переносчика восстановленного фолата (RCF1);
l. по меньшей мере, один аллель с тимином «Т» в локусе SNP в rs8007267 (положение 27 в SEQ ID NO. 18), где SEQ ID NO. 18 является частью геномной нуклеотидной последовательности GTP циклогидролазы 1 (GCH1);
m. по меньшей мере, один аллель с аланином «А» в локусе SNP в rs7639752 (положение 27 в SEQ ID NO. 19), где SEQ ID NO. 19 является частью геномной нуклеотидной последовательности холин-фосфат цитидилтрансферазы A (PCYT1A);
n. по меньшей мере, один аллель с тимином «Т» в локусе SNP в rs6275 (положение 27 в SEQ ID NO. 20), где SEQ ID NO. 20 является частью геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
о. по меньшей мере, один аллель с тимином «Т» в локусе SNP в rs1079596 (положение 27 в SEQ ID NO. 21), где SEQ ID NO. 21 представляет собой участок геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
p. по меньшей мере, один аллель с аланином «А» в локусе SNP в rs11240594 (положение 27 в SEQ ID NO. 22), где SEQ ID NO. 22 представляет собой участок геномной нуклеотидной последовательности допаминового рецептора D2 (DRD2);
q. по меньшей мере, один аллель с цитозином «С» в локусе SNP в rs4633 (положение 27 в SEQ ID NO. 23), где SEQ ID NO. 23 является частью геномной нуклеотидной последовательности катехол-O-метилтрансферазы (СОМТ);
r. по меньшей мере, один аллель с гуанином «G» в локусе SNP в rs4680 (положение 27 в SEQ ID NO. 24), где SEQ ID NO. 24 представляет собой участок геномной нуклеотидной последовательности катехин-O-метилтрансферазы (СОМТ);
s. по меньшей мере, один аллель с цитозином «С» в локусе SNP в rs250682 (положение 27 в SEQ ID NO. 25), где SEQ ID NO. 25 является частью геномной нуклеотидной последовательности 3 представителя 6 семейства переносчиков растворенных веществ (транспортер нейротрансмиттера допамина) (SLC6A3);
t. по меньшей мере, один аллель с тимином «Т» в локусе SNP в rs2277820 (положение 27 в SEQ ID NO. 26), где SEQ ID NO. 26 является частью геномной нуклеотидной последовательности формиминотрансферазы циклодеаминазы (FTCD); и
u. по меньшей мере, один аллель с аланином «А» в локусе SNP в rs2236225 (положение 27 в SEQ ID NO. 27), где SEQ ID NO. 27 является частью геномной нуклеотидной последовательности метилентетрагидрофолат дегидрогеназы (NADP + зависимой) 1 (MTHFD1);
v. ожирение (например, определенное по значению BMI, равному 30 кг/м2 или больше);
w. соотношение экспрессии SAM к SAH меньше, чем предварительно определенное эталонное соотношение;
x. экспрессия 4-HNE больше, чем предварительно определенное эталонное значение; и
y. экспрессия hsCRP больше чем около 2,3 мг на литр плазмы, измеренная в образце плазмы.
103. Композиция по любому из предшествующих абзацев, в которой фолат-содержащая композиция включает, по меньшей мере, около 5 мг фолата.
104. Композиция по любому из предшествующих абзацев, в которой фолат-содержащая композиция включает около 7,5-50 мг фолата.
105. Композиция по любому из предшествующих абзацев, в которой фолат-содержащая композиция дополнительно включает предварительно определенный профиль высвобождения.
106. Композиция по абзацу 105, в которой предварительно определенный профиль высвобождения включает профиль замедленного высвобождения.
107. Композиция по абзацу 106, в которой замедленное высвобождение является постоянным высвобождением.
108. Композиция по абзацу 105, в которой предварительно определенный профиль высвобождения включает профиль пульсирующего высвобождения.
109. Композиция по абзацу 105, в которой предварительно определенный профиль высвобождения включает профиль с время-контролируемым высвобождением.
110. Композиция по любому из абзацев 105-109, в которой фолат-содержащая композиция составлена для высвобождения, по меньшей мере, 30% фолат-содержащего соединения в течение периода, по меньшей мере, около 3-6 часов, после введения композиции.
111. Композиция по любому из предшествующих абзацев, в которой депрессия является большим депрессивным расстройством.
Некоторые избранные определения
Для удобства здесь собраны определенные термины, применяемые во всей заявке (включая, описание примеры, и прилагаемую формулу изобретения). Если иное не определено, все технические и научные термины, использованные здесь, имеют те же смыслы, которые вкладываются в них обычным специалистом области, к которой принадлежит данное изобретение.
Следует принять к сведению, что это изобретение не ограничивается описанными здесь конкретными методологией, протоколами и реактивами, и по этой причине может варьировать. Использованная в данном документе терминология необходима только для целей описания конкретных воплощений, и не предназначена для ограничения объема настоящего изобретения, который будет ограничен только прилагаемой формулой изобретения.
Следует принять к сведению, что за исключением текущих примеров, или где в ином случае указано, все числа, выражающие количества ингредиентов или реакционных состояний, использованных в данном документе, во всех случаях является модифицированными термином «около». Термин около, при использовании в описании настоящего изобретения, в сочетании с процентами означает ± 1%.
В одном аспекте, настоящее изобретение относится к описанным в данном документе композициям, способам и их соответствующему компоненту(ам), как существенным для изобретения, тем не менее открыто для включения неопределенных элементов, существенных или нет («включающий»). В некоторых воплощениях, другие элементы, которые будут включены в описание композиции, способ или его соответствующий компонент ограничены теми, которые существенно не влияют на основу и новую характеристику(и) изобретения («по существу состоящий из»). Это относится равным образом к стадиям в описанном способе, а также к композициям и их компонентам. В других воплощениях, изобретения, композиции, способы и соответствующие их компоненты, описанные в данном документе, предназначены для исключения любого элемента, который не считается существенным элементом компонента, композиции или способа («состоящий из»).
Все патенты, патентные публикации и публикации, идентифицированные и специально включенные в данный документ ссылкой, для целей описания и раскрытия, например, методологии, описанные в таких публикациях, которые могут быть использованы в связи с настоящим изобретением. Эти публикации представлены исключительно для их раскрытия до даты подачи настоящей заявки. Ничто в связи с этим не должно быть истолковано как признание того, что изобретение не имеет право датировать более ранним числом такие раскрытия посредством предшествующего изобретения. Все заявления относительно даты или представление относительно содержания этих документов основаны на информации, доступной для заявителей и не представляют собой какое-либо признание относительно правильности дат или содержания этих документов.
Термин «адъювант» при использовании в данном документе относится к любому агенту или сущности, которая повышает эффект другого агента или сущности. В определенных воплощениях термин «адъювант» используется в данном документе в ссылке на фолат-содержащее соединение для увеличения или усиления эффекта (например, эффективности и/или терапевтического эффекта) антидепрессантного лекарственного средства.
При использовании в данном документе термин «полиглутаматы» относится к фолатам, которые имеют, по меньшей мере, две или большее количество глутаматных групп.
Термин «производное» при использовании в данном документе относится к химическому веществу, сходному структурно с другим, т.е. «оригинальным» веществом, которое может называться «родительским» веществом. «Производное» может быть сделано из структурно-сходного родительского соединения в одну или большее количество стадий. В некоторых воплощениях общие физические и химические свойства производного могут быть схожими с родительским соединением или отличаться от них.
При использовании в данном документе, термин «изомер» относится к соединениям, имеющим такую же молекулярную массу, но отличающимся по структуре. Изомеры, которые отличаются только в конфигурации и/или конформации относятся к «стереоизомерам». Термин «изомер» также используется для ссылки на энантиомер.
Термин «энантиомер» используется для описания одного из пары молекулярных изомеров, который является зеркальным отражением другого и не совпадающим при наложении. Другие термины, используемые для обозначения или ссылки на энантиомеры, включают «стереоизомеры» (из-за различного расположения или стереохимии вокруг хирального центра; хотя все энантиомеры являются стереоизомерами, не все стереоизомеры являются энантиомерами) или «оптическими изомерами» (из-за оптической активности чистых энантиомеров, которая является способностью различных чистых энантиомеров вращать плоско поляризованный свет в различных направлениях). Энантиомеры в общем имеют идентичные физические свойства, такие как температуры плавления и температуры кипения, и также имеют идентичные спектроскопические свойства. Энантиомеры могут отличаться друг от друга по их взаимодействию с плоско поляризованным светом и по биологической активности.
Обозначения «R» и «S» используются для обозначения абсолютной конфигурации молекулы около их хирального центра(ов). Данные обозначения могут появляться как префикс или как суффикс; они могут быть или могут не быть разделены от изомеров с помощью дефиса; они могут или могут не быть разделены дефисом; и они могут или могут не быть окружены круглыми скобками. Обозначения или префиксы «(+) и (-)» используются для обозначения знака вращения плоскополяризованного света соединением, причем (-) обозначает, что соединение является левовращающим (вращает влево). Соединение с префиксом (+) является правовращающим (вращает вправо).
Термин «рацемическая смесь» относится к смеси двух энантиомеров одного соединения, в любом соотношении. Идеальная рацемическая смесь является 50:50 смесью обоих энантиомеров соединения, так что оптическое вращение (+) энантиомера компенсирует оптическое вращение (-) энантиомера.
Термин «нуклеиновая кислота» хорошо известен в данной области. «Нуклеиновая кислота» при использовании в данном документе, в общем, относится к молекуле (т.е. цепи) ДНК, РНК или их производного или аналога, содержащего нуклеиновое основание. Нуклеиновое основание включает, например, естественное пуриновое или пиримидиновое основание, обнаруживаемое в ДНК (например, аденин «А», гуанин «G» тимин «Т» или цитозин «С») или в РНК (например, А, G, урацил «U» или С). Термин «нуклеиновая кислота» охватывает термины «олигонуклеотид» и «полинуклеотид», каждый как подрод термина «нуклеиновая кислота». Термин «олигонуклеотид» относится к молекуле между около 3 и около 100 нуклеотидных оснований в длину. Термин «полинуклеотид» относится, по меньшей мере, к одной молекуле больше чем около 100 нуклеотидных оснований в длину.
Термин «последовательность нуклеиновой кислоты» относится к одно- или двухцепочечному полимеру деоксирибонуклеотидных или рибонуклеотидных оснований, считываемых от 5'- к 3'-концу. Термин включает хромосомную ДНК, самореплицирующиеся плазмиды, инфекционные полимеры ДНК или РНК, и ДНК или РНК, которые осуществляют главным образом структурную роль. «Последовательность нуклеиновой кислоты» также относится к упорядоченному перечню сокращений, букв, символов или слов, которые представляют нуклеотиды. В одном воплощении нуклеиновая кислота может быть «зондом», который является относительно короткой нуклеиновой кислотой, как правило, меньшей чем 100 нуклеотидов в длину.
Термин «олигонуклеотид», при использовании в данном документе, относится к праймерам и зондам, описанным в данном документе, и определяется как молекула нуклеиновой кислоты, которая содержит, по меньшей мере, два или большее количество рибо- или деоксирибонуклеотидов. Точный размер олигонуклеотида будет зависеть от различных факторов и от конкретного применения или использования олигонуклеотида. Термин «зонд» при использовании в данном документе, относится к олигонуклеотиду, полинуклеотиду или нуклеиновой кислоте, либо РНК, либо ДНК, как естественно полученной в виде очищенного гидролизата рестрикционных ферментов или полученной синтетически, которая способна отжигаться с или специфически гибридизоваться с нуклеиновой кислоты с последовательностями, комплементарными зонду. Зонд может быть либо одноцепочечным, либо двухцепочечным. Точная длина зонда будет зависеть от множества факторов, включая температуру, источник зонда и использованный способ. Например, для диагностических применений, в зависимости от сложности целевой последовательности, олигонуклеотидный зонд, как правило, содержит 15-25 или большее количество нуклеотидов, хотя он может содержать меньшее количество нуклеотидов. Зонды, как описано в данном документе, выбраны так, чтобы быть фактически комплементарными различным цепям различным цепям конкретной целевой нуклеотидной последовательности. Это означает, что зонды должны быть достаточно комплементарными с тем, чтобы быть способным «специфически гибридизоваться» или отжигаться с их соответствующими целевыми цепями. Следовательно, последовательность зонда не должна точно отражать комплементарную последовательность мишени. Например, некомплементарный нуклеотидный фрагмент может быть прикреплен к 5' или 3' концу зонда, с оставшейся последовательностью зонда, являющейся комплементарной целевой последовательности. В ином случае некомплементарные основания или более длинные последовательности могут быть рассеяны по зонду, при условии, что последовательность зонда значимо комплементарна последовательности целевой нуклеиновой кислоты для специфического отжига на ней.
В контексте некоторых воплощений различных аспектов, описанных в данном документе, термин «зонд» относится к молекуле, которая может детектируемо распознавать цель среди молекул, различающихся по структуре (например, нуклеотидной или белковой последовательности). Детекция может быть завершена множеством различных путей, в зависимости от типа используемого зонда и типа целевой последовательности. Таким образом, например, детекция может быть основана на дискриминации по детекции специфического связывания. Примеры такого специфического связывания включают связывание антитела и нуклеиновой кислоты связывание антитела с белком, связывание нуклеиновой кислоты с нуклеиновой кислотой, или связывание аптамера с белком или нуклеиновой кислотой. Таким образом, например, зонды могут включать ферментные субстраты, антитела и антительные фрагменты и предпочтительно нуклеотидные гибридизационные зонды.
Термин «специфически гибридизоваться» относится к ассоциации между двумя одноцепочечными нуклеотидными молекулами соответствующей комплементарной последовательности для обеспечения такой гибридизации в заранее определенных условиях, как правило, применяемых в данной области (иногда последовательности обозначаются как «фактически комплементарные»). В частности, термин «специфически гибридизоваться» также относится к гибридизации олигонуклеотида с фактически комплементарной последовательностью по сравнению с некомплементарной последовательностью.
Термин «специфически» при использовании в данном документе со ссылкой на зонд, который используется для специфической детекции различия в последовательности, относится к зонду, который идентифицирует конкретное различие в последовательности на основании исключительной гибридизации с различием в последовательности в жестких условиях гибридизации и/или исключительной амплификации или репликации различия в последовательности.
В самом широком смысле, термин «фактически» при использовании в данном документе в отношении «фактически комплементарный» или когда используется в данном документе в отношении нуклеотидной последовательности в отношении к эталонной или целевой нуклеотидной последовательности, означает нуклеотидную последовательность, имеющую процент идентичности между фактическим комплементарной нуклеотидной последовательностью и полностью комплементарной последовательностью эталонной или целевой нуклеотидной последовательностью, по меньшей мере, 60%, по меньшей мере, 70%, по меньшей мере, 80% или 85%, по меньшей мере, 90%, по меньшей мере, 93%, по меньшей мере, 95% или 96%, по меньшей мере, 97% или 98%, по меньшей мере, 99% или 100% (последнее эквивалентно термину «идентичный» в данном контексте). Например, идентичность оценивается по участку длиной, по меньшей мере, 10 нуклеотидов, или, по меньшей мере, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22 или вплоть до 50 нуклеотидов всей длины нуклеотидной последовательности с эталонной последовательностью (если не указано иное ниже). Сравнение последовательностей может быть проведено с использованием GAP анализа по умолчанию в GCG Университета Висконсина, в приложении SEQWEB из GAP, основанном на алгоритме Нидлмана и Вунша Needleman and Wunsch (1970) J Mol. Biol. 48: 443-453; как определено выше). Нуклеотидная последовательность «фактически комплементарная» эталонной нуклеотидной последовательности гибридизуется с эталонной нуклеотидной последовательностью в условиях пониженной жесткости, предпочтительно в условиях средней жесткости, наиболее предпочтительно в условиях высокой жесткости.
В самом широком смысле термин «фактически идентичная» при использовании в данном документе в отношении нуклеотидной последовательности, означает, что нуклеотидная последовательность, соответствующая эталонной или целевой нуклеотидной последовательности, в которой процент идентичности между фактически идентичной нуклеотидной последовательностью составляет, по меньшей мере, 60%, по меньшей мере, 70%, по меньшей мере, 80% или 85%, по меньшей мере, 90%, по меньшей мере, 93%, по меньшей мере, 95% или 96%, по меньшей мере, 97% или 98%, по меньшей мере, 99% или 100% (последнее эквивалентно термину «идентичный» в данном контексте). Например, идентичность оценивается на участке длиной 10-22 нуклеотида, такой как, по меньшей мере, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22 или вплоть до 50 нуклеотидов последовательности нуклеиновой кислоты с эталонной последовательностью (если ниже не указано иное). Сравнение последовательностей проводится с использованием GAP анализа по умолчанию в GCG Университета Висконсина, в приложении SEQWEB из GAP, основанном на алгоритме Нидлмана и Вунша Needleman and Wunsch (1970) J Mol. Biol. 48: 443-453; как определено выше). Нуклеотидная последовательность «фактически идентичная» эталонной нуклеотидной последовательности, гибридизуется с полностью комплементарной последовательностью эталонной нуклеотидной последовательности (т.е. она соответствует цепи в двухцепочечной молекуле) в условиях пониженной жесткости, предпочтительно в условиях средней жесткости, наиболее предпочтительно в условиях высокой жесткости. Гомологии специфической нуклеотидной последовательности включают нуклеотидные последовательности, которые кодируют аминокислотную последовательность, которая является, по меньшей мере, на 24% идентичной, на 35% идентичной, на 50% идентичной, на 65% идентичной, эталонной аминокислотной последовательности, при измерении с помощью параметров, описанных выше, где аминокислотная последовательность кодируется гомологом, который имеет такую же биологическую активность, что и белок, кодируемый специфическим нуклеотидом. Термин «фактически неидентичный» относится к нуклеотидной последовательности, которая не гибридизуется с последовательностью нуклеиновой кислоты в жестких условиях. Термин «фактически идентичный» при использовании в данном документе в отношении полипептида означает белок, соответствующий эталонному полипептиду, где полипептид имеет фактически такую же структуру и функцию, что и эталонный белок, например, когда изменения в аминокислотной последовательности не влияют на функцию полипептида. При использовании в отношении полипептида или аминокислотной последовательности, процент идентичности между фактически похожим и эталонным полипептидом или аминокислотной последовательностью составляет, по меньшей мере, 24%, по меньшей мере, 30%, по меньшей мере, 45%, по меньшей мере, 60%, по меньшей мере, 75%, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 99%, с использованием параметров по молчанию GAP анализа, как описано выше. Гомологи являются аминокислотными последовательностями, которые, по меньшей мере, на 24% идентичны, более предпочтительно, по меньшей мере, на 35%, еще более предпочтительно, по меньшей мере, па 50% идентичны, еще более предпочтительно идентичны; по меньшей мере, на 65%, эталонному полипептиду или аминокислотной последовательности, что измерено с помощью параметров, описанных выше, где аминокислотная последовательность кодируемая гомологом имеет такую же биологическую активность, что и эталонный полипептид.
Термин «праймер» при использовании в данном документе относится к олигонуклеотиду либо РНК либо ДНК, либо одноцепочечному либо двухцепочечному, либо полученному из биологической системы, образованному расщеплением рестрикционными ферментами, либо полученному синтетически, который, при помещении в соответствующее окружение, способен функционировать в качестве инициатора зависимого от матрицы синтеза нуклеиновой кислоты. В присутствии соответствующей нуклеотидной матрицы подходящего предшественников-нуклеозид трифосфатов нуклеиновых кислот, фермента полимеразы, подходящих кофакторов и состояний, таких как подходящая температура и pH, праймер может быть удлинен по своему 3'-концу путем добавления нуклеозидов под действием полимеразы или схожей активности для получения продукта удлинения праймера. Праймер может варьировать по длине в зависимости от конкретных состояний и требований применения. Например, в диагностических применения олигонуклеотидный праймер, как правило, имеет 15-25 или более нуклеотидов в длину. Праймер должен быть достаточно комплементарным искомой матрице для праймирования синтеза искомого продукта удлинения, то есть должен быть способным отжигаться с цепью искомой матрицы так, чтобы обеспечить 3' гидроксильную группу праймера в соответствующем непосредственном расположении для применения в инициации синтеза полимеразой или схожим ферментом. Не требуется, чтобы последовательность праймера являлась полностью комплементарной искомой матрице. Например, некомплементарная нуклеотидная последовательность может быть прикреплена к 5'-концу в остальном комплементарного праймера. В ином случае не комплементарные основания могут быть вставлены в последовательность олигонуклеотидного праймера, при условии, что праймерная последовательность достаточно комплементарна последовательности цепи искомой матрицы для функционального обеспечения комплекса матрица-праймер для синтеза продукта удлинения.
Термин «комплементарно» или «комплементарная последовательность» при использовании в данном документе относится к широкой концепции комплементарности последовательностей между участками двух цепей нуклеиновых кислот или между двумя участками одной и той же цепи нуклеиной кислоты. Известно, что остаток аденина участка первой нуклеиновой кислоты способе формировать специфические водородные связи («спаривание оснований») с остатком участка второй нуклеиновой кислоты, которая является антипараллельной первому участку, если остаток является тимином или урацилом. Подобным образом, известно, что остаток цитозина цепи первой нуклеиновой кислоты способен спариваться с остатком цепи второй нуклеиновой кислоты, которая является антипараллельной первой цепи, если остаток является гуанином. Первая область нуклеиновой кислоты является комплементарной второй области такой же или другой нуклеиновой кислоты, если (когда оба участка расположены антипараллельным образом), по меньшей мере, один нуклеотидный остаток первого участка способен спариваться с остатком второго участка. Предпочтительно, если первый участок содержит первую часть, а второй участок содержит вторую часть, тем самым, когда первая и вторая части располагаются антипараллельным образом, так чтобы, по меньшей мере, около 50%, и предпочтительно, по меньшей мере, около 75%, по меньшей мере, около 90%, или, по меньшей мере, около 95%, или, по меньшей мере, около 100%, нуклеотидных остатков первой части способны спариваться с нуклеотидными остатками второй части. Более предпочтительно, если все нуклеотидные остатки первой части способны спариваться с нуклеотидными остатками второй части.
Термины «вариант», «вариация», «мутация» или «полиморфизм» используются в данном документе взаимозаменяемо, и относятся к различию в последовательности нуклеиновой кислоты среди представителей популяции индивидуумов. Полиморфизмы могут иногда называться «однонуклеотидным полиморфизмом» или «SNP», если они варьируют в одиночном нуклеотиде. В некоторых воплощениях полиморфизмы могут быть синонимичными или антисмысловыми. Синонимичные полиморфизмы, при наличии в кодируем участке или некодирующем участке, как правило, не приводят к замене аминокислоты, но могут привести к изменению стабильности мРНК или измененным альтернативным участкам сплайсинга. Антисмысловой полиморфизм, при наличии в кодирующей области, может привести к изменению одного или нескольких кодонов, что приводит к аминокислотной замене в аминокислотной цепи. Такие мутации и полиморфизмы могут быть либо гетерозиготными, либо гомозиготными в пределах индивидуума. Гомозиготные индивидуумы имеют идентичные аллели по одному или нескольким соответствующим локусам на гомологичных хромосомах, тогда как гетерозиготные индивидуумы имеет два различных аллеля в одном или нескольких соответствующих локусах на гомологичных хромосомах. Полиморфизм, таким образом, считается «аллельным», в том отношении, что из-за существования полиморфизма некоторые представители вида, несут ген с одной последовательностью (например, нормальный аллель или аллель дикого типа), тогда как другие представители могут, иметь измененную последовательность (например, вариантный или мутантный аллель).
Термин «генотип» относится к специфической аллельной композиции целой клетки или определенного гена, тогда как термин «фенотип» относится к детектируемым внешним проявлениям специфического генотипа.
Термин «аллель», при использовании в данном документе, относится к представителю пары различных форм гена. При использовании в данном документе аллели относятся к кодирующим и некодирующим последовательностям. Аллели занимают один и тот же локус или расположение на гомологичных хромосомах. Если субъект имеет два идентичных аллеля гена, то считается, что субъект гомозиготен по гену или аллелю. если субъект имеет два различных аллеля гена, считается, что субъект гетерозиготен по гену. Аллели конкретного гена могут отличаться друг от друга в одиночном нуклеотиде, или нескольких нуклеотидах, и могут включать замены, делеции и вставки нуклеотидов. Аллель гена также может быть формой гена, содержащего мутацию.
При использовании в данном документе термин «вводить» относится к помещению композиции в субъект способом или путем, который приводит, по меньшей мере, к частичной локализации композиции в искомом участке, так что вырабатывается искомый эффект. Пути введения подходящие для способов, описанных в данной области могут включать как местное, так и системное введение. В общем, местное введение приводит к более высокому количеству антидепрессанта (например, SSRI) и/или фолат-содержащего соединения доставленному в конкретное место (например, серотониновые рецепторы в центральной и/или периферической нервных системах) по сравнению со всем организмом субъекта, тогда как системное введение приводит к доставке антидепрессанта (например, SSRI) и/или фолат-содержащего соединения фактически по всему организму субъекта. В некоторых воплощениях композиции, описанные в данном документе, вводятся субъектам с депрессией перорально. В других воплощениях композиции, описанные в данном документе, могут быть введены субъектам с депрессией с помощью инъекции.
ПРИМЕРЫ
Примеры, представленные в данном документе, частично относятся к применению фолат-содержащего соединения, например, 6(S)-5-MTHF, отдельно или в качестве вспомогательного средства к антидепрессантному лекарственному средству для лечения пациента с депрессией, например, большого депрессивного расстройства (MDD). Примеры, представленные в данном документе, также относятся к способам идентификации генетических полиморфизмов, периферических биомаркеров и клинических признаков, вовлеченных в отбор пациентов с депрессией для получения фолат-содержащего соединения, например, в качестве вспомогательного лечения к антидепрессантному лекарственному средству, например, селективному ингибитору обратного захвата серотонина (SSRI). По всей данной заявке даны ссылки на различные публикации. Описания всех публикаций и тех источников, которые процитированы в этих публикациях во всей полноте настоящим включены ссылкой в данную заявку в целях более полного описания уровня техники, к которому принадлежит данное изобретение. Следующие примеры не предназначены для ограничения объема изобретения, но скорее приведены в качестве примера определенных воплощений. Любые вариации примерных способов, которые могут прийти на ум специалисту в данной области, подпадают под объем притязаний настоящего изобретения.
Пример 1. Двойное слепое плацебо-контролируемое исследование фолат-содержащего соединения среди SSRI-устойчивых амбулаторных пациентов с большим депрессивным расстройством (MDD)
Примерный дизайн исследования
Используя последовательный параллельный дизайн [51] (см., например, Фиг. 1А-1В и 2), 60-дневная, двойная слепая обработка, либо введение фолат-содержащего соединения (например, 6(S)-5-MTHF) или плацебо в дополнение к SSRI, может быть разделена на две фазы по 30 дней каждая, с оценками, осуществляемыми каждые 10 дней. В ходе первой фазы двойного слепого лечения, пациенты, подходящие для участия в исследовании, могут быть рандомизированы на 30 дней лечения либо 6(S)-5-MTHF (15 мг/день) (n=19) или плацебо (n=56), с соотношением 2:3:3 для случайного назначения последовательностей лечения лекарственное средство/лекарственное средство (в отношении 6(S)-5-MTHF), плацебо/плацебо и плацебо/лекарственное средство. К примеру, если существует 10% частота отсева в ходе первой фазы, 50 пациентов на плацебо завершили бы первую 30 дневную фазу, 17 пациентов на 15 мг/день 6(S)-5-MTHF завершили бы первую фазу. Пациенты рандомизированно назначенные в последовательность лекарственное средство/лекарственное средство оставались на той же дозе 6(S)-5-MTHF (15 мг/день) в течение второй фазы, вне зависимости от того, был или нет ответ у пациентов в течение первой фазы. Для рандомизированно назначенных в последовательность плацебо/плацебо, как продемонстрировавшие ответ, так и не продемонстрировавшие ответ на плацебо в течение первой фазы (n=25) остались на плацебо в течение второй фазы. С другой стороны, для рандомизированно назначенных в последовательность плацебо/лекарственное средство, как продемонстрировавшие ответ, так и не продемонстрировавшие ответ на плацебо в течение первой фазы (n=25) перешли на получение 15 мг/день 6(S)-5-MTHF в течение второй фазы. В некоторых воплощениях некоторые обработанные плацебо пациенты (например, около 27% обработанных плацебо пациентов) могут отвечать в ходе первой фазы, и что часть оставшихся не отвечавших на плацебо (например, около 9% не отвечавших на плацебо) в ходе первой фазы могут иметь ответ в течение второй фазы, тогда как большая часть обработанных 6(S)-5-MTHF пациентов (например, около 48% пациентов, обработанных 6(S)-5-MTHF) может отвечать в ходе первой фазы, и что часть не отвечавших на плацебо (например, около 35% не ответивших на плацебо) в течение первой фазы могут иметь ответ на 15 мг/день 6(S)-5-MTHF в течение второй фазы. Данные из предшествующего двойного слепого плацебо-контролируемого исследования (Испытание 1) могут быть объединены в текущем исследовании (Испытание 2) для обеспечения более точной оценки размера эффекта плацебо, со средневзвешенным значением из двух Фаз 1 (одна из Испытания 1 и одна из Испытания 2) и двух Фаз 2 (одна из Испытания 1 и одна из Испытания 2). С 149 пациентами, рандомизированными на плацебо в течение фазы 1 или оставшимися на плацебо в течение фазы 2 после отсутствия ответа на плацебо в Испытании 1; и с пациентами, рандомизированными на плацебо в течение фазы 1 (n=56) или оставшимися на плацебо в течение фазы 2 после отсутствия ответа на плацебо в Испытании 2 (n=18) в Испытании 2, и средневзвешенная частота ответа примерно 19% в течение всего периода Испытаний 1 и 2 (общее n=222); и пациенты, рандомизированные на 15 мг/день 6(S)-5-MTHF в течение фазы 1 (n=19) или 15 мг/день 6(S)-5-MTHF в течение фазы 2 после отсутствия ответа на плацебо (n=18) и средневзвешенная частота ответа примерно 41,5% (всего n=37) в Испытании 2, статистическая мощность для демонстрации различия лекарственное средство-плацебо в частотах ответа больше чем 0,8.
Выбор субъектов
Критерии включения: (1) Возраст 18-65; (2) письменное информированное согласие; (3) соответствие критериям DSM-IV (по структурированному клиническому интервью для DSM-IV - SCID-I/P) для MDD, текущие пациенты; (4) Быстрый Опросник Депрессивной Симптоматики - самостоятельная оценка (QIDS-SR) [52] балл, по меньшей мере, 12 при исходных посещениях и посещениях для обследования; (5) Пациенты, получавшие SSRI в адекватных дозах, например, как показано в таблице 1 (определено как 20 мг/день или более из флуоксетина, циталопрама, пароксетина или 10 мг/день или больше эсциталопрама и 50 мг/день или более сертралина) в ходе текущего эпизода в течение не менее 8 недель; и (6) Во время первого визита, пациенты должны быть на стабильной дозе SSRI в течение последних 4 недель.
В некоторых воплощениях 40% пациентов, выбранных для исследования в испытании 2, были на начальных дозах. В некоторых воплощениях, 90% пациентов, выбранных для исследования испытания 2, не доходили до максимального значения в диапазоне терапевтических доз.
|
Критерии исключения: (1) Беременные женщины или женщины детородного возраста, которые не использовали приемлемые с медицинской точки зрения средства контрацепции (включая оральный контрацептив или имплантат, презерватив, диафрагму, спермициды, внутриматочные средства, перевязку маточных труб, или партнера с вазэктомией); (2) Пациенты, которые больше не соответствуют критериям DSM-IV для MDD в течение базового визита; (3) Пациенты, которые демонстрируют более 25%-ное снижение симптомов депрессии, что отражается на общем балле QIDS-SR - показатели осмотра к с базовым показателям; (4) Пациенты с серьезным риском самоубийства или убийства, по оценке врача; (5) Пациенты с нестабильной соматическими заболеваниями, включая сердечнососудистые заболевания, заболевания печени, почек, дыхательной, эндокринной, нервной систем, или гематологические заболевания; (6) Пациенты со следующими диагнозами DSM-IV: токсикомания, активная в течение последних шести месяцев, любое биполярное расстройство (в настоящем или прошлом), любое психотическое расстройство (в настоящем или прошлом); (7) Пациенты с историей эпилепсии или клиническими признаками нелеченного гипотиреоза; (8) Пациенты, которым требуются исключенные лекарства (подробности см. в таблице 2); (9) Пациенты с психотическими признаками в текущем эпизоде или историей психотических признаков, по оценке SCID; (10) Пациенты с предварительным ростом MTHF, или непереносимостью MTHF в любой дозе; (11) Пациенты с любым исследуемым психотропным препаратом в течение последних 3 месяцев; (12) Пациенты, которые не прошли более чем на 2 испытания адекватного антидепрессанта в течение Большого Депрессивного эпизода. Некоторые примеры адекватной дозировки испытания антидепрессанта включают либо больше чем 150 мг имипрамина (или его трициклического эквивалента), больше чем 60 мг фенелзина (или его эквивалента ингибитора моноаминоксидазы), больше чем 20 мг флуоксетина (или его SSRI-эквивалента), больше чем 150 мг бупропиона, больше чем 300 мг тразодона (нефазодона), или больше чем 150 мг венлафаксина. Испытание адекватной продолжительности был определено как испытание, в течение которого пациент был на том или ином антидепрессанте в адекватной дозе в течение минимум 6 недель; и (13) Пациенты с историей гипомании, индуцированной антидепрессантами.
Участие и характеристики обследуемых людей: Все участвовало 75 индивидуумов с MDD в возрасте 18-65 лет. Люди были стабильны с медицинской точки зрения, что было определено по протоколу, описанному в данном документе. Пациенты, исключенные из исследования включают пациентов с острым риском самоубийства, злоупотреблением активными веществами или зависимостями, со средней депрессией, неадекватно обработанные SSRI или те, которые не прошли более чем 2 испытания, те, которые получали MTHF для лечения депрессии в прошлом, и те, у которые страдают от психоза или биполярного расстройства. Пациенты в возрасте младше 18 лет или старше 65 лет также были исключены.
Лекарственные средства, разрешаемые или исключаемые как сопутствующая лекарственная терапия в ходе исследования.
Лекарственные средства, которые могут быть даны пациенту, включают любые прописанные средства или средства, продаваемые без рецепта, такие как аспирин, ацетаминофен и средства от насморка и кашля, которые специально не исключены протоколом. Пациенты, нуждающиеся в сопутствующей лекарственной терапии исключенными лекарственными средствами, исключены из исследования. В Таблице 2 показан перечень лекарственных средств, разрешенных (Y) и не разрешенных (N) в качестве сопутствующей лекарственной терапии. Некоторые классы лекарственных средств в Таблице 2 имеют числовые значения в скобках, что указывает на дополнительные примечания, показанные ниже.
|
(1) Бензодиазепиновые анксиолитики и небензодиазепиновые снотворные и успокоительные, отмеченные выше, разрешаются только, если пациенты находились на стабильном режиме приема, по меньшей мере, за 2 недели до исходного уровня, в дозах, не превышающих их эквивалент: клоназепам 1,0 ежедневно и золпидем 10 мг ежечасно.
(2) Пациенты должны были обработаны до начала исследования адекватными дозами SSRI (например, минимальные дозы: флуоксетина/пароксетина/циталопрама 20 мг/день, эсциталопрама 10 мг/день, сертралина 50 мг/день) в течение, по меньшей мере, 8 недель только при отсутствии ответа. Они должны быть на SSRI в момент включения в исследование, и они, должно быть на текущей дозе, по меньшей мере, за 4 недели до первого визита. Пациенты должны также согласиться продолжать осуществлять свое лечение SSRI в той же дозе во время лечения с помощью 6(S)-5-MTHF. Если пациенты также принимают другие психотропные препараты, они, должны принимать текущую дозу психотропных лекарственных средств в течение, по меньшей мере, 4 недель, и они также должны согласиться продолжать осуществлять свое лечение в той же дозе во время лечения с помощью 6(S)-5-MTHF.
(3) Пропранолол, метопролол, ацебутолол, резерпин, клонидин и алдомет исключены.
(4) Адекватное восстановление щитовидной железы, которое было стабильно в течение 6 месяцев и более, является приемлемым, как и замена эстрогена для женщин в постменопаузе или использование оральных контрацептивов, инициирование которых не совпадает с началом или обострением депрессии.
(5) Стандартные поливитамины с или без минеральных веществ разрешены (с не более чем 400 мкг фолиевой кислоты и 6 мкг В12) если их прием начат, по меньшей мере, за 12 месяцев до первого визита. Диетические добавки с предполагаемой активностью в ЦНС, исключены, в том числе SAMe, зверобой, DHEA, инозит, Гинкго билоба и Омега-3-жирные кислоты, включая DHA и льняное масло.
Зачисление субъектов
Семьдесят пять субъектов вошли в двойное слепое лечение на 12 месяцев (Испытание 2, Общее количество участников в Испытаниях 1 и 2 равно 225). Данное испытание проводилось в соответствии с рекомендациями FDA. Письменное информированное согласие было получено от всех пациентов до проведения процедур, определенных протоколом. Субъекты получены в основном из амбулаторной выборки пациентов с MDD, диагностированных с помощью структурированного клинического интервью для расстройств «DSM-IV Расстройства I Оси - Редакция для Пациентов (SCID-I/P)». В начале исследования, субъекты должны соответствовать критериям SCID для депрессивного эпизода, и иметь балл QIDS-SR не менее 12 при первом визите и визите скрининга. Кроме того, их текущий основной депрессивный эпизод (MDE) следует рассматривать устойчивым к SSRI: в течение текущего MDE, все пациенты должны получить хотя бы один курс SSRI в адекватной дозе и продолжительности, как это определено в Анкете Ответа на лечение антидепрессантами MGH (MGH-ATR) [53] MGH-ATR определяет адекватное испытание SSRI, как 10 мг или больше эсциталопрама, 20 мг или больше флуоксетина, циталопрама или пароксетина, 50 мг или больше сертралина в течение минимум 6 недель. Кроме того, в ходе первого визита пациенты должны принимать стабильную дозу SSRI в течение последних 4 недель или более.
Процедуры исследования
После того, как пациенты дали согласие на участие в исследовании, подписав документ об информированном согласии, берется полное медицинский и психиатрический анамнез и выполняется врачебный осмотр. Выполняется шкала оценок скрининга. Отобранных и подходящих для участия в исследовании пациентов просят вернуться через две недели после первого визита, когда они рандомизируются на двойное слепое лечение с плацебо или 15 мг/день 6(S)-5-MTHF с дизайном исследования, изложенном выше. Двойная слепая обработка длится 60 дней, в течение которых пациенты наблюдаются каждые 10 дней (Визиты 1-6 Фазы 1 - см. Таблицу 4 ниже). Субъектам присвоены номера рандомизации в последовательном порядке. Перечень рандомизации является перечнем сгенерированных компьютером случайных чисел и поддерживается фармакологом-исследователем. Кроме того, наличие любого побочного эффекта или нежелательных явлений со всеми предосторожностями документируется с помощью SAFTEE-SI [54]. Причины для преждевременного прерывания, включая непереносимые побочные эффекты, записываются.
Все сопутствующие лекарственные терапии, принимаемые в течение исследования, записываются в форме истории болезни, вместе с информацией о дозировке и датами начала и окончания. Пациенты, нуждающиеся в исключенных лекарственных средствах (для подробностей см. Таблицу 2), исключаются из исследования. Организация терапии и клинические рейтинги осуществляются врачами-клиницистами исследования.
Для пациентов рандомизированно назначенных в последовательность лекарственное средство/лекарственное средство, доза 6(S)-5-MTHF составляет 15 мг/день в течение обоих фаз исследования. Для пациентов рандомизированно назначенных в последовательность плацебо/лекарственное средство, доза 6(S)-5-MTHF также составляет 15 мг/день в течение второй фазы исследования. Всех пациентов просят принимать одну таблетку лекарственной терапии слепого исследования утром, в дополнение к их стабильной дозе продолжающегося лечения с помощью SSRI. Каждая таблетка лекарственной терапии исследования либо содержит 15 мг 6(S)-5-MTHF, либо является подобранным плацебо. Следовательно, для пациентов рандомизированно назначенных в последовательность плацебо/плацебо, таблетки лекарственной терапии исследования являются плацебо в течение обоих фаз исследования. Для пациентов, рандомизированно назначенных в последовательность лекарственное средство/лекарственное средство таблетки являются 15 мг 6(S)-5-MTHF в течение обоих фаз исследования. Для пациентов рандомизированно назначенных в последовательность плацебо/лекарственное средство таблетки являются плацебо в течение первой фазы исследования, при этом таблетки являются 15 мг 6(S)-5-MTHF в течение второй фазы исследования.
Субъекты, неспособные переносить лекарственную терапию исследования, исключаются из исследования. Пациенты должны соблюдать режим дозирования и принимать все лекарственные средства, в соответствии с инструкцией. Все пациенты инструктируются по поводу возвращения любого избытка лекарственных средств при каждом визите. Проводится подсчет таблеток в соответствии с записью лекарственного средства исследования. Нарушение протокола определяется как менее чем 80% соответствие счетчику таблеток.
Процедура сбора образцов
Образцы крови необходимо брать у пациентов после ночного голодания. Следующие образцы, как показано в Таблице 3, включены для метаболического тестирования.

Инструкции сбора образцов
Плазма: Около 5 мл крови забирается в пробирку-вакуумтейнер с гепарином натрия. Образцы необходимо центрифугировать в пределах одного часа после сбора при 2000g в течение ~10 минут. Около 2 мл плазмы разделяют на аликвоты в 2 пластиковых флаконах для хранения (~1 мл в каждом). Флаконы метят и замораживают при -80°C.
Сыворотка: Около 5 мл крови забирают в пробирку-вакуумтейнер (обычный красный верх), которая не содержит добавок. Содержащую кровь пробирку оставляют при комнатной температуре в течение около 20 минут и позволят крови свернуться. Затем образец центрифугируют при ~2000g в течение ~10 минут. Примерно 2 мл плазмы разделяют на аликвоты в 2 пластиковых флакона для хранения (~1 мл в каждом). Флаконы метят и замораживают при -20°С или -80°С.
Гемолизат цельной крови: 100 мкл полностью суспендированной гепаринизированной крови точно пипетируют в тестовую пробирку с предварительно изготовленным раствором, с последующим перемешиванием на вибрационном смесителе и замораживанием при -20°С или -80°С.
Цельная кровь: Около 4 мл цельной крови разделяют на аликвоты в 2 пластиковых флакона для хранения (~2 мл в каждом). Флаконы метят и замораживают при -20°С или -80°С.
Измерения эффективности
Любые нейропсихологические тесты могут быть использованы для измерения эффективности ответа пациента, обработанного плацебо или 6(S)-5-MTHF в сочетании с SSRI. Первичная мера эффективности может включать изменение в балле рейтинговой шкалы депрессии Гамильтона из 17 пунктов (HAM-D-17) [55]. В данном исследовании ответ, например, определен как 50% или большее снижение балла HAM-D-17 от исходного уровня. Ремиссия, например, определена как балл HAM-D-17 меньше, чем 8 в конечной точке. Вторичные меры эффективности могут включать изменение в бале CGI-тяжесть заболевания, с «определенным клиническим ответом» в виде CGI-S 1 или 2 в конечной точке. Пациенты с баллом CGI-I больше чем 5 в любой визит после первого или 50 процентное или большее ухудшение депрессивных симптомов от исходного уровня до текущего, выводятся из исследования. Субъекты также выводятся из исследования при любом проявлении, склонности к самоубийству, убийству, мании или психозу. Дополнительные примерные инструменты, которые могут быть введены согласно графику исследования, включают следующее:
(1) Структурированное клиническое интервью для DSM-IV: SCID-I/P, вводимый клиническим врачом, продолжается модулями для диагностики различных расстройств Оси I. Вопросы задаются точно как написано, и каждый основан на индивидуальных критериях из DSM-IV. Ответы, в общем, оцениваются по шкале 1-3 1 = сомнительно, 2 = вероятно, 3 = определенно), и основываются на количестве положительных ответов, диагноз определяется клиническим врачом. Хотя весь SCID-I/P вводится при исследовании, модуль настроения проводят при каждом последующем контрольном визите.
(2) Опросник истории лечения антидепрессантом MGH (MGH-ATR) [53]: В MGH-ATR предлагаются конкретные критерии для адекватной дозы и адекватной длительности испытания, для то что считать провалом, таким образом позволяя клиническим врачам систематически собирать данные с целью оценки степени устойчивости к лечению текущего большого депрессивного эпизода.
(3) Шкала Депрессии Гамильтона из 28 пунктов (HAM-D-28) [55]: Эта версия позволяет выставлять баллы в 17, 21-, 25- и 28-пунктовых шкалах HAM-D. Этот инструмент выполняется клиническим врачом с помощью структурированного интервью и определенных якорных точек, и его целью является количественная оценка степени депрессии в течение последних 7 дней. HAM-D является наиболее широко исследованным инструментом депрессии, и его надежность и достоверность являются высокими.
(4) Общее клиническое впечатление - Тяжесть заболевания и Улучшение (CGI-S, CGI-I): Эти два инструмента оцениваются от 1 до 7 баллов клиническим врачом на основании оценки клинического статуса пациента. Они измеряют на основании истории и баллов других инструментов а) Тяжесть депрессии (CGI-S) и b) Клиническое улучшение (CGI-I). Также используются версии обеих шкал, оцениваемые пациентом (PGI-S/I).
(5) QIDS-SR [52]: Это короткий (из 16 пунктов) опросник по принципу самоотчета основных депрессивных симптомов, таких как сон, подавленные настроение, аппетит, концентрация, суицидальные мысли, интерес, энергия, психомоторная заторможенность и тревожное возбуждение.
(6) Опросник Массачусетского Общего Госпиталя по Когнитивному и Физическому Функционированию: Это краткий (из 7 пунктов) опросник по принципу самоотчета для оценки часто значимых когнитивных симптомов, сонливости и усталости.
(7) Опросник Массачусетского Общего Госпиталя по Сексуальному Функционированию [56]: Это шкала по принципу самоотчета, которая измеряет общие симптомы сексуальной дисфункции, такие как пониженное либидо и трудности оргазма.
(8) Визуальная аналоговая шкала [57]: Это коротка (из 8 пунктов) шкала по принципу самоотчета для измерения болезненных симптомов депрессии в ходе лечения лекарственной терапией исследования (6(S)-5-MTHF) или плацебо.
Измерения безопасности
Как только пациент согласился участвовать в данном исследовании, подписав документ информированного согласия, показатели жизненно важных функций (масса, пульс и кровяное давление стоя и лежа), записываются при каждом посещении, а осмотр осуществляется при скрининге и 6 визите (День 60, или конечная точка Фазы I). Истощающие привычки (например, курение, алкоголь и напитки с кофеином) записываются при первом визите, в День 30, День 60, День 150, День 240, День 330 и День 420 (или в конечной точке) (См. Таблицы 4 и 5 ниже). Тест мочи на беременность (для женщин детородного возраста) также проводится во время визита скрининга и визита 3 (день 30). Беременные женщины не могут быть зачислены в данное исследование.
Кроме того собраны базовые образцы крови для оценки генетического полиморфизма для (i) T677C аллеля метилентетрагидрофолатредуктазы (MTHFR), (ii) А1298С аллеля гена MTHFR, (iii) A66G аллеля гена редуктазы метионинсинтазы и (iv) A2746G аллеля гена метионинсинтазы.
Кроме того, образы крови исходного уровня. Дня 30, День 60 и День 420 (или конечной точки) собирают для измерения фолата плазмы, фолата RBC, гомоцистеина плазмы, витамина В12, ММА (метилмалоновой кислоты), SAMe, асимметричного диметиларгинина (ADMA), малондиальдегида (MDA), 4-гидроксиноненаля (4-HNE), F2-Изопростановы, и высокочувствительного C-реактивного белка (hs-CRP).
Вредные побочные эффекты или случаи
Документация о наличии каких-либо побочных эффектов или нежелательных явлений заполняется при каждом визите с помощью SAFTEE-SI. Субъекты могут контактировать с клиническим врачом в любое время между визитами, по вопросу нежелательных явлений или ухудшения симптомов. Суицидальные мысли оцениваются при каждом визите. Субъекты, которые по ощущениям врача-клинициста исследования имеют высокий риск самоубийства, исключаются из исследования и направляются на госпитализацию для дальнейшего лечения при наличии клинических показаний (см. Таблицы 4 и 5 ниже).
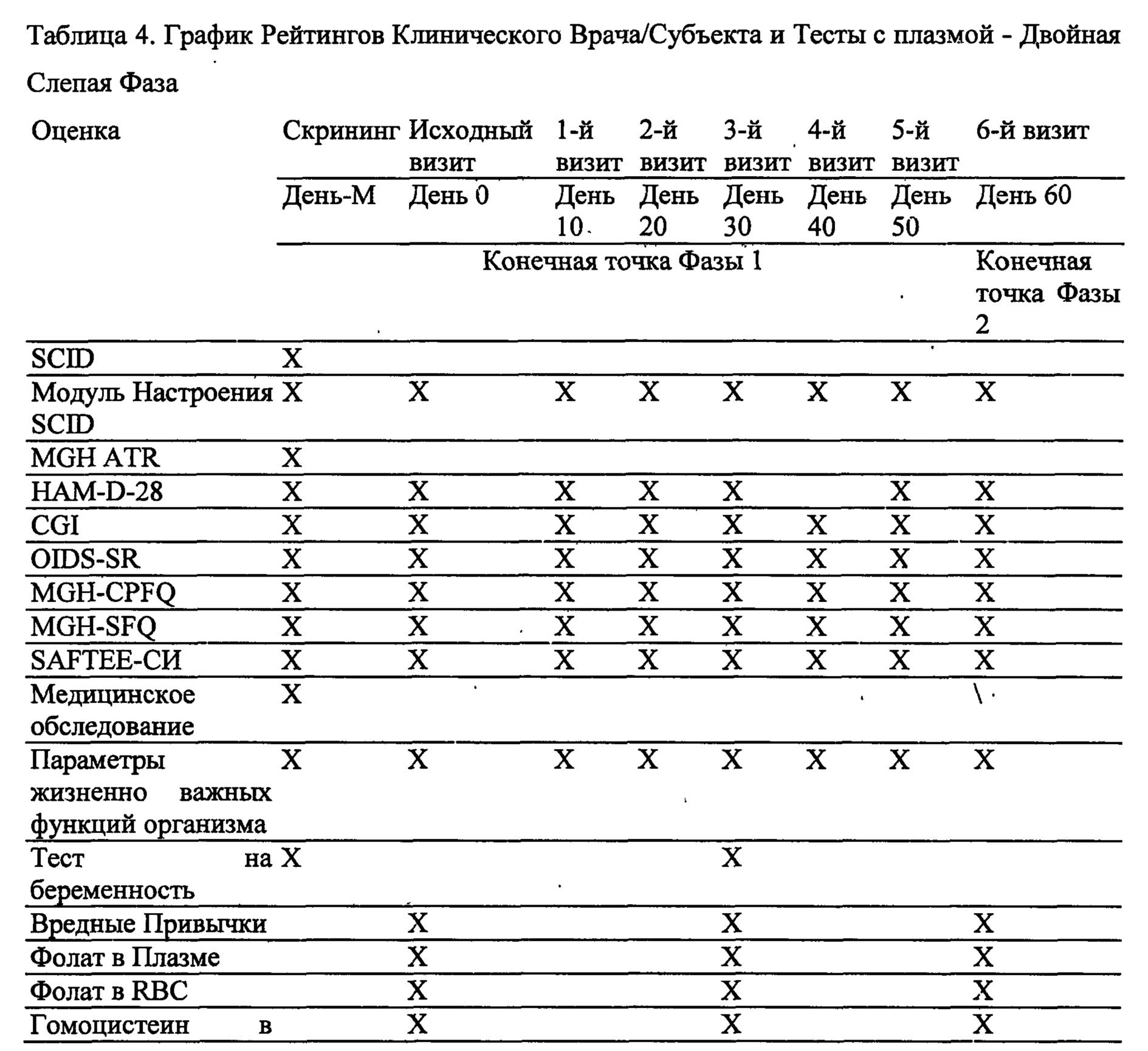

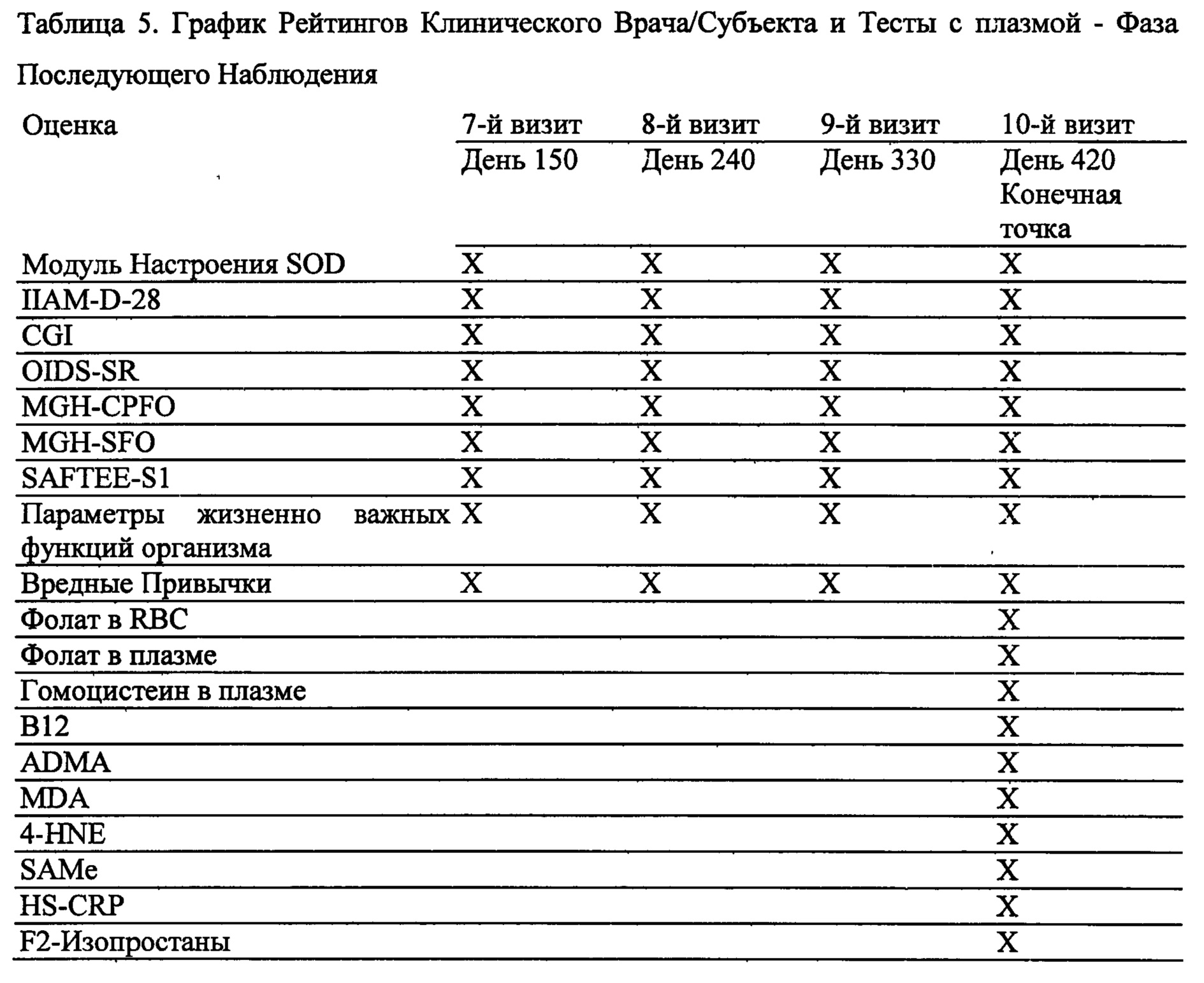
Прекращение
Приемлемые причины для раннего прекращения включают следующие: 1) просьба пациента, 2) решение врача, 3) серьезное нежелательное явление, 4) нарушение протокола, 5) усугубление депрессии или клиническое ухудшение, требующее госпитализации.
Примерное управление данными
Клинические данные в каждый визит записываются с помощью формы стандартизованной оценки клиническим врачом и набора рейтинговых шкал пациента. Отредактированные и исправленные данные добавляют в базу данных, которая готова для использования в качестве входных данных для статистического программного обеспечения (например, STATA) для разработки и анализа данных. Все данные сохранялись в закрытых картотеках. Никаких идентификаторов, отличных от ID исследования не включены в данные. Персонал исследования и субъекты могут иметь возможность ввести клинические данные напрямую в базу данных, с помощью «DatStat IllumeTM», платформы для сбора электронных данных, что упрощает сбор и управление данными, и обеспечивает целостность данных, что приводит к улучшению качества данных. Субъекты и/или исследовательский персонал вводят ответы на опросы в электронные формы оценки, и ответы затем надежно передаются через зашифрованное соединение и сохраняются в базе данных.
Примерные статистические анализы
Общие соображения: Данные вводятся и ошибки проверяются в каждом клиническом участке, включенном в исследование. Персонал исследования и субъекты могут иметь возможность ввести самостоятельные оценки в систему прямо с помощью «DatStat IllumeTM». Процесс ввода данных контролируется персоналом DCRP. После того, как набор данных был введен и проверен, проводились анализы. Как конечный анализ всех пациентов, закончивших испытание, так и анализ в популяции всех пациентов, прошедших рандомизацию, изучающий всех пациентов включенных в исследование, использовались для определения тяжести депрессии в конечной точке. Проверка как закончивших исследование, так и всех рандомизированных пациентов, может дать широкую оценку эффектов лечения в испытаниях такого рода. Данные из Испытания 2 могут быть объединены с данными из Испытания 1 с дизайном последовательного параллельного сравнения, для того, чтобы дать оценку ответу на плацебо на основании большего размера выборки. Согласно аналитическому плану дизайна последовательного параллельного сравнения, эффект активного лечения оценивается с помощью z-балла. При нулевой гипотезе отсутствия различия между лекарственным средством и плацебо, z-балл в среднем равен 0. Пусть p1, q1 являются частотами ответа на первое введение лекарственного средства и плацебо, соответственно, а р2, q2 являются частотами ответа на вторую обработку. Для анализа этих данных использовалась статистика на основе h=w(p1-q1)+(1-w)(p2-q2). Масса (w) и рандомизированная фракция (а) выбираются для максимизации силы теста, на основании альтернативной гипотезы. Рандомизированная фракция (а) может быть включена в расчет р1, q1, р2 и/или q2. Например, умножением общего объема выборки на рандомизированную фракцию(а), для получения знаменателя частоты ответа, например, р1. Стандартная ошибка для h требует специальной формулы, потому что некоторые из пациентов, включенных в оценку р2, q2, включены в оценку p1, q1. Вычисление облегчается с учетом таблицы результатов, где в этом случае р1, р2, q1, q2 имеют теоретические вероятности, а не наблюдаемые относительные частоты. Более подробное описание анализов дано в Fava et al. ссылкой на дизайн последовательного параллельного сравнения [51].
Анализ отсева исследования: Рассчитывается подробный анализ количества и времени вышедших из исследования. Потенциальные различия между группами обработки в отсеявшихся изучаются с помощью точного критерия Фишера; если обнаруживаются даже слабые тенденции (p<0,05), указывающие на дифференциальный отсев, то проводится более подробный анализ выживаемости для того, чтобы проиллюстрировать временной паттерн и величину этих различий. Эти анализы отсева могут быть использованы для лучшего понимания результатов, показанных нижеследующими анализами.
Анализы величины ответов: Величина ответа между двумя группами обработки может быть измерена по уменьшению в исходных баллах HAM-D-17. Однофакторный ковариационный анализ (скорректированный с учетом исходных баллов HAM-D-17) может быть использован для оценки различий в баллах HAM-D-17 в конечной точке, объединяя данные из Испытаний 1 и 2 из обеих фаз с использованием последовательного параллельного дизайна.
Анализ процента ответивших и вернувшихся к ремиссии: Примерным статистическим тестом для анализа различий в доле ответивших на условия лечения является точный критерий Фишера, объединяющий данные из Испытаний 1 и 2 и из обоих фаз с использованием последовательного параллельного дизайна. Логистический регрессионный анализ также может быть проведен, с ответом или отсутствием ответа и ремиссией или отсутствием ремиссии в качестве зависимых переменных, с исходным баллом HAM-D, полом и возрастом, в качестве независимых переменных. Исследовательский ковариационный анализ может быть проведен для исследования любых различий в частотах ремиссии, наблюдаемых в связи с полом, возрастом и другими переменными.
Анализы количества неблагоприятных явлений: Однофакторный дисперсионный анализ может быть использован для оценки различий в общем количестве SAFTEE-SI АЕ между исходным уровнем и конечным уровнем.
Анализы прогностических факторов большей разницы 6(S)-5-MTHF/плацебо в частотах ответа: Уровни фолата классифицируются либо как низкие (<=2,5 нг/мл), либо как нормальные; и уровни гомоцистеина либо как нормальные, либо как повышенные (>=13,2 ммоль/литр). Наличие или отсутствие, по меньшей мере, одного аллеля Т677С гена MTHFR вводится в качестве дихотомической переменной (наличие или отсутствие). 2×2 Дисперсионный анализ (ANOVA) может быть использован для тестирования того, может ли наличие низкого уровня сыворочного фолата прогнозировать большее различие лекарственного средства/плацебо в ответе. С использованием фолата в качестве примерного прогностического фактора, наличие или отсутствие низкого уровня сыворочного фолата вместе с распределением в группы лечения 2×2, факториальный ANOVA, используя балы улучшения депрессии (исходный уровень минус конечный уровень баллов HAM-D-17) в качестве зависимой переменной. Эффект прогностического фактора может быть обозначен эффектом взаимодействия, отражая потенциальный дифференциальный эффект 6(S)-5-MTHF на индивидуумов с низким по сравнению с нормальным фолатом. Подобные анализы (т.е. отдельные 2×2 ANOVA) могут быть выполнены подстановкой наличия низких уровней фолата в присутствии других прогностических факторов, как описано в данном документе. Аналогичным образом, влияние других прогностических факторов может быть обозначено эффектом взаимодействия, представляющего потенциальное модулирующее влияние этих переменных.
Пример 2. Оценка эффективности 6(S)-5-MTHF в качестве стратегии аугментации у пациентов с MDD (Испытание 1)
Используя дизайн исследования и последовательный параллельный дизайн, как описано в Примере 1, 60-дневное многоцентровое плацебо-контролируемое исследование (Испытание 1) эффективности аугментации 6(S)-5-MTHF селективных ингибиторов обратного захвата серотонина было закончено на 148 пациентах с большим депрессивным расстройством (MDD), устойчивым к лечению SSRI. В исследовании принимали участие в общей сложности 148 пациентов с MDD в течение 12 месяцев в 10 медицинских центрах или больницах в Соединенных Штатах. Амбулаторных пациентов, страдающих MDD, лечили либо 7,5 мг/день 6(S)-5-MTHF либо плацебо в качестве адъюванта для SSRI в течение 60 дней с использованием дизайна последовательного параллельного сравнения [51]. В соответствии с последовательным параллельным дизайном [51], 60-ти дневная, двойная слепая обработка была разделена на две фазы по 30 дней каждая, с оценками, выполняемыми каждые 10 дней. Как показано на Фиг. 1А, в течение первой фазы двойной слепой обработки, 148 пациентов, подходящих для исследования, были рандомизированы на 30 дней обработки либо 7,5 мг/день 6(S)-5-MTHF («лекарственное средство») либо плацебо, с соотношением 2:3:3 для случайной оценки последовательностей обработки лекарственное средство/лекарственное средство, плацебо/плацебо и плацебо/лекарственное средство. У пациентов, рандомизированно назначенных в последовательность лекарственное средство/лекарственное средство, доза 6(S)-5-MTHF увеличивалась с 7,5 мг/день до 15 мг/день в течение второй фазы, вне зависимости от того, был (n=12) или нет (n=20) ответ у пациентов в течение первой фазы. Для рандомизированно назначенных в последовательность плацебо/плацебо, как продемонстрировавшие ответ, так и не продемонстрировавшие ответ на плацебо в течение первой фазы остались на плацебо в течение второй фазы. С другой стороны, для рандомизированно назначенных в последовательность плацебо/лекарственное средство, как продемонстрировавшие ответ, так и не продемонстрировавшие ответ на плацебо в течение первой фазы перешли на получение 7,5 мг/день 6(S)-5-MTHF в течение второй фазы.
Данные из Испытания 1, как показано в Таблицах 6-7, говорят о том, что 7,5 мг/день 6(S)-5-MTHF не является эффективной при действии в качестве вспомогательного средства для SSRI. Хотя 6(S)-5-MTHF, кажется, не вызывает никакого неблагоприятного побочного эффекта при введении с SSRI, не было никакого существенного различия в результата эффективности (если судить по различным параметрам, таким как HDRS-17, QIDS-SR и CGI-S) между пациентами MDD, получавших SSRI в сочетании либо с 7,5 мг/день 6(S)-5-MTHF либо плацебо.
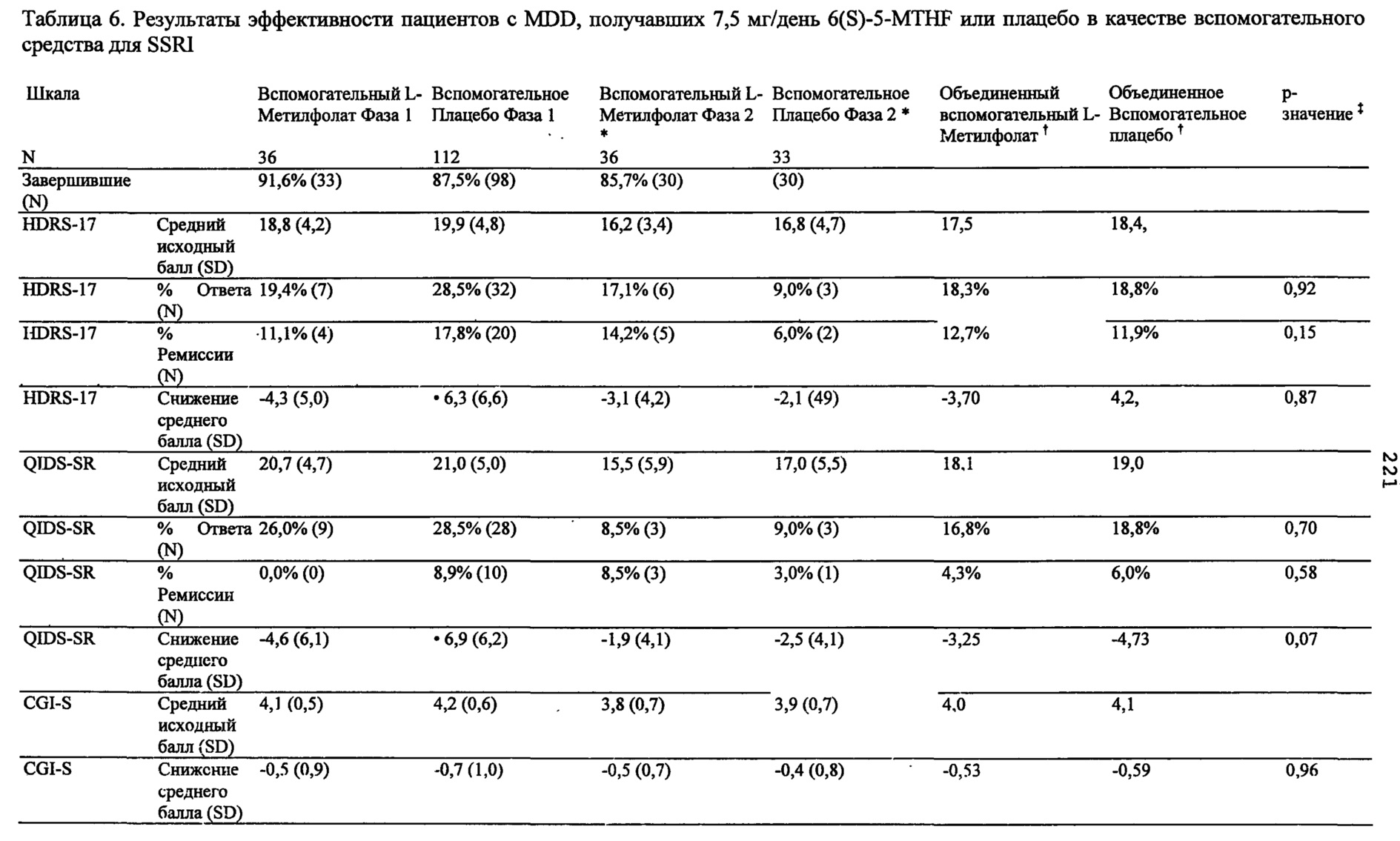

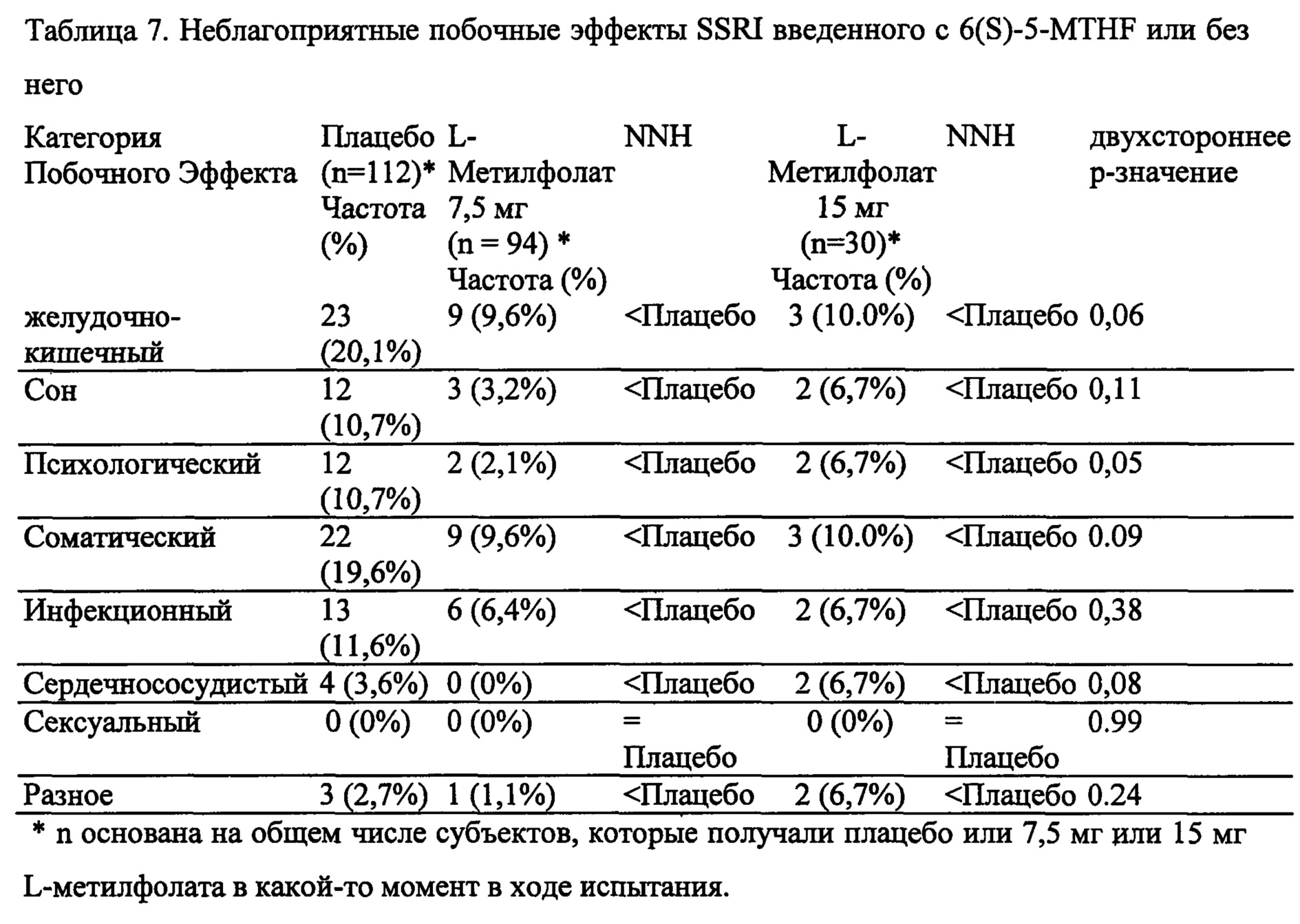
Однако повышение дозы 6(S)-5-MTHF с 7,5 мг/день до 15 мг/день в пациентах, распределенных в последовательность лекарственное средство/лекарственное средство в течение второй фазы продемонстрировало значительное повышение в ответе и частоте ремиссии, например, например, повышение, по меньшей мере, в 2 раза, по сравнению с группой, получавшей плацебо с SSRI (24% против 9%, р=0,1: Такой результат не включен в Таблицу 6. Соответственно, для использования в Испытании 2 была определена более высокая доза аугментации перорального 6(S)-5-MTHF, 15 мг/день.
Пример 3. Оценка эффективности 6(S)-5-MTHF в качестве стратегии аугментации у пациентов с MDD (Испытание 2)
Используя дизайн исследования и последовательный параллельный дизайн, как описано в Примере 1, этот Пример 2 демонстрирует 60-дневное многоцентровое плацебо-контролируемое исследование (Испытание 2) эффективности более высокой дозы (15 мг ежедневно) аугментации пероральным 6(S)-5-MTHF селективных ингибиторов обратного захвата серотонина на 75 пациентах с большим депрессивным расстройством (MDD) устойчивым к лечению SSRI. Дизайн Испытания 2 (как показано на Фиг. 1В) был идентичен Испытанию 1, за исключение того, что дозировка 6(S)-5-MTHF, которая составляла 15 мг/день в течение всего испытания для этих пациентов, распределенных на группу плацебо-лекарственное средство и группу лекарственное средство-лекарственное средство.
Критически важная клиническая цель данного изобретения заключалась в определении, будет ли применение высокой дозы перорального 6(S)-5-MTHF в качестве вспомогательного средства для SSRI более эффективным, чем плацебо в качестве вспомогательного средства для SSRI, при уменьшении депрессивных симптомов у амбулаторных пациентов с MDD с частичным или отсутствующим ответом на лечение SSRI. Дополнительная цель данного исследования заключалась в демонстрации безопасности и переносимости аугментации 15 мг/день 6(S)-5-MTHF. В исследовании принимали участие всего 75 пациентов с MDD в течение 12 месяцев в 6 различных медицинских центрах и больницах в Соединенных Штатах. Амбулаторных пациентов, страдающих MDD, лечили либо 15 мг/день 6(S)-5-MTHF, либо плацебо в течение 60 дней с использованием дизайна последовательного параллельного сравнения [51]. На Фиг. 2 показано фактическое количество закончивших испытание в каждой группе в конце исследования.
На Фиг. 3А показано, что существует статистически значимая разница в проценте ответивших на лечение (50% или большее снижение по HAM-D-17 на конечном уровне) при двух условиях лечения (т.е. SSRI + 15 мг/день 6(S)-5-MTHF против SSRI + плацебо) после 30 дней. С помощью дизайна последовательного параллельного сравнения [51], было определено, что частота ответа выше для группы 6(S)-5-MTHF, чем для группы плацебо, при этом частоту ответа на плацебо оценивали исходя из Испытаний 1 и 2.
На Фиг. 3В показано, что существует статистически значимое различие между двумя условиями лечения (т.е. SSRI + 15 мг/день 6(S)-5-MTHF против SSRI + плацебо) после 30 дней по степени улучшения, что измерено по изменению балла 17-пунктовой Шкале Гамильтона для оценки депрессии (HAM-D-17) от исходного уровня до конечного уровня, QID-SR, или Общее клиническое впечатление - Тяжесть заболевания (CGI-S), с использованием дизайна последовательного параллельного сравнения [51]. С помощью дизайна последовательного параллельного сравнения [51], было определено, что в группе 6(S)-5-MTHF, больше чем в группе плацебо уменьшение баллов HAM-D-17, QIDS-SR и CGI-S, соответственно, при этом изменение на плацебо оценивали исходя из Испытаний 1 и 2.
На Фиг. 3C-3D показано, что нет значимого различия в проценте пациентов с ремиссией (балл HAM-D-17<8 на конечном уровне или балл QIDS-SR≤5 на конечном уровне) при двух условиях лечения (т.е. SSRI + 15 мг/день 6(S)-5-MTHF против SSRI + плацебо) после 30 дней.
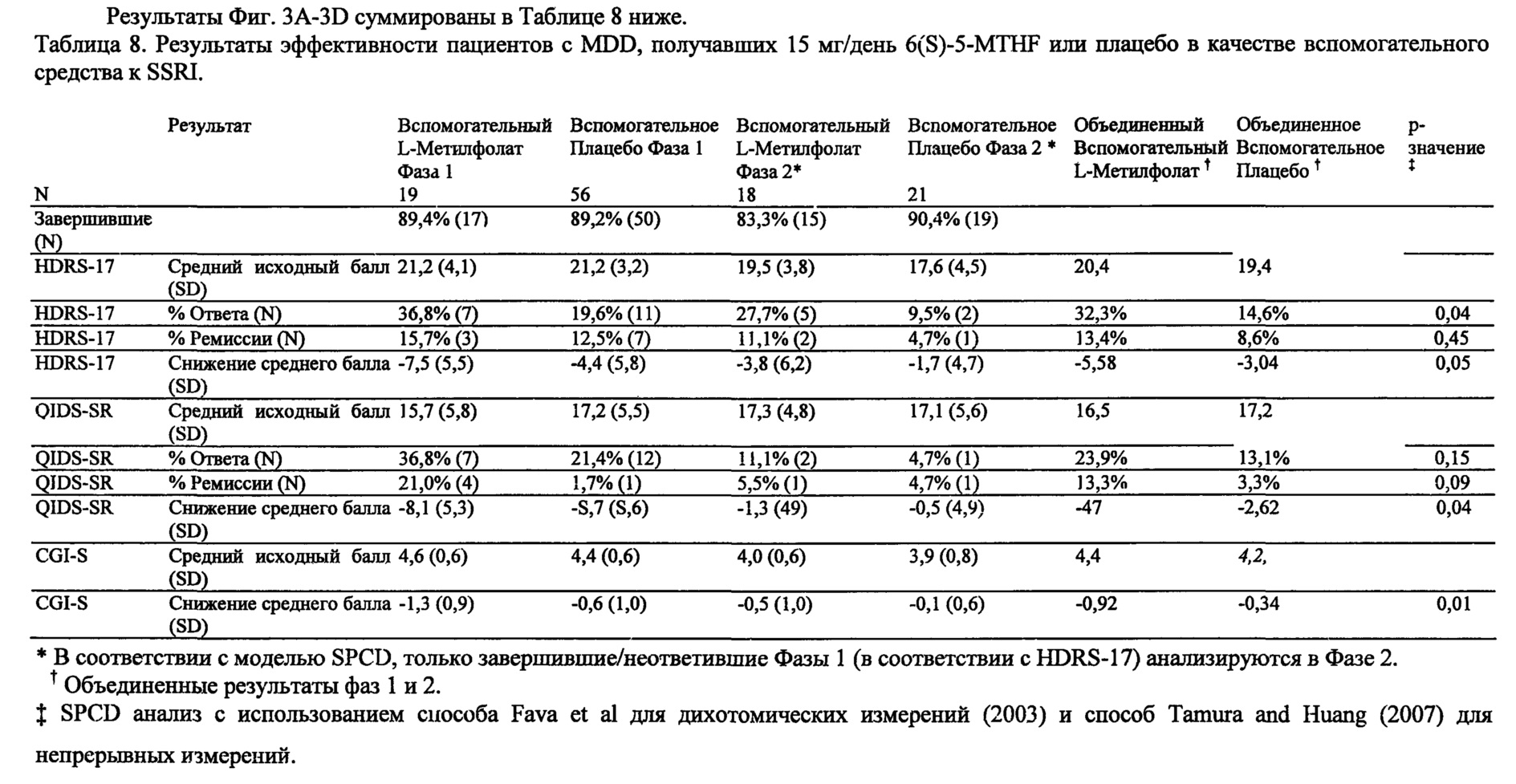
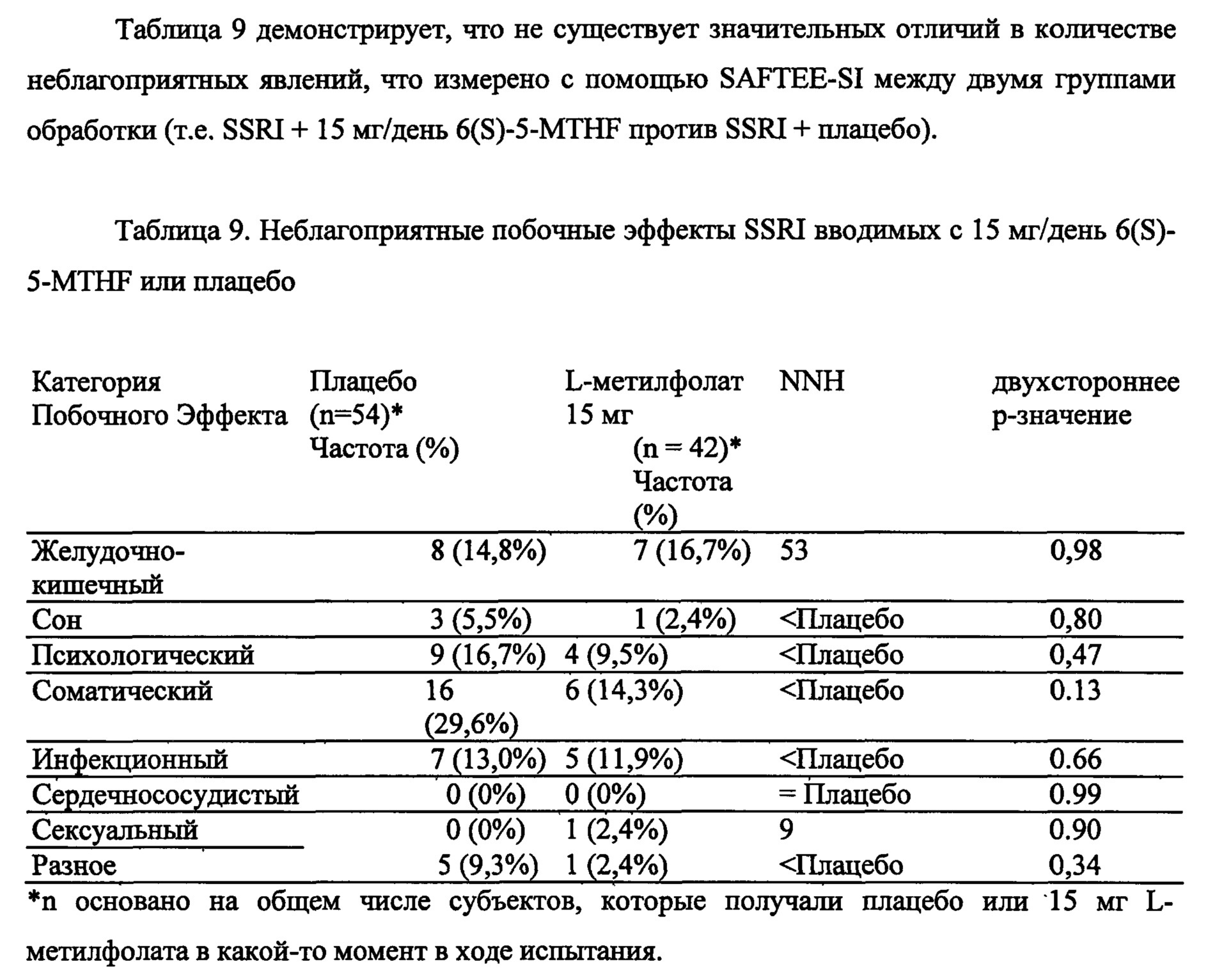
Как показано на Фиг. 3Е, нет различий по досрочному выходу из исследования из-за общих неблагоприятных побочных эффектов или событий исключения. Из испытания пациент, которому вводили 6(S)-5-MTHF в качестве адъюванта к его/ее SSRI, удалялся из-за подъема настроения. Медицинская история пациента, указывающая на биполярное расстройство, которое не было обнаружено при первом визите.
Исследование с отслеживанием
В конце двойного слепого исследования, как продемонстрировавшие ответ, так и не продемонстрировавшие ответ, которые закончили двойную слепую фазу, имели возможность получения бесплатного немаскированного дополнительного лечения 15 мг/день 6(S)-5-MTHF в течение 12 месяцев. Субъекты, которые согласились получать немаскированное лечение 6(S)-5-MTHF в течение 12 месяцев, оценивались каждые три (3) месяца до конца фазы последующего наблюдения. В течение каждого визита пациенты выполняли HAM-D-28, CGI, QIDS-SR, SAFTEE-SI, MGH-CPFQ и MGH-SFQ (см., например, таблицу 10 ниже). Доза их сопутствующего SSRI могла быть скорректирована в течение 12 месяцев последующего наблюдения, так же как и доза 6(S)-5-MTHF (например, вплоть до 15 мг дважды в день). Субъектам также позволялось изменить их антидепрессант в течение курса последующего наблюдения, если это было сочтено целесообразным. Для пациентов, которые отказались от 12 месячного бесплатного лечения последующего наблюдения, предлагалось направление к психиатру.
Таблица 10 демонстрирует, что пациенты с ремиссией в конце двойной слепой фазы, которые получали дополнительное лечение 15 мг/день 6(S)-5-MTHF, не имели рецидива в течение 12 месяцев фазы последующего наблюдения.

Пример 4. Идентификация биомаркеров для выбранных пациентов с депрессией для лечения, включающего фолат-содержащее соединение в комбинации с SSRI
Двойное слепое плацебо-контролируемое исследование 6(S)-5-MTHF среди устойчивых к SSRI амбулаторных пациентов с большим депрессивным расстройством (MDD) осуществлено, как описано в Примерах 1-3, для идентификации генетических полиморфизмов, периферических биомаркеров и/или клинических признаков, которые ассоциированы с более эффективным ответом, когда пациенту назначали фолат-содержащее соединение (например, 6(S)-5-MTHF) в дополнение к антидепрессантному лекарственному средству, например, SSRI.
На Фиг. 4А-4В показан эффект однонуклеотидного полиморфизма (SNP) в гене MTHFR (MTHFR C677T) в отношении эффективности лечения, включающего фолат-содержащее соединение (например, 6(S)-5-MTHF) и SSRI, пациента с депрессией, что было измерено с помощью HDRS-28 (Шкалы Гамильтона для оценки депрессии из 28 пунктов) и CGI-S (Общее клиническое впечатление - Тяжесть заболевания), соответственно. Полученные данные Фиг. 4А-4В указывают на то, что пациенты, имеющие, по меньшей мере, один Т-аллель (например, СТ или ТТ) в положении 677 в SEQ ID NO: 1, соответствующей части геномной последовательности гена MTHFR, демонстрируют большую степень улучшения в тесте HDRS-28 или CGI-S, когда их лечили фолат-содержащим соединением в сочетании с SSRI, по сравнению с пациентами без Т-алллеля, детектируемого в положении 677 в SEQ ID NO: 1.
На Фиг. 5А-5В показан эффект ожирения (т.е. BMI равное, по меньшей мере, 30 кг/м2 или выше) в отношении эффективности лечения, включающего фолат-содержащее соединение (например, 6(S)-5-MTHF) и SSRI, пациента с депрессией, что было измерено с помощью HDRS-28 (Шкалы Гамильтона для оценки депрессии из 28 пунктов) и CGI-S (Общее клиническое впечатление - Тяжесть заболевания), соответственно. Полученные данные Фиг. 5А-5В указывают на то, что пациенты, страдающие ожирением (т.е. с BMI, равным, по меньшей мере, 30 кг/м2 или выше) демонстрируют большую степень улучшения в тесте HDRS-28 или CGI-S, когда их лечили фолат-содержащим соединением в сочетании с SSRI, по сравнению с пациентами без ожирения.
Некоторые примерные прогностические факторы больших частот эффективного ответа у пациентов, получающих 6(S)-5-MTHF в сочетании с SSRI, могут включать низкий уровень фолата в плазме и/или RBC, низкие уровни В12 и SAM в плазме, низкие соотношения уровней SAM/SAH, повышенный уровень гомоцистеина в плазме, наличие аутоантител к фолатным рецепторам (FRAs), асимметричный диметиларгинин (ADMA), малондиальдегид (MDA), 4-гидроксиноненаль (4-HNE), высокочувствительный С-реактивный белок (hs-CRP), F2-Изопростаны (8-OH-Dg), уровни Нейротрофического фактора мозга (BDNF), а также следующие генетические полиморфизмы: а) аллель Т677С в метилентетрагидрофолатредуктазе (MTHFR); b) аллель А1298С в гене MTHFR; с) аллель A66G в гене редуктазы метионинсинтетазы; и d) аллель A2746G в гене метионинсинтазы.
Различные комбинации генетических и биомаркеров оценивали по их воздействиям на эффективность лечения, включающего фолат-содержащее соединение (например, 6(S)-5-MTHF) и SSRI, пациентов с депрессией. В частности, специфические генетические и биомаркеры, которые оценивались, включают следующие:
(a) расчет BMI, по меньшей мере, около 30 кг/м2;
(b) соотношение экспрессии SAM/SAH меньше, чем 2,8 (например, 2,71) при измерении в образце плазмы;
(c) уровень 4-HNE не меньше чем 3,28 μг/мл (при измерении в образце плазмы);
(d) наличие редких вариантов СТ или ТТ в положении 677 в SEQ ID NO: 1, соответствующей части геномной нуклеотидной последовательности метилентетрагидрофолатредуктазы (MTHFR) (сокращенно обозначенном ниже как «MTHFR 677»);
(е) наличие редких вариантов AG или GG в положении 2756 в SEQ ID NO: 2, соответствующей части геномной нуклеотидной последовательности метионинсинтазы (MTR) (сокращенно обозначенном ниже как «MTR 2756»); и
(f) наличие редких вариантов AG или GG в положении 66 в SEQ ID NO: 3, соответствующей части геномной нуклеотидной последовательности редуктазы метионинсинтазы (MTRR) (сокращенно обозначенном ниже как «MTRR 66»).
Результаты того, как различные комбинации вышеуказанных состояний (a)-(f) влияют на степень улучшения, при измерении с помощью баллов HAMD-17 и HAMD-28, при лечении пациентов фолат-содержащим соединением (например, 6(S)-5-MTHF) и SSRI, показаны в Таблицах 11-36 ниже. Эффект эффективности определяется путем измерения среднего изменения в балле HAMD-17 и балле HAMD-28 в конце Фазы I и Фазы II, по сравнению с исходным уровнем.
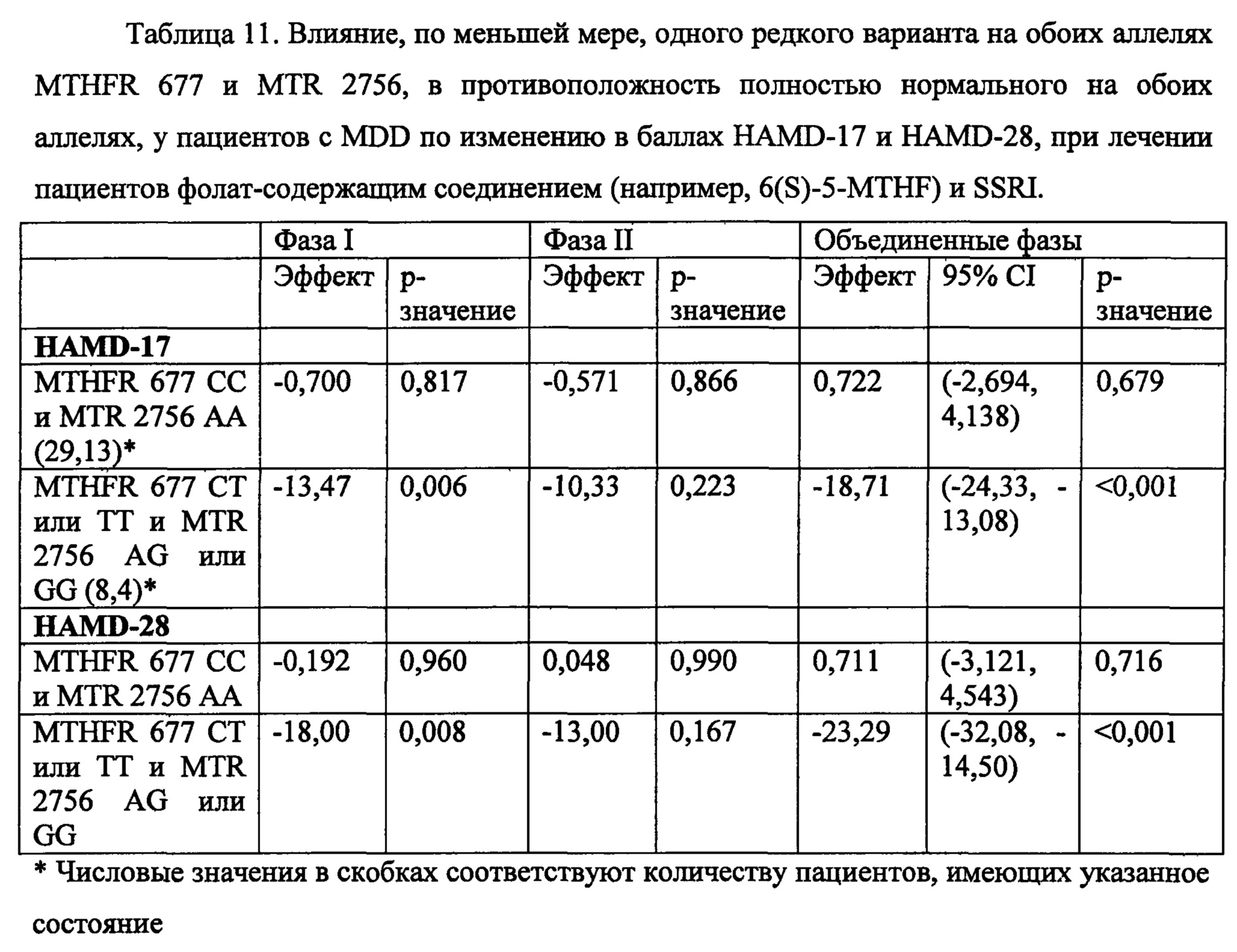
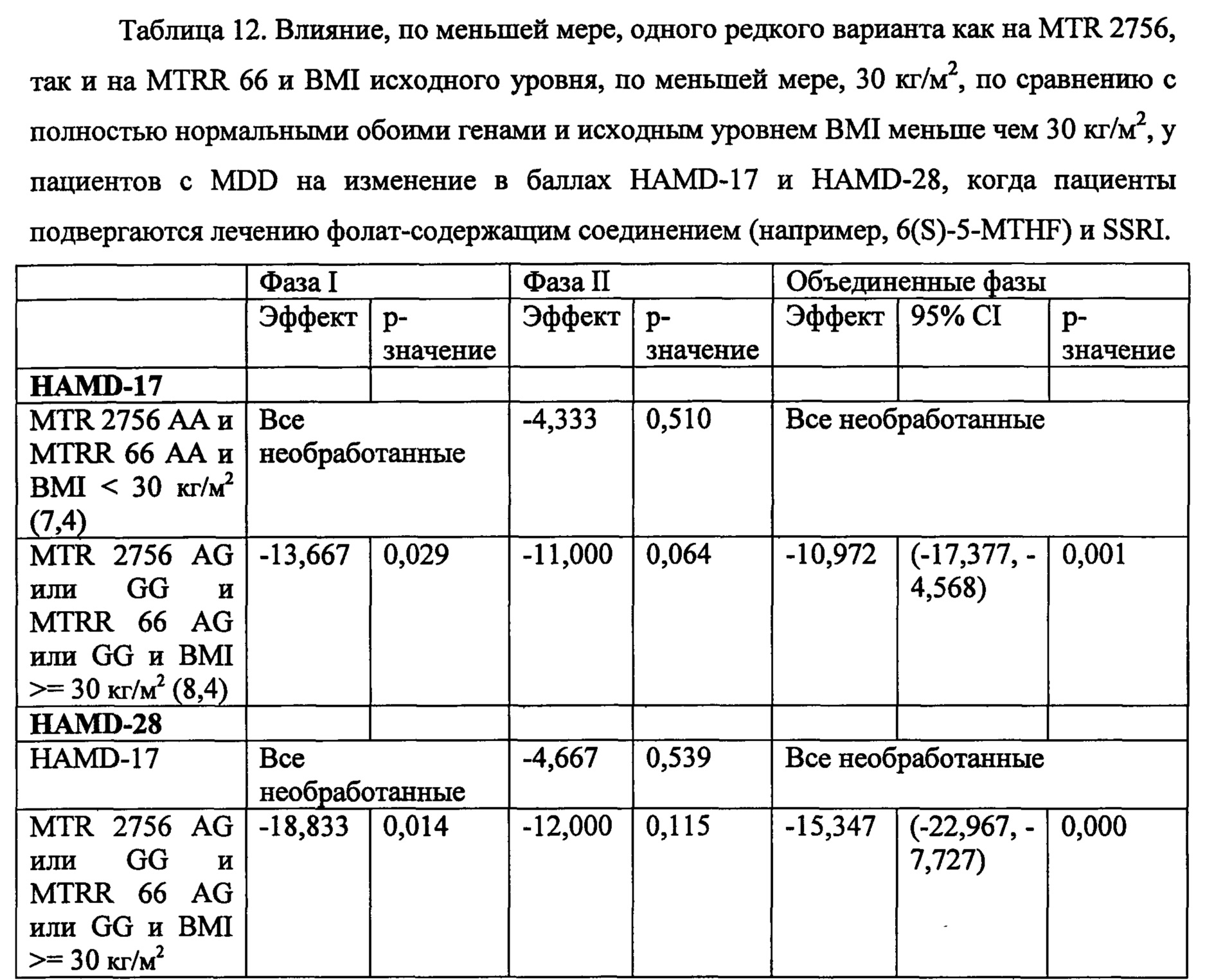
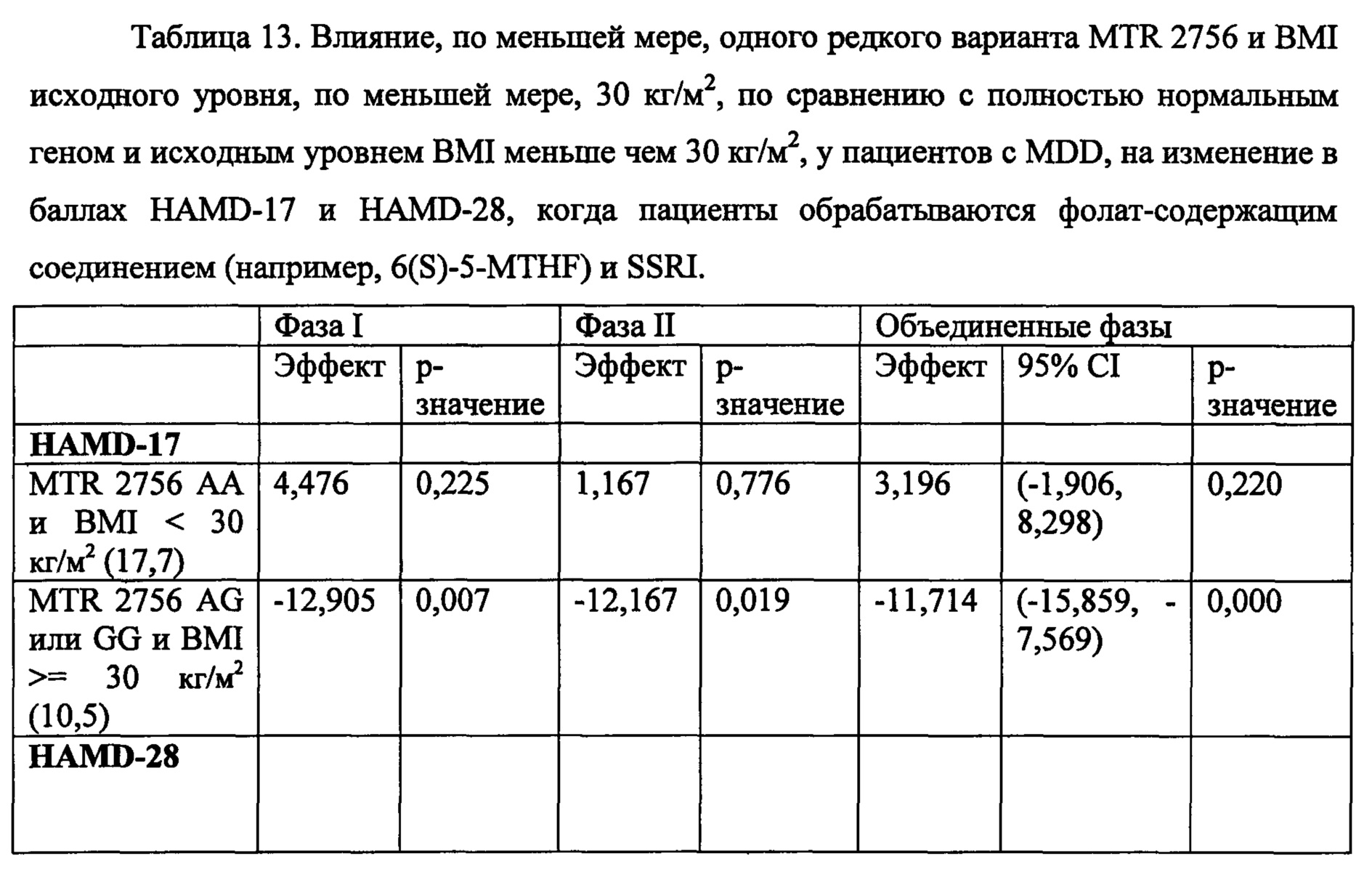

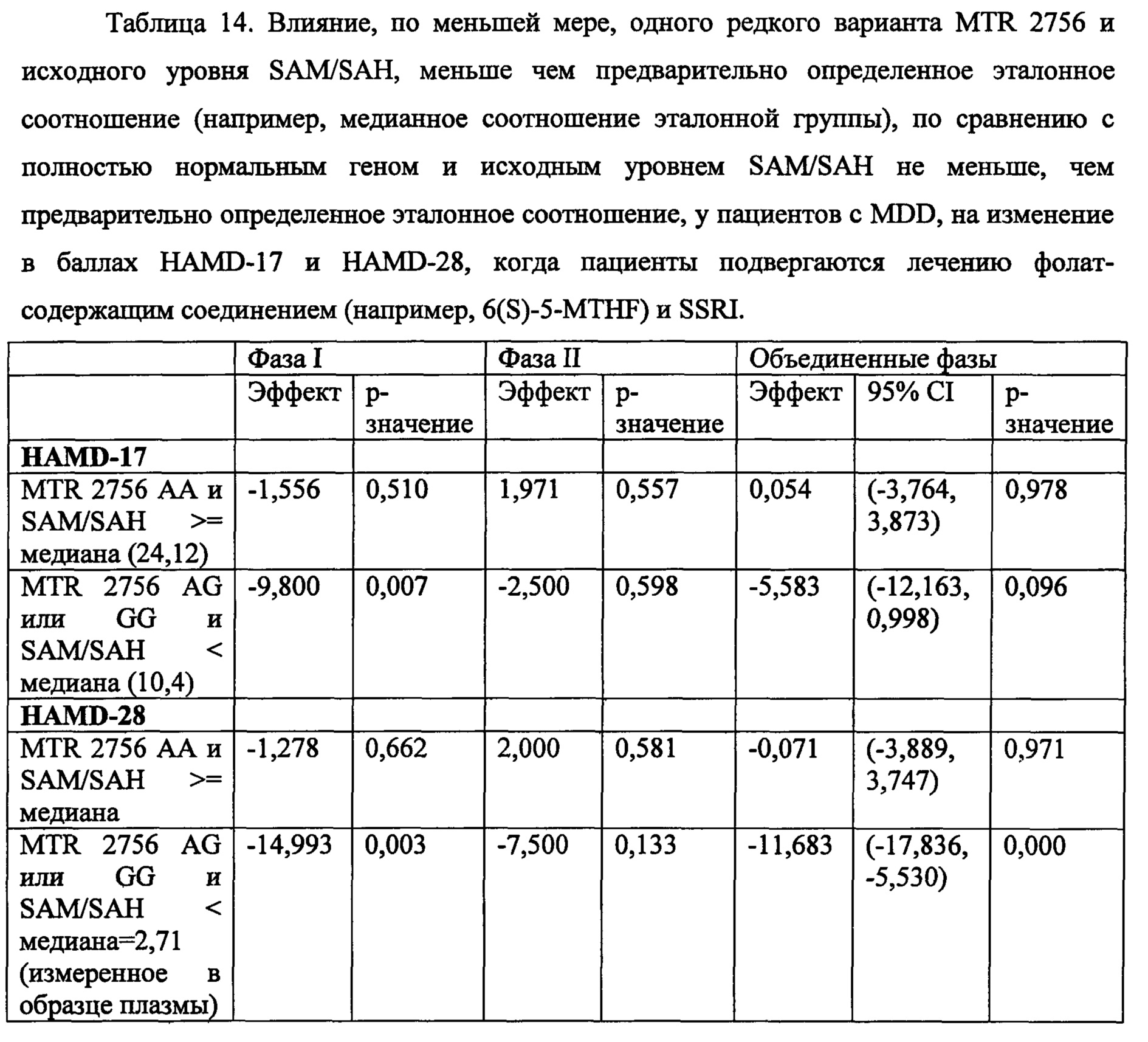

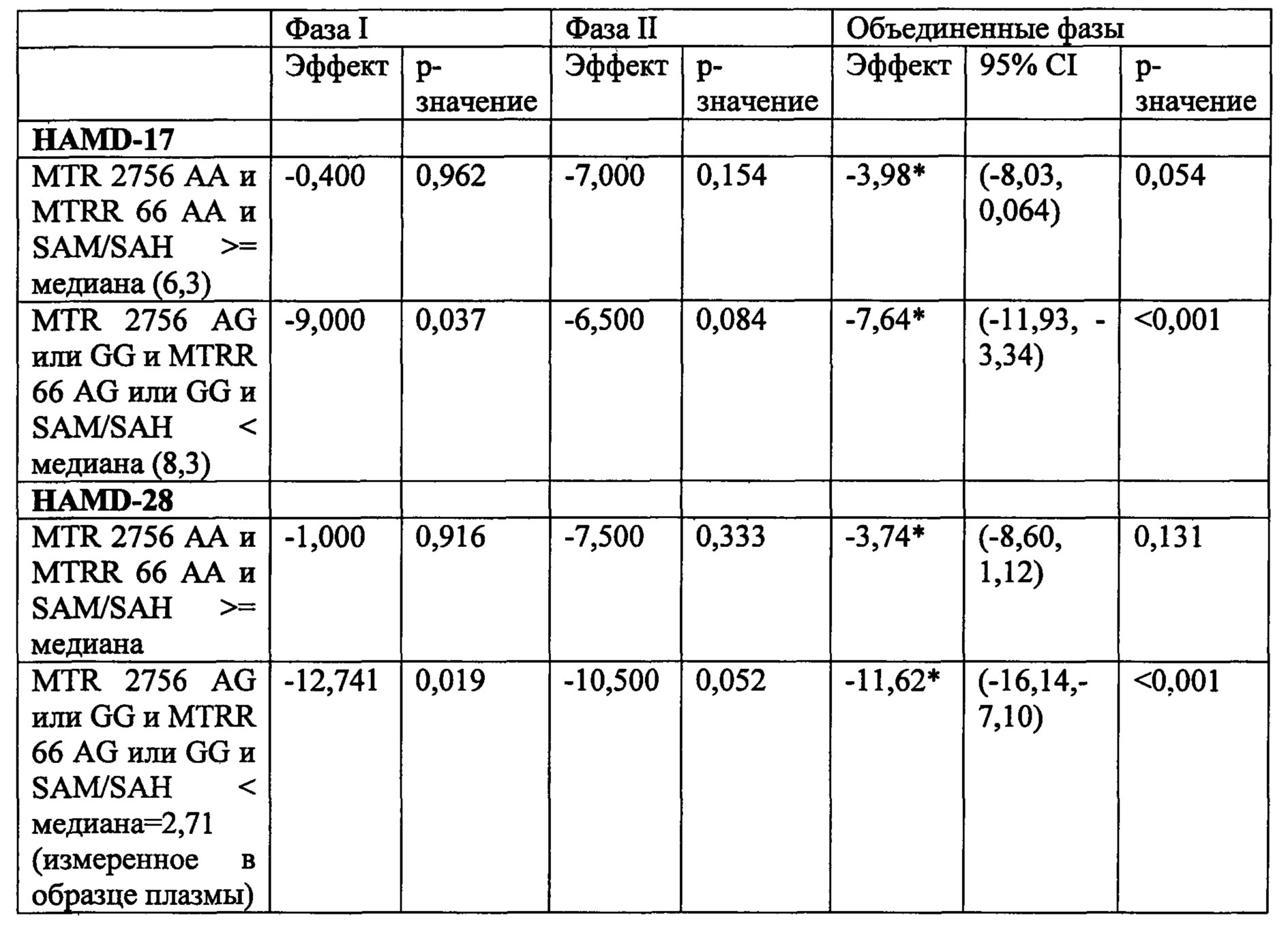
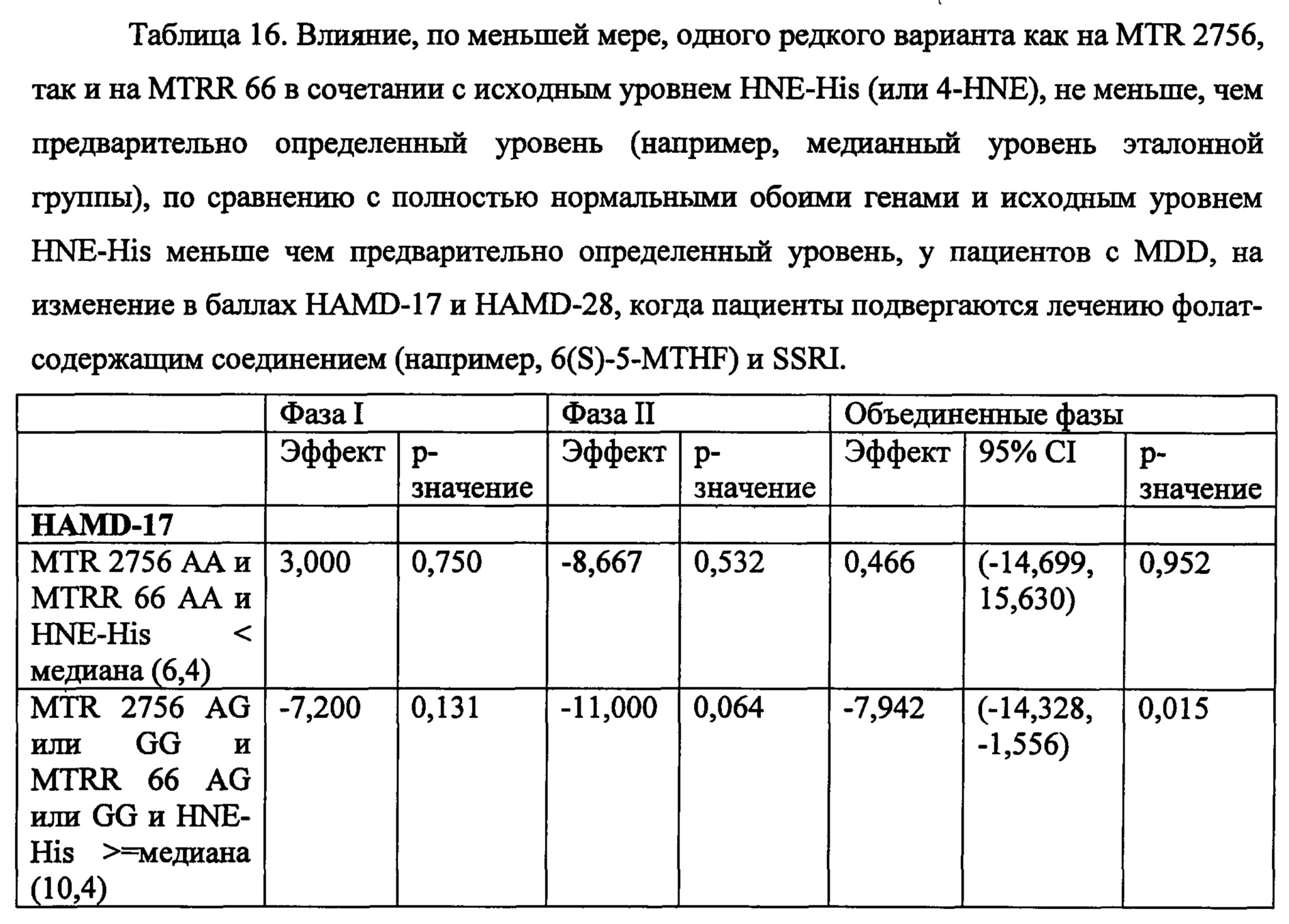

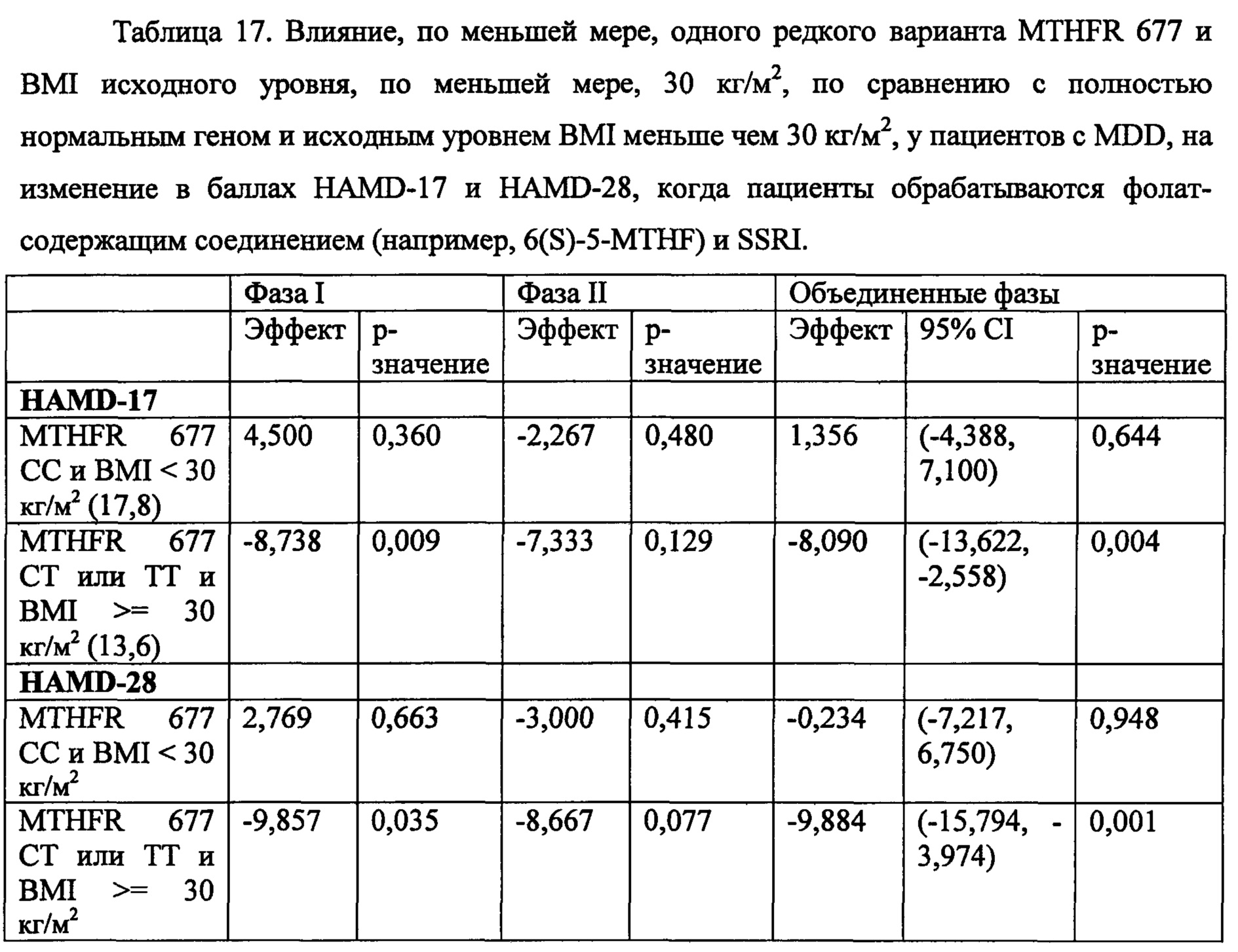

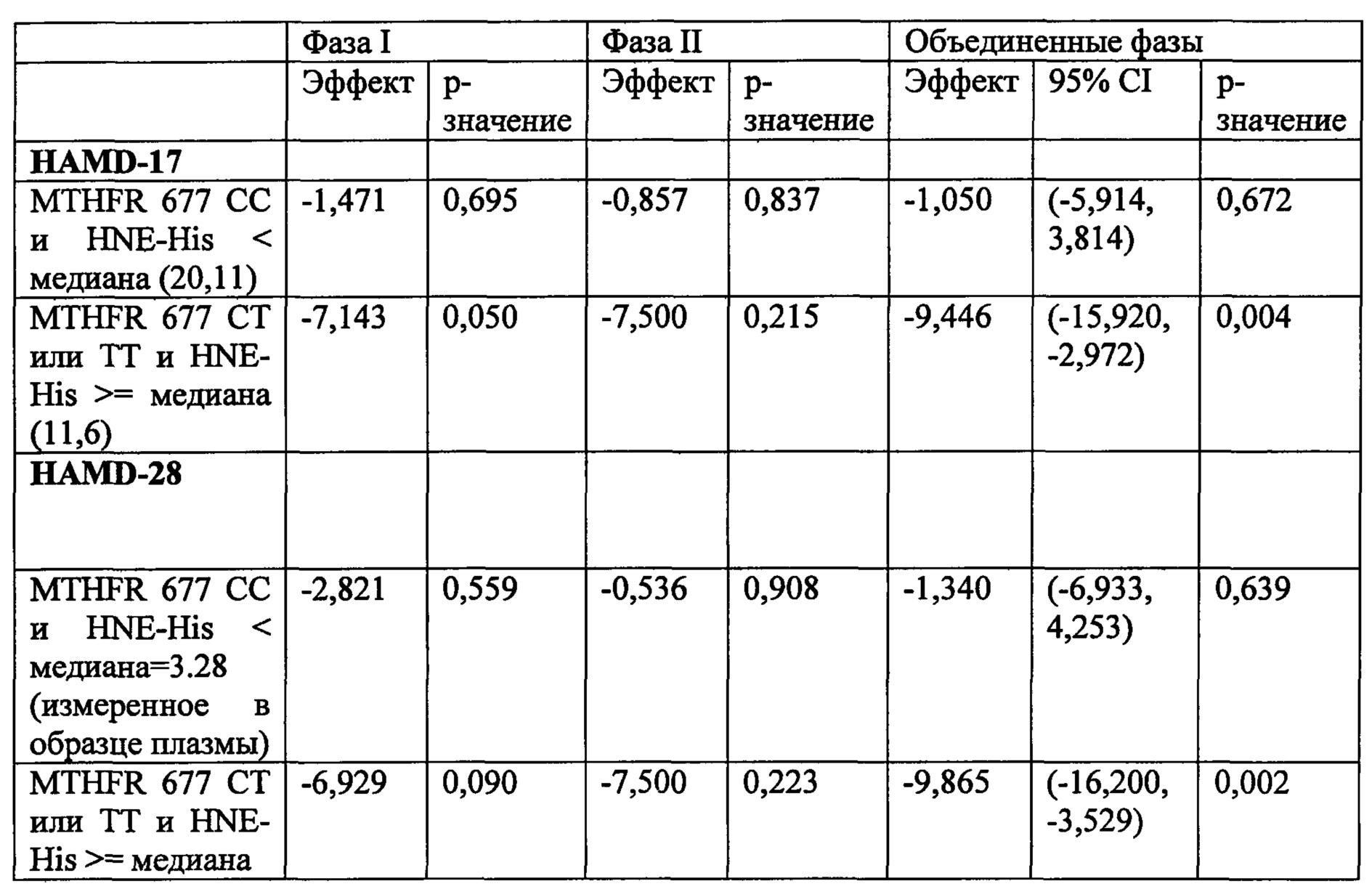
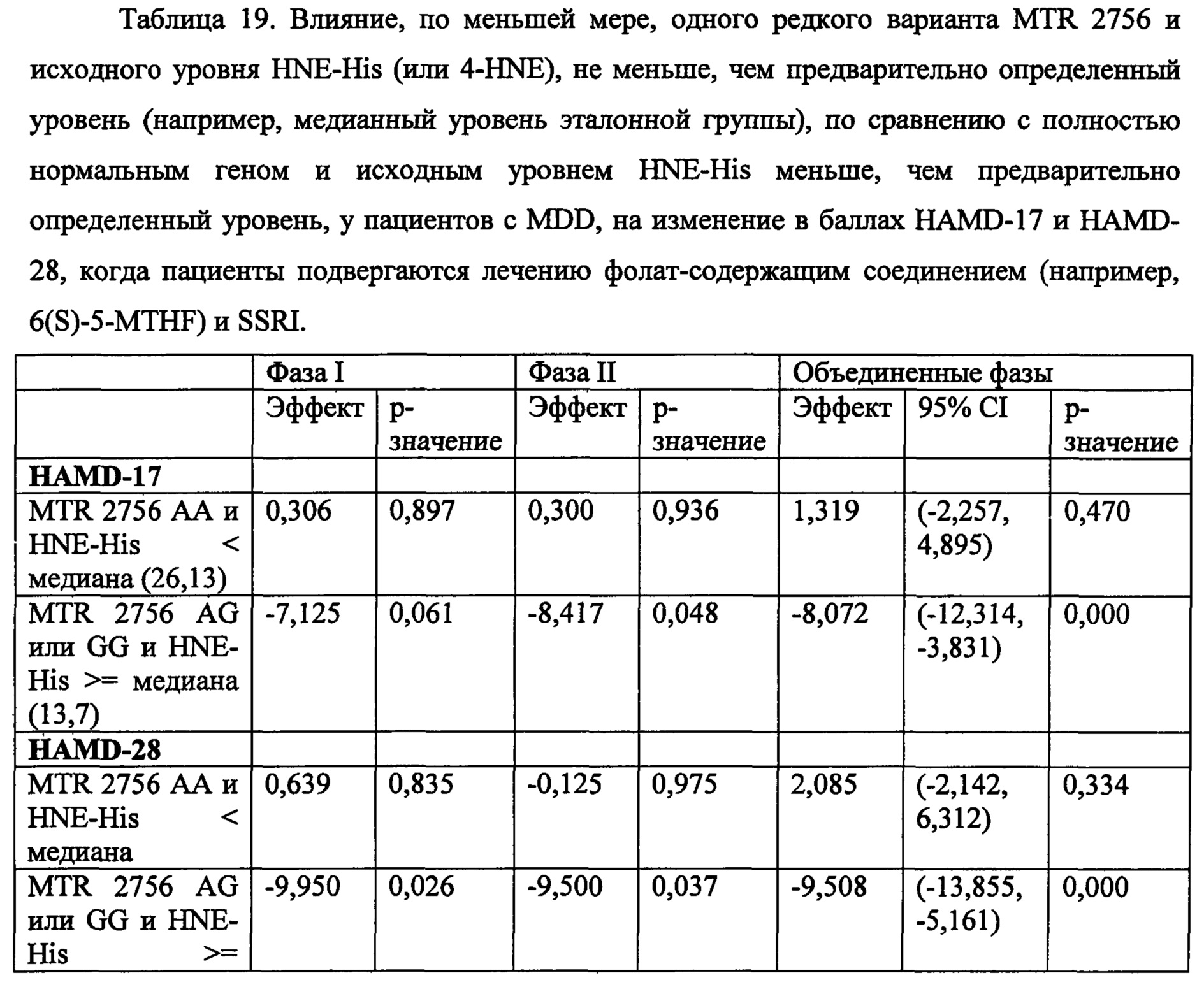
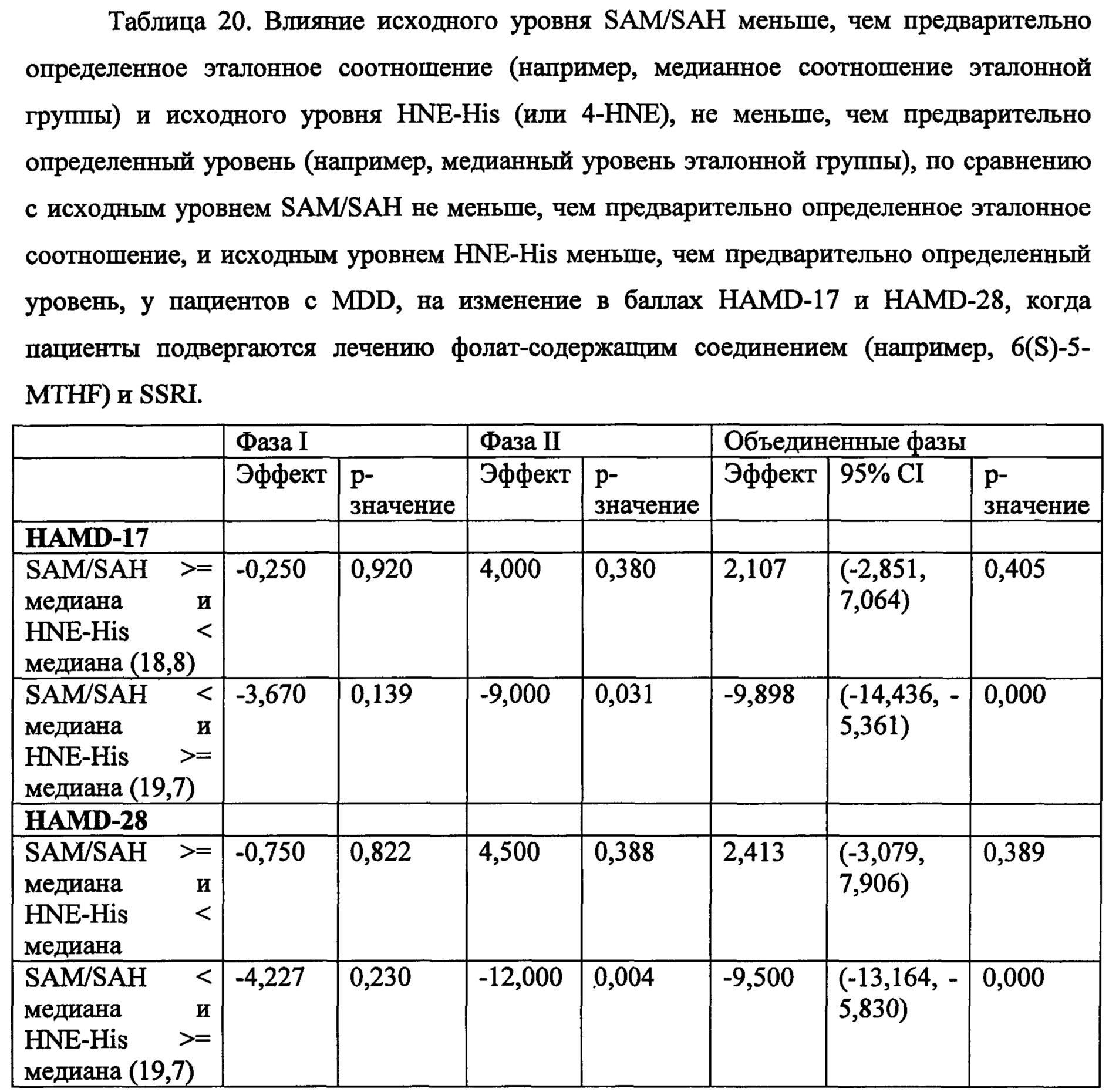

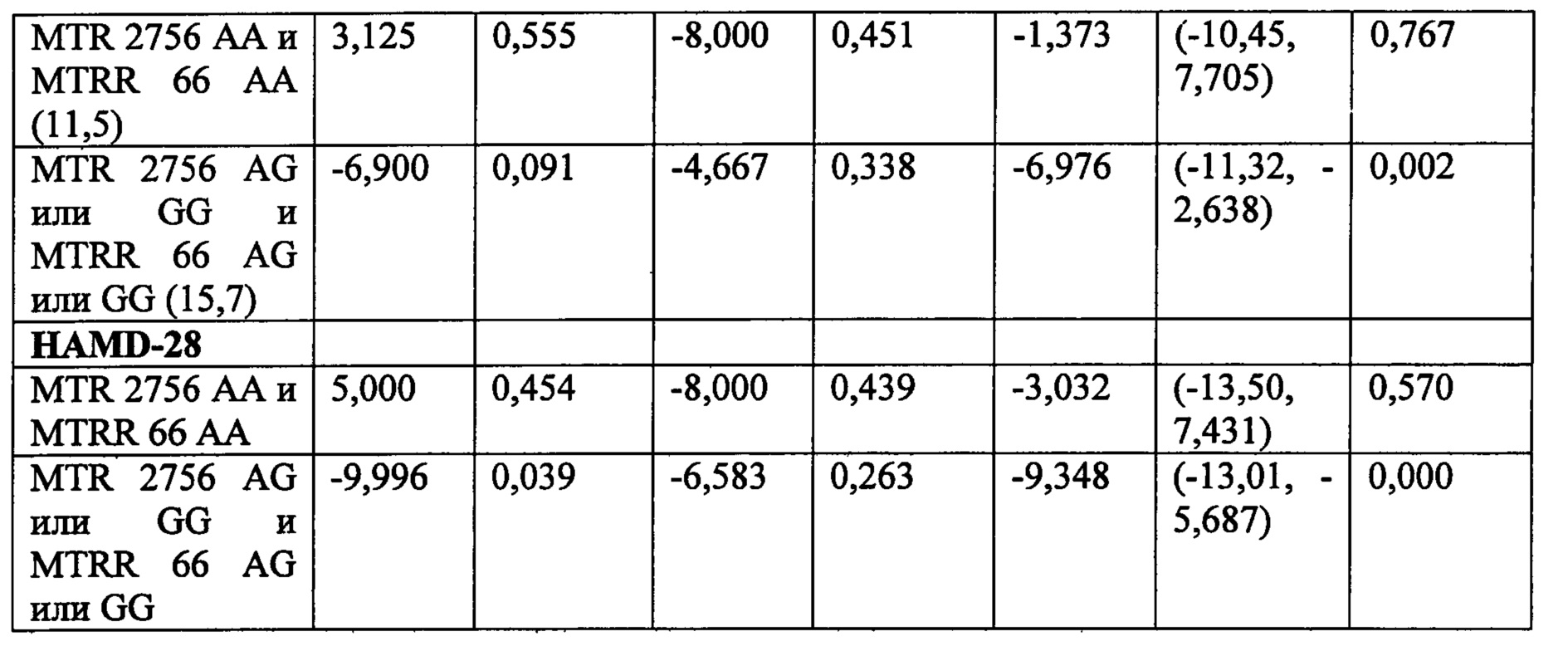
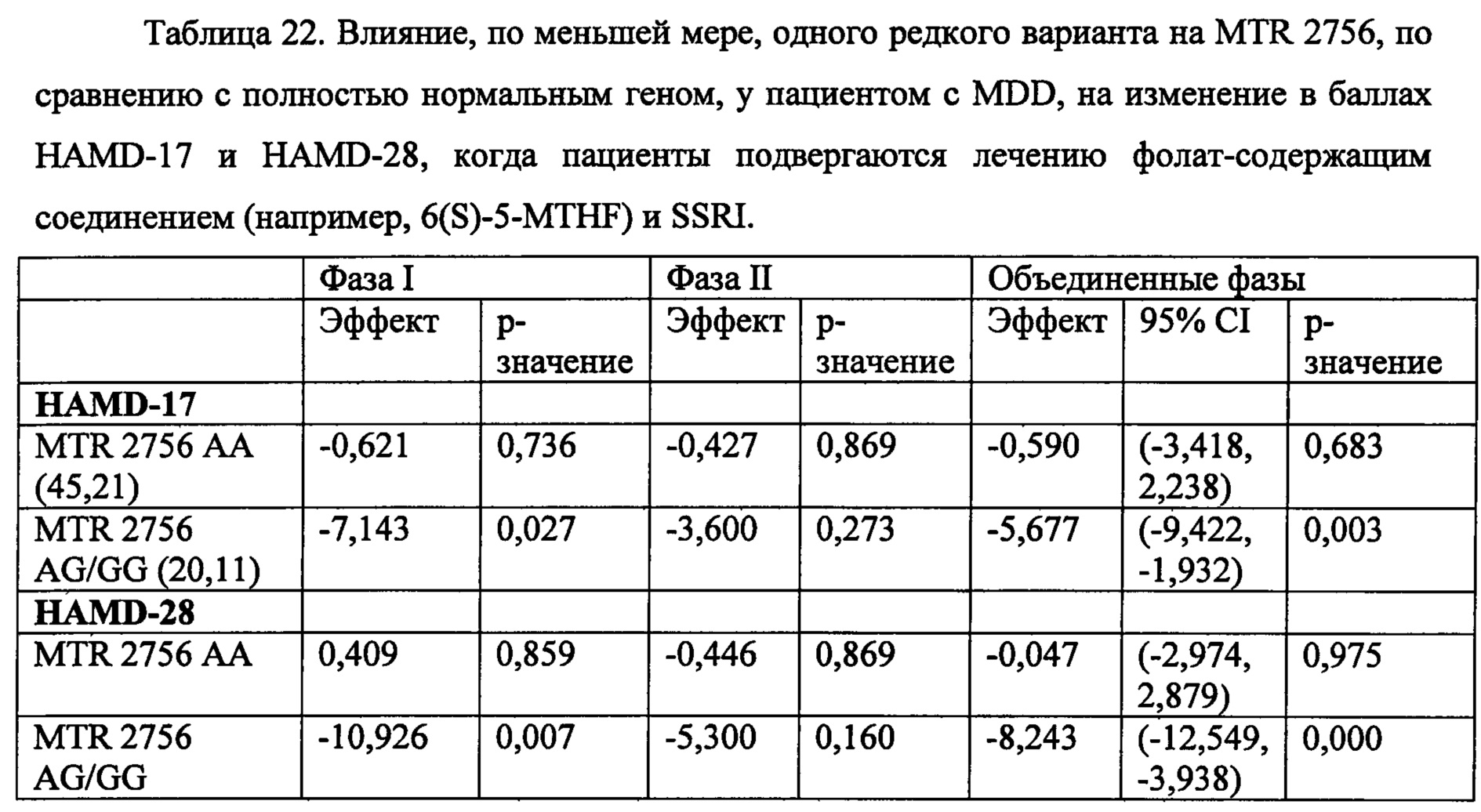

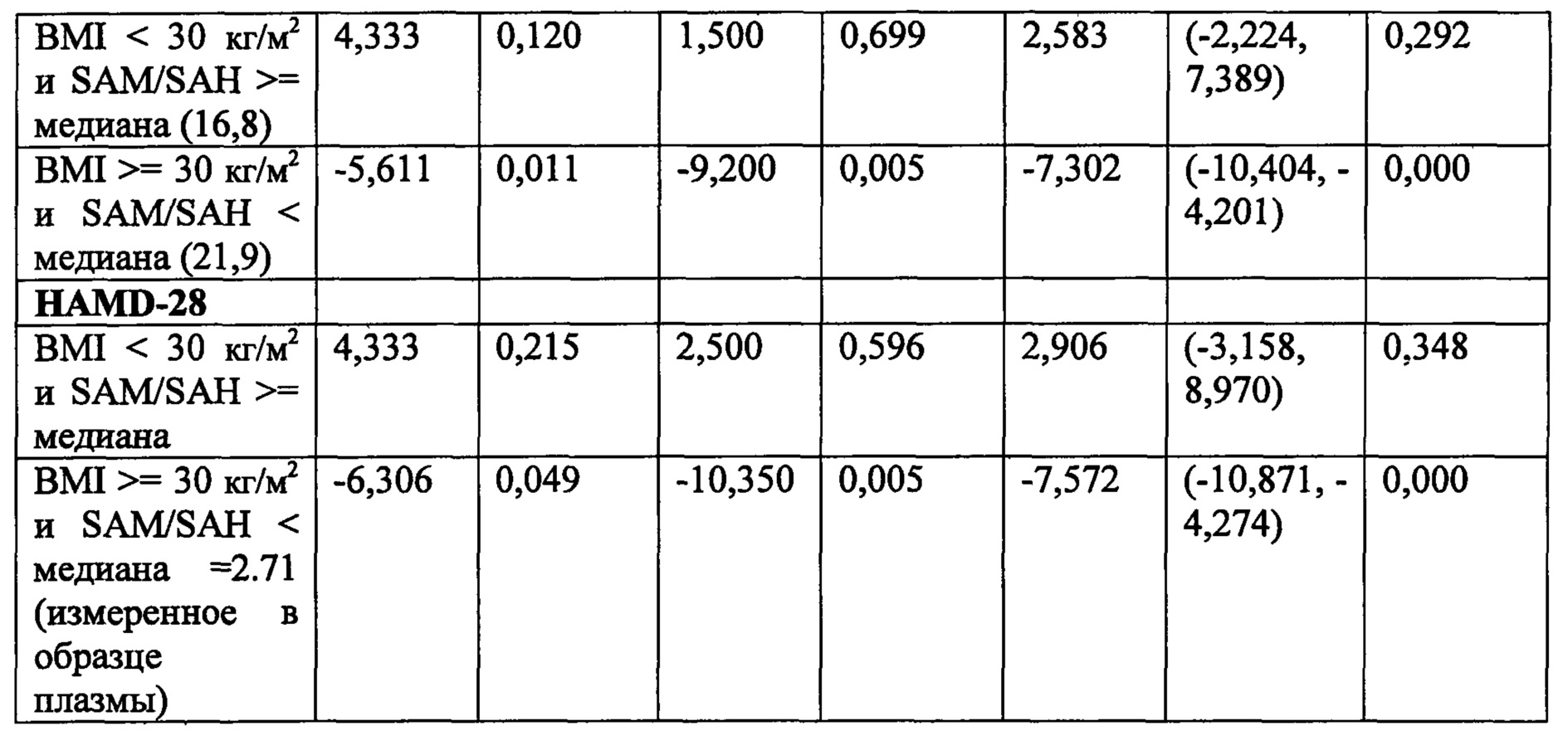
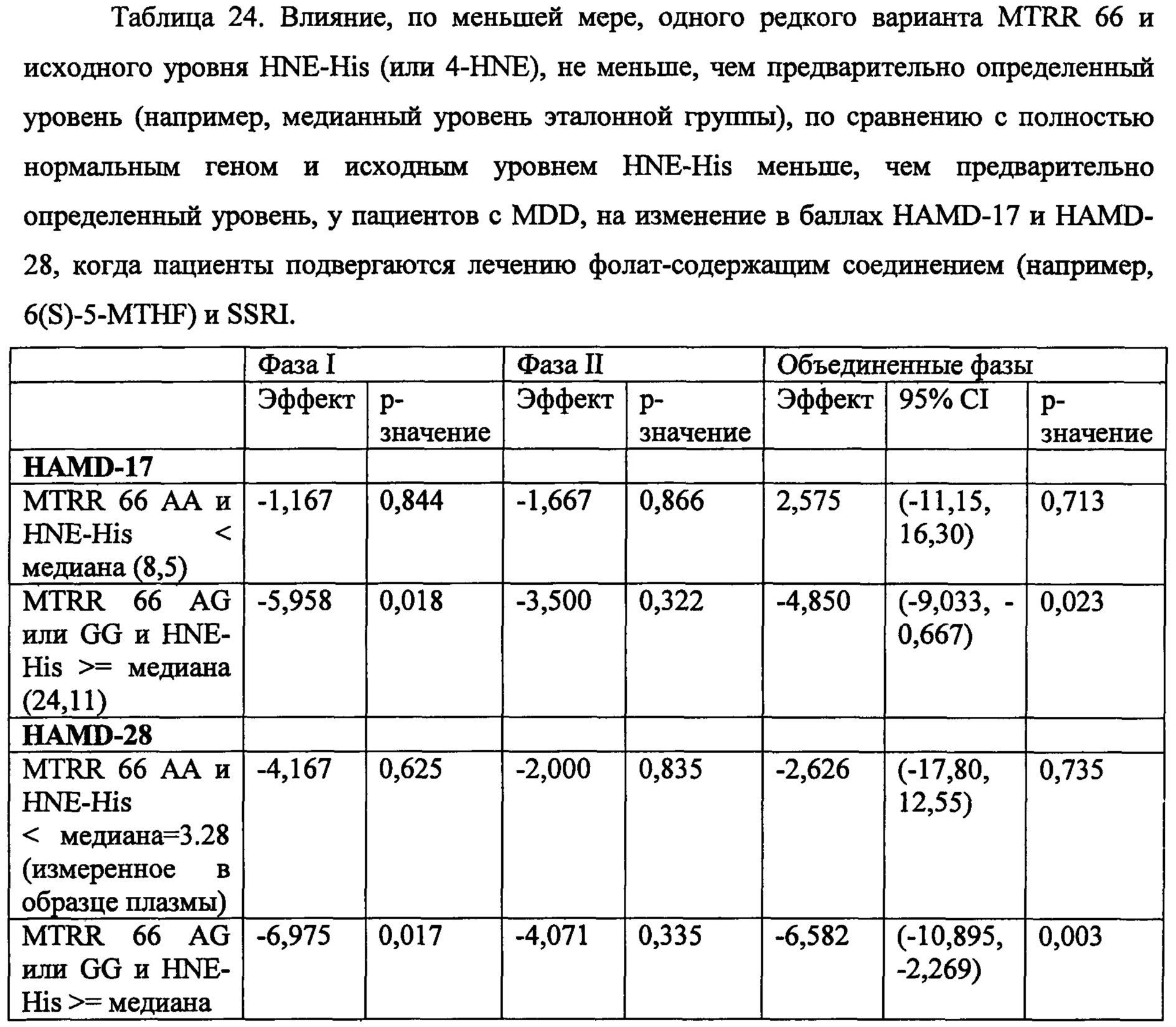
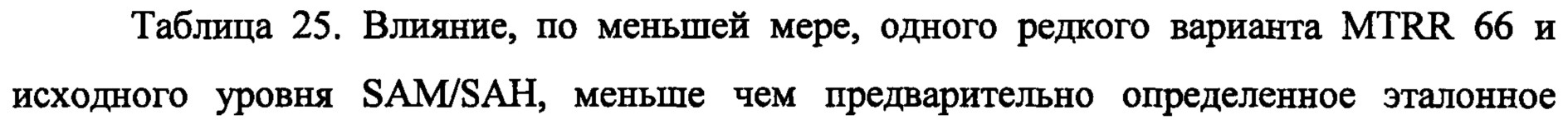
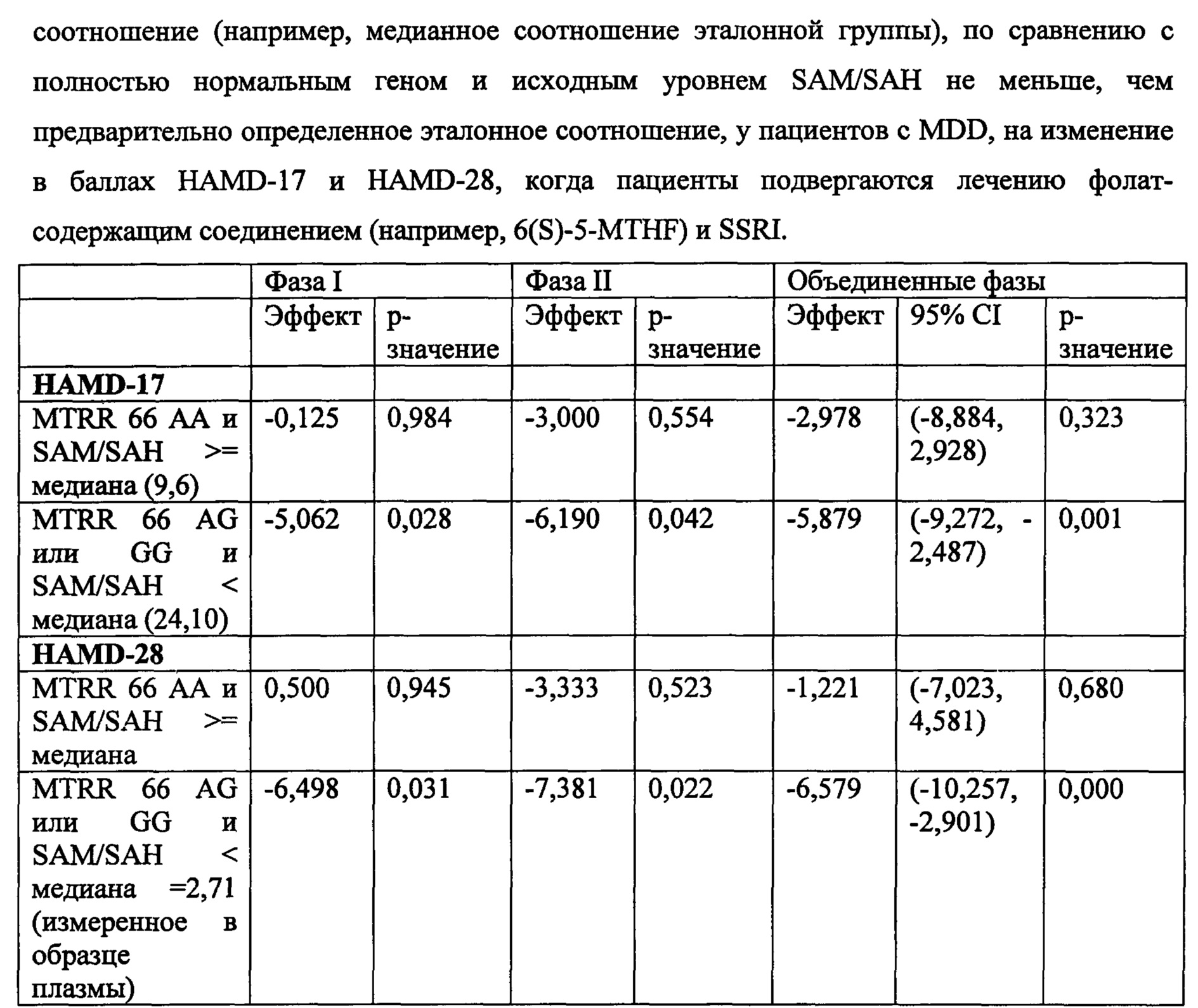
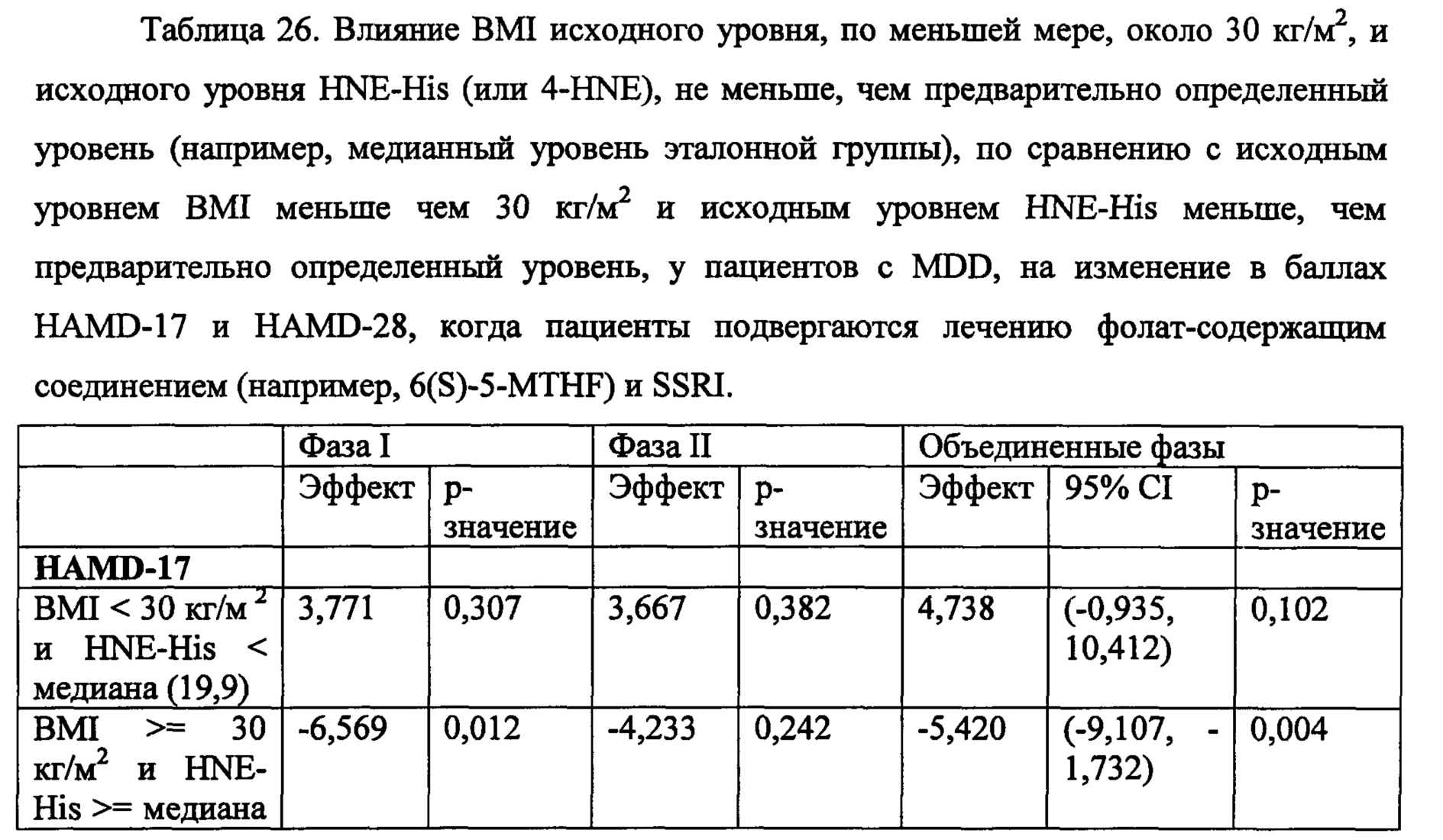

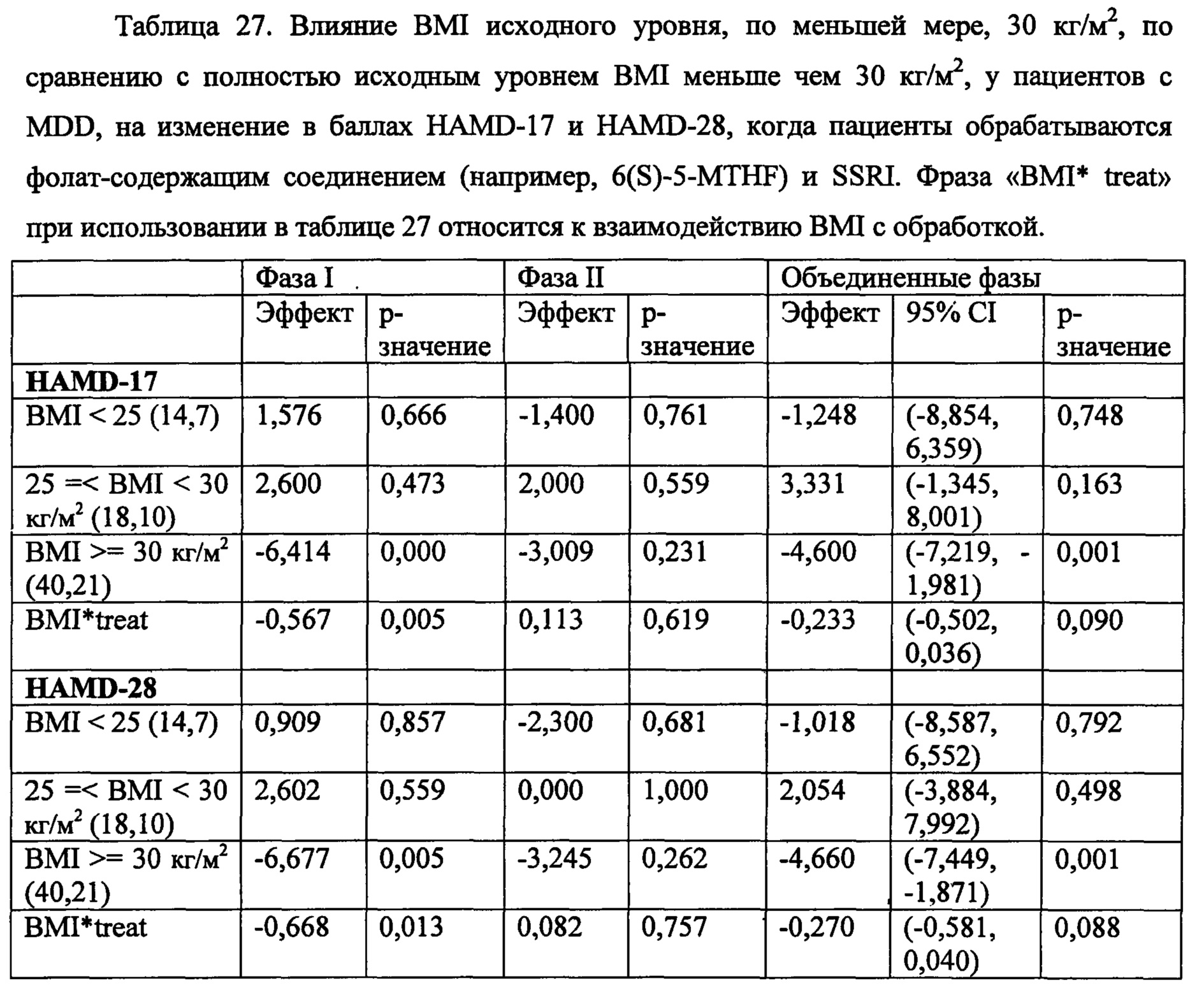

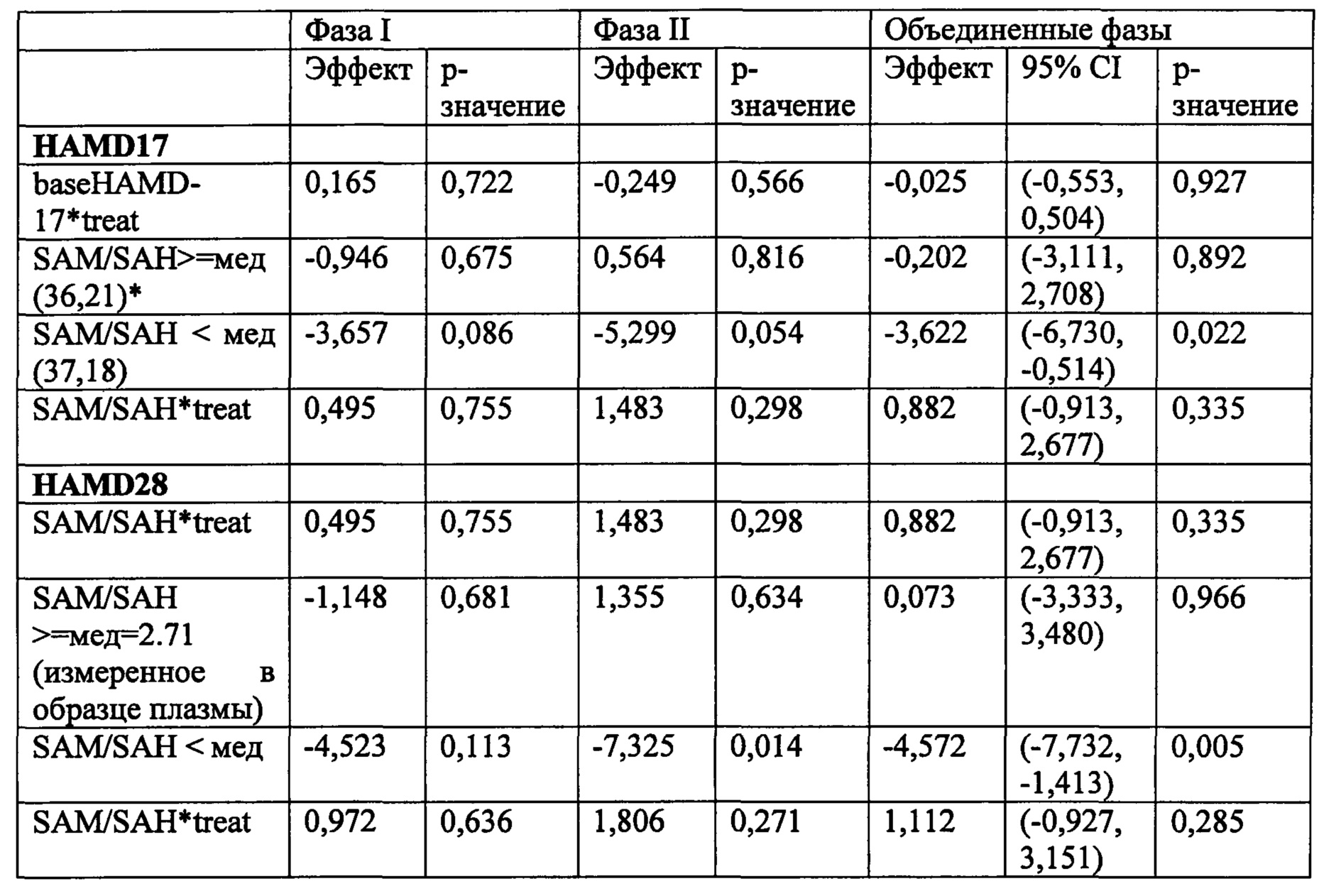
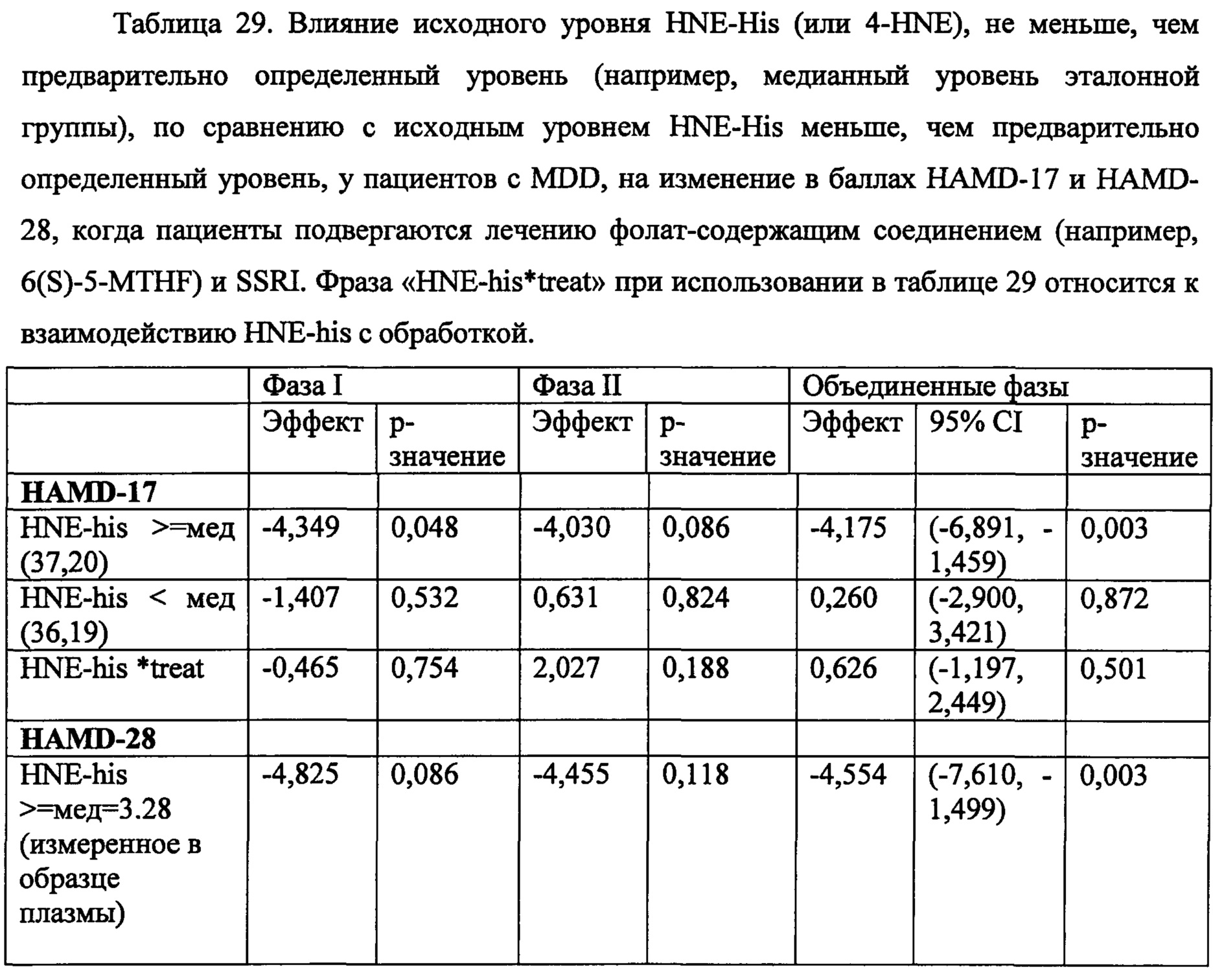

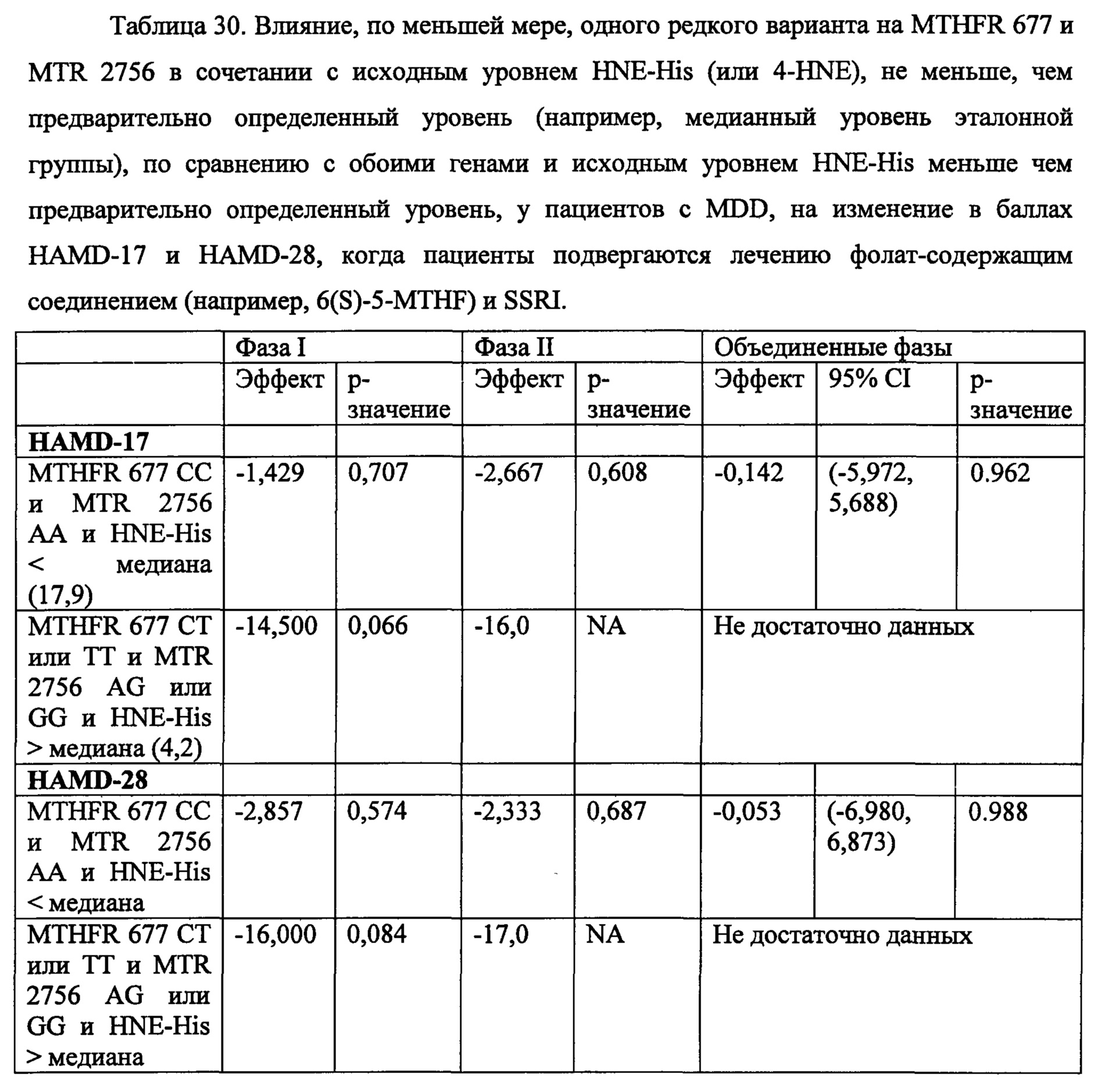

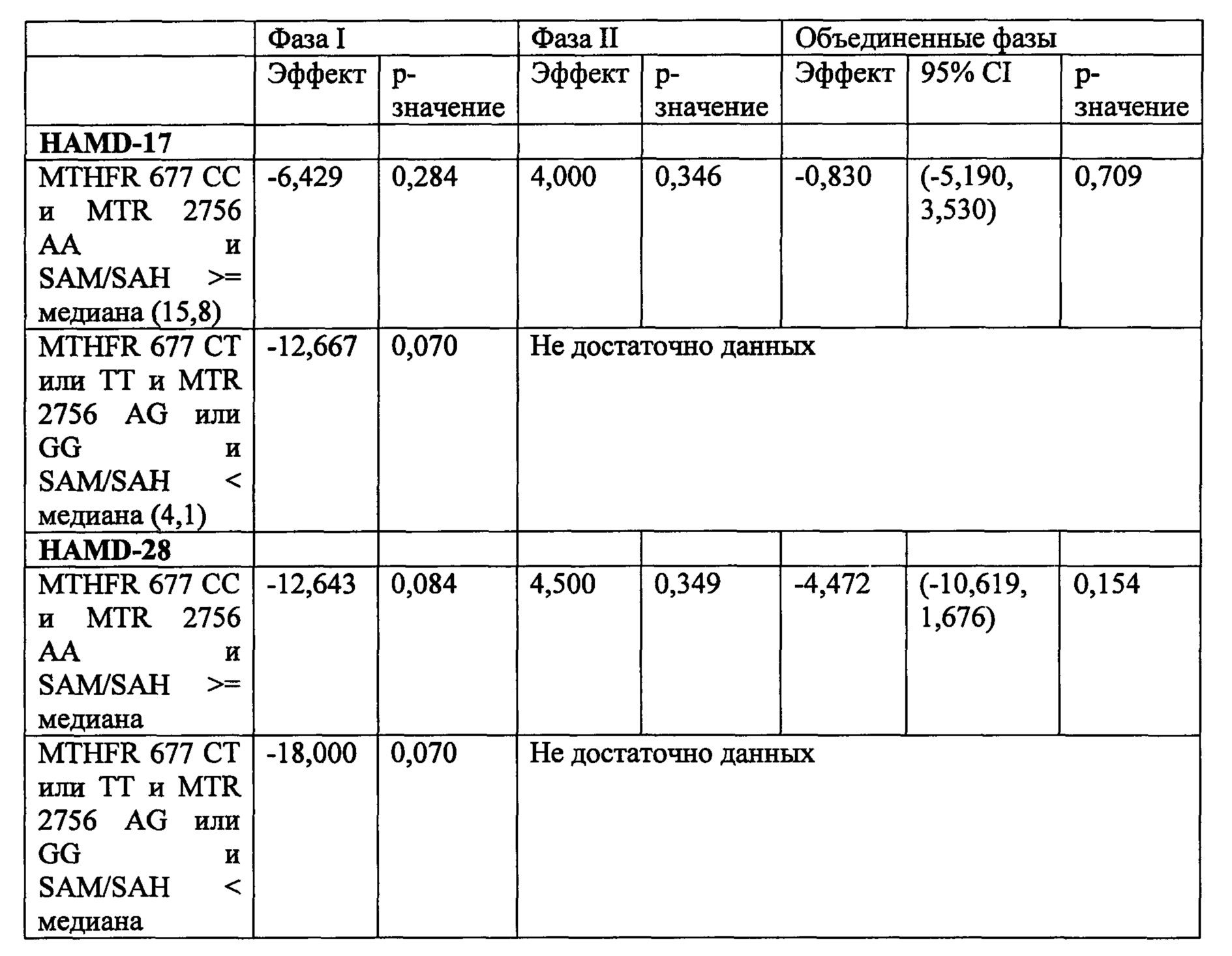
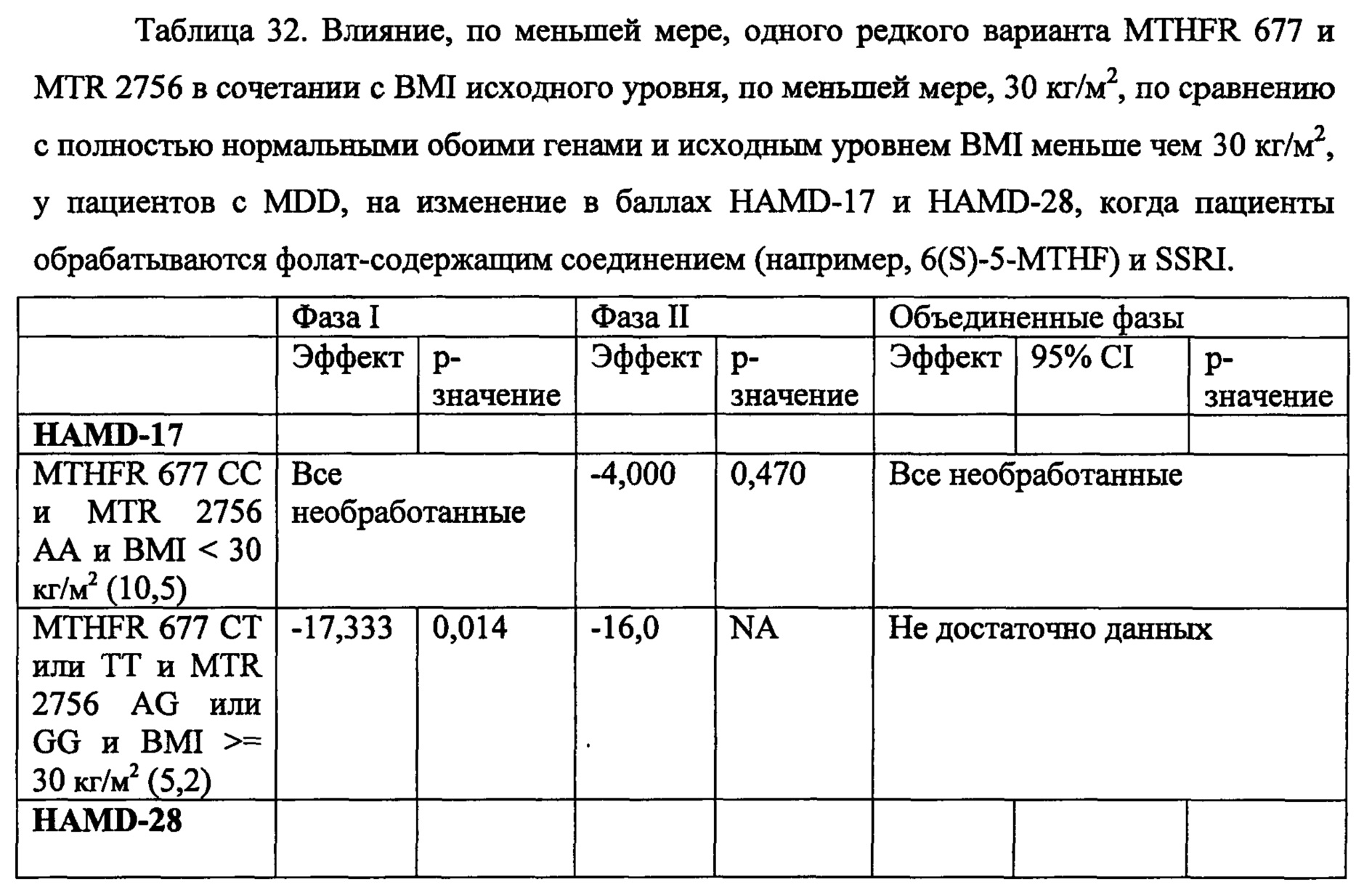

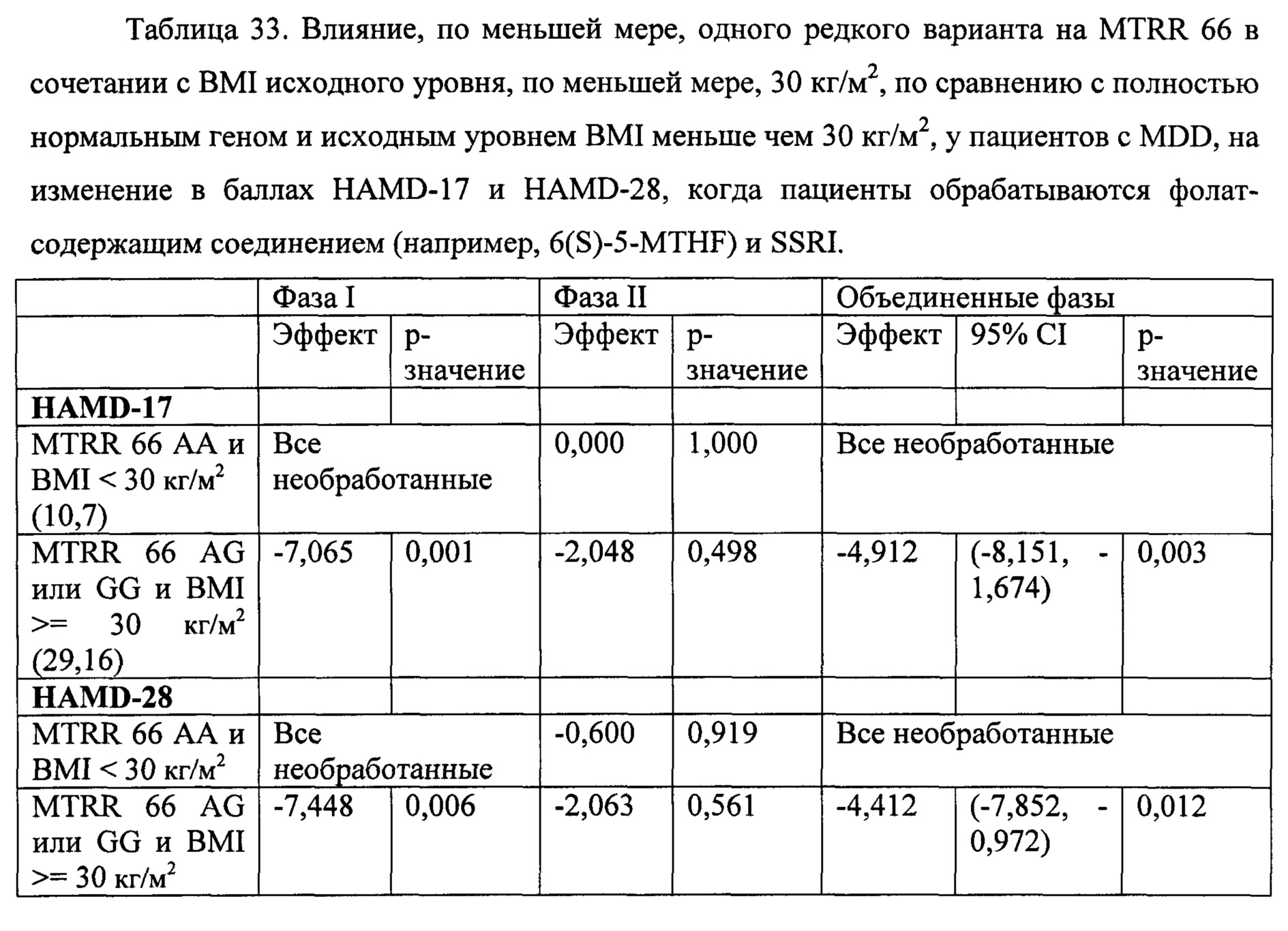


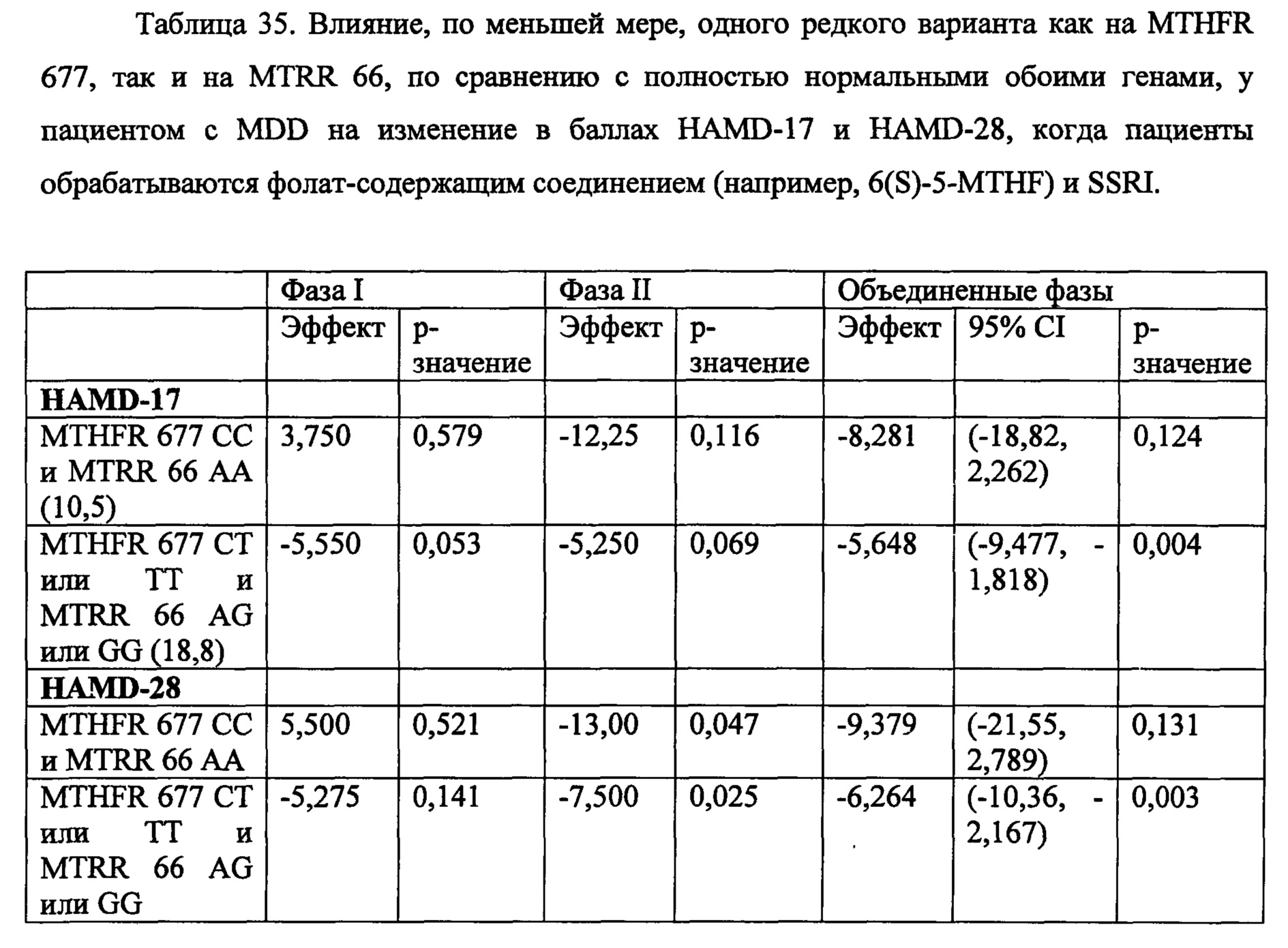
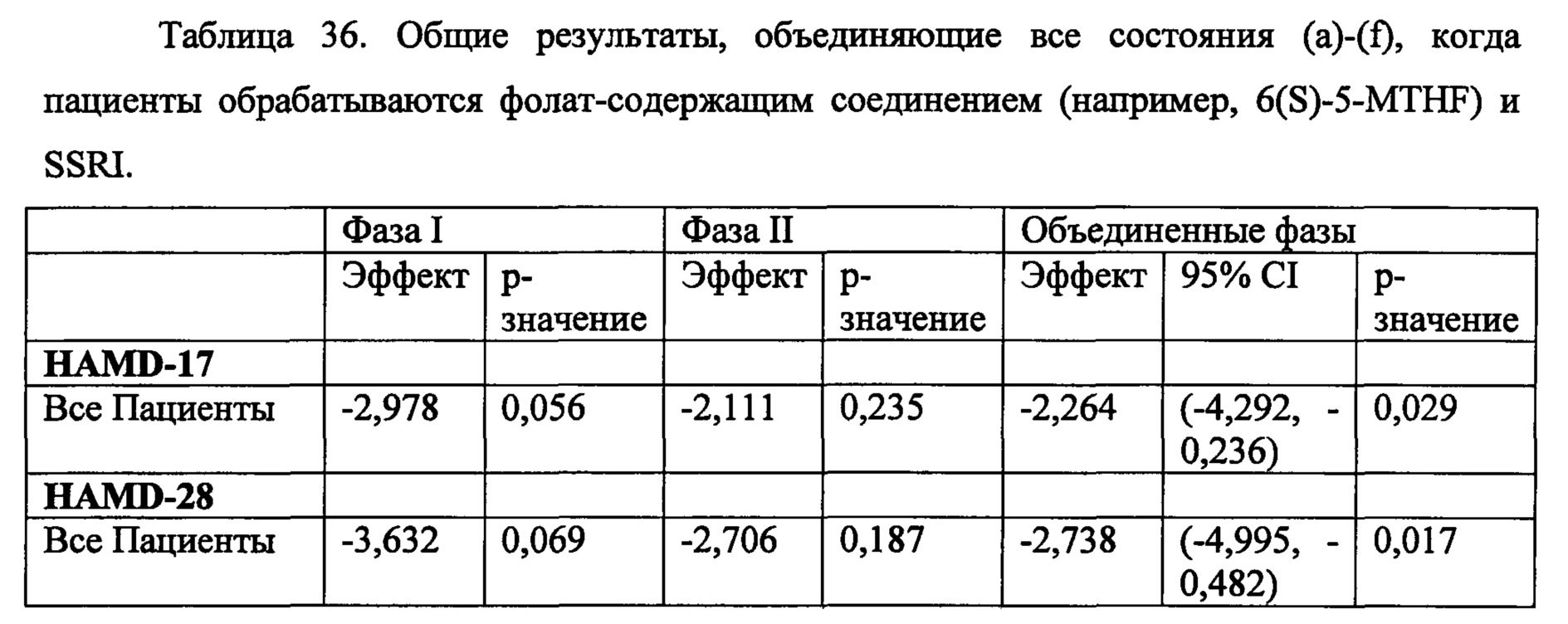
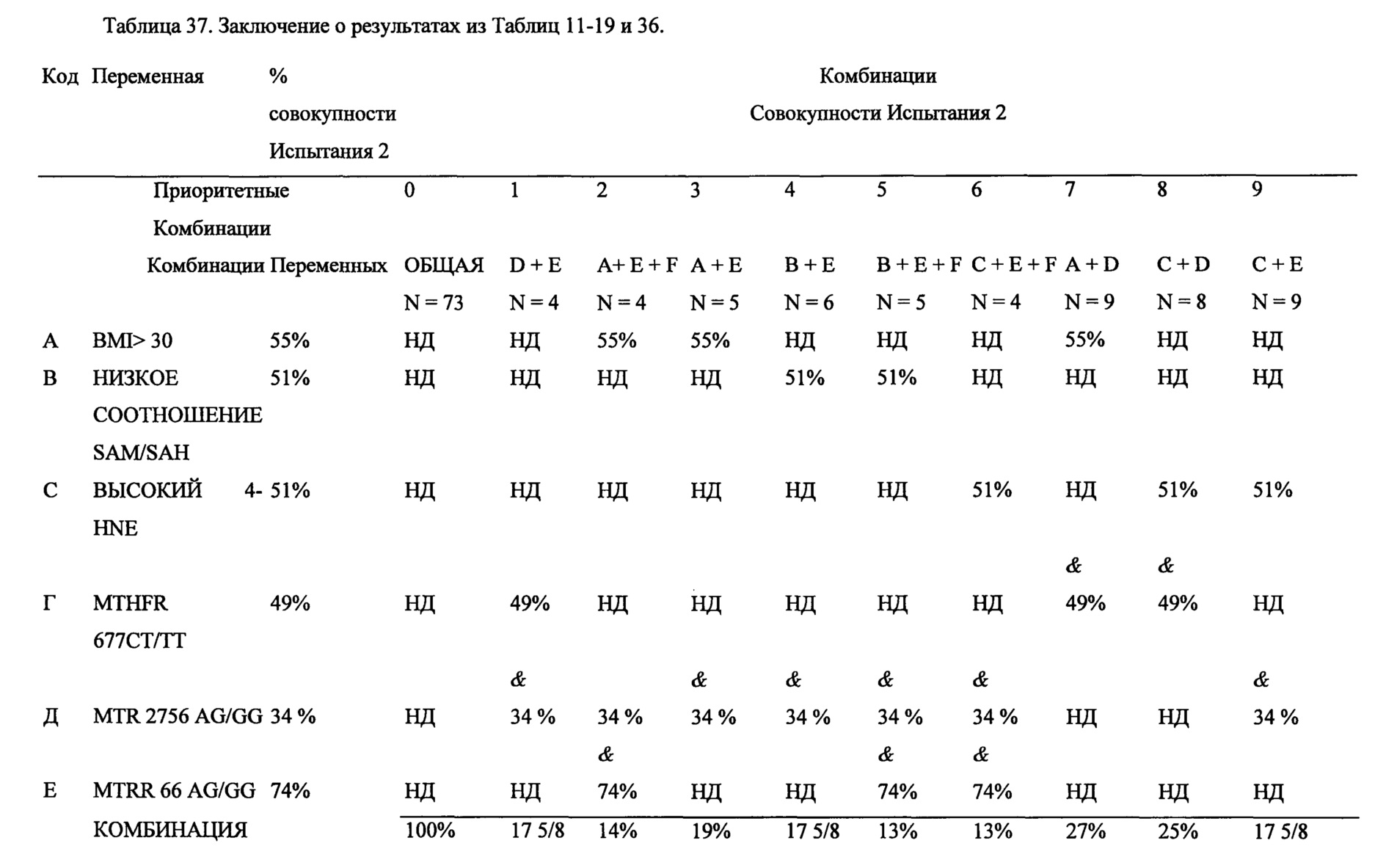
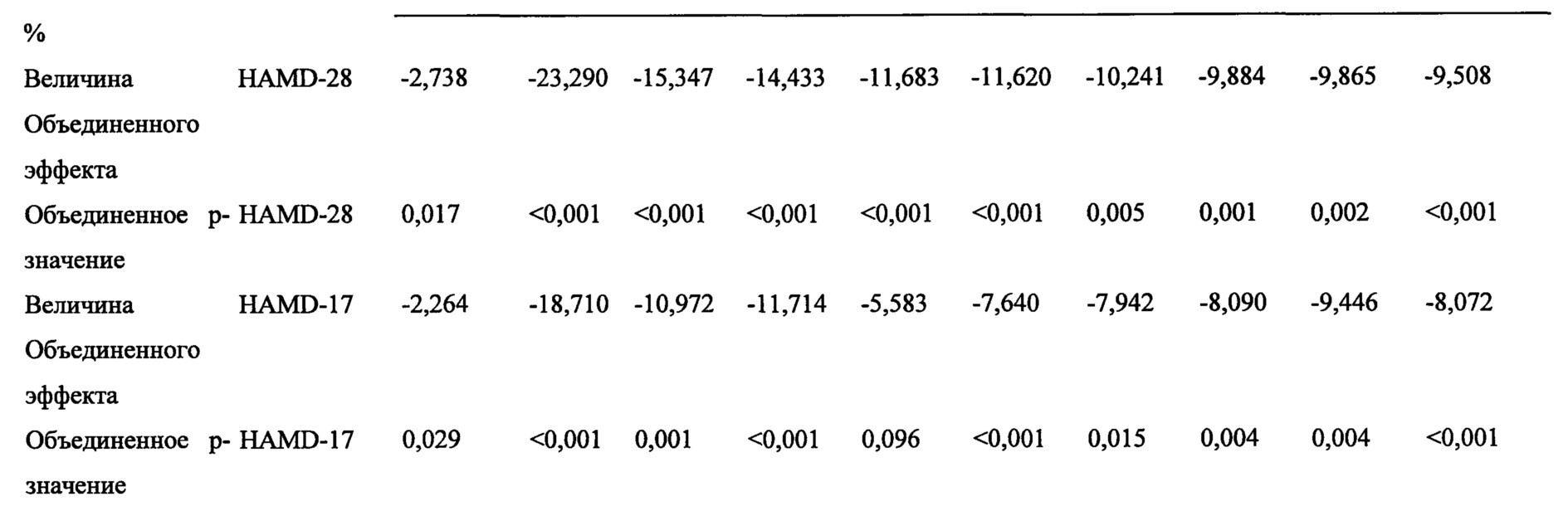
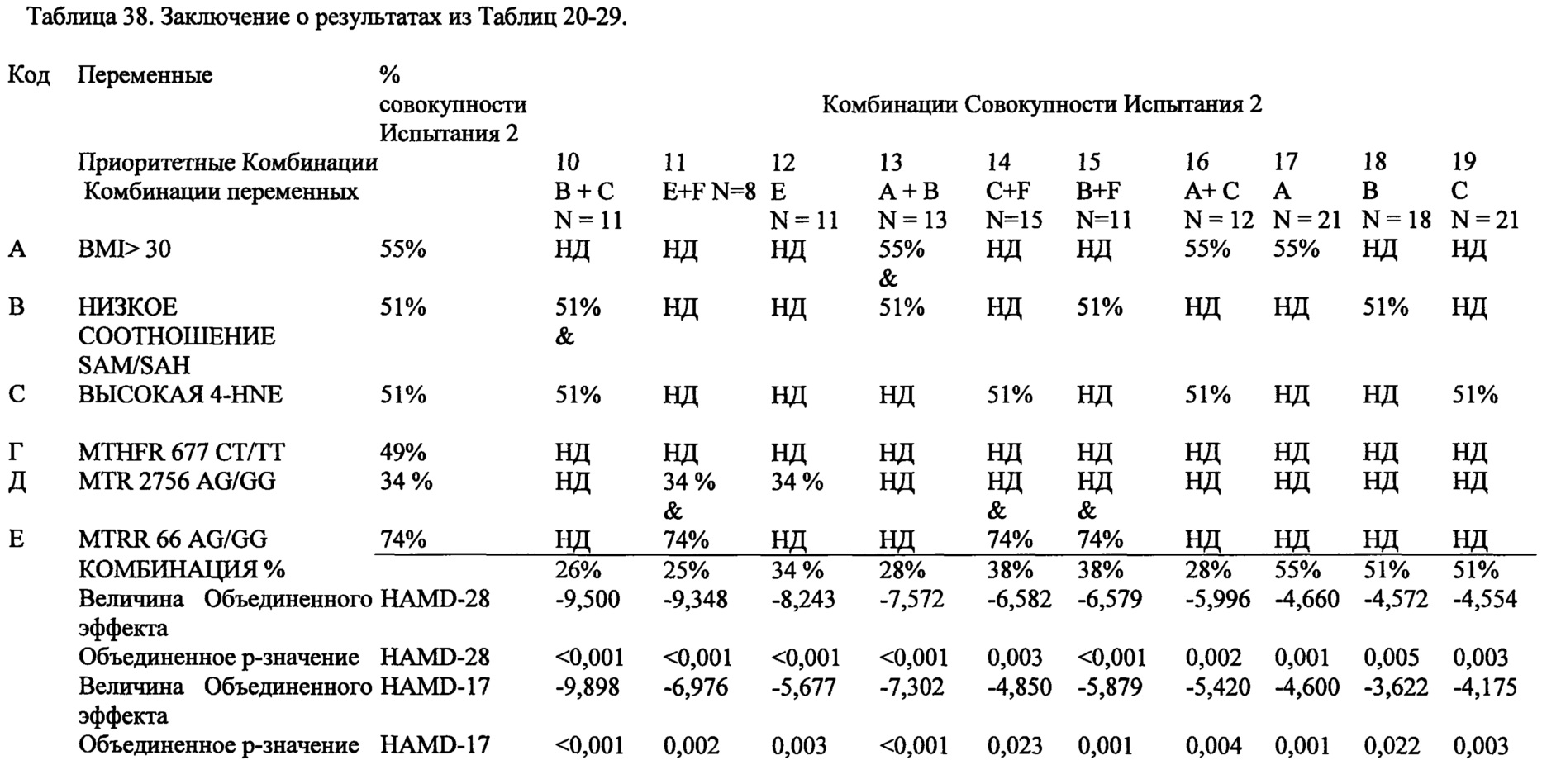
В дополнение к использованию для оценки воздействий шкал HAMD-17 или HAMD-28, другие шкалы, такие как Опросник социального функционирования (SFQ), визуальная аналоговая шкала (VAS), Опросник когнитивных и физических функций (CPFQ), Maier и HAMD-7 - подписала HAMD, также использовались для анализа воздействий и результатов, представленных на Фиг. 9А-9С и Фиг. 10А-10Е.
Дополнительные SNP-биомаркеры также оценивали по их воздействиям на изменение в HAMD-28 у пациентов с MDD, по меньшей мере, с одним редким вариантом как указано ниже, в противоположность полностью нормальному гену, когда они подвергались лечению фолат-содержащим соединением (например, 6(S)-5-MTHF) и SSRI. Хотя Таблица 39 перечисляет индивидуальные SNP-биомаркеры по их понижающему воздействию у пациентов с MDD (т.е. SNP-маркер с большим снижением в HAMD-28 перечислен ранее в таблице), это не должно толковаться как то, что один SNP-биомаркер более предпочтителен, чем другой биомаркер для применения в тестах, способах, системах и наборах описанных в данном документе, поскольку все эти SNP-биомаркеры показали значимое изменение по HAMD-28, когда пациенты с MDD, несущие, по меньшей мере, один указанный редкий вариант, подвергались лечению фолат-содержащим соединением, по сравнению с пациентами с MDD, несущими нормальные аллели гена. В некоторых воплощениях определенная комбинация любых SNP-биомаркеров индивидуально с низких приоритетом влияния могут производить синергичный эффект и/или даже иметь большую предиктивную силу, чем одиночный SNP-биомаркер с более высоким приоритетом влияния.
Таблица 39, как показано на следующей странице, демонстрирует влияния наличия, по меньшей мере, одного редкого варианта в указанных SNP-биомаркерах, в противоположность полностью нормальному гену, у пациентов с MDD на изменение балла HAMD-28, когда пациентов подвергали лечению фолат-содержащим соединением (например, 6(S)-5-MTHF) и SSRI.
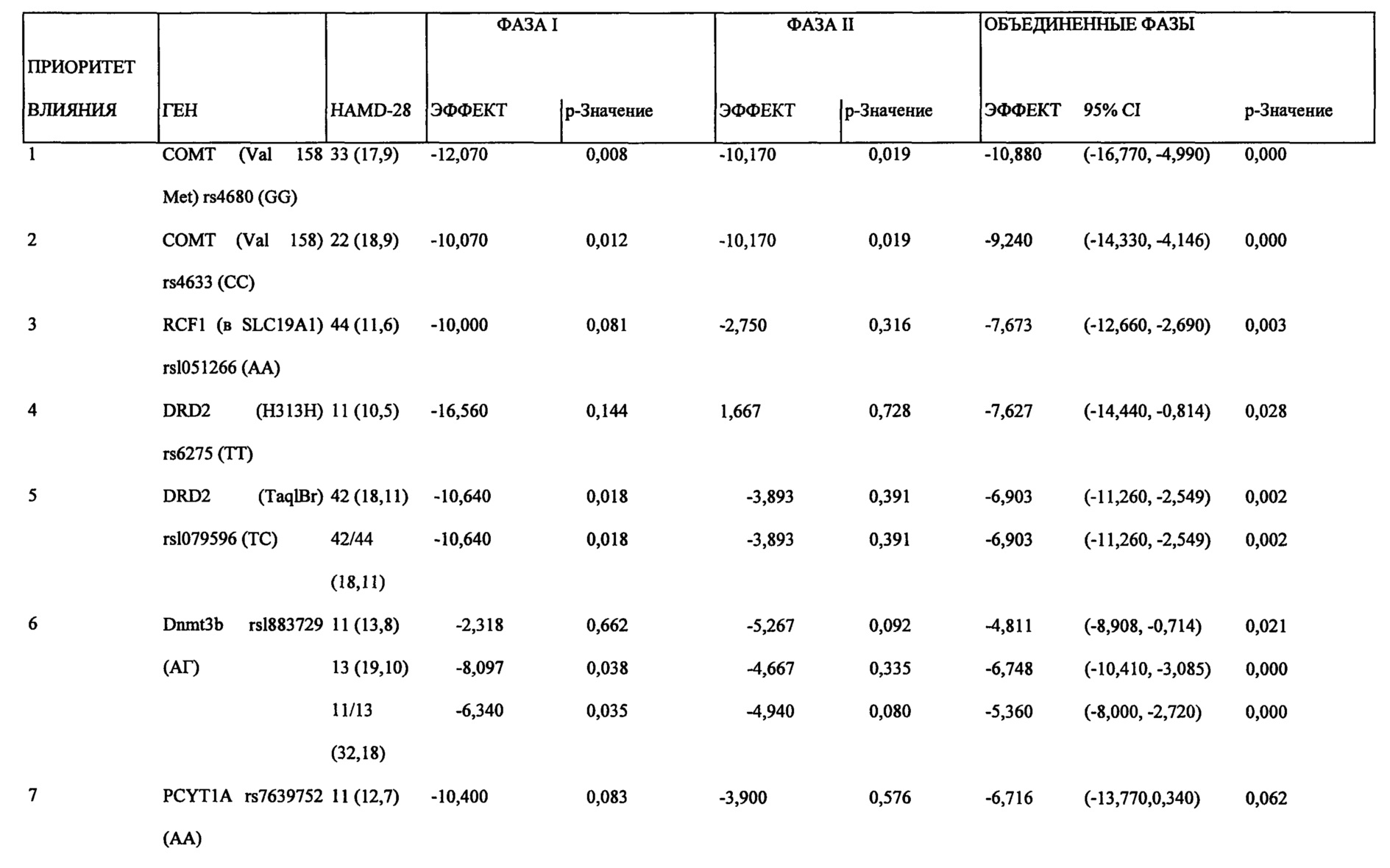
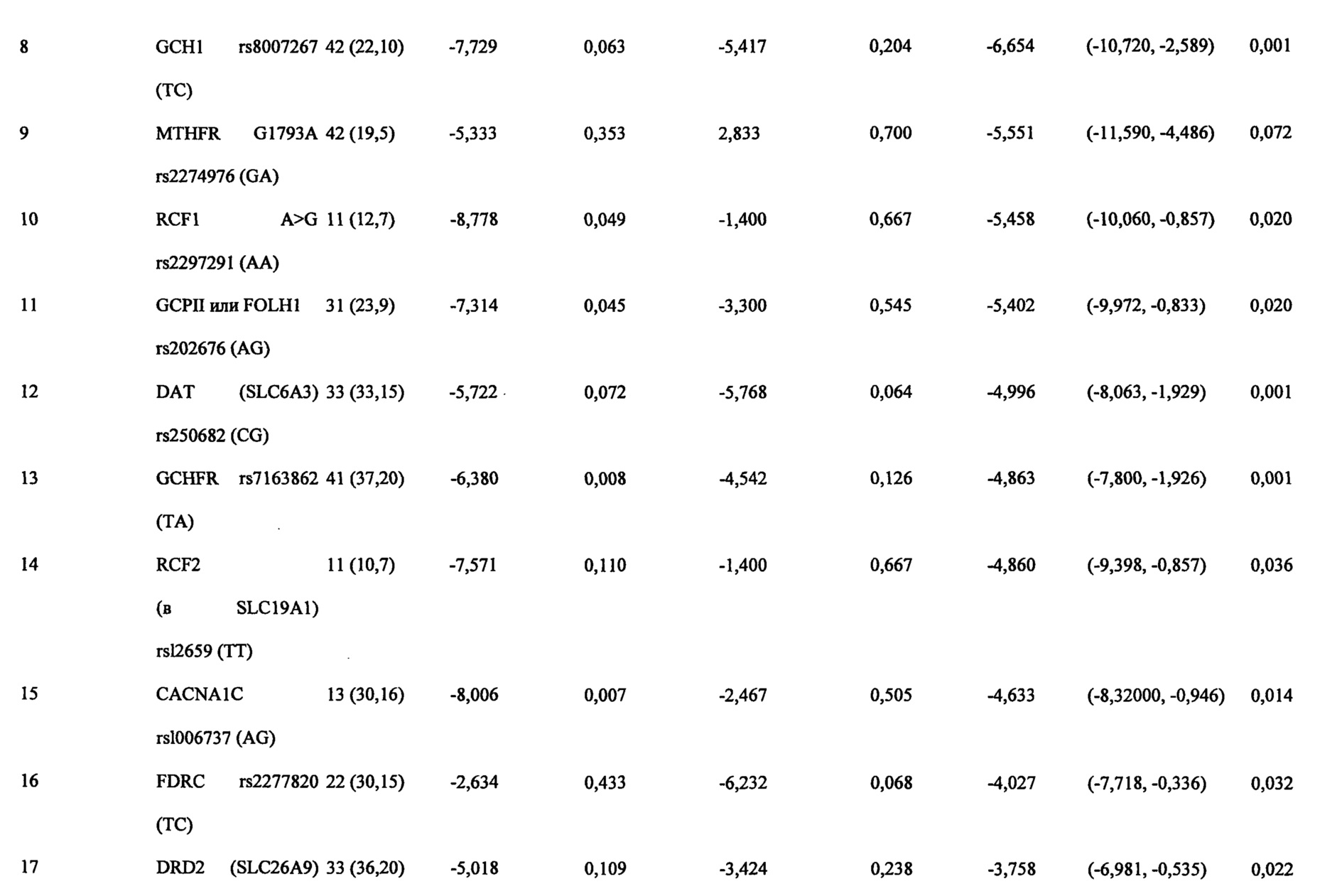
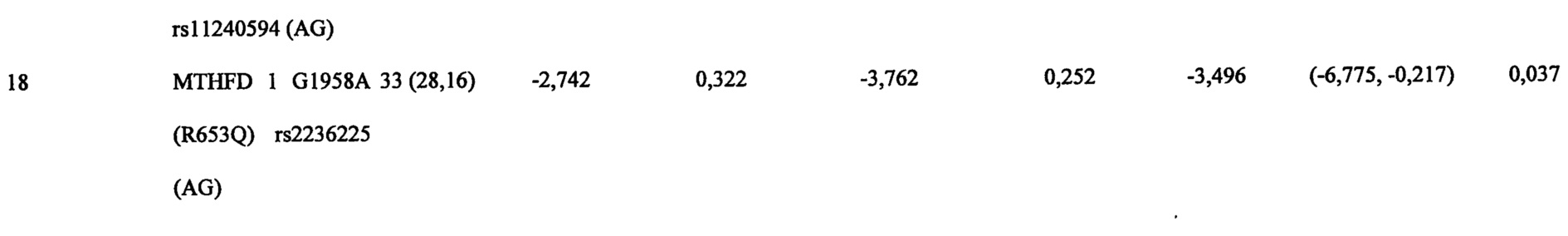
Пример 5. Примерные способы выбора пациентов для фолат-содержащей аугментационной терапии (с SSRI) и персонализированный прогноз пациентов с MDD, подвергнутых такой терапии.
На основании двойного слепого плацебо-контролируемого распределенного исследования аугментации лечения MDD с помощью фолат-содержащего соединения, например, DEPLIN®15, в котором 36 пациентов получали фолат-содержащее соединение, например, DEPLIN®15, которое приводило к снижению их HAMD-28 относительно измерения на исходном уровне, пациенты диагностированные с помощью, по меньшей мере, одного из состояний, описанных в Панели Тестов (РТ) с соответствующими «Значениями» (как представлено подробно ниже), в общем, отвечали в соответсвии с ожидаемым HAMD-28-снижением, как показано в Таблице 40 ниже.
Соответственно, способы лечения пациентов с MMD и/или определения или улучшения эффективности антидепрессантного лекарственного средства, принимаемого пациентами с MDD, также представлены в данном дкоументе. Например, в некоторых воплощениях способ может включать (1) скрининг для устойчивых к лечению пациентов с MDD (для подробностей см., например, Стадию 1 ниже); и (2) осуществление Панели Тестов на тестируемом образце пациента с MDD (для подробностей см., например, Стадию 2 ниже). В некоторых воплощениях, если результаты РТ демонстрируют, по меньшей мере, один Код группы как показано в Таблице 40 ниже, пациенту может быть рекомендован режим лечения, включающий антидепрессантное лекарственное средство и фолат-содержащее соединение (например, DEPLIN®15). В некоторых воплощениях если результаты РТ демонстрируют, по меньшей мере. Код группы как показано в Таблице 40 ниже, то ожидается, что соответствующее снижение в HAMD-28 от исходного значения (например, значения, измерение при первом визите) будет достигнуто при минимум 4 неделя лечения фолат-содержащим соединением (например, DEPLIN®15) в комбинации с антидепрессантным лекарственным средством (например, SSRI).
Стадия 1: Пациенты с MDD, устойчивые к лечению, подвергались скринингу для определения (а) если они соответствуют критериям DSM-IV для MDD; и (b) если они находятся на адекватной дозе SSRI и не имели адекватного ответа на один или несколько курсов SSRI. Если пациент удовлетворяет обоим критериям скрининга (а) и (b), то рекомендуется, чтобы врач заказал панель теста (РТ), как описано ниже.
Стадия 2: Может быть осуществлен пример панели теста (РТ), представленный ниже.

Панель теста (РТ), как показано выше, может быть модифицирована для удаления или добавления, по меньшей мере, одного или любой комбинации биомаркеров, показанных в Таблицах 41А-41В, прилагаемых к данному документу.
Стадия 3: На основании тестовых результатов состояний, перечисленных в РТ стадии (2), идентифицированы любые из РТ (пункты A-F) протестированные как положительные (т.е. с Решением ДА), и затем записаны в алфавитном порядке «Кодов», наибольшее число кодов представлено в Таблице 40 ниже. После того как группа Кода выбрана для РТ данного пациента, соответствующие «95% CI» (95% доверительные области) для этой группы Кода могут быть рассмотрены в Таблице 40. В некоторых воплощениях если верхняя граница CI ниже нуля, то снижение HAMD-28 от значения исходного уровня вероятно может быть значимым. В других воплощениях, если верхняя граница CI выше нуля, то снижение HAMD-28 от значения исходного уровня должно интерпретироваться с осторожностью.
Стадия 4: Ожидаемое снижение в HAMD-28 от исходного уровня может быть определено, например, следующим образом:
(a) Если пациент имеет только одно совпадение в РТ (то есть одно условие положительно), то снижение HAMD-28 с исходного уровня может быть основано на Коде «Все»; или
(b) Если пациент имеет двойное совпадение в РТ (два состояния являются положительными), то снижение HAMD-28 с исходного уровня может быть основано на максимально высоком ответе (т.е. наибольшее изменение HAM-D-28) полученное из А, В, С, Е или «ВСЕ», как показано в Таблице 40. В некоторых воплощениях если двойное совпадение является «D+F,» то снижение может быть основано на Коде «ВСЕ»;
(c) Если пациент имеет тройное совпадение в РТ (т.е. три состояния являются положительными), то снижение HAMD-28 с исходного уровня может быть основано на максимально высоком ответе (т.е. наибольшее изменение HAM-D-28), полученном из лучшей комбинации (т.е. лучшее из 2-кодовых комбинаций), как показано в Таблице 40. К примеру, если пациент имеет тройное совпадение на А, С и Е в РТ, возможными 2-кодовые комбинации являются А+С, А+Е и С+Е. Среди этих комбинаций, поскольку комбинация «А+Е» соответствует наибольшему снижению HAMD-28, как показано в Таблице 40, комбинация «А+Е» считается наилучшей комбинацией, которая соответствуют самому большому снижению HAMD-28. Однако, если тройное совпадение содержит «D+F», то снижение HAMD-28 должно быть основано на наибольшем ответе, полученном из одиночных кодов А, В, С, Е или «ВСЕ»;
(d) Отрицательные значения HAMDA в Таблице 40 отражают потенциальное снижение от исходного уровня HAMD-28 Испытания 2 (~24,47). Число HAMDA представляет собой ожидаемое снижение в шкале HAMD-28, которое может быть у пациента в ответ на аугментационную терапию Deplin®15 (с SSRI) всего за 4 недели. В некоторых воплощениях фактическое снижение может быть оказаться где-либо в пределах 95%, как показано в Таблице 40 ниже.
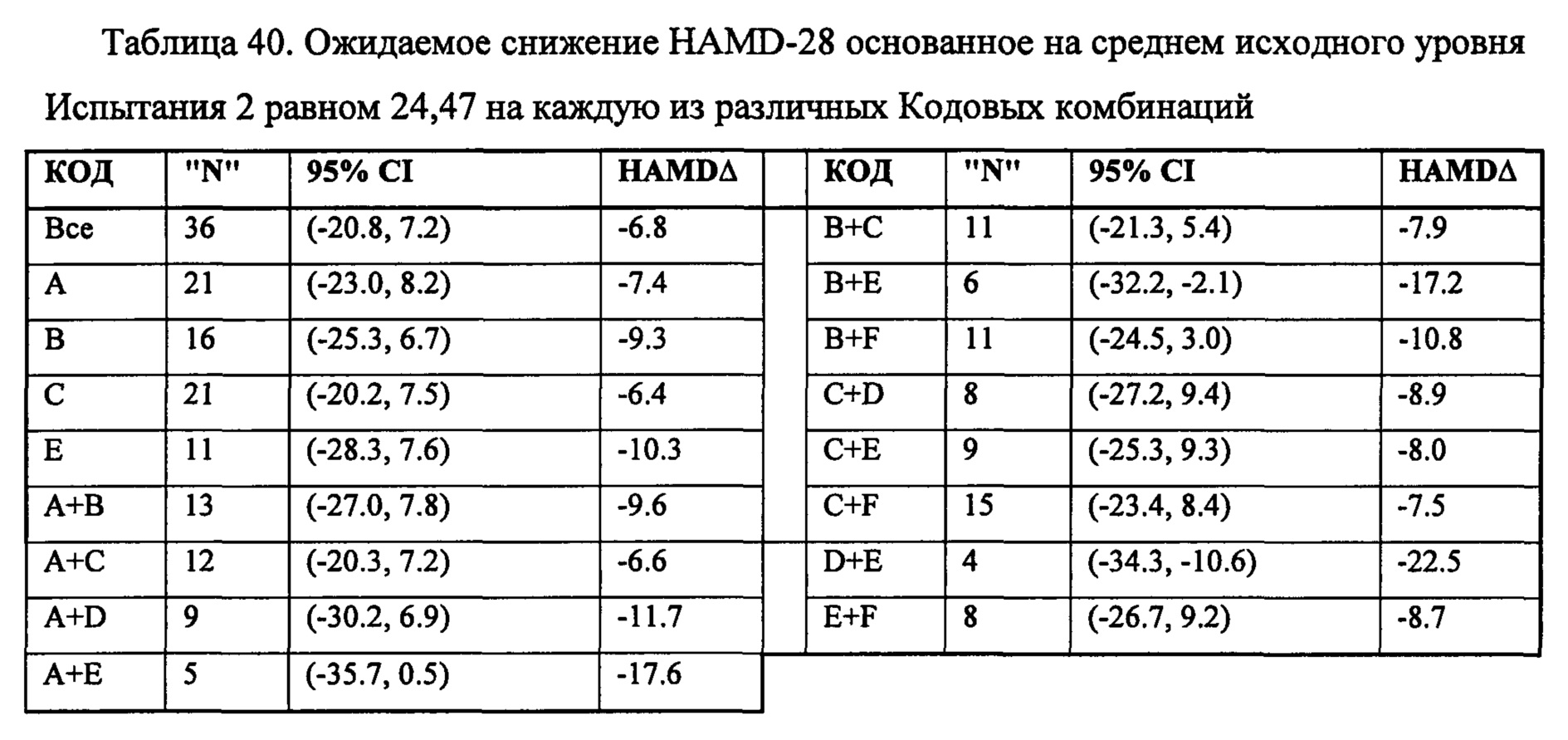
Список литературы
1. V. Herbert, Experimental nutritional folate deficiency in man. Trans Assoc Am Phys 75 (1961), p. 307.
2. M.W.P. Carney, Serum folate values in 423 psychiatric patients. Br Med J 4 (1967), p. 512.
3. E.H. Reynolds, J.M. Preece, J. Bailey and A. Coppen, Folate deficiency in depressive illness. Br J Psychiatry 117 (1970), p. 287.
4. S.D. Shorvon, M.W.P. Carney, I. Chanarin and E.H. Reynolds, The neuropsychiatry of megaloblastic anaemia. Br Med J 281 (1980), p. 1036.
5. MRC Vitamin Study Research Group, Prevention of neural tube defects: results of the Medical Research Council Vitamin Study. Lancet 338 (1991), p. 131.
6. E.B. Rimm, W.C. Willett, F.B. Hu et al., Folate and vitamin B6 from diet and supplements in relation to risk of coronary heart disease among women. JAMA 279 (1998), p. 359.
7. D. Mischoulon, Herbal remedies for mental illness. Psychiatr Clin North Am Annu Drug Ther6 (1999), p. 1.
8. A. Fugh-Berman and J.M. Cott, Dietary supplements and natural products as psychotherapeutic agents. Psychosom Med 61 (1999), p. 712.
9. American Psychiatric Association. Diagnostic and statistical manual of mental disorders, 4th ed. Washington, DC: American Psychiatric Association, 1994.
10. Клетки Т. Bottiglieri, Folate, vitamin В12, and neuropsychiatric disorders. Nutr Rev 54 (1997), p. 382.
11. J.E. Alpert and M. Fava, Nutrition and depression: the role of folate. Nutr Rev 55 (1997), p. 145.
12. B.R. Hutto, Folate and cobalamin in psychiatric illness. Compr Psychiatry 38 (1997), p. 305.
13. M.I. Botez, Т. Botez, J. Leveille, P. Bielmann and M. Cadotte, Neurological correlates of folic acid deficiency: facts and hypotheses. In: M.I. Botez and E.H. Reynolds, Editors, Folic acid in neurology, psychiatry and internal medicine, Raven Press, New York (1979), p. 435.
14. E.H. Reynolds, Anticonvulsant drugs, folate metabolism and mental symptoms. In: M. Dam, L. Gram and J.K. Penry, Editors, Advances in epileptology. XIIth Epilepsy International Symposium, Raven Press, New York (1981), p. 621.
15. J. Edeh and B.K. Toone, Antiepileptic therapy, folate deficiency, and psychiatric morbidity: a general practice survey. Epilepsia 26 (1985), p. 434.
16. S.D. Shorvon, M.W.P. Carney, I. Chanarin and E.H. Reynolds, The neuropsychiatry of megaloblastic anemia. Br Med J 281 (1980), p. 1036.
17. S.N. Young and M. Ghadirian, Folic acid and psychopathology. Prog Neuropsychopharmacol Biol Psychiatry 13 (1989), p. 841.
18. R. Crellin, Т. Bottiglieri and E.H. Reynolds, Folates and psychiatric disorders: clinical potential. Drugs 45 (1993), p. 623.
19. A.M. Ghadirian, J. Anath and F. Engelsmann, Folic acid deficiency in depression. Psychosomatics 21 (1980), p. 926.
20. M.W.P. Carney, T.K.N. Chary, M. Laundy et al., Red cell folate concentrations in psychiatric patients. J Affect Dis 19 (1990), p. 207.
21. Клетки Т. Bottiglieri, К. Hyland, M. Laundy et al., Folate deficiency, biopterin and monoamine metabolism in depression. Psychol Med 22 (1992), p. 871.
22. A. Wilkinson, D. Anderson, M. Abou-Saleh et al., 5-Methyltetrahydrofolate level in the serum of depressed subjects and its relationship to the outcome of ЕСТ. J Affect Disord 32 (1994), p. 163.
23. M.T. Abou-Saleh and A. Coppen, Serum and red blood cell folate in depression. Acta Psychiatr Scand 80 (1989), p. 78.
24. E.H. Reynolds, J.M. Preece, J. Bailey and A. Coppen, Folate deficiency in depressive illness. Br J Psychiatry 117 (1970), p. 287.
25. V.A. Wesson, A.J. Levitt and R.T. Joffe, Change in folate status with antidepressant treatment. Psychiatry Res 53 (1994), p. 313.
26. A. Levitt and R. Joffee, Folate, В12, and life course of depressive illness. Biol Psychiatry 25 (1989), p. 867.
27. I.R. Bell, J.S. Edman, D.W. Marby et al., Vitamin В12 and folate status in acute geropsychiatric inpatients: affective and cognitive characteristics of a vitamin nondeficient population. Biol Psychiatry 27 (1990), p. 125.
28. M. Fava, J.S. Borus, J.E. Alpert et al., Folate, B12, and homocysteine in major depressive disorder. Am J Psychiatry 154 (1997), p. 426.
29. Alpert M, Silva R, Pouget E. Folate as a predictor of response to sertraline or nortriptyline in geriatric depression. Presented at the 36th Annual Meeting of the NCDEU. Boca Raton, FL, May 28-31, 1996.
30. M. Fava and K.G. Davidson, Definition and epidemiology of treatment-resistant depression. Psychiatr Clin North Am 119 (1996), p. 176.
31. P.S.A. Godfrey, B.K. Toone, M.W.P. Camey et al., Enhancement of recovery from psychiatric illness by methylfolate. Lancet 336 (1990), p. 392.
32. M.W.P. Camey and B.F. Sheffield, Associations of subnormal serum folate and vitamin B12 values and effects of replacement therapy. J Nerv Ment Dis 150 (1970), p. 404.
33. S. Lee, Y.K. Wing and S. Fong, A controlled study of folate levels in Chinese inpatients with major depression in Hong Kong. J Affect Disord 49 (1998), p. 73.
34. P.F. Jacques, J. Selhub, A.G. Bostom, P.W.F. Wilson and I.H. Rosenberg, The effect of folic acid fortification on plasma folate and total homocysteine concentrations. N Engl J Med 340 (1999), p. 1449.
35. M.T. Abou-Saleh and A. Coppen, The biology of folate in depression: implications for nutritional hypotheses of psychoses. J Psychiatr Res 20 (1986), p. 91.
36. W.E. Thorton and B.P. Thornton, Folic acid, mental function and dietary habits. J Clin Psychiatry 39 (1978), p. 315.
37. A. Coppen, S. Chaudry and C. Swade, Folic acid enhances lithium prophylaxis. J Affect Disord 10 (1986), p. 9.
38. M. Passeri, S. Ventura, G. Abate, D. Cucinotta and P. LaGreca, Oral 5-methyltetrahydrofolate (MTHF) in depression association with Senile Organic Mental Disorders (OMDs): a double-blind, multicenter study vs. trazodone (TRZ). Eur J Clin Invest 21 (1993), p. 24.
39. G. Guaraldi, M. Fava, F. Mazzi and P. LaGreca, An open trial of methyltetrahydrofolate (MTHF) in elderly depressed patients. Ann Clin Psychiatry 5 (1993), p. 101.
40. Alpert JE, Mischoulon D, Rubenstein GE, Bottonari K, Nierenberg AA, Fava M. Folinic acid (Leucovorin) as an adjunctive treatment for SSRI-refractory depression. Ann Clin Psychiatry. 2002 Mar; 14(1):33-8.
41. M. Spillman and M. Fava, S-adenosyl-methionine in psychiatric disorders: historical perspective and current status. CNS Drugs 6 (1996), p. 416.
42. A. Ruck, S. Kramer, J. Metz and M. Brennan, Methyltetrahydrofolate is a potent and selective agonist for kainic acid receptors. Nature 287 (1980), p. 852.
43. R.A. Schatz, Т.Е. Wilens and O.Z. Sellinger, Decreased in vivo protein and phospholipid methylation after in vivo elevation of brain S-adenosylhomocysteine. Biochem Biophys Res Commun 98 (1981), p. 1097.
44. P.J. Shaw, Excitatory amino acid receptors, excitotoxicity and the human nervous system. Curr Opin Neurol Newosurg 6 (1993), p. 414.
45. M.B. Bowers, Jr and E.H. Reynolds, Cerebrospinal fluid folate and acid monoamine metabolites. Lancet 2 (1972), p. 137.
46. M.I. Botez and S.N. Young, Effects of anticonvulsants and low levels of folate and thiamine on amine metabolites in cerebrospinal fluid. Brain 114 (1991), p. 333.
47. M.I. Botez, S.N. Young, J. Bachevalier and S. Gauthier, Folate deficiency and decreased brain 5-hydroxytryptamine synthesis in man and rat. Nature 278 (1979), p. 182.
48. R. Surtees, S. Heales and A. Bowron, Association of cerebrospinal fluid deficiency of 5-methyltetrahydrofolate, but not S-adenosylmethionine, with reduced concentrations of the acid metabolites of 5-hydroxytryptamine and dopamine. Clin Sci 986 (1994), p. 697.
49. Alpert JE, Mischoulon D, Nierenberg AA, Fava M. Nutrition and depression: focus on folate. Nutrition. 2000 Jul-Aug; 16(7-8):544-6
50. Fava M, Davidson KG. Definition and epidemiology of treatment-resistant depression. Psychiatr Clin North Am. 1996 Jun; 19(2): 179-200.
51. Fava M, Evins AE, Dorer DJ, Schoenfeld DA. The problem of the placebo response in clinical trials for psychiatric disorders: culprits, possible remedies, and a novel study design approach. Psychother Psychosom. 2003 May-Jun; 72(3):115-27.
52. Trivedi MH, Rush AJ, Ibrahim HM et al. The Inventory of Depressive Symptomatology, Clinician Rating (IDS-C) and Self-Report (IDS-SR), and the Quick Inventory of Depressive Symptomatology, Clinician Rating (QIDS-C) and Self-Report (QIDS-SR) in public sector patients with mood disorders: a psychometric evaluation. Psychol Med 2004; 34(1):73-82.
53. Fava M. Diagnosis and definition of treatment-resistant depression. Biol Psychiatry. 2003 Apr 15; 53(8):649-59.
54. Levine J, Schooler NR. General versus specific inquiry with SAFTEE. J Clin Psychopharmacol 1992; 12(6):448.
55. Hamilton M.A rating scale for depression. J Neurol Neurosurg Psychiatry. 1960 Feb; 23:56-62.
56. Fava M, Rankin MA, Alpert JE, Nierenberg AA, Worthington JJ. An open trial of oral sildenafil in antidepressant-induced sexual dysfunction. Psychother Psychosom. 1998; 67(6):328-31.
57. DeLoach LJ, Higgins MS, Caplan AB, Stiff JL. The visual analog scale in the immediate postoperative period: intrasubject variability and correlation with a numeric scale. Anesth Analg. 1998; 86(1):102-6.





Следует понимать, что примеры являются исключительно наглядными и их не следует принимать в качестве ограничивающих объем изобретения. Различные изменения и модификации изложенных воплощений, которые будут ясны специалистам в данной области, могут быть осуществлены, не выходя при этом за рамки смысла и сущности настоящего изобретения. Кроме того, все патенты и другие идентифицированные публикации, специально включены в данный документ ссылкой, для целей описания и раскрытия, например, методологий, описанных в таких публикациях, которые могут быть использованы в связи с настоящим изобретением. Эти публикации представлены исключительно для их раскрытия до даты подачи настоящей заявки. Ничто в связи с этим не должно быть истолковано как признание того, что изобретение не имеет право датировать более ранним числом такие раскрытия посредством предшествующего изобретения. Все заявления относительно даты или представление относительно содержания этих документов основаны на информации, доступной для заявителей, и не представляют собой какое-либо признание относительно правильности дат или содержания этих документов.