Результат интеллектуальной деятельности: Способ оценки качества клеточного материала
Вид РИД
Изобретение
Изобретение относится области микробиологии и медицины и может быть использовано, преимущественно, для оценки качества клеточного материала, полученного из пуповины и плаценты человека для медицинского применения по уровню метаболической активности с помощью МТТ-теста.
Выделение и культивирование клеток мезенхимального происхождения из постнатальных органов и тканей человека является основой для получения клеточных материалов (КМ), используемых в регенеративной медицине для терапии патологий различного генеза.
Медицинское применение КМ имеет ряд особенностей по сравнению с обычными фармакологическими препаратами. Прежде всего, это связано с тем, что КМ - это живой объект. Живые клетки в материале имеют свою вариативность: различный уровень жизнеспособности, степень зрелости, различные стадии жизненного цикла, и т.д. Отсюда вытекает главная проблема при медицинском использовании КМ - его стандартизация, которая будет обеспечивать не только биобезопасность такого препарата, но и предсказуемость клинического эффекта при его применении. Таким образом, экспериментальные исследования в области стандартизации производства и контроля качества КМ из первичных клеточных культур мезенхимального происхождения обладают несомненной научно-практической актуальностью.
В настоящем изобретении предложен способ оценки качества первичных клеточных культур по уровню метаболической активности с помощью МТТ-теста, где МТТ - 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-тетразолиум бромид (тетразолиевый краситель.
Известны способы оценки качества клеточного материала.
Один из способов, предназначенный для комплексной оценки ангиогенного потенциала прогениторных клеток [RU 2548801, С2, C12N 5/071, 20.04.2015], включает количественное измерение содержания мРНК и белков ключевых проангиогенных факторов, фактора роста эндотелия сосудов (VEGF), плацентарного фактора роста (PlGF), фактора роста гепатоцитов (HGF), ангиопоэтина-1 и ангиогенина, продуцируемых клетками, ангиогенной активности суммарных продуктов секреции клеток, содержащих по крайней мере указанные факторы, на модели формирования тубулярных структур эндотелиальными клетками человека в присутствии кондиционированной среды от прогениторных клеток, а также оценку способности собственных прогениторных клеток пациента стимулировать васкуляризацию подкожных имплантатов Матригеля, введенных иммунодефицитным мышам, при этом, вывод о сниженном ангиогенном потенциале делают при следующих значениях исследуемых параметров: VEGF <2,4 отн.ед. (мРНК) и <23 нг/млн клеток (уровень секреции), PlGF <6,6 отн.ед. (мРНК) и <0,5 нг/млн клеток (уровень секреции), HGF <2,5 отн.ед. (мРНК) и <20 нг/млн клеток (уровень секреции), ангиопоэтин-1 <2,4 отн.ед. (мРНК) и <1,0 нг/млн клеток (уровень секреции), ангиогенин <0,4 отн.ед. (мРНК) и <6,8 нг/млн клеток (уровень секреции), ангиогенная активность суммарных продуктов секреции <89143 отн.ед., уровень васкуляризации имплантатов Матригеля по общему количеству сосудов <69 отн.ед.
Недостатком способа является относительно большая сложность.
Кроме того, известен способ оценки жизнеспособности клеток [RU 2532839, С2, C12Q 1/06, G01N 33/48, G01N 21/64, 10.11.2014], включающий помещение клеток в ячейку для культивирования клеток микробиореактора, приготовление рабочего раствора витального красителя, пригодного для использования в качестве флуоресцентного маркера жизнеспособных клеток, внесение его в ячейку для культивирования клеток микробиореактора, инкубацию клеток в растворе витального красителя, удаление несвязавшегося с клетками раствора витального красителя путем замены раствора инкубации на ростовую среду, не содержащую краситель, при этом клетки помещают в мембранную ячейку сменного клеточного блока микробиореактора, оптический световод, соединенный со спектрометром, приводят в контакт с оптически прозрачным материалом сменного клеточного блока непосредственно под мембранной ячейкой сменного клеточного блока микробиореактора, после чего измеряют опорный спектр флуоресцентного сигнала как интеграл интенсивности флуоресценции в соответствующем витальному красителю диапазоне длин волн на мембранной ячейке сменного клеточного блока микробиореактора, в которой отсутствуют исследуемые клетки, а также измеряют спектр флуоресцентного сигнала как интеграл интенсивности флуоресценции в соответствующем витальному красителю диапазоне длин волн на мембранной ячейке сменного клеточного блока микробиореактора с исследуемыми клетками, после чего из полученного спектра флуоресцентного сигнала для мембранной ячейки сменного клеточного блока микробиореактора с исследуемыми клетками вычитают опорный спектр флуоресцентного сигнала для мембранной ячейки сменного клеточного блока микробиореактора без исследуемых клеток, вычисляют количество жизнеспособных клеток в мембранной ячейке сменного клеточного блока микробиореактора на основании полученной величины интенсивности сигнала флуоресценции.
Недостатком этого технического решения является его относительно низкая оперативность.
Наиболее близким по технической сущности к предложенному является способ оценки жизнеспособности клеток [Буронова В.В. Проблемы стандартизации при получении клеточных культур мехенхиального происхождения: экспериментальный и теоретический анализ. Автореферат диссертации на соискание ученой степени кандидата биологических наук. М,, 2011, стр. 4, 6, 7, 8, 19], согласно которому клеточный материал, полученный из пуповины и плаценты человека, пересевают пересевают в полной ростовой среде на 96-луночный планшет по 5000 клеток первые 8 лунок, по 2500 клеток во вторые 8 лунок и по 1250 клеток в третьи 8 лунок, через 6 часов из лунок удаляют среду и вносят в каждую лунку по 100 мкл культуральной среды без фетальной телячьей сыворотки и по 10 мкл раствора бромид 3-(4,5-диметилтиазол-2-ил)-2,5-тетразолия (МТТ) 10 мг/мл в PBS (натрий-фосфатный буфер, представляющий собой водный раствор солей, содержащий хлорид натрия, гидрофосфат натрия, хлорид калия и дигидрофосфат калия, в котором осмолярность и концентрации ионов в растворе соответствуют концентрациям в теле человека - изотонический буферный раствор), затем инкубируют 1 час при 37°С в атмосфере 5% CO2, после инкубации из лунок культурального планшета удаляляют среду без захвата клеток и вносят по 100 мкл диметилсульфоксида для экстракции внутриклеточного МТТ-формазана и измеряют оптическую плотность спектрофотометрически при длине волны 540 нм против диметилсульфоксида, по величине которой выносят суждение о жизнеспособности клеточного материала.
Недостатком наиболее близкого технического решения является его относительно низкая оперативность.
Действительно, величина оптической плотности используется в известном техническом решении при сравнении ряда образцов с учетом известной рекомендации, что, чем выше оптическая плотность, тем выше качество клеточного материала. Однако отсутствие относительно четких критериев оценки качества клеточного материала не позволяет оперативно решать вопрос о достаточном качестве имеющегося образца клеточного материала, что делает необходимым поведения дополнительных исследований. Это снижает оперативность известного способа.
Задачей, которая решается в изобретении, является повышение оперативности способа с целью возможности использования его в форме экспресс-диагностики, включая использование единичных образцов клеточного материала.
Требуемый технический результат, реализуемый при использовании способа, заключается в повышении оперативности.
Поставленная задача решается, а требуемый технический результат достигается тем, что, в способе оценки жизнеспособности клеточного материала, полученного из пуповины и плаценты человека, согласно которому клетки пересевают в полной ростовой среде на 96-луночный планшет по 5000 клеток первые 8 лунок, по 2500 клеток во вторые 8 лунок и по 1250 клеток в третьи 8 лунок, через 6 часов из лунок удаляют среду и вносят в каждую лунку по 100 мкл культуральной среды без фетальной телячьей сыворотки и по 10 мкл раствора бромид 3-(4,5-диметилтиазол-2-ил)-2,5-тетразолия (МТТ) 10 мг/мл в PBS (натрий-фосфатный буфер, представляющий собой водный раствор солей, содержащий хлорид натрия, гидрофосфат натрия, хлорид калия и дигидрофосфат калия, в котором осмолярность и концентрации ионов в растворе соответствуют концентрациям в теле человека - изотонический буферный раствор), затем инкубируют 1 час при 37°С в атмосфере 5% CO2, после инкубации из лунок культурального планшета удаляляют среду без захвата клеток и вносят по 100 мкл диметилсульфоксида для экстракции внутриклеточного МТТ-формазана и измеряют оптическую плотность спектрофотометрически при длине волны 540 нм против диметилсульфоксида, согласно изобретению, к жизнеспособному клеточному материалу относят III-VI пассажи с сигналом 6,5*105 опт.ед. и выше на 5 тыс./кл.
На чертежах представлены:
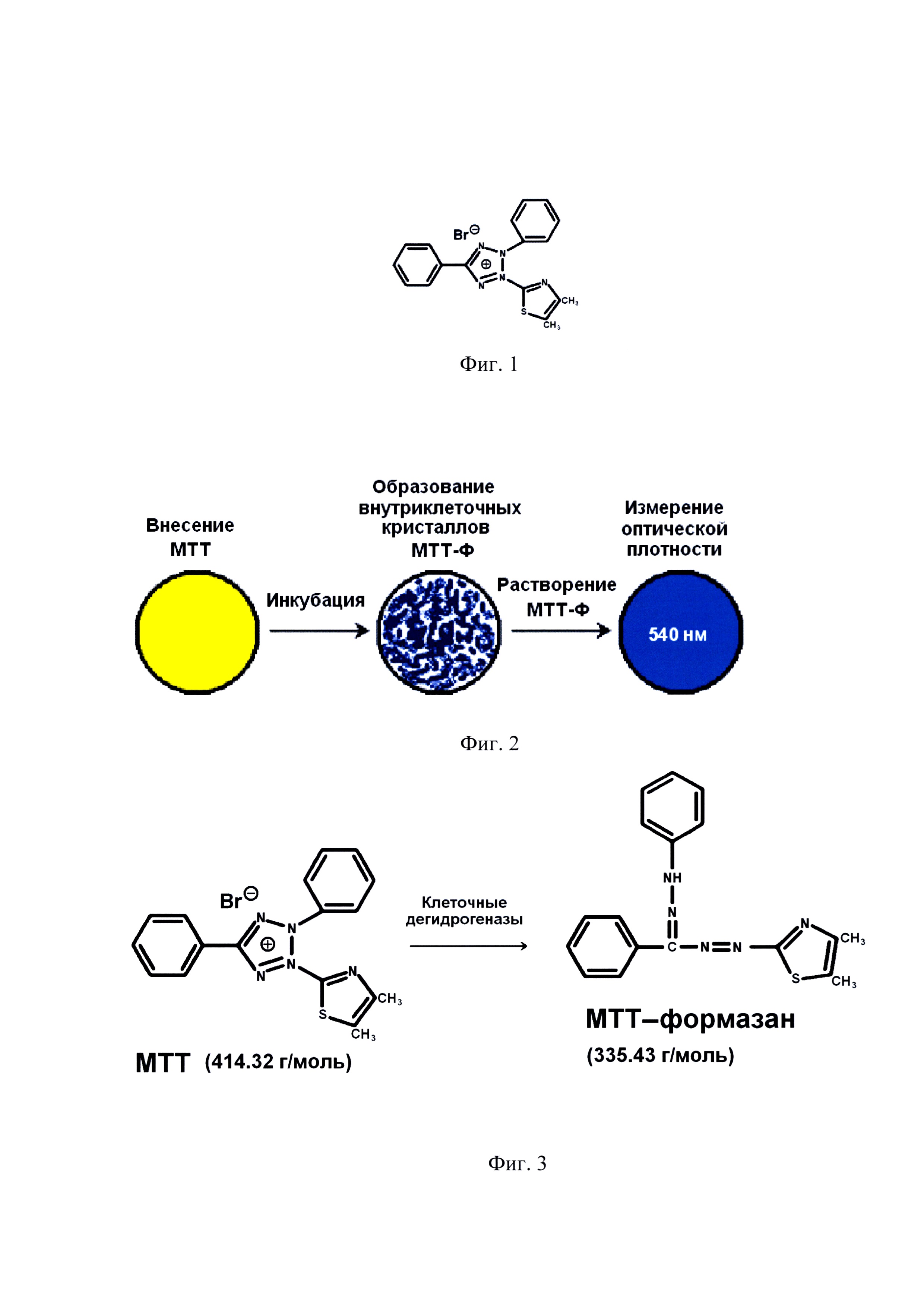
на фиг. 1 - структурная формула бромида 3-(4,5-диметилтиазол-2-ил)-2,5-тетразолия (МТТ) (414.3 г/моль);
на фиг. 2 - общая схема МТТ-теста;
на фиг. 3 - схема преобразования МТТ в МТТ-Ф под действием клеточных дегидрогеназ;
на фиг. 4 - кристаллы МТТ-формазана в цитоплазме первичных клеточных культур МСК человека (IV пассаж) (увеличение 200: А - МСК из пуповины; Б - МСК из плаценты);
на фиг. 5 - схема «комбинированной модели» МТТ-метода;
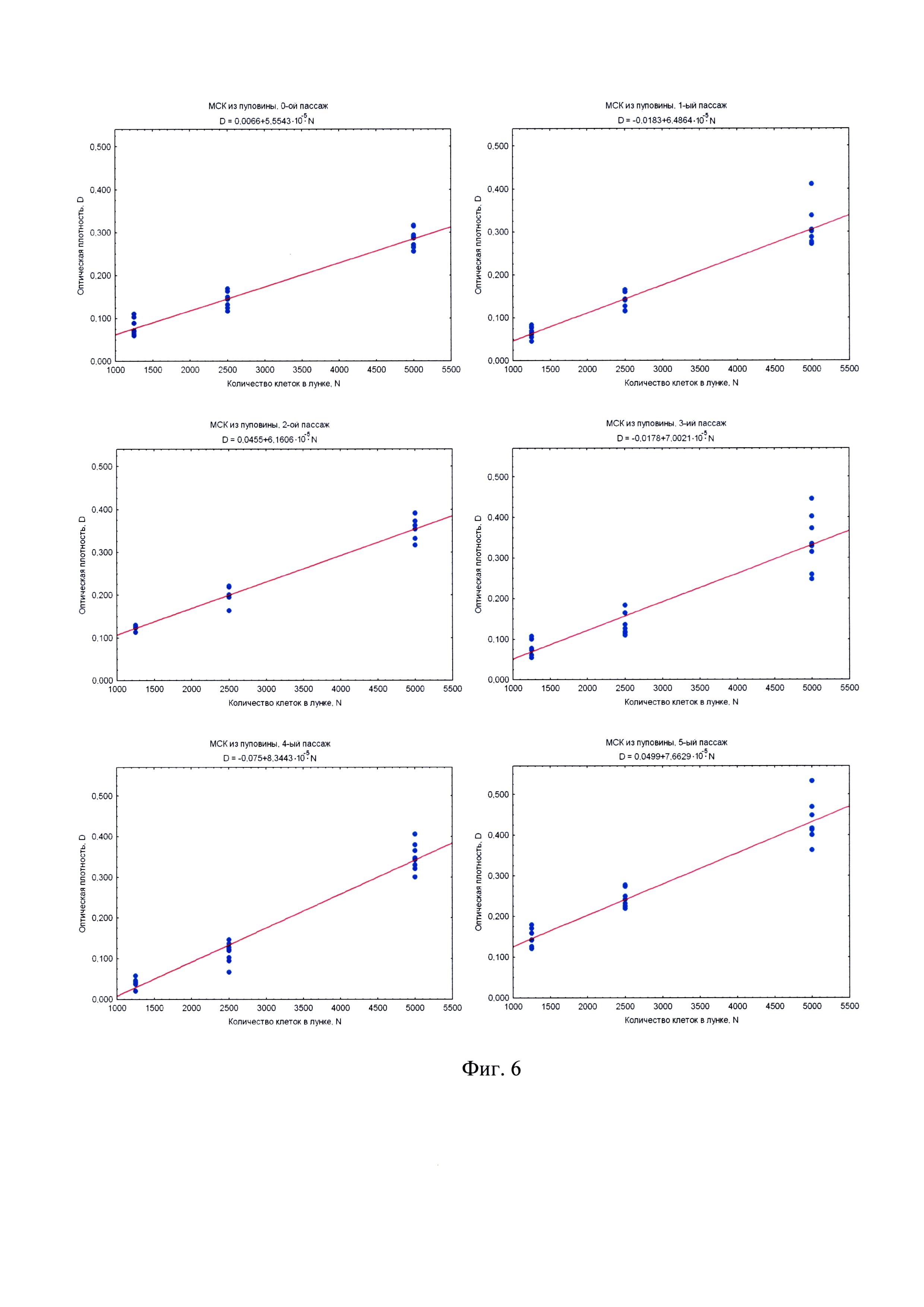
на фиг. 6 - наилучшие прямые, построенные методом наименьших квадратов по наборам данных МТТ-теста (по 8 повторов на каждую точку) для различных концентраций МСК из пуповины человека (оптическая плотность D измерялась в оптических единицах для 540 нм против DMSO);
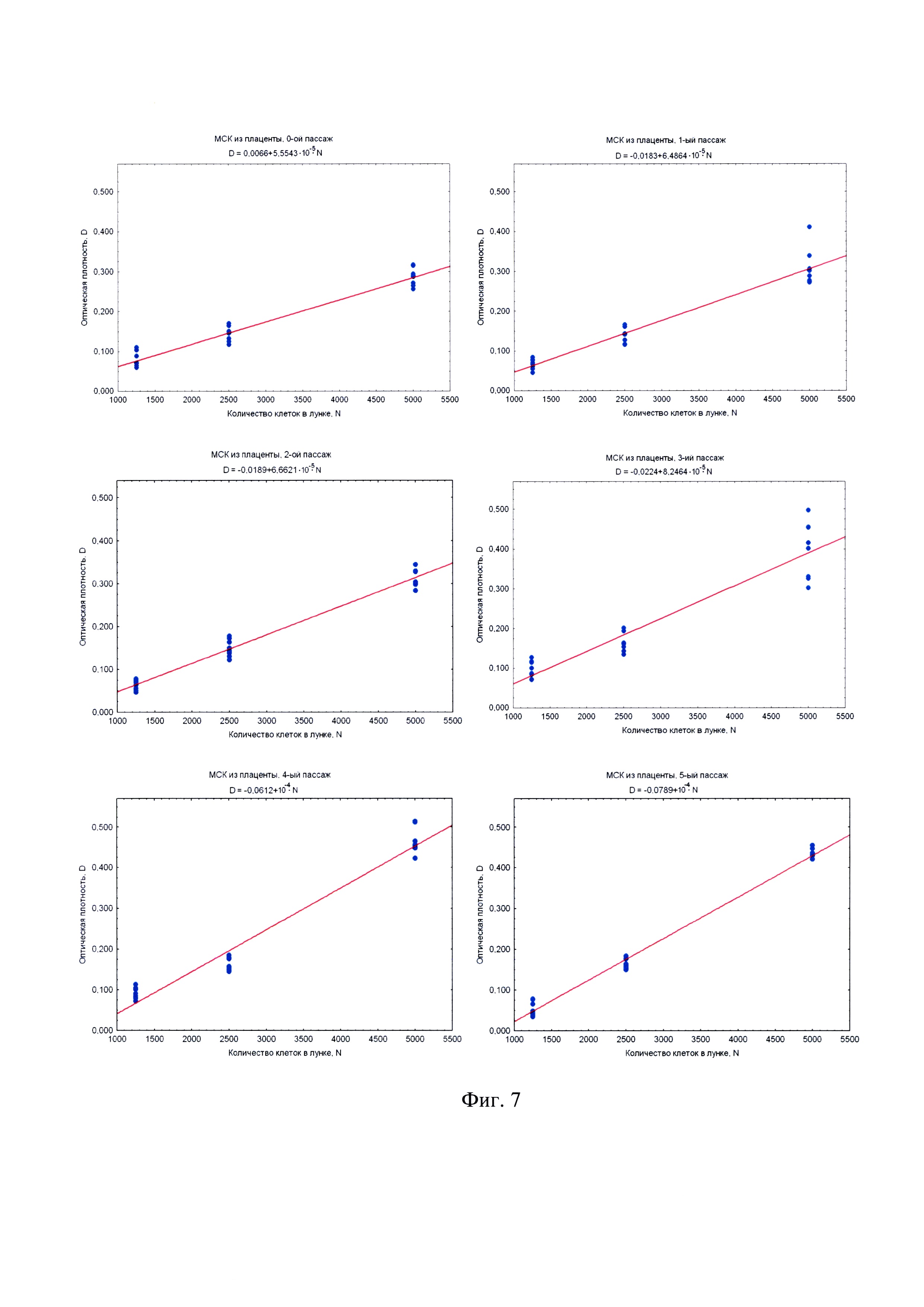
на фиг. 7 - наилучшие прямые, построенные методом наименьших квадратов по наборам данных МТТ-теста (по 8 повторов на каждую точку) для различных концентраций МСК из плаценты человека (оптическая плотность D измерялась в оптических единицах для 540 нм против DMSO);
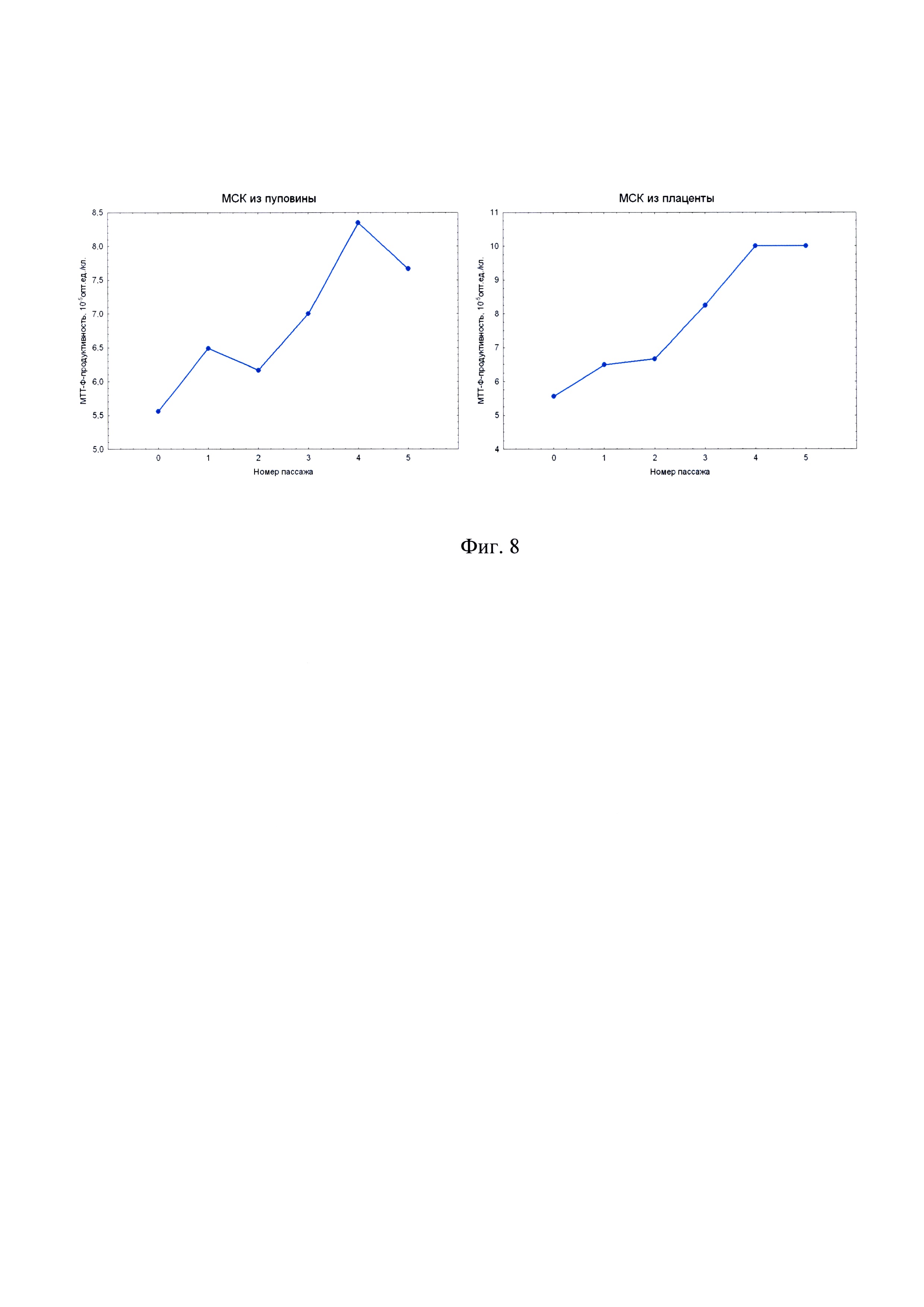
на фиг. 8 - зависимость МТТ-Ф-продуктивности от пассажа для первичных клеточных культур мезенхимального происхождения из пуповины и плаценты человека.
Предложенный способ оценки качества клеточного материала реализуется следующим образом.
В основу предложенного способа положен установленный заявителем факт, что уровень оптического сигналы в МТТ-способе диагностики прямо пропорционален количеству жизнеспособных клеток мезенхимального происхождения, что позволяет использовать этот способ для экспресс-анализа жизнеспособности клеточных культур. При этом, выявлено, что уровень дегидрогеназной активности в первичной культуре клеток мезенхимального происхождения возрастает на протяжении первых V-VII пассажей, после чего постепенно снижается. Это позволило разработать и внедрить лабораторный стандарт производства клеточного материала (КМ) на основе первичных культур клеток мезенхимального происхождения из плаценты и пуповины человека, интегрирующий в единую технологическую схему контроль жизнеспособности клеточных культур по уровню дегидрогеназной активности клеток.
Для этого в способе оценки жизнеспособности клеточного материала, полученного из пуповины и плаценты человека, клетки пересевают в луночный планшет и инкубируют, причем клетки пересевают в полной ростовой среде на 96-луночный планшет по 5000 клеток первые 8 лунок, по 2500 клеток во вторые 8 лунок и по 1250 клеток в третьи 8 лунок, через 6 часов из лунок удаляют среду и вносят в каждую лунку по 100 мкл культуральной среды без фетальной телячьей сыворотки и по 10 мкл раствора бромид 3-(4,5-диметилтиазол-2-ил)-2,5-тетразолия (МТТ) 10 мг/мл в PBS (натрий-фосфатный буфер, представляющий собой водный раствор солей, содержащий хлорид натрия, гидрофосфат натрия, хлорид калия и дигидрофосфат калия, в котором осмолярность и концентрации ионов в растворе соответствуют концентрациям в теле человека - изотонический буферный раствор), затем инкубируют 1 час при 37°С в атмосфере 5% СО2, после инкубации из лунок культурального планшета удаляляют среду без захвата клеток и вносят по 100 мкл диметилсульфоксида для экстракции внутриклеточного МТТ-формазана и измеряют оптическую плотность спектрофотометрически при длине волны 540 нм против диметилсульфоксида, по величине которой выносят суждение о жизнеспособности клеточного материала.
Обработка данных проводится методом наименьших квадратов, для которого оптимально 8 повторов на каждую точку. Чтобы этим методом построить наилучшие прямые (построенные методом наименьших квадратов по наборам данных МТТ-теста по 8 повторов на каждую точку), которые впоследствии могут служить калибровочными графиками, это делалось для различных концентраций клеток. Меньшее количество повторов может не обеспечить требуемую достоверность, а большее количество является излишне сложным и резко снижает оперативность способа. Оптическая плотность D измерялась в оптических единицах для 540 нм против DMSO.
Далее через 6 часов из лунок удаляют среду и вносят в каждую лунку по 100 мкл культуральной среды без фетальной телячьей сыворотки и по 10 мкл раствора бромид 3-(4,5-диметилтиазол-2-ил)-2,5-тетразолия (МТТ) 10 мг/мл в PBS (натрий-фосфатный буфер, используемый в биологических исследованиях, представляет собой водный раствор солей, содержащий хлорид натрия, гидрофосфат натрия, хлорид калия и дигидрофосфат калия. Осмолярность и концентрации ионов в растворе обычно соответствуют концентрациям в теле человека, т.е. данный буферный раствор является изотоническим).
Затем инкубируют 1 час при 37°С в атмосфере 5% СО2, после инкубации из лунок культурального планшета удаляют среду без захвата клеток и вносят по 100 мкл диметилсульфоксида для экстракции внутриклеточного МТТ-формазана и измеряют оптическую плотность спектрофотометрически при длине волны 540 нм против диметилсульфоксида, по величине которой выносят суждение о жизнеспособности клеточного материала.
МТТ-метод, первоначально предложенный Т. Mosmann (1983) для оценки жизнеспособности суспензионных клеточных культур, является удобным зондом для определения уровня дегидрогеназной активности клеток различного происхождения. Суть МТТ-метода заключается в способности живых клеток превращать растворимый желтый бромид 3-(4,5-диметилтиазол-2-ил)-2,5 тетразолия (МТТ) в нерастворимые пурпурно-синие внутриклеточные кристаллы МТТ-формазана (МТТ-Ф) под действием клеточных дегидрогеназ. Дегидрогеназы, осуществляющие превращение МТТ→МТТ-Ф, представляют собой группу ферментов из класса оксидоредуктаз, катализирующих перенос протонов от субстрата и пары электронов к акцептору. Дегидрогеназы представлены в реакциях углеводного (гликолиз, пентозофосфатный путь) и жирового обмена (окисление жирных кислот), а также в процессе клеточного дыхания (цикл трикарбоновых кислот, перенос электронов к системе цитохромов). Они локализуются в цитозоле и митохондриях клеток там же локализуются и кристаллы МТТ-Ф. Чем выше активность клеточных дегидрогеназ, тем выше уровень метаболизма в клетке, что является основным показателем ее жизнеспособности. Таким образом, чем выше оптическая плотность экстрагированного МТТ-формазана, тем выше жизнеспособность клеток.
Пример реализации способа
Клетки пересевали в полной ростовой среде. Состав ростовой среды: DMEM-F12, 10% фетальная телячья сыворотка, 100 Ед./мл пенициллина, 100 Ед./мл стрептомицина, 2 мМ глютамина, 1 мМ пирувата натрия, 10 нг/мл β-FGF («Gibco», США)) на 96-луночный планшет: в 8 лунок - по 5000 клеток, в другие 8 лунок - по 2500 клеток, в другие 8 лунок - по 1250 клеток. Через 6 ч, когда клетки полностью адсорбировались на пластике, из лунок удаляли среду и вносили в каждую лунку по 100 мкл культуральной среды без фетальной телячьей сыворотки и по 10 мкл раствора бромид 3-(4,5-диметилтиазол-2-ил)-2,5-тетразолия (МТТ) (фиг. 1) 10 мг/мл в PBS.
Затем инкубировали в течение 1 часа при 37°С в атмосфере 5% СО2. После инкубации из лунок культурального планшета осторожно удаляли среду (следя за тем, чтобы не захватить клетки) и вносили по 100 мкл диметилсульфоксида (ДМСО) для экстракции внутриклеточного МТТ-формазана. Оптическую плотность измеряли спектрофотометрически при длине волны 540 нм против 100 мкл ДМСО (фиг. 2).
Необходимость экспериментальной верификации зависимости уровня измеряемого сигнала от количества жизнеспособных клеток в МТТ-методе определяется отсутствием однозначных теоретических концепций. Действительно, МТТ-метод, первоначально предложенный для оценки жизнеспособности суспензионных клеточных культур, является удобным зондом для определения уровня дегидрогеназной активности клеток различного происхождения. Суть МТТ-метода заключается в способности живых клеток превращать растворимый желтый бромид 3-(4,5-диметилтиазол-2-ил)-2,5 тетразолия (МТТ) в нерастворимые пурпурно-синие внутриклеточные кристаллы МТТ-формазана (МТТ-Ф) под действием клеточных дегидрогеназ. Дегидрогеназы, осуществляющие превращение МТТ→МТТ-Ф (фиг. 3), представляют собой группу ферментов из класса оксидоредуктаз, катализирующих перенос протонов от субстрата и пары электронов к акцептору. Дегидрогеназы представлены в реакциях углеводного (гликолиз, пентозофосфатный путь) и жирового обмена (окисление жирных кислот), а также в процессе клеточного дыхания (цикл трикарбоновых кислот, перенос электронов к системе цитохромов). Они локализуются в цитозоле и митохондриях клеток именно в цитоплазме, но не в ядре, локализуются и кристаллы МТТ-Ф (фиг. 4).
С точки зрения априорных теоретических представлений, можно рассматривать два подхода к анализу взаимосвязи оптического сигнала МТТ-метода D с количеством живых клеток N.
В рамках «производственной модели» каждая клетка характеризуется собственной МТТ-Ф-продуктивностью (за фиксированное время инкубации с МТТ), и тогда
D=ε⋅d⋅N,
где ε - молярная экстинкция МТТ-Ф; d - средняя МТТ-Ф-продуктивность клеток в культуре (моль МТТ-Ф на клетку за фиксированное время инкубации с МТТ). В рамках этого подхода, зависимость D~N является прямо пропорциональной.
В рамках «ферментативной модели» каждая клетка рассматривается как «ферментативный контейнер», и если Е - средняя концентрация дегидрогеназ внутри клетки, ν - средний объем клетки, V - объем среды в лунке для постановки МТТ-теста, то концентрация фермента будет 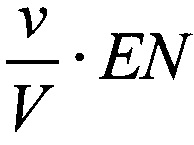 , и следует рассматривать ферментативное превращение
, и следует рассматривать ферментативное превращение
 ,
,
для которого зависимость концентрации МТТ-Ф от концентрации фермента 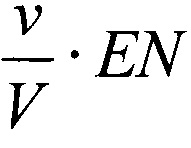 , в общем случае, существенно не линейна, а следовательно, не линейна и зависимость D~N.
, в общем случае, существенно не линейна, а следовательно, не линейна и зависимость D~N.
Очевидно, что положения и «производственной», и «ферментативной» моделей применимы по отношению к клеточной культуре. Вместе с тем, они приводят к различным результатам для зависимости D~N. Компромисс может быть найден в рамках «комбинированной модели»: внутриклеточное пространство рассматривается как «ферментативный контейнер», где действительно имеет место ферментативная кинетика, нелинейным образом связывающая количество продукта (МТТ-Ф) от концентрации фермента Е. Однако субстрат (МТТ) проникает внутрь клетки с некоторой конечной скоростью Uтр. (фиг. 5), которая пропорциональная суммарной площади клеточной поверхности, и, следовательно, пропорциональна количеству жизнеспособных клеток. В зависимости от соотношения и скорости внутриклеточного ферментативного внутриклеточного превращения МТТ→МТТ-Ф (Uв.ф.п.) возможны следующие варианты: если Uтр.<<Uв.ф.п., то кинетика превращения МТТ→МТТ-Ф будет определяться кинетикой транспорта МТТ внутрь клетки (как наиболее медленной лимитирующей стадии); если Uтр.>>Uв.ф.п., то кинетика превращения МТТ→МТТ-Ф будет определяться кинетикой ферментативного внутриклеточного превращения; если значения Uтр. и Uв.ф.п. сопоставимы, то кинетика превращения МТТ→МТТ-Ф будет иметь сложный характер.
Современные знания о клеточной физиологии не позволяют сделать однозначный вывод о соотношении скоростей Uтр. и Uв.ф.п., поэтому проблему формы зависимости D~N приходится решать экспериментально. Так, основатель МТТ-метода Tim Mosmann в 1983 г. обосновал наличие прямой пропорциональности D~N для мононуклеаров периферической крови [Mosmann-83], что открыло широкие возможности применения этого метода. Впоследствии подобные калибровки были проведены для широкого спектра первичных и перевиваемых клеточных культур, что позволило активно применять МТТ-метод для мониторинга уровня жизнеспособности клеточных систем - от скрининга противоопухолевых и антивирусных препаратов до иммунологии, гематологии и вирусологии. Однако изучение зависимости D~N в МТТ-методе на модели МСК из плаценты и пуповины человека до сих пор не были проведены. Вместе с тем, этот метод является хорошим способом стандартизации КМ, которая является необходимой процедурой, предшествующей их медицинскому использованию, т.к. зондирование биохимического профиля клеточной культуры является одним из важнейших элементов такой стандартизации.
Экспериментальное изучение зависимости уровня измеряемого сигнала от количества жизнеспособных клеток в МТТ-методе проводилось на модели первичных мезенхимальных клеточных культур. Значение оптической плотности D, измеряемой в МТТ-тесте, отражает суммарную дегидрогеназную активность исследуемой клеточной культуры. Проводя титрование клеток в лунках 96-луночного культурального планшета, можно легко и статистически достоверно в нескольких повторах оценить зависимость величины D от числа клеток в лунке N. Зависимость D~N для всех типов исследованных первичных клеточных культур (МСК из пуповины (фиг. 6) и МСК из плаценты (фиг. 7) надежно интерполируется прямо пропорциональной зависимостью. Угол наклона прямой D~N имеет смысл оптической плотности МТТ-Ф, произведенного одной клеткой, т.е. пропорционален дегидрогеназной активности культуры в расчете на одну клетку и носит название МТТ-Ф-продуктивности. Поскольку титрованные клетки находятся в одних и тех же экспериментальных условиях, то МТТ-Ф-продуктивность зависит только от функционального состояния клеточной культуры, но не от условий постановки МТТ-теста. Определяя указанные углы наклона (фиг. 6, фиг. 7), можно сравнивать дегидрогеназную активность клеточной культуры на различных пассажах (чего нельзя сделать, просто сравнивая D, поскольку МТТ-тест всякий раз проводится в несколько различных условиях).
Исследование МТТ-продуктивности клеточных культур в зависимости от пассажа позволяет установить изменение дегидрогеназной активности и метаболического потенциала первичной клеточной культуры в процессе подготовки КМ in vitro. Из графиков на фиг. 8 видно, что после выделения клеток мезенхимального происхождения в культуру in vitro, дегидрогеназная активность (угол наклона прямой D~N) возрастает на протяжении нескольких первых пассажей, но после V пассажа начинает постепенно снижаться. Этот эффект объясняется тем, что сразу после выделения клеточная культура обогащена зрелыми, имеющими пониженный уровень метаболизма, клетками. Доля юных, метаболически активных клеток с каждым пассажем возрастает вследствие удаления из культуры зрелых клеток. Однако этот процесс не может продолжаться неограниченно долго, и постепенно доля метаболически активных клеток снова сокращается. Снижение доли метаболически активных клеток и приводит к снижению дегидрогеназной активности, а как следствие, - к снижению МТТ-Ф-продуктивности в МТТ-тесте.
Пассажи клеточной культуры в окрестностях пика дегидрогеназной активности (как правило, III-VI пассажи, с сигналом 6,5*105 опт.ед. и выше на 5 тыс./кл.) наиболее пригодны для приготовления КМ. Полученные результаты согласуются с эмпирически выведенным правилом не использовать для приготовления КМ клеточные культуры старше V пассажа, так как в противном случае медицинское применение таких КМ имеет пониженную эффективность.
Таким образом, установлено, что к жизнеспособному клеточному материалу относят III-VI пассажи с сигналом 6,5*105 опт.ед. и выше на 5 тыс./кл., что позволяет оперативно осуществлять оценку качества, включая единичного клеточного материала, в режиме экспресс-диагностики без проведения дополнительных исследований.
Использованные источники информации
1. Bruder S.P., Fink D.J., Caplan A.I. Mesenchymal stem cells in bone development, bone repair, and skeletal regeneration therapy // J. Cell Biochem. - 1994. - V. 56. - P. 283-294.
2. Kassem M., Kristiansen M., Adbalah B.M. Mesenchymal stem cells: cell biology and potential use in therapy // Basic Clin. Pharmacol. Toxicol. - 2004. - V. 95. - P. 209-214.
3. Скворцова В.И., Губский Л.В., Таирова P.T., Поварова O.B., Чеглаков И.Б., Холоденко Р.В., Холоденко И.В., Ярыгин К.Н., Ярыгин В.Н. Применение мезенхимальных (стромальных) клеток костного мозга при экспериментальном ишемическом инсульте у крыс // Клеточные технологии в биологии и медицине. - 2008. - №1. - С. 14-20.
4. Скворцова В.И., Ярыгин В.Н., Пирогов Ю.А., Губский Л.В., Ярыгин К.Н., Таирова Р.Т., Учеваткин А.А., Глушкова Т.Г. Экспериментальная модель фокальной ишемии мозга крыс на основе эндоваскулярной микрохирургии // Журнал неврологии и психиатрии им. С.С.Корсакова. - 2009. - Т. 109. - №5. - С.62-68.
5. Dezawa M., Hoshino М., Ide С. Treatment of neurodegenerative diseases using adult bone marrow stromal cell-derived neurons // Expert Opin. Biol. Ther. - 2005. - V. 5. - P. 427-235.
6. Miyahara Y., Nagaya N., Kataoka M., Yanagawa B., Tanaka K., Hao H., Ishino K., Ishida H., Shimizu Т., Kangawa K., Sano S., Okano Т., Kitamura S., Mori H. Monolayered mesenchymal stem cells repair scarred myocardium after myocardium infarction // Nat. Med. - 2006. - V. 12. - N4. - P. 459-465.
7. Tang J., Xie Q., Pan G., Wang J., Wang M. Mesenchymal stem cells participate in angiogenesis and improve heart function in rat model of myocardial ischemia with reperfusion // Eur. J Cardiothorac. Surg. - 2006. - V. 30. - P. 353-361.
8. Zhang D., Gai L., Jin Q., Jin Q.H., Huang J.H., Zhu X.Y. Transplantation of autologous adipose-derived stem cells ameliorates cardiac function in rabbits with myocardial infarction // Clin. Med. J. - 2007. - V. 120. - P. 300-307.
9. Miranville A., Heechen C, Sengenes C, Curat C.A., Busse R., Bouloumie A. Improvement of postnatal neovascularization by human adipose tissue-derived stem cells // Circulation. - 2004. - V. 110. - P. 349-355.
10. Nakagami H., Maeda K., Morishita R., Iguchi S., Nishikawa T., Takami Y., Kikuchi Y., Saito Y., Tamai K., Ogihara Т., Kaneda Y. Novel autologous cell therapy in ischemic limb disease through growth factor secretion by cultured adipose tissue-derived stromal cells // Arterioscler. Thromb. Vasc. Biol. - 2005. - V. 25. - P. 2542-2547.
11. Урываева И.В. Стволовые клетки и регенерация печени // В кн.: Биология стволовых клеток и клеточные технологии / Ред. М.А. Пальцев. -М.: ОАО «Издательство "Медицина"», издательство «Шико», 2009. - Т. 2. - С. 211-252.
12. Chien C.C, Yen B.L., Lee F.K., Lai Т.Н., Chen Y.C, Chan S.H., Huang H.I. In vitro differentiation of human placenta-derived multipotent cells into hepatocyte-like cells // Stem Cells. - 2006. - V. 24. - N 7. - P. 1759-1768.
13. Aggarwal S., Pittenger M.F. Human mesenchymal stem cells modulate allogeneic immune cell responses // Blood. - 2005. - V. 105. - N4. - P. 1815-1822.
14. Di Nicola M., Carlo-Stella C, Magni M., Milanesi M., Longoni P.D., Matteucci P., Grisanti S., Gianni A.M. Human bone marrow stromal cells suppress T-lymphocyte proliferation induced by cellular or nonspecific mitogenic stimuli // Blood. - 2002. - V. 99. - P. 3838-3843.
15. Beyth S., Borovsky Z., Mevorach D., Liebergall M., Gazit Z., Asian H., Galun E., Rachmilewitz J. Human mesenchymal stem cells alter antigen-presenting cell maturation and induce T-cell unresponsiveness // Blood. - 2005. - V. 105. - N 5. - P. 2214-2219.
16. Quirici N., Soligo D., Bossolasco P., Servida F., Lumini C, Deliliers G.L. Isolation of bone marrow mesenchymal stem cells by anti-nerve growth factor receptor antibodies // Exp. Hematol. - 2002. - V. 30. - P. 783-791.
17. Луппа X. Основы гистохимии. - M.: Мир, 1980. - 344 с.
18. Пирс Э. Гистохимия теоретическая и прикладная. - М.: ИЛ, 1962. - 962 с.
19. Sheehan D., Hrapchak B. Theory and practice of histotechnology. - Columbus (Ohio): Battelle Press, 1980. - 481 p.
20. Бурунова B.B., Суздальцева Ю.Г., Воронов A.B., Чеглаков И.Б., Вахрушев И.В., Ярыгин К.Н., Ярыгин В.Н. Разработка и внедрение производственных стандартов для клеточных материалов мезенхимального происхождения // Клеточные технологии в биологии и медицине. - 2008. - №2. - С. 97-101.
21. Mosmann Т. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays // J. Immunol. Methods. - 1983. - V 65. - N 1-2. - P. 55-63.
22. Марри P., Греннер Д., Мейес П., Родуэлл В. Биохимия человека: в 2-х тт. - М.: Мир, 2004.
23. Boyd M.R. National Cancer Institute new drug development program // In: Accomplishments in Oncology / Eds.: E.J. Frei, E.J. Freireich. - Philadelphia, 1986. - V. 1. - P. 68-76.
24. Gong J.H., Liu X.J., Shang B.Y., Chen S.Z., Zhen Y.S. HERG K+ channel related chemosensitivity to sparfloxacin in colon cancer cells // Oncol. Rep.- 2010. - V. 23. - N 6. - P. 1747-1756.
25. Jabbar S.A.B., Twentyman P.R., Watson J.V. The MTT assay underestimates the growth inhibitory effect of interferons //Br. J. Cancer. - 1989. - V. 60. - P. 523-528.
26. Грибкова H.B., Еремин В.Ф., Вотяков В.И., Щелканов М.Ю., Пашкова Т.А., Карамов Э.В. Подавление репродукции вируса иммунодефицита человека (ВИЧ) цитокиноподобным антивирусным фактором // ЖМЭИ. - 1996. - N 5. - С. 27-29.
27. Кравченко И.Н., Кравченко Н.Н., Смирнов С.В. Колориметрический метод для оценки эффективности бласт-трансформации мононуклеаров периферической крови человека // Иммунология. - 1992. - N3. - C. 47-50.
28. Mosmann T.R., Fong Т.А. Specific assays forcytokine production by T cells // J. Immunol. Meth. - 1989. - V. 116. - P. 151-158.
29. Twentyman P.R., Fox N.E., Rees J.K.H. Chemosensitivity testing of fresh leukaemia cells using the MTT colorimetric assay // Br. J. Haematol. - 1989. - V. 71. - P. 19-24.
30. Price P., McMillan T.J. Use of the tetrazolium assay in measuring the response of human tumor cells to ionizing radiation // Cancer Res. - 1990. - V. 50. - P. 1392-1396.
31. Wieczorek M., Litwinska B. The influence of Namalwa cells on inhibition of HSV-1 replication // Med. Dosw. Mikrobiol. - 2009. - V. 61. - N 2. - P. 197-202. [in Polish].
Способ оценки жизнеспособности клеточного материала, полученного из пуповины и плаценты человека, согласно которому клетки пересевают в полной ростовой среде на 96-луночный планшет по 5000 клеток первые 8 лунок, по 2500 клеток во вторые 8 лунок и по 1250 клеток в третьи 8 лунок, через 6 часов из лунок удаляют среду и вносят в каждую лунку по 100 мкл культуральной среды без фетальной телячьей сыворотки и по 10 мкл раствора бромид 3 -(4,5-диметилтиазол-2-ил)-2,5-тетразолия (МТТ) 10 мг/мл в PBS (натрий-фосфатный буфер, представляющий собой водный раствор солей, содержащий хлорид натрия, гидрофосфат натрия, хлорид калия и дигидрофосфат калия, в котором осмолярность и концентрации ионов в растворе соответствуют концентрациям в теле человека - изотонический буферный раствор), затем инкубируют 1 час при 37°С в атмосфере 5% СО, после инкубации из лунок культурального планшета удаляляют среду без захвата клеток и вносят по 100 мкл диметилсульфоксида для экстракции внутриклеточного МТТ-формазана и измеряют оптическую плотность спектрофотометрически при длине волны 540 нм против диметилсульфоксида, отличающийся тем, что, к жизнеспособному клеточному материалу относят III-VI пассажи с сигналом 6,5*10 опт.ед. и выше на 5 тыс./кл.