Результат интеллектуальной деятельности: ЛЕЧЕНИЕ HBV ИНФЕКЦИИ
Вид РИД
Изобретение
Область изобретения
Настоящее изобретение относится к средству для РНК-интерференции (RNAi) и применению этого средства для RNAi для лечения инфекции, вызванной гепатитом B, у индивидов, а также фармацевтическим композициям, содержащим средства для RNAi по настоящему изобретению.
Предпосылки изобретения
«Гепатит» представляет собой общий термин, означающий ’воспаление печени’, и вызывается гепатит рядом факторов. Вирусные факторы находятся среди наиболее распространенных, и гепатит может быть вызван вирусом гепатита A, B, C, D или E. Вирус гепатита B (HBV), в частности, приводит к серьезному и распространенному инфекционному заболеванию печени, поражающему миллионы людей во всем мире.
HBV представляет собой гепатотропный ДНК-вирус, относящийся к Hepadnaviridae. Полная длина генома вируса равна приблизительно 3,2 т.о., и он имеет четыре открытые рамки считывания (ORF), в том числе поверхностный антиген ("ген S"), коровый антиген ("ген C"), ДНК-полимеразу ("ген P") и ген с неопределенной функцией под названием "ген X".
Более 2000 миллионов людей, живущих в настоящее время, были инфицированы HBV когда-либо в течение их жизни, и из них приблизительно 350 миллионов остаются хронически инфицированными и становятся носителями вируса. Инфекция HBV может вызывать гепатит B острого и хронического типа и может, в конечном итоге, привести к развитию хронической недостаточности печени, цирроза и гепатоцеллюлярной карциномы. К тому же, носители HBV могут передавать заболевание в течение многих лет.
HBV передается при чрескожном или парентеральном контакте с инфицированными биологическими жидкостями или кровью. Самым распространенным путем инфицирования является наследственная передача от матери к ее ребенку, а у взрослых через половые сношения или совместно используемые иглы для внутривенных инъекций или оборудование для прокалывания ушей. Однако многие случаи острой инфекции HBV происходят без прослеживаемого пути инфицирования.
Лица с хронической инфекцией HBV ("носители" - во всем мире приблизительно 350-400 миллионов людей) имеют в 12-300 раз более высокий риск развития гепатоцеллюлярной карциномы, чем не являющиеся носителями, и, в целом, HBV является причиной 60-80% случаев первичного рака печени в мире. Каждый год приблизительно 25% из более 4 миллионов острых клинических случаев (т.е. 1 миллион людей во всем мире) умирают от хронического активного гепатита, цирроза или HBV-индуцированного рака печени. Как следствие, HBV занимает второе место, уступая только табачным изделиям, в качестве известного канцерогена для человека.
Хотя вакцины против HBV широко применяются в течение нескольких десятилетий, коэффициент распространенности HBV в популяции все еще остается высоким. Существующие в настоящее время терапии хронической инфекции HBV оказывают лишь ограниченные ингибирующие эффекты на экспрессию и репликацию вирусных генов у большей части хронически инфицированных пациентов. Ламивудин, например, супрессирует репликацию HBV у носителей, но эффект является обратимым при прекращении терапии. Более того, основным ограничением продолжительной терапии ламивудином является развитие устойчивости вируса, которая, как правило, развивается через 6 месяцев лечения. Устойчивость, как правило, ассоциирована с мутациями в высоко консервативном каталитическом участке гена полимеразы HBV.
По этим причинам остается потребность в новом терапевтическом средстве для лечения инфекции HBV. Настоящее изобретение направлено на средство для РНК-интерференции (RNAi) и применение этого средства для RNAi для лечения инфекции, вызванной гепатитом B, у индивидов.
Путь RNAi запускается ферментом дайсер, который расщепляет молекулы двухцепочечной РНК (dsRNA) на короткие фрагменты (обычно называемых siRNA) из ~20-25 нуклеотидов. Одна из двух цепей каждого фрагмента, называемая направляющей цепью или активной цепью, затем соединяется с РНК-индуцированным комплексом сайленсинга (RISC) посредством связывания с представителем семейства белков argonaute. После интеграции в RISC осуществляется спаривание оснований направляющей цепи с ее мРНК-мишенью, и, как предполагается, осуществляется ингибирование мишени или путем ингибирования трансляции (путем остановки трансляционного механизма), и/или индуцирования расщепления мРНК, таким образом предотвращая ее использование в качестве матрицы для трансляции.
Несмотря на то, что фрагменты, образуемые дайсером, являются двухцепочечными, только направляющая цепь управляет сайленсингом генов. Другая цепь-спутник, более распространенно называемая сопровождающая цепь, цепь-носитель или * цепь, часто разрушается во время активации RISC (Gregory R, Chendrimada T, Cooch N, Shiekhattar R (2005). "Human RISC couples microRNA biogenesis and posttranscriptional gene silencing". Cell 123 (4): 631-40). Сборка RISC, как предполагается, управляется ферментом, который выбирает, какая цепь dsRNA-продукта дайсера вводится в RISC. Эта цепь, как правило, является той, 5’-конец которой менее прочно спарен с ее комплементарной цепью, и где также наблюдается явное смещение к A, и в меньшей степени к U в 5’-положении для облегчения связывания с некоторыми белками argonaute (Schwarz DS, Hutvagner G, Du T, Xu Z, Aronin N, Zamore PD (2003). "Asymmetry in the assembly of the RNAi enzyme complex". Cell 115 (2): Frank F, Sonenberg N, Nagar (2010) "Structural basis for 5’-nucleotide base-specific recognition of guide RNA by human AGO2". Nature. 465 (7299): 818-22).
Ссылка на любой предшествующий уровень техники в описании не признается и не должна признаваться подтверждением или предположением в любой форме того, что этот предшествующий уровень техники образует часть известных общедоступных сведений в Австралии или любом другом государстве, или что этот предшествующий уровень техники может обоснованно предполагаться как определенный, понятный и признанный соответствующим специалистом в данной области техники.
Краткое описание изобретения
Авторы настоящего изобретения обнаружили, что для ингибирования вируса можно целенаправленно воздействовать на уникальные последовательности в геноме вируса гепатита B (HBV). Посредством целенаправленного воздействия на специфические участки одного или нескольких генов ингибируют экспрессию этих генов, при этом осуществляют эффективный "сайленсинг" гена. Это дает новую возможность целенаправленного воздействия на экспрессию HBV в клетках для лечения инфекции HBV.
В одном аспекте настоящего изобретения предложено средство для направленной на ДНК РНК-интерференции (ddRNAi) (представляющее собой молекулу РНК) и кассета экспрессии или конструкт экспрессии этого средства в клетке (в том числе in vivo) для ингибирования экспрессии по меньшей мере одного гена вируса гепатита В (HBV), где средство содержит эффекторную последовательность (дополнительно описанную ниже) длиной по меньшей мере 17 нуклеотидов, комплементарную или, по существу, комплементарную предсказанной последовательности, транскрибирующейся с целевого участка, при этом целевой участок выбран из группы, состоящей из любых 10 или более смежных нуклеотидов в пределах последовательности из любой SEQ ID NO: 1-19. В альтернативном варианте осуществления целевой участок представляет собой последовательность, выбранную из группы, состоящей из любых 10 или более смежных нуклеотидов в пределах последовательности из любой SEQ ID NO: 20-27.
Эффекторная последовательность направлена на целевой участок целевой последовательности РНК, где целевая последовательность представляет собой транскрипт целевого гена. Таким образом, эффекторная последовательность ’направлена на’ целевой участок посредством того, что ее последовательность является достаточно комплементарной транскрипту целевого гена, содержащему целевой участок. Следовательно, средство для RNAi, такое как средство для ddRNAi, имеющее двухцепочечную часть, содержащую эффекторную последовательность, может "ингибировать экспрессию последовательности целевого гена" посредством последовательности целевого гена, содержащей целевой участок. Соответственно, в клетке, инфицированной HBV, средство для RNAi способно ингибировать экспрессию последовательности целевого гена, так как последовательность эффектора (обозначаемая ниже ’эффектором’) является, по существу, комплементарной (по меньшей мере) участку предсказанной целевой последовательности мРНК целевого гена. Это можно проиллюстрировать при помощи следующей короткой последовательности:
5’ATTGCG3’ - целевая последовательность ДНК гена,
5’AUUGCG3’ - целевой участок/последовательность мРНК в результате транскрипции гена
3’UAACGC5’ - эффекторная последовательность - которая, по существу, комплементарна участку предсказанной целевой последовательности мРНК.
Как правило, целевой участок представляет собой участок мРНК от гена, который необходимо подвергнуть сайленсингу или у которого необходимо снизить экспрессию (на уровне транскрипции или трансляции).
Средство разработано таким образом, что оно также содержит эффекторную комплементарную последовательность, т.е. последовательность, которая является, по существу, комплементарной эффекторной последовательности, в результате чего будет проявляться тенденция к гибридизации с образованием двухцепочечного сегмента РНК - необходимая степень комплементарности более подробно дополнительно объяснена ниже. Более того, как правило, один конец двухцепочечного сегмента будет соединен последовательностью петли так, чтобы образовать структуру в форме ’шпильки’. Она также известна как структура с ’прерванным инвертированным повтором’, поскольку ДНК, кодирующая эту последовательность РНК, содержит инвертированный повтор участка целевого гена, который транскрибируется в эффекторную последовательность, прерванный ’лишней’ или спейсерной последовательностью, кодирующей петлю.
В некоторых формах настоящего изобретения средство имеет более одной эффекторной последовательности. Несколько эффекторов могут целенаправленно воздействовать на один и тот же участок гена HBV, различные (возможно перекрывающиеся) участки одного и того же гена и/или различных генов HBV. Средства для RNAi, такие как средства для ddRNAi, могут содержать 2 или 3 различные эффекторные последовательности. Как объясняется выше, средство для ddRNAi содержит эффекторную комплементарную последовательность для каждой эффекторной последовательности, таким образом образуя пары эффектор - эффекторная комплементарная цепь (т.е. пара первый эффектор - первая эффекторная комплементарная цепь, пара второй эффектор - вторая эффекторная комплементарная цепь и т.д.). Эти пары могут быть, но не обязательно, смежными по отношению друг к другу, при условии, что средство для RNAi может сворачиваться так, чтобы обеспечить гибридизацию каждой пары. Различные другие соображения позволяют предположить тот или иной порядок эффекторов и эффекторных комплементарных цепей вдоль длины средства для RNAi. Таким образом, варианты осуществления настоящего изобретения включают одно или несколько из следующего:
- средство для ddRNAi, содержащее, в 5’-3’ направлении, первую эффекторную последовательность, вторую эффекторную последовательность, вторую эффекторную комплементарную последовательность и первую эффекторную комплементарную последовательность;
- средство для ddRNAi, содержащее, в 5’-3’ направлении, первую эффекторную последовательность, вторую эффекторную последовательность, третью эффекторную последовательность, третью эффекторную комплементарную последовательность, вторую эффекторную комплементарную последовательность и первую эффекторную комплементарную последовательность;
- средство для ddRNAi, содержащее, в 5’-3’ направлении, первый эффектор; первую эффекторную комплементарную последовательность, вторую эффекторную последовательность и вторую эффекторную комплементарную последовательность;
- средство для ddRNAi, содержащее, в 5’-3’ направлении, первую эффекторную последовательность, первую эффекторную комплементарную последовательность, вторую эффекторную последовательность, вторую эффекторную комплементарную последовательность, третью эффекторную последовательность и третью эффекторную комплементарную последовательность;
- средство для ddRNAi, содержащее, в 5’-3’ направлении, первую эффекторную последовательность, вторую эффекторную последовательность; последовательность из 2-100 некомплементарных нуклеотидов, вторую эффекторную комплементарную последовательность и первую эффекторную комплементарную последовательность;
- средство для ddRNAi, содержащее, в 5’-3’ направлении, первую эффекторную последовательность, последовательность из 2-100 некомплементарных нуклеотидов; первую эффекторную комплементарную последовательность, вторую эффекторную последовательность, последовательность из 2-100 некомплементарных нуклеотидов и вторую эффекторную комплементарную последовательность.
Как будет понятно специалисту в данной области техники, и как проиллюстрировано на фигурах, любая конкретная эффекторная последовательность может обмениваться положением с ее комплементарной цепью в средстве. В конкретных формах каждого из описанных выше вариантов осуществления каждая эффекторная последовательность имеет длину по меньшей мере 17 нуклеотидов и содержит нуклеотидную последовательность, выбранную из группы, состоящей из любых 10 или более смежных нуклеотидов из последовательности из любой SEQ ID NO: 1-19 или SEQ ID NO: 20-27. Все эффекторные последовательности могут быть одинаковыми, или могут быть различными, или могут представлять собой комбинацию, например, 2 эффекторных последовательностей по меньшей мере из 10 смежных нуклеотидов из SEQ ID NO:1 и одной, эффекторной последовательность по меньшей мере из 10 смежных нуклеотидов из SEQ ID NO: 4.
Предпочтительно эффекторная последовательность выбрана из группы, состоящей из любых смежных 11, 12, 13, 14, 15 или 16 нуклеотидов в любой из SEQ ID NO: 1-19 или SEQ ID NO: 20-27 и наиболее предпочтительно 17 или более смежных нуклеотидов в любой из SEQ ID NO: 1-19 или SEQ ID NO: 20-27. Как правило, эффекторная комплементарная цепь будет иметь такую же длину или приблизительно такую же длину (то есть, ±15% нуклеотидной длины), как и ее соответствующая эффекторная последовательность.
В альтернативных вариантах осуществления dsRNA состоит из 2 отдельных цепей РНК, которые гибридизируются с образованием дуплекса. Средства для ddRNAi могут экспрессироваться с ДНК-кассеты экспрессии, встроенной в любой подходящий вектор или конструкт для ddRNAi. Соответственно, в аспектах настоящего изобретения предложены кассеты экспрессии для ddRNAi, содержащие:
- одну или несколько промоторных последовательностей,
- одну или несколько последовательностей ДНК, предпочтительно являющихся последовательностями, которые кодируют любые 10 или более и предпочтительно любые 17 или более смежных нуклеотидов в пределах последовательности из любой из SEQ ID NO: 1-19 или SEQ ID NO: 20-27,
- одну или несколько последовательностей ДНК, которые кодируют одну или несколько эффекторных комплементарных последовательностей,
- одну или несколько терминаторных последовательностей, и необязательно
- одну или несколько последовательностей ДНК, которые кодируют последовательности петли, и
- одну или несколько энхансерных последовательностей.
В некоторых вариантах осуществления один промотор функционально связан с несколькими участками, кодирующими эффектор, так, чтобы он мог управлять их экспрессией, в то время как в других вариантах осуществления каждый участок, кодирующий эффектор, функционально связан с его собственным промотором. В конструктах, где присутствуют несколько промоторов, все они могут быть одинаковыми или различными. Предпочтительными промоторами являются U6 и H1.
Также предлагаются конструкты экспрессии для ddRNAi, в которые для экспрессии встроены кассеты экспрессии для ddRNAi. К тому же, если векторная основа конструкта является совместимой с системой доставки, конструкты экспрессии для ddRNAi также являются конструктами для доставки.
Настоящее изобретение также предлагает siRNA-средства, которые содержат последовательность длиной по меньшей мере 17 нуклеотидов, выбранную из группы, состоящей из любых 10 или более смежных нуклеотидов в пределах последовательности из любой из SEQ ID NO: 1-19 или SEQ ID NO: 20-27, и комплементарную последовательность, с которой последовательность образует дуплекс, и которые способны ингибировать экспрессию гена HBV.
Настоящее изобретение также предлагает способы лечения острой или хронической инфекции HBV у субъекта, снижения вирусной нагрузки HBV у субъекта, снижения тяжести симптомов, ассоциированных с инфекцией HBV, у субъекта и снижения инфективности HBV, включающие введение терапевтически эффективного количества конструкта для ddRNAi, средства для ddRNAi или siRNA-средства по настоящему изобретению, где конструкт для ddRNAi, средство для ddRNAi или siRNA-средство ингибирует экспрессию одной или нескольких целевых последовательностей в гене вируса гепатита B (HBV), предпочтительно по меньшей мере в гене полимеразы HBV.
Также предлагается фармацевтическая композиция, содержащая средство для ddRNAi, кассету экспрессии для ddRNAi, конструкт для ddRNAi или siRNA-средство по настоящему изобретению и фармацевтически приемлемый носитель или разбавитель.
Краткое описание графических материалов/фигур
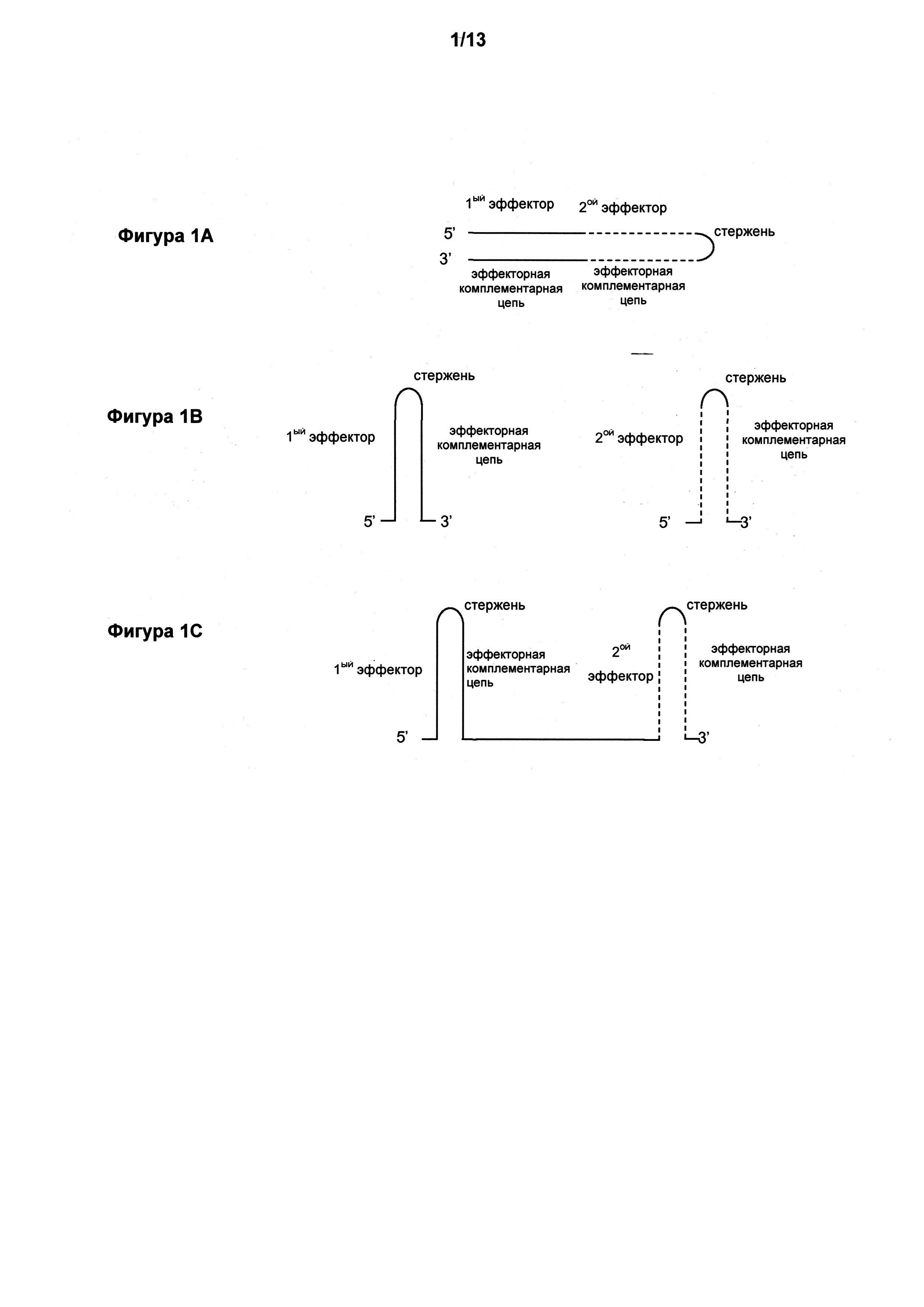
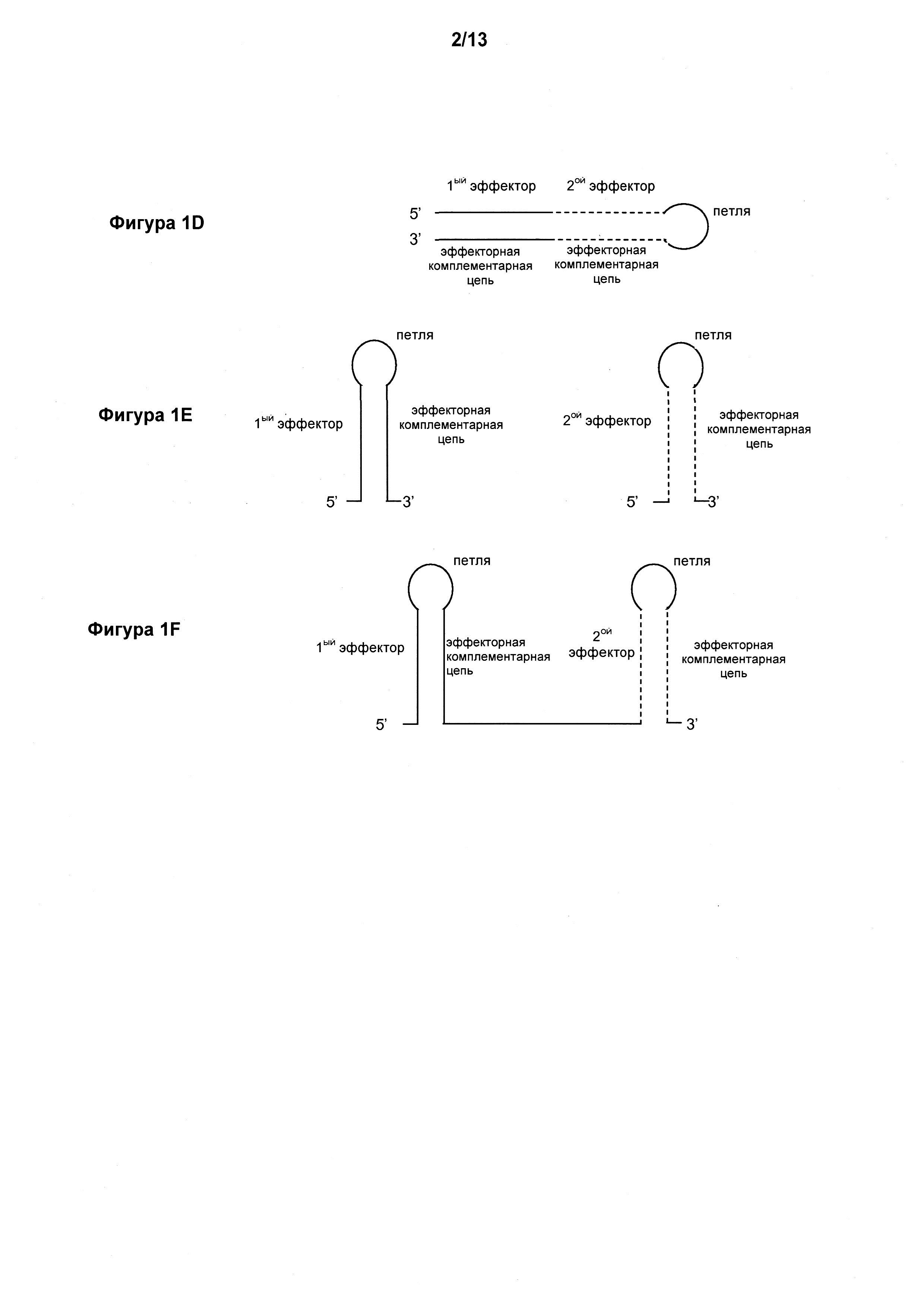
Фигура 1A-F иллюстрирует некоторые структуры средства для ddRNAi по настоящему изобретению.
На фигуре 2 показано распределение 642 клонов siRNA, полученных для гена полимеразы HBV, где линии обозначают участки, соответствующие отдельным клонам целой siRNA-мишени (EsT).
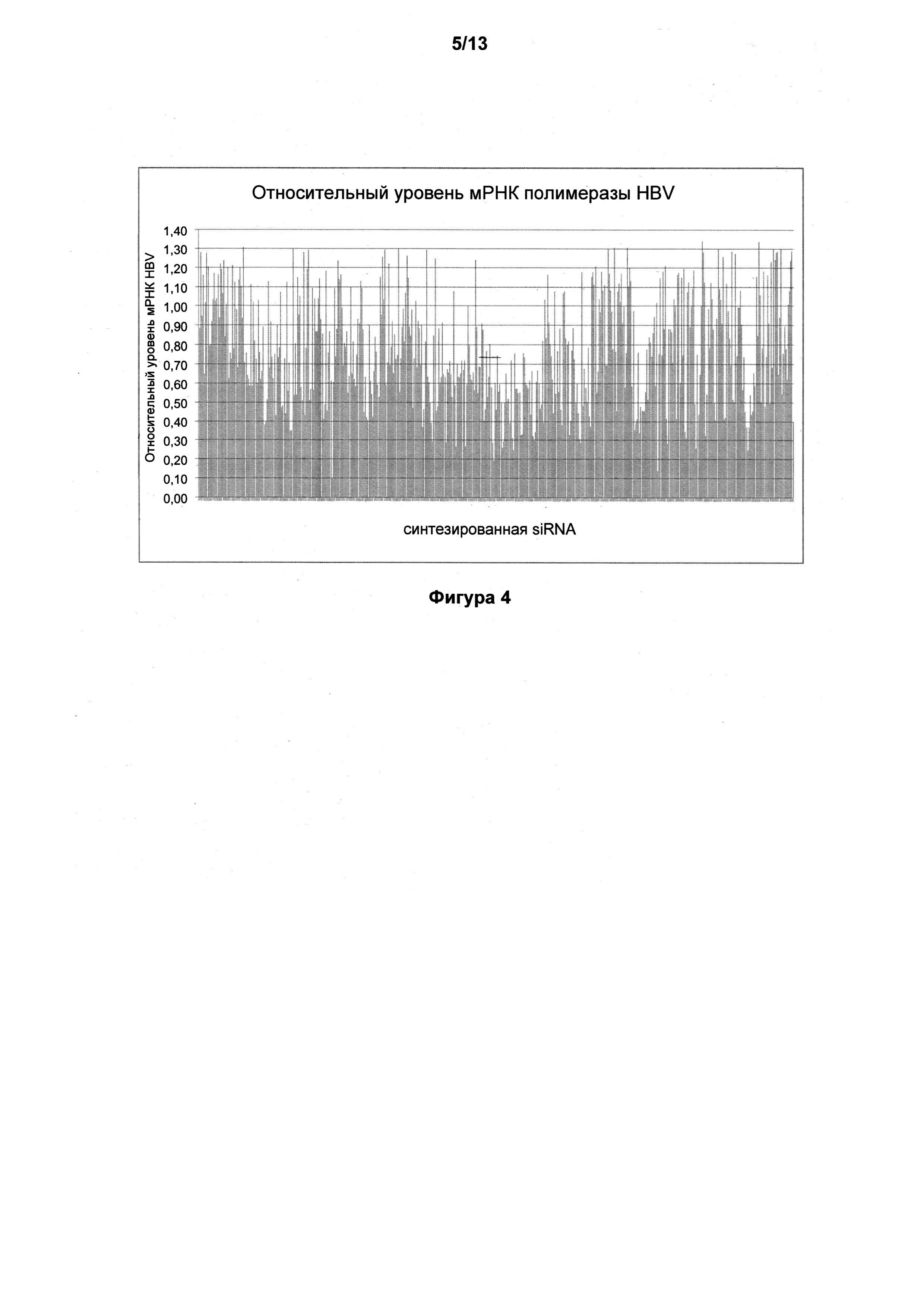
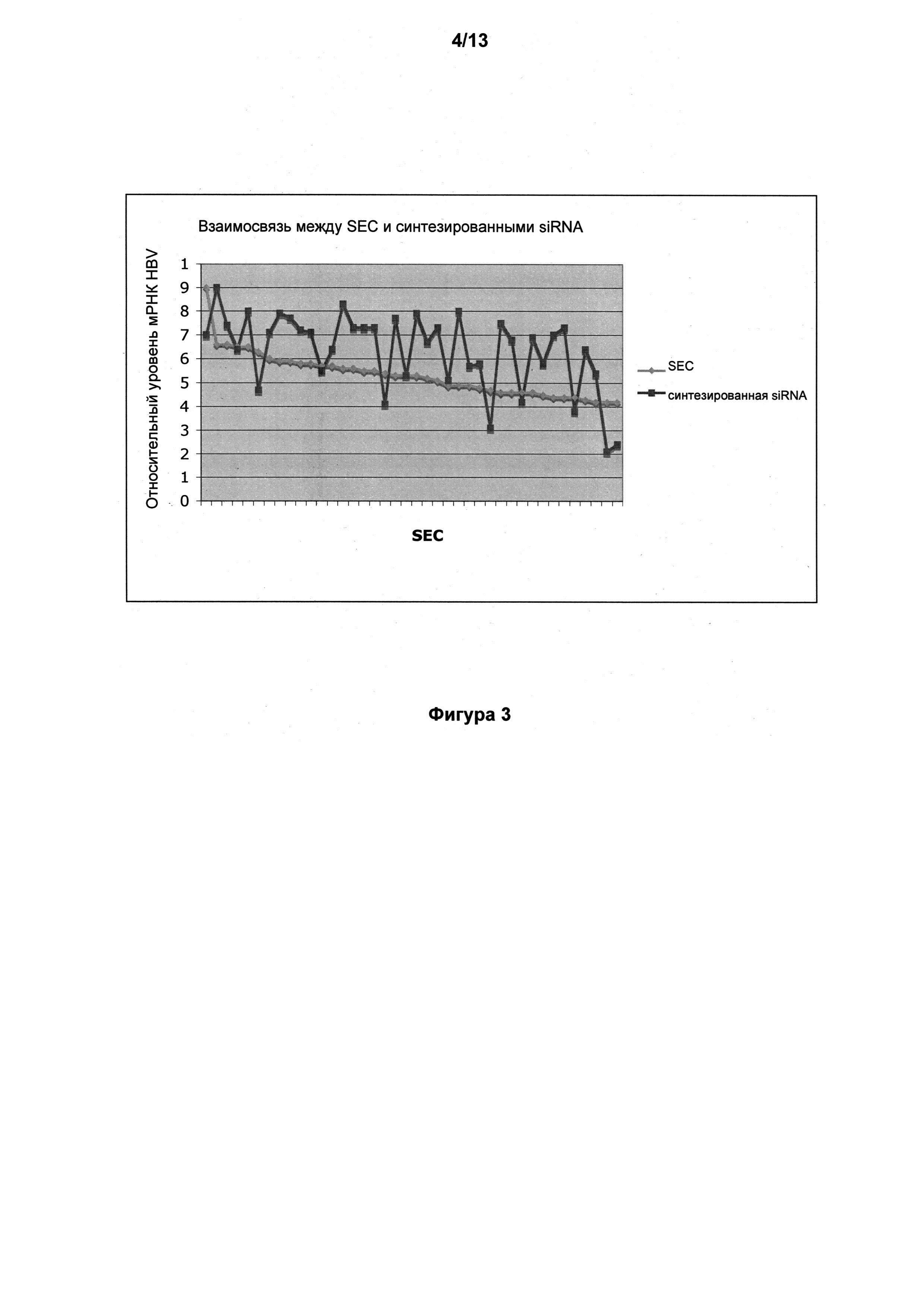
На фигуре 3 представлено сравнение эффективности RNAi при помощи кассет экспрессии siRNA (SEC) и их соответствующих синтетических siRNA в отношении уровней мРНК полимеразы HBV для подтверждения результатов первичного скрининга, полученных при ингибировании экспрессии полимеразы HBV при помощи SEC.
На фигуре 4 представлены результаты скрининга в отношении ингибирования полимеразы HBV при помощи 501 последовательности siRNA, полученной из библиотеки EsT.
Фигура 5, A представляет собой иллюстрацию распределения лучших 100 наиболее эффективных последовательностей siRNA (определенных в крупномасштабном скрининге на фигуре 4) для гена полимеразы HBV. Фигура 5, B иллюстрирует, каким образом можно картировать любую заданную последовательность по отношению к гену полимеразы HBV. Показаны области, на которых основаны SEQ ID NO: 1-3.
Фигура 6 представляет собой схему 5 отдельных кассет экспрессии и средств для RNAi, кодируемых ними, вместе с эффекторной последовательностью после процессинга при помощи дайсера. Кассеты экспрессии основаны на SEQ ID NO: 3, 9, 12, 13 и 23.
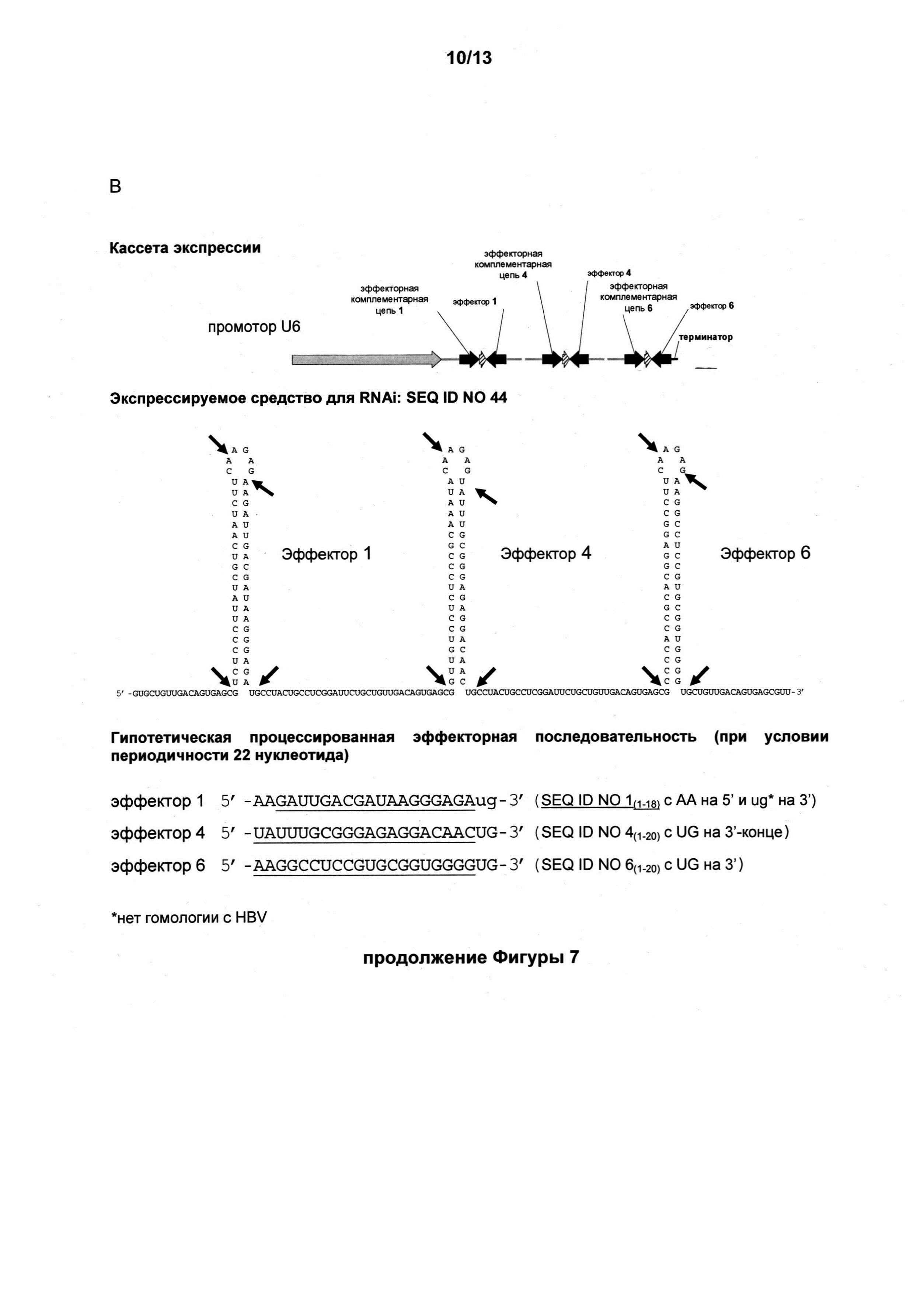
Фигура 7 представляет собой схему кассеты экспрессии с несколькими эффекторными последовательностями, содержащей (a) эффекторные последовательности, каждая из которых функционально связана с отдельными промоторными и терминаторными последовательностями для экспрессии отдельного средства для RNAi в форме короткого шпилечного средства для RNAi (shRNAi) (фигура 7, A); или (b) первую эффекторную последовательность, функционально связанную с промотором, и третью эффекторную последовательность, функционально связанную с терминатором так, чтобы экспрессировалось одно средство для RNAi с несколькими петлями на стебле. Кассеты экспрессии основаны на SEQ ID NO:1, SEQ ID NO: 4 и SEQ ID NO: 6.
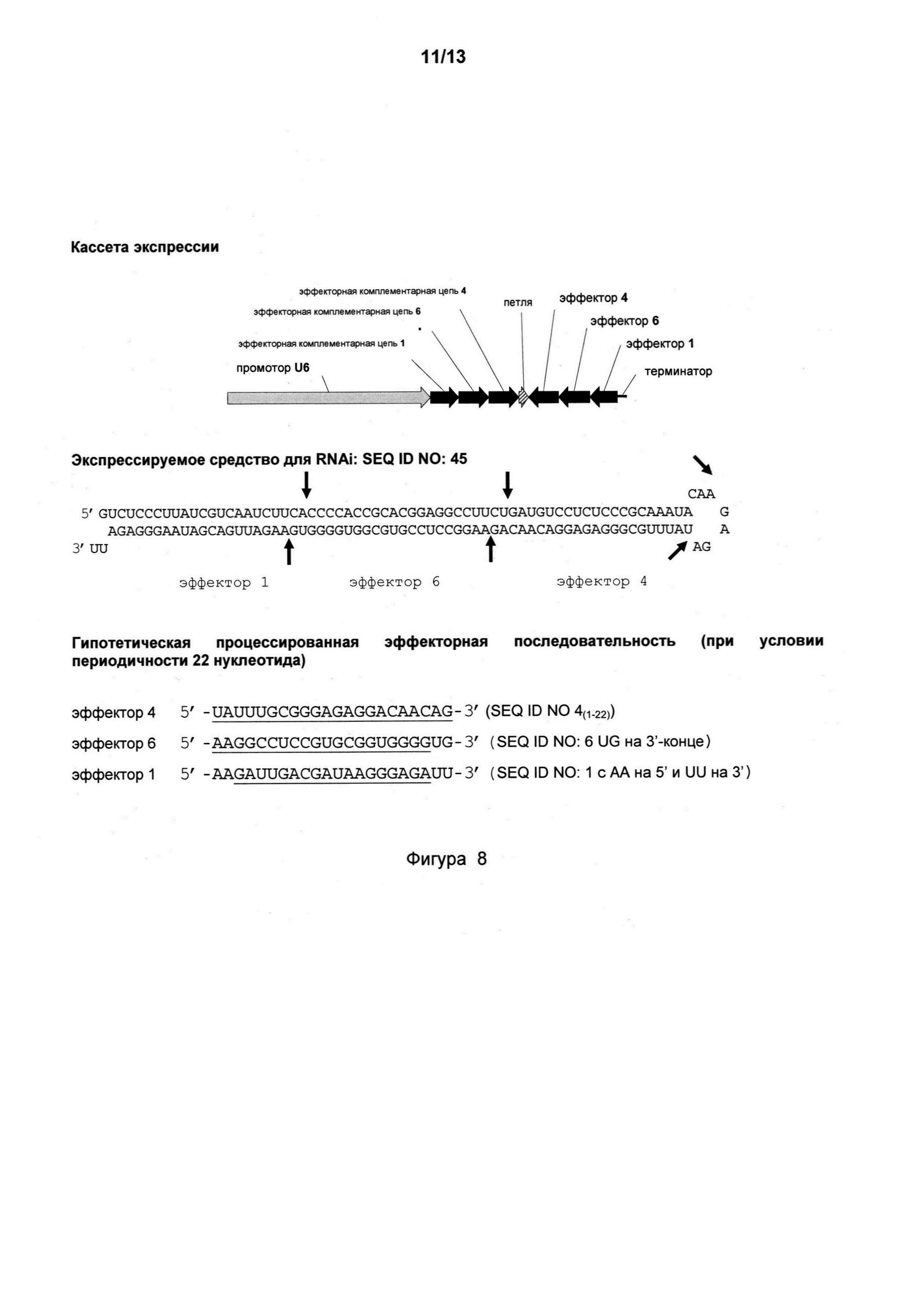
Фигура 8 представляет собой схему кассеты экспрессии с несколькими эффекторными последовательностями на основе SEQ ID NO: I, 4 и 6, которая в результате дает одно длинное шпилечное средство для RNAi.
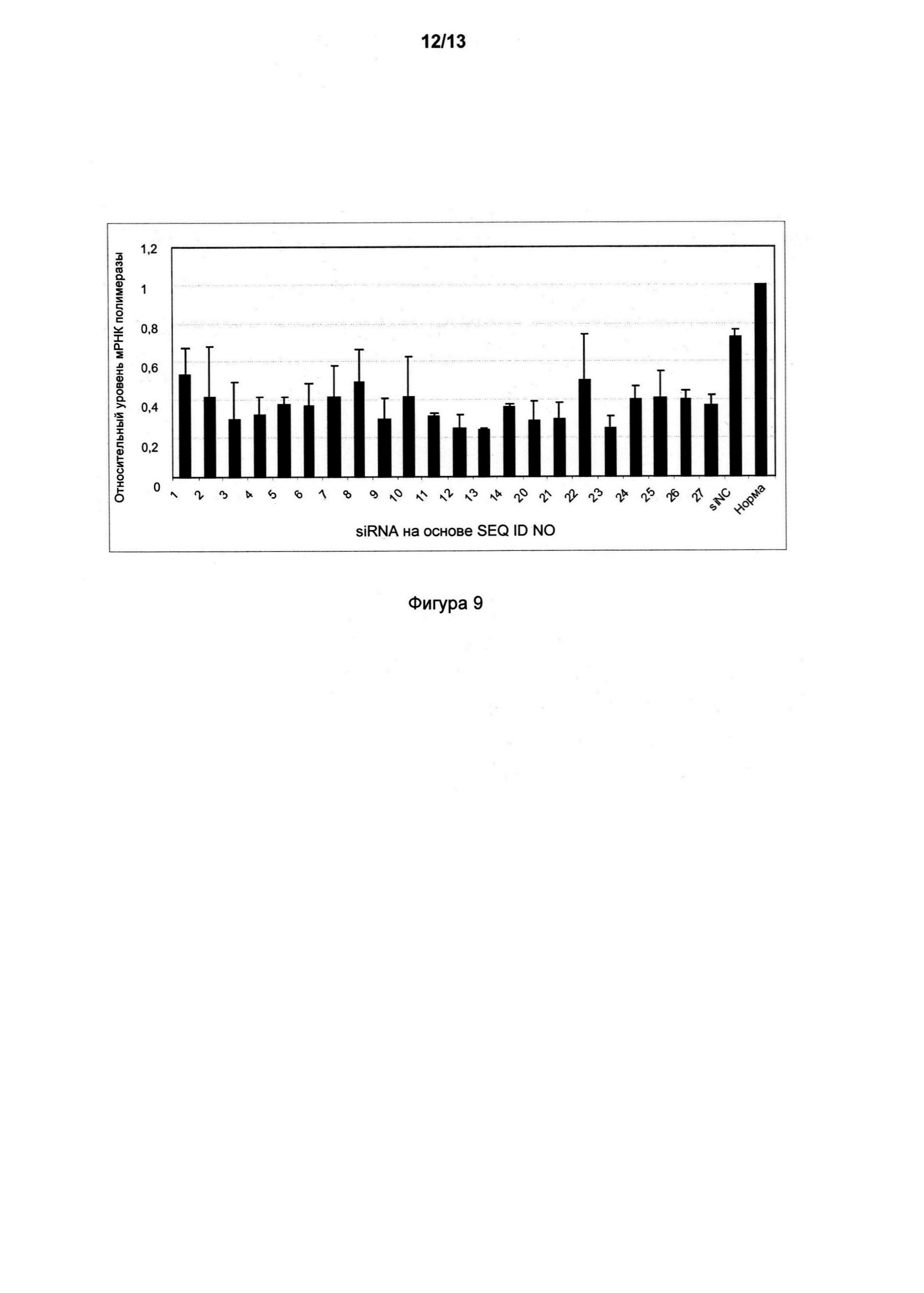
Фигура 9 иллюстрирует эффективность генного нокдауна при помощи SEQ ID NO: 1-14 и 20-27 после трансфекции в клетки HepG2 2.2.15. Эффективность нокдауна определяли посредством qRT-PCR анализа мРНК гена полимеразы. siNC представляют собой отрицательный контроль, при этом являясь siRNA без известных целевых последовательностей в HBV; причем нормальным является уровень мРНК полимеразы в нетрансфицированных клетках, стандартизованный к уровню 1.
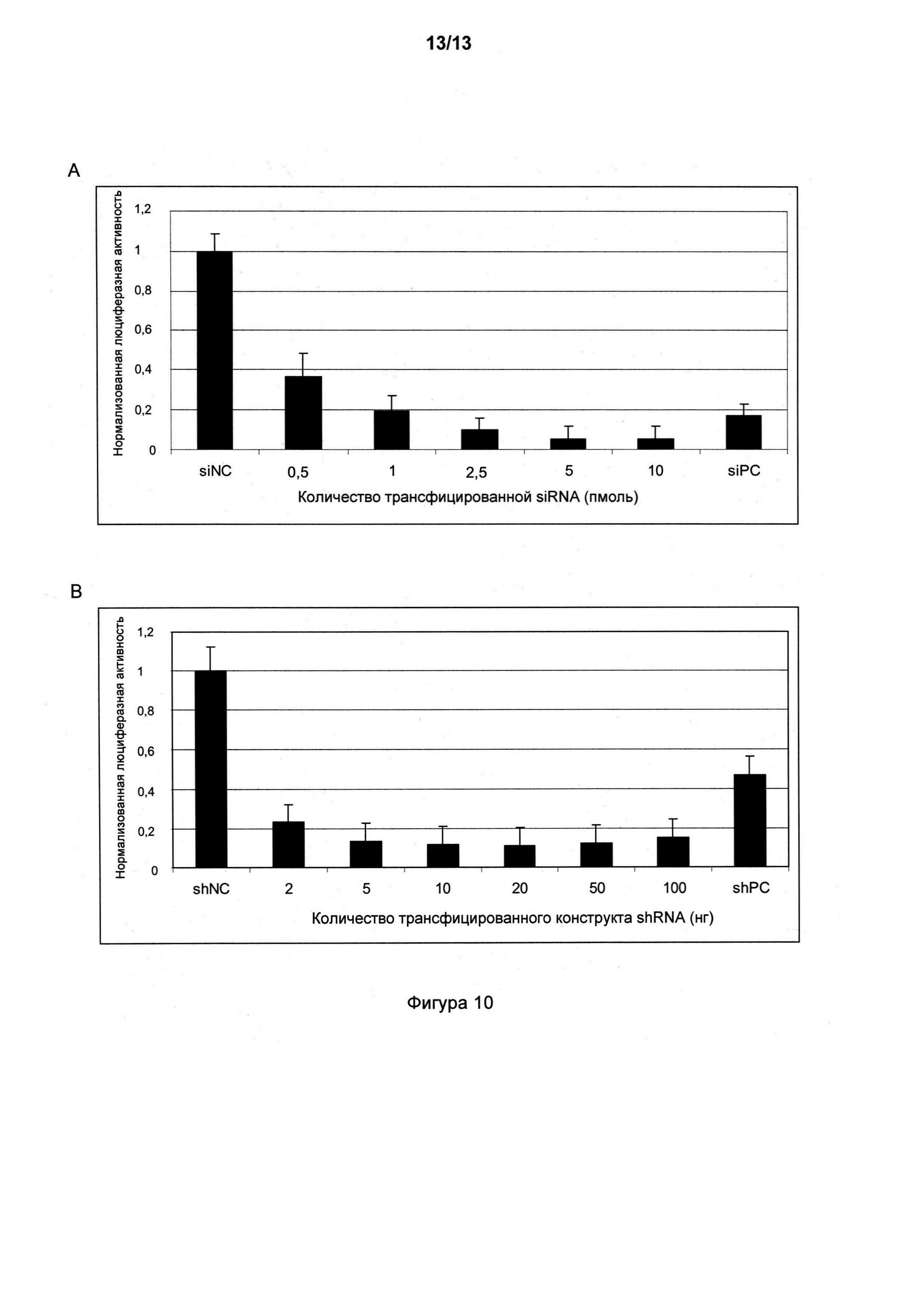
На фигуре 10, A и B показаны активности люциферазы (+/-SD; n=4) в клетках, трансфицированных различными количествами химически синтезированных конструктов экспрессии siRNA23 (A) или shRNA23 (B), нацеленных на pGL3-23, с использованием условий, перечисленных в таблицах 3 и 4. На фигуре 10, A siNC применяли как в качестве отрицательного контроля, так и для коррекции общих количеств siRNA, добавленных к клеткам, для того, чтобы избежать возможных артефактов вследствие неодинаковой трансфекции; siRNA к GL3 применяли в качестве положительного контроля с тем, чтобы она представляла собой siRNA, нацеленную на ген люциферазы. На фигуре 10, B pUC57 применяли как в качестве отрицательного контроля, так и для коррекции общих количеств плазмидных ДНК, добавленных к клеткам, для того, чтобы избежать возможных артефактов вследствие неодинаковой трансфекции. Плазмида, экспрессирующая shRNA к люциферазе на основе siRNA к GL3, применяли в качестве положительного контроля.
Подробное описание вариантов осуществления
Определения
Используемое в данном документе, за исключением тех случаев, где контекст требует другого, выражение "содержать" и варианты этого выражения, такие как "содержащий", "содержит" и "содержащийся", не предполагают исключение дополнительных добавок, компонентов, целых чисел или этапов.
Выражение "РНК-интерференция" или "RNAi" в целом относится к РНК-зависимому процессу сайленсинга генов, который запускается молекулами двухцепочечной РНК (dsRNA) в цитоплазме клетки. dsRNA снижает экспрессию целевой последовательности нуклеиновой кислоты, которая может представлять собой ДНК, РНК-продукты экспрессии которой снижены, или РНК, по отношению к с которой молекула dsRNA в значительной степени или полностью гомологична.
Под "двухцепочечной РНК" или "dsRNA" подразумевают двухцепочечную молекулу РНК, которая способна ингибировать экспрессию целевой последовательности нуклеиновой кислоты, с которой она гомологична. В некоторых вариантах осуществления dsRNA имеет шпилечную структуру или структуру ‘петля на стебле’ с участком дуплекса, необязательно связанным по меньшей мере 1 нуклеотидом, и называется "шпилечной РНК", или "коротким шпилечным средством для RNAi", или "shRNA". Дуплекс образуется между эффекторной последовательностью и последовательностью, комплементарной эффекторной последовательности, которая в данном документе называется "эффекторной комплементарной цепью". Как правило, эффекторная комплементарная цепь будет иметь такую же длину, что и ее соответствующая эффекторная последовательность. Как будет объяснено ниже, эффекторная последовательность является комплементарной целевой последовательности нуклеиновой кислоты.
"Эффекторная последовательность" представляет собой нуклеотидную последовательность, которая, когда она является частью комплекса RISC, связывается с целевой нуклеотидной последовательностью HBV, таким образом осуществляя нацеливание на эту последовательность с целью ее разрушения клеткой. Она является аналогичной "направляющей" цепи, обсуждаемой в разделе Предпосылки изобретения. Эффекторная последовательность ’направлена на’ целевой участок посредством того, что ее последовательность комплементарна или, по существу, комплементарна транскрипту от целевого участка так, что РНК-средство, имеющее двухцепочечную часть, содержащую эффекторную последовательность, ингибирует экспрессию последовательности целевого гена.
"Эффекторная комплементарная цепь", которая является аналогичной сопровождающей цепи, обсуждаемой в Предпосылках изобретения, является достаточно комплементарной эффектору для того, чтобы она гибридизировалась с эффекторной последовательностью. Возможно, что эффекторная комплементарная цепь будет иметь последовательность, сходную с последовательностью целевого гена, но это не обязательно.
Выражение "средство для RNA1" относится к последовательности dsRNA, вызывающей RNAi. Это выражение может применяться взаимозаменяемо с "малыми интерферирующими РНК" (siPHK-средства) и малыми шпилечными РНК (средства для shRNAi или hpRNAi).
Двухцепочечный или дуплексный участок средства для RNAi имеет длину по меньшей мере 17 пар оснований и, как правило, в диапазоне 17-30 пар оснований. Средства для RNAi можно синтезировать химически или ферментативно вне клеток и впоследствии доставить в клетки или их можно экспрессировать in vivo при помощи соответствующего вектора в клетках (см., например, патент США №6573099, документы WO 2004/106517 и WO 99/49029, все из которых включены в данный документ при помощи ссылки).
Выражение "средство для направленной на ДНК RNAi" или "средство для ddRNAi" относится к средству для RNAi, которое транскрибируется с ДНК-кассеты экспрессии ("кассета экспрессии для ddRNAi"). Средство для ddRNAi, транскрибирующееся с кассеты экспрессии, может транскрибироваться в виде одной РНК, которая способна гибридизироваться сама с собой в шпилечную структуру с дуплексным участком, связанным по меньшей мере 2 нуклеотидами, или в виде одной РНК с несколькими доменами shRNA, или в виде нескольких транскриптов, каждый из которых способен к укладке в виде одной shRNA.
Кассету экспрессии для ddRNAi можно лигировать в векторы, называемых векторы для ddRNAi или конструкты для ddRNAi. Векторы могут нести последовательности, обусловливающие транскрипцию кассеты экспрессии для ddRNAi in vivo или in vitro. Вектор может дополнительно служить в качестве «проводника» для доставки кассеты экспрессии для ddRNAi. Векторы на основе вирусов, например, будут образовывать конструкт для ddRNAi, пригодный для экспрессии кассеты экспрессии для ddRNAi, а также являющийся совместимым с доставкой при помощи вируса.
Клетка была "трансформирована", "трансдуцирована" или "трансфицирована" экзогенной или гетерологичной нуклеиновой кислотой или вектором, если такая нуклеиновая кислота была введена в клетку. Трансформирующая ДНК может быть или может не быть встроенной (ковалентно связанной) в геном клетки. Что касается эукариотических клеток, стабильно трансформированная клетка представляет собой клетку, в которой трансформирующая ДНК стала встроенной в хромосому клетки-хозяина или поддерживается во внехромосомном (эписомном) состоянии так, чтобы трансформирующая ДНК наследовалась дочерними клетками при размножении клеток. В неразмножающихся дифференцированных клетках трансформирующая ДНК может существовать в виде эписомы.
"Экспрессия генов" может иметь отношение к любому из транскрипции или трансляции или к обоим сразу.
"Ингибирование экспрессии" относится к отсутствию или наблюдаемому снижению уровня белкового и/или мРНК-продукта целевого гена. Ингибирование не должно быть полным, но может быть частичным ингибированием, достаточным для поддающегося обнаружению или наблюдаемого изменения в результате введения средства для RNAi или ddRNAi, или siRNA-средства, или конструкта для ddRNAi по настоящему изобретению. Ингибирование можно измерить посредством определения снижения уровня мРНК и/или белкового продукта от целевой нуклеиновой кислоты по сравнению с клеткой, не содержащей средство или конструкт для ddRNAi, и оно может составлять до 1%, 5% или 10%, или может быть полным, т.е. 100% ингибированием. Эффекты ингибирования можно определить посредством изучения видимых свойств, т.е. количественных и/или качественных, фенотипа клетки или организма, и они также включают оценку вирусной нагрузки после введения средства или конструкта для ddRNAi по настоящему изобретению.
Используемое в данном документе выражение "количественный фенотипический признак" относится к признаку, ассоциированному с молекулярной экспрессией нуклеиновой кислоты в клетке-хозяине, и, таким образом, может включать количество молекул РНК, которые образуются в результате транскрипции или репликации, количество молекул РНК, подвергшихся пост-транскрипционной модификации, количество пептидов или белков, образующихся в результате трансляции, или активность таких пептидов или белков.
Если фенотип представляет собой качественный признак, то снижение фенотипической экспрессии нуклеиновой кислоты означает, что в присутствии средства для RNAi по настоящему изобретению фенотипический признак переключается в другое состояние по сравнению с ситуацией, при которой средство для RNAi отсутствует. Снижение фенотипической экспрессии нуклеиновой кислоты, таким образом, можно измерить как снижение уровней в стабильном состоянии (части) этой нуклеиновой кислоты, снижение трансляции (части) этой нуклеиновой кислоты или снижение влияния присутствия образующихся в результате транскрипции РНК или полипептида(ов), образующихся в результате трансляции, на эукариотическую клетку или организм, и оно, в конечном итоге, даст измененные фенотипические признаки. Ясно, что снижение фенотипической экспрессии представляющей интерес нуклеиновой кислоты может сопровождаться или коррелировать с наблюдаемым изменением фенотипа. Оценку можно осуществлять посредством биохимических методик, таких как нозерн-блот гибридизация, анализы на основе количественной ПЦР в реальном времени, анализы экспрессии генов, связывания антител, ELISA, RIA, вестерн-блоттинг и другие анализы и методики, известные в данной области техники.
"Целевые нуклеиновые кислоты" могут представлять собой либо РНК, либо ДНК, на продукты транскрипции которой осуществляется целенаправленное воздействие, кодирующую или некодирующую последовательность, эндогенную или экзогенную. В предпочтительном варианте осуществления с целью ингибирования целенаправленно воздействуют на ген полимеразы (P) ДНК-вируса вируса гепатита B. Соответственно, в данном варианте осуществления целевая нуклеиновая кислота представляет собой по меньшей мере РНК-транскрипт гена полимеразы.
Эффекторная последовательность к мишени является комплементарной или, по существу, комплементарной предсказанному транскрипту участка целевого гена. Под "по существу, комплементарные" подразумевают, что последовательности способны к гибридизации или являются гибридизируемыми. По существу, комплементарная последовательность предпочтительно является приблизительно на 85% комплементарной части целевого гена. Более предпочтительно она является по меньшей мере на 85-90% комплементарной и наиболее предпочтительно по меньшей мере на 95, 96, 97, 98, 99 или 100% комплементарной. Существенная комплементарность, таким образом, включает 100% комплементарность, но 100% комплементарность во всем описании также может упоминаться как "комплементарный" или "являющийся комплементарным".
Последовательность, комплементарная или, по существу, комплементарная участку целевого гена, характеризуется степенью комплементарности последовательности по отношению к непрерывной целевой последовательности. В общем, участок двухцепочечной РНК по настоящему изобретению может подвергаться мутагенезу с образованием одной или нескольких замен, делеций или добавлений нуклеотидов.
"Терапевтическая композиция", или "фармацевтическая композиция", или "композиция для лечения инфекции HBV" относится к композиции, включающей средство для ddRNAi, кассету экспрессии для ddRNAi, конструкт для ddRNAi или siRNA-средство.
Слова "лечить" или "лечение" относятся к терапевтическому лечению, при котором целью является замедление (уменьшение) нежелательного физиологического изменения или расстройства. В контексте настоящего изобретения благоприятные или желательные клинические результаты включают, но без ограничения, ослабление симптомов инфекции HBV, сниженную инфективность HBV, уменьшение степени заболевания, стабилизированное (т.е., не ухудшающееся) состояние при заболевании, задержку или замедление прогрессирования заболевания, облегчение или временное облегчение состояния при заболевании и ремиссию (либо частичную, либо полную), либо поддающуюся обнаружению, либо не поддающуюся обнаружению. "Лечение" также может означать продление продолжительности жизни по сравнению с ожидаемой продолжительностью жизни без получения лечения. Лечение не обязательно может привести к полному клиренсу инфекции HBV, но может уменьшить или свести к минимуму осложнения и нежелательное влияние инфекции и прогрессирование инфекции.
Фраза "терапевтически эффективное количество" означает количество соединения по настоящему изобретению, которое (i) обеспечивает лечение определенного заболевания, состояния или расстройства, (ii) смягчает, облегчает или устраняет один или несколько симптомов определенного заболевания, состояния или расстройства или (iii) обеспечивает задержку манифестации одного или нескольких симптомов определенного заболевания, состояния или расстройства, описанных в данном документе.
Подробное описание
Настоящее изобретение предлагает новое средство для RNAi и применение средства для RNAi для целенаправленного воздействия на HBV у инфицированных индивидов. Лечение HBV направлено на:
i. устранение инфективности для предупреждения передачи и распространения HBV от одного индивида к другому и
ii. сведение к минимуму общего прогрессирования заболевания печени у инфицированного индивида.
Средство для ddRNAi
Средства для RNAi, экспрессирующиеся с кассет экспрессии для ddRNAi на основе ДНК, называются средствами для направленной на ДНК RNAi или средствами для ddRNAi. Они могут непосредственно оказывать целенаправленное воздействие на активность генов с минимальным количеством нецелевых событий. Под "нецелевыми событиями" подразумевают, что экспрессия отличных от целевых нуклеиновых кислот не ингибируется посредством средств для RNAi или ddRNAi. В случае инфекции HBV предоставляется уникальная возможность удовлетворения неудовлетворенных потребностей в клиническом лечении HBV. Соответственно, в одном аспекте настоящего изобретения предложено средство для направленной на ДНК РНК-интерференции (ddRNAi) для ингибирования экспрессии одной или нескольких целевых последовательностей в гене вируса гепатита B (HBV), при этом средство для ddRNAi содержит по меньшей мере:
первую эффекторную последовательность длиной по меньшей мере 17 нуклеотидов и
первую эффекторную комплементарную последовательность,
где первая эффекторная последовательность является, по существу, комплементарной предсказанному транскрипту участка целевого гена.
Как правило, первая эффекторная последовательность образует двухцепочечный участок с первой эффекторной комплементарной последовательностью.
Последовательности средства для ddRNAi по настоящему изобретению характеризуются достаточной комплементарностью к участку гена HBV для того, чтобы опосредовать мишенеспецифическую RNAi. Под "по существу, комплементарные" подразумевают, что последовательности способны к гибридизации или являются гибридизируемыми, и либо:
- последовательность первой эффекторной последовательности является по меньшей мере приблизительно на 80, 81, 82, 83, 84, 85, 86, 87, 88, 89 или 90% комплементарной по меньшей мере 17 или более смежным нуклеотидам целевой последовательности, более предпочтительно по меньшей мере приблизительно на 90, 91, 92, 92, 94 или 95% комплементарной и еще более предпочтительно по меньшей мере приблизительно на 95, 96, 97, 98 или 99% комплементарной или полностью комплементарной (т.е. на 100%) 17 или более смежным нуклеотидам целевой последовательности; либо
- эффекторная последовательность имеет по меньшей мере 10 или более смежных нуклеотидов, на 100% комплементарных мишени, и предпочтительно менее 6 нуклеотидов, которые не могут спариваться основаниями с целевой последовательностью. Таким образом, первая эффекторная последовательность может иметь 1, 2, 3, 4 или 5 нуклеотидов, которые не будут спариваться основаниями G-C/A-U с целевой последовательностью. Предполагается, что этот уровень различий не будет оказывать отрицательное влияние на способность средства для ddRNAi обеспечивать ингибирование экспрессии целевой последовательности.
Если первая эффекторная последовательность имеет 1, 2, 3, 4 или 5 нуклеотидов, которые не будут спариваться основаниями G-C/A-U с целевой последовательностью, предпочтительными являются различия по первым или последним 5 нуклеотидам первой эффекторной последовательности, при этом с заменами только 1 или 2 нуклеотидов в центральной части эффекторной последовательности.
Средство для ddRNAi также может содержать первую эффекторную последовательность, которая состоит из 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 нуклеотидов в длину, где эффекторная последовательность является, по существу, комплементарной предсказанному транскрипту участка целевого гена. Таким образом, средство для ddRNAi согласно данному варианту осуществления настоящего изобретения имеет максимальную длину, определенную при помощи длины эффекторной последовательности и количества эффекторных последовательностей, т.е. каждая эффекторная последовательность не содержится в пределах более длинной последовательности.
Как указано выше, предполагается, что существенная комплементарность означает, что последовательности способны к гибридизации или являются гибридизируемыми. Выражения "подвергающийся гибридизации" и "гибридизирующийся" (и грамматические эквиваленты) в данном описании применяются взаимозаменяемо в отношении нуклеотидных последовательностей и имеют отношение к нуклеотидным последовательностям, которые способны образовывать уотсон-криковские пары оснований благодаря их комплементарности. Предпочтительно, по существу, комплементарные последовательности способны подвергаться гибридизации в условиях со средней или высокой жесткостью:
- условия с высокой жесткостью: 0,1×SSPE (или 0.1×SSC), 0,1%SDS, 65°C
- условия со средней жесткостью: 0,2×SSPE (или 1.0×SSC), 0,1%SDS, 50°C.
В альтернативном случае, специалист в данной области техники также поймет, что "по существу, комплементарное" включает спаривание оснований, не относящееся к уотсон-криковскому, в особенности в контексте последовательностей РНК, например, так называемая "неканоническая пара", которая может образоваться между остатками гуанозина и урацила в РНК. "Комплементарный" используется в данном документе в обычном порядке для обозначения уотсон-криковского спаривания оснований, а выражение "некомплементарный" используют для обозначения спаривания оснований, не относящегося к уотсон-криковскому, даже в том случае, если такие некомплементарные последовательности могут образовывать неканонические пары или другие взаимодействия. В контексте настоящего изобретения упоминание "не образующих пары" последовательностей имеет отношение, в частности, к последовательностям, между которыми не образуются уотсон-криковские пары оснований.
Первая эффекторная последовательность имеет длину по меньшей мере 17 нуклеотидов, предпочтительно 17-50 нуклеотидов и наиболее предпочтительно 17-30 нуклеотидов. Она может иметь длину 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 нуклеотидов. Если первая эффекторная последовательность имеет длину более 17 нуклеотидов, то является предпочтительным, чтобы по меньшей мере 17 смежных нуклеотидов первой эффекторной последовательности образовывали двухцепочечный участок с комплементарной цепью.
Средства для ddRNAi по настоящему изобретению ингибируют экспрессию последовательностей нуклеиновой кислоты HBV. Предпочтительно целевой ген HBV представляет собой последовательность нуклеиновой кислоты, которая экспрессируется как ген полимеразы (P). Соответственно, в одном варианте осуществления настоящего изобретения средство для ddRNAi по настоящему изобретению ингибирует экспрессию одной или нескольких целевых последовательностей в гене полимеразы вируса гепатита B (HBV). Геном HBV имеет перекрывающиеся открытые рамки считывания. По этой причине, целенаправленное воздействие на определенные последовательности гена полимеразы также будет оказывать целенаправленное воздействие на такие же последовательности в перекрывающемся гене. Таким образом, средства по настоящему изобретению способны осуществлять целенаправленное воздействие на несколько генов при помощи одной эффекторной последовательности. В каждом предпочтительном варианте осуществления, однако, осуществляется целенаправленное воздействие по меньшей мере на ген полимеразы.
В конкретных вариантах осуществления первая эффекторная последовательность выбрана из любых 10 или более и предпочтительно любых 17 или более смежных нуклеотидов в пределах любой из эффекторных последовательностей SEQ ID NO: 1-19 или SEQ ID NO: 20-27, перечисленных ниже, для ddRNAi в отношении полимеразы HBV. Для упрощения, SEQ ID NO: в совокупности будут называться SEQ ID NO: 1-27.
|
Как объясняется в разделе Предпосылки изобретения, обе цепи dsRNA являются потенциальными эффекторными последовательностями. Однако существуют данные, что определенные характеристики последовательности могут способствовать включению одной цепи в RISC и разрушению другой цепи. Существуют данные, что для белка Argonaut 2 (AGO2) комплекса RISC предпочтительными являются последовательности с 5’ A и в меньшей степени с 5’ U. Кроме того, последовательности РНК с более высоким содержанием AU в 5’-участках, по-видимому, преимущественно соединяются с комплексами RISC благодаря механизму, который "определяет" термодинамическую стабильность по дуплексам РНК и способствует включению последовательностей с менее стабильного конца дуплекса. Эти предпочтения последовательностей отражены в предпочтительных вариантах осуществления, но не являются обязательными.
Например, в одном варианте осуществления данного аспекта настоящего изобретения предложено средство для направленной на ДНК РНК-интерференции (ddRNAi) для ингибирования экспрессии одной или нескольких целевых последовательностей в гене вируса гепатита В (HBV), при этом средство для ddRNAi содержит по меньшей мере
первую эффекторную последовательность из любых 10 или более смежных нуклеотидов в пределах GAUUGACGAUAAGGGAGA (SEQ ID NO: 1) и
первую эффекторную комплементарную последовательность.
Первая эффекторная последовательность является, по существу, комплементарной предсказанному транскрипту участка целевого гена.
Предпочтительно первая эффекторная последовательность представляет собой по меньшей мере 17 или более смежных нуклеотидов в пределах GAUUGACGAUAAGGGAGA (SEQ ID NO:1).
Если первая эффекторная последовательность имеет 1, 2, 3, 4 или 5 нуклеотидов, отличающихся от SEQ ID NO:1, то предпочтительно присутствуют различия по первым и/или последним 5 нуклеотидам, и по меньшей мере центральные 10 нуклеотидов являются на 100% комплементарными предсказанному транскрипту участка целевого гена.
В альтернативном варианте осуществления средство для ddRNAi содержит первую эффекторную последовательность из любых 10 или более, предпочтительно любых 17 или более смежных нуклеотидов в пределах SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26 и SEQ ID NO: 27.
В особенно предпочтительных вариантах осуществления средство для ddRNAi содержит первую эффекторную последовательность из любых 10 или более, предпочтительно любых 17 или более смежных нуклеотидов в пределах последовательности, способной ингибировать экспрессию участка целевого гена по меньшей мере на 70%. Предпочтительно в данном варианте осуществления первый эффектор выбран из SEQ ID NO: 3, SEQ ID NO: 9, SEQ ID NO: 12, SEQ ID NO: 13 и SEQ ID NO: 23.
Первая эффекторная последовательность может содержать последовательность, выбранную из любых 10 или более и предпочтительно любых 17 или более смежных нуклеотидов в пределах последовательности из группы, состоящей из SEQ ID NO: 1-27, или, в альтернативном случае, каждая эффекторная последовательность может представлять собой вариант SEQ ID NO: 1-27 с отличиями в 1, 2, 3, 4 или 5 нуклеотидах. В еще одном варианте осуществления каждая эффекторная последовательность может состоять из 22 нуклеотидов, из которых 17, 18, 19, 20, 21 или все 22 нуклеотида являются смежными нуклеотидами из последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-27.
Средства для ddRNAi с множественным нацеливанием
В предпочтительном варианте осуществления настоящего изобретения средство для ddRNAi содержит две или более эффекторные последовательности для обеспечения нацеливания на более чем одну целевую последовательность в геноме HBV. Несколько целевых последовательностей могут находиться в одном и том же участке гена HBV. Например, участок из 17-30 нуклеотидов, который характеризуется естественной изменчивостью последовательности у штаммов или однонуклеотидными полиморфизмами, которые возникли как придающие устойчивость к лекарственным средствам. В альтернативном случае, целевые последовательности могут находиться в различных участках одного целевого гена.
Для обеспечения большей специфичности средство для ddRNAi содержит следующее (в произвольном порядке):
- первую эффекторную последовательность длиной по меньшей мере 17 нуклеотидов,
- вторую эффекторную последовательность длиной по меньшей мере 17 нуклеотидов,
- первую эффекторную комплементарную последовательность, и
- вторую эффекторную комплементарную последовательность.
Первая и вторая эффекторные последовательности средства для ddRNAi с множественным нацеливанием образуют двухцепочечный участок с их соответствующими эффекторными комплементарными цепями. Предпочтительно первая и вторая эффекторные последовательности имеют длину 17-30 нуклеотидов. Более предпочтительно как первая, так и вторая эффекторные последовательности выбраны из любых 10 или более и предпочтительно любых 17 или более смежных нуклеотидов в пределах любой из последовательностей, перечисленных в таблице 1 выше, или являются последовательностями, отличающимися по 1, 2, 3, 4 или 5 нуклеотидам от тех последовательностей, которые перечислены в таблице 1.
В одном варианте осуществления первая эффекторная последовательность выбрана из любых 10 или более и предпочтительно любых 17 или более смежных нуклеотидов в пределах последовательности из любой из группы, состоящей из SEQ ID NO: 1-27, и вторая эффекторная последовательность выбрана из любых 10 или более и предпочтительно любых 17 или более смежных нуклеотидов в пределах последовательности из любой из группы, состоящей из SEQ ID NO: 1-27. Как первая, так и вторая эффекторная последовательность могут быть одинаковой последовательностью или, в альтернативном случае, могут быть различными последовательностями.
Каждая из первой и второй эффекторной последовательности может содержать последовательность, выбранную из любых 10 или более смежных нуклеотидов в пределах последовательности из группы, состоящей из SEQ ID NO: 1-27, или, в альтернативном случае, каждая эффекторная последовательность также может быть вариантом SEQ ID NO: 1-27 с отличиями в 1, 2, 3, 4 или 5 нуклеотидах. В еще одном варианте осуществления каждая эффекторная последовательность может состоять из 22 нуклеотидов, из которых 17, 18, 19, 20, 21 или все 22 нуклеотида представляют собой смежные нуклеотиды из последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-27. Если присутствуют две или более эффекторных последовательностей, они могут представлять собой комбинацию из 3 описанных выше типов.
В особенно предпочтительных вариантах осуществления первая и вторая эффекторные последовательности содержат любые 10 или более, предпочтительно любые 17 или более смежных нуклеотидов в последовательностях, способных ингибировать экспрессию участка целевого гена по меньшей мере на 70%. Предпочтительно в данном варианте осуществления каждая эффекторная последовательность выбрана из SEQ ID NO: 3, SEQ ID NO: 9, SEQ ID NO: 12, SEQ ID NO: 13 и SEQ ID NO: 23.
Применение средств для ddRNAi с несколькими эффекторными последовательностями имеет преимущество ограничения появления «ускользнувших» мутантов и целенаправленного воздействия на них, что является недостатком многих существующих в настоящее время противовирусных терапевтических средств. В одном аспекте настоящего изобретения нейтрализуют появляющихся "ускользнувших" мутантов при помощи средства для ddRNAi, которое содержит последовательности для RNAi на основе генной последовательности целевого гена, и, дополнительно, последовательности с точечными мутациями, при которых возникает устойчивость к лечению RNAi.
Подобным образом, средства для ddRNAi с несколькими эффекторными последовательностями имеют преимущество в том, что они способны целенаправленно воздействовать на ряд последовательностей, обнаруживающихся в различных генотипах или квазивидах вируса, а также преимущество аддитивных или синергичных эффектов, достигаемых с несколькими эффекторными последовательностями по сравнению с отдельной эффекторной последовательностью.
Однако, как упоминается выше, для отдельных эффекторных последовательностей можно достичь целенаправленного воздействия на несколько целей, когда целевая последовательность распространяется на 2 или более генов. HBV содержит ряд перекрывающихся рамок считывания так, что целенаправленное воздействие на последовательность в перекрывающихся участках будет ингибировать экспрессию обоих генов, которые содержат данную последовательность.
Длинношпилечный вариант
Если средство для ddRNAi содержит более одной эффекторной последовательности, и средство для ddRNAi экспрессируется в виде одной цепи РНК, она будет сворачиваться с образованием различных структур в зависимости от порядка эффекторных последовательностей и последовательностей, комплементарных эффекторным последовательностям. В одном варианте осуществления предложено средство для направленной на ДНК РНК-интерференции (ddRNAi) для ингибирования экспрессии одной или нескольких целевых последовательностей в гене вируса гепатита B (HBV), причем средство для ddRNAi содержит, в направлении от 5’ к 3’, по меньшей мере
первую эффекторную последовательность длиной по меньшей мере 17 нуклеотидов,
вторую эффекторную последовательность длиной по меньшей мере 17 нуклеотидов,
вторую эффекторную комплементарную последовательность и
первую эффекторную комплементарную последовательность,
где каждая эффекторная последовательность является, по существу, комплементарна предсказанному транскрипту участка целевого гена. Это даст в результате средство для ddRNAi со структурой, которая показана на фигуре 1A. Смотри также WO 2004/106517, включенную в данный документ с помощью ссылки.
В качестве альтернативы, по меньшей мере один эффектор и предпочтительно обе эффекторные последовательности на 100% комплементарны предсказанному транскрипту участка целевого гена.
Предпочтительно, чтобы как первая, так и вторая эффекторные последовательности были выбраны из группы, состоящей из любых 10 или более и предпочтительно любых 17 или более смежных нуклеотидов в любой из SEQ ID NO: 1-27. Например, в одном варианте осуществления предложено средство для направленной на ДНК РНК-интерференции (ddRNAi) для ингибирования экспрессии одной или нескольких целевых последовательностей в гене вируса гепатита B (HBV), причем средство для ddRNAi содержит, в направлении от 5’ к 3’, по меньшей мере
первую эффекторную последовательность из любых 10 или более смежных нуклеотидов в пределах GAUUGACGAUAAGGGAGA (SEQ ID NO: 1);
вторую эффекторную последовательность из любых 10 или более смежных нуклеотидов в пределах UUGAAGUCCCAAUCUGGAU (SEQ ID NO: 2) или GCCGGGCAACGGGGUAAAGGUUC (SEQ ID NO: 3);
вторую эффекторную комплементарную последовательность и
первую эффекторную комплементарную последовательность.
Каждая эффекторная последовательность, по существу, комплементарна предсказанному транскрипту участка целевого гена.
В качестве альтернативы, по меньшей мере один эффектор и предпочтительно обе эффекторные последовательности на 100% комплементарны предсказанному транскрипту участка целевого гена.
В особо предпочтительных вариантах осуществления первая и вторая эффекторные последовательности содержат любые 10 или более, предпочтительно любые 17 или более смежных нуклеотидов в пределах последовательностей, способных ингибировать экспрессию участка целевого гена по меньшей мере на 70%. Предпочтительно в данном варианте осуществления каждая эффекторная последовательность выбрана из SEQ ID NO: 3, SEQ ID NO: 9, SEQ ID NO: 12, SEQ ID NO: 13 и SEQ ID NO: 23.
В еще одном варианте осуществления, являющемся вариантом осуществления, в котором средство для ddRNAi имеет 3 эффекторные последовательности, предлагается средство для направленной на ДНК РНК-интерференции (ddRNAi) для ингибирования экспрессии одной или нескольких целевых последовательностей в гене вируса гепатита B (HBV), причем средство для ddRNAi содержит, в направлении от 5’ к 3’, по меньшей мере
первую эффекторную последовательность из любых 10 или более смежных нуклеотидов в пределах GAUUGACGAUAAGGGAGA (SEQ ID NO: 1),
вторую эффекторную последовательность из любых 10 или более смежных нуклеотидов в пределах UUGAAGUCCCAAUCUGGAU (SEQ ID NO: 2),
третью эффекторную последовательность из любых 10 или более смежных нуклеотидов в пределах GCCGGGCAACGGGGUAAAGGUUC (SEQ ID NO: 3),
третью эффекторную комплементарную последовательность,
вторую эффекторную комплементарную последовательность и
первую эффекторную комплементарную последовательность.
Каждая эффекторная последовательность, по существу, комплементарна предсказанному транскрипту участка целевого гена.
В качестве альтернативы, по меньшей мере один эффектор и необязательно 2 из 3 эффекторов или все 3 эффектора на 100% комплементарны предсказанному транскрипту участка целевого гена.
В особо предпочтительных вариантах осуществления первая, вторая и третья эффекторные последовательности содержат любые 10 или более, предпочтительно любые 17 или более смежных нуклеотидов в последовательностях, способных ингибировать экспрессию участка целевого гена по меньшей мере на 70%. Предпочтительно в данном варианте осуществления каждая эффекторная последовательность выбрана из SEQ ID NO: 3, SEQ ID NO: 9, SEQ ID NO: 12, SEQ ID NO: 13 и SEQ ID NO: 23.
Также специалисту будет понятно, что порядок эффектора и комплементарных цепей эффектора можно изменить при условии, что образуется отдельная длинношпилечная структура при гибридизации эффекторной последовательности с комплементарной цепью эффектора с образованием dsRNA. Например, в средстве для ddRNAi с 2-мя эффекторными последовательностями последовательности могут быть расположены в следующих иллюстративных порядках от 5’ к 3’:
- первый эффектор - второй эффектор - комплементарная цепь второго эффектора - комплементарная цепь первого эффектора,
- первый эффектор - комплементарная цепь второго эффектора - второй эффектор - комплементарная цепь первого эффектора,
- комплементарная цепь первого эффектора - комплементарная цепь второго эффектора - второй эффектор - первый эффектор,
- комплементарная цепь первого эффектора - второй эффектор - комплементарная цепь второго эффектора - первый эффектор.
В средстве для ddRNAi с 3-мя эффекторными последовательностями последовательности могут быть расположены в следующих иллюстративных порядках от 5’ к 3’:
- первый эффектор - второй эффектор - третий эффектор - комплементарная цепь третьего эффектора - комплементарная цепь второго эффектора - комплементарная цепь первого эффектора,
- первый эффектор - комплементарная цепь второго эффектора - третий эффектор - комплементарная цепь третьего эффектора - второй эффектор - комплементарная цепь первого эффектора,
- первый эффектор - второй эффектор - комплементарная цепь третьего эффектора - третий эффектор - комплементарная цепь второго эффектора - комплементарная цепь первого эффектора,
- комплементарная цепь первого эффектора - комплементарная цепь второго эффектора - комплементарная цепь третьего эффектора - третий эффектор - второй эффектор - комплементарная цепь первого эффектора,
- комплементарная цепь первого эффектора - комплементарная цепь второго эффектора - третий эффектор - комплементарная цепь третьего эффектора - второй эффектор - первый эффектор.
В дополнительных вариантах осуществления первую эффекторную последовательность можно выбрать из любых 10 или более и предпочтительно из любых 17 или более смежных нуклеотидов в пределах последовательности из группы, состоящей из SEQ ID NO: 1-27; вторую эффекторную последовательность можно выбрать из любых 10 или более и предпочтительно из любых 17 или более смежных нуклеотидов в пределах последовательности из группы, состоящей из SEQ ID NO: 1-27; третью эффекторную последовательность можно выбрать из любых 10 или более и предпочтительно из любых 17 или более смежных нуклеотидов в пределах последовательности из группы, состоящей из SEQ ID NO: 1-27; и любые дополнительные эффекторные последовательности можно выбрать из любых 10 или более и предпочтительно из любых 17 или более смежных нуклеотидов в пределах последовательности из группы, состоящей из SEQ ID NO: 1-27. В качестве альтернативы, каждая эффекторная последовательность может также являться вариантом SEQ ID NO: 1-27 с отличиями в 1, 2, 3, 4 или 5 нуклеотидах. Предпочтительно различия присутствуют в первых и/или последних 5 нуклеотидах, и по меньшей мере центральные 11-12 нуклеотидов на 100% комплементарны предсказанному транскрипту участка целевого гена. Такие варианты осуществления особенно пригодны для нацеливания на "ускользнувших" мутантов HBV, а также на различные генотипы и квазивиды вируса.
Каждая из первой, второй и третьей эффекторных последовательностей может содержать последовательность, выбранную из любых 10 или более смежных нуклеотидов в пределах последовательности из группы, состоящей из SEQ ID NO: 1-27, или, в качестве альтернативы, каждая эффекторная последовательность также может представлять собой вариант SEQ ID NO: 1-27 с отличиями в 1, 2, 3, 4 или 5 нуклеотидах. В дополнительном варианте осуществления каждая эффекторная последовательность может состоять из 22 нуклеотидов, из которых 17, 18, 19, 20, 21 или все 22 нуклеотида являются смежными нуклеотидами из последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-27. Если присутствуют несколько эффекторных последовательностей, они могут представлять собой комбинацию из 3 описанных выше типов.
Многошпилечный вариант
В альтернативом варианте осуществления предложено средство для направленной на ДНК РНК-интерференции (ddRNAi) для ингибирования экспрессии одной или нескольких целевых последовательностей в гене вируса гепатита B (HBV), причем средство для ddRNAi содержит, в направлении от 5’ к 3’, по меньшей мере
первую эффекторную последовательность длиной по меньшей мере 17 нуклеотидов,
комплементарную цепь первого эффектора,
вторую эффекторную последовательность длиной по меньшей мере 17 нуклеотидов, и
комплементарную цепь первого эффектора,
где каждая эффекторная последовательность, по существу, комплементарна предсказанному транскрипту участка целевого гена.
В качестве альтернативы, по меньшей мере один эффектор и предпочтительно обе эффекторные последовательности на 100% комплементарны предсказанному транскрипту участка целевого гена.
Это даст в результате средство для ddRNAi со структурой, которая показана на фигуре 1B или 1C, в зависимости от типа кассеты экспрессии, применяемой для его экспрессии (смотри далее в описании). Смотри также WO 2005/087926 и WO 2006/084209, включенные в данный документ с помощью ссылки.
Предпочтительно как первая, так и вторая эффекторные последовательности выбраны из любых 10 или более и предпочтительно из любых 17 или более смежных нуклеотидов в пределах последовательности из группы, состоящей из SEQ ID NO: 1-27. Например, в одном варианте осуществления предложено средство для направленной на ДНК РНК-интерференции (ddRNAi) для ингибирования экспрессии одной или нескольких целевых последовательностей в гене вируса гепатита B (HBV), причем средство для ddRNAi содержит, в направлении от 5’ к 3’, по меньшей мере
первую эффекторную последовательность из любых 10 или более смежных нуклеотидов в пределах GAUUGACGAUAAGGGAGA (SEQ ID NO: 1),
первую эффекторную комплементарную последовательность,
вторую эффекторную последовательность из любых 10 или более смежных нуклеотидов в пределах UUGAAGUCCCAAUCUGGAU (SEQ ID NO: 2) или GCCGGGCAACGGGGUAAAGGUUC (SEQ ID NO: 3) и
вторую эффекторную комплементарную последовательность.
Каждая эффекторная последовательность, по существу, комплементарна предсказанному транскрипту участка целевого гена.
В качестве альтернативы, по меньшей мере один эффектор и предпочтительно обе эффекторные последовательности на 100% комплементарны предсказанному транскрипту участка целевого гена.
В особенно предпочтительных вариантах осуществления первая и вторая эффекторные последовательности содержат любые 10 или более, предпочтительно любые 17 или более смежных нуклеотидов в пределах последовательностей, способных ингибировать экспрессию участка целевого гена по меньшей мере на 70%. Предпочтительно в данном варианте осуществления каждая эффекторная последовательность выбрана из SEQ ID NO: 3, SEQ ID NO: 9, SEQ ID NO: 12, SEQ ID NO: 13 и SEQ ID NO: 23.
В варианте осуществления, в котором средство для ddRNAi имеет 3 эффекторные последовательности, предложено средство для направленной на ДНК РНК-интерференции (ddRNAi) для ингибирования экспрессии одной или нескольких целевых последовательностей в гене вируса гепатита B (HBV), причем средство для ddRNAi содержит, в направлении от 5’ к 3’, по меньшей мере
первую эффекторную последовательность из любых 10 или более смежных нуклеотидов в пределах GAUUGACGAUAAGGGAGA (SEQ ID NO: 1),
первую эффекторную комплементарную последовательность,
вторую эффекторную последовательность из любых 10 или более смежных нуклеотидов в пределах UUGAAGUCCCAAUCUGGAU (SEQ ID NO: 2),
вторую эффекторную комплементарную последовательность,
третью эффекторную последовательность из любых 10 или более смежных нуклеотидов в GCCGGGCAACGGGGUAAAGGUUC (SEQ ID NO:3) и
третью эффекторную комплементарную последовательность.
Каждая эффекторная последовательность, по существу, комплементарна предсказанному транскрипту участка целевого гена.
В качестве альтернативы, по меньшей мере один эффектор и необязательно 2 из 3 эффекторов или все 3 эффектора на 100% комплементарны предсказанному транскрипту участка целевого гена.
В особенно предпочтительных вариантах осуществления первая, вторая и третья эффекторные последовательности содержат любые 10 или более, предпочтительно любые 17 или более смежных нуклеотидов в пределах последовательностей, способных ингибировать экспрессию участка целевого гена по меньшей мере на 70%. Предпочтительно в данном варианте осуществления каждая эффекторная последовательность выбрана из SEQ ID NO:3, SEQ ID NO: 9, SEQ ID NO: 12, SEQ ID NO: 13 и SEQ ID NO: 23.
В дополнительных вариантах осуществления первая эффекторная последовательность может представлять собой любые 10 или более смежных нуклеотидов в пределах последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-27; вторая эффекторная последовательность может представлять собой любые 10 или более смежных нуклеотидов в пределах последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-27; третья эффекторная последовательность может представлять собой любые 10 или более смежных нуклеотидов в пределах последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-27; и любые дополнительные эффекторные последовательности могут представлять собой любые 10 или более смежных нуклеотидов в пределах последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-27. Предпочтительно каждая эффекторная последовательность представляет собой по меньшей мере 17 смежных нуклеотидов.
Каждая эффекторная последовательность может также представлять собой вариант SEQ ID NO: 1-27 с отличиями в 1, 2, 3, 4 или 5 нуклеотидах. Предпочтительно различия присутствуют в первых и/или последних 5 нуклеотидах и по меньшей мере центральные 10-12 нуклеотидов на 100% комплементарны предсказанному транскрипту участка целевого гена. Такие варианты осуществления особенно пригодны для нацеливания на "ускользнувших" мутантов HBV, а также на различные генотипы и квазивиды вируса.
Каждая из первой, второй и третьей эффекторных последовательностей может содержать последовательность, выбранную из любых 10 или более смежных нуклеотидов в пределах последовательности из группы, состоящей из SEQ ID NO: 1-27, или, в качестве альтернативы, каждая эффекторная последовательность может также являться вариантом SEQ ID NO: 1-27 с отличиями в 1, 2, 3, 4 или 5 нуклеотидах. В дополнительном варианте осуществления каждая эффекторная последовательность может состоять из 22 нуклеотидов, из которых 17, 18, 19, 20, 21 или все 22 нуклеотида являются смежными нуклеотидами из последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-27. Если присутствуют несколько эффекторных последовательностей, они могут представлять собой комбинацию из 3 описанных выше типов. Кроме того, в длинношпилечной структуре или многошпилечной структуре средство для ddRNAi может включать дополнительные эффекторные последовательности и соответствующие комплементарные последовательности в соответствии с одной следующих формул:
Длинная шпилька:
- [эффекторная последовательность]1-10 [эффекторная комплементарная последовательность]1-10
Множество шпилек
- [эффекторная последовательность - эффекторная комплементарная последовательность]1-10
Предпочтительно в формуле длинной шпильки количество эффекторных последовательностей равно количеству эффекторных комплементарных последовательностей. Как правило, присутствуют 2, 3, 4 или 5 эффекторных последовательностей и 2, 3, 4 или 5 эффекторных комплементарных последовательностей, соответственно.
Если средство для ddRNAi содержит более чем одну эффекторную последовательность, то эффекторные последовательности могут быть одинаковыми или отличными. Например, если средство для ddRNAi имеет 3 эффекторные последовательности, 2 эффекторные последовательности могут иметь одинаковую последовательность, тогда как 1 является отличной. В качестве альтернативы все 3 эффекторные последовательности могут быть отличными. Предпочтительно эффекторные последовательности представляют собой любые 10 или более и предпочтительно любые 17 или более смежных нуклеотидов в пределах последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-27 или вариантов последовательностей SEQ ID NO: 1-27, которые имеют 1, 2, 3, 4 или 5 изменений нуклеотидов. Предпочтительно различия присутствуют в первых и/или последних 5 нуклеотидах, и по меньшей мере центральные 10-12 нуклеотидов на 100% комплементарны предсказанному транскрипту участка целевого гена.
При нацеливании на отдельный участок целевой последовательности, которая имеет встречающиеся в природе варианты (например, различные генотипы или квазивиды), "ускользнувшие" мутанты или однонуклеотидные полиморфизмы (SNP), предпочтительно, чтобы по меньшей мере одна эффекторная последовательность была выбрана из любых 10 или более и предпочтительно любых 17 или более смежных нуклеотидов в пределах последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-27, тогда как другие эффекторные последовательности были вариантами такой выбранной последовательности. Например, первая эффекторная последовательность может содержать 20 нуклеотидов из SEQ ID NO: 1; вторая эффекторная последовательность должна, следовательно, представлять собой вариант SEQ ID NO:1.
Шпилечные структуры
В вышеизложенных вариантах осуществления эффекторная последовательность гибридизируется с ее соответствущей эффекторной комплементарной последовательностью с образованием шпилечной структуры. На конце шпильки два или более несвязанных нуклеотидов образуют ’стержень’ или ’петлю’. В одном варианте осуществления несвязанные нуклеотиды являются частью эффекторной последовательности и эффекторной комплементарной последовательности, так, чтобы только часть из по меньшей мере 17 нуклеотидов эффекторной последовательности образовывали дуплекс с ее соответствущей эффекторной комплементарной последовательностью. Например, если как эффекторная последовательность, так и ее комплементарная цепь имеют длину 22 нуклеотида, 19 из нуклеотидов могут спариваться основаниями с образованием двухцепочечного участка, оставляя в сумме 6 нуклеотидов (3 от каждой цепи), образующих одноцепочечную петлю между эффекторной последовательностью и ее эффекторной комплементарной последовательностью и соединяя их.
В альтернативом варианте осуществления в ddRNAi можно включить дополнительную последовательность, которая является некомплементарной сама себе, целевой последовательности, эффекторной последовательности или последовательности, комплементарной эффекторной последовательности. В связи с этим в еще одном варианте осуществления настоящего изобретения средство для ddRNAi дополнительно включает последовательность из 2-100 неспаренных нуклеотидов, способных к образованию петли, более предпочтительно из 2-10 неспаренных нуклеотидов. В предпочтительном варианте осуществления петля включает нуклеотидную последовательность AA, UU, UUA, UUAG, UUACAA, CAAGAGA или N1AAN2, где N1 и N2 представляют собой любой из C, G, U и A и могут быть одинаковыми или различными.
В зависимости от структуры средства для ddRNAi может присутствовать одна или несколько петель. Если средство для ddRNAi имеет длинношпилечную структуру на основе формулы [эффекторная последовательность]1-10 [эффекторная комплементарная последовательность]1-10, то дополнительную несамокомплементарную последовательность, приводящая к образованию отдельной петлевой структуры, включают в состав между последней эффекторной последовательностью и эффекторной комплементарной последовательностью к этой последней эффекторной последовательности, как проиллюстрировано на Фигуре 1D. В данном варианте осуществления, следовательно, предложено средство для направленной на ДНК РНК-интерференции (ddRNAi) для ингибирования экспрессии одной или нескольких целевых последовательностей в гене вируса гепатита B (HBV), причем средство для ddRNAi содержит, в направлении от 5’ к 3’, по меньшей мере
первую эффекторную последовательность длиной по меньшей мере 17 нуклеотидов,
вторую эффекторную последовательность длиной по меньшей мере 17 нуклеотидов,
последовательность из 2-100 некомплементарных нуклеотидов,
вторую эффекторную комплементарную последовательность и
первую эффекторную комплементарную последовательность,
где каждая эффекторная последовательность, по существу, комплементарна предсказанному транскрипту участка целевого гена.
Если средство для ddRNAi имеет многошпилечную структуру на основе формулы [эффекторная последовательность - эффекторная комплементарная последовательность]1-10, то дополнительная несамокомплементарная последовательность включают в состав между каждой эффекторной последовательностью и ее комплементарной последовательностью, что приводит к образованию петлевой структуры, которая проиллюстрирована на Фигуре 1E и 1F (в зависимости от типа кассеты экспрессии, применяемой для ее экспрессии (смотри далее в описании)). В данном варианте осуществления предложено средство для направленной на ДНК РНК-интерференции (ddRNAi) для ингибирования экспрессии одной или нескольких целевых последовательностей в гене вируса гепатита B (HBV), причем средство для ddRNAi содержит, в направлении от 5’ к 3’, по меньшей мере
первую эффекторную последовательность длиной по меньшей мере 17 нуклеотидов,
последовательность из 2-100 некомплементарных нуклеотидов,
первую эффекторную комплементарную последовательность,
вторую эффекторную последовательность длиной по меньшей мере 17 нуклеотидов,
последовательность из 2-100 некомплементарных нуклеотидов и
вторую эффекторную комплементарную последовательность,
где каждая эффекторная последовательность, по существу, комплементарна предсказанному транскрипту участка целевого гена.
В данном варианте осуществления, в котором присутствует более двух эффекторов и двух эффекторных комплементарных последовательностей и, следовательно, более двух шпилечных структур, длина дополнительной несамокомплементарной последовательности, которая образует каждую петлевую структуру не должна быть одинаковой. Например, одна петлевая структура может содержать 5 нуклеотидов, тогда как другая петлевая структура может содержать 9 нуклеотидов.
2-х цепоченые средства для ddRNAi
Как будет понятно специалисту в данной области, не обязательно, чтобы средство для ddRNAi полностью экспрессировалось в виде одной последовательности. Например, в одном варианте осуществления настоящего изобретения можно получить первую эффекторную последовательность (например, транскрибировать с одной последовательности ДНК) и можно получить первую эффекторную комплементарную последовательность (например, транскрибировать с отдельной последовательности ДНК). Необязательно, последовательность петли может быть присоединена либо к транскрипту, либо к части петли, присоединенной к 3’ концу одного транскрипта и 5’ концу другого транскрипта. Внутри клетки два транскрипта затем образуют средство для ddRNAi путем гибридизации посредством соединения комплементарных цепей между эффекторной последовательностью/последовательностями и ее/их комплементарной цепью/цепями.
Экспрессированные in vitro средства для ddRNAi или химически синтезированные siRNA-средства
Хотя предполагается, что для эффективного лечения хронической инфекции HBV будет необходимо, чтобы средства для ddRNAi экспрессировались in vivo с конструктов для ddRNAi (как будет в общих чертах изложено ниже), может существовать много случаев, при которых желательно вводить средства для ddRNAi, которые экспрессируются in vitro, или вводить siRNA, которые являются химически синтезированными, таким образом функционируя скорее как временная терапия. На острую инфекцию HBV, например, может оказывать благоприятное воздействие кратковременное лечение при помощи siRNA, которые не встраиваются и не реплицируются в клетках.
Средства для ddRNAi согласно настоящему изобретению можно, следовательно, экспрессировать in vitro и затем доставить в целевые клетки. В качестве альтернативы, siRNA можно химически синтезировать и затем доставить в целевые клетки. В свете этого, в другом аспекте настоящего изобретения предложено средство на основе малой интерферирующей RNA (siRNA-средство) для ингибирования экспрессии одной или нескольких целевых последовательностей в гене вируса гепатита В (HBV), причем siRNA содержит
первую эффекторную последовательность длиной по меньшей мере 17 нуклеотидов и
первую эффекторную комплементарную последовательность,
где эффекторная последовательность, по существу, комплементарна предсказанному транскрипту участка целевого гена.
Подобно средствам для ddRNAi, описанным выше, siRNA-средство также может включать более одной эффекторной последовательности для целенаправленного действия на несколько мишеней. Эффекторные последовательности предпочтительно целенаправленно действуют на ген полимеразы HBV и наиболее предпочтительно выбраны из любых 10 или более и предпочтительно любых 17 или более смежных нуклеотидов в пределах последовательности из группы, состоящей из SEQ ID NO: 1-27.
При конструировании siRNA возможна значительная свобода действий. Как правило, siRNA состоят из молекул dsRNA с 5’-фосфатным и 3’-гидроксильным остатками, длины цепей могут изменяться от 21 до 29 нуклеотидов и необязательно могут сконструированы с включением 2-нуклеотидных 3’ "липких" концов. В некоторых вариантах осуществления каждую цепь можно синтезировать в виде N19-27TT (где TT могут быть дезоксирибонуклеотидами). siRNA можно легко сконструировать на основе участков из SEQ ID NO: 1-27, как описано выше, и можно использовать в терапии в виде отдельных последовательностей или в любых комбинациях. В качестве альтернативы siRNA-средства могут состоять из отдельных молекул РНК, содержащих эффектор и Эффекторные комплементарные последовательности, подобные или идентичные последовательностям, экспрессируемым с кассет экспрессии для ddRNAi. Эти последовательности могут быть основаны на SEQ ID NO: 1-27 и могут использоваться в терапии в виде отдельных последовательностей или в любой комбинации. siRNA можно химически синтезировать при помощи подходящим образом защищенных рибонуклеозид-фосфорамидитов и традиционного синтезатора, и они, следовательно, являются широко доступными коммерчески, и их можно сконструировать и синтезировать в соответствии с распространенными в данной области техники способами. В предпочтительных вариантах осуществления siRNA имеют последовательности из любых 10 или более смежных нуклеотидов в пределах последовательности из одной или нескольких из SEQ ID NO:1-27.
Ряд реактивов для трансфекции был использован для доставки siRNA в различные клеточные линии. Для доставки siRNA обычно применяют липофектамин 2000 и олигофектамин. Также, с помощью способов гидродинамической трансфекции были доставлены "голые" siRNA. Другие способы доставки будут известны специалисту в данной области.
Кассеты экспрессии для средства для ddRNAi
Как объясняется выше, средства для ddRNAi экспрессируются с ДНК-кассет экспрессии, вставленных в любой подходящий вектор или конструкт для ddRNAi. Кассеты экспрессии для ddRNAi содержат (в произвольном порядке):
- одну или несколько промоторных последовательностей,
- одну или несколько последовательностей ДНК, которые кодируют одну или несколько эффекторных последовательностей,
- одну или несколько последовательностей ДНК, которые кодируют одну или несколько эффекторных комплементарных последовательностей,
- одну или несколько терминаторных последовательностей
и, необязательно,
- одну или несколько последовательностей ДНК, которые кодируют последовательности петли,
- одну или несколько энхансерных последовательностей.
В одном варианте осуществления предложена кассета экспрессии для направленной на ДНК РНК-интерференции (ddRNAi) для экспрессии средства для ddRNAi, где средство для ddRNAi ингибирует экспрессию одной или нескольких целевых последовательностей в гене вируса гепатита B (HBV), причем кассета экспрессии для ddRNAi содержит, в направлении от 5’ к 3’,
промоторную последовательность,
последовательность ДНК, которая кодирует первую эффекторную последовательность,
необязательно, последовательность, которая кодирует последовательность, способную образовывать петлю,
последовательность ДНК, которая кодирует первую эффекторную комплементарную последовательность, и
терминаторную последовательность.
Последовательность ДНК, которая кодирует первую эффекторную последовательность, предпочтительно представляет собой ДНК, которая кодирует 10 или более, предпочтительно 17 или более смежных нуклеотидов в пределах последовательности из любой из SEQ ID NO: 1-27. В особенно предпочтительном варианте осуществления первая эффекторная последовательность содержит любые 10 или более, предпочтительно любые 17 или более смежных нуклеотидов в пределах последовательностей, способных ингибировать экспрессию участка целевого гена по меньшей мере на 70%. Предпочтительно в данном варианте осуществления первая эффекторная последовательность выбрана из SEQ ID NO: 3, SEQ ID NO: 9, SEQ ID NO: 12, SEQ ID NO: 13 и SEQ ID NO: 23.
В качестве альтернативы, как кратко изложено выше в отношении собственно средства для ddRNAi, последовательность, которая кодирует эффекторную последовательность, может кодировать эффекторную последовательность, которая отличается на 1, 2, 3, 4 или 5 нуклеотидов от SEQ ID NO: 1-27 без отрицательного воздействия на способность кодируемой эффекторной последовательности спариваться основаниями с целевой последовательностью и ингибировать экспрессию целевой последовательности.
Специалист в данной области поймет, что последовательность ДНК, кодирующая любую данную последовательность РНК, имеет такую же последовательность, что и РНК, но с тиминовыми (T) основаниями вместо урациловых (U) оснований.
Кассеты экспрессии для ddRNAi, кодирующие средства для ddRNAi, имеющие более одной эффекторной последовательности в длинношпилечной структуре, содержат, в направлении от 5’ к 3’,
промоторную последовательность,
последовательность ДНК, которая кодирует первую эффекторную последовательность,
последовательность ДНК, которая кодирует вторую эффекторную последовательность,
необязательно, последовательность, которая кодирует последовательность, способную образовывать петлю,
последовательность ДНК, которая кодирует вторую эффекторную комплементарную последовательность,
последовательность ДНК, которая кодирует первую эффекторную комплементарную последовательность, и
терминаторную последовательность.
Предпочтительно последовательности ДНК кодируют первую и вторую эффекторные последовательности, выбранные из любых 10 или более и предпочтительно любых 17 или более смежных нуклеотидов в пределах последовательности из группы, состоящей из SEQ ID NO: 1-27. Предпочтительно первая и вторая эффекторные последовательности выбраны из SEQ ID NO: 3, SEQ ID NO: 9, SEQ ID NO: 12, SEQ ID NO: 13 и SEQ ID NO: 23. В качестве альтернативы, последовательности ДНК кодируют эффекторную последовательность, которая отличается от SEQ ID NO: 1-27 на 1, 2, 3, 4 или 5 нуклеотидов, без отрицательного воздействия на способность кодируемой эффекторной последовательности спариваться основаниями с целевой последовательностью и ингибировать экспрессию целевой последовательности.
Если средство для ddRNAi имеет более одной эффекторной последовательности и многошпилечную структуру на основе формулы [эффекторная последовательность - эффекторная комплементарная последовательность]1-10, то экспрессия каждой пары [эффекторная последовательность - эффекторная комплементарная последовательность] может управляться одним промотором или, в качестве альтернативы, отдельными промоторами. Если предполагаются отдельные промоторы, то кассета экспрессии для ddRNAi содержит, в направлении от 5’ к 3’,
промоторную последовательность,
последовательность ДНК, которая кодирует первую эффекторную последовательность;
последовательность ДНК, которая кодирует первую эффекторную комплементарную последовательность,
необязательно, терминаторную последовательность,
промоторную последовательность;
последовательность ДНК, которая кодирует вторую эффекторную последовательность,
последовательность ДНК, которая кодирует вторую эффекторную комплементарную последовательность, и
терминаторную последовательность.
Если предполагается один промотор, то кассета экспрессии для ddRNAi содержит, в направлении от 5’ к 3’,
промоторную последовательность,
последовательность ДНК, которая кодирует первую эффекторную последовательность,
последовательность ДНК, которая кодирует эффекторную комплементарную последовательность к первой эффекторной последовательности;
последовательность ДНК, которая кодирует вторую эффекторную последовательность,
последовательность ДНК, которая кодирует эффекторную комплементарную последовательность ко второй эффекторной последовательности, и
терминаторную последовательность.
Подобно приведенным выше вариантам осуществления последовательности ДНК предпочтительно кодируют первую и вторую эффекторные последовательности, выбранные из любых 10 или более и предпочтительно любых 17 или более смежных нуклеотидов в пределах последовательности из группы, состоящей из SEQ ID NO: 1-27, или эффекторные последовательности, последовательность которых отличается от SEQ ID NO: 1-27 на 1, 2, 3, 4 или 5 нуклеотидов. Предпочтительно первая и вторая эффекторные последовательности выбраны из SEQ ID NO: 3, SEQ ID NO: 9, SEQ ID NO: 12, SEQ ID NO: 13 и SEQ ID NO: 23.
Кассета экспрессии для ddRNAi альтернативно может быть описана, исходя из общей длины экспрессируемого средства для ddRNAi, которое является продуктом с общей длиной последовательности между промотором и терминатором. Например, если длина эффекторной последовательности в отдельной эффекторной ddRNAi состоит из 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 нуклеотидов, то кассета экспрессии для ddRNAi будет иметь длину 34-60 нуклеотидов между промотором и терминатором. Эта длина может дополнительно включать 2-100 нуклеотидов из последовательности "петли" или "стержня", давая длину от 36 до 160 нуклеотидов. Для средства для ddRNAi с множественными эффекторными последовательностями, где каждая эффекторная последовательность состоит из 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 нуклеотидов, вся длина пропорционально увеличивается.
Одним подходящим способом конструирования кассет экспрессии для ddRNAi по настоящему изобретению является предположение, что дайсер делает разрез через каждые 22 нуклеотида (также называемое 22-нуклеотидной периодичностью) и процессирует от основания shRNA. Последовательности ДНК, которые кодируют эффекторные последовательности, следовательно, можно сконструировать как кодирующие любые 10 или более и предпочтительно любые 17 или более смежных нуклеотидов в последовательности из группы, состоящей из SEQ ID NO: 1-27, вместе с соответствующими спейсерами и другими необходимыми последовательностями для соответствующего промотора. Например, некоторые из последовательностей, приведенных в SEQ ID NO: 1-27, имеют длину более 22 нуклеотидов; в этих случаях только часть последовательности должна быть функционально связана с промотором.
Средства, нацеливающиеся на различные сайты мРНК, подходят для конструкции shRNA, поскольку они могут не допустить влияния вторичных структур мРНК и, таким образом, независимо осуществляют свои функции.
При применении промотора U6 предпочтительно, чтобы последовательность ДНК, функционально связанная с промотором, начиналась с основания гуанин (G); при применении промотора H1 предпочтительно, чтобы последовательность ДНК, функционально связанная с промотором, начиналась с основания аденин (A). Эффекторная кодирующая последовательность, следовательно, может быть соответствующим образом модифицированной. Для некоторых последовательностей из SEQ ID NO: 1-27 эффекторные последовательности имеют длину короче 22 нуклеотидов; в этих случаях предпочтительно включение последовательностей HBV рядом с сайтами-мишенями HBV. Это будет служить для максимализации гомологии эффекторных последовательностей с мРНК HBV и также может позволить включение остатков A или G с тем, чтобы сделать возможной эффективную инициацию транскрипции от промоторов U6 или H1, как описано выше. Более того, для US-транскрипции, в частности, эффекторную последовательность желательно расположить 3’ от петли для того, чтобы избежать 5’ G, что необходимо для эффективной U6-транскрипции.
В некоторых случаях может быть желательным исключение TTTT последовательности ДНК в эффекторе, комплементарной цепи эффектора или петлевых последовательностях, поскольку они могут играть роль терминаторов транскрипции в конструктах экспрессии, в которых используются промоторы Pol III, такие как U6 или H1. При разработке shRNA также следует учитывать, что при U6-терминации возможно добавление UU к 3’-концу shRNA. При разработке длинных шпилечных-РНК иногда предпочтительно модифицировать точный выбор эффекторных последовательностей (либо с помощью последовательностей от, либо рядом с SEQ ID NO: 1-27) для максимализации вероятности, что процессированные дайсером эффекторные последовательности будут включать 5’U или A, таким образом, способствуя встраиванию в AGO2.
Выбор того, управлять ли экспрессией каждой пары [эффекторная последовательность - комплементарная эффекторная последовательность], зависит от ряда факторов. Единичный промотор можно использовать для минимизации интерференции между промоторами. Конструкт для ddRNAi только с единичным промотором также имеет меньший размер, что может быть важным в некоторых случаях для стабильности конструкта как во время получения (например, репликации в E.coli), так и во время доставки. К тому же применение единичного промотора устраняет возможность любой гомологичной рекомбинации между промоторами.
В условиях, где все же необходим уровень регуляции экспрессии каждой эффекторной последовательности или комплементарной последовательности, преимущественной является разработка конструкта для ddRNAi с множеством промоторов, при этом управление экспрессией каждой пары [эффекторная последовательность - комплементарная эффекторная последовательность] управляется с помощью отдельного промотора. В условиях, где эффекторные последовательности происходят от отличной последовательности, природа последовательности говорит о том, что одна последовательность экспрессируется с более высокими уровнями экспрессии. При необходимости обеспечения более равных уровней экспрессии каждой эффекторной последовательности более высоко экспрессируемую эффекторную последовательность можно спарить с более слабым промотором и наоборот. Более того, можно достичь более эффективной экспрессии, поскольку длина любой подлежащей экспрессии последовательности короче. При применении нескольких промоторов предпочтительно, чтобы не все промоторы были одинаковыми для минимизации риска любой гомологичной рекомбинации между ними. В случае 2 промоторов предпочтительно, чтобы они отличались. В случае 3 промоторов, по меньшей мере 2 и необязательно все 3 отличаются друг от друга.
Последовательность ДНК, кодирующая эффекторную последовательность, функционально связана с промоторной последовательностью. Последовательность "функционально связана" с другой нуклеотидной последовательностью, если она помещена в функциональной взаимосвязи с другой нуклеотидной последовательностью. Например, если кодирующая последовательность функционально связана с промоторной последовательностью, это в целом означает, что промотор стимулирует транскрипцию кодирующей последовательности. Функционально связанный означает, что связанные последовательности ДНК, как правило, являются смежными и, при необходимости соединения двух кодирующих белок участков, смежными и в рамке считывания. Однако, поскольку энхансеры могут функционировать в случае, когда они удалены от промотора на несколько тысяч оснований, и интронные последовательности могут иметь различную длину, некоторые нуклеотидные последовательности могут быть функционально связаны, но не быть смежными.
"Промотор", или "про моторная последовательность", или "промоторный элемент" обычно представляет собой регуляторный участок ДНК, который может связываться с РНК-полимеразой в клетке и инициировать транскрипцию полинуклеотида или полипептид-кодирующую последовательность, такую как мРНК или любой тип РНК, транскрибируемый любым классом любой РНК-полимеразы. Промотор и терминатор можно взять из различных генов, но, как правило, они подходят друг к другу; то есть промоторные и терминаторные последовательности или элементы взяты из одного гена, в котором они встречаются в природе. Промоторы также могут быть или не быть модифицированы с помощью молекулярных техник, или в другом случае, например, посредством мутации регуляторных элементов, таких как энхансеры, для получения более высоких или низких уровней транскрипции.
Выражение "конститутивный" при употреблении в отношении промотора означает, что промотор может управлять транскрипцией функционально связанной последовательностью нуклеиновой кислоты в присутствии или отсутствии специфического стимула (например, тепловой шок, химические средства, свет и т.д.). Как правило, конститутивные промоторы могут управлять экспрессией кодирующей последовательности фактически в любой клетке и любой ткани. Промоторы, применяемые в кассетах экспрессии, для транскрибирования средства для ddRNAi предпочтительно являются конститутивными промоторами, такими как промоторы для генов убиквитина, CMV, β-актина, гистона H4, EF-1alfa или pgk, экспрессия которых управляется РНК-полимеразой II, связывающейся с промотором, или промоторными элементами, которые связаны РНК-полимеразой I. В других вариантах осуществления используют промотор Pol II, такой как промотор CMV, SV40, hAAT, U1, β-актина или гибридный промотор Pol II. В других вариантах осуществления применяют промоторные элементы, связываемые РНК-полимеразой III, такие как промоторы U6 (например, U6-1, U6-8, U6-9), H1 промотор, 7SL промотор, промоторы Y человека (hYl, hY3, hY4 (см. Maraia, et al., Nucleic Acids Res 22 (15): 3045-52 (1994)) и hY5 (см. Maraia, et al., Nucleic Acids Res 24 (18): 3552-59 (1994)), промотор MRP-7-2 человека, аденовирусный промотор VA1, промоторы тРНК человека, промоторы 5S рибосомальной РНК, а также функциональные гибриды и комбинации любых из этих промоторов. Также можно использовать варианты этих промоторов, где промотор модифицирован для уменьшения или увеличения его активности. Например, если сильный промотор приводит к слишком высокой экспрессии последовательности, функционально связанной с ним, его можно модифицировать для понижения его активности.
При применении промотора U6 предпочтительно, чтобы последовательность ДНК, функционально связанная с промотором, начиналась с основания гуанин (G); при применении промотора H1 предпочтительно, чтобы последовательность ДНК, функционально связанная с промотором, начиналась с основания аденин (A). Последовательности нуклеиновых кислот, следовательно, могут способствовать применению одного промотора по отношению к другому.
Альтернативно, в некоторых вариантах осуществления необязательно можно выбрать промоторы, которые обеспечивают индуцируемую экспрессию множества средств для ddRNAi, экспрессируемых с конструкта для ddRNAi. Ряд систем для индуцируемой экспрессии с помощью таких промоторов известны в настоящем уровне техники, включая без ограничения восприимчивую к тетрациклину систему и систему lac оператор-репрессор (см. публикацию WO 03/022052 A1; и публикацию патента США 2002/0162126 A1), контролируемую экдизоном систему или промоторы, контролируемые глюкокортикоидами, прогестинами, эстрогеном, RU-486, стероидами, тироидными гормонами, циклическими AMP, цитокинами, кальцифероловым семейством регуляторов, или металлотионеиновый промотор (контролируемый неорганическими металлами).
Промоторы, пригодные в некоторых вариантах осуществления настоящего изобретения, могут быть тканеспецифичными или клеткоспецифичными. Выражение "тканеспецифичный", при применении в отношении промотора, относится к промотору, который может управлять избирательной экспрессией представляющей интерес нуклеотидной последовательности по отношению к специфическому типу ткани при относительном отсутствии экспрессии той же представляющей интерес нуклеотидной последовательности в другом типе ткани (например, головном мозге). Выражение "клеткоспецифичный", при применении в отношении промотора, относится к промотору, который может управлять избирательной экспрессией представляющей интерес нуклеотидной последовательности в специфической типе клетки при относительном отсутствии экспрессии той же представляющей интерес нуклеотидной последовательности в другом типе клетки этой же ткани. Выражение "клеткоспецифичный" применительно в отношении промотора также означает промотор, способный стимулировать избирательную экспрессию представляющей интерес нуклеотидной последовательности в участке в пределах отдельной ткани. Альтернативно, промоторы могут быть конститутивными или регулируемыми. Дополнительно, промоторы могут быть модифицированы так, чтобы обладать различными специфичностями.
В случае инфекции HBV можно использовать печень-специфичные промоторы. Примерами печень-специфичных промоторов являются альфа-антитрипсиновый промотор человека (hAAT), промотор аполипопротеина H (ApoH) и лецитин-холестерол-ацетилтрансферазный промотор (LCAT). В качестве альтернативы, можно использовать транстиретиновый или TTR промотор. TTR промотор происходит из мышиного гена преальбумина и также называется преальбуминовым. TTR промотор полной длины в норме управляет экспрессией сывороточного тироксин-связывающего белка, который производится гепатоцитами и эпителием хориоидного сплетения у взрослых. В одном варианте осуществления предпочтительный TTR промотор представляет собой TTR промотор, в котором участок, который управляет экспрессией в эпителии хориоидного сплетения, удален, но сохранены участки, которые управляют печень-специфичной экспрессией. Смотри, например, WO 2007/120533 и US2 0060189561, включенные в данный документ с помощью ссылки.
Как указано выше, энхансерные элементы необязательно включены в конструкты для ddRNAi по настоящему изобретению. Одним предпочтительным энхансерным элементом является ApoE. Энхансерный элемент ApoE состоит из приблизительно 155 п.о., происходящих из аполипопротеина E (ApoE). ApoE опосредует связывание, интернализацию и катаболизм частиц липопротеина, а также является лигандом для рецептора липопротеинов низкой плотности (ApoB/E) и для рецептора ApoE в тканях печени. Генный энхансер, ассоциированный с геном ApoE является регуляторным элементом эукариот, который может повышать транскрипцию нуклеиновой кислоты, в частности, в печени. Энхансер ApoE может быть расположен за вплоть до 2000 нуклеотидов выше или ниже печень-специфичного промотора и может присутствовать в более чем одной копии. ApoE/hAAT является одной предпочтительной комбинацией энхансер/промотор.
В качестве альтернативы, можно применять синтетический энхансер (SynEnh), такой как описанный в US 20060189561 (включенный в данный документ с помощью ссылки).
Если кассета экспрессии или конструкт для ddRNAi содержит более чем одну терминаторную последовательность или элемент, терминаторные последовательности или элементы могут быть одинаковыми или отличаться, или может присутствовать комбинация терминирующих элементов, представленных только один раз, и терминирующих элементов, представленных два раза или более, внутри любой кассеты. Какие бы терминаторные последовательности или элементы не применялись, при их выборе следует следить за тем, чтобы они работали подходящим образом с применяемым печень-специфичным промотором. В случаях, когда применяют промоторы Pol I, Pol III или Pol III, следует использовать соответствующие терминаторные последовательности. Терминирующие элементы, применимые в настоящем изобретении, включают U1 терминирующая последовательность (U1 бокс), синтетический полиА терминатор и так называемый минимальный полиА терминатор. Сайты транскрипционной паузы, такие как MAZ1 и MAZ2 (смотри Ashfield et al. EMBO J 1994 Vol 13 No 23 5656 pp, и Yonaha and Proudfoot EMBO J. 2000 Jul. 17; 19 (14): 3770-7), можно вставить выше полиА терминаторов, чтобы способствовать сопряжению терминации транскрипции и полиаденилированию. Для промоторов Pol III последовательности TTTT, TTTTT или TTTTTT обычно применяют в качестве терминаторов. В этих случаях транскрипты, как правило, завершаются последовательностью UU.
Доставка конструктов для ddRNAi - конструкты для ddRNAi на основе вирусов
Сложная проблема при разработке любого терапевтического средства для HBV заключается в том, что практически все гепатоциты у пациентов являются инфицированными. В связи с этим средства для достижения эффективной и равномерной трансдукции всех клеток печени средством для ddRNAi по настоящему изобретению требуется обеспечить эффективную генную терапию хронической инфекции HBV. Более того, для эффективного in vivo лечения инфекции HBV кассета экспрессии для ddRNAi по настоящему изобретению должна быть способна к трансфекции в эмбриональные клетки, стволовые клетки и неделящиеся клетки.
Для преодоления этого ограничения кассеты экспрессии для ddRNAi по настоящему изобретению включают в вектор доставки, предпочтительно полученный из вирусов, чтобы обеспечить совместимость с вирусной доставкой, с получением конструктов для ddRNAi. Как указано ранее, основа вектора может служить для двух целей, являясь вектором экспрессии, а также вектором доставки. Создание конструкта можно осуществить с помощью любых подходящих методик генной инженерии, хорошо известных из уровня техники, включая без ограничения стандартные методики ПЦР, синтеза олигонуклеотидов, синтеза ДНК, расщепления рестрикционными нуклеазами, лигирование, трансформацию, очистку плазмид и секвенирование ДНК. Конструкт предпочтительно содержит, например, последовательности, необходимые для упаковки конструкта для ddRNAi в вирусные частицы, и/или последовательности, которые дают возможность интеграции конструкта для ddRNAi в геном целевой клетки. Вирусный конструкт также может содержать гены, которые создают возможность для репликации и размножения вируса, хотя в предпочтительных вариантах осуществления такие гены будут обеспечены при трансформации. Кроме того, конструкт для ddRNAi может содержать гены или генные последовательности из генома любого известного организма, встроенные в нативной форме или модифицированные. Например, предпочтительный вирусный конструкт содержит последовательности, применимые для репликации конструкта в бактерии.
Основу вирусного вектора можно выбрать из лентивирусных, аденовирусных (Adv) векторов и векторов на основе аденоассоциированных вирусов (AAV). Неинтегрирующие вирусные векторы можно применять для временной экспрессии в делящихся клетках средства для ddRNAi по настоящему изобретению или для долговременной устойчивой экспрессии в неделящихся клетках. Интегрирующие вирусные векторы, такие как лентивирусные векторы, опосредуют устойчивую долговременную экспрессию как в делящихся, так и неделящихся клетках.
В качестве альтернативы, миникольца, такие как описанные в US 20040214329, можно применять для доставки кассет экспрессии для ddRNAi. Миникольца обеспечивают постоянно высокие уровни транскрипции нуклеиновой кислоты и отличаются тем, что лишены бактериальных последовательностей, подавляющих экспрессию.
AAV векторы являются непатогенными и менее иммуногенными по сравнению с другими вирусными векторами. Способность AAV векторов инфицировать как делящиеся, так и неделящиеся клетки и управлять долговременной экспрессией гена в этих тканях делает его пригодным носителем для генной терапии. Более того, AAV имеет ряд псевдотипов с тропизмом в отношении различных тканей. Предпочтительным AAV вектором является двухцепочечный AAV псевдотипа 8 (dsAAV8).
Как правило, геном AAV содержит только два гена. Ген "rep" кодирует по меньшей мере четыре отдельных белка, используемых в репликации ДНК. Продукт гена "cap" подвергается дифференциальному сплайсингу с получением трех белков, которые содержатся в капсиде вируса. При упаковке генома в находящийся на стадии образования вирус обязательными последовательностями являются только инвертированные концевые повторы (ITR); rep и cap можно удалить из генома и заменить гетерологичными последовательностями выбора. Однако с целью продукции белков, необходимых для репликации и упаковки гетерологичного конструкта на основе AAV в находящийся на стадии образования вирион белки rep и cap должны быть обеспечены при трансформации. Вспомогательные функции, в норме обеспечиваемые конфекцией вирусом-помощником, таким как аденовирус или герпесвирус, можно также обеспечить при трансформации в форме одной или нескольких плазмид для экспрессии ДНК. Поскольку геном в норме кодирует только два гена, неудивительно, что в качестве носителя для доставки AAV ограничен вместимостью при упаковке в 4,5 тысячи оснований (т.о.) в виде одной цепи. Однако хотя такое ограничение по размеру может ограничивать гены, которые могут быть доставлены для заместительной генной терапии, оно не оказывает отрицательного воздействия на упаковку и экспрессию коротких последовательностей, таких как векторы для ddRNAi.
Соответственно, в другом аспекте настоящего изобретения обеспечен конструкт для ddRNAi, содержащий вирусный вектор, в который встроена кассета экспрессии для ddRNAi по настоящему изобретению. Предпочтительно кассета экспрессии кодирует несколько средств для RNAi, в виде либо длинношпилечных структур, либо многошпилечных структур. В одном варианте осуществления вирусный вектор представляет собой AAV вектор.
После создания конструкт для ddRNAi на основе вируса упаковывается в вирусные частицы. Любой способ, известный в данной области техники, можно использовать для получения инфекционных вирусных частиц, чей геном содержит копию вирусного конструкта для ddRNAi. В одном способе используют упаковывающие клетки, которые устойчиво экспрессируют при трансформации вирусные белки, которые требуются для встраивания вирусного конструкта для ddRNAi в вирусные частицы, а также другие последовательности, необходимые или предпочтительные для конкретной вирусной системы доставки (например, последовательности, необходимые для репликации, структурных белков и сборки вируса) и либо происходящие из вируса, либо искусственные лиганды для проникновения в ткань. После трансфекции в упаковывающие клетки вирусного конструкта для ddRNAi упаковывающие клетки затем реплицируют вирусные последовательности, экспрессируют вирусные белки и упаковывают конструкты для экспрессии ddRNAi в инфекционные вирусные частицы. Линия упаковывающих клеток может быть любой клеточной линией, которая способна экспрессировать вирусные белки, включая без ограничения 293, HeLa, A549, PerC6, D17, MDCK, BHK, bing cherry, phoenix, Cf2Th или любую другую клеточную линию, известную или разработанную специалистом в данной области техники. Одна линия упаковывающих клеток, например, в патенте США №6218181.
В качестве альтернативы, клеточную линию, которая не экспрессирует устойчиво необходимые вирусные белки, можно совместно трансфицировать одним или несколькими конструктами, чтобы достичь эффективного продуцирования функциональных частиц. Один из конструктов представляет собой конструкт для ddRNAi на основе вируса; другой конструкт содержит нуклеиновые кислоты, кодирующие белки, необходимые для обеспечения продукции клетками функционального вируса, а также других вспомогательных функций.
Линия упаковывающих клеток или репликационный и упаковочный конструкт может не экспрессировать продукты генов оболочки. В данных вариантах осуществления ген, кодирующий ген оболочки, может быть обеспечен на отдельном конструкте, которым совместно трансфицируют с конструктом для ddRNAi на основе вируса. Поскольку белок оболочки отвечает за круг хозяев вирусных частиц, вирусы могут быть псевдотипированными. Как описано выше, "псевдотипированный" вирус представляет собой вирусную частицу с белком оболочки, которая происходит из вируса, отличающегося от вируса, от которого происходит геном. Специалист в данной области может выбрать соответствующий псевдотип для применяемой вирусной системы доставки и клеток, на которые должен нацеливаться конструкт. Дополнительно к приданию конкретного круга хозяев выбранный псевдотип может позволять концентрировать вирус до очень высокого титра. Вирусы, в качестве альтернативы, могут быть псевдотипированны экотропными белками оболочки, которые ограничивают инфицирование конкретными видами (например, экотропные оболочки дают возможность инфицирования, например, только мышиных клеток, где амфотропные оболочки дают возможность инфицирования, например, как человеческих, так и мышиных клеток). К тому же генетически модифицированные лиганды можно использовать для специфичного к клеткам нацеливания, такие как асиалогликопротеин для гепатоцитов или трансферрин для рецептор-опосредованного связывания.
После продуцирования в линии упаковывающих клеток вирусные частицы, содержащие кассету экспрессии для ddRNAis, очищают и количественно определяют (титруют). Методики очистки включают центрифугирование в градиенте плотности или предпочтительно способы колоночной хроматографии.
Способы лечения
Введение средств для ddRNAi, конструктов для ddRNAi или средств для siRNA по настоящему изобретению ингибирует экспрессию генов HBV, экспрессирующихся в клетке, инфицированной HBV. Соответственно, в другом аспекте настоящего изобретения предлагается способ лечения инфекции HBV у субъекта, включающий обеспечение терапевтически эффективного количества средства для ddRNAi для пациента, нуждающегося в лечении, где средство для ddRNAi ингибирует экспрессию одной или нескольких целевых последовательностей в гене вируса гепатита B (HBV), предпочтительно ген полимеразы HBV. Средство для ddRNAi, которое нужно вводить пациенту, может представлять собой одно или несколько из:
- средства для ddRNAi, содержащего первую эффекторную последовательность и последовательность, комплементарную первому эффектору, где эффекторная последовательность, главным образом, комплементарна предсказанному транскрипту участка целевого гена;
- средства для ddRNAi, содержащего в направлении от 5’ к 3’ первую эффекторную последовательность, вторую эффекторную последовательность; последовательность, комплементарную второму эффектору, и последовательность, комплементарную первому эффектору, где каждая эффекторная последовательность, главным образом, комплементарна предсказанному транскрипту участка целевого гена;
- средства для ddRNAi, содержащего, в направлении от 5’ к 3’, первую эффекторную последовательность, вторую эффекторную последовательность, третью эффекторную последовательность, последовательность, комплементарную третьему эффектору, последовательность, комплементарную второму эффектору, и последовательность, комплементарную первому эффектору, где каждая эффекторная последовательность, главным образом, комплементарна предсказанному транскрипту участка целевого гена;
- средства для ddRNAi, содержащего в направлении от 5’ к 3’ первую эффекторную последовательность, последовательность, комплементарную первому эффектору, вторую эффекторную последовательность, и последовательность, комплементарную второму эффектору, где каждая эффекторная последовательность, главным образом, комплементарна предсказанному транскрипту участка целевого гена;
- средства для ddRNAi, содержащего в направлении от 5’ к 3’ первую эффекторную последовательность, последовательность, комплементарную первому эффектору, вторую эффекторную последовательность, последовательность, комплементарную второму эффектору, третью эффекторную последовательность, и последовательность, комплементарную третьему эффектору, где каждая эффекторная последовательность, главным образом, комплементарна предсказанному транскрипту участка целевого гена;
- средства для ddRNAi, содержащего в направлении от 5’ к 3’ первую эффекторную последовательность, вторую эффекторную последовательность, последовательность из 2-100 некомплементарных нуклеотидов, последовательность, комплементарную второму эффектору, и последовательность, комплементарную первому эффектору, где каждая эффекторная последовательность, главным образом, комплементарна предсказанному транскрипту участка целевого гена;
- средства для ddRNAi, содержащего в направлении от 5’ к 3’ первую эффекторную последовательность, последовательность из 2-100 некомплементарных нуклеотидов, последовательность, комплементарную первому эффектору, вторую эффекторную последовательность, последовательность из 2-100 некомплементарных нуклеотидов и последовательность, комплементарную второму эффектору, где каждая эффекторная последовательность, главным образом, комплементарна предсказанному транскрипту участка целевого гена.
Как будет понятно специалисту в данной области техники и как проиллюстрировано на фигурах, положение любой конкретной эффекторной последовательности можно поменять местами с последовательностью, комплементарной ей, в средстве. В конкретных формах каждого из вариантов осуществления, описанных выше, длина каждой эффекторной последовательности равна по меньшей мере 17 нуклеотидов, выбранных из группы, состоящей из любых 10 или более и предпочтительно любых 17 или более смежных нуклеотидов в последовательности из любой из SEQ ID NO: 1-27. Все эффекторные последовательности могут быть одинаковыми, или все они могут отличаться, или могут представлять собой комбинацию, например, 2 эффекторных последовательностей из по меньшей мере 10 смежных нуклеотидов из SEQ ID NO:1 и 1 эффекторной последовательности из по меньшей мере 10 смежных нуклеотидов из SEQ ID NO: 4.
Предпочтительно эффекторная последовательность выбрана из группы, состоящей из любых смежных 11, 12, 13, 14, 15 или 16 нуклеотидов в любой из SEQ ID NO: 1-27 и наиболее предпочтительно 17 или более смежных нуклеотидов в любой из SEQ ID NO: 1-27. Как правило, комплементарная эффекторная последовательность будет иметь одинаковую длину или приблизительно одинаковую длину (т.е. ±15% длины нуклеотидов), как и соответствующая ей эффекторная последовательность.
Каждое из этих средств для ddRNAi можно вводить посредством кассеты экспрессии для ddRNAi в конструкте для ddRNAi, который описан в вышеприведенных разделах описания. Множественное нацеливание может быть достигнуто путем доставки двух или более кассет экспрессии или конструктов для ddRNAi, каждый из которых способен экспрессировать отдельное средство для ddRNAi, или, в качестве альтернативы, путем доставки одной или нескольких кассет экспрессии или конструктов для ddRNAi, каждый из которых способен экспрессировать более чем одно средство для ddRNAi.
В альтернативных вариантах осуществления каждая из эффекторных последовательностей может быть на 100% комплементарной предсказанному транскрипту участка целевого гена или может только отличаться 1, 2, 3, 4 или 5 нуклеотидами.
Способ лечения инфекции HBV может необязательно включать предварительный этап идентификации индивида с инфекцией HBV, включающий идентификацию серотипа изолята HBV.
Для долговременного или устойчивого обеспечения средствами для ddRNAi по настоящему изобретению средство для ddRNAi обеспечивается посредством конструкта для ddRNAi по настоящему изобретению, т.е. экспрессии in vivo средства для ddRNAi из кассеты экспрессии для ddRNAi, встроенной в подходящий вектор, доставленный в клетку. Кассета экспрессии для ddRNAi содержит:
- одну или несколько промоторных последовательностей;
- одну или несколько последовательностей ДНК, выбранных из группы, состоящей из последовательностей, которые кодируют любые 10 или более смежных нуклеотидов в последовательности из SEQ ID NO: 1-27;
- одну или несколько последовательностей ДНК, которые кодируют одну или несколько последовательностей, комплементарных эффектору;
- одну или несколько терминаторных последовательностей
и необязательно
- одну или несколько последовательностей ДНК, которая кодирует последовательности петли;
- одну или несколько энхансерных последовательностей.
Как кратко излагалось ранее в описании, эти компоненты кассеты экспрессии для ddRNAi могут иметь разные расположения от 5’ к 3’ концу, все из которых являются подходящими для применения в способах по настоящему изобретению.
В способах по настоящему изобретению целевой ген HBV представляет собой по меньшей мере ген полимеразы (P) и, возможно, ген поверхностного антигена или ген X, когда целевая последовательность содержится в перекрывающихся открытых рамках считывания, и средство для ddRNAi содержит эффекторные последовательности для ddRNAi из любых 10 или более смежных нуклеотидов в последовательности из SEQ ID NO: 1-27, перечисленные в таблице 1. В качестве альтернативы, как подробно описано ранее, последовательность, которая кодирует эффекторную последовательность, или последовательность, комплементарную первой эффекторной последовательности, может отличаться от SEQ ID NO: 1-27 на 1, 2, 3, 4 или 5 нуклеотидов без отрицательного воздействия на способность кодируемой последовательности спариваться основаниями с целевой последовательностью и ингибировать экспрессию целевой последовательности HBV.
Как правило, каждая эффекторная последовательность образует двухцепочечный участок с соответствующей комплементарной эффекторной последовательностью.
В альтернативном варианте осуществления способ лечения инфекции HBV у индивида включает введение терапевтически эффективного количества конструкта для ddRNAi, который кодирует средство для ddRNAi с более чем одной эффекторной последовательностью, такое как перечисленные выше.
Инфекция HBV, которая подлежит лечению, может представлять собой хроническую инфекцию HBV. Под "хронической" подразумевается, что инфекция HBV является длительной или персистирующей. Выражение хронический описывает течение заболевания, или его скорость манифестации и развития. При лечении хронической инфекции HBV предпочтительно, чтобы конструкт для ddRNAi вводился и либо устойчиво сохранялся или интегрировался в целевую клетку, чтобы обеспечить долговременную экспрессию средства для ddRNAi. Как подробно описано выше, этого можно достичь с применением конструкта для ddRNAi с вирусной основой вектора. В соответствии с этим, предлагается способ лечения хронической инфекции HBV у индивида, включающий введение терапевтически эффективного количества конструкта для ddRNAi по настоящему изобретению пациенту, нуждающемуся в лечении.
Лечение хронической инфекции HBV направлено на снижение инфективности вируса, препятствуя репликации вируса. Это, в свою очередь, снижает риск передачи и распространения HBV. Таким образом, обеспечен способ снижения инфективности HBV у индивида, инфицированного HBV, включающий введение индивиду конструктов для ddRNAi по настоящему изобретению для оказания целенаправленного воздействия на ген HBV, предпочтительно ген полимеразы. Клинические результаты, используемые при терапии хронического гепатита B, будут различаться у пациентов с компенсированным гепатитом B (при котором устойчивое подавление вируса, серологическая реакция, улучшение гистологической картины, нормализация печеночных функциональных проб и прогресс в неклинических показателях являются ключевыми результатами) и таковых с декомпенсированным гепатитом B. У пациентов с декомпенсированным заболеванием печень широко подвергается рубцеванию и фиброзу, и предотвращение/обращение повреждения печени и предотвращение развития заболевания и устранение необходимости трансплантации печени являются главными целями терапии. Результатами для компенсированного гепатита B являются снижение вирусной нагрузки при серологическом и биохимическом улучшении, улучшение гистологической картины, показателя печеночной недостаточности и конечной стадии заболевания печени, осложнений, трансплантации и смертности.
В другом варианте осуществления предлагается способ сведения к минимуму развития заболевания печени у субъекта в результате инфекции HBV, включающий введение индивиду конструкта для ddRNAi по настоящему изобретению для оказания целенаправленного воздействия на ген HBV, предпочтительно ген полимеразы.
В еще одном варианте осуществления согласно настоящему изобретению предлагается способ сведения к минимуму симптомов, ассоциированных с инфекцией HBV, у субъекта, включающий введение индивиду конструкта для ddRNAi по настоящему изобретению для оказания целенаправленного воздействия на ген HBV, предпочтительно ген полимеразы.
Статус или тяжесть инфекции HBV у индивида можно оценить путем определения их вирусной нагрузки. Под "вирусной нагрузкой" подразумевают количество вируса, содержащееся в жидкости организма. Например, она может быть выражена в количестве копий РНК на миллилитр плазмы крови. Индивиды с высокой вирусной нагрузкой рассматриваются как имеющие более тяжелую инфекцию HBV. В качестве альтернативы, вирусная нагрузка является индикатором восприимчивости индивида к конкретному лечению. Если лечение работает и сохраняет уровни вируса низкими, это является показателем успешного лечения. Следовательно, целью лечения является снижение вирусной нагрузки на индивида. Соответственно, также предложен способ снижения вирусной нагрузки на индивида с инфекцией HBV, включающий введение индивиду конструкта для ddRNAi по настоящему изобретению для оказания целенаправленного воздействия на ген HBV, предпочтительно ген полимеразы.
Последующий мониторинг вирусной нагрузки у индивида, который получил лечение конструктом для ddRNAi по настоящему изобретению является, таким образом, фенотипическим индикатором эффективности конструкта для ddRNAi и средства для ddRNAi по настоящему изобретению.
В качестве альтернативы, лечение острой инфекции HBV может не требовать долговременного лечения, и фактически может быть предпочтительным рассчитывать на временное присутствие средства для ddRNAi или siRNA-средства по сравнению с долговременной экспрессией средств для ddRNAi из интегрированных или устойчиво сохраняемых конструктов для ddRNAi. Под "острым" подразумевают, что инфекция HBV характеризуется быстрой манифестацией и/или малой продолжительностью.
В соответствии с данным вариантом осуществления настоящего изобретения предлагается способ лечения острой инфекции HBV у индивида, включающий введение терапевтически эффективного количества синтезированного in vitro или химически синтезированного средства для ddRNAi пациенту, нуждающемуся в лечении, для ингибирования экспрессии одной или нескольких целевых последовательностей в гене вируса гепатита B (HBV), причем средство для ddRNAi содержит по меньшей мере:
первую эффекторную последовательность длиной по меньшей мере 17 нуклеотидов, выбранную из любых 10 или более смежных нуклеотидов в последовательности из группы, состоящей из SEQ ID NO: 1-27 и
последовательность, комплементарную первому эффектору,
где эффекторная последовательность, главным образом, комплементарна предсказанному транскрипту участка целевого гена. В данном варианте осуществления средство для ddRNAi согласно настоящему изобретению продуцируется in vitro или химически синтезируется и доставляется в клетку.
Любое из siRNA-средств или средств для ddRNAi согласно настоящему изобретению, описанные во всем описании, являются подходящими для экспрессии in vitro и доставки в клетку.
Предпочтительно целевой ген HBV представляет собой по меньшей мере ген полимеразы (P) и, возможно, поверхностный антиген, антиген сердцевины или ген X, когда целевая последовательность содержится в перекрывающихся открытых рамках считывания. Соответственно, в одном варианте осуществления согласно настоящему изобретению средство для ddRNAi ингибирует экспрессию одной или нескольких целевых последовательностей в гене полимеразы вируса гепатита B (HBV). Первая эффекторная последовательность предпочтительно выбрана из любых 10 или более и предпочтительно любых 17 или более смежных нуклеотидов в последовательности из эффекторных последовательностей SEQ ID NO: 1-27, перечисленных в таблице 1. В качестве альтернативы, эффекторная последовательность может отличаться от SEQ ID NO: 1-27 на 1, 2, 3, 4 или 5 нуклеотидов без неблагоприятного воздействия на способность эффекторной последовательности спариваться основаниями с целевой последовательностью и ингибировать экспрессию гена полимеразы HBV.
В альтернативном варианте осуществления можно вводить средство для siRNA. Предпочтительно средства для siRNA, подобно средству для ddRNAi, оказывают целенаправленное воздействие на ген полимеразы HBV и могут содержать последовательность, выбранную из любых 10 или более и предпочтительно любых 17 или более смежных нуклеотидов в последовательности из группы, состоящей из SEQ ID NO: 1-27, или может отличаться от SEQ ID NO: 1-27 на 1, 2, 3, 4 или 5 нуклеотидов без неблагоприятного воздействия на способность эффекторной последовательности спариваться основаниями с целевой последовательностью и ингибировать экспрессию гена полимеразы HBV.
Введение средства для ddRNAi или средства для siRNA по настоящему изобретению индивиду с острой инфекцией HBV может также снижать вирусную нагрузку, снижать тяжесть симптомов, ассоциированных с острой инфекцией, и снижать инфективность HBV.
В другом аспекте настоящего изобретения предлагается применение конструктов для ddRNAi, средств для ddRNAi или средств для siRNA по настоящему изобретению в получении лекарственных препаратов для лечения инфекции HBV, предпочтительно хронической инфекции HBV, снижения вирусной нагрузки HBV, снижения тяжести симптомов, ассоциированных с инфекцией HBV, и снижения инфективности HBV.
В дополнительном аспекте настоящего изобретения предлагаются конструкты для ddRNAi, средства для ddRNAi или средства для siRNA для лечения инфекции HBV, предпочтительно хронической инфекции HBV, снижения вирусной нагрузки HBV, снижения тяжести симптомов, ассоциированных с инфекцией HBV, и снижения инфективности HBV.
В дополнительном аспекте настоящего изобретения предлагается композиции, содержащая конструкты для ddRNAi, средства для ddRNAi или средства для siRNA в качестве активного ингредиента для лечения инфекции HBV, предпочтительно хронической инфекции HBV, снижения вирусной нагрузки HBV, снижения тяжести симптомов, ассоциированных с инфекцией HBV, и снижения инфективности HBV.
Одна или несколько эффекторных последовательностей конструктов для ddRNAi, средств для ddRNAi или средств для siRNA, применяемых в способах по настоящему изобретению, содержат любые 10 или более, предпочтительно любые 17 или более смежных нуклеотидов в последовательностях, способных ингибировать экспрессию участка целевого гена HBV по меньшей мере на 70%. Предпочтительно одна или несколько эффекторных последовательностей выбраны из SEQ ID NO: 3, SEQ ID NO: 9, SEQ ID NO: 12, SEQ ID NO: 13 и SEQ ID NO: 23.
Фармацевтические композиции
Средства для ddRNAi, средства для siRNA или векторы, содержащие кассеты экспрессии для ddRNAi по настоящему изобретению, можно составить в фармацевтические композиции путем объединения с подходящими фармацевтически приемлемыми носителями или разбавителями. Соответственно, предлагается фармацевтическая композиция, содержащая средство для ddRNAi, кассету экспрессии для ddRNAi, конструкт для ddRNAi или средство для siRNA по настоящему изобретению и фармацевтически приемлемый носитель или разбавитель.
В фармацевтических лекарственных формах средства или векторы, содержащие кассеты экспрессии для ddRNAi, можно вводить сами по себе либо в сочетании или комбинации с другими фармацевтически активными соединениями. Специалист в данной области техники легко поймет, что уровни дозы для средств или векторов, содержащих кассеты экспрессии для ddRNAi, будут изменяться в зависимости от природы среды для доставки, относительной легкости трансдукции в целевые клетки, уровня экспрессии средства для RNAi в целевых клетках и т.п.
Средства для ddRNAi, средства для siRNA или векторы, содержащие кассеты экспрессии для ddRNAi согласно настоящему изобретению, можно составить в препараты для инъекции или введения путем растворения, суспендирования или эмульгирования их в водном или неводном растворителе, таком как масла, синтетические глицериды алифатических кислот, сложные эфиры высших алифатических кислот или пропиленгликоля; и при необходимости с общепринятыми добавками, такими как солюбилизаторы, средства, обеспечивающие изотоничность, суспендирующие средства, эмульгирующие средства, стабилизаторы и консерванты.
Фармацевтически приемлемые носители или разбавители, предполагаемые настоящим изобретением, включают любые разбавители, носители, наполнители, и стабилизаторы, которые являются нетоксичными для реципиентов в используемых дозах и концентрациях, и включают буферы, такие как фосфатный, цитратный и буферы на основе других органических кислот; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония, хлорид бензетония; фенол, бутиловый или бензиловый спирт; алкилпарабены такой как метил- или пропилпарабен; катехин; резорцин; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные (менее приблизительно 10 остатков) полипептиды; белки, такие как альбумин плазмы, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие средства, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы с металлами (например, комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (PEG).
Фармацевтическую композицию можно получить для разнообразных путей и типов введения. В основном составы получают путем равномерного и тщательного объединения активного ингредиента с жидкими носителями или тонкоизмельченными твердыми носителями или и с теми, и с другими и, если необходимо, придания продукту формы. Составление можно проводить путем смешивания при температуре окружающей среды, при подходящем pH и при желаемой степени чистоты с физиологически приемлемыми носителями, т.е. носителями, которые являются нетоксичными для реципиентов в используемых дозировках и концентрациях.
Одна или несколько эффекторных последовательностей конструктов для ddRNAi, средств для ddRNAi или средств для siRNA, применяемых в композиции по настоящему изобретению, содержат любые 10 или более, предпочтительно любые 17 или более смежных нуклеотидов в пределах последовательностей, способных ингибировать экспрессию участка целевого гена HBV по меньшей мере на 70%. Предпочтительно одна или несколько эффекторных последовательностей выбраны из SEQ ID NO: 3, SEQ ID NO: 9, SEQ ID NO: 12, SEQ ID NO: 13 и SEQ ID NO: 23.
ПРИМЕРЫ
Следующие примеры являются иллюстративными по характеру и никак не предназначены для ограничения.
Пример 1: Получение библиотеки целой siRNA-мишени (EsT)
Ген полной длины РНК-зависимой ДНК-полимеразы HBV из HBV Adr-1 (код доступа М38454) субклонировали и применяли для создания библиотеки целой siRNA-мишени (EsT). 5000 клонов секвенировали, из которых 642 идентифицировали как имеющие неповторяющиеся последовательности в диапазоне 19-23 п.о. Последовательности, которые представляют возможные мишени для средств для ddRNAi по настоящему изобретению, распределяли по целевому гену (фигура 2).
Пример 2: Результаты крупномасштабного скрининга с использованием SEC с ≥50% нокдауном
Для идентификации наиболее эффективных последовательностей siRNA, которые можно затем использовать для получения средств для ddRNAi по настоящему изобретению, кассеты экспрессии для siRNA (SEC), амплифицированные с помощью ПЦР, трансфицировали в клетки HepG2 2.2.15. Воздействия на уровни экспрессии мРНК полимеразы HBV оценивали для идентификации функциональных последовательностей siRNA.
40 siRNA, которые соответствовали первым SEC, подвергнутым скринингу, химически синтезировали и трансфицировали в клетки HepG2 2.2.15 для подтверждения уровней нокдауна исходной мРНК полимеразы. HepG2 2.2.15 является стабильной клеточной линией, содержащей интегрированный тандемный димер генома HBV (№ доступа в Genbank U95551), и может устойчиво экспрессировать антигены HBV и частицы Дейна HBV. Результаты взаимозависимости показаны на фигуре 3.
Как можно увидеть из фигуры 3, если ингибирование экспрессии полимеразы SEC составляло >50%, большинство соответствующих синтетических последовательностей siRNA давали приблизительно 70% нокдаун мРНК HBV и только 2/23 давали уровни нокдауна ниже 50%. В отличие от SEC с эффективностью подавления <50% только 18% (3/17) соответствующих синтетических siRNA давали >70% нокдаун (p<0,05 - критерий хи-квадрат Пирсона, 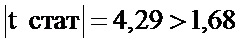 ). Кроме того, синтетическая siRNA (необходимо объяснение этого), которая давала >90% нокдаун, соответствовала клону SEC, который давал >65% нокдаун. Исходя из этого, сделали вывод, что существует соответствующая корреляция между нокдауном мРНК HBV с использованием siRNA из SEC и таковым, получаемым с использованием синтетических siRNA, при пороговом значении нокдауна ≥50% с использованием SEC. Это пороговое значение использовали для остальной части скрининга SEC.
). Кроме того, синтетическая siRNA (необходимо объяснение этого), которая давала >90% нокдаун, соответствовала клону SEC, который давал >65% нокдаун. Исходя из этого, сделали вывод, что существует соответствующая корреляция между нокдауном мРНК HBV с использованием siRNA из SEC и таковым, получаемым с использованием синтетических siRNA, при пороговом значении нокдауна ≥50% с использованием SEC. Это пороговое значение использовали для остальной части скрининга SEC.
Пример 3: Скрининг мишеней с применением кассет экспрессии для siRNA (SEC).
На Фигуре 4 показаны результаты крупномасштабного скрининга in vitro в отношении ингибирования накопления мРНК HBV (501 неповторяющиеся средства для siRNA). Из этих подвергнутых скринингу последовательностей 100 последовательностей siRNA были эффективны в обеспечении нокдауна мРНК HBV на ≥50%, 14 из которых давали в результате >70% нокдаун (таблица 2). Распределение 100 лучших мишеней siRNA на гене полимеразы HBV показано на фигуре 5, A; любую последовательность можно, в свою очередь, нанести на карту полимеразы. Фигура 5, B, например, представляет собой карту первых 3 последовательностей.
|
Относительную экспрессию мРНК можно измерить (с помощью способа одностадийной количественной RT-PCR с использованием набора для одностадийного анализа SensiMix SYBR One-Step Kit (Bioline, США) в соответствии с руководствами производителя) в трансфицированных клетках HepG2 2.2.15 в сравнении с контрольным пустым вектором, чей уровень произвольно приняли за 1,0. Специфичные праймеры для гена полимеразы HBV представляли собой прямой праймер 5’-TGTGGTTATCCTGCGTTAATG-3’, обратный праймер 5’-GCGTCAGCAAACACTTGG-3’, длина ПЦР продукта составляла 158 п.о. snRNA U6 (прямой праймер 5’-CTCGCTTCGGCAGCACA-3’, обратный праймер 5’-AACGCTTCACGAATTTGCGT-3’) использовали в качестве внутреннего контроля, длина ПЦР продукта составляла 94 п.о. Относительный уровень экспрессии гена полимеразы нормализовали с использованием 2-ΔΔtC способа анализа. Эксперименты проводили с независимыми трансдукциями в четырех повторностях.
Пример 4: Подтверждение активности с использованием синтезированных siRNA
На первом этапе скрининга использовали вектор с противоположными промоторами (pU6H1-GFP). В экспрессирующих shRNA конструктах shRNA находится под управлением единственного промотора. Соответственно, чтобы подтвердить эффективность 14 лучших последовательностей siRNA, показанных в таблице 2, перед разработкой конструктов экспрессии shRNA на их основе, клетки HepG2 2.2.15 трансфицировали каждой siRNA и анализировали ингибирование репликации HBV для определения уровней мРНК полимеразы HBV.
14 siRNA химически синтезировали с dTdT 3’ "липким" концом. 5’-меченные FAM siRNA-GL3 (pGL3 люциферазный репортерный вектор с неродственной последовательностью siRNA) служили отрицательным контролем. siRNA растворяли в 100 мкМ в обработанной DEPC воде, отбирали аликвоты и хранили при -20°C. К тому же SEQ ID NO:4, длина которой составляет 29 п.о., повторно разработали в 8 siRNA (SEQ ID NO:20-27), каждая из 22 п.о., состоящих из перекрывающейся последовательности из SEQ ID NO:4 (таблица 3 ниже):
|
Оптимизацию трансфекции осуществляли путем изменения 5’ FAM-меченных siRNA-GL3 и Lipofectamine 2000 (Invitrogen). Клетки поддерживали в DMEM (GIBCO, США), дополненной 10% PBS (Excellbio, Китай) и 200 мкг/мл G418 (Sangon, Китай) при 37°C, 5% CO2.
Клетки HepG2 2.2.15 трансфицировали siRNA с использованием оптимизированного протокола и собирали через 72 часа после трансфекции. Общую РНК выделяли с использованием Trizol (Invitrogen) и количественно определяли в одноэтапном способе количественной RT-PCR с использованием набора для одноэтапного анализа SensiMix SYBR One-Step Kit (Bioline, США) в соответствии с руководствами производителя, как уже подробно описано в примере 3.
Результаты
Результаты выражены в виде среднего значения ±STDV (таблица 4 и фигура 9).
|
Из 22 исследуемых siRNA все проявляли по меньшей мере приблизительно 50% ингибирование и большинство проявляли 60-70% ингибирование. Несмотря на высокую идентичность последовательности среди 22 п.о. вариантов SEQ ID NO: 20-27 из SEQ ID NO: 4 способность ингибировать экспрессию у этих последовательностей изменялась от 50% до 71%. На основе этих результатов SEQ ID NO: 3, 9, 12, 13 и 23 выбрали для дальнейшей разработки. Хотя все из этих SEQ ID NO оказывали целенаправленное воздействие на ген полимеразы, эти последовательности также выбирались на основе их распределения вдоль мРНК гена полимеразы (смотри колонку "Сайты-мишени HBV" в таблице 1).
Пример 5: Разработка и конструирование shRNA
Этап 1 - разработка эффекторной последовательности
Конструкты для экспрессии shRNA разработали на основе SEQ ID NO: 3. 9, 12, 13 и 23. Конструкты можно синтезировать с применением ряда промоторов, в том числе различных вариантов промоторов U6 человека с различными свойственными активностями (Domitrovich, AM and Kunkel, GR (2003) Multiple, dispersed human U6 small nuclear RNA genes with varied transcriptional efficiencies Nucleic Acids Research 31: 2344-2352) или различных промоторов pol II. При разработке этих конструктов принимались во внимание следующие обстоятельства:
- дайсер осуществляет процессинг с первого основания shRNA
- осуществляемый дайсером процессинг является неточным но, как предполагается, он преимущественно делает разрез каждые 22 нуклеотида
- при U6-терминировании возможно добавление UU к 3’-концу shRNA
- процессированная эффекторная последовательность желательно содержит 5’U или A для облегчения эффективного соединения с Ago 2
- эффекторная последовательность располагается 3’ от петли, чтобы избежать 5’G, предпочтительно для максимальной U6-транскрипции
- Остатки 5’A или U могут встраиваться в эффекторные последовательности shRNA путем встраивания последовательностей на 2 или 3 нуклеотида выше или ниже последовательностей, на которые осуществляется нацеливание при помощи средства для RNAi; это называют "скользящими" последовательностями на 1, 2 или 3 нуклеотида, т.е. эффекторная последовательность shRNA может основываться на последовательностях на 1, 2 или 3 нуклеотида 5’ или 3’ по отношению к 5’-концу эффекторной последовательности siRNA.
Применительно к 5 siRNA на основе SEQ ID NO: 3. 9, 12, 13 и 23:
i) Для shRNA на основе SEQ ID NO:3: gccgggcaacgggguaaagguucTT
"Наилучшая" эффекторная последовательность shRNA (сведение к минимуму 5’GC-последовательностей, скольжение "ниже" на 3 нуклеотида)
GGGCAACGGGGUAAAGGUUCuu (uu из pol III-терминирования)
ii) Для shRNA на основе SEQ ID NO:9: gggaaagcccuacgaaccacuTT
"Наилучшая" эффекторная последовательность shRNA (сведение к минимуму 5’ G, скольжение ниже на 3 нуклеотида для 5’ A, добавление GA к 3’ (из генома HBV для приведения к максимуму гомологии)
AAAGCCCUACGAACCACUGAuu
iii) Для shRNA на основе SEQ ID NO:12: gcccacucccauaggaauuuuccTT
"Наилучшая" эффекторная последовательность shRNA сдвигается на 2 нуклеотида для того, чтобы избежать UUUU (может привести к преждевременной терминации) в антисмысловой цепи, при этом добавляется AG из последовательности HBV, что обеспечивает включение 5’A
AGGCCCACUCCCAUAGGAAUU
iv) Для shRNA на основе SEQ ID NO:13: ggaucuugcagaguuuggTT
"Наилучшая" эффекторная последовательность shRNA (увеличение длины до 20 нуклеотидов, скольжение выше на 2 нуклеотида, добавление TG из последовательности HBV, что приводит к 5’ Т (т.е. U)
TGGGAUCUUGCAGAGUUUGGuu
v) Для shRNA на основе SEQ ID NO:23: ugcgggagaggacaacagaguuTT
В "наилучшей" эффекторной последовательности shRNA на 3’-конце размер снижается на 2 нуклеотида
UGCGGGAGAGGACAACAGAGUU
Этап 2 - кассета экспрессии
Получили и клонировали в pUC57 кассеты U6 shRNA (Genscript) на основе эффекторных последовательностей, разработанных на этапе (a).
Вставки кассет экспрессии, которые включали некоторые фланкирующие сайты рестрикции для последующих манипуляций, имели следующие последовательности:
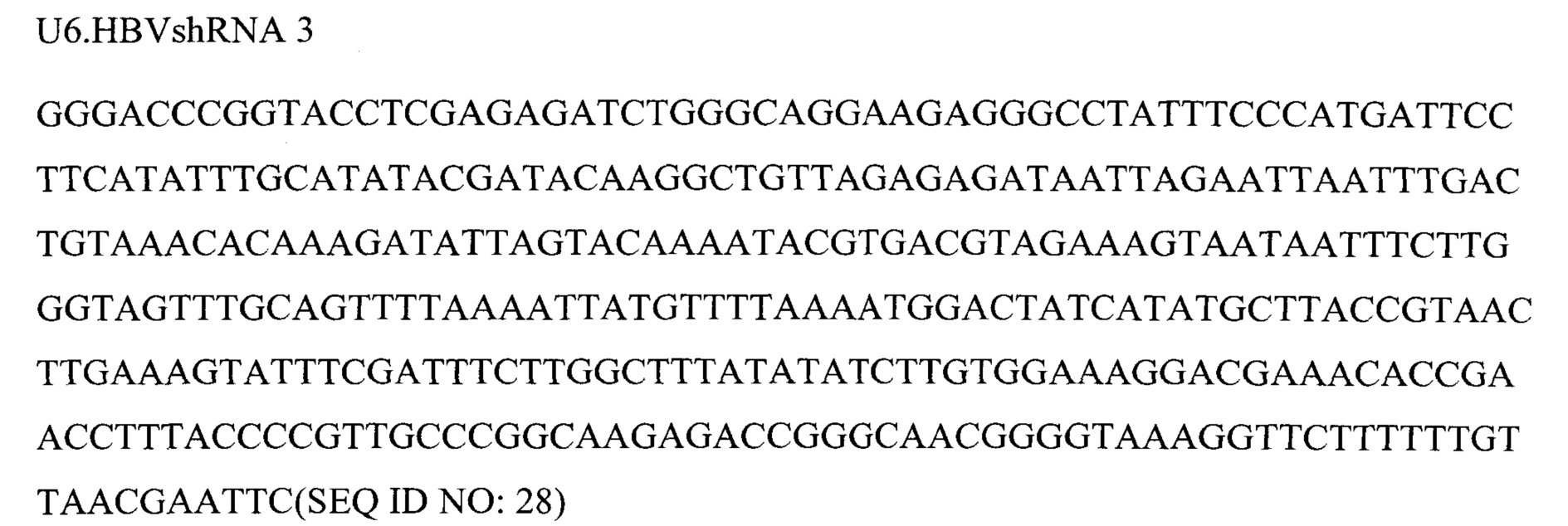
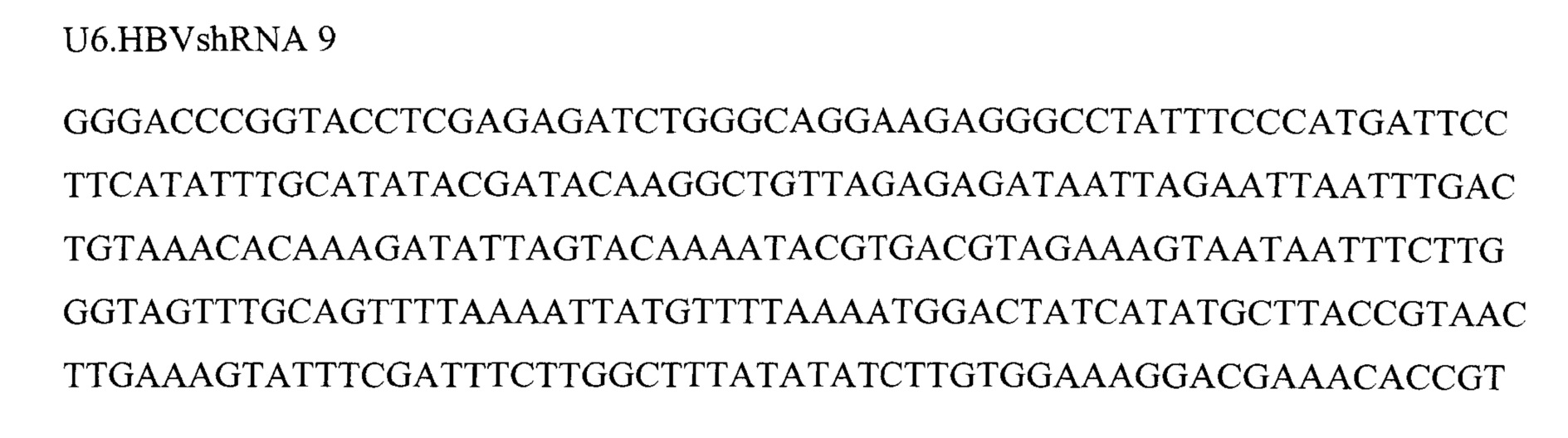
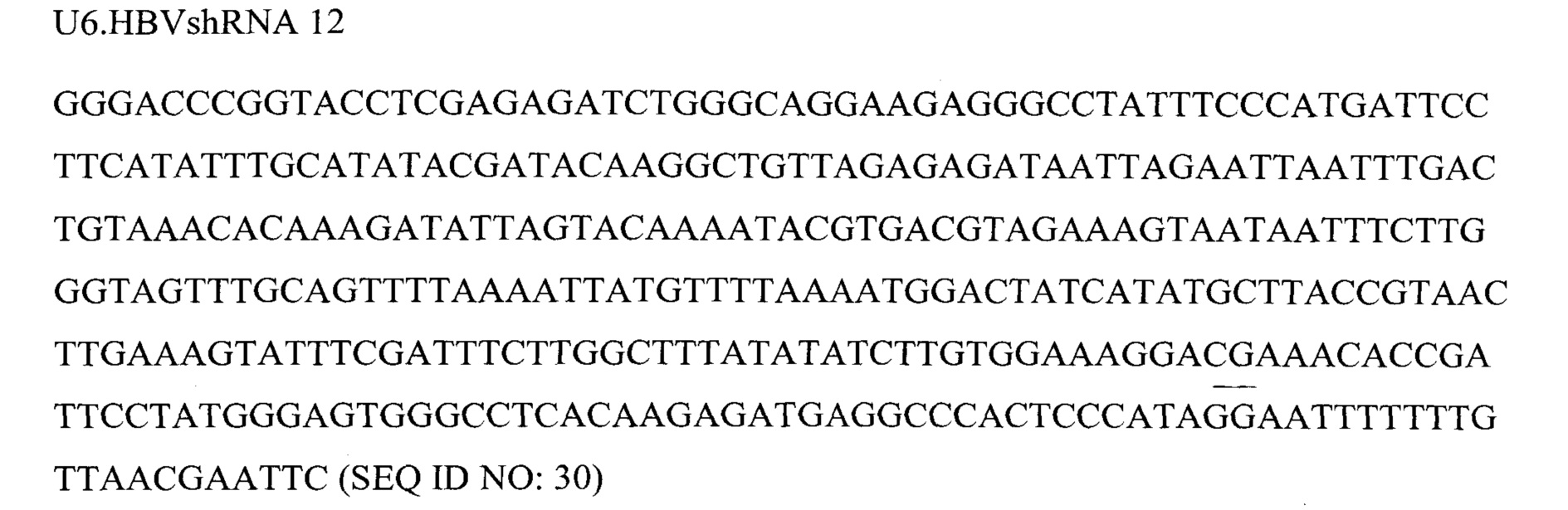
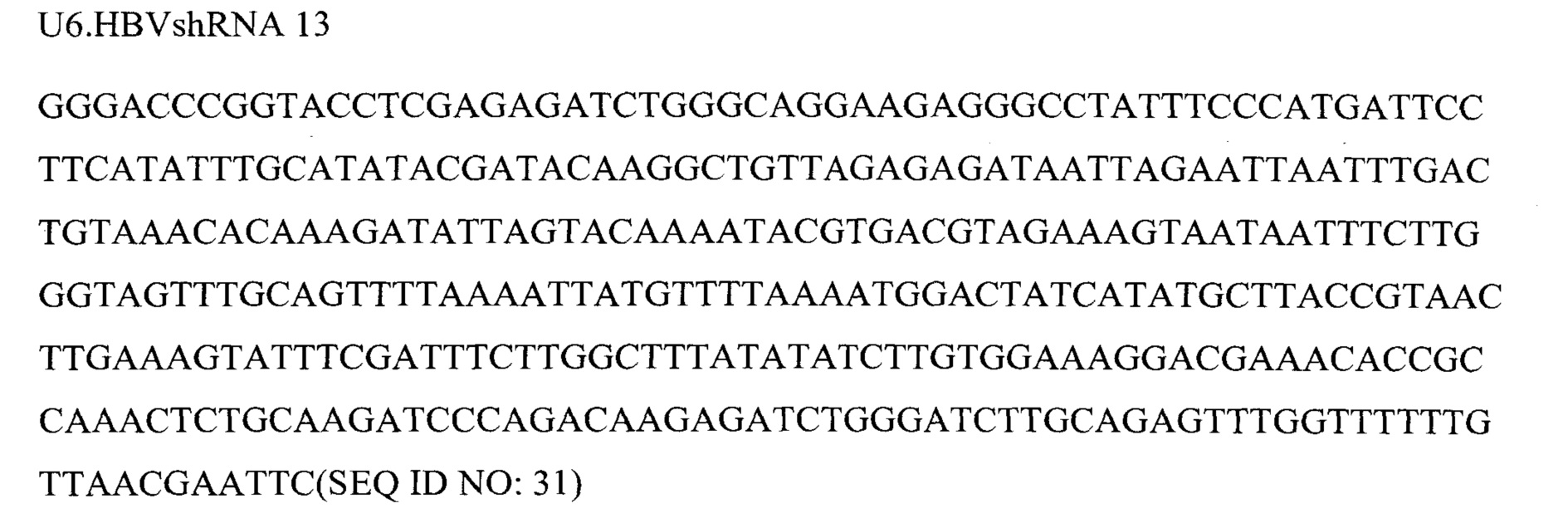
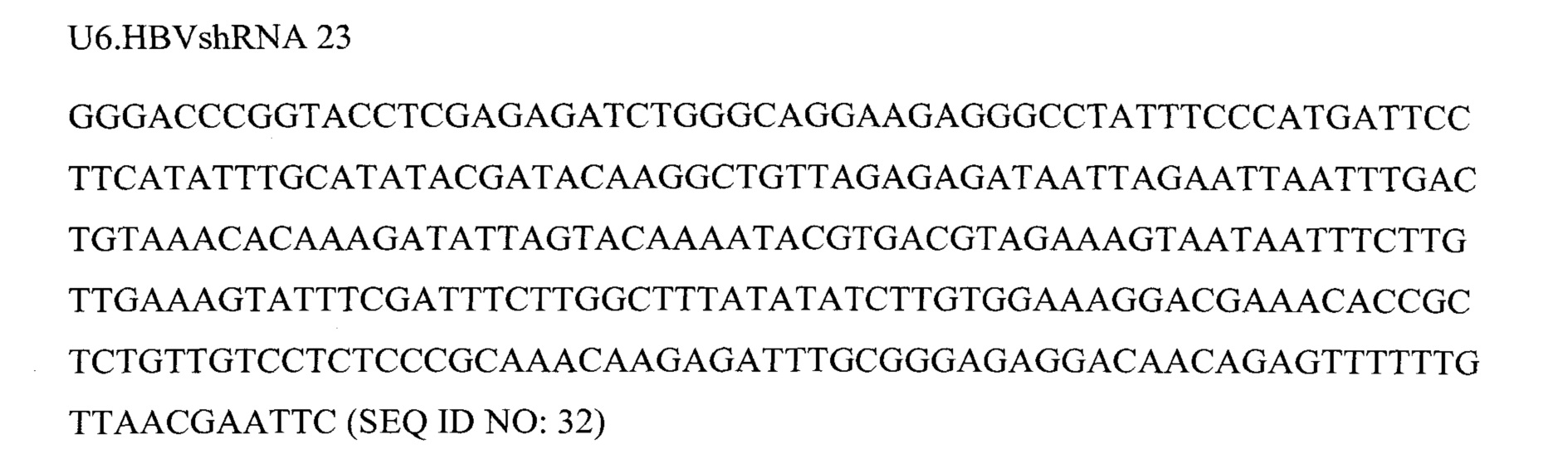
Соответствующая экспрессированная shRNA для каждой из этих кассет экспрессии показана на фигуре 6 (в виде SEQ ID NO: 36-40). Символ "∧" и "∨" указывает на потенциальные сайты процессинга shRNA в результате либо инициации транскрипции/терминации, либо процессинга дайсером, с периодом 22 нуклеотида и 3’-выступом на 2 нуклеотида, причем предсказанная эффекторная последовательность при условии такого процессинга показана ниже.
Пример 6: Создание клеток, стабильно экспрессирующих shRNA, с применением конструктов с несколькими последовательностями
Как указано выше, один применимый способ разработки кассет экспрессии для ddRNAi по настоящему изобретению предполагает то, что дайсер делает разрез каждые 22 нуклеотида (также называется периодичностью 22 нуклеотида). Следовательно, последовательности ДНК, которые кодируют эффекторные последовательности, могут быть разработаны для кодирования любых 10 или более и предпочтительно любых 17 или более смежных нуклеотидов в пределах последовательности из группы, состоящей из SEQ ID NO: 1-27, вместе с соответствующими спейсерами и другими необходимыми последовательностями для промотора и/или терминатора.
Конструкты для ddRNAi будут созданы со следующими структурами (с применением неограничивающих иллюстративных последовательностей):
i) кассета экспрессии для одной шпильки
Как указано выше, на фигуре 6 проиллюстрирована кассета экспрессии, обеспечивающая экспрессию шпилечного средства для RNAi и гипотетической эффекторной последовательности, процессированной дайсером (при условии периодичности 22 нуклеотида) на основе SEQ ID NO: 3 (фигура 6, A), SEQ ID NO:9 (фигура 6, B) и SEQ ID NO: 12 (фигура 6, С), SEQ ID NO: 13 (фигура 6, D) и SEQ ID NO: 23 (фигура 6, E). В кассете на фигурах 6, A и B кодируются 20 смежных нуклеотидов из SEQ ID NO: 3 и 9, соответственно, при этом в кассете на фигурах 6, C-E кодируется 21 смежный нуклеотид из SEQ ID NO: 12, 13 и 23 соответственно. Стрелки на шпилечном средстве для RNAi указывают на то, где дайсер, как предполагается, делает разрез для получения эффекторной последовательности, показанной ниже.
Последовательность из кассет экспрессии на фигурах 6, A-E уже была приведена выше (SEQ ID NOS: 28-32).
ii) Кассета экспрессии для нескольких шпилек
На фигуре 7 проиллюстрирована кассета экспрессии, обеспечивающая экспрессию шпилечного средства для RNAi (SEQ ID NO: 41-43 и гипотетической эффекторной последовательности, процессированной дайсером (при условии периодичности 22 нуклеотида), на основе SEQ ID NO: 1, SEQ ID NO:4 и SEQ ID NO:6, которые расположены в кассете так, чтобы привести к экспрессии отдельных шпилечных средств для RNAi (фигура 7, A) или одной РНК, содержащей 3 шпилечных средства для RNAi перед процессингом (фигура 7, B). SEQ ID NO: 1, 4 и 6 являются такими же, как описано выше по отношению к кассете экспрессии для одной шпильки. Символы "∧" и "∨" на шпилечном средстве для RNAi указывают на то, где дайсер, как предполагается, делает разрез для получения эффекторной последовательности, показанной ниже.
Кассета экспрессии на фигуре 7, A содержит последовательность ДНК

В кассете на фигуре 7, A каждая комплементарная цепь эффектора является функционально связанной с промоторной последовательностью, и соответствующая эффекторная последовательность является функционально связанной с терминирующими элементами или последовательностями.
В отличие от этого, в кассете экспрессии на фигуре 7, В первая комплементарная цепь эффектора (1-я эффекторная комплементарная цепь) является функционально связанной с промотором, и последний эффектор (эффектор 6) является функционально связанным с терминаторным элементом или последовательностью, причем стрелки указывают на предполагаемые сайты для процессинга дайсером. Эта кассета разработана для экспрессии одной молекулы РНК (SEQ ID NO: 44) и содержит последовательность ДНК
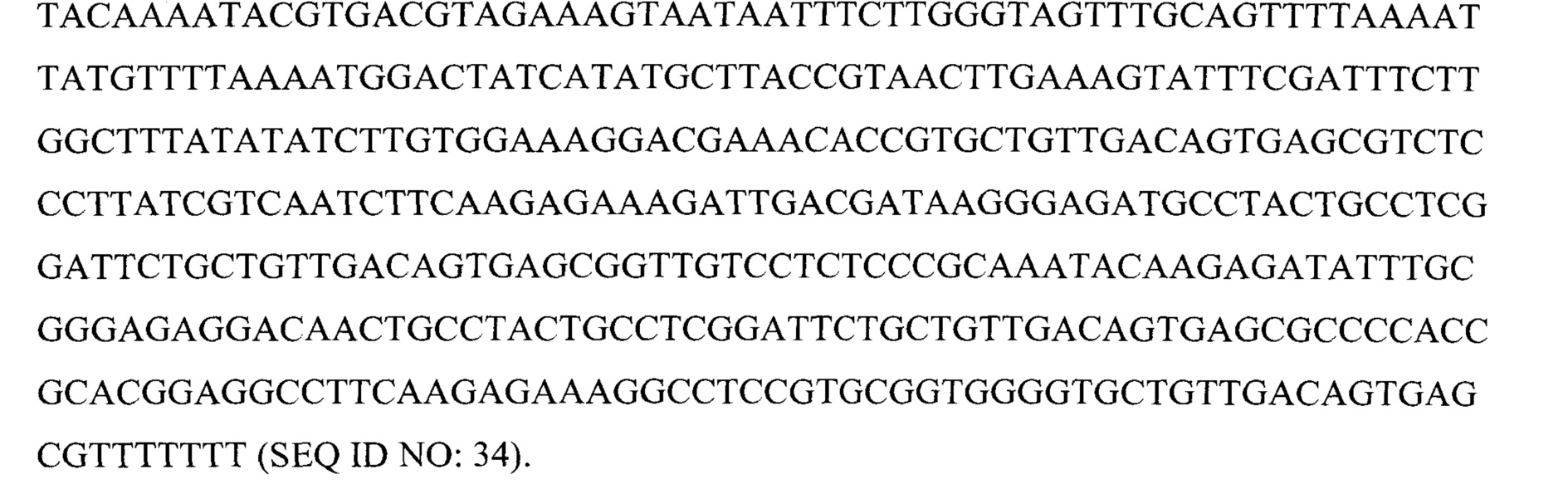
iii) Кассета экспрессии для длинной шпильки
На фигуре 8 проиллюстрирована кассета экспрессии, обеспечивающая экспрессию шпилечного средства для RNAi (SEQ ID NO: 45) и гипотетической эффекторной последовательности, процессированной дайсером (при условии периодичности 22 нуклеотида), на основе (по порядку) SEQ ID NO: 1, SEQ ID NO: 6 и SEQ ID NO: 4. В кассете на фигуре 8 кодируются 17 смежных нуклеотидов из SEQ ID NO: 1 и 20 смежных нуклеотидов из SEQ ID NO:6, как в вышеприведенных примерах, но в отличие от этого в кассетах на фигурах 7 и 8 кодируются только 18 смежных нуклеотидов из SEQ ID NO: 4. Стрелки на шпилечном средстве для RNAi указывают на то, где дайсер, как предполагается, делает разрез для получения эффекторной последовательности, показанной ниже.
Кассета экспрессии на фигуре 8 содержит последовательность ДНК
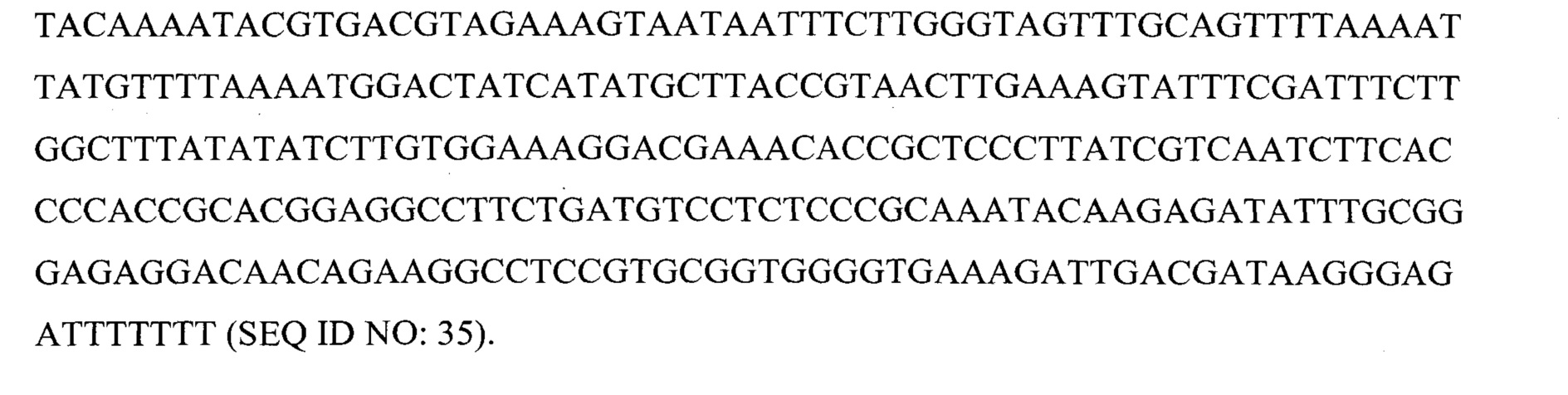
Пример 7: Анализ эффективности средств для ddRNAi in vitro
Для исследования эффективности средств для ddRNAi соответствующие клетки и клеточные линии можно трансфицировать РНК-средствами по настоящему изобретению и анализировать ингибирование репликации HBV.
Для анализа эффективности конструктов ddRNAi по настоящему изобретению сконструировали плазмидные ДНК на основе люциферазного репортерного вектора pGL3. Первый "pGL3 multi" содержит одиночные копии последовательности в 3’-нетранслируемых участках (UTR) люциферазы светлячка, которая экспрессируется плазмидой pGL3, кодирующей сайты-мишени для siRNA или shRNA 3, 9, 12, 13 и 23 на основе SEQ ID NO: 3. 9, 12, 13 и 23, соответственно. Второй "pGL3-23" содержит тройной повтор shRNA 23 на основе SEQ ID NO:23. Сайты-мишени HBV в этих плазмидах соответствуют смысловым последовательностям HBV, распознаваемым определенными siRNA или shRNA, и включают дополнительные 10 нуклеотидов последовательности HBV выше и ниже сайтов-мишеней.
Следующая информация относится к экспериментам, проведенным с применением конструкта pGL3-23.
Для удобства мы решили провести предварительные исследования с применением анализов с двумя люциферазами при промежуточных анализах на клетках HEK293. Клетки высевали в 96-луночные планшеты (0,1 мл среды/лунка) с достижением приблизительно 50% конфлюэнтности перед трансфекцией. Плазмидные ДНК и химически синтезированные siRNA (или векторы для shRNA) ко-трансфицировали в клетки НЕК293 с помощью Lipofectamine™ 2000 с применением протокола производителя (Invitrogen). Тестовые конструкты применяли вместе с конструктом, экспрессирующим люциферазу Renilla (pRL-TK, Promega), который играл роль внутреннего контроля в отношении эффективности трансфекции.
Если химически синтезированные siRNA или shRNA, экспрессирующаяся с векторов, являются эффективными при сайленсинге целевой последовательности, то уровни люциферазы в трансфицированных клетках будут сниженными, поскольку целевые последовательности являются функционально связанными с геном люциферазы.
Соответственно, осуществляли ко-трансфекцию различными количествами химически синтезированных siRNA или векторов экспрессии для shRNA вместе с постоянными количествами pGL3-23 и контрольных плазмид (смотри таблицы ниже).
|
Клетки трансфицировали указанными количествами pGL3-23 и контрольных (pRL-TK) плазмид и различными количествами siRNA на основе SEQ ID NO: 23 (siRNA23 для HBV). siNC, неродственную siRNA без известных целевых последовательностей в HBV, применяли как в качестве отрицательного контроля, так и для регулирования общих количеств siRNA, добавленных к клеткам, для того, чтобы избежать возможных артефактов вследствие неодинаковой трансфекции. siRNA к GL3 применяли в качестве положительного контроля с тем, чтобы она представляла собой siRNA, нацеленную на ген люциферазы.
|
Клетки трансфицировали указанными количествами pGL3-23 и контрольных (pRL-TK) плазмид и различными количествами тестовых плазмид для экспрессии shRNA на основе SEQ ID NO:23 (shRNA23 для HBV). pUC57 применяли как в качестве отрицательного контроля, так и для регулирования общих количеств плазмидных ДНК, добавленных к клеткам, для того, чтобы избежать возможных артефактов вследствие неодинаковой трансфекции. Плазмиду, экспрессирующую shRNA к люциферазе, на основе siRNA к GL3 применяли в качестве положительного контроля.
Осуществляли трансфекцию образцов для исследования в 4 отдельных лунках и определяли активности люциферазы светлячка и Renilla через 48 часов после трансфекции с применением Dual-Luciferase Assay System (Promega) и люминисцентного микропланшет-ридера Synergy™ 2 (Biotek) согласно соответствующему протоколу производителя. Для каждой лунки определяли соотношения активности для светлячка/Renilla и после нормализации по отношению к соответствующим контролям рассчитывали эффективность ингибирования при помощи siRNA или shRNA.
Результаты
На графиках на фигуре 10, A и B показаны активности люциферазы (+/-SD; n=4) в клетках, трансфицированных различными количествами химически синтезированных конструктов экспрессии siRNA23 (A) или shRNA23 (B), нацеленных на pGL3-23, с использованием условий, перечисленных в таблицах 5 и 6. Даже при наиболее низких концентрациях siRNA и shRNA на основе SEQ ID NO: 23 обеспечивают отрицательную регуляцию по сравнению с отрицательным контролем (siNC или shNC - условно принимают за 1). Положительный контроль siRNA и shRNA к люциферазе также обеспечивает отрицательную регуляцию уровней экспрессии люциферазы с pGL3-23.
Пример 8: Анализ эффективности средства для ddRNAi in vivo
Доступны мышиные модели для HBV, например, инфицированные HBV мыши NOD/SCID (Yang et al. 2002; Ketzinel-Gilad et al. 2006), а также линии трансгенных мышей, экспрессирующих HBV, одно из двух или оба из которых можно применять для этих экспериментов.
Для доставки средств к печени будет применяться инъекция средств для ddRNAi в хвостовые вены мышей. Ингибирование репликации HBV можно отслеживать в различные моменты времени с применением qRT-PCR анализов для определения уровней мРНК pol HBV в тканях печени или путем количественного определения уровней HBsAg и HBeAg в кровотоке у животных, обработанных средствами для ddRNAi по настоящему изобретению по сравнению с соответствующими контрольными животными, например, мышами, которым инъецировали скремблированную последовательность или несоответствующие ДНК, как описано выше.
Подходящие конструкты для экспрессии для стабильной экспрессии средств для ddRNAi включают лентивирусные векторы.
Пример 9: In vivo исследование доклинического кандидата на нормальной мышиной модели
Одна система доставки, предусмотренная для in vivo исследования доклинического кандидата на нормальной мышиной модели, представляет собой AAV. Применительно к AAV, конструкты для ddRNAi будут ’упакованы’ in vitro с применением методик, хорошо известных специалистам в данной области техники, и будут вводиться внутривенно инфицированным HBV мышам NOD/SCID и/или HBV трансгенным мышам. Ингибирование репликации HBV будет отслеживаться, как описано выше.
Следует понимать, что настоящее изобретение, раскрытое и определяемое в данном описании, распространяется на все альтернативные комбинации двух или более отдельных признаков, указанных или очевидных из текста или графических материалов. Все такие различные комбинации представляют собой различные альтернативные аспекты настоящего изобретения.