Результат интеллектуальной деятельности: Композиция для восстановления дефектов костной ткани на основе аденовирусных конструкций, несущих кДНК ВМР-2, фибринового геля и синтетического β-трикальцийфосфата и способ ее получения
Вид РИД
Изобретение
Изобретение предназначено для применения в регенеративной медицине с целью восстановления дефектов костной ткани, полученных в результате травматических и дегенеративных заболеваний.
Разработка новых эффективных средств лечения обширных костных дефектов, образовавшихся в результате травматических повреждений, дегенеративных процессов и хирургических резекций при онкологических заболеваниях, является актуальной задачей современной биологии и медицины. Ежегодно в мире существует потребность более чем в 800000 костных трансплантатов. Операции, направленные на восполнение объема костной ткани перед дентальной имплантацией, проводятся у 27 млн. европейцев в год. Более 44 млн. американцев и столько же жителей Европы подвержены остеопорозу [Иванов, 2009]. Традиционно для восполнения дефицита костной ткани используют следующие методы: пересадку собственных тканей пациента (аутопластику), трансплантацию аллогенной костной ткани и введение различных остеопластических материалов на основе ксеногенного костного матрикса, синтетических кальцийфосфатных соединений, полимерных композиций и различных гибридных материалов [Chatterjea, 2010].
Аутотрансплантация на сегодняшний день является «золотым стандартом» при лечении костных дефектов и позволяет обеспечить эффективное восполнение утраченной костной ткани и добиться лучших показателей остеоинтеграции имплантатов по сравнению с применением ординарных костно-пластических материалов [Деев и др., 2015, Вортингтон, Ланг, Лавелле, 2005]. Однако при аутопластике возникают проблемы, связанные с недостаточностью собственной костной ткани для пересадки и выраженными процессами резорбции трансплантатов. Забор материала из донорской зоны - это дополнительное хирургическое вмешательство, сопровождающееся болевыми ощущениями, потерей крови, развитием гематом, риском инфицирования и развития других осложнений [Laurie, 1984; Arrington, 1996; Frohlich, 2008]. Также аутотрансплантация не показана при остеопорозе, несовершенном остеогенезе и остеомиелите [Laurencin, 2003].
В случае использования аллогенной костной ткани требуется проведение децеллюляризации костного матрикса, что существенно снижает остеоиндуктивные потенции трансплантата и, следовательно, биологическую эффективность по сравнению с аутогенной костной тканью [Finkemeier, 2002].
В качестве альтернативы ауто- и аллотрансплантатам используются ординарные и активированные костно-пластические материалы. Ординарные материалы имеют выраженные остеокондуктивные свойства, обеспечивают клеточную адгезию и поддержание прорастающих сосудов, но не обладают достаточными остеиндуктивными свойствами [Finkemeier, 2002; Fellah, 2008; Bueno, 2009]. Активированные костно-пластические материалы представляют собой матрицу, содержащую факторы роста для привлечения и дифференцировки резидентных прогениторных клеток. В большинстве вариантов формула таких материалов представляет собой «ординарный костно-пластический материал + остеоиндуктор» [Деев и др., 2015]. В качестве факторов роста в большинстве случаев используются рекомбинантные ростовые факторы, включая белки семейства костных морфогенетических белков (BMP), VEGF, FGF и другие. Существенным недостатком применения рекомбинантных факторов является их быстрый распад в организме, что требует использования высоких концентраций белков, значительно превышающих физиологические пределы, для достижения терапевтического эффекта. Некорректный подбор концентрации при такой терапии нередко приводит к чрезмерному развитию костной ткани и ряду других осложнений. Применение rhBMP-2 при артродезе позвонков (иммобилизации) приводит к эктопическому формированию кости, отеку, развитию опухолей и других осложнений [Woo, 2012; Fu et al., 2013]. По данным Carragee риск развития опухолевых процессов увеличивается в пять раз спустя 2 года после хирургического вмешательства с использованием высоких доз rhBMP-2 [Carragee et аl., 2013]. Еще один фактор, ограничивающий их применение, - структура самого белка. Использование прокариотических клеток (Е. coli) для синтеза белка не обеспечивает его правильную модификацию и сворачивание из-за отсутствия соответствующих ферментов эукариот, что приводит к формированию белка с аномальной структурой и сниженной физиологической активностью, являющегося потенциальным аллергеном.
Альтернативным подходом к обеспечению в области регенерации терапевтических концентраций остеогенных факторов является генная терапия. Подход направлен на доставку в зону повреждения генных конструкций, содержащих гены ростовых или транскрипционных факторов, а также внутриклеточных регуляторных белков, которые поступают в клетки пациента и начинают экспрессировать данные факторы. Основные преимущества генной терапии перед использованием рекомбинантных белков заключаются в обеспечении локальной регулируемой экспрессии терапевтических факторов в области повреждения в течение продолжительного времени, что позволяет обеспечить терапевтические дозы рекомбинантных факторов без осложнений, связанных с высокой дозировкой препарата. В такой системе полностью решается проблема формирования правильной структуры белка - в эукариотических клетках для этого есть все необходимые ферменты и факторы [Evans, 2012]. Кроме того, генная терапия позволяет обеспечить выработку в клетке белков, которые будут использоваться внутри самой клетки, участвуя в регуляции сигнальных путей на различных этапах, что существенно расширяет терапевтические возможности данного подхода в сравнении с рекомбинантными факторами роста, оказывающими влияние только на уровне рецепторов.
Введение генетических конструкций, в зависимости от клинической задачи, осуществляется или путем прямой инъекции, или имплантации биосовместимых материалов (матриц), на которых иммобилизованы векторы. Материалы, импрегнированные генетическими конструкциями, называют ген-активированными материалами (ГАМ). В качестве матриц используют материалы на основе полимеров природного происхождения (коллагена, хитозана, фибрина, альгинатов), синтетических материалов (полиэфиров молочной, гликолевой кислоты), неорганических фосфатов и других материалов [Chang at al. 2010; Zhang at al. 2011].
Для доставки гена в зону повреждения используют две системы: трансфекцию плазмидами и вирусную трансдукцию. Использование плазмид - менее эффективный подход, требующий дополнительных реактивов для внедрения вектора в клетку, при этом его проникновение именно в ядро достигается далеко не всегда.
Вирусная трансдукция является методом эффективной доставки генетического материала, в основе которого заложены природные механизмы проникновения вирусных частиц в клетки. В настоящее время в экспериментальных исследованиях показана эффективность применения конструкций на основе аденовирусов, аденоассоциированных вирусов, лентивирусов и ретровирусов. Но среди всех вирусных векторов для клинического применения в генотерапии наиболее безопасными считаются аденовирусные конструкции, поскольку после трансдукции отсутствует интеграция вектора в геном клетки-хозяина и потенциальная возможность онкогенной трансформации исключается. Преимуществами таких векторов также являются большая пакующая емкость генома - от 7000-30000 п.о., способность инфицировать как делящиеся, так и неделящиеся клетки, возможность получения аденовирусных препаратов с высоким титром [Benihoud К., 1999, Bett А. 1993]. На модели критических дефектов бедренных костей у крыс было показано, что подкожное введение аденовирусных конструкций, несущих ген ВМР-2, VEGF или транскрипционного фактора Runx2 приводит к заживлению раны в зависимости от дозы [Betz et al., 2006, Betz et al., 2007]. При отсроченном введении аденовирусного вектора с ВМР-2 (Ad-BMP-2) эффективность заживления была еще выше [Betz et al., 2007]. Использование ГАМ на основе мышечной или жировой ткани, трансдуцированных ВМР-2, имеет такую же эффективность, как и аутотрансплантация [Evans et al., 2009; Betz et al., 2013]. Аналогичные результаты были получены и при введении аллогенных клеток, трансфицированных Ad-BMP-2, инкапсулированных внутри микросфер из поли (этиленгликоль) диакрилатного гидрогеля [Sonnet et al., 2013]. В ряде экспериментов была показана эффективность генно-клеточных трансплантаций на основе мультипотентных мезенхимальных стромальных клеток (ММСК), трансдуцированных Ad-BMP-2 [Lieberman et al., 1999; Peterson et al., 2005]. Инъекция в костный мозг аденовирусных конструкций, несущих ген RunX2, приводит к высокой минерализации костной ткани бедренных костей крыс [Bhat et al., 2008]. Эффективное формирование костной ткани при инъекции Ad-BMP-2 было показано также на модели дефекта черепа у кроликов и овец [Baltzer et al., 2000, Egermann et al., 2006]. Аденовирусная конструкция с ВМР-2 индуцирует заживление костного повреждения при остеопорозе у овец [Egermann et al., 2006]. Трансплантация аутологичных ММСК костного мозга, трансдуцированных Ad-BMP-2 на кальций-фосфатном носителе, приводила к полному заживлению дефектов большеберцовых костей крыс [Dai et al., 2005].
Применение генно-клеточных технологий, показанное во многих работах, безусловно, является эффективным приемом. Но этот подход имеет и свои серьезные недостатки - во-первых, требуется время для наращивания клеток пациента (аллогенные будут быстро элиминированы), что откладывает начало лечения и снижает его эффективность, а во-вторых, такой подход крайне дорогостоящий и потому может иметь очень ограниченное применение. Генная терапия с использованием вирусной трансдукции является более быстрым, простым и существенно менее затратным способом терапии, не уступающим по своей эффективности генно-клеточным методам.
Наиболее эффективным способом доставки вирусного вектора в зону дефекта является иммобилизация вирусной конструкции на остеопластическом материале. Такой способ обеспечивает, во-первых, локальное направленное введение вирусных частиц, а во-вторых, позволяет добиться отсроченного высвобождения конструкции по завершении стадии воспаления, когда начинается миграция и дифференцировка остеогенных предшественников. Также немаловажно, что остеопластический материал при трансплантации будет служить матрицей для прикрепления резидентных прогениторных и зрелых клеток, обеспечивая остеокондуктивные свойства препарата. В большинстве работ для иммобилизации аденовирусных конструкций с остеоиндуцирующими/ангиогенными факторами используют природные полимеры на основе коллагена [Gugala et al., 2007] или хитозана с коллагеном [Zhang et al., 2007; Zhang et al., 2009; Luo et al., 2011]. Выбранные материалы являются нетоксичными биорезорбируемыми полимерами, которые будут деградировать, замещаясь костной тканью, без образования токсичных продуктов распада, являясь привычным субстратом для клеточной адгезии. Недостатком этих материалов является очень быстрая резорбция в организме.
В настоящем изобретении в качестве материала для иммобилизации аденовирусных конструкций с кДНК ВМР-2 используют комбинацию фибринового геля с частицами костно-пластического материала на основе синтетического β-трикальцийфосфата. Фибрин - природный полимер, также как и коллаген, является отличной субстанцией для миграции и прикрепления резидентных клеток. При формировании фибрирового геля используют обогащенную тромбоцитами плазму крови (ОТП). Свойства ОТП основаны на продукции многочисленных ростовых факторов, которые высвобождаются при активации тромбоцитов (FGF, VEGF, PDGF, IGF и др.). Важно, что все эти компоненты находятся в ОТП в биологически предопределенных соотношениях, что обеспечивает их сбалансированное взаимодействие и выгодно отличает от использования рекомбинантных молекул [Zhang, 2013]. Факторы роста высвобождаются из α-гранул тромбоцитов при разрушении их плазматических мембран, при свертывании крови или добавлении тромбина и кальция [Marx, 2004]. Взаимодействие между этими факторами и рецепторами на поверхности клеток-мишеней активирует пути внутриклеточного сигналинга, что приводит к стимуляции ангиогенеза, хемотаксиса, митотической и метаболической активности клеток, участвующих в регенерации [Schliephake, 2002; Bucholz, 2006; Alsousou, 2009; Zhang, 2013].
Костно-пластический материал выполняет остеокондуктивную функцию, поддерживая клеточную адгезию, обеспечивая высвобождение ионов кальция и фосфора, участвующих в построении костной матрикса в течение требуемого для полноценного формирования костной ткани срока не менее 6 месяцев.
Задачей настоящего изобретения и техническим результатом является создание композиции для повышения регенеративной способности костной ткани. Для решения поставленной задачи предложена композиция на основе рекомбинантного аденовируса РПАН-ВМР2, фибринового геля и синтетического β-трикальцийфосфата в качестве костно-пластического материала.
Предложен способ получения композиции, включающий следующие стадии:
1. Получение псевдоаденовирусных частиц, несущих кДНК костного морфогенетического белка ВМР-2;
2. Получение обогащенной тромбоцитами плазмы крови;
3. Получение композиции на основе псевдоаденовирусных частиц, несущих кДНК ВМР-2, тромбоцитарного геля и костно-пластического материала β-трикальцийфосфата.
Получение псевдоаденовирусных частиц, несущих кДНК костного морфогенетического белка ВМР-2
Для получения псевдоаденовирусной конструкции со встроенным геном костного морфогенетического белка ВМР-2 сначала получают плазмиду, содержащую вставку кДНК ВМР-2, затем с помощью гомологичной рекомбинации встраивают кДНК ВМР-2 в вектор рекомбинантного аденовируса человека 5 серотипа, после чего получают рекомбинантные псевдоаденовирусные частицы, несущие кДНК ВМР-2.
Получение плазмиды pShuttle-CMV-BMP-2, содержащей вставку кДНК ВМР-2
1. Проводят синтез полной копии кДНК гена ВМР-2 с фланкирующими последовательностями, содержащими сайты рестрикции.
2. Данную последовательность клонируют в плазмиду pShuttle-CMV под контроль промотора цитомегаловируса человека, в результате чего получают вектор pShuttle-CMV-BMP-2. Используемый промотор обеспечивает высокий уровень экспрессии целевого гена.
Получение гибридной плазмиды pAd5-EASY-BMP-2, несущей геном рекомбинантного аденовируса человека 5 серотипа и кДНК ВМР-2
Проводят гомологичную рекомбинацию между полученной плазмидой pShuttle-CMV-BMP-2 и коммерческой плазмидой pAd5-EASY, которая содержит геном рекомбинантного аденовируса человека 5 серотипа.
1. Полученную плазмиду pShuttle-CMV-BMP-2 линеаризируют рестриктазой PmeI, смешивают с плазмидой pAd5-EASY и котрансформируют в клетки E. coli (штамм BJ5183).
2. Из полученных трансформантов выделяют плазмидную ДНК и анализируют ее молекулярный вес по электрофоретической подвижности ДНК в агарозном геле для подтверждения рекомбинации.
3. Отобранные в ходе анализа клоны ДНК проверяют на наличие вставки плазмиды pAd5-EASY ПЦР-анализом на аденовирусную часть ДНК.
4. Наличие вставки в плазмиду к ДНК ВМР-2 проверяют с помощью ПЦР-анализа с геноспецифическими праймерами.
5. Клон гибридной плазмиды pAd5-EASY-BMP-2, несущей геном рекомбинантного аденовируса человека 5 серотипа и кДНК ВМР-2, наращивают в препаративных количествах и очищают для дальнейшей работы с помощью коммерческого набора для выделения ДНК компании «GENOMED».
6. Полученную плазмидную ДНК анализируют по молекулярному весу при помощи ПЦР-анализа и электрофореза в полиакриламидном геле.
Получение рекомбинантных псевдоаденовирусных наночастиц, несущих кДНК ВМР-2
1. Для получения псевдоаденовирусных частиц используют клетки линии НЕК 293 (клеточная линия, полученная из эмбриональных почек человека, в 19 хромосому которой встроена часть генома аденовируса, обеспечивающая его воспроизведение).
2. Трансфекцию клеток линии HEK 293 проводят плазмидой pAd5-EASY-BMP-2, гидролизованной по сайту для рестриктазы Pad. Трансфекцию проводят в 24-луночном планшете («Nunc») с использованием реактива Metafectene Pro («Biontex»).
3. Через 10 суток после трансфекции клетки снимают раствором Версена с добавлением 0,25% трипсина, замораживают-оттаивают и полученным лизатом, содержащим рекомбинантный аденовирус pAd5-EASY-BMP-2 (РПАН - ВМР2), заражают клетки линии HEK 293 в 35 мм чашке («Nunc»).
4. Через 5 суток наблюдают специфический лизис клеток, обусловленный цитопатическим действием вируса.
5. Из полученных лизатов клеток выделяют ДНК и проводят ее ПЦР-анализ на аденовирусную часть, ПНР-анализ на наличие гена ВМР-2 и ПЦР-анализ на наличие ревертантов (частиц аденовируса дикого типа, которые могут возникать при рекомбинации с вирусными генами клеток пакующей линии HEK 293) с последующим электрофорезом фрагментов в полиакриламидном геле.
6. Полученный препарат рекомбинантного аденовируса РПАН-ВМР2 наращивают на клетках линии HEK293.
7. Из клеток HEK293 готовят лизат, в котором определяют количество бляшко-образующих единиц (БОЕ) по стандартному протоколу
http://www.virapur.com/protocols/Virus%20Plaque%20Assay%20Protocol.pdf
8. Лизат замораживают и хранят в сосудах Дьюара в жидком азоте при -196°С.
Получение обогащенной тромбоцитами плазмы крови
1. Венозную кровь пациента собирают в пробирки с ЭДТА в объеме от 1 до 5 мл в зависимости от требуемого объема конечного препарата.
2. Кровь привозят в лабораторию, переносят в стерильные центрифужные пробирки и осаждают эритроциты 10 мин при 1100 об/мин.
3. Супернатант переносят в другую пробирку и центрифугируют 15 мин при 3600 об/мин для осаждения тромбоцитов.
4. Половину супернатанта удаляют, в оставшемся объеме ресуспензируют клеточный осадок.
5. Полученную фракцию обогащенной тромбоцитами плазмы (ОТП) замораживают без добавления криопротектора и хранят в сосудах Дьюара в жидком азоте при -196°С.
Получение препарата на основе псевдоаденовирусной конструкции, несущей кДНК ВМР-2, тромбоцитарного геля и костно-пластического материала β-трикальцийфосфата
Для получения препарата суспензию псевдоаденовирусных частиц, несущих ген ВМР-2, смешивают с костно-пластическим материалом и заключают в фибриновый гель. Используют костно-пластический материал на основе синтетического β-трикальцийфосфата, например препарат «Клипдент» (ЗАО «ОЭЗ «ВладМива», рег. удостов. на медицинское изделие ФСР № ФСР 2010/08030. Для данного материала было показано, что он не обладает цитотоксичностью и способен к поддержанию клеточной адгезии и пролиферации.
Материал используется в виде гранул размером 100-500 мкм. Ожидаемая скорость резорбции - 9-10 месяцев. Резорбция протекает параллельно процессу регенерации.
Для получения композиции объемом 1 мл (1 см3) 300 мкл суспензии псевдоаденовирусных частиц, несущих кДНК ВМР-2, содержащей 108 бляшко-образующих единиц (БОЕ), смешивают с 300 мм3 стерильного костно-пластического материала и добавляют 300 мкл ОТП. Для образования фибрина из содержащегося в ОТП фибриногена в систему добавляют по каплям 100 мкл раствора тромбина в 10% растворе хлорида кальция. Полимеризация геля происходит в течение 3-5 мин.
Таким образом, получают композицию следующего состава:
1. РПАН- ВМР2 - 30%;
2. Фибриновый гель (30% ОТП + 10% раствора тромбина) - 40%;
3. Костно-пластический материал β-трикальцийфосфат - 30%.
Эффективность композиции на основе псевдоаденовирусной конструкции, несущей кДНК ВМР-2, тромбоцитарного геля и костно-пластического материала β-трикальцийфосфата
Тестирование на цитотоксичность с помощью МТТ-теста показало, что наблюдается гибель не более 5% клеток, что свидетельствует о высокой биосовместимости материала.
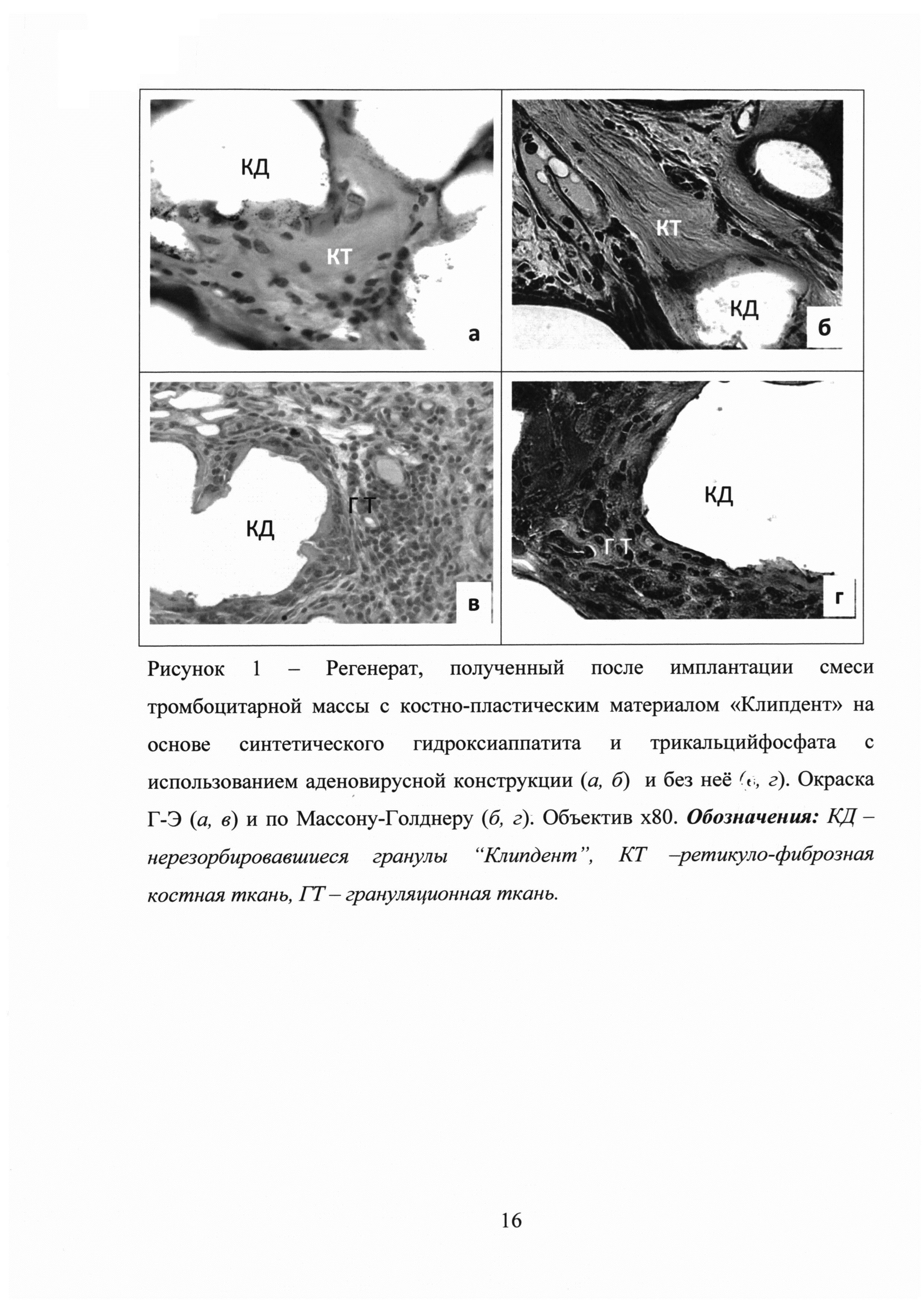
В эксперименте in vivo оценку остеоиндуктивного действия композиции на основе тромбоцитарного геля, костно-пластического материала «Клипдент» и псевдоаденовирусной конструкции, несущей кДНК ВМР-2, проводили на модели эктопического остеогенеза у самцов крыс линии Sprague-Dawley массой тела 300 г (n=20). Конструкции имплантировали подкожно между лопатками. Для этого под внутрибрюшинным наркозом (Золетил (Virbac, Франция) в дозировке 125 мкг/кг) крысам производили поперечный разрез кожи по линии, соединяющей верхний край лопаток. Далее тупым концом формировали ложе между лопатками и производили имплантацию исследуемых композиций. Рану ушивали.
Через 28 дней, что соответствует окончанию процессов первичного остеогенеза, крыс выводили из эксперимента передозировкой наркоза Золетил/Рометар. С помощью ножниц забирали область имплантации с окружающими тканями и фиксировали в 10% нейтральном формалине, после чего проводили декальцинирование. Затем образцы заливали в парафин и изготавливали серийные срезы по общепринятой методике. Срезы окрашивали гематоксилином и эозином. Дополнительно производили окраску по Массону-Голднеру с целью контрастирования межклеточного вещества.
Результаты гистологического исследования свидетельствуют о преобладании в регенерате ретикуло-фиброзной костной ткани в зоне трансплантации композиции с аденовирусной конструкцией, в то время как в контрольной группе (введение только остеопластического материала и ОТП) преобладает грануляционная ткань (рисунок 1, рисунок 2). Таким образом, показана высокая эффективность полученной композиции индуцировать неоостеогенез, что может быть использовано с целью восстановления объема костной ткани в практической медицине: предпочтительно, в травматологии, ортопедии, хирургической стоматологии и челюстно-лицевой хирургии.