Результат интеллектуальной деятельности: КОНЪЮГАТЫ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО И СПОСОБЫ
Вид РИД
Изобретение
На основании 35 USC § 119(e) по настоящей заявке, которая не является предварительной и которая была подана на основании 37 CFR § 1.53(b), испрашивается приоритет предварительной заявки США № 60/576517, поданной 1 июня 2004 года, и предварительной заявки США № 60/616098, поданной 5 октября 2004 года, каждая из которых приведена в настоящем описании в качестве ссылки в полном объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение в основном относится к соединениям с противоопухолевой активностью, и, более конкретно, к антителам, конъюгированным с химиотерапевтическими майтанзиноидными лекарственными средствами или токсинами. Изобретение также относится к способам применения соединений-конъюгатов антитело-лекарственное средство для in vitro, in situ и in vivo диагностики или обработки клеток млекопитающих или связанных с ними патологических состояний.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Лечение антителами было разработано для направленного лечения пациентов со злокачественными опухолями, иммунологическими и ангиогенными нарушениями. Применение конъюгатов антитело-лекарственное средство (ADC), то есть иммуноконъюгатов, для локальной доставки цитотоксических или цитостатических средств, то есть лекарственных средств, для уничтожения или ингибирования опухолевых клеток при лечении злокачественной опухоли (Payne, G. (2003) Cancer Cell 3:207-212; Trail et al. (2003) Cancer Immunol. Immunother. 52:328-337; Syrigos and Epenetos (1999) Anticancer Research 19:605-614; Niculescu-Duvaz and Springer (1997) Adv. Drug Del. Rev. 26:151-172; патент США № 4975278) теоретически обеспечивает направленную доставку лекарственного вещества к опухолям и их накопление внутри клеток, в тех случаях, когда системное введение этих неконъюгированных лекарственных средств может привести к нежелательным условиям токсичности не только в опухолевых клетках, подлежащих уничтожению, но и в здоровых клетках (Baldwin et al., (1986) Lancet pp. (Mar. 15, 1986):603-05; Thorpe, (1985) «Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review,» in Monoclonal Antibodies '84: Biological And Clinical Applications, A. Pinchera et al. (eds), pp. 475-506). Таким образом, необходимо получить максимальную эффективность при минимальной токсичности. Попытки создания и усовершенствования ADC были сфокусированы на селективности моноклональных антител (mAb), а также на свойствах связывания лекарственных средств и высвобождения лекарственных средств. В качестве подходящих для этих стратегий были указаны и поликлональные антитела, и моноклональные антитела (Rowland et al., (1986) Cancer Immunol. Immunother. 21:183-87). Используемые в этих способах лекарственные средства включают дауномицин, доксорубицин, метотрексат, митомицин, неокарциностатин (Takahashi et al. (1988) Cancer 61:881-888) и виндезин (Rowland et al., (1986), supra). Токсины, используемые в конъюгатах антитело-токсин, включают бактериальные токсины, такие как дифтерийный токсин, токсины растений, такие как рицин (патент США № 4753894; патент США № 5629197; патент США № 4958009; патент США № 4956453), низкомолекулярные токсины, такие как гелданамицин (Mandler et al. (2000) J. of the из Nat. Cancer Inst. 92(19):1573-1581; Mandler et al. (2000) Bioorganic & Med. Chem. Letters 10:1025-1028; Mandler et al. (2002) Bioconjugate Chem. 13:786-791), майтанзиноиды (EP 1391213; Liu et al., (1996) Proc. Natl. Acad. Sci. USA 93:8618-8623), и калихимицин (Lode et al. (1998) Cancer Res. 58:2928; Hinman et al. (1993) Cancer Res. 53:3336-3342). Токсины могут осуществлять свои цитотоксические и цитостатические эффекты посредством механизмов, в том числе связывания тубулина, связывания ДНК или ингибирование топоизомеразы. Некоторые цитотоксические лекарственные средства при конъюгации с большими антителами или белковыми лигандами рецепторов, как правило, становятся неактивными или менее активными.
ЗЕВАЛИН (ZEVALIN®) (ибритумомаб тиоксетан, Biogen/Idec), одобренный для применения конъюгат антитело-радиоактивный изотоп, состоящий из моноклонального антитела IgG1 каппа мыши против антигена CD20 и радиоактивного изотопа 111In или 90Y, связанных посредством тиокарбамидного линкера-хелатора (Wiseman et al. (2000) Eur. J. Nucl. Med. 27(7):766-77; Wiseman et al. (2002) Blood 99(12):4336-42; Witzig et al. (2002) J. Clin. Oncol. 20(10):2453-63; Witzig et al. (2002) J. Clin. Oncol. 20(15):3262-69). В 2000 году был одобрен МИЛОТАРГ (MYLOTARG™) (гемтузумаб озогамицин, Wyeth Pharmaceuticals), конъюгат антитело-лекарственное средство, состоящий из гуманизированного антитела к CD33, связанного с калихимицином, для лечения острого миелоидного лейкоза посредством инъекции (Drugs of the Future (2000) 25(7):686; патент США № 4970198; патент США № 5079233; патент США № 5585089; патент США № 5606040; патент США № 5693762; патент США № 5739116; патент США № 5767285; патент США № 5773001). Кантузумаб мертанзин (Immunogen, Inc.), конъюгат антитело-лекарственное средство, состоящий из антитела huC242, связанного посредством дисульфидного линкера SPP, связанного с майтаназоидным лекарственным веществом, DM1 (Xie et al. (2004) J. of Pharm. and Exp. Ther. 308(3):1073-1082; Tolcher et al. (2003) J. Clin. Oncology 21(2):211-222; патент США № 5208020), проходит I фазу испытаний для лечения злокачественных опухолей, экспрессирующих CanAg, таких как рак толстой кишки, рак поджелудочной железы, рак желудка и другие. В процессе разработки находится MLN-2704 (Millennium Pharm., BZL Biologies, Immunogen Inc.), который представляет собой конъюгат антитело-лекарственное средство, состоящий из моноклонального антитела к специфичному для предстательной железы мембранному антигену, связанного с майтаназоидным лекарственным веществом, DM1, и который предполагают использовать для лечения опухолей предстательной железы. То же майтаназоидное лекарственное вещество, DM1, связывали с мышиным моноклональным антителом, TA.1, посредством не являющегося дисульфидным линкера, SMCC (Chari et al. (1992) Cancer Research 52:127-131). Сообщалось, что такой конъюгат в 200 раз менее эффективен, чем соответствующий конъюгат с дисульфидным линкером. Было сделано предположение, что линкер SMCC является «нерасщепляемым» (также см. патент США № 4981979). Был описан ГЕРЦЕПТИН® (HERCEPTIN®) (трастузумаб), связанный посредством SMCC с DM1 (WO 2005/037992).
С целью обнаружения эффективных клеточных мишеней для диагностики и лечения злокачественных опухолей исследователями были сделаны попытки идентифицировать трансмембранные или другим образом ассоциированные с опухолями полипептиды, которые специфически экспрессированы на поверхности одного или нескольких конкретных типов клеток злокачественных опухолей по сравнению с одной или несколькими здоровыми незлокачественными клетками. Как правило, такие ассоциированные с опухолями полипептиды экспрессируются в большом количестве на поверхности клеток злокачественной опухоли по сравнению с экспрессией на поверхности незлокачественных клеток. Идентификация таких антигенных полипептидов клеточной поверхности, ассоциированных с опухолью, то есть ассоциированных с опухолями антигенов (TAA), давала возможность специфического воздействия на клетки злокачественной опухоли для их разрушения посредством терапии антителами.
Терапия моноклональными антителами была разработана для направленного лечения больных раком, иммунологическими и ангиогенными заболеваниями. Примером успешной терапии антителами является терапия ГЕРЦЕПТИНом® (HERCEPTIN®) (трастузумаб), рекомбинантным гуманизированным моноклональным антителом, полученным из ДНК, который обладает высокоаффинной селективностью связывания в клеточном анализе (Kd=5нМ) с внеклеточным доменом белка рецептора 2 эпидермального фактора роста человека, HER2 (ErbB2) (патент США № 5821337; патент США № 6054297; патент США № 6407213; патент США № 6639055; Coussens L, et al. (1985) Science 230:1132-9; Slamon DJ, et al. (1989) Science 244:707-12). Трастузумаб представляет собой антитело IgG1 каппа, содержащее каркасные области человека с участками, определяющими антитела мыши (4D5), связывающееся с HER2. Трастузумаб связывается с антигеном HER2 и, таким образом, ингибирует рост злокачественных клеток. Так как трастузумаб является гуманизированным антителом, то он предельно уменьшает любой ответ HAMA у пациентов. Гуманизированное антитело против HER2 получают в суспензионной культуре клеток млекопитающих (яичника китайского хомячка, CHO). Протоонкоген HER2 (или c-erbB2) кодирует трансмембранный рецепторный белок массой 185 кДа, сходный по структуре с рецептором эпидермального фактора роста. Сверхэкспрессия белка HER2 обнаруживается в 25%-30% случаев первичного рака молочной железы и ее можно определить, используя иммуногистохимические способы оценки фиксированных образцов опухолей (Press MF, et al. (1993) Cancer Res 53:4960-70). Как в анализах in vitro, так и моделях животных было показано, что трастузумаб ингибирует пролиферацию человеческих опухолевых клеток, у которых сверхэкспрессирован HER2 (Hudziak RM, et al. (1989) Mol Cell Biol 9:1165-72; Lewis GD, et al. (1993) Cancer Immunol Immunother; 37:255-63; Baselga J, et al. (1998) Cancer Res. 58:2825-2831). Трастузумаб представляет собой медиатор антителозависимой клеточной цитотоксичности, ADCC (Hotaling TE, et al. (1996) [реферат]. Proc. Annual Meeting Am Assoc Cancer Res; 37:471; Pegram MD, et al. (1997) [реферат]. Proc. Am Assoc Cancer Res; 38:602; Sliwkowski et al. (1999) Seminars in Oncology 26(4), Suppl. 12:60-70; Yarden Y. и Sliwkowski, M. (2001) Nature Reviews: Molecular Cell Biology, Macmillan Magazines, Ltd., Vol. 2:127-137). ГЕРЦЕПТИН® клинически эффективен у пациентов со сверхэкспрессирующим ErbB2 метастазирующим раком молочной железы, которые продолжительно получали предварительное противоопухолевое лечение (Baselga et al. (1996) J. Clin. Oncol. 14:737-744). Хотя открытие герцептина является прорывом в лечении больных со сверхэкспрессирующими ErbB2 формами рака молочной железы, которые получали продолжительное предварительное противоопухолевое лечение, у большинства пациентов этой группы лечение герцептином не эффективно или слабо эффективно. Таким образом, существует значительная клиническая необходимость в разработке дополнительных способов лечения злокачественных опухолей, направленных на HER2, у пациентов со сверхэкспрессирующими HER2 опухолями или другими заболеваниями, ассоциированными с экспрессией HER2, у которых лечение герцептином не эффективно или слабо эффективно. Кроме HER2, при направленных способах лечения существует возможность использовать другие ассоциированные с опухолями антигены.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым соединениям, обладающим биологической активностью против клеток злокачественных опухолей. Соединения могут ингибировать рост опухолей у млекопитающих и могут использоваться для лечения людей, больных раком.
Настоящее изобретение относится к доставке, транспорту в клетки, накоплению и задержке в клетках терапевтических соединений-конъюгатов антитело-лекарственное средство (ADC). Изобретение, в частности, относится к получению высоких концентраций молекул активных метаболитов в клетках злокачественных опухолей. Внутриклеточное нацеливание может быть достигнуто способами и соединениями, делающими возможным накопление и удержание биологически активных средств внутри клеток. Такое эффективное нацеливание может использоваться в целом ряде терапевтических композиций и процедур.
Было сделано неожиданное открытие, что конъюгаты антитело-лекарственное средство со стабильными линкерными группами, не являющимися дисульфидными, связывающими майтаназоидное лекарственное вещество с антителом, обуславливают увеличенную активность in vitro и эффективность in vivo. Кроме того, было показано, что конъюгаты антитело-лекарственное средство обладают неожиданным результатом, заключающимся в большей безопасности in vivo относительно известных конъюгатов с дисульфидными линкерами.
Соединения-конъюгаты антитело-лекарственное средство (ADC) содержат антитело, ковалентно связанное линкером с одним или несколькими майтаназоидными лекарственными веществами. ADC можно представить в виде формулы I:
|
где одно или несколько майтаназоидных лекарственных веществ (D) ковалентно связаны с помощью L антителом (Ab). Ab представляет собой антитело, связывающееся с рецептором ErbB или связывающееся с одним или несколькими ассоциированными с опухолями антигенами или рецепторами на клеточной поверхности. Линкер L может быть стабильным вне клетки, то есть внеклеточно. Линкер L, майтаназоидное лекарственное средство D или линкер и майтаназоидное лекарственное средство, взятые вместе (L-D), не содержат дисульфидной группы.
В одном из вариантов осуществления существенное количество лекарственного вещества не отщепляется от антитела до тех пор, пока конъюгат антитело-лекарственное средство не попадет в клетку через рецептор на клеточной поверхности, специфичный для данного антитела конъюгата антитело-лекарственное средство, и когда конъюгат антитело-лекарственное средство попадает в клетку, лекарственное вещество отщепляется от антитела.
В другом варианте осуществления ADC специфически связывается с рецептором, кодируемым геном ErbB, таким как EGFR, HER2, HER3 и HER4. ADC может специфически связываться с внеклеточным доменом рецептора HER2. ADC может ингибировать рост опухолевых клеток со сверхэкспрессией рецептора HER2.
В другом варианте осуществления, антитело (Ab) формулы I представляет собой гуманизированное антитело, такое как huMAb4D5-1, huMAb4D5-2, huMAb4D5-3, huMAb4D5-4, huMAb4D5-5, huMAb4D5-6, huMAb4D5-7 или huMAb4D5-8 (трастузумаб).
В другом аспекте изобретение относится к фармацевтической композиции, содержащей соединение формулы I или ее фармацевтически приемлемые соль или сольват и фармацевтически приемлемые разбавитель, носитель или эксципиент.
Другой аспект относится к фармацевтической композиции, содержащей соединение формулы I и второе соединение с противоопухолевыми свойствами или другими терапевтическими эффектами.
Еще один аспект относится к диагностическим и терапевтическим применениям соединений и композиций, описанных в данном документе.
Другой аспект относится к способу уничтожения или ингибирования пролиферации опухолевых клеток или клеток злокачественных опухолей, включающему обработку клеток таким количеством конъюгата антитело-лекарственное средство, или его фармацевтически приемлемых соли или сольвата, которое эффективно для уничтожения или ингибирования пролиферации опухолевых клеток или раковых клеток.
Другой аспект относится к способам лечения рака, включающим введение пациенту композиции соединения формулы I. Один из способов предназначен для лечения рака у млекопитающего, где рак отличается сверхэкспрессией рецептора ErbB. Лечение неконъюгированным антителом против ErbB у млекопитающего, необязательно, может быть не эффективно или слабо эффективно. Способ включает введение млекопитающему терапевтически эффективного количества соединения-конъюгата антитело-лекарственное средство.
Другой аспект относится к способу ингибирования роста опухолевых клеток, сверхэкспрессирующих рецептор фактора роста, выбранный из группы, состоящей из рецептора HER2 и рецептора EGF, где способ включает введение пациенту соединения-конъюгата антитело-лекарственное средство, специфически связывающегося с указанным рецептором фактора роста и химиотерапевтического средства, где указанный конъюгат антитело-лекарственное средство и указанное химиотерапевтическое средство вводят в количестве, эффективном для ингибирования роста опухолевых клеток у пациента.
Другой аспект относится к способу лечения человека, восприимчивого к заболеванию, отличительным признаком которого является сверхэкспрессия рецептора ErbB2, или у которого диагностировано такое заболевание, включающему введение сочетания соединения-конъюгата антитело-лекарственное средство формулы I и химиотерапевтического средства.
Другой аспект относится к способу обнаружения раковых клеток, включающему воздействие на клетки соединением-конъюгатом антитело-лекарственное средство и определение степени связывания соединения-конъюгата антитело-лекарственное средство с клетками.
Другой аспект относится к способам скрининга вероятных лекарственных средств ADC для лечения заболевания или нарушения, отличительным признаком заболевания или нарушения является сверхэкспрессия HER2.
Другой аспект относится к готовым изделиям, то есть наборам, содержащим конъюгат антитело-лекарственное средство, контейнер и листовку-вкладыш или этикетку с информацией о лечении.
Другой аспект относится к способам лечения заболевания или нарушения, отличительным признаком которого является сверхэкспрессия HER2, у пациента соединениями-конъюгатами антитело-лекарственное средство.
Другой аспект относится к способам получения, способам изготовления, способам синтеза, способам конъюгации и способам очистки соединений-конъюгатов антитело-лекарственное средство и промежуточных соединений для изготовления, синтеза и конъюгации соединений-конъюгатов антитело-лекарственное средство.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
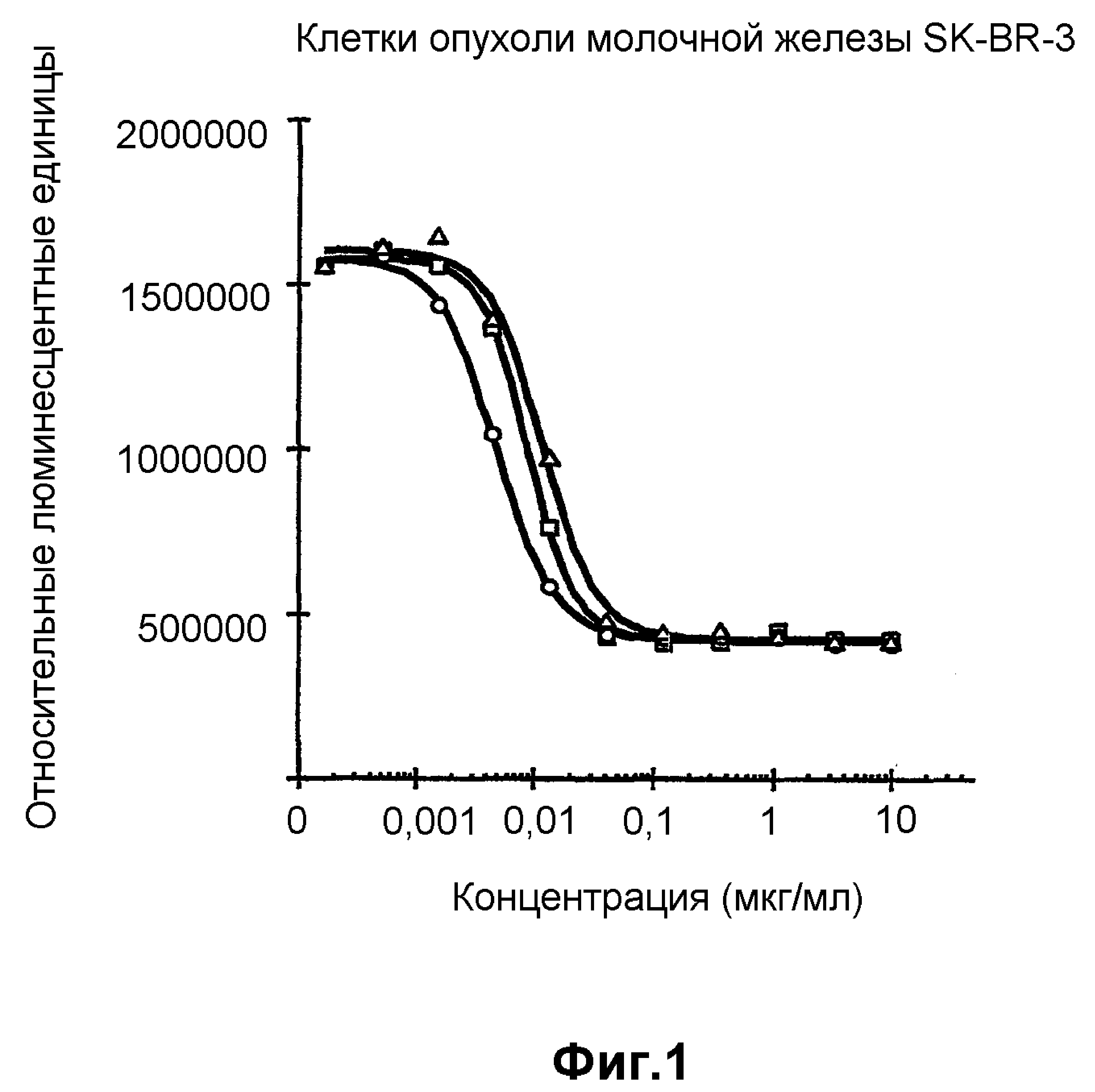
На фиг.1 показан анализ пролиферации клеток in vitro на клетках SK-BR-3, обработанных конъюгатами антитело-лекарственное средство: - □-трастузумаб-SPP-DM1, -Δ-трастузумаб-SPDP-DM1 и -o-трастузумаб-SMCC-DM1.
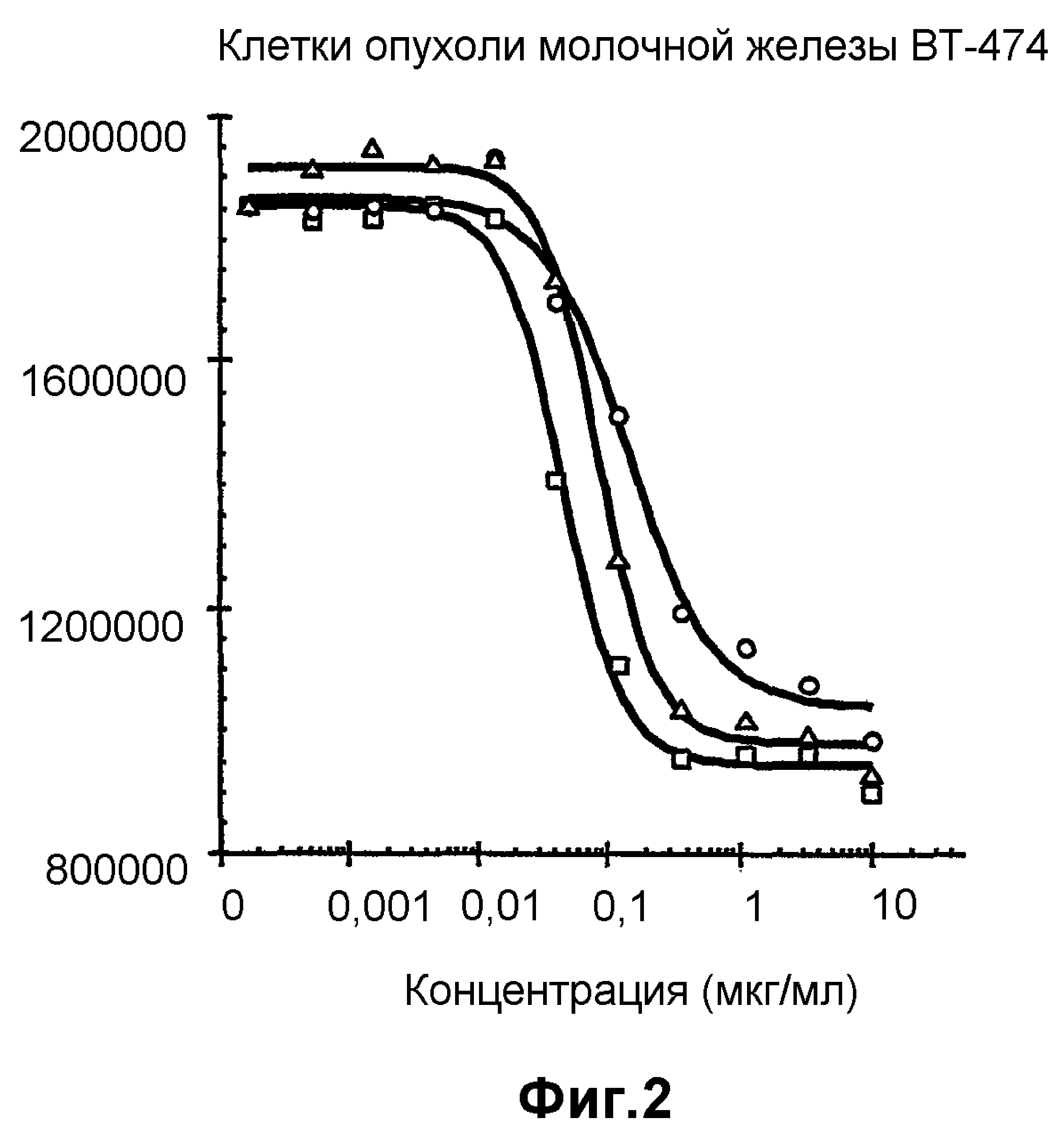
На фиг.2 показан анализ пролиферации клеток in vitro на клетках BT-474, обработанных конъюгатами антитело-лекарственное средство: -□-трастузумаб-SPP-DM1, -Δ-трастузумаб-SPDP-DM1 и -o-трастузумаб-SMCC-DM1.
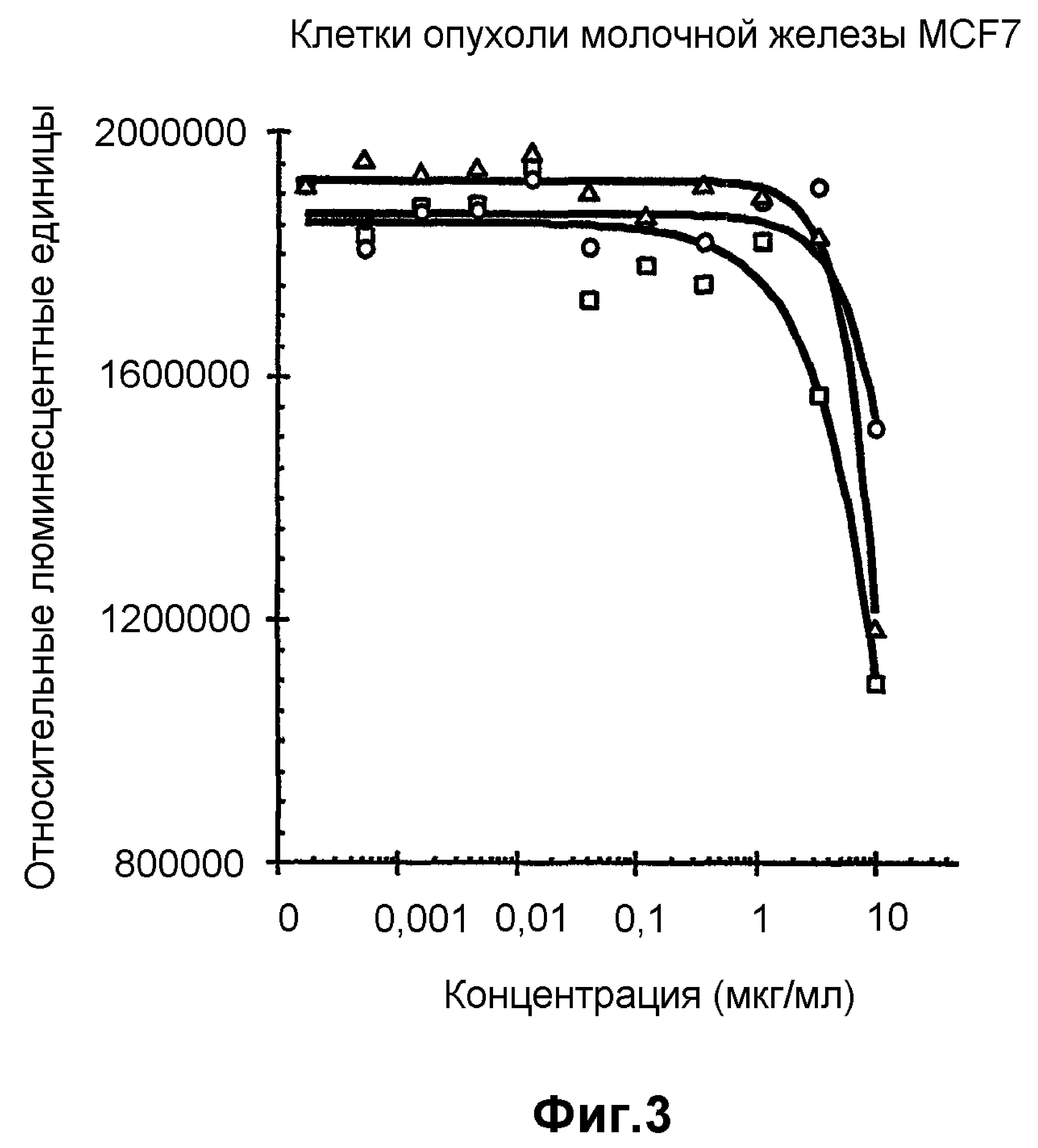
На фиг.3 показан анализ пролиферации клеток in vitro на клетках MCF7, обработанных конъюгатами антитело-лекарственное средство: -□-трастузумаб-SPP-DM1, -Δ-трастузумаб-SPDP-DM1 и -o-трастузумаб-SMCC-DM1.
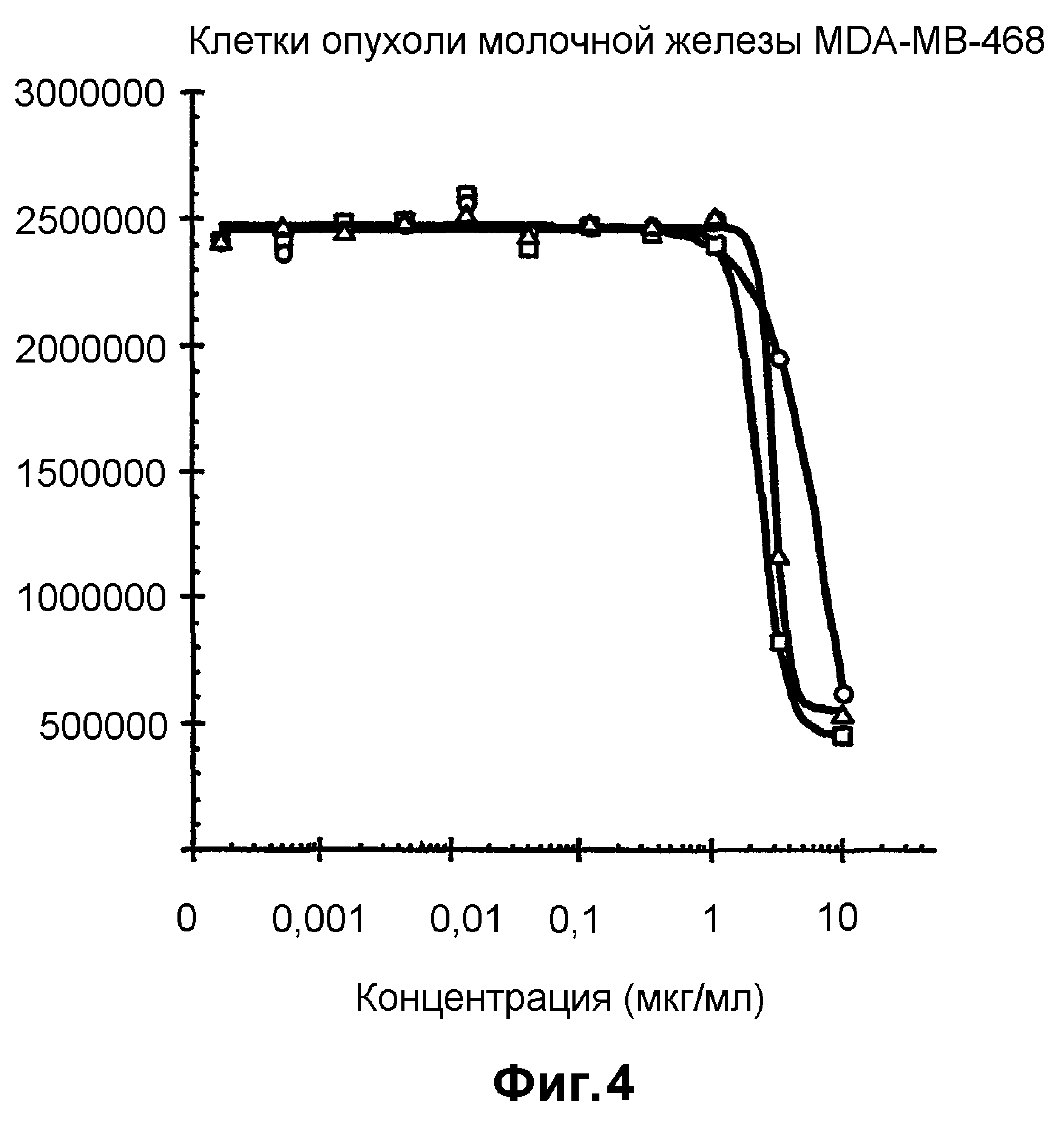
На фиг.4 показан анализ пролиферации клеток in vitro на клетках MDA-MB-468, обработанных конъюгатами антитело-лекарственное средство: -□-трастузумаб-SPP-DM1, -Δ-трастузумаб-SPDP-DM1 и -o-трастузумаб-SMCC-DM1.
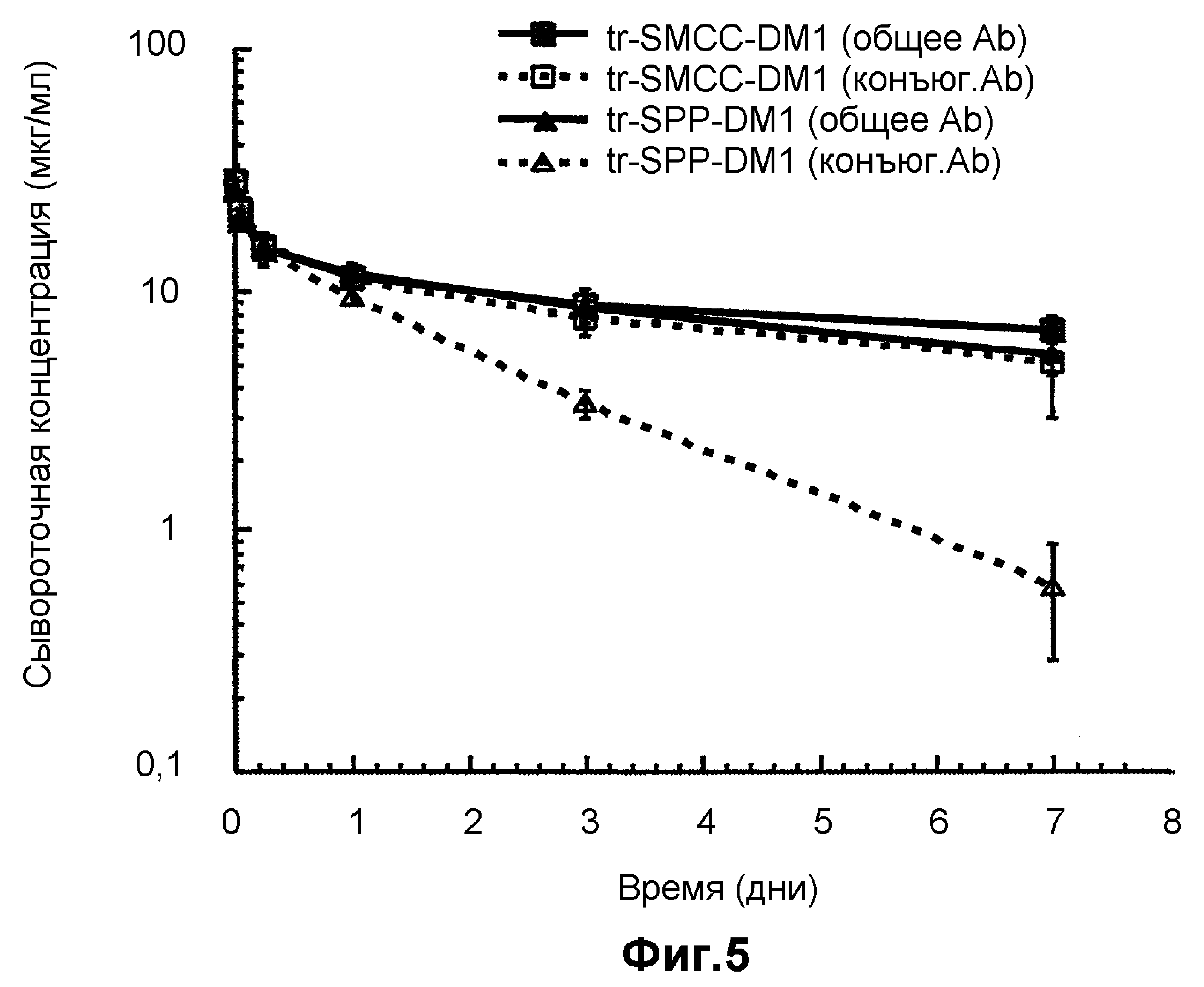
На фиг.5 показан сывороточный клиренс трастузумаба-SMCC-DM1 по сравнению с трастузумабом-SPP-DM1 у «голых» мышей с врожденным отсутствием NK-клеток, путем измерения сывороточной концентрации конъюгата и общей сывороточной концентрации антител в шести временных точках (5 минут, 1 час, 6 часов, 24 часа, 72, 168 часов после введения дозы) в течение 7 суток.
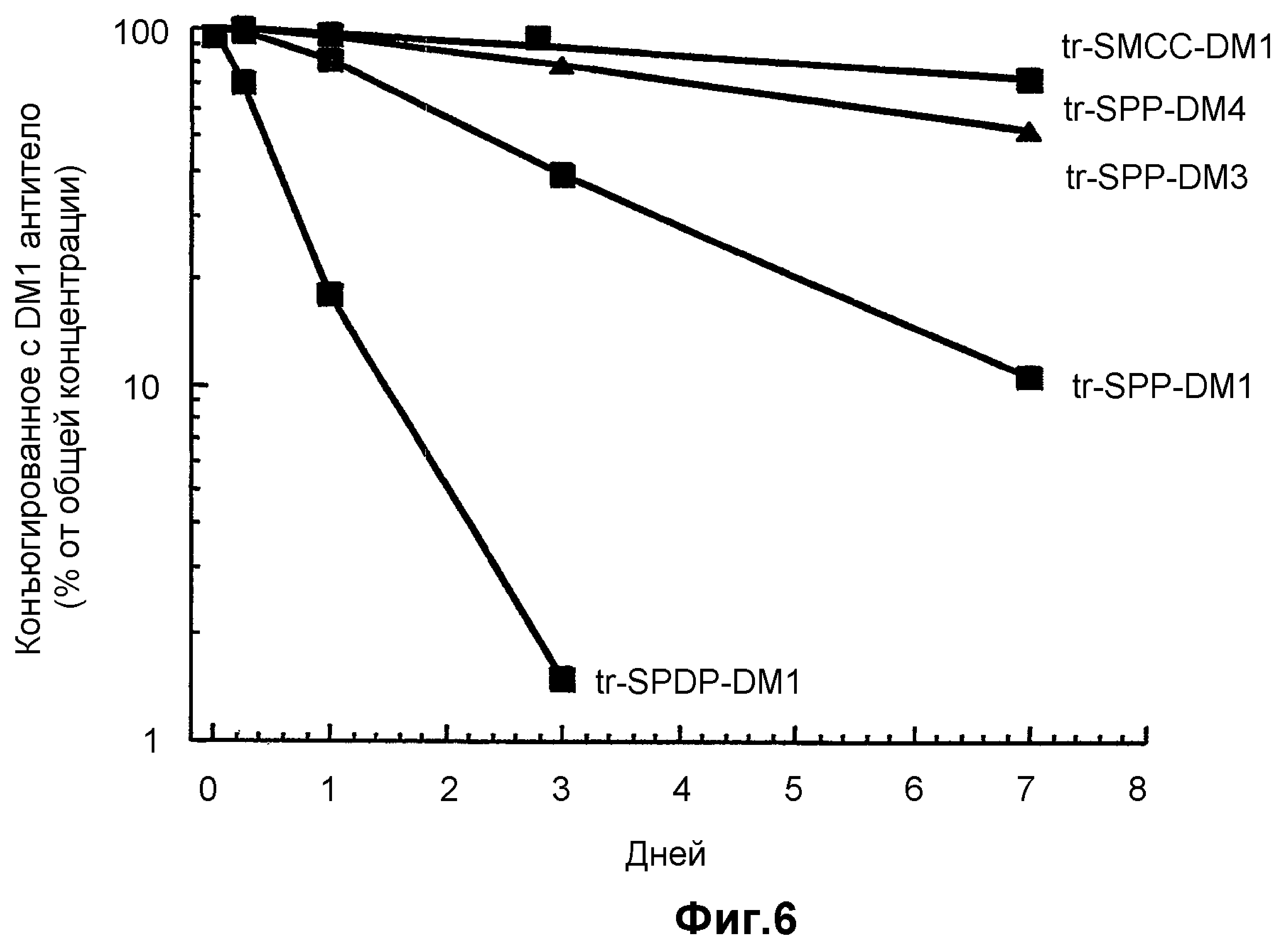
На фиг.6 показана стабильность конъюгатов: трастузумаб-SPDP-DM1, трастузумаб-SPP-DM1, трастузумаб-SPP-DM3, трастузумаб-SPP-DM4 и трастузумаб-SMCC-DM1, в динамике по времени у «голых» мышей без опухолей путем измерения сывороточной концентрации в шести временных точках (5 минут, 1 час, 6 часов, 24 часа, 72, 168 часов после введения дозы) в течение 7 суток.
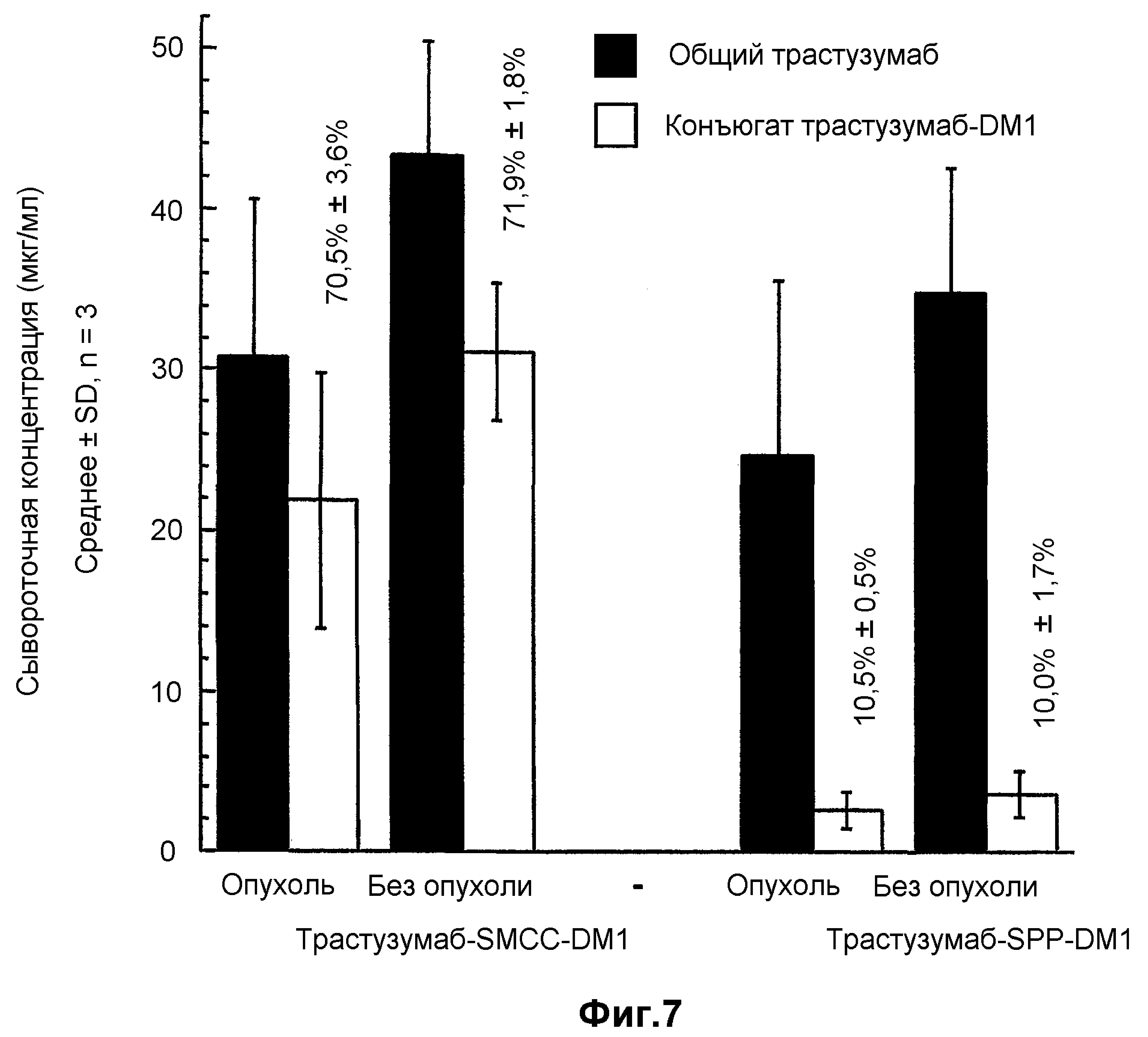
На фиг.7 показаны размеры сывороточных концентраций общего трастузумаба/трастузумаба-SMCC-DM1 и общего трастузумаба/трастузумаба-SPP-DM1 у мышей с опухолями и без через 7 суток после введения.
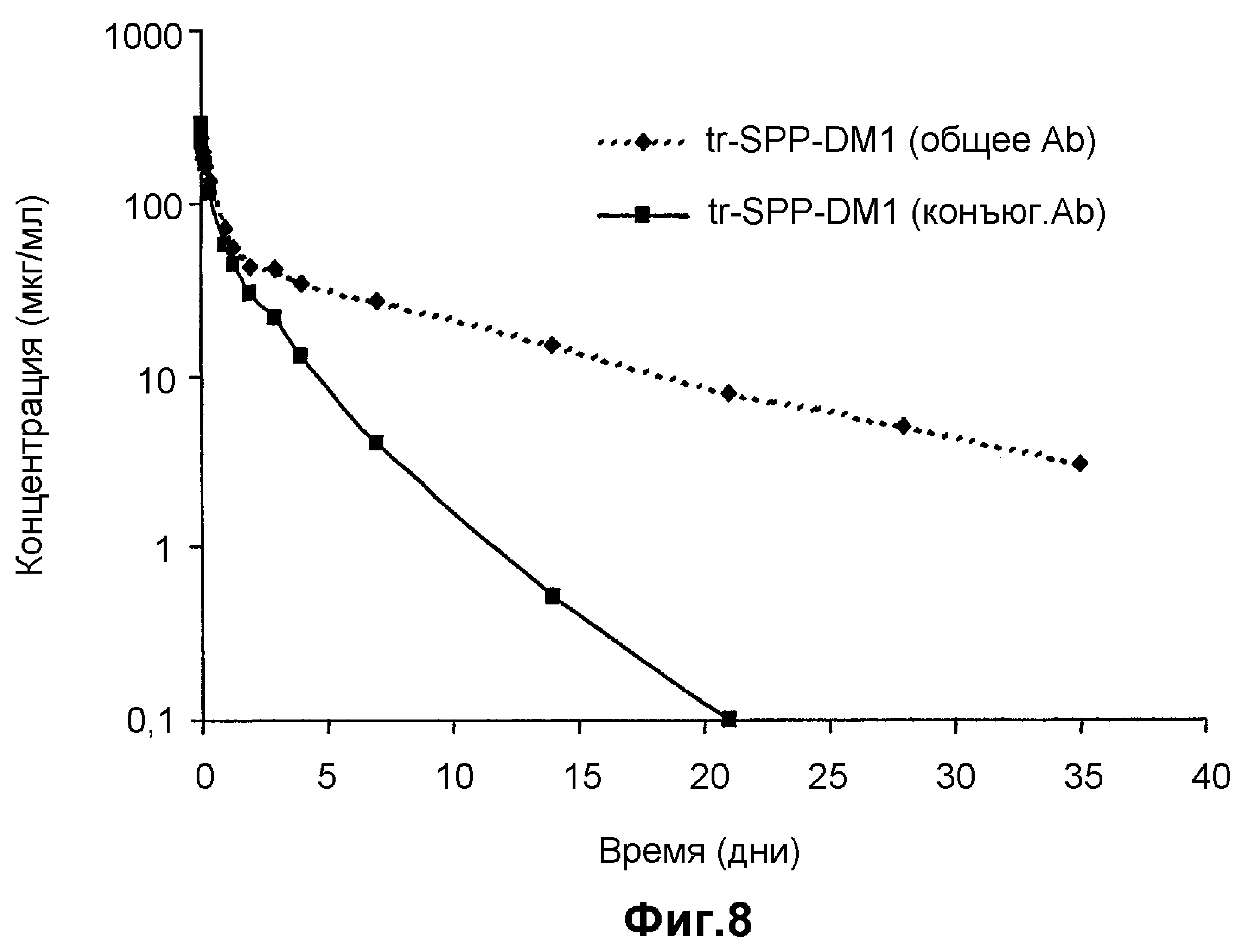
На фиг.8 представлен анализ клиренса плазматической концентрации после введения 10 мг/кг трастузумаба-SPP-DM1 4 особям крыс. Измеряли общую концентрацию антител и концентрацию трастузумаба-SPP-DM1 (tr=трастузумаб).
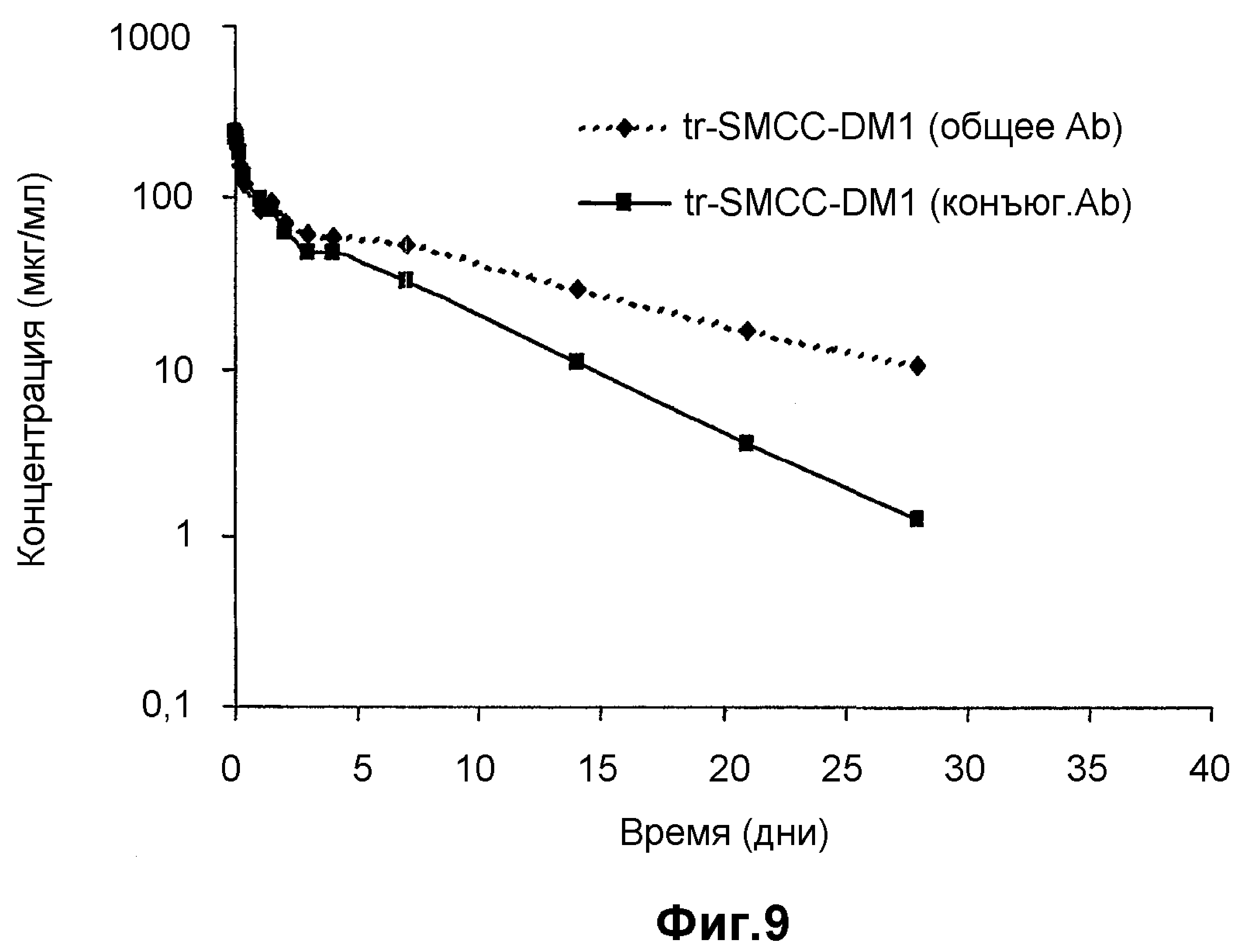
На фиг.9 представлен анализ клиренса плазматической концентрации после введения 10 мг/кг трастузумаба-SMCC-DM1 4 особям крыс. Измеряли общую концентрацию антител и концентрацию трастузумаба-SMCC-DM1.
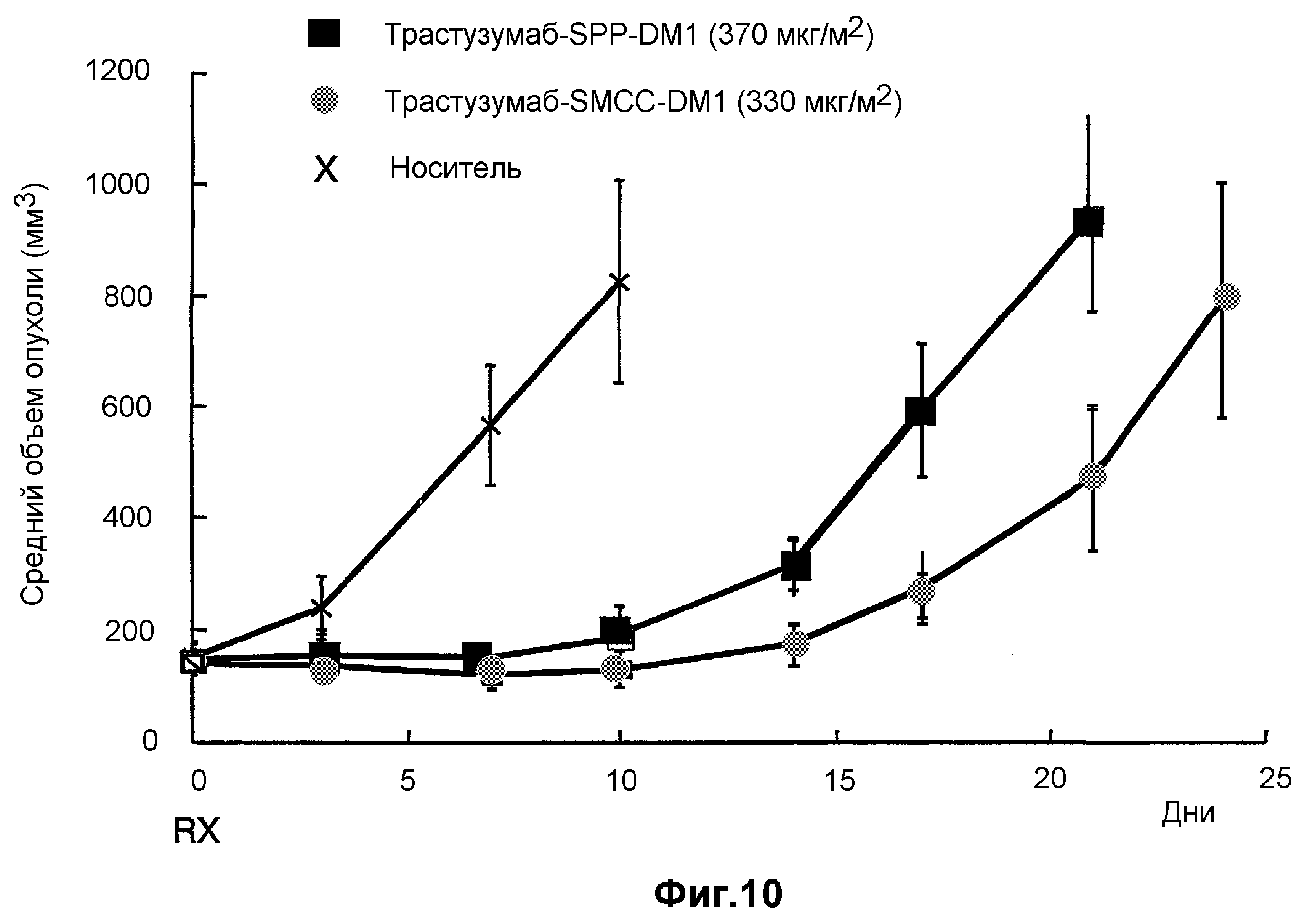
На фиг.10 показано среднее изменение размера опухоли в динамике по времени у мышей при введении дозы: носителя (PBS, pH 6,5), трастузумаба-SPP-DM1 (370 мкг DM1/м2) и трастузумаба-SMCC-DM1 (330 мкг DM1/м2), где доза является дозой вводимого DM1.
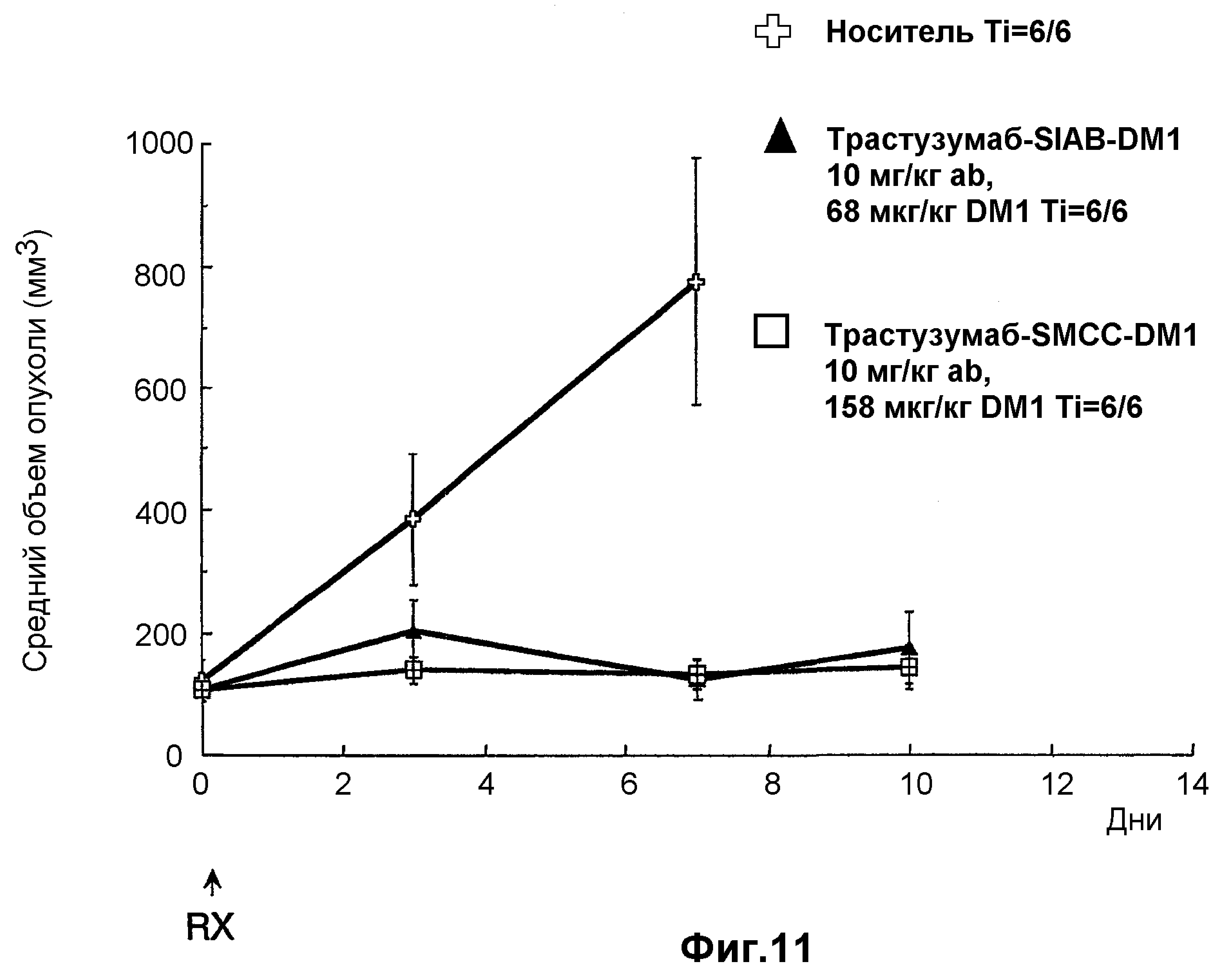
На фиг.11 показано среднее изменение размера опухоли в динамике по времени у бестимусных «голых» мышей с аллотрансплантатами опухоли Fo5 при введении на 0 день дозы: носителя (PBS, pH 6,5), 10 мг/кг трастузумаба-SIAB-DM1 (3,4 DM1/Ab; 168 мкг DM1/кг) и 10 мг/кг трастузумаба-SMCC-DM1 (3,2 DM1/Ab; 158 мкг DM1/кг), где дозой является доза вводимого конъюгата антитело-лекарственное средство.
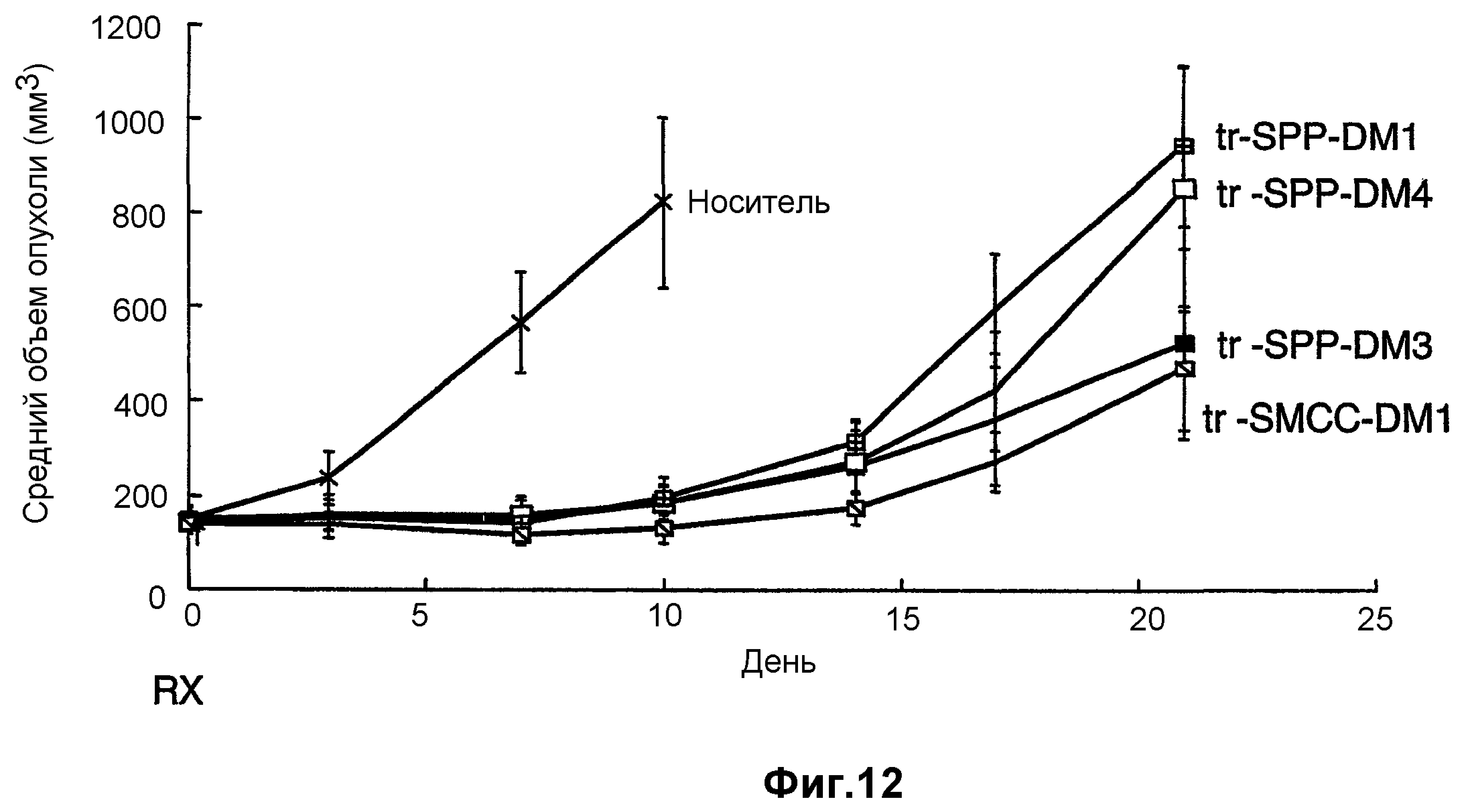
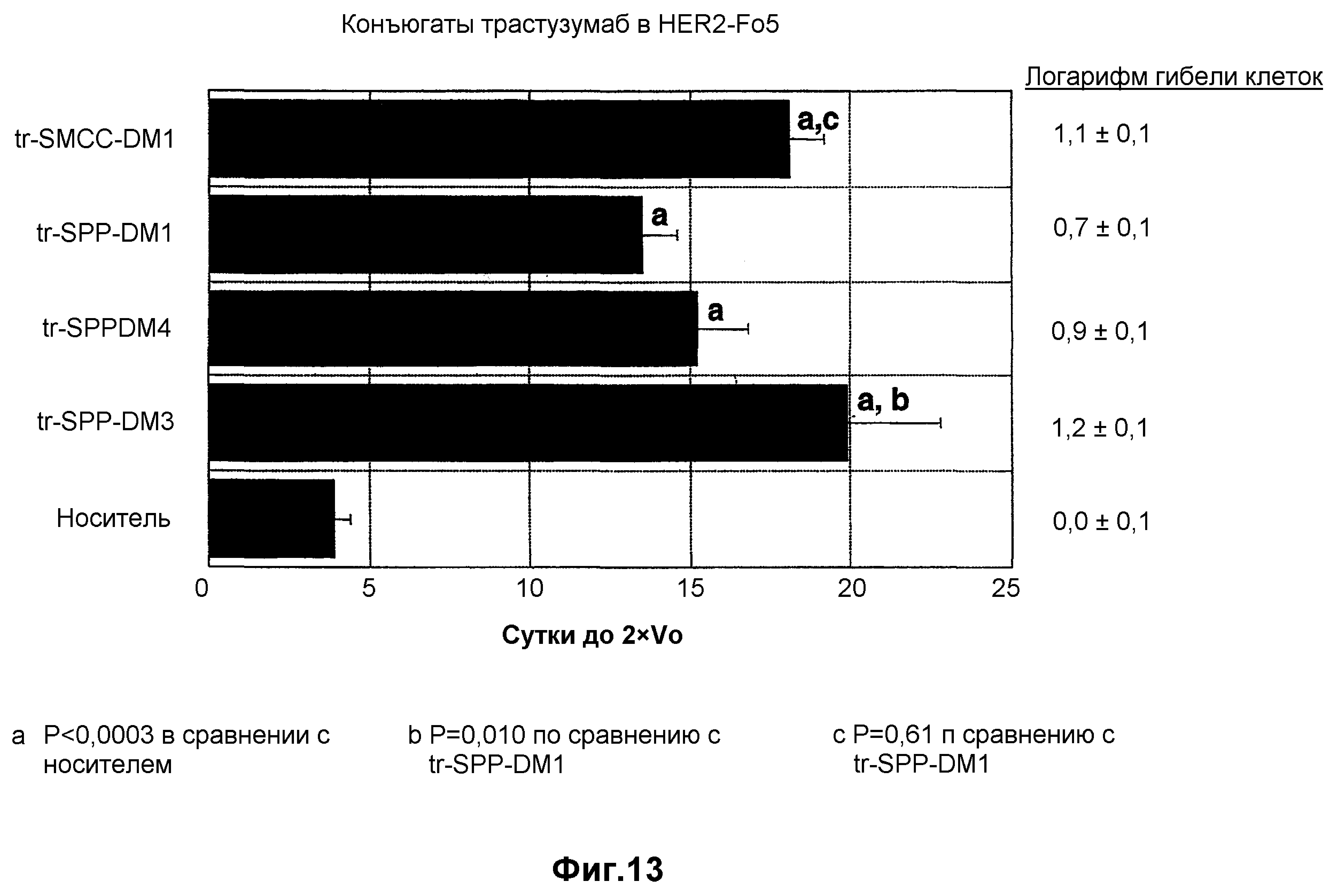
На фиг.12 показано среднее изменение размера опухоли в динамике по времени у «голых» мышей с врожденным отсутствием NK-клеток MMTV-Her2 Fo 5 (по семь в каждой группе, все с опухолями, Ti=7) при однократной инъекции носителя (PBS, pH 6,5), 10 мг/кг трастузумаба-SPP-DM1, 10 мг/кг трастузумаба-SPP-DM4, 10 мг/кг трастузумаба-SPP-DM3 и 10 мг/кг трастузумаба-SMCC-DM1.
На фиг.13 показано время до удвоения объема опухоли и log-анализ клеточной гибели для носителя (PBS, pH 6,5), трастузумаба-SPP-DM1, трастузумаба-SPP-DM4, трастузумаба-SPP-DM3 и трастузумаба-SMCC-DM1 в опухолях HER2-Fo5.
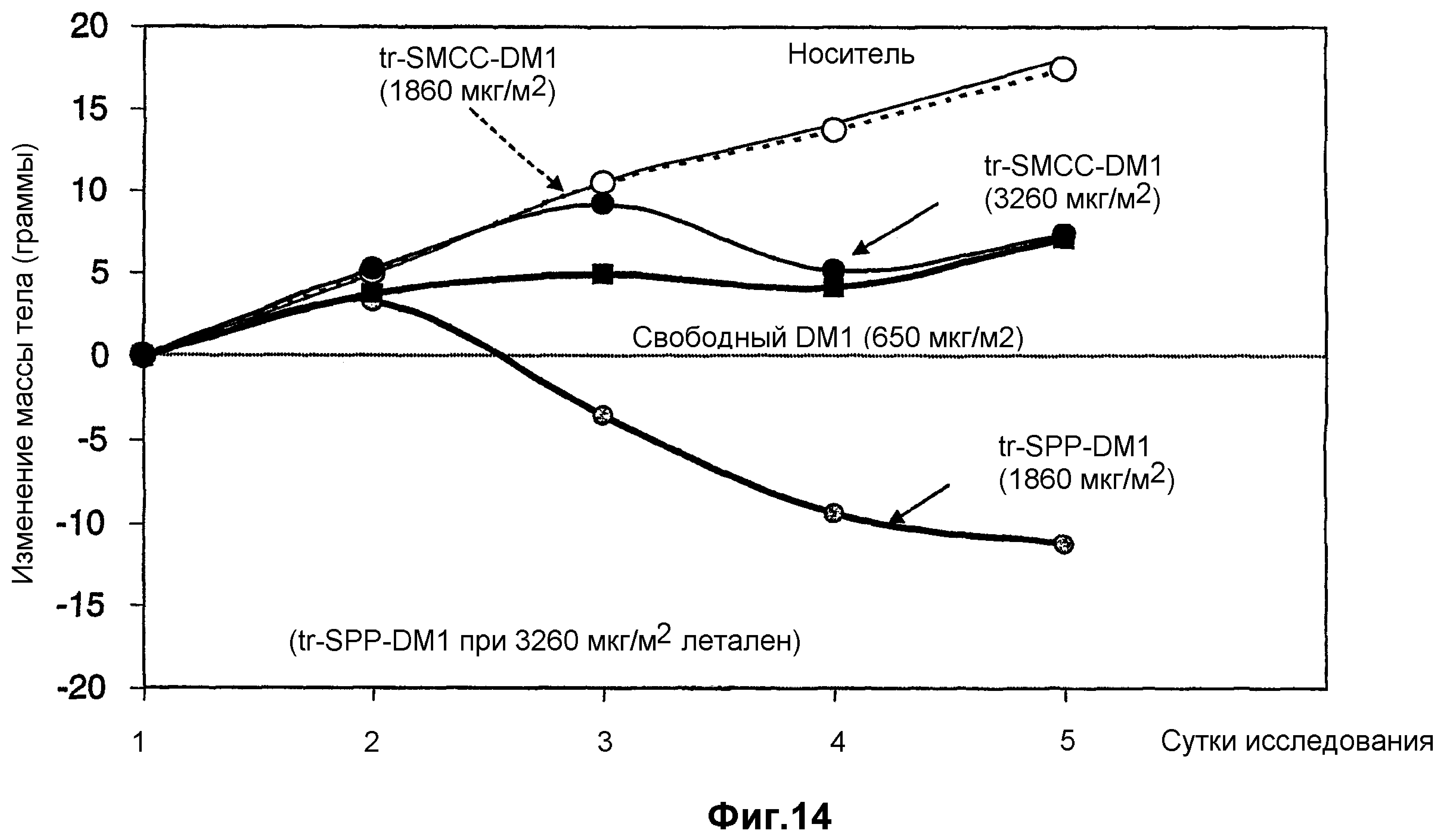
На фиг.14 показано изменение массы тела крыс в динамике по времени при введении дозы: носителя (10 мМ сукцинат натрия, 100 мг/мл сахароза, 0,1% Tween 20, pH 5,0), трастузумаба-SPP-DM1 (1860 мкг DM1/м2), трастузумаба-SMCC-DM1 (1860 мкг DM1/м2), трастузумаба-SMCC-DM1 (3260 мкг DM1/м2) и свободного DM1 (650 мкг/м2).
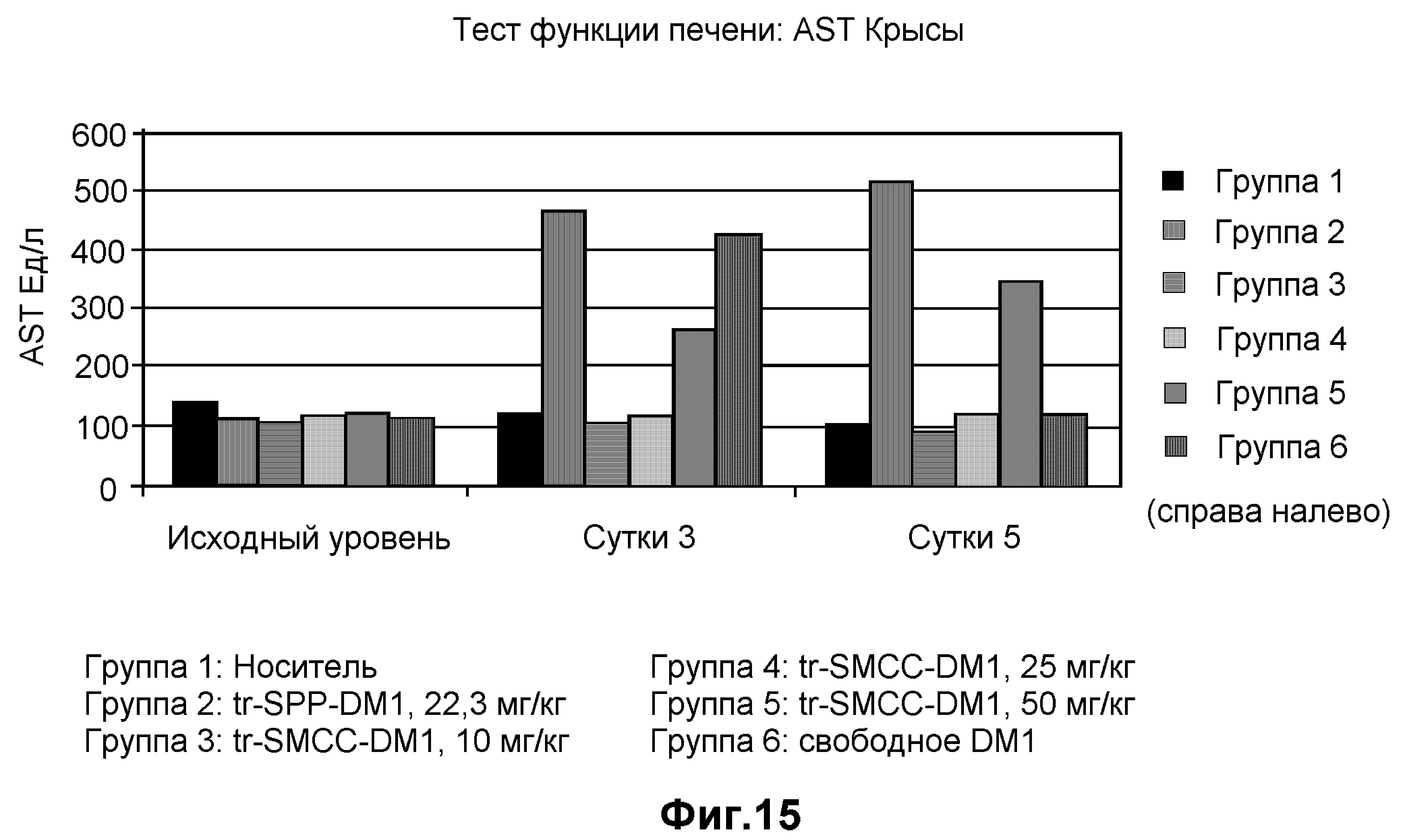
На фиг.15 показан функциональный анализ печени в единицах AST на литр в динамике по времени на модели крысы при введении дозы: носителя (10 мМ сукцинат натрия, 100 мг/мл сахароза, 0,1% Tween 20, pH 5,0), трастузумаба-SPP-DM1 (22,3 мг/кг), трастузумаба-SMCC-DM1 (10 мг/кг), трастузумаба-SMCC-DM1 (25 мг/кг), трастузумаба-SMCC-DM1 (50 мг/кг) и свободного DM1.
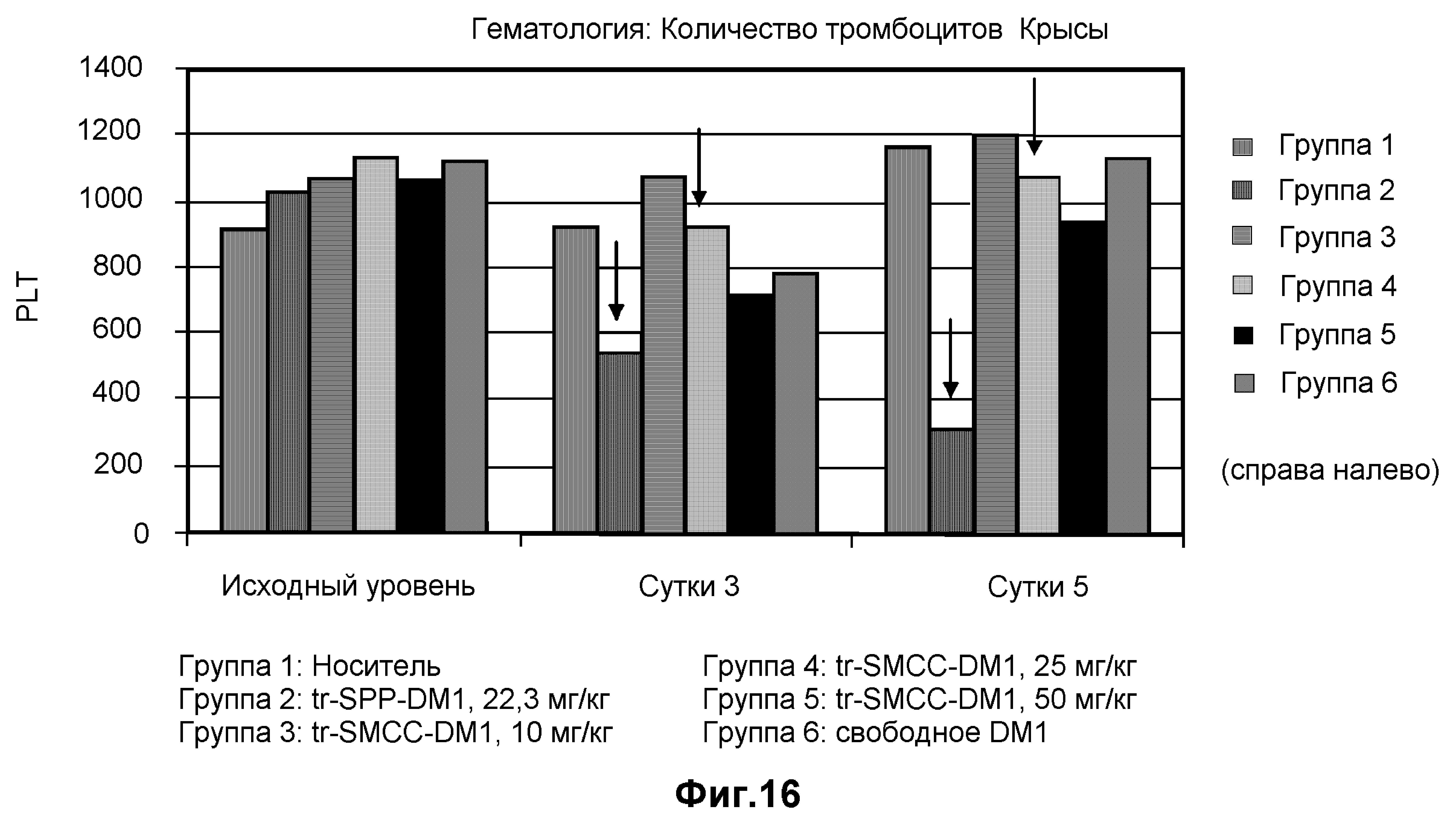
На фиг.16 показаны показатели безопасности в единицах PLT в клетках на литр в динамике по времени на модели крысы с введением дозы: носителя (10 мМ сукцинат натрия, 100 мг/мл сахароза, 0,1% Tween 20, pH 5,0), трастузумаба-SPP-DM1 (22,3 мг/кг), трастузумаба-SMCC-DM1 (10 мг/кг), трастузумаба-SMCC-DM1 (25 мг/кг), трастузумаба-SMCC-DM1 (50 мг/кг) и свободного DM1.
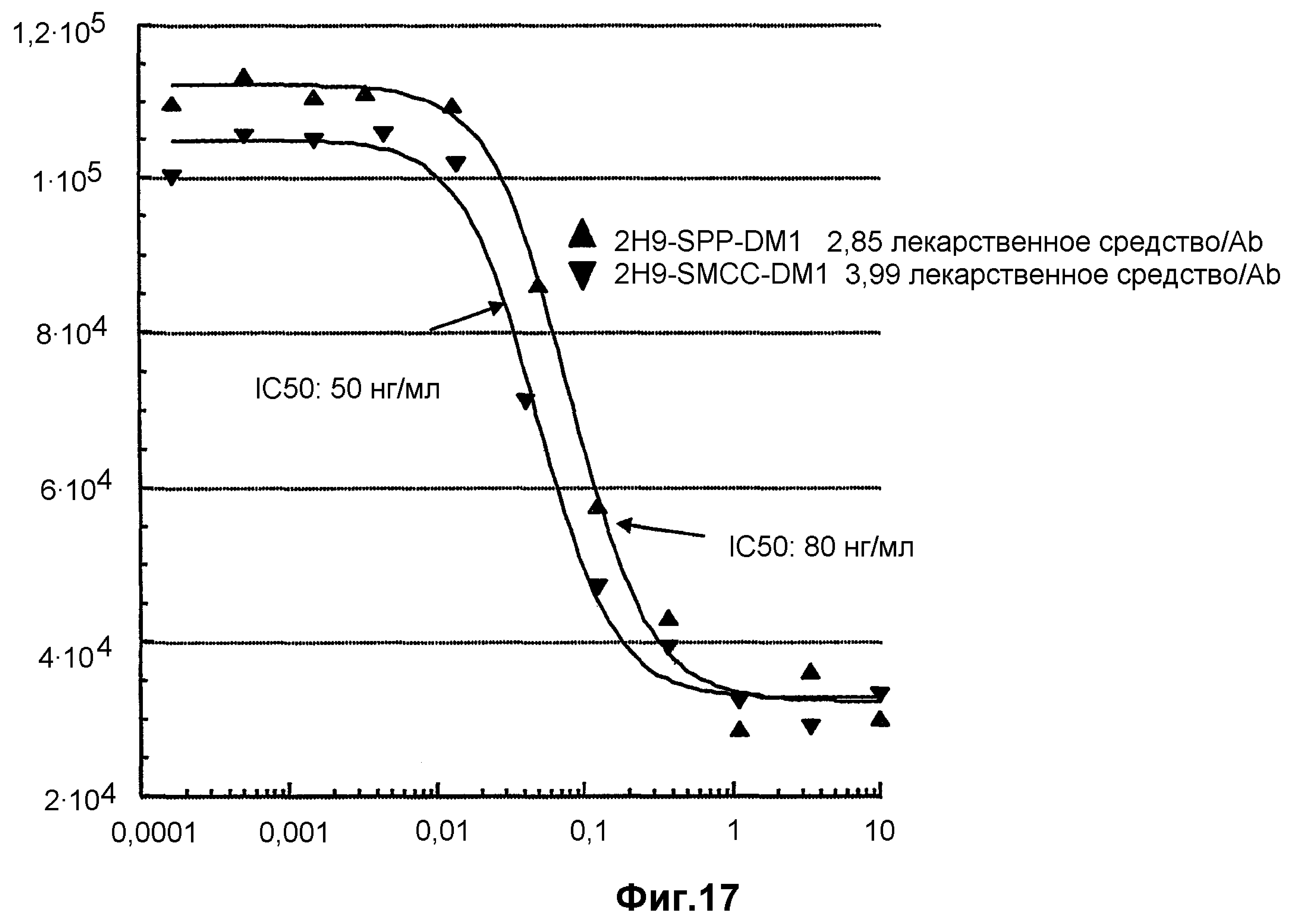
На фиг.17 показан анализ пролиферации клеток in vitro на клетках HT1080EphB2 (C8), обработанных конъюгатами антитело-лекарственное средство: -▲- antiEphB2R 2H9-SPP-DM1 и -▼- antiEphB2R 2H9-SMCC-DM1.
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Теперь будет сделано подробное указание на конкретные варианты осуществления изобретения, примеры которых проиллюстрированы сопровождающимися структурами и формулами. Хотя изобретение будет описано в отношении перечисленных вариантов осуществления, понятно, что эти варианты осуществления не ограничивают настоящее изобретение. Напротив, изобретение включает все альтернативы, модификации и эквиваленты, которые можно включить в объем настоящего изобретения, определенный формулой изобретения.
Специалисту в данной области известно множество способов и веществ, сходных или эквивалентных описанным в настоящем документе способам и веществам, которые можно использовать в практике настоящего изобретения. Настоящее изобретение абсолютно не ограничено описанными способами и веществами.
Если не определено иначе, технические и научные термины, используемые в данном документе, имеют те же значения, известные специалисту в области, к которой принадлежит настоящее изобретение, и согласуются с Singleton et al., (1994) Dictionary of Microbiology and Molecular Biology, 2nd Ed., J. Wiley & Sons, New York, NY и Janeway, C., Travers, P., Wal.port, M., Shlomchik (2001) Immuno Biology, 5th Ed., Garland Publishing, New York.
ОПРЕДЕЛЕНИЯ
Если не указано иначе, следующие термины и фразы, используемые в данном документе, имеют следующие значения:
Если в данном документе используют товарные знаки, то заявители независимо охватывают композицию товарного знака, основное лекарственное средство и активный фармацевтический(-ие) ингредиент(ы) продукта товарного знака.
Термин «антитело» в данном документе используют в широком смысле, и, конкретно, он охватывает моноклональные антитела, поликлональные антитела, димеры, мультимеры, полиспецифичные антитела (например, биспецифические антитела) и фрагменты антител, при условии, что они проявляют желательную биологическую активность (Miller et al. (2003) Jour. of Immunology 170:4854-4861). Антитела могут быть мышиными, человеческими, гуманизированными, химерными или полученными из других видов. Антитело представляет собой белок, вырабатываемый иммунной системой, способный распознать и связывать специфический антиген (Janeway, C., Travers, P., Walport, M., Shlomchik (2001) Immuno Biology, 5th Ed., Garland Publishing, New York). Как правило, мишеневый антиген несет множество сайтов связывания, также называемых эпитопами, распознаваемых CDR различных антител. Каждое антитело, специфически связывающееся с различным эпитопом, отличается своей структурой. Таким образом, у одного антигена может быть более одного соответствующего антитела. Антитело включает полноразмерную молекулу иммуноглобулина или иммунологически активную часть полноразмерной молекулы иммуноглобулина, то есть молекулу, которая содержит антигенсвязывающий сайт, иммуноспецифически связывающийся с мишеневым антигеном или его частью, где такие мишени включают в качестве неограничивающих примеров раковые клетки или клетки, продуцирующие аутоиммунные антитела, ассоциированные с аутоиммунным заболеванием. Описанный в данном документе иммуноглобулин может быть любого типа (например, IgG, IgE, IgM, IgD и IgA), класса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подкласса молекул иммуноглобулинов. Иммуноглобулины можно получать из любых видов. Однако в одном из аспектов иммуноглобулины являются человеческого, мышиного или кроличьего происхождения.
«Фрагменты антител» содержат часть полноразмерного антитела, как правило, его антигенсвязывающую или вариабельную область. Примеры фрагментов антител включают фрагменты Fab, Fab', F(ab')2, и Fv; димерные антитела; линейные антитела; фрагменты, получаемые с помощью экспрессионной библиотеки Fab, антиидиотипические (анти-Id) антитела, CDR (определяющая комплементарность область) и фрагменты, связывающие эпитопы, любого из указанного выше, которые специфически связываются с антигенами раковых клеток, вирусными антигенами или антигенами микроорганизмов, молекулы одноцепочечных антител; полиспецифические антитела, образуемые из фрагментов антител.
Как используется в данном документе термин «моноклональное антитело» относится к антителу, полученному из популяции, по существу, гомогенных антител, то есть к отдельным антителам, составляющим популяцию, которые идентичны, за исключением возможных природных мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела высокоспецифичны и направлены к одному антигенному сайту. Кроме того, в отличие от препаратов поликлональных антител, включающих в себя различные антитела, направленные к различным детерминантам (эпитопам), каждое моноклональное антитело направлено к одной детерминанте антигена. Кроме их специфичности, преимуществом моноклональных антител является возможность их синтеза без загрязнения другими антителами. Определение «моноклональное» означает свойство антитела как полученного, по существу, из гомогенной популяции антител и не предназначено как указание на конкретный способ получения антитела. Например, моноклональные антитела для применения по настоящему изобретению можно получить способом гибридом, впервые описанном Kohler et al. (1975) Nature 256:495, или их можно получить способами рекомбинантных ДНК (см. патент США № 4816567). Моноклональные антитела также можно выделять из фаговых библиотек антител, используя способы, описанные, например, Clackson et al. (1991) Nature, 352:624-628; Marks et al. (1991) J. Mol. Biol., 222:581-597.
В частности, моноклональные антитела в данном документе включают «химерные» антитела, у которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям антител, полученных из конкретного вида или принадлежащих конкретному классу или подклассу антител, тогда как остаток цепи(-ей) идентичен или гомологичен соответствующим последовательностям антител, полученных из другого вида или принадлежащих другому классу или подклассу антител, а также фрагменты таких антител, если они обладают желаемой биологической активностью (патент США № 4816567; и Morrison et al. (1984) Proc. Natl. Acad. Sci. USA, 81:6851-6855). В данном документе интересующие химерные антитела включают «приматизированные» антитела, содержащие антигенсвязывающие последовательности вариабельного домена, полученного из примата, не являющегося человеком (например, старосветская мартышка или человекообразная обезьяна), и последовательности константной области человека.
В данном документе «интактное антитело» представляет собой антитело, содержащее домены VL и VH, а также константный домен легкой цепи (CL) и константные домены тяжелых цепей, CH1, CH2 и CH3. Константные домены могут быть константными доменами с природной последовательностью (например, константные домены человека с природной последовательностью) или вариантами их аминокислотной последовательности. Интактное антитело может обладать одной или несколькими «эффекторными функциями», которые относятся к видам биологической активности, присущей Fc-области (Fc-область с природной последовательностью или вариант аминокислотной последовательности Fc-области) антитела. Примеры эффекторных функций антител включают связывание C1q; комплемент-зависимую цитотоксичность; связывание Fc-рецептора; антителозависимую клеточную цитотоксичность (ADCC); фагоцитоз и отрицательную регуляцию рецепторов клеточной поверхности, таких как рецептор B-клеток и BCR.
В зависимости от аминокислотной последовательности константного домена своих тяжелых цепей интактные антитела можно отнести к различным «классам». Существует пять основных классов интактных антител: IgA, IgD, IgE, IgG и IgM, а некоторые из них можно дополнительно разделить на «подклассы» (изотипы), например IgG1, IgG2, IgG3, IgG4, IgA и IgA2. Константные домены тяжелых цепей, которые соответствуют различным классам антител, обозначают α, δ, ε, γ и μ соответственно. Структура субъединиц и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны.
«Рецептор ErbB» представляет собой рецепторный белок тирозинкиназу, принадлежащий семейству рецепторов ErbB, являющихся важными медиаторами клеточного роста, дифференцировки и выживаемости. Семейство рецепторов ErbB включает четыре отличных друг от друга представителя, включая рецептор эпидермального фактора роста (EGFR, ErbB1, HER1), HER2 (ErbB2 или p185neu), HER3 (ErbB3) и HER4 (ErbB4 или tyro2). Группа антител против ErbB2 охарактеризована с помощью линии опухолевых клеток рака молочной железы человека SKBR3 (Hudziak et al. (1989) Mol. Cell. Biol. 9(3): 1165-1172). Максимальное ингибирование наблюдали у антитела, обозначенного как 4D5, которое ингибировало 56% клеточной пролиферации. Другие антитела в группе снижали клеточную пролиферацию в этом анализе в меньшей степени. Кроме того, было обнаружено, что антитело 4D5 повышает чувствительность линии опухолевых клеток рака молочной железы, сверхэкспрессирующих ErbB2, к цитотоксическим эффектам TNF-α (патент США № 5677171). Антитела против ErbB2, описанные Hudziak et al., дополнительно охарактеризованы Fendly et al. (1990) Cancer Research 50:1550-1558; Kotts et al. (1990) In Vitro 26(3):59A; Sarup et al. (1991) Growth Regulation 1:72-82; Shepard et al. (1991) J. Clin. Immunol. 11(3):117-127; Kumar et al. (1991) Mol. Cell. Biol. 11(2):979-986; Lewis et al. (1993) Cancer Immunol. Immunother. 37:255-263; Pietras et al. (1994) Oncogene 9:1829-1838; Vitetta et al. (1994) Cancer Research 54:5301-5309; Sliwkowski et al. (1994) J. Biol. Chem. 269(20):14661-14665; Scott et al. (1991) J. Biol. Chem. 266:14300-5; D'souza et al. Proc. Natl. Acad. Sci. (1994) 91:7202-7206; Lewis et al. (1996) Cancer Research 56:1457-1465; и Schaefer et al. (1997) Oncogene 15:1385-1394.
Другие антитела против ErbB2 с различными свойствами описаны Franklin et al. (2004) Cancer Cell 5:317-328; Tagliabue et al. (1991) Int. J. Cancer 47:933-937; McKenzie et al. (1989) Oncogene 4:543-548; Maier et al. (1991) Cancer Res. 51:5361-5369; Bacus et al. (1990) Molecular Carcinogenesis 3:350-362; Stancovski et al. (1991) PNAS (USA) 88:8691-8695; Bacus et al. (1992) Cancer Research 52:2580-2589; Xu et al. (1993) Int. J. Cancer 53:401-408; WO 94/00136; Kasprzyk et al. (1992) Cancer Research 52:2771-2776; Hancock et al. (1991) Cancer Res. 51:4575-4580; Shawver et al. (1994) Cancer Res. 54:1367-1373; Arteaga et al. (1994) Cancer Res. 54:3758-3765; Harwerth et al. (1992) J. Biol. Chem. 267:15160-15167; патент США № 5783186; и Klapper et al. (1997) Oncogene 14:2099-2109.
Скрининг идентичности последовательностей привел к идентификации двух других представителей семейства рецепторов ErbB; ErbB3 (патент США № 5183884; патент США № 5480968; Kraus et al. (1989) PNAS (USA) 86:9193-9197) и ErbB4 (EP 599274; Plowman et al. (1993) Proc. Natl. Acad. Sci. USA, 90:1746-1750; и Plowman et al. (1993) Nature 366:473-475). Оба этих рецептора проявляли повышенную экспрессию по меньшей мере в некоторых линиях опухолевых клеток рака молочной железы.
Как правило, рецептор ErbB содержит внеклеточный домен, который может связываться с лигандом ErbB; липофильный трансмембранный домен; консервативный внутриклеточный тирозинкиназный домен и C-концевой сигнальный домен, несущий несколько тирозиновых остатков, которые могут быть фосфорилированы. Рецептор ErbB может представлять собой рецептор ErbB с «природной последовательностью» или его «вариант аминокислотной последовательности». Рецептор ErbB может представлять собой природную последовательность рецептора ErbB человека. Таким образом, «представителем семейства рецепторов ErbB» является EGFR (ErbB1), ErbB2, ErbB3, ErbB4 или любой другой рецептор ErbB, известный в настоящее время или который будет идентифицирован в будущем.
Термины «ErbB1», «рецептор эпидермального фактора роста», «EGFR» и «HER1» в данном документе применяются взаимозаменяемо и относятся к EGFR, как описано, например, у Carpenter et al. (1987) Ann. Rev. BioChem. 56:881-914, включая природные мутантные формы (например, делеционный мутант EGFR, как у Humphrey et al., (1990) PNAS (USA), 87:4207-4211). Термин erbB1 относится к гену, кодирующему белковый продукт EGFR. Антитела против HER1 описаны, например, Murthy et al. (1987) Arch. BioChem. Biophys., 252:549-560 и в WO 95/25167.
Термин «ERRP», «белок рецептора EGF», «EGFR белок» и «белок рецептора эпидермального фактора роста белок» в данном документе используются взаимозаменяемо и относятся к ERRP, как описано, например, в патенте США № 6399743 и патенте США № 2003/0096373.
Выражения «ErbB2» и «HER2» в данном документе используются взаимозаменяемо и относятся к белку HER2 человека, описанному, например, Semba et al. (1985) PNAS (USA), 82:6497-6501 и Yamamoto et al. (1986) Nature, 319:230-234 (инвентарный номер Genbank X03363). Термин «erbB2» относится к гену, кодирующему ErbB2 человека, а «neu» относится к гену, кодирующему p185neu крысы.
«ErbB3» и «HER3» относятся к рецепторному полипептиду, описанному, например, в патенте США № 5183884; патенте США № 5480968; Kraus et al. (1989) PNAS (USA) 86:9193-9197. Антитела против ErbB3 известны в данной области (патент США № 5183884; патент США № 5480968; WO 97/35885).
Термины «ErbB4» и «HER4» в данном документе относятся к рецепторному полипептиду, описанному, например, в Европейской патентной заявке № 599274; Plowman et al., Proc. Natl. Acad. Sci. USA, 90:1746-1750 (1993) и Plowman et al., Nature, 366:473-475 (1993), включая их изоформы, например, описанные в WO 99/19488. Антитела против HER4 описаны, например, в WO 02/18444.
Антитела против рецепторов ErbB коммерчески доступны из ряда источников, в том числе, например, Santa Cruz Biotechnology, Inc., California, USA.
Под «лигандом ErbB» понимают белок, который связывается и/или активирует рецептор ErbB. Лиганд ErbB может представлять собой природную последовательность лиганда ErbB человека, такого как эпидермальный фактор роста (EGF) (Savage et al. (1972) J. Biol. Chem., 247:7612-7621); трансформирующий фактор роста альфа (TGF-α) (Marquardt et al. (1984) Science 223:1079-1082); амфирегулин, также известный как аутокринный фактор роста шванном или кератиноцитов (Shoyab et al. (1989) Science 243:1074-1076; Kimura et al. (1990) Nature 348:257-260; и Cook et al. (1991) Mol. Cell. Biol., 11:2547-2557); бетацеллюлин (Shing et al. (1993) Science 259:1604-1607 и Sasada et al. (1993) BioChem. Biophys. Res. Commun. 190:1173); гепаринсвязывающий эпидермальный фактор роста (HB-EGF) (Higashiyama et al. (1991) Science 251:936-939); эпирегулин (Toyoda et al. (1995) J. Biol. Chem. 270:7495-7500 и Komurasaki et al. (1997) Oncogene 15:2841-2848); херегулин (смотри ниже); нейрегулин-2 (NRG-2) (Carraway et al., Nature, 387:512-516 (1997)); нейрегулин-3 (NRG-3) (Zhang et al. (1997) Proc. Natl. Acad. Sci., 94:9562-9567); нейрегулин-4 (NRG-4) (Harari et al. (1999) Oncogene, 18:2681-89) или крипто (CR-1) (Kannan et al. (1997) J. Biol. Chem., 272(6):3330-3335). Лиганды ErbB, связывающие EGFR, включают EGF, TGF-α, амфирегулин, бетацеллюлин, HB-EGF и эпирегулин. Лиганды ErbB, связывающие ErbB3, включают херегулины. Лиганды ErbB, способные связывать ErbB4, включают бетацеллюлин, эпирегулин, HB-EGF, NRG-2, NRG-3, NRG-4 и херегулины. Лиганд ErbB также может быть синтетическим лигандом ErbB. Синтетический лиганд может быть специфичным к конкретному рецептору ErbB или может распознавать конкретные рецепторные комплексы ErbB. Пример синтетического лиганда представляет собой синтетический химерный бирегулин херегулин/EGF (см., например, Jones et al. (1999) FEBS Letters, 447:227-231, приведенный в данном документе в качестве ссылки).
«Херегулин» (HRG) относится к полипептидному продукту, кодируемому геном херегулина, как описано в патенте США № 5641869 или Marchionni et al. (1993) Nature 362:312-318. Примеры херегулинов включают херегулин-α, херегулин-β1, херегулин-β2 и херегулин-β3 (Holmes et al. (1992) Science 256:1205-1210 и патент США № 5641869); фактор дифференцировки neu (NDF) (Peles et al. (1992) Cell 69: 205-216); индуктор активности ацетилхолинового рецептора (ARIA) (Falls et al. (1993) Cell 72:801-815); глиальные факторы роста (GGF) (Marchionni et al. (1993) Nature, 362:312-318); фактор, полученный из чувствительных и двигательных нейронов (SMDF) (Ho et al. (1995) J. Biol. Chem. 270:14523-14532); γ-херегулин (Schaefer et al. (1997) Oncogene, 15:1385-1394). Термин включает биологически активные фрагменты и/или варианты аминокислотной последовательности природной последовательности полипептида HRG, такие как фрагмент их EGF-подобный домена (например, HRGβ1177-244).
«Гетероолигомер ErbB» представляет собой нековалентно связанный олигомер, содержащий по меньшей мере два различных рецептора ErbB. «Димер ErbB» представляет собой нековалентно связанный олигомер, содержащий два различных рецептора ErbB. Такие комплексы могут образовываться при воздействии на клетку, экспрессирующую два или более рецепторов ErbB, лиганда ErbB. Олигомеры ErbB, такие как димеры ErbB, можно выделять с помощью иммунопреципитации и анализировать с помощью SDS-PAGE, например, как описано у Sliwkowski et al. (1994) J. Biol. Chem., 269(20):14661-14665. Примеры таких гетероолигомеров ErbB включают комплексы EGFR-ErbB2 (также называемый HER1/HER2), ErbB2-ErbB3 (HER2/HER3) и ErbB3-ErbB4 (HER3/HER4). Кроме того, гетероолигомер ErbB может содержать два или более рецепторов ErbB2 в сочетании с другим рецептором ErbB, таким как ErbB3, ErbB4 или EGFR (ErbB1). В гетеродимер могут быть включены другие белки, такие как субъединица цитокинового рецептора (например, gp130).
Под «активацией рецептора ErbB лигандом» понимают передачу сигнала (например, вызванную внутриклеточным киназным доменом рецептора ErbB с фосфорилированием тирозиновых остатков рецептора ErbB или полипептидного субстрата), опосредованную связыванием лиганда ErbB с гетероолигомером ErbB, содержащим представляющий интерес рецептор ErbB. Как правило, к ней относится связывание лиганда ErbB с гетероолигомером ErbB, который активирует киназный домен одного или нескольких рецепторов ErbB в гетероолигомере и тем самым приводит к фосфорилированию тирозиновых остатков на одном или нескольких рецепторах ErbB и/или фосфорилированию тирозиновых остатков дополнительного полипептидного субстрата(ов). Активацию рецептора ErbB можно определить количественно с помощью различных анализов фосфорилирования тирозина.
Полипептид с «природной последовательностью» представляет собой полипептид с той же аминокислотной последовательностью, что и полипептид (например, рецептор ErbB или лиганд ErbB), полученный из природных условий. Такие полипептиды с природной последовательностью можно выделять из природных условий или получать рекомбинантными или синтетическими способами. Таким образом, полипептид с природной последовательностью может обладать аминокислотной последовательностью природного полипептида человека, полипептида мыши или полипептида другого вида млекопитающих.
Термин «вариант аминокислотной последовательности» относится к полипептидам с аминокислотными последовательностями, отличающимися от полипептида с природной последовательностью. Обычно последовательности вариантов аминокислотных последовательностей по меньшей мере приблизительно на 70% идентичны по меньшей мере одному рецептор-связывающему домену природного лиганда ErbB, или по меньшей мере одному лиганд-связывающему домену природного рецептора ErbB, или по меньшей мере приблизительно на 80% или по меньшей мере приблизительно на 90% гомологичны таким рецептор-связывающим или лиганд-связывающим доменам. Варианты аминокислотных последовательностей в определенных положениях аминокислотной последовательности природной аминокислотной последовательности несут замены, делеции и/или вставки.
«Идентичность последовательности» определяют как процент остатков в варианте аминокислотной последовательности, которые идентичны после выравнивания последовательностей и внесения, если необходимо, пропусков для достижения максимального процента идентичности последовательности. Способы и компьютерные программы для выравнивания хорошо известны в данной области. Одной из таких компьютерных программ является «Align 2», созданная Genentech, Inc., которая зарегистрирована вместе с документацией для пользователя в United States Copyright Office, Washington, DC 20559, 10 декабря 1991 года.
«Антителозависимая клеточная цитотоксичность» и «ADCC» относится к клеточной реакции, при которой неспецифические цитотоксические клетки, экспрессирующие Fc-рецепторы (FcRs) (например, природные клетки-киллеры (NK), нейтрофилы и макрофаги), распознают связавшееся на клетке-мишени антитело и затем вызывают лизис клетки-мишени. Основные клетки, опосредующие ADCC, NK-клетки, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гематопоэтических клетках приведена в табл.3 на странице 464 Ravetch and Kinet, (1991) Annu. Rev. Immunol, 9:457-92. Для оценки активности ADCC представляющей интерес молекулы можно провести анализ ADCC in vitro (патент США № 55003621; патент США № 5821337). Эффективные для таких анализов эффекторные клетки включают мононуклеарные клетки периферической крови (PBMC) и природные клетки киллеры (NK). Альтернативно или дополнительно активность ADCC представляющей интерес молекулы можно оценить in vivo, например, на модели животных, например, так, как описано Clynes et al. (1998) PNAS (USA), 95:652-656.
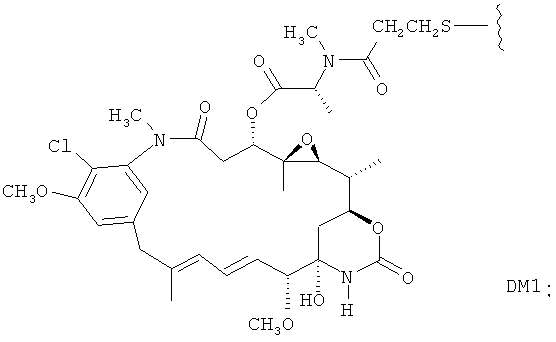
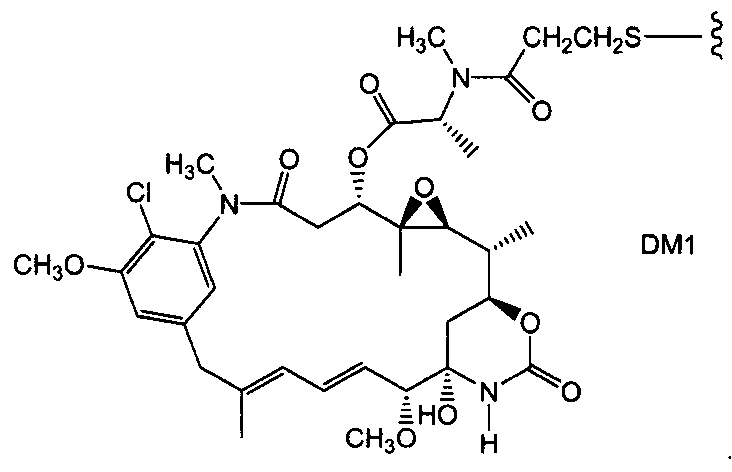
«Лекарственная группа майтаназина» обозначает субструктуру конъюгата антитело-лекарственное средство, которая имеет структуру соединения майтаназина. Майтаназин был впервые выделен из восточноафриканского кустарника Maytenus serrata (патент США № 3896111). Затем было обнаружено, что определенные микроорганизмы также продуцируют майтанзиноиды, такие как майтаназинол и C-3 майтаназиноловые сложные эфиры (патент США № 4151042). Были описаны синтетические майтаназинол и аналоги майтаназинола. См. патенты США №№ 4137230; 4248870; 4256746; 4260608; 4265814; 4294757; 4307016; 4308268; 4308269; 4309428; 4313946; 4315929; 4317821; 4322348; 4331598; 4361650; 4364866; 4424219; 4450254; 4362663 и 4371533 и Kawai et al. (1984) Chem. Pharm. Bull. 3441-3451), каждый из которых приведен в данном документе в качестве ссылки в полном объеме.
Термины «Fc-рецептор» или «FcR» применяют для обозначения рецептора, связывающего Fc-область антитела, например природной последовательности FcR человека. FcR может связывать антитело IgG (гамма-рецептор) и включает рецепторы подклассов FcγRI, FcγRII и FcγRIII, включая аллельные варианты и формы альтернативного сплайсинга этих рецепторов. Рецепторы FcγRII включают FcγRIIA («активирующий рецептор») и FcγRIIB («ингибирующий рецептор») со сходными аминокислотными последовательностями, которые отличаются в основном своими цитоплазматическими доменами. Активирующий рецептор FcγRIIA содержит в своем цитоплазматическом домене иммунорецепторный активационный мотив на основе тирозина (ITAM). Ингибирующий рецептор FcγRIIB содержит в своем цитоплазматическом домене иммунорецепторный ингибирующий мотив на основе тирозина (ITIM). (Смотри обзор M. in Daëron, Annu. Rev. Immunol., 15:203-234 (1997)). FcR рассмотрены Ravetch и Kinet, Annu. Rev. Immunol., 9:457-92 (1991); Capel et al. (1994) Immunomethods, 4:25-34 и de Haas et al. (1995) J. Lab. Clin. Med., 126:330-41. В настоящем описании термин “FcR” охватывает другие FcR, включая те, которые будут идентифицированы в будущем. Термин также включает неонатальный рецептор, FcRn, отвечающий за перенос материнских IgG плоду (Guyer et al. (1976) J. Immunol. 117:587 и Kim et al. (1994) J. Immunol., 24:249).
«Комплемент-зависимая цитотоксичность», или «CDC», относится к способности молекулы лизировать мишень в присутствие комплемента. Путь активации комплемента инициируется связыванием первого компонента системы комплемента (C1q) с молекулой (например, антитела), образующей комплекс с распознаваемым антигеном. Для оценки активации комплемента можно проводить анализ CDC, например, как описано Gazzano-Santoro et al. (1996) J. Immunol. Methods, 202:163.
«Природные антитела», как правило, представляют собой гетеротетрамерные гликопротеины массой приблизительно 150000 Дальтон, состоящие из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, тогда как количество дисульфидных связей между тяжелыми цепями у различных изотипов иммуноглобулинов варьирует. Каждая тяжелая и легкая цепь также несет расположенные с одинаковыми интервалами дисульфидные связи. Каждая тяжелая цепь на одном из концов несет вариабельный домен (VH), за которым следует ряд константных доменов. Каждая легкая цепь на одном конце несет вариабельный домен (VL), а на другом конце несет константный домен. Константный домен легкой цепи выровнен с первым константным доменом тяжелой цепи, а вариабельный домен легкой цепи выровнен с вариабельным доменом тяжелой цепи. Полагают, что конкретные аминокислотные остатки образуют взаимодействие между вариабельными доменами легкой цепи и тяжелой цепи.
Термин «вариабельный» обозначает, что определенные части вариабельных доменов антител значительно отличаются по последовательности и используются для связывания и специфического узнавания каждого конкретного антитела своего конкретного антигена. Однако вариабельность неравномерно распределена в вариабельных доменах антител. Она концентрируется в трех сегментах вариабельных доменов легких цепей и тяжелых цепей, называемых гипервариабельными областями. Наиболее высококонсервативные части вариабельных доменов называют каркасными областями (FR). Каждый из вариабельных доменов природных тяжелых и легких цепей содержит четыре FR, в основном принимающих конфигурацию β-слоя, соединенные тремя гипервариабельными областями, образующими петли, соединяющие, а в некоторых случаях образующие, части структуры β-слоя. Гипервариабельные области каждой цепи удерживаются вместе в непосредственной близости благодаря FR, и вместе с гипервариабельными областями другой цепи вносят вклад в образование антигенсвязывающего участка антител (смотри Kabat et al. (1991) Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD). Константные домены напрямую не вовлечены в связывание антитела с антигеном, но выполняют различные эффекторные функции, например участие антитела в антителозависимой клеточной цитотоксичности (ADCC).
В данном документе термин «гипервариабельная область» относится к аминокислотным остаткам антитела, ответственным за связывание антигена. Гипервариабельная область, как правило, содержит аминокислотные остатки «участка, определяющего комплементарность», или «CDR» (например, остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3), в вариабельном домене легкой цепи и 31-35 (H1), 50-65 (H2) и 95-102 (H3) в вариабельном домене тяжелой цепи; Kabat et al. выше) и/или остатки «гипервариабельной петли» (например, остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи и 26-32 (H1), 53-55 (H2) и 96-101 (H3) в вариабельном домене тяжелой цепи; Chothia и Lesk (1987) J. Mol. Biol., 196:901-917). Остатки «каркасной области» или «FR» представляют собой остатки вариабельного домена, отличающиеся от остатков гипервариабельных областей, как определено в данном документе.
Расщепление антител папаином приводит к получению двух идентичных антигенсвязывающих фрагментов, называемых «Fab»-фрагментами, каждый из которых обладает одним антигенсвязывающим участком, и осадочного «Fc»-фрагмента, название которого отражает его способность легко кристаллизоваться. Обработка пепсином приводит к образованию фрагмента F(ab')2 с двумя антигенсвязывающими участками и способного к перекрестному связыванию антигена.
«Fv» представляет собой минимальный фрагмент антитела, содержащий полный антигенраспознающий и антигенсвязывающий участок. Эта область состоит из димера одной тяжелой цепи и одного вариабельного домена легкой цепи в тесной нековалентной связи. Именно в этой конфигурации три гипервариабельные области каждого вариабельного домена взаимодействуют с образованием антигенсвязывающего участка на поверхности димера VH-VL. Все вместе шесть гипервариабельных областей обуславливают специфичность связывания антигена с антителом. Однако даже один вариабельный домен (или половина Fv, содержащая только три гипервариабельные области, специфичные для антигена) обладает способностью распознавать и связывать антиген, хотя и с меньшей аффинностью, чем целый участок связывания.
Fab-фрагмент также содержит константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. Fab'-фрагменты отличаются от Fab-фрагментов несколькими дополнительными остатками на C-конце CH1-домена тяжелой цепи, включающих в себя один или несколько цистеинов шарнирной области антитела. В данном документе Fab'-SH обозначает Fab', в котором цистеиновый остаток(ки) константных доменов несет по меньшей мере одну свободную тиольную группу. Фрагменты антител F(ab')2 исходно образуются как пары Fab'-фрагментов, которые связаны между собой шарнирными цистеинами. Также известны другие способы химического связывания фрагментов антител.
«Легкие цепи» антител любого вида позвоночных на основе аминокислотных последовательностей их константных доменов можно отнести к одному из двух четко различимых типов, обозначаемых каппа (κ) и лямбда (λ).
«Одноцепочечный Fv» или «scFv» означают одноцепочечные фрагменты вариабельной области антитела, содержащие домены антитела VH и VL, где эти домены находятся на одной полипептидной цепи. Полипептид Fv между доменами VH и VL может дополнительно содержать полипептидный линкер, позволяющий scFv образовать желательную структуру для связывания антигена (Plückthun in The Pharmacology Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994). Фрагменты scFv антител против ErbB2 описаны в WO 93/16185; патенте США № 5571894; патенте США № 5587458.
Термин «димерные антитела» относится к небольшим фрагментам антител с двумя антигенсвязывающими участками, где эти фрагменты содержат вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) на одной полипептидной цепи (VH-VL). С помощью линкера, который слишком короткий, чтобы обеспечить спаривание двух доменов одной и той же цепи, домены невольно спариваются с комплементарными доменами другой цепи и образуют два антигенсвязывающих участка. Димерные антитела подробно описаны, например, в EP 404097; WO 93/11161 и Hollinger et al. (1993) Proc. Natl. Acad. Sci. USA 90:6444-6448.
«Гуманизированные» формы антител, не являющихся антителами человека (например, антитела крыс), представляют собой химерные антитела, содержащие минимальную последовательность, полученную из иммуноглобулина, не являющегося иммуноглобулином человека. В большей части гуманизированные антитела представляют собой иммуноглобулины человека (реципиентное антитело), в которых остатки, образующие гипервариабельную область реципиента, заменены остатками гипервариабельной области вида, не являющегося человеком (донорное антитело), например мыши, крысы, кролика или примата, не являющегося человеком, обладающими желательной специфичностью, аффинностью и способностью. В некоторых случаях остатки каркасной области (FR) иммуноглобулина человека замещают соответствующими остатками, не являющимися человеческими. Кроме того, гуманизированные антитела могут содержать остатки, отсутствующие в реципиентном антителе или донорном антителе. Эти модификации производят для дополнительного улучшения характеристик антитела. Как правило, гуманизированное антитело, по существу, содержит все по меньшей мере из одного, а обычно из двух вариабельных доменов, в которых все или по существу все гипервариабельные петли соответствуют гипервариабельным петлям иммуноглобулина, не являющегося иммуноглобулином человека, и все или по существу все FR представляют собой FR последовательности иммуноглобулина человека. Гуманизированное антитело, необязательно, содержит по меньшей мере часть константной области иммуноглобулина (Fc), как правило, иммуноглобулина человека. Более подробное описание смотри Jones et al. (1986) Nature, 321:522-525; Riechmann et al. (1988) Nature 332:323-329; и Presta, (1992) Curr. Op. Struct. Biol., 2:593-596.
Гуманизированные антитела против ErbB2 включают huMAb4D5-1, huMAb4D5-2, huMAb4D5-3, huMAb4D5-4, huMAb4D5-5, huMAb4D5-6, huMAb4D5-7 и huMAb4D5-8 (ГЕРЦЕПТИН®, трастузумаб), как описано в табл.3 патента США № 5821337, приведенного в данный документ в качестве ссылки в полном объеме; гуманизированные антитела 520C9 (WO 93/21319) и 2C4.
«Выделенное» антитело представляет собой антитело, идентифицированное и выделенное и/или восстановленное из компонентов природного окружения. Загрязняющие компоненты природного окружения представляют собой вещества, препятствующие диагностическому или терапевтическому применению антитела и могут включать в себя ферменты, гормоны и другие белковые и небелковые растворенные вещества. Антитела можно очищать (1) до более чем 95% мас. антитела, например, по методу Лоури, или более чем 99% мас. (2) до степени, достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности, используя белковый секвестер с вращающимися чашками, или (3) до гомогенности, используя SDS-PAGE в восстанавливающих или невосстанавливающих условиях с окрашиванием Кумаси синим или серебром. К выделенному антителу относится антитело in situ в рекомбинантных клетках, так как отсутствует по меньшей мере один компонент природного окружения антитела. Однако обычно выделенное антитело получают посредством по меньшей мере одной стадии очистки.
Антитело «связывающее» представляющий интерес антиген, например, антиген ErbB2, представляет собой антитело, способное связывать этот антиген с достаточной аффинностью так, чтобы это антитело можно было использовать для выявления клетки, экспрессирующей антиген. Когда антитело представляет собой антитело, связывающее ErbB2, то, как правило, оно предпочтительно связывает ErbB2, в отличие от других рецепторов ErbB, и может быть антителом, у которого отсутствует значительная перекрестная реактивность с другими белками, такими как EGFR, ErbB3 или ErbB4. В таких вариантах осуществления степень связывания антитела с белками, не являющимися ErbB2 (например, связывание клеточной поверхности с эндогенным рецептором), составляет меньше 10%, как, например, определяют анализом сортировки активированных флуоресценцией клеток (FACS) или радиоиммунопреципитацией (RIA). Иногда антитело против ErbB2 не обладает значительной перекрестной реактивностью с белком крысы neu, например, как описано Schecter et al. (1984) Nature 312:513 и Drebin et al. (1984) Nature, 312:545-548.
Антитело, которое «блокирует» активацию рецептора ErbB лигандом, снижает или предотвращает такую активацию, где антитело способно блокировать активацию рецептора ErbB лигандом значительно более эффективно, чем моноклональное антитело 4D5, например, приблизительно так же эффективно, как моноклональные антитела 7F3 или 2C4 или их Fab-фрагменты. Например, антитело, которое блокирует активацию рецептора ErbB лигандом, может представлять собой антитело, которое приблизительно на 50-100% более эффективно, блокирует формирование гетероолигомера, чем 4D5. Блокирование активации рецептора ErbB лигандом может происходить любыми способами, например, влияя на связывание лиганда с рецептором ErbB, образование комплекса ErbB, на тирозинкиназную активность рецептора ErbB в комплексе ErbB и/или на фосфорилирование тирозинкиназного остатка(ов) в рецепторе ErbB или рецептором ErbB.
Антитело с «биологическим свойством» указанного антитела, такого как моноклональное антитело, обозначенное 2C4 (Omnitarg, Genentech, Inc.), представляет собой антитело, обладающее одним или несколькими биологическими свойствами этого антитела, которые отличают его от других антител, которые связывают тот же антиген (например, ErbB2). Например, антитело с биологическим свойством 2C4 может блокировать активацию HRG гетероолигомера ErbB, содержащего ErbB2 и ErbB3, ErbB1 или ErbB4; блокировать EGF, TGF-α, HB-EGF, эпирегулиновую и/или амфирегулиновую активацию рецептора ErbB, содержащего EGFR и ErbB2; блокировать опосредованную EGF, TGF-α и/или HRG активацию MAPK; и/или связывать на внеклеточном домене ErbB2 тот же эпитоп, который связывает 2C4 (например, которое блокирует связывание моноклонального антитела 2C4 с ErbB2).
Если не указано иначе, выражение «моноклональное антитело 2C4» относится к антителу, несущему антигенсвязывающие остатки антитела 2C4 мыши или антигенсвязывающие остатки, полученные из антитела 2C4 мыши, из примеров ниже. Например, моноклональное антитело 2C4 может представлять собой мышиное моноклональное антитело 2C4 или его вариант, такое как гуманизированное антитело 2C4, несущее антигенсвязывающие аминокислотные остатки моноклонального антитела 2C4 мыши (WO 01/00245). Если не указано иначе, выражение «rhuMAb 2C4», используемое в настоящем документе, относится к антителу, содержащему последовательности вариабельного домена легкой цепи (VL) и вариабельного домена тяжелой цепи (VH) SEQ ID NO:3 и 4, соответственно, слитого с последовательностями константных областей тяжелых и легких цепей IgG1 человека (аллотип не-A), необязательно, экспрессируемых клетками яичника китайского хомяка (CHO) (WO 01/00245).
Если не указано иначе, термин «моноклональное антитело 4D5» относится к антителу, несущему антигенсвязывающие остатки антитела 4D5 мыши (ATCC CRL 10463). Например, моноклональное антитело 4D5 может представлять собой моноклональное антитело 4D5 мыши или его вариант, такой как гуманизированное антитело 4D5, несущее антигенсвязывающие аминокислотные остатки моноклонального антитела 4D5 мыши. Иллюстративные гуманизированные антитела 4D5 включают huMAb4D5-1, huMAb4D5-2, huMAb4D5-3, huMAb4D5-4, huMAb4D5-5, huMAb4D5-6, huMAb4D5-7 и huMAb4D5-8 (ГЕРЦЕПТИН®), как, например, в патенте США № 5821337.
«Ингибирующее рост средство» относится к соединению или композиции, ингибирующему рост клетки, например раковых клеток, экспрессирующих ErbB, in vitro или in vivo. Таким образом, ингибирующее рост средство может представлять собой средство, значительно снижающее долю клеток, экспрессирующих ErbB, в S-фазе. Примеры ингибирующих рост средств включают средства, блокирующие прохождение клеточного цикла (на любой стадии, кроме S-фазы), такие как средства, индуцирующие остановку клеточного цикла в G1 и в M-фазе (The Molecular Basis of Cancer, Mendelsohn and Israel, eds., глава 1, озаглавленная «Cell cycle regulation, oncogenes, and antineoplastic drugs» под редакцией Murakami et al. (WB Saunders: Philadelphia, 1995), особенно стр. 13). Примеры «ингибирующих рост» антител представляют собой антитела, связывающиеся с ErbB2 и ингибирующие рост раковых клеток, сверхэкспрессирующих ErbB2. Ингибирующие рост антитела против ErbB2 могут ингибировать рост клеток опухоли молочной железы SK-BR-3 в клеточной культуре более чем на 20% или более чем на 50% (например, приблизительно от 50% до приблизительно 100%) при концентрации антитела приблизительно от 0,5 до 30 мкг/мл, где ингибирование роста определяют через шесть суток после воздействия антитела на клетки SK-BR-3 (патент США № 5677171).
Антитело, которое «индуцирует клеточную гибель», представляет собой антитело, являющееся причиной того, что жизнеспособные клетки становятся нежизнеспособными. Клетка, как правило, представляет собой клетку, экспрессирующую рецептор ErbB2, особенно клетку, сверхэкспрессирующую рецептор ErbB2. Клетка может представлять собой раковую клетку, например опухолевую клетку рака молочной железы, яичника, желудка, эндометрия, слюнной железы, легкого, почки, толстой кишки, щитовидной железы, поджелудочной железы или мочевого пузыря. In vitro клетка может представлять собой клетку SK-BR-3, BT474, Calu 3, MDA-MB-453, MDA-MB-361 или SKOV3. Клеточную гибель in vitro можно определять в отсутствие комплемента и эффекторных иммунных клеток для отличия гибели клеток, вызванной антитело-зависимой клеточной цитотоксичностью (ADCC) от гибели клеток, вызванной цитотоксичностью комплемента (CDC). Таким образом, анализ на клеточную гибель можно проводить с применением инактивированной нагреванием сыворотки (то есть в отсутствие комплемента) и в отсутствие эффекторных иммунных клеток. Для определения того, способно ли антитело индуцировать клеточную гибель можно оценивать нарушение целостности мембраны по захвату йодида пропидия (PI), трипанового синего (см. Moore et al. (1995) Cytotechnology, 17:1-11) или 7AAD по сравнению с необработанными клетками. Антитела, индуцирующие клеточную гибель, представляют собой антитела, которые индуцируют захват PI в анализе захвата PI клетками BT474 (см. ниже).
Антитело, «индуцирующее апоптоз», представляет собой антитело, индуцирующее программированную клеточную гибель, что определяют по связыванию аннексина V, фрагментации ДНК, сморщиванию клетки, расширению эндоплазматического ретикулума, фрагментации клетки и/или образованию мембранных везикул (называемых апоптозными тельцами). Как правило, клетка представляет собой клетку, сверхэкспрессирующую рецептор ErbB2, включая опухолевую клетку, например, молочной железы, яичника, желудка, эндометрия, слюнной железы, легкого, почки, толстой кишки, щитовидной железы, поджелудочной железы или мочевого пузыря. In vitro клетка может представлять собой клетку SK-BR-3, BT474, Calu 3, MDA-MB-453, MDA-MB-361 или SKOV3.
Термины «лечить» или «лечение» относятся как к терапевтическому лечению, так и к профилактическим или превентивным мерам, где у индивидуума необходимо предотвратить или замедлить (уменьшить) нежелательное физиологическое изменение или нарушение, такое как развитие или распространение злокачественной опухоли. Для целей настоящего изобретения благоприятные или желательные клинические результаты включают в качестве неограничивающих примеров частичное снижение симптомов, уменьшение распространения заболевания, стабилизирование (то есть отсутствие ухудшения) состояния заболевания, задержку или замедление прогрессирования заболевания, улучшение или облегчение состояния заболевания и ремиссию (частичную или полную). «Лечение» также может означать увеличение продолжительности жизни по сравнению с ожидаемой продолжительностью жизни в отсутствие лечения. Индивидуумы, нуждающиеся в лечении, включают тех больных с соответствующим состоянием или нарушением, а также индивидуумов, которые предрасположены к возникновению состояния или нарушения, или индивидуумов, у которых требуется профилактика соответствующего состояния или нарушения.
«Нарушение» представляет собой любое состояние, для которого было бы эффективно лечение по настоящему изобретению. Нарушение включает хронические и острые нарушения или заболевания, включающие в себя патологические состояния, которые предрасполагают млекопитающих к рассматриваемому заболеванию. Неограничивающие примеры нарушений, для которых в данном случае лечение могло бы иметь эффект, включают доброкачественные и злокачественные опухоли; лейкемические и лимфоидные злокачественные заболевания; в частности, рак молочной железы, яичника, желудка, эндометрия, слюнной железы, легкого, почки, толстой кишки, щитовидной железы, поджелудочной железы, предстательной железы или мочевого пузыря; нейрональные, глиальные, астроцитарные, гипоталамические нарушения и нарушения, связанные с другими железами, макрофагальные, эпителиальные, стромальные и бластные нарушения; и воспалительные, ангиогенные и иммунологические нарушения. Пример нарушения, для которого эффективно лечение по настоящему изобретению, представляет собой солидную злокачественную опухоль.
Термин «терапевтически эффективное количество» относится к количеству лекарственного средства, эффективному для лечения заболевания или нарушения у млекопитающего. В случае рака терапевтически эффективное количество лекарственного средства может: (i) уменьшать число раковых клеток; (ii) уменьшать размер опухоли, (iii) ингибировать, тормозить, до некоторой степени замедлять и предпочтительно останавливать, инфильтрацию раковых клеток в периферические органы; (iv) ингибировать (то есть до некоторой степени замедлять и предпочтительно останавливать) метастазирование опухоли; (v) ингибировать рост опухоли и/или (vi) до некоторой степени ослаблять один или несколько симптомов, связанных с раком. По степени предотвращения роста клеток и/или уничтожения существующих клеток лекарственное средство может быть цитостатическим и/или цитотоксическим. В моделях на животных эффективность можно оценивать физическими измерениями опухоли в период введения ADC и определением частичной или полной ремиссии опухоли. Для терапии рака эффективность можно измерять, например, оценкой времени прогрессирования заболевания (TTP) и/или определением процента отклика (RR).
Термин «биодоступность» относится к системной доступности (то есть уровням в крови/плазме) данного количества лекарственного средства, вводимого пациенту. Биодоступность представляет собой безусловный термин, означающий измерение времени (скорости) и общего количества (объема), которое лекарственное средство достигает в общей циркуляции при вводимой лекарственной форме.
Термины «рак» и «раковый» относятся к или ими обозначают физиологическое состояние млекопитающих, которое, как правило, характеризуется как нерегулярным клеточным ростом. «Опухоль» содержит одну или несколько злокачественных клеток. Неограничивающие примеры рака включают карциному, лимфому, бластому, саркому и лейкемические или лимфоидные злокачественные заболевания. Более конкретные примеры таких злокачественных опухолей включают плоскоклеточный рак (например, эпителиальный плоскоклеточный рак), рак легких, включая мелкоклеточный рак легких, немелкоклеточный рак легких («NSCLC»), аденокарциному легких и плоскоклеточную карциному легкого, рак брюшины, гепатоцеллюлярный рак, рак желудка, включая рак желудочно-кишечного тракта, стромальную опухоль желудочно-кишечного тракта (GIST), рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, рак прямой кишки, колоректальный рак, эндометриальную или маточную карциному, карциному слюнной железы, рак почек, рак предстательной железы, рак вульвы, рак щитовидной железы, карциному печени, карциному ануса, карциному полового члена, а также рак головы и шеи.
«Рак с экспрессией ErbB» представляет собой опухоль с клетками, на поверхности которых представлен белок ErbB. «Рак с экспрессией ErbB2» представляет собой рак с клетками, на поверхности которых продуцируются достаточные уровни ErbB2, так что антитело к ErbB2 может связываться с ними и оказывать терапевтический эффект в отношении злокачественной опухоли.
Рак со «сверхэкспрессией» рецептора, например рецептора ErbB, представляет собой рак с достаточно высокими уровнями рецептора, такого как ErbB2, на поверхности его клеток по сравнению с незлокачественными клетками того же тканевого типа. Такая сверхэкспрессия может быть вызвана амплификацией гена или увеличенной транскрипцией или трансляцией. Сверхэкспрессия рецептора ErbB может быть определена в диагностическом или прогностическом анализе, оценивая увеличенные уровни белка ErbB на поверхности клетки (например, с помощью иммуногистохимического анализа; IHC). Альтернативно или дополнительно можно измерять уровни нуклеиновой кислоты, кодирующей ErbB, в клетке, например, с помощью флуоресцентной гибридизации in situ (FISH; см. WO 98/45479), способов саузерн-блоттинга или полимеразной цепной реакции (ПЦР), например количественной ПЦР в реальном времени (RT-PCR). Сверхэкспрессия лиганда ErbB может быть определена для диагностики, оценивая уровни лиганда (или кодирующей его нуклеиновой кислоты) у пациента, например в биопсии опухоли, или различными диагностическими анализами, такими как IHC, FISH, саузерн-блоттинг, ПЦР или описанными выше анализами in vivo. Также сверхэкспрессию рецептора ErbB можно исследовать, измеряя «слущивающийся» антиген (например, внеклеточный домен ErbB) в биологической жидкости, такой как сыворотка (см., например, патент США № 4933294; WO 91/05264; патент США № 5401638 и Sias et al. (1990) J. Immunol. Methods 132:73-80). Помимо указанных выше анализов специалистам в данной области доступны различные другие анализы in vivo. Например, можно воздействовать на клетки в организме пациента антителом, которое необязательно мечено детектируемой меткой, например радиоактивным изотопом, и у пациента можно оценивать связывание антитела с клетками, например, внешним сканированием радиоактивности или анализом биопсии, взятой у пациента, предварительно подвергнутого воздействию антитела.
Опухоли со сверхэкспрессией HER2 по иммуногистохимическим оценкам классифицируют в соответствии с количеством копий молекул HER2, экспрессирующихся на клетку, и их можно определить биохимически: 0=0-10000 копий/клетку, 1+=по меньшей мере, приблизительно 200000 копий/клетку, 2+=по меньшей мере, приблизительно 500000 копий/клетку, 3+=приблизительно 1-2×106 копий/клетку. Сверхэкспрессия HER2 на уровне 3+, приводящая к независимой от лиганда активации тирозинкиназы (Hudziak et al., (1987) Proc. Natl. Acad. Sci. USA 84:7159-7163), возникает приблизительно в 30% случаев рака молочной железы, и у этих пациентов интервал без рецидивов и общая продолжительность жизни уменьшена (Slamon et al. (1989) Science 244:707-712; Slamon et al. (1987) Science, 235:177-182). Напротив, рак “с отсутствием сверхэкспрессии рецептора ErbB2» представляет собой злокачественную опухоль, которая в диагностическом анализе по сравнению с незлокачественной клеткой того же тканевого типа не экспрессирует рецептор ErbB2 на уровнях, больших, чем нормальные. Моноклональное антитело мыши против HER2 ингибирует рост клеточных линий рака молочной железы со сверхэкспрессией HER2 на уровнях 2+ и 3+ (1-2×106 рецепторов HER2 на клетку), но не проявляет активности в отношении клеток, экспрессирующих меньшие уровни HER2 (Lewis et al. (1993) Cancer Immunol. Immunother. 37:255-263). На основании этого наблюдения гуманизировали антитело 4D5 (huMAb4D5-8, rhuMAb HER2, патент США № 5821337; Carter et al. (1992) Proc. Natl. Acad. Sci. USA 89: 4285-4289) и оценивали у больных с раком молочной железы, опухоли которых сверхэкспрессировали HER2, но у которых наблюдали прогрессирование болезни после обычно химиотерапии (Cobleigh et al. (1999) J. Clin. Oncol. 17: 2639-2648). Опухоли у большинства пациентов в данном испытании экспрессировали HER2 на уровне 3+, но часть - на уровне 2+.
«Гормононезависимая» злокачественная опухоль представляет собой злокачественную опухоль, чей рост не зависит от присутствия гормона, связывающегося с рецептором, экспрессируемым раковыми клетками. Такие злокачественные опухоли не обнаруживают клинического регресса при проведении фармакологических или хирургических способов, уменьшающих концентрацию гормонов в опухоли или вокруг нее. Примеры гормононезависимых злокачественных опухолей включают рак предстательной железы, независимый от андрогенов, рак эндометрия, независимый от андрогенов, рак молочной железы, независимый от эстрогенов, рак эндометрия и рак яичников. Такие злокачественные опухоли в начале своего развития могут быть гормонозависимыми и прогрессировать от гормоночувствительной стадии до гормоноустойчивой опухоли после антигормональной терапии.
Как используют в данном документе термин «цитотоксическое средство» относится к веществу, ингибирующему или предотвращающему функционирование клеток и/или вызывающему разрушение клеток. Термин охватывает радиоактивные изотопы (например, 211At, 131I, 125I, 90Y, 186Re, 188Re, 153Sm, 212Bi, 32P, 60C и радиоактивные изотопы Lu), химиотерапевтические средства и токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, включая их синтетические аналоги и производные.
«Химиотерапевтическое средство» представляет собой химическое соединение, эффективное для лечения злокачественной опухоли. Примеры химиотерапевтических средств включают эрлотиниб (ТАРЦЕВА (TARCEVA®), Genentech/OSI Pharm.), бортезомиб (ВЕЛКЕЙД (VELCADE®), Millenium Pharm.), фулвестрант (ФАСЛОДЕКС (FASLODEX®), Astrazeneca), сутент (SU11248, Pfizer), летрозол (ФЕМАРА® (FEMARA®), Novartis), иматиниба мезилат (ГЛИВЕК® (GLEEVEC®), Novartis), PTK787/ZK 222584 (Novartis), оксалиплатин (Элоксатин (Eloxatin®), Sanofi), 5-FU (5-фторурацил), лейковорин, рапамицин (сиролимус, РАПАМУН (RAPAMUNE®), Wyeth), лапатиниб (GSK572016, GlaxoSmithKline), лонафарниб (SCH 66336), сорафениб (BAY43-9006, Bayer Labs.) и гефитиниб (ИРЕССА (IRESSA®), Astrazeneca), AG1478, AG1571 (SU 5271; Sugen), алкилирующие средства, такие как тиотепа и ЦИТОКСАН® (CYTOXAN®) циклофосфамид; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включающие в себя альтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилмеламин; ацетогенины (особенно буллатацин и буллатацинон); камптотецин (включая синтетический аналог топотекан); бриостатин; каллистатин; CC-1065 (включая его адозелезиновые, карзелезиновые и бизелезиновые синтетические аналоги); криптофицины (особенно криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналог, KW-2189 и CB1-TM1); элеутеробин; панкратистатин; саркодиктин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, голофосфамид, эстрамустин, ифосфамид, мехлоретамин, гидрохлорид оксида мехлоретамина, мелфалан, новембихин, фенэстерин, преднимустин, трофосфамид, урациловый иприт; производные нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как ендиеновые антибиотики (например, калихимицин, особенно калихимицин гамма1I и калихимицин омегаI1 (Angew Chem Intl. Ed. Engl. (1994) 33:183-186); динемицин, включая динемицин A; бисфосфонаты, такие как хлодронат; эсперамицин; а также хромофор неокарциностатин и родственные хромопротеиновые ендиеновые антибиотические хромофоры), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, акрцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин АДРИАМИЦИН (ADRIAMYCIN®) (включая морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролинодоксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцеломицин, митомицины, такие как митомицин C, микофеноловую кислоту, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, теберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мапистиостан, тестолактон; антиадреналовые средства, такие как аминоглутетимид, митотан, трилостан; компенсаторы фолиевой кислоты, такие как фролиновую кислоту; ацеглатон; альдофосфамид гликозид; аминолевулиновую кислоту; енилурацил; амсакрин; бестрабуцил; бизантрен; эдатраксат; дефофамин; демеколицин; диазиквон; эльфорнитин; эллиптиум ацетат; эпотилон; этоглюцид; нитрат галлия; гидроксимочевину; лентинан; лонидайнин; майтанзиноиды, такие как майтаназин и анзамитоцины; митогуазон; митоксантрон; мопиданмол; нитраерин; пентостатин; фенамет; пирарубицин; лозоксантрон; подофилиновую кислоту; 2-этилгидразид; прокарбацин; полисахаридный комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2"-трихлортриэтиламин; трихотецены (особенно токсин T-2, верракурин A, роридин A и ангуидин); уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («Ara-C»); циклофосфамид; тиотепа; таксоиды, например, паклитаксел ТАКСОЛ® (TAXOL®) (Bristol-Myers Squibb Oncology, Princeton, N.J.), АБРАКСАН (ABRAXANE™) без кремофора, препарат сконструированных на основе альбумина наночастиц паклитаксила (American Pharmaceutical Partners, Schaumberg, Illinois), и доцетаксел ТАКСОТЕР® (TAXOTERE®) (Rhone- Poulenc Rorer, Antony, France); хлоранбуцил; гемцитабин ГЕМЗАР® (GEMZAR®); 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; платину; этопозид (VP-16); ифосфамид; митоксантрон; винкристин; винорелбин НАВЕЛЬБИН® (NAVELBINE®); новантрон; тенипозид; эдатрексат; дауномицин; аминоптерин; кселода; ибандронат; CPT-11; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; капецитабин и фармацевтически приемлемые соли, кислоты или производные любого из указанного выше.
Также определение «химиотерапевтическое средство» охватывает: (i) антигормональные средства, которые регулируют или ингибируют действие гормонов на опухоли, такие как антиэстрогены и селективные модуляторы рецепторов эстрогенов (SERM), включая, например, тамоксифен (включая тамоксифен НОЛВАДЕКС (NOLVADEX®)), ралоксифен, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен ФАРЕСТОН (FARESTON); (ii) ингибиторы ароматазы, ингибирующие фермент ароматазу, регулирующий образование эстрогенов в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглутэтимид, мегестрол ацетат МЕГАЗА (MEGASE®), экземестан АРОМАЗИН® (AROMASIN®), форместан, фадрозол, ворозол РИВИЗОР (RIVISOR®), летрозол ФЕМАРА® (FEMARA®) и анастрозол (АРИМИДЕКС®); (iii) антиандрогены, такие как флутамид, нилутамид, бикалутамид, леупролид и гозерелин; а также троксацитабин (1,3-диокслолановый аналог нуклеозина цитозина); (iv) ингибиторы ароматазы; (v) ингибиторы протеинкиназы; (vi) ингибиторы липидкиназы; (vii) антисмысловые олигонуклеотиды, в частности те, которые ингибируют экспрессию генов в путях передачи сигнала, вовлеченных в амплификацию аномальных клеток, такие как, например, PKC-альфа, Ralf и H-Ras; (viii) рибозимы, такие как ингибитор экспрессии VEGF (например, рибозим АНГИОЗИМ (ANGIOZYME®)) и ингибитор экспрессии HER2; (ix) вакцины, такие как генотерапевтические вакцины, например, вакцина АЛЛОВЕКТИН (ALLOVECTIN®), вакцина ЛЕЙВЕКТИН (LEUVECTIN®) и вакцина ВАКСИД (VAXID®); rIL-2 ПРОЛЕЙКИН (PROLEUKIN®); ингибитор топоизомеразы 1 ЛУРТОТЕКАН (LURTOTECAN®); rmRH АБАРЕЛИКС (ABARELIX®); (x) антиангиогенные средства, такие как бевацизумаб (АВАСТИН® (AVASTIN®), Genentech) и (xi) фармацевтически приемлемые соли, кислоты или производные любого из указанного выше.
Ингибиторы протеинкиназ включают ингибиторы протеинкиназ, до некоторой степени ингибирующие тирозинкиназную активность тирозинкиназы, например рецептора ErbB. Примеры ингибиторов протеинкиназ включают направленные на EGFR лекарственные средства, такие как: (i) антитела, связывающиеся с EGFR, включающие в себя MAb 579 (ATCC CRL HB 8506), MAb 455 (ATCC CRL HB8507), MAb 225 (ATCC CRL 8508), MAb 528 (ATCC CRL 8509) (см. патент США № 4943533, Mendelsohn et al.) и их варианты, такие как химеризованное антитело 225 (C225 или цетуксимаб; ЭРБИТУКС (ERBITUX®), Imclone) и реконструированное человеческое антитело 225 (H225) (WO 96/40210, Imclone Systems Inc.); антитела, связывающие мутантный EGFR типа II (патент США № 5212290); гуманизированные и химерные антитела, связывающие EGFR (патент США № 5891996), и человеческие антитела, связывающие EGFR, такие как ABX-EGF (WO 98/50433); (ii) антитело к EGFR, конъюгированное с цитотоксическим средством (EP 659439A2), и связывающиеся с EGFR низкомолекулярные вещества, включающие в себя ZD1839 или гефитиниб (ИРЕССА (IRESSA™); Astra Zeneca), эрлотиниб HCl (CP-358774, ТАРЦЕВА (TARCEVA™); Genentech/OSI) и AG1478, AG1571 (SU 5271; Sugen), хиназолины, такие как PD 153035, 4-(3-хлоранилино)хиназолин, пиридопиримидины, пиримидопиримидины, пирролопиримидины, 4-(фениламино)-7H-пирроло[2,3-d] пиримидины, куркумин (диферулоилметан, 4,5-бис-(4-фторанилино)фталимид), тирфостины, содержащие нитротиофеновые молекулы; PD-0183805 (Warner-Lambert); антисмысловые молекулы (например, молекулы, связывающие кодирующую ErbB нуклеиновую кислоту); хиноксалины (патент США № 5804396); трифостины (патент США № 5804396); ZD6474 (Astra Zeneca); PTK-787 (Novartis/Schering AG); ингибиторы всех видов ErbB, такие как CI-1033 (Pfizer); аффинитак (ISIS 3521; Isis/Lilly); иматиниба мезилат (Гливек; Novartis); PKI 166 (Novartis); GW2016 (Glaxo SmithKline); CI-1033 (Pfizer); EKB-569 (Wyeth); семаксаниб (Sugen); ZD6474 (AstraZeneca); PTK-787 (Novartis/Schering AG); INC-1C11 (Imclone) или, как описано в патенте США № 5804396; WO 99/09016 (American Cyanamid); WO 98/43960 (American Cyanamid); WO 97/38983 (Warner Lambert); WO 99/06378 (Warner Lambert); WO 99/06396 (Warner Lambert); WO 96/30347 (Pfizer, Inc); WO 96/33978 (Zeneca); WO 96/3397 (Zeneca) и WO 96/33980 (Zeneca).
«Антиангиогенное средство» относится к соединению, блокирующему или до некоторой степени препятствующему развитию кровеносных сосудов. Антиангиогенный фактор может быть, например, низкомолекулярным соединением или антителом, связывающимся с фактором роста или рецептором фактора роста, вовлеченным в активацию ангиогенеза. Иллюстративное антиангиогенное средство представляет собой антитело, связывающееся с фактором роста сосудистого эндотелия, такое как бевацизумаб (АВАСТИН® (AVASTIN®), Genentech).
Термин «цитокин» является общим термином для белков, высвобождаемых одной клеточной группой, действующих на другие клетки в качестве межклеточных медиаторов. Примерами таких цитокинов являются лимфокины, монокины и обычные пептидные гормоны. В число цитокинов входят гормон роста, такой как гормон роста человека, N-метионил гормон роста человека и бычий гормон роста; паратиреоидный гормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, такие как фоликулстимулирующий гормон (FSH), тиреотропный гормон (TSH) и лютеинизирующий гормон (LH); фактор роста печени; фактор роста фибробластов; пролактин; плацентарный лактоген; фактор некроза опухоли-α и -β; мюллерова ингибирующая субстанция; ассоциированный с мышиным гонадотропином пептид; ингибин; активин; фактор роста сосудистого эндотелия; интегрин; тромбопоэтин (TPO); факторы роста нервов, такие как NGF-β; фактор роста тромбоцитов; трансформирующие факторы роста (TGF), такие как TGF-α и TGF-β; инсулиноподобный фактор роста-I и -II; эритропоэтин (EPO); остеоиндуктивные факторы; интерфероны, такие как интерферон-α, -β и -γ; колониестимулирующие факторы (CSF), такие как макрофагальный-CSF (M-CSF); гранулоцитарно-макрофагальный-CSF (GM-CSF) и гранулоцитарный-CSF (G-CSF); интерлейкины (IL), такие как IL-1, IL-1α, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12; фактор некроза опухоли, такой как TNF-α или TNF-β, и другие полипептидные факторы, включая LTF и лиганд kit (KL). Использующийся в данном документе термин цитокин включает белки из природных источников или из рекомбинантной клеточной культуры и биологически активные эквиваленты природных последовательностей цитокинов.
Использующийся в данной заявке термин «пролекарственное средство» относится к предшественнику или производному фармацевтически активного вещества, который менее цитотоксичен для опухолевых клеток по сравнению с исходным лекарственным средством и способен ферментативно активироваться или преобразоваться в более активную исходную форму. См., например, Wilman, «Prodrugs in Cancer Chemotherapy» Biochemical Society Transactions, 14, pp. 375-382, 615th Meeting Belfast (1986) и Stella et al., «Prodrugs: A Chemical Approach to Targeted Drug Delivery», Directed Drug Delivery, Borchardt et al. (ed.), pp. 247-267, Humana Press (1985). Пролекарственные средства по настоящему изобретению включают в качестве неограничивающих примеров пролекарственные средства, содержащие фосфаты, пролекарственные средства, содержащие тиофосфаты, пролекарственные средства, содержащие сульфаты, пролекарственные средства, содержащие пептиды, пролекарственные средства, модифицированные D-аминокислотами, гликозилированные пролекарственные средства, содержащие β-лактамы, пролекарственные средства, содержащие необязательно замещенные феноксиацетамиды, или пролекарственные средства, содержащие необязательно замещенные фенилацетамиды, пролекарственные средства с 5-фторцитозином или 5-фторуридином, которые можно преобразовывать в более активное цитотоксическое свободное лекарственное средство. Примеры цитотоксических лекарственных средств, которые можно преобразовывать в форму пролекарственного средства для применения по настоящему изобретению, включают в качестве неограничивающих примеров описанные выше химиотерапевтические средства.
«Липосома» представляет собой небольшую везикулу, состоящую из липидов различных типов, фосфолипидов и/или поверхностно-активного вещества, которая может использоваться для доставки лекарственного средства (такого как антитела против ErbB2, описанные в данном документе и, необязательно, химиотерапевтическое средство) млекопитающему. Компоненты липосомы, как правило, упорядочены в структуру бислоя, сходны с расположением липидов в биологических мембранах.
Применяемый термин «листовка-вкладыш» относится к инструкциям, которые обычно включают в коммерческие упаковки терапевтических продуктов, инструкциям, которые содержат информацию о показаниях, применении, дозировке, введении, противопоказаниях и/или предостережениях, относящихся к применению таких терапевтических продуктов.
«Кардиопротектор» представляет собой соединение или композицию, предотвращающую или уменьшающую дисфункцию миокарда (то есть кардиомиопатию и/или застойную сердечную недостаточность), связанную с введением пациенту лекарственного средства, такого как антрациклиновый антибиотик и/или антитело против ErbB2. Например, кардиопротектор может блокировать или уменьшать кардиотоксический эффект, опосредованный свободными радикалами, и/или предотвращать или уменьшать повреждение при кислородном стрессе. Примеры кардиопротекторов, охватываемых настоящим определением, включают хелатирующее железо средство дексразоксан (ICRF-187) (Seifert et al., The Annals of Pharmacotherapy, 28:1063-1072 (1994)); средство, снижающее концентрацию липидов, и/или антиоксидант, такой как пробукол (Singal et al., J. Mol. Cell Cardiol., 27:1055-1063 (1995)); амифостин (аминотиоловый эфир 2-[(3-аминопропил)амино]-этантиолдигидрофосфата, также называемый WR-2721, и его дефосфорилированная форма, захватываемая клетками, называемая WR-1065) и S-3-(3-метиламинопропиламино)-пропилфосфоротиоловая кислота (WR-151327), см. Green et al. (1994) Cancer Research, 54:738-741; дигоксин (Bristow, M.R. ed. (1980) Drug-Induced Heart Disease. New York: Elsevier 191-215); бета-блокаторы, такие как метопролол (Hjalmarson et al. (1994) Drugs 47:Suppl 4:31-9; и Shaddy et al. (1995) Am. Heart J., 129:197-9); витамин E; аскорбиновая кислота (витамин C); акцепторы свободных радикалов, такие как олеинолевая кислота, урсоловая кислота и N-ацетилцистеин (NAC); соединения-спиновые ловушки, такие как альфа-фенил-трет-бутилнитрон (PBN); (Paracchini et al. (1993) Anticancer Res., 13:1607-1612); селеноорганические соединения, такие как P251 (Elbesen); и тому подобное.
Молекулы «выделенной» нуклеиновой кислоты представляют собой молекулы нуклеиновой кислоты, идентифицированной и отделенной по меньшей мере от одного вида загрязняющих молекул нуклеиновой кислоты, с которой она обычно связана в природном источнике нуклеиновой кислоты, кодирующей антитело. Выделенные молекулы нуклеиновой кислоты отличаются по форме и условиям, в которых они находятся в природе. Таким образом, выделенные молекулы нуклеиновой кислоты отличаются от молекул нуклеиновой кислоты в форме, в которой они существуют в природных клетках. Однако выделенные молекулы нуклеиновой кислоты включают молекулы нуклеиновой кислоты, содержащиеся в клетках, которые обычно экспрессируют антитело, где, например, молекулы нуклеиновой кислоты расположены на хромосоме в другом положении, чем в природных клетках.
«Алкил» представляет собой C1-C18-углеводород, содержащий обычные, вторичные, третичные или циклические атомы углерода. Примеры алкильных радикалов включают C1-C8-углеводородные группы, в качестве неограничивающих примеров, такие как метильная (Me, -CH3), этильная (Et, -CH2CH3), 1-пропильная (n-Pr, н-пропил, -CH2CH2CH3), 2-пропильная (i-Pr, изопропил, -CH(CH3)2), 1-бутильная (n-Bu, н-бутил, -CH2CH2CH2CH3), 2-метил-1-пропильная (i-Bu, изобутил, -CH2CH(CH3)2), 2-бутильная (s-Bu, втор-бутил, -CH(CH3)CH2CH3), 2-метил-2-пропильная (t-Bu, трет-бутил, -C(CH3)3), 1-пентильная (н-пентил, -CH2CH2CH2CH2CH3), 2-пентильная (-CH(CH3)CH2CH2CH3), 3-пентил (-CH(CH2CH3)2), 2-метил-2-бутильная (-C(CH3)2CH2CH3), 3-метил-2-бутильная (-CH(CH3)CH(CH3)2), 3-метил-1-бутильная (-CH2CH2CH(CH3)2), 2-метил-1-бутильная (-CH2CH(CH3)CH2CH3), 1-гексильная (-CH2CH2CH2CH2CH2CH3), 2-гексильная (-CH(CH3)CH2CH2CH2CH3), 3-гексильная (-CH(CH2CH3)(CH2CH2CH3)), 2-метил-2-пентильная (-C(CH3)2CH2CH2CH3), 3-метил-2-пентильная (-CH(CH3)CH(CH3)CH2CH3), 4-метил-2-пентильная (-CH(CH3)CH2CH(CH3)2), 3-метил-3-пентильная (-C(CH3)(CH2CH3)2), 2-метил-3-пентильная (-CH(CH2CH3)CH(CH3)2), 2,3-диметил-2-бутильная (-C(CH3)2CH(CH3)2), 3,3-диметил-2-бутильная (-CH(CH3)C(CH3)3.
«Алкенил» представляет собой C2-C18-углеводород, содержащий обычные, вторичные, третичные или циклические атомы углерода по меньшей мере с одной ненасыщенной связью, то есть двойной sp2-связью углерод-углерод. Примеры алкенильных радикалов включают C2-C8-углеводородные группы, в качестве неограничивающих примеров, такие как этилен или винил (-CH=CH2), аллил (-CH2CH=CH2), циклопентил (-C5H7) и 5-гексенил (-CH2CH2CH2CH2CH=CH2).
«Алкинил» представляет собой C2-C18-углеводород, содержащий обычные, вторичные, третичные или циклические атомы углерода по меньшей мере с одной ненасыщенной связью, то есть тройной sp-связью углерод-углерод. Примеры алкинильных радикалов включают C2-C8-углеводородные группы, в качестве неограничивающих примеров, такие как ацетиленовая (-C≡CH) и пропаргиловая (-CH2C≡CH).
«Алкилен» относится к насыщенным углеводородному радикалу, углеводородному радикалу с разветвленной или неразветвленной цепью или циклическому углеводородному радикалу из 1-18 атомов углерода и обладающему двумя одновалентными радикальными центрами, образуемыми удалением двух атомов водорода от одного или двух различных атомов углерода исходного алкана. Характерные алкиленовые радикалы включают C1-C8-углеводородные группы, в качестве неограничивающих примеров, такие как метиленовая (-CH2-) 1,2-этиленовая (-CH2CH2-), 1,3-пропиленовая (-CH2CH2CH2-), 1,4-бутиленовая (-CH2CH2CH2CH2-) и тому подобное.
«Алкинилен» относится к ненасыщенным углеводородному радикалу, углеводородному радикалу с разветвленной или неразветвленной цепью или циклическому углеводородному радикалу из 2-18 атомов углерода и обладающему двумя одновалентными радикальными центрами, образуемыми удалением двух атомов водорода от одного или двух различных атомов углерода исходного алкина. Характерные алкиниленовые радикалы включают C2-C8-углеводородные группы, в качестве неограничивающих примеров, такие как ацетиленовую (-C≡C-), пропаргиловую (-CH2CHC-) и 4-пентиниловую (-CH2CH2CH2C≡C-).
«Арил», самостоятельно или в сочетании, означает одновалентный ароматический углеводородный радикал из 6-20 атомов углерода, получаемый удалением одного атома водорода от одного атома углерода исходной ароматической кольцевой системы. Арильный радикал может содержать одно, два или три кольца, где такие кольца могут быть соединены вместе в виде боковых заместителей, например бифенил, или могут являться конденсированными, например нафталин или антрацен. Некоторые арильные группы представлены в иллюстративных структурах как «Ar». Типичные арильные группы включают C6-C12-углеводородные группы, в качестве неограничивающих примеров, такие как радикалы, полученные из бензола, замещенного бензола, нафталина, антрацена, бифенила и тому подобное.
«Арилалкил» относится ациклическому алкильному радикалу, в котором один из атомов азота, связанных с атомом углерода, обычно концевым или sp3-атомом углерода, замещен арильным радикалом. Характерные арилалкильные группы включают в качестве неограничивающих примеров бензил, 2-фенилэтан-1-ил, 2-фенилэтен-1-ил, нафтилметил, 2-нафтилэтан-1-ил, 2-нафтилэтен-1-ил, нафтобенизл, 2-нафтофенилэтан-1-ил и тому подобное. Арилалкильная группа содержит от 6 до 20 атомов углерода, например алкильная группа, включающая в себя алкильную, алкенильную или алкинильную группы, из арилалкильной группы состоит из от 1 до 6 атомов углерода, а арильная группа состоит из от 5 до 14 атомов углерода.
«Гетероарилалкил» относится к ациклическому алкильному радикалу, в котором один из атомов водорода, связанный с атомом углерода, обычно концевым или sp3-атомом углерода, замещен гетероарильным радикалом. Характерные гетероарилалкильные группы включают в качестве неограничивающих примеров 2-бензимидазолилметил, 2-фурилэтил и тому подобное. Гетероарилалкильная группа содержит от 6 до 20 атомов углерода, например алкильная группа, включающая в себя алкильную, алкенильную или алкинильную группы, гетероарилалкильной группы состоит из от 1 до 6 атомов углерода, а гетероарильная группа состоит из от 5 до 14 атомов углерода и от 1 до 3 гетероатомов выбраны из N, O, P и S. Гетероарильная группа гетероарилалкильной группы может представлять собой моноциклическую группу с количеством членов в кольце от 3 до 7 (от 2 до 6 атомов углерода) или бициклическую группу с количеством членов в кольцах от 7 до 10 (от 4 до 9 атомов углерода), и от 1 до 3 гетероатомов выбраны из N, O, P и S, например бициклическая [4,5], [5,5], [5,6] или [6,6] система.
Алкильная, алкиленовая, арильная, арилалкильная и гетероарилалкильная группы могут быть замещенными, где один или несколько атомов водорода, каждый независимо, замещены заместителем. Типичные заместители включают в качестве неограничивающих примеров -X, -R, -O-, -OR, -SR, -S-, -NR2, -NR3, =NR, -CX3, -CN, -OCN, -SCN, -N=C=O, -NCS, -NO, -NO2, =N2, -N3, -NC(=O)R, -C(=O)R, -C(=O)NR2, -SO3 -, -SO3H, -S(=O)2R, -OS(=O)2OR, -S(=O)2NR, -S(=O)R, -OP(=O)(OR)2, -P(=O)(OR)2, -PO3 -, -PO3H2, -C(=O)R, -C(=O)X, -C(=S)R, -CO2R, -CO2 -, -C(=S)OR, -C(=O)SR, -C(=S)SR, -C(=O)NR2, -C(=S)NR2, -C(=NR)NR2, где каждый X независимо представляет собой галоген: F, Cl, Br или I; и каждый R независимо представляет собой H, C1-C18-алкил, C6-C20-арил, C3-C14-гетероцикл, защитную группу или пролекарственное вещество. Алкиленовые, алкениленовые и алкиниленовые группы, такие как описанные выше, также могут быть замещены аналогичным образом.
«Гетероарил», также называемый гетероциклом или гетероциклилом, относится к радикалу циклической системы, в котором один или несколько атомов кольца представляют собой гетероатом, например азот, кислород или серу. Гетероарильный радикал содержит от 5 до 14 атомов углерода и от 1 до 3 гетероатомов, выбранных из N, O, P и S. Гетероарил может представлять собой моноцикл с количеством членов в цикле от 3 до 7 (от 2 до 6 атомов углерода и от 1 до 3 гетероатомов, выбранных из N, O, P и S) или бициклическую систему с количеством членов в кольцах от 7 до 10 (от 4 до 9 атомов углерода и от 1 до 3 гетероатомов, выбранных из N, O, P и S), например бициклическая [4,5], [5,5], [5,6] или [6,6] система. Гетероарильные соединения описаны Paquette, Leo A.; «Principles of Modern Heterocyclic Chemistry» (W.A. Benjamin, New York, 1968), в частности, в главах 1, 3, 4, 6, 7 и 9; «The Chemistry of Heterocyclic Compounds, A series of Monographs» (John Wiley & Sons, New York, с 1950 до настоящего времени), в особенности в номерах 13, 14, 16, 19 и 28 и J. Am. Chem. Soc. (1960) 82:5566.
«Линкер» или «связь» означает химическую группу, содержащую ковалентную связь или цепочку атомов, ковалентно присоединяющую антитело к лекарственному веществу. В различных вариантах осуществления линкер указан как L. Линкеры включают бивалентный радикал, такой как алкилен, арилен, гетероарилен, группы, такие как -(CR2)nO(CR2)n-, повторяющиеся единицы алкилокси (например, полиэтиленокси, PEG, полиметиленокси) и алкиламино (например, полиэтиленамино, Jeffamine™) и сложные эфиры и амиды двухосновных кислот, включающих в себя сукцинат, сукцинамид, дигликолат, малонат и капроамид.
Термин «хиральный» относится к молекулам со свойством несовпадения со своим зеркальным отражением, тогда как термин «ахиральный» относится к молекулам, которые совпадают со своим зеркальным отражением.
Термин «стереоизомеры» относится к соединениям с одинаковым химическим составом, но отличающимся пространственным расположением атомов или групп.
«Диастереомер» относится к стереоизомеру с двумя или более центрами хиральности и чьи молекулы не являются зеркальными отражениями друг друга. Диастереомеры обладают различными физическими свойствами, например точками плавления, точками кипения, спектральными свойствами и реакционноспособностью. Смеси диастереомеров можно разделить посредством высокоразрешающих аналитических процедур, таких как электрофорез и хроматография.
«Энантиомеры» относятся к двум стереоизомерам соединения, не совпадающим с зеркальными отражениями друг друга.
Стереохимические определения и соглашения, используемые в данном документе, в основном соответствуют S. P. Parker, Ed., McGraw-Hill Dictionary of Chemical Terms (1984) McGraw-Hill Book Company, New York и Eliel, E. and Wilen, S., Stereochemistry of Organic Compounds (1994) John Wiley & Sons, Inc., New York. Многие органические соединения существуют в оптически активных формах, то есть они обладают способностью вращать плоскость плоскополяризованного света. В описании оптически активного соединения префиксы D и L или R и S применяют для обозначения абсолютной конфигурации молекулы относительно ее хирального центра(ов). Префиксы d и l или (+) и (-) используют для обозначения знака вращения соединением плоскополяризованного света, где (-) или l означает, что соединение является левовращающим. Соединение, которому предшествует (+) или d, является правовращающим. Для заданной химической структуры эти стереоизомеры являются идентичными за исключением того, что они являются зеркальными отражениями друг друга. Конкретный стереоизомер также можно назвать энантиомером, а смесь таких изомеров часто называют энантиомерной смесью. Смесь энантиомеров 50:50 называют рацемической смесью или рацематом, который образуется, когда в химической реакции или химическом процессе отсутствует стереоселекция или стереоспецифичность. Термины «рацемическая смесь» и «рацемат» относятся к эквимолярной смеси двух энантиомерных молекул, лишенной оптической активности.
Как используется в данном документе фраза «фармацевтически приемлемая соль» относится к фармацевтически приемлемым органическим или неорганическим солям ADC. Иллюстративные соли включают в качестве неограничивающих примеров, соли сульфат, цитрат, ацетат, оксалат, хлорид, бромид, иодид, нитрат, бисульфат, фосфат, кислый фосфат, изоникотинат, лактат, салицилат, кислый цитрат, тартрат, олеат, таннат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкоуронат, сахаринат, формат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат (то есть 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)). Фармацевтически приемлемая соль может включать в себя введение другой молекулы, такой как ацетат-ион или сукцинат-ион или другой противоион. Противоион может представлять собой любую органическую или неорганическую группу, которая стабилизирует заряд исходного соединения. Кроме того, в структуре фармацевтически приемлемой соли может присутствовать более одного заряженного атома. В тех случаях, когда частью фармацевтически приемлемой соли являются несколько заряженных атомов, могут присутствовать несколько противоионов. Таким образом, в фармацевтически приемлемой соли могут присутствовать один или несколько заряженных атомов и/или один или несколько противоионов.
«Фармацевтически приемлемый сольват» относится к ассоциации одного или нескольких молекул растворителя и ADC. Примеры растворителей, образующих фармацевтически приемлемые сольваты, включают в качестве неограничивающих примеров воду, изопропанол, этанол, метанол, DMSO, этилацетат, уксусную кислоту и этаноламин.
КОНЪЮГАТЫ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО
Соединения по настоящему изобретению включают соединения с противоопухолевой активностью. Конкретно, соединения включают антитело, конъюгированное, то есть ковалентно присоединенное с помощью линкера, к лекарственному веществу, где лекарственное средство, если не конъюгировано с антителом, обладает цитотоксическим или цитостатическим действием. Таким образом, биологическая активность лекарственного вещества конъюгацией с антителом модулируется. Конъюгаты антитело-лекарственное средство (ADC) по изобретению могут селективно доставлять эффективную дозу цитотоксического средства к опухолевой ткани благодаря большей селективности, то есть эффект может быть достигнут при меньшей дозе.
В одном из вариантов осуществления увеличена биодоступность ADC или внутриклеточного метаболита ADC у млекопитающего по сравнению с одним соответствующим майтаназоидным соединением. Также увеличена биодоступность ADC или внутриклеточного метаболита ADC у млекопитающего по сравнению с одним соответствующим антителом (антитело ADC без лекарственного вещества или линкера).
В одном из вариантов осуществления майтаназоидное лекарственное средство ADC не отщепляется от антитела до тех пор, пока конъюгат антитело-лекарственное средство не свяжется с рецептором на клеточной поверхности или не попадет в клетку вместе с рецептором на клеточной поверхности, специфичным для антитела конъюгата антитело-лекарственное средство. Лекарственное вещество может отщепляться от антитела после того, как конъюгат антитело-лекарственное средство попадет в клетку. Майтаназоидное лекарственное средство у млекопитающих может внутриклеточно отщепляться от антитела соединения или становиться внутриклеточным метаболитом соединения под действием ферментов посредством гидролиза, окисления или другого механизма. Например, но не ограничивая изобретение конкретным механизмом действия, атом серы майтаназоидного лекарственного средства ADC можно окислять до сульфоновой или сульфоксидной группы. Протоны на атомах углерода, связанных с сульфоном или сульфоксидом, могут удаляться в условиях общего или ферментативного катализа внутри клетки и приводить к фрагментации посредством бета-отщепления, отщепляющего и отделяющего лекарственное вещество от антитела из ADC. Альтернативно сходные механизмы фрагментации/отщепления внутри клетки могут осуществлять другие удаляющие электроны группы, такие как амиды в линкере.
Конъюгаты антитело-лекарственное средство (ADC) могут быть представлены формулой I:
|
или ее фармацевтически приемлемыми солью или сольватом, где
Ab представляет собой антитело, связывающееся с рецептором ErbB или связывающееся с одним или несколькими ассоциированными с опухолями антигенами или рецепторами на клеточной поверхности, выбранными из (1)-(36):
(1) BMPR1B (рецептор морфогенетического белка кости типа IB, инвентарный номер Genbank NM_001203);
(2) E16 (LAT1, SLC7A5, инвентарный номер Genbank NM_003486);
(3) STEAP1 (шестой трансмембранный антиген предстательной железы, инвентарный номер Genbank NM_012449);
(4) 0772P (CA125, MUC16, инвентарный номер Genbank AF361486);
(5) MPF (MPF, MSLN, SMR, потенцирующий фактор мегакариоцитов, мезотелин, инвентарный номер Genbank NM_005823);
(6) Napi3b (NAPI-3B, NPTIIb, SLC34A2, семейство растворимых носителей 34 (фосфат натрия), представитель 2, натрийзависимый переносчик фосфата 3b типа II, инвентарный номер Genbank NM_006424);
(7) Sema 5b (FLJ10372, KIAA1445, Mm.42015, SEMA5B, SEMAG, семафорин 5b Hlog, домен sema, семь тромбоспондиновых повторов (типа 1 и подобные типу 1), трансмембранный домен (TM) и короткий цитоплазматический домен, (семафорин) 5B, инвентарный номер Genbank AB040878);
(8) PSCA hlg (2700050C12Rik, C530008O16Rik, RIKEN кДНК 2700050C12, ген RIKEN кДНК 2700050C12, инвентарный номер Genbank AY358628);
(9) ETBR (рецептор эндотелина типа B, инвентарный номер Genbank AY275463);
(10) MSG783 (RNF124, гипотетический белок FLJ20315, инвентарный номер Genbank NM_017763);
(11) STEAP2 (HGNC_8639, IPCA-1, PCANAP1, STAMP1, STEAP2, STMP, ассоциированный со злокачественной опухолью предстательной железы ген 1, ассоциированный со злокачественной опухолью предстательной железы белок 1, шестой трансмембранный эпителиальный антиген предстательной железы 2, шестой трансмембранный эпителиальный белок предстательной железы, инвентарный номер Genbank AF455138);
(12) TrpM4 (BR22450, FLJ20041, TRPM4, TRPM4B, временный рецепторный потенциальный катионный канал, подсемейство M, представитель 4, инвентарный номер Genbank NM_017636);
(13) CRIPTO (CR, CR1, CRGF, CRIPTO, TDGF1, полученный из тератокарциномы фактор роста, инвентарный номер Genbank NP_003203 или NM_003212);
(14) CD21 (CR2 (рецептор комплемента 2) или C3DR (C3d/рецептор вируса Эпштейна-Барр) или Hs.73792, инвентарный номер Genbank M26004);
(15) CD79b (CD79B, CD79β, IGb (ассоциированный с иммуноглобулином бета), B29, инвентарный номер Genbank NM_000626);
(16) FcRH2 (IFGP4, IRTA4, SPAP1A (содержащий домен SH2 фосфатазный якорный белок 1a), SPAP1B, SPAP1C, инвентарный номер Genbank NM_030764);
(17) HER2 (инвентарный номер Genbank M11730);
(18) NCA (инвентарный номер Genbank M18728);
(19) MDP (инвентарный номер Genbank BC017023);
(20) IL20Rα (инвентарный номер Genbank AF184971);
(21) Бревикан (инвентарный номер Genbank AF229053);
(22) EphB2R (инвентарный номер Genbank NM_004442);
(23) ASLG659 (инвентарный номер Genbank AX092328);
(24) PSCA (инвентарный номер Genbank AJ297436);
(25) GEDA (инвентарный номер Genbank AY260763;
(26) BAFF-R (рецептор активирующего B-клетки фактора, рецептор BLyS 3, BR3, NP_443177.1);
(27) CD22 (изоформа B-клеточного рецептора CD22-B, NP-001762.1);
(28) CD79a (CD79A, CD79α, ассоциированный с иммуноглобулинами альфа, специфичный для B-клеток белок, ковалентно взаимодействующий с Ig бета (CD79B) и образующий комплекс на поверхности с молекулами IgM, переносит сигнал, вовлеченный в дифференцировку B-клеток, инвентарный номер Genbank NP_001774.1);
(29) CXCR5 (рецептор лимфомы Беркита 1, рецептор, связанный с G-белком, активирующийся хемокином CXCL13, действующий при миграции лимфоцита и в гуморальной защите, играющий роль в инфекции HIV-2 и, возможно, развитии СПИДа, лимфомы, миеломы и лейкоза, инвентарный номер Genbank NP_001707.1);
(30) HLA-DOB (бета-субъединица молекулы MHC класса II (антиген Ia), связывающая пептиды и представляющая их CD4+ T-лимфоцитам, инвентарный номер Genbank NP_002111.1);
(31) P2X5 (пуринергический рецепторный P2X лигандзависимый ионный канал 5, ионный канал, управляемый внеклеточной АТФ, может быть вовлечен в синаптическую передачу и нейрогенез, дефицит может вносить вклад в патофизиологию идиопатической нестабильности детрузора, инвентарный номер Genbank NP_002552.2);
(32) CD72 (антиген дифференцировки B-клеток CD72, Lyb-2, инвентарный номер Genbank NP_001773.1);
(33) LY64 (лимфоцитарный антиген 64 (RP105), мембранный белок семейства белков с богатыми лейцином повторами (LRR) типа I, регулирует активацию и апоптоз B-клеток, потеря функции ассоциирована с увеличенной активностью заболевания у пациентов с системной красной волчанкой, инвентарный номер Genbank NP_005573.1);
(34) FcRH1 (белок подобный рецептору Fc 1, предполагаемый рецептор домена Fc иммуноглобулинов, содержащий подобные Ig и ITAM домены типа C2, может играть роль в дифференцировке B-лимфоцитов, инвентарный номер Genbank NP_443170.1);
(35) IRTA2 (ассоциированный с транслокацией рецептор из иммуноглобулинового суперсемейства 2, предполагаемый иммунорецептор с возможной ролью в развитии B-клеток и лимфомагенезе; нарушение регуляции гена посредством транслокации происходит в некоторых B-клеточных злокачественных опухолях, инвентарный номер Genbank NP_112571.1); и
(36) TENB2 (возможный трансмембранный протеогликан, родственный семейству ростовых факторов EGF/херегулин и фоллистатину, инвентарный номер Genbank AF179274);
при условии, что антитело не представляет собой TA.1.
L не является дисульфидным линкером. L в качестве неограничивающих примеров включает структуры:
где волнистые линии указывают на ковалентные связи с Ab и D;
X представляет собой:
Y представляет собой
R независимо представляет собой H или C1-C6-алкил; а n равно от 1 до 12;
D представляет собой майтаназоидное лекарственное средство. Майтанзиноиды включают в качестве неограничивающих примеров структуру:
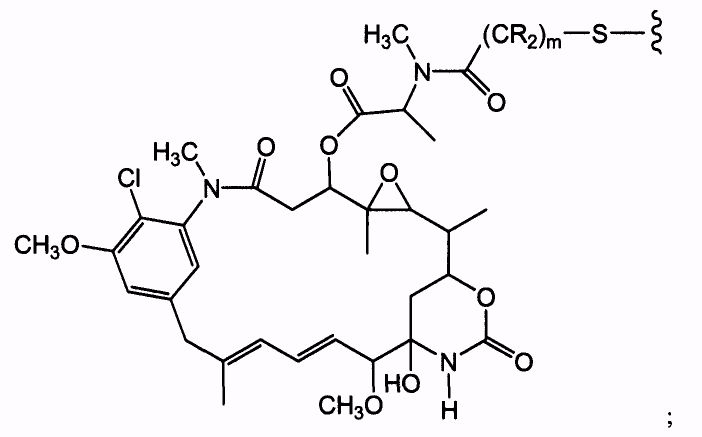
где волнистая линия обозначает ковалентную связь с L;
R независимо представляет собой H или C1-C6-алкил; и
m равно 1, 2 или 3.
Соотношение лекарства и антитела или нагрузки лекарственным средством для соединений формулы I представлено посредством p. Значение нагрузки лекарственным средством p составляет от 1 до 8. Соединения формулы I включают все смеси по разному нагруженных и присоединенных конъюгатов антитело-лекарственное средство, где к антителу ковалентно присоединены 1, 2, 3, 4, 5, 6, 7 и 8 лекарственных групп.
В другом варианте осуществления Ab представляет собой антитело, связывающееся с одним или несколькими ассоциированными с опухолями антигенами или рецепторами на клеточной поверхности, выбранными из (1)-(16) и (18)-(36), то есть не с рецептором ErbB, включая HER2.
АНТИТЕЛА
Часть из молекулы антитела (Ab-) формулы I включает в свои рамки любую молекулу антитела, которая связывает или реактивно связывается, или образует комплексы с рецептором, антигеном или другими реактивными компонентами, связанными с данной группой клеток-мишеней. Антитело может представлять собой любую белковую или подобную белковой молекулу, которая связывается, образует комплексы или реагирует с компонентом клеточной группы, которую рассматривают для терапевтической или другой биологической модификации. В одном из аспектов молекула антитела действует для доставки майтаназоидного лекарственного средства к конкретной группе клеток-мишеней, с которыми молекула антитела реагирует. Такие антитела включают в качестве неограничивающих примеров белки большой молекулярной массы, такие как полноразмерные антитела и фрагменты антител.
Содержащие антитела конъюгаты антитело-лекарственное средство по настоящему изобретению предпочтительно сохраняют антигенсвязывающую способность их природных эквивалентов дикого типа. Таким образом, антитела по настоящему изобретению способны связывать, предпочтительно специфически, антигены. Такие антигены включают, например, ассоциированные с опухолями антигены (TAA), рецепторные белки клеточной поверхности и другие молекулы клеточной поверхности, факторы, регулирующие жизнеспособность клеток, факторы, регулирующие клеточную пролиферацию, факторы, молекулы, связанные (например, известные или с предполагаемым функциональным вкладом) с развитием или дифференцировкой тканей, лимфокинами, цитокинами, молекулами, вовлеченными в регуляцию клеточного цикла, молекулами, вовлеченными в образование и развитие сосудов, и молекулы, связанные (например, известные или с предполагаемым функциональным вкладом) с ангиогенезом. Ассоциированный с опухолью антиген может представлять собой фактор кластерной дифференцировки (то есть CD-белок). Антиген, с которым способно связываться антитело по изобретению, может представлять собой представителя подмножества одной из указанных выше категорий, где другое подмножество(а) указанной категории содержит другие молекулы/антигены, которые обладают отличающейся характеристикой (по сравнению с представляющим интерес антигеном).
В одном из вариантов осуществления, антитело конъюгатов антитело-лекарственное средство (ADC) специфически связывается с рецептором, кодируемым геном ErbB. Антитело может специфически связываться с рецептором ErbB, выбранным из EGFR, HER2, HER3 и HER4. ADC может специфически связываться с внеклеточным доменом (ECD) рецептора HER2 и ингибировать рост опухолевых клеток, сверхэкспрессирующих рецептор HER2. Антитело ADC может представлять собой моноклональное антитело, например моноклональное антитело, химерное антитело или гуманизированное антитело. Гуманизированное антитело может представлять собой huMAb4D5-1, huMAb4D5-2, huMAb4D5-3, huMAb4D5-4, huMAb4D5-5, huMAb4D5-6, huMAb4D5-7 или huMAb4D5-8 (трастузумаб). Антитело может представлять собой фрагмент антитела, например Fab-фрагмент.
Антитела в конъюгатах антитело-лекарственное средство (ADC) формулы I, которые могут быть эффективны для лечения злокачественных опухолей, включают в качестве неограничивающих примеров антитела к рецепторам клеточной поверхности и ассоциированным с опухолями антигенам (TAA). Такие ассоциированные с опухолями антигены известны в данной области и могут быть получены для образования антител способами, известными в данной области, и информации, известной в данной области. Попытки исследователей обнаружить эффективные клеточные мишени для диагностики и лечения злокачественных опухолей были направлены на идентификацию трансмембранных или другим образом ассоциированных с опухолями полипептидов, специфически экспрессируемых на поверхности одного или нескольких конкретных типов клеток злокачественных опухолей по сравнению с одной или несколькими нормальными незлокачественными клетками. Часто экспрессия таких ассоциированных с опухолью полипептидов на поверхности клеток злокачественных опухолей выше, чем экспрессия на поверхности незлокачественных клеток. Идентификация таких ассоциированных с опухолью антигенных полипептидов клеточной поверхности дала возможность специфического нацеливания на клетки злокачественных опухолей для разрушения с помощью способов лечения, основанных на антителах.
Примеры TAA включают в качестве неограничивающих примеров перечисленные ниже антигены, ассоциированные с опухолями (1)-(36). Для удобства информация об этих антигенах, каждый из которых известны в данной области, перечислена ниже и включает название антигена, альтернативное название, инвентарный номер Genbank и первичную ссылку(и), в соответствии с правилами идентификации последовательностей нуклеиновых кислот и белков National Center for Biotechnology Information (NCBI). Последовательности нуклеиновых кислот и белков, соответствующие TAA (1)-(36), представлены в общедоступных базах данных, таких как GenBank. Ассоциированные с опухолями антигены, являющиеся мишенью антител, включают все варианты аминокислотных последовательностей и изоформ, которые по меньшей мере приблизительно на 70%, 80%, 85%, 90% или 95% идентичны последовательности, идентифицированной в цитируемых ссылках, или которые обладают, по существу, такими же биологическими свойствами и характеристиками, что и TAA с последовательностью, найденной в цитируемых ссылках. Например, TAA с вариантной последовательностью, как правило, способно специфически связываться с антителом, специфически связывающимся с TAA с соответствующей последовательностью в списке. Последовательности и описания ссылок, конкретно перечисленных в данном документе, приведены в качестве ссылки в полном объеме.
АССОЦИИРОВАННЫЕ С ОПУХОЛЯМИ АНТИГЕНЫ (1)-(36):
(1) BMPR1B (рецептор морфогенетического белка кости типа IB, инвентарный номер Genbank NM_001203);
ten Dijke, R, et al. Science 264 (5155):101-104 (1994), Oncogene 14 (11):1377-1382 (1997)); WO 2004063362 (пункт 2); WO 2003042661 (пункт 12); US 2003134790-A1 (страницы 38-39); WO 2002102235 (пункт 13; страница 296); WO 2003055443 (страница 91-92); WO 200299122 (пример 2; страница 528-530); WO 2003029421 (пункт 6); WO 2003024392 (пункт 2; фиг. 112); WO 200298358 (пункт 1; страница 183); WO 200254940 (страницы 100-101); WO 200259377(страницы 349-350); WO 200230268 (пункт 27; страница 376); WO 200148204 (пример; фиг. 4);
NP_001194 рецептор морфогенетического белка кости, тип IB /pid=NP_001194.1 -
Перекрестные ссылки: MIM:603248; NP_001194.1; AY065994
(2) E16 (LAT1, SLC7A5, инвентарный номер Genbank NM_003486);
Biochem. Biophys. Res. Commun. 255 (2), 283-288 (1999), Nature 395 (6699):288-291 (1998), Gaugitsch, H.W., et al. (1992) J. Biol. Chem. 267 (16):11267-11273); WO 2004048938 (пример 2); WO 2004032842 (пример IV); WO 2003042661 (пункт 12); WO 2003016475 (пункт 1); WO 200278524 (пример 2); WO 200299074 (пункт 19; страницы 127-129); WO 200286443 (пункт 27; страницы 222, 393); WO 2003003906 (пункт 10; страница 293); WO 200264798 (пункт 33; страницы 93-95); WO 200014228 (пункт 5; страницы 133-136); US2003224454 (фиг. 3); WO 2003025138 (пункт 12; страница 150); патент США № 20050107595; патент США № 20050106644;
NP_003477 семейство растворимых носителей 7 (катионный переносчик аминокислот, система y+), представитель 5 /pid=NP_003477.3 - Homo sapiens
Перекрестные ссылки: MIM:600182; NP_003477.3; NM_015923; NM_003486_1
(3) STEAP1 (шестой трансмембранный антиген предстательной железы, инвентарный номер Genbank NM_012449);
Cancer Res. 61 (15), 5857-5860 (2001), Hubert, R.S., et al. (1999) Proc. Natl. Acad. Sci. USA 96 (25):14523-14528); WO 2004065577 (пункт 6); WO 2004027049 (фиг. 1L); EP 1394274 (пример 11); WO 2004016225 (пункт 2); WO 2003042661 (пункт 12); US 2003157089 (пример 5); US 2003185830 (пример 5); US 2003064397 (фиг. 2); WO200289747 (пример 5; страницы 618-619); WO 2003022995 (пример 9; фиг. 13A, пример 53; страница 173, пример 2; фиг. 2A);
NP_036581 шестой трансмембранный антиген предстательной железы
Перекрестные ссылки: MIM:604415; NP_036581.1; NM_012449_1
(4) 0772P (CA125, MUC16, инвентарный номер Genbank AF361486)
J. Biol. Chem. 276 (29):27371-27375 (2001)); WO 2004045553 (пункт 14); WO 200292836 (пункт 6; фиг. 12); WO 200283866 (пункт 15; страница 116-121); US 2003124140 (пример 16); US 2003091580 (пункт 6); WO 200206317 (пункт 6; страницы 400-408);
Перекрестные ссылки: GI:34501467; AAK74120.3; AF361486_1
(5) MPF (MPF, MSLN, SMR, потенцирующий фактор мегакариоцитов, мезотелин, инвентарный номер Genbank NM_005823);
Yamaguchi, N., et al. Biol. Chem. 269 (2), 805-808 (1994), Proc. Natl. Acad. Sci. USA 96 (20):11531-11536 (1999), Proc. Natl. Acad. Sci. USA 93 (1):136-140 (1996), J. Biol. Chem. 270 (37):21984-21990 (1995)); WO 2003101283 (пункт 14); (WO 2002102235 (пункт 13; страницы 287-288); WO 2002101075 (пункт 4; страницы 308-309); WO 200271928 (страницы 320-321); WO 9410312 (страницы 52-57);
Перекрестные ссылки: MIM:601051; NP_005814.2; NM_005823_1
(6) Napi3b (NAPI-3B, NPTIIb, SLC34A2, семейство растворимых носителей 34 (фосфат натрия), представитель 2, натрийзависимый переносчик фосфата 3b типа II, инвентарный номер Genbank NM_006424);
J. Biol. Chem. 277 (22):19665-19672 (2002), Genomics 62 (2):281-284 (1999), Feild, J.A., et al. (1999) Biochem. Biophys. Res. Commun. 258 (3):578-582); WO 2004022778 (пункт 2); EP 1394274 (пример 11); WO 2002102235 (пункт 13; страница 326); EP 875569 (пункт 1; страницы 17-19); WO 200157188 (пункт 20; страница 329); WO2004032842 (пример IV); WO 200175177 (пункт 24; страницы 139-140);
Перекрестные ссылки: MIM:604217; NP_006415.1; NM_006424_1
(7) Sema 5b (FLJ10372, KIAA1445, Mm.42015, SEMA5B, SEMAG, семафорин 5b Hlog, домен sema, семь тромбоспондиновых повторов (типа 1 и подобные типу 1), трансмембранный домен (TM) и короткий цитоплазматический домен, (семафорин) 5B, инвентарный номер Genbank AB040878)
Nagase T., et al. (2000) DNA Res. 7 (2):143-150); WO 2004000997 (пункт 1); WO 2003003984 (пункт 1); WO 200206339 (пункт 1; страница 50); WO 200188133 (пункт 1; страницы 41-43, 48-58); WO 2003054152 (пункт 20); WO 2003101400 (пункт 11);
Доступ: Q9P283; EMBL; AB040878; BAA95969.1. Genew; HGNC:10737;
(8) PSCA hlg (2700050C12Rik, C530008O16Rik, RIKEN кДНК 2700050C12, ген RIKEN кДНК 2700050C12, инвентарный номер Genbank AY358628);
Ross et al. (2002) Cancer Res. 62:2546-2553; US 2003129192 (пункт 2); US 2004044180 (пункт 12); US 2004044179 (пункт 11); US 2003096961 (пункт 11); US 2003232056 (пример 5); WO 2003105758 (пункт 12); US 2003206918 (пример 5); EP 1347046 (пункт 1); WO 2003025148 (пункт 20);
Перекрестные ссылки: GI:37182378; AAQ88991.1; AY358628_1
(9) ETBR (рецептор эндотелина типа B, инвентарный номер Genbank AY275463);
Nakamuta M., et al. Biochem. Biophys. Res. Commun. 177, 34-39, 1991; Ogawa Y., et al. Biochem. Biophys. Res. Commun. 178, 248-255, 1991; Arai H., et al. Jpn. Circ. J. 56, 1303-1307, 1992; Arai H., et al. J. Biol. Chem. 268, 3463-3470, 1993; Sakamoto A., Yanagisawa M., et al. Biochem. Biophys. Res. Commun. 178, 656-663, 1991; Elshourbagy N.A., et al. J. Biol. Chem. 268, 3873-3879, 1993; Haendler B., et al. J. Cardiovasc. Pharmacol. 20, s1-S4, 1992; Tsutsumi M., et al. Gene 228, 43-49, 1999; Strausberg R.L., et al. Proc. Natl. Acad. Sci. U.S.A. 99, 16899-16903, 2002; Bourgeois C, et al. J. Clin. Endocrinol. Metab. 82, 3116-3123, 1997; Okamoto Y., et al. Biol. Chem. 272, 21589-21596, 1997; Verheij J.B., et al. Am. J. Med. Genet. 108, 223-225, 2002; Hofstra R.M.W., et al. Eur. J. Hum. Genet. 5, 180-185, 1997; Puffenberger E.G., et al. Cell 79, 1257-1266, 1994; Attie T., et al., Hum. Mol. Genet. 4, 2407-2409, 1995; Auricchio A., et al. Hum. Mol. Genet. 5:351-354, 1996; Amiel J., et al. Hum. Mol. Genet. 5, 355-357, 1996; Hofstra R.M.W., et al. Nat. Genet. 12, 445-447, 1996; Svensson P.J., et al. Hum. Genet. 103, 145-148, 1998; Fuchs S., et al. Mol. Med. 7, 115-124, 2001; Pingault V., et al. (2002) Hum. Genet. 111, 198-206; WO 2004045516 (пункт 1); WO 2004048938 (пример 2); WO 2004040000 (пункт 151); WO 2003087768 (пункт 1); WO 2003016475 (пункт 1); WO 2003016475 (пункт 1); WO 200261087 (фиг. 1); WO 2003016494 (фиг. 6); WO 2003025138 (пункт 12; страница 144); WO 200198351 (пункт 1; страницы 124-125); EP 522868 (пункт 8; фиг. 2); WO 200177172 (пункт 1; страницы 297-299); US 2003109676; US 6518404 (фиг. 3); US 5773223 (пункт 1a; кол. 31-34); WO 2004001004;
(10) MSG783 (RNF124, гипотетический белок FLJ20315, инвентарный номер Genbank NM_017763);
WO 2003104275 (пункт 1); WO 2004046342 (пример 2); WO 2003042661 (пункт 12); WO 2003083074 (пункт 14; страница 61); WO 2003018621 (пункт 1); WO 2003024392 (пункт 2; фиг. 93); WO 200166689 (пример 6);
Перекрестные ссылки: LocusID:54894; NP_060233.2; NM_017763_1
(11) STEAP2 (HGNC_8639, IPCA-1, PCANAP1, STAMP1, STEAP2, STMP, ассоциированный со злокачественной опухолью предстательной железы ген 1, ассоциированный со злокачественной опухолью предстательной железы белок 1, шестой трансмембранный эпителиальный антиген предстательной железы 2, шестой трансмембранный эпителиальный белок предстательной железы, инвентарный номер Genbank AF455138);
Lab. Invest. 82 (11):1573-1582 (2002)); WO 2003087306; US 2003064397 (пункт 1; фиг. 1); WO 200272596 (пункт 13; страницы 54-55); WO 200172962 (пункт 1; фиг. 4B); WO 2003104270 (пункт 11); WO 2003104270 (пункт 16); US 2004005598 (пункт 22); WO 2003042661 (пункт 12); US 2003060612 (пункт 12; фиг. 10); WO 200226822 (пункт 23; фиг. 2); WO 200216429 (пункт 12; фиг. 10);
Перекрестные ссылки: GI:22655488; AAN04080.1; AF455138_1
(12) TrpM4 (BR22450, FLJ20041, TRPM4, TRPM4B, временный рецепторный потенциальный катионный канал, подсемейство M, представитель 4, инвентарный номер Genbank NM_017636);
Xu, X.Z., et al. Proc. Natl. Acad. Sci. USA 98 (19):10692-10697 (2001), Cell 109 (3):397-407 (2002), J. Biol. Chem. 278 (33):30813-30820 (2003)); US 2003143557 (пункт 4); WO 200040614 (пункт 14; страница 100-103); WO 200210382 (пункт 1; фиг. 9A); WO 2003042661 (пункт 12); WO 200230268 (пункт 27; страница 391); US 2003219806 (пункт 4); WO 200162794 (пункт 14; фиг. 1A-D);
Перекрестные ссылки: MIM:606936; NP_060106.2; NM_017636_1
(13) CRIPTO (CR, CR1, CRGF, CRIPTO, TDGF1, полученный из тератокарциномы фактор роста, инвентарный номер Genbank NP_003203 или NM_003212);
Ciccodicola, A., et al. EMBO J. 8 (7): 1987-1991 (1989), Am. J. Hum. Genet. 49 (3):555-565 (1991)); US 2003224411 (пункт 1); WO 2003083041 (пример 1); WO 2003034984 (пункт 12); WO 200288170 (пункт 2; страницы 52-53); WO 2003024392 (пункт 2; фиг. 58); WO 200216413 (пункт 1; страницы 94-95, 105); WO 200222808 (пункт 2; фиг. 1); US 5854399 (пример 2; колонки 17-18); US 5792616 (фиг. 2);
Перекрестные ссылки: MIM:187395; NP_003203.1; NM_003212_1
(14) CD21 (CR2 (рецептор комплемента 2) или C3DR (C3d/рецептор вируса Эпштейна-Барр) или Hs.73792, инвентарный номер Genbank M26004);
Fujisaku et al. (1989) J. Biol. Chem. 264 (4):2118-2125); Weis J.J., et al. J. Exp. Med. 167, 1047-1066, 1988; Moore M., et al. Proc. Natl. Acad. Sci. USA 84, 9194-9198, 1987; Barel M., et al. Mol. Immunol. 35, 1025-1031, 1998; Weis J.J., et al. Proc. Natl. Acad. Sci. USA 83, 5639-5643, 1986; Sinha S.K., et al. (1993) J. Immunol. 150, 5311-5320; WO 2004045520 (пример 4); US 2004005538 (пример 1); WO 2003062401 (пункт 9); WO 2004045520 (пример 4); WO 9102536 (фиг. 9.1-9.9); WO 2004020595 (пункт 1);
Доступ: P20023; Q13866; Q14212; EMBL; M26004; AAA35786.1.
(15) CD79b (CD79B, CD79β, IGb (ассоциированный с иммуноглобулином бета), B29, инвентарный номер Genbank NM_000626 или 11038674);
Proc. Natl. Acad. Sci. U.S.A. (2003) 100 (7):4126-4131, Blood (2002) 100 (9):3068-3076, Muller et al. (1992) Eur. J. Immunol. 22 (6):1621-1625); WO 2004016225 (пункт 2, фиг. 140); WO 2003087768, US 2004101874 (пункт 1, страница 102); WO 2003062401 (пункт 9); WO 200278524 (пример 2); US 2002150573 (пункт 5, страница 15); US 5644033; WO 2003048202 (пункт 1, страницы 306 и 309); WO 99/558658, US 6534482 (пункт 13, фиг. 17A/B); WO 200055351 (пункт 11, страницы 1145-1146);
Перекрестные ссылки: MIM:147245; NP_000617.1; NM_000626_1
(16) FcRH2 (IFGP4, IRTA4, SPAP1A (содержащий домен SH2 фосфатазный якорный белок 1a), SPAP1B, SPAP1C, инвентарные номера Genbank NM_030764, AY358130);
Genome Res. 13 (10):2265-2270 (2003), Immunogenetics 54 (2):87-95 (2002), Blood 99 (8):2662-2669 (2002), Proc. Natl. Acad. Sci. USA 98 (17):9772-9777 (2001), Xu, M.J., et al. (2001) Biochem. Biophys. Res. Commun. 280 (3):768-775; WO 2004016225 (пункт 2); WO 2003077836; WO 200138490 (пункт 5; фиг. 18D-1-18D-2); WO 2003097803 (пункт 12); WO 2003089624 (пункт 25);
Перекрестные ссылки: MIM:606509; NP_110391.2; NM_030764_1
(17) HER2 (ErbB2, инвентарный номер Genbank M11730)
Coussens L., et al. Science (1985) 230(4730):1132-1139); Yamamoto T., et al. Nature 319, 230-234, 1986; Semba K., et al. Proc. Natl. Acad. Sci. USA 82, 6497-6501, 1985; Swiercz J.M., et al. J. Cell Biol. 165, 869-880, 2004; Kuhns J.J., et al. J. Biol. Chem. 274, 36422-36427, 1999; Cho H.-S., et al. Nature 421, 756-760, 2003; Ehsani A., et al. (1993) Genomics 15, 426-429; WO 2004048938 (пример 2); WO 2004027049 (фиг. 11); WO 2004009622; WO 2003081210; WO 2003089904 (пункт 9); WO 2003016475 (пункт 1); US 2003118592; WO 2003008537 (пункт 1); WO 2003055439 (пункт 29; фиг. 1A-B); WO 2003025228 (пункт 37; фиг. 5C); WO 200222636 (пример 13; страницы 95-107); WO 200212341 (пункт 68; фиг. 7); WO 200213847 (страницы 71-74); WO 200214503 (страницы 114-117); WO 200153463 (пункт 2; страницы 41-46); WO 200141787 (страница 15); WO 200044899 (пункт 52; фиг. 7); WO 200020579 (пункт 3; фиг. 2); US 5869445 (пункт 3; Col 31-38); WO 9630514 (пункт 2; страницы 56-61); EP 1439393 (пункт 7); WO 2004043361 (пункт 7); WO 2004022709; WO 200100244 (пример 3; фиг. 4);
Доступ: P04626; EMBL; M11767; AAA35808.1. EMBL; M11761; AAA35808.1.
(18) NCA (CEACAM6, инвентарный номер Genbank M18728);
Barnett T., et al. Genomics 3, 59-66, 1988; Tawaragi Y., et al. Biochem. Biophys. Res. Commun. 150, 89-96, 1988; Strausberg R.L., et al. Proc. Natl. Acad. Sci. USA 99:16899-16903, 2002; WO 2004063709; EP 1439393 (пункт 7); WO 2004044178 (пример 4); WO 2004031238; WO 2003042661 (пункт 12); WO 200278524 (пример 2); WO 200286443 (пункт 27; страница 427); WO 200260317 (пункт 2);
Доступ: P40199; Q14920; EMBL; M29541; AAA59915.1. EMBL; M18728;
(19) MDP (DPEP1, инвентарный номер Genbank BC017023)
Proc. Natl. Acad. Sci. USA 99 (26):16899-16903 (2002)); WO 2003016475 (пункт 1); WO 200264798 (пункт 33; страницы 85-87); JP 05003790 (фиг. 6-8); WO 9946284 (фиг. 9);
Перекрестные ссылки: MIM:179780; AAH17023.1; BC017023_1
(20) IL20Rα (IL20Ra, ZCYTOR7, инвентарный номер Genbank AF184971);
Clark H.F., et al. Genome Res. 13, 2265-2270, 2003; Mungall A.J., et al. Nature 425, 805-811, 2003; Blumberg H., et al. Cell 104, 9-19, 2001; Dumoutier L., et al. J. Immunol. 167, 3545-3549, 2001; Parrish-Novak J., et al. J. Biol. Chem. 277, 47517-47523, 2002; Pletnev S., et al. (2003) Biochemistry 42:12617-12624; Sheikh F., et al. (2004) J. Immunol. 172, 2006-2010; EP 1394274 (пример 11); US 2004005320 (пример 5); WO 2003029262 (страницы 74-75); WO 2003002717 (пункт 2; страница 63); WO 200222153 (страницы 45-47); US 2002042366 (страницы 20-21); WO 200146261 (страницы 57-59); WO 200146232 (страницы 63-65); WO 9837193 (пункт 1; страницы 55-59);
Доступ: Q9UHF4; Q6UWA9; Q96SH8; EMBL; AF184971; AAF01320.1.
(21) Бревикан (BCAN, BEHAB, инвентарный номер Genbank AF229053)
Gary S.C., et al. Gene 256, 139-147, 2000; Clark H.F., et al. Genome Res. 13, 2265-2270, 2003; Strausberg R.L., et al. Proc. Natl. Acad. Sci. USA 99, 16899-16903, 2002; US 2003186372 (пункт 11); US 2003186373 (пункт 11); US 2003119131 (пункт 1; фиг. 52); US 2003119122 (пункт 1; фиг. 52); US 2003119126 (пункт 1); US 2003119121 (пункт 1; фиг. 52); US 2003119129 (пункт 1); US 2003119130 (пункт 1); US 2003119128 (пункт 1; фиг. 52); US 2003119125 (пункт 1); WO 2003016475 (пункт 1); WO 200202634 (пункт 1);
(22) EphB2R (DRT, ERK, Hek5, EPHT3, Tyro5, инвентарный номер Genbank NM_004442)
Chan, J. и Watt, V.M., Oncogene 6 (6), 1057-1061 (1991) Oncogene 10 (5):897-905 (1995), Annu. Rev. Neurosci. 21:309-345 (1998), Int. Rev. Cytol. 196:177-244 (2000)); WO 2003042661 (пункт 12); WO 200053216 (пункт 1; страница 41); WO 2004065576 (пункт 1); WO 2004020583 (пункт 9); WO 2003004529 (страницы 128-132); WO 200053216 (пункт 1; страница 42);
Перекрестные ссылки: MIM:600997; NP_004433.2; NM_004442_1
(23) ASLG659 (B7h, инвентарный номер Genbank AX092328)
US 20040101899 (пункт 2); WO 2003104399 (пункт 11); WO 2004000221 (фиг. 3); US 2003165504 (пункт 1); US 2003124140 (пример 2); US 2003065143 (фиг. 60); WO 2002102235 (пункт 13; страница 299); US 2003091580 (пример 2); WO 200210187 (пункт 6; фиг. 10); WO 200194641 (пункт 12; фиг. 7b); WO 200202624 (пункт 13; фиг. 1A-1B); US 2002034749 (пункт 54; страницы 45-46); WO 200206317 (пример 2; страница 320-321, пункт 34; страницы 321-322); WO 200271928 (страницы 468-469); WO 200202587 (пример 1; фиг. 1); WO 200140269 (пример 3; страницы 190-192); WO 200036107 (пример 2; страницы 205-207); WO 2004053079 (пункт 12); WO 2003004989 (пункт 1); WO 200271928 (страница 233-234, 452-453); WO0116318;
(24) PSCA (предшественник антигена стволовой клетки предстательной железы, инвентарный номер Genbank AJ297436)
Reiter R.E., et al. Proc. Natl. Acad. Sci. USA 95, 1735-1740, 1998; Gu Z., et al. Oncogene 19, 1288-1296, 2000; Biochem. Biophys. Res. Commun. (2000) 275(3):783-788; WO 2004022709; EP 1394274 (пример 11); US 2004018553 (пункт 17); WO 2003008537 (пункт 1); WO 200281646 (пункт 1; страница 164); WO 2003003906 (пункт 10; страница 288); WO 200140309 (пример 1; фиг. 17); US 2001055751 (пример 1; фиг. 1b); WO 200032752 (пункт 18; фиг. 1); WO 9851805 (пункт 17; страница 97); WO 9851824 (пункт 10; страница 94); WO 9840403 (пункт 2; фиг. 1B);
Доступ: О43653; EMBL; AF043498; AAC39607.1.
(25) GEDA (инвентарный номер Genbank AY260763);
белок подобный партнеру по слиянию AAP14954 липомы HMGIC /pid=AAP14954.1 - Homo sapiens; Вид: Homo sapiens (человек) WO 2003054152 (пункт 20); WO 2003000842 (пункт 1); WO 2003023013 (пример 3, пункт 20); US 2003194704 (пункт 45);
Перекрестные ссылки: GI:30102449; AAP14954.1; AY260763_1
(26) BAFF-R (рецептор активирующего B-клетки фактора, рецептор BLyS 3, BR3, инвентарный номер Genbank AF116456); рецептор BAFF /pid=NP_443177.1 - Homo sapiens
Thompson, J.S., et al. Science 293 (5537), 2108-2111 (2001); WO 2004058309; WO 2004011611; WO 2003045422 (пример; страницы 32-33); WO 2003014294 (пункт 35; фиг. 6B); WO 2003035846 (пункт 70; страница 615-616); WO 200294852 (Col 136-137); WO 200238766 (пункт 3; страница 133); WO 200224909 (пример 3; фиг. 3);
Перекрестные ссылки: MIM:606269; NP_443177.1; NM_052945_1; AF132600
(27) CD22 (изоформа B-клеточного рецептора CD22-B, BL-CAM, Lyb-8, Lyb8, SIGLEC-2, FLJ22814, инвентарный номер Genbank AK026467);
Wilson et al. (1991) J. Exp. Med. 173:137-146; WO 2003072036 (пункт 1; фиг. 1);
Перекрестные ссылки: MIM:107266; NP_001762.1; NM_001771_1
(28) CD79a (CD79A, CD79α, ассоциированный с иммуноглобулинами альфа, специфичный для B-клеток белок, ковалентно взаимодействующий с Ig бета (CD79B) и образующий комплекс на поверхности с молекулами IgM, переносит сигнал, вовлеченный в дифференцировку B-клеток)
ПОСЛЕДОВАТЕЛЬНОСТЬ БЕЛКА Полная mpggpgv...dvqlekp (1..226; 226 а./к.), pI: 4.84, MW: 25028 TM: 2 [P] Хромосома генома: 19q13.2, инвентарный номер Genbank NP_001774.10)
WO 2003088808, US 20030228319; WO 2003062401 (пункт 9); US 2002150573 (пункт 4, страницы 13-14); WO 9958658 (пункт 13, фиг. 16); WO 9207574 (фиг. 1); US 5644033; Ha et al. (1992) J. Immunol. 148(5):1526-1531; Mueller et al. (1992) Eur. J. Biochem. 22:1621-1625; Hashimoto et al. (1994) Immunogenetics 40(4):287-295; Preud'homme et al. (1992) Clin. Exp. Immunol. 90(1):141-146; Yu et al. (1992) J. Immunol. 148(2) 633-637; Sakaguchi et al. (1988) EMBO J. 7(11):3457-3464;
(29) CXCR5 (рецептор лимфомы Беркита 1, рецептор, связанный с G-белком, активирующийся хемокином CXCL13, действующий при миграции лимфоцита и при гуморальной защите, играющий роль в инфекции HIV-2 и, возможно, в развитии СПИДа, лимфомы, миеломы и лейкоза)
ПОСЛЕДОВАТЕЛЬНОСТЬ БЕЛКА Полная mnypltl..atslttf (1..372; 372 а./к.), pI: 8.54 MW: 41959 TM: 7 [P] Хромосома генома: 11q23.3, инвентарный номер Genbank NP_001707.1)
WO 2004040000; WO 2004015426; US 2003105292 (пример 2); US 6555339 (пример 2); WO 200261087 (фиг. 1); WO 200157188 (пункт 20, страница 269); WO 200172830 (страницы 12-13); WO 200022129 (пример 1, страницы 152-153, пример 2, страницы 254-256); WO 9928468 (пункт 1, страница 38); US 5440021 (пример 2, col 49-52); WO 9428931 (страницы 56-58); WO 9217497 (пункт 7, фиг. 5); Dobner et al. (1992) Eur. J. Immunol. 22:2795-2799; Barella et al. (1995) Biochem. J. 309:773-779;
(31) P2X5 (пуринергический рецепторный P2X лигандзависимый ионный канал 5, ионный канал, управляемый внеклеточной АТФ, может быть вовлечен в синаптическую передачу и нейрогенез, дефицит может вносить вклад в патофизиологию идиопатической нестабильности детрузора) ПОСЛЕДОВАТЕЛЬНОСТЬ БЕЛКА Полная mgqagck..lephrst (1..422; 422 а./к.), pI: 7.63, MW: 47206 TM: 1 [P] Хромосома генома: 17p13.3, инвентарный номер Genbank NP_002552.2)
Le et al. (1997) FEBS Lett. 418(1-2):195-199; WO 2004047749; WO 2003072035 (пункт 10); Touchman et al. (2000) Genome Res. 10:165-173; WO 200222660 (пункт 20); WO 2003093444 (пункт 1); WO 2003087768 (пункт 1); WO 2003029277 (страница 82);
(32) CD72 (антиген дифференцировки B-клеток CD72, Lyb-2) ПОСЛЕДОВАТЕЛЬНОСТЬ БЕЛКА Полная maeaity..tafrfpd (1..359; 359 а./к.), pI: 8.66, MW: 40225 TM: 1 [P] Хромосома генома: 9p13.3, инвентарный номер Genbank NP_001773.1)
WO 2004042346 (пункт 65); WO 2003026493 (страницы 51-52, 57-58); WO 200075655 (страницы 105-106); Von Hoegen et al. (1990) J. Immunol. 144(12):4870-4877; Strausberg et al. (2002) Proc. Natl. Acad. Sci USA 99:16899-16903;
(33) LY64 (лимфоцитарный антиген 64 (RP105), мембранный белок семейства белков с богатыми лейцином повторами (LRR) типа I, регулирует активацию и апоптоз B-клеток, потеря функции ассоциирована с увеличенной активностью заболевания у пациентов с системной красной волчанкой)
ПОСЛЕДОВАТЕЛЬНОСТЬ БЕЛКА Полная mafdvsc.rwkyqhi (1..661; 661 а./к.), pI: 6.20, MW: 74147 TM: 1 [P] Хромосома генома: 5q12, инвентарный номер Genbank NP_005573.1)
US 2002193567; WO 9707198 (пункт 11, страницы 39-42); Miura et al. (1996) Genomics 38(3):299-304; Miura et al. (1998) Blood 92:2815-2822; WO 2003083047; WO 9744452 (пункт 8, страницы 57-61); WO 200012130 (страницы 24-26);
(34) FcRH1 (белок подобный рецептору Fc 1, предполагаемый рецептор домена Fc иммуноглобулинов, содержащий подобные Ig и ITAM домены типа C2, может играть роль в дифференцировке B-лимфоцитов, инвентарный номер Genbank NP_443170.1) ПОСЛЕДОВАТЕЛЬНОСТЬ БЕЛКА Полная mlprlll..vdyedam (1..429; 429 а./к.), pI: 5.28, MW: 46925 TM: 1 [P] Хромосома генома: 1q21-1q22, инвентарный номер Genbank NP_443170.1)
WO 2003077836; WO 200138490 (пункт 6, фиг. 18E-1-18-E-2); Davis et al. (2001) Proc. Natl. Acad. Sci USA 98(17):9772-9777; WO 2003089624 (пункт 8); EP 1347046 (пункт 1); WO 2003089624 (пункт 7);
(35) IRTA2 (ассоциированный с транслокацией рецептор из иммуноглобулинового суперсемейства 2, предполагаемый иммунорецептор с возможной ролью в развитии B-клеток и лимфомагенезе; нарушение регуляции гена посредством транслокации происходит в некоторых B-клеточных злокачественных опухолях) ПОСЛЕДОВАТЕЛЬНОСТЬ БЕЛКА Полная mllwvil..assaphr (1..977; 977 а./к.), pI: 6.88 MW: 106468 TM: 1 [P] Хромосома генома: 1q21, инвентарный номер Genbank Человек:AF343662, AF343663, AF343664, AF343665, AF369794, AF397453, AK090423, AK090475, AL834187, AY358085; Мышь:AK089756, AY158090, AY506558; NP_112571.1
WO 2003024392 (пункт 2, фиг. 97); Nakayama et al. (2000) Biochem. Biophys. Res. Commun. 277(1):124-127; WO 2003077836; WO 200138490 (пункт 3, фиг. 18B-1-18B-2);
(36) TENB2 (возможный трансмембранный протеогликан, родственный семейству ростовых факторов EGF/херегулин и фоллистатину)
ПОСЛЕДОВАТЕЛЬНОСТЬ БЕЛКА Полная mvlwesp..rastrli (1..374; 374 а./к., Доступ NCBI: AAD55776, AAF91397, AAG49451, NCBI RefSeq: NP_057276; NCBI Gene: 23671; OMTM: 605734; SwissProt Q9UIK5; инвентарный номер Genbank AF179274; AY358907, CAF85723, CQ782436
WO 2004074320 (SEQ ID NO 810); JP 2004113151 (SEQ ID NOS 2, 4, 8); WO 2003042661 (SEQ ID NO 580); WO 2003009814 (SEQ ID NO 411); EP 1295944 (страницы 69-70); WO 200230268 (страница 329); WO 200190304 (SEQ ID NO 2706); US 2004249130; US 2004022727; WO 2004063355; US 2004197325; US 2003232350; US 2004005563; US 2003124579; патент США № 6410506; US 66420061; Horie et al. (2000) Genomics 67:146-152; Uchida et al. (1999) Biochem. Biophys. Res. Commun. 266:593-602; Liang et al. (2000) Cancer Res. 60:4907-12; Glynne-Jones et al. (2001) Int J Cancer. Oct 15;94(2):178-84.
ПОЛУЧЕНИЕ АНТИТЕЛ
Для получения моноклональных антител (MAb) использовали различные способы. В гибридомной технологии, которая относится к клонированной клеточной линии, продуцирующей антитела одного типа, используют клетки различных видов, включая клетки мышей, хомяков, крыс и человека. В других способах получения MAb, включая химерные и гуманизированные антитела, используют генную инженерию, то есть технологию рекомбинантных ДНК.
Поликлональные антитела можно индуцировать множественными подкожными (sc) или внутрибрюшинным (ip) инъекциями соответствующего антигена и адъюванта. Моноклональные антитела получают из группы, по существу, гомогенных антител, то есть индивидуальные антитела, составляющие группу, являются идентичными, исключая возможные природные мутации, которые могут присутствовать в небольших количествах.
Также для получения человеческих моноклональных антител описаны клеточные линии человеческой миеломы и гетеромиеломы мыши-человека (Kozbor, (1984) J. Immunol., 133:3001 и Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987)). Культуральную среду, в которой растут гибридомные клетки, оценивают на продукцию моноклональных антител против данного антигена. Специфичность связывания моноклональных антител, продуцируемых гибридомными клетками можно определять с помощью иммунопреципитации или с помощью анализа связывания in vitro, такого как радиоиммунологический анализ (RIA) или твердофазный иммуноферментный анализ (ELISA). Аффинность связывания моноклонального антитела можно определять, например, анализом Скэтчарда, Munson et al. (1980) Anal. Biochem. 107:220.
Кодирующую моноклональные антитела ДНК легко выделить и секвенировать с помощью обычных процедур (например, с помощью олигонуклеотидных зондов, способных специфически связываться с генами, кодирующими тяжелые и легкие цепи антител мыши). Источником такой ДНК служат гибридомные клетки. После выделения ДНК можно помещать в экспрессирующие векторы, которые затем трансфицируют в клетки-хозяева, такие как клетки E.coli, обезьяньи клетки COS, клетки яичника китайского хомяка (CHO) или миеломные клетки, которые другим путем не продуцируют белок антитела, для обеспечения синтеза моноклональных антител в рекомбинантных клетках-хозяевах (патент США № 2005/0048572; патент США № 2004/0229310). Обзорные статьи о рекомбинантной экспрессии в бактериях ДНК, кодирующей антитело, включают Skerra et al. (1993) Curr. Opinion in Immunol. 5:256-262 и Plückthun (1992) Immunol. Revs. 130:151-188.
В дополнительном варианте осуществления моноклональные антитела или фрагменты антител можно выделять из фаговых библиотек антител, полученных способами, описанными McCafferty et al. (1990) Nature 348:552-554; Clackson et al. (1991) Nature 352:624-628; и в статье Marks et al. (1991) J. Mol. Biol., 222:581-597, описано выделение антител мыши и человека, соответственно, с применением фаговых библиотек. В следующих публикациях описано получение высокоаффинных (диапазон нМ) антител человека посредством перестановки цепей (Marks et al. (1992) Bio/Technology 10:779-783), а также комбинационная инфекция и рекомбинация in vivo, как стратегия конструирования очень больших фаговых библиотеке (Waterhouse et al. (1993) Nuc. Acids. Res. 21:2265-2266). Таким образом, эти способы являются альтернативными традиционными способами гибридом моноклональных антител для выделения моноклональных антител.
ДНК также можно модифицировать, например, замещая кодирующими последовательностями константных доменов тяжелых человека и легких цепей гомологичных последовательностей мыши (патент США № 4816567); и Morrison et al. (1984) Proc. Natl Acad. Sci. USA 81:6851), или ковалентным связыванием с кодирующей последовательностью иммуноглобулина всей или части кодирующей последовательности полипептида, не являющегося иммуноглобулином.
Как правило, такими полипептидами, не являющимися иммуноглобулинами, замещают константные домены антитела или ими замещают вариабельные домены одного антигенсвязывающего участка антитела для получения химерного бивалентного антитела, содержащего один антигенсвязывающий участок со специфичностью к одному антигену и другой антигенсвязывающий участок со специфичностью к другому антигену.
Приведенное ниже описание является иллюстрацией способов получения антител (Ab), используемых в конъюгатах антитело-лекарственное средство (ADC) по настоящему изобретению. Получение антител представлено для антитела против ErbB2, но специалистам в данной области будет ясно, что подобным способом можно получать и модифицировать антитела против других представителей семейства рецепторов ErbB, а также против любого другого рецептора или ассоциированного с опухолью антигена или мишени.
Антиген ErbB2, используемый для получения антител, может представлять собой, например, растворимую форму внеклеточного домена ErbB2 или его часть, содержащую желательный эпитоп. Альтернативно, для получения антител можно использовать клетки, экспрессирующие на своей клеточной поверхности ErbB2, например, клетки NIH-3T3, трансобразованные для сверхэкспрессии ErbB2, или карциномную клеточную линию, такую как клетки SK-BR-3 (Stancovski et al. (1991) PNAS (USA) 88:8691-8695). Специалистам в данной области понятно, что для получения антител могут использоваться другие пригодные формы ErbB2.
В примере 1 описано получение иллюстративного гуманизированного антитела против ErbB2. Гуманизированное антитело может, например, содержать не являющиеся человеческими остатки гипервариабельной области, встроенные в вариабельный домен тяжелой цепи человека, и дополнительно может содержать замену в каркасной области (FR) в положении выбранном из группы, состоящей из 69H, 71H и 73H, используя систему нумерации вариабельных доменов установленную Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991). В одном из вариантов осуществления гуманизированное антитело содержит замены в FR по двум или всем положениям 69H, 71H и 73H.
В качестве альтернативы гуманизированию можно получать антитела человека. Например, в настоящее время можно получать трансгенных животных (например, мышей), способных после иммунизации продуцировать полных набор человеческих антител в отсутствие эндогенной продукции иммуноглобулинов (Jakobovits et al. (1993) Proc. Natl. Acad. Sci. USA, 90:2551; Jakobovits et al. (1993) Nature 362:255-258; Bruggermann et al. (1993) Year in Immuno. 7:33; и патент США № 5591669; патент США № 5589369; патент США № 5545807).
Альтернативно, для получения антител человека и фрагментов антител in vitro из наборов генов вариабельных (V) доменов иммуноглобулинов от неиммунизированных доноров можно применять технологию фагового дисплея (McCafferty et al. (1990) Nature 348:552-553) (Johnson, Kevin S. и Chiswell, David J. (1993) Current Opinion in Structural Biology 3:564-571). Можно сконструировать набор генов V от неиммунизированных человеческих доноров и, в принципе, можно выделять антитела против разнообразного набора антигенов (включая собственные антигены) (Marks et al. (1991) J. Mol. Biol. 222:581-597; Griffith et al. (1993) EMBO J. 12:725-734; патент США № 5565332; патент США № 5573905). Антитела человека также можно получать из B-клеток, активированных in vitro (патент США № 5567610; патент США № 5229275). Антитела человека против ErbB2 описаны (патент США № 5772997 и WO 97/00271.
Для получения фрагментов антител разработаны различные способы. Как правило, такие фрагменты получают протеолитическим расщеплением интактных антител (см. Morimoto et al. (1992) Journal of Biochemical and Biophysical Methods 24:107-117 и Brennan et al. (1985) Science 229:81). Фрагменты антител также можно получать непосредственно с помощью рекомбинантных клеток-хозяев и фаговых библиотек антител, описанных выше. Фрагменты Fab'-SH можно восстанавливать непосредственно из E.coli и химически связывать с образованием фрагментов F(ab')2 (Carter et al. (1992) Bio/Technology 10:163-167). Согласно еще одному подходу фрагменты F(ab')2 можно выделять непосредственно из культуры рекомбинантных клеток-хозяев. Специалистам в данной области известны другие способы получения фрагментов антител. В других вариантах осуществления выбранное антитело представляет собой одноцепочечный фрагмент Fv (scFv). Смотри WO 93/16185; патент США № 5571894 и патент США № 5587458. Фрагмент антитела также может представлять собой «линейное антитело», например, как описано в патенте США № 5641870. Такие линейные фрагменты антител могут быть моноспецифическими или биспецифическими.
Биспецифические антитела со специфичностью связывания по меньшей мере к двум различным эпитопам (Millstein et al. (1983), Nature 305:537-539) могут связывать два различных эпитопа белка ErbB2. Другие такие антитела могут сочетать участок связывания ErbB2 с участком(амии) связывания EGFR, ErbB3 и/или ErbB4. Альтернативно, ветвь против ErbB2 можно сочетать с ветвью, связывающей стимулирующую молекулу на лейкоците, такую как молекула T-клеточного рецептора (например, CD2 или CD3) или Fc-рецепторы для IgG (FcγR), такие как FcγRI (CD64), FcγRII (CD32) и FcγRIII (CD16), с тем, чтобы сфокусировать механизмы клеточной защиты на экспрессирующей ErbB2 клетке. Биспецифические антитела также можно применять для локализации цитотоксических средств клеток, экспрессирующих ErbB2 (WO 96/16673; патент США № 5837234; WO 98/02463; патент США № 5821337). Способы очистки биспецифических антител описаны (WO 93/08829; Traunecker et al. (1991) EMBO J. 10:3655-3659; WO 94/04690; Suresh et al. (1986) Methods in Enzymology 121:210; патент США № 5731168). Биспецифические антитела можно получать с применением лейциновых застежек (Kostelny et al. (1992) J. Immunol, 148(5):1547-1553) и димеров одноцепочечных Fv (sFv) (Gruber et al. (1994) J. Immunol. 152:5368).
Также описаны способы получения биспецифических антител из фрагментов антител, например, химическое связывание, где интактные антитела протеолитически расщепляют с получением фрагментов F(ab')2 (Brennan et al. (1985) Science 229:81). Для образования биспецифических антител из E.coli можно восстановить фрагменты Fab'-SH и химически связать (Shalaby et al. (1992) J. Exp. Med. 175:217-225). Альтернативный способ получения биспецифических фрагментов антител предоставляет технология «димерных антител» (Hollinger et al. (1993) Proc. Natl. Acad. Sci. USA 90:6444-6448).
В рамках настоящего изобретения предусмотрены антитела более чем с двумя валентностями. Поливалентные «осьминоговые» антитела с тремя и более антигенсвязывающими участками и двумя или более вариабельными доменами можно легко получить рекомбинантной экспрессией нуклеиновой кислоты, кодирующей полипептидные цепи антитела (патент США № 2002/0004586; WO 01/77342). Например, можно получать триспецифические антитела (Tutt et al. (1991) J. Immunol. 147:60).
В рамках настоящего изобретения предусмотрена модификация(и) аминокислотной последовательности антител. Например, для повышения аффинности связывания и/или улучшения других биологических характеристик антитела могут быть получены мутанты и различные изоформы антител, связывающих ассоциированные с опухолями антигены. Варианты аминокислотных последовательностей антитела получают внесением соответствующих нуклеотидных замен в кодирующую антитело нуклеиновую кислоту или с помощью пептидного синтеза. Такие модификации, например, включают делеции остатков из аминокислотных последовательностей антитела, и/или вставки, и/или замены остатков. Для получения конечной конструкции можно производить любую комбинацию делеций, вставок и замен, при условии, что конечная конструкция будет обладать желательными свойствами. Замены аминокислот также могут изменять посттрансляционную модификацию антитела, например, изменение количества или положения участков гликозилирования.
Эффективным способом идентификации определенных остатков или областей антитела, которые являются предпочтительными участками мутагенеза, является «сканирующий аланином мутагенез» (Cunningham и Wells (1989) Science 244:1081-1085), где для оптимизации взаимодействия аминокислот с антигеном идентифицируют аминокислотный остаток или группу мишеневых остатков (например, заряженные остатки, такие как arg, asp, his, lys и glu) и заменяют нейтральной и отрицательно заряженной аминокислотой, такой как аланин или полиаланин. Вставки включают в себя слияние с N- и/или C-концом аминокислотных последовательностей в диапазоне от одного остатка до полипептидов, содержащих сто или более остатков, а также вставки одного или несколько аминокислотных остатков внутрь последовательности. Примеры концевых вставок включают антитело против ErbB2 с N-концевым остатком метионина или антитело, слитое с цитотоксическим полипептидом. Другие варианты антитела против молекулы ErbB2 со вставками включают слияние N- или C-конца антитела против ErbB2 с ферментом (например, для ADEPT: Tietze et al. (2003) Current Pharm. Design 9:2155-2175) или полипептидом, увеличивающим время полужизни антитела в сыворотке, таким как альбуминсвязывающий пептид.
Связывание плазматических белков может быть эффективным способом улучшения фармакокинетических свойств быстро разрушающихся молекул. Альбумин является наиболее встречающимся белком плазмы. Связывающие сывороточный альбумин пептиды (ABP) могут изменять фармакодинамику слитых белков с активными доменами, включая изменение захвата тканями, проницаемости и диффузии. Эти фармакодинамические параметры можно модулировать посредством специфического отбора соответствующей пептидной последовательности, связывающей сывороточный альбумин (патент США № 20040001827). Ряд связывающих альбумин пептидов идентифицирован скринированием фагового дисплея (Dennis et al. (2002) «Albumin Binding As A General Strategy For Improving The Pharmacokinetics Of Proteins» J Biol Chem. 277:35035-35043; WO 01/45746). Соединения по изобретению включают последовательности ABP, указанные: (i) Dennis et al. (2002) J Biol Chem. 277:35035-35043 в таблицах III и IV, страница 35038; (ii) патент США № 20040001827, абзац [0076] SEQ ID NO: 9-22, и (iii) WO 01/45746, страницы 12-13, SEQ ID NO: z1-z14; и каждый из которых приведен в данный документ в качестве ссылки.
Аминокислотную последовательность, как правило, изменяют посредством изменения кодирующей ее последовательности нуклеиновой кислоты. Молекулы нуклеиновой кислоты, кодирующие варианты аминокислотных последовательностей антитела, получают множеством способов, известных в данной области способов. Эти способы включают в качестве неограничивающих примеров выделение из природного источника (в случае природных вариантов аминокислотных последовательностей) или получение посредством опосредованного олигонуклеотидами (или сайт-специфического) мутагенеза, мутагенеза на основе ПЦР и кассетного мутагенеза ранее полученного варианта или безвариантной версии антитела. Интересующие участки для замещающего мутагенеза включают гипервариабельные области, но можно также изменить FR.
Значительных изменений биологических свойств антитела достигают посредством выбора замен, которые значительно отличаются по их действию на поддержание (a) структуры полипептидного каркаса в области замены, например, конформации листа или спирали, (b) заряда или гидрофобности молекулы в участке-мишени или (c) объема боковой цепи. Природные остатки разделяют на группы на основе общих свойств боковых цепей:
(1) гидрофобные: норлейцин, met, ala, val, leu, ile;
(2) нейтральные гидрофильные: cys, ser, thr;
(3) кислые: asp, glu;
(4) основные: asn, gln, his, lys, arg;
(5) остатки, влияющие на ориентацию цепи: gly, pro; и
(6) ароматические: trp, tyr, phe.
Неконсервативные замены приводят к замене представителя одного из этих классов на представителя другого класса.
Также можно замещать любой цистеиновый остаток, не вовлеченный в поддержание правильной конформации антитела, как правило, на серин, для увеличения устойчивости молекулы к окислению и предотвращения образования аномальных перекрестных связей. С другой стороны, в антитело можно вводить цистеиновую связь(и) для увеличения стабильности (особенно, когда антитело представляет собой фрагмент антитела, такой как фрагмент Fv).
Для увеличения времени полужизни антитела в сыворотке в антитело (особенно в фрагмент антитела) можно ввести эпитоп связывания спасательного рецептора, например, как описано в патенте США № 5739277. Как используется в данном документе, термин «эпитоп связывания спасательного рецептора» относится к эпитопу Fc-области молекулы IgG (например, IgG1, IgG2, IgG3 или IgG4), ответственному за увеличение времени полужизни молекулы IgG из сыворотки in vivo (патент США № 2003/0190311, US 6821505; патент США № 6165745; патент США № 5624821; патент США № 5648260; патент США № 6165745; патент США № 5834597).
К вариантам гликозилирования антител относятся варианты, в которых изменен профиль гликозилирования антитела. Под изменением подразумевают удаление одной или нескольких углеводных групп, найденных в антителе, добавление в антитело одной или нескольких углеводных групп, изменение структуры гликозилирования (профиля гликозилирования) или степени гликозилирования.
Антитела могут быть гликозилированы по консервативным положениям (N-связанное или O-связанное) в их константных областях (Hse et al. (1997) J. Biol. Chem. 272:9062-9070; Jefferis и Lund, (1997) Chem. Immunol. 65:111-128; Wright and Morrison, (1997) TibTECH 15:26-32). Олигосахаридные боковые цепи иммуноглобулинов влияют на функцию белков (Boyd et al. (1996) Mol. Immunol. 32:1311-1318; Wittwe и Howard, (1990) Biochem. 29:4175-4180) и межмолекулярное взаимодействие между частями гликопротеина, которое может влиять на конформацию и показанную трехмерную структуру поверхности гликопротеина (Hefferis и Lund, выше; Wyss and Wagner (1996) Current Opin. Biotech. 7:409-416). Олигосахариды также могут служить для нацеливания данного гликопротеина на определенные молекулы на основании специфических распознающих структур (Malhotra et al. (1995) Nature Med. 1:237-243; Umana et al. (1999) Nature Biotech. 17:176-180). Удаление олигосахаридов может оптимизировать связывание антигена и другие свойства антитела (Boyd et al. (1996) Mol. Immunol. 32:1311-1318).
Факторы, влияющие на гликозилирование в течение рекомбинантного получения антител, включают способ роста, состав среды, плотность культуры, насыщенность кислородом, pH, схемы очистки и тому подобное (патент США № 5047335; патент США № 5510261; патент США № 5278299). Гликозилирование или определенные типы гликозилирования могут быть ферментативно удалены из гликопротеина с помощью эндогликозидазы H (Endo H). Кроме того, рекомбинантную клетку-хозяина можно сконструировать генетически, например, сделать дефектной по процессингу определенных типов полисахаридов. Эти и другие способы хорошо известны в данной области.
Структуру гликозилирования антител можно легко проанализировать обычными способами анализа углеводов, включая хроматографию с лектинами, ЯМР, масс-спектрометрию, ВЭЖХ, GPC, анализ моносахаридного состава, последовательное ферментативное отщепление и HPAEC-PAD, в которых используют анионообменную хроматографию при высоком pH для разделения олигосахаридов по заряду. Способы выделения олигосахаридов для аналитических целей также хорошо известны и включают, но ими не ограничиваются, ферментативную обработку (обычно проводимую с применением пептид-N-гдикозидазы F/эндо-β-галактозидазы), элиминацию, используя сильное щелочное окружение для высвобождения преимущественно O-связанных структур, и химические способы с применением безводного гидразина для высвобождения и N- и O-связанных олигосахаридов.
МОЛЕКУЛЫ МАЙТАНАЗОИДНЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Майтаназиновые соединения ингибируют клеточную пролиферацию, ингибируя образование микротрубочек в процессе митоза посредством ингибирования полимеризации белка микротрубочек, тубулина (Remillard et al. (1975) Science 189:1002-1005; патент США № 5208020). Майтаназин и майтанзиноиды являются высокоцитотоксическими, но их клиническое применение для лечения злокачественных опухолей сильно ограничено из-за тяжелых системных побочных эффектов, главным образом, связанных с их слабой селективностью в отношении опухолей. Клинические испытания с майтаназином были прекращены вследствие серьезных побочных эффектов на центральную нервную систему и желудочно-кишечный тракт (Issel et al. (1978) Can. Treatment. Rev. 5:199-207).
Молекулы майтаназоидных лекарственных средств могут быть эффективными молекулами лекарственных средств в конъюгатах антитело-лекарственное средство из-за того, что они: (i) относительно удобны для получения производных ферментативных продуктов путем ферментативной или химической модификации, (ii) их функциональные группы могут быть модифицированы для конъюгации с антителами посредством несульфидных линкеров, (iii) они стабильны в плазме и (iv) эффективны против множества опухолевых клеточных линий.
Майтаназиновые соединения, которые могут использоваться в качестве молекул майтаназоидных лекарственных средств, хорошо известны в данной области и их можно выделить известными способами из природных источников, получить способами генной инженерии (см. Yu et al. (2002) PNAS 99:7968-7973), или майтаназинол и аналоги майтаназинола известными способами получают синтетически.
Иллюстративные молекулы майтаназоидных лекарственных средств включают молекулы с модифицированным ароматическим циклом, такие как C-19-дехлор (патент США № 4256746) (получаемые восстановлением ансамитоцина P2 с помощью алюмогидрида лития); C-20-гидрокси (или C-20-деметил) +/-C-19-дехлор (патенты США №№ 4361650 и 4307016) (получаемые путем деметилирования с применением Streptomyces или Actinomyces или дехлорирования с применением LAH) и C-20-деметокси, C-20-ацилокси (-OCOR), +/-дехлор (патент США № 4294757) (получаемые путем ацилирования с применением хлорангидридов) и молекулы с модификациями в других положениях.
Иллюстративные молекулы майтаназоидных лекарственных средств также включают молекулы с такими модификациями, как C-9-SH, получаемой реакцией майтаназинола с H2S или P2S5 (патент США № 4424219); C-14-алкоксиметил(деметокси/CH2OR) (патент США № 4331598); C-14-гидроксиметил или ацилоксиметил (CH2OH или CH2OAc), получаемые из Nocardia (патент США № 4450254); C-15-гидрокси/ацилокси, получаемые преобразованием майтаназинола Streptomyces (патент США № 4364866); C-15-метокси, выделяемый из Trewia nudlflora (патент США № 4313946 и патент США № 4315929); C-18-N-деметил, получаемый деметилированием майтаназинола Streptomyces (патент США № 4362663 и патент США № 4322348) и 4,5-дезокси, получаемый восстановлением майтаназинола трихлоридом титана/LAH (патент США № 4371533).
Ряд положений на майтаназиновых соединениях известны как подходящие в качестве положения для связывания, в зависимости от типа связи. Например, для образования сложноэфирной связи подходят все положения C-3 с гидроксильной группой, положения C-14, модифицированное гидроксиметилом, положения C-15 с гидроксильной группой и положения C-20 с гидроксильной группой.
Молекулы майтаназоидных лекарственных средств (D) включают молекулы со структурой:
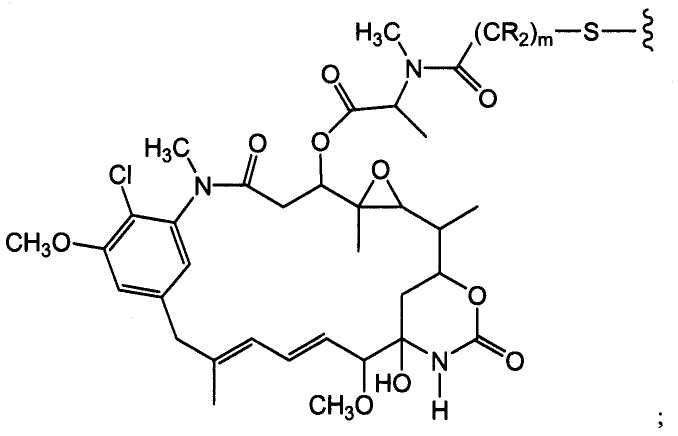
где волнистая линия указывает ковалентное связывание атома серы D с линкером (L) конъюгата антитело-лекарственное средство (ADC). R может независимо представлять собой H или C1-C6-алкил. Алкиленовая цепь, присоединяющая амидную группу к атому серы, может представлять собой метил, этил или пропил, то есть m равно 1, 2 или 3 (патенты США №№ 633410, 5208020, Chari et al. (1992) Cancer Res. 52:127-131; Liu et al. (1996) Proc. Natl. Acad. Sci 93:8618-8623).
Настоящее изобретение охватывает все стереоизомеры майтаназоидного лекарственного средства, то есть любое сочетание R- и S-конфигураций хиральных атомов углерода D. В одном из вариантов осуществления майтаназоидное лекарственное средство (D) обладает следующим стереохимическим строением:
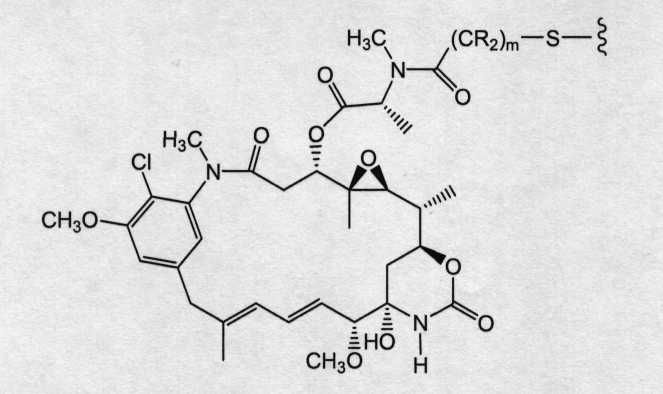
Варианты D включают:
DM1 (N2,-деацетил-N2,-(3-меркапто-1-оксопропил)майтаназин), где (CR2)m=CH2CH2:
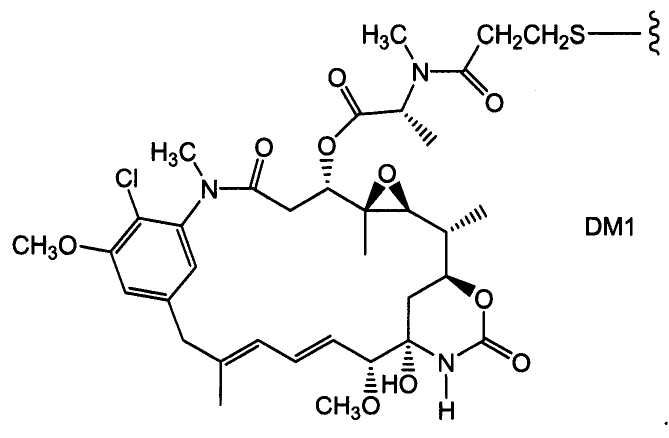
DM3 (N2,-деацетил-N2,-(4-меркапто-1-оксопентил)майтаназин), где (CR2)m=CH2CH2CH(CH3):
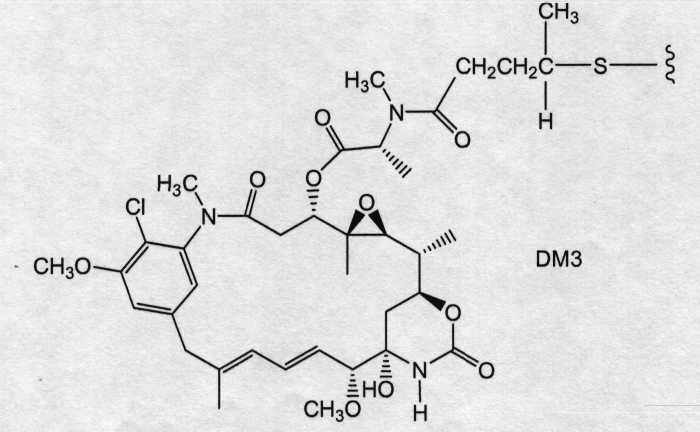
DM4 (N2'-деацетил-N2'-(4-метил-4-меркапто-1-оксопентил)-майтаназин), где (CR2)m=CH2CH2C(CH3)2:
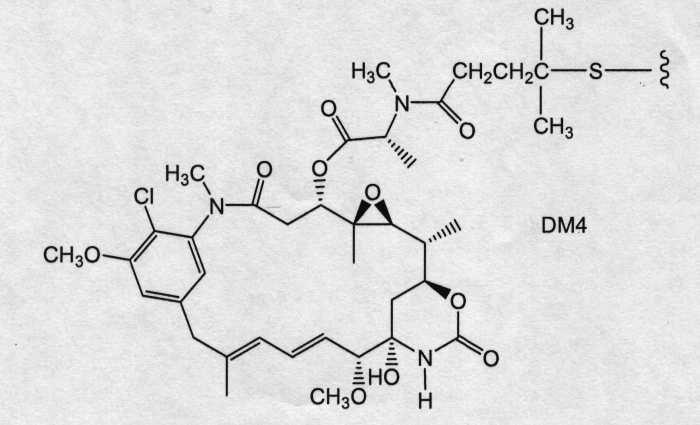
Стерическое затруднение, создаваемое алкильными группами, такими как метильные группы, для атома углерода, расположенного рядом с атомом серы DM3 и DM4, могут влиять на скорость внутриклеточного расщепления ADC (патент США № 2004/0235840 A1). Таким образом, различные алкильные единицы (CR2)m могут влиять на результативность, эффективность и безопасность/токсичность in vitro и in vivo.
ЛИНКЕРЫ
Линкер, L, связывает антитело с лекарственным веществом с помощью ковалентной связи(ей), не включающей дисульфидную группу. Линкер представляет собой бифункциональную или полифункциональную молекулу, которую можно использовать для связывания одной или нескольких молекул лекарственного вещества (D) с молекулой антитела (Ab) с образованием конъюгатов антитело-лекарственное средство (ADC) формулы I. Конъюгаты антитело-лекарственное средство (ADC) можно легко получить с применением линкера с реакционной способностью в отношении связывания с лекарственным средством и антителом. Тиольная группа цистеина или амина, например N-конец или боковая цепь аминокислоты, такой как лизин, антитела могут образовать связь с функциональной группой на линкерном реагенте, молекуле лекарственного вещества или реагенте лекарственное вещество-линкер.
Предпочтительно, линкеры стабильны вне клеток. Перед транспортировкой или доставкой в клетку конъюгат антитело-лекарственное средство (ADC), предпочтительно, стабилен и остается интактным, то есть антитело остается связанным с молекулой лекарственного средства. Линкеры стабильны вне клетки-мишени и могут расщепляться с определенной эффективной скоростью внутри клетки. Эффективный линкер: (i) сохраняет свойства специфического связывания антитела; (ii) обеспечивает внутриклеточную доставку конъюгата или молекулы лекарственного средства; (iii) остается стабильным и неповрежденным, то есть не расщепляется, до тех пор, пока не осуществится доставка или транспортировка конъюгата к намеченному участку, и (iv) сохраняет цитотоксическое, уничтожающее клетки действие или цитостатическое действие майтаназоидного лекарственного средства. Стабильность ADC можно измерить стандартными аналитическими способами, такими как масс-спектрометрия, ВЭЖХ и способ разделения/анализа LC/MS.
Для ковалентного связывания антитела и молекулы лекарственного средства необходимо, чтобы у линкера были две реакционные функциональные группы, то есть он был бивалентным с точки зрения взаимодействия. Бивалентные линкерные реагенты, которые могут использоваться для присоединения двух или более функциональных или биологически активных молекул, таких как пептиды, нуклеиновые кислоты, лекарственные средства, токсины, антитела, гаптены и репортерные группы, хорошо известны, и способы, приводящие к получению конъюгатов, описаны (Hermanson, G.T. (1996) Bioconjugate Techniques; Academic Press: New York, p234-242).
Линкеры могут обладать структурами, выбранными из:
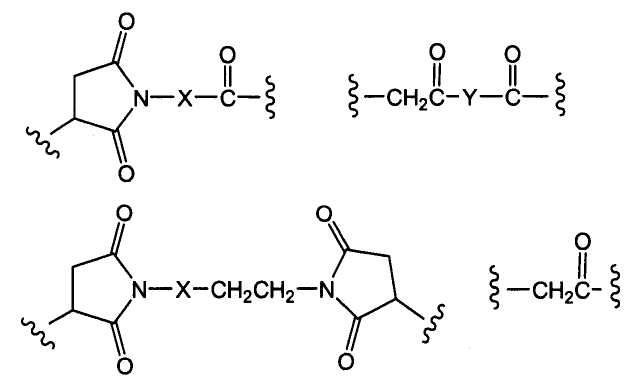
где волнистые линии указывают на ковалентную связь Ab и D в любой ориентации. X может обладать структурами в любой ориентации:

где R независимо представляет собой H или C1-C6-алкил; и n равно от 1 до 12. Y может обладать структурами в любой ориентации:
где R независимо представляет собой H или C1-C6-алкил; и n равно от 1 до 12.
Например, линкер может обладать структурой, обозначенной как SMCC:
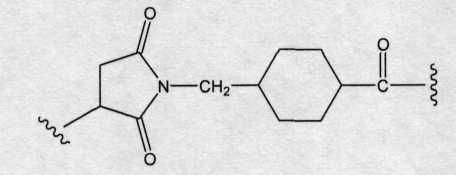
В другом варианте осуществления, линкер (L) обладает структурой:
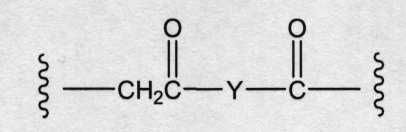
где волнистые линии указывают на ковалентную связь Ab и D в любой ориентации.
Например, линкер может обладать структурой, обозначенной как SLAB:
В другом варианте осуществления, линкер (L) обладает структурой:
 .
.
В другом варианте осуществления, линкер может быть замещен группами, модулирующими растворимость и реакционноспособность. Например, сульфонатный заместитель может увеличивать растворимость реагента в воде и облегчать реакцию присоединения линкерного реагента и антитела или молекулы лекарственного средства или облегчать реакцию связывания Ab-L с D или D-L с Ab, в зависимости от применяемого для получения ADC способа синтеза.
В другом варианте осуществления линкер обладает реакционноспособной функциональной группой, которая несет нуклеофильную группу, способную к реакции с электрофильной группой, находящейся на антителе. Подходящие электрофильные группы на антителе включают, но ими не ограничиваются, альдегидную и кетоновую карбонильные группы. Гетероатом нуклеофильной группы линкера может реагировать с электрофильной группой на антителе и образовать ковалентную связь с молекулой антитела. Подходящие нуклеофильные группы на линкере включают, но ими не ограничиваются, гидразид, оксим, амино, гидразин, тиосемикарбазон, гидразинкарбоксилат и арилгидразид. Электрофильная группа на антителе обеспечивает подходящий участок для присоединения линкера.
Линкеры могут быть пептидными и содержать одну или несколько аминокислотных единиц. Пептидные линкерные реагенты можно получать способами твердофазного или жидкофазного синтеза (E. Schröder and K. Lübke, The Peptides, volume 1, pp.76-136 (1965) Academic Press), которые хорошо известны в области пептидной химии, включая химические реакции с t-BOC (Geiser et al. «Automation of solid-phase peptide synthesis» in Macromolecular Sequencing and Synthesis, Alan R. Liss, Inc., 1988, pp. 199-218) и химические реакции с Fmoc/HBTU (Fields, G. and Noble, R. (1990) «Solid phase peptide synthesis utilizing 9-fluoroenylmethoxycarbonyl amino acids», Int. J. Peptide Protein Res. 35:161-214), на автоматическом синтезаторе, таком как Rainin Symphony Peptide Synthesizer (Protein Technologies, Inc., Tucson, AZ), или Model 433 (Applied Biosystems, Foster City, CA).
Соединения, которые могут использоваться в качестве ADC, полученные с применением перекрестносшивающих реагентов включают, но ими не ограничиваются, BMPEO, BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC и сульфо-SMPB и SVSB (сукцинимидил-(4-винилсульфон)бензоат), включая бис-малеимидные реагенты: DTME, BMB, BMDB, BMH, BMOE, BM(PEO)3 и BM(PEO)4, коммерчески доступные от Pierce Biotechnology, Inc., Customer Service Department, P.O. Box 117, Rockford, IL. 61105 USA, USA 1-800-874-3723, International +815-968-0747. Смотри страницы 467-498, 2003-2004 Applications Handbook and Catalog. Бис-малеимидные реагенты обеспечивают связывание свободной тиольной группы цистеинового остатка антитела с содержащей тиол молекулой лекарственного средства, меткой или линкерным промежуточным соединением, последовательным или одновременным способом. Другие функциональные группы кроме малеимида, которые способны взаимодействовать с тиольной группой антитела, майтаназоидного лекарственного средства или линкерным промежуточным соединением включают йодоацетамид, бромацетамид, винилпиридин, дисульфид, пиридилдисульфид, изоцианат и изотиоцианат.
Иллюстративные конъюгаты антитело-лекарственное средство, где DM1 связано через линкер BMPEO с тиольной группой трастузумаба, обладают структурой:
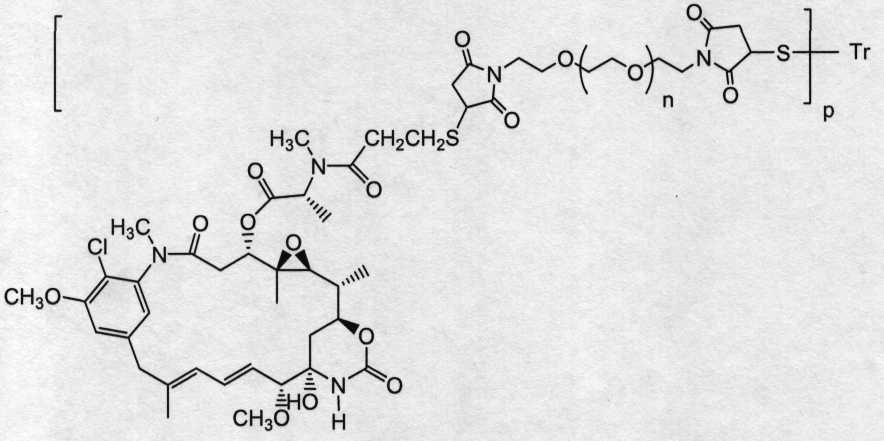
где Tr представляет собой трастузумаб; n равно 0, 1 или 2; а p равно 1, 2, 3 или 4.
Линкерные реагенты, которые могут использоваться, также можно получать из коммерческих источников, например, Molecular Biosciences Inc. (Boulder, CO) или синтезировать в соответствии со способами, описанными Toki et al. (2002) J. Org. Chem. 67:1866-1872; в патенте США № 6214345, выданном Firestone et al.; WO 02/088172; патенте США № 2003130189; патенте США № 2003096743; WO 03/026577; WO 03/043583 и WO 04/032828.
Линкер может представлять собой линкер ветвящегося типа для ковалентного связывания с антителом более чем одной молекулы лекарственного средства посредством разветвленной, полифункциональной линкерной молекулы (Sun et al. (2002) Bioorganic & Medicinal Chemistry Letters 12:2213-2215; Sun et al. (2003) Bioorganic & Medicinal Chemistry 11:1761-1768; King et al. (2002) Tetrahedron Letters 43:1987-1990). Ветвящиеся линкеры могут увеличивать молярное соотношение лекарственного средства и антитела, то есть нагрузку, которая связана с эффективностью ADC. Таким образом, когда антитело несет только одну реакционную тиольную группу цистеина, несколько молекул лекарственного средства можно присоединить посредством ветвящегося линкера.
Следующие иллюстративные варианты осуществления дендритных линкерных реагентов позволяют конъюгировать до 9 нуклеофильных молекул реагента лекарственного средства посредством реакции с хлорэтильными функциональными группами азотистого иприта:
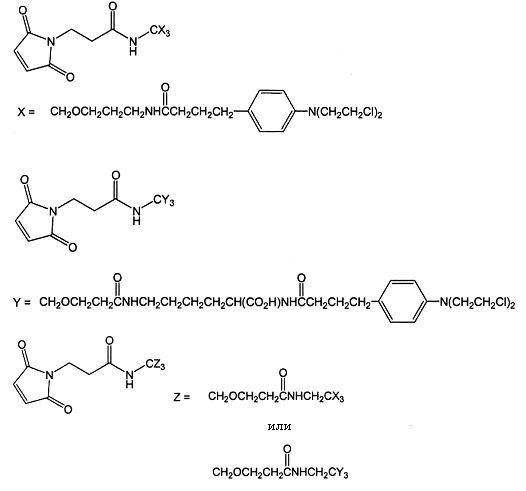
НАГРУЗКА ЛЕКАРСТВЕННЫМ СРЕДСТВОМ
Нагрузка лекарственным средством на формуле молекулы I представлена посредством p, средним количеством молекул майтанзиноидных лекарственных средств на антитело. Нагрузка лекарственным средством может находиться в диапазоне от 1 до 8 молекул лекарственных средств (D) на антитело (Ab), то есть когда 1, 2, 3, 4, 5, 6, 7 и 8 молекул лекарственного средства ковалентно связаны с антителом. Композиции ADC формулы I включают наборы антител, конъюгированных с диапазоном молекул лекарственных средств от 1 до 8. Среднее число молекул лекарственных средств на антитело в препаратах ADC после реакций конъюгации можно охарактеризовать обычными способами, такими как масс-спектрометрия, анализ ELISA, электрофорез и ВЭЖХ. Также можно определить количественное распределение ADC в единицах p. Посредством ELISA можно определить среднее значение p в конкретном препарате ADC (Hamblett et al. (2004) Clinical Cancer Res. 10:7063-7070; Sanderson et al. (2005) Clinical Cancer Res. 11:843-852). Однако распределение значений p (лекарственного средства) не различимо из-за связывания антиген-антитело и ограничения определения ELISA. Также анализ ELISA для детекции конъюгатов антитело-лекарственное средство не определяет место присоединения молекулы лекарственного средства к антителу, такого как фрагменты тяжелой цепи или фрагменты легкой цепи или конкретные аминокислотные остатки. В некоторых случаях разделение, очистку и характеристику гомогенного ADC, где p представляет собой определенное значение на основе ADC с другими нагрузками лекарственным средством, можно оценить такими способами, как ВЭЖХ с обратной фазой или электрофорез.
Для некоторых конъюгатов антитело-лекарственное средство p может быть ограничено количеством участков присоединения на антителе. Например, когда участок присоединения представляет собой тиол цистеина, как в иллюстративных вариантах осуществления выше, на антителе могут присутствовать только одна или несколько тиольных групп цистеина или могут присутствовать только одна или несколько достаточно реакционноспособных тиольных групп, посредством которых может быть присоединен линкер. Большая нагрузка лекарственным средством, например p > 5, может вызвать агрегацию, нерастворимость, токсичность или потерю проницаемости в клетки для определенных конъюгатов антитело-лекарственное средство.
Как правило, в течение реакции конъюгации с антителом конъюгирует меньше молекул лекарственного средства, чем теоретический максимум. Антитело может содержать, например, множество остатков лизина, которые не реагируют с промежуточным соединением лекарственное средство-линкер (D-L) или линкерным реагентом. Только наиболее реакционноспособные лизиновые группы могут реагировать с амин-реактивным линкерным реагентом. Также только наиболее реакционноспособные тиольные группы цистеинов могут реагировать с тиол-реактивным линкерным реагентом. Как правило, антитела не содержат свободных и реакционноспособных тиольных групп цистеинов, которые могут связываться с молекулой лекарственного средства, или содержат их в незначительном количестве. Большинство тиольных остатков цистеинов в антителах соединений существуют в виде дисульфидных мостиков и их необходимо восстановить восстановителем, таким как дитиотреитол (DTT) или TCEP, в частичных или полностью восстанавливающих условиях. Кроме того, антитело необходимо поместить в денатурирующие условия для открытия реакционноспособных нуклеофильных групп, таких как лизин или цистеин. Нагрузку (отношение лекарственное средство/антитело) ADC можно контролировать несколькими различными способами, включающими: (i) ограничение молярного избытка промежуточного соединения лекарственное средство-линкер (D-L) или линкерного реагента относительно антитела, (ii) ограничение времени или температуры реакции конъюгации и (iii) частичные или ограниченные восстанавливающие условия для модификации тиолов цистеинов.
Когда с промежуточным соединением лекарственное средство-линкер или линкерным реагентом с последующей молекулой реагента лекарственного вещества реагирует более чем одна нуклеофильная или электрофильная группа антитела, тогда получаемый продукт представляет собой смесь соединений ADC с распределением молекул лекарственного средства, присоединенных к антителу, например 1, 2, 3 и т.д. С помощью способов жидкостной хроматографии, таких как полимерная обратная фаза (PLRP) и гидрофобное взаимодействие (HIC), можно разделить соединения в смеси по значениям нагрузки лекарственным средством. Можно выделить препараты ADC с одним значением нагрузки лекарственным средством (p) («Effect of drug loading on the pharmacology, pharmacokinetics, and toxicity of an anti-CD30 antibody-drug conjugate», Hamblett, K.J., et al., Abstract No. 624, American Association for Cancer Research; 2004 Annual Meeting, March 27-31, 2004, Proceedings of the AACR, Volume 45, March 2004; «Controlling the Location of Drug Attachment in Antibody-Drug Conjugates», Alley, S.C., et al., Abstract No. 627, American Association for Cancer Research; 2004 Annual Meeting, March 27-31, 2004, Proceedings of the AACR, Volume 45, March 2004). Однако эти ADC с одинаковым значением нагрузки все еще могут оставаться гетерогенными смесями вследствие того, что молекулы лекарственного средства могут через линкер присоединяться по другим участкам антитела.
ПОЛУЧЕНИЕ КОНЪЮГАТОВ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО
ADC формулы I можно получать различными способами, применяя реакции органической химии, условия и реагенты, известные специалистам в данной области, включая: (1) реакцию нуклеофильной группы или электрофильной группы антитела с бивалентным линкерным реагентом с образованием посредством ковалентной связи промежуточного продукта антитело-линкер Ab-L с последующей реакцией с активированной молекулой лекарственного средства D; и (2) реакцию нуклеофильной группы или электрофильной группы молекулы лекарственного средства с линкерным реагентом с образованием посредством ковалентной связи промежуточного соединения лекарственное средство-линкер D-L с последующей реакцией с нуклеофильной группой или электрофильной группой антитела. Способы конъюгации (1) и (2) можно использовать для множества антител, молекул лекарственного средства и линкеров с получением конъюгатов антитело-лекарственное средство формулы I.
Нуклеофильные группы на антителах включают, но ими не ограничиваются: (i) N-концевые аминогруппы, (ii) аминогруппы боковых цепей, например лизина, (iii) тиольные группы боковых цепей, например цистеина, и (iv) гидроксильные группы или аминогруппы сахаров, если антитело гликозилировано. Амино, тиольные и гидроксильные группы являются нуклеофильными и способны взаимодействовать с образованием ковалентной связи с электрофильными группами линкерных молекул и линкерных реагентов, включая: (i) активные сложные эфиры, такие как сложные эфиры NHS, сложные эфиры HOBt, галогенформиаты и галогенангидриды; (ii) алкил и бензилгалогениды, такие как галогенацетамиды; (iii) альдегидные, кетоновые, карбоксильные и малеимидные группы. Определенные антитела несут межцепочечные дисульфиды, которые могут быть восстановленными, то есть цистеиновые мостики. Антитела можно сделать реакционноспособными для конъюгации с линкерными реагентами посредством обработки восстановителем, таким как DTT (реагент Клеланда, дитиотреитол) или TCEP (трис(2-карбоксиэтил)фосфингидрохлорид; Getz et al. (1999) Anal. Biochem. Vol 273:73-80; Soltec Ventures, Beverly, MA). Таким образом, каждый цистеиновый дисульфидный мостик теоретически будет образовать два реакционноспособных тиольных нуклеофила. Дополнительные нуклеофильные группы могут быть введены в антитела с помощью реакции лизинов с 2-иминотиоланом (реагент Траута), что приводит к преобразованию амино в тиол.
Конъюгаты антитело-лекарственное средство также можно получать посредством модификации антитела с введением электрофильных групп, которые могут реагировать с нуклеофильными заместителями на линкерном реагенте или лекарственном средстве. На гликозилированных антителах можно окислять сахара, например, с применением окисляющих реагентов периодатов, с образованием альдегидных или кетоновых групп, которые могут реагировать с аминогруппой линкерных реагентов или молекул лекарственного средства. Полученные иминовые группы оснований Шиффа могут образовать стабильную связь или их можно восстанавливать, например, борогидридными реагентами с образованием стабильных аминных связей. В одном из вариантов осуществления реакция углеводной части гликозилированного антитела с галактозоксидазой или метапериодатом натрия может приводить к образованию в белке карбонильных (альдегидной или кетоновой) групп, которые могут взаимодействовать с подходящей группой на лекарственном средстве (Hermanson, G.T. (1996) Bioconjugate Techniques; Academic Press: New York, p.234-242). В другом варианте осуществления белки, содержащие N-концевые остатки серина или треонина, могут реагировать с метапериодатом натрия, что приводит к образованию альдегида вместо первой аминокислоты (Geoghegan & Stroh, (1992) Bioconjugate Chem. 3:138-146; патент США № 5362852). Такой альдегид может взаимодействовать с молекулой лекарственного средства или линкерным нуклеофилом.
Подобным образом нуклеофильные группы молекулы лекарственного средства включают в качестве неограничивающих примеров: аминогруппу, тиольную, гидроксильную, гидразидную, оксимную, гидразиновую, тиосемикарбазоновую, гидразинкарбоксилатную и арилгидразидную группы, способные к взаимодействию с образованием ковалентных связей с электрофильными группами на линкерных молекулах и линкерных реагентах, включающими: (i) активные сложные эфиры, такие как сложные эфиры NHS, сложные эфиры HOBt, галогенформиаты и галогенангидриды; (ii) алкил- и бензилгалогениды, такие как галогенацетамиды; (iii) альдегидные, кетоновые, карбоксильные и малеимидные группы.
Например, майтаназин можно преобразовывать в May-SSCH3, который может быть восстановлен до свободного тиола, May-SH, и взаимодействовать с модифицированным антителом (Chari et al. (1992) Cancer Research 52:127-131) с получением иммуноконъюгата майтаназоидное средство-антитело с дисульфидным линкером. Конъюгаты антитело-майтаназоидное средство с дисульфидными линкерами описаны (WO 04/016801; патент США № 6884874; патент США № 2004/039176 A1; WO 03/068144; патент США № 2004/001838 A1; патент США № 6441163; патент США № 5208020; патент США № 5416064; WO 01/024763). Дисульфидный линкер SPP состоит из линкерного реагента N-сукцинимидил 4-(2-пиридилтио)пентаноата. Конъюгаты антитело-SPP-DM1 представлены структурой:
Конъюгаты антитело-лекарственное средство с дисульфидными (S-S) линкерами тестировали для сравнения с ADC без дисульфидных линкеров по изобретению. Трастузумаб-SPP-DM1 получали в соответствии с примером 3 (Ranson, M. and Sliwkowski M. (2002) Oncology 63 (suppl 1):17-24). Также тестировали дисульфидные конъюгаты антитело-лекарственное средство: трастузумаб-SPDP-DM1, трастузумаб-SPP-DM3 и трастузумаб-SPP-DM4, и они имеют ниже приведенные структуры:
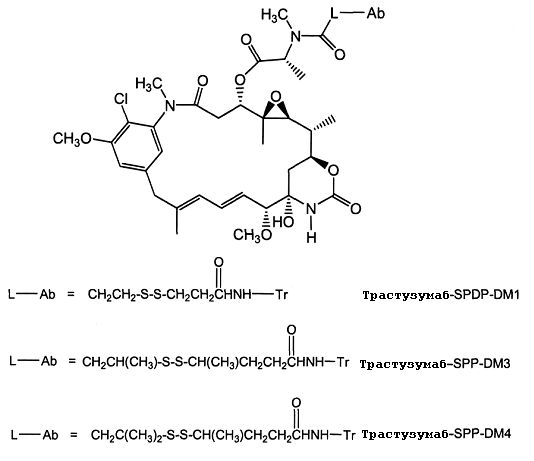
ADC по изобретению включают линкеры SMCC, а майтаназоидное лекарственное средство DM1, представлено как Ab-SMCC-DM1:
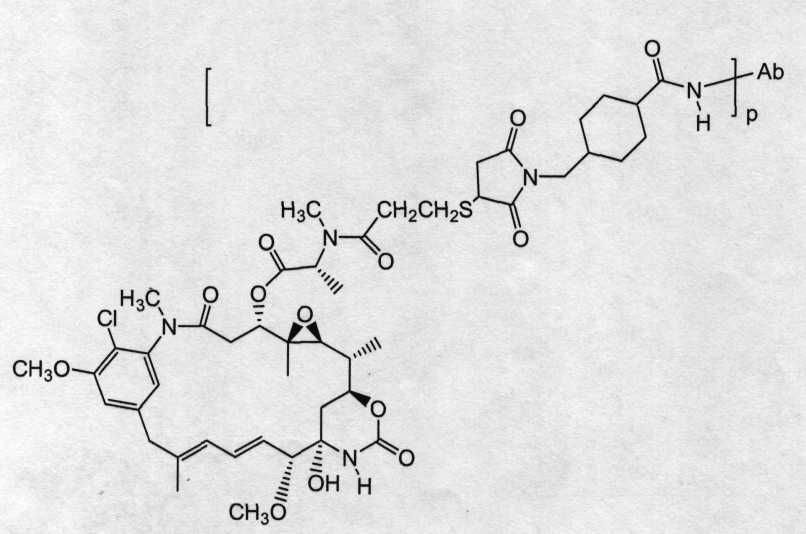 .
.
В одном из вариантов осуществления Ab-SMCC-DM1 представляет собой трастузумаб-SMCC-DM1, где p равно 1, 2, 3 или 4 (Ab=трастузумаб, Tr, WO 2005/037992). В другом варианте осуществления ADC представляет собой трастузумаб-SIAB-DM1 (трастузумаб=Tr) со структурой:
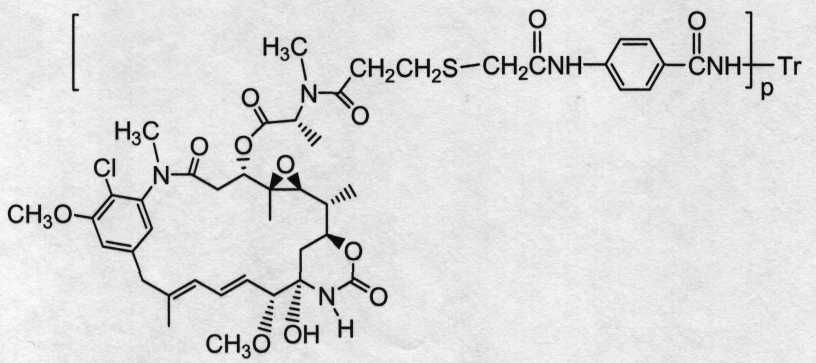 .
.
СКРИНИНГ НА КОНЪЮГАТЫ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО (ADC), ПРОТИВ АНТИГЕНОВ, АССОЦИИРОВАННЫХ С ОПУХОЛЯМИ, И РЕЦЕПТОРОВ КЛЕТОЧНОЙ ПОВЕРХНОСТИ
Для скрининга конъюгатов антитело-лекарственное средство (ADC), которые, вероятно, могут использоваться в качестве профилактических или терапевтических средств для лечения заболеваний или нарушений со сверхэкспрессией антигенов, ассоциированных с опухолями, и рецепторов на клеточной поверхности, например HER2, особенно удобно использовать трансгенных животных и клеточные линии (патент США № 6632979). Скрининг на подходящие ADC может включать в себя введение трансгенному животному ADC-кандидата в диапазоне доз и определение в различные моменты времени воздействие ADC на оцениваемое заболевание или нарушение. Альтернативно или дополнительно, если возможно, лекарственное средство можно вводить до воздействия средства, индуцирующего заболевание, или одновременно с ним. ADC-кандидат можно скринировать серийно или индивидуально или одновременно в условиях средне- или высокопроизводительного скрининга. Скорость, с которой ADC можно скринировать на эффективность для профилактического или терапевтического лечения заболеваний или нарушений, ограничена только скоростью синтеза и методологией скринирования, включая детекцию/измерение/анализ данных.
Один из вариантов осуществления относится к способу скринирования, который включает (a) трансплантацию клеток стабильной клеточной линии рака молочной железы животному, не являющемуся человеком, (b) введение животному, не являющемуся человеком вероятного лекарственного средства ADC и (c) определение его способности ингибировать образование опухолей из трансплантированной клеточной линии. Изобретение также относится к способу скрининга ADC-кандидатов на способность оказывать лечебный эффект на заболевание или нарушение, отличающееся сверхэкспрессией рецепторного белка, включающему (a) контактирование клеток стабильной клеточной линии рака молочной железы с возможным лекарственным средством и (b) оценку способности ADC-кандидата ингибировать рост стабильной клеточной линии.
Один из вариантов осуществления относится к способу скрининга, который включает (a) контактирование клеток стабильной клеточной линии рака молочной железы с вероятным лекарственным средством ADC и (b) оценку способности ADC-кандидата блокировать активацию HER2 лигандом. В другом варианте осуществления оценивали способность ADC-кандидата блокировать связывание херегулина. В другом варианте осуществления оценивали способность ADC-кандидата блокировать стимулируемое лигандом фосфорилирование тирозина.
Другой вариант осуществления представляет собой способ скрининга, включающий (a) контактирование клеток стабильной клеточной линии рака молочной железы с вероятным лекарственным средством ADC и (b) оценку способности ADC-кандидата индуцировать гибель клеток. В одном из вариантов осуществления оценивали способность ADC-кандидата индуцировать апоптоз.
Другой вариант осуществления относится к способу скрининга, который включает (a) введение вероятного лекарственного средства ADC трансгенному не являющемуся человеком млекопитающему со сверхэкспрессией, например, клетками молочной железы, природного белка человека, например HER2 или его фрагмента, где такое трансгенное животное несет стабильно интегрированную в его геном последовательность нуклеиновой кислоты, кодирующей природный белок человека или его фрагмент, с биологической активностью природного белка человека, функционально связанную с последовательностями, регулирующими транскрипцию, которые регулируют его экспрессию, и у которого развивается опухоль, например опухоль молочной железы, лечение антителами которой не эффективно или слабо эффективно, например, лечение антителом против HER2, или введение млекопитающему, не являющемуся человеком, с опухолью, трансплантированной от указанного трансгенного млекопитающего, не являющегося человеком; и (b) оценку эффекта ADC-кандидата в отношении исследуемого заболевания или нарушения. Без ограничений заболевание или нарушение может представлять собой рак со сверхэкспрессирующей HER2, такой как рак молочной железы яичника, желудка, эндометрия, слюнной железы, легкого, почки, толстой кишки, щитовидной железы, поджелудочной железы или мочевого пузыря. Раком может быть рак молочной железы, экспрессирующий HER2 по меньшей мере в количестве приблизительно 500000 копий на клетку или по меньшей мере приблизительно 2000000 копий на клетку. Например, вероятное лекарственное средство ADC можно оценивать по способности индуцировать клеточную гибель и/или апоптоз, используя способы, хорошо известные в данной области и описанные в данном документе далее.
В одном из вариантов осуществления ADC-кандидат скринируют, вводя его трансгенному животному в различном диапазоне доз и оценивая физиологический ответ животного на соединения в динамике по времени. Введение может быть пероральным или посредством подходящей инъекции в зависимости от химической природы оцениваемого соединения. В некоторых случаях подходящим может быть введение соединения в сочетании с кофакторами, которые могли бы увеличить эффективность соединения. Если для скрининга соединения, которое может быть эффективно для лечения различных заболеваний, связанных со сверхэкспрессией определенных ассоциированных с опухолями антигенных белков или рецепторов клеточной поверхности, например со сверхэкспрессией HER2, применяют клеточные линии, полученные от исследуемых трансгенных животных, то тестируемые соединения в течение соответствующего времени добавляют к клеточной культуральной среде, и оценивают клеточный ответ на соединение в динамике по времени, используя соответствующие биохимические и/или гистологические способы анализа. В некоторых случаях подходящим может быть введение представляющего интерес соединения в культуральную среду в сочетании с кофакторами, которые могли бы увеличить эффективность соединения.
Таким образом, настоящее изобретение относится к способам идентификации ADC, специфической мишенью которых является сверхэкспрессированный белок HER2 и которые связывают этот белок, присутствие которого коррелирует с патологической функцией клеток и играет роль в патогенезе клеточной пролиферации и/или дифференцировке молочной железы, что является причиной развития рака молочной железы.
Для идентификации ADC, блокирующих активацию лигандов рецептора ErbB (например, ErbB2), можно определять способность соединения блокировать связывание лиганда ErbB с клетками, экспрессирующими рецептор ErbB (ErbB2) (например, в сочетании с другим рецептором ErbB, с которым представляющий интерес рецептор ErbB образует гетероолигомер ErbB). Например, клетки, выделенные из трансгенного животного, сверхэкспрессирующие HER2 и трансфицированные с тем, чтобы экспрессировать ещё один рецептор ErbB (с которым HER2 образует гетероолигомер), можно инкубировать, то есть культивировать, с ADC, а затем подвергать воздействию меченого лиганда ErbB. Затем можно оценивать способность соединения блокировать связывание лиганда с рецептором ErbB в гетероолигомере ErbB.
Например, ингибирующая активность ADC-кандидата в отношении связывания херегулина (HRG) с клеточными линиями рака молочной железы, сверхэкспрессирующими HER2 и полученными в данном документе из млекопитающих, не являющихся человеком (например, мышей), можно проводить с помощью монослойных культур на льду в 24-луночном планшете. Моноклональные антитела против ErbB2 добавляют к каждой лунке и инкубируют в течение 30 минут. Затем добавляют меченный 125I rHRGβ1177-224 (25000 имп./мин) и инкубацию продолжают в течение от 4 до 16 часов. Получают кривые доза-ответ и для представляющего интерес соединения рассчитывают значение IC50.
Альтернативно или дополнительно, можно оценивать способность ADC блокировать лиганд-стимулируемое фосфорилирование тирозина рецептора ErbB, находящегося в гетероолигомере ErbB. Например, клеточные линии, полученные из трансгенных животных, как описано в данном документе, можно инкубировать с тестируемым ADC и затем оценивать на активность лиганд-зависимого фосфорилирования тирозина ErbB с применением моноклонального антитела против фосфотирозина (которое, необязательно, конъюгировано с визуализируемой меткой). Также для определения активации рецептора ErbB и блокирования этой активности соединением можно использовать анализ активации киназного рецептора, описанный в патенте США № 5766863.
В одном из вариантов осуществления можно проводить скрининг на ADC, который ингибирует стимуляцию фосфорилирования тирозина p180 в клетках MCF7 с помощью HRG, по существу, так, как описано ниже. Например, клеточную линию, полученную от трансгенного по HER2 животного, помещают в 24-луночные планшеты и к каждой лунке добавляют соединение и инкубируют 30 минут при комнатной температуре; затем к каждой лунке добавляют rHRGβ1177-244 в конечной концентрации 0,2 нМ и инкубацию продолжают в течение приблизительно 8 минут. Из каждой лунки отсасывают среду и реакцию останавливают, добавляя 100 мкл буфера для образцов с SDS (5% SDS, 25 мМ DTT, и 25 мМ Tris-HCl, pH 6,8). Каждый образец (25 мкл) подвергают электрофорезу на градиентном геле 4-12% (Novex) и затем электрофоретически переносят на поливинилидендифторидную мембрану. Получают иммуноблоты с антителами против фосфотирозина (при концентрации 1 мкг/мл) и посредством отражательной денситометрии количественно определяют интенсивность преобладающей реагирующей полосы с Mr=180000. Альтернативным способом оценки ингибирования фосфорилирования рецептора является анализ KIRA (активация киназного рецептора) (Sadick et al. (1998) Jour. of Pharm. and Biomed. Anal. 1-9). В качестве положительного контроля в этом анализе можно использовать некоторые из хорошо изученных моноклональных антител против HER2, которые, как известно, ингибируют стимуляцию фосфорилирования тирозина p180 посредством HRG,. Получают кривую доза-ответ для ингибирования стимуляции фосфорилирования тирозина p180 посредством HRG, определенную отражательной денситометрией и для представляющего интерес соединения рассчитывают IC50.
Также можно оценивать ингибирующие рост эффекты тестируемого ADC на клеточные линии, полученные от трансгенного по HER2 животного (Schaefer et al. (1997) Oncogene 15:1385-1394). В соответствии с этим анализом клетки обрабатывают тестируемым соединением в различных концентрациях в течение 4 суток и окрашивают кристаллическим фиолетовым или окислительно-восстановительным красителем Alamar Blue. Инкубация с соединением показывает ингибирующий рост эффект на эту клеточную линию подобно воздействию, демонстрируемому моноклональным антителом 2C4 на клетки MDA-MB-175 (Schaefer et al., выше). В дополнительном варианте осуществления экзогенный HRG изменяет значительно данное ингибирование.
Для идентификации ингибирующих рост соединений ADC, которые специфически направлены против HER2, можно проводить скрининг на ADC, которое ингибирует рост сверхэкспрессирующих HER2 раковых клеток, полученных от трансгенных животных (патент США № 5677171). В соответствии с этим анализом сверхэкспрессирующие HER2 клетки растят в среде смеси F12 и DMEM 1:1, дополненной 10% эмбриональной телячьей сывороткой, глутамином и пенициллином со стрептомицином. Эти клетки в количестве 20000 клеток вносят в 35-мм чашку для клеточной культуры (2 мл/35 мм чашку) и добавляют тестируемое соединение в разных концентрациях. Через шесть суток с помощью электронного счетчика клеток COULTER™ подсчитывают количество клеток по сравнению с необработанными клетками. Те ADC, которые ингибируют клеточный рост приблизительно на 20-100% или приблизительно на 50-100% могут быть выбраны в качестве ингибирующих рост соединений.
Для отбора ADC, индуцирующих клеточную гибель, можно оценивать нарушение целостности мембраны, на что указывает, например, захват PI, трипанового синего или 7AAD, по сравнению с контролем. Для анализа захвата PI используют клетки, выделенные из ткани опухоли молочной железы трансгенного животного. В соответствии с этим анализом клетки культивируют в модифицированной Дульбекко среде Игла (D-MEM): F-12 Хама (50:50), дополненной 10% ЭТС, инактивированной нагреванием, (Hyclone) и 2 мМ L-глутамином. Таким образом, анализ проводят в отсутствие комплемента и иммунных эффекторных клеток. Клетки высевают при плотности 3 × 106 на чашку в 100 × 20 мм чашки и оставляют на ночь для прикрепления. Затем среду удаляют и заменяют на свежую среду или свежую среду, содержащую различные концентрации соединения. Клетки инкубируют в течение 3 суток. После каждой обработки монослои отмывают PBS и проводят трипсинизацию для открепления клеток. Затем клетки центрифугируют при 1200 об/мин в течение 5 минут при 4°C, осадок ресуспендируют в 3 мл охлажденного буфера, связывающего Ca2+ (10 мМ Hepes, pH 7,4, 140 мМ NaCl, 2,5 мМ CaCl2) и отбирают аликвоты в покрытые 35 мм фильтром 12 × 75 мм пробирки (1 мл на пробирку, 3 пробирки на обработанную группу) для удаления клеточных скоплений. Затем в пробирки вносят PI (10 мкг/мл). Затем образцы анализируют с помощью проточного цитометра FACSCAN™ и программного обеспечения FACSCONVERT™ CellQuest (Becton Dickinson). Те соединения, которые индуцируют статистически значимые уровни клеточной гибели, которые определяют посредством захвата PI, отбирают в качестве индуцирующих клеточную гибель соединений.
Для отбора соединений, индуцирующих апоптоз, проводят анализ связывания аннексина с применением клеток, полученных из ткани опухоли молочной железы трансгенного животного. Клетки культивируют и высевают в чашки, как описано в предыдущем параграфе. Затем среду удаляют и заменяют на свежую среду или среду, содержащую 10 мкг/мл конъюгата антитело-лекарственное средство (ADC). После инкубации в течение трех суток монослои отмывают PBS и проводят трипсинизацию. Для открепления клеток затем клетки центрифугируют и ресуспендируют в связывающем Ca2+ буфере и отбирают аликвоты в пробирки, как описано выше для анализа клеточной гибели. Затем в пробирки добавляют меченный аннексин (например, аннексин V-FITC) (1 мкг/мл). Затем образцы анализируют с помощью проточного цитометра FACSCAN™ и программного обеспечения FACSCONVERT™ CellQuest (Becton Dickinson). Те соединения, которые индуцируют статистически значимые уровни связывания аннексина по сравнению с контролем, выбирают в качестве индуцирующих апоптоз соединений.
АНАЛИЗЫ ПРОЛИФЕРАЦИИ КЛЕТОК IN VITRO
Как правило, цитотоксическую или цитостатическую активность конъюгата антитело-лекарственное средство (ADC) измеряют следующим образом: на клетки млекопитающих с антигенами, ассоциированными с опухолями, или с рецепторными белками воздействуют антителом ADC в клеточной культуральной среде; культивируют клетки в течение приблизительно от 6 часов до приблизительно 5 суток; измеряют жизнеспособность клеток. Клеточные анализы in vitro применяют для измерения жизнеспособности, то есть пролиферации (IC50), цитотоксичности (EC50) и индукции апоптоза (активация каспазы) ADC.
Эффективность конъюгатов антитело-лекарственное средство in vitro измеряли с помощью анализа пролиферации клеток (фиг. 1-4). Анализ CellTiter-Glo® Luminescent Cell Viability Assay представляет собой коммерчески доступный (Promega Corp., Madison, WI) способ гомогенного анализа на основе рекомбинантной экспрессии люциферазы Coleoptera (патент США № 5583024; патент США № 5674713; патент США № 5700670). В этом анализе пролиферации клеток определяют количество живых клеток в культуре на основании количественного определения присутствующей АТФ, индикатора метаболически активных клеток (Crouch et al. (1993) J. Immunol. Meth. 160:81-88; патент США № 6602677). Анализ CellTiter-Glo® Assay проводили в 96-луночном планшете, изменяя его для автоматизированного высокопроизводительного скрининга (HTS) (Cree et al. (1995) AntiCancer Drugs 6:398-404). Процедура гомогенного анализа включает добавление одного реагента (CellTiter-Glo® Reagent) непосредственно к клеткам, культивируемым в среде, дополненной сывороткой. Отмывка клеток, удаление среды и ряд стадий пипетирования не требуется. Система обнаруживает минимально 15 клеток/лунку в 384-луночном планшете через 10 минут после добавления реагента и смешивания.
Гомогенная форма «добавление-смешивание-измерение» приводит к лизису клеток и генерации люминесцентного сигнала, пропорционального количеству присутствующей АТФ. Количество АТФ прямо пропорционально количеству присутствующих в культуре клеток. В анализе CellTiter-Glo® Assay при люциферазной реакции образуется люминесцентный сигнал «типа свечения», который обладает временем полужизни, как правило, более пяти часов в зависимости от типа клеток и используемой среды. Живые клетки выражают в относительных люминесцентных единицах (RLU). Субстрат, люциферин жука, подвергают окислительному декарбоксилированию посредством рекомбинантной люциферазы светляка, что сопровождается преобразованием АТФ в АМФ и образованием фотонов. Повышенное время полужизни устраняет необходимость в использовании инъекторов реагента и обеспечивает гибкость в отношении непрерывного или группового способа обработки нескольких планшетов. Этот анализ пролиферации клеток можно использовать в различных многолуночных форматах, например 96- или 384-луночном формате. Данные можно записывать посредством люминометра или устройства получения изображений с камерой CCD. Результат люминесценции представляют в виде относительных световых единиц (RLU), измеренных в течение времени.
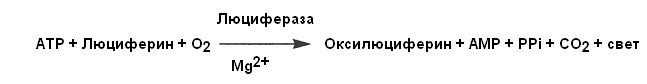
Антипролиферативные эффекты трех конъюгатов антитело-лекарственное средство измеряли с помощью клеточной пролиферации, указанного выше анализа гибели клеток in vitro относительно четырех различных клеточных линий опухоли молочной железы (фиг.1-4). На фиг.1 показаны измерения результативности при увеличивающихся концентрациях трастузумаба-SPP-DM1, трастузумаба-SPDP-DM1 и трастузумаба-SMCC-DM1 через 3 суток обработки клеток опухоли молочной железы SK-BR-3 (HER2 3+). На фиг.2 показаны измерения результативности при увеличивающихся концентрациях трастузумаба-SPP-DM1, трастузумаба-SPDP-DM1 и трастузумаба-SMCC-DM1 через 3 суток обработки клеток опухоли молочной железы BT-474 (HER2 3+). На фиг.3 показаны измерения результативности при увеличивающихся концентрациях трастузумаба-SPP-DM1, трастузумаба-SPDP-DM1 и трастузумаба-SMCC-DM1 через 3 суток обработки клеток опухоли молочной железы MCF7 (низкое содержание HER2). На фиг.4 показаны измерения результативности при увеличивающихся концентрациях трастузумаба-SPP-DM1, трастузумаба-SPDP-DM1 и трастузумаба-SMCC-DM1 через 3 суток обработки клеток опухоли молочной железы MDA-MB-468 (отсутствие HER2).
Значения IC50 определяли для SK-BR-3 и BT-474, которые, как известно, сверхэкспрессируют белок рецептора HER2. Большинство конъюгатов трастузумаб-SPP-DM1 с 2,8 DM1 на молекулу трастузумаба (лекарственное средство/Ab) давало среднее значение IC50 в размере 14,4 мкг/мл с интервалом от 9,1 до 22,3 мкг/мл для 6 экспериментов по сравнению с клетками SK-BR-3, и среднее значение IC50 в размере 51,7 мкг/мл с интервалом от 28,7 до 63,1 мкг/мл для 4 экспериментов по сравнению с клетками BT-474. Большинство конъюгатов трастузумаб-SMCC-DM1 с 2,7 DM1 на молекулу трастузумаба (лекарственное средство/Ab) давало среднее значение IC50 в размере 15,2 мкг/мл с интервалом от 12,6 до 18,8 мкг/мл для 4 экспериментов по сравнению с клетками SK-BR-3 и среднее значение IC50 в размере 94,9 мкг/мл с интервалом от 75,2 до 114,6 мкг/мл для 2 экспериментов по сравнению с клетками BT-474. Конъюгаты были неактивны в отношении клеток MCF7 и MDA-MB-468, у которых отсутствует сверхэкспрессия HER2.
Конъюгат антитела против CD19-SMCC-DM1 продемонстрировал эффективное уничтожение клеток in vitro в отношении клеток Raji (IC50=<0,25 мкг/мл), при этом “голое” антитело и контрольный ADC, трастузумаб-SMCC-DM1, не показали эффекта. Конъюгаты антитела против CD79a-SMCC-DM1 и антитела к CD79b-SMCC-DM1 продемонстрировали эффективное уничтожение клеток in vitro в отношении клеток Ramos (IC50=<0,25 мкг/мл), при этом “голое” антитело и контрольный ADC, трастузумаб-SMCC-DM1 не показало эффекта.
На фиг.17 показан анализ пролиферации клеток in vitro (пример 5) с клетками HT1080EphB2 (C8), обработанными конъюгатами антитела против EphB2R 2H9-лекарственное средство: 2H9-SPP-DM1 (IC50 80 нг/мл) и 2H9-SMCC-DM1 (IC50 50 нг/мл).
СЫВОРОТОЧНЫЙ КЛИРЕНС И СТАБИЛЬНОСТЬ У МЫШЕЙ IN VIVO
Сывороточный клиренс и стабильность ADC исследовали у “голых” мышей без воздействия (без опухолей, привнесенных посредством экзогенных трансплантатов). На фиг.5 показан сывороточный клиренс трастузумаба-SMCC-DM1 по сравнению с трастузумабом-SPP-DM1 у “голых” мышей с врожденным отсутствием NK-клеток без опухолей, с измерением сывороточной концентрации конъюгата и общего антитела в шести временных точках в течение 7 суток. Различие в количестве общего антитела и ADC указывает на расщепление линкера и отделение антитела от его части DM1. Как показано, SMCC-связанный ADC оставались интактными in vivo более длительный срок, чем связанные SPP конъюгаты, на что указывает более высокая сывороточная концентрация конъюгированного антитела через семь суток.
На фиг.6 показана стабильность конъюгатов в динамике по времени у «голых» мышей без опухолей: трастузумаб-SPDP-DM1, трастузумаб-SPP-DM1, трастузумаб-SPP-DM3, трастузумаб-SPP-DM4 и трастузумаб-SMCC-DM1, с измерением сывороточной концентрации в шести временных точках в течение 7 суток. ADC с линкером SMCC были более стабильны in vivo, чем конъюгаты, связанные SPP или SPDP, хотя трастузумаб-SMCC-DM1 обладал сходной стабильностью, как и наиболее защищенный дисульфидный конъюгат, трастузумаб-SPP-DM4.
Показанные на фиг.5 и 6 эксперименты проводили на «голых» мышах без опухолей. Однако связанные SMCC конъюгаты у «голых» мышей с опухолями показали сходную увеличенную стабильность по сравнению со SPP-связанными конъюгатами. Как показано на фиг.7, в виде конъюгата оставалось приблизительно 72% исходного трастузумаб-SMCC-DM1 через 7 суток после обработки, тогда как ~10% исходного трастузумаб-SPP-DM1 оставались в виде конъюгата через 7 суток после обработки, что демонстрирует повышенную стабильность ферментативно не расщепляемых конъюгатов трастузумаб-SMCC-DM1 у «голых» мышей с опухолями.
СЫВОРОТОЧНЫЙ КЛИРЕНС И СТАБИЛЬНОСТЬ У КРЫС IN VIVO
На фиг.8 и 9 показана сравнительная стабильность и профили клиренса ADC с дисульфидным линкером (трастузумаб-SPP-DM1 и ADC с линкером, не являющимся дисульфидным (трастузумаб-SMCC-DM1) у крыс. Параметры исследования включали в себя:
|
ADC с линкером, не являющимся дисульфидным, трастузумаб-SMCC-DM1 (фиг.9) продемонстрировал лучшую стабильность в сыворотке крыс, чем ADC с дисульфидным линкером, трастузумаб-SPP-DM1 (фиг.8).
ЭФФЕКТИВНОСТЬ IN VIVO
Эффективность конъюгатов антитело-лекарственное средство по изобретению можно измерять in vivo, пересаживая аллотрансплантаты или ксенотрансплантаты из клеток злокачественных опухолей у грызунов и обрабатывая опухоли ADC. Результаты различались в зависимости от клеточной линии, специфичности связывания антитела ADC с рецепторами, присутствующими на раковых клетках, режима дозирования и других факторов. Эффективность in vivo ADC против HER2 измеряли посредством мышиной модели трансгенного эксплантата с высокой экспрессией HER2. Аллотрансплантат происходил от трансгенной мыши Fo5 mmtv, терапия герцептином которой была неэффективной или слабоэффективной. Субъектам однократно вводили ADC и проводили наблюдение в течение 3-6 недель для измерения времени удвоения опухоли, логарифма клеточной гибели и уменьшения опухоли. Последовательно проводили эксперименты доза-ответ и множественного дозирования.
Опухоли легко возникают у трансгенных мышей, экспрессирующих форму neu, активированную мутациями, гомолог HER2 крысы, но HER2, сверхэкспрессируемый при раке молочной железы, не является мутантным и образование опухоли у мышей, сверхэкспрессирующих немутантный HER2, менее устойчиво (Webster et al. (1994) Semin. Cancer Biol. 5:69-76).
Для улучшения образования опухоли с немутированным HER2, трансгенных мышей получали с помощью плазмиды с кДНК HER2, в которой был удален вышерасположенный ATG, находящийся в направлении 3'-5', для предотвращения трансляции с таких вышерасположенных кодонов ATG, которая могла бы уменьшить частоту инициации трансляции с аутентичных кодонов инициации HER2, расположенных в направлении 5'-3' (например, см. Child et al. (1999) J. Biol. Chem. 274: 24335-24341). Кроме того, на 5'-конце был добавлен химерный интрон, что также увеличивает уровень экспрессии, как было описано ранее (Neuberger and Williams (1988) Nucleic Acids Res. 16: 6713; Buchman and Berg (1988) Mol. Cell. Biol. 8:4395; Brinster et al. (1988) Proc. Natl. Acad. Sci. USA 85:836). Химерный интрон получали из вектора Promega, экспрессирующего вектора млекопитающих pCI-neo (п.н. 890-1022). кДНК 3'-конца фланкировали экзонами человеческого гормона роста 4 и 5 и последовательностями полиаденилирования. Кроме того, использовали мышей FVB, так как эта линия более чувствительна к развитию опухолей. Для обеспечения тканеспецифической экспрессии HER2 в молочной железе использовали промотор MMTV-LTR. Для увеличения чувствительности к образованию опухолей млекопитающих держали на диете ATN 76A (Rao et al. (1997) Breast Cancer Res. and Treatment 45:149-158).
На фиг.10-13 показано, что ADC обладают сильной противоопухолевой активностью у аллотрансплантатах HER2-позитивных опухолей (Fo5), которые исходно возникали у трансгенных мышей MMTV-HER2. Только антитело (например, трастузумаб) в этой модели не обладало значимой противоопухолевой активностью (Erickson et al., патент США № 6632979). Как проиллюстрировано на фиг.10 и 11, рост опухолей при обработке ADC по сравнению с контрольным (носитель) уровнем роста замедлялся. Рост опухоли наиболее замедлялся при обработке конъюгатами трастузумаб-SMCC-DM1 и трастузумаб-SIAB-DM1. Как показано на фиг.10, 12 и 13, конъюгат трастузумаб-SMCC-DM1 больше замедлял рост опухоли, чем конъюгаты с линкерами SPP линкеры, то есть был более эффективным, что было измерено по времени удваивания опухолей у «голых» мышей или по логарифму гибели клеток, соответствующему показанным измерениям времени удваивания (фиг.13).
Эффективность in vivo ADC с антителом против CD22 измеряли на модели ксенотрансплантата опухоли мыши. Группам из восьми мышей SCID с 20 миллионами ксенотрансплантированных опухолевых клеток Bjab-luc (экспрессирующие люциферазу клетки BjaB) на мышь на 1-е сутки однократно вводили дозу (исключения отмечали) конъюгата антитело против CD22-лекарственное средство или “голого” антитела (пример 8).
|
Измеряли время удваивания размера опухоли (MTD, среднее время удваивания опухоли). Три “голых” антитела против CD22, по существу, продемонстрировали отсутствие эффективного действия по сравнению с неспецифически связанным ADC (трастузумаб-SMCC-DM1). Все соответствующие конъюгаты продемонстрировали эффект значительного замедления роста опухоли. Действие многократного введения дозы устанавливали с помощью RFB4-SMCC-DM1, где MTD для мышей с однократным введением дозы составляло 18 суток, тогда как MTD для мышей с трехкратным введением дозы, на 1, 7 и 14 сутки составляло 55 суток. Полное исчезновение опухоли происходило у всех 8 мышей в группе с трехкратным введением дозы. Другие конъюгаты антитело против CD22-SMCC-DM1, с антителами 12F7, 9A8, 8C9, 8G10, 3F11, 10D2, 6C9, 14D1 и 11H10, продемонстрировали уменьшение исходного объема опухоли или замедление роста опухоли относительно контроля (трастузумаб-SMCC-DM1) через 7 суток после введения первой дозы (400 мкг DM1/м2) у мышей SCID с 20 миллионами ксенотрансплантированных опухолевых клеток Bjab-luc на мышь. Конъюгаты с антителом против CD22, RFB4-SMCC-DM1, 5E8-SMCC-DM1 и 7A2-SMCC-DM1 также были эффективны для замедления роста опухоли относительно контроля (трастузумаб-SMCC-DM1) через 11 суток после первой дозы (200 мкг DM1/м2) у мышей SCID с 5 миллионами ксенотрансплантированных опухолевых клеток Ramos RA1 на мышь.
Конъюгат RFB4-SMCC-DM1 исследовали при трех различных нагрузках лекарственным средством в группах из десяти мышей с ксенотрансплантатами Bjab-luc (пример 8). Низко (1,95) и средне (3,7) нагруженные лекарственным средством конъюгаты продемонстрировали эффект значительного замедления опухолевого роста с MTD в размере приблизительно 15 суток. Высоко нагруженный (6,75) конъюгат не продемонстрировал эффект, значительно отличающийся от контрольного конъюгата GP120-SMCC-DM1 или “голого” антитела REB4.
|
Конъюгаты антитело против CD19-SMCC-DM1 и антитело против CD22-SMCC-DM1 не продемонстрировали активности in vivo на модели ксенотрансплантата мышиной опухоли из клеток Raji. Другие конъюгаты с антителом против CD19 и антителом к CD22 могут обладать активностью in vivo для моделей опухолей с другими клетками злокачественных опухолей.
Эффективность ADC с антителом против CD79a (альфа) и антителом против CD79b (бета) in vivo измеряли на модели ксенотрансплантата мышиной опухоли. Группам из восьми мышей SCID с 20 миллионами ксенотрансплантированных опухолевых клеток Bjab-luc на мышь на 1-е сутки однократно вводили дозу образцов из таблицы ниже и после примера 8.
|
Все конъюгаты SN8 против CD79b-SMCC-DM1, 17A7 против CD79b-SMCC-DM1 и 8H9 к CD79a-SMCC-DM1 продемонстрировали уменьшение исходного объема опухоли (среднее 160 мм3) через 7 суток. В группах из 8 мышей конъюгат SN8 против CD79b-SMCC-DM1 приводил к частичной ремиссии (PR) у 4 животных и полной ремиссии (CR) у 2 животных. Конъюгат 17A7 против CD79b-SMCC-DM1 приводил к CR у 1 животного. Конъюгат 8H9 против CD79a-SMCC-DM1 приводил к PR у 2 животных и CR у 1 животного. Другие конъюгаты антитело против CD79b-SMCC-DM1, с антителами 2F2, 5C3, 7H7, 8D11, 15E4 и 16C11 продемонстрировали задержку роста опухоли или уменьшение исходного объема опухоли относительно контроля (трастузумаб-SMCC-DM1) через 8 суток после однократной дозы (192 мкг DM1/м2) у мышей CB17 ICR SCID с 20 миллионами Bjab-luc ксенотрансплантированными опухолевыми клетками на мышь. У мышей, которым вводили антитело против CD79b-SMCC-DM1, измеряли влияние дозы на ответ. Группам из восьми мышей SCID с 20 миллионами ксенотрансплантированных опухолевых клеток Bjab-luc на мышь на сутки 1 вводили дозы образцов из таблицы ниже (пример 8). Антитело против CD79b-SMCC-DM1 вводили в дозе с уровнями 0,5, 2,0 и 3,64 мг Ab/кг мыши.

Эффективность ADC с антителом против TENB2 in vivo измеряли на модели ксенотрансплантата мышиной опухоли. TENB2 представляет собой опухолевый антиген, для которого показано, что он почти исключительно экспрессируется в предстательной железе человека и сверхэкспрессируется в опухолях предстательной железы человека (Glynne-Jones et al. (2001) Int J Cancer. Oct 15;94(2):178-84). PC3-TVA-919cv1:5 представляет собой клеточную линию рака предстательной железы человека, экспрессирующую высокий уровень TENB2.
|
Конъюгаты антитела против TENB2-DM1 мыши продемонстрировали противоопухолевое действие против опухолей PC3-TENB2 относительно отрицательного контроля и контрольного носителя. Конъюгат 10H1 против NaPi3b-SMCC-DM1 мыши не продемонстрировал действия против PC3-NaPi3b относительно отрицательного контроля и контрольного носителя. Другие варианты антител конъюгатов с антителами против NaPi3b могут обладать активностью in vivo против опухолей PC3-NaPi3b или клеточных линей других злокачественных опухолей.
ТОКСИЧНОСТЬ У КРЫС
Конъюгаты антитело-лекарственное средство и контроль без ADC, «носитель» оценивали на модели острой токсичности у крыс. Токсичность ADC исследовали с помощью обработки самок крыс Sprague-Dawley ADC и последующего наблюдения и анализа воздействий на различные органы. На основе наблюдений за общей массой (масса тела), клинических патологических параметров (химический состав сыворотки и гематология) и гистопатологии можно наблюдать токсичность ADC, характеризовать ее и измерять. Было обнаружено, что на уровнях эквивалентных доз трастузумаб-SMCC-DM1 вызывал меньшую острую токсичность, чем трастузумаб-SPP-DM1.
Клинический биохимический анализ, анализ сывороточных ферментов и гематологический анализ проводили на 3 и 5 сутки, завершая полным вскрытием трупа с гистопатологической оценкой. Показатели токсичности включали в себя клиническое наблюдение за потерей массы.
Полагают, что потеря массы или изменение массы у животных, получавших только носитель, у животных после введения дозы ADC, является видимым и общим индикатором системной и локальной токсичности. На фиг.14 показано изменение массы тела (в граммах) в течение 5 суток. У крыс, получавших дисульфидный ADC, трастузумаб-SPP-DM1, показана заметная, зависимая от дозы токсичность, выявляемая по летальности при более высокой дозе и снижению массы тела при более низкой дозе. В отличие от этого у крыс, получающих трастузумаб-SMCC-DM1, масса увеличилась при том, что у крыс, получавших меньшую дозу, наблюдали отсутствие снижения в скорости увеличения массы относительно получавших плацебо в виде носителя крыс. У крыс, получавших высокие дозы трастузумаб-SMCC-DM1, также происходило уменьшение массы по сравнению с введением свободного цитотоксина DM1
Гепатотоксичность измеряли по увеличенным уровням печеночных ферментов, увеличенному количеству фигур митоза или апоптоза и некрозу гепатоцитов. Гематолимфоидную токсичность наблюдали по уменьшению лейкоцитов, первичных гранулоцитов (нейтрофилов) и/или тромбоцитов и по вовлечению лимфоидных органов, то есть атрофии или апоптотической активности. Токсичность также регистрировали по очагам повреждения желудочно-кишечного тракта, таким как увеличенные количества фигур митоза и фигур апоптоза, и дегенеративному энтероколиту.
Исследуемые ферменты, указывающие на повреждение печени, включают:
AST (аспартатаминотрансферазу)
- Локализация: цитоплазма; печень, сердце, мышцы скелета, почки
- Отношение печень:плазма составляет 7000:1
- T1/2: 17 часов
ALT (аланинаминотрансфераза)
- Локализация: цитоплазма; печень, почки, сердце, мышцы скелета
- Отношение печень:плазма составляет 3000:1
- T1/2: 42 часа; суточное изменение
GGT (g-глутамилтрансфераза)
- Локализация: плазматическая мембрана клеток с высокой секреторной и всасывающей способностью; печень, почки, кишечники
- Слабый показатель повреждения печени; обычно увеличен при нарушениях желчного протока.
Ни один из трех ферментов, измеряемых выше, не является специфичным для печени. Обнаружено, что ADC по настоящему изобретению вызывают временное, умеренное увеличение печеночных ферментов ALT и AST, с временной ретикулоцитопенией (фиг.15). Значимых воздействий на гранулоциты или тромбоциты периферической крови не наблюдали (фиг.16).
На фиг.15 и 16 показано, что у крыс, которым вводили 22,3 мг/кг трастузумаба-SPP-DM1, (группа 2) наблюдали наиболее тяжелую клиническую токсичность в течение этих пяти суток исследования острой токсичности. У этих животных выявляли наиболее значительную потерю массы тела, увеличение в тестах функции печени, лейко- и тромбоцитопению и морфологические доказательства токсичности в отношении гематолимфоидных тканей. Степень токсичности была сходной со степенью токсичности, наблюдаемой в предыдущих исследованиях с применением дозы 25 мг/кг. В отличие от этого животные в группах 3 и 4, получавшие трастузумаб-SMCC-DM1 при 10 и 25 мг/кг, соответственно, не отличались от животных, которым вводили носитель, на основании данных клинической патологии и массы тела. Морфологически у этих животных наблюдали умеренно увеличенное количество фигур митоза в печени, однако периферические лимфоидные и гематопоэтические ткани находились в нормальных пределах.
Животные из группы 5, получавшие 50 мг/кг трастузумаба-SMCC-DM1, продемонстрировали признаки токсичности. Однако за исключением одного теста функции печени (ALT), острота токсичности была ниже, чем у животных получавших 50% от дозы того же лекарственного средства в виде трастузумаба-SPP-DM1 (группа 2). Приблизительно при той же дозе трастузумаб-SMCC-DM1 (группа 4, 22,3 мг/кг) продемонстрировал приблизительно 25% от уровня трастузумаба-SPP-DM1 (группа 2, 25 мг/кг). На сутки 5 этого исследования, у животных группы 5 наблюдали увеличение массы тела (после временной потери в течение суток 3 и 4), уменьшение сывороточного билирубина и повышение количества тромбоцитов (фиг.15).
Животные, получавшие свободное майтаназоидное средство DM1 (группа 6), продемонстрировали такой же профиль токсичности, что и животные, получавшие конъюгаты трастузумаба. Эта доза свободного DM1 соответствовала такому количеству вводимого лекарственного средства как доза 10 мг/кг трастузумаба-SPP-DM1 в предыдущих исследованиях. Степень токсичности у животных группы 6 была меньше, чем наблюдали у животных в группе 2, но больше, чем у животных, наблюдавшихся ранее, получавших 10 мг/кг трастузумаба-SPP-DM1. Восстановление происходило довольно быстро: у животных, получавших свободный майтаназин, на срезах селезенки были видны увеличенные количества незрелых гематопоэтических элементов; также было показано, что параметры LFT и клинические гематологические параметры нормализовались у животных в группе 6 на 5 сутки.
ТОКСИЧНОСТЬ/БЕЗОПАСНОСТЬ У ДЛИННОХВОСТЫХ МАКАК
Можно оценивать токсичность и безопасность ADC может быть оценена при введении длиннохвостым макакам. Исследование токсичности/безопасности конъюгата антитело-лекарственное средство, трастузумаб-SMCC-DM1, проводили на длиннохвостых макаках. Для оценки токсичности трастузумаба-SMCC-DM1, вводимого внутривенной инъекцией в увеличивающихся дозах, относительно контроля (носитель) исследовали три группы обезьян. Группе 1 (4 субъекта) вводили только носитель (PBS, pH 6,5, то есть состав без ADC) на 1 сутки и 22 сутки, с последующим вскрытием на 36 сутки. Группе 2 (4 субъекта) вводили трастузумаб-SMCC-DM1 4900 мкг/м2 на 1-е сутки и 22 сутки. Группе 3 (4 субъекта) вводили трастузумаб-SMCC-DM1 при 7200 мкг/м2 на 22 сутки.
Делали заключение о гепатотоксичности при измерении повышенных уровней печеночных ферментов из исследования токсичности у крыс. Длиннохвостым обезьянам вводили носитель (группа 1) и трастузумаб-SMCC-DM1 (группа 2: 4900 мкг/м2; группа 3: 7200 мкг/м2). У длиннохвостых обезьян, которым вводили трастузумаб-SMCC-DM1, измеряли печеночный фермент AST, количество тромбоцитов, белых клеток крови, общих нейтрофилов, красных клеток крови, ретикулоцитов и проводили сравнение 2 в/в режимов дозирования (пример 10).
ВВЕДЕНИЕ ФАРМАЦЕВТИЧЕСКИХ СОСТАВОВ КОНЪЮГАТОВ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО
Терапевтические конъюгаты антитело-лекарственное средство (ADC) можно вводить любым способом, подходящим для состояния, на которое направлено лечение. Как правило, ADC вводят парентерально, то есть посредством инфузии, подкожной, внутримышечной, внутривенной, интрадермальной, интратекальной, болюсной, внутриопухолевой инъекции или эпидурально (Shire et al. (2004) J. Pharm. Sciences 93(6):1390-1402). Фармацевтические композиции терапевтических конъюгатов антитело-лекарственное средство (ADC), как правило, получают для парентерального введения с фармацевтически приемлемым парентеральным носителем и в стандартной лекарственной форме для инъекции. Конъюгат антитело-лекарственное средство (ADC) с желаемой степенью чистоты, необязательно, смешивают с фармацевтически приемлемыми разбавителями, носителями, эксципиентами или стабилизаторами в форме лиофилизированного композиции или водного раствора (Remington's Pharmaceutical Sciences (1980) 16th edition, Osol, A. Ed.).
Приемлемые парентеральные наполнители, разбавители, носители, эксципиенты и стабилизаторы являются нетоксическими для реципиентов при применяемых дозах и концентрациях и включают буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включающие аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексония; хлорид бензалкония, хлорид бензетония; фенол, бутиловый и бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехин; резорцин; циклогексанол; 3-пентанол и м-крезол); низкомолекулярные (менее чем приблизительно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включающие глюкозу, маннозу или декстрины; хелаторы, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; образующие соли противоионы, такие как натрий; комплексные соединения металлов (например, комплекс Zn-белок); и/или неионные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (PEG). Например, составы лиофилизированного антитела к ErbB2 описаны в WO 97/04801, явно включенном в данный документ в качестве ссылки. Иллюстративный состав ADC, такого как трастузумаб-SMCC-DM1, содержит приблизительно 100 мг/мл трегалозы (2-(гидроксиметил)-6-[3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]окси-тетрагидропиран-3,4,5-триола; C12H22O11; CAS Number 99-20-7) и приблизительно 0,1% TWEEN™ 20 (полисорбат 20; 2-[2-[3,4-бис(2-гидроксиэтокси)тетрагидрофуран-2-ил]-2-(2-гидроксиэтокси)этокси]этиловый эфир додекановой кислоты; C26H50O10; CAS Number 9005-64-5) приблизительно при pH 6.
Фармацевтические композиции терапевтического конъюгата антитело-лекарственное средство (ADC) могут содержать определенные количества непрореагировавших молекул лекарственного средства (D), промежуточных продуктов антитело-линкер (Ab-L), и/или промежуточного соединения лекарственное средство-линкер (D-L), как результат неполной очистки и отделения от избытка реагентов, загрязнений и субпродуктов в процессе получения ADC; или временного/температурного гидролиза или деградации при хранении большого количества ADC или составленной композиции ADC. Например, в композиции ADC, трастузумаб-SMCC-DM1, может содержаться обнаруживаемое количество свободного лекарственное средство DM1. Альтернативно или кроме того, в нем может содержаться обнаруживаемое количество промежуточного соединения лекарственное средство-линкер, DM1-SMCC. Альтернативно или кроме того, в нем может содержаться обнаруживаемое количество антитела трастузумаб. Иллюстративный состав трастузумаба-SMCC-DM1 может содержать до 10% молярного эквивалента DM1-SMCC. Неожиданно в анализе клеточной пролиферации in vitro (пример 5) было определено, что DM1-SMCC (IC50 0,05 мкм) приблизительно в 20 раз менее эффективен для уничтожения клеток, чем свободное лекарственное средство DM1 (IC50 0,0045 мкм) в отношении клеток рака молочной железы SK-BR-3 и BT-474.
Активные фармацевтические ингредиенты также можно помещать в микрокапсулы, полученные, например, способами коацервации или межфазной полимеризации, например, гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли(метилметацилатные) микрокапсулы, соответственно, в коллоидных системах доставки лекарственного средства (например, липосомы, микросферы альбумина, микроэмульсии, наночастицы и нанокапсулы) или в микроэмульсиях. Такие способы описаны в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980).
Можно получать препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемые матриксы твердых гидрофобных полимеров, содержащих ADC, где матрицы находятся в виде имеющих определенную форму продуктов, например в виде пленок или микрокапсул. Примеры матриксов с замедленным высвобождением включают сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтил-метакрилат) или поли(виниловый спирт)), полилактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и гамма-этил-L-глутамата, недеградируемый этиленвинилацетат, деградируемые сополимеры молочной кислоты и гликолевой кислоты, такие как LUPRON DEPOT™ (инъецируемые микросферы, состоящие из сополимера молочной кислоты и гликолевой кислоты и ацетата лейпролида) и поли-D-(-)-3-гидроксимаслянную кислоту.
Композиции для введения in vivo должны быть стерильными, что легко осуществляется фильтрацией через стерильные фильтрационные мембраны.
Композиции включают композиции, пригодные для указанных выше способов введения. Композиции удобно получать в виде стандартной лекарственной формы и их можно получать любым хорошо известным в области фармации способом. Способы и композиции, как правило, представлены в Remington's Pharmaceutical Sciences (Mack Publishing Co., Easton, PA). Такие способы включают стадию объединения активного ингредиента с носителем, который содержит одно или несколько дополнительных ингредиентов. В основном композиции получают посредством однородного и тесного объединения активного ингредиента с жидкими носителями или мелкоизмельченными твердыми носителями или с обоими, а затем, если необходимо, придания продукту формы.
Водные суспензии содержат активные вещества (ADC) в смеси с эксципиентами, пригодными для получения водных суспензий. Такие эксципиенты включают суспендирующее средство, такое как карбоксиметилцеллюлоза натрия, кроскармеллоза, повидон, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагакантовую камедь и гуммиарабик, и диспергирующие или увлажняющие средства, такие как природные фосфолипиды (например, лецитин), продукт конденсации алкиленоксида с жирной кислотой (например, полиоксиэтиленстеарат), продукт конденсации этиленоксида с алифатическим спиртом с длинной цепью (например, гептадекаэтиленоксикетанол), продукт конденсации этиленоксида с неполным эфиром многоатомного спирта, полученным из житной кислоты и гекситангидрида (например, моноолеат полиоксиэтиленсорбитана). Водные суспензии также могут содержать один или несколько консервантов, таких как этил- или н-пропил или п-гидроксибензоат, один или несколько красителей, одну или несколько вкусовых добавок и одно или несколько подслащивающих веществ, таких как сахароза или сахарин.
Фармацевтические композиции ADC могут находиться в форме стерильного препарата для инъекции, такого как стерильная водная или масляная суспензия для инъекции. Суспензию можно получать способами, известными в данной области, используя такие подходящие диспергирующие или увлажняющие средства и суспендирующие средства, которые указаны выше. Стерильный препарат для инъекции также может представлять собой стерильный раствор для инъекции или суспензию в нетоксическом приемлемом для парентерального приема разбавителе или растворителе, такой как раствор в 1,3-бутан-диоле, или может быть получен в виде лиофилизированного порошка. Приемлемые наполнители и растворители, которые можно применять, включают воду, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, если удобно, в качестве растворителей или суспендирующей среды можно применять стерильные жирные масла. Для этой цели можно применять любое безвкусное жирное масло, включая синтетические моно- или диглицериды. Кроме того, для получения препаратов для инъекции аналогично можно использовать жирные кислоты, такие как олеиновая кислота.
Количество активного ингредиента, которое можно комбинировать с веществом носителя для получения стандартной лекарственной формы будет изменяться в зависимости от хозяина, лечение которого осуществляют, и конкретного способа введения. Например, для того чтобы инфузия подходящего объема могла происходить при скорости приблизительно 30 мл/ч, водный раствор, предназначенный для внутривенного введения, может содержать приблизительно от 3 до 500 мкг активного ингредиента на миллилитр раствора. Подкожное (болюсное) введение можно проводить приблизительно при общем объеме 1,5 мл или менее и концентрации ADC приблизительно 100 мг на мл. Для ADC, которые необходимо вводить часто и длительно, можно применять подкожный способ, такой как посредством предварительно заполненного шприца или технологии автоинжекторного устройства.
В качестве общей схемы начальное фармацевтически эффективное количество ADC, вводимое на дозу, находится в диапазоне приблизительно 0,01-100 мг/кг, а именно приблизительно от 0,1 до 20 мг/кг массы тела пациента в сутки с обычным исходным диапазоном применяемого соединения от 0,3 до 15 мг/кг/сутки. Например, больным людям сначала можно назначать дозу приблизительно 1,5 мг ADC на кг массы тела пациента. Дозу можно увеличивать до максимальной переносимой дозы (MTD). Схема введения может быть предусмотрена на каждые 3 недели, но в соответствии с диагностированным состоянием или ответом схема может предусматривать более или менее частое введение. Дозу в течение курса лечения можно дополнительно регулировать с тем, чтобы она была на уровне или ниже MTD, которую можно безопасно вводить в течение нескольких циклов, например приблизительно 4 или более.
Композиции, подходящие для парентерального введения, включают водные и неводные стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостатики и растворенные вещества, которые делают состав изотоническим с кровью намеченного реципиента, и водные и неводные стерильные суспензии, которые могут содержать суспендирующие средства и загустители.
Хотя пероральное введение белковых терапевтических средств, как правило, не является предпочтительным ввиду плохой биодоступности из-за ограниченного всасывания, гидролиза или денатурации в кишечнике, можно получать составы ADC, пригодные для перорального введения, в виде дискретных единиц, таких как капсулы, саше или таблетки, где каждая содержит заранее определенное количество ADC.
Композиции можно помещать в однодозовые или многодозовые контейнеры, например запаянные ампулы или флаконы, и можно хранить в высушенном замораживанием (лиофилизированном) состоянии, для которого требуется лишь добавление стерильного жидкого носителя, например воды для инъекций, непосредственно перед использованием. Приготовленные для немедленного приема растворы и суспензии получают из стерильных порошков, гранул и таблеток, такого типа, как описан ранее. Характерные составы для однократного дозирования содержат суточную дозу активного ингредиента или поддозу суточной единицы, или ее соответствующую часть.
Изобретение дополнительно относится к ветеринарным композициям, содержащим по меньшей мере один активный ингредиент, как определено выше, но вместе с пригодным в ветеринарии носителем. Пригодные в ветеринарии носители представляют собой вещества, пригодные для введения композиции, и могут быть твердыми, жидкими или газообразными веществами, которые во всем остальном являются инертными или приемлемыми в области ветеринарии и сочетаются с активным ингредиентом. Данные ветеринарные композиции можно вводить парентерально, перорально или любым другим желаемым способом.
СПОСОБЫ ЛЕЧЕНИЯ КОНЪЮГАТАМИ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО
Предусмотрено, что конъюгаты антитело-лекарственное средство (ADC) по настоящему изобретению можно использовать для лечения различных заболеваний или нарушений, таких как рак и аутоиммунные состояния. Иллюстративные состояния или нарушения включают доброкачественные или злокачественные опухоли, лейкемические и лимфоидные злокачественные заболевания, другие нарушения, такие как нейрональные, глиальные, астроцитарные, гипоталамические нарушения и нарушения, связанные с другими железами, макрофагальные, эпителиальные, стромальные, бластные, воспалительные, ангиогенные и иммунологические нарушения. Злокачественная опухоль, чувствительная к лечению ADC, включает опухоли, которые характеризуются сверхэкспрессией определенных антигенов, ассоциированных с опухолями или рецепторов клеточной поверхности, например, HER2.
Соединения ADC, которые идентифицированы на животных моделях и в клеточных анализах, можно дополнительно тестировать на высших приматах с опухолями и в клинических испытаниях на людях. Клинические испытания на людях можно спроектировать подобно клиническим испытаниям тестирования эффективности моноклонального антитела против HER2 ГЕРЦЕПТИНА у пациентов со сверхэкспрессирующим HER2 метастазирующим раком молочной железы, которые получали продолжительное предварительное противоопухолевое лечение, как описано Baselga et al. (1996) J. Clin. Oncol. 14:737-744. Можно спроектировать клиническое испытание для оценки эффективности ADC в сочетании с известными терапевтическими воздействиями, такими как радиация и/или химиотерапия, включая известные химиотерапевтический и/или цитотоксические средства (Pegramet al. (1999) Oncogene 18:2241-2251).
Как правило, заболеванием или расстройством, для которого лечение может быть эффективно, является рак. Примеры рака, для которого лечение по настоящему изобретению может быть эффективно, включают, но ими не ограничиваются, карциному, лимфому, бластому, саркому и лейкемические или лимфоидные злокачественные заболевания. Конкретные примеры таких злокачественных опухолей включают плоскоклеточный рак (например, эпителиальный плоскоклеточный рак), рак легких, включая мелкоклеточный рак легких, немелкоклеточный рак легких, аденокарциному легких и плоскоклеточную карциному легкого, рак брюшины, гепатоцеллюлярный рак, рак желудка, включая рак желудочно-кишечного тракта, стромальную опухоль желудочно-кишечного тракта (GIST), рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, рак прямой кишки, колоректальный рак, карциному эндометрия или матки, карциному слюнной железы, рак почек, рак предстательной железы, рак вульвы, рак щитовидной железы, карциному печени, карциному ануса, карциному полового члена, а также рак головы и шеи.
Злокачественная опухоль для лечения в соответствии с данным документом может представлять собой опухоль, характеризующуюся избыточной активацией рецептора ErbB, например HER2. Такая избыточная активация может являться признаком сверхэкспрессии или повышенной продукции рецептора ErbB или лиганда ErbB. В одном из вариантов осуществления для определения того, характеризуется ли злокачественная опухоль у пациента избыточной активацией рецептора ErbB, проводят диагностический или прогностический анализ. Например, можно определить амплификацию гена ErbB и/или сверхэкспрессию рецептора ErbB в злокачественной опухоли. В данной области доступны различные анализы для определения такой амплификации/сверхэкспрессии и к ним относятся анализы IHC, FISH и анализ «слущивающихся» антигенов, описанные выше. Альтернативно или дополнительно известными способами можно определять уровни лиганда ErbB, такого как TGF-альфа, опухоли или ассоциированных с опухолью. С помощью таких анализов в образце для тестирования можно детектировать белок и/или кодирующую его нуклеиновую кислоту. В одном из вариантов осуществления уровни лиганда ErbB в опухоли можно определять с применением иммуногистохимии (IHC); см., например, Scher et al. (1995) Clin. Cancer Research 1:545-550. Альтернативно или дополнительно в образце для тестирования можно оценивать уровни нуклеиновой кислоты, кодирующей лиганд ErbB; например, способами FISH, саузерн-блоттингом или ПЦР. В одном из вариантов осуществления сверхэкспрессию ErbB2 можно анализировать с помощью IHC, например, с применением HERCEPTEST (Dako). Помещенные в парафин тканевые срезы биопсии опухоли можно подвергать анализу IHC и сравнивать интенсивность окрашивания белка ErbB2 со следующими критериями: балл 0, окрашивания не наблюдается или окрашивание мембраны наблюдают менее чем у 10% опухолевых клеток; балл 1+, слабо/с трудом обнаруживаемое окрашивание мембран наблюдается более чем у 10% опухолевых клеток, только часть мембран клеток окрашена; балл 2+, полное окрашивание мембран от слабого до умеренного, наблюдается более чем у 10% опухолевых клеток; балл 3+, полное окрашивание мембран от умеренного до сильного наблюдается более чем у 10% опухолевых клеток. Опухоли с баллами 0 или 1+ при оценке сверхэкспрессии ErbB2 можно охарактеризовать как не обладающие сверхэкспрессией ErbB2, тогда как опухоли с баллами 2+ или 3+ можно охарактеризовать как сверхэкспрессирующие ErbB2.
Альтернативно или дополнительно на фиксированной формалином помещенной в парафин опухолевой ткани можно проводить анализы FISH, такие как INFORM™ (Ventana Co., Ariz.) или PATHVISION™ (Vysis, 111.) для определения степени (если есть) сверхэкспрессии ErbB2 в опухоли.
Кроме того, сверхэкспрессию или амплификацию рецептора ErbB или лиганда ErbB можно оценивать с применением диагностического анализа in vivo, например, посредством введения молекулы (такой как антитело), которая связывает молекулу для обнаружения и помечена детектируемой меткой (например, радиоактивным изотопом), и наружного сканирования пациента на локализацию метки.
Для профилактики или лечения заболевания соответствующая доза ADC будет зависеть от типа заболевания для лечения, как определено выше, тяжести и течения заболевания, вводится ли молекула для профилактических или терапевтических целей, предшествующей терапии, истории болезни пациента и ренакции на антитело и от решения лечащего врача. Таким образом, молекулу вводят пациенту однократно или в течение ряда курсов лечения. В зависимости от типа и тяжести заболевания исходная предположительная доза для введения пациенту составляет приблизительно от 1 мкг/кг до 15 мг/кг (например, 0,1-20 мг/кг) молекул, или в виде одного или нескольких отдельных введений, или посредством непрерывной инфузии. Обычная суточная доза может изменяться приблизительно от 1 мкг/кг до 100 мг/кг или более, в зависимости от указанных выше факторов. Характерная доза ADC для введения пациенту находится в диапазоне приблизительно от 0,1 до приблизительно 10 мг/кг массы пациента.
Для повторных введений в течение нескольких суток или более в зависимости от состояния лечение продолжают до тех пор, пока не произойдет желательного подавления симптомов заболевания. Характерный режим дозирования представляет собой введение начальной нагрузочной дозы приблизительно 4 мг/кг, с последующей еженедельной поддерживающей дозой приблизительно 2 мг/кг антитела к ErbB2. Могут использоваться другие режимы дозирования. Успехи такого лечения легко контролировать обычными способами и анализами.
КОМБИНИРОВАННОЕ ЛЕЧЕНИЕ
Конъюгат антитело-лекарственное средство (ADC) можно комбинировать в фармацевтический комбинированный состав или в схеме дозирования в виде комбинированного лечения со вторым соединением с противоопухолевыми свойствами. Второе соединение фармацевтической комбинированной композиции или схемы дозирования обладает комплементарным к ADC из сочетания действием так, что они не оказывают неблагоприятного воздействия друг на друга.
Второе соединение может представлять собой химиотерапевтическое средство, цитотоксическое средство, цитокин, ингибирующее рост средство, антигормональное свойство, ингибитор ароматазы, ингибитор протеинкиназы, ингибитор липидкиназы, антиандрогенное средство, антисмысловой олигонуклеотид, рибозим, генотерапевтическую вакцину, антиангиогенное средство и/или кардиопротектор. Таким образом, такие молекулы находятся в композиции в таких количествах, которые эффективны для намеченной цели. Фармацевтическая композиция, содержащая ADC, также может содержать терапевтически эффективное количество химиотерапевтического средства, такого как ингибитор образования тубулина, ингибитор топоизомеразы или связывающее ДНК средство.
Альтернативно или дополнительно второе соединение может представлять собой антитело, связывающееся с ErbB2 и блокирующее активацию рецептора ErbB лигандом. Второе антитело может представлять собой моноклональное антитело 2C4 или гуманизированное 2C4 «Omnitarg» (WO 01/00245). Второе антитело может быть конъюгировано с цитотоксическим или химиотерапевтическим средством, например майтаназоидным средством, ауристатином, калихимицином или молекулой 1,8-бис-нафталимида. Например, может быть желательным в одной композиции или схеме дозирования дополнительно предоставить антитела, связывающиеся с EGFR, ErbB2, ErbB3, ErbB4 или фактором эндотелия сосудов (VEGF).
С введением противоопухолевого средства, идентифицированного по данному изобретению, можно сочетать другие терапевтические схемы. Комбинированную терапию можно проводить в виде совместного или последовательного режима. При введении последовательно сочетание можно вводить с применением двух или более введений. Комбинированное введение включает совместное введение с использованием раздельных композиций в одном фармацевтическом составе и последовательное введение в любом порядке, где существует временной период, когда оба (или все) активные средства одновременно проявляют свою биологическую активность.
В одном из вариантов осуществления лечение ADC по настоящему изобретению включает комбинированное введение противоопухолевого средства, идентифицированного в данном документе, и одного или нескольких химиотерапевтических средств или ингибирующего рост средств, включая совместное введение смесей различных химиотерапевтических средств, необязательно, вместе с лечением антителом к ErbB2, таким как трастузумаб. Химиотерапевтические средства включают Эрлотиниб HCl (CP-358774, ТАРЦЕВА TARCEVA™; Genentech/OSI), таксаны (такие как паклитаксел и доксетаксел) и/или антрациклиновые антибиотики. Получение и режимы дозирования для таких химиотерапевтических средств можно применять по инструкциям производителя или как эмпирически определено лечащим врачом. Получение и схемы дозирования для такой химиотерапии также описаны в Chemotherapy Service Ed., M.C. Perry, Williams & Wilkins, Baltimore, Md. (1992).
Противоопухолевое средство можно комбинировать с антигормональным соединением, например антиэстрогеновым соединением, таким как тамоксифен; антипрогестероновым соединением, таким как онапристон (EP 616812), или антиандрогенным соединением, таким как флутамид, в дозах, известных для таких молекул. Когда рак, на который направлено лечение, представляет собой гормононезависимый рак, пациента предварительно можно подвергнуть антигормональной терапии, а после того как рак станет гормононезависимым, пациенту можно вводить антитело против ErbB2 (и, необязательно, другие описанные в данном документе средства). Может быть полезным также совместно вводить пациенту кардиопротектор (для профилактики или уменьшения дисфункции миокарда, связанной с таким лечением) и один или несколько цитокинов. В дополнение к указанным выше режимам лечения пациента можно подвергнуть хирургическому удалению раковых клеток и/или радиационной терапии.
Подходящие дозы для любого из указанных выше совместно вводимых средств представляют собой дозы, используемые в настоящее время, и их можно уменьшать вследствие сочетанного действия (синергии) нового идентифицированного средства и других химиотерапевтических средств или способов лечения.
МЕТАБОЛИТЫ КОНЪЮГАТОВ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО
Также данное изобретение относится к метаболическим продуктам in vivo описанных в данном документе соединений ADC в том случае, когда такие продукты являются новыми и неочевидными из предшествующей области. Такие продукты могут образовываться вследствие окисления, восстановления, гидролиза, амидирования, этерификации, ферментативного расщепления и т.п. вводимого соединения. Таким образом, изобретение относится к новым и неочевидным соединениям, получаемым в процессе, включающем в себя нахождение соединения по изобретению у млекопитающего в период времени, достаточный для образования продукта его метаболизма.
Продукты метаболизма можно идентифицировать получением радиоактивно меченных (например, 14C или 3H) ADC, парентеральным их введением в обнаруживаемой дозе (например, большей чем приблизительно 0,5 мг/кг) животному, такому как крыса, мышь, морская свинка, обезьяна или человеку, отводя достаточное количество времени на метаболизм (обычно, приблизительно от 30 секунд до 30 часов) и выделяя продукты его превращения из мочи, крови или других биологических образцов. Эти продукты легко выделить, так как они помечены (другие выделяют с помощью антител, способных связывать эпитопы, оставшиеся в метаболите). Обычным способом, например, с помощью анализов MS, LC/MS или ЯМР, определяют структуры метаболитов. Обычно анализ метаболитов проводят таким же образом, как и обычные исследования метаболизма лекарственных средств, которые хорошо известны специалистам в данной области. Продукты конверсии, если они не обнаруживаются in vivo, могут использоваться в диагностических анализах для определения терапевтической дозы соединений ADC.
Метаболиты включают продукты расщепления ADC in vivo, в которых происходит расщепление любой связи, присоединяющей молекулу лекарственного средства к антителу. Таким образом, результатом метаболического расщепления может являться “голое“ антитело или фрагмент антитела. Метаболит антитела может быть связан с частью линкера или со всем линкером. В результате метаболического расщепления также могут образовываться молекулы лекарственного средства или его части. Метаболит молекулы лекарственного средства может быть связан с частью линкера или со всем линкером.
ГОТОВЫЕ ИЗДЕЛИЯ
Другой вариант осуществления относится к готовому изделию, или «набор», содержащий ADC и материалы, которые могут использоваться для лечения описанных выше заболеваний. Готовое изделие содержит контейнер и этикетку или листовку-вкладыш на контейнере или связанные с контейнером. Подходящие контейнеры включают, например, бутылки, флаконы, шприцы или блистерные упаковки. Контейнеры можно получать из различных материалов, таких как стекло или пластик. Контейнер может содержать композицию конъюгата антитело-лекарственное средство (ADC), которая эффективна для лечения состояния, и может иметь стерильное входное отверстие (например, контейнер может представлять собой резервуар для внутривенного раствора или флакон с пробкой, прокалываемые иглой для подкожной инъекции). По меньшей мере, одно активное средство в композиции представляет собой ADC. Этикетка или листовка-вкладыш указывает на то, что композиция применяется для лечения выбранного состояния, такого как рак. В одном из вариантов осуществления этикетка или листовки-вкладыши указывают на то, что композицию, содержащую антитело, связывающееся с ErbB2, можно использовать для лечения рака, экспрессирующего рецептор ErbB, выбранный из группы, содержащей рецептор эпидермального фактора роста (EGFR), ErbB2, ErbB3 и ErbB4. Кроме того, этикетка или листовка-вкладыш могут указывать на то, что пациентом, для которого лечение будет эффективно, является пациент, страдающий раком, отличающимся избыточной активацией рецептора ErbB, выбранного из EGFR, ErbB2, ErbB3 или ErbB4. Например, рак может представлять собой злокачественную опухоль, которая сверхэкспрессирует один из этих рецепторов и/или которая сверхэкспрессирует лиганд ErbB (такой, как TGF-α). Этикетка или листовка-вкладыш также могут указывать на то, что композицию можно использовать для лечения рака, где рак не характеризуется сверхэкспрессией рецептора ErbB2. В других вариантах осуществления, листовка-вкладыш может указывать на то, что композицию ADC также можно использовать для лечения гормононезависимой злокачественной опухоли, рака предстательной железы, рака толстой кишки или колоректального рака.
Готовое изделие может содержать (a) первый контейнер с содержащимся в нем соединением, где соединение содержит ADC по настоящему изобретению, где антитело из ADC представляет собой первое антитело, связывающее ErbB2 и ингибирующее рост раковых клеток, сверхэкспрессирующих ErbB2; и (b) второй контейнер с содержащимся в нем соединением, где соединение содержит второе антитело, связывающееся с ErbB2 и блокирующее активацию рецептора ErbB лигандом, или конъюгат этого второго антитела с майтаназоидным соединением. Готовое изделие в данном варианте осуществления может дополнительно содержать листовку-вкладыш, указывающую, что первое и второе соединения можно применять для лечения злокачественной опухоли. Альтернативно или дополнительно готовое изделие может содержать второй (или третий) контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), фосфатно-солевой буфер, раствор Рингера и раствор декстрозы. Он может дополнительно включать в себя другие материалы, желательные с коммерческой или потребительской точки зрения, включая другие буферы, разбавители, фильтры, иглы и шприцы.
ПРИМЕРЫ
Пример 1. Получение, характеристика и гуманизация моноклонального антитела 4D5 против ErbB2
Моноклональное антитело 4D5 мыши, которое специфически связывает внеклеточный домен ErbB2, получали, как описано Fendly et al. (1990) Cancer Research 50:1550-1558. Кратко, клетки NIH 3T3/HER2-3400 (экспрессирующие приблизительно 1×105 молекул ErbB2/клетку), полученных, как описано Hudziak et al. (1987) Proc. Natl. Acad. Sci. (USA) 84:7158-7163, собирали с помощью фосфатно-солевого буфера (PBS), содержащего 25 мМ EDTA и использовали для иммунизации мышей BALB/c. Мышам внутривенно вводили 107 клеток в 0,5 мл PBS на 0, 2, 5 и 7 недели. На 9 и 13 неделю мышам внутрибрюшинно вводили мембранные экстракты ErbB2, очищенные на агглютинине пророщенной пшеницы (WGA)-сефарозе, вместе с антисывороткой, которая иммунопреципитирует меченный 32P ErbB2. После этого внутривенно вводили инъекцию 0,1 мл препарата ErbB2 и спленоциты сливали с миеломной линией X63-Ag8.653 мыши. Супернатанты гибридомы скринировали на связывание ErbB2 посредством ELISA и радиоиммунопреципитации.
Моноклональное антитело 4D5 мыши гуманизировали с применением стратегии «мутагенеза на основе конверсии генов», как описано в патенте США № 5821337, полное описание которого приведено в данном документе в качестве ссылки в полном объеме. Гуманизированное моноклональное антитело 4D5, используемое в следующих экспериментах, обозначали как huMAb4D5-8. Это антитело представляет собой изотип IgG1.
Пример 2. Очистка трастузумаба
Один флакон, содержащий 440 мг ГЕРЦЕПТИНА® (антитело huMAb4D5-8, rhuMAb HER2, патент США № 5821337) растворяли в 50 мл буфера MES (25 мМ MES, 50 мМ NaCl, pH 5,6) и наносили на катионообменную колонку (сефароза S, 15 см × 1,7 см), уравновешенную тем же буфером. Затем колонку промывали тем же буфером (5 объемов колонки). Трастузумаб элюировали, повышая концентрацию NaCl в буфере до 200 мМ. Фракции, содержащие антитело, объединяли, разводили до 10 мг/мл и подвергали диализу в буфер, содержащий 50 мм фосфата калия, 50 мМ NaCl, 2 мМ EDTA, pH 6,5.
Пример 3. Получение конъюгатов антитело-лекарственное средство: трастузумаб-SPP-DM1:
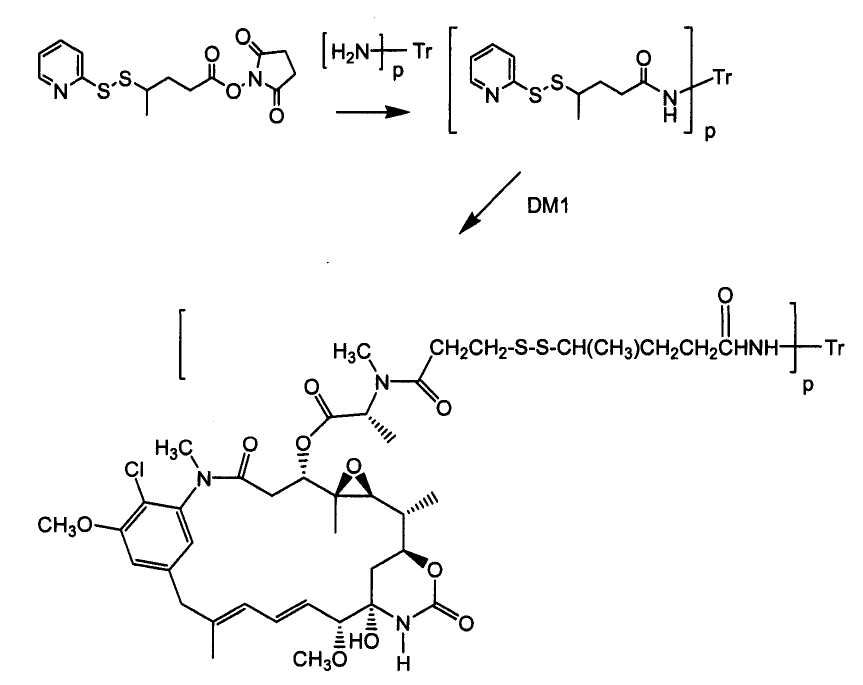
Очищенный трастузумаб модифицировали N-сукцинимидил-4-(2-пиридилтио)пентаноатом, введя дитиопиридильные группы. Трастузумаб (376,0 мг, 8 мг/мл) в 44,7 мл 50 мМ фосфатно-калийного буфера (pH 6,5), содержащего NaCl (50 мМ) и EDTA (1 мМ) обрабатывали SPP (5,3 молярных эквивалентов в 2,3 мл этаноле). После инкубации в течение 90 минут в атмосфере аргона при температуре окружающей среды реакционную смесь подвергали гель-фильтрации через колонку с Sephadex G25, уравновешенную 35 мМ цитратом натрия, 154 мМ NaCl, 2 мМ EDTA. Содержащие антитело фракции объединяли и анализировали. Степень модификации антитела определяли как описано выше. Выход модифицированного антитела (трастузумаб-SPP-Py) составлял 337 мг (89,7%) с 4,5 высвобождаемых связанных 2-тиопиридиновых групп на антитело (p').
Трастузумаб-SPP-Py (337,0 мг, 9,5 мкмоль высвобождаемых 2-тиопиридиновых групп) разбавляли с применением приблизительно 35 мМ цитратно-натриевого буфера, pH 6,5, до конечной концентрации 2,5 мг/мл. Затем к раствору антитела добавляли DM1 (N2'-деацетил-N2'-(3-меркапто-1-оксопропил)майтаназин), структура которого представлена на фиг.1 (1,7 эквивалентов, 16,1 мкмоль), в 3,0 мМ диметилацетамиде (DMA, 3% об./об. в конечной реакционной смеси). Реакцию проводили при температуре окружающей среды в атмосфере аргона в течение 20 часов.
Реакционную смесь наносили на колонку для гель-фильтрации с Sephacryl S300 (5,0 см × 90,0 см, 1,77 л), уравновешенную 35 мМ цитратом натрия, 154 мМ NaCl, pH 6,5. Скорость потока составляла 5,0 мл/мин и собирали 65 фракции (20,0 мл каждая). Основной пик находился в районе фракции № 47 (фиг.3). Основной пик содержит мономерный трастузумаб-SPP-DM1, фракции 44-51 объединяли и анализировали. Количество молекул лекарственного средства DM1, связанных на молекулу антитела (p'), определяли измерением поглощения при 252 нм и 280 нм и обнаружили, что оно составляет 3,7 молекул лекарственного средства на молекулу антитела.
Пример 4. Получение конъюгатов антитело-лекарственное средство: трастузумаб-SMCC-DM1
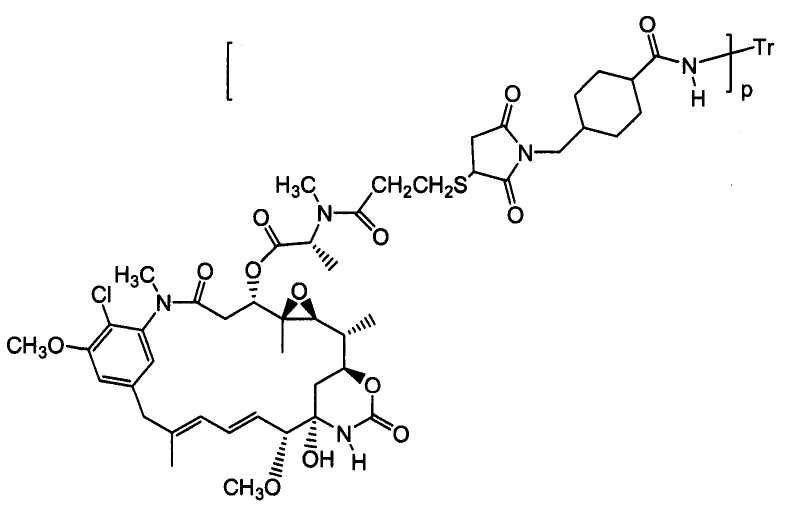
Очищенный трастузумаб модифицировали (сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат, SMCC, Pierce Biotechnology, Inc), внося линкер SMCC. Трастузумаб очищали от ГЕРЦЕПТИНА®, как в примере 2, и проводили замену буфера при 20 мг/мл в 50 мМ фосфата калия/50 мМ хлорида натрия/2 мМ EDTA, pH 6,5 с 7,5 до 10 молярных эквивалентов SMCC (20 мМ в DMSO или DMA (диметилацетамид), 6,7 мг/мл). После перемешивания в течение от 2 до 4 часов в атмосфере азота при температуре окружающей среды реакционную смесь фильтровали через колонку с Sephadex G25, уравновешенную 50 мМ фосфат калия/50 мМ хлорида натрия/2 мМ EDTA, pH 6,5. Альтернативно реакционную смесь подвергали гель-фильтрации с 30 мМ цитрата и 150 мМ хлорида натрия при pH 6. Содержащие антитело фракции очищали и анализировали. Выход трастузумаба-SMCC составлял 88%.
Промежуточное соединение лекарственное средство-линкер, трастузумаб-SMCC, полученное как указано выше, разбавляли 50 мМ фосфатом калия/50 мМ хлоридом натрия/2 мМ EDTA, pH 6,5, до конечной концентрации 10 мг/мл и подвергали реакции с 10 мМ раствором DM1 (1,7 эквивалентов на 5 SMCC/трастузумаб, 7,37 мг/мл) в диметилацетамиде. Реакционную смесь перемешивали при температуре окружающей среды в атмосфере аргона в течение от 4 до приблизительно 16 часов. Смесь после реакции конъюгации фильтровали через колонку для гель-фильтрации с Sephadex G25 (1,5 × 4,9 см) с 1 × PBS при pH 6,5. Альтернативно реакционную смесь подвергали гель-фильтрации с 10 мМ сукцинатом и 150 мМ хлоридом натрия при pH 5. Отношение DM1/трастузумаб (p) составляло 3,1, измеряя при поглощении при 252 нм и при 280 нм. Отношение лекарственного средства к антителу (p) можно также измерять посредством масс-спектрометрии. Конъюгацию также можно контролировать электрофорезом в полиакриламидном геле с SDS. Агрегацию можно оценить посредством рассеяния лазерного излучения.
Конъюгаты антитело-SMCC-DM1:
Следуя этому протоколу, получали другие конъюгаты антитело-лекарственное средство с линкером SMCC и молекулой лекарственного средства DM1, включающие:
|
Конъюгаты антитело-BMPEO-DM1
Для конъюгации с цистеином антитело можно восстанавливать таким восстановителем как дитиотреитол (DTT) или TCEP в присутствие EDTA. После инкубации в течение одного часа при 37°C, pH доводят приблизительно до 7 с помощью 100 мМ фосфата калия. Восстановленное антитело модифицируют бисмалеимидным реагентом BM(PEO)4 (Pierce Chemical), удаляющим непрореагировавшие малеимидные группы на поверхности антитела. Модифицирование можно проводить, растворяя BM(PEO)4 в 50% смеси этанол/вода до концентрации 10 мМ и добавляя десятикратного молярного избытка к раствору, содержащему антитело в фосфатно-солевом буфере при концентрации приблизительно 1,6 мг/мл (10 мкм) и оставлять реагировать в течение 1 часа с образованием Ab-BMPEO. Избыток BM(PEO)4 удаляют гель-фильтрацией (колонка HiTrap, Pharmacia) в 30 мМ цитрате, pH 6 с 150 мМ буфера NaCl. Приблизительно десятикратный молярный избыток DM1 растворяют в диметилацетамиде (DMA) и добавляют к промежуточному соединению Ab-BMPEO. Для растворения реагента молекул лекарственного средства также можно применять диметилформамид (DMF). Перед гель-фильтрацией или диализом в PBS для удаления непрореагировавшего DM1 смесь оставляют реагировать в течение ночи. Для удаления высокомолекулярных агрегатов и получения очищенного Ab-BMPEO-DM1 использовали гель-фильтрацию на колонках S200 в PBS.
Следуя этому протоколу, получали другие конъюгаты антитело-лекарственное средство с линкером BMPEO и молекулой лекарственного средства DM1, включая:
|
Пример 5. Анализ пролиферации клеток in vitro
Эффективность ADC измеряли в анализе пролиферации клеток, применяя следующий протокол (Promega Corp. Technical Bulletin TB288; Mendoza et al. (2002) Cancer Res. 62:5485-5488).
1. Аликвоту 100 мкл клеточной культур, содержащую приблизительно 104 клеток (SKBR-3, BT474, MCF7 или MDA-MB-468) в среде, вносили в каждую лунку 96-луночного планшета с непрозрачными стенками.
2. Получали контрольные лунки, содержащие среду и не содержащие клетки.
3. К экспериментальным лункам добавляли ADC и инкубировали в течение 3-5 суток.
4. Планшеты уравновешивали до клеточной температуры в течение приблизительно 30 минут.
5. В каждую лунку добавляли объем реагента CellTiter-Glo Reagent, равный объему находящейся в ней среды с клеточной культурой.
6. Содержимое перемешивали в течение 2 минут на орбитальной качалке для индукции лизиса клеток.
7. Планшет инкубировали при комнатной температуре в течение 10 минут для стабилизации люминесцентного сигнала.
8. Люминесцентный сигнал записывали и наносили на диаграммы в виде RLU=относительные люминесцентные единицы.
Пример 6. Сывороточный клиренс и стабильность у мышей
Исследовали «голых» мышей с врожденным отсутствием NK-клеток, которых не подвергали воздействию (без опухолей) в шести группах из четырех животных. На 0 сутки каждой мыши вводили однократную дозу 2 мг/кг ADC в 200 мкл водного носителя, за исключением группы с носителем, которой вводили только носитель. Посредством сердечной пункции при анестезии собирали кровь в каждую временную точку (5 минут, 1 час, 6 часов, 24 часа, 72 часов и 168 часов) после введения дозы. Выделяли сыворотки и измеряли содержание антитела и ADC.
Группа 1: Носитель (PBS, pH 6,5, без ADC)
Группа 2: Трастузумаб-SMCC-DM1
Группа 3: Трастузумаб-SPP-DM1
Группа 4: Трастузумаб-SPDP-DM1
Группа 5: Трастузумаб-SPP-DM3
Группа 6: Трастузумаб-SPP-DM4
Пример 7. Стабильность в сыворотке у крыс
Исследовали шесть групп дозирования с 6 крысами Sprague-Dawley (100-125 грамм каждая) на группу. На 0 сутки животным вводили однократную внутривенную дозу носителя 10 мг/кг трастузумаба-SPP-DM1 или 10 мг/кг трастузумаба-SMCC-DM1 в объеме дозы 10 мл/кг через латеральную хвостовую вену. Приблизительно 300 мкл цельной крови собирали в каждую временную точку: 0 (перед дозой), 10 и 30 минут; 1, 2, 4, 8, 24 и 36 часов и 2, 3, 4, 7, 14, 21, 28 суток после дозы.
Мыши с высокоэкспрессирующим HER2 трансгенным эксплантатом.
Животных, подходящих для трансгенных экспериментов, можно получить из стандартных коммерческих источников, таких как Taconic (Germantown, N.Y.). Подходят многие линии, но предпочтительными являются самки FVB из-за их высокой восприимчивости к образованию опухоли. Самцов FVB применяли для спаривания и вазэктомизированных племенных CD.1 применяли для стимуляции псевдобеременности. Вазэктомированных мышей можно получать у любого коммерческого поставщика. Основателей скрещивали либо с мышами FVB, либо с гетерозиготными мышами 129/BL6 x FVB p53. Мыши с гетерозиготностью по аллелям p53 применяли для потенциального увеличения образования опухолей. Однако было доказано, что это излишне. Таким образом, некоторые опухоли F1 являлись опухолями смешанных линий. Опухоли основателей были только FVB. Получили шесть основателей с некоторым развитием опухолей без потомства.
Животным с опухолями (аллотрансплантат, пересаженный от трансгенных мышей Fo5) вводили однократную инъекцию конъюгата трастузумаб-майтаназоидное средство DM1 (10 мг/кг/дозу) и объем опухоли оценивали в течение более 20 суток после инъекции.
Мыши SCID с ксенотрансплантатом от Bjab-luc.
Группам мышей SCID в количестве от восьми до десяти с 20 миллионами ксенотрансплантированными опухолевыми клетками Bjab-luc на мышь на сутки 1 вводили дозу конъюгата антитело-лекарственное средство или «голое» антитело. В группе из восьми мышей каждую тестировали с ADC с антителом против CD22, «голыми» антителами против CD22 и контролем. Контрольный ADC (трастузумаб-SMCC-DM1; нагрузка: DM1/трастузумаб=3,2) не является специфическим связывающим средством и его вводили в количестве 200 мкг DM1/м2, 4,2 трастузумаб/кг/мышь, и он приводил к среднему времени удваивания опухоли приблизительно 3 суток. Конъюгаты с антителом к CD22 7A2-SMCC-DM1 (нагрузка: DM1/Ab=3,6), 5E8-SMCC-DM1 (нагрузка: DM1/Ab=3,6), и RFB4-SMCC-DM1 (нагрузка: DM1/Ab=4,3). Ненагруженные антитела, 7A2, 5E8 и RFB4 вводили в дозе 4 мг/кг/мышь.
Пример 9. Токсичность у крыс
Оценивали профиль острой токсичности трастузумаба-SPP-DM1 (дисульфидный линкер) по сравнению со свободным DM1 и трастузумабом-SMCC-DM1 (не дисульфидный линкер). Животным вводили инъекцию на 1 сутки, полные биохимические и гематологические профили получали на исходном уровне, на 3 сутки и на 5 сутки, а полную аутопсию проводили на 5 сутки, на трех случайных животных из каждой группы проводили обычный гистологический анализ для следующих тканей: грудинная кость, печень, почка, тимус, селезенка, толстый и тонкий кишечник. Экспериментальные группы были следующими:
Группа 1: Носитель (10 мМ сукцинат натрия, 100 мг/мл сахароза, 0,1% Tween 20, pH 5,0)
Группа 2: Трастузумаб-SPP-DM1, 22,3 мг/кг
Группа 3: Трастузумаб-SMCC-DM1, 10 мг/кг
Группа 4: Трастузумаб-SMCC-DM1, 25 мг/кг
Группа 5: Трастузумаб-SMCC-DM1, 50 мг/кг
Группа 6: Свободный DM1, 160 мкг/кг
Пример 10. Токсичность/безопасность у длиннохвостых макак
Исследовали три группы по четыре (2 самца, 2 самки), не обработанных Macaca fascicularis (длиннохвостых макака).
Группа 1: (4 животных) получали только носитель (PBS, pH 6,5, то есть состав без ADC) на сутки 1 и сутки 22, с последующим вскрытием на сутки 36.
Группа 2: (4 животные) получала трастузумаб-SMCC-DM1 4900 мкг/м2 на сутки 1 и сутки 22.
Группа 3: (4 животные) получала трастузумаб-SMCC-DM1 7200 мкг/м2 на сутки 22.
Дозы выражены в площади поверхности животного с тем, чтобы быть релевантными относительно других видов, то есть доза в мкг/м2 не зависит от вида и, таким образом, сравнима между видами. Составы трастузумаб-SMCC-DM1 для исследований группы 2 и группы 3 содержали PBS, 5,4 мМ фосфат натрия, 4,2 мМ фосфат калия, 140 мМ хлорид натрия, pH 6,5.
Кровь для гематологического анализа собирали до первого введения дозы (период сбора) и на сутки 3, 7, 11 и 14 после первой дозы (группы 1 и 2) и на сутки 3, 7, 11, 14 и 21 после второй дозы (группы 1, 2 и 3). Подсчитывали количество эритроцитов (RBC)
и тромбоцитов (PLT) способом светорассеяния. Количество лейкоцитов (WBC) подсчитывали способом пероксидаза/базофил. Количество ретикулоцитов подсчитывали способом светорассеяния с катионным красителем. Количество клеток подсчитывали на устройстве Advia 120. ALT (аланинаминотрансферазу) и AST (аспарагинаминотрансферазу) измеряли в Ед/л с помощью UV/NADH; способа IFCC на устройстве Olympus AU400 и с тестов применением Total Ab ELISA-ECD/GxhuFc-HRP. Conj. Ab ELISA-xDM1/ECD-Bio/SA-HRP.
Все патенты, патентные заявки и ссылки, цитируемые в настоящем описании, приведены в качестве ссылки в полном объеме.