Результат интеллектуальной деятельности: Стабилизированная композиция пеметрекседа
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к стабилизированной композиции пеметрекседа и более конкретно к стабилизированной композиции пеметрекседа, содержащей ацетилцистеин в качестве антиоксиданта и цитратную соль в качестве буфера.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Конкретные соединения, известные как обладающие антифолатной активностью, хорошо известны в качестве химиотерапевтических агентов для лечения рака. В патенте US № 5344932 раскрыты способы получения некоторых антифолатных замещенных производных на основе пирроло[2,3-d]пиримидина, включая пеметрексед, а в публикации Европейского патента № 0434426 раскрыта серия производных 4-гидроксипирроло[2,3-d]пиримидин-L-глутаминовой кислоты.
Пеметрексед, представляющий собой 5-замещенный пирроло[2,3-d]пиримидин, является многоцелевой антифолатом, проявляющим противораковые эффекты против различных видов рака, включая немелкоклеточный рак легкого, посредством ингибирования активности метаболитов, вовлеченных в метаболизм фолата.
Известно, что пеметрексед проникает в клетки посредством переносчика восстановленных фолатов (RFC), представляющего собой основную фолатную транспортную систему, а затем активируется фолилполиглутаматсинтетазой (FPGS) с образованием полиглутаматных производных, имеющих в качестве мишени тимидилатсинтазу (TS) и дигидрофолатредуктазу (DHFR).
В настоящее время пеметрексед имеется в продаже под торговым названием Алимта и применяется в качестве средства для лечения злокачественной плевральной мезотелиомы и немелкоклеточного рака легкого (см. Physicians' Desk Reference, 60th ed., pp. 1722-1728 (2006)). Алимта имеется в продаже в виде лиофилизированной композиции, которую следует восстанавливать перед введением. Конкретно, Алимта имеется в продаже в виде лиофилизированной порошкообразной композиции (100 мг или 500 мг), которую необходимо восстанавливать 0,9% раствором хлорида натрия и в заключение разводить 0,9% раствором хлорида натрия до конечной концентрации 0,25 мг/мл перед введением пациенту.
Получение лиофилизированных порошкообразных композиций является сложным, и способы получения этих композиций являются очень дорогостоящими. Кроме того, лиофилизированные композиции подвержены риску контаминации микроорганизмами при восстановлении, и фармацевты, врачи, медсестры и тому подобные лица, вовлеченные в приготовление лекарственных средств, содержащих эти композиции, с высокой вероятностью подвергаются воздействию веществ, разрушающих клетки. Так, в случае цитотоксических противораковых средств, таких как пеметрексед, необходимо скорее разрабатывать готовые к применению жидкие композиции, которые можно хранить в течение длительного периода времени, чем разрабатывать лиофилизированные композиции.
Во многих случаях проблема жидких композиций заключается в нестабильности во время хранения. Вследствие этой нестабильности большое число инъекционных композиций применяют в форме лиофилизированных композиций, которые растворяют непосредственно перед инъекцией. Даже в случае пеметрекседа или его фармацевтически приемлемой соли, недавно разработанных в форме лиофилизированных композиций, получение композиции в виде водного раствора вызывает проблемы, связанные с неизвестными примесями, количество которых возрастает при хранении при комнатной температуре в течение длительного периода времени. То есть в отношении данной композиции в виде водного раствора существует проблема стабильности. В связи с этой проблемой стабильности при клинических применениях пеметрексед или его фармацевтически приемлемую соль в настоящее время применяют в форме лиофилизированных композиций.
Чтобы преодолеть описанные выше недостатки, предложено несколько композиций. Например, в патенте US № 6686365 (соответствующем публикации патента Кореи № 2002-0081293) раскрыта стабильная жидкая композиция пеметрекседа, содержащая терапевтически эффективное количество пеметрекседа, эффективное количество антиоксиданта и фармацевтически приемлемый эксципиент, где антиоксидант выбран из группы, состоящей из монотиоглицерина, L-цистеина и тиогликолевой кислоты.
Тем не менее, в отношении проблемы композиции, раскрытой в указанном выше патенте, сообщалось, что при хранении этой композиции при 25°C в течение длительного периода времени происходило осаждение, что позволяет предположить, что долгосрочную стабильность данной композиции в течение желаемого периода нельзя гарантировать (международная патентная публикация РСТ № WO 2012/015810). До сих пор ни одна жидкая композиция пеметрекседа, стабильная в течение долгосрочного хранения, не была получена экспериментально или не была выпущена в продажу. В действительности, авторы настоящего изобретения получили жидкую композицию, содержащую пеметрексед, используя указанный выше антиоксидант L-цистеин, и провели тест на стабильность полученной композиции, наблюдая при этом только несколько проблем, включая изменение внешнего вида, такое как изменение цвета, увеличение количества примесей и снижение рН, после 2 недель в условиях стрессового тестирования. Кроме того, авторы настоящего изобретения получили жидкие композиции, содержащие пеметрексед, используя около 60 видов стабилизаторов, включая аскорбиновую кислоту, тиосульфат натрия, бутилированный гидроксианизол, пропилгаллат, этилендиаминтетрауксусную кислоту (ЭДТА), L-метионин и ацетилцистеин, но все эти композиции обладали недостаточной стабильностью.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Техническая задача
По сравнению с предшествующим уровнем техники авторы настоящего изобретения провели обширные исследования по преодолению проблемы стабильности жидких композиций пеметрекседа и в результате обнаружили, что при совместном использовании ацетилцистеина в качестве антиоксиданта и цитратной соли в качестве буфера получают стабильную композицию пеметрекседа, обладающую высокой стабильностью и поддерживаемую в состоянии прозрачного раствора без осаждения во время хранении, в которой образование примеси изомера пеметрекседа и неизвестных примесей эффективно контролируется и ингибируется, в результате чего обеспечивается настоящее изобретение.
Техническое решение
Цель настоящего изобретения состоит в разработке стабилизированной композиции пеметрекседа.
Полезные эффекты изобретения
В настоящем изобретении может быть предложена композиция пеметрекседа, которая может быть легко получена коммерческим путем, в отношении которой может быть предотвращена микробная контаминация, которая обычно происходит во время лиофилизации и восстановления, причем эта композиция обладает большими удобством и стабильностью. Кроме того, в настоящем изобретении может быть предложена стабилизированная композиция пеметрекседа, которая содержит ацетилцистеин в качестве антиоксиданта вместе с цитратом натрия в качестве буфера и за счет этого не проявляет отклонений в отношении внешнего вида, таких как изменение цвета или осаждение, и удовлетворяет критериям приемлемости в отличие от традиционных инъекционных жидких композиций, содержащих пеметрексед.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
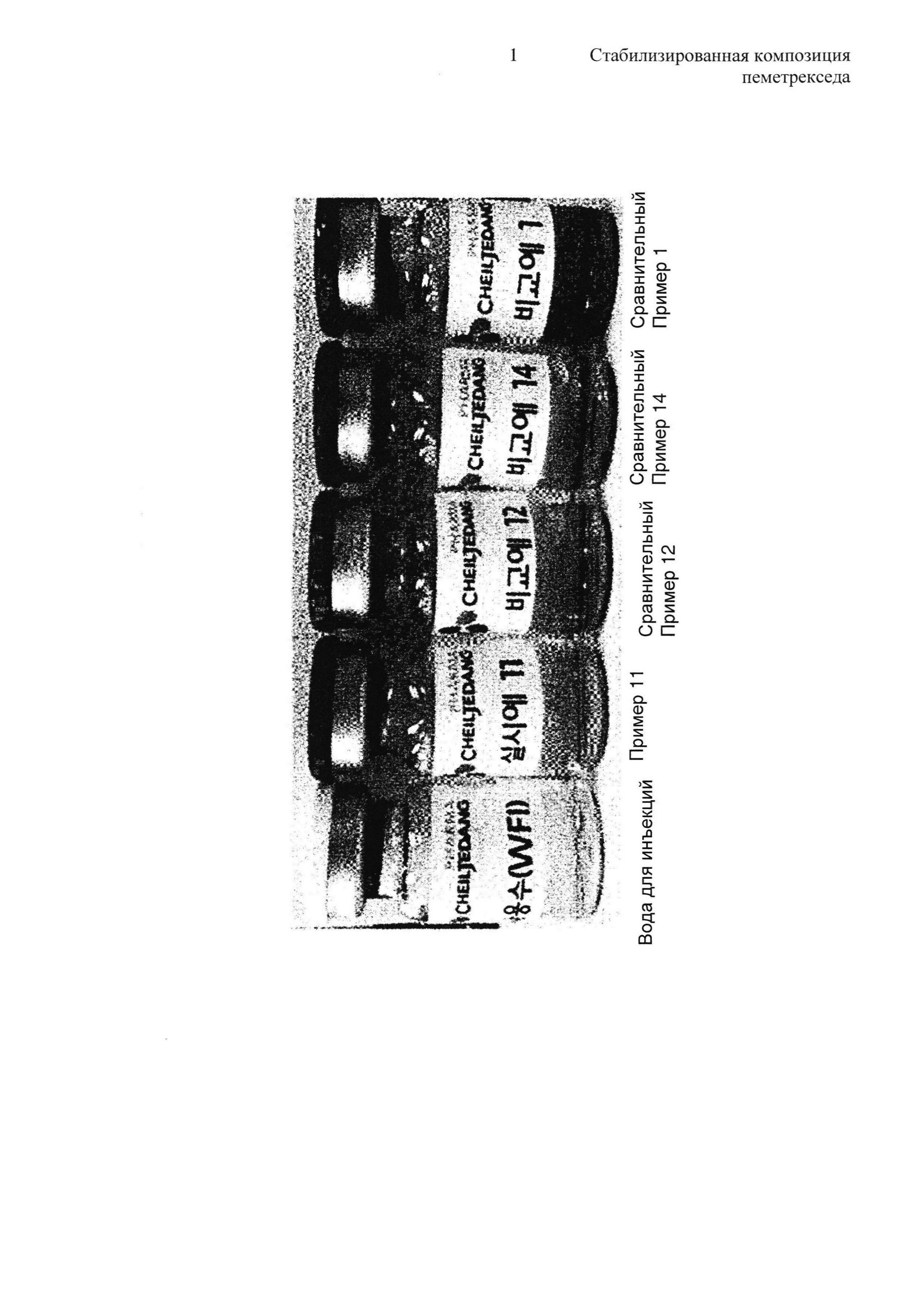
На Фиг. показано сравнение внешнего вида между традиционными содержащими пеметрексед инъекционными жидкими композициями (Сравнительные примеры 1, 12 и 14) и содержащей пеметрексед жидкой композицией согласно настоящему изобретению (Пример 11) после 4-недельного стрессового теста на стабильность (60°C и 80%). Для сравнения на Фиг. также показан внешний вид воды для инъекций (WFI).
Лучший вариант осуществления изобретения
В одном аспекте в настоящем изобретении предложена композиция пеметрекседа, содержащая пеметрексед или его фармацевтически приемлемую соль в качестве активного ингредиента; N-ацетил-L-цистеин и цитратную соль.
В настоящем изобретении пеметрексед или его фармацевтически приемлемая соль, N-ацетил-L-цистеин и цитратная соль могут присутствовать с отношением концентраций, составляющим 1-30:0,15-2,0:1,0-15,0.
Предпочтительно пеметрексед или его фармацевтически приемлемая соль, N-ацетил-L-цистеин и цитратная соль могут присутствовать с отношением концентраций, составляющим 1-30:1,5:1,0-15,0.
В настоящем изобретении композиция может представлять собой жидкую композицию, которую можно хранить в состоянии раствора.
В настоящем изобретении композиция может представлять собой инъекционную жидкую композицию, содержащуюся в герметичном контейнере, таким образом, что она является готовой к применению.
Тем не менее, объем настоящего изобретения необязательно ограничен инъекционной жидкой композицией и включает другие жидкие композиции и нежидкие композиции, которые могут быть получены в соответствии с общими принципами, известными специалистам в данной области техники, или в соответствии со способами, обычно применяемыми в соответствующей области техники.
Далее настоящее изобретение описано подробно.
Как правило, в целях стабилизации композиций применяют широкий ряд антиоксидантов, и их конкретные примеры включают сложноэфирные производные парагидроксибензойной кислоты, спирты, производные фенола, тимеросал, уксусный ангидрид, карбоксилат натрия, лаурилсульфат, антиоксиданты, сульфидные соединения, сульфит, цистин, цистеин, цистеамин, аминокислоты, органические кислоты, такие как аскорбиновая кислота, ретинол, токоферол, бутилированный гидроксианизол и т.д.
Кроме того, в патенте Кореи, регистрационный № 10-0774366, раскрыта N-ацетиламинокислота в качестве антиоксиданта для паклитаксела, и в публикации патента Кореи № 10-2007-0028331 раскрыт монотиоглицерин и этилендиаминтетрауксусная кислота в качестве антиоксидантов для композиций диклофенака.
Авторы настоящего изобретения протестировали описанные выше антиоксиданты в инъекционных композициях пеметрекседа, но суточные дозы таких традиционно применяемых веществ ограничены при применении в качестве эксципиентов (антиоксидантов), но не в качестве активных фармацевтических ингредиентов (АФИ), в частности, в инъекционных композициях. Кроме того, антиоксиданты сами по себе не улучшали стабильность композиции. Кроме того, при применении аскорбиновой кислоты, молочной кислоты и тому подобных веществ, часто применяемых в традиционных инъекционных композициях, эти инъекционные композиции частично меняли цвет, и/или в них образовывался осадок, что указывает на то, что данные композиции неустойчивы к кислоте (экспериментальные Примеры 1 и 2).
Тем не менее, авторы настоящего изобретения неожиданно обнаружили, что при применении композиции, содержащей пеметрексед или его фармацевтически приемлемую соль в качестве активного ингредиента, совместно с ацетилцистеином и цитратом натрия активный ингредиент по существу не модифицировался в течение 4-недельного периода тестирования стабильности в условиях стрессового тестирования (60°C и 80%), и ни изменения цвета, ни осаждения не наблюдали, что указывает на то, что данная композиция обладает стабильностью, удовлетворяющей требованиям критериев приемлемости (Экспериментальные Примеры 1 и 2). И ацетилцистеин, и цитрат натрия представляют собой традиционно используемые вещества, а также выгодны в коммерческом отношении благодаря их низкой стоимости.
Композиция пеметрекседа по настоящему изобретению содержит пеметрексед или его фармацевтически приемлемую соль в качестве активного ингредиента. Данный пеметрексед согласно настоящему изобретению включает фармацевтически активное лекарственное средство или лекарственное средство, которое становится фармакологически активным в результате химического или ферментативного процесса in vivo. В частности, пеметрексед, применяемый в настоящем изобретении, может представлять собой само лекарственное средство пеметрексед или его фармацевтически приемлемую соль.
Как используют в данном описании, термин "пеметрексед" относится к соединению под названием 5-замещенный пирроло[2,3-d]пиримидин. В частности, этот термин относится к многоцелевому антифолату, представленному приведенной ниже формулой 1 и проявляющему противораковые эффекты против различных видов рака, включая немелкоклеточный рак легких и злокачественную плевральную мезотелиому:
Формула 1
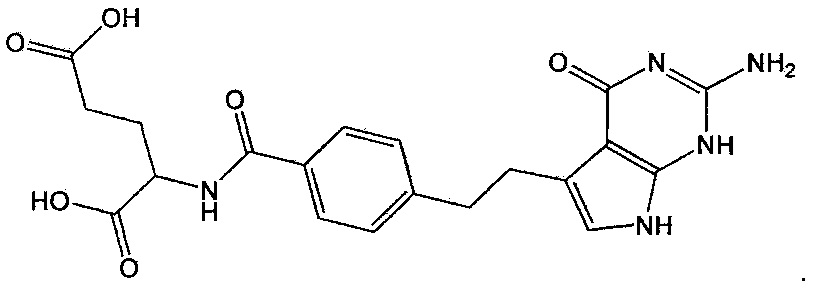
Пеметрексед проявляет противораковые эффекты против различных видов рака, включая немелкоклеточный рак легких и злокачественную плевральную мезотелиому, посредством ингибирования активности метаболитов, вовлеченных в метаболизм фолата.
Как используют в данном описании, термин "фармацевтически приемлемая соль" относится к соли, полученной в соответствии с традиционным способом, известным в данной области техники. Данный способ получения известен специалистам в данной области техники. Конкретные примеры фармацевтически приемлемой соли включают, но не ограничены ими, соли, образованные из фармакологически или физиологически приемлемых неорганических кислот, органических кислот и оснований, как описано ниже. Примеры подходящих кислот включают соляную кислоту, бромноватую кислоту, бромисто-водородную кислоту, серную кислоту, азотную кислоту, перхлорную кислоту, фумаровую кислоту, малеиновую кислоту, фосфорную кислоту, гликолевую кислоту, молочную кислоту, салициловую кислоту, янтарную кислоту, пара-толуолсульфоновую кислоту, винную кислоту, уксусную кислоту, лимонную кислоту, метансульфоновую кислоту, муравьиную кислоту, бензойную кислоту, малоновую кислоту, нафталин-2-сульфоновую кислоту, бензолсульфоновую кислоту и т.д. Примеры солей, образованных их подходящих оснований, включают, но не ограничены ими, соли щелочных металлов, таких как натрий и калий, и соли щелочноземельных металлов, таких как магний.
Как используют в данном описании, термин "ацетилцистеин" относится к соединению под названием N-ацетил-L-цистеин (NAC, C5H9NO3S, регистрационным номер CAS 616-91-1), который применяют в качестве антиоксиданта в композиции пеметрекседа по настоящему изобретению. В настоящем изобретении "ацетилцистеин" и "N-ацетил-L-цистеин" используют взаимозаменяемо друг с другом.
Ацетилцистеин в качестве антиоксиданта описан в Фармакопее США (см. U.S. Pharmacopeia 35 - National Formulary 10, p 2069). Ацетилцистеин является предшественником аминокислоты L-цистеина, содержащейся в пищевых продуктах. Цистеин легко изменяется до нерастворимого вещества в результате окисления, тогда как ацетилцистеин является стабильным и легко не изменяется, поэтому его вводят перорально или внутривенно.
Как используют в данном описании, термин "цитратная соль" относится к соли лимонной кислоты и означает соединение, применяемое в качестве буфера в композиции пеметрекседа по настоящему изобретению. Цитратная соль может представлять собой цитрат натрия.
Согласно настоящему изобретению композиция пеметрекседа, дающая возможность фармацевтического хранения пеметрекседа в стабильном состоянии при температуре от 1 до 30°C в течение длительного периода времени, может быть получена с использованием ацетилцистеина в качестве антиоксиданта вместе с цитратом в качестве буфера.
В композиции пеметрекседа по настоящему изобретению отношение концентраций пеметрексед или его фармацевтически приемлемая соль : N-ацетил-L-цистеин : цитратная соль предпочтительно составляет 1-30:0,15-2,0:1,0-15,0 и более предпочтительно 1-30:1,5:1,0-15,0. В настоящей заявке каждая из концентраций может быть представлена в единицах мкг/мл. Видно, что в случае композиций пеметрекседа, имеющих отношение концентраций вне приведенного выше диапазона отношения концентраций, образование примесей увеличивалось сверх пределов критериев приемлемости по мере течения срока хранения (Экспериментальный Пример 1).
В настоящем изобретении композиция пеметрекседа может содержать фармацевтически приемлемый носитель и агент, регулирующий рН.
В настоящем изобретении композиция пеметрекседа может предпочтительно представлять собой жидкую композицию, которую можно хранить в состоянии раствора, и более предпочтительно инъекционную жидкую композицию, содержащуюся в герметичном контейнере, таким образом, что она является готовой к применению.
Когда композиция пеметрекседа по настоящему изобретению представляет собой инъекционную жидкую композицию, фармацевтически приемлемый носитель представляет собой WFI (воду для инъекций).
В настоящем изобретении рН инъекционной жидкой композиции пеметрекседа может предпочтительно составлять приблизительно 6,0-8,0 и более предпочтительно приблизительно 7,2-7,8. Значение рН жидкой композиции можно регулировать, используя кислоты, такие как соляная кислота, или основания, такие как гидроксид натрия.
Хотя возможно, чтобы композиция пеметрекседа по настоящему изобретению могла не содержать других добавок, кроме ацетилцистеина и цитратных солей, она может дополнительно содержать фармацевтически приемлемый эксципиент. Примеры фармацевтически приемлемого эксципиента включают известные добавки, такие как лактоза, декстроза, циклодекстрин и его производные, сахароза, глицерин, карбонат натрия. Предпочтительные эксципиенты могут представлять собой хлорид натрия и маннит.
В способе получения композиции по настоящему изобретению проводят продувание инертным газом, таким как азот или аргон, в целях поддержания условий низкого содержания кислорода, с последующей стерилизацией и фильтрованием.
Кроме того, стабилизированная композиция пеметрекседа по настоящему изобретению может быть упакована в подходящий контейнер, известный в данной области техники. Например, контейнер может представлять собой стеклянный флакон, стеклянную бутылку, картридж, предварительно заполненный шприц или тому подобное. Предпочтительно контейнер представляет собой стеклянный флакон.
Инъекционную жидкую композицию пеметрекседа согласно настоящему изобретению распределяют в предварительно промытый и стерилизованный контейнер и контейнер герметично закрывают тефлоновой крышкой, поверхность которой не вступает в реакцию с жидкой композицией. При необходимости пространство между инъекционной жидкой композицией и пробкой заполняют инертным газом. Крышку присоединяют, используя кримпер, а затем при необходимости флакон, заполненный инъекционной жидкой композицией, нагревают и стерилизуют.
ТЕХНИЧЕСКОЕ ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Далее настоящее изобретение описано более подробно со ссылкой на примеры. Тем не менее, понятно, что эти примеры предназначены только для иллюстративных целей и не предназначены для ограничения объема настоящего изобретения.
Примеры 1-14: Получение пеметрекседсодержащих инъекционных растворов, содержащих различные количества ацетилцистеина в качестве антиоксиданта и цитрата натрия в качестве буфера
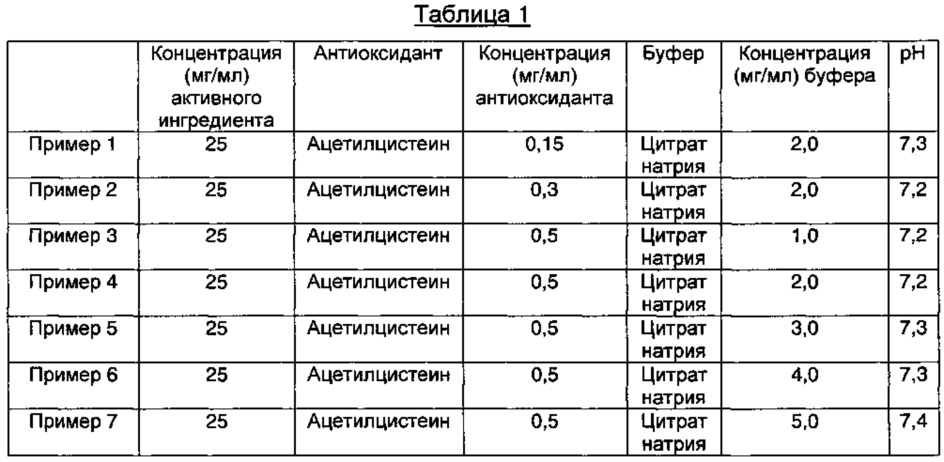
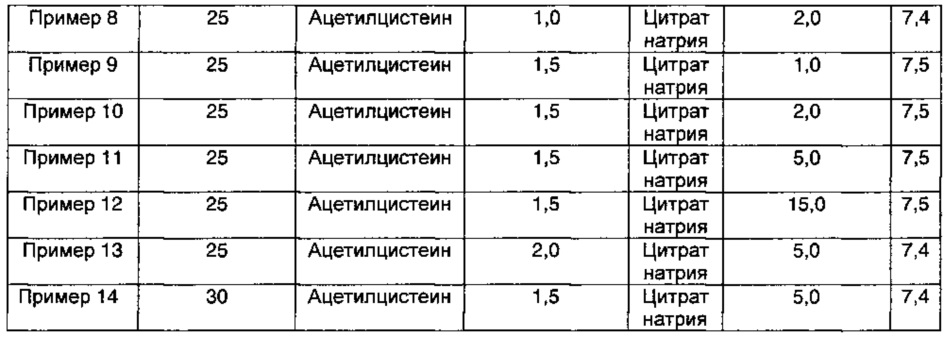
2,5 г D-маннита растворяли в 100 мл WFI (воды для инъекций), а затем последовательно добавляли ацетилцистеин и цитрат натрия при концентрациях, представленных в Таблице 1 ниже, и они полностью растворялись. К этим растворам медленно добавляли 2,5 г пеметрекседа (3,0 г пеметрекседа медленно добавляли в Примере 14) и растворы перемешивали, пока они не становились прозрачными. Затем эти растворы доводили до значений рН, приведенных в Таблице 1, используя водный раствор соляной кислоты или гидроксида натрия. Эти растворы асептически фильтровали через стерилизованный 0,22 мкм мембранный фильтр в чистой комнате. Полученные растворы заполняли в промытые/стерилизованные герметично закрываемые контейнеры, которые предварительно были продуты азотом.
Компоненты и значения рН полученных инъекционных растворов, содержащих пеметрексед, представлены в Таблице 1 ниже.
Примеры 15 и 16: Получение пеметрекседсодержащих инъекционных растворов, имеющих различные значения рН
2,5 г D-маннита растворяли в 100 мл WFI (воды для инъекций), а затем последовательно добавляли ацетилцистеин и цитрат натрия при концентрациях, представленных в Таблице 2 ниже, и они полностью растворялись. К этим растворам медленно добавляли 2,5 г пеметрекседа и растворы перемешивали, пока они не становились прозрачными. Затем растворы доводили до значений рН, приведенных в Таблице 2, используя водный раствор соляной кислоты или гидроксида натрия. Эти растворы асептически фильтровали через стерилизованный 0,22 мкм мембранный фильтр в чистой комнате. Полученные растворы заполняли в промытые/стерилизованные герметично закрываемые контейнеры, которые предварительно были продуты азотом.
Компоненты и значения рН полученных инъекционных растворов, содержащих пеметрексед, представлены в Таблице 2 ниже.

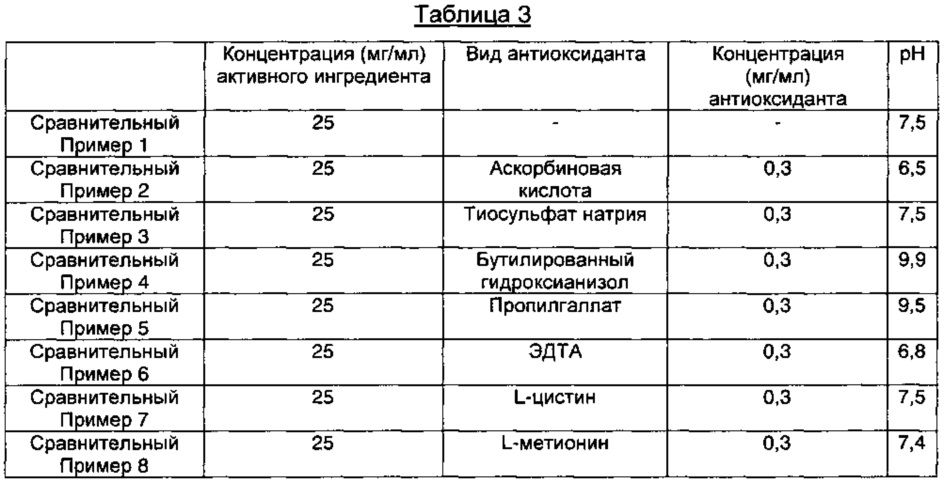
Сравнительные примеры 1-8: Получение пеметрекседсодержащих инъекционных растворов, используя различные виды антиоксидантов
В соответствии с компонентами и их содержанием, представленными в Таблице 3 ниже, содержащие пеметрексед растворы готовили так же, как описано в Примере 1. В Сравнительном Примере 1 готовили раствор без антиоксиданта, содержащий только WFI (воду для инъекций) в качестве носителя.
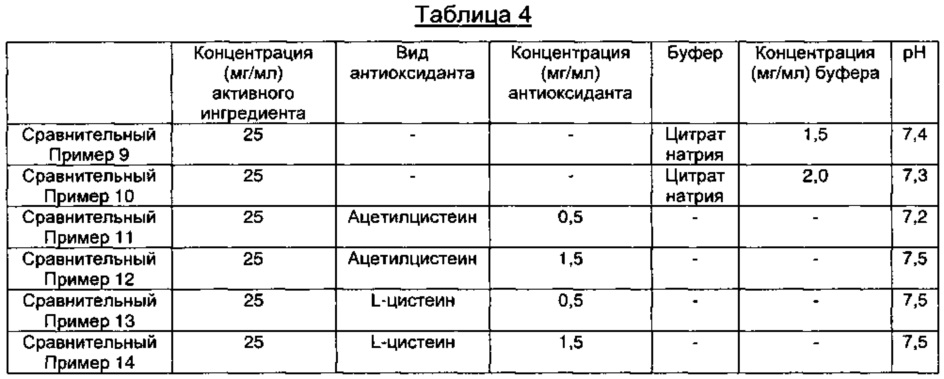
Сравнительные Примеры 9-14: Получение пеметрекседсодержащих инъекционных растворов, содержащих различные виды антиоксидантов и содержащих или не содержащих буфер
В соответствии с компонентами и их содержанием, представленными в Таблице 4 ниже, содержащие пеметрексед растворы готовили так же, как описано в Примере 1.
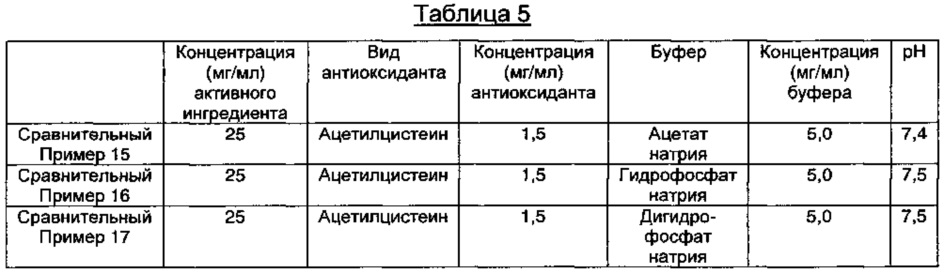
Сравнительные Примеры 15-17: Получение инъекционных растворов, содержащих пеметрексед, содержащих различные виды буферов
В соответствии с компонентами и их содержанием, представленными в Таблице 5 ниже, содержащие пеметрексед растворы готовили так же, как описано в Примере 1.
Экспериментальные Примеры: Тест на стабильность
Композиции, полученные в Примерах 1-16 и Сравнительных Примерах 1-17, тестировали на их стабильность в условиях стрессового тестирования (60°C и 80%) в течение 4 недель. Среди этих композиций композиции Примера 11 и Сравнительных Примеров 1, 12 и 14 также тестировали на стабильность в ускоренных условиях (40°C и 70%) в течение 4 месяцев. Оценку стабильности проводили путем измерения содержания пеметрекседа и примесей в водных растворах, используя высокоэффективную жидкостную хроматографию, в условиях, представленных в Таблице 6 ниже.

Экспериментальный Пример 1: Стрессовое тестирование стабильности (60°C/80%, 4-недельная оценка)
Стрессовое тестирование стабильности проводили как описано выше, и результаты теста приведены в Таблицах 7-11 ниже.
На Фиг. также показано сравнение внешнего вида между пеметрекседсодержащей инъекционной жидкой композицией согласно настоящему изобретению (Пример 11) и пеметрекседсодержащими инъекционными жидкими композициями предшествующего уровня техники (Сравнительные Примеры 1, 12 и 14) в течение 4-недельного периода тестирования стабильности в условиях стрессового тестирования (60°C и 80%). Для сравнения на Фиг. также показан внешний вид WFI (воды для инъекций).
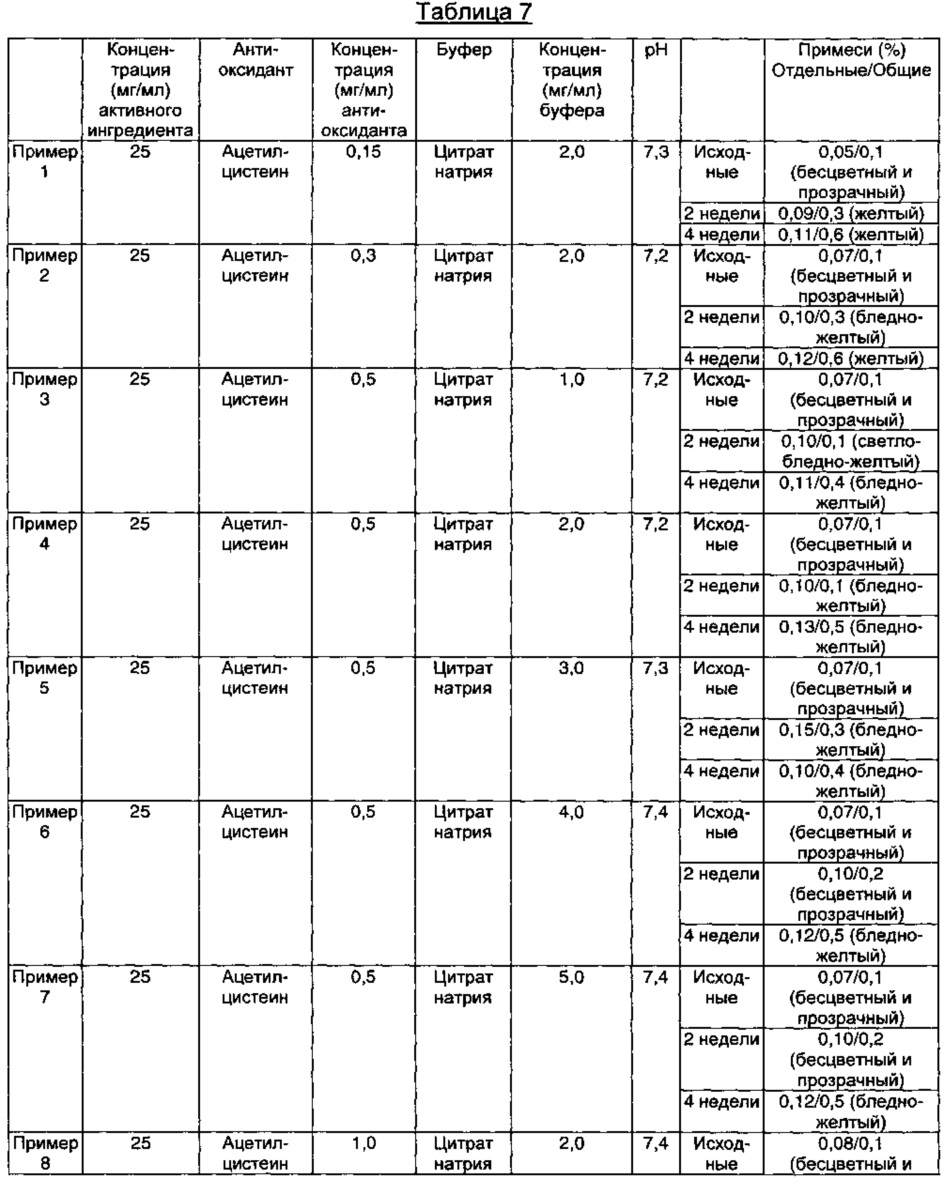
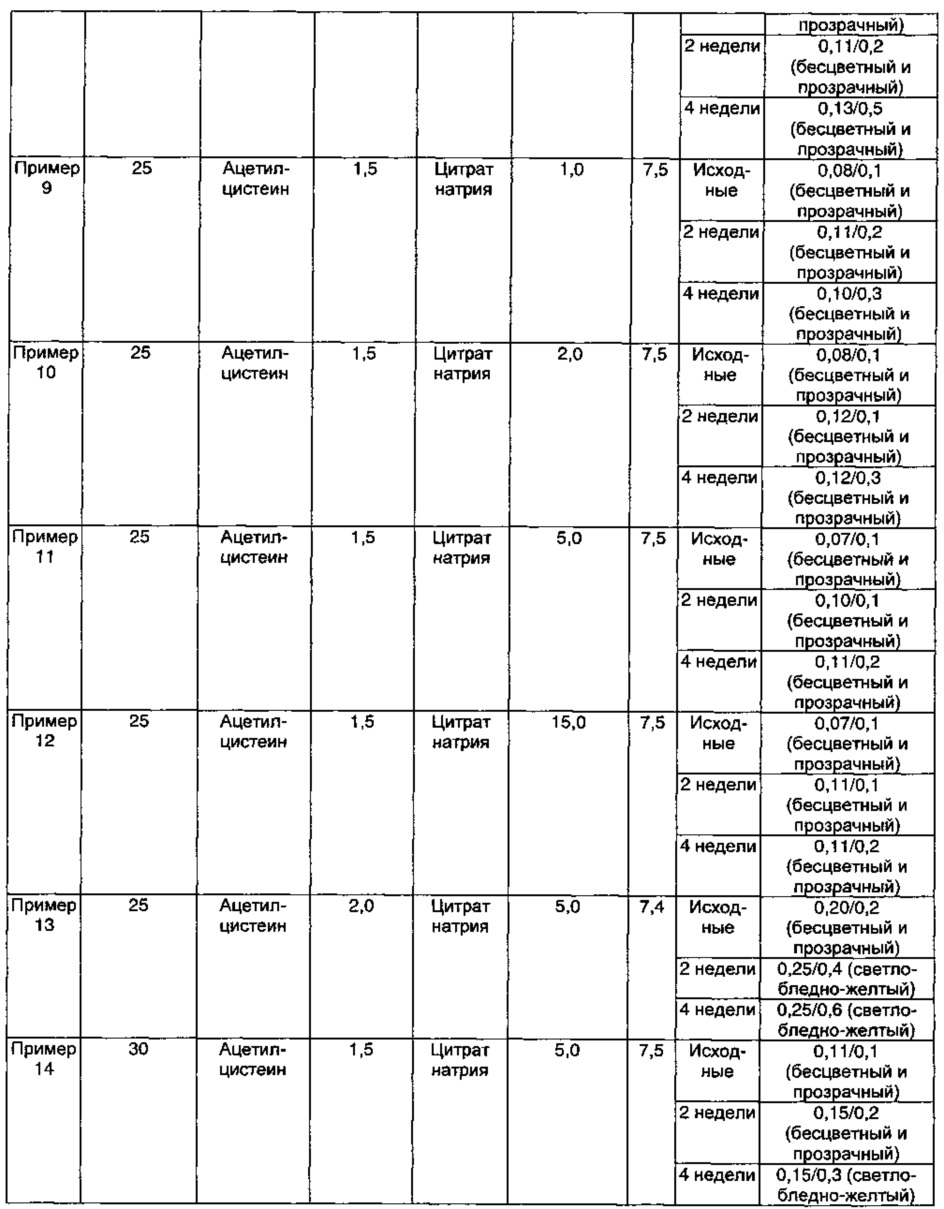
Как видно из результатов в Таблице 7, композиции, содержащие 1,5 мг/мл ацетилцистеина в качестве антиоксиданта вместе с 1-15 мг/мл цитрата натрия в качестве буфера, показали содержание отдельных примесей 0,2% или менее и общее содержание примесей 1,0% или менее в течение 4-недельного периода стрессовых условий, что указывает на то, что данные композиции обладают превосходной стабильностью (Примеры 9-12).
Кроме того, композиции, содержащие 1,0-1,5 мг/мл ацетилцистеина и 2,0 мг/мл цитрата натрия в качестве буфера, показали содержание отдельных примесей 0,2% или менее и общее содержание примесей 1,0% или менее, что указывает на то, что данные композиции обладают превосходной стабильностью (Примеры 8 и 10). Тем не менее, наблюдали, что, когда концентрация ацетилцистеина была ниже, чем 1,0-1,5 мг/мл, наблюдали изменение внешнего вида (изменение цвета), хотя содержание примесей удовлетворяло критериям приемлемости (Примеры 1-2).
Кроме того, когда концентрация ацетилцистеина составляла 2,0 мг/мл, а концентрация цитрата натрия составляла 5,0 мг/мл, содержание примесей удовлетворяло критериям приемлемости, но происходило изменение внешнего вида (изменение цвета) (Пример 13).
Кроме того, когда концентрация ацетилцистеина составляла 0,5 мг/мл, а концентрация цитрата натрия составляла 1,0-5,0 мг/мл, содержание примесей удовлетворяло критериям приемлемости, но происходило изменение внешнего вида (изменение цвета) (Примеры 3-7).
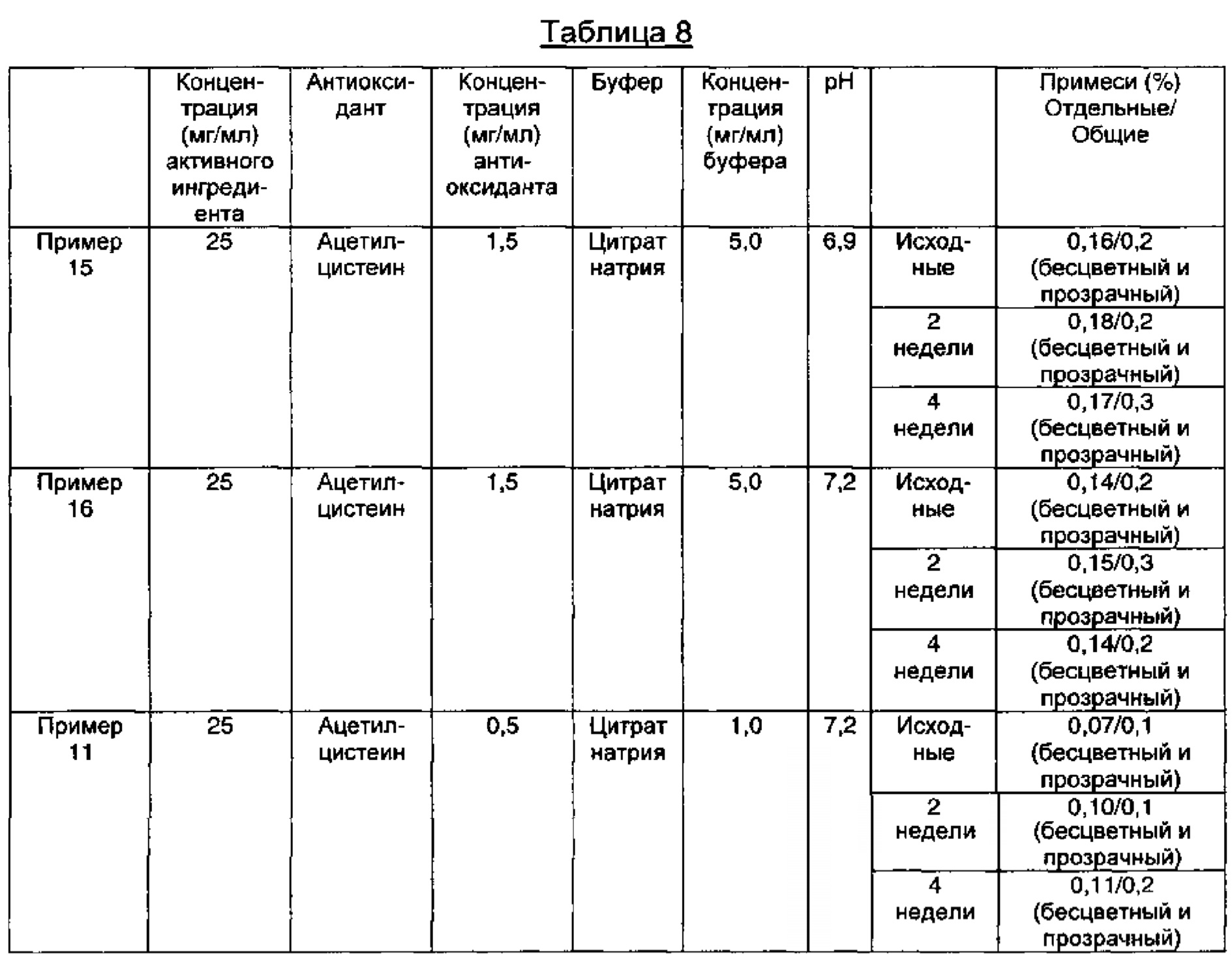
Как видно из результатов в Таблице 8 выше, композиции, содержащие ацетилцистеин в качестве антиоксиданта вместе с цитратом натрия в качестве буфера, показали содержание отдельных примесей 0,2% или менее и общее содержание примесей 1,0% или менее в течение 4-недельного периода стрессовых условий, несмотря на изменения рН, что указывает на то, что данные композиции обладают превосходной стабильностью.
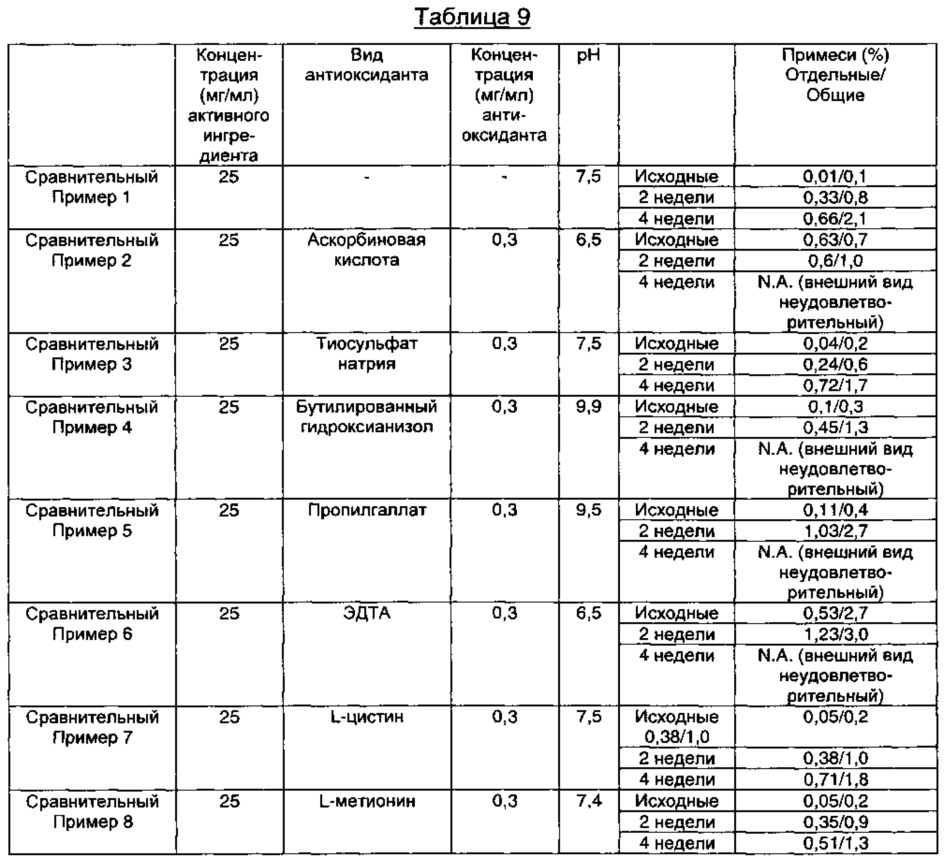
Как видно из результатов в Таблице 9 выше, в композициях, содержащих антиоксиданты, обычно применяемые в данной области техники, происходит изменение внешнего вида (осаждение или изменение цвета) в течение периода тестирования стабильности в стрессовых условиях, либо содержание отдельной примеси возрастает до более 0,2%, и общее содержание примесей возрастает до более 1,0%. Это показывает, что пеметрекседсодержащие инъекционные композиции, содержащие антиоксиданты, обычно применяемые в данной области техники, не обеспечивают достаточную стабильность в отношении примесей или изменения внешнего вида.
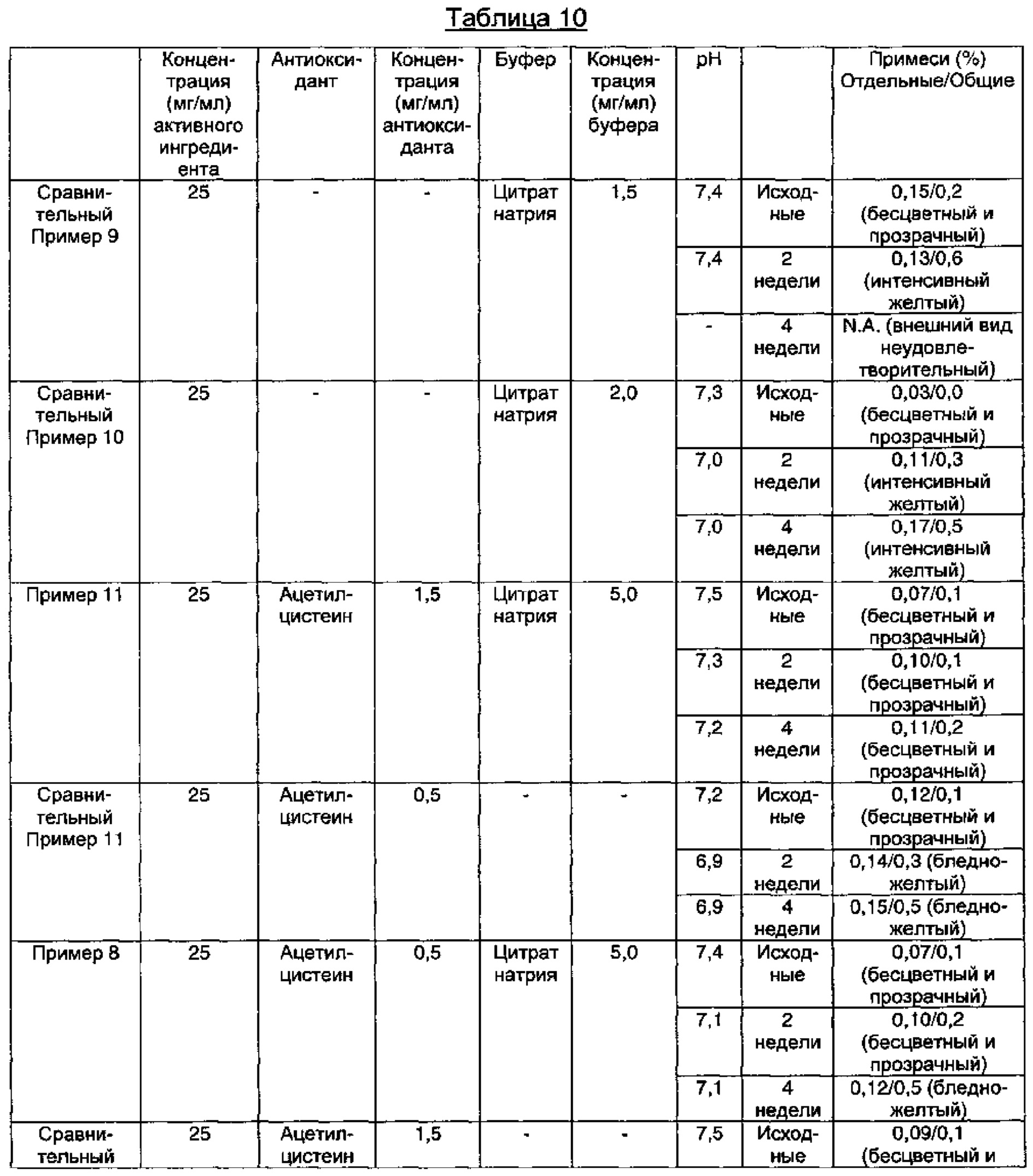
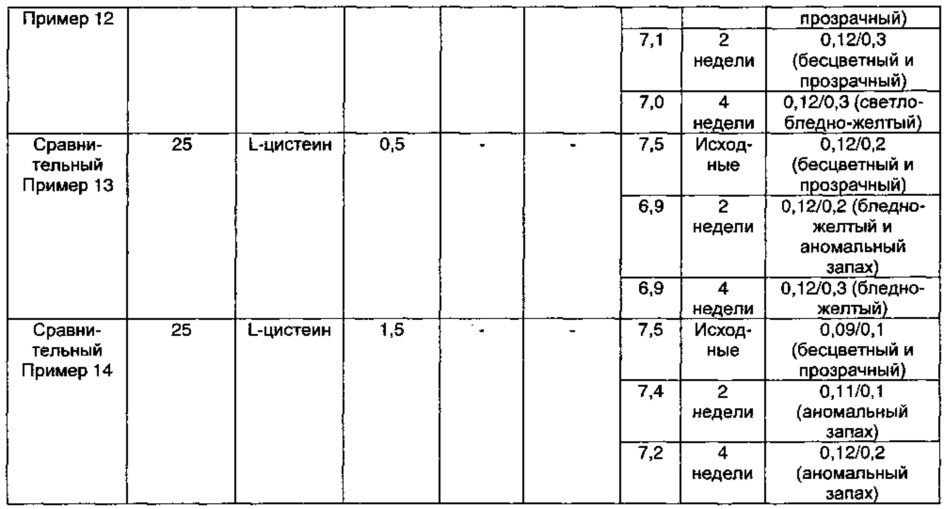
Как видно из результатов в Таблице 10 выше, когда композиция содержала ацетилцистеин в качестве антиоксиданта вместе с цитратом натрия в качестве буфера, предпочтительно когда концентрация ацетилцистеина составляла 1,5 мг/мл, а концентрация цитрата натрия составляла 5,0 мг/мл, композиция показывала содержание отдельных примесей 0,2% или менее, и общее содержание примесей 1,0% или менее в течение 4-недельного периода тестирования стабильности в стрессовых условиях, что указывает на то, что композиция обладает превосходной стабильностью (Пример 11).
Тем не менее, в случае, когда раствор композиции содержал только цитрат натрия в качестве буфера, явно наблюдали, что цвет раствора начинал изменяться до интенсивно-желтого после 2 недель в стрессовых условиях (Сравнительные Примеры 9 и 10). Кроме того, в случае, когда композиция содержала L-цистеин или ацетилцистеин в качестве антиоксиданта явно наблюдали, что цвет раствора начинал изменяться до бледно-желтого после 2 недель в стрессовых условиях и что рН значительно снижался в течение 4-недельного периода тестирования в стрессовых условиях (Сравнительные Примеры 11 и 12-14). Иными словами, видно, что комбинированное применение ацетилцистеина и цитрата натрия значительно повышало стабильность в отношении примесей, в отличие от применения только ацетилцистеина или только цитрата натрия.
Кроме того, было показано, что в растворах композиции Сравнительных Примеров 13 и 14, содержащих только L-цистеин, после 2 недель в жестких условиях начинал появляться аномальный запах, подобный запаху тухлого яйца, но в композиции по настоящему изобретению этот аномальный запах не появлялся.

Как видно из результатов в Таблице 11 выше, сравнивали стабильности композиций, содержащих ацетилцистеин в качестве антиоксиданта и различные обычно применяемые буферы, и было обнаружено, что при использовании буферов, отличных от цитрата натрия, на исходной стадии происходило изменение внешнего вида (изменение цвета), либо содержание отдельных примесей возрастало до более 0,2%, а общее содержание примесей возрастало до более 1,0%.
Таким образом, было подтверждено, что только пеметрекседсодержащий инъекционный раствор, содержащий ацетилцистеин в качестве антиоксиданта вместе с цитратом натрия в качестве буфера, показал лучшую стабильность.
Экспериментальный Пример 2: Ускоренный тест на стабильность (40°C/70%, 4-месячная оценка)
Ускоренный тест на стабильность проводили, как описано выше, и результаты этого теста представлены в Таблице 12 ниже.
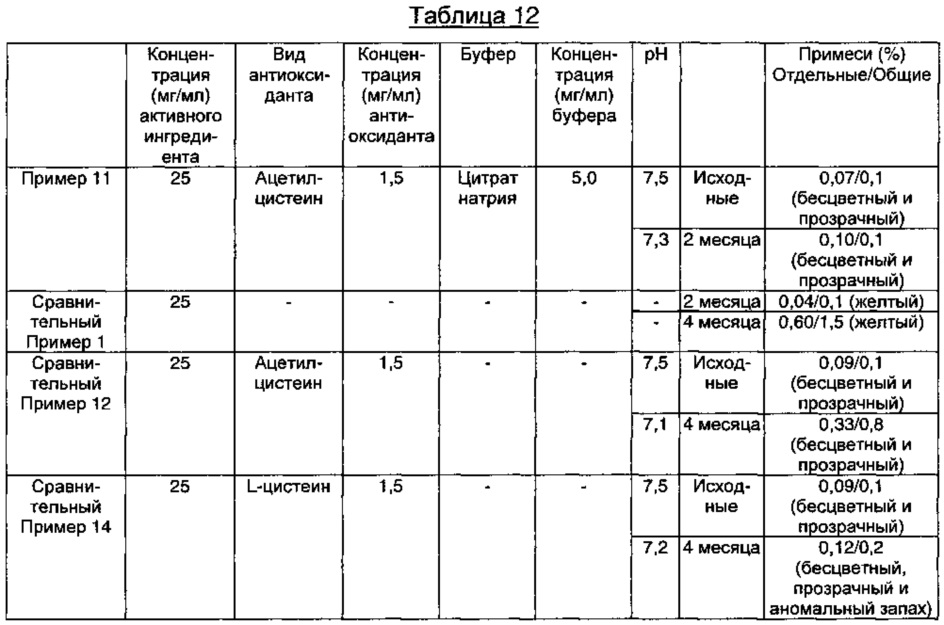
Как видно из результатов в Таблице 12 выше, в композиции Сравнительного Примера 1, который готовили, используя только WFI (воду для инъекций) в качестве носителя без добавления антиоксиданта, внешний вид раствора изменялся до желтого через 2 месяца в ускоренных условиях, и этот раствор показал содержание отдельных примесей 0,2% или более и общее содержание примесей 1% через 4 месяца, что указывает на то, что данная композиция обладает недостаточной стабильностью. В то же время, композиция Примера 11, содержащая ацетилцистеин в качестве антиоксиданта вместе с цитратным буфером в качестве буфера, показала содержание отдельных примесей 0,2% или менее и общее содержание примесей 1,0% или менее в течение 6-месячного периода тестирования в ускоренных условиях, что указывает на то, что данная композиция обладает превосходной стабильностью.
Напротив, было обнаружено, что в композиции, содержащей только ацетилцистеин в качестве антиоксиданта, цвет раствора изменился до желтого после 4 месяцев в ускоренных условиях, а содержание отдельных примесей составляло более 0,2%, что указывает на то, что данная композиция обладает недостаточной стабильностью (Сравнительный Пример 12).
Кроме того, в случае композиции Сравнительного Примера 14, содержащего только L-цистеин, содержание примесей удовлетворяло критериям приемлемости, и появлялся аномальный запах, подобный запаху тухлого яйца, как и в результатах стрессового теста на стабильность. Тем не менее, этот аномальный запах не появлялся в композиции по настоящему изобретению, то есть в композиции Примера 11.