Результат интеллектуальной деятельности: ТВЕРДЫЕ ФОРМЫ (1,1-ДИОКСО-4-ТИОМОРФОЛИНИЛ)-[6-[[3-(4-ФТОРФЕНИЛ)-5-МЕТИЛ-4-ИЗОКСАЗОЛИЛ]МЕТОКСИ]-3-ПИРИДИНИЛ]-МЕТАНОНА
Вид РИД
Изобретение
Настоящее изобретение относится к новым твердым формам соединений формулы (I)
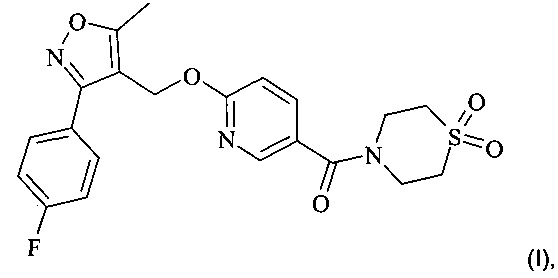
а также их сольватам, комплексам включения с другими подходящими соединениями, сольватам их комплексов включения с другими подходящими соединениями, способам их получения, фармацевтическим композициям, содержащим эти твердые формы, и их применению в качестве лекарств.
Предшествующий уровень техники изобретения
Полиморфизм представляет собой способность соединения кристаллизоваться в виде более чем одного определенного вида кристалла. У разных полиморфных форм (или полиморфов) существуют разные конфигурации или конформации молекул в кристаллической решетке. Если твердое вещество не обладает отличительной кристаллической решеткой и молекулярное расположение молекул беспорядочно, то вещество считается аморфным. Аморфное состояние сходно по структуре с жидким состоянием [W. McCrone, Phys. Chem. Org. Solid State (1965) 2: 725767].
Полиморфные формы лекарственного вещества могут иметь разные химические, физические и физико-технические свойства. Различия могут быть обусловлены, например, упаковкой молекул в кристаллической структуре (плотность, показатель преломления, электропроводность, гигроскопичность), термодинамическими свойствами (температура плавления, теплоемкость, давление пара, растворимость), кинетическими свойствами (скорость растворения, стабильность), свойствами поверхности (поверхностная свободная энергия, поверхностное натяжение, форма, морфология) и механическими свойствами (прессуемость, прочность при растяжении). Эти свойства могут оказывать непосредственное влияние на способ и изготовление активного фармацевтического ингредиента (АФИ) и лекарственного продукта. Кроме того, у полиморфизма есть фармакологические последствия из-за измененных свойств твердого состояния и пригодности к конкретному изготовлению состава. Таким образом, полиморфизм АФИ может влиять на качество, безопасность, эффективность и проявляемость лекарственного продукта, и поэтому обладает первостепенной важностью [D. Giron et al., J. Therm. Anal. Cal. (2004) 77:709].
В дополнение к полиморфным модификациям АФИ может кристаллизоваться в разных солевых формах с соответствующим противоионом. Подобно полиморфизму солевые формы отличаются друг от друга степенью растворимости и многими другими физическими и химическими факторами, как обозначено выше. По сравнению со свободной кислотой или свободным основанием АФИ соответствующая солевая форма может обладать улучшенными растворимостью в воде, скоростью растворения, гигроскопичностью, химической устойчивостью, температурой плавления или механическими свойствами.
Сольваты, также известные как псевдополиморфы, представляют собой кристаллические формы, имеющие либо стехиометрические, либо нестехиометрические количества растворителя, включенного в кристаллическую решетку. Если включенным растворителем является вода, то сольват обычно называют гидратом.
И соли, и комплексы включения представляют собой многокомпонентные системы. Соли образуются в ходе ионных взаимодействий с полным переносом протона между кислотой и основанием, тогда как в комплексах включения молекулы нейтральны в кристаллическом состоянии и связаны главным образом посредством водородных связей или ван-дер-ваальсовых взаимодействий [S.L. Morissette et al., Adv. Drug Del. Rev. (2004) 56: 275-300].
Циклодекстрины состоят из шести, семи или восьми глюкозных остатков, соответственно, и обладают гидрофильными внешними полостями и гидрофобными внутренними полостями [V.J. Stella et al., Adv. Drug Del. Rev. (2007) 59: 677-694]. Эти характеристики ответственны за их растворимость в воде и способность включать гидрофобные молекулярные группировки в их полости. Циклодекстрины можно использовать в качестве веществ, образующих комплекс включения, для комплексов включения с АФИ, в которых АФИ захватывается полостью молекул циклодекстрина. В литературе было опубликовано, что кристаллические структуры комплексов включения циклодекстрина обычно преобладают при пространственном расположении молекул-хозяина. Таким образом, циклодекстрин может образовывать определенную уплотненную конфигурацию, подобную кристаллическому состоянию, при этом АФИ не занимает четко определенные положения в решетке [T. Uyar et al., Cryst. Growth Des. (2006) 6: 1113-1119, T. Toropainen et al., Pharm. Res. (2007) 24: 1058-1066].
Среди имеющихся в продаже циклодекстринов γ-циклодекстрин (γ-ЦД), как сообщают, является устойчивым, и обнаружено, что безопасным для перорального введения [I.C. Munro et al., Regulatory Toxicology and Pharmacology (2004) 39: S3-S13]. Однако γ-циклодекстрины не использовались в продаваемых лекарственных препаратах до настоящего времени. Только недавно монография (12/2008) была включена в Европейскую фармакопею. Образование комплексов включения с циклодекстринами не предсказывали, и существует потребность всестороннего экспериментального исследования. В тех случаях, когда образуются комплексы включения с γ-циклодекстрином, самые активные фармацевтические ингредиенты образуют комплекс 2:1 (соотношение между веществом, образующим комплекс включения, и АФИ). Образование комплексов включения циклодекстрина и их стехиометрии гость к хозяину сильно зависят от молекулярных структур и геометрических размеров молекул гостя [T. Uyar et al., Cryst. Growth Des. (2006) 6: 1113-1119].
Соединение формулы (I), его изготовление, его фармакологическая активность в качестве обратных агонистов ГАМК A α5 рецептора и его применение для лечения, предотвращения и/или замедления развития разных состояний центральной нервной системы (ЦНС) описано в WO 2009/071476. Исходя из своих физико-химических свойств, соединение формулы (I), как описано в WO 2009/071476, представляет собой соединение BCS 2, проявляющее низкую растворимость в воде и высокую проницаемость в соответствии с биофармацевтической системой классификации [G.L Amidon, H. Lennernas, V.P. Shah, J.R. Crison, Pharm. Res. (1995) 12: 413-420]. Следовательно, ограниченная биодоступность при пероральном введении является основной проблемой разработки пероральных препаратов.
Если безводные твердые формы соединения формулы (I), как описано в WO 2009/071476, выбирают для клинического исследования, то возможна физическая неустойчивость с точки зрения образования гидрата в ходе фармацевтического способа и/или хранения лекарственного продукта. Кроме того, обнаружено, что безводная твердая форма A соединения формулы (I), как описано в WO 2009/071476 и в этом документе, является, тем не менее, метастабильной и, следовательно, может превращаться в разные твердые формы. Следовательно, существует потребность в обнаружении новых твердых форм, которые обладают расширенными физико-химическими свойствами и улучшенной биодоступностью.
Кроме того, открытие новых твердых форм АФИ (полиморфов, сольватов, солей, комплексов включения) увеличивает состав веществ, которыми располагает разработчик для создания фармацевтической лекарственной формы вещества с заданным профилем высвобождения или другими требуемыми характеристиками. Поэтому существует потребность в обнаружении большего количества твердых форм соединения формулы (I).
Неожиданно было обнаружено, что при определенных условиях можно получить новые твердые формы, особенно кристаллические или аморфные формы, в особенности кристаллические формы, соединения формулы (I), которые описаны далее, которые обладают преимущественными пользой и свойствами. Они проявляют по существу разные и превосходные физические и физико-химические свойства, которые могут быть полезны в разных аспектах, относящихся к разработке АФИ и лекарственного продукта, например для растворения АФИ, устойчивости и срока годности АФИ и лекарственного продукта, и/или упрощенным способам изготовления или очистки. Согласно настоящему изобретению предложены новые твердые формы соединения формулы (I) с улучшенными растворимостью, скоростью растворения, биодоступностью при пероральном введении, а также повышенной устойчивостью АФИ.
Кроме того, согласно настоящему изобретению предложены новые комплексы включения соединений формулы (I) с циклодекстринами. Подобные комплексы включения дополнительно отличаются улучшенными скоростью растворения и биодоступностью.
Новые твердые формы, как описано в этом документе, различаются при порошковой рентгеновской дифракции, структурном анализе кристаллов, вибрационной спектроскопии, магнитном резонансе и масс-спектроскопии, калориметрии, термогравиметрии, динамической сорбции паров, а также под микроскопом.
Если не указано иное, то все технические и научные термины, используемые в этом описании, имеют такие же значения, какие обычно понимает под ними один из специалистов в области техники, к которой данное изобретение относится. Несмотря на то, что способы и вещества, подобные или эквивалентные тем, что описаны в этом документе, можно использовать на практике или при проверке изобретения, ниже описаны подходящие способы и вещества.
Все публикации, заявки на патенты, патенты и другие ссылочные материалы, упомянутые в этом документе, включены сюда полностью путем ссылки на них.
Номенклатура, используемая в этой Заявке, основывается на систематической номенклатуре ИЮПАК, если не указано иное.
Любая открытая валентность, встречающаяся на атоме углерода, кислорода, серы или азота в структурах в этом документе, указывает на присутствие водорода, если не указано иное.
Термин "возможный" или "возможно" означает, что в дальнейшем описанное событие или обстоятельство может иметь место, но не требуется, и что описание включает случаи, когда событие или обстоятельство происходит, и случаи, при которых оно не происходит.
Термин "заместитель" означает атом или группу атомов, замещающую атом водорода в исходной молекуле.
Термин "замещенный" означает, что определенная группа несет один или более заместителей. Когда группа может нести многочисленные заместители, и предложен ряд возможных заместителей, тогда заместители независимо выбраны и не обязательно они будут одинаковыми. Термин "незамещенный" означает, что определенная группа не несет заместителей. Термин "возможно замещенный" означает, что определенная группа не замещена или замещена одним или более заместителями, независимо выбранными из группы возможных заместителей. При указании числа заместителей термин "один или более" означает от одного заместителя до максимально возможного числа заместителей, т.е. замену одного водорода до замены всех водородов заместителями.
Термин "галоген" означает фтор, хлор, бром или йод. Особым галогеном является фтор.
Термин "алкил" означает одновалентную линейную или разветвленную насыщенную углеводородную группу от 1 до 12 атомов углерода. В особых воплощениях алкил имеет от 1 до 7 атомов углерода, и в более конкретных воплощениях от 1 до 4 атомов углерода. Примеры алкила включают метил, этил, пропил, изопропил, н-бутил, изобутил, втор-бутил или трет-бутил. Особым алкилом является метил.
Термин "алкокси" означает группу формулы -O-Rʹ, где Rʹ представляет собой алкильную группу. Примеры алкокси группировок включают метокси, этокси, изопропокси и трет-бутокси.
Термин "галоалкил" означает алкильную группу, где по меньшей мере один из атомов водорода алкильной группы замещен одинаковыми или разными атомами галогена, особенно атомами фтора. Примеры галоалкила включают монофтор-, дифтор- или трифтор-метил, -этил или -пропил, например 3,3,3-трифторпропил, 2-фторэтил, 2,2,2-трифторэтил, фторметил или трифторметил. Термин "пергалоалкил" обозначает алкильную группу, где все атомы водорода алкильной группы замещены одинаковыми или разными атомами галогена.
Термин "гидроксиалкил" обозначает алкильную группу, где по меньшей мере один из атомов водорода алкильной группы замещен гидрокси-группой. Примеры гидроксиалкила включают гидроксиметил, 2-гидроксиэтил, 2-гидроксипропил, 3-гидроксипропил, 1-(гидроксиметил)-2-метилпропил, 2-гидроксибутил, 3-гидроксибутил, 4-гидроксибутил, 2,3-дигидроксипропил, 2-гидрокси-1-гидроксиметилэтил, 2,3-дигидроксибутил, 3,4-дигидроксибутил или 2-(гидроксиметил)-3-гидроксипропил.
Термин "гетероциклоалкил" означает одновалентную насыщенную или частично ненасыщенную моно- или бициклическую кольцевую систему от 3 до 9 кольцевых атомов, включающую 1, 2 или 3 кольцевых гетероатома, выбранных из N, O и S, остальные кольцевые атомы представляют собой углерод. В особых воплощениях гетероциклоалкил представляет собой одновалентную насыщенную моноциклическую кольцевую систему от 4 до 7 кольцевых атомов, включающую 1, 2 или 3 кольцевых гетероатома, выбранных из N, O и S, остальные кольцевые атомы представляют собой углерод. Примерами моноциклического насыщенного гетероциклоалкила являются азиридинил, оксиранил, азетидинил, оксетанил, пирролидинил, тетрагидрофуранил, тетрагидротиенил, пиразолидинил, имидазолидинил, оксазолидинил, изоксазолидинил, тиазолидинил, пиперидинил, тетрагидропиранил, тетрагидротиопиранил, пиперазинил, морфолинил, тиоморфолинил, 1,1-диоксо-тиоморфолин-4-ил, азепанил, диазепанил, гомопиперазинил или оксазепанил. Примерами бициклического насыщенного гетероциклоалкила являются 8-аза-бицикпо[3.2.1]октил, хинуклидинил, 8-окса-3-аза-бицикло[3.2.1]октил, 9-аза-бицикло[3.3.1]нонил, 3-окса-9-аза-бицикло[3.3.1]нонил или 3-тиа-9-аза-бицикло[3.3.1]нонил. Примерами частично ненасыщенного гетероциклоалкила являются дигидрофурил, имидазолинил, дигидро-оксазолил, тетрагидро-пиридинил или дигидропиранил. Особым гетероциклоалкилом является (1,1-диоксо-1λ6-тиоморфолин-4-ил).
Термин "ароматический" обозначает традиционное представление об ароматичности, как определено в литературе, в частности в ИЮПАК - Compendium of Chemical Terminology, 2nd, A.D. McNaught & A. Wilkinson (Eds). Blackwell Scientific Publications, Oxford (1997).
Термин "арил" означает одновалентную ароматическую карбоциклическую моно- или бициклическую кольцевую систему, включающую от 6 до 10 кольцевых атомов углерода. Примеры арильных группировок включают фенил и нафтил. Особым арилом является фенил.
Термин "гетероарил" означает одновалентную ароматическую гетероциклическую моно- или бициклическую кольцевую систему от 5 до 12 кольцевых атомов, включающую 1, 2, 3 или 4 гетероатома, выбранных из N, O и S, остальные кольцевые атомы представляют собой углерод. Примеры гетероарильных группировок включают пирролил, фуранил, тиенил, имидазолил, оксазолил, тиазолил, триазолил, оксадиазолил, тиадиазолил, тетразолил, пиридинил, пиразинил, пиразолил, пиридазинил, пиримидинил, триазинил, азепинил, диазепинил, изоксазолил, бензофуранил, изотиазолил, бензотиенил, индолил, изоиндолил, изобензофуранил, бензимидазолил, бензоксазолил, бензизоксазолил, бензотиазолил, бензизотиазолил, бензоксадиазолил, бензотиадиазолил, бензотриазолил, пуринил, хинолинил, изохинолинил, хиназолинил или хиноксалинил.
Термин "активный фармацевтический ингредиент" (или "АФИ") означает соединение в фармацевтической композиции, которое обладает особой биологической активностью.
Термин "фармацевтически приемлемый" означает свойство вещества, которое полезно при получении фармацевтической композиции, которая в целом безопасна, нетоксична и не биологически, не иным образом нежелательна и приемлема для использования в ветеринарии, а также фармацевтического использования человеком.
Термины "фармацевтически приемлемый эксципиент" и "терапевтически инертный эксципиент" можно использовать взаимозаменяемо и они обозначают любой фармацевтически приемлемый ингредиент в фармацевтической композиции, не обладающий терапевтической активностью и не являющийся токсичным к объекту, которому вводиться, такой как разрыхлители, связующие вещества, наполнители, растворители, буферы, регулирующие тоничность вещества, стабилизаторы, антиоксиданты, поверхностно-активные вещества, носители, разбавители или скользящие вещества, используемые при изготовлении фармацевтических продуктов.
Термин "фармацевтическая композиция" означает смесь или раствор, включающий терапевтически эффективное количество активного фармацевтического ингредиента вместе с фармацевтически приемлемыми эксципиентами, который вводиться млекопитающему, например, человеку, нуждающемуся в этом.
Термин "твердая форма" или "форма" является общим термином для обозначения кристаллической формы и/или аморфной формы твердого вещества.
Термины "кристаллическая форма" и "форма кристалла" можно использовать взаимозаменяемо для обозначения полиморфов и псевдополиморфов кристаллического твердого вещества.
Термины "полиморф" и "модификация" можно использовать синонимично для обозначения каждой отдельной кристаллической структуры, в которой соединение может кристаллизоваться. Разные полиморфы имеют разные конфигурации или конформации молекул в кристаллической решетке, но все относятся к одной и той же элементарной композиции.
Термин "полиморфизм" означает способность соединения образовывать более одного полиморфа.
Термин "энантиотропия" обозначает отношение между двух или более полиморфов одного и того же вещества, в котором порядок ранжирования термодинамических устойчивостей полиморфов изменяется обратимо при определенной температуре.
Термин "монотропия" обозначает отношение между двух или более кристаллических форм одного и того же вещества, в котором порядок ранжирования термодинамических устойчивостей полиморфов сохраняется при всех температурах ниже температуры плавления. "Метастабильная" форма является кристаллической формой, которая не имеет наивысшего порядка ранжирования термодинамической устойчивости.
Термины "сольват" и "псевдополиморф" можно использовать синонимично для обозначения кристалла, имеющего либо стехиометрические, либо нестехиометрические количества растворителя, включенного в кристаллическую решетку. Если включенным растворителем является вода, то образующийся сольват представляет собой "гидрат". Когда включенным растворителем является спирт, то образующийся сольват представляет собой "алкоголят".
Термин "соль" означает вещество, которое состоит из двух компонентов, кислоты и основания с четко определенным стехиометрическим соотношением двух составителей соли. Кристаллы соли образуются в ходе ионных взаимодействий с полным переносом ионов водорода между кислотой и основанием.
Термин "форма кристалла" означает основное тело элемента(ов) (многогранника(ов)), из которого монокристалл состоит. Форму кристалла описывают с помощью индексов Миллера для плоскостей решетки многогранника(ов).
Термин "кристаллическая структура" означает морфологию кристалла и, следовательно, внешний вид твердой формы. Варианты кристаллической структуры объясняются разными темпами роста плоскостей решетки. Различают следующие структуры [USP, General Chapter <776> (Optical Microscopy)], изображенные на ФИГ. 23:
a) Изометрические кристаллы являются равноразмерными (подобно кубам или сферам);
b) Пластины представляют собой плоские кристаллы в форме таблички и имеют одинаковую ширину и длину; толще чем чешуйки;
c) Чешуйки представляют собой тонкие, плоские кристаллы, которые имеют одинаковую ширину и длину; тоньше чем пластины;
d) Стебли (рейки) являются вытянутыми, тонкими кристаллами, имеющими форму лопасти;
e) Иглы представляют собой остроконечные, тонкие и сильно вытянутые кристаллы, имеющие одинаковую длину и ширину;
f) Колонки представляют собой вытянутые, призматические кристаллы с большей длиной и толщиной, чем иглы.
Термин "эквивалентный сферический диаметр" (или ЭСД) несферического объекта, например частицы неправильной формы, является диаметром сферы эквивалентного объема.
Термины "значение d50" и "среднемассовый диаметр" (или СМД) можно использовать взаимозаменяемо, и они обозначают средний размер частиц по массе, т.е. средний эквивалентный диаметр частицы, который определяют как диаметр, когда 50% (масс) частиц ансамбля имеют больший эквивалентный сферический диаметр, и другие 50% (масс) имеют меньший эквивалентный сферический диаметр.
Термин "аморфная форма" означает твердое вещество, которое не обладает отличительной кристаллической решеткой и в молекулярной конфигурации молекул отсутствует дальний порядок. В частности, аморфный обозначает вещество, которое не показывает острый пик дифракции Брэгга. Закон Брэгга описывает дифракцию кристаллического вещества с помощью уравнения "2d⋅sin(тета)=n⋅лямбда", где "d" обозначает вертикальное расстояние (в ангстремах) между парами соседних плоскостей в кристалле ("межатомное расстояние в ангстремах"), "тета" обозначает угол Брэгга, "лямбда" обозначает длину волны, и "n" является целым числом. Когда закон Брэгга выполняется, отраженные лучи находятся в фазе и испытывают конструктивную интерференцию таким образом, что наблюдаются пики дифракции Брэгга на дифракционной рентгенограмме. При углах наклона, отличных от угла Брэгга, отраженные лучи не совпадают, и происходит деструктивная интерференция или гашение. Для аморфного вещества закон Брэгга не выполняется, и не наблюдаются острые пики дифракции Брэгга на дифракционной рентгенограмме. Кроме того, диаграмма XRPD аморфного вещества характеризуется одним или более чем одним аморфным ореолом.
Термин "комплекс включения" означает стехиометрический многокомпонентный комплекс. В отличие от солей в комплексах включения предполагается отсутствие или только частичный перенос протона. Комплекс включения может представлять собой аморфную форму или кристаллическую форму. Особенно комплекс включения представляет собой кристаллическую форму. Вещества, образующие комплекс включения, являются твердыми при комнатной температуре. Особым веществом, образующим комплекс включения, является циклодекстрин, в особенности γ-циклодекстрин (γ-ЦД). Особенно вещество, образующее комплекс включения, находится в кристаллическом состоянии в комплексе включения. Особенно комплекс включения представляет собой стехиометрический 1:1 или 2:1 комплекс включения (соотношение между веществом, образующим комплекс включения, и АФИ). В особенности комплекс включения представляет собой стехиометрический 1:1 комплекс включения (соотношение между веществом, образующим комплекс включения, и АФИ). Комплексы включения могут образовывать сольваты, гидраты и могут существовать в виде разных полиморфных форм.
Термин "Форма A", как используется в этом документе, означает кристаллическую безводную полиморфную форму A (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанона.
Термин "Форма B", как используется в этом документе, означает кристаллическую полиморфную форму B (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанона моногидрата.
Термин "Форма C", как используется в этом документе, означает кристаллическую безводную полиморфную форму C (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанона.
Термин "Форма D", как используется в этом документе, означает кристаллическую полиморфную форму D (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанона трифторэтанола моносольвата.
Термин "Форма E", как используется в этом документе, означает безводную кристаллическую полиморфную форму E (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанона.
Термин "Аморфная форма", как используется в этом документе, означает аморфную форму (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанона.
Термин "γ-ЦД комплекс включения", как используется в этом документе, означает кристаллический 1:1 комплекс включения (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанона с γ-циклодекстрином.
Термин "XRPD" означает аналитический способ порошковой рентгеновской дифракции. Диаграммы XRPD регистрировали при условиях окружающей среды при геометрии пропускания с помощью дифрактометра STOE STADI P (источник Си К альфа-излучения, первичный монохроматор, детектор, определяющий изменение положения, угловой диапазон от 3° до 42° 2Тета, общее время измерения приблизительно 60 минут). Воспроизводимость угловых значений находится в диапазоне 2Тета ± 0,2°. Термин "приблизительно", приводимый в сочетании с угловым значением, означает воспроизводимость, которая находится в диапазоне 2Тета ± 0,2°. Образцы получали и анализировали без дополнительной обработки (например измельчения или просеивания) вещества. Относительная интенсивность пика XRPD зависит от многих факторов, таких как структурный фактор, температурный фактор, степень кристаллизации, поляризационный фактор, мультиплетность и фактор Лоренца. Относительные интенсивности могут существенно различаться от одного измерения к другому вследствие предпочтительных эффектов ориентации.
Контрольные XRPD анализы влажности проводили при геометрии отражения с помощью дифрактометра Siemens D5000 (источник излучения Cu, Ni K бета фильтр, сцинтилляционный детектор, угловой диапазон от 3° до 42° 2Тета, общее время измерения на уровень влажности приблизительно 180 минут). Дифрактометр оборудован камерой влажности MRI (Materials Research Instruments). Влажность в камере устанавливали с помощью регулятора влажности ANSYCO (SYCOS Н-НОТ).
Для структурного анализа монокристалла монокристаллический образец помещали в нейлоновую петлю на гониометре и измеряли при условиях окружающей среды. Альтернативно кристалл охлаждали в потоке азота в ходе измерения. Данные регистрировали на дифрактометре GEMINI R Ultra от Oxford Diffraction. Для регистрации данных использовали Cu-излучение 1,54 A длины волны. Данные обрабатывали с помощью программного обеспечения Oxford Diffraction CRYSALIS. Устанавливали кристаллическую структуру и обрабатывали с помощью стандартного кристаллографического программного обеспечения. В этом случае использовали программу ShelXTL от Bruker AXS (Карлсруэ).
Аббревиатура "ПШПВ" означает полную ширину на половине высоты, что является шириной пика (например наблюдаемого в спектре, особенно на диаграмме XRPD) на его полувысоте.
Термин "острый пик дифракции Брэгга" применительно к дифракционным рентгенограммам означает пик, который наблюдается, если выполняется закон дифракции Брэгга. Как правило, ПШПВ острого пика дифракции Брэгга составляет менее 0,5° 2-тета.
Термин "аморфный ореол" применительно к дифракционным рентгенограммам означает приблизительно колоколообразный дифракционный максимум на порошковой дифракционной рентгенограмме аморфного вещества. ПШПВ аморфного ореола принципиально больше, чем ПШПВ пика кристаллического вещества.
Термины "ФПИК" и "ИК" обозначают аналитический способ инфракрасной спектроскопии. ИК-спектры образцов регистрируют в виде пленки суспензии Nujol, состоящей из прибл. 5 мг образца и прибл. 5 мг Nujol (вазелинового масла), между двумя пластинками из хлорида натрия (поперечное сечение 13 мм) при пропускании с помощью ФПИК-спектрометра. Спектры регистрировали в спектральном диапазоне между 4000 см-1 и 600 см-1, разрешение 2 см-1, и 300 наложенных снимков на Magna 860 (thermo/Nicolet), оборудованного детектором ДТГС.
Термин "КР" означает аналитический способ спектроскопии комбинационного рассеяния. Для регистрации спектров КР образцы наносили на предметное стекло. Спектры КР регистрировали в диапазоне 150-3800 см-1 с помощью микроскопа КР ARAMIS (HoribaJobinYvon), оборудованного ПЗС-детектором с охлаждающим элементом Пельтье, при возбуждении 633 нм, 1200 л/мм решеткой, х50 объективом и с 3 облучениями 3s или 7s для слабых рассеивающих элементов КР.
Термин "ДСК" означает аналитический способ дифференциальной сканирующей калориметрии. Термограммы ДСК регистрировали, используя дифференциальный сканирующий калориметр Mettler-Toledo™ DSC820, DSC821 или DSC1 с датчиком FRS05. Тесты на пригодность системы осуществляли с индием в качестве вещества сравнения, и калибровки проводили, используя индий, бензойную кислоту, бифенил и цинк качестве веществ сравнения.
Для измерений приблизительно 2-6 мг образца помещали в алюминиевые тигли, точно взвешенные и герметично закрытые с помощью перфорированных крышек. Перед измерением крышки автоматически прокалывали, получая в результате прибл. 1,5 мм отверстия. Затем образцы нагревали в потоке азота около 100 мл/мин, используя скорости нагрева обычно 10 К/мин.
Для измерений аморфных форм приблизительно 2-6 мг образца помещали в алюминиевые тигли, точно взвешенные и герметично закрытые. Затем образцы нагревали в потоке азота около 100 мл/мин, используя скорости нагрева 10 К/мин.
Термин "начало" означает точку пересечения основной линии перед переходом и прямой многократного отражения.
Термин "температура стеклования" (Тс) означает температуру, выше которой стеклообразное аморфное твердое вещество становиться эластичным.
Термин "ТГА" означает аналитический способ термогравиметрического анализа. ТГА анализ проводили на термогравиметрическом анализаторе Mettler-Toledo™ (TGA850 или TGA851). Тесты на пригодность системы осуществляли с Hydranal в качестве вещества сравнения, и калибровки проводили, используя алюминий и индий в качестве веществ сравнения.
Для термогравиметрических анализов прибл. 5-10 мг образца помещали в алюминиевые тигли, точно взвешенные и герметично закрытые с помощью перфорированных крышек. Перед измерением крышки автоматически прокалывали, получая в результате прибл. 1,5 мм отверстия. Затем образцы нагревали в потоке азота около 50 мл/мин, используя скорость нагрева 5 K/мин.
Термин "микронизация" означает способ, когда размер частиц твердого вещества уменьшают до значения d50 менее чем 10 мкм при помощи подходящего способа, такого как дробление, разбивание или растирание.
Термин "фильтрация тонкой очистки" означает способ фильтрации, когда раствор фильтруют, используя 0,2 мкм фильтр, особенно 0,2 мкм фильтрующий картридж Pall N66 Posidyne®, чтобы удалить тонкодисперсные частицы.
Термин "замена растворителя в ходе перегонки" означает термическую перегонку при пониженном или нормальном давлении, когда одну жидкость (растворитель или антирастворитель) заменяют другой жидкостью (растворителем или антирастворителем), обычно при постоянном уровне жидкости в реакционном сосуде.
Термин "растворитель" означает любой вид жидкости, в которой продукт по меньшей мере частично растворим (растворимость продукта >1 г/л).
Термин "антирастворитель" означает любой вид жидкости, в которой продукт нерастворим или при максимуме умеренно растворим (растворимость продукта <0,01 моль/л).
Термин "кристаллизация в антирастворителе" означает способ, когда перенасыщение и как результат этого кристаллизация достигаются при добавлении антирастворителя к раствору продукта.
Термин "условия окружающей среды" обозначает условия, какие опытным путем установлены в метрологической лаборатории, например атмосферное давление, воздух, температура окружающей среды между 18°C и 28°C, влажность между 30% rH и 80% rH.
Термин "гигроскопичность" описывает способность твердого вещества поглощать влагу. Гигроскопичность некоторого АФИ характеризуется [European Pharmacopoeia - 6th Edition (2008), Chapter 5.11) увеличением массы, когда относительная влажность увеличивается от 0% rH до 90% rH:
- негигроскопичный: увеличение массы Δm<0,2%;
- слегка гигроскопичный: увеличение массы 0,2%≤Δm<2,0%;
- гигроскопичный: увеличение массы 2,0%≤Δm<15,0%;
- сильно гигроскопичный: увеличение массы Δm≥15,0%;
- растворяющийся: поглощается достаточно воды с образованием жидкости.
Согласно лямбда-обозначению ИЮПАК (W.H. Powell, Pure & Appl. Chem. (1984) 56 (6): 769-778) предложен общий способ для указания нестандартных валентных состояний гетероатомов в молекуле. Число связей "п" гетероатома является суммой общего числа валентных связей со смежными атомами, при наличии, и числа присоединенных атомов водорода. Число связей гетероатома является стандартным, когда оно имеет значение, приведенное в следующей таблице:
n=4: С, Si, Ge, Sn, Pb;
n=3: B, Ν, P, As, Sb, Bi;
n=2: O, S, Se, Te, Po;
n=1: F, Cl, Br, I, At.
Нестандартное число связей (нейтрального) гетероатома указывают символом "λn", где "n" является числом связей. Если используют локант, число, указывающее положение внутри молекулы, для гетероатома с нестандартным числом связей, то символ λn приводится сразу после этого локанта.
Термины (1,1-диоксо-1λ6-тиоморфолин-4-ил)-, (1,1-диоксо-1λ6-тиоморфолин-4-ил)-, (1,1-диоксо-1λ6-тиоморфолин-4-ил)- и (1,1-диоксо-тиоморфолин-4-ил)-используются в этом документе взаимозаменяемо для обозначения тиоморфолинил-радикала, где кольцевой атом серы замещен двумя оксо группами структуры, как указано ниже:
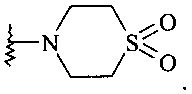
Подробное описание изобретения
Подробно настоящее изобретение относится к новым твердым формам, особенно кристаллическим или аморфным формам, в особенности к кристаллическим формам, соединений формулы (I)
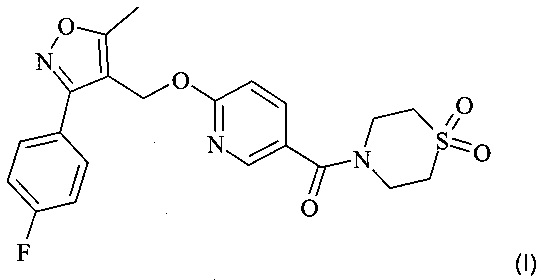
или их сольвата; или их комплекса включения с одним или более чем одним агентом, образующим комплекс включения; или сольвата их комплекса включения с одним или более чем одним агентом, образующим комплекс включения.
(1,1-Диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанон [CAS No. 1159600-41-5] относится к соединению формулы (I) и наоборот.
В особом воплощении изобретение относится к твердым формам соединений формулы (I), как описано выше, отличающимся диаграммой XRPD, включающей по меньшей мере один пик XRPD в диапазоне углов дифракции 2Тета от 10,3° до 13,3°.
В особом воплощении изобретение относится к твердым формам соединения формулы (I), как описано выше; или его сольвата; или его комплекса включения с одним или более чем одним агентом, образующим комплекс включения; или сольвата его комплекса включения с одним или более чем одним агентом, образующим комплекс включения; отличающимся диаграммой XRPD, включающей по меньшей мере один пик XRPD в диапазоне углов дифракции 2Тета от 10,3° до 13,3°.
В особом воплощении изобретения твердая форма соединения формулы (I), как описано выше, является кристаллической формой.
В особом воплощении изобретения твердая форма соединения формулы (I), как описано выше, входит в состав определенной твердой формы с чистотой по меньшей мере 90% (масс/масс), особенно по меньшей мере 95% (масс/масс), в особенности по меньшей мере 99% (масс/масс).
(1,1-Диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанон в безводной полиморфной форме A (Форма A) описан в WO 2009/071476.
Установлено, что Форма A представляет собой метастабильный полиморф с температурой плавления прибл. 145°C (экстрапол. пик ДСК). Из-за своего метастабильного характера Форма A не подходит оптимально для разработки лекарственного продукта.
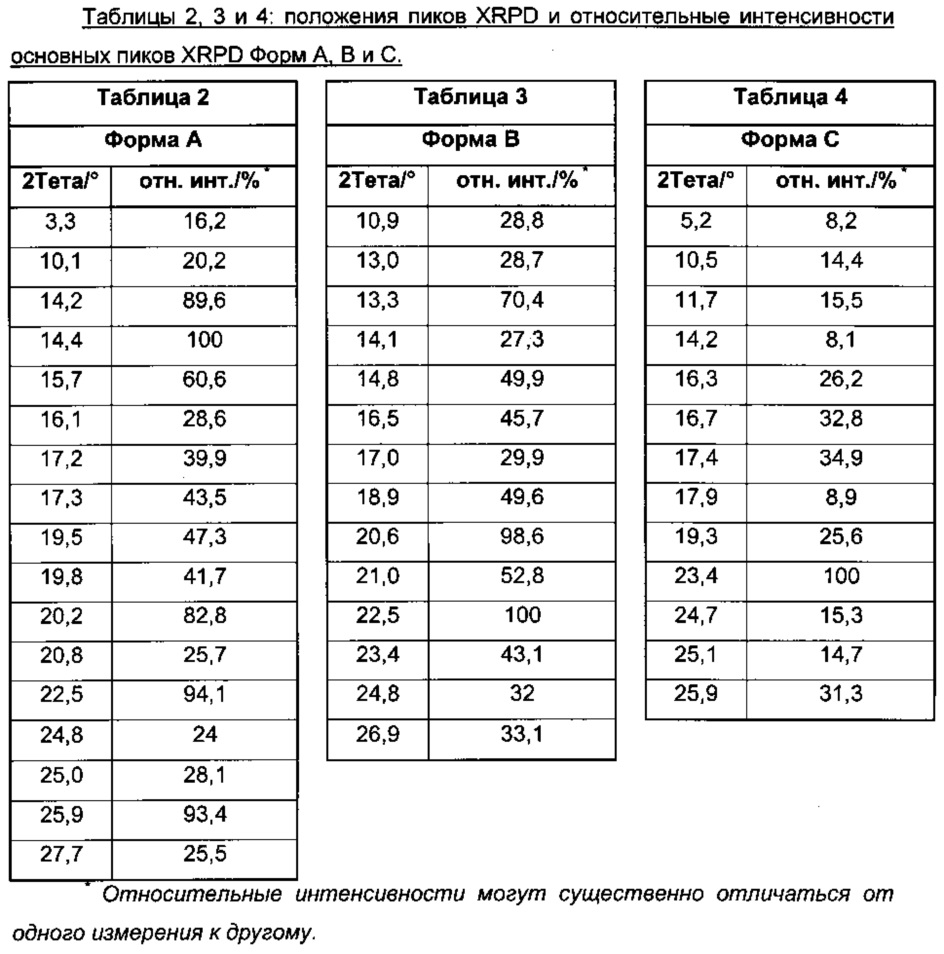
Форма A характеризуется пиками XRPD при углах дифракции 2Тета 3,3°, 10,1°, 14,2°, 14,4°, 15,7°, 16,1°, 17,2°, 17,3°, 19,5°, 19,8°, 20,2°, 20,8°, 22,5°, 24,8°, 25,0°, 25,9°, 27,7°; особенно пиками XRPD, наблюдаемыми при угле дифракции 2Тета 14,4°, 20,2°, 22,5°, 25,9°.
Форма A характеризуется дифракционной диаграммой XRPD на фигуре 1.
Форма A характеризуется дифракционной диаграммой XRPD, включающей пики XRPD при положениях пиков, как указано в Таблице 2.
Форма A характеризуется спектром ФПИК на фигуре 8.
Форма A характеризуется спектром КР на фигуре 14.
Форма A характеризуется температурой плавления с температурой начала разложения (ДСК) в диапазоне приблизительно от 141°C до 145°C.
Установлено, что (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанон можно выделить в зависимости от способа получения в других разных кристаллических и аморфных модификациях, которые различаются своими рентгеновскими порошковыми дифракционными диаграммами, вибрационными спектрами и своими параметрами плавления, и которые проявляют удивительные, но существенные преимущества полезные для разработки и введения АФИ и лекарственного продукта по сравнению с ранее описанной Формой A.
Кроме прежде описанной Формы A (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанона две дополнительные полиморфные безводные формы (Форма C и Форма E), одна форма моногидрата (Форма B), трифторэтанольная форма (Форма D), а также аморфная форма открыты и охарактеризованы.
Форма B (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанона представляет собой гигроскопичный моногидрат, который превращается в Форму A при нагревании до >100°C. Устойчивость Формы B существенно увеличена по сравнению с Формой A в присутствии влажности, например при условиях окружающей среды.
Температурные контрольные анализы XRPD Формы B показывают фазовый переход в Форму A при повышенной температуре. В температурном диапазоне 105-135°C присутствует только Форма A. В температурном диапазоне 65-95°C наблюдается промежуточное состояние, которое характеризуется значительными изменениями в положениях пиков.
Одно особое воплощение изобретения относится к кристаллическому (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанона моногидрату в полиморфной форме B (Форма B), как описано в этом документе.
В особом воплощении изобретения Форма В характеризуется дифракционной диаграммой XRPD, включающей пики XRPD при углах дифракции 2Тета приблизительно 13,3°, 20,6°, 22,5°.
В особом воплощении изобретения Форма B характеризуется дифракционной диаграммой XRPD, включающей пики XRPD при углах дифракции 2Тета приблизительно 10,9°, 13,0°, 13,3°, 14,1°, 14,8°, 16,5°, 17,0°, 18,9°, 20,6°, 21,0°, 22,5°, 23,4°, 24,8°, 26,9°.
В особом воплощении изобретения Форма В характеризуется дифракционной диаграммой XRPD на фигуре 2.
В особом воплощении изобретения Форма В характеризуется дифракционной диаграммой XRPD, включающей пики XRPD при положениях пиков, как указано в Таблице 3.
В особом воплощении изобретения Форма B характеризуется спектром ФПИК на фигуре 9.
В особом воплощении изобретения Форма B характеризуется спектром КР на фигуре 15.
В особом воплощении изобретения Форма B характеризуется широким эндотермическим сигналом от 90°C до 110°C с последующей потерей массы (измеренной с помощью ТГА).
Установлено, что Форма С (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанона более устойчива, чем Форма A. В действительности обнаружено, что Форма C является самым устойчивым полиморфом из всех. Кроме того, Форма C менее гигроскопична, чем Форма A, и имеет температуру плавления прибл. 151°C (экстрапол. пик ДСК). Растворимость в искусственном желудочном соке (SGF от simulated gastric fluid) Формы C существенно улучшена по сравнению с Формой В. В присутствии воды Форма C превращается в Форму В во взвешенном состоянии, тогда как хранение при 100% rH при температуре окружающей среды в течение длительного времени, например в течение 30 дней не вызывает этого фазового перехода.
Температурные контрольные анализы XRPD полиморфов Формы A и Формы C не показывают изменения твердой формы при повышенной температуре.
Одно особое воплощение изобретения относится к кристаллическому (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанону в безводной полиморфной форме C (Форма C), как описано в этом документе.
В особом воплощении изобретения Форма C характеризуется дифракционной диаграммой XRPD, включающей пики XRPD при углах дифракции 2Тета приблизительно 17,4°, 23,4°.
В особом воплощении изобретения Форма С характеризуется дифракционной диаграммой XRPD, включающей пики XRPD при углах дифракции 2Тета приблизительно 11,7°, 17,4°, 23,4°.
В особом воплощении изобретения Форма C характеризуется дифракционной диаграммой XRPD, включающей пики XRPD при углах дифракции 2Тета приблизительно 10,5°, 11,7°, 14,2°, 16,3°, 16,7°, 17,4°, 17,9°, 19,3°, 23,4°, 24,7°, 25,1°, 25,9°.
В особом воплощении изобретения Форма С характеризуется дифракционной диаграммой XRPD на фигуре 3.
В особом воплощении изобретения Форма С характеризуется дифракционной диаграммой XRPD, включающей пики XRPD при положениях пиков, как указано в Таблице 4.
В особом воплощении изобретения Форма С характеризуется спектром ФПИК на фигуре 10.
В особом воплощении изобретения Форма С характеризуется спектром КР на фигуре 16.
В особом воплощении изобретения Форма С характеризуется температурой плавления с температурой начала разложения (ДСК) в диапазоне приблизительно от 146°c до 150°C.
Форма D (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанона представляет собой моносольват трифторэтанола, который может быть получен в ходе кристаллизации из смесей трифторэтанола/метанола. Форма D обладает преимуществом над Формой A в том, что ее легко получить в случае использования трифторэтанола в технологическом процессе.
Одно особое воплощение изобретения относится к кристаллическому (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанона трифторэтанола моносольвату в полиморфной форме D (Форма D). как описано в этом документе. Форма D имеет температуру плавления прибл. 97,9°C (экстрапол. пик ДСК).
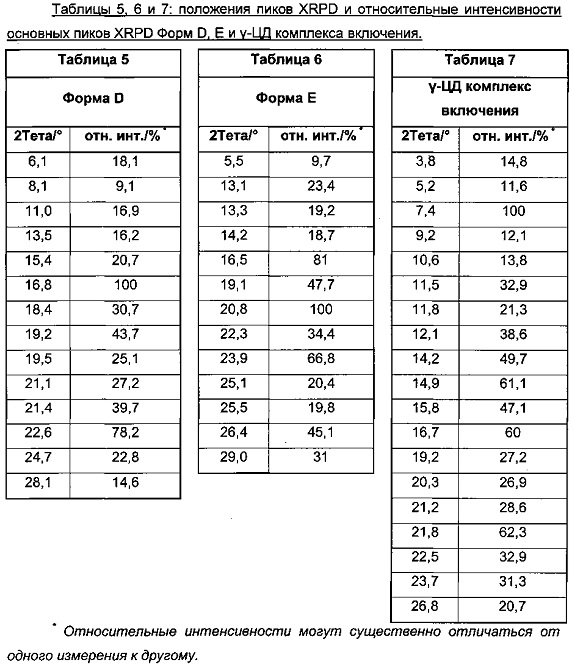
В особом воплощении изобретения Форма D характеризуется дифракционной диаграммой XRPD, включающей пики XRPD при углах дифракции 2Тета приблизительно 6,1°, 16,8°, 22,6°.
В особом воплощении изобретения Форма D характеризуется дифракционной диаграммой XRPD, включающей пики XRPD при углах дифракции 2Тета приблизительно 6,1°, 11,0°, 16,8°, 22,6°.
В особом воплощении изобретения Форма D характеризуется дифракционной диаграммой XRPD, включающей пики XRPD при углах дифракции 2Тета приблизительно 6,1°, 8,1°, 11,0°, 13,5°, 15,4°, 16,8°, 18,4°, 19,2°, 19,5°, 21,1°, 21,4°, 22,6°, 24,7°, 28,1°.
В особом воплощении изобретения Форма D характеризуется дифракционной диаграммой XRPD на фигуре 4.
В особом воплощении изобретения Форма D характеризуется дифракционной диаграммой XRPD, включающей пики XRPD при положениях пиков, как указано в Таблице 5.
В особом воплощении изобретения Форма D характеризуется спектром ФПИК на фигуре 11.
В особом воплощении изобретения Форма D характеризуется температурой плавления с температурой начала разложения (ДСК) в диапазоне приблизительно от 96°C до 100°C.
Форма E (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанона представляет собой ангидрид, который проявляет лишь ограниченную устойчивость при условиях окружающей среды. Форму E получают в ходе дегидратации Формы B в процессе хранения при <5% rH. Быстрое преобразование Формы E в Форму B наблюдается после воздействия>5% rH.
Подобным образом также после сушки моногидрата Формы B посредством контрольного XRPD анализа влажности наблюдается Форма E при 0% rH.
Одно особое воплощение изобретения относится к кристаллическому (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанону в безводной полиморфной форме E (Форма E). как описано в этом документе.
В особом воплощении изобретения Форма E характеризуется дифракционной диаграммой XRPD, включающей пики XRPD при углах дифракции 2Тета приблизительно 16,5°, 20,8°.
В особом воплощении изобретения Форма E характеризуется дифракционной диаграммой XRPD, включающей пики XRPD при углах дифракции 2Тета приблизительно 13,1°, 16,5°, 20,8°.
В особом воплощении изобретения Форма E характеризуется дифракционной диаграммой XRPD, включающей пики XRPD при углах дифракции 2Тета приблизительно 5,5°, 13,1°, 13,3°, 14,2°, 16,5°, 19,1°, 20,8°, 22,3°, 23,9°, 25,1°, 25,5°, 26,4°, 29,0°.
В особом воплощении изобретения Форма E характеризуется дифракционной диаграммой XRPD, включающей пики XRPD при положениях пиков, как указано в Таблице 6.
В особом воплощении изобретения Форма E характеризуется дифракционной диаграммой XRPD на фигуре 5.
В особом воплощении изобретения Форма E характеризуется спектром КР на фигуре 17.
Температура стеклования аморфной Формы (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанона составляет прибл. 66°C (середина второго нагрева). Аморфное вещество слегка гигроскопично, но фазового перехода не наблюдается при хранении при 100% rH при температуре окружающей среды.
Одно особое воплощение изобретения относится к аморфному (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанону (Аморфная форма), как описано в этом документе.
В особом воплощении изобретения Аморфная форма характеризуется по меньшей мере одним аморфным ореолом и отсутствием острого пика дифракции Брэгга на дифракционной диаграмме XRPD.
В особом воплощении изобретения Аморфная форма характеризуется дифракционной диаграммой XRPD на фигуре 6.
В особом воплощении изобретения Аморфная форма характеризуется спектром ФПИК на фигуре 12.
В особом воплощении изобретения Аморфная форма характеризуется спектром КР на фигуре 18.
В особом воплощении изобретения Аморфная форма характеризуется температурой стеклования Тс от 60°c до 70°C, особенно от 65°C до 67°C, в особенности 66°C.
Кроме того, в настоящем изобретении обнаружен комплекс включения 1:1 (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанона с γ-циклодекстрином (γ-ЦД комплекс включения) с полезными свойствами. γ-ЦД комплекс включения является высококристаллическим (что подтверждено с помощью XRPD). Установлено, что сухой γ-ЦД комплекс включения имеет остаточное содержание воды прибл. 7,3% (что подтверждено с помощью ТГА). Было обнаружено, что сухой γ-ЦД комплекс включения и влажный порошкообразный образец показывают разные диаграммы XRPD. По-видимому, кристаллическая структура γ-ЦД комплекса зависит от содержания воды в образце. По всей видимости, вода придает устойчивость кристаллической структуре описанного комплекса включения, и значительная потеря воды способна привести к изменениям кристаллической структуры. Обнаружено, что γ-ЦД комплекс включения, содержащий остаточную воду, обладает улучшенной растворимостью в воде по сравнению с сухими γ-ЦД комплексами включения [T. Toropainen et al., Pharm. Res. (2007) 24: 1058-1066]. Было установлено, что молярное отношение между АФИ и γ-ЦД в γ-ЦД комплексе включения составляет 1:1 (что подтверждено с помощью СВЭЖХ). Константу связывания комплекта 510,4 М-1 рассчитывали для комплекса включения соединений формулы (I) и γ-ЦД, как описано в этом документе. Данная константа связывания и профили растворения in vitro указывают на повышенную скорость растворения и таким образом увеличенную биодоступность по сравнению с другими твердыми формами (Фигуры 21 и 22).
Одно особое воплощение изобретения относится к комплексу включения 1:1 (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанона с γ-циклодекстрином (γ-ЦД комплекс включения), как описано в этом документе.
Одно особое воплощение изобретения относится к комплексу включения 1:1 (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанона с γ-циклодекстрином (γ-ЦД комплекс включения), как описано в этом документе, включающему остаточное содержание воды от 1% до 20% (масс/масс), особенно от 5% до 15% (масс/масс), в особенности от 8% до 12% (масс/масс).
В особом воплощении изобретения Форма Ε характеризуется дифракционной диаграммой XRPD, включающей пики XRPD при углах дифракции 2Тета приблизительно 7,4°, 14,9°, 16,7°, 21,8°.
В особом воплощении изобретения Форма Ε характеризуется дифракционной диаграммой XRPD, включающей пики XRPD при углах дифракции 2Тета приблизительно 7,4°, 12,1°, 14,9°, 16,7°, 21,8°.
В особом воплощении изобретения Форма Ε характеризуется дифракционной диаграммой XRPD, включающей пики XRPD при углах дифракции 2Тета приблизительно 3,8°, 5,2°, 7,4°, 9,2°, 10,6°, 11,5°, 11,8°, 12,1°, 14,2°, 14,9°, 15,8°, 16,7°, 19,2°, 20,3°, 21,2°, 21,8°, 22,5°, 23,7°, 26,8°.
В особом воплощении изобретения γ-ЦД комплекс включения характеризуется дифракционной диаграммой XRPD на фигуре 7.
В особом воплощении изобретения γ-ЦД комплекс включения характеризуется дифракционной диаграммой XRPD, включающей пики XRPD при положениях пиков, как указано в Таблице 7.
В особом воплощении изобретения γ-ЦД комплекс включения характеризуется спектром ФПИК на фигуре 13.
В особом воплощении изобретения γ-ЦД комплекс включения характеризуется спектром КР на фигуре 19.
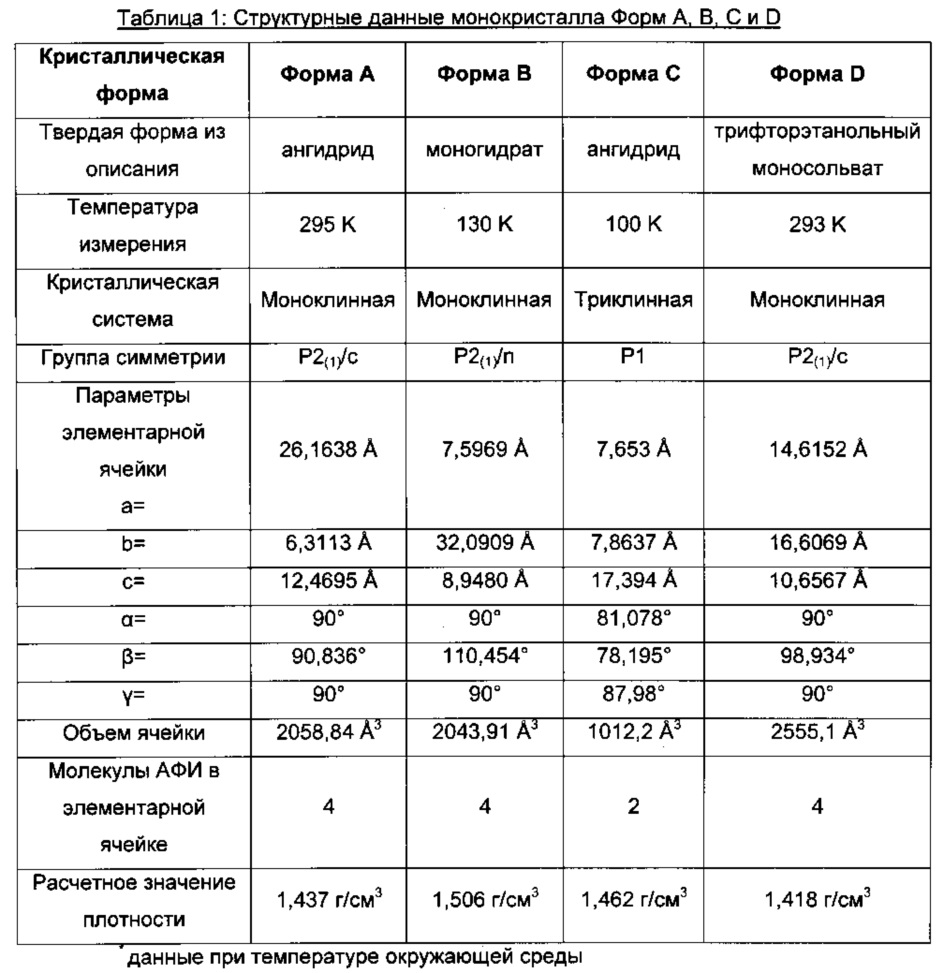
В таблице 1 приведены релевантные данные кристаллических структур Формы A, Формы B, Формы C и Формы D (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанона. Кристаллические структуры Формы A, Формы B, Формы C и Формы D уточнены. Форма E кристаллизуется только при сухих условиях и регидратируется при относительной влажности >5%, одиночные кристаллические образцы отсутствуют.
Параметры решетки, объем элементарной ячейки и расчетное значение плотности основываются на данных при температуре окружающей среды. С этой целью параметры решетки, полученные в ходе анализа монокристаллической структуры, были уточнены с помощью эталонных диаграмм XRPD при экспериментальных условиях окружающей среды при использовании программного обеспечения TOPAS 4.0, Bruker AXS.
Кроме того, изобретение относится к способу замены растворителя в ходе перегонки для получения твердых форм соединений формулы (I), как определено выше, согласно которому:
a) растворяют выделенную твердую форму в растворителе;
b) осуществляют перегонку растворителя, при этом поддерживая уровень жидкости в реакционном сосуде постоянным, заменяя дистиллят антирастворителем;
c) проводят физическое отделение требуемой твердой формы от суспензии.
В особом воплощении требуемая твердая форма, полученная в ходе подобной замены растворителя при перегонке на стадии c), представляет собой кристаллический (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанон в безводной полиморфной форме С (Форма C), как определено выше.
В особом воплощении выделенная твердая форма на стадии a) выбрана из Формы A или Формы B, в особенности из Формы B.
В особом воплощении растворитель, используемый на стадии a), выбран из ТГФ, ДМФА или ацетона, или их смеси, особенно выбран из ТГФ.
В особом воплощении антирастворитель, используемый на стадии b), выбран из этанола, изопропанола или н-гептана, или их смеси, особенно выбран из этанола.
В особом воплощении стадию b) проводят при повышенной температуре, особенно при 50-80°C.
В особом воплощении стадию b) проводят при пониженном давлении, особенно при 100-300 мбар.
В особом воплощении стадия b) возможно предшествует или проходит вместе с затравливанием с требуемой твердой формой в виде порошка или суспензии, в особенности затравливанием с 1-10% (масс/масс) (относительно конечного выхода) требуемой твердой формы в виде порошка или суспензии.
В особом воплощении физическое отделение на стадии c) проводят посредством фильтрации.
Кроме того, изобретение относится к способу с большими сдвиговыми усилиями для получения твердых форм соединений формулы (I), как определено выше, согласно которому:
d) вводят раствор выделенной твердой формы в растворителе в мешалку с большими сдвиговыми усилиями, содержащую антирастворитель;
e) встряхивают систему типа ротор-статор мешалки с большими сдвиговыми усилиями;
f) проводят физическое отделение требуемой твердой формы от суспензии.
В особом воплощении требуемая твердая форма, полученная в ходе этого способа с большими сдвиговыми усилиями на стадии f), представляет собой кристаллический (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанон в безводной полиморфной форме C (Форма C), как определено выше.
В особом воплощении выделенная твердая форма на стадии d) выбрана из Формы A или Формы B, особенно выбрана из Формы B.
В особом воплощении раствор выделенной твердой формы на стадии d) вводят при постоянной скорости потока 1,6 г/мин.
В особом воплощении растворитель, используемый на стадии d), выбран из ТГФ, ДМФА или ацетона, или их смеси, особенно выбран из ТГФ.
В особом воплощении антирастворитель, используемый на стадии d), выбран из этанола, изопропанола или н-гептана, или их смеси, особенно выбран из н-гептана.
В особом воплощении антирастворитель циркулирует по всей мешалке с большими сдвиговыми усилиями на стадиях d) и e) при постоянной скорости, особенно при постоянной скорости 20 л/ч.
В особом воплощении антирастворитель на стадии d) возможно включает частицы для затравки требуемой твердой формы, особенно 1-10% (масс/масс) (относительно конечного выхода) частиц для затравки требуемой твердой формы, в особенности 5-10% (масс/масс) (относительно конечного выхода) частиц для затравки требуемой твердой формы.
В особом воплощении система типа ротор-статор на стадии е) вращается со скоростью вращения от 15000 об/мин до 24000 об/мин.
В особом воплощении стадии d) и e) проводят при пониженной температуре, особенно при -20°С до 0°С, в особенности при -5°С.
В особом воплощении физическое отделение на стадии f) проводят посредством фильтрации.
В другом воплощении предложены фармацевтические композиции или лекарства, включающие твердые формы соединений формулы (I), как описано в этом документе, и фармацевтически приемлемый эксципиент, а также способы применения соединений по изобретению для получения подобных композиций и лекарств.
Композиции готовят, дозируют и вводят в виде, согласующемся с надлежащей медицинской практикой. Рассматриваемые в этой связи факторы включают конкретное заболевание, подвергаемое лечению, конкретное млекопитающее, подвергаемое лечению, клиническое состояние отдельного пациента, причину заболевания, место доставки агента, способ введения, планирование введения и другие факторы, известные практикующим врачам.
Твердые формы соединений формулы (I), как описано в этом документе, можно вводить подходящими способами, включая пероральное, местное (включая буккальное и подъязычное), ректальное, вагинальное, трансдермальное, парентеральное, подкожное, внутрибрюшинное, внутрилегочное, внутрикожное, интратекальное и эпидуральное, и внутриносовое, и, если требуется для местного лечения, внутриочаговое введение. Парентеральные вливания включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение.
Твердые формы соединений формулы (I), как описано в этом документе, можно вводить в любой подходящей форме введения, например в виде таблеток, порошков, капсул, растворов, дисперсий, суспензий, сиропов, спреев, суппозиториев, гелей, эмульсий, пластырей и т.п. Подобные композиции могут содержать компоненты, общепринятые в фармацевтических препаратах, например разбавители, носители, рН модификаторы, консерванты, солюбилизаторы, стабилизаторы, смачивающие вещества, эмульгаторы, подсластители, красители, ароматизаторы, соли для изменения осмотического давления, буферы, маскирующие агенты, антиоксиданты и дополнительные активные агенты. Также они могут еще содержать и другие терапевтически ценные вещества.
Обычный препарат получают, смешивая твердую форму соединений формулы (I), как описано в этом документе, и фармацевтически приемлемый эксципиент. Подходящие эксципиенты хорошо известны квалифицированным специалистам в данной области техники и описаны подробно, например, у Ansel Н.С. et al., Anselʹs Pharmaceutical Dosage Forms and Drug Delivery Systems (2004) Lippincott, Williams & Wilkins, Philadelphia; Gennaro A.R. et al., Remington: The Science and Practice of Pharmacy (2000) Lippincott, Williams & Wilkins, Philadelphia; и Rowe R.C, Handbook of Pharmaceutical Excipients (2005) Pharmaceutical Press, Chicago. Препараты также могут включать один или более буферов, стабилизаторов, поверхностно-активных веществ, смачивающих веществ, смазывающих веществ, эмульгаторов, суспендирующих веществ, консервантов, антиоксидантов, кроющих веществ, скользящих веществ, вспомогательных веществ, красителей, подсластителей, ароматизирующих веществ, вкусовых веществ, разбавителей и других известных дополнительных веществ для получения наилучшего представления лекарства (т.е. соединения по настоящему изобретению или фармацевтической композиции) или помощи при изготовлении фармацевтического продукта (т.е. лекарства).
Дозировка, в которой твердые формы соединений формулы (I), как описано в этом документе, могут быть введены, может изменяться в широких пределах и, конечно, будет приспособлена к индивидуальным требованиям в каждом конкретном случае. Как правило, в случае перорального введения суточная доза приблизительно от 0,1 до 1000 мг на пациента твердой формы соединений формулы (I), как описано в этом документе, должна быть подходящей, хотя вышеприведенный верхний предел также может быть превышен при необходимости. Особое воплощение изобретения относится к суточной дозе от 0,1 до 1000 мг (п/о), особенно от 10 до 500 мг (п/о), в особенности от 75 до 350 мг (п/о).
Пример подходящей формы пероральной дозы представляет собой таблетку, включающую приблизительно от 100 мг до 500 мг твердой формы соединений формулы (I), как описано в этом документе, смешанной с приблизительно от 30 до 90 мг безводной лактозы, приблизительно от 5 до 40 мг кроскармеллозы натрия, приблизительно от 5 до 30 мг поливинилпирролидона (ПВП) КЗО и приблизительно от 1 до 10 мг стеарата магния. Порошкообразные компоненты сначала смешивают вместе и затем смешивают с раствором ПВП. Полученную в результате композицию можно высушить, гранулировать, смешать со стеаратом магния и спрессовать в форму таблетки, используя традиционное оборудование.
Пример аэрозольного препарата может быть получен путем растворения твердой формы соединений формулы (I), как описано в этом документе, например от 10 до 100 мг, в подходящем буферном растворе, например фосфатном буфере, при добавлении вспомогательного вещества, например, соли, такой как хлорид натрия, при желании. Раствор может быть отфильтрован, например, используя 0,2 мкм фильтр, для удаления примесей и загрязняющих веществ.
Твердые формы соединений формулы (I), как описано в этом документе, обладают ценными фармакологическими свойствами и, как оказалось, представляют собой лиганды ГАМК А α5 рецепторов. Следовательно, твердые формы соединений формулы (I) по настоящему изобретению можно использовать, либо отдельно, либо в сочетании с другими лекарствами, для лечения или предотвращения заболеваний, которые изменяются под воздействием лигандов ГАМК А рецепторов, содержащих α5 субъединицу. Эти заболевания включают, но не ограничиваются этим, острые и/или хронические неврологические расстройства, когнитивные расстройства, болезнь Альцгеймера, нарушения памяти, шизофрению, позитивные, негативные и/или когнитивные симптомы, связанные с шизофренией, биполярные расстройства, аутизм, синдром Дауна, нейрофиброматоз I типа, нарушения сна, расстройства суточного ритма, боковой амиотрофический склероз (ALS от amyotrophic lateral sclerosis), слабоумие, вызванное СПИДом, психические расстройства, интоксикационное психическое расстройство, тревожные расстройства, генерализованное тревожное расстройство, панический синдром, бредовое расстройство, обсессивно-компульсивные расстройства, острое стрессовое расстройство, лекарственные привыкания, двигательные расстройства, болезнь Паркинсона, синдром усталых ног, нарушения познавательной способности, мультиинфарктную деменцию, расстройства настроения, депрессию, психоневрологические состояния, психоз, синдром дефицита внимания с гиперактивностью, невропатическую боль, инсульт, множественный склероз (МС), острый менингит, алкогольный синдром плода, расстройства внимания, состояния ЦНС, возникающие после инсульта, и потребность в улучшении познавательной способности.
Поэтому изобретение также относится к фармацевтическим композициям, включающим твердые формы соединений формулы (I), как описано в этом документе, и фармацевтически приемлемый эксципиент.
Подобным образом изобретение охватывает твердые формы соединений формулы (I), как описано в этом документе, для применения в качестве терапевтически активных веществ.
Подобным образом изобретение охватывает твердые формы соединений формулы (I), как описано в этом документе, для применения в качестве терапевтически активных веществ для лечения или предотвращения заболеваний, которые связаны с ГАМК A α5 рецептором.
Подобным образом изобретение охватывает твердые формы соединений формулы (I), как описано в этом документе, для применения в качестве терапевтически активных веществ для лечения или предотвращения острых и/или хронических неврологических расстройств, когнитивных расстройств, болезни Альцгеймера, нарушений памяти, шизофрении, позитивных, негативных и/или когнитивных симптомов, связанных с шизофренией, биполярных расстройств, аутизма, синдрома Дауна, нейрофиброматоза I типа, нарушений сна, расстройств суточного ритма, бокового амиотрофического склероза (ALS), слабоумия, вызванного СПИДом, психических расстройств, интоксикационного психического расстройства, тревожных расстройств, генерализованного тревожного расстройства, панического синдрома, бредового расстройства, обсессивно-компульсивных расстройств, острого стрессового расстройства, лекарственных привыканий, двигательных расстройств, болезни Паркинсона, синдрома усталых ног, нарушений познавательной способности, мультиинфарктной деменции, расстройств настроения, депрессии, психоневрологических состояний, психоза, синдрома дефицита внимания с гиперактивностью, невропатической боли, инсульта, множественного склероза (МС), острого менингита, алкогольного синдрома плода и расстройств внимания, для реабилитационной терапии после инсульта, или для применения в качестве усилителей когнитивных функций.
В другом воплощении изобретение относится к способу лечения или предотвращения заболеваний, которые связаны с ГАМК A α5 рецептором, согласно которому вводят твердые формы соединений формулы (I), как описано в этом документе, человеку или животному.
В другом воплощении изобретение относится к способу лечения или предотвращения острых и/или хронических неврологических расстройств, когнитивных расстройств, болезни Альцгеймера, нарушений памяти, шизофрении, позитивных, негативных и/или когнитивных симптомов, связанных с шизофренией, биполярных расстройств, аутизма, синдрома Дауна, нейрофиброматоза I типа, нарушений сна, расстройств суточного ритма, бокового амиотрофического склероза (ALS), слабоумия, вызванного СПИДом, психических расстройств, интоксикационного психического расстройства, тревожных расстройств, генерализованного тревожного расстройства, панического синдрома, бредового расстройства, обсессивно-компульсивных расстройств, острого стрессового расстройства, лекарственных привыканий, двигательных расстройств, болезни Паркинсона, синдрома усталых ног, нарушений познавательной способности, мультиинфарктной деменции, расстройств настроения, депрессии, психоневрологических состояний, психоза, синдрома дефицита внимания с гиперактивностью, невропатической боли, инсульта, множественного склероза (МС), острого менингита, алкогольного синдрома плода и расстройств внимания, для реабилитационной терапии после инсульта, или для усиления когнитивной деятельности, согласно которому вводят твердые формы соединений формулы (I), особенно соединения формулы (I), как описано в этом документе, человеку или животному.
Изобретение также охватывает применение твердых форм соединений формулы (I), как описано в этом документе, для лечения или предотвращения заболеваний, которые связаны с ГАМК A α5 рецептором.
Изобретение также охватывает применение твердых форм соединений формулы (I), как описано в этом документе, для лечения или предотвращения острых и/или хронических неврологических расстройств, когнитивных расстройств, болезни Альцгеймера, нарушений памяти, шизофрении, позитивных, негативных и/или когнитивных симптомов, связанных с шизофренией, биполярных расстройств, аутизма, синдрома Дауна, нейрофиброматоза I типа, нарушений сна, расстройств суточного ритма, бокового амиотрофического склероза (ALS), слабоумия, вызванного СПИДом, психических расстройств, интоксикационного психического расстройства, тревожных расстройств, генерализованного тревожного расстройства, панического синдрома, бредового расстройства, обсессивно-компульсивных расстройств, острого стрессового расстройства, лекарственных привыканий, двигательных расстройств, болезни Паркинсона, синдрома усталых ног, нарушений познавательной способности, мультиинфарктной деменции, расстройств настроения, депрессии, психоневрологических состояний, психоза, синдрома дефицита внимания с гиперактивностью, невропатической боли, инсульта, множественного склероза (МС), острого менингита, алкогольного синдрома плода и расстройств внимания, или для усиления когнитивной деятельности.
Также изобретение относится к применению твердых форм соединений формулы (I), как описано в этом документе, для получения лекарств для лечения или предотвращения заболеваний, которые связаны с ГАМК A α5 рецептором, особенно для лечения или предотвращения острых и/или хронических неврологических расстройств, когнитивных расстройств, болезни Альцгеймера, нарушений памяти, шизофрении, позитивных, негативных и/или когнитивных симптомов, связанных с шизофренией, биполярных расстройств, аутизма, синдрома Дауна, нейрофиброматоза I типа, нарушений сна, расстройств суточного ритма, бокового амиотрофического склероза (ALS), слабоумия, вызванного СПИДом, психических расстройств, интоксикационного психического расстройства, тревожных расстройств, генерализованного тревожного расстройства, панического синдрома, бредового расстройства, обсессивно-компульсивных расстройств, острого стрессового расстройства, лекарственных привыканий, двигательных расстройств, болезни Паркинсона, синдрома усталых ног, нарушений познавательной способности, мультиинфарктной деменции, расстройств настроения, депрессии, психоневрологических состояний, психоза, синдрома дефицита внимания с гиперактивностью, невропатической боли, инсульта, множественного склероза (МС), острого менингита, алкогольного синдрома плода и расстройств внимания, для реабилитационной терапии после инсульта, или для получения усилителей когнитивных функций. Подобные лекарства включают соединение, как описано выше.
А именно, настоящее изобретение относится к применению твердых форм соединений формулы (I), как описано в этом документе, для лечения, предотвращения и/или замедления развития состояний ЦНС, вызванных нарушениями, связанными с неврологическим развитием, которые приводят к чрезмерному ГАМК-эргическому ингибированию в коре головного мозга и гиппокампе, где состояние ЦНС выбрано из нарушений познавательной способности при синдроме Дауна, при аутизме, при нейрофиброматозе I типа или после инсульта.
Лечение или предотвращение расстройств познавательной способности, болезни Альцгеймера, шизофрении, позитивных, негативных и/или когнитивных симптомов, связанных с шизофренией, синдрома Дауна и нейрофиброматоза I типа являются особыми воплощениями настоящего изобретения.
Особое воплощение изобретения охватывает лечение или предотвращение болезни Альцгеймера.
Особое воплощение изобретения охватывает лечение или предотвращение синдрома Дауна.
Особое воплощение изобретения охватывает лечение или предотвращение нейрофиброматоза I типа.
Особое воплощение изобретения охватывает восстановление после инсульта.
Описание чертежей
Фигура 1: Диаграмма XRPD Формы A.
Фигура 2: Диаграмма XRPD Формы B.
Фигура 3: Диаграмма XRPD Формы C.
Фигура 4: Диаграмма XRPD Формы D.
Фигура 5: Диаграмма XRPD Формы E, анализировали при 0% rH или после сушки при 70°C.
Фигура 6: Диаграмма XRPD аморфной Формы.
Фигура 7: Диаграмма XRPD γ-ЦД комплекса включения.
Фигура 8: Спектр ФПИК Формы A.
Фигура 9: Спектр ФПИК Формы B.
Фигура 10: Спектр ФПИК Формы C.
Фигура 11: Спектр ФПИК Формы D.
Фигура 12: Спектр ФПИК Аморфной Формы.
Фигура 13: Спектр ФПИК γ-ЦД комплекса включения.
Фигура 14: Спектр КР Формы A.
Фигура 15: Спектр КР Формы B.
Фигура 16: Спектр КР Формы C.
Фигура 17: Спектр КР Формы E.
Фигура 18: Спектр КР Аморфной Формы.
Фигура 19: Спектр КР γ-ЦД комплекса включения.
Фигура 20: Фазовая диаграмма растворимости (1.1-диоксо-1λ6-тиоморфолин-4-ил){6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси1-пиридин-3-ил}-метанона и γ-ЦД.
Растворимость АФИ показана в [мкг/мл]. Твердую фазу в равновесии с насыщенным раствором проверяли в выбранных точках (стрелки) в ходе измерений КР и XRPD для определения и подтверждения возможных твердофазных превращений, таких как образование полиморфа В (моногидрата) из первоначально используемого полиморфа A, или переход свободного АФИ в γ-ЦД комплекс включения.
Фигура 21: Средние профили растворения in vitro в SGF Средние профили растворения in vitro тонкодисперсных порошков Формы A (○), Формы B (▼), Формы C (■) и γ-ЦЦ комплекса включения (Δ) в SGF при комнатной температуре. Измерения проводили в трех параллельных опытах (n=3).
Фигура 22: Средние профили растворения in vitro в FeSSIF Средние профили растворения in vitro тонкодисперсных порошков Формы А (○), Формы В (▼), Формы C (■) и γ-ЦД комплекса включения (Δ) в FeSSIF при комнатной температуре. Измерения проводили в трех параллельных опытах (n=3).
Фигура 23: Виды кристаллических структур
Примеры
Следующие примеры 1-28 приведены для иллюстрации изобретения. Они не ограничивают объем изобретения, а лишь представляют его.
Пример 1: Получение кристаллического (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанона в безводной полиморфной форме A (Форма A)
Форму A можно получить, как описано в WO 2009/071476.
Стадия a: (E)- и/или (Z)-4-Фтор-бензальдегида оксим
К суспензии 4-фторбензальдегида (24,8 г, 200 ммоль) (6,75 г, 54 ммоль) и гидроксиламина гидрохлорида (4,16 г, 60 ммоль) в этаноле (4,3 мл) и воде (13 мл) добавляли лед (25 г). Затем раствор гидроксида натрия (5,5 г, 138 ммоль) в воде (6,5 мл) добавляли по каплям в течение 10 минут (температура увеличивалась от -8°c до+ 7°C), после чего большая часть твердого вещества растворялась. После 30 минут перемешивания при комнатной температуре в осадок выпадало белое твердое вещество, и полученную в результате смесь потом разбавляли водой и подкисляли HCl (4 н). Затем белый осадок отфильтровывали, промывали водой и сушили в высоком вакууме, получая указанное в заголовке соединение (23,3 г, 84%), которое получали в виде белого твердого вещества. МС т/е (ЭИ): 139,1 [М]+.
Стадия b) (E)- и/или (Z)-N-Гидрокси-4-фтор-бензолкарбоксимидоилхлорид
К раствору (E)- и/или (Z)-4-фтор-бензальдегида оксима (23,3 г, 167 ммоль) (6,9 г, 50 ммоль) в ДМФА (50 мл) добавляли N-хлорсукцинимид (6,6 г, 50 ммоль) частями в течение 1 часа, сохраняя температуру ниже 35°C. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Потом смесь выливали в ледяную воду и экстрагировали этилацетатом. Объединенные органические слои затем промывали водой и солевым раствором, сушили над сульфатом натрия и выпаривали, получая указанное в заголовке соединение (25,9 г, 89%), которое получали в виде твердого вещества белого оттенка. МС т/е (ЭИ): 173,0 [М]+.
Стадия c) Этиловый эфир 3-(4-фтор-фенил)-5-метил-изоксазол-4-карбоновой кислоты
К раствору (E)- и/или (Z)-N-гидрокси-4-фтор-бензолкарбоксимидоилхлорида (15,4 г, 89 ммоль) (11,1 г, 64 ммоль) в диэтиловом эфире (151 мл) добавляли этил 2-бутиноат (7,2 г, 7,5 мл, 64 ммоль) при 0°C, затем по каплям добавляли триэтиламин (7,8 г, 10,7 мл, 77 ммоль) и полученную в результате смесь нагревали до комнатной температуры в течение ночи. Потом смесь выливали в ледяную воду и экстрагировали диэтиловым эфиром. Объединенные органические слои затем промывали водой и солевым раствором, сушили над сульфатом натрия и выпаривали. Очистка с помощью хроматографии (SiO2, гептан:этилацетат = 100:0 до 1:1) давала указанное в заголовке соединение (9,8 г, 44%), которое получали в виде твердого вещества белого оттенка. МС: т/е = 250,1 [M+H]+.
Стадия d) [3-(4-Фтор-Фенил)-5-метил-изоксазол-4-ил]-метанол
К раствору этилового эфира 3-(4-фтор-фенил)-5-метил-изоксазол-4-карбоновой кислоты (3,0 г, 12 ммоль) (6,18 г, 25 ммоль) в ТГФ (320 мл) добавляли частями алюмогидрид лития (528 мг, 14 ммоль) при 0°C и реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Затем смесь охлаждали до 0°C и добавляли воду (518 мкл), потом гидроксид натрия (15% раствор, 518 мкл) и потом снова воду (1,5 мл), и затем смесь перемешивали в течение ночи при комнатной температуре. Осадок потом отфильтровывали и промывали ТГФ. Объединенные промывные воды и фильтрат затем выпаривали. Очистка с помощью хроматографии (SiO2, гептан : этилацетат = 100:0 до 1:1) давала указанное в заголовке соединение (1,8 г, 71%), которое получали в виде белого твердого вещества. МС: т/е = 208,3 [M+H]+.
Стадия е: Метиловый эфир 6-[3-(4-фтор-Фенил)-5-метил-изоксазол-4-илметокси]-никотиновой кислоты
К суспензии гидрида натрия (55% дисперсия в минеральном масле, 852 мг, 20 ммоль) в ТГФ (27 мл) добавляли раствор [3-(4-фтор-фенил)-5-метил-изоксазол-4-ил]-метанола (103 мг, 0,55 ммоль) (3,68 г, 18 ммоль) в ТГФ (54 мл) при 0°C и реакционная смесь нагревали до комнатной температуры в течение 30 минут. Затем раствор метил 6-хлорникотината (3,35 г, 20 ммоль) в ТГФ (1,5 мл) добавляли по каплям при 0°C и реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем реакционную смесь выливали в водный хлорид натрия (насыщенный) и смесь экстрагировали этилацетатом. Объединенные органические слои потом промывали водой и солевым раствором и затем сушили над сульфатом натрия, фильтровали и выпаривали. Очистка с помощью хроматографии (SiO2, гептан : этилацетат = 7:3) давала указанное в заголовке соединение (81 мг, 47%), которое получали в виде светло-желтого твердого вещества. МС: т/е = 343,3 [M+H]+.
Стадия f: 6-[3-(4-Фтор-Фенил)-5-метил-изоксазол-4-илметокси]-никотиновая кислота
К раствору метилового эфира 6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-никотиновой кислоты (1,4 г, 4,2 ммоль) (538 мг, 1,1 ммоль) в ТГФ (5 мл) добавляли раствор моногидрата гидроксида лития (94 мг, 2,2 ммоль) в воде (5 мл) и добавляли метанол (1 мл), и полученную в результате смесь перемешивали при комнатной температуре в течение ночи. Смесь подкисляли до pH 4 с HCl (25%, 3 капли) и добавляли метанол (2 капли). Начинала образовываться смола и смесь охлаждали при 0°C в течение 1,5 часов, и затем сливали водный слой. Растирание с диэтиловым эфиром и гексаном давало указанное в заголовке соединение (1,1 г, 78%), которое получали в виде белого твердого вещества. МС: т/е = 327,3 [M-H]-.
Стадия g: Кристаллический (1,1-диоксо-1λ6-тиоморфолин-4-ил{6-[3-(4-Фтор-Фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил)-метанон в безводной полиморфной форме A (Форма A)
К раствору 6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-никотиновой кислоты (99 мг, 0,33 ммоль (69 мг, 0,2 ммоль)) в ДМФА (300 мкл) добавляли 2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурония тетрафторборат (71 мг, 0,22 ммоль), Ν,Ν-диизопропилэтиламин (171 мкл, 1,0 ммоль) и тиоморфолин-S,S-диоксид (17,3 мкл, 0,22 ммоль). Полученную в результате реакционную смесь перемешивали в течение 1 часа при комнатной температуре. Концентрирование и очистка с помощью хроматографии (SiO2, гептан : этилацетат = 100:0 до 1:1) давали указанное в заголовке соединение (73 мг, 55%) в виде белого твердого вещества. МС: т/е = 446,1 [M+H]+.
Пример 2: Получение Формы A
Раствор 0,1 г (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанона в 0,7 мл 2-пентанола или ТГФ быстро охлаждали жидким азотом, выделяли в ходе центрифугирования при 25°C и сушили при 20°C и пониженном давлении при <5 мбар в течение 2 дней.
Пример 3: Получение Формы A
152,4 мг (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанона растворяли в 2,14 мл 2-пентанола при 60°C, получая бесцветный раствор. Растворитель выпаривали медленно досуха (перфорированная защитная пленка, 5 дней при условиях окружающей среды), получая кристаллы, имеющие форму лопасти.
Пример 4: Получение Формы A
700,0 г 6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-никотиновой кислоты (стадия f пр. 1), 10 л ТГФ и 469,0 г 1,1-карбодиимидазола перемешивали при температуре окружающей среды в течение одного часа. Последовательно добавляли 407,0 г тиоморфолин-S,S-диоксида, 12,0 г 4-диметиламинопиридина и 340 мл триэтиламина ч.д.а. и нагревали с обратным холодильником при перемешивании в течение двух ночей. Добавляли дополнительные 82,0 г тиоморфолин-S,S-диоксида и 68,0 мл триэтиламина ч.д.а. и еще нагревали с обратным холодильником при перемешивании в течение ночи. Пробу охлаждали до прибл. 30°C. Последовательно добавляли 10 л обессоленной воды и 16 л этанола. Получающийся раствор охлаждали до 20°C, затравливали с 12 г Формы A и перемешивали при температуре окружающей среды в течение 30 минут. Суспензию приводили к 16 л при макс. 35°C. Для замены ТГФ добавляли 20 л этанола. Суспензию перемешивали при температуре окружающей среды в течение ночи и затем фильтровали. Осадок на фильтре промывали 7,4 л смеси 1:1 обессоленной воды/этанола и сушили при 50°C в течение ночи, получая 820 г Формы A (86%).
Пример 5: Получение Формы A
16,32 г Формы B растворяли в 257 г ТГФ при 50°C. Для удаления воды из раствора 172 г ТГФ отгоняли при пониженном давлении при 80°C. Затем этот безводный раствор продукта охлаждали до комнатной температуры.
Поддерживая температуру в рубашке постоянной при -5°C, 238 г гептана прокачивали через мешалку с большими сдвиговыми усилиями со скоростью 20 л/ч, используя шланговый насос. Через 5 минут мешалку с большими сдвиговыми усилиями запускали со скоростью вращения от 15000 об/мин до 24000 об/мин, и раствор продукта из вышеприведенной смеси подавали насосом со скоростью потока 1,6 г/мин непосредственно через инжектор в систему типа ротор-статор. После завершения добавления полученные в результате кристаллы фильтровали и сушили при 40°C при 30 мбар в течение 15 часов, получая Форму A.
Пример 6: Получение Формы A
100 г Формы В растворяли в 1200 г ТГФ при 50°C. Около 50% ТГФ отгоняли при 70°C при пониженном давлении (800 мбар), получая 20% (масс/масс) раствор Формы B в ТГФ. В ходе замены растворителя при перегонке ТГФ/воду (гидратация) заменяли на сухой ТГФ при 800 мбар и при 70°C в то же время, поддерживая уровень растворителя постоянным до тех пор, пока содержание воды было ниже 0,1% (масс/масс). 888 г гептана при 5°C в качестве антирастворителя затравливали с 1% (масс/масс) Формой A. Затем раствор продукта охлаждали до 50°C и дозировали в течение 30 минут, используя температурный рукав внизу поверхности, в гептан, находящийся при 5°C. Полученные в результате кристаллы фильтровали и сушили при пониженном давлении до постоянной массы, получая Форму A (92%).
Пример 7: Получение Формы A
41 г Формы В растворяли в 170 г ТГФ при 50°C. 30 г этанола добавляли и раствор охлаждали до 30°C. В ходе замены растворителя при перегонке растворитель (ТГФ/этанол) заменяли на антирастворитель этанол при температуре 30°C и при пониженном давлении (300 мбар), в то же время объем сохраняли постоянным, непрерывно заменяя дистиллят всего 340 г этанола. Через 20 минут после начала перегонки кристаллизацию вызывали введением затравки 2% (масс/масс) кристаллов Формы A. Затем давление понижали до 230 мбар. Через 50 минут после начала перегонки давление понижали до 130 мбар. Через 67 минут после начала перегонки замена растворителя завершалась. Полученную в результате суспензию перемешивали в течение 1,5 часа при температуре окружающей среды и затем фильтровали. Полученные кристаллы сушили в вакуумной сушилке при 40°C в течение ночи, получая 36,4 г Формы A (92,4%).
Пример 8: Получение кристаллического (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанона моногидрата в полиморфной форме B (Форма B)
Стадия a) (E)- и/или (Z)-4-фтор-бензальдегида оксим
К суспензии 4-фтор-бензальдегида (30,4 г, 0,24 моль) в воде (50 мл) добавляли при 0-5°C в течение 5 минут раствор гидроксиламина гидрохлорида (17,7 г, 0,25 моль) в воде (30 мл) и полученную в результате смесь перемешивали в течение 15 минут при 0-5°C. Затем смесь обрабатывали при 15-25°C в течение 15 минут 32% NaOH (24,44 мл, 0,26 моль), и полученную в результате суспензию перемешивали в течение одного дополнительного часа и затем экстрагировали этилацетатом (3×100 мл). Объединенные органические слои промывали водой (2×100 мл) и затем концентрировали досуха, получая 31,9 г (95%) указанного в заголовке оксима в виде белого твердого вещества.
Стадия b) Этиловый эфир 3-(4-фтор-фенил)-5-метил-изоксазол-4-карбоновой кислоты
К суспензии 4-фтор-бензальдегида оксима (1,39 г, 10,0 ммоль) в ДМФА (10 мл) добавляли частями в течение 5 минут при 15 до 20°C N-хлорсукцинимид (1,36 г, 10,0 ммоль) и полученную в результате смесь перемешивали при комнатной температуре в течение 90 минут. Желтый раствор (содержащий N-гидрокси-4-фтор-бензолкарбоксимидоилхлорид) потом обрабатывали в течение 2 минут при комнатной температуре раствором этил-3-(1-пирролидино)кротоната (1,89 г, 10,0 ммоль) в 5 мл ДМФА и полученный в результате раствор перемешивали при комнатной температуре в течение 28 часов. Смесь разбавляли водой (25 мл) и затем экстрагировали этилацетатом (4×25 мл). Объединенные органические слои промывали 1 Μ HCl (2×25 мл) и водой (2×25 мл), сушили над Na2SO4 и затем концентрировали досуха (45°C/25 мбар), получая 2,37 г (95%) указанного в заголовке эфира в виде коричневатого твердого вещества с чистотой 100% (согласно ГХ) и 97% (согласно ВЭЖХ).
Стадия c) 3-(4-Фтор-фенил)-5-метил-изоксазол-4-карбоновая кислота
Смесь 179,5 г (0,72 моль) этилового эфира 3-(4-фтор-фенил)-5-метил-изоксазол-4-карбоновой кислоты в 880 г 95% этанола перемешивали при 20-30°C в течение 40 минут и затем обрабатывали 78,5 г твердого гидроксида натрия. Полученную в результате смесь перемешивали в течение 5 часов при 20-30°C. Этанол удаляли в вакууме при 45-50°C и остаток затем обрабатывали 500 г воды при 20-30°C, получая прозрачный раствор. Раствор перемешивали в течение 40 минут и фильтровали. К фильтрату добавляли 235 г метил-трет-бутилового эфира и 600 г воды, и полученную в результате смесь перемешивали в течение 20 минут и затем выдерживали в течение 20 минут. Слои разделяли, и водный слой подкисляли до pH<1 соляной кислотой. Кристаллы фильтровали и промывали водой, получая 147 г неочищенного влажного продукта. Неочищенный влажный продукт суспендировали в 680 г толуола и смесь нагревали при 75-85°C в течение 7 часов. Смесь охлаждали до 20-30°C и перемешивали в течение 1 часа при этой температуре. Кристаллы отфильтровывали и сушили при 50-55°C в вакууме в течение ночи, получая 137 г (выход 86%) указанной в заголовке кислоты в виде твердого вещества от белого до слегка желтого цвета с чистотой 99,9% (ВЭЖХ). Стадия d) [3-(4-Фторфенил)-5-метил-изоксазол-4-ил]-метанол Суспензию 448 г тетрагидрофурана и 95 г (0,70 моль) хлорида цинка перемешивали при 20-30°C в течение 1 часа. 23,6 г (0,62 моль) боргидрида натрия добавляли частями при 20-38°C и смесь затем перемешивали при 60-65°C в течение 3 часов. Раствор 69 г (0,31 моль) 3-(4-фтор-фенил)-5-метил-изоксазол-4-карбоновой кислоты в 220 г ТГФ добавляли по каплям и полученную в результате смесь перемешивали при 60-65°C в течение 16 часов. Затем реакцию гасили, по каплям добавляя смесь 93 г HCl в 202 г воды при 5-10°C.Смесь перемешивали при этой температуре в течение 2 часов, чтобы полностью растворить твердые вещества. Растворитель удаляли при пониженном давлении с температурой в рубашке 35-40°C.К остатку добавляли 510 г воды. Полученную в результате суспензию охлаждали до 20-30°C, и кристаллы отфильтровывали и промывали водой. Неочищенный влажный продукт перемешивали в течение 1 часа в смеси 150 г воды, 31 г HCl и 419 г МТБЭ. Нижнюю водную фазу удаляли и органическую фазу сушили с 25 кг безводного сульфата натрия, перемешивали в течение 0,5 часа и фильтровали в азоте. Фильтрат почти полностью концентрировали при пониженном давлении при 40-45°C.Остаток обрабатывали при 20-25°C 100 г МТБЭ. Смесь перемешивали при 55-60°C в течение 2 часов, охлаждали до 0°C и затем перемешивали при этой температуре в течение дополнительных 2 часов. Кристаллы отфильтровывали и сушили при 45-50°C в вакууме в течение ночи, получая 42 г (выход 66%) указанного в заголовке спирта в виде твердого вещества белого оттенка с чистотой 99,9% (ВЭЖХ).
Стадия е) 6-[3-(4-Фтор-Фенил)-5-метил-изоксазол-4-илметокси]-никотинонитрил
К суспензии гидрида натрия (60% в минеральном масле, 7,9 г, 181 ммоль, 1,5 экв.) в ТГФ (65 мл) добавляли в течение 30 минут при комнатной температуре раствор [3-(4-фторфенил)-5-метил-изоксазол-4-ил]-метанола (25,0 г, 121 ммоль) и 6-хлорникотинонитрила (16,7 г, 121 ммоль) в ТГФ (120 мл) и полученную в результате смесь перемешивали в течение одного часа. Добавляли раствор лимонной кислоты (18,5 г, 96,5 ммоль) в воде (185 мл) к реакционной смеси в течение 30 минут. Из полученной в результате смеси ТГФ/вода ТГФ отгоняли при пониженном давлении при температуре в рубашке 60°C и заменяли этанолом. Всего добавляли 284 г этанола. Полученную в результате суспензию перемешивали в течение одного часа при комнатной температуре. Кристаллы отфильтровывали, промывали смесью этанола (60 мл) и воды (60 мл) и затем сушили при 50°C/<25 мбар, получая 36,5 г (уточненный выход 91%) указанного в заголовке нитрила в виде твердого вещества белого оттенка с содержанием 93% (масс/масс).
Стадия И 6-[3-(4-Фтор-фенил)-5-метил-изоксазол-4-илметокси]-никотиновая кислота
6-[3-(4-Фтор-фенил)-5-метил-изоксазол-4-илметокси]-никотинонитрил (58,8 г, 190 ммоль) суспендировали в воде (440 мл) и этаноле (600 мл) и обрабатывали 32% раствором гидроксида натрия (178 мл, 1,92 моль). Смесь нагревали до 50-55°C и затем перемешивали при этой температуре в течение 15 часов. Слегка мутную смесь осветляли фильтрованием, чтобы удалить эфирный побочный продукт 6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметоксиметил-3-(4-фтор-фенил)-5-метил-изоксазол. Первый сосуд и переходные линии промывали смесью воды (50 мл) и этанола (50 мл). Фильтрат обрабатывали при 20-25°C в течение одного часа 25% соляной кислотой (прибл. 280 мл) до pH<2,0. Полученную в результате суспензию перемешивали в течение одного часа при комнатной температуре. Кристаллы отфильтровывали, промывали смесью этанола (200 мл) и воды (200 мл) и затем сушили при 50°C/<25 мбар до постоянной массы, получая 52,0 г (83%) указанной в заголовке кислоты в виде твердого вещества белого оттенка с чистотой 99,5%.
Стадия q) Очистка тиоморфолин-1,1-диоксида HCl
Смесь 60 г тиоморфолин-1,1-диоксида HCl в 600 мл ТГФ, 105 мл воды и 30 мл ДМФА нагревали до 63-66°C (слегка нагревали с обратным холодильником) и полученный в результате прозрачный или слегка мутный раствор перемешивали при этой температуре в течение 5-10 часов. Затем смесь обрабатывали при 63-66°C в течение 30 минут 300 мл ТГФ. Потом смесь охлаждали до 0-5°C в течение 3 часов и полученную в результате суспензию перемешивали при этой температуре в течение одного дополнительного часа. Кристаллы отфильтровывали, промывали ТГФ (2×25 мл) и сушили при 50°C и при пониженном давлении (<20 мбар), получая 56,6 г (94%) тиоморфолин-1,1-диоксида HCl с чистотой 100% (площадь) и содержанием ТГФ 0,14%.
Стадия h) Кристаллический (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-Фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил)-метанона моногидрат в полиморфной Форме B (Форма B)
6-[3-(4-Фтор-фенил)-5-метил-изоксазол-4-илметокси]-никотиновую кислоту (23,0 г, 70,1 ммоль) и 1,1-карбонилдиимидазол (15,3 г, 94,6 моль, 1,35 экв.) растворяли в ТГФ (120 мл) и полученный в результате раствор перемешивали в течение одного часа при комнатной температуре. Затем этот раствор добавляли к суспензии тиоморфолин-1,1-диоксида HCl (16,9 г, 98,5 ммоль), ДМАП (400 мг, 3,27 ммоль) и триэтиламина (9,78 г, 96,7 ммоль) в ТГФ (120 мл). Полученную в результате смесь нагревали до температуры флегмы и затем перемешивали при этой температуре в течение 50 часов. Смесь охлаждали до комнатной температуры и потом обрабатывали в течение одного часа водой (300 мл). Из полученной в результате суспензии отгоняли ТГФ при пониженном давлении и с температурой в рубашке 60°C и непрерывно заменяли этанолом (426 г) при постоянном объеме. Суспензию охлаждали до комнатной температуры и перемешивали в течение 2 часов. Кристаллы отфильтровывали, промывали смесью этанола (100 мл) и воды (100 мл) и затем сушили при 55°C/<25 мбар до постоянной массы, получая 28,9 г (92%) Формы В в виде бесцветного твердого вещества с чистотой 99,7% (площадь), измеренной с помощью ВЭЖХ.
Пример 9: Получение Формы В
Форму A выдерживали в течение 8 дней в водной суспензии. Выделение в ходе фильтрации давало кристаллические стебли, которые промывали водой и затем сушили в условиях окружающей среды.
Пример 10: Получение Формы B
155,9 мг Формы A растворяли в 2,2 мл 15% воды в ацетоне при 60°C, получая бесцветный раствор. Растворитель медленно выпаривали досуха (перфорированная защитная пленка, 5 дней в условиях окружающей среды), получая изометрические кристаллы.
Пример 11: Получение Формы В
509 мг Формы А растворяли в 7,1 мл 15%-об. вода/ацетон при 60°C, получая бесцветный раствор. Затем растворитель медленно выпаривали в течение 8 дней (перфорированная защитная пленка, условия окружающей среды). Остаток сушили при 20°C/<5 мбар в течение ночи (вакуумная полочная сушилка), получая 440 мг (86%) изометрических кристаллов.
Пример 12: Получение Формы B
10,0 г Формы C растворяли в 50 мл ТГФ и 17 мл ДМФА при перемешивании при температуре окружающей среды. В течение 30 минут раствор постепенно нагревали до 50-55°C и перемешивали при этой температуре в течение 15 минут. 75 мл воды добавляли по каплям в течение 2-3 часов при перемешивании при 50-55°C.Полученную в результате суспензию перемешивали в течение дополнительных 15 минут при 50-55°C и после этого постепенно охлаждали до 15-20°C в течение 2-4 часов. Суспензию перемешивали в течение 5 часов при 15-20°C, фильтровали и промывали небольшим количеством воды. Полученные кристаллы сушили в течение 12 часов при 40°C при пониженном давлении (20 мбар), получая Форму B (95%).
Пример 13: Получение кристаллического (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанона в безводной полиморфной форме C (Форма C)
4,5 кг Формы A растворяли в 40 л ТГФ при температуре окружающей среды. После фильтрации тонкой очистки фильтр промывали 5 л ТГФ. Из объединенных растворов отгоняли растворитель при пониженном давлении при температуре ниже 70°C, в то же время объем сохраняли постоянным, непрерывно заменяя дистиллят всего 90 л этанола. Суспензию охлаждали до температуры окружающей среды в течение 12 часов. Добавляли 25 л этанола, суспензию нагревали до 78°C при давлении окружающей среды, охлаждали до температуры окружающей среды в течение 12 часов и перемешивали в течение одного дополнительного часа. Кристаллизация при давлении окружающей среды происходила при 78°C до 70°C.25 л этанола отгоняли при пониженном давлении при 35-40°C и суспензию охлаждали до температуры окружающей среды в течение 12 часов. Продукт выделяли в ходе фильтрации и промывали 20 л этанола. Кристаллы сушили в вакуумной полочной сушилке (50°C/5 мбар в течение 3 дней), получая 4,1 кг (91%) бесцветных пластинчатовидных кристаллов. Возможно воспроизвести эксперимент с количеством 10 г.
Пример 14: Получение Формы C
200 мг Формы A перемешивали в 0,8 мл этилацетата при температуре окружающей среды в течение 14 дней (суспензия). После выделения твердых веществ в ходе фильтрации и сушки в вакуумной полочной сушилке (50°C/<5 мбар в течение 12 часов) получали Форму C. Альтернативно, этанол или толуол можно использовать вместо этилацетата.
Пример 15: Получение Формы C
41 г Формы B растворяли 170 г ТГФ при 50°C. Добавляли 30 г этанола и раствор охлаждали до 30°C. В ходе замены растворителя при перегонке растворитель (ТГФ/этанол) заменяли антирастворителем этанолом при температуре 30°C и при пониженном давлении (300 мбар), в то же время объем сохраняли постоянным, непрерывно заменяя дистиллят всего 340 г этанола. Через 20 минут после начала перегонки давление понижали до 230 мбар. Через 30 минут после начала перегонки прежде прозрачный желтый раствор становился мутным. Через две минуты мутный раствор превращался в густую суспензию. Через 50 минут после начала перегонки давление понижали до 130 мбар. Через 68 минут после начала перегонки замену растворителя завершали. Полученную в результате суспензию перемешивали в течение 2 часов при температуре окружающей среды и затем фильтровали. Полученные кристаллы сушили в вакуумной сушилке при 40°C в течение ночи, получая 35,8 г Формы С.
Пример 16: Получение Формы C
10 г Формы B (22,4 ммоль) растворяли в 350 мл ТГФ при перемешивании при температуре окружающей среды, фильтровали и фильтр промывали 40 мл ТГФ. В ходе замены растворителя при перегонке растворитель фильтрата заменяли этанолом при температуре 60°C и при пониженном давлении (100-300 мбар), в то же время объем сохраняли постоянным, непрерывно заменяя дистиллят всего 200 мл этанола. Кристаллизацию вызывали после добавления первых 20 мл этанола при затравке кристаллами Формы C. Полученную в результате суспензию перемешивали в течение 1 часа при температуре окружающей среды, затем фильтровали и промывали 50 мл этанола. Полученные кристаллы сушили в вакуумной сушилке при 50°C в течение ночи, получая 8,8 г (88%) Формы C.
Пример 17: Получение Формы C
82 г (177 ммоль) Формы B растворяли в 340 г ТГФ при 50°C.Добавляли 60 г этанола, чтобы приготовить 17% (масс/масс) раствор Формы В в смеси ТГФ/этанол 85:15 (масс/масс). Прозрачный раствор охлаждали до 35°C при перемешивании. Добавляли 10% (масс/масс) затравляющую суспензию 0,8 г Формы C, суспендированную в 7,2 г 50:50 (масс/масс) смеси ТГФ/этанол (10% (масс/масс) Формы C относительно конечного теоретического выхода), и реакционную смесь перемешивали в течение 30 минут при температуре окружающей среды. Давление уменьшали до 300 мбар, в то же время температуру увеличивали до 50°C. В ходе замены растворителя при перегонке объем сохраняли постоянным, непрерывно заменяя дистиллят всего 680 г этанола, который добавляли линейно (5,6 г/мин) в течение общего времени 120 минут. Давление в реакционной смеси уменьшали через 20 минут после добавления этанола до 230 мбар и через 50 минут после добавления всего этанола до 130 мбар. Через 115 минут после добавления этанола температуру постепенно понижали до 5°C при скорости охлаждения 1°C/мин (время охлаждения 30 минут). Суспензию перемешивали в течение 30 минут при 5°C, фильтровали и промывали 68 г этанола. Полученные кристаллы сушили при 40°C при 30 мбар в течение 16 часов, получая 98,5% Формы C.
Альтернативно, данное получение можно осуществить с ацетоном в качестве растворителя вместо ТГФ.
Альтернативно, данное получение можно осуществить с изопропанолом и/или н-гептаном в качестве антирастворителя вместо этанола.
Пример 18: Получение Формы C
16,32 г Формы B растворяли в 257 г ТГФ при 50°C.Чтобы удалить воду из раствора 172 г ТГФ отгоняли при пониженном давлении при 80°C.Затем этот безводный раствор продукта охлаждали до комнатной температуры.
К 238 г гептана при температуре -5°C 1,6 г (10% (масс/масс) относительно конечного теоретического выхода) Формы С добавляли при перемешивании в качестве затравочного вещества. Поддерживая температуру в рубашке постоянной при -5°C, полученной в результате суспензии давали циркулировать через мешалку с большими сдвиговыми усилиями со скоростью 20 л/ч, используя шланговый насос. Через 5 минут мешалку с большими сдвиговыми усилиями запускали со скоростью вращения от 15000 об/мин до 24000 об/мин и вышерассмотренный раствор продукта прокачивали со скоростью потока 1,6 г/мин непосредственно через инжектор в систему типа ротор-статор. После завершения добавления полученные в результате кристаллы фильтровали и сушили при 40°C при 30 мбар в течение 15 часов, получая 91% Формы С со средним размером частиц d50<10 мкм.
При осуществлении Примера 18 без затравки получали Форму A (смотрите Пример 5). Используя 2% (масс/масс) кристаллы затравки Формы C, получали смесь из Формы A (доминирующая) и C. Используя 5% (масс/масс) кристаллы затравки Формы C, получали смесь из Формы C (доминирующая) и A.
Пример 19: Получение Формы C
14,12 г Формы В растворяли в 240 г ТГФ при 50°C. Чтобы удалить воду из раствора, 160 г ТГФ отгоняли при пониженном давлении при 80°C. Безводный раствор охлаждали в течение 15 минут до 25°C и добавляли 0,07 г кристаллов затравки Формы C (0,5% (масс/масс) относительно конечного теоретического выхода). Через 30 минут перемешивания температуру понижали в течение 135 минут до 15°C и параллельно добавляли 9,0 г гептана. Полученную в результате суспензию перемешивали в течение 30 минут, затем температуру повышали в течение 15 минут до 35°C. Через 30 минут температуру снова уменьшали в течение 165 минут до 15°C и параллельно добавляли другие 11 г гептана. Через 30 минут перемешивания температуру снова увеличивали до 35°C и суспензию снова перемешивали в течение 30 минут. После этого температуру опять снижали до 15°C в течение 495 минут и параллельно добавляли 33 г гептана. Полученную в результате конечную суспензию перемешивали в течение дополнительных 120 минут, затем фильтровали, сушили при 40°C и 30 мбар в течение 16 часов, получая 94% Формы C со средним размером частиц d50>50 мкм.
Пример 20: Получение кристаллического (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанона трифторэтанола моносольвата в полиморфной форме D (Форма D)
40 мг Формы A уравновешивали в 400 мкл смеси 3:1 трифторэтанола/метанола (ТФЭ/МеОН) в течение 7 дней при комнатной температуре при круговом вращении с магнитной мешалкой в 2 мл ВЭЖХ стеклянных волнистых пробирках. После установления равновесия твердую фазу отделяли от жидкой фазы центрифугированием. Растворитель удаляли с помощью пипетки и с помощью полосок фильтровальной бумаги. Оставшиеся твердые вещества сушили при 40°C в вакуумной полочной сушилке до 10 часов при 20 мбар.
Пример 21: Получение Формы D
2 г Формы A растворяли в 20 мл смеси 3:1 трифторэтанола/метанола. Добавляли кристаллы затравки Формы D и смесь хранили закрытой при температуре окружающей среды в течение 3 дней. Оставшиеся кристаллы в форме колонок выделяли в ходе фильтрации (стеклянный фильтр) и сушили в вакуумной полочной сушилке (температура окружающей среды/20 мбар в течение 24 часов).
Пример 22: Получение кристаллического (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанона в безводной полиморфной форме E (Форма E)
50 мг Формы B подвергали циклам дегидратации/гидратации. При<5% rH наблюдалось обратимое превращение в Форму E при помощи контрольных XRPD анализов влажности.
Пример 23: Получение Формы E
50 мг Формы B помещали в десикатор, где образец сушили над концентрированной серной кислотой в течение 36 часов при температуре окружающей среды.
Пример 24: Получение аморфного (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанона (Аморфная Форма)
0,554 г Формы C растворяли в 4,0 мл дихлорметана в круглодонной колбе. Прозрачный раствор быстро концентрировали, используя роторный испаритель (40°C температура окружающей среды, вакуум постадийно уменьшали до 14 мбар). Остаток сушили в вакуумной полочной сушилке (50°C/<5 мбар в течение 2 дней), получая 0,498 г (90%) бесцветного порошка.
Пример 25: Получение Аморфной Формы
150 мг Формы A плавили при 160°C в стеклянной пробирке, используя струйную воздушную сушилку, и охлаждали до температуры окружающей среды, получая аморфное вещество.
Пример 26: Получение комплекса включения 1:1 (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанона с γ-циклодекстрином (γ-ЦД комплекс включения)
300 мг Формы A взвешивали в 20 мл стеклянной пробирке с завинчивающейся крышкой. Добавляли 6 мл деионизированной воды и γ-ЦД в молярном отношении 1:2. Суспензию уравновешивали при комнатной температуре в течение 32 дней при круговом вращении, используя мешалку Heidolph Reax 2 (VWR International AG, Dietikon, Switzerland). Отделение плотной жидкости проводили с фильтрующей центрифугой amicon Ultrafree-MC® (0,45 мкм Durapore ПВДФ мембраной, Millipore, Bedford, ΜΑ), получая кристаллы γ-ЦД комплекса включения.
Пример 27: Фазовый Анализ Растворимости
Фазовые диаграммы растворимости используют для описания комплексообразования между двумя соединениями и для представления растворимости АФИ как функции концентрации циклодекстрина. Фазовая диаграмма растворимости (1,1-диоксо-1λ6-тиоморфолин-4-ил)-{6-[3-(4-фтор-фенил)-5-метил-изоксазол-4-илметокси]-пиридин-3-ил}-метанона с γ-циклодекстрином показала Bs-тип поведения согласно классификации Хигучи [Т. Higuchi et al., Adv. Anal. Chem. Instrum. (1965) 4: 117-212] и Brewster [Μ.E. Brewster et al. Adv. Drug Delivery Rev. (2007) 59: 645-666] (фигура 20). Концентрация АФИ сначала повышалась с увеличивающейся концентрацией циклодекстрина вследствие комплексообразования АФИ с молекулами циклодекстрина. После первоначального увеличения растворимости лекарства достигалась максимальная растворимость комплекса и комплекс начинал выпадать в осадок, что указывает на образование менее растворимого комплекса включения (γ-ЦД комплекс включения). В конце пологого участка кривой израсходован целый твердый АФИ и дополнительное добавление АФИ будет приводить к уменьшению АФИ в растворе в ходе комплексообразования и сопутствующему осаждению нерастворимого комплекса. 150 мМ является пределом растворимости γ-циклодекстрина в водном растворе.
Константу связывания (К) γ-ЦД комплекса включения рассчитывали, исходя из начального прямолинейного участка фазовой диаграммы растворимости в ходе линейной регрессии, согласно следующему уравнению [Т. Higuchi et al., Adv. Anal. Chem. Instrum. (1965) 4:117-212]:
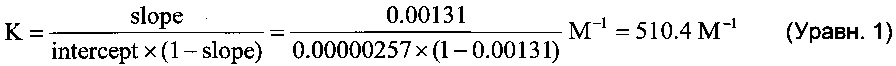
Константа связывания γ-ЦД комплекса включения, рассчитанная по уравнению (1), составляла 510,4 М-1. Константа связывания (К) является мерой сродства АФИ в отношении относительно аполярной полости ЦД. Желаемой ситуацией является наличие достаточного сродства, то есть увеличение концентрации всего растворенного лекарства, но еще возможна диссоциация комплекса с последующей абсорбцией АФИ. Константа связывания 510,4 М-1 в случае γ-ЦД комплекса включения находится в хорошем диапазоне и указывает на то, что должна быть выполнима пероральная твердая форма дозирования с увеличенной скоростью растворения.
Пример 28: Результаты растворения in vitro
Изучения растворения in vitro, выполненные в этой работе, проводили в миниатюризированной системе с 100 мл среды для растворения на эксперимент. По сравнению с 1000 мл сосудами традиционной аппаратуры фармакопеи США экспериментальная установка, которую использовали в этом изучении, была уменьшена и упрощена (магнитное перемешивание вместо лопастных мешалок, комнатная температура вместо 37°C). Эксперименты по растворению проводили в условиях неполного растворения (концентрация лекарства >10% значения растворимости). Искусственный желудочный сок (SGF) получали с 2 г/л NaCl и 1 г/л Triton® Х-100 в 0,1 н HCl. Полученный в результате измеренный pH SGF составил 1,2. Искусственный желудочный сок после еды (FeSSIF от simulated fed state intestinal fluid) получали, как прежде было изложено у Galia E. et al. (Pharm. Res. (1996) 13: S-262), и он содержал 15 мМ таурохолат натрия, 3,75 мМ лецитин и имел pH 5,0.
Пероральная абсорбция лекарственного соединения из твердой формы дозирования зависит от скорости растворения и растворимости. В настоящей работе растворение in vitro γ-ЦД комплекса включения сравнивали с тонкодисперсными порошками Формы A, Формы B и Формы C полиморфа. Фигура 21 представляет профили растворения, измеренные в искусственном желудочном соке (SGF), и Фигура 22 показывает профили растворения в искусственном желудочном соке после еды (FeSSIF). В обеих растворяющих средах γ-ЦД комплекс включения ведет себя совершенно отлично от тонкодисперсных порошков Формы A, Формы B и Формы C полиморфа. γ-ЦД комплекс включения достигал значительно большей исходной концентрации в SGF и FeSSIF, которая быстро уменьшалась в первые 60 минут до уровня, который сравним со значениями полиморфа C. В случае тонкодисперсных порошков полиморфов растворимость при насыщении определенных полиморфов относительно быстро достигалась 30 минут) и содержание растворенного лекарственного средства оставалось без изменений до конца эксперимента (180 минут). Изменения значений pH в растворенных исследуемых образцах, взятых в разные моменты времени, не наблюдались. Ранжирование разных твердых форм относительно скорости растворения и достигнутой максимальной концентрации лекарства было одинаковым в обеих средах. Различия в профилях растворения в SGF и FeSSIF можно объяснить разной композицией двух сред, поскольку растворение обычно зависит от ряда факторов, таких как pH, поверхностно-активное вещество, буферная емкость, ионная сила и т.п. Способность γ-ЦД комплекса включения образовывать супернасыщенный раствор обеспечивает многообещающие возможности к увеличению абсорбции in vivo и биодоступности при пероральном введении по сравнению с кристаллическими чистыми фазами Формы A, Формы B и Формы C.
Для сохранения перенасыщения, активированного γ-ЦД комплексом включения, может быть полезным добавление определенных ингибиторов осаждения, таких как гидроксипропилметилцеллюлоза (ГПМЦ), поливинилпирролидон (ПВП) и т.п., к конечной форме дозирования. Продление супернасыщенного состояния может сильно укрепить и улучшить in vivo абсорбцию и биодоступность.
![ТВЕРДЫЕ ФОРМЫ (1,1-ДИОКСО-4-ТИОМОРФОЛИНИЛ)-[6-[[3-(4-ФТОРФЕНИЛ)-5-МЕТИЛ-4-ИЗОКСАЗОЛИЛ]МЕТОКСИ]-3-ПИРИДИНИЛ]-МЕТАНОНА](https://fips.edrid.ru/images/rid/3a/d7/a8/95db029f9c6d822b23c6cb5e163f9911.png)
![ТВЕРДЫЕ ФОРМЫ (1,1-ДИОКСО-4-ТИОМОРФОЛИНИЛ)-[6-[[3-(4-ФТОРФЕНИЛ)-5-МЕТИЛ-4-ИЗОКСАЗОЛИЛ]МЕТОКСИ]-3-ПИРИДИНИЛ]-МЕТАНОНА](https://fips.edrid.ru/images/rid/3a/d7/a8/3f6e213e008c3a134e658afff367c9a8.png)
![ТВЕРДЫЕ ФОРМЫ (1,1-ДИОКСО-4-ТИОМОРФОЛИНИЛ)-[6-[[3-(4-ФТОРФЕНИЛ)-5-МЕТИЛ-4-ИЗОКСАЗОЛИЛ]МЕТОКСИ]-3-ПИРИДИНИЛ]-МЕТАНОНА](https://fips.edrid.ru/images/rid/3a/d7/a8/818f39c28708db1dba210aeadd8104de.jpg)
![ТВЕРДЫЕ ФОРМЫ (1,1-ДИОКСО-4-ТИОМОРФОЛИНИЛ)-[6-[[3-(4-ФТОРФЕНИЛ)-5-МЕТИЛ-4-ИЗОКСАЗОЛИЛ]МЕТОКСИ]-3-ПИРИДИНИЛ]-МЕТАНОНА](https://fips.edrid.ru/images/rid/3a/d7/a8/d149d1b5427c7022e76f21c8c1f31812.png)
![ТВЕРДЫЕ ФОРМЫ (1,1-ДИОКСО-4-ТИОМОРФОЛИНИЛ)-[6-[[3-(4-ФТОРФЕНИЛ)-5-МЕТИЛ-4-ИЗОКСАЗОЛИЛ]МЕТОКСИ]-3-ПИРИДИНИЛ]-МЕТАНОНА](https://fips.edrid.ru/images/rid/3a/d7/a8/35bda0297c88398ff97259ba4d89eb82.png)
![ТВЕРДЫЕ ФОРМЫ (1,1-ДИОКСО-4-ТИОМОРФОЛИНИЛ)-[6-[[3-(4-ФТОРФЕНИЛ)-5-МЕТИЛ-4-ИЗОКСАЗОЛИЛ]МЕТОКСИ]-3-ПИРИДИНИЛ]-МЕТАНОНА](https://fips.edrid.ru/images/rid/3a/d7/a8/d090044c7ea690008f9099c1d2455737.png)
![ТВЕРДЫЕ ФОРМЫ (1,1-ДИОКСО-4-ТИОМОРФОЛИНИЛ)-[6-[[3-(4-ФТОРФЕНИЛ)-5-МЕТИЛ-4-ИЗОКСАЗОЛИЛ]МЕТОКСИ]-3-ПИРИДИНИЛ]-МЕТАНОНА](https://fips.edrid.ru/images/rid/3a/d7/a8/8762b4f9108a16a22da614aeda0f8d0d.png)
![ТВЕРДЫЕ ФОРМЫ (1,1-ДИОКСО-4-ТИОМОРФОЛИНИЛ)-[6-[[3-(4-ФТОРФЕНИЛ)-5-МЕТИЛ-4-ИЗОКСАЗОЛИЛ]МЕТОКСИ]-3-ПИРИДИНИЛ]-МЕТАНОНА](https://fips.edrid.ru/images/rid/3a/d7/a8/58470bcf4e3b73a408758f77c646270b.png)
![ТВЕРДЫЕ ФОРМЫ (1,1-ДИОКСО-4-ТИОМОРФОЛИНИЛ)-[6-[[3-(4-ФТОРФЕНИЛ)-5-МЕТИЛ-4-ИЗОКСАЗОЛИЛ]МЕТОКСИ]-3-ПИРИДИНИЛ]-МЕТАНОНА](https://fips.edrid.ru/images/rid/3a/d7/a8/c57d0a01a9167d8fbd83a639c9953ecc.png)
![ТВЕРДЫЕ ФОРМЫ (1,1-ДИОКСО-4-ТИОМОРФОЛИНИЛ)-[6-[[3-(4-ФТОРФЕНИЛ)-5-МЕТИЛ-4-ИЗОКСАЗОЛИЛ]МЕТОКСИ]-3-ПИРИДИНИЛ]-МЕТАНОНА](https://fips.edrid.ru/images/rid/3a/d7/a8/a2b756a716329f110e5b910f374b903c.png)
![ТВЕРДЫЕ ФОРМЫ (1,1-ДИОКСО-4-ТИОМОРФОЛИНИЛ)-[6-[[3-(4-ФТОРФЕНИЛ)-5-МЕТИЛ-4-ИЗОКСАЗОЛИЛ]МЕТОКСИ]-3-ПИРИДИНИЛ]-МЕТАНОНА](https://fips.edrid.ru/images/rid/3a/d7/a8/af2c74bc3ff8e39cf21cbc3f1a0f11aa.png)
![ТВЕРДЫЕ ФОРМЫ (1,1-ДИОКСО-4-ТИОМОРФОЛИНИЛ)-[6-[[3-(4-ФТОРФЕНИЛ)-5-МЕТИЛ-4-ИЗОКСАЗОЛИЛ]МЕТОКСИ]-3-ПИРИДИНИЛ]-МЕТАНОНА](https://fips.edrid.ru/images/rid/3a/d7/a8/eebfb0085d2d19240aef129441198708.png)
![ТВЕРДЫЕ ФОРМЫ (1,1-ДИОКСО-4-ТИОМОРФОЛИНИЛ)-[6-[[3-(4-ФТОРФЕНИЛ)-5-МЕТИЛ-4-ИЗОКСАЗОЛИЛ]МЕТОКСИ]-3-ПИРИДИНИЛ]-МЕТАНОНА](https://fips.edrid.ru/images/rid/3a/d7/a8/f3c9f936f28c1c4ea31974ad04f88a60.png)
![ТВЕРДЫЕ ФОРМЫ (1,1-ДИОКСО-4-ТИОМОРФОЛИНИЛ)-[6-[[3-(4-ФТОРФЕНИЛ)-5-МЕТИЛ-4-ИЗОКСАЗОЛИЛ]МЕТОКСИ]-3-ПИРИДИНИЛ]-МЕТАНОНА](https://fips.edrid.ru/images/rid/3a/d7/a8/feb2e0368ec49bedf2d3baec95b6dee1.png)
![ТВЕРДЫЕ ФОРМЫ (1,1-ДИОКСО-4-ТИОМОРФОЛИНИЛ)-[6-[[3-(4-ФТОРФЕНИЛ)-5-МЕТИЛ-4-ИЗОКСАЗОЛИЛ]МЕТОКСИ]-3-ПИРИДИНИЛ]-МЕТАНОНА](https://fips.edrid.ru/images/rid/3a/d7/a8/6cb0c9b54269240468d25b8905831189.png)
![ТВЕРДЫЕ ФОРМЫ (1,1-ДИОКСО-4-ТИОМОРФОЛИНИЛ)-[6-[[3-(4-ФТОРФЕНИЛ)-5-МЕТИЛ-4-ИЗОКСАЗОЛИЛ]МЕТОКСИ]-3-ПИРИДИНИЛ]-МЕТАНОНА](https://fips.edrid.ru/images/rid/3a/d7/a8/1b3b0636325ceb89dc2755ec7e0f6cdd.png)
![ТВЕРДЫЕ ФОРМЫ (1,1-ДИОКСО-4-ТИОМОРФОЛИНИЛ)-[6-[[3-(4-ФТОРФЕНИЛ)-5-МЕТИЛ-4-ИЗОКСАЗОЛИЛ]МЕТОКСИ]-3-ПИРИДИНИЛ]-МЕТАНОНА](https://fips.edrid.ru/images/rid/3a/d7/a8/29b7e9cbb45da75992300b90bea5e795.png)
![ТВЕРДЫЕ ФОРМЫ (1,1-ДИОКСО-4-ТИОМОРФОЛИНИЛ)-[6-[[3-(4-ФТОРФЕНИЛ)-5-МЕТИЛ-4-ИЗОКСАЗОЛИЛ]МЕТОКСИ]-3-ПИРИДИНИЛ]-МЕТАНОНА](https://fips.edrid.ru/images/rid/3a/d7/a8/f854a61188e707a34514933afac8e6e0.png)
![ТВЕРДЫЕ ФОРМЫ (1,1-ДИОКСО-4-ТИОМОРФОЛИНИЛ)-[6-[[3-(4-ФТОРФЕНИЛ)-5-МЕТИЛ-4-ИЗОКСАЗОЛИЛ]МЕТОКСИ]-3-ПИРИДИНИЛ]-МЕТАНОНА](https://fips.edrid.ru/images/rid/3a/d7/a8/1f20078a31b96ec50830c377cff2fc55.png)
![ТВЕРДЫЕ ФОРМЫ (1,1-ДИОКСО-4-ТИОМОРФОЛИНИЛ)-[6-[[3-(4-ФТОРФЕНИЛ)-5-МЕТИЛ-4-ИЗОКСАЗОЛИЛ]МЕТОКСИ]-3-ПИРИДИНИЛ]-МЕТАНОНА](https://fips.edrid.ru/images/rid/3a/d7/a8/99690e340e75698a8edcfc6e4dff7e30.jpg)
![ТВЕРДЫЕ ФОРМЫ (1,1-ДИОКСО-4-ТИОМОРФОЛИНИЛ)-[6-[[3-(4-ФТОРФЕНИЛ)-5-МЕТИЛ-4-ИЗОКСАЗОЛИЛ]МЕТОКСИ]-3-ПИРИДИНИЛ]-МЕТАНОНА](https://fips.edrid.ru/images/rid/3a/d7/a8/72e8c1fc3bc1c22e58cd05f81392b6f6.png)
![ТВЕРДЫЕ ФОРМЫ (1,1-ДИОКСО-4-ТИОМОРФОЛИНИЛ)-[6-[[3-(4-ФТОРФЕНИЛ)-5-МЕТИЛ-4-ИЗОКСАЗОЛИЛ]МЕТОКСИ]-3-ПИРИДИНИЛ]-МЕТАНОНА](https://fips.edrid.ru/images/rid/3a/d7/a8/935d8ad697bd35e8e0af89ce923312b0.png)
![ТВЕРДЫЕ ФОРМЫ (1,1-ДИОКСО-4-ТИОМОРФОЛИНИЛ)-[6-[[3-(4-ФТОРФЕНИЛ)-5-МЕТИЛ-4-ИЗОКСАЗОЛИЛ]МЕТОКСИ]-3-ПИРИДИНИЛ]-МЕТАНОНА](https://fips.edrid.ru/images/rid/3a/d7/a8/e1bed00f9aa8b6e83b4e59f577e44e2b.png)
![ТВЕРДЫЕ ФОРМЫ (1,1-ДИОКСО-4-ТИОМОРФОЛИНИЛ)-[6-[[3-(4-ФТОРФЕНИЛ)-5-МЕТИЛ-4-ИЗОКСАЗОЛИЛ]МЕТОКСИ]-3-ПИРИДИНИЛ]-МЕТАНОНА](https://fips.edrid.ru/images/rid/3a/d7/a8/1d9d3bb38ad684e710a090ffa769519a.png)
![ТВЕРДЫЕ ФОРМЫ (1,1-ДИОКСО-4-ТИОМОРФОЛИНИЛ)-[6-[[3-(4-ФТОРФЕНИЛ)-5-МЕТИЛ-4-ИЗОКСАЗОЛИЛ]МЕТОКСИ]-3-ПИРИДИНИЛ]-МЕТАНОНА](https://fips.edrid.ru/images/rid/3a/d7/a8/f7f547b3d5eae9f54b82ebbb540f4d5a.png)

