Результат интеллектуальной деятельности: ИНГИБИРУЮЩЕЕ ВОЛОКНО ПРОТИВ ОБРАЗОВАНИЯ ФАКТОРОВ ВИРУЛЕНТНОСТИ И СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к ингибирующему волокну против образования факторов вирулентности, включающему волокно и ингибирующий образование факторов вирулентности компонент, соединенный с волокном химическими связями, и к способу изготовления ингибирующего волокна против образования факторов вирулентности.
Уровень техники
Для лечения инфекционных заболеваний используются антибактериальные лекарственные средства, такие как антибиотики. Однако в результате чрезмерного использования антибактериальных лекарственных средств появились резистентные к множеству лекарственных средств бактерии, которые являются устойчивыми к антибиотикам и вызывают внутрибольничные инфекции. Поскольку в настоящее время отсутствует эффективный способ лечения внутрибольничных инфекций, эта серьезная медицинская проблема остается нерешенной. Примеры основных вирулентных бактерий, которые вызывают внутрибольничные инфекции, включают синегнойную палочку (Pseudomonas aeruginosa) и золотистый стафилококк (Staphylococcus aureus). Как синегнойная палочка, так и золотистый стафилококк являются типичными оппортунистическими патогенами по отношению к человеку. Пациенты могут быть инфицированы этими бактериями при ослаблении своей иммунной функции, и инфекция может время от времени приводить к смерти. Хотя оба эти вида вирулентных бактерий имеют высокую устойчивость к дезинфицирующим средствам и антибиотикам по своей природе, существует также множество бактерий, которые приобрели устойчивость к лекарственным средствам. Таким образом, оказывается затруднительным лечение заболеваний, когда они развиваются.
Как разъясняется выше, антибиотики не являются эффективными по отношению к вирулентным бактериям, которые приобрели устойчивость к лекарственным средствам (в частности, устойчивость к множеству лекарственных средств). То есть, поскольку существуют ограничения по использованию антибактериальных лекарственных средств, включая антибиотики, желательной становится разработка терапевтических и профилактических лекарственных средств, имеющих совершенно иные механизмы действия по сравнению с антибиотиками. В последние годы было обнаружено, что молекулы клеточной сигнализации, так называемые автоиндукторы, которые производятся множеством вирулентных бактерий, включая резистентные к множеству лекарственных средств бактерии, способствуют образованию факторов вирулентности (токсинов) бактериями. Автоиндукторы имеют различные структуры в зависимости от того или иного штамма. В частности, автоиндукторы, производимые грамотрицательными бактериями, и автоиндукторы, производимые грамположительными бактериями, имеют совершенно различные структуры. В то время как автоиндукторы, производимые грамотрицательными бактериями, представляют собой соединения, называемые гомосеринлактонами, автоиндукторы, производимые грамположительными бактериями, представляют собой циклические олигопептиды.
Таким образом, были сделаны попытки снижения патогенности вирулентных бактерий путем регулирования уровня их автоиндукторов. Для ингибирования действия автоиндукторов Принстонский университет, компания University Technologies International Inc. и другие в 2003 г. предложили способ, использующий вещество, структурно подобное автоиндукторам (т.е. аналог) (патентный документ 1), а компания Haptogen Ltd. в 2006 г. предложила способ, использующий автоиндукторные антитела (патентный документ 2), чтобы ингибировать производство токсинов бактериями. Эти способы не производят селективного давления, потому что они ингибируют не рост вирулентных бактерий, а только производство токсинов, и, таким образом, они привлекают внимание как возможные терапевтические и профилактические лекарственные средства против инфекционных заболеваний, которые с меньшей вероятностью приводят к возникновению устойчивых бактерий. Кроме того, некоторые из авторов настоящего изобретения предложили использование этилендиаминтетраацетата (EDTA) для ингибирования производства токсинов бактериями (патентный документ 3). Кроме того, непатентный документ 1 описывает, что активность полифосфаткиназы (PPK) ослабляется путем инактивации генов PPK, что уменьшает накопление полифосфата в клетках вирулентных бактерий, и в результате этого сокращается синтез автоиндукторов и ингибируется образование факторов вирулентности. Вещества, предлагаемые в этих патентных документах, действительно являются эффективными, но их использование в реальной медицинской практике оказывается затруднительным.
Документы предшествующего уровня техники
Патентные документы
Патентный документ 1: JP 2003-532698 A
Патентный документ 2: JP 2006-508910 A
Патентный документ 3: JP 2010-095489 A
Непатентный документ
Непатентный документ 1: M. Harunur Rashid et al., “Polyphosphate kinase is essential for biofilm development, quotum sensing, and virulence of Pseudomonas aeruginosa”, PNAS, Vol. 97, No. 17, pp. 9636 to 9641, August, 15, 2000.
Сущность изобретения
Проблема, решаемая изобретением
С учетом вышеизложенного настоящее изобретение предлагает ингибирующее волокно против образования факторов вирулентности, включающее волокно и определенный ингибирующий образование факторов вирулентности компонент, соединенный с волокном химическими связями, которое можно использовать в реальной медицинской практике. Настоящее изобретение также предлагает способы изготовления ингибирующего волокна против образования факторов вирулентности.
Средства решения проблемы
Ингибирующее волокно против образования факторов вирулентности согласно настоящему изобретению представляет собой ингибирующее волокно против образования факторов вирулентности, включающее волокно и ингибирующий образование факторов вирулентности компонент, соединенный с волокном химическими связями. Ингибирующий образование факторов вирулентности компонент включает по меньшей мере один компонент, выбранный из группы, которую составляют содержащее фосфатную группу соединение, содержащее карбоксильную группу соединение и содержащее кетонную группу соединение.
Один способ изготовления ингибирующего волокна против образования факторов вирулентности согласно настоящему изобретению представляет собой способ изготовления ингибирующего волокна против образования факторов вирулентности, включающего волокно и ингибирующий образование факторов вирулентности компонент, соединенный с волокном химическими связями. Данный способ включает облучение волокна электронным пучком и приведение в контакт с волокном по меньшей мере одного соединения, выбранного из группы, которую составляют содержащее фосфатную группу соединение, содержащее карбоксильную группу соединение и содержащее кетонную группу соединение, для химического связывания по меньшей мере одного соединения с волокном.
Еще один способ изготовления ингибирующего волокна против образования факторов вирулентности согласно настоящему изобретению представляет собой способ изготовления ингибирующего волокна против образования факторов вирулентности, включающего целлюлозное волокно и ингибирующий образование факторов вирулентности компонент, соединенный с целлюлозным волокном химическими связями. Данный способ включает приведение водного раствора, содержащего фосфорную кислоту и мочевину, в контакт с целлюлозным волокном для химического связывания сложного эфира фосфорной кислоты с целлюлозным волокном.
Эффекты изобретения
Согласно настоящему изобретению ингибирующий образование факторов вирулентности компонент (ингибитор образования факторов вирулентности), включающий по меньшей мере одно соединение, выбранное из группы, которую составляют содержащее фосфатную группу соединение, содержащее карбоксильную группу соединение и содержащее кетонную группу соединение, соединяется с волокном химическими связями. Таким образом, становится возможным предложить ингибирующее волокно против образования факторов вирулентности, обладающее способностью ингибирования образования факторов вирулентности и пригодное к использованию в реальной медицинской практике. Кроме того, поскольку ингибирующий образование факторов вирулентности компонент не удаляется даже при промывании волокна, способность волокна ингибировать образование факторов вирулентности обладает высокой устойчивостью к промыванию. Кроме того, считается, что ингибирующее волокно против образования факторов вирулентности согласно настоящему изобретению ингибирует образование факторов вирулентности посредством ингибирования бактерий, обладающих способностью дистанционного взаимодействия, т.е. производящих автоиндукторы бактерий в отношении образования автоиндукторов. Кроме того, ингибирующее волокно против образования факторов вирулентности согласно настоящему изобретению также производит ингибирующее действие на образование факторов вирулентности грибами. Способы изготовления согласно настоящему изобретению обеспечивают введение ингибирующего образование факторов вирулентности компонента в волокно, такое как целлюлозное волокно, эффективным и рациональным образом.
Краткое описание чертежей
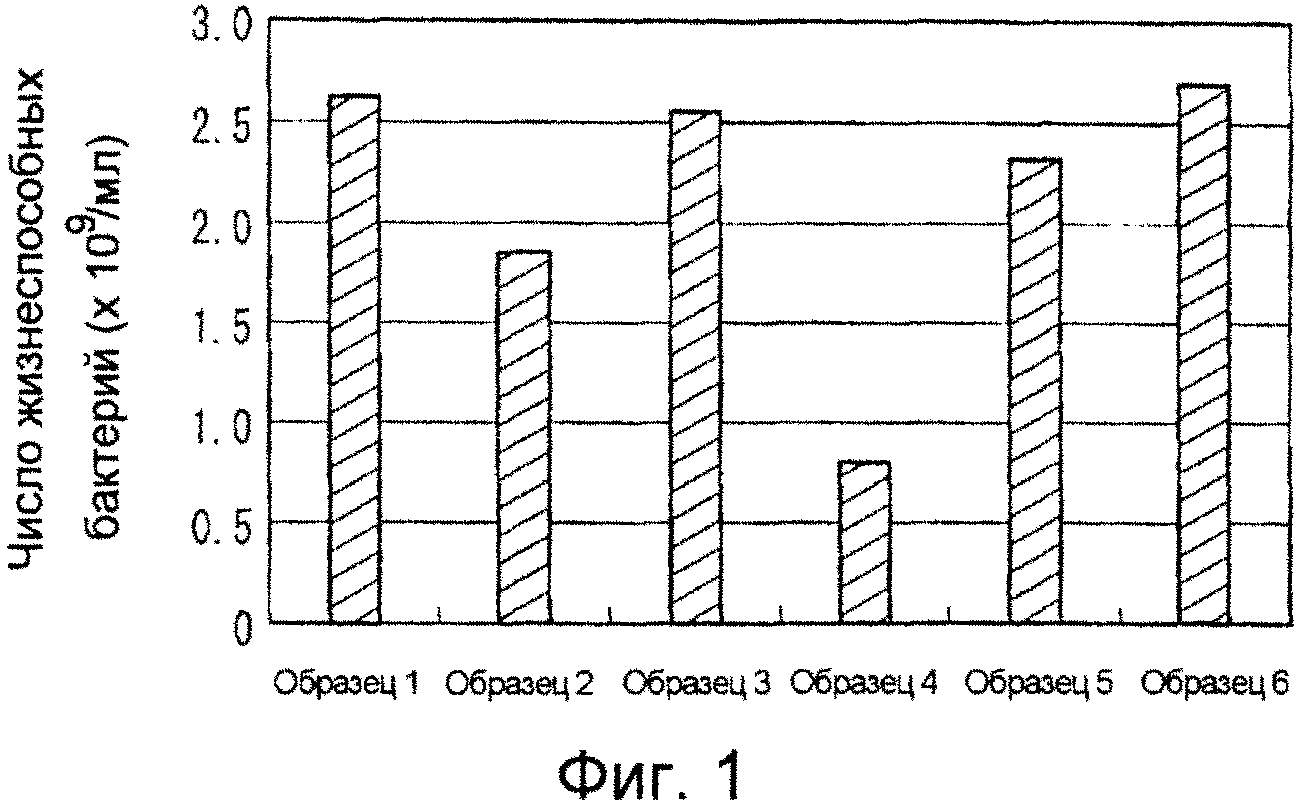
[Фиг. 1] Фиг. 1 представляет график, иллюстрирующий воздействие материалов согласно примерам и сравнительному примеру настоящего изобретения на число жизнеспособных бактерий.
[Фиг. 2] Фиг. 2 представляет график, иллюстрирующий воздействие материалов согласно примерам и сравнительному примеру настоящего изобретения на количество производимого пиоцианина (относительное значение).
[Фиг. 3] Фиг. 3 представляет график, иллюстрирующий воздействие материалов согласно примерам и сравнительному примеру настоящего изобретения на количество производимого пиоцианина по отношению к числу жизнеспособных бактерий (относительное значение).
Описание изобретения
Согласно настоящему изобретению ингибирующий образование факторов вирулентности компонент включающий по меньшей мере одно соединение, выбранное из группы, которую составляют содержащее фосфатную группу соединение, содержащее карбоксильную группу (группу карбоновой кислоты) соединение и содержащее кетонную группу соединение, соединяется с волокном химическими связями. Содержащее фосфатную группу соединение предпочтительно представляет собой одно или несколько соединений, выбранных из группы, которую составляют сложный эфир фосфорной кислоты и фосфат. Содержащее карбоксильную группу соединение предпочтительно представляет собой одно или несколько соединений, выбранных из группы, которую составляют акрилат и иминодиацетат. Содержащее кетонную группу соединение не ограничивается определенным образом. Однако оказывается предпочтительным использовать, например, ацетилацетон, бензоилацетон, диацетон и т.п., причем более предпочтительным является использование одного или нескольких соединений, выбранных из группы, которую составляют моноацетоацетатмонометакрилат этиленгликоля и диацетонакриламид. Соотношение ингибирующего образование факторов вирулентности компонента и волокна составляет предпочтительно от 0,01 до 3 ммоль/г и предпочтительнее от 0,1 до 1,5 ммоль/г. Соотношение в вышеупомянутых пределах обеспечивает сохранение на высоком уровне ингибирующей способности против образования факторов вирулентности и не нарушает волоконное наполнение.
Волокна, которые можно использовать согласно настоящему изобретению, не ограничиваются определенным образом, но предпочтительно представляют собой, например, целлюлозные волокна, полиэтиленовые волокна, полипропиленовые волокна, нейлоновые волокна и поливинилспиртовые волокна, пригодные для привитой полимеризации под действием электронного пучка. В частности, волокно предпочтительно включает целлюлозное волокно, которое может представлять собой, например, хлопковое, льняное, вискозное или медно-аммиачное волокно. Оказывается предпочтительным, чтобы целлюлозное волокно составляло от 10 до 100% масс. всей массы волокна. Волокно может присутствовать в любой форме, такой как пряжа, неочищенное волокно, лента или полотно. Кроме того, материал может представлять собой любой материал, такой как тканый материал, трикотажный материал или нетканый материал.
Первый способ изготовления согласно настоящему изобретению включает облучение волокна электронным пучком и приведение в контакт с волокном по меньшей мере одного соединения, выбранного из группы, которую составляют содержащее фосфатную группу соединение, содержащее карбоксильную группу соединение и содержащее кетонную группу соединение, для химического связывания, предпочтительно путем прививки, по меньшей мере одного соединения к волокну. Стадию облучения электронным пучком можно осуществлять до и/или после стадии приведения в контакт с волокном по меньшей мере одного соединения, выбранного из группы, которую составляют содержащее фосфатную группу соединение, содержащее карбоксильную группу соединение и содержащее кетонную группу соединение. В любом случае по меньшей мере одно соединение можно химически связывать с волокном, предпочтительно путем прививки. Кроме того, нейтрализационную обработку щелочью можно осуществлять в качестве следующей стадии. Для нейтрализационной обработки щелочью оказывается предпочтительным использование водного раствора гидроксида щелочного металла, такого как NaOH, KOH или LiOH. Кроме того, можно не осуществлять нейтрализационную обработку за счет заблаговременного использования фосфата натрия, карбоксилата натрия, фосфата калия или фосфата лития.
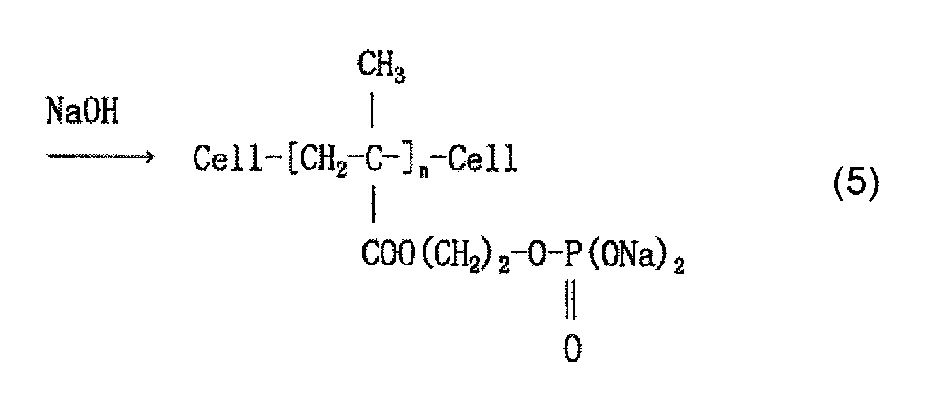
Когда используют, например, моно(2-метакрилоилоксиэтил)фосфат (он также известен как кислый фосфооксиэтилметакрилат и далее называется «P1M») в качестве содержащего фосфатную группу соединения и наносят P1M на целлюлозное волокно, считается, что облучение электронным пучком обеспечивает привитое связывание P1M и целлюлозы, как представлено в приведенной ниже формуле (2) и/или (3), и сложный эфир фосфорной кислоты (фосфат) образуется в результате нейтрализационной обработки, как представлено в приведенной ниже формуле (4) и/или (5).
[Химическая формула 1]
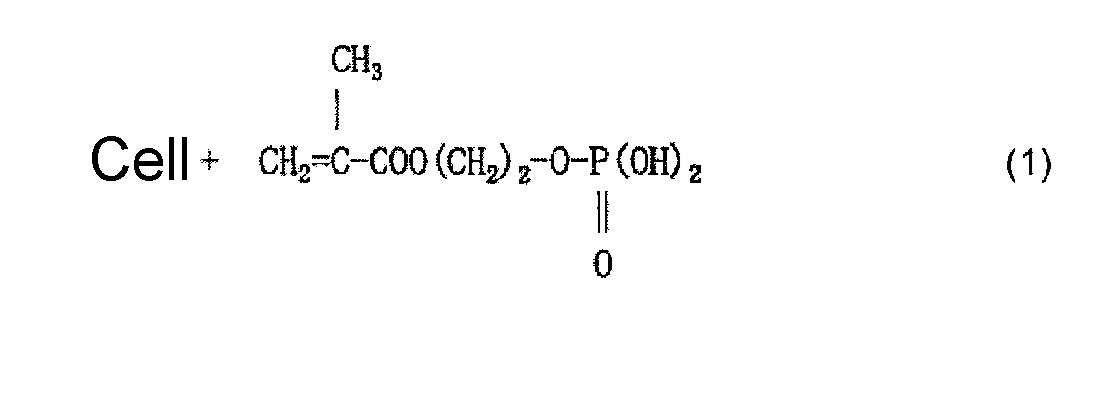
(где Cell означает целлюлозу; такое же обозначение используется и далее)
[Химическая формула 2]
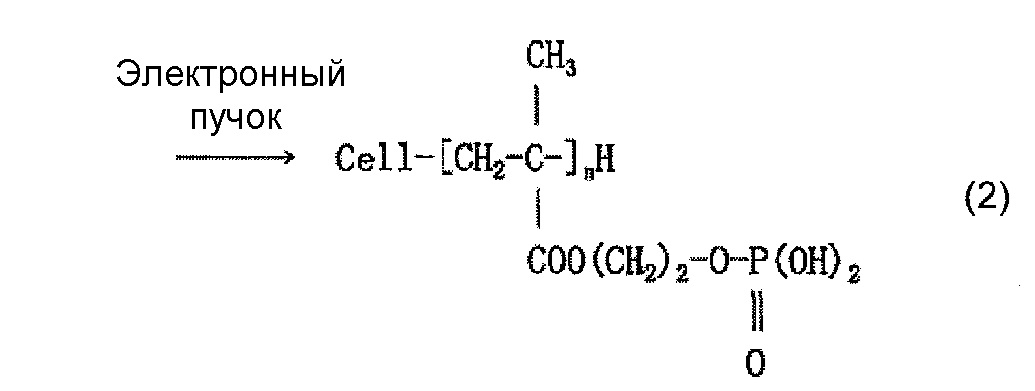
(где n означает целое число, составляющее 1 или более; такое же обозначение используется и далее)
[Химическая формула 3]
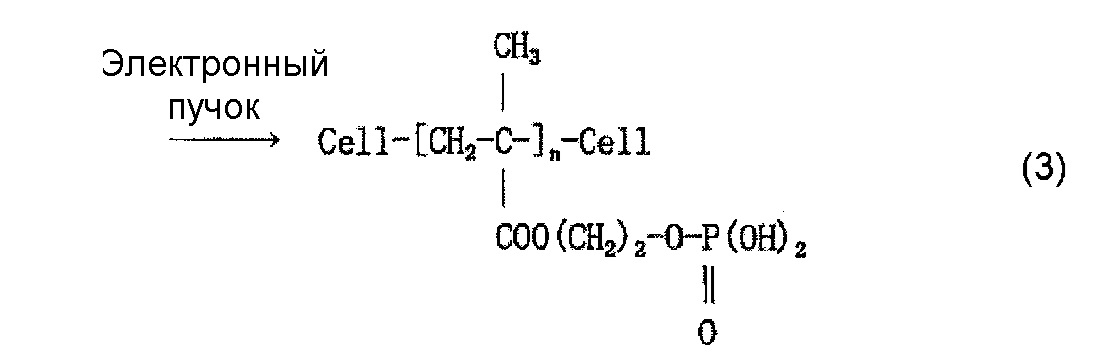
(где Cell... Cell означает, что соединение ([CH2-C-]n) связано с целлюлозой внутри молекулы; такое же обозначение используется и далее)
[Химическая формула 4]
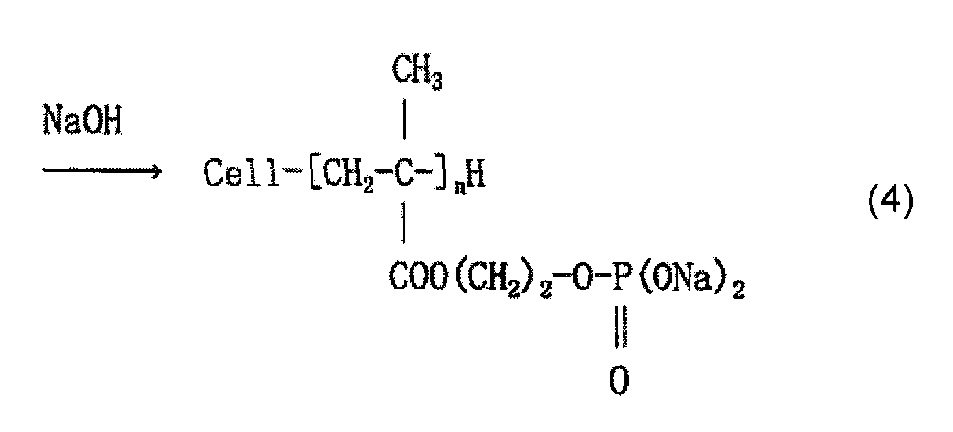
[Химическая формула 5]
Когда используется, например, акриловая кислота как содержащее карбоксильную группу соединение, и акриловую кислоту наносят на целлюлозное волокно, считается, что облучение электронным пучком обеспечивает привитое связывание акриловой кислоты и целлюлозы, как представлено в приведенной ниже формуле (7) и/или (8), и сложный эфир карбоновой кислоты (карбоксилат) образуется в результате нейтрализационной обработки, как представлено в приведенной ниже формуле (9) и/или (10).
[Химическая формула 6]
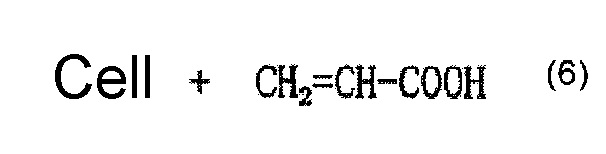
[Химическая формула 7]
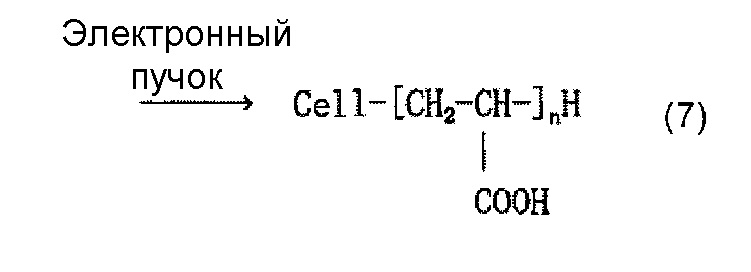
[Химическая формула 8]
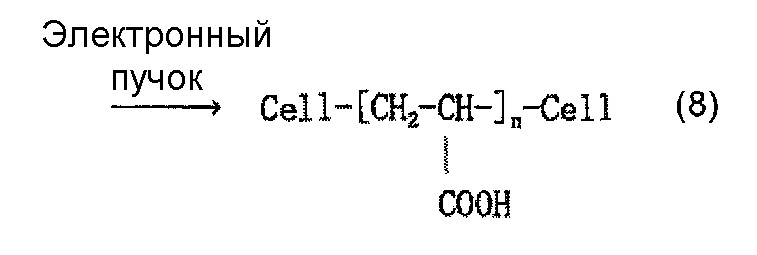
[Химическая формула 9]
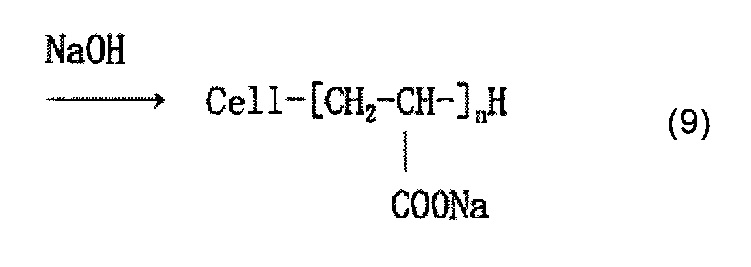
[Химическая формула 10]
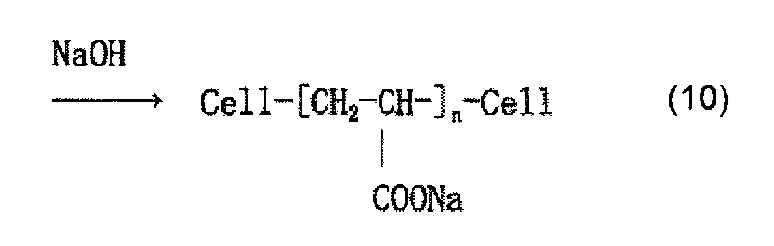
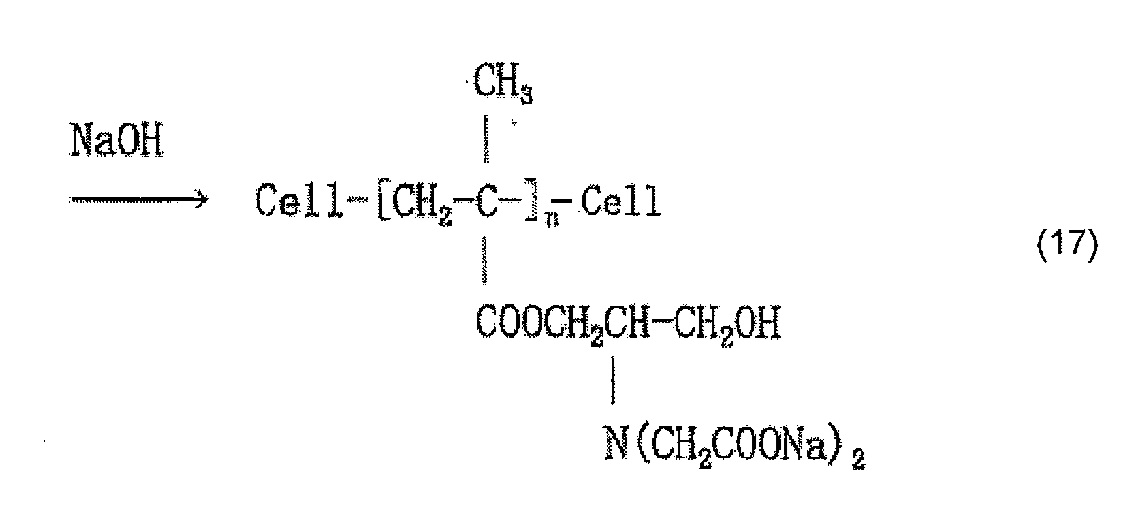
Когда осуществляют привитое связывание, например, глицидилметакрилата в качестве содержащего карбоксильную группу соединения и целлюлозного волокна, введение иминодиуксусной кислоты (хелатообразующей группы) и нейтрализационную обработку, считается, что облучение электронным пучком обеспечивает привитое связывание глицидилметакрилата и целлюлозы, как представлено в приведенной ниже формуле (12) и/или (13), иминодиуксусная кислота (хелатообразующая группа) вводится, как представлено в приведенной ниже формуле (14) и/или (15), и карбоксилат (иминодиацетат) образуется в результате нейтрализационной обработки, как представлено в приведенной ниже формуле (16) и/или (17) ниже.
[Химическая формула 11]
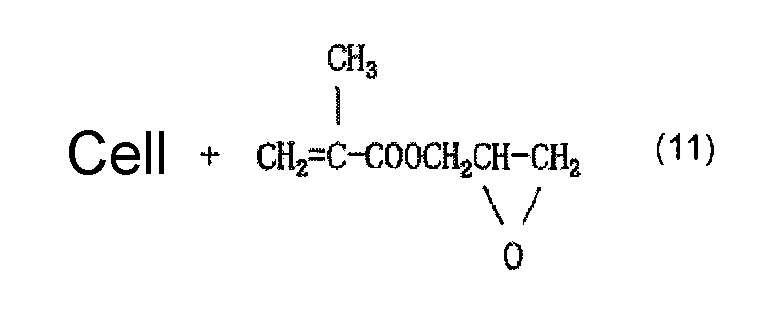
[Химическая формула 12]
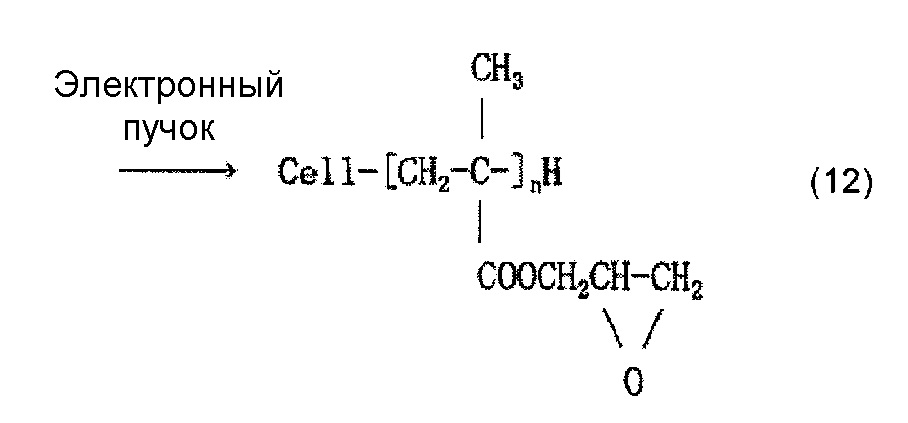
[Химическая формула 13]
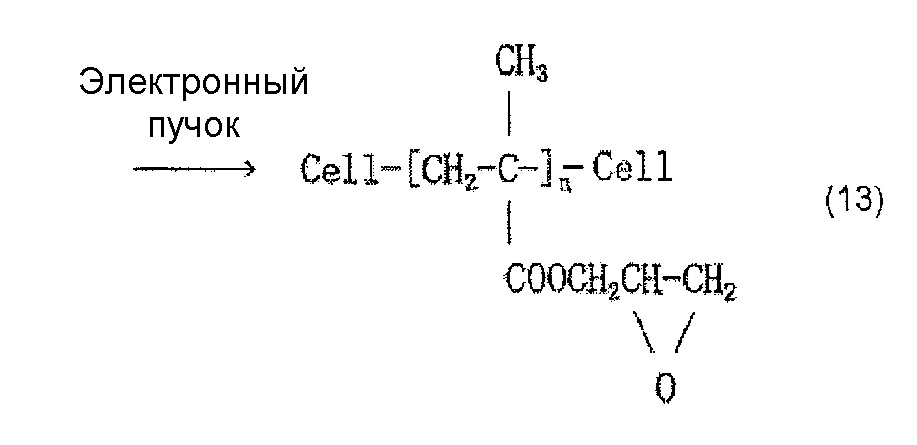
[Химическая формула 14]
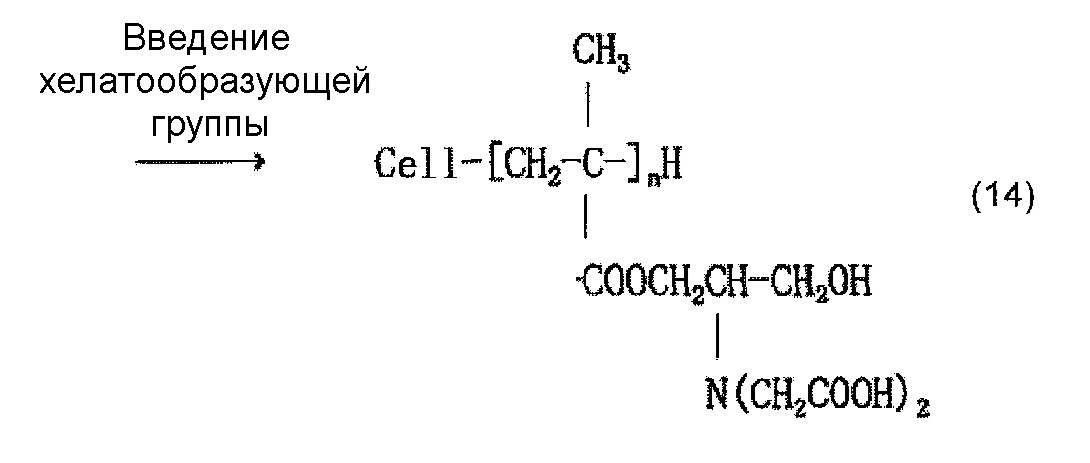
[Химическая формула 15]
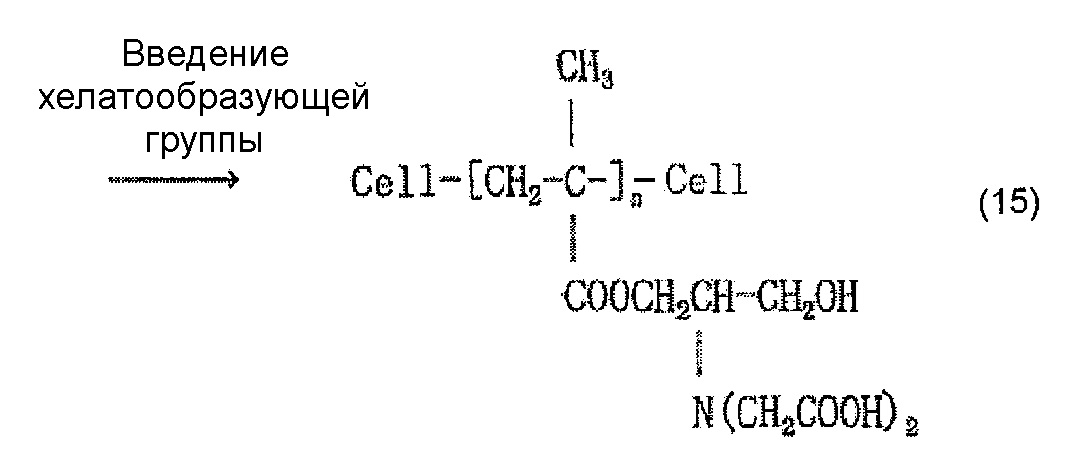
[Химическая формула 16]
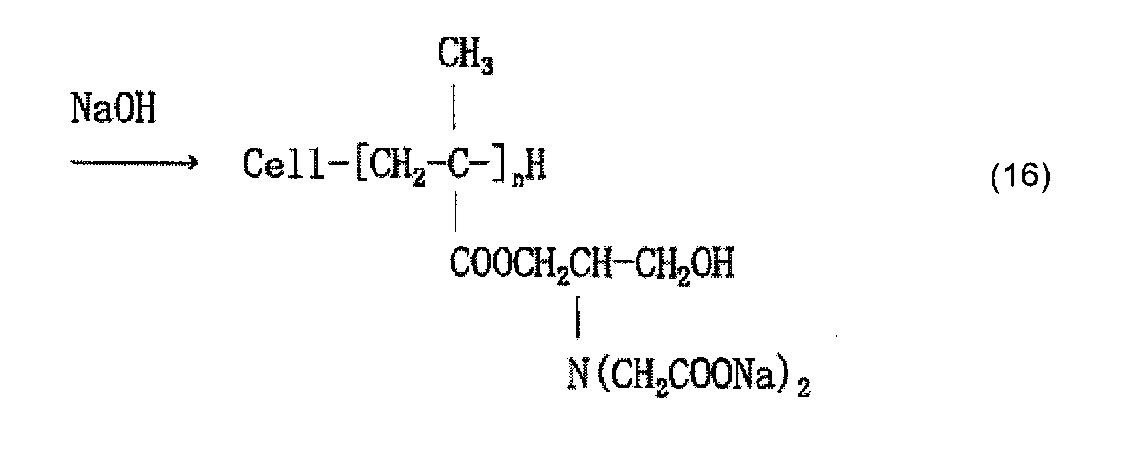
[Химическая формула 17]
Второй способ изготовления согласно настоящему изобретению включает приведение водного раствора, содержащего фосфорную кислоту и мочевину, в контакт с целлюлозным волокном для химического связывания, предпочтительно, ковалентного связывания сложного эфира фосфорной кислоты и целлюлозного волокна. Чтобы сделать введение сложного эфира фосфорной кислоты более эффективным, химическое связывание, предпочтительно, ковалентное связывание сложного эфира фосфорной кислоты и целлюлозного волокна достигается путем приведения водного раствора, содержащего фосфорную кислоту и мочевину, в контакт с целлюлозным волокном и термической обработки целлюлозного волокна. Например, целлюлозное волокно (материал) пропитывают водным раствором, содержащим фосфорную кислоту и мочевину (далее также называется раствор для обработки фосфорной кислотой) для ковалентного связывания сложного эфира фосфорной кислоты и целлюлозного волокна. Например, в одном растворе для обработки фосфорной кислотой (100% масс.) 85% масс. фосфорная кислота составляет до 10% масс., мочевина составляет до 30% масс., и вода составляет остальную массу раствора для обработки фосфорной кислотой. При этом значение pH предпочтительно составляет приблизительно 2,1. В еще одном растворе для обработки фосфорной кислотой (100% масс.) 85% масс. фосфорная кислота составляет до 10% масс., мочевина составляет до 30% масс., 28% масс. аммиачная вода составляет до 8% масс., и вода составляет остальную массу раствора для обработки фосфорной кислотой. При этом значение pH предпочтительно составляет приблизительно 6,5. Значение pH можно регулировать путем использования заданного количества аммиачной воды. Оказывается предпочтительным осуществление термической обработки при температуре от 100 до 180°C в течение от 0,5 до 5 минут. Посредством этой обработки, например, 0,1% масс. или более, предпочтительно 2-8% масс., особенно предпочтительно 5-8% масс. сложного эфира фосфорной кислоты можно ковалентно присоединить к целлюлозному волокну. Нейтрализацию щелочью можно осуществлять после стадии химического связывания.
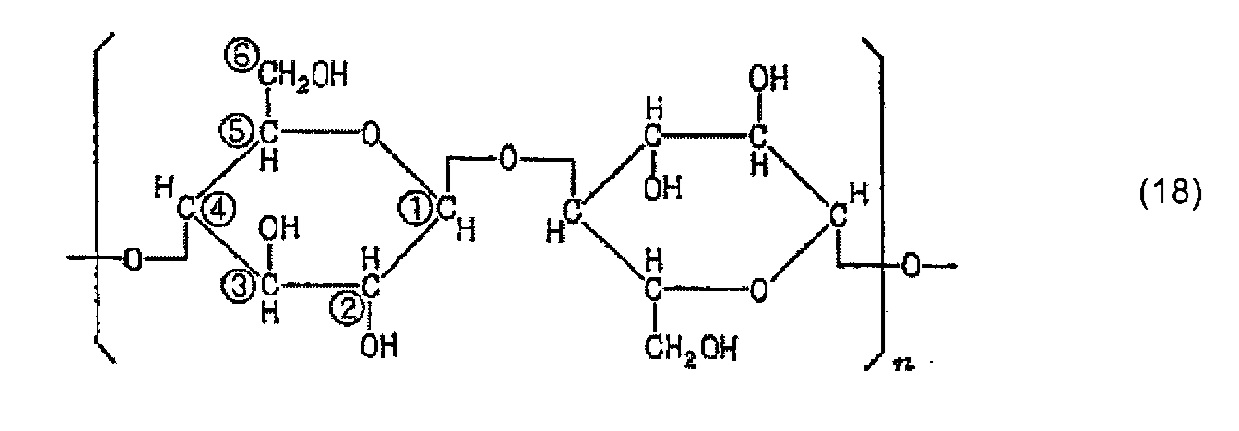
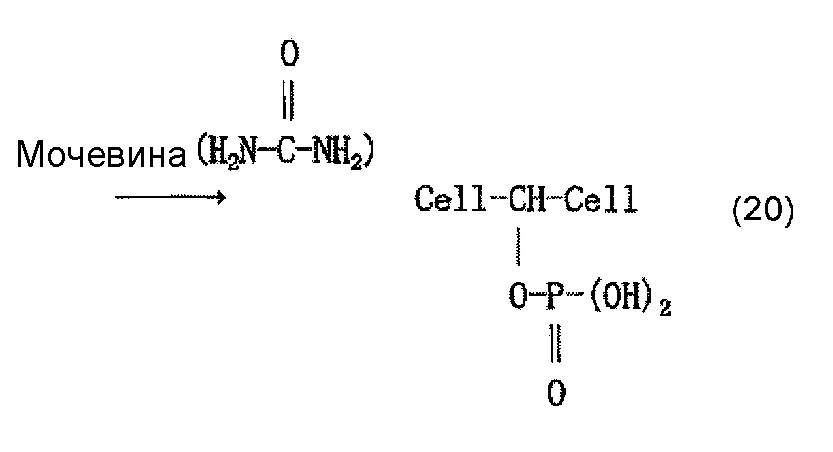
Молекулу целлюлозы представляет приведенная ниже формула (18) (где n представляет собой целое число, составляющее 1 или более). Молекула целлюлозы содержит имеющие высокую реакционную способность гидроксильные группы, занимающие положения при атомах С-2, C-3 и С-6 глюкозного остатка, и считается, что фосфорная кислота образует сложноэфирные связи с глюкозным остатком в этих положениях. Приведенная ниже формула (20) представляет пример, в котором фосфорная кислота образует сложноэфирную связь с глюкозным остатком в положении при атоме С-2. В формуле (20) группа -CH-, с которой фосфорная кислота образует сложноэфирную связь, представляет собой углеводородную группу в целлюлозной цепи. После этого фосфат образуется в результате нейтрализационной обработки, как представляет приведенная ниже формула (21).
[Химическая формула 18]
[Химическая формула 19]
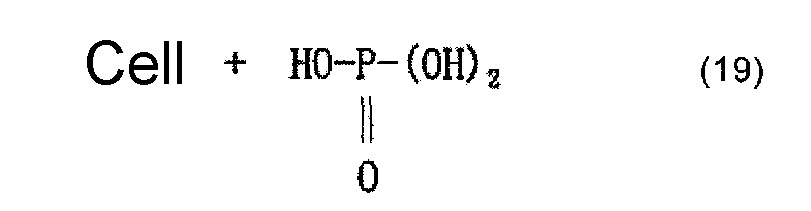
[Химическая формула 20]
[Химическая формула 21]
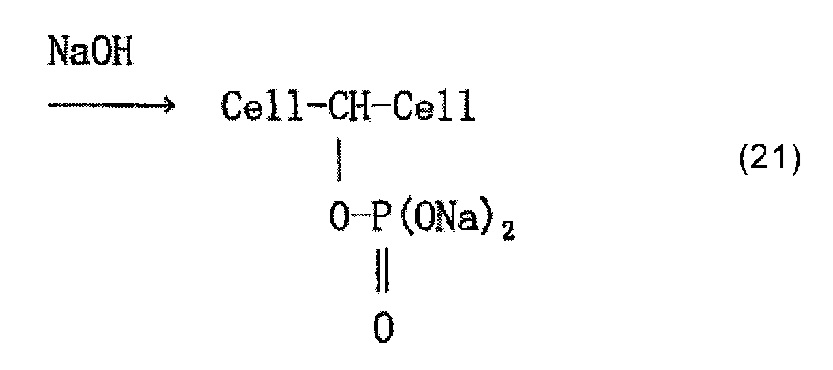
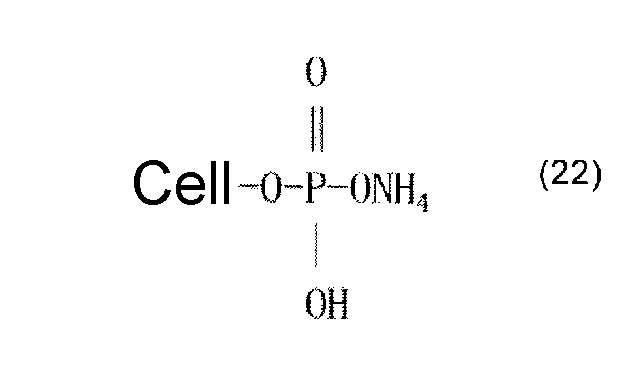
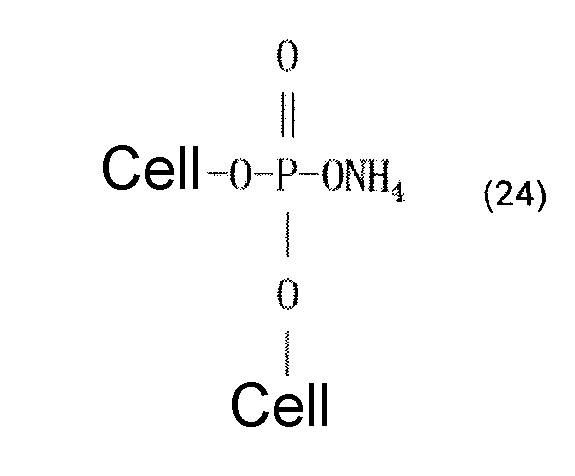
В качестве альтернативы, считается, что может образовываться сложный эфир фосфорной кислоты, который представляют приведенные ниже формулы (22)-(24). В формуле (22) молярное соотношение фосфора и азота составляет 1:1. Формулы (23) и (24) представляют обогащенные фосфором сложноэфирные соединения, причем соединение, представленное формулой (24), имеет сшитую структуру. Считается, что когда соединения, представленные формулами (22)-(24), промывают разбавленной хлористоводородной кислотой или разбавленной щелочью, азот выделяется в форме аммиака.
[Химическая формула 22]
[Химическая формула 23]
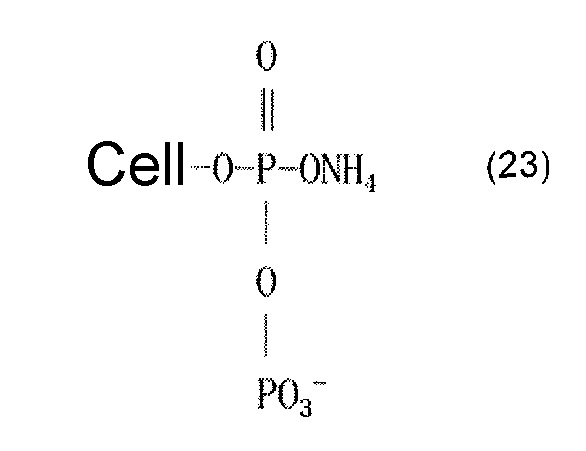
[Химическая формула 24]
Согласно настоящему изобретению сочетание одного или нескольких соединений, выбранных из группы, которую составляют содержащее фосфатную группу соединение, содержащее карбоксильную группу соединение и содержащее кетонную группу соединение, можно прикреплять к материалу, или волокна, к которым прикреплены соответствующие соединения, можно смешивать друг с другом для изготовления материала.
Считается, что ингибирующее волокно против образования факторов вирулентности (материал) согласно настоящему изобретению ингибирует образование факторов вирулентности посредством ингибирования образования автоиндукторов бактериями, имеющими способности дистанционного взаимодействия, т.е. производящими автоиндукторы бактериями. Хотя содержащее фосфатную группу соединение, содержащее карбоксильную группу соединение и/или содержащее кетонную группу соединение, которые прикрепляются к целлюлозному волокну, имеют лишь умеренную ионную силу и, таким образом, низкую бактерицидную активность, волокно обладает высокой способностью ингибирования образования факторов вирулентности посредством ингибирования образования автоиндукторов бактериями. В частности, посредством использования хелатообразующих эффектов, которыми обладают содержащее фосфатную группу соединение, содержащее карбоксильную группу соединение и/или содержащее кетонную группу соединение (молекула), прикрепляющиеся к волокну, такому как целлюлозное волокно, удаляется магний, ослабляется активность PPK, таким образом, что предотвращается накопление полифосфорной кислоты в бактериальных клетках и ингибируется образование автоиндукторов. В результате считается, что ингибируется образование факторов вирулентности. То есть автоиндукторы становятся мишенью для цели сокращения образования факторов вирулентности (токсинов). Таким образом, значительно снижается вероятность возникновения устойчивых к обработке штаммов. По этим причинам ингибирующее волокно против образования факторов вирулентности согласно настоящему изобретению можно применять по отношению ко всем вирулентным бактериям, имеющим способности дистанционного взаимодействия, причем его можно применять как к грамотрицательным, так и к грамположительным бактериям. Кроме того, поскольку ингибирующее волокно против образования факторов вирулентности согласно настоящему изобретению также производит ингибирующее воздействие на образование факторов вирулентности грибами, его можно также применять по отношению к вирулентным грибам.
Примеры вирулентных бактерий, имеющих способности дистанционного взаимодействия включают Actinobacillus actinomycetemcomitans, Acinetobacter baumannii, Bordetella pertussis, виды рода Brucella, виды рода Campylobacter, виды рода Capnocytophaga, Cardiobacterium hominis, Eikenella corrodens, Francisella tularensis, Haemophilus ducreyi, Haemophilus influenzae, Helicobacter pylori, Kingella kingae, Legionella pneumophila, Pasteurella multocida, виды рода Citrobacter, виды рода Enterobacter, Escherichia coli, Klebsiella pneumoniae, виды рода Proteus, Salmonella enteriditis, Salmonella typhi, Serratia marcescens, виды рода Shigella, Yersinia enterocolitica, Yersinia pestis, Neisseria gonorrhoeae, Neisseria meningitidis, Moraxella catarrhalis, виды рода Veillonella, Bacteroides fragilis, виды рода Bacteroides, виды рода Prevotella, виды рода Fusobacterium, Spirillum minus, виды рода Aeromonas, Plesiomonas shigelloides, Vibrio cholerae, Vibrio parahaemolyticus, Vibrio vulnificus, виды рода Acinetobacter, виды рода Flavobacterium, Pseudomonas aeruginosa, Burkholderiacepacia, Burkholderia pseudomallei, Xanthomonas maltophilia, Stenotrophomonas maltophila, Staphylococcus aureus, виды рода Bacillus, виды рода Clostridium, Lesteria monocytogenes и виды рода Streptococcus. Примеры вирулентных грибов включают Trichophyton, Candida и Aspergilloma. Ингибирующее волокно против образования факторов вирулентности согласно настоящему изобретению производит ингибирующее воздействие на образование мицелия грибка стригущего лишая (Trichophyton).
Примеры
Далее настоящее изобретение будет описано более подробно посредством следующих примеров. Следует отметить, что настоящее изобретение не ограничивается представленными ниже примерами.
Пример 1
В данном примере содержащее фосфатную группу соединение (далее также называется фосфорное соединение) прикрепляли к целлюлозному волокну материала методом пропитывания. Данный пример соответствует случаям, которые представляют приведенные выше формулы (1)-(5). Путем использования излучателя электронного пучка типа электронного экрана (EC 250/30/90L; производитель Eye Electron Beam Co., Ltd.) одну сторону материала средней толщины, изготовленного из мерсеризованного 100% хлопкового волокна (поверхностная плотность 300 г/м2), облучали электронным пучком в атмосфере газообразного азота при ускоряющем напряжении 200 кВ и поглощенной дозе 40 кГр. Материал, облученный электронным пучком, погружали в водный раствор 10% масс. P1M [моно(2-метакрилоилоксиэтил)фосфат; производитель Kyoeisha Chemical Co., Ltd.], отжимали, используя каландр, до тех пор, пока не была достигнута остаточная масса, составляющая приблизительно 70% масс., и затем оставляли для выдерживания в течение ночи при 35°C. Для отделения не прореагировавших и связанных мономеров от материала, оставленного для выдерживания в течение ночи, материал промывали горячей водой и затем обычной водой. После этого материал отжимали, используя каландр, и затем высушивали на булавочной растягивающей раме при 150°C в течение 90 секунд. Количество введенных фосфатных групп на единицу массы волокна, которое вычисляли по разности масс материала до и после описанного выше процесса и молекулярной массе P1M, составляло 0,22 ммоль/г.
Нейтрализационная обработка
Затем содержащий фосфатные группы материал оставляли для выдерживания в течение ночи в водном растворе 1 г/л гидроксида натрия при температуре окружающей среды для замещения фосфатных групп фосфатом натрия. Чтобы удалить избыток гидроксида натрия, материал промывали горячей водой и затем обычной водой. После этого материал отжимали, используя каландр, и высушивали на булавочной растягивающей раме при 150°C в течение 90 секунд. Полученный материал использовали как исследуемый образец (образец 2).
Пример 2
В данном примере метод пропитывания, который использовали в примере 1, заменяли методом погружения. Водный раствор 10% масс. P1M предварительно продували азотом, чтобы установить концентрацию растворенного кислорода в растворе на уровне 0,1 части на миллион (ppm) или ниже. Путем использования излучателя электронного пучка типа электронного экрана (EC 250/30/90L; производитель Eye Electron Beam Co., Ltd.) одну сторону материала средней толщины, изготовленного из мерсеризованного 100% хлопкового волокна (поверхностная плотность 300 г/м2), облучали электронным пучком в атмосфере газообразного азота при ускоряющем напряжении 200 кВ и поглощенной дозе 40 кГр. Материал, облученный электронным пучком, погружали в водный раствор 10% масс. P1M, изготовленный, как описано выше, и имеющий концентрацию растворенного кислорода на уровне 0,1 части на миллион или ниже (промывочное соотношение составляло приблизительно 1:15). После герметизации контейнера материал оставляли для выдерживания в течение одного часа при 50°C и затем в течение ночи при 35°C. Для отделения не прореагировавших и связанных мономеров от материала, оставленного для выдерживания в течение ночи, материал промывали горячей водой и затем обычной водой. После этого материал отжимали, используя каландр, и затем высушивали на булавочной растягивающей раме при 150°C в течение 90 секунд. Количество введенных фосфатных групп на единицу массы волокна, которое вычисляли по разности масс материала до и после описанного выше процесса и молекулярной массе P1M, составляло 1,6 ммоль/г.
Нейтрализационная обработка
Затем содержащий фосфатные группы материал оставляли для выдерживания в течение ночи в водном растворе 3 г/л гидроксида натрия при температуре окружающей среды для замещения фосфатных групп фосфатом натрия. Чтобы удалить избыток гидроксида натрия, материал промывали горячей водой и затем обычной водой. После этого материал отжимали, используя каландр, и высушивали на булавочной растягивающей раме при 150°C в течение 90 секунд. Полученный материал использовали как исследуемый образец (образец 3).
Пример 3
В данном примере акриловую кислоту использовали как содержащее карбоксильную группу соединение и прикрепляли к целлюлозному волокну материала методом пропитывания. Данный пример соответствует случаям, которые представляют приведенные выше формулы (6)-(10). Путем использования излучателя электронного пучка типа электронного экрана (EC 250/30/90L; производитель Eye Electron Beam Co., Ltd.) одну сторону материала средней толщины, изготовленного из мерсеризованного 100% хлопкового волокна (поверхностная плотность 300 г/м2), облучали электронным пучком в атмосфере газообразного азота при ускоряющем напряжении 200 кВ и поглощенной дозе 40 кГр. Материал, облученный электронным пучком, погружали в водный раствор 10% масс. акриловой кислоты (производитель Nacalai Tesque, Inc.), отжимали, используя каландр, до тех пор, пока не была достигнута остаточная масса, составляющая приблизительно 70% масс., и затем оставляли для выдерживания в течение ночи при 35°C. Для отделения не прореагировавших и связанных мономеров от материала, оставленного для выдерживания в течение ночи, материал промывали горячей водой и затем обычной водой. После этого материал отжимали, используя каландр, и затем высушивали на булавочной растягивающей раме при 150°C в течение 90 секунд. Количество введенных карбоксильных групп на единицу массы волокна, которое вычисляли по разности масс материала до и после описанного выше процесса и молекулярной массе акриловой кислоты, составляло 1,12 ммоль/г.
Нейтрализационная обработка
Затем содержащий карбоксильные группы материал оставляли для выдерживания в течение ночи в водном растворе 1 г/л гидроксида натрия при температуре окружающей среды для замещения карбоксильных групп карбоксилатом натрия. Чтобы отделить избыток гидроксида натрия, материал промывали горячей водой и затем обычной водой. После этого материал отжимали, используя каландр, и высушивали на булавочной растягивающей раме при 150°C в течение 90 секунд. Полученный материал использовали как исследуемый образец (образец 4).
Пример 4
В данном примере содержащее карбоксильную группу соединение прикрепляли к целлюлозному волокну материала методом пропитывания. Данный пример соответствует случаям, которые представляют приведенные выше формулы (11)-(17). Путем использования излучателя электронного пучка типа электронного экрана (EC 250/30/90L; производитель Eye Electron Beam Co., Ltd.) одну сторону материала средней толщины, изготовленного из мерсеризованного 100% хлопкового волокна (поверхностная плотность 300 г/м2), облучали электронным пучком в атмосфере газообразного азота при ускоряющем напряжении 200 кВ и поглощенной дозе 40 кГр. Материал, облученный электронным пучком, погружали в водный раствор, содержащий 10% масс. глицидилметакрилат (производитель Nacalai Tesque, Inc.) и 0,5% масс. Tween 20 (производитель Nacalai Tesque, Inc.), отжимали, используя каландр, до тех пор, пока не была достигнута остаточная масса, составляющая приблизительно 70% масс., и затем оставляли для выдерживания в течение ночи при 35°C. Для отделения не прореагировавших и связанных мономеров от материала, оставленного для выдерживания в течение ночи, материал промывали горячей водой и затем обычной водой. После этого материал отжимали, используя каландр, и затем высушивали на булавочной растягивающей раме при 150°C в течение 90 секунд. Количество введенных эпоксидных групп на единицу массы волокна, которое вычисляли по разности масс материала до и после описанного выше процесса и молекулярной массе глицидилметакрилата, составляло 0,34 ммоль/г.
Введение хелатообразующей группы
Содержащий эпоксидные группы материал оставляли для выдерживания в течение ночи в водном растворе 2,5% масс. иминодиуксусной кислоты (производитель Nacalai Tesque, Inc.) при 35°C для введения хелатообразующих групп в материал. Чтобы удалить избыток иминодиуксусной кислоты, материал промывали горячей водой и затем обычной водой. После этого материал отжимали, используя каландр, и высушивали на булавочной растягивающей раме при 150°C в течение 90 секунд.
Нейтрализационная обработка
Затем содержащий хелатообразующие группы материал оставляли для выдерживания в течение ночи в водном растворе 3 г/л гидроксида натрия при температуре окружающей среды для замещения иминодиуксусной кислоты иминодиацетатом натрия. Чтобы удалить избыток гидроксида натрия, материал промывали горячей водой и затем обычной водой. После этого материал отжимали, используя каландр, и высушивали на булавочной растягивающей раме при 150°C в течение 90 секунд. Полученный материал использовали как исследуемый образец (образец 5).
Пример 5
В данном примере метод пропитывания, который использовали в примере 4, заменяли методом погружения. Водный раствор, содержащий 10% масс. глицидилметакрилата (производитель Nacalai Tesque, Inc.) и 0,5% масс. Tween 20 (производитель Nacalai Tesque, Inc.) предварительно продували азотом, чтобы установить концентрацию растворенного кислорода в растворе на уровне 0,1 части на миллион или ниже. Путем использования излучателя электронного пучка типа электронного экрана (EC 250/30/90L; производитель Eye Electron Beam Co., Ltd.) одну сторону материала средней толщины, изготовленного из мерсеризованного 100% хлопкового волокна (поверхностная плотность 300 г/м2), облучали электронным пучком в атмосфере газообразного азота при ускоряющем напряжении 200 кВ и поглощенной дозе 40 кГр. Материал, облученный электронным пучком, погружали в водный раствор, изготовленный, как описано выше, и содержащий 10% масс. глицидилметакрилат и 0,5% масс. Tween 20 и имеющий концентрацию растворенного кислорода на уровне 0,1 части на миллион или ниже (промывочное соотношение составляло приблизительно 1:15). После герметизации контейнера материал оставляли для выдерживания в течение одного часа при 50°C и затем в течение ночи при 35°C. Для отделения не прореагировавших и связанных мономеров от материала, оставленного для выдерживания в течение ночи, материал промывали горячей водой и затем обычной водой. После этого материал отжимали, используя каландр, и затем высушивали на булавочной растягивающей раме при 150°C в течение 90 секунд. Количество введенных эпоксидных групп на единицу массы волокна, которое вычисляли по разности масс материала до и после описанного выше процесса и молекулярной массе глицидилметакрилата, составляло 2,6 ммоль/г.
Введение хелатообразующей группы
Содержащий эпоксидные группы материал оставляли для выдерживания в течение ночи в водном растворе 2,5% масс. иминодиуксусной кислоты (производитель Nacalai Tesque, Inc.) при 35°C для введения хелатообразующих групп в материал. Чтобы удалить избыток иминодиуксусной кислоты, материал промывали горячей водой и затем обычной водой. После этого материал отжимали, используя каландр, и высушивали на булавочной растягивающей раме при 150°C в течение 90 секунд.
Нейтрализационная обработка
Затем содержащий хелатообразующие группы материал оставляли для выдерживания в течение ночи в водном растворе 3 г/л гидроксида натрия при температуре окружающей среды для замещения иминодиуксусной кислоты иминодиацетатом натрия. Чтобы отделить избыток гидроксида натрия, материал промывали горячей водой и затем обычной водой. После этого материал отжимали, используя каландр, и высушивали на булавочной растягивающей раме при 150°C в течение 90 секунд. Полученный материал использовали как исследуемый образец (образец 6).
Таблица 1 представляет для каждого образца концентрацию ингибирующего образование факторов вирулентности компонента (далее также называется просто ингибитор). В таблице 1 образец 1 представляет собой необработанное изделие (изготовленный из мерсеризованного 100% хлопкового волокна материал, имеющий среднюю толщину и поверхностную плотность 300 г/м2) и соответствует сравнительному примеру. Следует отметить, что эффективная концентрация ингибитора (мМ) в таблице 1 представляет собой концентрацию ингибитора, когда 1 мл бактериальной суспензии инокулировали приблизительно в 0,4 г материала.
|
После стерилизации в автоклаве каждый из исследуемых образцов (0,4 г), полученных из образцов 1-6, по 1 мл бактериальной суспензии синегнойной палочки (штамм PA 01) в культуральной среде Луриа-Бертани (Luria-Bertani или LB), в которой концентрация бактерий составляла 2,7×103 бактерий/мл, инокулировали в каждый исследуемый образец. После статического выращивания бактерий при 37°C в течение 96 часов культуральный раствор, абсорбированный каждым исследуемым образцом, отделяли центрифугированием (4000 об./мин, 2 минуты). Кроме того, каждый культуральный раствор центрифугировали (14000 об./мин, 2 минуты), и полученную надосадочную жидкость (0,4 мл) использовали для определения количества производимого пиоцианина. Объем оставшейся фракции доводили до 20 мл, используя физиологический солевой раствор, и его часть высевали в агаровую среду LB для вычисления числа жизнеспособных бактерий. Пиоцианин экстрагировали с использованием хлороформа, растворенного в 0,2 М HCl и количественно определяли путем измерения поглощения (длина волны составляла 490 нм) пиоцианина, растворенного в HCl. Измерение осуществляли пять раз (n=5) и вычисляли среднее значение. Результаты представлены в таблице 2 и на фиг. 1-3.
|
Как очевидно показано в таблице 2 и на фиг. 1-3, не наблюдалось никакого различия между материалами, полученными в примерах 1-5, и необработанным материалом в отношении числа жизнеспособных бактерий после культивирования, но абсолютное и относительное содержание пиоцианина и количество производимого пиоцианина по отношению к числу жизнеспособных бактерий (относительное значение) были малыми в материалах примеров 1-5, демонстрируя, что они обладали ингибирующей способностью по отношению к образованию факторов вирулентности.
Пример 6
Введение сложного эфира фосфорной кислоты
Тонкий материал, изготовленный из мерсеризованного 100% хлопкового волокна (поверхностная плотность 140 г/м2), погружали в водный раствор, содержащий 13,6% масс. фосфорной кислоты (производитель Nacalai Tesque, Inc.) и 41% масс. мочевины (производитель Nacalai Tesque, Inc.), отжимали, используя каландр, до тех пор, пока не была достигнута остаточная масса, составляющая приблизительно 70% масс., и высушивали на булавочной растягивающей раме при 150°C в течение 150 секунд. Высушенный материал промывали горячей водой и затем обычной водой в достаточной степени, отжимали, используя каландр, и высушивали на булавочной растягивающей раме при 150°C в течение 90 секунд. Количество введенных фосфатных групп на единицу массы волокна, которое вычисляли по разности масс материала до и после описанного выше процесса и молекулярной массе фосфорной кислоты, составляло 0,38 ммоль/г.
Нейтрализационная обработка
Затем содержащий сложный эфир фосфорной кислоты материал погружали в водный раствор 5% масс. гидроксида натрия (производитель Nacalai Tesque, Inc.) и затем отжимали, используя каландр, до тех пор, пока не была достигнута остаточная масса, составляющая приблизительно 70% масс. Чтобы отделить избыток гидроксида натрия, материал промывали горячей водой и затем обычной водой. После этого материал отжимали, используя каландр, и высушивали на булавочной растягивающей раме при 150°C в течение 90 секунд. Полученный материал использовали как образец B1.
Пример 7
Введение сложного эфира фосфорной кислоты
Тонкий материал, изготовленный из мерсеризованного 100% хлопкового волокна (поверхностная плотность 140 г/м2), погружали в водный раствор, содержащий 13,6% масс. фосфорной кислоты (производитель Nacalai Tesque, Inc.) и 41% масс. мочевины (производитель Nacalai Tesque, Inc.), отжимали, используя каландр, до тех пор, пока не была достигнута остаточная масса, составляющая приблизительно 70% масс., и высушивали на булавочной растягивающей раме при 150°C в течение 90 секунд. Кроме того, материал обрабатывали на булавочной растягивающей раме при 165°C в течение 105 секунд. Обработанный материал промывали горячей водой и затем обычной водой в достаточной степени, обрабатывали, используя каландр, и высушивали на булавочной растягивающей раме при 150°C в течение 90 секунд. Количество введенных фосфатных групп на единицу массы волокна, которое вычисляли по разности масс материала до и после описанного выше процесса и молекулярной массе фосфорной кислоты, составляло 0,71 ммоль/г. В примере 7 количество введенных фосфатных групп было больше, чем в примере 6.
Нейтрализационная обработка
Затем содержащий сложный эфир фосфорной кислоты материал погружали в водный раствор 5% масс. гидроксида натрия (производитель Nacalai Tesque, Inc.) и затем отжимали, используя каландр, до тех пор, пока не была достигнута остаточная масса, составляющая приблизительно 70% масс. Чтобы удалить избыток гидроксида натрия, материал промывали горячей водой и затем обычной водой. После этого материал отжимали, используя каландр, и высушивали на булавочной растягивающей раме при 150°C в течение 90 секунд. Полученный материал использовали как образец B2.
Пример 8
Ингибирующее волокно против образования факторов вирулентности изготавливали таким же образом, как в примере 6, за исключением того, что использовали тонкий материал, изготовленный из мерсеризованной смеси 65% сложнополиэфирного волокна и 35% хлопкового волокна (поверхностная плотность 120 г/м2; далее называется также материал T/C), вместо тонкого материала, изготовленного из мерсеризованного 100% хлопкового волокна. В примере 8 количество введенных фосфатных групп на единицу массы волокна составляло 0,37 ммоль/г. Полученный материал в примере 8 использовали как образец B3.
Пример 9
Ингибирующее волокно против образования факторов вирулентности изготавливали таким же образом, как в примере 7, за исключением того, что использовали тонкий материал, изготовленный из мерсеризованной смеси 65% сложнополиэфирного волокна и 35% хлопкового волокна (поверхностная плотность 120 г/м2), вместо тонкого материала, изготовленного из мерсеризованного 100% хлопкового волокна. В примере 9 количество введенных фосфатных групп на единицу массы волокна составляло 0,40 ммоль/г. Полученный материал в примере 9 использовали как образец B4.
Пример 10
Водный раствор, содержащий 5% масс. EGMM (моноацетоацетатмонометакрилат этиленгликоля) (производитель Tokyo Chemical Industry Co., Ltd.) и 0,5% масс. Tween 20 (производитель Nacalai Tesque, Inc.) предварительно продували азотом, чтобы установить концентрацию растворенного кислорода в растворе на уровне 0,1 части на миллион или ниже. Путем использования излучателя электронного пучка типа электронного экрана (EC 250/30/90L; производитель Eye Electron Beam Co., Ltd.) одну сторону тонкого материала, изготовленного из мерсеризованного 100% хлопкового волокна (поверхностная плотность 140 г/м2), облучали электронным пучком в атмосфере газообразного азота при ускоряющем напряжении 200 кВ и поглощенной дозе 40 кГр. Материал, облученный электронным пучком, погружали в водный раствор, изготовленный, как описано выше, содержащий 5% масс. EGMM и 0,5% масс. Tween 20 и имеющий концентрацию растворенного кислорода на уровне 0,1 части на миллион или ниже (промывочное соотношение составляло приблизительно 1:15). После герметизации контейнера реакцию проводили при 50°C в течение двух часов. После реакции материал промывали горячей водой и затем обычной водой для отделения не прореагировавших и связанных мономеров от материала. После этого материал отжимали, используя каландр, и затем высушивали на булавочной растягивающей раме при 150°C в течение 90 секунд. Количество введенного содержащего кетонную группу соединения на единицу массы волокна, которое вычисляли по разности масс материала до и после описанного выше процесса и молекулярной массе EGMM, составляло 1,10 ммоль/г. Полученный материал в примере 10 использовали как образец B5.
Пример 11
Водный раствор 5% масс. DAA (диацетонакриламид) (производитель Nippon Kasei Chemical Co., Ltd.) предварительно продували азотом, чтобы установить концентрацию растворенного кислорода в растворе на уровне 0,1 части на миллион или ниже. Путем использования излучателя электронного пучка типа электронного экрана (EC 250/30/90L; производитель Eye Electron Beam Co., Ltd.) одну сторону тонкого материала, изготовленного из мерсеризованного 100% хлопкового волокна (поверхностная плотность 140 г/м2), облучали электронным пучком в атмосфере газообразного азота при ускоряющем напряжении 200 кВ и поглощенной дозе 40 кГр. Материал, облученный электронным пучком, погружали в водный раствор 5% масс. DAA, изготовленный, как описано выше, и имеющий концентрацию растворенного кислорода на уровне 0,1 части на миллион или ниже (промывочное соотношение составляло приблизительно 1:10). После герметизации контейнера реакцию проводили при 50°C в течение двух часов. После реакции материал промывали горячей водой и затем обычной водой для отделения не прореагировавших и связанных мономеров от материала. После этого материал отжимали, используя каландр, и затем высушивали на булавочной растягивающей раме при 150°C в течение 90 секунд. Количество введенного содержащего кетонную группу соединения на единицу массы волокна, которое вычисляли по разности масс материала до и после описанного выше процесса и молекулярной массе DAA, составляло 1,45 ммоль/г. Полученный материал в примере 11 использовали как образец B6.
Пример 12
Водный раствор, содержащий 10,9% масс. P1M-Na (натриевую соль P1M получали, заблаговременно нейтрализуя P1M водным раствором гидроксида натрия), предварительно продували азотом, чтобы установить концентрацию растворенного кислорода в растворе на уровне 0,1 части на миллион или ниже. Путем использования излучателя электронного пучка типа электронного экрана (EC 250/30/90L; производитель Eye Electron Beam Co., Ltd.), неочищенное вискозное шелковое волокно (производитель OmiKenshi Co., Ltd., тонина 3,3 дтекс, длина волокна 51 мм) облучали электронным пучком в атмосфере газообразного азота при ускоряющем напряжении 250 кВ и поглощенной дозе 40 кГр. Неочищенное вискозное шелковое волокно, облученное электронным пучком, погружали в водный раствор 10,9% масс. P1M-Na, изготовленный, как описано выше, и имеющий концентрацию растворенного кислорода на уровне 0,1 части на миллион или ниже (промывочное соотношение составляло приблизительно 1:10). После герметизации контейнера реакцию проводили при температуре окружающей среды в течение двух-трех часов. После реакции неочищенный волокнистый материал промывали горячей водой и затем обычной водой для отделения не прореагировавших и связанных мономеров от материала. После этого материал отжимали, используя каландр, и затем высушивали на воздухе, используя воздушную сушилку. Количество введенных фосфатных групп на единицу массы волокна, которое вычисляли по разности масс материала до и после описанного выше процесса и молекулярной массе P1M-Na, составляло 0,89 ммоль/г. Полученный материал использовали как образец B7.
Пример 13
Тонкий материал, изготовленный из мерсеризованного 100% хлопкового волокна (поверхностная плотность 140 г/м2), погружали в водный раствор, содержащий 8,5% масс. фосфорной кислоты (производитель Nacalai Tesque, Inc.) и 30% масс. мочевины (производитель Nacalai Tesque, Inc.), отжимали, используя каландр, до тех пор, пока не была достигнута остаточная масса, составляющая приблизительно 70% масс., и высушивали на булавочной растягивающей раме при 150°C в течение 90 секунд. Кроме того, материал обрабатывали на булавочной растягивающей раме при 165°C в течение 105 секунд. Обработанный материал промывали горячей водой и затем обычной водой в достаточной степени, обрабатывали, используя каландр, и высушивали на булавочной растягивающей раме при 150°C в течение 90 секунд. Количество введенных фосфатных групп на единицу массы волокна, которое вычисляли по разности масс материала до и после описанного выше процесса и молекулярной массе фосфорной кислоты, составляло 0,54 ммоль/г.
Нейтрализационная обработка
Затем содержащий сложный эфир фосфорной кислоты материал погружали в водный раствор 1% масс. гидроксида натрия (производитель Nacalai Tesque, Inc.) и затем отжимали, используя каландр, до тех пор, пока не была достигнута остаточная масса, составляющая приблизительно 70% масс. Чтобы удалить избыток гидроксида натрия, материал промывали горячей водой и затем обычной водой. После этого материал отжимали, используя каландр, и высушивали на булавочной растягивающей раме при 150°C в течение 90 секунд. Полученный материал использовали как образец B8.
Исследовали ингибирующее влияние материалов, полученных в примерах 6-13 (образцы B1-B8) на образование факторов вирулентности. Тонкий материал, изготовленный из мерсеризованного 100% хлопкового волокна, использовали как контрольный образец 1, и тонкий мерсеризованный материал, изготовленный из смеси 65% сложнополиэфирного волокна и 35% хлопкового волокна, использовали как контрольный образец 2. Неочищенное вискозное шелковое волокно (производитель OmiKenshi Co., Ltd., тонина 3,3 дтекс, длина волокна 51 мм), которое промывали горячей водой и затем обычной водой, чтобы исключить влияние масла, а затем высушивали, использовали как контрольный образец 3.
Для материалов, полученных в примерах 6-9 и 13, исследовали устойчивость к промыванию ингибирующего воздействия на образование факторов вирулентности. В соответствии со стандартом JIS L 0217 103, материалы примеров 6-9 промывали 10 раз, и материал примера 13 промывали заданное число раз, используя стандартное моющее средство JAFET вместо предусмотренного моющего средства. После промывания материалы вывешивали и высушивали на воздухе.
Метод исследования
После обработки в автоклаве каждого из исследуемых образцов (0,4 г), полученных из исходных образцов, по 1 мл бактериальной суспензии синегнойной палочки (штамм PA 01) в культуральной среде Луриа-Бертани (Luria-Bertani, или LB), в которой концентрация бактерий составляла 2,7×103 бактерий/мл, инокулировали в каждый исследуемый образец. После статического выращивания бактерий при 37°C в течение 48 часов культуральный раствор, абсорбированный каждым исследуемым образцом, отделяли центрифугированием (7840 об./мин, 5 минут). Кроме того, каждый культуральный раствор центрифугировали (14000 об./мин, 2 минуты), и полученную надосадочную жидкость (0,4 мл) использовали для определения количества производимого пиоцианина. Объем осажденной центрифугированием фракции клеточных тел доводили до 20 мл, используя физиологический солевой раствор, и ее часть использовали для определения поглощения (длина волны составляла 570 нм), и вычисляли число жизнеспособных бактерий. Пиоцианин экстрагировали с использованием хлороформа, растворенного в 0,2 M HCl, и количественно определяли путем измерения поглощения (длина волны составляла 490 нм) пиоцианина, растворенного в HCl. Для исследования волокна примера 13 (образец B8) резистентную к множеству лекарственных средств синегнойную палочку штамма JCM14847 использовали вместо синегнойной палочки штамма PA 01. Измерение осуществляли пять раз (n=5), и вычисляли среднее значение. Результаты представлены в таблицах 3-7.
|
|
|
|
|
На основании представленных выше таблиц 3-7 были сделаны следующие выводы.
(1) На основании таблицы 3 было обнаружено, что содержащие сложный эфир фосфорной кислоты материалы примеров 6 и 7, оба из которых были изготовлены из 100% хлопкового волокна и промыты, не отличались от необработанного материала в отношении числа жизнеспособных бактерий после культивирования, но количество производимого пиоцианина по отношению к числу жизнеспособных бактерий (относительное значение) было малым в обоих случаях, демонстрируя устойчивость к промыванию их способности ингибирования образования факторов вирулентности.
(2) На основании таблицы 4 было обнаружено, что содержащие сложный эфир фосфорной кислоты материалы T/C примеров 8 и 9, которые подвергались промыванию, не отличались от необработанного материала в отношении числа жизнеспособных бактерий после культивирования, но количество производимого пиоцианина по отношению к числу жизнеспособных бактерий (относительное значение) было малым в обоих случаях, демонстрируя устойчивость к промыванию их способности ингибирования образования факторов вирулентности.
(3) На основании таблицы 5 было обнаружено, что материалы примеров 10 и 11, к которым содержащее кетонную группу соединение было прикреплено химическими связями, не отличались от необработанного материала в отношении числа жизнеспособных бактерий после культивирования, но количество производимого пиоцианина по отношению к числу жизнеспособных бактерий (относительное значение) было малым в обоих случаях, демонстрируя их способность ингибирования образования факторов вирулентности.
(4) На основании таблицы 6 было обнаружено, что обработанное неочищенное вискозное волокно примера 12, в которое было введено содержащее фосфатную группу соединение, не отличалось от необработанного материала в отношении числа жизнеспособных бактерий после культивирования, но количество производимого пиоцианина по отношению к числу жизнеспособных бактерий (относительное значение) было малым, демонстрируя способность ингибирования образования факторов вирулентности.
(5) Что касается воздействия содержащего 100% хлопковое волокно материала примера 13 на резистентную к множеству лекарственных средств синегнойную палочку, на основании таблицы 7 было обнаружено, что данный материал не отличался от необработанного материала в отношении числа жизнеспособных бактерий после культивирования, но количество производимого пиоцианина по отношению к числу жизнеспособных бактерий (относительное значение) было малым, демонстрируя устойчивость к промыванию способности ингибирования образования факторов вирулентности.
Пример 14
Тонкий материал, изготовленный из мерсеризованного 100% хлопкового волокна (поверхностная плотность 140 г/м2), погружали в водный раствор, содержащий 8,5% масс. фосфорной кислоты (производитель Nacalai Tesque, Inc.) и 30% масс. мочевины (производитель Nacalai Tesque, Inc.), отжимали, используя каландр, до тех пор, пока не была достигнута остаточная масса, составляющая приблизительно 70% масс., и высушивали на булавочной растягивающей раме при 150°C в течение 90 секунд. Кроме того, материал обрабатывали на булавочной растягивающей раме при 165°C в течение 105 секунд. Обработанный материал промывали горячей водой и затем обычной водой в достаточной степени, обрабатывали, используя каландр, и высушивали на булавочной растягивающей раме при 150°C в течение 90 секунд. Количество введенных фосфатных групп на единицу массы волокна, которое вычисляли по разности масс материала до и после описанного выше процесса и молекулярной массе фосфорной кислоты, составляло 0,54 ммоль/г.
Нейтрализационная обработка
Затем содержащий сложный эфир фосфорной кислоты материал погружали в водный раствор 1% масс. гидроксида натрия (производитель Nacalai Tesque, Inc.) и затем отжимали, используя каландр, до тех пор, пока не была достигнута остаточная масса, составляющая приблизительно 70% масс. Чтобы отделить избыток гидроксида натрия, материал промывали горячей водой и затем обычной водой. После этого материал отжимали, используя каландр, и высушивали на булавочной растягивающей раме при 150°C в течение 90 секунд. Полученный материал использовали как образец C1.
Ингибирующее воздействие на образование факторов вирулентности материала, полученного в примере 14 (образец C1) на листерию моноцитогенную (Listeria monocytogenes), золотистый стафилококк (Staphylococcus aureus) и кишечную палочку (Escherichia coli) O157 исследовали на основании следующего метода оценки. Результаты представлены в таблицах 8-10. Необработанный тонкий материал, изготовленный из мерсеризованного 100% хлопкового волокна, использовали как контрольный образец C1.
Ингибирующее воздействие на образование факторов вирулентности листерии моноцитогенной
Бактерии листерии моноцитогенной, культивированные в бульоне с сердечно-мозговым экстрактом (производитель Becton, Dickinson and Company) в течение 4 часов, отделяли центрифугированием (7500 об./мин, 2 минуты) и собранные бактерии суспендировали в культуральной среде RPMI1640 (производитель Nacalai Tesque, Inc.) таким образом, что концентрация бактерий была в 10 раз выше, чем в исходной культуральной среде. По 1 мл бактериальной суспензии (концентрация бактерий составляла 2,7×104 бактерий/мл) инокулировали в каждый обработанный в автоклаве исследуемый образец (0,7 г). После статического культивирования бактерий при 37°C в течение 24 часов культуральный раствор, абсорбированный каждым исследуемым образцом, отделяли центрифугированием (7840 об./мин, 5 минут). Полученную надосадочную жидкость подвергали ультрафильтрации (пороговая масса составляла 30 кДа), чтобы сконцентрировать надосадочную жидкость в 20 раз, и 0,1 мл концентрированной надосадочной жидкости использовали для определения гемолитической активности. Объем осажденной центрифугированием фракции клеточных тел доводили до 20 мл, используя физиологический солевой раствор, и ее часть использовали для определения поглощения (длина волны составляла 570 нм), и вычисляли число жизнеспособных бактерий. Для определения гемолитической активности использовали консервированную овечью кровь и количество гемолизированных эритроцитов определяли путем измерения поглощения (длина волны составляла 415 нм). Количество образующегося гемолизина (листериолизин O) определяли путем измерения гемолитической активности. Чем ниже гемолитическая активность, тем меньше гемолизина образует листерия моноцитогенная.
Ингибирующее воздействие на образование факторов вирулентности золотистого стафилококка
Бактерии золотистого стафилококка, культивированные в бульоне с сердечно-мозговым экстрактом в течение 4 часов, отделяли центрифугированием (7500 об./мин, 2 минуты) и собранные бактерии суспендировали в культуральной среде RPMI1640 таким образом, что концентрация бактерий была в 10 раз выше, чем в исходной культуральной среде. По 1 мл бактериальной суспензии (концентрация бактерий составляла 2,7×104 бактерий/мл) инокулировали в каждый обработанный в автоклаве исследуемый образец (0,7 г). После статического культивирования бактерий при 37°C в течение 24 часов культуральный раствор, абсорбированный каждым исследуемым образцом, отделяли центрифугированием (7840 об./мин, 5 минут). Полученную надосадочную жидкость подвергали ультрафильтрации (пороговая масса составляла 30 кДа), чтобы сконцентрировать надосадочную жидкость в 20 раз, и концентрированную надосадочную жидкость использовали для измерения энтеротоксина E. Объем осажденной центрифугированием фракции клеточных тел доводили до 20 мл, используя физиологический солевой раствор, и ее часть использовали для определения поглощения (длина волны составляла 570 нм), и вычисляли число жизнеспособных бактерий. Энтеротоксин E определяли, используя комплект RPLA “Seiken” (производитель Denka-Seiken Co., Ltd.).
Ингибирующее воздействие на образование факторов вирулентности кишечной палочки O157
В культуральную среду CAYE “Seiken” (производитель Denka-Seiken Co., Ltd.) для использования в исследовании по определению веротоксина кишечной палочки инокулировали предварительно культивированные бактерии кишечной палочки O157 и затем бактерии культивировали в режиме встряхивания при 37°C в течение 20 часов. После этого полученную суспензию бактерий (0,1 мл) суспендировали в 10 мл культуральной среды CAYE. После выдерживания исследуемых образцов (0,7 г) в центрифужных пробирках объемом 50 мл для стерилизации в автоклаве по 1 мл полученной бактериальной суспензии (концентрация бактерий составляла 6,80×106 бактерий/мл) инокулировали в каждый исследуемый образец и бактерии статически культивировали при 37°C в течение 20 часов. После культивирования культуральный раствор в каждом исследуемом образце отделяли путем центрифугирования (7500 об./мин, 5 минут), затем подвергали центрифугированию в течение 2 минут при 13500 об./мин, и полученную надосадочную жидкость использовали для измерения веротоксинов. После суспендирования осажденных бактерий в 20 мл физиологического солевого раствора осуществляли последовательные разбавления и число жизнеспособных бактерий вычисляли путем определения количества колоний. При измерении веротоксинов использовали набор для определения бактериальных токсинов (VTEC-RPLA “SeiKen”). Согласно данному методу исследования титр агглютининов, составляющий 1:4 или более, определяли как положительный. Чем выше титр агглютининов, тем меньше образование веротоксинов.
|
|
|
Как представлено в таблице 8, содержащий сложный эфир фосфорной кислоты материал из 100% хлопкового волокна в примере 14 не отличался от необработанного контрольного образца в отношении числа жизнеспособных бактерий листерии моноцитогенной после культивирования, но гемолитическая активность по отношению к числу жизнеспособных бактерий была малой, демонстрируя, что материал производил ингибирующее воздействие на образование факторов вирулентности (гемолизин) бактерий листерии моноцитогенной.
Кроме того, как представлено в таблице 9, содержащий сложный эфир фосфорной кислоты материал из 100% хлопкового волокна в примере 14 не отличался от необработанного контрольного образца в отношении числа жизнеспособных бактерий золотистого стафилококка после культивирования, но количество производимого энтеротоксина E по отношению к числу жизнеспособных бактерий было малым, демонстрируя, что материал производил ингибирующее воздействие на образование факторов вирулентности бактерий золотистого стафилококка.
Кроме того, как представлено в таблице 10, содержащий сложный эфир фосфорной кислоты материал из 100% хлопкового волокна в примере 14 не отличался от необработанного контрольного образца в отношении числа жизнеспособных бактерий кишечной палочки O157 после культивирования, но титр агглютининов каждого из веротоксина типа I и веротоксина типа II был выше, демонстрируя, что материал примера производил ингибирующее воздействие на образование факторов вирулентности кишечной палочки O157.
Пример 15
Тонкий материал, изготовленный из мерсеризованного 100% хлопкового волокна (поверхностная плотность 140 г/м2), погружали в водный раствор, содержащий 5,1% масс. фосфорной кислоты (производитель Nacalai Tesque, Inc.) и 18% масс. мочевины (производитель Nacalai Tesque, Inc.), отжимали, используя каландр, до тех пор, пока не была достигнута остаточная масса, составляющая приблизительно 70% масс., и высушивали на булавочной растягивающей раме при 150°C в течение 90 секунд. Кроме того, материал обрабатывали на булавочной растягивающей раме при 165°C в течение 105 секунд. Обработанный материал промывали горячей водой и затем обычной водой в достаточной степени, обрабатывали, используя каландр, и высушивали на булавочной растягивающей раме при 150°C в течение 90 секунд. Количество введенных фосфатных групп на единицу массы волокна, которое вычисляли по разности масс материала до и после описанного выше процесса и молекулярной массе фосфорной кислоты, составляло 0,21 ммоль/г.
Обработка кислотой
Затем содержащий сложный эфир фосфорной кислоты материал погружали в водный раствор 1% масс. уксусной кислоты (производитель Nacalai Tesque, Inc.) и затем отжимали, используя каландр, до тех пор, пока не была достигнута остаточная масса, составляющая приблизительно 70% масс. Чтобы удалить избыток уксусной кислоты, материал промывали горячей водой и затем обычной водой. После этого материал отжимали, используя каландр, и высушивали на булавочной растягивающей раме при 150°C в течение 90 секунд. Полученный материал использовали как образец D1.
Ингибирующее воздействие материала, полученного в примере 15 (образец D1), на образование факторов вирулентности грибка стригущего лишая (Trichophyton) исследовали путем определения способности образования мицелия грибка стригущего лишая следующим образом. Результаты представлены в приведенной ниже таблице 11. Необработанный тонкий материал, изготовленный из мерсеризованного 100% хлопкового волокна, использовали как контрольный образец D1.
Воздействие на грибок стригущего лишая
Раствор, полученный путем суспендирования 0,5 мл глюкозной среды Сабуро (Sabouraud) в 5 мл предварительно культивированной скошенной среды затем добавляли в 5 мл глюкозной среды Сабуро, чтобы получить споровую суспензию. По 0,5 мл споровой суспензии однократно распыляли на исследуемые образцы (0,1 г), и исследуемые образцы помещали в чашки Петри для культивирования грибков при 28°C в течение 9 суток. После культивирования считали число грибков (число колоний), образовавшихся в каждом исследуемом образце. Кроме того, измеряли площадь каждой колонии, образовавшейся на каждом исследуемом образце, и определяли среднюю площадь одной колонии.
|
Как можно видеть из результатов, представленных в таблице 11, содержащий сложный эфир фосфорной кислоты материал из 100% хлопкового волокна в примере 15 не отличался от необработанного контрольного образца в отношении числа жизнеспособных грибков стригущего лишая после культивирования, но средняя площадь одной колонии была меньше в случае материала примера 15, чем в случае контрольного образца, демонстрируя, что материал примера 15 ингибировал способность образования мицелия грибков стригущего лишая.
Основной пример 1
В производящую пиоцианин культуральную среду, содержащую синегнойную палочку (штамм PA 01) в концентрации 2,7×103 бактерий/мл, добавляли фосфорную кислоту, акриловую кислоту и трифосфорную кислоту, причем концентрации каждой из них представлены в таблицах 12 и 13, и бактерии культивировали в режиме встряхивания при 37°C в течение 48 часов. После этого по 1 мл каждой культуральной среды центрифугировали (14000 об./мин, 2 минуты) и полученную надосадочную жидкость использовали для определения пиоцианина. Фракцию осажденных бактерий суспендировали в 0,5 мл физиологического солевого раствора, часть суспензии использовали для измерения поглощения (длина волны составляла 570 нм) и вычисляли число жизнеспособных бактерий. Пиоцианин экстрагировали с использованием хлороформа, растворенного в 0,2 M HCl и количественно определяли путем измерения поглощения (длина волны составляла 490 нм) пиоцианина, растворенного в HCl. Производящую пиоцианин культуральную среду, содержащую синегнойную палочку в концентрации 2,7×103 бактерий/мл, в которую не добавляли ни одно из вышеупомянутых соединений, культивировали в режиме встряхивания при 37°C в течение 48 часов и использовали в качестве контрольного образца. Результаты представлены в таблицах 12 и 13.
|
|
Как можно видеть в таблице 12, практически отсутствовало различие в отношении числа жизнеспособных бактерий между содержащей синегнойную палочку культуральной средой, в которую были добавлены фосфорная кислота, акриловая кислота и трифосфорная кислота, и контрольным образцом, в который не было добавлено ни одно из данных соединений. Как можно видеть в таблице 13, по сравнению с контрольным образцом, количество производимого пиоцианина по отношению к числу жизнеспособных бактерий оказалось значительно меньшим в содержащей синегнойную палочку культуральной среде, в которую была добавлена трифосфорная кислота, и эффект этого уменьшения становился более выраженным по мере увеличения количества добавляемой трифосфорной кислоты. С другой стороны, количество производимого пиоцианина по отношению к числу жизнеспособных бактерий не различалось в такой значительной степени между содержащей синегнойную палочку культуральной средой, в которую была добавлена фосфорная кислота, и контрольным образцом, и количество производимого пиоцианина по отношению к числу жизнеспособных бактерий фактически не изменялось при увеличении количества добавляемой фосфорной кислоты. В случае содержащей синегнойную палочку культуральной среды, в которую была добавлена акриловая кислота, количество производимого пиоцианина по отношению к числу жизнеспособных бактерий оказалось большим, чем в контрольном образце. На основании вышеизложенного было обнаружено, что трифосфорная кислота в чистом виде производила ингибирующее воздействие на образование факторов вирулентности (пиоцианина), но фосфорная кислота и акриловая кислота в чистом виде не производили ингибирующего воздействия на образование факторов вирулентности и были способны ингибировать образование факторов вирулентности только в том случае, когда они были соединены с волокном химическими связями.
Промышленная применимость
Ингибирующее волокно (материал) против образования факторов вирулентности согласно настоящему изобретению можно использовать, например, в следующих областях.
(1) Медицинский белый халат и спецодежда медсестер
Когда для одежды используют материал, к которому прикреплен ингибирующий образование факторов вирулентности компонент, и который, таким образом, становится эффективным также по отношению к резистентным к множеству лекарственных средств бактериям, становится возможным предотвращение внутрибольничных инфекций, переносчиками которых являются предметы одежды врачей и медсестер.
(2) Нижняя одежда и белье
Считается, что суперантиген, который производят стафилококки, усиливает атопический дерматит, когда воспаленные участки инфицируются бактериями. Если волокно согласно настоящему изобретению способно ингибировать образование суперантигена золотистым стафилококком, становится возможной разработка нижнего белья, которое может ослаблять атопический дерматит.
(3) Медицинские повязки, марля и маски
Когда ингибирующее волокно (материал) против образования факторов вирулентности согласно настоящему изобретению используют в форме марли, повязки, маски и т.д., которая ингибирует вирулентную бактериальную инфекцию через хирургические раны, гематомы, пролежни лежачих пациентов и т.д., становится возможным ингибирование инфекции, которую вызывают резистентные к множеству лекарственных средств бактерии.
(4) Липкий пластырь
Ингибирующее волокно против образования факторов вирулентности согласно настоящему изобретению можно использовать в качестве материала липких пластырей, наносимых на раны.
(5) Материалы интерьера, такие как обои и ковры, постельное белье, такое как простыни, и оборудование для ухода за больными
Становится возможным предотвращение внутренней инфекции в больницах, домах престарелых, лечебно-реабилитационных центрах, яслях и детских садах.