Результат интеллектуальной деятельности: Лиганд для получения комплекса переходного металла, способ его получения и способ получения комплекса переходного металла с использованием лиганда
Вид РИД
Изобретение
Изобретение относится к области элементоорганической химии, в частности к новому способу получения 4,5-бис(дифенилфосфино)триазола - лиганда, а также комплекса с солями переходного металла на его основе.
Известен способ получения комплексов дитио- и диселенилфосфорилзамещенных триазолов с щелочными металлами. В нем раствор исходного лиганда в тетрагидрофуране обрабатывают непосредственно щелочными металлами либо их магнийорганическими производными.
J.A. Balanta-Diaz, М. Moya-Cabrera, V. Jancik, L.W. Pineda-Cedeno, R.A. Toscano, R. Cea-Olivares. Structural variety of alkali metal compounds containing P-E-M (E=S, Se; M=Li, Na, K) units derived from nitrogen rich heterocycles. Inorganic Chemistry, v. 48, n. 6, 2009, p. 2518-2525.
Недостатком этого способа является необходимость использования легко воспламеняющихся щелочных металлов либо металлорганических соединений.
Известен способ получения окисей бис-фосфиноизоксазолинов, 1,3-диполярным циклоприсоединением окиси 1,2-дифосфиноэтилена к С,N-дифенилнитрону.
N. Vinokurov, K.М. Pietrusiewicz, S. Frynas, М. Wiebckec, Н. Butenschon. Asymmetric 1,3-dipolar cycloaddition with a P-stereogenic dipolarophile: An efficient approach to novel P-stereogenic 1,2-diphosphine systems. Chem. Commun., 2008, p. 5408-5410.
К недостаткам этого способа можно отнести необходимость использования микроволнового излучения.
Известен способ получения 4,5-бис-фосфинозамещенных триазолов и их комплексов на основе платины. Окись дифенилфосфиноацетилена переводят в его магнийорганическое производное, реагирующее с борофосфиназидом, с последующим восстановлением фенилсиланом.
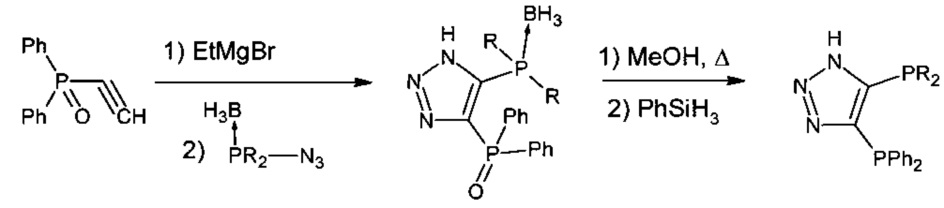
Далее были получены комплексы на основе платины
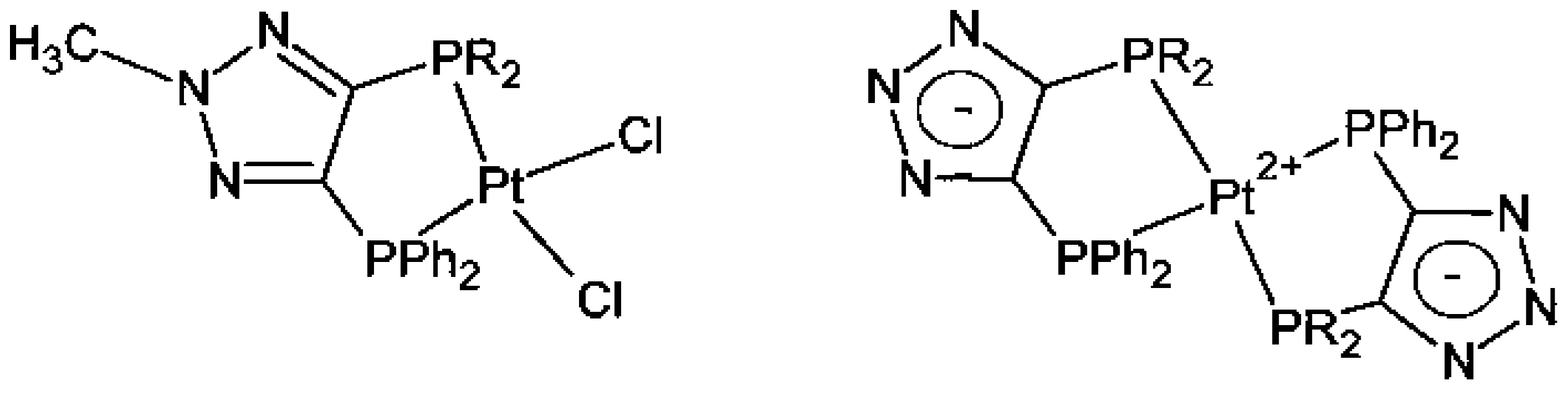
Е.A. Slutsky Smith, G. Molev, M. Botoshansky and M. Gandelman. Modifiable bidentate systems via N-rearrangemein triazoles. Chem. Commun., 2011, v. 47, p. 319-321.
Недостатком способа является сложное аппаратурное оформление и труднодоступность борофосфиназида.
Известен способ получения пятичленных дифосфоланзамещенных гетероциклов с одним гетероатомом и комплексов с металлами на их основе. В качестве гетероцикла выступают замещенные пиррол, индол, тиофен, бензотиофен, в качестве металла - родий, рутений, иридий
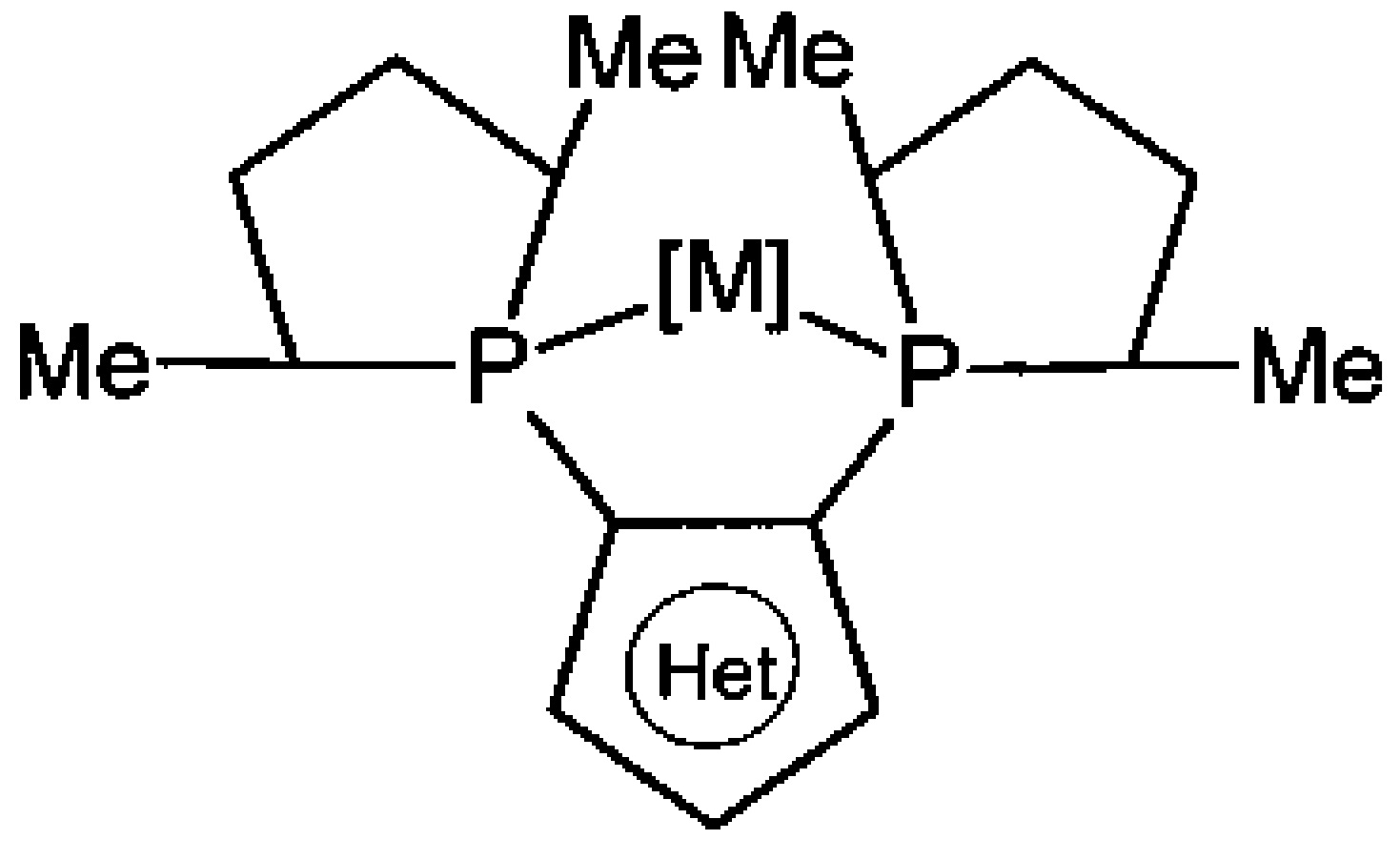
В незамещенный гетероцикл в несколько стадий вводят два фосфиновых заместителя, затем формируют два фосфолановых цикла. WO 2003074169 А2, 03.03.2003.
К недостаткам способа можно отнести многостадийность и использование металлорганических и фосфорсодержащих реагентов, а также относительно небольшие суммарные выходы целевых продуктов реакции.
Известен способ получения замещенных 4,5-бис-фосфинотриазолов взаимодействием тетраэтилацетилендифосфоната с азидом натрия, последующим алкилированием или ацилированием и восстановлением алюмогидридом лития. WO 2008055963 A1, 15.05.2008. С некоторыми из лигандов были получены комплексы на основе родия.
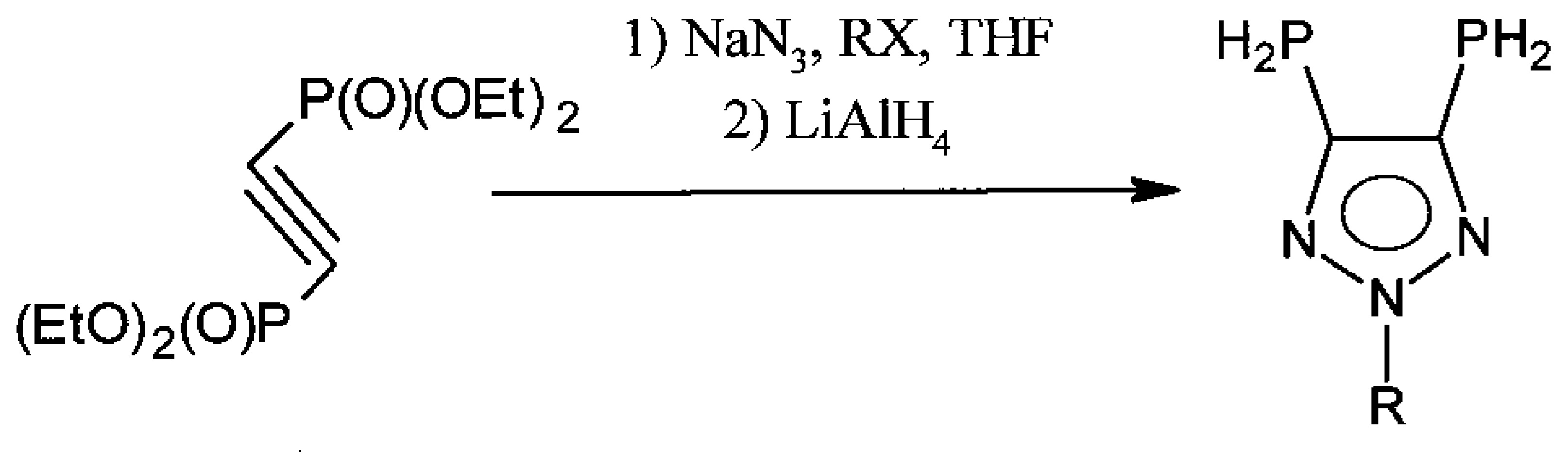
К недостаткам способа можно отнести невозможность получить бис-диарилфосфинопроизводные, а также использование пожароопасного алюмогидрида лития, в качестве восстановителя, кроме того, по этому методу получают только симметричные замещенные триазолы.
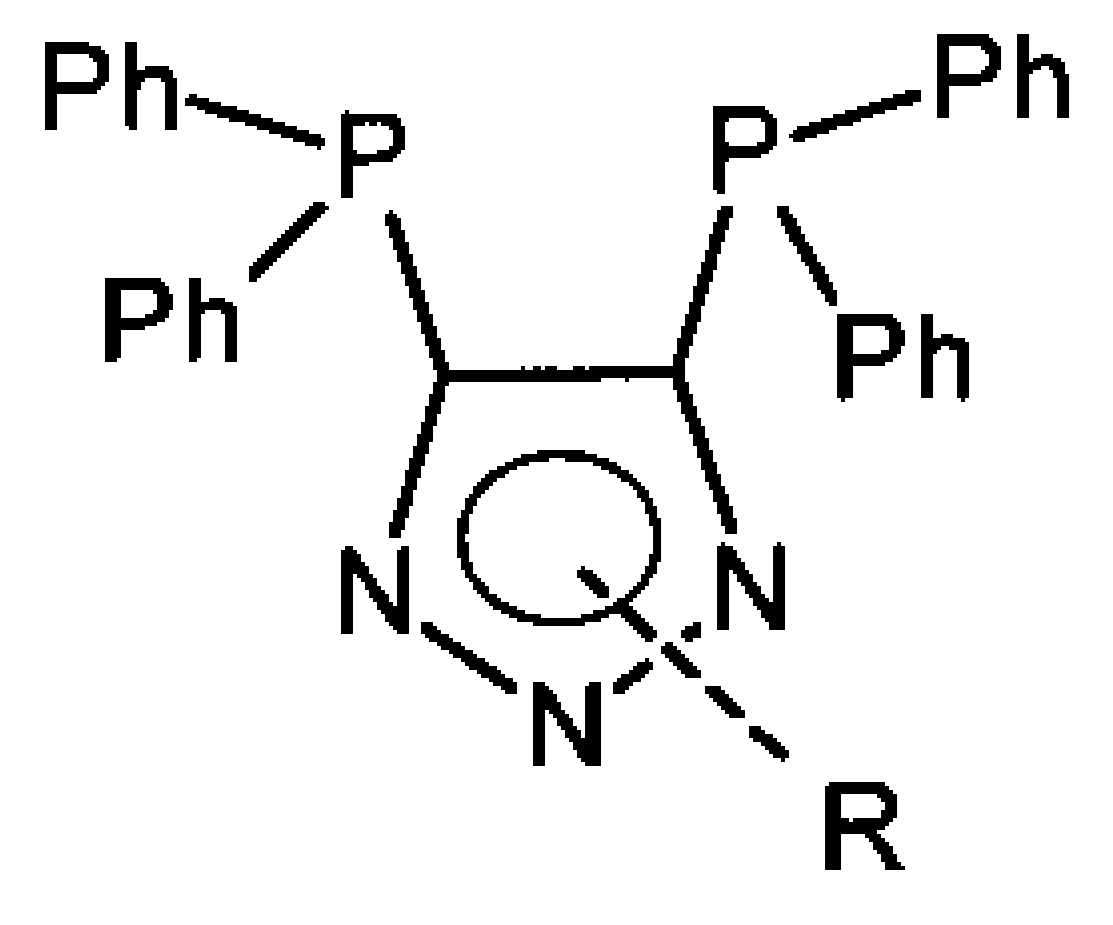
Наиболее близким к заявляемому является способ получения 4,5-бис(дифенилфосфино)-1,2,3-триазола, раскрытый в S. Trofimenko, A.L. Rheingold, С.D. Incarvito. 4,5-Bis(diphenylphosphanyl)-1,2,3-triazole and its conversion to 1,1,3,3,-tetraphenyl-1,3-diphospha-2,4,5,6-tetraazapentalene. Angew. Chem. Int. Ed. 2003, v. 42, p. 3506-3509. Бис-дифенилфосфиноацетилен взаимодействует последовательно с селеном, азидом натрия и триэтилфосфитом. Известны комплексы 4,5-бис(дифенилтиофосфино)-1,2,3-триазола, в качестве лигандов на основе палладия. A.L. Rheingold, L.М. Liable-Sands, S. Trofimenko. 4,5-Bis(diphenylthiophosphinoyl)-1,2,3-triazole, LT-S2: a new varidentate ligand containing diphenylthiophosphinoyl moieties. Inorganica Chimica Acta,, 2002, v. 330, p. 38-43.
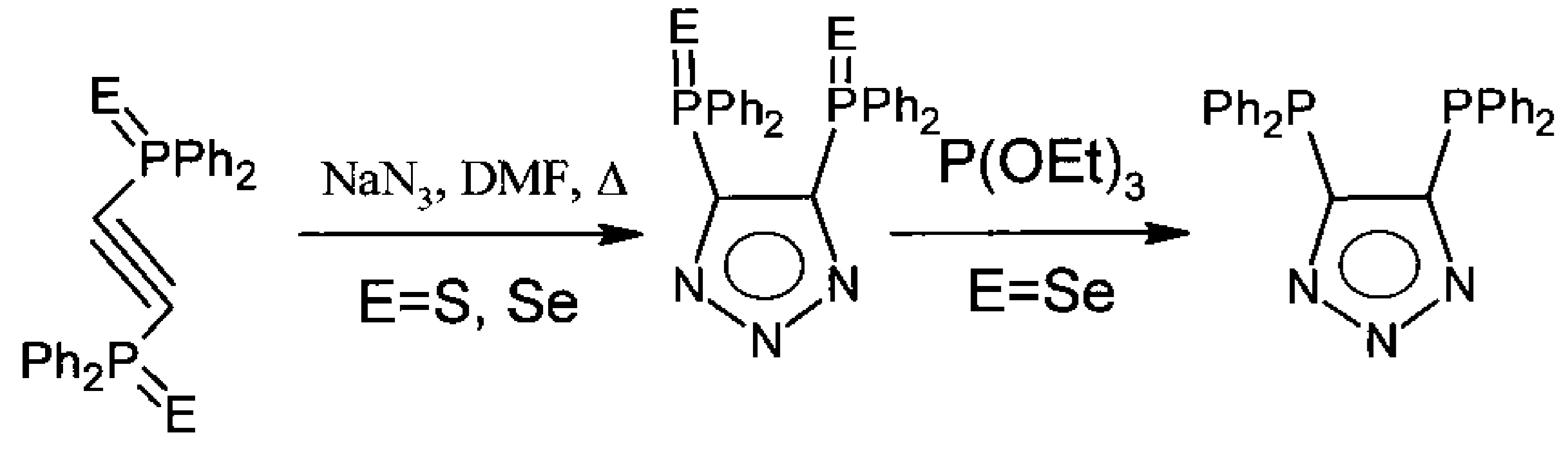
К недостаткам способа можно отнести использование токсичных триэтилфосфита и селена. Замена селена на серу приводит к невозможности получения дифосфинотриазолилпроизводных реакцией соответствующих тиопроизводных с триэтилфосфитом.
Технической задачей заявленной группы изобретений является разработка простого способа получения лиганда - 4,5-бис(дифенилфосфино)триазола и способа получения комплекса с переходным металлом на его основе с хорошим выходом и высокой чистотой.
Технический результат от реализации заявленного изобретения заключается в упрощении процесса и повышении его технологичности за счет проведения в условиях, не требующих сложного оборудования и токсичных реагентов, с выходом целевых продуктов до 85 масс. % высокой чистоты.
Технический результат достигается тем, что синтез 4,5-бис(дифенилфосфино)триазола проводят в соответствии с уравнениями реакций в три стадии. Первая стадия - осуществляют синтез окиси дифосфиноацетилена из ацетилена и хлордифенилфосфина с использованием никелевого и медного катализаторов и третичного амина в качестве основания и последующим окислением дифосфиноацетилена перекисью водорода;
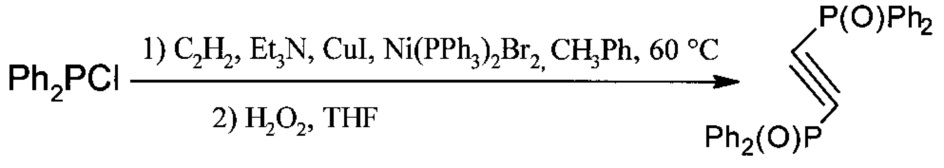
Вторая стадия - образование 1,2,3-триазольного цикла реакцией с соответствующим органическим азидом, выбранным из группы: n-гексилазид, 2-(тиогексил)этилазид или смесью NaN3 с соответствующим органическим галогенидом, выбранным из группы: метилиодид, 1-хлорбутан, 1-иодгексан, 1-хлороктан, аллилбромид, 6-хлоргексен-1, хлорацетонитрил, 2-хлорметилстирол, этилхлорацетат, ацетилхлорид.
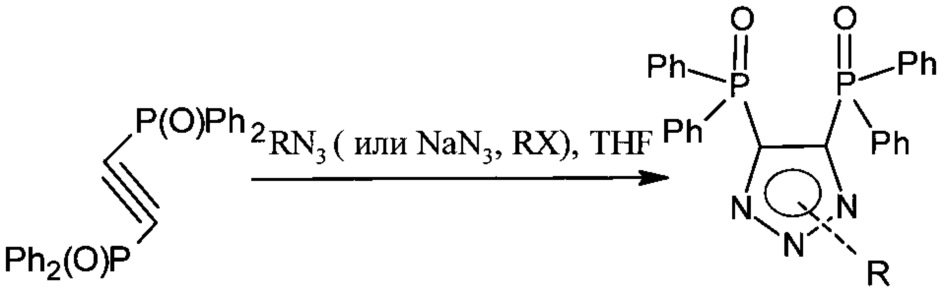
Третья стадия - получение целевого продукта восстановлением трихлорсиланом, после которого хроматографически выделяют целевой продукт:
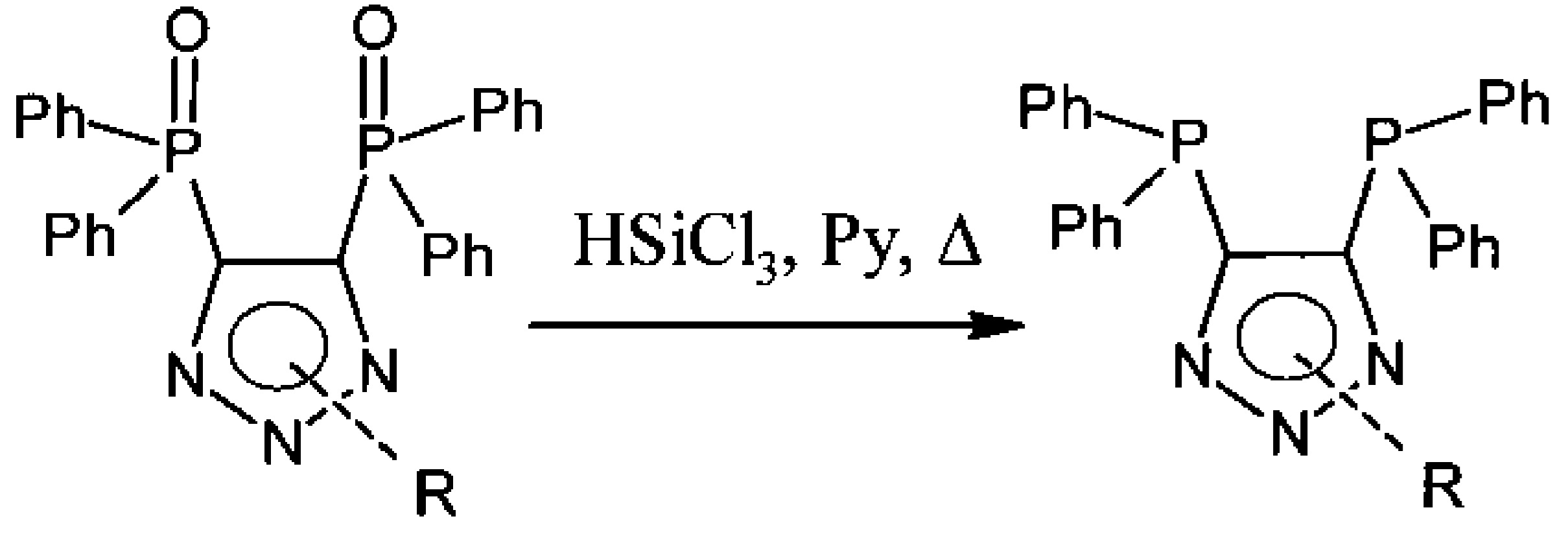
Выход ацетилендифосфин оксида составляет 61 масс. % на две стадии, выход лиганда на стадии восстановления достигает 77 масс. %.
В результате получают лиганд - 4,5-бис(дифенилфосфино)триазол для получения комплекса переходного металла, представляющий собой соединение, выбранное из группы: 4,5-бис(дифенилфосфино)-1-(гексил)-1Н-1,2,3-триазол, 4,5-бис(дифенилфосфино)-1-(2-октилтио)этил-1Н-1,2,3-триазол, 4,5-бис(дифенилфосфино)-2-(метил)-2Н-1,2,3-триазол, 4,5-бис(дифенилфосфино)-2-(бутил)-2Н-1,2,3-триазол, 4,5-бис(дифенилфосфино)-2-(гексил)-2Н-1,2,3-триазол, 4,5-бис(дифенилфосфино)-2-(октил)-2Н-1,2,3-триазол, 4,5-бис(дифенилфосфино)-2-(аллил)-2Н-1,2,3-триазол, 4,5-бис(дифенилфосфино)-2-(гекс-5-ен-1-ил)-2Н-1,2,3-триазол, 4,5-бис(дифенилфосфино)-2-(цианометил)-2Н-1,2,3-триазол, 4,5-бис(дифенилфосфино)-2-(винилбензил)-2Н-1,2,3-триазол, этил(2-(4,5-бис(дифенилфосфино)-2Н-1,2,3-триазол-2-ил)ацетат, 1-(4,5-бис(дифенилфосфино)-2Н-1,2,3-триазол-2-ил)этан-1-он.
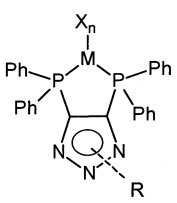
Способ получения комплекса переходного металла предусматривает реакцию вышеобозначенного лиганда с галогенидом соответствующего переходного металла в растворе тетрагидрофурана в атмосфере аргона, дегазирование полученной суспензии и перемешивание в течение 17-18 ч при комнатной температуре, полученный продукт выделяют и сушат.
Выход комплекса составляет до 85 масс. %.
Получают комплекс с переходным металлом общей формулы:
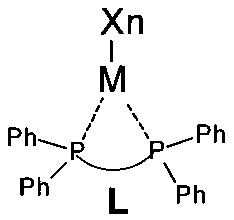
где L - лиганд, М - переходный металл, X - галогенид, n - число атомов галогена следующие:
L=4,5-бис(дифенилфосфино)-1-гексил-1Н-1,2,3-триазол, М=Cr, Х=Cl, n=3;
L=4,5-бис(дифенилфосфино)-1-(2-октилтио)этил-1Н-1,2,3-триазол, М=Cr, Х=Cl, n=3;
L=4,5-бис(дифенилфосфино)-2-(метил)-2Н-1,2,3-триазол, M=Pd, Х=Cl, n=2;
L=4,5-бис(дифенилфосфино)-2-(бутил)-2Н-1,2,3-триазол, М=Cr, Х=Cl, n=3;
L=4,5-бис(дифенилфосфино)-2-(гексил)-2Н-1,2,3-триазол, М=Cr, Х=Cl, n=3;
L=4,5-бис(дифенилфосфино)-2-(октил)-2Н-1,2,3-триазол М=Cr, Х=Cl, n=3;
L=4,5-бис(дифенилфосфино)-2-(аллил)-2Н-1,2,3-триазол, М=Cr, Х=Cl, n=3;
L=4,5-бис(дифенилфосфино)-2-(гекс-5-ен-1-ил)-2Н-1,2,3-триазол, М=Cr, Х=Cl, n=3;
L=4,5-бис(дифенилфосфино)-2-(цианометил)-2Н-1,2,3-триазол, М=Cr, Х=Cl, n=3;
L=4,5-бис(дифенилфосфино)-2-(винилбензил)-2Н-1,2,3-триазол, М=Cr, Х=Cl, n=3;
L=этил(2-(4,5-бис(дифенилфосфино)-2Н-1,2,3-триазол-2-ил)ацетат, M=Ni, Х=Br, n=2;
L=1-(4,5-бис(дифенилфосфино)-2Н-1,2,3-триазол-2-ил)этан-1-он, M=Fe, Х=Cl, n=2.
Изобретение иллюстрируется следующими примерами.
Пример 1.
Получение 1,2-бис(дифенилфосфино)ацетилена.
Раствор 50 г (0,23 моль) Ph2PCl, 1,3 г (6,81 ммоль) CuI, 57,4 г (0,568 моль) Et3N, 4 г (5,68 ммоль) NiBr2(PPh3)2 в 100 мл толуола перемешивают в атмосфере сухого и очищенного ацетилена, полученного из 73 г (1,135 моль) CaC2, при температуре 60°C в течение 18 ч. Далее растворитель упаривают, из остатка хроматографически (силикагель, элюент хлороформ-гексан 1:10) выделяют 32 г (71 масс. %) 1,2-бис(дифенилфосфино)ацетилена. ЯМР 1Н (400 МГц, CDCl3): δ (м.д.) 7,34 - 7,46 (13Н, м, HAr), 7,60-7,73 (8Н, м, HAr). ЯМР 31P{1H} (161,98 МГц, CDCl3): δ (м.д.) - 32,13 (1Р, с,). ЯМР13С (101 МГц, CDCl3): δ (м.д.) 106,9, 128,7, 129.2, 132,6 132,8, 135,7.
Получение ацетилен-1,2-диилбис(дифенилфосфин оксида).
К охлажденному до 5°C раствору 10 г (25,4 ммоль) 1,2-бис(дифенилфосфино)ацетилена в 100 мл ТГФ при перемешивании прикапывают 6,51 мл (76,1 ммоль) 35%-ного водного раствора перекиси водорода, перемешивают в течение 30 мин. Затем прибавляют 50 мл насыщенного водного раствора тиосульфата натрия и перемешивают в течение 30 мин, экстрагируют 3×50 мл хлороформа. Органический слой сушат над Na2SO4. Получают ацетилен-1,2-бис(дифенилфосфин оксид), в виде светло-желтого порошка 9,30 г (86 масс%). ЯМР 1H (400 МГц, CDCl3): δ (м.д.) 7,45-7,55 (8Н, м, HAr), 7,57-7,64 (4Н, м, HAr), 7,73-7,85 (8Н, м, HAr). ЯМР 31P{1H} (161,98 МГц, CDCl3): δ (м.д.) 9,78 (1Р, с). ЯМР 13С (101 МГц, CDCl3): δ (м.д.) 99,9, 129,2, 129,7, 131,0, 131,1, 132,2, 133,3.
Получение (2Н-1,2,3-триазол-4,5-диил)бис(дифенилфосфин оксида).
К раствору 9,30 г (21,8 ммоль) ацетилен-1,2-бис(дифенилфосфин оксида) в 75 мл ТГФ добавляют 1,84 г (28,3 ммоль) NaN3 и перемешивают при температуре 50°C в течение 10 ч. Затем реакционную массу упаривают досуха, остаток растворяют в 100 мл воды и подкисляют до рН 5. Выпавший осадок отфильтровывают, промывают на фильтре водой (3×30 мл), сушат в вакууме. Получают 7,8 г (76 масс. %) (2Н-1,2,3-триазол-4,5-диил)бис(дифенилфосфин оксида). ЯМР 1Н (400 МГц, CDCl3): δ (м.д.) 7,45-7,55 (8Н, м, HAr), 7,57-7,66 (84Н, м, HAr), 7,83 (8Н, дд, J=13,83, 8,11 Гц, HAr). ЯМР 31Р{1Н} (161,98 МГц, CDCl3): δ (м.д.) 9,18 (1Р, с).
Получение 4,5-бис(дифенилфосфино)-2Н-1,2,3-триазола.
К раствору 6,6 г (0,014 моль) (2Н-1,2,3-триазол-4,5-диил)бис(дифенилфосфин оксида) в 75 мл абсолютного толуола в атмосфере аргона прикапывают 11,5 г (0,085 моль) трихлорсилана, а затем 20,1 г (0,255 моль) пиридина. Реакционную смесь перемешивают при температуре 90°C в течение 2 ч. Реакционную смесь фильтруют, фильтрат упаривают, остаток хроматографируют (силикагель, элюент этилацетат-гексан 1:10). Получают 2,5 г (41 масс. %) 4,5-бис(дифенилфосфино)-2Н-1,2,3-триазола). ЯМР 1H (300 МГц, CDCl3): δ (м.д.) 7,21-7,56 (20Н, м, HAr), 12,42 (1H, уш.с, NH). ЯМР 31Р{1Н} (161,98 МГц, CDCl3): δ (м.д.) - 36,26 (1Р, с), - 32,49 (1Р, с).
Получение комплекса 4,5-бис(дифенилфосфино)-2Н-1,2,3-триазол-Р,Р-трихлорохром(III).
В 100 мл колбу Шленка, снабженную магнитным якорем, помещают 1,44 г (9,1 ммоль) CrCl3 и 4,4 г (10,1 ммоль) 4,5- бис(дифенилфосфино)-2Н-1,2,3-триазола. Колбу вакуумируют и заполняют аргоном. В токе аргона добавляют 50 мл абсолютного тетрагидрофурана (ТГФ), полученную суспензию дегазируют и перемешивают при комнатной температуре в течение 18 ч. Растворитель упаривают, остаток промывают гексаном, высушивают под вакуумом. Получают 3,9 г (71 масс. %) комплекса (4,5-бис(дифенилфосфино)-2Н-1,2,3-триазол)-Р,Р-трихлорохром(III), в виде сине-фиолетового порошка. Тпл>250°C. C26H21Cl3CrN3P2. Вычислено: С 52,42 Н 3,55; N 7,05. Найдено: С 52,66; Н 3,99; N 7,44.
Пример 2.
Осуществляют аналогично Примеру 1, но вместо NaN3, добавляют 3,59 г (28,3 ммоль) n-гексилазид. Получают 8,8 г (73 масс. %) 1-(гексил)-(1Н-1,2,3-триазол-4,5-диил)бис(дифенилфосфин оксида). ЯМР 1Н (400 МГц, DMSO-d6): δ (м.д.) 0,74-0,84 (3Н, м, CH3), 1,09-1,19 (6Н, м, 3×CH2), 1,75 (2Н, кв, J=7,23 Гц, CH2), 5,05 (2Н, т, J=7,31 Гц, CH2), 7,21-7,59 (16Н, м, HAr), 7,85-7,91 (4Н, м, HAr). ЯМР 31Р{1Н} (161,98 МГц, CDCl3): δ (м.д.) 18,05 (1Р, с), 21,22 (1Р, с).
Аналогично Примеру 1, восстановлением 7,75 г (0,014 моль) 1-(гексил)-(1H-1,2,3-триазол-4,5-диил)бис(дифенилфосфин оксида) получают 5,46 г (74 масс. %) 4,5-бис(дифенилфосфино)-1-гексил-1Н-1,2,3-триазола. ЯМР 1Н (400 МГц, CDCl3): δ (м.д.) 0,80-0,87 (3Н, м, СН3), 1,10-1,23 (6Н, м, 3×СН2), 1,65 - 1,69 (2Н, м, СН2), 4,40 (2Н, т, J=7,63 Гц, СН2), 7,19-7,36 (20Н, м, HAr). ЯМР 31Р{1Н} (161,98 МГц, CDCl3): δ (м.д.) - 36,09 (1Р, м).
Аналогично Примеру 1, из 1,44 г (9,1 ммоль) CrCl3 и 5,29 г (10,1 ммоль) 4,5-бис(дифенилфосфино)-1-гексил-1Н-1,2,3-триазола получают 5,1 г (82 масс. %) комплекса (4,5-бис(дифенилфосфино)-1-гексил-1Н-1,2,3-триазол)-Р,Р-трихлорохром(III) в виде сине-фиолетового порошка. Тпл>250°C. C32H33Cl3CrN3P2. Вычислено: С 56,53; Н 4,89; N 6,18. Найдено: С 56,37; Н 5,29; N 5,94.
Пример 3.
Осуществляют аналогично Примеру 1, но вместо NaN3, добавляют 6,1 г (28,3 ммоль) 2-тиогексилэтилазид. Получают 10,8 г (77 масс. %) 1-(2-октилтио(этил)-1Н-1,2,3-триазол-4,5-диил)бис(дифенилфосфин оксида). ЯМР 1Н (400 МГц, CD2Cl2): δ (м.д.) 0,92 (3Н, т, J=6,83 Гц, CH3), 1,19-1,61 (12Н, м, 6×CH2), 2,41-2,57 (2Н, м, CH2), 2,87-3,01 (2Н, м, CH2), 2,88-3,02 (2Н, м, CH2), 5,25 (2Н, т, J=7,31 Гц, CH2), 7,27-7,58 (16Н, м, HAr), 7,83-8,00 (4Н, м, HAr). ЯМР 31Р{1Н} (161,98 МГц, CD2Cl2): δ (м.д.) 17,00 (1Р, с), 20,88 (1Р, с).
Аналогично Примеру 1, восстановлением 9,0 г (0,014 моль) 1-(2-октилтио(этил)-1Н-1,2,3-триазол-4,5-диил)бис(дифенилфосфин оксида) получают 6,5 г (76 масс. %) 4,5-бис(дифенилфосфино)-1-(2-октилтио)этил-1Н-1,2,3-триазола. ЯМР 1Н (400 МГц, CDCl3): δ (м.д.) 0,84-0,97 (3Н, м, CH3), 1,23-1,55 (12Н, м, 6×CH2), 2,38-2,47 (2Н, м, CH2), 2,76-2,85 (2Н, м, CH2), 4,66 (2Н, т, J=7,63 Гц, CH2), 7,27-7,41 (20Н, м, HAr). ЯМР 31Р{1Н} (161,98 МГц, CDCl3): δ (м.д.) - 36,09 (1Р, с).
Аналогично Примеру 1, из 1,44 г (9,1 ммоль) CrCl3 и 6,2 г (10,1 ммоль) 4,5-бис(дифенилфосфино)-1-(2-октилтио)этил-1Н-1,2,3-триазола получают 4,4 г (80 масс. %) комплекса (4,5-бис(дифенилфосфино)-1-(2-октилтио)этил-1Н-1,2,3-триазол)-Р,Р-трихлорохром(III), в виде сине-фиолетового порошка. Тпл>250°C. C36H39Cl3CrN3OP2S. Вычислено: С 56,29; Н 5,38; N 5,47. Найдено: С 55,88; Н 5,91; N 5,38.
Пример 4.
Осуществляют аналогично Примеру 1, но помимо NaN3, в реакционную смесь добавляют 3,1 г (21,8 ммоль) метилиодида, нагревают при температуре 70°C с обратным холодильником и перемешивании в течение 8 ч. Получают 6,5 г (62 масс. %) (2-(метил)-2Н-1,2,3-триазол-4,5-диил)бис(дифенилфосфин оксида). ЯМР 1Н (400 МГц, C6D6): δ (м.д.) 4,31 (3Н, с, CH3), 7,31-7,75 (20Н, м, HAr). ЯМР 31P{1H} (161,98 МГц, C6D6): δ (м.д.) 18,65 (1Р, с).
Аналогично Примеру 1, восстановлением 6,8 г (0,014 моль) (2-(метил)-2Н-1,2,3-триазол-4,5-диил)бис(дифенилфосфин оксида) получают 4,3 г (68 масс. %) 4,5-бис(дифенилфосфино)-2-(метил)-2Н-1,2,3-триазола. ЯМР 1Н (500 МГц, CDCl3): δ (м.д.) 4,23 (3Н, м, CH3), 7,24-7,31 (12Н, м, HAr), 7,36-7,44 (8Н, м, HAr). ЯМР 31Р{1Н} (202 МГц, CDCl3): δ (м.д.) - 34,29 (1Р, с).
Аналогично Примеру 1, из 1,61 г (9,1 ммоль) PdCl2 и 4,98 г (10,1 ммоль) 4,5-бис(дифенилфосфино)-2-(метил)-2Н-1,2,3-триазола получают 4,1 г (71 масс. %) комплекса (4,5-бис(дифенилфосфино)-2-(метил)-2Н-1,2,3-триазол)-Р,Р-дихлоропалладий(II), в виде темно-синего порошка. Тпл>250°C. C27H23Cl2PdN3P2. Вычислено: С 51,58; Н 3,69; N 6,68. Найдено: С 51,79; Н 3,24; N 6,72.
Пример 5.
Осуществляют аналогично Примеру 1, но помимо NaN3, в реакционную смесь добавляют 2,0 г (21,8 ммоль) 1-хлорбутана, 3,27 г (21,8 ммоль) иодида натрия, нагревают при температуре 70°C с обратным холодильником и перемешивании в течение 8 ч. Получают 7,6 г (66 масс. %) (2-(бутил)-2Н-1,2,3-триазол-4,5-диил)бис(дифенилфосфин оксида). ЯМР 1Н (400 МГц, CDCl3): δ (м.д.) 0,91 (3Н, т, J=7,31 Гц, CH3), 1,28-1,34 (2Н, м, CH2), 1,93 (2Н, кв,, J=7,15 Гц, CH2), 4,50 (2Н, т, J=7,15 Гц, CH2), 7,31-7,36 (8Н, м, HAr), 7,43-7,50 (4Н, м, HAr), 7,67-7,73 (8Н, м, HAr). ЯМР 31Р{1Н} (161,98 МГц, CDCl3): δ (м.д.)21,81 (1Р, с).
Аналогично Примеру 1, восстановлением 7,4 г (0,014 моль) (2-(бутил)-2Н-1,2,3-триазол-4,5-диил)бис(дифенилфосфин оксида) получают 4,4 г (64 масс. %) 4,5-бис(дифенилфосфино)-2-(бутил)-2Н-1,2,3-триазола. ЯМР 1H (400 МГц, CD2Cl2): δ (м.д.) 0,90-0,96 (3Н, м, CH3), 1,25-1,35 (2Н, м, CH2), 1,88-1,96 (2Н, м, CH2), 4,47 (2Н, т, J=7,13 Гц, CH2), 7,24-7,30 (12Н, м, HAr), 7,37-7,44 (8Н, м, HAr). ЯМР 31P{1H} (202 МГц, CDCl3):δ (м.д.) - 34,10(1Р, с).
Аналогично Примеру 1, из 1,44 г (9,1 ммоль) CrCl3 и 5,38 г (10,1 ммоль) 4,5-бис(дифенилфосфино)-2-(бутил)-2Н-1,2,3-триазола получают 4,1 г (69 масс. %) комплекса (4,5-бис(дифенилфосфино)-2-(бутил)-2Н-1,2,3-триазол)-Р,Р-трихлорохром(III), в виде синего порошка. Тпл>250°C. C32H33Cl3CrN3P2. Вычислено: С 55,28; Н 4,48; N 6,45. Найдено: С 54,89; Н 4,84; N 5,98.
Пример 6.
Осуществляют аналогично Примеру 1, но помимо NaN3, в реакционную смесь добавляют 4,6 г (21,8 ммоль) 1-иодгексана, нагревают при температуре 70°C с обратным холодильником и перемешивании в течение 8 ч. Получают 8,6 г (71 масс. %) (2-(гексил)-2Н-1,2,3-триазол-4,5-диил)бис(дифенилфосфин оксида). ЯМР 1Н (400 МГц, DMSO-d6): δ (м.д.) 0,93 (3Н, т, J=6.83 Гц, CH3), 1,31-1,38 (4Н, м, 2×CH2), 1,77-1,87 (2Н, м, CH2), 3,17-3,30 (2Н, м, CH2), 4,53 (2Н, т, J=6,83 Гц, CH2), 7,33-7,46 (8Н, м, HAr), 7,51-7,58 (4Н, м, HAr), 7,62-7,66 (8Н, м, HAr). ЯМР 31P{1H} (161,98 МГц, DMSO-d6): δ (м.д.) 17,90 (1P, с).
Аналогично Примеру 1, восстановлением 7,75 г (0,014 моль) (2-(гексил)-2Н-1,2,3-триазол-4,5-диил)бис(дифенилфосфин оксида) получают 5,53 г (75 масс. %) 4,5-бис(дифенилфосфино)-2-(гексил)-2Н-1,2,3-триазола. ЯМР 1Н (400 МГц, CD2Cl2): δ (м.д.) 0,89-0,97 (3Н, м, CH3), 1,25-1,36 (6Н, м, 3×CH2), 1,90-2,03 (2Н, м, CH2), 4,50 (2Н, т, J=6,99 Гц, CH2), 7,28-7,46 (20Н, м, HAr). ЯМР 31Р{1Н} (161,98 МГц, CD2Cl2): δ (м.д.) - 34,02 (1Р, с).
Аналогично Примеру 1, из 1,44 г (9,1 ммоль) CrCl3 и 5,29 г (10,1 ммоль) 4,5-бис(дифенилфосфино)-2-(гексил)-2Н-1,2,3-триазола получают 5,82 г (85 масс. %) комплекса (4,5-бис(дифенилфосфино)-2-(гексил)-2Н-1,2,3-триазол)-Р,Р-трихлорохром(III), в виде синего порошка. Тпл>250°C. C32H33Cl3CrN3P2. Вычислено: С 56,53; Н 4,89; N 6,18. Найдено: С 56,37; Н 5,29; N 5,94.
Пример 7.
Осуществляют аналогично Примеру 1, но помимо NaN3, в реакционную смесь добавляют 3,2 г (21,8 ммоль) 1-хлороктан, 3,27 г (21,8 ммоль) иодида натрия, нагревают при температуре 70°C с обратным холодильником и перемешивании в течение 8 ч. Получают 8,5 г (67 масс. %) (2-(октил)-2Н-1,2,3-триазол-4,5-диил)бис(дифенилфосфин оксида). ЯМР 1H (400 МГц, DMSO-d6): δ (м.д.) 0,79-0,92 (3Н, м, CH3), 1,10-1,35 (4Н, м, 2×CH2), 1,68-1,91 (6Н, м, 3×CH2), 3,12-3,26 (2Н, м, CH2), 4,50 (2Н, т, J=6,99 Гц, CH2), 7,34-7,47 (8Н, м, HAr), 7,45-7,55 (4Н, м, HAr), 7,65-7,78 (8Н, м, HAr). ЯМР 31Р{1Н} (161,98 МГц, DMSO-d6): δ (м.д.) 17,62 (1Р, с).
Аналогично Примеру 1, восстановлением 8,14 г (0,014 моль) (2-(октил)-2Н-1,2,3-триазол-4,5-диил)бис(дифенилфосфин оксида) получают 5,23 г (68 масс. %) 4,5-бис(дифенилфосфино)-2-(октил)-2Н-1,2,3-триазола. ЯМР 1Н (400 МГц, CD2Cl2): δ (м.д.) 0,88-0,98 (3Н, м, CH3), 1,18-1,31 (10Н, м, 5×CH2), 1,87-1,99 (2Н, м, CH2), 4,47 (2Н, т, J=6,99 Гц, CH2), 7,25-7,43 (20Н, м, HAr). ЯМР 31P{1H} (161,98 МГц, CD2Cl2): δ (м.д.) - 34,14 (1Р, с).
Аналогично Примеру 1, из 1,44 г (9,1 ммоль) CrCl3 и 5,55 г (10,1 ммоль) 4,5-бис(дифенилфосфино)-2-(октил)-2Н-1,2,3-триазола получают 5,3 г (77 масс. %) комплекса (4,5-бис(дифенилфосфино)-2-(октил)-2Н-1,2,3-триазол)-Р,Р-трихлорохром(III), в виде сине-фиолетового порошка. Tпл>250°C. C34H37Cl3CrN3P2. Вычислено: С 57,68; Н 5,27; N 5,94. Найдено: С 57,31; Н 5,56; N 5,54.
Пример 8.
Осуществляют аналогично Примеру 1, но помимо NaN3, в реакционную смесь добавляют 2,6 г (21,8 ммоль) аллилбромида, нагревают при температуре 70°C с обратным холодильником и перемешивании в течение 8 ч. Получают 8,3 г (75 масс. %) (2-(аллил)-2Н-1,2,3-триазол-4,5-диил)бис(дифенилфосфин оксида). ЯМР 1Н (400 МГц, CD2Cl2): δ (м.д.) 5,14 (2Н, д, J=6.36 Гц, CH2), 5,22-5,35 (2Н, м,=CH2), 6,0-6,13 (1H, м, =СН), 7,35-7,38 (8Н, м, HAr), 7,48-7,58 (4Н, м, HAr), 7,61-7,74 (12Н, м, HAr). ЯМР 31Р{1Н} (161,98 МГц, CD2Cl2): δ (м.д.) 18,37 (1Р, с).
Аналогично Примеру 1, восстановлением 7,1 г (0,014 моль) (2-(аллил)-2Н-1,2,3-триазол-4,5-диил)бис(дифенилфосфин оксида) получают 5,0 г (75 масс. %) 4,5-бис(дифенилфосфино)-2-(аллил)-2Н-1,2,3-триазола. ЯМР 1H (400 МГц, CD2Cl2): δ (м.д.) 5,08-5,35 (4Н, м, 2×CH2), 6,04-6,22 (1H, м, СН), 7,24-7,31 (12Н, м, HAr), 7,28-7,69 (20Н, м, HAr). ЯМР 31Р{1Н} (161,98 МГц, CD2Cl2): δ (м.д.) - 33,69 (1Р, с).
Аналогично Примеру 1, из 1,44 г (9,1 ммоль) CrCl3 и 4,8 г (10,1 ммоль) 4,5-бис(дифенилфосфино)-2-(аллил)-2Н-1,2,3-триазола получают 5,8 г (78 масс. %) комплекса (4,5-бис(дифенилфосфино)-2-(аллил)-2Н-1,2,3-триазол)-Р,Р-трихлорохром(III), в виде синего порошка. Тпл>250°C. C29H25Cl3CrN3P2. Вычислено: С 54,78; Н 3,96; N 6,61. Найдено: С 55,20; Н 4,01; N 6,43.
Пример 9.
Осуществляют аналогично Примеру 1, но помимо NaN3, в реакционную смесь добавляют 2,6 г (21,8 ммоль) 6-хлоргексена-1, 3,27 г (21,8 ммоль) иодида натрия, нагревают при температуре 70°C с обратным холодильником и перемешивании в течение 8 ч. Получают 7,85 г (65 масс. %) (2-(гекс-5-ен-1-ил)-2Н-1,2,3-триазол-4,5-диил)бис(дифенилфосфин оксида). ЯМР 1Н (400 МГц, DMSO-d6): δ (м.д.) 1,07-1,30 (2Н, m, CH2), 1,77-1,85 (2H, m, CH2), 1,87-1,95 (2H, m, CH2), 4,54 (2Н, т, J=6,68 Гц, CH2CH=СН2), 4.89-4.96 (2Н, м, СН=CH2), 5,63-5,75 (1Н, м, СН=СН2), 7,39-7,48 (8Н, м, HAr) 7,55 (12Н, д, J=11,44 Гц). ЯМР 31Р{1Н} (161,98 МГц, DMSO-d6): δ (м.д.) 15,82 (1P, с).
Аналогично Примеру 1, восстановлением 7,85 г (0,014 моль) (2-(гекс-5-ен-1-ил)-2Н-1,2,3-триазол-4,5-диил)бис(дифенилфосфин оксида) получают 5,24 г (71%) 4,5-бис(дифенилфосфино)-2-(гекс-5-ен-1-ил)-2Н-1,2,3-триазола. ЯМР 1Н (400 МГц, CD2Cl2): δ (м.д.) 1,18-1,48 (3Н, м, CH3), 1,90-2,17 (4Нб м, CH2), 4,51 (2Н, т, 7=6,99 Гц,=CHCH2), 4,87-5,17 (2Н, м, CH2=СН), 5,79 (1H, ддт, J=17,05, 10,29, 6,68, 6,68 Гц, СН2=СН), 7,24-7,53 (20Н, м, HAr). ЯМР 31Р{1Н} (161,98 МГц, CD2Cl2): δ (м.д.) - 34,00 (1Р, с).
Аналогично Примеру 1, из 1,44 г (9,1 ммоль) CrCl3 и 5,24 г (10,1 ммоль) 4,5-бис(дифенилфосфино)-2-(гекс-5-ен-1-ил)-2Н-1,2,3-триазола получают 4,93 г (72 масс. %) комплекса (4,5-бис(дифенилфосфино)-2-(гекс-5-ен-1-ил)-2Н-1,2,3-триазол)-Р,Р-трихлорохром(III), в виде сине-фиолетового порошка. Тпл>250°C.C32H31Cl3CrN3P2. Вычислено: С 56,70; Н 4,61; N 6,20. Найдено: С 56,29; Н 5,96; N 6,14.
Пример 10.
Осуществляют аналогично Примеру 1, но помимо NaN3, в реакционную смесь добавляют 1,6 г (21,8 ммоль) хлорацетонитрила, нагревают при температуре 70°C с обратным холодильником и перемешивании в течение 8 ч. Получают 6,95 г (67 масс. %) (2-(цианометил)-2Н-1,2,3-триазол-4,5-диил)бис(дифенилфосфин оксида). ЯМР 1Н (400 МГц, DMSO-d6): δ (м.д.) 5,46 (2Н, с, CH2), 7,37-7,44 (8Н, м, HAr) 7,55-7,73 (12Н, м, HAr). ЯМР 31P{1H} (161,98 МГц, DMSO-d6): δ (м.д.) 17,55 (1Р, с).
Аналогично Примеру 1, восстановлением 6,66 г (0,014 моль) (2-(цианометил)-2Н-1,2,3-триазол-4,5-диил)бис(дифенилфосфин оксида) получают 4,4 г (70 масс. %) 4,5-бис(дифенилфосфино)-2-(цианометил)-2Н-1,2,3-триазола. ЯМР 1H (400 МГц, CD2Cl2): δ (м.д.) 5,23(2Н, с, CH2), 7,14-7,36 (20Н, м, HAr). ЯМР 31Р{1Н} (161,98 МГц, CD2Cl2): δ (м.д.) - 32,18(1Р, с).
Аналогично Примеру 1, из 1,44 г (9,1 ммоль) CrCl3 и 4,44 г (10,1 ммоль) 4,5-бис(дифенилфосфино)-2-(цианометил)-2Н-1,2,3-триазола получают 4,00 г (70 масс. %) комплекса (4,5-бис(дифенилфосфино)-2-(цианометил)-2Н-1,2,3-триазол)-Р,Р-трихлорохром(III), в виде фиолетового порошка. Tпл>250°C. C28H22Cl3CrN4P2. Вычислено: С 52,98; Н 3,49; N 8,83. Найдено: С 53,29; Н 3,88; N 8,78.
Пример 11.
Осуществляют аналогично Примеру 1, но помимо NaN3, в реакционную смесь добавляют 3,3 г (21,8 ммоль) 2-хлорметилстирола, 3,27 г (21,8 ммоль) иодида натрия, нагревают при температуре 70°C с обратным холодильником и перемешивании в течение 8 ч. Получают 8,32 г (69 масс. %) (2-(2-винилбензил)-2Н-1,2,3-триазол-4,5-диил)бис(дифенилфосфин оксида). ЯМР 1Н (400 МГц, DMSO-d6): δ (м.д.) 5,28-5,30 (1Н, м, СН=СН2), 5,61-5,64 (1H, м, СН=СН2), 5,71 (2Н, с, СН2), 7,04-7,78 (21Н, м, СН=СН2+HAr). ЯМР 31Р{1Н} (161,98 МГц, DMSO-d6): δ (м.д.) 17,16 (1Р, с).
Аналогично Примеру 1, восстановлением 8,2 г (0,014 моль) (2-(2-винилбензил)-2Н-1,2,3-триазол-4,5-диил)бис(дифенилфосфин оксида) получают 5,73 г (74 масс. %) 4,5-бис(дифенилфосфино)-2-(2-винилбензил)-2Н-1,2,3-триазола. ЯМР 1Н (400 МГц, CD2Cl2): δ (м.д.) 5,25-5,28 (1H, м, СН=СН2), 5,58-5,60 (1H, м, СН=CH2), 5,70 (2Н, с, СН2), 7,05-7,48 (21Н, м, СН=СН2+HAr). ЯМР 31Р{1Н} (161,98 МГц, CD2Cl2): δ (м.д.) - 34,19 (1Р, с).
Аналогично Примеру 1, из 1,44 г (9,1 ммоль) CrCl3 и 5,54 г (10,1 ммоль) 4,5-бис(дифенилфосфино)-2-(2-винилбензил)-2Н-1,2,3-триазола получают 4,85 г (75 масс. %) комплекса (4,5-бис(дифенилфосфино)-2-(2-винилбензил)-2Н-1,2,3-триазол)-Р,Р-трихлорохром(III), в виде синего порошка. Tпл>250°C. C35H29Cl3CrN3P2. Вычислено: С 59,05; Н 4,11; N 5,90. Найдено: С 59,25; Н 3,99; N 6,10.
Пример 12.
Осуществляют аналогично Примеру 1, но помимо NaN3, в реакционную смесь добавляют 2,7 г (21,8 ммоль) этил хлорацетата, 3,27 г (21,8 ммоль) иодида натрия, нагревают при температуре 70°C с обратным холодильником и перемешивании в течение 8 ч. Получают 9,7 г (78 масс%) этил 2-(4,5-бис(дифенилфосфорил)-2Н-1,2,3-триазол-2-ил) ацетата. ЯМР 1Н (400 МГц, DMSO-d6): δ (м.д.) 1,26 (3Н, т, J=7,2 Гц, СН2СН3), 4,25 (2Н, кв, J=6,99 Гц, CH2CH3), 5,31 (2Н, с, СН2), 7,04-7,88 (20Н, м, HAr). ЯМР 31P{1H} (161,98 МГц, DMSO-d6): δ (м.д.) 17,64 (1Р, с).
Аналогично Примеру 1, восстановлением 7,8 г (0,014 моль) этил 2-(4,5-бис(дифосфин оксид)-2Н-1,2,3-триазол-2-ил ацетата получают 5,64 г (77 масс. %) этил 2-(4,5-бис(дифосфин оксид)-2Н-1,2,3-триазол-2-ил ацетата. ЯМР 1Н (400 МГц, CD2Cl2): δ (м.д.) 1,23 (3Н, т, J=7,2 Гц, СН2СН3), 4,25 (2Н, кв, J=6,99 Гц, CH2CH3), 5,26 (2Н, с, СН2), 7,24-7,48 (20Н, м, HAr). ЯМР 31Р{1H} (161,98 МГц, DMSO-d6): δ (м.д.) - 34,11 (1Р, с).
Аналогично Примеру 1, из 1,99 г (9,1 ммоль) NiBr2 и 5,28 г (10,1 ммоль) этил 2-(4,5-бис(дифенилфосфино)-2Н-1,2,3-триазол-2-ил ацетата получают 5,34 г (79 масс. %) комплекса (этил2-(4,5-бис(дифенилфосфино)-2Н-1,2,3-триазол-2-ил)ацетат)-Р,Р-дибромоникель (II), в виде красно-коричневого порошка. Тпл>250°C. C30H27Br2N3NiO2P2. Вычислено: С 48,56; Н 3,67; N 5,66. Найдено: С 48,76; Н 3,84; N 5,32.
Пример 13.
Осуществляют аналогично Примеру 1, но помимо NaN3, в реакционную смесь добавляют 1,7 г (21,8 ммоль) ацетилхлорида, нагревают при температуре 70°C с обратным холодильником и перемешивании в течение 8 ч. Получают 8,1 г (73 масс. %) 1-(4,5-бис(дифосфин оксид)-2Н-1,2,3-триазол-2-ил)этан-1-она. ЯМР 1Н (400 МГц, DMSO-d6): δ (м.д.) 2,13 (3Н, с, СН3), 7,14-7,98 (20Н, м, HAr). ЯМР 31Р{1Н} (161,98 МГц, DMSO-d6): δ (м.д.) 22,97 (1Р, с).
Аналогично Примеру 1, восстановлением 7,2 г (0,014 моль) 1-(4,5-бис(дифосфин оксид)-2Н-1,2,3-триазол-2-ил)этан-1-она получают 4,7 г (70 масс. %) 1-(4,5-бис(дифенилфосфино)-2Н-1,2,3-триазол-2-ил)этан-1-он. ЯМР 1Н (400 МГц, CD2Cl2): δ (м.д.) 2,10 (3Н, с, CH3), 7,20-7,48 (20Н, м, HAr). ЯМР 31P{1H} (161,98 МГц, DMSO-d6): δ (м.д.)-36,90 (1P, с).
Аналогично Примеру 1, из 1,16 г (9,1 ммоль) FeCl2 и 4.84 г (10,1 ммоль) 1-(4,5-бис(дифенилфосфино)-2Н-1,2,3-триазол-2-ил)этан-1-она получают 3,97 г (72 масс. %) комплекса (1-(4,5-бис(дифенилфосфино)-2Н-1,2,3-триазол-2-ил)этан-1-он)-Р,Р-дихлорожелезо(II), в виде коричневого порошка. Тпл>250°C. C28H23Cl2FeN3OP2. Вычислено: С 55,48; Н 3,82; N 6,93. Найдено: С 55,75; Н 3,95; N 6,89.
Комплексы с переходными металлами на основе 4,5-бис(дифенилфосфино)триазолов могут использоваться как катализаторы олигомеризации этилена для получения фракции высших олефинов C10-C30, являющихся ценным многоцелевым сырьем, имеющим различные области применения.