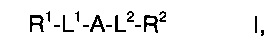Результат интеллектуальной деятельности: СОЕДИНЕНИЯ АЗЕТИДИНА, КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ РАСТВОРИМОЙ ЭПОКСИДГИДРОЛАЗЫ
Вид РИД
Изобретение
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к производным азетидина, полезным для терапии и/или профилактики у пациента, и, в частности, к ингибиторам растворимой эпоксидгидролазы (sEH; от англ. "Soluble Epoxide Hydrolase"). Эти соединения полезны для лечения болезненных состояний, опосредованных sEH, включающих мочеполовые болезненные состояния, болевые болезненные состояния, респираторные болезненные состояния, сердечно-сосудистые болезненные состояния, метаболические болезненные состояния, неврологические болезненные состояния, иммунологические болезненные состояния, воспалительные болезненные состояния, рак, нефропатию, инсульт, дисфункцию эндотелия, предупреждение ишемических событий и защиту концевых органов.
Эпоксидгидролазы представляют собой группу ферментов, катализирующих присоединение воды к эпоксиду с образованием в результате вицинального диола (Hammock et al (1997) в кн. Comprehensive Toxicology: Biotransformation (Elsevier, New York), pp. 283-305). У млекопитающих охарактеризовано несколько типов эпоксидгидролаз, включающих растворимую эпоксидгидролазу (sEH), также известную как цитозольная эпоксидгидролаза, эпоксидгидролазу холестерина, гидролазу лейкотриена А4 (LTA4), эпоксидгидролазу гепоксилина и микросомальную эпоксидгидролазу (mEH; от англ. "microsomal epoxide hydrolase") (Fretland and Omiecinski, Chemico-Biological Interactions, 129:41-59 (2000)). Эпоксидгидролазы обнаружены в ряде тканей у позвоночных, включающих сердце, почки и печень.
У людей sEH (hsEH, EPHX2) представляет собой бифункциональный гомодимерный фермент, локализованный как в цитозоле, так и в пероксисомах, обладающий активностью гидролазы и фосфатазы (Newman et al, Prog. Lipid Res, 44: 1-51(2005)). В частности, С-концевой гидролазный мотив sEH преобразует четыре региоизомера эпоксиэйкозатриеновых кислот (ЕЕТ; от англ. "epoxyeicosatrienoic acids"), а именно 5,6-, 8,9-, 11,12- и 14,15-эпоксиэйкозатриеновую кислоту (ЕЕТ). Продукты, образованные путем гидролиза этих субстратов, представляют собой дигидроксиэпоксиэйкозатриеновые кислоты или DHETS (от англ. "dihydroxyeicosatrienoic acids"), 5,6-, 8,9-, 11,12- и 14,15-дигидроксиэпоксиэйкозатриеновую кислоту соответственно, в результате чего биологические эффекты ЕЕТ уменьшены или устранены (Yu et al., Circ. Res, 87: 992-7 (2000)). Также известно, что субстратами являются эпоксиды линолевой кислоты, известные как лейкотоксин или изолейкотоксин. Как ЕЕТ, так и лейкотоксины образованы членами семейства монооксигеназы цитохрома Р450 (Capdevila et al., J. Lipid Res., 41: 163-181 (2000)).
Недавно описаны структурные требования sEH к субстратам (Morisseau et al., Biochem. Pharmacol. 63:1599-1608 (2002)) и их кристаллическая структура, а также структуры сокристаллов с определенными ингибиторами (Argiriadi et al., Proc. Natl. Acad. Sci. USA 96: 10637-10642 (1999)). Также описан ряд ингибиторов sEH (Mullin and Hammock, Arch. Biochem. Biophys. 216:423-439 (1982), Morisseau et al., Proc. Natl. Acad. Sci. USA 96:8849-8854 (1999), McElroy et al., J. Med. Chem. 46:1066-1080 (2003)). Для растворимой эпоксидгидролазы недавно описана фосфатазная активность в отношении фосфорилированных форм гидроксиненасыщенных жирных кислот; эта активность делает ее бифункциональным ферментом (Newman et al., Proc. Natl. Acad. Sci. USA 100:1558-1563 (2003)).
Физиологическая роль ЕЕТ лучше всего установлена при вазодилатации сосудистых лож. Накоплены данные в пользу того, что ЕЕТ в действительности функционируют как эндотелиальные факторы гиперполяризации или EDHF (от англ. "endothelium-derived hyperpolarizing factors") (Campbell et al., Circ. Res. 78:415-423 (1996)). ЕЕТ образуются в эндотелиальных клетках, индуцируют вазодилатацию в гладкомышечных клетках кровеносных сосудов посредством механизма, приводящего в результате к активации "макси-K" калиевых каналов с сопутствующей гиперполяризацией и релаксацией (Hu and Kim, Eur. J. Pharmacol. 230:215-221 (1993)). Показано, что 14,15-ЕЕТ осуществляет свои физиологические эффекты посредством связывания с рецепторами клеточной поверхности, которые регулируются внутриклеточным циклическим аденозинмонофосфатом (АМФ) и механизмом преобразования сигнала, в который вовлечена протеинкиназа A (Wong et al., J. Lipid Med. Cell Signal. 16:155-169 (1997)). Более недавно было продемонстрировано, что данная ЕЕТ-зависимая релаксация в гладкой мышце коронарной артерии происходит посредством белка, связывающего нуклеотид гуанин, Gsα, что сопровождается АДФ-рибозилированием (Li et al., Circ. Res. 85:349-56 (1999)). Альтернативно недавно показано, что катионный канал TRPV4 активируется 5,6-ЕЕТ в клетках сосудистого эндотелия аорты мыши (Watanabe et al., Nature 424:434-438 (2003)). Это вызвало интерес к ЕЕТ и растворимой эпоксидгидролазе в качестве мишеней гипотензивных средств. Действительно, самцы нокаут-мышей по sEH имеют сниженное кровяное давление по сравнению с контролями дикого типа (Sinal et al., J. Biol. Chem. 275:40504-40510 (2000)). Кроме того, ингибирование sEH у спонтанно гипертензивных крыс вызывало снижение кровяного давления (Yu et al., Circ. Res. 87:992-998 (2000)).
Миметики или фармакологические воздействия на ЕЕТ, предназначенные либо для повышения синтеза ЕЕТ, либо для предотвращения распада ЕЕТ (при сниженных уровнях DHET), предложены в качестве потенциальной терапевтической стратегии для ряда заболеваний. Кроме того, постулировано, что ингибирование биохимического пути NF-каппа В в результате ингибирования sEH может обладать терапевтическими эффектами в отношении ряда болезненных состояний (Shen, Expert Opin. Ther. Patents, 20(7): 941-956 (2010)).
Продемонстрировали, что sEH полезны для лечения воспалительных болезненных состояний, например, ревматоидного артрита, и сердечнососудистых болезненных состояний, таких как гипертензия, инфаркт миокарда, почечных заболеваний и ишемического инсульта (Fang et al, Drugs of the Future, 34(7): 579-585 (2009), Shen, Expert Opin. Ther. Patents, 20(7): 941-956 (2010), US 20070117782; WO 2003/002555).
Было заявлено, что дополнительным показанием ингибиторов sEH является нефропатия у пациентов с диабетом типа II (US 20090018092 и WO 2005/089380).
Ингибиторы sEH могут быть полезные для лечения мочеполовых болезненных состояний, включающих состояния расстройства гладкой мускулатуры, такие как эректильная дисфункция, гиперактивность мочевого пузыря, сокращения матки и синдром раздраженной кишки (US 20090270452, US 2009082402, WO 2008/074678).
Ингибиторы sEH были предложены для уменьшения легочной инфильтрации нейтрофилами (US 20050222252, WO 2005/094373) и, как оказалось, обладают синергетическим действием при уменьшении числа нейтрофилов в легком, что показывает, что ингибиторы sEH могут быть полезны для лечения обструктивных болезненных состояний легких, рестриктивных процессов дыхательных путей и астмы (Shen, Expert Opin. Ther. Patents, 20(7): 941-956 (2010), US 20050222252).
Ингибиторы sEH были также заявлены как полезные для лечения невропатической боли (WO 2009/062073).
Кроме того, сообщали, что ингибиторы sEH полезны для лечения метаболических синдромов, включая ожирение, гипертензию, диабет и гиперхолестеринемию (Shen, Expert Opin. Ther. Patents, 20(7): 941-956 (2010), US 20080221105).
Понятно, что ингибиторы sEH эффективны при лечении опосредованных Т-лимфоцитами иммунологических и аутоиммунологических болезненных состояний (WO 2000/23060).
В дополнительных исследованиях выявлен эффект sEH на уменьшение повреждения в результате инсульта (US 20060148744).
Объектами настоящего изобретения являются новые соединения формулы I, их стереоизомеры, таутомеры или фармацевтически приемлемые соли, их применение для лечения болезненных состояний, опосредованных sEH, включающих мочеполовые болезненные состояния, болевые болезненные состояния, респираторные болезненные состояния, сердечно-сосудистые болезненные состояния, метаболические болезненные состояния, неврологические болезненные состояния, иммунологические болезненные состояния, воспалительные болезненные состояния, рак, нефропатию, инсульт, дисфункцию эндотелия, предупреждение ишемических событий и защиту концевых органов, и лекарственные средства на основе соединения в соответствии с изобретением при контроле или предупреждении заболеваний.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
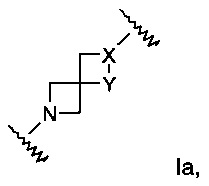
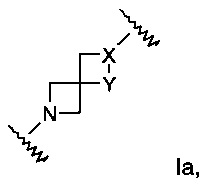
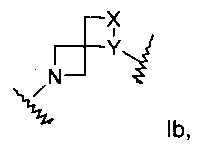
Изобретение относится к производным азетидина формулы I:

где
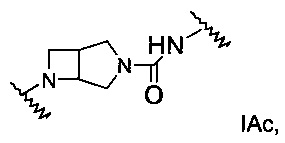
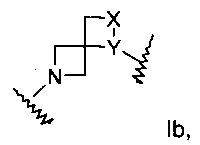
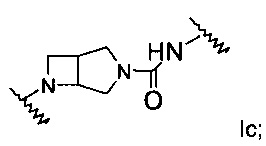
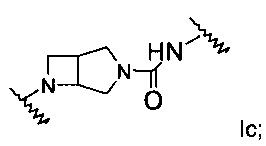
А выбран из группы, состоящей из Ia, Ib или Ic:

где
X представляет собой N или СН;
Y представляет собой NH или СН2; или

где
Х представляет собой NH или СН2;
Y представляет собой N или СН; или

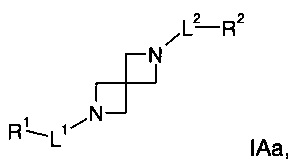
где
L1 представляет собой связь, -(CH2)1-3-, -NH-(СН2)0-3-С(O)-, -(СН2)0-3-С(O)-, -(СН2)0-3-SO2- или -(CH2)0-3-NR3-C(O)-;
L2 представляет собой связь, -(СН2)1-3-, -С(O)-(СН2)0-3-NH-, -NH-(СН2)0-3-C(O)-NH-, -(СН2)0-3-С(O)-, -(СН2)0-3-SO2- или -(CH2)0-3-NR3-C(O)-;
R1 представляет собой связь фенил, 5- или 6-членный гетероарил, адамантил или -(СН2)1-3-фенил, где такой фенил, гетероарил или адамантил является незамещенным или замещен R5 в количестве от одного до трех;
R2 представляет собой фенил, 5- или 6-членный гетероарил или -(CH2)1-3-фенил, где такой фенил или гетероарил является незамещенным или замещен R5 в количестве от одного до трех;
R3 представляет собой атом водорода или низший алкил;
R4 представляет собой атом водорода или низший алкил;
R5 представляет собой атом галогена, низший алкил, низший галогеналкил, низший галогеналкокси или -C(O)OR4, или
к их стереоизомерам, таутомерам или фармацевтически приемлемым солям за исключением следующих соединений: (4-бромфенил)[6-[(4-метилфенил)сульфонил]-1,6-диазаспиро[3,3]гепт-1-ил]метанона, 6-[(4-метилфенил)сульфонил]-1-(фенилметил)-1,6-диазаспиро[3,3]гептана, 2,6-бис[(4-метилфенил)сульфонил]-2,6-диазаспиро[3,3]гептана и 2-фенил-6-(фенилметил)-2,6-диазаспиро[3,3]гептана, при условии, что, когда L2 представляет собой -С(O)-NH-, L1 представляет собой не -CH2-, при условии, что, когда L2 представляет собой -СН2-, L1 представляет собой не связь, при условии, что, когда L2 представляет собой -SO2-, L1 представляет собой не -CH2-, и при условии, что L1 и L2 являются различными.
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Определения
Технические и научные термины, используемые в данном описании, имеют значение, обычно понимаемые обычным специалистом в области техники, к которой принадлежит настоящее изобретение, если не определено иное. В данном описании сделана ссылка на различные методологии и материалы, известные специалистам в данной области техники. Стандартные справочники, в которых изложены общие принципы фармакологии, включают Goodman and Gilman’s The Pharmacological Basis of Therapeutics, 10th Ed., McGraw Hill Companies Inc., New York (2001).
Выражение объекта в единственном числе, как используют в данном описании, относится к одному или более из этих объектов; например, соединений относится к одному или более соединений или по меньшей мере к одному соединению. Как таковые, термины единственного числа, "один или более" и "по меньшей мере один" могут быть использованы в данном описании взаимозаменяемо.
Как используют в данном описании, если в переходной фразе или в тексте формулы изобретения термины "содержит (содержат)" и "содержащий" следует интерпретировать как имеющие неограничивающее значение. То есть, эти термины следует интерпретировать как синонимы выражений "имеющий по меньшей мере" или "включающий по меньшей мере". При использовании в контексте способа термин "содержащий" означает, что этот способ включает по меньшей мере перечисленные стадии, но может включать дополнительные стадии. При использовании в контексте соединения или композиции термин "содержащий" означает, что соединение или композиция включает по меньшей мере перечисленные признаки или компоненты, но может также включать дополнительные признаки или компоненты.
Как используют в данном описании, если специально не указано иное, слово "или" используют во "включающем" смысле "и/или", а не в "исключающем" смысле "либо/либо".
Как используют в данном описании, если специально не указано иное, термины "включающий" и "включает (включают) используют во "включающем, но не ограничивающем" смысле.
Термин "алкил" относится к насыщенному линейному или разветвленному одновалентному углеводородному радикалу, имеющему от одного до семи атомов углерода (С-атомов) (C1-C7 алкил). В частности, алкил представляет собой "низший алкил", то есть (C1-C6) алкил. С0 относится к связи. Примеры алкильных групп включают метил (Me, -СН3), этил (Et, -CH2CH3), 1-пропил (n-Pr, н-пропил, -СН2СН2СН3), 2-пропил (i-Pr, изопропил, -СН(СН3)2), 1-бутил (n-Bu, н-бутил, -СН2СН2СН2СН3), 2-метил-1-пропил (i-Bu, изобутил, -СН2СН(СН3)2), 2-бутил (s-Bu, втор-бутил, -СН(СН3)СН2СН3), 2-метил-2-пропил (t-Bu, трет-бутил, -С(СН3)3), 1-пентил (n-пентил, -CH2CH2CH2CH2CH3), 2-пентил (-СН(СН3)СН2СН2СН3), 3-пентил (-СН(СН2СН3)2), 2-метил-2-бутил (-С(СН3)2СН2СН3), 3-метил-2-бутил (-СН(СН3)СН(СН3)2), 3-метил-1-бутил (-СН2СН2СН(СН3)2), 2-метил-1-бутил (-СН2СН(СН3)СН2СН3), 1-гексил (-СН2СН2СН2СН2СН2СН3), 2-гексил (-СН(СН3)СН2СН2СН2СН3), 3-гексил (-СН(СН2СН3)(СН2СН2СН3) и 1-гептил.
Термины "галогеналкил" или "низший галогеналкил" относится к "алкилу" или "низшему алкилу", как определено в данном изобретении, где один или более атомов углерода замещено одним или более атомов галогена.
Термин "алкокси", как используют в данном описании, означает -O-алкильную группу, где алкил является таким, как определено выше, такую как метокси, этокси, n-пропилокси, изопропилокси, н-бутилокси, изобутилокси, трет-бутилокси, пентилокси, гексилокси, включая их изомеры. "Низший алкокси", как используют в данном описании, обозначает группу "алкокси"с "низшей алкильной" группой, как определено выше.
Термины "галогеналкокси" или "низший галогеналкокси" относится к группе "алкокси" или "низший алкокси", где один или более атомов углерода замещено одним или более атомов галогена.
"Галоген" или "атом галогена" относится к F, Cl, Br или I.
Термин "гетероарил" относится к 5- или 6-членным ароматическим карбоциклическим радикалам, в которых по меньшей мере один кольцевой атом представляет собой атом азота, где остальные кольцевые атомы представляют собой атомы углерода. Примеры "гетероарила" включают пирролил, пиразолил, имидазолил, пиридинил, пиримидинил, пиридазинил и пиразинил. В частности, "гетероарил" представляет собой пиримидинил.
Термин "мочеполовое болезненное состояние" относится к болезненным состояниям, связанным с мочевыми путями, включающим следующие состояния: гиперактивность мочевого пузыря; обструкцию выходного отверстия мочевого пузыря; недостаточность выходного отверстия мочевого пузыря; доброкачественную гиперплазию простаты; интерстициальный цистит; мужскую эректильную дисфункцию и повышенную чувствительность таза. В частности, соединения по настоящему изобретению могут быть полезны при лечении симптомов, обусловленных описанными выше болезненными состояниями, например, императивных позывов, частоты, измененной емкости мочевого пузыря, недержания мочи, болезненного позыва на мочеиспускание, нестабильных сокращений мочевого пузыря, спастичности сфинктера, гиперрефлексии детрузора (нейрогенного мочевого пузыря), нестабильности детрузора, доброкачественной гиперплазии простаты (ДГП), стриктуры уретры, опухолей, низких скоростей тока мочи, затруднения при начале мочеиспускания, повышенной подвижности уретры, врожденной недостаточности сфинктера, смешанного недержания мочи, стрессового недержания мочи, тазовой боли, интерстициального (клеточного) цистита, простадинии, простатита, вульводинии, уретрита, орхиалгии и других симптомов, обусловленных гиперактивностью мочевого пузыря.
Термин "болезненное состояние" относится к любому заболеванию, состоянию, симптому, расстройству или показанию.
"Респираторное болезненное состояние" относится ко всем болезненным состояниям дыхательных путей, включающим следующие состояния: острый бронхит; астму; хронический бронхит; грипп; фиброз легких; синдром внезапной детской смертности; респираторный дистресс-синдром взрослых; интерстициальный легочный процесс; и хроническую обструктивную болезнь легких (ХОБЛ).
"Болевые болезненные состояния" означают любое болевое болезненное состояние, включающее невропатическую боль; воспалительную боль; операционную боль; висцеральную боль; зубную боль; предменструальную боль; центральную боль; хроническую боль, боль вследствие ожогов; боль вследствие мигрени или кластерные головные боли; боль вследствие повреждения нервов; боль вследствие неврита; невралгии; боль вследствие отравления; боль вследствие ишемического повреждения; раковую боль; боль, обусловленную вирусной, паразитарной или бактериальной инфекцией; посттравматическое повреждение или боль, обусловленную синдромом раздраженной кишки.
"Метаболические болезненные состояния" означают любое метаболическое болезненное состояние, включающее ожирение; гипертензию; диабет и дислипидемии, включая гиперхолестеринемию.
"Воспалительные болезненные состояния" означают любые болезненные состояния, характеризующиеся воспалением, включающее воспаление почек; воспаление печени; воспаление сосудов; воспаление легких; воспалительные заболевания, связанные с глазами; ревматоидный артрит (РА); воспалительное кишечное заболевание; болезнь Крона; неспецифический язвенный колит; псориаз; контактный дерматит; замедленные аллергические реакции; аллергический ринит или аллергический дерматит. В частности, воспалительное болезненное состояние представляет собой ревматоидный артрит (РА).
"Сердечно-сосудистые болезненные состояния" означают класс заболеваний, в которые вовлечено сердце или кровеносные сосуды, включающих гипертрофию сердца; сердечную аритмию; кардиомиопатию; коронарную болезнь сердца; атеросклероз; рестеноз; кардиомегалию; инфаркт миокарда или застойную сердечную недостаточность.
"Неврологические болезненные состояния" означают любое болезненное состояние нервной системы, включающее болезнь Альцгеймера; болезнь Пика; кортикобазальную дегенерацию; прогрессирующий надъядерный паралич; лобно-височную деменцию и паркинсонизм; боковой амиотрофический склероз; синдром Гийена-Барре; синдром Мебиуса и синдром Туретта.
"Инсульт" означает ишемический и геморрагический инсульт, в частности ишемический инсульт.
"Защита концевых органов" относится к защите основных органов, снабжаемых системой кровообращения, от повреждения вследствие неконтролируемой гипертензии, гипотензии или гиповолемии, включая защиту почек, защиту головного мозга и защиту сердца.
"Ишемические события" означают события, относящиеся к ишемическому каскаду, включающие реперфузионные повреждения.
"Иммунологические болезненные состояния" включают (1) аутоиммунные болезненные состояния, (2) болезненные состояния, обусловленные иммунными ответами, опосредованными Т-лимфоцитами, (3) трансплантацию; отторжение аллотрансплантата и ксенотрансплантата и (4) болезнь трансплантат против хозяина.
"Аутоиммунные болезненные состояния" означают любые болезненные состояния, возникающие вследствие гиперактивного иммунного ответа организма против веществ и тканей, в норме присутствующих в организме, включающие следующие болезненные состояния: тиреоидит Хасимото; системную красную волчанку; рецепторный аутоиммунитет; аутоиммунную гемолитическую анемию; аутоиммунную тромбоцитопеническую пурпуру; аутоиммунный гепатит; склеродерму; полимиозит; пернициозную анемию; идиопатическую болезнь Аддисона; адренергическую лекарственную резистентность; крапивницу и атопический дерматит; аутоиммунный ангионевротический отек; аутоиммунную апластическую анемию; аутоиммунную вегетативную дистонию; аутоиммунную гиперлипидемию; аутоиммунный иммунодефицит; аутоиммунное заболевание внутреннего уха (AIED; от англ. "autoimmune inner ear disease"); аутоиммунный миокардит; аутоиммунный панкреатит; аутоиммунную ретинопатию; аутоиммунную тромбоцитопеническую пурпуру (АТП) и аутоиммунную крапивницу.
"Болезненные состояния, обусловленные иммунными ответами, опосредованными Т-лимфоцитами" означают любые болезненные состояния, обусловленные иммунными ответами, опосредованными Т-лимфоцитами, включающие следующие болезненные состояния: рассеянный склероз; псориаз; эритемы; кератит; болезнь Крона; ринит; экзему; фотоаллергическую чувствительность; эндотоксиновый шок и саркоидоз.
Термины "рак" и "раковый" относится к физиологическому состоянию пациента, в характерном случае характеризующемуся нерегулируемым клеточным ростом, или описывает это состояние. "Опухоль" содержит одну или более раковых клеток. Примеры рака включают карциному; лимфому; бластому; саркому и лейкоз или лимфоидные злокачественные новообразования. Более конкретные примеры таких раков включают чешуйчатоклеточный рак (например, эпителиальный чешуйчатоклеточный рак); рак легкого, включающий мелкоклеточный рак легкого, немелкоклеточный рак легкого ("НМКРЛ"), аденокарциному легкого и чешуйчатую карциному легкого; рак брюшины; печеночно-клеточный рак; рак желудочно-кишечного тракта или желудка; рак поджелудочной железы; глиобластому; рак шейки матки; рак яичника; рак печени; рак мочевого пузыря; гепатому; рак молочной железы; рак ободочной кишки; рак прямой кишки; колоректальный рак; карциному эндометрия или матки; карциному слюнной железы; рак почки или почечно-клеточный рак; рак простаты; рак вульвы; рак щитовидной железы; карциному печени; анальную карциному; карциному пениса; а также рак головы и шеи.
Выражение "терапевтически эффективное количество" означает количество соединения по настоящему изобретению, осуществляющее следующие действия: (i) лечит или предупреждает конкретное болезненное состояние, (ii) ослабляет, облегчает или устраняет один или более симптомов конкретного болезненного состояния или (iii) предупреждает или задерживает появление одного или более симптомов конкретного болезненного состояния, раскрытого в данном описании. В случае рака терапевтически эффективное количество лекарственного средства может уменьшить число раковых клеток; уменьшить размер опухоли; ингибировать (то есть до некоторой степени замедлить или альтернативно остановить) инфильтрацию раковых клеток в периферические органы; ингибировать (то есть до некоторой степени замедлить или альтернативно остановить) метастазы опухоли; до некоторой степени ингибировать опухолевый рост; и/или до некоторой степени облегчить один или более симптомов, обусловленных раком. В той степени, в которой лекарственное средство может предотвратить рост и/или уничтожить существующие раковые клетки, оно может быть цитостатическим и/или цитотоксическим. Для терапии рака эффективность может быть, например, измерена путем оценки времени до прогрессирования заболевания (ТТР; от англ. «time to disease progression») и/или определения скорости ответа (RR; от англ. «response rate»). В случае иммунологических болезненных состояний терапевтически эффективное количество представляет собой количество, достаточное для уменьшения или облегчения аллергического расстройства, симптомов аутоиммунного и/или воспалительного болезненного состояния или симптомов острой воспалительной реакции (например, астмы).
Термин "стереоизомеры" относится к соединениям, имеющим идентичный химический состав, но различающимся в отношении расположения атомов или групп в пространстве. Стереоизомеры включают диастереомеры, энантиомеры и тому подобное.
"Диастереомер" относится к стереоизомеру, имеющему два или более центров хиральности, и молекулы которого не являются зеркальными отображениями друг друга. Диастереомеры обладают различными физическими свойствами, например, температурами плавления, температурами кипения, спектральными свойствами и реакционными способностями. Смеси диастереомеров можно разделить аналитическими методами высокого разрешения, такими как электрофорез и хроматография.
"Энантиомеры" относятся к двум стереоизомерам соединения, являющимся неналагаемыми зеркальными отображениями друг друга.
Стереохимические определения и правила, используемые в данном описании, обычно следуют руководствам S.P. Parker, Ed., McGraw-Hill Dictionary of Chemical Terms (1984) McGraw-Hill Book Company, New York; и Eliel, E. and Wilen, S., "Stereochemistry of Organic Compounds", John Wiley & Sons, Inc., New York, 1994. Многие органические соединения существуют в оптически активных формах, то есть они обладают способностью вращать плоскость плоскополяризованного света. При описании оптически активного соединения префиксы D и L или R и S используют для обозначения абсолютной конфигурации молекулы относительно ее хирального центра (центров). Префиксы d и l или (+) и (-) используют для обозначения знака вращения плоскополяризованного света соединением, где (-) или l означает, что соединение является левовращающим. Соединение с префиксом (+) или d является правовращающим. Для данной химической структуры эти стереоизомеры идентичны за исключением того, что они являются зеркальными отображениями друг друга. Определенный стереоизомер может быть также назван энантиомером, и смесь таких изомеров часто называют энантиомерной смесью. Смесь энантиомеров 50:50 называют рацемической смесью или рацематом, и она может образоваться в том случае, если при химической реакции или процессе отсутствовала стереоселекция или стереоспецифичность. Термины "рацемическая смесь" и "рацемат" относятся к эквимолярной смеси двух энантиомерных соединений, не обладающей оптической активностью.
Термин "таутомер" или "таутомерная форма" относится к структурным изомерам, обладающим различными энергиями, которые являются взаимопревращаемыми посредством низкого энергетического барьера. Например, протонные таутомеры, также известные как прототропные таутомеры, включают взаимные превращения посредством миграции протона, такой как кетоенольная и имино-енаминная изомеризация. Валентные таутомеры включают взаимные превращения посредством реорганизации некоторых из электронов связи.
Выражение "фармацевтически приемлемая соль", как используют в данном описании, относится к фармацевтически приемлемым органическим или неорганическим солям соединения, включенного в настоящее изобретение. "Фармацевтически приемлемые соли" включают как соли присоединения кислоты, так и соли присоединения основания. В образование фармацевтически приемлемой соли может быть вовлечено включение другой молекулы, такой как ацетатный ион, сукцинатный ион или другой противоион. Противоион может представлять собой любую органическую или неорганическую группировку, стабилизирующую заряд на исходном соединении. Кроме того, фармацевтически приемлемая соль может иметь более чем один заряженный атом в своей структуре. Случаи, где множественные заряженные атомы составляют часть фармацевтически приемлемой соли, могут иметь множественные противоионы. Следовательно, фармацевтически приемлемая соль может иметь один или более заряженных атомов и/или один или более противоионов, например, соль дигидрохлорид или формиат.
"Фармацевтически приемлемая соль присоединения кислоты" относится к солям, сохраняющим биологическую эффективность и свойства свободных оснований, и не являющимся ни биологически, ни иначе нежелательными, образованным неорганическими кислотами, такими как соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, угольная кислота, фосфорная кислота и тому подобное, а органические кислоты могут быть выбраны из следующих классов органических кислот: алифатических, циклоалифатических, ароматических, аралифатических, гетероциклических, карбоциклических и сульфоновых кислот, например, из муравьиной кислоты, уксусной кислоты, пропионовой кислоты, гликолевой кислоты, глюконовой кислоты, молочной кислоты, пировиноградной кислоты, щавелевой кислоты, яблочной кислоты, малеиновой кислоты, малоновой кислоты, янтарной кислоты, фумаровой кислоты, винной кислоты, лимонной кислоты, аспарагиновой кислоты, аскорбиновой кислоты, глутаминовой кислоты, антраниловой кислоты, бензойной кислоты, коричной кислоты, миндальной кислоты, эмбоновой кислоты, фенилуксусной кислоты, метансульфоновой кислоты, этансульфоновой кислоты, бензолсульфоновой кислоты, пара-толуолсульфоновой кислоты, салициловой кислоты и тому подобного.
"Фармацевтически приемлемые соли присоединения основания" включают соли, образованные от неорганических оснований, такие как соли натрия, калия, лития, аммония, кальция, магния, железа, цинка, меди, марганца, алюминия и тому подобные. В частности, соли присоединения основания представляют собой соли аммония, калия, натрия, кальция и магния. Соли, образованные от фармацевтически приемлемых органических нетоксичных оснований, включают соли первичных, вторичных и третичных аминов, замещенных аминов, включая природные замещенные амины, циклических аминов и основных ионообменных смол, такие как соли изопропиламина, триметиламина, диэтиламина, триэтиламина, трипропиламина, этаноламина, 2-диэтиламиноэтанола, трометамина, дициклогексиламина, лизина, аргинина, гистидина, кофеина, прокаина, гидрабамина, холина, бетаина, этилендиамина, глюкозамина, метилглюкамина, теобромина, пурина, пиперазина, пиперидина, N-этилпиперидина, полиаминных смол и тому подобное. В частности, органические нетоксичные основания представляют собой изопропиламин, диэтиламин, этаноламин, трометамин, дициклогексиламин, холин и кофеин.
СОЕДИНЕНИЯ-ИНГИБИТОРЫ sEH
Изобретение относится к производным азетидина формулы I:

где
А выбран из группы, состоящей из Ia, Ib или Ic:

где
Х представляет собой N или СН;
Y представляет собой NH или CH2; или

где
Х представляет собой NH или CH2;
Y представляет собой N или СН; или

где
L1 представляет собой связь, -(CH2)1-3-, -NH-(СН2)0-3-С(O)-, -(СН2)0-3-С(О)-, -(СН2)0-3-SO2- или -(CH2)0-3-NR3-C(O)-;
L2 представляет собой связь, -(СН2)1-3-, -С(O)-(СН2)0-3-NH-, -NH-(СН2)0-3-С(O)-NH-, -(СН2)0-3-С(O)-, -(СН2)0-3-SO2- или -(CH2)0-3-NR3-C(O)-;
R1 представляет собой фенил, 5- или 6-членный гетероарил, адамантил или -(СН2)1-3-фенил, где такой фенил, гетероарил или адамантил является незамещенным или замещен R5 в количестве от одного до трех;
R2 представляет собой фенил, 5- или 6-членный гетероарил или -(СН2)1-3-фенил, где такой фенил или гетероарил является незамещенным или замещен R5 в количестве от одного до трех;
R3 представляет собой атом водорода или низший алкил;
R4 представляет собой атом водорода или низший алкил;
R5 представляет собой атом галогена, низший алкил, низший галогеналкил, низший галогеналкокси или -C(O)OR4, или
к их стереоизомерам, таутомерам или фармацевтически приемлемым солям за исключением (4-бромфенил)[6-[(4-метилфенил)сульфонил]-1,6-диазаспиро[3,3]гепт-1-ил]метанона, 6-[(4-метилфенил)сульфонил]-1-(фенилметил)-1,6-диазаспиро[3,3]гептана, 2,6-бис[(4-метилфенил)сульфонил]-2,6-диазаспиро[3,3]гептана и 2-фенил-6-(фенилметил)-2,6-диазаспиро[3,3]гептана, при условии, что, когда L2 представляет собой -С(O)-NH-, L1 представляет собой не -СН2-, при условии, что, когда L2 представляет собой -СН2-, L1 представляет собой не связь, при условии, что, когда L2 представляет собой -SO2-, L1 представляет собой не -СН2-, и при условии, что L1 и L2 являются различными.
Соединения по данному изобретению, включающие по меньшей мере одну группу -С(=O)-NH-, проявляют неожиданно усиленную ингибиторную активность по сравнению с аналогами, имеющими другие боковые цепи.
Если не указано иное, волнистой линией указано место присоединения.
В одном воплощении формулы I Х представляет собой N, и Y представляет собой CH2:

где
L1 представляет собой связь, -(СН2)0-3-С(O)-, -(СН2)0-3-SO2-;
L2 представляет собой -C(O)-(CH2)0-3-NH-;
R1 представляет собой фенил или 5- или 6-членный гетероарил, где такой фенил или гетероарил является незамещенным или замещен одним R5;
R2 представляет собой фенил или -(CH2)1-3-фенил, где такой фенил является незамещенным или замещен двумя R5;
R4 представляет собой атом водорода;
R5 представляет собой -C(O)OR4, или
его стереоизомеры, таутомеры или фармацевтически приемлемые соли.
В одном воплощении формулы IAa L1 представляет собой связь, -С(O)- или -SO2-.
В одном воплощении формулы IAa L1 представляет собой связь, -С(O)- или -SO2-, и R1 представляет собой фенил или пиримидинил, где такой фенил или пиримидинил является незамещенным или замещен одним R5.
В одном воплощении формулы IAa L1 представляет собой связь, -С(O)- или -SO2-, и R1 представляет собой фенил или пиримидинил, где такой фенил or пиримидинил является незамещенным или замещен одним R5 в 4-положении.
В одном воплощении формулы IAa L1 представляет собой связь, -С(O)- или -SO2-, и R1 представляет собой фенил или пиримидинил, где такой фенил или пиримидинил является незамещенным или замещен одним R5 в 4-положении, и где R5 представляет собой -C(O)OR4.
В одном воплощении формулы IAa L1 представляет собой связь, -С(O)- или -SO2-, и R1 представляет собой фенил или пиримидинил, где такой фенил или пиримидинил является незамещенным или замещен одним R5 в 4-положении, и где R5 представляет собой -С(O)ОН.
В одном воплощении формулы IAa L1 представляет собой связь, -С(O)- или -SO2-, R1 представляет собой фенил или пиримидинил, где такой фенил или пиримидинил является незамещенным или замещен одним R5 в 4-положении, и где R5 представляет собой -С(O)ОН, и L2 представляет собой -С(O)-NH-.
В одном воплощении формулы IAa L1 представляет собой связь, -С(O)- или -SO2-, R1 представляет собой фенил или пиримидинил, где такой фенил или пиримидинил является незамещенным или замещен одним R5 в 4-положении, и где R5 представляет собой -С(O)ОН, L2 представляет собой -С(O)-NH-, и R2 представляет собой -СН2-фенил, незамещенный или замещенный двумя R5.
В одном воплощении формулы IAa L1 представляет собой связь, -С(O)- или -SO2-, R1 представляет собой фенил или пиримидинил, где такой фенил или пиримидинил является незамещенным или замещен одним R5 в 4-положении, и где R5 представляет собой -С(O)ОН, L2 представляет собой -C(O)-NH-, и R2 представляет собой -CH2-фенил, незамещенный или замещенный двумя R5 в 2- и 4-положении.
В одном воплощении формулы IAa L1 представляет собой связь, -С(O)- или -SO2-, R1 представляет собой фенил или пиримидинил, где такой фенил или пиримидинил является незамещенным или замещен одним R5 в 4-положении, и где R5 представляет собой -С(O)ОН, L2 представляет собой -С(O)-NH-, и R2 представляет собой -СН2-фенил, незамещенный или замещенный двумя атомами галогена в 2- и 4-положении.
В одном воплощении формулы IAa L1 представляет собой связь, -С(O)- или -SO2-, R1 представляет собой фенил или пиримидинил, где такой фенил или пиримидинил является незамещенным или замещен одним R5 в 4-положении, и где R5 представляет собой -С(O)ОН, L2 представляет собой -С(O)-NH-, и R2 представляет собой -СН2-фенил, незамещенный или замещенный двумя -Cl в 2-и 4-положении.
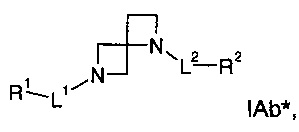
В одном воплощении формулы I Х представляет собой СН2, и Y представляет собой N:

где
L1 представляет собой -NH-(СН2)0-3-С(O)-; или -(СН2)0-3-SO2-;
L2 представляет собой связь, -(СН2)1-3-, -C(O)-(CH2)0-3-NH- или -(СН2)0-3-SO2-
R1 представляет собой фенил, адамантил или -(СН2)1-3-фенил, где такой фенил или адамантил является незамещенным или замещен одним или двумя R5;
R2 представляет собой фенил или -(СН2)1-3-фенил, где такой фенил является незамещенным или замещен одним или двумя R5;
R5 представляет собой галоген, низший галогеналкил или низший галогеналкокси; или
его стереоизомеры, таутомеры или фармацевтически приемлемые соли.
В одном воплощении формулы IAb* L1 представляет собой -NH-С(О)- или -SO2-.
В одном воплощении формулы IAb* L1 представляет собой -NH-С(О)- или -SO2-, и R1 представляет собой фенил, адамантил, -СН2-фенил, -(СН2)2-фенил или -(СН2)3-фенил, где такой фенил или адамантил является незамещенным или замещен одной или двумя R5.
В одном воплощении формулы IAb* L1 представляет собой -NH-С(О)- или -SO2-, и R1 представляет собой фенил, адамантил, -СН2-фенил, -(CH2)2-фенил или -(СН2)3-фенил, где такой фенил или адамантил является незамещенным или замещен одним или двумя R5 в 2- и/или 4-положении.
В одном воплощении формулы IAb* L1 представляет собой -NH-С(О)- или -SO2-, и R1 представляет собой фенил, адамантил, -СН2-фенил, -(СН2)2-фенил или -(СН2)3-фенил, где такой фенил или адамантил является незамещенным или замещен одним или двумя R5 в 2- и/или 4-положении, где такой R5 представляет собой атом галогена или низший галогеналкокси.
В одном воплощении формулы IAb* L1 представляет собой -NH-С(О)- или -SO2-, и R1 представляет собой фенил, адамантил, -СН2-фенил, -(СН2)2-фенил или -(СН2)3-фенил, где такой фенил или адамантил является незамещенным или замещен одним или двумя R5 в 2- и/или 4-положении, где такой R5 представляет собой -Cl или -OCF3.
В одном воплощении формулы IAb* L1 представляет собой -NH-С(О)- или -SO2-, R1 представляет собой фенил, адамантил, -СН2-фенил, -(CH2)2-фенил или -(СН2)3-фенил, где такой фенил или адамантил является незамещенным или замещен одним или двумя R5, где такой R5 представляет собой -Cl или -OCF3, и L2 представляет собой связь, -СН2-, -С(O)-NH- или -SO2-.
В одном воплощении формулы IAb* L1 представляет собой -NH-C(O)- или -SO2-, R1 представляет собой фенил, адамантил, -СН2-фенил, -(СН2)2-фенил или -(СН2)3-фенил, где такой фенил или адамантил является незамещенным или замещен одним или двумя R5, где такой R5 представляет собой -Cl или -OCF3, L2 представляет собой связь, -СН2-, -С(O)-NH- или -SO2-, и R2 представляет собой фенил, пиримидинил или -СН2-фенил, где такой фенил или пиримидинил является незамещенным или замещен одним или двумя R5.
В одном воплощении формулы IAb* L1 представляет собой -NH-С(О)- или -SO2-, R1 представляет собой фенил, адамантил, -СН2-фенил, -(СН2)2-фенил или -(СН2)3-фенил, где такой фенил или адамантил является незамещенным или замещен одним или двумя R5, где такой R5 представляет собой -Cl или -OCF3, L2 представляет собой связь, -СН2-, -С(O)-NH- или -SO2-, и R2 представляет собой фенил, пиримидинил или -СН2-фенил, где такой фенил или пиримидинил является незамещенным или замещен одним или двумя R5 в 2- и/или 4-положении.
В одном воплощении формулы IAb* L1 представляет собой -NH-С(О)- или -SO2-, R1 представляет собой фенил, адамантил, -СН2-фенил, -(СН2)2-фенил или - (СН2)3-фенил, где такой фенил или адамантил является незамещенным или замещен одним или двумя R5, где такой R5 представляет собой -Cl или -OCF3, L2 представляет собой связь, -СН2-, -C(O)-NH- или -SO2-, и R2 представляет собой фенил, пиримидинил или -СН2-фенил, где такой фенил или пиримидинил является незамещенным или замещен одним или двумя R5 в 2- и/или 4-положении, где R5 представляет собой атом галогена или низший галогеналкил.
В одном воплощении формулы IAb* L1 представляет собой -NH-С(О)- или -SO2-, R1 представляет собой фенил, адамантил, -СН2-фенил, -(СН2)2-фенил или -(СН2)3-фенил, где такой фенил или адамантил является незамещенным или замещен одним или двумя R5, где такой R5 представляет собой -Cl или -OCF3, L2 представляет собой связь, -СН2-, -С(O)-NH- или -SO2-, и R2 представляет собой фенил, пиримидинил или -СН2-фенил, где такой фенил или пиримидинил является незамещенным или замещен одним или двумя R5 в 2- и/или 4-положении, где R5 представляет собой -F, -Cl или -CF3.
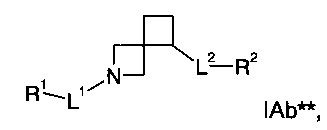
В одном воплощении формулы I Х представляет собой СН2, и Y представляет собой СН:

где
L1 представляет собой -(СН2)0-3-SO2-;
L2 представляет собой -С(O)-(СН2)0-3-NH- или -NH-(СН2)0-3-С(O)-NH-;
R1 представляет собой фенил, где такой фенил является незамещенным или замещен одним R5;
R2 представляет собой -(СН2)1-3-фенил, где такой фенил является незамещенным или замещен двумя R5;
R5 представляет собой галоген, или
его стереоизомеры, таутомеры или фармацевтически приемлемые соли.
В одном воплощении формулы IAb** L1 представляет собой -SO2-.
В одном воплощении формулы IAb** L1 представляет собой -SO2-, и R1 представляет собой фенил, где такой фенил замещен одним R5.
В одном воплощении формулы IAb** L1 представляет собой -SO2-, и R1 представляет собой фенил, где такой фенил замещен одним R5 в 2- или 4-положении.
В одном воплощении формулы IAb** L1 представляет собой -SO2-, и R1 представляет собой фенил, где такой фенил замещен одним R5 в 2- или 4-положении, где R5 представляет собой атом галогена.
В одном воплощении формулы IAb** L1 представляет собой -SO2-, и R1 представляет собой фенил, где такой фенил замещен одним R5 в 2- или 4-положении, где R5 представляет собой -Cl.
В одном воплощении формулы IAb** L1 представляет собой -SO2-, R1 представляет собой фенил, где такой фенил замещен одним R5 в 2- или 4-положении, где R5 представляет собой -Cl, и L2 представляет собой -NH-С(О)-NH- или -С(O)-NH-.
В одном воплощении формулы IAb** L1 представляет собой -SO2-, R1 представляет собой фенил, где такой фенил замещен одним R5 в 2- или 4-положении, где R5 представляет собой -Cl, L2 представляет собой -NH-С(O)-NH- или -С(O)-NH-, и R2 представляет собой -СН2-фенил, -(СН2)2-фенил или -(СН2)3-фенил, где такой фенил является незамещенным или замещен двумя R5.
В одном воплощении формулы IAb** L1 представляет собой -SO2- R1 представляет собой фенил, где такой фенил замещен одним R5 в 2- или 4-положении, где R5 представляет собой -Cl, L2 представляет собой -NH-С(O)-NH- или -С(O)-NH-, и R2 представляет собой -СН2-фенил, -(СН2)2-фенил или -(CH2)3-фенил, где такой фенил является незамещенным или замещен двумя R5 в 2- и 4-положении.
В одном воплощении формулы IAb** L1 представляет собой -SO2-, R1 представляет собой фенил, где такой фенил замещен одним R5 в 2- или 4-положении, где R5 представляет собой -Cl, L2 представляет собой -NH-С(O)-NH- или -C(O)-NH-, и R2 представляет собой -СН2-фенил, -(СН2)2-фенил или -(СН2)3-фенил, где такой фенил является незамещенным или замещен двумя атомами галогена в 2- и 4-положении.
В одном воплощении формулы IAb** L1 представляет собой -SO2-, R1 представляет собой фенил, где такой фенил замещен одним R5 в 2- или 4-положении, где R5 представляет собой -Cl, L2 представляет собой -NH-C(O)-NH- или -С(O)-NH-, и R2 представляет собой -СН2-фенил, -(CH2)2-фенил или -(СН2)3-фенил, где такой фенил является незамещенным или замещен двумя -Cl в 2- и 4-положении.
Одно воплощение формулы I представляет собой:

где:
L1 представляет собой связь, -(СН2)0-3-С(O)- или -(СН2)0-3-SO2-;
L2 представляет собой -(CH2)1-3-;
R1 представляет собой фенил или 5- или 6-членный гетероарил, где такой фенил или гетероарил является незамещенным или замещен одним R5;
R2 представляет собой фенил, где такой фенил является незамещенным или замещен двумя R5;
R4 представляет собой атом водорода или низший алкил;
R5 представляет собой атом галогена или -C(O)OR4, или
его стереоизомеры, таутомеры или фармацевтически приемлемые соли.
В одном воплощении формулы IAc L1 представляет собой связь, -С(O)- или -SO2-.
В одном воплощении формулы IAc L1 представляет собой связь, -С(O)- или -SO2-, и R1 представляет собой фенил или пиримидинил, где такой фенил или пиримидинил является незамещенным или замещен одним R5.
В одном воплощении формулы IAc L1 представляет собой связь, -С(O)- или -SO2-, и R1 представляет собой фенил или пиримидинил, где такой фенил или пиримидинил является незамещенным или замещен одним R5 в 4-положении.
В одном воплощении формулы IAc L1 представляет собой связь, -С(O)- или -SO2-, и R1 представляет собой фенил или пиримидинил, где такой фенил или пиримидинил является незамещенным или замещен одним R5 в 4-положении, где R5 представляет собой -C(O)OR4.
В одном воплощении формулы IAc L1 представляет собой связь, -С(O)- или -SO2-, и R1 представляет собой фенил или пиримидинил, где такой фенил или пиримидинил является незамещенным или замещен одним R5 в 4-положении, где R5 представляет собой -С(O)ОН.
В одном воплощении формулы IAc L1 представляет собой связь, -С(O)- или -SO2-, R1 представляет собой фенил или пиримидинил, где такой фенил или пиримидинил является незамещенным или замещен одним R5 в 4-положении, где R5 представляет собой -С(O)ОН, и L2 представляет собой -СН2-.
В одном воплощении формулы IAc L1 представляет собой связь, -С(O)- или -SO2-, R1 представляет собой фенил или пиримидинил, где такой фенил или пиримидинил является незамещенным или замещен одним R5 в 4-положении, где R5 представляет собой -С(O)ОН, L2 представляет собой -СН2-, и R2 представляет собой фенил, где такой фенил замещен двумя R5.
В одном воплощении формулы IAc L1 представляет собой связь, -С(O)- или -SO2-, R1 представляет собой фенил или пиримидинил, где такой фенил или пиримидинил является незамещенным или замещен одним R5 в 4-положении, где R5 представляет собой -С(O)ОН, L2 представляет собой -CH2-, и R2 представляет собой фенил, где такой фенил замещен двумя R5 в 2-положении и 4-положении.
В одном воплощении формулы IAc L1 представляет собой связь, -С(O)- или -SO2-, R1 представляет собой фенил или пиримидинил, где такой фенил или пиримидинил является незамещенным или замещен одним R5 в 4-положении, где R5 представляет собой -С(O)ОН, L2 представляет собой -СН2-, и R2 представляет собой фенил, где такой фенил замещен двумя атомами галогена в 2-положении и 4-положении.
В одном воплощении формулы IAc L1 представляет собой связь, -С(O)- или -SO2-, R1 представляет собой фенил или пиримидинил, где такой фенил или пиримидинил является незамещенным или замещен одним R5 в 4-положении, где R5 представляет собой -С(O)ОН, L2 представляет собой -СН2-, и R2 представляет собой фенил, где такой фенил замещен двумя -Cl в 2-положении и 4-положении.
Кроме того, понятно, что каждое воплощение, относящееся к конкретному остатку A, R1, R2, L1 и L2, как раскрыто в данном изобретении, можно объединять с любым другим воплощением, относящимся к другому остатку A, R1, R2, L1 и L2, как раскрыто в данном изобретении.
В изобретении предложено соединение формулы I, выбранное из группы, состоящей из следующих соединений:
6-Бензоил-2,6-диазаспиро[3.3]гептан-2-карбоновой кислоты 2,4-дихлор-бензиламида;
4-[6-(2,4-Дихлор-бензилкарбамоил)-2,6-диазаспиро[3.3]гепт-2-ил]-бензойной кислоты;
6-(2,4-Дихлор-бензилсульфонил)-2,6-диазаспиро[3.3]гептан-2-карбоновой кислоты бензиламида;
6-Пиримидин-2-ил-2,6-диазаспиро[3.3]гептан-2-карбоновой кислоты 2,4-дихлор-бензиламида;
N-(2,4-Дихлорбензил)-1-(4-фторфенилсульфонил)-1,6-диазаспиро[3.3]гептан-6-карбоксамида;
6-(4-Хлорфенилсульфонил)-N-(2,4-дихлорбензил)-1,6-диазаспиро[3.3]гептан-1-карбоксамида;
N-(2,4-Дихлорбензил)-1-(пиримидин-2-ил)-1,6-диазаспиро[3.3]гептан-6-карбоксамида;
Бензил-1,6-диазаспиро[3.3]гептан-6-карбоновой кислоты (3-фенил-пропил)-амида;
1-(4-Хлор-бензилсульфонил)-1,6-диазаспиро[3.3]гептан-6-карбоновой кислоты (3-фенил-пропил)-амида;
1-(4-Хлор-бензилсульфонил)-1,6-диазаспиро[3.3]гептан-6-карбоновой кислоты адамантан-1-иламида;
1-(4-Хлор-бензилсульфонил)-1,6-диазаспиро[3.3]гептан-6-карбоновой кислоты 2,4-дихлор-бензиламида;
1-(4-Хлор-бензилсульфонил)-1,6-диазаспиро[3.3]гептан-6-карбоновой кислоты 2-трифторметокси-бензиламида;
1-(2-Трифторметил-бензилсульфонил)-1,6-диазаспиро[3.3]гептан-6-карбоновой кислоты (3-фенил-пропил)-амида;
(R)-2-(2-Хлорфенилсульфонил)-N-(3-фенилпропил)-2-азаспиро[3.3]гептан-5-карбоксамида;
(S)-2-(2-Хлорфенилсульфонил)-N-(3-фенилпропил)-2-азаспиро[3.3]гептан-5-карбоксамида;
(R)-1-(2-(4-Хлорфенилсульфонил)-2-азаспиро[3.3]гептан-5-ил)-3-(2,4-дихлорбензил)мочевины;
(S)-1-(2-(4-Хлорфенилсульфонил)-2-азаспиро[3.3]гептан-5-ил)-3-(2,4-дихлорбензил)мочевины;
рац-6-Бензоил-3,6-диаза-бицикло[3.2.0]гептан-3-карбоновой кислоты 2,4-дихлор-бензиламида;
рац-6-Бензилсульфонил-3,6-диаза-бицикло[3.2.0]гептан-3-карбоновой кислоты 2,4-дихлор-бензиламида;
рац-6-Пиримидин-2-ил-3,6-диаза-бицикло[3.2.0]гептан-3-карбоновой кислоты 2,4-дихлор-бензиламида; и
рац-4-[3-(2,4-Дихлор-бензилкарбамоил)-3,6-диаза-бицикло[3.2.0]гепт-6-ил]-бензойной кислоты, или их фармацевтически приемлемых солей.
В изобретении предложено соединение формулы I, выбранное из группы, состоящей из следующих соединений:
6-Бензоил-2,6-диазаспиро[3.3]гептан-2-карбоновой кислоты 2,4-дихлор-бензиламида;
6-(2,4-Дихлор-бензилсульфонил)-2,6-диазаспиро[3.3]гептан-2-карбоновой кислоты бензиламида;
N-(2,4-Дихлорбензил)-1-(4-фторфенилсульфонил)-1,6-диазаспиро[3.3]гептан-6-карбоксамида;
N-(2,4-Дихлорбензил)-1-(пиримидин-2-ил)-1,6-диазаспиро[3.3]гептан-6-карбоксамида;
1-(4-Хлор-бензилсульфонил)-1,6-диазаспиро[3.3]гептан-6-карбоновой кислоты 2-трифторметокси-бензиламида;
(S)-2-(2-Хлорфенилсульфонил)-N-(3-фенилпропил)-2-азаспиро[3.3]гептан-5-карбоксамида;
рац-6-Бензоил-3,6-диаза-бицикло[3.2.0]гептан-3-карбоновой кислоты 2,4-дихлор-бензиламида; и
рац-6-бензилсульфонил-3,6-диаза-бицикло[3.2.0]гептан-3-карбоновой кислоты 2,4-дихлор-бензиламида; или их фармацевтически приемлемых солей.
В изобретении предложено соединение формулы IAa, выбранное из группы, состоящей из следующих соединений:
6-Бензоил-2,6-диазаспиро[3.3]гептан-2-карбоновой кислоты 2,4-дихлор-бензиламида;
4-[6-(2,4-Дихлор-бензилкарбамоил)-2,6-диазаспиро[3.3]гепт-2-ил]-бензойной кислоты;
6-(2,4-Дихлор-бензилсульфонил)-2,6-диазаспиро[3.3]гептан-2-карбоновой кислоты бензиламида; и
6-Пиримидин-2-ил-2,6-диазаспиро[3.3]гептан-2-карбоновой кислоты 2,4-дихлор-бензиламида; или их фармацевтически приемлемых солей.
В изобретении предложено соединение формулы IAb*, выбранное из группы, состоящей из следующих соединений:
N-(2,4-Дихлорбензил)-1-(4-фторфенилсульфонил)-1,6-диазаспиро[3.3]гептан-6-карбоксамида;
6-(4-Хлорфенилсульфонил)-N-(2,4-дихлорбензил)-1,6-диазаспиро[3.3]гептан-1-карбоксамида;
N-(2,4-Дихлорбензил)-1-(пиримидин-2-ил)-1,6-диазаспиро[3.3]гептан-6-карбоксамида;
Бензил-1,6-диазаспиро[3.3]гептан-6-карбоновой кислоты (3-фенил-пропил)-амида;
1-(4-Хлор-бензилсульфонил)-1,6-диазаспиро[3.3]гептан-6-карбоновой кислоты (3-фенил-пропил)-амида;
1-(4-Хлор-бензилсульфонил)-1,6-диазаспиро[3.3]гептан-6-карбоновой кислоты адамантан-1-иламида;
1-(4-Хлор-бензилсульфонил)-1,6-диазаспиро[3.3]гептан-6-карбоновой кислоты 2,4-дихлор-бензиламида;
1-(4-Хлор-бензилсульфонил)-1,6-диазаспиро[3.3]гептан-6-карбоновой кислоты 2-трифторметокси-бензиламида; и
1-(2-трифторметил-бензилсульфонил)-1,6-диазаспиро[3.3]гептан-6-карбоновой кислоты (3-фенил-пропил)-амида; или их фармацевтически приемлемых солей.
В изобретении предложено соединение формулы IAb**, выбранное из группы, состоящей из следующих соединений:
(R)-2-(2-Хлорфенилсульфонил)-N-(3-фенилпропил)-2-азаспиро[3.3]гептан-5-карбоксамида;
(S)-2-(2-Хлорфенилсульфонил)-N-(3-фенилпропил)-2-азаспиро[3.3]гептан-5-карбоксамида;
(R)-1-(2-(4-Хлорфенилсульфонил)-2-азаспиро[3.3]гептан-5-ил)-3-(2,4-дихлорбензил)мочевины; и
(S)-1-(2-(4-Хлорфенилсульфонил)-2-азаспиро[3.3]гептан-5-ил)-3-(2,4-дихлорбензил)мочевины; или их фармацевтически приемлемых солей.
В изобретении предложено соединение формулы IAc, выбранное из группы, состоящей из следующих соединений:
рац-6-Бензоил-3,6-диаза-бицикло[3.2.0]гептан-3-карбоновой кислоты 2,4-дихлор-бензиламида;
рац-6-бензилсульфонил-3,6-диаза-бицикло[3.2.0]гептан-3-карбоновой кислоты 2,4-дихлор-бензиламида;
рац-6-Пиримидин-2-ил-3,6-диаза-бицикло[3.2.0]гептан-3-карбоновой кислоты 2,4-дихлор-бензиламида; и
рац-4-[3-(2,4-Дихлор-бензилкарбамоил)-3,6-диаза-бицикло[3.2.0]гепт-6-ил]-бензойной кислоты; или их фармацевтически приемлемых солей.
Примеры репрезентативных соединений, включенных в настоящее изобретение и находящихся в пределах объема изобретения, представлены в приведенной ниже таблице. Эти приведенные ниже примеры и примеры получения предложены, чтобы дать возможность специалистам в данной области техники более четко понимать и осуществлять настоящее изобретении на практике. Их не следует рассматривать как ограничивающие объем изобретения, но исключительно как иллюстративные и репрезентативные.
В целом номенклатура, используемая в данном изобретении, основана на программе AUTONOMTM v.4.0, компьютеризированная система института Бельштейна, для создания систематической номенклатуры ИЮПАК. Если имеется расхождение между изображенной структурой и названием на основании этой структуры, изображенную структуру следует придавать большее значение. Кроме того, если на стереохимии структуры или части структуры не указаны, например, полужирные или пунктирные линии, эту структуру или часть структуры следует интерпретировать как включающую все ее стереоизомеры.
В таблице I изображены примеры соединений азетидина в соответствии с общей формулой I:




СИНТЕЗ СОЕДИНЕНИЙ-ИНГИБИТОРОВ sEH
При осуществлении настоящего изобретения можно использовать любые подходящие материалы, известные специалистам в данной области техники. Тем не менее, предпочтительные материалы и способы описаны в данном изобретении. Материалы, реагенты и тому подобное, на которые сделана ссылка в последующем описании и в примерах, могут быть получены из коммерческих источников, если не указано иное.
Получение соединений по настоящему изобретению может быть выполнено последовательными или конвергентными путями синтеза. Синтезы соединений по изобретению показаны на приведенных ниже схемах. Более подробное описание индивидуальных стадий реакций см. ниже в разделе Примеры.
Проводить реакции удобно в присутствии или в отсутствие растворителя. Конкретного ограничения на природу используемого растворителя нет при условии, что он не обладает вредным воздействием на реакцию или вовлеченные в нее реагенты, и что он может растворять реагенты, по меньшей мере до некоторой степени. Описанные реакции могут протекать на протяжении широкого диапазона температур, и точная температура реакции не является принципиально важной для изобретения. Описанные реакции удобно проводить в диапазоне температур, составляющем от -78°С до температуры образования флегмы. Время, требующееся для реакции, может также широко варьировать в зависимости от многих факторов, а именно от температуры реакции и природы реагентов. Тем не менее, для получения описанных промежуточных соединений и соединений обычно достаточен период, составляющий от 0,5 ч до нескольких суток. Последовательность реакций не ограничена последовательностью, изображенной на схемах, тем не менее, в зависимости от исходных веществ и их соответствующей реакционной способности последовательность стадий реакций может быть свободно изменена.
На каждой из схем может быть предпочтительным отделение продуктов реакции друг от друга и/или от исходных веществ. Диастереомерные смеси могут быть разделены на их индивидуальные диастереоизомеры на основании их физико-химических различий способами, хорошо известными специалистам в данной области техники, например, с помощью хроматографии и/или фракционной кристаллизации. Энантиомеры могут быть разделены путем преобразования энантиомерной смеси в диастереомерную смесь путем взаимодействия с подходящим оптически активным соединением (например, с хиральным вспомогательным веществом, таким как хиральный спирт или хлорангидрид Мошера), разделения диастереоизомеров и преобразования (например, гидролиза) индивидуальных диастереоизомеров на соответствующие чистые энантиомеры. Энантиомеры можно также разделить путем использования хиральной колонки ВЭЖХ.
Отдельный стереоизомер, например, энантиомер, по существу свободный от его стереоизомера, может быть, кроме того, получен путем разделения рацемической смеси с использованием способа, такого как образование диастереомеров, используя оптически активные разделяющие агенты (Eliel, E. and Wilen, S., Stereochemistry of Organic Compounds, John Wiley & Sons, Inc., New York, 1994; Lochmuller, C.H., J. Chromatogr., 113(3):283-302 (1975)). Рацемические смеси хиральных соединений по изобретению могут быть разделены и выделены любым подходящим способом, включающим следующие способы: (1) образование ионных, диастереомерных солей с хиральными соединениями и разделение с помощью фракционной кристаллизации или другими способами, (2) образование диастереомерных соединений с хиральными дериватизирующими реагентами, разделение диастереомеров и преобразование в чистые стереоизомеры, и (3) выделенные по существу чистых или обогащенных стереоизомеров непосредственно в хиральных условиях. См. руководство Drug Stereochemistry, Analytical Methods and Pharmacology, Irving W. Wainer, Ed., Marcel Dekker, Inc., New York (1993).
Диастереомерные соли могут быть образованы путем взаимодействия энантиомерно чистых хиральных оснований, таких как бруцин, хинин, эфедрин, стрихнин, α-метил-β-фенилэтиламин (амфетамин) и тому подобное, с асимметрическими соединениями, несущими кислотную функциональную группу, такую как карбоновая кислота и сульфокислота. Разделение диастереомерных солей можно индуцировать путем фракционной кристаллизации или ионной хроматографии. Для разделения оптических изомеров аминосоединений присоединение хиральных карбоновых или сульфоновых кислот, таких как камфорсульфоновая кислота, винная кислота, миндальная кислота или молочная кислота, может привести в результате к образованию диастереомерных солей.
Альтернативно субстрат, подлежащий разделению, подвергают взаимодействию с одним энантиомером хирального соединения с образованием диастереомерной пары (Eliel, E. and Wilen, S., Stereochemistry of Organic Compounds, John Wiley & Sons, Inc., New York, 1994, p. 322). Диастереомерные соединения могут быть образованы путем взаимодействия асимметрических соединений с энантиомерно чистыми, хиральными дериватизирующими реагентами, такими как производные ментила, с последующим разделением диастереомеров и гидролизом с получением чистого или обогащенного энантиомера. Способ определения оптической чистоты включает получение хиральных эфиров, таких как ментиловый эфир, например, (-)-ментилхлорформиата, в присутствии основания, или сложного эфира Мошера, α-метокси-α-(трифторметил)фенилацетата (Jacob, J. Org. Chem. 47:4165 (1982)), рацемической смеси и анализ спектра ЯМР на присутствие двух атропизомерных энантиомеров или диастереомеров. Способом (3) рацемическую смесь двух энантиомеров можно разделить с помощью хроматографии, используя хиральную стационарную фазу (Chiral Liquid Chromatography W.J. Lough, Ed., Chapman and Hall, New York, (1989); Okamoto, J. of Chromatogr. 513:375-378 (1990)). Обогащенные или очищенные энантиомеры можно различить способами, используемыми для различения других хиральных молекул, имеющих асимметрические атомы углерода, такими как оптическое вращение и круговой дихроизм.
ОБЩИЕ СХЕМЫ
Настоящие соединения формул I, IAa, IAb*, IAb** и IAc, их стереоизомеры, таутомеры или фармацевтически приемлемые соли могут быть получены способами, известными в данной области техники, например, способами, описанными ниже, включающие взаимодействие соединения формул II-VI
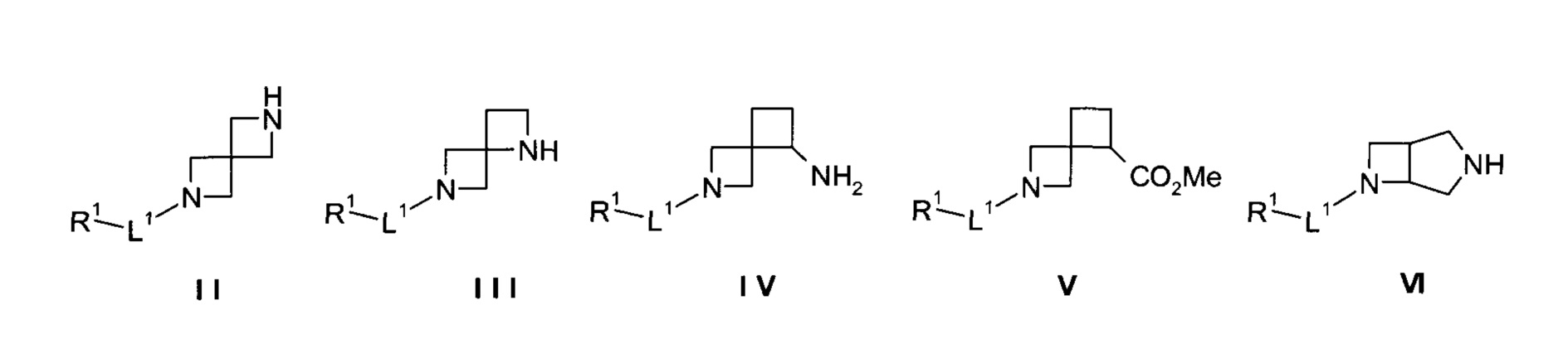
с химическими соединениями формул VII-Х

в присутствии основания, и дополнительно для химической формулы Х возможно в присутствии подходящего катализатора, с получением соединения формул I, IAa, IAb*, IAb** или IAc

где L1, L2, R1 и R2 являются такими, как описано выше,
или взаимодействие соединения формул XI-XIV

с соединениями химических формул VII-IX или XV
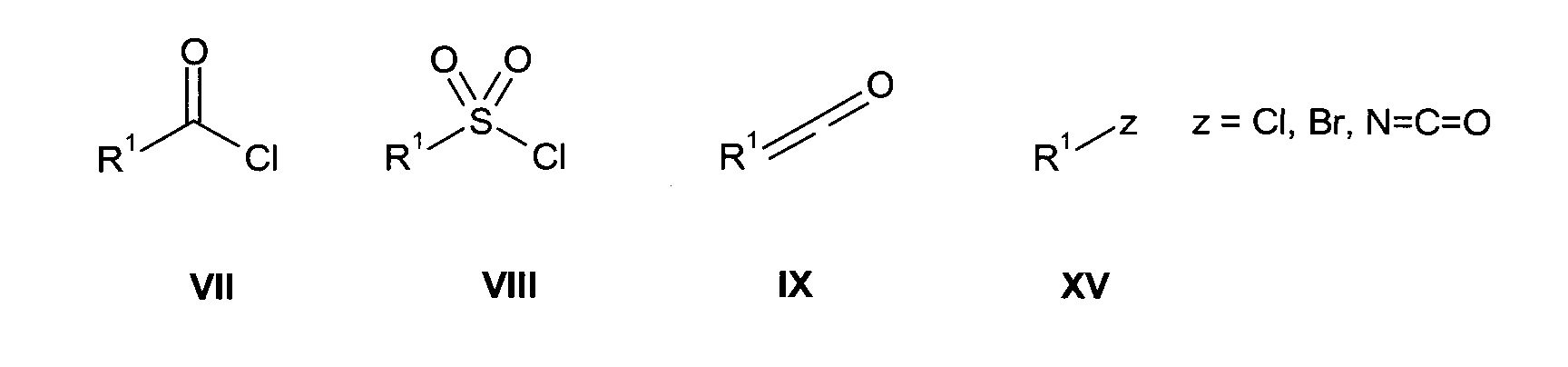
в присутствии основания, и дополнительно для химической формулы XV возможно в присутствии подходящего катализатора, с получением соединения формул I, IAa, IAb*, IAb** или IAc

где L1, L2, R1 и R2 являются такими, как описано выше, и при желании преобразование соединения формул I, IAa, IAb*, IAb** или IAc в фармацевтически приемлемую соль.
На приведенных ниже схемах более подробно описан способ получения соединений формул I, IAa, IAb*, IAb** или IAc. Исходные вещества приведенных ниже формул представляют собой известные соединения или могут быть получены способами, известными в данной области техники.
Схема 1

Согласно схеме 1 соединения формулы IAa могут быть получены, как описано ниже:
К перемешанному раствору 6-(трет-бутоксикарбонил)-2,6-диазаспиро[3.3]гептана, формула XVI, в подходящем растворителе, например, в дихлорметане, добавляют подходящее основание, например, триэтиламин, а затем изоцианат формулы IX, и смесь перемешивают при температуре окружающей среды или при повышенной температуре. Затем полученный в результате продукт подвергают взаимодействию с кислотой, например, с трифторуксусной кислотой (ТФУ), в подходящем растворителе, например, в дихлорметане, с получением в качестве мочевины формулы XVII 2,6-диазаспиро[3.3]гептан-2-карбоновой кислоты 2,4-дихлор-бензиламида. Это соединение XVII преобразуют в конечный продукт формулы IAa либо путем взаимодействия амина XVII в подходящем растворителе, например, в дихлорметане, с сульфонилхлоридом формулы VIII в присутствии подходящего основания, например, триэтиламина, при температуре окружающей среды или при повышенной температуре, либо путем взаимодействия амина XVII в подходящем растворителе, например, в дихлорметане, с карбонилхлоридом формулы VII в присутствии подходящего основания, например, триэтиламина, при температуре окружающей среды или при повышенной температуре, либо путем взаимодействия амина XVII в подходящем растворителе, например, в толуоле, с арилбромидом формулы XV в присутствии катализатора, например, Pd2dba3/BINAP (Pd2dba3/2,2’-бис(дифенилфосфино)-1,1’-бинафтила), и подходящих оснований, например, триэтиламина и трет-бутилата калия, при повышенной температуре с последующей реакцией омыления подходящим агентом, например, водным гидроксидом натрия, в подходящем растворителе, например, в метаноле или в тетрагидрофуране, при температуре окружающей среды или при повышенной температуре.
Схема 2

Согласно схеме 2 соединения формулы lAb* могут быть получены, как описано ниже:
К перемешанному раствору 1-бензил-1,6-диазаспиро[3.3]гептана, формула XVIII, в подходящем растворителе, например, в дихлорметане, добавляют подходящее основание, например, триэтиламин, а затем изоцианат формулы IX, и смесь перемешивают при температуре окружающей среды или при повышенной температуре. Альтернативно 1-бензил-1,6-диазаспиро[3.3]гептан, формула XVIII, обрабатывают в подходящем растворителе, например, в метаноле, подходящим основанием, например, триэтиламином, а затем BOC2O, и смесь перемешивают при температуре окружающей среды или при повышенной температуре. В результате гидрогенизации полученного в результате продукта в подходящем растворителе, например, в метаноле, в присутствии подходящего катализатора, например, палладия на угле, при температуре окружающей среды получают амин XIX, который далее может быть преобразован путем взаимодействия с сульфонилхлоридом формулы VIII в присутствии подходящего основания, например, триэтиламина, в подходящем растворителе, например, в дихлорметане, при температуре окружающей среды или при повышенной температуре, в сульфонамид формулы XX, который затем обрабатывают кислотой, например, трифторуксусной кислотой, в подходящем растворителе, например, в дихлорметане, с последующим взаимодействием в подходящем растворителе, например, в дихлорметане, с подходящим основанием, например, с триэтиламином, и с изоцианатом формулы IX при температуре окружающей среды или при повышенной температуре с получением конечного продукта формулы IAb*. Амин XIX преобразуют в мочевину формулы XXI путем взаимодействия в подходящем растворителе, например, в дихлорметане, с подходящим основанием, например, с триэтиламином, и с изоцианатом формулы IX при температуре окружающей среды или при повышенной температуре, которую затем далее преобразуют в конечный продукт формулы IAb* путем взаимодействия с кислотой, например, с трифторуксусной кислотой, в подходящем растворителе, например, в дихлорметане, с последующим взаимодействием в подходящем растворителе, например, в дихлорметане, с подходящим основанием, например, с триэтиламином, и с сульфонилхлоридом формулы VIII при температуре окружающей среды или при повышенной температуре. Амин XIX преобразуют в промежуточное соединение XXII путем взаимодействия в подходящем растворителе, например, в метаноле, с подходящим основанием, например, с триэтиламином, и с 2-хлор-пиримидином формулы XV при повышенной температуре, которое затем преобразуют в конечный продукт формулы IAb* путем взаимодействия с кислотой, например, с трифторуксусной кислотой, в подходящем растворителе, например, в дихлорметане, с последующим взаимодействием в подходящем растворителе, например, в дихлорметане, с подходящим основанием, например, с триэтиламином, и с изоцианатом формулы IX при температуре окружающей среды или при повышенной температуре.
Схема 3

Согласно схеме 3 соединения формулы IAb* могут быть получены, как описано ниже:
К перемешанному раствору 1-(трет-бутоксикарбонил)-1,6-диазаспиро[3.3]гептана, формула XXIII, в подходящем растворителе, например, в дихлорметане, добавляют подходящее основание, например, триэтиламин, а затем изоцианат формулы IX, и смесь перемешивают при температуре окружающей среды или при повышенной температуре с получением мочевины формулы XXIV, которую затем преобразуют в конечный продукт формулы IAb* путем взаимодействия с кислотой, например, трифторуксусной кислотой, в подходящем растворителе, например, в дихлорметане, с последующим взаимодействием в подходящем растворителе, например, в дихлорметане, с подходящим основанием, например, с триэтиламином, и с сульфонилхлоридом формулы VIII при температуре окружающей среды при повышенной температуре.
Схема 4


Согласно схеме 4 соединения формулы рац-IAb** могут быть получены, как описано ниже:
В результате гидрогенизации (R,S)-метил-2-бензгидрил-2-азаспиро[3.3]гептан-5-карбоксилата, формула рац-XXV, в подходящем растворителе, например, в метаноле, в присутствии подходящего катализатора, например, гидроксида палладия, при температуре окружающей среды с последующим взаимодействием в подходящем растворителе, например, в дихлорметане, с подходящим основанием, например, с триэтиламином, и с сульфонилхлоридом формулы VIII при температуре окружающей среды или при повышенной температуре получают промежуточный сложный эфир формулы рац-XXVI, который обрабатывают амином формулы Х в присутствии триметилалюминия в подходящем растворителе, например, в диоксане, при повышенной температуре с получением конечного продукта формулы рац-IAb**.
Амин рац-XXVII обрабатывают в подходящем растворителе, например, в метаноле, подходящим основанием, например, триэтиламином, а затем BOC2O, и смесь перемешивают при температуре окружающей среды или при повышенной температуре с последующей гидрогенизацией в подходящем растворителе, например, в метаноле, в присутствии подходящего катализатора, например, гидроксида палладия, при температуре окружающей среды с получением промежуточного амина формулы рац-XXVIII, который далее преобразуют в сульфонамид формулы рац-XXIX путем взаимодействия в подходящем растворителе, например, в дихлорметане, с подходящим основанием, например, с триэтиламином, и с сульфонилхлоридом формулы VIII при температуре окружающей среды или при повышенной температуре. Затем получают конечный продукт формулы рац-IAb** путем взаимодействия с кислотой, например, с трифторуксусной кислотой, в подходящем растворителе, например, в дихлорметане, с последующим взаимодействием в подходящем растворителе, например, в дихлорметане, с подходящим основанием, например, с триэтиламином, и с изоцианатом формулы IX при температуре окружающей среды или при повышенной температуре.
Разделение конечных соединений рац-IAb** на их энантиомеры IAb** выполняют с помощью хиральной ВЭЖХ.
Схема 5

Согласно схеме 5 соединения формулы рац-IAc может быть получено, как описано ниже:
К перемешанному раствору рац-3,6-диаза-бицикло[3.2.0]гептан-6-карбоновой кислоты трет-бутилового эфира, формула рац-ХХХ, в подходящем растворителе, например, в дихлорметане, добавляют подходящее основание, например, триэтиламин, а затем изоцианат формулы IX, и смесь перемешивают при температуре окружающей среды или при повышенной температуре с получением мочевины формулы рац-XXXI, которую затем преобразуют в конечный продукт формулы рац-IAc путем взаимодействия с кислотой, например, с трифторуксусной кислотой, в подходящем растворителе, например, в дихлорметане, а затем либо взаимодействия в подходящем растворителе, например, в дихлорметане, с подходящим основанием, например, с триэтиламином, и с сульфонилхлоридом формулы VIII при температуре окружающей среды или при повышенной температуре, либо взаимодействия в подходящем растворителе, например, в толуоле, с арилбромидом формулы XV в присутствии катализатора, например, Pd2dba3/BINAP, и подходящих оснований, например, триэтиламина и трет-бутилата калия, при повышенной температуре с последующей реакцией омыления подходящим агентом, например, водным раствором гидроксида натрия, в подходящем растворителе, например, в метаноле или в тетрагидрофуране, при температуре окружающей среды или при повышенной температуре.
Разделение конечных соединений рац-IAc на их энантиомеры IAc может быть выполнено с помощью хиральной ВЭЖХ.
ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ВВЕДЕНИЕ
В другом воплощении предложены фармацевтические композиции или лекарственные средства, содержащие соединение по настоящему изобретению, его стереоизомеры, таутомеры или фармацевтически приемлемые соли, и терапевтически инертный носитель, разбавитель или эксципиент. В одном примере соединения по настоящему изобретению можно включать в препараты путем смешивания при температуре окружающей среды, при подходящем рН и при желаемой степенью чистоты с физиологически приемлемыми носителями, то есть с носителями, нетоксичными для реципиентов при дозировках и концентрациях, применяемых в галеновой форме введения. Значение рН препарата зависит от конкретного применения и от концентрации соединения, и может в любом случае находиться в диапазоне от приблизительно 3 до приблизительно 8. В одном примере соединение по настоящему изобретению включают в препарат в ацетатном буфере при рН 5. В другом воплощении изобретения соединения по настоящему изобретению являются стерильными. Соединение можно хранить, например, в виде твердой или аморфной композиции, в виде лиофилизированного препарата или в виде водного раствора.
Соединения включают в препараты, дозируют и вводят в соответствии с надлежащей медицинской практикой. Факторы, учитываемые в данном контексте, включают следующие факторы: конкретное расстройство, подлежащее лечению, конкретного пациента, подлежащего лечению, клиническое состояние индивидуального пациента, причину расстройства, сайт доставки агента, способ введения, режим введения и другие факторы, известные практикующим медицинским работникам. Такими соображениями руководствуются при определении "эффективного количества" соединения, которое нужно вводить, и оно представляет собой минимальное количество, необходимое для ингибирования активности sEH. Например, такое количество может быть ниже количества, токсичного для нормальных клеток или для пациента в целом.
В одном примере фармацевтически эффективное количество соединения по изобретению, вводимого парентерально, на дозу находится в диапазоне, составляющем приблизительно 0,01-100 мг/кг в сутки. В другом воплощении изобретения пероральные стандартные дозируемые формы, такие как таблетки и капсулы, содержат приблизительно 0,01-1000 мг соединения по изобретению.
Соединения по изобретению можно вводить любыми подходящими путями, включающими следующие пути: местное (включая трансбуккальное или подъязычное), ректальное, вагинальное, чрескожное, парентеральное, подкожное, интраперитонеальное, внутрилегочное, внутрикожное, подоболочечное, ингаляционное, эпидуральное и интраназальное, и, если это желательно для локального лечения, введение внутрь пораженных тканей. Парентеральные инфузии включают следующие пути: внутримышечное, внутривенное, внутриартериальное, интраперитонеальное или подкожное введение.
Соединения по настоящему изобретению можно вводить в любой удобной форме введения, например, в форме таблеток, порошков, капсул, растворов, дисперсий, суспензий, сиропов, спреев, суппозиториев, гелей, эмульсий, пластырей, аэрозолей и т.д. Такие композиции могут содержать компоненты, традиционные в фармацевтических препаратах, например, разбавители, носители, модификаторы рН, подсластители, объемообразующие агенты и дополнительные активные агенты.
Характерный препарат готовят путем смешивания соединения по настоящему изобретению и носителя или наполнителя. Подходящие носители и наполнители хорошо известны специалистам в данной области техники и подробно описаны, например, в следующих руководствах: Ansel, Howard С., et al., Ansel’s Pharmaceutical Dosage Forms and Drug Delivery Systems. Philadelphia: Lippincott, Williams & Wilkins, 2004; Gennaro, Alfonso R., et al. Remington: The Science and Practice of Pharmacy. Philadelphia: Lippincott, Williams & Wilkins, 2000; и Rowe, Raymond C. Handbook of Pharmaceutical Excipients. Chicago, Pharmaceutical Press, 2005. В препараты можно также включать один или более следующих агентов: буферов, стабилизирующих агентов, поверхностно-активных веществ, увлажняющих агентов, смазывающих веществ, эмульгаторов, суспендирующих агентов, консервантов, антиоксидантов, кроющих агентов, веществ, способствующих скольжению, технологических добавок, красителей, подсластителей, ароматизирующих агентов, корригентов, разбавителей и других известных добавок для получения элегантного представления лекарственного средства (то есть соединения по настоящему изобретению или его фармацевтической композиции) или помощи при получении фармацевтического препарата (то есть лекарственного средства).
Воплощение изобретения, таким образом, включает фармацевтическую композицию, содержащую соединение по настоящему изобретению, его стереоизомеры, таутомеры или фармацевтически приемлемые соли. Следующее воплощение изобретения включает фармацевтическую композицию, содержащую соединение по настоящему изобретению, стереоизомеры, таутомеры или фармацевтически приемлемые соли вместе с фармацевтически приемлемым носителем или эксципиентом. Следующее воплощение изобретения включает фармацевтическую композицию, содержащую соединение по настоящему изобретению, его стереоизомеры, таутомеры или фармацевтически приемлемые соли вместе с фармацевтически приемлемым носителем.
Другое воплощение изобретения включает фармацевтическую композицию, содержащую соединение по настоящему изобретению, его стереоизомеры, таутомеры или фармацевтически приемлемые соли, применяемую при лечении заболевания, реагирующего на уровни ЕЕТ.
Другое воплощение изобретения включает фармацевтическую композицию, содержащую соединение по настоящему изобретению, его стереоизомеры, таутомеры или фармацевтически приемлемые соли, применяемую при лечении следующих болезненных состояний: мочеполовых болезненных состояний, болевых болезненных состояний, респираторных болезненных состояний, сердечно-сосудистых болезненных состояний, метаболических болезненных состояний, неврологических болезненных состояний, иммунологических болезненных состояний, воспалительных болезненных состояний, рака, нефропатии, инсульта, дисфункции эндотелия, предупреждения ишемических событий и защиты концевых органов.
Другое воплощение изобретения включает применение соединения по настоящему изобретению, его стереоизомеров, таутомеров или фармацевтически приемлемых солей в качестве терапевтически активного вещества.
Другое воплощение изобретения включает применение соединения по настоящему изобретению, его стереоизомеров, таутомеров или фармацевтически приемлемых солей для лечения болезненных состояний, реагирующих на уровни ЕЕТ у пациента.
Другое воплощение изобретения включает применение соединения по настоящему изобретению, его стереоизомеров, таутомеров или фармацевтически приемлемых солей для лечения следующих болезненных состояний: мочеполовых болезненных состояний, болевых болезненных состояний, респираторных болезненных состояний, сердечно-сосудистых болезненных состояний, метаболических болезненных состояний, неврологических болезненных состояний, иммунологических болезненных состояний, воспалительных болезненных состояний, рака, нефропатии, инсульта, дисфункции эндотелия, предупреждения ишемических событий и защиты концевых органов.
Другое воплощение изобретения включает применение соединения по настоящему изобретению, его стереоизомеров, таутомеров или фармацевтически приемлемых солей при получении лекарственного средства для лечения болезненных состояний, реагирующих на уровни ЕЕТ у пациента.
Другое воплощение изобретения включает применение соединения по настоящему изобретению, его стереоизомеров, таутомеров или фармацевтически приемлемых солей при получении лекарственного средства для лечения следующих болезненных состояний: мочеполовых болезненных состояний, болевых болезненных состояний, респираторных болезненных состояний, сердечно-сосудистых болезненных состояний, метаболических болезненных состояний, неврологических болезненных состояний, иммунологических болезненных состояний, воспалительных болезненных состояний, рака, нефропатии, инсульта, дисфункции эндотелия, предупреждения ишемических событий и защиты концевых органов.
Другое воплощение изобретения включает соединение по настоящему изобретению, его стереоизомеры, таутомеры или фармацевтически приемлемые соли, применяемые при лечении болезненных состояний, реагирующих на уровни ЕЕТ у пациента.
Другое воплощение изобретения включает соединение по настоящему изобретению, его стереоизомеры, таутомеры или фармацевтически приемлемые соли, применяемые при лечении следующих болезненных состояний: мочеполовых болезненных состояний, болевых болезненных состояний, респираторных болезненных состояний, сердечно-сосудистых болезненных состояний, метаболических болезненных состояний, неврологических болезненных состояний, иммунологических болезненных состояний, воспалительных болезненных состояний, рака, нефропатии, инсульта, дисфункции эндотелия, предупреждения ишемических событий и защиты концевых органов.
Другое воплощение изобретения включает способ лечения болезненного состояния, реагирующего на уровни ЕЕТ у пациента, где способ включает введение эффективного количества соединения по настоящему изобретению, его стереоизомеров, таутомеров или фармацевтически приемлемых солей пациенту.
Другое воплощение изобретения включает способ лечения следующих болезненных состояний: мочеполовых болезненных состояний, болевых болезненных состояний, респираторных болезненных состояний, сердечнососудистых болезненных состояний, метаболических болезненных состояний, неврологических болезненных состояний, иммунологических болезненных состояний, воспалительных болезненных состояний, рака, нефропатии, инсульта, дисфункции эндотелия, предупреждения ишемических событий и защиты концевых органов, где способ включает введение эффективного количества соединения по настоящему изобретению, его стереоизомеров, таутомеров или фармацевтически приемлемых солей пациенту.
В другом воплощении изобретения соединения по настоящему изобретению, их стереоизомеры, таутомеры или фармацевтически приемлемые соли в высокой степени подходят для применения при лечении сердечнососудистых болезненных состояний, метаболических болезненных состояний, болевых болезненных состояний, иммунологических болезненных состояний, воспалительных болезненных состояний, предупреждения ишемических событий и защиты концевых органов.
В другом воплощении изобретения соединения по настоящему изобретению, их стереоизомеры, таутомеры или фармацевтически приемлемые соли также в высокой степени подходят для применения при лечении сердечнососудистых болезненных состояний, метаболических болезненных состояний, болевых болезненных состояний, иммунологических болезненных состояний и воспалительных болезненных состояний.
В другом воплощении изобретения соединения по настоящему изобретению, их стереоизомеры, таутомеры или фармацевтически приемлемые соли также в высокой степени подходят для применения при лечении сердечнососудистых болезненных состояний, метаболических болезненных состояний и воспалительных болезненных состояний.
ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Пример 1
6-Бензоил-2,6-диазаспиро[3.3]гептан-2-карбоновой кислоты 2,4-дихлор-бензиламид

а) 6-(2,4-Дихлор-бензилкарбамоил)-2,6-диазаспиро[3.3]гептан-2-карбоновой кислоты трет-бутиловый эфир

К перемешанному раствору 6-(трет-бутоксикарбонил)-2,6-диазаспиро[3.3]гептана оксалата (200 мг, 1,01 ммоль) в дихлорметане (10 мл) добавляли триэтиламин (141 мкл, 1,01 ммоль), а затем 2,4-дихлор-1-(изоцианатометил)бензол (204 мг, 1,01 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 1 ч. Сырую реакционную смесь концентрировали при пониженном давлении. Остаток очищали хроматографией (SiO2; метанол : дихлорметан от 0:1 до 1:9) с получением соединения, указанного в заголовке (344 мг, 85%), в виде белого твердого вещества. Масс-спектрометрия (МС) (ионизация электронным ударом (EI; от англ. "electron impact") m/e: 400?0 (М+Н)+.
b) 2,6-Диазаспиро[3.3]гептан-2-карбоновой кислоты 2,4-дихлор-бензиламид

6-(2,4-Дихлор-бензилкарбамоил)-2,6-диазаспиро[3.3]гептан-2-карбоновой кислоты трет-бутиловый эфир (20 мг, 50 мкмоль) и трифторуксусную кислоту (740 мг, 6,49 ммоль) растворяли в дихлорметане (2 мл), и реакционную смесь перемешивали в течение 30 мин при температуре окружающей среды. В результате концентрирования реакционной смеси в вакууме получили соединение, указанное в заголовке, которое использовали без дополнительной очистки.
с) 6-Бензоил-2,6-диазаспиро[3.3]гептан-2-карбоновой кислоты 2,4-дихлор-бензиламид
2,6-Диазаспиро[3.3]гептан-2-карбоновой кислоты 2,4-дихлор-бензиламид (245 мг, 416 мкмоль) и триэтиламин (200 мг, 198 ммоль) растворяли в дихлорметане (5 мл) с последующим добавлением бензоилхлорида (70 мг, 499 мкмоль), и реакционную смесь перемешивали в течение 1 ч при температуре окружающей среды. Сырую реакционную смесь концентрировали при пониженном давлении. Остаток очищали хроматографией (SiO2; метанол : дихлорметан от 0:1 до 1:19) с получением соединения, указанного в заголовке (106 мг, 63%), в виде бесцветного твердого вещества. МС (EI) m/e: 404,1 (М+Н)+.
Пример 2
4-[6-(2,4-Дихлор-бензилкарбамоил)-2,6-диазаспиро[3.3]гепт-2-ил]-бензойная кислота

а) 4-[6-(2,4-Дихлор-бензилкарбамоил)-2,6-диазаспиро[3.3]гепт-2-ил]-бензойной кислоты этиловый эфир

По аналогии с экспериментальным методом примера 21а) 2,6-диазаспиро[3.3]гептан-2-карбоновой кислоты 2,4-дихлор-бензиламид вместо рац-3-(2,4-дихлор-бензилкарбамоил)-3,6-диаза-бицикло[3.2.0]гептана был преобразован в соединение, указанное в заголовке (44 мг, 23%), которое получили в виде бесцветного твердого вещества и использовали без дополнительной очистки.
b) 6-(4-[6-(2.4-Дихлор-бензилкарбамоил)-2,6-диазаспиро[3.3]гепт-2-ил]-бензойная кислота
По аналогии с экспериментальным методом примера 21b) 4-[6-(2,4-дихлор-бензилкарбамоил)-2,6-диазаспиро[3.3]гепт-2-ил]-бензойной кислоты этиловый эфир вместо рац-4-[3-(2,4-дихлор-бензилкарбамоил)-3,6-диаза-бицикло[3.2.0]гепт-6-ил]-бензойной кислоты этилового эфира был преобразован в соединение, указанное в заголовке (27 мг, 65%), которое получили в виде белого твердого вещества. МС (EI) m/e: 420,1 (М+Н)+.
Пример 3
6-(2,4-Дихлор-бензилсульфонил)-2,6-диазаспиро[3.3]гептан-2-карбоновой кислоты бензиламид

По аналогии с экспериментальным методом примера 1а) 2-бензилсульфонил-2,6-диазаспиро[3.3]гептан вместо 6-(трет-бутоксикарбонил)-2,6-диазаспиро[3.3]гептана оксалата был преобразован, используя 2,4-дихлор-1-(изоцианатометил)бензол, в соединение, указанное в заголовке (107 мг, 99%), которое получили в виде бесцветного твердого вещества. МС (EI) m/e: 440,1 (М+Н)+.
Пример 4
6-Пиримидин-2-ил-2,6-диазаспиро[3.3]гептан-2-карбоновой кислоты 2,4-дихлор-бензиламид

По аналогии с экспериментальным методом примера 1а) 2-пиримидин-2-ил-2,6-диазаспиро[3.3]гептан вместо 6-(трет-бутоксикарбонил)-2,6-диазаспиро[3.3]гептана оксалата был преобразован, используя 2,4-дихлор-1-(изоцианатометил)бензол, в соединение, указанное в заголовке (32 мг, 62%), которое получили в виде бесцветного твердого вещества. МС (EI) m/e: 378,1 (М+Н)+.
Пример 5
N-(2,4-Дихлорбензил)-1-(4-фторфенилсульфонил)-1,6-диазаспиро[3.3]гептан-6-карбоксамид

а) трет-Бутил-1-бензил-1,6-диазаспиро[3.3]гептан-6-карбоксилат

К раствору 1-бензил-1,6-диазаспиро[3.3]гептана оксалата (1,55 г, 3,32 ммоль) в метаноле (10 мл) добавляли триэтиламин (1,85 мл, 13,3 ммоль). Через 5 мин добавляли Boc2O (1,7 мл, 7,31 ммоль), и реакционную смесь перемешивали при температуре окружающей среды в течение ночи, а затем концентрировали при пониженном давлении. В результате растирания с диэтиловым эфиром и концентрирования полученного в результате фильтрата получили соединение, указанное в заголовке (1,79 г), в виде желтого масла. МС (EI) m/e: 289,1 (М+Н)+.
b) 6-(трет-Бутоксикарбонил)-6-аза-1-азонийспиро[3.3]гептана оксалат

трет-Бутил-1-бензил-1,6-диазаспиро[3.3]гептан-6-карбоксилат (1,79 г, 6,21 ммоль) растворяли в метаноле (33 мл) и добавляли Pd (10% на угле; 628 мг, 590 мкмоль). Создавали атмосферу водорода (баллон), и смесь перемешивали при температуре окружающей среды в течение 24 ч. Добавляли дополнительное количество Pd (10% на угле; 100 мг, 94 мкмоль, 0,015 экв.), и перемешивание в атмосфере водорода продолжали еще в течение 24 ч. Сырую суспензию фильтровали через целлит, и фильтрационный кек тщательно промывали метанолом, и фильтрат концентрировали при пониженном давлении. К раствору остатка в диэтиловом эфире (140 мл) добавляли раствор безводной щавелевой кислоты (279 мг, 3,1 ммоль) в этаноле (0,6 мл), и при этом сразу образовывался осадок. Твердое вещество фильтровали и высушивали при пониженном давлении с получением соединения, указанного в заголовке (1,18 г, 78%), в виде аморфного бесцветного твердого вещества. МС (EI) m/е: 199,2 (М+Н)+.
с) трет-Бутил-1-(4-фторфенилсульфонил)-1,6-диазаспиро[3.3]гептан-6-карбоксилат

К перемешанному раствору 6-(трет-бутоксикарбонил)-1,6-диазаспиро[3.3]гептана оксалата (350 мг, 719 мкмоль) в дихлорметане (6 мл) при 0°С добавляли триэтиламин (221 мкл, 1,58 ммоль), а затем 4-фторбензил-1-сульфонилхлорид (294 мг, 1,51 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 15 ч. Добавляли дополнительное количество 4-фторбензил-1-сульфонилхлорида (100 мг, 0,51 ммоль) и триэтиламина (200 мкл, 1,4 ммоль), реакционную смесь перемешивали при температуре окружающей среды еще в течение 3 ч. Затем реакционную смесь разбавляли дихлорметаном (10 мл) и гасили водой (10 мл). Водную фазу экстрагировали CH2Cl2, и объединенные органические фазы промывали рассолом, высушивали над сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали хроматографией (SiO2; гептан : этилацетат 2:1) с получением соединения, указанного в заголовке (456 мг, 89%), в виде бесцветного масла. МС (EI) m/e: 357,1 (М+Н)+.
d) N-(2,4-Дихлорбензил)-1-(4-фторфенилсульфонил)-1,6-диазаспиро[3.3]гептан-6-карбоксамид
К раствору трет-бутил-1-(4-фторфенилсульфонил)-1,6-диазаспиро[3.3]гептан-6-карбоксилата (452 мг, 1,27 ммоль) в дихлорметане (8 мл) добавляли трифторуксусную кислоту (489 мкл, 6,34 ммоль). После 2 ч при температуре окружающей среды добавляли другое количество трифторуксусной кислоты (300 мкл, 3,89 ммоль). Реакционную смесь перемешивали в течение 1,5 ч при температуре окружающей среды и концентрировали при пониженном давлении. Остаток распределяли в толуоле (10 мл), а затем концентрировали, данную процедуру повторяли дважды с получением неочищенного амина (540 мг), который использовали непосредственно в следующей стадии без дополнительной очистки. К раствору полученных 1-(4-фторфенилсульфонил)-1,6-диазаспиро[3.3]гептанов в ацетонитриле (10 мл) добавляли 2,4-дихлор-1-(изоцианатометил)бензол (216 мкл, 1,47 ммоль), а затем триэтиламин (294 мкл, 2,11 ммоль), и смесь перемешивали в течение 1 ч при температуре окружающей среды. Растворитель выпаривали в вакууме, и полученное в результате твердое вещество очищали хроматографией (SiO2; гептан : этилацетат 1:4 - дихлорметан/метанол/аммиак 95:4,5:0,5) с получением соединения, указанного в заголовке (530 мг, 91%), в виде бесцветного твердого вещества. Масс-спектроскопия высокого разрешения (МСВР) (EI): 457,0431 (точная масса, вычисленная для C19H17Cl2FN3O3S ([М]+)=457,0430).
Пример 6
6-(4-Хлорфенилсульфонил)-N-(2,4-дихлорбензил)-1,6-диазаспиро[3.3]гептан-1-карбоксамид

а) трет-Бутил-1-(2,4-дихлорбензилкарбамоил)-1,6-диазаспиро[3.3]гептан-6-карбоксилат

К раствору 6-(трет-бутоксикарбонил)-1,6-диазаспиро[3.3]гептана оксалата (350 мг, 719 мкмоль) в ацетонитриле (5 мл) добавляли 2,4-дихлор-1-(изоцианатометил)бензол (291 мг, 1,44 ммоль), а затем триэтиламин (201 мкл, 1,44 ммоль), и смесь перемешивали в течение ночи. Добавляли дополнительное количество 2,4-дихлор-1-(изоцианатометил)бензола (100 мг, 0,49 ммоль). После 1 часа при температуре окружающей среды реакционную смесь концентрировали при пониженном давлении. Остаток очищали хроматографией (SiO2; гептан : этилацетат 1:4) с получением соединения, указанного в заголовке (378 мг, 65%), в виде бесцветной пены. МС (EI) m/e: 400,2 (М+Н)+.
b) 6-(4-Хлорфенилсульфонил)-N-(2,4-дихлорбензил)-1,6-диазаспиро[3.3]гептан-1-карбоксамид
К раствору трет-бутил-1-(2,4-дихлорбензилкарбамоил)-1,6-диазаспиро[3.3]гептан-6-карбоксилата (440 мг, 1,10 ммоль) в дихлорметане (7 мл) добавляли ТФУ (593 мкл, 7,7 ммоль). После перемешивания в течение 2 ч при температуре окружающей среды реакционную смесь концентрировали при пониженном давлении. Остаток распределяли в толуоле (10 мл), а затем концентрировали; эту процедуру повторяли дважды с получением свободного амина (468 мг), который использовали без дополнительной очистки в следующей стадии. К раствору полученного ранее N-(2,4-дихлорбензил)-1,6-диазаспиро[3.3]гептан-1-карбоксамида в дихлорметане (12 мл) при 0°С добавляли триэтиламин (217 мкл, 1,56 ммоль), а затем 4-хлорбензил-1-сульфонилхлорид (329 мг, 1,56 ммоль). Реакционную смесь оставляли подогреваться до температуры окружающей среды в течение ночи, а затем разбавляли дихлорметаном (10 мл) и гасили водой (10 мл). Водную фазу экстрагировали дихлорметаном, и объединенные органические фазы промывали рассолом, высушивали над сульфатом натрия и концентрировали при пониженном давлении. В результате очистки хроматографией (SiO2; гептан : этилацетат 1:4) получили соединение, указанное в заголовке (445 мг, 85%), в виде бесцветного твердого вещества. МСВР (EI): 473,0134 (точная масса, вычисленная для C19H18Cl3N3O3S ([М]+)=473,0134).
Пример 7
N-(2,4-Дихлорбензил)-1-(пиримидин-2-ил)-1,6-диазаспиро[3.3]гептан-6-карбоксамид

а) N-(2,4-Дихлорбензил)-1-(пиримидин-2-ил)-1,6-диазаспиро[3.3]гептан-6-карбоксамид

К перемешанному раствору 6-(трет-бутоксикарбонил)-1,6-диазаспиро[3.3]гептана оксалата (350 мг, 719 мкмоль) в метаноле (20 мл) добавляли 2-хлорпиримидин (181 мг, 1,58 ммоль) и триэтиламин (241 мкл, 1,73 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 15 ч. Добавляли дополнительное количество 2-хлорпиримидина (80 мг, 0,70 ммоль) и триэтиламина (100 мкл, 0,71 ммоль), затем реакционную смесь нагревали с обратным холодильником еще в течение 8 ч. После добавления лабораторной лопаточки тетрабутиламмония йодида смесь перемешивали с обратным холодильником в течение 60 ч. Затем реакционную смесь концентрировали при пониженном давлении, разбавляли этилацетатом и промывали водным гидроксидом натрия (15%). Объединенные органические экстракты высушивали над сульфатом натрия и концентрировали при пониженном давлении. Это вещество очищали хроматографией (SiO2; гептан:этилацетат 1:2) с получением соединения, указанного в заголовке (293 мг, 73%), в виде бесцветного масла. МС (EI) m/е: 277,2 (М+Н)+.
b) N-(2,4-Дихлорбензил)-1-(пиримидин-2-ил)-1,6-диазаспиро[3.3]гептан-6-карбоксамид
По аналогии с экспериментальным методом примера 5d) трет-бутил-1-(пиримидин-2-ил)-1,6-диазаспиро[3.3]гептан-6-карбоксилат вместо трет-бутил-1-(4-фторфенилсульфонил)-1,6-диазаспиро[3.3]гептан-6-карбоксилата был преобразован в соединение, указанное в заголовке (181 мг, 45%), которое получили в виде бесцветного твердого вещества. МСВР (EI): 378,0876 (точная масса, вычисленная для C17H17Cl2N5([М+H]+)=378,0883).
Пример 8
Бензил-1,6-диазаспиро[3.3]гептан-6-карбоновой кислоты (3-фенил-пропил)-амид

К раствору 1-бензил-1,6-диазаспиро[3.3]гептана (41 мг, 217 мкмоль) в дихлорметане (2 мл) добавляли диизопропил-этил-амин (112 мг, 868 мкмоль), а затем (3-изоцианато-пропил)-бензил (84 мг, 521 мкмоль), и реакционной смеси давали возможность перемешиваться при температуре окружающей среды в течение 16 ч. После полного потребления исходного вещества реакционную смесь разбавляли дихлорметаном и последовательно промывали водой и рассолом. Органический слой высушивали над сульфатом натрия и выпаривали при пониженном давлении. В результате очистки высокоэффективной жидкостной хроматографией (ВЭЖХ) получили соединение, указанное в заголовке (9 мг, 12%), в виде беловатого твердого вещества. МС m/e: 350 (М+Н)+.
Пример 9
1-(4-Хлор-бензилсульфонил)-1,6-диазаспиро[3.3]гептан-6-карбоновой кислоты (3-фенил-пропил)-амид

а)6-(3-Фенил-пропилкарбамоил)-1,6-диазаспиро[3.3]гептан-1-карбоновой кислоты трет-бутиловый эфир

По аналогии с экспериментальным методом примера 8) 1,6-диазаспиро[3.3]гептан-1-карбоновой кислоты трет-бутиловый эфир вместо 1-бензил-1,6-диазаспиро[3.3]гептана был преобразован, используя (3-изоцианато-пропил)-бензол, в соединение, указанное в заголовке, которое использовали непосредственно в следующей стадии без дополнительной очистки.
b) 1-(4-Хлор-бензилсульфонил)-1,6-диазаспиро[3.3]гептан-6-карбоновой кислоты (3-фенил-пропил)-амид
По аналогии с экспериментальным методом примера 6b) 6-(3-фенил-пропилкарбамоил)-1,6-диазаспиро[3.3]гептан-1-карбоновой кислоты трет-бутиловый эфир вместо трет-бутил-1-(2,4-дихлорбензилкарбамоил)-1,6-диазаспиро[3.3]гептан-6-карбоксилата был преобразован, используя 4-хлорбензил-1-сульфонилхлорид, в соединение, указанное в заголовке, которое получили в виде бесцветного липкого твердого вещества (25 мг, 17%). МС m/е: 434 (М+Н)+.
Пример 10
1-(4-Хлор-бензилсульфонил)-1,6-диазаспиро[3.3]гептан-6-карбоновой кислоты адамантан-1-иламид

а) 6-(Адамантан-1-илкарбамоил)-1,6-диазаспиро[3.3]гептан-1-карбоновой кислоты трет-бутиловый эфир

По аналогии с экспериментальным методом примера 8) 1,6-диазаспиро[3.3]гептан-1-карбоновой кислоты трет-бутиловый эфир вместо 1-бензил-1,6-диазаспиро[3.3]гептана был преобразован, используя 1-изоцианато-адамантан вместо (3-изоцианато-пропил)-бензола, в соединение, указанное в заголовке, которое использовали непосредственно в следующей стадии без дополнительной очистки.
b) 1-(4-Хлор-бензилсульфонил)-1,6-диазаспиро[3.3]гептан-6-карбоновой кислоты адамантан-1-иламид
По аналогии с экспериментальным методом примера 6b) 6-(адамантан-1-илкарбамоил)-1,6-диазаспиро[3.3]гептан-1-карбоновой кислоты трет-бутиловый эфир вместо трет-бутил-1-(2,4-дихлорбензилкарбамоил)-1,6-диазаспиро[3.3]гептан-6-карбоксилата был преобразован, используя 4-хлорбензил-1-сульфонилхлорид, в соединение, указанное в заголовке, которое получили в виде беловатого липкого твердого вещества (29 мг, 35%). МС m/е: 450 (М+Н)+.
Пример 11
1-(4-Хлор-бензилсульфонил)-1,6-диазаспиро[3.3]гептан-6-карбоновой кислоты 2,4-дихлор-бензиламид

а) 6-(2,4-Дихлор-бензилкарбамоил)-1,6-диазаспиро[3.3]гептан-1-карбоновой кислоты трет-бутиловый эфир

По аналогии с экспериментальным методом примера 8) 1,6-диазаспиро[3.3]гептан-1-карбоновой кислоты трет-бутиловый эфир вместо 1-бензил-1,6-диазаспиро[3.3]гептана был преобразован, используя 2,4-дихлор-1-изоцианатометил-бензол вместо (3-изоцианато-пропил)-бензола, в соединение, указанное в заголовке, которое использовали непосредственно в следующей стадии без дополнительной очистки.
b) 1-(4-Хлор-бензилсульфонил)-1,6-диазаспиро[3.3]гептан-6-карбоновой кислоты 2,4-дихлор-бензиламид
По аналогии с экспериментальным методом примера 6b) 6-(2,4-дихлор-бензилкарбамоил)-1,6-диазаспиро[3.3]гептан-1-карбоновой кислоты трет-бутиловый эфир вместо трет-бутил-1-(2,4-дихлорбензилкарбамоил)-1,6-диазаспиро[3.3]гептан-6-карбоксилата был преобразован, используя 4-хлорбензил-1-сульфонилхлорид, в соединение, указанное в заголовке, которое получили в виде беловатого твердого вещества (41 мг, 23%). МС m/е: 474 (М+Н)+.
Пример 12
1-(4-Хлор-бензилсульфонил)-1,6-диазаспиро[3.3]гептан-6-карбоновой кислоты 2-трифторметокси-бензиламид

а) 6-(2-Трифторметокси-бензилкарбамоил)-1,6-диазаспиро[3.3]гептан-1-карбоновой кислоты трет-бутиловый эфир

По аналогии с экспериментальным методом примера 8) 1,6-диазаспиро[3.3]гептан-1-карбоновой кислоты трет-бутил о вы и эфир вместо 1-бензил-1,6-диазаспиро[3.3]гептана был преобразован, используя 1-трифторметокси-2-изоцианатометил-бензол вместо (3-изоцианато-пропил)-бензола, в соединение, указанное в заголовке, которое использовали непосредственно в следующей стадии без дополнительной очистки.
b) 1-(4-Хлор-бензилсульфонил)-1,6-диазаспиро[3.3]гептан-6-карбоновой кислоты 2-трифторметокси-бензиламид
По аналогии с экспериментальным методом примера 6b) 6-(2-хлор-бензилкарбамоил)-1,6-диазаспиро[3.3]гептан-1-карбоновой кислоты трет-бутиловый эфир вместо трет-бутил-1-(2,4-дихлорбензилкарбамоил)-1,6-диазаспиро[3.3]гептан-6-карбоксилата был преобразован, используя 4-хлорбензил-1-сульфонилхлорид, в соединение, указанное в заголовке, которое получили в виде беловатого твердого вещества (64 мг, 62%). МС m/е: 490 (М+Н)+.
Пример 13
1-(2-Трифторметил-бензилсульфонил)-1,6-диазаспиро[3.3]гептан-6-карбоновой кислоты (3-фенил-пропил)-амид

По аналогии с экспериментальным методом примера 6b) 6-(3-фенил-пропилкарбамоил)-1,6-диазаспиро[3.3]гептан-1-карбоновой кислоты трет-бутиловый эфир вместо трет-бутил-1-(2,4-дихлорбензилкарбамоил)-1,6-диазаспиро[3.3]гептан-6-карбоксилата был преобразован, используя 2-трифторметилбензил-1-сульфонилхлорид вместо 4-хлорбензил-1-сульфонилхлорида, в соединение, указанное в заголовке, которое получили в виде беловатого твердого вещества (38 мг, 25%). МС m/е: 468 (М+Н)+.
Пример 14 и 15
(R)-2-(2-Хлорфенилсульфонил)-N-(3-фенилпропил)-2-азаспиро[3.3]гептан-5-карбоксамид и (S)-2-(2-хлорфенилсульфонил)-N-(3-фенилпропил)-2-азаспиро[3.3]гептан-5-карбоксамид
 и
и 
а) (R,S)-Метил-2-(2-хлорфенилсульфонил)-2-азаспиро[3.3]гептан-5-карбоксилат

К раствору (R,S)-метил-2-бензгидрил-2-азаспиро[3.3]гептан-5-карбоксилата (325 мг, 1,01 ммоль) в метаноле (15 мл) добавляли катализатор Перлмана (нагрузка 20 масс. %, 142 мг, 202 мкмоль) при комнатной температуре. Создавали атмосферу водорода (баллон), и смесь перемешивали при температуре окружающей среды в течение 60 ч. Добавляли дополнительное количество катализатора Перлмана (нагрузка 20 масс. %, 230 мг, 327 мкмоль), и смесь перемешивали в течение 5 ч при температуре окружающей среды в атмосфере водорода. Сырую суспензию фильтровали через целлит, и фильтрационный кек тщательно промывали метанолом. Фильтрат концентрировали при пониженном давлении с получением масла, которое использовали без дополнительной очистки в следующей стадии. К раствору метил-2-азаспиро[3.3]гептан-5-карбоксилата в дихлорметане (6 мл) при 0°С добавляли триэтиламин (244 мкл, 1,75 ммоль), а затем 2-хлорбензил-1-сульфонилхлорид (284 мг, 1,35 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 1 ч, а затем разбавляли дихлорметаном и водой. Водную фазу экстрагировали дихлорметаном, и объединенные органические экстракты промывали рассолом, высушивали над сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали хроматографией (SiO2; гептан : этил ацетат 2:1) с получением соединения, указанного в заголовке, в виде бесцветного масла (112 мг, 34%). МС (EI) m/е: 330,0 (М+Н)+.
b (R,S)-2-(2-Хлорфенилсульфонил)-N-(3-фенилпропил)-2-азаспиро[3.3]гептан-5-карбоксамид

К раствору 3-фенилпропан-1-амина (170 мкл, 1,19 ммоль) в диоксане (1,5 мл) добавляли по каплям триметилалюминий (2 М в гептанах; 594 мкл, 1,19 ммоль) в атмосфере азота (охлаждая таким образом, чтобы температура составляла 20-25°С), После перемешивания в течение 1,5 ч при температуре окружающей среды добавляли раствор (R,S)-метил 2-(2-хлорфенилсульфонил)-2-азаспиро[3.3]гептан-5-карбоксилата (112 мг, 340 мкмоль) в диоксане (0,3 мл). Раствор перемешивали в течение 2 ч при 100°С, а затем при температуре окружающей среды в течение 15 ч. После охлаждения до 0°С реакционную смесь осторожно разбавляли этилацетатом (1 мл), и осторожно добавляли 1 М раствор карбоната натрия (1 мл). Водный слой отделяли и экстрагировали этилацетатом (1 мл × 2). Органические слои промывали водой (1 мл) и рассолом (1 мл), высушивали над сульфатом натрия и концентрировали при пониженном давлении. Полученный в результате остаток очищали хроматографией (SiO2; гептан : этилацетат 1:1) с получением соединения, указанного в заголовке (118 мг, 80%), в виде бледно-желтого масла. МСВР (EI): 432,1271 (точная масса, вычисленная для C22H24ClN2O3S ([М+Н]+)=432,1274).
с) (R)-2-(2-Хлорфенилсульфонил)-N-(3-фенилпропил)-2-азаспиро[3.3]гептан-5-карбоксамид и (S)-2-(2-хлорфенилсульфонил)-N-(3-фенилпропил)-2-азаспиро[3.3]гептан-5-карбоксамид
(R,S)-2-(2-Хлорфенилсульфонил)-N-(3-фенилпропил)-2-азаспиро[3.3]гептан-5-карбоксамид (140 мг, 323 мкмоль) разделяли на хиральной ВЭЖХ с получением (R)-2-(2-хлорфенилсульфонил)-N-(3-фенилпропил)-2-азаспиро[3.3]гептан-5-карбоксамида (55 мг, 39%) в виде бесцветного масла (МС (EI) m/e: 433,1 (М+Н)+) и (S)-2-(2-хлорфенилсульфонил)-N-(3-фенилпропил)-2-азаспиро[3.3]гептан-5-карбоксамида (53 мг, 38%) в виде бесцветного масла (МС (EI) m/e: 433,1 (М+Н)+).
Пример 16 и 17
(R)-1-(2-(4-Хлорфенилсульфонил)-2-азаспиро[3.3]гептан-5-ил)-3-(2,4-дихлорбензил)мочевина и (S)-1-(2-(4-Хлорфенилсульфонил)-2-азаспиро[3.3]гептан-5-ил)-3-(2,4-дихлорбензил)мочевина
 и
и 
а) (R,S)-трет-бутил-2-бензгидрил-2-азаспиро[3.3]гептан-5-илкарбамат

К раствору (R,S)-2-бензгидрил-2-азаспиро[3.3]гептан-5-амина (1,31 г, 4,71 ммоль) в метаноле (10 мл) добавляли триэтиламин (1,31 мл, 9,41 ммоль) и Boc2O (1,2 мл, 5,18 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 1 ч, а затем концентрировали при пониженном давлении. Остаток очищали хроматографией (SiO2; гептан : этилацетат 4:1 - 1:1) с получением соединения, указанного в заголовке, в виде бесцветной пены. МС (EI) m/e: 379,3 (М+Н)+.
b) (R,S)-5-(трет-бутоксикарбониламино)-2-аза-спиро[3.3]гептана оксалат

К раствору (R,S)-трет-бутил-2-бензгидрил-2-азаспиро[3.3]гептан-5-илкарбамата (1,23 г, 3,25 ммоль) в метаноле (40 мл), добавляли катализатор Перлмана (нагрузка 20 масс. %, 913 мг, 1,3 ммоль) при температуре окружающей среды. Создавали атмосферу водорода (баллон), и смесь перемешивали при температуре окружающей среды в течение 3 ч. Сырую суспензию фильтровали через целлит, и фильтрационный кек осторожно промывали метанолом, и фильтрат концентрировали при пониженном давлении. К раствору промежуточного свободного азетидина в диэтиловом эфире (75 мл) добавляли раствор безводной щавелевой кислоты (146 мг, 1,62 ммоль) в этаноле (0,3 мл), и при этом сразу образовывался осадок. Твердое вещество фильтровали и высушивали при пониженном давлении с получением соединения, указанного в заголовке (648 мг, 77%), в виде бесцветного твердого вещества. МС (EI) m/е: 213,2 (М+Н)+.
с) (R,S)-трет-Бутил-2-(4-хлорфенилсульфонил)-2-азаспиро[3.3]гептан-5-илкарбамат

К раствору (R,S)-5-(трет-бутоксикарбониламино)-2-аза-спиро[3.3]гептана оксалата (250 мг, 486 мкмоль) в дихлорметане (4 мл) при 0°С добавляли триэтиламин (271 мкл, 1,94 ммоль), а затем 4-хлорбензил-1-сульфонилхлорид (226 мг, 1,07 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 3 ч, а затем разбавляли дихлорметаном (10 мл) и гасили водой (10 мл). Водную фазу экстрагировали дихлорметаном, и объединенные органические фазы промывали рассолом, высушивали над сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали хроматографией (SiO2; гептан : этилацетат 2:1) с получением продукта, указанного в заголовке (295 мг, 78%), в виде бесцветной пены. МС (EI) m/e: 387,1 (М+Н)+.
d) (R,S)-1-(2-(4-Хлорфенилсульфонил)-2-азаспиро[3.3]гептан-5-ил)-3-(2,4-дихлорбензил)мочевина

По аналогии с экспериментальным методом примера 5d) (R,S)-трет-бутил-2-(4-хлорфенилсульфонил)-2-азаспиро[3.3]гептан-5-илкарбамат (292 мг, 755 мкмоль) вместо трет-бутил-1-(4-фторфенилсульфонил)-1,6-диазаспиро[3.3]гептан-6-карбоксилата был преобразован в соединение, указанное в заголовке (312 мг, 84%), которое получили в виде бесцветной пены. МСВР (EI): 487,0293 (точная масса, вычисленная для C20H20Cl3N3O3S ([М]+)=487,0291).
е) (R)-1-(2-(4-Хлорфенилсульфонил)-2-азаспиро[3.3]гептан-5-ил)-3-(2,4-дихлорбензил)мочевина и (S)-1-(2-(4-хлорфенилсульфонил)-2-азаспиро[3.3]гептан-5-ил)-3-(2,4-дихлорбензил)мочевина
(R,S)-1-(2-(4-Хлорфенилсульфонил)-2-азаспиро[3.3]гептан-5-ил)-3-(2,4-дихлорбензил)мочевину (312 мг, 638 мкмоль) разделяли на хиральной ВЭЖХ с получением (R)-1-(2-(4-хлорфенилсульфонил)-2-азаспиро[3.3]гептан-5-ил)-3-(2,4-дихлорбензил)мочевины (124 мг, 39%) в виде бесцветного твердого вещества (МС (EI) m/е: 490,0 (М+Н)+) и (S)-1-(2-(4-хлорфенилсульфонил)-2-азаспиро[3.3]гептан-5-ил)-3-(2,4-дихлорбензил)мочевины (126 мг, 40%) в виде бесцветного твердого вещества (МС (EI) m/е: 490,0 (М+Н)+).
Пример 18
рац-6-Бензоил-3,6-диаза-бицикло[3.2.0]гептан-3-карбоновой кислоты 2,4-дихлор-бензиламид

а) рац-3-(2,4-Дихлор-бензилкарбамоил)-3,6-диаза-бицикло[3.2.0]гептан-6-карбоновой кислоты трет-бутиловый эфир

По аналогии с экспериментальным методом примера 1а) рац-3,6-диаза-бицикло[3.2.0]гептан-6-карбоновой кислоты трет-бутиловый эфир вместо 6-(трет-бутоксикарбонил)-2,6-диазаспиро[3.3]гептана оксалата был преобразован, используя 2,4-дихлор-1-(изоцианатометил)бензол, в соединение, указанное в заголовке (691 мг, 88%), которое получили в виде бесцветного твердого вещества. МС (EI) m/e: 400,1 (М+Н)+.
b) рац-3-(2,4-Дихлор-бензилкарбамоил)-3,6-диаза-бицикло[3.2.0]гептан

По аналогии с экспериментальным методом примера 1b) рац-3-(2,4-дихлор-бензилкарбамоил)-3,6-диаза-бицикло[3.2.0]гептан-6-карбоновой кислоты трет-бутиловый эфир вместо 6-(2,4-дихлор-бензилкарбамоил)-2,6-диазаспиро[3.3]гептан-2-карбоновой кислоты трет-бутилового эфира был преобразован в соединение, указанное в заголовке (935 мг, 99%), которое получили в виде бесцветного твердого вещества. МС (EI) m/e: 300,3 (М+Н)+.
с) рац-6-Бензоил-3,6-диаза-бицикло[3.2.0]гептан-3-карбоновой кислоты 2,4-дихлор-бензиламид
По аналогии с экспериментальным методом примера 1с) рац-3-(2,4-дихлор-бензилкарбамоил)-3,6-диаза-бицикло[3.2.0]гептан вместо 6-(2,4-дихлор-бензилкарбамоил)-2,6-диазаспиро[3.3]гептана, используя бензоилхлорид, был преобразован в соединение, указанное в заголовке (92 мг, 84%), которое получили в виде белого твердого вещества. МС (EI) m/e: 404,2 (М+Н)+.
Пример 19
рац-6-бензилсульфонил-3,6-диаза-бицикло[3.2.0]гептан-3-карбоновой кислоты 2,4-дихлор-бензиламид

К раствору рац-3,6-диаза-бицикло[3.2.0]гептан-3-карбоновой кислоты 2,4-дихлор-бензиламида (150 мг, 270 мкмоль) в дихлорметане (6 мл) добавляли триэтиламин (82 мг, 810 мкмоль), пиридин (1 мл) и бензилсульфонилхлорид (52 мг, 297 мкмоль). Реакционную смесь перемешивали при температуре окружающей среды в течение ночи, после чего концентрировали в вакууме. В результате очистки хроматографией (SiO2; дихлорметан : метанол 1:0-19:1) получили соединение, указанное в заголовке (56 мг, 47%), в виде бесцветного твердого вещества. МС (EI) m/e: 440,1 (М+Н)+.
Пример 20
рац-6-Пиримидин-2-ил-3,6-диаза-бицикло[3.2.0]гептан-3-карбоновой кислоты 2,4-дихлор-бензиламид

К раствору рац-3,6-диаза-бицикло[3.2.0]гептан-3-карбоновой кислоты 2,4-дихлор-бензиламида (150 мг, 270 мкмоль) в толуоле (6 мл) добавляли 2-бромпиримидин (43 мг, 270 мкмоль) и триэтиламин (27 мг, 270 мкмоль). После добавления трис(дибензилиденацетон)дипалладия(0) (5 мг, 5 мкмоль), BINAP (10 мг, 16 мкмоль) и трет-бутилата калия (30 мг, 270 мкмоль) реакционную смесь нагревали в атмосфере аргона до 110°С в течение 20 ч. Смесь фильтровали и концентрировали в вакууме. В результате очистки хроматографией (SiO2; дихлорметан : метанол 1:0-9:1) получили соединение, указанное в заголовке (26 мг, 25%) в виде белого твердого вещества. МС (EI) m/e: 378,3 (М+Н)+.
Пример 21
рац-4-[3-(2,4-Дихлор-бензилкарбамоил)-3,6-диаза-бицикло[3.2.0]гепт-6-ил]-бензойной кислоты

а) рац-4-[3-(2,4-Дихлор-бензилкарбамоил)-3,6-диаза-бицикло[3.2.0]гепт-6-ил]-бензойной кислоты этиловый эфир

По аналогии с экспериментальным методом примера 20) рац-3-(2,4-дихлор-бензилкарбамоил)-3,6-диаза-бицикло[3.2.0]гептан, используя этил-4-бромбензоат вместо 2-бромпиримидина, был преобразован в соединение, указанное в заголовке, которое получили в виде белого твердого вещества и непосредственно использовали без дополнительной очистки.
b) рац-4-[3-(2,4-Дихлор-бензилкарбамоил)-3,6-диаза-бицикло[3.2.0]гепт-6-ил]-бензойная кислота
К раствору рац-4-[3-(2,4-дихлор-бензилкарбамоил)-3,6-диаза-бицикло[3.2.0]гепт-6-ил]-бензойной кислоты этилового эфира (55 мг, 123 мкмоль) в метаноле (2 мл) и тетрагидрофуране (2 мл) добавляли водный гидроксид натрия (1 М, 2 мл), и реакционную смесь нагревали до 60°С в течение 1 ч. Растворители частично удаляли концентрированием в вакууме, добавляли тетрагидрофуран (2 мл), и в результате фильтрования получили соединение, указанное в заголовке (30 мг, 58%), в виде белого твердого вещества. МС (EI) m/e: 420,2 (М+Н)+.
Описанное выше изобретение раскрыто несколько более подробно путем иллюстрации и примера в целях ясности и понимания. Специалистам в данной области техники очевидно, что изменения и модификации можно осуществлять на практике в пределах объема прилагаемой формулы изобретения. Таким образом, понятно, что приведенное выше описание подразумевают как иллюстративное и неограничивающее. Объем изобретения следует, таким образом, определять не со ссылкой на приведенное выше описание, но вместо этого его следует определять со ссылкой на приведенную ниже прилагаемую формулу изобретения, параллельно с полным объемом эквивалентов, к которым принадлежит данная формула изобретения.
БИОЛОГИЧЕСКИЕ ПРИМЕРЫ
Пример А
Ферментативный анализ растворимой эпоксидгидролазы человека
Тестируемые соединения (1,6 мМ исходный раствор в ДМСО) разводили в 3 раза серийно в ДМСО, и 0,8 микролитров на лунку добавляли в 384-луночные планшеты NBS (Coming). Субстрат эпоксирезоруфин (20 мкМ исходный раствор в ДМСО) разводили до 5 мкМ аналитическим буфером (25 мМ бис-Трис-HCl, рН 7,0, 1 мМ дитиотрейтол (ДТТ) и 0,2 мг/мл бычьего сывороточного альбумина (БСА)), и 8 микролитров на лунку добавляли в микропланшеты. Затем добавляли тридцать два микролитра на лунку 3,6 мМ растворимой эпоксидгидролазы в аналитическом буфере. Образцы инкубировали при комнатной температуре, и мониторинг сигналов анализа проводили путем считывания флуоресценции возбуждения при 530 нм и испускания при 590 нм на считывающем устройстве PlateVision (Zeiss) каждые 2 минуты 8 раз. Скорость реакции, % ингибирования и значения IC50 вычисляли, используя программное обеспечение AssayAnalyzer и Condoseo (Genedata AG, Basel, Switzerland).
Все эксперименты проводили в трех повторах.
Соединения по настоящему изобретению были протестированы на их способность к ингибированию активности sEH. Примеры были протестированы в описанном выше анализе, и было обнаружено, что они имеют значения IC50, составляющие от приблизительно 79 нМ до приблизительно 2792 нМ. Значения для конкретных соединений приведены в таблице 1.