Результат интеллектуальной деятельности: ДВУХСЛОЙНАЯ, ПЛОСКАЯ, ПРОЗРАЧНАЯ ПОДЛОЖКА ГИДРОГЕЛЯ ДЛЯ ДЛИТЕЛЬНОГО КУЛЬТИВИРОВАНИЯ КЛЕТОК
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к области биологии и касается изделия-подложки для культивирования клеток и способа его изготовления.
Уровень техники
Новое поколение лекарственных средств, внедряемых фармацевтическими компаниями в последние двадцать лет, отличается возможностью избирательного воздействия не только на тканевом, но и на клеточном уровне. Высокомолекулярные соединения (рекомбинантные белки, производные моноклональных антител, иммуноконъюгаты, ферментные комплексы) обладают селективностью к определенным типам человеческих клеток, различая их функциональное состояние и степень дифференцировки. В этом их главное отличие от традиционных лекарственных средств, представляющих собой химические вещества с широким спектром действия, и продуктов микробиологического производства (антибиотиков, бактериофагов), дискриминирующих классы микроорганизмов.
Высокая избирательность взаимодействия с клеточным объектом, присущая физиологически активным белковым структурам, создает проблему при отборе новых кандидатов в лекарственные препараты. В идеальном случае испытания следует проводить на человеческом материале в условиях, максимально приближенных к нативным. Даже отработанные приемы тестирования на животных не позволяют воспроизвести таргетные свойства объекта воздействия.
Альтернативой необходимости испытания лекарственных средств нового поколения непосредственно на человеке является создание функциональных аналогов тканевых структур на основе адекватных человеческих клеток. Особо актуальна эта задача для моделирования хронически измененных состояний, при которых адаптационная де-дифференцировка клеток в обычной культуре представляет неразрешимую проблему. Для длительного культивирования клеток человека без смены фенотипа единственной возможностью является использование в качестве субстрата близкого к естественному внеклеточного матрикса, приготовленного из очищенных компонентов человеческого происхождения.
Известной и наиболее распространенной подложкой для культивирования клеток является подложка на основе пластика, обработанного различными белками внеклеточного матрикса. Такими белками могут быть: ламинин и хондроитин сульфат [1], смесь фибронектина и коллагена I типа (FNCCoatingMix®) [2], ламинин 5 [3]. Однако эта подложка и способ ее получения не являются физиологичным из-за того, что клетки культивируются на жестком пластике и в конечном итоге клетки изменяются морфологически.
Известна другая подложка и способ ее получения, когда клетки «вмешиваются» в еще жидкую смесь раствора коллагена I типа и раствора фибронектина, после чего смесь полимеризуется [4]. Полученная таким образом подложка позволяет культивировать клетки в 3D-условиях. Однако основным недостатком такой подложки является короткое поддержание жизнеспособности и функциональности культуры клеток.
В литературе описано большое количество объемных пористых подложек для культивирования клеток. Shea et al. [5] предложили использовать высокопористую подложку на основе полимолочных кислот (PLGA). Petronis et al. [6] для культивирования гепатоцитов использовали титановую керамическую подложку. Kim et al [7] использовали трехмерную пористую коллаген-хитозановую подложку, полученную с помощью лиофилизации и химически модифицированную EDS для улучшения механических свойств. Ya Nan Wei et al. [8] использовали трехмерную пористую подложку, приготовленную из химически модифицированного хитозана, для культивирования клеток эндотелия. Однако все эти подложки не поддерживают адгезию клеток, которая особенно необходима для культур человеческих клеток.
Наиболее близкой к заявляемой подложке по технической сущности и достигаемому эффекту является подложка, представляющая из себя трехмерный пористый гидрогель [9]. Способ приготовления такой подложки состоит в лиофилизации гидрогеля. Каркасной основой такого гидрогеля является химически прошитый альгинат или гиалуроновая кислота. Недостатками подложки является использование химически прошитого альгината или гиалуроновой кислоты в качестве основного компонента, которые не являются естественными составляющими большинства типов тканей, тем самым не воссоздается естественное микроокружение, которое необходимо для длительного поддержания фенотипа культивируемых клеток in vitro. Кроме того, при культивировании клеток необходимо учитывать параметр жесткости подложки, который не учитывается в указанной заявке на изобретение.
Близким заявленному изобретению по характеру влияния на культивируемые эндотелиальные клетки является Матригель™ (препарат базальной мембраны, получаемый из EHS опухоли мышей; коммерческий препарат Corning-Matrigel, etc.). Этот препарат подложки с успехом применяется для in vitro теста ангиогенеза, в котором эндотелиальные клетки высеваются на подложку и формируют капилляроподобные структуры [10]. Для теста могут использоваться как первичные культуры эндотелиальных клеток (например, HUVEC - эндотелиальные клетки пупочной вены человека), так и иммортализованные клеточные линии человека и животных (SVEC4-10, НМЕС-1), а также первичные клетки из тканей пациентов для определения индивидуального ответа на действие регуляторов ангиогенеза [11]. Сам метод дифференцировки эндотелиальных клеток в капилляроподобные структуры был описан в 1988 году Kubota с соавторами [12]. С тех пор метод широко применяется для изучения индукторов и ингибиторов ангиогенеза, фундаментальных основ ангиогенеза, а также способности некоторых раковых клеток (при определенных условиях) приобретать «сосудистый» фенотип (например, в работе Francescone III с соавторами раковые линии меланомы B16F1 и рака груди MDA-MB-435 образуют сосудистую сеть на подложке Матригель, что согласуется с поведением этих клеток в организме человека и животных моделях) [13].
Однако следует отметить, что описываемый аналог подложки на основе Матригеля имеет существенный недостаток, заложенный в природе этого матрикса и технологии его получения - это значительная степень вариабельности от лота к лоту, что может приводить к получению невоспроизводимых результатов экспериментов (http://muthuswamylab.cshl.edu/protocols/Testing%20Matrigel%20Lots.pdf).
В отличие от указанных выше аналогов заявленная подложка лишена перечисленных выше недостатков, в том числе потому, что производится из высокоочищенных компонентов и имеет строго детерминированный состав.
Раскрытие изобретения
Задачей, решаемой в рамках настоящей заявки, являлось создание биорелевантной подложки для культивирования клеток, в особенности для эндотелиальных клеток человека. Было высказано предположение, что для длительного культивирования клеток эндотелия человека с поддержанием их фенотипа, необходимо воссоздать естественную нишу обитания этих клеток, т.е. воссоздать структуру, свойства и состав естественного внеклеточного матрикса-подложки - базальной мембраны.
Таким образом, первый аспект предлагаемого изобретения касается двухслойной, плоской, прозрачной подложки гидрогеля, имеющей толщину в гидратированном состоянии в диапазоне 25-500 мкм и радиус кривизны менисков 10-150 мкм, обеспечивающей длительное культивирование клеток, в которой на поверхности структурообразующего слоя, состоящего из трехмерного коллагенового гидрогеля, контролируемого состава, с жесткостью в диапазоне 0,3 кПа - 30 кПа, имеется слой белков, необходимых для моделирования естественного микроокружения клеток, обеспечивающего сохранение способности клеток к адгезии.
Предпочтительно в подложке по изобретению коллагеновый гидрогель включает в себя коллаген I типа, коллаген III типа и белки, способствующие адгезии и миграции клеток и в ней коллаген I, III типов являются коллагеном человека, быка, свиньи, крысы (но не ограничивается ими) I, III типа.
В одном из вариантов коллаген I, III типов может быть коллагеном человека I, III типа. Предпочтительно способствующие к адгезии и миграции клеток белки в коллагеновом гидрогеле представляют собой фибронектин.
Предпочтительно подложка содержит коллаген I типа 70-85%, коллагена III типа 10-30%, фибронектин 5-15%.
Предпочтительно в слой белков, иммобилизованных на поверхности гидрогеля, входят: коллаген IV типа, ламинин, фибронектин, при этом указанные белки имеют животное (в том числе человеческое) происхождение.
В одном из вариантов подложка содержит коллаген IV типа 60-70%, ламинин 20-34%, фибронектин плазмы крови 1-10%.
Предпочтительно подложка по изобретению содержит коллагеновый гидрогель с жесткостью после регидратации, которая характеризуется эластическим модулем упругости в диапазоне 0.3-5 кПа.
В одном из вариантов подложка по изобретению имеет толщину в гидратированном состоянии в диапазоне 100-500 мкм, является прозрачной и поглощает не более 15% света с длиной волны λ=650 нм. Подложка в верхнем слое может дополнительно содержать фактор роста фибробластов-2 (bFGF), предпочтительно в концентрации 5-50 нг/мл.
Подложка по изобретению может обеспечивать сохранение фенотипа эндотелиальными клетками и эпителиальными клетками при их длительном культивировании.
В одном из вариантов подложка может дополнительно содержать в верхнем слое белки, характерные для патологического изменения состава базальной мембраны кровеносных сосудов в состоянии хронического воспаления, включающие фактор фон Виллебранда, витронектин, фибрин, С-реактивный белок, иммуноглобулины IgM.
Другим аспектом изобретения является способ получения заявляемой подложки. Способ включает следующие стадии:
- желирование, при этом смешивают жидкие составляющие подложки и переводят их в гелеобразное состояние для формирования гидрогеля;
- витрификация, при этом сформированный гидрогель переводится в форму стеклоподобной мембраны (подложки); и
- иммобилизация белков на поверхности подложки с получением двухслойной, плоской, прозрачной подложки гидрогеля, имеющей толщину в гидратированном состоянии в диапазоне 25-500 мкм и радиус кривизны менисков 10-150 мкм, в которой на поверхности структурообразующего слоя, состоящего из трехмерного коллагенового гидрогеля, с контролируемым составом и с жесткостью в диапазоне 0,3 кПа - 30 кПа, имеется слой белков, обеспечивающих адгезию клеток и необходимых для моделирования естественного микроокружения клеток.
Таким образом, предлагаемая подложка состоит из двух компонентов: нижнего слоя коллагенового гидрогеля, основным компонентом которого является коллаген человека I типа, а также небольшая примесь коллагена человека III типа и фибронектина плазмы крови человека, обеспечивающего необходимую жесткость подложки. Соотношение коллагена I типа и коллагена III типа в подложке зависит от типа моделируемой (воссоздаваемой) ткани. Необходимое соотношение достигается путем смешивания препарата высокоочищенного коллагена I типа (НС11, ООО фирмы «Имтек») с препаратом высокоочищенного коллагена III типа (НС33, ООО фирмы «Имтек»); и верхнего слоя иммобилизованных на поверхности нижнего слоя белков внеклеточного матрикса, контактирующих с клетками, представляющего из себя сетку коллагена человека IV типа, фибронектина плазмы крови человека и плацентарного ламинина человека.
Оказалось, что использование смеси указанных компонентов человеческого происхождения позволяет обеспечить условия микроокружения, необходимые для длительного культивирования клеток эндотелия человека с поддержанием их фенотипа.
Применяемые при приготовлении подложки компоненты: коллаген человека I, III и IV типов, фибронектин плазмы крови человека и плацентарный ламинин человека были получены по стандартным методикам, описанным в литературе.
В каркасную основу подложки для культивирования клеток в настоящем изобретении входит коллаген человека I и III типов, и фибронектин плазмы крови человека.
Коллаген I типа - это наиболее распространенный и изученный тип коллагена. Более 90% белков внеклеточного матрикса большинства интерстициальных соединительных тканей составляет коллаген I типа. Этот тип коллагена способен формировать высокоорганизованные супрамолекулярные агрегаты, фибриллы, с характерной структурой. Коллагеновые фибриллы, ответственные за прочность матрикса и его эластичность, в основном состоят из коллагенов I и III типов.
Фибронектин - это высокомолекулярный димерный гликопротеин, экспрессирующийся в больших количествах различными типами клеток в эмбриональных и взрослых тканях. Он организован в виде фибрилл и находится во внеклеточном матриксе. На поверхности клетки фибронектин организует фибриллярную сетку, а через клеточные рецепторы регулирует адгезию клеток, миграцию, рост и дифференцировку.
Коллаген IV типа - один из основных белковых компонентов базальных мембран, образует характерную структуру сетки с латеральной ассоциацией. Коллаген IV типа, как и все коллагены, состоит из трех альфа-цепей с молекулярной массой около 180 кДа. Молекулы коллагена образуют супрамолекулярную сетку, стабилизированную -S=N-связями. Одной из основных функций коллагена IV типа является поддержание структуры тканей в процессе эмбриогенеза, ремоделинга и регенерации. Молекула коллагена IV типа является лигандом для интегринов, рецепторов на поверхности клеток, обеспечивая клеточную адгезию, миграцию и дифференцировку.
Ламинины являются семейством гликопротеинов, которые секретируются во внеклеточный матрикс в виде α-β-γ гетеротримеров, каждый из которых имеет пять, четыре и три генетически различные формы соответственно. Ламинины обладают множеством функций, чаще всего они связаны с клеточными функциями (адгезия, дифференцировка, миграция, поддержка фенотипа и защита от апоптоза). Исходя из своего природного расположения, в базальной мембране, которая плотно прилежит к тканям, в основном состоящим из коллагена I и III типов, вытекает задача иммобилизации коллагена IV типа на поверхности коллагеновых гидрогелей.
Основными свойствами подложки являются:
Состав коллагенового гидрогеля (нижний слой)
|
Состав верхнего слоя
|
Физические свойства подложки
|
Процесс приготовления подложки разделяется на три стадии: желирование, витрификация, иммобилизация белков на поверхности гидрогеля.
Желирование
Для приготовления коллагенового гидрогеля в лунках 96- и/или 24-луночного планшета были смешаны стерильный, прозрачный, нейтральный раствор коллагена человека I типа (НС11, ООО фирмы «Имтек»), стерильный, прозрачный нейтральный раствор коллагена человека III типа (НС33, ООО фирмы «Имтек») и стерильный, прозрачный, нейтральный раствор фибронектина плазмы крови человека (HFne_s, ООО фирмы «Имтек») в соотношении 80%, 15% и 5% (в пересчете на сухой вес белка на единицу объема готового геля). Для предотвращения преждевременного желирования все операции выполняют на льду.
Крайне важным параметром для подложки является кривизна мениска, так как требование ровного слоя поверхности является критическим для автоматизированной микроскопической фотосъемки клеточных культур.
Для достижения ровного слоя планшет с раствором белков центрифугируют на центрифуге Beckman на скорости 4000 об/мин при температуре +37°С в течение 3 часов. Плотность гидрогеля можно варьировать путем изменения концентрации коллагена в коллагеновом гидрогеле.
Витрификация
На этом этапе происходит сушка коллагенового гидрогеля в условиях контролируемой температуры и влажности. По окончании витрификации коллагеновый гидрогель переходит в форму стеклоподобной мембраны.
Иммобилизация белков на поверхности гидрогеля
Иммобилизация коллагена IV типа, плацентарного ламинина и фибронектина на поверхности сухой коллагеновой мембраны проводится путем нековалентной адсорбции или химической пришивки указанных белков к материалу мембраны. Предпочтительным является использование компонентов человеческого происхождения.
Далее в описании более подробно описаны осуществление изобретения, метод изготовления подложки для культивирования клеток и методы ее тестирования. Приведенные примеры являются иллюстративными и не должны стать основанием для ограничения притязаний по изобретению.
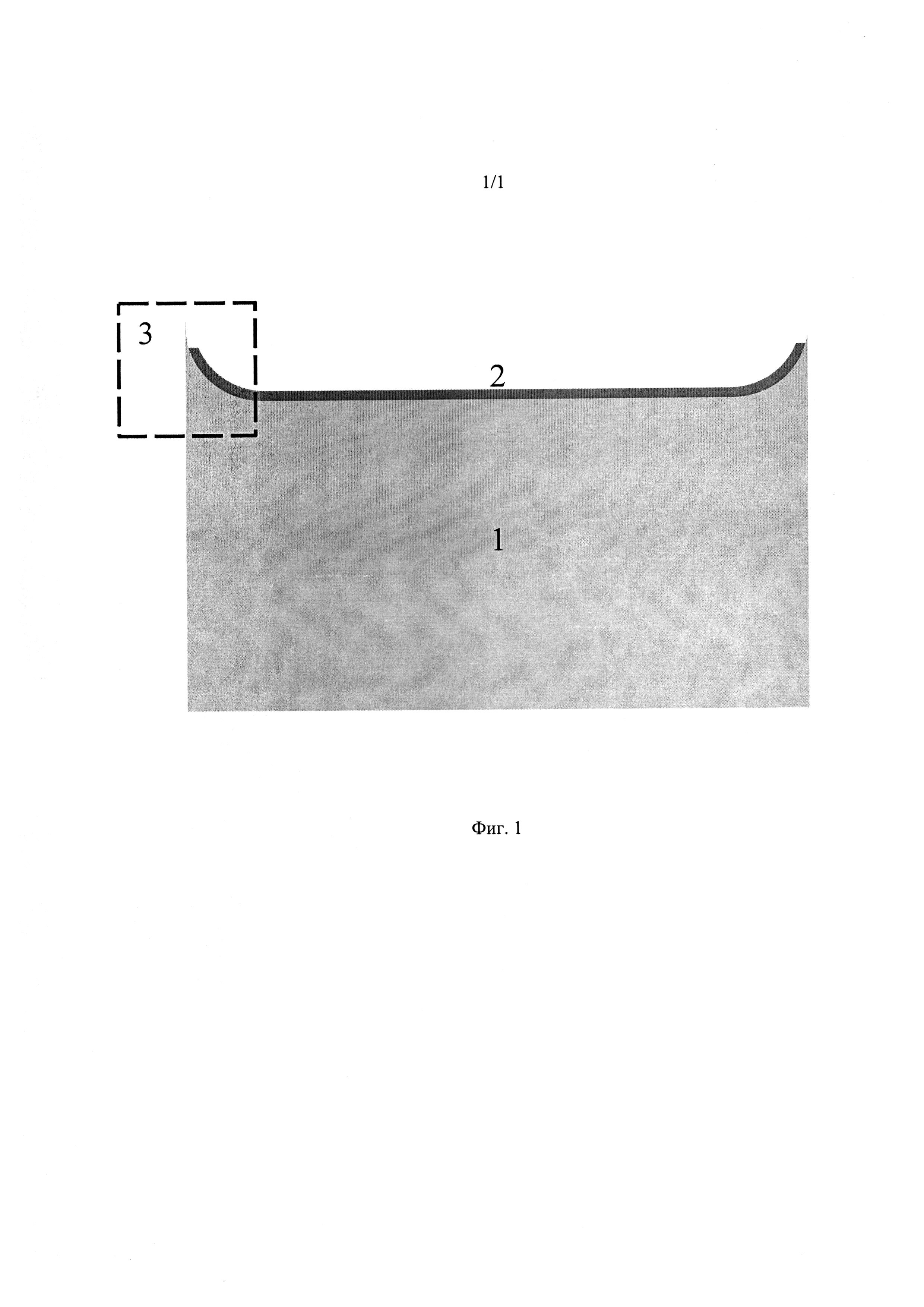
Краткое описание фиг. 1.
Двухслойная, плоская, прозрачная подложка гидрогеля, имеющая толщину в гидратированном состоянии в диапазоне 25-500 мкм и радиус кривизны менисков 10-150 мкм, для длительного культивирования клеток.
1 - Нижний слой подложки, включающий в себя коллаген I типа, коллаген III типа и белки, способствующие адгезии и миграции клеток.
2 - Верхний слой подложки, включающий в себя слой белков, иммобилизованных на поверхности нижнего слоя.
3 - Зона мениска
Осуществление изобретения
Пример 1. Способ изготовления подложки для длительного культивирования клеток
Приготовление коллагеновой мембраны:
В стерильном пластиковом стакане объемом 25 мл смешивают прозрачный нейтральный, стерильный раствор 5% коллагена человека I типа (Н С11, ООО фирмы «Имтек»), прозрачный нейтральный, стерильный раствор 5% коллагена человека III типа (Н С33, ООО фирмы «Имтек») и стерильный раствор фибронектина плазмы крови человека (Н Fne_s, ООО фирмы «Имтек») таким образом, чтобы в конечной смеси было 80% коллагена I типа, 15% коллагена III типа и 5% фибронектина плазмы крови. В каждую лунку 24-луночного полистирольного планшета (92424, Tissue Plastic Production) добавляют по 1 мл приготовленной смеси. Для достижения ровного слоя планшет с раствором белков центрифугируют на центрифуге Beckman при скорости 10000 об/мин и температуре +37°С в парах аммиака в течении 3 часов. В результате в каждой лунке планшета формируется коллагеновый гидрогель. Затем планшет с коллагеновыми гидрогелями подвергают сушке с сохранением асептических условий при температуре, не превышающей +30°С, и относительной влажности 40%. Сушка считалась полностью завешенной при переходе коллагенового гидрогеля в форму жесткой стеклоподобной мембраны.
Иммобилизация на поверхности коллагеновой мембраны слоя белков:
В стерильном пластиковом стакане объемом 15 мл смешивают прозрачный нейтральный, стерильный раствор 1% коллагена человека IV типа (Н С44, ООО фирмы «Имтек»), прозрачный стерильный 1% раствор плацентарного ламинина человека (Н Lmn, ООО фирмы «Имтек») и стерильный раствор 1% фибронектина плазмы крови человека (Н Fne_s, ООО фирмы «Имтек») таким образом, чтобы в конечной смеси было 65% коллагена IV типа, 30% плацентарного ламинина и 5% фибронектина плазмы крови. Иммобилизацию приготовленной смеси белков на поверхности сухой коллагеновой мембраны проводят следующим образом: сначала по 0,5 мл приготовленной смеси белков равномерно наносят на поверхность мембраны в каждую лунку планшета, затем планшет инкубируют в термостате в течение 2 часов при температуре +37°С. По истечении этого временного интервала остатки невпитавшейся жидкости удаляют, а планшет вновь подвергают сушке с сохранением асептических условий при температуре, не превышающей +30°С, до полного высыхания мембраны.
Измерение модуля упругости:
Оценка жесткости гидрогелей была проведена при помощи атомно силового микроскопа MFP 1-Dи MFP 3-D (Asylum Research, Santa Barbara, США). Кривые силы были записаны, используя кронштейны с пирамидальной насадкой и номинальной константой жесткости пружины k=0,06 Н/м (DNP, Veeco, Santa Barbara, США). Эту константу калибровали, используя метод термических волн (14). Предполагая, что отношение Пуассона ν=0,45, эластический модуль упругости был получен из модели Хертца (15), и используя следующее уравнение с учетом пирамидальной формы насадки:
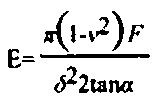
было получено значение эластического модуля упругости Е=938 Па.
Пример 2. Соотнесение толщины подложки с прозрачностью
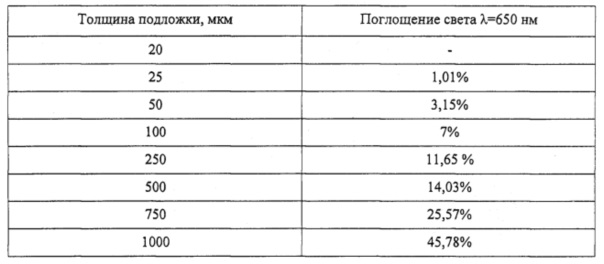
По методике, описанной в примере 1, была приготовлена линейка коллагеновых подложек с различной толщиной. Контроль прозрачности коллагеновых гидрогелей был проведен при помощи планшетного спектрофотометра (xMark™, BioRad) с установленной длиной волны λ=650 нм. Из результатов, представленных в таблице, видно, что при толщине мембраны, превышающей 500 мкм, поглощение света с длиной волны λ=650 нм начинает превышать 15%, что существенно затрудняет просмотр поверхности подложки при ее анализе. Также стоит отметить, что при толщине подложки ≤20 мкм на ее поверхности были обнаружены множественные трещины, поэтому на таких подложках измерение прозрачности не проводилось.
Таблица 1
Пример 3. Соотнесение состава подложки с радиусом кривизны менисков
Чтобы обеспечить удобство при автоматизированном сканировании рабочей площади поверхности подложки и увеличить видимое поле при фокусировке на центр подложки, радиус кривизны менисков должен быть в пределах от 10 до 150 мкм.
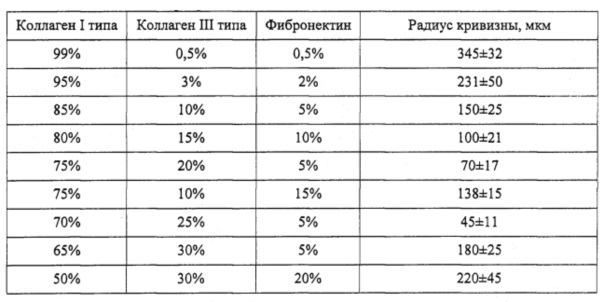
По методике, описанной в примере 1, была приготовлена линейка коллагеновых подложек различного состава. Радиус кривизны менисков был определен с помощью микроскопа (CKX41, Olympus), который был снабжен окулярным микрометром с шагом винта 1 мм и ценой деления отсчетного барабана 0,01 мм. Из результатов, представленных в таблице, видно, что для выполнения требования, наложенного на величину радиуса кривизны менисков, оптимальным является соотношение: коллаген I типа 70-85%, коллаген III типа 10-30%, фибронектин 5-15%.
Таблица 2
Пример 4. Тест на ангиогенез - образование капилляроподобных структур на подложке со значением модуля упругости в диапазоне 0,3-30 кПа
Возможность применения изобретения для выращивания клеток эндотелия и формирования ими капилляроподобных структур при определенной жесткости подложки тестировали на первичных клетках эндотелия пупочной вены человека (HUVEC - human umbilical vein endothelial cells). Первичную культуру HUVEC получали по методике, описанной в работе Davis с соавторами, 2007 [16] и замораживали в жидком азоте для длительного хранения. После размораживания клетки культивировали в культуральных матрасах, поверхность которых была модифицирована фибронектином (HFne_s, ООО фирмы «Имтек») и коллагеном IV типа (Н С44, ООО фирмы «Имтек»). В качестве культуральной среды использовали специализированную ростовую среду для эндотелия EGM-2 (Endothelial cell growth medium-2; Lonza, cat. no. CC-3162). Условия культивирования: CO2 инкубатор - 5% CO2, 37°C, 95% влажность. Культуру пассировали стандартно с помощью раствора трипсин-ЭДТА. Клетки HUVEC до применения в эксперименте пассировали не более 5 раз. Полученную культуру клеток оценивали морфологически и иммуноцитохимически с помощью визуализации специфических антигенов:
- CD31 (Pecam 1) - один из основных белков межклеточных контактов эндотелиальных клеток (Abcam, ab28364);
- vWF-фактор фон Виллебранда, депонируемый клетками эндотелия в тельцах Вейбеля-Паладе (Abcam, ab6994).
Затем культуру клеток переносили на заранее подготовленные 24-луночные планшеты с иммобилизованными подложками, как описано в примере 1. Жесткость подложки варьировали в пределах 0,3-30 кПа; протестировали следующие точки эластического модуля упругости: 0,3, 1, 2,5, 5, 10, 20, 30 кПа. В каждую лунку помещали 50000 клеток в 1 мл культуральной среды, поддерживающей активацию ангиогенеза (EGM-2) с добавлением 10 нг/мл bFGF (фактор роста фибробластов) и 1 мкг/мл гидрокортизона. В другой серии экспериментов к культуральной среде добавляли ингибитор ангиогенеза сульфорафан в концентрации 20 мкМ (Sigma, кат. № S4441) [10, 17]. Планшеты культивировали в течение ночи в СО2-инкубаторе, после чего регистрировали результат эксперимента с помощью фотокамеры. Клетки эндотелия на подложке, приготовленной как описано в примере 1, создавали капилляроподобные структуры, что является одной из основных характеристик эндотелия. При этом капилляроподобные структуры образовывались только на гелях с жесткостью 0,3-5 кПа; жесткость геля 10-30 кПа способствовала диффузному характеру роста эндотелиальных клеток. В то же время, в присутствии ингибитора ангиогенеза сульфорафана образование капилляроподобных структур не наблюдалось при любой из исследованного диапазона жесткости коллагенового геля. Таким образом, подложка может использоваться в фундаментальных исследованиях ангиогенеза, а также скрининге потенциальных противоопухолевых препаратов.
Пример 5. Длительное культивирование эндотелиальных клеток с сохранением нормального фенотипа с целью моделирования эндотелиальной дисфункции
Эндотелиальные клетки HUVEC поддерживают в культуре путем пересева с уменьшением плотности клеток по достижении ими монослоя. Однако состояние пролиферации и миграции не является характерным для нормального эндотелия сосудов и наблюдается в процессе ангиогенеза. Для выполнения эндотелием специфических функций (в том числе барьерной) необходимо наличие плотных контактов между клетками, что достигается экспрессией на клеточной поверхности определенных молекул (клаудин-5, васкулярно-эндотелиальный кадгерин). Эти поверхностные белки могут повреждаться при постоянном пассировании культуры с помощью диссоциирующих агентов (например, раствора трипсина). Кроме того, существуют наблюдения, что с каждым пересевом экспрессия признаков, характерных для нормального фенотипа, уменьшается. Так, в работе Davison с соавторами [18] показано, что при культивировании эндотелиальных клеток краевой вены уха кролика с каждым пассажем наблюдается прогрессивное уменьшение количества телец Вейбеля-Паладе, что связано с уменьшением экспрессии фактора фон Виллебранда. Таким образом, для моделирования эндотелиальной дисфункции in vitro требуется статическая культура эндотелиальных клеток с сохранением нормального фенотипа в течение длительного периода времени (до 3 недель). Этот пример показывает возможность длительного культивирования клеток HUVEC на подложке, приготовленной как описано в примере 1, с сохранением признаков нормального фенотипа эндотелия.
Культуру клеток HUVEC извлекали из криохранилища и культивировали до начала эксперимента в течение 1 недели. Затем культуру клеток переносили на заранее подготовленные 24-луночные планшеты с иммобилизованными подложками, как описано в примере 1. В каждую лунку помещали 50000 клеток в 1 мл культуральной среды EGM-2 и культивировали в течение 3 дней до достижения культурой монослойного состояния. Затем культуральную среду меняли на ЕВМ-2 (Endothelial Basal Medium; Lonza, cat. no. CC-3156) с добавлением 2% фетальной бычьей сыворотки и 10 мкг/мл гепарина. С этого момента начинался эксперимент по длительному поддержанию клеток HUVEC в культуре. Смену среды производили каждые 2 дня. Фенотип культуры оценивали морфологически и иммуноцитохимически с помощью визуализации специфических антигенов в начале (1 день) и в конце (21 день) эксперимента:
- CD31 (Pecam 1) - один из основных белков межклеточных контактов эндотелиальных клеток (Abcam, ab28364);
- VE cadherin - васкулярно-эндотелиальный кадгерин - играет важную роль в биологии эндотелия, контролируя и организуя межклеточные контакты;
- vWF-фактор фон Виллебранда, депонируемый клетками эндотелия в тельцах Вейбеля-Паладе (Abcam, ab6994).
Функциональность эндотелиальных клеток оценивали при помощи теста на захват ацетилированного липопротеина низкой плотности (DiI-Ac-LDL), интернализация которого осуществляется посредством рецепторного эндоцитоза [19]. Степень активированности эндотелия оценивали по уровню экспрессии Е-селектина в реакции ОТ-ПЦР [20].
При культивировании клеток HUVEC на подложке, приготовленной как описано в примере 1, сохраняется специфическая брусчатоподобная морфология монослоя клеток, а также экспрессия основных эндотелиальных маркеров и функциональность. Уровень экспрессии Е-селектина не изменяется в пределах статистической погрешности. Это позволяет использовать данную подложку для моделирования эндотелиальной дисфункции и скрининга потенциальных лекарственных препаратов в течение 21 дня. В течение этого срока сохраняется нормальный фенотип эндотелия, поэтому при воздействии на такую культуру исследуемых веществ или препаратов наблюдаемые эффекты будут отражать воздействие внешних факторов, а не изменение самих клеток с течением времени.
Пример 6. Сравнение вариантов подложки, приготовленных из коллагена (I, III, IV типы) и других белковых компонентов (ламинин, фибронектин) человеческого и животного (бык, свинья, крыса) происхождения.
Варианты подложки на основе компонентов человеческого и животного происхождения тестировали на культуре первичных эмбриональных фибробластов мыши и клеток рака легкого человека А549. Оценивали скорость первичного прикрепления и степень распластывания клеток на подложках, а также миграцию и пролиферацию.
Различия в поведении обеих культур на подложках из компонентов животного и человеческого происхождения отсутствовали.
Пример 7. Подложка, в которой в верхний слой введен дополнительный компонент, обеспечивающий миграцию и пролиферацию клеток, - фактор роста фибробластов-2 (bFGF) с диапазоном концентраций 5-50 нг/мл.
Данный вариант подложки тестировали на культуре первичных эмбриональных фибробластов мыши. Оценивали направленную миграцию клеток по градиенту концентрации фактора роста в матриксе (гаптотаксис) и скорость пролиферации клеток. Для цели эксперимента создали вариант подложки, в которой верхний белковый слой готовился таким образом, что одна половина его содержала фактор роста фибробластов, а другая - нет. Клетки высаживались в место стыка в культуральной среде DMEM без добавления фетальной сыворотки, и имели возможность мигрировать как в сторону уменьшения концентрации фактора роста, так и в сторону увеличения. Клетки быстрее мигрировали по матриксу, содержащему фактор роста фибробластов, чем по матриксу без фактора роста - за 24 часа клетками в первом случае было пройдено расстояние, в два раза превышающее расстояние во втором случае. Кроме того, клетки на матриксе, содержащем фактор роста фибробластов, пролиферировали на 50% быстрее, чем на матриксе без фактора роста фибробластов. Исследовали различные концентрации фактора роста фибробластов и пришли к заключению, что концентрация bFGF менее 5 нг/мл не влияла на направленность миграции и скорость пролиферации культуры клеток - в обе стороны клетки мигрировали медленно на одинаковое расстояние и пролиферировали с одинаковой скоростью. И наоборот, при концентрации фактора роста фибробластов более 50 нг/мл эффект на пролиферацию клеток снижался, вероятно, вследствие насыщения клеточных рецепторов и изменения экспрессии специфичных генов, играющих роль в клеточном цикле. Таким образом, патентуемая подложка с включением в состав фактора роста фибробластов в диапазоне концентраций 5-50 нг/мл дополнительно способствует миграции и пролиферации клеток на поверхности подложки. Тем не менее, модификация не ограничена конкретным фактором роста и может состоять во включении в состав подложки других не обязательных, но имеющих эффект компонентов, например, витронектина, фибрина или фактора фон Виллебранда.
Пример 8. Подбор оптимального состава верхнего (второго) слоя подложки
Целью было определить состав верхнего слоя подложки, подходящего для большинства модельных клеток. Оптимальный состав верхнего слоя подложки, с которым непосредственно контактируют клетки, определяли на разных культурах клеток - клетки сосудистого эндотелия (HUVEC), первичные эмбриональные фибробласты мыши (MEF), первичные нервные клетки крысы, раковые линии человека - А549 (карцинома легкого человека) и HepG2 (гепатокарцинома). Определяли скорость первичного прикрепления клеток к субстрату и степень распластывания клеток на поверхности субстрата. Протестированные варианты состава верхнего слоя подложки представлены в таблице 3:
Таблица 3
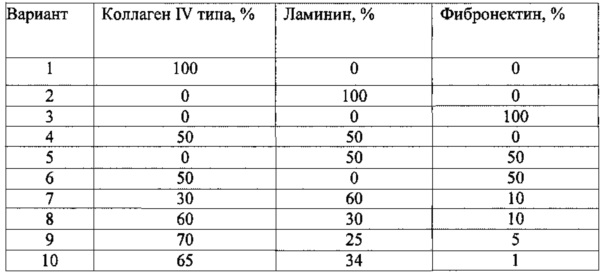
Все протестированные типы клеток наиболее быстро прикреплялись (в течение 30-40 минут) и хорошо распластывались на вариантах подложки 8, 9, 10, тогда как в других случаях наблюдалось либо увеличение времени первичного прикрепления (до 90-120 минут) - варианты 1, 2, 4, либо ограниченное распластывание всех (вариант 5) или части (варианты 3, 6, 7) протестированных типов клеток. Таким образом, универсальное процентное соотношение компонентов верхнего слоя подложки следующее: коллаген IV типа 60-70%, ламинин 20-34%, фибронектин 1-10%.
Список литературы
1. Engelmann, K., et al, 1988. Invest. Ophthalmol. Vis. Sci. 29, 1656-1662.
2. Joyce, N.C., et al. 2004. Cornea 23, S8-S19.
3. Yamaguchi, M„ et al., 2011. Invest. Ophthalmol. Vis. Sci. 52, 679-684.
4. Jeffrey S. Schechner, et al., 2000, PNAS, 97/16, 9191-9196.
5. Shea et al., 1999, Nature Biotechnology, 17,551-554.
6. Petronis et al., 2001, J. Mat Sci: Mater Med, 12,523-528.
7. Kim et al., 2001, Fibers and Polymers, 2/2, 64-70.
8. Ya Nan Wei et al., 2013, J. Mat Sci: Mater Med, 24, 1781 -1787.
9. US 2004/0063206 Al.
10. Arnaoutova and Kleinman. 2010. Nature protocols, 5, 628-635.
11. Van Beijnum, J.R., et al., 2008. Nat. Protoc. 3, 1085-109.
12. Kubota, Y., et al., 1988. J. Cell Biol. 107, 1589-1597.
13. Francescone et al., 2011, J. Vis Exp. 55: 3040.
14. Hutteret al., 1993. Rev. Scientific. Instruments. 64, 7, 1868-1873.
15. Domke et al., 1998. Langmuir, 14, 2, 3320-3325.
16. Davis et al, 2007. J. Vis Exp.(3): 183.
17. Bertl E et al., 2006. Mol Cancer Ther., 5(3):575-85.
18. Davison et al., 1980. J. Cell Biol. 85, 187-198.
19. Voyta et al., 1984. J. Cell Biol; 99: 2034-40.
20. Pober et al., 1986. J. Immunol; 137(6): 1893-986.