Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ БАКТЕРИОФАГА
Вид РИД
Изобретение
Изобретение относится к микробиологии и может быть использовано в биотехнологии получения продукции, содержащей бактериофаги.
Бактериофаги - это вирусы, характеризующиеся специфической способностью к избирательному инфицированию бактериальных клеток, принадлежащих к одному штамму или антигенно-гомологичным штаммам одного вида или рода с последующим лизисом (после внутриклеточной репликации) клетки-хозяина - вирулентные фаги или интегрированием в бактериальный геном с образованием лизогенов - умеренные фаги (Adams Н.М. Bacteriophages. - New York: Interscience Publishers, Inc., London: Interscience Publishers ltd., 1959. - 592 p.). По многочисленным данным литературы, фаги могут быть использованы в качестве природных антимикробных агентов для борьбы с бактериальными инфекциями у людей, животных и сельскохозяйственных культур (Alisky J., Iczkowski K., Rapoport A., Troitsky N. Bacteriophages show promise as antimicrobial agents // The Journal of infection. - 1998. - Vol. 36, №1. - P. 5-15; Brussow H. Phage therapy: the Escherichia coli experience // Microbiology. - 2005. - Vol. 151, Pt. 7. - P. 2133-2140; Бондаренко B.M. Клинический эффект и пути рационального использования лечебных бактериофагов в медицинской практике // Приложение к Журналу инфектологии. - 2011. - Т. 3, №3. - С. 15-19). Ряд авторов допускают возможность практического применения бактериофагов как средств деконтаминации в пищевой промышленности как безопасной для человека и безвредной для окружающей среды альтернативы химическим и физическим методам элиминации бактерий (Greer G.G. Bacteriophage control of foodborne bacteria // Journal of food protection. - 2005. - Vol. 68, №5. - P. 1102-1111; Lang L.H. FDA approves
use of bacteriophages to be added to meat and poultry products // Gastroenterology. - 2006. - Vol. 131, №5. - P. 1370-1372; Алешкин A.B., Зейгарник M.B. Возможности применения бактериофагов в качестве пробиотических средств деконтаминации в области питания // Вопросы диетологии. - 2012. - Т. 2, №4. - С. 24-34).
Одним из приоритетных показателей производства фагосодержащей продукции является получение фаголизатов с исходно высоким титром бактериофагов (Гольдфарб Д.М. Бактериофагия. - М.: Медгиз, 1961. - С. 17-19).
Известным предложенным для различных бактериофагов способом получения фаголизатов с высоким титром бактериофагов является культивирование бактерий штамма-хозяина с бактериофагом на плотной питательной среде с последующим получением суспендированного фаголизата с поверхности плотной питательной среды (SU 64612, 30.04.1945; Кузьмин Н.А., Комаров Б.А. Способ быстрого получения сибиреязвенных фагов в высоких концентрациях // Лабораторное дело. - 1967. - №12. - С. 741-743).
Основными недостатками данных аналогов заявляемого изобретения являются недостаточная универсальность способа для получения продукции с использованием различных бактериофагов, недостаточная стабильность высокого титра бактериофагов в фаголизате.
Также известным аналогом является способ получения концентрированных препаратов фага, заключающийся в посеве на чашки с агаром смеси из концентрированной культуры бактерий и фага в количестве, достаточном для получения сплошного лизиса. После инкубации при 37°С в течение 12-18 часов в чашки наливают 3-5 мл бульона и оставляют на 20 минут. Затем бульон сливают и центрифугируют. Надосадочную жидкость отсасывают. Согласно прототипу приготовленный таком образом фаг может содержать 1011-1012 частичек на 1 мл (Гольдфарб Д.М. Бактериофагия. - М.: Медгиз, 1961. - С. 18).
Основными недостатками данных аналогов заявляемого изобретения являются недостаточная универсальность способа для получения продукции с использованием различных бактериофагов, недостаточная стабильность высокого титра бактериофагов в фаголизате.
Наиболее близким аналогом-прототипом является способ получения бактериофага, согласно которому бактериальную культуру штамма-хозяина в титре 108-109 КОЕ/мл засевают в сосуд для культивирования на скошенную плотную питательную среду с толщиной слоя от 10 мм до 25 мм, культивируют в течение 3-3,5 часов при оптимальной температуре для роста культуры штамма-хозяина, затем на полученный газон культуры штамма-хозяина засевают маточный бактериофаг в титре 105-106 БОЕ/мл, герметично закрывают сосуд для культивирования, культивируют в течение 13-15 часов при оптимальной температуре для роста культуры штамма бактериофага и толщине слоя воздуха над поверхностью плотной питательной среды от 25 мм до 40 мм, получают фаголизат при суспендировании бактериофага с поверхности плотной питательной среды физиологическим раствором или буферным раствором с рН 7,0-7,2 в количестве 0,04-0,045 мл на 1 см2 поверхности плотной питательной среды, отсасывают фаголизат в стерильную емкость, добавляют хлороформ, выдерживают в течение 30-45 минут при непрерывном шуттелировании, центрифугируют в течение 30-45 минут при 5000-6000 об./мин., стерилизуют надосадочную жидкость фильтрацией через фильтр с диаметром пор 0,2-0,22 мкм и пропускают полученный фильтрат через колонку, содержащую агент, аффинный к эндотоксину (RU 2525141, 10.08.2014). После центрифугирования можно смешивать надосадочные жидкости, содержащие бактериофаги, затем стерилизовать смесь надосадочных жидкостей фильтрацией через фильтр с диаметром пор 0,2-0,22 мкм и пропускать полученный фильтрат через колонку, содержащую агент, аффинный к эндотоксину. В качестве сосуда для культивирования можно использовать стеклянный микробиологический матрац.
Основным недостатком прототипа является зависимость стабильности достижения высокого титра бактериофага при получении фаголизата от соблюдения как постоянства рецептуры питательной среды, так и небольшого размаха варьирования значений показателей культивирования штамма-хозяина и бактериофага, а также отсутствие критериев, универсально обеспечивающих достижение высокого титра бактериофага с использованием плотной питательной среды и жидкой питательной среды, что затрудняет промышленное применение известного способа получения бактериофага.
Главной задачей заявляемого изобретения является обеспечение стабильности достижения высокого титра бактериофага (1012-1014 БОЕ/мл при культивировании на плотной питательной среде и 1010-1012 БОЕ/мл при культивировании на жидкой питательной среде) при получении фаголизата в условиях изменения рецептур и плотности питательных сред, при увеличении размаха варьирования значений показателей культивирования штамма-хозяина и бактериофага.
Задача решена тем, что через 30-120 мин после начала культивирования при оптимальной температуре для роста культуры быстро растущего штамма-хозяина каждые 30-60 мин. из культуры штамма-хозяина с поверхности плотной питательной среды или из жидкой среды культивирования делают мазки, окрашивают мазки раствором акридинового оранжевого в конечной концентрации от 0,001% до 0,02% или акридинового желтого в конечной концентрации от 0,01% до 0,2%, микроскопируют окрашенные мазки в флуоресцентном микроскопе, устанавливают момент времени для засева маточного бактериофага по достижению в окрашенном мазке не менее 50% по отношению к общему количеству клеток штамма-хозяина доли клеток, флуоресцирующих оттенками оранжевого или красного цвета при окрашивании акридиновым оранжевым или флуоресцирующих оттенками желтого или оранжевого цвета при окрашивании акридиновым желтым, при достижении не менее 10% по отношению к общему количеству клеток штамма-хозяина доли клеток с неравномерной флуоресценцией, а именно: парных, соприкасающихся полюсами клеток в форме палочек с неравномерной флуоресценцией цитоплазмы или клеток шаровидной и эллипсоидной формы со слабо флуоресцирующим центральным сечением, и затем засевают маточный бактериофаг.
Под термином «быстро растущий штамм-хозяин» авторы имеют в виду штаммы бактерий, колонии или сплошной рост которых можно обнаружить визуально через 6-48 часов культивирования на плотной питательной среде, используемой при культивировании бактериофагов.
В качестве способа окрашивания мазка акридиновыми красителями может быть использован любой из описанных в литературе вариантов (например, McCarthy L.R., Senne J.E. Evaluation of acridine orange stain for detection of microorganisms in blood cultures. // Journal of clinical microbiology. - 1980. - Vol. 11, №3. - P. 281-285; Mirrett S. Acridine orange stain. // Infection Control. - 1982. - Vol. 3, №3. - P. 250-252; Kepner R.L. Jr., Pratt J.R. Use of fluorochromes for direct enumeration of total bacteria in environmental samples: past and present // Microbiological reviews. - 1994. - Vol. 58, №4. - P. 603. - 615; Kronvall G., Myhre E. Differential staining of bacteria in clinical specimens using acridine orange buffered at low pH. // Acta Pathologica Microbiologica Scandinavica Section В Microbiology. - 1977. - Vol. 85B, №4. - P. 249-254; Afifi S.A., 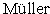 G. Fluoreszenz-Bakterioskopie, eine direkte Methode zur bakteriologischen Lebensmitteluntersuchung // Nahrung. - 1975. - Vol. 19, №17. - P. 557-567), обеспечивающих достаточную для реализации заявленного способа флуоресценцию бактериальных клеток.
G. Fluoreszenz-Bakterioskopie, eine direkte Methode zur bakteriologischen Lebensmitteluntersuchung // Nahrung. - 1975. - Vol. 19, №17. - P. 557-567), обеспечивающих достаточную для реализации заявленного способа флуоресценцию бактериальных клеток.
Флуоресцентное микроскопирование предпочтительнее проводить при увеличении не менее ×1000 с использованием светофильтра возбуждения, пропускающего свет в диапазонах длин волн, которые подходят для конкретного применяемого акридинового красителя согласно описанным в литературе вариантам (например, Mirrett S. Acridine orange stain. // Infection Control. - 1982. - Vol. 3, №3. - P. 250-252; Kepner R.L. Jr., Pratt J.R. Use of fluorochromes for direct enumeration of total bacteria in environmental samples: past and present // Microbiological reviews. - 1994. - Vol. 58, №4. - P. 603. - 615; Lunau M., Lemke A., Walther K., Martens-Habbena W., Simon M. An improved method for counting bacteria from sediments and turbid environments by epifluorescence microscopy. // Environmental microbiology. - 2005. - Vol. 7, №7. - P. 961-968; Kronvall G., Myhre E. Differential staining of bacteria in clinical specimens using acridine orange buffered at low pH. // Acta Pathologica Microbiologica Scandinavica Section В Microbiology. - 1977. - Vol. 85B, №4. - P. 249-254; Afifi S.A., 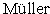 G. Fluoreszenz-Bakterioskopie, eine direkte Methode zur bakteriologischen Lebensmitteluntersuchung // Nahrung. - 1975. - Vol. 19, №17. - P. 557-567).
G. Fluoreszenz-Bakterioskopie, eine direkte Methode zur bakteriologischen Lebensmitteluntersuchung // Nahrung. - 1975. - Vol. 19, №17. - P. 557-567).
Под термином «момент времени для засева маточного бактериофага» авторы имеют в виду время, в течение которого засев маточного бактериофага обеспечивает достижение наиболее высокого титра бактериофага при получении фаголизата.
В результате впервые проведенных нами исследований было определено сочетание новых оригинальных отличительных признаков, обеспечивающее решение поставленной задачи (стабильности достижения высокого титра бактериофага (1012-1014 БОЕ/мл при культивировании на плотной питательной среде и 1010-1012 БОЕ/мл при культивировании на
жидкой питательной среде) при получении фаголизатов в условиях изменения рецептур и плотности питательных сред, при увеличении размаха варьирования значений показателей культивирования штамма-хозяина и бактериофага), - сочетание критериев установления момента времени для засева маточного бактериофага на основе флуоресцентной микроскопии окрашенных акридиновым оранжевым или акридиновым желтым мазков культуры штамма-хозяина с поверхности плотной питательной среды или из жидкой среды культивирования - достижение в окрашенном мазке не менее 50% по отношению к общему количеству клеток штамма-хозяина доли окрашенных акридиновым оранжевым клеток, флуоресцирующих оттенками оранжевого или красного цвета, или доли окрашенных акридиновым желтым клеток, флуоресцирующих оттенками желтого или оранжевого цвета, в сочетании с достижением не менее 10% по отношению к общему количеству клеток штамма-хозяина доли клеток с неравномерной флуоресценцией, а именно: парных, соприкасающихся полюсами клеток в форме палочек с неравномерной флуоресценцией цитоплазмы или клеток шаровидной и эллипсоидной формы со слабо флуоресцирующим центральным сечением. На основе использование данного нового сочетания отличительных признаков установлен увеличенный размах варьирования значений показателей культивирования штамма-хозяина и маточного бактериофага (в том числе титров засеваемой суспензии бактериальных клеток штамма-хозяина и засеваемого маточного бактериофага, толщины слоя плотной питательной среды, толщины слоя воздуха над поверхностью плотной питательной среды) с расширением перечня рецептур и плотности питательных сред, включающих ингредиенты различных производителей.
Из патентно-технической литературы и практики производства фагосодержащей продукции неизвестно о способе получения бактериофага, включающего культивирование бактериальных клеток штамма-хозяина, который был бы идентичен заявляемому.
Отсюда правомерен вывод о соответствии заявляемого решения критерию «новизна».
Указанная выше совокупность существенных признаков необходима и достаточна для получения технического результата - обеспечения стабильности достижения высокого титра бактериофага (1012-1014 БОЕ/мл при культивировании на плотной питательной среде и 1010-1012 БОЕ/мл при культивировании на жидкой питательной среде) при получении фаголизата в условиях изменения рецептур и плотности питательных сред, при увеличении размаха варьирования значений показателей культивирования штамма-хозяина и бактериофага.
Между существующими признаками и решаемой задачей существует причинно-следственная связь, где каждый признак необходим и влияет на получение технического результата, а вместе взятые признаки достаточны для его получения. Правомерен вывод о соответствии заявляемого технического решения критерию «изобретательский уровень».
Предлагаемый способ может быть реализован многократно с использованием присущих ему существенных признаков, а, значит, заявляемое техническое решение соответствует критерию «промышленная применимость».
Заявляемое изобретение апробировано при получении вариантов очищенного фаголизата, содержащего различные бактериофаги. Ниже приводятся результаты этой апробации. При этом приведенные примеры получения бактериофагов показывают конкретную реализацию заявляемого изобретения, но не ограничивают объем притязаний формулы заявляемого изобретения.
Пример 1. Для получения бактериофага, активного в отношении Salmonella enterica серовар Enteritidis, бактериальную культуру штамма-хозяина - Salmonella enterica серовар Enteritidis - в титре 108 КОЕ/мл засеяли в сосуд для культивирования на плотную питательную среду (ГМФ-агар) с толщиной слоя 3 мм.
Штамм-хозяин культивировали при отсутствии посторонней микрофлоры, при толщине слоя воздуха над поверхностью плотной питательной среды 5 мм при оптимальной температуре для его роста (+37°С). Через 30 минут после начала культивирования каждые 30 минут с поверхности плотной питательной среды делали мазки, которые окрашивали раствором акридинового оранжевого в конечной концентрации 0,001% и микроскопировали в флуоресцентном микроскопе. Установили момент времени для засева маточного бактериофага по достижению 63% по отношению к общему количеству клеток доли клеток, флуоресцирующих оттенками оранжевого или красного цвета, при достижении 10% по отношению к общему количеству клеток доли клеток в форме палочек с неравномерной флуоресценцией. На полученный газон культуры Salmonella enterica серовар Enteritidis засеяли маточный бактериофаг в титре 107 БОЕ/мл и культивировали в течение 13 часов при отсутствии посторонней микрофлоры, при толщине слоя воздуха над поверхностью плотной питательной среды 5 мм и при оптимальной температуре для роста культуры штамма бактериофага (+37°С).
Фаголизат получили при суспендировании бактериофага с поверхности плотной питательной среды физиологическим раствором в количестве 0,04 мл на 1 см2 поверхности плотной питательной среды.
Затем отсосали фаголизат в стерильную емкость и его очистили стерилизующей фильтрацией через фильтр с диаметром пор 0,2 мкм.
Полученный очищенный фаголизат в виде фильтрата содержал бактериофаги в титре 1012 БОЕ/мл при отсутствии бактерий и ингредиентов использованной питательной среды.
Пример 2. Для получения бактериофага, активного в отношении Escherichia coli О104:Н4, бактериальную культуру непатогенного штамма-хозяина - Escherichia coli К12 С600 - в титре 1010 КОЕ/мл засеяли в сосуд для культивирования на плотную питательную среду (мясо-пептонный агар) с толщиной слоя 10 мм.
Штамм-хозяин культивировали при отсутствии посторонней микрофлоры, при толщине слоя воздуха над поверхностью плотной питательной среды 15 мм при оптимальной температуре для его роста (+37°С). Через 60 минут после начала культивирования каждые 45 минут с поверхности плотной питательной среды делали мазки, которые окрашивали раствором акридинового оранжевого в конечной концентрации 0,005% и микроскопировали в флуоресцентном микроскопе. Установили момент времени для засева маточного бактериофага по достижению 70% по отношению к общему количеству клеток доли клеток, флуоресцирующих оттенками оранжевого или красного цвета, при достижении 15% по отношению к общему количеству клеток доли клеток в форме палочек с неравномерной флуоресценцией. На полученный газон культуры Escherichia coli К12 С600 засеяли маточный бактериофаг в титре 109 БОЕ/мл и культивировали в течение 14 часов при отсутствии посторонней микрофлоры, при толщине слоя воздуха над поверхностью плотной питательной среды 15 мм и при оптимальной температуре для роста культуры штамма бактериофага (+37°С).
Фаголизат получили при суспендировании бактериофага с поверхности плотной питательной среды буферным раствором с рН 7,0 в количестве 0,045 мл на 1 см2 поверхности плотной питательной среды.
Затем отсосали фаголизат в стерильную емкость и его очистили центрифугированием в течение 30 мин. при 6000 об./мин. и стерилизующей фильтрацией через фильтр с диаметром пор 0,22 мкм.
Полученный очищенный фаголизат в виде фильтрата содержал бактериофаги в титре 1013 БОЕ/мл при отсутствии бактерий и ингредиентов использованной питательной среды.
Пример 3. Для получения бактериофага, активного в отношении Staphylococcus aureus, бактериальную культуру штамма-хозяина - Staphylococcus aureus - в титре 1012 КОЕ/мл засеяли в стеклянный микробиологический матрац на плотную питательную среду (агар LB) с толщиной слоя 25 мм.
Штамм-хозяин культивировали при отсутствии посторонней микрофлоры, при толщине слоя воздуха над поверхностью плотной питательной среды 25 мм при оптимальной температуре для его роста (+37°С). Через 120 минут после начала культивирования каждые 60 минут с поверхности плотной питательной среды делали мазки, которые окрашивали раствором акридинового оранжевого в конечной концентрации 0,02% и микроскопировали в флуоресцентном микроскопе. Установили момент времени для засева маточного бактериофага по достижению 50% по отношению к общему количеству клеток доли клеток, флуоресцирующих оттенками оранжевого или красного цвета, при достижении 57% по отношению к общему количеству клеток шаровидной и эллипсоидной формы со слабо флуоресцирующим центральным сечением. На полученный газон культуры Staphylococcus aureus засеяли маточный бактериофаг в титре 1010 БОЕ/мл и культивировали в течение 15 часов при отсутствии посторонней микрофлоры, при толщине слоя воздуха над поверхностью плотной питательной среды 25 мм и при оптимальной температуре для роста культуры штамма бактериофага (+37°С).
Фаголизат получили при суспендировании бактериофага с поверхности плотной питательной среды буферным раствором с рН 7,2 в количестве 0,05 мл на 1 см2 поверхности плотной питательной среды.
Затем отсосали фаголизат в стерильную емкость и его очистили добавлением к нему хлороформа, выдерживанием в течение 15 мин. при непрерывном шуттелировании, центрифугированием в течение 60 мин. при 3000 об./мин. и стерилизующей фильтрацией через фильтр с диаметром пор 0,22 мкм.
Полученный очищенный фаголизат в виде фильтрата содержал бактериофаги в титре 1014 БОЕ/мл при отсутствии бактерий и ингредиентов использованной питательной среды.
Пример 4. Для получения бактериофага, активного в отношении Salmonella enterica серовар Typhimurium, бактериальную культуру штамма-хозяина - Salmonella enterica серовар Typhimurium - в титре 109 КОЕ/мл засеяли в сосуд для культивирования на плотную питательную среду (агар LB) с толщиной слоя 10 мм.
Штамм-хозяин культивировали при отсутствии посторонней микрофлоры, при толщине слоя воздуха над поверхностью плотной питательной среды 40 мм при оптимальной температуре для его роста (+37°С). Через 30 минут после начала культивирования каждые 45 минут с поверхности плотной питательной среды делали мазки, которые окрашивали раствором акридинового желтого в конечной концентрации 0,01% и микроскопировали в флуоресцентном микроскопе. Установили момент времени для засева маточного бактериофага по достижению 75% по отношению к общему количеству клеток доли клеток, флуоресцирующих оттенками желтого или оранжевого цвета, при достижении 25% по отношению к общему количеству клеток доли клеток в форме палочек с неравномерной флуоресценцией. На полученный газон культуры Salmonella enterica серовар Typhimurium засеяли маточный бактериофаг в титре 108 БОЕ/мл и культивировали в течение 14 часов при отсутствии посторонней микрофлоры, при толщине слоя воздуха над поверхностью плотной питательной среды 40 мм и при оптимальной температуре для роста культуры штамма бактериофага (+37°С).
Фаголизат получили при суспендировании бактериофага с поверхности плотной питательной среды буферным раствором с рН 7,4 в количестве 0,045 мл на 1 см2 поверхности плотной питательной среды.
Затем отсосали фаголизат в стерильную емкость и его очистили фильтрацией через фильтр с диаметром пор 0,8 мкм, стерилизующей фильтрацией через фильтр с диаметром пор 0,22 мкм и пропусканием полученного фильтрата через колонку, содержащую агент, аффинный к эндотоксину.
Полученный фаголизат в виде элюата содержал бактериофаги в титре 1012 БОЕ/мл при отсутствии бактерий, ингредиентов использованной питательной среды и при концентрации эндотоксина менее 50 ЕЭ/мл.
Пример 5. Для получения бактериофага, активного в отношении Pseudomonas aeruginosa, бактериальную культуру штамма-хозяина - Pseudomonas aeruginosa - в титре 1010 КОЕ/мл засеяли в сосуд для культивирования на плотную питательную среду (ГМФ-агар) с толщиной слоя 10 мм.
Штамм-хозяин культивировали при отсутствии посторонней микрофлоры, при толщине слоя воздуха над поверхностью плотной питательной среды 50 мм при оптимальной температуре для его роста (+37°С). Через 30 минут после начала культивирования каждые 30 минут с поверхности плотной питательной среды делали мазки, которые окрашивали раствором акридинового желтого в конечной концентрации 0,1% и микроскопировали в флуоресцентном микроскопе. Установили момент времени для засева маточного бактериофага по достижению 50% по отношению к общему количеству клеток доли клеток, флуоресцирующих оттенками желтого или оранжевого цвета, при достижении 14% по отношению к общему количеству клеток доли клеток в форме палочек с неравномерной флуоресценцией. На полученный газон культуры Pseudomonas aeruginosa засеяли маточный бактериофаг в титре 109 БОЕ/мл и культивировали в течение 15 часов при отсутствии посторонней микрофлоры, при толщине слоя воздуха над поверхностью плотной питательной среды 50 мм и при оптимальной температуре для роста культуры штамма бактериофага (+37°С).
Фаголизат получили при суспендировании бактериофага с поверхности плотной питательной среды буферным раствором с рН 7,3 в количестве 0,05 мл на 1 см2 поверхности плотной питательной среды.
Затем отсосали фаголизат в стерильную емкость и его очистили добавлением к нему хлороформа, выдерживанием в течение 45 мин. при непрерывном шуттелировании, центрифугированием в течение 45 мин. при 6000 об./мин., стерилизующей фильтрацией через фильтр с диаметром пор 0,45 мкм и пропусканием полученного фильтрата через колонку, содержащую агент, аффинный к эндотоксину.
Полученный фаголизат в виде элюата содержал бактериофаги в титре 1012 БОЕ/мл при отсутствии бактерий, ингредиентов использованной питательной среды и при концентрации эндотоксина менее 50 ЕЭ/мл.
Пример 6. Для получения бактериофага, активного в отношении Staphylococcus aureus, бактериальную культуру штамма-хозяина - Staphylococcus aureus - в титре 1012 КОЕ/мл засеяли в сосуд для культивирования на плотную питательную среду (ГРМ-агар) с толщиной слоя 15 мм.
Штамм-хозяин культивировали при отсутствии посторонней микрофлоры, при толщине слоя воздуха над поверхностью плотной питательной среды 35 мм при оптимальной температуре для его роста (+37°С). Через 60 минут после начала культивирования каждые 60 минут с поверхности плотной питательной среды делали мазки, которые окрашивали раствором акридинового желтого в конечной концентрации 0,02% и микроскопировали в флуоресцентном микроскопе. Установили момент времени для засева маточного бактериофага по достижению 80% по отношению к общему количеству клеток доли клеток, флуоресцирующих оттенками желтого или оранжевого цвета, при достижении 55% по отношению к общему количеству клеток шаровидной и эллипсоидной формы со слабо флуоресцирующим центральным сечением. На полученный газон культуры Staphylococcus aureus засеяли маточный бактериофаг в титре 109 БОЕ/мл и культивировали в течение 15 часов при отсутствии посторонней микрофлоры, при толщине слоя воздуха над поверхностью плотной питательной среды 35 мм и при оптимальной температуре для роста культуры штамма бактериофага (+37°С).
Фаголизат получили при суспендировании бактериофага с поверхности плотной питательной среды физиологическим раствором в количестве 0,045 мл на 1 см2 поверхности плотной питательной среды.
Затем отсосали фаголизат в стерильную емкость и его очистили центрифугированием в течение 40 мин. при 5000 об./мин.
Для получения бактериофага, активного в отношении Listeria monocytogenes, бактериальную культуру непатогенного штамма-хозяина - Listeria innocua - в титре 1011 КОЕ/мл засеяли в сосуд для культивирования на скошенную плотную питательную среду (мясо-пептонный агар с добавлением глюкозы) с толщиной слоя 17 мм.
Штамм-хозяин культивировали при отсутствии посторонней микрофлоры, при толщине слоя воздуха над поверхностью плотной питательной среды 30 мм при оптимальной температуре для его роста (+37°С). Через 60 минут после начала культивирования каждые 30 минут с поверхности плотной питательной среды делали мазки, которые окрашивали раствором акридинового оранжевого в конечной концентрации 0,001% и микроскопировали в флуоресцентном микроскопе. Установили момент времени для засева маточного бактериофага по достижению 65% по отношению к общему количеству клеток доли клеток, флуоресцирующих оттенками оранжевого или красного цвета, при достижении 12% по отношению к общему количеству клеток доли клеток в форме палочек с неравномерной флуоресценцией. На полученный газон культуры Listeria innocua засеяли маточный бактериофаг в титре 1010 БОЕ/мл и культивировали в течение 14 часов при отсутствии посторонней микрофлоры, при толщине слоя воздуха над поверхностью плотной питательной среды 30 мм и при оптимальной температуре для роста культуры штамма бактериофага (+24°С).
Фаголизат получили при суспендировании бактериофага с поверхности плотной питательной среды буферным раствором с рН 7,1 в количестве 0,045 мл на 1 см2 поверхности плотной питательной среды.
Затем отсосали фаголизат в стерильную емкость и его очистили добавлением к нему хлороформа, выдерживанием в течение 30 мин. при непрерывном шуттелировании, центрифугированием в течение 45 мин. при 4500 об./мин.
Смешивали надосадочные жидкости двух полученных фаголизатов.
Смесь надосадочных жидкостей очистили стерилизующей фильтрацией через фильтр с диаметром пор 0,22 мкм.
Полученная очищенная смесь (коктейль) фаголизатов в виде фильтрата содержала стафилококковый бактериофаг в титре 1013 БОЕ/мл и листериозный бактериофаг в титре 1012 БОЕ/мл при отсутствии бактерий и ингредиентов использованной питательной среды.
Пример 7. Для получения бактериофага, активного в отношении Salmonella enterica серовар Infantis, бактериальную культуру штамма-хозяина - Salmonella enterica серовар Infantis - в титре 5×108 КОЕ/мл засеяли в сосуд для культивирования в жидкую питательную среду (мясо-пептонный бульон).
Штамм-хозяин культивировали при отсутствии посторонней микрофлоры, при оптимальной температуре для его роста (+37°С). Через 45 минут после начала культивирования каждые 45 минут из жидкой среды культивирования делали мазки, которые окрашивали раствором акридинового оранжевого в конечной концентрации 0,01% и микроскопировали в флуоресцентном микроскопе. Установили момент времени для засева маточного бактериофага по достижению 58% по отношению к общему количеству клеток доли клеток, флуоресцирующих оттенками оранжевого или красного цвета, при достижении 10% по отношению к общему количеству клеток доли клеток в форме палочек с неравномерной флуоресценцией. В полученную культуральную жидкость Salmonella enterica серовар Infantis засеяли маточный бактериофаг в титре 109 БОЕ/мл и культивировали в течение 8 часов при отсутствии посторонней микрофлоры, и при оптимальной температуре для роста культуры штамма бактериофага (+37°С).
Затем полученный фаголизат очистили фильтрацией через фильтр с диаметром пор 0,8 мкм и стерилизующей фильтрацией через фильтр с диаметром пор 0,22 мкм.
Полученный очищенный фаголизат в виде фильтрата содержал бактериофаги в титре 1012 БОЕ/мл при отсутствии бактерий.
Пример 8. Для получения бактериофага, активного в отношении Escherichia coli O157:Н7, бактериальную культуру штамма-хозяина - Escherichia coli К12 С600 - в титре 1010 КОЕ/мл засеяли в сосуд для культивирования в жидкую питательную среду (бульон Мартена).
Штамм-хозяин культивировали при отсутствии посторонней микрофлоры, при оптимальной температуре для его роста (+37°С). Через 60 минут после начала культивирования каждые 60 минут из жидкой среды культивирования делали мазки, которые окрашивали раствором акридинового оранжевого в конечной концентрации 0,02% и микроскопировали в флуоресцентном микроскопе. Установили момент времени для засева маточного бактериофага по достижению 50% по отношению к общему количеству клеток доли клеток, флуоресцирующих оттенками оранжевого или красного цвета, при достижении 12% по отношению к общему количеству клеток доли клеток в форме палочек с неравномерной флуоресценцией. В полученную культуральную жидкость Escherichia coli К12 С600 засеяли маточный бактериофаг в титре 1010 БОЕ/мл и культивировали в течение 7 часов при отсутствии посторонней микрофлоры, при оптимальной температуре для роста культуры штамма бактериофага (+37°С).
Фаголизат получили при суспендировании бактериофага с поверхности плотной питательной среды физиологическим раствором в количестве 0,045 мл на 1 см2 поверхности плотной питательной среды.
Затем полученный фаголизат очистили добавлением к нему хлороформа, выдерживанием в течение 30 мин. при непрерывном шуттелировании, центрифугированием в течение 45 мин. при 4500 об./мин., стерилизующей фильтрацией через фильтр с диаметром пор 0,22 мкм и пропусканием полученного фильтрата через колонку, содержащую агент, аффинный к эндотоксину.
Полученный фаголизат в виде элюата содержал бактериофаги в титре 1012 БОЕ/мл при отсутствии бактерий и при концентрации эндотоксина менее 50 ЕЭ/мл.
Пример 9. Для получения бактериофага, активного в отношении Staphylococcus aureus, бактериальную культуру штамма-хозяина - Staphylococcus aureus - в титре 109 КОЕ/мл засеяли в сосуд для культивирования в жидкую питательную среду (мясо-пептонный бульон с добавлением глюкозы).
Штамм-хозяин культивировали при отсутствии посторонней микрофлоры, при оптимальной температуре для его роста (+37°С). Через
30 минут после начала культивирования каждые 30 минут из жидкой среды культивирования делали мазки, которые окрашивали раствором акридинового оранжевого в конечной концентрации 0,001% и микроскопировали в флуоресцентном микроскопе. Установили момент времени для засева маточного бактериофага по достижению 62% по отношению к общему количеству клеток доли клеток, флуоресцирующих оттенками оранжевого или красного цвета, при достижении 15% по отношению к общему количеству клеток шаровидной и эллипсоидной формы со слабо флуоресцирующим центральным сечением. В полученную культуральную жидкость Staphylococcus aureus засеяли маточный бактериофаг в титре 109 БОЕ/мл и культивировали в течение 6 часов при отсутствии посторонней микрофлоры, при оптимальной температуре для роста культуры штамма бактериофага (+37°С).
Затем полученный фаголизат очистили фильтрацией через фильтр с диаметром пор 0,45 мкм и стерилизующей фильтрацией через фильтр с диаметром пор 0,22 мкм.
Полученный очищенный фаголизат в виде фильтрата содержал бактериофаги в титре 1011 БОЕ/мл при отсутствии бактерий.
Пример 10. Для получения бактериофага, активного в отношении Klebsiella pneumoniae, бактериальную культуру штамма-хозяина - Klebsiella pneumoniae - в титре 1010 КОЕ/мл засеяли в сосуд для культивирования в жидкую питательную среду (ГМФ-бульон).
Штамм-хозяин культивировали при отсутствии посторонней микрофлоры, при оптимальной температуре для его роста (+37°С). Через 60 минут после начала культивирования каждые 45 минут из жидкой среды культивирования делали мазки, которые окрашивали раствором акридинового желтого в конечной концентрации 0,05% и микроскопировали в флуоресцентном микроскопе. Установили момент времени для засева маточного бактериофага по достижению 65% по отношению к общему количеству клеток доли клеток, флуоресцирующих оттенками желтого или оранжевого цвета, при достижении 20% по отношению к общему количеству клеток доли клеток в форме палочек с неравномерной флуоресценцией. В полученную культуральную жидкость Klebsiella pneumoniae засеяли маточный бактериофаг в титре 1010 БОЕ/мл и культивировали в течение 6 часов при отсутствии посторонней микрофлоры, и при оптимальной температуре для роста культуры штамма бактериофага (+37°С).
Затем полученный фаголизат очистили добавлением к нему хлороформа, выдерживанием в течение 30 мин. при непрерывном шуттелировании, центрифугированием в течение 60 мин. при 5000 об./мин., стерилизующей фильтрацией через фильтр с диаметром пор 0,22 мкм и пропусканием полученного фильтрата через колонку, содержащую агент, аффинный к эндотоксину.
Полученный фаголизат в виде элюата содержал бактериофаги в титре 1012 БОЕ/мл при отсутствии бактерий и при концентрации эндотоксина менее 50 ЕЭ/мл.
Пример 11. Для получения бактериофага, активного в отношении Enterococcus faecium, бактериальную культуру штамма-хозяина - Enterococcus faecium - в титре 108 КОЕ/мл засеяли в сосуд для культивирования в жидкую питательную среду (бульон LB).
Штамм-хозяин культивировали при отсутствии посторонней микрофлоры, при оптимальной температуре для его роста (+37°С). Через 30 минут после начала культивирования каждые 30 минут из жидкой среды культивирования делали мазки, которые окрашивали раствором акридинового желтого в конечной концентрации 0,01% и микроскопировали в флуоресцентном микроскопе. Установили момент времени для засева маточного бактериофага по достижению 55% по отношению к общему количеству клеток доли клеток, флуоресцирующих оттенками желтого или оранжевого цвета, при достижении 18% по отношению к общему количеству клеток шаровидной и эллипсоидной формы со слабо флуоресцирующим центральным сечением. В полученную культуральную жидкость Enterococcus faecium засеяли маточный бактериофаг в титре 108 БОЕ/мл и культивировали в течение 7 часов при отсутствии посторонней микрофлоры, при оптимальной температуре для роста культуры штамма бактериофага (+37°С).
Затем полученный фаголизат очистили центрифугированием в течение 30 мин. при 4000 об./мин., фильтрацией через фильтр с диаметром пор 0,45 мкм и стерилизующей фильтрацией через фильтр с диаметром пор 0,22 мкм.
Полученный очищенный фаголизат в виде фильтрата содержал бактериофаги в титре 1010 БОЕ/мл при отсутствии бактерий.
Пример 12. Для получения бактериофага, активного в отношении Streptococcus pneumoniae, бактериальную культуру штамма-хозяина - Streptococcus pneumoniae - в титре 109 КОЕ/мл засеяли в сосуд для культивирования в жидкую питательную среду (бульон Мартена с добавлением глюкозы).
Штамм-хозяин культивировали при отсутствии посторонней микрофлоры, при оптимальной температуре для его роста (+37°С). Через 45 минут после начала культивирования каждые 60 минут из жидкой среды культивирования делали мазки, которые окрашивали раствором акридинового желтого в конечной концентрации 0,2% и микроскопировали в флуоресцентном микроскопе. Установили момент времени для засева маточного бактериофага по достижению 59% по отношению к общему количеству клеток доли клеток, флуоресцирующих оттенками желтого или оранжевого цвета, при достижении 20% по отношению к общему количеству клеток шаровидной и эллипсоидной формы со слабо флуоресцирующим центральным сечением. В полученную культуральную жидкость Streptococcus pneumoniae засеяли маточный бактериофаг в титре 109 БОЕ/мл и культивировали в течение 6 часов при отсутствии посторонней микрофлоры, при оптимальной температуре для роста культуры штамма бактериофага (+37°С).
Затем полученный фаголизат очистили фильтрацией через фильтр с диаметром пор 0,8 мкм и стерилизующей фильтрацией через фильтр с диаметром пор 0,22 мкм.
Полученный очищенный фаголизат в виде фильтрата содержал бактериофаги в титре 1011 БОЕ/мл при отсутствии бактерий.
Способ получения бактериофага, включающий культивирование бактериальных клеток штамма-хозяина при отсутствии посторонней микрофлоры, получение фаголизата, а также очистку фаголизата осаждением и/или фильтрацией, отличающийся тем, что через 30-120 мин после начала культивирования при оптимальной температуре для роста культуры быстро растущего штамма-хозяина каждые 30-60 мин из культуры штамма-хозяина с поверхности плотной питательной среды или из жидкой среды культивирования делают мазки, окрашивают мазки раствором акридинового оранжевого в конечной концентрации от 0,001% до 0,02% или раствором акридинового желтого в конечной концентрации от 0,01% до 0,2%, микроскопируют окрашенный мазок в флуоресцентном микроскопе, устанавливают момент времени для засева маточного бактериофага по достижению в окрашенном мазке не менее 50% по отношению к общему количеству клеток штамма-хозяина доли окрашенных акридиновым оранжевым клеток, флуоресцирующих оттенками оранжевого или красного цвета, или доли окрашенных акридиновым желтым клеток, флуоресцирующих оттенками желтого или оранжевого цвета, при достижении не менее 10% по отношению к общему количеству клеток штамма-хозяина доли клеток с неравномерной флуоресценцией, а именно парных соприкасающихся полюсами клеток в форме палочек с неравномерной флуоресценцией цитоплазмы или клеток шаровидной и эллипсоидной формы со слабо флуоресцирующим центральным сечением, и затем засевают маточный бактериофаг.
