ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ
Вид РИД
Изобретение
РОДСТВЕННЫЕ ЗАЯВКИ
[001] Настоящая заявка испрашивает приоритет на основании предварительной заявки на патент США 61/320202, поданной 1 апреля 2010 года Мехди Паборджи (Mehdi Paborji) и озаглавленной «ФАРМАЦЕВТИЧЕСКИЕ СОСТАВЫ ДЛЯ ЛЕЧЕНИЯ ГИПЕРАКТИВНОСТИ МОЧЕВОГО ПУЗЫРЯ» ("PHARMACEUTICAL FORMULATIONS FOR THE TREATMENT OF OVERACTIVE BLADDER"), которая полностью включена в настоящую заявку посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[002] Настоящее изобретение относится к области фармацевтических составов и, в частности, составов, содержащих пилокарпин и цевимелин, составов, содержащих мускариновый антагонист, и составов, содержащих комбинацию пилокарпина или цевимелина и мускаринового антагониста.
УРОВЕНЬ ТЕХНИКИ
[003] Известно, что антагонисты мускариновых рецепторов, такие как тольтеродин, применяются для лечения гиперактивности мочевого пузыря. Тем не менее, неблагоприятным побочным эффектом такого лечения является сильная сухость во рту. Указанный побочный эффект причиняет пациенту существенный дискомфорт и значительно снижает точность соблюдения врачебных предписаний. Более ранние исследования показали, что комбинация тольтеродина или оксибутинина и пилокарпина, агониста мускариновых рецепторов, усиливающего слюноотделение, может существенно сократить число случаев сухости во рту, при этом не влияя на эффективность антагониста мускариновых рецепторов. См., например, патенты США 7666894, 7678821 и 7781472 и публикации заявок на патенты США 2009/0275629 и 2010/0152263, полностью включенные в настоящую заявку посредством ссылки.
[004] Как описано в вышеназванных публикациях, нельзя просто принимать мускариновый антагонист и пилокарпин или цевимелин и ожидать достижения желаемой клинической эффективности. Время приема мукаринового агониста должно быть должным образом рассчитано с учетом приема мускаринового антагониста так, чтобы максимальное увеличение слюноотделения вследствие приема мускаринового агониста достигалось в то же время, что и максимальная сухость во рту, наступающая в результате приема мускаринового антагониста. Прием двух таблеток в разное время, при котором интервал между двумя приемами должен четко соблюдаться, неудобен, затруднителен и провоцирует пациента не следовать инструкциям. Поэтому необходим единый фармацевтический состав, обеспечивающий сочетание желаемой временной задержки и схемы высвобождения.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[005] В настоящем изобретении предложены фармацевтические композиции, содержащие множество первых гранул, каждая из которых содержит ядро; первый слой, содержащий пилокарпин, цевимелин или их фармацевтически приемлемую соль; и второй слой, содержащий первый полимер. Также предложены фармацевтические композиции, содержащие множество вторых гранул, каждая из которых содержит: ядро и первый слой, содержащий мускариновый антагонист или его фармацевтически приемлемую соль. Также предложены фармацевтические составы, содержащие: а) множество первых гранул; b) множество вторых гранул; или с) множество первых гранул и множество вторых гранул.
ПОЛНОЕ ОПИСАНИЕ ВАРИАНТОВ РЕАЛИЗАЦИИ ИЗОБРЕТЕНИЯ
[006] Аспекты настоящего описания включают фармацевтические составы, содержащие мускариновый антагонист в составе с немедленным высвобождением. После приема пациентом мускариновый антагонист в указанных составах начинает высвобождаться в кишечнике для системного всасывания в кровоток. Другие аспекты настоящего изобретения включают фармацевтические составы, содержащие пилокарпин или цевимелин, оба из которых являются мускариновыми агонистами. Мускариновый агонист присутствует в фармацевтических составах в составе с отсроченным немедленным высвобождением. После приема мускариновый агонист не высвобождается некоторое время. Однако, когда мускариновый агонист начинает высвобождаться, высвобождение происходит немедленно.
[007] В некоторых вариантах реализации изобретения мускариновый антагонист, входящий в составы, описанные в настоящей заявке, представляет собой соединение, которое применяется для лечения гиперактивности мочевого пузыря. В определенных вариантах реализации мускариновый антагонист выбран из группы, состоящей из тольтеродина, 5-гидроксиметилтольтеродина, фезотеродина, оксибутинина, солифенацина, дарифенацина, троспия, имидафенацина, пропиверина и дицикломина.
[008] В контексте настоящего изобретения «немедленное высвобождение» или «высвобождается немедленно» означает, что по меньшей мере 70% принятого активного фармацевтического ингредиента в лекарственной форме высвобождается из фармацевтического состава в пределах примерно 30-60 минут после приема лекарственной формы. Под терминами «не высвобождается» или «отсроченное высвобождение» понимается, что менее 20% принятого активного фармацевтического ингредиента в лекарственной форме высвобождается из фармацевтического состава к тому моменту, когда задержка завершается и высвобождение становится немедленным.
[009] В настоящем описании термин «примерно» применительно к определенной величине означает, что предполагаемый диапазон значений составляет ±10% и предпочтительно диапазон значений составляет ±5%. Так, например, содержание примерно 70% активного фармацевтического ингредиента (АФИ) включает наличие АФИ в пределах от 63% до 87% и предпочтительно от 66,5% до 73,5%; или на другом примере, «примерно 45 минут» означает, что предполагаемое значение находится в пределах от 40,5 минуты до 49,5 минуты и предпочтительно от 42,75 минуты до 47,25 минуты.
[0010] В настоящей заявке предложены гранулы, или системы в форме множества частиц, содержащие мускариновый агонист, т.е. пилокарпин или цевимелин, и другие гранулы, содержащие мускариновый антагонист. В объем настоящего изобретения также включены фармацевтические композиции, содержащие только гранулы мускаринового агониста, только гранулы мускаринового антагониста, или композиции, содержащие как гранулы мускаринового агониста, так и гранулы мускаринового антагониста. Гранулы только мускаринового агониста или гранулы только мускаринового антагониста можно вводить отдельно или в комбинации с гранулами или другими фармацевтическими составами, содержащими другие активные ингредиенты.
ГРАНУЛЫ МУСКАРИНОВОГО АГОНИСТА
[0011] Таким образом, в одном аспекте в настоящем изобретении предложены фармацевтические композиции, содержащие множество первых гранул, каждая из которых содержит:
ядро;
первый слой, содержащий мускариновый агонист, т.е. пилокарпин или цевимелин, или их фармацевтически приемлемую соль; и второй слой, содержащий первый полимер.
[0012] В некоторых вариантах реализации ядро содержит полимер. В определенных вариантах реализации полимер ядра представляет собой целлюлозный полимер. В некоторых из указанных вариантов реализации целлюлозный полимер представляет собой микрокристаллическую целлюлозу. В других вариантах реализации ядро содержит сахар. В некоторых вариантах реализации сахар выбран из группы, состоящей из глюкозы, сахарозы, лактозы, маннитола, мальтодекстрина, ксилитола и сорбитола. В других вариантах реализации ядро содержит диоксид кремния.
[0013] В некоторых вариантах реализации ядро получено в промышленных условиях. Неограничивающими примерами коммерчески доступных гранул, которые могут использоваться в качестве ядра для гранул, описанных в настоящей заявке, являются сахарные сферы (например, сферы Paular), ядра Cellets®, такие как Cellets® 100, Cellets® 200, Cellets® 350, Cellets® 500, Cellets® 700 или Cellets® 1000 (производства Glatt Air Techniques Inc., Рамси, Нью-Джерси). В других вариантах реализации ядро получают de novo, например, путем приготовления полимерной смеси, экструдирования смеси и получения сфер экструдированной смеси с получением сферических или полусферических гранул. В некоторых вариантах реализации гранулы способны к набуханию, так что их попадание в водную среду приводит к их набуханию и быстрому и эффективному высвобождению активного ингредиента.
[0014] В некоторых вариантах реализации ядро составляет от примерно 10% до примерно 50% от общей массы готовой гранулы. В некоторых вариантах реализации ядро составляет от примерно 15% до примерно 40% от общей массы готовой гранулы. В некоторых вариантах реализации ядро составляет от примерно 20% до примерно 30% от общей массы готовой гранулы. В некоторых вариантах реализации ядро составляет примерно 20% от общей массы готовой гранулы. В некоторых вариантах реализации ядро составляет примерно 25% от общей массы готовой гранулы.
[0015] В некоторых вариантах реализации получают раствор мускаринового агониста, его свободного основания или его фармацевтически приемлемой соли, который далее наносят распылением на ядро и затем высушивают. Распыление и сушка приводят к образованию на грануле слоя (первого слоя) АФИ (т.е. пилокарпина или цевимелина). В некоторых вариантах реализации раствор содержит полимер, вызывающий более эффективное сцепление АФИ с ядром. Количество АФИ, присутствующее в лекарственной форме, можно регулировать, регулируя толщину первого слоя и/или регулируя концентрацию раствора, содержащего АФИ. Чем толще первый слой или чем более концентрирован раствор АФИ, тем больше АФИ присутствует в лекарственной форме. Как только первый слой попадает в водную среду, например в желудочный или кишечный сок, содержащийся в нем пилокарпин немедленно растворяется в водной среде. Способы нанесения первого слоя равномерно на ядро хорошо известны в данной области техники.
[0016] В некоторых вариантах реализации первый слой составляет от примерно 1% до примерно 50% от общей массы гранулы. В некоторых вариантах реализации первый слой составляет от примерно 2% до примерно 40% от общей массы гранулы. В некоторых вариантах реализации первый слой составляет от примерно 5% до примерно 30% от общей массы гранулы. В некоторых вариантах реализации первый слой составляет от примерно 7% до примерно 25% от общей массы гранулы. В некоторых вариантах реализации первый слой составляет от примерно 8% до примерно 15% от общей массы гранулы. В некоторых вариантах реализации первый слой составляет примерно 8% от общей массы гранулы. В некоторых вариантах реализации первый слой составляет примерно 10% от общей массы гранулы. В некоторых вариантах реализации первый слой составляет примерно 12% от общей массы гранулы. В некоторых вариантах реализации первый слой составляет примерно 15% от общей массы гранулы.
[0017] В некоторых вариантах реализации пилокарпин или цевимелин присутствуют в виде свободного основания. В других вариантах реализации пилокарпин или цевимелин присутствуют в виде фармацевтически приемлемой соли. Термин «фармацевтически приемлемая соль» относится к составу соединения, который не устраняет биологическую активность и полезные свойства указанного соединения. Фармацевтические соли могут быть получены путем проведения реакции соединения, предложенного в настоящем изобретении, с неорганическими кислотами, такими как соляная кислота, бромоводородная кислота, серная кислота, азотная кислота, фосфорная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота и т.п. Фармацевтические соли могут быть получены путем проведения реакции соединения, предложенного в настоящем изобретении, с неорганическими кислотами, такими как тартроновая кислота (tartric acid), оксолиновая кислота (oxolic acid), "углекислота" с образованием бикарбонатной или карбонатной соли соединения, уксусная кислота, муравьиная кислота, бензойная кислота и тому подобные. Фармацевтические соли могут быть также получены путем проведения реакции соединения, предложенного в настоящем изобретении, с основанием с образованием соли, такой как соль аммония, соль щелочного металла, такой как соль натрия или калия, соли щелочноземельного металла, такой как соль кальция или магния, соль органических оснований, таких как дициклогексиламин, N-метил-D-глюкамин, трис-(гидроксиметил)-метиламин, и с образованием солей с аминокислотами, такими как аргинин, лизин и тому подобное. В некоторых вариантах реализации пилокарпин представляет собой пилокарпин HCl или нитрат пилокарпина.
[0018] Когда АФИ (пилокарпин, цевимелин или их соль) нанесен на гранулу, гранулу покрывают вторым слоем. Второй слой задерживает воздействие водной среды на первый слой. Второй слой содержит по меньшей мере один полимер, первый полимер.
[0019] В некоторых вариантах реализации первый полимер представляет собой растворимый пленкообразующий полимер. Под «растворимым» понимается, что полимер растворим в водной среде, что означает, что по меньшей мере 50% указанного полимера оказывается растворенным спустя один час после попадания в водную среду. Известно, что некоторые полимеры диспергируются в водных растворах. Такая дисперсия отличается от растворения. Для того чтобы соединение или полимер были растворимы, необходима некоторая концентрация соединения или полимера в растворителе, характеризующаяся взаимодействиями «растворенное вещество - растворитель», что известно из наук химического цикла.
[0020] В некоторых вариантах реализации первый полимер представляет собой сахар или полисахарид. В некоторых из указанных вариантов реализации сахар или полисахарид выбран из группы, состоящей из целлюлозы, гидроксиэтилцеллюлозы, гидроксипропилцеллюлозы, гидроксипропилметилцеллюлозы, карбоксиметилцеллюлозы, мальтодекстрина, сахарозы, модифицированного крахмала, соли альгиновой кислоты, растворимых смол и каррагинана. В других вариантах реализации первый полимер представляет собой поливинилпирролидон (ПВП) или поливинилполипирролидон (ПВПП).
[0021] В некоторых вариантах реализации обеспечивающий растворимость полимер представляет собой смесь двух или более полимеров. В некоторых вариантах реализации смесь содержит гидроксипропилметилцеллюлозу (ГПМЦ) и гидроксипропилцеллюлозу (ГПЦ).
[0022] В некоторых вариантах реализации изобретения гидроксипропилметилцеллюлоза присутствует в количестве от примерно 1% до примерно 50% от общей массы гранулы. В некоторых вариантах реализации гидроксипропилметилцеллюлоза присутствует в количестве от примерно 2% до примерно 40% от общей массы гранулы. В некоторых вариантах реализации гидроксипропилметилцеллюлоза присутствует в количестве от примерно 5% до примерно 30% от общей массы гранулы. В некоторых вариантах реализации гидроксипропилметилцеллюлоза присутствует в количестве от примерно 7% до примерно 25% от общей массы гранулы. В некоторых вариантах реализации гидроксипропилметилцеллюлоза присутствует в количестве от примерно 8% до примерно 15% от общей массы гранулы. В некоторых вариантах реализации гидроксипропилметилцеллюлоза присутствует в количестве примерно 8% от общей массы гранулы. В некоторых вариантах реализации гидроксипропилметилцеллюлоза присутствует в количестве примерно 10% от общей массы гранулы. В некоторых вариантах реализации гидроксипропилметилцеллюлоза присутствует в количестве примерно 12% от общей массы гранулы. В некоторых вариантах реализации гидроксипропилметилцеллюлоза присутствует в количестве примерно 15% от общей массы гранулы.
[0023] В некоторых вариантах реализации изобретения гидроксипропилцеллюлоза присутствует в количестве от примерно 1% до примерно 90% от общей массы гранулы. В некоторых вариантах реализации гидроксипропилцеллюлоза присутствует в количестве от примерно 5% до примерно 40% от общей массы гранулы. В некоторых вариантах реализации гидроксипропилцеллюлоза присутствует в количестве от примерно 10% до примерно 30% от общей массы гранулы. В некоторых вариантах реализации гидроксипропилцеллюлоза присутствует в количестве от примерно 15% до примерно 25% от общей массы гранулы. В некоторых вариантах реализации гидроксипропилцеллюлоза присутствует в количестве от примерно 20% до примерно 25% от общей массы гранулы. В некоторых вариантах реализации гидроксипропилцеллюлоза присутствует в количестве примерно 21,50% от общей массы гранулы. В некоторых вариантах реализации гидроксипропилцеллюлоза присутствует в количестве примерно 22,25% от общей массы гранулы. В некоторых вариантах реализации гидроксипропилцеллюлоза присутствует в количестве примерно 22,75% от общей массы гранулы. В некоторых вариантах реализации гидроксипропилцеллюлоза присутствует в количестве примерно 24,50% от общей массы гранулы.
[0024] В некоторых вариантах реализации второй слой дополнительно содержит нерастворимый пленкообразующий полимер. Под «нерастворимым» понимается, что полимер нерастворим в водной среде, что означает, что не более чем примерно 10% полимера оказывается растворенным спустя час после попадания в водную среду. Присутствие нерастворимого пленкообразующего полимера во втором слое вызывает более длительную задержку контакта первого слоя с водной средой. Указанный нерастворимый пленкообразующий полимер и растворимый пленкообразующий полимер образуют матрицу, в которой при попадании в водную среду растворимый полимер растворяется, оставляя поры в сетке нерастворимого полимера, через которые АФИ в первом слое вымывается в водную среду.
[0025] В некоторых вариантах реализации нерастворимый пленкообразующий полимер представляет собой полисахарид. В некоторых из указанных вариантов реализации полисахарид выбран из группы, состоящей из этилцеллюлозы, ацетатфталата целлюлозы, фталата гидроксипропилметилцеллюлозы и нерастворимых камедей. В других вариантах реализации нерастворимый пленкообразующий полимер выбран из группы, состоящей из полиметакрилата, поливинилового спирта, шеллака и поливинилацетатфталата.
[0026] В некоторых вариантах реализации этилцеллюлоза присутствует в количестве от примерно 1% до примерно 90% от общей массы гранулы. В некоторых вариантах реализации этилцеллюлоза присутствует в количестве от примерно 5% до примерно 40% от общей массы гранулы. В некоторых вариантах реализации этилцеллюлоза присутствует в количестве от примерно 10% до примерно 30% от общей массы гранулы. В некоторых вариантах реализации этилцеллюлоза присутствует в количестве от примерно 15% до примерно 25% от общей массы гранулы. В некоторых вариантах реализации этилцеллюлоза присутствует в количестве от примерно 20% до примерно 25% от общей массы гранулы. В некоторых вариантах реализации этилцеллюлоза присутствует в количестве примерно 21,50% от общей массы гранулы. В некоторых вариантах реализации этилцеллюлоза присутствует в количестве примерно 22,25% от общей массы гранулы. В некоторых вариантах реализации этилцеллюлоза присутствует в количестве примерно 22,75% от общей массы гранулы. В некоторых вариантах реализации этилцеллюлоза присутствует в количестве примерно 24,50% от общей массы гранулы.
[0027] В некоторых вариантах реализации второй слой содержит гидроксипропилцеллюлозу и этилцеллюлозу. В некоторых вариантах реализации соотношение гидроксипропилцеллюлозы и этилцеллюлозы составляет от примерно 5:1 до примерно 1:5 по массе. В некоторых вариантах реализации соотношение гидроксипропилцеллюлозы и этилцеллюлозы составляет от примерно 4:1 до примерно 1:4 по массе. В некоторых вариантах реализации соотношение гидроксипропилцеллюлозы и этилцеллюлозы составляет от примерно 3:1 до примерно 1:3 по массе. В некоторых вариантах реализации соотношение гидроксипропилцеллюлозы и этилцеллюлозы составляет от примерно 2:1 до примерно 1:2 по массе. В некоторых вариантах реализации соотношение гидроксипропилцеллюлозы и этилцеллюлозы составляет примерно 1:1 по массе.
[0028] В некоторых вариантах реализации первая гранула дополнительно содержит вещество для снижения клейкости или вещество, способствующее скольжению. В некоторых вариантах реализации указанное вещество для снижения клейкости или вещество, способствующее скольжению, представляют собой инертный минерал. Инертный минерал представляет собой минерал, т.е. неорганическое соединение или соль, который фармацевтически приемлем и не препятствует фармакологическому действию терапевтического соединения. В некоторых вариантах реализации инертный минерал представляет собой минерал магния. В других вариантах реализации минерал магния представляет собой силикат магния. В некоторых вариантах реализации указанное вещество для снижения клейкости или вещество, способствующее скольжению, выбраны из группы, состоящей из талька, моноглицерида, диглицерида, глицерилмоностеарата, стеарата кальция и стеарата магния.
[0029] В некоторых вариантах реализации вещество для снижения клейкости или вещество, способствующее скольжению, присутствуют в количестве от примерно 1% до примерно 50% от общей массы гранулы. В некоторых вариантах реализации вещество для снижения клейкости или вещество, способствующее скольжению, присутствуют в количестве от примерно 2% до примерно 40% от общей массы гранулы. В некоторых вариантах реализации вещество для снижения клейкости или вещество, способствующее скольжению, присутствуют в количестве от примерно 3% до примерно 20% от общей массы гранулы. В некоторых вариантах реализации вещество для снижения клейкости или вещество, способствующее скольжению, присутствуют в количестве от примерно 4% до примерно 10% от общей массы гранулы. В некоторых вариантах реализации вещество для снижения клейкости или вещество, способствующее скольжению, присутствуют в количестве примерно 4% от общей массы гранулы. В некоторых вариантах реализации вещество для снижения клейкости или вещество, способствующее скольжению, присутствуют в количестве примерно 4,5% от общей массы гранулы. В некоторых вариантах реализации вещество для снижения клейкости или вещество, способствующее скольжению, присутствуют в количестве примерно 5% от общей массы гранулы. В некоторых вариантах реализации вещество для снижения клейкости или вещество, способствующее скольжению, присутствуют в количестве примерно 5,5% от общей массы гранулы. В некоторых вариантах реализации вещество для снижения клейкости или вещество, способствующее скольжению, присутствуют в количестве примерно 6% от общей массы гранулы. В некоторых вариантах реализации вещество для снижения клейкости или вещество, способствующее скольжению, присутствуют в количестве примерно 6,5% от общей массы гранулы.
[0030] В некоторых вариантах реализации первый полимер представляет собой или содержит липидный наполнитель. Липидный наполнитель может быть выбран из группы, состоящей из глицерилбегената, глицериновых эфиров жирных кислот, глицерилдибегената, бегеноил-макроголглицеридов, глицерилдистеарата, глицеролдистеарата, глицерилпальмитостеарата, лауроил-макроголглицеридов, стеароил-макроголглицеридов, продуктов абитека, глицерилмоноолеата, моно- и диглицеридов со средней длиной цепи, глицерилмонокаприлата, глицерилтрикаприлата/капрата/стеарата, гидрогенизированного растительного масла, гидрогенизированного хлопкового масла, гидрогенизированного соевого масла, гидрогенизированного соевого масла и касторового воска, полиоксиэтилена 8 каприловых/каприновых глицеридов, полиоксиэтилена 6 каприловых/каприновых глицеридов, полиоксиэтилена 32 лауриновых глицеридов, полиоксиэтилена 6 эфиров пропиленгликоля, полиоксиэтилена 7 глицеридов кокосового масла, полиоксиэтилена 30 глицеридов кокосового масла, полиоксиэтилена 80 глицеридов кокосового масла, полиоксипропилена 15 стерилового эфира, полиоксиэтилена 26 глицерилового эфира, полиоксиэтилена 35 соевых глицеридов, полиоксиэтилена 20 сорбитола, полиоксипропилена 3 миристилового эфира, полиоксипропилена 10 цетостеарилового эфира, пальмового кернеламида диэтаноламида, триглицерол моноолеата, продуктов сазола, гидрогенизированных кокоглицеридов, цетилпальмитата, тримиристина, трипальмитина, тристеарина, гидрогенизированного пальмового масла, глицерилмоностеарата, глицерилстеарата, цетеарилового спирта, цетилового спирта, капринового триглицерида, ацетилированных глицеридов, глицерилкокоата и полиэтиленгликоля.
[0031] В некоторых вариантах реализации первая гранула дополнительно содержит пластификатор. В некоторых вариантах реализации пластификатор выбран из группы, состоящей из пластификатора на основе фталата, тримеллитата, пластификатора на основе адипината, пластификатора на основе себацината, органофосфата, малеата, сульфонамида, гликолей или полиэфиров, ацетилированного моноглицерида и алкилцитрата.
[0032] В некоторых вариантах реализации пластификатор на основе фталата выбран из группы, состоящей из бис(2-этилгексил)фталата (ДЭГФ), диизононилфталата (ДИНФ), бис(н-бутил)фталата (ДнБФ, ДБФ), бутилбензилфталата (ББзФ), диизодецилфталата (ДИДФ), ди-н-октилфталата (ДОФ или ДнОФ), диизооктилфталата (ДИОФ), диэтилфталата (ДЭФ), диизобутилфталата (ДИБФ) и ди-н-гексилфталата. В некоторых вариантах реализации тримеллитат выбран из группы, состоящей из триметил тримеллитата (ТМТМ), три-(2-этилгексил)тримеллитата (ТЭГТМ-МГ) три-(н-октил, н-децил)тримеллитата (ATM), три-(гептил, нонил)тримеллитата (ЛТМ) и н-октил тримеллитата (ОТМ). В некоторых вариантах реализации пластификатор на основе адипата выбран из группы, состоящей из бис(2-этилгексил)адипата (ДЭГА), диметиладипата (ДМА), монометиладипата (ММА) и диоктиладипата (ДОА). В некоторых вариантах реализации пластификатор на основе себацината представляет собой дибутилсебацинат (ДБС). В некоторых вариантах реализации малеат представляет собой дибутилмалеат (ДБМ) или диизобутилмалеат (ДИБМ). В некоторых вариантах реализации сульфонамид выбран из группы, состоящей из орто- или пара- N-этилтолуолсульфонамида (ЭТСА), N-(2-гидроксипирол)-бензолсульфонамида (ГП БСА) и N-(н-бутил)-бензолсульфонамида (ББСА-N-ББС). В некоторых вариантах реализации органофосфат представляет собой трикрезилфосфат (ТКФ) или трибутилфосфат (ТБФ). В некоторых вариантах реализации гликоль или полиэфир выбраны из группы, состоящей из триэтиленгликоля дигексаноата (3Г6, 3ГГ), тетраэтиленкликоля дигептаноата (4Г7) и полиэтиленгликоля. В некоторых вариантах реализации алкилцитрат выбран из группы, состоящей из триэтилцитрата (ТЭЦ), ацетилтриэтилцитрата (АТЭЦ), трибутилцитрата (ТБЦ), ацетилтрибутилцитрата (АТБЦ), триоктилцитрата (ТОЦ), ацетилтриоктилцитрата (АТОЦ), тригексилцитрата (ТГЦ), ацетилтригексилцитрата (АТГЦ), бутирилтригексилцитрата (БТГЦ, тригексил о-бутирилцитрата) и триметилцитрата (ТМЦ). В некоторых вариантах реализации пластификатор выбран из группы, состоящей из дибутилсебацината, полиэтиленгликоля, глицерина, триацетина, диэтилфталата, пропиленгликоля, триэтилцитрата, минерального масла, ацетилированного моноглицерида и олеиновой кислоты.
[0033] В некоторых вариантах реализации пластификатор присутствует в количестве от примерно 1% до примерно 50% от общей массы гранулы. В некоторых вариантах реализации пластификатор присутствует в количестве от примерно 2% до примерно 40% от общей массы гранулы. В некоторых вариантах реализации пластификатор присутствует в количестве от примерно 3% до примерно 20% от общей массы гранулы. В некоторых вариантах реализации пластификатор присутствует в количестве от примерно 4% до примерно 10% от общей массы гранулы. В некоторых вариантах реализации пластификатор присутствует в количестве примерно 4% от общей массы гранулы. В некоторых вариантах реализации пластификатор присутствует в количестве примерно 4,5% от общей массы гранулы. В некоторых вариантах реализации пластификатор присутствует в количестве примерно 5% от общей массы гранулы. В некоторых вариантах реализации пластификатор присутствует в количестве примерно 5,5% от общей массы гранулы. В некоторых вариантах реализации пластификатор присутствует в количестве примерно 6% от общей массы гранулы. В некоторых вариантах реализации пластификатор присутствует в количестве примерно 6,5% от общей массы гранулы.
[0034] В некоторых вариантах реализации масса второго слоя составляет от примерно 50% до примерно 300% массы гранулы до нанесения второго слоя. В некоторых вариантах реализации масса второго слоя составляет от примерно 75% до примерно 250% массы гранулы до нанесения второго слоя. В некоторых вариантах реализации масса второго слоя составляет примерно 75% массы гранулы до нанесения второго слоя. В некоторых вариантах реализации масса второго слоя составляет примерно 100% массы гранулы до нанесения второго слоя. В некоторых вариантах реализации масса второго слоя составляет примерно 125% массы гранулы до нанесения второго слоя. В некоторых вариантах реализации масса второго слоя составляет примерно 150% массы гранулы до нанесения второго слоя. В некоторых вариантах реализации масса второго слоя составляет примерно 175% массы гранулы до нанесения второго слоя. В некоторых вариантах реализации масса второго слоя составляет примерно 200% массы гранулы до нанесения второго слоя. В некоторых вариантах реализации масса второго слоя составляет примерно 225% массы гранулы до нанесения второго слоя. В некоторых вариантах реализации масса второго слоя составляет примерно 250% массы гранулы до нанесения второго слоя.
ГРАНУЛЫ МУСКАРИНОВОГО АНТАГОНИСТА
[0035] В другом аспекте в настоящем изобретении предложены фармацевтические композиции, содержащие множество вторых гранул, каждая из которых содержит:
ядро; и
первый слой, содержащий мускариновый антагонист или его фармацевтически приемлемую соль.
[0036] В некоторых вариантах реализации мускариновый антагонист представляет собой свободное основание. В других вариантах реализации мускариновый антагонист представляет собой фармацевтически приемлемую соль. Определение фармацевтически приемлемых солей приведено выше. В некоторых вариантах реализации мускариновый антагонист выбран из группы, состоящей из тольтеродина, 5-гидроксиметил-тольтеродина, фезотеродина, оксибутинина, солифенацина, дарифенацина, троспия, имидафенацина, пропиверина и дицикломина. В некоторых вариантах реализации тольтеродин представляет собой тартрат тольтеродина. В других вариантах реализации оксибутинин представляет собой хлорид оксибутинина.
[0037] В некоторых вариантах реализации ядро множества вторых гранул состоит из того же материала, что и ядро множества первых гранул, описанных выше.
[0038] В некоторых вариантах реализации ядро составляет от примерно 10% до примерно 90% от общей массы готовой гранулы. В некоторых вариантах реализации ядро составляет от примерно 25% до примерно 85% от общей массы готовой гранулы. В некоторых вариантах реализации ядро составляет от примерно 40% до примерно 80% от общей массы готовой гранулы. В некоторых вариантах реализации ядро составляет примерно 80% от общей массы готовой гранулы. В некоторых вариантах реализации ядро составляет примерно 75% от общей массы готовой гранулы. В некоторых вариантах реализации ядро составляет примерно 85% от общей массы готовой гранулы.
[0039] В некоторых вариантах реализации получают раствор АФИ (т.е. мускаринового антагониста) или его фармацевтически приемлемой соли, затем наносят его распылением на ядро и затем высушивают. Распыление и сушка приводят к образованию на грануле слоя (первого слоя) АФИ. В некоторых вариантах реализации раствор содержит полимер, вызывающий более эффективное сцепление АФИ с ядром. Количество АФИ, присутствующее в лекарственной форме, можно регулировать, регулируя толщину первого слоя. Чем толще первый слой, тем больше АФИ присутствует в лекарственной форме. Как только первый слой попадает в водную среду, например в желудочный или кишечный сок, содержащийся в нем тольтеродин немедленно растворяется в водной среде. Способы равномерного нанесения первого слоя на ядро хорошо известны в данной области техники.
[0040] В некоторых вариантах реализации первый слой составляет от примерно 1% до примерно 50% от общей массы гранулы. В некоторых вариантах реализации первый слой составляет от примерно 2% до примерно 40% от общей массы гранулы. В некоторых вариантах реализации первый слой составляет от примерно 4% до примерно 25% от общей массы гранулы. В некоторых вариантах реализации первый слой составляет от примерно 5% до примерно 15% от общей массы гранулы. В некоторых вариантах реализации первый слой составляет от примерно 5,5% до примерно 10% от общей массы гранулы. В некоторых вариантах реализации первый слой составляет примерно 6% от общей массы гранулы. В некоторых вариантах реализации первый слой составляет примерно 6,5% от общей массы гранулы. В некоторых вариантах реализации первый слой составляет примерно 7% от общей массы гранулы. В некоторых вариантах реализации первый слой составляет примерно 8% от общей массы гранулы.
[0041] В некоторых вариантах реализации первый слой содержит растворимый пленкообразующий полимер, как определено выше.
[0042] В некоторых вариантах реализации гидроксипропилметилцеллюлоза присутствует в количестве от примерно 1% до примерно 50% от общей массы гранулы. В некоторых вариантах реализации гидроксипропилметилцеллюлоза присутствует в количестве от примерно 2% до примерно 40% от общей массы гранулы. В некоторых вариантах реализации гидроксипропилметилцеллюлоза присутствует в количестве от примерно 5% до примерно 30% от общей массы гранулы. В некоторых вариантах реализации гидроксипропилметилцеллюлоза присутствует в количестве от примерно 7% до примерно 25% от общей массы гранулы. В некоторых вариантах реализации гидроксипропилметилцеллюлоза присутствует в количестве от примерно 8% до примерно 15% от общей массы гранулы. В некоторых вариантах реализации гидроксипропилметилцеллюлоза присутствует в количестве примерно 8% от общей массы гранулы. В некоторых вариантах реализации гидроксипропилметилцеллюлоза присутствует в количестве примерно 10% от общей массы гранулы. В некоторых вариантах реализации гидроксипропилметилцеллюлоза присутствует в количестве примерно 12% от общей массы гранулы. В некоторых вариантах реализации гидроксипропилметилцеллюлоза присутствует в количестве примерно 15% от общей массы гранулы.
[0043] В некоторых вариантах реализации вторая гранула дополнительно содержит вещество для снижения клейкости или вещество, способствующее скольжению, как определено выше. В некоторых вариантах реализации вещество для снижения клейкости или вещество, способствующее скольжению, присутствуют в количестве от примерно 1% до примерно 50% от общей массы гранулы. В некоторых вариантах реализации вещество для снижения клейкости или вещество, способствующее скольжению, присутствуют в количестве от примерно 2% до примерно 40% от общей массы гранулы. В некоторых вариантах реализации вещество для снижения клейкости или вещество, способствующее скольжению, присутствуют в количестве от примерно 3% до примерно 20% от общей массы гранулы. В некоторых вариантах реализации вещество для снижения клейкости или вещество, способствующее скольжению, присутствуют в количестве от примерно 4% до примерно 10% от общей массы гранулы. В некоторых вариантах реализации вещество для снижения клейкости или вещество, способствующее скольжению, присутствуют в количестве примерно 3% от общей массы гранулы. В некоторых вариантах реализации вещество для снижения клейкости или вещество, способствующее скольжению, присутствуют в количестве примерно 3,5% от общей массы гранулы. В некоторых вариантах реализации вещество для снижения клейкости или вещество, способствующее скольжению, присутствуют в количестве примерно 4% от общей массы гранулы. В некоторых вариантах реализации вещество для снижения клейкости или вещество, способствующее скольжению, присутствуют в количестве примерно 4,5% от общей массы гранулы. В некоторых вариантах реализации вещество для снижения клейкости или вещество, способствующее скольжению, присутствуют в количестве примерно 5% от общей массы гранулы. В некоторых вариантах реализации вещество для снижения клейкости или вещество, способствующее скольжению, присутствуют в количестве примерно 5,5% от общей массы гранулы.
[0044] В некоторых вариантах реализации первый слой дополнительно содержит липидный наполнитель. Липидный наполнитель может быть выбран из группы, состоящей из глицерилбегената, глицериновых эфиров жирных кислот, глицерилдибегената, бегеноил-макроголглицеридов, глицерилдистеарата, глицеролдистеарата, глицерилпальмитостеарата, лауроил-макроголглицеридов, стеароил-макроголглицеридов, продуктов абитека, глицерилмоноолеата, моно- и диглицеридов со средней длиной цепи, глицерилмонокаприлата, глицерилтрикаприлата/капрата/стеарата, гидрогенизированного растительного масла, гидрогенизированного хлопкового масла, гидрогенизированного соевого масла, гидрогенизированного соевого масла и касторового воска, полиоксиэтилена 8 каприловых/каприновых глицеридов, полиоксиэтилена 6 каприловых/каприновых глицеридов, полиоксиэтилена 32 лауриновых глицеридов, полиоксиэтилена 6 эфиров пропиленгликоля, полиоксиэтилена 7 глицеридов кокосового масла, полиоксиэтилена 30 глицеридов кокосового масла, полиоксиэтилена 80 глицеридов кокосового масла, полиоксипропилена 15 стеарилового эфира, полиоксиэтилена 26 глицерилового эфира, полиоксиэтилена 35 соевых глицеридов, полиоксиэтилена 20 сорбитола, полиоксипропилена 3 миристилового эфира, полиоксипропилена 10 цетостеарилового эфира, пальмового кернеламида диэтаноламида, триглицерола моноолеата, продуктов сазола, гидрогенизированных кокоглицеридов, цетилпальмитата, тримиристина, трипальмитина, тристеарина, гидрогенизированного пальмового масла, глицерилмоностеарата, глицерилстеарата, цетеарилового спирта, цетилового спирта, капринового триглицерида, ацетилированных глицеридов, глицерилкокоата и полиэтиленгликоля.
[0045] В некоторых вариантах реализации вторая гранула дополнительно содержит пластификатор, как определено выше. В некоторых вариантах реализации пластификатор представляет собой полиэтиленгликоль. В определенных вариантах реализации полиэтиленгликоль представляет собой ПЭГ 400.
[0046] В некоторых вариантах реализации пластификатор присутствует в количестве от примерно 0,1% до примерно 50% от общей массы гранулы. В некоторых вариантах реализации пластификатор присутствует в количестве от примерно 0,1% до примерно 40% от общей массы гранулы. В некоторых вариантах реализации пластификатор присутствует в количестве от примерно 0,1% до примерно 5% от общей массы гранулы. В некоторых вариантах реализации пластификатор присутствует в количестве от примерно 0,2% до примерно 2% от общей массы гранулы. В некоторых вариантах реализации пластификатор присутствует в количестве примерно 0,1% от общей массы гранулы. В некоторых вариантах реализации пластификатор присутствует в количестве примерно 0,15% от общей массы гранулы. В некоторых вариантах реализации пластификатор присутствует в количестве примерно 0,2% от общей массы гранулы. В некоторых вариантах реализации пластификатор присутствует в количестве примерно 0,25% от общей массы гранулы. В некоторых вариантах реализации пластификатор присутствует в количестве примерно 0,3% от общей массы гранулы. В некоторых вариантах реализации пластификатор присутствует в количестве примерно 0,35% от общей массы гранулы. В некоторых вариантах реализации пластификатор присутствует в количестве примерно 0,4% от общей массы гранулы.
[0047] В некоторых вариантах реализации вторые гранулы дополнительно содержат второй слой. В некоторых вариантах реализации второй слой содержит ингредиенты, сходные с первым слоем, описанным выше, за исключением того, что во втором слое нет какого-либо АФИ. В некоторых вариантах реализации первый слой и второй слой характеризуются идентичным набором ингредиентов, в то время как в других вариантах реализации первый и второй слои характеризуются разными комбинациями ингредиентов.
ФАРМАЦЕВТИЧЕСКИЕ СОСТАВЫ
[0048] В другом аспекте в настоящем изобретении предложены фармацевтические составы, содержащие одну из следующих комбинаций описанных выше гранул: а) множество первых гранул; b) множество вторых гранул; или с) множество первых гранул и множество вторых гранул.
[0049] Предложенные фармацевтические составы содержат достаточное число гранул, чтобы обеспечить единичную вводимую дозу субъекту. В некоторых вариантах реализации единичная вводимая доза для мускаринового агониста находится в пределах 0,5-50 мг. В некоторых вариантах реализации единичная вводимая доза пилокарпина выбрана из группы, состоящей из 3 мг, 4 мг, 5 мг, 6 мг, 10 мг, 11 мг и 12 мг. В других вариантах реализации единичная вводимая доза цевимелина выбрана из группы, состоящей из 5 мг, 10 мг, 15 мг, 20 мг, 25 мг, 30 мг, 40 мг, 50 мг и 60 мг. В определенных вариантах реализации единичная вводимая доза для мускаринового агониста находится в пределах 0,1-100 мг. В определенных вариантах реализации единичная вводимая доза выбрана из группы, состоящей из 0,1 мг, 0,2 мг, 0,4 мг, 0,5 мг, 1 мг, 2 мг, 3 мг, 4 мг, 5 мг, 6 мг, 7 мг, 7,5 мг, 8 мг, 10 мг, 12 мг, 15 мг, 30 мг и 60 мг.
[0050] В некоторых вариантах реализации фармацевтические составы представлены в форме капсул. Капсулы могут включать твердые капсулы, например, изготовленные из гидроксипропилметилцеллюлозы, твердые капсулы с кольцом, а также мягкие герметичные капсулы, изготовленные из желатина и пластификатора, такого как глицерол или сорбитол.
[0051] В некоторых вариантах реализации фармацевтические составы представлены в форме трубочек для втягивания дозы. В некоторых вариантах реализации фармацевтические составы представлены в форме трубочек. В некоторых вариантах реализации гранулы помещены в трубочку, и пациент затем пьет жидкость через трубочку, и путем питья жидкость, втягиваемая через трубочку, переносит гранулы в рот вместе с жидкостью.
[0052] В некоторых вариантах реализации фармацевтические составы представлены в форме сухих саше. В некоторых вариантах реализации гранулами из сухого саше посыпают пищу или смешивают их с питьем и принимают перорально. Для того чтобы доза была эффективной, описанные гранулы насыпаны в пакет-саше вместе с дополнительными вспомогательными веществами, необходимыми для получения легко диспергируемой суспензии.
Когда пакет открывают и содержимое выливают в пищу или питье, гранулы и вспомогательные вещества смешиваются с пищей или питьем и образуют удобную для приема дисперсию, которую принимает пациент. Наполнители вещества, такие как стимуляторы слюноотделения и вещества, способствующие скольжению, добавляют для того, чтобы содержимое было легко проглотить и требовалось как можно меньше жевать, чтобы не повредить оболочки во рту.
[0053] В некоторых вариантах реализации фармацевтические составы представлены в форме готовых к применению саше. В некоторых вариантах реализации гранулы предварительно смешаны с готовой к употреблению питательной субстанцией с высокой вязкостью (например, йогуртом или энергетическим гелем), и все содержимое пакета принимают перорально. Вспомогательные вещества, такие как стимуляторы слюноотделения и вещества, способствующие скольжению, добавлены для того, чтобы содержимое было легко проглотить и требовалось как можно меньше жевать, чтобы не повредить оболочки во рту.
[0054] В некоторых вариантах реализации фармацевтические составы представлены в форме суспензий. В некоторых вариантах реализации суспензии содержат такие ингредиенты, как глицерин, микрокристаллическая целлюлоза, натриевая соль карбоксиметилцеллюлозы, раствор сорбитола, ксантановая камедь и тому подобное, и различные красители и ароматизаторы для того, чтобы суспензии были удобны для применения для детей и пожилых людей.
[0055] В некоторых вариантах реализации первые гранулы, описанные выше, содержащие пилокарпин или его фармацевтически приемлемую соль и имеющие первый и второй слои, покрывают третьим слоем, содержащим тольтеродин или его фармацевтически приемлемую соль. Третий слой аналогичен или похож на первый слой вторых гранул, описанный выше. В некоторых вариантах реализации первая гранула, покрытая тольтеродином, дополнительно покрыта четвертым слоем, который аналогичен или похож на второй слой вторых гранул, описанный выше.
ПРИМЕРЫ
Пример 1: Материалы, применяемые в процессе производства гранул
[0056] Для получения гранул пилокарпина и тольтеродина применяли сырье, перечисленное в Таблице 1.


Пример 2: Определение скорости растворения
[0058] Данный способ описывает методику определения скорости растворения пилокарпина HCl и комбинированных составов тольтеродина с применением способа обращенно-фазовой, градиентной высокоэфективной жидкостной хроматографии (ВЭЖХ), с применением способов, широко известных в данной области техники.
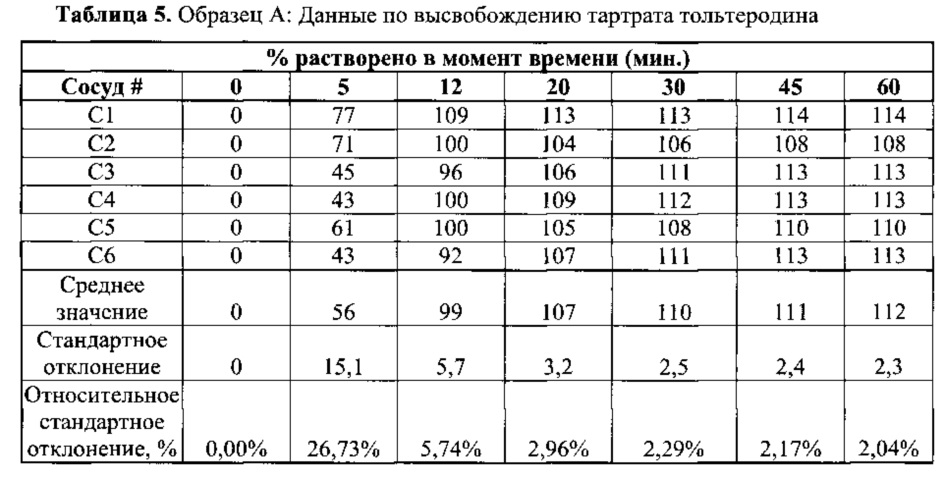
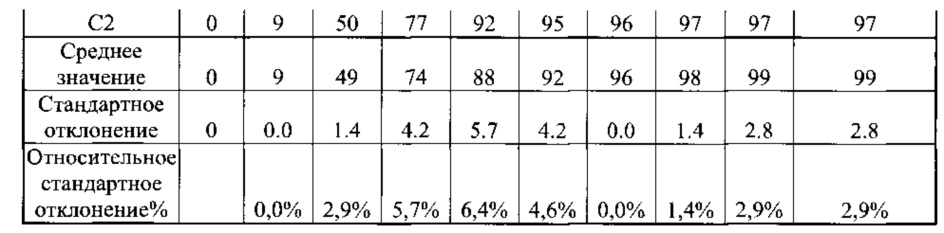
[0059] Маточные растворы пилокарпина HCl и тартрата тольтеродина получали в качестве рабочих стандартов. Гранулы, содержащие пилокарпин HCl и тартрат тольтеродина, раздельно смешивали с фиксированным объемом в 0,1 н. HCl. В установленные моменты времени после того, как началось смешивание, аликвоты растворяемых смесей вводили в ВЭЖХ, затем вводили несколько аликвот рабочих стандартов. Количества высвобожденных (растворенных) частиц тольтеродина и пилокарпина в составах подсчитали, используя соответствующие площади пика тольтеродина и пилокарпина.
[0060] Метод USP 2 Paddles применяли для определения растворения различных составов при следующих условиях.
Среда растворения: 0,1 н. HCl
Скорость перемешивания: 50 об./мин
Температура сосуда: 37°C±0,5°C
Объем пробы: 1,0 мл
Объем растворения: 500 мл
Пример 3: Получение гранул
[0061] Гранулы получали путем нанесения слоев лекарственных средств на гранулы микрокристаллической целлюлозы с помощью водосодержащих целлюлозных систем покрытия, содержащих пилокарпин HCl или тартрат тольтеродина. Из гранул формировали единичные стандартные дозы. Составы покрытий представлены в Таблицах 3 и 4 ниже.

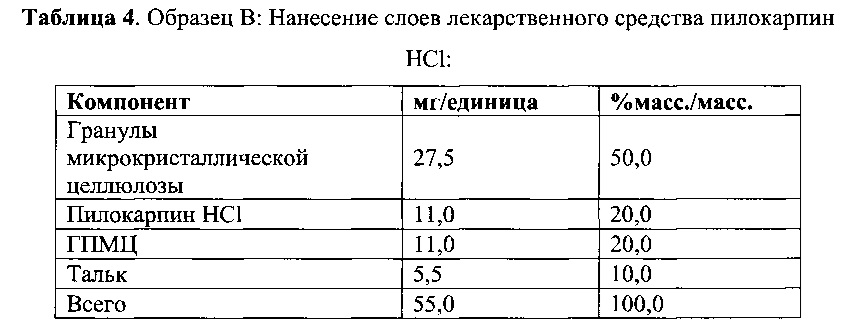
[0062] Оба раствора для нанесения покрытия наносили на пеллеты микрокристаллической целлюлозы (МКЦ) при помощи аппарата с псевдосжиженным слоем «Vector FLM-1» с конфигурацией покрытия по способу Вурстера (Wurster). Гранулы вручную помещали в желатиновые капсулы размера 2 и испытывали на растворение с применением методики согласно Примеру 2. Данные по растворимости гранул, покрытых слоем лекарственного средства, приведены в Таблицах 5 и 6.

[0063] Гранулы обоих типов, покрытые слоем лекарственных средств, покрывали верхним слоем. Гранулы тольтеродина покрывали тонкой системой покрытия с немедленным высвобождением на основе ГПМЦ, чтобы исключить потерю тартрата тольтеродина вследствие эрозии. Верхнее покрытие для гранул пилокарпина HCl разрабатывали на этапах 2-5 разработки.
Пример 4: Получение гранул
[0064] Из настоящего примера видно, что при разработке основное внимание уделялось применению целлюлозных полимеров нескольких типов и степеней чистоты с целью формирования полупроницаемого барьера, который задержал бы высвобождение. Все нанесенные покрытия характеризовались относительно небольшим увеличением массы, не выше 50%. Было определено, что нанесение с большим увеличением массы давало желаемый профиль с отсроченным высвобождением. Составы и профили высвобождения приведены в Таблице 7 ниже.

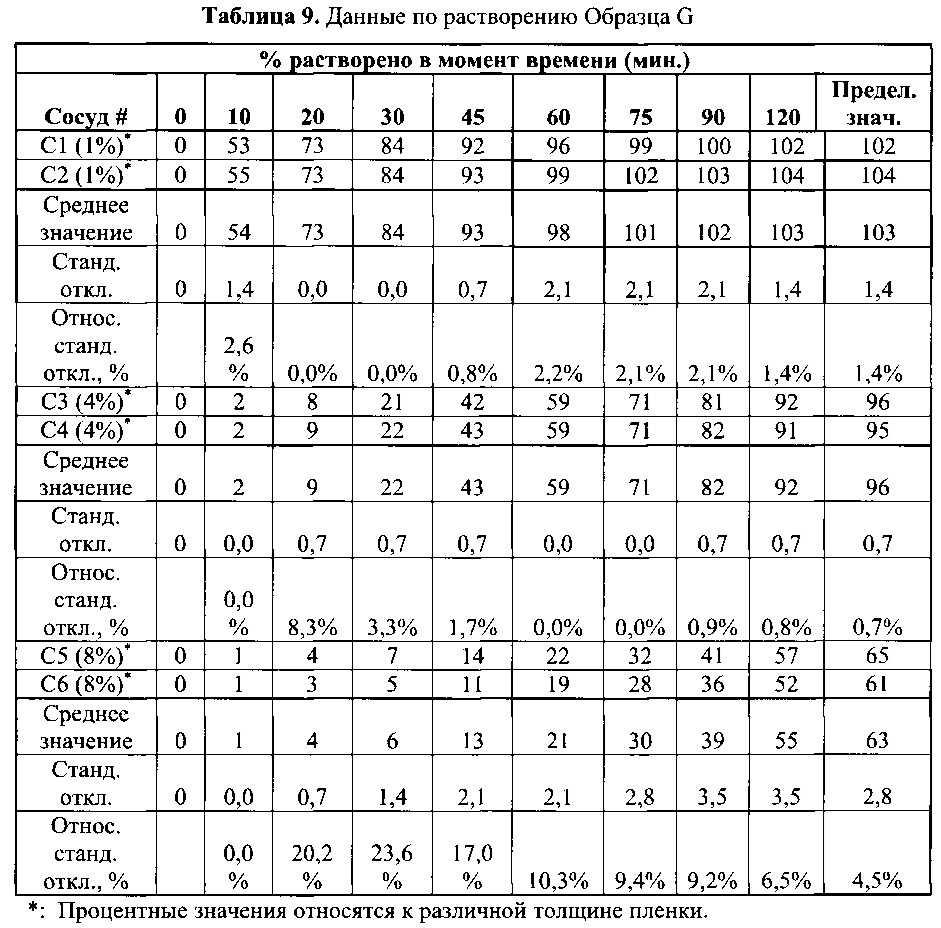
[0065] Данные по растворении гранул Образцов F и G, полученные при помощи методики согласно Примеру 2, приведены в Таблицах 8 и 9.

Пример 5: Получение гранул
[0066] В настоящем примере получали способные к набуханию гранулы, содержащие пилокарпин HCl. Во-первых, получили гранулы плацебо для того, чтобы сравнить два типичных суперразрыхлителя. Критерием для выбора суперразрыхлителя было увеличение объема при помещении гранул в 0,1 н. HCl. Составы и результаты представлены ниже в Таблице 9.

[0067] Получили два способных к набуханию состава гранул пилокарпина HCl с различным содержанием пилокарпина. Каждую из указанных гранул затем покрывали той же системой покрытия на основе этилцеллюлозы и испытывали на растворение. Составы и результаты представлены ниже в Таблице 10.

[0068] Как видно из данных о растворении в Таблице 11, указанные составы характеризовались желаемым отсроченным высвобождением, достигнутым при помощи методики согласно Примеру 2.

Пример 5: Получение гранул
[0069] Настоящий пример иллюстрирует покрытие ядер микрокристаллической целлюлозы, покрытых слоем лекарственного средства, целлюлозными полимерами до большого увеличения массы (до 200%). Первый состав для нанесения покрытия состоял из растворимого полимера, гидроксипропилцеллюлозы (ГПЦ), которая образует набухший в воде гель, задерживающий высвобождение. Второй состав состоял из ГПЦ и этилцеллюлозы в отношении 1:1. Толщина обоих типов пленки непосредственно коррелировала с задержкой в высвобождении пилокарпина HCl. Составы для каждого из прототипов приведены ниже в Таблице 12.

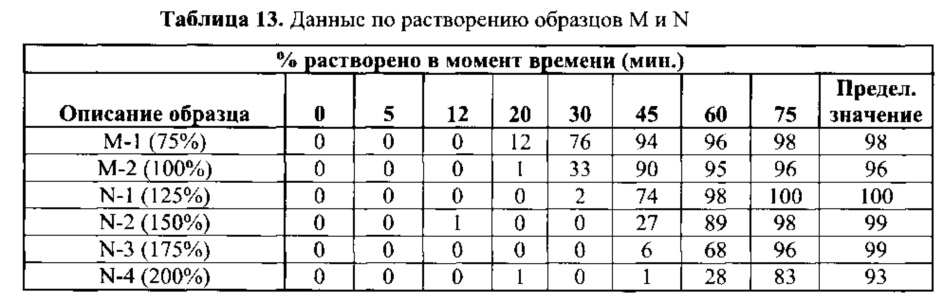
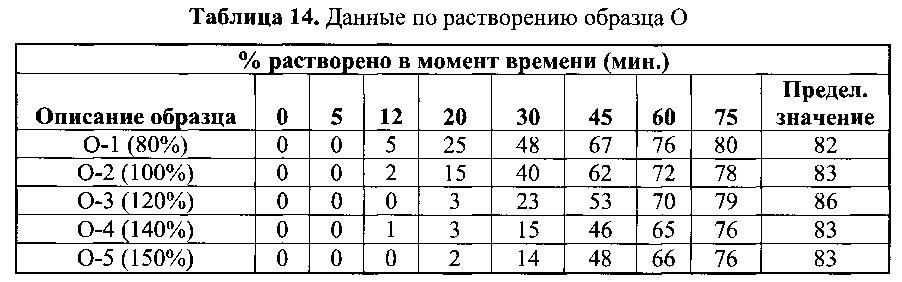
[0070] Получили гранулы со следующим увеличением массы: 75%, 100%, 125%, 150%, 175% и 200%. Указанный набор гранул характеризовался широким диапазоном времени задержки, за которой следовало немедленное высвобождение. Задержка высвобождения регулировалась толщиной пленки. Данные по растворению, полученные по методике согласно Примеру 2, приведены в Таблицах 13 и 14.
Пример 6: Получение гранул цевимелина
[0071] Гранулы цевимелина получали практически таким же способом, что гранулы пилокарпина, как описано выше, за исключением того, что цевимелин использовали вместо пилокарпина.
Пример 7: Получение гранул мускаринового антагониста
[0072] Гранулы, содержащие мускариновый антагонист и выбранные из группы, состоящей из 5-гидроксиметил-тольтеродина, фезотеродина, оксибутинина, солифенацина, дарифенацина, троспия, имидафенацина, пропиверина и дикломицина, получают практически таким же способом, что гранулы тольтеродина, как описано выше, за исключением того, что определенный мускариновый антагонист используется вместо тольтеродина.

