СПОСОБЫ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ ТРОМБООБРАЗОВАНИЯ ИЛИ ЭМБОЛИИ
Вид РИД
Изобретение
В этой заявке утверждается преимущество патентной заявки Индии № 2388/MUM/2010, зарегистрированной 26 августа 2010 года, содержание которой включено здесь посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к лечению или профилактике тромбообразования или эмболии. Настоящее изобретение уменьшает недостатки антитромбоцитарных лекарственных средств, таких как клопидогрель, в результате применения (S)-оксо-клопидогреля или его производных, в его свободной форме или в форме фармацевтически приемлемой соли, для облегчения симптомов тромбообразования и/или эмболии посредством ингибирования агрегации тромбоцитов.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗ ОБРЕТЕНИЯ
Состояния, обусловленные тромбозными или тромбоэмболическими событиями, представляют собой основные причины заболеваемости и смертности у взрослого населения в западной цивилизации. Внутрисосудистный тромбоз и эмболизм являются общими клиническими проявлениями для многих заболеваний. Неконтролируемая активация гемостатической системы может быть потенциальной причиной тромбообразования и эмболии, что может уменьшать кровоток в критических органах, таких как головной мозг и миокард. Были выявлены определенные группы пациентов, которые чрезвычайно предрасположены к тромбообразованию и эмболии. Они включают в себя пациентов, (1) иммобилизованных после хирургического вмешательства, (2) с хронической сердечной недостаточностью с застойными явлениями, (3) с атеросклеротическим сосудистым заболеванием, (4) со злокачественным новообразованием или (5) беременных женщин. Большинство индивидуумов с «предрасположенностью к тромбообразованию» имеет недифференцируемое гемостатическое расстройство, хотя существуют определенные группы индивидуумов, имеющих наследственные или приобретенные «гиперкоагуляционные» или «претромботические» состояния, которые делают этих индивидуумов предрасположенными к рецидивирующему тромбообразованию (Harrison's Principles of Internal Medicine, 12th ed. McGraw Hill).
Для эффективного первичного гемостаза необходимо три ключевых события: адгезия тромбоцитов, секреция гранул и агрегация тромбоцитов. На протяжении нескольких секунд после повреждения, тромбоциты налипают на фибриллы коллагена в сосудистом субэндотелиальном слое. Этому взаимодействию способствует фактор Виллебранда, адгезивный гликопротеин, который позволяет тромбоцитам оставаться прикрепленными к стенке сосуда несмотря на интенсивное поперечное усилие, генерируемое в просвете сосуда. Фактор Виллебранда выполняет эту задачу путем создания связи между рецепторными участками тромбоцитов и субэндотелиальными фибриллами коллагена.
После того, как первичная гемостатическая пробка сформирована, коагуляционные белки плазмы активируются для инициации вторичного гемостаза. Существует небольшое различие между гемостатическими пробками, которые представляют собой физиологический ответ на повреждение, и патологическими тромбами. Тромбообразование часто описывается как коагуляция, произошедшая не в том месте, или не в то время. Гемостатические пробки или тромбы, которые сформированы в венах, где кровоток является медленным, являются богатыми фибрином и захваченными эритроцитами, и содержат в себе относительно немного тромбоцитов. Эти тромбы часто формируются в венах ног и могут отрываться и эмболизировать малый круг кровообращения. Напротив, сгустки, которые формируются в артериях в условиях высокого кровотока, преимущественно состоят из тробмоцитов и имеют небольшое количество фибрина. Эти артериальные тромбы могут удаляться из артериальной стенки и эмболизировать удаленные участки, являясь причиной временной или постоянной ишемии. Это особенно распространено в церебральном или сетчаточном кровообращении и может приводить к преходящей неврологической дисфункции (преходящие ишемические атаки), в том числе к преходящей монокулярной слепоте (временный амавроз) или нарушениям мозгового кровообращения. Кроме того, существуют увеличивающиеся доказательства, что большинство случаев инфаркта миокарда развиваются из-за тромбов, которые формируются внутри атеросклеротических коронарных артерий. (Данное предшествующее обсуждение взято, главным образом, из Harrison's Principles of Internal Medicine, 12th ed., McGraw Hill.)
Внеклеточные нуклеотиды и их рецепторы тромбоцитов являются важными компонентами сердечно-сосудистой системы, и они вовлечены в такие функции, как активация тромбоцитов и контроль сосудистого тонуса. Аденозиндифосфат (АДФ) и аденозинтрифосфат (АТФ) играют ключевые роли в физиологических процессах гемостаза и в развитии и распространении артериального тромбоза (2). Сам по себе АДФ является слабым агонистом агрегации тромбоцитов, стимулируя только обратимые реакции, по сравнению с сильными агонистами, такими как тромбин или коллаген. Однако по причине его присутствия в больших количествах в тромбоцитарных плотных гранулах и его секреции при активации в участках сосудистого повреждения, АДФ является важным так называемым вторичным агонистом, который усиливает большинство тромбоцитарных реакций и способствует стабилизации тромба. Рецепторы внеклеточных нуклеотидов принадлежат семейству Р2, которое включает в себя два класса мембранных рецепторов: Р2Х лиганд-управляемых катионных каналов (Р2Х1-7) и гликопротеин-ассоциированные рецепторы P2Y (P2Y1, 2, 4, 6, 11, 12, 13, 14). Каждый из этих рецепторов имеет определенную функцию в течение активации и агрегации тромбоцитов, что, естественным образом, имеет значение для их вовлеченности в тромбообразование.
Поскольку АДФ и АТФ играют ключевую роль в активации тромбоцитов, их рецепторы представляют собой потенциальные мишени для антитромботических лекарственных средств. АТФ-управляемый ионный канал Р2Х1 и два G-протеин ассоциированных рецептора АДФ, P2Y1 и P2Y12, выборочно способствуют агрегации тромбоцитов и формированию тромба. Благодаря его центральной роли в росте и стабилизации тромба, рецептор P2Y12 представляет собой признанную мишень для антитромботических лекарственных средств, главным образом соединений тиенопиридинового класса, таких как тиклопидин, клопидогрель, прасугрель и тому подобное.
Основной антитромбоцитарной терапией для пациентов с острыми коронарными синдромами (ACS), в том числе тех, которые подвергаются раннему чрескожному коронарному вмешательству (PCI) и имплантации стента, является прием комбинации аспирина и клопидогреля. Аспирин ингибирует продукцию тромбоцитами тромбоксана А2 и активацию тромбоцитов, и снижает риск рецидивирующих ишемических событий у пациентов с высоким риском развития васкулярных событий на 22% (абсолютное снижение риска (ARR) приблизительно 2%) за счет повышения вероятности событий массивного кровотечения на приблизительно 60% (абсолютное повышение риска (ARI) приблизительно 0,5%). Клопидогрель ингибирует АДФ-опосредованную активацию тромбоцитов посредством блокирования тромбоцитарного рецептора P2Y12, что в комбинации с приемом аспирина пациентом с ACS, снижает риск рецидивирующих ишемических событий еще на 20% (ARR приблизительно 2,1%), причем события массивного кровотечения статистически не увеличиваются по сравнению с монотерапией аспирином.
Клопидогрель (формула I), имеющий химическое название «’(+)-(S)-метил 2-(2-хлорфенил)-2-(6,7-дигидротиено[3,2-c]пиридин-5(4Н)-ил)ацетат», в настоящее время считается золотым стандартом при ингибировании агрегации тромбоцитов. Клопидогрель позиционируется на рынке в виде его кислой сернокислой соли, гидрохлорида, и соли бензолсульфокислоты. На протяжении последних 12 лет или более его широко и эффективно используют для контроля ишемических событий и других сердечно-сосудистых нарушений.
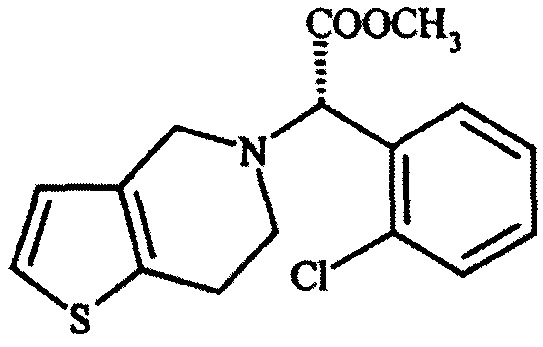
Формула I: клопидогрель
Однако клопидогрель имеет некоторые потенциальные ограничения. Во-первых, отмечены задержка начала действия и латентный период между введением и терапевтическим действием. Терапевтически значимый уровень 50% ингибирования АДФ-опосредованной активации тромбоцитов, как измерено посредством световой трансмиссионной агрегометрии (LTA) (5 мкМ АДФ ex-vivo) не достигается до 4-6 часов после введения ударной дозы 300 мг клопидогреля или до 2 часов после введения удвоенной дозы до 600 мг. Во-вторых, присутствует эффект насыщения дозы, поскольку утроенная доза с обычной дозы 300 мг до 900 мг вызывает только 60% ингибирование АДФ-опосредованной агрегации тромбоцитов (при 5 мкМ АДФ), и менее чем 50% ингибирование агрегации тромбоцитов (опосредованное 20 мкМ АДФ (ex vivo)). В-третьих, почти во всех клинических испытаниях клопидогреля выявлено, что терапевтические уровни ингибирования тромбоцитов не достигаются у большинства пациентов по причине большой межиндивидуальной вариативности реакции на терапию клопидогрелем. Эту популяцию пациентов называют «не дающей клинического ответа» или «дающей слабый клинический ответ» на клопидогрель. Пациенты, не дающие клинического ответа, составляют около 14% в популяции этнических китайцев и 3-4% среди представителей белой европеоидной расы. Суммарно, пациенты, дающие слабый клинический ответ, составляют около 23% общей популяции больных, и разброс ингибирующей активности сообщается приблизительно в 45% общей популяции больных. Сверхбыстрый метаболизм клопидогреля был подтвержден у пациентов, имеющих определенный фенотип изоформы CYP (приблизительно 4-18% пациентов), что приводит к событиям более тяжелого кровотечения с более высокой агрегацией тромбоцитов. Принимая во внимание эти факты и результаты клинических испытаний, FDA требует, чтобы в упаковку было включено предупреждение на этикетке клопидогреля, с особо подчеркнутой неэффективностью клопидогреля для определенных категорий больных, и с рекомендацией проведения до начала лечения скрининга больных на генотип для выявления пациентов, дающих слабый клинический ответ на клопидогрель.
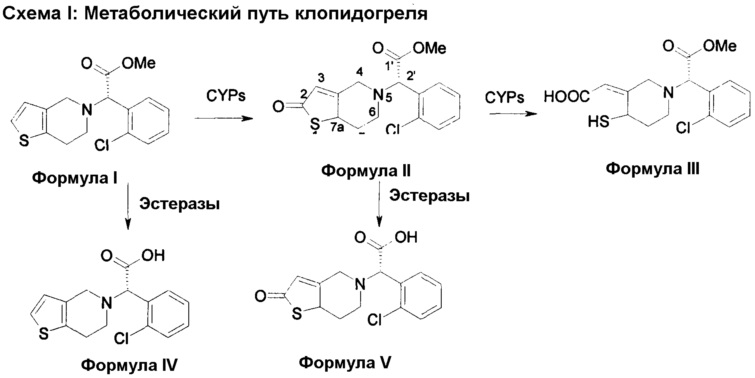
Было обнаружено, что неравномерность ингибирующей активности клопидогреля возникает в результате различной активности печеночных ферментов, которые метаболизируют клопидогрель. После приема внутрь клопидогрель претерпевает серию метаболических реакций для образования метаболитов. Эти реакции опосредованы цитохромом Р450 (CYP 450), а также действием печеночной карбоксилэстеразы человека (hCE). Метаболический путь клопидогреля представлен ниже. Ранее не было предложено применение специфических метаболитов в качестве терапевтических агентов для введения пациентам вместо клопидогреля.
Также, в качестве альтернативы клопидогрелю, можно использовать прасугрель. Однако лечение пациентов прасугрелем делало их чувствительными к эпизодам кровотечения, что может быть угрозой жизни, ограничивая применения прасугреля у больных, имеющих массу тела менее 60 кг и возраст старше 75 лет. Также было обнаружено, что прием прасугреля увеличивает риск заболевания печени/токсичности у пациентов имеющих риск развития цирроза, и вследствие этого FDA рекомендует фармакологический надзор. Поскольку эти тяжелые побочные действия вызывают беспокойство, прием клопидогреля является относительно более безопасным, что в результате приводит в целом к меньшим кровотечениям и печеночной токсичности. Более того, частота случаев смертей по причине сердечно-сосудистой патологии значительно снижена после лечения клопидогрелем по сравнению с прасугрелем, и следовательно повышение эффективности клопидогреля, вероятно снижает риск тромбообразования и/или эмболии в группе пациентов значительно лучше, чем другие структурно модифицированные лекарственные средства.
Из-за серьезных побочных эффектов, в том числе риска кровотечений, связанных с приемом прасугреля, рекомендовано использование прасугреля только для достижения первичного сдвига более сильного ингибирования агрегации тромбоцитов. Затем применяют клопидогрель для последующего ингибирования тромбоцитов, после первоначального использования прасугреля.
Таким образом, существует необходимость в устранении побочных эффектов клопидогреля или прасугреля. Необходимы соединения, проявляющие более быстрое начало действия, более низкую межиндивидуальную вариабельность, лучший статус метаболизирования, улучшенный эффект насыщения дозы, и повышенную эффективность в результате повышения ингибирующего потенциала на агрегацию тромбоцитов, индуцированную АДФ.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения обнаружили, что применение клопидогреля представляет существенные клинически значимые ограничения в ингибировании агрегации тромбоцитов безопасно и быстро в согласованном порядке, несмотря на то, что он считается золотым стандартом среди доступных в настоящее время противотромботических лекарственных средств. Таким образом, целью данного изобретения является обеспечение улучшенных методов лечения/профилактики тромбообразования и эмболии, а также композиций для использования в таких методах, что облегчает, по меньшей мере, один из клинических недостатков клопидогреля, о которых говорилось выше.
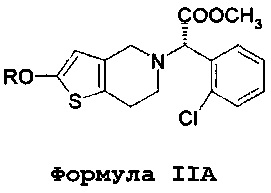
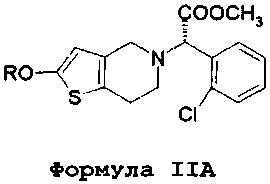
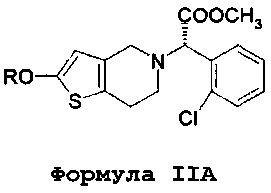
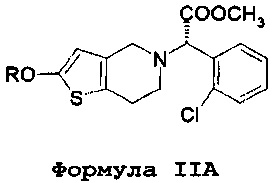
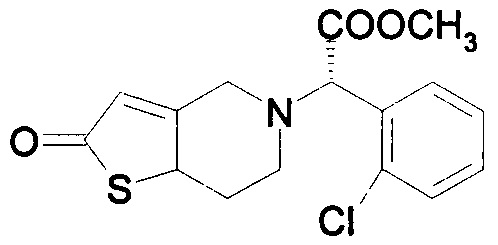
В соответствии с первым аспектом, данное изобретение обеспечивает способ лечения/профилактики тромбообразования и/или эмболии у нуждающегося в таком лечении больного, и в то же время позволяет избежать и/или уменьшить побочные эффекты, связанные с метаболизмом кислоты клопидогрель по формуле IV, включающий в себя введение количества (S)-оксо-клопидогреля или его производных или фармацевтически приемлемой соли. В одном варианте осуществления вводится изолированный (S)-оксо-клопидогрель по формуле II или его производные или фармацевтически приемлемая соль.
В предпочтительных вариантах осуществления этого аспекта настоящего изобретения данный способ обеспечивает терапевтический эффект более высокий, или эквивалентный тому, который наблюдали после введения существенно более высокой дозы клопидогреля.
В соответствии со вторым аспектом настоящего изобретения обеспечен способ лечения и/или профилактики тромбообразования и/или эмболии у нуждающегося в таком лечении пациента, и в то же время позволяющий избежать и/или уменьшить побочные эффекты, связанные с метаболизмом кислоты клопидогрель по формуле IV, включающий в себя введение количества (S)-оксо-метаболита клопидогреля или его производных или фармацевтически приемлемой соли.
В предпочтительных вариантах осуществления настоящего изобретения данный способ приводит к формированию in vivo активного метаболита клопидогреля в концентрации, более высокой, или эквивалентной той, которая наблюдается после введения существенно более высокой дозы клопидогреля.
В соответствии с третьим аспектом настоящего изобретения обеспечен улучшенный способ доставки активного метаболита клопидогреля in vivo для лечения и/или профилактики тромбообразования и/или эмболии у человека, нуждающегося в таком лечении, и в то же время позволяющий избежать и/или уменьшить побочные эффекты, связанные с метаболизмом кислоты клопидогрель по формуле IV, где данное улучшение состоит по существу в введении количества (S)-оксо-метаболита клопидогреля или его производных или фармацевтически приемлемой соли.
Во всех аспектах настоящего изобретения начало терапевтического действия является, по меньшей мере, на 50% более быстрым чем то, которое наблюдается после введения существенно более высокой дозы клопидогреля.
Более того, во всех аспектах настоящего изобретения могут вводиться различные количества оксо-метаболита клопидогреля или его производного по формуле IIA. Например, вводимое количество может составлять от 20 до 60 мг, и существенно более высокая доза клопидогреля может составлять 300 мг. Альтернативно, количество оксо-метаболита или его производного по формуле IIA может составлять от 35 до 80 мг, и существенно более высокая доза клопидогреля может составлять 600 мг. В альтернативных вариантах осуществления данное количество оксо-метаболита или его производного по формуле IIA может составлять от 50 до 100 мг, а существенно более высокая доза клопидогреля может составлять 900 мг. В дополнительных вариантах осуществления, данное количество оксо-метаболита или его производного по формуле IIA может составлять от 5 до 15 мг, и существенно более высокая доза клопидогреля может составлять 75 мг. Альтернативно, количество оксо-метаболита или его производного по формуле IIA может составлять от 6 до 20 мг, и существенно более высокая доза клопидогреля может составлять 150 мг.
В качестве альтернативы лечению, которое включает в себя введение больному серий повторяющихся доз, более высокая ударная доза может сопровождаться одной или несколькими поддерживающими дозами. Например, больному может быть введена ударная доза 30-60 мг оксо-клопидогреля или его производного по формуле IIA, обеспечивающая более чем 50% ингибирование агрегации тромбоцитов, опосредованной АДФ. В некоторых вариантах осуществления настоящего изобретения больному вводится эта, или альтернативная ударная доза, после которой может быть введена поддерживающая доза 6-25 мг оксо-клопидогреля или его производного по формуле IIA, что в результате приводит к более, чем 50% ингибированию агрегации тромбоцитов человека, индуцированной АДФ. Дозы, которые здесь обсуждаются, предназначены для больных со средней массой тела 60 кг. Следует понимать, что данная доза может быть установлена с учетом массы тела больного, состояния здоровья/состояния данного больного, тяжести заболевания, метаболических особенностей данных соединений по настоящему изобретению. Специалист в данной области имеет квалификацию и компетентность для установления требующейся дозировки.
В соответствии с четвертым аспектом настоящего изобретения, обеспечен способ минимизации вариабельности между пациентами реактивности тромбоцитов и метаболической нагрузки при лечении и/или профилактике тромбообразования и/иди эмболии, наблюдающихся после введения дозы клопидогреля, указанный способ включает в себя введение нуждающемуся в таком лечении больному эффективного количества метаболита (S)-оксо-клопидогреля или его производных или фармацевтически приемлемой соли.
Вариабельность между пациентами может быть обусловлена изоформами CYP450 и его полиморфными проявлениями, например, в аллеле CYP2C19*2 или аллеле CYP2C19*17. Дополнительно или альтернативно, данная вариабельность между пациентами может быть обусловлена оттоком Р-гликопротеина. По существу, в варианте осуществления, (S)-оксо-клопидогрель вводится пациенту, имеющему полиморфизм CYP450, который может вызывать устойчивость к клопидогрелю. Предпочтительно, данным полиморфизмом CYP450 является CYP2C19*2, *1, *2, *3, *4, *5, *6, *7, *8, *9, *10 и/или *17; более предпочтительно CYP2C19*2 и/или *17; и наиболее предпочтительно CYP2C19*2.
В соответствии с пятым аспектом настоящего изобретения, обеспечен способ лечения или профилактики тромбообразования или эмболии, включающий в себя введения метаболита (S)-оксо-клопидогреля или его производных или фармацевтически приемлемой соли, и ингибитора протонной помпы.
Во всех аспектах настоящего изобретения способы, обсуждаемые здесь, могут дополнительно включать в себя этап применения одного или нескольких дополнительных терапевтических средств. Они могут включать в себя, например, антитромбоцитарные средства, выбранные из аспирина, цилостазола и дипиридамола. Эти дополнительные средства могут быть введены одновременно, последовательно или после основного активного ингредиента.
В соответствии с шестым аспектом настоящего изобретения предусмотрены композиции для применения в описанных здесь способах. Во избежание каких-либо неясностей относительно ссылки на введение количества действующего ингредиента, это может входить в состав этого аспекта данного изобретения.
В соответствии с седьмым аспектом настоящего изобретения обеспечена композиция в фиксированной дозе (S)-оксо-клопидогреля или его производного по формуле IIA, характеризующаяся тем, что указанная композиция включает в себя дозу 5-35 мг оксо-клопидогреля или его производного по формуле IIA.
В предпочтительном аспекте настоящего изобретения данная композиция в фиксированной дозе содержит в себе дозу оксо-клопидогреля или его производного по формуле IIA, равную 5-15 мг. Данная композиция в фиксированной дозе может дополнительно или альтернативно включать в себя одно или несколько антитромбоцитарных средств, выбранных из аспирина, цилостазола и дипиридамола.
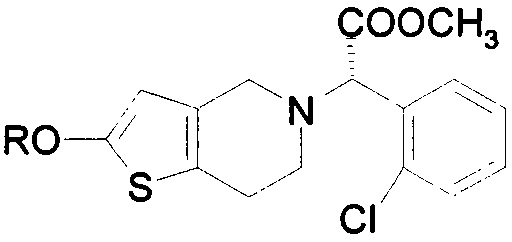
Преимущества настоящего изобретения осуществляются в результате применения соединений по формуле II или формуле IIA, а также их солей или таутомеров,
|
где R представляет собой водород или гидролизуемую группу, ацил или алкил замещенную силильную группу. Данный термин «ацил» относится к функциональной группе, имеющей общую формулу R1-CO-, где R1 может представлять собой арил, алкил (неразветвленная цепь или разветвленная цепь), алкенил или алкинил. Предпочтительной алкильной группой является ацетил.
Соединение по формуле II представляет собой метаболит клопидогреля. Несмотря на то что структура этого метаболита и его положение в метаболическом пути клопидогреля известны почти 20 лет, его применение в качестве активного вещества при лечении тромбообразования и/или эмболии ранее предложено не было. Например, способ получения такого соединения в качестве промежуточного соединения для производства предположительно эффективного аналога клопидогреля (а не в качестве активного вещества самого по себе) раскрыто в примере 3 в WO 2011/095049. Авторы данного изобретения установили, что данное соединения по формуле II (а также его фармацевтически приемлемые соли, таутомеры и производные по формуле IIA) могут быть успешно введены непосредственно в организм пациента вместо клопидогреля, и что это устраняет некоторые, если не все, недостатки, связанные с применением клопидогреля.
Отчасти, причина этого заключена в том, что данный метаболит, определенный формулой IV в пути метаболизма, предоставленном выше, был обнаружен неактивным. В результате введения соединения по формуле II в организм пациента, данный неактивный метаболит не вырабатывается in vivo. Более того, для превращения данного соединения по формуле II (в отличии от клопидогреля) в активный метаболит необходимо на один этап, опосредованный CYP, меньше. Таким образом, снижается воздействие на способность данного пациента метаболизировать.
Как упоминалось выше, применение метаболитов клопидогреля в качестве действующих веществ самих по себе, в особенности по формуле II, ранее не сообщалось или предполагалось для устранения недостатков клопидогреля, и, следовательно, преимущества их применения, которые обсуждаются здесь, не могли быть обнаружены.
Данное изобретение обеспечивает способ лечения и/или профилактики тромбообразования и/или эмболии, где данный способ включает в себя введение предопределенной дозы изолированного (S)-изомера соединения тиолактона по формуле II, или его таутомера, или производного, в его свободной форме или в виде фармацевтически приемлемой соли, так что это в результате приводит к формированию in vivo активного метаболита клопидогреля в концентрации, или выше, чем та, которая достигается в результате введения значительно более высокой дозы клопидогреля. В предпочтительном варианте осуществления настоящее изобретение делает возможным существенное снижение дозы активного ингредиента, требуемой для достижения терапевтической концентрации активного метаболита клопидогреля по сравнению с введением общепринятых терапевтических доз клопидогреля. Таким образом переносимость и эффективность дозы значительно увеличиваются.
В другом аспекте, по данному изобретению могут быть доставлены более высокие концентрации активных метаболитов клопидогреля в системный кровоток вскоре после введения, по сравнению с применением клопидогреля. Это не только совершенствует начало терапевтического действия в результате достижения более чем 50% ингибирования агрегации тромбоцитов, индуцированной АДФ, и межиндивидуальную вариабельность, но также и устраняет побочные эффекты, связанные с неактивным кислотным метаболитом (формула IV) и снижает метаболическую нагрузку на печень.
В аспектах настоящего изобретения могут быть введены одно или несколько активных соединений, в том числе антитромбоцитарные средства, такие как аспирин, цитостазол и тому подобное. Механизм действия данных антитромбоцитарных средств может быть схожим, или отличаться, от такового активного метаболита клопидогреля для достижения необходимых уровней антитромбоцитарной активности. Второе или последующее антитромбоцитарное средство может быть введено отдельно, последовательно или одновременно с (S)-изомером соединения тиолактона по формуле II (также называемое (S)-оксо-клопидогрель) или его таутомером или производным в его свободной форме или в качестве его фармацевтически приемлемой соли.
В аспектах настоящего изобретения доза, в пределах 20-100 мг соединения по формуле II или его таутомеров или производных по формуле IIA, может быть введена в качестве начальной насыщающей дозы, и, при необходимости, может быть последовательно введена низкая поддерживающая доза 5-35 мг, так что системная концентрация активного метаболита является более высокой, чем та величина, которая получена при введении насыщающей дозы 300-900 мг и поддерживающей дозы 75-150 мг клопидогреля. Более предпочтительно, данная насыщающая доза по настоящему изобретению составляет 40-75 мг, и поддерживающая доза составляет 6-25 мг. Еще более низкие дозы могут быть введены, если требуемое ингибирование эквивалентно, или немного ниже обеспечиваемого клопидогрелем. Дозы, обсуждаемые здесь, предназначены для пациентов со средней массой тела 60 кг. Следует понимать, что доза может быть подобрана в соответствии с массой тела больного, состояния здоровья/состояния больного, тяжести заболевания, метаболического профиля данных соединений по настоящему изобретению. Специалист в данной области обладает компетенцией и квалификацией для подбора требуемой дозировки.
Производное по формуле IIA может быть получено из таутомера соединения по формуле II, предпочтительно представляет собой сложноэфирное (алкил, арил или силил) производное. Более предпочтительно, данное производное представляет собой ацилированный тиолактон по формуле VI.
В аспектах настоящего изобретения предусмотрены композиции для применения в обсуждаемых здесь методах. Например, настоящим изобретением обеспечена фармацевтическая композиция в фиксированной дозе, содержащая в себе от 5 мг до 35 мг соединения по формуле II, или его таутомеров или его производного по формуле IIA, или фармацевтически приемлемой соли, и, необязательно, один или несколько фармацевтически приемлемых инертных наполнителей. Данная композиция в фиксированной дозе по настоящему изобретению может быть введена вместе с одним или несколькими активными соединениями, в том числе антитромбоцитарными средствами, такими как аспирин, цитостазол, PPI (ингибиторы протонной помпы, например, омепразол) и тому подобное, чей механизм действия может быть схожим, или отличаться от механизма действия активного метаболита клопидогреля.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Если не указано иное, все технические и научные термины, используемые здесь, имеют то же значение, как это обычно понимается специалистом в области, к которой принадлежит данное изобретение. Несмотря на то что любые методы и материалы, схожие или аналогичные описанным здесь, можно использовать в применении на практике или тестировании настоящего изобретения, описаны предпочтительные методы и материалы. Для описания данного изобретения некоторые термины определены здесь специально, как указано далее.
Если не сформулировано в противоположном смысле, любое из выражений «в том числе», «включает в себя», «содержащий в себе», «состоящий из» имеет значение «включающий в себе без ограничений», и не должно толковаться как ограничение любого из утверждения общего характера, которое сопровождает конкретные или аналогичные предметы или вещества, следующие сразу после этих слов. Варианты осуществления данного изобретения не являются взаимоисключающими, но могут быть осуществлены в различных комбинациях. Описанные варианты осуществления и раскрытые примеры приведены с целью иллюстрации, а не ограничения данного изобретения, что изложено в прикрепленной формуле изобретения.
Неожиданно было обнаружено, что возможно достичь более высокого ингибирования агрегации тромбоцитов, индуцированной АДФ, с более ранним началом, что устранит один или несколько из недостатков применения клопидогреля. Настоящее изобретение соответствует давно назревшей необходимости в лечении тромбообразования и эмболии, и связанных с ними патологических состояний. Различные аспекты данного изобретения описаны подробно с конкретными вариантами осуществления/условиями далее.
В соответствии с одним аспектом, настоящее изобретение обеспечивает методы лечения и/или профилактики тромбообразования и/или эмболии, а также композиции для применения в таких методах, где данный метод включает в себя введение изолированного (S)-изомера соединения тиолактона по формуле II (также обозначаемое здесь как (S)-оксо-клопидогрель, или (S)-оксо метаболит клопидогреля, или (S)-тиолактон) или его производного в свободной форме или фармацевтически приемлемой соли. Это в результате приводит к формированию in vivo активного метаболита клопидогреля в концентрации, более высокой или эквивалентной концентрации активного метаболита, полученной в результате введения клопидогреля, где доза указанного тиолактона или производного значительно ниже, чем соответствующая доза клопидогреля. Предпочтительно, данная доза тиолактона (оксо-клопидогреля) или его производного ниже в два раза, более предпочтительно ниже в 3 раза, еще более предпочтительно ниже приблизительно в 5 раз, и еще более предпочтительно, снижена приблизительно в 10 раз или больше. Например, доза первичного активного компонента по настоящему изобретению от 20 до 40 мг, от 35 до 80 мг, или от 50 до 100 мг, будет обеспечивать усиленный терапевтический эффект, или более высокую in vivo концентрацию данного активного метаболита клопидогреля, чем наблюдаемые после введения дозы клопидогреля 300 мг, 600 мг или 900 мг, соответственно. Схожим образом, доза данного первичного активного ингредиента по настоящему изобретению от 5 до 15 мг, или от 6 до 30 мг, будет обеспечивать усиленный терапевтический эффект, или более высокую in vivo концентрацию данного активного метаболита клопидогреля, чем наблюдаемые после введения дозы клопидогреля 75 мг или 150 мг, соответственно. В соответствии с настоящим изобретением, полученная активность данного активного метаболита является более высокой, или эквивалентной клопидогрелю, при дозе, значительно более низкой, чем доза вводимого клопидогреля.
Следует понимать, что соединение тиолактона по формуле II находится в таутомерной форме по формуле IIA и данные таутомеры могут быть использованы в способах и композициях по настоящему изобретению. Производные данного соединения тиолактона включают в себя, но не ограничиваются ими, сложные эфиры или силиловые эфиры, где гидроксильная группа данного соединения по формуле IIA является дериватизированной. Данная дериватизированная группа предпочтительно является гидролизуемой in vivo эстеразами после введения. Предпочтительными эфирными группами являются алкиловые (с неразветвленной цепью или разветвленной цепью) или ариловые эфиры, более предпочтительны ацетиловые или н-бутил/трет-бутил эфиры, как представлено в формуле IIA.
Настоящее изобретение обеспечивает сниженную дозу активного ингредиента, требуемую для достижения терапевтического эффекта, по сравнению с применением клопидогреля. Данные соединения по формуле II или IIA могут быть введены в виде их кислых/основных аддитивных солей, и поскольку масса сопутствующей кислоты/основания изменятся от одного к другому, доза может быть рассчитана на основании свободного тиолактона или его производного. Дозы, обсуждаемые здесь, предназначены для пациентов со средней массой тела 60 кг. Следует понимать, что доза может быть подобрана, принимая во внимание массу тела больного, состояние здоровья/состояние больного, тяжесть заболевания, метаболический профиль данных соединений по настоящему изобретению. Специалист в данной области обладает квалификацией и компетенцией для подбора необходимой дозировки.
Изобретательский отбор соединений по формуле II или IIA в значительной степени способствует усовершенствованию антитромбоцитарной терапии, по сравнению с использованием клопидогреля, и улучшает терапевтическую эффективность приблизительно в 5-15 раз, а также снижает сопутствующие токсические/побочные действия или метаболическую нагрузку, которые связаны с лечением клопидогрелем.
Настоящее изобретение может обеспечить терапевтически эффективную концентрацию активного метаболита клопидогреля в короткий промежуток времени после введения, что не только усовершенствует начало действия, но также обеспечивает более чем 50% ингибирование агрегации тромбоцитов, индуцированной АДФ. Начало действия может быть (как определено по 50% ингибированию агрегации тромбоцитов, индуцированной АДФ) обеспечено менее чем через 1 час, более предпочтительно, через 30 минут, по сравнению с 4-6 часами для клопидогреля. Вне зависимости от дозы соединений по формуле II или IIA, максимальная агрегация тромбоцитов может быть достигнута менее чем через 1 час после перорального применения. Это изобретение, таким образом, усовершенствует эффект насыщения дозой, наблюдаемый с более высокими дозами клопидогреля, и обеспечивает значительно более высокую продукцию и сниженную метаболическую нагрузку в печени. Более того, поскольку клопидогрель представляет собой субстрат P-гликопротеина (Pgp), на его абсорбцию влияют ингибиторы или индукторы Pgp, которые вероятно изменяют клиническое действие клопидогреля. Этот эффект также должен быть снижен в значительной степени путем введения композиций по настоящему изобретению. Дополнительно, данное изобретение может допустить применение ингибиторов протоновой помпы в комбинации с клопидогрелем. Полагают, что причина состоит в том, что роль CYP2C19 (который играет значительную роль в метаболизме клопидогреля) снижена существенно при использовании композиций и методов по настоящему изобретению, PPI являются ингибиторами CYP2C19.
В соответствии с аспектами настоящего изобретения начальная насыщающая доза 20-100 мг соединения по формуле II или его производного (формула IIA) или его соли, может быть введена человеку, нуждающемуся в лечении или профилактике эмболии сосудов или тромбообразования, и, при необходимости, поддерживающая низкая доза 5-40 мг может быть введена, так что концентрация активного метаболита клопидогреля в плазме крови человека является более высокой, чем наблюдаемая после введения насыщающей дозы 300-900 мг и поддерживающей дозы 75-150 мг клопидогреля. Предпочтительно, доза 40-60 мг соединения тиолактона по формуле II/IIA обеспечит более чем 50% ингибирование агрегации тромбоцитов, индуцированной АДФ, в течение часа, и поддерживающая доза 6-25 мг является достаточной для поддержания ингибирования тромбоцитов на необходимом уровне, или выше, в течение периода поддержания дозы. Тем не менее, следует отметить, что подбор дозы может быть осуществлен с учетом массы тела пациента, что не должно рассматриваться как ограничение данного изобретения.
Помимо повышения концентрации активного метаболита и достижения более высокой ингибирующей тромбоциты активности, композиции и способы по настоящему изобретению, как полагают, снижают токсичность и/или сопутствующие побочные эффекты, наблюдаемые в результате образования клопидогрель кислоты (формула IV) после введения клопидогреля. Смертельная доза клопидогреля составляет около 5000 мг на кг у крыс и 90% клопидогреля превращается в клопидогрель кислоту in vivo. Таким образом, выяснено, что около 90% токсичности клопидогреля может быть связано с метаболитом клопидогрель кислоты (формула IV). С учетом того, что в композициях и способах по настоящему изобретению успешно обеспечивают снижение количества вводимого пациенту действующего ингредиента, а также устраняется формирование метаболитов клопидогрель кислоты после введения, сопутствующая токсичность и побочные эффекты будут снижены, по меньшей мере, в 9-10 раз по сравнению с используемым в настоящее время терапевтическим клопидогрелем.
Соединения, задействованные в композициях и способах по настоящему изобретению, предпочтительно находятся в форме их фармацевтически приемлемых солей, предпочтительны кислые соли. Примеры таких солей присоединения кислоты включают в себя соли с неорганическими кислотами, в особенности галогенводородными кислотами (например, фтористоводородная кислота, бромистоводородная кислота, йодистоводородная кислота или соляная кислота), азотной кислотой, углекислотой, серной кислотой или фосфорной кислотой; соли с низшими алкилсульфоновыми кислотами, например, метансульфоновой кислотой, трифторметансульфоновой кислотой или этансульфоновой кислотой; соли с арилсульфоновыми кислотами, например, бензолсульфоновой кислотой или п-толуолсульфоновой кислотой; и соли с органическими карбоновыми кислотами, такими как уксусная кислота, пропионовая кислота, масляная кислота, фумаровая кислота, винная кислота, щавелевая кислота, малоновая кислота, малеиновая кислота, оксиянтарная кислота, янтарная кислота, бензойная кислота, миндальная кислота, аскорбиновая кислота, молочная кислота, глюконовая кислота или лимонная кислота. Соли, которые не являются фармацевтически приемлемыми, также можно использовать при получении соединений, задействованных в способах и композициях по данному изобретению. Предпочтительные соли включают в себя хлористоводородную, кислую сернокислую и малеиновокислую соли.
В способах и композициях по настоящему изобретению может быть дополнительно задействовано одно или несколько активных соединений, в том числе антитромбоцитарные средства, такие как аспирин, цилостазол, дипиридамол и тому подобное, которые могут иметь аналогичный или отличный механизм действия с активным метаболитом клопидогреля для достижения требуемых уровней антитромбоцитарной активности. Данное второе или последующее антитромбоцитарное средство может быть введено отдельно, одновременно или последовательно с соединением по формуле II или его таутомером, или его производным, в его свободной форме или в качестве его фармацевтически приемлемой соли. Настоящее изобретение охватывает такие модификации для достижения желаемой цели ингибирования агрегации тромбоцитов.
В других аспектах настоящее изобретение обеспечивает фармацевтическую композицию в фиксированной дозе соединения по формуле II или его таутомеров, или производного по формуле IIA, или фармацевтически приемлемых солей, где данная доза указанного тиолактона выбрана из диапазона от 5 мг до 35 мг, и данная композиция, не обязательно, содержит в себе фармацевтически приемлемые инертные наполнители. Данная композиция в фиксированной дозе по настоящему изобретению может содержать в себе, или может вводиться вместе с одним или несколькими активными соединениями, включающими в себя антитромбоцитарные средства, такие как аспирин, цилостазол или тому подобное, которые могут иметь аналогичный или отличный механизм действия с активным метаболитом клопидогреля.
Данные фармацевтические композиции в фиксированной дозе по настоящему изобретению предпочтительно вводятся перорально ежедневно в виде лекарственной формы немедленного высвобождения или модифицированного высвобождения.
Данная лекарственная форма может быть сформулирована в виде дозированной формы для однократного введения, в виде двух раздельных дозированных форм, и/или в любом из множества вариантов, известных в данной области, которые включают в себя, но не ограничиваются ими, таблетки, пилюли, твердые капсулы, мягкие капсулы, фармацевтические пакеты-саше и порошки для восстановления.
Данные композиции по данному изобретению могут дополнительно содержать в себе нерастворимые в воде проницаемые полимеры, здесь определяемые как «полимеры модифицированного высвобождения», для урегулирования их профиля высвобождения. Эти полимеры могут быть нанесены слоем на композиции, такие как таблетки, микрогранулы, капсулы или пилюли, или могут быть смешаны с другими ингредиентами любой из композиций, перечисленных выше.
В одном варианте осуществления, данные фармацевтические композиции по настоящему изобретению обеспечены в форме таблеток, полученных в результате смешивания активных веществ с инертными наполнителями. Стандартные инертные наполнители включают в себя разбавители, филлеры, связующие вещества, смазывающие вещества, вещества, вызывающие дезинтеграцию, скользящие вещества, красящие вещества, пигменты, вещества, исправляющие вкус и запах лекарственного средства, полимеры модифицированного высвобождения, подслащивающие вещества, пластификаторы, и любые допустимые вспомогательные вещества, такие как усилители абсорбции, вещества, способствующие проникновению, поверхностно-активные вещества, вспомогательные поверхностно-активные вещества, и специализированные масла. Примеры инертных наполнителей включают в себя фосфаты кальция, такие как двухосновный фосфат кальция, безводный двухосновный фосфат кальция, трехосновный фосфат кальция, и тому подобное; микрокристаллическую целлюлозу, порошкообразную целлюлозу; крахмал, предварительно клейстеризованный крахмал; карбоксиметилкрахмал натрия; декстраты; маннитол; сорбитол; повидон; этилцеллюлозу; лактозу; каолин; кремневую кислоту; смазывающие вещества, такие как стеарат магния, стеарат кальция, стеариновая кислота, минеральное масло, глицерин, лаурилсульфат натрия, полиэтиленгликоль; и/или тальк. Карбоксиметилкрахмал натрия, тальк и смазывающее вещество стеарат магния могут быть использованы при получении композиций по настоящему изобретению для облегчения производства таблеток. Предварительно подготовленная смесь соединения по формуле II/IIA может быть получена в результате смешивания указанного соединения с ингредиентами, и следующим шагом является либо непосредственное прессование данной смеси в таблетки, или наполнение указанной смесью капсул, при желании вместе с другими подходящими ингредиентами, для получения конечной лекарственной формы. Унифицированная доза свободной формы соединения по формуле II/IIA может быть получена в виде гранулированной предварительно подготовленной смеси, с помощью соответствующей обработки этого соединения с приемлемыми ингредиентами, такими как полимеры, которая может быть непосредственно спрессована, или сформулирована с дополнительными инертными наполнителями.
Данные композиции и способы по настоящему изобретению можно применять для предотвращения и/или лечения патологических состояний, таких как заболевания сердечно-сосудистой и церебрально-васкулярной систем, таких как тромбоэмболические осложнения, ассоциированные с атеросклерозом или с диабетом, например, нестабильной стенокардией, мозговым повреждением, рестенозом после ангиопластики, эндартерэктомии или установкой металлических эндоваскулярных протезов, с повторным тромбообразованием после тромболизиса, с образованием инфаркта, с деменцией ишемического происхождения, с периферическими артериальными нарушениями, с гемодиализом, с мерцательной аритмией или во время применения сосудистых протезов или аортокоронарного шунтирования, или в отношении стабильной или нестабильной стенокардии.
Соединения по формуле II или их кислые соли могут быть получены любыми способами, раскрытыми в патентах США №№ 4740510 и 5190938, которые включены здесь посредством ссылки, для их различных сложноэфирных производных.
Без дополнительного описания, полагают, что специалист в данной области может, применяя предшествующее описание и последующие иллюстративные примеры, создать и применить соединения по настоящему изобретению, и применить на практике заявленные методы. Последующие примеры приведены для иллюстрации настоящего изобретения. Следует понимать, что данное изобретение не ограничено специфическими условиями или деталями, описанными в этих примерах.
Пример 1: (±)-соединение тиолактона по формуле II
10,43 г бикарбоната калия, 7,852 г йодида натрия и 11 г метил-2-бром-2-(хлорфенилацетата) добавляли в раствор 10 г 5,6,7,7a-тетрагидро-4H-тиено[3,2-c]пиридин-2-он гидрохлорида в 100 мл диметилформамида. Данную среду нагревали до 60°C в течение 2 часов и затем вливали в 600 мл воды. Продукт экстрагировали с использованием этилацетата.
Пример 2: Метил-(R)-2-гидрокси-2-(2-хлорфенил)ацетат
В сосуд объемом 1 л добавляли 120 г (0,643 моль) (R)-2-хлорминдальной кислоты, 480 мл метанола и 4,8 г концентрированной серной кислоты. Затем данный раствор нагревали до рециркуляции в течение 2 часов, и избыток метанола перегоняли в вакууме. Масляный остаток поглощали 650 мл хлороформа и отмывали с помощью 240 г водного раствора 10% карбоната калия и концентрировали под действием вакуума. Было получено 124,4 г метил-(R)-2-гидрокси-2-(2-хлорфенил)ацетата в форме бесцветного масла.
Пример 3: Метил-(R)-2-(4-нитрофенилсульфонилокси)-2-(2-хлорфенил)ацетат
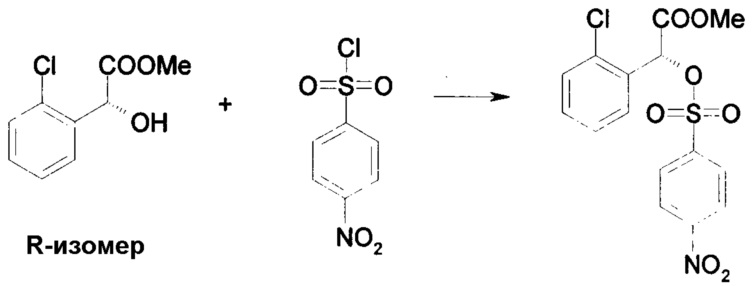
В сухую реакционную колбу добавляли 0,72 г (6 ммоль; 0,1 экв.) 4-диметиламинопиридина, 12,0 г (60 ммоль; 1 экв.) метил-(R)-2-гидрокси-2-(2-хлорфенил)ацетата и 7,8 г (78 ммоль; 1,3 экв.) триэтиламина и 20 мл дихлорметана. Полученный бесцветный раствор охлаждали до 0°C, а затем, действуя при этой температуре, добавляли 13,14 г (60 ммоль; 1 эквивалент) 4-нитробензолсульфонил хлорида в виде раствора в 30 мл дихлорментана. Данную реакционную смесь перемешивали в течение 3 часов при 0°C, и 240 мл 1 н. соляной кислоты и 240 мл дихлорметана добавляли по каплям, во время перемешивания данной смеси. После декантирования дихлорметановую фазу отмывали разбавленной соляной кислотой и затем водой, перед концентрированием в условиях пониженного давления. Химически чистый образец был получен после очистки на капиллярной кварцевой колонке. Таким образом, получен метил-(R)-2-(4-нитрофенилсульфонилокси)-2-(2-хлорфенил)ацетат: Выход: 98%. Оптическая чистота: 99%.
Пример 4: Метил-(S)-2(2-хлорфенил)-2(2,4,5,6,7,7а-гексагидротиено[3,3-с]-5-пиридин-2-он)ацетат
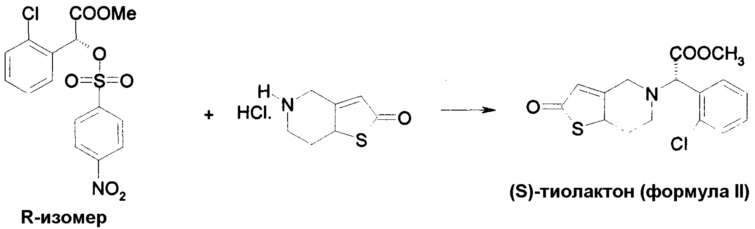
В сухой реакционной колбе объемом 50 мл смешивали 5 ммоль 5,6,7,7a-тетрагидро-4H-тиено[3,2-c]пиридин-2-он в виде раствора 7,5 мл дихлорметана (приготовлен из хлористоводородной соли после нейтрализации водным карбонатом калия) и 2,85 г 30% водного раствора карбоната калия. После перемешивания в течение 10 минут, добавляли 5 ммоль метил-(R)-2-(4-нитрофенилсульфонилокси)-2-(2-хлорфенил)ацетата в виде раствора в 2,5 мл дихлорметана. Таким образом полученную двухфазную среду нагревали с обратным холодильником в течение 1 часа и затем охлаждали до 7°C и декантировали. После выделения продукта реакции был получен (S)-изомер, называемый метил-(S)-2-(2-хлорфенил)-2-(2,4,5,6,7,7a-гексгидротиено[3,2-c]-5-пиридин-2-он)ацетат [(S)-тиолактон по формуле II]. Оптическая чистота (2'S)>98%.
Пример 5: Метил-(S)-2-(2-хлорфенил)-2-(2,4,5,6,7,7а-гексагидротиено[3,2-с]-5-пиридин-2-он)ацетат
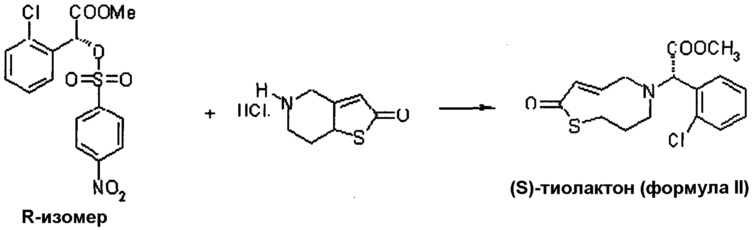
В сухой реакционной колбе объемом 250 мл смешивали 5,94 г (31,1 ммоль) 5,6,7,7a-тетрагидро-4H-тиено[3,2-c]пиридин-2-он гидрохлорида, 39 мл дихлорметана и 29,8 г 30% водного раствора карбоната калия. После перемешивания в течение 10 минут добавляли 10 г (25,9 ммоль) метил-(R)-2-(4-нитрофенилсульфонилокси)-2-(2-хлорфенил)ацетата в виде раствора в 13 мл дихлорметана. Таким образом полученную двухфазную среду нагревали с обратным холодильником в течение 6 часов. Затем охлаждали до приблизительно 30°C. Фильтровали данную реакционную массу. Фильтрат состоял из двух слоев. Слой MDC отмывали концентрированным соляным раствором. Высушивали безводным сернокислым натрием. После концентрирования был получен метил-(S)-2-(2-хлорфенил)-2-(2,4,5,6,7,7a-гексгидротиено[3,2-c]-5-пиридин-2-он)ацетат [(S)-тиолактон по формуле II].
Пример 6: Ацетил сложный эфир соединения по формуле II
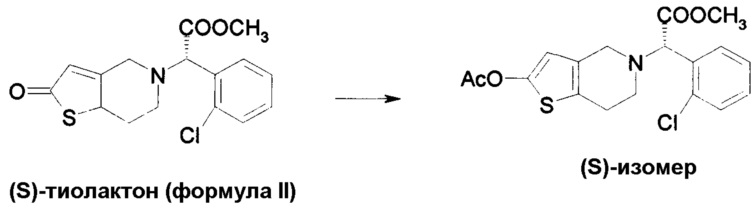
83,85 г (S)-соединения тиолактона по формуле II, полученного выше, растворяли в 120 мл изопренил ацетата и смешивали с 7,8 г п-толуолсульфокислоты. Данную смесь нагревали до 90°C при перемешивании в течение 6 часов. Затем, данную реакционную массу охлаждали приблизительно до 20°C, и к данной смеси добавляли 20 мл воды. Затем повышали основность данной смеси посредством добавления насыщенного водного раствора бикарбоната натрия, и экстрагировали добавлением этилацетата. Слой этилацетата далее отмывали дважды водой и перегоняли в вакууме для удаления этилацетата. Полученный остаток растворяли в ацетоне и пропускали газ HCl через данный раствор при охлаждении. Полученный осадок фильтровали, перекристаллизовывали из ацетона для получения хлористоводородной соли ацетил-производного. Оптическая чистота >99,5%.
Пример 7: Ацетил сложный эфир соединения по формуле II
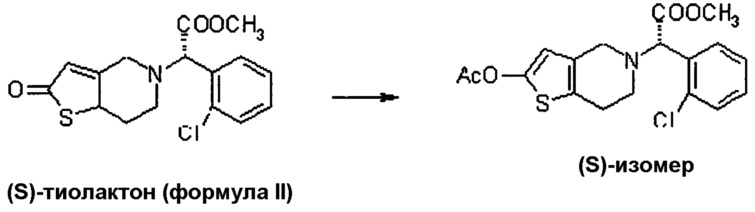
25 г (74 ммоль) соединения (S)-тиолактона по формуле II брали в 250 мл ацетонитрила. Данная смесь была охлаждена. Затем добавляли 9,03 г (95,1 ммоль) триэтиламина при перемешивании, после чего добавляли 9,11 г (95,1 ммоль) ангидрида уксусной кислоты при охлаждении. После добавления реакционную массу перемешивали при температуре окружающей среды. Затем отгоняли ацетонитрил. Остаток растворяли в этилацетате, отмывали водой и концентрировали. Полученный остаток растворяли в изопропаноле. Добавляли 1 моль эквивалент изопропанол·HCl раствора. Полученный преципитат фильтровали для получения хлористоводородной соли ацетильного производного.
Пример 8: Фармакология и токсикология
Фармакологические и токсикологические результаты, которые представлены ниже, демонстрируют свойства данных композиций по данному изобретению и с точки зрения токсичности и переносимости, и с точки зрения их активностей, в частности ингибирования тромбоцитов и тромбозной агрегации.
A. Токсикологическое исследование
Композиции по данному изобретению демонстрируют великолепную переносимость и низкую токсичность. Кроме того, тесты, проведенные на острую, хроническую, субхроническую и отложенную токсичность у различных видов животных, не выявили никакой местной или системной реакции, отклонения или нарушения при биохимических, макроскопических или микроскопических исследованиях, осуществленных в ходе этих экспериментов.
B. Фармакологическое исследование
Ингибирующую агрегацию тромбоцитов активность и токсичность композиций по данному изобретению сравнивали с таковыми клопидогреля, как описано в патенте Франции № 8212599 (публикация № 2530247), который включен здесь посредством ссылки.
Ингибирующие агрегацию тромбоцитов активности и антитромботические активности данных соединений были изучены на крысах с использованием стандартных методов.
1. Определение агрегации тромбоцитов с АДФ
Действие на агрегацию тромбоцитов, индуцированную АДФ или коллагеном, было определено ex-vivo.
Продукты реакции, растворенные в этаноле (200 мг/мл) и разбавленные водой, содержащей в себе аравийскую камедь (5% вес/об), были введены перорально группе из пяти самок крыс линии CD-COBS, с массой тела 250-300 г, в количестве 10 мл суспензии на килограмм, за два часа до забора образцов крови.
Образцы крови были взяты у животных, получивших анестезию диэтилэфиром, посредством прокола брюшной аорты, и помещены в 3,8% водный раствор цитрата натрия (1 об/9 объемов крови). Богатая тромбоцитами плазма затем была изолирована посредством центрифугирования при 200×g в течение 10 минут.
Агрегацию индуцировали путем добавления к 400 мкл богатой тромбоцитами плазме 2 мкл агрегирующего раствора. Используемые агрегирующие растворы: 500 мкМ водного раствора АДФ (конечная концентрация 2,5 мкМ).
Агрегацию тромбоцитов отслеживали, как описано у Born (Nature 194, p. 927 (1967)), включено здесь посредством ссылки, с использованием агрегометра Coultronics® при температуре 37°C и перемешивании при 900 об/мин.
Для агрегации с АДФ данный агрегометр формирует кривую, представляющую собой агрегацию тромбоцитов, измеренную по изменению оптической плотности. Высота данной кривой определяется как высота агрегации. Степень агрегации представляет собой соотношение между высотой агрегации, измеренной, и высотой, соответствующей 100% агрегации ×100. Процент ингибирования определяется по формуле:

Результаты, полученные для агрегации с АДФ, представлены в таблице 1, и они демонстрируют эту активность данной молекулы. Контроли представлены без лекарственного средства.
|
2. Антитромботическая активность
Антитромботическую активность также изучали в эсперименте венозного тромбоза на винтовой нарезке, описанном у Kumada T. et al. в Thromb. Res 18 p. 189 (1980).
Самкам крыс того же вида, как описанные ранее, в группах по 10 животных, давали анестезию диэтилэфиром, и выделяли их полую вену после лапаротомии.
Металлическую винтовую нарезку длиной 21 мм, состоящую из зубоврачебного сверла, реализуемого компанией Dyna (France), размер № 30, вводили в просвет этой вены непосредственно ниже почечной бифуркации, нисходящей по направлению к подвздошной вене, без повреждения стенки; 19-20 мм длины данной винтовой нарезки были имплантированы, а оставшийся 1 мм выступает через закрытый желудок наружу.
Тромбы формировались быстро и через пять часов, под анестезией пентобарбитала, брюшную полость повторно вскрывали и лигатуры накладывали выше и ниже винтовой нарезки, которую извлекали после продольного рассечения вены, и выделенный тромб взвешивали.
Результаты, которые представлены в Таблице 2, демонстрируют, что тиолактон по формуле II превосходит клопидогрель. Контроль представлен без лекарственного средства.
|
Несмотря на то что некоторые предпочтительные в настоящее время варианты осуществления данного изобретения были специфически описаны здесь, специалисту в области, к которой принадлежит данное изобретение, будет очевидно, что варианты и модификации различных вариантов осуществления, представленных и описанных здесь, могут быть осуществлены без отклонения от смысла и диапазона данного изобретения. Следовательно, предполагается, что данное изобретение ограничено только до степени, предусмотренной прикрепленной формулой изобретения и применимыми нормами закона.