Результат интеллектуальной деятельности: Способ формирования эзофагогастроанастомоза у больных с портальной гипертензией
Вид РИД
Изобретение
Изобретение относится к медицине, в частности к абдоминальной хирургии, и может быть использовано для формирования эзофагогастроанастомоза у больных с портальной гипертензией цирротического генеза.
Портальная гипертензия (ПГ) - гемодинамическое расстройство, связанное с тяжелыми осложнениями, включая асцит, печеночную энцефалопатию и кровотечение из варикозно расширенных вен пищевода и желудка. Заболевание характеризуется повышением давления в системе воротной вены с развитием коллатеральных путей тока крови в обход препятствия, вследствие чего и возникает указанный симптомокомплекс. Самой частой причиной ПГ является цирроз печени, при этом более чем у 90% пациентов развивается варикозное расширение вен (ВРВ) пищевода и/или желудка. ВРВ - прогрессирующее состояние, не имеющее тенденции к регрессу (Воробей А.В. Активная хирургическая тактика в лечении кровоточащего пищеводно-желудочного варикоза при портальной гипертензии / А.В. Воробей, В.В. Климович, А.В. Жура, Д.А. Некрасов, В.В. Ермак // Вестник хирургической гастроэнтерологии. - М., 2007. - №1. - с. 38-43).
Портальная гипертензионная гастропатия, варикозная трансформация вен желудка и пищевода, сосудистая эктазия антрального отдела желудка - основные причины кровотечений из верхних отделов желудочно-кишечного тракта, которые возникают у 17-41% больных циррозом печени. Профилактика пищеводно-желудочных кровотечений у таких пациентов является одной из главных проблем, так как при первом эпизоде геморрагии смертность больных достигает 50% и более (Мовчан К.Н. Эндоскопия в диагностике, профилактике и лечении кровотечений из варикозно расширенных вен пищевода / К.Н. Мовчан, А.В. Филин, Л.М. Мяукина [и др.] // Клиническая эндоскопия. - 2003. - №1. - С. 6-11; Жигалова С.Б. Варикозное расширение вен желудка у больных с портальной гипертензией: диагностика и лечение / С.Б. Жигалова, А.Г. Шерцингер, А.Б. Мелкумов // Анналы хирургической гепатологии. - 2010. - Т. 15. - №3. - С.59-63).
Высокая летальность при первичных кровотечениях из варикозно расширенных вен пищевода и желудка, ранние рецидивы и малая выживаемость при консервативном ведении этих больных говорят о необходимости хирургического лечения, как на высоте кровотечения, так и с целью предупреждения развития этого грозного осложнения (Ключников О.Ю. Хирургическое лечение кровотечений из варикозно расширенных вен пищевода и желудка: автореф. дис.... канд. мед. наук. / Ключников Олег Юрьевич. - Краснодар, 2007. - 15 с.).
В литературе продолжается дискуссия об эффективности и преимуществах консервативных и оперативных методов остановки и предупреждения кровотечений из варикозно расширенных вен пищевода и желудка при синдроме портальной гипертензии.
В настоящее время многие отечественные и зарубежные авторы при хирургическом лечении этой категории больных останавливают свой выбор на операциях азигопортального разобщения, которые используют наравне с портосистемным шунтированием (Ерамишанцев А.К. Эволюция хирургического лечения кровотечений из варикозно расширенных вен пищевода и желудка / А.К. Ерамишанцев // В кн.: 50 лекций по хирургии / Под ред. B.C. Савельева. - М.: Триада-Х, 2004. - С.490-50; Назыров Ф.Г. Тактика лечения кровотечения из варикозных вен гастроэзофагеального коллектора у больных с циррозом печени, осложненным портальной гипертензией / Ф.Г. Назыров, Х.А. Акилов, А.А. Мансуров // Вестн. хир. - 2002. - Т. 161, №3. - С.81-83). Однако одним из недостатков разобщающих операций является разрушение кардиального сфинктера, что ведет к развитию рефлюкс-эзофагита, который, в свою очередь, может послужить причиной рецидива кровотечения.
Это определяет актуальность поиска новых более радикальных методов воздействия на патогенетические механизмы возникновения кровотечения из варикозных вен пищевода.
Известен способ профилактики кровотечений из варикозно расширенных вен пищевода (патент РФ №2218104, 10.12.2003), заключающийся в верхне-средне-срединной лапаротомии, отличающийся тем, что выполняют спленэктомию, деваскуляризацию желудка по большой кривизне от уровня коротких сосудов до пищевода, деваскуляризацию желудка по малой кривизне от угла желудка до пищевода, пилоропластику, деваскуляризацию абдоминального отдела пищевода, мобилизацию и отведение левой доли печени, прошивание и перевязку диафрагмальной вены, сагиттальную диафрагмокруротомию, деваскуляризацию нижнегрудного отдела пищевода до уровня нижней легочной вены, пересечение в поперечном направлении пищевода на уровне нижнегрудного отдела и сшивание его.
Недостатки данного способа - сложная техника исполнения, высокий травматизм, отсутствие профилактики рецидивных кровотечений, несостоятельности анастомозов вследствие их формирования в зоне измененных тканей, а также отсутствие профилактики рефлюкс-эзофагита.
Известен способ хирургического лечения и предупреждения кровотечений при варикозном расширении вен пищевода и желудка (патент РФ №2220663, 10.01.2004), включающий внеслизистую миотомию и циркулярное прошивание вен в подслизистом слое, отличающийся тем, что абдоминальным доступом прецизионно выполняют наружную деваскуляризацию пищевода, кардии и проксимальных отделов дна и тела желудка, внеслизистую миотомию пищеводно-желудочного перехода осуществляют продольно и после циркулярного прошивания расширенных варикозных вен на всем протяжении миотомии, восстанавливают арефлюксную кардию.
Известен способ хирургического лечения и предупреждения кровотечений при варикозном расширении вен пищевода и желудка (патент РФ №2223696, 20.02.2004), включающий выполнение ваготомии, деваскуляризацию пищевода и желудка и наложение анастомоза, отличающийся тем, что абдоминальным доступом выполняют наружную деваскуляризацию пищевода, кардии и проксимальных отделов дна и тела желудка, выполняют продольную миотомию пищеводно-желудочного перехода с выделением подслизистого слоя, затем циркулярно пересекают слизисто-подслизистый слой пищевода, перевязывают варикозно расширенные вены слизисто-подслизистого слоя и восстанавливают последний анастомозом «конец в конец» рассасывающейся мононитью с захватом расширенных вен, завершают операцию формированием арефлюксной кардии, предварительно ушив миотомную рану.
Недостатками вышеописанных способов являются сложная техника исполнения и отсутствие профилактики рецидивных кровотечений и несостоятельности анастомозов вследствие их формирования в зоне измененных тканей.
Известен способ лечения варикозного расширения вен пищевода и кардиального отдела желудка (патент РФ №2285459, 20.10.2006) путем воздействия на варикозно расширенные вены пищевода, отличающийся тем, что проводят деваскуляризацию нижней трети пищевода и кардиального отдела желудка, циркулярное иссечение слизистой кардиального отдела желудка с варикозно расширенными венами с наложением двухрядного скобочного муко-субмукозного шва кардиального отдела желудка.
Выше указанный способ имеет свои недостатки. Способ недостаточно эффективен из-за высокого риска несостоятельности скобочного муко-субмукозного шва кардиального отдела желудка, отсутствия профилактики рефлюкса желудочного содержимого в пищевод, а также необходимости использовать дорогостоящие специальные инструменты и аппаратуру.
С точки зрения радикальности в ликвидации ВРВ пищевода и желудка, остановки кровотечения из вариксов и его профилактики существенное преимущество имеют операции азигопортального разобщения, в частности методики, при которых осуществляется резекция пищевода и формирование эзофагогастроанастомоза (Жерлов Г.К. Операция азигопортального разобщения при варикозном расширении вен пищевода / Г.К. Жерлов, Т.Г. Жерлова, А.П. Кошевой [и др.] // Бюллетень сибирской медицины. - 2007. - №3. - С. 76-82; Оноприев В.И. Азигопортальное разобщение с формированием арефлюксной кардии при варикозном расширении вен пищевода / В.И. Оноприев, В.М. Дурлештер, О.А. Усова [и др.] // Хирургия. - 2007. - №5. - С. 9-12; Гарелик П.В. Операции азигопортального разобщения в профилактике и лечении кровотечений из варикозно расширенных вен пищевода и желудка / П.В. Гарелик Э.В. Могилевец, Г.Г. Мармыш // Журнал Гродненского государственного мед. университета. - 2011. - №3(35). - С. 7-11). Однако для создания нового соустья между пищеводом и желудком и приемлемой эффективности такого вмешательства необходимо иметь представление о выраженности венозной сети желудка.
Известен способ эндоскопического лечения варикозных вен пищевода и профилактики эзофагеального кровотечения (патент РФ №2470598, 27.12.2012), заключающийся в визуальной оценке вен пищевода и выполнении лигирования вариксов в пищеводе с последующей аргоно-плазменной коагуляцией слизистой нижней трети пищевода, отличающийся тем, что через 14-20 дней после заживления язвенных дефектов после выполненного первоначального лигирования проводят эндосоноскопическую оценку строения венозного сосудистого русла в нижней трети пищевода, при обнаружении перфорантных вен и наличия кровотока в оставшихся венах после лигирования планируют и выполняют повторное прицельное лигирование вен пищевода и еще через 14-20 дней осуществляют эндоскопический контроль, оценивают визуально спадание вен пищевода, а затем используют аргоно-плазменную коагуляцию слизистой нижней трети пищевода, при этом локализацию вен во время эндосоноскопии осуществляют по циферблату, используя аорту, как постоянный ориентир на 12 часах, а для эндосоноскопии используют ультразвуковой зонд с радиальным сканированием, который проводится через биопсийный канал эндоскопа с торцевой оптикой.
Описанный способ не только не позволяет прервать патологический коллатеральный венозный сброс, но и существенно растянут во времени (длительность лечения достигает 1,5 месяцев), что существенно снижает эффективность методики, так как в течение этого срока риск возникновения рецидивного варикозного кровотечения остается крайне высоким.
Прототипом заявляемого метода нами выбран способ хирургического лечения и профилактики рецидива кровотечений при варикозном расширении вен пищевода и кардиального отдела желудка (патент РФ №2412657, 27.02.2011), включающий ваготомию и пересечение пищевода, отличающийся тем, что выполняют проксимальную селективную ваготомию, мобилизацию кардии, дна желудка и абдоминального отдела пищевода, абдоминальным доступом выполняют резекцию кардиального отдела желудка, ушивают культю желудка, формируют связочный аппарат пищевода, на передней стенке верхней трети желудка визуально определяют наименее васкуляризированную и недесерозированную зону, где накладывают двухрядный эзофагогастроанастомоз, после этого абдоминальный отдел пищевода и эзофагогастроанастомоз оборачивают дном желудка, которое подшивают и фиксируют к переднебоковым поверхностям пищевода и к правой и левой ножкам диафрагмы, ближе к их грудной части, затем дно желудка фиксируют к большой кривизне и передней стенке ниже эзофагогастроанастомоза.
Отсутствие объективной оценки васкуляризации передней стенки желудка является недостатком способа-прототипа, негативно сказывающимся на результатах операции, в частности на состоянии формируемого эзофагогастроанастомоза и профилактике кровотечений из соустья.
Задача изобретения - разработка индивидуальной системы эндосонографического определения объемной плотности сосудов передней стенки желудка для выявления наименее васкуляризированной зоны, оптимальной для формирования эзофагогастроанастомоза, при хирургическом лечении больных с портальной гипертензией.
Поставленная задача решается тем, что пациенту предварительно проводят эндоскопическую ультрасонографию, определяют толщину стенки органа, длину подслизистых вен и их диаметр в 3 позициях: две позиции - места ветвления сосудов, одна позиция - средний сегмент сосуда, рассчитывают объем тканей и общий сосудистый объем, вычисляют сосудистую плотность в области кардии и средней трети тела желудка и выбирают для оперативного вмешательства зону с сосудистой плотностью менее 50%.
Технический результат, получаемый от использования данной методики, заключается в сокращении числа послеоперационных осложнений и рецидивных кровотечений за счет информативности и точности выбора места формирования эзофагогастроанастомоза.
Заявляемое изобретение иллюстрируется фиг. 1-2.
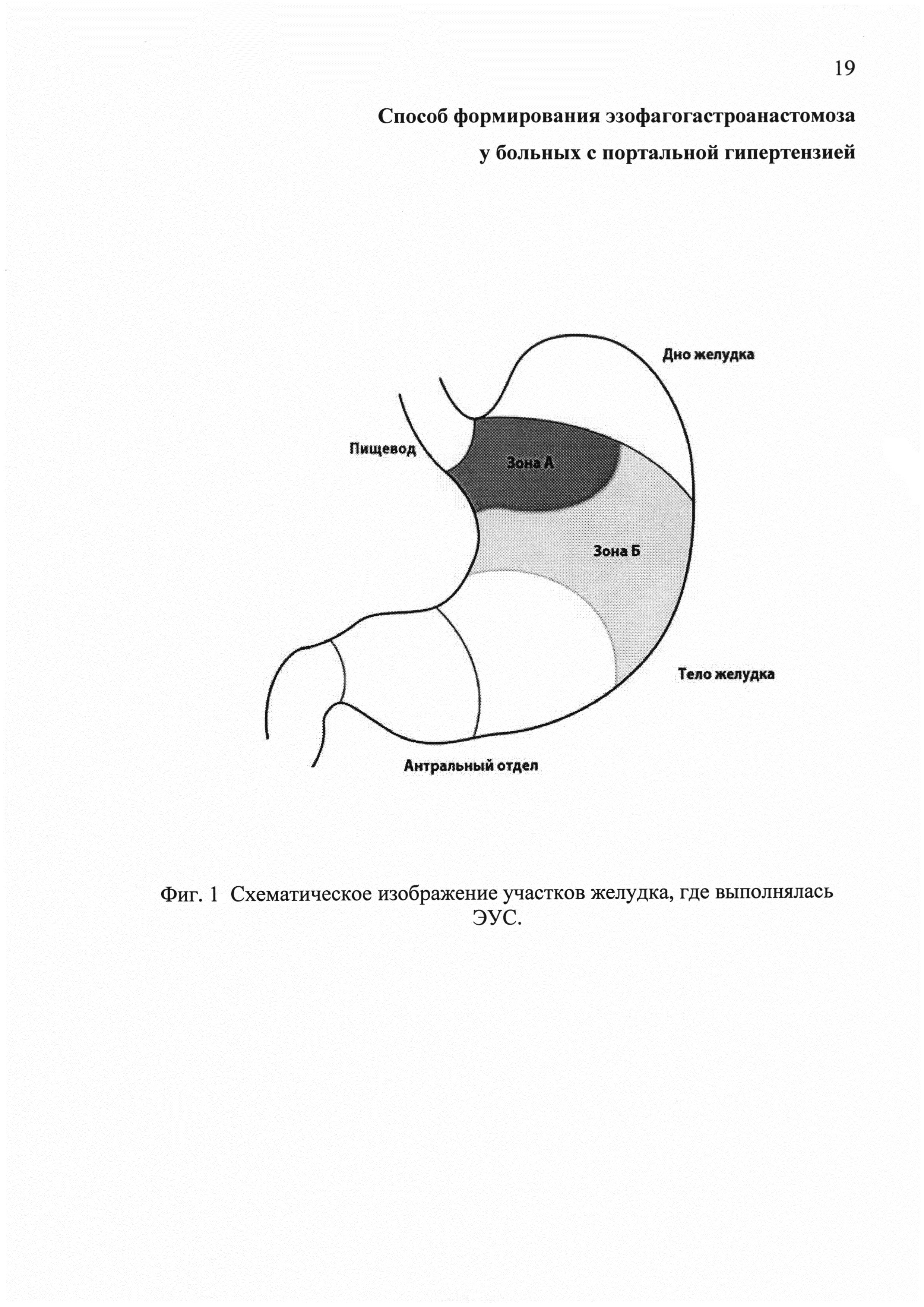
Фиг. 1 - схематическое изображение участков желудка, где выполнялась ЭУС.
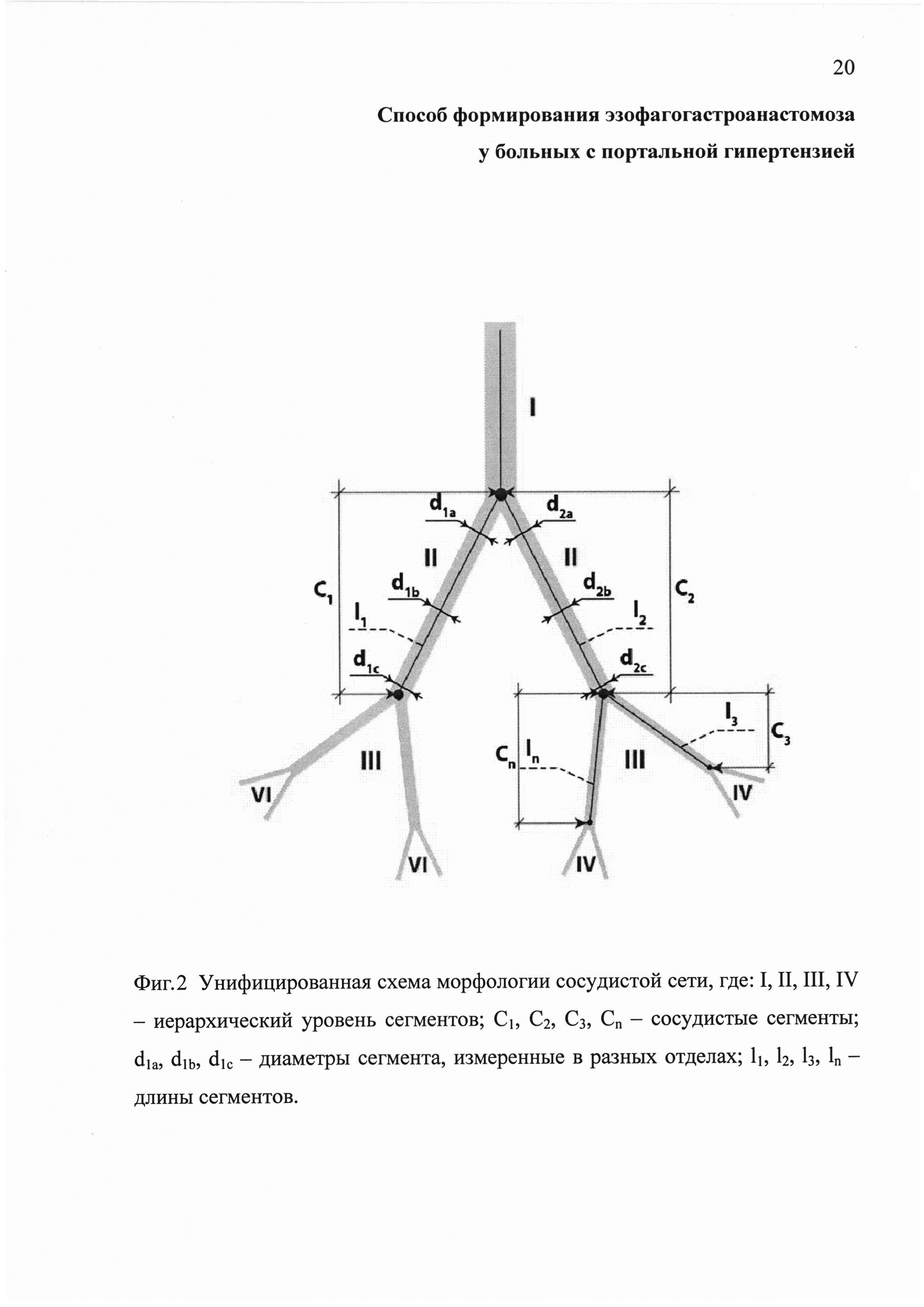
Фиг. 2 - унифицированная схема морфологии сосудистой сети, где I, II, III, IV - иерархический уровень сегментов; C1, С2, С3, Сn - сосудистые сегменты; d1a, d1b, d1c - диаметры сегмента, измеренные в разных отделах; l1, l2, l3, ln - длины сегментов.
С появлением новых технических решений, в частности эндоскопической ультрасонографии (ЭУС), стало возможным не только оценивать просвет органа, но и осуществлять ультразвуковое исследование его стенки, проводить осмотр сосудов системы воротной вены и коллатералей (Seicean A. Endoscopic ultrasound in the diagnosis and treatment of upper digestive bleeding: a useful tool / A. Seicean // Gastrointestin Liver Dis. - 2013. - Vol.22(4). - P. 465-469). Наиболее актуальным данное исследование представляется у больных циррозом печени, имеющих ПГ и ВРВ пищевода и желудка (Hammoud G.M. Utility of endoscopic ultrasound in patients with portal hypertension / G.M. Hammoud, J.A. Ibdah // World J Gastroenterol. - 2014. - Vol.20(39). - P. 14230-14236).
Благодаря комбинации эндоскопических и ультразвуковых возможностей, ЭУС позволяет визуализировать подслизистые вены пищевода и желудка при их расширении, что дает возможность проводить не только скрининговую диагностику ПГ, устанавливать степень ВРВ, но и, как следствие, определять лечебную тактику (Shim J.J. Use fulness of endoscopic ultrasound in esophagogastric varices / J.J. Shim // ClinEndosc. - 2012. - Vol.45(3). - P. 324-327; Sato T. Use fullness of electronic radial endoscopic color Doppler ultrasonography in esophageal varices: comparison with convex type / T. Sato, K. Yamazaki, J. Toyota [et al.] // J Gastroenterol. - 2006. - No.41. - P. 28-33). Следует отметить, что именно степень выраженности ВРВ во многом определяет тактику лечения больных с портальной гипертензией.
Разработанная нами методика определения сосудистой плотности (СП) с использованием ЭУС позволяет объективно определить наименее васкуляризированный участок передней стенки желудка, на котором будет производиться формирование эзофагогастроанастомоза, что обеспечивает надежность формируемого соустья и снижает риск ранних послеоперационных и рецидивных кровотечений. Тем самым повышается эффективность способа хирургического лечения и профилактики рецидива кровотечений при варикозном расширении вен пищевода и кардиального отдела желудка у пациентов с портальной гипертензией.
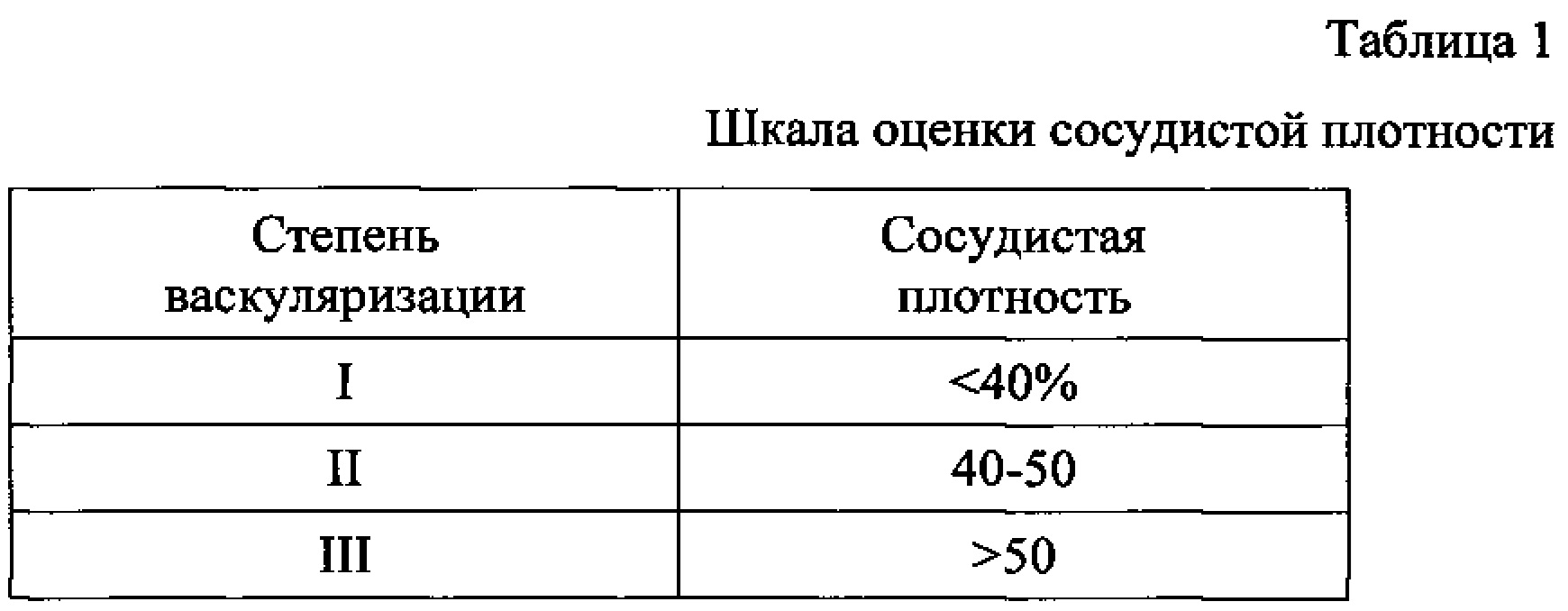
Нами была разработана шкала оценки СП, которая отображает степень васкуляризации стенки желудка (Таблица 1).
Представленные критерии основаны на анализе 50 клинических случаев ВРВ пищевода и желудка III и IV степени.
В ходе проведения ЭУС прицельно исследовались участки передней стенки желудка в области кардии (зона А) и средней трети его тела (зона Б) в связи с тем, что эти зоны представляются наиболее удобными для формирования анастомоза между пищеводом и желудком (Фиг. 1).
Опираясь на анатомические данные строения сосудистой системы, в частности ее иерархической структуры, ветвистости и неравномерности линейных и поперечных параметров, для проведения всех необходимых расчетов нами была использована схема, представленная на фиг.2.
Чтобы рассчитать СП, предварительно осуществляли расчеты промежуточных параметров, а именно: среднего диаметра сосудистого сегмента (Dc); площади, занимаемой сосудистым сегментом (sc); общей сосудистой площади (Sνas); объема сосудистого сегмента (νc), общего сосудистого объема (Vνas) и объема тканей (Vtis). Расчеты проводили по следующим формулам.
Диаметр сосудистого сегмента (Dc) вычисляли путем усреднения трех диаметров, измеренных в проксимальной, средней и дистальной точках вдоль сегмента:

где d - диаметр различных участков сегмента (а, b, с),
n - число измеренных участков сегмента.
Занимаемую сосудистым сегментом площадь (Sc) вычисляли путем умножения среднего диаметра сегмента (Dc) на его длину 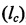 , которую определяли как расстояние между двумя точками ветвления по центральной оси сосуда:
, которую определяли как расстояние между двумя точками ветвления по центральной оси сосуда:

где Dc - средний диаметр сегмента,
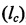 - длина сегмента.
- длина сегмента.
Расчет площади, занимаемой всеми сосудистыми сегментами на определенном участке ткани (Sνas), производили путем суммирования площадей каждого измеренного сегмента:
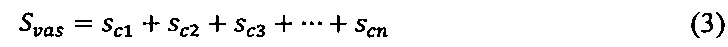
где sc - площадь сегмента (1, 2, 3…n),
n - n-й сегмент.
Для определения объемов сосудистых сегментов (νc) и общего сосудистого объема (Vνas) использовали следующие формулы:

где Dc - средний диаметр сегмента,
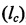 - длина сегмента;
- длина сегмента;
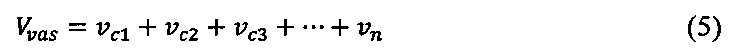
где ν - объем сегмента (1,2, 3…n),
n - n-й измеренный сегмент.
Объем тканей (Vtis), в котором осуществляли исследование сосудов, рассчитывали по формуле:

где Stis - площадь тканей,
htis - толщина тканей.
Конечный расчет, определяющий долю, занимаемую сосудами в конкретном объеме тканей (Dνas), производили по формуле:

где Vtis - объем тканей,
Vνas - общий сосудистый объем.
Реализация системы количественного определения СП в ткани была выполнена в программе Microsoft Office Excel (Microsoft, 2007), где стандартными средствами осуществлялся автоматизированный расчет всех параметров. Статистические расчеты были проведены в программе STATISTICA 10 (Stat Soft, Inc., 2011).
На основании данных, полученных в ходе исследования, установлено:
1) вне зависимости от степени выраженности ВРВ сосудистая плотность в области кардии (зона А) существенно превышает аналогичный показатель в средней трети тела желудка (зона Б) - 51,95±11,93% и 29,38±5,65% соответственно;
2) сосудистая плотность стенки желудка изменчива и зависит от степени ВРВ, однако средняя треть передней стенки, в сравнении с его кардиальным отделом, менее васкуляризирована, каким бы не было варикозное расширение вен. Данная зона, с точки зрения надежности формирования эзофагогастроанастомоза и профилактики ранних и поздних кровотечений, может рассматриваться как оптимальная.
Нами установлено, что 400 мм2 - это минимально допустимая величина площади, на которой в последующем может быть сформировано соустье.
Подробное описание метода и примеры его клинического выполнения
При поступлении всем больным с портальной гипертензией цирротического генеза, имеющим варикозное расширение вен пищевода и желудка, выполняют эзофагогастродуоденоскопию (ЭГДС) и определяют степень ВРВ (по А.Г. Шерцингеру). Больным, которым предполагается хирургическое вмешательство в объеме резекции пищевода и формирования эзофагогастроанастомоза? наряду с ЭГДС? выполняют ЭУС. Для удобства проведения, информативности и комфортных условий для пациента исследование проводят натощак после местной анестезии глотки под в/в наркозом (Нечипай A.M. ЭУСбука. Руководство по эндоскопической ультрасонографии / A.M. Нечипай, С.Ю. Орлов, Е.Д. Федоров [и др.]. - М.: Практическая медицина, 2013. - 398 с.).
Исследование больных проводят с помощью видеоэндоскопической системы Olympus Ехеrа II эхоэндоскопами радиального и конвексного типа с частотой сканирования 7,5 МГц. Система ультразвуковой диагностики Olympus EU-ME1 для преобразования УЗ-волн от датчика смонтирована на отдельной стойке. Сканирование производили в В-режиме с поддержкой режима цветового допплеровского картирования.
В ходе исследования прицельно исследуют участки передней стенки желудка, в области кардии (зона А) и средней трети его тела (зона Б), так как эти зоны представляются наиболее удобными при формировании анастомоза между пищеводом и желудком (Фиг. 1).
Площадь исследуемых участков при этом составляет 400 мм2. Это минимально допустимая величина площади, на которой в последующем может быть сформировано соустье.
На исследуемых участках определяют толщину стенки органа, протяженность (длину) подслизистых вен и их диаметр в 3 позициях: две позиции - места ветвления сосудов, и одна позиция - средний сегмент сосуда.
На основании полученных значений производят расчет, определяющий сосудистую плотность (СП) каждого исследованного участка, по формуле:
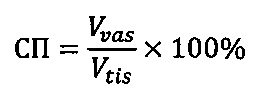
где Vνas - общий сосудистый объем,
Vtis - объем тканей.
Результирующие данные вносят в протокол эндоскопического исследования с указанием зоны с наименьшей СП. В последующем эти данные использует хирург при оперативном лечении больного.
При значениях СП свыше 50% степень васкуляризации считается высокой, от 40-50% - умеренно выраженной, менее 40% - низкой (см. таблицу 1). Оптимальными для формирования анастомоза являются участки с васкуляризацией I-II степени, которые и выбирают для формирования эзофагогастроанастомоза. Формирование эзофагогастроанастомоза на передней стенке верхней трети желудка в наименее васкуляризированной и недесерозированной зоне позволяет снизить риск рецидивных кровотечений и несостоятельности анастомоза.
Выбор места формирования эзофагогастроанастомоза и тактики хирургического лечения при варикозном расширении вен пищевода и желудка осуществляется лечащим хирургом на основании данных обследования индивидуально для каждого больного.
Работоспособность заявляемого способа подтверждается следующими клиническими примерами.
Клинический пример 1. Больная К-ец, 63 лет, поступила в хирургическое отделение 16.10.2014 г. с диагнозом: Цирроз печени вирусной этиологии, класс «С» по Чайд-Пью. Синдром портальной гипертензии. Варикозное расширение вен пищевода III-IV ст. Рецидивные пищеводные кровотечения. 16.10.2014 г. выполнено эдоскопическое исследование пищевода и желудка с последующей эндосонографией желудка. Протокол исследования. При исследовании выявлена деформация просвета пищевода за счет расширенных подслизистых вен, розетка кардии смыкается не полностью. Желудок обычной формы и размеров, складки слизистой выражены, направлены продольно, извиты, сама слизистая отечна, гиперемирована. При эндосонографии желудка (УЗ-центр EU-ME1, частота сканирования 7,5 МГц) с осмотром кардиального отдела (зона А) и тела (зона Б) исследовано по 4 участка на передней поверхности. Стенка желудка равномерно пятислойная, толщина ее в зоне А - 3,9 мм, в зоне Б - 3,6 мм. В подслизистом слое визуализируются множественные сосуды, с неоднородными расширениями от 3,3 до 5,2 мм. Выполнены замеры протяженности и диаметра сосудистых структур в указанных зонах. Заключение: эндоскопические признаки ВРВП IV ст., недостаточность кардии. СП в зоне А - 59,7%, в зоне Б - 46,6%.
17.10.14 г. больной выполнили: лапаротомию, селективную проксимальную ваготомию, резекцию эзофагокардиального перехода, сформировали анастомоз между пищеводом и телом желудка в зоне Б, произвели коррекцию пищеводно-желудочного перехода. Послеоперационный период протекал гладко. Больная была выписана в удовлетворительном состоянии на 21 сутки после операции. При контрольном осмотре через месяц состояние удовлетворительное. На ЭФГДС: пищевод свободно проходим, слизистая пищевода без признаков воспаления, при контакте с аппаратом не кровоточит, существенное запустевание варикозных вен.
Клинический пример 2. Больной П-ов, 45 лет, поступил в хирургическое отделение 06.08.2014 г. с диагнозом: Цирроз печени вирусной этиологии, класс «С» по Чайд-Пью. Синдром портальной гипертензии. Варикозное расширение вен пищевода III-IV ст. Рецидивные пищеводные кровотечения. 07.08.2014 г. выполнено эдоскопическое исследование пищевода и желудка с последующей эндосонографией желудка по протоколу клинического случая №1. Заключение: эндоскопические признаки ВРВП III ст., недостаточность кардии. СП в зоне А - 53,1%, в зоне Б - 39,3%.
08.08.14 г. больной оперирован. На передней стенке тела желудка сформирован эзофагогастроанастомоз, выполнена реконструкция эзофагокардиального перехода. Послеоперационный период протекал без осложнений. Больной был выписан в удовлетворительном состоянии на 18 сутки после операции.
Клинический пример 3. Больная С-ко, 56 лет, поступила в хирургическое отделение 25.07.2014 г. с диагнозом: Цирроз печени на фоне склерозирующего холангита класс «В» по Чайд-Пью. Синдром портальной гипертензии. Варикозное расширение вен пищевода III ст. Рецидивные пищеводные кровотечения. 25.07.2014 г. выполнено эдоскопическое исследование пищевода и желудка с последующей эндосонографией желудка по протоколу клинических случаев №1 и №2. Заключение: эндоскопические признаки ВРВП IV ст., недостаточность кардии. СП в зоне А - 61,1%, в зоне Б - 44,5%.
28.07.14 г. больной выполнено азигопортальное разобщение с формированием эзофагогастроанастомоза на передней стенке тела желудка, реконструкция эзофагокардиального перехода. Послеоперационный период протекал без осложнений. В удовлетворительном состоянии больная была выписана на 20 сутки после операции.
Методом эндоскопии пищевода и желудка с использованием эндосонографии обследованы 50 пациентов с портальной гипертензией цирротического генеза, имеющих различную степень ВРВ. Исследован желудок, в области его тела, с определением толщины передней стенки, визуализацией подслизистых вен в режиме допплерографии, осуществлением замеров линейных и объемных параметров сосудов. В ходе проведения ЭУС прицельно исследовались участки передней стенки желудка, в области кардии (зона А) и средней трети его тела (зона Б) в связи с тем, что эти зоны представляются наиболее удобными при формировании анастомоза между пищеводом и желудком.
Показатель СП в желудке изменчив в разных его отделах, пропорционален степени ВРВ и определяет зону наименьшей васкуляризации.
Среди обследованных пациентов ВРВ пищевода I ст. имели 9 (18%) больных, 13 (26%) больных - II ст., 15 (30%) больных - III ст. варикоза, и 13 (26%) - IV ст.
Методика определения сосудистой плотности стенки желудка позволяет объективно подходить к выбору места формирования эзофагогастроанастомоза.
Послеоперационных осложнений и летальных исходов не наблюдалось. Наблюдение за больными в поздние сроки после операции (до 12 мес) показало высокую эффективность заявляемого способа формирования эзофагогастроанастомоза у больных с портальной гипертензией.
С точки зрения надежности формирования эзофагогастроанастомоза у больных с портальной гипертензией и профилактики ранних и поздних кровотечений, участок передней стенки желудка с васкуляризацией I и II степени является оптимальным. Метод является объективным, надежным, малозатратным и технически простым в исполнении за счет индивидуальной оценки сосудистой плотности стенки желудка у больных с портальной гипертензией в предоперационном периоде.
Преимущества заявляемого способа формирования эзофагогастроанастомоза у больных с портальной гипертензией:
1. Способ позволяет повысить эффективность хирургического лечения ВРВ пищевода и кардиального отдела желудка у больных с портальной гипертензией.
2. Способ позволяет значительно снизить риск рецидивных кровотечений и несостоятельности анастомоза.
3. Способ позволяет предупредить и сократить число послеоперационных осложнений.
Способ формирования эзофагогастроанастомоза у больных с портальной гипертензией апробирован в клинике и может быть рекомендован к применению в хирургической практике в специализированных стационарах.
Заявляемый способ формирования эзофагогастроанастомоза у больных с портальной гипертензией апробирован на достаточном клиническом материале и может быть рекомендован к применению в специализированных стационарах.
Способ формирования эзофагогастроанастомоза у больных с портальной гипертензией, включающий исследование васкуляризации желудка, отличающийся тем, что на участках передней стенки желудка в области кардии и в зоне средней трети тела желудка рассчитывают объемы тканей и общие сосудистые объемы, являющиеся суммой объемов сосудистых сегментов, вычисляют в процентах сосудистую плотность участка стенки желудка как отношение общего сосудистого объема к объему тканей, и для наложения эзофагогастроанастомоза выбирают участок с плотностью менее 50%.