Результат интеллектуальной деятельности: Способ ранней доклинической диагностики болезни Паркинсона
Вид РИД
Изобретение
Изобретение относится к медицине, в частности к неврологии, и может быть использовано для диагностики болезни Паркинсона (БП) на ранней доклинической стадии.
Известен способ оценки функционального состояния центральной нервной системы, который, как и предлагаемый способ, может быть использован для ранней диагностики хронических заболеваний центральной нервной системы (Патент РФ №2039524). Сущность методики заключается в том, что регистрируют электроэнцефалограммы (ЭЭГ), выделяют определенные ритмы с последующей математической обработкой и оценкой активности мозга.
Недостатками является то, что ЭЭГ дает интегральную характеристику активности мозга и из нее, даже с помощью современных математических подходов, крайне сложно вычленить диагностические маркеры, соответствующие болезни Паркинсона. Следствием этого является низкая точность постановки диагноза, что не позволяет применять адекватные способы лечения. Кроме того, данный способ не позволяет дифференцировать две основные клинические формы болезни Паркинсона - ригидную и дрожательную.
Известен также способ дифференциальной диагностики нейродегенеративных заболеваний у больных с проявлениями деменции, в том числе при болезни Паркинсона. Способ заключается в том, что проводят исследования вызванных потенциалов Р300 с использованием вербальных и невербальных стимулов. Далее при наличии равномерно сниженных значений амплитуд потенциала Р300 по лобным и теменным отведениям делают вывод о деменции коркового типа (Патент РФ №2228708). Однако данный способ не используется для диагностики заболевания на доклинической стадии, а следовательно, не позволяет осуществить профилактическое лечение. Кроме того, данная методика является весьма трудоемкой.
Наиболее близким к предлагаемому изобретению является способ ранней диагностики болезни Паркинсона (заявка № WO 2011152699 [А2]), заключающийся в биохимической оценке уровня дофамина-хинона - продукта спонтанного окисления дофамина - в плазме крови испытуемого больного. В отличие от способов, известных по патентам РФ №№2039524; 2039524, данный способ является легковоспроизводимым и позволяет провести раннюю диагностику болезни Паркинсона.
К недостаткам данного способа можно отнести низкую точность постановки диагноза, поскольку при исследовании плазмы крови оценивается только дофамин-хинон - продукт спонтанного окисления дофамина (ДА), а не сами дофамины или прочие катехоламины, например, норадреналин (НА), и их функционально значимые метаболиты - 3,4-диоксифенилаланин (L-ДОФА) и диоксифенилуксусная кислота (ДОФУК). Кроме того, при разработке данного способа анализировалась только плазма крови пациентов с диагностированной болезнью Паркинсона, т.е. на клинической стадии, что не позволяет однозначно судить о воспроизводимости полученных результатов и для доклинической стадии заболевания.
Задача, которую решает предлагаемое изобретение, - это своевременная легкодоступная ранняя доклиническая диагностика болезни Паркинсона с возможностью дифференциации двух основных форм болезни Паркинсона - ригидной и дрожательной. Предлагаемая диагностика основана на комплексном анализе состава плазмы крови у больных на ранней клинической стадии.
Поставленная задача решается с помощью проведения диагностического теста методом оценки в плазме крови биомаркеров, являющихся прямыми показателями патологических изменений в метаболизме катехоламинов в масштабах целостного организма.
Создание теста основано на представлениях о том, что первые клинические проявления нарушений двигательной функции (моторные симптомы болезни Паркинсона) проявляются только после дегенерации большинства дофаминергических нейронов нигростриатной системы и вызванной этим денервации стриатума. При этом в процессе дегенерации нейронов включаются компенсаторные механизмы пластичности мозга, которые предотвращают проявление клинических моторных симптомов на протяжении десятков лет, а следовательно, исключают возможность ранней симптоматической диагностики заболевания. Однако в последние годы показано, что болезнь Паркинсона является системным заболеванием, причем немоторные проявления патологического процесса (нарушения работы сердца, желудочно-кишечного тракта, обонятельных рецепторов) проявляются гораздо раньше, чем нарушения моторной функции. Катехоламины и метаболиты легко диффундируют в общую систему циркуляции из катехоламинергических нейронов периферической нервной системы, а при болезни Паркинсона, в условиях нарушения гематоэнцефалического барьера, еще и из нейронов центральной нервной системы. При этом следует ожидать, что деградации центральных и периферических катехоламинергических нейронов у больных приведет к изменению содержания катехоламинов и метаболитов в плазме крови.
Сущность предлагаемого изобретения заключается в проведении диагностического теста путем сравнения состава образцов плазмы крови, полученных у испытуемого пациента с соответствующими показателями, полученными предварительно у здоровых людей, представляющих контрольную группу.
При проведении предложенного диагностического теста у испытуемого производят забор образцов плазмы крови и проводят биохимический анализ этих образцов с помощью метода высокоэффективной жидкостной хроматографии с электрохимической детекцией. При этом вместо измерения концентрации дофамина-хинона - продукта спонтанного окисления дофамина - измеряют концентрацию основных катехоламинов: норадреналина (НА) и дофамина (ДА), а также их функционально значимых метаболитов: L-ДОФА и ДОФУК. Измеренные концентрации упомянутых веществ в плазме крови испытуемого затем сравниваются с такими значениями параметров, как концентрация норадреналина (НА), дофамина (ДА), L-ДОФА и ДОФУК, предварительно определенными у здоровых людей. В случае значительных отличий концентраций определяемых веществ у испытуемого по сравнению со значениями в норме делается вывод о включении обследованного в группу риска по болезни Паркинсона, а также о форме этого заболевания - дрожательной или ригидной.
Проведение комплексного сравнительного анализа позволяет с высокой вероятностью поставить диагноз на доклинической стадии болезни Паркинсона с определением формы заболевания с целью применения адекватных способов лечения. Комплексный сравнительный анализ показывает, что характерной особенностью болезни Паркинсона у испытуемых пациентов является существенное снижение концентрации норадреналина (НА), дофамина (ДА), L-ДОФА и ДОФУК в плазме крови у больных с ригидной формой болезни Паркинсона по сравнению со значениями в норме, и существенное снижение концентрации норадреналина (НА) и L-ДОФА в плазме крови у больных с дрожательной формой болезни Паркинсона по сравнению со значениями в норме.
Перечень чертежей и их краткое описание.
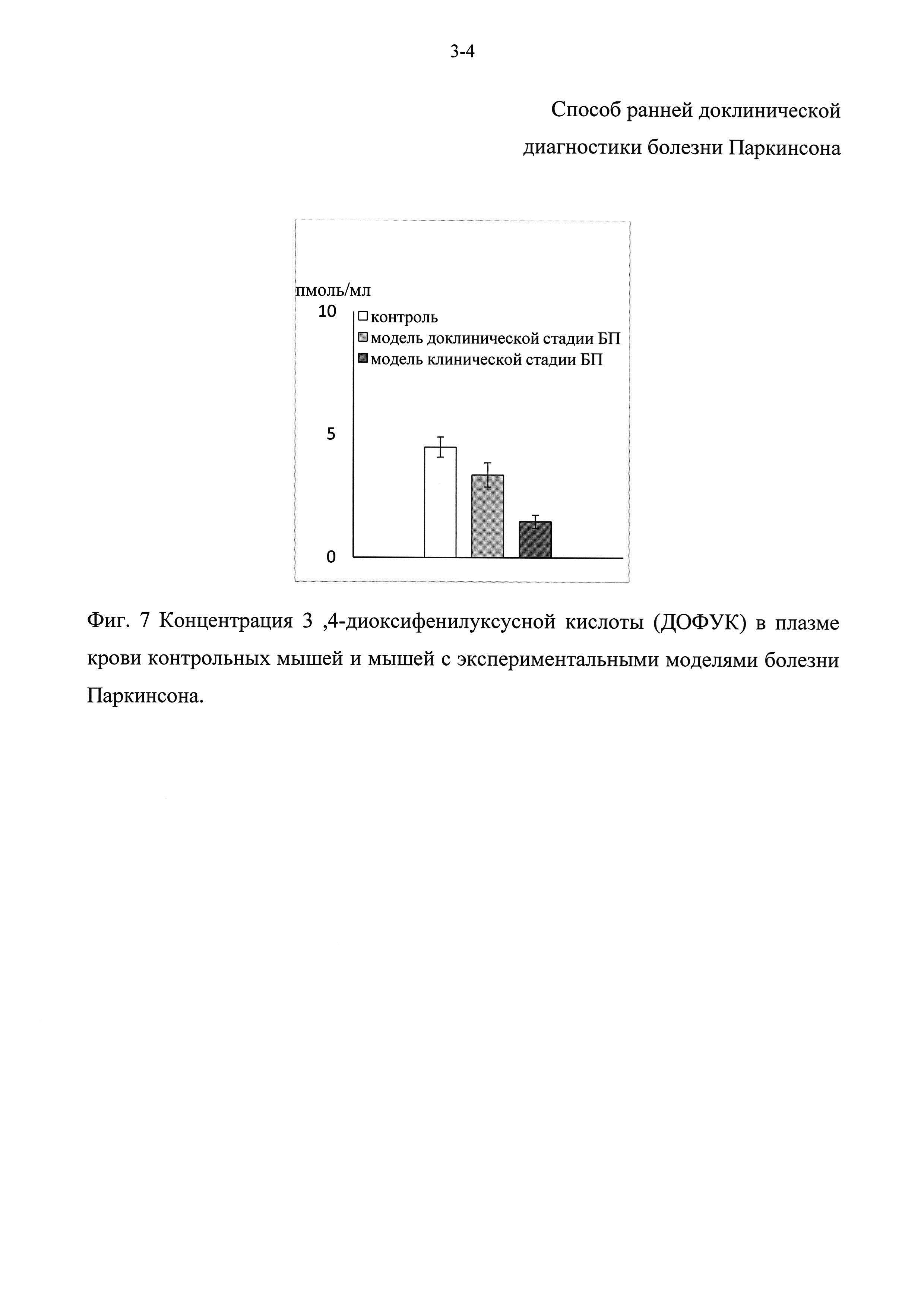
Фиг. 1 - Концентрация норадреналина (НА) в плазме крови у нелеченых больных на ранней стадии дрожательной или ригидной формы болезни Паркинсона.
Фиг. 2 - Концентрация дофамина (ДА) в плазме крови у нелеченых больных на ранней стадии дрожательной или ригидной формы болезни Паркинсона.
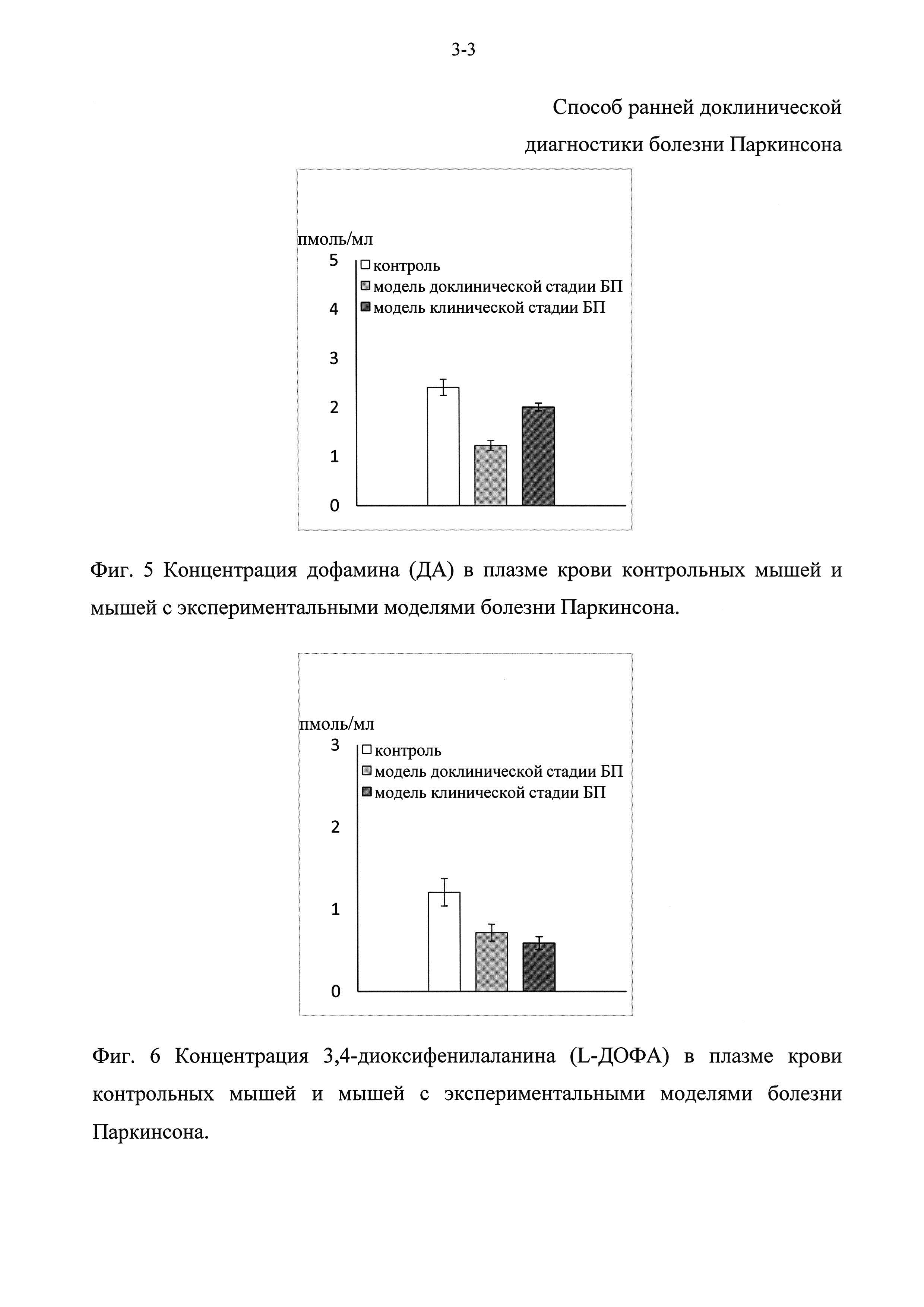
Фиг. 3 - Концентрация 3,4-диоксифенилаланина (L-ДОФА) в плазме крови у нелеченых больных на ранней стадии дрожательной или ригидной формы болезни Паркинсона.
Фиг. 4 - Концентрация 3,4-диоксифенилуксусной кислоты (ДОФУК) в плазме крови у нелеченых больных на ранней стадии дрожательной или ригидной формы болезни Паркинсона.
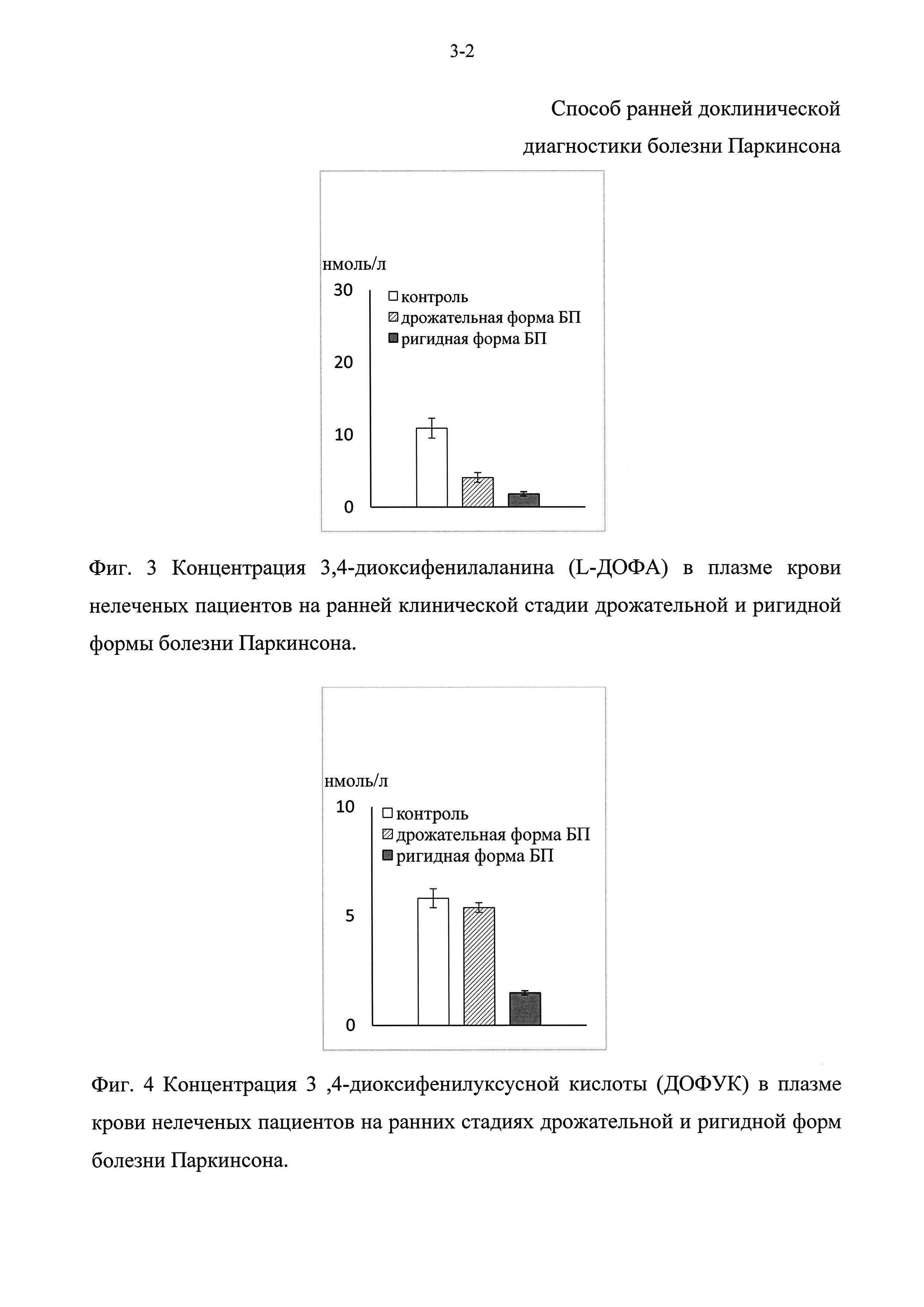
Фиг. 5 - Концентрация дофамина (ДА) в плазме крови у мышей в контроле и на моделях доклинической и ранней клинической стадии болезни Паркинсона.
Фиг. 6 - Концентрация 3,4-диоксифенилаланина (L-ДОФА) в плазме крови у мышей в контроле и на моделях доклинической и ранней клинической стадии болезни Паркинсона.
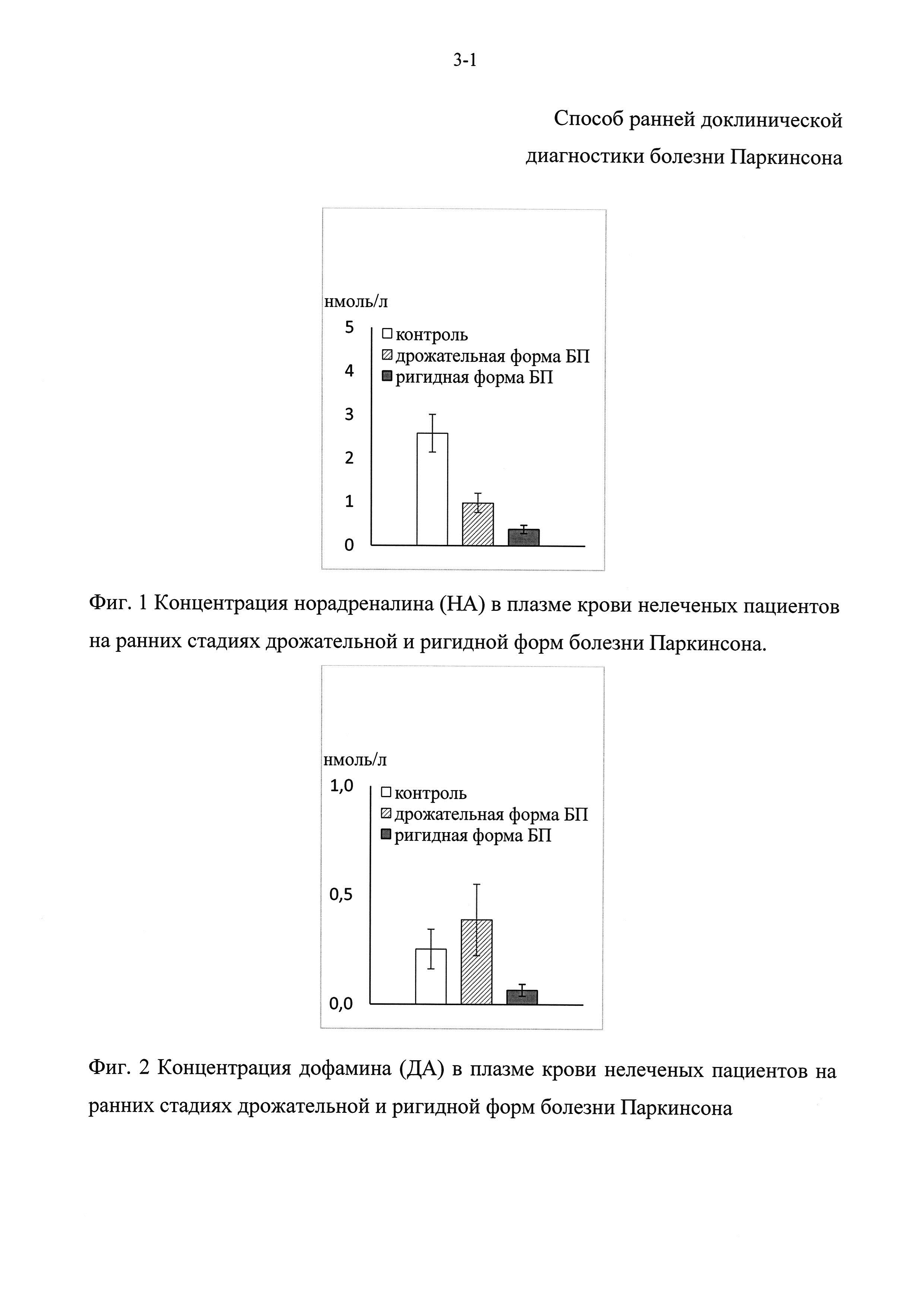
Фиг. 7 - Концентрация 3,4-диоксифенилуксусной кислоты (ДОФУК) в плазме крови у мышей в контроле и на моделях доклинической и ранней клинической стадии болезни Паркинсона.
Предлагаемый способ доклинической диагностики болезни Паркинсона осуществляется следующим образом. Кровь для определения катехоламинов отбирается у испытуемых в положении лежа. Кровь из локтевой вены (около 10 мл) собирается в охлаждаемую льдом пластиковую пробирку, содержащую 200 мкл 5% ЭДТА с 100 мкл 10% метабисульфита калия, осторожно перемешивается и сразу центрифугируется со скоростью 2500 об/мин при 4°C в течение 20 минут. Полученная плазма (супернатант) отбирается, замораживается и хранится до начала биохимических исследований (не более 60 дней) при -70°C.
Для определения содержания катехоламинов и их метаболитов используется высокочувствительный и селективный метод высокоэффективной жидкостной хроматографии с электрохимическим детектированием (ВЭЖХ-ЭД). Разделение анализируемых веществ производится с помощью обратно-фазовой хроматографии на колонках с сорбентом С-18 (4×100 мм, диаметр частиц 3 мкм) при температуре 23°C в условиях постоянного давления в подвижной фазе следующего состава: 0,1 М цитратно-фосфатный буфер, 0,3 мМ октансульфат натрия, 0,1 мМ ЭДТА и 8% ацетонитрил, рН 2,2. Потенциал стеклоуглеродного электрода электрохимического детектора равен +0,85 В, скорость потока - 1 мл/мин, температура колонки - 30°C. Концентрации норадреналина (НА), адреналина, дофамина (ДА), L-ДОФА и ДОФУК рассчитываются по площадям хроматографических пиков методом внутреннего стандарта.
Каждый из результатов анализа крови: концентрации норадреналина (НА), дофамина (ДА), L-ДОФА и ДОФУК является самостоятельным биомаркером, позволяющим диагностировать болезнь Паркинсона и определить обе или одну из форм заболевания. Снижение концентрации норадреналина (НА) в плазме крови на 57-67% является маркером дрожательной формы болезни Паркинсона. Снижение концентрации норадреналина (НА) на 80-90% - маркер ригидной формы болезни Паркинсона. Снижение концентрации дофамина (ДА) в плазме крови на 69-79% также является маркером ригидной формы болезни Паркинсона. Снижение концентрации L-ДОФА на 57-67% является маркером дрожательной формы болезни Паркинсона, а на 78-88% - маркером ригидной формы. Снижение концентрации ДОФУК на 69-79% является маркером ригидной формы болезни Паркинсона. Наибольшая точность постановки диагноза достигается при использовании комплексной оценки всех 4 показателей.
В сомнительных случаях уточнение диагноза осуществляется с помощью позитронно-эмиссионной томографии.
Следующие примеры иллюстрируют данный способ.
В исследовании приняли участие 20 нелеченых пациентов с недавно диагностированной в ходе неврологического обследования ранней клинической стадией болезни Паркинсона, среди которых 10 человек с дрожательной формой (7 женщин/3 мужчин, средний возраст 60,7 года), 10 - с ригидной (4 женщины/6 мужчин, средний возраст 57,8 лет). Стадии развития заболевания по пятибалльной шкале Хена и Яра для больных с дрожательной формой болезни Паркинсона в среднем были равны 1,5, а для больных с ригидной формой - 1,65. В группу контроля вошли 14 человек (12 женщин/2 мужчин, средний возраст 55,36 лет).
Исследование было выполнено на базе Госпиталя для ветеранов войн. Подбор пациентов для исследования проводился сотрудниками Центра экстрапирамидной патологии г. Казани. На проведение исследований получено разрешение этического комитета Минздрава Республики Татарстан. Все испытуемые подписали информированное согласие на участие в исследовании.
Концентрация норадреналина (НА) в плазме крови у пациентов как при дрожательной, так и при ригидной форме была гораздо ниже, чем в контрольной группе - в среднем соответственно на 62% и 84% (Фиг. 1). Более того, у больных с ригидной формой болезни Паркинсона концентрация норадреналина (НА) статистически достоверно ниже, чем у больных с дрожательной формой (Фиг. 1). Концентрация дофамина (ДА) в крови у пациентов с ригидной формой болезни Паркинсона была снижена на 74% в среднем по сравнению с контролем (Фиг. 2). Несмотря на то, что по средним значениям концентрация дофамина (ДА) в крови у больных с дрожательной формой выше, чем у испытуемых в контроле, достоверные различия отсутствуют из-за больших индивидуальных различий у больных с дрожательной формой. Тем не менее, концентрация дофамина (ДА) у больных с дрожательной формой многократно выше, чем у больных с ригидной формой (Фиг. 2). Концентрации L-ДОФА была снижена по сравнению с контролем при обеих формах болезни Паркинсона, однако при ригидной форме в большей степени, чем при дрожательной форме - соответственно на 83% и на 62% (Фиг. 3). Концентрация ДОФУК - продукта деградации дофамина (ДА), у больных с ригидной формой болезни Паркинсона была ниже на 75%, чем в группе контроля и у больных с дрожательной формой. При этом концентрация ДОФУК у больных с дрожательной формой была такая же, как и в контрольной группе (Фиг. 4).
Таким образом, проведенные клинические исследования показали наличие существенных изменений (уменьшения) концентрации катехоламинов и их метаболитов в плазме крови у нелеченых пациентов с дрожательной и ригидной формами болезни Паркинсона по сравнению друг с другом и с нормой.
Комплекс медицинского оборудования при проведении диагностического теста состоял из охлаждающей центрифуги для отделения плазмы крови, низкотемпературного холодильника для хранения замороженных образцов и жидкостного хроматографа с электрохимическим детектором для измерения концентрации катехоламинов.
Клиническим исследованиям предшествовало исследование на экспериментальных моделях болезни Паркинсона у животных. Моделирование болезни Паркинсона проводилось с помощью введения 1-метил-4-фенил-1,2,3,6-тетрагидропиридина (МФТП) - предшественника специфического нейротоксина катехоламинергических нейронов, который в мозге превращается в МПП+ - непосредственно нейротоксин. В опытах было использовано 27 самцов мышей линии C57BL/6N, возрастом 2-2,5 месяца и весом 22-26 г. Модель доклинической (n=9) стадии болезни Паркинсона воспроизводили двукратным подкожным введением МФТП (здесь и далее все реактивы - Sigma, США), в разовой дозе 8 мг/кг, модель ранней клинической стадии болезни Паркинсона (n=9) - четырехкратным введением МФТП в разовой дозе 10 мг/кг. В обоих случаях интервал между инъекциями составлял 2 часа. Контрольным животным (n=9) вводили физраствор по аналогичной схеме. Через 2 недели животных декапитировали с предварительной дислокацией шейных позвонков и собирали кровь в пробирки, в которые добавляли 5% ЭДТА и 10% метабисульфит натрия. Далее кровь центрифугировали в течение 10 мин при 400 g и 4°C, к отобранной плазме добавляли раствор внутреннего стандарта 3,4-дигидроксибензиламина (ДГБА) до конечной концентрации 25 пмоль/мл, после чего еще раз центрифугировали в течение 10 минут при 2000 g и 4°C. Отобранный супернатант замораживали в жидком азоте и хранили при -70°C до последующего измерения катехоламинов. Катехоламины плазмы крови осаждали на оксиде алюминия, после чего измеряли их концентрацию методом обращенно-фазовой высокоэффективной жидкостной хроматографии с электрохимической детекцией с использованием хроматографа LC-20ADsp (Shimadzu, Япония) и детектора Decade II (Antec, Нидерланды). Разделение проводили на 4×100 мм колонке Reprosil-Pur С18, 3 мкм (Dr. Maisch, Германия) в подвижной фазе следующего состава: 0,1 М цитратно-фосфатный буфер, 0,3 мМ октансульфат натрия, 0,1 мМ ЭДТА и 8% ацетонитрил, рН 2,2. Потенциал стеклоуглеродного электрода был равен +0,85 В, скорость потока - 1 мл/мин, температура колонки - 30°C. Концентрации норадреналина (НА), адреналина, дофамина (ДА), L-ДОФА и ДОФУК рассчитывали по площадям хроматографических пиков методом внутреннего стандарта.
На модели доклинической стадии болезни Паркинсона концентрация дофамина в плазме крови была снижена на 50% (Фиг. 5), а L-ДОФА - на 40% по сравнению с контролем (Фиг. 6), в то время как на модели ранней клинической стадии концентрация L-ДОФА была снижена на 51% (Фиг. 6), концентрация дофамина (ДА) не была снижена (Фиг. 5), а концентрация ДОФУК понизилась на 68% (Фиг. 7). Обнаруженное в плазме крови снижение уровня метаболитов дофамина (ДА) на модели ранней клинической стадии болезни Паркинсона хорошо согласуется с результатами, полученными при анализе крови у нелеченых больных, страдающих от ригидной формы болезни Паркинсона. Учитывая, что изменения, обнаруженные на моделях доклинической и ранней стадий болезни Паркинсона, не полностью соответствуют друг другу, и не все изменения, наблюдаемые в крови у больных на ранней клинической стадии болезни Паркинсона, могут служить потенциальными биомаркерами на доклинической стадии заболевания, то это повышает значимость предлагаемого подхода к комплексной оценке целой группы физиологически взаимосвязанных маркеров.
Таким образом, на экспериментальных моделях доклинической и ранней клинической стадий болезни Паркинсона продемонстрировано существенное снижение уровня катехоламинов и их метаболитов, что в значительной степени согласуются с изменениями, показанными при анализе крови у нелеченых больных.
Предлагаемый способ ранней доклинической диагностики болезни Паркинсона по использованию в качестве биомаркеров концентрации катехоламинов и их метаболитов в плазме крови может широко применяться при проведении диспансеризации населения, и в настоящее время является одним из наиболее достоверных. Его применение впервые позволит выявить заболевание на доклинической стадии по использованным показателям, а следовательно, применять профилактическое лечение с целью остановки гибели нейронов и продления доклинической стадии на неограниченно долгое время.
Способ ранней доклинической диагностики болезни Паркинсона, включающий определение в плазме крови с помощью ВЭЖХ концентрации норадреналина (НА), дофамина (ДА), 3,4-диоксифениоаланина (L-ДОФА), 3.4-диоксифенилуксусной кислоты (ДОФУК), сравнение концентрации этих показателей с концентрацией предварительно измеренной у здоровых людей и при снижении концентрации НА на 57-67% диагностируют дрожательную форму; при снижении концентрации норадреналина НА на 80-90% диагностируют ригидную форму; при снижении концентрации ДА в плазме крови на 69-79% - диагностируют ригидную форму; при снижении концентрации L-ДОФА на 57-67% диагностируют дрожательную форму; при снижении L-ДОФА на 78-88% диагностируют ригидную форму; при снижении концентрации ДОФУК на 69-79% диагностируют ригидную форму болезни Паркинсона.