Результат интеллектуальной деятельности: МОНОГИДРАТ МЕЗИЛАТА N-[5-(АМИНОСУЛЬФОНИЛ)-4-МЕТИЛ-1,3-ТИАЗОЛ-2-ИЛ]-N-МЕТИЛ-2-[4-(2-ПИРИДИНИЛ)ФЕНИЛ]АЦЕТАМИДА, ОБЛАДАЮЩИЙ ОПРЕДЕЛЕННЫМ ДИАПАЗОНОМ РАСПРЕДЕЛЕНИЯ ЧАСТИЦ ПО РАЗМЕРАМ И УДЕЛЬНОЙ ПЛОЩАДИ ПОВЕРХНОСТИ, ДЛЯ ИСПОЛЬЗОВАНИЯ В ФАРМАЦЕВТИЧЕСКИХ ПРЕПАРАТАХ
Вид РИД
Изобретение
Настоящее изубретение относится к кристаллическому моногидрату мономезилатной соли N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида с определенным диапазоном распределения частиц по размерам и удельной площади поверхности, который проявляет повышенную долговременную стабильность и улучшенную кинетику высвобождения из фармацевтических композиций, а также относится к фармацевтическим композициям, содержащим указанный моногидрат мономезилата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида, имеющий вышеуказанный диапазон распределения частиц по размерам и удельной площади поверхности.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Синтез N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида известен из EP 1244641 B1, а применение кислотных компонентов, включая метансульфоновую кислоту, при получении таблеток, содержащих микро измельченный N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамид, описано в WO 2006/103011 A1.
Целью настоящего изобретения является разработка специфической формы соли соединения N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида, которая характеризуется улучшенными свойствами в отношении стабильности и биодоступности, и таким образом делает эту специфическую форму соли предпочтительной при создании фармацевтических композиций, а также разработка фармацевтических композиций, содержащих такую специфическую соль, таким образом указанные фармацевтические композиции будут характеризоваться улучшенными свойствами в отношении стабильности и биодоступности, присущим содержащейся в них специфической форме соли соединения N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида.
Цель настоящего изобретения достигается, как изложено в независимых пунктах формулы изобретения. Другие предпочтительные признаки, особенности и детали настоящего изобретения становятся ясными из зависимых пунктов формулы изобретения, описания, фигур и примеров настоящей заявки.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
При комнатной температуре существуют четыре полиморфные формы и аморфная форма свободного основания N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида. Кроме того, могут быть обнаружены некоторые сольваты свободного основания N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида, в зависимости от растворителя. На основе существования вышеуказанных форм свободного основания N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида при комнатной температуре не может быть сделано заключение по термической стабильности. Следовательно, свободное основание N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида не является подходящим для долгосрочного стабильного препарата, поскольку долгосрочные свойства свободного основания N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида не могут быть определены. Кроме того, по сравнению с моногидратом мезилатной соли, низкая растворимость оказывает неблагоприятное воздействие на высвобождение лекарственного средства и свойства резорбции.
Неожиданно было обнаружено, что моногидрат мезилатной соли N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида преодолевает все недостатки свободного основания или других солей, если указанный моногидрат мезилатной соли обладает специфическими PSD (распределение частиц по размерам), PSR (интервал размера частиц) и SSA (удельная площадь поверхности).
Таким образом, настоящее изобретение относится к кристаллическому моногидрату N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты следующей формулы
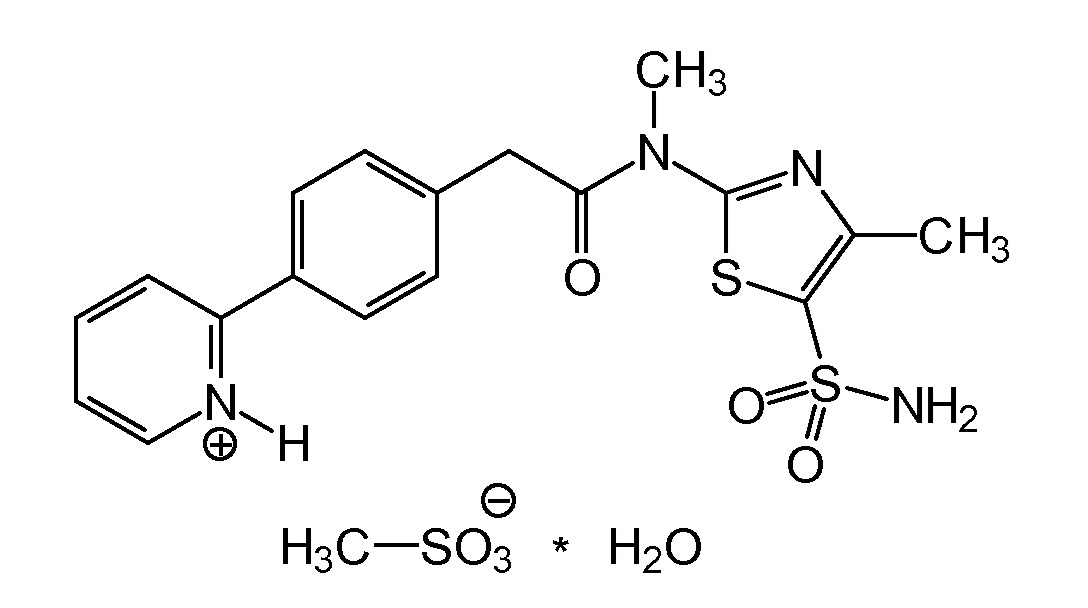
где частицы моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты имеют размер частиц в интервале от 1 до 500 мкм, распределение частиц по размерам, которое определяется как d(0,1) от 2 до 100 мкм, d(0,5) от 30 до 210 мкм и d(0,9) от 70 до 400 мкм и удельную площадь поверхности менее чем 1,0 м2/г.
Синтез моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты показан ниже
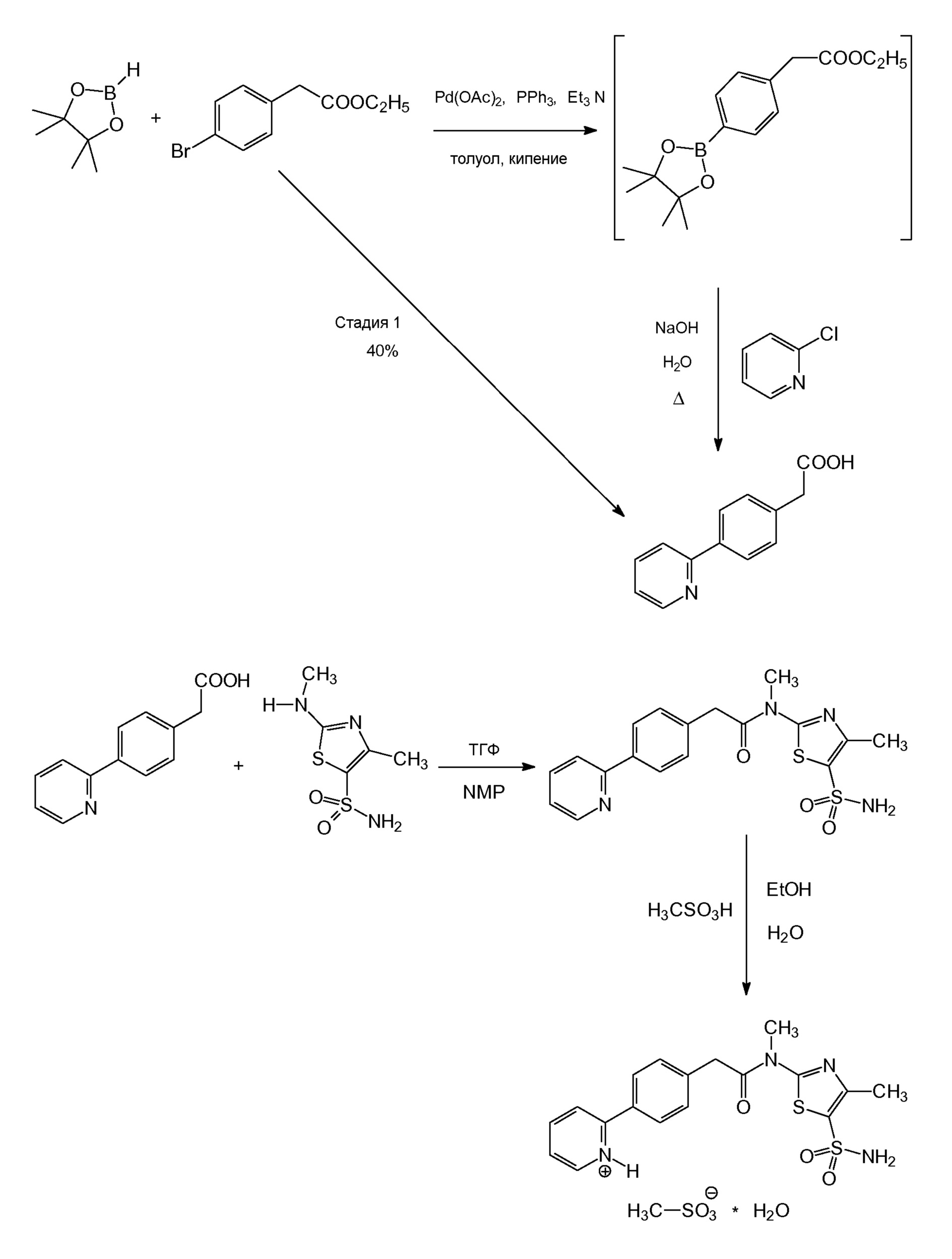
В вышеуказанном синтезе используется производное бороновой кислоты, боролановый или боринановый реагент, который подвергают взаимодействию с этил-4-бромфенилацетатом с целью получения ключевого промежуточного соединения, (4-пиридин-2-илфенил)уксусной кислоты, в одну стадию с общим выходом более 40% от теоретического. (4-Пиридин-2-илфенил)уксусную кислоту подвергают взаимодействию с 4-метил-2-(метиламино)-1,3-тиазол-5-сульфонамидом с образованием N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида (которое также называют в данном документе как «свободное основание»), который затем преобразуют в конкретный моногидрат мономезилатной соли (также называемый в данном документе как «моногидрат мезилата» или «моногидрат мезилатной соли»), обладающий специфическими PSD, PSR и SSA. Одностадийные стадии реакций для синтеза моногидрата мезилата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида представлены далее.
Стадия A: Взаимодействие соединения A следующей общей формулы A*
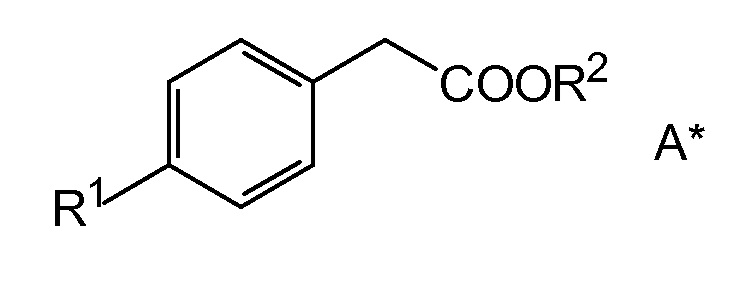 ,
,
где
R1 представляет собой удаляемую группу и
R2 представляет собой алкильный остаток, содержащий от 1 до 6 атомов углерода, или циклоалкильный остаток, содержащий от 3 до 6 атомов углерода,
с производным бороновой кислоты, бороланом, боринаном или реагентом дибороновой кислоты с элиминированием R1-H или R1-B(OR)2 и образованием промежуточного производного бороновой кислоты, соединения A,
где предпочтительными катализаторами реакции являются системы реагентов ацетата палладия с триэтиламином и с трифенилфосфином или PdCl2(PPh3)2 с триэтиламином,
где промежуточное производное бороновой кислоты затем подвергают взаимодействию с производным пиридина B следующей общей формулы B*
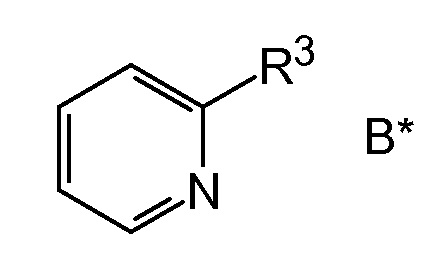 ,
,
где
R3 представляет собой удаляемую группу,
в основных условиях с целью получения (4-пиридин-2-илфенил)уксусной кислоты в виде щелочного раствора соответствующей карбоксилатной соли.
Полученную (4-пиридин-2-илфенил)уксусную кислоту очищают простым промыванием при различных pH и осуществляют стадии фильтрации после высаживания или кристаллизации, предпочтительно, путем установления должного рН водного кислого раствора (4-пиридин-2-илфенил)уксусной кислоты с соответствующим количеством основания равным 3,5-5,0, предпочтительно, 3,8-4,7. Помимо простой фильтрации и стадии промывки, дополнительной очистки (4-пиридин-2-илфенил)уксусной кислоты или какого-нибудь из промежуточных соединений, например, путем перекристаллизации или хроматографии, не требуется.
Стадия B: Взаимодействие (4-пиридин-2-илфенил)уксусной кислоты, полученной на стадии A, с 4-метил-2-(метиламино)-1,3-тиазол-5-сульфонамидом
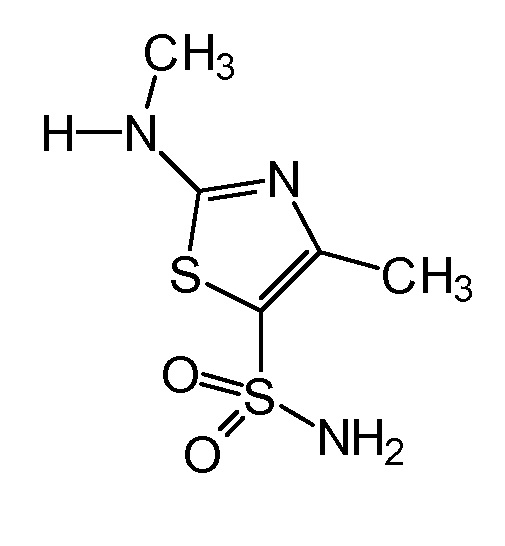
с целью получения N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида формулы
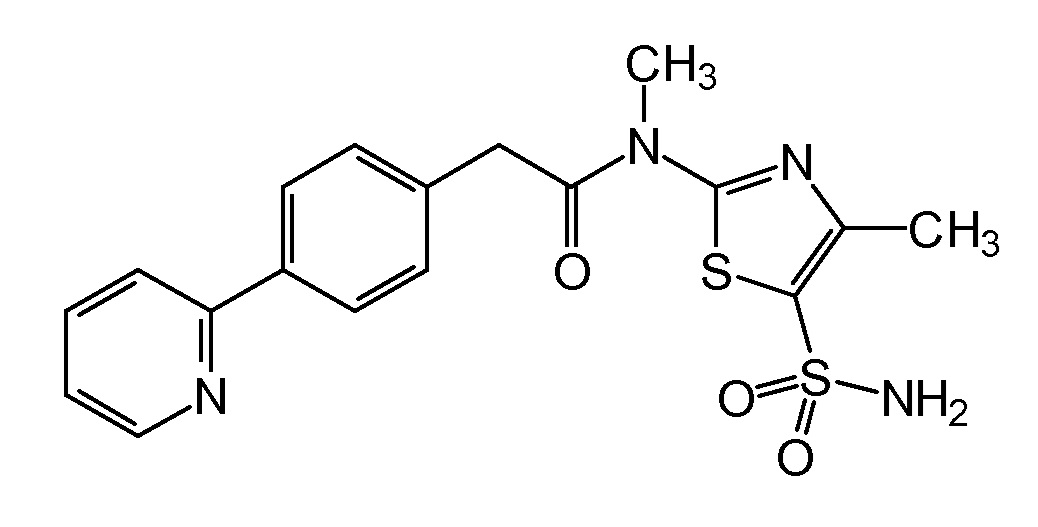
Далее, наиболее предпочтительно, N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамид преобразуют (как на стадии C) в неизвестный до настоящего времени моногидрат мезилатной соли N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида. Полученный моногидрат мезилата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамид затем формируют в виде частиц, имеющих размер частиц в интервале от 1 мкм до 500 мкм, и с распределением частиц по размерам, определяемым как d(0,1) от 2 до 100 мкм, d(0,5) от 30 до 210 мкм и d(0,9) от 70 до 400 мкм и имеющих удельную площадь поверхности частиц менее чем 1,0 м2/г, и, более предпочтительно, PSD определяемый как d(0,1) от 10 до 75 мкм, d(0,5) от 100 до 175 мкм, d(0,9) от 200 до 350 мкм с SSA частиц менее чем 0,3 м2/г.
В вышеуказанном синтезе термин «удаляемая группа», используемый в данном документе, обозначает молекулярный фрагмент, который отходит с парой электронов при гетеролитическом расщеплении связи. Удаляемые группы могут быть анионами или нейтральными молекулами. Общеизвестными анионными удаляемыми группами являются галогениды, такие как Cl-, Br- и I-, и сложные сульфонатные эфиры, такие как пара-толуолсульфонат («тозилат», TsO-), трифторметансульфонат («трифлат», TfO-, CF3SO2O-), бензолсульфонат («безилат», C6H5SO2O-) или метансульфонат («мезилат», MsO-).
Общая формула A*, показанная ниже,
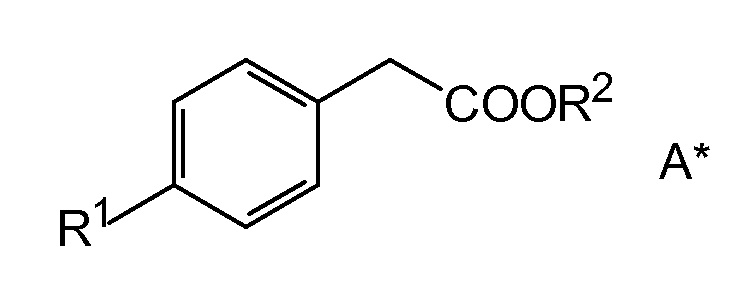
охватывает все сложные эфиры фенилуксусной кислоты, имеющие удаляемую группу на фенильном остатке в положении 4.
Таким образом, R1, предпочтительно, представляет собой -F, -Cl, -Br, -I, -OMs, -OTf и -OTs. Группа «-OMs» относится к -OМезилату, группа «-OTf» относится к -OТрифлату, и группа «-OTs» относится к -OТозилату.
Группа R2 представляет собой алкильный остаток, содержащий от 1 до 6 атомов углерода или циклоалкильный остаток, содержащий от 3 до 6 атомов углерода, и, предпочтительно, представляет собой -CH3, -C2H5, -C3H7, -CH(CH3)2, -C4H9, -CH2-CH(CH3)2, -CH(CH3)-C2H5, -C(CH3)3, -C5H11, -C6H13, цикло-C3H5, цикло-C4H7, цикло-C5H9, цикло-C6H11. Более предпочтительными являются -CH3, -C2H5, -C3H7, -CH(CH3)2, -C4H9, -CH2-CH(CH3)2, -CH(CH3)-C2H5, -C(CH3)3 и -C5H11. Особенно предпочтительными являются -CH3, -C2H5, -C3H7 и -CH(CH3)2.
На стадия А синтеза по изобретению, описанного в данном документе, могут быть использованы различные производные бороновой кислоты, бороланы и боринаны, а также производные соответствующей дибороновой кислоты. Предпочтительными являются бороланы следующей общей формулы:
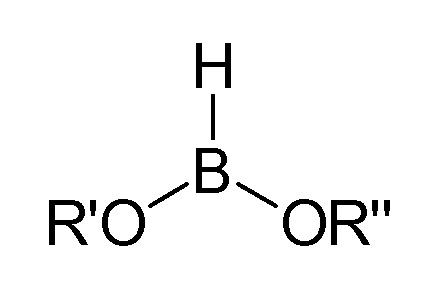
где
R′ и R″, независимо друг от друга, представляют собой замещенную или незамещенную, линейную или разветвленную алкильную группу, содержащую от 1 до 10 атомов углерода, или циклоалкильную группу, содержащую от 3 до 10 атомов углерода, или R′ и R″ также могут вместе с атомом бора образовывать гетероциклическое кольцо, где R′ и R″ вместе образуют замещенную или незамещенную, линейную или разветвленную алкиленовую группу, содержащую от 2 до 10 атомов углерода. Предпочтительно, R′ и R″ представляют собой, независимо друг от друга, -CH3, -C2H5, -C3H7, -CH(CH3)2, -C4H9, -CH2-CH(CH3)2, -CH(CH3)-C2H5, -C(CH3)3 и -C5H11. Циклические бороланы являются предпочтительными.
Следующие бороланы, боринаны и производные дибороновой кислоты являются предпочтительными:
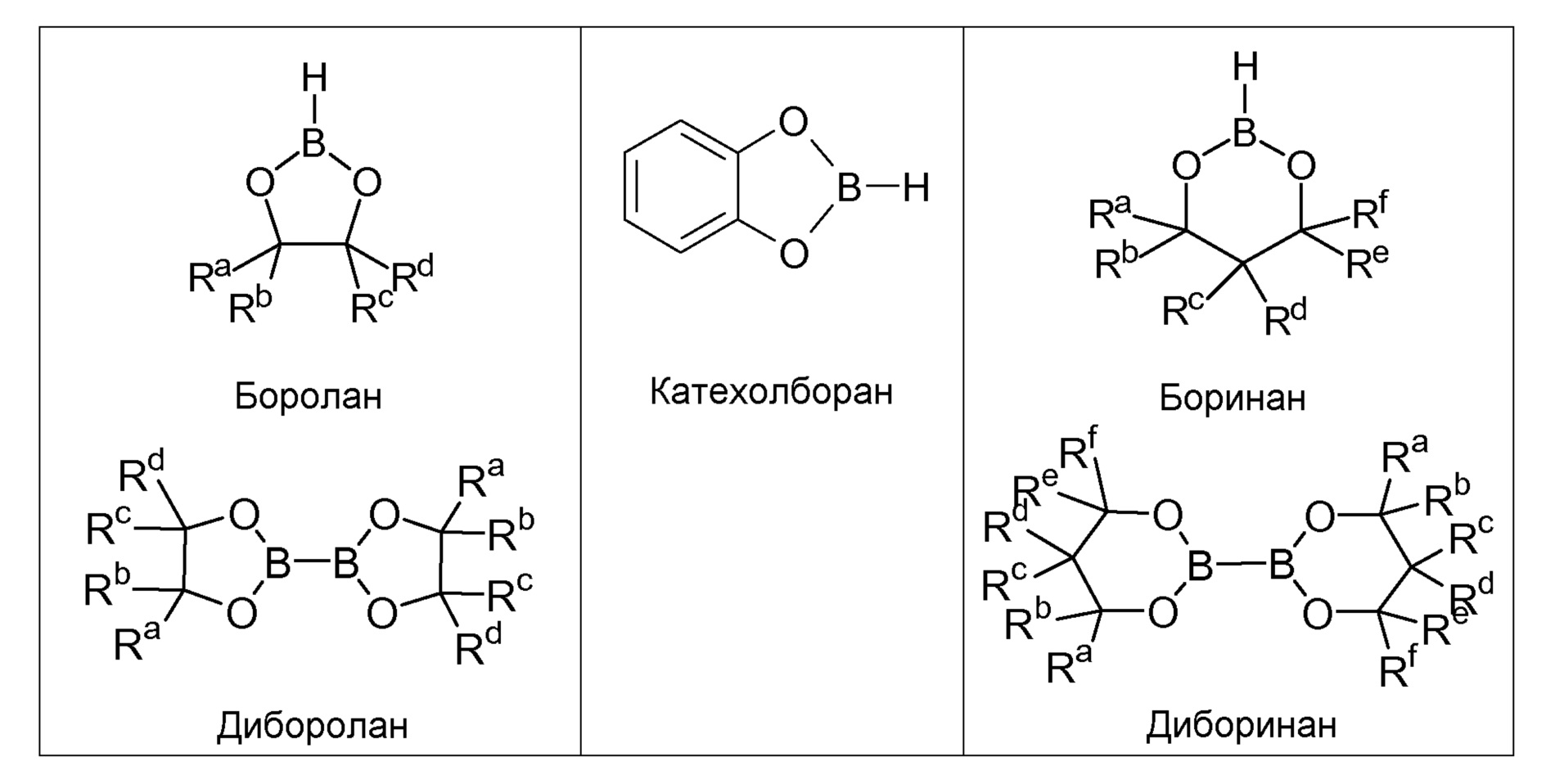
где Ra, Rb, Rc, Rd, Re и Rf представляют собой, независимо друг от друга, замещенную или незамещенную, линейную или разветвленную алкильную группу, содержащую от 1 до 10 атомов углерода, или циклоалкильную группу, содержащую от 3 до 10 атомов углерода. Предпочтительными являются линейные алкильные остатки, содержащие от 1 до 6 атомов углерода, и наиболее предпочтительными являются -CH3, -C2H5, -C3H7 и -CH(CH3)2.
Особенно предпочтительными примерами для вышеуказанных борсодержащих соединений являются 4,4,5,5-тетраметил[1,3,2]диоксаборолан (пинаколборан), [1,3,2]диоксаборолан, [1,3,2]диоксаборинан, 5,5-диметил[1,3,2]диоксаборинан, 4,6,6-триметил[1,3,2]диоксаборинан, 4,4,6,6-тетраметил[1,3,2]диоксаборинан, 4,4,5,5,6,6-гексаметил[1,3,2]диоксаборинан, диизопропоксиборан, гексагидробензо[1,3,2]диоксаборол, 9,9-диметил-3,5-диокса-4-бора-трицикло[6,1,1,62,6]декан, 6,9,9-триметил-3,5-диокса-4-бора-трицикло[6,1,1,62,6]декан, B2Pin2 (бис(пинаколато)диборан), бис(неопентилгликолято)диборон и катехолборан.
На стадии A указанное производное бороновой кислоты, боролан, боринан или реагент дибороновой кислоты, подвергают взаимодействию с соединением A общей формулы A* с целью получения промежуточного бороланового или боринанового реагента, который не выделяют и не очищают. Эта реакция может быть проведена с использованием либо катализаторов, образуемых in situ путем комбинации палладиевой соли, такой как [Pd(OAc)2] и PdCl2, с трифенилфосфином (PPh3), три-орто-толилфосфином (P(o-Tol)3), трициклогексилфосфин (PCy3), три-трет-бутилфосфином, 1,4-бис-(дифенилфосфино)бутаном (dppb) и 1,1′-бис-(дифенилфосфино)ферроценом (dppf), либо с предварительно полученными катализаторами, такими как Pd(PPh3)2Cl2, Pd(PPh3)4, Fibrecat 1032 и Pd(dppf)Cl2, в присутствии различных органических и неорганических оснований, таких как триэтиламин (Et3N), NaOAc, KOAc и K3PO4. При проведении данной реакции используется нагревание при температуре в интервале между 70°C и 150°C, предпочтительно, между 80°C и 130°C, более предпочтительно, между 90°C и 110°C. Кроме того, используются апротонные и, предпочтительно, аполярные растворители и, предпочтительно, ароматические растворители, такие как бензол, или толуол, или ксилолы.
Промежуточный реагент бороновой кислоты затем подвергают взаимодействию с пиридинильным соединением общей формулы B*, где R3 представляет собой удаляемую группу. Таким образом, R3 представляет собой -F, -Cl, -Br, -I, -OMs, -OTf и -OTs и, предпочтительно, -Cl или -Br.
Соответствующий сложный эфир (4-пиридин-2-илфенил)уксусной кислоты in situ обрабатывают водным основанием с целью расщепления сложноэфирной связи. Может быть удобным нагревать реакционную смесь в процессе стадии конденсации/омыления до средней температуры и, предпочтительно, до температуры в интервале между 40°C и 90°C, более предпочтительно, между 45°C и 80°C, еще более предпочтительно, между 50°C и 70°C и, наиболее предпочтительно, между 55°C и 65°C.
Посредством очистки и выделения ключевой промежуточной (4-пиридин-2-илфенил)уксусной кислоты получают (4-пиридин-2-илфенил)уксусную кислоту с выходом около 40% от теоретического, включая только одну стадию выделения и очистки.
Затем (4-пиридин-2-илфенил)уксусную кислоту подвергают взаимодействию с 4-метил-2-(метиламино)-1,3-тиазол-5-сульфонамидом формулы
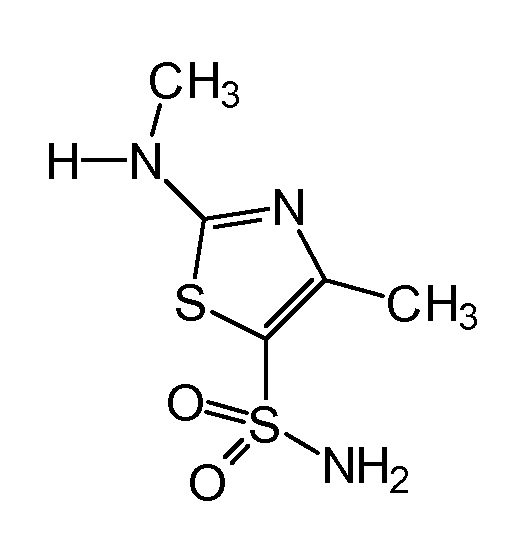
который был получен в соответствии с синтезом, описанным в EP 1244641 B1, с целью получения N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида формулы
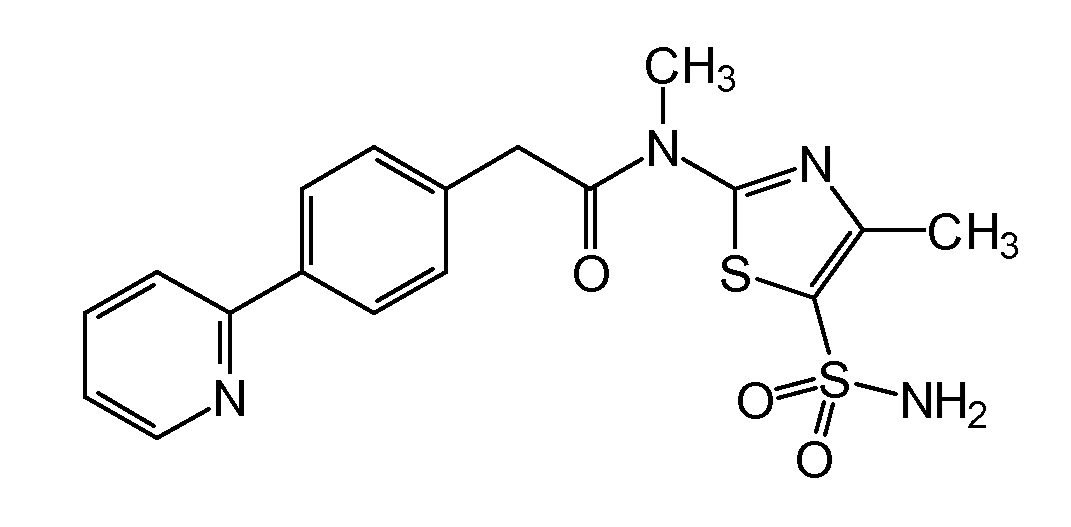
Указанный N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамид затем преобразуют в кристаллический моногидрат мезилатной соли, где типичный интервал размера частиц составляет от 1 до 500 мкм и распределение частиц по размерам, предпочтительно, определяется как d(0,1) от 2 до 100 мкм, d(0,5) от 30 до 210 мкм и d(0,9) от 70 до 400 мкм, и где кристаллические частицы имеют удельную площадь поверхности менее чем 1,0 м2/г, и, более предпочтительно, PSD определяется как d(0,1) от 10 до 75 мкм, d(0,5) от 100 до 175 мкм, d(0,9) от 200 до 350 мкм, и SSA частиц составляет менее чем 0,3 м2/г.
Параметр d(0,1) относится к размеру, выраженному в меш, отдельного условного сита, позволяющему пройти сквозь него 10% от общего количества всех частиц образца. Таким образом, d(0,1)=2-100 мкм означает, что верхний предел интервала размера частиц, определяющий 10% наименьших частиц в образце, составляет между 2 мкм и 100 мкм. Таким образом, 10% всех частиц имеют размер частиц не более чем d(0,1), это означает, что в этом случае они имеют максимальный размер от 2 мкм до 100 мкм.
Соответственно, параметр d(0,5) относится к размеру в меш отдельного условного сита, позволяющему пройти сквозь него 50% от общего количества всех частиц образца. Таким образом, d(0,5)=30-210 мкм означает, что верхний предел интервала размера частиц, определяющий теоретическую половину образца, содержащего более маленькие частицы, составляет между 30 мкм и 210 мкм. Таким образом, 50% всех частиц имеют размер частиц не более чем d(0,5), это означает, что в этом случае они имеют максимальный размер от 30 мкм до 210 мкм.
Соответственно, параметр d(0,9) относится к размеру в меш отдельного условного сита, позволяющему пройти сквозь него 90% от общего количества всех частиц образца, то есть, удерживается только 10% образца. Таким образом, d(0,9)=70-400 мкм означает, что верхний предел интервала размера частиц, определяющий 10% самых крупных частиц в образце, составляет между 70 мкм и 400 мкм. Таким образом, 90% всех частиц имеют размер частиц не более чем d(0,9), это означает, что в этом случае они имеют максимальный размер от 70 мкм до 400 мкм.
Кроме того, предпочтительным является, чтобы размер частиц для частиц кристаллического моногидрата мезилата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида был в интервале от 1 мкм до 500 мкм, предпочтительно, в интервале от 1,5 мкм до 450 мкм и, более предпочтительно, в интервале от 2 мкм до 400 мкм. Таким образом, интервал размера частиц (PSR) моногидрата мезилата составляет от 1,0 мкм до 500 мкм, предпочтительно, от 1,5 мкм до 450 мкм, более предпочтительно, от 2,0 мкм до 400 мкм, еще более предпочтительно, от 2,5 мкм до 300 мкм и, наиболее предпочтительно, от 3,0 мкм до 250 мкм. Если PSR совсем не указан или если отсылка к PSR сделана без указания определенного значения, то он должен быть отнесен к размеру частиц в интервале от 1 до 500 мкм.
Более того, предпочтительным является, когда распределение частиц по размерам для частиц кристаллического моногидрата мезилата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида охарактеризовано как d(0,1) от 4 до 100 мкм, d(0,5) от 30 до 210 мкм и d(0,9) от 70 до 400 мкм, более предпочтительно, d(0,1) от 6 до 95 мкм, d(0,5) от 50 до 200 мкм и d(0,9) от 100 до 390 мкм, еще более предпочтительно, d(0,1) от 7 до 90 мкм, d(0,5) от 70 до 190 мкм и d(0,9) от 130 до 380 мкм, еще более предпочтительно, d(0,1) от 8 до 85 мкм, d(0,5) от 80 до 185 мкм и d(0,9) от 160 до 370 мкм, еще более предпочтительно, d(0,1) от 9 до 80 мкм, d(0,5) от 90 до 180 мкм и d(0,9) от 180 до 360 мкм, еще более предпочтительно, d(0,1) от 10 до 75 мкм, d(0,5) от 100 до 175 мкм и d(0,9) от 200 до 350 мкм и, наиболее предпочтительно, d(0,1) от 11 до 70 мкм, d(0,5) от 110 до 170 мкм и d(0,9) от 220 до 340 мкм.
Кроме того, предпочтительным является, когда удельная площадь поверхности кристаллических частиц составляет менее чем 1,0 м2/г, более предпочтительно, менее чем 0,9 м2/г, еще более предпочтительно, менее чем 0,8 м2/г, еще более предпочтительно, менее чем 0,7 м2/г, еще более предпочтительно, менее чем 0,6 м2/г, еще более предпочтительно, менее чем 0,5 м2/г, еще более предпочтительно, менее чем 0,4 м2/г и, наиболее предпочтительно, SSA частиц составляет менее чем 0,3 м2/г.
Как используется в настоящем документе, термин «моногидрат мезилата, или «кристаллический моногидрат мезилата», или «моногидрат метансульфоновой кислоты», или «кристаллический моногидрат метансульфоновой кислоты», или «моногидрат мезилата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида», или «моногидрат N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида метансульфоновой кислоты» относится к кристаллическому моногидрату N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты, имеющего характеристики PSD, PSR и SSA, как определено в настоящем документе.
Кристаллический моногидрат N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты в соответствии с изобретением, предпочтительно, объединяют и используют в комбинации с ацетилсалициловой кислотой, трифлуридином, идоксуридином, фоскарнетом, цидофовиром, ганцикловиром, ацикловиром, пенцикловиром, валацикловиром, фамцикловиром и/или валганцикловиром. Особенно предпочтительными являются комбинации с ацетилсалициловой кислотой или ацикловиром или пенцикловиром, или с ацетилсалициловой кислотой или ацикловиром, или с ацетилсалициловой кислотой и пенцикловиром.
Моногидрат мезилата по изобретению или вышеупомянутые комбинации лекарственных средств используются, предпочтительно, при получении фармацевтической композиции для лечения и/или профилактики инфекционных заболеваний и профилактики передачи инфекционного заболевания и особенно инфекционного заболевания, вызванного вирусами простого герпеса.
Кристаллический моногидрат мезилата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида, который может быть получен описанным выше способом синтеза, затем используется для получения фармацевтической композиции, где моногидрат мезилата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида имеет распределение частиц по размерам (PSD), удельную площадь поверхности (SSA) и интервал размера частиц (PSR), как определено в настоящем документе. В указанную фармацевтическую композицию может быть добавлена ацетилсалициловая кислота, трифлуридин, идоксуридин, фоскарнет, цидофовир, ганцикловир, ацикловир, пенцикловир и/или их соответствующие пролекарства валацикловир, фамцикловир и/или валганцикловир. Некоторые поставщики используют название acyclovir вместо aciclovir. Более того, указанные фармацевтические композиции являются, предпочтительно, твердыми фармацевтическими композициями, не содержащими растворителей, разбавителей или жидкостей, обладающих солюбилизирующими свойствами в отношении активного фармацевтического ингредиента, для того, чтобы частицы не растворялись и оставались неизменными в отношении их распределения размера частиц, интервала размера частиц и удельной площади поверхности.
В WO2006/10301 1A описан способ влажного гранулирования при получении таблеток с использованием для основной формы разных кислот, включая метансульфоновую кислоту. В серии экспериментов по кристаллизации, исходя из N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида и бензойной кислоты, молочной кислоты и серной кислоты, кристаллическая соль (по-видимому, образующаяся в виде различных полиморфных форм) могла быть выделена только в случае с серной кислотой. Тем не менее, использование серной кислоты в процессе влажного гранулирования приводит к таблетке, обладающей неблагоприятными свойствами растворения (смотри таблицу 3 в WO2006/10301 1A). Повторение процесса влажного гранулирования (смотри пример 5 в WO2006/10301 1A) с использованием 1 эквивалента метансульфоновой кислоты в качестве кислотного компонента приводит к грануляту, который содержит смесь кристаллического свободного основания и моногидрата мезилатной соли (прибл. 90:10, обнаруживаемую путем сравнения спектров рентгеновской порошковой дифракции, которые существенно не изменялись в течение 4 недель при температуре 40°C (смотри фигуру 1). Было обнаружено, что эта смесь мезилат/свободное основание является неподходящей для получения таблеток, из-за свойств низкой растворимости и растворения, возникновения, по меньшей мере, четырех полиморфных форм и дополнительного риска дальнейшего взаимного превращения между основанием и солью формы при длительном хранении (также зависящим от зависимости содержания воды и таблеточной смеси). Таким образом, было весьма неожиданным, что может быть получен определенный моногидрат мезилатной соли N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида, и что этот определенный моногидрат мезилатной соли N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида, имеющий характеристики PSR, PSD и SSA, как описано в настоящем документе, устраняет все проблемы уровня техники, обеспечивает возможность получения стабильных, стабильных в течение длительного периода времени, и фармакологически применимых фармацевтических композиций, которые показывают явные преимущества для твердых композиций.
Для таблетирования текучесть смеси моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты, имеющего PSR, PSD и SSA, как определено в настоящем документе, с обычными фармацевтическими ингредиентами, улучшается при частицах большего размера и с более узким распределением частиц по размерам. По мере того, как размер частиц уменьшается, некоторые силы между частицами, такие как механическое взаимодействие, водородное связывание, электростатические и Ван-дер-Ваальсовы силы, могут преобладать над силами притяжения. Эти силы действуют на поверхности частиц, и более мелкие частицы имеют большую площадь поверхности по отношению к их массе, чем более крупные. Кроме того, эти переменные результаты могут быть обусловлены различиями в схемах измерения текучести, влажности воздуха и/или свойствах частиц, таких как исходный размер частиц. Широкое распределение частиц по размерам вызывает сегрегацию, которая оказывает влияние на усилие таблетирования, вес таблетки и однородность содержимого таблетки. Широкое распределение частиц по размерам порождает больше проблем с сегрегацией в процессе таблетирования, чем в случае партии гранул с меньшим распределением по размерам в пределах определенного диапазона. Таким образом, ввиду различных возможных диапазонов размера частиц, распределения частиц по размерам и удельных площадей поверхности, регулируемых различными способами, для специалиста в данной области было неожиданным, что диапазоны для PSD, SSA и PSR, как определено в настоящем документе, являются наиболее подходящими для получения фармацевтических композиций.
Узкое распределение частиц по размерам кристаллической формы моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты, например, для данного среднего размера частиц они имеют меньшее количество больших и маленьких частиц, является выгодным для прямого прессования в качестве способа изготовления таблетки. Полученное распределение частиц по размерам кристаллического моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты, где характеристики PSR, PSD и SSA являются такими, как определено в настоящем документе и, предпочтительно, где распределение частиц по размерам определяется значением d(0,1) от 2 до 100 мкм, d(0,5) от 30 до 210 мкм и d(0,9) от 70 до 400 мкм при удельной площади поверхности частиц менее 1,0 м2/г, и, более предпочтительно, определяется значением d(0,1) от 10 до 75 мкм, d(0,5) от 100 до 175 мкм, d(0,9) от 200 до 350 мкм при удельной площади поверхности частиц менее 0,3 м2/г, обладает физическими свойствами, которые специально адаптированы, чтобы иметь возможность обеспечить изготовление путем прямого прессования, минуя стадию мокрой или сухой грануляции.
В соответствии с изобретением, предпочтительно, что, по меньшей мере, 65% объем/объем, более предпочтительно, по меньшей мере, 70% объем/объем, даже более предпочтительно, по меньшей мере, 80% объем/объем, даже более предпочтительно, по меньшей мере, 85% объем/объем, даже более предпочтительно, по меньшей мере, 90% объем/объем, даже более предпочтительно, по меньшей мере, 95% объем/объем и наиболее предпочтительно, по меньшей мере, 99% объем/объем частиц кристаллического моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты попадают в диапазон размера частиц от 2 до 400 мкм. Более предпочтительно 40% объем/объем частиц моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида метансульфоновой кислоты попадают в диапазон размера частиц от 2-250 мкм.
Неожиданно было обнаружено, что использование кристаллической формы моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты в виде частиц, где характеристики PSR, PSD и SSA являются такими, как определено в настоящем документе, и, предпочтительно, где распределение частиц по размерам определяется значением d(0,1) от 2 до 100 мкм, d(0,5) от 30 до 210 мкм и d(0,9) от 70 до 400 мкм при удельной площади поверхности частиц менее 1,0 м2/г, и, более предпочтительно, определяется значением d(0,1) от 10 до 75 мкм, d(0,5) от 100 до 175 мкм, d(0,9) от 200 до 350 мкм при удельной площади поверхности частиц менее 0,3 м2/г в конечной смеси демонстрирует улучшенные сыпучие и когезивные характеристики порошка и демонстрирует свойство когезивного формования и сухого гранулирования, действие которых имеет большое значение для эффективного и надежного прямого прессования. Если присутствует слишком большое количество кристаллических частиц моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты, размеры частиц которого меньше, чем около 4 мкм, при последующей обработке обычно возникают дефекты на поверхности таблеток и прилипание. Если присутствует слишком большое количество кристаллических частиц моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты, размеры которых больше, чем около 400 мкм, прессуемость становится слишком слабой. Таким образом, наблюдается, что, по меньшей мере, 65% объем/объем кристаллического моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты подпадает в интервал размера частиц от 2 до 400 мкм, где распределение частиц по размерам, предпочтительно, определяется значением d(0,1) от 2 до 100 мкм, d(0,5) от 30 до 210 мкм и d(0,9) от 70 до 400 мкм при удельной площади поверхности частиц менее 1,0 м2/г, и, более предпочтительно, определяется значением d(0,1) от 10 до 75 мкм, d(0,5) от 100 до 175 мкм, d(0,9) от 200 до 350 мкм при удельной площади поверхности частиц менее 0,3 м2/г. При обработке кристаллического моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты распределение его частиц по размерам по существу неизменно, как правило, остается полностью неизменным. С точки зрения улучшения общих характеристик, предпочтительным является, что, по меньшей мере, 65% объем/объем, более предпочтительно, по меньшей мере, 70% объем/объем, еще более предпочтительно, по меньшей мере, 80% объем/объем, даже более предпочтительно, по меньшей мере, 85% объем/объем, даже более предпочтительно, по меньшей мере, 90% объем/объем, даже более предпочтительно, по меньшей мере, 95% объем/объем и наиболее предпочтительным, по меньшей мере, 99% объем/объем частиц кристаллического моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты имеют характеристики PSR, PSD и SSA, как определено в настоящем документе, и, более предпочтительно, подпадают в интервал размера частиц от 2 до 400 мкм, где распределение частиц по размерам, предпочтительно, определяется значением d(0,1) от 2 до 100 мкм, d(0,5) от 30 до 210 мкм и d(0,9) от 70 до 400 мкм при удельной площади поверхности частиц менее 1,0 м2/г, и еще более предпочтительно, определяется значением d(0,1) от 10 до 75 мкм, d(0,5) от 100 до 175 мкм, d(0,9) от 200 до 350 мкм при удельной площади поверхности частиц менее 0,3 м2/г.
Еще одним преимуществом таблетки в соответствии с изобретением является то, что таблетка будет иметь оптимальную скорость разрушения, исходя из распределения частиц по размеру его кристаллической формы моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты, который имеет характеристики PSD, PSR и SSA, как определено в настоящем документе, и, таким образом, препарат может абсорбироваться в кровоток гораздо быстрее по сравнению с N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамидом или его солью. Кроме того, неожиданные периоды времени дисперсии, полученные с таблетками в соответствии с изобретением, являются предпочтительными для проглатываемых таблеток. В дополнительном варианте осуществления таблетки в соответствии с изобретением могут быть представлены для получения дисперсии в воде.
Кристаллический моногидрат мезилатной соли N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида, где характеристики PSR, PSD и SSA являются такими, как определено в настоящем документе, демонстрирует улучшенные свойства долговременной стабильности и желаемую кинетику высвобождения и долговременность высвобождения из фармацевтических композиций, которые превосходят характеристики других солей N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида, которые, как известно из уровня техники, также включают другие мезилатные соли.
Как видно из фигуры 4, на которой показан рентгеноструктурный анализ монокристаллического моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты, соль образуется между мезилатом и протонированным пиридинильным кольцом. Кроме того, строго один моль эквивалента метансульфоновой кислоты и один моль эквивалента воды включен в кристаллическую структуру, где атомы водорода молекулы воды образуют водородные мостики с атомами кислорода двух различных молекул мезилата.
Предпочтительными условиями кристаллизации моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты является получение суспензии основания в около 10 об. (об. = л/кг свободного основания) этанол/воды (1:1), с добавлением 1,15 эквивалентов метансульфоновой кислоты при температуре 50-55°С в течение <15 мин, с затравкой 0,5% моль конечного продукта, выдержкой в течение 1-1,5 ч при температуре 50°C и охлаждением до 20-25°С в течение 2,5 час. После дополнительного перемешивания в течение 1 часа целевой продукт может быть выделен фильтрованием и сушкой в вакууме, в результате чего выход продукта составляет >95%. Используя эту процедуру, моногидрат N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида метансульфоновой кислоты, имеющий характеристики PSR, PSD и SSA, как определено, и, предпочтительно, имеющий интервал размера частиц от 2 до 400 мкм, где распределение частиц по размерам, предпочтительно, определяется значением d(0,1) от 2 до 100 мкм, d(0,5) от 30 до 210 мкм и d(0,9) от 70 до 400 мкм при удельной площади поверхности частиц менее 1,0 м2/г, и, более предпочтительно, определяется значением d(0,1) от 10 до 75 мкм, d(0,5) от 100 до 175 мкм, d(0,9) от 200 до 350 мкм при удельной площади поверхности частиц менее 0,3 м2/г, c чистотой >99% с содержанием <2 частей на миллион остаточного Pd, может быть получен воспроизводимо относительно выхода, чистоты, полиморфной формы, характеристик PSD, PSR и SSA, из перенасыщенного раствора N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида путем кристаллизации в контролируемых условиях, как описано далее.
Спонтанная кристаллизация из перенасыщенного раствора приводит к соосаждению свободного основания. Для имитации этого процесса, образец моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты растворяли в смеси этанола и воды (1:1) при температуре 50°C, а затем охлаждали и перемешивали при температуре 0°C в течение примерно 5 час. Образцы осадка отбирали для микроскопии, которая показывала в основном небольшие частицы иглообразной формы (фиг. 3А), в отличие от моногидрата мезилата, который кристаллизовался в виде призм (фиг. 3B). При исследовании выделенных частиц иглообразной формы с использованием 1Н ЯМР анализа (ядерный магнитный резонанс) мезилат обнаружен не был, демонстрируя, таким образом, присутствие, в основном, формы свободного основания. Содержание суспензии этого осадка при температуре от 0°C или при комнатной температуре показало медленный рост призм, использующих частицы иглообразной формы (фиг. 3C), что свидетельствовало об очень медленном превращении в форму мезилатной соли. Этот эксперимент демонстрирует важность выбора хорошо подобранных условий кристаллизации.
Для получения моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты с желаемыми характеристиками PSD, PSR и SSA, также является предпочтительным снижение до медленного перемешивания указанной смеси и постепенное охлаждение этой смеси до комнатной температуры. Кроме того, предпочтительным является добавление метансульфоновой кислоты в течение 5-15 минут при повышенной температуре и выдерживание полученной смеси при этой повышенной температуре в течение от 1 до 2 часов после завершения добавления метансульфоновой кислоты. Охлаждение до комнатной температуры осуществляют в течение от 2 до 3 часов, и смесь затем медленно перемешивают в течение дополнительного часа при комнатной температуре. Затем кристаллы отфильтровывают, промывают смесью спирт/вода и сушат в вакууме при температуре в интервале между 20°C и 60°C, предпочтительно, начиная при температуре 20°C и заканчивая при температуре 60°C.
В модифицированном способе получения моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты с желаемыми характеристиками PSD, PSR и SSA используют следующие условия для кристаллизации. Метансульфоновую кислоту добавляют при повышенной температуре, и, предпочтительно, между 30°C и 90°C, более предпочтительно, между 35°C и 80°C, еще более предпочтительно, между 40°C и 70°C, еще более предпочтительно, между 45°C и 60°C и, наиболее предпочтительно, при температуре 50°C-55°C, в смесь органического растворителя и воды, содержащей N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамид, получая перенасыщенный раствор мезилата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида. Органические растворители, которые растворяются или смешиваются с водой, являются предпочтительными, такие как MeOH, EtOH, н-PrOH, изо-PrOH, ацетонитрил, ТГФ, ацетон. Кроме того, предпочтительным является добавление затравочных кристаллов моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты в данную перенасыщенную смесь также при повышенной температуре, такой как от 30°C до 90°C, предпочтительно, от 35°C до 80°C, более предпочтительно, от 40°C до 70°C, еще более предпочтительно, от 45°C до 60°C, и, наиболее предпочтительно, при температуре 50°C-55°C. Также предпочтительным являются снижение до медленного перемешивания данной смеси и медленное охлаждение данной смеси до комнатной температуры. Кроме того, предпочтительным является добавление метансульфоновой кислоты в течение от 5 до 15 минут при повышенной температуре и выдерживая полученную смесь при этой повышенной температуре в течение от 0,5 до 5 часов и, более предпочтительно, от 1 до 2 часов, после завершения добавления метансульфоновой кислоты. Охлаждение до комнатной температуры осуществляют в течение от 1 до 5 часов и, предпочтительно, от 2 до 3 часов, и смесь затем медленно перемешивают, предпочтительно, в течение другого часа при комнатной температуре. Затем кристаллы отфильтровывают, промывают смесью спирт/вода и, предпочтительно, сушат в вакууме при температуре между 20°C и 60°C, предпочтительно, начиная при температуре 20°C и заканчивая при температуре 60°C.
Кристаллический моногидрат N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты с характеристиками PSD, PSR и SSA, как определено в настоящем документе, проявляет оптимизированную кинетику высвобождения из фармацевтических композиций и улучшенную биодоступность. Кроме того, свойства хранения, особенно в долгосрочной перспективе стабильности активного фармацевтического ингредиента (API), а также фармацевтические препараты являются превосходными. Спектры порошковой рентгеновской дифракции таблеток с пленочным покрытием (содержание действующего вещества в лекарственной форме 5 мг, 25 мг, 100 мг, растертые в порошок для измерения по сравнению с плацебо) через 24 месяца при комнатной температуре не выявили никаких изменений в кристалличности (смотри фигуры 5-7).
По сравнению с мезилатной солью N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида, моногидрат мезилатной соли N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида, где распределение частиц по размерам, предпочтительно, определяется как d(0,1) от 2 до 100 мкм, d(0,5) от 30 до 210 мкм и d(0,9) от 70 до 400 мкм при удельной площади поверхности частиц менее чем 1,0 м2/г, и, более предпочтительно, определяется как d(0,1) от 10 до 75 мкм, d(0,5) от 100 до 175 мкм, d(0,9) от 200 до 350 мкм при удельной площади поверхности частиц менее чем 1,0 м2/г, предпочтительно, менее чем 0,6 м2/г, и, наиболее предпочтительно, менее чем 0,3 м2/г, удивительно и неожиданно имеет большую термостабильность, вплоть до 170°C. Ясным преимуществом моногидрата мезилата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида, где характеристики PSD, PSR и SSA являются такими, как определено в настоящем документе, является его доказанная долгосрочная стабильность. Таким образом, моногидрат мезилата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида по изобретению, который имеет характеристики PSD, PSR и SSA, как описано в настоящем документе, лучше подходит для получения долгосрочных и стабильных таблеток по сравнению со свободным основанием, N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамидом.
Кристаллический моногидрат N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты в соответствии с изобретением является полезным соединением для лечения и/или профилактики инфекционных заболеваний и/или профилактики передачи инфекционных заболеваний.
Кристаллический моногидрат N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты обладает высокой активностью против герпесвирусов и инфекций, вызванных герпесвирусами и/или передачей вируса герпеса или вирусов герпеса. Таким образом, кристаллический моногидрат N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты по изобретению особенно полезен при получении фармацевтической композиции для лечения и/или профилактики заболеваний, которые вызваны герпесвирусами или вызваны передачей вируса герпеса или вирусов герпеса.
Моногидрат мезилатной соли по изобретению особенно полезен для лечения и/или профилактики инфекций, которые вызваны вирусами простого герпеса, или для профилактики передачи вируса герпеса или вирусов герпеса. Инфекции с вирусами простого герпеса (HSV, подтипа 1 и 2) относятся к одной из категорий нескольких различных нарушений, связанных с локализацией инфекции. Орофациальная инфекция простого герпеса, видимые симптомы которой в просторечии называют герпетической лихорадкой или пузырьковым лишаем, поражает лицо и рот. Орофациальный герпес является наиболее распространенной формой инфекции. Генитальный герпес является второй распространенной формой инфекции простого герпеса. Хотя генитальный герпес в основном, как полагают, вызывается только HSV-2, генитальные инфекции HSV-1 возрастают. Другие нарушения, такие как герпетический панариций, герпес борцов (gladiatorum), глазной герпес (кератит), инфекция церебрального герпетического энцефалита, менингит Mollaret, неонатальный герпес и, возможно, паралич Белла, также вызваны вирусами простого герпеса.
Моногидрат мезилатной соли по изобретению, таким образом, может быть использован для лечения и/или профилактики инфекций, которые вызваны вирусами простого герпеса и/или для профилактики передачи вирусов простого герпеса.
Моногидрат мезилатной соли по настоящему изобретению может быть объединен и введен вместе с противовоспалительным агентом, таким как ацетилсалициловая кислота и ацетаминофен. Таким образом, комбинации по изобретению моногидрата мезилата с ацетилсалициловой кислотой и/или ацетаминофеном, а также фармацевтические композиции, содержащие такую комбинацию, являются предпочтительными.
Более того, моногидрат мезилата по изобретению может быть объединен и может быть использован в комбинации с антивирусным агентом. Антивирусный агент, предпочтительно, представляет собой антиметаболит и, наиболее предпочтительно, лекарственное средство нуклеотидного аналога, нуклеотидного аналога или нуклеозидного аналога. Является более предпочтительным, если антивирусный агент используется против герпесвирусов и/или против передачи вируса герпеса или вирусов герпеса и выбран из группы лекарственных веществ, включающей, но этим не ограничивающейся, или состоящей из: трифлуридина, идоксуридина, фоскарнета, цидофовира, ганцикловира, ацикловира или пенцикловира или соответствующих пролекарств валацикловира, фамцикловира или валганцикловира.
Комбинация по изобретению моногидрата мезилата и другого активного агента, такого как противовоспалительный, иммуномодуляторный или противовирусный агент, такие как терапевтические вакцины, миРНК, антисмысловые олигонуклеотиды, наночастицы или ингибиторы вируса захвата, такие как н-докозанол, могут быть введены одновременно в виде одной отдельной фармацевтической композиции или более чем одной фармацевтической композицией, где каждая композиция содержит, по меньшей мере, один активный агент.
Фармацевтические композиции по настоящему изобретению могут быть изготовлены с подходящим уровнем доз известным образом в стандартном твердом веществе и общеизвестном в фармацевтическом производстве вспомогательном веществе. Предпочтительные препараты могут быть приспособлены для перорального использования. Такие вводимые формы включают, например, пилюли, таблетки, таблетки с пленочным покрытием, таблетки с покрытием, составы с замедленным высвобождением и капсулы.
Фармацевтические композиции в соответствии с изобретением, предпочтительно, содержат от 5 до 70% по массе, более предпочтительно, от 10 до 30% по массе кристаллического моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты (все процентные данные представляют собой массовые проценты относительно массы фармацевтического препарата), где характеристики PSD, PSR и SSA определены в настоящем документе. Фармацевтическая композиция содержит обычно от 2 до 600 мг кристаллического моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты, предпочтительно, от 5 до 500 мг, более предпочтительно, от 10 до 300 мг, и, особенно предпочтительно, от 20 до 200 мг, где характеристики PSD, PSR и SSA являются такими, как описано выше.
Фармацевтическая композиция в соответствии с изобретением необязательно содержит один или несколько наполнителей, которые, например, выбраны из группы, состоящей из: микрокристаллической целлюлозы, целлюлозного волокна, фосфатов кальция и маннита. В соответствии с изобретением, предпочтительно, используются микрокристаллическая целлюлоза и маннит. Целесообразно, чтобы фармацевтическая композиция содержала от 20 до 80%, предпочтительно, от 40 до 80%, особенно предпочтительно, от 45 до 70% микрокристаллической целлюлозы, и от 1 до 40%, предпочтительно, от 5 до 30%, особенно предпочтительно, от 10 до 20% маннита. Фармацевтический препарат в соответствии с изобретением может содержать, по меньшей мере, одно вспомогательное разрыхляющее вещество, которое, например, выбрано из группы, включающей крахмал, предварительно желатинизированный крахмал, гликоляты крахмала, поперечно-связанный поливинилпирролидон, натрий карбоксиметилцеллюлозу (= кроскармеллоза натрия) и другие соли карбоксиметилцеллюлозы. Также может быть использована смесь двух разрыхляющих агентов. В соответствии с изобретением предпочтительным является применение натрий кросскармелозы. Фармацевтическая композиция целесообразно содержит от 3 до 35%, предпочтительно, от 5 до 30% и, особенно предпочтительно, от 5 до 10% вспомогательного(ых) разрыхляющего(их) вещества(веществ). Фармацевтическая композиция по изобретению может содержать, по меньшей мере, один лубрикант, выбранный из группы, состоящей из жирной кислоты и ее соли. В соответствии с изобретением особенно предпочтительным является применение стеарата магния.
Фармацевтическая композиция по изобретению может содержать агент, придающий текучесть, который может представлять собой коллоидный безводный диоксид кремния или порошок тальк. В соответствии с изобретением особенно предпочтительным является применение коллоидного безводного диоксида кремния. Агент, придающий текучесть, целесообразно использовать в количестве от 0,3 до 2,0%, особенно предпочтительно, от 0,4 до 1,5% и, наиболее предпочтительно, от 0,5 до 1%.
Особенно предпочтительная фармацевтическая композиция по изобретению содержит: 5%-30% кристаллического моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты, где характеристики PSD, PSR и SSA являются такими, как определено в настоящем документе, и, предпочтительно, распределение частиц по размерам определяется как d(0,1) от 2 до 100 мкм, d(0,5) от 30 до 210 мкм и d(0,9) от 70 до 400 мкм при удельной площади поверхности частиц менее чем 1,0 м2/г, и, более предпочтительно, определяется как d(0,1) от 10 до 75 мкм, d(0,5) от 100 до 175 мкм, d(0,9) от 200 до 350 мкм при удельной площади поверхности частиц менее чем 0,3 м2/г, 5%-10% натрий кросскармелозы, 0,5-0,7% стеарата магния, 40%-70% микрокристаллической целлюлозы, 10%-20% маннита и от 0,5% до 1% коллоидного безводного диоксида кремния.
Кроме того, фармацевтические композиции в соответствии с изобретением, предпочтительно, содержат от 30 до 90%, более предпочтительно, от 50 до 70% по массе кристаллического моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты, где характеристики PSD, PSR и SSA являются такими, как определено в настоящем документе, и, предпочтительно, распределение частиц по размерам определяется как d(0,1) от 2 до 100 мкм, d(0,5) от 30 до 210 мкм и d(0,9) от 70 до 400 мкм при удельной площади поверхности частиц менее чем 1,0 м2/г, и, более предпочтительно, определяется как d(0,1) от 10 до 75 мкм, d(0,5) от 100 до 175 мкм, d(0,9) от 200 до 350 мкм при удельной площади поверхности частиц менее чем 0,3 м2/г (все процентные данные представляют собой массовые проценты относительно массы фармацевтического препарата). Фармацевтическая композиция содержит обычно от 20 до 750 мг кристаллического моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты, где характеристики PSD, PSR и SSA являются такими, как определено в настоящем документе, и, предпочтительно, от 50 до 500 мг и, особенно предпочтительно, от 50 до 250 мг в расчете на отдельную дозу.
Фармацевтическая композиция в соответствии с изобретением необязательно содержит один или несколько сухих связующих, которые, например, выбраны из группы, состоящей из микрокристаллической целлюлозы, целлюлозного волокна, фосфатов кальция и маннита. Предпочтительно используется микрокристаллическая целлюлоза. Она является коммерчески доступной, например, под названием AvicelB. Фармацевтическая композиция целесообразно содержит от 1 до 20%, предпочтительно, от 1 до 10%, особенно предпочтительно, от 1 до 5% сухого(их) связующего(их). Фармацевтический препарат в соответствии с изобретением может содержать, по меньшей мере, одно вспомогательное разрыхляющее вещество, которое, например, выбрано из группы, состоящей из крахмала, предварительно желатинизированного крахмала, крахмала гликолятов, поперечно-связанного поливинилпирролидона, натрий карбоксиметилцеллюлозы (= кроскармеллоза натрия) и других солей карбоксиметилцеллюлозы. Также может быть использована смесь двух разрыхляющих агентов. Применение натрий кросскармелозы и поперечно-связанного поливинилпирролидона или смеси их обоих, является предпочтительным. Фармацевтическая композиция целесообразно содержит от 3 до 35%, предпочтительно, от 10 до 30% и, особенно предпочтительно, от 15 до 25% вспомогательного(ых) разрыхляющего(их) вещества(веществ). Фармацевтический препарат по изобретению может содержать, по меньшей мере, один лубрикант, выбранный из группы, состоящей из жирных кислот и их солей. Особенно предпочтительным является применение стеарата магния.
Фармацевтическая композиция для таблетки с 25 мг активного фармакологического ингредиента (рассчитывается на основную форму) содержит 32,3 мг моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты, где характеристики PSD, PSR и SSA являются такими, как определено в настоящем документе, и, предпочтительно, распределение частиц по размерам определяется как d(0,1) от 2 до 100 мкм, d(0,5) от 30 до 210 мкм и d(0,9) от 70 до 400 мкм при удельной площади поверхности частиц менее чем 1,0 м2/г, и, более предпочтительно, определяется как d(0,1) от 10 до 75 мкм, d(0,5) от 100 до 175 мкм, d(0,9) от 200 до 350 мкм при удельной площади поверхности частиц менее чем 0,3 м2/г, 60,9 мг микрокристаллической целлюлозы, 9,8 мг натрий кросскармелозы, 20,0 мг маннита, 1,3 мг коллоидного безводного диоксида кремния и 0,9 мг стеарата магния. Общая масса смеси составляет 125,0 мг.
Также фармацевтическая композиция для таблетки со 100 мг активного фармакологического ингредиента содержит 129,0 мг моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты по изобретению, 243,4 мг микрокристаллической целлюлозы, 39,0 мг натрий кросскармелозы, 80,1 мг маннита, 5,0 мг коллоидного безводного диоксида кремния и 3,5 мг стеарата магния. Общая масса смеси составляет 500,0 мг.
Кроме того, настоящее изобретение также включает фармацевтические композиции для сублингвального применения, препараты на основе которых, помимо обычных наполнителей, содержат в качестве активного ингредиента, по меньшей мере, кристаллический моногидрат N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты, где характеристики PSD, PSR и SSA являются такими, как определено в настоящем документе.
Фармацевтическая композиция по изобретению может содержать следующие консерванты: феноксиэтанол, раствор формальдегида, парабены, пентандиол или сорбиновую кислоту.
В качестве фармацевтически приемлемого носителя, инертного наполнителя и/или разбавителей могут быть использованы носители, такие как, предпочтительно, инертный носитель подобный лактозе, крахмал, сахароза, целлюлоза, стеарат магния, фосфат дикальция, сульфат кальция, тальк, маннит, этиловый спирт (капсулы с жидким наполнением); подходящие связующие включают крахмал, желатин, природные сахара, кукурузные подсластители, природные и синтетические смолы, такие как аравийская камедь, альгинат натрия, карбоксиметилцеллюлоза, полиэтиленгликоль и воски, сахара, такие как сахароза, крахмалы, полученные из пшеницы, кукурузы, риса и картофеля, природные смолы, такие как аравийская камедь, желатин и трагакант, полученные из морских водорослей, такие как альгиновая кислота, альгинат натрия и альгинат аммония кальция, целлюлозные материалы, такие как метилцеллюлоза, натрий карбоксиметилцеллюлоза и гидроксипропилметилцеллюлоза, поливинилпирролидон, и неорганические соединения, такие как силикат магния алюминия; лубриканты, такие как борная кислота, бензоат натрия, ацетат натрия, хлорид натрия, стеарат магния, стеарат кальция или стеарат калия, стеариновая кислота, воски с высокой температурой плавления и другие водорастворимые лубриканты, такие как хлорид натрия, бензоат натрия, ацетат натрия, олеат натрия, полиэтиленгликоли и D,L-лейцин; разрыхляющие агенты (разрыхлители), такие как крахмал, метилцеллюлоза, гуаровая камедь, модифицированные крахмалы, такие как натрий карбоксиметилкрахмал, природные и синтетические смолы, такие как псевдоакация, карайи, гуаровая, трагакант и агар, производные целлюлозы, такие как метилцеллюлоза и натрий карбоксиметилцеллюлоза, микрокристаллические целлюлозы и поперечно-связанные микрокристаллические целлюлозы, такие как кроскармеллоза натрия, альгинаты, такие как альгиновая кислота и альгинат натрия, глины, такие как бентониты, и шипучие смеси; окрашивающие агенты, подслащивающие агенты, ароматизирующие агенты, консерванты; глидантами являются, например, диоксид кремния и тальк; подходящими адсорбентами являются глина, оксид алюминия, подходящими разбавителями являются водные или смешанные вода/пропиленгликоль растворы для парентеральных инъекций, сок, сахара, такие как лактоза, сахароза, маннит и сорбит, крахмалы, полученные из пшеницы, кукурузы, риса и картофеля, и целлюлозы, такие как микрокристаллическая целлюлоза.
Следующие примеры включены для демонстрации предпочтительных вариантов осуществления по изобретению. Специалистам в данной области должно быть понятно, что способы, описанные в примерах, которые следуют далее, представляют собой методы, описанные авторами настоящего изобретения как хорошо работающие при практическом осуществлении изобретения, и, таким образом, могут рассматриваться как представляющие собой предпочтительные способы при осуществлении изобретения на практике. Однако, в свете настоящего описания, специалисты в данной области должны учитывать, что могут быть проделаны многие изменения в конкретных вариантах осуществления, которые описаны, и что возможно еще получить подобный или аналогичный результат без отклонения от сущности и объема изобретения.
Фармацевтические композиции в соответствии с изобретением могут быть введены пациенту, при необходимости этого, одноразовой суточной дозой, содержащей от около 20 до 750 мг кристаллического моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты, где характеристики PSD, PSR и SSA являются такими, как определено в настоящем документе, и, предпочтительно, распределение частиц по размерам определяется как d(0,1) от 2 до 100 мкм, d(0,5) от 30 до 210 мкм и d(0,9) от 70 до 400 мкм при удельной площади поверхности частиц менее чем 1,0 м2/г, и, более предпочтительно, определяется как d(0,1) от 10 до 75 мкм, d(0,5) от 100 до 175 мкм, d(0,9) от 200 до 350 мкм при удельной площади поверхности частиц менее чем 0,3 м2/г, предпочтительно, от 50 до 500 мг и, особенно предпочтительно, от 50 до 250 мг в расчете на отдельную дозу. Фармацевтические композиции в соответствии с изобретением также могут быть введены пациенту, при необходимости этого, три раза в день, два раза в день, один раз в день, три раза в неделю, два раза в неделю, или один раз в неделю. Введение на основе трех раз в неделю, двух раз в неделю или одного раза в неделю является предпочтительным, и особенно предпочтительным является введение один раз в неделю, то есть, введение один раз в неделю фармацевтической композиции, содержащей от 400 мг до 500 мг моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты по изобретению. Более того, предпочтительным является начинать введение моногидрата мезилата по настоящему изобретению с высокой нагрузочной дозы, например, с начальной отдельной дозы от 400 мг до 800 мг, и продолжать введение с более низкой дозы, от 100 мг до 150 мг в день или в неделю, в период лечения.
Дальнейшие модификации и альтернативные варианты осуществления различных аспектов изобретения будут очевидны специалистам в данной области техники с учетом данного описания. Соответственно, данное описание следует рассматривать только как иллюстративное и имеющее целью ознакомить специалистов в данной области техники общим методам осуществления изобретения. Должно быть понятно, что формы по изобретению, показанные и описанные в данном документе, должны восприниматься как примеры вариантов осуществления. Элементы и материалы могут быть заменены теми, которые проиллюстрированы и описаны в данном документе, части и способы могут быть изменены, и некоторые признаки изобретения могут быть использованы независимо, как все это должно быть очевидно специалистам в данной области техники, для наилучшего осуществления изобретения, что следует из данного описания. Изменения могут быть сделаны в элементах, описанных в данном документе, без отклонения от духа и объема изобретения, описываемого следующей далее формулой изобретения.
ПРИМЕРЫ
Пример 1
Синтез моногидрата метансульфоната N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида, имеющего характеристики PSD, PSR и SSA по изобретению
Стадия 1 (Конденсация и омыление по Сузуки-Мияура)
В инертизированный реактор помещали хлорид бис(трифенилфосфин)палладия(II) (0,010 экв.) и вновь осуществляли инертизацию. Затем добавляли толуол (1,65 об.). После нагревания до температуры 40°C добавляли триэтиламин (3,00 экв.). Добавляли раствор этил-4-бромфенилацетата (1,00 экв.) в толуоле (0,82 об.). Полученную суспензию нагревали до 90-95°C, затем дозировали пинакол боран (1,30 экв.) в течение периода 60-90 мин. Перемешивание при температуре 90-95°C продолжали в течение, по меньшей мере, более 2 часов, затем преобразование проверяли с помощью ВЭЖХ. После охлаждения до 10°C в реакционную смесь помещали 2-хлорпиридин (1,00 экв.). Затем добавляли 30% NaOH (6,00 экв.) с последующим нагреванием при 55-60°C. Перемешивание при указанной температуре продолжали в течение, по меньшей мере, 4 часов, затем преобразование проверяли с помощью ВЭЖХ. После того, как преобразование считалось завершенным, реакционную смесь концентрировали под давлением около 300 мбар до 0,8 об. (об. относится к кг исходного вещества (=1,00 экв.) на соответствующих стадиях, то есть, л/кг исходного вещества) собранного дистиллята. Реакционную смесь разбавляли водой (2,72 об.), охлаждали до 20°C и фазы разделяли. Органический слой отбрасывали, при этом pH водного слоя устанавливали равным pH 1 путем добавления 33%-ной HCl при температуре 20°C. Добавляли MIBK (2,30 об.) и целит (165 г/кг), и полученную смесь перемешивали в течение, по меньшей мере, 15 мин при температуре 20°C, затем твердые продукты удаляли путем фильтрации. Реактор и лепешку на фильтре промывали далее водой, и объединенный фильтрат опять переносили в реактор. Фазы разделяли, и водный слой промывали еще два раза MIBK. После разбавления водой водный кислый раствор продукта нагревали до температуры 55°C и фильтровали через слой, составленный из целита на дне и активированного древесного угля сверху. Слой целит/уголь промывали еще раз предварительно нагретой водой (0,5 об., 55°C), и объединенный фильтрат помещали обратно в реактор. При температуре 20°C доводили pH до ~3,0 путем добавления 30%-ного NaOH, затем раствор продукта нагревали до температуры 60°C. Дозировали еще NaOH до установления pH 4,1-4,3. Полученную суспензию перемешивали в течение 1-1,5 часа при температуре 60°C, затем охлаждали до температуры 20°C. После дополнительного перемешивания в течение, по меньшей мере, 1 часа при указанной температуре, продукт фильтровали, промывали два раза водой, предварительно сушили в потоке N2 и в заключение сушили в вакууме при температуре 50-65°C. Типичный выход: 38-41%.
Стадия 2 (амидная конденсация)
В реактор помещали продукт со стадии 1 (1,00 экв.) и 4-метил-2-(метиламино)-1,3-тиазол-5-сульфонамид (1,02 экв.). Добавляли ТГФ (7,08 об.) и NMP (1,11 об.). Полученную суспензию охлаждали до температуры 0°C, затем добавляли гидрохлорид 1-этил-3-(3-диметил-1-аминопропил)карбодиимида (1,23 экв.) 4-мя равными порциями в течение периода >90 мин. Через, по меньшей мере, еще 2 часа выдерживания при температуре 0°C, реакционную смесь нагревали до температуры 20°C. При указанной температуре перемешивание продолжали в течение еще 2 часов, затем преобразование проверяли с помощью ВЭЖХ. Далее, при температуре 10-15°C около 2% (0,2 об.) реакционной смеси добавляли в воду (12,3 об.) в течение, по меньшей мере, 5 мин. Полученную тонкую суспензию перемешивали при температуре 10-15°C в течение, по меньшей мере, 1 часа, затем дозировали оставшийся объем реакционной смеси в течение >4 час. Перемешивание при температуре 10-15°C продолжали в течение, по меньшей мере, 0,5 часа, затем твердые продукты отфильтровывали, промывали водой и сушили на нутч-фильтре в стационарном потоке N2, пока они не полагались достаточно сухими (LOD <45% масс./масс.; LOD: потери при сушке).
В линейный реактор помещали сырой продукт, ТГФ (8,15 об.) и воду (вплоть до 1,17 об., в зависимости от потери при сушке сырого продукта). Полученную суспензию нагревали до температуры 60-65°C и перемешивали в течение 1 часа при указанной температуре. Получали почти прозрачный раствор, который подвергали окончательной фильтрации с использованием нагреваемого линзового фильтра с подогревом до температуры 60°C. Линейный реактор, передаточные линии и фильтр последовательно промывали смесью ТГФ (0,44 об.) и очищенной воды (0,06 об.) при температуре 60-65°C. Объединенный фильтрат объединяли в отдельном реакторе и нагревали до температуры 50-55°C. В содержимое реактора дозировали воду (3,23 об.) в течение, по меньшей мере, 30 мин. Перемешивание при температуре 50-55°C продолжали в течение 1-1,5 часа, затем медленно добавляли другую часть воды (8,93 об.) в течение 2 часов. После перемешивания в течение 1-1,5 часов при температуре 50°C полученную суспензию охлаждали до температуры 5°C в течение 2,5 часов и перемешивали в течение еще 0,5 часа. Затем твердые продукты отфильтровывали, промывали водой (3×2,96 об.) и предварительно сушили на нутч-фильтре в стационарном потоке N2. Окончательную сушку осуществляли в вакууме при температуре 50-65°C с использованием конической сушки. Типичный выход: 78-83%.
Стадия 3 (Образование соли)
В реактор помещали продукт со стадии 2 (1,00 экв.), этанол (4,96 об.) и воду (4,96 об.). После нагревания полученной суспензии до температуры 50-55°C добавляли метансульфоновую кислоту (1,15 экв.) в течение <15 мин. Полное растворение исходных веществ обычно наблюдали в самом конце добавления. Сразу в течение следующих 5 мин перемешивание уменьшали до минимально приемлемой скорости, и реакционную смесь затравливали моногидратом метансульфоната N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида (0,005 экв.), который был получен в желаемой полиморфной форме в предыдущем эксперименте. Медленное перемешивание при температуре 50-55°C продолжали в течение от 60 до 90 мин, затем охлаждали до температуры от 20 до 25°C в течение >2,5 час. После перемешивания в течение еще 1 часа твердые продукты отфильтровывали, промывали смесью этанол/вода 5:2 объем/объем (3,10 об.), предварительно сушили в потоке азота и переносили в конический осушитель для окончательной сушки в вакууме при температуре от 20 до 60°C.
Типичный выход: >95%.
Анализ частиц и обнаружение
Для жидкой дисперсии использовали анализатор Malvern Mastersizer 2000 с блоком дисперсионного анализа Hydro Malvern 2000S. Диспергирующий агент Span™ 80 использовали в концентрации 0,1% (объем/объем) в н-гептане. Скорость перемешивания составляла 2500 оборотов в минуту. Как правило, суспензию 50 мг моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты получали в пробирке, содержащей от 4 до 5 мл диспергатора. Если имели место любые агломераты, их затем преобразовали в первичные частицы путем ультразвуковой обработки в течение 10 секунд. Специалистам в данной области техники очевидно, что ультразвуковая обработка является обычной практикой в преобразовании агломератов в частицы меньшего размера. После образования суспензии, ее с помощью пипетки помещали в анализатор Malvern Mastersizer 2000 с блоком дисперсионного анализа Hydro Malvern 2000S, пока не достигался оптимальный диапазон концентрации. Оптимальный диапазон концентрации оценивали по значению затемнения отображаемого Malvern Mastersizer 2000. Обычно оптимальные значения затемнения находились в интервале от примерно 10 до примерно 20 процентов. Далее проводили измерение с автоматическим вычитанием фона. Данные анализировали автоматически с помощью уравнения дифракции Фраунгофера. Для микроскопии использовали либо суспензию, используемую для анализа размера частиц, либо новую партию. Размер наблюдаемых частиц определяли с помощью программного обеспечения analySIS start 5,0 (Olympus Soft Imaging Solutions GmbH). Описанная выше процедура соответствует Фармакопее США (USP 429) (измерение размера частиц методом дифракции света) и Европейской Фармакопее (Ph.Eur. 2.9.31) (анализ размера частиц методом лазерной дифракции света). В дополнение к анализу размера частиц методом лазерной дифракции света выполняли оптическое исследование с помощью микроскопа. В случае измерений выхода, перед диспергированием должно было быть выполнено тестирование пригодности системы, что является обычной практикой для специалистов в данной области техники.
Пример 2
Исследования, описанные в примере 2, выполняли для того, чтобы оценить влияние распределения размера частиц (PSD) активного фармацевтического ингредиента (API) на свойство растворимости ядер таблеток.
Термин «распределение частиц по размерам» порошка, или гранулированного вещества, или частиц, диспергированных в жидкости, используемый в настоящей заявке, представляет собой перечень значений или математическую функцию, которая определяет относительные количества присутствующих частиц, фракционированных по размеру. Значения d(0,1), d(0,5) и d(0,9) показывают, что 10%, 50% и 90% измеренных частиц имеют размер меньший или равный заданному. Например, значения d(0,1)=52, d(0,5)=129 и d(0,9)=257 означают, что 10% частиц имеют размер меньше или равный 52 мкм, 50% меньше чем или равный 129 мкм и 90% меньше или равный 257 мкм (см. таблицу 1, номер исследуемой пробы G05). Для изучения свойств растворимости ядер таблеток с различным PSD моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида метансульфоновой кислоты по изобретению, изготовляли 100 мг и 25 мг (в пересчете на форму свободного основания) таблетки, содержащие моногидрат N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты по изобретению в количестве 129 и 32,3 мг соответственно.
Тип и размер таблеточных ядер
- 100 мг таблеточное ядро, диаметр 11 мм
- 25 мг таблеточное ядро, диаметр 7 мм
Оборудование
Смешивание: Bohle MC5 со стеклянной трубкой
Таблетирование
• Роторный таблеточный пресс Kilian, снабженный питающим башмаком с камерами
• Теснение 100 мг показатель дозы активного вещества в фармацевтическом препарате: 11r11 или 12r11 с риской с одной стороны
• Теснение 25 мг показатель дозы активного вещества в фармацевтическом препарате: 7r6
Анализ
• Растворение (1000 мл, 0,1 М HCl, прибор с лопастью в соответствии с USP Apparatus 2, скорость лопасти 50 оборотов в минуту, n=6)
Соединения (API, активный фармацевтический ингредиент)
API: моногидрат N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида метансульфоновой кислоты, по меньшей мере, 65% объем/объем частиц моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты попадают в диапазон размера частиц от 2 до 500 мкм (микрон).
G01, G02, G03, G04, G05 - это пять различных аналитических проб таблеток моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида метансульфоновой кислоты, где размер частиц находится в диапазоне от 1 до 400 мкм с распределением частиц по размерам d(0,1), d(0,5) и d(0,9), как показано в таблице 1.
|
Получение готовых смесей
Получали пять готовых смесей (пробы G01-G05) с различными пробами API. Композиции ядер (25 мг и 100 мг показатель дозы активного вещества в фармацевтическом препарате, в пересчете на форму свободного основания) показаны в таблице 2.
|
Готовые смеси получали путем просеивания сырых веществ, используя сито с размером ячейки 1,0 мм. Моногидрат N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида метансульфоновой кислоты, то есть API, в котором распределение частиц по размерам находится в диапазоне от 1 до 400 мкм, микрокристаллическую целлюлозу, кроскармеллозу натрия, маннит и безводный коллоидный диоксид кремния смешивали в течение 30 мин в блендере с загрузкой навалом. Добавляли стеарат магния, и смесь перемешивали в течение дополнительных 5 минут. В ходе процесса затруднений не возникало.
Объемные свойства проб G01-G05 представлены в таблицах 3 и 4.
|
Значительное отличие в объемной плотности наблюдали для пробы G03. Это была готовая смесь, которая содержит микронизированный API. Таким образом, объемная плотность была ниже по сравнению со смесями, которые содержат крупнозернистый API.
Среди всех готовых смесей проба G03 также обладала худшей текучестью. Это также могло быть связано с применением микронизированного API.
Таблетирование
Готовые смеси проб G01-G04 и часть готовой смеси пробы G05 подвергали прессованию в виде 100 мг показателя дозы активного вещества в фармацевтическом препарате. Другая часть готовой смеси пробы G05 подвергали прессованию в виде 25 мг показателя дозы активного вещества в фармацевтическом препарате.
В процессе прессования 100 мг показателя дозы активного вещества в фармацевтическом препарате проб G01, G02, G04 и G05, дополнительных затруднений не возникало.
Неожиданно было обнаружено, что таблеточная масса колеблется в процессе прессования пробы G03. Непредвиденно возникли сложности с однородностью массы. Кроме того, таблеточная масса прилипала к инструментам. Было очевидно, что обе проблемы были вызваны применением микронизированного API. Соответственно целесообразно пропустить стадию микронизации для таблетирования, что приведет к улучшению обработки и уменьшению времени получения продукта.
Прессование 25 мг дозы активного вещества в фармацевтическом препарате пробы G05 было выполнено без затруднений.
Данные IPC (межоперационные проверки) проб G01-G05 представлены в таблицах 4 и 5.
|
|
Аналитические данные
Таблетки или капсулы, принимаемые перорально, остаются одним из наиболее эффективных средств имеющегося лечения. Эффективность таких лекарственных форм основана на растворении препарата в жидкостях желудочно-кишечного тракта перед абсорбцией в общий кровоток. Поэтому скорость растворения таблетки или капсулы является крайне важной.
Растворение: Критерий растворения в средах с рН 1 Q=75 через 45 минут.
Влияние распределение частиц по размерам на растворимость: Выполняли растворение ядер из проб G01-G05. Результаты растворения показаны на фиг.8 и в таблице 6.
|
Результаты растворения проб G01-G05 соответствуют описанию. Отсутствует существенная разница в разрушении ядер, которые содержат измельченный или неизмельченный API.
Однородность содержимого (CU): исследовали однородность содержимого проб G01-G04. Результаты показаны в таблице 7.
|
Все результаты соответствуют Ph. Eur. 2.9.40 (Европейская Фармакопея). Однородность содержимого пробы G03 является более низкой по сравнению с однородностью содержимого других проб. Очевидно, что это связано с проблемами в процессе прессования с учетом микронизированного API.
ВЫВОДЫ
Распределение частиц API по размерам оказывает влияет на объемные свойства готовой смеси и на характеристики таблетирования. Проба G03, которая содержит микронизированный API, обладает худшей текучестью. Таким образом, в процессе прессования возникают проблемы с гомогенной массой. Кроме того, наблюдали остаточные проблемы, а данные ядер CU не являются такими положительными, как результаты ядер с немикронизированным API. При использовании немикронизированного API на гомогенность массы и полученной CU не оказывалось влияние распределения частиц по размерам, когда распределение частиц по размерам, предпочтительно, определяется значением d(0,1) от 2 до 100 мкм, d(0,5) от 30 до 210 мкм и d(0,9) от 70 до 400 мкм c удельной площадью поверхности частиц менее чем 1,0 м2/г, и более предпочтительно, определяется значением d(0,1) от 10 до 75 мкм, d(0,5) от 100 до 175 мкм, d(0,9) от 200 до 350 мкм при удельной площади поверхности частиц менее чем 0,3 м2/г. Результаты не показывают значительного влияния распределения частиц по размерам на распад ядер, поскольку они находятся в пределах предварительно определенных диапазонов.
Пример 3
Таблетка, содержащая 60 мг N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида (что соответствует 76,9 мг кристаллического моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты в соответствии с изобретением), в которой по меньшей мере 65% объем/объем составляют частицы моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты, где распределение частиц по размерам предпочтительно определяется значением d(0,1) от 2 до 100 мкм, d(0,5) от 30 до 210 мкм и d(0,9) от 70 до 400 мкм при удельной площади поверхности частиц менее чем 1,0 м2/г, и более предпочтительно, определяется значением d(0,1) от 10 до 75 мкм, d(0,5) от 100 до 175 мкм, d(0,9) от 200 до 350 мкм при удельной площади поверхности частиц менее чем 0,3 м2/г; содержание активного вещества составляет около 59% (исходя из непокрытой таблетки):
|
|
Пример 4
Таблетка, содержащая 50 мг N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида (что соответствует 64 мг кристаллического моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты), в которой, по меньшей мере, 65% объем/объем составляют частицы моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты, где распределение частиц по размерам, предпочтительно, определяется значением d(0,1) от 2 до 100 мкм, d(0,5) от 30 до 210 мкм и d(0,9) от 70 до 400 мкм при удельной площади поверхности частиц менее чем 1,0 м2/г, и более предпочтительно, определяется значением d(0,1) от 10 до 75 мкм, d(0,5) от 100 до 175 мкм, d(0,9) от 200 до 350 мкм при удельной площади поверхности частиц менее чем 0,3 м2/г; содержание активного вещества составляет около 59% (исходя из непокрытой таблетки):
|
|
Пример 5
Кристаллическая структура моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты формулы C19H24N4O7S3, М=516,62, F(000)=540, бесцветная пластина, размер 0,02·0,13·0,15 мм3, триклинная, пространственная группа P -1, Z=2, а=9,4908(7)Å, b=9,5545(7)Å, с=14,4137(9)Å, α=86,130(3)°, β=72,104 (3)°, γ=68,253 (4)°, V=1153,68(15) Å3, Dcalc.=1487 Мг·м-3. Кристалл анализировали с помощью дифрактометра Nonius KappaCCD при 293 К, используя графит-монохроматическое Mo Kα-излучение с λ=0,71073, Θmax=30,065°. Минимальный/максимальный коэффициент пропускания соответствовал 0,95/0,99, μ=0,370 мм-1. Для сбора и интегрирования данных использовали пакет COLLECT. Из, в общей сложности, 43492 отражений, независимыми были 6761 (поглощение r=0,026). Из них 4955 оценивались наблюдением (I>3,0σ(I)), и были использованы для уточнения 298 параметров. Структуру определяли с помощью программы SIR92 прямыми методами. Выполняли уточнение структуры методом наименьших квадратов относительно F в отношении всех не водородных атомов, используя программу CRYSTALS. R=0,0313 (данные наблюдений), WR=0,0432 (все данные), GOF=1,0736. Минимальная/максимальная остаточная плотность электронов = -0,28/0,33 e Å-3. Для завершения уточнения структуры использовали полиномы Чебышева.
В таблице 8 представлены параметры монокристаллической структуры для моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты.
|
Пример 6
Увеличение однократной дозы и фармакокинетика
Преимуществом таблеток по изобретению является то, что таблетка будет иметь оптимизированную скорость растворения, основанную на распределении частиц по размерам кристаллической формы моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты, в котором распределение частиц по размерам, предпочтительно, определяется значением d(0,1) от 2 до 100 мкм, d(0,5) от 30 до 210 мкм и d(0,9) от 70 до 400 мкм при удельной площади поверхности частиц менее чем 1,0 м2/г, и, более предпочтительно, определяется значением d(0,1) от 10 до 75 мкм, d(0,5) от 100 до 175 мкм, d(0,9) от 200 до 350 мкм при удельной площади поверхности частиц менее чем 0,3 м2/г, и, таким образом, препарат может абсорбироваться в кровоток значительно быстрее по сравнению с N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамидом в виде кристаллической основной формы. Кроме того, неожиданное время дисперсии полученной таблетки по изобретению является предпочтительным для проглатываемых таблеток. В дополнительном варианте осуществления таблетки по изобретению могут быть в виде, предназначенном для диспергирования в воде.
Таким образом, в фармакокинетических исследованиях на людях применяли следующие как однократные, так и многократные введения дозы соли моногидрата мезилата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида, где распределение частиц по размерам, предпочтительно, определяется значением d(0,1) от 2 до 100 мкм, d(0,5) от 30 до 210 мкм и d(0,9) от 70 до 400 мкм при удельной площади поверхности частиц менее 1,0 м2/г, и, более предпочтительно, определяется значением d(0,1) от 10 до 75 мкм, d(0,5) от 100 до 175 мкм, d(0,9) от 200 до 350 мкм при удельной площади поверхности частиц менее 0,3 м2/г.
Однократные пероральные дозы соли мезилата моногидрата N-[5-(аминосульфонил)4-метил-1,3тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида, используя композиции в соответствии с примером 2, таблица 2, вводили шести добровольцам на каждой стадии дозирования. Общий объем концентраций в плазме в зависимости от профиля времени был аналогичен при всех дозах.
Наблюдали быстрый и непрерывный рост концентраций в плазме, возникающий в период заметно более низкой абсорбции, и признаки эффекта «плато» экспозиции. В дальнейшем, начиная через 4,0-4,5 часа после введения, происходило снижение концентраций для всех исследуемых доз. Этот этап сопровождался фазой длительной экспозиции, которая характеризовалась длительным периодом полувыведения, что благоприятно для лечения инфекционных заболеваний. Средний конечный элиминационный период полувыведения (t1/2z) колебался в пределах 52 час и 85 час.
Для доз от 5 мг до 480 мг наблюдали пропорциональное дозе увеличение AUC∞ (AUC, площадь под кривой); однократная доза, составляющая 600 мг, не вызывала дальнейшего увеличения экспозиции, как показано AUC0-∞ (см. рисунок 9).
Максимальные концентрации в плазме были линейно связаны с дозами, составляющими от 5 мг до 400 мг. При более высокой дозе, до 600 мг, не получали дальнейшего увеличения экспозиции, что показывали и Cmax, и AUC0-∞ Median Tmax в диапазоне от 1,5 до 4,25 часа без видимой зависимости от дозы. Итоговая сводка фармакокинетических параметров однократной дозы представлена в таблице 9.
Таблица 9: Фармакокинетические параметры после возрастания пероральных доз соли моногидрата мономезилата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида в препаратах в соответствии с композицией, описанной на стр. 39, где распределение частиц по размерам, предпочтительно, определяется значением d(0,1) от 2 до 100 мкм, d(0,5) от 30 до 210 мкм и d(0,9) от 70 до 400 мкм при удельной площади поверхности частиц менее чем 1,0 м2/г, и более предпочтительно, определяется значением d(0,1) от 10 до 75 мкм, d(0,5) от 100 до 175 мкм, d(0,9) от 200 до 350 мкм при удельной площади поверхности частиц менее 0,3 м2/г.
Далее представлены определения сокращений, используемых в таблице 9.
AUC0-∞: Площадь под кривой зависимости концентрации анализируемого вещества от времени, начиная с момента введения до бесконечности, рассчитываемая как
AUC0-∞ = AUC0-посл. + Спосл./λz
где AUC0-посл. определяется как площадь под кривой зависимости концентрации анализируемого вещества от времени в интервале до момента определения последней концентрации, рассчитываемая путем линейного вверх/вниз суммирования, и Cпосл. определяется как последняя количественно наблюдаемая концентрация анализируемого вещества. λz является кажущейся константой скорости терминальной элиминации, определяется путем линейной регрессии опорных точек кривой концентрация аналита-время. Cmax является максимальной наблюдаемой концентрацией анализируемого вещества, и tmax представляет собой время достижения Cmax; t1/2z определяется как кажущийся конечный период полуэлиминации (полувыведение), рассчитываемый как
где λz определено выше.
МРТ: среднее время удержания; вычисленная величина AUMC, деленная на AUC, где AUMC является площадью под первым моментом кривой концентрация-время в интервале от нуля до ∞ с экстраполяцией терминальной фазы, и AUC соответствует площади под кривой концентрация-время в интервале от нуля до ∞ с экстраполяцией терминальной фазы. CL/F относится к клиренсу после перорального введения лекарственного средства, и Ae относится к количеству лекарственного средства, выводимого с мочой.
|
Исходя из данных для 80 мг дозы, женщины, по-видимому, демонстрируют более высокую экспозицию по сравнению с мужчинами в соответствии с AUC∞ и Cmax (смотри таблицу 9). Однако, нормализация массы тела показала, что эта очевидная разница может объясняться более низкой массой тела женщин-добровольцев по сравнению с мужчинами. Таким образом, не следует предполагать клиническое значение любых различий, связанных с половой принадлежностью, в фармакокинетике.
Краткое изложение результатов примера 6: Для доз от 5 мг до 400 и 480 мг, соответственно, имелось линейное, то есть пропорциональное дозе, увеличение AUC∞ и Cmax с дозой; более высокие дозы дополнительно не увеличивали экспозицию. Средняя терминальная элиминация (t1/2z) колебалась в пределах 52 ч и 85 ч. Для однократной дозы, составляющей 80 мг, не было обнаружено никакого клинического релевантного различия, связанного с половой принадлежностью, в экспозиции.
Пример 7
Увеличение многократной дозы и фармакокинетика
Для трех исследованных доз соли моногидрата мезилата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида в композиции в соответствии с примером 1, таблица 2 (5, 25 и 100 мг, пероральное введение один раз в день, 20 дней), где распределение частиц по размерам предпочтительно определяется значением d(0,1) от 2 до 100 мкм, d(0,5) от 30 до 210 мкм и d(0,9) от 70 до 400 мкм при удельной площади поверхности частиц менее чем 1,0 м2/г, и более предпочтительно, определяется значением d(0,1) от 10 до 75 мкм, d(0,5) от 100 до 175 мкм, d(0,9) от 200 до 350 мкм при удельной площади поверхности частиц менее 0,3 м2/г, индивидуальные кривые концентрация-время N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида на 1 день (после первого введения) имели очень похожие по своей общей форме и крутизне профили, полученные в исследовании с увеличением однократной дозы (см. пример 6). Что касается исследования с увеличением однократной дозы, описанного в примере 6, на 1 день наблюдали пропорциональное дозе увеличение AUC0-24ч и Cmax.
В течение 20-дневного лечения с введением соли моногидрата мезилата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида, где распределение частиц по размерам, предпочтительно, определяется значением d(0,1) от 2 до 100 мкм, d(0,5) от 30 до 210 мкм и d(0,9) от 70 до 400 мкм при удельной площади поверхности частиц менее 1,0 м2/г, и более предпочтительно определяется значением d(0,1) от 10 до 75 мкм, d(0,5) от 100 до 175 мкм, d(0,9) от 200 до 350 мкм при удельной площади поверхности частиц менее 0,3 м2/г, один раз в день, достижение равновесных состояний было продемонстрировано посредством практически идентичных минимальных или «остаточных» концентраций N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида, достигнутых между 9 и 13 днями. В равновесном состоянии была низкая межиндивидуальная вариабельность минимальных или «остаточных» концентраций с CV (коэффициентом вариации) между 16,7 и 21,7% (21 день). Для всех доз кривые зависимости индивидуальной и средней концентрации от времени для N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида на 21 день были очень схожи, по своей форме и крутизне, с профилями, полученными в 1 день.
В таблице 10 кратко представлена фармакокинетика в равновесном состоянии N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида.
Таблица 10: Фармакокинетические параметры в равновесном состоянии N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида на 21-й день после ежедневного введения 5, 25 или 100 мг соли моногидрата мезилата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида в композиции в соответствии с примером 2, таблица 2, здоровым добровольцам (n=12 на дозу), где распределение частиц по размерам, предпочтительно, определяется значением d(0,1) от 2 до 100 мкм, d(0,5) от 30 до 210 мкм и d(0,9) от 70 до 400 мкм при удельной площади поверхности частиц менее 1,0 м2/г, и, более предпочтительно, определяется значением d(0,1) от 10 до 75 мкм, d(0,5) от 100 до 175 мкм, d(0,9) от 200 до 350 мкм при удельной площади поверхности частиц менее чем 0,3 м2/г.
Далее приведены определения сокращений, используемых в таблице 10.
Cостаточная: измеряемая концентрация в плазме сразу после дозирования в 21-й день (в конце интервала дозирования в равновесном состоянии); AUCT, то есть в равновесном состоянии AUC (площадь под кривой) в пределах интервала дозирования, равного 24 час, Cmax,ss относится к максимальной наблюдаемой концентрации анализируемого вещества в равновесном состоянии. Cav определяется как среднее значение концентрации в плазме в течение интервала дозирования соли моногидрата мономезилата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида в равновесном состоянии, R-AUC относится к отношению накопления AUC, то есть AUCT/AUC0-24ч,день 1, R-Cmax относится к отношению накопления Cmax, то есть Cmax,ss/Cmax,день 1; значение t1/2z определено выше
|
Для трех применяемых доз было пропорциональное дозе увеличение для всех измерений экспозиции в равновесном состоянии ((Cостаточная, AUCT, Cmax,ss и Cav) (смотри таблицу 10).
Для AUC и Cmax, отношение накопления R во всех вводимых дозах было весьма аналогичным, соответствуя примерно фактору 5 (смотри таблицу 10).
Время достижения Cmax,ss было аналогичным для трех доз (0,5-4,5 ч). Колебания между максимальной и минимальной концентрациями в равновесном состоянии находились в диапазоне от 59 до 64%.
Период полувыведения находился в том же самом диапазоне, что и после введения однократной дозы, 82,6 ч (5 мг), 68,6 час (25 мг) и 59,8 ч (100 мг). Кажущийся суммарный клиренс (CL/F) оценивали как аналогичный для всех исследуемых доз (0,99-1,08 л/ч).
Краткое изложение результатов примера 7: В равновесных состояниях увеличение дозы соли моногидрата мезилата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида в композиции в соответствии с примером 2, таблица 2, где распределение частиц по размерам, предпочтительно, определяется значением d(0,1) от 2 до 100 мкм, d(0,5) от 30 до 210 мкм и d(0,9) от 70 до 400 мкм при удельной площади поверхности частиц менее чем 1,0 м2/г, и, более предпочтительно, определяется значением d(0,1) от 10 до 75 мкм, d(0,5) от 100 до 175 мкм, d(0,9) от 200 до 350 мкм при удельной площади поверхности частиц менее чем 0,3 м2/г, приводило к пропорциональному увеличению экспозиции N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида. В общем, концентрации в плазме в равновесном состоянии должны быть, как ожидается, примерно в пять раз выше, чем после ведения однократной дозы той же дозы, что является отражением полураспада и интервала дозирования. Межиндивидуальная изменчивость экспозиции в равновесном состоянии была довольно низкой, что обнаруживается низким коэффициентом вариации, например, для минимальных или «остаточных» концентраций и колебаний между максимальной и минимальной концентрациями. Скорость элиминации и конечного полураспада в равновесном состоянии были сравнимы со случаем однократной дозы.
Эти результаты ясно показывают, что введение дозы соли моногидрата мезилата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида, где распределение частиц по размерам, предпочтительно, определяется значением d(0,1) от 2 до 100 мкм, d(0,5) от 30 до 210 мкм и d(0,9) от 70 до 400 мкм при удельной площади поверхности частиц менее 1,0 м2/г, и, более предпочтительно, определяется значением d(0,1) от 10 до 75 мкм, d(0,5) от 100 до 175 мкм, d(0,9) от 200 до 350 мкм при удельной площади поверхности частиц менее чем 0,3 м2/г в композициях, как описано выше, один раз в день (или даже менее частое введение) является достаточным для достижения соответствующей концентрации в плазме для лечения вирусных заболеваний, например, инфекции, вызванной вирусом герпеса или вирусами герпеса. В дополнительном исследовании на человеке было показано, что введение более высокой дозы 400-600 мг, предпочтительно, около 500 мг соли моногидрата мезилата по настоящему изобретению, также достаточно для достижения соответствующей концентрации в плазме для лечения вирусных заболеваний, например, инфекции, вызванной вирусом герпеса или вирусами герпеса.
Описание чертежей
Фигура 1
Показано наложение рентгеновских порошковых дифрактограмм, полученных после исследований грануляции; сверху вниз: моногидрата мезилата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида
N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида (свободное основание),
N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида, гранулирование свободного основания с использованием 1 эквивалента метансульфоновой кислоты в соответствии с WO 2006/103011, пример 5;
нижняя кривая показывает матрицу грануляции массы.
1:1 (масса на массу) смесь свободного основания и моногидрата мезилата анализировали с помощью рентгеновской порошковой дифракции в виде точного определения соотношения свободного основания и соли. Соотношение рассчитывали на основе интегрирования и показывает гранулирование смеси с содержанием формы моногидрата мезилата от 8 до 12 процентов.
Фигура 2
Показано наложение спектров рентгеновской порошковой дифракции грануляций смеси моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты с N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамидом монометансульфоновой кислоты после закрытого хранения при 40°С в течение четырех недель (вверху), после закрытого хранения при 40°С в течение четырех дней (в центре) и исходного образца, то есть смеси моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты с N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамидом монометансульфоновой кислоты
Фигура 3
Показаны фотографии, полученные с помощью микроскопа,
А) формы свободного основания,
B) кристаллического моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты и
С) спонтанно кристаллизованного вещества после добавления метансульфоновой кислоты.
Фигура 4
Показана рентгеновская структура моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты с указанными водородными мостиками. Показано, что атом азота в пиридинильном кольце (правая сторона внизу) протонирован, и что водородный мостик образуется между водородом, который протонирует азот в пиридинильном кольце, и одним атомом кислорода мезилатаниона, а другой водородный мостик образуется между другим атомом кислорода мезилатаниона и атомом водорода молекулы воды, тогда как другой атом водорода молекулы воды образует водородный мостик с атомом кислорода другого мезилатаниона.
Фигура 5
Показана дифрактограмма рентгеновской порошковой дифрактометрии таблеток с пленочным покрытием с 5 мг моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты, в котором распределение частиц по размерам предпочтительно определяется значением d(0,1) от 2 до 100 мкм, d(0,5) от 30 до 210 мкм и d(0,9) от 70 до 400 мкм при удельной площади поверхности частиц менее чем 1,0 м2/г, и более предпочтительно, определяется значением d(0,1) от 10 до 75 мкм, d(0,5) от 100 до 175 мкм, d(0,9) от 200 до 350 мкм при удельной площади поверхности частиц менее 0,3 м2/г, таблетки плацебо и моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты после 24 месяцев при 25°C.
Фигура 6
Показана дифрактограмма рентгеновской порошковой дифрактометрии таблеток с пленочным покрытием с 25 мг моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты, где распределение частиц по размерам, предпочтительно, определяется значением d(0,1) от 2 до 100 мкм, d(0,5) от 30 до 210 мкм и d(0,9) от 70 до 400 мкм при удельной площади поверхности частиц менее чем 1,0 м2/г, и более предпочтительно, определяется значением d(0,1) от 10 до 75 мкм, d(0,5) от 100 до 175 мкм, d(0,9) от 200 до 350 мкм при удельной площади поверхности частиц менее 0,3 м2/г, таблетки плацебо и моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты через 24 месяца при 25°C.
Фигура 7
Показана дифрактограмма рентгеновской порошковой дифрактометрии таблеток с пленочным покрытием с 100 мг моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты, где распределение частиц по размерам, предпочтительно, определяется значением d(0,1) от 2 до 100 мкм, d(0,5) от 30 до 210 мкм и d(0,9) от 70 до 400 мкм при удельной площади поверхности частиц менее 1,0 м2/г, и более предпочтительно, определяется значением d(0,1) от 10 до 75 мкм, d(0,5) от 100 до 175 мкм, d(0,9) от 200 до 350 мкм при удельной площади поверхности частиц менее 0,3 м2/г, таблетки плацебо и моногидрата N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты через 24 месяца при 25°C.
Фигура 8
Показаны кривые растворения шести различных таблеток в соответствии с таблицей 7.
Фигура 9
Показана зависимость между однократными дозами (5 мг - 600 мг) таблеток, содержащих моногидрат N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамида монометансульфоновой кислоты, где распределение частиц по размерам предпочтительно определяется значением d(0,1) от 2 до 100 мкм, d(0,5) от 30 до 210 мкм и d(0,9) от 70 до 400 мкм при удельной площади поверхности частиц менее чем 1,0 м2/г, и более предпочтительно, определяется значением d(0,1) от 10 до 75 мкм, d(0,5) от 100 до 175 мкм, d(0,9) от 200 до 350 мкм при удельной площади поверхности частиц менее чем 0,3 м2/г, и AUC∞, измеренной по N-[5-(аминосульфонил)-4-метил-1,3-тиазол-2-ил]-N-метил-2-[4-(2-пиридинил)фенил]ацетамиду.
![МОНОГИДРАТ МЕЗИЛАТА N-[5-(АМИНОСУЛЬФОНИЛ)-4-МЕТИЛ-1,3-ТИАЗОЛ-2-ИЛ]-N-МЕТИЛ-2-[4-(2-ПИРИДИНИЛ)ФЕНИЛ]АЦЕТАМИДА, ОБЛАДАЮЩИЙ ОПРЕДЕЛЕННЫМ ДИАПАЗОНОМ РАСПРЕДЕЛЕНИЯ ЧАСТИЦ ПО РАЗМЕРАМ И УДЕЛЬНОЙ ПЛОЩАДИ ПОВЕРХНОСТИ, ДЛЯ ИСПОЛЬЗОВАНИЯ В ФАРМАЦЕВТИЧЕСКИХ ПРЕПАРАТАХ](https://fips.edrid.ru/images/rid/e2/03/be/0812276aa19b9dbcbe83fbc420f6fec2.png)
![МОНОГИДРАТ МЕЗИЛАТА N-[5-(АМИНОСУЛЬФОНИЛ)-4-МЕТИЛ-1,3-ТИАЗОЛ-2-ИЛ]-N-МЕТИЛ-2-[4-(2-ПИРИДИНИЛ)ФЕНИЛ]АЦЕТАМИДА, ОБЛАДАЮЩИЙ ОПРЕДЕЛЕННЫМ ДИАПАЗОНОМ РАСПРЕДЕЛЕНИЯ ЧАСТИЦ ПО РАЗМЕРАМ И УДЕЛЬНОЙ ПЛОЩАДИ ПОВЕРХНОСТИ, ДЛЯ ИСПОЛЬЗОВАНИЯ В ФАРМАЦЕВТИЧЕСКИХ ПРЕПАРАТАХ](https://fips.edrid.ru/images/rid/e2/03/be/da16b421b5d879544c93912861778029.png)
![МОНОГИДРАТ МЕЗИЛАТА N-[5-(АМИНОСУЛЬФОНИЛ)-4-МЕТИЛ-1,3-ТИАЗОЛ-2-ИЛ]-N-МЕТИЛ-2-[4-(2-ПИРИДИНИЛ)ФЕНИЛ]АЦЕТАМИДА, ОБЛАДАЮЩИЙ ОПРЕДЕЛЕННЫМ ДИАПАЗОНОМ РАСПРЕДЕЛЕНИЯ ЧАСТИЦ ПО РАЗМЕРАМ И УДЕЛЬНОЙ ПЛОЩАДИ ПОВЕРХНОСТИ, ДЛЯ ИСПОЛЬЗОВАНИЯ В ФАРМАЦЕВТИЧЕСКИХ ПРЕПАРАТАХ](https://fips.edrid.ru/images/rid/e2/03/be/ab62b9405745cf969d7304d6f38365bc.png)
![МОНОГИДРАТ МЕЗИЛАТА N-[5-(АМИНОСУЛЬФОНИЛ)-4-МЕТИЛ-1,3-ТИАЗОЛ-2-ИЛ]-N-МЕТИЛ-2-[4-(2-ПИРИДИНИЛ)ФЕНИЛ]АЦЕТАМИДА, ОБЛАДАЮЩИЙ ОПРЕДЕЛЕННЫМ ДИАПАЗОНОМ РАСПРЕДЕЛЕНИЯ ЧАСТИЦ ПО РАЗМЕРАМ И УДЕЛЬНОЙ ПЛОЩАДИ ПОВЕРХНОСТИ, ДЛЯ ИСПОЛЬЗОВАНИЯ В ФАРМАЦЕВТИЧЕСКИХ ПРЕПАРАТАХ](https://fips.edrid.ru/images/rid/e2/03/be/194d0bced3e64fa0c99623b9850e9f93.png)
![МОНОГИДРАТ МЕЗИЛАТА N-[5-(АМИНОСУЛЬФОНИЛ)-4-МЕТИЛ-1,3-ТИАЗОЛ-2-ИЛ]-N-МЕТИЛ-2-[4-(2-ПИРИДИНИЛ)ФЕНИЛ]АЦЕТАМИДА, ОБЛАДАЮЩИЙ ОПРЕДЕЛЕННЫМ ДИАПАЗОНОМ РАСПРЕДЕЛЕНИЯ ЧАСТИЦ ПО РАЗМЕРАМ И УДЕЛЬНОЙ ПЛОЩАДИ ПОВЕРХНОСТИ, ДЛЯ ИСПОЛЬЗОВАНИЯ В ФАРМАЦЕВТИЧЕСКИХ ПРЕПАРАТАХ](https://fips.edrid.ru/images/rid/e2/03/be/d4323173fc78964f738cde931e1ebdaf.jpg)
![МОНОГИДРАТ МЕЗИЛАТА N-[5-(АМИНОСУЛЬФОНИЛ)-4-МЕТИЛ-1,3-ТИАЗОЛ-2-ИЛ]-N-МЕТИЛ-2-[4-(2-ПИРИДИНИЛ)ФЕНИЛ]АЦЕТАМИДА, ОБЛАДАЮЩИЙ ОПРЕДЕЛЕННЫМ ДИАПАЗОНОМ РАСПРЕДЕЛЕНИЯ ЧАСТИЦ ПО РАЗМЕРАМ И УДЕЛЬНОЙ ПЛОЩАДИ ПОВЕРХНОСТИ, ДЛЯ ИСПОЛЬЗОВАНИЯ В ФАРМАЦЕВТИЧЕСКИХ ПРЕПАРАТАХ](https://fips.edrid.ru/images/rid/e2/03/be/faa3536a211927780b03348e2fd5cbff.png)
![МОНОГИДРАТ МЕЗИЛАТА N-[5-(АМИНОСУЛЬФОНИЛ)-4-МЕТИЛ-1,3-ТИАЗОЛ-2-ИЛ]-N-МЕТИЛ-2-[4-(2-ПИРИДИНИЛ)ФЕНИЛ]АЦЕТАМИДА, ОБЛАДАЮЩИЙ ОПРЕДЕЛЕННЫМ ДИАПАЗОНОМ РАСПРЕДЕЛЕНИЯ ЧАСТИЦ ПО РАЗМЕРАМ И УДЕЛЬНОЙ ПЛОЩАДИ ПОВЕРХНОСТИ, ДЛЯ ИСПОЛЬЗОВАНИЯ В ФАРМАЦЕВТИЧЕСКИХ ПРЕПАРАТАХ](https://fips.edrid.ru/images/rid/e2/03/be/b9455ed141edadfc3e0e4bb72421139c.jpg)
![МОНОГИДРАТ МЕЗИЛАТА N-[5-(АМИНОСУЛЬФОНИЛ)-4-МЕТИЛ-1,3-ТИАЗОЛ-2-ИЛ]-N-МЕТИЛ-2-[4-(2-ПИРИДИНИЛ)ФЕНИЛ]АЦЕТАМИДА, ОБЛАДАЮЩИЙ ОПРЕДЕЛЕННЫМ ДИАПАЗОНОМ РАСПРЕДЕЛЕНИЯ ЧАСТИЦ ПО РАЗМЕРАМ И УДЕЛЬНОЙ ПЛОЩАДИ ПОВЕРХНОСТИ, ДЛЯ ИСПОЛЬЗОВАНИЯ В ФАРМАЦЕВТИЧЕСКИХ ПРЕПАРАТАХ](https://fips.edrid.ru/images/rid/e2/03/be/34664e135db6c012709acd1930d9e23c.png)
![МОНОГИДРАТ МЕЗИЛАТА N-[5-(АМИНОСУЛЬФОНИЛ)-4-МЕТИЛ-1,3-ТИАЗОЛ-2-ИЛ]-N-МЕТИЛ-2-[4-(2-ПИРИДИНИЛ)ФЕНИЛ]АЦЕТАМИДА, ОБЛАДАЮЩИЙ ОПРЕДЕЛЕННЫМ ДИАПАЗОНОМ РАСПРЕДЕЛЕНИЯ ЧАСТИЦ ПО РАЗМЕРАМ И УДЕЛЬНОЙ ПЛОЩАДИ ПОВЕРХНОСТИ, ДЛЯ ИСПОЛЬЗОВАНИЯ В ФАРМАЦЕВТИЧЕСКИХ ПРЕПАРАТАХ](https://fips.edrid.ru/images/rid/e2/03/be/fe27fcf6bb0e0d0d50f5e92d1d5b6599.png)
![МОНОГИДРАТ МЕЗИЛАТА N-[5-(АМИНОСУЛЬФОНИЛ)-4-МЕТИЛ-1,3-ТИАЗОЛ-2-ИЛ]-N-МЕТИЛ-2-[4-(2-ПИРИДИНИЛ)ФЕНИЛ]АЦЕТАМИДА, ОБЛАДАЮЩИЙ ОПРЕДЕЛЕННЫМ ДИАПАЗОНОМ РАСПРЕДЕЛЕНИЯ ЧАСТИЦ ПО РАЗМЕРАМ И УДЕЛЬНОЙ ПЛОЩАДИ ПОВЕРХНОСТИ, ДЛЯ ИСПОЛЬЗОВАНИЯ В ФАРМАЦЕВТИЧЕСКИХ ПРЕПАРАТАХ](https://fips.edrid.ru/images/rid/e2/03/be/d6583f6d4323578651451207ed75efdf.png)
![МОНОГИДРАТ МЕЗИЛАТА N-[5-(АМИНОСУЛЬФОНИЛ)-4-МЕТИЛ-1,3-ТИАЗОЛ-2-ИЛ]-N-МЕТИЛ-2-[4-(2-ПИРИДИНИЛ)ФЕНИЛ]АЦЕТАМИДА, ОБЛАДАЮЩИЙ ОПРЕДЕЛЕННЫМ ДИАПАЗОНОМ РАСПРЕДЕЛЕНИЯ ЧАСТИЦ ПО РАЗМЕРАМ И УДЕЛЬНОЙ ПЛОЩАДИ ПОВЕРХНОСТИ, ДЛЯ ИСПОЛЬЗОВАНИЯ В ФАРМАЦЕВТИЧЕСКИХ ПРЕПАРАТАХ](https://fips.edrid.ru/images/rid/e2/03/be/49463850dfea590c933f316fa9f2d9b3.png)

