Результат интеллектуальной деятельности: СПОСОБ МОДЕЛИРОВАНИЯ ТРОМБОЭМБОЛИИ ЛЕГОЧНОЙ АРТЕРИИ У КРЫС
Вид РИД
Изобретение
Изобретение относится к экспериментальной медицине и может быть использовано в качестве модели для изучения фундаментальных основ патогенеза разных форм тромбоэмболии легочной артерии и для доклинических испытаний по профилактике и лечению данного состояния потенциальных антиагрегантов, антикоагулянтов и тромболитиков в условиях in vivo.
Существует несколько моделей тромбозов различной локализации на лабораторных животных, достаточно подробно описанных в Руководстве по проведению доклинических исследований лекарственных средств [Руководство по проведению доклинических исследований лекарственных средств. Часть первая. - М.: Гриф и К°, 2012. - 944 с.]. Однако модели тромбоэмболии легочной артерии в руководстве отсутствуют.
Известен способ моделирования тромбоэмболии легочной артерии крыс, включающий внутривенное введение в бедренную вену готовых тромбов, приготовленных ex vivo [Золотницкая В.П. Моделирование тромбоэмболии легочной артерии (обзор литературы и собственный опыт) // СПб., 1995, - Деп. в ВИНИТИ, №310 - В 96, - 22 с.]. Однако данная модель использования готовых эмболов исключает ключевые патогенетические аспекты образования тромбов в большом круге кровообращения, что делает невозможным адекватно оценивать эффективность терапии, направленной как на лечение, так и на профилактику данного состояния.
Наиболее близким аналогом изобретения является способ моделирования тромбоэмболии легочной артерии крыс, включающий наложение зажима на бедренную артерию крысы с целью вызвать тромбоз бедренной вены с последующей экстракцией тромбов с участком бедренной вены, их разбавлением в физиологическом растворе и внутривенным введением в противоположную интактную бедренную вену [Ji Y.Q. Establishment of rat model of venous thromboembolism / Ji Y.Q., Zhang Z.H., Lu W.X., Feng M., Wang C. // Zhonghua Yi Xue Za Zhi. 2009 Feb 3; 89(4):271-5.]. Однако данная модель, основанная на создании условий формирования аутотромбов, продолжительна во времени, требует двукратного операционного вмешательства, не физиологична за счет многократного повреждения сосудистой стенки разных регионов кровотока (наложение клипсы на бедренную артерию, экстракции тромбов из одной бедренной вены и инъекции в другую бедренную вену), не поддается прогнозу в аспекте массивности тромбоэмболии легочной артерии. Это делает невозможным изучение фундаментальных основ патогенеза разных форм тромбоэмболии легочной артерии и проведение адекватной оценки эффективности терапии, направленной как на лечение, так и на профилактику данного состояния.
Задачей изобретения является расширение арсенала модельных состояний тромбоэмболии легочной артерии для изучения фундаментальных основ патогенеза данного состояния и доклинических испытаний потенциальных антиагрегантов, антикоагулянтов и тромболитиков в условиях in vivo.
Технический результат - повышение точности моделирования за счет формирования патогенетической модели тромбоэмболии легочной артерии от уровня мелких ветвей до долевых артерий легочной артерии.
Указанный технический результат достигается тем, что в способе моделирования тромбоэмболии легочной артерии у крыс, включающем формирование условий тромбообразование в вене, согласно изобретению перекрывают кровоток в нижней полой вене и для развития тромбоэмболии мелких ветвей легочной артерии на уровне сегментарных артерий окклюзию вены сохраняют в течение 1,5-3,0 часов, а для формирования тромбоэмболии на уровне долевых артерий окклюзию вены сохраняют в течение 3,1-6,0 часов с последующим открытием кровотока.
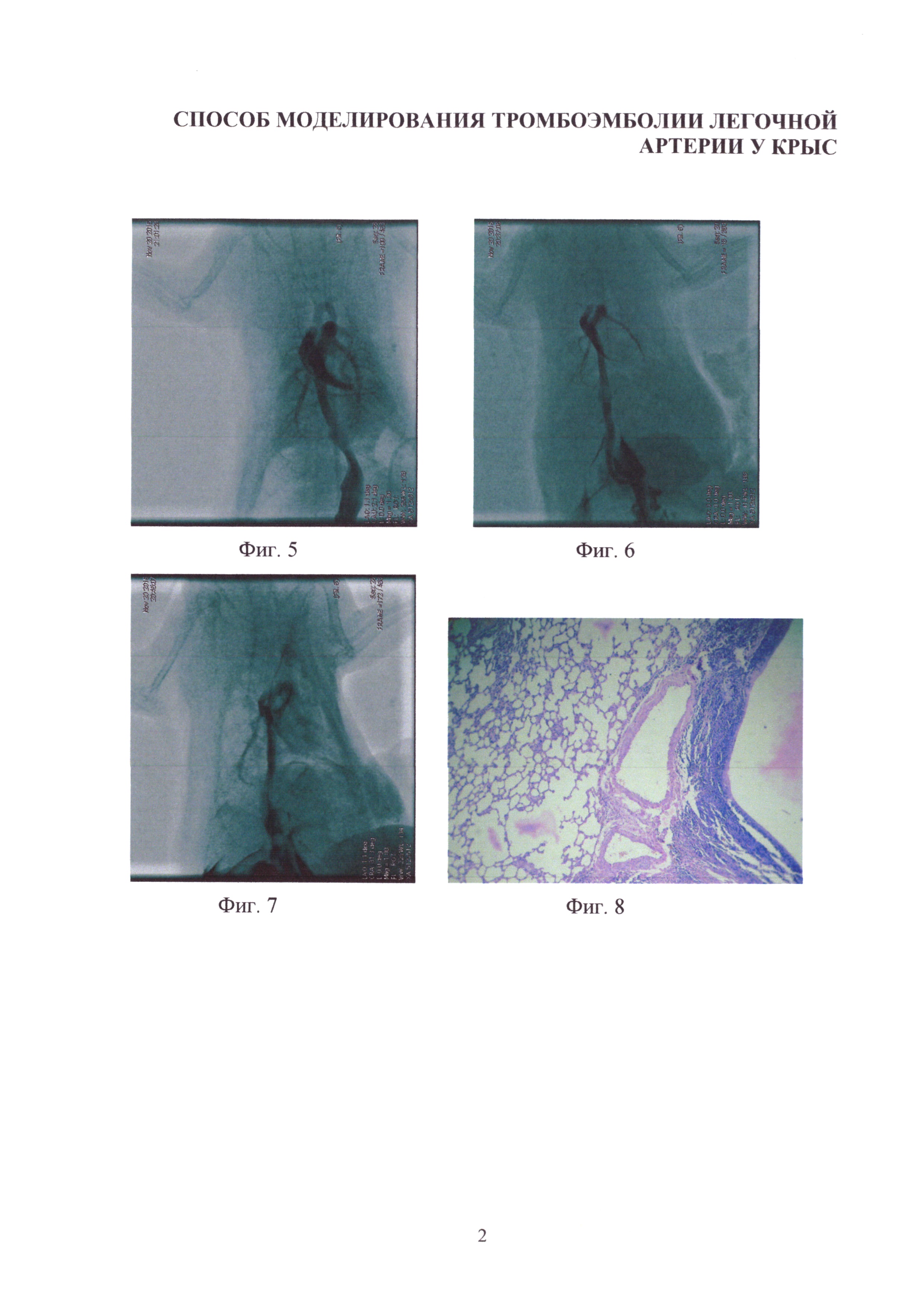
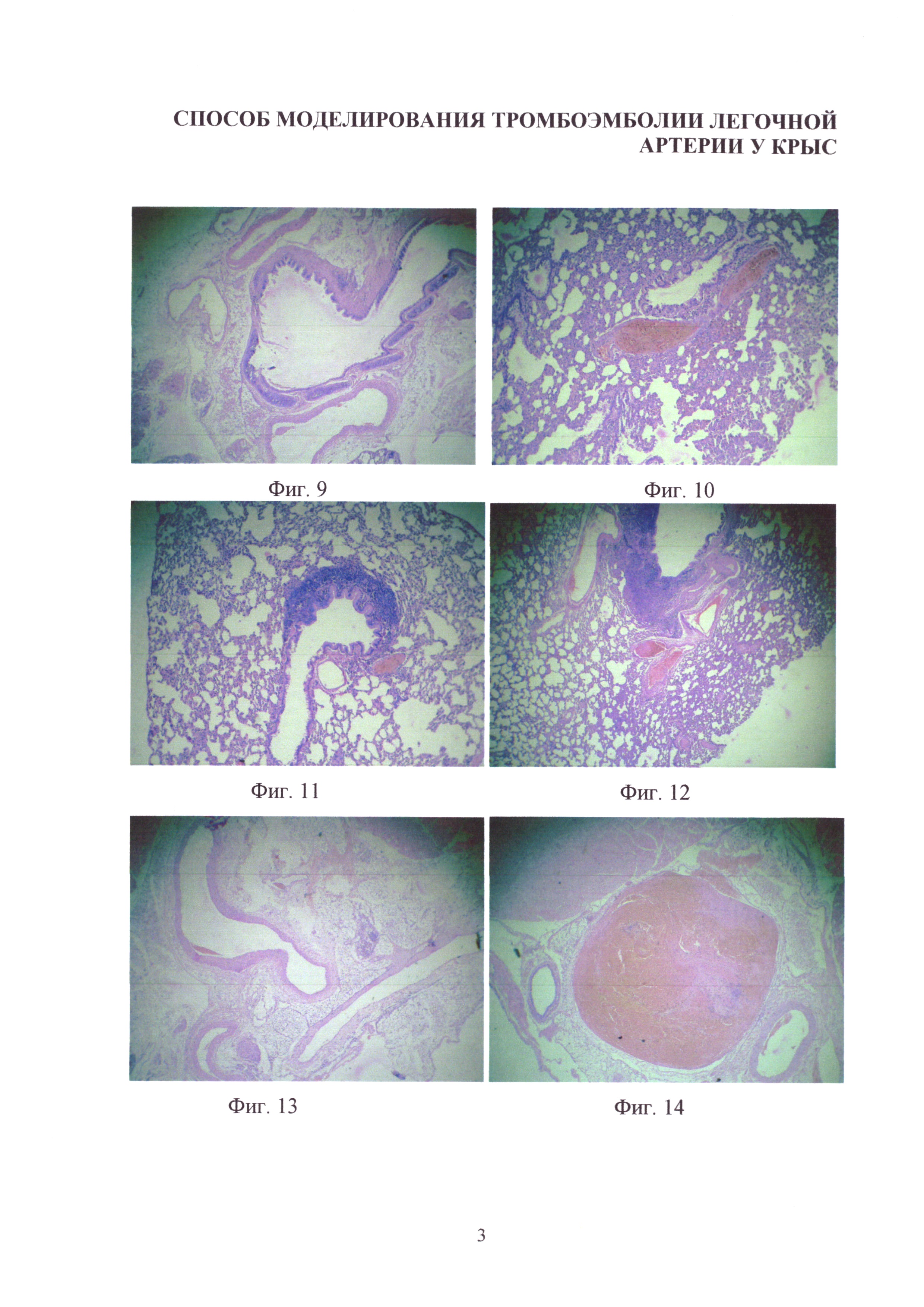
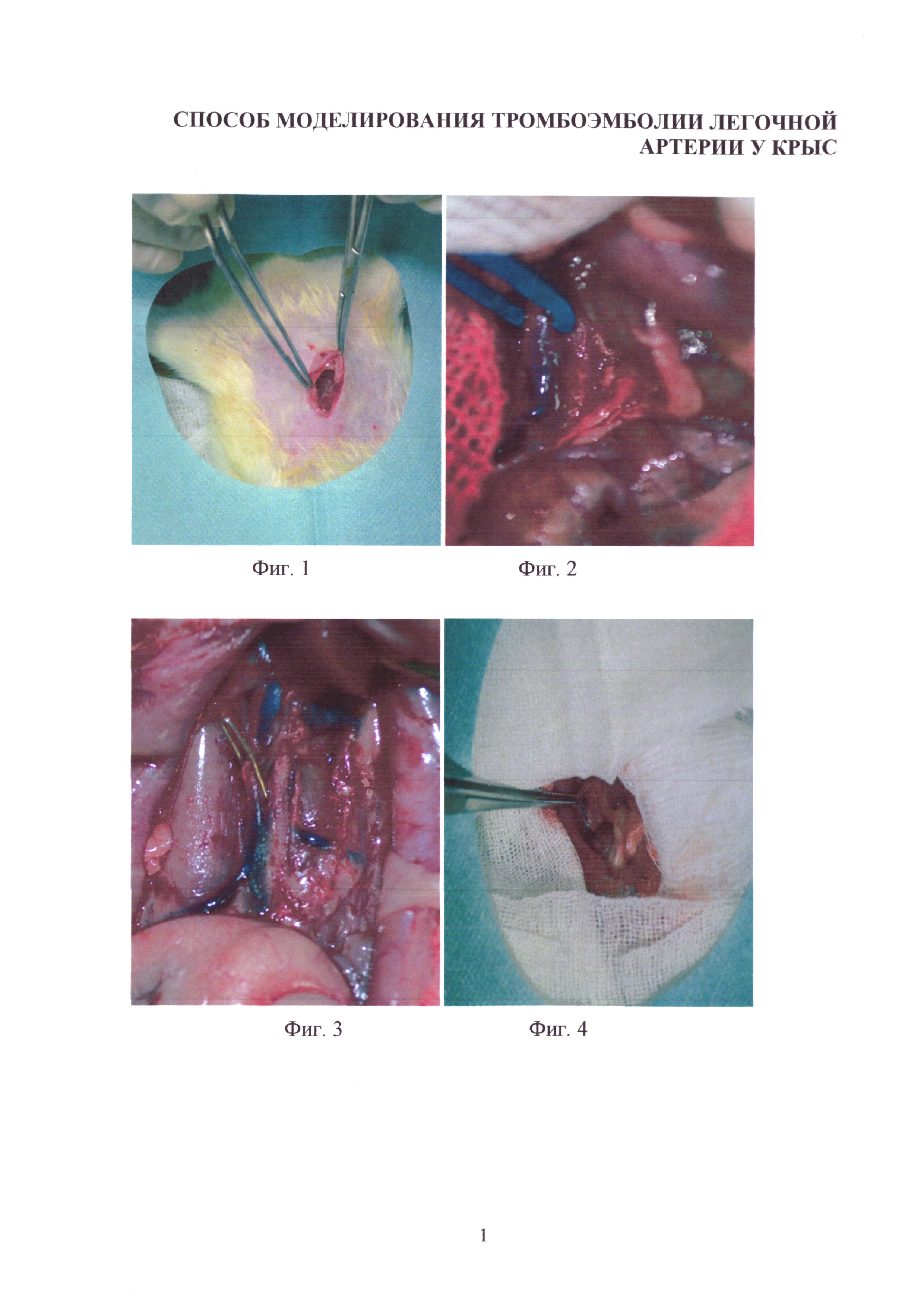
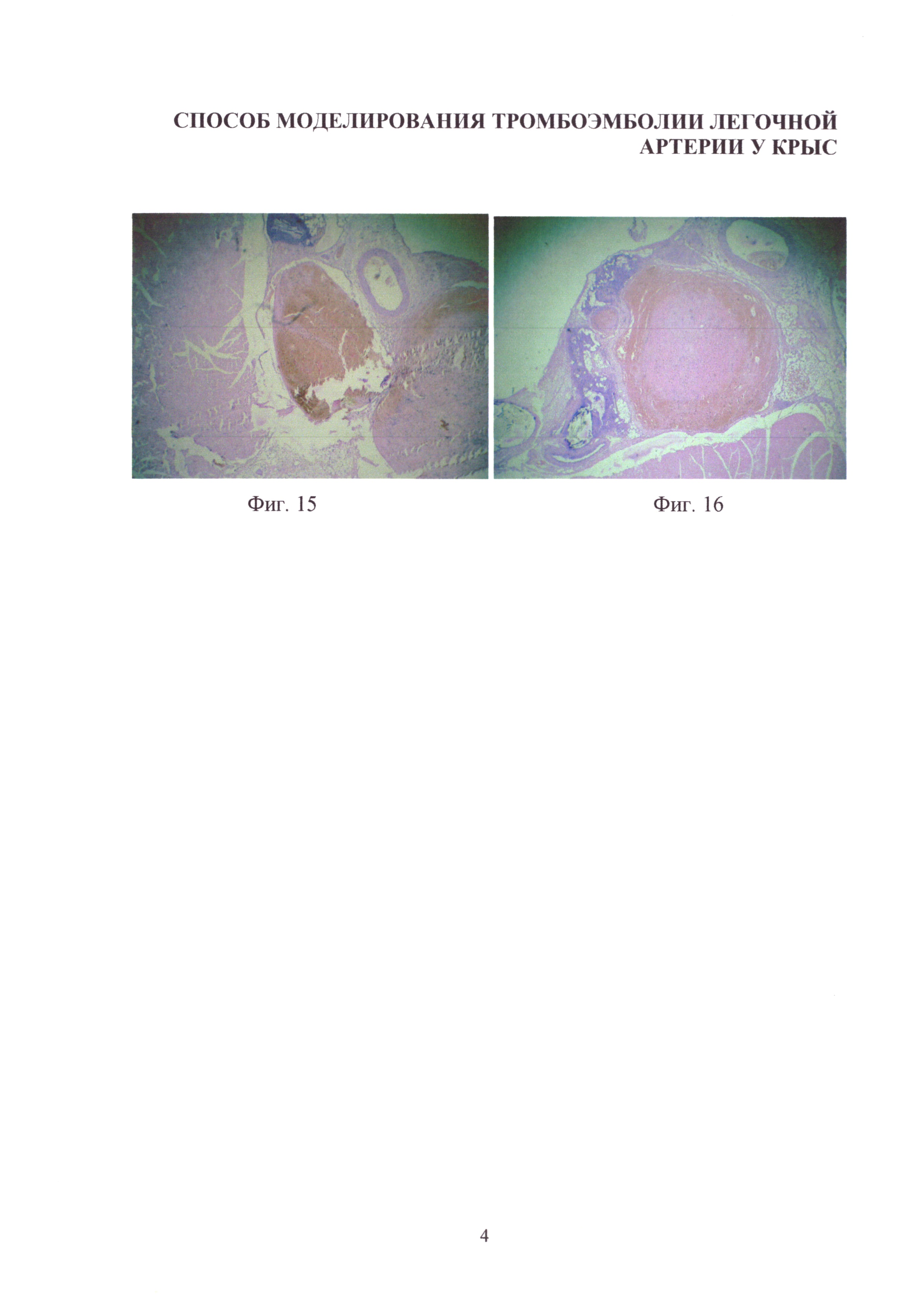
Изобретение иллюстрируется следующими фигурами: на фиг. 1-4 - основные этапы моделирования тромбоэмболии легочной артерии у крыс: срединная лапаротомия, взятие нижней полой вены на лигатуру, наложение клипсы (лигатуры) на нижнюю полую вену, удаление клипсы (лигатуры) с пуском кровотока; на фиг. 5-7 - ангиопульмонограммы крыс контрольной группы, группы крыс с пуском кровотока через 1,5 часа окклюзии нижней полой вены, группы крыс с пуском кровотока через 3,1 часа окклюзии нижней полой вены; на фиг. 8-12 - гистологическая картина легких крыс, гематоксилин-эозин ×100, контрольной группы, группы крыс с пуском кровотока через 1,4 часа окклюзии нижней полой вены, группы крыс с пуском кровотока через 1,5 часа окклюзии нижней полой вены, группы крыс с пуском кровотока через 3,1 часа окклюзии нижней полой вены, группы крыс с пуском кровотока через 6,1 часа окклюзии нижней полой вены; на фиг. 13-16 - гистологическая картина нижней полой вены крыс, гематоксилин-эозин ×100, контрольной группы, группы крыс с окклюзией нижней полой вены 1,5 часа, группы крыс с окклюзией нижней полой вены 3,1 часа, группы крыс с окклюзией нижней полой вены 6,1 часа.
Предлагаемый способ моделирования тромбоэмболии легочной артерии (ТЭЛА) осуществляется следующим образом. Экспериментальным животным в стерильных условиях после предоперационной подготовки (бритье, обработка операционного поля) под наркозом (тиопентал натрия 50 мг/кг, внутрибрюшинно) проводят срединную лапаротомию на протяжении 3 см (фиг. 1). Освобождают от соединительной ткани участок нижней полой вены длиной 2 см в каудальном направлении от места впадения левой почечной вены (фиг. 2), подводят под нижнюю полую вену лигатуру (фиг. 3) и завязывают ее, полностью перекрывая просвет сосуда, либо накладывают хирургическую клипсу, полностью перекрывающую кровоток. В зависимости от длительности окклюзии и восстановления кровотока по нижней полой вене возможно развитие разных форм тромбоэмболии легочных артерий:
0-1,4 часа - тромбоэмболия легочной артерии маловероятна по причине отсутствия организованных тромбов в нижней полой вене;
1,5-3,0 часа - развивается тромбоэмболия мелких ветвей легочных артерий на уровне сегментарных артерий;
3,1-6,0 часов - развивается тромбоэмболия легочной артерии на уровне долевых артерий;
более 6,0 часов - тромб нижней полой вены организован, фиксирован к сосудистой стенке, поэтому развитие тромбоэмболии легочной артерии непредсказуемо по времени и форме: от маловероятной и мелких ветвей до массивной и фатальной.
После необходимого времени окклюзии нижней полой вены лигатуру срезают (либо разжимают клипсу), восстанавливая кровоток по системе нижней полой вены с тромбами (фиг. 4), локализованными дистальнее перевязки, вызывая тромбоэмболию мелких ветвей легочных артерий. Факт тромбоэмболии ветвей легочных артерий подтверждается прижизненной ангиопульмонографией и морфологическими исследованиями легких крыс и участков нижней полой вены.
Пример 1. Ангиопульмонографическое исследование крыс с тромбоэмболией легочной артерии, смоделированной по заявляемому методу
Экспериментальные исследования выполнены на 80 белых беспородных половозрелых крысах-самцах массой 220±10 г с соблюдением международных рекомендаций Европейской конвенций по защите позвоночных животных, правил лабораторной практики при проведении доклинических исследований в РФ (ГОСТ 3 51000.396 и 51000.496, ГОСТР 5025892) и приказа Минздравсоцразвития России №708н от 23.08.2010 "Об утверждении Правил лабораторной практики" (GLP). Лабораторные крысы исходно были разделены на восемь групп по 10 особей в каждой: группа крыс с пуском кровотока через 1,4 часа окклюзии нижней полой вены, группа крыс с пуском кровотока через 1,5 часа окклюзии нижней полой вены, группа крыс с пуском кровотока через 3,0 часа окклюзии нижней полой вены, группа крыс с пуском кровотока через 3,1 часа окклюзии нижней полой вены, группа крыс с пуском кровотока через 6,0 часов окклюзии нижней полой вены, группа крыс с пуском кровотока через 6,1 часа окклюзии нижней полой вены, группа ложнооперированных крыс (объем операции ограничен лапаротомией, время операции соответствовало времени моделирования тромбоэмболии легочной артерии) и группа интактных крыс. Животные содержались в стандартных условиях вивария при комнатной температуре на обычном рационе, были клинически здоровы. За 24 часа до начала экспериментальной работы прекращали кормление без ограничения доступа к воде. Моделирование тромбоэмболии проводилось по заявляемому методу. Через 24 часа динамического наблюдения после восстановления кровотока по системе нижней полой вены доказывали факт тромбоэмболии легочной артерии ангиопульмонографией.
Ангиопульмонографию проводили на ангиографическом комплексе GI Innova 3100 (GE Healthcare, США). В качестве контрастного вещества использовали водорастворимый оптирей 350 (Tyco Healthcare, Канада). Контраст вводили в бедренную вену крыс.
В группах интактных, ложнооперированных и крыс с пуском кровотока через 1,4 часа окклюзии нижней полой вены при ангиопульмонографии регистрировался симметричный и свободный ток контрастного вещества по малому кругу кровообращения с равномерным окрашиванием легочного рисунка (фиг. 5).
В результате исследования группы крыс с пуском кровотока через 1,5 и 3,0 часа окклюзии нижней полой вены выявлен «размытый» характер контрастирования с множественными дефектами наполнения в просвете сосудов в 100% случаях на уровне сегментарных артерий крыс. Отмечалась деформация легочного рисунка в виде расширения и извитости сегментарных сосудов (фиг. 6). В результате исследования группы крыс с пуском кровотока через 3,1 и 6,0 часов окклюзии нижней полой вены выявлены дефекты наполнения контраста в просвете сосудов в 100% случаях на уровне долевых артерий крыс, преимущественно в 80% случаях справа. Отмечалась деформация легочного рисунка в виде расширения и извитости и сегментарных и долевых сосудов (фиг. 7). Ангиопульмонографическая картина 7 выживших животных группы крыс с пуском кровотока через 6,1 часа окклюзии нижней полой вены характеризовалась неоднородностью - выявлены дефекты наполнения контраста в просвете сосудов в 60,0% случаях на уровне долевых артерий, в 40% случаях на уровне сегментарных артерий крыс преимущественно в 80% случаях справа. Отмечалась деформация легочного рисунка в виде расширения и извитости и сегментарных и долевых сосудов.
Пример 2. Морфологическое исследование легких крыс с тромбоэмболией легочной артерии, смоделированной по заявляемому методу
Экспериментальные исследования выполнены на 80 белых беспородных половозрелых крысах-самцах массой 220±10 г с соблюдением международных рекомендаций Европейской конвенции по защите позвоночных животных, правил лабораторной практики при проведении доклинических исследований в РФ (ГОСТ 3 51000.396 и 51000.496, ГОСТР 5025892) и приказа Минздравсоцразвития России №708н от 23.08.2010 "Об утверждении Правил лабораторной практики" (GLP). Лабораторные крысы исходно были разделены на восемь групп по 10 особей в каждой группе крыс с пуском кровотока через 1,4 часа окклюзии нижней полой вены, группа крыс с пуском кровотока через 1,5 часа окклюзии нижней полой вены, группа крыс с пуском кровотока через 3,0 часа окклюзии нижней полой вены, группа крыс с пуском кровотока через 3,1 часа окклюзии нижней полой вены, группа крыс с пуском кровотока через 6,0 часов окклюзии нижней полой вены, группа крыс с пуском кровотока через 6,1 часа окклюзии нижней полой вены, группа ложнооперированных крыс (объем операции ограничен лапаротомией, время операции соответствовало времени моделирования тромбоэмболии легочной артерии) и группа интактных крыс. Животные содержались в стандартных условиях вивария при комнатной температуре на обычном рационе, были клинически здоровы. За 24 часа до начала экспериментальной работы прекращали кормление без ограничения доступа к воде. Моделирование тромбоэмболии проводилось по заявляемому методу. Через 24 часа динамического наблюдения после восстановления кровотока по системе нижней полой вены доказывали факт тромбоэмболии легочной артерии морфогистологической оценкой легких крыс.
Для световой микроскопии материал фиксировали в 10%-ном растворе формалина. После стандартной проводки готовили парафиновые срезы микротомом LEICA RM 2145 (Leica Biosystems, Германия), которые окрашивали гематоксилином-эозином. Оценка морфологических изменений проводилась в 10 полях зрения на световом оптическом уровне при увеличении ×40 и ×100 с помощью бинокулярного микроскопа LEICA СМЕ (Leica Biosystems, Германия).
На гистологических срезах тканей легких интактных, ложнооперированных и крыс с пуском кровотока через 1,4 часа окклюзии нижней полой вены патологических изменений легочной ткани не обнаружено: в альвеолах и сосудах повреждений не наблюдалось; эритроциты в ткани и альвеолах, а также отечная жидкость в патологических количествах отсутствовали (фиг. 8-9). Морфологическая картина легких у всех 20 крыс экспериментальных групп с пуском кровотока через 1,5 и 3,0 часа окклюзии нижней полой вены была идентичной. Макроскопически объем легких увеличен. На разрезах обнаруживаются множественные свертки крови в виде "червячков" в просветах средних и мелких артерий. Микроскопически картина легких отличается неоднородностью. Паренхима легких отечна, сосуды полнокровны, определяются очаги лимфо-гистоцитарной инфильтрации с примесью нейтрофилов. Одновременно в артериальных сосудах мелкого и среднего калибров определяются тромбы смешанного характера, полностью или частично обтурирующие просвет (фиг. 10). Морфологическая картина легких у всех 20 крыс экспериментальных групп с пуском кровотока через 3,1 и 6,0 часов окклюзии нижней полой вены была идентичной. Макроскопически объем легких увеличен. На разрезах обнаруживаются множественные свертки крови в виде "червячков" в просвете долевых артерий. Микроскопически картина легких отличается неоднородностью. Паренхима легких отечна, сосуды полнокровны, определяются очаги лимфо-гистоцитарной инфильтрации с примесью нейтрофилов. В артериальных сосудах долевых артерий определяются тромбы смешанного характера, полностью или частично обтурирующие просвет (фиг. 11). Морфологическая картина легких у 7 выживших крыс (летальность в этой группе 30%) экспериментальной группы с пуском кровотока через 6,1 часа окклюзии нижней полой вены характеризовалась многообразием форм тромбоэмболии легочной артерии. Макроскопически объем легких увеличен. На разрезах обнаруживаются множественные свертки крови в виде "червячков" в просвете сегментарных, долевых артерий. Микроскопически картина легких отличается неоднородностью. Паренхима легких отечна, сосуды полнокровны, определяются очаги лимфо-гистоцитарной инфильтрации с примесью нейтрофилов. В артериальных сосудах сегментарных и долевых артерий определяются тромбы смешанного характера, полностью или частично обтурирующие просвет (фиг. 12).
Пример 3. Применение модели тромбоэмболии легочной артерии у крыс для изучения эффективности тромболизиса альтеплазой
Экспериментальные исследования выполнены на 30 белых беспородных половозрелых крысах-самцах массой 220±10 г с соблюдением международных рекомендаций Европейской конвенции по защите позвоночных животных, правил лабораторной практики при проведении доклинических исследований в РФ (ГОСТ 3 51000.396 и 51000.496, ГОСТР 5025892) и приказа Минздравсоцразвития России №708н от 23.08.2010 "Об утверждений Правил лабораторной практики" (GLP). Животные содержались в стандартных условиях вивария при комнатной температуре на обычном рационе, были клинически здоровы. За 24 часа до начала экспериментальной работы прекращали кормление без ограничения доступа к воде. Непосредственно перед операцией животных опытных групп предварительно взвешивали. Моделирование тромбоэмболии проводилось по заявленному методу. Через 6 часов динамического наблюдения после восстановления кровотока по системе нижней полой вены доказывали факт тромбоэмболии легочной артерии ангиопульмонографией (согласно примеру 1).
Затем проводилось лечение диагностированной тромбоэмболии легочной артерии. Исходя из дальнейшей тактики лечения, все лабораторные животные были разделены на следующие группы:
1. Группа 0,9%-ного раствора NaCl (n=10).
2. Группа ложнооперированных крыс (объем операции ограничен лапаротомией, время операции соответствовало времени моделирования ТЭЛА), (n=10).
3. Группа альтеплазы (n=10).
Группы интактных и ложнооперированных крыс использовали для подтверждения, что тромбоэмболия обусловлена именно перевязкой нижней полой вены с последующим пуском кровотока. Животным контрольной группы внутривенно вводили 1,0 мл стерильного 0,9%-ного раствора NaCl. Альтеплазу экспериментальным крысам вводили внутривенно из расчета 3 мг/кг массы тела [Umemura, K. Effects of Alteplase, a Thrombolytic Agent, in a Rat Photothrombotic Middle Cerebral Artery Occlusion Model / K. Umemura, K. Higo, T. Sakata et al. // Pathophysiol Haemost Thromb. - 2007. - Vol. 36. - P. 245-250]. В качестве альтеплазы использовали препарат Актилизе® (Boehringer Ingelheim Pharma, Германия). Через 30 минут всем крысам проводили повторную ангиопульмонграфию и оценивали эффективность альтеплазы как тромболитического средства.
В группе ложнооперированных крыс рентгенологическая картина соответствовала данным интактных крыс (пример 1). В группе крыс, получивших 0,9%-ного раствора NaCl, рентгенохирургическая картина после инъекции физиологического раствора полностью соответствовала исходной рентгенологической картине - «размытый» характер контрастирования с множественными дефектами наполнения в просвете сосудов. В группе альтеплазы отмечалось реканализация ранее пораженных эмболией сосудов легких с полным восстановлением нормальной рентгенологической картины - симметричный и свободный ток контрастного вещества по малому кругу кровообращения с равномерным окрашиванием легочного рисунка.
Пример 4. Гистологическое исследование участков нижней полой вены крыс, подвергшихся окклюзии нижней полой вены на разные промежутки времени.
Экспериментальные исследования выполнены на 70 белых беспородных половозрелых крысах-самцах массой 220±10 г с соблюдением международных рекомендаций Европейской конвенции по защите позвоночных животных, правил лабораторной практики при проведении доклинических исследований в РФ (ГОСТ 3 51000.396 и 510001496, ГОСТР 5025892) и приказа Минздравсоцразвития России №708н от 23.08.2010 "Об утверждении Правил лабораторной практики" (GLP). Лабораторные крысы исходно были разделены на семь групп по 10 особей в каждой: группа крыс с окклюзией нижней полой вены 1,4 часа, группа крыс с окклюзией нижней полой вены 1,5 часа, группа крыс с окклюзией нижней полой вены 3,0 часа, группа крыс с окклюзией нижней полой вены 3,1 часа, группа крыс с окклюзией нижней полой вены 6,0 часов, группа крыс с окклюзией нижней полой вены 6,1 часа и группа интактных крыс. Животные содержались в стандартных условиях вивария при комнатной температуре на обычном рационе, были клинически здоровы. За 24 часа до начала экспериментальной работы прекращали кормление без ограничения доступа к воде. Полная окклюзия нижней полой вены проводилось по заявляемому методу. По истечении необходимого времени окклюзии крыс выводили из эксперимента, участки перевязанных нижних полых вен подвергали гистологическому исследованию.
Для световой микроскопии материал фиксировали в 10%-ном растворе формалина. После стандартной проводки готовили парафиновые срезы микротомом LEICA RM 2145 (Leica Biosystems, Германия), которые окрашивали гематоксилином-эозином. Оценка морфологических изменений проводилась в 10 полях зрения на световом оптическом уровне при увеличении ×40 и ×100 с помощью бинокулярного микроскопа LEICA СМЕ (Leica Biosystems, Германия).
Гистологическое исследование нижней полой вены интактных крыс и крыс с окклюзией нижней полой вены в течение 1,4 часа показало соответствие их строения. Четко определялись три оболочки: tunica intima, tunica media и tunica adventitia (фиг. 13). Просвет вены свободный, без форменных элементов (для интактных крыс) или с небольшим количеством форменных элементов (для крыс с окклюзией нижней полой вены 1,4 часа) без признаков организованных тромбов. Отсутствуют условия для развития тромбоэмболии легочной артерии.
Гистологическое исследование нижней полой вены крыс с окклюзией нижней полой вены в течение 1,5 и 3,0 часов показало идентичные изменения. В некоторых участках отмечались незначительные дистрофические изменения эндотелия, просвет нижней полой вены расширен, в просвете определяется большое количество форменных элементов с повышенным содержанием нитей фибрина (фиг. 14). Оптимальные условия для развития тромбоэмболии мелких ветвей на уровне сегментарных артерий.
Гистологическая картина нижней полой вены крыс с окклюзией нижней полой вены в течение 3,1 и 6,0 часов показала идентичные изменения. Дистрофические изменения эндотелия в редких участках, расширенный просвет нижней полой вены. В просвете определяются небольшие пристеночные тромбы смешанного характера, состоящие из фибрина, большого количества эритроцитов, скоплений тромбоцитов и единичных лейкоцитов (фиг. 15). Оптимальные условия для развития тромбоэмболии на уровне долевых ветвей легочных артерий.
Гистологическая картина нижней полой вены крыс с окклюзией нижней полой вены в течение 6,1 часа характеризуется следующими особенностями - просвет вены расширен и в нем определяется обтурирующий тромб смешанного характера, состоящий из фибрина, большого количества эритроцитов, скоплений тромбоцитов и лейкоцитов. В некоторых участках отмечались выраженные дистрофические изменения эндотелия и в отдельных отсутствие клеток эндотелия (фиг. 16).
Способ моделирования тромбоэмболии легочной артерии у крыс, включающий формирование условий тромбообразования в вене, отличающийся тем, что перекрывают кровоток в нижней полой вене и для развития тромбоэмболии мелких ветвей легочной артерии на уровне сегментарных артерий окклюзию вены сохраняют в течение 1,5-3,0 часов, а для формирования тромбоэмболии на уровне долевых артерий окклюзию вены сохраняют в течение 3,1-6,0 часов с последующим открытием кровотока.