Результат интеллектуальной деятельности: ДИСУЛЬФИДНЫЙ ПОЛИКАТИОННЫЙ АМФИФИЛ, КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ С НЕЙТРАЛЬНЫМ ФОСФОЛИПИДОМ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ
Вид РИД
Изобретение
Изобретение относится к области химии, биотехнологии, медицины и химико-фармацевтической промышленности, и раскрывает дисульфидный поликатионный амфифил, композицию на его основе для транспорта нуклеиновых кислот в клетки в присутствии сыворотки крови в ростовой среде и способ получения такой композиции. Композиция включает дисульфидный поликатионный амфифил и нейтральный фосфолипид и образует комплекс с нуклеиновой кислотой. При этом катионный липид присутствует в количестве 50% (мол.) на общее количество липидов в композиции.
Для лечения наследственных и приобретенных заболеваний в последние десятилетия разрабатывается подход, получивший название генная терапия, основанный на введении терапевтических нуклеиновых кислот в дефектные клетки-мишени [Ginn S.L. et al. Gene therapy clinical trials worldwide to 2012 - an update //J. Gene Med., 2013, Vol.15, №2, pages 65-77; Flotte T.R. Gene therapy: The first two decades and the current state-of-the-art //J. Cell. Physiol., 2007, Vol.213, №2, pages 301-305]. Успешная доставка нуклеиновых кислот к месту терапевтического действия является лимитирующим фактором данного подхода. Катионные амфифилы и липосомы на их основе представляют одно из основных средств доставки генетического материала в эукариотические клетки [Ibraheem D. et al. Gene therapy and DNA delivery systems //Int. J. Pharm., 2014, Vol. 459, №1-2, pages 70-83; Vitor M.T. et al. Cationic liposomes as non-viral vector for RNA delivery in cancer immunotherapy //Recent Pat. Drug Deliv. Formul, 2013, Vol.7, №2, pages 99-110; Deshpande P.P. et al. Current trends in the use of liposomes for tumor targeting // Nanomedicine (Lond), 2013, Vol.8, №9, pages 1509-1528]. В структуру катионного амфифила должна входить положительно заряженная группа/группы, необходимые для связывания и компактизации молекулы нуклеиновой кислоты, и гидрофобный домен, обеспечивающий защиту нуклеиновой кислоты путем инкапсулирования и прохождение через отрицательно заряженную клеточную мембрану эукариотических клеток по механизму эндоцитоза [Barrait G. Delivery to intracellular targets by nanosized particles in intracellular delivery (fundamental biomedical technologies, 5ed. (Ed. Prokop A.) //Springer Netherlands, 2011, pages 73-95; Lee Y. et al. Delivery of nucleic acid drugs in nucleic acid drugs (Ed. Murakami A.) // Springer Berlin Heidelberg, 2012, Vol. 249, pages 95-134]. Данные структурные элементы, как правило, связаны между собой спейсерами различной длины и природы [Mintzer M.A. et al. Nonviral vectors for gene delivery // Chem. Rev., 2009, Vol.109, pages 259-302].
Среди липофильных полиаминов производные тетраамина - спермина - наиболее эффективно связывают и упаковывают нуклеиновые кислоты [Geall A.J. et al. Synthesis of cholesteryl polyamine carbamates: pKa studies and condensation of calf thymus DNA // Bioconjugate Chem., 2000, Vol.11, pages 314-326; Maslov M.A. et al. Novel cholesterol spermine conjugates provide efficient cellular delivery ofplasmid DNA and small interfering RNA //J. Control. Release, 2012, Vol.160, pages 182-193] и поэтому лучше переносят их в клетки. Однако эффективность таких соединений все еще остается недостаточно высокой для их клинического применения. Это связано с большим количеством биологических барьеров, препятствующих попаданию нуклеиновых кислот в эукариотические клетки [Wiethoff С.М. et al. Barriers to nonviral gene delivery // J. Pharm. Set, 2003, Vol.92, pages 203-217]. Один из подходов, позволяющих улучшить эффективность доставки за счет контролируемого высвобождения нуклеиновых кислот в цитоплазму, заключается во введении в структуру катионного амфифила дисульфидной группы, способной разрушаться под действием внутриклеточных восстановителей, прежде всего глутатиона [Østergaard H. et al. Monitoring disulfide bond formation in the eukaryotic cytosol //J. Cell Biol, 2004, Vol. 166, pages 337-345].
В экспериментах по доставке катионные амфифилы часто смешивают с так называемыми липидами-помощниками, подобными 1,2-ди-О-олеоилфосфатидилэтаноламину (DOPE) или холестерину, так как такие липиды способны переходить из ламелярной фазы в инвертированную гексагональную, которая способствует улучшению доставки нуклеиновой кислоты [Zhdanov R.I. et al. Cationic lipid-DNA complexes-lipoplexes for gene transfer and therapy//Bioelectrochemistry, 2002, Vol.58, №1, pages 53-64].
На эффективность доставки нуклеиновых кислот оказывает огромное воздействие сыворотка крови, которая вызывает агрегацию и деградацию комплексов катионных липосом с нуклеиновыми кислотами под действием макромолекул, находящихся в крови, что является основным препятствием для успешного их применения в условиях in vivo. Поэтому необходимым условием оценки эффективности систем доставки нуклеиновых кислот в условиях in vitro является биологический скрининг в присутствии сыворотки крови в ростовой среде.
Техническим результатом заявленного изобретения является расширение арсенала средств, способных эффективно доставлять нуклеиновые кислоты в клетки в присутствии сыворотки в ростовой среде.
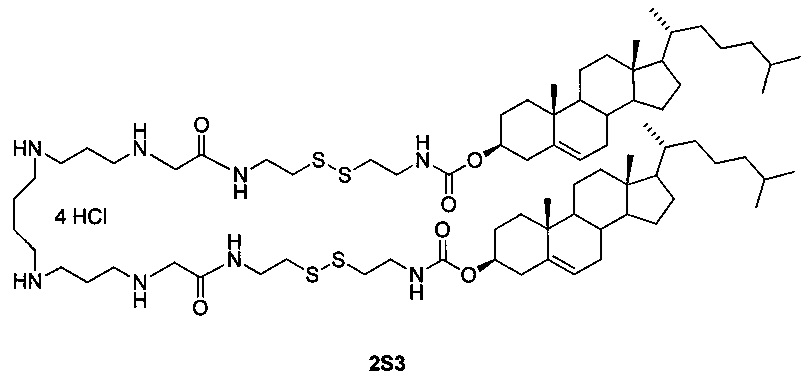
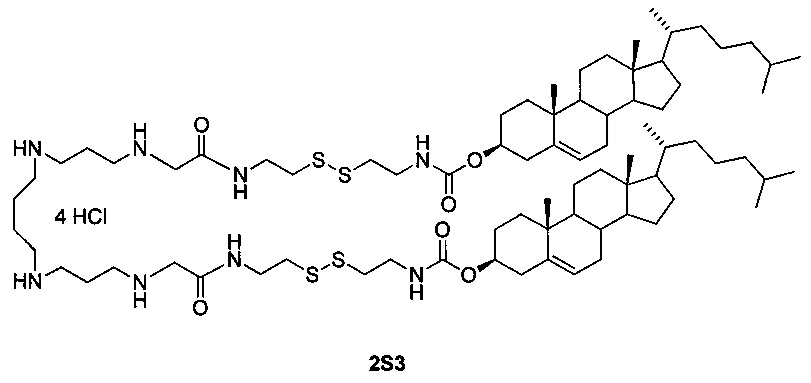
Технический результат достигается дисульфидным поликатионным амфифилом 1,32-бис(холест-5-ен-3β-илоксикарбониламино)-8,25-диоксо-3,4,21,22-тетратиа-7,10,14,19,23,26-гексаазадотриаконтан тетрагидрохлоридом (2S3), представляющим собой аналог поликатионного амфифила с высоким трансфицирующим потенциалом [Maslov М.А. et al. Novel cholesterol spermine conjugates provide efficient cellular delivery of plasmid DNA and small interfering RNA // J. Control. Release, 2012, Vol. 160, pages 182-193, патент РФ №2423147, опубл. 10.07.2011], следующего строения:
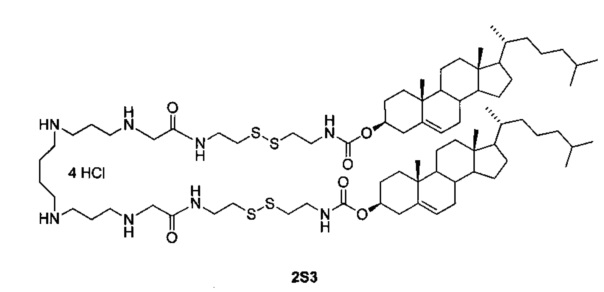
В структуру дисульфидного поликатионного амфифила 2S3 входит остаток спермина для связывания и компактизации молекулы нуклеиновой кислоты, остаток холестерина для формирования гидрофобного окружения. Для связывания гидрофобной и сперминовой частей используют биодеградируемые линкеры дисульфидного или карбамоильного типа. Наличие дисульфидного линкера улучшает эффективность доставки за счет контролируемого высвобождения нуклеиновых кислот в цитоплазму под действием внутриклеточных восстановителей.
Технический результат также достигается предлагаемой композицией, которая содержит: 1) дисульфидный поликатионный амфифил 2S3 в качестве компонента, связывающего и упаковывающего нуклеиновую кислоту и 2) нейтральный фосфолипид в качестве структурообразующего и промотирующего компонента.
Технический результат также достигается способом получения композиции для доставки коротких и протяженных нуклеиновых кислот, характеризующийся тем, что липидную пленку, состоящую из дисульфидного поликатионного амфифила и нейтрального фосфолипида DOPE, гидратируют в воде и полученную эмульсионно-дисперсионную систему подвергают ультразвуковой обработке или экструзии.
Исходным соединением в синтезе предлагаемого дисульфидного поликатионного амфифила 2S3 являлся спермин (1), из которого было получено региоселективно защищенное производное спермина (2) согласно описанному ранее методу [Petukhov I.A. et al. Synthesis of polycationic lipids based on cholesterol and spermine // Russ. Chem. Bull., 2010, Vol. 59, pages 260-268]. Алкилирование соединения (2) действием этилового эфира бромуксусной кислоты в присутствии карбоната цезия в условиях реакции Фукуямы [Bajaj A. et al. Effect of the nature of the spacer on gene transfer efficacies of novel thiocholesterol derived gemini lipids in different cell lines: a structure-activity investigation //J. Med. Chem., 2008, Vol. 51, pages 2533-2540; Fraix A. et al. Cationic lipophosphoramidates with two disulfide motifs: synthesis, behaviour in reductive media and gene transfection activity // Org. Biomol. Chem., 2013, Vol 11, pages 1650-1659] приводило к соединению (3). Удаление 2-нитробензолсульфонильных групп действием тиофенола в присутствии карбоната калия давало соединение (4). Затем осуществляли блокирование вторичных аминогрупп ди-трет-бутилпирокарбонатом в присутствии триэтиламина при 0°С, получая полностью защищенное производное спермина, гидролиз которого действием водно-метанольного раствора гидроксида натрия давал соединение (5). Для введения дисульфидной группы цистамин (2,2'-диаминодиэтил дисульфида) вводили во взаимодействие с хлорформиатом холестерина (6), получая соединение (7). Ключевой стадией синтеза являлась реакция конденсации сперминового производного (5) с холестериновой компонентой (7) в присутствии 2-этокси-1-этоксикарбонил-1,2-дигидрохинолина. На заключительной стадии для соединения (8) проводили удаление Вос-защитных групп действием 3М раствора хлороводорода в диоксане, получая целевое соединение (9).
N,N-диизопропилэтиламин, N,N-диметилформамид, 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин, триэтиламин, хлорформиат холестерина, цистамина дигидрохлорид, этилбромацетат были получены от Aldrich; ди-трет-бутилдикарбонат, холестерин, цезия карбонат получены от Fluka; спермин был получен от Sigma; тиофенол был получен от Merck. Остальные растворители и реагенты были отечественного производства.
Хлористый метилен, триэтиламин и N,N-диизопропилэтиламин кипятили над гидридом кальция и перегоняли перед реакцией. Метанол и N,N-диметилформамид выдерживали над прокаленными молекулярными ситами 3 и 4 Å соответственно.
Тонкослойную хроматографию проводили на пластинках Kieselgel 60 F254 (Merck). Обнаружение пятен на хроматограммах проводили раствором фосформолибденовая кислота - церий (IV) сульфат с последующим прогреванием и с помощью УФ-лампы (254 нм). Колоночную хроматографию осуществляли на силикагеле Kieselgel 60 (0.040-0.063 мм и 0.063-0.200 мм, Merck). Спектры ЯМР 1Н и 13С регистрировали на приборах Bruker DPX 300 и Bruker DRX 500 с использованием CDCl3 в качестве растворителя, если не указано иное. Химические сдвиги ЯМР 1H приведены относительно остаточного сигнала CHCl3 (δΗ 7.26 м.д.). Химические сдвиги ЯМР 13С приведены относительно центрального сигнала растворителя (δC 77.0 м.д. для растворов в CDCl3). Масс-спектры получали на время-пролетном масс-спектрометре «Bruker Ultraflex» (Германия) методом матриксной лазерно-десорбционной ионизации на матрице с использованием в качестве матрицы 2,5 дигидроксибензойной кислоты, если не указано иное. Оптическое вращение измеряли на цифровом поляриметре ПУ-07 (Россия).
На основе дисульфидного поликатионного амфифила 2S3 и нейтрального фосфолипида DOPE была приготовлена композиция (2S3:DOPE, 1:1, мольное соотношение). Структурообразующий нейтральный липид 1,2-ди-О-олеоилфосфатидилэтаноламин (DOPE), чаще всего используется в качестве второго компонента систем доставки нуклеиновых кислот. DOPE не может самостоятельно переносить нуклеиновые кислоты, так как не имеет в своей структуре катионной группировки, необходимой для связывания и компактизации нуклеиновых кислот. Для формирования композиций использовали гидратирование липидной пленки, состоящей из поликатионного амфифила и DOPE, взятых в соотношении 1:1 (мол.), с последующей ультразвуковой обработкой или экструзией.
Для изучения способности предлагаемой композиции доставлять нуклеиновые кислоты в клетки млекопитающих использовали протяженную плазмидную ДНК (pEGFP-C2, «Clontech» (Германия)) и короткую 21-звенную двуцепочечную РНК (siPHK, ИХБФМ СО РАН) (последовательность смысловой цепи 5'-GCGCCGAGGUGAAGUUCGATT-3', антисмысловой цепи - 5'-UCGAACUUCACCUCGGCGCGG-3').
Для формирования комплексов нуклеиновых кислот с предлагаемой композицией инкубировали аликвоты растворов нуклеиновых кислот и композиции, рассчитанные в соответствии с соотношением положительных зарядов аминогрупп к отрицательным зарядам фосфатных групп (соотношение N/P=6/1).
Эффективность проникновения нуклеиновых кислот с использованием композиции 2S3:DOPE в клетки млекопитающих in vitro была исследована в экспериментах по трансфекции клеток плазмидной ДНК, кодирующей зеленый флуоресцирующий белок (EGFP) и короткой интерферирующей РНК, направленной против матричной РНК гена, кодирующего EGFP.
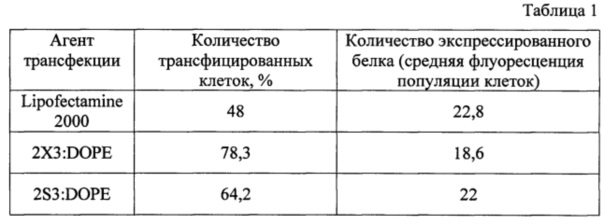
Сопоставительный анализ заявляемой композиции 2S3:DOPE с известными и широко используемыми трансфектантами, такими как Lipofectamine®2000 и композицией 2X3:DOPE [Maslov M. A. et al. Novel cholesterol spermine conjugates provide efficient cellular delivery of plasmid DNA and small interfering RNA // J. Control. Release, 2012, Vol.160, pages 182-193] показал, что предлагаемые соединения обладают следующими преимуществами:
1) заявляемая композиция с высокой эффективностью доставляет в клетки млекопитающих протяженные и короткие нуклеиновые кислоты в присутствии сыворотки крови в ростовой среде, что позволяет рассматривать ее в качестве перспективного средства доставки терапевтических нуклеиновых кислот в эукариотические клетки.
2) заявляемая композиция не требует сложной процедуры приготовления, для получения рабочего раствора достаточно подвергнуть ультразвуковой обработке или экструзии гидратированную липидную пленку, состоящую из дисульфидного поликатионного амфифила и DOPE, взятых в соотношении 1:1.
3) Заявляемая композиция стабильна при хранении как в сухом виде, так и в виде водных формуляций.
4) Заявляемая композиция превосходит известные аналоги по эффективности трансфекции в эукариотические клетки.
Поиск по источникам научно-технической и патентной литературы показал, что заявляемое соединение, композиция на его основе и способ ее получения в известных источниках не описаны.
Изобретение иллюстрируется следующими примерами.
Пример 1. Синтез дисульфидного поликатионного амфифила 2S3 (1,32-бис(холест-5-ен-3β-илоксикарбониламино)-8,25-диоксо-3,4,21,22-тетратиа-7,10,14,19,23,26-гексаазадотриаконтан тетрагидрохлорида)
Этап 1. Получение диэтил N7,N12-ди-трет-бутоксикарбонил-N3,N16-бис(2-нитробензолсульфонил)-3,7,11,16-тетраазаоктадекан-1,18-диоата (2) К раствору соединения 1 (0.1530 г, 0.1980 ммоль) в безводном Ν,Ν-диметилформамиде (3 мл) добавили карбонат цезия (0.1290 г, 0.3960 ммоль) и этилбромацетат (0.11 мл, 0.9900 ммоль). Реакционную смесь перемешивали 30 ч при 65°С, фильтровали через Celite®545, промывая дихлорметаном. Растворители удалили в вакууме. Остаток хроматографировали на колонке с силикагелем, элюируя смесью хлороформ - метанол - 1% водн. уксусная кислота (120:1:0.2). Получили 0.1406 г (90%) соединения 2 в виде бледно-желтого масла. Масс-спектр ESI, m/z: 967 [M+Na]+. Вычислено для C40H60N6O16S2: 967.3405 [M+Na]+. Спектр ЯМР 1Н (δ, м.д., J, Гц): 1.18 (т, 6 Η, 2 СН2СН3, J=7.1), 1.42 (уш.с, 22 Η, 2 СМе3), NCH2(CH2)2CH2N), 1.76-1.81 (м, 4 H, 2 NCH2CH2CH2N), 3.12-3.18 (м, 8 H, 2 NCH2CH2CH2N, NCH2(CH2)2CH2N), 3.37-3.42 (m, 4 H, 2 NCH2CH2CH2N), 4.09 (кв, 4 H, 2 CH2CH3, J=7.1), 4.18 (с, 4 H, 2 СН2СОО), 7.58-7.63 (м, 2 H), 7.67-7.72 (м, 4 H) и 8.04-8.07 (м, 2 Н, 2 С6Н4). Спектр ЯМР 13С (δ, м.д.): 14.14, 25.96, 26.97, 28.55, 44.60, 46.44, 47.06, 47.95, 61.58, 79.68, 124.24, 130.96, 131.82, 133.30, 133.72, 148.10, 155.33, 168.75.
Этап 2. Получение диэтил N7,N12-ди-трет-бутоксикарбонил-3,7,12,16-тетраазаоктадекан-1,18-диоата (3)
К раствору соединения 2 (0.7001 г, 0.7411 ммоль) в безводном Ν,Ν-диметилформамиде (6 мл) добавили карбонат калия (0.2553 г, 1.852 ммоль), через 15 минут тиофенол (0.76 мл, 7.411 ммоль). Реакционную смесь перемешивали 1 ч при 24°С, затем фильтровали через Celite®545, промывая хлороформом. Растворители удалили в вакууме. Остаток хроматографировали на колонке с силикагелем, элюируя сначала хлороформом, затем смесью хлороформ - метанол - 25% водн. аммиак (100:1:0.1) с повышением полярности до 100:6:0.1. Получили 0.2689 г (63%) соединения 3 в виде желтого масла. Спектр ЯМР 1H (δ, м.д., J, Гц): 1.20 (т, 6 Η, 2 СН2СН3, J=7.1), 1.37 (уш.с, 22 Η, 2 СМе3, NCH2(CH2)2CH2N), 1.63-1.67 (м, 4 H, 2 NCH2CH2CH2NH), 2.53-2.57 (m, 4 H, 2 NCH2CH2CH2NH), 3.10-3.17 (m, 8 H, 2 NCH2CH2CH2NH, NCH2(CH2)2CH2N), 3.33 (с, 4 H, 2 CH2COO), 4.11 (кв, 4 H, СН2СН3, J=7.1). Спектр ЯМР 13C (δ, м.д.): 14.36, 25.76, 26.16, 28.60, 41.94, 46.81, 46.99, 50.89, 60.98, 79.49, 155.37, 171.92.
Этап 3. Получение диэтил N3,N7,N12,N16-тетра-трет-бутоксикарбонил-3,7,12,16-тетраазаоктадекан-1,18-диоата (4)
К охлажденному до 0°С раствору соединения 3 (0.1400 г, 0. 2436 ммоль) и безводного триэтиламина (0.17 мл, 1.218 ммоль) в безводном хлористом метилене (5 мл) прикапали раствор ди-трет-бутилдикарбоната (0.1310 г, 0.6087 ммоль) в безводном хлористом метилене (3 мл). Реакционную смесь перемешивали 48 ч при 24°С. Затем разбавили 20 мл хлористого метилена, промыли 3% водн. хлористоводородной кислоты (до рН 4), водой до рН 7. Органический слой сушили сульфатом натрия, фильтровали, растворители удалили в вакууме. Остаток хроматографировали на колонке с силикагелем, элюируя смесью толуол - ацетон (10:1). Получили 0.130 г (69%) соединения 4 в виде бесцветного кристаллизующегося масла. Спектр ЯМР 1Н (δ, м.д., J, Гц): 1.26 (т, 6 Н, 2 СН2СН3, J=7.1), 1.40-1.46 (м, 40 Н, 4 СМе3, NCH2(CH2)2CH2N), 1.72-1.76 (м, 4 Н, 2 NCH2CH2CH2N), 3.13-3.19 (м, 8 Н, 2 NCH2CH2CH2N, NCH2(CH2)2CH2N), 3.20-3.29 (м, 4 Η, 2 NCH2CH2CH2N), 3.84 (уш.с, 2 H, СН2СОО), 3.93 (уш.с, 2 H, СН2СОО), 4.17 (кв, 4 Н, 2 СН2СН3, J=7.1). Спектр ЯМР 13С (δ, м.д.): 14.38, 25.78, 28.34, 28.50, 28.58, 44.82, 46.58, 49.39, 52.05, 61.08, 79.38, 80.36, 155.60, 155.79, 170.68.
Этап 4. Получение N3,N7,N12,N16-тетра-трет-бутоксикарбонил-3,7,12,16-тетраазаоктадекан-1,18-диовой кислоты (5)
К раствору соединения 4 (0.130 г, 0.1677 ммоль) в метаноле (3 мл) добавили раствор гидроксида натрия (0.0335 г, 0.8387 ммоль) в метанол - вода (0.6 мл, 50:1 объемн.). Реакционную смесь перемешивали 96 ч при 24°С, затем прикапали 2% водн. хлористоводородная кислота до рН 4, растворители удалили в вакууме. Остаток хроматографировали на колонке с силикагелем, элюируя смесью хлороформ - метанол - 1% водн. уксусная кислота (10:1:0.1) с повышением полярности до 2:1:0.1. Получили 0.1038 г (87%) соединения 5 в виде бежевых кристаллов. Тпл 62-64°С. Масс-спектр ESI, m/z: 741 [М+Na]+. Вычислено для C34H62N4O12: 741.4262 [М+Na]+. Спектр ЯМР 1H (CDCl3:CD3OD=1:1, δ, м.д., J, Гц): 1.41 (уш.с, 40 Η, 4 СМе3, NCH2(CH2)2CH2N), 1.69-1.73 (м, 4 Η, 2 NCH2CH2CH2N), 3.11-3.19 (м, 8 Η, 2 NCH2CH2CH2N, NCH2(CH2)2CH2N), 3.20-3.29 (м, 4 Η, 2 NCH2CH2CH2N), 3.75 (уш.с, 4 Η, 2 СН2СОО). Спектр ЯМР 13С (δ, м.д.): 25.35, 27.36, 27.54, 28.74, 44.69, 45.39, 46.55, 49.36, 79.34, 79.76, 155.50, 155.62, 167.77.
Этап 5. Получение (холестен-5-ен-3β-ил)-N-(2-[(2-аминоэтил)дитио]этил}карбамат гидрохлорида (7)
К раствору цистамин дигидрохлорида (0.300 г, 1.332 ммоль) в 0.7 M водн. гидроксиде натрия (4 мл) прилили метанол (30 мл), растворитель удалили в вакууме. Сухой остаток растворили в безводном хлористом метилене (15 мл), раствор декантировали, добавили к нему безводный триэтиламин (38 мкл, 0.2664 ммоль), охладили до 0°С и по каплям добавили раствор хлорформиата холестерина (0.1190 г, 0.2664 ммоль) в безводном хлористом метилене (1 мл). Реакционную смесь перемешивали 2 ч при 22°С, разбавили хлористым метиленом (20 мл) и промыли 1% водн. хлористоводородной кислотой (1×15 мл). Водную фазу экстрагировали хлористым метиленом (5×10 мл). Объединенный органический экстракт промыли насыщ. водн. хлоридом натрия (2×15 мл), объединенный водный экстракт промыли этилацетатом (2×20 мл). Объединенный органический экстракт сушили над сульфатом натрия, фильтровали, растворитель удалили в вакууме. Остаток хроматографировали на силикагеле в системе хлороформ - метанол (15:1) с повышением полярности до 12:1. Получили 0.103 г (66%) соединения 7 в виде бледно-желтых кристаллов. Тпл=130-132°С. [α]D23 -27.13 (с 1, хлористый метилен). Масс-спектр, m/z (Ioтн(%))· 564.456 [M-Cl]+. Вычислено для C32H56N2O2S2: 564.378 [М-Cl]+. Спектр ЯМР 1H (500 МГц, CDCl3:CD3OD=10:1, δ, м.д., J, Гц): 0.61 (с, 3 Н, С(13)Ме), 0.79 (д, 3 H, J=6.6, С(25)Ме), 0.80 (д, 3Н, J=6.6, С(25)Ме), 0.85 (д, 3 H, J=6.2, С(20)Ме), 0.94 (с, 3 Н, С(10)Ме), 0.87-1.62 (м, 21 Н, Chol), 1.65-2.07 (м, 5 Н, Chol), 2.17-2.35 (м, 2 Н, Н2С(4) Chol), 2.68-2.77 (м, 4 Н, 2 CH2S), 2.90-2.96 (м, 2 H, CH2NH3), 3.35-3.44 (м, 2 H, CH2NHC(O)O), 4.34-4.47 (м, 1 Н, Н(3) Chol), 5.25-5.34 (м, 1 Н, Н(6) Chol), 5.39-5.46 (м, 1 H, NHCO). Спектр ЯМР 13С (δ, м.д.): 11.83, 18.69, 19.28, 21.05, 22.51, 22.76, 23.83, 24.27, 27.99, 28.16, 28.21, 31.90, 35.79, 36.20, 36.57, 36.98, 38.17, 38.53, 39.52, 39.76, 39.92, 41.32, 42.33, 50.06, 56.18, 56.72, 74.70, 122.58, 139.77, 156.43.
Этап 6. Получение N10,N14,N19,N23-тетра-трет-бутоксикарбонил-1,32-бис(холест-5-ен-3β-илоксикарбониламино)-8,25-диоксо-3,4,21,22-тетратиа-7,10,14,19,23,26-гексаазадотриаконтана (8)
К раствору соединения 7 (0.0850 г, 0.1413 ммоль) в безводном хлористом метилене (5 мл) при перемешивании добавили N,N-диизопропилэтиламин (49 мкл, 0.2826 ммоль), затем через 10 мин последовательно добавили раствор соединения 5 (0.0400 г, 0.0565 ммоль) в безводном хлористом метилене (3 мл) и 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин (0.0350 г, 0.1413 ммоль) в безводном хлористом метилене (3 мл) и перемешивали 48 ч при 50°С. Реакционную смесь разбавили хлористым метиленом (30 мл), промыли насыщ. водн. карбонатом натрия (1×10 мл), водой (1×10 мл), 1% водн. хлористоводородной кислотой (1×10 мл), водой (2×10 мл). Органический экстракт сушили сульфатом натрия, фильтровали, растворитель удалили в вакууме. Остаток хроматографировали на колонке с силикагелем, элюируя смесью хлороформ - метанол (100:1) с повышением полярности до 50:1. Получили 0.070 г (69%) соединения 8 в виде бледно-желтого кристаллизующегося масла. Масс-спектр ESI, m/z: 1835 [M+Na]+. Вычислено для C98H170N8O14S4: 1834.1617 [M+Na]+. Спектр 1H ЯМР (500 МГц, δ, м.д., J, Гц): 0.66 (с, 6 Η, 2 С(13)Ме), 0.83 (д, 6H, J=6.6, 2 С(25)Ме), 0.85 (д, 6 H, J=6.6, 2 С(25)Ме), 0.90 (д, 6 H, J=6.2, 2 С(20)Ме), 0.99 (с, 6 Н, 2 С(10)Ме), 1.01-1.58 (м, 42 Н, Chol), 1.43 (уш.с, 18 Н, 2 СМе3), 1.45 (уш.с, 18 Н, 2 СМе3), 1.71-1.76 (м, 4 H, NCH2(CH2)2CH2N), 1.79-2.02 (м, 10 Н, Chol), 2.21-2.37 (м, 4 Н, 2 Н2С(4) Chol), 2.74-2.84 (м, 8 Н, 4 CH2S), 3.10-3.21 (м, 8 Н, 2 NCH2CH2CH2N, NCH2(CH2)2CH2N), 3.22-3.29 (м, 4 Н, 2 NCH2CH2CH2N), 3.42-3.50 (м, 4 Н, 2 NHCH2CH2S), 3.53-3.61 (м, 4 Н, 2 NHCH2CH2S), 3.81 (с, 4 Н, 2 СН2СОО), 4.42-4.52 (м, 2 Н, 2 Н(3) Chol), 5.18-5.31 (м, 2Н, 2 NHCO), 5.32-5.38 (м, 2Н, 2 Н(6) Chol). Спектр 13С ЯМР (δ, м.д.): 11.11, 13.34, 17.98, 18.58, 20.31, 21.80, 22.05, 23.09, 23.54, 24.95, 26.55, 27.25, 27.42, 27.47, 27.65, 27.77, 28.76, 30.68, 31.15, 35.04, 35.45, 35.69, 35.83, 36.26, 36.94, 37.44, 37.82, 38.78, 39.01, 41.58, 43.98, 45.99, 49.30, 50.94, 55.43, 55.96, 73.80, 78.69, 80.09, 117.52, 120.25, 121.78, 139.05, 154.69, 155.38, 161.77, 169.13.
Этап 7. Получение 1,32-бис(холест-5-ен-3β-илоксикарбониламино)-8,25-диоксо-3,4,21,22-тетратиа-7,10,14,19,23,26-гексаазадотриаконтан тетрагидрохлорид (9)
К охлажденному до 0°С раствору соединения 8 (0.0900 г, 0. 0496 ммоль) в безводном CH2Cl2(10 мл) добавили 3N раствор хлористоводородной кислоты в диоксане (6 мл), перемешивали 24 ч при 22°С. Растворитель удалили в вакууме, остаток перекристаллизовывали последовательно из этанола (5 мл) и диэтилового эфира (5 мл). Получили 0.070 г (91%) соединения 9 в виде бежевых кристаллов, разлагается при нагревании выше 180°С. Масс-спектр, m/z (/отн(%)): 1412.276 [М+2Н]+, 1414.282 [М+4Н]+. Вычислено для C78H138N8O6S4: 1410.962 [М]+. Спектр 1H ЯМР (CDCl3:CD3OD=1:1, δ, м.д, J, Гц): 0.61 (с, 6 Н, 2 С(13)Ме), 0.78 (д, 6 H, J=6.6, 2 С(25)Ме), 0.79 (д, 6 H, J=6.6, 2 С(25)Ме), 0.84 (д, 6 H, J=6.2, 2 С(20)Ме), 0.94 (с, 6 Н, 2 С(10)Ме), 0.99-1.57 (м, 42Н, Chol), 1.71-1.88 (м, 10Н, Chol), 1.89-1.99 (м, 4 Н, NCH2(CH2)2CH2N), 2.18-2.33 (м, 4 Н, 2 Н2С(4) Chol), 2.69-2.79 (м, 8 Н, 4 CH2S), 2.91-3.09 (м, 4 Н, 2 NCH2CH2CH2N), 3.30-3.40 (м, 8 Н, 2 NCH2CH2CH2N, NCH2(CH2)2CH2N), 3.44-3.52 (м, 4 Н, 2 NHCH2CH2S), 3.85-3.95 (м, 4 Н, 2 NHCH2CH2S), 4.18 (с, 4 Н, 2 СН2СОО), 4.32-4.44 (м, 2 Н, 2 Н(3) Chol), 5.25-5.33 (м, 2 Н, 2 Н(6) Chol).
Пример 2. Получение композиции 2S3:DOPE
Раствор дисульфидного поликатионного амфифила 2S3 и нейтрального фосфолипида DOPE в соотношении (1:1) в подходящем органическом растворителе упаривали в вакууме до образования липидной пленки. Полученную липидную пленку гидратировали в необходимом количестве автоклавированной деионизированной воды в течение 5 часов, а затем озвучивали на ультразвуковой бане до получения однородной композиции. Озвучивание можно заменить экструзией через поликарбонатную мембрану с размером пор от 50 до 200 нм.
Пример 3. Трансфекция клеток НЕК 293 плазмидной ДНК с использованием липосом 2S3:DOPE
Исследование доставки плазмидной ДНК в клетки НЕК 293 проводили с помощью проточной флуоциториметрии. Эффективность трансфекции оценивали по количеству клеток, содержащих зеленый флуоресцентный белок (EGFP) от общего количества клеток в образце. Клетки НЕК 293 высаживали в 24-луночные планшеты (1×105 клеток на лунку в 500 мкл среды DMEM с 10% эмбриональной телячьей сывороткой) и культивировали в течение суток при 37°С в атмосфере, содержащей 5% CO2. Перед проведением трансфекции для экспериментов в присутствии сыворотки среду в лунках заменяли на 200 мкл среды DMEM с 10% эмбриональной телячьей сывороткой. Липосомы 2S3:DOPE в 25 мкл среды OptiMEM смешивали с раствором pEGFP-C2 (0.5 мкг в лунке) в 25 мкл этой же среды в оптимальном соотношении N/P=6/1 и инкубировали 20 мин при 25°С. Полученную смесь добавляли к клеткам и выдерживали в течение 4 ч при 37°С в атмосфере, содержащей 5% CO2, затем заменяли среду на 500 мкл DMEM с 10% эмбриональной телячьей сывороткой. Через 48 ч клетки промывали фосфатно-солевым буфером (300 мкл), добавляли 50 мкл раствора трипсина и инкубировали 2 мин (37°С, 5% CO2). По окончании инкубации в лунки добавляли 400 мкл DMEM с 10% эмбриональной телячьей сывороткой, клетки суспендировали и переносили в пробирки. Полученную клеточную суспензию центрифугировали при 1200 об/мин, отбирали среду и промывали 500 мкл фосфатно-солевого буфера. Затем клетки фиксировали 600 мкл 2% раствора формальдегида в фосфатно-солевом буфере. Анализ уровня трансфекции клеток проводили на флуоцитометре АСЕА NovoCyte™ 3000 (Bioscience Inc., USA). В этих экспериментах определяли количество клеток, экспрессирующих белок EGFP, и средний уровень флуоресценции клеток при длине волны возбуждения 488 нм. В качестве объекта сравнения был выбран коммерчески доступный препарат - Lipofectamine 2000 и липосомы 2X3:DOPE.
Результаты трансфекции клеток плазмидной ДНК pEGFP-C2 в присутствии эмбриональной телячьей сыворотки в ростовой среде представлены в таблице 1.
Пример 4. Трансфекция клеток ВНК IR-780 короткой интерферирующей РНК с использованием композиций 2S3:DOPE
Исследование проникновения siPHK, направленной на подавление синтеза зеленого флуоресцирующего белка EGFP, проводили на клетках линии ВНК IR-780, стабильно экспрессирующих данный белок. В качестве мишени была выбрана мРНК, кодирующая белок EGFP, таким образом по уменьшению флуоресценции клеток, определяемой этим белком, можно судить об эффективности доставки siPHK в цитоплазму клетки.
Клетки ВНК IR-780 высаживали в 24-луночные планшеты (0.13×105 клеток на лунку в 500 мкл среды DMEM с 10% эмбриональной телячьей сывороткой) и культивировали в течение суток при 37°С в атмосфере, содержащей 5% СО2. Перед проведением трансфекции для экспериментов в присутствии сыворотки среду в лунках заменяли на 200 мкл среды DMEM с 10% эмбриональной телячьей сывороткой. Композиции при оптимальном соотношении N/P=6/1 в 25 мкл среды OptiMEM смешивали с раствором siPHK (с конечной концентрацией siPHK 50 нМ) в 25 мкл этой же среды и выдерживали 20 мин при 25°С. Полученную смесь добавляли к клеткам и выдерживали в течение 4 ч при 37°С в атмосфере, содержащей 5% СО2, затем заменяли среду на 500 мкл DMEM с 10% эмбриональной телячьей сывороткой. Через 72 ч клетки обрабатывали, как описано в примере 3. В качестве объекта сравнения был выбран коммерчески доступный препарат - Lipofectamine 2000 и липосомы 2X3:DOPE. Результаты по трансфекции клеток короткой интерферирующей РЕК с композициями в присутствии сыворотки в ростовой среде, определенные по уровню снижения экспрессии белка EGFP, представлены в таблице 2.
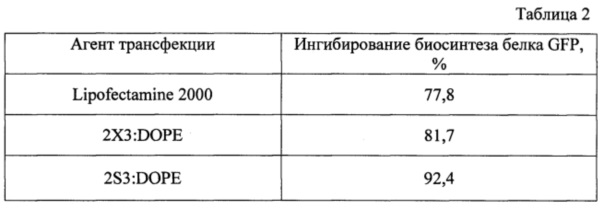
Таким образом, приведенные примеры однозначно указывают на способность предлагаемой композиции 2S3:DOPE, состоящей из дисульфидного поликатионного амфифила и нейтрального фосфолипида, эффективно способствовать проникновению коротких и протяженных нуклеиновых кислот в клетки млекопитающих в присутствии сыворотки крови, что позволяет использовать их в качестве агентов для доставки нуклеиновых кислот в клетки млекопитающих в условиях как in vitro, так и in vivo.