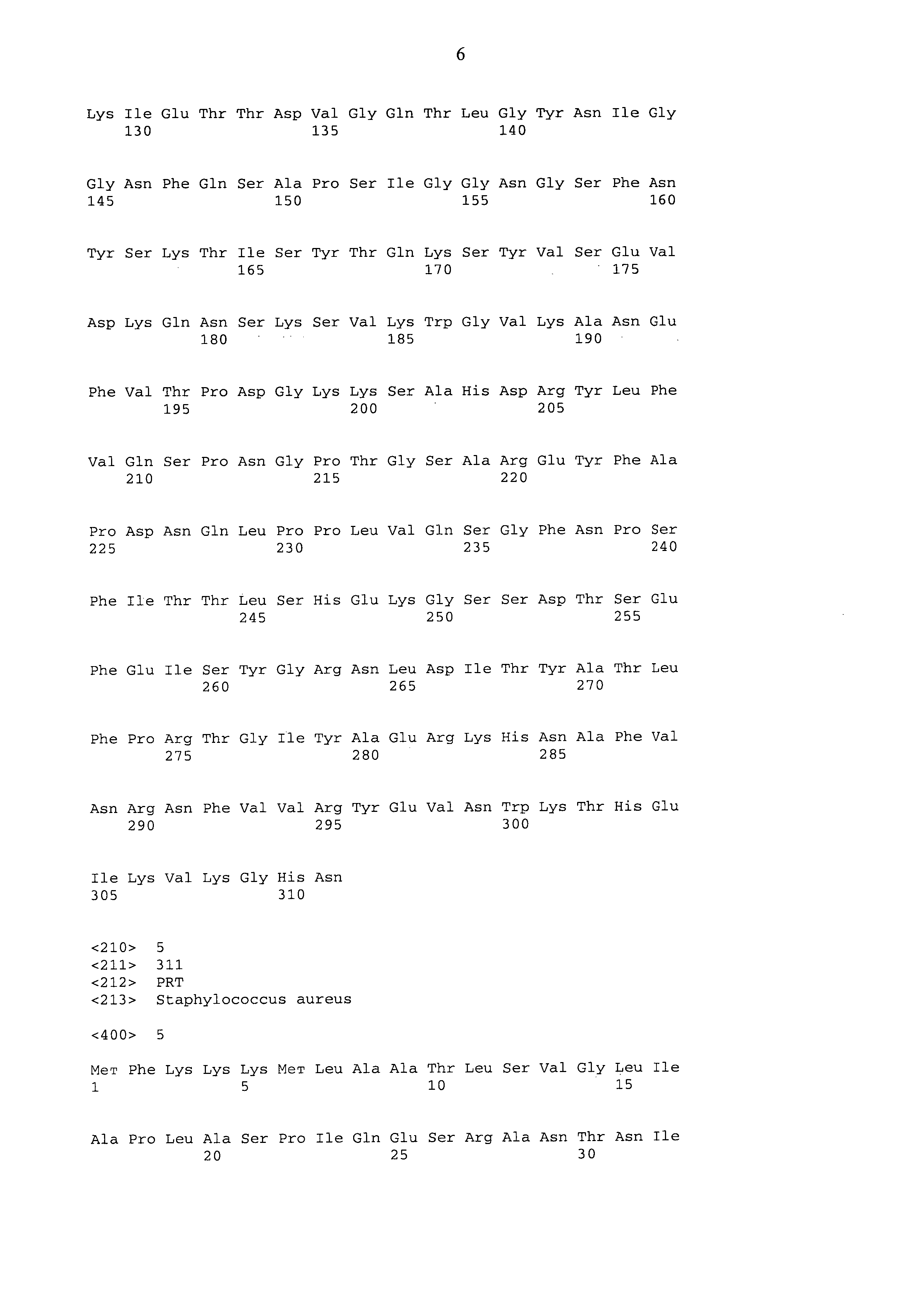Результат интеллектуальной деятельности: СПОСОБ ИНГИБИРОВАНИЯ ТОКСИЧНОСТИ ЛЕЙКОЦИДИНА ED STAPHYLOCOCCUS AUREUS У СУБЪЕКТА
Вид РИД
Изобретение
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Данная заявка заявляет приоритет, согласно предварительной заявке на патент США №61/498,606, зарегистрированной 19 июня 2011, которая в полном объеме включена в данный документ посредством ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0002] Настоящее изобретение относится к способам лечения и предупреждения ВИЧ-инфекций. Настоящее изобретение также относится к способам лечения воспалительных состояний и инфекций, вызванных Staphylococcus aureus.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Staphylococcus aureus
[0003] Staphylococcus aureus ("S. aureus") является бактерией, которая в качестве комменсала колонизирует более 25% представителей человеческой популяции. Важно отметить, что данный микроорганизм способен мигрировать из начального участка колонизации, что приводит к распространению бактерий и развитию болезни. S. aureus является главной причиной внутрибольничных инфекций, наиболее распространенным возбудителем инфекционного эндокардита, а также возбудителем инфекций кожи и мягких тканей, а также является одним из четырех основных причин болезней пищевого происхождения. В общей сложности, S. aureus заражает более 1,2 миллиона пациентов в год в больницах США. Угроза S. aureus для здоровья человека возрастает в связи с появлением устойчивых к антибиотикам штаммов (т.е. метициллинорезистентных (MRSA) штаммов S. aureus), в том числе штаммов, устойчивых к ванкомицину, антибиотику, который считается последней линией защиты от инфекций S. aureus. Эти факты подчеркивают важность разработки новых лекарственных средств против данного важного патогена.
[0004] S. aureus синтезирует разнообразные факторы вирулентности и токсины, которые позволяют данной бактерии нейтрализовывать и выдерживать атаку различных типов иммунных клеток, в частности, субпопуляций лейкоцитов, которые представляют основную систему защиты организма. Выработка факторов вирулентности и токсинов позволяют S. aureus поддерживать инфекционное состояние (Nizet, "Understanding How Leading Bacterial Pathogens Subvert Innate Immunity to Reveal Novel Therapeutic Targets," J. Allergy din. Immunol. 120(1):13 22 (2007)). Из этих факторов вирулентности S. aureus производит несколько двухкомпонентных лейкотоксинов, которые повреждают мембраны защитных клеток хозяина и эритроцитов объединенным действием двух неассоциированных белков или субъединиц (см. Menestrina et al., "Mode of Action of Beta-Barrel Pore-Forming Toxins of the Staphylococcal Alpha-Hemolysin Family," Toxicol. 39(11):1661-1672 (2001)). Среди этих двухкомпонентных лейкотоксинов, гамма-гемолизин (HlgAB и HlgCB) и Pantone-Valentine лейкоцидин (PVL) описаны наиболее подробно.
[0005] Токсичность лейкоцидинов по отношению к клеткам млекопитающих обусловлена действием двух компонентов. Первая субъединица названа субъединицей класса S (т.е., "slow-eluted", медленно элюируемая), а вторая субъединицей класса F (т.е., " fast -eluted", быстро элюируемая). S-и F-субъединицы действуют синергически и образуют Поры в белых клетках крови, таких как моноциты, макрофаги, дендритные клетки и нейтрофилы (вместе известные как фагоциты) (Menestrina et al., "Mode of Action of Beta-Barrel Pore-Forming Toxins of the Staphylococcal Alpha-Hemolysin Family," Toxicol. 39(11):1661 1672 (2001)). Механизм, с помощью которого двухкомпонентные токсины образуют поры в мембранах клеток-мишеней, изучен не до конца. Предлагаемый механизм действия этих токсинов включает в себя связывание S-субъединицы с мембраной клетки-мишени, скорее всего через рецептор, с последующим присоединением F-субъединицы к S-субъединице, при этом формируется олигомер, который образует предварительные поры в мембране клетки-мишени (Jayasinghe et al., "The Leukocidin Pore: Evidence for an Octamer With Four LukF Subunits and Four LukS Subunits Alternating Around a Central Axis," Protein. Sci. 14(10):2550 2561 (2005)). Поры, образованные двухкомпонентными лейкотоксинами, обычно катион-селективны. Формирование пор вызывает гибель клеток путем лизиса, который, как сообщается, вызывается осмотическим дисбалансом из-за притока катионов в случае, если мишенью являются белые клетки крови (Miles et al., "The Staphylococcal Leukocidin Bicomponent Toxin Forms Large Ionic Channels," Biochemistry 40(29):8514 8522 (2001)).
[0006] Разработка эффективной терапии для лечения MRSA-инфекции была особенно сложной. В дополнение к устойчивости к метициллину и родственным антибиотикам, для MRSA также были показаны значительные уровни устойчивости к макролидам (например, к эритромицину), комбинациям ингибиторов бета-лактамаз (например, Unasyn, Augmentin) и фторхинолонам (например, ципрофлоксацину), а также к клиндамицину, триметоприму/сульфаметоксизолу (Bactrim) и рифампицину. В случае серьезной инфекции S. aureus, врачи прибегают к внутривенному введению ванкомицина. Тем не менее, были сообщения об устойчивости S. aureus к ванкомицину. Таким образом, существует необходимость в разработке новых антибиотиков, которые смогут эффективно бороться с инфекцией S. aureus.
С-С рецептор хемокина 5
[0007] С-С рецептор хемокина 5 (CCR5) является членом семьи бета-рецепторов хемокинов (Samson M et al., "Molecular Cloning and Functional Expression of a New Human CC-Chemokine Receptor Gene" Biochemistry 35:3362 (1996)). Нормальными лигандами для этого рецептора являются RANTES, Miplb и Mipla (см. Samson, выше and Gon W et al "Monocyte Chemotactic Protein-2 Activates CCR5 and Blocks CD4/CCR5 Mediated HIV-1 Entry/Replication," J. Biol. Chem. 273:4289 (1998)). CCR5 экспрессируется в подмножестве Т-клеток, макрофагов, дендритных клеток, естественных клеток-киллеров, и микроглии. CCR5"1" Т-клетки секретируют провоспалительные цитокины и скапливаются в местах воспаления. Таким образом, вполне вероятно, что CCR5 играет важную роль в воспалительных реакциях при инфекции и в патологических состояниях, таких как аутоиммунные заболевания. CCR5 также является рецептором для основного штамма ВИЧ-инфекции. (Deng H et al., "Identification of a Major Co-Receptor for Primary Isolates of HIV-1," Nature 381:661-666 (1996)). У лиц, инфицированных ВИЧ, вирусы, использующие CCR5 являются преобладающими элементами, выделяемыми на ранних стадиях вирусной инфекции. Предполагается, что эти вирусы могут иметь селективное преимущество при передаче или острой фазе заболеваний. Более того, по меньшей мере у половины всех инфицированных были отмечены только использующие CCR5 вирусы на протяжении всего течения инфекции. Около 1% северных европейцев лишены функциональной экспрессии CCR5 в связи с делецией в 32 паре нуклеотидов в данном гене. Лица с Д32 аллелью CCR5 здоровы, что предполагает, что CCR5 является в значительной степени несущественным элементом. Тем не менее, эти люди имеют очень сильный иммунитет к ВИЧ-инфекции (Liu R et al., "Homozygous Defect in HIV-1 Coreceptor Accounts for Resistance of Some Multiply-Exposed Individuals to HIV-1 Infection," Cell 86:367-377 (1996)). Действительно, больной СПИДом, который имел миелоидный лейкоз, был подвержен химиотерапии для подавления рака, в результате которого погибли все его Т-клетки. Затем пациенту была перелита донорская кровь, которая содержала мутантные 32 bp CCR5 с делецией, для восстановления иммунной системы. После 600 дней пациент был здоров и в крови, тканях мозга и ректальных тканях ВИЧ обнаружен не был (Hutter G et al., "Long-Term Control of HIV by CCR5 Delta32/Delta32 Stem-Cell Transplantation," N. Engl. J. Med. 360:692-698 (2009)). Был разработан ряд новых экспериментальных лекарств против ВИЧ, названных «ингибиторами входа», чтобы помешать взаимодействию CCR5 и ВИЧ, в том числе PRO 140, Vicriviroc, Aploviroc и Maraviroc (Pfizer), из которых последний в настоящее время является одобренным препаратом против ВИЧ-инфекции.
[0008] CCR5 также участвует в неконтролируемом воспалении (Charo et al., "The Many Roles of Chemokine Receptors in Inflammation," N. Engl. J. Med. 354:610-621 (2006)). Данная ассоциация основана на роли этого рецептора хемокинов при рекрутировании воспалительных лейкоцитов. В частности, CCR5 экспрессируется в подмножестве эффекторных Т-клеток, которые продуцируют провоспалительные цитокины, такие как гамма-интерферон (IFNg) и интерлейкин-17 (IL-17), количество которых увеличивается локально во время воспаления. Таким образом, CCR5 в настоящее время рассматривается в качестве мишени для ослабления воспалительных заболеваний, таких как ревматоидный артрит (RA), болезнь Крона (CD), атеросклероз и псориаз.
[0009] Настоящее изобретение направлено на преодоление этих и других ограничений в данной области.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0010] Первый аспект настоящего изобретения относится к способу профилактики или лечения вируса иммунодефицита человека (ВИЧ) у субъекта. Этот способ включает введение состава, содержащего выделенный лейкоцидин Е (LukE) в виде белка или полипептида и выделенный лейкоцидин D (LukD) в виде белка или полипептида в количестве, эффективном для профилактики или лечения ВИЧ-инфекции у субъекта.
[0011] Другой аспект настоящего изобретения относится к способу профилактики ВИЧ-инфекции у субъекта. Этот способ включает получение состава, содержащего выделенный белок LukE или его полипептид и выделенный белок LukD или его полипептид и контакт ткани субъекта с составом в условиях, эффективных для блокирования инфекционности ВИЧ клеток в ткани и, тем самым, ингибирования ВИЧ-инфекции субъекта.
[0012] Другой аспект настоящего изобретения относится к составу, включающему терапевтически эффективное количество выделенного белка LukE или его полипептида, выделенного белка LukD или его полипептида, или их комбинации, и одного или более дополнительных средств, выбранных из группы, состоящей из лубриканта, противомикробного средства, увлажнителя, эмульгатора, и смеси двух или более из них.
[0013] Другой аспект изобретения относится к способу лечения воспалительного состояния у субъекта. Этот способ включает введение составу, включающему выделенный белок LukE или его полипептид и выделенный белок LukD или его полипептид в количестве, эффективном для лечения воспалительного состояния у субъекта.
[0014] Другой аспект настоящего изобретения относится к способу профилактики болезни«трансплантат против хозяина» (graft-versus-host-disease или GVHD) у субъекта. Этот способ включает введение составу, включающему выделенный белок LukE или его полипептид и выделенный белок LukD или его полипептид в количестве, эффективном для предотвращения болезни «трансплантат против хозяина» (GVHD) у субъекта.
[0015] Другой аспект настоящего изобретения относится к способу лечения инфекции Staphylococcus aureus у субъекта. Этот способ включает выбор субъекта, имеющего инфекцию S. aureus, и введение ему составу, включающему антагонист CCR5 в количестве, эффективном для лечения инфекции S. aureus у данного субъекта.
[0016] Как показано в данном документе, заявители обнаружили, что двухкомпонентный лейкотоксин Staphylococcus aureus, лейкоцидин E/D, реализует свою цитотоксичность с помощью рецептора CCR5 на поверхности лейкоцитов. Эксплуатация данного взаимодействия токсина-рецептора имеет ряд терапевтических последствий. Во-первых, поскольку LukE/D играют значительную роль в патогенезе S. aureus, использование антагонистов рецепторов CCR5 предполагает новый терапевтический подход для лечения инфекций S. aureus, особенно таких, которые вызваны штаммами MRSA. Во-вторых, в связи с его участием в инфекционности ВИЧ, разнообразные ССР5-антагонисты в настоящее время проходят клинические испытания в качестве анти-ВИЧ препаратов. Использование состава, включающего LukE и LukD, для поражения латентно-инфицированных клеток у ВИЧ-инфицированных лиц представляет собой превосходную терапевтическую стратегию по сравнению с ССР5-антагонизмом, поскольку использование этого токсина будет истощать все CCR5-положительные клетки, тем самым устраняя ВИЧ-положительные клетки. Состав, содержащий LukE и LukD, также можно вводить профилактически для предотвращения передачи ВИЧ, убивая при этом CCR5-положительные клетки, которые необходимы для передачи ВИЧ. Данные терапевтические подходы являются новыми, поскольку они будут ликвидировать у субъекта клетки ВИЧ или клетки, восприимчивые к ВИЧ-инфекции. Наконец, так как CCR5 также участвует в неконтролируемом воспалении, применение состава LukE/D для поражения и истощения CCR5-положительных клеток предлагает новый подход в борьбе с локализованными воспалительными состояниями. Этот подход к лечению имеет высокую избирательность по отношению к источнику воспаления, что позволяет тем самым избегать побочных эффектов, часто сопровождающих современные подходы к лечению воспалений.
КРАТКОЕ ОПИСАНИЕ ФИГУР
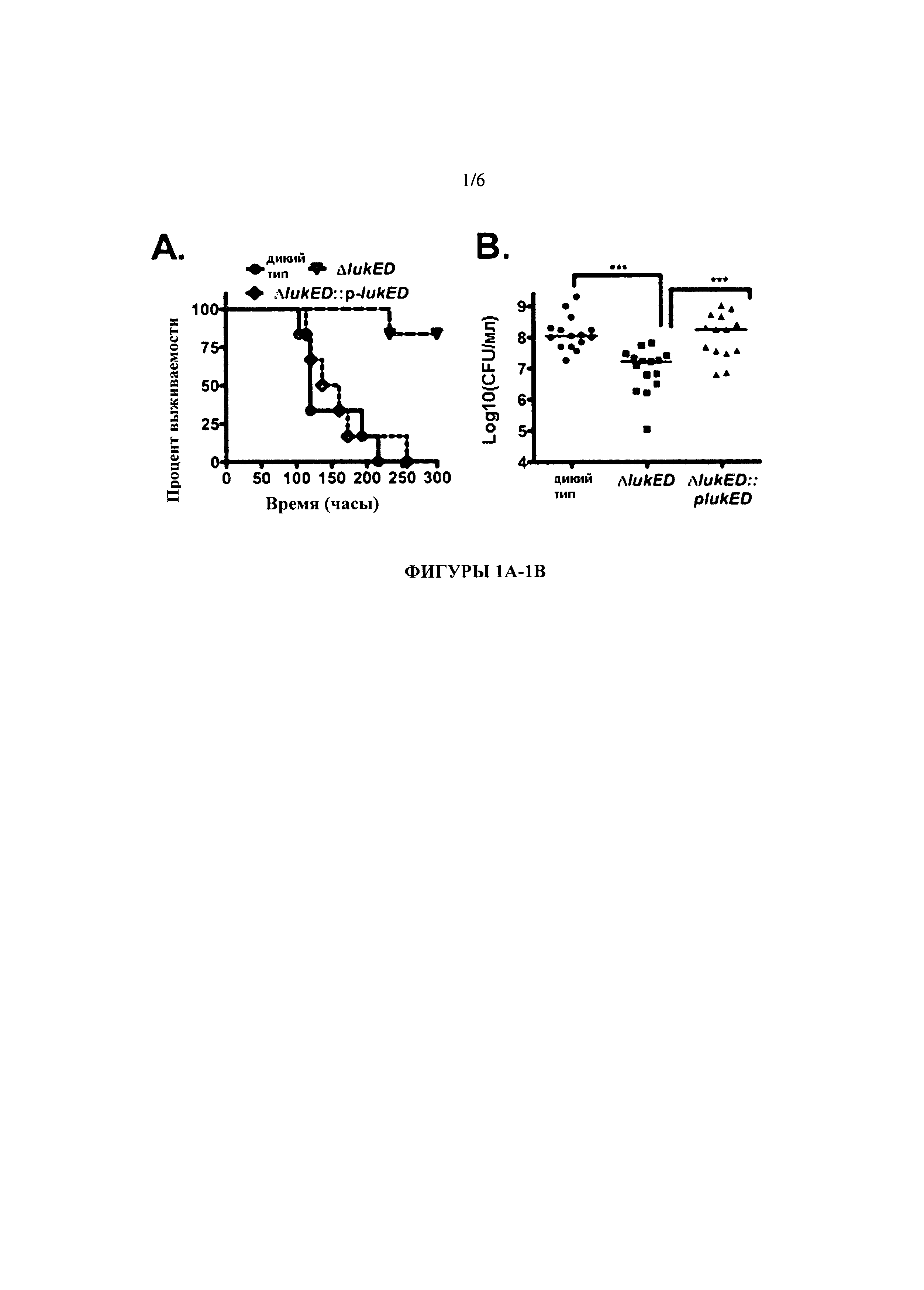
[0017] На Фигурах 1А-1В проиллюстрировано, что LukE/D способствует инфекции S. aureus в модели системной инфекции у мышей. На Фигуре 1А проиллюстрировано, что LukE/D имеет решающее значение при смерти мышей, системно зараженных S. aureus. Выживание мышей контролировали после внутривенной инъекции с КОЕ ~ 1×107 штамма S. aureus дикого типа Ньюмана, мутанта ΔlukE/D, и дополненного ΔlukE/D::plukE/D штамма. Общее количество мышей в каждой группе было N=6. Статистическая значимость между кривыми выживаемости определялась с помощью Log-rank-теста (тест Мантеля-Кокса) (р≤0,0005). На Фигуре 1 В проиллюстрировано, что LukE/D необходим для пролиферации S. aureus in vivo. Бактериальная нагрузка определялась пересчетом бактериальных КОЕ из почек спустя 96 часов после инфицирования, как проиллюстрировано на фигуре 1А. Статистическая значимость была определена с использованием 1-Way ANOVA с множественными посттестовыми сравнениями Тьюки (***, p≤0.0005).
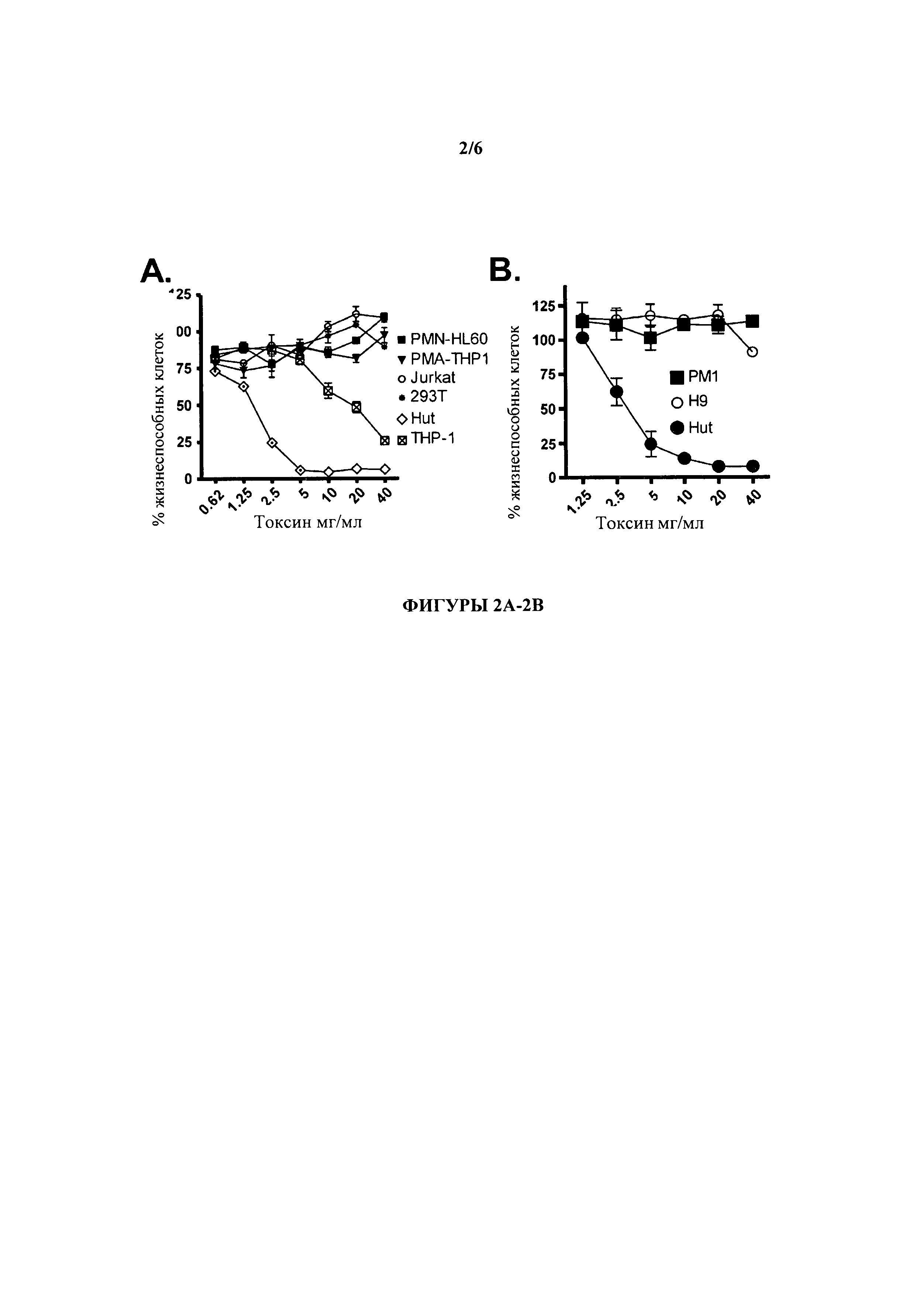
[0018] На Фигурах 2А-2В проиллюстрировано, что LukE/D является токсичным для определенных линий иммунных клеток человека. На Фигуре 2А проиллюстрировано, что LukE/D селективно токсичен для моноцит-подобных клеток линии ТНР-1 и лимфоцит-подобных клеток линии Hut. Цитотоксичность определялась жизнеспособностью клеток, когда указанные линии иммунных клеток человека вводились в состояние интоксикации различными концентрациями эквимолярной смеси LukE+LukD (LukE/D). Жизнеспособность клеток контролировалась спустя 1 час после интоксикации с помощью CellTiter, где клетки, выращенные в среде, были определены как имеющие 100% клеточную гибель. Результаты представляют среднее значение по трем образцам ±S.D. На Фигуре 2В проиллюстрировано, что LukE/D убивает Hut-клетки, но не другие Т-лимфоцит-подобные клеточные линии. Указанные клеточные линии были введены в состояние интоксикации различными концентрациями эквимолярной смеси LukE+LukD (LukE/D), жизнеспособность данных клеток отображена на фигуре 2А. Результаты представляют среднее значение трех образцов j: S.D.
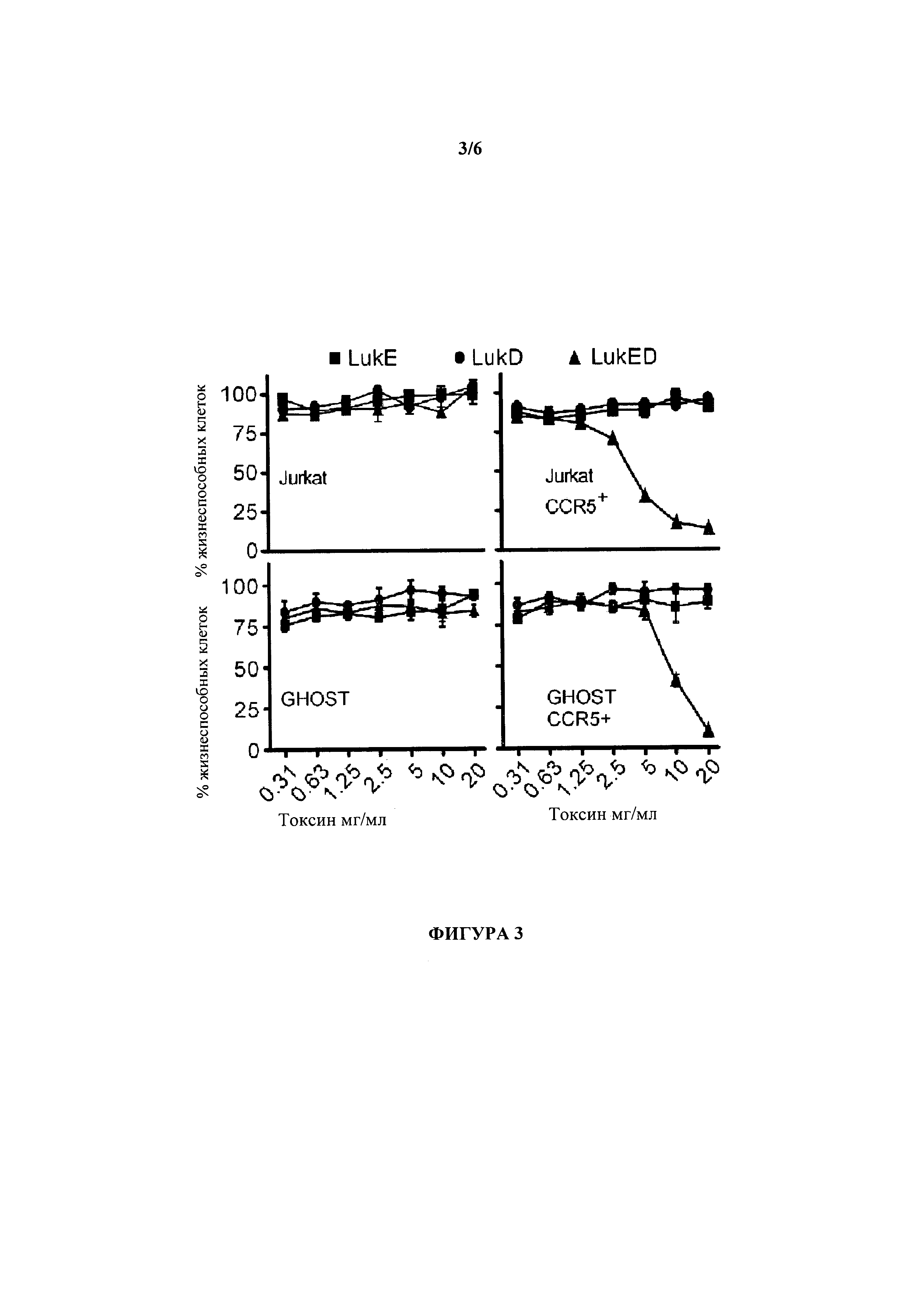
[0019] На Фигуре 3 проиллюстрировано, что CCR5 рецептор хемокинов необходим и его наличия достаточно, для того, чтобы сделать клетки млекопитающих чувствительными к цитотоксичности LukE/D. Родительские клетки Jurkat (сверху, слева) и клетки GHOST (внизу, слева) или эти же клетки, трансдуцированные CCR5 кДНК (Jurkat CCR5+, сверху/справа; GHOST CCR5+, внизу/справа), были подвержены интоксикации LukE, LukD или эквимолярной смесью LukE+LukD (LukE/D). Жизнеспособность клеток спустя один час после интоксикации контролировали с помощью CellTiter, где клетки, выращенные в среде, были определены как имеющие 100% клеточную гибель. Результаты представляют среднее значение по трех образцам ±S.D.
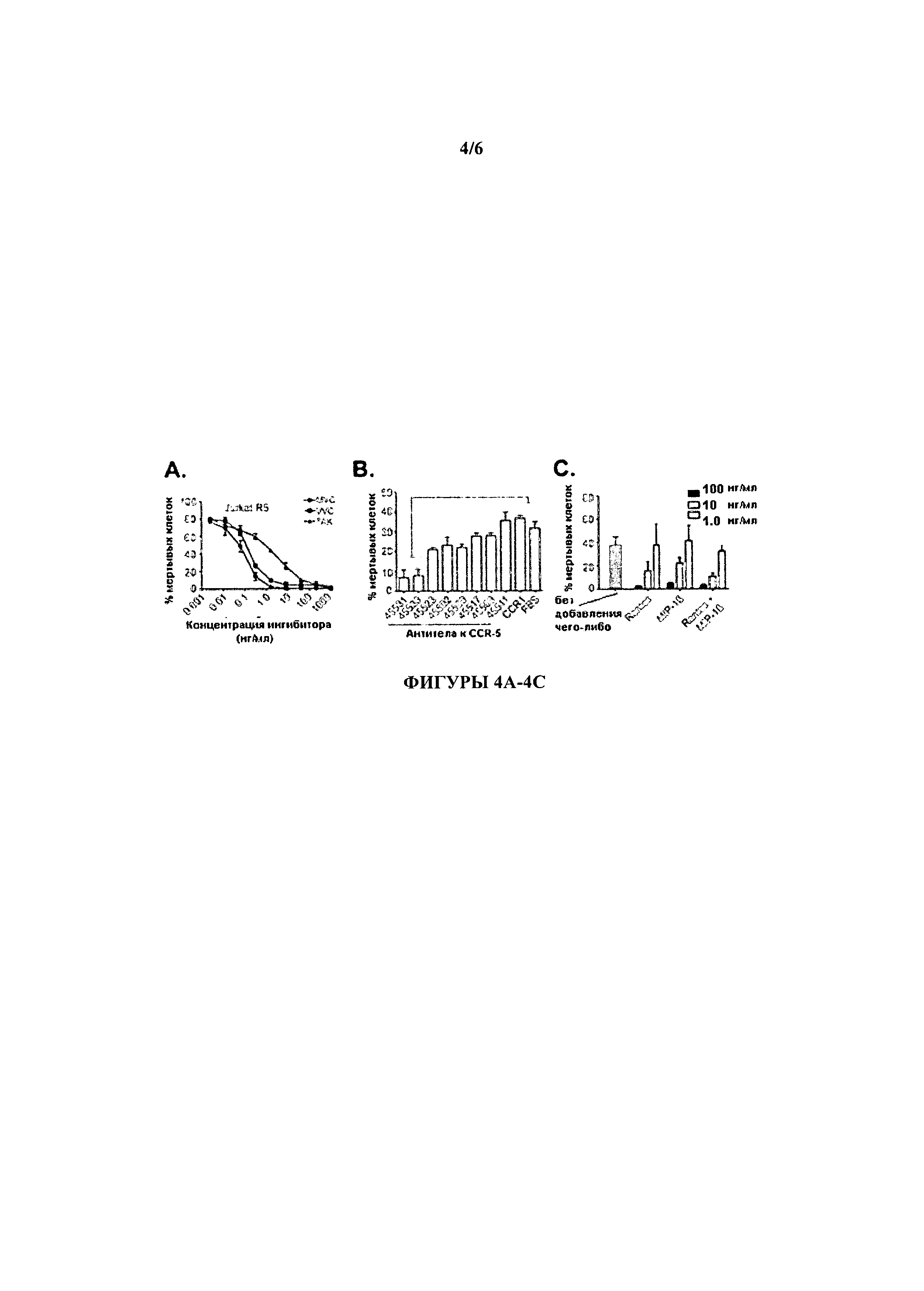
[0020] На фигурах 4А-4С проиллюстрировано, что цитотоксичность LukE/D по отношению к клеткам-хозяевам блокируется ингибиторами CCR5. На Фигуре 4А проиллюстрировано, что ССР5-специфичный антагонист эффективно блокирует цитотоксичность LukE/D по отношению к CCR5+-клеткам. Клетки CCR5+ Jurkats предварительно инкубировали с различными концентрациями Maraviroc (MVC), Vicriviroc (VVC), или ТАК-779 (ТАК) в течение 30 минут с последующей интоксикацией эквимолярной смесью LukE+LukD (LukE/D). Процент смертности среди клеток спустя один час после интоксикации контролировали с помощью CellTiter, где клетки, выращенные в среде +LukE/D, были определены, как имеющие 100% клеточную гибель. Результаты представляют среднее значение по трех образцам ±S.D. На Фигуре 4В проиллюстрировано, что моноклональные антитела к CCR5 ингибируют цитотоксичность LukE/D по отношению к CCR5+-клеткам. Клетки CCR5+Jurkat преинкубировали с указанными моноклональными антителами в течение 30 минут, после чего интоксицировали эквимолярной смесью LukE+LukD (LukE/D). Жизнеспособность клеток спустя один час после интоксикации контролировали с помощью CellTiter, где клетки, выращенные в среде, были определены как имеющие 100% клеточную гибель. Результаты представляют среднее значение по трех образцам ±S.D. На Фигуре 4С проиллюстрировано, что CCR5 лиганды ингибируют цитотоксичность LukE/D по отношению к CCR5+-клеткам. Клетки CCR5+ Jurkat преинкубировали с буфером (PBS; отрицательный контроль) или с различными концентрациями указанных лигандов в течение 30 минут, после чего интоксицировали эквимолярной смесью LukE+LukD (LukE/D). Жизнеспособность клеток спустя один час после интоксикации контролировали с помощью CellTiter, где клетки, выращенные в среде, были определены как имеющие 100% клеточную гибель. Результаты представляют среднее значение по трех образцам ±S.D.
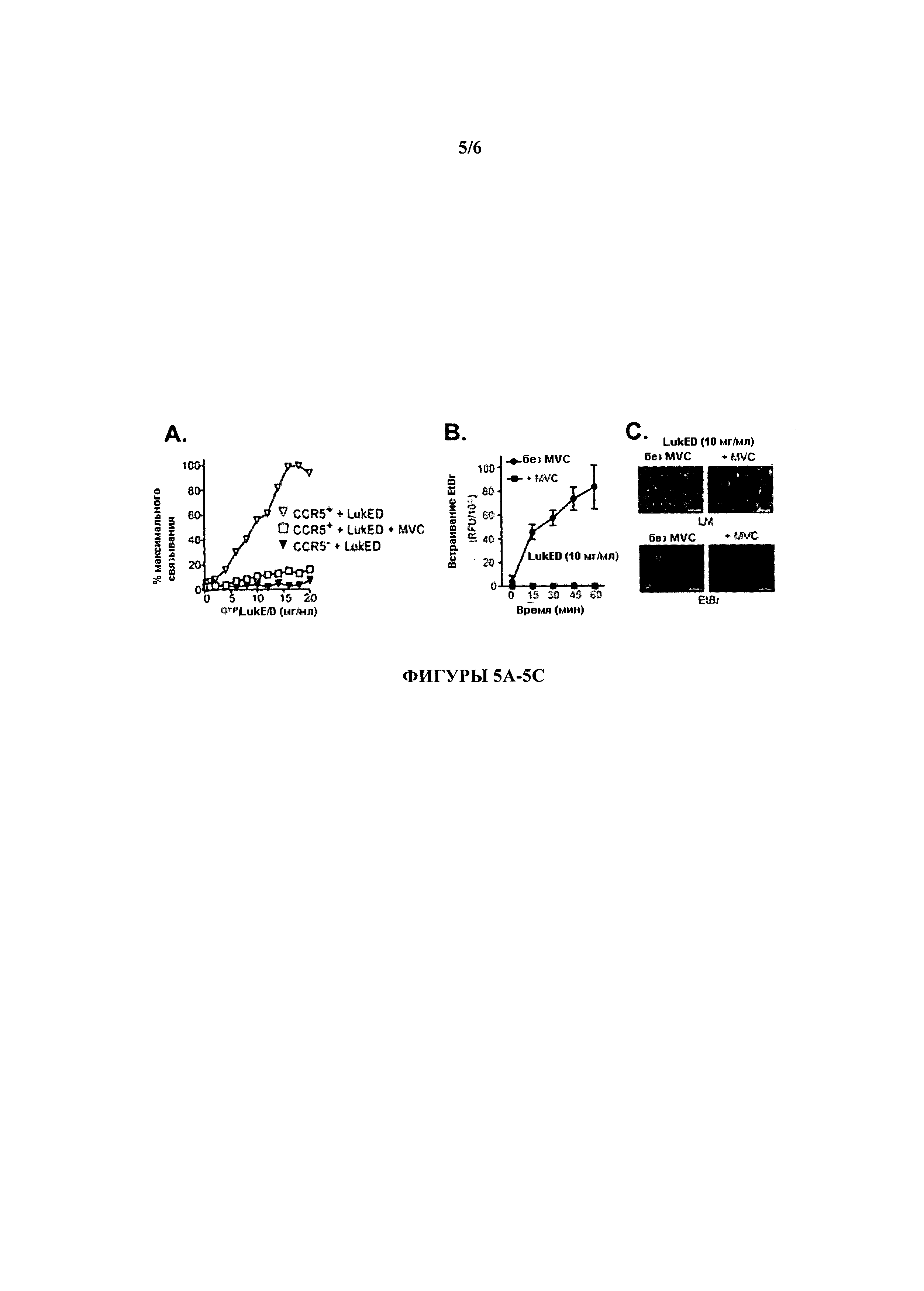
[0021] На Фигурах 5А-5С проиллюстрировано, что блокирование связывания LukE/D и плазматической мембраны клеток-мишеней защищает клетки от цитотоксического воздействия LukE/D. На Фигуре 5А проиллюстрировано, что LukE/D связывается к клетками-хозяевами CCR5-зависимым путем и что это связывание эффективно подавляется Maraviroc. Клетки Jurkat (CCR5+) и CCR5+ Jurkat (CCR5+) предварительно инкубировали с буфером или с Maraviroc (CCR5++MVC) с последующим инкубированием эквимолярной смесью LukE, связанного с зеленым флуоресцентным белком (GFP), и LukD токсином (GFPLukE/D). Связывание токсина с плазматической мембраной клеток контролировали с помощью проточной цитометрии. На Фигуре 5 В проиллюстрировано, что LukE/D формирует поры в плазматической мембране CCR5+-клеток, и этот способ эффективно блокируется Maraviroc. Клетки CCR5+ Jurkat предварительно инкубировали с Maraviroc (MVC) и впоследствии подвергали интоксикации эквимолярной смесью LukE+LukD (LukE/D) в присутствии этидиумбромида. Формирование пор контролировалось во времени путем мониторинга связывания этидиумбромида. Результаты представляют среднее значение по трем образцам ±S.D. Фигура 5С демонстрирует, что формирование пор под действием LukE/D связано с клеточным отеком, причем данный цитопатический эффект эффективно ингибируется Maraviroc. Клетки CCR5+ Jurkat предварительно инкубировали с буфером (NO MVC) или с Maraviroc (MVC), а затем вводили в состояние интоксикации эквимолярной смесью of LukE+LukD (LukE/D) в присутствии этидиумбромида. Мониторинг интоксицированных клеток проводился при свете (верхние панели) и с помощью флуоресцентной микроскопии для определения поглощение этидиумбромида. Репрезентативные изображения показаны.
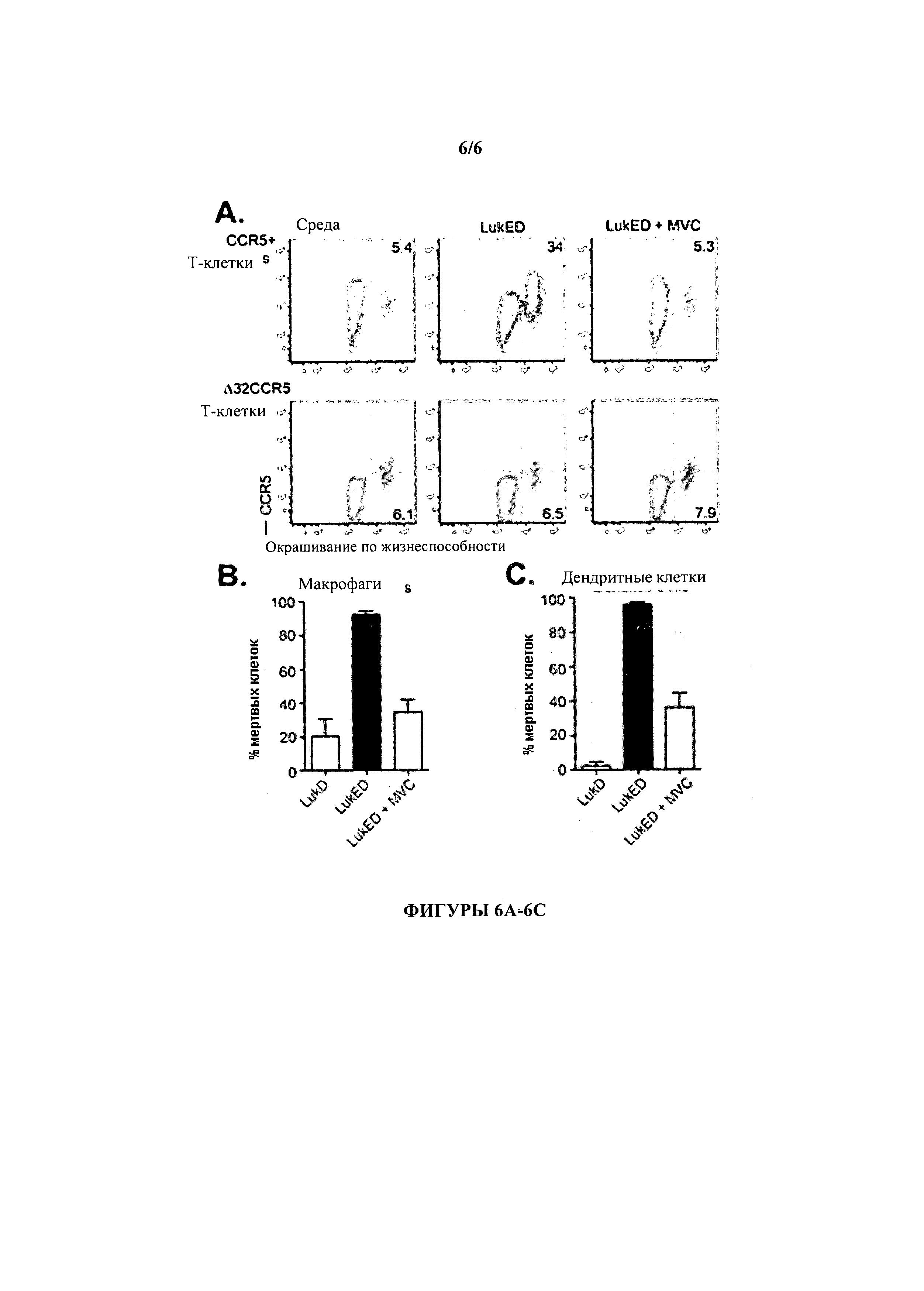
[0022] На фигурах 6А-С проиллюстрировано, что LukE/D эффективно убивает CCR5+ первичные иммунные клетки человека. На Фигуре 6А проиллюстрировано, что мишенью LukE/D являются первичные Т-лимфоциты человека CCR5-зависимым образом. Т-клетки человека, такие как мононуклеарные клетки периферической крови (РВМС) дикого типа CCR5 и донора A32CCR5 были выращены in vitro и затем инкубировались в среде (при отрицательном контроле) с эквимолярной смесью LukE+LukD (LukE/D) или с Maraviroc (MVC), с последующей интоксикацией эквимолярной смесью LukE+LukD (LukE/D). Затем клетки окрашивали антителом к CCR5 и их жизнеспособность оценивалась с помощью контроля красителя способом проточной цитометрии. На Фигурах 6 В-6С проиллюстрировано, что LukE/D цитотоксичен по отношению к первичным человеческим макрофагам (фигура 6В) и первичных дендритных клеток человека (фигура 6С) и что Maraviroc эффективно защищает данные клетки от цитотоксичности LukE/D. Макрофаги и дендритные клетки инкубировали в среде (при отрицательном контроле) с эквимолярной смесью LukE+LukD (LukE/D) или с Maraviroc (MVC), с последующей интоксикацией эквимолярной смесью LukE+LukD (LukE/D). Процент смертности оценивался спустя один час после интоксикации с помощью проточной цитометрии.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0023] Первый аспект настоящего изобретения относится к составу, содержащему терапевтически-эффективное количество выделенного белка LukE или его полипептида, выделенного белка LukD или его полипептида и фармацевтически приемлемого носителя.
[0024] В соответствии с данным аспектом настоящего изобретения, подходящие выделенные белки LukE включают такие, которые можно получить из любого штамма S. aureus. Аминокислотная последовательность белков LukE из различных штаммов S. aureus, которые подходят для состава согласно настоящему изобретению, показаны в таблице 1, приведенной ниже (т.е. SEQ ID Nos:1-10). SEQ ID NO:11 в таблице 1 представляет консенсусную последовательность LukE и демонстрирует высокий уровень идентичности последовательности с белками LukE различных штаммов S. aureus. Соответственно, в одном варианте осуществления настоящего изобретения выделенный белок LukE содержит аминокислотную последовательность SEQ ID NO:11. В другом варианте осуществления настоящего изобретения, выделенный белок LukE содержит аминокислотную последовательность, имеющую около 70-80% сходство последовательности с SEQ ID NO:11 или, что более предпочтительно, около 80-90% сходство последовательности в SEQ ID NO:11, или более предпочтительное 90-95% сходство последовательности с SEQ ID NO:11, или наиболее предпочтительное около 95-99% сходство с последовательностью SEQ ID NO:11.
[0025] В другом варианте осуществления настоящего изобретения состав содержит выделенный полипептид LukE. Подходящие полипептиды LukE имеют длину от около 50 до около 100 аминокислот. Более предпочтительные LukE полипептиды имеют в длину примерно 100-200 аминокислот, более предпочтительные - около 200-250 аминокислот в длину, а наиболее предпочтительные - 250-300 аминокислот в длину. Аминокислотные остатки N-концов полного LukE представляют нативную последовательность секреции/сигналинга. Таким образом, «зрелая» секретируемая форма LukE представлена аминокислотными остатками 29-311 в каждой из последовательностей SEQ ID NO:1-10 и SEQ ID NO:11. Соответственно, аминокислотные остатки 1-311 в каждом из SEQ ID NO:1-10 и SEQ ID NO:11, обозначаются как "незрелая" форма LukE. Соответственно, в одном варианте осуществления настоящего изобретения полипептид LukE содержит аминокислотные остатки 29-311 из SEQ ID NO:11, аминокислотные остатки 48-291 из SEQ ID NO:11, аминокислотные остатки 29-301 из SEQ ID No:11 и аминокислоты 48-301 из SEQ ID NO:11. В любом случае, подходящие полипептиды LukE также включают те полипептиды, которые содержат аминокислотную последовательность, имеющую сходство около 70-80%, предпочтительнее сходство последовательностей 80-90%, более предпочтительно сходство последовательностей 90-95% и наиболее предпочтительно 95-99% сходство последовательности аминокислотным остаткам 29-311 из SEQ ID NO:11 или 48-291 из SEQ ID NO:11.
[0026] В соответствии с этим аспектом настоящего изобретения, подходящие выделенные белки LukD включают такие, которые получены из любого штамма S. aureus. Аминокислотная последовательность LukD белков из различных штаммов S. aureus, которые подходят для состава согласно настоящему изобретению, показаны в таблице 2, приведенной ниже (т.е. SEQ ID Nos: 12-21). SEQ ID NO:22 в таблице 2 представляет собой консенсусную последовательность белка LukD, которая демонстрирует высокий уровень идентичности последовательности с белками LukD различных штаммов S. aureus. Соответственно, в одном варианте осуществления настоящего изобретения, выделенный белок LukD содержит аминокислотную последовательность SEQ ID NO:22. В другом варианте осуществления настоящего изобретения, выделенный белок LukD содержит аминокислотную последовательность, имеющую сходство последовательностей около 70-80% с SEQ ID NO:22, предпочтительнее около 80-90% сходство последовательности с SEQ ID NO:22, более предпочтительно 90-95% сходство последовательности с SEQ ID NO:22, и наиболее предпочтительно около 95-99% сходство последовательности с SEQ ID NO:22.
[0027] В другом варианте осуществления настоящего изобретения состав содержит выделенный полипептид LukD. Подходящие полипептиды LukD имеют от около 50 до около 100 аминокислот в длину. Более предпочтительны полипептиды LukD около 100-200 аминокислот в длину, более предпочтительны около 200-250 аминокислот в длину и наиболее предпочтительны около 250-300 аминокислот в длину. Аминокислотные остатки N-концов от полного LukD представляют собой нативную последовательность секреции/сигналинга. Таким образом, "зрелая" секретируемая форма LukD представлена аминокислотными остатками 27-327 в каждой из последовательностей SEQ ID NO:12-21 и SEQ ID NO:22. Соответственно, аминокислотные остатки 1-327 из SEQ ID NO:12-21 и SEQ ID NO:22 обозначаются как "незрелая" форма LukD. Соответственно, в одном варианте осуществления настоящего изобретения полипептид LukD содержит аминокислотные остатки 27-327 из SEQ ID NO:22. В другом случае, полипептид LukD согласно настоящего изобретения содержит аминокислотные остатки 46-307, аминокислотные остатки 27-312, и аминокислотные остатки 46-312 из SEQ ID NO:22. В любом случае, подходящими полипептидами являются такие, которые включают аминокислотную последовательность, имеющую сходство около 70-80%, предпочтительнее 80-90% сходство последовательностей, более предпочтительно 90-95% сходство последовательностей и наиболее предпочтительно 95-99% сходство последовательности аминокислотным остаткам 27-327 из SEQ ID NO:22, аминокислотным остаткам 46-307 из SEQ ID NO:22, аминокислотным остаткам 46-312 из SEQ ID NO:22, или аминокислотным остаткам 27-312 из SEQ ID NO:22.








[0028] Таким образом, если не указано обратное, как незрелые, так и зрелые формы нативных LukE и LukD, а также последовательности, имеющие менее 100% сходство с нативным LukE (т.е. нативные последовательности и аналоги, вместе называемые в данном документе "LukE" и "LukD"), могут быть использованы в способах для настоящего изобретения.
[0029] Белки и полипептиды LukE и LukD, описанные в настоящем изобретении, могут отличаться от нативных полипептидов, обозначенных как SEQ ID NOS:1-11 и 12-22 соответственно с точки зрения одной или более дополнительных аминокислотных вставок, замен или делеций. К примеру, один или несколько аминокислотных остатков в SEQ ID NOS:1-22 могут быть замещены другой аминокислотой подобной полярности, которая действует как функциональный эквивалент, и приводит к "молчащему" изменению. То есть изменение относительно нативной последовательности не будет заметно уменьшать основные свойства нативных LukE или LukD. Любой подобный аналог LukE или LukD может быть подвергнут скринингу в соответствии с протоколами, приведенными в данном документе (например, анализа цитотоксичности и анализа повреждений мембраны), чтобы определить сохраняет ли аналогактивность нативных LukE или LukD. Замены для этих лейкоцидинов могут быть выбраны из других членов класса, к которому принадлежит аминокислота. Например, неполярные (гидрофобные) аминокислоты, а именно аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан и метионин. Полярными нейтральными аминокислотами являются глицин, серин, треонин, цистеин, тирозин, аспарагин и глутамин. Положительно заряженными (основными) аминокислотами являются аргинин, лизин и гистидин. Отрицательно заряженными (кислыми) аминокислотами являются аспарагиновая кислота и глутаминовая кислота.
[0030] В других вариантах осуществления неконсервативные изменения (например, одна или несколько аминокислотных замен, делеций и/или дополнений) могут быть сделаны для целей повышения селективности и/или активность LukE и/или LukD. Модифицированный LukE и LukD могут использовать в лекарственных средствах, описанных в данном документе. Молекулярные изменения могут быть выполнены способами, хорошо известными в данной области, в том числе удлинением праймера на матрице плазмиды с использованием одноцепочечных шаблонов (Kunkel et al.,, Proc. Acad. Sci:, USA 52:488-492 (1985), цитата в полном объеме включена в данный документ посредством ссылки), двухцепочечные ДНК-матрицы (Papworth et al., Strategies 9(3):3-4 (1996), цитата в полном объеме включена в данный документ посредством ссылки) и с помощью ПЦР-клонирования (Braman, J. (ed.), IN VITRO MUTAGENESIS PROTOCOLS, 2nd ed. Humana Press, Totowa, N.J. (2002), цитата в полном объеме включена в данный документ посредством ссылки). Способы определения того, изменяет ли данная молекулярная альтернатива LukE и LukD цитотоксичность LukE/D, описаны в данном документе.
[0031] В предпочтительном варианте осуществления настоящего изобретения используется высокоочищенный препарат LukE/LukD. Способы очистки токсинов LukE и LukD известны в данной области (Gravet et al., "Characterization of a Novel Structural Member, LukE-LukD, of the Bi-Component Staphylococcal Leucotoxins Family," FEBS 436: 202-208 (1998), цитата в полном объеме включена в данный документ посредством ссылки). Согласно данному документу, при применении "выделенного" белка или полипептида, они относится к белку или полипептиду, которые были отделены от других белков, липидов и нуклеиновых кислот, с которыми они были естественно ассоциированы. Чистоту можно измерить любым подходящим стандартным способом, например, с помощью колоночной хроматографии, электрофореза в полиакриламидном геле, анализа HPLC. Выделенный согласно настоящему изобретению белок или полипептид может быть очищен из природного источника, получен с помощью технологии рекомбинантной ДНК или с помощью химических способов.
[0032] Лекарственные средства настоящего изобретения получают путем сочетания LukE и LukD с фармацевтически приемлемым носителем и, что необязательно, с фармацевтически приемлемым наполнителем. Используемые в данном документе термины " фармацевтически приемлемый носитель" и "фармацевтически приемлемый наполнитель " (например, добавки, такие как разбавители, иммуностимуляторы, адъюванты, антиоксиданты, консерванты и солюбилизирующие средства) являются нетоксичными для клетки или млекопитающего, подвергаемого воздействию ими в принятых дозах и рабочих концентрациях. Примером фармацевтически приемлемого носителя является вода, к примеру, буферизированная фосфатом, цитратом и другой органической кислотой. Репрезентативные примеры фармацевтически приемлемых наполнителей, которые могут быть использованы в настоящем изобретении, включают антиоксиданты, такие как аскорбиновая кислота; низкомолекулярные (менее 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; адъюванты (которые выбирают таким образом, чтобы избежать адъювантно-индуцированной токсичности; такие как β-глюкан, как описано в патенте США 6355625, Pavliak et al., цитата в полном объеме включена в данный документ посредством ссылки; или гранулоцитарный колониестимулирующий фактор (GCSF)); гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие средства, такие как EDTA; сахарные спирты, такие как маннит или сорбит; солеобразующие противоионы, такие как натрий; и/или неионные поверхностно-активные вещества, такие как TWEEN®, полиэтиленгликоль (ПЭГ) и PLURONICS®.
[0033] Лекарственные средства согласно настоящему изобретению могут быть подготовлены для хранения смешиванием активного ингредиента(ов), имеющих требуемую степень чистоты, с фармацевтически приемлемым носителем и, что необязательно, с эксципиентом и/или дополнительным активным средством в виде лиофилизированных составов или водных растворы.
[0034] Другой аспект настоящего изобретения относится к способу профилактики или лечения вируса иммунодефицита человека (ВИЧ) у субъекта. Этот способ включает введение составу, включающему выделенный белок LukE или его полипептид и выделенный белок LukD или его полипептид в количестве, эффективном для профилактики или лечения ВИЧ-инфекции у субъекта.
[0035] В соответствии с этим аспектом настоящего изобретения, подходящий состав для введения субъекту для лечения ВИЧ-инфекции содержит белки или полипептиды как LukE так и LukD, которые способны связываться с рецептором и сохраняют цитотоксическую функцию полных белков LukE или LukD. Подходящий состав для введения субъекту для профилактики ВИЧ-инфекции содержит белки или полипептиды как LukE так и LukD, которые способны связываться с рецептором и сохраняют цитотоксическую функцию. В другом варианте осуществления настоящего изобретения, LukE и LukD белки сохраняют функцию связывания рецептора, но при этом не цитотоксичны или обладают меньшей цитотоксичностью.
[0036] В соответствии с данным аспектом настоящего изобретения, подходящими белками и полипептидами LukE и LukD являются те, которые описаны выше. Данный аспект настоящего изобретения основан на открытии заявителей, заключающемся в том, что LukE/D связывается с рецептором лейкоцитов CCR5, который опосредует входу и инфекционности клеток ВИЧ. Связывание LukE/D с CCR5 опосредует цитотоксичность LukE/D. Поэтому, при лечении субъекта, имеющего ВИЧ, белки или полипептиды LukE и LukD из состава связываются с рецептором CCR5 и приводят к смерти всех ВИЧ-положительных клеток. Этот способ лечения лучше современных терапевтических стратегий борьбы с ВИЧ, поскольку лечение с помощью LukE/D будет избирательно и специально разрушать все CCR5 положительные, и, соответственно, все ВИЧ-положительные клетки у субъекта.
[0037] При назначении LukE/D составы согласно настоящему изобретению для профилактики ВИЧ-инфекции у субъекта, белки или полипептиды LukE и LukD предпочтительно должны быть изменены, чтобы уменьшить цитотоксичность, как описано выше, и/или должна быть повышена способность LukE/LukD связываться с рецептором. Соответственно, состав может содержать модифицированный белок или полипептид LukE или LukD, который сохраняет, по крайней мере, 70% сходство с последовательностями SEQ ID NO:11 и 22 соответственно. Предпочтительно, чтобы белки или полипептиды LukE и LukD согласно настоящему изобретению сохраняли по крайней мере 80% сходство с последовательностями SEQ ID NO:11 и 22 соответственно. Более предпочтительно, чтобы белки или полипептиды LukE и LukD согласно настоящему изобретению сохраняли по крайней мере 90% сходство с последовательностями SEQ ID NO:11 и 22 соответственно. Наиболее предпочтительно, чтобы белки или полипептиды LukE и LukD согласно настоящему изобретению сохраняли по крайней мере 95% сходство с последовательностями SEQ ID NO:11 и 22 соответственно.
[0038] Лекарственные средства настоящего изобретения могут быть назначены как часть комбинированной терапии в сочетании с другим средством против ВИЧ. Соответственно, состав, включающий выделенный белок LukE или его полипептид и выделенный белок LukD или его полипептид, может дополнительно включать или вводиться в комбинации с одним или более противовирусными или другими средствами, полезными в лечении ВИЧ-инфекции. Подходящими противовирусными средствами являются нуклеозидные ингибиторы обратной транскриптазы, ненуклеозидные ингибиторы обратной транскриптазы и ингибиторы протеазы. В частности, подходящими противовирусными средствами являются, без ограничения, зидовудин, ламивудин, зальцитабин, диданозин, ставудин, абакавир, адефовир дипивоксил, лобукавир, ВС Н-10652, эмитрицитабин, бета-L-FD4, DAPD, лоденозин, невирапин, делавиридин, эфавиренц, PNU-142721, AG-1549, МКС-442, (+)-каланолид А и В, саквинавир, индинавир, ритонавир, нелфинавир, лазинавир, DMP- 450, BMS-2322623, АВТ-378, ампренавир, гидроксимочевину, рибавирин, IL-2, IL-12, пентафузид, Yissum №11607 и AG-1549.
[0039] Для целей этого и других аспектов настоящего изобретения, целевой "субъект" является любым животным, предпочтительно млекопитающим, более предпочтительно - человеком. В контексте назначения состава согласно настоящему изобретению для целей профилактики ВИЧ-инфекции у субъекта, целевой субъект - это такой субъект, который находится в опасности заражения ВИЧ-инфекцией. В контексте назначения состава согласно настоящему изобретению в целях лечения ВИЧ-инфекции у субъекта, целевой субъект - это такой субъект, который инфицирован ВИЧ.
[0040] В контексте использования лекарственных средств согласно настоящему изобретению для лечения инфекции ВИЧ, терапевтически эффективное количество LukE и LukD является таким количеством, которое способно привести к уменьшению симптомов, связанных с инфекцией, уменьшению тяжести проявления по крайней мере одного симптома, снижению вирусной нагрузки на субъекта, и, предпочтительно, полному искоренению вируса у субъекта.
[0041] Терапевтически эффективные количества состава LukE и LukD могут быть определены в соответствии со стандартными процедурами, которые принимают во внимание многочисленные факторы, в том числе, например, концентрации этих активных средств в составе, способ и частоту их введения, тяжесть ВИЧ-инфекции, подлежащей лечению (или предотвращению) и учитывают такие детали, как возраст, вес и общее состояние здоровья и иммунитета. Общее руководство можно найти, к примеру, в публикациях Международной конференции по гармонизации и в REMINGTON'S PHARMACEUTICAL SCIENCES (Mack Publishing Company, 1990), цитата в полном объеме включена в данный документ посредством ссылки. Врач может назначать составы, включающие белки или полипептиды LukE и LukD, до тех пор, пока доза не будет достигнута, что обеспечит желаемый или необходимый профилактический или терапевтический эффект. Прогресс этой терапии легко контролировать стандартными анализами.
[0042] Лекарственные средства согласно настоящему изобретению могут быть введены в виде разовой дозы или по протоколу нескольких доз. Например по протоколу нескольких доз, лекарственное средство может вводиться один раз или дважды ежедневно, еженедельно, ежемесячно или в зависимости от тяжести состояния подлежащего лечению субъекта. Различные дозировки, время доз, и относительные количества лекарственного средства могут быть выбраны и отрегулированы любым специалистом в данной области. Способы введения лекарственных средств согласно настоящему изобретению, описаны ниже.
[0043] Другой аспект настоящего изобретения относится к способу профилактики ВИЧ-инфекции у субъекта. Этот способ включает получение составу, включающему выделенный белок LukE или его полипептида и выделенный белок LukD или его полипептид, и контактирование ткани субъекта с составом в условиях, эффективных для блокирования инфекционности ВИЧ клеток в ткани и тем самым ингибирования ВИЧ-инфекции у субъекта.
[0044] В соответствии с данным аспектом настоящего изобретения, состав, включающий LukE и LukD, служит в качестве микробицидного средства против ВИЧ, убивая клетки, которые чувствительны к ВИЧ-инфекции, прежде чем происходит заражение. Состав можно вводить любому субъекту мужского или женского пола, для которого существует риск заражения ВИЧ, в качестве профилактического средства профилактики ВИЧ-инфекции
[0045] В соответствии с данным аспектом настоящего изобретения, составы, включающие LukE и LukD, согласно настоящему изобретению могут дополнительно содержать одно или более дополнительных средств. Одно или более дополнительные средства включают, например, без ограничения, лубрикант, антимикробное средство, антиоксидант, увлажнитель, эмульгатор, спермицидное средство или смесь двух или более из них.
[0046] Подходящими лубрикантами являются, без ограничения, цетиловые эфиры воска, гидрированные растительные масла, стеарат магния, метилстеарат, минеральное масло, сополимер полиоксиэтилена и полиоксипропилена, полиэтиленгликоль, поливиниловый спирт, лаурилсульфат натрия или белый воск, или смесь двух или более из них. Подходящими противомикробными средствами являются, без ограничения, пропиленгликоль, метилпарабен или пропилпарабен, или смесь двух или более из них. Подходящими антиоксидантами являются, без ограничения, бутилированный гидроксианизол, бутилированный гидрокситолуол, динатрия эдетат или смесь двух или более из них. Подходящими увлажнителями являются, без ограничения, этиленгликоль, глицерин или сорбит, или смесь двух или более из них. Подходящими эмульгаторами являются, без ограничения, карбомер, полиоксиэтилен-10-стеариловый эфир, полиоксиэтилен-20-стеариловый эфир, цетостеариловый спирт, цетиловый спирт, холестерин, стеарат дигликоля, глицерилмоностеарат, глицерил стеарат, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, ланолин, полиоксиэтиленлауриловый эфир, метилцеллюлоза, стеарат полиоксиэтилена, полисорбат, пропиленгликоль моностеарат, сложные эфиры сорбитана или стеариновой кислоты, или смесь двух или более из них.
[0047] В одном варианте осуществления данного аспекта изобретения состав составлен для местного применения. Составы для местного введения в соответствии с настоящим изобретением могут быть приготовлены в виде растворов, мазей, кремов, пен, суспензий, лосьонов, порошков, паст, гелей, спреев, аэрозолей или масла для вагинального, анального или трансбуккального введения. В другом варианте осуществления настоящего изобретения состав составлен для вагинального и/или ректального введения. В другом варианте осуществления настоящего изобретения состав составлен для медленного высвобождения из влагалищного устройства, такого как вагинальное кольцо, IUD, губки или других противозачаточных средств (например, презерватива). В еще одном варианте осуществления настоящего изобретения состав составлен для применения в качестве перорального полоскания. В предпочтительном варианте осуществления настоящего изобретения состав наносят или непосредственно контактирует с кожей или слизистой оболочкой субъекта.
[0048] Другой аспект изобретения относится к способу лечения воспалительного состояния у субъекта. Этот способ включает введение состава по настоящему изобретению, включающей выделенный белок LukE или его полипептид, а также выделенный белок LukD или его полипептид, в количестве, эффективном для лечения воспалительного состояния у субъекта.
[0049] Заявители обнаружили, что мишенью LukE/D, которую он убивает, являются CCR5-положительные лейкоциты человека и что данная цитотоксичность LukE/D специфична для этих клеток, но не других ядерных клеток млекопитающих. Так как CCR5 экспрессируется в подмножестве эффекторных Т-клеток, продуцирующих провоспалительные цитокины, количество которых локально возрастает во время воспаления, составы, согласно настоящему изобретению, включающие протеины и полипептиды LukE и LukD, полезны при лечении воспалительных состояний, уничтожая популяции CCR5-положительных клеток. Любой субъект, предпочтительно млекопитающее, более предпочтительно человек, может быть подвергнут лечению в соответствии с данным аспектом настоящего изобретения, независимо от причины воспаления, например, при любой бактериальной или вирусной инфекции. Подходящие составы, включающие LukE и LukD белки и/или полипептиды, описаны выше.
[0050] Лекарственные средства согласно настоящему изобретению могут быть использованы для лечения ряда воспалительных заболеваний, включая, но не ограничиваясь, острыми воспалительными заболеваниями, ревматоидным артритом, болезнью Крона, атеросклерозом, псориазом, неспецифическим язвенным колитом, псориатическим артритом, рассеянным склерозом, волчанкой, диабетом I типа, первичным билиарным циррозом, воспалительным заболеванием кишечника, туберкулезом, ранами и кожными инфекциями, тканевыми абсцессами, фолликулитом, остеомиелитом, пневмонией, синдромом ошпаренной кожи, сепсисом, септическим артритом, миокардитом, эндокардитом, токсическим шоком, аллергическим контактным дерматитом, острой гиперчувствительностью, острым неврологическим воспалительным расстройством (например, вызванным острой инфекцией).
[0051] Острые воспалительные состояния охватывают первоначальный ответ организма на вторженческие стимулы, и включают в себя рекрутирование плазмы и белых кровяных клеток (лейкоцитов) в локализованной области поврежденных или инфицированных тканей. Острые воспалительные заболевания имеют быстрое развитие и тяжелые симптомы. Продолжительность периода от проявления болезни, от нормального состояния пациента до такого, при котором проявляются серьезные симптомы воспаления, как правило, длится до около 72 часов. Острые воспалительные состояния, которые поддаются лечению лекарственными средствами согласно настоящему изобретению, включают конъюнктивит, ирит, увеит, центральный ретинит, наружный отит, острый гнойный средний отит, мастоидит, лабиринтит, хронический ринит, острый ринит, синусит, фарингит, тонзиллит, контактный дерматит, дермонекроз, диабетический полиневрит, полимиозит, оссифицирующий миозит, дегенеративный артрит, ревматоидный артрит, скапулогумеральный периартрит и деформирующий остит. При одном из вариантов осуществления настоящего изобретения, острыми воспалительными состояниями считаются инфицированные раны кожи или мягкой ткани.
[0052] В контексте лечения воспалительного состояния, эффективным количеством состава LukE и LukD является такое количество, которое терапевтически эффективно в том смысле, что при лечении можно достичь уменьшения воспаления, снижения тяжести воспаления, или даже общего облегчения воспалительного состояния.
[0053] Противовоспалительные составы согласно настоящему изобретению могут быть назначены к введению любым способом, как описано ниже. В случае лечения острых воспалительных локализованных состояний, не системное введение может быть предпочтительным, в этом случае лекарственное средство вводится на или вокруг места острого воспаления. В этом отношении предпочтительны составы для местного применения. В дополнение к местному применения, описанному выше, формы для местного применения могут также иметь вид пластырей или повязок, пропитанных активным ингредиентом(ами), и могут в необязательном порядке содержать один или несколько наполнителей или разбавителей. В некоторых вариантах осуществления, форма местного применения включает в себя материал, который усиливает абсорбцию или проникновение активного средства(средств) через кожу или другие пораженные участки.
[0054] Терапевтически эффективным количеством состава LukE/LukD в соответствии с этим и другими аспектами изобретения является такое количество, которое необходимо для получения полезных или желаемых результатов. Терапевтически эффективное количество может быть назначено к применению в один или несколько приемов, аппликаций или доз и не предназначено для ограничения конкретного состава или способа введения.
[0055] Кроме того, в соответствии с данным аспектом изобретения состав LukE/LukD можно назначать в сочетании с другими противовоспалительными составами, ингибитором TNFa, или их комбинациями. Возможные противовоспалительные препараты содержат, но не ограничиваются, нестероидными противовоспалительными препаратами (NSAID), анальгетиками, глюкокортикоидами, болезнь-модифицирующими противоревматическими препаратами, ингибиторами дигидрофолатредуктазы (например, метотрексатом), модификаторами биологического отклика и любыми их комбинациями.
[0056] Подходящим NSAID является селективный ингибитор циклооксигеназы-2 (СОХ-2). Типичные ингибиторы СОХ-2 представлены, без ограничения, нимесулидом, 4-гидроксинимесулидом, флосулидом, мелоксикамом, целекоксибом и Рофекоксибом (Vioxx). В качестве альтернативы, неселективный ингибитор NSAID вводится в сочетании с LukE/D составом настоящего изобретения. Возможными неселективными ингибиторами NSAID являются, без ограничения, диклофенак, дифлунизал, этодолак, фенопрофен, флурбипрофен, ибупрофен, индометацин, кетопрофен, кеторолак, мефенамовая кислота, мелоксикам, набуметон, напроксен, оксапрозин, пироксикам, салсалат, сулиндак и толметин.
[0057] Предпочтительными анальгетиками являются, без ограничения, ацетаминофен, оксикодон, трамадол и гидрохлорид пропоксифена.
[0058] Предпочтительными глюкокортикоидами являются, без ограничения, кортизон, гидрокортизон, дексаметозон, метилпреднизолон, преднизолон и преднизон.
[0059] Предпочтительными модификаторами биологического отклика являются ингибитор В-клеток, такой как Ритуксимаб или ингибитор активации Т-клеток, например, Лефлюномид, Этанерцепт (Enbrel), или Инфликсимаб (Remicade).
[0060] Подходящими ингибиторами TNFα являются антитела к TNF-α, матриксные ингибиторы металлопротеиназы, кортикостероиды, тетрациклиновый антагонист TNFα, фторхинолоновый антагонист TNFα и хинолоновый антагонист TNFα. Примерами антагонистичных антител к TNFα. являются, без ограничения, инфликсимаб, этанерцепт, CytoFAb, AGT-1, афелимомаб, PassTNF и CDP-870. Примерами кортикостероидов являются, без ограничения, мометазон, флутиказон, циклезонид, будезонид, беклометазон, беконаз, флунизолид, дефлазакорт, бетаметазон, метил-преднизолон, дексаметазон, преднизолон, гидрокортизон, кортизол, триамцинолон, кортизон, кортикостерона дигидроксикортизон, дипропионат беклометазон и преднизолон. Примерами антагонистов тетрациклина TNF-α являются, без ограничения, доксициклин, миноциклин, окситетрациклин, тетрациклин, лимециклин и 4-гидрокси-4-диметиламинотетрациклин.
[0061] Другой аспект настоящего изобретения относится к способу профилактики реакции «трансплантат против хозяина» (GVHD) у субъекта. Этот способ включает введение составу, включающему выделенный белок LukE или его полипептид и выделенный белок LukD или его полипептид в количестве, эффективном для предотвращения реакции «трансплантат против хозяина» (GVHD) у субъекта.
[0062] Реакция «трансплантат против хозяина» (GVHD) остается основным осложнением клинической трансплантации костного мозга (ВМТ) и является основным препятствием для широкого применения этого важного лечебного способа. Отличительной чертой GVHD является инфильтрация Т-лимфоцитов донора в эпителиальные отделы кожи, кишечника и желчевыводящих путей хозяина. GVHD происходит, когда зрелые Т-клетки, включающиеся в костном мозге трансплантата, передаются иммуно-подавленным хозяевам. После трансплантации, антиген-представляющие клетки хозяина (АПК) активируют Т-клетки трансплантата (Т-клетки донора), представляя антигены гистосовместимости хозяина донорским Т-клеткам. АПК донора также могут активировать Т-клетки донора с помощью кросс-представляющих аллоантигенов хозяина. Популяции вновь образованных хозяин-специфических Т-эффекторов (hsTeff) затем мигрируют в периферические органы хозяина, что отображается в виде урона органам-мишеням.
[0063] GVHD обычно проходит в острой или хронической форме. Острая форма GVHD будет наблюдаться в течение примерно первых 100 дней после ВМТ, в то время как хроническая GVHD обнаруживается после первых 100 дней. В дополнение к хронологии, существуют различные клинические симптомы проявления острой GVHD либо хронической GVHD. Острая GVHD в целом характеризуется повреждением печени, кожи, слизистой оболочки и кишечного эпителия хозяина, хотя также сообщалось об обнаружении некоторых форм идиопатической пневмонии. Хронический GVHD связан, с другой стороны, с повреждением соединительной ткани, а также органов и тканей, поврежденных на этапе острого GVHD у хозяина. В целом, способы настоящего изобретения относятся к терапии или решению проблем, связанных с GVHD, которые уже присутствуют у субъекта, или профилактики возникновения GVHD у субъекта. В одном варианте осуществления настоящее изобретение относится к способам лечения или профилактики острого GVHD. В частности, способы, согласно настоящему изобретению, подходят для лечения острого GVHD, когда GVHD наносит ущерб кишечному эпителию хозяина. Способы согласно настоящему изобретению также подходят для лечения острого GVHD, когда GVHD наносит ущерб по меньшей мере одной ткани из группы, в которую входят печень, кожа, легкие и слизистые оболочки хозяина. Конечно, эти способы могут быть также использованы для лечения острого GVHD, в случае, когда GVHD наносит ущерб более одной ткани.
[0064] В соответствии с данным вариантом осуществления настоящего изобретения, CCR5-позитивные Т-клетки донора трансплантируют реципиенту в течение аллогенной трансплантации при GVHD. Соответственно, в одном варианте осуществления настоящего изобретения клетки донора костного мозга обрабатывают составом, включающим LukE и LukD, перед трансплантацией для того, чтобы вызвать гибель всех CCR5+-клеток, тем самым предотвращая GVDH.
[0065] В другом варианте осуществления настоящего изобретения обработка клеток костного мозга донора достигается путем обработки трансплантата. "Обработка трансплантата" означает введение состава или выполнения процедуры с трансплантационным материалом, когда при этом не предполагается прямое воздействие на организм хозяина. Конечно, успешная обработка трансплантата будет косвенно влиять на организм хозяина таким образом, что тяжесть GVHD может быть уменьшена или даже удастся полностью избежать GVHD. Способы согласно изобретению не ограничены размещением трансплантата во время обработки трансплантата. Таким образом, в одном варианте осуществления трансплантат обрабатывают до удаления из организма-донора. В другом варианте осуществления трансплантат обрабатывают после удаления из организма-донора. В еще одном варианте осуществления трансплантат обрабатывают после удаления из организма-донора, но перед трансплантацией принимающему субъекту. В еще одном варианте осуществления трансплантат обрабатывается после трансплантации в организм хозяина.
[0066] В соответствии с данным аспектом настоящего изобретения, состав, включающий LukE и LukD, может быть введен как часть комбинированной терапии. Например, состав LukE/D может быть назначен совместно с другими фармацевтически-активными веществами, такими как, но без ограничений, метотрексат и циклоспорин. Дополнительными средствами, которые могут быть назначены совместно, являются, но не ограничиваются ими, антитела к различным мишеням, такролимус, сиролимус, интерфероны, опиоиды, TNFα (фактор некроза опухоли-α), связывающие белки, микофенолятмофетил и другие ингибиторы инозинмонофосфатдегидрогеназы (IMPDH), глюкокортикоиды, азатиоприн и другие цитостатические средства, такие как, но без ограничений, антиметаболиты и алкилирующие средства. В одном варианте трансплантат или донор до трансплантации может быть предварительно обработан путем введения иммунодепрессантов, таких как циклоспорин (отдельно или в комбинации со стероидами) и метотрексат. Для профилактики, иммуносупрессивная терапия обычно состоит из комбинированных схем метотрексата (МТХ), циклоспорина (CsA), такролимуса (FK 506), и/или кортикостероида. Внутривенные препараты гамма-глобулина, как было показано, также были полезным при профилактике GVHD. Кроме того, пентоксифиллин, производное ксантина, способен регулировать снижение производства TNFα и может быть введен с циклоспорином с дополнением метотрексатом или метилпреднизолоном для уменьшения частоты GVHD. Хронический GVHD может лечиться стероидами, такими как преднизон, озотиоприн и циклоспорин. Кроме того, могут быть использованы антитимоцитарный глобулин (ATG) и/или Урсодиол. Многообещающие результаты при лечении хронической GVHD показал Талидомид с иммуносупрессивными свойствами. Подобно талидомиду, клофазимин также может быть назначен вместе с составом согласно настоящему изобретению, включающим LukE и LukD. Мишенями для совместно вводимых антител могут выступать, но без ограничений, Т-клеточный рецептор (TCR), рецептор интерлейкина-2 (IL-2) и IL- 2. Кроме того, для профилактики GVHD могут быть совместно введены CD(25) моноклональные антитела, моноклональные антитела npOTHB-CD8, или моноклональные антитела против CD103.
[0067] В соответствии с данным и всеми прочими аспектами настоящего изобретения, составы согласно настоящему изобретению могут быть приготовлены для фармацевтического применения и назначены для парентерального, местного, внутривенного, перорального, подкожного, внутрибрюшинного, интраназального, внутримышечного, внутриартериального, внутричерепного, внутрикожного введения для профилактического и/или терапевтического лечения
[0068] Когда желательно доставить фармацевтические составы, согласно настоящему изобретению, системно, то они могут быть приготовлены для парентерального введения путем инъекции, например, спомощью болюсной инъекции или непрерывной инфузии. Препараты для инъекции могут быть представлены в единичной дозированной форме, например в ампулах или в многодозовых контейнерах с добавлением консерванта. Составы могут быть представлены такими формами, как суспензии, растворы или эмульсии в масляных или водных носителях и могут содержать вспомогательные средства, такие как суспендирующие, стабилизирующие и/или диспергирующие средства. Растворы или суспензии средства могут быть получены в воде, с соответствующим образом добавленным сурфактантом, таким как гидроксипропилцеллюлоза. Дисперсионные растворы также могут быть получены в глицерине, жидких полиэтиленгликолях и их смесях в маслах. Подходящими маслами являются полученные из нефти, животного, растительного или синтетического происхождения масла, например арахисовое масло, соевое масло или минеральное масло. В целом, вода, физиологический раствор, водный раствор декстрозы, раствор сахара и гликоли, такие как пропиленгликоль или полиэтиленгликоль, являются предпочтительными жидкими носителями, особенно для инъекционных растворов. При обычных условиях хранения и использования эти препараты должны содержать консервант для предотвращения роста микроорганизмов.
[0069] Фармацевтические препараты, пригодные для инъекционного применения, включают стерильные водные растворы или дисперсионные растворы и стерильные порошки для приготовления стерильных инъецируемых растворов или дисперсионных растворов. Во всех случаях форма должна быть стерильной и быть достаточно жидкой, чтобы легко вводиться с помощью шприца. Она должна быть стабильной в условиях производства и хранения и должна быть защищена от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Носитель может быть растворителем или дисперсионной средой, включающей, к примеру, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль), подходящие смеси из вышеперечисленного и растительные масла.
[0070] Внутрибрюшинное или интратекальное введение средств согласно настоящему изобретению также может быть достигнуто с помощью инфузионных насосных устройств, к примеру таких, которые предоставляются Medtronic, Northridge, СА. Такие устройства обеспечивают непрерывную инфузию нужных соединений, позволяя избегать нескольких инъекций и нескольких манипуляций.
[0071] В дополнение к препаратам, описанным выше, фармацевтические составы могут также быть приготовлены в виде препарата-депо. Такие длительно действующие препараты могут быть приготовлены с помощью подходящих полимерных или гидрофобных материалов (например, в виде эмульсии в подходящем масле) или ионообменных смол, или в виде труднорастворимых производных, например в виде умеренно растворимой соли.
[0072] Требуемая доза составу, включающему LukE и LukD, согласно настоящему изобретению, зависит от выбора пути введения; природы препарата; природы заболевания субъекта; размера, веса, площади поверхности, возраста и пола субъекта; других назначенных лекарственных средств; решения лечащего врача. Приемлемые дозы лежат в интервале 0,01-100 мг/кг. Вариаций в необходимой дозировке можно ожидать с учетом доступности различных соединений, и различной эффективности разных путей введения. Вариации в дозировке могут быть скорректированы с использованием стандартных эмпирических процедур для оптимизации, хорошо известных в данной области. Инкапсуляция соединения в подходящем средстве доставки (например, в форме полимерных микрочастиц или имплантируемых устройств) может повысить эффективность доставки.
[0073] Другой аспект настоящего изобретения относится к способу лечения инфекции Staphylococcus aureus у субъекта. Этот способ включает выбор субъекта, имеющего инфекции S. aureus, и введение субъекту составу, включающему антагонист CCR5 в количестве, эффективном для лечения инфекции S. aureus у субъекта.
[0074] Для целей данного аспекта настоящего изобретения, целевым объектом может являться любое животное, предпочтительно млекопитающее, более предпочтительно человек, который заражен и/или находится в опасности быть зараженным S. aureus. Особенно подходящими субъектами являются младенцы, подростки, взрослые и пожилые люди, а также люди с ослабленным иммунитетом. Кроме того, подходящими субъектами являются субъекты, инфицированные метициллин-устойчивым штаммом S. aureus (MRS А) или метициллин-чувствительным штаммом S. aureus (MSSA).
[0075] В соответствии с данным аспектом настоящего изобретения, пригодные антагонисты CCR5 для ингибирования цитотоксичности LukE/D из S. aureus, и тем самым подходящие для лечения или профилактики инфекции S. aureus, известны в данной области, и ими являются, без ограничения, Maraviroc, Vicriviroc, NCB- 9471, PRO-140, CCR5 mAb004, 8-[4-(2-бутоксиэтокси)фенил]-1-изобутил-N-[4-[[(1-пропил-1Н-имидазол-5-ил-)метил]сульфинил]фенил]-1,2,3,4-тетрагидро-1-бензакоцин-5-карбоксамид, метил-эндо-{8-[(3S)-3-(ацетиламино)-3-(3-фторфенил)пропил]-8-азабицикло[3.2.1]окт-3-ил}-2-метил-4,5,6,7-тетрагидро-1Н-имидазо[4,5-с]пиридин-5-карбоксилат, метил 3-эндо-{8-[(3S)-3-(ацетамидо)-3-(3-фторфенил)пропил]-8-азабицикло[3.2.-1]окт-3-ил}-2-метил-4,5,6,7-тетрагидро-3Н-имидазо[4,5-с]пиридин-5-карбоксилат, этил 1-эндо-{8-[(3S)-3-(ацетиламино)-3-(3-фторфенил)пропил]-8-азабицикло[3.2.1]окт-3-ил}-2-метил-4,5,6,7-тетрагидро-1Н-имидазо[4,5-с]пиридин-5-карбоксилат, и N-{(18)-3-[3-эндо-(5-изобутирил-2-метил-4,5,6,7-тетрагидро-1Н-имидазо[4,5-с]пиридин-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-(3-фторфенил)пропил} ацетамид).
[0076] Дополнительные антагонисты CCR5 и составы, которые их содержат, описаны в патенте США №2007/ 0010509, Shiota et al., патенте США №7625905, Lemoine et al., патенте США №6476062, Chu et al., патенте США №7728135, Shi et al. и патенте США №7220856 на Dunning et al., которые в полном объеме включены в данный документ посредством ссылок.
[0077] Антагонист CCR-5 может быть назначен как часть комбинированной терапии в сочетании с другим активным средством в зависимости от природы инфекции S. aureus, подлежащей лечению. Такими дополнительными активными средствами являются антиинфекционные средства, антибиотические средства и антибактериальные средства. Репрезентативными противоинфекционными средствами, которые могут быть использованы в настоящем изобретении, являются ванкомицин и лизостафин. Другими подходящими антиинфекционными средствами являются средства, которые ингибируют цитотоксичность LukE/D (например, антитело к LukE, антитело к LukD, антитело к LukE/D).
[0078] Репрезентативными антибиотиками и противомикробными средствами, которые могут быть использованы в настоящем изобретении, являются пенициллиназа-устойчивые пенициллины, цефалоспорины и карбапенемы, в том числе ванкомицин, лизостафин, пенициллин G, ампициллин, оксациллин, нафциллин, клоксациллин, диклоксациллин, цефалотин, цефазолин, цефалексин, цефрадин, цефамандол, цефокситин, имипенем, меропенем, гентамицин, тейкопланин, линкомицин и клиндамицин. Дозировки этих антибиотиков хорошо известны в данной области техники. См., например, MERCK MANUAL OF DIAGNOSIS AND THERAPY, Section 13, Ch. 157, 100th Ed. (Beers & Berkow, eds., 2004), который в полном объеме включен в данный документ посредством ссылки. Противовоспалительные, антибактериальные, антибиотические и/или противомикробные средства могут быть объединены перед введением или введены одновременно (как часть того же состава ли в виде другого состава) или последовательно с составом, включающим антагонист CCR5 согласно настоящему изобретению. В некоторых вариантах осуществления назначение повторяется.
[0079] Составы, включающие антагонисты CCR-5 можно вводить парентерально, местно, внутривенно, перорально, подкожно, внутрибрюшинно, интраназально, внутримышечно, внутриартериально, внутричерепно или в виде внутрикожных инъекций для профилактического и/или терапевтического лечения.
[0080] Другой аспект настоящего изобретения относится к способу определения подходящего типа лечения имеющейся инфекции S. aureus. Данный способ включает получение образца от субъекта и обнаружения или количественного определения уровня экспрессии CCR5 и количества CCR5 в образце. Способ дополнительно включает в себя сравнение обнаруженного уровня экспрессии CCR5 и поверхностного уровня CCR5 в образце с контрольным образцом с известным или базовым уровнем экспрессии CCR5 и поверхностным уровнем CCR5 и определения подходящего типа лечения субъекта на основе этого сравнения. Способ в дальнейшем включает назначение определенного подходящего лечения для субъекта.
[0081] В соответствии с данным аспектом настоящего изобретения, лица, не имеющие CCR5 или имеющие низкие уровни экспрессии CCR5 будет более устойчивыми к инфекции lukE/D+ S. aureus по сравнению с лицами с более высоким уровнем CCR5. Лица, имеющие большие количества CCR5 являются более подходящими кандидатами для лечения с использованием антагониста CCR5-рецептора, как описано в данном документе.
[0082] Еще один аспект настоящего изобретения относится к способу прогнозирования тяжести инфекции S. aureus у субъекта путем мониторинга количества CCR5 у субъекта. Этот способ включает выделение РВМС из цельной крови субъекта и выполнения анализа способом проточной цитометрии для определения поверхностной экспрессии CCR5. В количественном отношении поверхностная экспрессия CCR5 в клетках субъекта сравнивается с количеством CCR5 в контрольном образце, который производит малые или неопределяемые количества CCR5, и контрольным образцом, который производит большие количества CCR5 (например, Jurkat CCR5+), в результате тяжесть S. aureus прогнозируется на основе количества CCR5. Большие количества CCR5 у субъекта предполагают более тяжелую инфекции 5. aureus, а более низкие концентрации CCR5 у субъекта предполагают менее тяжелую инфекцию. Способы выделения и/или маркировки РВМС из образца цельной крови для анализа FACS хорошо известны в данной области.
ПРИМЕРЫ
[0083] Следующие примеры приведены для иллюстрации вариантов осуществления настоящего изобретения, но никоим образом не предназначены для ограничения сферы его применения.
ПРИМЕР 1 - LukE/D вносит значительный вклад в патогенез S. aureus
[0084] Чтобы проверить, играет ли LukE/D важную роль в патогенезе септической инфекции S. aureus, был сконструирован мутант ΔlukE/D в MSSA штамме Newman и было протестировано влияние удаления LukE/D на его вирулентность. Выживание с течением времени резко возросло у мышей, инфицированных 107 КОЕ мутанта ΔlukE/D, по сравнению с мышами, инфицированными диким типом (ДТ) S. auerus. Все мыши, инфицированные ДТ S. aureus погибли от инфекции спустя 250 часов. В противоположность этому, почти 100% мышей, зараженных мутантом AlukE/D прожили, по меньшей мере, 300 часов после заражения, с фенотипом, полностью дополненным путем введения lukE/D в мутантный штамм ΔlukE/D (ΔlukE/D::plukE/D; Фигура 1А). В добавок к этому, бактериальная нагрузка на почки была снижена в 10 раз по сравнению с ДТ или дополненным штаммом (Фигура 1 В). Эти результаты показывают, что LukE/D является критическим фактором вирулентности для системной инфекции S. aureus. Таким образом, LukE/D является выгодной новой целью при разработке новых лекарственных средств для борьбы с инфекцией S. aureus.
ПРИМЕР 2 - LukE/D избирательно убивает линии иммунных клеток человека
[0085] Как описано выше, LukE/D вносит вклад в развитие системной инфекции и опосредованного S. aureus сепсиса (Фигура 1А-1 В), при этом ингибирование LukE/D может оказаться инновацией, с помощью которой можно будет лечить инфекции S. aureus.
[0086] Один из механизмов, посредством которого LukE/D может быть заблокирован, является ингибирование взаимодействия токсина с его рецептором. В качестве первоначальной стратегии для понимания того, как LukE/D взаимодействует с клетками хозяина, коллекцию линий иммунных клеток человека инкубировали ("интоксицировали") с различными концентрациями либо отдельных субъединиц (т.е., LukE или LukD) либо эквимолярной смеси LukE+LukD (LukE/D). Эти эксперименты показали, что LukE/D проявляет цитотоксичность к клеткам ТНР1 (моноцитам человека) и клеткам Hut (Т-лимфоцит-подобным клеткам) (Фигура 2А). Интересно, что LukE/D проявлял цитотоксичность к клеткам Hut, но не к клеткам Jurkat, хотя оба типа являются широко использующимися Т-лимфоцит-подобными клетками. Интоксикация дополнительных линий лимфоцитов (РМ1 и Н9) показали, что только клетки Hut были чувствительны токсичности LukE/D (Фигура 2В). В дальнейших исследованиях было проиллюстрировано, что клетки Hut, использовавшиеся в предыдущих исследованиях, были запрограммированы на сверхэкспрессию СС-хемокининовых рецепторов 5 (CCR5), рецепторов для хемокинов MIP-1α, MIP-1β и RANTES.
ПРИМЕР 3 - LukE/D намечают мишень и убивают клетки CCRS-зависимым способом
[0087] Чтобы непосредственно определить вклад CCR5 в способность LukE/D к намечанию мишени и уничтожению клетки-хозяева, CCR5 был введен в клетки Jurkat с помощью вирусной трансдукции CCR5 кДНК с появлением CCR5+ Jurkat. Клетки Jurkat и CCR5+ Jurkat были подвергнуты интоксикации различными концентрациями либо отдельными субъединицами (т.е., LukE или LukD) либо эквимолярными смесями LukE+LukD (LukE/D). Этот эксперимент показал, что синтеза CCR5 было достаточно, чтобы сделать клетки Jurkat чувствительны к токсичности LukE/D (Фигура 3, верхняя панель). Важно отметить, что подобные результаты наблюдались, когда клетки линии остеосаркомы человека "GHOST" были запрограммировали для получения CCR5 на их поверхности (Фигура 3, нижняя панель). В целом, эти данные показывают, что CCR5 делает клетки млекопитающих чувствительными к цитотоксичности LukE/D.
ПРИМЕР 4 - LukE/D-опосредованное нацеливание на клетки CCR5+ блокируется антагонистами, антителами и лигандами CCR5
[0088] CCR5 представляет собой белок, который был хорошо изученной из-за его важной роли в инфекции ВИЧ-1. Вместе с CD4, CCR5 используется вирусом для проникновения в клетки. Важность CCR5 в патогенезе ВИЧ-инфекции в организме человека подчеркивается фактом обнаружения субъектов, которые имеют мутацию в гене CCR5 (т.е. A32CCR5), предотвращающую поверхностную экспозицию CCR5. Пациенты с этой мутацией слабо восприимчивы к ВИЧ-инфекции. В настоящее время разнообразные антагонисты CCR5 (например, пептидомиметики, антитела, малые молекулы) проходят испытания в клинических испытаниях, чтобы использоваться в качестве анти-ВИЧ препаратов, а также противовоспалительных средств.
[0089] Чтобы определить блокируется ли LukE/D с помощью CCR5, было оцененно влияние нескольких антагонистов и лигандов CCR5 на способность LukE/D убивать CCR5+-клетки. На ингибирование активности LukE/D были проверены такие антагонисты CCR5, как лекарственные препараты Selzentry/Celsentri/Maraviroc (MVC), Vicriviroc (VVC) и ТАК- 779 (ТАК). Клетки CCR5+Jurkat предварительно инкубировали с различными концентрациями антагонистов, а затем подвергали интоксикации эквимолярной смесью LukE+LukD (LukE/D). Эти эксперименты показали, что все три антагониста CCR5 эффективно блокируют цитотоксичность LukE/D (Фигура 4А). Кроме того, по экспериментальному протоколу, описанному для антагонистов CCR5, также был оценен потенциал моноклональных антител к CCR5 к защитите клеток от цитотоксичности LukE/D. Эти эксперименты также показали, что некоторые из испытанных моноклональных антител были способны эффективно блокировать цитотоксичность LukE/D (Фигура 4В). Наконец, также был оценен потенциал ингибирующего действие природных лигандов CCR5. Клетки CCR5+ Jurkat предварительно инкубировали с различными концентрациями RANTES, MIP-1β, или комбинации эквимолярной смеси RANTES+MIP-1 Р затем подвергали интоксикации эквимолярной смесью LukE+LukD (LukE/D). Эти эксперименты также показали, что лиганды CCR5 эффективно ингибируют цитотоксический эффект LukE/D (Фигура 4С). В совокупности, эти данные демонстрируют, что мощная цитотоксическая активность LukE/D может быть заблокирована с использованием антагониста и/или лигандов CCR5.
ПРИМЕР 5 - Maraviroc блокирует связывание LukE/D с клетками CCR5+ и препятствует формированию пор, вызванных действием LukE/D
[0090] Для выяснения механизма, с помощью которого LukE/D использует CCR5 для определения мишени и уничтожения клеток-хозяев, клетки Jurkat (CCR5+) и CCR5+ Jurkat (CCR5+) инкубировали с LukE/D, связанным с GFP (GFPLukE/D), после чего связывание флуоресцирующего токсина с плазматической мембраной клеток контролировалось с помощью проточной цитометрии. Эти эксперименты показали, что LukE/D связывается с клетками CCR5+ Jurkat, но не с клетками CCR5+ Jurkat (Фигура 5А). Для выяснения механизма, с помощью которого Maraviroc ингибирует цитотоксичнось LukE/D, клетки CCR5+ Jurkat предварительно инкубировали с Maraviroc (MVC) с последующей инкубацией с GFP-меченым LukE/D токсином, при этом связывание токсина с клетками оценивали с помощью проточной цитометрии. Эти эксперименты показали, что Maraviroc эффективно замедлял связывание LukE/D с CCR5+-клетками (Фигура 5А).
[0091] Чтобы изучить механизм, посредством которого LukE/D является токсичным для CCR5+-клеток, клетки инкубировали в присутствии и в отсутствии Maraviroc и впоследствии подвергали интоксикации LukE/D в присутствии этидийбромида, низкомолекулярного катионного красителя, для которого обычно клеточные мембраны непроницаемы, но он может проникнуть в клетки через поры, образованные токсином. Эти эксперименты показали, что LukE/D с течением времени формирует поры в плазматической мембране CCR5+-клеток. Важно отметить, что Maraviroc (MVC) эффективно заблокировал образование пор под действием LukE/D (Фигура 5 В). Кроме того, образование пор под действием LukE/D были связаны с клеточным отеком, характерным при интоксикации клеток лейкотоксинами, каковой эффект был эффективно заблокирован Maraviroc (MVC) (Фигура 5С). В целом, эти результаты показывают, что LukE/D связывается с клетками-хозяевами CCR5-зависимым путем, что ведет к образованию пор в плазматической мембране клеток-мишеней, что приводит к наблюдаемой цитотоксичности LukE/D. Важно отметить, что антагонист CCR5 Maraviroc, эффективно ингибирует LukE/D, блокируя взаимодействие LukE/D с поверхностью CCR5+-клеток, тем самым предотвращая образование пор и гибель клеток.
ПРИМЕР 6 - LukE/D в качестве мишени поражает CCR5, при этом уничтожая лимфоциты, макрофаги и дендритные клетки человека
[0092] Если CCR5 представляет собой рецептор LukE/D, то основными клетками-мишенями являются такие, поверхность которых несет CCR5 (например, Т-лимфоциты, макрофаги, естественные клетки-киллеры, дендритные клетки и т.д.) и они будут подвергаться вызванной LukE/D гибели. Чтобы исследовать это более подробно, первичные мононуклеарные клетки периферической крови человека (РВМС) были выделены у донора с диким типом CCR5 (CCR5+) и донора с A32CCR5 (CCR5+), после чего Т-лимфоциты были интоксицированы LukE/D и жизнеспособность клеток определялась с помощью проточной цитометрии. Первичные Т-лимфоциты человеческие от CCR5+ донора были очень восприимчивы к LukE/D (5,4% смертность клеток в среде по сравнению с 34% смертностью интоксицированных LukE/D клеток; Фигура 6А, верхняя панель), но данный эффект эффективно нейтрализовался Maraviroc (LukE/D vs. LukE/D+MVC; Фигура 6А, верхняя панель). В противоположность этому, Т-лимфоциты от донора A32CCR5 были очень устойчивы к цитотоксичности LukE/D (Фигура 6А, нижняя панель).
[0093] В дополнение к Т-лимфоцитам, также была оценена цитотоксическая активность LukE/D по отношению к первичным макрофагам человека и дендритным клеткам. Макрофаги и дендритные клетки инкубировали с LukD (при отрицательном контроле), интоксицировали эквимолярной смесью LukE+LukD (LukE/D) или инкубировали с Maraviroc (MVC) с последующей интоксикацией эквимолярной смесью LukE+LukD (LukE/D). LukE/D, но не LukD эффективно уничтожали как макрофагов (Фигура 6 В) так и дендритные клетки (Фигура 6С). Важно отметить, что цитотоксический эффект LukE/D по отношению к этим фагоцитам был эффективно нейтрализованы Maraviroc (LukE/D vs. LukE/D+MVC; Фигуры 6В и 6С). В совокупности эти данные свидетельствуют о том, что мишенью LukE/D, которую он уничтожает, являются первичные лейкоциты человека, включающие CCR5 на поверхности, и что антагонист CCR5 Maraviroc эффективно блокирует цитотоксические эффекты LukE/D. Таким образом, блокаду LukE/D антагонистом и/или ингибиторами CCR5 можно предлагать в качестве нового терапевтического подхода для профилактики и лечения инфекции S. aureus.
[0094] Хотя изобретение было подробно описано с целью его иллюстрации, следует понимать, что такие подробности приводятся исключительно для указанной цели и вариации в нем могут быть осуществлены специалистами в данной области без отхода от сущности и области изобретения, определенных прилагаемой формулой изобретения.