АНТИГЕННЫЕ КОМПОЗИЦИИ РЕСПИРАТОРНОГО СИНЦИТИАЛЬНОГО ВИРУСА И СПОСОБЫ
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет по предварительной заявке США №61/485669, поданной 13 мая 2011, и №61/362029, поданной 7 июля 2010, при этом обе эти заявки включены в настоящее описание в полном объеме.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к композициям и способам профилактики инфекции респираторным синцитиальным вирусом, в частности к композициям в виде многослойной пленки, содержащей антигенные эпитопы.
УРОВЕНЬ ТЕХНИКИ
Респираторный синцитиальный вирус (RSV) является наиболее важной причиной серьезного заболевания нижних отделов дыхательных путей у детей первого года жизни и детей младшего возраста во всем мире, а также является потенциально опасным для пожилых пациентов и пациентов с ослабленным иммунитетом. В Соединенных Штатах RSV инфекции в результате приводят к госпитализации до 126000 детей первого года жизни и госпитализации до 60000 пожилых людей в год. Поскольку природная инфекция RSV не индуцирует устойчивый длительный иммунитет, пациенты подвержены повторному инфицированию тем же или другим штаммом вируса на протяжении всей жизни. RSV ассоциируется со вторичными инфекциями, такими как воспаление среднего уха, и может вызывать предрасположенность у детей младшего возраста к заболеваниям, родственным астме, в дальнейшей жизни.
После более 40 лет попыток безопасной и эффективной вакцины против RSV не существует. Самые ранние попытки разработать инактивированную формалином осажденную алюминиевыми квасцами RSV (FI-RSV) вакцину в 1960-х годах фактически вызвали предрасположенность вакцинированных детей к более серьезному заболеванию и даже смерти при последующем природном инфицировании. Точный механизм этой реакции не был полностью охарактеризован, но, по-видимому, он зависит от отклонения иммунного ответа в направлении воспалительного Th2-доминантного фенотипа, характеризующегося несоответствующей активацией цитокиновых и хемокиновых путей.
Принимая во внимание экономический эффект RSV заболевания, по оценкам приблизительно $700 миллионов в год в США в 2004, опасные для жизни осложнения, которые могут быть результатом RSV инфекции у детей первого года жизни, у пожилых людей и у пациентов с ослабленным иммунитетом, разработка безопасных и эффективных вакцин против RSV имеет первостепенное значение.
Существует необходимость в улучшении антигенных композиций, подходящих для стимуляции иммунного ответа на RSV.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном варианте осуществления композиция содержит первый полипептидный эпитоп из RSV и второй полипептидный эпитоп из RSV, где первый и второй полипептидные эпитопы ковалентно связаны с одним или более полиэлектролитами, где один или более полиэлектролитов находятся в одной или нескольких многослойных пленках, где одна или несколько многослойных пленок каждая содержит два или более слоев полиэлектролитов, где смежные слои содержат противоположно заряженные полиэлектролиты и где полиэлектролит содержит поликатионное вещество или полианионное вещество, имеющее молекулярную массу, превышающую 1000, и по меньшей мере 5 зарядов на молекулу, и где первый полипептидный эпитоп из RSV и второй полипептидный эпитоп из RSV находятся в одной и той же или в разных многослойных пленках.
В другом варианте осуществления композиция содержит первый полипептидный эпитоп из RSV и второй полипептидный эпитоп из RSV, где первый и второй полипептидные эпитопы находятся в виде одной или нескольких многослойных пленок, где одна или несколько многослойных пленок каждая содержит два или более слоя полиэлектролитов, где смежные слои содержат противоположно заряженные полиэлектролиты и где по меньшей мере один полиэлектролит многослойной пленки содержит сконструированный полипептид, где сконструированный полипептид имеет достаточный заряд для стабильного связывания с противоположно заряженной поверхностью и где сконструированный полипептид содержит первый полипептидный эпитоп из RSV, второй полипептидный эпитоп из RSV или оба, где полиэлектролит, который не представляет собой сконструированный полипептид, содержит поликатионное вещество или полианионное вещество, имеющее молекулярную массу, превышающую 1000, и по меньшей мере 5 зарядов на молекулу, и где первый полипептидный эпитоп из RSV и второй полипептидный эпитоп из RSV находятся в одной и той же или в разных многослойных пленках.
Композиция содержит RSV-G полипептидный эпитоп, ковалентно связанный с одним или несколькими полиэлектролитами, где один или несколько полиэлектролитов находятся в одной или нескольких многослойных пленках, где одна или несколько многослойных пленок каждая содержит два или более слоев полиэлектролитов, где смежные слои содержат противоположно заряженные полиэлектролиты и где полиэлектролит содержит поликатионное вещество или полианионное вещество, имеющее молекулярную массу, превышающую 1000, и по меньшей мере 5 зарядов на молекулу.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
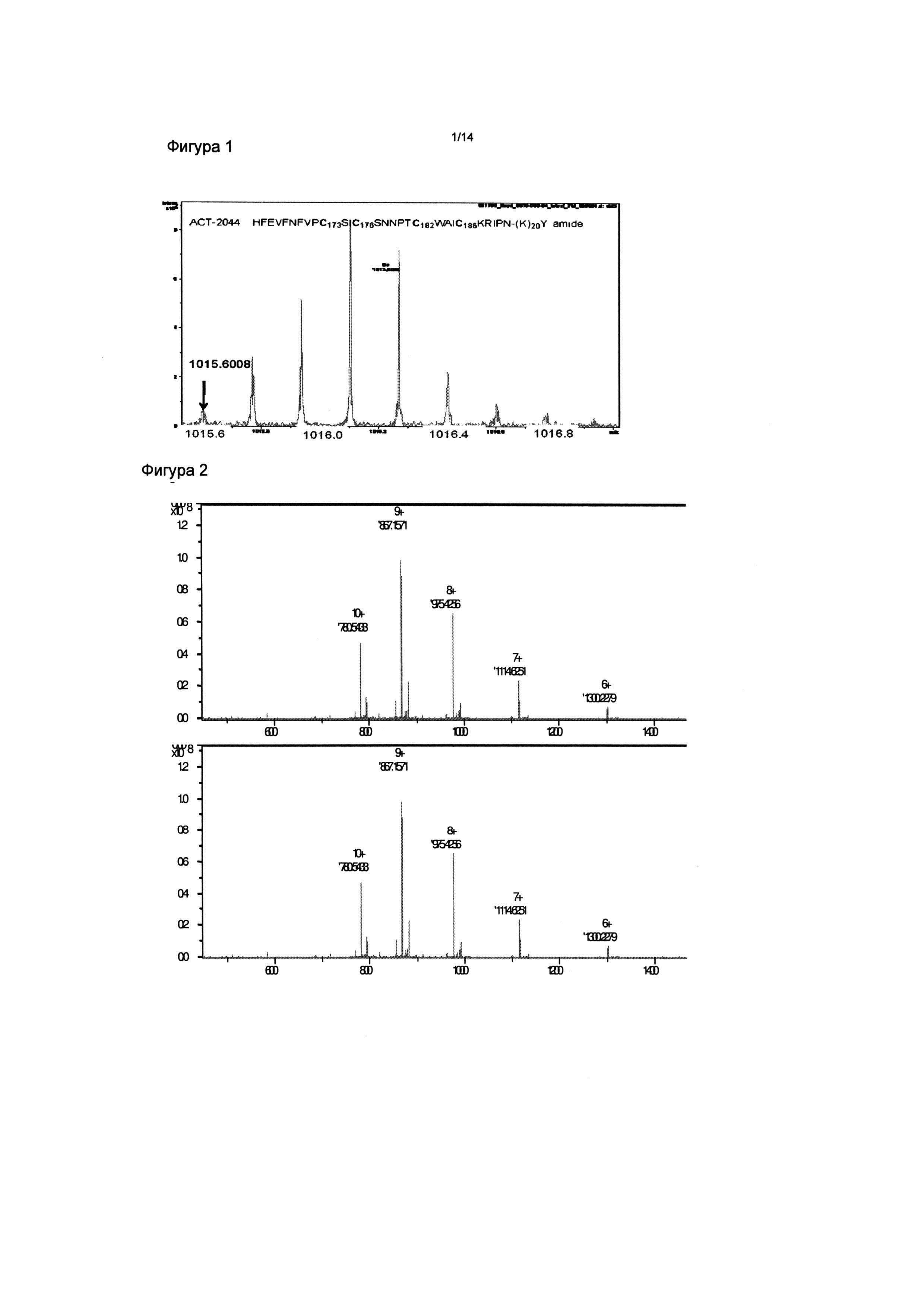
Фигура 1: Расширенный FT-ICR масс-спектр для MH6+6 зарядового состояния интактного ACT-2044 (SEQ ID NO:8). Ожидаемое моноизотопное m/z для полностью окисленного пептида = 1015,43, найдено = 1015,6008. Этот результат полностью согласуется с двумя внутримолекулярными дисульфидами в АСТ-2044.
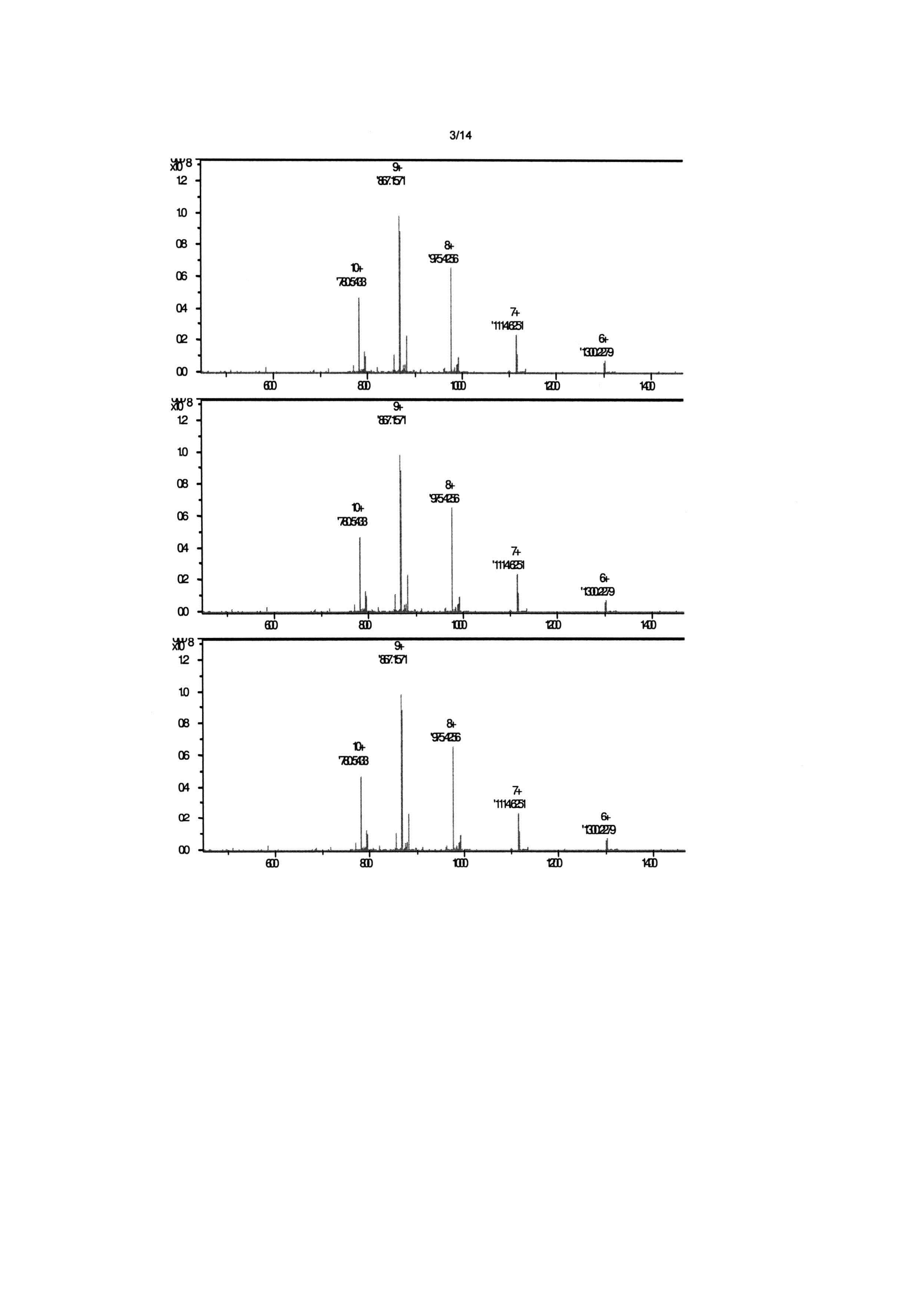
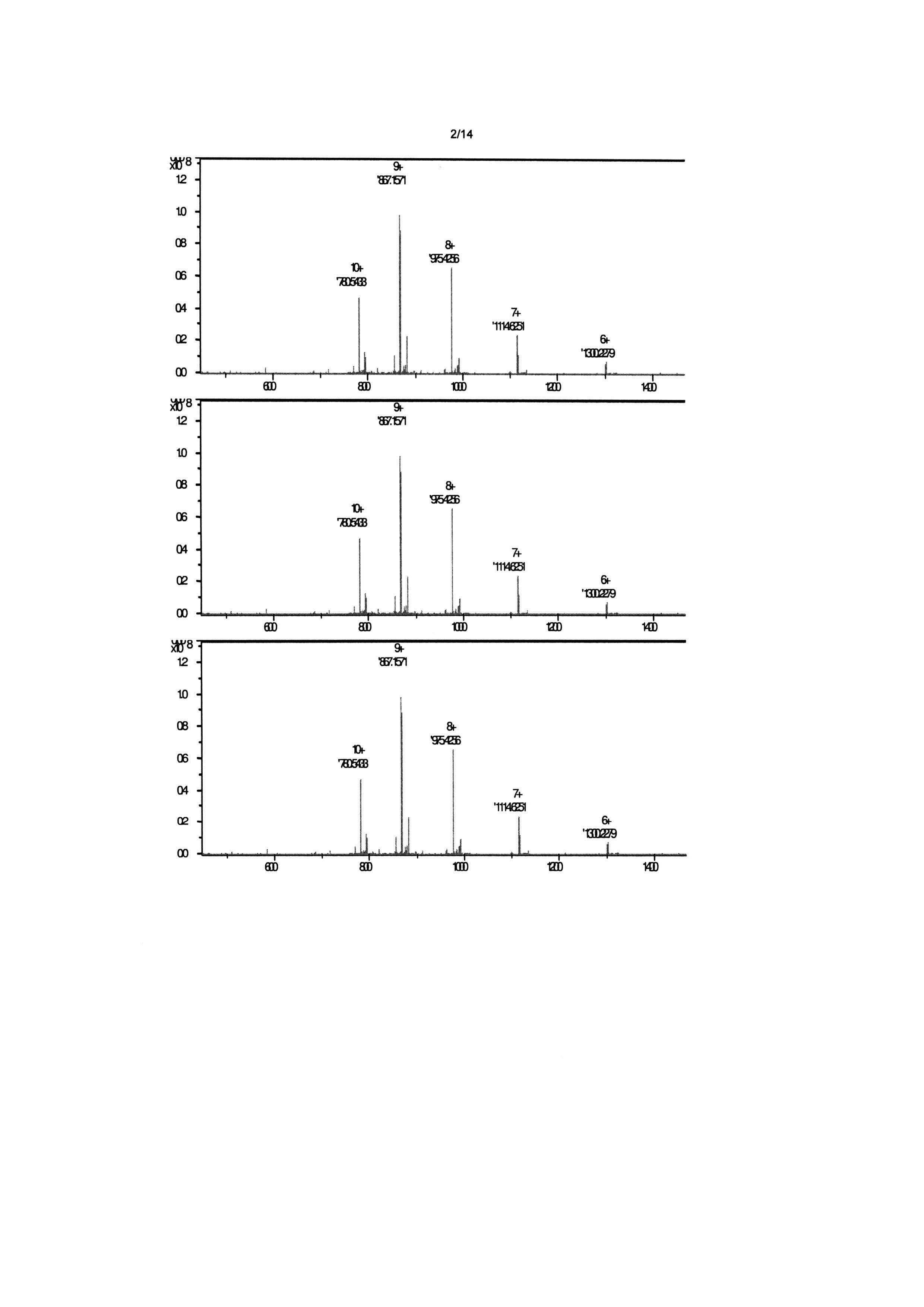
Фигура 2: FT-ICR масс-спектр для ACT-2086 (SEQ ID NO:13). MH9+9 моноизотопный пик имеет m/z 867,1571, соответствующее моноизотопной массе 7795,344 атомных единиц массы (а.е.м.), которая очень близка к вычисленной моноизотопной массе 7795,33 а.е.м. Этот результат полностью согласуется с наличием двух дисульфидных связей в АСТ-2086.
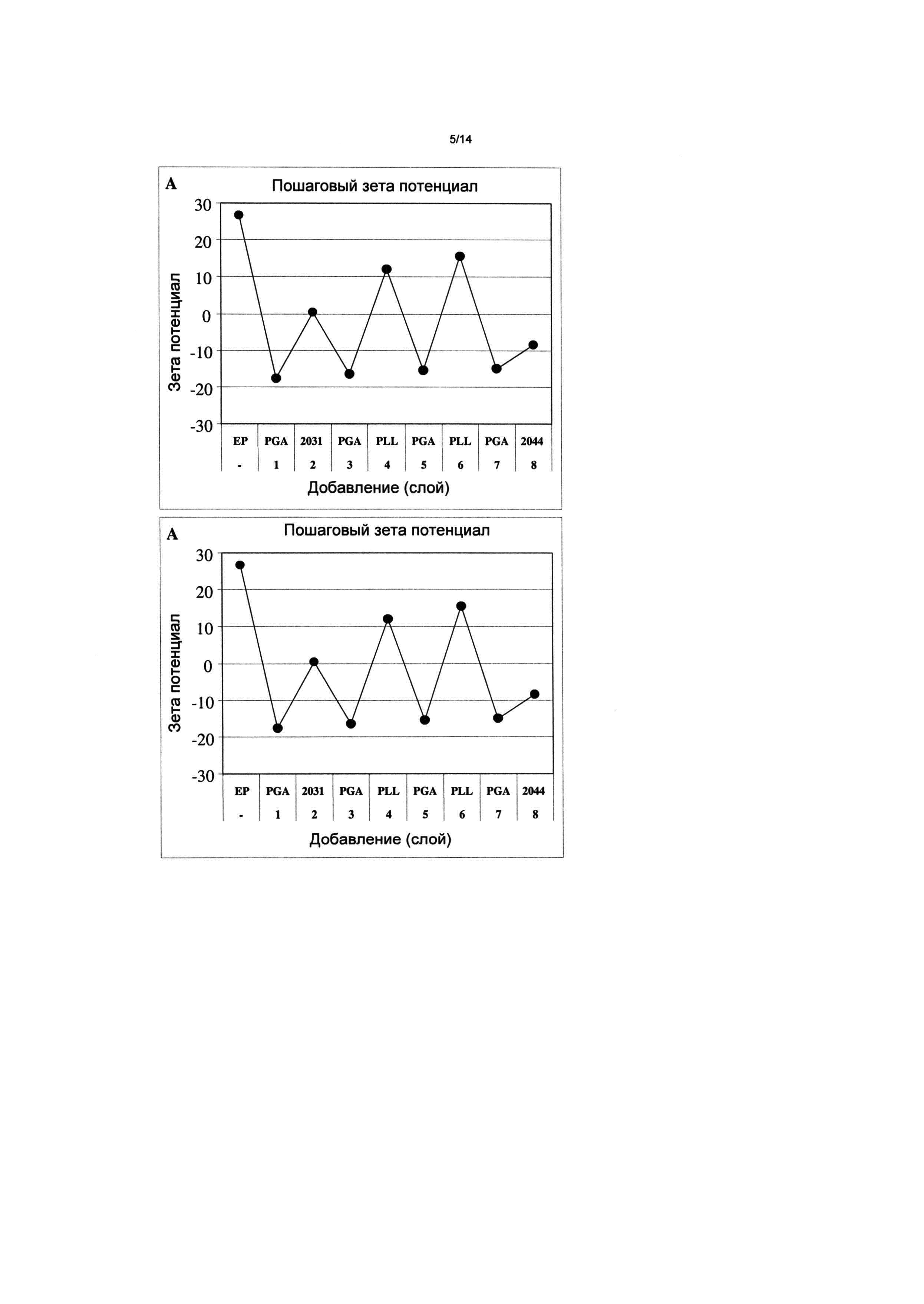
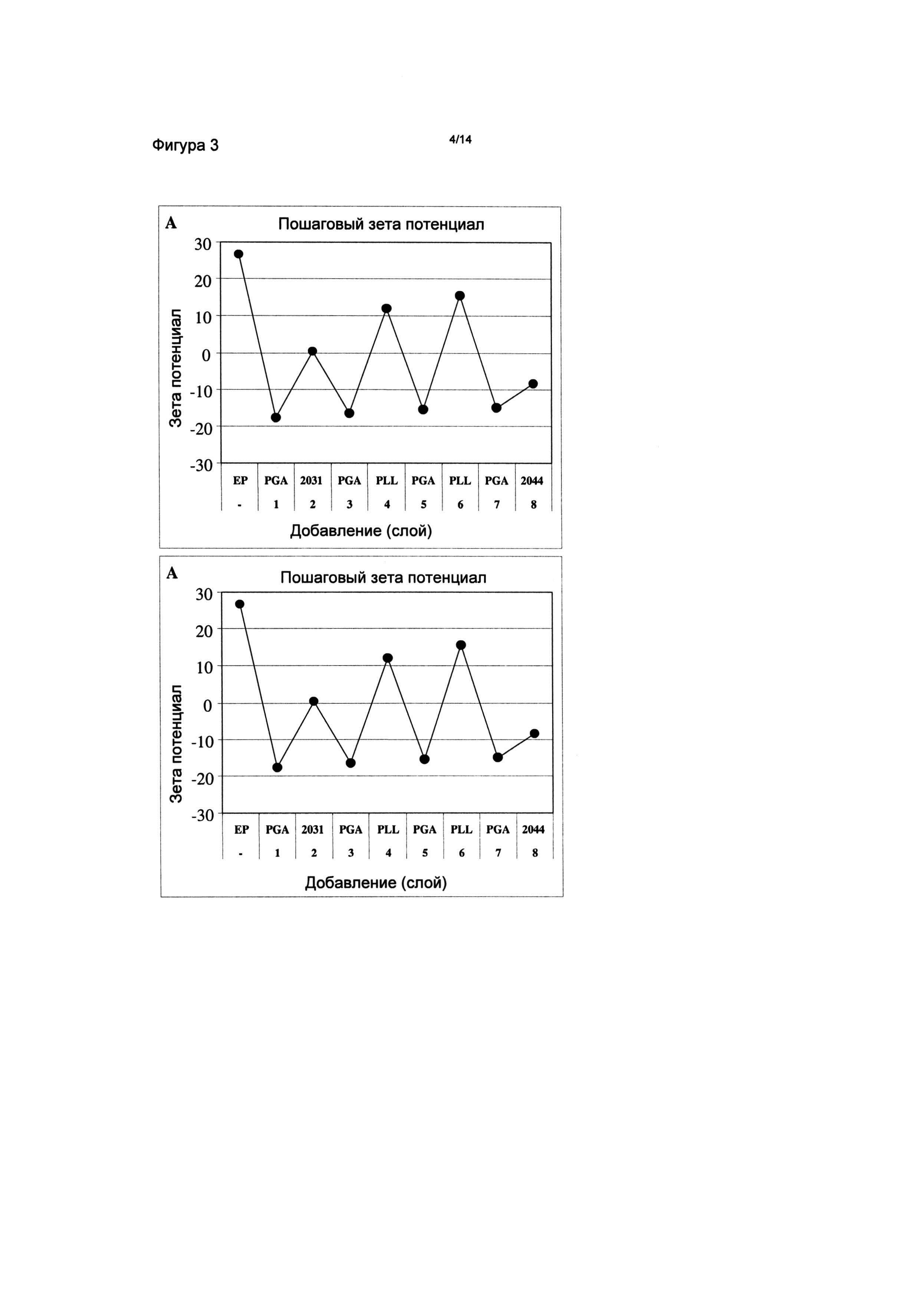
Фигура 3: Поверхностный (зета) потенциал наночастиц, измененный после каждой стадии наслоения ELBL. Непокрытые частицы (ЕР) имеют положительную величину зета. Нанесение одного слоя PGA придает отрицательную величину зета. Последующие стадии наслаивания сконструированным пептидом АСТ-2031, полипептидами PGA и PLL или сконструированным пептидом ACT-2044 вызывают изменение положительного или отрицательного сдвигов в зета потенциале, указывая на успешные стадии ELBL.
Фигура 4: Иммунизация мышей BALB/c три раза наночастицами ACT-1042 (SEQ ID NO:8; RSV-G164-191) посредством инъекции в подушечки лап; образцы сыворотки собирали и тестировали посредством ELISA. Образцы сыворотки распознавали конформационный RSV-G CX3C эпитопный пептид ACT-2044 (SEQ ID NO:8).
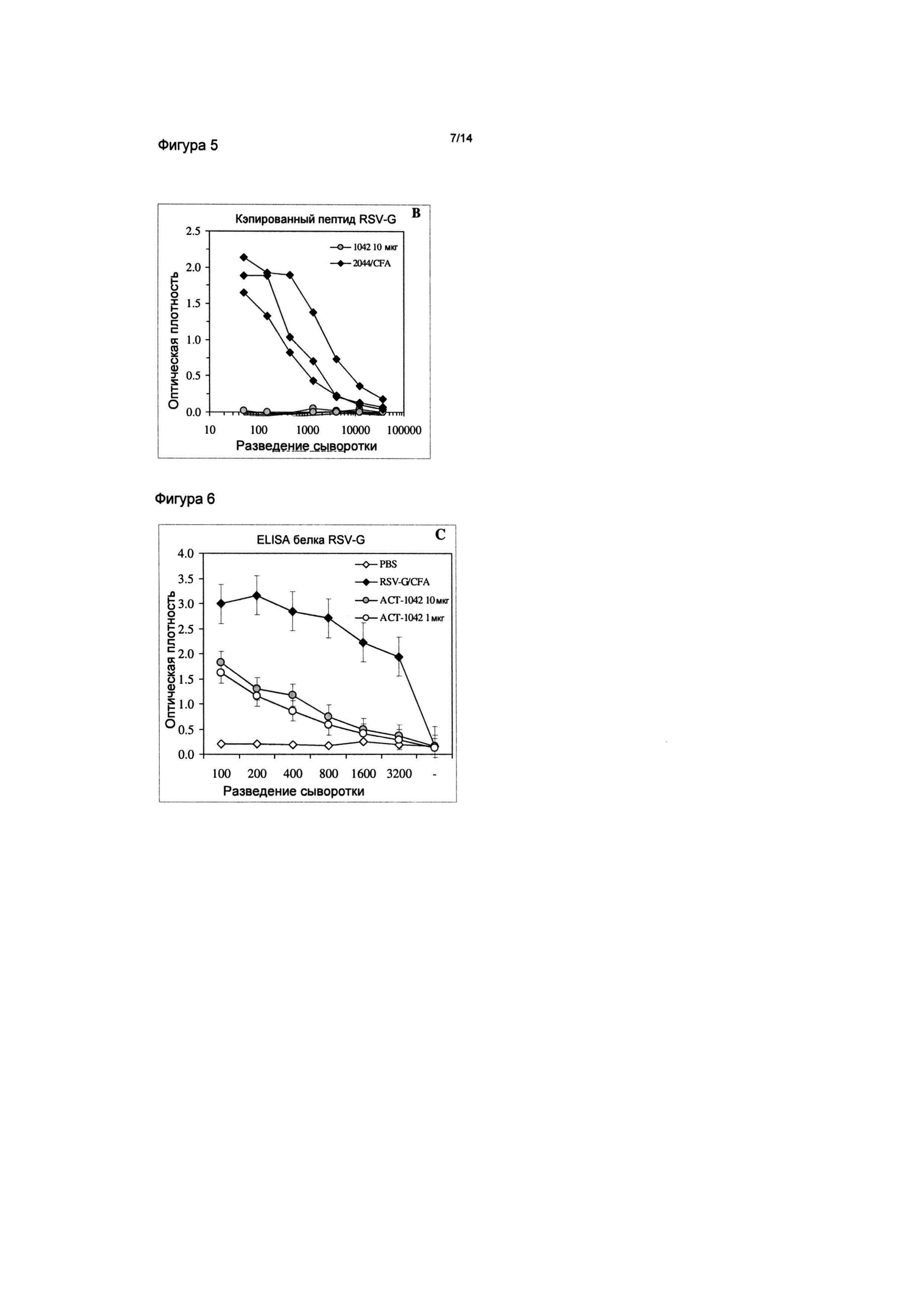
Фигура 5: Иммунизация мышей BALB/c три раза наночастицами ACT-1042 (SEQ ID NO:8; RSV-G164-191) посредством инъекции в подушечки лап; образцы сыворотки собирали и тестировали посредством ELISA. Образцы сыворотки не распознавали вариант того же пептида (ACT-2054; SEQ ID NO:9), который был линеаризован путем кэппирования остатков цистеина.
Фигура 6: Иммунизация мышей BALB/c три раза наночастицами ACT-1042 (SEQ ID NO:8; RSV-G164-191) посредством инъекции в подушечки лап; образцы сыворотки собирали и тестировали посредством ELISA. Образцы сыворотки также распознавали нативный белок RSV-G.
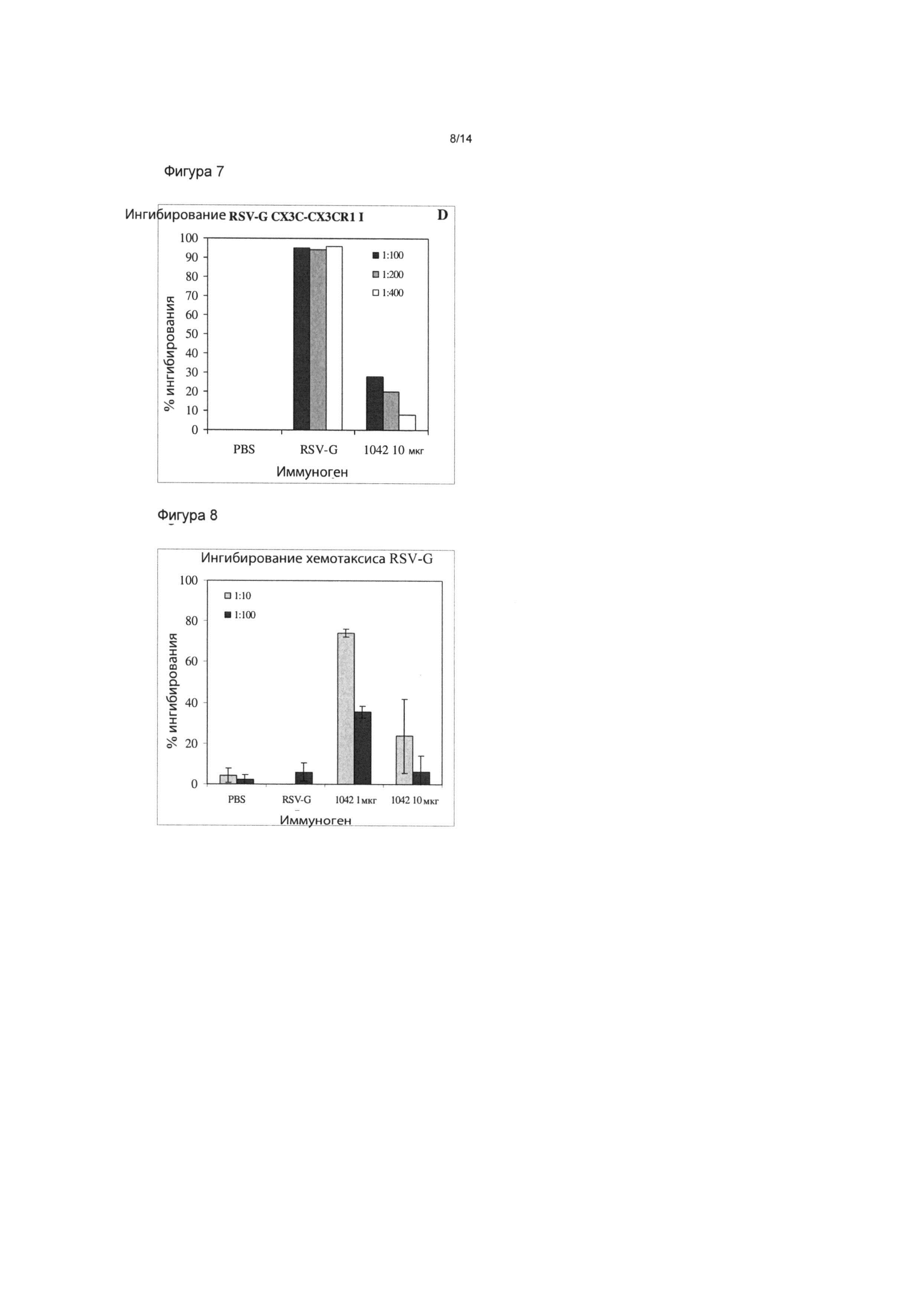
Фигура 7: Иммунизация мышей BALB/c три раза наночастицами ACT-1042 (SEQ ID NO:8; RSV-G164-191) посредством инъекции в подушечки лап; образцы сыворотки собирали и тестировали в анализе биохимического связывания, измеряя ингибирование связывания RSV-G с хемокиновым рецептором CX3CR1. Биологическую активность антительного ответа, индуцируемого под действием АСТ-1042, подтверждали путем ингибирования связывания RSV-G с хемокиновым рецептором.
Фигура 8: Иммунизация мышей BALB/c три раза наночастицами ACT-1042 (SEQ ID NO:8; RSV-G164-191) посредством инъекции в подушечки лап; образцы сыворотки собирали и тестировали в анализе миграции клеток. Биологическую активность антительного ответа, индуцируемого под действием ACT-1042, подтверждали путем ингибирования миграции РВМС человека к очищенному RSV-G.
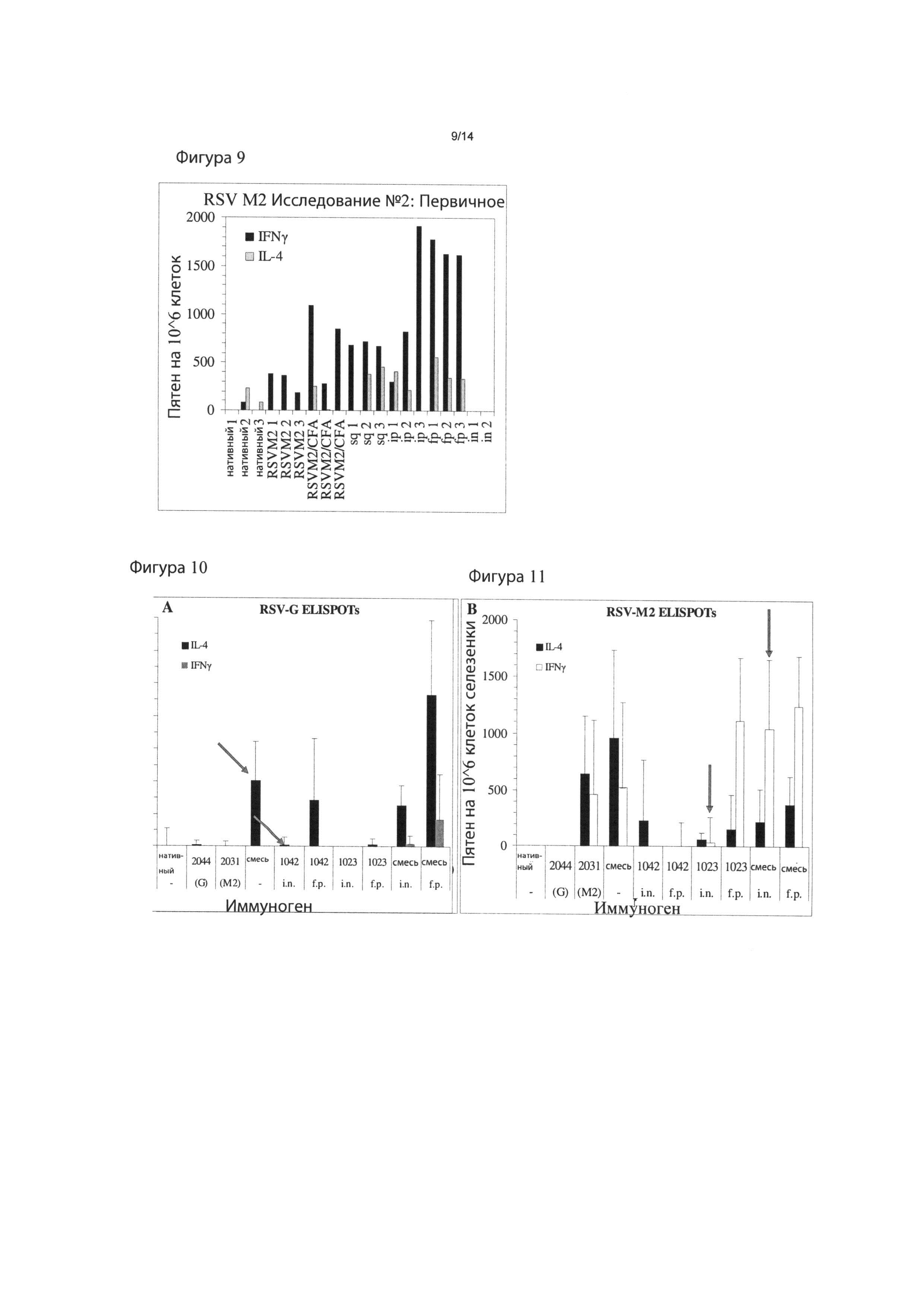
Фигура 9: RSV М2-специфичные Т-клеточные ответы после иммунизации с использованием ACT-1023 (SEQ ID NO:12; RSV-M281-98) посредством подкожного, внутрибрюшинного, интраназального введения и введения в подушечки лап. Спленоциты собирали у мышей на 14 день после иммунизации и рестимулировали в IL-4 или IFNγ ELISPOT планшетах с ACT-2019 (SEQ ID NO:7), пептидом RSV-M2. Результаты отражают число антиген-специфичных Т-клеток/106 клеток у отдельных интактных или иммунизированных животных.
Фигура 10: Иммуногенность мультивалентной RSV вакцины в виде смеси наночастиц. Мышей BALB/c (5 на группу, возраст 5-6 недель) иммунизировали на 0 и 21 день. Антительные ответы на RSV-G: образцы сыворотки собирали на 28 день и титры RSV-G-специфичных IgG антител измеряли с помощью ELISA. Данные показывают среднее значение ±SD 5 мышей на группу.
Фигура 11: Иммуногенность мультиваленной RSV вакцины в виде смеси наночастиц. Мышей BALB/c (5 на группу, возраст 5-6 недель) иммунизировали на 0 и 21 день. Т-клеточные ответы на RSV-M2: клетки селезенки собирали на 28 день и рестимулировали с использованием RSV-M2 (ACT-2031; SEQ ID NO:12) пептида в IFNγ или IL-4 ELISPOT планшетах. Данные показывают среднее значение ±SD 5 мышей на группу.
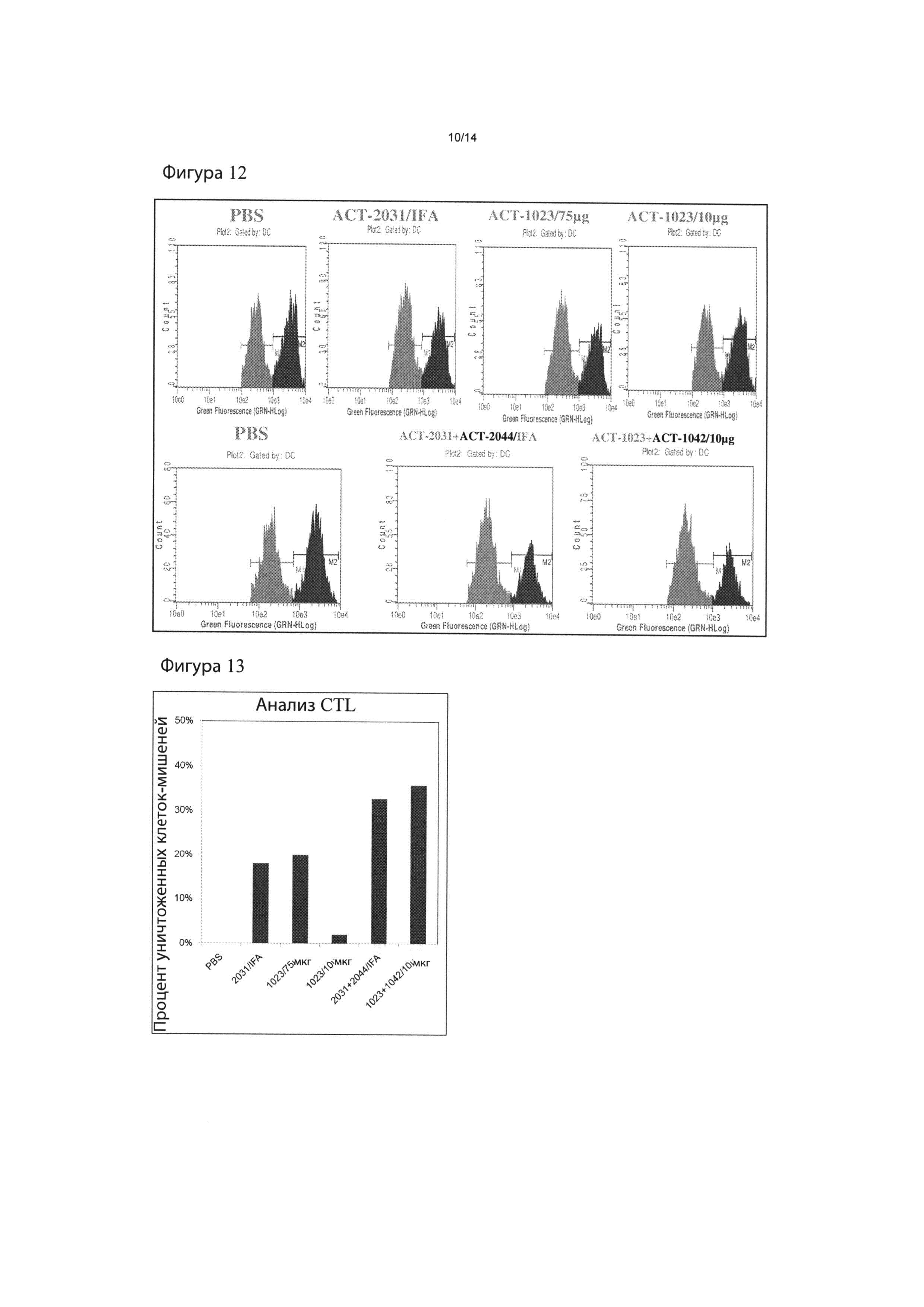
Фигура 12: Индукция in vivo CTL активности под действием иммунизации наночастицами RSV. Мышей BALB/c иммунизировали, как показано, и сенсибилизировали 7 дней спустя путем внутривенной инъекции сингенных клеток селезенки, активированных под действием АСТ-2031 (RSV-M2; SEQ ID NO:12) и меченных высокой дозой флуоресцентного индикатора CFSE (синие пики), смешанного с сингенными клетками селезенки, меченными низкой дозой CFSE и без целевого пептида (красные пики). На следующий день селезенки иммунизированных мышей анализировали проточной цитометрией для установления выживаемости дифференциально-меченых донорских клеток-мишеней. Каждая гистограмма показывает результаты, полученные от одной иммунизированной мыши в этой испытуемой группе.
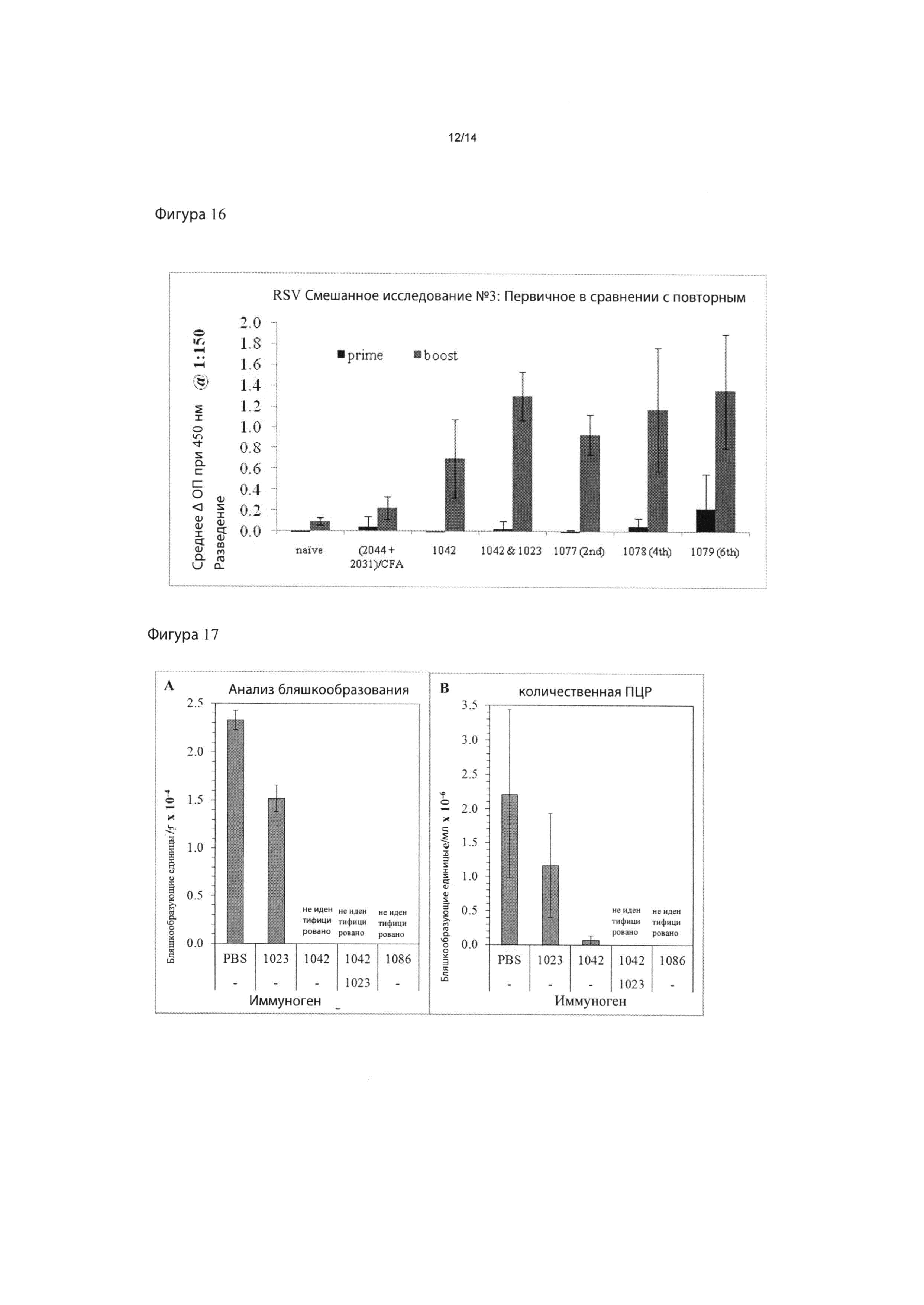
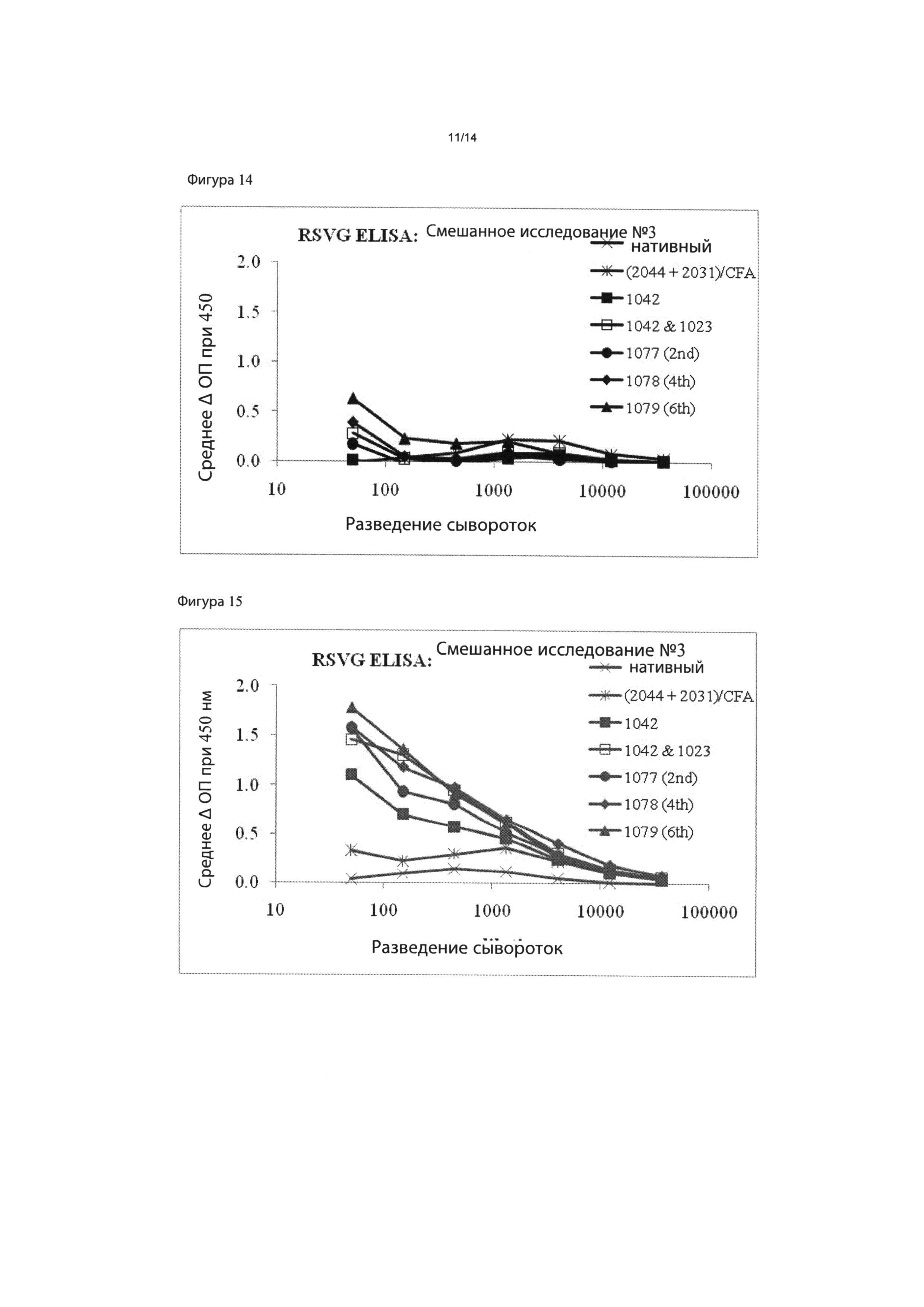
Фигура 13: индукция in vivo CTL активности под действием иммунизации наночастицами RSV. Результаты показывают процент специфического уничтожения клеток-мишеней, меченных RSV-M2, на Фигуре 12, вычисленный путем сравнения относительного числа клеток в каждом пике в пределах гистограммы. На Фигурах 14 и 15 показан антительный ответ после первичной (14) и повторной (15) иммунизации частицами RSV с использованием одноэпитопных и многоэпитопных конструкций.
Фигура 16 представляет собой столбчатую диаграмму результатов, показанных на Фигурах 14 и 15.
На Фигуре 17 показаны результаты сенсибилизации живым RSV мышей, иммунизированных наночастицами RSV, содержащими либо RSV-G, RSV-M2, либо комбинацию. Данные показаны в виде анализа бляшкообразования и количественной ПЦР.
Фигура 18: индукция in vivo CTL активности путем иммунизации наночастицами RSV. Мышей BALB/c иммунизировали, как показано, и сенсибилизировали 7 дней спустя внутривенной инъекцией сингенных клеток селезенки, активированных с использованием ACT-2031 (RSV-M2; SEQ ID NO:12) и меченных высокой дозой флуоресцентного индикатора CFSE (синие пики), в смеси с сингенными клетками селезенки, меченными низкой дозой CFSE и без целевого пептида (красные пики). На следующий день селезенки иммунизированных мышей анализировали проточной цитометрией для установления выживаемости дифференциально-меченых донорских клеток-мишеней. Каждая гистограмма показывает результаты, полученные от одной иммунизированной мыши в этой испытуемой группе.
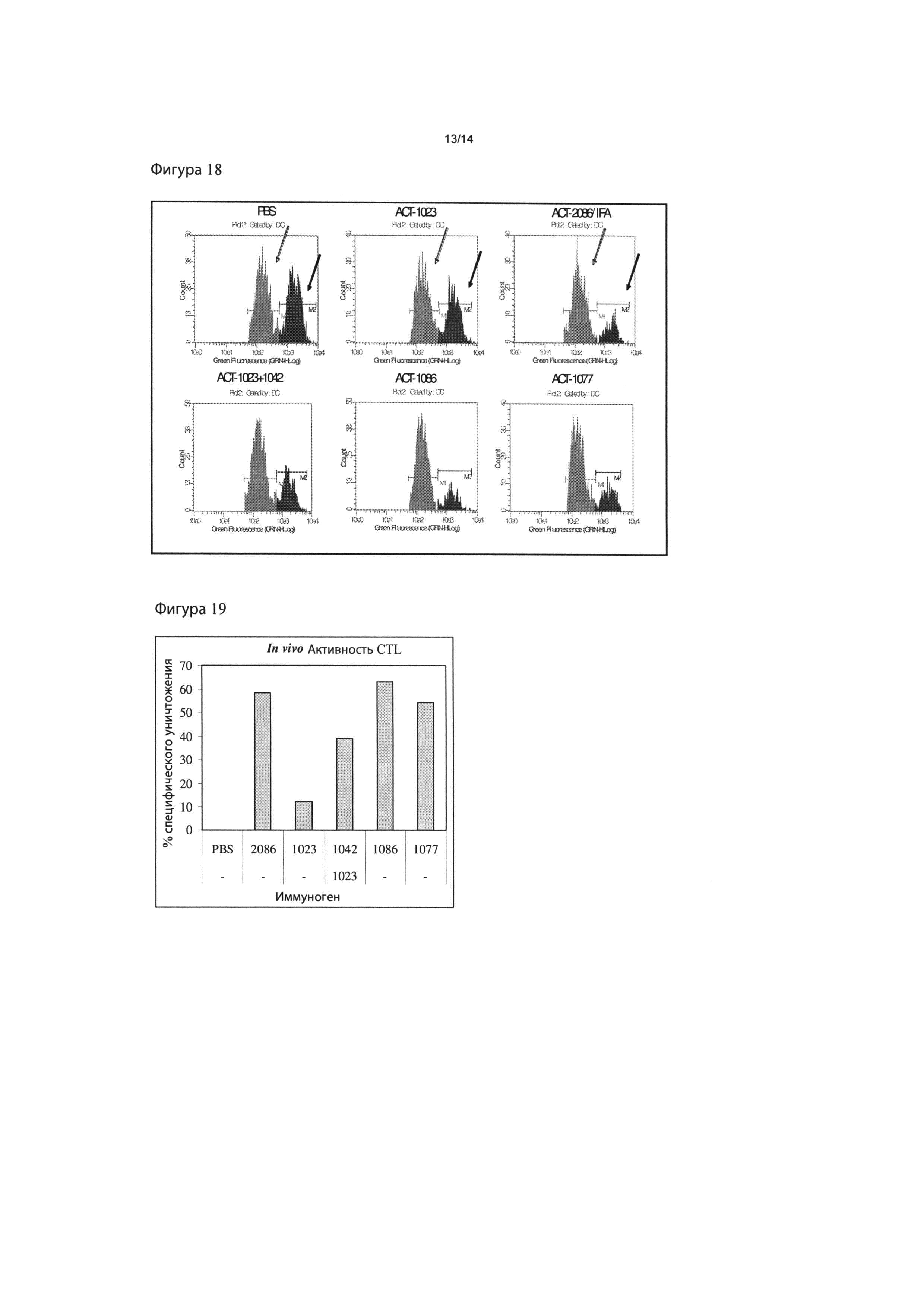
Фигура 19: Индукция in vivo CTL активности путем иммунизации наночастицами RSV. Результаты показывают процент специфичного уничтожения клеток-мишеней, меченных RSV-M2 на Фигуре 18, вычисленный путем сравнения относительного числа клеток в каждом пике в пределах гистограммы.
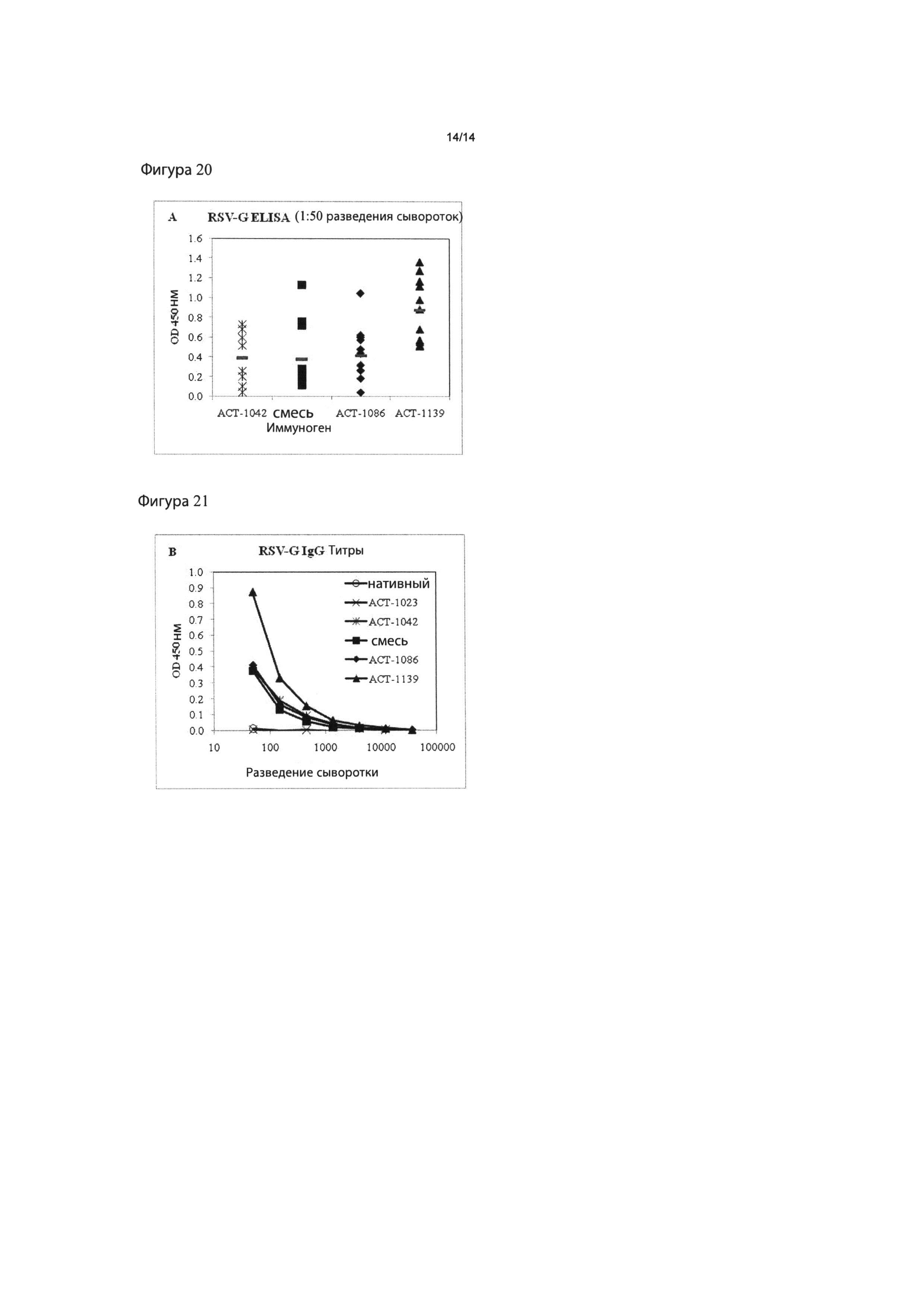
Фигуры 20 и 21: RSV-G-специфичные антительные ответы. Мышей BALB/c иммунизировали на 0 и 21 день. Титры RSV-G-специфичных IgG антител в образцах сыворотки после повторной иммунизации измеряли с помощью ELISA. (20) Величины OD отдельных образцов сыворотки в разведении 1:50. Смесь=ACT-1023+1042. Горизонтальные столбцы представляют среднее отдельных величин в пределах группы. (21) Среднее 5 образцов сыворотки на группу в серийных титрованиях.
Описанные выше и другие отличительные особенности будут ясны и понятны специалистам в данной области из следующего подробного описания, чертежей и прилагаемой формулы изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящей заявке описаны многослойные пленки, содержащие полипептидные эпитопы из RSV, где многослойные пленки способны индуцировать иммунный ответ у хозяина при введении этому хозяину. В одном варианте осуществления, многослойные пленки содержат два полипептидных эпитопа из RSV, в частности эпитоп, который индуцирует специфический Т-клеточный ответ, например цитотоксический Т-клеточный ответ, и эпитоп, который индуцирует специфический антительный ответ. В этом варианте осуществления авторами изобретения неожиданно было показано, что путем комбинирования эпитопа, который индуцирует специфический Т-клеточный ответ, и эпитопа, который индуцирует специфический антительный ответ, способность к специфическому иммунному ответу, измеренная как Т-клеточный ответ, неожиданно улучшается по сравнению с ведением только одного компонента. В частности, комбинация эпитопов RSV-G (специфический антительный ответ) и RSV-M2 (специфический Т-клеточный ответ) в форме одной или нескольких многослойных пленок индуцирует значительно улучшенный Т-клеточный ответ по сравнению с многослойной пленкой, содержащей только один эпитоп RSV-M2.
В частности, многослойные пленки содержат чередующиеся слои противоположно заряженных полиэлектролитов, в которых один полиэлектролитный слой содержит полиэлектролит, имеющий ковалентно присоединенный к нему по меньшей мере один полипептидный эпитоп из RSV. Первый и второй полипептидные эпитопы RSV могут быть присоединены к одному и тому же или к разным полиэлектролитам и/или могут находиться в одной и той же или в разных многослойных пленках. В одном варианте осуществления первый и второй полипептидные эпитопы RSV ковалентно присоединены к одному и тому же полиэлектролиту и, следовательно, находятся в одной и той же многослойной пленке. В другом варианте осуществления первый и второй полипептидные эпитопы RSV ковалентно присоединены к различным полиэлектролитам, но наслоены в пределах одной и той же многослойной пленки. Еще в одном варианте осуществления первый и второй полипептид RSV ковалентно присоединен к различным полиэлектролитам, но наслоены в разных многослойных пленках, которые впоследствии перемешивают перед применением.
В одном варианте осуществления, многослойные пленки содержат чередующиеся слои противоположно заряженных полиэлектролитов, в которых один полиэлектролитный слой представляет собой сконструированный полипептид, содержащий по меньшей мере однин эпитоп из RSV. Первый и второй полипептидные эпитопы RSV могут находиться в одном и том же или в различных сконструированных полипептидах и/или могут находиться в одной и той же или в разных многослойных пленках. В одном варианте осуществления первый и второй полипептидные эпитопы RSV находятся в одном и том же сконструированном полипептиде и, следовательно, находятся в одной и той же многослойной пленке. В другом варианте осуществления первый и второй полипептид RSV находятся в разных сконструированных полипептидах, но наслоены в пределах одной и той же многослойной пленки. Еще в одном варианте осуществления первый и второй полипептид RSV находятся в разных сконструированных полипептидах, но наслоены в разных многослойных пленках, которые впоследствии перемешивают перед применением.
В одном варианте осуществления, полипептидные эпитопы RSV представляют собой эпитопы из белка RSV-G. Белок RSV-G (присоединение) был ассоциирован со многими нарушениями, включая измененную экспрессию мРНк СС и СХС хемокинов и Th2 цитокиновых ответов, которые, по-видимому, подтверждают неадекватные иммунологические результаты и усугубление заболевания. Центральная богатая цистеином консервативная область белка RSV-G содержит СХЗС хемокиновый мотив в аминокислотных положениях 182-186, который связывается с CX3CR1, фракталкиновым рецептором (CX3CL1). Мимикрия CX3CL1 RSV-G была показана для обеспечения RSV инфекции и препятствия нормальным адаптивным иммунным реакциям на этот вирус. Активная иммунизация пептидами, перекрывающими мотив СХ3С RSV-G, защищает мышей от RSV инфекции и воспаления легких. До сих пор эти RSV-G пептиды не были разработаны в безопасную и эффективную вакцину.
В другом варианте осуществления, полипептидные эпитопы RSV представляют собой эпитопы из белка RSV-F или RSV-M2. Помимо белка RSV-G белки RSV-F (слитый) и RSV-M2 (матриксный) являются возможными кандидатами для вакцин. Попытки разработать моновалентные вакцины RSV, содержащие только одну из главных антигенных детерминант, были затруднены неполной защитой от инфекционных и воспалительных заболеваний, указывая на то, что мультивалентный подход мог бы быть более успешным. Действительно, иммунизация мышей мультивалентными вакцинами, которые индуцируют как антительный, так и CD8+ Т-клеточный ответ, в результате приводит к уменьшению Th2 и повышению Th1/CD8 ответов, которые коррелируют с большей защитой от вирусной инфекции и меньшей воспалительной патологией легких. Эти результаты указывают на то, что идеальная созданная RSV вакцина включала бы эпитопы из двух или более вирусных белков и индуцировала бы как антитела, так и CD8+ Т-клетки, секретирующие IFNγ.
В другом варианте осуществления многослойная пленка содержит полипептидный эпитоп из RSV, где полипептидный эпитоп представляет собой эпитоп из RSV-G белка (специфический антительный ответ). Неожиданно было обнаружено, что мыши, иммунизированные наночастицами, содержащими эпитоп СХ3С RSV-G, были защищены от заражения живым RSV. Интересно то, что эпитоп RSV-M2 не обеспечивал защиту от заражения живым RSV, а комбинация RSV-G и RSV-M2 вакцины не обеспечивала улучшенную защиту по сравнению с одним только RSV-G. Не придерживаясь теории, считается, что высокая концентрация наночастиц, используемых в этих экспериментах, могла иметь скрытые потенциальные благоприятные эффекты комбинации наночастиц.
В одном варианте осуществления многослойная пленка расположена на ядре частицы, например наночастице СаСО3, латексной частице или частице железа. В основном используют частицы размером порядка 5 нанометров (нм) до 50 микрометров (мкм) в диаметре. Частицы, сделанные из других материалов, также могут быть использованы в качестве ядер, при условии, что они являются биосовместимыми, имеют контролируемое распределение по размеру и имеют достаточный поверхностный заряд (либо положительный, либо отрицательный) для связывания полиэлектролитных пептидов. Примеры включают наночастицы и микрочастицы, изготовленные из таких материалов, как полимолочная кислота (PLA), сополимер полимолочной кислоты и гликолевой кислоты (PLGA), полиэтиленгликоль (PEG), хитозан, гиалуроновая кислота, желатин или их комбинации. Ядра частиц также могли быть изготовлены из материалов, которые считаются неподходящими для использования людьми, при условии, что они могут быть растворены и отделены от многослойной пленки после производства пленки. Примеры веществ для матрицы ядра включают органические полимеры, такие как латекс, или неорганические вещества, такие как кремний.
Полиэлектролитные многослойные пленки представляют собой тонкие пленки (например, толщиной от нескольких нанометров до микрометров), состоящие из чередующихся слоев противоположно заряженных полиэлектролитов. Такие пленки могут быть сформированы послойной сборкой на подходящем субстрате. В электростатической послойной самосборке («ELBL») физическая основа ассоциации полиэлектролитов представляет собой электростатическое притяжение. Наращивание пленки является возможным, поскольку знак плотности поверхностного заряда пленки меняется на противоположный при нанесении последовательных слоев. Универсальность и относительная простота процесса ELBL для пленки позволяет разместить многие различные типы полиэлектролитов на многие различные типы поверхности. Полипептидные многослойные пленки представляют собой разновидность полиэлектролитных многослойных пленок, содержащих по меньшей мере один слой, содержащий заряженный полипептид, в настоящей заявке называемый сконструированным полипептидом. Ключевым преимуществом полипептидных многослойных пленок перед другими пленками, изготовленными из других полимеров, является их биосовместимость. Пленки ELBL также могут быть использованы для инкапсуляции. Применения полипептидных пленок и микрокапсул включают, например, нанореакторы, биосенсоры, искусственные клетки и носители для доставки лекарственных средств.
Термин «полиэлектролит» включает поликатионные и полианионные вещества, имеющие молекулярную массу более 1000 и по меньшей мере 5 зарядов на молекулу. Подходящие поликатионные вещества включают, например, полипептиды и полиамины. Полиамины включают, например, полипептид, такой как поли-L-лизин (PLL) или поли-L-орнитин, поливиниламин, поли(аминостирол), поли(аминоакрилат), поли(N-метиламиноакрилат), поли(N-этиламиноакрилат), поли(N,N-диметиламиноакрилат), поли(N,N-диэтиламиноакрилат), поли(аминометакрилат), поли(N-метиламино-метакрилат), поли(N-этиламинометакрилат), поли(N,N-диметиламинометакрилат), поли(N,N-диэтиламинометакрилат), поли(этиленимин), поли(диаллилдиметиламмония хлорид), поли(N,N,N-триметиламиноакрилат хлорид), поли(метакриламидопропилтриметиламмония хлорид), хитозан и комбинации, содержащие одно или более из указанных выше поликатионных веществ. Подходящие полианионные вещества включают, например, полипептид, такой как поли-L-глутаминовая кислота (PGA) и поли-L-аспарагиновая кислота, нуклеиновую кислоту, такую как ДНК и РНК, альгинат, каррагенан, фурцелларан, пектин, ксантан, гиалуроновая кислота, гепарин, гепарансульфат, хондроитинсульфат, дермантансульфат, декстрансульфат, поли(мет)акриловую кислоту, окисленную целлюлозу, карбоксиметилцеллюлозу, кислые полисахариды и кроскармелозу, синтетические полимеры и сополимеры, содержащие дополнительные боковые карбоксильные группы, и комбинации одного или нескольких указанных выше полианионных веществ. В одном варианте осуществления, эпитоп RSV и полиэлектролит имеют одинаковый знак заряда.
В одном варианте осуществления один или несколько полиэлектролитных слоев пленки, необязательно включающей полиэлектролит, содержащий эпитоп RSV, представляют собой сконструированный полипептид. В одном варианте осуществления принципы создания полипептидов, подходящие для электростатического послойного осаждения материала, освещены в патентной публикации US № 2005/0069950, включенной в настоящую заявку посредством ссылки для предоставления сведений о полипептидных многослойных пленках. Вкратце, основными особенностями конструкции являются длина и заряд полипептида. Электростатические параметры являются наиболее важной особенностью конструкции, поскольку это является основой ELBL. Без подходящих свойств заряда полипептид может не быть в значительной степени растворимым в водном растворе при рН 4-10 и не может легко использоваться для производства многослойной пленки путем ELBL. Другие особенности конструкции включают физическую структуру полипептидов, физическую растворимость пленок, образованных из этих полипептидов, и биосовместимость и биоактивность пленок и составляющих их полипептидов.
Сконструированный полипептид означает полипептид, который имеет достаточный заряд для стабильного связывания с противоположно заряженной поверхностью, то есть полипептид, который может быть осажден в слой многослойной пленки, где движущей силой образования пленки является электростатическая сила. Короткая стабильная пленка представляет собой пленку, которая, сформировавшись, сохраняет более половины своих компонентов после инкубирования в PBS при 37°С в течение 24 часов. В конкретных вариантах осуществления сконструированный полипептид составляет по меньшей мере 15 аминокислот в длину, и величина суммарного заряда на остаток полипептида является большей или равной 0,1, 0,2, 0,3, 0,4 или 0,5 при рН 7,0. Положительно заряженными (основными) природными аминокислотами при рН 7,0 являются аргинин (Arg), гистидин (His), орнитин (Orn) и лизин (Lys). Отрицательно заряженными (кислыми) природными аминокислотами при рН 7,0 являются глутаминовая кислота (Glu) и аспарагиновая кислота (Asp). Смесь аминокислотных остатков противоположного заряда может быть использована при условии, что суммарный чистый коэффициент заряда соответствует заданным критериям. В одном варианте осуществления сконструированный полипептид не является гомополимером. В другом варианте осуществления сконструированный полипептид является неразветвленным.
Одной особенностью конструкции является контроль стабильности полипептидных пленок ELBL. Ионные связи, водородные связи, Ван дер Ваальсовые взаимодействия и гидрофобные взаимодействия вносят свой вклад в стабильность многослойных пленок. Кроме того, ковалентные дисульфидные связи, образованные между сульфгидрилсодержащими аминокислотами в полипептидах в пределах одного и того же слоя или в смежных слоях, могут повысить структурную прочность. Сульфгидрилсодержащие аминокислоты включают цистеин и гомоцистеин, и эти остатки легко могут быть включены в синтетические сконструированные пептиды. Помимо сульфгидрильных групп в полиэлектролит могут быть включены гомополимеры, такие как поли-L-лизин или поли-L-глутаминовая кислота, способами, широко описанными в литературе. Сульфгидрилсодержащие аминокислоты могут быть использованы для «запирания» (связать вместе) и «отпирания» слоев многослойной полипептидной пленки путем изменения окислительного потенциала. Также включение сульфгидрилсодержащей аминокислоты в сконструированный полипептид дает возможность использовать относительно короткие пептиды в производстве тонкой пленки, посредством образования межмолекулярной дисульфидной связи.
В одном варианте осуществления сконструированные сульфгидрилсодержащие полипептиды, либо синтезированные химически, либо продуцированные в организме-хозяине, собирают посредством ELBL в присутствии восстанавливающего агента для предотвращения преждевременного образования дисульфидной связи. После сборки пленки восстанавливающий агент удаляют и добавляют окисляющий агент. В присутствии окисляющего агента образуются дисульфидные связи между сульфгидрильными группами, тем самым «запирая» вместе полипептиды внутри слоев и между слоями, где присутствуют тиольные группы. Подходящие восстанавливающие агенты включают дитиотреитол (DTT), 2-меркаптоэтанол (ВМЕ), восстановленный глутатион, трис(2-карбоксиэтил)фосфингидрохлорид (ТСЕР) и комбинации более одного из этих реактивов. Подходящие окисляющие агенты включают окисленый глутатион, трет-бутилгидропероксид (t-BHP), тимеросал, диамид, 5,5’-дитио-бис-(2-нитро-бензойную кислоту) (DTNB), 4,4’-дитиодипиридин, бромат натрия, перекись водорода, тетратионат натрия, порфириндин, ортойодособензоат и комбинации более одного из этих реактивов.
В качестве альтернативы дисульфидным связям, могут быть использованы химические составы, которые образуют другие ковалентные связи для стабилизации пленок ELBL. Для пленок, состоящих из полипептидов, химические составы, которые образуют амидные связи, являются особенно подходящими. В присутствии соответствующих связующих реагентов кислые аминокислоты (с боковыми цепями, содержащими группы карбоновой кислоты, такие как аспарагиновая кислота и глутаминовая кислота) будут вступать в реакцию с аминокислотами, боковые цепи которых содержат аминогруппы (такими как лизин и орнитин) с образованием амидных связей. Амидные связи являются более стабильными, чем дисульфидные связи, в биологических условиях, и амидные связи не будут подвергаться реакциям обмена. Многие реактивы могут быть использованы для активации боковых цепей полипептида для амидного связывания. Карбодиимидные реактивы, такие как водорастворимый 1-этил-3-(3-диметиламинопропил) карбодиимид (EDC), будут взаимодействовать с аспарагиновой кислотой или глутаминовой кислотой при слабокислом рН, образуя промежуточный продукт, который будет необратимо взаимодействовать с амином с образованием амидной связи. Добавки, такие как N-гидроксисукцинимид, зачастую добавляют к реакционной смеси для ускорения скорости и эффективности образования амида. После реакции растворимые реагенты удаляют из наночастиц или микрочастиц центрифугированием и аспирацией. Примеры других связующих реагентов включают диизопропилкарбодиимид, HBTU, HATU, HCTU, TBTU и РуВОР. Примеры других добавок включают сульфо-N-гидроксисукцинимид, 1-гидроксибензотриазол и 1-гидрокси-7-аза-бензотриазол. Степень амидного поперечного связывания может контролироваться путем изменения стехиометрии связующих реагентов, времени реакции или температуры реакции и может контролироваться такими способами, как инфракрасная спектроскопия с преобразованием Фурье (FT-IR).
Ковалентно поперечно связанные ELBL пленки обладают желаемыми свойствами, такими как повышенная стабильность. Большая стабильность дает возможность использования более жестких условий во время производства наночастиц, микрочастиц, нанокапсул или микрокапсул. Примеры жестких условий включают высокие температуры, низкие температуры, криогенные температуры, высокие скорости центрифугирования, буферы с высокой концентрацией солей, буферы с высоким рН, буферы с низким рН, фильтрование и длительное хранение.
Способ получения полиэлектролитной многослойной пленки включает напыление множества слоев противоположно заряженных химических соединений на субстрат. В одном варианте осуществления по меньшей мере один слой содержит сконструированный полипептид. Последовательно напыленные полиэлектролиты будут иметь противоположные суммарные заряды. В одном варианте осуществления напыление полиэлектролита включает воздействие на субстрат водным раствором, содержащим полиэлектролит при рН, при котором он имеет подходящий суммарный заряд для ELBL. В других вариантах осуществления напыление полиэлектролита на субстрат достигается последовательным распылением растворов противоположно заряженных полипептидов. Еще в одном варианте осуществления напыление на субстрат осуществляют путем одновременного распыления растворов противоположно заряженных полиэлектролитов.
В ELBL способе образования многослойной пленки противоположные заряды смежных слоев обеспечивают движущую силу для сборки. Не является крайне важным, чтобы полиэлектролиты в противоположных слоях имели одинаковую суммарную линейную плотность заряда, только чтобы противоположные слои имели противоположные заряды. Одна стандартная методика сборки пленки путем напыления включает образование жидких растворов полиионов при рН, при котором они являются ионизированными (т.е. рН 4-10), обеспечение субстрата, несущего поверхностный заряд, и попеременное погружение в заряженные полиэлектролитные растворы. Этот субстрат необязательно промывают между напылениями чередующихся слоев.
Концентрацию полиэлектролита, подходящую для напыления полиэлектролита, легко может определить специалист в данной области. Концентрация, приводимая в качестве примера, составляет от 0,1 до 10 мг/мл. Для типичных неполипептидных полиэлектролитов, таких как поли(акриловая кислота) и поли(аллиламингидрохлорид), характерная толщина слоя составляет примерно от 3 примерно до 5 Å, в зависимости от ионной силы раствора. Короткие полиэлектролиты обычно образуют более тонкие слои, чем длинные полиэлектролиты. Что касается толщины пленки, толщина полиэлектролитной пленки зависит от влажности, а также от числа слоев и состава пленки. Например, PLL/PGA пленки 50 нм толщиной сжимаются до 1,6 нм при высушивании азотом. В целом, пленки толщиной от 1 нм до 100 нм или более могут быть образованы в зависимости от состояния гидратации пленки и молекулярной массы полиэлектролитов, используемых в сборке.
Кроме того, количество слоев, необходимое для формирования стабильной полиэлектролитной многослойной пленки, будет зависеть от полиэлектролитов в пленке. Для пленок, содержащих только слои полипептидов с низкой молекулярной массой, пленка обычно будет иметь 4 или более бислоев противоположно заряженных полипептидов. Для пленок, содержащих полиэлектролиты с высокой молекулярной массой, такие как поли(акриловая кислота) и поли(аллиламингидрохлорид), пленки, содержащие один бислой противоположно заряженного полиэлектролита, могут быть стабильными. Исследования показали, что полиэлектролитные пленки являются динамичными. Полиэлектролиты, содержащиеся в пленке, могут мигрировать между слоями и могут обмениваться с растворимыми полиэлектролитами одноименного заряда при суспендировании в растворе полиэлектролитов. Более того, полиэлектролитные пленки могут разделяться или растворяться в ответ на изменение окружения, например температуры, рН, ионной силы или окислительного потенциала суспензионного буфера. Таким образом, некоторые полиэлектролиты и, в частности, пептидные полиэлектролиты, проявляют динамическую стабильность. Стабильность пептидных полиэлектролитых пленок можно контролировать путем суспендирования пленок в подходящем буфере в контролируемых условиях в течение фиксированного периода времени, а затем измерения количеств пептидов в пленке с помощью подходящего анализа, например анализа аминокислот, ВЭЖХ или флуоресцентного анализа. Пептидные полиэлектролитные пленки являются наиболее стабильными в условиях, которые соответствуют условиям их хранения и применения в качестве вакцин, например, в нейтральных буферах и при температуре окружающей среды 4-37°С. В этих условиях стабильные пептидные полиэлектролитные пленки будут сохранять большинство составляющих их пептидов по меньшей мере в течение 24 часов и зачастую вплоть до 14 дней и больше.
В одном варианте осуществления сконструированный полипептид содержит одну или более областей поверхностной абсорбции, ковалентно связанных с одним или более эпитопами RSV, где сконструированный полипептид и одна или более областей поверхностной абсорбции имеют одинаковый знак заряда, то есть оба положительно или оба отрицательно заряжены суммарно. В контексте настоящего изобретения область поверхностной абсорбции представляет собой заряженную область сконструированного полипептида, которая преимущественно обеспечивает достаточный заряд, так чтобы пептид, содержащий эпитоп из RSV, например, мог быть осажден в многослойной пленке. В одном варианте осуществления, одна или более областей поверхностной абсорбции и один или более эпитопов RSV имеют одинаковую суммарную полярность. В другом варианте осуществления растворимость сконструированного полипептида при рН 4-10 больше или равна примерно 0,1 мг/мл. В другом варианте осуществления растворимость сконструированного полипептида при рН 4-10 больше или равна примерно 1 мг/мл. Растворимость является ограничением практического характера для облегчения напыления полипептидов из водного раствора. Применяемый на практике верхний предел в отношении степени полимеризации антигенного полипептида составляет примерно 1000 остатков. Вероятно, однако, что более длинные составные полипептиды могли быть получены соответствующим способом синтеза.
В одном варианте осуществления сконструированный полипептид содержит один антигенный эпитоп RSV, фланкированный двумя областями поверхностной адсорбции и C-концевой областью поверхностной адсорбции. В другом варианте осуществления сконструированный полипептид содержит один антигенный эпитоп RSV, фланкированный одной областью поверхностной адсорбции, связанной с N-концом эпитопа RSV. В другом варианте осуществления сконструированный полипептид содержит один антигенный эпитоп RSV, фланкированный одной областью поверхностной адсорбции, связанной с С-концом эпитопа RSV.
Каждая из независимых областей (например, RSV эпитопы и области поверхностной адсорбции) сконструированного полипептида может быть синтезирована отдельно с помощью пептидного синтеза в жидкой фазе, твердофазного пептидного синтеза или генной инженерией подходящего организма-хозяина. Пептидный синтез в жидкой фазе представляет собой способ, используемый для получения большинства одобренных пептидных фармацевтических средств на рынке на сегодняшний день. Сочетание способов жидкой фазы и твердой фазы может быть использовано для синтеза относительно длинных пептидов и даже белков с низкой молекулярной массой. Компании, занимающиеся пептидным синтезом, обладают специальными знаниями и опытом для синтеза сложных пептидов на платной основе. Синтез проводят по правилам организации производства и контроля качества лекарственных средств (GMP) и в масштабе, подходящем для клинических испытаний и коммерческого выпуска лекарственного средства.
Альтернативно, различные независимые области могут быть синтезированы вместе в виде одной полипептидной цепи с помощью пептидного синтеза в жидкой фазе, твердофазного пептидного синтеза или методами генной инженерии подходящего организма-хозяина. Выбор подхода в каждом конкретном случае будет вопросом удобства и экономических факторов.
В тех случаях, когда различные эпитопы RSV и области поверхностной адсорбции синтезируют отдельно, после очистки, например, ионообменной хроматографией или высокоэффективной жидкостной хроматографией, их соединяют посредством синтеза пептидных связей. То есть N-конец области поверхностной адсорбции и С-конец эпитопа RSV ковалентно соединяют для получения сконструированного полипептида. Альтернативно, С-конец области поверхностной адсорбции и N-конец эпитопа RSV ковалентно соединяют для получения сконструированного полипептида. Отдельные фрагменты могут быть синтезированы твердофазными методами и получены в виде полностью защищенных, полностью незащищенных или частично защищенных сегментов. Эти сегменты могут быть ковалентно соединены в реакции, проходящей в жидкой фазе или твердофазной реакции. Если один полипептидный фрагмент содержит цистеин в виде его N-концевого остатка, а другой полипептидный фрагмент содержит сложный тиоэфир или предшественник сложного тиоэфира на его C-концевом остатке, эти два фрагмента будут соединяться спонтанно в растворе специфичной реакцией, общеизвестной (специалистам в данной области) как нативное лигирование. Нативное лигирование является особенно перспективным вариантом выбора для синтеза сконструированного пептида, поскольку оно может быть выполнено с пептидными фрагментами, с которых полностью снята защита, или частично защищенными пептидными фрагментами в водном растворе и в разбавленных концентрациях.
В одном варианте осуществления эпитопы RSV и/или области поверхностной адсорбции соединяют пептидными или непептидными связями, как описано в патенте США №7723294, включенном в настоящее описание посредством ссылки на содержащиеся в нем сведения по использованию непептидных связей для соединения сегментов полипептидов для использования в многослойных пленках. Подходящие непептидные линкеры включают, например, алкильные линкеры, такие как -NH-(CH2)s-С(O)-, где s=2-20. Алкильные линкеры необязательно замещены пространственно не затрудненными группами, такими как низший алкил (например, C1-С6), низший ацил, галоген (например, Cl, Br), CN, NH2, фенил и подобные. Другой приводимый в качестве примера непептидный линкер представляет собой полиэтиленгликольный линкер, такой как -NH-(CH2-CH2-O)n,-C(O)-, где n является таковым, что этот линкер имеет молекулярную массу от 100 до 5000 Да, в частности от 100 до 500 Да. Многие линкеры, описанные в настоящей заявке, доступны от коммерческих фирм-поставщиков в форме, подходящей для использования в твердофазном пептидном синтезе.
В одном варианте осуществления один или более полипептидных эпитопов из RSV ковалентно присоединен к одному или нескольким полиэлектролитам, таким как полипептид или другой полиэлектролит, посредством ковалентных связей. Примеры подходящих ковалентных связей включают амиды, сложные эфиры, простые эфиры, тиоэфиры и дисульфиды. Специалист в данной области может использовать преимущества ряда функциональных групп, обнаруженных в пределах эпитопного пептида для конструирования связи с подходящим электролитом. Например, карбоновая кислота в эпитопном полипептиде может находиться либо на С-конце, либо на боковой цепи аминокислот аспарагиновой кислоты или глутаминовой кислоты. Карбоновые кислоты могут быть активированы подходящими пептидными связующими реагентами, такими как 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC), для взаимодействия с первичными или вторичными аминами, которые находятся в пептидных полиэлектролитах, таких как поли-L-лизин. Полученная в результате амидная связь является стабильной в условиях внешней среды. С другой стороны, кислотные группы в пептидном полиэлектролите могут быть активированы с помощью EDC для взаимодействия с аминными группами в эпитопном пептиде. Подходящие аминные группы могут находиться на N-конце эпитопного пептида или на боковой цепи остатков лизина.
Эпитопные пептиды также могут быть присоединены к полиэлектролитам через дисульфидные связи. Полиэлектролиты, такие как PGA или PLL, могут быть химически модифицированы таким образом, чтобы фракция их боковых частей содержала сульфгидрильные группы. В присутствии подходящего окислителя эти сульфгидрилы будут вступать в реакцию с сульфгидрильной группой остатка цистеина, содержащегося в эпитопном пептиде. Цистеин может представлять собой либо нативный цистеин из белковой последовательности патогена, такого как RSV, либо он может представлять собой ненативный цистеин, который был намеренно встроен в эпитоп во время пептидного синтеза. Подходящие окислители включают DTNB, 2,2’-дитиопиридин, перекись водорода, цистеин и окисленный глутатион. Присоединение эпитопных пептидов к полиэлектролитам через дисульфидные связи является особенно удобным. Дисульфиды являются стабильными в обычных условиях производства пленок и хранения, но легко расщепляются восстанавливающими агентами, в естественных условиях находящимися в клетках, которые освобождают эпитопный пептид для иммунологического процессинга.
Эпитопные пептиды также могут быть присоединены к полиэлектролитам посредством тиоэфирных связей. Синтетические эпитопные пептиды могут быть синтезированы с соответствующими электрофилами, такими как галоацетильные группы, которые специфически взаимодействуют с сульфгидрилами. Например, эпитопный пептид, содержащий хлорацетил на своем N-конце, будет образовывать стабильную связь с полиэлектролитами, несущими сульфгидрил, такими как PGA-SH, описанная выше.
Эпитопные пептиды также могут быть присоединены ковалентно к полиэлектролитам через бифункциональные линкерные молекулы. Бифункциональные линкеры обычно содержат две электрофильные группы, которые могут вступать в реакцию с нуклеофилами, находящимися либо на эпитопном пептиде, либо на молекуле полиэлектролита. В продаже имеется два класса линкерных молекул, гомобифункциональные линкеры и гетеробифункциональные линкеры. Гомобифункциональные линкеры содержат две копии электрофильных групп, соединенных нереакционноспособным спейсером. Зачастую электрофилы представляют собой активные сложные эфиры, такие как N-гидроксисукцинимидные (NHS) сложные эфиры или сульфо-N-гидроксисукцинимидные сложные эфиры (сульфо NHS), которые вступают в реакцию с нуклеофильными аминами. Примеры гомобифункциональных NHS сложных эфиров включают бис(сульфосукцинимидил)суберат, дисукцинимидилглутарат, дитиобис(сукцинимидил)пропионат, дисукцинимидилсуберат, дисукцинимидилтартрат. Иногда электрофилами являются альдегидные группы, которые образуют имиды с нуклеофильными аминами на эпитопе и молекулах полиэлектролита. Имидные связи являются транзиторно стабильными, но могут быть преобразованы в стабильные структуры восстанавливающими агентами, такими как боргидрид натрия, или каталитическим гидрогенированием. Наиболее часто используемым гомобифункциональным альдегидным линкером является глутаральдегид.
Другие широко используемые гомобифункциональные линкеры, содержащие электрофилы, которые специфически взаимодействуют с нуклеофильными тиолами, которые могут быть использованы для связывания цистеин-содержащих эпитопных пептидов с полиэлектролитами, содержащими сульфгидрил, описаны выше. Примеры специфичных к сульфгидрилам гомобифункциональных линкеров включают 1,4-бисмалеимидобутан, 1,4-бисмалеимидил-2,3-дигидроксибутан, бисмалеимидогексан, бис-малеимидогексан, бис-малеимидоэтан, 1,4-ди-[3’-(2’-пиридилдитио)-пропионамидо]бутан, дитио-бисмалеимидоэтан, 1,6-гексан-бис-винилсульфон.
Представители гетеробифункционального класса поперечно-сшивающих реагентов содержат две группы с различной реакционной способностью, зачастую, но не всегда, электрофилы, которые специфично взаимодействуют с различными функциональными группами в молекулах субстрата. Особенно используемыми являются линкеры, которые содержат одну электрофильную группу, которая специфична в отношении сульфгидрила, и другой электрофил, который специфичен в отношении амина. Примеры этих реагентов включают N-сульфосукцинимидил[4-йодацетил]аминобензоат, N-сукцинимидил [4-йодацетил]аминобензоат, сукцинимидил 3-[бромацетамидо]пропионат, N-сукцинимидилйодацетат, сульфосукцинимидил 4-[N-малеимидометил]циклогексан-1-карбоксилат, сукцинимидил 4-[N-малеимидометил]циклогексан-1-карбоксилат, ([N-е-малеимидокапроилокси]сульфосукцинимидный сложный эфир, м-малеимидобензоил-N-гидроксисульфосукцинимидный сложный эфир, N-сукцинимидил 3-(2-пиридилдитио)-пропионат, сукцинимидил 6-(3-[2-пиридилдитио]-пропионамидо)гексаноат, 4-сукцинимидилоксикарбонил-метил-а-[2-пиридилдитио]толуол.
Разнообразные функциональные группы, которые обычно находятся как в эпитопных полипептидах, так и в полиэлектролитах, или которые легко могут быть помещены в любую из этих молекул, позволяют специалисту выбрать стратегию соединения, которая лучше всего соответствует субстрату, представляющему интерес. Подходящим примером является связывание цистеина, содержащего эпитопный пептид, с PLL.
Полипептидные сегменты могут быть присоединены различными путями, в зависимости от химических свойств непептидного линкера. Например, N-конец первого полипептидного сегмента присоединен к С-концу второго полипептидного сегмента; N-конец первого полипептидного сегмента присоединен к N-концу второго полипептидного сегмента; С-конец первого полипептидного сегмента присоединен к С-концу второго полипептидного сегмента; С-конец первого полипептидного сегмента присоединен к N-концу второго полипептидного сегмента; С-конец или N-конец первого полипептидного сегмента присоединен к концевой боковой цепи второго полипептидного сегмента или С-конец или N-конец второго полипептидного сегмента присоединен к концевой боковой цепи первого полипептидного сегмента. Независимо от точки присоединения, однако, первый и второй сегмента ковалентно присоединены посредством непептидного линкера.
В одном варианте осуществления сконструированный полипептид представляет собой уникальное сочетание ковалентно присоединенных одной или нескольких областей поверхностной адсорбции и одного или нескольких эпитопов RSV. Не существует конкретного ограничения в отношении длины эпитопов RSV, которые могут быть линейными эпитопами или конформационными эпитопами. Эпитопы могут содержать в любом месте примерно от трех аминокислотных остатков до нескольких сотен аминокислотных остатков для сложных конформационных эпитопов.
В одном варианте осуществления сконструированный полипептид содержит один эпитоп RSV и одну область поверхностной адсорбции. В другом варианте осуществления, сконструированный полипептид содержит один эпитоп RSV и две области поверхностной адсорбции, одна присоединена к N-концу эпитопа RSV и одна присоединена к С-концу эпитопа RSV. Назначением области (областей) поверхностной адсорбции является обеспечение адсорбции полипептида на противоположно заряженную поверхность для построения многослойной пленки.
Количество областей поверхностной адсорбции в сконструированном полипептиде относительно количества и/или длины эпитопов RSV связано с требованиями растворимости. Например, если эпитоп RSV представляет собой короткую аминокислотную последовательность, например из трех аминокислотных остатков, только одна область поверхностной адсорбции по меньшей мере из восьми аминокислотных остатков потребуется для адсорбции сконструированного полипептида на походящим образом заряженную поверхность. Если, напротив, эпитоп RSV представляет собой растворимый складчатый структурный домен белка, содержащий, например, 120 аминокислотных остатков, две области поверхностной адсорбции может потребоваться для придания достаточного заряда для сконструированного полипептида, чтобы он был водорастворимым и подходящим для адсорбции. Области поверхностной адсорбции могли быть смежными и располагаться на N-конце домена, смежными и располагаться на С-конце домена или несмежными с одной на N-конце и одной на С-конце. Кроме того, эпитоп RSV может содержать заряженный сегмент (либо отрицательно заряженный, либо положительно заряженный) в пределах нативной последовательности, которая может служить в качестве области поверхностной адсорбции.
Полипептид или антиген могут содержать одну или более различных антигенных детерминант. Антигенная детерминанта может относиться к иммуногенной части разветвленного белка.
Способы и методики для определения расположения и состава антигенной детерминанты или эпитопа для специфического антитела хорошо известны из уровня техники. Эти методики могут быть использованы для идентификации и/или характеристики эпитопов для использования в качестве эпитопов RSV. В одном варианте осуществления способы картирования/характеристики эпитопа для антиген-специфичного антитела могут быть определены посредством «отпечатка подошвы» эпитопа, с использованием химической модификации подвергаемых воздействию аминов/карбоксилов в антигенном белке. Одним примером такой методики «отпечатка подошвы» является использование HXMS (водород-дейтериевый обмен, регистрируемый масс-спектрометрией) где происходит водород-дейтериевый обмен рецептора и протонов амида лигандного белка, связывание и обратный обмен, где амидные группы остова, принимающие участие в связывании белка, защищены от обратного обмена и, следовательно, останутся дейтерированными. Релевантные области могут быть идентифицированы в этой точке пепсиновым протеолизом, разделением на высокочувствительной микроколонке высокоэффективной жидкостной хроматографией и/или масс-спектрометрией с ионизацией электрораспылением.
В другом варианте осуществления методикой идентификации подходящего эпитопа является картирование эпитопа ядерным магнитным резонансом (ЯМР), где обычно сравнивают положение сигналов в двумерных спектрах ЯМР свободного антигена и антигена, образовавшего комплекс с антиген-связывающим пептидом, таким как антитело. Антиген обычно является селективно меченным изотопом 15N так, чтобы только сигналы, соответствующие антигену, а не сигналы от антиген-связывающего белка были видны на ЯМР спектре. Антигенные сигналы, происходящие от аминокислот, вовлеченных во взаимодействие с антиген-связывающим пептидом, обычно будут сдвигать положение в спектре комплекса по сравнению со спектрами свободного антигена, и аминокислоты, вовлеченные в связывание, могут быть идентифицированы этим путем.
В другом варианте осуществления картирование эпитопа/характеристику можно осуществить с помощью пептидного сканирования. В этом подходе готовят серии перекрывающихся пептидов, охватывающих всю длину полипептидной цепи антигена, и тестируют по отдельности на иммуногенность. Титр антител соответствующего пептидного антигена определяют стандартным способом, например твердофазным иммуноферментным анализом. Различные пептиды затем могут быть классифицированы по иммуногенности, обеспечивая эмпирическую основу для выбора конструкции пептида для разработки вакцины.
В другом варианте осуществления, методики расщепления протеазой также могут быть использованы применительно к картированию эпитопа и идентификации. Области/последовательности, релевантные антигенным детерминантам, могут быть определены расщеплением протеазой, например, путем использования трипсина в соотношении примерно 1:50 к антигенному белку в расщеплении в течение ночи (O/N) при 37°С и рН 7-8, с последующим масс-спектрометрическим анализом (MS) для идентификации пептида. Пептиды, защищенные от расщепления трипсином антигенным белком, впоследствии могут быть идентифицированы путем сравнения образцов, подвергавшихся расщеплению трипсином, и образцов, инкубированных с CD38BP, а затем подвергавшихся расщеплению, например, трипсином (тем самым выявляя отпечаток подошвы для связующего). Другие ферменты, такие как химотрипсин, пепсин и т.д., также или альтернативно могут быть использованы в аналогичном способе характеристики эпитопа. Более того, расщепление протеазой может обеспечить быстрый способ определения локализации последовательности потенциальной антигенной детерминанты в пределах известного антигенного белка с использованием известного антитела. В другом варианте осуществления, методики протеазного расщепления также могут быть использованы применительно к картированию эпитопа и идентификации.
В настоящей заявке далее описана иммуногенная композиция, указанная иммуногенная композиция содержит многослойную пленку, содержащую два или более слоев полиэлектролитов, где смежные слои содержат противоположно заряженные полиэлектролиты, где один слой содержит эпитоп RSV. Эта иммуногенная композиция необязательно дополнительно содержит один или более слоев, содержащих сконструированный полипептид.
В одном варианте осуществления иммуногенная композиция содержит множество эпитопов RSV либо на одном и том же, либо на разных полиэлектролитах, например сконструированных полипептидах. Множество антигенных детерминант могут быть из одного и того же либо из разных инфекционных агентов. В одном варианте осуществления, иммуногенная композиция содержит множество уникальных антигенных полиэлектролитов. В другом варианте осуществления иммуногенная композиция содержит множество иммуногенных полиэлектролитов, содержащих многочисленные эпитопы RSV в пределах каждого полиэлектролита. Преимуществом этих иммуногенных композиций является то, что многочисленные антигенные детерминанты или многочисленные конформации одной линейной антигенной детерминанты могут присутствовать в одной синтетической вакцинной частице. Такие композиции с многочисленными антигенными детерминантами потенциально могут продуцировать антитела против многочисленных эпитопов, повышая вероятность того, что по меньшей мере некоторые антитела, продуцированные иммунной системой организма, будут нейтрализовать патоген или специфические антигены-мишени, например, на злокачественных клетках.
Иммуногенность иммуногенной композиции может быть увеличена целым рядом способов. В одном варианте осуществления, многослойная пленка необязательно содержит один или более дополнительных иммуногенных биоактивных молекул. Хотя это не является обязательным, одна или более дополнительных биоактивных молекул обычно будет содержать одну или более дополнительных антигенных детерминант. Подходящие дополнительные иммуногенные биоактивные молекулы включают, например, лекарственное средство, белок, олигонуклеотид, нуклеиновую кислоту, липид, фосфолипид, углевод, полисахарид, липополисахарид, иммуностимулирующую молекулу с низкой молекулярной массой или комбинацию, содержащую одну или более из указанных выше биоактивных молекул. Другие типы дополнительных усилителей иммунитета включают функциональный мембранный фрагмент, мембранную структуру, вирус, патоген, клетку, агрегат клеток, органеллу или комбинацию одной или более из указанных выше биоактивных структур.
В одном варианте осуществления многослойная пленка необязательно содержит одну или более дополнительных биоактивных молекул. Одна или более дополнительных биоактивных молекул может представлять собой лекарственное средство. Альтернативно, иммуногенная композиция находится в форме полой раковины или покрытия, окружающего ядро. Ядро содержит целый ряд различных инкапсулирующих веществ, например одну или более дополнительных биоактивных молекул, включая, например, лекарственное средство. Таким образом, иммуногенные композиции, сконструированные, как описано в настоящем изобретении, также могут быть использованы для комбинированной терапии, например, индуцируя иммунный ответ, и для направленной доставки лекарственного средства. «Ядра» микронного размера подходящего терапевтического вещества в «кристаллической» форме могут быть инкапсулированы иммуногенной композицией, содержащей антигенные полипептиды, и полученные в результате микрокапсулы могли быть использованы для доставки лекарственных средств. Ядро может быть нерастворимым в некоторых условиях, например при высоком рН или низкой температуре, и растворимым в условиях, при которых происходит контролируемое высвобождение. Поверхностный заряд на кристаллах можно определить путем измерения ζ-потенциала (используемого для определения заряда в электростатических единицах на коллоидных частицах в жидкой среде). Скорость, при которой содержимое микрокапсул высвобождается из внутреннего пространства микрокапсулы в окружающую среду, будет зависеть от ряда факторов, в том числе толщины инкапсулирующей оболочки, антигенных полипептидов, используемых в этой оболочке, наличия дисульфидных связей, степени перекрестного сшивания пептидов, температуры, ионной силы и способа, используемого для сборки пептидов. В основном, чем толще капсула, тем дольше время высвобождения.
В другом варианте осуществления дополнительная иммуногенная биомолекула представляет собой последовательность нуклеиновой кислоты, способную направлять синтез желаемого иммуногена в организме-хозяине или препятствовать экспрессии генетической информации из патогена. В первом случае такая последовательность нуклеиновой кислоты встроена, например, в подходящий вектор экспрессии способами, известными специалистам в данной области. Векторы экспрессии, подходящие для получения высокоэффективного переноса генов in vivo включают ретровирусные, аденовирусные и осповирусные векторы. Функциональные элементы таких векторов экспрессии включают по меньшей мере один промотор, по меньшей мере один оператор, по меньшей мере одну лидерную последовательность, по меньшей мере один стоп-кодон и любые другие последовательности ДНК, необходимые или предпочтительные для соответствующей транскрипции и последующей трансляции векторной нуклеиновой кислоты. В частности, предполагается, что такие векторы будут содержать по меньшей мере одну точку начала репликации, распознаваемую организмом-хозяином по меньшей мере наряду с одним селектируемым маркером и по меньшей мере одной промоторной последовательностью, способной инициировать транскрипцию последовательности нуклеиновой кислоты. В последнем случае, многочисленные копии такой последовательности нуклеиновой кислоты будут получены для доставки, например, путем инкапсулирования нуклеиновых кислот в полипептидной многослойной пленке в форме капсулы для внутривенной доставки.
В конструкции рекомбинантного вектора экспрессии дополнительно следует отметить, что многочисленные копии последовательности нуклеиновой кислоты, представляющей интерес, и сопровождающие ее функциональные элементы могут быть встроены в каждый вектор. В таком варианте осуществления организм-хозяин продуцировал бы большие количества желаемого белка на вектор. Число многочисленных копий последовательности нуклеиновой кислоты, которые могут быть встроены в векторы, ограничено только способностью полученного в результате вектора, вследствие его размера, к переносу и репликации и транскрипции в подходящем микроорганизме-хозяине.
Еще в одном варианте осуществления иммуногенная композиция содержит смесь антигенных полиэлектролитов/иммуногенных биоактивных молекул. Они могут быть получены из того же антигена, могут быть разными антигенами из одного и того же инфекционного агента или заболевания или они могут быть из разных инфекционных агентов или заболеваний. Этот комплекс или смесь, следовательно, будут вызывать иммунный ответ на ряд антигенов и, возможно, ряд инфекционных агентов или заболеваний, определенных компонентами антигенного пептида/белка системы доставки.
В одном варианте осуществления многослойная пленка/иммуногенная композиция вызывает ответ иммунной системы на патоген. В одном варианте осуществления вакцинная композиция содержит иммуногенную композицию в сочетании с фармацевтически приемлемым носителем. Таким образом, способ вакцинации от патогенного заболевания включает введение пациенту, нуждающемуся в вакцинации, эффективного количества иммуногенной композиции.
Фармацевтически приемлемые носители включают, но не ограничиваются, крупные, медленно метаболизирующиеся макромолекулы, такие как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, аминокислотные сополимеры, инактивированные вирусные частицы и подобное. Фармацевтически приемлемые соли также могут быть использованы в этой композиции, например минеральные соли, такие как гидрохлориды, гидробромиды, фосфаты или сульфаты, а также соли органических кислот, такие как ацетаты, пропионаты, малонаты или бензоаты. Композиция также может содержать жидкости, такие как вода, физиологический раствор, глицерин и этанол, а также такие вещества, как увлажняющие агенты, эмульгаторы или рН буферные агенты. Липосомы также могут быть использованы в качестве носителей.
Способ индукции иммунного ответа на заболевание или патоген у позвоночного (например, вакцинация) включает введение иммуногенной композиции, содержащей многослойную пленку, содержащую эпитоп RSV. В одном варианте осуществления полиэлектролит, содержащий эпитоп RSV, является самым внешним или подвергающимся воздействию растворителя слоем многослойной пленки. Иммуногенную композицию можно вводить перорально, интраназально, внутривенно, внутримышечно, подкожно, внутрибрюшинно, подъязычно, внутрикожно, пульмонально или чрескожно, либо с повторной дозой, либо без нее. В основном композиции вводят способом, совместимым с дозированным составом, и в таких количествах, которые будут профилактически и/или терапевтически эффективными. Точные количества вводимой иммуногенной композиции зависят от мнения лечащего врача и могут быть индивидуальными для каждого пациента. Специалисту в данной области будет очевидно, что терапевтически эффективное количество иммуногенной композиции будут зависеть, среди прочего, от схемы введения, единичной дозы вводимого антигена, вводят ли эти композиции в сочетании с другими терапевтическими средствами и иммунного статуса и состояния здоровья реципиента. Терапевтически эффективная доза может быть определена медицинским работником исходя из характеристик больного (возраст, масса тела, пол, состояние, осложнения, другие заболевания и т.д.), как хорошо известно в данной области. Более того, поскольку проводятся дополнительные рутинные исследования, более конкретная информация будет появляться в отношении соответствующих уровней доз для лечения различных заболеваний у различных пациентов, и специалист в данной области, принимая во внимание терапевтическую ситуацию, пол и общее состояние здоровья реципиента, сможет установить правильную дозу.
Иммуногенная композиция необязательно содержит адъювант. Адъюванты в основном содержат вещества, которые усиливают иммунный ответ организма-хозяина неспецифическим образом. Выбор адъюванта зависит от вакцинируемого пациента. Предпочтительно, используют фармацевтически приемлемый адъювант. Например, вакцина для человека должна избегать содержания масляных адъювантов или эмульсий углеводородов, в том числе полного и неполного адъюванта Фрейнда. Одним примером адъюванта, подходящего для использования у людей, являются алюмокалиевые квасцы (гель оксида алюминия). Вакцина для животного, однако, может содержать адъюванты, не подходящие для использования у людей.
Предполагается, что иммунный ответ может быть индуцирован через презентацию любого белка или пептида, способного индуцировать такой ответ. В одном варианте осуществления антиген представляет собой основной эпитоп, который вызывает сильный иммунный ответ на конкретный агент инфекционного заболевания, т.е. иммунодоминантный эпитоп. При необходимости, более одного антигена или эпитопа может быть включено в иммуногенную композицию для повышения вероятности иммунного ответа.
В одном варианте осуществления многочисленные пептиды RSV или пептидные эпитопы включены в пленку ELBL. Различные эпитопы могут быть синтезированы или экспрессированы в одной сконструированной пептидной молекуле. Ожидается, что расположение многочисленных эпитопов в одном сконструированном пептиде имеет определенные преимущества. Например, это должно упрощать процесс изготовления путем ELBL и повышать воспроизводимость. Кроме того, расположение многочисленных эпитопов в одном сконструированном пептиде будет фиксировать молярные соотношения различных эпитопов в желаемом соотношении, например 1:1. Альтернативно эпитопы могут быть встроены в отдельные сконструированные пептиды. Сконструированные пептиды встраивают в пленку ELBL во время одной или нескольких стадий наслоения. Изготовление пленок с использованием множества различных сконструированных пептидов также может представлять определенные преимущества. Это должно упростить синтез сконструированного пептида, снижая расходы. Также это должно обеспечить изменение и оптимизацию относительных доз каждого сконструированного пептида в пленке. Если, например, доклинические или клинические биологические данные показывали, что оптимальная вакцина должна содержать пять копий одного эпитопа на каждую копию второго эпитопа (соотношение 5:1), подход к конструированию пептида с отдельным эпитопом облегчил бы производство такой вакцины.
Сконструированные пептиды адсорбируют на поверхности пленок ELBL посредством электростатического притяжения между заряженными областями поверхностной адсорбции сконструированного пептида и противоположно заряженной поверхностью пленки. Эффективность адсорбции будет зависеть в значительной степени от состава области (областей) поверхностной адсорбции. Таким образом, сконструированные пептиды с различными эпитопами, но сходными областями поверхностной адсорбции будут адсорбироваться со сходной эффективностью. Для изготовления пленки с двумя разными сконструированными пептидами, каждый в молярном соотношении 1:1, можно смешать пептиды в этом молярном соотношении и нанести их одновременно на конкретный слой. Альтернативно, можно нанести каждый пептид отдельно на отдельные слои. Молярное соотношение адсорбированных пептидов будет в значительной степени отражать относительные концентрации, при которых они были нанесены, или количество стадий нанесения, во время которых они были встроены.
Количество сконструированных пептидов, включенных в ELBL пленку, можно измерить различными путями. Количественный анализ аминокислот (ААА) особенно хорошо подходит для этой цели. Пленки, содержащие сконструированные пептиды, распадаются до составляющих их аминокислот путем обработки концентрированной соляной кислотой (6 М) и нагревания, обычно при 115°С в течение 15 часов. Количества каждой аминокислоты затем измеряют с помощью хроматографических методик, хорошо известных специалистам в данной области. Аминокислоты, которые встречаются только в одном из сконструированных пептидов в пленке, могут быть использованы в качестве маркерных элементов для этого пептида. В тех случаях, когда сконструированные пептиды лишены уникальных аминокислот, неприродные аминокислоты (например, аминомасляная кислота или гомовалин) могут быть включены в сконструированные пептиды во время синтеза. Эти маркерные аминокислоты легко идентифицируются во время ААА эксперимента и могут быть использованы для определения количества пептида в пленке.
В контексте настоящего изобретения специфический Т-клеточный ответ представляет собой ответ, который является специфическим в отношении эпитопа, представляющего интерес, в частности эпитопа RSV, такого как эпитоп RSV-M2, описанный в настоящей заявке. Специфический Т-клеточный ответ может представлять собой либо цитотоксический Т-клеточный ответ, либо ответ Т-клеток хелперов, но который предпочтительно является цитотоксическим Т-клеточным ответом.
В контексте настоящего изобретения специфический антительный ответ представляет собой ответ, который является специфичным в отношении эпитопа, представляющего интерес, в частности эпитопа RSV, такого как эпитоп RSV-G, описанный в настоящей заявке.
В контексте настоящего изобретения «слой» означает наращивание толщины, например, на матрице для образования пленки, после стадии адсорбции. «Мультислой» означает множественные (т.е. два или более) наращивания толщины. «Полиэлектролитная многослойная пленка» представляет собой пленку, содержащую одно или более наращиваний толщины полиэлектролитов. После нанесения слои многослойной пленки могут не оставаться в виде дискретных слоев. В действительности, возможно, что существует значительное смешивание групп, в частности на границах раздела наращиваний толщины. Смешивание или его отсутствие можно отслеживать с помощью аналитических методик, например измерений ζ потенциала, рентгеновской фотоэлектронной спектроскопии и вторичной ионной масс-спектрометрии времени пролета.
«Аминокислота» означает структурный элемент полипептида. В контексте настоящего изобретения «аминокислота» включает 20 основных природных L-аминокислот, все другие природные аминокислоты, все неприродные аминокислоты и все миметики аминокислот, например пептоиды.
«Природные аминокислоты» означают глицин плюс 20 основных природных L-аминокислот, то есть аланин, валин, лейцин, изолейцин, серин, треонин, цистеин, метионин, аспарагиновую кислоту, аспарагин, глутаминовую кислоту, глутамин, аргинин, лизин, гистидин, фенилаланин, орнитин, тирозин, триптофан и пролин. «Неприродная аминокислота» означает аминокислоту, отличную от любой из 20 основных природных L-аминокислот. Неприродная аминокислота может иметь либо L-, либо D-стереохимию.
«Пептоид», или N-замещенный глицин, означает аналог соответствующего аминокислотного мономера с такой же боковой цепью, как в соответствующей аминокислоте, но с боковой цепью, присоединенной к атому азота аминогруппы, а не к α-углеродам этого остатка. Следовательно, химические связи между мономерами в полипептоиде не являются пептидными связями, которые могут быть использованы для ограничения протеолитического расщепления.
«Аминокислотная последовательность» и «последовательность» означает непрерывную длину полипептидной цепи, которая по меньшей мере составляет в длину два аминокислотных остатка.
«Остаток» означает аминокислоту в полимере или олигомере; это остаток аминокислотного мономера, из которого образуется полимер. Полипептидный синтез включает дегидрирование, то есть одна молекула воды «теряется» при добавлении аминокислоты к полипептидной цепи.
В контексте настоящего изобретения «пептид» и «полипептид» относятся к ряду аминокислот, соединенных одна с другой пептидными связями между альфа-амино и альфа-карбокси группами смежных аминокислот, и может содержать модификации, такие как гликозилирование, окисление боковой цепи или фосфорилирование, или быть свободным от них, при условии, что такие модификации или их отсутствие не разрушают иммуногенность. В контексте настоящего изобретения подразумевается, что термин «пептид» относится как к пептиду, так и к полипептиду или белку.
«Сконструированный полипептид» означает полипептид, который имеет достаточный заряд для стабильного связывания с противоположно заряженной поверхностью, то есть, полипептид, который может быть нанесен на слой многослойной пленки, где движущая сила для образования пленки является электростатической. В некоторых вариантах осуществления сконструированный полипептид составляет в длину по меньшей мере 15 аминокислот и величина суммарного заряда на остаток в полипептиде больше или равна 0,1, 0,2, 0,3, 0,4 или 0,5 при рН 7,0. В одном варианте осуществления соотношение количества заряженных остатков одинаковой полярности минус количество остатков противоположной полярности к общему количеству остатков в полипептиде больше или равно 0,5 при рН 7,0. Другими словами, величина суммарного заряда на остаток в полипептиде больше или равна 0,5. Хотя не существует абсолютного верхнего предела длины полипептида, в основном, сконструированные полипептиды, подходящие для нанесения путем ELBL, имеют практический верхний предел длины 1000 остатков. Сконструированные полипептиды могут включать последовательности, имеющиеся в природе, такие как эпитопы RSV, а также области, которые обеспечивают функциональную активность пептидов, например, заряженные области также называются в настоящей заявке областями поверхностной адсорбции, которые дают возможность наносить сконструированные полипептиды на полипептидную многослойную пленку.
«Первичная структура» означает непрерывную линейную последовательность аминокислот в полипептидной цепи, а «вторичная структура» означает более или менее правильные типы структуры в полипептидной цепи, стабилизированные нековалентными взаимодействиями, обычно водородными связями. Примеры вторичной структуры включают α-спираль, β-слой и β-виток.
«Полипептидная многослойная пленка» означает пленку, содержащую один или более сконструированных полипептидов, как определено выше. Например, полипептидная многослойная пленка содержит первый слой, содержащий сконструированный полипептид, и второй слой, содержащий полиэлектролит, имеющий суммарный заряд противоположной полярности по отношению к сконструированному полипептиду. Например, если первый слой имеет суммарный положительный заряд, второй слой имеет суммарный отрицательный заряд; и если первый слой имеет суммарный отрицательный заряд, второй слой имеет суммарный положительный заряд. Второй слой содержит другой сконструированный полипептид или другой полиэлектролит.
«Субстрат» означает твердое вещество с подходящей поверхностью для адсорбции полиэлектролитов из водного раствора. Поверхность субстрата может иметь, по существу, любую поверхность, например плоскую, сферическую, форму стержня и т.д. Поверхность субстрата может быть правильной или неправильной. Субстрат может представлять собой кристалл. Субстрат может представлять собой биологически активную молекулу. Субстраты классифицируются по размеру от наномерных до макромерных. Более того, субстрат необязательно содержит несколько небольших субчастиц. Субстрат может быть изготовлен из органического материала, неорганического материала, биоактивного материала или их сочетания. Неограничивающие примеры субстратов включают кремнийсодержащие подложки; заряженные коллоидные частицы, например микрочастицы СаСО3 или меламиноформальдегидной смолы; биологические клетки, такие как эритроциты, гепатоциты, бактериальные клетки или клетки дрожжей; органические полимерные каркасы, например каркасные структуры сополимеров полистирола или стирола; липосомы; органеллы и вирусы. В одном варианте осуществления субстрат представляет собой медицинское устройство, такое как искусственный водитель ритма, кохлеарный имплантат или стент.
В тех случаях, когда субстрат распадается или иным образом удаляется во время или после формирования пленки, его называют «матрицей» (для образования пленки). Частицы матрицы могут быть растворены в соответствующих растворителях или удалены термической обработкой. Например, в тех случаях, когда используют частично перекрестно сшитые меламинформальдегидные матричные частицы, матрица может распадаться под действием мягких химических способов, например в DMSO, или путем изменения значения рН. После растворения частиц матрицы остаются полые многослойные раковины, которые состоят из чередующихся полиэлектролитных слоев.
«Капсула» представляет собой полиэлектролитную пленку в форме полой раковины или покрытия, окружающего ядро. Ядро содержит целый ряд различных инкапсулятов, например белок, лекарственное средство или их сочетание. Капсулы с диаметрами примерно менее 1 мкм называются нанокапсулами. Капсулы с диаметром примерно более 1 мкм называются микрокапсулами.
«Перекрестное сшивание» означает образование ковалентной связи или нескольких связей или многих связей между двумя или более молекулами.
«Биологически активная молекула» означает молекулу, макромолекулу или совокупность макромолекул, обладающих биологическим действием. Специфическое биологическое действие может быть измерено в подходящем анализе и нормировано на единицу массы или на молекулу биологически активной молекулы. Биологически активная молекула может быть инкапсулирована, удерживаться в основе или быть инкапсулирована в пределах полиэлектролитной пленки. Неограничивающими примерами биологически активной молекулы являются: лекарственное средство, кристаллическая форма лекарственного средства, белок, функциональный фрагмент белка, комплекс белков, липопротеин, олигопептид, олигонуклеотид, нуклеиновая кислота, рибосома, активный терапевтический агент, фосфолипид, полисахарид, липополисахарид. В контексте настоящего изобретения «биологически активная молекула» дополнительно охватывает биологически активные структуры, например, такие как функциональный мембранный фрагмент, мембранная структура, вирус, патоген, клетка, агрегат клеток и органелла. Примерами белка, который может быть инкапсулирован или удерживается в основе полипептидной пленки, являются: гемоглобин; ферменты, например, такие как глюкозоксидаза, уреаза, лизоцим и подобные; белки внеклеточного матрикса, например фибронектин, ламинин, витронектин и коллаген; и антитело. Примерами клетки, которая может быть инкапсулирована или удерживаться в основе полиэлектролитной пленки, являются трансплантированные островковые клетки, эукариотические клетки, бактериальные клетки, клетки растений и клетки дрожжей.
«Биосовместимый» означает не вызывающий значительного неблагоприятного воздействия на здоровье при применении внутрь, наружном нанесении, чрескожном введении, подкожной инъекции, внутримышечной инъекции, ингаляции, имплантации или внутривенной инъекции. Например, биосовместимые пленки включают те, которые не вызывают значительной иммунной реакции при контакте с иммунной системой, например иммунной системой человека.
«Иммунный ответ» означает ответ клеточной или гуморальной иммунной системы на присутствие вещества в любом месте организма. Иммунный ответ может быть охарактеризован различными путями, например повышением в кровотоке числа антител, которые распознают определенный антиген. Антитела представляют собой белки, секретируемые В-клетками, а иммуноген представляет собой структуру, которая вызывает иммунный ответ. Организм человека борется с инфекцией и ингибирует повторное инфицирование путем повышения количества антител в кровотоке и в других местах.
«Антиген» означает чужеродное вещество, которое вызывает иммунный ответ (например, продукцию специфичных молекул антител) при введении в ткани восприимчивого организма позвоночного. Антиген содержит один или несколько эпитопов. Антиген может представлять собой чистое вещество, смесь веществ (в том числе клетки или фрагменты клеток). Термин «антиген» включает подходящую антигенную детерминанту, аутоантиген, собственный антиген, перекрестно реагирующий антиген, аллоантиген, толероген, аллерген, гаптен и иммуноген или их части и их сочетания и эти термины используют взаимозаменяемо. Антигены в основном имеют высокую молекулярную массу и в большинстве случаев являются полипептидами. Антигены, которые вызывают иммунные реакции, называют сильно иммуногенными. Участок на антигене, с которым может специфически связываться комплементарное антитело, называют эпитопом или антигенной детерминантой.
«Антигенный» относится к способности композиции вызывать образование антител, специфичных к этой композиции или вызывать опосредованный клетками иммунный ответ.
В контексте настоящего изобретения термины «эпитоп» и «антигенная детерминанта» используют взаимозаменяемо, и они означают структуру или последовательность антигена, например белка или сконструированного пептида, распознаваемую антителом. Обычно эпитоп будет находиться на поверхности белка. «Эпитоп непрерывного типа» представляет собой эпитоп, который включает в себя несколько смежных аминокислотных остатков, не тот, который включает в себя аминокислотные остатки, которые случайно оказываются в контакте или в ограниченной области пространства в уложенном белке. «Конформационный эпитоп» включает в себя аминокислотные остатки из различных частей линейной последовательности белка, которые приходят в контакт в трехмерной структуре белка. Для того чтобы между антигеном и антителом имело место эффективное взаимодействие, эпитоп должен быть легко доступен для связывания. Таким образом, эпитоп или антигенные детерминанты находятся в собственном антигенном клеточном окружении или только подвергаются воздействию при денатурации. В своей природной форме они могут быть цитоплазматическими (растворимыми), мембраносвязанными или секретируемыми. Количество, расположение и размер эпитопов будет зависеть от того, сколько антигенов презентировано во время процесса образования антител.
В контексте настоящего изобретения «вакцинная композиция» представляет собой композицию, которая индуцирует иммунный ответ у млекопитающего, которому введена эта композиция, и которая защищает иммунизированный организм от последующего заражения иммунизирующим агентом или иммунологически перекрестно реагирующим агентом. Защита может быть полной или частичной в отношении снижения симптомов или инфицирования по сравнению с невакцинированным организмом. Иммунологически перекрестно реагирующим агентом может быть, например, целый белок (например, глюкозилтрансфераза), из которого был получен субъединичный пептид для использования в качестве иммуногена. Альтернативно, иммунологически перекрестно реагирующий агент может быть другим белком, который распознается целиком или частично антителами, индуцированными иммунизирующим агентом.
В контексте настоящего изобретения «иммуногенная композиция» охватывает композицию, которая индуцирует иммунный ответ в организме, которому она введена, и которая может защищать или не защищать иммунизированное млекопитающее от последующего заражения иммунизирующим агентом. В одном варианте осуществления, иммуногенная композиция представляет собой вакцинную композицию. Настоящее изобретение далее будет проиллюстрировано следующими неограничивающими примерами.
ПРИМЕРЫ
Пример 1: Синтез сконструированных полипептидов (DP)
Сконструированные полипептиды были получены из эпитопов, находящихся в последовательностях белков RSV-G, RSV-F или RSV-M2. Аминокислотные последовательности полноразмерных белков представляют собой следующее (выбранные пептидные эпитопы, встроенные в сконструированные полипептиды, подчеркнуты).


Сконструированные пептиды были синтезированы путем ступенчатого твердофазного синтеза пептидов использованием Liberty ТМ (СЕМ, Matthews, NC) автоматизированного синтезатора с микроволновым регулятором температуры. Пептиды были синтезированы либо на Rink Amide, либо на кислую полистироловую смолу Ванга с использованием стандартных Fmoc аминокислот, HBTU/DIEA активации и обычного двойного связывания. После синтеза смолы сушили и пептиды расщепляли путем обработки с использованием TFA/триизопропилсилана/фенола/3,6-диоксо-1,8-октандитиола/воды (86:4:4:3:3) в течение двух часов. Неочищенные пептиды осаждали эфиром, центрифугировали и сушили под вакуумом. Пептиды очищали с помощью C18 ВЭЖХ с обращенной фазой, используя градиент воды (0,1% трифторуксусной кислоты)/ацетонитрила. Подлинность каждого очищенного пептида подтверждали масс-спектрометрией с электрораспылением (ESMS). Окончательный выход рассчитывали по УФ-поглощению при 280 нм и/или аминокислотным анализом. Пептиды были поделены на аликвоты, лиофилизированы и хранились в виде трифторацетатных солей при температуре -20°С до использования.
В Таблице 1 показаны выбранные эпитопы из белков RSV-G, RSV-F и RSV-M2. Каждый эпитоп был включен в сконструированный пептид (DP) путем добавления C-концевого полиионного хвоста, такого как Lys20 (K20) или Lys-Val-Lys-Ala повтора (KVKA)4. C-концевой тирозин, как правило, был включен в целях облегчения количественного анализа с помощью УФ. Нативная последовательность RSV-M2 содержит цистеин в положении 96. В синтетических эпитопных пептидах этот остаток был заменен на серин (C96S) для того, чтобы избежать нежелательных дисульфидных связей в этом положении.
|
|
Пример 2: Укладка и структурная конформация сконструированных полипептидов, которые содержат конформационный эпитоп из белка RSV-G
Белок прикрепления RSV (RSV-G белок) содержит четыре консервативных остатка цистеина, которые образуют две внутренние дисульфидные связи, расположенные в пределах аминокислот 169-191. Антитела, которые распознают эту область, могут нейтрализовать RSV так, чтобы конформационно-ограниченные синтетические пептиды, полученные из этого сегмента, могли бы быть эффективными компонентами вакцины. Предыдущие исследователи использовали сочетание протеолитического расщепления, ВЭЖХ и масс-спектрометрии, чтобы показать, что Cys173 связывается с Cys186 и что Cys176 связывается с Cys182. Пептиды, содержащие остатки 169-191 белка RSV-G, были синтезированы твердофазным пептидным синтезом. При нейтральном рН эти белки легко окисляются и полученные в результате продукты, по-видимому, содержат два внутренних дисульфида, как определено потерей четырех протонов в спектре ESMS, а также отрицательным сигналом в исследовании Эллмана (DTNB). Легкость, с которой проходят реакции окисления, и точность превращений убедительно иллюстрируют, что образуются нативные дисульфиды. В характерном эксперименте восстановленные пептиды RSV-G (например, SEQ ID NO:8, 11, 13, 14, 15) растворяют при концентрации 1-5 мг/мл в Трис-буфере с рН 7,4, содержащем 2,5 мМ глутатиона и 2,5 мМ глутатиола. Реакцию сворачивания контролируют с помощью C18 ВЭЖХ с обращенной фазой, поскольку окисленный продукт показывает сдвиг к несколько более короткому времени удерживания по сравнению с восстановленным белком. По этому критерию реакцию сворачивания считают завершенной после 2 часов при комнатной температуре или после 18 часов при 4°С.
Образец свернутого ACT-2044 (RSV-G164-191K21Y амид) (SEQ ID NO:8) был проанализирован с помощью масс-спектрометрии ионного циклотронного резонанса с Фурье-преобразованием с электрораспылением (FT-ICR MS). Заряженное состояние МН6+6 дало сильный сигнал, и расширенный спектр МН6+6 пиков показан на Фигуре 1. Моноизотопный пик при массе к заряду (m/z) 1015,6008 соответствует моноизотопной массе 6087,56 а.е.м., которая очень близка к расчетной моноизотопной массе 6088,51 а.е.м., и этот результат полностью согласуется с наличием двух дисульфидных связей в АСТ-2044. Точно так же образец свернутого ACT-2086 (RSV-M281-98G164-191K20Y амида (SEQ ID NO:13) был проанализирован с помощью FT-ICR MS и спектр показан на Фигуре 2. Сильные пики наблюдались для заряженных состояний МН6+6 - МН10+10. МН9+9 моноизотопный пик имел m/z 867,1571, соответствующий моноизотопной массе 7795,344 а.е.м., которая очень близка к расчетной моноизотопной массе 7795,33 а.е.м. Этот результат снова полностью согласуется с наличием двух дисульфидных связей.
Образец ACT-2044 (RSV-G164-191K21Y) (SEQ ID NO:8) подвергали расщеплению термолизином. ВЭЖХ анализ продукта расщепления показал полный расход исходного белка. FT-ICR спектр этого продукта содержал сложную смесь продуктов, но доминирующий ион был обнаружен при m/z 1106,4. Эти продукты реакции соответствуют заряженному состоянию MH+1 для внутримолекулярных связанных дисульфидами RSV-G175-184 (цикло-ICSNNPTCWA (SEQ ID NO:10), ожидаемая MH+ масса=1106,440, найденная=1106,438). Этот пептид является отличительным для нативной дисульфидной связи между Cys176 и Cys182. Таким образом, данные FT-ICR MS всецело поддерживают утверждение, что АСТ-2044 (и близкородственные белки ACT-2042 (SEQ ID NO:11), ACT-2086 (SEQ ID NO:13), ACT-2087 (SEQ ID NO:14), ACT-2088 (SEQ ID NO:15)) содержат две внутренние дисульфидные связи в соответствующем (нативном) образце.
Пример 3: Общая методика изготовления ELBL наночастиц
Наночастицы СаСО3 (NPCC-111) получали от NanoMaterials Technology (Singapore). Эксперименты, проведенные с помощью сканирующей электронной микроскопии (SEM), показали, что частицы имеют кубическую морфологию и в диаметре составляют приблизительно 50 нм. Полипептиды поли-l-лизин 15 кДа (PLL, № по каталогу Р6516), поли-l-глутаминовую кислоту 14,5 кДа (PGA, № по каталогу Р4636) и 1 М буферный раствор HEPES (№ по каталогу Н-3662) получали от Sigma-Aldrich (USA). Противоположно заряженные полипептиды оставляли для самосборки в многослойную пленку на ядрах наночастиц СаСО3 в следующих одна за другой стадиях адсорбции. Вкратце, PLL, PGA или сконструированный полипептид (DP, где указано) растворяли до концентрации 1 мг/мл (масса/объем) в 10 мМ HEPES, рН 7,4, и фильтровали через фильтр 0,22 мкм. Ядра наночастиц СаСО3 промывали три раза свободной от эндотоксина водой и центрифугировали при 16000 g в течение 1 минуты в микроцентрифуге. Наночастицы ресуспендировали до 6% (масса/объем) в 1 мг/мл PGA в качестве первого слоя. При нейтральном рН PGA демонстрирует суммарный отрицательный заряд, тогда как суммарный заряд частиц СаСО3 является положительным, таким образом, обеспечивая электростатическое взаимодействие и успешное нанесение первого слоя. Смесь подвергали воздействию ультразвука в течение 10 минут при комнатной температуре, затем промывали дважды 10 мМ буфером HEPES и центрифугировали при 48700×g в течение 1 минуты (TL-100 Ultracentrifuge, Beckman). Для нанесения второго слоя наночастицы ресуспендировали до 6% (мас./об.) в 1 мг/мл PLL (положительный заряд) и подвергали воздействию ультразвука в течение 10 минут при комнатной температуре также как и в случае первого слоя. Каждый последующий слой наносили таким же способом, используя PGA, PLL или DP, как указано в Таблице 2 или в Таблице 3. Обычно сконструированные пептиды наносили в концентрации 0,5-1,0 мг/мл. После нанесения конечного слоя наночастицы промывали дважды с использованием 10 мМ HEPES, рН 7 4 и аликвоты осаждали центрифугированием, аспирировали и хранили в виде сырых гранул при 4°С до использования. Несколько конструкций было получено с использованием в основном одной и той же методики и изменением последовательности и расположения сконструированного пептида; все наночастицы содержат всего восемь слоев в полипептидной биопленке. Конструкции наночастиц суммированы в Таблице 2. Концентрацию полипептида или DP на наночастицах определяли анализом аминокислот. Размер наночастиц определяли с помощью динамического рассеяния света (Malvern Nano S-90) 0,06% (мас./об.) суспензий в HEPES, рН 7,4, подвергали воздействию ультразвука в течение 20 минут в ультразвуковой водяной бане (Branson 1510, USA) до измерения. Уровни эндотоксина в наночастицах определяли анализом лизата амебоцитов мечехвоста, хромогенного анализа конечной точки (#50-647U, Lonza, Walkersville, MD). Полученные наночастицы хранили в виде сырых гранул ри 4°С до готовности к использованию.
|
Пример 4: Изготовление и характеристика ELBL наночастицы ACT-1077
Стандартная методика, описанная в Примере 3, представляла собой следующее. 1,0 мг/мл раствора сконструированного пептида ACT-2031 (RSV-M281-98(KVKA)4 (SEQ ID NO:12)) использовали во время второй стадии нанесения покрытия путем ELBL, и 1,0 мг/мл раствора сконструированного пептида АСТ-2044 (RSV-G164-191K21Y (SEQ ID NO:8)) использовали во время восьмой стадии ELBL. После каждой стадии наслоения наночастицы промывали и ресуспендировали до 6%. Аликвоту 10 мкл удаляли и разбавляли в 1,0 мл 10 мМ буфера HEPES для анализа поверхностного (зета) потенциала. На Фигуре 3 показаны поверхностные зета потенциалы, измеренные для наночастиц в каждой стадии ELBL процесса. Перед нанесением покрытия частицы СаСО3 демонстрировали положительный поверхностный потенциал примерно +28 мВ. После нанесения одного слоя PGA был измерен отрицательный поверхностный потенциал -18 мВ. Нанесение ACT-2031 (SEQ ID NO:12) на втором слое увеличивало зета потенциал примерно до 0 мВ, указывая на адсорбцию пептида. В дальнейшем каждая стадия наслоения вызывала отрицательный или положительный сдвиг в зета потенциале, указывая на успешную ELBL адсорбцию. После изготовления количество каждого адсорбированного сконструированного пептида вычисляли по сигналу от уникальных аминокислот в аминокислотной хроматограмме. Глицин является уникальным для АСТ-2031 и может быть использован для определения концентрации АСТ-2031, тогда как аргинин, гистидин и фенилаланин являются уникальными для ACT-2044 и могут быть использованы для определения концентрации ACT-2044. Из четырех отдельных партий средние количества ACT-2031 и ACT-2044, адсорбированные на 1% суспензии частиц СаСО3, составляли 21 мкг/мл и 53 мкг/мл соответственно.
Пример 5: Изготовление ELBL наночастицы ACT-1086
Методику нанесения покрытия ELBL, описанную в Примере 3, использовали для нанесения 50 нм наночастиц СаСО3 с семью слоями PGA и PLL. 0,5 мг/мл раствора сконструированного пептида ACT-2086 (SEQ ID NO:13; RSV-M281-98G164-191K20Y амид) в 10 мМ буфере HEPES использовали для нанесения конечного слоя. Количество адсорбированного сконструированного пептида измеряли аминокислотным анализом. Из трех отдельных партий среднее количество АСТ-2086, адсорбированного на 1% суспензии частиц СаСО3, составило 37 мкг/мл.
Пример 6: Изготовление ELBL наночастиц ACT-1139
ELBL методику нанесения покрытий, описанную в Примере 3, использовали для покрытия 50 нм наночастиц СаСО3 семью слоями PGA и PLL. 10 мМ раствор HEPES сконструированных пептидов ACT-2033 (SEQ ID NO:16; RSV M281-98 K20Y амид) и ACT-2044 (SEQ ID NO:8; RSV-G161-191 K21Y амид) каждый в конечной концентрации 0,25 мг/мл использовали для нанесения конечного слоя. Наночастицы промывали, осаждали и хранили в виде сырых гранул при 4°С. Количества каждого адсорбированного сконструированного пептида вычисляли по сигналу от уникальных аминокислот в аминокислотной хроматограмме. Глицин является уникальным для АСТ-2033 и может быть использован для определения концентрации АСТ-2033, тогда как аргинин, гистидин и фенилаланин являются уникальными для АСТ-2044 и могут быть использованы для определения концентрации ACT-2044. По результатам этого анализа определили, что 1% суспензия частиц содержала 25 мкг/мл АСТ-2033 и 24 мкг/мл ACT-2044.
Пример 7: Изготовление путем ELBL микрочастиц АСТ-1145
Микрочастицы Mesoporous 3 μm СаСО3 получали от PlasmaChem GmbH (Berlin, № по каталогу PL-CA3). Частицы суспендировали до 6% (масса/объем) в 10 мМ HEPES. Методику нанесения покрытия ELBL, описанную для наночастиц СаСО3 в Примере 3, использовали со следующими модификациями. Наночастицы СаСО3 3 мкм без труда оседали в условиях нормальной гравитации в водной суспензии, поэтому вместо обработки ультразвуком во время стадий нанесения слоев суспензии осторожно перемешивали на роторной установке в течение 10 минут. Также более медленные скорости центрифугирования могут быть использованы для гранулирования микрочастиц на последующих стадиях нанесения слоев и стадиях промывания. Таким образом, суспензии микрочастиц подвергали центрифугированию при 1500 g в течение 1 минуты. Для изготовления ACT-1145 использовали 1,0 мг/мл раствор PGA для нанесения первого слоя и 1,0 мг/мл слой PLL, меченный флуоресцеином (PLL-FITC, Sigma № по каталогу Р3543), использовали для второго слоя. PGA и PLL использовали для следующих пяти стадий нанесения слоев для покрытия микрочастиц суммарно семью полипептидными слоями (эти частицы могут быть использованы в эксперименте амидного поперечного связывания, описанного в Примере 8). Раствор 0,5 мг/мл ACT-2086 (SEQ ID NO:13; RSV-M281-98G164-191K20Y амид) использовали для нанесения конечного слоя. Микрочастицы промывали, центрифугировали и хранили в виде сырых гранул при 4°С. Количество АСТ-2086, адсорбированного на частицах, вычисляли с помощью анализа аминокислот, и было установлено, что оно составляет 43 мкг/мл для 1% суспензии частиц. Частицы изучали с помощью флуоресцентной микроскопии, было обнаружено, что они являются сферическими с диаметрами 3,0 (+/-1,5) мкм. Частицы представляли собой хорошо диспергированные одиночные частицы с несколькими агрегатами из двух или трех частиц.
Пример 8: Изготовление ELBL микрочастиц АСТ-1146
Методику Примера 7 использовали для изготовления 3 мкм микрочастиц СаСО3 с семью полипептидными слоями (PGA/PLL-FITC/PGA/PLL/PGA/PLL/PGA). Готовили свежие растворы 0,2 М фосфатно-натриевого буфера рН 6,5, содержащего 38 мг/мл (0,20 М) 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC, Sigma № по каталогу Е6383) и 11 мг/мл (0,05 М) N-гидроксисульфосукцинимид натриевой соли (сульфо-NHS, Sigma № по каталогу 56485). Семислойные микрочастицы суспендировали в растворе EDC/сульфо-NHS до 3% суспензии. Суспензию осторожно перемешивали в течение 30 минут при комнатной температуре, затем частицы центрифугировали и промывали три раза 10 мМ буфером HEPES. 0,5 мг/мл раствор ACT-2086 (SEQ ID NO:13; RSV-M281-98G164-191 K20Y амид) использовали для нанесения конечного слоя. Микрочастицы промывали, центрифугировали и хранили в виде сырых гранул при 4°С. Количество ACT-2086, адсорбированного на частицах, вычисляли с помощью анализа аминокислот, и было обнаружено, что оно составляет 49 мкг/мл для 1% суспензии частиц.
Пример 9: Изготовление ELBL микрокапсулы АСТ-1147
Микрочастицы СаСО3 АСТ-1146 из Примера 8 суспендировали до 6% (масса/объем) в растворе 0,5 М EDTA натрия, рН 8,0. Частицы осторожно перемешивали при комнатной температуре в течение 30 минут, центрифугировали в течение 3 минут при 1500 g и раствор EDTA аспирировали. Полученные в результате микрокапсулы дважды ресуспендировали в 10 мМ буфере HEPES и центрифугировали в течение 3 минут при 1500 g для удаления избытка солей. Микрокапсулы центрифугировавли, аспирировали и хранили в виде сырых гранул при 4°С. Количество ACT-2086, адсорбированного на капсулах, вычисляли с помощью анализа аминокислот, и было обнаружено, что оно составляет 41 мкг/мл для 1% суспензии частиц. Капсулы изучали посредством флуоресцентной микроскопии, и было обнаружено, что они являются сферическими с диаметрами 3,0 (+/-1,5) мкм. Капсулы представляли собой хорошо диспергированные одиночные капсулы с небольшим числом агрегатов из двух или трех капсул.
Пример 10: Иммуногенность RSV-G моновалентных наночастиц
Мышей BALB/c иммунизировали три раза наночастицами ACT-1042 (DP SEQ ID NO:8; RSV-G164-191) посредством инъекции в подушечки лап и образцы сыворотки собирали и тестировали посредством ELISA. Образцы сыворотки распознавали конформационный RSV-G СХ3С эпитопный пептид АСТ-1042 (Фигура 4), но не вариант того же пептида (АСТ-2054), который был линеаризован путем кэппирования остатков цистеина (Фигура 5). Образцы сыворотки также распознавали нативный белок RSV-G (Фигура 6), давая возможность предположить, что иммунизация наночастицами RSV-G ELBL вызывала конформационно-зависимые антительные ответы. Биологическая активность антительного ответа, индуцированного под действием ACT-1042, была подтверждена в исследованиях, измеряющих ингибирование RSV-G СХ3С хемокинового связывания (Фигура 7) и ингибирование миграции РВМС человека к очищенному RSV-G (Фигура 8). Таким образом, конструкция новой вакцины на основе наночастиц, которая включает сконструированный пептид на основе конформационно ограниченного RSV-G СХ3С эпитопа, может вызывать биологически релевантные антительные ответы.
Пример 11: Иммуногенность моновалентных наночастиц RSV-M2
Мышей BALB/c иммунизировали наночастицами ACT-1023 (RSV-M281-98) (DP SEQ ID NO:12) путем s.c. (подкожного), i.p. (внутрибрюшинного), i.n. (интраназального) введения или в подушечки лап. Мышей положительного контроля иммунизировали подкожно пептидом ACT-2019 (RSV-M281-95; SEQ ID NO:7) в полном адъюванте Фрейнда (CFA) и повторно иммунизировали АСТ-2019 в неполном адъюванте Фрейнда (IFA); неиммунизированные мыши служили в качестве отрицательного контроля. Т-клеточные ответы в селезенках измеряли в анализах IL-4 и IFNγ ELISPOT через 14 дней после иммунизации. Данные, приведенные на Фигуре 9, показывают, что иммунизация с использованием ACT-1023 индуцировала слабые IL-4 ELISPOT, как ожидалось для эпитопа CD8, содержащегося в DP. Напротив, мыши, иммунизированные посредством инъекции в подушечки лап, давали в результате сильные IFNγ реакции после однократной иммунизации. Группы s.c. и i.p. введения в результате давали менее мощные реакции, которые все же были сравнимы с группой положительного контроля CFA. Интраназальная доставка, по-видимому, не является иммуногенной в этом эксперименте. Иммунизация одним только пептидом давала в результате низкие уровни IFNγ реакций. Таким образом, авторы изобретения подтвердили, что эффективность пептида RSV-M2 значительно увеличивается путем заключения его в наночастицу ELBL.
Пример 12: Улучшенная иммуногенность RSV-G и RSV-M2 наночастиц при объединении в мультивалентную смешанную вакцину
Иммунизация мышей любой моновалентной вакциной на основе наночастиц индуцировала прогнозируемые иммунные реакции (см. Фигуры 4-8 и 9). Интересно отметить, что для антительных ответов, представленных на Фигурах 4-8, требовались три иммунизации (первичная + две повторные), тогда как для Т-клеточных реакций, представленных на Фигуре 9, требовалась только одна иммунизация (первичная). Для определения, могла ли мультивалентная вакцина на основе наночастиц, содержащая как RSV-G, так и RSV-M2, улучшать иммунную силу RSV-G компонента, мышей иммунизировали смесью RSV-G (ACT-1042,1 мкг DP на дозу) и RSV-M2 (ACT-1023, 5 мкг DP на дозу) наночастиц, доставляемых либо посредством инъекции в подушечки лап, либо интраназально. Титры антител после первичной иммунизации и после повторной иммунизации измеряли с помощью ELISA и Т-клеточные реакции после повторной иммунизации контролировали с помощью ELISPOT. Ни одна из мышей, получавших любую из этих конструкций, не имела измеряемого первичного антительного ответа (данные не показаны). На Фигуре 10 показаны результаты измерения посредством ELISA RSV-G-специфичных IgG после повторной иммунизации. У мышей, которые получали только АСТ-1042, только введение в подушечки лап в результате приводило к определяемым титрам. Добавление RSV-M2 наночастицы в группу введения в подушечки лап давало в результате титры антител, равные таковым, индуцированным под действием 5 мкг RSV-G пептида в CFA. Интраназальное введение смеси индуцировало титры почти такие же, что и f.p. инъекция только RSV-G наночастиц, тогда как i.n. введение только RSV-G наночастиц не индуцировало определяемых титров антител при повтрной иммунизации. Эти результаты демонстрируют, что включение RSV-M2 наночастиц, по-видимому, повышает эффективность антительного эпитопа в RSV-G и что i.n. введение наночастиц может индуцировать иммунный ответ.
Т-клеточные реакции у тех же мышей измеряли с помощью ELISPOT. На Фигуре 11 показано, что у мышей, иммунизированных посредством f.p. с использованием RSV-М2-содержащей наночастицы или смеси, повышался Т-клеточный ответ против эпитопа М2, который почти полностью представлял собой IFNγ, как ожидалось. При интраназальном введении только наночастиц RSV-M2 (ACT-1023) Т-клеточные реакции не индуцировались. Напротив, совместное введение RSV-M2 и RSV-G наночастиц (смесь) индуцировало мощный IFNγ ответ, который был сравним с таковым, индуцированным под действием иммунизации в подушечки лап только RSV-M2.
Т-клеточные реакции также изучали в in vivo анализе CTL, в котором измеряют активность цитотоксических Т-клеток у животного-хозяина. В моновалентной группе мышей BALB/c иммунизировали посредством введения в подушечки лап однократной инъекции PBS (отрицательный контроль), пептида АСТ-2031 (RSV-M2) в неполном адъюванте Фрейнда (IFA) или наночастицы ACT-1023 (RSV-M2). В мультивалентной группе мышей иммунизировали PBS, пептидом ACT-2031 (RSV-M2) плюс пептид АСТ-2044 (RSV-G) в IFA или ACT-1023 (RSV-M2) плюс ACT-1042 (RSV-G). Спустя семь дней клетки-мишени RSV-M2 получали путем примирования сингенных нативных клеток селезенки пептидом ACT-2031 и мечения высокой дозой флуоресцентной метки CFSE, тогда как контрольные клетки-мишени получали путем мечения сингенных нативных клеток селезенки низкой дозой CFSE и без целевого пептида. Две популяции клеток, меченных CFSE, перемешивали в соотношении 1:1 и 5×106 клеток вводили внутривенно иммунизированным мышам, в которых они направлялись обратно в селезенку организма-хозяина. Через 24 часа иммунизированных мышей скарифицировали и клетки селезенок анализировали на CFSE флуоресценцию для мониторинга выживания двух клеточных популяций. На Фигуре 12 крайние левые пики на гистограммах представляют выживание контрольных клеток-мишеней, а крайние правые пики представляют выживание клеток-мишеней, меченных RSV-M2. Как ожидалось, обе клеточные популяции выживали одинаково у неиммунизированных мышей (PBS). Напротив, у мышей, иммунизированных пептидом ACT-2031/IFA, приблизительно 18% клеток-мишеней RSV-M2 были уничтожены (сравнить размер правого пика с размером левого пика на гистограмме ACT-2031/IFA). Аналогичные результаты были получены у мышей, иммунизированных высокой дозой (75 мкг) наночастиц ACT-1023, по сравнению с неуничтожением меченых клеток-мишеней у мышей, иммунизированных более низкой дозой (10 мкг) ACT-1023. У мышей, иммунизированных комбинацией двух пептидов или двух наночастиц, наблюдалась более высокая степень уничтожения меченых клеток-мишеней. В частности, у мышей, иммунизированных смесью наночастиц (ACT-1023 + ACT-1042 по 10 мкг каждого), было уничтожено 35% меченных клеток-мишеней RSV-M2, что выше реакции, индуцированной даже высокой дозой моновалентной иммунизации (ACT-1023/75 мкг). Процент специфичного уничтожения клеток-мишеней, меченных RSV-M2, суммирован на Фигуре 13. Эти результаты согласуются с повышенными количествами IFNγ ELISPOT, определяемыми у мышей, иммунизированных смесью наночастиц RSV-G и RSV-M2 (смотри Фигуры 10, 11). Эти данные дают возможность предположить, что сочетание наночастиц RSV-G и RSV-M2 в смешанной вакцине обеспечивает взаимное улучшение иммунологической эффективности обоих компонентов. Тогда как улучшение антительного ответа на RSV-G (Фигура 10) могло быть приписано помощи Т-клеток, индуцированных RSV-M2, реципрокное улучшение Т-клеточного ответа на RSV-M2 после интраназального введения смеси (Фигура 11) было неожиданным.
Пример 13: Конструирование мультивалентной наночастицы
Дополнительные наночастицы были сконструированы для включения многочисленных эпитопов в одну и ту же частицу либо в виде отдельного DP с совместными слоями в одной и той же частице, либо в виде слитого DP, содержащего как RSV-G, так и RSV-M2 эпитопы. В Таблице 3 описана схема построения наночастиц с многочисленными эпитопами RSV, а в Таблице 4 описаны последовательности DP, использованные в каждой наночастице. Наночастицы ACT-1077-1079 содержат Т-клеточный эпитоп RSV-M2 в одном или многочисленных слоях, а B-клеточный эпитоп RSV-G - в восьмом слое. Наночастицы ACT-1086-1088 содержат спаренные эпитопные пептиды АСТ-2086-2088 соответственно, расположенные только в восьмом слое. Дополнительные конструкции могут быть представлены с использованием тех или иных эпитопов RSV либо с совместно нанесенными слоями, либо в одном слитом пептиде.
Таблица 3: Схема построения конструкций мультивалентных RSV наночастиц, RSV микрочастиц и RSV микрокапсул. ACT-1077-1079 содержат два отдельных DP, расположенных в различных слоях в одной и той же наночастице ELBL. ACT-1139 содержит два отдельных DP, расположенных в восьмом слое в той же наночастице ELBL. ACT-1086-1088 содержат один слитый пептид, включающий как антительные, так и Т-клеточные целевые эпитопы, расположенные в восьмом слое наночастицы ELBL. ACT-1145 и -1146 содержат один слитый пептид, включающий как антительные, так и Т-клеточные целевые эпитопы, расположенные в восьмом слое микрочастиц ELBL. ACT-1147 содержит один слитый пептид, включающий как антительные, так и Т-клеточные эпитопы, расположенные в восьмом слое микрокапсул ELBL
|
|
|
|
Пример 14: Дозозависимость конструкций DP-наночастиц
Одну и ту же дозу сконструированного пептида (1 мкг) использовали как в группе положительного контроля (CFA), так и наночастиц (1042). В предыдущих экспериментах 5-10 мкг использовали для CFA и 1 мкг - для наночастицы. Эти результаты показывают, что в эквивалентных дозах наночастицы являются более иммуногенными, чем CFA контроль.
|
Данные показаны на Фигурах 14-16.
Пример 15: Тиолирование поли-L-глутаминовой кислоты (PGA-SH) и присоединение цистеинсодержащего пептида
32 мг натриевой соли PGA средней молекулярной массы (продаваемой фирмой Sigma) растворяли в 1,0 мл 0,1 М фосфатно-натриевого буфера рН 7,2. Добавляли 22 мг 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC) и 15 мг сульфо-NHS и раствор держали при комнатной температуре в течение 15 мин. Добавляли 4,6 мг HCl соли цистамина и раствор оставляли для взаимодействия в течение 90 мин. Продукт очищали пропусканием через Desalt® колонку (продаваемую фирмой Pierce), предварительно уравновешенную разбавленным ацетатным буфером при рН 4,5. Элюент замораживали и хранили при -80°С. Степень тиолилирования оценивали с помощью анализа Элмана (DTNB), и было обнаружено, что она составляет приблизительно 24% от общего числа остатков глутамата.
Синтетический пептид, содержащий известный Т-клеточный эпитоп из белка RSV-G (RSV-G остатки 186-198, SED ID NO:24 CKRIPNKKPGKKT), может быть легко синтезирован стандартными способами твердофазного пептидного синтеза. 15 мг PGA-SH в 0,5 мл фосфатного буфера рН 7 можно обработать 0,4 мг DTNB (~1,0 мкмоль) в течение 30 мин при комнатной температуре. Раствор станет желтым. Реакцию активации можно контролировать путем УФ-спектроскопии, и судили о завершении, когда больше не было увеличения поглощения при 412 нм. Затем можно добавить 1,5 мг цистеинсодержащего эпитопного пептида (~1 мкмоль), и раствор оставляли взаимодействовать в течение 10 минут. Продукт может быть частично очищен диализом с использованием диализной трубки с отсечкой 5000 MW, и пептидная нагрузка может быть подтверждена аминокислотным анализом.
Пример 16: Тиоэфирное присоединение эпитопного пептида к PGA-SH
Синтетический пептид, содержащий известный Т-клеточный эпитоп из белка RSV-G (RSV-G остатки 187-198, SEQ ID NO:25 KRIPNKKPGKKT), может быть синтезирован на смоле для твердофазного пептидного синтеза. Перед отщеплением смолы бромацетильная группа может быть введена на N-конце путем обработки смолы бромуксусным ангидридом. После отщепления смолы и очистки 1,5 мг (~1 мкмоль) пептида (бромацетил-KRIPNKKPGKKT) может быть добавлен к раствору 15 мг PGA-SH в фосфатном буфере рН 7. Продукт может быть частично очищен диализом с использованием диализной трубки с отсечкой 5000 MW, и пептидная нагрузка может быть подтверждена аминокислотным анализом.
Пример 17: Перекрестное связывание цистеинсодержащего эпитопного пептида с PLL
Матричный раствор PLL средней молекулярной массы (продаваемый фирмой Sigma) в подходящей концентрации, обычно 0,5-50 мг/мл, и с почти нейтральным рН, обычно рН 6-8, перемешивают с перекрестно-сшивающим агентом, таким как сульфосукцинимидил 4-[N-малеимидометил]циклогексан-1-карбоксилатом (сульфо-SMCC). Количество сульфо-SMCC может варьироваться, но достаточное количество используют для модификации 1-25% остатков лизина в PLL. Характерное время реакции составляет 0,5-5 часов. Избыток сульфо-SMCC реагента затем удаляют, либо пропуская реакционный раствор через гель-фильтрационную колонку, либо путем диализа. Модифицированный PLL затем оставляют для взаимодействия с небольшим избытком цистеинсодержащего эпитопного пептида почти при нейтральном рН, обычно рН 6-8. Конечный конъюгат PLL-эпитоп очищают, либо пропуская раствор через гель-фильтрационную колонку, либо диализом. Этот реагент будет подходящим для включения в полиэлектролитную ELBL пленку способами, аналогично используемыми для PLL.
Пример 18: Защита от заражения RSV после иммунизации мышей наночастицами
Мышей заражали интраназально RSV на 28 день и скарифицировали 5 дней спустя. Легкие собирали и гомогенизировали и титры вируса измеряли анализом клеток Vero и с помощью qPCR амплификации гена RSV-M. Результаты (Фигура 17) демонстрируют по существу полную защиту любой композицией, которая содержит RSV-G (группы 3-6). В этом исследовании только RSV-M2 ни защищал, ни улучшал работу мультивалентной вакцины по сравнению с одним RSV-G, возможно в связи с относительно высокой используемой дозой (10 мкг).
Пример 19: Иммуногенность мультивалентных наночастиц, содержащих эпитопы RSV-G и RSV-M2 в одном и том же или в разных слоях
Мышей иммунизировали в 0 день инъекцией конструкций наночастиц RSV в подушечку задней лапы; иммуногены включали ACT-1023 (RSV-M2), ACT-1042 (RSV-G)+ACT-1023 (RSV-M2), ACT-1086 (RSV-M2+G слитый пептид в одном слое) и ACT-1077 (RSV-G + RSV-M2 пептиды в различных слоях). Мышей заражали клетками-мишенями, нагруженными RSV-M2, меченными CFSE, на 7 день. На следующий день клетки селезенки анализировали проточной цитометрией для определения выживания клеток-мишеней, меченных CFSE. Результаты (Фигуры 18 и 19) показывают, что хотя иммунизация любой наночастицей, содержащей эпитоп RSV-M2, индуцировала RSV-M2-специфичные эффекторные клетки, ответ был более мощным у мышей, иммунизированных мультивалентными конструкциями (RSV-M2+G), чем у мышей, иммунизированными моновалентными конструкциями (RSV-M2).
В отдельном исследовании мышей иммунизировали на 0 и 21 день инъекцией конструкциями наночастиц RSV в подушечку задней лапы; иммуногены включали ACT-1023 (RSV-M2), ACT-1042 (RSV-G), ACT-1042+ACT-1023, ACT-1086 (RSV-M2+G слитый пептид в одном слое) и ACT-1139 (RSV-G+RSV-M2 пептиды, совместно загруженные в одном и том же слое). У мышей брали кровь на 28 день и сыворотки анализировали на RSV-G-специфичные антитела с помощью ELISA. Результаты (Фигура 20, 21) показывают, что все композиции, которые содержали RSV-G эпитоп, индуцировали титры антител, хотя мультивалентная наночастица АСТ-1139, по-видимому, является наиболее эффективной.
Использование терминов в единственном числе и аналогичных ссылок (в частности, в контексте последующей формулы изобретения) охватывает как единственное, так и множественное число, если в настоящей заявке не указано иное или иное не противоречит контексту. Термины «первый», «второй» и т.д., используемые в контексте настоящего изобретения, не предназначены для обозначения какого-либо конкретного порядка, а просто для удобства обозначения, например, множества слоев. Термины «содержащий», «имеющий», «включающий» должны толковаться как открытые термины (т.е. означающие «включая, но не ограничиваясь»), если не указано иное. Перечисление диапазонов значений служит только как способ сокращения ссылки индивидуально для каждого отдельного значения, входящего в диапазон, если не указано иное, и каждое отдельное значение включено в описание, как если бы оно было индивидуально перечислено в настоящем описании. Конечные точки всех диапазонов включены в диапазон и независимо комбинируются. Все описанные здесь способы могут быть выполнены в подходящем порядке, если иное не указано в настоящем документе или иное явно не противоречит контексту. Использование любого и всех примеров или иллюстративных формулировок (например, «такой как») предназначено только для лучшей иллюстрации изобретения и не ограничивает объем изобретения, если иное не заявлено. В настоящем описании отсутствуют формулировки, которые должны быть истолкованы как указывающие на любой незаявленный элемент как необходимый для осуществления настоящего изобретения, в данном контексте.
Хотя настоящее изобретение было описано со ссылкой на вариант осуществления, приводимый в качестве примера, специалистам в данной области будет понятно, что могут быть сделаны различные изменения и эквиваленты могут быть заменены их элементами без отклонения от объема изобретения. Кроме того, многие модификации могут быть выполнены для того, чтобы адаптировать конкретную ситуацию или вещество к сведениям, представленным в настоящем изобретении, без отклонения от его существенного объема. Таким образом, предполагается, что изобретение не ограничивается конкретным вариантом осуществления, раскрытым как лучший вариант из предполагаемых для осуществления этого изобретения, но что изобретение будет включать все варианты осуществления, подпадающие под объем прилагаемой формулы изобретения. Любое сочетание описанных выше элементов во всех возможных их вариантах охватывается настоящим изобретением, если в настоящей заявке не указано иное или иное явным образом не противоречит контексту.