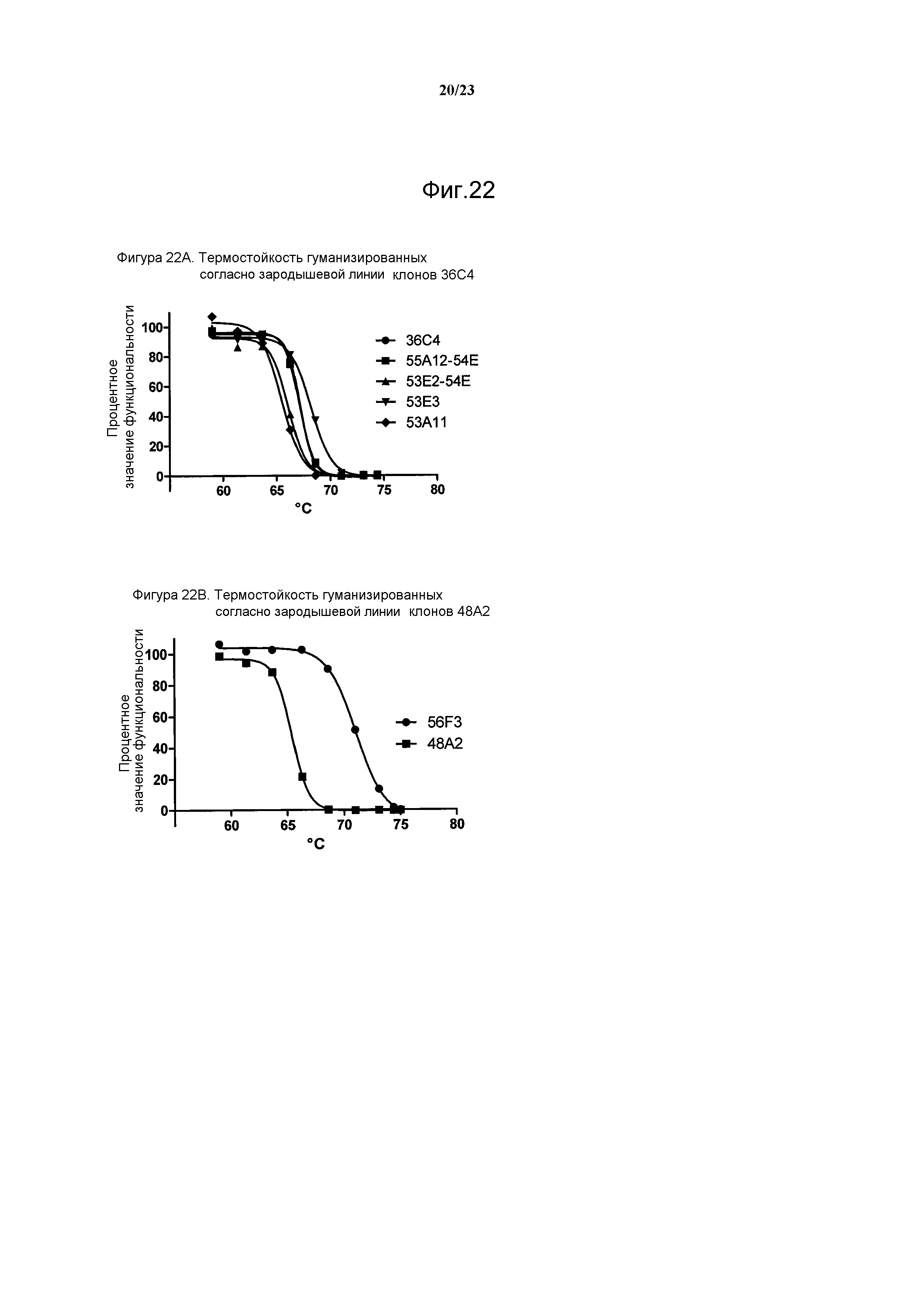
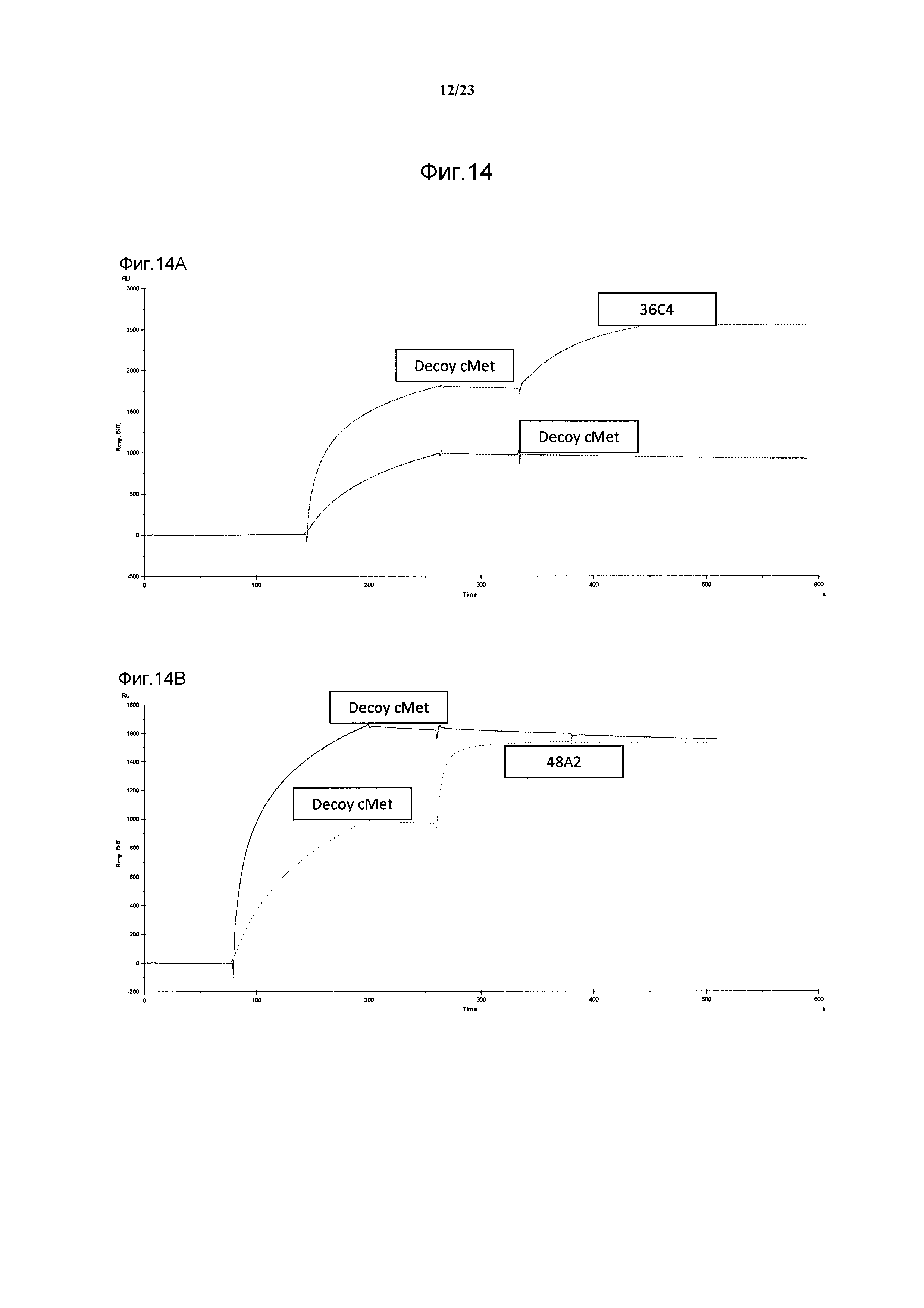
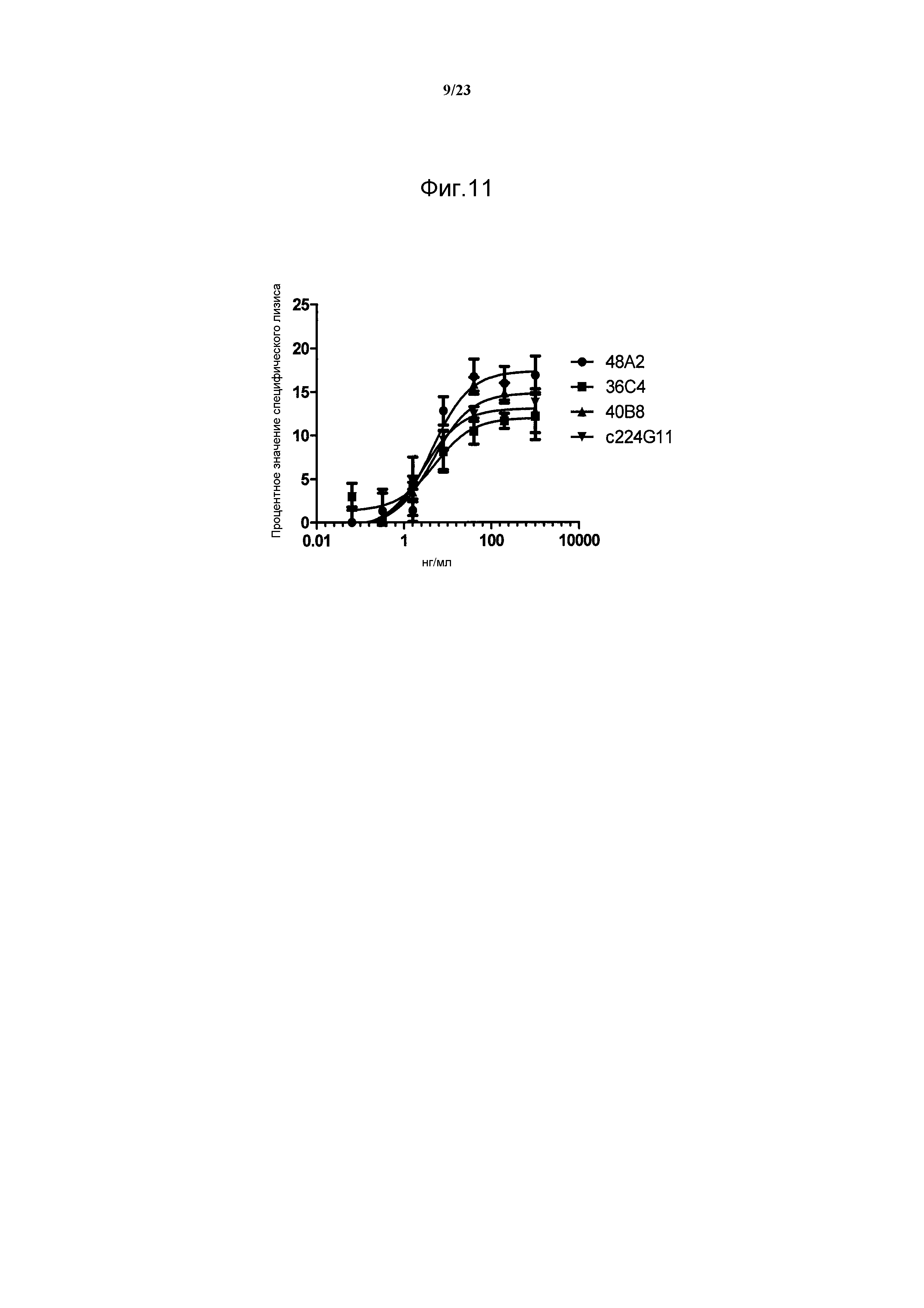
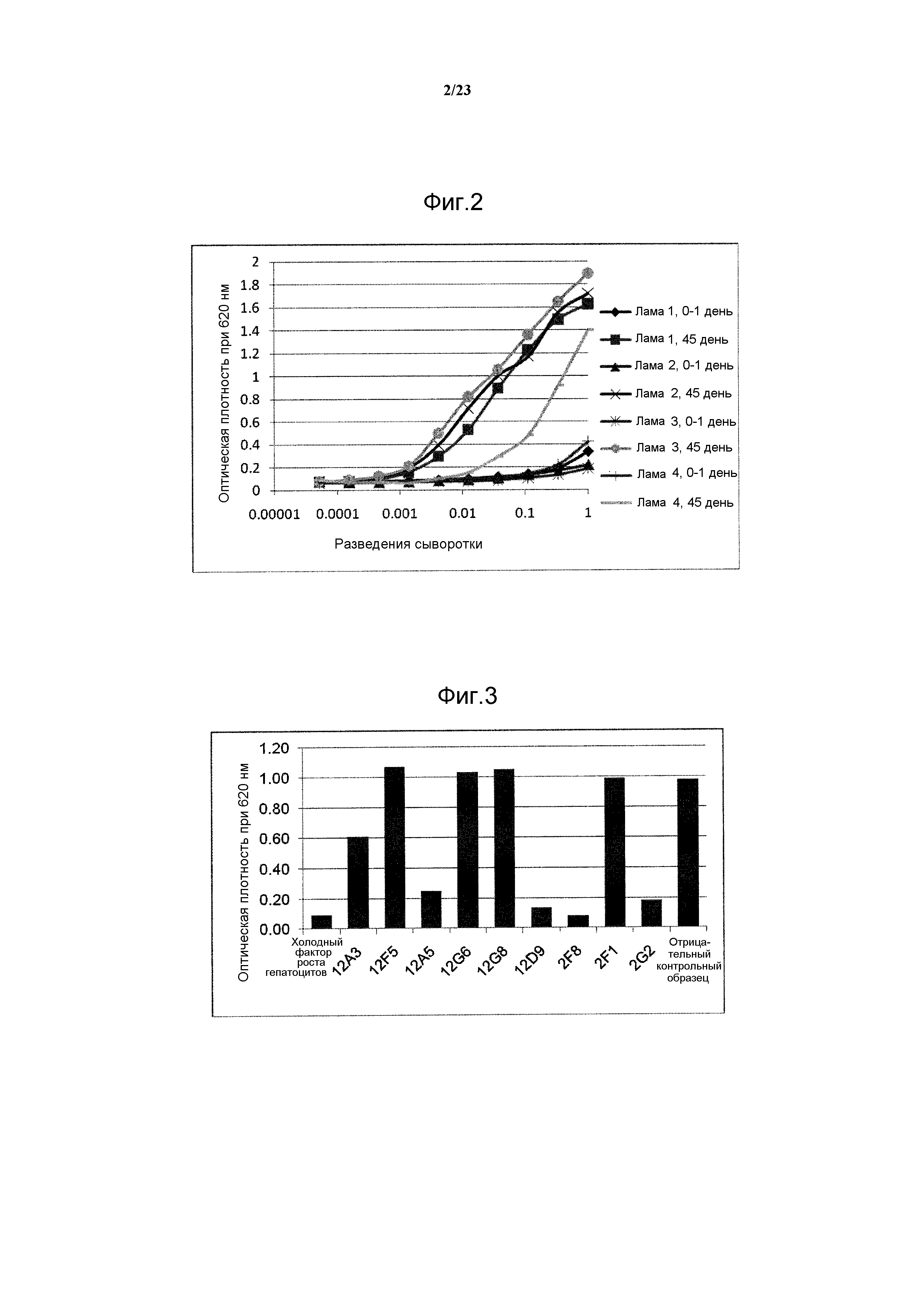
Результат интеллектуальной деятельности: АНТИТЕЛА ПРОТИВ БЕЛКА РЕЦЕПТОРА С-МЕТ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к антителам, которые специфически связываются с белком рецептора с-Met человека и действуют в качестве строгих антагонистов активации рецептора с-Met, опосредованной фактором роста гепатоцитов (HGF), и/или ингибируют HGF-независимую активацию рецептора с-Met.
Уровень техники
Рецептор, представляющий собой тирозинкиназу, с-Met, и его лиганд, являющийся фактором роста гепатоцитов (HGF), стали основными мишенями для целенаправленного лечения рака.
с-Met является рецептором фактора роста гепатоцитов (HGF) на поверхности клетки, который также известен как фактор рассеяния. Рецептор с-Met является гетеродимером, связанным дисульфидной связью, который состоит из внеклеточных α и β цепей. α-Цепь, гетеродимеризованная с аминоконцевой частью β-цепи, образует главный лигандсвязывающий центр во внеклеточном домене. Связывание HGF вызывает гомодимеризацию рецептора с-Met и фосфорилирование двух остатков тирозина (Y1234 и Y1235) на сайте катализации, регулирующем активность киназы.
HGF-опосредованная активация с-Met включает сложную генетическую программу, определяемую как “инвазивный рост”, которая состоит из ряда физиологических процессов, включающих пролиферацию, инвазию и развитие кровеносных сосудов, которые происходят в нормальных физиологических условиях в процессе развития эмбриона и в патологических условиях онкогенеза. Передача сигналов рецептором с-Met стимулирует пролиферацию и выживание клеток с участием разных эффекторов нижней области.
Активация рецептора с-Met в опухолевых клетках включает разные сигнальные пути, вызывающие рост, пролиферацию, инвазию и защиту клетки от апоптоза. Действие биологических механизмов онкогенности с-Met обычно достигается тремя разными способами, включающими: (а) образование аутокринных петель HGF/c-Met; (b) сверхэкспрессию с-Met или HGF; и (с) присутствие активирующих киназу мутаций в кодирующей последовательности рецептора с-Met. Экспрессия HGF и с-Met была обнаружена в биопсийном материале большинства солидных опухолей, и передача сигналов с-Met была документально подтверждена в целом ряде злокачественных новообразований человека, включающих рак мочевого пузыря, молочной железы, шейки матки, прямой и ободочной кишки, желудка, головы и шеи, печени, легкого, яичника, поджелудочной железы, предстательной железы, почки и щитовидной железы.
Активация с-Met его лигандом, HGF, может быть паракринной или аутокринной. Паракринная активация может стать патологической в присутствии анормального продуцирования HGF. Аутокринная активация возникает в тех случаях, когда опухолевые клетки аберрантно экспрессируют HGF и его рецептор. Кроме того, активация с-Met может происходить независимо от HGF, будучи опосредованной гомодимеризацией c-Met.
Целый ряд злокачественных новообразований человека характеризуются длительной стимуляцией, сверхэкспрессией или мутацией с-Met, включая рак молочной железы, печени, легкого, яичников, почки и щитовидной железы. Активирующие мутации с-Met были обнаружены у субъектов, страдающих определенной наследственной формой папилломы почки, что прямо указывает на участие с-Met в онкогенезе человека. Аберрантная передача сигналов по сигнальному пути с-Met вследствие неправильной регуляции рецептора с-Met или сверхэкспрессии его лиганда, HGF, ассоциирована с образованием агрессивного фенотипа. Данные, свидетельствующие о причастности передачи сигналов с-Met к прогрессированию и распространению нескольких типов рака, и все более глубокое понимание роли данного рецептора в развитии заболевания, вызвали значительный интерес к с-Met и HGF в качестве основных мишеней при создании противораковых лекарственных средств (Eder et al., Clin. Cancer Research.; 15(7); 2009).
В настоящее время клинические исследования проходят разные антагонисты сигнального пути с-Met, предназначенные для клинических применений. Предполагаемые антагонисты с-Met включают моноклональные антитела, блокирующие взаимодействие с-Met с его лигандом HGF. Наиболее полно описано антитело против с-Met 5D5, созданное компанией Genentech (WO096/38557). Антитело 5D5 является сильнодействующим агонистом при отдельном использовании в разных моделях и антагонистом при использовании в виде Fab-фрагмента или антитела с одним плечом (MetMab).
В публикации WO 2009/007427 описаны мышиные моноклональные антитела к с-Met и химерные варианты, в которых антигенсвязывающие домены мышиного моноклонального антитела или его гуманизированного варианта связаны с константной областью IgG1 человека. Однако, хотя исходное мышиное моноклональное антитело, 224G11, обладает антагонистической активностью при отсутствии значительной агонистической активности, в результате связывания антигенсвязывающих доменов 224G11 с IgG1 человеа образуется химерная форма 224G11, обладающая некоторой агонистической активностью, что влечет за собой снижение антагонистической эффективности. Агонистическая активность, проявляемая химерной формой антитела 224G11, может быть реверсирована путем создания точечных мутаций в шарнирной области тяжелой цепи IgG1 человека. В созданном варианте несколько аминокислотных остатков человека в шарнирной области заменены мышиными остатками, находящимися в таких же положениях последовательности IgG1 мыши. Антагонистическая активность рецептора с-Met была восстановлена в созданном варианте, но общая гомология структуры и последовательности данного антитела относительно человеческих антител уменьшилась в результате выполнения мутаций в шарнирной области. Кроме того, по меньшей мере одна из гипервариабельных петель в 224G11 приобретает каноническую структуру, не обнаруженную в спектре человеческих антител.
В публикации WO 2007/126799 описаны полностью человеческие моноклональные антитела к с-Met. Указанные антитела действуют в качестве антагонистов взаимодействия с HGF, при этом отсутствуют данные, относящиеся к агонистической активности, присущей таким антителам, и их способности ингибировать димеризацию с-Met.
В публикации WO 2010/059654 также описаны моноклональные антитела против с-Met. Указанные антитела связываются с α-цепью рецептора с-Met человека и вызывают интернализацию с-Met человека на поверхности клетки.
Описание изобретения
Настоящее изобретение относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека, при этом антитело обладает по меньшей мере двумя или всеми тремя следующими свойствами:
(а) является строгим антагонистом HGF-опосредованной активации белка с-Met человека;
(b) ингибирует HGF-независимую активацию белка с-Met человека; и
(с) не вызывает значительного уменьшения белка с-Met человека на поверхности клетки.
Один вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека, при этом антитело обладает следующими свойствами:
(а) является строгим антагонистом HGF-опосредованной активации белка с-Met человека;
(b) ингибирует HGF-независимую активацию белка с-Met человека.
Один вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека, при этом антитело обладает следующими свойствами:
(а) является строгим антагонистом HGF-опосредованной активации белка с-Met человека; и
(c) не вызывает значительного уменьшения белка с-Met человека на поверхности клетки.
Один вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека, при этом антитело обладает следующими свойствами:
(b) ингибирует HGF-независимую активацию белка с-Met человека; и
(c) не вызывает значительного уменьшения белка с-Met человека на поверхности клетки.
Другой вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека, при этом антитело обладает следующими свойствами:
(а) является строгим антагонистом HGF-опосредованной активации белка с-Met человека;
(b) ингибирует HGF-независимую активацию белка с-Met человека; и
(с) не вызывает значительного уменьшения белка с-Met человека на поверхности клетки.
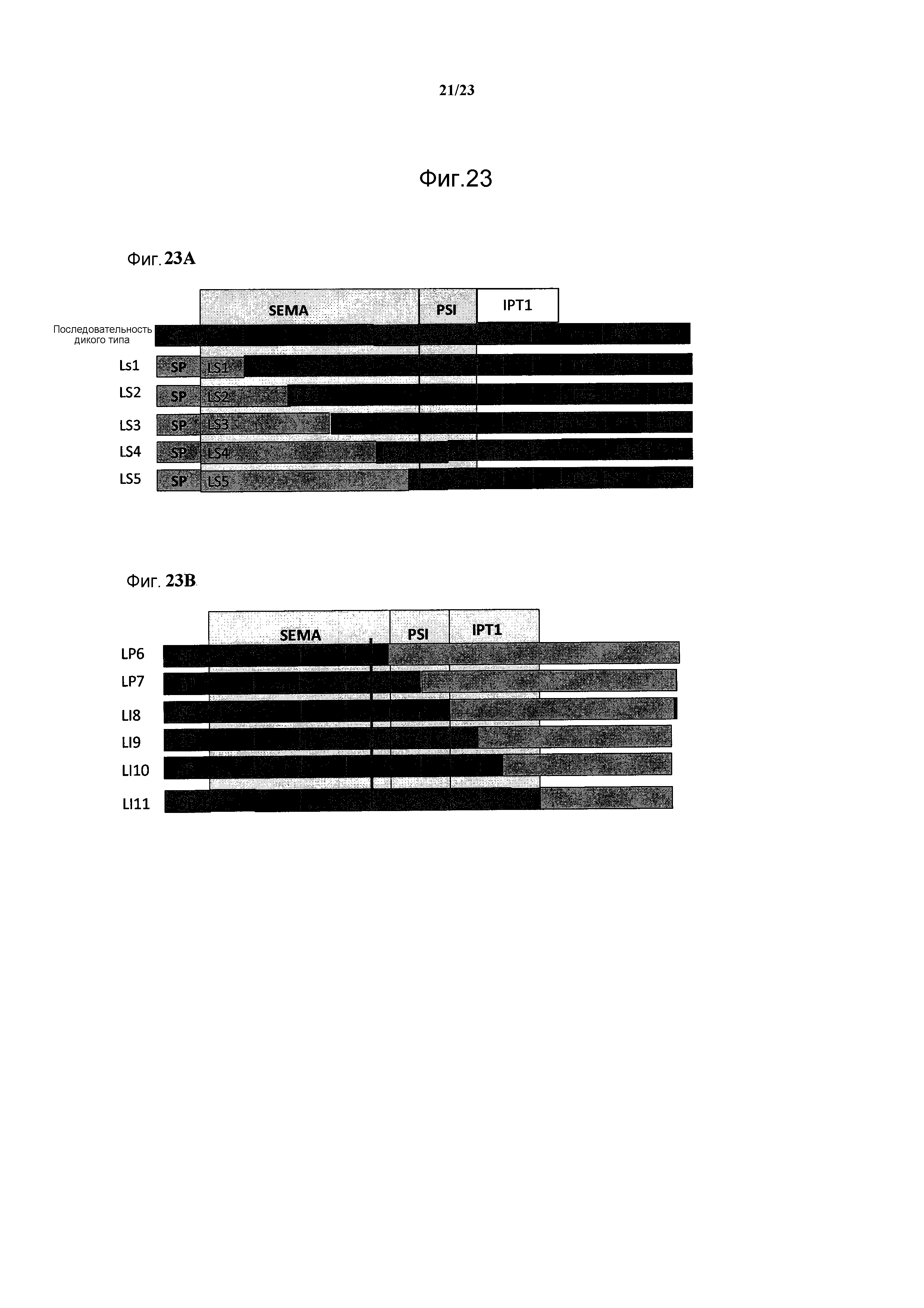
В конкретном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может связываться с эпитопом в области IPT белка с-Met человека, в частности, с эпитопом в доменах IPT 1-2, 2-3 или 3-4 белка с-Met человека, или с эпитопом в области PSI-IPT1 белка с-Met человека.
В другом варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может связываться с эпитопом в аминокислотной последовательности

(SEQ ID NO:136) в области PSI-IPT1 указанного белка с-Met человека.
В другом варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может блокировать связывание HGF с высокоаффинным HGF-связывающим сайтом белка с-Met человека.
Другой вариант осуществления изобретения относится к антителу или его антигенсвязывающему фрагменту, который:
(а) связывается с эпитопом в домене SEMA белка с-Met человека;
(b) не вызывает уменьшения белка с-Met человека на поверхности клетки.
В типичном варианте осуществления изобретения указанное антитело или его антигенсвязывающий фрагмент связывается с эпитопом в пептиде
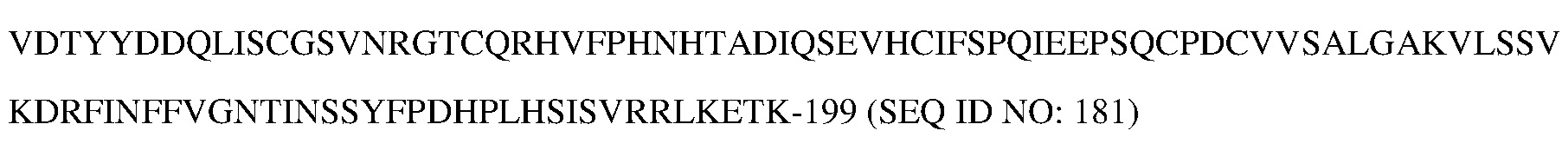
(SEQ ID NO:181) в домене SEMA белка с-Met человека.
Указанное антитело или его антигенсвязывающий фрагмент может блокировать связывание HGF с низкоаффинным HGF-связывающим сайтом белка с-Met человека.
В любом из вышеуказанных вариантов осуществления изобретения антитело или его антигенсвязывающий фрагмент может включать шарнирную область, имеющую полностью человеческую последовательность. Антитело или его антигенсвязывающий фрагмент также может обладать высокой гомологией с человеком, как указано в настоящем описании изобретения.
Один вариант осуществления изобретения относится к антителу, обладающему высокой гомологией с человеком, которое специфически связывается с белком рецептора с-Met человека и оказывает антагонистическое воздействие на HGF-опосредованную активацию рецептора с-Met.
Один вариант осуществления изобретения относится к выделенному антителу, обладающему высокой гомологией с человеком, которое специфически связывается с белком рецептора с-Met, является строгим антагонистом HGF-опосредованной активации рецептора с-Met и включает шарнирную область, имеющую полностью человеческую последовательность, при этом наличие шарнирной области человека не оказывает вредного воздействия на антагонистическую активность антитела.
Другой вариант осуществления изобретения относится к выделенному антителу, обладающему высокой гомологией с человеком, или его антигенсвязывающему фрагменту, которое специфически связывается с белком с-Met человека, блокирует связывание HGF с высокоаффинным HGF-связывающим сайтом белка с-Met человека и является строгим антагонистом HGF-опосредованной активации рецептора с-Met.
Другой вариант осуществления изобретения относится к выделенному антителу, обладающему высокой гомологией с человеком, или его антигенсвязывающему фрагменту, которое специфически связывается с белком с-Met человека, при этом указанное антитело или его антигенсвязывающий фрагмент связывается с эпитопом в области IPT или области PSI-IPT1 белка с-Met человека и является строгим антагонистом HGF-опосредованной активации рецептора с-Met. В одном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент связывается с эпитопом в доменах IPT 1-2, 2-3 или 3-4 белка с-Met человека.
Другой вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека, при этом указанное антитело или антигенсвязывающий фрагмент связывается с эпитопом в пептиде
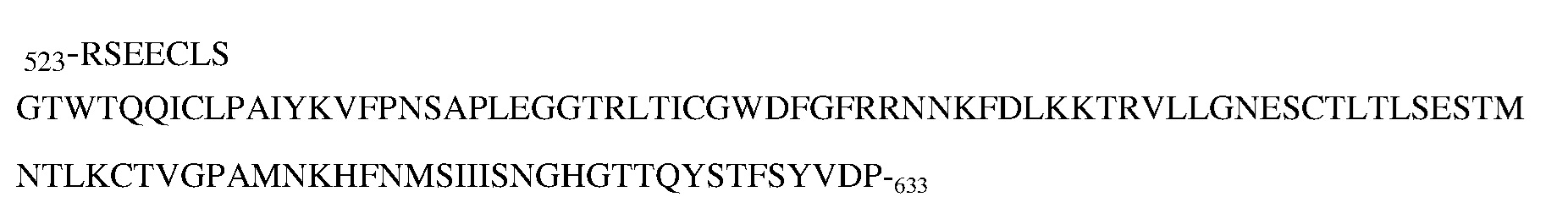
(SEQ ID NO:136) в области PSI-IPT1 белка с-Met человека.
В типичном варианте осуществления изобретения указанное антитело или его антигенсвязывающий фрагмент может быть строгим антагонистом HGF-опосредованной активации белка с-Met человека, а также может ингибировать HGF-независимую активацию белка с-Met человека и предпочтительно не вызывает значительного уменьшения белка с-Met человека на поверхности клетки.
В другом варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент связывается с конформационным эпитопом, включающим часть доменов IPT и часть другого домена с-Met, такого как домен SEMA.
Во всех вышеуказанных вариантах осуществления изобретения антитело может быть любым моноклональным антителом, полностью человеческим моноклональным антителом или гуманизированным моноклональным антителом, каждое из которых связывается при помощи двухвалентной связи с белком с-Met человека.
В конкретном варианте осуществления изобретения антитело, обладающее высокой гомологией с человеком, или его антигенсвязывающий фрагмент может включать вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL), при этом VH и VL домены либо одна или несколько CDR-областей выделены у верблюда.
Один вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и являющемуся строгим антагонистом HGF-опосредованной активации рецептора с-Met, которое включает вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL), при этом VH и VL домены либо одна или несколько CDR-областей выделены у верблюда. В конкретном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может включать VH и VL домены ламы или гуманизированные VH и VL ламы. Указанное антитело и его антигенсвязывающий фрагмент может также характеризоваться “высокой гомологией с человеком” в соответствии с настоящим описанием изобретения.
Неограничивающие варианты осуществления изобретения относятся к следующим антителам или их антигенсвязывающим фрагментам, определяемым на основании специфических структурных характеристик, то есть определенных аминокислотных последовательностей CDR-областей (одна или несколько SEQ ID NO:1-21, 71-73 или 83-85 (CDR-области тяжелой цепи) или SEQ ID NO:22-42, 74-76, 86, 87 или 137-148 (CDR-области легкой цепи) или всех вариабельных доменов (одна или несколько SEQ ID NO:45-58, 77, 78, 88, 89, 92-121 или 149-164). Все указанные антитела специфически связываюся с белком с-Met человека и являются строгими антагонистами HGF-опосредованной активации рецептора с-Met. В конкретных вариантах осуществления изобретения антитела, определяемые следующими структурными характеристиками, могут дополнительно обладать высокой гомологией с человеком в соответствии с настоящим описанием изобретения. Указанные антитела могут быть моноклональными антителами, полученными методами рекомбинантных ДНК. CDR-области следующих антител против с-Met могут быть выделены у верблюда, то есть получены из антител, образовавшихся в результате иммунизации верблюдов (в частности, лам) антигеном с-Met. Настоящее изобретение также относится к гуманизированным вариантам или вариантам зародышевого типа человека, аффинным вариантам и вариантам, содержащим консервативные замены аминокислот в соответствии с настоящим описанием изобретения. Настоящее изобретение также относится к химерным антителам, содержащим VH и VL домены, выделенные у верблюда, к гуманизированным вариантам или вариантам зародышевого типа, слитым с константными доменами человеческих антител, в частности, IgG1, IgG2, IgG3 или IgG4 человека. Указанные химерные антитела могут включать шарнирную область, имеющую полностью человеческую последовательность в соответствии с настоящим описанием изобретения.
Типичные варианты антител против с-Met будут дополнительно описаны со ссылкой на структурные характеристики.
Один вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему CDR3 вариабельного домена тяжелой цепи, имеющую последовательность, выбираемую из группы, состоящей из:
SEQ ID NO:21 [DVRVIATGWATANALDA] или варианта данной последовательности,
SEQ ID NO:15 [VDDYYLGYDY] или варианта данной последовательности,
SEQ ID NO:3 [RRDNYYGTSGEYDY] или варианта данной последовательности,
SEQ ID NO:6 [DTVVSGNGY] или варианта данной последовательности,
SEQ ID NO:9 [DLIGSHDY] или варианта данной последовательности,
SEQ ID NO:12 [GPGWYSGSRNDY] или варианта данной последовательности,
SEQ ID NO:18 [LEDYELAYDY] или варианта данной последовательности,
SEQ ID NO:73 [SGYGSSLGDFGS] или варианта данной последовательности,
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
Вариабельный домен тяжелой цепи указанного антитела может дополнительно включать CDR2 вариабельного домена тяжелой цепи, имеющую последовательность, выбираемую из группы, состоящей из:
(a) SEQ ID NO:ХХ1 [X1X2X3X4X5X6X7X8TYYAESMK] или варианта данной последовательности, где
Х1 означает любую аминокислоту, предпочтительно Т или А;
Х2 означает любую аминокислоту, предпочтительно I;
Х3 означает любую аминокислоту, предпочтительно S или N;
Х4 означает любую аминокислоту, предпочтительно W;
Х5 означает любую аминокислоту, предпочтительно N;
Х6 означает любую аминокислоту, предпочтительно D или G;
Х7 означает любую аминокислоту, предпочтительно I, G или S; и
Х8 означает любую аминокислоту, предпочтительно N или S;
(b) SEQ ID NO:ХХ2 [VIAYDGSTX1YSPSLKS] или варианта данной последовательности, где
Х1 означает любую аминокислоту, предпочтительно Y или D; и
(с) SEQ ID NO:ХХ3 [RIDPEX1GGTKYAQKFQG] или варианта данной последовательности, где
Х1 означает любую аминокислоту, предпочтительно D, N или Е;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
Вариабельный домен тяжелой цепи указанного антитела может дополнительно включать CDR1 вариабельного домена тяжелой цепи, имеющую последовательность, выбираемую из группы, состоящей из:
(а) SEQ ID NO:ХХ4 [X1DYX2MX3) или варианта данной последовательности, где
Х1 означает любую аминокислоту, предпочтительно D или S,
Х2 означает любую аминокислоту, предпочтительно А или V, и
Х3 означает любую аминокислоту, предпочтительно Т, N или S;
(b) SEQ ID NO:ХХ5 [X1NYYX2WS] или варианта данной последовательности, где
Х1 означает любую аминокислоту, предпочтительно G или Т, и
Х2 означает любую аминокислоту, предпочтительно А или Y;
(с) SEQ ID NO:ХХ6 (X1X2X3ID) или варианта данной последовательности, где
Х1 означает любую аминокислоту, предпочтительно М или N,
Х2 означает любую аминокислоту, предпочтительно N или Y, и
Х3 означает любую аминокислоту, предпочтительно S или V, и
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
Антитело или его антигенсвязывающий фрагмент может дополнительно включать CDR3 вариабельного домена легкой цепи, имеющую аминокислотную последовательность, выбираемую из группы, состоящей из:
(а) SEQ ID NO:YY1[QQGX1SFPX2X3] или варианта данной последовательности, где
Х1 означает любую аминокислоту, предпочтительно Y или W;
Х2 означает любую аминокислоту, предпочтительно Y или L;
Х3 означает любую аминокислоту, предпочтительно Т или S;
(b) SEQ ID NO:YY2 [ASYRX1X2X3X4X5X6V] или варианта данной последовательности, где
Х1 означает любую аминокислоту, предпочтительно S, I, R или Т;
Х2 означает любую аминокислоту, предпочтительно A, S, T или R;
Х3 означает любую аминокислоту, предпочтительно N или Т;
Х4 означает любую аминокислоту, предпочтительно N, D, R или K;
Х5 означает любую аминокислоту, предпочтительно A, V, Y, N или H;
Х6 означает любую аминокислоту, предпочтительно V, A, S или G,
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
Антитело или его антигенсвязывающий фрагмент может дополнительно включать CDR2 вариабельного домена легкой цепи, имеющую последовательность, выбираемую из группы, состоящей из:
(а) SEQ ID NO:YY3 [WASX1RES] или варианта данной последовательности, где
Х1 означает любую аминокислоту, предпочтительно I или Т;
(b) SEQ ID NO:YY4 [X1VX2X3RX4S] или варианта данной последовательности, где
Х1 означает любую аминокислоту, предпочтительно D, A или Е,
Х2 означает любую аминокислоту, предпочтительно N или S,
Х3 означает любую аминокислоту, предпочтительно R, Y или К,
Х4 означает любую аминокислоту, предпочтительно А или Р,
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
Антитело или его антигенсвязывающий фрагмент может дополнительно включать CDR1 вариабельного домена легкой цепи, имеющую последовательность, выбираемую из группы, состоящей из:
(а) SEQ ID NO:YY5 [KSSQSVLX1X2X3NX4KX5YLA] или варианта данной последовательности, где
Х1 означает любую аминокислоту, предпочтительно W, L или F;
Х2 означает любую аминокислоту, предпочтительно R или S;
Х3 означает любую аминокислоту, предпочтительно S или Р;
Х4 означает любую аминокислоту, предпочтительно Q или Н;
Х5 означает любую аминокислоту, предпочтительно N или S;
(b) SEQ ID NO:YY6 [X1GX2X3X4X5X6GX7X8X9YX10S] или варианта данной последовательности, где
Х1 означает любую аминокислоту, предпочтительно А или Т;
Х2 означает любую аминокислоту, предпочтительно Т или S;
Х3 означает любую аминокислоту, предпочтительно S или N;
Х4 означает любую аминокислоту, предпочтительно S или Т;
Х5 означает любую аминокислоту, предпочтительно D или N;
Х6 означает любую аминокислоту, предпочтительно V или I;
Х7 означает любую аминокислоту, предпочтительно Y, G, D или N;
Х8 означает любую аминокислоту, предпочтительно G или Y;
Х9 означает любую аминокислоту, предпочтительно N или Y;
Х10 означает любую аминокислоту, предпочтительно V или L;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
36С4, 20F1 и их варианты
Один вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи, где последовательность CDR3 вариабельного домена тяжелой цепи является SEQ ID NO:12 или SEQ ID NO:21 или вариантом данной последовательности, при этом вариант последовательности включает одну, две или три замены аминокислот в приведенной последовательности.
В одном варианте антитела или его антигенсвязывающего фрагмента
последовательность CDR3 вариабельного домена тяжелой цепи является SEQ ID NO:21 или SEQ ID NO:12 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена тяжелой цепи является SEQ ID NO:ХХ2 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена тяжелой цепи является SEQ ID NO:ХХ5 или вариантом данной последовательности; и
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В одном варианте антитела или его антигенсвязывающего фрагмента
последовательность CDR3 вариабельного домена тяжелой цепи является SEQ ID NO:21 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена тяжелой цепи является SEQ ID NO:20 или вариантом данной последовательности либо SEQ ID NO:83 или вариантом данной последовательности; и
последовательность CDR1 вариабельного домена тяжелой цепи является SEQ ID NO:19 или вариантом данной последовательности, и
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В одном варианте антитела или его антигенсвязывающего фрагмента
последовательность CDR3 вариабельного домена тяжелой цепи является SEQ ID NO:12 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена тяжелой цепи является SEQ ID NO:11 или вариантом данной последовательности; и
последовательность CDR1 вариабельного домена тяжелой цепи является SEQ ID NO:10 или вариантом данной последовательности; и
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В одном варианте антитела или его антигенсвязывающего фрагмента
последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:YY2 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:YY4 или вариантом данной последовательности; и
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:YY6 или вариантом данной последовательности; и
при этом вариант последовательности включает одну, две или три замены аминокислот в приведенной последовательности.
В одном варианте антитела или его антигенсвязывающего фрагмента
последовательность CDR3 вариабельного домена легкой цепи выбирают из группы, состоящей из SEQ ID NO:33 или варианта данной последовательности, SEQ ID NO:145 или варианта данной последовательности, SEQ ID NO:146 или варианта данной последовательности, SEQ ID NO:147 или варианта данной последовательности, и SEQ ID NO:148 или варианта данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:32 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:31 или вариантом данной последовательности либо SEQ ID NO:144 или вариантом данной последовательности, и
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В одном варианте антитела или его антигенсвязывающего фрагмента
последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:30 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:29 или вариантом данной последовательности; и
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:28 или вариантом данной последовательности; и
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
Другой вариант осуществления изобретения относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, где
последовательность CDR3 вариабельного домена тяжелой цепи является SEQ ID NO:21 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена тяжелой цепи выбирают из группы, состоящей из SEQ ID NO:20, SEQ ID NO:83 и SEQ ID NO:84 или варианта данной последовательности; и
последовательность CDR1 вариабельного домена тяжелой цепи является SEQ ID NO:19 или вариантом данной последовательности; и вариабельный домен легкой цепи включает комбинацию CDR-областей, выбираемых из следующих последовательностей:
(i) последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:33 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:32 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:31 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности; или
(ii) последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:145 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:32 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:144 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности; или
(iii) последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:146 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:32 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:31 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности; или
(iv) последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:147 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:32 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:144 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности; или
(v) последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:148 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:32 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:144 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В типичных вариантах осуществления изобретения антитело или его антигенсвязывающий фрагмент связывается с эпитопом в пептиде

(SEQ ID NO:181) в домене SEMA белка с-Met человека.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может быть строгим антагонистом HGF-опосредованной активации белка с-Met человека и может также ингибировать HGF-независимую активацию белка с-Met человека, предпочтительно не вызывая значительного уменьшения белка с-Met человека на поверхности клетки.
В одном варианте осуществления изобретения антитело включает СН1 домен, шарнирную область, СН2 домен и СН3 домен человеческого антитела, в частности, IgG1, IgG2, IgG3 или IgG4 человека.
Другой вариант осуществления изобретения относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, где
последовательность CDR3 вариабельного домена тяжелой цепи является SEQ ID NO:12 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена тяжелой цепи является SEQ ID NO:11 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена тяжелой цепи является SEQ ID NO:10 или вариантом данной последовательности;
последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:30 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:29 или вариантом данной последовательности; и
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:28 или вариантом данной последовательности; и
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может быть строгим антагонистом HGF-опосредованной активации белка с-Met человека и может также ингибировать HGF-независимую активацию белка с-Met человека, предпочтительно не вызывая значительного уменьшения белка с-Met человека на поверхности клетки.
В одном варианте осуществления изобретения антитело может включать СН1 домен, шарнирную область, СН2 домен и СН3 домен человеческого антитела, в частности, IgG1, IgG2, IgG3 или IgG4 человека.
Другой вариант осуществления изобретения относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, при этом вариабельный домен тяжелой цепи содержит последовательность VH, которая по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97%, 98% или 99% идентична последовательности, выбираемой из группы, состоящей из SEQ ID NO:51, 88, 92, 94, 96 и 98.
Другой вариант осуществления изобретения относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, при этом вариабельный домен тяжелой цепи содержит аминокислотную последовательность VH, выбираемую из группы, состоящей из SEQ ID NO:51, 88, 92, 94, 96 и 98.
Другой вариант осуществления изобретения относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, при этом вариабельный домен легкой цепи включает последовательность вариабельного домена лямбда-цепи, которая по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97%, 98% или 99% идентична аминокислотной последовательности, выбираемой из группы, состоящей из SEQ ID NO:55, 93, 95, 97, 99, 158, 159, 160, 161, 162, 163 и 164.
Другой вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, при этом вариабельный домен легкой цепи включает аминокислотную последовательность вариабельного домена лямбда-цепи, выбираемую из группы, состоящей из SEQ ID NO:55, 93, 95, 97, 99, 158, 159, 160, 161, 162, 163 и 164.
Другой вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека, предпочтительно являющемуся строгим антагонистом HGF-опосредованной активации рецептора с-Met и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, при этом вариабельный домен тяжелой цепи содержит последовательность VH, которая по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97%, 98% или 99% идентична последовательности, выбираемой из группы, состоящей из SEQ ID NO:51, 88, 92, 94, 96 и 98, и вариабельный домен легкой цепи содержит последовательность вариабельного домена лямбда-цепи, которая по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97%, 98% или 99% идентична аминокислотной последовательности, выбираемой из группы, состоящей из SEQ ID NO:55, 93, 95, 97, 99, 158, 159, 160, 161, 162, 163 и 164.
В типичных вариантах осуществления изобретения антитело связывается с эпитопом в пептиде

(SEQ ID NO:181) в домене SEMA белка с-Met человека.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может быть строгим антагонистом HGF-опосредованной активации белка с-Met человека и может также ингибировать HGF-независимую активацию белка с-Met человека, предпочтительно не вызывая значительного уменьшения белка с-Met человека на поверхности клетки.
В одном варианте осуществления изобретения антитело может включать СН1 домен, шарнирную область, СН2 домен и СН3 домен человеческого антитела, в частности, IgG1, IgG2, IgG3 или IgG4 человека.
Другой вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и предпочтительно являющемуся строгим антагонистом HGF-опосредованной активации рецептора с-Met, при этом антитело включает вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность, представленную SEQ ID NO:51 или SEQ ID NO:88, или ее гуманизированный или аффинный вариант, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность, представленную SEQ ID NO:55, или ее гуманизированный или аффинный вариант.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может быть строгим антагонистом HGF-опосредованной активации белка с-Met человека и может также ингибировать HGF-независимую активацию белка с-Met человека, предпочтительно не вызывая значительного уменьшения белка с-Met человека на поверхности клетки.
В одном варианте осуществления изобретения антитело может включать СН1 домен, шарнирную область, СН2 домен и СН3 домен человеческого антитела, в частности, IgG1, IgG2, IgG3 или IgG4 человека.
Другой вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека, предпочтительно являющемуся строгим антагонистом HGF-опосредованной активации рецептора с-Met и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, при этом вариабельный домен тяжелой цепи содержит последовательность VH, которая по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97%, 98% или 99% идентична аминокислотной последовательности, представленной SEQ ID NO:51 или SEQ ID NO:88, и вариабельный домен легкой цепи содержит последовательность вариабельного домена лямбда-цепи, которая по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97%, 98% или 99% идентична аминокислотной последовательности, представленной SEQ ID NO:55, ее гуманизированному или аффинному варианту.
Указанное антитело или его антигенсвязывающий фрагмент может включать CDR-области тяжелой цепи, идентичные CDR1, CDR2 и CDR3 SEQ ID NO:51 или CDR1, CDR2 и CDR3 SEQ ID NO:88, и CDR-области легкой цепи, идентичные CDR1, CDR2 и CDR3 SEQ ID NO:55, при наличии изменений аминокислотной последовательности в каркасных областях.
В типичных вариантах осуществления изобретения антитело или его антигенсвязывающий фрагмент связывается с эпитопом в пептиде
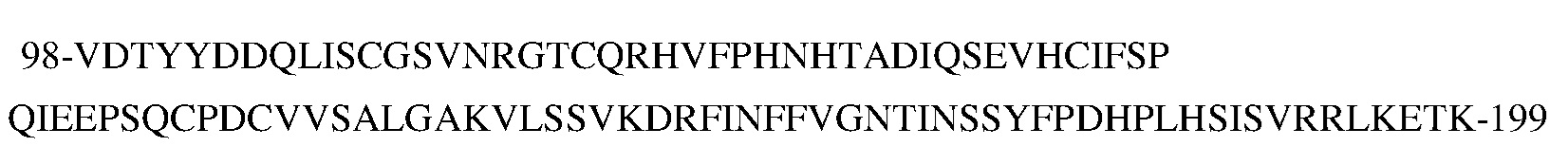
(SEQ ID NO:181) в домене SEMA белка с-Met человека.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может быть строгим антагонистом HGF-опосредованной активации белка с-Met человека и может также ингибировать HGF-независимую активацию белка с-Met человека, предпочтительно не вызывая значительного уменьшения белка с-Met человека на поверхности клетки.
В одном варианте осуществления изобретения антитело может включать СН1 домен, шарнирную область, СН2 домен и СН3 домен человеческого антитела, в частности, IgG1, IgG2, IgG3 или IgG4 человека.
Другой вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся белком с-Met человека и предпочтительно являющемуся строгим антагонистом HGF-опосредованной активации рецептора с-Met, при этом антитело является вариантом зародышевой линии человека антитела 36С4, включающим:
(а) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность, представленную SEQ ID NO:92, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность, представленную SEQ ID NO:93; или
(b) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность, представленную SEQ ID NO:94, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность, представленную SEQ ID NO:95; или
(с) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность, представленную SEQ ID NO:96, и вариабельный домен легкой цепим (VL), содержащий аминокислотную последовательность, представленную SEQ ID NO:97; или
(d) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность, представленную SEQ ID NO:98, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность, представленную SEQ ID NO:99; или
(е) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность, представленную SEQ ID NO:88, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность, выбираемую из группы, состоящей из SEQ ID NO:156, SEQ ID NO:157, SEQ ID NO:158, SEQ ID NO:159, SEQ ID NO:160, SEQ ID NO:161, SEQ ID NO:162, SEQ ID NO:163 и SEQ ID NO:164.
Антитела или антигенсвязывающие фрагменты, являющиеся вариантом антитела 36С4, включают комбинацию VH домена, определяемого со ссылкой на специфическую аминокислотную последовательность, и домена VL (вариабельный домен каппа-цепи), также определяемого со ссылкой на специфическую аминокислотную последовательность. В определение всех специфических комбинаций VH/VL входят антитела или антигенсвязывающие фрагменты, образованные путем объединения VH домена, имеющего последовательность, которая по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97% или по меньшей мере на 99% идентична указанной аминокислотной последовательности VH, и VL домена, имеющего последовательность, которая по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97% или по меньшей мере на 99% идентична указанной аминокислотной последовательности VL. В каждом случае VH и VL домены, определяемые процентным значением (%) идентичности последовательностей указанным аминокислотным последовательностям VH и VL, могут сохранять последовательности CDR, идентичные последовательностям, присутствующим в указанных аминокислотных последовательностях VH и VL, при наличии изменений аминокислотной последовательности в каркасных областях.
В типичных вариантах осуществления изобретения антитело или его антигенсвязывающий фрагмент связывается с эпитопом в пептиде
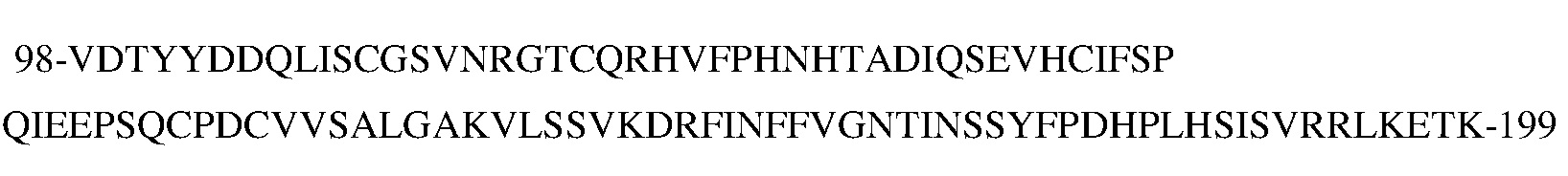
(SEQ ID NO:181) в домене SEMA белка с-Met человека.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может быть строгим антагонистом HGF-опосредованной активации белка с-Met человека и может также ингибировать HGF-независимую активацию белка с-Met человека, предпочтительно не вызывая значительного уменьшения белка с-Met человека на поверхности клетки.
В одном варианте осуществления изобретения антитело может включать СН1 домен, шарнирную область, СН2 домен и СН3 домен человеческого антитела, в частности, IgG1, IgG2, IgG3 или IgG4 человека.
Другой вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и предпочтительно являющемуся строгим антагонистом HGF-опосредованной активации рецептора с-Met, которое представляет собой аффинный вариант антитела 36C4Q, включающий вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность, представленную SEQ ID NO:88, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность, выбираемую из группы, состоящей из SEQ ID NO:156, SEQ ID NO:157, SEQ ID NO:158, SEQ ID NO:159, SEQ ID NO:160, SEQ ID NO:161, SEQ ID NO:162, SEQ ID NO:163 и SEQ ID NO:164.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может быть строгим антагонистом HGF-опосредованной активации белка с-Met человека и может также ингибировать HGF-независимую активацию белка с-Met человека, предпочтительно не вызывая значительного уменьшения белка с-Met человека на поверхности клетки.
В одном варианте осуществления изобретения указанное антитело может включать СН1 домен, шарнирную область, СН2 домен и СН3 домен человеческого антитела, в частности, IgG1, IgG2, IgG3 и IgG4 человека.
Другой вариант осуществления изобретения относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, при этом вариабельный домен тяжелой цепи содержит последовательность VH, которая по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97%, 98% или 99% идентична последовательности, представленной SEQ ID NO:48.
Другой вариант осуществления изобретения относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, при этом вариабельный домен тяжелой цепи содержит аминокислотную последовательность VH, представленную SEQ ID NO:48.
Другой вариант осуществления изобретения относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, при этом вариабельный домен легкой цепи содержит последовательность вариабельного домена лямбда-цепи, которая по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97%, 98% или 99% идентична последовательности, представленной SEQ ID NO:54.
Другой вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, при этом вариабельный домен легкой цепи включает аминокислотную последовательность вариабельного домена лямбда-цепи, представленную SEQ ID NO:48.
Другой вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и предпочтительно являющемуся строгим антагонистом HGF-опосредованной активации рецептора с-Met, при этом антитело включает вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность, представленную SEQ ID NO:48, ее гуманизированный или аффинный вариант, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность, представленную SEQ ID NO:54, ее гуманизированный или аффинный вариант.
В одном варианте осуществления изобретения антитело может включать СН1 домен, шарнирную область, СН2 домен и СН3 домен человеческого антитела, в частности, IgG1, IgG2, IgG3 и IgG4 человека.
48А2, 38Н10, 40В8 и их варианты
Другой вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи, в котором последовательность CDR3 является SEQ ID NO:15 или SEQ ID NO:18 или вариантом указанной последовательности, при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В одном варианте антитела или его антигенсвязывающего фрагмента
последовательность CDR3 вариабельного домена тяжелой цепи является SEQ ID NO:15 или SEQ ID NO:18 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена тяжелой цепи является SEQ ID NO:ХХ3 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена тяжелой цепи является SEQ ID NO:ХХ6 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В одном варианте антитела или его антигенсвязывающего фрагмента
последовательность CDR3 вариабельного домена тяжелой цепи является SEQ ID NO:15 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена тяжелой цепи является SEQ ID NO:14 или вариантом данной последовательности либо SEQ ID NO:85 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена тяжелой цепи является SEQ ID NO:13 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В одном варианте антитела или его антигенсвязывающего фрагмента
последовательность CDR3 вариабельного домена тяжелой цепи является SEQ ID NO:18 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена тяжелой цепи является SEQ ID NO:17 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена тяжелой цепи является SEQ ID NO:16 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В одном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент дополнительно включает вариабельный домен легкой цепи, где
последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:YY1 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:YY3 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:YY5 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В одном варианте антитела или его антигенсвязывающего фрагмента
последовательность CDR3 вариабельного домена легкой цепи выбирают из группы, состоящей из SEQ ID NO:87 или варианта данной последовательности, SEQ ID NO:139 или варианта данной последовательности и SEQ ID NO:141 или варианта данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:23 или вариантом данной последовательности либо SEQ ID NO:26 или вариантом данной последовательности; и
последовательность CDR1 вариабельного домена легкой цепи выбирают из группы, состоящей из SEQ ID NO:86 или варианта данной последовательности, SEQ ID NO:137 или варианта данной последовательности, SEQ ID NO:138 или варианта данной последовательности, SEQ ID NO:140 или варианта данной последовательности, SEQ ID NO:142 или варианта данной последовательности либо SEQ ID NO:143 или варианта данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В одном варианте антитела или его антигенсвязывающего фрагмента
последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:24 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:23 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:22 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В одном варианте антитела или его антигенсвязывающего фрагмента
последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:27 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:26 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:25 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
Другой вариант осуществления изобретения относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, где:
последовательность CDR3 вариабельного домена тяжелой цепи является SEQ ID NO:15 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена тяжелой цепи является SEQ ID NO:14 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена тяжелой цепи является SEQ ID NO:13 или вариантом данной последовательности;
последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:87 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:23 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:86 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент связывается с эпитопом в пептиде

(SEQ ID NO:136) в области PSI-IPT1 белка с-Met человека.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может быть строгим антагонистом HGF-опосредованной активации белка с-Met человека и может также ингибировать HGF-независимую активацию белка с-Met человека, предпочтительно не вызывая значительного уменьшения белка с-Met человека на поверхности клетки.
В одном варианте осуществления изобретения антитело может включать СН1 домен, шарнирную область, СН2 домен и СН3 домен человеческого антитела, в частности, IgG1, IgG2, IgG3 или IgG4 человека.
Другой вариант осуществления изобретения относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, где:
последовательность CDR3 вариабельного домена тяжелой цепи является SEQ ID NO:15 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена тяжелой цепи является SEQ ID NO:14 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена тяжелой цепи является SEQ ID NO:13 или вариантом данной последовательности; и вариабельный домен легкой цепи включает комбинацию CDR-областей, выбираемую из следующих последовательностей:
(i) последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:24 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:23 или вариантом данной последовательности; и
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:22 или вариантом данной последовательности; и
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности;
(ii) последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:87 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:26 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:137 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности; или
(iii) последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:139 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:26 или вариантом данной последовательности; и
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:138 или вариантом данной последовательности; и
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности; или
(iv) последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:141 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:26 или вариантом данной последовательности; и
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:140 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности; или
(v) последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:141 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:26 или вариантом данной последовательности; и
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:142 или вариантом данной последовательности; и
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности; или
(vi) последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:87 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:26 или вариантом данной последовательности; и
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:86 или вариантом данной последовательности; и
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности; или
(vii) последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:87 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:26 или вариантом данной последовательности; и
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:143 или вариантом данной последовательности; и
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент связывается с эпитопом в пептиде

(SEQ ID NO:136) в области PSI-IPT1 белка с-Met человека.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может быть строгим антагонистом HGF-опосредованной активации белка с-Met человека и может также ингибировать HGF-независимую активацию белка с-Met человека, предпочтительно не вызывая значительного уменьшения белка с-Met человека на поверхности клетки.
В одном варианте осуществления изобретения антитело может включать СН1 домен, шарнирную область, СН2 домен и СН3 домен человеческого антитела, в частности, IgG1, IgG2, IgG3 или IgG4 человека.
Другой вариант осуществления изобретения относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, где
последовательность CDR3 вариабельного домена тяжелой цепи является SEQ ID NO:18 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена тяжелой цепи является SEQ ID NO:17 или вариантом данной последовательности; и
последовательность CDR1 вариабельного домена тяжелой цепи является SEQ ID NO:16 или вариантом данной последовательности;
последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:27 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:26 или вариантом данной последовательности; и
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:25 или вариантом данной последовательности; и
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент связывается с эпитопом в пептиде

(SEQ ID NO:136) в области PSI-IPT1 белка с-Met человека.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может быть строгим антагонистом HGF-опосредованной активации белка с-Met человека и может также ингибировать HGF-независимую активацию белка с-Met человека, предпочтительно не вызывая значительного уменьшения белка с-Met человека на поверхности клетки.
В одном варианте осуществления изобретения антитело может включать СН1 домен, шарнирную область, СН2 домен и СН3 домен человеческого антитела, в частности, IgG1, IgG2, IgG3 или IgG4 человека.
Другой вариант осуществления изобретения относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, при этом вариабельный домен тяжелой цепи содержит последовательность VH, которая по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97%, 98% или 99% идентична аминокислотной последовательности, выбираемой из группы, состоящей из SEQ ID NO:49, 108, 110, 112, 114, 116, 118 и 120.
Другой вариант осуществления изобретения относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, при этом вариабельный домен тяжелой цепи содержит аминокислотную последовательность VH, выбираемую из группы, состоящей из SEQ ID NO:49, 108, 110, 112, 114, 116, 118 и 120.
Другой вариант осуществления изобретения относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, при этом вариабельный домен легкой цепи содержит последовательность вариабельного домена каппа-цепи, которая по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97%, 98% или 99% идентична аминокислотной последовательности, выбираемой из группы, состоящей из SEQ ID NO:52, 89, 109, 111, 113, 115, 117, 119, 121, 149, 150, 151, 152, 153, 154, 155, 156 и 157.
Другой вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, при этом вариабельный домен легкой цепи содержит аминокислотную последовательность VL, выбираемую из группы, состоящей из SEQ ID NO:52, 89, 109, 111, 113, 115, 117, 119, 121, 149, 150, 151, 152, 153, 154, 155, 156 и 157.
Другой вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, при этом вариабельный домен тяжелой цепи содержит последовательность VH, которая по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97%, 98% или 99% идентична аминокислотной последовательности, выбираемой из группы, состоящей из SEQ ID NO:49, 108, 110, 112, 114, 116, 118 и 120, и вариабельный домен легкой цепи содержит последовательность вариабельного домена каппа-цепи, которая по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97%, 98% или 99% идентична аминокислотной последовательности, выбираемой из группы, состоящей из SEQ ID NO:52, 89, 109, 111, 113, 115, 117, 119, 121, 149, 150, 151, 152, 153, 154, 155, 156 и 157.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент связывается с эпитопом в пептиде

(SEQ ID NO:136) в области PSI-IPT1 белка с-Met человека.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может быть строгим антагонистом HGF-опосредованной активации белка с-Met человека и может также ингибировать HGF-независимую активацию белка с-Met человека, предпочтительно не вызывая значительного уменьшения белка с-Met человека на поверхности клетки.
В одном варианте осуществления изобретения антитело может включать СН1 домен, шарнирную область, СН2 домен и СН3 домен человеческого антитела, в частности, IgG1, IgG2, IgG3 или IgG4 человека.
Другой вариант осуществления изобретения относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи, содержащий последовательность VH, которая по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97%, 98% или 99% идентична последовательности SEQ ID NO:49, и вариабельный домен легкой цепи (VL), содержащий последовательность вариабельного домена каппа-цепи, которая по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97%, 98% или 99% идентична аминокислотной последовательности, представленной SEQ ID NO:52, или аминокислотной последовательности, представленной SEQ ID NO:89.
Указанное антитело или его антигенсвязывающий фрагмент может включать CDR-области тяжелой цепи, идентичные CDR1, CDR2 и CDR3 SEQ ID NO:49, и CDR-области легкой цепи, идентичные CDR1, CDR2 и CDR3 SEQ ID NO:89 или CDR1, CDR2 и CDR3 SEQ ID NO:52, при наличии изменений аминокислотной последовательности в каркасных областях.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент связывается с эпитопом в пептиде

(SEQ ID NO:136) в области PSI-IPT1 белка с-Met человека.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может быть строгим антагонистом HGF-опосредованной активации белка с-Met человека и может также ингибировать HGF-независимую активацию белка с-Met человека, предпочтительно не вызывая значительного уменьшения белка с-Met человека на поверхности клетки.
В одном варианте осуществления изобретения антитело может включать СН1 домен, шарнирную область, СН2 домен и СН3 домен человеческого антитела, в частности, IgG1, IgG2, IgG3 или IgG4 человека.
Другой вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и предпочтительно являющемуся строгим антагонистом HGF-опосредованной активации рецептора с-Met, при этом антитело включает вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность, представленную SEQ ID NO:49, или ее гуманизированный или аффинный вариант, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность, представленную SEQ ID NO:52, или аминокислотную последовательность, представленную SEQ ID NO:89, или ее гуманизированный или аффинный вариант.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент связывается с эпитопом в пептиде

(SEQ ID NO:136) в области PSI-IPT1 белка с-Met человека.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может быть строгим антагонистом HGF-опосредованной активации белка с-Met человека и может также ингибировать HGF-независимую активацию белка с-Met человека, предпочтительно не вызывая значительного уменьшения белка с-Met человека на поверхности клетки.
В одном варианте осуществления изобретения антитело может включать СН1 домен, шарнирную область, СН2 домен и СН3 домен человеческого антитела, в частности, IgG1, IgG2, IgG3 или IgG4 человека.
Другой вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность, представленную SEQ ID NO:49, или ее гуманизированный или аффинный вариант, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательноть, представленную SEQ ID NO:89, или ее гуманизированный или аффинный вариант.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент связывается с эпитопом в пептиде

(SEQ ID NO:136) в области PSI-IPT1 белка с-Met человека.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может быть строгим антагонистом HGF-опосредованной активации белка с-Met человека и может также ингибировать HGF-независимую активацию белка с-Met человека, предпочтительно не вызывая значительного уменьшения белка с-Met человека на поверхности клетки.
В одном варианте осуществления изобретения антитело может включать СН1 домен, шарнирную область, СН2 домен и СН3 домен человеческого антитела, в частности, IgG1, IgG2, IgG3 или IgG4 человека.
Другой вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и предпочтительно являющемуся строгим антагонистом HGF-опосредованной активации рецептора с-Met, при этом антитело является вариантом антитела 48А2, гуманизированным согласно зародышевой линии человека, включающим:
(а) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность, представленную SEQ ID NO:108, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность, представленную SEQ ID NO:109; или
(b) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность, представленную SEQ ID NO:110, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность, представленную SEQ ID NO:111; или
(с) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность, представленную SEQ ID NO:112, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность, представленную SEQ ID NO:113; или
(d) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность, представленную SEQ ID NO:114, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность, представленную SEQ ID NO:115; или
(е) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность, представленную SEQ ID NO:116, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность, представленную SEQ ID NO:117; или
(f) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность, представленную SEQ ID NO:118, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность, представленную SEQ ID NO:119; или
(g) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность, представленную SEQ ID NO:120, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность, представленную SEQ ID NO:121; или
(h) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность, представленную SEQ ID NO:49, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность, выбираемую из группы, состоящей из SEQ ID NO:149, SEQ ID NO:150, SEQ ID NO:151, SEQ ID NO:152, SEQ ID NO:153, SEQ ID NO:154, SEQ ID NO:155, SEQ ID NO:156 и SEQ ID NO:157.
Указанные варианты антитела 48А2 или антигенсвязывающие области включают комбинацию VH домена, определяемого со ссылкой на специфическую аминокислотную последовательность, и VL домена (вариабельный домен каппа-цепи), также определяемого со ссылкой на специфическую аминокислотную последовательность. Для каждой конкретной комбинации VH/VL указанное определение включает антитела или антигенсвязывающие области, образованные путем объединения VH домена, содержащего последовательность, которая по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97% или по меньшей мере на 99% идентична указанной аминокислотной последовательности VH, и VL домена, содержащего последовательность, которая по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97% или по меньшей мере на 99% идентична указанной аминокислотной последовательности VL. В каждом случае VH и VL домены, последовательности которых в процентном выражении (%) идентичны указанным аминокислотным последовательностям VH и VL, могут сохранять последовательности CDR, идентичные последовательностям, присутствующим в указанных аминокислотных последовательностях VH и VL, при наличии изменений аминокислотной последовательности в каркасных областях.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент связывается с эпитопом в пептиде

(SEQ ID NO:136) в области PSI-IPR1 белка с-Met человека.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может быть строгим антагонистом HGF-опосредованной активации белка с-Met человека и может также ингибировать HGF-независимую активацию белка с-Met человека, предпочтительно не вызывая значительного уменьшения белка с-Met человека на поверхности клетки.
В одном варианте осуществления изобретения антитело может включать СН1 домен, шарнирную область, СН2 домен и СН3 домен человеческого антитела, в частности, IgG1, IgG2, IgG3 или IgG4 человека.
Другой вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагаменту, специфически связывающемуся с белком с-Met человека и предпочтительно являющемуся строгим антагонистом HGF-опосредованной активации рецептора с-Met, при этом указанное антитело является аффинным вариантом эталонного антитела 48А2, включающим вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность, представленную SEQ ID NO:49, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность, выбираемую из группы, состоящей из SEQ ID NO:149, SEQ ID NO:150, SEQ ID NO:151, SEQ ID NO:152, SEQ ID NO:153, SEQ ID NO:154, SEQ ID NO:155, SEQ ID NO:156 и SEQ ID NO:157.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может быть строгим антагонистом HGF-опосредованной активации белка с-Met человека и может также ингибировать HGF-независимую активацию белка с-Met человека, предпочтительно не вызывая значительного уменьшения белка с-Met человека на поверхности клетки.
В одном варианте осуществления изобретения антитело может включать СН1 домен, шарнирную область, СН2 домен и СН3 домен человеческого антитела, в частности, IgG1, IgG2, IgG3 или IgG4 человека.
Другой вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и предпочтительно являющемуся строгим антагонистом HGF-опосредованной активации рецептора с-Met, при этом указанное антитело включает вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность, представленную SEQ ID NO:50, или ее гуманизированный или аффинный вариант, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность, представленную SEQ ID NO:53, или ее гуманизированный или аффинный вариант.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может быть строгим антагонистом HGF-опосредованной активации белка с-Met человека и может также ингибировать HGF-независимую активацию белка с-Met человека, предпочтительно не вызывая значительного уменьшения белка с-Met человека на поверхности клетки.
В одном варианте осуществления изобретения антитело может включать СН1 домен, шарнирную область, СН2 домен и СН3 домен человеческого антитела, в частности, IgG1, IgG2, IgG3 или IgG4 человека.
20А11, 13Е6, 12G4
Другой вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи, содержащий последовательность CDR3, выбираемую из группы, состоящей из SEQ ID NO:3, SEQ ID NO:6, SEQ ID NO:9 или варианта указанной последовательности, при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В одном варианте антитела или его антигенсвязывающего фрагмента
последовательность CDR3 вариабельного домена тяжелой цепи выбирают из группы, состоящей из SEQ ID NO:3, SEQ ID NO:6, SEQ ID NO:9 или варианта указанной последовательности;
последовательность CDR2 вариабельного домена тяжелой цепи является SEQ ID NO:ХХ1 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена тяжелой цепи является SEQ ID NO:ХХ4 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В одном варианте антитела или его антигенсвязывающего фрагмента последовательность CDR3 вариабельного домена тяжелой цепи является SEQ ID NO:3 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена тяжелой цепи является SEQ ID NO:2 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена тяжелой цепи является SEQ ID NO:1 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В одном варианте антитела или его антигенсвязывающего фрагмента последовательность CDR3 вариабельного домена тяжелой цепи является SEQ ID NO:6 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена тяжелой цепи является SEQ ID NO:5 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена тяжелой цепи является SEQ ID NO:4 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В одном варианте антитела или его антигенсвязывающего фрагмента последовательность CDR3 вариабельного домена тяжелой цепи является SEQ ID NO:9 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена тяжелой цепи является SEQ ID NO:8 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена тяжелой цепи является SEQ ID NO:7 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В одном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент дополнительно включает вариабельный домен легкой цепи, где последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:YY2 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:YY4 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:YY6 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В одном варианте антитела или его антигенсвязывающего фрагмента последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:36 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:35 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:34 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В одном варианте антитела или его антигенсвязывающего фрагмента последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:39 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:38 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:37 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В одном варианте антитела или его антигенсвязывающего фрагмента последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:42 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:41 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:40 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
Другой вариант осуществления изобретения относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, где:
последовательность CDR3 вариабельного домена тяжелой цепи является SEQ ID NO:9 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена тяжелой цепи является SEQ ID NO:8 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена тяжелой цепи является SEQ ID NO:7 или вариантом данной последовательности;
последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:42 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:41 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:40 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может быть строгим антагонистом HGF-опосредованной активации белка с-Met человека и может также ингибировать HGF-независимую активацию белка с-Met человека, предпочтительно не вызывая значительного уменьшения белка с-Met человека на поверхности клетки.
В одном варианте осуществления изобретения антитело может включать СН1 домен, шарнирную область, СН2 домен и СН3 домен человеческого антитела, в частности, IgG1, IgG2, IgG3 или IgG4 человека.
Другой вариант осуществления изобретения относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, где:
последовательность CDR3 вариабельного домена тяжелой цепи является SEQ ID NO:6 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена тяжелой цепи является SEQ ID NO:5 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена тяжелой цепи является SEQ ID NO:4 или вариантом данной последовательности;
последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:39 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:38 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:37 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может быть строгим антагонистом HGF-опосредованной активации белка с-Met человека и может также ингибировать HGF-независимую активацию белка с-Met человека, предпочтительно не вызывая значительного уменьшения белка с-Met человека на поверхности клетки.
В одном варианте осуществления изобретения антитело может включать СН1 домен, шарнирную область, СН2 домен и СН3 домен человеческого антитела, в частности, IgG1, IgG2, IgG3 или IgG4 человека.
Другой вариант осуществления изобретения относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, где:
последовательность CDR3 вариабельного домена тяжелой цепи является SEQ ID NO:3 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена тяжелой цепи является SEQ ID NO:2 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена тяжелой цепи является SEQ ID NO:1 или вариантом данной последовательности;
последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:36 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:35 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:34 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может быть строгим антагонистом HGF-опосредованной активации белка с-Met человека и может также ингибировать HGF-независимую активацию белка с-Met человека, предпочтительно не вызывая значительного уменьшения белка с-Met человека на поверхности клетки.
В одном варианте осуществления изобретения антитело может включать СН1 домен, шарнирную область, СН2 домен и СН3 домен человеческого антитела, в частности, IgG1, IgG2, IgG3 или IgG4 человека.
Другой вариант осуществления изобретения относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, при этом вариабельный домен тяжелой цепи содержит последовательность VH, которая по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97%, 98% или 99% идентична аминокислотной последовательности, выбираемой из группы, состоящей из SEQ ID NO:45, 46 и 47.
Другой вариант осуществления изобретения относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, при этом вариабельный домен тяжелой цепи содержит аминокислотную последовательность VH, выбираемую из группы, состоящей из SEQ ID NO:45, 46 и 47.
Другой вариант осуществления изобретения относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, при этом вариабельный домен легкой цепи содержит последовательность вариабельного домена лямбда-цепи, которая по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97%, 98% или 99% идентична аминокислотной последовательности, выбираемой из группы, состоящей из SEQ ID NO:56, 57 и 58.
Другой вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, при этом вариабельный домен легкой цепи включает аминокислотную последовательность вариабельного домена лямбда-цепи, выбираемую из группы, состоящей из SEQ ID NO:56, 57 и 58.
Другой вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и предпочтительно являющемуся строгим антагонистом HGF-опосредованной активации рецептора с-Met, при этом антитело включает вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность, представленную SEQ ID NO:45, или ее гуманизированный или аффинный вариант, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность, представленную SEQ ID NO:56, или ее гуманизированный или аффинный вариант.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может быть строгим антагонистом HGF-опосредованной активации белка с-Met человека и может также ингибировать HGF-независимую активацию белка с-Met человека, предпочтительно не вызывая значительного уменьшения белка с-Met человека на поверхности клетки.
В одном варианте осуществления изобретения антитело может включать СН1 домен, шарнирную область, СН2 домен и СН3 домен человеческого антитела, в частности, IgG1, IgG2, IgG3 или IgG4 человека.
Другой вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и являющемуся строгим антагонистом HGF-опосредованной активации рецептора с-Met, при этом антитело включает вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность, представленную SEQ ID NO:46, или ее гуманизированный или аффинный вариант, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность, представленную SEQ ID NO:57, или ее гуманизированный или аффинный вариант.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может быть строгим антагонистом HGF-опосредованной активации белка с-Met человека и может также ингибировать HGF-независимую активацию белка с-Met человека, предпочтительно не вызывая значительного уменьшения белка с-Met человека на поверхности клетки.
В одном варианте осуществления изобретения антитело может включать СН1 домен, шарнирную область, СН2 домен и СН3 домен человеческого антитела, в частности, IgG1, IgG2, IgG3 или IgG4 человека.
Другой вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и являющемуся строгим антагонистом HGF-опосредованной активации рецептора с-Met, при этом антитело включает вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность, представленную SEQ ID NO:47, или ее гуманизированный или аффинный вариант, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность, представленную SEQ ID NO:58, или ее гуманизированный или аффинный вариант.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может быть строгим антагонистом HGF-опосредованной активации белка с-Met человека и может также ингибировать HGF-независимую активацию белка с-Met человека, предпочтительно не вызывая значительного уменьшения белка с-Met человека на поверхности клетки.
В одном варианте осуществления изобретения антитело может включать СН1 домен, шарнирную область, СН2 домен и СН3 домен человеческого антитела, в частности, IgG1, IgG2, IgG3 или IgG4 человека.
34Н7
Другой вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи, где последовательность CDR3 вариабельного домена тяжелой цепи является SEQ ID NO:73 или вариантом данной последовательности, при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В одном варианте антитела или его антигенсвязывающего фрагмента
последовательность CDR3 вариабельного домена тяжелой цепи является SEQ ID NO:73 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена тяжелой цепи является SEQ ID NO:72 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена тяжелой цепи является SEQ ID NO:71 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В одном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент дополнительно включает вариабельный домен легкой цепи, где
последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:76 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:75 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:74 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент, включающий все шесть указанных CDR-областей тяжелой цепи и легкой цепи, может быть строгим антагонистом HGF-опосредованной активации белка с-Met человека и также может ингибировать HGF-независимую активацию белка с-Met человека, предпочтительно не вызывая значительного уменьшения белка с-Met человека на поверхности клетки.
В одном варианте осуществления изобретения антитело может включать СН1 домен, шарнирную область, СН2 домен и СН3 домен человеческого антитела, в частности, IgG1, IgG2, IgG3 или IgG4 человека.
Другой вариант осуществления изобретения относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, при этом вариабельный домен тяжелой цепи содержит последовательность VH, которая по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97%, 98% или 99% идентична аминокислотной последовательности, представленной SEQ ID NO:77.
Другой вариант осуществления изобретения относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, при этом вариабельный домен тяжелой цепи содержит аминокислотную последовательность VH, представленную SEQ ID NO:77.
Другой вариант осуществления изобретения относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, при этом вариабельный домен легкой цепи содержит последовательность вариабельного домена лямбда-цепи, которая по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97%, 98% или 99% идентична аминокислотной последовательности, представленной SEQ ID NO:78.
Другой вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, при этом вариабельный домен легкой цепи содержит аминокислотную последовательность VL, представленную SEQ ID NO:78.
Другой вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и предпочтительно являющемуся строгим антагонистом HGF-опосредованной активации рецептора с-Met, при этом антитело включает вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность, представленную SEQ ID NO:77, или ее гуманизированный или аффинный вариант, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность, представленную SEQ ID NO:78, или ее гуманизированный или аффинный вариант.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может быть строгим антагонистом HGF-опосредованной активации белка с-Met человека и может также ингибировать HGF-независимую активацию белка с-Met человека, предпочтительно не вызывая значительного уменьшения белка с-Met человека на поверхности клетки.
В одном варианте осуществления изобретения антитело может включать СН1 домен, шарнирную область, СН2 домен и СН3 домен человеческого антитела, в частности, IgG1, IgG2, IgG3 или IgG4 человека.
Если конкретные антитела или антигенсвязывающие области включают комбинацию VH домена, определяемого со ссылкой на специфическую аминокислотную последовательность, и VL домена (вариабельный домен каппа-цепи), также определяемого со ссылкой на специфическую аминокислотную последовательность, тогда для каждой конкретной комбинации VH/VL (за исключением особо оговоренных случаев) указанное определение включает антитела или антигенсвязывающие области, образованные комбинацией VH домена, содержащего последовательность, которая по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97% или по меньшей мере на 99% идентична указанной аминокислотной последовательности VH, и VL домена, содержащего последовательность, которая по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97% или по меньшей мере на 99% идентична указанной аминокислотной последовательности VL. В каждом случае VH и VL домены, последовательности которых в процентном выражении (%) идентичны указанным аминокислотным последовательностям VH и VL, могут сохранять последовательности CDR, идентичные последовательностям, присутствующим в указанных аминокислотных последовательностях VH и VL, при наличии изменений аминокислотной последовательности в каркасных областях.
За исключением случаев, особо оговоренных в настоящем заявке на патент, % идентичности двух аминокислотных последовательностей может быть определен путем выполнения оптимального сравнительного анализа, при этом сравниваемая аминокислотная последовательность может включать добавления или делеции относительно эталонной последовательности, необходимые для оптимального совмещения двух указанных последовательностей. Процентное значение идентичности вычисляют, определяя число положений, в которых аминокислотные остатки являются идентичными в двух последовательностях, после чего число идентичных положений делят на общее число положений в окне сравнения и умножают полученный результат на 100 для получения процентного значения идентичности двух указанных последовательностей. Например, можно использовать программу BLAST, “BLAST 2 sequences” (Tatusova et al., “Blast 2 sequences - a new tool for comparing protein and nucleotide sequences”, FEMS Microbiol Lett. 174:247-250), доступную на сайте http://www.ncbi.nlm.nih.gov/gorf/bl2.html, в которой использованы параметры по умолчанию (в частности, для параметров “штраф за открытый разрыв”: 5, и “штраф за длинный разрыв”: 2; выбранная матрица является, например, матрицей “BLOSUM 62”, предлагаемой программой), при этом процентное значение идентичности двух сравниваемых последовательностей вычисляется непосредственно программой.
Антитела против с-Met или их антигенсвязывающие фрагменты по настоящему изобретению могут обладать одним или несколькими следующими свойствами/признаками или любой комбинацией указанных признаков.
Антитело или антигенсвязывающий фрагмент может действовать в качестве ингибитора HGF-независимой активации рецептора с-Met.
Антитело или антигенсвязывающий фрагмент может ингибировать HGF-независимую димеризацию, в частности, гомодимеризацию и/или гетеродимеризацию белка с-Met человека.
Антитело может обладать одной или несколькими эффекторными функциями, выбираемыми из антителозависимой клеточно-опосредованной цитотоксичности (ADCC), комплементзависимой цитотоксичности (CDC) и антителозависимого клеточно-опосредованного фагоцитоза (ADCP), в отношении клеток, экспрессирующий белок с-Met человека на поверхности клетки.
Антитело может обладать функцией ADCC, направленной против раковых клеток, содержащих с-Met.
Указанное антитело может обладать более выраженной функцией ADCC по сравнению с эталонным антителом, которое является эквивалентным антителом, включающим нативный Fc-домен человека. В неограничивающем варианте осуществления изобретения функция ADCC может быть усилена по меньшей мере в 10 раз по сравнению с эталонным антителом, включающим нативный Fc-домен человека. В данном контексте термин “эквивалент” может означать, что антитело с усиленной функцией ADCC обладает по существу идентичной антигенсвязывающей специфичностью и/или содержит аминокислотную последовательность, идентичную аминокислотной последовательности эталонного антитела, за исключением любых модификаций, произведенных (относительно нативного Fc-домена человека) с целью усиления ADCC.
Антитело может содержать шарнирную область, СН2 домен и СН3 домен IgG человека, наиболее предпочтительно IgG1 человека.
Антитело может включать модификации в Fc-области, рассмотренные в настоящем описании изобретения. В частности, антитело может представлять собой нефукозилированный IgG.
Другими объектами изобретения также являются полинуклеотидные молекулы, кодирующие вышеуказанные антитела против с-Met и их антигенсвязывающие фрагменты, а также экспрессирующие векторы, включающие указанные полинуклеотиды, клетки-хозяева, содержащие векторы, и способы рекомбинантной экспрессии/продуцирования антител против с-Met.
Еще одним объектом настоящего изобретения является фармацевтическая композиция, включающая любые вышеуказанные антитела против с-Met и фармацевтически приемлемый носитель или наполнитель.
Еще одним объектом настоящего изобретения являются способы консервативного лечения с использованием вышеуказанных антител против с-Met, в частности, при лечении рака, в том числе HGF-зависимых раков и HGF-независимых раков.
Определения терминов
“Антитело” или “иммуноглобулин”. В использованном здесь значении термин “иммуноглобулин” означает полипептид, включающий комбинацию из двух тяжелых и двух легких цепей, независимо от наличия или отсутствия специфической иммунореактивности. Термин “антитело” означает молекулы, обладающие значительной известной специфической иммунореактивностью в отношении представляющего интерес антигена (например, с-Met человека). Термин “антитела против с-Met” в использованном здесь значении означает антитела, обладающие иммунологической специфичностью в отношении белка с-Met человека. Как указано в настоящем описании изобретения, “специфичность” в отношении с-Met человека не исключает перекрестной реактивности в отношении видов, гомологичных с-Met. Антитела и иммуноглобулины включают легкие и тяжелые цепи при наличии или отсутствии межцепочечной ковалентной связи между указанными цепями. Структуры основных иммуноглобулинов у позвоночных относительно хорошо изучены.
В определение общего термина “иммуноглобулин” входят пять разных классов антител, отличающихся в биохимическом отношении. Все пять классов антител входят в объем настоящего изобретения, при этом описание обычно относится к молекулам иммуноглобулина класса IgG. Иммуноглобулины класса IgG включают две одинаковые легкие полипептидные цепи с молекулярной массой около 23000 дальтон и две одинаковые тяжелые цепи с молекулярной массой 53000-70000. Четыре указанные цепи соединены дисульфидными связями в виде “Y” конфигурации, где легкие цепи охватывают тяжелые цепи, начинающиеся у раздвоенного конца “Y” и проходящие через вариабельную область.
Легкие цепи антитела классифицированы как каппа или лямбда (κ, λ). Тяжелые цепи каждого класса могут быть связаны с легкой каппа- или лямбда-цепью. Как правило, легкие и тяжелые цепи связаны друг с другом ковалентной связью, и “хвостовые” части двух тяжелых цепей связаны друг с другом ковалентными дисульфидными связями или нековалентными связями в случае иммуноглобулинов, образованных гибридомами, В-клетками или генетически созданными клетками-хозяевами. Аминокислотные последовательности тяжелой цепи проходят от N-конца в положении раздвоенных концов Y конфигурации в направлении С-конца в положении основания каждой цепи. Специалистам в данной области известно, что тяжелые цепи классифицируются как гамма, мю, альфа, дельта или эпсилон (γ, µ, α, δ, ε) при наличии подклассов (например, γ1-γ4). Тип данной цепи определяет “класс” антитела как IgG, IgM, IgA, IgG или IgE. Подклассы иммуноглобулинов (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и т.д., хорошо исследованы и, как известно, определяют функциональную специализацию. Квалифицированный специалист может легко определить модифицированные варианты каждого из указанных классов и изотипов, входящие в объем настоящего изобретения, на основании настоящего описания изобретения.
Как было указано выше, вариабельная область антитела позволяет антителу избирательно узнавать и специфически связываться с эпитопами на антигенах. То есть, VL домен и VH домен антитела совместно образуют вариабельную область, определяющую трехмерный антигенсвязывающий сайт. Четвертичная структура антитела позволяет образовать антигенсвязывающий сайт в конце каждого плеча Y. В частности, антигенсвязывающий сайт образуется тремя областями, определяющими комплементарность, (CDR) во всех VH и VL цепях.
“Белок с-Met” или “рецептор с-Met”. В использованном здесь значении термины “белок с-Met”, “рецептор с-Met” или “с-Met” имеют взаимозаменяемые значения и означают рецептор тирозинкиназу, который в диком виде связывается с фактором роста гепатоцитов (HGF). Термины “белок с-Met человека”, “рецептор с-Met человека” или “с-Met человека” имеют взаимозаменяемые значения и означают с-Met человека, включая нативный белок с-Met человека, естественным образом экспрессированный в организме человека и/или на поверхности культивируемых линий клеток человека, а также его рекомбинантные формы и фрагменты, естественные мутантные формы, полиморфные варианты и функционально активные мутантные формы. Конкретные примеры с-Met человека включают, например, человеческий полипептид, кодированный нуклеотидной последовательностью, депонированной в GenBank под номером доступа NM_000245, или человеческий белок, кодированный полипептидной последовательностью, депонированной в GenBank под номером доступа NP_000236, или ее внеклеточным доменом. Одноцепочечный предшественник белка с-Met расщепляется после трансляции с образованием альфа- и бета-субъединиц, связанных дисульфидной связью с образованием зрелого рецептора. Антитела против с-Met по настоящему изобретению обычно связываются со зрелым белком с-Met человека, экспрессированным на поверхности клетки, например, экспрессированным в линии клеток желудка человека MKN-45, и с рекомбинантным белком с-Met человека (например, рекомбинантным димерным белком с-Met, предоставляемым компанией R&D systems, 358-MT/CF).
“Сайт связывания”. В использованном здесь значении термин “сайт связывания” означает область полипептида, отвечающую за избирательное связывание с исследуемым антигеном-мишенью (например, с-Met человека). Домены или области связывания включают по меньшей мере один сайт связывания. Типичные домены связывания включают вариабельный домен антитела. Молекулы антитела по настоящему изобретению могут включать один антигенсвязывающий сайт или несколько (например, два, три или четыре) антигенсвязывающих сайтов.
“Выделенный из”. В использованном здесь значении термин “выделенный из” указанного белка (например, антитело против с-Met или его антигенсвязывающий фрагмент) означает получение из конкретного полипептида. В одном варианте осуществления изобретения полипептид или аминокислотная последовательность, выделенная из конкретного исходного полипептида, является последовательностью CDR или родственной последовательностью. В одном варианте осуществления изобретения аминокислотная последовательность, выделенная из определенного исходного полипептида, не является смежной. Например, в одном варианте осуществления изобретения из исходного антитела может быть выделена одна, две, три, четыре, пять или шесть CDR-областей. В одном варианте осуществления изобретения полипептидная или аминокислотная последовательность, выделенная из определенной исходной полипептидной или аминокислотной последовательности, включает аминокислотную последовательность, которая по существу идентична исходной последовательности или ее части которая состоит по меньшей мере из 3-5 аминокислот, 5-10 аминокислот, по меньшей мере из 10-20 аминокислот, по меньшей мере из 20-30 аминокислот или по меньшей мере из 30-50 аминокислот, или может быть идентифицирована специалистом в данной области как часть исходной последовательности. В одном варианте осуществления изобретения одна или несколько последовательностей CDR, выделенных из исходного антитела, могут быть изменены с образования вариантных последовательностей CDR, например, аффинных вариантов, в которых вариантные последовательности CDR сохраняют активность связывания с с-Met.
“Выделенный у верблюда”. В определенных предпочтительных вариантах осуществления изобретения молекулы антитела против с-Met включают аминокислотные последовательности каркасных областей и/или аминокислотные последовательности CDR, выделенные из обычного антитела верблюда, образовавшегося в результате активной иммунизации верблюда антигеном с-Met. Однако антитела против с-Met, включающие аминокислотные последовательности, выделенные у верблюда, могут включать последовательности каркасной и/или константной области, полученные из аминокислотной последовательности человека или другого вида млекопитающих, отличного от верблюда. Например, антитела против с-Met могут включать каркасную область, часть тяжелой цепи и/или часть шарнирной области человека или примата кроме человека. В одном варианте осуществления изобретения в каркасной области антитела против с-Met, “выделенного у верблюда”, может присутствовать одна или несколько аминокислот, отличных от аминокислот верблюда, например, аминокислотная последовательность каркасной области верблюда может включать одну или несколько мутаций аминокислот, в которых присутствует соответствующий аминокислотный остаток человека или примата кроме человека. Кроме того, VH и VL домены, выделенные у верблюда, или их гуманизированные варианты могут быть связаны с константными доменами человеческих антител с образованием химерной молекулы, рассмотренной в настоящем описании изобретения.
“Консервативная замена аминокислоты”. “Консервативная замена аминокислоты” является заменой, в соответствии с которой аминокислотный остаток заменяется аминокислотным остатком, имеющим подобную боковую цепь. В данной области классифицированы семейства аминокислотных остатков, имеющие одинаковые боковые цепи, в том числе основные боковые цепи (например, лизин, аргинин, гистидин), кислотные боковые цепи (например, аспарагиновая кислота, глутаминовая кислота), незаряженные полярные боковые цепи (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), неполярные боковые цепи (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленные боковые цепи (например, треонин, валин, изолейцин) и ароматические боковые цепи (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, остаток заменимой аминокислоты в полипептиде иммуноглобулина может быть заменен другим аминокислотным остатком из семейства с такими же боковыми цепями. В другом варианте осуществления изобретения цепь аминокислот может быть заменена цепью, подобной в структурном отношении, которая отличается порядком и/или составом членов семейства боковых цепей.
“Часть тяжелой цепи”. В использованном здесь значении термин “часть тяжелой цепи” означает аминокислотные последовательности, выделенные из константных доменов тяжелой цепи иммуноглобулина. Полипептид, включающий часть тяжелой цепи, содержит по меньшей мере один из следующих элементов: СН1 домен, шарнирный домен (например, верхнюю, среднюю и/или нижнюю шарнирную область), СН2 домен, СН3 домен, их вариант или фрагмент. В одном варианте осуществления изобретения связывающая молекула по настоящему изобретению может включать Fc-часть тяжелой цепи иммуноглобулина (например, шарнирную часть, СН2 домен и СН3 домен). В другом варианте осуществления изобретения в связывающей молекуле по настоящему изобретению отсутствует по меньшей мере часть константного домена (например, весь СН2 домен или его часть). В определенных вариантах осуществления изобретения по меньшей мере один и предпочтительно все константные домены выделены из тяжелой цепи иммуноглобулина человека. Например, в одном предпочтительном варианте осуществления изобретения часть тяжелой цепи включает полностью человеческий шарнирный домен. В других предпочтительных вариантах осуществления изобретения часть тяжелой цепи включает полностью человеческую Fc-часть (например, последовательности шарнирного домена, СН2 и СН3 доменов из иммуноглобулина человека). В определенных вариантах осуществления изобретения константные домены части тяжелой цепи получены из разных молекул иммуноглобулина. Например, часть тяжелой цепи полипептида может включать СН2 домен, выделенный из молекулы IgG1, и шарнирную область, выделенную из молекулы IgG3 или IgG4. В других вариантах осуществления изобретения константные домены являются химерными доменами, включающими части разных молекул иммуноглобулина. Например, шарнирная область может включать первую часть из молекулы IgG1 и вторую часть из молекулы IgG3 или IgG4. Как было указано выше, специалисту в данной области должно быть известно, что константные домены части тяжелой цепи могут быть модифицированы с изменением аминокислотной последовательности из природной молекулы иммуноглобулина (дикого типа). То есть, полипептиды по настоящему изобретению могут включать изменения или модификации одного или нескольких константных доменов тяжелой цепи (СН1, шарнирная область, СН2 или СН3) и/или константного домена легкой цепи (CL). Типичные модификации включают добавления, делеции или замены одной или нескольких аминокислот в одном или нескольких доменах.
“Химерный”. “Химерный” белок включает первую аминокислотную последовательность, связанную со второй аминокислотной последовательностью, с которой данная аминокислотная последовательность не связывается в природе естественным образом. Аминокислотные последовательности могут существовать в отдельных белках, объединенных в слитом полипептиде, или могут существовать в одном белке, будучи по-новому расположенными в слитом полипептиде. Химерный белок может быть создан, например, путем химического синтеза или создания и трансляции полинуклеотида, в котором пептидные области кодированы в требуемой взаимосвязи. Типичные химерные антитела против с-Met включают слитые белки, содержащие VH и VL домены, полученные от верблюда, или их гуманизированные варианты, слитые с константными доменами человеческого антитела, например, IgG1, IgG2, IgG3 или IgG4 человека.
“Вариабельная область” или “вариабельный домен”. Термин “вариабельный” означает, что определенные части последовательностей вариабельных доменов VH и VL отличаются в антителах и предназначены для связывания и достижения специфичности каждого конкретного антитела к антигену-мишени. Однако вариабельность распределяется неравномерно в вариабельных доменах антител. Вариабельность сконцентрирована в трех сегментах, именуемых “гипервариабельными петлями” каждого VL домена и VH домена, которые образуют часть антигенсвязывающего сайта. Первая, вторая и третья гипервариабельные петли домена легкой лямбда-цепи определяются в настоящем описании изобретения как L1(λ), L2(λ) и L3(λ) и могут включать остатки 24-33 (L1(λ), состоящая из 9, 10 или 11 аминокислотных остатков), 49-53 (L2(λ), состоящая из 3 остатков) и 90-96 (L3(λ), состоящая из 5 остатков) в VL домене (Morea et al., Methods 20:267-279 (2000)). Первая, вторая и третья гипервариабельные петли домена легкой каппа-цепи определяются в настоящем описании изобретения как L1(κ), L2(κ) и L3(κ) и могут включать остатки 25-33 (L1(κ), состоящая из 6, 7, 8, 11, 12 или 13 остатков), 49-53 (L2(κ), состоящая из 3 остатков) и 90-97 (L3(κ), состоящая из 6 остатков) в VL домене (Morea et al., Methods 20:267-279 (2000)). Первая, вторая и третья гипервариабельные петли VH домена определяются в настоящем описании изобретения как Н1, Н2 и Н3 и могут включать остатки 25-33 (Н1, состоящая из 7, 8 или 9 остатков), 52-56 (Н2, состоящая из 3 или 4 остатков) и 91-105 (Н3, имеющая разную длину) в VH домене (Morea et al., Methods 20:267-279 (2000)).
За исключением особо оговоренных случаев термины L1, L2 и L3 соответственно относятся к первой, второй и третьей гипервариабельным петлям VL домена и означают гипервариабельные петли, полученные из изотипов Vкаппа и Vлямбда. Термины Н1, Н2 и Н3 соответственно относятся к первой, второй и третьей гипервариабельным петлям VH домена и означают гипервариабельные петли, полученные из известных изотипов тяжелых цепей, включающих γ, ε, δ, α или µ.
Гипервариабельные петли L1, L2, L3, H1, H2 и Н3 могут включать часть “области, определяющей комплементарность” или “CDR”, рассмотренной ниже. Термины “гипервариабельная петля” и “область, определяющая комплементарность” не являются полными синонимами, так как гипервариабельные петли (HV) определяются на основании структуры, в то время как области, определяющие комплементарность (CDR), определяются на основании вариабельности последовательности (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, Natiuonal Institutes of Health, Bethesda, MD., 1983), и границы гипервариабельных петель (HV) и CDR-областей могут отличаться в некоторых VH и VL доменах.
CDR-области VL и VH доменов могут включать следующие аминокислоты: остатки 24-34 (CDRL1), 50-56 (CDRL2) и 89-97 (CDRL3) в вариабельном домене легкой цепи и остатки 31-35 или 31-35b (CDRH1), 50-65 (CDRH2) и 95-102 (CDRH3) в вариабельном домене тяжелой цепи; (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, (1991)). Таким образом, гипервариабельные петли могут находиться внутри соответствующих CDR-областей, и приведенное в настоящем описании изобретения определение “гипервариабельные петли” VH и VL доменов включает соответствующие CDR-области и наоборот за исключением особо оговоренных случаев.
Более консервативные части вариабельных доменов именуются каркасными областями (FR), рассмотренными ниже. Вариабельные домены нативных тяжелых и легких цепей включают по четыре каркасные области (соответственно FR1, FR2, FR3 и FR4), в значительной степени определяющие β-складчатую конфигурацию, соединенную тремя гипервариабельными петлями. Гипервариабельные петли в каждой цепи удерживаются в непосредственной близости друг от друга каркасными областями (FR) и вместе с гипервариабельными петлями из другой цепи способствуют образованию антигенсвязывающего сайта антител. Структурный анализ антител выявил взаимосвязь между последовательностью и формой сайта связывания, образованного областями, определяющими комплементарность (Chotia et al., J. Mol. Biol. 227:799-817 (1992)); Tramontano et al., J. Mol. Biol., 215:175-182 (1990)). Несмотря на высокую вариабельность последовательностей пять из шести петель определяют лишь небольшой спектр конформаций главной цепи, именуемых “каноническими структурами”. Указанные конформации, во-первых, определяются длиной петель и, во-вторых, наличием основных остатков в определенных положениях в петлях и каркасных областях, определяющих конформацию благодаря упаковке, водородной связи или способности приобретать необычные конформации главной цепи.
“CDR”. В использованном здесь значении термин “CDR” или “область, определяющая комплементарность” означает несмежные антигенсвязывающие сайты, находящиеся в вариабельной области тяжелых и легких цепей полипептидов. Указанные области были описаны в публикациях Kabat et al., J. Biol. Chem. 252, 6609-6616 (1977), Kabat et al., Sequences of protein of immunological interest (1991), Chotia et al., J. Mol. Biol. 196:901-917 (1987) и MacCallum et al., J. Mol. Biol. 262:732-745 (1996), в которых указанные определения включают перекрывающиеся аминокислотные остатки или субпопуляции аминокислотных остатков, сравниваемых друг с другом. Аминокислотные остатки, образующие CDR-области, определяемые в каждой из вышеуказанных публикаций, приведены ниже для сравнения. Термин “CDR” предпочтительно означает CDR, определяемую Кабатом на основании сравнения последовательностей.
|
“Каркасная область”. Термин “каркасная область” или “FR-область” в использованном здесь значении означает аминокислотные остатки, являющиеся частью вариабельной области, но не входящие в CDR-области (например, при использовании определения CDR-областей Кабата). Поэтому каркасная область вариабельной области имеет длину, равную примерно 100-120 аминокислотам, но включает только аминокислоты, не входящие в CDR-области. В конкретном примере вариабельной области тяжелой цепи и CDR-областей по определению Кабата и др. каркасная область 1 соответствует домену вариабельной области, включающему аминокислоты 1-30; каркасная область 2 соответствует домену вариабельной области, включающему аминокислоты 36-49; каркасная область 3 соответствует домену вариабельной области, включающему аминокислоты 66-94, и каркасная область 4 соответствует домену вариабельной области, включающему аминокислоты от положения 103 до конца вариабельной области. Каркасные области легкой цепи аналогичным образом отделены друг от друга CDR-областями вариабельной области легкой цепи. В соответствии с определением CDR-областей Хотиа и др. или МакКаллума и др. границы каркасных областей отделены концами вышеуказанных соответствующих CDR-областей. В предпочтительных вариантах осуществления изобретения использовано определение CDR-областей Кабата.
В природных антителах шесть CDR-областей, присутствующих в каждом мономерном антителе, являются короткими несмежными последовательностями аминокислот, расположенными с возможностью образования антигенсвязывающего сайта в случае формирования антителом трехмерной конфигурации в водной среде. Остальные вариабельные домены тяжелых и легких цепей характеризуются меньшей межмолекулярной вариабельностью аминокислотных последовательностей и именуются каркасными областями. Каркасные области в основном имеют β-складчатую конформацию, при этом CDR-области образуют петли, которые соединяют и в некоторых случаях образуют часть β-складчатой структуры. Таким образом, указанные каркасные области образуют скелет, обеспечивающий правильную ориентацию шести CDR-областей в результате межцепочечного нековалентного взаимодействия. Антигенсвязывающий сайт, образованный соответствующим образом расположенными CDR-областями, определяет поверхность, комплементарную эпитопу на иммунореактивном антигене. Указанная комплементарная поверхность стимулирует нековалентное связывание антитела с эпитопом иммунореактивного антигена. Специалист в данной области может легко идентифицировать положение CDR-областей.
“Шарнирная область”. В использованном здесь значении термин “шарнирная область” означает часть молекулы тяжелой цепи, соединяющей СН1 домен с СН2 доменом. Шарнирная область включает примерно 25 остатков и является гибкой, позволяя независимо двигаться двум N-концевым антигенсвязывающим областям. Шарнирные области можно подразделить на три разных домена: верхние, средние и нижние шарнирные домены (Roux et al., J. Immunol. 1998, 161-4083). Антитела против с-Met, включающие “полностью человеческую” шарнирную область, могут содержать одну из последовательностей шарнирных областей, представленных в приведенной ниже таблице 2.
|
|
“СН2 домен”. В использованном здесь значении термин “СН2 домен” означает часть молекулы тяжелой цепи, расположенную, например, примерно от остатка 244 до остатка 360 антитела в соответствии со стандартными системами нумерации (остатки 244-360, система нумерации Кабата, и остатки 231-340, система нумерации EU, Kabat EA et al., Sequences of Proteins of Immunological Interest. Bethesda, US Department of Health and Human Services, NIH, 1991). СН2 домен является уникальным в том отношении, что он спарен с другим доменом. Между двумя СН2 доменами молекулы интактного нативного IgG расположены две N-связанные разветвленные углеводные цепи. Кроме того, установлено, что от СН2 домена до С-конца молекулы IgG расположен СН3 домен, включающий примерно 108 остатков.
“Фрагмент”. Термин “фрагмент” означает часть антитела или цепи антитела, включающую меньшее число аминокислотных остатков по сравнению с интактным или полным антителом или цепью антитела. Термин “антигенсвязывающий фрагмент” означает полипептидный фрагмент иммуноглобулина или антитела, который связывается с антигеном или конкурирует с интактным антителом (то есть с интактным антителом, из которого был выделен такой фрагмент) за связывание с антигеном (то есть за специфическое связывание с белком с-Met человека). В использованном здесь значении термин “фрагмент” молекулы антитела означает антигенсвязывающие фрагменты антител, например, вариабельный домен легкой цепи (VL) антитела, вариабельный домен тяжелой цепи (VH) антитела, одноцепочечное антитело (scFc), F(ab')2-фрагмент, Fab-фрагмент, Fd-фрагмент, Fv-фрагмент, фрагмент однодоменного антитела (DAb), (моновалентное) антитело с одним “плечом” или любую антигенсвязывающую молекулу, образованную путем объединения, сборки или конъюгации таких антигенсвязывающих фрагментов. Фрагменты могут быть получены, например, в результате химической или ферментативной обработки интактного или полного антитела или цепи антитела либо с помощью методов рекомбинантных ДНК.
“Валентность”. В использованном здесь значении термин “валентность” означает число потенциальных сайтов связывания мишени в полипептиде. Каждый сайт связывания мишени специфически связывается с одной молекулой-мишенью или со специфическим сайтом на молекуле-мишени. Если полипептид включает несколько сайтов связывания мишени, то каждый сайт связывания мишени может специфически связываться с одинаковыми или разными молекулами (например, может связываться с разными лигандами, разными антигенами или разными эпитопами на одном антигене). Связывающие молекулы предпочтительно содержат по меньшей мере один сайт связывания, специфичный к молекуле с-Met человека. В конкретных вариантах осуществления изобретения антитела против с-Met по настоящему изобретению могут быть по меньшей мере двухвалентными.
“Специфичность”. Термин “специфичность” означает способность специфически связываться (например, иммунореактивность) с данной мишенью, например, с-Met. Полипептид может быть моноспецифическим и может содержать один или несколько сайтов связывания, специфически связывающихся с мишенью, либо полипептид может быть мультиспецифическим и может содержать два или более сайтов связывания, специфически связывающихся с одинаковыми или разными мишенями. В одном варианте осуществления изобретения антитело по настоящему изобретению является специфичным к нескольким мишеням. Например, в одном варианте осуществления изобретения, мультиспецифическая связывающая молекула по настоящему изобретению связывается с с-Met и со второй молекулой, экспрессированной на опухолевой клетке. В данной области известны типичные антитела, включающие антигенсвязывающие сайты, которые связываются с антигенами, экспрессированными на опухолевых клетках, и антитело по настоящему изобретению может включать одну или несколько CDR-областей из таких антител.
“Синтетический”. В использованном здесь значении термин “синтетический” применительно к полипептидам означает полипептиды, включающие аминокислотную последовательность, не встречающуюся в природе. Например, не встречающиеся в природе полипептиды являются модифицированными формами природных полипептидов (например, включающими мутацию, такую как добавление, замена или делеция) или включают первую аминокислотную последовательность (которая может быть природной или неприродной), связанную в линейной последовательности аминокислот со второй аминокислотной последовательностью (которая может быть природной или неприродной), с которой она не связана в природе.
”Генетически созданный”. В использованном здесь значении термин “генетически созданный” означает манипулирование молекулами нуклеиновых кислот или полипептидов синтетическими методами (например, методами рекомбинантных ДНК, методами синтеза пептидов in vitro, методами ферментативного или химического связывания пептидов или какой-либо комбинацией указанных методов). Предпочтительно, антитела по настоящему изобретению являются генетически созданными, включая, например, гуманизированные и/или химерные антитела, а также антитела, которые были созданы с целью улучшения одного или нескольких свойств, таких как связывание с антигеном, устойчивость/время полужизни или эффекторная функция.
“Модифицированное антитело”. В использованном здесь значении термин “модифицированное антитело” означает синтетические формы антител, отличные от природных антител, например, антитела, которые включают по меньшей мере части двух тяжелых цепей, а не две полные тяжелые цепи (например, антитела с удаленным доменом или минитела); мультиспецифические формы антител (например, биспецифические, триспецифические и т.д.), измененные с возможностью связывания с двумя или более разными антигенами или с разными эпитопами на одном антигене); молекулы тяжелых цепей, связанные с молекулами scFv, и тому подобные. Молекулы scFv известны в данной области и описаны, например, в патенте США № 5892019. Кроме того, термин “модифицированное антитело” означает многовалентные формы антител (например, трехвалентные, четырехвалентные и т.д. антитела, которые связываются с тремя или более копиями одного антигена). В другом варианте осуществления изобретения модифицированное антитело по настоящему изобретению является слитым белком, включающим по меньшей мере часть одной тяжелой цепи с отсутствием СН2 домена и связывающий домен полипептида, содержащий часть, связывающуюся с одним членом пары рецептор-лиганд.
Термин “модифицированное антитело” также может означать варианты аминокислотной последовательности антитела против с-Met. Специалисту в данной области должно быть понятно, что антитело против с-Met может быть модифицировано с образованием вариантного антитела против с-Met, в котором изменена аминокислотная последовательность по сравнению с антителом против с-Met, из которого такое антитело было получено. Например, могут быть произведены консервативные замены нуклеотидов или аминокислот или замены остатков “заменимых” аминокислот (например, остатков CDR и/или каркасной области). Замены аминокислот могут включать замену одной или нескольких аминокислот природной или неприродной аминокислотой.
“Гуманизирующие замены”. В использованном здесь значении термин “гуманизирующие замены” означает замены аминокислот, в соответствии с которыми аминокислотный остаток, находящийся в определенном положении в VH или VL домене антитела против с-Met (антитело против с-Met, выделенное у верблюда), заменяют аминокислотным остатком, находящимся в таком же положении в эталонном VH или VL домене человека. Эталонный VH или VL домен человека может быть VH или VL доменом, кодированным зародышевой линией клеток человека, и в таком случае замененные остатки могут быть определены как “замены зародышевого типа”. Гуманизирующие замены/замены зародышевого типа могут быть произведены в каркасных областях и/или CDR-областях антитела против с-Met по настоящему изобретению.
“Аффинные варианты”. В использованном здесь значении термин “аффинный вариант” означает вариантное антитело, характеризующееся одним или несколькими изменениями аминокислотной последовательности по сравнению с эталонным антителом против с-Met, при этом аффинный вариант обладает измененным сродством к белку с-Met человека по сравнению с эталонным антителом. Аффинные варианты обычно обладают лучшим сродством к с-Met человека по сравннию с эталонным антителом против с-Met. Улучшение может заключаться в более низком значении КD по отношению к с-Met человека, более быстрой скоростью диссоциации в отношении с-Met человека или изменении перекрестной реактивности с гомологами с-Met, отличными от с-Met человека. Аффинные варианты обычно характеризуются одним или несколькими изменениями аминокислотной последовательности в CDR-областях по сравнению с эталонным антителом против с-Met. Такие изменения могут иметь место в результате замены исходной аминокислоты, находящейся в данном положении в CDR, другим аминокислотным остатком, который может быть природным аминокислотным остатком или неприродным аминокислотным остатком. Замены аминокислот могут быть консервативными или неконсервативными.
“Высокая гомология с человеком”. Антитело, включающее вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL), считается антителом, обладающим высокой гомологией с человеком, если аминокислотные последовательности VH доменов и VL доменов, вместе взятые, по меньшей мере на 90% идентичны наиболее совместимым последовательностям VH и VL доменов зародышевой линии клеток человека. Антитела, обладающие высокой гомологией с человеком, могут быть антителами, включающими VH и VL домены нативных антител, отличных от человеческих, которые характеризуются достаточно высокой процентной идентичностью последовательностей с последовательностями зародышевого типа человека, включая, например, антитела, содержащие VH и VL домены обычных антител верблюда, а также генетически созданные, в частности, гуманизированные варианты таких антител и “полностью человеческие” антитела.
В одном варианте осуществления изобретения VH домен антитела, обладающего высокой гомологией с человеком, может содержать аминокислотную последовательность, которая на 80% или больше идентична или гомологична одному или нескольким VH доменам в каркасных областях FR1, FR2, FR3 и FR4. В других вариантах осуществления изобретения идентичность аминокислотной последовательности или гомология последовательности VH домена полипептида по настоящему изобретению с наиболее совместимой последовательностью VH домена зародышевой линии клеток человека может составлять 85% или более, 90% или более, 95% или более, 97% или более либо до 99% или даже 100%.
В одном варианте осуществления изобретения VH домен антитела, обладающего высокой гомологией с человеком, может содержать одно или несколько (например, 1-10) ошибочных спариваний в аминокислотной последовательности каркасных областей FR1, FR2, FR3 и FR4 по сравнению с наиболее совместимой последовательностью VH домена человека.
В другом варианте осуществления изобретения VL домен антитела, обладающего высокой гомологией с человеком, может иметь последовательность, которая на 80% или больше идентична или гомологична одному или нескольким VL доменам человека в каркасных областях FR1, FR2, FR3 и FR4. В других вариантах осуществления изобретения идентичность аминокислотной последовательности или гомологичность последовательности VL домена полипептида по настоящему изобретению с наиболее совместимой последовательностью VL домена зародышевой линии клеток человека может составлять 85% или более, 90% или более, 95% или более, 97% или более либо до 99% или даже 100%.
В одном варианте осуществления изобретения VL домен антитела, обладающего высокой гомологией с человеком, может содержать одно или несколько (например, 1-10) ошибочных спариваний в аминокислотной последовательности каркасных областей FR1, FR2, FR3 и FR4 по сравнению с наиболее совместимой последовательностью VH домена человека.
Прежде чем приступить к анализу процентной идентичности последовательностей антитела, обладающего высокой гомологией с человеком, и VH и VL доменов зародышевой линии клеток человека, можно определить канонические складки, позволяющие идентифицировать семейство сегментов зародышевой линии клеток человека, и идентичную комбинацию канонических складок для Н1 и Н2 или L1 и L2 (и L3). Затем для оценки гомологии последовательностей выбирают член семейства зародышевой линии клеток человека, характеризующийся самой высокой степенью гомологии последовательности с вариабельной областью представляющего интерес антитела. Канонические классы гипервариабельных петель L1, L2, L3, H1 и H2 по классификации Хотиа можно определить при помощи прикладных биоинформационных программ, которые являются общедоступными на Web-странице www.bioinf.org.uk/abs/chothia.html.page. Требования, предъявляемые к основным остаткам, приведены в файле данных программы. В указанных файлах данных приведены положения основных остатков с возможными аминокислотами в каждом положении. Последовательность вариабельной области исследуемого антитела представлена в виде входных данных и сначала сравнивается с консенсусной последовательностью антитела для нумерации по системе Кабата. При выполнении анализа канонических складок используется набор матриц основных остатков, выделенных при помощи автоматизированного метода, разработанного Мартином и Торнтоном (Martin et al., J. Mol. Biol. 263:800-815 (1996)).
При наличии известного V сегмента зародышевой линии клеток человека, в котором использована такая же комбинация канонических складок для Н1 и Н2 или L1 и L2 (и L3), можно определить наиболее совместимый член семейства с точки зрения гомологии последовательности. Прикладные биоинформационные программы позволяют определить процентную идентичность аминокислотных последовательностей VH и VL доменов каркасных областей исследуемого антитела и соответствующих последовательностей, кодированных зародышевой линией клеток человека, но сравнительный анализ последовательностей также может быть выполнен вручную. Последовательности иммуноглобулина человека можно идентифицировать в нескольких базах данных белков, таких как VBase (http://vbase.mrc-cpe.cam.ac.uk/) или база данных Pluckthun/Honegger (http://www.bioc.unizh.ch/antibody/Sequences/Germlines). Для сравнения человеческих последовательностей с вариабельными областями VH или VL доменов в исследуемом антителе может быть использован алгоритм сравнения последовательностей, представленный на Web-сайтах, таких как www.expasy.ch/tools/#aligh, но сравнительный анализ с ограниченным набором последовательностей может быть также выполнен вручную. Выбирают последовательности легких и тяжелых цепей зародышевой линии клеток человека из семейств с одинаковыми комбинациями канонических складок и с самой высокой степенью гомологии с каркасными областями 1, 2 и 3 каждой цепи, которые сравнивают с вариабельной областью исследуемой последовательности; также сравнивают FR4 с JH и JK или JL областями зародышевой линии клеток человека.
Следует отметить, что при вычислении общей процентной гомологии последовательности остатки FR1, FR2 и FR3 оценивают, используя наиболее совместимую последовательность из семейства зародышевых линий клеток человека с идентичной комбинацией канонических складок. Оценивают только остатки, отличающиеся от наиболее совместимых или других членов семейства с такой же комбинацией канонических складок (примечение: исключая любые отличия, кодированные праймером). Однако в целях гуманизации остатки в каркасных областях, идентичные членам других семейств зародышевых линий клеток человека, не содержащие одинаковой комбинации канонических складок, могут считаться “человеческими” несмотря на “негативную” оценку в соответствии с вышеописанными строгими условиями. Данное допущение основано на методе гуманизации “mix and match”, в соответствии с которым каждую FR1, FR1, FR3 и FR4 отдельно сравнивают с наиболее совместимой последовательностью зародышевой линии клеток человека, поэтому гуманизированная молекула содержит комбинацию разных FR областей, как было описано в публикациях Qu et al., Clin. Cancer Res., 5:3095-3100 (1999) и Ono et al., Mol. Immunol. 36:387-395 (1999). Границы отдельных каркасных областей могут быть определены по системе нумерации IMGT, которая является адаптированной системой нумерации Хотиа (Lefranc et al., NAR 27:209-212 (1999); http://imgt.cines.fr).
Антитела, обладающие высокой гомологией с человеком, могут включать гипервариабельные петли или CDR-области, содержащие человеческие или человекоподобные канонические складки, подробно рассмотренные ниже. В одном варианте осуществления изобретения по меньшей мере одна гипервариабельная петля или CDR в VH домене или VL домене антитела, обладающего высокой гомологией с человеком, может быть получена или выделена из VH или VL домена антитела, отличного от человеческого, например, обычно антитело вида Camelidae обладает прогнозируемой или действительной канонической структурой складок, которая по сущесту идентична канонической структуре складок в человеческих антителах.
В данной области хорошо известно, что, хотя основные аминокислотные последовательности гипервариабельных петель в VH доменах и VL доменах, кодированных зародышевой линией клеток человека, по определению являются высоковариабельными, все гипервариабельные петли, за исключением Н3 CDR-области VH домена, образуют лишь несколько четко выраженных структурных конформаций, именуемых каноническими складками (Chothia et al., J. Mol. Biol. 196:901-917 (1987); Tramontano er al., Proteins, 6:382-94 (1989)), которые зависят от длины гипервариабельной петли и наличия так называемых канонических аминокислотных остатков (Chothia et al., J. Mol. Biol. 196:901-917 (1987)). Действительные канонические структуры гипервариабельных петель в интактных VH или VL доменах можно определить при помощи структурного анализа (например, при помощи рентгеновской кристаллографии), но также можно прогнозировать каноническую структуру с учетом основных аминокислотных остатков, характерных для определенной структуры (более подробно рассмотренных ниже). Специфический паттерн остатков, определяющих каждую каноническую структуру, образует “сигнатуру”, которая позволяет распознать каноническую структуру в гипервариабельных петлях VH или VL домена с неизвестной структурой; поэтому канонические структуры можно прогнозировать с учетом основных аминокислотных последовательностей.
Прогнозированные канонические структуры складок для гипервариабельных петель любой данной последовательности VH или VL домена в антителе, обладающем высокой гомологией с человеком, можно анализировать, используя алгоритмы, являющиеся общедоступными на сайтах www.bioinf.org.uk/abs/chothia.html, www.biochem.ucl.ac.uk/~martin/antibodies.html и www.bioc.unizh.ch/antibody/Sequences/Germlines/Vbase_hVk.html. Указанные программы позволяют производить сравнение последовательностей VH или VL доменов с последовательностями VH или VL доменов человека, имеющими известную каноническую структуру, и прогнозировать каноническую структуру гипервариабельных петель запрашиваемой последовательности.
В случае VH домена Н1 и Н2 петли могут быть оценены как имеющие каноническую структуру складок, “по существу идентичную” канонической структуре складок в человеческих антителах при удовлетворении по меньшей мере первому и предпочтительно обоим следующим критериям:
1. Длина, определяемая числом остатков, идентична ближайшему совместимому классу канонической структуры человека.
2. По меньшей мере 33% идентичность, предпочтительно по меньшей мере 50% идентичность с основными аминокислотными остатками, описанными для соответствующих классов канонических структур Н1 и Н2 петель.
(Следует отметить, что в соответствии с целями вышеуказанного анализа Н1 и Н2 петли анализируют отдельно и каждую петлю сравнивают с ближайшим совместимым классом канонической структуры человека).
Вышеуказанный анализ основан на прогнозировании канонической структуры Н1 и Н2 петель исследуемого антитела. Если действительные структуры Н1 и Н2 петель в исследуемом антителе известны, например, в результате выполнения рентгеновской кристаллографии, тогда Н1 и Н2 петли в исследуемом антителе могут быть оценены как имеющие каноническую структуру складок, “по существу идентичную” канонической структуре складок, известной в человеческих антителах, если длина петли отличается от ближайшего совместимого класса канонической структуры человека (обычно на ±1 или ±2 аминокислоты), но действительная структура Н1 и Н2 петель в исследуемом антителе соответствует канонической структуре складок человека.
Основные аминокислотные остатки, обнаруженные в классах канонических структур человека для первой и второй гипервариабельных петель VH доменов человека (Н1 и Н2), описаны в публикации Chothia et al., J. Mol. Biol., 227:799-817 (1992), которая полностью включена в настоящее описание изобретения в качестве ссылки. В частности, в таблице 3 на странице 802 публикации Chotia et al., которая включена в настоящее описание изобретения в качестве ссылки, представлены предпочтительные аминокислотные остатки на основных сайтах для канонических структур Н1, обнаруженные в зародышевой линии клеток человека, и в таблице 4 на странице 803, также включенной в настоящее описание изобретения в качестве ссылки, представлены предпочтительные аминокислотные остатки на основных сайтах для канонических структур CDR H2, обнаруженные в зародышевой линии клеток человека.
В одном варианте осуществления изобретения Н1 и Н2 в VH домене антитела, обладающего высокой гомологией с человеком, имеют прогнозированную или действительную каноническую структуру складок, которая по существу идентична канонической структуре складок в человеческих антителах.
Антитела, обладающие высокой гомологией с человеком, могут включать VH домен, в котором гипервариабельные петли Н1 и Н2 образуют комбинацию канонических структур складок, идентичную комбинации канонических структур, известных по меньшей мере в одном VH домене зародышевой линии клеток человека. Установлено, что только определенные комбинации канонических структур складок Н1 и Н2 действительно имеют место в VH доменах, кодированных зародышевой линией клеток человека. В одном варианте осуществления изобретения Н1 и Н2 петли в VH домене антитела, обладающего высокой гомологией с человеком, могут быть получены из VH домена вида, отличного от человека, например, вида Camelidae, благодаря образованию комбинации прогнозируемых или действительных канонических структур складок, идентичной комбинации канонических структур складок, известных в зародышевой линии клеток человека или в соматически мутированном VH домене. В неограничивающих вариантах осуществления изобретения Н1 и Н2 петли в VH домене антитела, обладающего высокой гомологией с человеком, могут быть получены из VH домена вида, отличного от человека, например, вида Camelidae, благодаря образованию одной из следующих комбинаций канонических складок: 1-1, 1-2, 1-3, 1-6, 1-4, 2-1, 3-1 и 3-5.
Антитело, обладающее высокой гомологией с человеком, может включать VH домен, характеризующийся высокой идентичностью/гомологией последовательности с VH доменом человека и содержащий гипервариабельные петли, обладающие структурной гомологией с VH доменом человека.
Желательно, чтобы канонические складки, присутствующие в Н1 и Н2 петлях VH домена антитела, обладающего высокой гомологией с человеком, и их комбинация были “правильными” для последовательности VH домена в зародышевой линии клеток человека, которая наиболее близко соответствует VH домену антитела, обладающего высокой гомологией с человеком, с точки зрения общей идентичности последовательности основных аминокислот. В качестве примера можно отметить, что, если последовательность наиболее близко соответствует VH3 домену в зародышевой линии клеток человека, желательно, чтобы Н1 и Н2 петли образовывали комбинацию канонических складок, также присутствующую в VH3 домене человека. Данное положение может быть особенно важным в случае антител, обладающих высокой гомологией с человеком, которые были выделены у вида, отличного от человека, например, в случае антител, содержащих VH и VL домены, выделенные из антител верблюда, в частности, антител, содержащих гуманизированные VH и VL домены верблюда.
Таким образом, в одном варианте осуществления изобретения VH домен антитела против с-Met, обладающего высокой гомологией с человеком, может иметь последовательность, которая на 80% или более, 85% или более, 90% или более, 95% или более, 97% или более либо до 99% или даже 100% идентична или гомологична VH домену человека в каркасных областях FR1, FR2, FR3 и FR4, и, кроме того, Н1 и Н2 петли в том же антителе могут быть получены из VH домена вида, отличного от человека (например, из вида Camelidae), при условии образования комбинации прогнозированных или действительных канонических структур складок, идентичной комбинации канонических складок, известной в аналогичном естественном VH домене человека.
В других вариантах осуществления изобретения L1 и L2 петли в VL домене антитела, обладающего высокой гомологией с человеком, получают из VL домена вида, отличного от человека (например, из VL домена верблюда), при этом L1 и L2 петли имеют прогнозированную или действительную каноническую структуру складок, которая по существу идентична канонической структуре складок в человеческих антителах.
Как и в случае VH доменов, гипервариабельные петли VL доменов типов Vлямбда и Vкаппа могут образовывать ограниченное число конформаций или канонических структур, определяемых частично длиной, а также наличием основных аминокислотных остатков в определенных положениях канонических структур.
В исследуемом антителе, обладающем высокой гомологией с человеком, L1, L2 и L3 петли, полученные из VL домена вида, отличного от человека, например, из вида Camelidae, могут быть оценены как имеющие каноническую структуру складок, “по существу идентичную” канонической структуре складок, известной в человеческих антителах, при удовлетворении по меньшей мере первому и предпочтительно обоим следующим критериям:
1. Длина, определяемая числом остатков, идентична ближайшему совместимому классу канонической структуры человека.
2. По меньшей мере 33% идентичность, предпочтительно по меньшей мере 50% идентичность с основными аминокислотными остатками, описанными для соответствующих классов канонических структур L1 и L2 петель из спектра Vлямбда или Vкаппа цепей.
(Следует отметить, что в соответствии с целями вышеуказанного анализа L1 и L2 петли анализируют отдельно и каждую петлю сравнивают с ближайшим совместимым классом канонической структуры человека).
Вышеуказанный анализ основан на прогнозировании канонической структуры L1, L2 и L3 петель VL домена исследуемого антитела. Если действительная структура L1, L2 и L3 петель известна, например, в результате выполнения рентгеновской кристаллографии, тогда L1, L2 и L3 петли в исследуемом антителе могут быть оценены как имеющие каноническую структуру складок “по существу идентичную” канонической структуре складок, известной в человеческих антителах, если длина петли отличается от ближайшего совместимого класса канонической структуры человека (обычно на ±1 или ±2 аминокислоты), но действительная структура петель Camelidae соответствует канонической структуре складки человека.
Основные аминокислотные остатки, обнаруженные в классах канонических структур человека для CDR-областей Vлямбда и Vкаппа доменов человека, описаны в публикациях Morea et al., Methods, 20:267-279 (2000) и Martin et al., J. Mol. Biol., 263:800-815 (1996). Спектр структур Vкаппа домена человека также описан в публикации Tomlinson et al., EMBO J. 14:4628-4638 (1995), и спектр структур Vлямбда домена описан в публикации Williams et al., J. Mol. Biol., 264:220-232 (1996). Содержание всех указанных документов включено в настоящее описание изобретения в качестве ссылки.
L1 и L2 петли в VL домене антитела, обладающего высокой гомологией с человеком, могут образовывать комбинацию прогнозированных или действительных канонических структур складок, идентичную комбинации канонических структур складок, известной в VL домене зародышевой линии клеток человека. В неограничивающих вариантах осуществления изобретения L1 и L2 петли в Vлямбда домене антитела, обладающего высокой гомологией с человеком (например, антитело, содержащее VL домен, выделенный у верблюда, или его гуманизированный вариант), могут образовывать одну из следующих комбинаций канонических складок: 11-7, 13-7 (А, В, С), 14-7 (А, В), 12-11, 14-11 и 12-12 (в соответствии с определением, приведенным в публикации Williams et al., J. Mol. Biol., 264:220-32 (1996), и представленных на сайте http://www.bioc.uzh.ch/antibody/Sequences/Germlines/VBase_hVL.html). В неограничивающих вариантах осуществления изобретения L1 и L2 петли в Vкаппа домене могут образовывать одну из следующих комбинаций канонических складок: 2-1, 3-1, 4-1 и 6-1 (в соответствии с определением, приведенным в публикации Tomlinson et al., EMBO J., 14:4628-38 (1995), и представленных на сайте http://www.bioc.uzh.ch/antibody/Seqiences/Germlines/VBase_hVK.html).
В другом варианте осуществления изобретения все три L1, L2 и L3 петли в VL домене антитела, обладающего высокой гомологией с человеком, могут иметь по существу человеческую структуру. Желательно, чтобы VL домен антитела, обладающего высокой гомологией с человеком, имел последовательность, характеризующуюся высокой идентичностью/гомологией с VL доменом человека, и чтобы гипервариабельные петли в VL домене имели структуру, гомологичную VL домену человека.
В одном варианте осуществления изобретения VL домен антитела против c-Met, обладающего высокой гомологией с человеком, может иметь последовательность, которая на 80% или более, 85% или более, 90% или более, 95% или более, 97% или более либо до 99% или даже 100% идентична VL домену человека в каркасных областях FR1, FR2, FR3 и FR4, и, кроме того, гипервариабельная петля L1 и гипервариабельная петля L2 могут образовывать комбинацию прогнозированных или действительных канонических структур складок, аналогичную комбинации канонических складок, известной в том же VL домене человека.
Конечно, можно предположить, что VH домены, обладающие высокой идентичностью/гомологией последовательностей с VH доменом человека, а также гомологией структуры с гипервариабельными петлями VH домена человека, могут быть объединены с VL доменами, обладающими высокой идентичностью/гомологией последовательностей с VL доменом человека, а также гомологией структуры с гипервариабельными петлями VL домена человека, с образованием антител, характеризующихся высокой гомологией с человеком, которые содержат объединенные пары VH/VL (например, объединенные пары VH/VL, полученное у верблюда), обладающие максимальной гомологией последовательностей и структуры с объединенными парами VH/VL человека.
“Строгий антагонист”. В использованном здесь значении “строгий антагонист” HGF-опосредованной активации рецептора с-Met обладает следующими свойствами: (1) является антагонистом HGF-опосредованной активации рецептора с-Met и (2) не обладает значительной агонистической активностью.
В использованном здесь значении термин “антагонист HGF-опосредованной активации рецептора с-Met” означает молекулу, такую как антитело против с-Met, способную ингибировать HGF-зависимую активацию/передачу сигнала с-Met в соответствующей системе анализа. Эффективные антитела-антагонисты способны ингибировать по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 75% или по меньшей мере 80% максимальной активности HGF по меньшей мере в одной системе анализа, позволяющей обнаружить HGF-зависимую активацию или передачу сигнала с-Met, которая включает, например, анализ HGF-зависимого фосфорилирования с-Met или анализ HGF-индуцированной пролиферации опухолевых клеток, анализы выживания клеток и т.д. Антитело против с-Met по настоящему изобретению может быть также признано сильнодействующим антагонистом HGF-опосредованной активации рецептора с-Met, если достигнутая антагонистическая активность по меньшей мере соответствует активности эталонного антитела c224G11 (описанного в WO 2009/007427), которое является мышино-человеческим химерным антителом изотипа IgG1, включающим вариабельный домен тяжелой цепи, имеющий аминокислотную последовательность, представленную SEQ ID NO:43, вариабельный домен легкой цепи, имеющий аминокислотную последовательность, представленную SEQ ID NO:44, и константную область человека с немодифицированной шарнирной областью, то есть включающую шарнирную область IgG1 человека дикого типа.
В использованном здесь значении термин “агонистическая активность” антитела против с-Met означает способность антитела активировать рецептор с-Met при отсутствии лиганда HGF. Агонистическую активность можно исследовать при помощи соответствующей системы анализа, например, анализа фосфорилирования с-Met в присутствии или отсутствии HGF. В одном варианте осуществления изобретения антитело обладает “значительной агонистической активностью”, если агонистическое действие, достигаемое при отсутствии HGF, превышает 20% или 16% от максимального действия HGF в той же системе анализа. И наоборот, считается, что антитело против с-Met не обладает значительной агонистической активностью, если агонистическое действие, достигаемое при отсутствии HGF, составляет менее 20%, менее 16%, менее 10% или менее 5% от максимального действия HGF в той же системе анализа. В качестве примера можно отметить, что антагонистическую активность и агонистическую активность антитела против с-Met можно определить, выполняя анализ рассеяния возбужденной флуоресценции клеток в присутствии или отсутствии HGF. Антитела, являющиеся “строгими антагонистами”, то есть не обладающие значительной агонистической активностью, обычно не вызывают детектируемого рассеивающего эффекта при отсутствии HGF и в значительной степени ингибируют HGF-индуцированное рассеяние в той же системе анализа. Агонистическую активность можно также определить при помощи анализа фосфорилирования, описанного в примере 9 настоящей заявки на патент. Антитело против с-Met предпочтительно оказывает воздействие, составляющее менее 20% от максимального действия HGF, в данной системе анализа.
Кроме того, считается, что антитела против с-Met по настоящему изобретению не обладают значительной агонистической активностью, если агонистическое действие, достигаемое при отсутствии HGF, равно или меньше действия эталонного антитела c224G11 (описанного в WO 2009/007427), которое является мышино-человеческим химерным антителом изотипа IgG1, включающим вариабельный домен тяжелой цепи, имеющий аминокислотную последовательность, представленную SEQ ID NO:43, вариабельный домен легкой цепи, имеющий аминокислотную последовательность, представленную SEQ ID NO:44, и константную область человека с немодифицированной шарнирной областью, то есть включающую шарнирную область IgG1 человека дикого типа.
Как было суммировано выше, настоящее изобретение относится к выделенным антителам (которые могут быть моноклональными антителами), обладающим высокой гомологией с человеком, которые специфически связываются с белком рецептора с-Met человека, при этом указанные антитела являются строгими антагонистами HGF-опосредованной активации рецептора с-Met. Дополнительно будут более подробно описаны свойства и характеристики антител против с-Met и фрагментов антител по настоящему изобретению.
Связывание с рецептором с-Met и сродство к указанному рецептору
Выделенные антитела, обладающие высокой гомологией с человеком, которые специфически связываются с белком рецептора с-Met человека, обычно характеризуются сродством связывания (KD) к с-Met человека, и, в частности, к внеклеточному домену с-Met человека, равным примерно 10 нМ или меньше, 1 нМ или меньше, 0,1 нМ или меньше или 10 пМ или меньше, и скоростью диссоциации при связывании с с-Met человека, равной 10-3с-1 или меньше или 10-4с-1 или меньше. Сродство связывания (KD) и скорость диссоциации (koff) можно измерить стандартными методами, хорошо известными специалистам в данной области, такими как, например, метод резонанса поверхностных плазмонов (BIAcore), описанный в прилагаемых примерах.
Антитела против с-Met по настоящему изобретению обладают иммунологической специфичностью в отношении связывания с с-Met человека и, в частности, с внеклеточным доменом с-Met человека, при этом не исключена перекрестная реактивность с гомологами белка с-Met, отличными от человеческих. Сродство связывания к гомологам с-Met приматов кроме человека (например, с-Met макака-резуса) обычно в 1-10, например, в 5-10 раз ниже сродства связывания к с-Met человека.
Антагонистические/агонистические свойства
Как указано в настоящем описании изобретения, антитела против с-Met являются “строгими антагонистами” HGF-опосредованной активации рецептора с-Met человека в соответствии с приведенным выше определением. Указанные антитела обладают сильным антагонизмом в отношении HGF-опосредованной активации с-Met при минимальной агонистической активности. Баланс между высокой антагонистической активностью и минимальной агонистической активностью имеет важное значение для терапевтической пригодности антител против с-Met, так как ранее было показано (WO 2010/069765), что утрата in vitro антагонистической активности, сопровождающаяся приобретением агонистической активности химерной формой мышиного моноклонального антитела 224G11, может привести к значительной утрате антагонистической активности in vivo.
В данной области описаны многие анализы in vitro и in vivo, пригодные для исследования антагонизма в отношении HGF-опосредованной активации с-Met и/или агонистической активности антител против с-Met, с которыми могут легко ознакомиться специалисты в данной области (см., например, WO 2010/059654, WO 2009/07427, WO 2010/069765, публикацию Pacchicina et al., JBC, документ M110.134031, сентябрь 2010 г., технические характеристики, относящиеся к таким анализам, изложенные в данном документе, включены в настоящее описание изобретения в качестве ссылки). Приемлемые анализы включают, например, анализ рассеяния возбужденной флуоресценции клеток, анализ заживления ран, анализ пролиферации, анализ фосфорилирования с-Met, анализ морфогенеза ветвления и анализы на основе ингибирования роста/апоптоза.
Ингибирование HGF-независимой активации с-Met
Антитела против с-Met по настоящему изобретению способны ингибировать HGF-независимую активацию рецептора с-Met. Анализы in vitro, пригодные для исследования HGF-независимой активации рецептора с-Met, описаны в прилагаемом примере.
В определенных вариантах осуществления изобретения антитела против с-Met могут ингибировать HGF-независимую активацию рецептора с-Met и, в частности, могут ингибировать HGF-независимое фосфорилирование с-Met в линии клеток рака желудка человека MKN-45. В определенных вариантах осуществления изобретения антитело против с-Met может ингибировать по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70% или по меньшей мере 80% HGF-независимой активации рецептора с-Met. В частности, антитело против с-Met может ингибировать по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70% или по меньшей мере 80% HGF-независимого аутофосфорилирования с-Met, измеренного при помощи анализа фосфорилирования, например, анализа фосфорилирования, рассмотренного в настоящем описании изобретения, который был выполнен с использованием линии клеток рака желудка человека MKN-45.
Антитело против с-Met должно обладать по меньшей мере такой же активностью, что и эталонное антитело c224G11, и предпочтительно должно более эффективно ингибировать HGF-независимую активацию (аутофосфорилирование) с-Met, чем эталонное антитело c224G11, особенно при измерении с помощью анализа фосфорилирования с использованием клеток MKN-45. Определенные антитела против с-Met по настоящему изобретению, в частности, антитела, включающие антигенсвязывающие домены 36С4, 48А2, и их гуманизированные варианты, являются более сильными ингибиторами HGF-независимого аутофосфорилирования с-Met по сравнению с эталонным антителом c224G11, характеризуясь при этом сравнимым (или лучшим) антагонизмом в отношении HGF-зависимой активации с-Met, чем эталонное антитело c224G11, и более низкими уровнями агонистической активности, чем эталонное антитело c224G11. Как было указано в настоящем описании изобретения, эталонное антитело c224G11 (описанное в WO 2009/007427) является мышино-человеческим химерным антителом изотипа IgG1, включающим вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность, представленную SEQ ID NO:181, вариабельный домен легкой цепи, содержащий аминокислотную последовательность, представленную SEQ ID NO:182, и константную область человека с немодифицированной шарнирной областью, то есть включающую шарнирную область IgG1 человека дикого типа.
Антитела против с-Met по настоящему изобретению также характеризуются более сильным ингибированием HGF-независимого аутофосфорилирования с-Met по сравнению с эталонным антителом 5D5, которое не проявляло ингибирующей активности в данной системе анализа.
Ингибирование димеризации рецептора с-Met
Антитела против с-Met по настоящему изобретению предпочтительно способны ингибировать димеризацию рецепторов с-Met и, в частности, способны ингибировать гомодимеризацию и/или гетеродимеризацию связанных с мембраной рецепторов с-Met, присутствующих на поверхности опухолевых клеток. Способность ингибировать димеризацию с-Met имеет непосредственное отношение к терапевтической пригодности антител против с-Met, так как антитела, ингибирующие димеризацию с-Met, могут быть использованы при лечении раков, обусловленных HGF-независимой активацией с-Met, помимо раков, обусловленных HGF-зависимой активацией с-Met. Гетеродимеризация с-Met рассмотрена в публикации Trusolino et al., Nature Reviews, Molecular Cell Biology, 2010, 11:834-848.
В данной области известны анализы, пригодные для исследования способности антител против с-Met ингибировать димеризацию с-Met, и специалисты в данной области могут легко ознакомиться с такими анализами (см., например, WO 2009/07427 и WO 2010/069765, технические характеристики, относящиеся к таким анализам, изложенные в данном документе, включены в настоящее описание изобретения в качестве ссылки).
В определенных вариантах осуществления изобретения антитела против с-Met могут ингибировать димеризацию с-Met в “Met-экспрессирующей” линии клеток, такой как, например, клетки EBC-1. В частности, антитела против с-Met могут ингибировать по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45% или по меньшей мере 50% (гомо)димеризации с-Met в линии клеток, экспрессирующей рецептор с-Met, такой как клетки ЕВС-1. Фенотип “экспрессии Met” имеет место в линиях клеток, характеризующихся устойчивой хромосомной амплификацией онкогена МЕТ, описанного в публикации Smolen et al., PNAS, vol. 103, pp.2316-2321, 2006.
Уменьшение экспрессии белка с-Met на поверхности клетки
Антитела против с-Met по настоящему изобретению предпочтительно не вызывают значительного уменьшения белка с-Met человека на поверхности клетки. Способность данного антитела против с-Met уменьшать экспрессию белка с-Met человека на поверхности клетки можно исследовать при помощи проточной цитометрии с использованием линии клеток, экспрессирующей с-Met, такой как, например, MKN-45. В одном варианте осуществления изобретения считается, что антитела против с-Met по настоящему изобретению не вызывают значительного уменьшения белка с-Met человека на поверхности клетки, если такие антитела уменьшают белок с-Met менее чем на 20%, менее чем на 15%, менее чем на 10% или менее чем на 5% в данной системе анализа. Кроме того, считается, что антитела против с-Met по настоящему изобретению не вызывают значительного уменьшения белка с-Met человека на поверхности клетки, если такие антитела вызывают такое же или меньшее уменьшение белка с-Met, чем эталонное антитело c224G11, представленное в настоящем описании изобретения.
Антитела против с-Met, которые не вызывают значительного уменьшения белка с-Met на поверхности клетки, могут быть особенно пригодны для терапевтических применений благодаря эффекторной функции антитела, то есть ADCC, CDC, ADCP, и, в частности, благодаря усиленной эффекторной функции. Антитела против с-Met, не вызывающие значительного уменьшения белка с-Met на поверхности клетки, не интернализированы и поэтому могут оставаться связанными с с-Met на поверхности клетки в течение более длительного периода времени по сравнению с интернализированными антителами против с-Met. Меньшая скорость интернализации (или отсутствие значительной интернализации) является отличительным преимуществом антител против с-Met, осуществляющих эффекторную функцию с помощью по меньшей мере одного из механизмов ADCC, CDC или ADCP. Поэтому антитела против с-Met по настоящему изобретению, которые выполняют эффекторную функцию (или усиленную эффекторную функцию) и не вызывают значительного уменьшения белка с-Met на поверхности клетки, могут быть особенно пригодны для определенных терапевтических применений, например, при лечении рака, которое является благоприятным благодаря наличию эффекторной функции антитела.
Эпитопы рецептора с-Met
Антитела против с-Met по настоящему изобретению связываются с эпитопами во внеклеточном домене с-Met человека и блокируют связывание HGF с внеклеточным доменом с-Met в разной степени.
Способность антител против с-Met по настоящему изобретению блокировать связывание HGF с рецептором с-Met можно измерить при помощи конкурентного анализа. Антитела против с-Met обычно блокируют связывание HGF с рецептором с-Met при значении IC50, равным 0,5 нМ или меньше.
Термин “эпитоп” означает специфическое расположение аминокислот, локализованных на пептиде или белке, с которыми связывается антитело или фрагмент антитела. Эпитопы часто состоят из химически активных поверхностных групп молекул, таких как аминокислоты или сахарные боковые цепи, и имеют специфическую трехмерную структуру, а также специфический заряд. Эпитопы могут быть линейными, то есть обеспечивающими связывание с одной последовательностью аминокислот, или конформационными, то есть обеспечивающими связывание с двумя или более последовательностями аминокислот в разных областях антигена, которые необязательно являются смежными.
Антитела против с-Met по настоящему изобретению могут связываться с разными (перекрывающимися или неперекрывающимися) эпитопами во внеклеточном домене белка с-Met человека.
Определенные антитела против с-Met могут связываться с эпитопами в домене SEMA с-Met человека. Домен SEMA находится в аминокислотных остатках 1-491 зрелого белка с-Met человека (при отсутствии сигнальной последовательности, как показано на фигуре 25) и известен в данной области как домен, содержащий сайт связывания для лиганда HGF белка с-Met.
В одном конкретном варианте осуществления изобретения антитело против с-Met по настоящему изобретению может связываться с эпитопом в пептиде
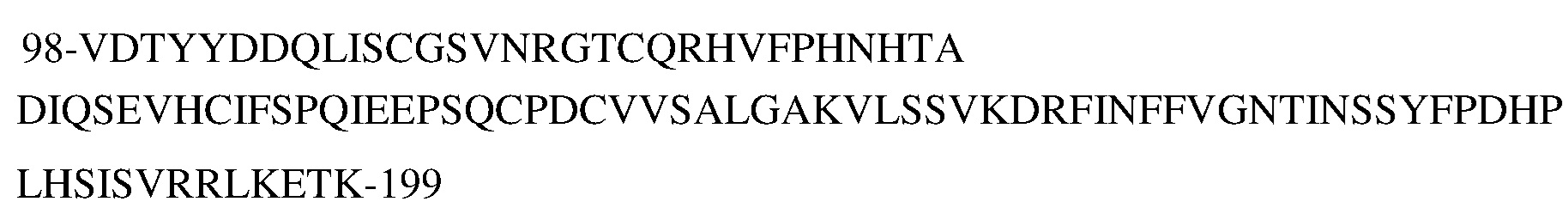
белка с-Met человека (SEQ ID NO:181). В частности, антитело, именуемое 36С4, его гуманизированные согласно зародышевой линии варианты и аффинные варианты связываются с эпитопом в области домена SEMA данного пептида. Указанная область домена SEMA имеет важное значение, так как известно, что данная область содержит сайт связывания для лиганда HGF белка c-Met. Особенно благоприятнымии являются антитела против с-Met, включающие антигенсвязывающие области антитела 36С4 или одного из его гуманизированных или аффинных вариантов, которые связываются с эпитопом пептида в домене SEMA белка с-Met человека и не вызывают значительного уменьшения белка с-Met на поверхности клетки. Такие антитела могут дополнительно выполнять одну или несколько эффекторных функций, выбираемых из ADCC, CDC и ADCP, или усиленную эффекторную функцию.
Другие антитела против с-Met по настоящему изобретению могут связываться с эпитопами в области IPT белка с-Met человека. Область IPT, как известно, включает аминокислотные остатки 544-909 зрелого белка с-Met человека, не имеющего сигнального пептида. Область IPT подразделена на домены IPT 1, 2, 3 и 4, как показано на фигуре 25. В результате картирования эпитопов было установлено, что несколько антител против с-Met по настоящему изобретению могут связываться с эпитопами в доменах IPT 1-2 белка c-Met человека (IPT-1 включает аминокислотные остатки 544-632 зрелого белка с-Met человека; IPT-2 включает аминокислоты 633-717 зрелого белка с-Met человека), при этом другие антитела могут связываться с эпитопами в доменах IPT 2-3 белка с-Met человека (IPT-2 включает аминокислотные остатки 633-717 зрелого белка с-Met человека; IPT-3 включает аминокислотные остатки 718-814 зрелого белка с-Met человека), и другие антитела могут связываться с эпитопами в доменах IPT 3-4 белка с-Met (IPT-3 включает аминокислотные остатки 718-814 зрелого белка с-Met человека; IPT-4 включает аминокислотные остатки 815-909 зрелого белка с-Met человека).
Было установлено, что домены IPT 3-4 содержат высокоаффинный сайт связывания для лиганда HGF (см., например, европейский патент № 2119448, включенный в настоящее описание изобретения в качестве ссылки), но до настоящего времени не были описаны антитела, способные связываться с доменами IPT 3-4 и оказывать антагонистическое воздействие на HGF-опосредованную активацию с-Met. Настоящее изобретение относится к сильнодействующим, строго антагонистическим антителам против с-Met, связывающимся с доменами IPT и, в частности, с доменами IPT 1-2, 2-3 и 3-4 или с областью PSI-OPT белка с-Met человека. Указанные антитела могут обладать высокой гомологией с человеком, как указано в настоящем описании изобретения, и могут быть получены в рекомбинантной форме, содержащей полностью человеческую шарнирную область и Fc-домен, в частности, изотипа IgG1 человека, без значительной утраты антагонистической активности или приобретения агонистической активности. Другие антитела против с-Met по настоящему изобретению могут связываться c конформационными эпитопами, содержащими часть или весь сайт узнавания в области IPT белка с-Met человека.
Антитела против с-Met могут направленно воздействовать на вышеуказанные домены IPT, на соединения между доменами IPT или на конформационные эпитопы, содержащие весь или часть сайта узнавания в области IPT белка с-Met человека.
Другие антитела против с-Met по настоящему изобретению могут связываться с эпитопом в области с-Met человека, заполняющим соединение между доменом PSI и доменом IPT 1 (PSI-IPT1). Домен PSI белка с-Met человека включает аминокислотные остатки 492-543 зрелого белка с-Met человека (при отсутствии сигнального пептида), при этом домен IPT 1 включает остатки 544-632 зрелого белка с-Met человека. В одном конкретном варианте осуществления изобретения антитело против с-Met может связываться с эпитопом в аминокислотной последовательности
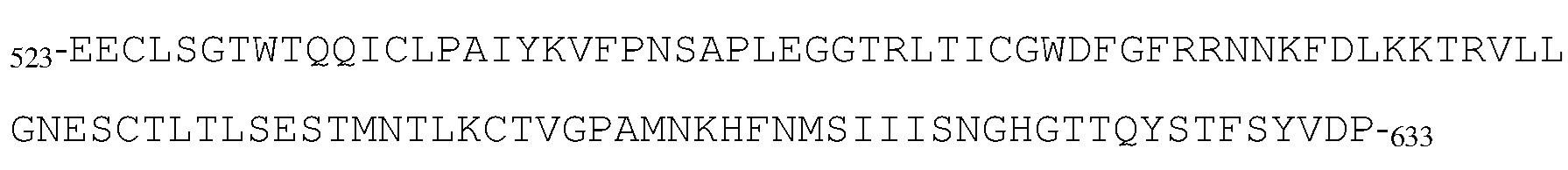
(SEQ ID NO:136) в области PSI-IPT1 белка с-Met человека. В частности, установлено, что антитело против с-Met, именуемое 48А2 в настоящем описании изобретения, гуманизированным согласно зародышевой линии и аффинные варианты антитела 48А2, рассмотренные в настоящем описании изобретения, связываются с конформационным эпитопом в пептиде PSI-IPT1 белка с-Met человека. Связывание антитела против с-Met с эпитопом в области PSI-IPT1 и, в частности, связывание с эпитопом, связанным антителом 48А2 и его вариантами, может блокировать связывание лиганда HGF белка c-Met с сайтом связывания в области IPT и предотвращать конформационное изменение, которым обычно сопровождается связывание HGF с белком с-Met.
Антитела против с-Met, выделенные у верблюда
Антитела по настоящему изобретению могут включать по меньшей мере одну гипервариабельную петлю или область, определяющую комплементарность, полученную из VH домена или VL домена вида семейства Camelidae, таких как VH и/или VL домены или их CDR-области, путем активной иммунизации аутбридинговых верблюдов, например, лам, антигеном с-Met человека.
Выражение “гипервариабельная петля или область, определяющая комплементарность, полученная из VH домена или VL домена вида семейства Camelidae” означает, что указанная гипервариабельная петля (HV) или CDR имеет аминокислотную последовательность, которая идентична или по существу идентична аминокислотной последовательности гипервариабельной петли или CDR, кодированной геном иммуноглобулина Camelidae. В данном контексте “ген иммуноглобулина” включает гены зародышевой линии клеток, гены иммуноглобулина, подвергнутые реаранжировке, а также соматически мутированные гены. Таким образом, аминокислотная последовательность HV или CDR, полученная из VH или VL домена вида Camelidae, может быть идентична аминокислотной последовательности HV или CDR, присутствующей в зрелом антителе Camelidae. Термин “полученный из” в данном контексте означает структурную взаимосвязь, выражающуюся в том, что гипервариабельные петли или CDR-области антитела против с-Met включают аминокислотную последовательность (или ее усеченные варианты), которая первоначально была кодирована геном иммуноглобулина Camelidae. Однако данный термин необязательно предполагает конкретную взаимосвязь с точки зрения способа продуцирования, использованного для получения антитела против с-Met.
Антитела против с-Met, выделенные у верблюда, могут быть получены у любого вида верблюдов, включающих наряду с прочими видами ламу, дромедара, альпака, викунью, гуанако или верблюда.
Антитела против с-Met, включающие VH и VL домены или CDR-области, выделенные у верблюда, обычно являются рекомбинантно экспрессированными полипептидами и могут быть химерными полипептидами. Термин “химерный полипептид” означает искусственный полипептид (не встречающийся в природе), созданный путем наложения двух или более пептидных фрагментов, которые в противном случае не встречаются в смежном положении. В определение данного термина входят химерные полипептиды, созданные путем наложения пептидных фрагментов, кодированных двумя или более видами, например, верблюдом и человеком.
CDR-области, выделенные у верблюда, могут включать одну из последовательностей CDR, представленных SEQ ID NO:1-21, 71-73 или 83-85 (CDR-области тяжелой цепи) или одной из последовательностей CDR, представленных SEQ ID NO:22-42, 74-76, 86, 87 или 137-148 (CDR-области легкой цепи).
В одном варианте осуществления изобретения весь VH домен и/или весь VL домен может быть получен из вида семейства Camelidae. В определенных вариантах осуществления изобретения VH домен, выделенный у верблюда, может включать аминокислотную последовательность, представленную SEQ ID NO:45, 46, 47, 48, 49, 50, 51, 77 или 88, и VL домен, выделенный у верблюда, может включать аминокислотную последовательность, представленную SEQ ID NO:52, 53, 54, 55, 56, 57, 58, 78, 89 или 149-164. VH домен и/или VL домен, выделенные у верблюда, могут быть модифицированы методом белковой инженерии, в соответствии с которым в аминокислотную последовательность верблюда вводят одну или несколько замен, инсерций или делеций аминокислот. Указанные изменения предпочтительно включают замены аминокислот относительно последовательности верблюда. Такие изменения включают “гуманизацию” или “гуманизацию согласно зародышевой линии”, когда один или несколько аминокислотных остатков в VH или VL домене верблюда заменяют эквивалентными остатками из гомологичного VH или VL домена человека.
Выделенные VH и VL домены верблюда, полученные путем активной иммунизации верблюда (например, ламы) антигеном с-Met человека, могут быть использованы в качестве основы для создания антигенсвязывающих полипептидов по настоящему изобретению. Используя в качестве основы интактные VH и VL домены верблюда, можно произвести одну или несколько замен, инсерций или делеций аминокислот, которые будут отличать полученную последовательность от исходной верблюжьей последовательности. В определенных вариантах осуществления изобретения такие замены, инсерции или делеции могут присутствовать в каркасных областях VH домена и/или VL домена. Целью таких изменений исходной аминокислотной последовательности может быть устранение неблагоприятных свойств, например, иммуногенности в организме человека (так называемая гуманизация), сайтов, вызывающих потенциальную гетерогенность продукта и/или неустойчивость (гликозилирование, деаминирование, изомеризация и т.д.), или усиление некоторых других благоприятных свойств молекулы (например, растворимости, устойчивости, биологической доступности и т.д.). В других вариантах осуществления изобретения изменения исходной аминокислотной последовательности могут быть произведены в одной или нескольких гипервариабельных петлях (или CDR-областях) VH и/или VL домена Camelidae, полученных путем активной иммунизации. Такие изменения могут быть произведены для усиления антигенсвязывающего сродства и/или специфичности, для устранения неблагоприятных свойств, например, иммуногенности в организме человека (так называемая гуманизация), сайтов, вызывающих потенциальную гетерогенность продукта и/или неустойчивость (гликозилирование, деаминирование, изомеризация и т.д.), или усиления некоторых других благоприятных свойств молекулы (например, растворимости, устойчивости, биологической доступности и т.д.).
Таким образом, один вариант осуществления изобретения относится к вариантному антителу против с-Met, которое содержит по меньшей мере одну замену аминокислоты по меньшей мере в одной каркасной области или CDR-области VH домена или VL домена по сравнению с VH или VL доменом, выделенным у верблюда, примеры которых включают, не ограничиваясь ими, VH домены верблюда, содержащие аминокислотные последовательности, представленные SEQ ID NO:45, 46, 47, 48, 49, 50, 51, 77 или 88, и VL домены верблюда, содержащие аминокислотные последовательности, представленные SEQ ID NO:52, 53, 54, 55, 56, 57, 58, 78, 89 или 149-164.
Другие варианты осуществления изобретения относятся к молекулам “химерного антитела”, включающим VH и VL домены, выделенные у верблюда, (или их генетически созданные варианты) и один или несколько константных доменов из антитела, отличного от верблюжьего, например, константные домены человека (или их генетически созданные варианты). В таких вариантах осуществления изобретения желательно, чтобы как VH домен, так и VL домен были получены из одного вида верблюдов, например, VH и VL домены могут быть получены из вида Lama glama, или VH и VL домены могут быть получены из вида Lama pacos (до введения изменений в созданную аминокислотную последовательность). В таких вариантах осуществления изобретения VH и VL домены могут быть выделены у одного животного, в частности, у животного, которое было активно иммунизировано антигеном с-Met человека.
В качестве альтернативы генетическим изменениям исходной аминокислотной последовательности VH и/или VL доменов вида Camelidae из VH/VL доменов верблюда могут быть выделены отдельные гипервариабельные петли или CDR-области и перенесены в другую каркасную область (отличную от верблюжьей), например, в каркасную область VH/VL человека, путем трансплантации CDR. В конкретных неограничивающих вариантах осуществления изобретения CDR-области, выделенные у верблюда, могут быть выбраны из CDR-областей, имеющих аминокислотные последовательности, представленные SEQ ID NO:1-21, 71-73 или 83-85 (CDR-области тяжелой цепи), или из CDR-областей, имеющих аминокислотные последовательности, представленные SEQ ID NO:22-42, 74-76, 86, 87 или 137-148 (CDR-области легкой цепи).
Антитела против с-Met, включающие VH и VL домены или их CDR-области, выделенные у верблюда, могут быть получены в разных вариантах, в которых присутствуют VH домен и VL домен. Термин “антитело” использован в настоящем описании изобретения в самом широком значении и включает, не ограничиваясь ими, моноклональные антитела (в том числе полноразмерные моноклональные антитела), поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела), если указанные антитела обладают соответствующей иммунологической специфичностью в отношении белка с-Met человека. Термин “моноклональное антитело” в использованном здесь значении означает антитело, полученное из популяции по существу гомогенных антител, то есть отдельные антитела, образующие популяцию, являются идентичными за исключением возможных естественных мутаций, присутствующих в незначительных количествах. Моноклональные антитела являются высокоспецифичными, будучи направленными против одного антигенного сайта. Кроме того, в отличие от препаратов обычных (поликлональных) антител, которые включают разные антитела, направленные против разных детерминант (эпитопов) на антигене, каждое моноклональное антитело направлено против одной детерминанты или эпитопа на антигене.
“Фрагменты антитела” включают часть полноразмерного антитела, обычно его антигенсвязывающий или вариабельный домен. Примеры фрагментов антитела включают Fab, Fab', F(ab)2, биспецифический Fab’-фрагмент и Fv-фрагменты, диатела, линейные антитела, одноцепочечные антитела, одноцепочечный фрагмент вариабельной области (scFv), доменные антитела и мультиспецифические антитела, образованные из фрагментов антител (см. публикацию Holliger and Hudson, Nature Biotechnol. 23:1126-36 (2005), которая включена в настоящее описание изобретения в качестве ссылки).
В неограничивающих вариантах осуществления изобретения антитела против с-Met, включающие VH и VL домены или их CDR-области, выделенные у верблюда, могут содержать СН1 домены и/или CL домены, аминокислотная последовательность которых является полностью или по существу человеческой. Если антигенсвязывающий полипептид по настоящему изобретению является антителом, предназначенным для терапевтического применения при лечении человека, вся константная область антитела или по меньшей мере ее часть содержит полностью или по существу человеческую аминокислотную последовательность. Поэтому одна или несколько комбинаций СН1 домена, шарнирной области, СН2 домена, СН3 домена и CL домена (и СН4 домена в случае его наличия) могут быть полностью или по существу человеческими в отношении аминокислотной последовательности.
СН1 домен, шарнирная область, СН2 домен, СН3 домен и CL домен (и СН4 домен в случае его наличия) могут содержать полностью или по существу человеческую аминокислотную последовательность. Применительно к константной области гуманизированного или химерного антитела или фрагмента антитела термин “по существу человеческий” служит для определения аминокислотной последовательности, которая по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97% или по меньшей мере на 99% идентична константной области человека. Термин “аминокислотная последовательность человека” в данном контексте означает аминокислотную последовательность, кодированную геном иммуноглобулина человека, включающим эмбриональные, реаранжированные и соматически мутированные гены. В объем настоящего изобретения также входят полипептиды, включающие константные домены “человеческой” последовательности, которые были изменены путем добавления, делеции или замены одной или нескольких аминокислот в человеческой последовательности, за исключением тех вариантов осуществления изобретения, в которых необходимо присутствие “полностью человеческой” шарнирной области.
Наличие “полностью человеческой” шарнирной области в антителах против с-Met по настоящему изобретению может быть благоприятным для минимизации иммуногенности и оптимизации устойчивости антитела.
Как указано в настоящем описании изобретения, замены, инсерции или делеции одной или нескольких аминокислот могут быть произведены в константной области тяжелой и/или легкой цепи, в частности, в Fc-области. Замены аминокислот могут включать замену аминокислоты другой естественной аминокислотой либо искусственной или модифицированной аминокислотой. Также допустимы другие модификации структуры, например, изменения паттерна гликолизирования (например, путем добавления или делеции N- или О-связанных сайтов гликозилирования). В зависимости от предполагаемого применения антитела может быть желательно изменить у антитела по настоящему изобретению свойства связывания с Fc-рецепторами, например, с целью модуляции эффекторной функции. Например, в Fc-область могут быть введены остатки цистеина, позволяющие образовать межцепочечную дисульфидную связь в данной области. Созданное таким образом гомодимерное антитело может характеризоваться лучшей способностью интернализации и/или более высоким комплемент-опосредованным лизисом клеток и антителозависимой клеточно-опосредованной цитотоксичностью (ADCC). См. публикации Caron et al., J. Exp. Med. 176:1191-1195 (1992) и Shopes, B., J. Immunol. 148:2918-2922 (1992). Альтернативно может быть создано антитело против с-Met с двумя Fc-областями, обладающее лучшими показателями комплемент-опосредованного лизиса и ADCC. См. публикацию Stevenson et al., Anti-Cancer Drug Design, 3:219-230(1989). Настоящее изобретение также относится к иммуноконъюгатам, включающим антитело по настоящему изобретению, конъюгированное с цитотоксическим агентом, таким как химиотерапевтическое средство, токсин (например, ферментативно активный токсин бактериального, грибного, растительного или животного происхождения или его фрагменты) или радиоактивный изотоп (то есть радиоактивный конъюгат). Fc-области также могут быть созданы с возможностью увеличения времени полужизни в кровяном русле, как описано в публикации Chan and Carter, Nature Reviews: Immunology, Vol. 10, pp.301-316, 2010, которая включена в настоящее описание изобретения в качестве ссылки.
Вариантные антитела против с-Met, в которых Fc-область модифицирована методом белковой инженерии, рассмотренным в настоящем описании изобретения, могут обладать более высокой эффективностью (например, при лечении рака) по сравнению с эквивалентным антителом (то есть с антителом, обладающим эквивалентными антигенсвязывающими свойствами) без модификации Fc-области.
В другом варианте осуществления изобретения Fc-область может быть модифицирована для повышения способности антитела опосредовать антителозависимую клеточно-опосредованную цитотоксичность (ADCC) и/или для увеличения сродства антитела к Fcγ-рецептору путем модификации одной или нескольких аминокислот.
В другом варианте осуществления изобретения может быть модифицировано гликозилирование антитела. Например, может быть получено негликозилированное антитело (то есть антитело с отсутствием гликозилирования). Гликозилирование может быть изменено, например, для увеличения сродства антитела к антигену-мишени белка с-Met. Углеводные модификации могут быть произведены, например, путем изменения одного или нескольких сайтов гликозилирования в последовательности антитела. Например, могут быть произведены замены одной или нескольких аминокислот, в результате чего будет устранен один или несколько сайтов гликозилирования вариабельного домена каркасной области с подавлением гликозилирования в указанном сайте. Отсутствие гликозилирования может увеличить сродство антитела к антигену.
Настоящее изобретение также относится к вариантным антителам против с-Met с измененным типом гликозилирования, таким как гипофукозилированное антитело с меньшим количеством остатков фукозила, нефукозилированное антитело (описанные в публикации Natsume et al., Drug Design Development and Therapy, Vol. 3, pp. 7-16 2009) или антитело с увеличенным числом рассекающих структур GlcNac. Установлено, что такие измененные паттерны гликозилирования повышают активность ADCC антител с достижением обычно 10-кратного увеличения ADCC по сравнению с эквивалентным антителом, включающим “нативный” Fc-домен человека. Такие углеводные модификации могут быть выполнены, например, в результате экспрессии антитела в клетке-хозяине с измененным ферментативным механизмом гликозилирования (как описано в публикации Yamane-Ohnuli and Satoh, mAbs 1:3, 230-236, 2009).
В других вариантах осуществления изобретения у антител против с-Met может отсутствовать эффекторная функция вследствие того, что Fc-часть антитела относится к изотипу, характеризующемуся естественным отсутствием эффекторной функции или обладающему значительно менее сильной эффекторной функцией, чем IgG1 человека, например, IgG2 человека или IgG4 человека, или вследствие того, что Fc-часть антитела создана с целью ослабления или устранения эффекторной функции, как описано в публикации Armour, K.L., et al., Eur. J. Immunol., 1999, 29:2613-2624.
В других вариантах осуществления изобретения Fc-часть антитела против с-Met может быть создана с возможностью облегчения предпочтительного образования биспецифических антител, в которых две тяжелые цепи антитела, включающие разные вариабельные домены, спарены с образованием Fc-части биспецифического антитела. Примеры таких модификаций включают модификации “выпуклость в углубление”, описанные в публикациях Ridgway JB, Presta LG, Carter P., “Knobs-into-holes” engineering of antibody CH3 domains for heavy chain heterodimerization. Protein Eng. 1996 Jul; 9(7):617-21 и Merchant AM, Zhu Z, Yuan JQ, Goddard A, Adams CW, Presta LG, Carter P. An efficient route to human bispecific IgG. Nat. Biotechnol. 1998 Jul; 16(7):677-81.
Определенные варианты осуществления изобретения относятся к химерным верблюд/человеческим антителам и, в частности, к химерным антителам, в которых VH и VL домены являются полностью верблюжьей последовательностью (например, ламы или альпака), и остальная часть антитела представляет собой полностью человеческую последовательность. Антитела против с-Met могут включать антитела, содержащие “гуманизированные” варианты или варианты “зародышевого типа” VH и VL доменов или их CDR-областей, выделенных у верблюда, и химерные верблюд/человеческие антитела, в которых VH и VL домены содержат одну или несколько замен аминокислот в каркасных областях по сравнению с VH и VL доменами верблюда, полученными в результате активной иммунизации верблюда антигеном с-Met человека. Такая “гуманизация” увеличивает % идентичность последовательности с VH или VL доменами зародышевой линии клеток человека в результате замены ошибочно спаренных аминокислотных остатков в исходном VH или VL домене Camelidae эквивалентным остатком, обнаруженным в VH или VL домене зародышевой линии клеток человека.
Антитела против с-Met также могут быть антителами с трансплантированными CDR-областями, в которых CDR-области (или гипервариабельные петли), выделенные из верблюжьего антитела, например, из верблюжьего антитела против с-Met, полученного в результате активной иммунизации белком с-Met человека или кодированного геном верблюда, трансплантируют в каркасную область VH и VL доменов человека, при этом остальная часть антитела является полностью человеческой. Такие CDR-трансплантированные антитела против с-Met могут содержать CDR-области, имеющие аминокислотные последовательности, представленные SEQ ID NO:1-21, 71-73 или 83-85 (CDR-области тяжелой цепи), или CDR-области, имеющие аминокислотные последовательности, представленные SEQ ID NO:22-42, 74-76, 86, 87 или 137-148 (CDR-области легкой цепи).
Гуманизированные, химерные и CDR-трансплантированные антитела против с-Met, которые были описаны выше, в частности, антитела, включающие гипервариабельные петли или CDR-области, выделенные у верблюдов, подвергнутых активной иммунизации антигеном с-Met человека, могут быть легко получены стандартными методами рекомбинантных ДНК и экспрессии при использовании прокариотических и эукариотических клеток-хозяев, созданных с возможностью продуцирования исследуемого полипептида, которые включают, не ограничиваясь ими, бактериальные клетки, дрожжевые клетки, клетки млекопитающих, клетки насекомых, растительные клетки, некоторые из которых рассмотрены в настоящем описании изобретения и проиллюстрированы прилагаемыми примерами.
Антитела против с-Met, выделенные у верблюда, включают варианты, в которых гипервариабельные петли или CDR-области VH домена и/или VL-домена получены из обычного антитела верблюда, созданного против с-Met человека, но при этом по меньшей мере одна из указанных (выделенных у верблюда) гипервариабельных петель или CDR-областей включает одну или несколько замен, добавлений или делеций аминокислот по сравнению с последовательностью верблюда. Такие изменения включают “гуманизацию” гипервариабельных петель/CDR-областей. Выделенные у верблюда гипервариабельные петли/CDR-области, которые были созданы указанным образом, могут иметь аминокислотную последовательность, “по существу идентичную” аминокислотной последовательности гипервариабельной петли/CDR верблюда. В данном контексте термин “существенная идентичность” означает замену не более одной или не более двух ошибочных спариваний в аминокислотной последовательности гипервариабельной петли/CDR верблюда. Конкретные варианты антитела против с-Met могут содержать гуманизированные варианты последовательностей CDR, представленных SEQ ID NO:1-21, 71-73 или 83-85 (CDR-области тяжелой цепи), и/или гуманизированные варианты последовательностей CDR, представленных SEQ ID NO:22-42, 74-76, 86, 87 или 137-148 (CDR-области легкой цепи).
Выделенные у верблюда антитела против с-Met по настоящему изобретению могут относиться к любому изотипу. Антитела, предназначенные для терапевтического применения при лечении человека, обычно относятся к IgA, IgD, IgE, IgG, IgM типу, часто к IgG типу, и в данном случае указанные антитела могут относиться к любому из четырех подклассов IgG1, IgG2a и b, IgG3 или IgG4. В каждом из указанных подклассов допускается выполнение одной или нескольких замен, инсерций или делеций аминокислот в Fc-части или других структурных модификаций, например, для усиления или ослабления Fc-зависимых функциональных свойств.
Гуманизация (создание последовательности зародышевого типа) VH и VL доменов, выделенных у верблюда
Обычные верблюжьи антитела представляют собой благоприятную основу для получения антител, предназначенных для применения в качестве терапевтических средств при лечении человека, благодаря следующим факторам, описанными в заявке на патент США 12/497239, которая включена в настоящее описание изобретения в качестве ссылки:
1) высокая % гомология последовательностей VH и VL доменов верблюда и их человеческих аналогов;
2) высокая степень гомологии структуры CDR-областей VH и VL доменов верблюда и их человеческих аналогов (то есть человекоподобные канонические структуры складок и человекоподобные комбинации канонических складок).
Верблюжья основа (например, ламы) также обладает значительным преимуществом с точки зрения функционального разнообразия получаемых антител против с-Met.
Пригодность антител против с-Met, включающих VH и/или VL домены верблюда, для лечения человека можно повысить путем “гуманизации” или “гуманизации согласно зародышевой линии” природных VH и VL доменов верблюда, например, сделав их менее иммуногенными в организме человека. Главной целью гуманизации является создание молекулы, в которой VH и VL домены характеризуются минимальной иммуногенностью при введении человеку, сохраняя при этом специфичность и сродство антигенсвязывающего сайта, образованного исходными VH и VL доменами.
Один метод гуманизации, так называемое “гуманизации согласно зародышевой линии”, включает изменение аминокислотной последовательности VH или VL домена верблюда с целью ее приближения к последовательности VH или VL домена человека.
Определение гомологии между VH (или VL) доменом верблюда и VH (или VL) доменом человека является важной стадией процесса гуманизации, как с точки зрения выбора заменяемых аминокислотных остатков верблюда (в данном VH или VL домене), так и с точки зрения выбора соответствующих заменяющих аминокислотных остатков.
Метод гуманизации обычных верблюжьих антител был создан на основе сравнения большого числа новых последовательностей VH (или VL) доменов верблюда, обычно соматически мутированных VH (или VL) доменов, которые, как известно, связываются с антигеном-мишенью, с последовательностями VH (или VL) доменов зародышевой линии клеток человека, консенсусными последовательностями VH (или VL) доменов человека, а также благодаря наличию информации о последовательностях зародышевого типа для ламы пакос.
В следующих абзацах представлены основные положения, которые могут быть применены для (i) выбора аминокислотных остатков “верблюда”, подлежащих замене в выделенном у верблюда VH или VL домене или CDR-области, и (ii) выбора заменяющих аминокислотных остатков “человека”, используемых для гуманизации любого данного VH (или VL) домена верблюда. Указанный метод может быть использован для получения гуманизированных вариантов выделенных у верблюда CDR-областей, содержащих аминокислотные последовательности, представленные SEQ ID NO:1-21, 71-73 или 83-85 (CDR-области тяжелой цепи), или аминокислотные последовательности, представленные SEQ ID NO:22-42, 74-76, 86, 87 или 137-148 (CDR-области легкой цепи), а также для гуманизации выделенных у верблюда VH доменов, содержащих последовательности, представленные SEQ ID NO:45-51, 77 или 88, и выделенных у верблюда VL доменов, содержащих последовательности, представленные SEQ ID NO:52-58, 78, 89 или 149-164.
Стадия 1. Выбор семейства (последовательностей зародышевого типа) человека и члена данного семейства, характеризующегося наибольшей гомологией/идентичностью со зрелой последовательностью верблюда, подлежащей гуманизации. Общая процедура идентификации наиболее совместимой последовательности зародышевого типа человека для любого данного VH (или VL) домена верблюда описана ниже.
Стадия 2. Выбор члена семейства последовательностей зародышевого типа человека. Предпочтительно выбирают последовательность зародышевого типа или члена такого семейства последовательностей зародышевого типа с наибольшей гомологией.
Стадия 3. Идентификация предпочтительных положений аминокислот, пригодных для гуманизации, на основании таблицы использования аминокислот для последовательности зародышевого типа верблюда, наиболее совместимой с выбранной последовательностью зародышевого типа человека.
Стадия 4. Замена аминокислот в последовательности зародышевого типа верблюда, отличающихся от наиболее совместимой последовательности зародышевого типа человека; гуманизация остатков каркасной области является более предпочтительной по сравнению с остатками CDR.
а. Предпочтительными являются аминокислоты в положениях, отличающихся от аналогичных положений в выбранной последовательности зародышевого типа человека, когда аминокислота, обнаруженная в последовательности верблюда, не совместима с выбранной последовательностью зародышевого типа и не обнаружена в других последовательностях зародышевого типа того же подкласса (как для аминокислот вариабельного домена, так и для J-кодированных аминокислот каркасной области).
b. Аминокислоты в положениях, отличающихся от выбранного члена семейства последовательностей зародышевого типа, но встречающихся в других последовательностях зародышевого типа того же семейства, также могут быть гуманизированы.
с. Дополнительные ошибочно спаренные аминокислоты (например, вследствие дополнительных соматических мутаций) по сравнению с выбранной последовательностью зародышевого типа человека также могут быть гуманизированы.
Для определения наиболее совместимой последовательности зародышевого типа человека для данного VH (или VL) домена верблюда может быть использован следующий метод:
Прежде чем приступить к анализу процентной идентичности последовательностей в VH и VL доменах последовательностей зародышевого типа Camelidae и человека, можно сначала определить канонические складки, которые позволяют идентифицировать семейство сегментов последовательности зародышевого типа человека с идентичной комбинацией канонических складок для Н1 и Н2 или L1 и L2 (и L3). Затем для оценки гомологии последовательностей может быть выбран член семейства последовательностей зародышевого типа человека, обладающий наибольшей степенью гомологии последовательности с исследуемой вариабельной областью Camelidae. Канонические классы гипервариабельных петель L1, L2, L3, Н1 и Н2 по системе Хотиа можно определить при помощи биоинформационных программ, общедоступных на Web-странице www.bioinf.org.uk/abs/chotia.html.page. В выходном файле данных указанной программы содержатся основные требования, предъявляемые к остаткам. В файлах данных приведены положения основных остатков с указанием допустимых аминокислот в каждом положении. Последовательность вариабельной области антитела представлена в виде входных данных и сначала сравнивается с консенсусной последовательностью антитела для определения соответствия с системой нумерации Кабата. При выполнении анализа канонических складок используется набор матриц основных остатков, выделенных при помощи автоматизированного метода, разработанного Мартином и Торнтоном (Martin et al., J. Mol. Biol. 263:800-815 (1996)). Границы отдельных каркасных областей могут быть определены с помощью системы нумерации IMGT, которая представляет собой адаптированную систему нумерации Хотиа (Lefranc et al., NAR 27:209-212 (1999); http://imgt.cines.fr).
На основании известного сегмента вариабельного домена последовательности зародышевого типа человека, в котором использована такая же комбинация канонических складок для Н1 и Н2 или L1 и L2 (и L3), можно определить наиболее совместимый член семейства в отношении гомологии последовательности. Процентную идентичность аминокислотных последовательностей VH и VL доменов каркасной области Camelidae и соответствующих последовательностей зародышевого типа человека можно определить при помощи биоинформационных программ, но также можно произвести сравнение последовательностей в ручном режиме. Иммуноглобулиновые последовательности человека можно идентифицировать, используя несколько баз данных белков, таких как VBase (http://vbase.mrc-cpe.cam.ac.uk/) или база данных Плактуна/Хонеггера (http://www.bioc.unizh.ch/antibody/Sequences/Germlines). Для сравнения последовательностей человека с вариабельными областями VH или VL доменов Camelidae может быть использован алгоритм сравнения последовательностей, представленный на таких Web-сайтах, как www.expasy.ch/tools/#align, но сравнение также может быть выполнено в ручном режиме с использованием ограниченного набора последовательностей. Последовательности зародышевого типа легкой и тяжелой цепей человека, относящиеся к семействам с такими же комбинациями канонических складок и наибольшей степенью гомологии с каркасными областями 1, 2 и 3 каждой цепи, можно выбрать и сравнить с исследуемой вариабельной областью Camelidae; кроме того, FR4 сравнивают с JH и JK или JL областями последовательности зародышевого типа человека.
Следует отметить, что общую процентную гомологию последовательностей остатков FR1, FR2 и FR3 вычисляют, используя наиболее совместимую последовательность из семейства последовательностей зародышевого типа человека с идентичной комбинацией канонических складок. Оценивают только остатки, отличающиеся от наиболее совместимых или других членов семейства с такой же комбинацией канонических складок (исключая любые отличия, кодированные праймером). Однако при этом могут быть гуманизированы остатки в каркасных областях, идентичные членам других семейств последовательностей зародышевого типа человека, но не имеющие такой же комбинации канонических складок, несмотря на то, что указанные остатки были признаны “негативными” в соответствии с вышеуказанными строгими условиями идентификации. Данное допущение основано на методе гуманизации “mix and match”, в соответствии с которым каждую каркасную область FR1, FR2, FR3 и FR4 отдельно сравнивают с наиболее совместимой последовательностью зародышевого типа человека, поэтому гуманизированная молекула содержит комбинацию разных каркасных областей, как описано в публикациях Qu et al., Clin. Cancer Res. 5:3095-3100 (1999) и Ono et al., Mol. Immunol. 36:387-395 (1999).
Только в качестве примера можно предположить, что гуманизированные варианты VH доменов, содержащих аминокислотные последовательности, представленные SEQ ID NO:45-51, 77 или 88, могут включать варианты, в которых аминокислотные остатки, встречающиеся в одном или нескольких положениях, перечисленных в следующей таблице, заменены аминокислотным остатком, встречающимся в эквивалентном положении в VH домене человека, например, в VH домене последовательности зародышевого типа человека. Соответствующие замены аминокислот могут быть произведены в соответствии с вышеописанным общим методом гуманизации.
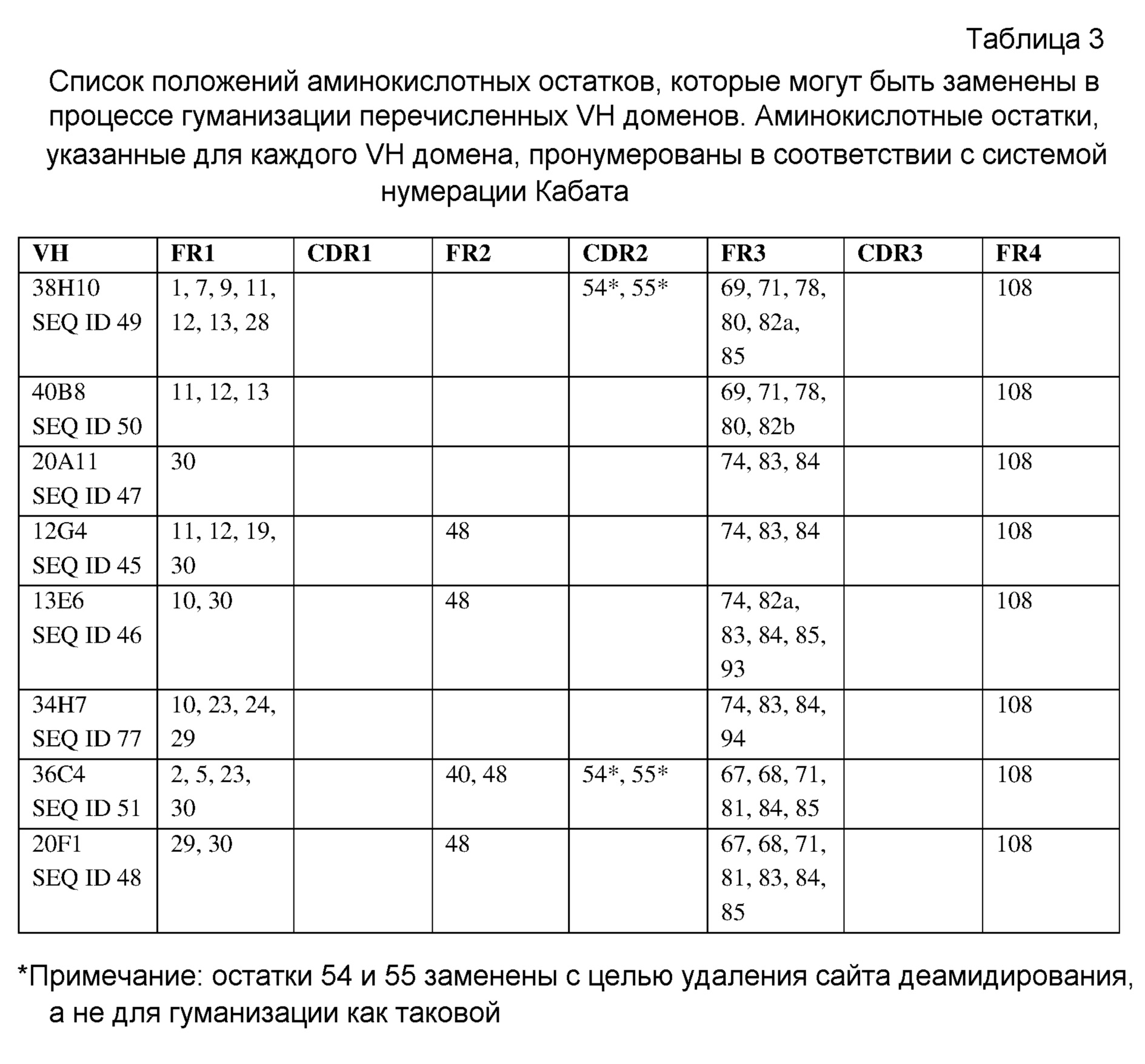
Только в качестве примера можно предположить, что гуманизированные варианты VL доменов, содержащих аминокислотные последовательности, представленные SEQ ID NO:52-58, 78, 89 или 137-148, могут включать варианты, в которых аминокислотные остатки, встречающиеся в одном или нескольких положениях, перечисленных в следующей таблице, заменены аминокислотным остатком, встречающимся в эквивалентном положении в VL домене человека, например, в VL домене последовательности зародышевого типа человека. Соответствующие замены аминокислот могут быть произведены в соответствии с вышеописанным общим методом гуманизации.
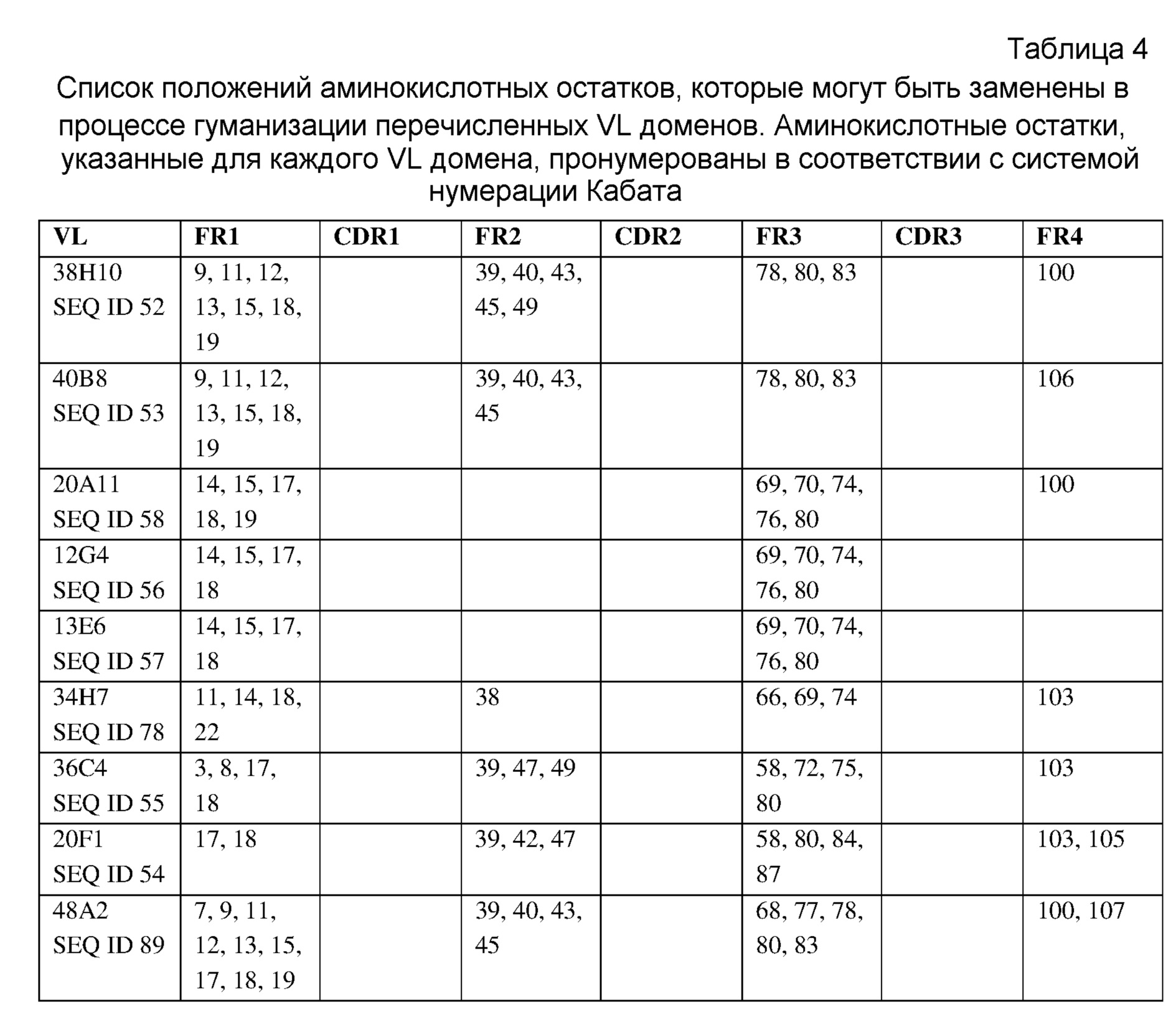
Перекрестно конкурирующие антитела
Моноклональные антитела или их антигенсвязывающие фрагменты, которые “перекрестно конкурируют” с молекулами, рассмотренными в настоящем описании изобретения, являются антителами, связывающимися с с-Met человека на сайтах, которые идентичны или перекрывают сайты, на которых связываются существующие антитела против с-Met. Конкурирующие моноклональные антитела или их антигенсвязывающие фрагменты могут быть идентифицированы, например, при помощи конкурентного анализа антител. Например, образец очищенного или неполностью очищенного с-Met человека может быть связан с твердой подложкой. Затем добавляют антитело или его антигенсвязывающий фрагмент по настоящему изобретению и моноклональное антитело или его антигенсвязывающий фрагмент, которые предположительно могут конкурировать с антителом по настоящему изобретению. Одну из двух молекул метят. Если меченое соединение и немеченое соединение связываются с разными сайтами на с-Met, то меченое соединение будет связываться на определенном уровне независимо от наличия или отсутствия предполагаемого конкурирующего соединения. Однако, если сайты их взаимодействия являются идентичными или перекрывающимися, немеченое соединение будет конкурировать за связывание, при этом количество меченого соединения, связанного с антигеном, уменьшится. Если немеченое соединение присутствует в избытке, меченое соединение свяжется с антигеном в небольшом количестве, если вообще такое связывание произойдет. В соответствии с целями настоящего изобретения конкурирующие моноклональные антитела или их антигенсвязывающие фрагменты являются такими антителами, которые уменьшают связывание существующих антител с с-Met примерно на 50%, примерно на 60%, примерно на 70%, примерно на 80%, примерно на 85%, примерно на 90%, примерно на 95% или примерно на 99%. В данной области известны методы выполнения таких конкурентных анализов, с которыми можно ознакомиться, например, в публикации Harlow and Lane (1988) Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, pages 567-569, ISBN 0-87969-314-2. Такие анализы могут быть выполнены количественным методом с использованием очищенных антител. Стандартную кривую строят, титруя одно антитело против него самого, то есть одно и то же антитело используют в качестве меченого антитела и его конкурента. Титруют способность немеченого конкурирующего моноклонального антитела или его антигенсвязывающего фрагмента ингибировать связывание меченой молекулы с планшетом. Результаты представляют в виде графика и сравнивают концентрации, необходимые для достижения требуемой степени ингибирования связывания.
Полинуклеотиды, кодирующие антитела против с-Met
Настоящее изобретение также относится к полинуклеотидным молекулам, кодирующим антитела против с-Met по настоящему изобретению, а также к экспрессирующим векторам, содержащим нуклеотидные последовательности, кодирующие антитела против с-Met по настоящему изобретению, функционально связанные с регуляторными последовательностями, обеспечивающими экспрессию антигенсвязывающего полипептида в клетке-хозяине или бесклеточной экспрессирующей системе, и к клетке-хозяину или бесклеточной экспрессирующей системе, содержащей указанный экспрессирующий вектор.
В конкретных вариантах осуществления изобретения полинуклеотид, кодирующий антитело против с-Met по настоящему изобретению, может включать одну или несколько полинуклеотидных последовательностей, представленных SEQ ID NO:59-70, 79-82, 90, 91, 122-135 или 165-180, которые кодируют VH или VL домены антител против с-Met, или вариантную последовательность, кодирующую функциональный VH или VL домен антитела против с-Met, при этом указанная вариантная последовательность является идентичной по меньшей мере на 80%, 85%, 90%, 95%, 97% или 99% при сравнении с одной из SEQ ID NO:59-70, 79-82, 90, 91, 122-135 или 165-180. В данном контексте процентную идентичность двух полинуклеотидных последовательностей можно определить, подвергая две указанные последовательности оптимальному сравнению, при котором сравниваемая полинуклеотидная последовательность может включать добавления или делеции относительно эталонной последовательности для достижения оптимального соответствия двух указанных последовательностей. Процентное значение идентичности вычисляют, определяя число идентичных положений, в которых нуклеотидный остаток является одинаковым в обеих последовательностях, с последующим делением числа идентичных положений на общее число положений в сравниваемом окне и умножением полученного результата на 100 для получения процентного значения идентичности двух указанных последовательностей. Например, можно использовать программу BLAST “BLAST 2 sequences” (Tatusova et al., “Blast 2 sequences - a new tool for comparing protein and nucleotide sequences”, FEMS Microbiol Lett. 174:247-250), доступную на сайте http://www.ncbi.nlm.nih.gov/gorf/bl2.html, в которой использованы параметры по умолчанию (в частности, такие параметры, как “штраф за открытый разрыв”: 5, и “штраф за длинный разрыв”: 2; выбираемая матрица является, например, матрицей “BLOSUM 62”, предлагаемой программой), при этом процентное значение идентичности двух сравниваемых последовательностей вычисляется непосредственно данной программой.
Полинуклеотидные молекулы, кодирующие антитела против с-Met по настоящему изобретению, включают, например, молекулы рекомбинантной ДНК. Термины “нуклеиновая кислота”, “полинуклеотид” или “полинуклеотидная молекула” имеют взаимозаменяемые значения и означают любую одноцепочечную или двухцепочечную молекулу ДНК или РНК и комплементарную последовательность в случае одноцепочечной молекулы. При рассмотрении молекул нуклеиновой кислоты последовательность или структура определенной молекулы нуклеиновой кислоты может быть описана в соответствии со стандартным условным обозначением последовательности в 5’-3’ направлении. В некоторых вариантах осуществления изобретения нуклеиновые кислоты или полинуклеотиды являются “выделенными”. Данный термин применительно к молекуле нуклеиновой кислоты означает молекулу нуклеиновой кислоты, отделенную от последовательностей, смежных с ней в естественном геноме организма, в котором находится такая молекула. Например, “выделенная нуклеиновая кислота” может включать молекулу ДНК, введенную в вектор, такой как плазмида или вирусный вектор, или встроенную в геномную ДНК прокариотической или эукариотической клетки или организма-хозяина, отличного от человека. Применительно к РНК термин “выделенный полинуклеотид” означает главным образом молекулу РНК, кодированную выделенной молекулой ДНК. Альтернативно, данный термин может означать молекулу РНК, которая была очищена/отделена от других нуклеиновых кислот, с которыми данная РНК ассоциирована в естественном состоянии (то есть в клетках или тканях). Выделенный полинуклеотид (ДНК или РНК) может также представлять собой молекулу, полученную биологическими или синтетическими методами и отделенную от других компонентов, присутствующих в процессе получения.
Для рекомбинантного продуцирования антитела против с-Met по настоящему изобретению может быть получен (стандартными методами молекулярной биологии) рекомбинантный полинуклеотид, кодирующий данное антитело, и введен в реплицирующий вектор для экспрессии в выбранной клетке-хозяине или бесклеточной экспрессирующей системе. Приемлемые клетки-хозяева могут быть прокариотическими, дрожжевыми или высшими эукариотическими клетками, в частности, клетками млекопитающих. Примерами приемлемых линий клеток-хозяев млекопитающих являются линия клеток почки обезьяны CV1, трансформированная SV40 (COS-7, ATCC CRL 1651); линия эмбриональных клеток почки человека (293 или клетки 293, субклонированные для выращивания в суспензионной культуре, Graham et al., J. Gen. Virol. 36:59 (1977)); клетки почки детеныша хомячка (ВНК, АТСС CCL 10); клетки яичника китайского хомячка/-DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); мышиные клетки Сертоли (ТМ4, Mather, Biol. Reprod. 23:243-251 (1980)); миеломные клетки мыши SP2/0-AG14 (ATCC CRL 1581; ATCC CRL 8287) или NS0 (коллекции культур НРА № 85110503); клетки почки обезьяны (CV1 ATCC CCL 70); клетки почки африканской зеленой мартышки (VERO-76, ATCC CRL-1587); клетки рака шейки матки человека (HELA, ATCC CCL 2); клетки почки собаки (MDCK, ATCC CCL 34); клетки печени буйволовой крысы (BRL 3A, ATCC CRL 1442); клетки легкого человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); опухолевые клетки молочной железы мыши (ММТ 060562, АТСС CCL51); клетки TRI (Mather et al., Annals N.Y. Acad. Sci. 383:44-68 (1982)); клетки MRC5; клетки FS4 и линия клеток гепатомы человека (Hep G2), а также линия клеток PERC-6 DSM. Экспрессирующие векторы, пригодные для использования в указанных клетках-хозяевах, также известны в данной области.
Следует отметить, что термин “клетка-хозяин” обычно означает культивируемую линию клеток. Человек, в организм которого введен экспрессирующий вектор, кодирующий антигенсвязывающий полипептид по настоящему изобретению, не входит в определение термина “клетка-хозяин”.
Получение антитела
Важным объектом изобретения также является способ получения антитела против с-Met по настоящему изобретению, который включает культивирование клетки-хозяина (или бесклеточной экспрессирующей системы), содержащей полинуклеотид (например, экспрессирующий вектор), кодирующий антитело против с-Met, в условиях, обеспечивающих экспрессию антитела против с-Met, и выделение экспрессированного антитела против с-Met. Указанный процесс рекомбинантной экспрессии может быть использован для крупномасштабного производства антител против с-Met по настоящему изобретению, в том числе моноклональных антител, предназначенных для применения при лечении человека. Приемлемые векторы, линии клеток и методы крупномасштабного производства рекомбинантных антител, предназначенных для терапевтического применения in vivo, широко распространены в данной области и должны быть хорошо известны квалифицированному специалисту.
Терапевтическое применение антител против с-Met
Антитела против с-Met по настоящему изобретению могут быть использованы при лечении HGF-зависимых и HGF-независимых раков.
Ненужная активация с-Met может быть вызвана специфическими генетическими поражениями, повышенной транскрипцией или лигандзависимыми аутокринными или паракринными механизмами (Comoglio et al., Nature Reviews Drug Discovery, 7:504-516, 2008). HGF-зависимые и HGF-независимые раки, котрые можно лечить антителами против с-Met, включают, не ограничиваясь ими, рак желудка, рак пищевода, медуллобластому, метастазы в печень рака ободочной кишки, папиллярный рак почки, плоскоклеточный рак головы и шеи, рак щитовидной железы, рак яичника, рак поджелудочной железы, рак предстательной железы, рак почки, гепатоцеллюлярный рак, рак молочной железы и колоректальный рак, глиобластомы, рабдомиосаркомы и остеосаркомы.
Термин “лечение” означает замедление, прерывание, прекращение, контролирование, задержку и уменьшение тяжести симптома, нарушения, состояния или заболевания и необязательно включает полное устранение всех симптомов заболевания, состояний или нарушений.
Антитела против с-Met по настоящему изобретению, предназначенные для терапевтического лечения человека, могут быть введены субъекту, нуждающемуся в таком лечении, в “эффективном количестве”. Термин “эффективное количество” означает количество или дозу антитела против с-Met, которое при однократном ии многократном введении субъекту обеспечивает достижение терапевтической эффективности при лечении заболевания. Терапевтически эффективные количества антитела против с-Met могут включать количество в интервале от около 0,1 мг/кг до около 20 мг/кг для однократной дозы. Терапевтически эффективное количество может быть определено специалистом в области здравоохранения для любого субъекта путем контролирования воздействия антитела против с-Met на биомаркер, такой как с-Met на поверхности клетки в опухолевых тканях, или симптома, такого как регрессия опухоли, и т.д. Количество антитела, вводимого в любой данный период времени, может быть различным, необходимым для введения оптимального количества антитела против с-Met, используемого отдельно или в комбинации с любым другим терапевтическим средством, на протяжении всего курса лечения.
Кроме того, антитела против с-Met по настоящему изобретению или фармацевтические композиции, включающие такие антитела, можно вводить в комбинации с любым другим методом лечения рака в виде комбинированной терапии.
Фармацевтические композиции
В объем изобретения входят фармацевтические композиции, содержащие одно антитело против с-Met по настоящему изобретению или комбинацию антител против c-Met или их антигенсвязывающие фрагменты в сочетании с одним или несколькими фармацевтически приемлемыми носителями или наполнителями. Такие композиции могут включать одно антитело против с-Met или комбинацию таких антител (например, два или более разных антител). Например, фармацевтическая композиция по настоящему изобретению может включать комбинацию антител, связывающихся с разными эпитопами на с-Met человека, например, антитело, связывающееся с доменом SEMA белка с-Met человека, в сочетании с антителом, связывающимся с доменом PSI-IPT белка с-Met человека.
Методы получения препаратов моноклональных антител, предназначенных для терапевтического применения при лечении человека, хорошо известны в данной области и описаны, например, в публикации Wang et al., Journal of Pharmaceutical Sciences, Vol.96, pp.1-26, 2007.
Краткое описание чертежей
Настоящее изобретение дополнительно будет описано со ссылкой на приведенные ниже экспериментальные примеры и прилагаемые чертежи.
Фигура 1. MKN-45-специфическая иммунная реакция в неиммунной сыворотке (0-й день) и иммунной сыворотке (45-й день), полученной у лам, иммунизированных клетками MKN-45, измеренная методом проточной цитометрии.
Фигура 2. Иммунная реакция на рекомбинантный белок с-Met в неиммунной сыворотке (0-й день) и иммунной сыворотке (45-й день), полученной у лам, иммунизированных клетками MKN-45, измеренная методом ELISA.
Фигура 3. Конкурентный анализ, показывающий, что Fab-содержащие периплазматические экстракты конкурируют с HGF, биотинилированным у N-конца, (25 нг/мл) за связывание с белком с-Met, захваченным при помощи С-концевой Fc-части.
Фигура 4. Анализ методом ELISA, показывающий, что антитело 40В8 связывается с доменом IPT1-2 белка с-Met (А) и антитело 36С4 связывается с доменом SEMA белка с-Met (В).
Фигура 5. Результаты анализа рассеяния с использованием клеток HPAF, показывающие, что антитело 38Н10 ингибирует HGF-индуцированное рассеяние в зависимости от дозы (верхний блок). Не было обнаружено агонистического воздействия при сравнении с контрольной средой.
Фигура 6. Конкурентный анализ на основе ELISA, показывающий степень конкуренции между антителами и HGF за связывание с с-Met при разных концентрациях антитела. Процентное значение конкуренции было вычислено при сравнении с контрольными антителами.
Фигура 7. Анализ пролиферации с использованием клеток ВхРС3. Химерное антитело 224G11 является антителом c224G11. (А) Вызванная антителом пролиферация в виде процентного значения максимального воздействия при 75 нг/мл HGF. (В) Воздействие антител на HGF-индуцированную пролиферацию при сравнении с максимальным воздействием, достигаемым при 75 нг/мл HGF.
Фигура 8. Агонизм, измеренный при выполнении анализа фосфорилирования с использованием клеток NSCLC A549. Процентное значение фсфорилирования c-Met, индуцированного антителами, представлено в виде процентного значения фосфорилирования, вызванного 100 нг/мл HGF. Мышиное антитело 224G11 (m224G11) и химерное антитело 224G11 (c224G11) были использованы в качестве положительных контрольных образцов, и антитело U16 было использовано в качестве отрицательного контрольного образца.
Фигура 9. Антагонизм, измеренный при выполнении анализа фосфорилирования с использованием клеток А549. Ингибирование HGF-индуцированного фосфорилирования с-Met антителами представлено в виде процентного значения при сравнении с максимальным воздействием при использовании 100 нг/мл только HGF в клетках А549. Химерное антитело 224G11 (c224G11) было использовано в качестве положительного контрольного образца, и антитело U16 было использовано в качестве отрицательного контрольного образца.
Фигура 10. Блокирование HGF-независимой активации, измеренное при выполнении анализа фосфорилирования с использованием клеток MKN-45. Ингибирование аутофосфорилирования в клетках MKN-45 антителами сравнивали с отрицательным контрольным антителом U16.1, при этом ингибирование антителом U16.1 было принято равным 0%.
Фигура 11. ADCC, вызванная антителом в клетках MKN-45, была измерена при помощи набора протеаз для мертвых клеток (анализ цитотоксичности CytoTox-Glo™). Процентное значение лизиса выражено в виде специфического лизиса при сравнении с отрицательным изотипически сходным контрольным образцом.
Фигура 12. ADCC, вызванная антителом 36С4 Potelligent™ в клетках NCI-H441, выражена в виде процентного значения лизиса клеток при измерении с помощью анализа высвобождения 51Cr.
Фигура 13. Воздействие антитела 36С4 на усиление ADCC in vivo в ксенотрансплантатах MKN-45 при инъецировании моноклонального антитела дважды в неделю.
Фигура 14А-В. Резонанс поверхностных плазмонов антител 36С4 и 48А2 при связывании с неперекрывающимися эпитопами. Было обнаружено связывание только для комплекса Met:48A2 (А) и только для комплекса Met:36C4 (B).
Фигура 15. Сравнительный анализ аминокислотных последовательностей с-Met человека и Llama glama.
Фигура 16А-В. Картирование доменов моноклональных антител с использованием химерного ECD с-Met. Связывание антитела 36С4 с с-Met человека (дикого типа) и IPT1-4 человека/ламы указывает на наличие связывания с областью SEMA-PSI (A). Связывание моноклонального антитела 13Е6 с с-Met человека и IPT1-4 ламы/человека (В).
Фигура 17. Ингибирование аутофосфорилирования при использовании комбинаций моноклональных антител против с-Met в клетках MKN-45.
Фигура 18. Результаты анализа фосфорилирования с использованием комбинаций моноклональных антител против с-Met в клетках NSCLC A549, показывающие агонистическое воздействие (А) и антагонистическое воздействие (В). Антитело U16 является изотипически сходным контрольным антителом, и антитело c224G11 является положительным контрольным антителом.
Фигура 19. Эксперимент с использованием ксенотрансплантата U87 MG in vivo, выполненный с целью определения воздействия введения 30 мг/кг антитела 36С4 на рост опухоли по сравнению с воздействием введения 30 мг/кг антитела c224G11.
Фигура 20. Анализ фосфорилирования с использованием гуманизированных согласно зародышевой линии антител 36С4 в клетках А549, показывающий агонизм (А) и антагонизм (В). Антитело U16 является изотипически сходным контрольным антителом, и антитело c224G11 является положительным контрольным антителом.
Фигура 21. Устойчивость в PBS гуманизированных согласно зародышевой линии вариантов антитела 36С4 при разных температурах. Исследования функциональности были выполнены методом резонанса поверхностных плазмонов с использованием гуманизированных согласно зародышевой линии антител 36С4 после инкубации в PBS при 4°С, комнатной температуре и 37°С в течение 56 дней.
Фигура 22. Термостойкость гуманизированных согласно зародышевой линии антител 36С4 (А) и 48А2 (В). Функциональность, исследованная методом резонанса поверхностных плазмонов, после инкубации при разных температурах в течение 1 часа.
Фигура 23. Схематическое изображение структуры химерных лама-человеческих конструкций с-Met, полученное: (А) для картирования пептидов антитела (например, 36С4), связывающегося с доменом SEMA белка с-Met. Последовательность с-Met ламы окрашена светло-серым цветом (LS); последовательность с-Met человека окрашена темно-серым цветом (hS). Указаны относительные положения сигнальной последовательности, домена SEMA, домена PSI и доменов IPT 1, 2, 3 и 4; (В) для картирования пептидов антитела (например, 48А2), связывающегося с доменом PSI-IPT1 белка с-Met. Последовательность с-Met ламы окрашена светло-серым цветом; последовательность с-Met человека окрашена темно-серым цветом. Указаны относительные положения сигнальной последовательности, домена SEMA, домена PSI и доменов IPT 1, 2, 3 и 4.
Фигура 24. Анализ уменьшения количества общего белка с-Met на поверхности клеток MKN-45 после введения разных антител против с-Met в концентрациях 1 мг/мл или 10 мкг/мл. Результаты выражены в виде процентного значения общего уменьшения с-Met.
Фигура 25. Аминокислотная последовательность внеклеточной части с-Met человека с указанием положений домена SEMA и доменов IPT.
Ссылки
В приведенном выше описании изобретения и в нижеследующих примерах приведены разные публикации, которые полностью включены в настоящее описание изобретения в качестве ссылки.
Примеры
Настоящее изобретение дополнительно будет описано со ссылкой на нижеследующие экспериментальные примеры, не ограничивающие объем изобретения.
Пример 1. Иммунизация лам
Иммунизацию лам и сбор лимфоцитов периферической крови (PBL), а также последующую экстракцию РНК и амплификацию фрагментов антител выполняли в соответствии с описанием, приведенным в публикации De Haard H, et al., JBC. 274:18218-30, 1999. Восемь лам иммунизировали линией клеток желудка человека MKN-45, сверхэкспрессирующих с-Met (DMSZ, ACC409) (сверхэкспрессия белка с-Met была подтверждена проточной цитометрией при использовании РЕ-конъюгированного антитела против HGFR (R&D systems, № по каталогу FAB3582P)). Две другие ламы иммунизировали линией клеток рака легкого NCI-H441. Лам иммунизировали при помощи внутримышечных инъекций в шею один раз в неделю в течение шести недель. В мышцы шеи было инъецировано примерно 107 клеток, и на расстоянии нескольких сантиметров от места инъекции клеток инъецировали неполный адъювант Фрейнда.
Пробы крови в количестве 10 мл были получены до и после иммунизации для исследования иммунной реакции. Через три-четыре дня после последней иммунизации брали 400 мл крови и экстрагировали полную РНК из лимфоцитов периферической крови (PBL), полученных из градиента фиколл-пака методом, описанным в публикации Chomczynski P. et al., Anal. Biochem. 162:156-159, 1987. Средний выход РНК был равен 450 мкг. Экстрагированную РНК затем использовали для синтеза произвольной кДНК и амплификации методом ПЦР V-областей тяжелой и легкой цепей (Vλ и Vκ) с целью создания библиотек Fab-содержащих фагов, описанных в публикации De Haard H, et al. (Biol. Chem. 274, 1999). Полученные библиотеки характеризовались хорошими уровнями разнообразия (1-7х108).
Иммунную реакцию на клетки MKN-45 или клетки NCI-H441 исследовали при помощи проточной цитометрии. К клеткам (2×105 клеток/лунку) добавляли 100 мкл/лунку разведенной сыворотки и инкубировали в течение 30 минут при 4°С. Культуры клеток промывали PBS и 1% BSA, добавляли 0,1 мкг/100 мкл/лунку FITC-конъюгированного антитела козы против ламы (BETHYL, № А160-100F) и инкубировали в течение 30 минут при 4°С. Культуры клеток промывали PBS и 1% BSA, затем считывали результаты в устройстве Calibur для FACS и строили график средних значений флуоресценции в зависимости от титров сыворотки (фигура 1).
Специфическую иммунную реакцию на с-Met определяли методом ELISA в иммобилизованном рекомбинантном белке с-Met (R&D systems, 358-MT/CF), используя неиммунную и иммунную сыворотку (соответственно 0-й день и 45-й день). IgG1 ламы, связанный с иммобилизованным белком с-Met, обнаруживали, используя IgG1 мыши против ламы (Daley LP, et al., Clin. Diagn. Lab. Immunol. 12:380-386, 2005) и HRP-конъюгированное антитело осла против мыши (Jackson). На фигуре 2 показана имунная реакция четырех из 10 иммунизированных лам. Аналогичная иммунная реакция была обнаружена у 4 других лам, иммунизированных клетками MKN-45, и не была обнружена у лам, иммунизированных клетками NCI-H441.
Пример 2. Отбор и скрининг Fab-фрагментов, специфичных к с-Met
Фаг, экспрессирующий Fab-фрагменты, был получен стандартными методами и использован для отбора на иммобилизованном рекомбинантном димерном белке с-Met (R&D systems, 358-MT/CF) или рекомбинантном внеклеточном домене белка с-Met. Фаг, связывающийся с с-Met, полностью элюировали трипсином стандартными методами отображения на фаге.
Выполняли два-четыре цикла селекции для обогащения экспрессированных на фаге Fab-фрагментов, специфичных к с-Met. Выделяли отдельные колонии и стандартными методами из всех библиотек получали периплазматические фракции (peris) путем индукции IPTG.
Производили скрининг Fab-фрагментов, специфичных к с-Met, пригодных для конкуренции со зрелым HGF за связывание с иммобилизованным с-Met при выполнении конкурентного анализа на основе ELISA. 2 мкл/мл антитела козы против Fcγ человека (Jackson) иммобилизовали на планшете Maxisorb, блокировали 1% казеином в PBS в течение 2 часов, добавляли 100 нг/мл рекобинантного димерного с-Met и инкубировли в течение 1 часа при комнатной температуре. Культуры промывали, добавляли 50 мкл Fab-содержащих периплазматических фракций, оставляли для связывания с захваченным с-Met и добавляли 25 нг/мл зрелого HGF, биотинилированного у N-конца (R&D systems, 294-HGN/CF). Биотинилирование N-конца выполняли в соответствии с инструкцией компании Thermo Scientific, используя 5-кратный избыток биотина NHS-LC в 50 нМ фосфатного буфера (рН 6,5) при 4°С в течение 24 часов. Биотинилированный зрелый HGF инкубировали при комнатной температуре в течение 1 часа, промывали, добавляли стрептавидин, конъюгированный с пероксидазой из хрена (srep-HRP), и инкубировали в течение еще одного часа. Добавляли ТМВ и считывали данные планшета при 620 нм. Неродственный периплазматический экстракт и 50-кратный избыток холодного (небиотинилированного) HGF вводили во все планшеты в качестве положительного контрольного образца. Пример Fab-содержащих периплазматических фракций, конкурирующих с HGF, приведен на фигуре 3.
Клоны, конкурирующие с HGF, секвенировали в VH и VL областях и распределяли в VH семейства на основании последовательности CDR3 в VH. Указанные VH семейства дополнительно исследовали методом резонанса поверхностных плазмонов (SPR) для определения скорости диссоциации (koff) и узнавания SEMA-PSI или внеклеточного домена с-Met (Decoy). 1000-2000 резонансных единиц (RU) димерного с-Met, SEMA-PSI или c-Met Decoy иммобилизовали на чипе VIA, производя связывание амином в натрий-ацетатном буфере (рН 4,5). Fab-содержащие периплазматические фракции добавляли со скоростью потока 30 мкл/мин и определяли связывание Fab-фрагментов по увеличению резонансных единиц. koff измеряли в течение 2 минут для каждого образца. В таблице 8 суммированы значения узнавания доменов и koff для разных VH семейств.
Несколько VH семейств узнавали домен SEMA-PSI, в то время как другие VH семейства узнавали только с-Met Decoy. Fab-фрагменты имели значение koff в диапазоне 10-3с-1-10-4с-1, при этом лучшее семейство (12G4) имело значение koff, равное 1,3×10-4с-1.
VH и VL домены антагонистических клонов гибридизировали с константными доменами IgG1 человека и Сκ или Сλ доменами человека, получая при этом двухвалентные моноклональные антитела в системе, описанной в заявке на патент WO 2009/145606, при выходе экспрессии, равном 15-30 мкг/мл, после очистки на протеине А.
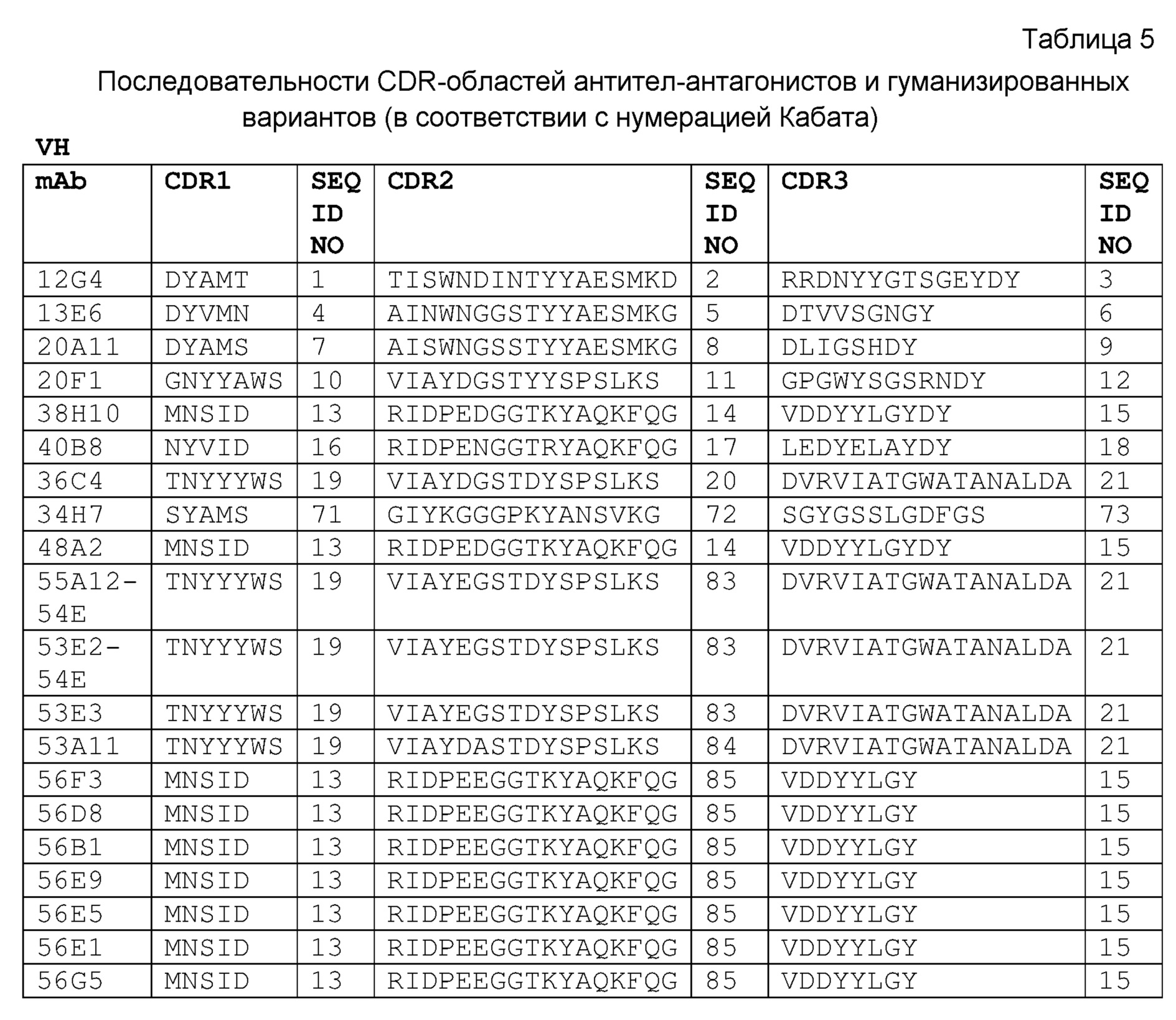
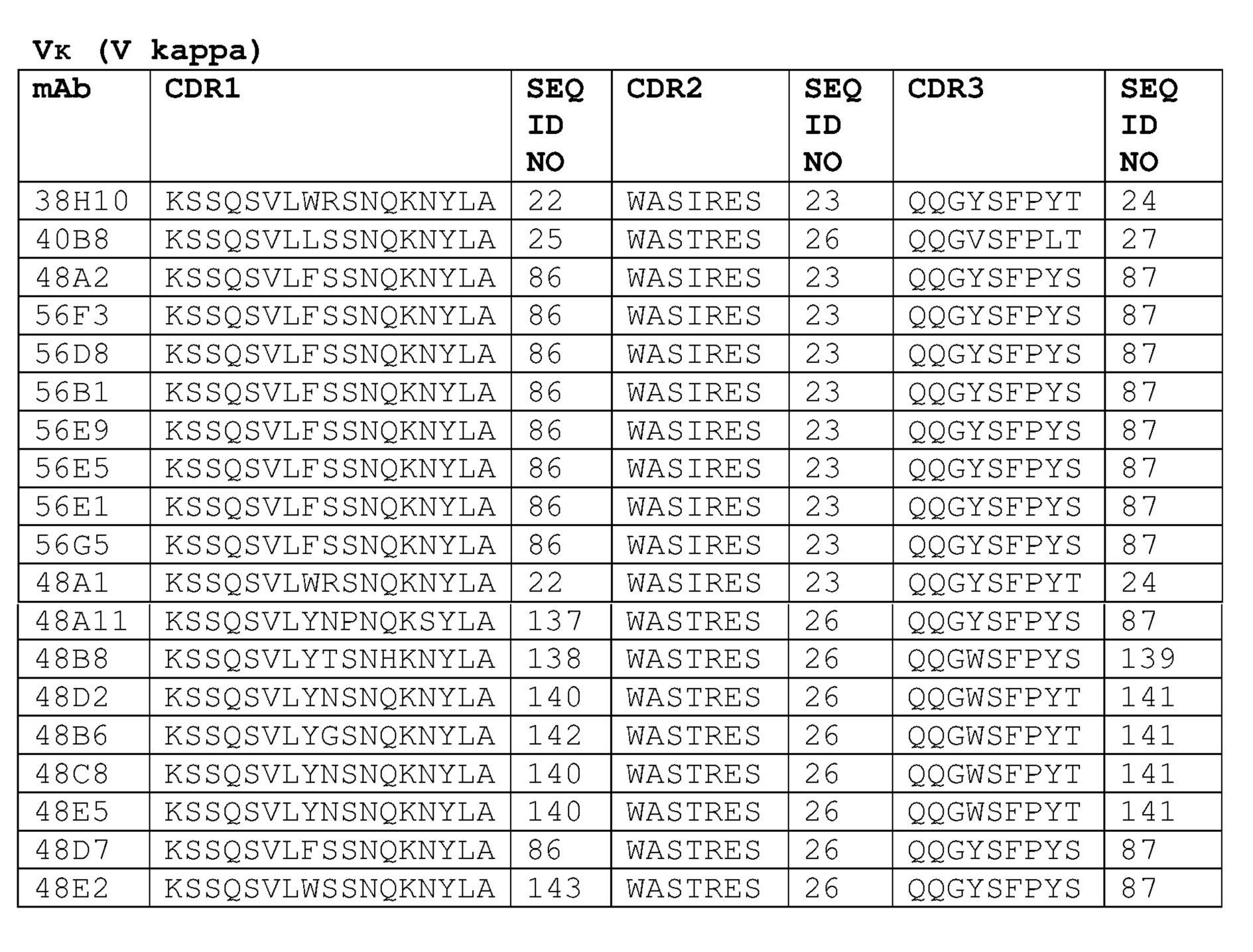
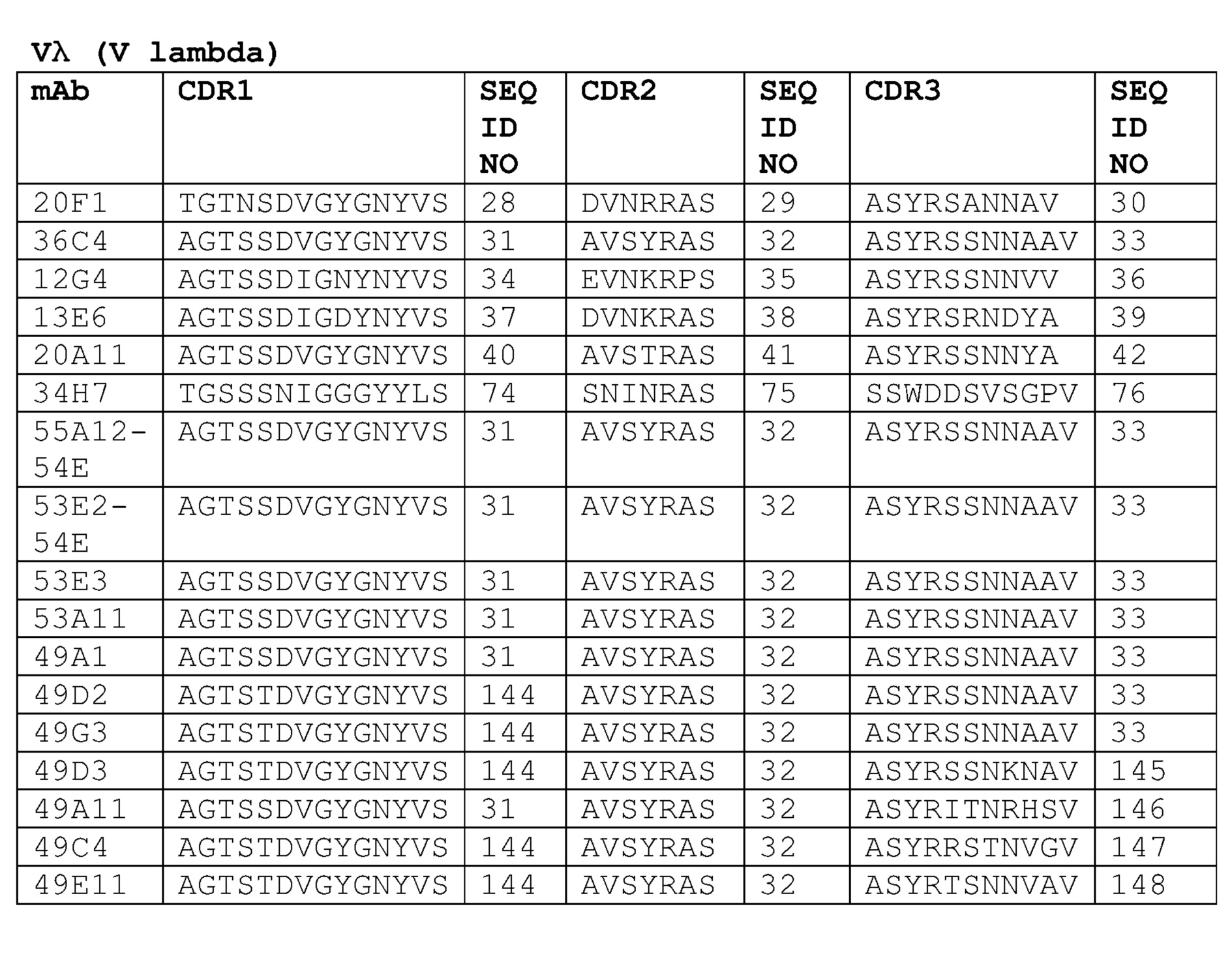












Пример 3. Картирование эпитопов
Разные эктодомены с-Met (Decoy, SEMA, SEMA-PSI, SEMA-PSI-IPT1-2 и IPT3-4 (C. Basilico, et al., J. Biol. Chem. 283:21267-2127, 2008) были иммобилизованы (1 мкг/мл) на планшете Maxisorb в PBS в течение ночи при 4°С. Антитела (mAb) добавляли в трехкратных титрах, начиная с 1 мкг/мл, и оставляли связываться в течение 1 часа при комнатной температуре. Связывание визуализировали при помощи HRP-конъюгированного протеина А и ТМВ, реакцию прекращали, добавляя H2SO4, и считывали данные при 450 нм.
На основании результатов связывания можно было картировать антитела в разных доменах с-Met за исключением нескольких антител, которые связывались только с доменом Decoy c-Met и не связывались с другими исследованными доменами (таблица 8). Некоторые антитела, связывающиеся только с доменом Decoy c-Met, способны связываться с областью IPT 2-3 или с конформационным эпитопом, который не виден на фрагментах рекомбинантного белка с-Met. Пример антитела 40В8, связывающегося с доменом IPT1-2, показан на фигуре 4А, и пример антитела 36С4, связывающегося с доменом SEMA, показан на фигуре 4В.
|
Пример 4. Анализ рассеяния возбужденной флуоресценции клеток
Раковые клетки поджелудочной железы человека (HPAF) культивировали в бессывороточной среде на 96-луночных планшетах в количестве 7000 клеток/лунку. Во 2-й день добавляли антитела в трех копиях в концентрациях 30, 10, 3 и 1 мкг/мл и инкубировали с клетками в течение 30 минут, после чего добавляли 1,25 нг/мл HGF/лунку. Клетки HPAF также инкубировали с антителами при отсутствии HGF. На 3-й день клетки фиксировали и окрашивали кристаллическим фиолетовым красителем. Величину рассеяния определяли три раза в результате выполнения трех независимых анализов двумя разными лицами.
Результаты свидетельствовали об ингибировании антителами HGF-индуцированного рассеяния возбужденной флуоресценции в зависимости от дозы, при этом было обнаружено сильное блокирование восемью антителами из 13 исследованных антител, из которых пять антител (12G4, 20A11, 38H10, 36C4 и 40В8) полностью блокировали рассеяние возбужденной флуоресценции при концентрации 30 мкг/мл. У всех восьми антагонистических антител (12G4, 13E6, 20F1, 20A11, 38H10, 34H7, 36С4 и 40В8) также отсутствовало агонистическое действие при концентрации 30 мкг/мл в отсутствие HGF. На фигуре 5 приведен пример результатов рассеяния возбужденной флуоресценции антитела 38Н10 в присутствии и в отсутствие HGF по сравнению с контрольной средой и контрольным образцом HGF.
Пример 5. Перекрестная реактивность на с-Met макака-резуса и мыши
Перекрестную реактивность на ECD с-Met макака-резуса (Maccaca mulatta, US20090191580_5) и с-Met мыши (R&D systems, № по каталогу 527-МЕ) определяли, выполняя анализ связывания методом ELISA. ECD макака-резуса иммобилизовали в PBS (1 мкг/мл) на 96-луночном планшете Maxisorb и инкубировали при 4°С в течение ночи. Белок блокировали 1% казеином в PBS, добавляли титры антител, начиная с 10 мкг/мл, и оставляли связываться в течение 1 часа при комнатной температуре. Планшет промывали, добавляли антитело козы против Fcγ человека (Jackson) и инкубировали в течение 1 часа при комнатной температуре. Планшет промывали, добавляли ТМВ и считывали данные планшета при 620 нм.
Так как белок с-Met мыши также содержал Fc-часть, антитела (2 мкг/мл) иммобилизовали на 96-луночном планшете Maxisorb в течение ночи при 4°С, блокировали, добавляли 100 нг/мл с-Met мыши и инкубировали в течение 1 часа при комнатной температуре. Добавляли HRP-конъюгированное мышиное антитело против His (Serotech) и инкубировали в течение 1 часа при комнатной температуре. Планшет промывали, добавляли ТМВ и считывали данные планшета при 620 нм. Биотинилированное антитело козы против с-Met мыши, визуализированное strep-HRP, использовали в качестве положительного контрольного образца для с-Met мыши.
Не было обнаружено значительного связывания (более чем 10-кратного) ни одного из антител с белком с-Met мыши.
Все шесть антител характеризовались перекрестной реактивностью на ECD с-Met макака-резуса, демонстрируя почти такую же силу связывания, что и с ECD c-Met человека (Decoy) (таблица 9).
|
Пример 6. Конкуренция с HGF за связывание с белком с-Met
Конкуренцию с HGF, биотинилированным у N-конца, за связывание с иммобилизованным белком с-Met определяли при помощи конкурентного анализа на основе ELISA. Пять мкг/мл мышиных антител против His (Serotech) иммобилизовали на планшете Maxisorb, блокировали 1% казеином в PBS в течение 2 часов, добавляли 100 нг/мл рекомбинантного димерного белка с-Met и инкубировали в течение 1 часа при комнатной температуре. Планшет промывали, добавляли титры антител, оставляли связываться с захваченным с-Met в течение 30 минут и добавляли 25 нг/мл HGF, биотинилированного у N-конца (R&D systems, 294-HGN/CF). Биотинилированный HGF инкубировали при комнатной температуре в течение 1 часа, после чего планшет промывали. Добавляли стрептавидин, конъюгированный с пероксидазой из хрена (strep-HRP), и инкубировали в течение еще одного часа. Добавляли ТМВ и считывали данные планшета при 620 нм. В качестве контрольного антитела использовали изотипически сходное антитело (hIgG1λ) и мышиное антитело 5D5. Конкуренцию выражали в виде процентного значения по сравнению с контрольными антителами (только strep-HRB или hIgG1λ) и строили график зависимости конкуренции от концентрации антител. IC50 вычисляли при помощи программы GraphPad Prism (таблица 10). Антитела 13Е6 и 20А11 лишь частично вытесняли HGF (примерно 50%), что может быть связано с эпитопом, узнаваемым двумя указанными антителами на с-Met. На фигуре 6 приведен пример антител против с-Met, конкурирующих с HGF за связывание с с-Met.
|
Пример 7. Агонистические и антагонистические свойства антител, измеренные при выполнении анализа пролиферации с использованием HGF-зависимых клеток ВхРС3 поджелудочной железы
Клетки ВхРС3 поджелудочной железы человека (№ по каталогу АТСС CRL-1687), реагирующие на HGF, были использованы при выполнении анализа пролиферации для дальнейшего исследования восьми антител-кандидатов. 15000 клеток высевали в присутствии сыворотки, и после прикрепления клеток (через 4-6 часов после посева) продолжали инкубацию в бессывороточной среде в течение ночи. Антитела добавляли в дозах от 20 нг/мл до 40 мкг/мл в присутствии или в отсутствие 75 нг/мл HGF для исследования соответственно антагонизма и агонизма. К клеткам, которые инкубировали в течение трех дней, добавляли аламаровый синий, инкубировали при 37°С в течение 4 дней и считывали показатели флуоресценции при длине волны возбуждения 550 нм и длине волны излучения 590 нм, получая таким образом данные о пролиферации клеток. Указанный анализ повторяли три раза. Пример одного независимо выполненного исследования агонизма (фигура 7А) и одного исследования антагонизма (фигура 7В) приведен для антител-кандидатов и эталонного антитела, включающего химерное антитело 224G11 (c224G11, Pierre Fabre). Пролиферация выражена в виде процентного значения пролиферации, полученной при использовании 75 нг/мл HGF. Три из указанных антител (38Н10, 40В8 и 36С4) характеризовали менее чем 20% индуцированной пролиферацией, при этом пролиферация антитела 38Н10 соответствовала уровню пролиферации эталонного антитела c224G11.
Пример 8. Перестановка VL для достижения лучшего сродства
Перестановку VL цепей производили для улучшения сродства двух антител 38Н10 и 48А2. В соответствии с указанным методом тяжелую цепь родительского клона (VHCH1 антитела 36С4 или 38Н10) повторно вводили в библиотеку легких цепей фага (см. пример 1). Тяжелую цепь экстрагировали из экспрессирующего вектора, в котором отсутствует выделенный из бактериофага ген 3, необходимый для отображения, во избежание загрязнения исходной легкой цепи в процессе отбора. Тяжелую цепь клонировали в библиотеку легких цепей фага, и лигированную ДНК электропорировали в клетки TG1 E. coli с созданием библиотеки переставленных легких цепей. Размер библиотек превышал 108 клонов.
Сродство в сочетании со скоростью диссоциации определяли с целью выбора Fab-фрагментов с переставленными цепями, обладающих лучшим сродством к с-Met. Была выбрана система, в которой разные количества Fab-экспрессирующих фагов инкубировали с Fc-Met в растворе в разных концентрациях (см. таблицу 11). Добавление избытка с-Met относительно фага, но в концентрации, которая ниже концентрации, необходимой для достижения требуемой аффинной константы, способствовало связыванию с фагом, обладающим более высоким сродством. Комплексы Fc-Met:фаг захватывали на титрационном микропланшете, сенсибилизированном антителом против Fc-фрагмента. Планшет промывали раствором decoy c-Met при 37°С для предотвращения повторного связывания диссоциированных фагов с захваченным Fc-Met. Время каждого цикла промывки (см. таблицу 11) увеличивали для отбора фагов с лучшей скоростью диссоциации путем вымывания вариантов с более низким сродством. Фаги элюировали трипсином и использовали для инфицирования клеток TG1 E. coli. В общей сложности было выполнено 5 циклов отбора. Кроме того, в последующих циклах отбора было уменьшено количество вводимого фага, с одной стороны, для ослабления фонового сигнала и, с другой стороны, для уменьшения концентрации антитела, что позволило повысить строгость отбора.
Скринингу подвергали по меньшей мере 30 клонов, полученных в циклах отбора III, IV и V. Клоны выращивали на планшетах с глубокими лунками (1 мл экспрессия), в результате чего были получены периплазматические фракции. Указанные периплазматические экстракты сначала исследовали в отношении конкуренции с HGF при выполнении анализа ELISA (см. пример 2). При использовании антитела 38Н10 частота конкурирующих клонов, характеризовавшихся слабыми сигналами ELISA, увеличивалась в последующих циклах отбора, при этом наблюдалось явное обогащение конкурентов в разных циклах отбора.
Затем клоны исследовали в отношении констант диссоциации методом резонанса поверхностных плазмонов. Примерно 3000 резонансных единиц (RU) Fc-Met иммобилизовали непосредственно на чипе СМ5 для получения четкого профиля связывания периплазматических экстрактов. Клоны с лучшими скоростями диссоциации были отправлены на секвенирование.
После перестановки легких цепей были получены оригинально спаренные легкие цепи (Vкаппа для 38Н10 и Vлямбда для 36С4), но лучшая скорость диссоциации по сравнению с исходным Fab-фрагментом была обнаружена только для варианта 48А2 антитела 38Н10 (10-кратное улучшение по результатам резонанса поверхностных плазмонов). Для антитела 36С4 не было достигнуто улучшение сродства, поэтому для дальнейшей работы было сохранено родительское антитело.
|
|
Некоторые Fab-фрагменты с переставленными VL цепями содержали вариабельный домен тяжелой цепи антитела 38Н10 (SEQ ID NO:49). Ниже приведены переставленные легкие цепи (аминокислотные и нуклеотидные последовательности представлены в таблицах 6 и 7) наряду с указанием скоростей диссоциации для соответствующих Fab-фрагментов (каждый Fab-фрагмент включает 38Н10 в качестве тяжелой цепи) (таблица 19).
|
|
Некоторые Fab-фрагменты с переставленными VL цепями, содержали вариабельный домен тяжелой цепи антитела 36C4Q (SEQ ID NO:88). Ниже приведены переставленные легкие цепи (аминокислотные и нуклеотидные последовательности представлены в таблицах 6 и 7) наряду с указанием скоростей диссоциации для соответствующих Fab-фрагментов (каждый Fab-фрагмент включает 36C4Q в качестве тяжелой цепи) (таблица 20).
|
Пример 9. Агонистические и антагонистические свойства антител, измеренные при выполнении анализа фосфорилирования с использованием HGF-зависимых клеток А549 NSCLC
Для дальнейшего исследования антител был выполнен анализ фосфорилирования с использованием HGF-зависимых клеток А549 NSCLC (№ по каталогу АТСС CCL-185). Клетки инкубировали в отсутствие HGF для оценки агонистической активности каждого антитела и в присутствии HGF для оценки антагонистической активности каждого антитела. На планшет высевали 40000 клеток, которые после прикрепления к планшету культивировали в бесссывороточной среде в течение ночи (через 4-6 часов после посева). Затем клетки обрабатывали антителами в течение 15 минут при 37°С. При выполнении анализа антагонизма добавляли 100 нг/мл HGF и инкубировали клетки еще 15 минут при 37°С. Также исследовали отдельно HGF (100 нг/мл) для получения эталонных значений в данном эксперименте. Клетки промывали холодным PBS и лизировали на льду мягким лизирующим буфером, содержащим PMSF (Cell signalling № 9803, включающий 1 мМ PMSF, Sigma Aldrih), в течение 15 минут. В каждую лунку 96-луночного планшета, предварительно сенсибилизированного антителом козы против с-Met, добавляли 50 мкл лизата и блокировали 1% казеином-PBS. с-Met в лизате оставляли связываться в течение ночи при 4°С. Фосфо-с-Met визуализировали при помощи антитела кролика против pY1234/1235 (Cell signaling) и HRP-конъюгированного антитела козы против кролика (Jackson Laboratories). Добавляли ТМВ, реакцию прекращали, добавляя 1М раствор H2SO4, и считывали данные при 450 нм.
Антитела исследовали в двух копиях в разных концентрациях, при этом в каждой серии экспериментов использовали контрольное антитело U16 (неродственное антитело, отрицательное контрольное антитело), химерное антитело 224G11 (c224G11, Pierre Fabre) и мышиное антитело 224G11 (mPF, Pierre Fabre), а также только HGF и клетки в качестве положительных и отрицательных контрольных образцов. На фигуре 8А-В показана низкая агонистическая активность трех антител по сравнению с контрольными антителами. Антитела 38Н10, 48А2 и 36С4 (не показаны) характеризовались более низкими уровнями фосфорилированного с-Met по сравнению с эталонным антителом c224G11. На фигуре 9 показана активность антител 48А2, 36С4 и 40В8 по блокированию HGF-индуцированного фосфорилирования по сравнению с эталонным антителом c224G11, при этом антитело 36С4 характеризовалось лучшей блокирующей активностью. Процентное значение фосфорилирования выражено в виде процентного значения максимального фосфорилирования, индуцированного 100 нг/мл HGF.
Анализы фосфорилирования с использованием клеток ВхРС3 были выполнены аналогично клеткам А549, при этом результаты были очень хорошо коррелированны с результатами, полученными при использовании клеток А549 (данные не показаны).
Пример 10. Ингибирующее воздействие антител против с-Met на аутофосфорилирование с-Met в клетках MKN-45
Для исследования способности антител ингибировать фосфорилирование в конститутивно активированных клетках были использованы клетки желудка MKN-45 (№ по каталогу DMSZ ACC 409). В указанных клетках происходит амплификация гена с-Met, вызывающая сверхэкспрессию с-Met и вследствие этого конститутивное фосфорилирование, то есть независимое от HGF.
5000 клеток высевали в присутствии сыворотки и инкубировали в течение 24 часов с антителами в разных концентрациях при 37°С. Количественное определение фосфорилированного белка с-Met выполняли при помощи анализа ELISA, описанного в примере 8.
На фигуре 10 показано блокирующее воздействие антител на фосфорилирование с-Met в клетках MKN-45 (% ингибирования). Реакцию нормализовали против отрицательного контрольного антитела U16.1 (0% ингибирования). Следует признать, что антитело 36С4 SIMPLE™ является самым сильнодействующим ингибитором HGF-независимого фосфорилирования в клетках MKN-45. Антитело c224G11 является менее сильнодействующим ингибитором, чем антитела 36С4 и 48А2. Антитело 40В8 блокирует только 40% при самой высокой концентрации и быстро утрачивает активность.
Пример 11. ADCC, вызываемая антителами в клетках MKN-45
200000 клеток MKN-45 высевали за день до добавления антитела. К клеткам добавляли титры антител и предварительно инкубировали в течение 60 минут до добавления эффекторных клеток (РВМС, выделенные из цельной крови одного донора, инкубировали в течение ночи до добавления к клеткам-мишеням) в отношении Е:Т (естественные клетки-киллеры (NK):линия клеток-мишеней), равном 5:1. Субпопуляцию NK-клеток в РВМС определяли при помощи проточной цитометрии для каждого донора в виде отношения антитела против CD16 к антителу против CD56. Планшеты инкубировали в течение 4 часов и считывали данные, используя набор протеаз для мертвых клеток (анализ цитотоксичности CytoTox-Glo™ компании Promega (№ по каталогу G9291)) для определения процентного значения лизированных клеток.
На фигуре 11 показан специфический лизис, вызванный тремя антителами, 48А2, 40В8 и 36С4, которые исследовали в зависимости от дозы при сравнении с антителом c224G11. ЕС50 трех исследованных антител соответствует диапазону антитела c224G11 (4,3, 4,6, 5,0 для антител 48А2, 40В8 и 36С4 и 2,8 нг/мл для антитела c224G11).
Пример 12. ADCC, вызываемая антителом 36С4 Potelligent™ в клетках NCI-H441
Дефукозилированное антитело 36С4 было получено в клетках СНО Potelligent™ (Biowa) и очищено протеином А. Мононуклеарные клетки периферической крови человека (РВМС), полученные у 3 доноров, отдельно очищали от гепаринизированной цельной крови стандартным методом отделения фиколлом и использовали в качестве эффекторных клеток. Клетки суспендировали в количестве 2×106/мл в среде, содержащей 200 ед/мл IL-2 человека, и инкубировали в течение ночи при 37°С. На следующий день адгезированные и неадгезированные клетки собирали и один раз промывали в культуральной среде.
Клетки-мишени и эффекторные клетки были использованы в отношении 1:50. Клетки суспендировали в количестве 5×106 клеток/мл и в каждую лунку добавляли 100 мкл.
106 клеток-мишеней NCI-H441 инкубировали с 100 мкCi 51Cr в 0,5 мл FCS на водяной бане при 37°С в течение 60 минут. Клетки промывали, ресуспендировали в 1 мл FCS и инкубировали на водяной бане при 37°С в течение 30 минут. Затем клетки дважды промывали средой, доводили до конечного объема, равного 2×105 клеток/мл, и добавляли 50 мкл в каждую лунку.
Анализ выполняли в трех копиях. 50 мкл меченых клеток инкубировали с 100 мкл эффекторных клеток и 50 мкл антитела. В один ряд лунок 96-луночного планшета помещали только клетки-мишени для контроля спонтанного высвобождения 51Cr. В один ряд лунок другого 96-луночного планшета помещали только клетки-мишени, обработанные 1% тритон-Х (для полного лизиса клеток), для получения данных о максимальном высвобождении 51Cr. Клетки инкубировали при 37°С в течение 4 часов, после чего собирали 50 мкл супернатанта, переносили на планшет Lumaplate-96, сушили и производили подсчет импульсов в счетчике бета-импульсов.
Процентное значение лизиса определяли по уравнению: % лизиса = (число импульсов в минуту образца - число импульсов в минуту при спонтанном высвобождении)/(число импульсов в минуту при максимальном высвобождении - число импульсов в минуту при спонтанном высвобождении)×100. На фигуре 12 показано процентное значение лизиса клеток NCI-H441 антителом 36С4 Potelligent (ADCC, повышенная дефукозилированием) по сравнению с нормальным фукозилированным антителом 36С4. Дефукозилированное антитело 36С4 (Potelligent 36C4) вызывает великолепный лизис клеток NCI-H441 при значении IC50, равном 0,13 нг/мл, в то время как нормальное фукозилированное антитело 36С4 не вызывает лизис клеток NCI-H441. Процентное значение лизиса, вызванного антителом c224G11, было очень низким. Дефукозилирование антитела 36С4 значительно повышает его способность индуцировать ADCC клеток NCI-H441.
Пример 13. Воздействие антитела 36C4 с повышенной ADCC на клетки NCI-H441 in vitro
Нефукозилированные антитела, полученные методом Potelligent™, не оказывают существенного воздействия на мышей in vivo. Однако установлено, что мутации в Fc-области (S239D, I332E) оказывают воздействие in vivo, усиливая действие ADCC антител благодаря увеличению сродства к FcγRIII мыши, CD16 (Lazar GA et al., PNAS, 103, 2006).
Мутации S239D, I332E вводили в IgG1 антитела 36С4 при помощи сайт-направленного мутагенеза с использованием специфических праймеров, образующих антитело 36С4Е. Антитело 36С4Е было получено аналогично родительскому антителу 36С4 при использовании клеток НЕК293Е и выполнении очистки протеином А. Не было обнаружено различий в уровнях продуцирования или уровне вытеснения HGF при выполнении конкурентного анализа на основе ELISA после введения мутаций по сравнению с родительским антителом 36С4. Действие ADCC исследовали при помощи анализа высвобождения 51Cr в клетках NCI-H441 (как описано в примере 12). Антитело 36С4 не оказывало никакого воздействия, и антитело 36С4 Potelligent вызывало несколько меньший лизис в процентном выражении по сравнению с антителом 36С4Е, содержащим мутированную Fc-область и обладающим более высокой ADCC. Значения ЕС50 для антитела 36C4-POT и антитела 36С4Е были соответственно равны 0,04 мкг/мл и 0,26 мкг/мл.
Пример 14. Воздействие антитела 36С4 с повышенной ADCC на ксенотрансплантаты MKN-45 in vivo
“Голым” мышам CD-1 в возрасте 6-8 недель подкожно инъецировали 3 миллиона клеток MKN-45. Опухоли приобрели измеряемый объем через 8 дней после инъекций, и лечение было начало на 9-й день путем внутрибрюшинного введения исследуемого антитела в разных количествах два раза в неделю. Группам из шести мышей вводили антитело 36С4Е (30, 10, 3 и 1 мг/кг) и измеряли объем опухолей (в момент выполнения инъекций). Изотипически сходное контрольное антитело IgG1 (Synagis®) было использовано в качестве контрольного образца наряду с антителом с224А11, которые вводили в самой высокой концентрации, равной 30 мг/кг.
На 23-й день после введения клеток (через 15 дней после начала лечения) у мышей, которым вводили антитело 36С4-Е, было отмечено воздействие на объем опухоли в зависимости от дозы. Антитело c224G11 не влияло на рост опухоли по сравнению с изотипически сходным контрольным антителом (фигура 13).
Пример 15. Химерные слитые белки с-Met человека-Llama glama
Химерные слитые белки ECD с-Met человека-Llama glama были созданы в результате обмена доменами IPT между с-Met человека и Llama glama с целью картирования доменов, узнаваемых антителами. Указанная конструкция была создана стандартными методами рекомбинантных ДНК и ПЦР. Белки с-Met Llama glama и человека амплифицировали из РНК, преобразованной в кДНК, из лимфоцитов периферической крови (PBL), полученных у двух доноров каждого вида. Белки ECD с-Met ламы и человека (аминокислоты 25-932) клонировали в эукариотический экспрессирующий вектор при наличии His-метки для экспрессии в виде растворимых белков клетками НЕК293. IPT1-4 (аминокислоты 568-932) ламы был заменен IPT1-4 человека в с-Met человека и наоборот - IPT1-4 человека был заменен IPT1-4 ламы в с-Met ламы при помощи сплайсирующей и перекрывающей ПЦР. Все четыре конструкции, с-Met ламы, IPT ламы/человека, с-Met человека, IPT человека/ламы, экспрессировали в клетках НЕК293 и очищали на колонках IMAC. На фигуре 15 показан сравнительный анализ (88% идентичность) с-Met человека (Genbank X54559) с белком с-Met Llama glama, амплифицированным из PBL двух доноров.
Пример 16. Картирование доменов антител с использованием химерного ECD с-Met
200 нг разных химерных рекомбинантных белков с-Met иммобилизовали на планшетах Maxisorb в течение ночи при 4°С. Планшеты промывали PBS, блокировали 0,1% казеином в течение 2 часов при комнатной температуре, добавляли антитела и оставляли связываться с с-Met в течение 1 часа при комнатной температуре. Планшет промывали, добавляли HRP-конъюгированное антитело козы против человека (разведенное в отношении 1/5000, Jackson Labs) и инкубировали в течение 1 часа при комнатной температуре, затем еще раз промывали и добавляли ТМВ. Считывали значения оптической плотности при 620 нм и представляли полученные значения в виде графика в зависимости от концентрации антител.
На фигуре 16А показано связывание антитела 36С4 с с-Met человека (дикого типа) и IPT-1 человека/ламы, указывающее на связывание с областью SEMA-PSI. На фигуре 16В показано связывание антитела 13Е6 с с-Met человека и IPT1-4 ламы/человека. Ни одно из антител не связывалось с с-Met ламы. Также было исследовано антитело 48А2, которое главным образом связывалось с конструкцией, содержащей SEMA-PSI человека, и в некоторой степени связывалось с конструкцией, содержащей IPT человека, из чего следует, что связывание происходило в перекрывающейся области доменов PSI-IPT.
Пример 17. Связывание антител 36С4 и 48А2 с неперекрывающимися эпитопами на с-Met, определяемое методом резонанса поверхностных плазмонов
Для исследования связывания двух антител 36С4 и 48А2 с неперекрывающимися эпитопами 3000 RU антитела 36С4 или 48А2 связывали с чипом СМ5. Вводили 60 мкл 40 мкг/мл мономерного белка Decoy Met с образованием комплекса на чипе. Вводили 60 мкл 10 мкг/мл антитела 36С4 (фигура 16А). Как показано на фигуре 16А, было обнаружено связывание только с комплексом Met:48А2. Аналогичным образом осуществляли связывание антитела 48А2 с комплексом Met:36C4 и комплексом Met:48A2, используя 3000 RU антитела 36С4 или 48А2, связанного с чипом СМ5. Вводили 60 мкл 40 мкг/мл белка Decoy Met для создания комплекса на чипе. Затем вводили 60 мкл 10 мкг/мл антитела 48А2. Как показано на фигуре 16В, было обнаружено связывание только с комплексом Met:36C4. Полученные результаты свидетельствуют об узнавании неперекрывающихся эпитопов антителами 36С4 и 48А2.
Пример 18. Более сильное ингибирующее воздействие, оказываемое на аутофосфорилирование с-Met при использовании комбинации антител против с-Met
Два антитела 36С4 и 48А2, узнающих неперекрывающиеся эпитопы на с-Met, как было установлено методом Biacore (фигура 16), объединяли в соотношении 1:1 при выполнении анализа фосфорилирования с использованием HGF-независимых клеток MKN-45, описанного в примере 10. Смесь антител сравнивали с антителами 36С2 и 48А2, используемыми в разных концентрациях, в отношении способности блокировать аутофосфорилирование с-Met (следует отметить, что общие концентрации антител в смеси равны общей концентрации отдельных антител, то есть для получения 0,2 нМ дозы смесь содержала по 0,1 нМ каждого антитела 36С4 и 48А2, при этом чистое антитело содержало 0,2 нМ антитела 36С4 или 48А2). Комбинация значительно лучше ингибировала аутофосфорилирование с-Met по сравнению с отдельными антителами. При содержании 0,78 нМ антитела смесь ингибировала 75% фосфорилирования по сравнению с 42% и 32% для используемых отдельно антител 36С4 и 48А2 (фигура 17). Комбинация антител 36С4 и 48А2 также сильнее блокировала аутофосфорилирование клеток NSCLC EBC-1 по сравнению с отдельными антителами (данные не показаны).
Пример 19. Комбинация неперекрывающихся антител характеризуется более низкими уровнями агонизма и лучшей блокирующей способностью при выполнении анализа фосфорилирования с использованием клеток NSCLC A549
Анализ фосфорилирования с использованием клеток NSCLC A549 выполняли в соответствии с описанием, приведенным в примере 9, для исследования антител 36С4 и 48А2 в комбинации (соотношение 1:1) или отдельно с целью определения их агонистической активности и антагонистической активности (соответственно в отсутствие или в присутствии HGF). Уровень агонизма был ниже для комбинации (36С4 и 48А2), чем для отдельно используемых антител (фигура 18А), и эффект блокирования HGF-индуцированного фосфорилирования был значительно выше для комбинации (36С4 и 48А2) по сравнению с отдельными антителами (фигура 18В).
Пример 20. Ингибирование роста опухоли в модели ксенотрансплантатов U87-MG
Для исследования ингибирующего воздействия антитела 36С4 на рост опухоли in vivo 3×106 клеток U87-MG с аутокринным HGF (АТСС HTB-14) подкожно инъецировали в заднюю часть правого бока “голых” мышей nu/nu CD1. Когда опухоль достигала 70-120 мм3 (19-й день), мышей распределяли по группам и два раза в неделю внутрибрюшинно вводили 30 мг/кг антитела 36С4, c224G11 и изотипически сходного контрольного антитела. Введение продолжали до 35-го дня после введения опухолевых клеток, когда эксперимент прекращали. Во время эксперимента при введении антител периодически измеряли размер опухоли; полученные результаты представлены на фигуре 19. Антитело 36С4, вводимое в количестве 30 мг/кг, ингибирует рост опухоли U87-MG, также как антитело-компаратор c224G11.
Пример 21. Гуманизация согласно зародышевой линии антител 36С4 и 48А2
Последовательности VH и VL доменов антител 36С4 и 48А2 сравнивали с последовательностями VH и VL доменов зародышевой линии клеток человека, при этом было установлено, что антитело 36С2 наиболее близко соответствует последовательностям зародышевого типа IGHV4-30-4*01 (идентичность каркасных областей равна 66/76) и IGLV2-18*02 (идентичность каркасных областей равна 61/69). Антитело 48А2 наиболее близко соответствовало последовательностям зародышевого типа IGHV1-46*01 (идентичность каркасных областей равна 66/76) и IGKV4-1*01 (идентичность каркасных областей равна 52/70).
Процесс гуманизации выполняли в соответствии с описанием, приведенным в WO 2010/001251 и публикациях Baca et al. (J. Biol. Chem. (1997) 272:10678-10684) и Tsurushita et al. (J. Immunol. Methods (2004) 295:9-19). Отличающиеся остатки каркасных областей человека и ламы вводили, используя библиотеку отображения на фаге. Библиотека гуманизированных согласно зародышевой линии последовательностей VH доменов антитела 36C4 или 48А2 и VL доменов антитела 36С4 или 48А2 была создана методом сборки генов на основе ПЦР с использованием перекрывающихся олигонуклеотидов со специфическими мутациями в определенных положениях (идентифицированных в таблицах 3 и 4). Мутации были вырожденными, что позволяло кодировать аминокислоты человека и ламы, предотвращая полную утрату связывания в том случае, когда остаток дикого типа имел важное значение для высокоаффинного связывания. Собранные гены клонировали в фаговом векторе, трансформируя СН и CL человека и TG1 E. coli с созданием библиотек, содержащих в общей сложности 109 клонов.
Функциональные Fab-фрагменты отбирали методом отображения на фаге в строгих условиях отбора (3-5 циклов отбора с уменьшением количества антигена и фага и увеличением продолжительности конкурентных промывок с избытком с-Met) (описанным в примере 8). Отдельные клоны исследовали в отношении скорости диссоциации и лучшие клоны секвенировали для определения идентичности последовательностям человека. Клоны, идентичные последовательностям человека >94%, продуцировали путем временной экспрессии в клетках НЕК293Е, и при выходе >15 мкг/мл указанные клоны подвергали дальнейшему исследованию.










Пример 22. Гуманизация согласно зародышевой линии антитела 36С4 не вызывает утраты активности
Четыре гуманизированных согласно зародышевой линии клона антитела 36С4 (55А12-54Е, 53Е2-54Е, 53Е3, 53А11) были подвергнуты дальнейшему исследованию для оценки агонистических и антагонистических свойств при выполнении анализа фосфорилирования А549, описанного в примере 9. Как показано на фигуре 20А, не было обнаружено усиления агонистических свойств гуманизированных антител 55А12-54Е и 53Е2-54Е по сравнению с родительским антителом 36С4. Для гуманизированных вариантов 53Е3 и 53А11 были получены аналогичные результаты. Антагонистическая активность гуманизированных антител также значительно не изменилась, как показано на фигуре 20В для антител 55А12-54Е и 53Е2-54Е.
Пример 23. Устойчивость гуманизированных согласно зародышевой линии антител 36С4 в физиологическом растворе с фосфатным буфером (PBS)
Устойчивость 3 мг/мл IgG в PBS+0,02% твин-80 исследовали в 0-й, 1-й, 7-й, 14-й, 28-й и 56-й день после хранения при 4°С, комнатной температуре и 37°С. Все образцы исследовали в отношении активности методом резонанса поверхностных плазмонов, определяя связывание с с-Met (15000-17000 резонансных единиц (RU)) и наклон кривой в период между 100-130 секунд при скорости потока 30 мкл/мин. Процентное значение функциональных антител вычисляли при сравнении с эталоном (гуманизированные антитела, хранившиеся при -20°С). На фигуре 21 показано, что не было обнаружено значительной утраты функциональности после инкубации в течение 56 дней при разных температурах и, по-видимому, не было существенных различий между четырьмя гуманизированными согласно зародышевой линии антителами.
Пример 24. Термостойкость гуманизированных согласно зародышевой линии антител 36С4 и 48А2
Термостойкость гуманизированных согласно зародышевой линии антител 36С4 и 48А2 исследовали, инкубируя антитела при разных температурах в течение 1 часа, затем образцы (0,5 мкг/мл) переносили на чип СМ-5, связанный с 15000-17000 резонансными единицами Decoy c-Met, и определяли наклон кривой в период между 100-130 секунд при скорости потока 30 мкл/мин. Процентное значение функциональных антител вычисляли при сравнении с эталоном (инкубированным при 4°С), термостойкость которого была задана равной 100%. Как показано на фигуре 22А, температуры плавления (ЕС50) гуманизированных согласно зародышевой линии антител были равны 67,2°С для 36С4, 67,1°С для 55А12-54Е, 66,1°С для 53Е2-54Е, 68,2°С для 53Е3 и 65,5°С для 53А11. В случае антитела 48А2, являющегося гуманизированным согласно зародышевой линии антителом 56F3, было отмечено значительное повышение температуры плавления с 65,4 до 71,1°С (фигура 22В).
Пример 25. Определение сайтов связывания с пептидами с-Met антител 36С4 и 48А2 при использовании лама-человеческого химерного белка с-Met
Для дальнейшего определения аминокислотных фрагментов с-Met, с которыми связывались антитела 36С4 и 48А2, были созданы химерные конструкции с-Met, содержащие примерно 20-300 аминокислот, перенесенных из с-Met человека в с-Met ламы путем амплификации методом ПЦР и лигирования в вектор, содержащий с-Met человека с меткой FLAG и стрептавидиновой меткой. На фигуре 23А показаны химерные конструкции с-Met, использованные для картирования пептидов антитела 36С4, связывающихся с доменом SEMA, и на фигуре 23В показаны химерные конструкции с-Met, использованные для картирования пептидов антитела 48А2, связывающихся с доменом PSI-IPT1.
Лама-человеческие химерные конструкции с-Met были получены в клетках НЕК293Е и очищены Стрептавидин Tactin-сефарозой НР (2-3 часа при 11°С) с последующей промывкой несвязанных белков. Связанные белки элюировали 2,5 мМ дестиобиотина, рН 8,2, и собирали фракции, равные 1,5 мл. Концентрацию белка определяли методом Nanodrop. Качество белка контролировали методом SDS-PAGE.
Анализ ELISA выполняли для исследования связывания антител с разными химерными конструкциями. Иммобилизовали 2 мкг/мл антитела 36С4 или 48А2, блокировали, добавляли химерные конструкции с-Met и визуализировали, используя 1/10000 стрептавидина-HRP (результаты анализа ELISA приведены в таблице 16).
Связывание антител с разными лама-человеческими химерными конструкциями с-Met также исследовали методом резонанса поверхностных плазмонов (SPR). 3000 резонансных единиц антител 36С4, 48А2 и HGF связывали на чипе СМ-5 в 10 мМ NaAc (рН 4,5). 60 мкл 10 мкг/мл раствора разных химерных конструкций с-Met пропускали через чип со скоростью потока 30 мкл/мин и оценивали ассоциацию в течение 2 минут. Чип регенерировали 20 мМ NaOH и 1 М раствором NaCl.
В таблице 16 показаны химерные конструкции с с-Met человека и аминокислоты (начиная с аминокислоты Е в зрелом белке с-Met человека), которые были заменены пептидами с-Met ламы, и результаты связывания, определенные методом резонанса поверхностных плазмонов и ELISA. Результаты были совместимы и свидетельствовали о том, что связывание антитела 36С4 прекращается в положении аминокислоты 199, из чего следует, что сайт узнавания находится в пределах аминокислот 98-199 с-Met человека. Данный сайт является частью домена SEMA, содержащего сайт связывания β-цепи HGF, как показано в кристаллической структуре, представленной в публикации Stamos et al., (EMBO J., 2004).
Антитело 48А2 связывалось с аминокислотами 523-633 с-Met человека, которые охватывают часть доменов PSI и IPT1, что свидетельствует об узнавании конформационного эпитопа в обоих доменах.
Метод вестерн-блоттинга с использованием с-Met в восстановительных условиях был выполнен для определения связывания антител 36С4 и 48А2 с линейными или конформационными эпитопами. Не было обнаружено связывания антител 36С4 или 48А2 с линейным эпитопом, что указывает на узнавание конформационного эпитопа (данные не показаны), и было подтверждено при использовании химерных белков с-Met.
|
|
Последовательность пептида с-Met человека, узнаваемая антителом 36С4 (аминокислоты 98-199), SEQ ID NO:181
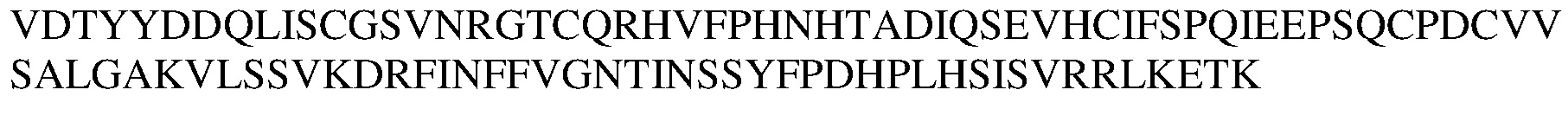
Последовательность пептида с-Met человека, узнаваемая антителом 48А2 (аминокислоты 523-633), SEQ ID NO:136
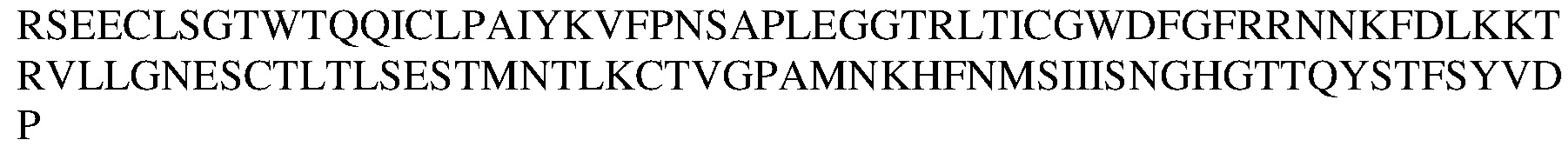
Пример 26. Уменьшение общего количества с-Met на клетках MKN-45 под воздействием антител
Общее количество с-Met, присутствующего на поверхности клеток MKN-45 после инкубации с антителами, измеряли при помощи проточной цитометрии.
На 96-луночный планшет высевали 25000 клеток MKN-45/лунку и инкубировали в течение 24 часов при 37°С, 5% СО2. Клетки культивировали в бессывороточной среде в течение 8 часов, добавляли антитела и HGF в количестве 10 или 1 мкг/мл, разведенные в бессывороточной среде, и исследовали в трех копиях. Мышиное антитело 5D5 и HGF использовали в качестве контрольных образцов для уменьшения общего количества с-Met. Отрицательным контрольным образцом является неродственное антитело IgG1, полученное аналогично антителам 36С4 и 48А2.
Клетки промывали PBS, добавляли 50 мкл/лунку раствора для диссоциации клеток без ферментов и инкубировали в течение 15 минут при 37°С. Клетки собирали на планшете для FACS, добавляли 100 мкл связывающего буфера (PBS+1% BSA) и центрифугировали со скоростью 2000 оборотов/минуту в течение 3 минут. Затем клетки выдерживали при 4°С. Клетки дважды промывали связывающим буфером и затем добавляли 2,5 мкл/мл мышиного антитела против с-Met (R&D Systems). Клетки инкубировали, встряхивая, в течение 1 часа при 4°С, и дважды промывали связывающим буфером. Добавляли АРС-конъюгированное антитело козы против мыши (Jackson Lab) в концентрации 1/500, и клетки инкубировали, встряхивая, в течение 1 часа. Затем клетки промывали связывающим буфером и считывали данные в устройстве Calibur для FACS. Было исследовано 2000 событий, при этом результаты уменьшения количества с-Met были выражены в виде процентного значения уменьшения количества с-Met в контрольной среде.
Антитела 36С4 и 48А2 не вызывали значительного уменьшения с-Met на поверхности клеток MKN-45 по сравнению с антителом 5D5 или HGF (см. фигуру 24), которые уменьшали количество с-Met на поверхности клеток на 50-60% после инкубации в течение ночи.