СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ
Вид РИД
Изобретение
Государственные капиталовложения
Настоящее изобретение было выполнено при поддержке правительственного гранта R01 AI 054193, предоставленным Национальным институтом здравоохранения. Правительство обладает определенными правами на изобретение.
Перекрестные ссылки на родственные заявки Настоящая заявка испрашивает приоритет предварительной заявки на патент US 61/258,549, поданной 5 ноября 2009 года, имеющей название «Соединения имидазо[1,2-а]пиридина, их синтез и способы применения», содержание которой включено здесь в полном объеме ссылкой.
Область техники
Воплощения, описанные здесь, относятся к области химии и биохимии, и, более конкретно, к имидазо[1,2-а]пиридиновым соединениям, их синтезу и способам применения.
Предпосылки создания изобретения
Во всем мире более двух миллиардов человек являются инфицированными туберкулезом (ТБ), и установлено, что 14400000 человек имеют активную форму ТБ. 83% из имеющих активную форму находятся в Африке, Юго-Восточной Азии и западной части Тихого океана. Общее воздействие ТБ огромно: каждый год от ТБ погибает 1,5 миллиона ВИЧ-отрицательных человек, и 0,2 миллиона ВИЧ-положительных человек. Новые штаммы, резистентные к лекарственным средствам, возникают каждый год.
Лечение активного, восприимчивого к действию лекарств ТБ включает тщательно отслеживаемую схему приема смеси рифампицина, изониазида, пиразинамида и этамбутола в течение двух месяцев, и рифампицина и изониазида дополнительно еще в течение четырех месяцев. Лечение мультирезистентной инфекции ТБ, требует длительного курса терапии, длительностью от двух до нескольких лет дорогостоящими и малоэффективными лекарствами. Вследствие длительности, сложности и дороговизны, данные схемы приема лекарств представляют собой неполноценные способы лечения в большинстве случаев ТБ. Чрезвычайно необходимы новые способы лечения инфекции ТБ, на протяжении более 40 лет и до сих пор ни одно новое лекарство для лечения ТБ не было одобрено.
Кроме того, в различных областях техники известно большое количество грибков, произрастающих на многих коммерческих полях, представляющих большую важность для человека. Для защиты как декоративных растений, так и пищевых культур от патогенных грибов было разработано огромное количество фунгицидов. Поскольку большое количество надежных и эффективных фунгицидов до сих пор еще используются, эволюция патогенных грибов и постоянно возрастающие требования по снижению уровня фунгицидов создают потребность в новых фунгицидах. Эффективная противогрибковая обработка крайне необходима для борьбы с грибковыми заражениями сельскохозяйственных культур.
Краткое описание фигур
Для более быстрого понимания воплощений ниже приводится подробное описание в сочетании с дополняющими фигурами. Воплощения иллюстрируются примерами, и не ограничиваются дополняющими фигурами.
Фигура 1 иллюстрирует низкую стоимость лечения ТБ высокими и низкими дозами имидазо[1,2-а]пиридина.
Фигура 2 отображает ЗАС (SAR) (зависимость активности от структуры) определенных агентов имидазо[1,2-а]пиридина и некоторые тенденции, обнаруженные в результате скрининга соединений в противо-ТБ исследовании.
Фигура 3 демонстрирует ЗАС определенных агентов имидазо[1,2-а]пиридина и некоторые тенденции, обнаруженные в результате скрининга соединений в противогрибковых исследованиях.
Фигура 4 демонстрирует структуры некоторых имидазо[1,2-а]пиридиновых агентов, показанных на Фиг.2 и 3.
Подробное описание раскрываемых воплощений
В приведенном ниже описании сделаны ссылки на дополняющие фигуры, являющиеся его частью, цель которых заключается в иллюстрировании возможных воплощений. Следует понимать, что другие воплощения также могут использоваться, возможны структурные или логические изменения без изменения объема изобретения. Поэтому, следующее подробное описание не следует рассматривать как ограничивающее объем изобретения, который определен посредством формулы и ее эквивалентов.
Различные операции можно описать как последовательность множества отдельных операций, способом, который может облегчить понимание воплощений; однако, порядок описания не следует истолковывать как операции, последовательность которых определена.
В целях изобретения, фраза вида «А/В» или вида «А и/или В» означает (А), (В) или (А и В). В целях описания изобретения, фраза вида «по меньшей мере один из А, В и С» означает (А), (В), (С), (А и В), (А и С), (В и С) или (А, В и С). В целях описания изобретения, фраза вида «(А)В» означает (В) или (АВ), т.е. А является необязательным элементом.
В описании могут использоваться термины «воплощение» или «воплощения», которые могут относиться к одному или нескольким одинаковым или разным воплощениям. Кроме того, термины «включающий», «содержащий», «обладающий» и тому подобное, используемые здесь по отношению к воплощениям, являются синонимичными.
Используемый здесь термин «галоген» относится к фтор-, бром-, хлор- и иод-заместителям.
Используемый здесь термин «алкил» относится к циклической, разветвленной или неразветвленной цепи алкильной группы, содержащей только углерод и водород, и содержащий, если не указано иное, от одного до двенадцати атомов углерода. Этот термин можно дополнительно охарактеризовать примером групп, таких как метил, этил, н-пропил, изопропил, изобутил, трет-бутил, пентил, пивалил, гептил, адамантил и циклопентил. Алкильные группы могут быть замещенными или незамещенными одним или несколькими заместителями, например, галогеном, алкилом, алкокси, алкилтио, трифторметилом, ацилокси, гидрокси, меркапто, карбокси, арилокси, арилом, арилалкилом, гетероарилом, амино, алкиламино, диалкиламино, морфолино, пипередино, пирролидин-1-илом, пиперазин-1-илом или другими производными, с образованием «функционализированного алкила».
Используемый здесь термин «замещенный алкил» относится к алкильному фрагменту, включающему 1-4 заместителя, выбранных из галогена, гетероцикла, циклоалкила, циклоалкенила, арила, амино, циано, нитро, -OQ10, -SQ10, -S(O)2Q10, -S(O)Q10, -OS(O)2Q10, -C(=NQ10)Q10, -C(=NOQ10)Q10, -S(O)2-N=S(O)(Q10)2, -S(O)2-N=S(Q10)2, -NQ10Q10, -C(O)Q10, -C(S)Q10, -C(O)OQ10, -OC(O)Q10, -C(O)NQ10Q10, -C(S)NQ10Q10, -N(Q10)C(S)NQ10Q10, -C(O)NQ10Q10, -C(S)NQ10Q10, C(O)C(Q16)2OC(O)Q10, -CN, =S, -NQ10C(O)Q10, -NQ10C(O)NQ10Q10, -S(O)2NQ10Q10, -NQ10S(O)2Q10, -NQ10S(O)Q10, -NQ10SQ10, и -SNQ10Q10. Каждый из гетероцикла, циклоалкила, циклоалкенила и арила может быть по усмотрению замещен 1-4 заместителями, независимо выбранными из галогена и Q15.
Используемый здесь термин «циклоалкил» относится к циклическому алкильному фрагменту. Если не указано иное, циклоалкильный фрагмент включает от 3 до 8 атомов углерода. Используемый здесь термин «алкен» относится к углеводородной молекуле с общей формулой CnH2n, содержащей одну или несколько двойных связей.
Используемый здесь термин «алкин» относится к фрагменту, характеризующемуся общей формулой C2H2n-2, соответствующей углеродным цепям с тройной связью углерод-углерод.
Используемый здесь термин «спирт» относится к любому органическому соединению, в котором гидрокси-группа (-ОН) привязана к углеродному атому алкильной или замещенной алкильной группы. Общая формула простых нецикличных спиртов CnH2n+1ОН.
Используемый здесь термин «эпоксид» относится к любому классу органических соединений, циклическим эфирам, содержащим трехчленное кольцо.
Используемый здесь термин «кетон» относится к органическим соединениям, содержащим карбонильную группу >С=O, к которой присоединены другие атомы углерода.
Используемый здесь термин «сложный эфир» относится к продукту взаимодействия карбоновой кислоты и спирта.
Используемый здесь термин «эфир» относится к органическому соединению, содержащему функциональную группу RO-R’.
Используемый здесь термин «альдегид» относится к органическому соединению, содержащему -СНО группу.
Используемый здесь термин «нитрил» относится к любому классу органических соединений, содержащих циано-радикал -CN.
Используемый здесь термин «тиол» относится к молекулярной группе, включающей связь серы и атома водорода (-SH).
Используемый здесь термин «тиоэфир» относится к соединению, полученному в результате связи серы с группой ацила, с общей формулой R-S-CO-R’. Тиоэфиры являются продуктом эстерификации карбоновой кислоты и тиола (вместо спирта в обычных эфирах).
Используемый здесь термин «сульфид» относится к органическому соединению, содержащему серу, связанную с углеродом. Термин «дисульфид» относится к структурной единице, составленной из связанной пары атомов серы.
Используемый здесь термин «сульфон» относится к химическому соединению, содержащему сульфонильную функциональную группу, присоединенную к двум атомам углерода. Центральный атом серы дважды связан двойной связью с кислородом и содержит еще два других углеводородных заместителя. Общая структурная формула R-S(=O)(=O)-R’, где R и R’ представляют собой органические группы.
Используемый здесь термин «сульфоксид» относится к химическому соединению, содержащему функциональную группу S=O, присоединенную к двум атомам углерода. Сульфоксиды можно рассматривать как окисленные сульфиды.
Используемый здесь термин «амин» относится к NH2, NHR или NR2. Если не отмечено иное, R может представлять собой алкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкинил, гетероцикл, или арил.
Используемый здесь термин «амид» относится к органическому соединению, содержащему группу -CONH2-.
Используемый здесь термин «карбамид» относится к органическому соединению химической формулы (NH2)2СО или RNHCONHR’.
Используемый здесь термин «карбамат» относится к любой группе органических соединений, обладающих общей функциональной группой общей формулы -NH(CO)O-. Карбаматы представляют собой эфиры карбаминовой кислоты, NH2COOH. Поскольку карбаминовая кислота содержит азот, присоединенный к карбоксильной группе, она также является амидом. Поэтому, карбаматные эфиры могут содержать алкильные или арильные группы, замещенные азотом, или амидной группой. Например, этилкарбамат является незамещенным, поскольку этил N-метилкарбамат содержит группу, присоединенную к азоту.
Используемый здесь термин «нитро» относится к NO2.
Используемый здесь термин «арил» относится к фенилу, замещенному фенилу, нафтилу и замещенному нафтилу.
Используемый здесь термин «морфолин» относится к органическому химическому соединению, характеризующемуся химической формулой O(CH2CH2)2NH. Данный гетероцикл содержит как аминовую, так и эфирную функциональную группы. Вследствие наличия аминовой группы, морфолин является основанием; его сопряженная кислота называется морфолином. Например, при нейтрализации морфолина соляной кислотой образуется соль морфолин хлорида.
Используемый здесь термин «тиоморфолин» относится к C4H9NS и представляет собой циклическое соединение, содержащее азот и серу. Его можно рассматривать как тиопроизводное морфолина.
Используемый здесь термин «пиперазин» относится к органическому соединению, состоящему из шестичленного кольца, содержащего два атома азота в противоположных положениях.
Используемый здесь термин «пиперидин» относится к органическому соединению молекулярной формулы (CH2)5NH. Данный гетероциклический амин состоит из шестичленного кольца, содержащего пять метиленовых единиц и один атом азота.
Используемый здесь термин «ацил» относится к любой группе или радикалу формы RCO-, где R представляет собой органическую группу.
Используемый здесь термин «фуран» относится к любому классу ароматических гетероциклических соединений, содержащих кольцо из четырех атомов углерода и атома кислорода; например, C4H4O. Используемый здесь термин «нитрофуран» относится к фурановому кольцу, содержащему нитрогруппу.
Используемый здесь термин «тиофен» относится к гетероциклическому соединению формулы C4H4S. Состоящий из плоского пятичленного кольца он является ароматическим, как показывают его продолжительные реакции замещения. К тиофену относятся бензотиофен и дибензотиофен, содержащие тиофеновое кольцо, сконденсированное с одним или двумя бензольными кольцами соответственно. Соединения, аналогичные тиофену, включают фуран (C4H4O) и пиррол (C4H4NH).
Используемый здесь термин «имидазол» относится к органическому соединению формулы C3H4N2. Данный ароматический гетероцикл классифицируют как алкалоид. Имидазол относится к родоначальному соединению, поскольку имидазолы представляют собой класс гетероциклов с одинаковой кольцевой структурой, но различными заместителями. Нитроимидазол представляет собой производное имидазола, содержащее нитрогруппу.
Используемый здесь термин «оксазол» относится к пятичленному гетероциклу, содержащему три атома водорода, один атом кислорода, один атом азота и две двойные связи; 1,3-изомер является ароматическим.
Используемый здесь термин «оксазолин» относится к ненасыщенному гетероциклическому соединению, содержащему пятичленное кольцо, две двойные связи, один атом азота и один атом кислорода; а также любые производные этого соединения.
Используемый здесь термин «тиазол» относится к любому классу ненасыщенных гетероциклических соединений, содержащих кольцо из трех атомов углерода, атом серы и атом азота; например, одним из простейших примеров является C3H3SN.
Используемый здесь термин «тиазолин» относится к ненасыщенному гетероциклическому соединению, содержащему пятичленное кольцо, две двойные связи, один атом азота и один атом серы, а также любое производное этого соединения.
Используемый здесь термин «триазол» относится к любой паре изомерных химических соединений с молекулярной формулой C2H3N3, содержащих пятичленное кольцо из двух атомов углерода и трех атомов азота.
Используемый здесь термин «пиридин» относится к любому классу ароматических гетероциклических соединений, содержащих кольцо из пяти атомов углерода и атома азота; простейшим примером является C5H5N.
Используемый здесь термин «пиразин» относится к диазину, в котором два атома азота находятся в пара-положении.
Используемый здесь термин «нафталин» относится к ароматическому, белого цвета, твердому углеводороду формулы С10Н8 и структуре из двух сконденсированных бензольных колец.
Используемый здесь термин «дикетопиперазин» относится к классу циклических органических соединений, получаемых в результате пептидного связывания двух аминокислот с образованием лактама. Они представляют собой наименьшие из возможных циклических пептидов.
Используемый здесь термин «хинолин» относится к любому классу ароматических гетероциклических соединений, состоящих из бензольного кольца, сконденсированного с кольцом из пяти атомов углерода и одного атома азота; простейшим примером является C9H7N. Изохинолин, известный также как бензо[с]пиридин или 2-бензанин, является гетероциклическим ароматическим органическим соединением. Он является структурным изомером хинолина. Изохинолин и хинолин представляют собой бензопиридины, состоящие из бензольного кольца, сконденсированного с пиридировым кольцом. В широком понимании, термин изохинолин используется в качестве ссылки на изохинолиновые производные.
Используемый здесь термин «оксазолидинон» относится к классу гетероциклических органических соединений, содержащих и атом азота и кислорода в 5-членном кольце. Используемый здесь термин «гетероциклический» относится к органическим соединениям, содержащим по меньшей мере одни атом углерода, по меньшей мере один атом, отличный от углерода, такой как сера, кислород или азот в структуре кольца. Подобные структуры могут содержать либо простые ароматические кольца, либо неароматические кольца. Каждое моноциклическое кольцо может быть ароматическим, насыщенным или частично ненасыщенным. Бициклические кольцевые системы могут включать моно-циклические кольца, содержащие один или несколько гетероатомов, сконденсированных с циклоалкильной или арильной группой. Бициклические кольцевые системы могут также включать моноциклические кольца, содержащие один или несколько гетероатомов, сконденсированных с другой моноциклической кольцевой системой.
Примеры «гетероциклов» включают, но не ограничиваются, пиридин, тиофен, фуран, пиразолин, пиримидин, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил, 3-пиразинил, 3-пиридазинил, 4-пиридазинил, 4-оксо-2-имидазолил, 1,2,4-оксадиазол, 1,3,4-оксадиазол, 4-пиридазинил, 3-пиразинил, 4-оксо-2-имидазолил, 2-имидазолил, 4-имидазолил, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил, 3-пиразолил, 4-пиразолил, 5-пиразолил, 2-оксазолил, 4-оксазолил, 4-оксо-2-оксазолил, 5-оксазолил, 1,2,3-оксатиазол, 1,2,3-оксадиазол, 1,2,5-оксадиазол, 2-тиазолил, 5-тиазолил, 3-изотиазол, 4-изотиазол, 5-изотиазол, 2-фуранил, 3-фуранил, 2-тиенил, 3-тиенил, 2-пирролил, 3-пирролил, 3-изопирролил, 4-изопирролил, 5-изопирролил, 1,2,3-оксатиазол-1-оксид, 1,2,4-оксадиазол-3-ил, 1,2,4-оксадиазол-5-ил, 5-оксо-1,2,4-оксадиазол-3-ил, 1,2,4-тиадиазол-3-ил, 1,2,4-тиадиазол-5-ил, 3-оксо-1,2,4-тиадиазол-5-ил, 1,3,4-тиадиазол-5-ил, 2-оксо-1,3,4-тиадиазол-5-ил, 1,2,4-триазол-3-ил, 1,2,4-триазол-5-ил, 1,2,3,4-тетразол-5-ил, 5-оксазолил, 3-изотиазолил, 4-изотиазолил, 5-изотиазолил, 1,3,4-оксодиазол, 4-оксо-2-тиазолинил, 5-метил-1,3,4-тиадиазол-2-ил, тиазолдион, 1,2,3,4-тиатриазол, 1,2,4-дитиазолон, фталимид, хинолин, морфолинил, бензимидазолил, бензо[d]тиазолил, бензо[d]оксазолил, диазинил, триазинил, хинолинил, хиноксолинил, нафтиридинил, азетидинил, пирролидинил, гидраноинил, оксотиоланил, диоксоланил, имидазолидинил, азабицикло[2.2.1]гептил, 2-метил-1,4-диокса-8-азаспиро[4.5]декан, 2,3-диметил-1,4-диоксо-8-азаспиро[4.5]декан, 3-метил-1,5-диоксо-9-азаспиро[5.5]ундекан и 2,4-диметил-1,5-диоксо-9-азаспио[5.5]ундекан.
Используемый здесь термин «гетероарил» относится к моно- или бицикло гетероциклу, в котором один или несколько циклических колец являются ароматическими.
Используемый здесь термин «замещенный гетероарил» относится к фрагменту гетероарила, замещенному одной или несколькими функциональными группами, выбранными из галогена, алкила, гидроксила, амино, алкокси, циано и нитро групп.
Используемый здесь термин «замещенный арил» относится к любому арильному фрагменту, содержащему 1-3 заместителя, выбранных из галогена, гетероцикла, алкила, замещенного алкила, алкенила, алкинила, циклоалкила, циклоалкенила, арила, циано, нитро, -OQ10, -SQ10, -S(O)2Q10, -S(O)Q10, -OS(O)2Q10, -C(=NQ10) Q10, -C(=NOQ10)Q10, -S(O)2-N=S(O)(Q10)2, -S(O)2-N=S(Q10)2, -NQ10Q10, -C(O)Q10, -C(S)Q10, -C(O)OQ10, -OC(O)Q10, -C(O)NQ10Q10, -C(S)NQ10Q10, -C(O)C(Q16)2OC(O)Q10, -NQ10C(O)Q10, -N(Q10)C(S)NQ10Q10, -N(Q10)C(S)Q10, -NQ10C(O)NQ10Q10, -S(O)2NQ10Q10, -NQ10S(O)2Q10, -NQ10S(O)Q10, -NQ10SQ10, и -SNQ10Q10. Гетероцикл, циклоалкил, циклоалкенил, алкенил, алкинил и арил могут быть, по усмотрению, замещены 1-3 заместителями, выбранными из галогена и Q15.
Каждый Q10 независимо друг от друга выбирают из Н, алкила, циклоалкила, гетероцикла, циклоалкенила и арила. Гетероцикл, циклоалкил, циклоалкенил и арил могут быть, по усмотрению, замещены 1-3 заместителями, выбранными из галогена и Q13. Каждый Q11 независимо выбирают из Н, галогена, алкила, арила, циклоалкила и гетероцикла. Алкил, арил, циклоалкил и гетероцикл могут быть, по усмотрению, замещены 1-3 заместителями, независимо друг от друга выбранными из галогена, нитро, циано, =S, =O и Q14.
Каждый Q13 независимо выбирают из Q11, -OQ11, -SQ11, -S(O)2Q11, -S(O)Q11, -OS(O)2Q11, -C(=NQ11)Q11, -S(O)2-N=S(O)(Q11)2, -S(O)2-N=S(Q11)2, -SC(O)Q11, -NQ11Q11, -C(O)Q11, -C(S)Q11, -C(O)OQ11, -OC(O)Q11, -C(O)NQ11Q11, -(S)NQ11Q11, -C(O)C(Q16)2OC(O)Q10, -CN, =O, =S, -NQ11C(O)Q11, -NQ11C(S)Q11, -NQ11C(O)NQ11Q11, -NQ11C(S)NQ11Q11, -S(Q)2NQ11Q11, -NQ11S(O)2Q11, -NQ11S(O)Q11, -NQ11SQ11, -NO2, и -SNQ11Q11.
Каждый Q14 независимо выбирают из Н, алкила, циклоалкила, фенила или нафтила, каждый из которых, независимо друг от друга и по усмотрению, может быть замещен 1-4 заместителями, независимо выбранными из F, Cl, Br, I, -OQ16, -SQ16, -S(O)2Q16, -S(O)Q16, -OS(O)2Q16, -NQ16Q16, -C(O)Q16, -C(S)Q16, -C(O)OQ16, -NO2, -C(O)NQ16Q16, -C(S)NQ16Q16, -CN, -NQ16C(O)Q16, -NQ16C(S)Q16, -NQ16C(O)NQ16Q16, -NQ16C(S)NQ16Q16, -S(O)2NQ16Q16, и -NQ16S(O)2Q16. Алкил, циклоалкил и циклоалкенил могут быть, по усмотрению, замещены =O или =S.
Каждый Q15 независимо выбирают из Н, алкила, циклоалкила, гетероарила, фенила или нафтила, каждый из которых, по усмотрению, замещен 1-4 заместителями, независимо выбранными из F, Cl, Br, I, -OQ16, -SQ16, -S(O)2Q16, -S(O)Q16, -OS(O)2Q16, -C(=NQ16)Q16, -S(O)2-N=S(O)(Q16)2, -S(O)2-N=S(Q16)2, -SC(O)Q16, -NQ16Q16, -C(O)Q16, -C(S)Q16, -C(O)OQ16, -OC(O)Q16, -C(S)NQ16Q16, -C(O)C(Q16)2OC(O)Q16, -CN, -NQ16C(O)Q16, -NQ16C(S)Q16, -NQ16C(O)NQ16Q16, -NQ16C(S)NQ16Q16, -S(O)2NQ16Q16, -NQ16S(O)2Q16, -NQ16S(O)Q16, -NQ16SQ16, -NO2, и -SNQ16Q16. Алкил, циклоалкил и циклоалкенил могут быть, по усмотрению, замещены =O или =S.
Каждый Q16 независимо выбирают из Н, алкила и циклоалкила. Алкил и циклоалкил, по усмотрению, включают 1-3 галогена.
Воплощения настоящего изобретения предоставляют новые имидазопиридины, например имидазо[1,2-а]пиридины. Некоторые воплощения описывают вещества и способы лечения и профилактики туберкулеза (ТБ). Другие воплощения описывают соединения и способы ингибирования роста разновидностей грибов, наносящих вред растениям. В иных воплощениях описаны способы синтеза раскрытых соединений имидазо[1,2-а]пиридина.
В воплощениях, имизадо[1,2-а]пиридиновые соединения могут быть полезными при лечении или профилактике туберкулеза. Активность in vitro описываемых соединений можно оценить стандартными тестами, например скринингом H37RV ТБ.
В воплощениях, имидазо[1,2-а]пиридиновые соединения, описанные здесь, могут быть полезными для лечения (например, улучшения или профилактики) устойчивого к действию лекарств (УДЛ) и неустойчивого ТБ. В одном воплощении соединение можно вводить пациенту местно или системно. В других воплощениях соединения имидазо[1,2-а]пиридина можно вводить парентерально, например подкожно, внутривенно или внутримышечно, или можно вводить перорально либо ингаляциями. Соединения имидазо[1,2-а]пиридина можно использовать отдельно либо в сочетании с другими противотуберкулезными агентами. В одном воплощении соединение имидазо[1,2-а]пиридина можно вводить в различных концентрациях, в зависимости от чувствительности инфекции к воздействию вводимого соединения, тяжести заболевания, латентности или активности инфекции, устойчивости к лекарствам и общего состояния пациента.
В одном воплощении, соединения имидазо[1,2-а]пиридина можно вводить в состав фармацевтической композиции. Воплощения настоящего изобретения включают любые рацемические, оптически-активные, полиморфные, таутомерные или стереоизомерные формы или смеси описываемых соединений, обладающих полезными свойствами, описываемыми в настоящем документе.
В случаях, когда соединения являются основными или кислотными, и образуют нетоксичные соли кислот или оснований, допустимо их использование в виде фармацевтически приемлемых солей. Примеры фармацевтически приемлемых солей включены в объем изобретения и включают соли присоединения органической кислоты, образующей физиологически приемлемый анион и неорганическую соль.
Фармацевтические композиции в соответствии с воплощениями можно получать, сочетая описываемые соединения с твердым или жидким фармацевтически приемлемым носителем, и, по усмотрению, с фармацевтически приемлемыми вспомогательными веществами и наполнителями, использующимися в стандартных и обычных способах. Твердые формы включают порошки, таблетки, диспергируемые гранулы, капсулы, крахмальные капсулы и суппозитории. Твердый носитель может представлять собой по меньшей мере одно вещество, которое также может играть функцию разбавителя, ароматизатора, растворителя, лубриканта, суспендирующего агента, связующего агента, вещества, улучшающего распадаемость таблеток и агента для инкапсулирования. Инертные твердые носители включают магния карбонат, магния стеарат, тальк, сахар, лактозу, пектин, декстрин, крахмал, желатин, целлюлозные материалы, легко плавящиеся воски, масло какао и т.п. Композиции в жидкой форме включают растворы, суспензии и эмульсии. Например, можно предложить растворы описываемых здесь соединений в воде и системах вода-пропиленгликоль, по усмотрению содержащие подходящие красители, ароматизаторы, стабилизаторы и/или загустители.
В одном воплощении фармацевтические композиции можно получать с помощью обычных способов в единичных лекарственных формах, содержащих эффективные количества одного или нескольких активных компонентов. В воплощениях, количество активного компонента (вещества) в фармацевтической композиции и единичной лекарственной форме может варьироваться или регулироваться в очень широких диапазонах, в зависимости от конкретного применения, эффективности конкретного соединения и желаемой концентрации. В одном воплощении количество активного компонента может варьировать от 0,5 мас.% до 90 мас.% от массы композиции.
В других воплощениях в терапевтическом применении для лечения, улучшения состояния, предотвращения или борьбы с ТБ у пациентов, соединения или фармацевтические композиции, их содержащие, можно вводить перорально, парентерально и/или путем ингаляций в дозах, обеспечивающих и поддерживающих концентрацию в крови активного компонента, установленную в тестах на животных как терапевтически эффективную. В одном воплощении, подобное терапевтически эффективное количество/доза активного компонента может находиться в диапазоне примерно от 0,1 до 100 мг/кг, например от 0,1 до 10 мг/кг живого веса в день. Следует понимать, что дозы могут меняться в зависимости от состояния пациента, тяжести инфицирования, конкретной микробиологической разновидности, активности или латентности инфекции, устойчивости штамма к воздействию лекарств, продолжительность инфицирования до начала лечения и конкретного используемого вещества. Также, следует понимать, что первоначально вводимая доза может превышать верхний уровень в целях более быстрого достижения желаемого уровня в крови, либо первоначальная доза может быть ниже оптимальной, а дневную дозу можно постепенно увеличивать во время курса лечения в зависимости от конкретной ситуации. При желании, дневную дозу можно разделить на несколько доз для введения, например для введения дважды или трижды в день.
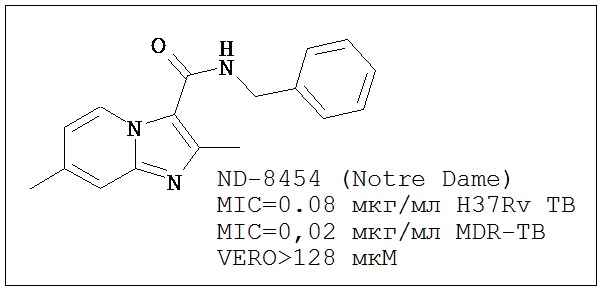
В одном воплощении, исходное соединения имидазо[1,2-а]пиридина было получено и протестировано в качестве показательного представителя противотуберкулезных агентов класса новых соединений имидазо[1,2-а]пиридина, описанных здесь. Такое соединение обозначено далее как вещество ND-8454, структура соединения показана в Таблице 1. Имидазо[1,2-а]пиридин представляет собой простое бициклическое производное, с атомом азота в головном мостиковом положении. Данный класс молекул не представлен в литературе, посвященной ТБ, и является очень привлекательным исходным классом вследствие низкой стоимости начальных материалов и простоты синтеза потенциальных противотуберкулезных соединений из данных стартовых материалов (<1 мг/мл).
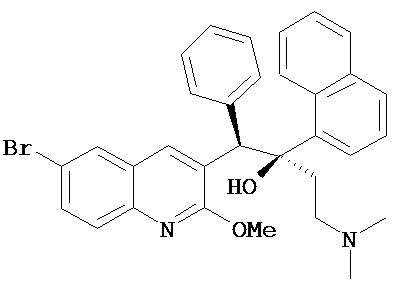
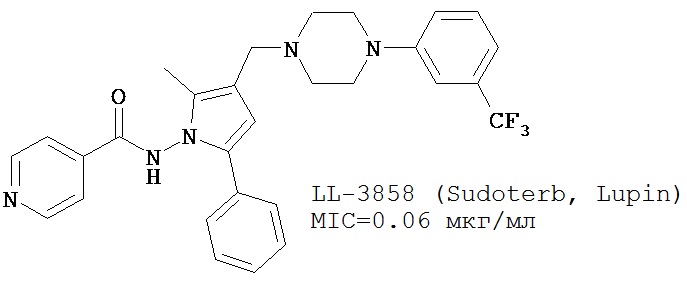
Большое количество существующих клинических претендентов в терапевтические средства против ТБ являются производными существующих основных молекул (например, моксифлоксацин и гатифлоксацин, см. Таблицу 1), что приводит к получению лекарств, гораздо более эффективных по отношению к возникающей устойчивости. Другие клинические претенденты представляют собой сложные соединения, получение которых является сложным и дорогостоящим (например, потенциальные противотуберкулезные соединения ТМС207, РА-824, ОРС-67683 и LL-3858, см. Таблицу 1). Напротив, ND-8454, N-бензил-2,7-диметилимидазо[1,2-а]пиридин-3-карбоксамид, начальный «успешный вариант» на основе структуры имидазо[1,2-а]пиридина, характеризуется активностью in vitro no отношению к H37Rv ТБ сравнимой с таковой для современных клинических претендентов ((MIC=0,08 мг/мл или 286 нМ) отсутствием обнаружимой токсичности к клеткам VERO или клеткам HeLa (>128 и >50 мкМ, соответственно).
|
В соответствии с различными воплощениями. Таблица 2 иллюстрирует эффективность нескольких примерных соединений по отношению к некоторым штаммам, устойчивым к определенным лекарствам против ТБ.
|
В соответствии с различными воплощениями. Таблица 3 иллюстрирует эффективность нескольких примерных соединений по отношению к штаммам, устойчивых к воздействию нескольких лекарств (MDR) ТБ.
|
В других воплощениях примерные соединения, описанные выше, можно синтезировать согласно следующему общему способу. ND-8454, например, можно получить синтезом в четыре стадии, из легкодоступных недорогих реагентов. Для оценки потенциальной доступности и полезности получения данного соединения в килограммовых количествах оценивали стоимость постадийного синтеза до ND-8454 с использованием следующего иллюстративного способа (см. Схему 1, ниже).
Схема 1. Синтез ND-8454
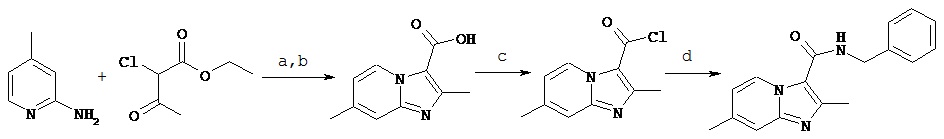
Реагенты: (а) 1,2-диметоксиэтан, кипячение с обратным холодильником, 48 часов, (b) 1H LiOH, EtOH, кипячение с обратным холодильником, 36 часов; (с) оксалил хлорид, CH2Cl2, ДМФ (диметилформамид) (кат.), комнатная температура, 4 часа; (d) бензиламин, Et3N, CH2Cl2, кипячение с обратным холодильником, 14 часов.
В данном примере синтеза ND-8454, раствор 2-амино-4-пиколина (10,00 г, 91,5 ммоль) и этил-2-хлорацетоацетат (7,93 г, 45,8 ммоль) растворили в 92 мл 1,2-диметоксиэтана (DME) и нагревали до кипения в течение 36 часов. Реакционную смесь отфильтровали, осадок (соль гидрохлорид 2-амино-4-пиколина) собрали и промыли гексаном. Фильтрат сконцентрировали в вакууме, остаток растворили в CH2Cl2, промыли 5% раствором уксусной кислоты (2 раза) и солевым раствором. Органическую фазу собрали, сушили над сульфатом натрия (Na2SO4), отфильтровали и затем сконцентрировали в вакууме. Полученный неочищенный материал очищали колоночной хроматографией с колонкой, заполненной силикагелем, с помощью системы растворителей 20% этилацетат; CH2Cl2, с получением 7,8 г (78%) этил 2,7-диметилимидазо[1,2-а]пиридин-3-карбоксилата в виде желтовато-коричневого осадка. Тпл 59-61°С; 1H ЯМР (300 МГц, CDCl3) 9,14 δ (d, J=7.1 Гц, 1H), 7.34 (S, 1H), 6.78 (dd, J=7.1, 1.7 Гц, 1H), 4.40 (q, J=7.1, 7.1, 7.1 Гц, 2Н), 2.66 (s, 3H), 2.42 (s, 3Н), 1.42 (t, J=7.1, 7.1 Гц, 3H). МСВР (Масс-спектрометрия с высоким разрешением) (EI), М+1 вычисл. для C12H15N2O2, 219,1155; обнаружено 219,1128. Время удержания = 1,4 минуты (подвижная фаза: 60% вода: ацетонитрил).
Этил 2,7-диметилимидазо[1,2-а]пиридин-3-карбоксилат (6,4 г, 29,3 ммоль) растворили в 75 мл этанола95%), добавили 1М LiOH (60 мл, 60 ммоль) и реакционную смесь нагревали до кипячения с обратным холодильником в течение 36 часов. Полученный раствор сконцентрировали до сухого, далее подкислили (рН~2-3), добавив 4 Н HCl; полученный осадок отфильтровали и сушили, получив 4,6 г (82%) 2,7-диметилимидазо[1,2-а]пиридин-3-карбоновую кислоту, в виде грязно-белого твердого остатка. Тпл. 180-183°С; 1H ЯМР (300 МГц, CD3OD) δ 9,52 (d, J=7,1 Гц, 1Н), 7,73 (td, J=1,8, 0,9, 0,9 Гц, 1Н), 7,48 (dd, J=7,1, 1,3 Гц, 1Н), 2,81 (s, 3H), 2,63 (s, 3H). МСВР (EI), М+1 вычисл. для C10H11N2O2, 191,0815; получено 191,0837. Время удержания = 0,6-0,7 минут (подвижная фаза: 60% водькацетонитрил)
2,7-диметилимидазо[1,2-а]пиридин-3-карбоновую кислоту (2,8 г, 14 ммоль) частично растворили в 35 мл безводного CH2Cl2 и далее добавили оксалил хлорид (3,3 мл, 39 ммоль) с катализатором (20 мкл) N’N-диметилформамидом (ДМФ).
Реакционную смесь перемешивали в атмосфере аргона при комнатной температуре в течение 4 часов. Прозрачный раствор оранжевого цвета сконцентрировали до сухого остатка и полученный кислый хлорид (3,6 г, 14 ммоль, желтый остаток) растворили в 35 мл безводного CH2Cl2. Медленно добавили триэтиламин (5,9 мл, 41,9 ммоль) и бензиламин (1,8 мл, 16,7 ммоль). Реакционную смесь нагревали до 50°С в атмосфере аргона в течение 16 часов. Далее реакционную смесь сконцентрировали до сухого остатка и полученный остаток растворили в этилацетате (EtOAc), затем промыли насыщенным раствором бикарбоната натрия (2 раза) и промыли солевым раствором.
Органическую фазу собрали и сушили над Na2SO4, осушитель отфильтровали, органическую фазу сконцентрировали до масла, кристаллизующегося при стоянии. Остаток очищали хроматографией на силикагеле, в качестве элюента используя градиент 1:10 (EtOAc: CH2Cl2) до 10:1 (EtOAc: CH2Cl2). Получили 2,75 г N-бензил-2, 7-диметилимидазо[1, 2-а] пиридин-3-карбоксамид (ND-8454, 70%) в виде грязно-белого твердого остатка. Тпл. 166-167°С; 1H ЯМР (500 МГц, CDCl3) δ 9,30 (d, J=7,1 Гц, 1Н), 7,39-7,28 (m, 5H), 7,25 (s, 1Н), 6,75 (dd, J=7,2, 1,8 Гц, 1Н), 6,05 (bs, 1Н, NH), 4,69 (d, J=5,7 Гц, 2Н), 2,65 (s, 3Н), 2,41 (s, 3Н). 13С ЯМР (126 МГц, CDCl3) δ 161,52, 146,54, 145,36, 138,30, 128,84, 127,67, 127,61, 127,35, 127,31, 115,72, 115,05, 43,42, 21,34, 16,83. МСВР (EI), М+1 вычисл. для C17H18N3O, 280,1444; найдено 280,1480. Время удержания = 0,8-1,1 минут (мобильная фаза: 60% вода: ацетонитрил).
В другом воплощении соединения имидазо[1,2-а]пиридина можно синтезировать в соответствии с общей схемой 2, приведенной ниже.
Схема 2. Химия имидазо[1,2-а]пиридина
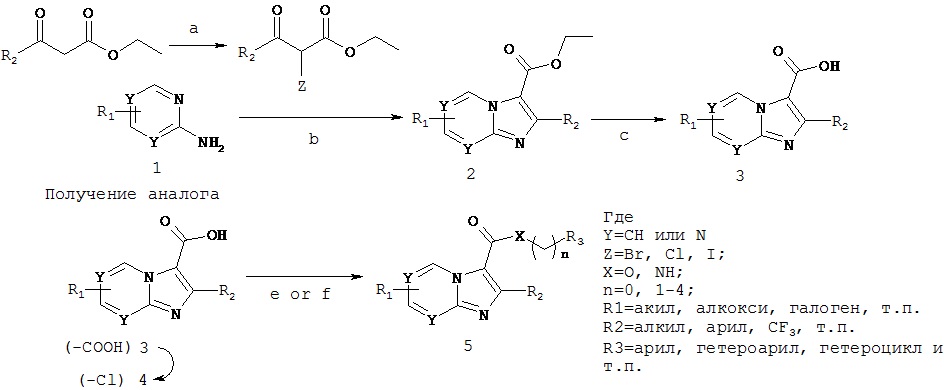
Реагенты: (a) N-Z сукцинимид, ДМСО, комнатная температура, 4 часа, где Z = Бромо, Хлор или Иод; (b) 1,2-диметоксиэтан, кипячение с обратным холодильником, 48 ч; (с) 1Н LiOH, EtOH, кипячение с обратным холодильником, 36 ч; (d) оксалил хлорид, CH2Cl2, ДМФ (кат.), комнатная температура, 4 ч; (е) R-NH2 или R-OH, EDC-HCl, DMAP, CH3CN, 16 ч; если хлорид (f) R-NH2 или R-OH, Et3N, CH2Cl2, 16 ч.
На фигуре 1 показано, что ND-8454 можно быстро получить из доступных реагентов, используя способ, описанный выше. Стоимость получения активных фармацевтических ингредиентов в коммерческом масштабе составляет $300-1000/кг. Это объясняет значительно низкую стоимость всего $0,03-$0,1/день при дневной дозе 100 мг. Поэтому, ND-8454 и подобные агенты имидазо[1,2-а]пиридина являются очень недорогими в получении и поэтому могут быть легкодоступными для населения в случае необходимости.
Воплощения настоящего изобретения также предлагают способ лечения или предотвращения инфицирования ТБ у пациента с помощью описываемых здесь соединений. Используемый здесь термин «туберкулез» и «ТБ» относится к микобактериальной инфекции, известному и часто смертельному инфекционному заболеванию вызываемому, как правило, Mycobacterium tuberculosis. Туберкулез обычно атакует легкие (легочный ТБ), но также может поражать центральную нервную систему, лимфатическую систему, систему кровообращения, мочеполовую систему, желудочно-кишечный тракт, кости, суставы и даже кожу. Другие микобактерии, такие как Mycobacterium bovis, Mycobacterium africanum, Mycobacterium canetti и Mycobacterium microti также вызывают туберкулез, однако данные разновидности менее характерны для человека.
Классические симптомы туберкулеза включают хронический кашель с кровянистой мокротой, повышенную температуру, ночную потливость и потерю веса. Инфицирование других органов имеет широкий диапазон симптомов. В некоторых воплощениях туберкулез диагностируют радиологически (флюорография), с помощью туберкулиновой кожной пробы, исследованиями крови, а также микроскопическим изучением и микробиологическим посевом физиологических жидкостей. Лечение туберкулеза является сложным процессом и обычно требует длительного курса различных антибиотиков, и резистентность к антибиотикам является растущей проблемой.
Примерно одна третья часть населения земли инфицирована М. tuberculosis. Однако, в большинстве случаев заболевание не развивается до ярко-выраженной стадии; бессимптомное, латентное течение болезни является наиболее распространенным. Примерно один случай из десяти подобных латентных инфекций переходит в активное заболевание, которое, в случае отсутствия лечения, приведет к смерти больше чем половины пациентов. В 2004 г. смертность и статистика заболеваемости включала 14,6 миллионов хронических активных случаев, 8,9 миллионов новых случаев и 1,6 миллионов смертей, главным образом в развивающихся странах. Кроме того, в развитом мире растет количество людей, заражающихся с туберкулезом вследствие снижения иммунитета из-за иммунодепрессивных лекарств, наркозависимости или СПИДА. Распределение туберкулеза в мире неравномерно, примерно 80% населения большинства стран Азии и Африки имеют положительную реакцию на туберкулезные тесты, в то время как в США только 5-10% населения имеют положительный отклик на тес. Установлено, что в США регистрируют 25000 новых случаев туберкулеза каждый год, 40% из которых возникают у иммигрантов из других стран, для которых туберкулез приобретает масштабы эпидемии.
Установленные 75% случаев активного туберкулеза включают легочный ТБ. Симптомы включают боль в груди, харканье кровью, тяжелый длительный кашель в течение более трех недель, повышенную температуру, озноб, ночное потение, потерю аппетита и веса, бледность, и часто быструю утомляемость. В других 25% активных случаев инфекция переходит из легких, вызывая внелегочный туберкулез. Подобное характерно для пациентов с пониженным иммунитетом и маленьких детей. Места внелегочного поражения включают плевру при туберкулезном плеврите, центральную нервную систему при менингите, лимфатическую систему при туберкулезном шейном лимфадените, мочеполовую систему при туберкулезе мочеполового тракта, а также кости и суставы при болезни Потта позвоночника. Особенно тяжелой формой является диссеминированный ТБ, более известный под названием милиарный туберкулез. Хотя внелегочный туберкулез является не контагиозным, он может сопровождаться легочным туберкулезом, являющимся контагиозным.
Возбудитель ТБ, Mycobacterium tuberculosis, представляет собой аэробную, грамположительную бактерию. Кроме того, комплекс М.tuberculosis включает три другие микобактерии: М.bovis, М.africanum and М.microti. M.africanum не является широко распространенной, однако в некоторых частях Африки является существенной причиной туберкулеза. М.bovis являлась до недавнего времени одной из наиболее распространенных причин возникновения туберкулеза, однако после внедрения пастеризации молока ее вклад в общую картину заболеваемости в развитых странах существенно сократилась. М.microti главным образом обнаруживается у пациентов с иммунодефицитом, хотя возможно, распространение данного патогена было недооценено.
Другие известные патогенные микобактерии, включают Mycobacterium leprae, Mycobacterium avium и М.kansasii. Последние две принадлежат к группе нетуберкулезных микобактерии (НТМ). Нетуберкулезные микобактерии не вызывают ни ТБ, ни проказу, но являются причиной болезней, сходных с ТБ.
Особенности полиморфизма гена IL12B связывают с предрасположенностью к ТБ. Кроме того, пациенты с сахарным диабетом принадлежат к группе повышенного риска возникновения контактного туберкулеза, такие пациенты более слабо откликаются на лечение, вероятно вследствие худшей адсорбции лекарства. Другие состояния, повышающие риск, включают внутривенное злоупотребление наркотиками, недавнее инфицирование ТБ, либо неправильное лечение ТБ в истории болезни; данные флюорографии, позволяющие сделать вывод о возникновении ТБ в прошлом, свидетельствующие о наличии фиброзов и узелков; силикоз, продолжительная терапия кортикостероидами и другие иммуносупрессивные терапии, раковые образования головы и шеи; гематологические и ретикулоэндотелиальные заболевания, такие как лейкемия и болезнь Ходжкина; последняя стадия болезни почек; шунтирование тонкой кишки или гастрэктомия; хронический синдром мальабсорбции, дефицит витамина Д, а также недостаток веса. Кроме того, некоторые лекарства, включая лекарства против ревматоидных артритов, выступающих в роли блокаторов фактора некроза опухолей альфа, повышают риск активации латентной формы инфекции, из-за важной роли этого цитокина в иммунной защите от ТБ. В воплощениях изобретения, пациенты с одним или несколькими перечисленными факторами риска могут быть подходящими кандидатами для эффективной терапии или предотвращения ТБ.
Как было описано выше, соединения в соответствии с воплощениями настоящего изобретения разработаны с выраженной противотуберкулезной активностью. В некоторых воплощениях предоставлены способы лечения или профилактики туберкулеза у пациента. Кратко, способ включает выбор пациента, нуждающегося в подобном лечении и введение пациенту терапевтически эффективного количества по меньшей мере одного соединения формулы
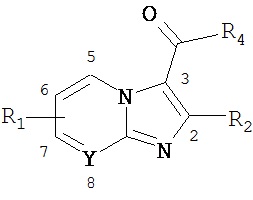
или его фармацевтически приемлемой соли. Согласно воплощениям, R1 представляет собой алкил, замещенный алкил, циклоалкил, функционализированный алкил, циклогетероалкил, арил, замещенный арил, гетероарил, либо гетероцикл, причем R1 является моно или полизамещенным; R2 представляет собой алкил, замещенный алкил, циклоалкил, функционализированный алкил, циклогетероалкил, арил, замещенный арил, гетероарил, либо гетероциклический, причем R2 является моно или полизамещенным; R3 представляет собой Н, алкил, замещенный алкил, циклоалкил, функционализированный алкил, циклогетероалкил, ацил, замещенный ацил, галоацил, арил, замещенный арил, гетероарил, замещенный гетероарил или гетероциклический, причем R3 моно или полизамещенный, также R3 не является метиловым эфиром, этиловым эфиром, трет-бутиловым эфиром или тиазолином, и Y представляет собой СН или N, в любом из положений 5, 6, 7 или 8.
В одном воплощении, соединение может также иметь формулу
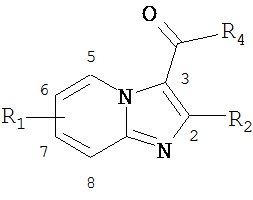
либо являться его фармацевтически приемлемой солью. Согласно воплощениям изобретения, R1 представляет собой алкил, замещенный алкил, циклоалкил, функционализированный алкил, циклогетероалкил, арил, замещенный арил, гетероарил, замещенный гетероарил, или гетероцикл, причем R1 является моно или полизамещенным; R2 представляет собой алкил, замещенный алкил, циклоалкил, функционализированный алкил, циклогетероалкил, алкокси, арил, замещенный арил, гетероарил, замещенный гетероарил, причем R2 является моно или полизамещенным Y представляет собой СН или N в любом из положений 5, 6, 7 или 8; и R4=OR1, NHR1, NR1R2, NHNR1, or NHOR1.
В некоторых примерах, не ограничивающих объем настоящего изобретения, соединения могут иметь формулу
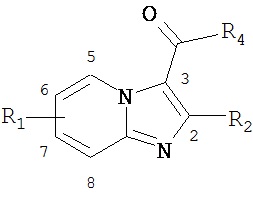
где(a) R1 представляет собой 7-СН3, R2 представляет собой СН3, R4 представляет собой (3-хлор-5-(трифторметил)пиридин-2-ил)метанамин (ND-9902);
(b) R1 представляет собой 7-СН3, R2 представляет собой СН3, R4 представляет собой 4-(4-(трифторметил) фенокси)анилин (ND-9903);
(c) R1 представляет собой 7-СН3, R2 представляет собой СН3, R4 представляет собой 4-(4-фторфенокси)бензиламино (ND-9758);
(d) R1 представляет собой 7-СН3, R2 представляет собой СН3, R4 представляет собой (3-этокси)бензиламино (ND-9906);
(e) R1 представляет собой 7-СН3, R2 представляет собой СН3, R4 представляет собой (3-изопропокси)бензиламино (ND-9872) или
(f) R1 представляет собой 6-СН3, R2 представляет собой СН3, R4 представляет собой (4-метилсульфонил)бензиламино (ND-9965).
В воплощениях изобретения, при скрининге in vitro, было выявлено что имидазо[1,2-а]пиридин обладает преимуществами по сравнению с другими противо-ТБ гетероциклами, оцененными ранее. Например, поскольку уровень эффективности эфирных аналогов (а именно бензил и этил) был хорошим в различных гетероциклических сериях (оксазолины, оксазолы, тиазолины, тиазолы и имидазо[1,2-а]пиридины), данные эфиры являлись метаболически лабильными. Поскольку предполагалось, что соответствующие амиды будут более стабильными, их анти-ТБ активность существенно снизилась, за исключением имидазо[1,2-а]пиридин бензил амидов (NHCH2Ph), которые оказались более перспективными. Кроме того, стабильность имидазо[1,2-а]пиридиновых аналогов в микросомах крыс, собак и человека оказалась в крайней степени более высокой (>80% сохранялось после инкубации в течение 15 мин). Кроме того, в отличие от других гетероциклических структур, имидазо[1,2-а]пиридины характеризовались крайне высокой метаболической стабильностью при исследованиях в искусственном желудочном соке (>90% сохранялось по истечении 15-минутной инкубации).
В других воплощениях были получены и оптимизированы имидазо[1,2-а]пиридиновые аналоги с помощью исследований in vitro SAR для улучшения эффективности, метаболизма, селективности организма и состава. Вкратце, получили набор аналогов имидазо[1,2-а]пиридина и исследовали метаболизм и селективность организма. На Фиг.2 представлены данные SAR некоторых имидазо[1,2-а]пиридиновых агентов и некоторые тенденции, выявленные в результате скрининга соединений. (На Фиг.4 изображены структуры соединений, результаты для которых представлены на Фиг.2) Исследование VERO представляет собой исследование токсичности, позволяющее определить жизнеспособность эпителиальных клеток почек африканских зеленых мартышек при воздействии исследуемых соединений. Другие исследования включали три скрининга H37Rv ТБ, отличающиеся только используемыми средами: GAS для солей глицерин-аланин с двойной солью лимоннокислого железа и лимоннокислого аммония, GAST для солей глицерин-аланин солей с Tween 80 вместо двойной соли лимоннокислого железа и лимоннокислого натрия, и 7Н12, являющейся средой, не содержащей глицерин. Микросомы, получаемые от мужских особей крыс линии Спраг Доули, содержали ферменты, метаболизирующие лекарства, такие как цитохром Р450, флавин монооксигеназы и УДФ-глюкоуронилтрансферазу. Исследования с искусственным желудочным соком, содержащим пепсин, начали при рН~1,2.
В воплощениях изобретения, соединения ND-8448, ND-8451 и ND-8454 использовали в скрининге в по отношению к серии различных организмов, включая грамположительные (Bacillus subtilis, Staphylococcus aureus, MRSA Staphylococcus aureus, VRE Enterococcus Faecalis), два грамотрицательных штамма (E.coli, Pseudomonas aeruginosa), дрожжи (Sporobolomyces salmonicolor) и грибы (Candida albicans и Penicillium notatum), а также пять линий опухолевых клеток (Huvec, K-562, HeLa, PC-3 и MCF-7), кроме этого, линию клеток VERO для проверки токсичности у млекопитающих. Следует отметить, что эти три соединения были неактивны по отношению ко всем организмам, используемым в исследованиях.
В одном воплощении, оценка может также включать скрининг имидазо[1,2-а]пиридинов по отношению к H37RV ТБ с использованием, по меньшей мере, двух разных сред для исследования, например GAST (соль глицерин-аланин с Tween 80) и 7Н12 (среда, не содержащая глицерин), с целью подтверждения факта, что на эффективность не действует отрицательным образом ни глицерин, ни Tween, и она не зависит от источника углерода. Соединения, характеризующиеся показателем MIC (минимальная ингибирующая концентрация) менее 5 мкМ, затем исследовали на клеточную токсичность VERO и восстановление LORA ТБ (Low Oxygen Recovery Assay; исследование, разработанное для стимулирования латентного состояния ТБ). Наиболее перспективные соединения, характеризующиеся выдающейся эффективностью (MIC<1 мкМ) и большим терапевтическим окном (IC50 (концентрация полумаксимального ингибирования)>128 мкМ в исследовании VERO) далее оценивали в исследованиях с микросомами крыс и искусственным желудочным соком.
В одном воплощении, соединения ND-8454, ND-8667 и ND-9361 изучали в отношении линии чрезвычайно невосприимчивых к лекарствам против ТБ штаммов HRESPOCTh, HREPKOTh, HRESPO, и затем в перекрестном скрининге в отношении М. smegmatis. Как показано в Таблице 4 ниже, все три лекарства являлись эффективными по отношению к штаммам с очень высокой устойчивостью к лекарствам (ОВУ).
|
В ином воплощении, соединения ND-8454, ND-9652, ND-9758, ND-9872, ND-9902, ND-9903 и ND-9965 изучали по отношению к нескольким не-туберкулезным микобактериям (НТМ). Как показано в Таблице 5 ниже, все семь лекарств были эффективными в отношении M.avium, M.bovis BCG и M.kansasii а также другим нетуберкулезным бактериальным штаммам в меньшей степени, показывая, что имидазо[1,2-а]пиридины являются селективными противобактериальными агентами.
|
Как обсуждалось выше, воплощения изобретения предоставляют способ лечения или предотвращения ТБ. Способ включает выбор пациента, нуждающегося в подобном лечении и введение пациенту терапевтически эффективного количества по меньшей мере одного соединения, описываемого здесь. Используемый здесь термин «терапевтически эффективное количество» включает количество конкретного соединения (такого как соединения имидазо[1,2-а]пиридина, описываемых здесь, например соединение ND-8454), необходимое для достижения желаемого воздействия на пациенту, подвергающемуся подобному лечению. Например, это может быть количество, необходимое для лечения микобактериальной инфекции, такой как Mycobacterium tuberculosis, M.bovis, M.africanum или M.microti инфекции у пациента, либо доза, достаточная для предотвращения развития, или приводящая к замедлению заболевания (такого как ТБ), либо обеспечивающая облегчение симптомов, вызванных заболеванием, легочные или внелегочные симптомы. В некоторых воплощениях, терапевтически эффективное количество соединений имидазо[1,2-а]пиридина представляет собой дозу, достаточную для снижения прогрессирования латентной формы ТБ в активную, либо для предотвращения повторной активации ТБ инфекции.
Различные дозировки и схемы введения можно адаптировать для терапевтического лечения ТБ животных и людей с помощью противо-ТБ агентов, описываемых здесь. В одном воплощении, подобное терапевтически эффективное количество активного компонента может находиться в диапазоне примерно от 0,1 до 100 мг/кг, или более предпочтительно около 0,1-10 мг/кг, массы тела/день. Подобные дозы могут варьироваться в зависимости от требований пациента, тяжести заболевания, длительности заболевания, формы инфекции - латентная или активная, микобактериального штамма, обладает ли микобактерия устойчивостью к лекарствам, либо конкретных симптомов (например, легочные или внелегочные) лечимого ТБ, а также особенностей используемого соединения. В некоторых воплощениях, противо-ТБ агенты можно вводить вместе с одним или несколькими другими противо-ТБ агентами/ такими как рифампицин, изониазид, пиразинамид, этамбутол, стрептомицин, этионамид, канамицин, циклосерин, тиоацетазон, р-аминосалициловая кислота или ципрофлоксацин.
В некоторых воплощениях, противо-ТБ агенты (например, ND-8454) можно вводить системно, причем в других воплощениях противо-ТБ агент можно вводить местно. Эффективная доза описанного противо-ТБ агента может вводиться системно различными способами. Например, системное введение может представлять собой пероральное введение либо путем инъекции, например, внутривенно, внутримышечно или подкожно. Местное (например, легочное) введение может включать введение путем ингаляции. В качестве примера, один способ введения в легкие пациента может представлять собой ингаляцию посредством использования распылителя или ингалятора. Например, противо-ТБ агент может входить в состав аэрозоли или дисперсии, и доставляться в легкие с помощью стандартного распылителя, хорошо известного специалистам данной области техники.
Эффективное количество противо-ТБ соединения можно вводить во время лечения одной дозой, или многократными дозами, например, ежедневно, либо каждые четыре, восемь или двенадцать часов. В одном воплощении, терапевтически эффективное количество противо-ТБ соединения можно вводить в виде пульс-дозы, болюсной дозы или пульс-доз, вводимой по истечении определенного времени. В некоторых примерах, не ограничивающих объем изобретения, пульс-дозы противо-ТБ соединения можно вводить в течение однодневного курса лечения, в течение недельного курса, месячного или в течение годового курса.
В других воплощениях соединения имидазо[1,2-а]пиридина, описанные здесь, используются для подавления роста грибов на посевах. В воплощениях изобретения соединения имидазо[1,2-а]пиридина могут иметь формулу

либо представлять фармацевтически приемлемые соли, где R1=алкил, замещенный алкил, циклоалкил, функционализированный алкил, циклогетероалкил, арил, замещенный арил, гетероарил, замещенный гетероарил, или гетероциклический, причем R1 является моно или полизамещенным; R2=алкил, замещенный алкил, циклоалкил, функционализированный алкил, циклогетероалкил, алкокси, арил, замещенный арил, гетероарил, замещенный гетероарил, причем R2 является моно или полизамещенным Y=СН или N в любом из положений 5, 6, 7 или 8. Другие воплощения представляют собой противогрибковые композиции, включающие по меньшей мере одно соединение имидазо[1,2-а]пиридина и его ботанически приемлемые носители. В других воплощениях противогрибковые составы дополнительно включают по меньшей мере одно дополнительное соединение, выбранное из группы, состоящей из инсектицидов и гербицидов.
Другие воплощения представляют собой способы контроля микоза. Данные способы могут включать, например, стадии предоставления по меньшей мере одного соединения имидазо[1,2-а]пиридина, описанного выше и использования соединения на поверхности, содержащей или прилегающей к грибковому поражению или заражению. В воплощениях изобретения композиция может включать по меньшей мере одно дополнительное соединение, выбранное из группы, состоящей из: инсектицидов, фунгицидов и гербицидов. Также раскрываются способы контроля грибкового заражения. В воплощениях изобретения способы включают стадии предоставления по меньшей мере одного соединения имидазо [1,2-а]пиридина, описанного здесь и применение соединения на поверхности, содержащей или прилегающей к грибковому заражению или поражению.
В воплощениях, соединения имидазо[1,2-а]пиридина, описанные здесь, могут обладать серьезным противогрибковым эффектом, в частности, в сельскохозяйственных применениях, например, для использования с сельскохозяйственными культурами, а также на плодоовощных культурах. В различных воплощениях, соединения имидазо[1,2-а]пиридина, описываемые здесь, могут применяться для эффективного контроля множества нежелательных грибов, поражающих сельскохозяйственные культуры. В некоторых примерах, не ограничивающих объем изобретения, противогрибковая активность была продемонстрирована, например, для следующих образцов грибков: бурая ржавчина пшеницы (Puccinia recondita tritici - PUCCRT) и септориозная пятнистость пшеницы (Septoria tritici - SEPTTR).
Обращаясь к Фиг.3, в качестве примера протестировали иллюстративные соединения имидазо[1,2-а]пиридина с целью измерения способности предотвращать инфицирование грибами (На Фиг.4 показаны структуры соединений, для которых приведена информация на Фиг.3). В воплощениях изобретения свойства ингибирования каждого примерного соединения определяли, обрабатывая восприимчивые опытные растения примерным соединением имидазо[1,2-а] пиридиновых соединений и затем подвергали опытные растения заражению спорами грибов. Противогрибковая активность соединений имидазо[1,2-а]пиридина определяли путем установления объема контроля грибкового заражения. Соединения вводили в композицию в количестве 200 ppm в 10 об.% ацетона плюс 90 об.% воды Triton X (деионизированная вода 99,99 мас.% +0,01 мас.% Triton X100), получая «композицию тестового соединения». Композицию тестового соединения применяли на сельскохозяйственных растениях, используя вращающийся распылитель, снабженным двумя противоположно направленными соплами для воздушного распыления, обеспечивающий подачу примерно 1500 л/ч от распыляемого объема. Все тестируемые культуры заражали спорами грибов (например, PUCCRT или SEPTTR) через день после обработки предполагаемым фунгицидом. Далее, растения инкубировали в среде, способствующей развитию заболевания. Тяжесть заболевания оценивали через 7-25 дней спустя, в зависимости от скорости распространения заболевания.
В некоторых примерах, не ограничивающих объем изобретения, выращивали образцы пшеницы (сорт «Юма» (Yuma)) из семян в горшечной смеси обедненного грунта на основе торфа (Metromix) до полного развития у саженцев первых листьев. В каждом контейнере содержалось 3-8 саженцев. На растения распыляли композиции тестовых соединений до состояния увлажнения. На следующий день листья заражали водной суспензией спор Puccinia recondita tritici и растения помещали в условия повышенной влажности на ночь, позволяя спорам развиться и инфицировать лист. Растения далее переносили в теплицу до момента развития заболевания на необработанных контрольных растениях. Тесты выполняли, используя содержание на уровне 200 ppm (миллионных долей), см., например, Фигуру 3.
В ином конкретном примере, не ограничивающем объем изобретения, выращивали из семян пшеницу (сорт «Юма» (Yuma)), в смеси 50% пастеризованный грунт/50% обедненный грунт до полного развития у саженцев первых листьев. В каждом контейнере содержалось 3-10 саженцев. На растения распыляли состав тестируемого соединения до состояния увлажнения. На следующий день листья заражали водной суспензией спор Septoria tritici, и затем растения помещали в условиях повышенной влажности (один день в темной увлажняемой камере и три дня в освещаемой увлажняемой камере) позволяя спорам развиться и инфицировать листву. Растения далее переносили в теплицу до момента развития заболевания на необработанных контрольных растениях. Тесты выполняли, используя содержание на уровне 200 ppm, см., например, Фигуру 3.
В воплощениях изобретения, контроль над развитием заболевания определяли визуально, устанавливая процент тяжести заражения в обработанных и необработанных контейнерах спустя 7-24 дня с момента заражения, в зависимости от скорости распространения заболевания. Как правило, оценку выполняли на 7 или 8 день после заражения в случае PUCCRT и 18-22 день после заражения в случае SEPTTR. Процент контроля заболевания (%КЗ) рассчитывали так; %КЗ=(1-%тяжесть заражения обработанных/%тяжесть заражения необработанных)*100.
В различных воплощениях, соединения имидазо [1,2-а]пиридина, описанные здесь, можно использовать в виде композиций, включающих одно или несколько соединений имидазо [1,2-а]пиридина с носителем, приемлемы в ботанике. Композиции могут включать, например, концентрированные составы, диспергированные в воде или другой жидкости для нанесения, либо составы в виде пыли или гранул, применяемые без дальнейшей обработки. Композиции можно получать способами, традиционными в области сельскохозяйственной химии.
Дисперсии, в которых применяются соединения имидазо[1,2-а]пиридина могут представлять, в некоторых примерах, водные суспензии или эмульсии, полученные из концентрированных составов соединений. Подобные водорастворимые, смешивающиеся с водой, либо образующие эмульсии составы также могут быть твердыми, обычно известными в виде смачивающихся порошков, либо жидкостями, обычно известными как эмульгируемые концентраты или водные суспензии. В воплощениях, соединения имидазо[1,2-а]пиридина можно добавлять к любому материалу, обеспечивающему надлежащее использование без существенного влияния на противогрибковую активность соединений имидазо[1,2-а]пиридина. В воплощениях, смачивающиеся порошки, которые можно спрессовать до получения диспергируемых в воде гранул, могут включать гомогенные смеси активного соединения имидазо[1,2-а]пиридина, инертного носителя и одно или несколько поверхностно-активных веществ. Концентрация соединения имидазо[1,2-а]пиридина может составлять, например, от 10 мас.% (мас./мас.%) до 90 мас.%, и в некоторых примерах концентрация может быть примерно от 25 мас.% до 75 мас.%. При приготовлении примерных смачиваемых порошковых композиций, активные ингредиенты можно смешивать с любым мелкодисперсным твердым объектом, таким как пирофиллит, тальк, мел, гипс, фуллерова глина, бентонит, аттапульгит, крахмал, казеин, глютен, монтмориллонитовая глина, диатомит, очищенный силикат, или подобное. В таких примерах, мелкодисперсный наполнитель можно измельчать или смешивать с токсикантом в летучем органическом растворителе. Определенные не ограничивающие объем изобретения примеры эффективных поверхностно-активных веществ, например, включают около 0,5-10% смачиваемого порошка, который можно использовать в сочетании с соединениями по изобретению, включая сульфонированные лигнины, нафталинсульфонаты, алкилбензолсульфонаты, алилсульфаты, а также неионогенные поверхностно-активные вещества, такие как аддукты этилен оксида или алкилфенолы.
В различных воплощениях, эмульгируемые концентраты соединений имидазо[1,2-а]пиридина, описываемых здесь, могут включать приемлемые концентрации примерно от 10 до 50 мас.% в подходящих жидкостях. Вкратце, один примерный способ получения таких эмульсий включает стадию растворения вещества в инертном носителе (например, либо в смешивающемся с водой растворителе, либо в смеси органических растворителей, смешивающихся с водой и эмульгаторами). В определенных воплощениях, концентраты можно разбавлять водой и маслом с получением смесей для опрыскивания в виде эмульсий масло-в-воде. Некоторые, не ограничивающие объем примеры органических растворителей, годных для использования, включают ароматические, особенно высококипящие нафталиновые и олефиновые фракции нефти, такие как тяжелая ароматическая фракция лигроина и подобное. В других воплощениях, можно использовать другие органические растворители, такие как терпеновые растворители, например, производные канифоли, алифатические кетоны, такие как циклогексанон, а также сложные спирты, такие как 1-этоксиэтанол.
В некоторых воплощениях могут применяться эмульгаторы, например, различные неионогенные, анионные, катионные и амфотерные эмульгаторы, либо смесь двух или нескольких эмульгаторов. Некоторые не ограничивающие объем примеры неионогенных эмульгаторов, применимых для получения эмульгируемых концентратов включают глицериновые эфиры полиалкиленов, и продукты конденсации фенолов алкилов и арилов, алифатических спиртов, алифатических аминов или жирных кислот с оксидом этилена, оксидами пропилена, такими как этоксилированные алкилфенолы, эфиры карбоновых кислот, растворенные в полиоле или полиоксиалкилене. Некоторые не ограничивающие объем примеры катионных эмульгаторов включают четвертичные аммонийные соединения и соли аминов жирных кислот. Определенные примеры неионогенных эмульгаторов, не ограничивающих объем, включают соли, растворимые в масле (например, кальция) алкиларилсульфоновых кислот, соли, растворимые в масле сульфированных эфиров полигликолей, и приемлемые соли фосфорилированных эфиров полигликолей.
Некоторые не ограничивающие объем примеры органических жидкостей, пригодных для получения эмульгируемых концентратов включают ароматические жидкости, такие как ксилол, фракции пропилбензола или смешанные нафталиновые фракции, минеральные масла, органические жидкости замещенных ароматических соединений, такие как диоктилфталат, керосин, и диалкиламиды различных жирных кислот; в частности диметиламиды жирных гликолей и производных гликоля, такие как н-бутиловый эфир, этиловый эфир или метиловый эфир триэтиленгликоля. В некоторых воплощениях, для получения эмульгируемого концентрата можно применять смеси двух или нескольких органических жидкостей. Некоторые не ограничивающие объем примеры пригодных органических жидкостей, включают фракции ксилола и пропилбензола. В некоторых, не ограничивающих объем примерах в жидких композициях могут использоваться поверхностно-активные диспергирующие агенты в количестве примерно от 0,1 до 20 мас.%, исходя из общего веса диспергирующего агента и активного соединения. В воплощениях изобретения композиции имидазо[1,2-а]пиридина могут также содержать другие совместимые добавки, например, регуляторы роста растений, а также другие биологически активные соединения, используемые в сельском хозяйстве.
Согласно различным воплощениям, водные суспензии могут включать суспензии нерастворимых в воде соединений имидазо[1,2-а]пиридина, диспергированные в водных разбавителях с концентрациями в диапазоне примерно от 5 до 50 мас.%. В одном конкретном примере, не ограничивающем объем изобретения, суспензию можно получить, тонко измельчив соединение и интенсивно перемешав его с разбавителем, включающим воду и поверхностно-активные вещества, описываемые выше. В воплощениях изобретения можно также добавлять инертные ингредиенты, такие как неорганические соли и синтетические или натуральные смолы, например для увеличения плотности и вязкости водного разбавителя. В некоторых примерах представляется эффективным измельчать и смешивать соединение одновременно с приготовлением водной смеси и гомогенизировать ее в оборудовании, таком как песочная мельница, шаровая мельница или гомогенизаторе поршневого типа.
В иных воплощениях, соединения имидазо[1,2-а]пиридина можно применять в виде гранулированных композиций, что особенно полезно при использовании композиции в почве. Некоторые не ограничивающие объем примеры гранулированных композиций могут включать примерно от 0,5 до 10 мас.% соединения, диспергированного в инертном носителе, содержащем полностью или в большей части грубо раздробленные аттапульгит, бентонит, диатомит, глину, либо подобные недорогостоящие субстанции. Такие композиции можно получить, например, растворением соединения в подходящем растворителе и нанося его на гранулированный носитель, обладающий соответствующим размером частиц, например в диапазоне около 0,5-3 мм. В различных воплощениях, подобные композиции можно также составлять, приготавливая тестообразную массу или пасту из носителя и соединения, с последующим дроблением и высушиванием, получая желаемые гранулированные частицы.
В других воплощениях изобретения пылевидный препарат, содержащий соединения имидазо[1,2-а]пиридина можно получить тщательным смешиванием соединения в порошковой форме с подходящим сельскохозяйственным носителем в виде пыли, таким как, например, каолиновая глина, измельченная вулканическая порода и т.п. В некоторых неограничивающих объем изобретения примерах такая пыль может включать соединение в количестве примерно от 1 до 10 мас.%.
Согласно различным воплощениям композиции соединений имидазо[1,2-а]пиридина могут содержать вспомогательные поверхностно-активные вещества для усиления свойств, таких как осаждение, смачивание, а также проникновение композиции в целевую сельскохозяйственную культуру и организм. В воплощениях изобретения данные вспомогательные поверхностно-активные вещества можно применять в качестве компонентов препарата или в виде части баковой смеси. Количество вспомогательного поверхностно-активного вещества может быть различным, в некоторых не ограничивающих объем изобретения примерах примерно от 0,01 до 1,0 об.% из расчета на объем распыляемой воды. В некоторых воплощениях изобретения количество вспомогательных поверхностно-активных веществ может составлять примерно от 0,05 до 0,5 об.%. Особые не ограничивающие объем изобретения примеры поверхностно-активных веществ включают этоксилированные нонилфенолы, этоксилированные синтетические или органические спирты, соли эфиров сульфоянтарной кислоты, этоксилированные органосиликоны, этоксилированные жирные амины, а также смеси поверхностно-активных веществ с минеральными или растительными маслами.
В воплощениях, композиции имидазо[1,2-а]пиридина могут включать сочетания, содержащие, например, по меньшей мере 1% одного или нескольких соединений имидазо[1,2-а]пиридина с другим активным с точки зрения сельского хозяйства ингредиентом (АИ). Подобный дополнительный АИ может включать, например, фунгициды, инсектициды, нематоциды, майтициды, артроподициды, бактерициды, гербициды или их сочетание, являющееся совместимым с соединениями имидазо[1,2-а]пиридина в среде, выбранной для применения. Соответственно, в таких воплощениях, в качестве дополнительных АИ используют АИ, отличные от соединений по изобретению для подобного или иного использования с растениями. В некоторых не ограничивающих объем примерах соединения в смесях могут, в общем, присутствовать в соотношении примерно от 1:10 до 100:1.
Другие воплощения представляют собой способы контроля или предотвращения грибковой инфекции. Данные способы могут включать применение активных соединений имидазо[1,2-а]пиридина в очаге поражения грибком, либо в области, где требуется предотвратить заражение (например, наносить их на злаковые или виноградные культуры). В воплощениях изобретения имидазо[1,2-а]пиридиновые соединения можно использовать для обработки различных культур в количествах, обеспечивающих противогрибковые свойства, вследствие низкой фитотоксичности.
Кроме того, в воплощениях изобретения соединения можно использовать в качестве защитного средства или эрадиканта. В воплощениях изобретения подобные соединения можно применять одним из многочисленных известных способов, либо в виде соединения, либо в виде композиции, включающей соединения. Например, соединения можно наносить на корни, семена или листву растений для контроля возникновения различных грибков, при этом не нанося урон коммерческой ценности растения. В воплощениях изобретения материалы наносят в виде препаратов любого типа, например, в виде растворов, пыли, смачивающихся порошков, жидких концентратов или эмульгируемых концентратов.
Согласно вышеприведенному описанию, в воплощениях соединения имидазо[1,2-а]пиридина могут обладать существенным противогрибковым эффектом, особенно с точки зрения сельского хозяйства. В некоторых воплощениях изобретения соединения имидазо[1,2-а]пиридина являются эффективными для использования с сельскохозяйственными культурами и плодоовощными растениями, либо для предотвращения или борьбой с ростом грибков в других материалах, таких как древесина, кожа, краска или основа ковра. В некоторых воплощениях изобретения соединения имидазо[1,2-а] пиридина могут эффективно контролировать многочисленные нежелательные грибы, поражающие ценные сельскохозяйственные культуры. В некоторых воплощениях изобретения соединения имидазо[1,2-а]пиридина могут обладать активностью по отношению к многочисленным грибам, включая, например, следующие репрезентативные разновидности грибов: ложная мучнистая роса виноградных культур (Plasmopara viticola - PLASVI), фитофтороз томатов (Phytophthora infestants - PHYTIN), парша яблок (Venturia inaequalis - VENTIN), бурая ржавчина пшеницы (Puccinia recondita tritici - PUCCRT), желтая ржавчина пшеницы (Puccinia striiformis - PUCCST), пирикуляриоз риса (Pyricularia oryzae - PYRIOR), пятнистый церкоспороз листьев свеклы (Cercospora beticola - CERCBE), настоящая мучнистая роса пшеницы (Erysiphe graminis - ERYSGT), гельминтоспориоз листьев пшеницы (Septoria tritici - SEPTTR), ризоктониоз стеблей и влагалищ риса (Rhizoctonia solani - RHIZSO), Церкоспорелезная прикорневая гниль пшеницы (Pseudocercosporella herpotrichoides PSDCHE), бурая гниль персиков (Monilinia fructicola MONIFC), а также септориоз колосковой чешуи пшеницы (Leptosphaeria nodorum - LEPTNO).
В воплощениях изобретения количество соединения имидазо[1,2-а]пиридина, применяемого в конкретных случаях, может зависеть не только от особенностей применяемого активного материала, но также от желаемого воздействия, разновидностей грибов, подлежащих контролю, их степени роста, а также части растения или иного продукта, вводимого в контакт с активным ингредиентом.
Несмотря на то, что в данном документе были описаны и проиллюстрированы некоторые воплощения, специалистам данной области техники очевидно огромное разнообразие альтернативных и/или равноценных воплощений или осуществлений, обеспечивающих достижение таких же целей, позволяющих заменить воплощения, приведенные и описанные без ограничения объема изобретения. Специалисты данной области техники высоко оценят многообразие воплощений, реализуемых многочисленными средствами. Данная заявка включает любые адаптации или вариации воплощений, описываемых здесь. Поэтому, очевидно, что воплощения ограничиваются только формулой и ее эквивалентами.
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/fd5c52d2c87d0e958e53218ec347e59c.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/59f3ac98284ede8f5a937bcc481c58f4.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/2d88ef6066414d685ebc7b08e6797cfc.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/26e23b6ea8bb7b08712f04a5087b435e.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/a6119da3df8e3befa371d94a155cbd84.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/46ce2a883037edb6d1e2dbc4d98ebbcc.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/8ae5238a8835d786e4e6f1ede6545bcc.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/ce6573cc7c1d1af3591eb680bd789eeb.jpg)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/c69f6be425e80924c9c62779ae272e04.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/d75c0f08b445f8864f108269918c0786.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/908600c5250fbacb8fbced8e80bd1c83.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/d9af6f02d2e7b3f5b221fa39aeb019e9.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/338a28360ab4922800862c19685084f2.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/bcb76768a58b6e7cc6f97ec9d7b65c0a.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/c5b51745c07facde9a8d9045f7c2e133.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/1d1f32760d2ed5beb081b2f9dd5a1669.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/4c0e97aded1d80d915fdd3eaf0ce8ff5.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/e632ccd2c4268f1d51d52fdc8604a4b7.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/25386a8ac707024e5ea0ff0566580827.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/f3e8c89fd1c27a3c06e5bc272faa2c98.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/1fc743ecf652eabd8f50b67609813cad.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/9eeb7092e208adfdf0427653c2d1fb89.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/d78259f406afeb0d1b14e9a4972e2eea.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/31f68a5226acfae0f389ed00edc1c011.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/cfab7e383171ff5393e44d2601cceccd.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/2f4d10147551ca99f36ee5aeae360cc8.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/211ff4fbb4e3fecd415ee915b83a2726.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/e0264ff111ae9800c1581c348fc527ec.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/255d7a9e410bd3dc0c8df561af082e24.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/4844c2d89e3894bd4764741a3e299c38.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/18db462fb5615f93e3ae9b461357bb7a.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/157a96e57f2586e0e1cbfce996403dfd.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/6da03957a2f39ebaab2a38018f0ab1ef.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/182c8e9bc1639131ab52981e83a97820.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/518026f21349ef0f0ca8e259236d7a5a.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/65d4dac93afc97b7ca6248f9d431babd.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/b8a6a144b923bf7a726188de655a3328.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/e6be047791c22e07d6d1268c7dc3f795.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/560f9e6c606a53079e5b43f170009df8.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/37143e0c2b99243d009477567df23481.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/cb57c6a87bd76fd60f1a0eebeaca0f69.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/902c9c4b12beb4c1b9eddf88385f6ad3.jpg)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/a8a88361ebbea556f86dd77732a868d0.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/69ff271ed5160a3fa16b7218502de15c.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/1f3fed88719022bb78672506fa6e4349.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/107f026d42ed051847b9e8cdd57f5dc0.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/7d1009005eac1af7c1f8bb2a2ee29593.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/2905ba9bc54a0c04024a754f9bc2e797.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/5e627fd2682e57a67e3e74e68eee14a8.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/93af1441adcb48de29289b33b7df8c79.jpg)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/cc404ef8ff074aebd533defea99285a4.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/a2168c45c9dbc6e9fd374bf6055797c0.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/dc56f28987e4dfbf39d8562b31afc8c6.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/c2e75f629107c65b910a5ca440b2db63.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/6408886df97767c5e5e4da190a5d1dcc.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/0b479466478eb71b18c3997c73dc6637.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/65538a9ed090bd23d0def776c4ff39d5.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/1c1f434cc9803fea9a46c385112ada9a.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/5363233d00ff6b2eba034aa2a579a66b.png)
![СОЕДИНЕНИЯ ИМИДАЗО[1,2-а] ПИРИДИНА, ИХ СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/9b/4d/bf/da40e401e0bcfc8429083efa5772bb4e.png)