Результат интеллектуальной деятельности: ЛИПОСОМАЛЬНОЕ СРЕДСТВО НА ОСНОВЕ УБИХИНОЛА И СПОСОБ ЕГО ПОЛУЧЕНИЯ
Вид РИД
Изобретение
Изобретение относится к медицине, химико-фармацевтической и косметической промышленности, а именно к способу получения липосомального средства на основе убихинола. Липосомальная фармацевтическая композиция включает лекарственное вещество (убихинол), липиды в виде фосфолипидов и стеринов, антиоксиданты, криопротекторы и консерванты, причем убихинол заключен во внешнюю оболочку липосом. Благодаря осуществлению изобретения обеспечивается повышение биодоступности лекарственного (активного) вещества за счет активного направленного транспорта к органам и тканям организма, а также повышении коэффициента захвата и стабильности удержания активного вещества в липосомах.
Липосомы представляют собой микроскопические замкнутые везикулы, имеющие внутреннюю фазу, окруженную одним или несколькими липидными бислоями, и способные удерживать водорастворимый материал во внутренней фазе, а маслорастворимый материал - в фосфолипидном бислое. При заключении активного вещества в липосому и доставке его в ткани-мишени важными задачами являются высокоэффективный захват активного соединения в липосому и обеспечение устойчивого удержания активного соединения липосомой.
Одно из преимуществ липосомальных лекарственных форм проявляется в защите здоровых клеток от токсического воздействия лекарственных веществ, а включенной субстанции от деградации в условиях организма; пролонгировании действия лекарственных веществ; селективном накоплении в области поражения; возможности создания водорастворимой лекарственной формы для ряда гидрофобных препаратов и увеличении тем самым их биодоступности (Фармацевтическая разработка: концепция и практические рекомендации. Научно-практическое руководство для фармацевтической отрасли. Под ред. Быковского С.Н. и др. - 2015. - 472 с.).
Очень важное свойство липосом стало основой для конструирования эффективных лекарственных препаратов. Речь идет о соотношении их размеров и диаметра пор капилляров. Так как размер липосом больше диаметра пор капилляров, их объем распределения ограничивается контрпараметрами введения, липосомы будут накапливаться в очагах воспаления и деформации. Это явление получило название пассивное нацеливание. Таким образом, существуют две причины, вследствие которых липосомальные препараты более эффективны по сравнению со стандартными: уменьшение токсичности и пассивное нацеливание (Патент РФ №2462236, дата публикации 27.09.2012).
В настоящее время на фармацевтическом рынке существует достаточное количество липосомальных препаратов, состав которых многообразен, а выбор того или иного компонента определен на основании анализа большого числа технологических, физико-химических и биологических факторов.
Основными структурными компонентами липосом являются фосфолипиды. Наиболее часто используемый в технологии липосомальных лекарственных форм полярный фосфолипид - фосфатидилхолин, имеет гидрофильную полярную группу (фосфохолин) и гидрофобные ацильные углеводородные цепи. Молекулы фосфатидилхолина нерастворимы в воде и водной среде, они ориентируются таким образом, что жирнокислотные цепи молекул обращены друг к другу, а полярные головки находятся в водной среде. Это позволяет преодолеть нестабильность одиночных молекул и приводит к формированию бислоя. Помимо фосфатидилхолина липосомы могут быть выполнены из фосфатидилэтаноламина, фосфатидилсерина, фосфатидилинозитола, фосфатидилглицерина, фосфатидовой кислоты, сфингофосфолипида, фосфолипидов яиц или соевых бобов или их смесей.
В то же время недостатками липосом как лекарственной формы являются сложности, связанные не только с их производством, но и возникающие при длительном хранении липосомальных суспензий.
Липосомальные суспензии представляют собой термодинамически нестабильные коллоидные системы, которые достаточно быстро, иногда в течение нескольких часов, расслаиваются с образованием двух фаз. Еще одним недостатком липосомальных композиций является то, что попадая в кровоток, липосомы поглощаются макрофагами, что не позволяет достичь специфического эффекта липосомальной лекарственной формы.
Сейчас найдены способы, позволяющие увеличить устойчивость липосом. Например, повышению их устойчивости способствует введение в состав липосом холестерина, который повышает стабильность бислоя и снижает его проницаемость. Холестерин может быть включен в липосомальную мембрану в достаточно высоких концентрациях (молярные соотношения фосфолипид/холестерин могут достигать значений 1:1 и даже 1:2). Включение в состав липосом полиэтиленгликоля препятствует их захвату макрофагами (Фармацевтическая разработка: концепция и практические рекомендации. Научно-практическое руководство для фармацевтической отрасли. Под ред. Быковского С.Н. и др. - 2015. - 472 с.).
Способы формирования липосом разнообразны и могут быть разделены на основные группы:
- тонкопленочные методы;
- методы, основанные на применении растворителей;
- ультразвуковой метод;
- методы с применением высокого давления.
Липосомальные формы лекарственных препаратов достаточно широко применяют для лечения пациентов антибиотиками, противоопухолевыми, противовирусными, противовоспалительными препаратами, а также при использовании иммуномодуляторов, антител, рентгеноконтрастных, цитостатических средств и средств для лечения инфаркта миокарда. Липосомы в этих случаях используются для создания препаратов для парентерального и перорального введения.
Несмотря на многочисленные разработки липосомальных препаратов, до настоящего времени проблема получения приемлемой и стабильной при хранении липосомальной формы восстановленного коэнзима Q10 не решена.
Убихинол (восстановленный коэнзим Q10, убидекаренол) относится к группе жирорастворимых бензохинолов является коферментом системы тканевого дыхания митохондрий, который участвует в процессе биохимического окисления. Антиоксидантная и мембраностабилизирующая активность коэнзима Q10 связана в основном с его восстановленной формой. Известно, что применение восстановленной формы коэнзима Q10 повышает его уровень в крови в несколько раз более эффективно, чем использование его окисленной формы. В силу этого применение убихинола возможно в меньших дозах, чем окисленной формы коэнзима Q10, с сохранением эквивалентного биологического эффекта, что доказывает актуальность разработки новых препаратов на основе убихинола.
Из уровня техники известна композиция, состоящая из действующего вещества - 6-декапренил-2,3-диметокси-5-метил-1,4-бензохинона, неионогенного ПАВ, антиоксиданта, консерванта, жирорастворимого стабилизатора эмульсии, водорастворимых производных целлюлозы, водорастворимого стабилизатора эмульсии и воды, которая отличается высокой биодоступностью и увеличенным сроком хранения. Способ получения указанной композиции заключается в том, что определенные количества неионогенного ПАВ и антиоксиданта смешивают, нагревают до 40-120°С, растворяют в полученном растворе необходимые количества жирорастворимого стабилизатора эмульсии и 6-декапренил-2,3-диметокси-5-метил-1,4-бензохинона, охлаждают полученную смесь до 30-60°С и при интенсивном перемешивании приливают в предварительно нагретый до 30-60°С смешанный раствор водорастворимых производных целлюлозы, водорастворимого стабилизатора эмульсии и консерванта в воде (Патент РФ №2445079, дата публикации 20.03.2012).
Недостатком этого способа является использование коэнзима Q10 в окисленной, а не восстановленной форме, а также использование в качестве готовой формы обычной эмульсии, которые склонны к быстрому расслаиванию и быстрому прогорканию.
Известен способ получения жиросодержащего пищевого продукта, обогащенного убихинолом, который содержит масло или жир с температурой плавления не ниже 20°С или с температурой плавления ниже 20°С, при этом продукт представляет собой эмульсию типа «масло в воде». Убихинол доставляют в организм путем приема внутрь жиросодержащего продукта. Способ получения жиросодержащего продукта предусматривает добавление убихинола совместно с эмульгатором и/или пищевым ингредиентом, содержащим масло/жир, к пищевому материалу. Изобретение позволяет обогатить пищевой продукт убихинолом в количествах, превышающих предел его растворимости в масле или жире без разделения на жидкую и твердую фазу при хранении. В продукте для сохранности убихинола предусмотрено содержание антиоксиданта из группы, состоящей из аскорбилпальмитата, аскорбилстеарата, катехина, лецитина, токоферола, токотриенола, лигнана и каротиноида (Патент РФ №2311801, дата публикации 10.12.2007).
Способ представляет собой получение обычной эмульсии и не предусматривает получение липосомальной формы коэнзима Q10. Кроме того, в документе не раскрывается возможность использования продукта для создания лекарственных средств.
Известен способ получения биологически активной порошковой субстанции в форме достаточно стабильных молекулярных комплексов включения восстановленного коэнзима Q10 в β-циклодекстрине с размерами частиц до 70-100 мкм, обладающей в 10 раз меньшей способностью к окислению по сравнению со свободным восстановленным коэнзимом Q10 и легко переходящей в водном растворе в солюбилизированную форму с размерами частиц 200-700 нм. Эти молекулярные комплексы способны к солюбилизации в воде и являются более стабильными (защищены от окисления) по сравнению с нерастворимым в воде и быстро окисляющимся свободным восстановленным коэнзимом Q10 (Патент РФ №2509760, дата публикации 20.03.2014).
Недостатком этого способа является получение солюбилизированной формы с комплексом включения достаточно большого размера 200-700 нм, что не позволяет их использовать в качестве препаратов направленного действия.
Известен способ получения водорастворимой формы коэнзима Q10, представляющей собой комплекс включения β-циклодекстрина с коэнзимом Q10, в котором молярное соотношение β-циклодекстрина и коэнзима Q10 составляет примерно 1:1, заключающийся в том, что β-циклодекстрин растворяют в воде при температуре от 55°С до температуры кипения, затем коэнзим Q10 добавляют в твердом виде и продолжают перемешивание при температуре 60-70°С, а затем при комнатной температуре (Патент РФ №2375053, дата публикации 10.12.2009).
Недостатком данного способа является невозможность получения по данной технологии восстановленной формы коэнзима, так как процесс получения комплекса идет при повышенных температурах 60-70°С, что приведет к окислению продукта. Кроме того, способ направлен на получение добавки в пищевые продукты, и не раскрываются особенности получения фармацевтических и косметических препаратов на основе комплекса включения.
В уровне техники описана композиция 6-декапренил-2,3-диметокси-5-метил-1,4-бензохинона в форме трансдермального, перорального и инъекционного средства, содержащая ПАВ и представленная в форме липосом (Патент WO 9835660 А1, дата публикации 20.08.1998).
Однако в указанном источнике раскрыта только возможность вхождения убихинона в состав липосом и не представлен ни состав, ни технология получения липосом на основе убихинона. Недостатком композиции является использование коэнзима Q10 в окисленной, а не восстановленной форме, что снижает биологическую эффективность средства.
В документе [SHUQIN XIA et al. / Optimization in the Preparation of Coenzyme Q10 Nanoliposomes / Journal of Agriculture and Food Chemistry / 2006, V. 54, pp. 6358-6366] раскрывается способ получения нанолипосом, содержащих убихинон-10 (коэнзим Q10), включающий растворение коэнзима Q10, фосфолипида, холестерина и Твина 80 при их различных соотношениях в этаноле при температуре 55°С, добавление этанольного раствора в фосфатный буфер (pH=7,4) при температуре 55°С и перемешивании, удаление этанола на роторном испарителе, добавление воды, обработку полученной суспензии ультразвуком. Отмечается, что оптимальный состав получен при массовом соотношении фосфолипид/коэнзим Q10/ холестерин/Твин 80 равном 2,5:1,2:0,4:1,8, при этом средний размер липосом составил 68 нм.
Недостатком способа является получение липосом, содержащих коэнзим Q10 в окисленной, а не восстановленной форме, что снижает биологическую эффективность средства. Кроме того, данный способ не подразумевает использование криопротекторов, таких как трегалоза, лактоза и др., что не позволяет лиофильно высушить и получить липосомальную форму активного агента в виде сыпучего порошка.
Обобщая данные по разработке лекарственных форм коэнзима Q10, можно сделать вывод, что в основном в качестве биологически активной субстанции используют коэнзим Q10 в окисленной форме, что с биологической точки зрения менее эффективно, причем включают коэнзим Q10 в основном в состав эмульсий, что не обеспечивает селективность терапевтического действия и повышение биодоступности активной субстанции. Эти недостатки носят принципиальный характер и не могут быть устранены без кардинального изменения технологии получения систем доставки убихинола.
Наиболее близким решением к предлагаемому является способ получения стабильного при хранении раствора липосом, содержащего в качестве действующего вещества восстановленную форму коэнзима Q10. Способ заключается в растворении фосфолипидов, восстановленного коэнзима Q10, в присутствии или в отсутствие ПАВ, в органическом растворителе, удаление органического растворителя с образованием пленки и диспергирование полученной липидной пленки в водной среде с применением ультразвука в течение 30 минут при температуре 4°С с последующим образованием раствора липосом (ЕР 1386905 А1, дата публикации 04.02.2004).
Недостатком данного способа является то, что данный метод не подразумевает использование криопротекторов, таких как трегалоза, лактоза и др., что не позволяет лиофильно высушить и получить липосомальную форму убихинола в виде сыпучего порошка. Данный факт не позволяет использовать липосомы для создания твердых лекарственных форм, что сокращает область применения липосом убихинола. В данном изобретении липосомы убихинола получают путем ультразвукового диспергирования, что затрудняет возможность внедрения данной технологии на производстве. Кроме того, не указан размер получаемых липосом, что затрудняет их использование для создания инъекционных лекарственных форм и не может подтвердить адресную доставку убихинола. При создании инъекционных липосомальных форм необходимо учитывать тот факт, что для селективного накопления биологически активного вещества в области поражения оптимальный размер липосом составляет от 50 до 200 нм. Также не указаны условия и оборудование для очистки липосом от не включенного в состав липосом убихинола, что не позволяет оценить степень включения убихинола в липосомальную мембрану в процессе получения и хранения. Из технологических моментов следует отметить отсутствие указаний на условия удаления органического растворителя, что важно, так как повышенная температура может повлиять на качество готового продукта. В изобретении указано, что содержание восстановленного коэнзима в липосомах может составлять до 50%, что не учитывает растворимость коэнзима и технологически невозможно осуществить даже в присутствии 20% ПАВ.
Технический результат настоящего изобретения заключается в повышении биодоступности коэнзима Q10, а также повышении коэффициента захвата и стабильности удержания коэнзима Q10 в липосомах.
Технический результат достигается способом получения липосомальной формы биологически активного вещества, включающим приготовление раствора, содержащего смесь фосфолипида и стерина при их массовом соотношении 1:0,1-2 соответственно, биологически активного вещества при его массовом соотношении к смеси фосфолипида и стерина равном 1:1-4 соответственно и сорастворитель в органическом растворителе, диспергирование полученного раствора, содержащего липидную фракцию, в водной среде, содержащей криопротектор, до получения суспензии липидных везикул с включенным в них биологически активным веществом, гомогенизацию суспензии липидных везикул и отделение липосом размером не более 220 нм с включенным в них биологически активным веществом.
В качестве биологически активного вещества используют - субстанцию убихинол (восстановленный коэнзим Q10, убидекаренол), липофильное соединение, практически нерастворимое в воде. Содержание убихинола в составе липосом зависит от создаваемой формы лекарственного препарата и от способа его применения. Предпочтительно включать 0,01-5 масс. % убихинола в состав липосом в форме водной суспензии или 0,1-50 масс. % убихинола в состав липосом в дегидратированной форме.
Фосфолипиды могут представлять смесь любых фосфолипидов животного и/или растительного происхождения, взятых в любом сочетании и соотношении. Предпочтительно, чтобы мембранные составляющие липосом по настоящему изобретению включали фосфолипиды и/или производные фосфолипидов. В качестве фосфолипидов и производных фосфолипидов можно использовать, например, фосфатидилэтаноламин, фосфатидилхолин, фосфатидилсерин, фосфатидилинозитол, фосфатидилглицерин, кардиолипин, сфингомиелин, церамид фосфорилэтаноламин, церамид фосфорилглицерин, церамид фосфорилглицеринфосфат, 1,2-димиристоил-1,2-дезоксифосфатидилхолин, плазмалоген, фосфатидную кислоту и так далее. Можно комбинировать один или несколько этих фосфолипидов и производных фосфолипидов. Не существует конкретных ограничений в отношении остатков жирных кислот в фосфолипидах и производных фосфолипидов и можно использовать, например, остатки насыщенных или ненасыщенных жирных кислот с числом атомов углерода от 12 до 20. Конкретно можно использовать ацильные группы из жирных кислот, таких как лауриновая, миристиновая, пальмитиновая, стеариновая, олеиновая и линолевая.
Можно также использовать фосфолипиды, полученные из природных веществ, такие как лецитин яичного желтка и соевый лецитин, частично гидрогенизированный лецитин яичного желтка, в котором остаток ненасыщенной жирной кислоты частично или полностью гидрогенизирован, (полностью) гидрогенизированный лецитин яичного желтка, частично гидрогенизированный соевый лецитин, (полностью) гидрогенизированный соевый лецитин и так далее.
Не существует конкретных ограничений в отношении смешиваемого количества фосфолипидов и/или производных фосфолипидов, которые используют при получении липосом, однако предпочтительно использовать от 10 до 80 масс. % по отношению ко всему составу мембран липосом, и более предпочтительно - от 30 до 60 масс. %.
Что касается компонентов мембран, помимо фосфолипидов и/или производных фосфолипидов липосомы по настоящему изобретению включают в качестве стабилизаторов мембран стерины, например, такие как холестерин. Не существует конкретных ограничений в отношении смешиваемого количества этих стеринов, используемых при получении липосом, однако предпочтительно использовать от 1 до 60 масс. % по отношению ко всему составу мембран липосом, более предпочтительно - от 10 до 50 масс. %).
В качестве органического растворителя используют этанол. Органический растворитель удаляют отгонкой на роторном испарителе под вакуумом и температуре 30-35°С.
Не существует конкретных ограничений в отношении растворителя во внутренней фазе липосом и можно упомянуть, например, буферные растворы, такие как фосфатный буферный раствор, цитратный буферный раствор и фосфатно-солевой буферный физиологический раствор, физиологический солевой раствор, культуральную среду для культивирования клеток и так далее. Что касается растворителя в случае, когда используют буферный раствор, предпочтительно, чтобы концентрация буферного средства составляла 5-300 мМ, и более предпочтительной является концентрация 10-100 мМ. Не существует конкретных ограничений в отношении pH внутренней фазы липосом, однако предпочтительными являются значения от 3 до 11 и более предпочтительными - от 5 до 9.
Наиболее предпочтительно в качестве водной среды для диспергирования липидной фракции используют 0,01М фосфатный буфер с pH равным 7,4.
В качестве сорастворителя субстанции убихинола используют неионогенное поверхностно-активное вещество (ПАВ). В качестве неионогенного ПАВ в данной композиции можно использовать Кремофор RH-40, Твин-20, Твин-60 или Твин-80 и другие, аналогичные им по свойствам поверхностно-активные вещества, а также их смеси.
Измельчение липосом проводят с помощью методов экструзии или гомогенизации/микрофлюидизации или замораживания-оттаивания или обработки ультразвуком (УЗ). Наиболее предпочтительно с помощью обработки ультразвуком с частотой 15-30 кГц в течение 1-60 минут в ледяной бане, наиболее предпочтительно в течение 5-40 минут.
Очистку липосом проводят с помощью гельпроникающей хроматографии или фильтрации полученного раствора через фильтры с размером пор 0,45 мкм и 0,22 мкм.
Для удаления фармацевтического средства, которое не инкапсулировано в липосому, проводится диализ при 4°С в течение 2 часов с применением диализных мешков (OrDial D-Clean, 10 кДа, 25 кДа, производитель Orange Scientific), и 5%-ного раствора глюкозы в качестве внешнего раствора, с перемешиванием на магнитной мешалке. После замены внешнего раствора проводится еще один диализ в течение двух часов с одновременным перемешиванием, с получением таким образом содержащего липосомального средства. Содержащее липосомальное средство, приготовленное таким образом, имеет средний диаметр частиц 160±10 нм.
В качестве антиоксидантов используют гидрофильные и липофильные антиоксиданты, такие как: α-токоферол, смесь токоферолов, аскорбиновая кислота и другие подходящие для стабилизации липосомальных форм антиоксиданты. Что касается количества антиоксидантов, достаточно если добавляют количество, способное обеспечить антиоксидантный эффект, однако предпочтительно использовать от 0,01 до 5 масс. % по отношению ко всему составу липосом, более предпочтительно - от 0,01 до 0,5 масс. %.
С целью увеличения сроков годности липосом и снижения степени гидролиза липосомы подвергают лиофильной сушке.
Для предотвращения слияния и агрегации, защиты от повреждения кристаллами льда лиофилизацию липосом проводят в присутствии криопротекторов, относящиеся к разным классам химических веществ, в частности: спирты (глицерин, диглицерин, полиглицерин, пропиленгликоль, полипропиленгликоль, этиленгликоль, диэтиленгликоль, триэтиленгликоль, полиэтиленгликоль, моноалкиловый эфир этиленгликоля, моноалкиловый эфир диэтиленгликоля, 1,3-бутиленгликольмоносахариды), амиды (диметилацетамид); оксиды (диметилсульфоксид), синтетические полимеры (поливинилпирролидон, синтетически модифицированные крахмалы), сахара (моносахариды такие как глюкоза, галактоза, манноза, фруктоза, инозит, рибоза и ксилоза; дисахариды, такие как лактоза, сахароза, целлобиоза, трегалоза и мальтоза; трисахариды, такие как раффиноза и мелицитоза; полисахариды, такие как циклодекстрин) и сахарные спирты (эритрит, ксилит, сорбит, маннит и мальтит). Наиболее предпочтительно в качестве криопротектора использовать углеводы (сахарозу, лактозу и трегалозу) или спирты (глицерин, полиэтиленгликоль, пропиленгликоль). В этом случае твердые препараты могут стабильно храниться в течение длительного периода времени.
Не существует конкретных ограничений в отношении концентрации сахара или спирта, содержащегося в липосомальной композиции, однако в ситуации, когда, например, липосомы диспергированы в растворителе, предпочтительно, чтобы концентрация сахара составляла от 2 до 20% (вес/объем), и более предпочтительно - от 5 до 10% (вес/объем). Что касается концентрации спирта, предпочтительными значениями являются от 1 до 5% (вес/объем), и более предпочтительными - от 2 до 2,5% (вес/объем).
В качестве консервантов липосомы могут содержать: метилпарабен, пропилпарабен, фенол и др. Содержание консервантов в растворе, предпочтительно использовать от 0,01 до 0,5 масс. %, и более предпочтительно от 0,1 до 0,3 масс. %
Очищенные липосомы убихинола можно использовать для создания различных фармацевтических средств, в том числе в различных лекарственных формах: инъекционных, пероральных и наружных.
В настоящем изобретении средневзвешенный размер частиц липосом определяли методом лазерной фотон-корреляционной спектроскопии, с помощью лазерного анализатора размеров наночастиц HORIBASZ-100Z (Horiba, Japan).
Размер липосомальных частиц можно дополнительно корректировать по мере необходимости, например, путем проведения экструдирования липосомальных дисперсий под высоким давлением с помощью поликарбонатных мембран с порами различного размера. Корректировку размеров частиц можно проводить в любое время в процессе производства липосом по настоящему изобретению.
Сущность предлагаемого способа иллюстрируется следующими примерами конкретного осуществления.
Пример 1. Предварительно готовят 100 мл 0,01М фосфатного буфера (pH 7,4) и растворяют в нем 5 г лактозы и 0,05 г аскорбиновой кислоты. Растворяют в 10 мл 95% спирта этилового 2,2 г смеси фосфолипидов фосфатидилхолина и холестерина при их массовом соотношении 4:1 соответственно, 0,05 г α-токоферола ацетата и 1,5 г сорастворителя твина-80 при температуре 55°С. В полученном спиртовом растворе растворяют убихинол в количестве 1 г, до получения прозрачного раствора. После этого быстро переносят полученный раствор в раствор лактозы в фосфатном буфере при температуре 55°С и перемешивают в течение 30 минут. Затем этанол отгоняют на роторном испарителе IKA (Германия) под вакуумом при температуре 30-35°С, а полученный раствор доводят водой до 100 мл. Полученную суспензию обрабатывают ультразвуком частоты 15 кГц в течение 40 минут, непрерывно охлаждая ледяной водой (ультразвуковой диспергатор 4710 Cole-Parmer Instruments, США). Липосомы отделяют от низкомолекулярных ингредиентов, используя гельпроникающую хроматографию - Sephadex G-25 и стерильно квалифицировали через фильтр с размером пор 0,22 мкм. Полученные липосомы фасуют во флаконы и укупоривают в токе азота.
Пример 2. Предварительно готовят 100 мл 0,01М фосфатного буфера (pH 7,4) и растворяют в нем 10 г трегалозы. Растворяют в 10 мл 95% спирта этилового 1,45 г смеси фосфолипидов фосфатидилхолина и холестерина при их массовом соотношении 4,8:1 соответственно, 0,2 г смеси токоферолов и 1,0 г смеси сорастворителей твина-80 и твина-20, массового соотношения 8:2, при температуре 55°С. В полученном спиртовом растворе растворяют убихинол в количестве 1 г, до получения прозрачного раствора. После этого быстро переносят полученный раствор в раствор трегалозы в фосфатном буфере при температуре 55°С и перешивают в течение 30 минут. Затем этанол отгоняют на роторном испарителе IKA (Германия) под вакуумом при температуре 30-35°С, а полученный раствор доводят водой до 100 мл. Полученную суспензию обрабатывают ультразвуком частоты 15 кГц в течение 30 минут, непрерывно охлаждая ледяной водой (ультразвуковой диспергатор 4710 Cole-Parmer Instruments, США). Липосомы отделяют от низкомолекулярных ингредиентов, используя гельпроникающую хроматографию - Sephadex G-25 и стерильно квалифицировали через фильтр с размером пор 0,22 мкм. Полученные липосомы фасуют во флаконы и лиофильно высушивают до получения порошка липосом.
Пример 3. Растворяют в 10 мл 95% спирта этилового 2,45 г смеси фосфолипидов фосфатидилхолина и холестерина при их массовом соотношении 6,25:1 соответственно и 1,5 г сорастворителя твина-60 при температуре 55°С. В полученном спиртовом растворе растворяют убихинол в количестве 1 г, до получения прозрачного раствора. После этого быстро переносят полученный раствор в 100 мл водной среды (0,01М фосфатный буфер, pH 7,4) при температуре 55°С и перешивают в течение 30 минут. Затем этанол отгоняют на роторном испарителе IKA (Германия) под вакуумом при температуре 30-35°С, а полученный раствор доводят водой до 100 мл. Полученную суспензию обрабатывают ультразвуком частоты 15 кГц в течение 5 минут, непрерывно охлаждая ледяной водой (ультразвуковой диспергатор 4710 Cole-Parmer Instruments, США). Липосомы квалифицировали через фильтр с размером пор 0,22 мкм.
Пример 4. Предварительно растворяют 9 г трегалозы и 1 г полиэтиленгликоля 400 в изотоническом стерильном растворе NaCl. Растворяют в 10 мл 95% спирта этилового 1,7 г смеси фосфолипидов фосфатидилхолина и холестерина при их массовом соотношении 5,8:1 соответственно, 0,1 г α-токоферола ацетата и 1,1 твина-20 при температуре 55°С. В полученном спиртовом растворе растворяют убихинол в количестве 1 г, до получения прозрачного раствора. После этого быстро переносят полученный раствор в раствор трегалозы и ПЭГ400 в изотоническом растворе при температуре 55°С и перешивают в течение 20 минут. Затем этанол отгоняют на роторном испарителе IKA (Германия) под вакуумом при температуре 30-35°С, а полученный раствор доводят водой до 100 мл. Полученную суспензию обрабатывают ультразвуком частоты 20 кГц в течение 10 минут, непрерывно охлаждая ледяной водой (ультразвуковой диспергатор 4710 Cole-Parmer Instruments, США). Липосомы отделяют от низкомолекулярных ингредиентов, используя гельпроникающую хроматографию - Sephadex G-25 и стерильно квалифицировали через фильтр с размером пор 0,22 мкм. Полученные липосомы фасуют во флаконы и лиофильно высушивают до получения порошка липосом.
Пример 5. Растворяют в 10 мл 95% спирта этилового 2,5 г смеси фосфолипидов фосфатидилхолина и холестерина при их массовом соотношении 6:1 соответственно и 1,5 г сорастворителя Кремофора RH-40 при температуре 55°С. В полученном спиртовом растворе растворяют убихинол в количестве 1 г, до получения прозрачного раствора. После этого спиртовой раствор отгоняют под вакуумом на роторном испарителе IKA (Германия) при температуре 30-35°С до получения тонкой пленки. Полученную пленку диспергируют в 100 мл 0,01М фосфатном буфере (pH 7,4) в течение 1 часа до полного перехода высушенных веществ в водную фазу. Полученную суспензию обрабатывали ультразвуком частоты 15 кГц в течение 30 минут, непрерывно охлаждая ледяной водой (ультразвуковой диспергатор 4710 Cole-Parmer Instruments, США). Липосомы квалифицировали через фильтр с размером пор 0,22 мкм.
Пример 6. Растворяют в 10 мл 95% спирта этилового 3,5 г смеси фосфолипидов фосфатидилхолина и холестерина при их массовом соотношении 1:1 соответственно и 2 г сорастворителя твина-80 при температуре 55°С. В полученном спиртовом растворе растворяют убихинол в количестве 1 г, до получения прозрачного раствора. После этого спиртовой раствор отгоняют под вакуумом на роторном испарителе IKA (Германия) при температуре 30-35°С до получения тонкой пленки. Полученную пленку диспергируют в 100 мл деионизированной воде в течение 45 минут до полного перехода высушенных веществ в водную фазу. Полученную суспензию гомогенизируют при высоком давлении. Липосомы квалифицировали через фильтр с размером пор 0,22 мкм.
Пример 7. Предварительно готовят 100 мл 0,01М фосфатного буфера (pH 7,4) и растворяют в нем 10 г трегалозы. Растворяют в 10 мл 95% спирта этилового 2,4 г смеси фосфолипидов фосфатидилхолина и холестерина при их массовом соотношении 5,5:1 соответственно и 1,3 г сорастворителя твина-80 при температуре 55°С. В полученном спиртовом растворе растворяют убихинол в количестве 1 г, до получения прозрачного раствора. После этого, используя шприц, быстро переносят полученный раствор в раствор трегалозы в фосфатном буфере при температуре 55°С и перешивают в течение 30 минут, используя магнитную мешалку. Затем этанол отгоняют на роторном испарителе IKA (Германия) под вакуумом при температуре 30-35°С, а полученный раствор доводят водой до 100 мл. Полученную суспензию обрабатывают ультразвуком частоты 15 кГц в течение 40 минут, непрерывно охлаждая ледяной водой (ультразвуковой диспергатор 4710 Cole-Parmer Instruments, США). Для удаления субстанции, которая не инкапсулирована в липосому, проводится диализ при 4°С в течение 2 часов с применением диализных мешков 25 кДа (OrDial D-Clean, производитель Orange Scientific), и 5%-ного раствора глюкозы в качестве внешнего раствора, с перемешиванием на магнитной мешалке. После замены внешнего раствора проводится еще один диализ в течение двух часов с одновременным перемешиванием. Далее липосомы стерильно квалифицировали через фильтр с размером пор 0,22 мкм. Полученные липосомы фасуют во флаконы и лиофильно высушивают до получения порошка липосом.
Пример 8. Растворяют в 10 мл 95% спирта этилового 3 г смеси липоид С45 (LIPOID GmbH (Германия)) и холестерина при их массовом соотношении 5:1 соответственно и 1,3 г сорастворителя твина-80 при температуре 55°С. В полученном спиртовом растворе растворяют убихинол в количестве 1 г, до получения прозрачного раствора. После этого, используя шприц, быстро переносят полученный раствор в 100 мл деионизированной воды при температуре 55°С и перешивают в течение 30 минут. Затем этанол отгоняют на роторном испарителе IKA (Германия) под вакуумом при температуре 30-35°С, а полученный раствор доводят водой до 100 мл. Полученную суспензию гомогенизируют при высоком давлении. Липосомы квалифицировали через фильтр с размером пор 0,22 мкм. Полученные липосомы используют для создания косметических средств, смешивая в необходимых пропорциях со вспомогательными веществами.
Пример 9. Растворяют в 10 мл 95% спирта этилового 2 г смеси соевого лецитина и холестерина при их массовом соотношении 4,5:1 соответственно и 1,1 г сорастворителя твина-80 при температуре 55°С. В полученном спиртовом растворе растворяют убихинол в количестве 1 г, до получения прозрачного раствора. После этого быстро переносят полученный раствор в 100 мл водной среды (0,01М боратном буфере pH 9,2) при температуре 55°С и перешивают в течение 30 минут. Затем этанол отгоняют на роторном испарителе IKA (Германия) под вакуумом при температуре 30-35°С, а полученный раствор доводят водой до 100 мл. Полученную суспензию обрабатывают ультразвуком частоты 15 кГц в течение 5 минут, непрерывно охлаждая ледяной водой (ультразвуковой диспергатор 4710 Cole-Parmer Instruments, США). После этого проводят экструдирование липосомальной дисперсии под высоким давлением с помощью поликарбонатных мембран с порами различного размера (от 450 до 50 нм). Средневзвешенный размер частиц липосом определяли методом лазерной фотон-корреляционной спектроскопии, с помощью лазерного анализатора размеров наночастиц HORIBASZ-100Z (Horiba, Japan). Липосомы, приготовленные таким образом, имеют средний диаметр частиц 160±10 нм.
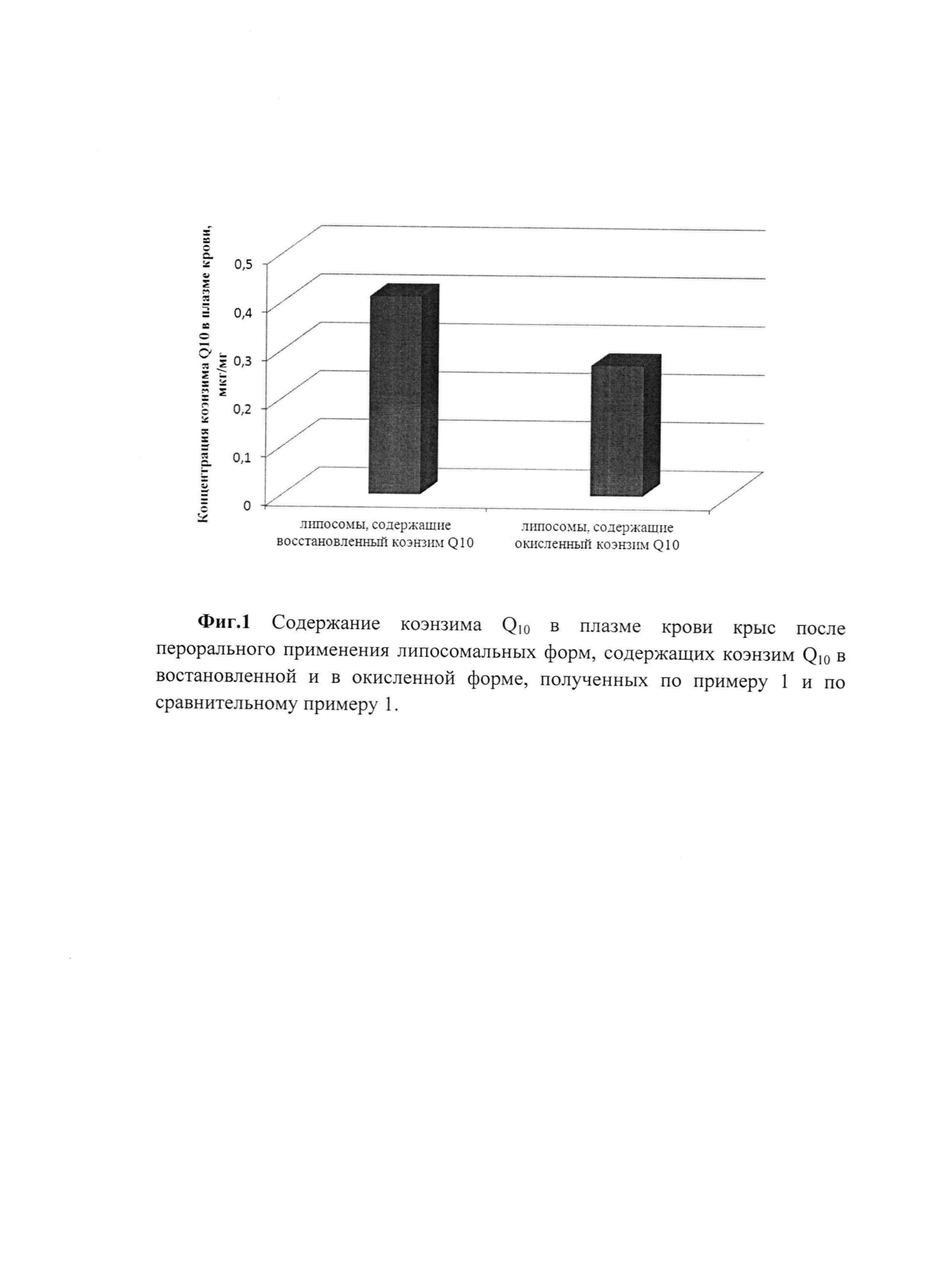
Пример 10. Сравнение биодоступности убихинола (восстановленного коэнзима Q10) и окисленного коэнзима Q10 in vivo из липосом.
При сравнении использовали липосомы, содержащие убихиннол, полученные по примеру 1, и липосомы, содержащие окисленный коэнзим Q10, которые были получены аналогично примеру 1 за исключением того, что вместо убихинола использовали окисленный коэнзим Q10 (сравнительный пример 1).
Образцы липосом вводили белым крысам однократно перорально через зонд в дозе 24 мг/кг. Образцы крови забирали через 5 ч. К отобранным и отцентрифугированным образцам плазмы крови (1 мл) добавляли внутренний стандарт (100 мкл раствора ретинола пальмитата с концентрацией 0,26 мг/мл), 1,7 мл метанола, интенсивно встряхивали, добавляли 4 мл гексана и экстрагировали в течение 10 мин. Гексановый экстракт отделяли, растворитель удаляли. Сухой остаток растворяли в 0,1 мл метанола и полученный раствор анализировали методом обратнофазной высокоэффективной жидкостной хроматографией на хроматографе высокого давления LC-20 (Shimadzu, Япония). Регистрация и обработка хроматограмм выполнена с помощью программного обеспечения LC Solution (Shimadzu, Япония). Полученные результаты приведены на фиг. 1, которые свидетельствуют о более высокой биодоступности восстановленного коэнзима Q10 в составе липосом, чем окисленного коэнзима Q10 в составе липосом.
Пример 11. Определение коэффициента захвата (коэффициента инкапсуляции) убихинола в липосомы.
Использовали липосомы, полученные по примеру 2 и по примеру 6, в которых массовое соотношение убихинола к смеси фосфолипида и стерина составляло 1:1,45 и 1:3,5 соответственно. Для сравнения определяли коэффициент захвата убихинола в липосомы, полученные аналогично примеру 2 за исключением соотношения убихинола к смеси фосфолипида и стерина: сравнительный пример 2 - соотношение убихинола к смеси фосфолипида и стерина составляло 1:0,5; сравнительный пример 3 - соотношение убихинола к смеси фосфолипида и стерина составляло 1:5. Липосомальную композицию с захваченным (инкапсулированным) активным соединением (убихинолом) подвергали диализу по методике, описанной в (Совершенствование технологии и разработка новых лекарственных форм. Учебно-методическое пособие к выполнению практических занятий по заводской технологии лекарственных средств. - 2007. - 16 с.). Концентрацию убихинола в фильтрате измеряли спектрофотометрическим методом при длине волны 290 нм, определяя количество убихинола, не включенного в липосомы. Коэффициент захвата (коэффициент инкапсуляции) убихинола рассчитывали по формуле:
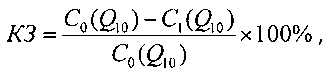
где КЗ - коэффициент захвата, или коэффициент инкапсуляции, C0(Q10) - изначально взятое количество убихинола, С1(Q10) - количество убихинола, не включенного в липосомы. Полученные результаты показаны в таблице 1.

Приведенные данные демонстрируют, что наиболее эффективная инкапсуляция убихинола в липосомы достигается при заявленных в настоящем изобретении соотношениях убихинола к смеси фосфолипида и стерина.
Пример 12. Оценка стабильности полученных образцов липосом при длительном хранении.
Стабильность полученных образцов липосом при длительном хранении определяли, измеряя их средний размер в нм методом динамического светорассеяния. При этом стабильность липосом заключается в сохранении в течение долгого времени их среднего размера, измеренного сразу после получения образцов липосом (отсутствие слипания, агрегации и разрушения липосом, сопровождающихся сильным увеличением размера липосом). Установлено, что после 12 месяцев хранения при температуре +2…+8°С размеры полученных в примерах 1-9 липосом, содержащих убихинол, не изменяются. На основе полученных данных можно сделать вывод, что липосомальная форма убихинола размером до 220 нм стабильна при хранении как минимум в течение 1 года.
Для сравнения была оценена стабильность липосом, содержащих убихинол, полученных аналогично примеру 1 за исключением того, что в одном варианте при получении липосом не использовали Твин-80 (неионогенное ПАВ) - сравнительный пример 4, а в другом варианте при получении липосом не использовали лактозу (криопротектор) - сравнительный пример 5. Липосомы, полученные согласно сравнительному примеру 4 были стабильны не более 8 месяцев, а полученные согласно сравнительному примеру 5 - не более 6 месяцев.