Результат интеллектуальной деятельности: ДИХЛОРАЦЕТАТ {3-[4-(7H-ПИРРОЛО[2,3-d]ПИРИМИДИН-4-ИЛ)-ПИРАЗОЛ-1-ИЛ]-1-ЭТИЛСУЛЬФОНИЛ-АЗЕТИДИН-3-ИЛ}-АЦЕТОНИТРИЛА В КАЧЕСТВЕ ИНГИБИТОРА ЯНУС КИНАЗ
Вид РИД
Изобретение
Настоящее изобретение относится к дихлорацетату замещенного {3-[(7Н-пирроло[2,3-d]пиримидин-4-ил)-азолил]азетидина, а также его композициям, способам применения и получения. Это соединение и его композиции являются ингибиторами Янус-киназ (JAK) и могут использоваться при лечении JAK-ассоциированных заболеваний, включая, например, воспалительные и аутоиммунные расстройства, а также рак.
Онкогенные протеинкиназы представляют собой одну из самых крупных и наиболее привлекательных групп белковых мишеней для разработки лекарственных средств. Янус-киназы играют важную роль в цитокинзависимой регуляции пролиферации и функции клеток, участвующих в иммунной реакции. В настоящее время известны четыре представителя семейства JAK у млекопитающих: JAK1, JAK2, JAK3 (также известная как Янус-киназа лейкоцитов; JAKL; L-JAK) и TYK2 (также известная как протеинтирозинкиназа 2). Блокировка передачи сигнала на уровне JAK-киназ перспективна для разработки методов лечения воспалительных заболеваний, аутоиммунных заболеваний, миелопролиферативных и раковых заболеваний человека. Предполагается, что ингибирование JAK-киназ имеет терапевтический эффект у пациентов, страдающих иммунными расстройствами кожи, такими как псориаз и сенсибилизация кожи. Эффективные ингибиторы JAK-киназ представляют безусловный интерес для разработки новых лекарственных средств. Некоторые JAK-ингибиторы, в том числе пирролопиримидины, представлены в WO 2009/114512. В этой серии соединений Барицитиниб (Baricitinib) является самым передовым лекарственным кандидатом. Барицитиниб показал быструю (через 6 месяцев лечения) и устойчивую эффективность при лечении ревматоидного артрита в трех клинических исследованиях III фазы [NCT02340104, NCT02263911, NCT01710358. http://www.medpagetoday.com/MeetingCoverage/EULAR/52084.http://www.fiercepharma.com/press-releases/lilly-and-incyte-announce-positive-top-line-results-phase-3-trial-baricitin].
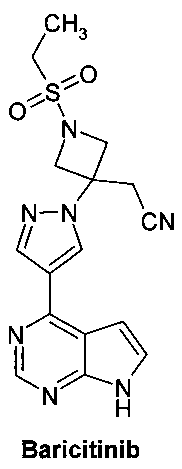
Поиск новых улучшенных JAK-ингибиторов является одним из основных направлений для разработки новых более эффективных лекарственных препаратов для лечения ревматоидного артрита, рака и других заболеваний. Соединения и способы, описанные здесь, направлены на удовлетворение этих потребностей.
Ниже приведены определения терминов, которые использованы в описании этого изобретения.
«Активный компонент» (лекарственное вещество, лекарственная субстанция, drug-substance) означает физиологически активное вещество синтетического или иного (биотехнологического, растительного, животного, микробного и прочего) происхождения, обладающее фармакологической активностью и являющееся активным началом фармацевтической композиции, используемой для производства и изготовления лекарственного препарата (средства).
«Лекарственное средство (препарат)» - вещество (или смесь веществ в виде фармацевтической композиции) в виде таблеток, капсул, инъекций, мазей и других готовых форм, предназначенное для восстановления, исправления или изменения физиологических функций у человека и животных, а также для лечения и профилактики болезней, диагностики, анестезии, контрацепции, косметологии и прочего.
«Фармацевтическая композиция» обозначает композицию, включающую в себя активный компонент и, по крайней мере, один из компонентов, выбранных из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых наполнителей, растворителей, разбавителей, носителей, вспомогательных, распределяющих и воспринимающих средств, средств доставки, таких как консерванты, стабилизаторы, наполнители, измельчители, увлажнители, эмульгаторы, суспендирующие агенты, загустители, подсластители, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, лубриканты, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от природы и способа назначения и дозировки. Примерами суспендирующих агентов являются этоксилированный изостеариловый спирт, полиоксиэтилен, сорбитол и сорбитовый эфир, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, а также смеси этих веществ. Защита от действия микроорганизмов может быть обеспечена с помощью разнообразных антибактериальных и противогрибковых агентов, например таких, как парабены, хлорбутанол, сорбиновая кислота и подобные им соединения. Композиция может включать также изотонические агенты, например сахара, хлористый натрий и им подобные. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного начала, например моностеарат алюминия и желатин. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, а также их смеси, растительные масла (такие, как оливковое масло) и инъекционные органические сложные эфиры (такие, как этилолеат). Примерами наполнителей являются лактоза, молочный сахар, цитрат натрия, карбонат кальция, фосфат кальция и им подобные. Примерами измельчителей и распределяющих средств являются крахмал, альгиновая кислота и ее соли, силикаты. Примерами лубрикантов являются стеарат магния, лаурилсульфат натрия, тальк, а также полиэтиленгликоль с высоким молекулярным весом. Фармацевтическая композиция для перорального, сублингвального, трансдермального, внутримышечного, внутривенного, подкожного, местного или ректального введения активного начала, одного или в комбинации с другим активным началом может быть введена животным и людям в стандартной форме введения в виде смеси с традиционными фармацевтическими носителями. Пригодные стандартные формы введения включают пероральные формы, такие как таблетки, желатиновые капсулы, пилюли, порошки, гранулы, жевательные резинки и пероральные растворы или суспензии, сублингвальные и трансбуккальные формы введения, аэрозоли, имплантаты, местные, трансдермальные, такие как мази и кремы, подкожные, внутримышечные, внутривенные, интраназальные или внутриглазные формы введения и ректальные формы введения.
Цель настоящего изобретения заключается в создании нового ингибитора JAK для лечения ревматоидного артрита, рака и других заболеваний.
Поставленная цель достигается дихлорацетатом {3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-пиразол-1-ил]-1-этилсульфонил-азетидин-3-ил}-ацетонитрила формулы 1 или его сольватом.
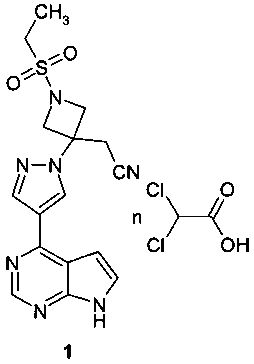
Предметом настоящего изобретения является новый JAK-ингибитор, представляющий собой дихлорацетат {3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-пиразол-1-ил]-1-этилсульфонил-азетидин-3-ил}-ацетонитрила (1) или его сольват.
Соединения по настоящему изобретению могут также включать все изотопы атомов, присутствующих в промежуточных или конечных соединениях. Изотопы включают атомы, имеющие одинаковый атомный номер, но разные массовые числа. Например, изотопы водорода включают тритий и дейтерий.
Новое соединение формулы (1) имеет значительно более высокую растворимость в водных средах, чем у Барицитиниба, что является его безусловным преимуществом. Так, растворимость соединения формулы (1) в воде при рН7 (7.10 мг/мл) в 177 раз выше растворимости Барицитиниба (0.004 мг/мл). Растворимость соединения (1) при рН 2 также выше (в 7.3 раз) растворимости Барицитиниба (Таблица 1).

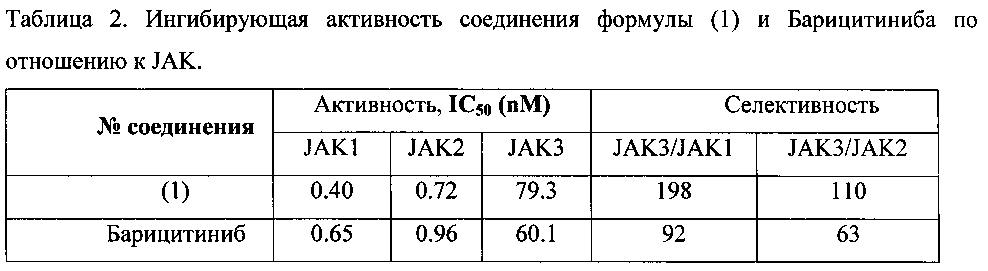
Ингибирующая активность соединения формулы (1) по отношению к JAK1 и JAK2 несколько выше соответствующей активности Барицитиниба, а по отношению к JAK3 ингибирующая активность соединения формулы (1) несколько ниже соответствующей активности Барицитиниба. В результате селективности соединения формулы (1) по отношению к JAK3 примерно в два раза выше селективности Барицитиниба (таблица 2), что весьма важно для ингибиторов JAK1 и JAK2. Ингибирующая активность соединения формулы (1) и Барицитиниба, представленная в таблице 2, получена в результате паралельного исследования в идентичных условиях. В качестве прототипа выбран Барицитиниб, который является самым продвинутым JAK-ингибитором и в настоящее время проходит фазу III клинических испытаний [NCT02340104, NCT02263911, NCT01710358; J.D. Clark, М.Е. Flanagan, J.-B. Telliez. Discovery and Development of Janus Kinase (JAK) Inhibitors for Inflammatory Diseases. J. Med. Chem. 2014, 57, 5023-5038].
Настоящее изобретение относится к способу получения дихлорацетата {3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-пиразол-1-ил]-1-этилсульфонил-азетидин-3-ил}-ацетонитрила (1) взаимодействием {3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-пиразол-1-ил]-1-этилсульфонил-азетидин-3-ил}-ацетонитрила с дихлоруксусной кислотой.
Соединение формулы (1) может быть получено в соответствии с синтетическим протоколом, описанным ниже в разделе примеров.
Дихлорацетат {3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-пиразол-1-ил]-1-этилсульфонил-азетидин-3-ил}-ацетонитрила (1) по настоящему изобретению ингибирует активность JAK. Термин "ингибировать" означает способность уменьшать активность одного или нескольких членов семьи JAK. Соответственно, соединение формулы (1) может быть использовано в способах ингибирования активности JAK.
В соответствии с настоящим изобретением соединение формулы (1) может действовать в качестве ингибитора одной или нескольких JAK.
В соответствии с настоящим изобретением соединение формулы (1) может быть использовано для ингибирования активности JAK-киназ у пациента, который нуждается в такой модуляции рецептора, путем введения ингибирующего количества соединения формулы (1).
Предметом настоящего изобретения является способ лечения заболеваний или расстройств у пациентов, связанных с JAK, путем введения пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтической композиции.
JAK-связанное заболевание может включать в себя любое заболевание, расстройство или состояние, непосредственно или косвенно связанные с экспрессией или активностью JAK, в том числе гиперэкспрессией и/или аномальным уровнем активности. JAK-сопутствующее заболевание может также включать любое заболевание, расстройство или состояние, которое может быть предотвращено, облегчено или вылечено путем модуляции JAK-активности.
Предметом настоящего изобретения является способ лечения JAK-ассоциированных аутоиммунных заболеваний, таких как рассеянный склероз, ревматоидный артрит, ювенильный артрит, псориатический артрит, диабет типа I, волчанка, псориаз, воспалительное заболевание кишечника, язвенный колит, болезнь Крона, миастения, нефропатия иммуноглобулинов, аутоиммунные заболевания щитовидной железы и тому подобное.
В соответствии с настоящим изобретением соединение формулы (1) может быть введено пациенту в виде фармацевтических композиций. Эти композиции могут быть получены способом, хорошо известным в фармацевтической области, и могут быть введены различными способами в зависимости от того, требуется местное или системное лечение и на площади, подлежащей обработке. Композиции могут быть в форме таблеток, пилюль, порошков, лепешек, облаток, эликсиров, суспензий, эмульсий, растворов, сиропов, аэрозолей (как твердое вещество или в жидкой среде), мазей, содержащих, например, до 10% по весу активного соединения, мягких и твердых желатиновых капсул, суппозиториев, стерильных инъекционных растворов и стерильно упакованных порошков. Композиции могут быть приготовлены в виде единичной дозы, причем каждая доза содержит от примерно 5 мг до примерно 1000 мг, обычно примерно от 100 мг до примерно 500 мг, активного ингредиента. Термин "единичные дозы" относится к физически дискретным единицам, пригодным в качестве единичных доз для человека и других млекопитающих, причем каждая единица содержит заданное количество активного материала, рассчитанное на получение желаемого терапевтического эффекта, в сочетании с подходящим фармацевтическим наполнителем.
Ниже изобретение будет описано более подробно с помощью конкретных примеров, которые представлены с целью иллюстрации и не предназначены для ограничения изобретения каким-либо образом. Специалисты в данной области техники легко поймут, различие некритических параметров, которые могут быть изменены или модифицированы, чтобы получить те же результаты.
Пример 1. Дихлорацетат {3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-пиразол-1-ил]-1-этилсульфонил-азетидин-3-ил}-ацетонитрила (1). К раствору 133 мг (0.36 ммоль) {3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-пиразол-1-ил]-1-этилсульфонил-азетидин-3-ил}-ацетонитрила в 10 мл тетрагидрофурана добавлют 46.2 мг (0.36 ммоль) дихлоруксусной кислоты. Смесь упаривают на роторном испарителе досуха. Продукт получают в виде белого твердого вещества. 1H-NMR (DMSO-d6, 400 MHz): 1.24(t, J=7.2Hz, 3H), 3.19-3.28(m, 2H), 3.69(s, 2H), 4.23(d, J=8.8Hz, 2H), 4.6(d, J=8.8Hz, 2H), 6.68(s, 1H), 7.06-7.11(m, 1H), 7.6-7.65(m, 1H), 8.48(s, 1H), 8.71(s, 1H), 8.93(s, 1H), 12.16(br.s, 1H).
Пример 2. Определение термодинамической растворимости соединения формулы (1) и Барицитиниба. Смешивали 5 мг исследуемого соединения с 1 мл универсального буфера (pION) с рН 2.0 или рН 7.0 в течение 15 мин при 25°С. Дополнительные количества веществ добавляли до тех пор, пока раствор не становился мутным. Виалы с раствором инкубировали при перемешивании в течение 24 ч при 25°С для достижения равновесия между раствором и осадком при насыщении. После уравновешивания 200 мкл раствора (в 2-х повторах) фильтровали через 96-луночный фильтровальный планшет (Millipore) для отделения осадка. Концентрацию соединений в фильтрате определяли спектрофотометрически с помощью стандартной калибровочной кривой. Проводили измерение спектра оптического поглощения вещества и построение калибровочной кривой при выбранной длине волны (обычно соответствующей максимуму поглощения вещества λmax). Концентрацию вещества в фильтрате (т.е. растворимость) рассчитывали по нижеприведенной формуле:
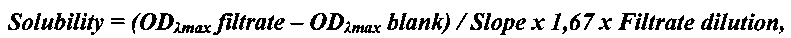
где
ODλmax filtrate - оптическая плотность фильтрата,
ODλmax blank - оптическая плотность холостого раствора без вещества,
Slope - наклон калибровочной кривой,
1,67 - фактор разведения фильтрата ацетонитрилом,
Filtrate dilution - фактор разведения фильтрата буфером.
Полученные результаты представлены в таблице 2.
Пример 3. Соединения тестировали в соответствии со стандартным протоколом Lyte скрининга компании Life Technologi. Тест соединения проверяются в 1% ДМСО (окончательный) в скважине. 100 нл 100х тестируемых соединений в 100% ДМСО добавляют 2,4 мкл киназного буфера (50 мМ HEPES, pH 6,5, 0,01% BRIJ-35, 10 мМ MgCl2, 1 мМ EGTA, 0,02% NaN3) в условиях низкой объемной NBS, черный 384 - Ну пластины (Corning Кат. #4514). После этого 5 мкл 2Х пептида / киназы смесь (Tyr06 / JAK1, окончательные концентрации 21.2-91.5 нг JAK1 и 2 мкм Тир 06) и 2,5 мкл 4×АТР (конечная концентрация 75 мкМ) решения в киназы буфера добавляют. Через 30 сек на шейкере реакция киназы инкубировали в течение 60 мин при комнатной температуре. После этого 5 мкл в 1:128 разбавлении развития реагента А инкубируют в течение еще 60 мин при комнатной температуре. Флуоресценция была измерена при возбуждении при 400 нм и эмиссией при 445 нм и 520. Степень фосфорилирования FRET-пептида может быть рассчитана из соотношения выбросов. Коэффициент выбросов будет оставаться низким, если лада-пептид не фосфорилируется (т.е. не киназы ингибирование) и будет высоким, если лада-пептид нефосфорилированный (т.е. киназы ингибирование), % фосфорилирования рассчитывается по формуле, указанной на странице 6 в стандартном протоколе скрининга Z′-LYTE (Life Technologies).
Концентрационная кривая зависимости активности киназы от концентрации тестируемых веществ построена с использованием сигмоидной модели.
Данные активности соединений общей формулы 1 по отношению к JAK1 представлены в таблице 2.
Пример 4. Получение лекарственного средства в форме таблеток. Смешали 1600 мг крахмала, 1600 мг измельченной лактозы, 400 мг талька и 1000 мг ингибитора (1) и спрессовывали в брусок. Полученный брусок измельчают в гранулы и просеивают через сита, собирая гранулы размером 14-16 меш. Полученные гранулы таблетировали в таблетки пригодной формы весом 500 мг каждая.
Пример 5. Получение лекарственного средства в форме капсул. Ингибитор (1) тщательно смешивали с лактозой в соотношении 2:1. Полученную порошкообразную смесь упаковывали по 600 мг в желатиновые капсулы подходящего размера.
Пример 6. Получение лекарственного средства в форме композиций для внутримышечных, внутрибрюшинных или подкожных инъекций. Смешали 500 мг ингибитора (1), 300 мг хлорбутанола, 2 мл пропиленгликоля и 100 мл воды для инъекций. Раствор фильтровали и помещали в 1 мл в ампулы, которые укупоривали.
Из приведенного выше описания специалистам в данной области техники очевидны различные модификации изобретения в дополнение к описанным здесь.
![ДИХЛОРАЦЕТАТ {3-[4-(7H-ПИРРОЛО[2,3-d]ПИРИМИДИН-4-ИЛ)-ПИРАЗОЛ-1-ИЛ]-1-ЭТИЛСУЛЬФОНИЛ-АЗЕТИДИН-3-ИЛ}-АЦЕТОНИТРИЛА В КАЧЕСТВЕ ИНГИБИТОРА ЯНУС КИНАЗ](https://fips.edrid.ru/images/rid/d2/56/a4/16845044a314a5d6c4b4dafc4ad5e312.png)

