АНТИ-IL-17F АНТИТЕЛА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ
Вид РИД
Изобретение
РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка претендует на приоритет временной заявки США №61/175512, поданной 5 мая 2009 г., содержание которой настоящим целиком включено сюда с помощью ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится в общем к получению моноклональных антител, например, полностью человеческих моноклональных антител, которые распознают IL-17F, но не распознают IL-17A, к моноклональным антителам, например, полностью человеческим моноклональным антителам, которые распознают гетеродимерный комплекс IL-17A/IL-17F, и к способам применения моноклональных антител в качестве терапевтических средств.
ИЗВЕСТНЫЙ УРОВЕНЬ ТЕХНИКИ
IL-17F (также известный как ML-1) является членом семейства IL-17 цитокинов, которое также включает белки IL-17A (также известные как CTL-8, IL-17), IL-17B, IL-17C, IL-17D, IL-17E (также называемые IL-25). Как IL-17A, так и IL-17F секретируются в виде соединенных дисульфидной связью гомодимеров, которые передают сигнал через рецепторы IL-17R, IL-17RC, или мультимерный рецепторный комплекс, состоящий из IL-17R и IL-17RC. Оба они также коэкспрессируются на одних и тех же субпопуляциях Т-клеток (преимущественно Th17 CD4+ Т-клетками). IL-17A и IL-17F также взаимодействуют и образуют гетеродимерный комплекс IL-17A/IL-17F.
Повышенные уровни IL-17F и комплекса IL-17A/IL-17F были ассоциированы с различными воспалительными расстройствами и аутоиммунными болезнями. Соответственно, существует потребность в терапиях, нейтрализующих биологические активности IL-17F.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение предусматривает моноклональные антитела, такие как полностью человеческие моноклональные антитела, которые специфически связываются с IL-17F и/или гетеродимерным комплексом IL-17A/IL-17F, но не связываются специфически с IL-17A. IL-17F типично экспрессируется и проявляет биологическую активность как гомодимерный белок. Таким образом, использование термина "IL-17F" и его эквивалентов относится к гомодимерному белку IL-17F, за исключением случаев, когда будет указано иное. Антитела по изобретению способны модулировать, например, блокировать, ингибировать, редуцировать, антагонизировать, нейтрализовать, или иначе препятствовать продуцированию IL-17F-медиируемого провоспалительного цитокина и/или хемокина.
Типичные примеры моноклональных антител по изобретению включают, например, антитело 5Е12, антитело 41 В10, антитело 11С5, антитело 21В10, антитело 1F1 и антитело 2Е12. Альтернативно, моноклональное антитело представляет собой антитело, которое связывается с тем же самым эпитопом, что и антитело 41В10, антитело 11С5, антитело 21В10, антитело 1F1, антитело 2Е12, антитело 5D3, антитело 22F8, антитело 28В11, антитело 41А4 и антитело 43G6. Эти антитела соответственно называются тут антителами "hulL17F". Антитела hulL-17F включают полностью человеческие моноклональные антитела, а также гуманизированные моноклональные антитела и химерные антитела.
Предпочтительно, полностью человеческое моноклональное антитело выбирают из антитела 11С5, антитела 21В10, антитела 1F1, антитела 2Е12, антитела 5D3, антитела 22F8, антитела 28В11, антитела 41А4 и антитела 43G6. Эти антитела проявляют более высокую аффинность к IL-17F и/или гетеродимерному комплексу IL-17A/IL-17F, чем другие антитела, которые связывают IL-17F и/или гетеродимерный комплекс IL-17A/IL-17F, такие как, например, антитело 5Е12 и антитело 41В10. Эти антитела являются лучшими ингибиторами по меньшей мере одной биологической активности или функции IL-17F, чем другие антитела, которые связывают IL-17F и/или гетеродимерный комплекс IL-17A/IL-17F, такие как, например, антитело 5Е12 и антитело 41В10. Например, антитело 11С5, антитело 21 В10, антитело 1F1, антитело 2Е12, антитело 5D3, антитело 22F8, антитело 28 В11, антитело 41А4 и антитело 43G6 ингибируют биологическую активность и/или функцию IL-17F в большей степени, чем антитело 5Е12 и/или антитело 41В10. В некоторых вариантах исполнения, антитело 11С5, антитело 21В10, антитело 1F1, антитело 2Е12, антитело 5D3, антитело 22F8, антитело 28В11, антитело 41А4 и антитело 43G6 снижают продуцирование провоспалительного цитокина в присутствии этих антител в большей степени, чем снижение продуцирования провоспалительного цитокина в присутствии других антител, которые связывают IL-17F и/или гетеродимерный комплекс IL-17A/IL-17F, таких как, например, антитело 5Е12 и/или антитело 41В10. Например, уровень продуцирования провоспалительного цитокина (например, IL-6) в присутствии антитела 11С5, антитела 21В10, антитела 1F1, антитела 2Е12, антитела 5D3, антитела 22F8, антитела 28В11, антитела 41А4 и антитела 43G6, на, или более чем на, 5%, 10%, 20%, 25%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 90%, 95%, 99%, или 100% ниже уровня продуцирования провоспалительного цитокина другими антителами, которые связывают IL-17F и/или гетеродимерный комплекс IL-17A/IL-17F, такими как, например, антитело 5Е12 и/или антитело 41В10.
Эти антитела проявляют специфичность к человеческому IL-17F и/или человеческому гетеродимерному комплексу IL-17A/IL-17F, и было показано, что они ингибируют IL-17F-медиируемое продуцирование цитокина. Эти антитела обладают различными специфичностями. В некоторых вариантах исполнения, антитела huIL-17F по изобретению специфически связывают IL-17F, но не связывают специфически IL-17A. Предпочтительно, антитела huIL-17 по изобретению также специфически связывают гомодимер IL-17F, но не связывают специфически гомодимер IL-17A. В некоторых вариантах исполнения, антитела huIL-17F по изобретению специфически связывают гетеродимерный комплекс IL-17A/IL-17F, но не связывают специфически IL-17A или гомодимер IL-17A. В некоторых вариантах исполнения, антитела huIL-17F по изобретению специфически связывают IL-17F и гетеродимерный комплекс IL-17A/IL-17F, но не связывают специфически IL-17A или гомодимер IL-17A. Например, антитела 11С5, 21В10, 1F1, 2Е12, 41В10, 5D3, 22F8, 28В11, 41А4 и 43G6 специфически связывают IL-17F, и эти антитела не связывают IL-17A или гомодимер IL-17A. Предпочтительно, антитела huIL-17F связывают IL-17F и перекрестно не реагируют с IL-17A или гомодимером IL-17A. Например, 5Е12, 11С5, 21В10, 1F1, 2Е12, 41В10, 5D3, 22F8, 28В11, 41А4 и 43G6 связывают IL-17F но перекрестно не реагируют с IL-17A.
Полностью человеческие антитела по изобретению содержат вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность по SEQ ID NOS: 10, 14, 18, 22, 26, 30, 34, 38 и 42. Человеческие антитела по изобретению содержат вариабельный участок легкой цепи, имеющий аминокислотную последовательность по SEQ ID NOS: 12 16 20 24, 28, 32, 36, 40 и 44. CDR (участки, определяющие комплементарность) тяжелой цепи включают область VH CDR1, содержащую аминокислотную последовательность, по меньшей мере на 90%, 92%, 95%, 97% 98%, 99% или больше идентичную последовательности, выбранной из группы, состоящей из SEQ ID NOs: 45, 48, 51, 56, 59, 64, 67 и 70; область VH CDR2, содержащую аминокислотную последовательность, по меньшей мере на 90%, 92%, 95%, 97% 98%, 99% или больше идентичную последовательности, выбранной из группы, состоящей из SEQ ID NOs: 46, 49, 52, 54, 57, 60, 62, 65, 68, 71 и 73; и область VH CDR3, содержащую аминокислотную последовательность, по меньшей мере на 90%, 92%, 95%, 97% 98%, 99% или больше идентичную последовательности, выбраной из группы, состоящей из SEQ ID NOs: 47, 50, 53, 55, 58, 61, 63, 66, 69 и 72. Три CDRs легкой цепи включают область VL CDR1, содержащую аминокислотную последовательность, по меньшей мере на 90%, 92%, 95%, 97% 98%, 99% или больше идентичную последовательности, выбранной из группы, состоящей из SEQ ID NOs: 74, 77, 80, 85, 88, 91 и 94; область VL CDR2, содержащую аминокислотную последовательность, по меньшей мере на 90%, 92%, 95%, 97% 98%, 99% или больше идентичную последовательности, выбранной из группы, состоящей из SEQ ID NOs: 75, 78, 81, 83, 86, 89, 92 и 96; и область VL CDR3, содержащую аминокислотную последовательность, по меньшей мере на 90%, 92%, 95%, 97% 98%, 99% или больше идентичную последовательности, выбранной из группы, состоящей из SEQ ID NOs: 76, 79, 82, 84, 87, 90, 93, 95, 97, 98 и 99.
Предпочтительно, CDRs тяжелой цепи включают область VH CDR1, содержащую аминокислотную последовательность, по меньшей мере на 90%, 92%, 95%, 97% 98%, 99% или больше идентичную последовательности, выбранной из группы, состоящей из SEQ ID NOs: 45, 48, 51, 64, 67 и 70; область VH CDR2, содержащую аминокислотную последовательность, по меньшей мере на 90%, 92%, 95%, 97% 98%, 99% или больше идентичную последовательности, выбранной из группы, состоящей из SEQ ID NOs: 46, 49, 52, 54, 62, 65, 68, 71 и 73; и область VH CDR3, содержащую аминокислотную последовательность, по меньшей мере на 90%, 92%, 95%, 97% 98%, 99% или больше идентичную последовательности, выбранной из группы, состоящей из SEQ ID NOs: 47, 50, 53 55, 63, 66, 69 и 72. Три CDRs легкой цепи включают область VL CDR1, содержащую аминокислотную последовательность, по меньшей мере на 90%, 92%, 95%, 97% 98%, 99% или больше идентичную последовательности, выбранной из группы, состоящей из SEQ ID NOs: 74, 77, 80, 85, 91 и 94; область VL CDR2, содержащую аминокислотную последовательность, по меньшей мере на 90%, 92%, 95%, 97% 98%, 99% или больше идентичную последовательности, выбранной из группы, состоящей из SEQ ID NOs: 75, 78, 81, 83, 86, 92 и 96; и область VL CDR3, содержащую аминокислотную последовательность, по меньшей мере на 90%, 92%, 95%, 97% 98%, 99% или больше идентичную последовательности, выбранной из группы, состоящей из SEQ ID NOs: 76, 79, 82, 84, 93, 95, 97, 98 и 99, при условии, что когда VL CDR1 содержит аминокислотную последовательность, по меньшей мере на 90%, 92%, 95%, 97% 98%, 99% или больше идентичную последовательности по SEQ ID NO: 85, то VL CDR2 содержит аминокислотную последовательность, по меньшей мере на 90%, 92%, 95%, 97% 98%, 99% или больше идентичную последовательности по SEQ ID NO: 86 и VL CDR3 содержит аминокислотную последовательность, по меньшей мере на 90%, 92%, 95%, 97% 98%, 99% или больше идентичную последовательности по SEQ ID NO: 98, и при условии, что когда VL CDR2 содержит аминокислотную последовательность, по меньшей мере на 90%, 92%, 95%, 97% 98%, 99% или больше идентичную последовательности по SEQ ID NO: 86, то VL CDR1 содержит аминокислотную последовательность, по меньшей мере на 90%, 92%, 95%, 97% 98%, 99% или больше идентичную последовательности по SEQ ID NO: 85 и VL CDR3 содержит аминокислотную последовательность, по меньшей мере на 90%, 92%, 95%, 97% 98%, 99% или больше идентичную последовательности по SEQ ID NO: 98.
Антитела по изобретению иммуноспецифически связывают IL-17F, причем антитело связывается с эпитопом, включающим один или несколько аминокислотных остатков на человеческом IL-17F. В некоторых вариантах исполнения, антитела по изобретению также специфически связывают гетеродимерный комплекс IL-17A/IL-17F, но не IL-17A, причем антитело связывается с эпитопом, включающим один или несколько аминокислотных остатков на человеческом IL-17F.
Антитела по изобретению также включают полностью человеческие антитела, которые специфически связывают IL-17F и/или гетеродимерный комплекс IL-17A/IL-17F, где антитело более чем на 50% ингибирует IL-17F-медиируемого продуцирования провоспалительного цитокина in vitro. Например, антитела по изобретению более чем на 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 92%, 95%, 97%, 98%, или 99% ингибируют секрецию IL-6 IL-17-стимулированными клетками. В используемом тут значении, термин "провоспалительный цитокин" относится к иммунорегуляторным цитокинам, которые промотируют воспаление и/или ассоциированы с воспалением. Провоспалительные цитокины и хемокины включают, например, IL-6, IL-8, G-CSF, и GM-CSF. Провоспалительные хемокины включают, например, GRO-a, GRO-b, LIX, GCP-2, MIG, IP10, I-TAC, и МСР-1, RANTES, Eotaxin, SDF-1, и MIP3a.
Настоящее изобретение также предусматривает способы лечения или профилактики патологий, ассоциированных с аберрантной активностью IL-17F (например, аберрантным продуцированием провоспалительного цитокина, таким как, например, аберрантное продуцирование IL-6), или облегчения симптома, ассоциированного с такими патологиями, путем введения моноклонального антитела по изобретению (например, полностью человеческого моноклонального антитела) субъекту, для которого такое лечение или профилактика являются желательными. Нуждающийся в лечении субъект является, например, человеком. Моноклональное антитело вводится в количестве, достаточном для лечения, профилактики или облегчения симптома, ассоциированного с патологией. Количество моноклонального антитела, достаточное для лечения или профилактики патологии у субъекта, представляет собой, например, количество, достаточное для снижения передачи сигналов IL-17F (например, IL-17F-индуцированное продуцирование одного или нескольких провоспалительных цитокинов, таких как, например, IL-6). В используемом тут значении, термин "пониженный" относится к пониженному продуцированию провоспалительного цитокина в присутствии моноклонального антитела по изобретению, где продуцирование, например, представляет собой местное продуцирование провоспалительного цитокина (например, на участке воспаленной ткани) или системное продуцирование провоспалительного цитокина. Передача сигналов IL-17F (например, IL-17F-индуцированного провоспалительного цитокина, такого как IL-6) снижается, когда уровень продуцирования провоспалительного цитокина (например, IL-6) в присутствии моноклонального антитела по изобретению является на, или более чем на, 5%, 10%, 20%, 25%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 90%, 95%, 99%, или 100% меньшим, чем контрольный уровень продуцирования провоспалительного цитокина (т.е., уровень продуцирования провоспалительного цитокина в отсутствие моноклонального антитела). Уровень продуцирования провоспалительного цитокина (например, IL-6) измеряют, например, путем проведения клеточных анализов IL-17F-стимулированных мышиных эмбриональных фибробластов (MEF), описанных тут. Квалифицированным специалистам будет понятно, что уровень продуцирования провоспалительного цитокина может быть измерен с использованием различных анализов, включая, например, коммерчески доступные наборы ELISA.
Патологии, лечение и/или профилактика которых проводятся с использованием моноклональных антител по изобретению (например, полностью человеческого моноклонального антитела) включают, например, острое воспаление, хроническое воспаление (например, хроническое воспаление, ассоциированное с аллергическими состояниями и астмой, хроническое воспаление, ассоциированное с артритными состояниями), аутоиммунные болезни (например, болезнь Крона, рассеянный склероз, ревматоидный артрит и другие аутоиммунные артритные состояния), воспалительную болезнь кишечника и отторжение трансплантата.
Фармацевтические композиции в соответствии с изобретением могут содержать антитело по изобретению и носитель. Такие фармацевтические композиции могут быть включены в наборы, такие как, например, диагностические наборы.
Настоящее изобретение также предусматривает растворимые белки IL-17F, способы экспрессии белков IL-17F, и способы очистки таких белков в растворимой форме.
В некоторых вариантах исполнения, требующая лечения патология представляет собой одну или несколько аутоиммунных болезней, воспалительных расстройств или раков. Например, без ограничений, патология представляет собой ревматоидный артрит и другие артритные состояния, болезнь Крона, псориаз, рассеянный склероз, хроническую обструктивную болезнь легких и/или астму, рак и ангиогенез.
Фармацевтические композиции в соответствии с изобретением могут содержать антитело по изобретению и носитель. Такие фармацевтические композиции могут быть включены в наборы, такие как, например, диагностические наборы.
Квалифицированному специалисту будет понятно, что антитела по изобретению имеют широкий спектр применения. Например, белки по изобретению используются в качестве терапевтических агентов для предотвращения активации рецептора IL-17F при таких расстройствах, как, например, ревматоидный артрит, болезнь Крона, псориаз, рассеянный склероз, хроническая обструктивная болезнь легких, ангиогенез, астма и рак. Антитела по изобретению также используются в качестве реагентов в диагностических наборах или в качестве диагностических инструментов, или эти антитела могут быть использованы в анализах конкурентного связывания для получения терапевтических реагентов.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
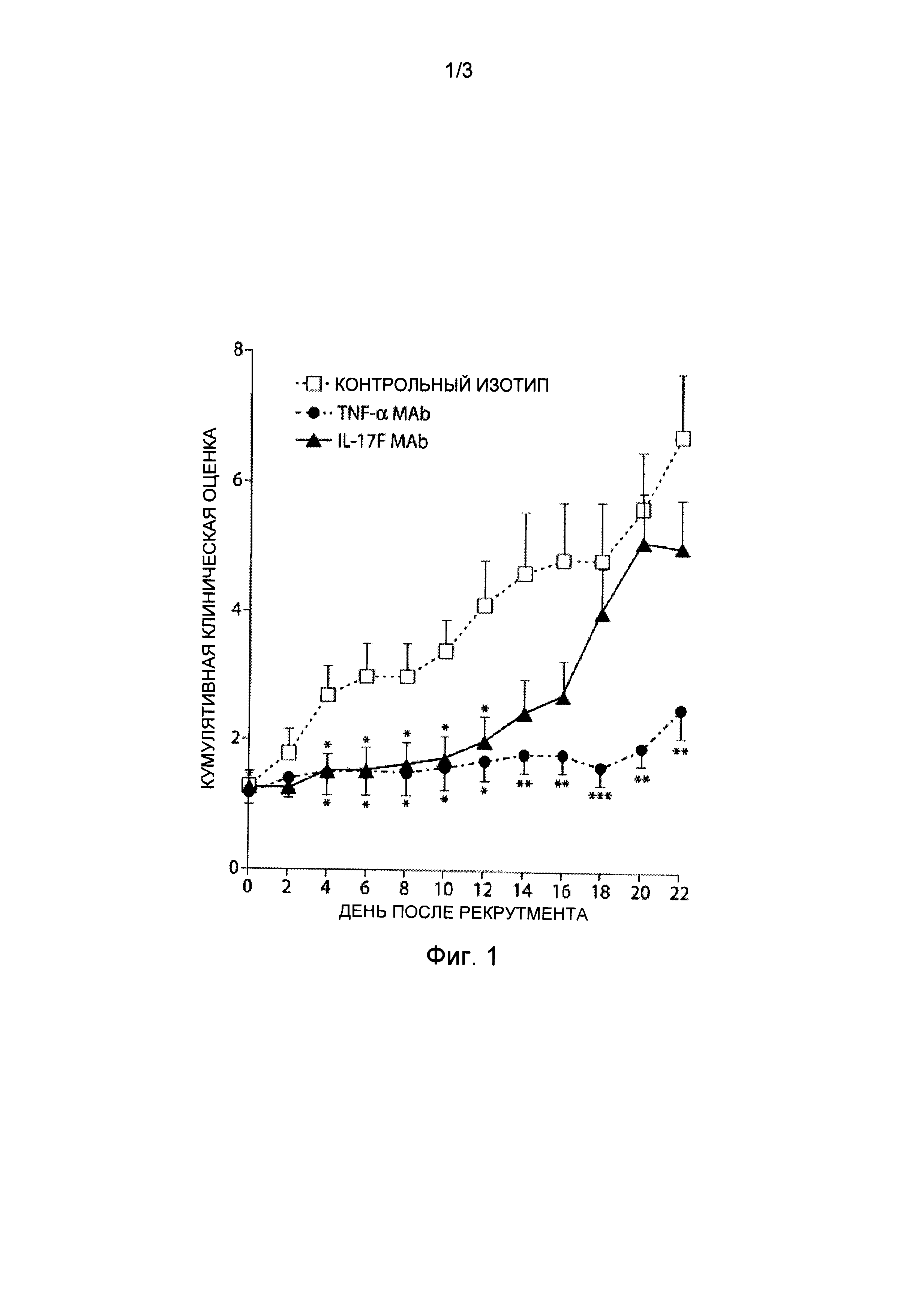
Фигура 1 представляет собой график, изображающий ход проведения клинической оценки коллаген-индуцированного артрита у мышей с использованием стандартных способов оценки артрита.
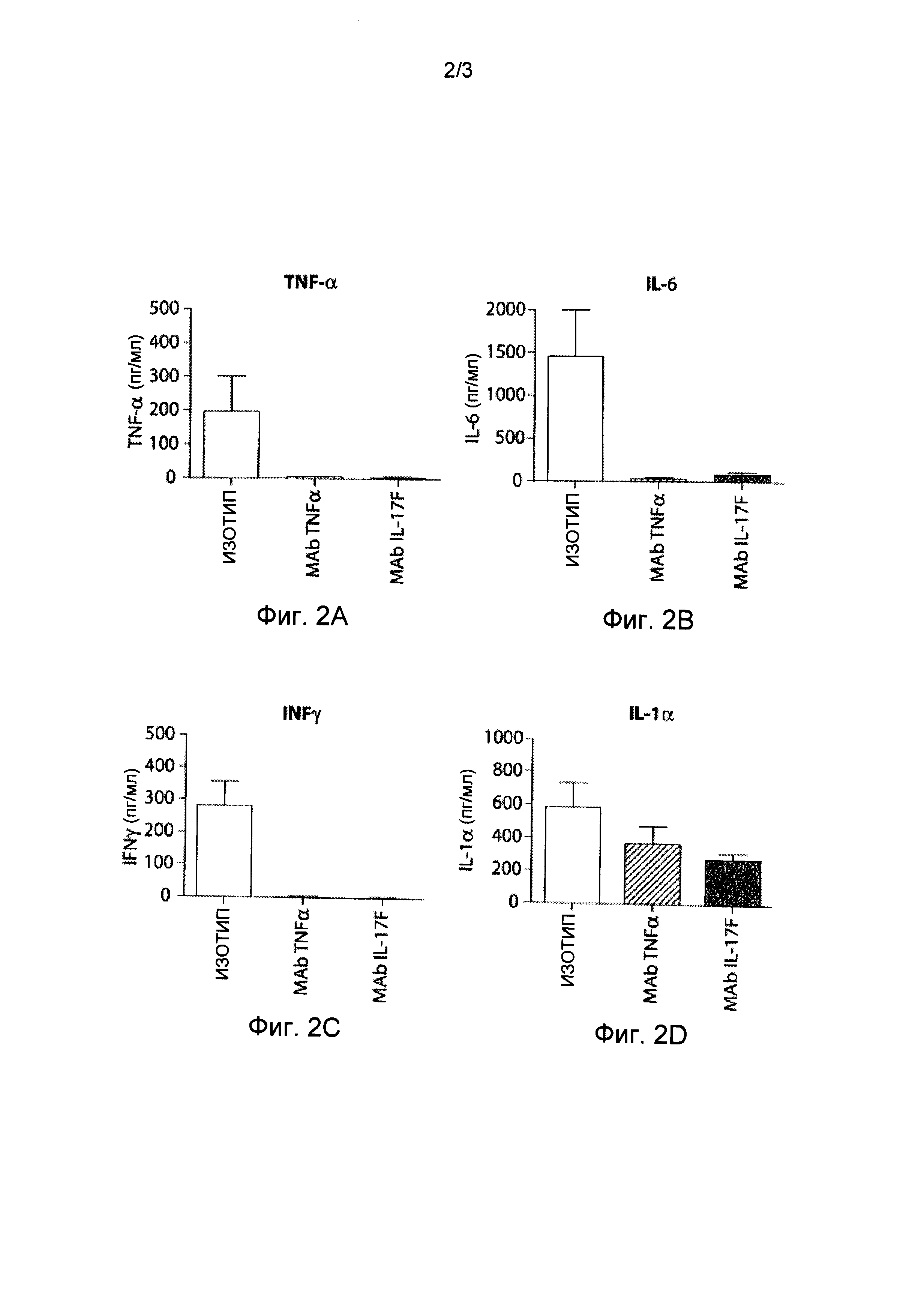
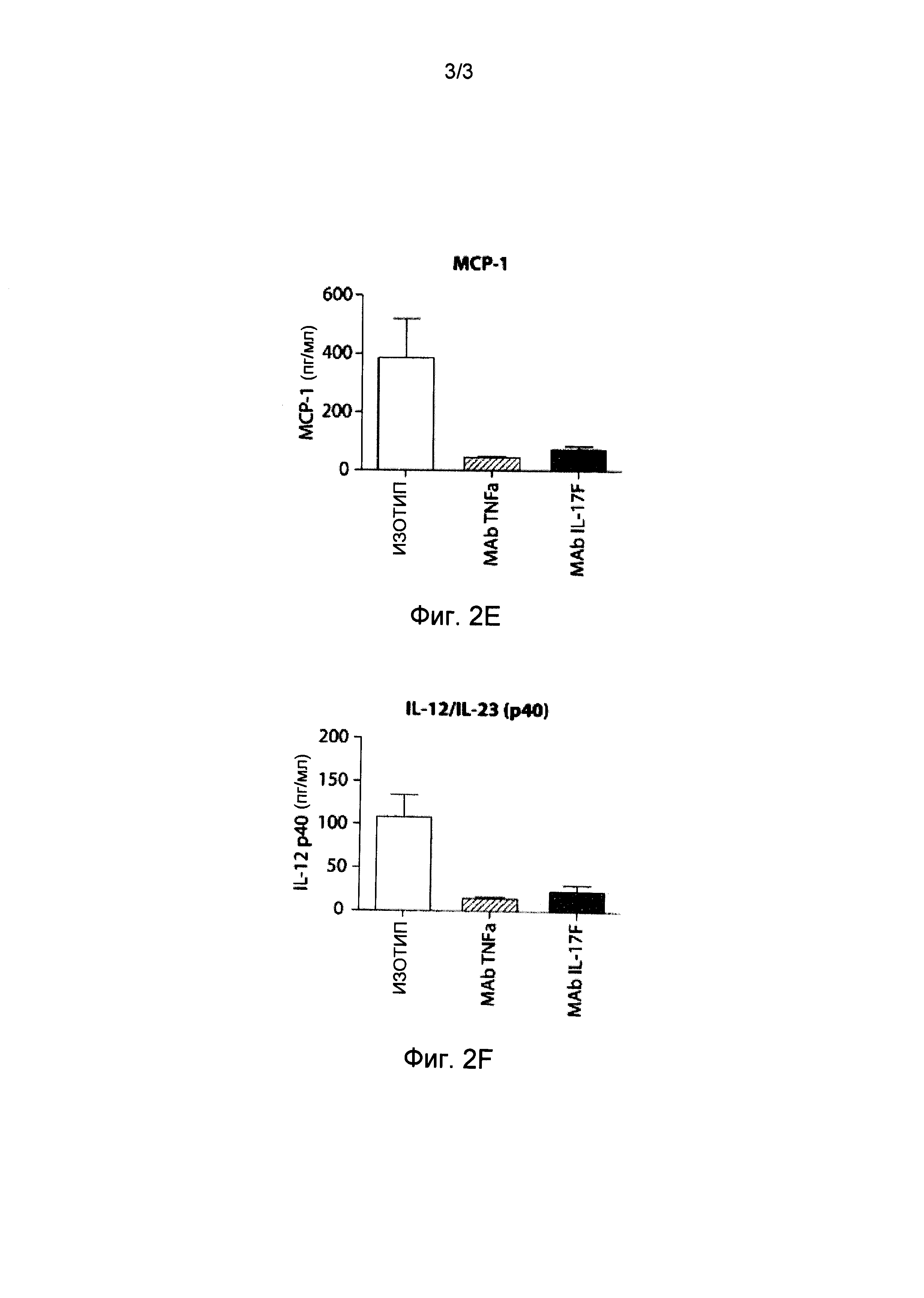
Фигуры 2A-2F представляют собой серию графиков, изображающих разные уровни цитокина в сыворотке мышей, иммунизованных бычьим коллагеном типа II, определенные в конце проведения эксперимента (день 22). Фигура 2А изображает определяемый уровень содержания в сыворотке фактора некроза опухоли-альфа (TNF-α); Фигура 2B изображает определяемый уровень содержания в сыворотке интерлейкина 6 (IL-6); Фигура 2 C изображает определяемый уровень содержания в сыворотке интерферона-гамма (IFN-γ); Фигура 2D изображает определяемый уровень содержания в сыворотке интерлейкина 1 альфа (IL-1α); Фигура 2E изображает определяемый уровень содержания в сыворотке моноцитарного хемотактического белка (МСР-1); и Фигура 2F изображает определяемый уровень содержания в сыворотке гетеродимерного комплекса интерлейкин 12/интерлейкин 23(IL-12/IL-23).
ДЕТАЛЬНОЕ ОПИСАНИЕ
Настоящее изобретение предусматривает моноклональные антитела, которые специфически связывают IL-17F. Изобретение дополнительно предусматривает моноклональные антитела, которые специфически связывают IL-17F и гетеродимерный комплекс IL-17A/IL-17F (также называемый тут гетеродимером IL-17A/IL-17F). Антитело, например, является полностью человеческим моноклональным антителом.
Антитела по изобретению специфически связывают IL-17F, но не IL-17A, причем антитело связывается с эпитопом, включающим один или несколько аминокислотных остатков человеческого IL-17F. В некоторых вариантах исполнения, антитела по изобретению специфически связывают IL-17F и гетеродимерный комплекс IL-17A/IL-17F, но не IL-17A или гомодимер IL-17A, причем антитело связывается с эпитопом, включающим один или несколько аминокислотных остатков человеческого IL-17F.
Антитела по настоящему изобретению связываются с эпитопом IL-17F с равновесной константой связывания (Kd)≤1 мкМ, например, ≤100 нМ, предпочтительно, ≤10 нМ, и более предпочтительно, ≤1 нМ. Например, антитела huIL-17F, предусматриваемые тут, демонстрируют Kd в интервале значений приблизительно от ≤1 нМ до примерно 1 пМ.
Кристаллическая структура IL-17F показывает, что белок принимает укладку типа цистеинового узла, что позволяет предположить связь с суперсемейством белков цистеинового узла. Однако, мотив цистеинового узла IL-17F использует только четыре цистеина вместо классических шести цистеинов для образования узла. Как и другие члены семейства цистеинового узла, IL-17F также существует в виде гетеродимера с IL-17A. Считается, что гетеродимер IL-17A/IL-17F передает сигналы через IL-17R и/или мультимерный комплекс IL-17R/IL-17RC. Недавно полученные данные показали, что цистеиновые остатки, использующиеся при образовании гетеродимера IL-17A/IL-17F, являются теми же цистеинами, которые используются при образовании гомодимера IL-17F. Эти данные позволяют предположить, что рецептор гомодимера IL-17F или гетеродимера IL-17A/IL-17F может связываться с консервативными цистеиновыми остатками на контактной поверхности димера, как и другие белки семейства цистеинового узла.
Сообщалось о многочисленных иммунно-регуляторных функциях цитокинов семейства IL-17, предположительно, вследствие индукции ими многих иммунных сигнальных молекул. IL-17A, экспрессируемый в виде гомодимера IL-17A, и IL-17F, экспрессируемый в виде гомодимера IL-17F, обладают очень схожими биологическими функциями в некоторых случаях. Оба промотируют секрецию провоспалительных цитокинов (например, IL-6, IL-8, G-CSF и GM-CSF), хемокинов (например, GRO-a, GRO-b, LIX, GCP-2, MIG, IP10, I-TAC и MCP-1, RANTES, Eotaxin, SDF-1 и MIP3a) и простагландинов (например, PGE2) широким спектром клеток, включая фибробласты, кератиноциты, макрофаги, эпителиальные клетки и эндотелиальные клетки. Также было показано, что оба они регулируют оборот хрящевого матрикса. Гомодимер IL-17F также имеет биологические функции, отличные от гомодимера IL-17A, такие как способность стимулировать пролиферацию и активацию Т-клеток и мононуклеарных клеток периферической крови (PBMCs), и ингибировать ангиогенез.
Антитела huIL17F по изобретению служат для модуляции, блокирования, ингибирования, редуцирования, антагонизации, нейтрализации или иного вмешательства в биологическую активность IL-17F. Биологические активности IL-17F включают, например, связывание с IL-17R, IL-17RC и/или мультимерным рецепторным комплексом IL-17R/IL-17RC, и индукцию экспрессии цитокинов и/или хемокинов (например, IL-6, IL-8, G-CSF, GM-CSF, GRO-a, GRO-b, LIX, GCP-2, MIG, IP10, I-TAC и МСР-1, RANTES, Eotaxin, SDF-1 и MIP3a) в клетках-мишенях. Например, антитела huIL-17F полностью или частично ингибируют биологическую активность IL-17F путем частичного или полного модулирования, блокирования, ингибирования, редуцирования, антагонизирования, нейтрализации или иного вмешательства в связывание IL-17F с его рецептором, или иного частичного или полного модулирования, блокирования, ингибирования, редуцирования, антагонизирования, нейтрализации сигнальной активности IL-17F.
Считается, что антитела huIL-17F полностью модулируют, блокируют, ингибируют, редуцируют, антагонизируют, нейтрализуют или иначе препятствуют проявлению биологической активности IL-17F, когда уровень активности IL-17F в присутствии антитела huIL-17F снижается на по меньшей мере 95%, например на 96%, 97%, 98%, 99% или 100%, по сравнению с уровнем активности IL-17F в отсутствие связывания с антителом huIL-17F, описанным тут. Считается, что антитела huIL-17F частично модулируют, блокируют, ингибируют, редуцируют, антагонизируют, нейтрализуют или иначе препятствуют проявлению активности IL-17F, когда уровень активности IL-17F в присутствии антитела huIL-17F снижается менее чем на 95%, например на 10%, 20%, 25%, 30%, 40%, 50%, 60%, 75%, 80%, 85% или 90%, по сравнению с уровнем активности IL-17F в отсутствие связывания с антителом huIL-17F, описанным тут.
Определения
Если не указано иное, научные и технические термины, используемые в связи с настоящим изобретением, должны иметь значения, являющиеся общепринятыми для рядовых специалистов в данной области техники. Кроме того, если иное не следует из контекста, термины в единственном числе должны включать множественное число, и термины во множественном числе должны включать единственное число. В общем, номенклатуры, используемые в связи с, и методики культивации клеток и тканей, молекулярной биологии, и химии и гибридизации белков и олиго- или полинуклеотидов, описанные тут, являются хорошо известными и общепринятыми для специалистов. Стандартные методики используются для рекомбинантных ДНК, олигонуклеотидного синтеза и культивации и трансформации тканей (например, электропорация, липофекция). Ферментативные реакции и методики очистки проводятся в соответствии с инструкциями производителя, или как известно специалистам, или как описано тут. Вышеупомянутые методики и процедуры обычно проводятся в соответствии с обычными способами, хорошо известными специалистам, и как описано в различных источниках как общего характера, так и более специализированных, которые упоминаются и обсуждаются в данном описании. См., например, Sambrook et al. Molecular Cloning; A Laboratory Manual (2d ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989)). Номенклатуры, используемые в связи с, и лабораторные процедуры и методики, аналитической химии, органического синтеза, и медицинской и фармацевтической химии, описанные тут, хорошо известны и широко используются специалистами. Стандартные методики используются для химических синтезов, химических анализов, изготовления, составления композиций, и доставки фармацевтических средств, и лечения пациентов.
При использовании в соответствии с данным описанием, следующие термины, если не указано иное, должны пониматься как имеющие такие значения:
В используемом тут значении, термины интерлейкин-17А, IL-17A, IL17A, IL-17, IL17, CTLA8, CTLA-8, цитотоксичный Т-лимфоцит-ассоциированный антиген 8 и прекурсор интерлейкина-17А являются синонимичными и могут быть использованы взаимозаменяемо. Каждый из этих терминов относится к гомодимерному белку, за исключением случаев, когда будет указано иное.
В используемом тут значении, термины интерлейкин-17F, IL-17F, IL17F, ML-1, ML1, интерлейкин-24, IL-24, IL24 и прекурсор интерлейкина-17F являются синонимичными и могут быть использованы взаимозаменяемо. Каждый из этих терминов относится к гомодимерному белку IL-17F, за исключением случаев, когда будет указано иное.
В используемом тут значении, термин "антитело" относится к молекулам иммуноглобулина и иммунологически активным участкам молекул иммуноглобулина (Ig), т.е., молекулам, содержащим антигенсвязывающий сайт, который специфически связывается с (иммунореагирует с) антигеном. "Специфически связывается" или "иммунореагирует с" или "направлен против" означает, что антитело реагирует с одной или несколькими антигенными детерминантами желательного антигена и не реагирует с другими полипептидами или связывается с ними с гораздо меньшей аффинностью (Kd>10-6). Антитела включают, без ограничений, поликлональные, моноклональные, химерные, dAb (доменное антитело), одноцепочечные, фрагменты Fab, Fab' и F(ab')2, scFvs, и библиотеку экспрессии Fab.
Известно, что базовая структурная единица антитела включает тетрамер. Каждый тетрамер состоит из двух идентичных пар полипептидных цепей, причем каждая пара содержит одну "легкую" (примерно 25 кДа) и одну "тяжелую" цепь (примерно 50-70 кДа). Аминоконцевой участок каждой цепи включает вариабельный участок из примерно 100-110 или больше аминокислот, ответственных преимущественно за распознавание антигена. Карбоксиконцевой участок каждой цепи образует константную область, ответственную преимущественно за эффекторную функцию. В общем, молекулы антител, полученных от людей, относятся к любому из классов IgG, IgM, IgA, IgE и IgD, которые отличаются друг от друга по характеру тяжелой цепи, присутствующей в молекуле. Определенные классы также имеют подклассы, такие как IgG1, IgG2 и другие. Кроме того, у людей легкая цепь может быть каппа-цепью или лямбда-цепью.
Термин "моноклональное антитело" (МАЬ) или "композиция моноклонального антитела", в используемом тут значении, относится к популяции молекул антитела, содержащей только одну молекулярную разновидность молекул антитела, состоящую из уникального генного продукта легкой цепи и уникального генного продукта тяжелой цепи. В частности, участки, определяющие комплементарность (CDRs), моноклонального антитела являются идентичными у всех молекул популяции. MAbs содержат антигенсвязывающий сайт, способный иммунореагировать с определенным эпитопом антигена, характеризующимся уникальной аффинностью связывания с ним.
В общем, молекулы антитела, полученные от людей, относятся к любому из класса IgG, IgM, IgA, IgE и IgD, которые отличаются друг от друга по природе тяжелой цепи, присутствующей в молекуле. Определенные классы имеют также подклассы, такие как IgG1, IgG2 и другие. Кроме того, у людей легкая цепь может быть каппа-цепью или лямбда-цепью.
Термин "антигенсвязывающий сайт" или "связывающий участок" относится к части молекулы иммуноглобулина, которая участвует в связывании антигена. Антигенсвязывающий сайт образован аминокислотными остатками N-концевых вариабельных ("V") областей тяжелой ("Н") и легкой ("L") цепей. Три сильно дивергентных отрезка в V областях тяжелой и легкой цепей, называемые "гипервариабельными участками", расположены между более консервативными фланкирующими отрезками, известными как "каркасные области", или "FRs". Таким образом, термин "FR" относится к аминокислотным последовательностям, которые обычно расположены между, и рядом с, гипервариабельными участками иммуноглобулинов. В молекуле антитела, три гипервариабельных участка легкой цепи и три гипервариабельных участка тяжелой цепи размещаются по отношению друг к другу в трехмерном пространстве таким образом, чтобы они образовывали антигенсвязывающую поверхность. Антигенсвязывающая поверхность является комплементарной к трехмерной поверхности связанного антигена, и три гипервариабельных участка каждой из тяжелой и легкой цепей называются "участками, определяющими комплементарность", или "CDRs". Отнесение аминокислот к каждому из доменов осуществляется в соответствии с определениями по Кабату (Kabat) последовательностей белков, представляющих иммунологический интерес (Sequences of Proteins of Immunological Interest) (National Institutes of Health, Bethesda, Md. (1987 и 1991)), или Chothia & Lesk J. Mol. Biol. 196:901-917 (1987), Chothia et al. Nature 342:878-883 (1989).
В используемом тут значении, термин "эпитоп" включает любую белковую детерминанту, способную специфически связываться с иммуноглобулином или его фрагментом, или Т-клеточным рецептором. Термин "эпитоп" включает любую белковую детерминанту, способную специфически связываться с иммуноглобулином или Т-клеточным рецептором. Эпитопные детерминанты обычно состоят из химически активных поверхностных группировок молекул, таких как аминокислоты или боковые цепи Сахаров и обычно обладают специфическими трезмерными структурными характеристиками, а также специфическими характеристиками заряда. Говорят, что антитело специфически связывает антиген, если константа диссоциации имеет значение ≤1 мкМ; например, ≤100 нМ, предпочтительно, ≤10 нМ, и более предпочтительно, ≤1 нМ.
В используемом тут значении, термины "иммунологическое связывание" и "способность к иммунологическому связыванию" относятся к нековалентным взаимодействиям типа, наблюдающегося между молекулой иммуноглобулина и антигеном, по отношению к которому иммуноглобулин является специфическим. Сила, или аффинность взаимодействий иммунологического связывания может быть выражена с помощью константы диссоциации (Kd) взаимодействия, причем меньшие значения Kd соответствуют большей аффинности. Способность к иммунологическому связыванию выбранных полипептидов может быть количественно определена с использованием способов, хорошо известных специалистам. Один из таких способов включает измерение скоростей образования и диссоциации комплекса антигенсвязывающий сайт/антиген, где указанные скорости зависят от концентраций партнеров по комплексу, аффинности взаимодействия, и геометрических параметров, в равной степени влияющих на скорость в обоих направлениях. Таким образом, как "константа ассоциации" (Kon), так и "константа диссоциации" (Koff) могут быть определены путем расчета концентраций и фактических скоростей ассоциации и диссоциации. (см. Nature 361:186-87 (1993)). Величина отношения Koff/Kon позволяет устранить все параметры, не связанные с аффинностью, и равна константе диссоциации Kd. (см., в общем, Davies et al. (1990) Annual Rev Biochem 59:439-473). Говорят, что антитело по настоящему изобретению специфически связывается с IL-17F и/или гетеродимером IL-17A/IL-17F, если равновесная константа связывания (Kd) имеет значение ≤1 мкМ, предпочтительно, ≤100 нМ, более предпочтительно, ≤10 нМ, и наиболее предпочтительно, от ≤100 пМ до примерно 1 пМ, при измерении такими методами анализа, как анализы связывания с использованием радиоактивных лигандов или подобные анализы, известные квалифицированным специалистам.
Термин "выделенный полинуклеотид", в используемом тут значении, должен обозначать полинуклеотид геномного, кДНК, или синтетического происхождения или некоторые его комбинации, который в силу своего происхождения (1) не ассоциирован со всем или частью полинуклеотида, в котором "выделенный полинуклеотид" существует в природе, (2) функционально связан с полинуклеотидом, с которым он не связан в природе, или (3) не встречается в природе в составе большей по размеру последовательности. Полинуклеотиды в соответствии с изобретением включают молекулы нуклеиновой кислоты, кодирующие тяжелую цепь молекулы иммуноглобулина, представленную SEQ ID NOS: 1, 5, 9, 13, 17, 21, 25, 29, 33, 37 и 41, и молекулы нуклеиновой кислоты, кодирующие легкую цепь молекулы иммуноглобулина, представленную SEQ ID NOS: 3,7, 11, 15, 19, 23, 27, 31, 35, 39 и 43.
Термин "выделенный белок", упоминаемый тут, обозначает белок кДНК, рекомбинантной РНК, или синтетического происхождения, или некоторые его комбинации, который в силу своего происхождения или источника получения (1) не ассоциирован с белками, существующими в природе, (2) не содержит других белков из этого же источника, например, не содержит белков из морских продуктов, (3) экспрессируется клетками, принадлежащими к разным видам, или (4) не встречается в природе.
Термин "полипептид" используется тут как родовой термин, относящийся к нативному белку, фрагментам, или аналогам полипептидной последовательности. Таким образом, фрагменты и аналоги нативного белка являются элементами рода полипептидов. Полипептиды в соответствии с изобретением содержат тяжелую цепь молекулы иммуноглобулина, представленную SEQ ID NOS: 2, 6, 10, 14, 18, 22, 26, 30, 34, 38 и 42, и легкую цепь молекулы иммуноглобулина, представленную SEQ ID NOS: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40 и 44, а также молекулы антитела, образованные комбинациями, содержащими тяжелую цепь молекулы иммуноглобулина с легкой цепью молекулы иммуноглобулина, такой как легкая каппа-цепь молекулы иммуноглобулина, и наоборот, а также их фрагменты и аналоги.
Термин "встречающийся в природе", в используемом тут значении, по отношению к объекту, относится к тому факту, что объект может быть найден в природе. Например, полипептидная или полинуклеотидная последовательность, присутствующая в организме (включая вирусы), которая может быть выделена из природного источника и которая не была целенаправленно модифицирована человеком в лаборатории или иначе, является встречающейся в природе.
Термин "функционально связанный", в используемом тут значении относится к расположению описываемых таким образом компонентов в такой взаимной связи, которая позволяет им функционировать предполагаемым для них образом. Контрольная последовательность, "функционально связанная" с кодирующей последовательностью, соединены таким образом, что экспрессия кодирующей последовательности происходит в условиях, совместимых с контрольными последовательностями.
Термин "контрольная последовательность", в используемом тут значении, относится к полинуклеотидным. последовательностям, необходимым для осуществления экспрессии и процессинга кодирующих последовательностей, с которыми они лигированы. Природа таких контрольных последовательностей различается в зависимости от организма-хозяина: у прокариотов такие контрольные последовательности обычно включают промотор, рибосомальный сайт связывания, и последовательность терминации транскрипции; у эукариотов, обычно, такие контрольные последовательности включают промоторы и последовательность терминации транскрипции. Подразумевается, что термин "контрольные последовательности" включает, как минимум, все компоненты, присутствие которых является существенным для экспрессии и процессинга, и может также включать дополнительные компоненты, присутствие которых является предпочтительным, например, лидерные последовательности и последовательности-партнеры слияния. Термин "полинуклеотид", упоминаемый тут, обозначает полимерную цепочку (boron) нуклеотидов, содержащую по меньшей мере 10 оснований в длину, будь то рибонуклеотиды или дезоксинуклеотиды или модифицированная форма любого типа нуклеотида. Термин включает одно- и двухцепочечные формы ДНК.
Термин "олигонуклеотид", упоминаемый тут, включает природные и модифицированные нуклеотиды, соединенные друг с другом природными и неприродными олигонуклеотидными связми. Олигонуклеотиды представляют собой подгруппу полинуклеотидов, обычно имеющих длину 200 оснований или меньше. Предпочтительно, олигонуклеотиды содержат от 10 до 60 оснований в длину, наиболее предпочтительно, 12, 13, 14, 15, 16, 17, 18, 19, или от 20 до 40 оснований в длину. Олигонуклеотиды обычно являются одноцепочечными, например, для зондов, хотя олигонуклеотиды могут быть двухцепочечными, например, для использования при конструировании генного мутанта. Олигонуклеотиды по изобретению являются смысловыми или антисмысловыми олигонуклеотидами.
Термин "природные нуклеотиды", упоминаемый тут, включает дезоксирибонуклеотиды и рибонуклеотиды. Термин "модифицированные нуклеотиды", упоминаемый тут, включает нуклеотиды с модифицированными или замещенными сахарными группами и т.п.Термин "олигонуклеотидные связи", упоминаемый тут, включает олигонуклеотидные связи, такие как фосфоротиоатные, фосфородитиоатные, фосфороселеноатные (phosphoroselerloate), фосфородиселеноатные (phospnorodiselenoate), фосфороанилотиоатные (phosphoroanilothioate), фосфораниладатные (phoshoraniladate), фосфороимидатные (phosphoronmidate) и т.п.См., например, LaPlanche et al. Nucl. Acids Res. 14:9081 (1986); Stec et al. J. Am. Chem. Soc. 106:6077 (1984), Stein et al. Nucl. Acids Res. 16:3209 (1988), Zon et al. Anti Cancer Drug Design 6:539 (1991); Zon et al. Oligonucleotides and Analogues: A Practical Approach, pp.87-108 (F. Eckstein, Ed., Oxford University Press, Oxford England (1991)); Stec et al. патент США №5151510; Uhlmann and Peyman, Chemical Reviews 90:543 (1990). Олигонуклеотид может включать метку для детектирования, если это желательно.
Термин "селективно гибридизуется", упоминаемый тут, обозначает детектируемое и специфическое связывание. Полинуклеотиды, олигонуклеотиды и их фрагменты в соответствии с изобретением селективно гибридизуются с цепями нуклеиновой кислоты в условиях гибридизации и промывки, которые минимизируют значительную величину детектируемого связывания с неспецифическими нуклеиновыми кислотами. Условия высокой суровости могут быть использованы для достижения условий селективной гибридизации, как известно специалистам и описано тут. Обычно, гомология последовательностей нуклеиновой кислоты между полинуклеотидами, олигонуклеотидами и фрагментами по изобретению и последовательностью нуклеиновой кислоты, представляющей интерес, будет составлять по меньшей мере 80%, более типично, с предпочтительно возрастающими степенями гомологии, составляющими по меньшей мере 85%, 90%, 95%, 99% и 100%. Две аминокислотные последовательности являются гомологичными, если между их последовательностями существует частичная или полная идентичность. Например, 85% гомологии означает, что 85% аминокислот являются идентичными, когда две последовательности выравнивают с максимальной степенью совпадения. Пробелы (в любой из двух сравниваемых последовательностей) являются допустимыми при максимизации совпадения, с предпочтительной длиной пробелов 5 или меньше, более предпочтительной, 2 или меньше. Альтернативно и предпочтительно, две белковые последовательности (или производные от них полипептидные последовательности, имеющие по меньшей мере 30 аминокислот в длину), являются гомологичными, в используемом тут значении этого термина, если они имеют оценку выравнивания не более (of at more) 5 (в стандартных единицах расхождения) при использовании программы ALIGN с матрицей мутационных данных и штрафом за делецию, равным 6 или больше. См. Dayhoff, M.O., в: Atlas of Protein Sequence and Structure, pp.101-110 (Volume 5, National Biomedical Research Foundation (1972)) и Приложение (Supplement) 2 к этому тому, стр.1-10. Две последовательности или их части являются более предпочтительно гомологичными, если их аминокислоты являются на 50% или более идентичными при оптимальном выравнивании с помощью программы ALIGN. Термин "соответствует" используется тут для обозначения того, что полинуклеотидная последовательность является гомологичной (т.е., является идентичной, не будучи строго эволюционно родственной) ко всей или части референсной полинуклеотидной последовательности, или что полипептидная последовательность является идентичной референсной полипептидной последовательности. В противоположность этому, термин "комплементарный к" используется тут для обозначения того, что комплементарная последовательность является гомологичной ко всей или части референсной полинуклеотидной последовательности. Для иллюстрации, нуклеотидная последовательность "ТАТАС" соответствует референсной последовательности "ТАТАС" и является комплементарной к референсной последовательности "GTATA".
Следующие термины используются для описания соотношения между двумя или больше полинуклеотидными или аминокислотными последовательностями: "эталонная последовательность", "окно сравнения", "идентичность последовательности", "процент идентичности последовательности" и "существенная идентичность". "Референсная последовательность" представляет собой определенную последовательность, используемую в качестве основы для сравнения последовательностей. Референсная последовательность может быть подмножеством большей по величине последовательности, например, сегментом полномерной кДНК или генной последовательности, приведенной в перечене последовательностей, или может включать полную кДНК или генную последовательность. Обычно, референсная последовательность имеет по меньшей мере 18 нуклеотидов или 6 аминокислот в длину, часто, по меньшей мере 24 нуклеотида или 8 аминокислот в длину, и часто, по меньшей мере 48 нуклеотидов или 16 аминокислот в длину. Поскольку две полинуклеотидные или аминокислотные последовательности могут каждая (1) включать последовательность (т.е., часть полной полинуклеотидной или аминокислотной последовательности), которая является сходной у двух молекул, и (2) могут дополнительно включать последовательность, являющуюся дивергентной между двумя полинуклеотидными или аминокислотными последовательностями, то сравнение последовательностей между двумя (или больше) молекулами типично осуществляют путем сравнения последовательностей двух молекул в "окне сравнения" для идентификации и сравнения местных областей сходства последовательностей. "Окно сравнения", в используемом тут значении, относится к воображаемому сегменту из по меньшей мере 18 непрерывных нуклеотидных позиций или 6 аминокислот, причем полинуклеотидная последовательность или аминокислотная последовательность может сравниваться с референсной последовательностью, состоящей из по меньшей мере 18 непрерывных нуклеотидов или 6 аминокислот, и где часть полинуклеотидной последовательности в окне сравнения может включать аддиции, делеции, замещения и т.п. (т.е., бреши), составляющие 20 процентов или меньше по сравнению с референсной последовательностью (которая не содержит аддиции или делеции) для оптимального выравнивания двух последовательностей. Оптимальное выравнивание последовательностей для установки положения окна сравнения может проводиться по алгоритму местной гомологии Смита-Уотермана (Smith and Waterman, Adv. Appl. Math. 2:482 (1981)), по алгоритму выравнивания гомологии Нидельмана-Вунша (Needleman and Wunsch, J. Mol. Biol. 48:443 (1970)), путем поиска подобия по методу Пирсона-Липмана (Pearson and Lipman, Proc. Natl. Acad. Sci. (U.S.A.) 85:2444 (1988)), с помощью компьютеризованных вариантов реализации этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в программном пакете Wisconsin Genetics Software Package Release 7.0, (Genetics Computer Group, 575 Science Dr., Madison, Wis.), в программных пакетах Geneworks или MacVector), или визуально, причем выбирают наилучшее выравнивание (т.е., приводящее к наибольшему проценту гомологии в окне сравнения), полученное разными способами.
Термин "идентичность последовательности" означает, что две полинуклеотидные или аминокислотные последовательности являются идентичными (т.е., на основании попарного сравнения нуклеотид-с-нуклеотидом или остаток-с-остатком) в окне сравнения. Термин "процент идентичности последовательности" рассчитывают путем сравнения двух оптимально выровненных последовательностей в окне сравнения, определения числа позиций, в которых находятся идентичные основания нуклеиновой кислоты (например, А, Т, С, G, U или I) или остатки в обоих последовательностях, с получением числа совпадающих позиций, деления числа совпадающих позиций на общее число позиций в окне сравнения (т.е., размер окна), и умножения результата на 100 для получения процента идентичности последовательности. Термины "существенная идентичность", в используемом тут значении, обозначает характеристику полинуклеотидной или аминокислотной последовательности, где полинуклеотид или аминокислота содержит последовательность, которая имеет по меньшей мере 85 процентов идентичности последовательности, предпочтительно, по меньшей мере 90-95 процентов идентичности последовательности, более обычно, по меньшей мере 99 процент идентичности последовательности, по сравнению с референсной последовательностью в окне сравнения, состоящем из по меньшей мере 18 нуклеотидных (6 аминокислотных) позиций, часто, в окне, состоящем из по меньшей мере 24-48 нуклеотидных (8-16 аминокислотных) позиций, где процент идентичности последовательности рассчитывают путем сравнения эталонной последовательности с последовательностью, которая может включать делеции или аддиции, составляющие в общей сложности 20 процентов или меньше от референсной последовательности в окне сравнения. Референсная последовательность может быть подмножеством более крупной последовательности.
В используемом тут значении, двадцать обычных аминокислот и их сокращенные обозначения соответствуют общепринятому употреблению. См. Immunology - A Synthesis (2nd Edition, E.S. Golub and D.R. Gren, Eds, Sinauer Associates, Sunderland7 Mass. (1991)). Стереоизомеры (например, D-аминокислоты) двадцати обычных аминокислот, неприродные аминокислоты, такие как α-, α-дизамещенные аминокислоты, N-алкиламинокислоты, молочная кислота и другие необычные аминокислоты также могут быть пригодными компонентами полипептидов по настоящему изобретению. Примеры необычных аминокислот включают: 4-гидроксипролин, γ-карбоксиглутамат, ε-N,N,N-триметиллизин, ε-N-ацетиллизин, O-фосфосерин, N-ацетилсерин, N-формилметионин, 3-метилгистидин, 5-гидроксилизин, σ-N-метиларгинин и другие подобные аминокислоты и иминокислоты (например, 4-гидроксипролин). В используемой тут полипептидной нотации, направление влево является направлением к амино-концу и направление вправо является направлением к карбокси-концу, в соответствии со стандартным использованием терминологии и условных обозначений.
Аналогично, если не указано иное, левый конец одноцепочечной полинуклеотидной последовательности является 5'-концом, направление влево двухцепочечной полинуклеотидной последовательности называется направлением к 5'-концу. Направление присоединения 5'-к-3' растущих РНК-транскриптов называется направлением транскрипции. Области последовательности ДНК-цепи, имеющие такую же последовательность, как и РНК, и ориентированные 5'-к-5'-концу РНК-транскрипты называются "последовательностями, расположенными выше/перед (upstream)", области последовательности ДНК-цепи, имеющие такую же последовательность, как и РНК, и ориентированные 3'-к-3'-концу РНК-транскрипта, называются "последовательностями, расположенными ниже/после (downstream)".
В применении к полипептидам, термин "существенная идентичность" означает, что две пептидные последовательности, при оптимальном выравнивании, таком как с помощью программ GAP или BESTFIT при использовании стандартных штрафов за открытие пробела (default gap weights), имеют по меньшей мере 80 процентов идентичности последовательностей, предпочтительно, по меньшей мере 90 процентов идентичности последовательностей, более предпочтительно, по меньшей мере 95 процентов идентичности последовательностей, и наиболее предпочтительно, по меньшей мере 99 процентов идентичности последовательностей.
Предпочтительно, позиции остатков, не являющихся идентичными, различаются консервативными аминокислотными замещениями.
Консервативные аминокислотые замещения относятся к взаимозаменяемости остатков, имеющих схожие боковые цепи. Например, в группу аминокислот, имеющих алифатические боковые цепи, входят глицин, аланин, валин, лейцин и изолейцин; в группу аминокислот, имеющих алифатические боковые цепи с гидроксилом, входят серин и треонин; в группу аминокислот, имеющих амидсодержащие боковые цепи, входят аспарагин и глутамин; в группу аминокислот, имеющих ароматические боковые цепи, входят фенилаланин, тирозин и триптофан; в группу аминокислот, имеющих основные боковые цепи, входят лизин, аргинин и гистидин; и в группу аминокислот, имеющих серасодержащие боковые цепи, входят цистеин и метионин. Предпочтительными консервативными группами аминокислотных замещений являются: валин-лейцин-изолейцин, фенилаланин-тирозин, лизин-аргинин, аланин-валин, глутаминовая кислота-аспарагиновая кислота, и аспарагин-глутамин.
Как описано тут, незначительные варианты аминокислотных последовательностей антител или молекул иммуноглобулина предусматриваются как охватываемые настоящим изобретением, при условии, что варианты аминокислотной последовательности сохраняют по меньшей мере 75%, более предпочтительно, по меньшей мере 80%, 90%, 95%, и наиболее предпочтительно, 99%. В частности, предусматриваются консервативные аминокислотные замещения. Консервативными замещениями являются те, которые происходят в пределах семейства аминокислот, родственных по их боковым цепям. Генетически кодированные аминокислоты в общем делятся на семейства: (1) кислотными аминокислотами являются аспартат, глутамат; (2) основными аминокислотами являются лизин, аргинин, гистидин; (3) неполярными аминокислотами являются аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан, и (4) незаряженными полярными аминокислотами являются глицин, аспарагин, глутамин, цистеин, серин, треонин, тирозин. Гидрофильные аминокислоты включают аргинин, аспарагин, аспартат, глутамин, глутамат, гистидин, лизин, серии и треонин. Гидрофобные аминокислоты включают аланин, цистеин, изолейцин, лейцин, метионин, фенилаланин, пролин, триптофан, тирозин и валин. Другие семейства аминокислот включают (i) серин и треонин, которые образуют алифатически-гидроксильное семейство; (ii) аспарагин и глутамин, которые образуют амидсодержащее семейство; (iii) аланин, валин, лейцин и изолейцин, которые образуют алифатическое семейство; и (iv) фенилаланин, триптофан и тирозин, которые образуют ароматическое семейство. Например, разумно ожидать, что изолированное замещение лейцина на изолейцин или валин, аспартата на глутамат, треонина на серин, или подобное замещение аминокислоты на структурно родственную аминокислоту не будет оказывать значительного эффекта на связывание или свойства образующейся молекулы, особенно, если замещение не затрагивает аминокислоту каркасного участка (framework site). Будет ли замена аминокислоты приводить к получению функционального пептида, может быть легко определено путем оценки специфической активности полипептидного производного. Анализы детально описаны в данном документе. Фрагменты или аналоги антител или молекул иммуноглобулина могут быть легко получены рядовыми специалистами в данной области. Предпочтительные амино-и карбокси-концы фрагментов или аналогов расположены рядом с границами функциональных доменов. Структурные и функциональные домены могут быть идентифицированы путем сравнения данных нуклеотидной и/или аминокислотной последовательности с общедоступными или находящимися в частной собственности базами данных последовательностей. Предпочтительно, компьютеризованные способы сравнения используются для идентификации мотивов последовательностей или предсказанных доменов пространственной структуры белка, присутствующих в других белках с известной структурой и/или функцией. Способы идентификации белковых последовательностей, которые укладываются в известную трехмерную структуру, являются известными. Bowie et al. Science 253:164 (1991). Таким образом, вышеприведенные примеры демонстрируют, что квалифицированные специалисты могут распознать мотивы последовательностей и структурные конформации, которые могут быть использованы для определения структурных и функциональных доменов в соответствии с изобретением.
Предпочтительными аминокислотными замещениями являются те, которые: (1) снижают чувствительность к протеолизу, (2) снижают чувствительность к окислению, (3) изменяют аффинность связывания при образовании белковых комплексов, (4) изменяют аффинности связывания, и (4) придают или модифицируют другие физико-химические или функциональные свойства таких аналогов. Аналоги могут включать различные мутеины последовательности, отличные от встречающейся в природе пептидной последовательности. Например, единичные или множественные аминокислотные замещения (предпочтительно, консервативные аминокислотные замещения) могут быть выполнены во встречающейся в природе последовательности (предпочтительно, в части полипептида за пределами домена (доменов), образующих межмолекулярные контакты). Консервативное аминокислотное замещение не должно существенно изменять структурные характеристики исходной последовательности (например, замещающая аминокислота не должна проводить к разрушению спирали, существующей в исходной последовательности, или разрушать другие типы вторичной структуры, которыми характеризуется исходная последовательность). Примеры известных специалистам вторичных и третичных структур полипептидов описаны в Proteins, Structures and Molecular Principles (Creighton, Ed., W. H. Freeman and Company, New York (1984)); Introduction to Protein Structure (C. Branden and J. Tooze, eds., Garland Publishing, New York, N.Y. (1991)); и Thornton et at. Nature 354:105 (1991).
Термин "полипептидный фрагмент", в используемом тут значении, относится к полипептиду, имеющему аминоконцевую и/или карбоксиконцевую делецию, но в котором остальная аминокислотная последовательность является идентичной соответствующим позициям встречающейся в природе последовательности, полученной, например, из полномерной последовательности кДНК. Фрагменты типично имеют в длину по меньшей мере 5, 6, 8 или 10 аминокислот, предпочтительно, по меньшей мере 14 аминокислот, более предпочтительно, по меньшей мере 20 аминокислот, обычно, по меньшей мере 50 аминокислот, и еще более предпочтительно, по меньшей мере 70 аминокислот в длину. Термин "аналог", в используемом тут значении, относится к полипептидам, состоящим из сегмента из по меньшей мере 25 аминокислот, имеющего существенную идентичность с частью выделенной аминокислотной последовательности, и обладающим специфическим связыванием с IL-17F самим по себе или с гетеродимером IL-17A/IL-17F (т.е., комплексом), в пригодных для связывания условиях. Типично, полипептидные аналоги содержат консервативное аминокислотное замещение (или аддицию или делецию) по отношению к встречающейся в природе последовательности. Аналоги типично имеют в длину по меньшей мере 20 аминокислот, предпочтительно, по меньшей мере 50 аминокислот или больше, и часто могут достигать в длину размера полномерного встречающегося в природе полипептида.
Пептидные аналоги широко используются в фармацевтической промышленности в качестве непептидных лекарственных средств, обладающих свойствами, аналогичными матричному пептиду. Такие типы непептидных соединений называются "пептидными миметиками" или "пептидомиметиками". Fauchere, J, Adv. Drug Res. 15:29 (1986), Veber and Freidinger TINS p.392 (1985); и Evans etal. J. Med. Chem. 30:1229 (1987). Такие соединения часто разрабатывают путем компьютеризованного молекулярного моделирования. Пептидные миметики, являющиеся структурно подобными терапевтически пригодным пептидам, могут быть использованы для создания эквивалентного терапевтического или профилактического эффекта. Обычно, пептидомиметики являются структурно подобными эталонному полипептиду (т.е., полипептиду, обладающему биохимическим свойством или фармакологической активностью), такому как человеческое антитело, но имеют одну или несколько пептидных связей, необязательно замещенных на связь, выбранную из группы, состоящей из: -CH2NH-, -CH2S-, -CH2-CH2-, -CH=CH- (цис- и транс-), -COCH2-, CH(OH)CH2- и -CH2SO-, с помощью способов, хорошо известных специалистам. Систематическое замещение одной или нескольких аминокислот консенсусной последовательности на D-аминокислоту такого же типа (например, D-лизин вместо L-лизина) может быть использовано для получения более стабильных пептидов. Кроме того, напряженные (constrained) пептиды, содержащие консенсусную последовательность или по существу идентичный вариант консенсусной последовательности, могут быть получены способами, известными специалистам (Rizo and Gierasch Ann. Rev. Biochem. 61:387 (1992)); например, путем прибавления внутренних цистеиновых остатков, способных образовывать внутримолекулярные дисульфидные мостики, которые циклизируют пептид.
Термин "агент" используется тут для обозначения химического соединения, смеси химических соединений, биологической макромолекулы, или экстракта, изготовленного из биологических материалов.
В используемом тут значении, термины "метка" или "меченый" относится к включению детектируемого маркера, например, путем включения радиоактивно меченой аминокислоты или присоединения к полипептиду биотиновых (biotinyl) фрагментов, которые могут быть детектированы меченым (marked) авидином (например, стрептавидином, содержащим флуоресцентный маркер или имеющим ферментативную активность, которая может быть детектирована оптическими или колориметрическими (calorimetric) способами). В определенных ситуациях, метка или маркер также могут быть терапевтическими. Разные способы мечения полипептидов и гликопротеинов известны специалистам и могут быть использованы. Примеры меток для полипептидов включают, без ограничений, следующие: радиоизотопы или радионуклиды (например, 3H, 14С, 15N, 35S, 90Y, 99Tc, 111In, 125I, 131I), флуоресцентные метки (например, FITC, родамин, лантанидные фосфоры), ферментативные метки (например, пероксидаза хрена, р-галактозидаза, люцифераза, щелочная фосфатаза), хемилюминесцентные, биотинилирующие группы, предварительно определенные полипептидные эпитопы, распознаваемые вторичным репортером (например, последовательности лейциновой "молнии", сайты связывания вторичных антител, металл-связывающие домены, эпитопные метки). В некоторых вариантах исполнения, метки присоединены с помощью спейсерных цепей различной длины для уменьшения потенциальных стерических затруднений. Термин "фармацевтический агент или лекарственное средство", в используемом тут значении, относится к химическому соединению или композиции, способным индуцировать желательный терапевтический эффект при надлежащем введении пациенту.
Другие химические термины в данном описании используются в соответствии с принятыми специалистами правилами, проиллюстрированными в The McGraw-Hill Dictionary of Chemical Terms (Parker, S., Ed., McGraw-Hill, San Francisco (1985)).
Термин "антинеопластический агент" используется тут по отношению к агентам, обладающим функциональным свойством ингибирования развития или прогрессирования неоплазмы у человека, в частности, злокачественного (ракового) поражения, такого как карцинома, саркома, лимфома или лейкемия. Ингибирование метастаз часто является свойством антинеопластических агентов.
В используемом тут значении, "по существу чистый" означает, что частицы объекта являются преобладающими присутствующими частицами (т.е., в молярном отношении, они являются более многочисленными, чем любые другие индивидуальные частицы в композиции), и предпочтительно, в существенной степени очищенной фракцией является композиция, в которой частицы объекта составляют по меньшей мере примерно 50 процентов (на молярной основе) от всех присутствующих макромолекулярных частиц.
Обычно, по существу чистая композиция будет содержать более чем примерно 80 процентов от всех макромолекулярных частиц, присутствующих в композиции, более предпочтительно, более чем примерно 85%, 90%, 95%, и 99%. Наиболее предпочтительно, частицы объекта очищены до по существу гомогенного состояния (частицы загрязнений не могут быть детектированы в композиции обычными способами детектирования), в котором композиция состоит по существу из одного вида макромолекулярных частиц.
Аутоиммунные болезни включают, например, синдром приобретенного иммунодефицита (СПИД, который представляет собой вирусную болезнь с аутоиммунным компонентом), гнездную алопецию, анкилозирующий спондилит, антифосфолипидный синдром, аутоиммунную аддисонову болезнь, аутоиммунную гемолитическую анемию, аутоиммунный гепатит, аутоиммунную болезнь внутреннего уха (AIED), аутоиммунный лимфопролиферативный синдром (ALPS), аутоиммунную тромбоцитопеническую пурпуру (АТР), болезнь Бехчета, кардиомиопатию, болезнь глютеновой недостаточности-герпетиформный дерматит; синдром хронической усталости-иммунной дисфункции (CFIDS), хроническую воспалительную демиелинизирующую полиневропатию (CIPD), рубцовый пемфигоид, болезнь холодового агглютинина, синдром crest (совокупность кальциноза, синдрома Рейно, дискинезии пищевода, склеродактилии и телеангиэктазии), болезнь Крона, синдром Дегоса, ювенильный дерматомиозит, дискоидную волчанку, эссенциальную смешанную криоглобулинемию, фибромиалгию-фибромиозит, базедову болезнь, синдром Гийена-Барре, тиреоидит Хашимото, идеопатический пневмофиброз, идеопатическую тромбоцитопеническую пурпуру (ITP), lgA-нефропатию, инсулинозависимый сахарный диабет, ювенильный хронический артрит (болезнь Стилла), ювенильный ревматоидный артрит, болезнь Меньера, смешанную соединительнотканную болезнь, рассеянный склероз, тяжелую псевдопаралитическую миастению, пернициозную анемию, нодозный полиартериит, полихондрит, плюригландулярные синдромы, ревматическую полимиалгию, полимиозит и дерматомиозит, первичную агаммаглобулинемию, первичный билиарный цирроз, псориаз, псориатический артрит, феномен Рейно, синдром Рейтера, ревматическую лихорадку, ревматоидный артрит, саркоидоз, склеродермию (прогрессирующий системный склероз (PSS), также известный как системный склероз (SS)), синдром Шегрена, синдром негнущегося человека, системную красную волчанку, синдром Такаясу, височный артериит/гигантоклеточный артериит, неспецифический язвенный колит, увеит, витилиго и гранулематоз Вегенера.
Воспалительные расстройства включают, например, хронические и острые воспалительные расстройства. Примеры воспалительных расстройств включают болезнь Альцгеймера, астму, атопическую аллергию, аллергию, атеросклероз, бронхиальную астму, экзему, гломерулонефрит, болезнь "трансплантат против хозяина", гемолитические анемии, остеоартрит, сепсис, инсульт, трансплантацию ткани и органов, васкулит, диабетическую ретинопатию и вентилятор-индуцированное повреждение легких.
Антитела huIL-17F
Моноклональные антитела по изобретению (например, полностью человеческие моноклональные антитела) связывают IL-17F, и в некоторых вариантах исполнения, гетеродимерный комплекс IL-17A/IL-17F, но не связывают IL-17A или гомодимер IL-17A. Такие моноклональные антитела обладают способностью ингибировать IL-17F-индуцированное продуцирование провоспалительного цитокина (например, IL-6). Ингибирование определяют, например, с помощью описанных тут клеточных анализов IL-17F-стимулированных мышиных эмбриональных фибробластов (MEF).
Типичные примеры антител по изобретению включают, например, антитело 5Е12, антитело 41 В10, антитело 11С5, антитело 21В10, антитело 1F1, антитело 2Е12, антитело 5D3, антитело 22F8, антитело 28В11, антитело 41А4 и антитело 43G6, описанные тут. Эти антитела проявляют специфичность к человеческому IL-17F и/или гетеродимерному комплексу IL-17A/IL-17F, и было показано, что они ингибируют индукцию человеческим IL-17F провоспалительного цитокина IL-6 in vitro.
Каждое из huIL-17F моноклональных антител, описанных тут, включает вариабельный участок тяжелой цепи (VH) и вариабельный участок легкой цепи (VL), как указано в аминокислотных и соответствующих нуклеотидных последовательностях, приведенных ниже.
Антитело 5Е12 включает вариабельный участок тяжелой цепи (SEQ ID NO: 2), кодируемый последовательностью нуклеиновой кислоты, указанной в SEQ ID NO:1, и вариабельный участок легкой цепи (SEQ ID NO:4), кодируемый последовательностью нуклеиновой кислоты, указанной в SEQ ID NO:3.
>5Е12 VH, последовательность нуклеиновой кислоты (SEQ ID NO:1)
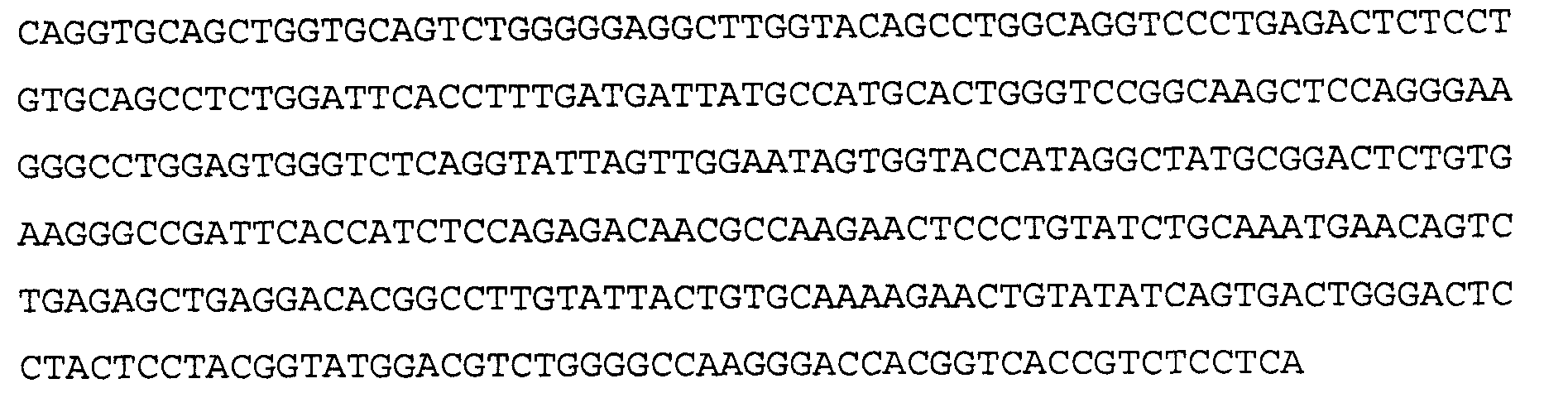
>5Е12 VH, аминокислотная последовательность (SEQ ID NO:2)
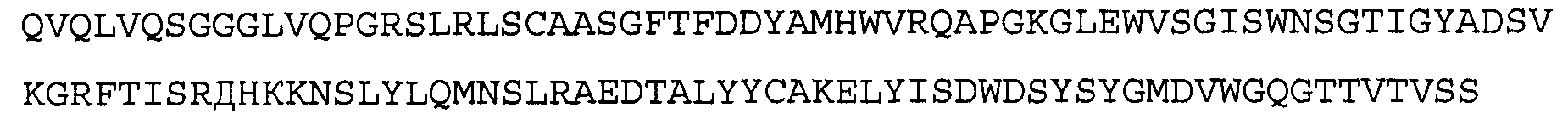
>5Е12 VL, последовательность нуклеиновой кислоты (SEQ ID NO:3)
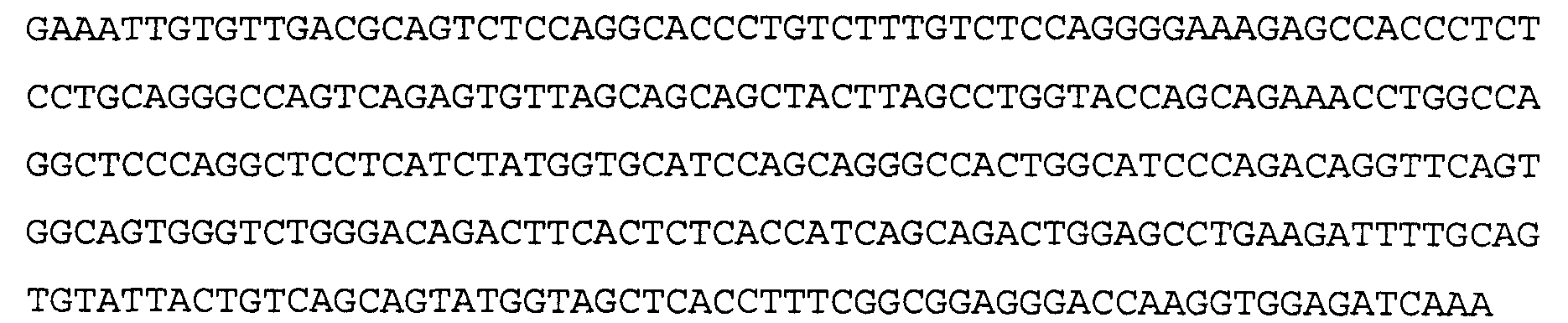
>5Е12 VL, аминокислотная последовательность (SEQ ID NO:4)
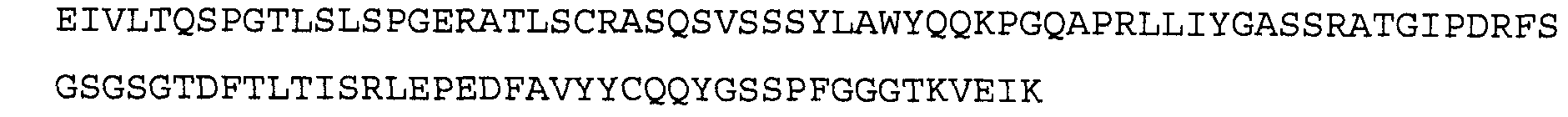
Антитело 41В10 включает вариабельный участок тяжелой цепи (SEQ ID NO:6), кодируемый последовательностью нуклеиновой кислоты, указанной в SEQ ID NO:5, и вариабельный участок легкой цепи (SEQ ID NO:8), кодируемый последовательностью нуклеиновой кислоты, указанной в SEQ ID NO:7.
>41В10 VH, последовательность нуклеиновой кислоты (SEQ ID NO:5)
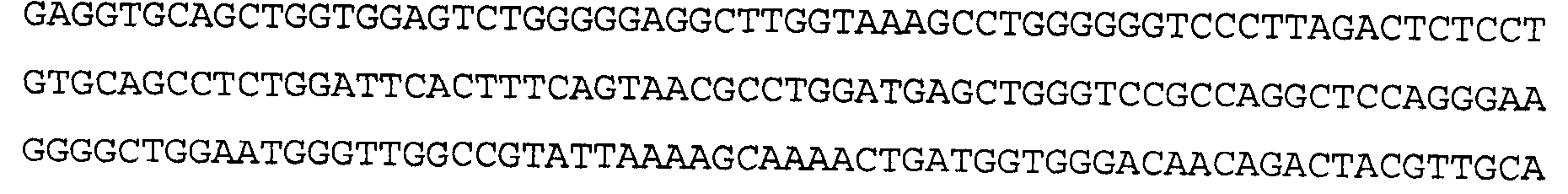
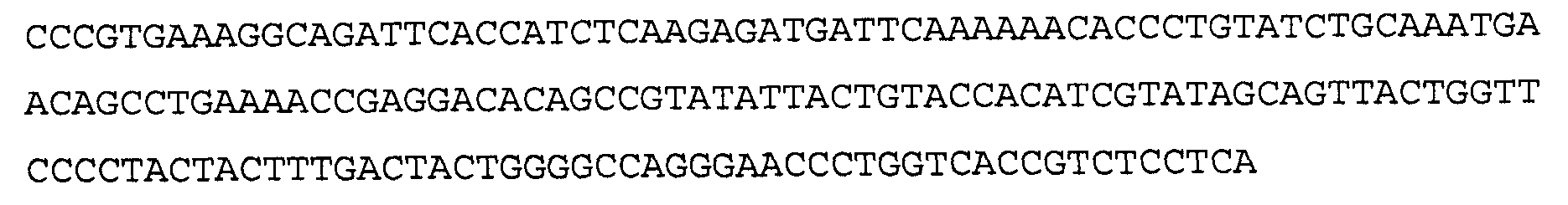
>41B10 VH, аминокислотная последовательность (SEQ ID NO:6)
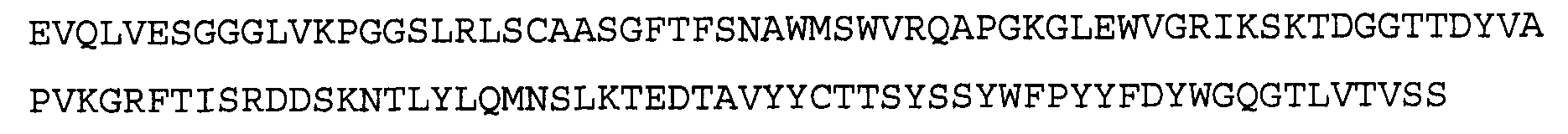
>41В10 VL, последовательность нуклеиновой кислоты (SEQ ID NO:7)
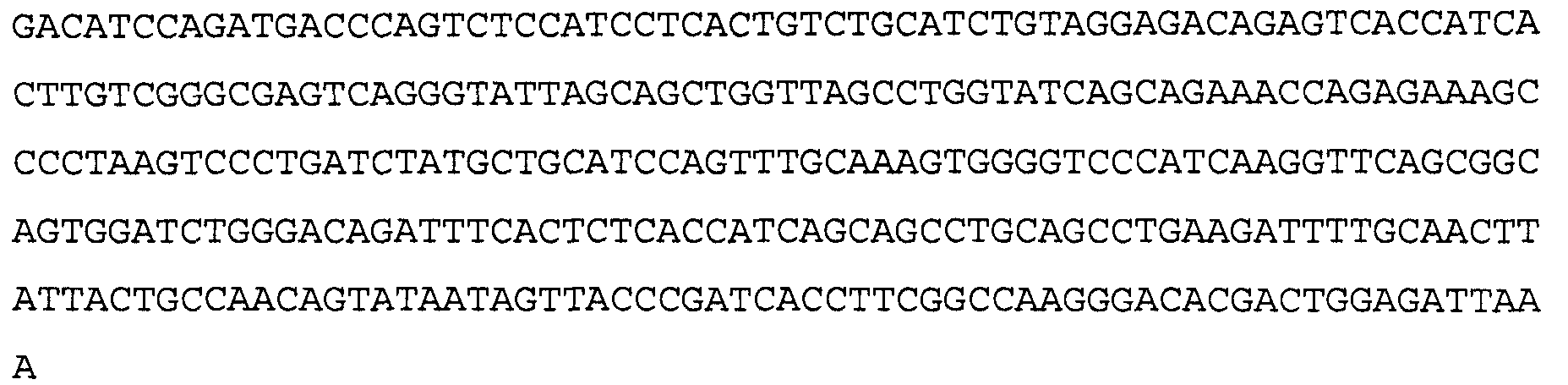
>41 В10 VL аминокислотная последовательность (SEQ ID NO:8)

Антитело 11С5 включает вариабельный участок тяжелой цепи (SEQ ID NO:10), кодируемый последовательностью нуклеиновой кислоты, указанной в SEQ ID NO:9, и вариабельный участок легкой цепи (SEQ ID NO:12), кодируемый последовательностью нуклеиновой кислоты, указанной в SEQ ID NO:11. Аминокислотная последовательность вариабельного участка легкой цепи антитела 11С5 включает мутации на 5'-конце для превращения остатков в остатки, присутствующие в соответствующей последовательности человеческой зародышевой линии. Немутированный вариант вариабельного участка легкой цепи аминокислотной последовательности для антитела 11С5 указан в SEQ ID NO:102, и немутированный вариант вариабельного участка легкой цепи последовательности нуклеиновой кислоты для антитела 11С5 указан в SEQ ID NO:103.
>11С5 VH, последовательность нуклеиновой кислоты (SEQ ID NO: 9)
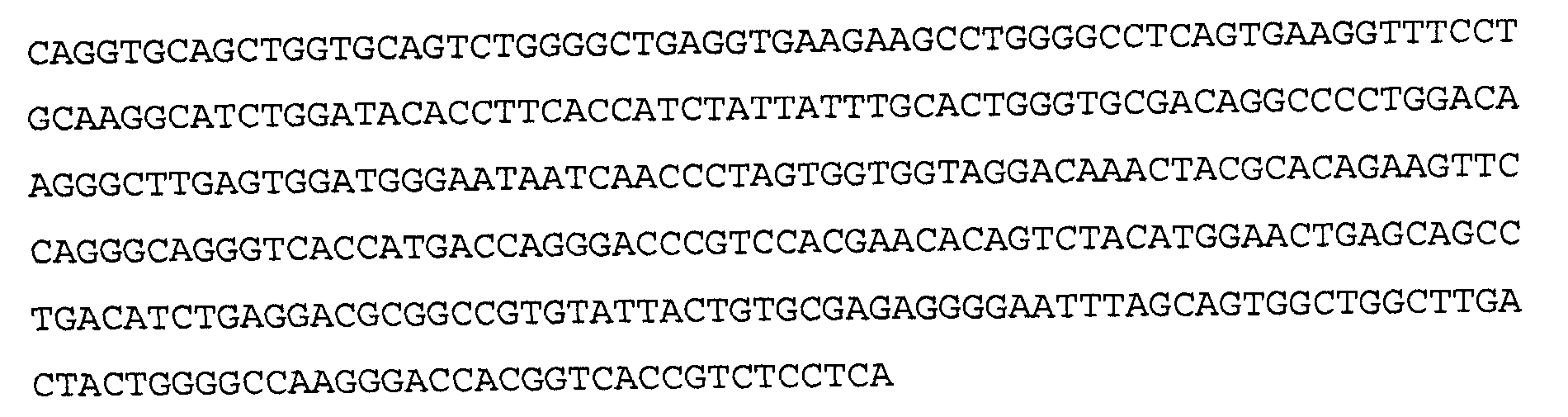
>11C5 VH, аминокислотная последовательность (SEQ ID NO:10)

>11С5 VL, последовательность нуклеиновой кислоты (SEQ ID NO:11)
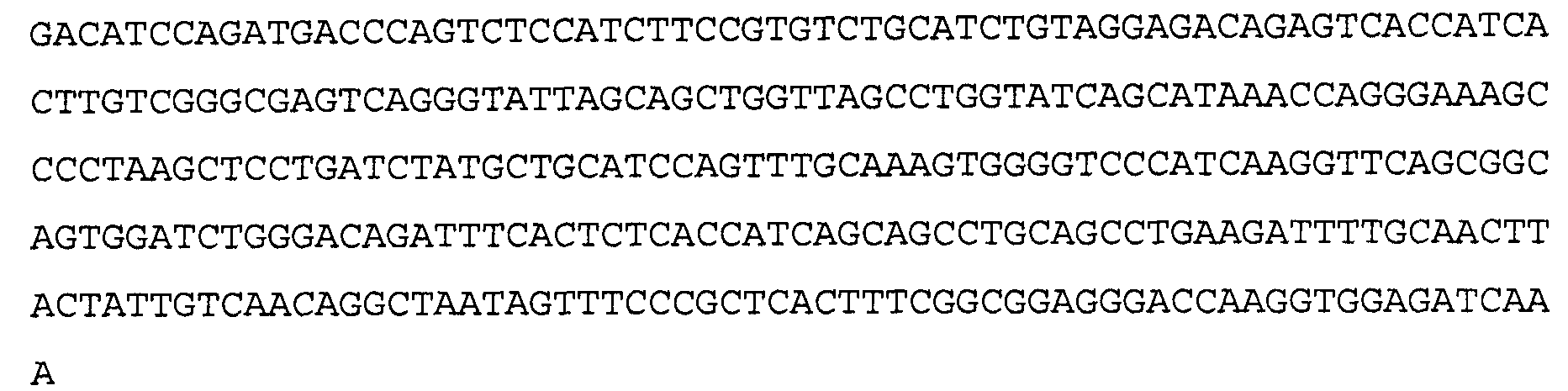
>11C5VL, аминокислотная последовательность (SEQ ID NO:12)
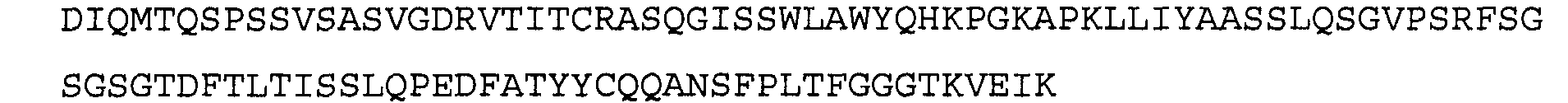
>11С5 VL, немутированная последовательность нуклеиновой кислоты (SEQ ID NO:102)
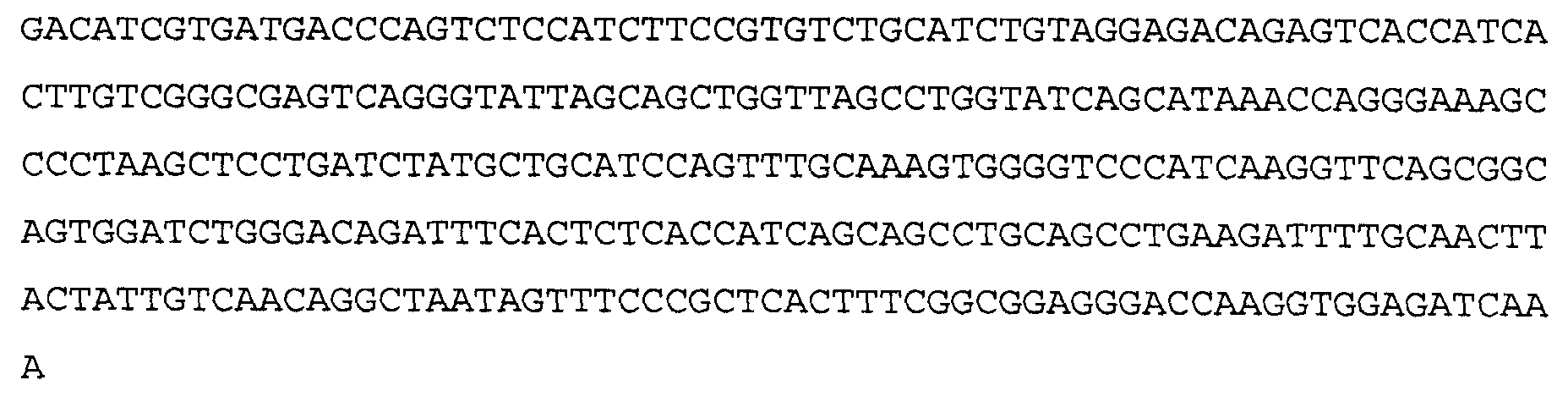
>11С5 VL, немутированная аминокислотная последовательность (SEQ ID NO:103)
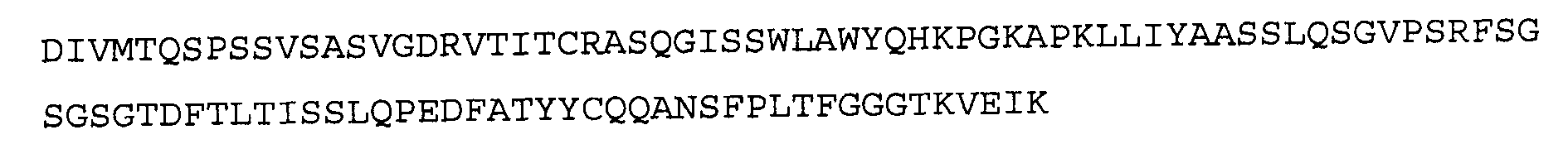
Антитело 21В10 включает вариабельный участок тяжелой цепи (SEQ ID NO:14), кодируемый последовательностью нуклеиновой кислоты, указанной в SEQ ID NO:13, и вариабельный участок легкой цепи (SEQ ID NO:16), кодируемый последовательностью нуклеиновой кислоты, указанной в SEQ ID NO:15.
>21В10 VH. последовательность нуклеиновой кислоты (SEQ ID NO: 13)
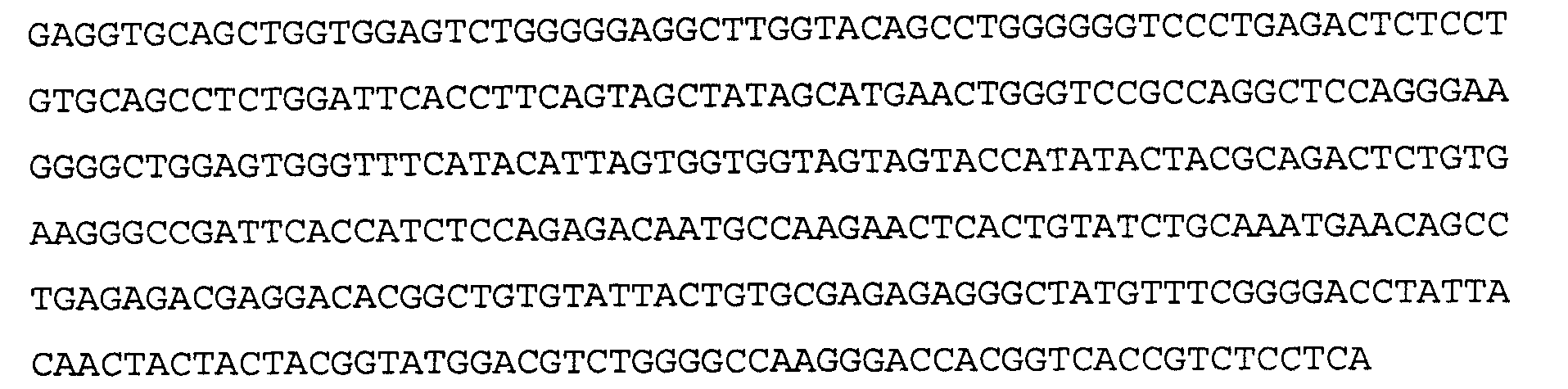
>21В10 VH, аминокислотная последовательность (SEQ ID NO:14)
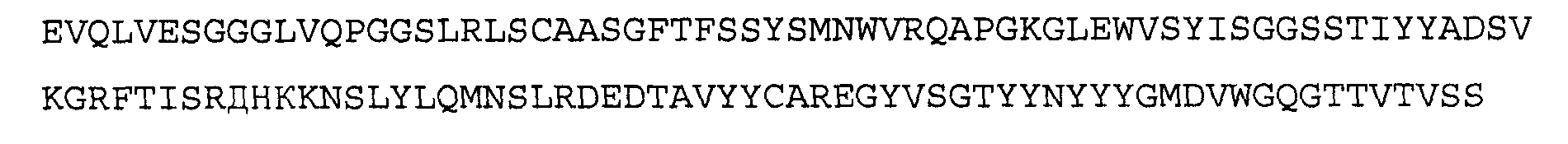
>21B10 VL, последовательность нуклеиновой кислоты (SEQ ID NO:15)
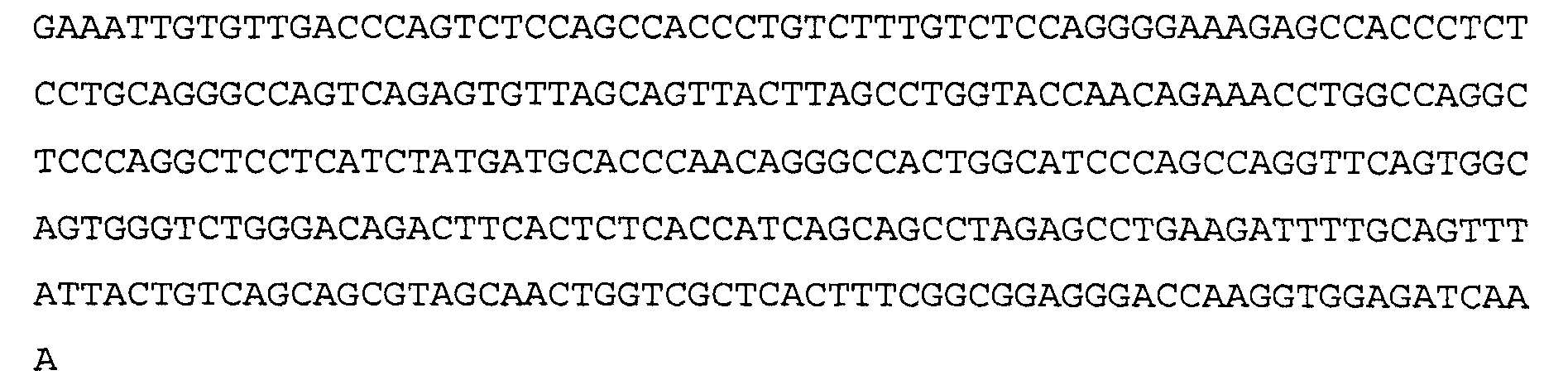
>21В10 VL, аминокислотная последовательность (SEQ ID NO:16)
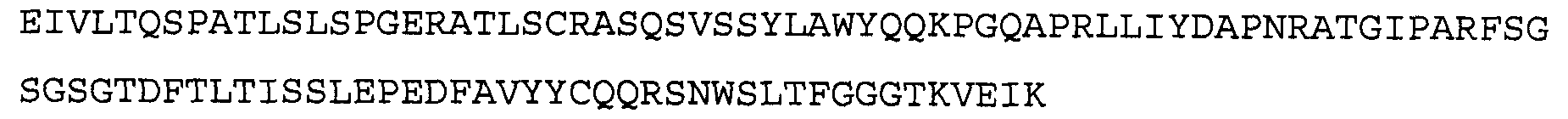
Антитело 1F1 включает вариабельный участок тяжелой цепи (SEQ ID N0:18), кодируемый последовательностью нуклеиновой кислоты, указанной в SEQ ID NO:17, и вариабельный участок легкой цепи (SEQ ID NO 20), кодируемый последовательностью нуклеиновой кислоты, указанной в SEQ ID NO:19. Аминокислотная последовательность вариабельного участка легкой цепи антитела 1F1 включают мутации на 5'-конце для превращения остатков в остатки, присутствующие в соответствующей последовательности зародышевой линии человека. Немутированный вариант вариабельного участка легкой цепи аминокислотной последовательности антитела 1F1 указан в SEQ ID NO: 104, и немутированный вариант вариабельного участка легкой цепи последовательности нуклеиновой кислоты антитела 1F1 указан в SEQ ID NO: 105.
>1F1 VH, последовательность нуклеиновой кислоты (SEQ ID NO:17)
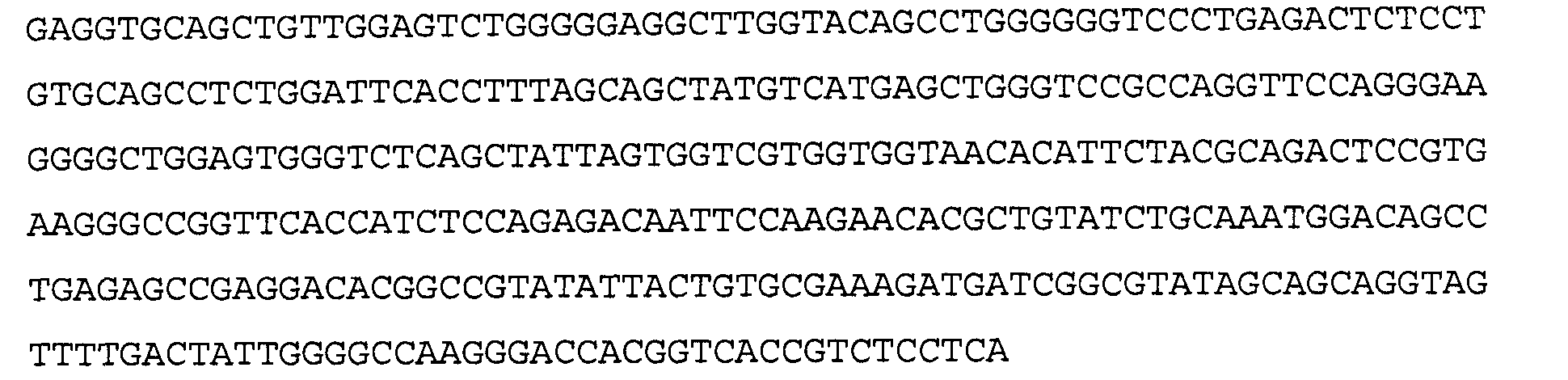
>1F1 VH, аминокислотная последовательность (SEQ ID NO:18)
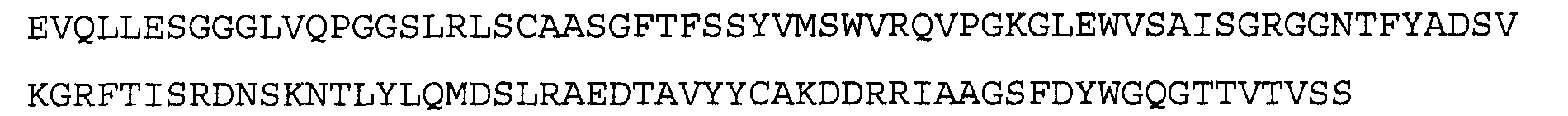
>1F1 VL, последовательность нуклеиновой кислоты (SEQ ID NO:19)
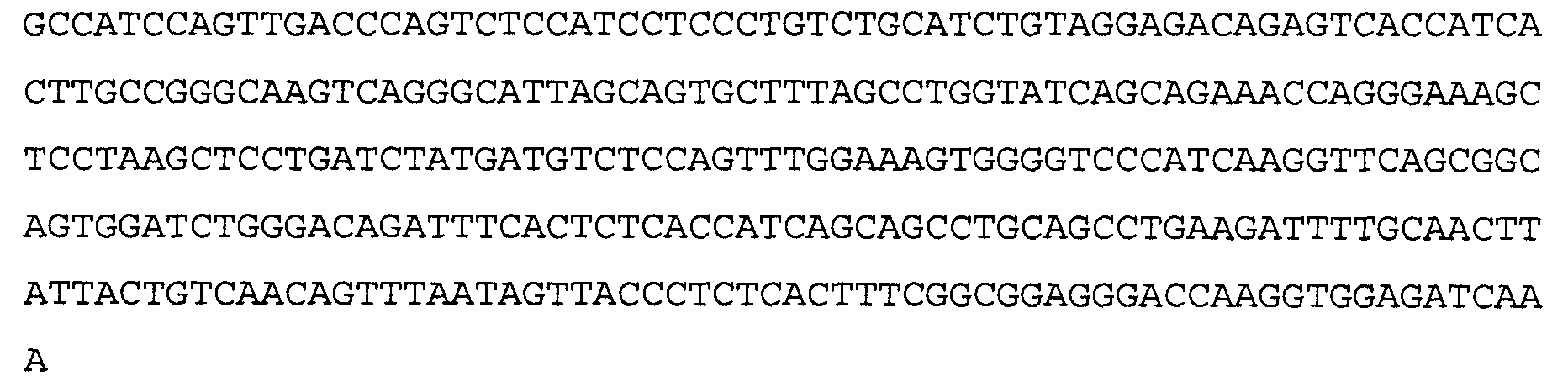
>1F1 VL. аминокислотная последовательность (SEQ ID NO:20)
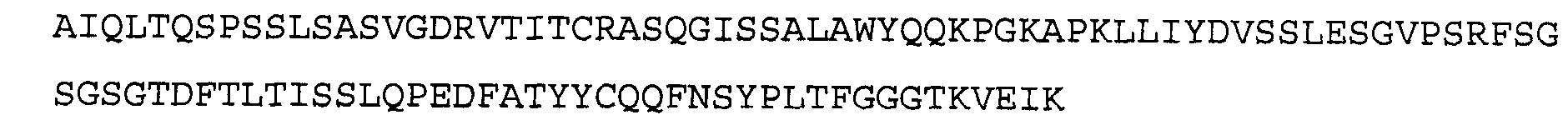
>1F1 VL, немутированная последовательность нуклеиновой кислоты (SEQ ID NO:104)
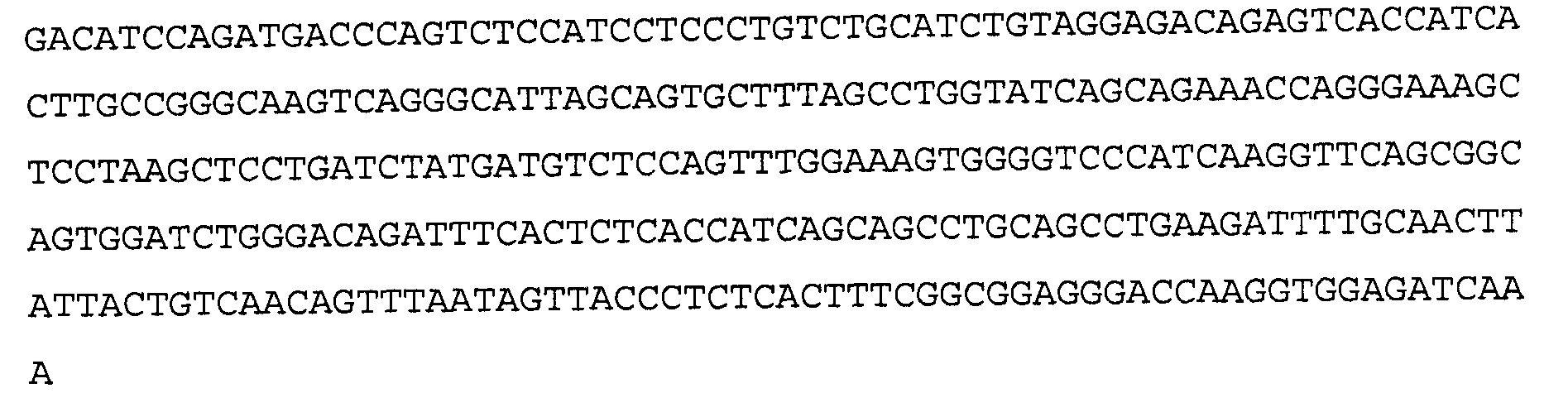
>1F1 VL, немутированная аминокислотная последовательность (SEQ ID NO:105)

Антитело 2Е12 включает вариабельный участок тяжелой цепи (SEQ ID NO:22), кодируемый последовательностью нуклеиновой кислоты, указанной в SEQ ID NO:21, и вариабельный участок легкой цепи (SEQ ID NO24), кодируемый последовательностью нуклеиновой кислоты, указанной в SEQ ID NO:23.
>2Е12 VH, последовательность нуклеиновой кислоты (SEQ ID NO:21)
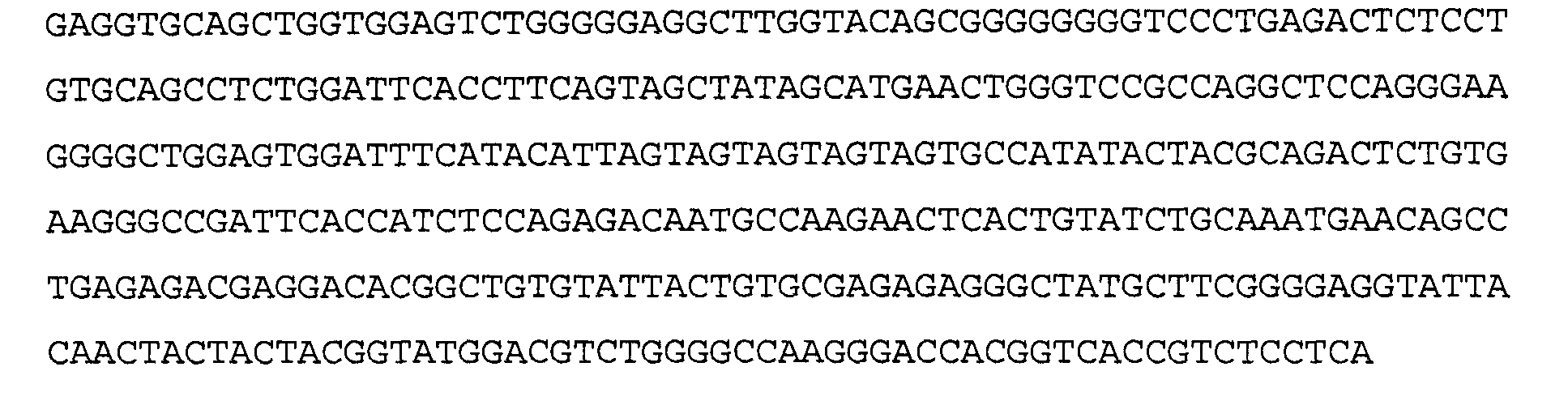
>2Е12 VH, аминокислотная последовательность (SEQ ID NO:22)
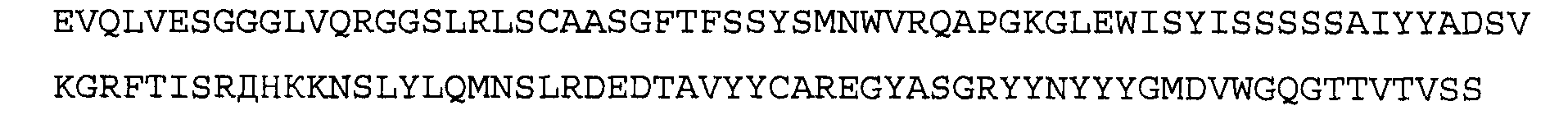
>2E12 VL, последовательность нуклеиновой кислоты (SEQ ID NO:23)
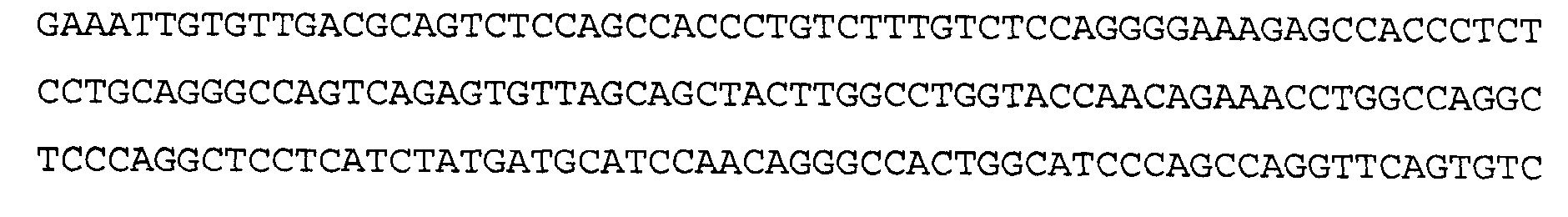
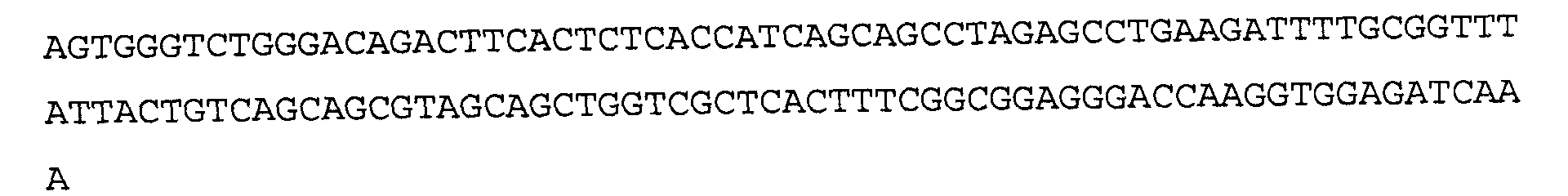
>2E12 VL, аминокислотная последовательность (SEQ ID NO:24)
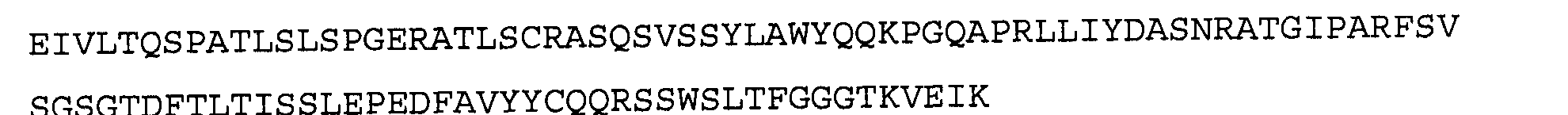
Антитело 5D3 включает вариабельный участок тяжелой цепи (SEQ ID NO:26), кодируемый последовательностью нуклеиновой кислоты, указанной в SEQ ID NO:25, и вариабельный участок легкой цепи (SEQ ID NO:28), кодируемый последовательностью нуклеиновой кислоты, указанной в SEQ ID NO:27.
>5D3 VH, последовательность нуклеиновой кислоты (SEQ ID NO:25)
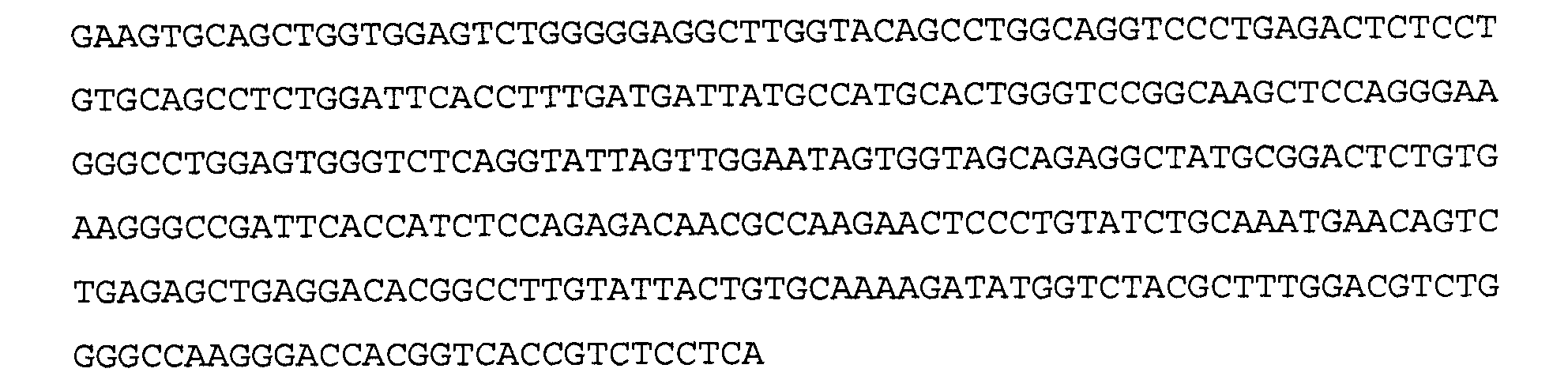
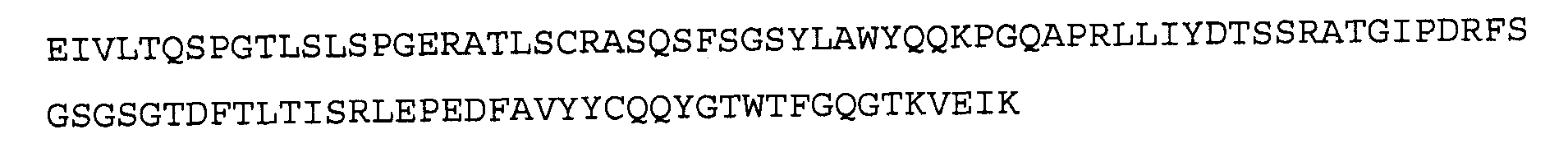
Антитело 22F8 включает вариабельный участок тяжелой цепи (SEQ ID NO:30), кодируемый последовательностью нуклеиновой кислоты, указанной в SEQ ID NO:29, и вариабельный участок легкой цепи (SEQ ID NO:32), кодируемый последовательностью нуклеиновой кислоты, указанной в SEQ ID NO:31.
>22F8 VH, последовательность нуклеиновой кислоты (SEQ ID NO: 29)
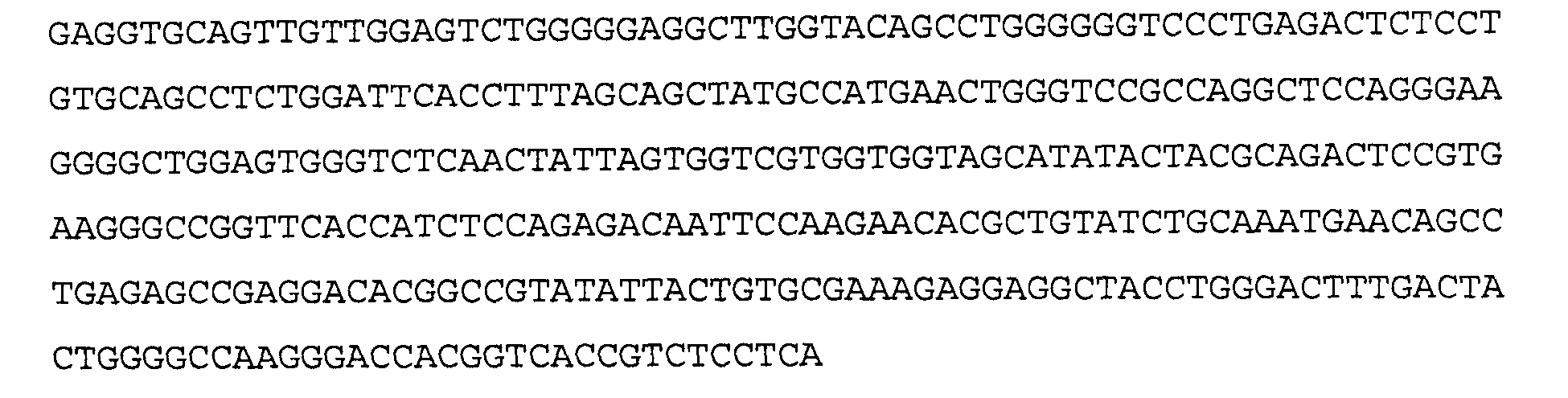
>22F8 VH, аминокислотная последовательность (SEQ ID NO:30)

>22F8 VL, последовательность нуклеиновой кислоты (SEQ ID NO: 31)
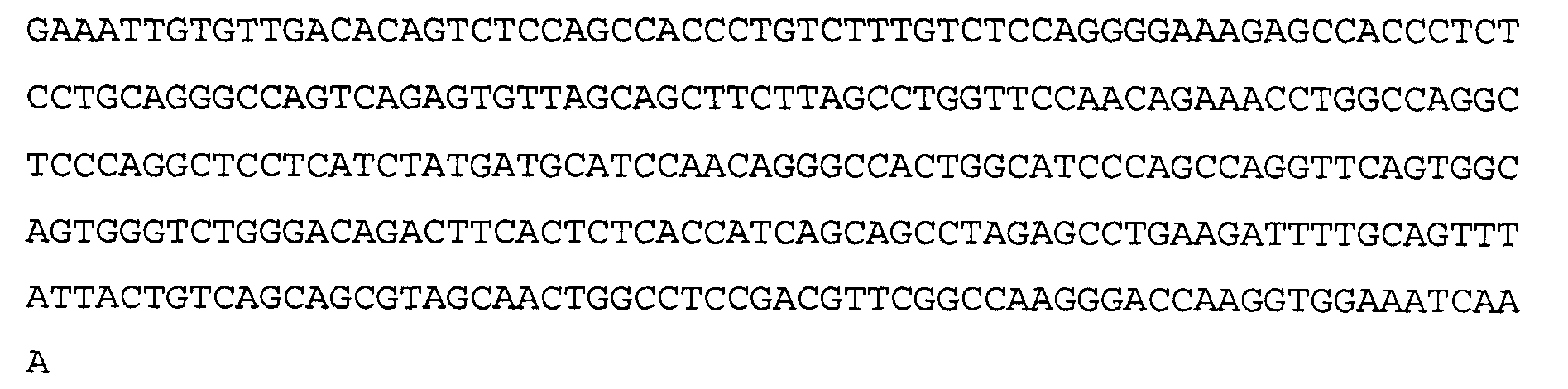
>22F8 VL. аминокислотная последовательность (SEQ ID NO:32)

Антитело 28 В11 включает вариабельный участок тяжелой цепи (SEQ ID NO:34), кодируемый последовательностью нуклеиновой кислоты, указанной в SEQ ID NO:33, и вариабельный участок легкой цепи (SEQ ID NO:36), кодируемый последовательностью нуклеиновой кислоты, указанной в SEQ ID NO:35.
>28В11 VH, последовательность нуклеиновой кислоты (SEQ ID NO:33)
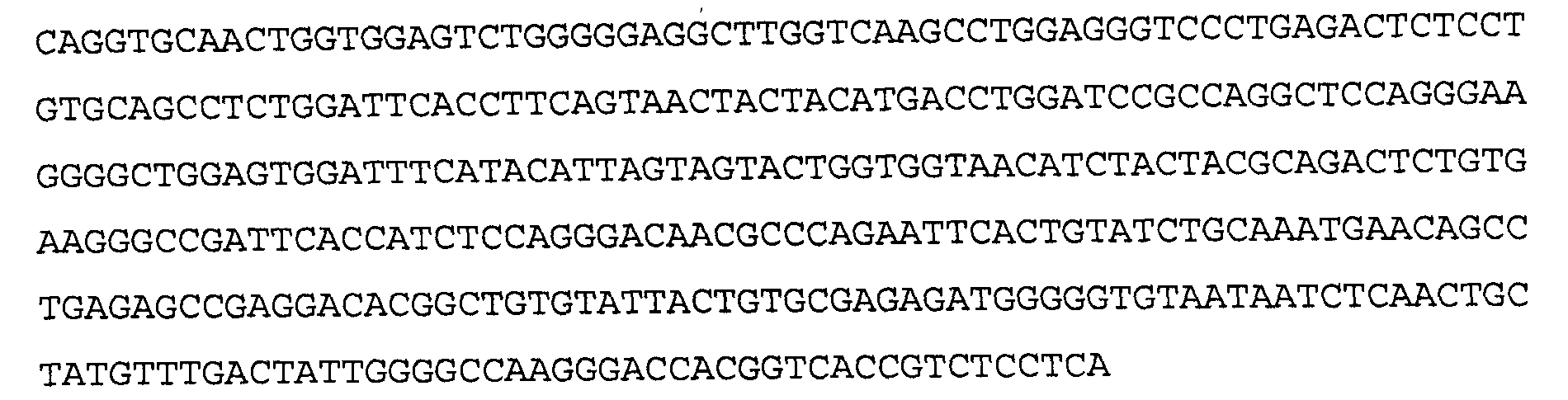
>28 В11 VH. аминокислотная последовательность (SEQ ID NO: 34)

>28B11 VL, последовательность нуклеиновой кислоты (SEQ ID NO: 35)
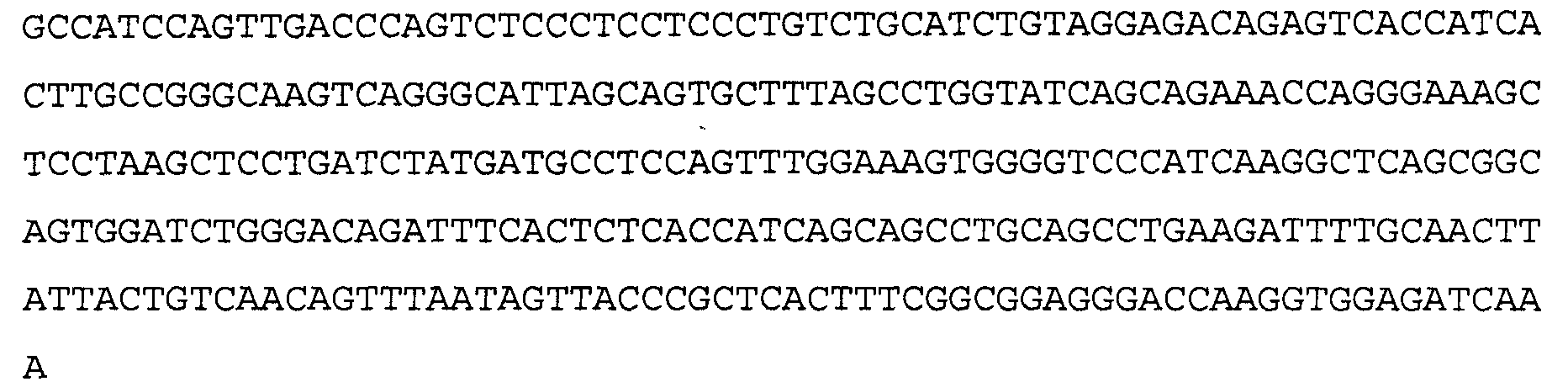
>28B11 VL, аминокислотная последовательность (SEQ ID NO: 36)
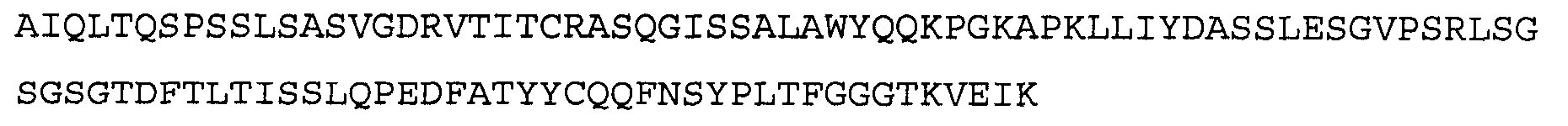
Антитело 41А4 включает вариабельный участок тяжелой цепи (SEQ ID NO:38), кодируемый последовательностью нуклеиновой кислоты, указанной в SEQ ID NO:37, и вариабельный участок легкой цепи (SEQ ID NO:40), кодируемый последовательностью нуклеиновой кислоты, указанной в SEQ ID NO:39.
>41А4 VH, последовательность нуклеиновой кислоты (SEQ ID NO:37)
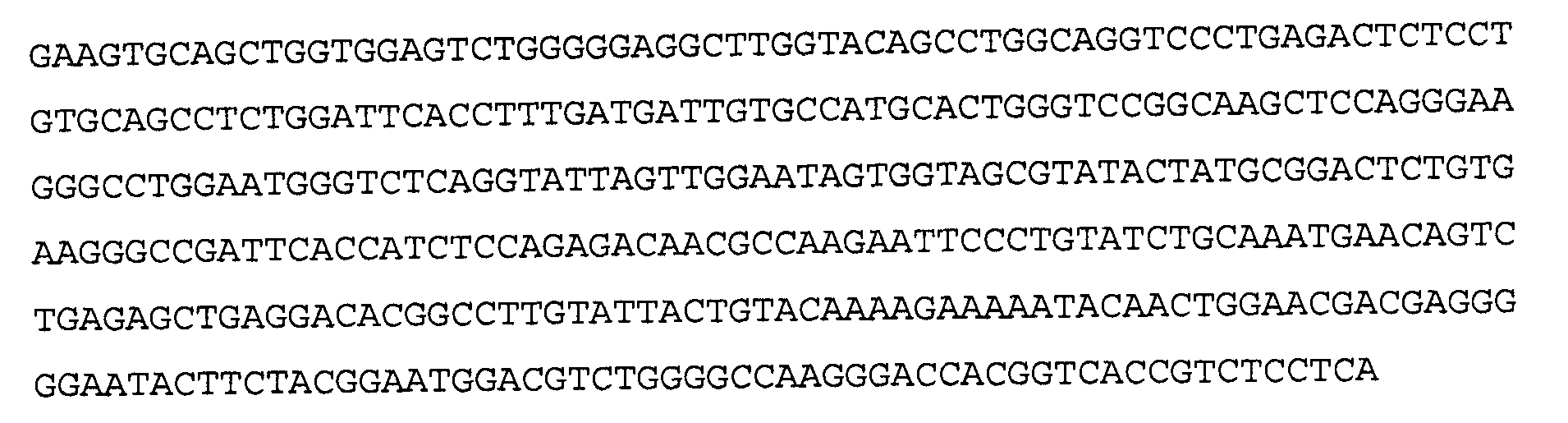
>41A4 VH, аминокислотная последовательность (SEQ ID NO:38)
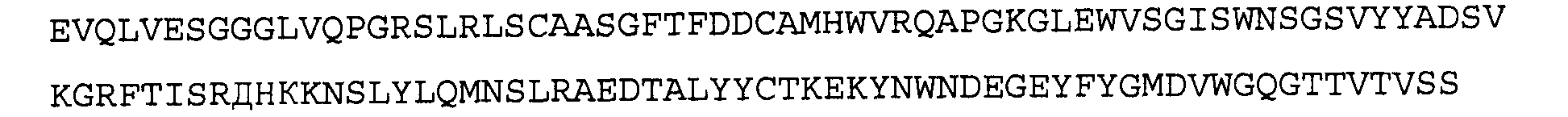
>41A4 VL, последовательность нуклеиновой кислоты (SEQ ID NO:39)
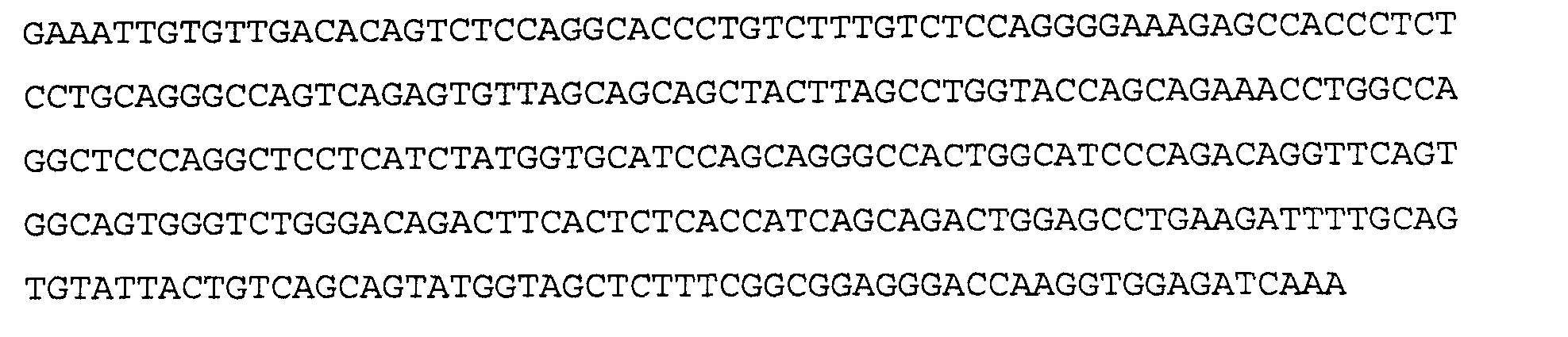
>41A4 VL, аминокислотная последовательность (SEQ ID NO: 40)
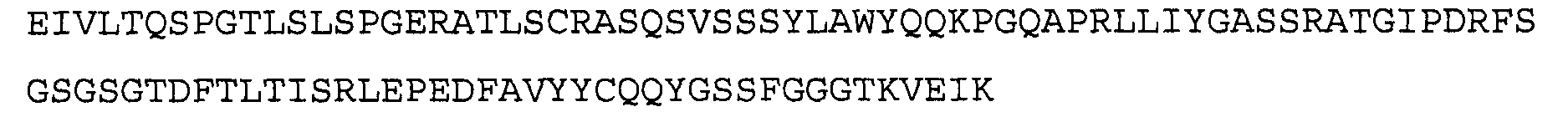
Антитело 43G6 включает вариабельный участок тяжелой цепи (SEQ ID NO:42), кодируемый последовательностью нуклеиновой кислоты, указанной в SEQ ID N0:41, и вариабельный участок легкой цепи (SEQ ID NO:44), кодируемый последовательностью нуклеиновой кислоты, указанной в SEQ ID NO:43.
>43G6 VH3. последовательность нуклеиновой кислоты (SEQ ID NO:41)
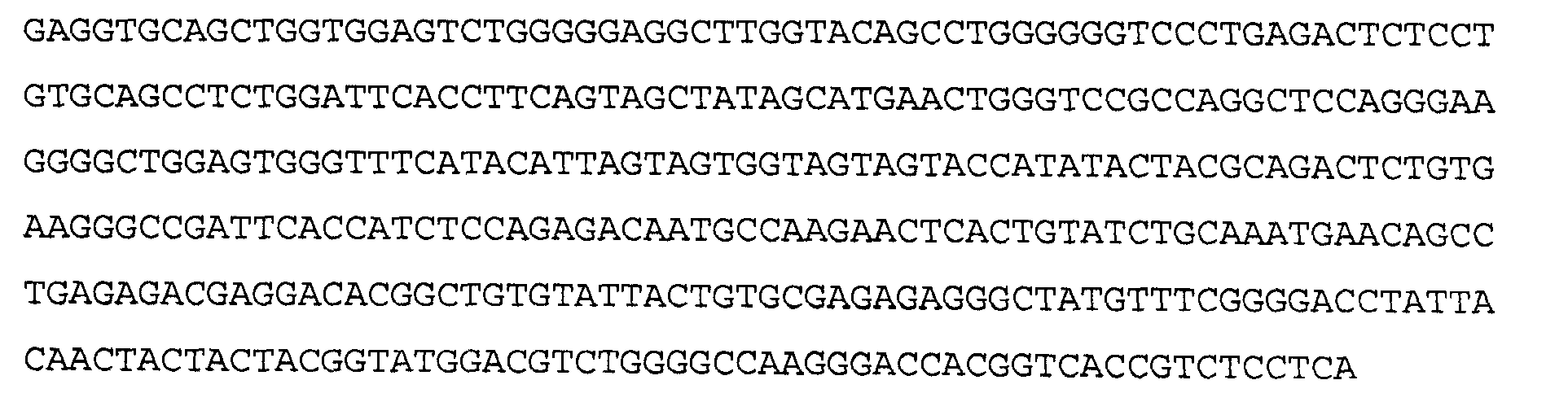
>43G6 VH3, аминокислотная последовательность (SEQ ID NO: 42)
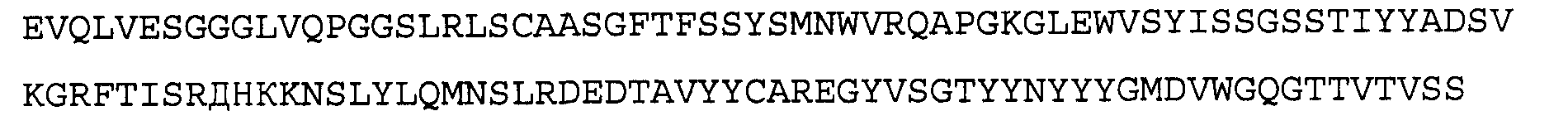
>43G6 VL3, последовательность нуклеиновой кислоты (SEQ ID NO:43)
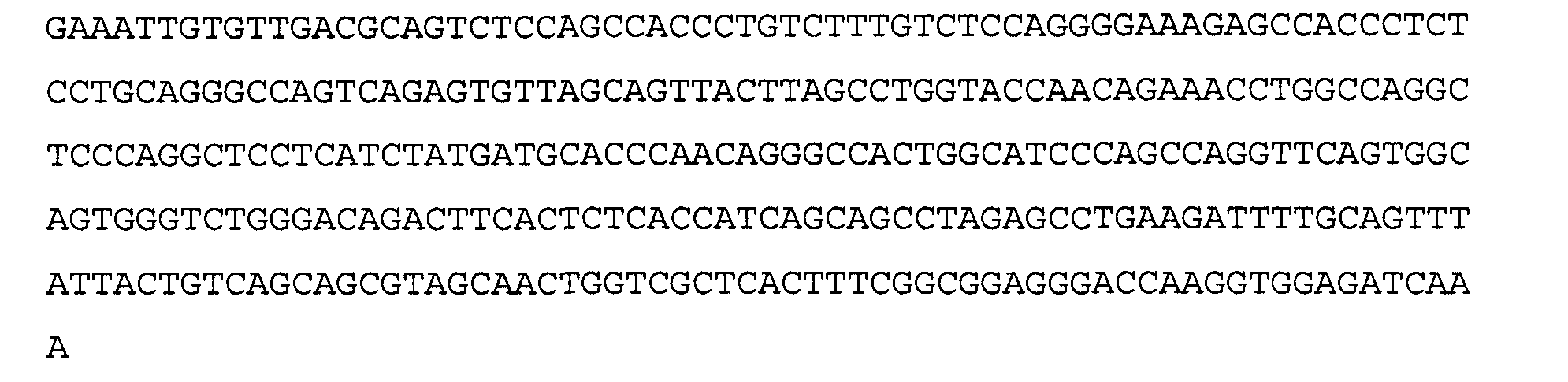
>43G6 VL3. аминокислотная последовательность (SEQ ID NO:44)
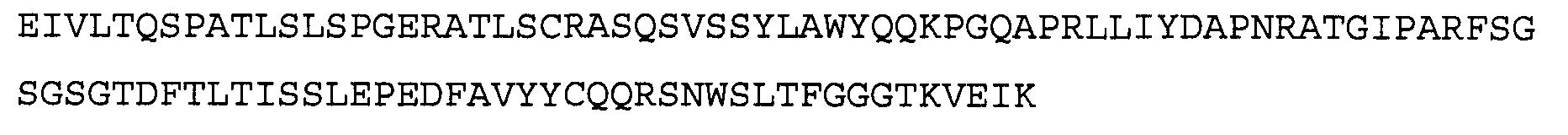
Антитела huIL-17F по изобретению также включают, например, участки, определяющие комплементарность, тяжелой цепи (VH CDRs), указанные в Таблице 1, CDRs легкой цепи (VL CDRs), указанные в Таблице 2, и их комбинации.
|
|
|
Аминокислоты, окружающие участки, определяющие комплементарность (CDR), описаны Е.А. Kabat et al. (см. Kabat, EA, et al., Sequences of Protein of immunological interest, Fifth Edition, US Department of Health and Human Services, US Government Printing Office (1991)).
Изобретение также включает антитела, которые связываются с тем же самым эпитопом, что и антитела, описанные тут. Например, антитела по изобретению специфически связываются с IL-17F и/или гетеродимерным комплексом IL-17A/IL-17F, причем антитело связывается с эпитопом, включающим один или несколько аминокислотных остатков человеческого IL-17F (№доступа ААН70124). В некоторых вариантах исполнения, антитела по изобретению специфически связывают IL-17F и гетеродимерный комплекс IL-17A/IL-17F, причем антитело связывается с эпитопом человеческого IL-17F (например, №доступа ААН70124).
Квалифицированным специалистам будет понятно, что можно определить, без чрезмерного экспериментирования, обладает ли моноклональное антитело (например, полностью человеческое моноклональное антитело) такой же специфичностью, как и моноклональное антитело по изобретению (например, клоны 5Е12, 41В10, 11С5, 21В10, 1F1, 2Е12, 5D3, 22F8, 28 В11, 41А4 и 43G6), путем определения того, препятствует ли первое из них связыванию последнего с IL-17F и/или гетеродимерным комплексом IL-17A/IL-17F. Если тестируемое моноклональное антитело конкурирует с моноклональным антителом по изобретению, что проявляется в уменьшении связывания моноклонального антитела по изобретению, то два моноклональные антитела связываются с одним и тем же, или с близко родственными, эпитопами.
Альтернативный способ определения того, обладает ли моноклональное антитело специфичностью моноклонального антитела по изобретению, заключается в предварительном инкубировании моноклонального антитела по изобретению с растворимым белком IL-17F и/или растворимыми белками гетеродимерного комплекса IL-17A/IL-17F и затем прибавлении тестируемого моноклонального антитела для определения того, ингибируется ли способность тестируемого моноклонального антитела связываться с IL-17F и/или гетеродимерным комплексом IL-17A/IL-17F. Если тестируемое моноклональное антитело ингибируется, то, по всей вероятности, оно обладает такой же, или функционально эквивалентной, эпитопной специфичностью, как и моноклональное антитело по изобретению.
Скрининг моноклональных антител по изобретению может быть также проведен, например, путем измерения IL-17F-индуцированного продуцирования цитокинов и/или хемокинов (например, IL-6, IL-8, G-CSF, GM-CSF, GRO-a, GRO-b, LIX, GCP-2, MIG, IP10, I-TAC, и МСР-1, RANTES, Eotaxin, SDF-1 и MIP3a), и определения того, является ли тестируемое моноклональное антитело способным модулировать, блокировать, ингибировать, редуцировать, антагонизировать, нейтрализовать или иначе препятствовать IL-17F-индуцированному продуцированию цитокинов и/или хемокинов.
Различные процедуры, известные специалистам, могут быть использованы для продуцирования моноклональных антител, направленных против IL-17F, или против их производных, фрагментов, аналогов, гомологов или ортологов (см., например, Antibodies: A Laboratory Manual, Harlow E., and Lane D., 1988, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, включенное сюда в качестве ссылки). Полностью человеческие антитела представляют собой молекулы антител, в которых полные последовательности как легкой цепи, так и тяжелой цепи, включая CDRs, присходят из человеческих генов. Такие антитела называются тут "человеческими антителами", или "полностью человеческими антителами". Человеческие моноклональные антитела получают, например, с использованием процедур, описанных в приведенных ниже примерах. Человеческие моноклональные антитела могут быть также получены путем использования триомной технологии; методики гибридомы человеческих В-клеток (см. Kozbor, et al., 1983 Immunol Today 4: 72); и методики гибридомы EBV (вирус Эпштейна-Барр) для получения человеческих моноклональных антител (см. Cole, et al., 1985 In: Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, Inc., pp.77-96). Человеческие моноклональные антитела могут быть использованы и могут быть получены с использованием человеческих гибридом (см. Cote, et al., 1983. Proc NatI Acad Sci USA 80: 2026-2030) или путем трансформации человеческих В-клеток вирусом Эпштейна-Барр in vitro (см. Cole, et al., 1985 In: Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, Inc., pp.77-96).
Антитела очищают хорошо известными методами, такими как аффинная хроматография с использованием протеина А или протеина G, из которых преимущественно состоит IgG фракция иммунной сыворотки. После этого, или альтернативно, специфический антиген, являющийся мишенью требуемого иммуноглобулина, или его эпитоп, могут быть иммобилизованы на колонке для очистки иммунного специфического антитела методом иммуноаффинной хроматографии. Очистка иммуноглобулинов обсуждается, например, D. Wilkinson (The Scientist, опубликовано The Scientist, Inc., Philadelphia PA, Vol.14, №8 (April 17, 2000), pp.25-28).
Антитела по изобретению (например, 5Е12, 41 В10, 11С5, 21В10, 1F1, 2Е12, 5D3, 22F8, 28В11, 41А4 и 43G6) представляют собой полностью человеческие моноклональные антитела. Моноклональные антитела, которые модулируют, блокируют, ингибируют, редуцируют, антагонизируют, нейтрализуют или иначе препятствуют продуцированию провоспалительного цитокина, медиируемому IL-17F, получают, например, путем иммунизации животного с помощью IL-17F такого как, например, мышиный, крысиный или человеческий IL-17F или его иммуногенный фрагмент, производное или вариант. Альтернативно, животное иммунизируют клетками, трансфицированными вектором, содержащим молекулу нуклеиновой кислоты, кодирующую IL-17F, так чтобы IL-17F экспрессировался и ассоциировался с поверхностью трансфицированных клеток. Альтернативно, антитела получают путем скрининга библиотеки, содержащей последовательности антитела или антигенсвязующего домена для связывания с IL-17F. Эту библиотеку готовят, например, в бактериофаге путем слияния белка или пептида с белком оболочки бактериофага, который экспрессируется на поверхности собранных фаговых частиц, и кодирующих ДНК-последовательностей, содержащихся в фаговых частицах (т.е., "библиотека фагового дисплея"). Гибридомы, образующиеся в результате слияний миеломы/В-клеток, затем подвергают скринингу на реакционную способность по отношению к IL-17F.
Моноклональные антитела получают, например, с использованием гибридомных способов, таких как описанные Kohler and Milstein, Nature, 256:495 (1975). В гибридомном способе, мышь, хомяка или другое пригодное животное-хозяина, типично, иммунизируют агентом иммунизации для выявления лимфоцитов, продуцирующих или способных продуцировать антитела, которые будут специфически связываться с агентом иммунизации. Альтернативно, лимфоциты могут быть иммунизованы in vitro.
Агент иммунизации будет типично содержать белковый антиген, его фрагмент или его слитый белок. Обычно используются лимфоциты периферической крови, если желательно получить клетки человеческого происхождения, или используются клетки селезенки или клетки лимфатического узла, если желательными источниками являются млекопитающие кроме человека. Лимфоциты затем сливают с иммортализованной клеточной линией при помощи пригодного агента слияния, такого как полиэтиленгликоль, с образованием гибридомной клетки (Goding, Monoclonal Antibodies: Principles and Practice, Academic Press, (1986) pp.59-103). Иммортализованные клеточные линии обычно представляют собой трансформированные клетки млекопитающих, особенно, клетки миеломы, принадлежащие грызунам, бычьим и человеку. Обычно используют клеточные линии миеломы крыс или мышей. Клетки гибридомы могут культивироваться в пригодной культуральной среде, которая предпочтительно содержит одно или несколько веществ, ингибирующих рост или выживание неслитых иммортализованных клеток. Например, если родительские клетки не содержат фермента гипоксантингуанинфосфорибозилтрансферазы (HGPRT или HPRT), то культуральная среда для гибридом типично будет содержать гипоксантин, аминоптерин и тимидин ("среда HAT") - вещества, предотвращающие рост HGPRT-дефицитных клеток.
Предпочтительными иммортализованными клеточными линиями являются способные к эффективному слиянию, поддерживающие стабильно высокий уровень экспрессии антитела выбранными антитело-продуцирующими клетками, и чувствительные к среде, такой как среда HAT. Предпочтительнее, иммортализованные клеточные линии являются мышиными линиями миеломы, которые могут быть получены, например, от Salk Institute Cell Distribution Center, San Diego, California, и American Type Culture Collection, Manassas, Virginia. Клеточные линии человеческой миеломы и мышино-человеческой гетеромиеломы также были описаны в связи с продуцированном моноклональных антител, (см. Kozbor, J. Immunol., 133:3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, Marcel Dekker, Inc., New York, (1987) pp.51-63)).
Культуральная среда для культивации клеток гибридомы может быть затем проанализирована на присутствие моноклональных антител, направленных против антигена. Предпочтительно, специфичность связывания моноклональных антител, продуцируемых клетками гибридомы, определяют методом иммунопреципитации или с помощью in vitro анализа связывания, такого как радиоиммунологический анализ (RIA) или иммуноферментный твердофазный анализ (ELISA). Такие методики и анализы известны специалистам. Аффинность связывания моноклонального антитела, например, может быть определена с помощью анализа распределения Скэтчарда по Munson and Pollard, Anal. Biochem., 107:220 (1980). Кроме того, при терапевтическом применении моноклональных антител важно идентифицировать антитела, обладающие высокой степенью специфичности и высокой аффинностью связывания с антигеном-мишенью.
После идентификации желательных клеток гибридомы, клоны могут быть субклонированы с помощью процедур серийного разбавления и выращены стандартными способами (см. Coding, Monoclonal Antibodies: Principles and Practice, Academic Press, (1986) pp.59-103). Пригодные для этого культуральные среды включают, например, модифицированную по Дульбекко среду Игла и среду RPMI-1640. Альтернативно, клетки гибридомы могут быть выращены in vivo в виде асцита у млекопитающего.
Моноклональные антитела, секретируемые субклонами, могут быть выделены или очищены из культуральной среды или асцитной жидкости с помощью обычных процедур очистки иммуноглобулинов, таких как, например, белок А-сефароза, хроматография на гидроксиапатите, электрофорез на геле, диализ, или аффинная хроматография.
Моноклональные антитела также могут быть получены методами рекомбинантной ДНК, такими как описанные в патенте США №4816567. ДНК, кодирующая Моноклональные антитела по изобретению, может быть легко выделена и секвенирована с использованием обычных процедур (например, с использованием олигонуклеотидных зондов, способных специфически связываться с генами, кодирующими тяжелую и легкую цепи мышиных антител). Клетки гибридомы по изобретению являются предпочтительными источниками таких ДНК. После выделения, ДНК может быть помещена в векторы экспрессии, которые затем трансфицируют в клетки-хозяева, такие как обезьяньи клетки COS, клетки яичника китайского хомячка (СНО), или клетки миеломы, которые иначе не продуцируют белок иммуноглобулина, для проведения синтеза моноклональных антител в рекомбинантных клетках-хозяевах. ДНК также может быть модифицирована, например, путем замещения кодирующей последовательности на человеческие константные домены тяжелой и легкой цепей вместо гомологичных мышиных последовательностей (см. патент США №4816567; Morrison, Nature 368, 812-13 (1994)) или путем ковалентного присоединения к кодирующей последовательности иммуноглобулина всей или части кодирующей последовательности не-иммуноглобулинового полипептида. Такой не-иммуноглобулиновый полипептид может быть замещен на константные домены антитела по изобретению, или может быть замещен на вариабельные домены одного антигенсвязывающего сайта антитела по изобретению для создания химерного бивалентного антитела.
Человеческие антитела и гуманизация антител
Моноклональные антитела по изобретению включают полностью человеческие антитела или гуманизированные антитела. Эти антитела являются пригодными для введения людям без возбуждения иммунного ответа у человека против введенного иммуноглобулина.
Антитело huIL-17F получают, например, с использованием процедур, описанных в приведенных ниже примерах.
В других, альтернативных, способах, антитело huIL-17F разрабатывают, например, с помощью способов фагового дисплея с использованием антител, содержащих только человеческие последовательности. Такие подходы хорошо известны специалистам, например, из W092/01047 и патента США №6521404, которые настоящим включены сюда в качестве ссылок. В данном подходе, проводят скрининг комбинаторной библиотеки фага, несущего случайные пары легких и тяжелых цепей, с использованием природного или рекомбинантного источника IL-17F или его фрагментов. В другом подходе, антитело huIL-17F может быть получено по способу, в котором по меньшей мере одна стадия процесса включает иммунизацию трансгенного животного кроме человека белком человеческого IL-17F. В этом подходе, некоторые из локусов эндогенных тяжелых и/или легких каппа-цепей такого ксеногенного животного кроме человека были повреждены и являлись неспособными к перестройке, необходимой для генерирования генов, кодирующих иммуноглобулины в ответ на антиген. Кроме того, по меньшей мере один локус человеческой тяжелой цепи и по меньшей мере один локус человеческой легкой цепи были стабильно трансфицированы животному. Таким образом, в ответ на введенный антиген, человеческие локусы перестраиваются для образования генов, кодирующих человеческие вариабельные участки, иммуноспецифические по отношению к антигену. После иммунизации, поэтому, ксеногенная мышь (xenomouse) продуцирует В-клетки, секретирующие полностью человеческие иммуноглобулины.
Специалистам хорошо известны различные методики продуцирования ксеногенных животных кроме человека. Например, см. патенты США №6075181 и №6150584, которые настоящим целиком включены сюда в качестве ссылок. Эта общая стратегия была продемонстрирована в связи с получением первых разновидностей XenoMouse™, как опубликовано в 1994 г.См., Green et al. Nature Genetics 7:13-21 (1994), которая настоящим целиком включена сюда в качестве ссылки. См. также патенты США №№6162963, 6150584, 6114598, 6075181 и 5939598 и патенты Японии №№3068180 В2, 3068506 В2 и 3068507 В2, и европейский патент №ЕР 0463151 В1 и международные патентные заявки №WO 94/02602, WO 96/34096, WO 98/24893, WO 00/76310, и родственные члены семейства.
В альтернативном подходе, другие авторы использовали подход "минилокуса", в котором экзогенный Ig локус имитируют путем включения отдельных элементов (pieces) (индивидуальных генов) из lg-локуса. Таким образом, один или несколько генов VH, один или несколько генов dh, один или несколько генов JH, мю-константная область, и вторая константная область (предпочтительно гамма-константная область) формируются в конструкт для вставки животному. См., например, патенты США №№5545806; 5545807; 5591669; 5612205; 5625825; 5625126; 5633425; 5643763; 5661016; 5721367; 5770429; 5789215; 5789650; 5814318; 5877397; 5874299; 6023010; и 6255458; и европейский патент №0546073 В1; и международные патентные заявки №№WO 92/03918, WO 92/22645, WO 92/22647, WO 92/22670, WO 93/12227, WO 94/00569, WO 94/25585, WO 96/14436, WO 97/13852 и WO 98/24884, и родственные члены семейства.
Было также продемонстрировано образование человеческих антител у мышей, которым были введены, путем микроклеточного слияния (microcell fusion), большие фрагменты хромосом или целые хромосомы. См. европейские патентные заявки №№773288 и 843961.
Реакция на человеческое антимышиное антитело (МАМА) побудила промышленность к получению химерных или другими способами гуманизированных антител. Хотя химерные антитела имеют человеческую константную область и иммунный вариабельный участок, ожидается, что будут наблюдаться определенные реакции человеческих антихимерных антител (НАСА), особенно, при хроническом или многодозовом применении антител. Таким образом, было бы желательным обеспечить полностью человеческие антитела против IL-17F и/или гетеродимерного комплекса IL-17A/IL-17F для ослабления или иного смягчения опасений и/или эффектов реакции НАМА или НАСА.
Продуцирование антител с пониженной иммуногенностью также достигается путем гуманизации, химеризации и дисплейных методов с использованием соответствующих библиотек. Следует понимать, что мышиные антитела или антитела других видов могут быть гуманизированы или приматизированы с использованием методов, хорошо известных специалистам. См., например, Winter and Harris, Immunol Today 14:43 46 (1993) и Wright et al. Crit, Reviews in Immunol. 12125-168 (1992). Антитело, представляющее интерес, может быть сконструировано с использованием методов рекомбинантной ДНК для замещения СН1, СН2, СН3, шарнирных доменов и/или каркасного домена на соответствующую человеческую последовательность (см. WO 92/102190 и патенты США №№5530101, 5585089, 5693761, 5693792, 5714350, и 5777085). Специалистам также известно использование кДНК Ig для конструирования химерных генов иммуноглобулина (Liu et al. P.N.A.S. 84:3439 (1987) и J. Immunol. 139:3521 (1987)), мРНК выделяют из гибридомы или другой клетки, продуцирующей антитело, и используют для продуцирования кДНК. Представляющая интерес кДНК может быть амплифицирована методом полимеразной цепной реакции с использованием специфических праймеров (патенты США №№4683195 и 4683202). Альтернативно, готовят библиотеку и проводят скрининг для выделения последовательности, представляющей интерес. ДНК-последовательность, кодирующую вариабельный участок антитела, затем сливают с последовательностями человеческой константной области. Последовательности генов человеческих константных областей приведены Kabat et al. (1991) Sequences of Proteins of Immunological Interest, N.I.H. publication №91-3242. Гены человеческой С-области легко доступны из известных клонов. Выбор изотипа будет определяться желательными эффекторными функциями, такими как фиксация комплемента, или активность в проявлении антитело-зависимой клеточной цитотоксичности. Предпочтительный изотипами являются lgG1, lgG3 и lgG4. Может быть использована любая из константных областей человеческой легкой цепи - каппа или лямбда. Химерное гуманизированное антитело затем экспрессируют обычными способами.
Фрагменты антитела, такие как Fv, F(ab')2 и Fab, могут быть получены путем расщепления интактного белка, например, протеазой или путем химического расщепления. Альтернативно, конструируется укороченный ген. Например, химерный ген, кодирующий часть фрагмента F(ab')2, будет включать ДНК последовательности, кодирующие домен СН1 и шарнирную область Н-цепи, за которыми идет кодон терминации трансляции для получения укороченной молекулы.
Консенсусные последовательности Н и L J-областей могут быть использованы для конструирования олигонуклеотидов для использования в качестве праймеров для введения полезных сайтов рестрикции в J-область для последующего связывания сегментов V-области с сегментами человеческой С-области. С-область кДНК может быть модифицирована сайт-направленным мутагенезом для размещения сайта рестрикции в положении, аналогичном человеческой последовательности.
Векторы экспрессии включают плазмиды, ретровирусы, YACs (искусственные хромосомы дрожжей), эписомы, полученные на основе вируса Эпштейна-Барр (EBV), и т.п. Удобным является вектор, кодирующий функционально полную последовательность человеческого СН или CL иммуноглобулина, с соответствующими сайтами рестрикции, сконструированными таким образом, чтобы любая VH или VL последовательность могла быть легко вставлена и экспрессирована. В таких векторах, сплайсинг обычно происходит между донорным сайтом сплайсинга во вставленной J-области и акцепторным сайтом сплайсинга, предшествующим человеческой С-области, а также в областях сплайсинга, расположенных в человеческих СН-экзонах. Полиаденилирование и терминация транскрипции происходят в нативных хромосомальных сайтах, расположенных после кодирующих участков. Образующееся химерное антитело может быть присоединено к любому сильному промотору, включая ретровирусные LTRs (длинные концевые повторы), например, ранний промотор SV-40, (Okayama et al. Mol. Cell. Bio. 3:280 (1983)), LTR вируса саркомы Payca (Gorman et al. P.N.A.S. 79:6777 (1982)), и LTR вируса мышиного лейкоза Молони (Grosschedl etal. Cell 41:885 (1985)). Следует также понимать, что могут быть использованы нативные lg-промоторы и т.п.
Кроме того, человеческие антитела или антитела других видов животных могут быть получены с помощью технологий дисплейного типа, включая, без ограничений, фаговый дисплей, ретровирусный дисплей, рибосомальный дисплей и другие методики, с использованием способов, хорошо известных специалистам, и полученные молекулы могут быть подвергнуты дополнительному созреванию, такому как созревание аффинности, по методикам, хорошо известным специалистам (Wright et al. Crit, Reviews in Immunol. 12125-168 (1992), Hanes and Pluckthun, PNAS USA 94:4937-4942 (1997) (рибосомальный дисплей), Parmley and Smith, Gene 73:305-318 (1988) (фаговый дисплей), Scott, TIBS, vol. 17:241-245 (1992), Cwiria e/ al. PNAS USA 87:6378-6382 (1990), Russel et al. Nucl. Acids Research 21:1081-1085 (1993), Hoganboom et al. Immunol. Reviews 130:43-68 (1992), Chiswell and McCafferty TIBTECH; 10:80-8A (1992), и патент США №5733743), Если дисплейные технологии используются для продуцирования нечеловеческих антител, то такие антитела могут быть гуманизированы, как описано выше.
С использованием таких методик могут быть получены антитела к IL-17F-экспрессирующим клеткам, к самому IL-17F, к формам эпитопов IL-17F или их пептидам, и к их библиотекам экспрессии (см. например, патент США №5703057), которые затем могут быть подвергнуты скринингу, как описано выше, на описанные тут активности.
Антитела huIL-17F по изобретению могут экспрессироваться вектором, содержащим сегмент ДНК, кодирующий одноцепочечное антитело, описанное выше.
Такие векторы могут включать векторы, липосомы, депротеинизированную ДНК, ДНК с адъювантом (adjuvant-assisted), генную пушку, катетеры и т.д. Векторы включают химические конъюгаты, такие как описанные в WO 93/64701, которые имеют нацеливающий фрагмент (например, лиганд рецептора клеточной поверхности), и связывающий фрагмент нуклеиновой кислоты (например, полилизин), вирусный вектор (например вирусный, ДНК или РНК-вектор), слитые белки, такие как описанные в PCT/US 95/02140 (WO 95/22618), представляющие собой слитый белок, содержащий нацеливающий фрагмент (например, антитело, специфическое по отношению к клетке-мишени) и связывающий фрагмент нуклеиновой кислоты (например, протамин), плазмиды, фаг и т.д. Векторы могут быть хромосомальными, нехромосомальными или синтетическими.
Предпочтительные векторы включают вирусные векторы, слитые белки и химические конъюгаты. Ретровирусные векторы включают вирусы мышиного лейкоза Молони. Предпочтительными являются вирусные ДНК-векторы. Такие векторы включают векторы оспы, такие как ортопокс-векторы или векторы оспы птиц (avipox), герпесвирусные векторы, такие как вектор вируса простого герпеса I (HSV) (см. Geller, A.I. et al., J. Neurochem, 64:487 (1995); Lim, F, et al., в: DNA Cloning: Mammalian Systems, D. Glover, Ed. (Oxford Univ. Press, Oxford England) (1995); Geller, A.I. et al., Proc Natl. Acad. Sci.: U.S.A. 90:7603 (1993); Geller, A.I., et at., Proc Natl. Acad. Sci USA 87:1149 (1990), Adenovirus Vectors (см. LeGal LaSalle et al., Science, 259:988 (1993); Davidson, et al., Nat. Genet 3:219 (1993); Yang, et al., J. Virol. 69:2004 (1995) и Adeno-associated Virus Vectors (см. Kaplitt, M.G. et al., Nat. Genet. 8:148(1994).
Оспенные вирусные векторы вводят ген в цитоплазму клеток. Векторы на основе вируса оспы птиц приводят только к кратковременной экспрессии нуклеиновой кислоты. Аденовирусные векторы, адено-ассоциированные вирусные векторы и векторы на основе вируса простого герпеса (HSV) являются предпочтительными для введения нуклеиновой кислоты в нервные клетки. Аденовирусный вектор обеспечивает более кратковременную экспрессию (примерно 2 месяца), чем адено-ассоциированный вирус (примерно 4 месяца), который, в свою очередь, уступает векторам HSV. Конкретный выбранный вектор будет зависеть от клетки-мишени и состояния, лечение которого проводится. Введение может быть осуществлено стандартными методами, например, инфекцией, трансфекцией, трансдукцией или трансформацией. Примеры способов переноса гена включают, например, депротеинизированную ДНК, преципитацию CaPO4, DEAE (диэтиламиноэтил)-декстран, электропорацию, слияние протопластов, липофекцию, микроинъекцию в клетку и вирусные векторы.
Вектор может быть использован для нацеливания на по существу любую желательную клетку-мишень. Например, стереотаксическая инъекция может быть использована для направления векторов (например, аденовирусного, HSV) к желательному месту. Дополнительно, частицы могут быть доставлены путем интрацеребровентрикулярной (icv) инфузии с помощью системы инфузионного мининасоса, такой как SynchroMed Infusion System. Способ, основанный на объемном потоке (bulk flow), называемом конвекцией (convection), также оказался эффективным для доставки крупных молекул к обширным областям мозга и может быть пригоден для доставки вектора к клетке-мишени (см. Bobo et at., Proc. Natl. Acad. Sci. USA 91:2076-2080 (1994); Morrison et al., Am. J. Physiol, 266:292-305 (1994)). Другие способы, пригодные для использования, включают катетеры, внутривенную, парентеральную, интраперитонеальную и подкожную инъекции, и пероральный или другие известные пути введения.
Эти векторы могут быть использованы для экспрессии больших количеств антител, которые могут быть использованы различными способами. Например, для детектирования присутствия IL-17F в образце. Антитело также может быть использовано для попытки связывания с и нарушения передачи IL-17F-ассоциированных сигналов.
Методики могут быть адаптированы для продуцирования одноцепочечных антител, специфических по отношению к антигенному белку по изобретению (см., например, патент США №4946778). Кроме того, способы могут быть адаптированы для конструирования библиотек экспрессии Fab (см. например, Huse, et al., 1989 Science 246: 1275-1281) для обеспечения возможности быстрой и эффективной идентификации моноклональных фрагментов Fab с желательной специфичностью к белку или его производным, фрагментам, аналогам или гомологам. Фрагменты антитела, содержащие идиотипы к белковому антигену, могут быть получены методами, известными специалистам, включая, без ограничений: (i) фрагмент F(ab')2, получаемый путем гидролиза пепсином молекулы антитела; (ii) фрагмент Fab, получаемый восстановлением дисульфидных мостиков фрагмента F(ab')2; (iii) фрагмент Fab, получаемый путем обработки молекулы антитела папаином и восстановителем, и (iv) фрагменты Fv.
Изобретение также включает анти-11--17F фрагменты Fv, Fab, Fab' и F(ab')2, одноцепочечные анти-IL-17F антитела, биспецифические анти-IL-17F антитела и гетероконъюгатные анти-IL-17F антитела.
Биспецифические антитела представляют собой антитела, обладающие специфичностями связывания с по меньшей мере двумя разными антигенами. В данном случае, одна из специфичностей связывания относится к IL-17F. Второй связываемой мишенью является любой другой антиген, предпочтительно, белок клеточной поверхности или рецептор или субъединица рецептора.
Способы изготовления биспецифических антител известны специалистам. Традиционно, рекомбинантное продуцирование биспецифических антител основано на коэкспрессии двух иммуноглобулиновых пар тяжелая цепь/легкая цепь, где две тяжелые цепи имеют разные специфичности (Milstein and Cuello, Nature, 305:537-539 (1983)). Вследствие случайного набора иммуноглобулиновых тяжелых и легких цепей, такие гибридомы (квадромы) продуцируют потенциально смесь десяти разных молекул антитела, из которых только одна имеет правильную биспецифическую структуру. Очистка требуемой молекулы обычно осуществляется с помощью постадийной аффинной хроматографии. Аналогичные процедуры раскрыты в WO 93/08829, опубликованном 13 мая 1993 г., и Traunecker et al., EMBO J, 10:3655-3659 (1991).
Вариабельные домены антитела с желательными специфичностями связывания (паратопы антитело-антиген) могут быть слиты с последовательностями константного домена иммуноглобулина. Слияние предпочтительно осуществляется с константным доменом тяжелой цепи иммуноглобулина, одержащим по меньшей мере часть шарнирной области, СН2, и СН3 областей. Предпочтительно, чтобы первая константная область тяжелой цепи (СН1) содержала сайт, необходимый для связывания легкой цепи, участвующей в по меньшей мере одном из слияний. ДНК, кодирующие слияния тяжелой цепи иммуноглобулина и, при необходимости, легкой цепи иммуноглобулина, вставляются в отдельные векторы экспрессии и ко-трансфицируются в пригодный организм-хозяин. Дополнительные подробности генерирования биспецифических антител приведены, например, в Suresh et al., Methods in Enzymology, 121:210 (1986).
В соответствии с другим подходом, описанным в WO 96/27011, контактная поверхность между парой молекул антитела может быть сконструирована таким образом, чтобы максимизировать процент гетеродимеров, извлекаемых из рекомбинантной клеточной культуры. Предпочтительная поверхность раздела включает по меньшей мере часть СН3-области константного домена антитела. В этом способе, одну или несколько малых боковых цепей аминокислоты с контактной поверхности первой молекулы антитела заменяют на более крупные боковые цепи (например, тирозин или триптофан). На контактной поверхности раздела второй молекулы антитела создают компенсирующие "полости", идентичные или близкие по размеру к крупной боковой цепи (цепям), путем замещения крупных аминокислотных боковых цепей на меньшие (например, аланин или треонин). Это обеспечивает механизм увеличения выхода гетеродимера по сравнению с нежелательными конечными продуктами, такими как гомодимеры.
Биспецифические антитела могут быть получены в виде полноразмерных антител или фрагментов антител (например, F(ab')2 биспецифических антител). Методики получения биспецифических антител из фрагментов антитела были описаны в литературе. Например, биспецифические антитела могут быть получены с использованием химических связей. Вгеппап et al., Science 229:81 (1985) описывают процедуру, в которой интактные антитела протеолитически расщепляют для получения фрагментов F(ab')2. Эти фрагменты восстанавливают в присутствии дитиольного комплексообразователя арсенита натрия для стабилизации вицинальных дитиолов и предотвращения образования межмолекулярных дисульфидных связей. Получаемые фрагменты Fab' затем превращают в тионитробензоатные (TNB) производные. Одно из производных Fab'-TNB затем снова превращают в Fab'-тиол путем восстановления меркаптоэтиламином и смешивают с эквимолярным количеством другого Fab'-TNB производного для образования биспецифического антитела. Продуцируемые биспецифическе антитела могут быть использованы в качестве агентов для селективной иммобилизации ферментов.
Дополнительно, фрагменты Fab' могут быть выделены непосредственно из Е. coli и химически связаны с образованием биспецифических антител. Shalaby et al., J. Exp.Med. 175:217-225 (1992) описывают продуцирование молекулы полностью гуманизированного биспецифического антитела F(ab')2. Каждый фрагмент Fab' отдельно секретируют из Е. coli и подвергают направленному химическому сочетанию in vitro для образования биспецифического антитела. Образованное таким образом биспецифическое антитело было способно связываться с клетками, надэкспрессирующими рецептор Erb2, и нормальными человеческими Т-клетками, а также запускать литическую активность человеческих цитотоксичных лимфоцитов против человеческих мишеней опухоли грудной железы.
Также были описаны различные методики получения и выделения биспецифических фрагментов антител непосредственно из рекомбинантных клеточных культур. Например, биспецифические антитела продуцировали с использованием лейциновых молний (Kostelny et al., J. Immunol. 148(5): 1547-1553 (1992)). Пептиды лейциновой молнии из белков Fos и Jun присоединяли к Fab'-участкам двух разных антител путем слияния генов. Гомодимеры антитела восстанавливали в шарнирной области для образования мономеров и затем повторно окисляли для образования гетеродимеров антитела. Этот способ также может быть использован для продуцирования гомодимеров антител. Технология "диател", описанная Hollinger et al., Proc. Natl. Acad. Sci. USA 90:6444-6448 (1993), обеспечивает альтернативный механизм получения биспецифических фрагментов антител. Фрагменты содержат вариабельный домен тяжелой цепи (VL), соединенный с вариабельным доменом легкой цепи (VH) с помощью линкера, который является слишком коротким для обеспечения возможности спаривания между двумя доменами одной и той же цепи. Соответственно, домены VH и VL. одного фрагмента вынуждены спариваться с комплементарными VL и VH доменами другого фрагмента, образуя при этом два антигенсвязывающих сайта. Также была описана другая стратегия получения биспецифических фрагментов антител с использованием одноцепочечных димеров Fv (sFv). См. Gruber et al, J. Immunol. 152:5368(1994).
Предусматриваются антитела с более чем двумя валентностями. Например, могут быть получены триспецифические антитела. Tutt et al., J. Immunol. 147:60(1991).
Типичные примеры биспецифических антител могут связываться с двумя разными эпитопами, по меньшей мере один из которых происходит от белкового антигена по изобретению. Альтернативно, анти-антигенная цепь молекулы иммуноглобулина может быть объединена с цепью, которая связывается с триггерной молекулой лейкоцита, такой как молекула Т-клеточного рецептора (например, CD2, CD3, CD28 или В7) или Fc рецепторы IgG (FcγR), такие как FcγRI (CD64), FcyRII (CD32) и FcγRIII (CD16), фокусирующие механизмы клеточной защиты на клеточной экспрессии конкретного антигена. Биспецифические антитела также могут быть использованы для нацеливания цитотоксичных агентов на клетки, экспрессирующие определенный антиген. Эти антитела содержат антигенсвязывающий фрагмент и фрагмент, связывающий цитотоксичный агент или комплексообразователь радионуклида, такой как EOTUBE, DPTA, DOTA или ТЕТА. Другое биспецифическое антитело, представляющее интерес, связывает описанный тут белковый антиген и дополнительно связывает тканевый фактор (TF).
Гетероконъюгат антитела также входит в объем настоящего изобретения. Гетероконъюгат антитела состоит из двух ковалентно соединенных антител. Такие антитела, например, были предложены для нацеливания клеток иммунной системы на нежелательные клетки (см. патент США №4676980) и для лечения инфекции ВИЛ (HIV) (см. WO 91/00360; WO 92/200373; ЕР 03089). Предусматривается, что антитела могут быть получены in vitro известными способами химического синтеза белков, включая способы с использованием сшивающих агентов. Например, иммунотоксины могут быть сконструированы с использованием реакции обмена дисульфида или путем образования тиоэфирной связи, Примеры пригодных для этого реагентов включают иминотиолат и метил-4-меркаптобутиримидат и материалы, раскрытые, например, в патенте США №4676980.
Может быть желательным модифицировать антитело по изобретению по отношению к его эффекторной функции, для того, чтобы повысить, например, эффективность антитела при лечении болезней и расстройств, ассоциированных с передачей сигналов IL-17F. Например, цистеиновый остаток (остатки) может быть введен в Fc-область, тем самым обеспечивая возможность образования межцепочечной дисульфидной связи в этой области. Полученное таким образом гомодимерное антитело может обладать повышенной способностью к интернализации и/или повышенной комплемент-медиируемой способностью к уничтожению клеток и опосредованной антителами клеточной цитотоксичностью (ADCC). (см. Caron et al., J. Exp Med., 176: 1191-1195 (1992) и Shopes, J. Immunol., 148: 2918-2922 (1992)). Альтернативно, может быть разработано антитело, имеющее сдвоенные Fc-области, которое благодаря этому обладает повышенной способностью к лизису комплемента и ADCC (см. Stevenson et al., Anti-Cancer Drug Design, 3:219-230 (1989)).
Изобретение также относится к иммуноконъюгатам, включающим антитело, конъюгированное с цитотоксичным агентом, таким как токсин (например, ферментативно активный токсин бактериального, грибкового, растительного или животного происхождения, или его фрагменты), или радиоактивный изотоп (т.е., радиоконъюгат).
Ферментативно активные токсины и их фрагменты, пригодные для использования, включают дифтерийную А-цепь, несвязывающие активные фрагменты дифтерийного токсина, А-цепь экзотоксина (из Pseudomonas aeruginosa), рициновую А-цепь, абриновую А-цепь, А-цепь модессина, альфа-сарцин, белки Aleurites fordii, белки dianthin, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор momordica charantia, курцин, кротин, ингибитор sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, еномицин и трикотецены. Разнообразные радионуклиды являются доступными для продуцирования радиоконъюгированных антител. Примеры включают 212Bi, 131I, 131In, 90Y и 186Re.
Конъюгаты антитела и цитотоксичного агента получают с использованием различных бифункциональных белок-связывающих агентов, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), иминотиолан (IT), бифункциональные производные сложных имидоэфиров (такие как диметиладипимидат-HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидо соединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол (tolyene)-2,6-диизоцианат), и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, рициновый иммунотоксин может быть получен, как описано Vitetta et al., Science 238: 1098 (1987). Меченая углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (МХ-DTPA) является типичным примером хелатирующего агента для конъюгации радионуклеотида с антителом (см. WO 94/11026).
Рядовому специалисту в данной области будет понятно, что широкий спектр возможных фрагментов может быть присоединен к получаемым антителам по изобретению (см., например, "Conjugate Vaccines", Contributions to Microbiology and Immunology, J. M. Cruse and R. E. Lewis, Jr (eds), Carger Press, New York, (1989), содержание которой целиком включено сюда в качестве ссылки).
Присоединение может быть осуществлено с помощью любой химической реакции, которая будет связывать две молекулы, при сохранеии антителом и другим фрагментом своих соответствующих активностей. Такое связывание может включать многие химические механизмы, например, ковалентное связывание, аффинное связывание, интеркаляцию, координационное связывание и комплексообразование. Предпочтительным связыванием, однако, является ковалентное связывание. Ковалентное связывание может быть достигнуто путем прямой конденсации имеющихся боковых цепей или путем включения внешних связывающих молекул. Многие бивалентные или поливалентные связующие агенты являются пригодными для связывания белковых молекул, таких как антитела по настоящему изобретению, с другими молекулами. Например, типичные связующие агенты могут включать органические соединения, такие как сложные тиоэфиры, карбодиимиды, сложные сукцинимидные эфиры, диизоцианаты, глутаральдегиды, диазобензолы и гексаметилендиамины. Этот перечень не должен рассматриваться как исчерпывающий по отношению к различным классам связующих агентов, известных специалистам, и скорее содержит типичные примеры наиболее распространенных связующих агентов (см. Killen and Lindstrom, Jour. Immun. 133:1335-2549 (1984); Jansen et al., Immunological Reviews 62:185-216 (1982); и Vitetta et al., Science 238:1098 (1987).
Предпочтительные линкеры описаны в литературе (см., например, Ramakrishnan, S. et al., Cancer Res. 44:201-208 (1984), где описано использование MBS (N-малеимидобензоил-N-гидроксисукцинимидный сложный эфир). См. также патент США №5030719, описывающий использование галогенированного производного ацетилгидразида, сопряженного с антителом с помощью олигопептидного линкера. Особенно предпочтительные линкеры включают: (i) EDC (1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорид; (ii) SMPT (4-сукцинимидилоксикарбонил-альфа-метил-альфа-(2-пиридилдитио)толуол (Pierce Chem. Co., Cat. (21558G); (iii) SPDP (сукцинимидил-6-[3-(2-пиридилдитио)-пропионамидо]гексаноат (Pierce Chem. Co., Cat #216510); (iv) Sulfo-LC-SPDP (сульфосукцинимидил-6-[3-(2-пиридилдитио)пропионамид]гексаноат (Pierce Chem. Co. Cat. #2165-G); и (v) сульфо-NHS (N-гидроксисульфосукцинимид: Pierce Chem, Co., Cat. #24510), конъюгированный с EDC.
Описанные выше линкеры содержат компоненты, имеющие различные характеристики, что приводит к получению конъюгатов с различными физико-химическими свойствами. Например, сложные эфиры сульфо-NHS с алкилкарбоксилатами являются более стабильными, чем сложные эфиры сульфо-NHS с ароматическими карбоксилатами. Линкеры, содержащие сложный эфир NHS, являются менее растворимыми, чем сложные эфиры сульфо-NHS. Кроме того, линкер SMPT содержит стерически затрудненную дисульфидную связь и может образовывать конъюгаты с повышенной стабильностью. Дисульфидные связи, в общем, являются менее стабильными, чем другие связи, потому что дисульфидная связь расщепляется in vitro, уменьшая количество доступного конъюгата. Сульфо-NHS, в частности, может повышать стабильность карбодиимидного связующего агента. Карбодиимидные связующие агенты (такие как EDC) при использовании совместно с сульфо-NHS образуют сложные эфиры, более устойчивые к гидролизу, чем соединения, полученные путем проведения одной лишь реакции карбодиимидного сочетания.
Антитела, раскрытые тут, также могут быть приготовлены в виде композиций иммунолипосом. Липосомы, содержащие антитело, получают известными специалистам способами, такими как описанные в Epstein et al., Proc. Natl. Acad. Sci. USA, 82: 3688 (1985); Hwang et al., Proc. Natl Acad. Sci. USA, 77: 4030 (1980); и патентах США №№4485045 и 4544545. Липосомы с увеличенным временем пребывания в циркуляции раскрыты в патенте США №5013556.
Особенно пригодные липосомы могут быть получены способом обращенно-фазового испарения из липидной композиции, содержащей фосфатидилхолин, холестерин и ПЭГ-дериватизованный фосфатидилэтаноламин (PEG-PE). Липосомы экструдируют через фильтры с определенным размером пор для получения липосом желательного диаметра. Фрагменты Fab' антитела по настоящему изобретению могут быть конъюгированы с липосомами, как описано Martin et al., J. Biol. Chem, 257: 286-288 (1982), с помощью реакции обмена дисульфида.
Использование антител против IL-17F
Следует понимать, что введение терапевтических частиц в соответствии с изобретением будет производиться с пригодными носителями, эксципиентами и другими агентами, которые включают в композиции для обеспечения улучшенного переноса, доставки, переносимости и т.п. Множество пригодных рецептур композиций можно найти в рецептурном справочнике, известном всем химикам-фармацевтам: Remington's Pharmaceutical Sciences (15th ed, Mack Publishing Company, Easton, PA (1975)), особенно, в Главе 87, авторов Blaug, Seymour. Такие композиции включают, например, порошки, пасты, жидкие мази, желе, воска, масла, липиды, липид (катионный или анионный)-содержащие везикулы (такие как Lipofectin™), ДНК-конъюгаты, безводные абсорбирующиеся пасты, эмульсии масло-в-воде и вода-в-масле, эмульсии карбовакс (carbowax) (полиэтиленгликоли разного молекулярного веса), полутвердые гели и полутвердые смеси, содержащие карбовакс. Любые из вышеперечисленных смесей могут быть пригодны для использования в лечении и терапиях в соответствии с настоящим изобретением, при условии, что активный ингредиент композиции не инактивируется композицией и композиция является физиологически совместимой и переносимой для пути введения. См. также Baldrick P. "Pharmaceutical excipient development: the need for preclinical guidance". Regul. Toxicol Pharmacol. 32(2):210-8 (2000), Wang W. "Lyophilization and development of solid protein pharmaceuticals". Int. J. Pharm. 203(1-2): 1-60 (2000), Charman WN "Lipids, lipophilic drugs, and oral drug delivery - some emerging concepts". J Pharm Sci. 89(8):967-78 (2000), Powell et al. "Compendium of excipients for parenteral formulations" PDA J Pharm Sci Technol. 52:238-311 (1998) и приведенные в них ссылки на дополнительную информацию, относящуюся к композициям, эксципиентам и носителям, хорошо известным химикам-фармацевтам.
В одном варианте исполнения, антитела по изобретению, которые включают моноклональное антитело по изобретению (например, полностью человеческое моноклональное антитело), могут быть использованы в качестве терапевтических агентов. Такие агенты будут обычно использоваться для диагностики, прогнозирования, контроля, лечения, облегчения и/или предотвращения болезни или патологии, ассоциированной с передачей сигналов IL-17F у субъекта. Схема лечения осуществляется путем идентификации субъекта, например, пациента, страдающего от (или с риском развития) воспалительной болезни или расстройства, с использованием стандартных способов. Препарат антитела, предпочтительно, имеющий высокую специфичность и высокую аффинность к его антигену-мишени, вводится субъекту и, обычно, проявляет эффект вследствие связывания с мишенью. Введение антитела может прекращать или ингибировать или препятствовать функции передачи сигналов мишени (например, IL-17F). Введение антитела может прекращать или ингибировать или препятствовать связыванию мишени (например, IL-17F) с эндогенным лигандом (например, IL-17R или IL-17RC), с которым он нормально связывается. Например, антитело связывается с мишенью и модулирует, блокирует, ингибирует, редуцирует, антагонизирует, нейтрализует или иначе препятствует IL-17F-индуцированному продуцированию провоспалительного цитокина.
Болезни или расстройства, связанные с передачей сигналов IL-17F, включают аутоиммунные болезни или воспалительные болезни или расстройства, включая, без ограничений, ревматоидный артрит, болезнь Крона, псориаз, рассеянный склероз, хроническую обструктивную болезнь легких и астму. Было обнаружено, что IL-17F подвергается повышающей регуляции в слюне пациентов с кистозным фиброзом (см. McAllister et al., J. Immunol. 175: 404-412 (2005)), и в ободочной кишке пациентов, страдающих от воспалительной болезни кишечника (см. Seiderer et al., Inflamm. Bowel Dis. Dec. 18 2007, электронная публикация до выхода из печати). Было показано, что IL-17A/IL-17F играют определенную роль в рекрутменте нейтрофилии дыхательных путей (airway neutrophilia), что позволяет предположить его участие в патогенезе респираторных болезней (см. Liang et al, J, Immunol. 179(11): 7791-9 (2007)).
Аутоиммунные болезни включают, например, синдром приобретенного иммунодефицита (СПИД, который представляет собой вирусную болезнь с аутоиммунным компонентом), гнездную алопецию, анкилозирующий спондилит, антифосфолипидный синдром, аутоиммунную аддисонову болезнь, аутоиммунную гемолитическую анемию, аутоиммунный гепатит, аутоиммунную болезнь внутреннего уха (AIED), аутоиммунный лимфопролиферативный синдром (ALPS), аутоиммунную тромбоцитопеническую пурпуру (АТР), болезнь Бехчета, кардиомиопатию, болезнь глютеновой недостаточности-герпетиформный дерматит; синдром хронической усталости-иммунной дисфункции (CFIDS), хроническую воспалительную демиелинизирующую полиневропатию (CIPD), рубцовый пемфигоид, болезнь холодового агглютинина, синдром crest, болезнь Крона, синдром Дегоса, ювенильный дерматомиозит, дискоидную волчанку, эссенциальную смешанную криоглобулинемию, фибромиалгию-фибромиозит, базедову болезнь, синдром Гийена-Барре, тиреоидит Хашимото, идеопатический пневмофиброз, идеопатическую тромбоцитопеническую пурпуру (ITP), IgA-нефропатию, инсулинозависимый сахарный диабет, ювенильный хронический артрит (болезнь Стилла), ювенильный ревматоидный артрит, болезнь Меньера, смешанную соединительнотканную болезнь, рассеянный склероз, тяжелую псевдопаралитическую миастению, пернициозную анемию, нодозный полиартериит, полихондрит, плюригландулярные синдромы, ревматическую полимиалгию, полимиозит и дерматомиозит, первичную агаммаглобулинемию, первичный билиарный цирроз, псориаз, псориатический артрит, феномен Рейно, синдром Рейтера, ревматическую лихорадку, ревматоидный артрит, саркоидоз, склеродермию (прогрессирующий системный склероз (PSS), также известный как системный склероз (SS)), синдром Шегрена, синдром негнущегося человека, системную красную волчанку, синдром Такаясу, височный артериит/гигантоклеточный артериит, неспецифический язвенный колит, увеит, витилиго и гранулематоз Вегенера.
Воспалительные расстройства включают, например, хронические и острые воспалительные расстройства. Примеры воспалительных расстройств включают болезнь Альцгеймера, астму, атопическую аллергию, аллергию, атеросклероз, бронхиальную астму, экзему, гломерулонефрит, болезнь "трансплантат против хозяина", гемолитические анемии, остеоартрит, сепсис, инсульт, трансплантацию ткани и органов, васкулит, диабетическую ретинопатию и вентилятор-индуцированное повреждение легких.
Было также показано, что повышающая регуляция IL-17F происходит путем передачи сигналов IL-21, что позволяет предположить, что провоспалительные эффекты, ассоциированные с передачей сигналов IL-21, медиируются IL-17F, в дополнение к IL-17A и/или комплексу IL-17F/IL17A (Wei et al., J Biol Chem. 282(48):34605-10 (2007)). Как таковые, антитела по изобретению также являются пригодными для диагностики, прогнозирования, мониторинга и/или лечения расстройств и болезней, медиируемых передачей сигналов IL-21, включая, без ограничений, воспалительные/аутоиммунные расстройства, такие как воспалительная болезнь кишечника, ревматоидный артрит, отторжение трансплантата и псориаз.
Антитела huIL-17F no изобретению являются пригодными для лечения, ослабления, задержки проявления и/или прогрессирования, или иного снижения тяжести артритного состояния или одного или нескольких его симптомов. До создания настоящего изобретения, в результате проведения исследований было определено, что IL-17F играет незначительную, или не играет вообще никакой роли, в развитии и/или прогрессировании аутоиммунных артритных состояний (см. Ishigame et al., Immunity, vol. 30: 108-119 (2009)). Эксперименты и данные, приведенные в примерах данного описания, демонстрируют неожиданный и удивительный результат, заключающийся в том, что модулирование, например, ингибирование, нейтрализация или иное блокирование, экспрессии и/или активности гомодимера IL-17F, но не гетеродимерного комплекса IL-17A/IL-17F, в значительной степени задерживает прогрессирование артритного состояния и снижает уровень воспалительных медиаторов, таких как TNF-α, IL-6, IFN-γ, IL-1α, МСР-1 и IL-12/IL-23 (р40) при коллаген-индуцированном артрите, являющемся животной моделью ревматоидного артрита.
Соответственно, изобретение включает способы лечения, ослабления, задержки проявления и/или прогрессирования, и/или облегчения симптома артритного состояния путем введения нуждающемуся в этом субъекту антитела huIL-17F по изобретению (например, 5Е12, 41В10, 11С5, 21В10, 1F1, 2Е12, 5D3, 22F8, 28В11, 41А4 и 43G6) или антитела, которое связывается с тем же или схожим эпитопом, что и антитело huIL-17F по изобретению. Антитело huIL-17F или антитело, которое связывается с тем же самым эпитопом, что и антитело huIL-17F по изобретению, вводится в количестве, достаточном для лечения, ослабления, задержки проявления, задержки прогрессирования, и/или облегчения одного или нескольких симптомов артритного состояния. Субъект, например, является человеком. В некоторых вариантах исполнения, артритное состояние представляет собой аутоиммунное артритное состояние, например, в некоторых вариантах исполнения, артритное состояние является ревматоидным артритом.
Симптомы, ассоциированные с воспалительными расстройствами, включают, например, воспаление, лихорадку, общее недомогание, лихорадку, боль, часто локализованную воспаленным участком, ускоренный пульс, боль или боли в суставе (артралгия), ускоренное дыхание или другой аномальный характер дыхания, озноб, спутанное сознание, дезориентацию, возбуждение, головокружение, кашель, диспноэ, легочные инфекции, сердечную недостаточность, дыхательную недостаточность, отек, увеличение веса, слизисто-гнойные рецидивы (mucopurulent relapses), кахексию, чихание, головную боль, и симптомы в брюшной полости, такие как, например, боль в животе, диарея или запор. Симптомы, ассоциированные с иммунными расстройствами, включают, например, воспаление, лихорадку, потерю аппетита, потерю веса, симптомы в брюшной полости, такие как, например, боль в животе, диарея или запор, боль или боли в суставе (артралгия), утомление, сыпь, анемию, крайнюю чувствительность к холоду (феномен Рейно), мышечную слабость, мышечное утомление, изменения тонуса кожи или ткани, одышку или другой аномальный характер дыхания, боль в груди или сокращение мышц грудной клетки, аномальную частоту сердцебиений (например, повышенную или пониженную), светочувствительность, расплывчатое или иное аномальное зрение, и пониженную функцию органа.
Терапевтически эффективное количество антитела по изобретению относится в общем к количеству, необходимому для достижения цели лечения. Как отмечалось выше, это может быть связующее взаимодействие между антителом и его антигеном-мишенью, которое, в определенных случаях, препятствует функционированию мишени. Количество, которое должно быть введено, будет дополнительно зависеть от аффинности связывания антитела с его специфическим антигеном, и будет также зависеть от скорости, с которой происходит истощение введенного антитела в свободном объеме другого субъекта, которому оно вводится. Обычные интервалы значений терапевтически эффективных доз антитела или фрагмента антитела по изобретению могут составлять, в качестве неограничивающего примера, от примерно 0,1 мг/кг веса тела до примерно 50 мг/кг веса тела. Обычная частота введения доз может составлять, например, от двух раз в день до раза в неделю.
Эффективность лечения определяют в сочетании с любым известным способом диагностики или лечения конкретного связанного с воспалением расстройства. Облегчение одного или нескольких симптомов связанного с воспалением расстройства указывает, что антитело проявляет клинический полезный эффект.
Способы скрининга антител, обладающих желательной специфичностью, включают, без ограничений, иммуноферментный твердофазовый анализ (ELISA) и другие иммунологически медиируемые методики, известные специалистам.
В другом варианте исполнения, антитела, направленные против IL-17F и/или комплекса IL-17F/IL17A, могут быть использованы в способах, известных специалистам, относящихся к локализации и/или количественному определению IL-17F или комплекса IL-17A/IL-17F (например, для использования при измерении уровней IL-17F и/или комплекса IL-17A/IL-17F в пригодных физиологических образцах, для использования в диагностических способах, для использования при визуализации белка и т.п.). В данном варианте исполнения, антитела, специфические по отношению к IL-17F и/или комплексу IL-17A/IL-17F, или их производное, фрагмент, аналог или гомолог, содержащие выделенный из антитела антигенсвязующий домен, используются в качестве фармакологически активных соединений (называемых тут и далее "лекарственными средствами").
В другом варианте исполнения, антитело, специфическое по отношению к IL-17F и/или гетеродимерному комплексу IL-17A/IL-17F, может быть использовано для выделения полипептида IL-17F и/или полипептида гетеродимерного комплекса IL-17A/IL-17F стандартными методами, такими как иммуноаффинность, хроматография или иммунопреципитация. Антитела, направленные против белка IL-17F и/или гетеродимерного комплекса IL-17A/IL-17F (или его фрагмента) могут быть использованы диагностически для контроля уровней белка в ткани в качестве части процедуры клинического тестирования, например, для определения эффективности данной схемы лечения. Детектированию может способствовать связывание (т.е., физическое связывание) антитела с детектируемым веществом. Примеры детектируемых веществ включают различные ферменты, простетические группы, флуоресцентные материалы, люминесцентные материалы, биолюминесцентные материалы и радиоактивные материалы. Примеры пригодных ферментов включают пероксидазу хрена, щелочную фосфатазу, β-галактозидазу или ацетилхолинэстеразу; примеры пригодных комплексов простетических групп включают стрептавидин/биотин и авидин/биотин; примеры пригодных флуоресцентных материалов включают умбеллиферон, флуоресцеин, флуоресцеинизотиоцианат, родамин, дихлортриазиниламинфлуоресцеин, дансилхлорид или фикоэритрин; примером люминесцентного материала является люминол; примеры биолюминесцентных материалов включают люциферазу, люциферин и экворин, и примеры пригодных радиоактивных материалов включают 125I, 131I, 35S или 3H
В еще одном варианте исполнения, антитело в соответствии с изобретением может быть использовано в качестве агента для детектирования присутствия IL-17F (или его белкового фрагмента) в образце. В некоторых вариантах исполнения, антитело содержит детектируемую метку. Антитела являются поликлональными, или более предпочтительно, моноклональными. Используется интактное антитело или его фрагмент (например, Fab, scFv, или F(ab)2). Подразумевается, что термин "меченый", по отношению к зонду или антителу, охватывает прямое мечение зонда или антитела путем присоединения (т.е., физического связывания) детектируемого вещества к зонду или антителу, а также непрямое мечение зонда или антитела путем его взаимодействия с другим реагентом, который является меченым непосредственно. Примеры непрямого мечения включают детектирование первичного антитела с использованием флуоресцентно-меченого вторичного антитела и мечение концевого участка ДНК-зонда биотином, так чтобы его можно было детектировать с помощью флуоресцентно-меченого стрептавидина. Подразумевается, что термин "биологический образец" включает ткани, клетки и биологические жидкости, полученные от субъекта, а также ткани, клетки и жидкости, присутствующие в субъекте. Использование термина "биологический образец", таким образом, включает кровь и фракцию или компонент крови, включая сыворотку крови, плазму крови или лимфу. Таким образом, способ детектирования по изобретению может быть использован для детектирования аналита мРНК, белка или геномной ДНК в биологическом образце in vitro, а также in vivo. Например, in vitro методики детектирования аналита мРНК включают гибридизации с использованием нозерн-блоттинга и гибридизации in situ. In vitro методики для детектирования аналита белка включают твердофазовые иммуноферментные анализы (ELISAs), вестерн- блоттинг, иммунопреципитации и иммунофлуоресценцию. In vitro методики детектирования аналита геномной ДНК включают саузерн-гибридизации. Процедуры проведения иммуноанализов описаны, например, в "ELISA: Theory and Practice: Methods in Molecular Biology", Vol.42, J. R. Crowther (Ed.) Human Press, Totowa, NJ, 1995; "Immunoassay", E. Diamandis and T. Christopoulus, Academic Press, Inc., San Diego, CA, 1996; и "Practice and Theory of Enzyme Immunoassays", P. Tijssen, Elsevier Science Publishers, Amsterdam, 1985. Кроме того, in vivo методики детектирования аналита белка включают введение субъекту меченого антитела против аналита белка, например, антитело может быть меченым радиоактивным маркером, присутствие и локализация которого у субъекта может быть детектировано стандартными методиками визуализации.
Терапевтическое введение и композиции антител huIL-17F
Антитела по изобретению (также называемые тут "активными соединениями"), и их производные, фрагменты, аналоги и гомологи, могут быть включены в фармацевтические композиции, пригодные для введения. Принципы и соображения, связанные с приготовлением таких композиций, а также рекомендации по выбору компонентов приведены, например, в Remington's Pharmaceutical Sciences: The Science and Practice Of Pharmacy 19th ed. (Alfonso R. Gennaro, et al., editors) Mack Pub. Co., Easton, Pa.: 1995; Drug Absorption Enhancement: Concepts, Possibilities, Limitations, and Trends, Harwood Academic Publishers, Langhorne, Pa., 1994; и Peptide and Protein Drug Delivery (Advances In Parenteral Sciences, Vol.4), 1991, M. Dekker, New York.
Такие композиции типично содержат антитело и фармацевтически приемлемый носитель. В тех случаях, когда используются фрагменты антитела, предпочтительным является наименьший ингибирующий фрагмент, который специфически связывается со связывающим доменом белка-мишени. Например, на основании последовательности вариабельной области антитела, могут быть сконструированы пептидные молекулы, которые сохраняют способность связывать последовательность белка-мишени. Такие пептиды могут быть синтезированы химически и/или получены по технологии рекомбинантной ДНК (см., например, Marasco et al., Proc. Natl. Acad. Sci. USA, 90: 7889-7893 (1993)).
В используемом тут значении, термин "фармацевтически приемлемый носитель" должен включать любые и все растворители, дисперсионные среды, покрытия, антибактериальные и антигрибковые агенты, изотонические агенты и средства, замедляющие всасывание, и т.п., совместимые с фармацевтическим введением. Пригодные носители описаны в последнем издании Remington's Pharmaceutical Sciences, являющемся стандартным справочным источником в данной области, который включен сюда в качестве ссылки. Предпочтительные примеры таких носителей или разбавителей включают, без ограничений, воду, солевой раствор, растворы Рингера, декстрозный раствор и 5% альбумин человеческой сыворотки. Также могут быть использованы липосомы и неводные носители, такие как невысыхающие масла. Использование таких сред и агентов для фармацевтически активных веществ хорошо известно специалистам. За исключением случаев несовместимости любой обычной среды или агента с активным соединением, предусматривается их использование в композициях.
Композиции, предназначенные для in vivo введения, должны быть стерильными. Это легко достигается путем фильтрации через мембраны для стерильной фильтрации.
Фармацевтическая композиция по изобретению составляется так, чтобы она была совместимой с ее предполагаемым путем введения. Примеры путей введения включают парентеральное, например, внутривенное, интрадермальное, подкожное, пероральное (например, ингаляция), трансдермальное (т.е., местное), трансмукозальное и ректальное введение. Растворы или суспензии, используемые для парентерального, интрадермального или подкожного применения, могут включать следующие компоненты: стерильный разбавитель, такой как вода для инъекций, солевой раствор, невысыхающие масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные агенты, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие агенты, такие как этилендиаминтетрауксусная кислота (EDTA); буферы, такие как ацетаты, цитраты или фосфаты, и агенты для регулировки тоничности, такие как хлорид натрия или декстроза. Величина рН может быть отрегулирована с помощью кислот или оснований, таких как хлористоводородная кислота или гидроксид натрия. Парентеральный препарат может быть заключен в ампулы, шприцы одноразового пользования или флаконы с многократными дозами, изготовленные из стекла или пластика.
Фармацевтические композиции, пригодные для инъекционного применения, включают стерильные водные растворы (в тех случаях, когда они являются водорастворимыми) или дисперсии и стерильные порошки для экстемпорального приготовления стерильных растворов или дисперсии для инъекций. Для внутривенного введения, пригодные носители включают физиологический солевой раствор, бактериостатическую воду, Cremophor EL™ (BASF, Parsippany, N.J.) или забуференный фосфатом солевой раствор (PBS). Во всех случаях, композиция должна быть стерильной и должна быть остаточно жидкой для обеспечения возможности легкого введения шприцем. Она должна быть стабильной в условиях производства и хранения и должна быть защищена от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Носитель может быть растворителем или дисперсионной средой, содержащей, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т.п.), и их пригодные смеси. Надлежащая текучесть может поддерживаться, например, путем использования покрытия, такого как лецитин, путем поддержания требуемого размера частиц в случае дисперсии и путем использования поверхностно-активных веществ. Предотвращение действия микроорганизмов может быть достигнуто различными антибактериальными и антигрибковыми агентами, например, парабенами, хлорбутанолом, фенолом, аскорбиновой кислотой, тимеросалом и т.п. Во многих случаях, будет предпочтительным включение в композицию изотонических агентов, например, Сахаров, многоатомных спиртов, таких как маннит, сорбит, хлорида натрия. Замедленное всасывание композиций для инъекций может быть достигнуто путем включения в композицию агента, замедляющего всасывание, например, моностеарата алюминия и желатина.
Стерильные растворы для инъекций могут быть получены путем включения активного соединения в требуемом количестве в пригодный растворитель с одним или комбинацией ингредиентов, перечисленных выше, при необходимости, с последующей стерилизацией фильтрованием. Обычно, дисперсии готовят путем включения активного соединения в стерильный носитель, содержащий основную дисперсионную среду и другие необходимые ингредиенты из вышеперечисленных. В случае стерильных порошков для приготовления стерильных растворов для инъекций, способами получения являются вакуумная сушка и лиофилизация, которые позволяют получить порошок активного ингредиента плюс любого дополнительного желательного ингредиента из их предварительно стерилизованного фильтрованием раствора.
Пероральные композиции обычно включают инертный разбавитель или пищевой носитель. Они могут быть заключены в желатиновые капсулы или спрессованы в таблетки. Для перорального терапевтического введения, активное соединение может быть объединено с эксципиентами и использовано в форме таблеток, пастилок или капсул. Пероральные композиции также могут быть получены с использованием жидкого носителя для применения в качестве жидкости для полоскания рта, где соединение в жидком носителе применяется в полости рта путем полоскания и сплевывания или проглатывания. Фармацевтически совместимые связующие и/или вспомогательные материалы могут быть включены в композицию. Таблетки, пилюли, капсулы, пастилки и т.п. могут содержать любые из следующих ингредиентов, или соединения схожей природы: связующее, такое как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; эксципиент, такой как крахмал или лактоза, распадающееся вещество, такое как альгиновая кислота, материал Primogel, или кукурузный крахмал; смазывающее вещество, такое как стеарат магния или материал Sterotes; скользящее вещество, такое как коллоидная двуокись кремния; подсластитель, такой как сахароза или сахарин; или вкусовое вещество, такое как перечная мята, метилсалицилат или апельсиновый ароматизатор.
Для введения путем ингаляции, соединения доставляются в форме распыляемого аэрозоля из находящегося под давлением контейнера или дозирующего устройства, содержащего пригодный пропелент, например, газ, такой как двуокись углерода, или распылителя.
Системное введение также может быть осуществлено трансмукозальными или трансдермальными средствами. Для трансмукозального или трансдермального введения, в композиции используются пенетранты, соответствующие барьеру, который требуется преодолеть. Такие пенетранты широко известны специалистам, и включают, например, для трансмукозального введения, детергенты, желчные соли и производные фусидовой кислоты. Трансмукозальное введение может быть осуществлено путем использования назальных спреев или суппозиториев. Для трансдермального введения, активные соединения вводят в композиции жидких мазей, мазей, гелей или кремов, как хорошо известно специалистам.
Соединения также могут быть приготовлены в форме суппозиториев (например, с обычной основой суппозитория, такой как какао-масло, и другими глицеридами) или удерживающих клизм для ректальной доставки.
В одном варианте исполнения, активные соединения готовят с носителями, которые будут защищать соединение от быстрого выведения из организма, такими как композиции с замедленным/контролируемым высвобождением, включая имплантаты и микроинкапсулированные системы доставки. Могут быть использованы биодеградируемые, биосовместимые полимеры, такие как этилен-винилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Способы приготовления таких композиций будут известны квалифицированным специалистам.
Например, активные ингредиенты могут быть заключены в микрокапсулы, приготовленные, например, методами коацервации или межфазной полимеризации, например, гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли(метилметакрилатные) микрокапсулы, соответственно, в коллоидных системах доставки лекарственного средства (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы), или макроэмульсии.
Могут быть приготовлены препараты с замедленным высвобождением. Пригодные примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие антитело, причем матрицы имеют форму фигурных изделий, например, пленок, или микрокапсул. Примеры матриц с замедленным высвобождением включают сложные полиэфиры, гидрогели (например, поли-(2-гидроксиэтилметакрилат) или поливиниловый спирт)), полилактиды (патент США №3773919), сополимеры L-глутаминовой кислоты и γ-этил-L-глутамата, недеградирующий этилен-винилацетат, деградирующие сополимеры молочной кислоты-гликолевой кислоты, такие как LUPRON DEPOT™ (микросферы для инъекций, состоящие из сополимера молочной кислоты-гликолевой кислоты и лейпролид ацетат), и поли-D-(-)-3-оксимасляную кислоту. Если полимеры, такие как этилен-винилацетат и молочная кислота-гликолевая кислота, обеспечивают высвобождение молекул на протяжении более чем 100 дней, то определенные гидрогели высвобождают белки в течение более коротких периодов времени.
Материалы также могут быть получены коммерчески от фирмы Alza Corporation и Nova Pharmaceuticals, Inc. Липосомальные суспензии (включающие липосомы, нацеленные на инфицированные клетки моноклональными антителами к вирусным антигенам) также могут быть использованы в качестве фармацевтически приемлемых носителей. Они могут быть получены в соответствии со способами, известными квалифицированным специалистам, например, как описано в патенте США №4522811.
Особенно предпочтительно, композиции для перорального или парентерального введения составляют в виде дозированной лекарственной формы для простоты введения и единообразия доз. Дозированная лекарственная форма, в используемом тут значении, относится к физически дискретным единицам, пригодным для использования в качестве разовых доз для нуждающегося в лечении субъекта; каждая единица содержит предварительно определенное количество активного соединения, рассчитанное на создание желательного терапевтического эффекта, в сочетании с требуемым фармацевтическим носителем. Требования к дозированным лекарственным формам по изобретению продиктованы и напрямую зависят от уникальных характеристик активного соединения и конкретного терапевтического эффекта, который должен быть достигнут, и от ограничений, существующих в технологии составления композиций такого активного соединения для лечения пациентов.
Фармацевтические композиции могут быть заключены в контейнер, упаковку или дозирующее устройство, вместе с инструкциями по введению.
Композиция также может содержать несколько активных соединений, если это необходимо при конкретном показании, лечение которого проводится, предпочтительно, обладающих взаимодополняющими активностями, которые не будут оказывать неблагоприятного влияния друг на друга. Альтернативно, или кроме этого, композиция может содержать агент, усиливающий ее функцию, такой как, например, цитотоксичный агент, цитокин, химиотерапевтический агент или агент, ингибирующий рост.Такие молекулы пригодно присутствуют в комбинации в количествах, эффективных для их предполагаемого назначения.
В одном варианте исполнения, активные соединения вводят в виде комбинированной терапии, т.е., в сочетании с другими агентами, например, терапевтическими агентами, пригодными для лечения патологических состояний или расстройств, таких как аутоиммунные расстройства и воспалительные болезни. Термин "в сочетании" в данном контексте означает, что агенты вводятся по существу в одно время, будь то одновременно или поочередно. При поочередном введении, при начале введения второго соединения, первое из двух соединений, предпочтительно, еще детектируется в эффективных концентрациях на участке проведения лечения.
Например, комбинированная терапия может включать одно или несколько антител по изобретению, в совместной композиции с, и/или при совместном введении с, одним или несколькими дополнительными терапевтический агентами, например, одним или несколькими цитокинами и ингибиторами фактора роста, иммунодепрессантами, противовоспалительными агентами, ингибиторами метаболизма, ингибиторами ферментов и/или цитотоксичными или цитостатическими агентами, как детальнее описано ниже. Кроме того, одно или несколько антител, описанных тут, могут быть использованы в комбинации с двумя или больше терапевтическими агентами, описанными тут. Такие комбинированные терапии могут предпочтительно использовать более низкие дозы вводимых терапевтических агентов, тем самым избегая возможных токсичностей или осложнений, ассоциированных с различными монотерапиями.
Предпочтительными терапевтическими агентами, используемыми в комбинации с антителом по изобретению, являются агенты, создающие препятствия на разных стадиях воспалительной реакции. В одном варианте исполнения, одно или несколько антител, описанных тут, могут быть приготовлены в виде совместной композиции с, и/или введены совместно с, одним или несколькими дополнительными агентами, такими как другие антагонисты цитокина или фактора роста (например, растворимые рецепторы, пептидные ингибиторы, малые молекулы, лиганды слияния); или антитела или их антигенсвязывающие фрагменты, которые связываются с другими мишенями (например, антитела, которые связываются с другими цитокинами или факторами роста, их рецепторы, или другие молекулы клеточной поверхности); и противовоспалительные цитокины или их агонисты. Неограничивающие примеры агентов, пригодных для использования в комбинации с антителами, описанными тут, включают, без ограничений, антагонисты одного или нескольких интерлейкинов (ILs) или их рецепторов, например, антагонисты IL-1, IL-2, IL-6, IL-7, IL-8, IL-12, IL-13, IL-15, IL-16, IL-18, IL-21 и IL-22; антагонисты цитокинов или факторов роста или их рецепторов, таких как фактор некроза опухолей (TNF), LT, EMAP-11, GM-CSF, FGF и PDGF. Антитела по изобретению также могут быть объединены с ингибиторами, например, антителами против молекул клеточной поверхности, таких как CD2, CD3, CD4, CD8, CD20 (например, ингибитор CD20 ритуксимаб (RITUXAN®)), CD25, CD28, CD30, CD40, CD45, CD69, CD80 (В7.1), CD86 (В7.2), CD90, или их лигандов, включая CD154 (gp39 или CD40L), или LFA-1/1САМ-1 и VLA-4/VCAM-1 (Yusuf-Makagiansar et al. (2002) Med. Res. Rev. 22:146-67). Предпочтительные антагонисты, пригодные для использования в комбинации с антителами, описанными тут, включают антагонисты IL-1, IL-12, TNFα, IL-15, IL-18, и 1L-22.
Примеры таких агентов включают антагонисты IL-12, такие как химерные, гуманизированные, человеческие или полученные in vitro антитела (или их антигенсвязывающие фрагменты), которые связываются с IL-12 (предпочтительно, человеческим IL-12), например, антитело, раскрытое в WO 00/56772; ингибиторы рецептора IL-12, например, антитела против человеческого рецептора IL-12; и растворимые фрагменты рецептора IL-12, например человеческого рецептора IL-12. Примеры антагонистов IL-15 включают антитела (или их антигенсвязывающие фрагменты) против IL-15 или его рецептора, например химерные, гуманизированные, человеческие или полученные in vitro антитела против человеческого IL-15 или его рецептора, растворимых фрагментов рецептора IL-15 и IL-15-связывающих белков. Примеры антагонистов IL-18 включают антитела, например, химерные, гуманизированные, человеческие или полученные in vitro антитела (или их антигенсвязывающие фрагменты), против человеческого IL-18, растворимых фрагментов рецептора IL-18 и IL-18-связывающих белков (IL-18BP). Примеры антагонистов IL-1 включают ингибиторы интерлейкин-1-превращающего фермента (ICE), такие как Vx740, антагонисты IL-1, например, IL-1RA (anikinra, KINERET™, Amgen), sILIRII (Immunex), и антитела против рецептора IL-1 (или их антигенсвязывающие фрагменты).
Примеры антагонистов TNF включают химерные, гуманизированные, человеческие или полученные in vitro антитела (или их антигенсвязывающие фрагменты) против TNF (например, человеческого TNFa), такие как (HUMIRA™, D2E7, антитело человеческого TNFa), CDP-571/CDP-870/BAY-10-3356 (гуманизированное антитело против TNFα; Celltech/Pharmacia), cA2 (химерное антитело против TNFa; REMICADE®, Centocor); фрагменты антитела против TNF (например, CPD870); растворимые фрагменты рецепторов TNF, например, р55 или р75 рецепторы человеческого TNF или их производные, например, 75 kdTNFR-IgG (слитый белок 75 кДа рецептора TNF-IgG, ENBREL™; Immunex), р55 kdTNFR-IgG (слитый белок 55 кДа рецептора TNF-IgG (LENERCEPT®)); антагонисты ферментов, например, ингибиторы TNFα-превращающего фермента (ТАСЕ) (например, производное альфа-сульфонилгидроксамовой кислоты, и N-гидроксиформамидный ингибитор ТАСЕ GW 3333, -005 или -022); и TNF-bp/s-TNFR (растворимый TNF-связывающий белок). Предпочтительными антагонистами TNF являются растворимые фрагменты рецепторов TNF, например, р55 или р75 рецепторы человеческих TNF или их производные, например, 75 kdTNFR-IgG, и ингибиторы TNFα превращающего фермента (ТАСЕ).
В других вариантах исполнения, описанные тут антитела могут быть введены в комбинации с одним или несколькими из следующих материалов: антагонисты IL-13, например, растворимые рецепторы IL-13 (slL-13) и/или антитела против IL-13 антагонисты; IL-2, например, DAB 486-IL-2 и/или DAB 389-IL-2 (слитые белки IL-2, Seragen), и/или антитела против IL-2R, например, anti-Tac (гуманизированное aHTH-IL-2R, Protein Design Labs). Еще одна комбинация включает антитела по изобретению, антагонистические малые молекулы, и/или ингибирующие антитела в комбинации с неистощающимися (nondepleting) анти-CD4 ингибиторами (DEC-CE9.1/SB 210396; неистощающимся приматизированным анти-CD4 антителом; IDEC/SmithKline). Еще другие предпочтительные комбинации включают антагонисты костимулирующего пути CD80 (В7.1) или CD86 (В7.2), включая антитела, растворимые рецепторы или антагонистические лиганды; а также лиганд п-селектинового гликопротеина (PSGL), противовоспалительные цитокины, например, IL-4 (DNAX/Schering); IL-10 (SCH 52000; рекомбинантный IL-10 DNAX/Schering); IL-13 и TGF-β, и их агонисты (например, агонистические антитела).
В других вариантах исполнения, одно или несколько антител по изобретению могут быть приготовлены в виде совместной композиции с, и/или введены овместно с, одним или несколькими противовоспалительными лекарственными препаратами, иммунодепрессантами или ингибиторами метаболизма или ферментов. Неограничивающие примеры лекарственных средств или ингибиторов, пригодных для использования в комбинации с антителами, описанными тут, включают, без ограничений, один или несколько из таких материалов: нестероидный противовоспалительный лекарственный препарат (препараты) (NSAIDs), например, ибупрофен, тенидап, напроксен, мелоксикам, пироксикам, диклофенак и индометацин; сульфасалазин; кортикостероиды, такие как преднизолон; цитокин-супрессорный противовоспалительный лекарственный препарат (препараты) (CSAIDs); ингибиторы биосинтеза нуклеотидов, например, ингибиторы биосинтеза пурина, антагонисты фолата (например, метотрексат (N-[4-[[(2,4-диамино-6-птеридинил)метил]метиламино]бензоил]-L-глутаминовая кислота); и ингибиторы биосинтеза пиримидина, например, ингибиторы дигидрооротатдегидрогеназы (DHODH). Предпочтительные терапевтические агенты для использования в комбинации с антителами по изобретению включают NSAIDs, CSAIDs, ингибиторы (DHODH) (например, лефлуномид), и антагонисты фолата (например, метотрексат).
Примеры дополнительных ингибиторов включают один или несколько из таких материалов: кортикостероиды (перорально, ингаляции и местные инъекции); иммунодепрессанты, например, циклоспорин, такролимус (FK-506); и ингибиторы mTOR, например, сиролимус (рапамицин - RAPAMUNE™ или производные рапамицина, например, растворимые производные рапамицина (например, сложноэфирные производные рапамицина, например, CCI-779); агенты, препятствующие передаче сигналов провоспалительными цитокинами, такими как TNFa или IL-1 (например, IRAK, NIK, IKK, р38 или ингибиторы MAP киназы); ингибиторы СОХ2, например, целекоксиб, рофекоксиб, и их варианты; ингибиторы фосфодиэстеразы, например, R973401 (ингибитор фосфодиэстеразы типа IV); ингибиторы фосфолипазы, например, ингибиторы цитозольной фосфолипазы 2 (cPLA2) (например, аналоги трифторметилкетона); ингибиторы фактора роста клеток сосудистого эндотелия или рецептора фактора роста, например, ингибитор VEGF и/или ингибитор VEGF-R; и ингибиторы ангиогенеза. Предпочтительными терапевтическими агентами для использования в комбинации с антителами по изобретению являются иммунодепрессанты, например, циклоспорин, такролимус (FK-506); ингибиторы mTOR, например, сиролимус (рапамицин) или производные рапамицина, например, растворимые производные рапамицина (например, сложноэфирные производные рапамицина, например, CCI-779); ингибиторы СОХ2, например, целекоксиб и его варианты; и ингибиторы фосфолипазы, например, ингибиторы цитозольной фосфолипазы 2 (cPLA2), например, аналоги трифторметилкетона.
Дополнительные примеры терапевтических агентов, которые могут быть скомбинированы с антителом по изобретению, включают один или несколько из таких материалов: 6-меркаптопурины (6-МР); азатиоприн сульфасалазин; месалазин; олсалазин; хлороквин/гидроксихлороквин (PLAQUENIL®); пеницилламин; ауротиорналат (внутримышечно и перорально); азатиоприн; колхицин (coichicine); агонисты бета-2 адренорецептора (салбутамол, тербуталин, салметерал); ксантины (теофиллин, арнинофиллин); кромогликат; недокромил; кетотифен; ипратропиум и окситропиум; микофенолат мофетил; агонисты аденозина; антитромботические агенты; ингибиторы комплемента; и адренергические агенты.
Неограничивающие примеры агентов для лечения или профилактики артритных расстройств (например, ревматоидного артрита, воспалительного артрита, ревматоидного артрита, ювенильного ревматоидного артрита, остеоартрита и псориатического артрита), с которыми может быть скомбинировано антитело по изобретению, включают один или несколько из следующих материалов: антагонисты IL-12, как описано тут; NSAIDs; CSAIDs; TNFs, например, антагонисты TNFα, как описано тут; неистощающиеся анти-CD4 антитела, как описано тут; антагонисты IL-2, как описано тут; противовоспалительные цитокины, например, IL-4, IL-10, IL-13 и TGFα, или их агонисты; антагонисты IL-1 или рецептора IL-1, как описано тут; ингибиторы фосфодиэстеразы, как описано тут; ингибиторы Сох-2, как описано тут; илопрост: метотрексат; талидомид и родственные с талидомидом лекарственные средства (например, Celgen); лефлуномид; ингибитор активации плазминогена, например, транексамовая кислота; ингибитор цитокина, например, Т-614; простагландин EI; азатиоприн; ингибитор интерлейкин-1 превращающего фермента (ICE); ингибитор zap-70 и/или Ick (ингибитор тирозинкиназы zap-70 или Ick); ингибитор фактора роста клеток сосудистого эндотелия или рецептора фактора роста клеток сосудистого эндотелия, как описано тут; ингибитор ангиогенеза, как описано тут; кортикостероидные противовоспалительные лекарственные препараты (например, SB203580); ингибиторы TNF-конвертазы; ингибиторы IL-11; IL-13; IL-17; золото; пеницилламин; хлороквин; гидроксихлороквин; хлорамбуцил; циклофосфамид; циклоспорин; тотальное лимфоидное облучение; антитимоцитарный иммуноглобулин; СОб-токсины; перорально вводимые пептиды и коллаген; лобензарит динатрий; цитокин-регулирующие агенты (CRAs) НР228 и НР466 (Houghten Pharmaceuticals, Inc.); ICAM-1 антисмысловые фосфоротиоатные олигодезоксинуклеотиды (ISIS 2302; Isis Pharmaceuticals, Inc.); растворимый рецептор 1 комплемента (ТР10; Т Cell Sciences, Inc.); преднизон; орготеин; гликозминогликан полисульфат; миноциклин (MINOCIN®); анти-IL-2F антитела; липиды морских организмов и растительные (botanical) липиды (жирные кислоты рыб и растительных семян); ауранофм (auranofm); фенилбутазон; меклофенамовая кислота; флуфенамовая кислота; иммуноглобулин внутривенно; зилеутон; микофеноловая кислота (RS-61443); такролимус (FK-506); сиролимус (рапамицин); амиприлоз (терафектин); кладрибин (2-хлордезоксиаденозин); и азарибин. Предпочтительные комбинации включают одно или несколько антител по изобретению в комбинации с метотрексатом или лефлуномидом и, в случае умеренной тяжести или тяжелого ревматоидного артрита, циклоспорин.
Предпочтительные примеры ингибиторов для использования в комбинации с антителами по изобретению для лечения артритных расстройств включают антагонисты TNF (например, химерные, гуманизированные, человеческие или полученные in vitro антитела, или их антигенсвязывающие фрагменты, которые связываются с TNF; растворимые фрагменты рецептора TNF, например, р55 или р75 человеческого рецептора TNF или их производные, например, 75 kdTNFR-IgG (слитый белок 75 кДа рецептора TNF-IgG,. ENBREL™), слитый белок р55 кДа рецептора TNF-IgG; антагонисты фермента TNF, например, ингибиторы TNFα-превращающего фермента (ТАСЕ)); антагонисты IL-12, IL-15, IL-18, IL-22; агенты, снижающие количество Т-клеток и В-клеток (например, анти-CD4 или анти-CD22 антитела); малые молекулы-ингибиторы, например, метотрексат и лефлуномид; сиролимус (рапамицин) и его аналоги, например, ингибиторы CCI-779; сох-2 и CPLA2; NSAIDs; ингибиторы р38, TPL-2, ингибиторы Mk-2 и NFkb; RAGE или растворимый RAGE; Р-селектин или ингибиторы PSGL-1 (например, малые молекулы-ингибиторы, антитела против него, например, антитела против Р-селектина); агонисты бета-рецептора эстрогена (ERB) или антагонисты ERB-NFkb. Наиболее предпочтительные дополнительные терапевтические агенты которые могут быть совместно введены и/или приготовлены в виде совместных композиций с одним или несколькими антителами по изобретению, включают один или несколько из: растворимого фрагмента рецептора TNF, например, р55 или р75 человеческого рецептора TNF, или их производные, например, 75 kdTNFR-IgG (слитый белок 75 кДа рецептора TNF-IgG, ENBREL™); метотрексата, лефлуномида, или сиролимуса (рапамицина) или его аналога, например, CCl-779.
Неограничивающие примеры агентов для лечения или профилактики рассеянного склероза, с которыми могут быть скомбинированы антитела по изобретению, включают следующие материалы: интерфероны, например, интерферон-альфа Ia (например, AVONEX™, Biogen) и интерферон-lb (BETASERON™ Chiron/Berlex); Copolymer 1 (Сор-1; COPAXONE™ Teva Pharmaceutical Industries, Inc.); кислород под повышенным давлением; иммуноглобулин внутривенно; кладрибин; антагонисты TNF, как описано тут; кортикостероиды; преднизолон; метилпреднизолон; азатиоприн; циклофосфамид; циклоспорин; циклоспорин А, метотрексат; 4-аминопиридин; и тизанидин. Дополнительные антагонисты, пригодные для использования в комбинации с антителами по изобретению, включают антитела против или антагонисты других человеческих цитокинов или факторов роста, например, TNF, LT, IL-1, IL-2, IL-6, EL-7, IL-8, IL-12 IL-15, IL-16, IL-18, EMAP-11, GM-CSF, FGF и PDGF. Антитела, описанные тут, могут быть объединены с антителами против молекул клеточной поверхности, таких как CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD80, CD86, CD90 или их лиганды. Антитела по изобретению также могут быть скомбинированы с такими агентами, как метотрексат, циклоспорин, FK506, рапамицин, микофенолат мофетил, лефлуномид, NSAIDs, например, ибупрофен, кортикостероиды, такие как преднизолон, ингибиторы фосфодиэстеразы, агонисты аденозина, антитромботические агенты, ингибиторы комплемента, адренергические агенты, агенты, препятствующие передаче сигналов провоспалительными цитокинами, как описано тут, ингибиторы IL-Ib-превращающего фермента (например, V×740), анти-P7s, PSGL, ингибиторы ТАСЕ, ингибиторы передачи сигналов Т-клеток, такие как ингибиторы киназы, ингибиторы металлопротеиназы, сульфасалазин, азатлоприн, 6-меркаптопурины, ингибиторы ангиотензин-превращающего фермента, растворимые рецепторы цитокинов и их производные, как описано тут, и противовоспалительные цитокины (например, IL-4, IL-10, IL-13 и TGF).
Предпочтительные примеры терапевтических агентов для рассеянного склероза, с которыми могут быть скомбинированы антитела по изобретению, включают интерферон-р, например, IFNβ-1a и IFNβ-1b; копаксон, кортикостероиды, IL-1 ингибиторы, ингибиторы TNF, антитела против лиганда CD40 и CD80, антагонисты IL-12.
Неограничивающик примеры агентов для лечения или профилактики воспалительной болезни кишечника (например, болезнь Крона, неспецифический язвенный колит), с которыми может быть скомбинировано антитело по изобретению, включают такие материалы: буденозид; эпидермальный фактор роста; кортикостероиды; циклоспорин; сульфасалазин; аминосалицилаты; 6-меркаптопурин; азатиоприн; метронидазол; ингибиторы липоксигеназы; месаламин; олсалазин; балсалазид; антиоксиданты; ингибиторы тромбоксана; антагонисты рецептора IL-1; анти-IL-1 моноклональные антитела; анти-IL-S моноклональные антитела; факторы роста; ингибиторы эластазы; пиридинил-имидазольные соединения; антагонисты TNF, как описано тут; IL-4, IL-10, IL-13 и/или TGFβ цитокины или их агонисты (например, агонистические антитела); IL-11; глюкуронид- или декстран-конъюгированные пролекарственные формы преднизолона, дексаметасон или будесонид; 1САМ-1 антисмысловые фосфоротиоатные олигодезоксинуклеотиды (ISIS 2302; Isis Pharmaceuticals, Inc.); растворимый рецептор 1 комплемента (ТР10; Т Cell Sciences, Inc.); месалазин с замедленным высвобождением; метотрексат; антагонисты фактора активации тромбоцитов (PAF); ципрофлоксацин; и лигнокаин.
Неограничивающие примеры агентов для лечения или профилактики псориаза, с которыми может быть скомбинировано антитело по изобретению, включают такие материалы: кортикостероиды; витамин D3 и его аналоги; ретиноиды (например, сориатан); метотрексат; циклоспорин, 6-тиогуанин; аккутан; гидреа; гидроксимочевина; сульфасалазин; микофенолат мофетил; азатиоприн; такролимус; сложные эфиры фумаровой кислоты; "биологические агенты" (biologies), такие как Amevive, Enbrel, Humira, Raptiva и Remicade, Ustekinmab, и XP-828L; фототерапия; и фотохимиотерапия (например, комбинация псоралена и ультрафиолетовой фототерапии).
Неограничивающие примеры агентов для лечения или профилактики воспалительных болезней дыхательных путей/респираторных болезней (например, хронического обструктивного легочного расстройства, астмы), с которыми может быть скомбинировано антитело по изобретению, включают такие материалы: агонисты бета-2-адренорецептора (например, салбутамол (албутерол USAN), левалбутерол, тербуталин, битольерол); долгодействующие агонисты бета-2-адренорецептора (например, салметерол, формотерол, бамбутерол); адренергические агонисты (например, ингаляции эпинефрина и эфедрин в таблетках); антихолинергические лекарственные средства (например, ипратропиум бромид); комбинации ингаляций стероидов и долгодействующие бронходилататоры (например, флутикасон/салметерол (Advair в США, и Seretide в Великобритании)) или будесонид/формотерол (Symbicort)); ингаляции глюкокортикоидов (например, циклесонид, беклометасон, будесонид, флунисолид, флутикасон, мометасон, триамцинолон); модификаторы лейкотриена (например, монтелукаст, зафирлукаст, пранлукаст и зилеутон); стабилизаторы мастоцитов (например, кромогликат (кромолин) и недокромил); антимускариновые/антихолинергические средства (например, ипратропиум, окситропиум, тиотропиум); метилксантины (например, теофиллин, аминофиллин); антигистаминовые препараты; блокаторы IgE (например, омализумаб); М3 мускариновые антагонисты (антихолинергические средства) (например, ипратропиум, тиотропиум); кромоны (например, хромогликат, недокромил); зантины (например, теофиллин); и антагонисты TNF (например, инфликсимаб, адалимумаб и танерцепт).
В одном варианте исполнения, антитело по изобретению может быть использовано в комбинации с одним или несколькими антителами, направленными на другие мишени, участвующие в регуляции иммунных ответов, например, отторжении трансплантата.
Неограничивающие примеры агентов для лечения или профилактики иммунных ответов, с которыми может быть скомбинировано антитело по изобретению, включают такие материалы: антитела против других молекул клеточной поверхности, включая, без ограничений, CD25 (рецептор-а интерлейкина-2), CD11a (LFA-1), CD54 (ICAM-1), CD4, CD45, CD28/CTLA4 (CD80 (87.1), например, CTLA4 Ig - абатацепт (ORENCIA®)), ICOSL, ICOS и/или CD86 (87.2). В еще одном варианте исполнения, антитело по изобретению используется в комбинации с одним или несколькими неспецифическими иммунодепрессивными агентами, такими как циклоспорин А или FK506.
В других вариантах исполнения, антитела используются в качестве адъювантов вакцины против аутоиммунных расстройств, воспалительных болезней и т.д. Комбинация адъювантов для лечения этих типов расстройств является пригодной для использования в сочетании с широким спектром антигенов из таргетных (молекулярно-нацеленных) (targeted) собственных антигенов, т.е., аутоантигенов, участвующих в аутоиммунитете, например, миелинового основного белка; воспалительных аутоантигенов, например, белка амилоидного пептида, или антигенов трансплантата, например, аллоантигенов. Антиген может содержать пептиды или полипептиды, полученные из белков, а также фрагменты любого из следующих материалов: сахаридов, белков, полинуклеотидов или олигонуклеотидов, аутоантигенов, белка амилоидного пептида, антигенов трансплантата, аллергенов или других макромолекулярных компонентов. В некоторых случаях, антигенная композиция содержит более одного антигена.
Например, желательные вакцины для смягчения ответа на аллергены у хозяина-позвоночного, содержащие комбинации адъюванта по настоящему изобретению, включают комбинации, содержащие аллерген или его фрагмент. Примеры таких аллергенов описаны в патенте США №5830877 и опубликованной международной патентной заявке №WO 99/51259, которые настоящим целиком включены сюда в качестве ссылок, и включают пыльцу, яды насекомых, перхоть животных, грибковые споры и лекарственные препараты (такие как пенициллин). Вакцины препятствуют продуцированию IgE антител, являющихся известной причиной аллергических реакций. В другом примере, желательные вакцины для профилактики или лечения болезни, характеризующейся отложением амилоидов у хозяина-позвоночного, содержащие комбинации адъюванта по настоящему изобретению, включают комбинации, содержащие фрагменты белка амилоидного пептида (АРР). Эта болезнь называется разными авторами болезнью Альцгеймера, амилоидозом или амилоидогенной болезнью. Таким образом, вакцины по настоящему изобретению включают комбинации адъюванта по настоящему изобретению плюс Аβ пептид, а также фрагменты Аβ пептида и антител против Аβ пептида или его фрагментов.
Разработка и получение других лекарственных средств
В соответствии с настоящим изобретением и на основании активности антител по настоящему изобретению, продуцируемых и охарактеризованных тут по отношению к IL-17F и/или гетеродимерному комплексу IL-17A/IL-17F, предусматривается разработка других способов терапевтического воздействия помимо использования фрагментов антитела. Такие способы воздействия включают, без ограничений, усовершенствованные лекарственные средства на основе антител, такие как биспецифические антитела, иммунотоксины, и радиоактивно меченые лекарственные средства, создание пептидных лекарственных средств, генные терапии, в частности интратела (внутриклеточные антитела), антисмысловые лекарственные средства, и малые молекулы.
Например, в связи с биспецифическими антителами, могут быть получены биспецифические антитела, которые содержат (i) два антитела - одно со специфичностью по отношению к IL-17F и/или гетеродимерному комплексу IL-17A/IL-17F, и другое - ко второй молекуле, конъюгированные друг с другом, (ii) одно антитело, имеющее одну цепь, специфическую к IL-17F и/или гетеродимерному комплексу IL-17A/IL-17F, и вторую цепь - специфическую ко второй молекуле, или (iii) одноцепочечное антитело, обладающее специфичностью к IL-17F и/или гетеродимернму комплексу IL-17A/IL-17F, и ко второй молекуле. Такие биспецифические антитела создают с использованием методик, которые являются хорошо известными, например, в связи с (i) и (ii), см., например, Fanger et al. Immunol Methods 4:72-81 (1994) и Wright et al. Crit, Reviews in Immunol. 12125-168 (1992), и в связи с (iii), см., например, Traunecker et al. Int. J. Рак (Suppl.) 7:51-52 (1992).
В связи с иммунотоксинами, антитела могут быть модифицированы так, чтобы они действовали как иммунотоксины, с использованием методик, хорошо известных специалистам. См., например, Vitetta, Immunol Today 14:252 (1993). См. также патент США №5194594. В связи с изготовлением радиоактивно меченых антител, такие модифицированные антитела также могут быть легко получены с использованием методик, хорошо известных специалистам. См., например, Junghans et al., в Cancer Chemotherapy and Biotherapy 655-686 (2d edition, Chafner and Longo, eds., Lippincott Raven (1996)). См. также патенты США №№4681581, 4735210, 5101827, 5102990 (RE 35500), 5648471 и 5697902. Любые из иммунотоксинов и радиоактивно меченых молекул будут вероятно уничтожать клетки, экспрессирующие IL-17F и/или гетеродимерный комплекс IL-17A/IL-17F.
В связи с изготовлением терапевтических пептидов, путем использования структурной информации, относящейся к IL-17F и/или гетеродимерному комплексу IL-17A/IL-17F и антителам против них, таким как антитела по изобретению, или скрининга пептидных библиотек, могут быть получены терапевтические пептиды, направленные против IL-17F и/или гетеродимерного комплекса IL-17A/IL-17F. Разработка и скрининг пептидных лекарственных средств обсуждается в связи с Houghten et al. Biotechniques 13:412-421 (1992), Houghten PNAS USA 82:5131-5135 (1985), Pinalla et al. Biotechniques 13:901-905 (1992), Blake and Litzi-Davis BioConjugate Chem. 3:510-513 (1992). Иммунотоксины и радиоактивно меченые молекулы также могут быть получены похожим образом в связи с пептидными фрагментами, как описано выше для антител. Учитывая, что молекула IL-17F и/или гетеродимерного комплекса IL-17A/IL-17F (или форма, такая как сплайсинговый вариант или альтернативная форма) является функционально активной в болезненном процессе, будет также возможным сконструировать ген и антисмысловые лекарственные средства против него обычными методами. Такие способы воздействия могут быть использованы для модулирования функции IL-17F и/или гетеродимерного комплекса IL-17A/IL-17F. В связи с этим, антитела по настоящему изобретению облегчают разработку и использование связанных с ними функциональных анализов. Разработка и стратегия антисмысловых лекарственных средств детально обсуждается в международной патентной заявке №WO 94/29444. Разработка и стратегии генной терапии являются хорошо известными. Однако, в частности, использование генно-терапевтических методик с применением интрател может оказаться особенно предпочтительным. См., например, Chen et al. Human Gene Therapy 5:595-601 (1994) и Marasco, Gene Therapy 4:11-15 (1997). Общая схема разработки и соображения, относящиеся к генным лекарственным средствам, также обсуждаются в международной патентной заявке № WO 97/38137.
Знания, полученные при изучении структуры молекулы IL-17F и/или гетеродимерного комплекса IL-17A/IL-17F и ее взаимодействий с другими молекулами в соответствии с настоящим изобретением, такими как антитела по изобретению, и другие, могут быть использованы для конструктивной разработки дополнительных терапевтических способов воздействия. В этом отношении, конструктивные методики разработки лекарственных средств, такие как рентгеновская кристаллография, автоматизированное (или компьютеризированное) молекулярное моделирование (САММ), количественные или качественные соотношения структура-активность (QSAR), и подобные технологии могут быть использованы для форсирования усилий на выявлении лекарственных средств. Конструктивная разработка позволяет прогнозировать белковые или синтетические структуры, способные взаимодействовать с молекулой или ее специфическими формами, которые могут быть использованы для модификации или модуляции активности IL-17F и/или гетеродимерного комплекса IL-17A/IL-17F. Такие структуры могут быть синтезированы химически или экспрессированы в биологических системах. Этот подход был рассмотрен в Capsey et al. Genetically Engineered Human Therapeutic Drugs (Stockton Press, NY (1988)). Кроме того, могут быть разработаны и синтезированы комбинаторные библиотеки для использования в программах скрининга, таких как высокопроизводительный скрининг.
Способы скрининга
Изобретение предусматривает способы (также называемые тут "скрининговые анализы") идентификации модуляторов, т.е., соединений-кандидатов или тестируемых соединений или агентов (например, пептидов, пептидомиметиков, малых молекул или других лекарственных средств), которые модулируют, блокируют, ингибируют, редуцируют, антагонизируют, нейтрализуют или иначе препятствуют связыванию IL-17F и/или гетеродимерного комплекса IL-17A/IL-17F с их природным рецептором, или соединений-кандидатов или тестируемых соединений или агентов, которые модулируют, блокируют, ингибируют, редуцируют, антагонизируют, нейтрализуют или иначе препятствуют функции передачи сигналов IL-17F и/или гетеродимерного комплекса IL-17A/IL-17F. Также предусматриваются способы идентификации соединений, пригодных для лечения расстройств, ассоциированных с передачей сигналов IL-17F и/или гетеродимерного комплекса IL-17A/IL-17F. Изобретение также включает соединения, идентифицируемые скрининговыми анализами, описанными тут.
В одном варианте исполнения, изобретение предусматривает анализы для скрининга соединений-кандидатов или тестируемых соединений, которые модулируют функцию передачи сигналов IL-17F и/или гетеродимерного комплекса IL-17A/IL-17F. Тестируемые соединения по изобретению могут быть получены с использованием любых из многочисленных подходов в способах комбинаторных библиотек, известных специалистам, включая: биологические библиотеки; пространственно адресуемые твердофазные или в фазе раствора библиотеки; методы синтетических библиотек, требующие деконволюции; метод библиотеки "одна бусина-одно соединение"; и методы синтетических библиотек с использованием для выбора аффинной хроматографии. Подход с использованием биологических библиотек ограничен пептидными библиотеками, в то время как другие четыре подхода применимы к библиотекам пептидных, непептидных олигомерных соединений или малых молекул (см., например, Lam, 1997. Anticancer Drug Design 12: 145).
"Малую молекулу", в используемом тут значении, следует понимать как относящуюся к композиции, имеющей молекулярный вес менее примерно 5 кДа, наиболее предпочтительно, менее примерно 4 кДа. Малые молекулы могут быть, например, нуклеиновми кислотами, пептидами, полипептидами, пептидомиметиками, углеводами, липидами или другими органическими или неорганическими молекулами. Библиотеки химических и/или биологических смесей, такие как грибковые, бактериальные или водорослевые экстракты, известны специалистам и могут быть подвергнуты скринингу с помощью любого из анализов по изобретению.
Примеры способов синтеза молекулярных библиотек являются доступными для специалистов, например: DeWitt, et al., 1993. Proc. Natl. Acad. Sci. U.S.A. 90: 6909; Erb, et al., 1994. Proc. Natl. Acad. Sci. U.S.A. 91: 11422; Zuckermann, et al., 1994. J. Med. Chem. 37: 2678; Cho, et al., 1993. Science 261: 1303; Carrell, et al., 1994. Angew. Chem. Int. Ed. Engl. 33: 2059; Carell, et al., 1994. Angew. Chem. Int. Ed. Engl. 33: 2061; и Gallop, et al., 1994. J. Med. Chem. 37: 1233.
Библиотеки соединений могут быть презентованы в растворе (см. например, Houghten, 1992. Biotechniques 13: 412-421), или на бусинах (см. Lam, 1991. Nature 354: 82-84), на чипах (см. Fodor, 1993. Nature 364: 555-556), в бактериях (см. патент США №5223409), спорах (см. патент США 5233409), плазмидах (см. Cull, et al., 1992. Proc. Natl. Acad. Sci. USA 89: 1865-1869) или на фаге (см. Scott and Smith, 1990. Science 249: 386-390; Devlin, 1990. Science 249: 404-406; Cwiria, et al., 1990. Proc. Natl. Acad. Sci. U.S.A. 87: 6378-6382; Felici, 1991. J. Mol. Biol. 222: 301-310; и патент США №5233409.).
В одном варианте исполнения, вносят соединение-кандидат к комплексу антитело-антиген и определяют, разрушает ли соединение-кандидат комплекс антитело-антиген, причем разрушение данного комплекса указывает, что соединение-кандидат модулирует функцию передачи сигналов IL-17F и/или гетеродимерного комплекса IL-17A/IL-17F. Например, антитело является моноклональным антителом 5Е12 ("Mab05") и антиген является IL-17F и/или гетеродимерным комплексом IL-17A/IL-17F.
В другом варианте исполнения, обеспечивается гомодимер IL-17F и экспонируется по меньшей мере одним нейтрализующим моноклональным антителом. Детектируют образование комплекса антитело-антиген, и вносят одно или несколько соединений-кандидатов к комплексу. Если комплекс антитело-антиген разрушается после внесения одного или нескольких соединений-кандидатов, то соединения-кандидаты являются пригодными для лечения расстройств, ассоциированных с передачей сигналов IL-17F.
В другом варианте исполнения, обеспечивается растворимый белок IL-17F и экспонируется по меньшей мере одним нейтрализующим моноклональным антителом. Детектируют образование комплекса антитело-антиген, и вносят одно или несколько соединений-кандидатов к комплексу. Если комплекс антитело-антиген разрушается после внесения одного или нескольких соединений-кандидатов, то соединения-кандидаты являются пригодными для лечения расстройств, ассоциированных с передачей сигналов IL-17F.
Определение способности тестируемого соединения взаимодействовать с или разрушать комплекс антитело-антиген может быть осуществлено, например, путем связывания тестируемого соединения с радиоизотопом или ферментной меткой, так чтобы связывание тестируемого соединения с антигеном или его биологически активной частью могло быть определено путем детектирования меченого соединения в комплексе, например, тестируемые соединения могут быть мечены 125I, 35S, 14C или 3H прямо или опосредованно, и радиоизотоп детектируют прямым подсчетом радиоизлучения или сцинтиляционным подсчетом. Альтернативно, тестируемые соединения могут быть ферментно-мечеными, например, пероксидазой хрена, щелочной фосфатазой или люциферазой, и ферментную метку детектируют путем определения конверсии соответствующего субстрата в продукт.
В одном варианте исполнения, анализ включает введение в контакт комплекса антитело-антиген с тестируемым соединением и определение способности тестируемого соединения взаимодествовать с антигеном или иначе разрушать существующий комплекс антитело-антиген. В этом варианте исполнения, определение способности тестируемого соединения взаимодействовать с антигеном и/или разрушать комплекс антитело-антиген включает определение способности тестируемого соединения предпочтительно связываться с антигеном или его биологически активной частью, по сравнению с антителом.
В другом варианте исполнения, анализ включает введение в контакт комплекса антитело-антиген с тестируемым соединением и определение способности тестируемого соединения модулировать комплекс антитело-антиген. Определение способности тестируемого соединения модулировать комплекс антитело-антиген может быть осуществлено, например, путем определения способности антигена связываться с или взаимодействовать с антителом, в присутствии тестируемого соединения.
Квалифицированным специалистам будет понятно, что, в любом из способов скрининга, раскрытых тут, антитело может быть нейтрализующим антителом, таким как, например, моноклональные антитела 5Е12, 41В10, 11С5, 21В10, 1F1, 2Е12, 5D3, 22F8, 28В11, 41А4, и 43G6, каждое из которых модулирует или иначе препятствует продуцированию провоспалительного цитокина.
Способы скрининга, раскрытые тут, могут быть осуществлены в виде клеточного анализа или бесклеточного анализа. Бесклеточные анализы по изобретению могут использовать растворимый IL-17F, растворимый комплекс IL-17A/IL-17F и их фрагменты.
В нескольких вариантах исполнения, может быть желательным иммобилизировать антитело или антиген для облегчения разделения закомплексованной и незакомплексованной форм одного или обоих из них после введения соединения-кандидата, а также для автоматизации анализа. Наблюдение комплекса антитело-антиген в присутствии соединения-кандидата и без него может осуществляться в любом сосуде, пригодном для удерживания реагентов. Примеры таких сосудов включают микротитровальные планшеты, лабораторные пробирки и микроцентрифужные пробирки. В одном варианте исполнения, может быть обеспечен слитый белок с добавленным доменом, позволяющим присоединить один или оба белка к матрице. Например, слитые белки GST-антитело или слитые белки GST-антиген могут быть адсорбированы на глутатион-сефарозных бусинах (Sigma Chemical, St. Louis, МО) или глутатион-дериватизованных микротитровальных планшетах, которые затем объединяют с тестируемым соединением, и смесь инкубируют в условиях, способствующих образованию комплекса (например, при физиологических условиях содержания соли и величины рН). После инкубации, бусины или лунки микротитровального планшета промывают для удаления любых несвязанных компонентов, и иммобилизованый на матрице, в случае бусин, комплекс определяют прямыми или косвенными методами. Альтернативно, комплексы могут быть диссоциированы от матрицы, и уровень образования комплекса антитело-антиген может быть определен с использованием стандартных методов.
Другие методики иммобилизации белков на матрицах также могут быть использованы при скрининговых анализах по изобретению. Например, антитело (например, 5Е12, 41В10, 11С5, 21В10, 1F1, 2Е12, 5D3,22F8, 28В11, 41А4 и 43G6) или антиген (например, белок IL-17F или комплекс IL-17A/IL-17F) могут быть иммобилизованы путем конъюгации биотина и стрептавидина. Биотинилированные молекулы антитела или антигена могут быть получены из биотина-NHS (N-гидроксисукцинимид) с использованием методик, хорошо известных специалистам (например, набор для биотинилирования, Pierce Chemicals, Rockford, III.), и иммобилизованы в лунках покрытых стрептавидином 96-луночных планшетов (Pierce Chemicals). Альтернативно, другие антитела, реакционноспособные по отношению к антителу или антигену, представляющему интерес, но не препятствующие образованию комплекса антитело-антиген, представляющего интерес, могут быть дериватизованы в лунках планшета, и несвязанные антитело или антиген удерживаются в лунках путем конъюгации антитела. Способы детектирования таких комплексов, в дополнение к описанным выше для GST-иммобилизованных комплексов, включают иммунодетектирование комплексов с использованием таких других антител, реакционноспособных по отношению к антителу или антигену.
Изобретение дополнительно относится к новым агентам, идентифицируемым любыми из вышеупомянутых скрининговых анализов, и их использованию для лечения, как описано тут.
Диагностический и профилактические композиции
huIL-17F MAbs по изобретению используются в диагностических и профилактических композициях. В одном варианте исполнения, антагонист IL-17F, такой как huIL-17F MAb по изобретению, вводится пациентам с риском развития одного или нескольких из вышеупомянутых аутоиммунных или воспалительных болезней, таких как, например, без ограничений, ревматоидный артрит и другие аутоиммунные артритные состояния, болезнь Крона, псориаз, рассеянный склероз, хроническая обструктивная болезнь легких, астма, остеоартрит и рак. Предрасположенность пациента или органа к одной или нескольким из вышеупомянутых аутоиммунных или воспалительных болезней может быть определена с использованием генотипических, серологических или биохимических маркеров.
В другом варианте исполнения изобретения, антагонист IL-17F, такой как антитело huIL-17F, вводится людям с диагностированным клиническим показанием, ассоциированным с одной или несколькими из вышеупомянутых аутоиммунных или воспалительных болезней, таких как ревматоидный артрит или другие аутоиммунные артритные состояния, болезнь Крона, псориаз, рассеянный склероз, хроническая обструктивная болезнь легких, астма, остеоартрит и рак. После диагностики, антагонист IL-17F, такой как антитело huIL-17F, вводится для ослабления или обращения эффектов клинического показания, ассоциированного с ревматоидным артритом и другими аутоиммунными артритными состояниями, болезнью Крона, псориазом, рассеянным склерозом, хронической обструктивной болезнью легких, астмой, остеоартритом и раком.
Антитела по изобретению также пригодны для детектирования IL-17F и/или гетеродимерного комплекса IL-17A/IL-17F в образцах, взятых у пациента, и соответственно пригодны для использования в качестве диагностических средств. Например, антитела huIL-17F по изобретению используются при in vitro анализах, например, ELISA, для детектирования уровней IL-17F и/или гетеродимерного комплекса IL-17A/IL-17F в полученном от пациента образце.
В одном варианте исполнения, антитело huIL-17F по изобретению иммобилизовано на твердой подложке (например, в лунке (лунках) микротитровального планшета). Иммобилизованное антитело служит улавливающим антителом для любого IL-17F и/или любого гетеродимерного комплекса IL-17A/IL-17F, которые могут присутствовать в тестируемом образце. Перед введением иммобилизованного антитела в контакт со взятым у пациента образцом, твердую подложку промывают и обрабатывают блокирующим агентом, таким как молочный белок или альбумин, для предотвращения неспецифической адсорбции аналита.
После этого лунки обрабатывают тестируемым образцом, предположительно содержащим антиген, или раствором, содержащим стандартное количество антигена. Такой образец, например, представляет собой образец сыворотки субъекта с подозрением на наличие уровней циркулирующего антигена, считающихся диагностическими для патологии. После смывания тестируемого образца или стандарта, твердую подложку обрабатывают вторым антителом, которое является детектируемо меченым. Меченое второе антитело служит детектирующим антителом. Измеряют уровень детектируемой метки, и концентрацию антигена IL-17F и/или гетеродимерного комплекса IL-17A/IL-17F в тестируемом образце определяют путем сравнения со стандартной кривой, построенной по стандартным образцам.
Следует понимать, что на основании результатов, полученных при использовании антител huIL-17F по изобретению для проведения in vitro диагностического анализа, можно определить стадию болезни (например, клиническое показание, ассоциированное с ишемией, аутоиммунное или воспалительное расстройство) у субъекта по уровням экспрессии антигена IL-17F и/или гетеродимерного комплекса IL-17A/IL-17F. Для данной болезни, берут образцы крови у субъектов с установленными диагнозами различных стадий прогрессирования болезни, и/или в различные моменты времени терапевтического лечения болезни. Используя популяцию образцов, обеспечивающую статистически значимые результаты для каждой стадии прогрессирования или терапии, определяют интервалы значений концентрации антигена, которые могут считаться характерными для каждой стадии.
Все публикации и патентные документы, упомянутые тут, включены сюда в качестве ссылок, как если бы каждая такая публикация или документ была конкретно и индивидуально указана как включенная сюда в качестве ссылки. Упоминание про публикации и патентные документы не должно пониматься как допущение того, что любой из них является известным уровнем техники, относящимся к предмету заявки, или как какое-либо допущение, касающееся его содержания или даты публикации. Изобретение было изложено с помощью письменного описания, и квалифицированным специалистам будет понятно, что изобретение может практиковаться в различных вариантах исполнения, и что предшествующее описание и приведенные ниже примеры предназначены для иллюстрации и не ограничивают представленную далее формулу изобретения.
ПРИМЕРЫ
Изложенные далее примеры, включая проведенные эксперименты и полученные результаты, приводятся только для иллюстрации и не должны рассматриваться как ограничивающие настоящее изобретение.
ПРИМЕР 1: Кпонирование. экспрессия и очистка человеческого IL-17F, крысиного IL-17F. IL-17F макака-крабоеда (cvnomolqus).
Кпонирование
KДHKs, кодирующие зрелый человеческий IL-17F (AF384857, аа 31-163) крысиный IL-17F (МН91568, аа 21-153) и IL-17F макака-крабоеда (cynomolgus) (идентична последовательности ХР_001106517 аа 31-163,), амплифицируют методом ПЦР и клонируют в вектор PCR4TOPO (Invitrogen). На другой стадии ПЦР вводят метку His или метку His с последующим AviTag (Avidity, Denver СО) на N-конце кодирующей последовательности цитокина. Эти конструкты затем сливают с лидерной последовательностью и субклонируют в соответствующие векторы экспрессии.
Экспрессия и очистка человеческого IL-17F и крысиного IL-17F из инфицированных бакуловирусом клеток
His-меченый huIL-17F или крысиный IL-17F с предшествующей GP67 лидерной последовательностью (MLLVNQSHQGFNKEHTSKMVSAIVLYVLLAAAA-HSAFA) (SEQ ID NO: 100) субклонируют в бакуловирусный бакмидный (bacmid) вектор pFASTBAC Dual (Invitrogen). После трансфекции в клетки Sf9, рекомбинантный вирус выделяют и амплифицируют.Для продуцирования белка, клетки Hi5 или клетки SF9 инфицируют бакуловирусом и инкубируют при 27°С в течение 3 дней. Клеточную культуральную среду осветляют центрифугированием, фильтруют и концентрируют приблизительно 10-кратно в SartoFlow Slice 200 (Sartorius - Hydrosart, порог отсечения 10 кДа). После доведения рН до 7,0 и еще одной стадии центрифугирования, концентрированный белок очищают с помощью стандартных процедур на колонках Ni-NTA Superflow (Qiagen) или колонках HiTrap Chelating HP (GE Healthcare), заряженных ионами Ni2+. Фракции, содержащие IL-17F, объединяют и обессоливают на колонках PD-10 (GE Healthcare).
Человеческий IL-17F и крысиный IL-17F из инфицированных бакуловирусом клеток по существу не содержали загрязнений после одной стадии очистки, и представляли собой преимущественно соединенные дисульфидными связями гомодимеры, что было продемонстрировано методом SDS-PAGE в невосстанавливающих условиях. Биологическая активность His-меченого, экспрессируемого бакуловирусом человеческого IL-17F была сравнимой с активностью коммерческих цитокинов (экспрессируемый e.co//huIL-17F, Peprotech ЕС или R&D Systems)
Экспрессия и очистка человеческого IL-17F и крысиного IL-17F из клеток CHOK1SV
Кодирующие последовательности huIL-17F или крысиного IL-17F с предшествующей CD33 лидерной последовательностью (MPLLLLLPLLWAGALAMD; SEQ ID NO:101), плюс His-метка и AviTag (Avidity, Denver CO) помещают под контроль промотора hCMV в векторе экспрессии рЕЕ14.4. IL-17F экспрессируют из бицистронной мРНК, содержащей вирусный участок внутренней посадки рибосомы (IRES) и кодирующую последовательность GFP в качестве второго цистрона. Вектор рЕЕ14.4. содержит ген глутаминсинтетазы (GS), существенный для выживания трансфицированных клеток в селективной среде, содержащей метионинсульфоксимин (MSX). Стабильные трансфектанты были получены в клеточной линии CHOK1SV, являющейся собственностью Lonza Biologies. После четырех недель культивации в присутствии MSX были идентифицированы клоны с высокой экспрессией, растянуты и использованы для продуцирования человеческого или крысиного IL-17F.
Экспрессируемый CHOK1SV человеческий IL-17F и крысиный IL-17F были очищены Ni2+-аффинной хроматографией. Они по существу не содержали примесей и представляли собой соединенные дисульфидными связями гомодимеры на невосстанавливающих гелях для SDS-PAGE. Биологическая активность His+Avi-меченого, экспрессируемого СНО человеческого IL-17F была значительно снижена по сравнению с активностью коммерческого huIL-17F, возможно, вследствие присутствия объемной сдвоенной метки на N-конце.
Экспрессия и очистка человеческого IL-17F и сп IL-17F из клеток PEAK
Кодирующие последовательности His-меченого huIL-17F или cnlL-17F сливают с лидерной последовательностью люциферазы Gaussia princeps (AF015993) и помещают под контроль промотора EF1 в эписомальный вектор экспрессии рЕАК8. После кодирующей цитокин последовательности был расположен вирусный участок внутренней посадки рибосомы (IRES) и второй цистрон (GFP). Вектор рЕАК8 содержит ген резистентности к пуромицину, ядерный антиген 1 EBV (вирус Эпштейна-Барр) (EBNA1) и точку начала репликации oriP. EBNA1 и oriP необходимы для воспроизведения вектора рЕАК8 как эписомальной ДНК в человеческих клетках и получения стабильных трансфектантов. Стабильно трансфицированные клетки получают после 7-10 дней культивации в присутствии 2 мкг/мл пуромицина. Популяции пуромицин-резистентных клеток растягивают и используют для продуцирования цитокина.
Экспрессируемый PEAK продукт, очищенный Ni2+-аффинной хроматографией, имел чистоту >95% и находился преимущественно в форме соединенных дисульфидными связями гомодимеров, что было продемонстрировано методом SDS-PAGE в невосстанавливающих условиях. Биологическая активность His-меченого экспрессируемого PEAK человеческого IL-17F была близкой к активности huIL-17F из коммерческих источников.
ПРИМЕР 2: Иммунизации
Полностью человеческие моноклональные антитела были получены с использованием трансгенных линий мышей, у которых экспрессия гена мышиного антитела была подавлена и заменена на экспрессию гена человеческого антитела. Были использованы три линии трансгенных мышей:
1) мыши HuMab® (Medarex, Princeton NJ)
2) мыши КМ™, кроссбред между мышами HuMAb и мышами Kirin's TC (Kirin Pharma Company, Japan)
3) мыши KM (FCyRllb-KO), линия, выведенная из мышей КМ™, с инактивированным геном Fcgr2b, кодирующим ингибирующий Fc гамма-рецептор IIB.
Мышей иммунизируют человеческим IL-17F или совместно человеческим IL-17F и крысиным IL-17F. Для иммунизации были использованы две формы антигена: неконъюгированный IL-17F или IL-17F, конъюгированный с гемоцианином моллюска фиссуреллии (Keyhole Limpet Hemocyanin, KLH). Стратегии иммунизации соответствовали стандартным протоколам, описанным в литературе.
Сыворотку иммунизованных животных периодически подвергали скринингу методом ELISA на присутствие человеческого IgG, направленного против huIL-17F и крысиного IL-17F. У большинства животных развивался интенсивный гуморальный иммунный ответ на человеческий IL-17F. В тех случаях, когда для иммунизации использовались крысиный IL-17F и hulL-17, у большинства животных развивался интенсивный гуморальный иммунный ответ на оба антигена. Антитела, перекрестно-реактивные по отношению к hulL-17A, спорадически генерировались у КМ и KM (FCyRllb-KO) мышей, иммунизованных huIL-17F в качестве единственного антигена (т.е., без крысиного IL-17F). В отличие от КМ и KM (FCYRIIb-KO) мышей, у мышей HuMAb не развивалась перекрестная реактивность на IL-17A, независимо от использованного протокола иммунизации.
ПРИМЕР 3: Получение гибридом
Слияние клеток лимфатических узлов с SP2/0 клетками миеломы
Для получения гибридом, подколенные, паховые, парааортальные, подчелюстные, цервикальные, аксиальные и брахиальные лимфатические узелы удаляли у мышей и гидролизовали коллагеназой и ДНКазой. Суспензию единичных клеток лимфатических узлов смешивают в соотношении 1:1 с клетками миеломы SP2/0 и суспендируют в среде Cytofusion Low Conductivity Medium (CPS-LCMC, CytoPulse Sciences, Inc.). Слияние проводят с использованием 30-60 миллионов спленоцитов в аппарате CytoPulse CEEF50 Electrofusion в соответствии с инструкциями производителя (Cyto Pulse Sciences, Inc). После электрослияния, клетки инкубируют в течение приблизительно 1 часа при 37°С для обеспечения возможности выделения, после чего распределяют по 96-луночным планшетам.
Культура гибридом
Слитые клетки ресуспендируют в селективной среде HAT и высеивают на 44-52 96-луночных планшета с концентрацией клеток 0,1-0,2×105 спленоцитов на лунку в 200 мкл среды. Селекция гибридом продолжалась 14 дней. Слияние лимфатических узлов иммунизованных мышей приводило к образованию гибридом, продуцирующих антитела, специфические по отношению к huIL-17F или перекрестно-реактивные антитела, специфические по отношению как к huIL-17F, так и к IL-17A.
Скрининггибридом
Через четырнадцать дней после слияния, гибридома-содержащие планшеты подвергают скринингу на наличие связывания человеческого IgG с человеческим IL-17F и/или человеческим IL-17A методом FLISA (твердофазный иммуноферментный анализ с флуоресцентным усилением). Вкратце, бусины размером 6 микрон (Polybeads, cat. No 07312, Polysciences Inc.) покрывают huIL-17F (оба производства фирмы Peprotech EC) или BSA (Sigma) и распределяют по FMAT® 384-луночным оптическим планшетам (Applied Biosystems) при плотности 5000 бусин на лунку. Бусины смешивают с небольшим объемом супернатанта культуры гибридом (30 мкл на лунку) и инкубируют в течение ночи перед добавлением козьего анти-человеческого IgG Fc (Jackson Immunoresearch No 109-005-098), конъюгированного с красителем FMAT Blue® (Applied Biosystems). После периода инкубации от 2 до 8 часов измеряют флуоресценцию бусин с помощью анализатора 8200 Cellular Detection System (Applied Biosystems). Гибридомы, продуцирующие человеческие IgGs, которые связываются с huIL-17F, но не с BSA, растягивают и используют для проведения дальнейших анализов.
ПРИМЕР 4: Получение рекомбинантного антитела
Клонирование последовательности антитела из гибридомы Для выделения вариабельных последовательностей тяжелой и легкой цепей антитела, сначала экстрагируют РНК из выбранной гибридомы и подвергают обратной транскрипции. Затем последовательности VH и VL амплифицируют методом ПЦР, клонируют и далее анализируют методом ДНК-секвенирования. Вкратце, экстрагируют матричную РНК из гибридомы с помощью набора RNeasy Plus (QIAGEN) и получают кДНК с использованием набора Ready-To-Go You-Prime First-Strand Beads (GE Healthcare, No 27-9264-01) с олиго-dT праймерами для обратной транскрипции. Последовательности VH и VL затем амплифицируют методом ПЦР с использованием наборов праймеров, распознающих семейства человеческих вариабельных тяжелых и легкых цепей. Амплифицированные последовательности клонируют в вектор pCR®4 с использованием набора ТОРО® ТА Cloning Kit for Sequencing (Invitrogen). Выбранные клоны затем подвергают ДНК-секвенированию.
Реформатирование антитела, превращение в антитело эмбрионального типа (germlining) и экспрессия
Вариабельные последовательности тяжелых и легких цепей реформатируют в векторы экспрессии млекопитающих для продуцирования и характеризации антитела. Вкратце, проводят анализ последовательностей выделенных VH и VL для определения их зародышевой линии. Вследствие ошибочного спаривания праймера, были внесены мутации в 1F1 и 11С5 5' VL на стадии ПЦР-амплификации. После этого используют сайт-направленный мутагенез, проводимый с использованием набора Quikchange (Strategene), для превращения этих мутаций снова в последовательность человеческой зародышевой линии. Затем последовательности VH и VL субклонируют в систему экспрессии млекопитающих в рамках основных цепей человеческого lgG1 и Ig-каппа. Векторы, соответствующие тяжелой и легкой цепям антитела, затем трансфицируют в клетки PEAK с помощью реагента для трансфекции TranslT®-LT1 (Mirus Bio) и культивируют в DMEM+lgG-истощенная сыворотка+глутамин. Экспрессированные PEAK антитела затем выделяют из супернатанта с использованием суспензии MabSelectSure (GE Healthcare).
ПРИМЕР 5: Перекрестная реактивность антител huIL-17F
Анализ связывания: Антитела huIL-17F тестируют на их способность связываться с другими членами семейства цитокинов IL-17, а также с IL-17A и IL-17F от других видов. Анализ проводят в формате FLISA, как описано выше. Следующие рекомбинантные цитокины были закреплены на полистирольных бусинах и протестированы на их способность связывать антитела huIL-17F: hulL17B (PeprotechEC, cat No 200-28), hulL-17C (R&D Systems, cat No), hulL-17D (PeprotechEC, cat No 200-27), hulL-17E (hulL-25, PeprotechEC, cat No 200-24), mulL-17A (PeprotechEC, cat No 210-17), mulL-17F (PeprotechEC, cat No 200-17F), крысиный IL-17F (His-меченый, получен нами в клетках насекомых), крысиный IL-17A (His-меченый, получен нами в клетках PEAK), cylL-17F (His-меченый, получен нами в клетках PEAK), и cylL-17A (His-меченый, получен нами в клетках PEAK). Способность индивидуальных антител huIL-17F связываться с такими различными цитокинами указана в Таблице 3 ниже:
|
ПРИМЕР 6: Нейтрализующая активность антител huIL-17F
Секреция IL-6 IL-17-стимулированными мышиными эмбриональными
фибробластами
Человеческие и принадлежащие макаку-крабоеду (cynomolgus) IL-17A и IL-17F связывают соответствующий комплекс мышиного рецептора IL-17. Вследствие этого, мышиные фибробласты реагируют на человеческие или принадлежащие макаку-крабоеду IL-17A и IL-17F секрецией IL-6. Было показано, что костимулирование мышиным TNF действует синергично с сигнализацией IL-17 (Ruddy et al. 2004, J. Biol. Chem 279:2559), значительно увеличивая чувствительность мышиных фибробластов к цитокинам IL-17. Поэтому мышиные C57BL/6 эмбриональные фибробласты (MEF, ATCC No SCRC-1008) были использованы для анализов нейтрализующей способности антител huIL-17F по отношению к биологической активности huIL-17F, cylL-17F, гетеродимера hulL-17A/F и гетеродимера cylL-17A/F.
Вкратце, клетки MEF, высеянные на 96-луночные планшеты в среду DMEM+глутамин+10% сыворотки плода коровы (FBS), культивируют в течение 48 ч перед добавлением цитокинов IL-17 и мышиного TNFa в концентрации 10 нг/мл (Peprotech EC, cat No 315-01A). В анализах нейтрализующей активности МАЬ, цитокины IL-17 предварительно инкубируют с антителом в течение 1 часа до прибавления к клеткам. После 24 часов стимулирования в присутствии человеческих или принадлежащих макаку-крабоеду гетеродимеров IL-17A/F (50 нг/мл) или после 40 часов стимулирования в присутствии человеческого или принадлежащего макаку-крабоеду IL-17F (5 нг/мл), собирают супернатанты и концентрацию мышиного IL-6 измеряют методом сэндвич-ELISA с использованием крысиного антимышиного IL6-антитела (BD cat No 554400) для улавливания, и второго, биотинилированного крысиного антимышиного ILe-антитела (BD 554402) плюс стрептавидин HRP (Jackson Immunoresearch 016-030-084) - для детектирования. Не наблюдалось какого-либо ингибирования гетеродимера huIL-17A/F или гетеродимера cyIL-17A/F любым из проанализированных анти-IL-17F антител. Значения IC50, полученные для человеческих и принадлежащих макаку-крабоеду гомодимеров IL-17F приведены в Таблице 4 ниже и были получены стандартными статистическими методами с использованием калибровочных кривых IL-6.
|
ПРИМЕР 7: Экспериментальная модель болезни: коллаген-индуцированный артрит (CIA)
IL-17A играет важную роль в патогенезе артрита, промотируя высвобождение медиаторов воспаления и разрушения хрящевой ткани. Было продемонстрировано, что нейтрализация IL-17A ослабляет артрит в различных экспериментальных моделях, включая CIA (коллаген-индуцированный артрит). Учитывая, что IL-17F является близко родственным с IL-17A, и тот факт, что он надэкспрессируется в синовиальной жидкости пациентов с ревматоидным артритом (RA), был исследован эффект нейтрализации этого цитокина в модели RA. С этой целью было получено aHTH-mIL-17F (мышиный IL-17F) антитело, которое интенсивно нейтрализовало мышиные гомодимеры IL-17F, но не гетеродимеры IL-17A/F, и было проведено тестирование эффекта этого анти-miL-17F антитела в животной CIA-модели RA.
Вкратце, самцов мышей DBA-1J в возрасте 8-10 недель иммунизируют 100 микрограммами бычьего коллагена типа II в полном адъюванте Фрейнда (CFA). Коллаген типа II в CFA вводят интрадермальной инъекцией в основание хвоста. Через три недели, 100 микрограмм коллагена типа II в неполном адъюванте Фрейнда (IFA) вводят интрадермальной инъекцией для индуцирования болезни. Первые признаки болезни обычно появляются через 4-10 дней после коллаген-IFA бустинга. Животных, у которых начинает развиваться артрит, рекрутируют в испытания и распределяют по следующим экспериментальным группам:
1) Изотипический контроль (мышиный IgGlk), два раза в неделю на протяжении трех недель по 300 микрограмм на инъекцию (n=10)
2) Хомяка-мышиный химерный анти-TNF-альфа, раз в неделю на протяжении трех недель по 300 микрограмм на инъекцию (n=10)
3) Антитело против мышиного IL-17F (мышиный IgGlk), два раза в неделю на протяжении трех недель по 300 микрограмм на инъекцию (n=11)
Три экспериментальные группы уравновешивали так, чтобы они включали эквивалентное число рекрутированных животных с разными оценками клинической тяжести (от 1 до 3). Клиническая оценка болезни проводилась три раза в неделю с использованием стандартных способов балльной оценки артрита. Балльная оценка определялась по шкале от 0 до 4 на лапу (где 0 означает отсутствие болезни и 4 соответствует отеку, охватывающему всю лапу) с теоретической максимальной кумулятивной оценкой, равной 16 баллам на животное. В дополнение к балльной оценке клинической тяжести, определяли уровни ключевых провоспалительных цитокинов в сыворотке с помощью Luminex в конце проведения испытаний (день 22 после рекрутмента).
Прогрессирование клинических оценок и уровни цитокина в сыворотке приведены на Фигурах 1 и 2 соответственно. Нейтрализация гомодимеров IL-17F была достаточной для того, чтобы значительно замедлить Прогрессирование болезни и снизить уровни воспалительных медиаторов. Эти результаты позволяют предположить, что IL-17F является кандидатом в мишени для терапии аутоиммунных болезней, таких как ревматоидный артрит.
Изобретение было описано с помощью письменного изложения и примеров, и квалифицированным специалистам будет понятно, что изобретение может практиковаться в различных вариантах исполнения, и что приведенные выше описание и примеры предназначены для иллюстрации и не ограничивают представленную ниже формулу изобретения.