Результат интеллектуальной деятельности: СПОСОБ ДЛЯ СНИЖЕНИЯ РАСПРОСТРАНЕНИЯ ИНФЕКЦИИ У ДЕТЕЙ МЛАДШЕГО ВОЗРАСТА
Вид РИД
Изобретение
Настоящее изобретение относится к снижению распространения инфекции у детей младшего возраста и/или к уменьшению количества инфекционных заболеваний у детей младшего возраста.
ОПИСАНИЕ УРОВНЯ ТЕХНИКИ
Уровень в крови докозагексаеновой кислоты (DHA) и арахидоновой кислоты (ARA), как правило, выше у грудных детей с естественным вскармливанием, чем у грудных детей, получающих искусственное питание, не содержащее эти жирные кислоты. По этим причинам производители и потребители детского питания заинтересованы в том, чтобы младенцы непосредственно получали DHA и ARA. В соответствии с действующими рекомендациями детское питание должно быть дополнено ARA в количествах, по меньшей мере равных количествам DHA.
WO 2005/122790 описывает композицию, включающую олигосахариды и длинноцепочечные полиненасыщенные жирные кислоты (LC-PUFA) для улучшения целостности кишечного барьера. LC-PUFA включают комбинацию DHA, эйкозапентаеновой кислоты (EPA) и ARA, в которой ARA, как это было установлено, является особенно эффективной в снижении проницаемости плотного контакта и, таким образом, может содержаться в относительно высоких количествах, предпочтительно по меньшей мере 0,1% масс. ARA по общей массе жиров.
WO 2006/022543 раскрывает комбинацию олигосахаридов и иммуноглобулинов для лечения инфекций. Эта комбинация может быть включена в детские смеси, дополнительно включающие LC-PUFA, причем предполагается, что ARA, DHA и EPA действуют синергически с олигосахаридами. Эта заявка выступает в защиту высоких содержаний ARA. WO 2006/115412 содержит аналогичную информацию.
Публикации из другой области ЕР 1.71.564 и WO 2008/054192 относятся к дыхательной недостаточности, индуцированной пылевым клещом, и аллергии на домашнюю пыль, и к висцеральному ожирению, соответственно. С этой целью оба этих документа в целом описывают в пересчете на общее содержание жира 0,1-5% масс. LC-PUFA с 20 и 22 атомами углерода, однако их фактические раскрытия включают исследования, в которых группа пациентов получала значительное количество ARA, а также рецепты детского питания, содержащие только 0,25-0,27% масс. DHA и EPA в пересчете на содержание липидов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения в клиническом исследовании с детьми младшего возраста установили, что при назначении конкретного состава количество инфекционных заболеваний и распространение инфекции у детей младшего возраста значительно уменьшаются. Обзор исследования приведен в Примере 1 (включая Фиг. 1 и Фиг. 2). Процент детей младшего возраста, которые пострадали от инфекции, значительно уменьшался при назначении состава, обогащенного конкретной композицией олигосахаридов и LCPUFA, включающей незначительное количество ARA. Второе клиническое исследование с младенцами, как описано в Примере 2, подтвердило, что эти низкие уровни ARA не ставят под угрозу серологические уровни в сыворотке крови n3 LCPUFA (например, DHA и EPA). Фактически, было найдено, что превосходные серологические значения DHA и EPA получались при назначении младенцам низких количеств ARA, но значительных количеств DHA и EPA. Подробности приведены ниже.
Принимая во внимание текущее состояние данной области техники, удивительно, что эти результаты наблюдаются у детей младшего возраста. Например, в данной области техники много положительных эффектов было приписано составам, включающим ARA. Однако настоящая композиция имеет низкое содержание ARA. Исследования также доказывают, что для того, чтобы уменьшить распространение инфекции и достичь удовлетворительных серологических уровней LCPUFA, требуется существенное количество n3 LCPUFA (например, DHA и EPA).
В дополнение к этому, удивительно, что положительные эффекты наблюдались у младенцев, которые уже потребляли разные пищевые продукты, и только относительно небольшая часть диет была обеспечена описанными композициями (молочными смесями) с представленным составом и количествами. Особенно трудно предсказать эффект смеси ингредиентов у детей младшего возраста.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к фармацевтической или пищевой композиции, предназначенной для лечения и/или предупреждения инфекций у детей младшего возраста; для уменьшения распространения инфекции у детей младшего возраста и/или для уменьшения количества инфекционных заболеваний у детей младшего возраста, которая включает
a) LC-PUFA с 20 и 22 атомами углерода, в которых количество ARA составляет менее 0,06 г на 100 г жирных кислот и которые включают
(i) 0,3-0,6 г DHA (DHA, n-3) на 100 г жирных кислот; и
(ii) 0,2-0,4 г EPA (EPA, n-3) на 100 г жирных кислот;
и
b1) от 1,5 до 2,5 г неусваиваемых олигосахаридов на 100 ккал, включающих
(i) 1,4-2 г галактоолигосахаридов со степенью полимеризации (DP) 2-7 и
(ii) 0,1-0,5 г фруктополисахаридов с DP 2-150; или
b2) от 4 до 8 г суточного количества неусваиваемых олигосахаридов, включающих, в пересчете на сутки,
i) 3,7-6,4 г галактоолигосахаридов с DP 2-7 и
ii) 0,3-1,6 г фруктополисахаридов с DP 2-150.
Другими словами, настоящее изобретение предлагает способ для лечения и/или предупреждения инфекций; уменьшения распространения инфекции и/или уменьшения количества инфекционных заболеваний путем назначения ребенку младшего возраста описанной в настоящем документе композиции.
Настоящее изобретение также относится к применению описанной в настоящем документе композиции в производстве (фармацевтической или пищевой) композиции для лечения и/или предупреждения инфекций у детей младшего возраста; уменьшения распространения инфекции и/или уменьшения количества инфекционных заболеваний у детей младшего возраста.
Полиненасыщенные жирные кислоты
Авторы настоящего изобретения неожиданно обнаружили, что n3-LCPUFA, особенно EPA (EPA, 20:5 n-3) и DHA (DHA, 22:6 n-3), наиболее предпочтительна DHA, в отсутствие или при значительно низком/очень ограниченном количестве ARA, и в комбинации с упомянутыми олигосахаридами эффективно помогают в уменьшении распространения и в снижении серьезности инфекций и количества инфекционных заболеваний.
Авторы настоящего изобретения обнаружили, что более низкие концентрации LC-PUFA были эффективны в уменьшении распространения и в снижении серьезности инфекций. Следовательно, содержание LC-PUFA с 20 и 22 атомами углерода в настоящей композиции предпочтительно не превышает 2,0% масс. от полного содержания жира, более предпочтительно не превышает 1,5% масс., еще более предпочтительно не превышает 1,4% масс. и наиболее предпочтительно не превышает 1,2% масс. от полного содержания жира. Термин «LCPUFA», используемый в настоящем изобретении, относится к полиненасыщенным жирным кислотам, содержащим цепочку из 20 или 22 атомов углерода. Предпочтительно настоящая композиция включает LCPUFA с 20 и 22 атомами углерода в количестве по меньшей мере 0,50% масс., предпочтительно по меньшей мере 0,60% масс., более предпочтительно по меньшей мере 0,70% масс. от полного содержания жира.
Содержание EPA предпочтительно находится в диапазоне от 0,25% масс. до 0,35% масс. по массе жирных кислот, более предпочтительно не превышает 0,30% масс. по массе жирных кислот. Содержание DHA предпочтительно находится в диапазоне от 0,35% масс. до 0,55% масс., более предпочтительно не превышает 0,50% масс. по массе жирных кислот.
Предпочтительно, чтобы по меньшей мере 80% масс., более предпочтительно по меньшей мере 85% масс., наиболее предпочтительно 85-100% масс. LCPUFA с 20 и 22 атомами углерода обеспечивалось комбинацией EPA и DHA.
Однако, в то время как предшествующий уровень техники поддерживает использование существенного количества ARA в формулах для грудных детей, авторами настоящего изобретения было найдено, что превосходные результаты получаются, когда уровни ARA на самом деле являются низкими, предпочтительно ниже, чем 0,05% масс. по общей массе жира. Предпочтительно, чтобы композиция включала относительно низкие количества, предпочтительно менее 0,04% масс. по общей массе жира. Количество ARA предпочтительно находится в диапазоне от 0% масс. до 0,05% масс., более предпочтительно в диапазоне от 0,01% масс. до 0,05% масс.
Если ARA присутствует, массовое соотношение ARA:DHA предпочтительно составляет менее 0,2, более предпочтительно менее 0,15, наиболее предпочтительно менее 0,10. Если ARA присутствует, массовое соотношение ARA:EPA предпочтительно составляет менее 0,8, более предпочтительно менее 0,5, наиболее предпочтительно менее 0,2. Массовое соотношение DHA:EPA предпочтительно составляет от 1:1 до 2:1, предпочтительно приблизительно 3:2. Следует отметить, что это всего лишь приблизительная граница.
Содержание докозапентаеновой кислоты (DPA) предпочтительно находится в диапазоне от 0,01% масс. до 0,20% масс. по общей массе жирных кислот. Предпочтительно настоящая композиция включает 0,01-0,15 г DPA (DPA, 22:5 n-3) на 100 г жирных кислот.
Предпочтительно, чтобы массовое соотношение омега-6 LC-PUFA: омега-3 LC-PUFA составляло от 1:1 до 7:1, более предпочтительно от 2:1 до 6:1, наиболее предпочтительно от 3:1 до 5:1, наиболее предпочтительно менее чем 5:1, в частности, менее чем 4,8:1.
Настоящая композиция предпочтительно включает 5-75% масс. полиненасыщенных жирных кислот по общей массе жира, предпочтительно 10-50% масс., наиболее предпочтительно 10-25% масс.
LC-PUFA с 20 и 22 атомами углерода могут быть обеспечены как жирные кислоты в свободном состоянии, в форме триглицерида, в форме фосфолипида, либо как смесь одного или более из вышеупомянутого. Настоящая композиция предпочтительно включает по меньшей мере одну из EPA и DHA, более предпочтительно по меньшей мере DHA, в форме триглицерида. Предпочтительно настоящая композиция содержит рыбий жир.
Настоящая пищевая композиция предпочтительно обеспечивает также омега-9 (n-9) жирную кислоту (предпочтительно олеиновую кислоту, 18:1) с тем, чтобы обеспечить достаточное питание. Предпочтительно настоящая композиция обеспечивает по меньшей мере 15% масс. n-9 жирной кислоты по общей массе жирных кислот и более предпочтительно по меньшей мере 25% масс. Содержание n-9 жирных кислот предпочтительно меньше, чем 80% масс.
Предпочтительно поддерживать массовые соотношения стеаридоновой кислоты (18:4) с DHA и с EPA ниже 0,1.
Олигосахариды
Настоящая композиция предпочтительно включает на 100 ккал 1,5-2,5 г неусваиваемых олигосахаридов, включающих
i) 1,4-2 г галактоолигосахаридов с DP 2-7 и
ii) 0,1-0,5 г фруктополисахаридов с DP 2-150.
В одном варианте осуществления настоящая композиция предпочтительно включает суточное количество от 4 до 8 г, предпочтительно 5-7 г неусваиваемых олигосахаридов на суточное количество, включающее, в пересчете на сутки,
i) 3,7-6,4 г, предпочтительно 4,5-5,6 г галактоолигосахаридов с DP 2-7, и
ii) 0,3-1,6 г, предпочтительно 0,5-1,4 г фруктополисахаридов с DP 2-150.
Термин “фруктополисахариды” включает фруктаны и инулин, а также продукты их гидролиза и используется взаимозаменяемо с термином “фруктоолигосахариды”. Предпочтительными галактоолигосахаридами являются трансгалактоолигосахариды. Предпочтительно, чтобы по меньшей мере 95% масс., предпочтительно 95-100% масс. неусваиваемых олигосахаридов обеспечивалось галактоолигосахаридами и фруктополисахаридами.
В особенно предпочтительном варианте осуществления настоящая композиция включает трансгалактоолигосахарид. Трансгалактоолигосахарид может быть определен как [галактоза]n-глюкоза и/или [галактоза]n-глюкоза-[галактоза], где n является целым числом от 1 до 7 включительно. Предпочтительно настоящая композиция включает [галактоза]n-глюкозу, в которой n является целым числом от 1 до 6 включительно. Этот тип галактоолигосахаридов иногда упоминается как scGOS.
Используемый в настоящем документе термин "фруктополисахарид" предпочтительно относится к неусваиваемому полисахаридному углеводу, включающему цепочку из по меньшей мере двух β-связанных блоков фруктозы со степенью полимеризации (DP) от 2 до 250, предпочтительно 7-100, более предпочтительно 20-60. Предпочтительно используется инулин. Инулин доступен под товарным знаком “Raftilin HP®” (Orafti). Средняя степень полимеризации настоящего фруктополисахарида предпочтительно составляет по меньшей мере 7, более предпочтительно по меньшей мере 10, предпочтительно менее 100, наиболее предпочтительно 10-30, наиболее предпочтительно 20-23. Фруктополисахарид со средней DP 10-30 иногда упоминается как lcFOS. Используемый фруктополисахарид предпочтительно имеет блоки фруктозы (большинство этих блоков), связанные связью β(2→1). Другие термины для фруктополисахаридов включают инулин, фруктоолигосахарид, полифруктозу, фруктаны и олигофруктозу. Настоящая композиция предпочтительно включает фруктополи/олигосахариды с DP от 2 до 100.
Состав
Настоящая композиция предпочтительно назначается перорально.
Настоящая композиция предпочтительно включает белок, углевод и жир. Предпочтительно она назначается в жидкой форме. Используемый в настоящем документе термин “жидкое питание” включает сухое питание (например, порошки), которое сопровождается инструкциями по смешиванию упомянутой сухой продовольственной смеси с подходящей жидкостью (например, водой).
Настоящая композиция предпочтительно обеспечивается как упакованный порошок или упакованная готовая к употреблению формула. Для того чтобы предотвратить порчу продукта, размер упаковки готовой к употреблению формулы предпочтительно не превышает одной порции, например, предпочтительно не превышает 1500 мл; и размер упаковки настоящей композиции в форме порошка предпочтительно не превышает 250 порций. Подходящие размеры упаковки для порошка составляют 2000 г или менее, предпочтительно 1000 г или менее.
Поскольку лактоза является важным источником углевода для детей младшего возраста, настоящая композиция предпочтительно включает по меньшей мере 35% масс. лактозы по общей массе усваиваемых углеводов, более предпочтительно по меньшей мере 50% масс., наиболее предпочтительно по меньшей мере 75% масс. Предпочтительно композиция включает по меньшей мере 1 г лактозы на 100 мл, более предпочтительно по меньшей мере 2 г на 100 мл, еще более предпочтительно по меньшей мере 5 г на 100 мл. Настоящая композиция предпочтительно включает 4-18 г, более предпочтительно 4-14 г усваиваемых углеводов на 100 мл композиции.
Предпочтительно настоящая композиция включает 4-20% эн. белков, 20-50% эн. жиров и 25-85% эн. углеводов. Более предпочтительно настоящая композиция включает 8-10% эн. белков, 35-45% эн. жиров и 45-55% эн. углеводов. Термин “% эн.” является сокращением для энергетического процента и представляет собой относительное количество, которое каждый элемент вносит в значение общей калорийности продукта. Калорийность обеспечивается усваиваемыми углеводами, белками и жирами. Белок может включать элементы, выбираемые из группы, состоящей из гидролизованного молочного белка, овощного белка и/или аминокислот.
В предпочтительном варианте осуществления настоящая композиция включает витамин D. Витамин D является группой жирорастворимых секостероидов. Существуют две главные физиологически релевантные формы, которые являются витамином D2 (эргокальциферол) и витамином D3 (холекальциферол). Они известны в совокупности как кальциферол. В контексте настоящего изобретения термин «витамин D» относится ко всем формам витамина D, а именно D1, D2, D3 или D4, в частности D2 и D3, или к любой их смеси. Превосходные результаты получаются при включении витамина D для иммунитета и при инфекции. Витамин D может быть обеспечен в активной (1,25(OH)2D) или неактивной (Vit D3 или D2) форме.
Упакованные продукты, предпочтительно снабженные ярлыками, которые явно или неявно указывают потребителю, как использовать упомянутые продукты в соответствии с одной или более вышеупомянутых или нижеупомянутых целей, охватываются настоящим изобретением. Такие ярлыки могут, например, ссылаться на настоящий способ путем включения в них такой формулировки, как “уменьшение инфекции”, “уменьшенное количество инфекционных заболеваний”, «защищает Вашего ребенка», “защита против бактерий и вирусов”, или подобных формулировок в соответствии с выводами клинического исследования.
В одном варианте осуществления настоящая композиция предпочтительно является пищевой или диетической добавкой, предназначенной для целевой группы младенцев, не претендуя таким образом на детское (молочное) питание.
Настоящая композиция предпочтительно готовится путем смешивания порошкообразной композиции с водой. Настоящее изобретение таким образом также относится к упакованной порошковой композиции, в которой упомянутая упаковка снабжена инструкциями для смешивания порошка с подходящим количеством жидкости.
В одном предпочтительном варианте осуществления настоящая композиция назначается ребенку младшего возраста, причем вышеупомянутые олигосахариды вводятся в дозе 0,8-1,6 г/100 мл, предпочтительно 1,0-1,4 г/100 мл, а упомянутые n-3 LCPUFA вводятся в дозе 15-25 мг/100 мл, предпочтительно 18-22 мг/100 мл.
В одном предпочтительном варианте осуществления настоящая композиция вводится ребенку младшего возраста, причем вышеупомянутые олигосахариды вводятся в суточной дозе 4-8 г, предпочтительно 4,5-7,5 г, более предпочтительно 5-7 г, а упомянутые n-3 LCPUFA вводятся в суточной дозе 60-130 мг, предпочтительно 70-120 мг, более предпочтительно 80-110 мг.
Предпочтительно настоящая композиция вводится в жидкой форме ребенку младшего возраста в количестве 250-750 мл в сутки, более предпочтительно 400-750 мл в сутки, более предпочтительно 400-600 мл в сутки, оптимально приблизительно 500 мл в сутки. Предпочтительно, чтобы суточная дозировка неусваиваемых олигосахаридов (предпочтительно GOS и фруктополисахаридов) составляла по меньшей мере 3,5 г, а суточная дозировка n-3 LCPUFA составляла по меньшей мере 55 мг. Предпочтительно, однако, чтобы олигосахариды и n-3 LCPUFA назначались в суточной дозе приблизительно 5,0-7,0 г и 80-110 мг, соответственно. Рекомендуемые суточные количества составляют приблизительно 6,0 г и 100 мг для олигосахаридов и n-3 LCPUFA, соответственно. Следует отметить, что эти рекомендуемые значения являются лишь приблизительными пределами. В данном параграфе “олигосахариды” должны пониматься как комбинация (i) галактоолигосахаридов с короткой цепью и (ii) длинноцепочечных фруктополисахаридов, описанных выше. Термин “n-3 LCPUFA” в данном параграфе относится к комбинации DHA и EPA.
В соответствии с одним вариантом осуществления витамин D назначается в суточном количестве 200-800 мкг, предпочтительно 300-700 мкг, более предпочтительно 400-600 мкг. В соответствии с одним вариантом осуществления витамин D используется в количестве 40-160 мкг на 100 мл, предпочтительно 60-140 мкг, более предпочтительно 80-120 мкг на 100 мл. Вышеприведенные числа могут быть преобразованы в IU, если это необходимо.
Предпочтительно настоящая композиция назначается ребенку младшего возраста по меньшей мере дважды в неделю, более предпочтительно по меньшей мере 5 раз в неделю, более предпочтительно ежедневно. Предпочтительно настоящая композиция назначается в течение по меньшей мере 10 недель подряд, предпочтительно по меньшей мере 26 недель подряд, более предпочтительно по меньшей мере 50 недель подряд.
Инфекции
Настоящее изобретение относится к использованию настоящей композиции для детей младшего возраста от 10 до 48 месяцев, предпочтительно от 10 до 36 месяцев, более предпочтительно от 11 до 40 месяцев, более предпочтительно от 1 года до 3 лет. Предпочтительно дети младшего возраста являются здоровыми детьми, предпочтительно детьми младшего возраста, у которых не диагностировано расстройство или заболевание.
Настоящее изобретение предпочтительно относится к инфекциям дыхательных путей и/или кишечника. Как дыхательные пути, так и кишечник являются общими местами для патогенных инфекций. В одном варианте осуществления настоящее изобретение предпочтительно относится к уменьшению распространения инфекций дыхательных путей. В другом варианте осуществления настоящее изобретение предпочтительно относится к уменьшению распространения кишечных инфекций. Настоящая композиция предпочтительно назначается детям младшего возраста, посещающим дневные детские сады. Эти дети подвергаются воздействию множества микроорганизмов, которые могут вызывать инфекции.
Настоящее изобретение также предлагает упакованную жидкую или порошкообразную композицию, обеспечивающую на 100 мл жидкой композиции или на 100 мл разбавленной водой порошковой композиции
a. 15-25 мг LCPUFA (LC-PUFA) с 20 и 22 атомами углерода, в которых количество ARA составляет менее 0,06 г на 100 г жирных кислот и которые включают
(i) 0,3-0,6 г DHA (DHA, n-3) на 100 г жирных кислот и
(ii) 0,2-0,4 г EPA (EPA, n-3) на 100 г жирных кислот; и
b. 1-1,5 г неусваиваемых олигосахаридов на 100 мл, а также 1,5-2,5 г неусваиваемых олигосахаридов на 100 ккал, которые включают
(i) 1,4-2 г на 100 ккал галактоолигосахаридов с DP 2-7 и
(ii) 0,1-0,5 г на 100 ккал фруктополисахаридов с DP 2-150 и средней DP 10-30.
В одном варианте осуществления настоящее изобретение также предлагает упакованную жидкую или порошкообразную композицию, обеспечивающую для суточной дозировки
a) 60-130, предпочтительно 70-120 мг, более предпочтительно 80-110 мг LC-PUFA с 20 и 22 атомами углерода, в которых количество арахидоновой кислоты (ARA) составляет менее 0,06 г на 100 г жирных кислот и которые включают
(i) 0,3-0,6 г DHA (DHA, n-3) на 100 г жирных кислот и
(ii) 0,2-0,4 г EPA (EPA, n-3) на 100 г жирных кислот; и
b) 4-8 г, предпочтительно 5-7 г неусваиваемых олигосахаридов в сутки, включающих, в пересчете на сутки:
(i) 3,7-6,4 г, предпочтительно 4,5-5,6 г галактоолигосахаридов с DP 2-7, и
(ii) 0,3-1,6 г, предпочтительно 0,5-1,4 г фруктополисахаридов с DP 2-150, и средней DP 10-30.
Настоящая композиция предпочтительно включает 4-20% эн. белков, 20-50% эн. жиров и 25-85% эн. углеводов. Более предпочтительно настоящая композиция включает 8-10% эн. белков, 35-45% эн. жиров и 45-55% эн. углеводов.
В одном варианте осуществления упакованная жидкая или порошкообразная композиция дополнительно включает витамин D, предпочтительно в формах и количествах, указанных выше.
ПРИМЕР 1 - клиническое исследование распространения инфекций
Цель исследования состояла в том, чтобы исследовать эффект композиции по настоящему изобретению на распространение инфекций среди детей, посещающих дневные детские сады, в возрасте 1-3 лет.
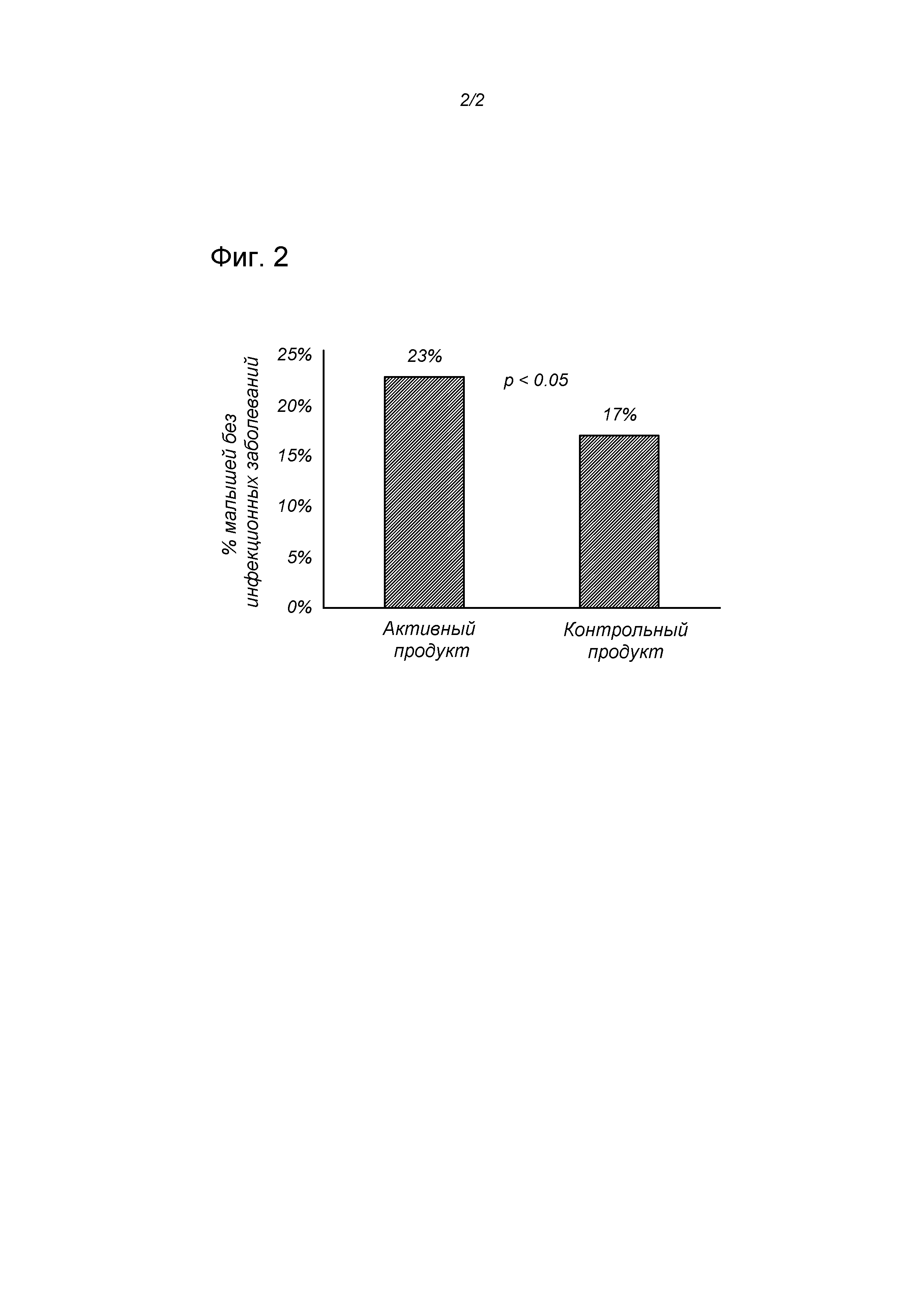
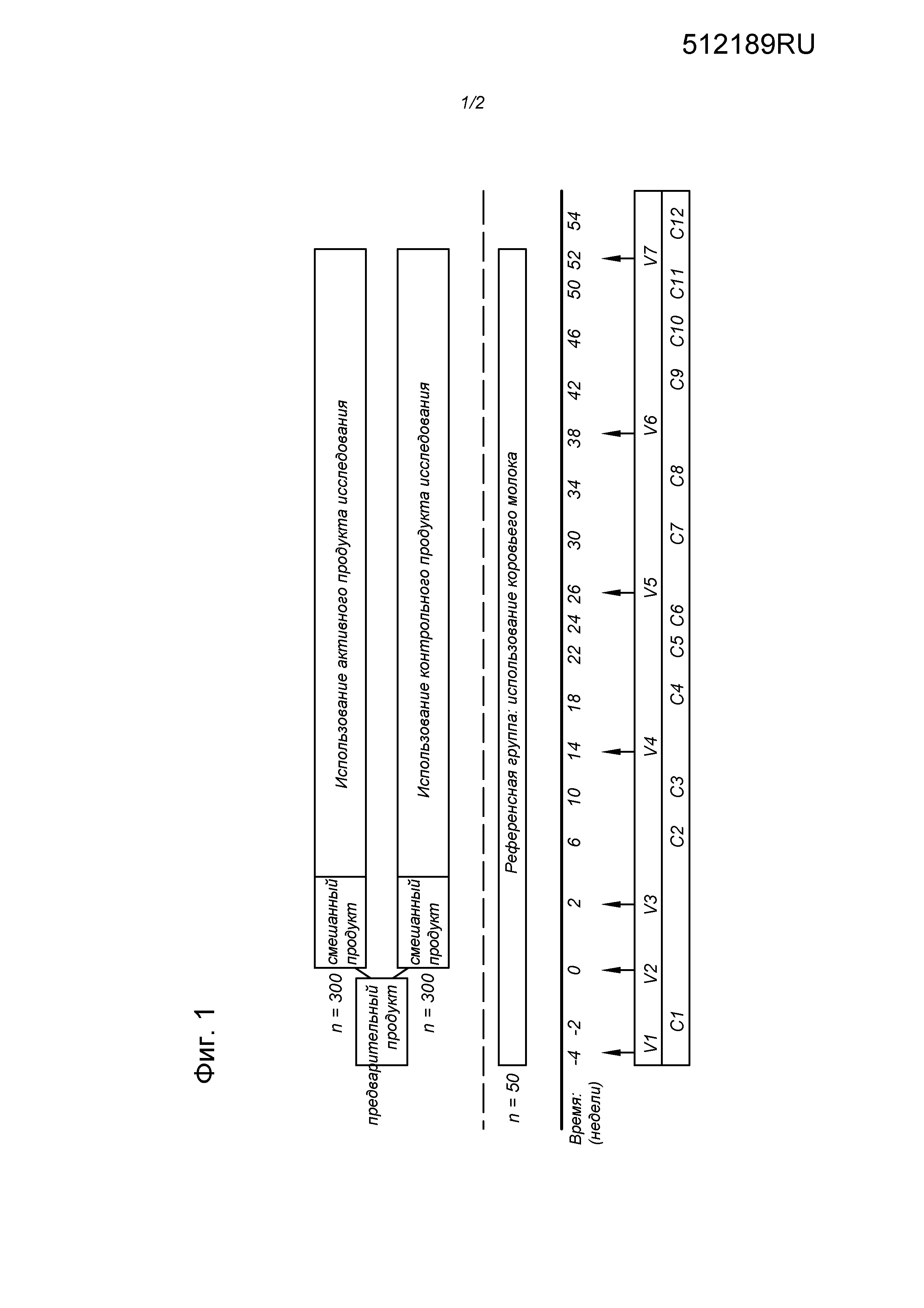
Схема исследования показана на Фиг. 1, а статистика приведена в Таблице 1.
Составы контрольной диеты и «диеты по настоящему изобретению» приведены в Таблице 2 (Таблица 2A показывает составы жирных кислот). Диета по настоящему изобретению имела полное содержание насыщенных жирных кислот, равное 25,2% (от всех жирных кислот); массовое соотношение омега-6:омега-3, равное 4,1:1; и массовое соотношение LA:ALA, равное 5,4:1. Аналогичные значения для контрольной диеты составляли 24,9%, 5,5:1 и 5,4:1, соответственно.
|
|
|
|
|
В рандомизированном, двустороннем слепом, управляемом, параллельном, многонациональном воздействующем испытании 767 здоровых детей в возрасте 11-29 месяцев получали «диету по настоящему изобретению», содержащую scGOS/lcFOS/LCPUFA, или «контрольную диету» (без scGOS/lcFOS/LCPUFA) в течение 52 недель.
Для диеты по настоящему изобретению ежедневное целевое введение составляло по меньшей мере 6,0 г scGOS/lcFOS и 100 мг n-3 LC-PUFA (DHA и EPA) в 500 мл. Композиция включала 1,2 г/100 мл scGOS/lcFOS (массовое соотношение приблизительно 9:1) и 19,2 мг/100 мл n-3 LC-PUFA (DHA и EPA).
Родители заполняли ежедневник при возникновении симптомов болезни (без различия между инфекциями верхних дыхательных путей и желудочно-кишечными инфекциями).
Использовалась модель отрицательно-биномиальной регрессии со множеством нулевых значений, которая комбинирует две отдельные части: биномиальную часть (субъект инфицирован: да/нет) и отрицательно-биномиальную часть, учитывающую количество инфекций для субъектов.
Результаты
Дети из группы, получавшей диету по настоящему изобретению, по сравнению с контрольной группой имели сниженный риск заражения по меньшей мере одной инфекцией (299/388 (77%) против 313/379 (83%), соответственно, RR=0,93, 95% CI 0,87-1; хи квадрат p=0,057; логистическая регрессия p=0,0259).
Другими словами, результаты показывают тенденцию к снижению количества инфекционных заболеваний (p=0,0743). Эта тенденция увеличивает шансы исключить инфекцию вообще, как показано на Фиг. 2, в терминах процента детей младшего возраста, у которых не было отмечено случаев инфекции (p<0,05).
ПРИМЕР 2 - клиническое исследование серологических уровней LCPUFA
Цель этого исследования заключалась в том, чтобы измерить влияние на здоровых детей добавки, содержащей scGOS/lcFOS (массовое соотношение приблизительно 9:1) и n-3 LCPUFA.
В этом двустороннем слепом, плацебо-контролируемом исследовании 195 детей в возрасте 1-3 лет были рандомизированы для получения композиции, содержащей scGOS/lcFOS и 16,9 мг/100 мл n-3 LC-PUFA (Группа 1), композиции, содержащей scGOS/lcFOS и 1,3 мг/100 мл n-3 LC-PUFA (Группа 2), или композиции, не содержащей scGOS/lcFOS и содержащей 1,3 мг/100 мл n-3 LC-PUFA (Группа 3) в течение 12 недель. Средний суточный прием составлял приблизительно 540 мл упомянутых составов.
Таблица 3 показывает содержание жирных кислот в композиции.
|
|
Образцы сыворотки крови были получены у 128 детей в начале исследования и на 12 неделе.
Как показано в Таблице 3, концентрации ARA и n-3 LC-PUFA в добавке для Группы 1 составляли приблизительно 0,04 г и 0,84 г на 100 г жирных кислот, соответственно, в соответствии с данными, сообщенными для экспериментальной диеты Примера 1 (т.е. 0,034 г и 0,73 г на 100 г, соответственно). Концентрации ARA и n-3 LC-PUFA в добавках для Групп 2 и 3 составляли приблизительно 0,108 г и 0,065 г на 100 г жирных кислот. В Группах 1 и 3 уровни scGOS/lcFOS были подобны уровням в примере 1, т.е. целевой суточный прием составлял по меньшей мере 6,0 г scGOS/lcFOS.
Результаты
В начале эксперимента не было никаких различий в характеристиках между исследуемыми группами. Средний прием композиции был одинаковым во всех группах во время исследования (диапазон 530-542 мл/сутки). Между началом эксперимента и 12 неделей наблюдалось значительное увеличение содержания в сыворотке крови DHA (46,0-53,7 мг/л, p<0,001) и EPA (7,0-8,6 мг/л, p=0,001) в Группе 1, при одновременном значительном уменьшении содержания в сыворотке крови DHA и EPA как в Группе 2 (45,6─40,0 мг/л и 7,2-4,6 мг/л, соответственно, причем для обеих кислот p<0,001), так и в Группе 3 (45,4-39,0 мг/л, p<0,001 и 7,1-5,4 мг/л, p=0,007, соответственно). Эти изменения существенно отличались в Группе 1 по сравнению с Группой 3 и Группой 2 (в обоих случаях p<0,001), но не отличались при сравнении Группы 2 с Группой 3 (p=0,858).
Уменьшение содержания в сыворотке крови DHA и EPA, наблюдаемое в Группе 2 и в Группе 3 (до 1,3 мг/100 мл DHA+EPA) за 12-недельный период, указывает на то, что может происходить истощение n-3 LCPUFA. Следовательно, детское питание с адекватно высокими уровнями n-3 LCPUFA (включающей малые количества ARA) может помочь улучшить статус n-3 LC-PUFA у детей в возрасте от 1 до 3 лет.