Результат интеллектуальной деятельности: КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПРОБИОТИЧЕСКИЕ БАКТЕРИИ, ДЛЯ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ ИММУННЫХ РАССТРОЙСТВ
Вид РИД
Изобретение
Настоящее изобретение относится к композиции, содержащей пробиотические бактерии, для лечения патологий, ассоциированных с изменениями иммунной системы. В частности, настоящее изобретение относится к применению выбранных пробиотических бактерий для приготовления композиции для лечения аллергий, таких как атопический дерматит.
Хорошо известно, что атопический дерматит (далее АД для краткости) является хроническим рецидивирующим кожным заболеванием, которое начинается в неонатальный период или в детстве и может сохраниться во взрослом состоянии. Таким образом, фазы АД разделены на неонатальные, детские и взрослые. АД представляет собой воспалительное заболевание кожи, которое, как астма и аллергический ринит, ассоциировано с локальной инфильтрацией Т-лимфоцитов, которые продуцируют интерлейкин 4 (IL-4) и интерлейкин 5 (IL-5).
Хорошо известно, что IL-4 регулирует развитие Т-хелпера фенотипа 2 (Th2) с последующей гиперпродукцией иммуноглобулина (lg) и эозинофилией. Повышенные уровни IgE в сыворотке крови и кожные тесты, положительные в отношении пищевых и ингаляционных аллергенов, могут быть продемонстрированы у 80-90% субъектов, страдающих от атопического дерматита.
АД основан на наследственных факторах и на иммунологических факторах, даже в том случае, когда большое количество внешних факторов может модифицировать его проявление. В 60% случаев АД имеет место семейная история атопии; другими словами, если у одного из родителей есть атопический диатез, то имеется 60% вероятность того, что дети будут страдать от атопии.
Атопия представляет собой генетическую предрасположенность к развитию локализованных анафилактических реакций после контакта, приема пищи, прививки или ингаляции аллергенов. Иммунологические факторы, принимаемые во внимание в этиологии АД, представляют собой: аллергию на продукты, аллергию, вызванную контактом с аллергенами и раздражителями, аллергию, вызванную аэроаллергенами и иммунорегуляторными аномалиями.
Среди множества способов лечения, направленных на терапию и/или профилактику аллергий или воспалений кожи, в частности, при лечении атопического дерматита, выделяют способы лечения, основанные на применении лекарственных средств.
У основанных на применении лекарственного средства способах лечения есть несколько противопоказаний, которые ограничивают их применение. Более того, эти лекарственные средства, по-видимому, плохо переносятся некоторыми категориями пациентов.
Тем не менее, в настоящее время не существует лечения, обладающего абсолютной и определенной эффективностью. Можно только выполнить некоторые предостережения против возникновения аллергий или, при необходимости, принимать средства для уменьшения беспокоящих симптомов, таких как зуд и покраснение кожи.
Таким образом, сохраняется потребность в лечении, которое не имеет ограничений, основанных на применении лекарственных средств и способов лечения, и которое можно применять для всех категорий пациентов.
В частности, сохраняется потребность в лечении, которое может способствовать борьбе с началом аллергий и развитием воспалений кожи и/или для уменьшения беспокоящих симптомов, таких как покраснение кожи, зуд и экзема.
Заявитель предложил решение вышеупомянутой задачи путем отбора специфических пробиотических бактериальных штаммов после интенсивной научно-исследовательской деятельности.
Объект настоящего изобретения представляет собой композицию, содержащую по меньшей мере одну культуру пробиотических бактерий, как заявлено в формуле изобретения.
Кроме того, объект настоящего изобретения относится к применению по меньшей мере одной культуры пробиотических бактерий, как заявлено в формуле изобретения. Другие предпочтительные воплощения настоящего изобретения изложены в следующем подробном описании посредством не ограничивающих объем настоящего изобретения примеров.
Задача настоящего изобретения заключалась в отборе специфических бактериальных штаммов с целью оценки их действия на клинический курс и качество жизни пациентов с умеренным или тяжелым АД, и с целью определения их влияния на клинические и иммунологические параметры.
Кроме того, задача настоящего изобретения заключалась в отборе бактериальных штаммов, обладающих пробиотической активностью, которые переносятся пациентами и способны колонизировать кишечный тракт.
Диагноз умеренного/тяжелого АД оценивали, используя стандартизированный индекс тяжести для атопического дерматита - далее обозначенного как АД - (Индекс SCORAD=Индекс оценки атопического дерматита). Указанный индекс известен специалистам в данной области техники.
Обнаружено, что бактериальные штаммы по настоящему изобретению обладают высоким иммуномодулирующим действием и, таким образом, полезны для лечения патологий, ассоциированных с изменениями иммунной системы.
После интенсивных научных исследований, заявитель выбрал из множества протестированных штаммов следующие пробиотические бактериальные штаммы:
1) Lactobacillus salivarius (LS01) DSM 22775, депонированный 23.07.2009 компанией Probiotical SpA of Novara - Италия;
2) Bifidobacterium breve (BR03) DSM 16604, депонированный 20.07.2004 компанией Probiotical SpA of Novara - Италия;
3) Lactobacillus pentosus (LPS01) DSM 21980, депонированный 14.11.2008 компанией Probiotical SpA of Novara - Италия;
4) Streptococcus thermophilus (FP4) DSM 18616, депонированный 13.09.2006 компанией Mofin Sri of Novara - Италия;
5) Lactobacillus casei ssp.rhamnosus (LR04) DSM 16605, депонированный 20.07.2004 компанией Probiotical SpA of Novara - Италия; и
6) Lactobacillus acidophilus (LA02) DSM 21717, депонированный 06.08.2008 компанией Probiotical SpA of Novara - Италия.
Все перечисленные выше культуры депонированы в немецкой коллекции микроорганизмов и клеточных культур (Deutsche Sammlung von Mikroorganismen und Zellkulturen - GmbH, (DSMZ)) в Германии в соответствии с Будапештским соглашением.
В контексте настоящего изобретения перечисленные выше культуры пробиотических бактерий могут находиться в форме живых бактерий, мертвых бактерий или клеточных компонентов, клеточных экстрактов или их лизатов.
В предпочтительном воплощении композиция содержит по меньшей мере одну бактериальную культуру для применения в качестве иммуномодулирующей композиции, способной модулировать иммунную систему.
Выражение "иммуномодулирующая композиция" означает, что композиция способна модулировать иммунную систему в том смысле, что способна стимулировать/вызывать несколько ответов иммунной системы, делая ее более реакционно-способной, например, выступая посредником в продукции специфических цитокинов.
Преимущественно указанная иммуномодулирующая композиция индуцирует иммунную систему в отношении продукции цитокинов 1 типа.
Преимущественно продемонстрировано, что бактериальные штаммы и соответствующие бактериальные культуры способны улучшать клинические и иммунологические параметры. В частности, обнаружено, что они способны:
1) значительно улучшать индекс SCORAD и DLQI (дерматологический индекс качества жизни);
2) уменьшать микробную транслокацию (уровни LPS (липополисахаридов) в плазме крови) и активацию CD8+Т-лимфоцитов;
3) увеличивать процентную долю как общих регуляторных T-лимфоцитов (Treg), так и экспрессирующих маркеры TLR2- и TLR4;
4) улучшать соотношения Th1/Th2 и Th17/Treg.
Таким образом, композиция по настоящему изобретению (иммуномодулирующая композиция) способна предупреждать, уменьшать и/или лечить патологии, ассоциированные с изменениями иммунной системы, такие как аллергии, атопию, аллергический ринит, пищевую гиперчувствительность, атопический дерматит, экзему, астму и иммунодефициты.
В соответствии с одним из воплощений, настоящее изобретение относится к композиции, содержащей или, альтернативно, состоящей из по меньшей мере одной культуры пробиотических бактерий, выбранной из группы, включающей или, альтернативно, состоящей из культур Lactobacillus salivarius (LS01) DSM 22775, Bifidobacterium breve (BR03) DSM 16604 и Lactobacillus pentosus (LPS01) DSM 21980.
В предпочтительном воплощении композиция содержит или, альтернативно, состоит из культуры Lactobacillus salivarius (LS01) DSM 22775 и Bifidobacterium breve (BR03).
В предпочтительном воплощении композиция содержит или, альтернативно, состоит из указанной культуры Lactobacillus salivarius (LS01) DSM 22775 и указанной культуры Bifidobacterium breve (BR03) DSM 16604 в ассоциации с по меньшей мере одной другой культурой, выбранной из группы, включающей или, альтернативно, состоящей из: Lactobacillus pentosus (LPS01) DSM 21980, Streptococcus thermophilus (FP4) DSM 18616, Lactobacillus casei ssp.rhamnosus (LR04) DSM 16605 и Lactobacillus acidophilus (LA02) DSM 21717.
В предпочтительном воплощении композиция содержит или, альтернативно, состоит из культуры Lactobacillus salivarius (LS01) DSM 22775, Bifidobacterium breve (BR03) и Lactobacillus pentosus (LPS01) DSM 21980.
В соответствии с еще одним предпочтительным воплощением, настоящее изобретение относится к применению по меньшей мере одной культуры пробиотических бактерий, выбранных из группы, включающей или, альтернативно, состоящей из культуры Lactobacillus salivarius (LS01) DSM 22775, Bifidobacterium breve (BR03) DSM 16604 и Lactobacillus pentosus (LPS01) DSM 21980, для приготовления композиции, способной предупреждать, уменьшать и/или лечить патологии, ассоциированные с изменениями иммунной системы, такие как аллергии, атопия, аллергический ринит, пищевая гиперчувствительность, атопический дерматит, экзема, астма и иммунодефициты.
В соответствии с еще одним предпочтительным воплощением настоящее изобретение относится к применению композиции, содержащей или, альтернативно, состоящей из указанной культуры Lactobacillus salivarius (LS01) DSM 22775 и Bifidobacterium breve (BR03).
Предпочтительно изобретение относится к применению указанной культуры Lactobacillus salivarius (LS01) DSM 22775 и указанной культуры Bifidobacterium breve (BR03) DSM 16604 в ассоциации с по меньшей мере одной другой культуры, выбранной из группы, включающей: Lactobacillus pentosus (LPS01) DSM 21980, Streptococcus thermophilus (FP4) DSM 18616, Lactobacillus casei ssp.rhamnosus (LR04) DSM 16605 и Lactobacillus acidophilus (LA02) DSM 21717, для приготовления композиции для профилактического и/или терапевтического лечения атопического дерматита.
В соответствии с еще одним предпочтительным воплощением настоящее изобретение относится к применению композиции, содержащей или, альтернативно, состоящей из указанной культуры Lactobacillus salivarius (LS01) DSM 22775, Bifidobacterium breve (BR03) и Lactobacillus pentosus (LPS01) DSM 21980.
Предпочтительно композиция содержит или, альтернативно, состоит из Lactobacillus salivarius (LS01) DSM 22775 и Bifidobacterium breve (BR03) DSM 16604 в массовом отношении от 1:3 до 3:1, предпочтительно 1:1.
Альтернативно композиция содержит или, альтернативно, состоит из Lactobacillus salivarius (LS01) DSM 22775, Bifidobacterium breve (BR03) DSM 16604 и Lactobacillus pentosus (LPS01) DSM 21980, предпочтительно в массовом отношении 1:1:1.
Бактериальные культуры по настоящему изобретению можно рассматривать как "активные ингредиенты", которые могут быть смешаны в соответствующих пропорциях с физиологически и/или фармацевтически приемлемыми эксципиентами. Для усиления своей активности действующие начала могут быть введены системно, преимущественно перорально, в форме композиции в твердом состоянии, приготовленной в соответствии со способами, известными специалистам в данной области техники.
В предпочтительном воплощении композиции находятся в форме лиофилизатов, порошков, гранул, таблеток, мягких желатиновых капсул или суспензий.
Композиции по настоящему изобретению могут представлять собой фармацевтические, диетические, пищевые или нутрицевтические композиции.
Композиции по настоящему изобретению также могут содержать диетические волокна с пребиотической активностью, такие как фруктоолигосахариды (FOS), инулин и частично гидролизованную гуаровую камедь (PHGG).
Фармацевтические, диетические, пищевые или нутрицевтические композиции по настоящему изобретению содержат по меньшей мере одну культуру пробиотических бактерий, как указано выше. Конечная концентрация композиции составляет от 1×107 до 1×1011 КОЕ (колониеобразующих единиц)/г композиции, предпочтительно от 1×108 до 1×1010 КОЕ/г композиции.
Композиции по настоящему изобретению, которые содержат выбранные пробиотические бактерии, полезны в качестве иммуномодулирующих композиций, способных модулировать иммунную систему.
Указанные композиции способны лечить и/или предупреждать патологии, ассоциированные с изменениями функций следующих цитокинов: Th1 (IFN-γ и IL-12) и Th2 (IL-4, IL-5 и IL-10). Кроме того, указанные композиции способны индуцировать иммунную систему в направлении продукции цитокинов 1 типа.
Таким образом, композиции по настоящему изобретению можно эффективно применять для профилактического и/или терапевтического лечения патологий, ассоциированных с изменениями иммунной системы, в частности для профилактического и/или терапевтического лечения аллергий, атопии, аллергического ринита, пищевой гиперчувствительности, атопического дерматита, экземы, астмы или иммунодефицитов. Предпочтительно, композиции по настоящему изобретению можно эффективно применять для профилактического и/или терапевтического лечения атопического дерматита.
Предпочтительно прием пациентами, страдающими атопическим дерматитом АД, пробиотической композиции, содержащей культуру Lactobacillus salivarius (LS01) DSM 22775 и культуру Bifidobacterium breve (BR03) DSM 16604 в концентрации, составляющей от 1×107 до 1×1011 КОЕ, предпочтительно 1×109 КОЕ/г, вызывает снижение индекса Scorad (меньшее значение Scorad указывает на более хорошее качество жизни). Кроме того, введение указанной пробиотической композиции в течение от 12 до 24 недель, предпочтительно 16 недель, способно уменьшать/блокировать секрецию цитокина IL-4.
Экспериментальная часть (I)
Заявитель тестировал все шесть вышеупомянутых штаммов.
Первое клиническое исследование проводили для тестирования композиции, содержащей культуру Lactobacillus salivarius (LS01) DSM 22775 и культуру Bifidobacterium breve (BR03) DSM 16604.
Группу из 40 пациентов (мужчин и женщин, в возрасте от 18 до 55 лет), страдающих от умеренного/тяжелого АД, произвольным образом разделяли (1:1) на две группы.
Диагноз умеренного/тяжелого АД оценивали с использованием стандартизированного индекса тяжести АД (индекс SCORAD - индекс оценки атопического дерматита). Указанный индекс известен специалистам в данной области техники.
Т0 представляет нулевой период, то есть начальную точку лечения, тогда как Т16 представляет 16-недельный период лечения. В момент Т16 осуществляли проверку путем определения индекса Scorad и отбора проб.
Группу A лечили композицией, содержащей культуру Lactobacillus salivarius (LS01) DSM 22775 и культуру Bifidobacterium breve (BR03) DSM 16604, имеющей концентрацию 1×109 КОЕ (соответствующую 0,01 г). Две культуры смешивали с 1 г кукурузного крахмала с получением конечной композиции 1,01 г в саше. 20 пациентов из группы A получали 2 саше в сутки в течение 16 недель.
Группу В лечили плацебо, представляющим собой 1 г (исключительно) кукурузного крахмала. 20 пациентов в группе B получали 2 саше плацебо в сутки в течение 16 недель.
Проводили тесты на следующие цитокины: Th1 (IFN-γ и IL-12) и Th2 (IL-4, IL-5 и IL-10).
Все данные для 40 пациентов тщательно собирали и анализировали.
На Фиг.1 показана гистограмма индекса Scorad в момент T0 и Т16.
Полученные результаты демонстрируют, что прием 20 пациентами из группы A пробиотической композиции, содержащей культуру Lactobacillus salivarius (LS01) DSM 22775 и культуру Bifidobacterium breve (BR03) DSM 16604 в концентрации 1×109 КОЕ, приводил к снижению индекса Scorad у пациентов, пораженных АД (меньшее значение Scorad указывает на более хорошее качество жизни).
Кроме того, введение указанной пробиотической композиции в течение 16 недель было способно блокировать секрецию рассматриваемого цитокина, IL-4, среднее значение которого сравнимо со значением, полученным в момент регистрации. Напротив, введение плацебо не было способно блокировать высвобождение цитокина IL-4, уровень которого значительно увеличивался после 16 недель лечения (развитие заболевания).
Серии преклинических исследований in vitro проводили на группе бактерий, содержащей среди прочих культуру Lactobacillus salivarius (LS01) DSM 22775 и культуру Bifidobacterium breve (BR03) DSM 16604.
Преклинические исследования in vitro, в которых сравнивали иммуномодулирующие способности тестируемых бактериальных штаммов, показали, что культура Lactobacillus salivarius (LS01) DSM 22775 и культура Bifidobacterium breve (BR03) DSM 16604 демонстрируют превосходную способность индуцировать продукцию цитокинов 1 типа.
Также тестировали культуры бактерий Lactobacillus pentosus (LPS01) DSM 21980, Streptococcus thermophilus (FP4) DSM 18616, Lactobacillus casei ssp.rhamnosus (LR04) DSM 16605 и Lactobacillus acidophilus (LA02) DSM 21717.
Было показано in vitro, что культура штамма L. pentosus (LPS01) DSM 22775 индуцирует очень сильный про-Th1 цитокиновый профиль.
Кроме того, все культуры штаммов Lactobacillus pentosus (LPS 01) DSM 21980, Streptococcus thermophilus (FP4) DSM 18616, Lactobacillus casei ssp.rhamnosus (LR04) DSM 16605 и Lactobacillus acidophilus (LA02) DSM 21717 тестировали в отношении их способности индуцировать синтез IL-12 мононуклеарными клетками периферической крови (РВМС) в исследовании in vivo. IL-12 представляет собой цитокин Th1-типа и является ключевым элементом в лечении аллергий и других атопических патологий.
В качестве примера приведены данные в отношении L.pentosus (LPS01) DSM 21980, тестированные на РВМС: Th-1 (пг/мл)=1,754; Th-2 (пг/мл)=326; Th1/Th2=5,38.
Экспериментальная часть (II)
Заявитель провел первое клиническое исследование с использованием композиции, содержащей культуры Lactobacillus salivarius (LS01) DSM 22775 и Bifidobacterium breve (BR03), и второе клиническое исследование с использованием композиции, содержащей культуры Lactobacillus salivarius (LS01) DSM 22775, Bifidobacterium breve (BR03) и Lactobacillus pentosus (LPS01) DSM 21980. Для упрощения приведена подробная информация только об указанном первом клиническом исследовании, поскольку указанное второе клиническое исследование осуществляли путем одинаковых способов. Оба клинических исследования (первое и второе) продемонстрировали сравнимые результаты.
Заявитель провел первое указанное клиническое исследование (рандомизированное, с двойным контролем, на пациентах, пораженных тяжелым или умеренным атопическим дерматитом) для оценки клинической эффективности введения двух штаммов пробиотических бактерий, а именно Lactobacillus salivarius (LS01), депонированного в DSMZ и имеющего номер DSM 22775, и Bifidobacterium breve (BR03), депонированного в DSMZ и имеющего номер DSM 16604.
Материалы и методы
48 пациентов, пораженных атопическим дерматитом (далее АД), привлекли в данное исследование. Их характеристики приведены в таблице 1.
|
Настоящее клиническое исследование проводили в период с апреля по сентябрь 2010 года.
32 пациента (в группе, которая получала лечение) получали препарат, содержащий два штамма пробиотических бактерий, а именно L. salivarius (LS01) DSM 22775 и B.breve (BR03) DSM 16604, в дозе 1×109 КОЕ/г каждого штамма в мальтодекстрине.
Тогда как 16 пациентов (группа плацебо) получали препарат только мальтодекстрина. Обе группы получали лечение два раза в сутки в течение 12 недель. Композиции в лиофилизированной форме растворяли в воде и вводили пациентам перорально.
Ни один из пациентов не менял свою диету, и всех попросили не употреблять ферментированные продукты, содержащие живые микроорганизмы, во время клинического исследования. Пациентов, которые страдали аллергическим заболеванием в активной форме (респираторным или кожным) или инфекционным заболеванием во время беременности или кормления грудью, исключили из данного исследования. Пациентов, которые получили лечение пробиотиками, антибиотиками или иммуномодуляторами в течение шести месяцев до регистрации или которые получали лечение пероральными стероидами за месяц до регистрации, исключили из данного исследования. Все пациенты дали свое согласие об информированности во время регистрации.
Клиническая оценка была основана на индексе SCORAD (оценка атопического дерматита), на DLQI (дерматологический индекс качества жизни) и на микробной транслокации и иммунологических параметрах. Для каждого отдельного пациента все оценки делались во время регистрации (базовые), после 3 месяцев лечения (ms) и спустя два месяца после окончания терапии (3+2ms).
Опросник по симптомам и качеству жизни
Диагностические критерии для АД были установлены в соответствии с недавно опубликованным клиническим руководством. Клиническую тяжесть оценивали с использованием индекса SCORAD, разработанного Европейской рабочей группой по атопическому дерматиту. В ходе исследования для измерения варьирования симптомов, связанных с патологией, все зарегистрированные пациенты заполнили специфический опросник DLQI (дерматологический индекс качества жизни). Оценку SCORAD осуществляли в начале, конце и спустя два месяца после приостановки лечения (пробиотиками или плацебо) оператором, который не знал, в какую группу включен пациент. DLQI заполнялся пациентами во время регистрации и на 12 и 20 недели.
Разделение плазмы и мононуклеарных клеток периферической крови (РВМС)
Для разделения плазмы и мононуклеарных клеток периферической крови (РВМС) образцы периферической венозной крови отбирали у всех исследуемых субъектов во время регистрации, после 3 месяцев лечения и спустя 2 месяца после приостановки терапии. Плазму хранили до времени анализа, тогда как РВМС отделяли путем центрифугирования в градиенте плотности. Жизнеспособность клеток определяли с использованием счетчика клеток Adam-МС.
Стимуляция РВМС
РВМС инкубировали в течение 18 часов в присутствии или в отсутствие липополисахаридной (LPS) бактериальной стимуляции. Анализ цитокинов, индуцированных аллергенным стимулом, осуществляли путем проточной цитометрии с добавлением брефельдина A в качестве ингибитора клеточного транспорта в течение последних часов культуры.
Иммуносренотипический анализ
Процент активированных CD8+ T-лимфоцитов рассчитывали непосредственно на образцах периферической венозной крови путем цитофлуориметрического анализа с использованием моноклональных антител (mAb), конъюгированных с флуорохромами (CD8, CD38, CD45RO). После инкубации с mAb эритроциты лизировали, и клетки фиксировали и анализировали при помощи проточного цитометра FC500 (Beckman Coulter).
Анализ субпопуляций лимфоцитов
Идентификацию различных субпопуляций Т лимфоцитов осуществляли на не стимулированных культурах РВМС и культурах РМВС, стимулированных в течение 18 часов LPS во все моменты (базовый, 3ms и 3+2ms). Маркировку клеток осуществляли путем одновременного использования комбинаций флуоресцентных антител, способных к распознаванию молекул на поверхности клеток и на внутриклеточных компонентах. Конкретно, Т-хелперные лимфоциты 1 типа (Th1) идентифицировали как CD4+/IFN-γ+/Tbet+; Т-хелперные лимфоциты 2 типа (Th2) как CD4+/IL-4+/GATA3+; Т-хелперные лимфоциты 17 типа (Th17) как CD4+/IL-17+/RORγT+ и, наконец, регуляторные T-хелперы (Treg) как CD4+/CD25+/FoxP3+/IL-10+/TGF-β+.
Оценка экспрессии toll-подобных рецепторов (TLR) на регуляторных T-лимфоцитах
Анализ осуществляли на не стимулированных РВМС в соответствии с протоколом, предложенным производителем mAb. Конкретно, необходимы следующие mAb: CD4, CD25, FoxP3, TLR-4, TLR-2.
Анализ LPS в плазме крови
Для определения концентрации LPS в образцах плазмы крови использовали набор "LAL Chromogenic Endopoint Assay" от компании Hycult biotechnology в соответствии с указаниями производителя. Тест осуществляли в 96-луночном планшете. После 45 минут инкубации при комнатной температуре поглощение при длине волны 405 нм регистрировали при помощи спектрофотометра, и концентрацию LPS, выраженную в пг/мл, рассчитывали путем интерполяции с кривой известной концентрации.
Сбор и хранение образцов фекалий
Образцы фекалий собирали на момент регистрации, после 3 месяцев лечения и спустя 2 месяца после окончания исследования. Образцы немедленно помещали при температуре 4°C, отбирали аликвоты и хранили при -80°C до момента анализа.
Количественный анализ бактерий, присутствующих в образцах фекалий
Количественный анализ осуществляли для всех аэробных бактерий и для следующих групп бактерий: Enterobacteria, Staphylococci, Lactobacilli (в частности L.salivarius LS01) и Bifidobacteria (в частности, B.breve BR03). Образцы фекалий растворяли в физиологическом растворе, и соответствующие разведения инкубировали согласно следующей схеме:
Все АЭРОБНЫЕ бактерии: Триптический соевый агар с 5% овечьей кровью (AS);
Enterobacteria: Агар макконки (MC);
Staphylococci: Агар с солью маннита (MSA);
Lactobacilli: агар Мана, Рогоза и Шарпа (MRS);
Bifidobacteria: селективная среда для бифидобактерий (BSM). Среды MC и BSM инкубировали при 37°C в течение 24 и 48 часов соответственно. Среды AS, MRS и BSM инкубировали при 37°C в присутствии 10% диоксида углерода в течение 24, 48 и 72 часов соответственно.
Все колонии идентифицировали путем выращивания в селективных средах, окрашивания по Граму, по клеточной морфологии и путем тестирования на каталазу и оксидазу.
Композицию кишечной микробиоты выражали как количество (среднее±стандартное отклонение по основанию десятичного логарифма (Iog10) на грамм фекалий) для каждой бактериальной группы. Пределы обнаружения составляли 2 log10 КОЕ/г для всех микроорганизмов за исключением B.breve, предел для которого составлял 5 log10 КОЕ/г. Модификации количеств различных микробных групп рассчитывали как:
[(Log 10 КОЕ/г для Т12 или Т16)-(Log 10 КОЕ/г для T0)]
Молекулярная идентификация L.salivarius LS01 и В.breve BR03
Два бактериальных штамма исходно идентифицировали на основе их морфологических особенностей: L.salivarius LS01, выращенный на агаризованной среде BSM, формирует светло-кремовые окрашенные колонии, кругловатые с удлиненной формой и диаметром от 2 до 4 мм; В.Breve BR03 на агаризованной среде BSM образует колонии розового цвета, кругловатые с удлиненной формой и диаметром от 1 до 2 мм.
В культурах, в которых возможно допустить присутствие штаммов L.salivarius и В.breve, 10 случайных колоний анализировали посредством полимеразной цепной реакции (PCR) в соответствии с рекомендациями, изданными Национальным институтом здравоохранения. Все колонии, классифицированные как L.salivarius или B.Breve, дополнительно характеризовали путем гель-электрофореза в пульсирующем поле (PFGE) и сравнения профилей с подходящими референсными образцами.
Статистический анализ
Результаты анализировали с использованием соответствующих статистических тестов. Т-тесты использовали для сравнения пациентов во время лечения. Возможные взаимосвязи оценивали с использованием теста корреляции Пирсона. Вариации в количестве бактерий анализировали с использованием теста Вилкоксон-Манна-Уитни. Статистический анализ осуществляли с использованием статистического пакета SPSS.
Результаты
а) Клиническая эффективность
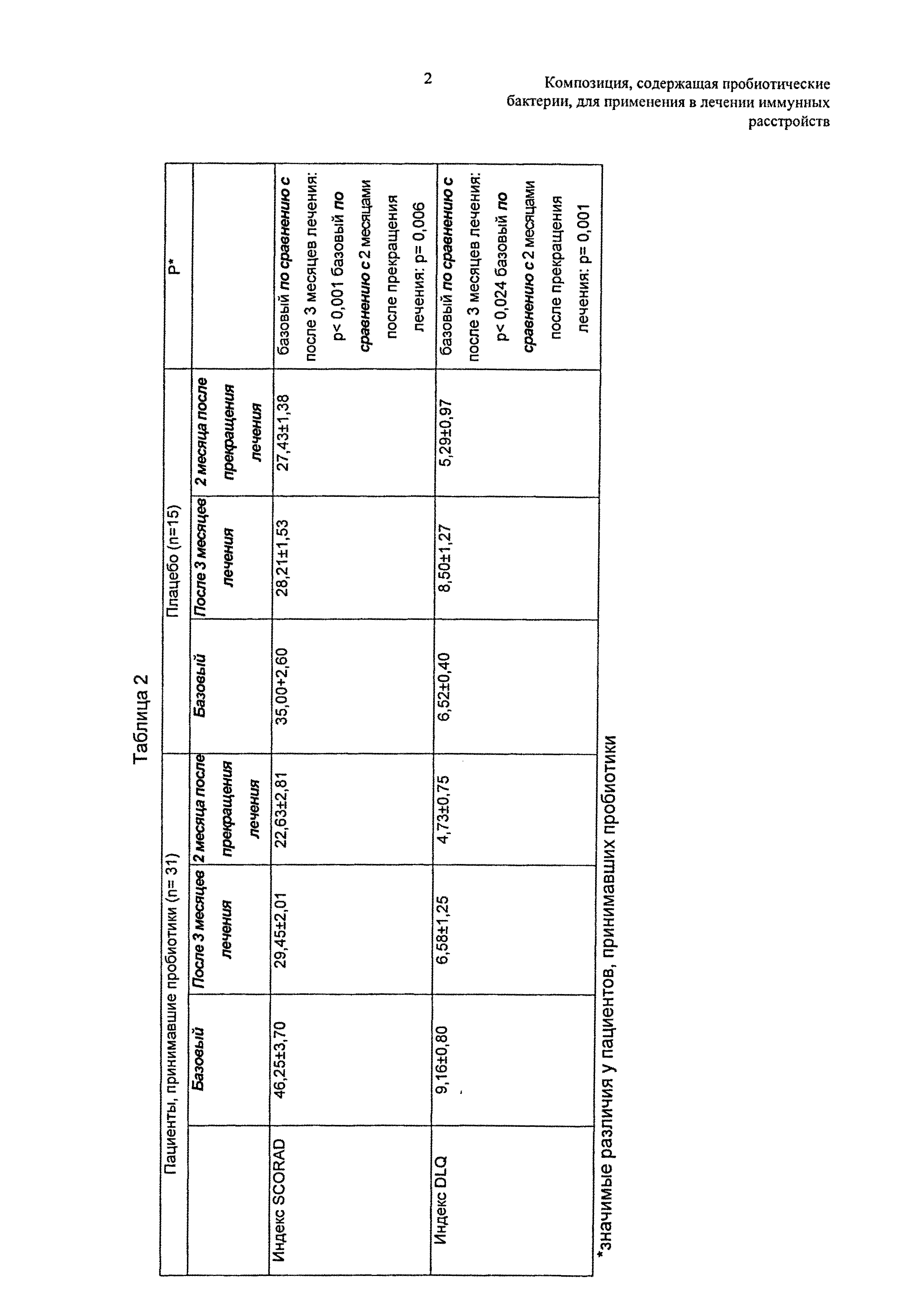
46 пациентов, страдающих АД, завершили клиническое исследование; 2 пациента (1 пациент на группу) были исключены. Оценку SCORAD (индекс SCORAD) и DLQI провели во время последующих исследований. Пациенты, которых лечили пробиотиками, демонстрировали значительное снижение SCORAD к концу лечения (p равно 0,001), которое также сохранялось после прекращения лечения (p равно 0,006) (Таблица 2) (см. в конце описания).
Аналогично, DLQI продемонстрировал улучшение у пациентов, которых лечили пробиотической смесью (момент регистрации по сравнению с 3 месяцами лечения: p равно 0,024; момент регистрации по сравнению с 2 месяцами после прекращения лечения: р равно 0,001). В группе пациентов, которым вводили плацебо, никакое значимое различие не обнаружено с точки зрения SCORAD или DLQI (Таблица 2).
б) Концентрация LPS в плазме крови
Концентрация LPS представляет собой индекс микробной транслокации; увеличение концентрации LPS связано с изменениями кишечной проницаемости. Лечение двумя пробиотическими штаммами индуцировало снижение концентрации LPS в плазме крови, которое сохранялось после прекращения лечения (базовый момент по сравнению с 3 месяцами лечения: p равно 0,050; базовый момент по сравнению с 2 месяцами после прекращения лечения: p меньше 0,001; 3 месяца лечения по сравнению с 2 месяцами после прекращения лечения: p меньше 0,001), как показано ниже (Таблица 3).
|
У пациентов, получавших плацебо, обнаружено существенное повышение уровней LPS в плазме крови во время периода исследования (базовый уровень по сравнению с 2 месяцами после прекращения лечения: p равно 0,004; 3 месяца лечения по сравнению с 2 месяцами после прекращения лечения: p равно 0,016) (Таблица 3). В конце исследования концентрация LPS в плазме крови была значительно выше в контрольной группе (плацебо) по сравнению с группой, получавшей лечение (p меньше 0,001).
в) Активированные Т лимфоциты
Активированные CD8+ Т-клетки анализировали, оценивая экспрессию на тех же самых CD38 и CD45 молекулах. Прогрессирующее снижение наблюдали в указанных клетках во время периода исследования у пациентов, которых лечили этими двумя пробиотиками (базовый момент по сравнению с 2 месяцами после прекращения лечения: p меньше 0,001; 3 месяца лечения по сравнению с 2 месяцами после прекращения лечения: p меньше 0,001) (Таблица 4). Никакое значимое различие не обнаружено в плацебо группе.
|
г) Регуляторные T-клетки (Treg)
Регуляторные T-клетки оценивали как в отсутствие стимуляции, так и после стимуляции LPS. После лечения пробиотической смесью процент не стимулированных Treg лимфоцитов был значительно повышен (базовый момент по сравнению с 2 месяцами после прекращения лечения: р равно 0,002; 3 месяца лечения по сравнению с 2 месяцами после прекращения лечения: р равно 0,034) (Таблица 5А и Таблица 5 В). Аналогичные результаты получены в результате анализа после стимуляции LPS.
|
|
д) Экспрессия Toll-подобных рецепторов на регуляторных Т лимфоцитах
Экспрессию Toll-подобных рецепторов 2 (TLR-2) и 4 (TLR-4) оценивали непосредственно в периферической венозной крови. Как показано в Таблице 5С и Таблице 5D, экспрессия обеих молекул на Treg лимфоцитах значительно увеличивалась после 3 месяцев применения пробиотиков; этот результат также сохранялся спустя 2 месяца после прекращения лечения (TLR-2: Базовый момент по сравнению с 3 месяцами лечения: р меньше 0,001; Базовый момент по сравнению с 2 месяцами после прекращения лечения: p равно 0,010; TLR-4: Базовый момент по сравнению с 3 месяцами лечения: p меньше 0,001; Базовый момент по сравнению с 2 месяцами после прекращения лечения: p равно 0,011). В контрольной группе (плацебо) существенное уменьшение наблюдалось в экспрессии молекулы TLR-2 Treg лимфоцитами в конце исследования (3 месяца лечения по сравнению с 2 месяцами после прекращения лечения: p равно 0,009).
|
|
e) Субпопуляции лимфоцитов ТЫ. Th2 и Th17
Субпопуляции лимфоцитов Th1, Th2 и Th17 оценивали в отсутствие стимуляции и после стимуляции LPS в обеих группах, подвергающихся анализу: процент субпопуляции Th1, идентифицированной на основе экспрессии молекул CD4 и Tbet и секреции цитокина IFN-γ, был значительно выше у субъектов, которых лечили пробиотической смесью, как при отсутствии стимуляции, так и после стимуляции LPS (без стимуляции: Базовый момент по сравнению с 3 месяцами лечения: р равно 0,003; LPS: Базовый момент по сравнению с 3 месяцами лечения: р равно 0,025; Базовый момент по сравнению с 2 месяцами после прекращения лечения: p равно 0,019) (Таблица 6А и Таблица 6B). У пациентов, получивших лечение пробиотиками, спустя два месяца после окончания лечения обнаружено дополнительное уменьшение в клетках Th1 (p<0,001).
|
|
Процент субпопуляции клеток Th2, идентифицированных на основе экспрессии молекул CD4 и GATA3 и секреции цитокина IL-4 был значительно, снижен во время введения пробиотиков, но после прекращения лечения вновь повышался (без стимуляции: Базовый момент по сравнению с 3 месяцами лечения: p равно 0,016; 3 месяца лечения по сравнению с 2 месяцами после прекращения лечения: р равно 0,005; LPS: Базовый момент по сравнению с 3 месяцами лечения: р равно ns; 3 месяца лечения по сравнению с 2 месяцами после прекращения лечения: p равно 0,0045) (Таблица 6С и Таблица 6D).
|
|
Процент субпопуляции клеток Th17, идентифицированных на основе экспрессии молекул CD4 и RORγT и секреции цитокина IL-17, был снижен у пациентов, которых лечили пробиотиками, после 3 месяцев лечения (без стимуляции: Базовый момент по сравнению с 3 месяцами лечения: р равно 0,037; LPS: Базовый момент по сравнению с 3 месяцами лечения: р равно 0,046) (Таблица 6Е и Таблица 6F). Спустя два месяца после прекращения лечения значимые различия обнаружены между двумя группами, подвергающимися анализу в отношении субпопуляций лимфоцитов Th2 и Th17 (р равно 0,008 и р равно 0,031 соответственно). Никакое значимое различие не обнаружено в клеточных популяциях Th1, Th2 и Th17 у субъектов в контрольной группе (плацебо).
|
|
ж) Соотношения Th1/Th2 и Th17/Treq
После 3 месяцев введения пробиотиков значимое увеличение обнаружено в соотношении Th1/Th2 (р равно 0,028) (Таблица 7A). Этот эффект исчезает после прекращения лечения (р равно 0,002). Напротив, в группе, которую лечили бактериальные смесью, соотношение Th17/Treg прогрессивно уменьшалось, и этот результат также обнаружен спустя 2 месяца после прекращения лечения (р равно 0,029). Во время исследования субъекты, зарегистрированные в контрольной группе (плацебо), не продемонстрировали какого-либо значимого различия в соотношениях Th1/Th2 и Th17/Treg. Соотношение Th17/Treg значительно выше в группе плацебо по сравнению с группой, получавшей пробиотик, после 3 месяцев лечения (P равно 0,037) (Таблица 7B).
|
|
з) Корреляции
У пациентов, которым вводили пробиотики, в конце лечения обнаружена отрицательная корреляция между SCORAD и процентом Treg лимфоцитов после стимуляции LPS (р равно 0,020) и между процентом активированных CD8+ T-лимфоцитов и клеток ТМ, стимулированных LPS (р равно 0,046).
Значимая положительная корреляция обнаружена между концентрацией LPS в плазме крови и процентом не стимулированных клеток Th2 (р равно 0,016), между концентрацией LPS в плазме крови и процентом клеток Th17, стимулированных LPS (р равно 0,04), и между процентом активированных CD8+ T-лимфоцитов и клеток Th7, стимулированных LPS (р равно 0,037).
и) Модификации фекальной микробиоты и обнаружение штаммов L.salivarius LS01 и В.breve BR03
Количества клеток на момент регистрации, после 3 месяцев лечения и спустя 2 месяца после окончания введения приведены в Таблице 8.
|
* Значимо уменьшенный (Р меньше 0,05) по сравнению с базовым моментом
◇ Значимо уменьшенный (P меньше 0,05) по сравнению с плацебо в тот же момент времени.
В контрольной группе (плацебо) никакие значимые изменения не обнаружены в фекальной флоре. В группе, которую лечили пробиотиками, после 3 месяцев обнаружено значимое уменьшение уровня стафилококков. Это открытие было значимым также по сравнению с контрольной группой после 3 месяцев лечения. Уменьшение остается статистически значимым даже спустя два месяца после прекращения приема пробиотиков. Никакие значимые модификации не обнаружены ни в какой другой микробной проанализированной группе.
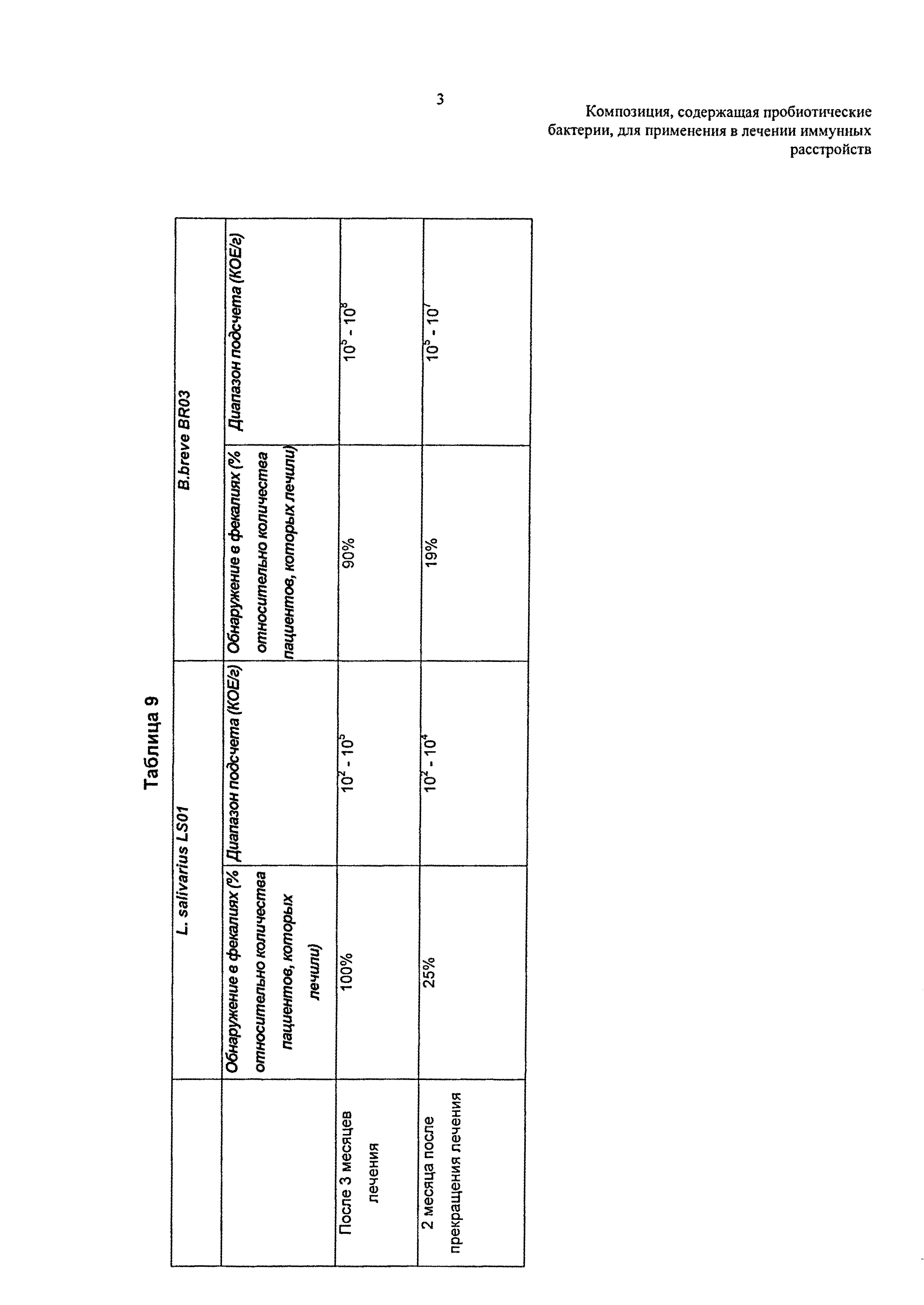
Результаты, связанные с пробиотическими штаммами в фекальных образцах субъектов, зарегистрированных в исследовании, представлены в Таблице 9 (см. в конце описания). Все колонии с морфологией, соответствующей морфологии рассматриваемых штаммов, идентифицировали анализом PCR и PFGE, соответствовали колониям штаммов, ранее идентифицированных как L.salivarius LS01 или B.breve BR03.
Штамм L.salivarius LS01 обнаружен у всех субъектов после 3 месяцев лечения в количестве, равном 102-105 КОЕ/г. Штамм В.breve BR03 обнаружен у 90% субъектов после трех месяцев лечения в количестве, равном 106-108 КОЕ/г.
У некоторых пациентов оба штамма также выделены спустя 2 месяца после прекращения лечения, но в меньшем количестве по сравнению с полученными непосредственно после прекращения введения.
Заявитель сумел подтвердить, что композиции по настоящему изобретению, в частности указанные в первом клиническом исследовании (Lactobacillus salivarius (LS01) DSM 22775, и Bifidobacterium breve (BR03) DSM 16604) и указанные во втором клиническом исследовании (Lactobacillus salivarius (LS01) DSM 22775, Bifidobacterium breve (BR03) DSM16604 и Lactobacillus pentosus (LPS01) DSM 21980), вводимые в течение 3 месяцев взрослым субъектам, страдающим от серьезного или умеренного атопического дерматита, демонстрируют способность улучшить клинические и иммунологические параметры. В частности, к концу лечения пробиотиками обнаружено следующее:
1) существенное улучшение индексов SCORAD и DLQI;
2) сокращение микробной транслокации (уровни LPS в плазме крови) и активации CD8+ Т лимфоцитов;
3) повышение процента как общего количества регуляторных T-лимфоцитов (Treg), так и экспрессирующих маркеры TLR2-H TLR4;
4) улучшение соотношений Th1/Th2 и Th17/Treg.
Благоприятным образом продемонстрировано, что используемые пробиотические штаммы способны колонизировать желудочно-кишечный тракт пациентов и уменьшать стафилококковый уровень в фекалиях.
Благоприятным образом, клинический эффект введения пробиотиков с точки зрения улучшения симптомов патологии и качества жизни проявился после 3 месяцев лечения. Продемонстрировано, что указанный эффект сохраняется даже спустя 2 месяца после прекращения лечения.
Благоприятным образом, присутствие 3 пробиотических бактериальных штаммов (Lactobacillus salivarius (LS01) DSM 22775, Bifidobacterium breve (BR03) DSM16604 и Lactobacillus pentosus (LPS01) DSM 219809) в желудочно-кишечном тракте также обнаружено после прекращения лечения, что свидетельствует о способности специфических бактериальных комбинаций колонизировать тонкий кишечник.
Изменения в кишечной проницаемости играют ключевую роль в патогенезе атопического дерматита и при других заболеваниях, характеризуемых воспалительным компонентом. Результаты, полученные в результате клинического исследования, демонстрируют важный аспект, который состоит в присутствии отрицательной корреляции между уровнями LPS в плазме крови и атопией. Конкретно, существенное улучшение микробного проникновения как во время, так и после лечения пробиотиком демонстрирует иммуномодулирующий эффект, которым обладают 3 бактериальных штамма, способные улучшить барьер тонкого кишечника, действуя непосредственно и опосредованно.
Исследования в области инфекций HIV (вирус иммунодефицита) продемонстрировали связь между микробной транслокацией и иммунологической активацией с чрезмерным обновлением T-клеток. Оценка процента активированных CD8+ Т-лимфоцитов, рассматриваемых в качестве важного прогностического фактора при ВИЧ-инфекциях, представляет собой один из наиболее широко принятых маркеров опосредованной LPS активации иммунной системы. Как ожидалось, у пациентов, страдающих атопическим дерматитом, зарегистрированных в настоящем исследовании, уменьшение уровней LPS в плазме крови обнаружено вместе со снижением уровня активированных CD8+ Т-клеток. Эти данные демонстрируют, что у тестированных бактериальных штаммов существует сильная иммуномодулирующая активность как следствие их способности увеличивать барьер тонкого кишечника. В группе плацебо эта корреляция не обнаружена.
Четыре различных субпопуляции CD4+ Т-хелперных лимфоцитов идентифицировали на основе их способности секретировать цитокины: Th1, основные продуценты IFN-γ и IL-2, вовлечены в опосредованные клетками иммунные ответы; Th2, секретирующие IL-4, ответственны за запуск гуморального ответа; Th17, секретирующие IL-17, IL-21 и IL-22, вовлечены в иммунные реакции, направленные против внеклеточных патогенов и при аутоиммунных заболеваниях; регуляторные Т-клетки, обладающие иммунорегулирующей функцией, контролирующей гиперактивацию иммунных ответов.
Сообщали об уменьшении уровня клеток Treg у пациентов, страдающих атопическим дерматитом и астмой, и их количество обратно пропорционально секреции IgE, эозинофилии и уровням IFN-γ.
Прием пробиотических штаммов вызывает существенное увеличение процента общих Treg лимфоцитов и значимое увеличение Treg лимфоцитов, экспрессирующих рецепторы TLR2 и TLR4 после лечения. Эти клеточные субпопуляции осуществляют иммунодепрессивную деятельность в качестве своей основной функции. Колонизация S. aureus представляет собой критический фактор для развития атопического дерматита, как положительная корреляция между тяжестью болезни и колонизацией S.aureus. Благоприятные воздействия пробиотиков могли иметь место из-за опосредованного Treg-клетками восстановления иммунологической толерантности в отношении S.aureus и грамотрицательных бактерий. Кроме того, отрицательная корреляция найдена между индексом SCORAD и клетками Treg клетки, что свидетельствует о положительной роли последних в развитии атопического дерматита.
Подтип Th2 играет критическую роль в патогенезе аллергических реакций и является ответственным за острую фазу атопического дерматита, в то время как у субпопуляции Th1 имеется защитная функция, которая связана с хронической фазой болезни. У пациентов, страдающих атопическим дерматитом, уровень клеток Th17 увеличивается при острых поражениях кожи, но не при хронических поражениях, и положительно коррелирует с тяжестью заболевания. Данные, полученные в этом исследовании, демонстрируют, что эта новая пробиотическая комбинация увеличивает функциональность клеток Th1 в ущерб субпопуляций Th2 и Th7, таким образом увеличивая соотношения Th1/Th2 и Th7/Treg.
Подтипы Th2 и Th7 положительно коррелируют с уровнями LPS в плазме крови, что свидетельствует о сильном взаимодействии между микробной транслокацией и модификациями иммунной системы. Это обнаружение дополнительно подтверждается положительной корреляцией между Th7 и активированными CD8+. Кроме того, роль, выполняемая микробной флорой кишечника в развитии иммунологической толерантности и в патогенезе аллергических заболеваний, продемонстрирована в достаточной степени. Изменение в микрофлоре кишечника играет роль в возникновении атопического дерматита и в ухудшении симптомов кожи. Те же самые авторы, анализируя композицию фекальной микробиоты у сенситизированных страдающих от астмы и не страдающих от астмы детей, заметили, что лактобактерии и бифидобактерии похожи в обеих группах.
В настоящем исследовании обнаружено значимое различие в микробной композиции этих двух проанализированных групп в отношении стафилококков. Таким образом, возможно, что у указанного рода может быть важная роль как на уровне кожи, так и в тонком кишечнике пациентов, страдающих атопическим дерматитом, и введение пробиотической комбинации по настоящему изобретению может восстановить равновесие.
В настоящем клиническом исследовании продемонстрировано, что бактериальные штаммы по настоящему изобретению хорошо переносятся и способны колонизировать кишечный тракт и вызывать благоприятные клинические эффекты у субъектов, страдающих атопическим дерматитом, путем модуляции некоторых из наиболее важных иммунопатологических изменений, типичных для воспалительного заболевания кожи.
Объект настоящего изобретения представляет собой применение тестированных выше бактериальных штаммов в дополнительной терапии, поддерживающей лечение атопического дерматита у взрослых субъектов.