Результат интеллектуальной деятельности: РАСТЕНИЕ, ОБЛАДАЮЩЕЕ ПОВЫШЕННОЙ УСТОЙЧИВОСТЬЮ ИЛИ ЧУВСТВИТЕЛЬНОСТЬЮ К ИНГИБИТОРУ 4-HPPD
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к агенту для придания растению устойчивости или чувствительности к ингибитору 4-HPPD, трансгенной клетке растения, способной к регенерации растения, обладающего повышенной устойчивостью или чувствительностью к ингибитору 4-HPPD, растению, регенерированному из этой клетки, и способам их создания. Кроме того, настоящее изобретение относится к способу определения того, обладает ли растение устойчивостью или чувствительностью к ингибитору 4-HPPD, и способу селекции растения, обладающего повышенной устойчивостью или чувствительностью к ингибитору 4-HPPD, используя это определение.
Предпосылки создания изобретения
Вместе с увеличением спроса на топливный биоэтанол чрезмерно возросла импортная цена фуражного зерна из-за границы, что наложило тяжелое бремя на животноводческие хозяйства в Японии. В этой ситуации для увеличения внутреннего производства и уровня самообеспеченности фуражом выращивают не рис-падди, а чередующиеся культуры, используя земли под паром и т.д. Однако использование рисовых полей, подходящих для выращивания этих чередующихся культур, ограничено из-за таких проблем, как плохой дренаж. По этой причине были стимулированы использование риса в качестве фуража и разработки особенных культиваров фуражного риса с высокой продуктивностью (культиваров с высокой урожайностью). Для проявления такими культиварами с высокой урожайностью своих характерных свойств, относящихся к высокой урожайности, и демонстрации ими способности к стабильному росту, а также для увеличения вкусовой привлекательности и пищевой ценности скота борьба с сорняками на посевных рисовых полях является важным методом борьбы при выращивании (непатентная литература 1). Кроме того, для стабильных и экономичных производств не только культиваров с высокой урожайностью и риса, но также культур необходима недорогая, энергосберегающая и легкая борьба с сорняками. Разработка и использование гербицида с высокой избирательностью являются эффективными в такой борьбе (непатентная литература 2). Поэтому необходимы разработка и выращивание культур, устойчивых к используемому гербициду.
Между тем, в борьбе с сорняками на посевных рисовых полях широко используются гербициды на основе сульфонилмочевин (SU), поскольку эти гербициды являются эффективными против широкого ряда сорняков в низкой дозе и оказывают незначительное влияние на человека, а также на окружающую среду. Тем не менее, было обнаружено появление таких сорняков, как Scirpus juncoides Roxb., обладающих устойчивостью к гербицидам на основе SU. Это приводит к проблеме в борьбе при выращивании риса и т.д.
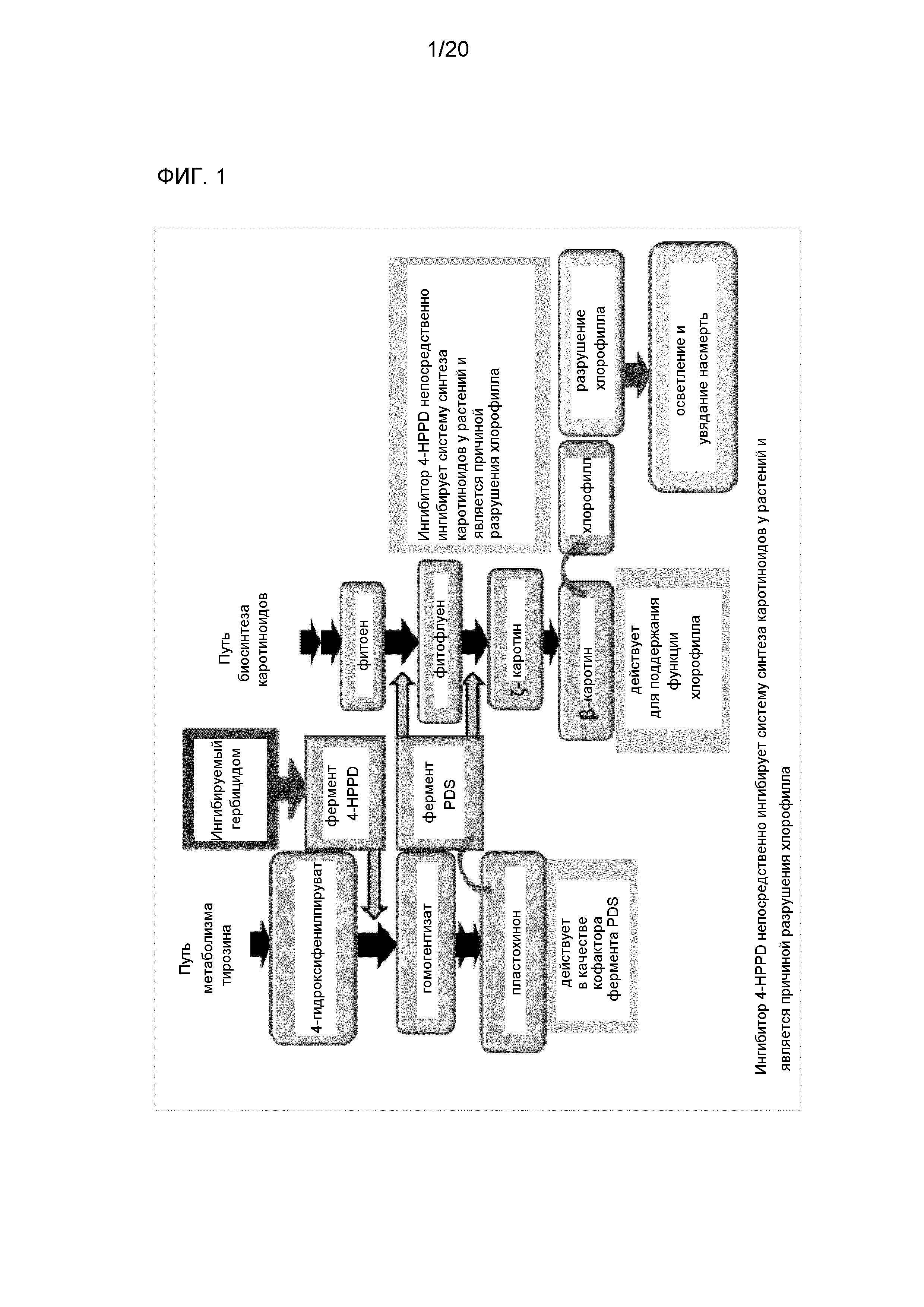
Недавно, в качестве средства против такой проблемы компоненты гербицидов, такие как бензобициклон (BBC), мезотрион и тефурилтрион, которые являются также эффективными против растений, устойчивых к гербицидам на основе SU, были разработаны и введены в практическое применение. Все из BBC, мезотриона и тефурилтриона являются агентами для ингибирования функционирования 4-гидроксифенилпируватдиоксигеназы (4-HPPD) (ингибиторами 4-HPPD). Ингибирование функционирования этого фермента опосредованно ингибирует систему синтеза каротиноидов и является причиной разрушения хлорофилла с осветлением и увяданием тем самым растения насмерть (см. фиг. 1). Безопасность этих ингибиторов против культиваров пищевого риса была в достаточной мере подтверждена, так что эти ингибиторы быстро широко распространились при выращивании риса.
Однако чувствительность культиваров с высокой урожайностью к ингибиторам 4-HPPD не была проверена в достаточной степени на стадии разработки или других стадиях. На настоящий момент сообщено, что семь культиваров фуражного риса с высокой урожайностью чувствительны к ингибиторам 4-HPPD и могут засохнуть насмерть в некоторых случаях (непатентная литература 1 и 3).
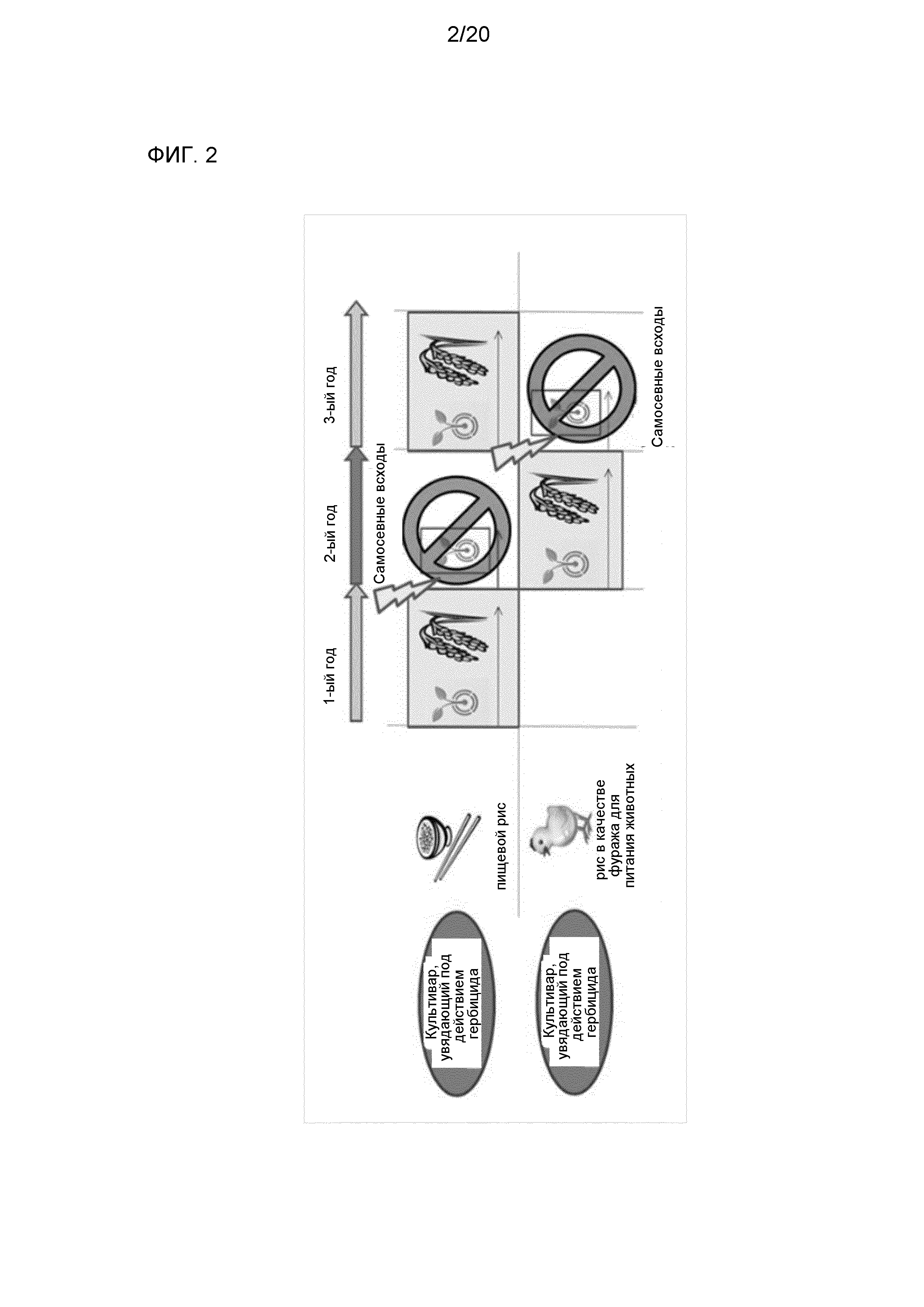
Разработки способа, с помощью которого можно надежно определить устойчивость или чувствительность к ингибитору 4-HPPD, и способа, с помощью которого можно увеличить устойчивость или чувствительность к ингибитору 4-HPPD, сделали бы возможным использование ингибитора 4-HPPD для борьбы с угрозой прорастания (проблемой из-за упавших семян и проростков) «самосевных семян» предшествующего года в циклах чередования культур - культиваров пищевого и фуражного риса, как представлено на фиг. 2, например; в результате можно было ожидать увеличение производства культивара фуражного риса и т.д. Вдобавок, используя эти способы, ингибитор 4-HPPD можно также использовать в способе борьбы на полях в случае выращивания таких культур, как рис, при необходимости. Кроме того, в случае обнаружения гена, служащего в качестве маркера для определения устойчивости или чувствительности к ингибитору 4-HPPD, можно эффективно осуществлять селекцию культур, включая рис.
Соответственно, была сильно желательной разработка способа для придания растению устойчивости или чувствительности к ингибитору 4-HPPD и способа определения того, обладает ли растение устойчивостью или чувствительностью к ингибитору 4-HPPD. Однако способы, с помощью которых эффективно достигаются эти цели, до сих пор не разработаны.
Список ссылочной литературы
Непатентная литература
Непатентная литература 1: Keisuke Sekino et al., "Sensitivity of Nineteen Varieties and Line of Forage Rice to Paddy Herbicide, benzobicyclon," Japanese Journal of Crop Science, March 25, 2009, vol. 227, extra issue, pp. 120 to 121
Непатентная литература 2: Terry R. Wright et al., Proc Natl Acad Sci USA., November 23, 2010, vol. 107, no. 47, pp. 20240 to 20245
Непатентная литература 3: Kiyoaki Maruyama et al., "Forage rice and so forth are revealed to be susceptible to some herbicide", [опубликованная в сети], March 26, 2010, National Agriculture and Food Research Organization Agricultural Research Center, Press Release, [исправленная 29 сентября 2010], the Internet URL:http://narc.naro.affrc.go.jp/press/h22/0326/index.htm
Краткое изложение сущности изобретения
Техническая проблема
Настоящее изобретение было сделано в связи с проблемами описанных выше традиционных способов. Целью настоящего изобретения является обеспечение совокупности способов, с помощью которых можно эффективно придать растению устойчивость или чувствительность к ингибитору 4-HPPD, и обеспечение совокупности способов, с помощью которых можно эффективно определить, обладает ли растение устойчивостью или чувствительностью к ингибитору 4-HPPD.
Решение проблемы
Для достижения вышеуказанной цели авторы настоящего изобретения сначала попытались идентифицировать гены, связанные с устойчивостью к ингибитору 4-HPPD, в растении. А именно, авторы настоящего изобретения сначала выполнили анализ локуса количественных признаков (QTL), используя чувствительный к ингибитору 4-HPPD рис и устойчивый к ингибитору 4-HPPD рис. Его результат показал, что генный локус для определения устойчивости к ингибитору 4-HPPD расположен на коротком плече хромосомы 2 риса. Затем авторы настоящего изобретения проверили фенотип (чувствительность к ингибитору 4-HPPD), используя линию Nipponbare, имеющую ретротранспозон Tos17, вставленный в гипотетический ген железо/аскорбат-зависимой оксидоредуктазы, расположенный в генном локусе, определенном с помощью анализа QTL. Было установлено, что гомозиготные по вставке Tos17 отдельные представители проявляют чувствительность к ингибитору 4-HPPD. Когда обнаруженный таким образом ген железо/аскорбат-зависимой оксидоредуктазы был введен в Arabidopsis thaliana (A. thaliana) и рис, эти трансгенные растения проявили устойчивость к ингибитору 4-HPPD. Это подтверждало, что этот ген является геном, ответственным за придание растению устойчивости к ингибитору 4-HPPD (ниже также называемым реагирующим на ингибитор 4-гидроксифенилпируватдиоксигеназы геном № 1 (HIS1)). Кроме того, гены с высокой степенью гомологии с геном HIS1 риса также существуют в ячмене, сорго, кукурузе и т.п.
Далее авторы настоящего изобретения сравнили структуру гена HIS1 между чувствительным к ингибитору 4-HPPD рисом и устойчивым к ингибитору 4-HPPD рисом с помощью анализа с использованием ПЦР. В результате, культивары риса, проявляющие чувствительность к ингибитору 4-HPPD, имели вставку в районе с четвертого экзона по пятый экзон гена HIS1 или делецию из него. Это может означать, что подавление функционирования гена HIS1 придает растению чувствительность к ингибитору 4-HPPD.
Сверх того, было обнаружено, что ген риса (ген HSL1), обладающий наибольшей степью гомологии с геном HIS1, расположен на хромосоме 6 риса. Кроме того, было также обнаружено, что после введения гена HSL1 в рис трансгенный рис также проявлял устойчивость к ингибитору 4-HPPD.
На основе этих обнаружений авторы настоящего изобретения установили, что использование гена HIS1 или гомологичного ему гена делает возможным создание растения, обладающего повышенной устойчивостью или чувствительностью к ингибитору 4-HPPD, и что использование этих генов в качестве мишеней делает возможным определение того, обладает ли растение устойчивостью или чувствительностью к ингибитору 4-HPPD. Эти обнаружения привели к завершению настоящего изобретения.
Конкретнее, настоящее изобретение заключается в следующем.
(1) Агент для придания растению устойчивости к ингибитору HPPD, включающий по крайней мере одну ДНК или вектор, содержащий встроенную в него ДНК, кодирующую белок, обладающий силой придать растению устойчивость к ингибитору 4-HPPD, при этом ДНК выбирают из группы, состоящей из следующих ДНК (a)-(d):
(a) ДНК, кодирующей белок, имеющий аминокислотную последовательность, представленную в любой из SEQ ID NO: 2 и 17;
(b) ДНК, кодирующей белок, имеющий аминокислотную последовательность, представленную в любой из SEQ ID NO: 2 и 17, в (из) которой одна или более аминокислот замещены, делетированы, добавлены и/или вставлены;
(c) ДНК, гибридизующейся в жестких условиях с ДНК, имеющей последовательность оснований, представленную в любой из SEQ ID NO: 1 и 16; и
(d) ДНК, кодирующей аминокислотную последовательность, гомологичную на 60% или более аминокислотной последовательности, представленной в любой из SEQ ID NO: 2 и 17.
(2) Трансгенная клетка растения, способная к регенерации растения, обладающего повышенной устойчивостью к ингибитору 4-HPPD, включающая по крайней мере одну ДНК или вектор, содержащий встроенную в него ДНК, кодирующую белок, обладающий силой придать растению устойчивость к ингибитору 4-HPPD, при этом ДНК выбирают из группы, состоящей из следующих ДНК (a)-(d):
(a) ДНК, кодирующей белок, имеющий аминокислотную последовательность, представленную в любой из SEQ ID NO: 2 и 17;
(b) ДНК, кодирующей белок, имеющий аминокислотную последовательность, представленную в любой из SEQ ID NO: 2 и 17, в (из) которой одна или более аминокислот замещены, делетированы, добавлены и/или вставлены;
(c) ДНК, гибридизующейся в жестких условиях с ДНК, имеющей последовательность оснований, представленную в любой из SEQ ID NO: 1 и 16; и
(d) ДНК, кодирующей аминокислотную последовательность, гомологичную на 60% или более аминокислотной последовательности, представленной в любой из SEQ ID NO: 2 и 17.
(3) Растение, обладающее повышенной устойчивостью к ингибитору 4-HPPD, которое регенерировано из трансгенной клетки растения в соответствии с (2).
(4) Растение, обладающее повышенной устойчивостью к ингибитору 4-HPPD, которое представляет собой любой из потомка и клона растения в соответствии с (3).
(5) Материал для размножения растения, обладающего повышенной устойчивостью к ингибитору 4-HPPD, в соответствии с любым из (3) и (4).
(6) Способ создания растения, обладающего повышенной устойчивостью к ингибитору 4-HPPD, включающий:
(I) стадию введения в клетку растения по крайней мере одной ДНК или вектора, содержащего встроенную в него ДНК, кодирующую белок, обладающий силой придать растению устойчивость к ингибитору 4-HPPD, при этом ДНК выбирают из группы, состоящей из следующих ДНК (a)-(d):
(a) ДНК, кодирующей белок, имеющий аминокислотную последовательность, представленную в любой из SEQ ID NO: 2 и 17;
(b) ДНК, кодирующей белок, имеющий аминокислотную последовательность, представленную в любой из SEQ ID NO: 2 и 17, в (из) которой одна или более аминокислот замещены, делетированы, добавлены и/или вставлены;
(c) ДНК, гибридизующейся в жестких условиях с ДНК, имеющей последовательность оснований, представленную в любой из SEQ ID NO: 1 и 16; и
(d) ДНК, кодирующей аминокислотную последовательность, гомологичную на 60% или более аминокислотной последовательности, представленной в любой из SEQ ID NO: 2 и 17; и
(II) стадию регенерации растения из трансгенной клетки растения, в которую введена ДНК или вектор, содержащий встроенную в него ДНК, на стадии (I).
(7) Агент для придания растению чувствительности к ингибитору HPPD, включающий по крайней мере одну ДНК или вектор, содержащий встроенную в него ДНК, кодирующую РНК, обладающую силой придать растению чувствительность к ингибитору 4-HPPD, при этом ДНК выбирают из группы, состоящей из следующих ДНК (a)-(с):
(a) ДНК, кодирующей двухцепочечную РНК, комплементарную транскрипту с ДНК в соответствии с (1);
(b) ДНК, кодирующей антисмысловую РНК, комплементарную транскрипту с ДНК в соответствии с (1); и
(c) ДНК, кодирующей РНК, обладающую рибозимной активностью специфического расщепления транскрипта с ДНК в соответствии с (1).
(8) Трансгенная клетка растения, способная к регенерации растения, обладающего повышенной чувствительностью к ингибитору 4-HPPD, включающая по крайней мере одну ДНК или вектор, содержащий встроенную в него ДНК, кодирующую РНК, обладающую силой придать растению чувствительность к ингибитору 4-HPPD, при этом ДНК выбирают из группы, состоящей из следующих ДНК (a)-(с):
(a) ДНК, кодирующей двухцепочечную РНК, комплементарную транскрипту с ДНК в соответствии с (1);
(b) ДНК, кодирующей антисмысловую РНК, комплементарную транскрипту с ДНК в соответствии с (1); и
(c) ДНК, кодирующей РНК, обладающую рибозимной активностью специфического расщепления транскрипта с ДНК в соответствии с (1).
(9) Растение, обладающее повышенной чувствительностью к ингибитору 4-HPPD, которое регенерировано из трансгенной клетки растения в соответствии с (8).
(10) Растение, обладающее повышенной чувствительностью к ингибитору 4-HPPD, которое представляет собой любой из потомка и клона растения в соответствии с (9).
(11) Материал для размножения растения, обладающего повышенной чувствительностью к ингибитору 4-HPPD, в соответствии с любым из (9) и (10).
(12) Способ создания растения, обладающего повышенной чувствительностью к ингибитору 4-HPPD, включающий:
(I) стадию введения в клетку растения по крайней мере одной ДНК или вектора, содержащего встроенную в него ДНК, кодирующую РНК, обладающую силой придать растению чувствительность к ингибитору 4-HPPD, при этом ДНК выбирают из группы, состоящей из следующих ДНК (a)-(с):
(a) ДНК, кодирующей двухцепочечную РНК, комплементарную транскрипту с ДНК в соответствии с (1);
(b) ДНК, кодирующей антисмысловую РНК, комплементарную транскрипту с ДНК в соответствии с (1); и
(c) ДНК, кодирующей РНК, обладающую рибозимной активностью специфического расщепления транскрипта с ДНК в соответствии с (1), и
(II) стадию регенерации растения из трансгенной клетки растения, в которую введена ДНК или вектор, содержащий встроенную в него ДНК, на стадии (I).
(13) Способ определения того, обладает ли растение устойчивостью или чувствительностью к ингибитору 4-HPPD, который включает анализ последовательности оснований по крайней мере одной ДНК, в исследуемом растении, выбираемой из группы, состоящей из следующих ДНК (a)-(d), или последовательности оснований контролирующей экспрессию области ДНК:
(a) ДНК, кодирующей белок, имеющий аминокислотную последовательность, представленную в любой из SEQ ID NO: 2 и 17;
(b) ДНК, кодирующей белок, имеющий аминокислотную последовательность, представленную в любой из SEQ ID NO: 2 и 17, в (из) которой одна или более аминокислот замещены, делетированы, добавлены и/или вставлены;
(c) ДНК, гибридизующейся в жестких условиях с ДНК, имеющей последовательность оснований, представленную в любой из SEQ ID NO: 1 и 16; и
(d) ДНК, кодирующей аминокислотную последовательность, гомологичную на 60% или более аминокислотной последовательности, представленной в любой из SEQ ID NO: 2 и 17.
(14) Способ определения того, обладает ли растение устойчивостью или чувствительностью к ингибитору 4-HPPD, который включает определение экспрессии по крайней мере одной ДНК, в исследуемом растении, выбираемой из группы, состоящей из следующих ДНК (a)-(d), или молекулярной массы любого из продукта амплификации ДНК и продукта экспрессии (с) ДНК:
(a) ДНК, кодирующей белок, имеющий аминокислотную последовательность, представленную в любой из SEQ ID NO: 2 и 17;
(b) ДНК, кодирующей белок, имеющий аминокислотную последовательность, представленную в любой из SEQ ID NO: 2 и 17, в (из) которой одна или более аминокислот замещены, делетированы, добавлены и/или вставлены;
(c) ДНК, гибридизующейся в жестких условиях с ДНК, имеющей последовательность оснований, представленную в любой из SEQ ID NO: 1 и 16; и
(d) ДНК, кодирующей аминокислотную последовательность, гомологичную на 60% или более аминокислотной последовательности, представленной в любой из SEQ ID NO: 2 и 17.
(15) Способ селекции растения, обладающего повышенной устойчивостью к ингибитору 4-HPPD, включающий:
(a) стадию скрещивания культивара растения, устойчивого к ингибитору 4-HPPD, с каким-либо культиваром;
(b) стадию определения того, обладают ли отдельные представители, полученные в результате скрещивания на стадии (a), устойчивостью или чувствительностью к ингибитору 4-HPPD, с помощью способа в соответствии с любым из (13) и (14); и
(c) стадию отбора отдельного представителя, который в соответствии с определением обладает устойчивостью к ингибитору 4-HPPD.
(16) Способ селекции растения, обладающего повышенной чувствительностью к ингибитору 4-HPPD, включающий:
(a) стадию скрещивания культивара растения, чувствительного к ингибитору 4-HPPD, с каким-либо культиваром;
(b) стадию определения того, обладают ли отдельные представители, полученные в результате скрещивания на стадии (a), устойчивостью или чувствительностью к ингибитору 4-HPPD, с помощью способа в соответствии с любым из (13) и (14); и
(c) стадию отбора отдельного представителя, который в соответствии с определением обладает чувствительностью к ингибитору 4-HPPD.
Полезные эффекты настоящего изобретения
Использование генов, идентифицированных в настоящем изобретении, делает возможным эффективное создание растения, обладающего повышенной устойчивостью или чувствительностью к ингибитору 4-HPPD. Кроме того, использование генов, идентифицированных в настоящем изобретении, в качестве мишеней делает возможным эффективное определение того, обладает ли растение устойчивостью или чувствительностью к ингибитору 4-HPPD.
Краткое описание чертежей
Фиг. 1 представляет собой диаграмму для иллюстрации схемы пути метаболизма тирозина и пути биосинтеза каротиноидов и их связи с ингибитором 4-HPPD.
Фиг. 2 представляет собой диаграмму для иллюстрации схемы борьбы с угрозой прорастания «самосевных семян» предшествующих лет в циклах чередования культур - культиваров пищевого и фуражного риса.
Фиг. 3 является представлением для иллюстрации схемы бинарного вектора (pIG121-Hm/HIS1), используемого для трансформации Arabidopsis thaliana методом с использованием Agrobacterium, который был получен посредством соединения краевых последовательностей (RB: правой краевой последовательности, LB: левой краевой последовательности) с кассетами для экспрессии гена устойчивости к канамицину (NPTII), управляемой промотором nos (nos-P), экспрессии гена устойчивости к гигромицину (hygR), управляемой промотором CaMV35S (CaMV35S-P), и экспрессии AK065581 (HIS1), управляемой промотором CaMV35S.
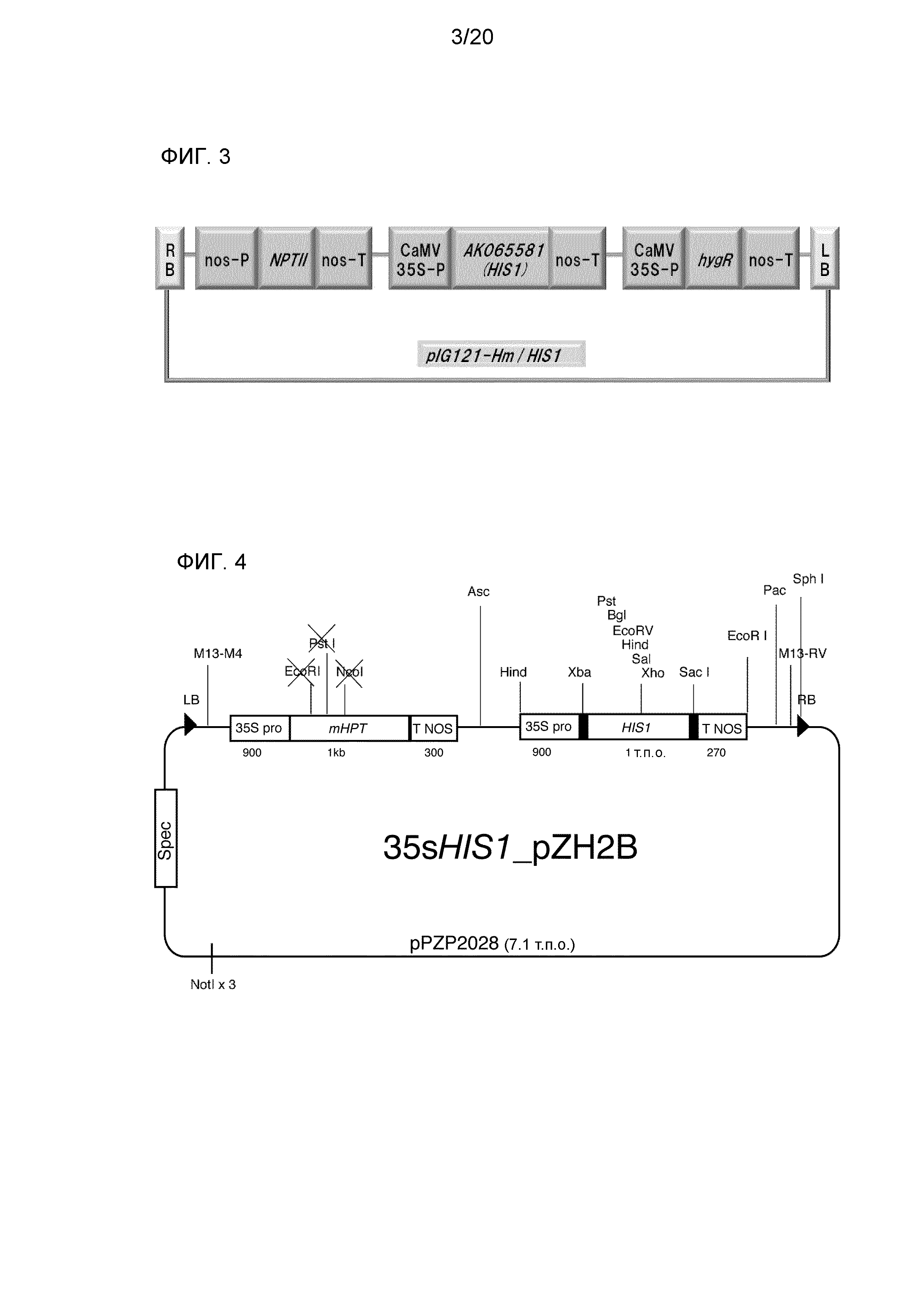
Фиг. 4 является представлением для иллюстрации схемы бинарного вектора (35sHIS1 pZH2B), используемого для трансформации Arabidopsis thaliana и риса методом с использованием Agrobacterium, который был получен посредством соединения краевых последовательностей (RB: правой краевой последовательности, LB: левой краевой последовательности) с кассетами для экспрессии гена устойчивости к гигромицину (mHPT), управляемой промотором CaMV35S (35S Pro), и экспрессии AK065581 (HIS1), управляемой промотором CaMV35S (35S Pro).
Фиг. 5 является представлением для иллюстрации схемы бинарного вектора (35sHIS1 pZK3), используемого для трансформации помидоров методом с использованием Agrobacterium, который был получен посредством соединения краевых последовательностей (RB: правой краевой последовательности, LB: левой краевой последовательности) с кассетами для экспрессии гена устойчивости к канамицину (NPT2), управляемой промотором nos (NOSpro), и экспрессии AK065581 (HIS1), управляемой промотором CaMV35S (35S Pro).
Фиг. 6 является представлением для иллюстрации схемы бинарного вектора (35sHSL1 pZH2B), используемого для трансформации Arabidopsis thaliana и риса методом с использованием Agrobacterium, который был получен посредством соединения краевых последовательностей (RB: правой краевой последовательности, LB: левой краевой последовательности) с кассетами для экспрессии гена устойчивости к гигромицину (mHPT), управляемой промотором CaMV35S (35S Pro), и экспрессии AK241948 (HSL1), управляемой промотором CaMV35S (35S Pro).
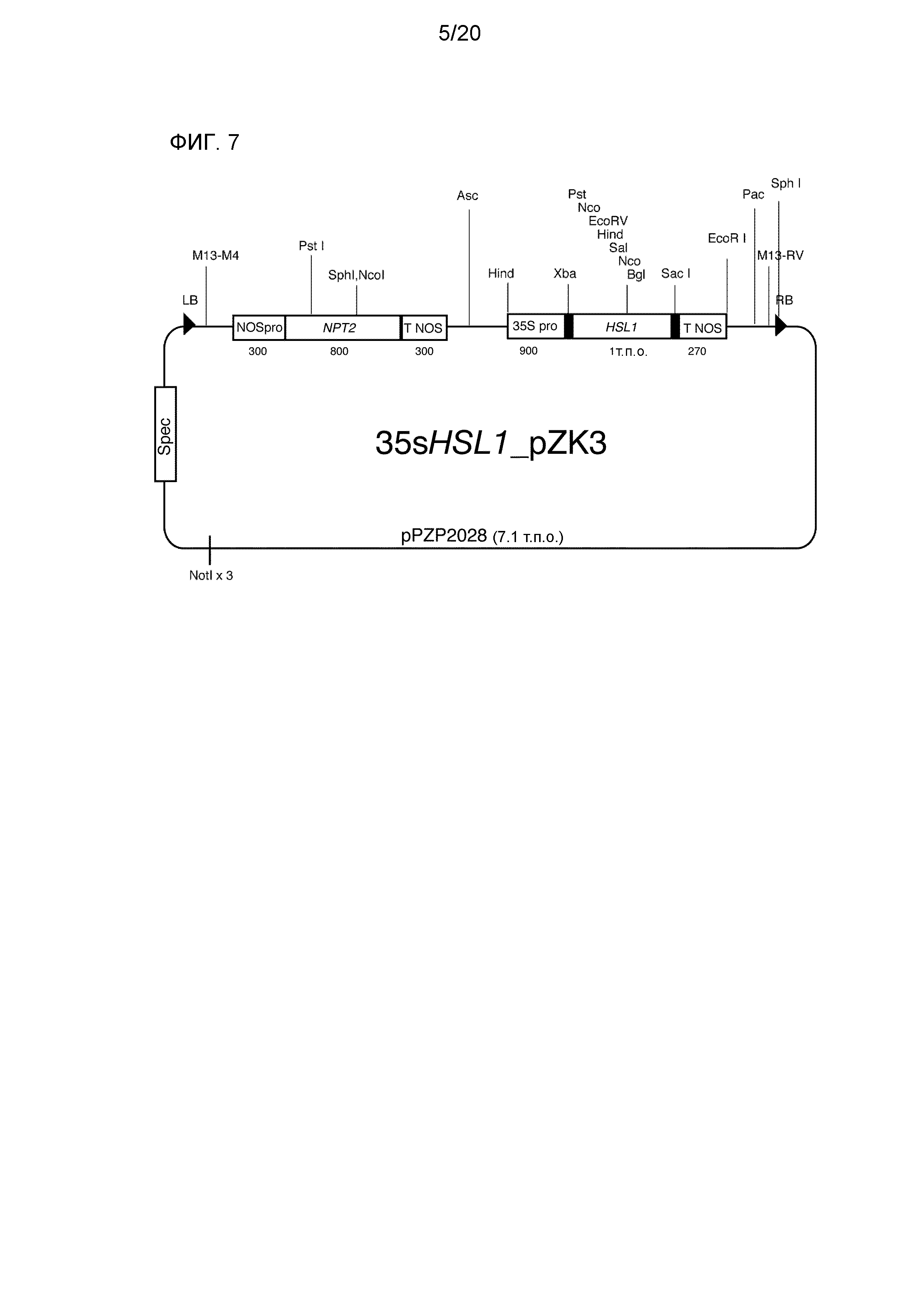
Фиг. 7 является представлением для иллюстрации схемы бинарного вектора (35sHSL1 pZK3), используемого для трансформации помидоров методом с использованием Agrobacterium, который был получен посредством соединения краевых последовательностей (RB: правой краевой последовательности, LB: левой краевой последовательности) с кассетами для экспрессии гена устойчивости к канамицину (NPT2), управляемой промотором nos (NOSpro), и экспрессии AK241948 (HSL1), управляемой промотором CaMV35S (35S Pro).
Фиг. 8 является представлением для демонстрации гена устойчивости к ингибитору 4-HPPD (AK065581), определенного с помощью анализа QTL, и гомологичных ему генов, которые находятся на хромосомах риса.
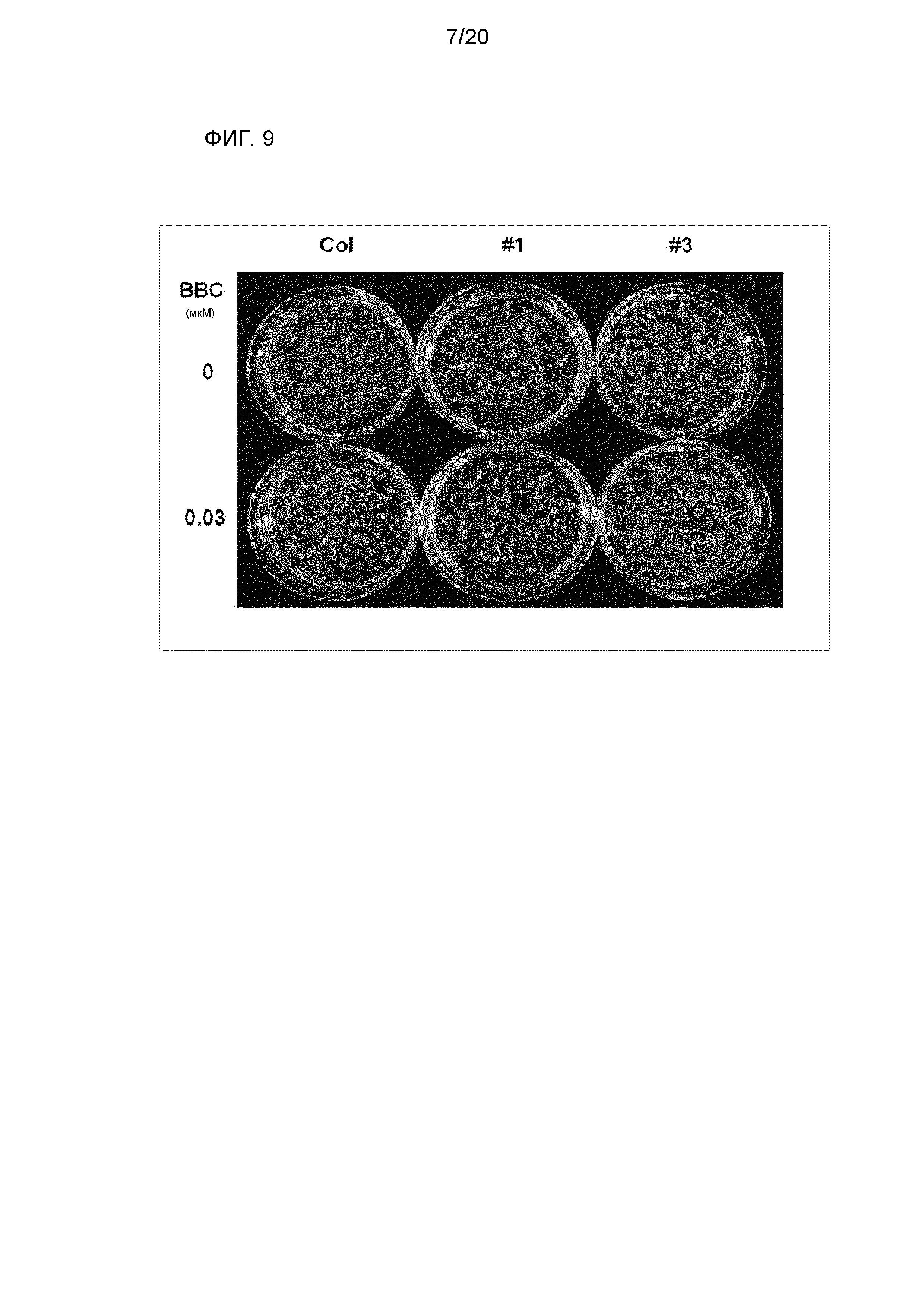
На фиг. 9 представлена фотография для иллюстрации устойчивости к ингибитору 4-HPPD (бензобициклону (ВВС)) рекомбинантного A. thaliana (экотипа Columbia), содержащего введенный в него ген-мишень (AK065581). Примите к сведению, что на фигуре «Col» указывает на результат для A. thaliana дикого типа (экотипа Columbia), «#1» и «#3» указывают на результаты для рекомбинантного A. thaliana (экотипа Columbia), содержащего введенный в него ген-мишень (AK065581).
На фиг. 10 представлены фотографии для иллюстрации устойчивости к ингибитору 4-HPPD (бензобициклону) рекомбинантного риса (чувствительного к ингибитору 4-HPPD культивара: Kanto 239), содержащего введенный в него ген-мишень (AK065581). Примите к сведению, что на фигуре «Kanto 239» указывает на результат для Kanto 239 (дикого типа), а «BBC21-23B» и «BBC21-23C» указывают на результаты для Kanto 239 (рекомбинантного риса), содержащего введенный в него ген-мишень (AK065581).
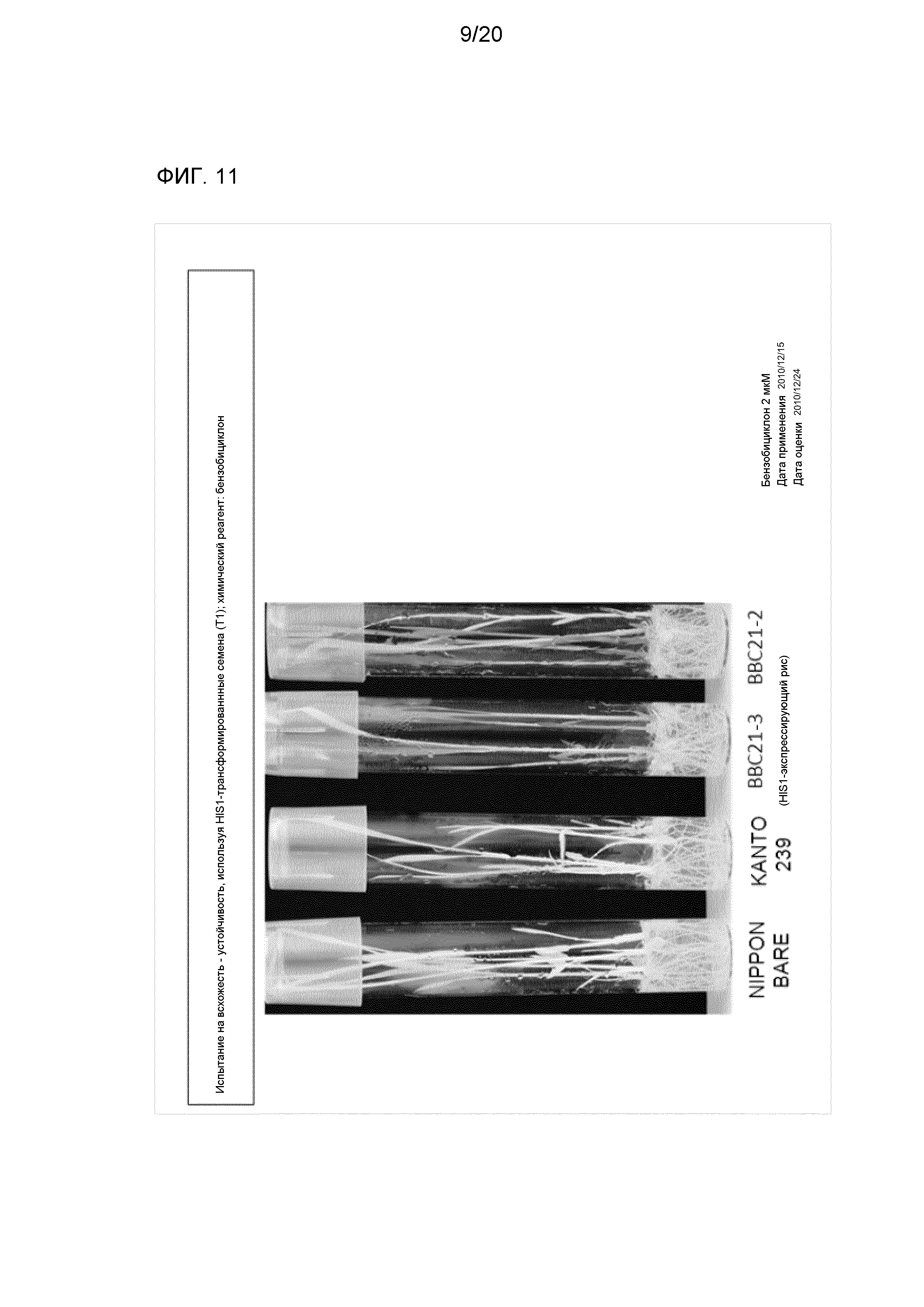
На фиг. 11 представлена фотография для иллюстрации устойчивости к ингибитору 4-HPPD (бензобициклону) рекомбинантного риса (Kanto 239), содержащего введенный в него ген-мишень (AK065581). Примите к сведению, что на фигуре «Nipponbare» и «Kanto 239», соответственно, указывают на результаты для Nipponbare (дикого типа) (устойчивого к ингибитору 4-HPPD культивара) и Kanto 239 (дикого типа), а «BBC21-1A, 2, 3, 3D, 3F, 3-3, 9, 15» указывают на результаты для Kanto 239 (рекомбинантного риса), содержащего введенный в него ген-мишень (AK065581) (это же распространяется на фиг. 12-15). Кроме того, «Дата применения» и «Дата оценки» означают, соответственно, «дату, когда семена засевали в твердую (агаровую) среду, дополненную ингибитором 4-HPPD», и «дату, когда проверяли состояние роста растений, выращиваемых из семян» (это же распространяется на фиг. 12-15 и 22).
На фиг. 12 представлена фотография для иллюстрации устойчивости к ингибитору 4-HPPD (мезотриону) рекомбинантного риса (Kanto 239), содержащего введенный в него ген-мишень (AK065581).
На фиг. 13 представлены фотографии для иллюстрации устойчивости к ингибитору 4-HPPD (тефурилтриону) рекомбинантного риса (Kanto 239), содержащего введенный в него ген-мишень (AK065581).
На фиг. 14 представлена фотография для иллюстрации устойчивости к ингибитору 4-HPPD (темботриону) рекомбинантного риса (Kanto 239), содержащего введенный в него ген-мишень (AK065581).
На фиг. 15 представлена фотография для иллюстрации устойчивости к ингибитору 4-HPPD (NTBC) рекомбинантного риса (Kanto 239), содержащего введенный в него ген-мишень (AK065581).
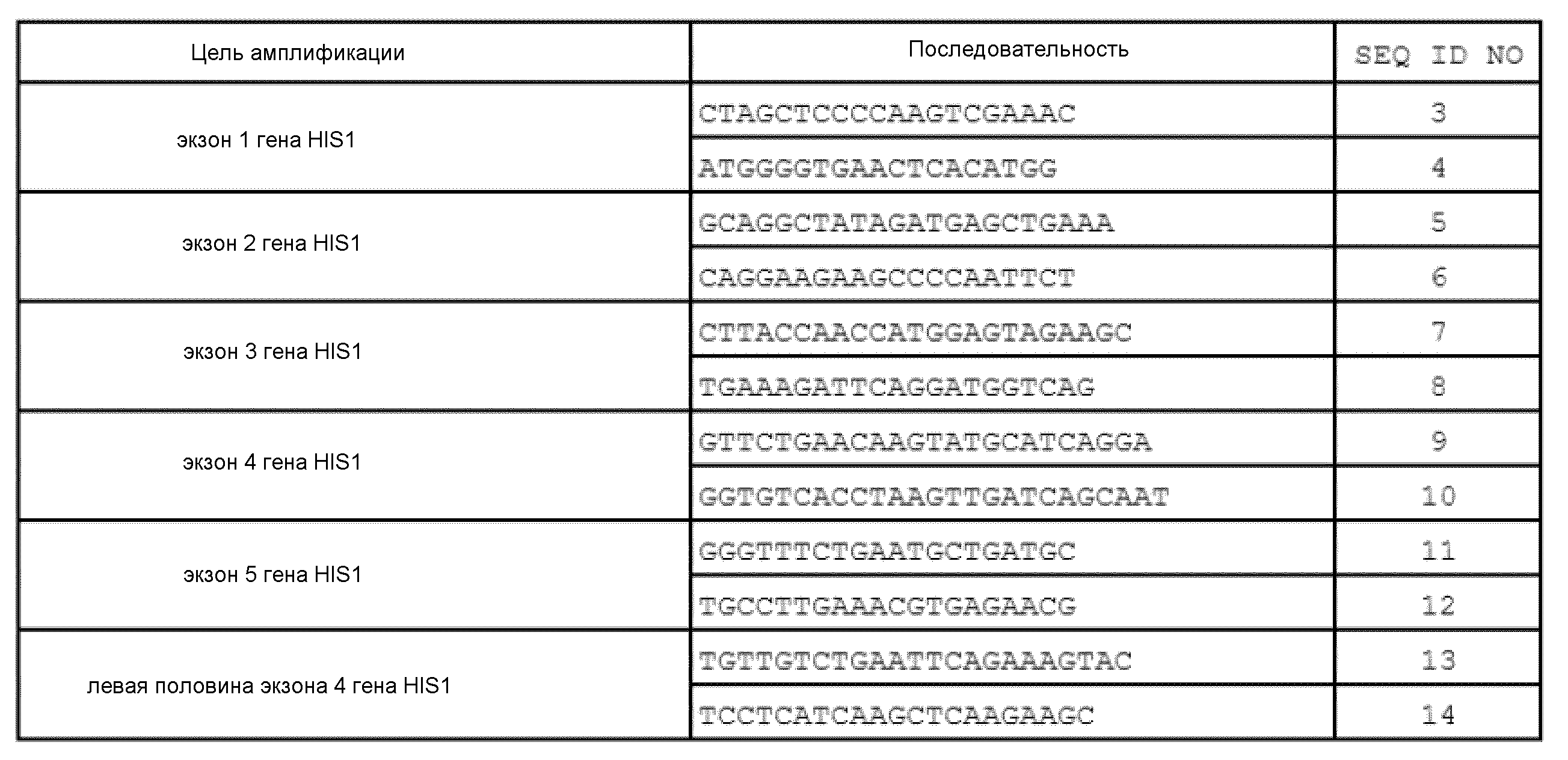
На фиг. 16 представлены изображения после электрофореза для иллюстрации полученных в результате ПЦР множеств амплифицированных экзонных районов гена HIS1 культиваров риса. Примите к сведению, что на фигуре «1» указывает на результат для Nipponbare, «2» указывает на результат для Koshihikari, «3» указывает на результат для Kasalath, «4» указывает на результат для Hokuriku 193, «5» указывает на результат для Takanari, «6» указывает на результат для Momiroman, и «M» означает маркер размера. Кроме того, «экзон 1» означает район экзона 1 гена HIS1, который был амплифицирован с помощью ПЦР, используя праймер, имеющий последовательность оснований SEQ ID NO: 3, и праймер, имеющий последовательность оснований SEQ ID NO: 4, «экзон 2» означает район экзона 2 гена HIS1, который был амплифицирован с помощью ПЦР, используя праймер, имеющий последовательность оснований SEQ ID NO: 5, и праймер, имеющий последовательность оснований SEQ ID NO: 6, «экзон 3» означает район экзона 3 гена HIS1, который был амплифицирован с помощью ПЦР, используя праймер, имеющий последовательность оснований SEQ ID NO: 7, и праймер, имеющий последовательность оснований SEQ ID NO: 8, «экзон 4» означает район экзона 4 гена HIS1, который был амплифицирован с помощью ПЦР, используя праймер, имеющий последовательность оснований SEQ ID NO: 9, и праймер, имеющий последовательность оснований SEQ ID NO: 10, и «экзон 5» означает район экзона 5 гена HIS1, который был амплифицирован с помощью ПЦР, используя праймер, имеющий последовательность оснований SEQ ID NO: 11, и праймер, имеющий последовательность оснований SEQ ID NO: 12. Кроме того, «левая половина экзона 4» означает левую пол-область внутри экзона 4 гена HIS1, которая была амплифицирована с помощью ПЦР, используя праймер, имеющий последовательность оснований SEQ ID NO: 13, и праймер, имеющий последовательность оснований SEQ ID NO: 14. Кроме того, на фигуре стрелки указывают на размеры, составляющие 100 п.о., 200 п.о. и 500 п.о.
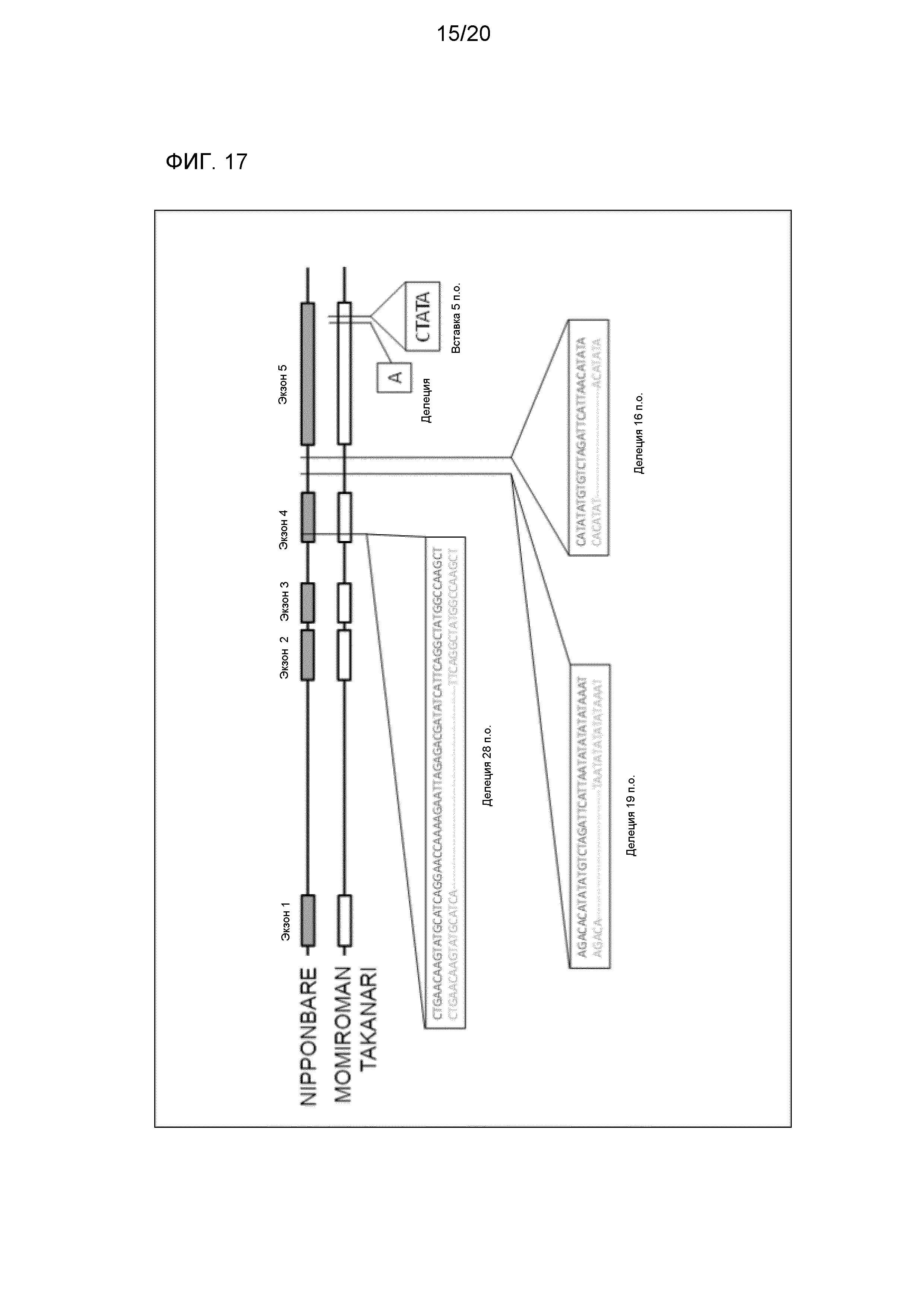
Фиг. 17 является представлением в схематическом виде для иллюстрации результата сравнения структуры гена HIS1 Nipponbare с таковыми соответствующих генов Momiroman и Takanari.
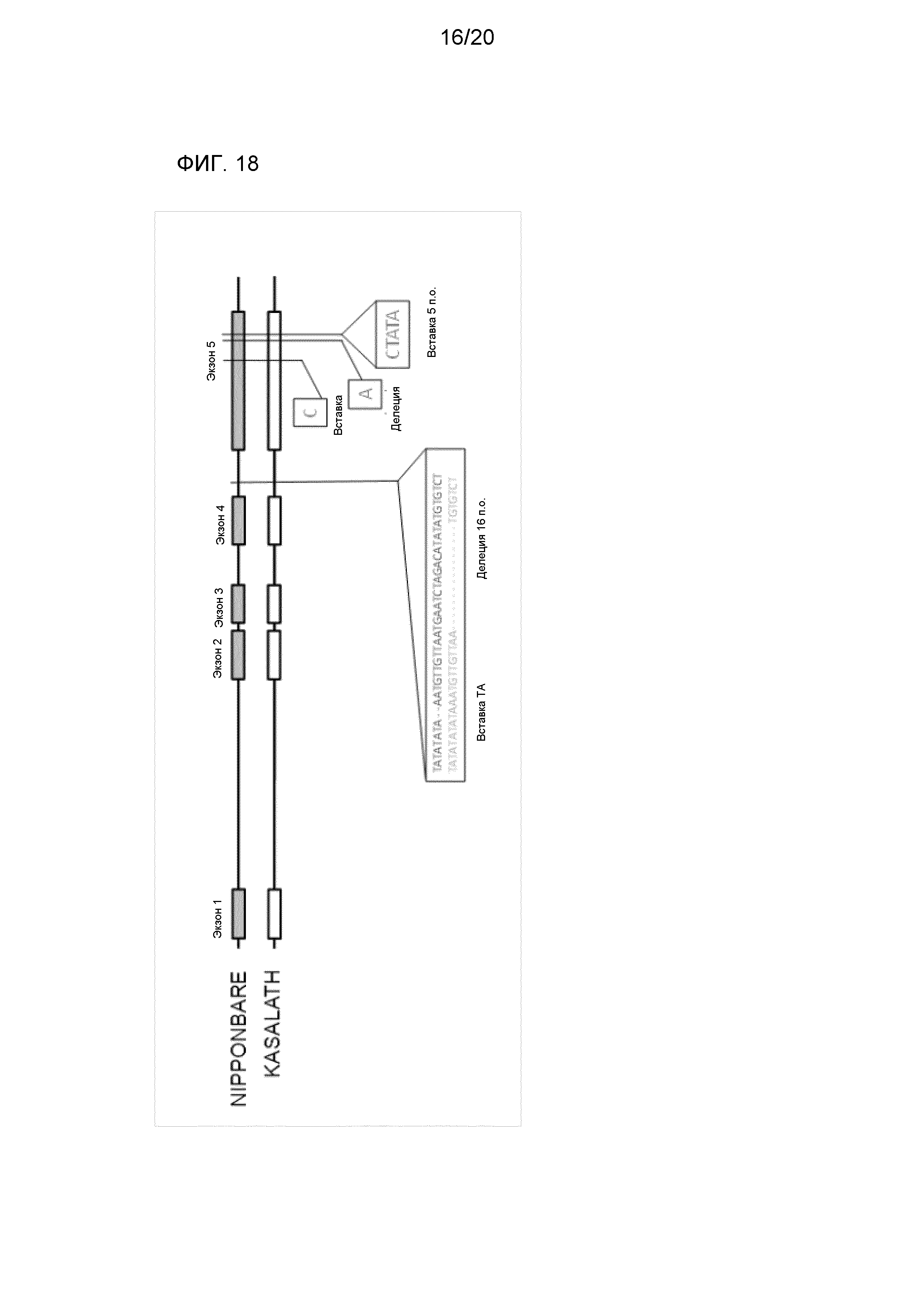
Фиг. 18 является представлением в схематическом виде для иллюстрации результата сравнения структуры гена HIS1 Nipponbare с таковой соответствующего гена Kasalath.
Фиг. 19 является представлением для сравнения аминокислотных последовательностей белков, кодируемых геном HIS1 и гомологичным ему геном (геном HSL1), и иллюстрации гомологии.
На фиг. 20 представлены диаграммы для иллюстрации характеров экспрессии в тканях с генного локуса (хромосомы 2), в котором расположен ген HIS1, и с генного локуса (хромосомы 6), в котором расположен гомологичный ген (ген HSL1: Os06g0176700/Os06g0178500).
Фиг. 21 представляет собой филогенетическое дерево для иллюстрации того, что ген HIS1 и гомологичный ген относятся к генам, специфическим для растений Poaceae (однодольных растений). Примите к сведению, что на фигуре «HSL» является сокращением «подобного HIS1», указывающим на гомологичный ген HIS1.
На фиг. 22 представлена фотография для иллюстрации устойчивости к ингибитору 4-HPPD (бензобициклону) рекомбинантного риса (Kanto 239), в который был введен ген (HSL1; AK241948), обладающий высокой степенью гомологии с геном HIS1. Примите к сведению, что на фигуре «Kanto 239» указывает на результат для Kanto 239 (дикого типа), а «23-1», «23-21» и «23-25» указывают на результаты для Kanto 239 (рекомбинантного риса), содержащего введенный в него гомологичный ген (AK241948).
Описание вариантов осуществления
Агент для придания растению устойчивости к ингибитору 4-HPPD
Агент для придания растению устойчивости к ингибитору 4-HPPD настоящего изобретения характеризуется тем, что он включает ДНК или вектор, содержащий встроенную в него ДНК, кодирующую белок, обладающий силой придать растению устойчивость к ингибитору 4-HPPD, (которая ниже может называться ДНК устойчивости настоящего изобретения).
В настоящем изобретении «ингибитор 4-HPPD» означает агент для ингибирования функционирования 4-HPPD (4-гидроксифенилпируватдиоксигеназы) (ингибитор 4-HPPD). Как представлено на фиг. 1, ингибитор 4-HPPD ингибирует функционирование 4-HPPD и тем самым опосредованно ингибирует систему синтеза каротиноидов и является причиной разрушения хлорофилла с осветлением и увяданием растения насмерть. В настоящем изобретении примеры «ингибитора 4-HPPD» включают ингибиторы 4-HPPD типа трикетонов, такие как бензобициклон (BBC), мезотрион, тефурилтрион, темботрион и 2-(2-нитро-4-трифторметилбензоил)циклогексан-1,3-дион (NTBC), и ингибиторы 4-HPPD типа пиразолов, такие как пиразолат, бензофенап и пиразоксифен. Ингибитором 4-HPPD, устойчивость к которому придают растению с использованием ДНК устойчивости настоящего изобретения, являются предпочтительно ингибиторы 4-HPPD типа трикетонов, такие как BBC, мезотрион, тефурилтрион, темботрион и NTBC; особенно предпочтительно - BBC.
Примите к сведению, что, хотя компоненты гербицидов, такие как ингибиторы 4-HPPD, описанные выше, являются совершенно разными соединениями, гербициды можно подразделить на несколько групп на основе механизма действия, как указано далее (см. "From Pesticides to Agrobioregulators - disease, pest, and weed controls at present and in the future", Japan, CMC Publishing Co., Ltd., January 2010).
(I) Ингибирующие ацетил-КоА карбоксилазу (ACCase) гербициды
Эта группа гербицидов ингибирует ACCase, участвующую в первой стадии синтеза липидов, и ингибирует синтез клеточной мембраны, препятствуя росту растения. Гербициды, относящиеся к этой группе, далее подразделяют на гербициды (1) типа 4-арилоксифеноксипропионатов, (2) типа циклогександионоксимов и (3) типа дионов.
(II) Ингибирующие ацетолактатсинтазу (ALS) гербициды
Эта группа гербицидов, мишенью которой является ALS, ингибирует активность ALS и ингибирует синтез разветвленных аминокислот, препятствуя тем самым росту растения. Гербициды, относящиеся к этой группе, далее подразделяют на гербициды (1) типа сульфонилмочевин, (2) типа триазолинонов, (3) типа триазолопиримидинов, (4) типа пиримидинилсалицилатов и (5) типа имидазолинонов.
(III) Ингибирующие метаболизм 4-HPPD гербициды
Эта группа гербицидов ингибирует метаболизм 4-HPPD в пути метаболизма тирозина и опосредованно ингибирует систему синтеза каротиноидов растения с осветлением и увяданием растения насмерть. Гербициды, относящиеся к этой группе, далее подразделяют на гербициды (1) типа циклогександионов, (2) типа пиразолов, (3) типа бициклических соединений, (4) типа изоксазолов и (5) типа трикетонов. Кроме того, примеры гербицидов (1) типа циклогександионов включают производные бензоилциклогексан-1,3-диона. Примеры гербицидов (2) типа пиразолов включают пиразолат, бензофенап и пиразоксифен. Примеры гербицидов (3) типа бициклических соединений включают 3-замещенные производные бензоил-бицикло[4,1,0]гептан-2,4-диона. Примером гербицидов (4) типа изоксазолов является изоксафлутол. Примеры гербицидов (5) типа трикетонов включают BBC, мезотрион, тефурилтрион и темботрион.
(IV) Гербициды - ингибиторы фотопорфириноген IX-оксидазы (PPO)
Гербициды этой группы ингибируют синтез хлорофилла, разрушают клеточную мембрану и являются причиной гибели в результате увядания. Гербициды, относящиеся к этой группе, далее подразделяют на гербициды (1) типа дифенилового эфира, (2) типа диаллила и (3) типа пиразола.
(V) Ингибирующие элонгазу очень длинноцепочечных жирных кислот (VLCFAE) гербициды
Гербициды этой группы ингибируют ферменты системы биосинтеза очень длинноцепочечных жирных кислот, имеющих C20 или более, в системе биосинтеза липидов растения и приводят к увяданию растения насмерть.
(VI) Ингибирующие фитоендесатуразу (PDS) гербициды
Эта группа гербицидов ингибирует фермент PDS в пути биосинтеза каротиноидов и является причиной разрушения хлорофилла с осветлением и увяданием растения насмерть.
(VII) Ингибирующие PS II гербициды
Ингибиторы этой группы связываются с пластохиноном (PQ) и в результате ингибируют перенос электронов, в котором участвует PQ, с фотосистемы II (PS II) на фотосистему I (PS I), так что функция фиксации углерода в растении не может осуществляться, и растение подвергается увяданию насмерть.
(VIII) Гербициды - синтетические ауксины
Ингибиторы этой группы действуют подобно природному ауксину, который присутствует в растениях в низкой концентрации и регулирует рост растения, так что растение дифференцируется и растет анормально и в результате подвергается увяданию насмерть.
(IX) Ингибирующие EPSP-синтазу (EPSPS) гербициды
Ингибиторы этой группы связываются с EPSPS в пути шикимовой кислоты и ингибируют синтез EPSP. В результате биосинтез триптофана, фенилаланина и тирозина не происходит, и растение подвергается увяданию насмерть.
В качестве примеров ДНК устойчивости настоящего изобретения последовательность оснований гипотетического гена (гена HIS1; Os02g0280700) железо/аскорбат-зависимой оксидоредуктазы, происходящего из Nipponbare, представлена в SEQ ID NO: 1, а аминокислотная последовательность белка, кодируемого этой ДНК, представлена в SEQ ID NO: 2.
Кроме того, в качестве другого примера ДНК устойчивости настоящего изобретения последовательность оснований гена (подобного HIS1 (HSL) 1 гена; Os06g0176700/Os06g0178500 (AK241948), происходящего из Nipponbare, представлена в SEQ ID NO: 16), а аминокислотная последовательность белка, кодируемого этой ДНК, представлена в SEQ ID NO: 17.
Одной формой ДНК устойчивости настоящего изобретения является ДНК, кодирующая белок, имеющий аминокислотную последовательность SEQ ID NO: 2 (типично ДНК, включающая кодирующую область последовательности оснований SEQ ID NO: 1).
Кроме того, другой формой ДНК устойчивости настоящего изобретения является ДНК, кодирующая белок, имеющий аминокислотную последовательность SEQ ID NO: 17 (типично ДНК, включающая кодирующую область последовательности оснований SEQ ID NO: 16).
После получения информации о последовательности оснований такой ДНК на текущем уровне техники квалифицированные в данной области техники специалисты могли бы модифицировать последовательности оснований различными путями для получения гена с мутацией(ями), кодирующего белок, обладающий силой придать растению устойчивость к ингибитору 4-HPPD. Кроме того, в природе также последовательность оснований может подвергаться мутированию. Поэтому ДНК устойчивости настоящего изобретения включает ДНК, кодирующую белок, имеющий аминокислотную последовательность, представленную в любой из SEQ ID NO: 2 и 17, в которой одна или более аминокислот являются замещенными, делетированными, добавленными и/или вставленными, при условии, что кодируется белок, обладающий вышеописанной силой. Здесь термин «более» относится, как правило, к 50 аминокислотам или менее, предпочтительно 30 аминокислотам или менее, более предпочтительно 10 аминокислотам или менее и особенно предпочтительно нескольким аминокислотам или менее (например, 5 аминокислотам или менее, 3 аминокислотам или менее, 2 аминокислотам или менее, или 1 аминокислоте) во всей аминокислотной последовательности белка HIS1 или белка HSL1.
Кроме того, после получения конкретной ДНК устойчивости на текущем уровне техники квалифицированные в данной области техники специалисты могли бы использовать информацию о последовательности оснований ДНК для выделения гомологичного гена, который кодирует белок, обладающий силой придать растению устойчивость к ингибитору 4-HPPD, из растения того же или отличного вида. В качестве растения, из которого получают такой гомологичный ген, предпочтительными являются однодольные растения, а особенно предпочтительными являются растения Poaceae. Примеры растений Poaceae включают рис (например, устойчивые к ингибитору 4-HPPD культивары Nipponbare, Koshihikari, Kitaaoba, Akihikari, Akitakomachi, Fukuhibiki, Bekoaoba, Bekogonomi, Yumeaoba, Hokuriku 193, Leaf Star, Tachisugata, Kusanohoshi, Hoshiaoba, Nishiaoba, Tachiaoba, Makimizuho, Mogumoguaoba, Hamasari, Minamiyutaka), ячмень, сорго, кукурузу и т.п.
Примеры способа получения гомологичного гена включают методы гибридизации (Southern, E. M., J. Mol. Biol., 98: 503, 1975) и методы с использованием полимеразной цепной реакции (ПЦР) (Saiki, R. K., et al. Science, 230: 1350-1354, 1985, Saiki, R. K. et al. Science, 239: 487-491, 1988). Для выделения гомологичного гена, как правило, реакцию гибридизации выполняют в жестких условиях. Примеры жестких условий гибридизации включают условия 6 M мочевины, 0,4% SDS и 0,5×SSC; и условия гибридизации эквивалентной им жесткости. Можно ожидать, что при использовании условий большей жесткости, например, условий 6 M мочевины, 0,4% SDS и 0,1×SSC, будет выделяться ген с большей степенью гомологии. ДНК устойчивости настоящего изобретения включает ДНК, гибридизующуюся в жестких условиях с ДНК, имеющей последовательность оснований, представленную в любой из SEQ ID NO: 1 и 16, при условии, что кодируется белок, обладающий силой придать растению устойчивость к ингибитору 4-HPPD.
Белок, кодируемый гомологичным геном, полученным таким образом, как правило, обладает высокой степенью гомологии с аминокислотной последовательностью, представленной в любой из SEQ ID NO: 2 и 17. Высокая степень гомологии относится к гомологии последовательностей, составляющей по крайней мере 60% или более, предпочтительно 80% или более (например, 85%, 90%, 95%, 97%, 99% или более). Гомологию последовательностей можно определить, используя программу BLASTX (на аминокислотном уровне) (Altschul et al. J. Mol. Biol., 215: 403-410, 1990). Эта программа основана на алгоритме BLAST Karlin и Altschul (Proc. Natl. Acad. Sci. USA, 87: 2264-2268, 1990, Proc. Natl. Acad. Sci. USA, 90: 5873-5877, 1993). При анализе аминокислотной последовательности с использованием BLASTX параметры устанавливают, например, на оценке = 50 и длине слова = 3. Альтернативно, при анализе аминокислотной последовательности с использованием программы BLAST с использованием пропусков анализ можно выполнить, как описано в Altschul et al. (Nucleic Acids Res. 25: 3389-3402, 1997). При использовании программ BLAST и BLAST с использованием пропусков используют параметры по умолчанию каждой программы. Специфические процедуры этих методов анализа известны. ДНК устойчивости настоящего изобретения включает ДНК, кодирующую аминокислотную последовательность, гомологичную на 60% или более аминокислотной последовательности, представленной в любой из SEQ ID NO: 2 и 17, при условии, что кодируется белок, обладающий силой придать растению устойчивость к ингибитору 4-HPPD. Примеры такой ДНК включают происходящий из ячменя ген (HvHCP1 (AF527606)), происходящий из кукурузы ген (ZmHSL1 (BT062842), ZmHSL2 (NM_001153464)) и происходящий из сорго ген (SbHSL1 (XM_002436546)) (см. фиг. 21).
Обладает ли белок, кодируемый конкретным геном, силой придать растению устойчивость к ингибитору 4-HPPD, можно определить, например, посредством введения гена в растение и анализа того, придана ли растению, созданному таким образом, устойчивость, как описывается в Примерах позже (см. пример 2). А именно, в случае использования A. thaliana (экотипа Columbia), который подвергался бы увяданию под влиянием агаровой среды, содержащей 0,03 мкМ BBC, если трансформант, полученный в результате введения гена в A. thaliana, может расти без его увядания в присутствии BBC в вышеотмеченной концентрации, можно вынести решение, что белок, кодируемый геном, обладает силой придать растению устойчивость к ингибитору 4-HPPD. Кроме того, в случае использования чувствительного к BBC культивара риса «Kanto 239», который подвергался бы увяданию под влиянием агаровой среды, содержащей 0,1 мкМ BBC, если трансформант, полученный в результате введения гена в Kanto 239, может расти без его увядания в присутствии BBC в вышеотмеченной концентрации, можно вынести решение, что белок, кодируемый геном, обладает силой придать растению устойчивость к ингибитору 4-HPPD. Кроме того, в случае использования ингибитора 4-HPPD типа трикетонов, отличного от BBC, (мезотриона, тефурилтриона, темботриона, NTBC или т.п.), если трансформант, полученный в результате введения гена в Kanto 239, может расти без его увядания в присутствии 1 мкМ мезотриона, 2,5 мкМ тефурилтриона, 0,5 мкМ темботриона или 1 мкМ NTBC, можно вынести решение, что белок, кодируемый геном, обладает силой придать растению устойчивость к ингибитору 4-HPPD.
Форма ДНК устойчивости настоящего изобретения особенно не ограничивается и включает, помимо кДНК, геномную ДНК и химически синтезированную ДНК. Эти ДНК можно получить, используя обычные для квалифицированных в данной области техники специалистов способы. Геномную ДНК можно получить, например, посредством экстрагирования геномной ДНК из растения, создания геномной библиотеки (вектором, который может использоваться, является плазмида, фаг, космида, BAC, PAC или т.п.), расчленения библиотеки с последующей гибридизацией колоний или гибридизацией бляшек, используя зонд, приготовленный на основе последовательности оснований гена HIS (например, ДНК, имеющей SEQ ID NO: 1) или гена HSL1 (например, ДНК, имеющей SEQ ID NO: 16). Альтернативно, геномную ДНК можно также получить посредством создания праймера, специфического для гена HIS1 или гена HSL1, с последующей ПЦР, используя этот праймер. Между тем, кДНК можно получить, например, посредством синтеза кДНК на основе мРНК, экстрагированной из растения, встраивания кДНК в вектор, такой как λZAP, для создания библиотеки кДНК, расчленения библиотеки с последующей ПЦР или с последующей гибридизацией колоний или гибридизацией бляшек так же, как указано выше. Альтернативно, используя имеющийся в продаже ДНК-синтезатор, целевую ДНК можно также получить посредством синтеза.
Агент для придания растению чувствительности к ингибитору 4-HPPD
Сверх того, настоящим изобретением обеспечивается агент для придания растению чувствительности к ингибитору 4-HPPD. Как демонстрируется в Примерах позже, подавление функционирования белка, кодируемого геном HIS1, подавляет устойчивость к ингибитору 4-HPPD. Таким образом, агент для придания растению чувствительности к ингибитору 4-HPPD настоящего изобретения характеризуется тем, что он включает ДНК или вектор, содержащий встроенную в него ДНК, кодирующую РНК, обладающую силой придать растению чувствительность к ингибитору 4-HPPD.
Одной формой ДНК, кодирующей РНК, обладающую силой придать растению чувствительность к ингибитору 4-HPPD, является ДНК, кодирующая дцРНК (двухцепочечную РНК), комплементарную транскрипту с эндогенной ДНК устойчивости настоящего изобретения, описанной выше. Введение дцРНК, имеющей последовательность, одинаковую или схожую с последовательностью гена-мишени, в клетку может индуцировать явление, называемое РНК-интерференцией, в результате которой экспрессии и введенного экзогенного гена, и эндогенного гена-мишени подавляются. При введении в клетку от приблизительно 40 до нескольких сотен пар оснований дцРНК подобная РНКазе III нуклеаза, называемая дайсером, которая имеет хеликазный домен, удаляет приблизительно 21-23 пары оснований дцРНК с 3'-конца за один раз в присутствии АТФ, образуя киРНК (короткую интерферирующую РНК). Специфический белок связывается с киРНК с образованием нуклеазного комплекса (RISC: индуцированного РНК комплекса сайленсинга). Этот комплекс распознает последовательность, идентичную таковой киРНК, и связывается с ней, и расщепляет транскрипт (мРНК) с гена-мишени в положении, соответствующем центральной части киРНК, с помощью подобной РНКазе III ферментативной активности. Между тем, независимо от этого пути, антисмысловая цепь киРНК связывается с мРНК и действует в качестве праймера для РНК-зависимой РНК-полимеразы (RsRP), и синтезируется дцРНК. Эта дцРНК снова служит в качестве субстрата для дайсера с образованием другой киРНК и рассматривается как путь расширения действия.
ДНК, кодирующая дцРНК настоящего изобретения, включает антисмысловую ДНК, кодирующую РНК, антисмысловую по отношению к какой-либо области транскрипта (мРНК) с гена-мишени, т.е. эндогенной ДНК устойчивости настоящего изобретения; и смысловую ДНК, кодирующую РНК, смысловую по отношению к какой-либо области мРНК. Антисмысловая РНК и смысловая РНК могут экспрессироваться с антисмысловой ДНК и смысловой ДНК, соответственно. Кроме того, дцРНК можно приготовить с использованием этих антисмысловой РНК и смысловой РНК.
В качестве конфигурации для включения системы для экспрессии дцРНК настоящего изобретения в вектор или т.п. антисмысловая РНК и смысловая РНК могут экспрессироваться с одного и того же вектора, или антисмысловая РНК и смысловая РНК могут экспрессироваться с различных векторов, соответственно. В качестве конфигурации, в которой антисмысловая РНК и смысловая РНК экспрессируются с одного и того же вектора, например, конструируют кассету для экспрессии антисмысловой РНК и кассету для экспрессии смысловой РНК, в каждой из который промотор, способный к экспрессии короткой РНК, такой как система полимеразы III, связан 5' от антисмысловой ДНК и смысловой ДНК, и эти кассеты встраивают в вектор в одном и том же направлении или в противоположных направлениях.
Кроме того, можно создать экспрессионную систему, в которой антисмысловая РНК и смысловая РНК расположены в противоположных направлениях друг против друга в различных цепях. Эта конструкция включает одну двухцепочечную ДНК (кодирующую киРНК ДНК), в которой кодирующая антисмысловую РНК цепь спарена с кодирующей смысловую РНК цепью; и промоторы, находящие друг против друга с обоих краев ДНК, так что антисмысловая РНК и смысловая РНК могут экспрессироваться с соответствующих цепей. В этом случае, во избежание добавления дополнительных последовательностей 3' от смысловой РНК и антисмысловой РНК, предпочтительным является обеспечение терминатора на 3'-концк каждой из цепей (кодирующей антисмысловую РНК цепи, кодирующей смысловую РНК цепи). В качестве терминатора может использоваться последовательность из четырех или более следующих друг за другом оснований - A (аденинов), или т.п. Кроме того, в этой палиндромной экспрессионной системе, тип двух промотором предпочтительно является отличным.
Между тем, в качестве конфигурации, в которой антисмысловая РНК и смысловая РНК экспрессируются с различных векторов, например, создают кассету для экспрессии антисмысловой РНК и кассету для экспрессии смысловой РНК, в каждой из который промотор, способный к экспрессии короткой РНК, такой как система полимеразы III, связан 5' от антисмысловой ДНК и смысловой ДНК, и эти кассеты встроены в различные векторы.
Используемой в настоящем изобретении дцРНК предпочтительно является киРНК. «киРНК» означает двухцепочечную РНК, созданную из коротких цепей в таком диапазоне, что внутри клетки не проявляется токсичность. Длина особенно не ограничивается при условии, что экспрессию гена-мишени можно подавить, и токсичность не будет проявляться. Длина дцРНК составляет, например, от 15 до 49 пар оснований, предпочтительно от 15 до 35 пар оснований, и более того предпочтительно от 21 до 30 пар оснований.
В качестве ДНК, кодирующей дцРНК настоящего изобретения, можно также использовать такую конструкцию, которая включает соответствующую последовательность (желательно последовательность интрона), вставленную между инвертированными повторами последовательности-мишени, чтобы кодировать двухцепочечную РНК, имеющую шпилечную структуру, (самокомплементарную «шпилечную» РНК (шРНК)) (Smith, N. A., et al. Nature, 407: 319, 2000, Wesley, S. V. et al. Plant J. 27: 581, 2001, Piccin, A. et al. Nucleic Acids Res. 29: E55, 2001).
ДНК, кодирующая дцРНК настоящего изобретения, не должна обязательно иметь последовательность, полностью одинаковую с таковой гена-мишени, но гомология последовательностей составляет по крайней мере 70% или более, предпочтительно 80% или более, и более того предпочтительно 90% или более (например, 95%, 96%, 97%, 98%, 99% или более). Гомологию последовательностей можно определить с использованием описанной выше процедуры (программы BLAST).
В дцРНК двухцепочечная часть РНК, в которой РНК спарены, может включать не только РНК, которые являются полностью спаренными, но также неспаренную часть в результате несовпадения (соответствующие основания не комплементарны друг другу), выпуклость (одна цепь не содержит соответствующее основание), или т.п. В настоящем изобретении двухцепочечный участок РНК, в котором РНК дцРНК спарены, может включать и выпуклость и несовпадение.
Другой формой ДНК, кодирующей РНК, обладающую силой придать растению чувствительность к ингибитору 4-HPPD, является ДНК (антисмысловая ДНК), кодирующая антисмысловую РНК, комплементарную транскрипту с эндогенной ДНК устойчивости настоящего изобретения. Примеры действия, с помощью которого антисмысловая ДНК подавляет экспрессию гена-мишени, включают ингибирование инициации транскрипции в результате образования тройных цепей; подавление транскрипции в результате образования гибрида в месте, где РНК-полимераза локально образует открытую петлевую структуру; ингибирование транскрипции в результате образования гибрида с синтезируемой РНК; подавление сплайсинга в результате образования гибрида на границе между интроном и экзоном; подавление сплайсинга в результате образования гибрида в месте, где образуется сплайсингосома; подавление транслокации из ядра в цитоплазму в результате образования гибрида с мРНК; подавление сплайсинга в результате образования гибрида в сайте кэппирования или сайте добавления поли(A); подавление инициации трансляции в результате образования гибрида в сайте связывания фактора инициации трансляции; подавление трансляции в результате образования гибрида в сайте связывания рибосомы вблизи инициирующего кодона; ингибирование элонгации пептидной цепи в результате образования гибрида в транслируемой области и в сайте связывания полирибосомы мРНК; подавление экспрессии гена в результате образования гибрида в месте, где нуклеиновая кислота взаимодействует с белком и т.п. Они ингибируют процесс транскрипции, сплайсинга или трансляции и подавляют экспрессию гена-мишени (Hirajima and Inoue, "Shin Seikagaku Jikken Kouza (New Courses in Biochemistry Experiments) 2, Kakusan (nucleic acid) IV, Idenshi no Fukusei to Hatsugen (Gene Replication and Expression)", edited by the Japanese Biochemical Society, Tokyo Kagaku Dojin, pp. 319-347, 1993). Антисмысловая ДНК, используемая в настоящем изобретении, может подавлять экспрессию гена-мишени в результате любого из вышеотмеченных действий. В качестве одного образа действия, если антисмысловую последовательность создают комплементарной нетранслируемой области вблизи 5'-конца мРНК гена-мишени, она будет эффективно ингибировать трансляцию с гена. Тем не менее, можно использовать последовательность, комплементарную нетранслируемой области с 3'-края или кодирующей области. Как описано выше, антисмысловая ДНК, используемая в настоящем изобретении, также включает ДГК, содержащую последовательность, антисмысловую по отношению к последовательностям не только транслируемой области, но также нетранслируемой области гена. Используемая антисмысловая ДНК связана 3' от подходящего промотора, и предпочтительно последовательность, содержащая сигнал терминации транскрипции, связана с 3'-края.
Антисмысловую ДНК можно получить на основе информации о последовательности ДНК устойчивости настоящего изобретения (например, ДНК, имеющей последовательность оснований SEQ ID NO: 1) способом образования фосфоротиоатных связей (Stein, Nucleic Acids Res., 16: 3209-3221, 1988) или т.п. Полученную таким образом ДНК можно ввести в растение с помощью известных способов, описываемых позже. Последовательностью антисмысловой ДНК предпочтительно является последовательность, комплементарная транскрипту с эндогенной ДНК устойчивости настоящего изобретения растения, но она не должна быть полностью комплементарной при условии, что экспрессия с гена может эффективно ингибироваться. Транскрибированная РНК комплементарна предпочтительно на 90% или более (например, 95%, 96%, 97%, 98%, 99% или более) транскрипту с гена-мишени. Для эффективного ингибирования экспрессии с гена-мишени длина антисмысловой ДНК составляет по крайней мере 15 оснований или более, предпочтительно 100 оснований или более, и более того предпочтительно 500 оснований или более. Как правило, длина используемой антисмысловой ДНК короче, чем 5 т.о., предпочтительно короче, чем 2,5 т.о.
Другой формой ДНК, кодирующей РНК, обладающую силой придать растению чувствительность к ингибитору 4-HPPD, является ДНК, кодирующая РНК, обладающую ризозимной активностью специфического расщепления транскрипта с эндогенной ДНК устойчивости настоящего изобретения. Рибозимы включают рибозим, имеющий размер, составляющий 400 нуклеотидов или более, такой как рибозим типа интронов группы I и M1РНК, включенная в РНКазу P, а также рибозим, называемый рибозимом типа головки молотка или шпилечного типа, имеющий активный домен из приблизительно 40 нуклеотидов (Makoto Koizumi and Eiko Ohtsuka, Tanpakushitu Kakusan Koso (Protein, Nucleic Acid, Enzyme), 35: 2191, 1990).
Например, саморасщепляющий домен рибозима типа головки молотка отщепляет 3'-край C15-G13U14C15; но для его активности важно, чтобы U14 и A в положении 9 образовывали пару оснований, и основание в положении 15, как установлено, отщепляется, если A или U присутствует вместо C (Koizumi et al., FEBS Lett. 228: 225, 1988). Подобный рестриктазе, расщепляющий РНК рибозим, который распознает такую последовательность, как UC, UU или UA, в РНК-мишени, можно создать, если связывающий субстрат сайт рибозима создают комплементарным последовательности РНК вблизи сайта-мишени (Koizumi et. al., FEBS Lett. 239: 285, 1988, Makoto Koizumi and Eiko Ohtsuka, Tanpakushitu Kakusan Koso (protein, nucleic acid, enzyme), 35: 2191, 1990, Koizumi et. al., Nucleic. Acids. Res. 17: 7059, 1989).
Между тем, рибозим шпилечного типа также применим для цели настоящего изобретения. Рибозим шпилечного типа обнаружен, например, в «минус»-цепи сателлитной РНК вируса кольцевой пятнистости табака (Buzayan, Nature 323: 349, 1986). Установлено, что это рибозим можно также сконструировать так, чтобы происходило специфическое для мишени расщепление РНК (Kikuchi and Sasaki, Nucleic Acids Res. 19: 6751, 1992, Yo Kikuchi, Kagaku to Seibutsu (Chemistry and Biology) 30: 112, 1992). Рибозим, созданный так, что он способен расщеплять мишень, связывают с промотором, таким как промотор 35S вируса мозаики цветной капусты, и последовательностью терминации транскрипции, так что рибозим может транскрибироваться в клетках растений. Эффект можно увеличить посредством последовательного расположения таких составных единиц, так что расщепление может происходить во множестве мест гена-мишени (Yuyama et al., Biochem. Biophys. Res. Commun. 186: 1271, 1992). Такой рибозим используется для специфического расщепления транскрипта-мишени с эндогенной ДНК устойчивости настоящего изобретения, так что экспрессия с ДНК может подавляться.
Вектор, содержащий встроенную в него ДНК в соответствии с настоящим изобретением
Вектор, содержащий встроенную в него ДНК настоящего изобретения (ДНК устойчивости настоящего изобретения или ДНК, кодирующую РНУ, обладающую силой придать растению чувствительность к ингибитору 4-HPPD), особенно не ограничивается при условии, что введенный ген может экспрессироваться в клетке растения. Вектор в соответствии с настоящим изобретением может включать промотор для постоянной или индуцируемой экспрессии ДНК настоящего изобретения. Примеры промотора для постоянной экспрессии включают промотор 35S вируса мозаики цветной капусты, промотор актина риса, промотор убиквитина кукурузы и т.п. Между тем, примеры промотора для индуцируемой экспрессии включают промоторы, которые, как известно, экспрессируются под действием внешних факторов, таких как инфекция и инвазия гифомицетов, бактерий и вирусов, низкая температура, высокая температура, сухость, ультрафиолетовое облучение и распыление определенного соединения; и другие промоторы. Примеры таких промоторов включают промотор гена хитиназы риса и промотор гена белка PR табака, экспрессируемые в результате инфекции и инвазии гифомицетов, бактерий и вирусов; промотор гена lip19 риса, индуцируемый при низкой температуре; промоторы гена hsp80 и гена hsp72 риса, индуцируемые при высокой температуре; промотор гена rab16 Arabidopsis thaliana, индуцируемый в результате сухости; промотор хальконсинтазы петрушки, индуцируемый под действием ультрафиолетового облучения, промотор алкогольдегидрогеназы кукурузы, индуцируемый при анаэробных условиях и т.п. Кроме того, промотор гена хитиназы риса и промотор гена белка PR табака можно также индуцировать с помощью особого соединения, такого как салициловая кислота, а rab16 можно также индуцировать при распылении гормона растения, абсцизивной кислотой.
Агент настоящего изобретения может быть сам по себе ДНК настоящего изобретения или вектором, содержащим встроенную в него ДНК, или может включать другие компоненты, смешанные с ним. Такие другие компоненты особенно не ограничиваются, и их примеры включают стерильную воду, солевой раствор, растительное масло, поверхностно-активное вещество, липид, солюбилизатор, буфер и консервант. Кроме того, когда трансгенную клетку растения настоящего изобретения получают описываемым ниже способом с использованием Agrobacterium, агент может включать Agrobacterium, содержащий введенную в него ДНК.
Трансгенная клетка растения настоящего изобретения
Трансгенная клетка растения, способная к регенерации растения, обладающего повышенной устойчивостью к ингибитору 4-HPPD, настоящего изобретения является клеткой растения, трансформированной в результате введения в нее ДНК устойчивости настоящего изобретения или вектора, содержащего встроенную в него ДНК, кодирующую белок, обладающий силой придать растению устойчивость к ингибитору 4-HPPD.
Кроме того, трансгенная клетка растения, способная к регенерации растения, обладающего повышенной чувствительностью к ингибитору 4-HPPD, настоящего изобретения является клеткой растения, трансформированной в результате введения в нее вышеуказанной ДНК или вектора, содержащего встроенную в него ДНК, кодирующую РНК, обладающую силой придать растению чувствительность к ингибитору 4-HPPD.
Растение, из которого происходит клетка растения настоящего изобретения, особенно не ограничивается, и его примеры включают растения Poaceae, такие как рис, ячмень, пшеница, сорго, кукуруза и полевица болотная; растения Brassicaceae, такие как Arabidopsis thaliana; растения Solanaceae, такие как помидор; растения Fabaceae, такие как соя, люцерна и Lotus japonicas; растения Malvaceae, такие как хлопчатник; и растения Chenopodiaceae, такие как сахарная свекла.
В частности, чувствительные к ингибитору 4-HPPD культивары этих растений являются предпочтительными в качестве мишени настоящего изобретения, устойчивость которой к ингибитору 4-HPPD должна быть увеличена. Примеры чувствительного к ингибитору 4-HPPD культивара риса включают Habataki, Takanari, Momiroman, Mizuhochikara, Ruriaoba, Odorokimochi, Hyogo-ushiwakamaru, Kasalath и Kanto 239, но без ограничения ими.
Между тем, в частности, устойчивые к ингибитору 4-HPPD культивары этих растений являются предпочтительными в качестве мишени настоящего изобретения, чувствительность которой к ингибитору 4-HPPD должна быть увеличена. Примеры устойчивого к ингибитору 4-HPPD культивара риса включают Nipponbare, Koshihikari, Kitaaoba, Akihikari, Akitakomachi, Fukuhibiki, Bekoaoba, Bekogonomi, Yumeaoba, Hokuriku 193, Leaf Star, Tachisugata, Kusanohoshi, Hoshiaoba, Nishiaoba, Tachiaoba, Makimizuho, Mogumoguaoba, Hamasari и Minamiyutaka, но без ограничения ими.
Клетка растения настоящего изобретения включает, помимо клеток культур, клетки в растениях. Кроме того, клетка растения настоящего изобретения включает клетки растений в различных формах, например, клетки суспензионной культуры, протопласты, части листьев, каллюсы, незрелые зародыши, пыльцу и т.п.
В качестве способа введения в клетку растения вектора, содержащего встроенную в него ДНК устойчивости настоящего изобретения, можно использовать различные способы, известные квалифицированным в данной области техники специалистам, такие как способ с использованием полиэтиленгликоля, способ электропорации, способ с использованием Agrobacterium и способ генной пушки.
Растение настоящего изобретения, его материал для размножения и способ создания растения
Настоящим изобретением обеспечивается растение, регенерированное из вышеуказанной трансгенной клетки растения, (ниже также называемое трансгенным растением). Растение можно регенерировать из трансгенной клетки растения с использованием способов, известных квалифицированным в данной области техники специалистам, в зависимости от типа клетки растения.
Например, уже создано несколько методов процедуры получения трансгенных растений риса, такие как способ, в котором ген вводят в протопласты, используя полиэтиленгликоль, и растение регенерируют (Datta, S. K. In Gene Transfer To Plants (Potrykus I and Spangenberg Eds.) pp 66-74, 1995); способ, в котором ген вводят в протопласты, используя электрический импульс, и растение регенерируют (Toki et al. Plant Physiol. 100, 1503-1507, 1992); способ, в котором ген непосредственно вводят в клетки методом генной пушки, и растение регенерируют (Christou et al. Bio/technology, 9: 957-962, 1991); и способ, в котором ген вводят с использованием Agrobacterium, и растение регенерируют (Hiei et al. Plant J. 6: 271-282, 1994). Эти способы широко используются в области техники настоящего изобретения.
Кроме того, примеры процедуры получения трансгенных растений ячменя включают способы, описанные Tingay и др. (Tingay S. et al. Plant J. 11: 1369-1376, 1997), Murray и др. (Murray F et al. Plant Cell Report 22: 397-402, 2004) и Travalla и др. (Travalla S et al. Plant Cell Report 23: 780-789, 2005).
В качестве способа регенерации растений сорго предпочтительно используемыми являются, например, способ, в котором ген вводят в незрелые зародыши или каллюсы методом с использованием Agrobacterium или методом генной пушки, и растение регенерируют; и способ, в котором пыльцу, содержащую ген, введенный в нее, используя ультразвук, используют для опыления (J. A. Able et al., In Vitro Cell. Dev. Biol. 37: 341-348, 2001, A. M. Casas et al., Proc. Natl. Acad. Sci. USA 90: 11212-11216, 1993, V. Girijashankar et al., Plant Cell Rep 24: 513-522, 2005, J. M. JEOUNG et al., Hereditas 137: 20-28, 2002, V Girijashankar et al., Plant Cell Rep 24 (9): 513-522, 2005, Zuo-yu Zhao et al., Plant Molecular Biology 44: 789-798, 2000, S. Gurel et al., Plant Cell Rep 28 (3): 429-444, 2009, ZY Zhao, Methods Mol Biol, 343: 233-244, 2006, AK Shrawat and H Lorz, Plant Biotechnol J, 4 (6): 575-603, 2006, D Syamala and P Devi Indian J Exp Biol, 41 (12): 1482-1486, 2003, Z Gao et al., Plant Biotechnol J, 3 (6): 591-599, 2005).
Кроме того, пример процедуры для Arabidopsis thaliana включает способ, описанный Akama и др. (Akama et al. Plant Cell Reports 12: 7-11, 1992). В настоящем изобретении эти способы могут предпочтительно использоваться.
После получения растения, содержащего ДНК настоящего изобретения, введенную в геном, можно получить потомство от растения половым размножением или неполовым размножением. Кроме того, из растения или его потомка или клона получают материалы для размножения (например, семена, плоды, колосы, пеньки, каллюсы, протопласты и т.п.), из которых растение можно также получить в большом количестве. Таким образом, настоящее изобретение включает клетки растений, включающие ДНК настоящего изобретения, растения, включающие эти клетки, потомства и клоны растений, а также материалы для размножения растений, потомства и клоны.
Кроме того, настоящим изобретением также обеспечивается способ создания растения, обладающего повышенной устойчивостью к ингибитору 4-HPPD, включающий:
(I) стадию введения в клетку растения ДНК устойчивости настоящего изобретения или вектора, содержащего встроенную в него ДНК; и
(II) стадию регенерации растения из трансгенной клетки растения, в которую введена ДНК или вектор, содержащий встроенную в него ДНК, на стадии (I).
Кроме того, настоящим изобретением также обеспечивается способ создания растения, обладающего повышенной чувствительностью к ингибитору 4-HPPD, включающий:
(I) стадию введения в клетку растения ДНК, кодирующей РНК, обладающую силой придать растению чувствительность к ингибитору 4-HPPD, или вектора, содержащего встроенную в него ДНК; и
(II) стадию регенерации растения из трансгенной клетки растения, в которую введена ДНК или вектор, содержащий встроенную в него ДНК, на стадии (I).
Способ определения того, обладает ли растение устойчивостью или чувствительностью к ингибитору 4-HPPD
Способ определения того, обладает ли растение устойчивостью или чувствительностью к ингибитору 4-HPPD, настоящего изобретения характеризуется тем, что он включает анализ последовательности оснований ДНК устойчивости настоящего изобретения или ДНК соответствующей чувствительности (ниже называемой являющейся целью определения ДНК настоящего изобретения) в исследуемом растении или последовательности оснований контролирующей экспрессию области ДНК. Примите к сведению, что «ДНК чувствительности» является ДНК, кодирующая белок, обладающий силой придать растению чувствительность к ингибитору 4-HPPD.
Являющейся целью определения ДНК настоящего изобретения является типично по крайней мере одна ДНК, выбираемая из группы, состоящей из следующих ДНК (a)-(d):
(a) ДНК, кодирующей белок, имеющий аминокислотную последовательность, представленную в любой из SEQ ID NO: 2 и 17;
(b) ДНК, кодирующей белок, имеющий аминокислотную последовательность, представленную в любой из SEQ ID NO: 2 и 17, в (из) которой одна или более аминокислот замещены, делетированы, добавлены и/или вставлены;
(c) ДНК, гибридизующейся в жестких условиях с ДНК, имеющей последовательность оснований, представленную в любой из SEQ ID NO: 1 и 16; и
(d) ДНК, кодирующей аминокислотную последовательность, гомологичную на 60% или более аминокислотной последовательности, представленной в любой из SEQ ID NO: 2 и 17.
Примите к сведению, что ДНК (a)-(d) по существу означают ДНК, описанные выше, но, в частности, означают эндогенную ДНК, что касается являющейся целью определения ДНК настоящего изобретения, и, как подразумевается, включают и ДНК устойчивости, и ДНК чувствительности.
Как демонстрируется в Примерах, приведенных позже, по сравнению с геном HIS1 устойчивого к ингибитору 4-HPPD культивара Nipponbare, вставка или делеция основания отмечается в последовательностях соответствующих генов, чувствительных к ингибитору 4-HPPD культиваров Momiroman, Takanari и Kasalath. Таким образом, анализ последовательности оснований являющейся целью определения ДНК настоящего изобретения делает возможным определение того, обладает ли растение устойчивостью или чувствительностью к ингибитору 4-HPPD.
Кроме того, как демонстрируется в Примерах, приведенных позже, чувствительность к ингибитору 4-HPPD наследуется по рецессивному типу. Соответственно, анализ уровня экспрессии с являющейся целью определения ДНК настоящего изобретения, а также последовательности оснований области (энхансера, промотора, сайленсера, инсулятора), контролирующей уровень экспрессии, также делает возможным определение того, обладает ли растение устойчивостью или чувствительностью к ингибитору 4-HPPD.
При анализе последовательности оснований являющейся целью определения ДНК настоящего изобретения или контролирующей экспрессию области можно использовать продукт амплификации являющейся целью определения ДНК настоящего изобретения или контролирующей экспрессию области, амплифицированный с помощью ПЦР. При выполнении ПЦР используемый праймер не ограничивается при условии, что можно специфически амплифицировать являющуюся целью определения ДНК настоящего изобретения или контролирующую экспрессию область. Праймер можно сконструировать соответствующим образом на основе информации о последовательности (например, SEQ ID NO: 1) являющейся целью определения ДНК настоящего изобретения или контролирующей экспрессию области. Примеры предпочтительного праймера включают праймер, имеющий последовательность оснований SEQ ID NO: 13, и праймер, имеющий последовательность оснований SEQ ID NO: 14. При объединении этих праймеров соответствующим образом можно амплифицировать конкретную последовательность оснований являющейся целью определения ДНК настоящего изобретения или контролирующей экспрессию области.
Примите к сведению, что определение того, обладает ли исследуемое растение устойчивостью или чувствительностью к ингибитору 4-HPPD, может включать, например, стадию сравнения с «контрольной последовательностью оснований». «Контрольной последовательностью оснований», сравниваемой с последовательностью оснований являющейся целью определения ДНК настоящего изобретения или контролирующей экспрессию области в исследуемом растении, типично является последовательность оснований являющейся целью определения ДНК настоящего изобретения или контролирующей экспрессию области, в случае риса, устойчивого к ингибитору 4-HPPD культивара (например, Nipponbare, Koshihikari, Kitaaoba, Akihikari, Akitakomachi, Fukuhibiki, Bekoaoba, Bekogonomi, Yumeaoba, Hokuriku 193, Leaf Star, Tachisugata, Kusanohoshi, Hoshiaoba, Nishiaoba, Tachiaoba, Makimizuho, Mogumoguaoba, Hamasari, Minamiyutaka) или чувствительного к ингибитору 4-HPPD культивара (например, Habataki, Takanari, Momiroman, Mizuhochikara, Ruriaoba, Odorokimochi, Hyogo-ushiwakamaru, Kasalath, Kanto 239).
Примите к сведению, что в качестве примера ДНК чувствительности настоящего изобретения, последовательность оснований гипотетического гена (мутированного гена HIS1) железо/аскорбат-зависимой оксидоредуктазы, происходящего из Takanari или Momiroman, представлена в SEQ ID NO: 15.
Путем сравнения определенной последовательность оснований являющейся целью определения ДНК настоящего изобретения или контролирующей экспрессию области в исследуемом растении с последовательностью оснований (например, SEQ ID NO: 1, SEQ ID NO: 16) устойчивых к ингибитору 4-HPPD культиваров или последовательностью оснований (например, SEQ ID NO: 15) чувствительных к ингибитору 4-HPPD культиваров можно определить, обладает ли исследуемое растение устойчивостью или чувствительностью к ингибитору 4-HPPD. Например, если последовательность оснований является очень отличной (в частности, если молекулярная масса или аминокислотная последовательность кодируемого белка является значительно измененной вследствие появления нового стоп-кодона или сдвига рамки) от последовательности оснований (например, SEQ ID NO: 1) устойчивого к ингибитору 4-HPPD культивара, исследуемое растение в соответствии с определением, весьма вероятно, обладает чувствительностью к ингибитору 4-HPPD.
Примите к сведению, что в способе определения настоящего изобретения ДНК можно получить из исследуемого растения, используя обычные способы, например, способ CTAB. В качестве растения, из которых получают ДНК, можно использовать не только взрослое растение, но также семя и проросток. Кроме того, последовательность оснований можно определить обычными способами, например, способом расшифровки последовательности ДНК, способом Максама-Гилберта или т.п. При определении последовательности оснований могут использоваться имеющиеся в продаже наборы для секвенирования и секвенаторы.
Является ли последовательность оснований являющейся целью определения ДНК настоящего изобретения или контролирующей экспрессию области в исследуемом растении отличной от контрольной последовательности оснований, можно напрямую проанализировать с помощью различных способов, помимо прямого определения последовательности оснований, как описано выше. Примеры таких способов включают анализ SSCP (одноцепочечного конформационного полиморфизма) с помощью ПЦР, анализ RFLP или анализ RFLP с помощью ПЦР, используя полиморфизм длин рестрикционных фрагментов (RFLP), электрофорез в градиентном геле в денатурирующих условиях (DGGE), метод гибридизации с использованием аллель-специфических олигонуклеотидов (ASO) и метод расщепления в местах несовпадений с использованием рибонуклеазы A.
Другой способ определения того, обладает ли растение устойчивостью или чувствительностью к ингибитору 4-HPPD, настоящего изобретения характеризуется тем, что он включает определение экспрессии с по крайней мере одной ДНК, в исследуемом растении, выбираемой из группы, состоящей из вышеуказанных ДНК (a)-(d), или молекулярной массы любого из продукта амплификации или продукта экспрессии (с) ДНК.
Как демонстрируется в Примерах, приведенных ниже, левая половина четвертого экзона гена HIS1 каждого устойчивого к ингибитору 4-HPPD культивара из Nipponbare, Koshihikari и Hokuriku 193 длиннее таковой у чувствительных к ингибитору 4-HPPD культиваров Momiroman и Takanari. Таким образом, определение молекулярной массы любого из продукта амплификации и продукта экспрессии (с) являющейся целью определения ДНК настоящего изобретения делает возможным определение того, обладает ли растение устойчивостью или чувствительностью к ингибитору 4-HPPD.
Кроме того, как демонстрируется в Примерах, приведенных ниже, чувствительность к ингибитору 4-HPPD наследуется по рецессивному типу. Соответственно, определение экспрессии являющейся целью определения ДНК настоящего изобретения делает возможным определение того, обладает ли растение устойчивостью или чувствительностью к ингибитору 4-HPPD.
Здесь выражение «определение экспрессии ДНК», как подразумевается, включает определение как на транскрипционном уровне, так и на трансляционном уровне. Кроме того, выражение «определение экспрессии ДНК», как подразумевается, включает не только определение присутствия или отсутствия экспрессии, но также определение степени экспрессии.
Являющуюся целью определения ДНК настоящего изобретения (например, геномную ДНК) можно аплифицировать способом с использованием ПЦР (полимеразной цепной реакции).
ДНК в соответствии с настоящим изобретением можно определить на транскрипционном уровне с помощью обычных методов, например, метода с использованием ОТ-ПЦР (полимеразной цепной реакции с использованием обратной транскриптазы) или метода с использованием Нозерн-блоттинга. Праймер, используемый при выполнении ПЦР, особенно не ограничивается при условии, что являющуюся целью определения ДНК настоящего изобретения можно амплифицировать специфически. Праймер можно сконструировать соответствующим образом на основе информации о последовательности (например, SEQ ID NO: 1, SEQ ID NO: 16, SEQ ID NO: 15) ДНК устойчивости или ДНК чувствительности настоящего изобретения, которая уже определена. Примеры предпочтительного праймера включают праймеры, имеющие последовательность оснований любой из SEQ ID NO: 3-14. Кроме того, при объединении этих праймеров соответствующим образом можно амплифицировать конкретную последовательность оснований являющейся целью определения ДНК настоящего изобретения.
Между тем, определение на трансляционном уровне можно выполнить с помощью обычных методов, например, метода с использованием Вестерн-блоттинга. Антителом, используемым в Вестерн-блоттинге, может быть поликлональное антитело или моноклональное антитело. Способы получения этих антител хорошо известны квалифицированным в данной области техники специалистам.
Кроме того, экспрессию с являющейся целью определения ДНК настоящего изобретения можно определить посредством конструирования вектора, содержащего ген-репортер, функционально связанный 3' от контролирующей экспрессию области являющейся целью определения ДНК настоящего изобретения; введения вектора в клетку растения; и определение активности репортера.
В результате определения экспрессии гена, если уровень экспрессии являющейся целью определения ДНК настоящего изобретения исследуемого растения значительно ниже уровня экспрессии в устойчивом к ингибитору 4-HPPD культиваре (например, в случае риса, Nipponbare, Koshihikari, Kitaaoba, Akihikari, Akitakomachi, Fukuhibiki, Bekoaoba, Bekogonomi, Yumeaoba, Hokuriku 193, Leaf Star, Tachisugata, Kusanohoshi, Hoshiaoba, Nishiaoba, Tachiaoba, Makimizuho, Mogumoguaoba, Hamasari, Minamiyutaka) (например, если являющаяся целью определения ДНК настоящего изобретения по существу не экспрессируется), или если молекулярная масса любого из продукта амплификации и продукта экспрессии (с) являющейся целью определения ДНК настоящего изобретения значительно отличается от молекулярной массы в устойчивом к ингибитору 4-HPPD культиваре (например, Nipponbare, Koshihikari, Kitaaoba, Akihikari, Akitakomachi, Fukuhibiki, Bekoaoba, Bekogonomi, Yumeaoba, Hokuriku 193, Leaf Star, Tachisugata, Kusanohoshi, Hoshiaoba, Nishiaoba, Tachiaoba, Makimizuho, Mogumoguaoba, Hamasari, Minamiyutaka), исследуемое растение в соответствии с определением, весьма вероятно, обладает чувствительностью к ингибитору 4-HPPD. На самом деле, как демонстрируется в Примерах, приведенных ниже, молекулярная масса ДНК чувствительности чувствительных к ингибитору 4-HPPD культиваров (Momiroman, Takanari) значительно меньше по сравнению с ДНК устойчивости устойчивых к ингибитору 4-HPPD культиваров (Nipponbare, Koshihikari, Hokuriku 193).
Способ селекции растения настоящего изобретения
Настоящим изобретением обеспечивается способ селекции растения, обладающего повышенной устойчивостью к ингибитору 4-HPPD. Способ селекции включает:
(a) стадию скрещивания культивара растения, устойчивого к ингибитору 4-HPPD, с любым культиваром растения;
(b) стадию определения того, обладают ли отдельные представители, полученные в результате скрещивания, устойчивостью или чувствительностью к ингибитору 4-HPPD, с помощью вышеотмеченного способа определения настоящего изобретения; и
(c) стадию отбора культивара, который в соответствии с определением обладает устойчивостью к ингибитору 4-HPPD.
Кроме того, настоящим изобретением обеспечивается способ селекции растения, обладающего повышенной чувствительностью к ингибитору 4-HPPD. Способ селекции включает:
(a) стадию скрещивания культивара растения, чувствительного к ингибитору 4-HPPD, с любым культиваром растения;
(b) стадию определения того, обладают ли отдельные представители, полученные в результате скрещивания, устойчивостью или чувствительностью к ингибитору 4-HPPD, с помощью вышеотмеченного способа определения настоящего изобретения; и
(c) стадию отбора культивара, который в соответствии с определением обладает чувствительностью к ингибитору 4-HPPD.
Примеры «какого-либо культивара растения», скрещиваемого с культиваром растения, устойчивым к ингибитору 4-HPPD, включают чувствительные к ингибитору 4-HPPD культивары и отдельных представителей, полученных в результате скрещивания устойчивых к ингибитору 4-HPPD культиваров с чувствительными к ингибитору 4-HPPD культиварами, но не ограничиваются ими. Кроме того, примеры «какого-либо культивара растения», скрещиваемого с культиваром растения, чувствительным к ингибитору 4-HPPD, включают устойчивые к ингибитору 4-HPPD культивары и отдельных представителей, полученных в результате скрещивания устойчивых к ингибитору 4-HPPD культиваров с чувствительными к ингибитору 4-HPPD культиварами, но не ограничиваются ими. Поскольку чувствительность к ингибитору 4-HPPD наследуется по рецессивному типу, для того, чтобы отдельные представители, полученные в результате скрещивания, проявили чувствительность к ингибитору 4-HPPD, предпочтительно иметь ген HIS1 чувствительности к ингибитору 4-HPPD в гомозиготной форме.
Использование способа селекции настоящего изобретения делает возможным отбор устойчивого или чувствительного к ингибитору 4-HPPD культивара на стадии семени или проростка, отсюда делая возможной селекцию культивара, обладающего этой характерной чертой, за короткий период времени.
Примеры
В дальнейшем настоящее изобретение будет описано конкретнее на основе Примеров. Однако настоящее изобретение не ограничивается следующими Примерами. Между тем, эксперименты и анализы в следующих Примерах были выполнены, как указано ниже.
Анализ локуса количественных признаков (QTL)
Были исследованы линии с заменой сегмента хромосомы Koshihikari/Habataki и Tachisugata//Tachisugata/Momiroman BC1F4. А именно, были проанализированы линии с заменами сегментов хромосом Koshihikari/Habataki (KHSL), в которых часть фрагментов хромосом устойчивого культивара Koshihikari, служащего в качестве генетического фона, была заменена хромосомой чувствительного культивара типа indica - Habataki. Примите к сведению, что KHSL состоит из 32 линий и делает возможным анализ на всех из всего 12 хромосом Habataki (в отношении KHSL см. Kazumasa Murata et al., "Development and evaluation of CSSLs carrying overlapping chromosome segments of rice cultivar Habataki in a genetic background of cultivar Koshihikari," Breeding Research, March 27, 2009, vol. 11, supplement issue 1, p. 66). Кроме того, были проанализированы 94 линии BC1F4, полученные в результате разового обратного скрещивания устойчивого культивара Tachisugata с чувствительным культиваром Momiroman, используя 80 маркеров SSR (в отношении используемых маркеров SSR см. "Development and mapping of 2240 new SSR markers for rice (Oryza sativa L.)", DNA Res, 2002, vol. 9, iss. 6, pp. 199 to 207, and http://www.gramene.org/).
Анализ сцепления, используя линии со вставкой Tos17
Ретротранспозон Tos17, обнаруженный в рисе, активируется при культивировании тканей, и его копии переносятся в геноме. Известно, что, когда место переноса находится внутри гена, ген должен разрушаться, вызывая мутацию (см. Hirochika et al., Proc. Natl. Acad. Sci. USA, 1996, vol. 93, pp. 7783 to 7788). В настоящих примерах использовалась популяция риса, имеющая аккумулированные мутации, вызванные культивированием тканей, используя это явление (панель мутантов, название базы данных: база данных, касающихся панели мутантов, полученных в результате переноса Tos17 (http://tos.nias.affrc.go.jp/ to miyao/pub/tos17/)). Из базы данных, касающихся панели мутантов, полученных в результате переноса Tos17, были выбраны две линии, в каждой из которых Tos17 был вставлен в транскрипционный сайт гипотетического гена железо/аскорбат-зависимой оксидоредуктазы, который в соответствии с сильным подозрением связан с чувствительностью к BBC, который был расположен в генном локусе, определенном с помощью анализа QTL. Затем семена, полученные в результате самооплодотворения при посадке 15 отдельных представителей каждой из этих двух линий, использовали для проверки фенотипа (чувствительности к BBC) и генотипа (вставки Tos17).
Приобретение клона гена
Гипотетическая мРНК (AK065581) для гена железо/аскорбат-зависимой оксидоредуктазы, расположенного в генном локусе, определенном с помощью анализа, была получена из банка генов риса.
Конструирование векторов и трансформация
Для трансформации методом с использованием Agrobacterium бинарные векторы были сконструированы посредством соединения кассеты для экспрессии гена устойчивости к канамицину (NPT2), управляемой промотором nos, или кассеты для экспрессии гена устойчивости к гигромицину (mHPT), управляемой промотором CaMV35S, с кассетой для экспрессии AK065581 (гена HIS1) или AK241948 (гена HSL1), управляемой промотором CaMV35S (см. фиг. 3-7).
Для трансформации A. thaliana, использовали экотип «Columbia», и выполняли способ погружения растений (см. Weigel and Glazebrook, Arabidopsis, a laboratory manual, Cold Spring Harbor Laboratory Press (2002) p131-132). А именно, сначала Agrobacterium подвергали культивированию со встряхиванием в жидкой среде (LB или YEB), содержащей антибиотик. Спустя приблизительно 16 часов 2 мл суспензии культуры добавляли в жидкую среду (LB или YEB), содержащую антибиотик, и подвергали дальнейшему культивированию со встряхиванием. Затем суспензию культуры, полученную спустя приблизительно 16 часов с этого момента времени, подвергали центрифугированию при 8000 об./мин при 4°C в течение 10 минут. Супернатант отбрасывали, и результирующий осадок суспендировали в 500 мл раствора, содержащего 5% сахарозы. Впоследствии, непосредственно перед трансформацией, реагент для трансформации silwet (зарегистрированный товарный знак: SILWET L-77, № продукта: BMS-SL7755, производства Bio Medical Science Inc.) добавляли к ней в конечной концентрации, составляющей 0,025%. Затем в суспензию Agrobacterium, полученную таким образом, погружали Arabidopsis, из которого были удалены отцветшие и опыленные почки, на 30-120 секунд. Впоследствии растения выдерживали в течение 16 часов, а затем выращивали для получения семян.
Для трансформации риса использовали чувствительный к BBC культивар риса Kanto 239, и выполняли способ, описанный в "Taniguchi et al., Plant Cell Rep., 2010, vol. 29, iss. 11, pp. 1287 to 1295", с некоторой модификацией. А именно, сначала стерилизованные зрелые семена засевали в среду N6D. После культивирования при 30°C в течение 7 дней семена инфицировали Agrobacterium и подвергали сокультивированию в содержащей ацетосирингон (AS) среде N6 (среде 2N6-AS) в темноте при 25°C в течение 3 дней. Впоследствии инфицированные ткани подвергали культивированию в содержащей карбенициллин среде N6D в течение 4-6 недель (длина дня = 18 часов) в присутствии 40 мг/л гигромицина (Hyg), и устойчивые к Hyg каллюсы были редифференцированы.
В случае трансформации помидоров проверяли культивар «Micro-Tom», и метод с использованием Agrobacterium выполняли, используя векторы (35SHIS1 pZK3, 35SHSL1 pZK3), представленные на фиг. 5 и 7. Примите к сведению, что, когда семена исходного культивара Micro-Tom проращивали на агаровой среде, содержащей 0,3 мкМ бензобициклона (BBC), используя термостат при 25°C, спустя приблизительно 2 недели явно наблюдалось, что их листовые части увядали.
В результате трансформации помидоров было получено множество редифференцированных растений, содержащих ген HIS1 или ген HSL1, введенный в них. Кроме того, гены, введенные в редифференцированные растения, подтверждали с помощью ПЦР.
Анализ устойчивости к BBC на рекомбинантах
Рекомбинанты A. thaliana (поколения T2) и рекомбинанты риса (поколения T0) были получены и подвергнуты анализу на устойчивость к BBC, используя вещество BBC, которым обладает SDS Biotech K.K., в концентрации, которая приводится позже.
Анализ устойчивости к ингибиторам 4-HPPD типа трикетонов на рекомбинантах
Рекомбинанты риса (поколений T1 и T2) были получены и подвергнуты анализу на устойчивость к ингибиторам 4-HPPD типа трикетонов, т.е. мезотриону, тефурилтриону, темботриону и NTBC, используя имеющиеся в продаже реагенты в концентрациях, которые приводятся позже.
ПЦР
Праймеры для специфической амплификации пяти экзонных районов HIS1 (AK065581) были созданы и использованы для ПЦР. Примите к сведению, что ПЦР выполняли в 35 циклах, каждый из которых состоял из 94°C в течение 30 секунд, 55°C в течение 30 секунд и 72°C в течение 30 секунд, используя праймеры, имеющие последовательности оснований, представленные в таблице 1. Кроме того, в качестве матрицы используемыми ДНК были геномные ДНК, экстрагированные методом CTAB из листьев чувствительных к BBC культиваров риса (Momiroman, Takanari, Kasalath) и устойчивых к BBC культиваров риса (Nipponbare, Koshihikari, Hokuriku 193).
|
Пример 1: Определение генного локуса устойчивости к ингибитору 4-HPPD
У риса типа japonica не известен культивар, обладающий чувствительностью к BBC, одному из ингибиторов 4-HPPD. Между тем, культивар риса, отобранный при скрещивании типа japonica с типом indica, может обладать чувствительностью к BBC.
Соответственно, анализ QTL был выполнен, как описано выше, на линиях с заменами сегментов хромосом Koshihikari/Habataki (KHSL), используя устойчивый к BBC культивар риса «Koshihikari» и чувствительный культивар риса «Habataki». В результате лишь KHSL (KHSL04), область короткого плеча хромосомы 2 которого была заменена таковой типа Habataki, проявил чувствительность. Это показало, что генный локус для определения устойчивости к BBC расположен на коротком плече хромосомы 2 Koshihikari (см. таблицу 2). Примите к сведению, что в таблице 2 представлена часть результатов анализа QTL на KHSL. Кроме того, в таблице 2 «A» указывает на то, что маркер был получен из Koshihikari, а «B» указывает на то, что маркер был получен из Habataki.
|
Кроме того, анализ QTL был выполнен, как описано выше, на Tachisugata//Tachisugata/Momiroman BC1F4, используя устойчивый к BBC культивар риса «Tachisugata» и чувствительный культивар риса «Momiroman». В результате было обнаружено, что генный локус для определения устойчивости к BBC расположен на коротком плече хромосомы 2 Tachisugata, как и в вышеприведенном случае. Было выявлено, что генные локусы, определенные с помощью анализов QTL с использованием различных культиваров риса, расположены в одной и той же области, и что существуют 11 генов-кандидатов в соответствии с информацией, касающейся базы для культивара риса «Nipponbare» (см. таблицу 3).
|
Более того, было также обнаружено, что как последовательности оснований 11 генов-кандидатов, так и гипотетические аминокислотные последовательности не гомологичны ферментам и их генам в пути метаболизма тирозина и пути биосинтеза каротиноидов, на которые оказывал воздействие BBC (см. фиг. 1).
Кстати, в соответствии с информацией, касающейся базы данных для культивара риса «Nipponbare», ген риса, обладающий наибольшей степенью гомологии с известным геном, кодирующим фермент HPPD, активность которого ингибирует BBC, расположен на коротком плече хромосомы 2, но его генный локус был отличен от такового, определенного с помощью анализа QTL (см. фиг. 8).
Кроме того, чтобы сузить область, в которой расположен ген, связанный с устойчивостью к BBC, была получена популяция F2 посредством скрещивания KHSL04 с Koshihikari, и популяция для анализа короткого плеча хромосомы 2 была получена из линий BC1F4, полученных в результате разового обратного скрещивания Tachisugata с Momiroman. Анализ предприняли снова, используя эти две популяции. В результате было обнаружено, что ген, связанный с устойчивостью к BBC, находится между SSR-маркерами RM12980 и RM12983. Более того, среди генов, находящихся в суженной таким образом области, искали RAP-DB. Результат показал существование 10 генов-кандидатов, исключая белок, схожий с глиоксалазой I (741 п.о.).
Пример 2: Идентификация гена устойчивости к ингибитору 4-HPPD
Как описано выше, анализ QTL говорил о том, ген для определения устойчивости к ингибитору 4-HPPD расположен на коротком плече хромосомы 2 риса. Соответственно, сосредотачивая внимание на гипотетическом гене железо/аскорбат-зависимой оксидоредуктазы, расположенном в этом генном локусе, были проверены линии со вставками Tos17 для выявления связи фенотипа (высокой чувствительностью к BBC) и генотипа, а также были получены рекомбинанты чувствительного к BBC A. thaliana и риса, содержащего введенный в него ген, для проверки эффекта обеспечения устойчивости к BBC.
А именно, в генном локусе для определения устойчивости к BBC, определенном с помощью анализа QTL, расположен гипотетический ген железо/аскорбат-зависимой оксидоредуктазы (ниже также называемый «геном-мищенью»), аналогично ферменту HPPD, активность которого ингибирует BBC (см. таблицу 4).
|
Хотя исходный культивар «Nipponbare» для линий со вставками Tos17 является устойчивым к BBC культиваром, отдельные представители, чувствительные к BBC, получены из линий, содержащих Tos17, вставленный в транскрипционный сайт гена-мишени. Фенотип (чувствительность к BBC) и генотип (гомозиготность по вставке Tos17) были проверены с использованием анализа сцепления, проведенного всего на 30 отдельных представителях. В результате все потомки шести отдельных представителей, гомозиготных по вставке Tos17, проявили чувствительность к BBC. Между тем, все потомки 18 отдельных представителей, гетерозиготных по вставке Tos17, распадались на чувствительных к BBC отдельных представителей. Эти результаты говорили о том, что гипотетический ген железо/аскорбат-зависимой оксидоредуктазы тесно связан с устойчивостью к BBC.
Соответственно, для подтверждения того, что ген-мишень является геном устойчивости к BBC, были приготовлены рекомбинанты (поколения T2) посредством введения гена-мишени в A. thaliana (экотипа Columbia), который увядал бы под влиянием агаровой среде, содержащей 0,03 мкМ BBC, и состояние роста рекомбинантов проверяли в присутствии BBC в этой концентрации. На фиг. 9 представлен полученный результат.
Кроме того, были приготовлены рекомбинанты (поколения T0) посредством введения гена-мишени в чувствительный к BBC культивар риса «Kanto 239», который увядал бы под влиянием агаровой среде, содержащей 0,1 мкМ BBC, и состояние роста рекомбинантов проверяли в компостированной почве, обработанной BBC в количестве 300 грамм активного ингредиента/гектар. На фиг. 10 представлен полученный результат.
Кроме того, были приготовлены рекомбинанты посредством введения гена-мишени в чувствительный к BBC культивар риса «Kanto 239», который увядал бы под влиянием агаровой среде, содержащей 0,1 мкМ BBC, и были получены семена T1 или семена T2. Эти семена высевали в агаровую среду, содержащую 2 мкМ BBC, и проверяли состояние роста рекомбинантов. На фиг. 11 представлен полученный результат. Кроме того, семена высевали в агаровую среду, содержащую 1 мкМ мезотриона, 2,5 мкМ тефурилтриона, 0,5 мкМ темботриона или 1 мкМ NTBC, и проверяли состояние роста рекомбинантов. На фиг. 12-15 представлены полученные результаты.
Как видно из результата, представленного на фиг. 9, рекомбинанты A. thaliana, содержащие введенный в них ген-мишень, росли без увядания под влиянием агаровой среды, содержащей 0,03 мкМ BBC. Кроме того, как видно из результата, представленного на фиг. 10, рекомбинанты риса, содержащие введенный в них ген-мишень, росли без увядания под влиянием компостированной почвы, обработанной BBC в количестве 300 грамм активного ингредиента/гектар. Кроме того, как видно из результата, представленного на фиг. 11, рекомбинанты риса, содержащие введенный в них ген-мишень, росли без увядания под влиянием агаровой среды, обработанной 2 мкМ BBC. Следует отметить, что эта концентрация является высокой концентрацией, достаточной для увядания устойчивого к BBC культивара Nipponbare.
Кроме того, как видно из результатов, представленных на фиг. 12-15, рекомбинанты риса, содержащие введенный в них ген-мишень, росли без увядания также в среде, содержащей ингибитор 4-HPPD типа трикетонов (мезотрион, тефурилтрион, темботрион или NTBC), отличный от BBC. А именно, рекомбинанты риса, содержащие введенный в них ген-мишень, росли без увядания под влиянием агаровой среды, обработанной 1 мкМ мезотрионом, 2,5 мкМ тефурилтрионом, 0,5 мкМ темботрионом или 1 мкМ NTBC.
Эти результаты служили подтверждением того, что ген-мишень был геном устойчивости к 4-HPPD (геном HIS1), т.е. ДНК, кодирующей белок, обладающий силой придать растению устойчивость к ингибитору 4-HPPD.
Пример 3: Определение устойчивости или чувствительности к ингибитору 4-HPPD с помощью анализа последовательности оснований гена HIS1
Хотя ген HIS1 на хромосоме 2 риса типа japonica был определен, продукт амплификации гена HIS1, амплифицированного с помощью ПЦР, был также получен из чувствительных к BBC культиваров риса. Кроме того, иногда трудно определить, обладает ли Kasalath, среди чувствительных к BBC культиваров риса, чувствительностью или устойчивости, в зависимости от условия обработки ВВС. По этой причине проверили, возможно ли определить связь между последовательностью оснований гена HIS1 и степенью чувствительности к BBC, с помощью ПЦР, с помощью которой амплифицировали конкретный район гена HIS1.
Следует отметить, что хотя и не было проиллюстрировано, все из Momiroman, Takanari и Kasalath являются чувствительными к BBC культиварами на различных уровнях; было подтверждено, что Momiroman и Takanari проявляют высокую степень чувствительности к BBC по сравнению со степенью чувствительности к BBC Kasalath.
Поэтому сначала проанализировали чувствительные к BBC культивары (Momiroman, Takanari, Kasalath) и устойчивые к BBC культивары (Nipponbare, Koshihikari, Hokuriku 193) с помощью ПЦР, используя праймеры для специфической амплификации пяти экзонных районов гена HIS1. На фиг. 16 представлен полученный результат.
Как видно из результата, представленного на фиг. 16, результат анализа с помощью ПЦР, используя праймер для специфической амплификации левой половины четвертого экзона гена HIS1, показал, что молекулярные массы продуктов ПЦР в высокой степени чувствительных к BBC культиваров Momiroman и Takanari меньше таковых устойчивых к BBC культиваров.
Кроме того, последовательности геномных ДНК чувствительных к BBC культиваров Momiroman и Takanari были сравнены с таковой устойчивого к BBC культивара Nipponbare. На фиг. 17 представлен полученный результат.
Как видно из результата, представленного на фиг. 17, в соответствии с представленным выше результатом анализа с помощью ПЦР, было установлено, что Momiroman и Takanari имеют делецию 28 п.о. в левой половины четвертого экзона гена HIS1. Кроме того, было обнаружено, что интрон между четвертым экзоном и пятым экзоном гена HIS1 также имеет сайты делеции 19 п.о. и 16 п.о. Кроме того, было отмечено, что пятый экзон гена HIS1 имеет делецию 1 п.о. (аденина) и вставку 5 п.о.
Кроме того, последовательность геномной ДНК чувствительного к BBC культивара Kasalath была сравнена с таковой устойчивого к BBC культивара Nipponbare. На фиг. 18 представлены полученные результаты.
Как видно из результата, представленного на фиг. 18, в соответствии с представленным выше результатом анализа с помощью ПЦР, делеция в левой половине четвертого экзона гена HIS1 не наблюдалась в Kasalath. Тем не менее, было обнаружено, что интрон между четвертым экзоном и пятым экзоном гена HIS1 имеет вставку TA и сайт делеции 16 п.о. Более того, было отмечено, что пятый экзон гена HIS1 имеет делецию аденина, вставку 5 п.о. и вставку цитозина.
Таким образом, эти результаты показывали, что сила, которой обладал белок, кодируемый геном HIS1, чтобы придать растению устойчивость к ингибитору 4-HPPD, была подавлена делецией оснований и/или вставкой из(в) в район(а) с четвертого экзона по пятый экзон гена HIS1. Кроме того, по-видимому, отличие Momiroman и Takanari от Kasalath в чувствительности к ингибитору 4-HPPD связано с тем, присутствует ли делеция в левой половине четвертого экзона гена HIS1, и т.д.
Пример 4: Анализ гена, гомологичного гену HIS1.
Затем в базе данных искали ген, гомологичный гену HIS1. А именно, используя NCBI Blast, выполняли поиск tBLASTN (с использованием установки по умолчанию), используя аминокислотную последовательность белка, кодируемого геном HIS-1, в качестве запроса. Примете к сведению, что данные, в которых проводился поиск, были nr/nt (совокупностью не дублированных нуклеотидных последовательностей).
В результате было обнаружено, что ген риса (ген HSL1), обладающий наибольшей степенью гомологии с геном HIS1, расположен на хромосоме 6, и что гомология гипотетических аминокислотных последовательностей составляла вплоть до 86% (см. фиг. 19). Более того, было также обнаружено, что гомологичные гены на хромосоме 6 образуют кластер генов неподалеку.
Однако полагают, что белки, кодируемые этими гомологичными генами на хромосоме 6, также экспрессируются в чувствительном культиваре, имеющем мутированный ген HIS1.
Касательно этой точки зрения, как представлено на фиг. 20, ген HIS1 в основном экспрессируется в листьях, в то время как гомологичные гены на хромосоме 6 в основном экспрессируются в корнях и созревающих семенах. По этой причине полагают, что, хотя белки, кодируемые гомологичными генами на хромосоме 6, потенциально обладают силой придать растению устойчивость к ингибитору 4-HPPD, эффект может не проявляться, поскольку уровень экспрессии в листьях является низким.
Кстати, фиг. 20 основана на результате анализа характеров экспрессий HIS1 (Os02g0280700) и гомологичных генов (Os06g0176700/Os06g0178500) на хромосоме 6 в различных тканях и в различные периоды роста, используя RiceXPro (базу данных, касающуюся экспрессии генов риса/http://ricexpro.dna.affrc.go.jp/) (см. Sato et al., Nucleic Acids Res. November 2, 2010 [Epub ahead of print]).
Более того, было обнаружено, что гены, гомологичные гену HIS1, распространены только среди однодольных растений и не обнаруживаются у двудольных растений (см. фиг. 21). Кроме того, гены, обладающие немного меньшей степенью гомологии с геном HIS1, включая гены этиленсинтезирующих ACC-оксидаз, широко распространены среди растений, но их функции, как полагают, являются отличными. Кстати, фиг. 21 получена посредством выбора аминокислотных последовательностей белков, гомологичных HIS1, при анализе tBLASTN, выполнения анализа филогенетического дерева на основе полученных последовательностей, используя программное обеспечение ClustalW, и представления результата в виде чертежа с использованием программного обеспечения TreeView.
Пример 5: Анализ гена HSL1
Ген риса (ген HSL1), обладающий наибольшей степенью гомологии с геном HIS1 и расположенный на хромосоме 6, проверяли в отношении того, является ли ген HSL1 ДНК, кодирующей белок, обладающей силой придавать растению устойчивость к ингибитору 4-HPPD.
А именно, были приготовлены рекомбинанты посредством введения гена-мишени в чувствительный к BBC культивар риса «Kanto 239», который увядал бы под влиянием агаровой среды, содержащей 0,1 мкМ BBC, и были получены семена T1 и семена T2. Эти семена высевали в агаровую среду, содержащую 0,12 мкМ BBC, и проверяли состояние роста рекомбинантов. На фиг. 22 представлен полученный результат.
Как видно из результата, представленного на фиг. 22, рекомбинанты риса, содержащие введенный в них гомологичный ген, росли без увядания под влиянием агаровой среды, содержащей 0,12 мкМ BBC. Эта концентрация является концентрацей, при которой устойчивый к BBC культивар «Nipponbare» не увядает. Этот результат служил подтверждением того, что, хотя уровень устойчивости был низким, ген HSL1 был ДНК, кодирующей белок, обладающей силой придавать растению устойчивость к ингибитору 4-HPPD, аналогично гену HIS1.
Промышленная применимость
При использовании и выращивании растений, обладающих повышенной устойчивостью к ингибитору 4-HPPD, настоящего изобретения борьбу с сорняками можно эффективно проводить на посевных рисовых полях или посевных полях. Кроме того, способ определения того, является ли растение устойчивым или чувствительным к ингибитору 4-HPPD, настоящего изобретения может использоваться, например, для уменьшения угрозы прорастания «самосевных семян» предшествующего года в циклах чередования культур. Таким образом настоящее изобретение может значительно способствовать стабильному производству и увеличению урожая полезных растений.
Нестандартный формат списка последовательностей
SEQ ID NO: 3-14
<223> последовательности искусственно синтезированных праймеров