ВАРИАНТЫ ГУМАНИЗИРОВАННЫХ ИММУНОМОДУЛИРУЮЩИХ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ
Вид РИД
Изобретение
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области иммунотерапии и, более конкретно, оно относится к гуманизированным моноклональным антителам, подходящим для лечения различных показаний, в частности, для лечения злокачественной опухоли и иммунодефицитных нарушений.
УРОВЕНЬ ТЕХНИКИ, К КОТОРОМУ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Быстрое накопление знаний в последние годы о молекулярных и клеточных основах иммунной регуляции, в частности, на уровне T-клеточных ответов, обеспечило новый арсенал иммунотерапевтических подходов, включающих разработку противоопухолевых вакцин. Было показано, что определенные моноклональные антитела обладают иммуномодулирующей активностью, включая способность связывать детерминанты на поверхности T-клеток и индуцировать пролиферацию, активацию, созревание или дифференцировку этих клеток.
BAT (также обозначаемое как mBAT-1 или BAT-1) представляет собой моноклональное антитело мыши, полученное против мембранного препарата клеточной линии лимфомы Беркитта (Daudi), для которого было показано, что оно проявляет противоопухолевые и иммуностимулирующие эффекты в отношении различных типов опухолей (Hardy et al., 2001, Int. J. Oncol. 19:897). Это моноклональное антитело первоначально было описано в патенте США № 5897862, выданном Hardy et al. BAT-1 секретируется гибридомной клеточной линией, имеющей номер доступа CNCM № I-1397. Иммуномодулирующий эффект BAT мыши также был исследован in vitro. BAT мыши активирует CD4+ T-клетки и индуцирует секрецию IFN-γ из этих клеток (Hardy et al., 2000, Int. Immunol. 12:1623 и Quaglino E. et al., 2005, Vaccine 9:23(25):3280-7). Кроме того, было обнаружено, что BAT запускает пролиферацию T-клеток и увеличивает их цитолитическую активность (Hardy, B. et al., 1997, Hum. Antibodies, 8:95).
Полинуклеотидные и аминокислотные последовательности BAT мыши описаны в WO 00/58363, Hardy et al., и патенте США № 7695715.
Ряд гуманизированных моноклональных антител (mAb) на основе BAT мыши описан в патенте США № 7332582, содержание которого включено в настоящее описание в качестве ссылки. В конкретных вариантах осуществления US 7332582 гуманизированные моноклональные антитела включают вариабельную область легкой цепи, выбранную из SEQ ID NO:1-4 (обозначаемые как BATRKD, BATRKA, BATRKB и BATRKC, соответственно), и вариабельную область тяжелой цепи, выбранную из SEQ ID NO:5-9 (обозначаемые как BATRHC, BATRHA, BATRHB, BATRHD и BATRHE, соответственно). Аминокислотные последовательности вариантов антител по легкой и тяжелой цепи представлены в таблице 1 настоящего описания ниже. Остатки, которые отличаются в указанных вариабельных областях, обозначены с помощью серого фона (положения 2, 30, 69, 77, 97 и 98 области легкой цепи и положения 35, 69, 70 и 71 тяжелой цепи).
В соответствии с U.S. 7332582, оказалось, что гуманизированные моноклональные антитела BAT индуцируют более высокий противоопухолевый эффект, чем противоопухолевый эффект, индуцируемый исходным антителом BAT мыши. Среди различных исследованных модельных систем, противоопухолевую активность BAT исследовали у мышей SCID (тяжелое комбинированное иммунодефицитное заболевание), мышей beige с дефицитом NK-клеток и мышей nude с дефицитом T-клеток (Hardy, B., 1997, Proc. Natl. Acad. Sci. USA 94:5756). Всем мышам внутривенно инъецировали клетки меланомы B16 мыши, у которых впоследствии развивались опухоли в легких. Антитела BAT проявляли противоопухолевый эффект только у мышей SCID, которым были пересажены лимфоциты либо мыши, либо человека. У бестимусных мышей nude и мышей beige антитела BAT проявляли противоопухолевую активность, хотя эта активность была менее эффективной по сравнению с противоопухолевой активностью антител BAT у мышей дикого типа.
Следует иметь ввиду, что не ожидается, что антитела BAT будут нацеливаться на сами опухолевые клетки, а скорее они будут нацеливаться на клетки с иммунной функцией у индивидуума или пациента для модулирования иммунного ответа полезным образом.
Berger et al. (2008) описали введение гуманизированного моноклонального антитела CT-011, которое основано на mBAT-1, пациентам с развернутыми гематологическими злокачественными опухолями, и связанную с ним фармакокинетику (Berger et al. Clin. Cancer Res. 2008; 14(10) May 15, 2008).
WO 09/101611 относится к способам ингибирования роста опухоли, повышения выживаемости индивидуума, имеющего опухоль, и индукции защиты против рецидива опухоли у млекопитающего, включающим введение гуманизированного моноклонального антитела, содержащего области CDR, происходящие из моноклонального антитела мыши, обозначаемого как mBAT-1, в комбинации с по меньшей мере одним химиотерапевтическим средством.
Нигде на уровне техники не описано или не предложено, что применение гуманизированного моноклонального антитела mBAT-1, содержащего по меньшей мере одну сайт-специфическую аминокислотную модификацию, является преимущественным для терапии различных показаний, в частности, при лечении злокачественной опухоли и связанных с иммунодефицитом заболеваний и нарушений.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к мутантным гуманизированным моноклональным антителам или их фрагментам, имеющим сайт-специфические аминокислотные модификации включая, но не ограничиваясь ими, аминокислотные замены и делеции, по сравнению с известными гуманизированными моноклональными антителами hBAT-1. Кроме того, изобретение относится к фармацевтическим композициям, содержащим модифицированные антитела или их фрагменты, и к их применению для лечения злокачественной опухоли и иммунодефицитных нарушений. В некоторых вариантах осуществления модифицированные антитела по изобретению сохраняют иммуномодулирующую активность hBAT-1, связывают B-лимфобластоидные клетки и индуцируют пролиферацию и активацию лимфоцитов периферической крови человека.
Антитела по настоящему изобретению демонстрируют улучшенные признаки, например, увеличенную биоактивность и стабильность и/или сниженную иммуногенность, посредством конкретной модификации по меньшей мере одной аминокислоты вариантов антитела hBAT-1, как подробно описано ниже.
|
|
|
|
В таблице 1 приведены аминокислотные последовательности вариабельных и константных областей легкой и тяжелой цепи вариантов антитела hBAT-1. По меньшей мере одна аминокислота, которая в некоторых вариантах осуществления заменена для получения антител по изобретению, представлена полужирным шрифтом. В конкретных вариантах осуществления по меньшей мере одна аминокислота выбрана из группы, состоящей из: аминокислот в положениях 5, 20, 71, 75, 76, 93 и 97 SEQ ID NO:1; аминокислот в положениях 54, 55 и 107 SEQ ID NO:5, аминокислот в положениях 157, 158, 169, 170 SEQ ID NO:11; и аминокислот в положениях 120, 124, 159, 160, 203, 204, 221, 222, 225, 252, 270, 271, 280, 281, 297, 298, 315, 316, 384, 385, 399, 400, 401, 402, 434, 435, 447 и 428 SEQ ID NO:13.
В соответствии с одним из аспектов, настоящее изобретение относится к антителу или его антигенсвязывающему фрагменту, содержащим вариабельную область легкой цепи, выбранную из группы, состоящей из SEQ ID NO:1, 2, 3 и 4, и вариабельную область тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO:5, 6, 7, 8 и 9, где антитело или его антигенсвязывающий фрагмент содержат по меньшей мере одну аминокислотную замену в положении, выбранном из: Phe 97 и Phe 93 вариабельной области легкой цепи на Ala, Leu или Val, или замену Trp 107 вариабельной области тяжелой цепи на Ala, Leu, Val или Tyr.
В некоторых вариантах осуществления изобретения антитело или его антигенсвязывающий фрагмент содержат аминокислотную замену Phe 97 вариабельной области легкой цепи и аминокислотную замену Trp 107 вариабельной области тяжелой цепи. В другом варианте осуществления антитело или его антигенсвязывающий фрагмент содержат аминокислотную замену Phe 93 вариабельной области легкой цепи и аминокислотную замену Trp 107 вариабельной области тяжелой цепи.
В другом варианте осуществления вариабельная область легкой цепи содержит аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO:14, 15, 16, 17, 18, 19, 20 и 21. В одном из вариантов осуществления вариабельная область легкой цепи содержит аминокислотную последовательность, как указано в SEQ ID NO:14. В другом варианте осуществления вариабельная область легкой цепи содержит аминокислотную последовательность, как указано в SEQ ID NO:15. В конкретном варианте осуществления вариабельная область легкой цепи содержит аминокислотную последовательность, как указано в SEQ ID NO:29. В другом конкретном варианте осуществления вариабельная область легкой цепи содержит аминокислотную последовательность, как указано в SEQ ID NO:30.
В другом варианте осуществления вариабельная область тяжелой цепи содержит аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO:24, 25, 26, 27 и 28. В конкретном варианте осуществления вариабельная область тяжелой цепи содержит аминокислотную последовательность, как указано в SEQ ID NO:24. В другом конкретном варианте осуществления вариабельная область тяжелой цепи содержит аминокислотную последовательность, как указано в SEQ ID NO:31.
В другом варианте осуществления антитело или его антигенсвязывающий фрагмент дополнительно содержат по меньшей мере одну аминокислотную замену в положении, выбранном из группы, состоящей из: Thr 5, Thr 20, Cys 71, Asn 75, Ser 76 вариабельной области легкой цепи, и Asp 54 и Ser 55 вариабельной области тяжелой цепи.
В соответствии с другим аспектом, настоящее изобретение относится к антителу или его антигенсвязывающему фрагменту, содержащим вариабельную область легкой цепи, выбранную из группы, состоящей из SEQ ID NO:1, 2, 3 и 4, и вариабельную область тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO:5, 6, 7, 8 и 9, где антитело или его антигенсвязывающий фрагмент содержит по меньшей мере одну аминокислотную модификацию в положении, выбранном из группы, состоящей из: Thr 5, Thr 20, Cys 71, Asn 75, Ser 76, Phe 93 и Phe 97 вариабельной области легкой цепи и Asp 54, Ser 55 и Trp 107 вариабельной области тяжелой цепи. Каждая возможность отражает отдельный вариант осуществления настоящего изобретения.
В соответствии с некоторыми вариантами осуществления изобретения аминокислотная модификация представляет собой аминокислотную замену. В соответствии с одним из вариантов осуществления аминокислотная замена представляет собой консервативную замену. В соответствии с другим вариантом осуществления аминокислотная замена представляет собой неконсервативную замену. В соответствии с другим вариантом осуществления аминокислотная модификация представляет собой делецию аминокислоты. В соответствии с некоторыми вариантами осуществления модифицированные антитела по изобретению содержат комбинацию аминокислотных модификаций, такую как аминокислотная замена одного остатка и делеция аминокислоты другого остатка. В соответствии с другим вариантом осуществления модифицированное антитело содержит по меньшей мере одну аминокислотную замену и по меньшей мере одну аминокислотную делецию.
В соответствии с различными вариантами осуществления изобретения модифицированное антитело или его фрагмент содержат комбинацию вариабельной области тяжелой цепи и вариабельной области легкой цепи, причем комбинация выбрана из группы, состоящей из: SEQ ID NO:5/SEQ ID NO:1; SEQ ID NO:6/SEQ ID NO:2; SEQ ID NO:7/SEQ ID NO:2; SEQ ID NO:7/SEQ ID NO:3; SEQ ID NO:8/SEQ ID NO:3; и SEQ ID NO:7/SEQ ID NO:1. В соответствии с конкретными вариантами осуществления изобретения антитело или его антигенсвязывающий фрагмент содержат комбинацию вариабельных областей, соответствующую SEQ ID NO:5/SEQ ID NO:1. Комбинация вариабельных областей тяжелой и легкой цепи в одном варианте осуществления содержит по меньшей мере одну аминокислотную модификацию в положении, выбранном из группы, состоящей из: Thr 5, Thr 20, Cys 71, Asn 75, Ser 76, Phe 93 и Phe 97 вариабельной области легкой цепи и Asp 54, Ser 55 и Trp 107 вариабельной области тяжелой цепи. В другом варианте осуществления комбинация вариабельных областей тяжелой и легкой цепи содержит по меньшей мере одну аминокислотную модификацию в положении, выбранном из: Phe 93 и Phe 97 вариабельной области легкой цепи и Trp 107 вариабельной области тяжелой цепи. Каждая возможность отражает отдельный вариант осуществления настоящего изобретения.
В соответствии с другим вариантом осуществления изобретения антитело содержит константную область легкой цепи, как указано в SEQ ID NO:10. В соответствии с другим вариантом осуществления антитело содержит модифицированную константную область легкой цепи, содержащую по меньшей мере одну аминокислотную модификацию в положении, выбранном из группы, состоящей из: Asn 51, Ser 52, Asp 63 и Ser 64 SEQ ID NO:10. Каждая возможность отражает отдельный вариант осуществления настоящего изобретения.
В соответствии с другим вариантом осуществления изобретения, антитело содержит легкую цепь, как указано в SEQ ID NO:11. В соответствии с другим вариантом осуществления антитело содержит модифицированную легкую цепь, как указано в SEQ ID NO:11, содержащую аминокислотную модификацию в положении, выбранном из группы, состоящей из: Asn 157, Ser 158, Asp 169 и Ser 170 SEQ ID NO:11. Каждая возможность отражает отдельный вариант осуществления настоящего изобретения.
В соответствии с другим вариантом осуществления изобретения, антитело содержит константную область тяжелой цепи, как указано в SEQ ID NO:12. В соответствии с другим вариантом осуществления, антитело содержит модифицированную константную область тяжелой цепи, содержащую по меньшей мере одну аминокислотную модификацию в положении, выбранном из группы, состоящей из: Thr 3, Ser 7, Asn 42, Ser 43, Asn 86, His 87, Asp 104, Lys 105, Thr 108, Met 135, Asp 153, Pro 154, Asp 163, Gly 164, Asn 180, Ser 181, Asn 198, Gly 199, Asn 267, Gly 268, Asp 282, Ser 283, Asp 284, Ser 285, Asn 317, His 318, Lys 330 и Met 311 SEQ ID NO:12. Каждая возможность отражает отдельный вариант осуществления настоящего изобретения.
В соответствии с другим вариантом осуществления изобретения, антитело содержит тяжелую цепь, как указано в SEQ ID NO:13. В соответствии с другим вариантом осуществления антитело содержит тяжелую цепь, как указано в SEQ ID NO:13, содержащую по меньшей мере одну аминокислотную модификацию в положении, выбранном из группы, состоящей из: Thr 120, Ser 124, Asn 159, Ser 160, Asn 203, His 204, Asp 221, Lys 222, Thr 225, Met 252, Asp 270, Pro 271, Asp 280, Gly 281, Asn 297, Ser 298, Asn 315, Gly 316, Asn 384, Gly 385, Asp 399, Ser 400, Asp 401, Ser 402, Asn 434, His 435, Lys 447 и Met 428 SEQ ID NO:13. Каждая возможность отражает отдельный вариант осуществления настоящего изобретения.
В соответствии с другим аспектом, настоящее изобретение относится к антителу или его антигенсвязывающему фрагменту, причем антитело содержит вариабельную область легкой цепи, выбранную из группы, состоящей из SEQ ID NO:1, 2, 3 и 4, и/или вариабельную область тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO:5, 6, 7, 8 и 9, или аминокислотную последовательность, которая по меньшей мере на 85% идентична им, где антитело содержит по меньшей мере одну аминокислотную модификацию в положении, выбранном из группы, состоящей из:
(i) Thr 5, Thr 20, Cys 71, Asn 75, Ser 76, Phe 93 и Phe 97 вариабельной области легкой цепи, имеющей аминокислотную последовательность SEQ ID NO:1-4;
(ii) Asp 54, Ser 55 и Trp 107 вариабельной области тяжелой цепи, имеющей аминокислотную последовательность SEQ ID NO:5-9;
(iii) Asn 51, Ser 52, Asp 63 и Ser 64 константной области легкой цепи, имеющей аминокислотную последовательность SEQ ID NO:10; и
(iv) Thr 3, Ser 7, Asn 42, Ser 43, Asn 86, His 87, Asp 104, Lys 105, Thr 108, Met 135, Asp 153, Pro 154, Asp 163, Gly 164, Asn 180, Ser 181, Asn 198, Gly 199, Asn 267, Gly 268, Asp 282, Ser 283, Asp 284, Ser 285, Asn 317, His 318, Lys 330 и Met 311 константной области тяжелой цепи, имеющей аминокислотную последовательность SEQ ID NO:12.
В другом варианте осуществления изобретения антитело содержит вариабельную область легкой цепи, выбранную из группы, состоящей из SEQ ID NO:1, 2, 3 и 4, или вариабельную область тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO:5, 6, 7, 8 и 9, или аминокислотную последовательность, которая по меньшей мере на 88%, по меньшей мере на 90%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или 99% идентична им, где каждая возможность отражает отдельный вариант осуществления настоящего изобретения.
В соответствии с различными вариантами осуществления изобретения, антитело или его антигенсвязывающий фрагмент содержат комбинацию модифицированных аминокислот, включая, но не ограничиваясь ими, по меньшей мере две аминокислотные модификации, по меньшей мере три аминокислотные модификации, по меньшей мере четыре аминокислотные модификации или по меньшей мере пять аминокислотных модификаций, где каждая возможность отражает отдельный вариант осуществления настоящего изобретения.
В соответствии с другим вариантом осуществления антитело или его антигенсвязывающий фрагмент содержат по меньшей мере одну аминокислотную модификацию в положении, выбранном из группы, состоящей из: Thr 5, Thr 20, Cys 71, Asn 75, Ser 76, Phe 93 и Phe 97 SEQ ID NO:1-4; и по меньшей мере одну аминокислотную модификацию в положении, выбранном из группы, состоящей из: Asp 54, Ser 55 и Trp 107 SEQ ID NO:5-9. Каждая возможность отражает отдельный вариант осуществления настоящего изобретения.
В соответствии с другим вариантом осуществления вариабельная область легкой цепи имеет одну аминокислотную модификацию, выбранную из группы, состоящей из: Thr 5, Thr 20, Cys 71, Asn 75, Ser 76, Phe 93 и Phe 97 любой из SEQ ID NO:1, 2, 3, 4 или 11. В соответствии с другим вариантом осуществления вариабельная область тяжелой цепи имеет одну модифицированную аминокислоту, выбранную из группы, состоящей из: Asp 54, Ser 55 и Trp 107 любой из SEQ ID NO:5, 6, 7, 8, 9 или 13.
В конкретном варианте осуществления аминокислотная модификация находится в положении Cys 71 любой из SEQ ID NO:1, 4 или 11. В другом варианте осуществления Cys 71 заменен на аминокислоту, выбранную из группы, состоящей из: Ser, Val, Gly, Thr, Ile, Leu и Ala. Без связи с какой-либо теорией или механизмом действия, замена указанного остатка цистина снижает риск нежелательных дисульфидных связей.
Без связи с какой-либо теорией или механизмом действия, модификация одной или обеих аминокислот следующих пар аминокислот: Asn-Ser; Asp-Ser; Asn-His или Asn-Gly, снижает риск дезамидации, тем самым, увеличивая растворимость антитела по изобретению. В конкретном варианте осуществления аминокислотная модификация находится в положении, выбранном из группы, состоящей из: Asn 75, Ser 76 любой из SEQ ID NO:1, 2, 3, 4 или 11. В другом варианте осуществления аминокислотная модификация находится в положении, выбранном из группы, состоящей из: Asn 157, Ser 158 SEQ ID NO:10. В другом варианте осуществления аминокислотная модификация находится в положении, выбранном из группы, состоящей из: Asn 159, Ser 160, Asn 297, Ser 298 SEQ ID NO:11.
В одном из вариантов осуществления пара аминокислот Asn-Ser заменена на Ser-Asn. В другом варианте осуществления пара аминокислот Asn-Ser заменена на любую пару аминокислот, отличную от Asp-Ser; Asn-His или Asn-Gly. В конкретных вариантах осуществления Asn заменен на любую аминокислоту, выбранную из Ala, Val, Ser, Leu, Gly, Glu или Ser. В другом конкретном варианте осуществления Asn заменен на любую аминокислоту, отличную от Gln или Asp. В конкретных вариантах осуществления Ser заменен на любую аминокислоту, выбранную из Ala, Val, Leu, Gly, Ile, Thr или Asn. В другом конкретном варианте осуществления Ser заменен на любую аминокислоту, выбранную из Ala, Val, Leu, Gly, Ile или Asn. В другом конкретном варианте осуществления Ser заменен на любую аминокислоту, отличную от Gly. Каждая возможность отражает отдельный вариант осуществления настоящего изобретения.
В другом варианте осуществления аминокислотная модификация находится в положении, выбранном из группы, состоящей из: Asp 54, Ser 55 любой из SEQ ID NO:5, 6, 7, 8, 9 или 13.
В одном из вариантов осуществления пара аминокислот Asp-Ser заменена на Ser-Asp. В другом варианте осуществления пара аминокислот Asp-Ser заменена на любую пару аминокислот, отличную от Asn-Ser; Asn-His или Asn-Gly. В конкретных вариантах осуществления Asp заменен на любую аминокислоту, выбранную из Ala, Val, Ser, Leu, Gly или Ser. В другом конкретном варианте осуществления Asp заменен на любую аминокислоту, отличную от Glu или Asn. В конкретных вариантах осуществления Ser заменен на любую аминокислоту, выбранную из Ala, Val, Leu, Ile, Gly или Asn. В другом конкретном варианте осуществления Ser заменен на любую аминокислоту, отличную от Gly. Каждая возможность отражает отдельный вариант осуществления настоящего изобретения.
В другом варианте осуществления модификация представляет собой замену по меньшей мере одного остатка, выбранного из пары остатков: Asn 203 и His 204; Asn 315 и Gly 316; Asn 384 и Gly 385; Asn 434 и His 435 SEQ ID NO:11. В конкретных вариантах осуществления пара аминокислот переставлена местами (например, Asn-His заменена на His-Asn; Asn-Gly заменена на Gly-Asn). В другом варианте осуществления пара аминокислот Asn-his заменена на любую пару аминокислот, отличную от Asn-Ser; Asp-Ser или Asn-Gly. В другом варианте осуществления пара аминокислот Asn-Gly заменена на любую пару аминокислот, отличную от Asn-Ser; Asp-Ser или Asn-His. Каждая возможность отражает отдельный вариант осуществления настоящего изобретения.
В другом варианте осуществления аминокислотная модификация находится в положении, выбранном из Thr 5, Thr 20 вариабельной области легкой цепи. В другом варианте осуществления аминокислотная модификация находится в положении, выбранном из группы, состоящей из: Thr 3, Ser 7 и Thr 108 константной области тяжелой цепи, как указано в качестве SEQ ID NO:12. В другом варианте осуществления аминокислотная модификация находится в положении, выбранном из группы, состоящей из: Thr 120, Ser 124, Thr 225 тяжелой цепи, как указано в качестве SEQ ID NO:13. В другом варианте осуществления остаток треонина заменен на любую аминокислоту, отличную от серина. В другом варианте осуществления остаток серина заменен на любую аминокислоту, отличную от треонина. В конкретном варианте осуществления остаток треонина и/или серина заменен на остаток аланина. Без связи с какой-либо теорией или механизмом действия, замена указанного остатка треонина или серина снижает риск нежелательного O-связанного гликозилирования.
Без связи с какой-либо теорией или механизмом действия, модификация одной или обеих аминокислот следующей пары аминокислот: Asp-Ser; Asp-Lys; Asp-Gly; снижает риск изомеризации аспарагиновой кислоты, тем самым, препятствуя или снижая риск деградации. В конкретном варианте осуществления аминокислотная модификация находится в положении, выбранном из группы, состоящей из: Asp 63-Ser 64 SEQ ID NO:10; Asp 169-Ser 170 SEQ ID NO:11; Asp 104-Lys 105, Asp 163-Gly 164, Asp 282-Ser 283, Asp 285, Ser 286 SEQ ID NO:12; и Asp 221-Lys 222, Asp 280-Gly 281, Asp 339-Ser 400, Asp 401, Ser 402 SEQ ID NO:13. В конкретных вариантах осуществления пара аминокислот переставлена местами (например, Asp-Ser заменена на Ser-Asp). В другом варианте осуществления пара аминокислот заменена на любую пару аминокислот, отличную от Asp-Ser, Asp-Lys или Asp-Gly. В одном варианте осуществления Asp заменен на Glu. Каждая возможность отражает отдельный вариант осуществления настоящего изобретения.
В соответствии с различными вариантами осуществления, антитело или его антигенсвязывающий фрагмент по изобретению имеют противоопухолевую активность, сходную или превышающую противоопухолевую активность mBAT-1. В соответствии с другим вариантом осуществления, указанное антитело или его антигенсвязывающий фрагмент имеют противоопухолевую активность, сходную или превышающую противоопухолевую активность hBAT-1. В соответствии с другим вариантом осуществления указанное антитело или его антигенсвязывающий фрагмент имеют усиленную стабильность по сравнению с hBAT-1.
В соответствии с различными вариантами осуществления, фрагмент гуманизированного антитела выбран из группы, состоящей из: Fv, F(ab'), F(ab')2 и одноцепочечного антитела.
В соответствии с другим вариантом осуществления настоящее изобретение относится к полинуклеотидным последовательностям, кодирующим антитело по изобретению или его фрагменты.
В соответствии с другим вариантом осуществления, предусматривается вектор, содержащий полинуклеотидную последовательность, кодирующую антитело по изобретению или его фрагменты. В соответствии с конкретным вариантом осуществления, предусмотрен вектор, содержащий полинуклеотидную последовательность, кодирующую антитело по изобретению или его фрагменты, выбранные из группы, состоящей из: целого гуманизированного антитела, вариабельной области легкой цепи, вариабельной области тяжелой цепи, обеих цепей вариабельной области.
В соответствии с другим аспектом, предусмотрены клетки-хозяева, содержащие вектор, содержащий полинуклеотидную последовательность, кодирующую антитело по изобретению или его фрагменты.
В соответствии с другим аспектом, предусмотрена фармацевтическая композиция, содержащая в качестве активного ингредиента антитело по изобретению или его антигенсвязывающий фрагмент и фармацевтически приемлемый носитель, разбавитель или стабилизатор.
В соответствии с другим вариантом осуществления, фармацевтическую композицию, содержащую в качестве активного ингредиента антитело по изобретению, используют для лечения злокачественной опухоли. В соответствии с другим вариантом осуществления фармацевтическую композицию можно вводить либо после выявления первичных или вторичных опухолей у индивидуума, либо в качестве профилактической терапии индивидуума, имеющего высокий риск развития злокачественных опухолей. В соответствии с некоторыми вариантами осуществления, антитело по изобретению индуцирует противоопухолевые эффекты в различных опухолях.
В соответствии с другим аспектом, настоящее изобретение относится к способу лечения заболевания или нарушения у индивидуума, нуждающегося в этом, включающему введение индивидууму эффективного количества фармацевтической композиции, содержащей антитело по изобретению в качестве активного ингредиента или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления заболевание или нарушение представляет собой злокачественную опухоль. В некоторых вариантах осуществления заболевание или нарушение представляет собой связанное с иммунодефицитом заболевание или нарушение.
В одном из вариантов осуществления индивидуум имеет опухоль, выбранную из солидной опухоли или несолидной опухоли. В некоторых вариантах осуществления опухоль представляет собой солидную опухоль. В некоторых вариантах осуществления опухоль представляет собой несолидную опухоль. В некоторых вариантах осуществления несолидная опухоль представляет собой гематологическую злокачественную опухоль.
В конкретных вариантах осуществления злокачественная опухоль выбрана из группы, состоящей из карциномы ободочной и прямой кишки, немелкоклеточного рака легкого (NSCLC), мелкоклеточного рака легкого (SCLC), карциномы молочной железы; меланомы; карциномы яичника, карциномы шейки матки, рака поджелудочной железы, карциномы головы и шеи, желудочно-кишечной карциномы, опухоли пищевода, печеночно-клеточной карциномы, множественной миеломы, почечноклеточного рака, опухоли предстательной железы, неходжскинской лимфомы, болезни Ходжкина, лимфомы из клеток мантийной зоны, саркомы Капоши, плоскоклеточной карциномы, базально-клеточной карциномы, острого миелоидного лейкоза (AML), хронического миелоцитарного лейкоза (CML), острого лимфоцитарного лейкоза (ALL) и хронического лимфоцитарного лейкоза (CLL). Каждая возможность отражает отдельный вариант осуществления настоящего изобретения.
В соответствии с конкретными вариантами осуществления, злокачественная опухоль выбрана из группы, состоящей из: карциномы ободочной и прямой кишки, меланомы, рака поджелудочной железы, карциномы головы и шеи, опухоли пищевода, множественной миеломы, почечноклеточного рака, неходжскинской лимфомы и болезни Ходжкина.
В соответствии с различными вариантами осуществления, индивидуумом является не являющееся человеком млекопитающее. В соответствии с различными предпочтительными вариантами осуществления, индивидуумом является человек.
В дополнительном аспекте изобретение относится к антителу или его антигенсвязывающему фрагменту по настоящему изобретению для применения для лечения опухоли. В другом варианте осуществления изобретение относится к антителу или его антигенсвязывающему фрагменту, содержащим вариабельную область легкой цепи, выбранную из группы, состоящей из SEQ ID NO:1-4, и вариабельную область тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO:5-9, где антитело или его антигенсвязывающий фрагмент содержат по меньшей мере одну аминокислотную модификацию в положении, выбранном из группы, состоящей из: Thr 5, Thr 20, Cys 71, Asn 75, Ser 76, Phe 93 и Phe 97 вариабельной области легкой цепи и Asp 54, Ser 55 и Trp 107 вариабельной области тяжелой цепи, для применения при лечении опухоли.
В дополнительном аспекте изобретение относится к антителу или его антигенсвязывающему фрагменту по настоящему изобретению для получения лекарственного средства для лечения опухоли. В другом варианте осуществления изобретение относится к антителу или его антигенсвязывающему фрагменту, содержащим вариабельную область легкой цепи, выбранную из группы, состоящей из SEQ ID NO:1-4, и вариабельную область тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO:5-9, где антитело или его антигенсвязывающий фрагмент содержат по меньшей мере одну аминокислотную модификацию в положении, выбранном из группы, состоящей из: Thr 5, Thr 20, Cys 71, Asn 75, Ser 76, Phe 93 и Phe 97 вариабельной области легкой цепи и Asp 54, Ser 55 и Trp 107 вариабельной области тяжелой цепи, для получения лекарственного средства для лечения опухоли.
Другие задачи, признаки и преимущества настоящего изобретению станут очевидными из следующего подробного описания и прилагаемой формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
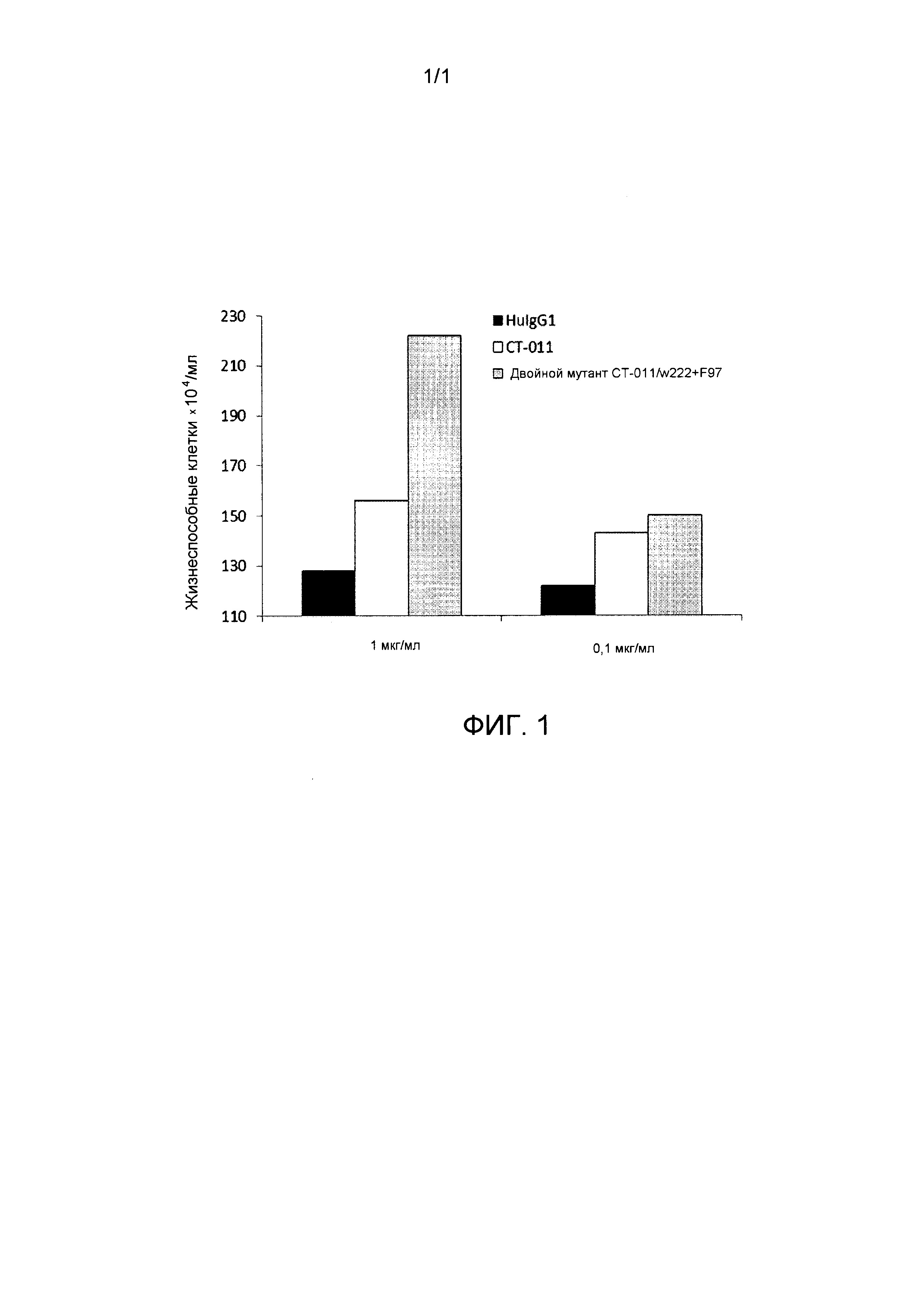
На фиг.1 представлен график, демонстрирующий жизнеспособность CD4+ T-лимфоцитов после инкубации с гуманизированным моноклональным антителом BAT-1 (обозначаемым как CT-011) и двойным мутантом CT-011, содержащим замены на аланин в положении Phe 97 вариабельной области легкой цепи и Trp 107 вариабельной области тяжелой цепи.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к гуманизированным моноклональным антителам, фармацевтическим композициям, содержащим указанные антитела, и к их применению для лечения различных показаний, включая, но не ограничиваясь ими, злокачественную опухоль и иммунодефицитные нарушения. В частности, настоящее изобретение относится к модифицированным антителам или их фрагментам, имеющим определенные аминокислотные модификации, такие как аминокислотные замены, по сравнению с вариантами гуманизированного моноклонального иммуномодулирующего антитела hBAT-1.
В соответствии с другим вариантом осуществления предусмотрено антитело или его антигенсвязывающий фрагмент, содержащие вариабельную область легкой цепи, по меньшей мере на 85% идентичную любой из SEQ ID NO:1-4, и вариабельную область тяжелой цепи, по меньшей мере на 85% идентичную любой из SEQ ID NO:5-9, причем антитело или его антигенсвязывающий фрагмент содержат по меньшей мере одну модифицированную аминокислоту, выбранную из группы, состоящей из: Thr 5, Thr 20, Cys 71, Asn 75, Ser 76, Phe 93 и Phe 97, по сравнению с SEQ ID NO:1, или по меньшей мере одну модифицированную аминокислоту, выбранную из группы, состоящей из: Asp 54, Ser 55 и Trp 107, по сравнению с SEQ ID NO:5. Каждая возможность отражает отдельный вариант осуществления настоящего изобретения.
В другом варианте осуществления изобретения антитело содержит вариабельную область легкой цепи, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 92%, по меньшей мере на 95% или по меньшей мере на 98% идентичную любой из SEQ ID NO:1-4, и вариабельную область тяжелой цепи, как указано в любой из SEQ ID NO:5-9. В другом варианте осуществления антитело содержит вариабельную область тяжелой цепи, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 92%, по меньшей мере на 95% или по меньшей мере на 98% идентичную любой из SEQ ID NO:5-9, и вариабельную область легкой цепи, как указано в любой из SEQ ID NO:1-4. В другом варианте осуществления антитело содержит вариабельную область легкой цепи, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 92%, по меньшей мере на 95% или по меньшей мере на 98% идентичную любой из SEQ ID NO:1-4, и вариабельную область тяжелой цепи, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 92%, по меньшей мере на 95% или по меньшей мере на 98% идентичную любой из SEQ ID NO:5-9. Каждая возможность отражает отдельный вариант осуществления настоящего изобретения.
Термин ″идентичный по меньшей мере на X процентов″ или ″имеющий идентичность по меньшей мере X процентов″ относится к проценту аминокислотных остатков, которые идентичны в двух сравниваемых последовательностях, когда последовательности оптимальным образом выравнивают. Таким образом, например, 85% идентичность аминокислотных последовательностей означает, что 85% аминокислот в двух или более оптимально выровненных полипептидных последовательностях являются идентичными.
В соответствии с другим вариантом осуществления предусматривается антитело или его антигенсвязывающий фрагмент, содержащие вариабельную область легкой цепи, выбранную из SEQ ID NO:1-4, и вариабельную область тяжелой цепи, выбранную из SEQ ID NO:5-9, где вариабельная область легкой цепи содержит по меньшей мере одну аминокислотную модификацию в положении, выбранном из группы, состоящей из: Thr 5, Thr 20, Cys 71, Asn 75, Ser 76, Phe 93 и Phe 97; или где вариабельная область тяжелой цепи содержит по меньшей мере одну аминокислотную модификацию в положении, выбранном из группы, состоящей из: Asp 54, Ser 55 и Trp 107. Каждая возможность отражает отдельный вариант осуществления настоящего изобретения.
В соответствии с одним из вариантов осуществления вариабельная область легкой цепи имеет аминокислотную последовательность, как указано в SEQ ID NO:1 (BATRKD). В соответствии с другим вариантом осуществления вариабельная область легкой цепи имеет аминокислотную последовательность, как указано в SEQ ID NO:2 (BATRKA). В соответствии с другим вариантом осуществления вариабельная область легкой цепи имеет аминокислотную последовательность, как указано в SEQ ID NO:3 (BATRKB). В соответствии с другим вариантом осуществления вариабельная область легкой цепи имеет аминокислотную последовательность, как указано в SEQ ID NO:4 (BATRKC).
В соответствии с другим вариантом осуществления антитело или его фрагмент содержат по меньшей мере одну аминокислотную модификацию в положении, выбранном из группы, состоящей из: Thr 5, Thr 20, Cys 71, Asn 75, Ser 76, Phe 93 и Phe 97 любой из SEQ ID NO:1 или SEQ ID NO:4. Каждая возможность отражает отдельный вариант осуществления настоящего изобретения.
В соответствии с другим вариантом осуществления антитело или его фрагмент содержат по меньшей мере одну аминокислотную модификацию в положении, выбранном из группы, состоящей из: Thr 5, Thr 20, Asn 75, Ser 76, Phe 93 и Phe 97 любой из SEQ ID NO:2 или SEQ ID NO:3. Каждая возможность отражает отдельный вариант осуществления настоящего изобретения.
В соответствии с другим вариантом осуществления вариабельная область тяжелой цепи имеет аминокислотную последовательность, как указано в SEQ ID NO:5 (BATRHC). В соответствии с другим вариантом осуществления вариабельная область легкой цепи имеет аминокислотную последовательность, как указано в SEQ ID NO:6 (BATRHA). В соответствии с другим вариантом осуществления вариабельная область легкой цепи имеет аминокислотную последовательность, как указано в SEQ ID NO:7 (BATRHB). В соответствии с другим вариантом осуществления вариабельная область легкой цепи имеет аминокислотную последовательность, как указано в SEQ ID NO:8 (BATRHD). В соответствии с другим вариантом осуществления вариабельная область легкой цепи имеет аминокислотную последовательность, как указано в SEQ ID NO:9 (BATRHE).
В соответствии с другим вариантом осуществления антитело или его антигенсвязывающий фрагмент по изобретению содержат аминокислотную модификацию в положении, выбранном из Phe 93 или Phe 97 вариабельной области легкой цепи. В другом варианте осуществления вариабельная область легкой цепи (любая из SEQ ID NO:1-4) модифицирована путем замены Phe 93 или Phe 97 на любую аминокислоту, отличную от Trp и Tyr. Неограничивающие примеры аминокислотных замен Phe и/или Trp включают Ala, Leu и Val. В конкретных вариантах осуществления вариабельная область легкой цепи содержит аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO:14, 15, 16, 17, 18, 19, 20 и 21. В другом конкретном варианте осуществления вариабельная область легкой цепи содержит аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO:14, 16, 18, 20 и 22. В другом конкретном варианте осуществления вариабельная область легкой цепи содержит аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO:15, 17, 19, 21 и 23. В дополнительном варианте осуществления вариабельная область легкой цепи содержит аминокислотную последовательность, как указано в качестве SEQ ID NO:14. В другом варианте осуществления вариабельная область легкой цепи содержит аминокислотную последовательность, как указано в качестве SEQ ID NO:15. В другом варианте осуществления остаток Phe заменен на остаток Ala.
В другом варианте осуществления вариабельная область легкой цепи содержит аминокислотную замену Phe 93 и Phe 97 на Ala, Leu или Val. В конкретном варианте осуществления вариабельная область легкой цепи имеет аминокислотную последовательность SEQ ID NO:22. В другом варианте осуществления вариабельная область легкой цепи содержит аминокислотную замену Phe 93 и Phe 97 на Ala. В конкретном варианте осуществления вариабельная область легкой цепи имеет аминокислотную последовательность SEQ ID NO:23.
В другом варианте осуществления изобретения вариабельная область тяжелой цепи (любая из SEQ ID NO:5-9) модифицирована путем замены Trp 107 на любую аминокислоту, отличную от Phe. Неограничивающие примеры аминокислотных замен Trp включают Ala, Leu Tyr и Val. В конкретных вариантах осуществления вариабельная область тяжелой цепи содержит аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO:24, 25, 26, 27 и 28. В другом варианте осуществления вариабельная область тяжелой цепи содержит аминокислотную последовательность, как указано в качестве SEQ ID NO:24. В другом варианте осуществления остаток Trp заменен на остаток Ala.
В соответствии с другим вариантом осуществления антитело или его антигенсвязывающий фрагмент содержат аминокислотную модификацию в положении, выбранном из Trp 107 вариабельной области тяжелой цепи и Phe 97 вариабельной области легкой цепи. В соответствии с другим вариантом осуществления антитело или его антигенсвязывающий фрагмент содержат аминокислотную модификацию Trp 107 вариабельной области тяжелой цепи и Phe 97 вариабельной области легкой цепи. В соответствии с другим вариантом осуществления антитело или его антигенсвязывающий фрагмент содержат аминокислотную модификацию в положении, выбранном из Trp 107 вариабельной области тяжелой цепи и Phe 93 вариабельной области легкой цепи. В соответствии с другим вариантом осуществления антитело или его антигенсвязывающий фрагмент содержат аминокислотную модификацию Trp 107 вариабельной области тяжелой цепи и Phe 93 вариабельной области легкой цепи. В конкретном варианте осуществления указанная модификация представляет собой замену на остаток аланина.
|
|
|
|
В соответствии с другим вариантом осуществления настоящее изобретение относится к полинуклеотидным последовательностям, кодирующим антитело по изобретению или его фрагменты. Таким образом, модифицированное антитело получают путем экспрессии полинуклеотидов, где полинуклеотиды могут кодировать целое гуманизированное антитело или вариабельную область легкой цепи или вариабельную область тяжелой цепи или вариабельную область обеих цепей гуманизированного антитела. Кроме того, гуманизированное антитело можно экспрессировать в клетке-хозяине после ко-трансфекции отдельных векторов, каждый из которых содержит полинуклеотиды, кодирующие тяжелую или легкую цепь, или после трансфекции единого вектора, содержащего полинуклеотидные последовательности как легкой, так и тяжелой цепей.
В соответствии с другим вариантом осуществления предусмотрен вектор, содержащий полинуклеотидную последовательность, кодирующую модифицированное антитело по изобретению или его фрагменты.
В соответствии с другим вариантом осуществления предусмотрен вектор, содержащий полинуклеотидную последовательность, кодирующую модифицированное антитело по изобретению или его фрагменты, выбранные из группы, состоящей из: целого гуманизированного антитела, вариабельной области легкой цепи, вариабельной области тяжелой цепи, обеих цепей вариабельной области.
В соответствии с другим вариантом осуществления вектор дополнительно содержит по меньшей мере одну последовательность, кодирующую компонент, выбранный из группы, состоящей из: генов устойчивости, промотора, сигнального пептида, поли-A терминатора транскрипции, селективных маркеров, геномной константной области каппа человека.
В соответствии с другим предпочтительным вариантом осуществления компоненты вектора выбирают из группы, состоящей из: гена устойчивости к ампициллину, гена устойчивости к неомицину, предраннего промотора HCMV, геномной константной области каппа человека, последовательности сигнального пептида иммуноглобулина мыши, последовательности Козака, интрона сигнальной последовательности, поли-A терминатора транскрипции BGH, селективного маркера Neo/G418, селективного маркера dhfr хомячка.
В соответствии с другим вариантом осуществления вектор дополнительно содержит по меньшей мере одну последовательность, кодирующую компонент, выбранный из группы, состоящей из: генов устойчивости, промотора, сигнального пептида, поли-A терминатора транскрипции, селективных маркеров, геномной константной области Ig человека.
В соответствии с другим предпочтительным вариантом осуществления компоненты вектора выбирают из группы, состоящей из: гена устойчивости к ампициллину, гена устойчивости к неомицину, предраннего промотора HCMV, геномной константной области IgG1 человека, последовательности сигнального пептида иммуноглобулина мыши, последовательности Козака, интрона сигнальной последовательности, поли-A терминатора транскрипции BGH, селективного маркера Neo/G418, селективного маркера dhfr хомячка.
В соответствии с другим аспектом, предусмотрены клетки-хозяева, содержащие вектор, содержащий полинуклеотидную последовательность, кодирующую антитело по изобретению или его фрагменты, для хранения, увеличения в количестве, продукции антител и терапевтических применений.
В соответствии с другим вариантом осуществления клетка-хозяин может быть выбрана из группы, состоящей из: CHO, CHOdhfr, NSO, NSO/GS, COS, COS7.
Определения
Термины ″модифицированные антитела″, ″мутантные антитела″ и сходные грамматические выражения относятся к изменению в аминокислотной последовательности, например, путем замены или делеции или химической модификации одного или нескольких аминокислотных остатков, по сравнению с последовательностью исходных известных гуманизированных моноклональных антител на основе иммуноглобулина BAT-1.
″Гуманизированные моноклональные антитела hBAT-1″ относится к ряду гуманизированных моноклональных антител на основе BAT мыши (mBAT-1), описанных в патенте США № 7332582 (содержание которого включено в настоящее описание в качестве ссылки). mAb hBAT-1 содержат вариабельную область легкой цепи, выбранную из группы, состоящей из: SEQ ID NO:1, 2, 3 и 4 (обозначаемые как BATRKD, BATRKA, BATRKB и BATRKC, соответственно) и вариабельную область тяжелой цепи, выбранную из группы, состоящей из: SEQ ID NO:5, 6, 7, 8 и 9 (обозначаемую как BATRHC, BATRHA, BATRHB, BATRHD и BATRHE, соответственно). Аминокислотные последовательности вариантов антител по легкой и тяжелой цепям (SEQ ID NO:1, 2, 3, 4, 5, 6, 7, 8 и 9) представлены в таблице 1. Остатки, которые отличаются в указанных вариабельных областях, указаны серым фоном (положения 2, 30, 69, 77, 97 и 98 области легкой цепи и положения 35, 69, 70 и 71 тяжелой цепи). Полинуклеотидные и аминокислотные последовательности BAT мыши (mBAT-1) описаны в патенте США № 7695715, содержание которого включено в настоящее описание в качестве ссылки. Конкретные комбинации вариабельной области тяжелой цепи и вариабельной области легкой цепи антитела hBAT-1 выбирают из группы, состоящей из: SEQ ID NO:5/SEQ ID NO:1; SEQ ID NO:6/SEQ ID NO:2; SEQ ID NO:7/SEQ ID NO:2; SEQ ID NO:7/SEQ ID NO:3; SEQ ID NO:8/SEQ ID NO:3; и SEQ ID NO:7/SEQ ID NO:1. В конкретном варианте осуществления настоящего изобретения мутантные антитела основаны на описанных выше конкретных комбинациях вариабельных областей тяжелой и легкой цепей и содержат по меньшей мере одну сайт-специфическую мутацию, такую как замена, выбранная из описанных аминокислот.
″Аминокислотная модификация″, как используют в настоящем изобретении, относится к изменению аминокислоты, например, путем замены или делеции или химической модификации указанной аминокислоты. Кроме того, антитела по изобретению могут быть химически модифицированными в одном или нескольких аминокислотных остатках, либо посредством естественных процессов, таких как процессинг или другие посттрансляционные модификации, либо способами химической модификации. Химические модификации включают, но не ограничиваются ими, ацетилирование, ацилирование, амидацию, ADP-рибозилирование, гликозилирование, образование GPI-якоря, ковалентное присоединение жидкого или липидного производного, метилирование, миристилирование, пегилирование, пренилирование, фосфорилирование, убиквитинилирование или любой сходный процесс.
Термин ″аминокислота″ используют в его наиболее широком значении, и он включает природные аминокислоты, а также не встречающиеся в природе аминокислоты, включая аналоги аминокислот. Ввиду этого широкого определения, специалисту в данной области будет известно, что указание в настоящем описании на аминокислоту включает, например, природные протеогенные (L)-аминокислоты, (D)-аминокислоты, химически модифицированные аминокислоты, такие как аналоги аминокислот, встречающиеся в природе непротеогенные аминокислоты, такие как норлейцин, и химически синтезированные соединения, имеющие свойства, известные в данной области тем, что они являются характерными для аминокислот. Как используют в настоящем изобретении, термин ″протеогенный″ указывает на то, что аминокислота может быть включена в белок в клетке путем метаболического каскада. Аминокислоты, используемые в этом изобретении, представляют собой аминокислоты, которые являются коммерчески доступными или доступны с помощью общепринятых способов синтеза. Для определенных остатков могут требоваться особые способы включения в пептид, и в настоящем изобретении пригодны либо последовательные, либо расходящиеся и сходящиеся подходы для синтеза пептидной последовательности. Когда не указано, можно использовать либо L-, либо D-изомеры.
Консервативная замена аминокислот, как известно специалистам в данной области, находится в объеме настоящего изобретения. Консервативные аминокислотные замены включают замену одной аминокислоты другой аминокислотой, имеющей тот же тип функциональной группы или боковой цепи, например алифатическую, ароматическую, положительно заряженную, отрицательно заряженную. Специалисту в данной области будет понятно, что отдельные замены, делеции или вставки в пептидную, полипептидную или белковую последовательность, которые изменяют, добавляют или удаляют одну аминокислоту или небольшой процент аминокислот в кодируемой последовательности, являются ″консервативно модифицированным вариантом″, где изменение приводит к замене аминокислоты химически сходной аминокислотой. Таблицы консервативных замен, в которых предоставлены функционально сходные аминокислоты, хорошо известны в данной области.
Каждая из следующих шести групп содержит аминокислоты, которые являются консервативными заменами друг для друга:
1) Аланин (Ala; A), серин (Ser; S), треонин (Thr; T);
2) Аспарагиновая кислота (Asp; D), глутаминовая кислота (Glu; E);
3) Аспарагин (Asn; N), глутамин (Gln; Q);
4) Аргинин (Arg; R), гистидин (His, H), лизин (Lys; K);
5) Изолейцин (Ile; I), лейцин (Leu; L), метионин (Met; M), валин (Val; V); и
6) Фенилаланин (Phe; F), тирозин (Tyr; Y), триптофан (Trp; W).
В соответствии с одним из вариантов осуществления аминокислотная замена представляет собой консервативную замену.
В соответствии с другим вариантом осуществления аминокислотная замена представляет собой неконсервативную замену. Как используют в настоящем изобретении, ″неконсервативная замена″ представляет собой любую аминокислотную замену, отличную от консервативной замены, описанной выше. Неограничивающие примеры неконсервативных замен включают замену фенилаланина или триптофана на аланин, лейцин или валин.
В конкретном варианте осуществления модификации аминокислот путем замены по изобретению (т.е. для получения модифицированного антитела по изобретению) отличается от замен, описанных в патенте США № 7332582.
Термин ″антитело″ (также обозначаемый в настоящем описании как ″иммуноглобулин″) используют в наиболее широком значении и, в частности, он охватывает моноклональные антитела (включая полноразмерные моноклональные антитела) и фрагменты антител, при условии, что они проявляют желаемую биологическую активность. ″Фрагменты антител″ содержат часть полноразмерного антитела, как правило, его антигенсвязывающую или вариабельную область. Примеры фрагментов антител включают фрагменты Fab, Fab', F(ab')2 и Fv; диатела; линейные антитела; молекулы одноцепочечных антител; и полиспецифические антитела, образованные из фрагментов антител.
Основным элементом встречающейся в природе структуры антитела является гетеротетрамерный гликопротеиновый комплекс массой приблизительно 150000 дальтон, состоящий из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей, связанных вместе посредством как нековалентных ассоциаций, так и дисульфидных связей. Каждая тяжелая и легкая цепь также имеет регулярно расположенные межцепочечные дисульфидные мостики. Существует пять классов антител человека (IgG, IgA, IgM, IgD и IgE) и в пределах этих классов известны различные подклассы, исходя из структурных различный, таких как количество иммуноглобулиновых элементов в одной молекуле антитела, структура дисульфидного мостика отдельных элементов и отличия в длине цепи и последовательности. Классом или подклассом антитела является его изотип.
N-концевые области тяжелой и легкой цепей являются более разнообразными по последовательности, чем C-концевые области, и, таким образом, их называют вариабельными доменами. Эта часть структуры антитела обеспечивает антигенсвязывающую специфичность антитела. Вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL) вместе образуют один антигенсвязывающий центр, таким образом, основной иммуноглобулиновый элемент имеет два антигенсвязывающих центра. Полагают, что конкретные аминокислотные остатки образуют поверхность контакта между вариабельными доменами легкой и тяжелой цепей (Chothia et al., J. Mol. Biol. 186, 651-63 (1985); Novotny and Haber, (1985) Proc. Natl. Acad. Sci. USA 82 4592-4596).
C-концевая часть тяжелой и легкой цепей образует константные домены, т.е. CH1, CH2, CH3, CL. Хотя в этих доменах разнообразие является значительно меньшим, существуют отличия от одного вида животного к другому, и, кроме того, у одного и того же индивидуума имеется несколько различных изотипов антитела, каждый из которого имеет отличающуюся функцию.
Термин ″каркасная область″ или ″FR″ относится к аминокислотным остаткам в вариабельном домене антитела, которые отличаются от аминокислотных остатков гипервариабельной области, как определено в настоящем описании. Термин ″гипервариабельная область″, как используют в настоящем изобретении, относится к аминокислотным остаткам в вариабельном домене антитела, которые отвечают за связывание антигена. Гипервариабельная область содержит аминокислотные остатки из ″определяющей комплементарность области″ или ″CDR″. CDR, главным образом, отвечают за связывание с эпитопом антигена. Размер FR и CDR точно установлен (см., Kabat et al., там же).
Термин ″акцепторный иммуноглобулин человека″ относится к иммуноглобулину человека, предоставляющему каркасную область для гуманизированного антитела.
Как используют в настоящем изобретении, термин ″гуманизированное антитело″ относится к антителу, содержащему каркасную область из антитела человека и одну или несколько CDR из не являющегося человеческим иммуноглобулина (обычно мыши или крысы). Части гуманизированного иммуноглобулина, за исключением, возможно, CDR, по существу идентичны соответствующим частям природных последовательностей иммуноглобулинов человека. Однако в некоторых случаях конкретные аминокислотные остатки, например, в каркасных областях, могут быть модифицированными, так чтобы оптимизировать характеристики гуманизированного антитела. Важно, что ожидается, что гуманизированное антитело будет связываться с тем же антигеном, что и донорное антитело, которое предоставляет CDR. Для дальнейших подробностей см., например, патент США № 5225539, выданный Medical Research Council, Великобритания.
Термины ″каркасная область из акцепторного иммуноглобулина человека″ и ″каркасная область, происходящая из акцепторного иммуноглобулина человека″, и сходные грамматические выражения используют в настоящем изобретении взаимозаменяемо для обозначения каркасной области или ее части, которая имеет ту же аминокислотную последовательность, что и акцепторный иммуноглобулин человека.
Термин ″антитело человека″ относится к антителу, кодируемому геном, в действительности встречающимся у человека, или его аллелем, вариантом или мутантом.
Модифицированное гуманизированное моноклональное антитело по изобретению, предпочтительно, получают с помощью способов рекомбинантных ДНК с использованием пересадки CDR.
Термин ″млекопитающее″ означает любое млекопитающее, включая домашних животных, таких как собаки и кошки; сельскохозяйственных животных, таких как свиньи, крупный рогатый скот, овцы и козы; лабораторных животных, таких как мыши и крысы; приматов, таких как обезьяны мартышки, обезьяны и шимпанзе; и, предпочтительно, люди.
Способы по изобретению
Иммунотерапевтические средства против злокачественной опухоли нацеливаются посредством, и по большей части, на модулирование ответа иммунной системы для индукции или усиления уничтожения опухолевых клеток и контроля роста опухоли. В этом подходе используются различные иммуномодуляторы, включая моноклональные антитела, которые селективно связываются с определенными детерминантами на T-клетках, тем самым, либо инициируя каскад активации, либо индуцируя ингибиторный эффект.
В соответствии с другим аспектом настоящее изобретение относится к способу диагностики или лечения заболевания или нарушения, в частности, злокачественной опухоли, включающему введение индивидууму, нуждающемуся в этом, эффективного количества фармацевтической композиции, содержащей антитело по изобретению или его фрагмент в качестве активного ингредиента.
Способами по настоящему изобретению можно лечить все типы опухолей. Опухоли могут быть солидными или несолидными.
Некоторые примеры солидных опухолей, которые можно лечить с помощью комбинации по настоящему изобретению, включают карциномы, саркомы, бластомы или глиомы. Некоторые примеры таких опухолей включают эпидермоидные опухоли, плоскоклеточные опухоли, такие как опухоли головы и шеи, опухоли ободочной и прямой кишки, опухоли предстательной железы, опухоли молочной железы, опухоли легких, включая мелкоклеточные и немелкоклеточные опухоли легких, опухоли поджелудочной железы, опухоли щитовидной железы, опухоли яичника, опухоли печени, опухоли пищевода и опухоли желудка. Другие примеры включают саркому Капоши, новообразования ЦНС, нейробластомы, капиллярные геманиобластомы, менингиомы и метастазы в головной мозг, меланому, желудочно-кишечные и почечные карциномы и саркомы, рабдомиосаркому, глиобластому, предпочтительно, мультиформную глиобластому и лейомиосаркому. Примеры васкуляризованного рака кожи включают плоскоклеточную карциному, базально-клеточную карциному и типы рака кожи, которые можно лечить путем подавления роста злокачественных кератиноцитов, таких как злокачественные кератиноциты человека.
Некоторые примеры несолидных опухолей включают лейкозы, множественные миеломы и лимфомы. Некоторые примеры лейкозов включают острый миелоцитарный лейкоз (AML), хронический миелоцитарный лейкоз (CML), острый лимфоцитарный лейкоз (ALL), хронический лимфоцитарный лейкоз (CLL), эритроцитарный лейкоз или моноцитарный лейкоз. Некоторые примеры лимфом включают лимфомы, связанные с болезнью Ходжкина, неходжкинской болезнью или лимфомой из клеток мантийной зоны.
Предпочтительные в настоящее время типы опухолей выбирают из следующей группы: карцинома ободочной и прямой кишки; карцинома легкого, включая немелкоклеточный рак легкого (NSCLC) и мелкоклеточный рак легкого (SCLC); карцинома молочной железы; меланома; карцинома яичника; карцинома шейки матки, рак поджелудочной железы; карцинома головы и шеи; желудочно-кишечная карцинома; карцинома пищевода; печеночно-клеточная карцинома; множественная миелома; почечноклеточный рак; опухоли предстательной железы; неходжскинскую лимфому; болезнь Ходжкина; лимфома из клеток мантийной зоны; саркома Капоши; плоскоклеточную карциному; базально-клеточная карцинома; острый миелоидный лейкоз (AML); хронический миелоцитарный лейкоз (CML); острый лимфоцитарный лейкоз (ALL); хронический лимфоцитарный лейкоз (CLL).
Термин ″противоопухолевый эффект″, как используют в настоящем изобретении, относится к благоприятному биологическому эффекту, который может проявляться одним или несколькими из: снижение или стабилизация объема опухоли, снижение или стабилизация количества опухолевых клеток, снижение или стабилизация скорости роста опухоли, снижение или стабилизация количества метастазов, защита от рецидива, увеличение средней продолжительности жизни или выживаемости индивидуума с опухолью, увеличение средней продолжительности жизни или выживаемости без прогрессирования заболеваний у индивидуума с опухолью или смягчение различных физиологических симптомов, связанных со злокачественным состоянием. ″Противоопухолевый эффект″ также может проявляться способностью предупреждать возникновение опухоли изначально или рецидива опухоли. Учитывая их свойства, способы по изобретению можно использовать для лечения острой злокачественной опухоли, латентной, контролируемой или стабилизированной злокачественной опухоли, а также для профилактики злокачественной опухоли.
Термин ″увеличенная выживаемость″, как используют в настоящем изобретении, относится к пролонгированному периоду времени, в ходе которого индивидуум или пациент являются живыми после лечения способом по изобретению. Увеличенная выживаемость означает увеличенную возможность для индивидуума, страдающего злокачественной опухолью, оставаться без прогрессирования заболевания после конкретного лечения. Также ее используют для описания повышенного процента индивидуумов в группе, заболевание у которых будет оставаться стабильным (без проявления признаков заболевания) после указанного периода времени по сравнению с контрольной группой. Также ее используют для описания увеличенного процента индивидуумов в группе, заболевание у которых, вероятно, будет вылечено (без проявления признаков заболевания) после указанного периода времени по сравнению с контрольной группой. Этот параметр может быть измерен с помощью любого из общепринятых клинических результатов, называемых ″выживаемостью без прогрессирования″, ″общей выживаемостью″ и ″выживаемостью без заболевания″, используемых в качестве показателя эффективности конкретного способа лечения.
Термин ″рецидив опухоли″ относится к повторному возникновению, повторному появлению, повторному росту или пролиферации опухоли того же типа либо в той же области, либо в другой области, после периода времени, в ходе которого рост первоначальной опухоли был обращен вспять, остановлен или ингибирован.
Термин ″усиливает или увеличивает выживаемость лимфоцитов″, как используют в настоящем изобретении, относится к способности антител по изобретению продлевать жизнеспособность лимфоцитов in vitro или in vivo, по сравнению с жизнеспособностью идентичной популяции клеток, не контактировавшей с антителом по изобретению. Что касается комбинированной терапии по изобретению, термин относится к способности конкретной комбинации способов лечения продлевать жизнеспособность лимфоцитов in vitro или in vivo по сравнению с жизнеспособностью идентичной популяции клеток в случае только одного из способов лечения.
Противоопухолевая активность, сходная с mBAT-1 или hBAT-1, относится к противоопухолевому эффекту, составляющему приблизительно 5% или не более 10%, сходному с противоопухолевым эффектом mBAT-1 или hBAT-1. Противоопухолевая активность, превышающая противоопухолевую активность mBAT-1 или hBAT-1, относится к противоопухолевой активности, более чем на 10%, более чем на 30% или более чем на 30% превышающей противоопухолевую активность mBAT-1 или hBAT-1.
В соответствии с другим вариантом осуществления антитело по изобретению вводят вместе, до или после введения других средств, которые могут действовать аддитивным или синергическим образом с ними.
В соответствии с другим вариантом осуществления антитело по изобретению вводят вместе с, до или после введения средств, выбранных из группы, состоящей из: цитокинов, IL-1 (интерлейкин-1), IL-2, IL-6, IFN-α (интерферон-α), клеточных вакцин, антител, T-клеточных стимуляторных антител, противоопухолевых терапевтических антител. Каждая возможность является отдельным вариантом осуществления настоящего изобретения.
В другом варианте осуществления заболевание или нарушение, которые лечат способами по изобретению, представляют собой связанное с иммунодефицитом заболевание или нарушение, выбранное из тяжелого комбинированного иммунодефицитного заболевания, синдрома приобретенного иммунодефицита и любого нарушения, которое вовлекает истощение, ослабление и/или нарушение функции лимфоцитов, в частности, T-клеток, NK-клеток, NK-T-клеток, B-клеток, моноцитов, макрофагов или любой их комбинации.
В другом варианте осуществления заболевание или нарушение представляет собой иммунодефицит, нарушение иммунной функции или иммунную недостаточность, в совокупности далее в настоящем описании называемые иммунодефицитными нарушениями, развившиеся после химиотерапии или лучевой терапии. В соответствии с определенными вариантами осуществления, фармацевтическую композицию, содержащую антитело по изобретению, используют вместе с трансплантацией аутологичных, аллогенных или сингенных стволовых клеток, происходящих из костного мозга, пуповинной крови или периферической крови, и инфузией лейкоцитов донора.
В соответствии с другим вариантом осуществления, иммунодефицитное нарушение выбрано из группы, состоящей из: тяжелого комбинированного иммунодефицитного заболевания, синдрома приобретенного иммунодефицита, X-сцепленной агаммаглобулинемии, вариабельного неклассифицируемого иммунодефицита, IgA-дефицита, дефицита подкласса IgG, синдрома Вискотта-Олдрича, аномалии ДиДжорджи, атаксии-телеангиэктазии, дефицита аденозиндезаминазы и дефицита индуцируемой активацией цитидиндезаминазы.
В соответствии с другим вариантом осуществления иммунодефицитное нарушение связано с вирусной инфекцией, грибковой инфекцией или бактериальной инфекцией. В соответствии с другим вариантом осуществления иммунодефицитное нарушение связано с интоксикацией.
В соответствии с другим вариантом осуществления, способ по изобретению используют для лечения анемии, в частности, апластической анемии и миелодиспластических синдромов (MDS), главным образом, чтобы избежать дальнейшего осложнения анемии вследствие иммунодефицитных нарушений.
Комбинированная терапия с химиотерапией
В соответствии с определенными аспектами настоящего изобретения, введение иммуностимулирующего гуманизированного антитела, содержащего модифицированные аминокислоты вместе с по меньшей мере одним противоопухолевым химиотерапевтическим средством действует, усиливая противоопухолевый эффект химиотерапевтических средств и наоборот. В предпочтительных вариантах осуществления комбинации иммуностимулирующего антитела с по меньшей мере одним химиотерапевтическим средством значительно улучшают клинический исход относительно каждого из способов лечения отдельно. В предпочтительном варианте осуществления существует синергия, когда опухоли лечат гуманизированным антителом по изобретению вместе с по меньшей мере одним химиотерапевтическим средством, и необязательно дополнительно вместе с лучевой терапией.
Иными словами, в соответствии с одним из аспектов настоящего изобретения, противоопухолевый эффект гуманизированного антитела по изобретению усиливается более, чем ожидается, при комбинировании с по меньшей мере одним химиотерапевтическим средством.
Противоопухолевый эффект, индуцируемый комбинациями по изобретению, включает предупреждение, ингибирование прогрессирования опухоли, снижение роста опухоли и защиту против рецидива опухоли, включая злокачественные и незлокачественные опухоли. Прогрессирование опухоли включает инвазивность, метастазирование, рецидив и увеличение размера опухоли. Снижение роста опухоли также включает разрушение или устранение опухоли, ведущие к полной ремиссии.
В другом варианте осуществления антитело по изобретению является эффективным для увеличения переносимости химиотерапевтических средств. Как известно в данной области, основным препятствием для пациентов, подвергаемых химиотерапии злокачественной опухоли, является возникновение тяжелых и вредоносных неблагоприятных побочных эффектов вследствие высокой токсичности большинства химиотерапевтических средств.
Кроме того, изобретение относится к способу увеличения выживаемости у индивидуума с опухолью, который включает введение гуманизированного антитела по изобретению, либо самого по себе, либо необязательно в комбинации с дополнительным введением одного или нескольких химиотерапевтических средств.
Кроме того, изобретение относится к способу снижения или предупреждения рецидива опухоли, который включает введение гуманизированного антитела по изобретению, либо самого по себе, либо необязательно в комбинации с дополнительным введением одного или нескольких химиотерапевтических средств. В некоторых вариантах осуществления комбинированное лечение экспериментальных животных с использованием гуманизированного антитела по изобретению и химиотерапевтических средств индуцировало эффект ″памяти″, так что рецидив опухоли ингибировался при повторной нагрузке первоначальным типом опухоли.
В соответствии с другим вариантом осуществления, настоящее изобретение относится к способу лечения опухоли, причем способ включает (i) введение индивидууму, нуждающемуся в этом, эффективного количества антитела по изобретению или его фрагмента; и (ii) введение индивидууму эффективного количества по меньшей мере одного химиотерапевтического средства; тем самым, осуществляя лечение опухоли.
В соответствии с другим вариантом осуществления изобретение, кроме того, относится к способу увеличения переносимости по меньшей мере одного химиотерапевтического средства, причем способ включает введение индивидууму, нуждающемуся в этом, эффективного количества антитела по изобретению или его фрагмента, где индивидуум подвергается химиотерапии посредством по меньшей мере одного химиотерапевтического средства; тем самым увеличивая переносимость указанного химиотерапевтического средства.
Термин ″переносимость химиотерапевтических средств″ относится к физиологической, физико-химической и иммунологической способности индивидуума переносить неблагоприятные побочные эффекты, связанные с одним или несколькими химиотерапевтическими средствами. Таким образом, термин ″улучшение переносимости химиотерапевтических средств″ относится к увеличению физиологической и физико-химической способности к таким неблагоприятным побочным эффектам, так чтобы тяжесть неблагоприятных побочных эффектов снижалась и/или уменьшалось количество побочных эффектов. Таким образом, ″улучшение переносимости химиотерапевтических средств″ может относиться к повышению качества жизни пациентов со злокачественной опухолью, которых лечат химиотерапевтическими средствами.
В соответствии с другим вариантом осуществления изобретения предусмотрен способ увеличения выживаемости или ингибирования прогрессирования заболевания у индивидуума, имеющего опухоль, где индивидуума лечат по меньшей мере одним химиотерапевтическим средством, причем способ включает введение эффективного количества антитела по изобретению или его фрагмента, тем самым повышая выживаемость индивидуума.
В соответствии с другим вариантом осуществления изобретение относится к способу снижения или предупреждения рецидива опухоли, причем способ включает введение индивидууму, нуждающемуся в этом, эффективного количества антитела по изобретению или его фрагмента, тем самым уменьшая или предупреждая рецидив опухоли. В соответствии с одним вариантом осуществления способ снижения или предупреждения рецидива опухоли, кроме того, включает введение индивидууму по меньшей мере одного химиотерапевтического средства. В соответствии с конкретными вариантами осуществления индивидуум подвергается или завершил курс химиотерапии посредством по меньшей мере одного химиотерапевтического средства.
В соответствии с различными вариантами осуществления введение антитела по изобретению и по меньшей мере одного химиотерапевтического средства осуществляют по существу одновременно, совместно, поочередно, последовательно или подряд. В некоторых вариантах осуществления антитело и по меньшей мере одно химиотерапевтическое средство вводят в соответствии с перекрывающимися режимами.
В соответствии с конкретными вариантами осуществления, введение антитела осуществляют до первоначального введения по меньшей мере одного химиотерапевтического средства.
В соответствии с другими вариантами осуществления, введение любого или обоих из антитела и по меньшей мере одного химиотерапевтического средства осуществляют путем, выбранным из группы, состоящей из внутривенного, перорального, внутрибрюшинного, подкожного введения, изолированной перфузии конечностей, инфузии в орган и их комбинаций.
В конкретных вариантах осуществления способы по изобретению, кроме того, включают оценку по меньшей мере одного параметра, выбранного из группы, состоящей из: скорости роста опухоли, объема опухоли, количества метастазов, рецидива опухоли и их комбинаций.
Следует отметить, что, в соответствии с идей настоящего изобретения, модифицированное гуманизированное антитело по изобретению можно вводить до, в ходе или после начала химиотерапии и, необязательно, лучевой терапии, а также любой их комбинации, т.е. до и в ходе, до и после, в ходе и после, или до, в ходе и после начала химиотерапии и, необязательно, лучевой терапии. Например, антитело по изобретению можно вводить от 1 до 30 суток до или после начала химиотерапии. Кроме того, антитело можно вводить между курсами химиотерапии.
В способах комбинированной терапии по изобретению антитела можно вводить параллельно химиотерапии, например, по существу совместно или одновременно. Также можно использовать другие режимы введения, например, перекрывающиеся режимы или режимы, которые вовлекают поочередное, совместное или одновременное проведение двух типов лечения.
В соответствии с различными вариантами осуществления по меньшей мере одно химиотерапевтическое средство выбрано из группы, состоящей из: антиметаболитов, лекарственных средств на основе платины, ингибиторов митоза, антрациклиновых антибиотиков, ингибиторов топоизомеразы, антиантигенных средств и их комбинаций.
В соответствии с другим конкретным вариантом осуществления по меньшей мере одно химиотерапевтическое средство выбрано так, чтобы модифицированный hBAT-1 по изобретению усиливал выживаемость лимфоцитов при использовании в комбинации с химиотерапевтическим средством. Как правило, усиленную или увеличенную выживаемость можно удобным образом анализировать in vitro.
Таким образом, в различных вариантах осуществления химиотерапевтическое средство можно выбирать из антиметаболитов, таких как аналог пиримидина 5-фторурацил или цитарабин, или лекарственных средств на основе платины, таких как оксалиплатин или цисплатин. Кроме того, в различных вариантах осуществления химиотерапевтическое средство может отличаться от средства, выбранного из ингибитора топоизомеразы I (такого как SN-38) и алкилирующего средства (такого как циклофосфамид).
В соответствии с некоторыми вариантами осуществления, по меньшей мере одно химиотерапевтическое средство представляет собой антиметаболит, включая антагонисты пуринов, антагонисты пиримидинов и антагонисты фолатов. В соответствии с некоторыми вариантами осуществления, антиметаболит представляет собой антагонист пиримидинов. В соответствии с некоторыми вариантами осуществления, антиметаболит выбран из группы, состоящей из: 5-фторурацила, урамустина, урацила, капецитабина, 6-меркаптопурина, метотрексата, гемцитабина, цитарабина, флударабина и пеметрекседа.
В соответствии с некоторыми вариантами осуществления по меньшей мере одно химиотерапевтическое средство представляет собой 5-фторурацил. В соответствии с некоторыми вариантами осуществления, по меньшей мере одно химиотерапевтическое средство представляет собой цитарабин. В соответствии с некоторыми вариантами осуществления, по меньшей мере одно химиотерапевтическое средство представляет собой лекарственное средство на основе платины, выбранное из группы, состоящей из: цисплатина, карбоплатина и оксалиплатина. В соответствии с другими вариантами осуществления, по меньшей мере одно химиотерапевтическое средство представляет собой ингибитор митоза, выбранный из группы, состоящей из: паклитаксела, доцетаксела, этопозида, винбластина, винкристина и винорелбина. В соответствии с другими вариантами осуществления, по меньшей мере одно химиотерапевтическое средство представляет собой антрациклиновый антибиотик, выбранный из группы, состоящей из: даунорубицина, респиномицина D и идарубицина. В соответствии с некоторыми вариантами осуществления, по меньшей мере одно химиотерапевтическое средство представляет собой антиантиогенное средство, выбранное из группы, состоящей из: бевацизумаба, дофамина, тетратиомолибдата и антиангиогенных вариантов VEGF. В соответствии с некоторыми вариантами осуществления по меньшей мере одно химиотерапевтическое средство отличается от ингибитора топоизомеразы I. В соответствии с некоторыми вариантами осуществления, по меньшей мере одно химиотерапевтическое средство отличается от алкилирующего средства.
Химиотерапевтические средства подразделяют на несколько групп, исходя из их эффекта на злокачественные клетки, клеточных видов активности или процессов, которым препятствует лекарственное средство, или конкретных фаз клеточного цикла, на которые лекарственное средство влияет. Таким образом, химиотерапевтические средства относятся к одной из следующих категорий: алкилирующие средства, нитрозомочевина, антиметаболиты, антрациклины, ингибиторы топоизомеразы I и II, ингибиторы митоза, в том числе лекарственные средства на основе платины, стероиды и антиангиогенные средства.
Антиметаболиты, также называемые ″нуклеозидными аналогами″, заменяют природные вещества в качестве структурных элементов в молекулах ДНК, тем самым изменяя функцию ферментов, требуемых для клеточного метаболизма и синтеза белка. В случае, когда они имитируют питательные вещества, требуемые для роста клеток, клетки в конечном итоге претерпевают лизис. Если нуклеозид заменяется на нефункциональный нуклеозидный аналог, последний включается в ДНК и РНК, в конечном итоге индуцируя остановку клеточного цикла и апоптоз путем ингибирования способности клеток синтезировать ДНК. Антиметаболиты являются специфичными к клеточному циклу и наиболее эффективны в ходе S-фазы деления клеток, поскольку они в основном действуют на клетки, претерпевающие синтез новой ДНК для образования новых клеток. Токсичность, связанная с этими лекарственными средствами, наблюдается в клетках, которые быстро растут и делятся. Примеры антиметаболитов включают антагонисты пуринов, антагонисты пиримидинов и антагонисты фолатов. Эти средства повреждают клетки в ходе S-фазы и их обычно используют для лечения лейкозов, опухолей молочной железы, яичника и желудочно-кишечного тракта, а также других злокачественных опухолей. Конкретные примеры антиметаболитов включают 5-фторурацил (также известный как 5FU), капецитабин, 6-меркаптопурин, метотрексат, гемцитабин, цитарабин, флударабин и пеметрексед.
Химиотерапевтические средства на основе платины сшивают ДНК несколькими различными путями, препятствуя делению клеток путем митоза. Поврежденная ДНК индуцирует механизмы репарации ДНК, которые в свою очередь активируют апоптоз, когда репарация оказывается невозможной. Наиболее примечательными среди изменений ДНК являются 1,2-внутрицепочечные сшивки с пуриновыми основаниями. Они включают 1,2-внутрицепочечные аддукты d(GpG), которые образуют практически 90% аддуктов и менее часто 1,2-внутрицепочечные аддукты d(ApG). Встречаются 1,3-внутрицепочечные аддукты d(GpXpG), однако они без труда вырезаются посредством эксцизионной репарации нуклеотидов (NER). Другие аддукты включают внутрицепочечные сшивки и нефункциональные аддукты, которые, как утверждается, вносят вклад в активность лекарственных средств на основе платины. Взаимодействие с клеточными белками, в частности, белками с доменом HMG, также было выдвинуто в качестве механизма препятствования митозу, хотя это, возможно, не является их основным способом действия. Химиотерапевтические средства на основе платины включают цисплатин (также известный как cysplatinum или цис-диаминдихлорплатина II (CDDP), карбоплатин и оксалиплатин. Цисплатин часто принимают за алкилирующее средство, хотя он не имеет алкильной группы и не может осуществлять реакции алкилирования. Правильно его классифицировать как подобное алкилирующему. Химиотерапевтические средства на основе платины используют для лечения различных типов злокачественных опухолей, включая саркомы, некоторые карциномы (например, мелкоклеточный рак легкого и рак яичника), лимфомы и герминогенные опухоли.
Ингибиторы митоза препятствуют делению клеток. Наиболее известными химиотерапевтическими средствами в этой категории являются паклитаксел (также известный как Taxol®, ″растительный алкалоид″, ″таксан″ и ″антимикротубулиновое средство″). Вместе с доцетакселом он образует категорию лекарственных средств таксанов. Однако известны другие ингибиторы митоза, включая, но не ограничиваясь ими, этопозид, винбластин и винкристин. Паклитаксел действует, препятствуя нормальному росту микротрубочек в ходе деления клеток путем остановки их функции; он сверхстабилизирует их структуру. Это нарушает способность клеток использовать их цитоскелет подвижным образом. В частности, паклитаксел связывается с β-субъединицей тубулина, ″структурным элементом″ микротрубочек, и связывание паклитаксела закрепляет эти структурные элементы на месте. Образовавшийся комплекс микротрубочка/паклитаксел не обладает способностью разбираться. Это неблагоприятным образом влияет на функцию клеток, поскольку укорочение и удлинение микротрубочек (называемое динамической нестабильностью) необходимо для их функционирования в качестве механизма для транспорта других клеточных компонентов. Например, в ходе митоза микротрубочки обеспечивают расположение хромосом на протяжении всей их репликации и последующего расхождения в два дочерних ядра. Более того, паклитаксел индуцирует запрограммированную гибель клеток (апоптоз) в злокачественных клетках путем связывания с останавливающим апоптоз белком Bcl-2 (B-клеточный лейкоз 2) и, таким образом, остановки его функции.
Другой группой взаимодействующих с ДНК лекарственных средств, широко используемых в химиотерапии злокачественной опухоли, является группа антрациклиновых антибиотиков, которая включает, среди прочих, даунорубицин, доксорубицин (также известный как Adriamycin® и доксорубицина гидрохлорид), респиномицин D и идарубицин. Эти лекарственные средства взаимодействуют с ДНК путем интеракаляции и ингибирования биосинтеза макромолекул, тем самым ингибируя продвижение фермента топоизомеразы II, который расплетает ДНК для транскрипции. Они стабилизируют комплекс топоизомеразы II после того, как он разделяет цепь ДНК для репликации, препятствуя повторному смыканию двойной спирали ДНК и, тем самым, останавливая процесс репликации. Их часто используют для лечения широкого диапазона злокачественных опухолей.
Алкилирующие антинеопластические средства воздействуют прямо на ДНК. Они присоединяют алкильную группу к ДНК, сшивая гуаниновые нуклеиновые основания в двухспиральных цепях ДНК. Это делает цепи неспособными к разворачиванию и разделению. Поскольку это необходимо для репликации ДНК, клетки не могут далее делиться. Эти лекарственные средства действуют неспецифически. Циклофосфамид представляет собой алкилирующее средство, он является высокоэффективным иммунодепрессивным веществом.
Ингибиторы топоизомеразы I и II препятствуют ферментативной активности топоизомеразы I и 2, соответственно, что в конечном итоге приводит к ингибированию как репликации, так и транскрипции ДНК. Примеры ингибиторов топоизомеразы I включают топотекан и иринотекан. Иринотекан представляет собой пролекарство, преобразующееся в биологически активный метаболит 7-этил-10-гидроксикамптотецин (SN-38) посредством карбоксилэстераза-конвертирующего фермента. Будучи в тысячу раз более эффективным, чем его исходное соединение иринотекан, SN-38 ингибирует активность топоизомеразы I путем стабилизации расщепляемого комплекса между топоизомеразой I и ДНК, что приводит к разрывам в ДНК, которые ингибируют репликацию ДНК и запускают апоптотическую гибель клеток. Поскольку необходим происходящий синтез ДНК, чтобы иринотекан оказывал его цитотоксические эффекты, его также классифицируют как средство, специфичное к S-фазе. Примеры ингибиторов топоизомеразы II включают этопозид и тенипозид.
Антиангиогенные средства препятствуют образованию новых кровеносных сосудов, что в конечном итоге приводит к ″голоданию″ опухолей. Неограничивающие примеры антиангиогенных средств включают моноклональное антитело бевацизумаб, дофамин и тетратиомолибдат.
Сосудисто-эндотелиальный фактор роста (VEGF) представляет собой димерный гликопротеин массой 32-42 кДа, который опосредует расширение сосудов, увеличенную проницаемость сосудов и митогенез эндотелиальных клеток. Дифференциалььный сплайсинг экзонов гена VEGF приводит к трем основным разновидностям мРНК, которые кодируют три секретируемые изоформы (индексы обозначают количества аминокислот): VEGF189, VEGF165 и VEGF121. Также описан ряд второстепенных вариантов по сплайсингу (VEGF206, VEGF183, VEGF145 и VEGF148). Варианты полипептидов VEGF и их применение в терапии злокачественной опухоли описаны, например, в WO/2003/012105.
Комбинированная терапия с лучевой терапией
В соответствии с различными вариантами осуществления, способы дополнительно включают лечение индивидуума лучевой терапией. В соответствии с различными вариантами осуществления, способы включают все из введения антитела по изобретению, введения по меньшей мере одного химиотерапевтического средства и лечения индивидуума лучевой терапией. В соответствии с некоторыми вариантами осуществления, введение антитела, по меньшей мере одного химиотерапевтического средства и лучевую терапию проводят по существу совместно, одновременно, поочередно, последовательно или согласно перекрывающимся схемам.
Источник излучения, который можно использовать в комбинации с модифицированным антителом по изобретению и химиотерапевтическим средством, может быть либо внешним, либо внутренним для подвергаемого лечению пациента. Когда источник является внешним для пациента, терапия известна как лучевая терапия внешним пучком (EBRT). Когда источник облучения является внутренним для пациента, лечение называют брахитерапией (BT).
Лучевую терапию проводят в соответствии с хорошо известными стандартными способами с использованием стандартного оборудования, изготовленного для этой цели, такого как AECL Theratron и Varian Clinac.
Расстояние между источником внешнего излучения и точкой вхождения в организм пациента может представлять собой любое расстояние, которое отражает приемлемый баланс между уничтожением клеток-мишеней и минимизацией побочных эффектов. Как правило, источник внешнего излучения находится на расстоянии от 70 до 100 см от точки вхождения в организм пациента.
Брахитерапию обычно проводят путем помещения источника излучения в организм пациента. Как правило, источник излучения помещают на расстоянии приблизительно 0-3 см от ткани, подлежащей обработке. Известные способы включают интерстициальную, внутриполостную и поверхностную брахитерапию. Радиоактивные импланты можно имплантировать на постоянной основе или временно. Некоторые типичные радиоактивные атомы, которые используют в постоянных имплантах, включают йод-125 и радон. Некоторые типичные радиоактивные атомы, которые используют во временных имплантах, включают радий, цезий-137 и иридий-192. Некоторые дополнительные радиоактивные атомы, которые используют в брахитерапии, включают америций-241 и золото-198.
Доза радиации зависит от ряда факторов, как хорошо известно в данной области. Такие факторы включают орган, подвергаемый обработке, здоровые органы на пути излучения, на которые может быть непроизвольно оказано неблагоприятное влияние, переносимость пациентом лучевой терапии, и область организма, нуждающуюся в обработке. Доза обычно составляет от 1 до 100 Гр, и более конкретно от 2 до 80 Гр. Некоторые дозы, которые были описаны, включают 35 Гр для спинного мозга, 15 Гр для почек, 20 Гр для печени и 65-80 Гр для предстательной железы. Однако следует подчеркнуть, что изобретение не ограничивается какой-либо конкретной дозой. Дозу будет определять лечащий врач в соответствии с конкретными факторами в данной ситуации, включая факторы, упомянутые выше.
Доза радиации для брахитерапии может быть такой же, как указано выше для лучевой терапии внешним пучком. В дополнение к упомянутым выше факторам для определения дозы лучевой терапии внешним пучком, также при определении дозы брахитерапии учитывается природа используемого радиоактивного атома.
Гуманизированное антитело по изобретению
Как используют в настоящем изобретении, термины ″BAT″ и ″антитело BAT″ используют в широком значении и, в частности, они охватывают антитела, идентичные или основанные на моноклональном антителе мыши, известном как mBAT-1, или его антигенсвязывающем фрагменте. Моноклональное антитело mBAT-1 секретируется гибридомной клеточной линией, депонированной в Collection Nationale de Cultures de Microorganismes (CNCM), под номером доступа № 1-1397, как описано в патенте США № 5897862. Кроме того, ″BAT″ и ″антитело BAT″ могут относиться к антителу, которое распознает тот же антигенный эпитоп, что и mBAT-1, например, к химерному антителу, как описано в публикации патентной заявки США № 2003/0026800. Антитело BAT также включает гуманизированное антитело, различные примеры которого описаны в WO03/099196 и публикации патентной заявки США № 2008/0025980, и взаимозаменяемо обозначаемое как ″CT-011″, ″hBAT″ и ″hBAT-1″.
Как правило, вариабельная область легкой цепи гуманизированного моноклонального антитела характеризуется формулой:
FRL1-CDRL1-FRL2-CDRL2-FRL3-CDRL3-FRL4
где каждая FR независимо представляет собой каркасную область антитела человека и каждая CDR независимо представляет собой определяющую комплементарность область моноклонального антитела mBAT-1.
Как правило, вариабельная область тяжелой цепи гуманизированного моноклонального антитела характеризуется формулой:
FRH1-CDRH1-FRH2-CDRH2-FRH3-CDRH3-FRH4
где каждая FR независимо представляет собой каркасную область антитела человека и каждая CDR независимо представляет собой определяющую комплементарность область моноклонального антитела mBAT-1.
В конкретных вариантах осуществления FR происходят из вариабельной области легкой цепи антитела TEL9 человека, или модифицированы на ее основе по определенным аминокислотным остаткам. Антитело TEL-9 человека было идентифицировано в разнообразных библиотеках вариабельных (V) генов тяжелой (VH) и легкой (каппа V и лямбда V) цепей иммуноглобулинов, полученных из лимфоцитов периферической крови человека неиммунизированных доноров (Marks et al. J Mol. Biol. 1991, 222:581-97). Было показано, что это антитело специфично связывается с антигеном лизоцима яичного белка индейки (TEL).
В конкретных вариантах осуществления FR происходят из вариабельной области тяжелой цепи антитела hsighv1295 человека, или модифицированы на ее основе по определенным аминокислотным остаткам. Антитело hsiggvl295 человека было выделено из стабильных гибридом и линий трансформированных вирусом Эпштейна-Барр B-клеток из синовиальной жидкости или периферической крови трех пациентов с ревматоидным артритом и одного пациента с системной красной волчанкой (Fang et al., J Exp Med. 1994, 179:1445-56).
Композиции, введение и дозировки
Для применения в способах по изобретению гуманизированное антитело можно составлять общепринятым образом с использованием одного или нескольких фармацевтически приемлемых носителей, стабилизаторов или эксципиентов (наполнителей) для формирования фармацевтической композиции, как известно в данной области, в частности, в отношении белковых активных веществ. Носитель(и) является ″приемлемым″ в том смысле, что он является совместимым с другими ингредиентами композиции и не является вредоносным для его реципиента. Подходящие носители, как правило, включают физиологический раствор или полиолы этанола, такие как глицерин или пропиленгликоль.
Антитело можно составлять в качестве нейтральной и солевой форм. Фармацевтически приемлемые соли включают кислотно-аддитивные соли (образованные со свободными аминогруппами) и которые образованы с неорганическими кислотами, такими как хлористоводородная или фосфорная кислоты, или такими органическими кислотами, как уксусная, щавелевая, виннокаменная и малеиновая. Соли, образованные со свободными карбоксильными группами, также могут быть образованы с неорганическими основаниями, такими как гидроксиды натрия, калия, аммония, кальция или железа, и органическими основаниями, такими как изопропиламин, триметиламин, 2-этиламиноэтанол, гистидин и прокаин.
Композиции можно пригодным образом составлять для внутривенного, внутримышечного, подкожного или внутрибрюшинного введения, и они удобным образом содержат стерильные водные растворы антитела, которые, предпочтительно, являются изотоническими с кровью реципиента. Такие составы обычно получают путем растворения твердого активного ингредиента в воде, содержащей физиологически совместимые вещества, такие как хлорид натрия, глицин и т.п., и имеющей буферное значение pH, совместимое с физиологическими условиями, с получением водного раствора и стерилизации указанного раствора. Их можно получать в контейнерах для однократной или многократных доз, например, запаянных ампулах или флаконах.
Композиции могут включать стабилизатор, например, такой как полиэтиленгликоль, белки, сахариды (например, трегалоза), аминокислоты, неорганические кислоты и их смеси. Стабилизаторы используют в водных растворах в соответствующей концентрации и при соответствующем pH. Значение pH водного раствора корректируют так, чтобы оно находилось в диапазоне 5,0-9,0, предпочтительно, в диапазоне 6-8. При составлении антитела можно использовать антиадсорбционное средство. Другие подходящие эксципиенты, главным образом, могут включать антиоксидант, такой как аскорбиновая кислота.
Композиции можно составлять в качестве препаратов с контролируемым высвобождением, которое могут быть достигнуто с использованием полимера, образующего комплекс с белками или абсорбирующего их. Подходящие полимеры для составов с контролируемым высвобождением включают, например, полиэфир, полиаминокислоты, поливинил, пирролидон, этиленвинилацетат и метилцеллюлозу. Другим возможным способом для контролируемого высвобождения является включение антитела в частицы из полимерного материала, такого как полиэфиры, полиаминокислоты, гидрогели, поли(молочная кислота) или сополимеры этилена и винилацетата. Альтернативно вместо включения этих средств в полимерные частицы, можно заключать эти материалы в микрокапсулы, полученные, например, способами коацервации или межповерхностной полимеризации, например, микрокапсулы на основе гидроксиметилцеллюлозы или желатина и микрокапсулы на основе поли(метилметацилата), соответственно, или в коллоидные системы для доставки лекарственных средств, например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы, или в макроэмульсии.
Когда являются желательными пероральные препараты, композиции можно комбинировать с носителями, такими как лактоза, сахароза, крахмал, тальк, стеарат магния, кристаллическая целлюлоза, метилцеллюлоза, карбоксиметилцеллюлоза, глицерин, альгинат натрия или гуммиарабик.
Гуманизированное антитело по изобретению предпочтительно вводят парентерально, главным образом, путем внутривенной инфузии. Введение также можно проводить внутрибрюшинным, пероральным, подкожным или внутримышечным путем. Антитела, как правило, вводят в диапазоне от приблизительно 0,1 до приблизительно 20 мг/кг массы пациента, обычно от приблизительно 0,5 до приблизительно 10 мг/кг, и часто от приблизительно 1 до приблизительно 5 мг/кг. В связи с этим, предпочтительно, использовать антитела, имеющие время полужизни в кровотоке по меньшей мере 12 часов, предпочтительно по меньшей мере 4 суток, более предпочтительно, вплоть до 21 суток. Ожидается, что химерные и гуманизированные антитела будут иметь время полужизни в кровотоке вплоть до четырех и вплоть до 14-21 суток, соответственно. В некоторых случаях может быть преимущественным введение большой нагрузочной дозы с последующими периодическими (например, раз в неделю) поддерживающими дозами на протяжении периода времени. Антитела также можно доставлять с помощью систем для доставки с медленным высвобождением, насосов, и других известных систем для доставки с непрерывной инфузией. Режимы дозирования можно варьировать для обеспечения желаемых уровней в кровотоке конкретного антитела, исходя из его фармакокинетики. Таким образом, дозы вычисляют так, чтобы поддерживался желаемый уровень лекарственного средства в кровотоке.
Как правило, эффективная доза определяется состоянием индивидуума, а также массой тела и площадью поверхности индивидуума, подлежащего лечению. Размер дозы и режим дозирования также определяются существованием, природой и степенью любых неблагоприятных побочных эффектов, которые сопровождают введение модифицированных антител по изобретению у конкретного индивидуума. При определении эффективного количества терапевтической композиции, подлежащей введению, врач должен оценить, среди прочего, циркулирующие в плазме уровни, токсичность и прогрессирование заболевания.
Термин ″эффективное количество″ в отношении гуманизированного антитела и химиотерапевтического средства(средств) по изобретению следует понимать как количество каждого из этих активных веществ, требуемое для достижения терапевтического эффекта, без возникновения чрезмерных или неконтролируемых неблагоприятных побочных эффектов. Эффективное количество, требуемое для достижения терапевтического конечного результата, может зависеть от ряда факторов, включая, например, конкретный тип опухоли и тяжесть состояния пациента, и от того, вводят ли комбинацию дополнительно совместно с лучевой терапией. Эффективное количество (доза) активных веществ, в контексте настоящего изобретения, должны быть достаточными для обеспечения благоприятного терапевтического ответа у индивидуума с течением времени, включая ингибирование роста опухоли, снижение скорости роста опухоли, предупреждение роста опухоли и метастазов и увеличенную выживаемость.
В различных вариантах осуществления способов комбинирования по изобретению, антитело и химиотерапевтическое средство можно вводить в соответствии с любой из ряда схем лечения, также называемых ″схемами дозирования″ и ″режимами введения″, относящихся к частоте введения и порядку введения каждого активного вещества. Например, антитело и химиотерапевтическое средство можно вводить по существу одновременно, т.е. в одно и то же время, с использованием, например, комбинированной дозированной формы или отдельных дозированных форм. Эта форма введения также может называться ″совместным″ введением. Сосуществующее введение относится к введению активных средств в пределах одного и того же периода времени, например, в тот же день(дни), но не обязательно в то же время. Например, для одного активного вещества может требоваться введение с пищей, в то время как для другого активного вещества требуется введение в состоянии наполовину натощак. Поочередное введение включает введение одного средства в ходе конкретного периода времени, например, в течение нескольких дней или недели, а затем введение другого средства в ходе последующего идентичного периода времени, а затем повторения этой схемы на протяжении одного или нескольких циклов. Последовательное введение или введение подряд включает введение одного средства в течение первого периода времени с использованием одной или нескольких доз, а затем введение другого средства в течение второго периода времени с использованием одной или нескольких доз. Также можно использовать перекрывающуюся схему, которая включает введение активных средств в различные дни в течение периода лечения, не обязательно с регулярной последовательностью. Также можно использовать варианты этих общих рекомендаций, в зависимости используемых средств и состояния индивидуума.
В некоторых конкретных комбинациях может быть преимущественным использование конкретной последовательности введения, например, одного средства перед другим.
После общего описания изобретения, вышеуказанное станет хорошо понятно с помощью следующих примеров, которые предоставлены в качестве иллюстрации и не предназначены для ограничения настоящего изобретения.
ПРИМЕРЫ
ПРИМЕР 1
Жизнеспособность CD4+ T-лимфоцитов после инкубации с двойным мутантом CT-011
Получали двойное мутантное антитело CT-011, содержащее аминокислотные замены Trp 107 на Ala и Phe 97 на Ala (обозначаемое как w222+F97). Репрезентативным примером являются активированные в течение 48 часов CD4+ T-лимфоциты человека, инкубированные с 1 мкг/мл или 0,1 мкг/мл CT-011 или двойным мутантом CT-011 W222+F97 или изотипическим контрольным антителом в течение дополнительных 72 часов. Жизнеспособность клеток оценивали по вытеснению трипанового синего.
Как видно на фиг.1, жизнеспособность лимфоцитов является более высокой в культурах, включающих двойное мутантное антитело. На оси Y фигуры 1 указана концентрация жизнеспособных клеток.
ПРИМЕР 2
Эффект in vivo модифицированного hBAT-1 в модели опухоли на мышах
Чтобы исследовать, могут ли модифицированные антитела по настоящему изобретению передавать биологические эффекты, характерные для mBAT-1 или hBAT-1, исследуют эффективность модифицированных антител in vivo.
Мышам C57BL инокулируют клетки меланомы B16 для индукции метастазов в легких. Возрастающие количества (1, 10 и 20 мкг) модифицированного mAb по изобретению инъецируют на 12 сутки после инокуляции опухоли и сравнивают с оптимальной дозой 10 мкг mBAT-1 и/или hBAT-1. Массу легких можно измерять на 24 сутки после инокуляции опухоли, чтобы показать развитие опухоли. Средняя масса легких на лечение является показательной для различных исследованных mAb.
ПРИМЕР 3
Ингибирование меланомы человека (SK-28) у мышей SCID с помощью модифицированного hBAT-1
Было показано, что mAb BAT-1 мыши и человека ингибирует образование метастазов опухоли человека в присутствии лимфоцитов периферической крови человека (hPBL). Для оценки эффективности модифицированного hBAT-1 при ингибировании злокачественной опухоли у человека, модифицированное антитело исследуют в модели, сочетающей в себе как опухоли, так и лимфоциты человека. Мышам с тяжелым комбинированным иммунодефицитом (SCID) трансплантируют hPBL для восстановления иммунной компетентности. Мышей нагружают клетками меланомы человека (SK-28) и вводят им возрастающие концентрации гуманизированного антитела, вводимые в однократной в/в дозе на 11 сутки после инокуляции опухоли.
ПРИМЕР 4
Иммунотерапия метастазов в печень рака ободочной и прямой кишки человека с помощью модифицированного mAb hBAT-1 у мышей Nude
LIM6 и HM7 являются двумя субклонами клеточной линии CRC человека LS174T, которые были выбраны вследствие их высокого синтеза муцина и метастатического потенциала. Опухолевые клетки инъецируют в обнаженную селезенку мышей nude под анестезией. Через 1 минуту селезенки извлекают и разрезы закрывают. Через 12 суток вводят низкие дозы антител mBAT-1, hBAT-1 и модифицированного hBAT-1 по изобретению и мышей умерщвляют через 35 суток после инокуляции опухоли. Печени взвешивают, количество метастатических узлов подсчитывают, и ткань печени обрабатывают для исследования гистологии и иммуногистохимии.
ПРИМЕР 5
Совместная локализация модифицированного hBAT с CD4 и CD8
Было показано, что BAT-1 мыши и человека связывают лимфоциты человека, распознавая как подгруппу CD4+, так и подгруппу CD8+. Для установления специфичности связывания модифицированных гуманизированных mAb по изобретению, лимфоциты периферической крови человека (PBL) выделяют из крови здоровых доноров, как описано в настоящем описании ниже, и анализируют в отношении совместной локализации hBAT с известными маркерами лимфоцитов.
Мононуклеарные клетки периферической крови (PBMC) выделяют с помощью фиколла и инкубируют в чашках для культивирования тканей для удаления прикрепляющихся клеток. Из выделенных клеток выделяют лимфоциты по размеру и гранулярности и живые клетки по исключению йодида пропидия (PI). Связывание проводят при 4°C в течение 1 ч, и определяют с помощью проточной цитометрии выделенных лимфоцитов.
ПРИМЕР 6
Связывание модифицированного hBAT-1 с B-лимфоцитами
Модифицированные гуманизированные mAb по изобретению индуцируют против мембран клеток Daudi, линии B-клеточной лимфомы человека. PBL от нормальных доноров выделяют с помощью фиколла, как известно в данной области, а затем прикрепляют на чашки для культивирования тканей. Неприкрепляющиеся клетки исследуют в отношении колокализации антител с B-клеточными маркерами, включая CD19 и CD20. Связывание проводят при 4°C в течение 1 ч, и определяют с помощью проточной цитометрии выделенных лимфоцитов.
ПРИМЕР 7
Стабильность модифицированного hBAT-1
mAb CT-001, содержащие по меньшей мере одну аминокислотную модификацию в положении, выбранном из: Thr 5, Thr 20, Cys 71, Asn 75, Ser 76, Phe 93 и Phe 97 вариабельной области легкой цепи, имеющей аминокислотную последовательность SEQ ID NO:1-4; Asp 54, Ser 55 и Trp 107 вариабельной области тяжелой цепи, имеющей аминокислотную последовательность SEQ ID NO:5-9; Asn 51, Ser 52, Asp 63 и Ser 64 константной области легкой цепи, имеющей аминокислотную последовательность SEQ ID NO:10; или Thr 3, Ser 7, Asn 42, Ser 43, Asn 86, His 87, Asp 104, Lys 105, Thr 108, Met 135, Asp 153, Pro 154, Asp 163, Gly 164, Asn 180, Ser 181, Asn 198, Gly 199, Asn 267, Gly 268, Asp 282, Ser 283, Asp 284, Ser 285, Asn 317, His 318, Lys 330 и Met 311 константной области тяжелой цепи, имеющей аминокислотную последовательность SEQ ID NO:12, получают, как известно в данной области.
Стабильность модифицированных mAb оценивают с использованием различных биохимических и биофизических способов, которые оценивают размер, состояние агрегации, структуру и межмолекулярные контакты антител, как известно в данной области. Например, чистоту и агрегационное состояние антител можно исследовать с помощью эксклюзионной хроматографии (SEC) и аналитического ультрацентрифугирования (AUC).
Представленное выше описание конкретных вариантов осуществления настолько полно раскрывает общую природу изобретения, что другие могут, с использованием существующих знаний, без труда модифицировать и/или адаптировать для различных применений такие конкретные варианты осуществления без излишнего экспериментирования и без отклонения от общей идеи, и, таким образом, такие адаптации и модификации должны охватываться и подразумевается, что они охватываются, значением и диапазоном эквивалентов описанных вариантов осуществления. Следует понимать, что фразеология или терминология, используемые в настоящем описании, предназначены для цели описания, а не для ограничения. Значения, материалы и стадии для осуществления различных описанных функций могут принимать множество альтернативных форм без отклонения от изобретения.