Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ПОРОШКА ДИБОРИДА ТИТАНА
Вид РИД
Изобретение
Изобретение относится к металлургии тугоплавких соединений, в частности к синтезу порошков боридов титана, и может быть использовано в получении огнеупоров из индивидуальных и композиционных соединений для высокотемпературных агрегатов химической, цветной и черной металлургии.
Известен карботермический способ получения диборида титана (Самсонов Г.В., Серебрякова Т.И., Неронов В.А. Бориды. М.: Атомиздат, 1975, 376 с.), позволяющий получать конгломераты конечного продукта из относительно крупных зерен (50-100 мкм). Недостатки способа - высокая температура процесса, большая энергоемкость и низкая производительность оборудования, определяют и высокую стоимость продукта. Последнее предопределило интенсивный поиск решений повышения экономической эффективности карботермического синтеза диборида титана как в составе углеграфитовых изделий, так и в виде индивидуального порошкового продукта.
Известен способ стабилизации диборидтитановой структуры углеродного блока (патент US №7462271, опубл. 2008 г.), в котором процесс синтеза диборида титана предлагается считать только укрепляющим объем углерод-TiB2 массива, состоящего из исходной шихты следующего состава:
Антрацит - 50% мас.
TiO2+В2О3 - 1÷10% мас.
TiB2 - 40÷49% мас.
Связующее - 12÷19 мас. % к массе сухой шихты.
Предполагается, что в условиях электролиза при 700÷1000°C и фильтрации алюминия в структуру блока происходит полная конверсия исходных оксидных компонентов в диборид титана по реакции:
3TiO2+3B2O3+10Al→3TiB2+5Al2O3.
Утверждается, что синтез TiB2+Al2O3 по границам зерен наполнителя (углерода и TiB2) будет цементировать макроструктуру катода. Концепция и назначение металлотермического процесса в объеме блоков обосновывается необходимостью стабилизации боридтитановой субструктуры блоков, которая деградирует под воздействием фильтрата криолитового и алюминиевого расплавов.
Недостатком способа является неравномерность этого процесса по площади и объему подины, поскольку фильтрация алюминия в структуру катода не контролируется, неравномерная во времени и локальном распределении. Соответственно, продукты синтеза TiB2 и Al2O3 будут накапливаться в структуре блоков неравномерно, создавая местные напряжения и опасность деструкции поверхностного слоя.
Известен способ синтеза диборида титана (патент US №4465581, опубл. 1984 г.) в составе катодных блоков для алюминиевых электролизеров, в котором на первом этапе порошок TiO2 рассеивается в смеси частиц нефтяного кокса различных фракций, после чего рассев при 175°C диспергируется в жидком высокотемпературном каменноугольном (или нефтяном) пеке до формирования пластической массы. Далее на втором этапе эта масса прессуется или экструдируется, подвергается термической обработке при 700÷100°C в течение 1÷10 дней до формирования твердого композита C-TiO2 с высокопористой структурой, а затем в несколько автоклавных циклов вакуума и давления пропитывается водной дисперсией В2О3 и сажи в сосуде высокого давления. Второй подготовительный этап заканчивается сушкой заготовки стехиометрической реакционной смеси при 100°C. На третьем этапе нагревом заготовки в печи обжига до 1200÷1800°C осуществляется собственно синтез TiB2 в составе блока по реакции TiO2+B2O3+5С→TiB2+5СО. Утверждается, что процесс синтеза начинает медленно развиваться при 800°C, ускоряется при 1200°C и достигает высоких скоростей примерно при 1750°C. Термическая обработка блока может осуществляться в несколько циклов пропитки заготовки водной дисперсией В2О3 и сажи, сушки, пропитки пеком и последующим обжигом, чтобы создать необходимую плотность блока и концентрацию TiB2 в его составе (до 60% по массе). Последний этап создания композитного материала TiB2-графит состоит в нагреве обожженной заготовки до температур графитизации материала выше 2000°C, предпочтительно до 2400÷2500°C.
Обсуждаемый способ производства катодных блоков композитного состава не решает задачу снижения температуры синтеза диборида титана и требует предварительного высокоэнергетического обжига изделий. Кроме того, существенным недостатком способа является сложный в аппаратурном и технологическом обеспечении многоступенчатый и циклический процесс подготовки к синтезу диборида титана в составе графитизированных изделий. Это в значительной степени удорожает конечную продукцию, т.е. повышает себестоимость и снижает эффективность производства алюминия.
В способах получения диборида титана (патент US №2973247, опубл. 1961 г., патент RU №2498880, опубл. 2013 г.) увеличение реакционной поверхности компонентов, а значит снижение температуры синтеза, решают подготовкой исходной шихты во взвешенном состоянии водной дисперсионной среды. По сути, осуществляют диспергирование субмикронных порошков оксида титана (пигмента) и сажи в растворе борной кислоты в расчетных стехиометрических или нестехиометрических количествах карботермической реакции: TiO2+2Н3ВО3+5С→TiB2+3H2O+5СО. После сушки водной дисперсии и удаления связанной воды при 150÷200°C процесс синтеза диборида титана осуществляют в инертной атмосфере при температурах 1200÷1500°C в течение 3-4 часов. Сообщается о высоком выходе целевого продукта 93-95% (остальное TiC/TiO) с частицами порошка размером до 5-15 мкм в неагрегированной форме.
Известен способ синтеза диборида титана (патент US №8216536, опубл. 2012 г.), в котором, после предварительного приготовления водной дисперсионной смеси оксида титана, оксида бора (или борной кислоты) и углерода и последующей распылительной сушки суспензии, карботермический процесс получения диборида титана ведут в соответствии с основными процессами синтеза: TiO2+2Н3ВО3+5С→TiB2+3H2O+5СО.
Получение порошка диборида титана целевого размера и морфологии достигается выбором типа углерода с известным содержанием серы от 0,1 до 4,0 мас. %, проведением карботермического процесса при температурах 1300÷1700°C в течение 0,5÷4 часов и с регулировкой потока аргона в реакционной зоне в пределах от 0,25 до 3 л/мин.
Известен способ синтеза диборида титана (патент US №5160698, опубл. 1992 г.), в котором водную дисперсию реакционной смеси двуокиси титана, борной кислоты и ацетиленовой сажи подают через специальное распылительное устройство в сушилку с температурой на входе 290°C и на выходе 104°C с получением частиц от 5 до 25 микрон. Далее субмикронный порошок оксидов с углеродом нагревается в инертной атмосфере в тигле или в трубчатом реакторе при температурах от 1200 до 2500°C (предпочтительные температуры 1500÷2500°C) с выдержкой в течение от 1 секунды до 5 минут для преобразования в диборид титана: TiO2+B2O3+5С=TiB2+5СО. После этой выдержки печь отключалась и остывала в атмосфере Ar до комнатной температуры. Средняя крупность частиц TiB2 в диапозоне 10÷150 мкм.
Известные способы требуют длительного времени и сложного оборудования на предварительную подготовку реакционной смеси (сушку распылением и агломерацию) и измельчение готового продукта. Кроме того, несмотря на тщательную подготовку смеси температура синтеза высокая, что является существенным недостатком методов, снижающим технологические и экономические параметры процесса получения целевого продукта.
Известен способ синтеза диборида титана (Krishnarao R.V., Subrahmanyam J. Studies on the formation of TiB2 through carbothermal reduction of TiO2 and B2O3. // Materials Science and Engineering, A362, 2003, p. 145-151), принятый за прототип. Получение TiB2 осуществляют в форме вискеров и в виде порошка с помощью карботермического восстановления TiO2 и В2О3 при 900÷1600°C в атмосфере аргона. Для обеспечения жидкопарового механизма роста тела вискеров применялись добавки K2CO3 (с TiO2 образует легкоплавкую жидкость) и NiCl2 (катализатор газификации углерода), которые предварительно растворялись в воде. Компоненты TiO2, NiCl2, K2CO3, сажа и B2O3 составлялись в мольном соотношении TiO2 : NiCl2 : K2CO3 : С : B2O3=x : 0,15 : 0,144 : 4 : 1 (где х=1/0,5/0,25). Суспензия оксида титана в водном растворе NiCl2 и K2CO3 сушилась в печи при 110°C, после чего добавляли В2О3 и сажу с последующим измельчением смеси в пластмассовой емкости с металлическими шарами в течение 7 часов. Синтез TiB2 производили в печи сопротивления в графитовом тигле при 1100, 1200, 1400, 1500 и 1600°C в атмосфере аргона в течение 45 минут с интенсивностью нагрева около 40°C/мин. Вискеры формируются при низких температурах реакции (1100÷1200°C), выше 1400°C получали частицы TiB2 в агломерированном виде.
Недостатком является то, что в способе достигают низкотемпературного синтеза диборида титана при 1100÷1200°C, но только в форме вискеров, которые применяются для усиления кромок режущего инструмента, используемого в обработке стали с высоким содержанием никеля. Такое применение вискеров допускает наличие в материале примесей Ni, K (в составе смеси) и Fe (за счет «намола» шарами), но не может использоваться для изготовления широкой номенклатуры индивидуальных или композитных компактных изделий, в которых не допускается наличие примесей. Кроме того, существенными недостатками способа являются продолжительное время синтеза и высокие энергетические затраты, определяемые необходимостью длительного измельчения исходной смеси в шаровой мельнице и синтезом порошкового TiB2 при повышенных температурах. Это снижает производительность и эффективность производства.
Задачей предлагаемого технического решения является повышение технико-экономических показателей процесса получения диборида титана за счет организации синтеза в энергосберегающих условиях при низких температурах с применением стандартного оборудования.
Техническим результатом является повышение технологичности синтеза, обеспечение коммерческого качества продукта, снижение энергетических затрат и повышение эффективности производства диборида титана.
Технический результат достигается тем, что в способе получения порошка диборида титана, включающем приготовление мокрой реакционной смеси исходных титансодержащих, борсодержащих компонентов и восстановителя в виде углеродсодержащих компонентов, сушку смеси и карботермическое восстановление в реакционной смеси при нагреве, в качестве титансодержащих компонентов применяют диоксид титана в форме анатаза или прекурсоры диоксида титана, подвергают их гидролизу и модифицированию фторид-анионом, а карботермическое восстановление в реакционной смеси ведут при нагреве до температуры 1000÷1050°C с выдержкой в атмосфере динамического вакуума. По окончании стадии синтеза атмосфера динамического вакуума заменяется на атмосферу аргона. В качестве прекурсоров диоксида титана применяются гидратированный диоксид титана, тетрахлорид титана, сульфат титанила и гексафторотитанат аммония. Кроме того, в качестве углеродсодержащих компонентов исходной реакционной смеси используются активные формы углерода в виде сажи, или содержащиеся в патоке, сахарозе, лимонной кислоте.
Техническая сущность предлагаемого решения заключается в следующем.
Одна из специфических особенностей твердых тел состоит в том, что их активность (реакционная способность) определяется не только химическим и фазовым составом, но и состоянием кристаллической решетки, обусловленным способом приготовления и обработки реагента или наличием в ней различных видов дефектов. При переходе из одного фазового состояния в другое, в данном случае анатаза в рутил а-TiO2→r-TiO2, происходит перестройка порядка кристаллической решетки, увеличивается подвижность ее составных частей, и, таким образом, стимулируется реакционная способность оксида титана. С термодинамической точки зрения активная и стабильная фазы характеризуются соответствующими энергиями Гиббса ΔGT* и ΔGT. Тогда мерой интегральной активности твердой фазы является избыток энергии Гиббса (ΔGT изб) по отношению к фазе тождественного состава, находящейся в нормальном состоянии: ΔGT изб=ΔGT* - ΔGT. Для анатаза и рутила ΔGT изб>0 во всем интервале температур и при 1000°C составляет всего +2,3 кДж/моль (Smith S.J. et al. Heat capacities and thermodynamic functions of TiO2 anatase and rutile: Analysis of phase stability // American Mineralogist, v. 94, 2009, p. 236-243). С одной стороны, это определяет метастабильность анатаза а-TiO2, а с другой, учитывая малую величину ΔGT изб, позволяет другим факторам, включая размер частиц и примесное содержание, потенциально существенно изменять относительную устойчивость анатаза и рутила. Наноразмерный анатаз является стабильной фазой TiO2 в случае его низкой поверхностной энергии (в сравнении с таковой у рутила) при относительно невысоких температурах и давлениях только до крупности частиц 14 нм. С ростом зерна или агломерацией частиц при нагревании анатаз становиться нестабильным и трансформируется в рутил. Поэтому более надежным способом стабилизировать анатаз является внесение в его решетку примесных элементов. В частности, допированием метастабильного анатаза фтором в определенных условиях можно снизить ΔGT изб примерно до -58,0 кДж/моль (Hanaor D.A.H. et al. Ab Initio Study of Phase Stability in Doped TiO2 // Computational Mechanics 50, (2), 2012, p. 185-194) и тем самым повысить стабильность анатаза с 600÷700°C до 1000÷1050°C (Седнева Т.А. и др. Зависимость фазовых переходов и фотокаталитической активности наноразмерного диоксида титана от допирования фторид-ионами. // Перспективные материалы, 2007, №6, стр. 49-55). А это уже температурный и энергетический интервал, в котором возможна карботермическая реакция синтеза TiB2.
Такой эффект применения фтора объясняется тем, что энергия его связи с титаном (IV) выше, чем других доступных анионов и катионов, т.е. способность к комплексообразованию возрастает в ряду NO3 2-<Cl-<SO4 2-<PO4 3-<I-<F- и Al3+<Fe3+<Si4+<F-. Эта особенность связана со сложным механизмом сорбции F--ионов оксидом титана, сочетающем в себе вклад электростатического фактора, водородной связи и, что особенно важно, специфической сорбции, когда между лигандом (F--ионом) и металлом отсутствует гидратная оболочка аниона и характеризуется наличием прочной ковалентной связи. Это означает невозможность вытеснения F--ионов другими сорбируемыми ионами с поверхности оксида титана, тогда как обратное возможно. Поэтому допирование анатаза фторид-ионами наиболее приемлемо. Кроме того, исключается загрязнение исходных компонентов и продуктов синтеза.
Таким образом, сдвиг температурного интервала фазовой трансформации а-TiO2→r-TiO2 с 600÷700°C в область 1000÷1050°C позволяет осуществлять карботермический синтез диборида титана. При этом инициирование и развитие этого эндотермического процесса до полного расходования исходных продуктов требует не только достаточной тепловой энергии, но и кинетического стимулирования реакции. В данном случае для сдвига равновесия а-TiO2+B2O3+5С→TiB2+5CO↑ вправо требуется интенсивное удаление из зоны реакции большого количества газов СО↑ с помощью продувки аргоном или создания динамического разрежения. Но аргоновая атмосфера так же, как и восстановительная, стимулирует анатаз-рутил трансформацию и вызывает преждевременную стабилизацию оксида титана. Наоборот, вакуум позволяет затормозить фазовый переход a-TiO2→r-TiO2. Поэтому наиболее предпочтительным порядком кинетического стимулирования синтеза является вакуумирование реакционного пространства в течение цикла разогрева и выдержки при температурах синтеза 1000÷1050°C с последующей заменой разряженной атмосферы на аргон для увеличения выхода годного продукта и предотвращения окисления мелкодисперсного TiB2.
Способ осуществляется следующим образом.
Реализация этого процесса требует при составлении реакционной смеси модифицирования (допирования) оксида титана с использованием гидролиза минеральных солей титана, который протекает с образованием метатитановой кислоты. Формирование комплекса метатитановой кислоты в присутствии фтористоводородной кислоты (источник фтор-иона) и гидроксида аммония (активатор гидролиза и регулятор рН) протекает следующим образом:
TiOSO4+2NH4OH+xHF→TiO(OH)2-xFx↓+xH2O+(NH4)2SO4
TiCl4+4NH4OH+xHF→TiO(OH)2-xFx↓+(1+x)H2O+4NH4Cl, где х≤1.
В случае использования фторсодержащей соли титана, в частности гексафторотитаната аммония, присутствия фтористоводородной кислоты не требуется, и гидролиз протекает согласно реакции:
(NH4)2TiF6+(4-x)NH4OH→TiO(OH)2-xFx↓+xH2O+(6-x)NH4F.
Эти процессы допирования оксида титана происходят на молекулярном уровне и представляют самый близкий уровень ассоциации с фтором. При допировании фтор-ионом диоксида титана в гидратированной форме и анатаза идет по методу влажного пропитывания по схеме:
TiO2xH2O+NH4OH+xHF→TiO(OH)2-xFx↓+xH2O+NH3
а-TiO2+NH4OH+xHF→TiO(OH)2-xFx↓+H2O+NH3 x≤1.
Далее в гелеобразный раствор TiO(OH)2-xFx последовательно при постоянном перемешивании добавляются остальные компоненты реакционной смеси: борная кислота и углерод в виде сажи или патоки, сахарозы, лимонной кислоты. Готовая смесь сушится на воздухе, затем при 80-90°C в сушильном шкафу. Полученный агломерированный композит нагревается в ячейке в атмосфере динамического вакуума до температуры синтеза диборида титана. С разогревом смеси происходит последовательное удаление воды из ее компонентов: при 180÷230°C связанная борной кислотой 2Н3ВО3=В2О3+3H2O↑, и при 300÷400°C в период кристаллизации анатаза из аморфного осадка, содержащего в своей структуре фторид-ион TiO(OH)2-xFx→TiO2-xFx+H2O↑. И эта фаза остается стабильной при нагреве вплоть до интервала температур 990÷1050°C, в котором происходит трансформация анатаза в рутил a-TiO2→r-TiO2 с перестройкой кристаллической решетки и параллельно идущим синтезом диборида титана:
TiO2F+В2О3+5С→TiB2+5СО↑+F↑(при х=1).
Завершение этого процесса при температурах синтеза и в период охлаждения системы ведется в нейтральной атмосфере аргона.
Таким образом, при корректном составлении исходной реакционной смеси, учитывающей стехиометрию карботермической реакции и потери компонентов на всех стадиях процесса, продуктом синтеза будет чистый неагломерированный порошок диборида титана TiB2. И этот процесс, учитывая низкие температуры синтеза, может быть осуществлен в составе углеграфитовых изделий, проходящих стадию обжига при 1000÷1200°C.
Предлагаемый способ осуществляется следующим образом.
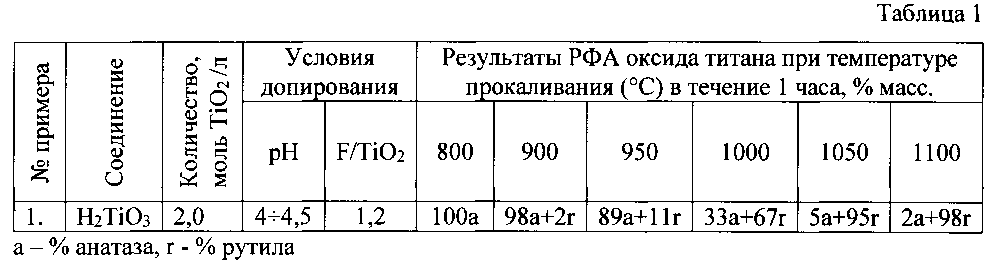
Пример 1. В 50 мл дистиллированной воды при перемешивании вводят фторид-ионы в виде HF в количестве F/TiO2=1,2 (массовая доля) и осуществляют регулировку кислотности раствора добавкой гидроксида аммония NH4OH до рН=4÷4,5. После охлаждения до 20°C в раствор в виде порошка вводят метатитановую кислоту H2TiO3 в количестве 2,0 моль/л (в пересчете на TiO2), раствор белого цвета перемешивают в течение 0,5 часа. Изменение рН раствора до 7÷7,5 свидетельствует об образовании гелеобразного осадка модифицированной фтором метатитановой кислоты TiO(OH)2-xFx. Осадок высушивают на воздухе и в шкафу при температуре 80°C. После сушки фиксированные количества порошка нагревают до температур 800, 900, 950, 1000, 1050 и 1100°C в атмосфере динамического вакуума с выдержкой при каждой температуре 1 час. После замены разряженной атмосферы на аргон и охлаждения ячейки образцы направлялись на РФА для анализа на фазовый состав оксида титана. Количественный состав фаз рассчитывается по известному эмпирическому уравнению R. Spurru и Н. Myers из соотношения наибольших интенсивностей рутила (Ir) и анатаза (Ia) в смеси: Ха=(1+1,26·Ir/Ia)-1.
Результаты опыта по условиям примера 1 свидетельствуют о начале рутилизации анатаза при температуре около 950°C и окончании перехода а-TiO2→r-TiO2 при 1100°C. Но основной процесс трансформации происходит при 1000÷1050°C (таблица 1).
Пример 2. По примеру 1 с использованием метатитановой кислоты H2TiO3 готовится допированный фтор-ионом гелеобразный осадок ортотитановой кислоты TiO(OH)2-xFx, и далее последовательно при постоянном перемешивании добавляются борная кислота и сахароза в количествах, обеспечивающих сверхстехиометрическое соотношение C/TiO2+B2O3 около 0,5 по массе. Готовая смесь сушится на воздухе, затем при 80-90°C в сушильном шкафу. Полученный агломерированный композит нагревается в ячейке в атмосфере динамического вакуума раздельно до температур синтеза диборида титана 950, 1000, 1050 и 1100°C. После выдержки при этих температурах в течение 2 часов производят замену разряженной атмосферы на аргон, печь отключают и охлаждают ячейку до комнатной температуры. Полученный рассыпчатый порошок серого цвета направляется на РФА для определения фазового состава.
Основные параметры способа и полученные результаты по Примерам 2-7 согласно заявляемому способу представлены в таблице 2.
Пример 3. По примеру 1 с использованием порошка анатаза а-TiO2 готовится допированный фтор-ионом гелеобразный осадок ортотитановой кислоты TiO(OH)2-xFx, и далее последовательно при постоянном перемешивании добавляются борная кислота и сажа в количествах, обеспечивающих соотношение С/TiO2+В2О3 около 0,55 по массе. Готовая смесь сушится на воздухе, затем при 80-90°C в сушильном шкафу. Полученный агломерированный композит нагревается в ячейке в атмосфере динамического вакуума раздельно до температур синтеза диборида титана 1000, 1050 и 1100°C. После выдержки при этих температурах в течение 2 часов производят замену разряженной атмосферы на аргон, печь отключают и охлаждают ячейку до комнатной температуры. Полученный рассыпчатый порошок серого цвета направляется на РФА для определения фазового состава, результаты которого представлены в таблице 2.
Пример 4. По примеру 3 с использованием порошка анатаза а-TiO2 готовится допированный фтор-ионом гелеобразный осадок ортотитановой кислоты TiO(OH)2-xFx, и далее последовательно при постоянном перемешивании добавляются борная кислота и сажа в количествах, обеспечивающих соотношение С/TiO2+В2О3 около 0,55 по массе. Готовая смесь сушится на воздухе, затем при 80-90°C в сушильном шкафу. Полученный агломерированный композит нагревается в ячейке в атмосфере динамического вакуума раздельно до температур синтеза диборида титана 1000, 1050 и 1100°C. После выдержки при этих температурах в течение 2 часов замену разряженной атмосферы на аргон не производят, печь отключают и охлаждают ячейку до комнатной температуры. Полученный рассыпчатый порошок серого цвета направляется на РФА для определения фазового состава, результаты которого представлены в таблице 2.
Пример 5. В 40 мл раствора минеральной соли TiCl4 с концентрацией 2,0 моль/л в пересчете на TiO2 вводят при перемешивании фторид-ионы в виде HF в количестве 1,1F/TiO2 (массовая доля), дистиллированную воду и осуществляют регулировку кислотности раствора добавкой гидроксида аммония NH4OH до рН=4,2. После перемешивания в течение 0,5 часа рН раствора с помощью аммиачной воды доводят до 12 и осуществляют гидролиз соли при температуре 20°C в течение 20-40 минут с образованием осадка модифицированной фтором метатитановой кислоты TiO(OH)2-xFx.
Далее в гелеобразный раствор TiO(OH)2-xFx последовательно при постоянном перемешивании добавляются борная кислота и лимонная кислота в количествах, обеспечивающих соотношение С/TiO2+В2О3 около 0,56 по массе. Готовая смесь сушится на воздухе, затем при 80-90°C в сушильном шкафу. Полученный агломерированный композит нагревается в ячейке в атмосфере динамического вакуума раздельно до температур синтеза диборида титана 1000 и 1050°C. После выдержки при этих температурах в течение 2 часов производят замену разряженной атмосферы на аргон, печь отключают и охлаждают ячейку до комнатной температуры. Полученный рассыпчатый порошок серого цвета направляется на РФА для определения фазового состава, результаты которого представлены в таблице 2.
Пример 6. По примеру 5 с использованием сульфата титанила TiOSO4 готовится допированный фтор-ионом гелеобразный осадок ортотитановой кислоты TiO(OH)2-xFx, и далее последовательно при постоянном перемешивании добавляются борная кислота и сажа в количествах, обеспечивающих соотношение С/TiO2+В2О3 около 0,53 по массе. Готовая смесь сушится на воздухе, затем при 80-90°C в сушильном шкафу. Полученный агломерированный композит нагревается в ячейке в атмосфере динамического вакуума раздельно до температур синтеза диборида титана 1000 и 1050°C. После выдержки при этих температурах в течение 2 часов производят замену разряженной атмосферы на аргон, печь отключают и охлаждают ячейку до комнатной температуры. Полученный рассыпчатый порошок серого цвета направляется на РФА для определения фазового состава, результаты которого представлены в таблице 2.
Пример 7. В 50 мл раствора минеральной соли гексафторотитаната аммония (NH4)2TiF6 с содержанием фторид-ионов в ее составе 1,425F/TiO2 (массовая доля) и с концентрацией соли в растворе 0,4 моль/л в пересчете на TiO2 вводят при перемешивании 50 мл дистиллированной воды и осуществляют регулировку кислотности раствора добавкой гидроксида аммония NH4OH до рН=4,2. После перемешивания в течение 0,5 часа рН раствора с помощью аммиачной воды доводят до 12 и осуществляют гидролиз соли при температуре 20°C в течение 20-40 минут с образованием осадка модифицированной фтором метатитановой кислоты TiO(OH)2-xFx.
Далее в гелеобразный раствор TiO(OH)2-xFx последовательно при постоянном перемешивании добавляются борная кислота и сажа в количествах, обеспечивающих соотношение С/TiO2+В2О3 около 0,56 по массе. Готовая смесь сушится на воздухе, затем при 80-90°C в сушильном шкафу. Полученный агломерированный композит нагревается в ячейке в атмосфере динамического вакуума раздельно до температур синтеза диборида титана 1000 и 1050°C. После выдержки при этих температурах в течение 2 часов производят замену разряженной атмосферы на аргон, печь отключают и охлаждают ячейку до комнатной температуры. Полученный рассыпчатый порошок серого цвета направляется на РФА для определения фазового состава, результаты которого представлены в таблице 2.
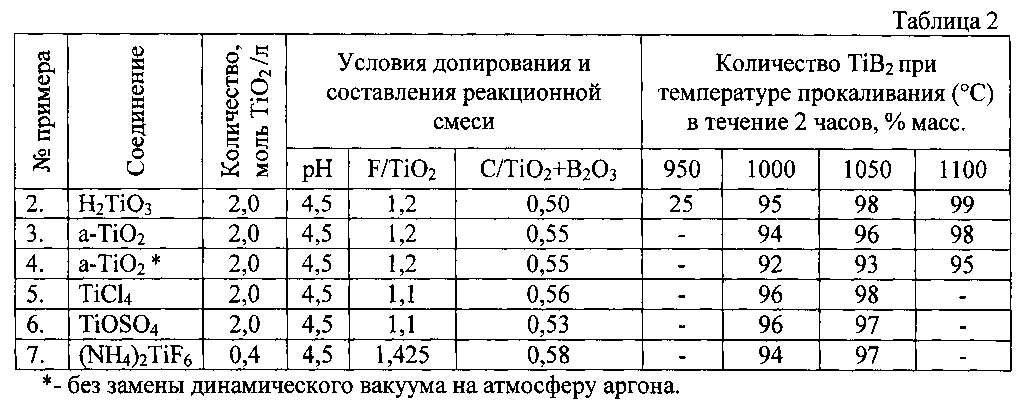
Результаты модифицирования диоксида титана, его прекурсоров и синтеза диборида титана по условиям примеров 2÷7 свидетельствуют о наиболее приемлемом и эффективном интервале температур 100÷1050°C, при которых процесс получения TiB2 проходит с 95-98% выходом конечного продукта. Основными примесями являются оксиды титана различных промежуточных степеней окисления.
При температуре 950°C синтез диборида титана проходит неполно с высоким остаточным содержанием углерода и аморфной фазы. Температура синтеза 1100°C является чрезмерной и ведет к неоправданному перерасходу электроэнергии на обеспечение процесса.
Отсутствие замены разряженной газовой среды на нейтральную атмосферу аргона (пример 4) по окончании процесса синтеза диборида титана снижает выход годного продукта и увеличивает количество примесных компонентов в виде промежуточных продуктов синтеза - оксидов титана, карбида бора.
Заявляемый способ низкотемпературного синтеза диборида титана в виде порошка является энергосберегающим процессом, который осуществляется на доступном стандартном оборудовании. Это позволяет осуществлять производство диборида титана как самостоятельного продукта, а также проводить синтез в составе любых композитных огнеупорных изделий, в том числе оксидных и углеграфитовых, проходящих стадию технологического обжига при 1000÷1200°C и выше.
Эти особенности предлагаемой технологии получения диборида титана открывают возможности расширения коммерческого применения конечного продукта в виде компактных индивидуальных или композитных изделий, для развития новых технологий в металлургии, химической и электродной промышленности.

