Результат интеллектуальной деятельности: АНТИТЕЛА ПРОТИВ IgG1 ЧЕЛОВЕКА
Вид РИД
Изобретение
В настоящей заявке описаны антитела, специфично связывающиеся с антителами человека класса IgG1, и их применение.
Предпосылки создания изобретения
С момента создания первых моноклональных антител Келером и Мильштейном в 1974 году много усилий было направлено на разработку антител, применяемых для терапии у людей. Первые ставшими доступными моноклональные антитела были получены в мышах и крысах. За последние десять лет на рынке появилось все увеличивающееся число человеческих моноклональных антител или гуманизированных моноклональных антител. Известные примеры включают, например, Герцептин ® и Мабтера ® от компании F. Hoffmann-La Roche AG, Базель.
Довольно значительное число человеческих или гуманизированных моноклональных антител находится на стадии исследований, и перед тем, как перейти к первым испытаниям у человека, такие антитела необходимо исследовать на экспериментальных животных. Изучению подвергаются такие важные критерии, как, например, биологическая доступность антител и их выведение (клиренс). Многие из таких исследований требуют количественной оценки терапевтического антитела на фоне собственных антител экспериментального животного. В большинстве случаев в качестве экспериментальных животных используют млекопитающих. Токсичность часто сначала оценивают на грызунах, таких как мыши или крысы. На более поздних этапах разработки лекарственных препаратов, в частности перед началом применения препарата на людях, в такие доклинические исследования необходимо включать даже обезьян.
В кровотоке млекопитающих обычно циркулирует от 10 до 30 миллиграмм антител на мл. Терапевтические моноклональные антитела, как правило, тестируют при их содержании в сыворотке крови в пределах от примерно 1 нг на мл до примерно 100 мкг на мл. Терапевтическое антитело, таким образом, детектируют на фоне антител экспериментального животного, которые находятся приблизительно в 100-кратном - 10000000-кратном избытке.
Детекция человеческих или гуманизированных терапевтических антител на фоне антител экспериментального животного представляет собой довольно важную задачу для фармаколога. Детекция человеческих или гуманизированных антител представляет тем более трудную задачу, чем ближе родство экспериментального животного к Н. sapiens.
В патенте США 2004/214761 предложен способ лечения множественной миеломы. Способ качественного и количественного определения антител класса IgG человека предложен в патенте ЕР-А-1098198. В международной публикации WO 2006/066912 описана детекция терапевтических антител у экспериментальных животных. Анализ антител к лекарственным препаратам описан в международной публикации WO 2008/031532. В патенте США 5332665 описаны видоспецифичные высокоафинные моноклональные антитела.
В работе Jefferis, P. и соавторов (Immunol. Lett. 31 (1992) 143-168 and Immunol. Lett. 10 (1985) 223-252) описана оценка моноклональных антител, специфичных по отношению к подклассу IgG человека. Эпитопы, специфичные по отношению к подклассу IgG человека, узнаваемые мышиными моноклональными антителами, описаны в работе Jefferis R. (Monographs in Allergy, Karger, Basel (CH), 20 (1986) 26-33). Lewis A.P. et al. описывают клонирование и анализ последовательности кДНК иммуноглобулинов каппа и гамма обезьян циномолгус (Dev. Compar. Immunol. 17 (1993) 549-560). Молекулярные и функциональные характеристики подкласса IgG обезьян циномолгус описаны Jacobsen, F.W. с соавторами (J. Immunol. 186 (2011) 341-349). В работе Calvas P. с соавторами (Scand. J. Immunol. 49 (1999) 595-610) дана характеристика трех подклассов иммуноглобулинов G макак. Оценка иммунологического анализа для количественного определения специфичных для человека терапевтических антител в образцах сыворотки крови от приматов, отличных от человека, описана в работе Stubenrauch K-G и соавторов (J. Pharm. Biomed. Analysis 49 (2009) 1003-1008). В работе Liang Т. и соавторов (Vet. Immunol. Immunopat. 80 (2001) 259-270) описано клонирование и характеристика кДНК, кодирующих четыре различных цепи гамма-иммуноглобулина собак.
Сущность изобретения
Один из аспектов, описанный в настоящей заявке, представляет собой эпитоп, который присутствует на антителах человека, относящихся к классу иммуноглобулинов IgG1, и который не присутствует на антителах человека, относящихся к классу IgG2, IgG3 и IgG4. Кроме того, указанный эпитоп не присутствует на антителах обезьян циномолгус.
В качестве одного из аспектов в настоящей заявке описаны антитела, специфично связывающиеся с антителами человека класса IgG1 и антителами шимпанзе класса IgG, но не связывающиеся специфично с антителами экспериментальных животных, таких как обезьяны циномолгус.
Также один из аспектов, описанный в настоящей заявке, представляет собой применение антител, как указано в настоящей заявке, для анализа.
Антитела, описанные в настоящей заявке, можно применять, например, для определения терапевтического антитела человека класса IgG1 в сыворотке крови обезьян циномолгус и макак-резус.
В одном аспекте, эпитоп, описанный в настоящей заявке, характеризуется тем, что он включает аминокислоты в положениях 16, 82 и 97 последовательности SEQ ID NO:04 (домен СН1 IgG1 человека).
Другой аспект, описанный в настоящей заявке, представляет собой антитело, которое может быть получено из клеточной линии DSM ACC3076 (М-1.19.31). Это антитело имеет сниженную внутривидовую перекрестную реактивность, например, по сравнению с антителом M-R10Z8E9, продуцируемым клеточной линией DSM ACC2708. Данное антитело связывается с различным эпитопами, находящимися в Fab-области, и при этом на него не оказывает влияния соседний сайт гликозилирования, и данное антитело можно применять вместе с антителом, выбранным из антитела М-1.3.2 продуцируемого клеточной линией DSM ACC3006, антитела М-1.5 0,8, продуцируемого клеточной линией DSM АСС3007, антитела М-1.7.10, продуцируемого клеточной линией DSM ACC3008, и антитела M-R10Z8E9, продуцируемого клеточной линией DSM ACC2708, в иммунологическом анализе для определения как полноразмерных антител человека класса IgG1, так и Fab-фрагментов антител, включающих домен СН1 IgG1 человека, поскольку сайт связывания каждого из антител представлен в таких терапевтических антителах только один раз.
Один из аспектов, описанный в настоящем документе, представляет собой моноклональное антитело, специфично связывающееся с антителами человека класса IgG1 и антителами шимпанзе класса IgG или их Fab-фрагментами. В одном варианте реализации антитело представляет собой антитело, полученное от животного, не являющегося человеком. В одном варианте реализации антитело специфично связывается с константной областью тяжелой цепи антитела человека класса IgG1. В одном варианте реализации антитело специфично связывается с Fab-областью антитела человека класса IgG1. В одном варианте реализации антитело специфично связывается с СН1-доменом антитела человека класса IgG1. В одном варианте реализации антитело специфично связывается с антителом шимпанзе класса IgG. В одном варианте реализации антитело не связывается специфично с антителами экспериментального животного. В одном варианте реализации антитело не связывается специфично с антителами обезьяны циномолгус и антителами макака-резус.
Другой аспект, описанный в настоящей заявке, представляет собой моноклональное антитело, полученное из клеточной линии DSM ACC3076.
Также один из аспектов, описанный в настоящей заявке, представляет собой антитело, которое специфично связывается с таким же эпитопом, как и антитело, продуцируемое клеточной линией DSM ACC3076, или с перекрывающимся с ним эпитопом.
Одним из аспектов, описанных в настоящей заявке, является клеточная линия DSM ACC3076.
Другой аспект, описанный в настоящей заявке, представляет собой применение антитела, описанного в настоящей заявке, в иммунологическом анализе.
Еще один аспект, описанный в настоящей заявке, представляет собой набор, содержащий
а) антитело, полученное из клеточной линии DSM ACC3076,
б) антитело, полученное из клеточной линии DSM ACC2708, или DSM АСС 3006, или DSM ACC3007, или DSM ACC3008.
Кроме того, один из аспектов, описанный в настоящей заявке, представляет собой способ детекции терапевтического антитела человека класса IgG1 в образце, полученном от экспериментального животного, способ, включающий стадии:
а) получение образца для анализа,
б) инкубация образца с антителом, описанным в настоящей заявке,
в) возможно, инкубация образца с реагентом для селективной детекции суммарного, активного, связанного с антителом к лекарственному препарату (anti-drug antibody, ADA) или связанного с антигеном терапевтического антитела,
г) установление корреляции комплекса, образованного на стадии (б) или (в), с наличием терапевтического антитела, и таким образом, выявление терапевтического антитела.
Один из аспектов, описанный в настоящей заявке, представляет собой способ определения терапевтического антитела человека класса IgG1 в образце, полученном от экспериментального животного, с помощью мостикового иммунологического анализа, включающего иммобилизованное антитело (или «антитело захвата», англ. capture antibody) и меченое антитело (англ. tracer antibody), отличающийся тем, что иммобилизованное антитело и меченое антитело независимо выбраны из антител, связывающихся с тем же эпитопом, что и антитело, продуцируемое клеточной линией DSM АСС 3006, или DSM ACC3007, или DSM ACC3008, или DSM ACC3076.
В одном варианте реализации терапевтическое антитело представляет собой Fab-фрагмент, включающий домен СН1 IgG1 человека. В одном варианте реализации экспериментальное животное выбрано из группы, включающей представителей семейств мармозеток и тамаринов, обезьян Старого Света, карликовых и мышиных лемуров, гиббонов и малых человекообразных обезьян, настоящих лемуров, а также их гибриды. В одном варианте реализации экспериментальное животное представляет собой макака-резус, или мармозетку, или павиана, или обезьяну циномолгус. В одном из вариантов реализации экспериментальное животное представляет собой макака. В одном из вариантов реализации экспериментальное животное представляет собой обезьяну циномолгус или макака-резус.
Один из аспектов, изложенный в настоящем изобретении, представляет собой применением антител, которые специфично связываются с терапевтическим антителом класса IgG1 человека для определения концентрации суммарного, активного, ADA-связанного (связанного с антителом к лекарственному препарату), или антигенсвязанного терапевтического антитела в образце, полученном от экспериментального животного, при этом указанное антитело связывается с таким же эпитопом, что и антитело, продуцируемое клеточной линией DSM ACC3006, или DSM ACC3007, или DSM ACC3008, или DSM ACC3076.
Один из аспектов, изложенный в настоящем изобретении, представляет собой композицию антител, содержащую смесь антитела, продуцируемого клеточной линией DSM ACC3006, и/или клеточной линией DSM ACC2708, и/или клеточной линии DSM ACC3007, и/или клеточной линией DSM ACC3008, и/или клеточной линией DSM ACC3076.
Один из аспектов, изложенный в настоящем изобретении, представляет собой применение композиции антител согласно настоящему изобретению в способе согласно настоящему изобретению.
В одном варианте реализации иммуноанализ представляет собой иммуноанализ формата «сэндвич». В другом варианте реализации конъюгацию антитела с его молекулой-партнером осуществляют с помощью химического связывания N-концевой и/или ε-аминогруппы (лизин), ε-аминогруппы разных лизинов, карбокси-, сульфгидрильной-, гидроксильной и/или фенольной функциональных групп аминокислотного остова антитела и/или сахарных спиртовых групп углеводной структуры антител. В одном из вариантов реализации иммобилизованное антитело иммобилизовано с помощью пары молекул со специфическим связыванием. В одном варианте реализации иммобилизованное антитело конъюгировано с биотином, и иммобилизация осуществляется с помощью иммобилизованного авидина или стрептавидина. В одном варианте реализации меченое антитело конъюгировано с детектируемой меткой с помощью пары молекул со специфическим связыванием. В одном варианте реализации меченое антитело конъюгировано с дигоксигенином и связывание с детектируемой меткой осуществляется с помощью антител против дигоксигенина. В одном из вариантов реализации терапевтическое антитело представляет собой человеческое или гуманизированное антитело. В одном варианте реализации человеческое или гуманизированное антитело представляет собой моноклональное антитело. В одном варианте реализации детектируют суммарное терапевтическое антитело, в другом варианте реализации детектируют активное терапевтическое антитело, и в еще одном варианте реализации детектируют терапевтическое антитело, которое связано со своим антигеном.
Подробное описание изобретения
Антитело против IgG человека, обозначенное как M-R10Z8E9 (полученное из клеточной линии DSM ACC2708), связывается с эпитопом в домене СН2 человеческого иммуноглобулина класса G рядом с сайтом гликозилирования Asn297. Описанное в настоящей заявке антитело М-1.19.31 (продуцируемое клеточной линией DSM ACC3076) демонстрирует более низкую перекрестную реактивность, по сравнению с антителом M-R10Z8E9, связывается с другим эпитопом в области Fab, чем антитело M-R10Z8E9, продуцируемое клеточной линией DSM ACC2708, антитело М-1.3.2, продуцируемое клеточной линией DSM АСС3006, антитело М-1.5.8, продуцируемое клеточной линией DSM ACC3007, и антитело М-1.7.10, продуцируемое клеточной линией DSM ACC3008, на него не оказывает влияния соседний сайт гликозилирования и может его применять в иммуноанализе для определения терапевтического антитела, в частности Fab-фрагмента терапевтического антитела, вместе с антителом M-R10Z8E9, продуцируемым клеточной линией DSM ACC2708, антителом М-1.3.2, продуцируемым клеточной линией DSM АСС3006, антителом М-1.5. 8, продуцируемым клеточной линией DSM ACC3007, и/или антителом М-1.7.10, продуцируемым клеточной линии DSM ACC3008, поскольку сайты связывания каждого из антител представлены только один раз в Fab-фрагменте человеческого или гуманизированного антитела.
Термин «терапевтическое антитело» обозначает антитело, которое тестируют в клинических исследованиях для одобрения его в качестве терапевтического средства для применения у человека и которое можно вводить индивиду для лечения заболеваний. В одном варианте реализации терапевтическое антитело представляет собой моноклональное антитело. В еще одном варианте реализации терапевтическое антитело получено от человекообразной обезьяны или от животного, трансформированного локусом, кодирующим антитело человека, или оно представляет собой моноклональное антитело человека или гуманизированное моноклональное антитело. В одном варианте реализации терапевтическое антитело представляет собой человеческое моноклональное антитело. В еще одном варианте реализации терапевтическое антитело представляет собой гуманизированное моноклональное антитело. Терапевтические антитела широко применяют для лечения различных заболеваний, таких как онкологические заболевания (например, гематологические и солидные злокачественные новообразования, включая неходжкинскую лимфому, рак молочной железы и колоректальный рак), иммунологические заболевания, заболевания центральной нервной системы, сосудистые болезни или инфекционные заболевания. Такими антителами, например, являются антитела к CD19, CD20, CD22, HLA-DR, CD33, CD52, EGFR, G250, GD3, HER2, PSMA, CD56, VEGF, VEGF2, СЕА, антигену Люис Y, рецептору IL-6 (IL6R) или рецептору IGF-1 (IGF1R).
Термин «антитело» включает различные формы антител, включая целые антитела и фрагменты антител. Антитело в соответствии с настоящим изобретением в одном из вариантов реализации представляет собой человеческое антитело, гуманизированное антитело, химерное антитело или антитело, лишенное Т-клеточного антигена. Конструирование антител с помощью методов генетической инженерии, например, описано в работах Morrison, S.L., et al., Proc. Natl. Acad Sci. USA 81 (1984) 6851-6855; патент США №US 5202238 и US 5204244; Riechmann, L, et al., Nature 332 (1988) 323-327; Neuberger, M.S., et al., Nature 314 (1985) 268-270; Lonberg, N., Nat. Biotechnol. 23 (2005) 1117-1125. В зависимости от аминокислотной последовательности константной области тяжелой цепи антитела разделяют на следующие классы: IgA, IgD, IgE, IgG и IgM. Некоторые из этих классов, в свою очередь, делятся на подклассы (изотипы), т.е. IgG подразделяют на IgG1, IgG2, IgG3 и IgG4, IgA - на IgA1 или IgA2. В соответствии с классом иммуноглобулина, к которому принадлежит антитела, константные области тяжелой цепи иммуноглобулинов обозначают, соответственно: α (IgA), δ (IgD), ε (IgE), γ (IgG) и µ (IgM). Термин «антитело человека класса IgG1» обозначает антитело, аминокислотная последовательность константных доменов которого происходит от аминокислотной последовательности IgG1 человека, приведенной в SEQ ID NO:01, SEQ ID NO:02, SEQ ID NO:03 или SEQ ID NO:04. В таком антителе должен присутствовать по меньшей мере домен СН1. Этот термин включает человеческие антитела, гуманизированные антитела, химерные антитела и конъюгаты антител.
«Гуманизированные» формы антител, полученных не от человека (например, от грызунов), представляют собой химерные антитела, которые включают часть последовательности от антитела, полученного не от человека, и часть последовательности от человеческого антитела. В основном гуманизированные антитела получают на основе человеческого антитела (антитело-реципиент), в котором остатки из гипервариабельного участка заменяют остатками из гипервариабельного участка антитела, обладающего требуемой специфичностью и аффинностью, полученного от вида, отличного от человека (антитело-донор), такого как мышь, крыса, кролик или примат. В ряде случаев остатки каркасной области (FR) антитела человека заменяют соответствующими остатками антитела, полученного не от человека. Кроме того, гуманизированные антитела могут включать дополнительные модификации, например остатки аминокислот, которые не встречаются в антителе-реципиенте или в антителе-доноре. Данные модификации приводят к образованию вариантов таких антител-реципиентов или антител-доноров, которые гомологичны, но не идентичны соответствующей родительской последовательности. Такие модификации осуществляют для проведения дальнейшей очистки антитела.
Как правило, гуманизированное антитело включает в основном все из по меньшей мере одного и, как правило, двух вариабельных доменов, в которых все или в основном все из гипервариабельных петель соответствуют петлям антитела-донора, полученного не от человека, и все или в основном все из каркасных областей FR представляют собой области человеческого антитела-реципиента. Гуманизированное антитело также может включать по меньшей мере часть константной области антитела, как правило, человеческого антитела.
Методы гуманизации антител, полученных не от человека, описаны в данной области техники. В одном варианте реализации гуманизированное антитело имеет один или более аминокислотный остаток, введенный в него из антитела вида, отличного от человека. Такие аминокислотные остатки от вида, отличного от человека, часто называют «импортированными» остатками, которые, как правило, взяты из «импортированного» вариабельного домена. Гуманизацию в основном проводят согласно методу, предложенному Winter с сотрудниками путем замещения последовательностей гипервариабельных участков соответствующими последовательностями антитела, полученного не от человека. Таким образом, такие «гуманизированные» антитела представляют собой химерные антитела, в которых по существу меньший участок, чем интактный человеческий вариабельный домен, замещен соответствующей последовательностью, полученной от вида, отличного от человека. В действительности гуманизированные антитела, как правило, представляют собой человеческие антитела, в которых некоторые остатки гипервариабельного участка и, возможно, некоторые остатки каркасной области замещены остатками из аналогичных сайтов антител грызунов или приматов, отличных от человека.
Термин «моноклональное антитело» при использовании в настоящей заявке относится к антителу, полученному из популяции по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, идентичны, за исключением возможных природных мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются высокоспецифичными, будучи направленными на единственный антигенный сайт. Кроме того, в противоположность препаратам поликлональных антител, которые включают разные антитела, направленные на различные антигенные сайты (детерминанты или эпитопы), каждое моноклональное антитело направлено на один антигенный сайт на антигене. В дополнение к своей специфичности, моноклональные антитела имеют преимущество в том, что их можно синтезировать без загрязнения другими антителами. Определение «моноклональное» указывает на тип антитела как получаемого из по существу гомогенной популяции антител, и его не следует ограничивать требованием того, чтобы антитело было образовано каким-либо определенным способом.
Термин «химерное антитело» означает антитело, содержащее вариабельный домен, т.е. область связывания, полученный от первого вида и по меньшей мере часть константной области, полученной от другого второго источника или вида, которое обычно получают с помощью методов рекомбинантной ДНК.
Термин «экспериментальное животное» при использовании в настоящей заявке обозначает представителей семейств порядка приматов, включающего мармозеток и тамаринов (семейство Callitrichidae), капуцинов (семейство Cebidae), мартышек (семейство Cercopithecidae), карликовых и мышиных лемуров (семейство Cheirogaleidae), айе-айе (семейство Daubentoniidae), различные виды галаго (семейство Galagonidae), гиббонов и других представителей гиббоновых (семейство Hylobatidae), индри, сифака и близкие виды (семейство Indridae), настоящих лемуров (семейство Lemuridae), лори (семейство Loridae), тонкотелых лемуров (семейство Megaladapidae), долгопятов (семейство Tarsiidae), а также их гибриды.
В одном варианте реализации экспериментальное животное выбрано из группы, включающей членов семейства мармозеток и тамаринов, обезьян Старого Света, карликовых и мышиных лемуров, гиббонов и малых человекообразных обезьян, настоящих лемуров, а также их гибриды. В этом варианте реализации исключены ближайшие родственники человека, высшие приматы, в частности группа шимпанзе, бонобо, гориллы и орангутанги. В одном варианте реализации экспериментальное животных является представителем рода Macaca. В одном варианте экспериментальное животное выбрано из Масаса fascicularis (яванский макак, или циномолгус) и Масаса mulatta (макак-резус).
«Образец» согласно настоящему изобретению может представлять собой образец любой ткани или жидкости, полученный от экспериментального животного. Предпочтительно, образец представляет собой жидкость, такую как слюна, моча, цельная кровь, плазма или сыворотка. Предпочтительно, образец представляет собой цельную кровь, плазму или сыворотку.
«Антитело, специфично связывающееся с терапевтическим антителом человека класса IgG1 и не связывающееся специфично с антителом экспериментального животного» или «антитело, которое специфично связывается с терапевтическим антителом человека класса IgG1 и не связывается специфично с антителом экспериментального животного», связывается с терапевтическим антителом человека класса IgG1 с константой диссоциации (=Kдисс), равной по меньшей мере 10-8 моль/л. Таким образом, термин «специфичное связывание» обозначает связывание антитела или Fab-фрагмента с константой диссоциации (=Kдисс) от 10-8 моль/л или менее. Термины «не связывающийся специфично» или «не связывается специфично» обозначает связывание антитела или Fab-фрагмента с константой диссоциации (=Kдисс) в большей мере 10-7 моль/л и более, т.е. 10-5 моль/л. В то же время свойство «отсутствие специфичного связывания с антителами экспериментального животного» обеспечивается Kдисс, равной 10-7 моль/л или менее эффективно. В одном варианте реализации антитело, специфично связывающееся с терапевтическим антителом, но не связывающееся специфично с антителами экспериментального животного, будет иметь разницу по Kдисс не менее 100 раз по сравнению с его реактивностью по отношению к антителу человека класса IgG1 и по отношению к антителу экспериментального животного.
Свойства связывания антитела, в частности Kдисс, в одном варианте реализации оценивают с помощью прибора BIAcore®. В этом методе свойства связывания оценивают по изменению поверхностного плазменного резонанса (ППР, англ. surface plasmon resonance, SPR). Как правило, анализируемое антитело связывают с твердофазным носителем (так называемым «чипом») и оценивают связывание моноклонального антитела, поликлонального антитела или даже сыворотки, содержащей IgG, с антителами, нанесенными на такой чип.
Термин «эпитоп» обозначает белковую детерминанту, способную специфично связываться с антителом. Эпитопы обычно состоят из химически активных поверхностных групп молекул, таких как аминокислоты или боковые цепи сахара, и обычно эпитопы имеют характерную трехмерную структуру, а также специфический заряд. Конформационные и неконформационные эпитопы отличаются тем, что связывание с первыми, но не с последними, нарушается в присутствии денатурирующих растворителей. В одном варианте реализации антитело, описанное в настоящей заявке, связывается с нативным, но не с денатурированным IgG1 человека.
Термин «связывание с тем же эпитопом, как и антитело, продуцируемое клеточной линией DSM ACC3076» при использовании в настоящей заявке, относится к антителу, которое связывается с тем же эпитопом IgG1 человека, с которым связывается и антитело М-1.19.31 (продуцируемое клеточной линией DSM ACC3076). Свойства связывания с эпитопом антитела, связывающегося с антителом класса IgG1 человека, в соответствии с настоящим изобретением, можно определить с помощью методов, известных в данной области. Связывание IgG1 человека можно определить с помощью поверхностного плазменного резонанса (ППР) при 25°С в анализе конкурентного ингибирования in vitro для определения способности антитела ингибировать связывание антитела М-1.19.31 с IgG1 человека. Такой анализ можно провести с помощью системы BIAcore (Pharmacia Biosensor AB, Uppsala, Sweden), как описано, например, в Примере 12. В Примере 12 процент (%) ожидаемого ответа связывания антитела с антителом человека IgG1 класса в соответствии с настоящим изобретением, конкурирующим с антителом М-1.19.31, рассчитывается по Формуле I
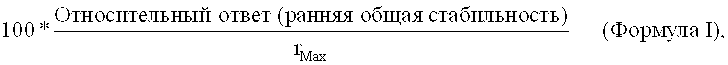
где rMax рассчитывается по Формуле II
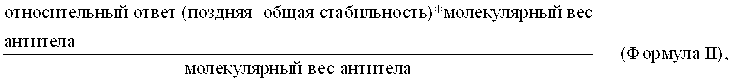
как описано в инструкции по картированию эпитопов с помощью системы BIAcore. Минимальный ответ связывания также рассчитывают с помощью пары одинаковых антител 1 и 2 (см. Пример 12). Таким образом, полученное максимальное значение +50% принимается за пороговое значение для значимой конкуренции и, таким образом, значимого связывания с тем же эпитопом.
В одном аспекте в настоящей заявке описаны антитела, которые конкурируют с антителами М-1.19.31 для связывания с антителом человека класса IgG1. Такое конкурентное связывание можно определить с помощью методов, известных в данной области. Связывания антител определяют при 25°C с помощью поверхностного плазменного резонанса (ППР) в анализе конкурентного ингибирования in vitro, определяя способность антител ингибировать связывание антитела М-1.19.31 с антителом человека класса IgG1. Такой анализ можно провести с помощью системы BIAcore (Pharmacia Biosensor AB, Uppsala, Sweden), как описано, например, в Примере 12.
Антитело, специфично связывающееся с (терапевтическим) антителом человека класса IgG1, но связывающееся специфично с антителом экспериментального животного, в одном варианте реализации представляет собой моноклональное антитело, или фрагмент такого антитела, или генетическую конструкцию, включающую связывающий домен такого антитела. Можно применять любой фрагмент антитела, сохраняющий вышеуказанные критерии специфичного связывания с антителом человека класса IgG1 и отсутствия специфичного связывания с антителом экспериментального животного.
Возможно, в ходе доклинических исследований, будет необходимо оценивать различные аспекты, связанные с применением терапевтических антител человека класса IgG1 у экспериментальных животных. В некоторых ситуациях может быть необходим анализ суммарного количества терапевтических антител человека класса IgG1, или может быть необходим анализ некоторых фрагментов терапевтического антитела человека класса IgG1, или некоторых модификаций терапевтического антитела человека класса IgG1, или концентрации терапевтического антитела человека класса IgG1, связанного с антигеном, или доли терапевтического антитела человека класса IgG1, способного специфично связываться с антигеном. В одном из вариантов реализации антитела и способы, описанные в настоящей заявке, можно применять для детекции суммарного, активного, ADA-связанного или связанного с антигеном терапевтического антитела человека класса IgG1, соответственно. Термин «суммарное терапевтическое антитело» относится к любому определяемому антителу, вне зависимости от того, является ли антитело активным (т.е. сохраняющим способность взаимодействовать со своим антигеном), неактивным и/или связанным с антигеном. Суммарное терапевтическое антитело можно разделить на активное терапевтическое антитело и неактивное терапевтическое антитело.
Термин «активное терапевтическое антитело» обозначает терапевтическое антитело, присутствующее в организме экспериментального животного, которое сохраняет способность к связыванию со своим антигеном. Данные антитела, например, не содержат в своем антигенсвязывающем центре связанного антигена или какую-либо другую молекулу.
«Неактивное терапевтическое антитело» можно подразделить на связанное с антигеном терапевтическое антитело, связанное с терапевтическим антителом терапевтическое антитело (терапевтическое антитело, связанное с антителом к лекарственному препарату, англ. ADA, anti-drug antibody, ADA-связанное терапевтическое антитело) и денатурированное антитело.
Термин «связанное с антигеном терапевтическое антитело» обозначает терапевтическое антитело, в том виде, как оно присутствует в кровотоке экспериментального животного, которое связано со своим антигеном.
Суммарное, активное, ADA-связанное или антигенсвязанное терапевтическое антитело, как определено выше, можно непосредственно определить с помощью антитела и в способах, как описано в настоящем изобретении. Кроме того, можно обнаружить другие формы неактивных терапевтических антител, таких как терапевтические антитела, связанные с антителами к лекарственному препарату, или антиидиотипические антитела, или, в частности, нейтрализующие антитела против лекарственного препарата.
Кроме того, возможно также косвенным образом оценить любое «неактивное терапевтическое антитело». Такое неактивное терапевтическое антитело может, например, представлять собой терапевтическое антитело, связанное со своим антигеном, терапевтическое антитело, связанное с перекрестно реактивным антигеном, или терапевтическое антитело, блокированное аутоантителом или антиидиотипическим антителом к терапевтическому антителу. В случае, если количество суммарного антитела больше, чем сумма активного антитела и связанного с антигеном антитела, то будет присутствовать дополнительная фракция антитела, содержащая неактивное антитело, не связанное с соответствующим антигеном.
Суммарное терапевтическое антитело, например, можно выявить с помощью так называемой системы конкурентного иммуноанализа или системы анализа типа «сэндвич». Такой анализ можно проводить в одном варианте реализации без стадии отмывки (гомогенный иммуноанализ), или, как в другом варианте реализации, со стадией отмывки (гетерогенный иммуноанализ).
В одном варианте реализации суммарное терапевтическое антитело детектируют в иммуноанализе типа «сэндвич», при этом с обеих сторон «сэндвича» применяют антитело, которое специфично связывается с терапевтическим антителом, но не связывается специфично с антителом экспериментального животного. Антитело, применяемое с одной стороны такого «сэндвича» связано или способно связываться с твердофазной подложкой (часто упоминается как антитело захвата или иммобилизованное антитело), тогда как антитело на другой стороне такого «сэндвича» мечено для облегчения прямой или опосредованной детекции (так называемое меченое антитело, или антитело для детекции). Количество меченого антитела, связавшегося в такой системе анализа типа «сэндвич», напрямую коррелирует с количеством терапевтического антитела в исследуемом образце.
Детекция активного терапевтического антитела в образце может быть осуществлена с помощью подходящих процедур, известных в данной области техники. Однако детекция суммарного терапевтического антитела или фракции терапевтического антитела, связанной антигеном, достаточно сложна и требует совершенно иных систем анализа и, в частности, требует специально подобранных реагентов для каждого из различных вариантов анализа. С помощью антитела, описанного в настоящей заявке, которое специфично связывается с терапевтическим антителом, но связывается специфично с антителом экспериментального животного, можно оценить долю активного терапевтического антитела, суммарного терапевтического антитела, связанного с ADA или связанного с антигеном терапевтического антитела в тест-системах, которые аналогичны друг другу. Такая сравнительная оценка суммарного, активного, связанного с ADA или связанного с антигеном терапевтического антитела имеет преимущества, поскольку в данном случае осуществляется количественное сравнение этих различных фракций терапевтического антитела.
В одном варианте реализации для детекции активного терапевтического антитела разрабатывают систему анализа типа «сэндвич». В одном варианте реализации антитело, которое специфично связывается с терапевтическим антителом, но не связывается специфично с антителом экспериментального животного, применяют в качестве иммобилизованного антитела, а на этапе детекции такого анализа «сэндвич» либо используют антиген в меченой форме, либо после связывания антигена применяют второе антитело, не связывающееся или конкурирующее с эпитопом, узнаваемым терапевтическим антителом, при этом второе антитело специфично детектируемо, и/или мечено для облегчения прямой или косвенной детекции.
Связанное с антигеном терапевтическое антитело в одном варианте реализации выявляют с помощью анализа в формате «сэндвич», используя в качестве реагента «захвата» антитело, специфично связывающееся с терапевтическим антителом, но не связывающееся специфично с антителом экспериментального животного. При детекции, в одном из вариантов реализации, применяют второе антитело, которое связывается с эпитопом антигена, который не конкурирует с эпитопом терапевтического антитела. Второе антитело, в одном варианте реализации, метят для облегчения прямой или косвенной детекции.
Для прямой детекции метящая группа может быть выбрана из любых известных детектируемых маркерных групп, таких как красители, люминесцентные метящие группы, такие как хемолюминесцентные группы, например акридиновые эфиры или диоксетаны, либо флуоресцентные красители, например флуоресцеин, кумарин, родамин, оксацин, резофурин, цианин или их производные. Другими примерами метящих групп являются люминесцентные комплексы металлов, такие как комплексы рутения или европия, ферменты, например, как используют для ELISA (твердофазный иммуноферментный анализ) или для CEDIA (иммуноанализ с донорным клонированным ферментом), и радиоизотопы. В одном варианте реализации групп, испускающих сигнал, в качестве детектируемых меток можно применять хелаты металлов, которые могут быть детектированы посредством электрохемилюминесценции, при этом особое предпочтение отдается хелатам рутения. В одном из вариантов реализации метящая группа представляет собой рутений(бипиридил)3 2+ хелат.
Системы опосредованной детекции включают реагент для детекции, например антитело для детекции, меченный первым партнером связывающейся пары. Примерами подходящих пар связывания являются гаптен или антиген/антитело, биотин или аналоги биотина, такие как аминобиотин, иминобиотин или дезтиобиотин/авидин или срептавидин, сахар/лектин, нуклеиновая кислота или аналог нуклеиновой кислоты/комплементарная нуклеиновая кислота и рецептор/лиганд, например рецептор стероидного гормона/стероидный гормон. В одном варианте реализации первый член пары связывания выбран из гаптена, антигена или гормона. В одном варианте реализации гаптен выбран из дигоксигенина и биотина и их аналогов. Второй партнер такой пары связывания, например антитело, стрептавидин и т.п., обычно метят, чтобы обеспечить возможность прямой детекции, например, с помощью меток, как описано выше.
Во всех вышеописанных иммунологических методах детекции выбирают условия для реагентов, которые обеспечивают связывание используемых реагентов, например связывание антитела с соответствующим антигеном. Специалист в данной области обычно описывает результат такого связывания с помощью термина «комплекс». Образование комплекса согласно настоящему изобретению коррелирует согласно положению процедур, известных в данной области техники, с соответствующей концентрацией указанного терапевтического антитела. В зависимости от применяемого реагента для детекции на этапе установления корреляции можно получить данные о концентрации суммарного, активного, связанного с ADA или антигенсвязанного терапевтического антитела.
Как будет понятно специалисту в данной области специалист, способы, представленные в настоящем изобретении, позволяют определить концентрации суммарного, антигенсвязанного, активного и даже неактивного терапевтического антитела. Вследствие применения одного и того же реагента, т.е. антитела, связывающегося с терапевтическим антителом и не связывающегося с антителом указанного экспериментального животного, в различных системах анализах, полученные значения можно легко сравнить друг с другом и даже оценить их соотношения. В другом предпочтительном варианте реализации настоящее изобретение относится к соотношению активного и суммарного терапевтического антитела. Данное соотношение действительно может служить показателем эффективности терапевтического антитела.
Было обнаружен один эпитоп, который присутствует на антителах класса IgG1 человека и отсутствует на антителах других классов IgG человека, таких как IgG2, IgG3 и IgG4, и который также отсутствует на антитела экспериментального животного, в частности на иммуноглобулинах обезьян циномолгус или макак-резус. Этот эпитоп характеризуется связыванием с антителом М-1.19.31, продуцируемым депонированной клеточной линией DSM ACC3076. В связи с этим один из аспектов, описанный в настоящей заявке, относится к антителу, продуцируемому клеточной линией DSM ACC3076.
Поскольку данный эпитоп, который распознается антителом, продуцируемым депонированной клеточной линией, имеет уникальную Fab-область антитела человека класса IgG1, еще один аспект, описанный в настоящей заявке, относится к эпитопу, связывающемуся с антителом, полученным из депонированной клеточной линии DSM ACC3076. Поскольку данное антитело идентифицируется по его связыванию с Fab-фрагментом антитела, указанный эпитоп дополнительно характеризуется тем, что он находится на определенном Fab-фрагменте антитела человека класса IgG1. В одном варианте реализации указанный эпитоп характеризуется тем, что он находится на домене СН1 человеческого IgG1. В одном аспекте, описанном в настоящей заявке, антитело специфично связывается с терапевтическим антителом человека класса IgG1, но не связывается специфично с антителом экспериментального животного, и указанное антитело характеризуется тем, что оно представляет собой антитело к тому же эпитопом, что антитело, продуцируемое клеточной линией DSM ACC3076.
Например, можно применять способ, в котором определяют идентичность эпитопа или перекрывание связывания эпитопа с двумя различными антителами с помощью системы анализа конкурентного связывания. Для этого, например, с помощью иммуноферментного анализа оценивают степень, в которой исследуемое антитело конкурирует с известным антителом при связывании с иммобилизованным антигеном-мишенью. Для этой цели соответствующий иммобилизованный антиген-мишень инкубируют с известным меченым антителом и с избытком исследуемого антитела. По детекции связанного меченого антитела можно легко установить ту степень, в которой исследуемое антитело может вытеснять при связывании известное антитело. Если такое вытеснение составляет более 20% или в другом варианте более 30%, при такой же концентрации, степень вытеснения составляет более 70%, или в другом варианте реализации - более 80%, при более высоких концентрациях, в одном варианте реализации при 103-105-обратном избытке исследуемого антитела относительно известного антитела, то в таких случаях наблюдается перекрывание эпитопа, и оба антитела связываются одним и тем же эпитопом или с перекрывающимися эпитопами.
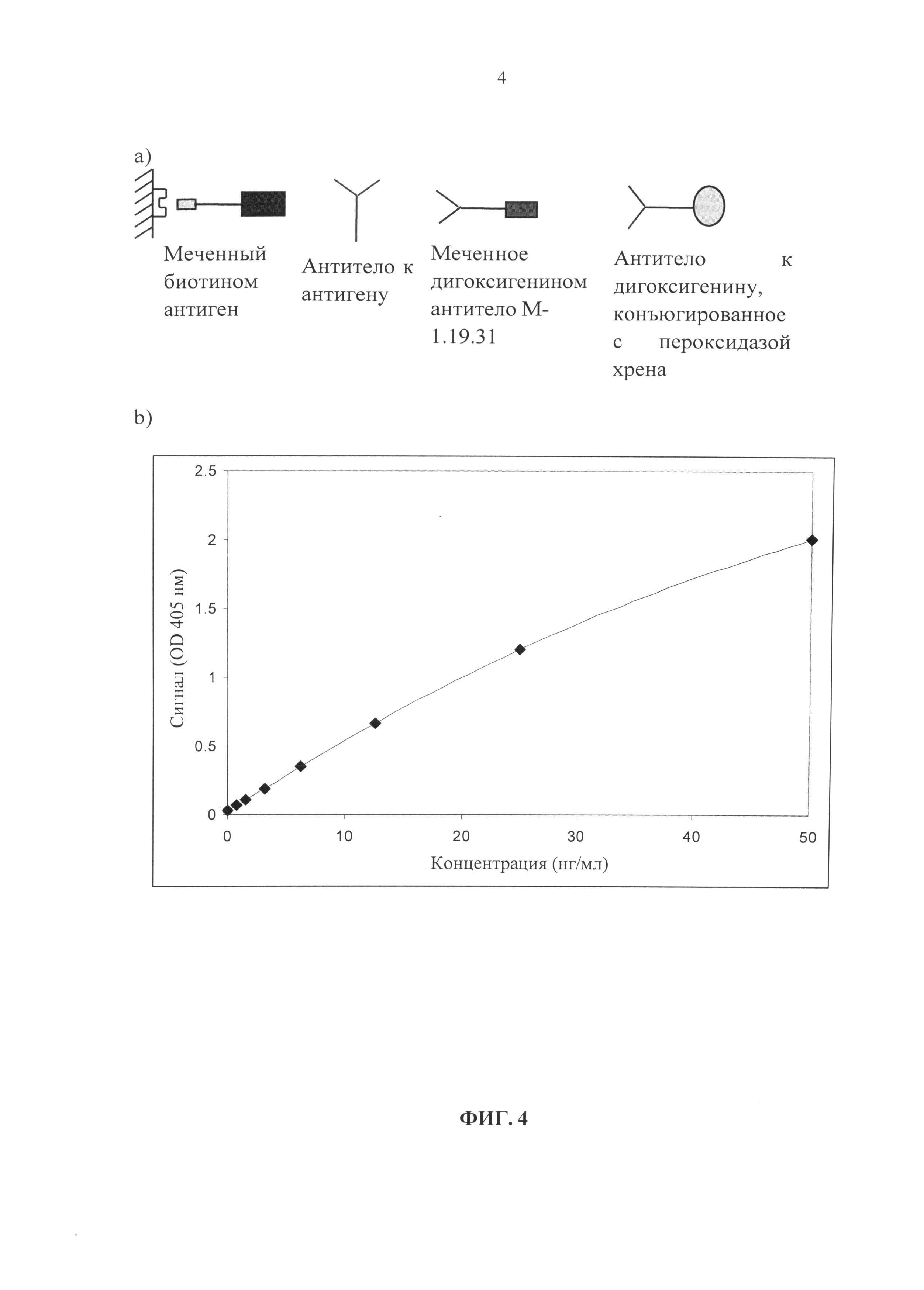
Специфичность антитела, полученного из депонированной клеточной линии DSM ACC3076, может быть продемонстрирована с помощью ИФА типа «сэндвич» с применением соответствующих вариантов антител, одно из которых мечено биотинином, а другое - дигоксигенином, и сыворотки от различных видов. В таком анализе (см. схему на Фиг. 1) иммобилизованное антитело («антитело захвата») и антитело для детекции (меченое антитело) получены из одной и той же клеточной линии и связываются с идентичными эпитопами. Чтобы такая система анализа была в целом применима для детекции и количественного определения человеческого IgG в сыворотке крови экспериментального животного, в такой системе анализа необходимо антитело к IgG человека, сайт связывания которого не зависит от каких-либо вторичных модификаций антитела, таких как, например, наличия сайтов гликозилирования или потенциальных сайтов дезаминирование. В противном случае была бы необходима оптимизация анализа для каждого нового терапевтического антитела, которое необходимо детектировать и оценить количественно. Кроме того, описанное в настоящей заявке антитело также отличается от анализируемого терапевтического антитела, и его можно применять в качестве стандарта и положительного контроля.
Таким образом, антитело, описанное в настоящей заявке, высокоспецифично по отношению к иммуноглобулинам человека и шимпанзе класса G, и оно проявляет лучшую межвидовую специфичность, чем антитело M-R10Z8E9, и не связывается специфично с иммуноглобулином класса G экспериментального животного.
Специфичность антитела, описанного в настоящей заявке, также может быть продемонстрирована с применением явления поверхностного плазменного резонанса с использованием технологии BIAcore. С помощью экспериментов дот-блот можно показать, что эпитоп, с которым связывается антитело, описанное в настоящей заявке, представляет собой конформационный эпитоп, поскольку связывание не происходит при денатурации иммуноглобулина человека (Фиг. 2).
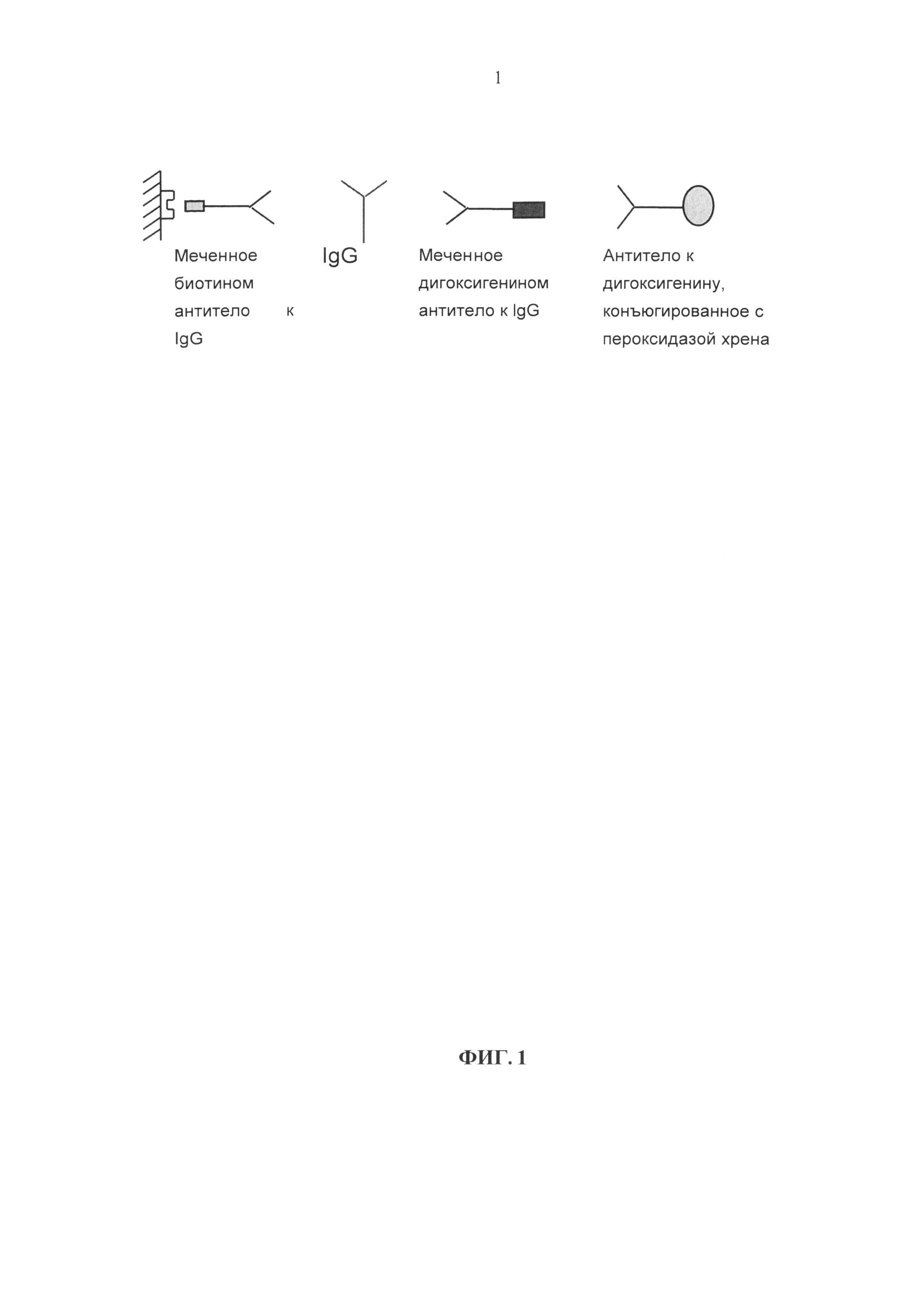
Другой аспект, описанный в настоящем документе, представляет собой систему количественного анализа антитела класса IgG1 человека или его производного, такого как Fab-фрагмент, содержащий домен СН1 человеческого IgG1, в образце, полученном от экспериментального животного, содержащую меченные биотином антитела, как описано в настоящей заявке, в качестве иммобилизованных антител («антител захвата») и меченые дигоксигенином антитела, как описано в настоящей заявке, в качестве антител-меток. На Фиг. 3 показана схема такого анализа («антитело захвата», например меченное биотином М-1.19.31, определяемое вещество: Fab-фрагмент антитела человека, «антитело-метка», например меченное дигоксигенином М-1.3.2). Для такого анализа необходимы «антитело захвата» и «антитело-метка», которые связываются с Fab-фрагментами человеческого IgG по двум различным эпитопам.
Другой аспект, описанный в настоящей заявке, представляет собой систему анализа, включающего «антитело захвата» и «антитело-метку», которые специфично связываются с эпитопами на различных доменах человеческого IgG. В таком варианте анализа только интактное терапевтическое антитело даст положительный результат анализа и детектируемый сигнал. В одном варианте реализации «антитело захвата» и «антитело-метка» независимо выбраны из антитела М-1.3.2, 1.5.8 М-, М-1.7.10 и М-1.19.31, с одной стороны, и антитела М-R10Z8E9, с другой стороны. В примере варианта анализа в соответствии с этим аспектом для доказательства структурной целостности человеческого IgG у экспериментального животного, в качестве «антитела захвата» можно применять меченное биотином M-R10Z8E9, в качестве определяемого вещества - антитело к IL13R, и в качестве «антитела-метки» - меченное дигоксигенином М-1.19.31 (на Фиг. 4 приведена схема анализа и калибровочная кривая для данного анализа).
Еще один аспект, описанный в настоящей заявке, представляет собой систему анализа, в котором антитело к IgG человека применяется в качестве стандарта и/или положительного контроля, имитирующего антитело против лекарственного средства (ADA, anti-drug antibody). Такую систему можно применять при разработке системы анализа для определения оптимальных условий анализа и для проверки надежности анализа, т.е. для проверки результативности анализа с различными стандартными реагентами/положительными контролями. Особенно предпочтительной данная система является с учетом того, что ADA-антитела могут быть поликлональными, и они могут быть направлены как к Fab-фрагментам, так и к Fc-области.
В еще одном аспекте, описанном в настоящей заявке, антитело, полученное из клеточной линии DSM ACC3076, применяют в качестве антитела, специфично связывающегося с терапевтическим антителом человека класса IgG1, но не связывающегося специфично с антителом экспериментального животного в способе, описанном в настоящей заявке.
Один аспект, описанный в настоящей заявке, относится к применению антитела, которое специфично связывается с терапевтическим антителом человека класса IgG1, но не связывается специфично с антителом экспериментального животного для определения концентрации суммарного, активного, ADA-связанного или связанного с антигеном терапевтического антитела человека класса IgG1 в образце, полученном от экспериментального животного. В одном варианте реализации антитело, применяемое в указанном способе, выбрано из антитела к такому же эпитопу или к эпитопу, перекрывающемуся с эпитопом антитела, полученного из клеточной линии DSM ACC3076.
Один аспект, описанный в настоящей заявке, относится к применению двух антител, оба из которых специфично связываются с терапевтическим антителом человека класса IgG1, но не связываются специфично с антителом экспериментального животного, для определения концентрации суммарного, активного, ADA-связанного или связанного с антигеном антитела терапевтического антитела человека класса IgG1 в образце, полученном от экспериментального животного, при этом одно из антител представляет собой антитело «захвата», а другое антитело представляет собой меченое антитело. В одном варианте реализации терапевтическое антитело представляет собой Fab-фрагмент.
Гибридомные клеточные линии MAK <H-IgG> M-1.3.2, MAK <H-IgG> M-1.5.8, MAK <H-IgG> М-1.7.10, MAK <H-IgG> М-1.19.31, экспрессирующие антитела М-1.3.2, 1.5.8 М-, М-1.7.10 и М-1.19.31, соответственно, депонированы в соответствии с Будапештским договором о международном признании депонирования микроорганизмов для целей патентной процедуры в Немецкой коллекции микроорганизмов и клеточных культур (Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH (DSMZ)), Германия:
|
Указанные клеточные линии и антитела, полученные из указанных клеточных линий, представляют собой аспекты настоящего изобретения.
Конкретные варианты реализации
Вариант 1: Моноклинальное антитело, отличающееся тем, что антитело специфично связывается с антителом человека класса IgG1 и не связывается специфично с иммуноглобулином макака-резус, мармозетки, павиана и циномолгуса.
Вариант 2: Антитело согласно Варианту 1, отличающееся тем, что антитело связывается с легкой цепью каппа антитела человека класса IgG1.
Вариант 3: Антитело по любому из предыдущих вариантов, отличающееся тем, что антитело не связывается с легкой цепью лямбда антитела человека класса IgG1.
Вариант 4: Антитела по любому из Вариантов 1 и 2, отличающееся тем, что антитело связывается с легкой цепью лямбда антитела человека класса IgG1.
Вариант 5: Антитело по любому из Вариантов 1, 2 и 4, отличающееся тем, что антитело не связывается с антителом человека класса IgG2.
Вариант 6: Антитело по любому из Вариантов 1, 2 и 4, 5, отличающееся тем, что антитело не связывается с антителом человека класса IgG4.
Вариант 7: Антитело по любому из Вариантов 1, 2 и 4, 6, отличающееся тем, что антитело связывается с легкой цепью лямбда Fab-фрагмента антитела человека класса IgG1.
Вариант 8: Антитело по любому из предыдущих Вариантов, отличающееся тем, что антитело связывается с легкой цепью каппа Fab-фрагмента антитела человека класса IgG1.
Вариант 9: Антитело по любому из предыдущих Вариантов, отличающееся тем, антитело не связывается с антителом человека класса IgG3.
Вариант 10: Антитело по любому из предыдущих Вариантов, отличающееся тем, что антитело представляет собой антитело, полученное от животного, не являющегося человеком.
Вариант 11: Антитело по любому из предыдущих Вариантов, отличающееся тем, что антитело специфично связывается с константной областью 1 тяжелой цепи антитела человека класса IgG1.
Вариант 12: Моноклональное антитело, полученное из клеточной линии DSM ACC3006.
Вариант 13: Моноклональное антитело, отличающееся тем, что антитело специфично связывается с таким же эпитом или с перекрывающимся эпитопом, как и антитело, продуцируемое клеточной линией DSM ACC3006 или клеточной линией DSM ACC3007.
Вариант 14: Клеточная линия DSM ACC3006.
Вариант 15: Моноклональное антитело, полученное из клеточной линии DSM ACC3007.
Вариант 16: Моноклональное антитело, полученное из клеточной линии DSM ACC3008.
Вариант 17: Моноклональное антитело, отличающееся тем, что антитело специфично связывается с таким же или перекрывающимся эпитопом, как и антитело, продуцируемое клеточной линией DSM ACC3008.
Вариант 18: Клеточная линия DSM ACC3007.
Вариант 19: Клеточная линия DSM ACC3008.
Вариант 20: Моноклональное антитело, полученное из клеточной линии DSM ACC3076.
Вариант 21: Моноклональное антитело, отличающееся тем, что указанное антитело специфично связывается с таким же или с перекрывающимся эпитопом, как и антитело, продуцируемое клеточной линией DSM ACC3076.
Вариант 22: Клеточная линия DSM ACC3076.
Вариант 23: Применение антитела по любому из Вариантов 1-13 и 15-17, Вариантов 20-21 в иммуноанализе.
Вариант 24: Набор, включающий
а) антитело, полученное из клеточной линии DSM ACC3006, или DSM ACC3007, или DSM ACC3008, или DSM ACC3076 в качестве иммобилизованного реагента (реагента «захвата»),
б) антитело, полученное из клеточной линии DSM ACC3006, или DSM ACC3007, или DSM ACC3008, или DSM ACC3076 в качестве меченого реагента.
Вариант 25: Способ детекции терапевтического антитела человека класса IgG1 в образце, полученном от экспериментального животного, включающий стадии
а) инкубации анализируемого образца с моноклональными антителами по любому из Вариантов 1-13, 15-17 и 20- 21,
б) возможно, инкубации образца с реагентом для селективной детекции суммарного, активного, ADA-связанного или связанного с антигеном терапевтического антитела, и
в) установление корреляции комплекса, образованного на этапе (а) или (б) с присутствием терапевтического антитела, и таким образом, выявление терапевтического антитела.
Вариант 26: Способ определения терапевтического антитела человека класса IgG1 в образце, полученном от экспериментального животного, с применением иммуноанализа, включающего иммобилизованное антитело (антитело «захвата») и меченого антитела, отличающийся тем, что антитело захвата и/или индикаторное (меченое) антитело независимо выбраны из антитела по любому из Вариантов 1-13, 15-17 и 20-21.
Вариант 27: Способ по любому из Вариантов 25-26, отличающийся тем, что терапевтическое антитело представляет собой Fab-фрагмент.
Вариант 28: Антитело согласно Вариантам 1-13, 15-17 и 20-21 и способ согласно одному из Вариантов 25-27, отличающиеся тем, что экспериментальное животное выбрано из группы, включающей из представителей семейств мармозеток и тамаринов, обезьян Старого Света, карликовых и мышиных лемуров, гиббонов и малых обезьян, настоящих лемуров, а также их гибридов.
Вариант 29: Применение антитела, которое специфично связывается с терапевтическим антителом человека класса IgG1, но не связывающегося специфично с иммуноглобулином экспериментального животного, для определения концентрации суммарного, активного, ADA-связанного или связанного с антигеном терапевтического антитела в образце, полученном от экспериментального животного, при этом антитело представляет собой антитело по любому из вариантов 1-13, 15-17 и 20-21.
Вариант 30: Композиция антител, отличающаяся тем, что она содержит смесь антител, продуцируемых клеточной линией DSM ACC3006, и/или клеточной линией DSM ACC3007, и/или клеточной линией DSM ACC3008, и/или клеточной линией DSM ACC3076, и/или клеточной линией DSM ACC2708.
Вариант 31: Применение композиции антител согласно Варианту 30 в способе согласно одному из Вариантов 25-27.
Следующие примеры и фигуры приведены для облегчения понимания настоящего изобретения, объем которого изложен в прилагаемой Формуле изобретения. Очевидно, что возможны модификации процедур, изложенных в настоящей заявке, без отклонения от сущности настоящего изобретения.
Описание Фигур
SEQ ID NO:01 IgG1 человека (Европеоидный аллотип)
SEQ ID NO:02 IgG1 человека (Афроамериканский аллотип)
SEQ ID NO:03 Вариант IgG1 человека (Европеоидный аллотип)
SEQ ID NO:04 СН1-домен IgG1 человека
Описание Фигур
Фиг. 1. Формат системы анализа в общем виде для количественного определения антител человека (человеческих IgG) у экспериментального животного.
Фиг. 2. Дот-блот-анализ антител к IgG человека; в качестве типичных стандартных антител были выбраны антитела к P-селектину; референсное антитело нанесено в нативной форме (левая колонка) и в денатурированной форме (правая колонка) на нитроцеллюлозную мембрану, и оно детектировано соответствующими меченными дигоксигенином антителами к IgG человека;) М-R10Z8E9, б) М-1.19.31.
Фиг. 3. Количественный анализ производных антител человека в образце, полученном от экспериментального животного: схема анализа.
Фиг. 4. Анализ, доказывающий структурную целостность IgG человека у экспериментального животного: а) схема анализа, b) калибровочная кривая.
Пример 1 Получение F(ab')2-фрагмента IgG человека (иммуноген)
Полноразмерное антитело человека класса G (IgG человека) в 100 мМ натрий-цитратном буфере, рН 3,7, инкубировали с пепсином (1 мкг пепсина на мг IgG). Фрагментацию оценивали с помощью аналитической гель-фильтрации, останавливая ее после 90 минут путем подведения значения рН до 6,5 добавлением фосфата калия. После диализа смеси против 10 мМ натрий-цитратного буфера с 10 мМ хлоридом натрия, рН 5,5, раствор наносили на хроматографическую колонку с SP-сефарозой, изолированные фракции, элюированные в солевом градиенте, анализировали по отдельности путем аналитической гель-фильтрации. Пул, содержащий F(ab')2-фрагменты антител, наносили на аффинный матрикс с иммобилизованными поликлональными антителами против Fcγ-фрагментов человека для устранения остаточных количеств Fcγ-фрагментов. Элюаты объединяли, концентрировали до примерно 16 мг/мл и в заключение наносили на колонку для гель-фильтрации (Superdex 200).
Пример 2
Получение моноклональных антител к IgG человека
а) Иммунизация мышей
Самок мышей NMRI в возрасте 8-12 недель сначала иммунизировали внутрибрюшинно с помощью 100 мкг F(ab')2-фрагментов антител, полученных в соответствии с Примером 1, смешанных с ПАФ (полным адъювантом Фрейнда). Два последующих этапа внутрибрюшинной иммунизации проводили через 6 и 10 недель, каждый с помощью 100 мкг F(ab')2-фрагментов антител на мышь, смешанных с НАФ (неполным адъювантом Фрейнда). Затем за три дня до слияния проводили внутривенные бустер-инъекции, каждая с 50 мкг F(ab')2-фрагментов антител в ФСБ (фосфатно-солевом буфере).
б) Слияние и «локирование
Клеток селезенки мышей, иммунизированных в соответствии а), сливали с клетками миеломы согласно Галфре и Мильштейну (Galfre, G. and Milstein, С, Methods Enzymol. 73 (1981) 3-46). Около 2,1×108 спленоцитов смешивали с 4,2×107 клеток миеломы (P3X63-Ag8.653, ATCC CRL1580) и центрифугировали (10 мин при 300 × g и 4°С). После этого клетки промывали однократно культуральной средой RPMI 1640 без ФТС (фетальной телячьей сыворотки) и повторно центрифугировали при 400 × g во флаконах объемом 50 мл. Затем добавляли 1 мл ПЭГ (поли(этиленгликоль), молекулярная масса 4000 г/моль) и перемешивали с помощью пипетирования. Через 1 мин на водяной бане при температуре 37°С добавляли по каплям 5 мл RPMI 1640 без ФТС, суспензию перемешивали, добавляли RPMI 1640 с 10% (об./об.) ФТС в конечном объеме 50 мл и затем центрифугировали. Осажденные клетки ресуспендировали в RPMI 1640 с 10% ФТС и рассевали на селективную среду с гипоксантином-азасерином (100 ммоль/л гипоксантина, 1 мкг/мл азасерина в RPMI 1640 с 10% ФТС), содержащую фактор роста рекомбинантного мышиного интерлейкина-6 (Peprotech, 0,5 нг/мл). После 11 дней оценивали синтез первичных антител в первичных культурах (см. Пример 3). Первичные культуры, демонстрирующие связывание с биотинилированным F(ab')2-фрагментом антитела, а также с биотинилированным нормальным IgG человека отделяли, помещая отдельные клетки в 96-луночные культуральные планшеты с использованием проточной цитометрии (FACSAria, BD Biosciences) в среду, содержащую фактор роста рекомбинантного мышиного интерлейкина 6 (Peprotech, 0,5 нг/мл). Согласно этому протоколу была получена клеточная линия DSM АСС3076.
в) Продукция иммуноглобулинов
Гибридомную клеточную линию, полученную на этапе б), инокулировали при начальной плотности клеток (живые клетки) около 2×105 клеток на мл в RPMI 1640 с добавлением 10% ФТС и обычно используемых добавок и выращивали в Т-колбах (CELLine, IBS) в течение примерно трех недель. Очистку антител из культуральной жидкости проводили в соответствии со стандартными методиками химии белка, например, как описано в работе Bruck, С., et al., Methods Enzymol. 121 (1986)587-596.
Пример 3
Скрининг для детекции антител к IgG человека
а) Первичный скрининг на антитела, связывающиеся с IgG человека
Для определения специфичности антител в супернатанте культуры клеток гибридомы на ТМ (титрационные микропланшеты) с предварительно нанесенным рекомбинантным стрептавидином (MicroCoat, Bernried, lot MC 1098) наносили 250 нг/мл биотинилированных гуманизированных IgG, использованных для иммунизации, или 250 нг/мл биотинилированных IgG человека, соответственно, в ФСБ с добавлением 1,0% (вес/объем) БСА II (100 мкл на лунку, 60 мин инкубации при температуре окружающей среды, при встряхивании), а затем три раза промывали 0,9% (вес/объем) NaCl/0,05% Tween ® 20. На следующем этапе добавляли по 100 мкл на лунку раствора анализируемых антител (супернатант культуры) и инкубировали в течение 60 мин при комнатной температуре при встряхивании. После трех промывок с 0,9% (вес/объем) NaCl/0,05% Tween ® 20 на лунку добавляли по 100 мкл на лунку меченных пероксидазой хрена F(ab')2-фрагментов поликлональных овечьих антител к Fcγ мыши для детекции связанного антитела в образцах и инкубировали в течение 60 мин при комнатной температуре при встряхивании. После этого проводили промывку, как указано выше. В заключение добавляли по 100 мкл на лунку ABTS ® (Roche Diagnostics GmbH, Mannheim, Germany; кат №16843021684302). Через 30 мин инкубации при температуре окружающей среды измеряли оптическую плотность (OD) при 405 и 492 нм [405/492] с помощью коммерческого планшет-ридера для ИФА. В результате такого скрининга были выбраны антитела, связывающиеся эффективно с гуманизированными IgG, а также человеческими IgG. Выбранные антитела дополнительно анализировали согласно б).
б) Селекция антител с минимальной перекрестной реактивностью с IgG других видов
На первом этапе биотинилированные человеческие IgG связывали с лунками покрытых стрептавидином микротитрационного планшета (SA-MTP). Избыток несвязавшихся антител удаляли путем промывки. После этого образцы и стандарты (например, антитела к IgG, полученные в соответствии с Примером 2) разводили в буфере и 10% сыворотке яванского макака. Разбавленные образцы добавляли в лунки планшета и инкубировали в течение 60 мин при комнатной температуре при встряхивании. После того отмывки от несвязавшихся веществ в лунки планшета добавляли человеческие IgG с первого этапа в меченной дигоксигенином форме и инкубировали еще 60 мин. После промывки связавшиеся меченные дигоксигенином антитела детектировали с помощью антител к дигоксигенину, конъюгированных с ПХ. ПХ (пероксидаза хрена) из конъюгата с антитело-фермент катализирует колориметрическую реакцию с субстрата ABTS. Сигнал оценивали с помощью планшет-ридера для ИФА при длине волны 405 нм (референсная длина волны: 490 нм). Значения абсорбции каждого образца сыворотки определяли в трех повторностях.
Отбирали антитела с высокой интенсивностью ответа в сыворотке обезьян циномолгус и в буфере. В результате такого второго скрининга были выбраны бору антитела, связывающиеся эффективно с IgG человека с минимальной перекрестной реактивностью по отношению к IgG других видов.
Пример 4
Оценка связывания/специфичности антитела с помощью поверхностного плазмонного резонанса
Все измерения проводили с помощью прибора BIAcore® T100 с использованием чипа СМ5. Нанесение антитела на такой чип осуществляли с помощью стандартной схемы с использованием реакции сочетания по аминогруппам. Если не указано иное, все инкубации проводили в буфере HBS (HEPES, NaCl, pH 7,4) при 25°С. Насыщающее количество поликлонального козьего антитела к Fc-гамма мышей иммобилизовали с помощью сочетания по аминогруппам на одной проточной ячейке чипа СМ5. После этого вводили моноклональные антитела мыши, направленные против IgG человека в течение 60 секунд при скорости потока 30 мкл/мин, и они связывались с антителами к мышиным Fc. Все сыворотки животных разводили в буфере HBS. Связывание оценивали путем инъекции разведенной 1:100 сыворотки и инкубации в течение 60 сек при скорости потока 30 мкл/мин. Диссоциацию оценивали путем промывки поверхности чипа с помощью буфера HBS в течение 180 сек. С помощью программного обеспечения BIAevaluation от BIAcore® рассчитывали значения константы диссоциации (=KD) с помощью аппроксимации по модели Ленгмюра 1:1. Для всех сывороток животных такие расчеты были основаны на предположении, что уровень IgG составляет 15 мг/мл. Для сравнения количества связавшегося IgG использовали значения сигнала через 80 сек после начала введения тестируемого антитела (см. Таблицу 1).
|
Пример 5
а) Очистка мышиных моноклональных антител к IgG человека
Супернатант после культивирования клеточной линии, полученной в Примере 2, концентрировали примерно в десять раз и переносили в буфер, содержащий 20 мМ Трис, 1 М сульфат аммония, рН 9,0, и наносили на хроматографическую колонку с протеином А-сефарозой. Элюат, полученный с применением 0,2 М цитрата натрия, 0,2 М сульфата аммония при рН 5,0, подвергали диализу против фосфатного буфера, рН 7,5. Примеси бычьего IgG (от ФТС в культуральной среде) отделяли с помощью иммуноадсорбции с иммобилизованными антителами против бычьего IgG.
б) Приготовление биотинилированных антител к IgG человека
Антитела к IgG человека, полученные на этапе а), в фосфатном буфере, рН 8,5, доводили до концентрации белка около 5 мг/мл. N-гидроксисукцинимид D-биотиноил-аминокапроновой кислоты растворяли в ДМСО и добавляли к раствору антител в молярном соотношении 1:5. Реакцию останавливали после 60 мин путем добавления L-лизина и избыток реагента для мечения удаляли путем диализа против 50 мМ калий-фосфатного буфера, 150 мМ NaCl, рН 7,5.
в) Приготовление меченных дигоксигенином антител к IgG человека
Антитела к IgG человека, полученные на этапе а), в фосфатном буфере, рН 8,5, доводили до концентрации белка около 5 мг/мл. N-гидроксисукцинимид дигоксигенин-3-О-метилкарбонил-ε-аминокапроновой кислоты растворяли в ДМСО и добавляли в раствор антител в молярном соотношении 1:4. Реакцию останавливали после 60 мин путем добавления L-лизина и избыток реагента для мечения удаляли путем диализа против 50 мМ калий-фосфатного буфера, 150 мМ NaCl, рН 7,5.
Пример 6
Стандартный анализ для количественного определения антител человека (человеческих IgG) в образце от экспериментального животного
На первом этапе биотинилированное антитело М-1.19.31 связывают с покрытым стрептавидином титрационным микропланшетом (SA-MTP). Избыток несвязавшегося антитела удаляют путем промывки. Образцы/стандарты, например антитела к IL1R, антитело к IL13Ra1, бета-амиолиду (Abeta) и антитело к IL6R, в сыворотке циномолгуса добавляют в серии концентраций к планшету и инкубируют в течение 60 мин при комнатной температуре при встряхивании. После отмывки несвязавшихся антител к планшету добавляют по 100 мкл меченных дигоксигенином антител М-1.19.31. После промывки связавшиеся меченные дигоксигенином антитела детектируют с помощью антител к дигоксигенину, конъюгированных с ПХ. Значения абсорбции для каждого образца сыворотки определяют в трех повторностях (схему метода см. на Фиг. 1).
Пример 7
Количественное определение производных антител человека (например, Fab-фрагментов) в образце из экспериментального животного
На первом этапе биотинилированное антитело М-1.19.31 связывают с покрытым стрептавидином титрационным микропланшетом (SA-MTP). Избыток несвязавшегося антитела удаляют путем промывки. Образцы/стандарты, например Fab-фрагмент антитела к IGF1R, в сыворотке циномолгуса добавляют в серии концентраций к планшету, и инкубируют в течение 60 мин при комнатной температуре при встряхивании. После отмывки не связавшихся антител к планшету добавляют по 100 мкл меченных дигоксигенином антител М-1.3.2. После промывки связавшиеся меченные дигоксигенином антитела детектируют с помощью антител к дигоксигенину, конъюгированных с ПХ. Значения абсорбции для каждого образца сыворотки определяют в трех повторностях (схему метода см. на Фиг. 3).
Пример 8
Анализ для проверки структурной целостности человеческого IgG в образце от экспериментального животного
Биотинилированное антитело М-1.19.31 связывают с покрытым стрептавидином титрационным микропланшетом (SA-MTP). Избыток несвязавшегося антитела удаляют путем промывки. Образцы/стандарты, например антитело к IL13Rα1, в сыворотке циномолгуса добавляют в серии концентраций к планшету и инкубируют в течение 60 мин при комнатной температуре при встряхивании. После отмывки не связавшихся антител к планшету добавляют по 100 мкл меченных дигоксигенином антител М-1.3.2. После промывки связавшиеся меченные дигоксигенином антитела детектируют с помощью антител к дигоксигенину, конъюгированных с ПХ. Значения абсорбции для каждого образца сыворотки определяют в трех повторностях.
Пример 9
Количественный анализ антител человека (человеческих IgG) в образце от экспериментального животного с использованием Fc-гибридного белка (антигена) в сочетании с антителом к IgG человека в соответствии с настоящим изобретением
На первом этапе биотинилированный антиген (Bi-X) связывают с покрытым стрептавидином титрационным микропланшетом (SA-MTP). Избыток несвязавшегося антигена удаляют путем промывки. После этого антитело к Х (анти-X) сыворотке циномолгуса связывают с иммобилизованным человеческим рецептором X. После отмывки несвязавшихся веществ анти-Х антитела детектируют с помощью меченного дигоксигенином моноклонального антитела против человеческого Fab-фрагмента (антителл М-1.19.31), с последующей инкубацией с меченными пероксидазой хрена антителами к дигоксигенину. Значения абсорбции для каждого образца сыворотки определяют в трех повторностях.
|
Пример 10:
Дот-блот-анализ - конформационный или линейный эпитоп
Для определения того, детектирует ли антитело к IgG конформационный эпитоп или линейный эпитоп, проводили дот-блот-анализ.
В ходе такого анализа антиген-белок (человеческий IgG) наносили на нитроцеллюлозную мембрану в нативной и денатурированной форме. Для получение денатурированной формы антиген-белок инкубировали в ДСН на качалке при 37°С в течение ночи. Обе формы наносили на мембрану в серии концентраций. После полного высыхания мембраны поверхность блокировали с помощью блокирующего буфера (Roti-Block, Roth, Germany) в течение 60 мин при комнатной температуре при встряхивании. После промывки мембрану инкубировали с раствором, содержащим меченные дигоксигенином антитела М-1.19.31. После промывки связавшиеся меченные дигоксигенином антитела детектировали с помощью конъюгата антитело-ПХ против дигоксигенина. Конъюгат антитело-фермент ПХ катализирует колориметрическую реакцию BM-Blue substrate. Сигнал можно непосредственно наблюдать визуально и фиксировать с помощью сканера.
Пример 11
Оценка связывающей способности/специфичности антитела с помощью ИФА
Для определения того, какой тип подкласса IgG человека связывается с исследуемыми античеловеческими антителами, проводили мостиковый ИФА.
На первом этапе биотинилированные антитела M-R10Z8E9, М-1.3.2, М-1.5.8, М-1.7.10 и М-1.19.31 связывали с стрептавидиновым титрационным микропланшетом. На втором этапе проводили инкубацию с человеческими антителами IgG различных подклассов. Получали серии разведений антител человеческого IgG1 каппа; человеческого IgG1 лямбда; человеческого IgG4; химерного человеческого IgG1, человеческого IgG2 (поликлональный очищенный человеческий IgG2) и человеческого IgG3 (поликлональный очищенный человеческий IgG3) и инкубировали их стрептавидиновым титрационным микропланшетом, покрытым биотинилированным античеловеческим антителом. После промывки те же антитела, которые применяли для покрытия, использованы в качестве антител для детекции в форме, меченной дигоксигенином. Это означает, что тот же самый клон античеловеческого антитела используют для нанесения покрытия и для детекциия. Например, на один микропланшет наносили покрытие из M-Bi 1.7.10 и антитело 1.7.10-M-Dig использовали для детекции. После инкубации и промывки проводили инкубацию с меченными пероксидазой хрена антителами к дигоксигенину. Значения абсорбции для каждого образца сыворотки определяли в трех повторностях.
|
Пример 12
Характеристика эпитопов антитела против антител человека класса IgG1 на основании перекрестного конкурентного связывания с помощью ППР
Прибор: BIACORE®T100
Чип: СМ5 (BIAcore BR-1006-68)
Прикрепление антитела: амидное сочетание
Буфер: ФСБ (BIAcore BR-1006-72), рН 7.4, 25°С
Для сортировки (определения групп) эпитопов с помощью перекрестного конкурентного связывания большое количество антител против Fcγ мыши (козьи, Jackson Immuno Research кат. №115-005-071) прикрепляли к поверхности сенсорного чипа для презентации антитела к IgG человека (около 8000-12000 ОЕ). После введения 10 мкг/мл первых антител к IgG человека остаточную свободную связывающую способность иммобилизованного мышиного антитела («антитела захвата») насыщали добавлением 250 мкг/мл иммуноглобулинов мыши. После блокирования свободных антимышиных сайтов связывания вводили человеческий Fab-фрагмент в концентрации 10 мкг/мл в течение 1 мин, с которым связывается первое антитело к IgG человека. Второе антитело к IgG человека вводят в концентрации 10 мкг/мл в течение 1 мин. В случае если сайты связывания первого и второго антитела различны, второе антитело сможет связаться с иммобилизованным человеческим Fab-фрагментом. При наличии идентичных сайтов связывания не будет происходить связывание второго антитела против IgG человека. Положительный ответ при втором связывании определяют с помощью границы разделения 10 ОЕ связывания. После каждого цикла сенсорный чип регенерируют путем инъекции 100 мМ Н3РО4 для удаления связавшегося иммунного комплекса. Только ковалентно связанные антимышиные антитела остаются связанными с чипом.
На основании анализа всех возможных комбинаций античеловеческих антител, можно определить группы эпитопов.
|
|