Результат интеллектуальной деятельности: СПИРОЦИКЛИЧЕСКИЕ АМИНОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ S1P
Вид РИД
Изобретение
Область изобретения
Настоящее изобретение относится к новым спироциклическим аминовым производным, обладающим сродством к S1P рецепторам, к фармацевтической композиции, содержащей указанные соединения, а также к применению указанных соединений для получения лекарственного средства для лечения, облегчения или предотвращения заболеваний и состояний, в которые вовлечен какой-либо S1P рецептор, или в которые вовлечена модуляция эндогенной S1P сигнальной системы через какой-либо S1P рецептор.
Предпосылки изобретения
Сфингозин-1-фосфат (S1P) представляет собой биоактивный сфинголипид, который опосредует множество различных клеточных ответов, таких как пролиферация, цитоскелетная организация и миграция, адгезионная и плотная соединительная сборка и морфогенез. S1P может связываться с членами семейства генов эндотелиальной клеточной дифференциации (EDG рецепторы), локализованных на плазменной мембране связанных с G-белком рецепторов. К настоящему времени идентифицировано пять членов этого семейства в качестве S1P рецепторов в различных типах клеток: S1P1 (EDG-1), S1P2 (EDG-5), S1P3 (EDG-3), S1P4 (EDG-6) и S1P5 (EDG-8). S1P может вызывать цитоскелетные перегруппировки во многих типах клеток для регулировки иммунного клеточного траффика, сосудистого гомеостаза и клеточной коммуникации в центральной нервной системе (ЦНС) и в периферических системах органов.
Известно, что S1P секретируется сосудистым эндотелием и присутствует в крови в концентрациях 200-900 наномоль и связывается альбумином и другими белками плазмы. Это обеспечивает как стабильный резервуар во внеклеточных жидкостях, так и эффективную доставку к высокоаффинным клеточно-поверхностным рецепторам. S1P связывается с низким наномолярным сродством с пятью рецепторами S1P1-5. Кроме того, тромбоциты также содержат S1P и могут локально высвобождаться, вызывая, например, вазоконстрикцию. Подтипы рецептора S1P1, S1P2 и S1P3 широко экспрессируются и являются доминирующими рецепторами в сердечно-сосудистой системе. Кроме того, S1P1 также является рецептором, присутствующим на лимфоцитах. S1P4 рецепторы присутствуют почти исключительно в гемопоэтической и лимфоидной системе. S1P5 преимущественно (но не исключительно) экспрессируется в центральной нервной системе. Экспрессия S1P5, по-видимому, ограничивается олигодентроцитами у мышей, миелинизирующими клетками головного мозга, тогда как у крыс и человека была обнаружена экспрессия на уровне астроцитов и эндотелиальных клеток, но не на олигодентроцитах.
Модуляторы S1P рецептора представляют собой соединения, которые осуществляют передачу сигнала как (ант)агонисты на одном или нескольких S1P рецепторах. Настоящее изобретение относится к модуляторам S1P5 рецептора, в частности к агонистам, и предпочтительно к агонистам с селективностью в отличие от S1P1 и/или S1P3 рецепторов, в свете нежелательных сердечно-сосудистых и/или иммуномодуляторных эффектов. К настоящему времени обнаружено, что S1P5 агонисты можно использовать в лечении когнитивных расстройств, в частности, возрастного ухудшения познавательной способности.
Хотя продолжаются исследования, направленные на разработку терапевтических средств, которые можно использовать для лечения возрастного ухудшения познавательной способности и деменции, это дало не много успешных кандидатов. Поэтому существует потребность в новых терапевтических средствах с желаемыми свойствами.
Описание изобретения
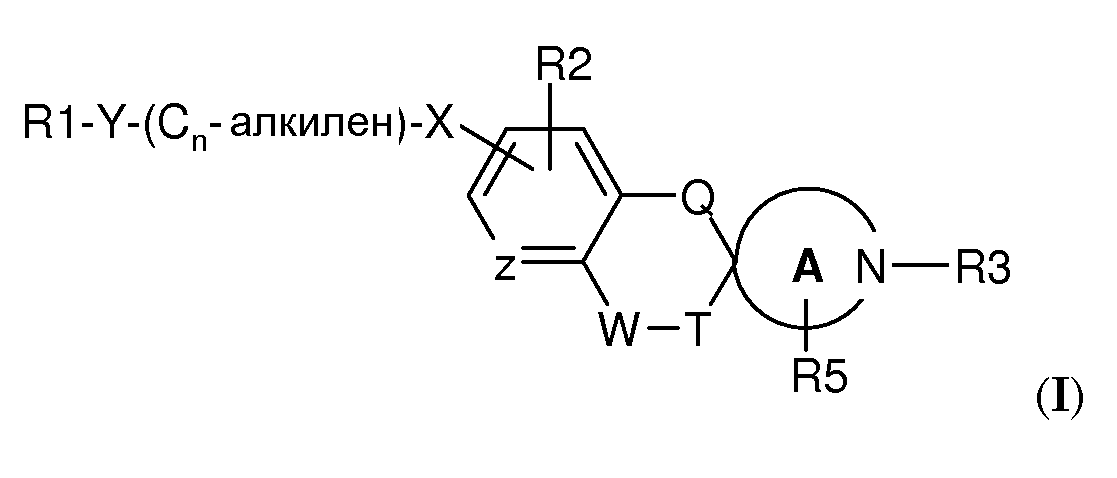
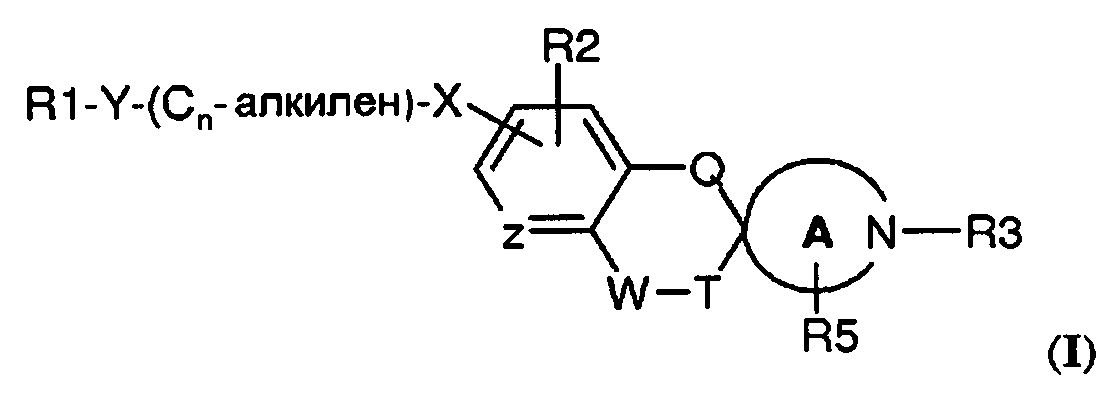
Было обнаружено, что спироциклические аминовые производные формулы (I)
где
R1 выбран из
циано,
(2-4C)алкенила, (2-4C)алкинила, (1-4C)алкила, каждый из которых необязательно замещен CN или одним или несколькими атомами фтора,
(3-6C)циклоалкила, (4-6C)циклоалкенила или (8-10C)бициклической группы, где каждая из таких групп необязательно замещена галогеном или (1-4C)алкилом,
фенила, бифенила, нафтила, каждый из которых необязательно замещен одним или несколькими заместителями, независимо выбранными из галогена, циано, (1-6C)алкила, необязательно замещенного одним или несколькими атомами фтора, (1-6C)алкокси, необязательно замещенного одним или несколькими атомами фтора, амино, ди(1-4C)алкиламино и (3-6C)циклоалкила, необязательно замещенного фенилом, который может быть замещен (1-4C)алкилом или галогеном,
фенила, замещенного фенокси, бензилом, бензилокси, фенилэтилом или моноциклическим гетероциклом, каждый из которых необязательно замещен (1-4C)алкилом, необязательно замещенным одним или несколькими атомами фтора,
моноциклического гетероцикла, необязательно независимо замещенного галогеном, (1-6C)алкилом, необязательно замещенным одним или несколькими атомами фтора, (3-6C)циклоалкилом или фенилом, необязательно замещенным (1-4C)алкилом или галогеном,
и
бициклического гетероцикла, необязательно замещенного галогеном или (1-4C)алкилом, необязательно замещенным одним или несколькими атомами фтора;
-Y-(Cn-алкилен)-X- представляет собой связывающую группу, где
Y присоединен к R1 и выбран из связи, -О-, -CO-, -S-, -SO-, -SO2-, -NH-, -CH=CH-, -C(CF3)=CH-, -C≡C-, -CH2-O-, -O-CO-, -CO-O-, -CO-NH-, -NH-CO- и транс-циклопропилена;
n представляет собой целое число, имеющее значение от 0 до 10; и
X присоединен к фениленовой/пиридильной группе и выбран из связи, -О-, -S-, -SO-, -SO2-, -NH-, -CO-, -CH=CH- и транс-циклопропилена;
R2 представляет собой H или независимо выбран из одного или нескольких заместителей, выбранных из галогена, (1-4C)алкокси и (1-4C)алкила, необязательно замещенного одним или несколькими атомами фтора; и
R3 представляет собой (1-4C)алкилен-R4, где алкиленовая группа может быть замещена одним или несколькими атомами галогена или (CH2)2 с образованием циклопропильной группы, или R3 представляет собой (3-6C)циклоалкилен-R4, -CH2-(3-6C)циклоалкилен-R4, (3-6C)циклоалкилен-CH2-R4 или -CO-CH2-R4, где R4 представляет собой -OH, -PO3H2, -OPO3H2, -COOH, -COO(1-4C)алкил или тетразол-5-ил;
Q представляет собой связь или -О-;
-W-T- выбран из -CH=CH-, -CH2-CH2-, -CH2-О-, -О-CH2-, -O-CH2- CH2- и -CO-O-;
R5 представляет собой H или независимо выбран из одного или нескольких галогенов;
Z представляет собой CH, CR2 или N; и
A представляет собой морфолиновую кольцевую структуру или 5-, 6- или 7-членный циклический амин;
или их фармацевтически приемлемые соли, сольваты или гидраты или один или несколько их N-оксидов демонстрируют сродство в отношении S1P рецепторов. В частности, соединения по настоящему изобретению демонстрируют селективное сродство в отношении S1P5 рецептора в отличие от S1P1 и/или S1P3 рецептора(рецепторов).
В документах предшествующего уровня техники раскрыты структуры спироиндолиновых производных, имеющие некоторую схожесть со структурами соединений по настоящему изобретению, например, в WO 2005063745. Однако эти соединения являются модуляторами Mas рецептора. Нет никакого предположения или раскрытия, что спироиндолиновые соединения, раскрытые в WO 2005063745, могут демонстрировать сродство в отношении S1P рецепторов.
Соединения по настоящему изобретению являются модуляторами S1P рецептора, в частности, S1P5 рецептора. Более конкретно, соединения по настоящему изобретению являются агонистами S1P5 рецептора. Соединения по настоящему изобретению являются полезными для лечения, облегчения и предотвращения заболеваний и состояний, в которые вовлечен(вовлечены) (какой-либо) S1P рецептор(рецепторы), в частности S1P5, или в которые вовлечена модуляция эндогенной S1P сигнальной системы через какой-либо S1P рецептор. В частности, соединения по настоящему изобретению можно использовать для лечения, облегчения или предотвращения расстройств ЦНС (центральной нервной системы), таких как нейродегенеративные расстройства, в частности, но не ограничиваясь этим, когнитивные расстройства (в частности, возрастное ухудшение познавательной способности) и связанные с этим состояния, болезнь Альцгеймера, (сосудистая) деменция, болезнь Ниманна-Пика и расстройства познавательной способности при шизофрении, обсессивно-компульсивное поведение, глубокая депрессия, аутизм, рассеянный склероз и боль, и т.п. Предпочтительно, соединения по настоящему изобретению можно использовать для лечения, облегчения или предотвращения когнитивных расстройств (в частности, возрастного ухудшения познавательной способности) и связанных с этим состояний.
В одном варианте воплощения настоящего изобретения соединения имеют формулу (I), где R3 выбран из -(CH2)2-OH, -CH2-COOH, -(CH2)2-COOH, -(CH2)3-COOH, -CH2-CHCH3-COOH, -CH2-C(CH3)2-COOH, -CHCH3-CH2-COOH, -CH2-CF2-COOH, -CO-CH2-COOH, 1,3-циклобутилен-COOH, -(CH2)2-PO3H2, -(CH2)3-PO3H2, -(CH2)2-OPO3H2, -(CH2)3-OPO3H2, -CH2-тетразол-5-ила, -(CH2)2-тетразол-5-ила и -(CH2)3-тетразол-5-ила. Предпочтительные группы R3 выбраны из -(CH2)2-COOH, -CH2-CHCH3-COOH, -CH2-C(CH3)2-COOH, -CHCH3-CH2-COOH, -CH2-CF2-COOH, -CO-CH2-COOH и 1,3-циклобутилен-COOH. Наиболее предпочтительным является -(CH2)2-COOH.
В другом варианте воплощения Q представляет собой связь.
В другом варианте воплощения соединения имеют формулу (I), где R2 представляет собой H, метил, хлор или фтор. В других вариантах воплощения R2 представляет собой H.
В следующем варианте воплощения настоящего изобретения Z представляет собой CH или CR2.
В другом варианте воплощения соединения имеют формулу (I). -W-T- выбран из -CH2-О-, -О-CH2-, -О-CH2-CH2- и -CO-О-. В предпочтительных вариантах воплощения -W-T- представляет собой -О-CH2-.
Кроме того, в одном варианте воплощения настоящего изобретения, в группе -Y-(Cn-алкилен)-X-, Y выбран из связи, -О-, -CO-, -CH=CH-, -C(CF3)=CH-, -C≡C- и транс-циклопропилена; n представляет собой целое число, имеющее значение от 0 до 6. Предпочтительно, Y выбран из связи, -О-, -CH=CH-, -C≡C- и транс-циклопропилена. В других вариантах воплощения X выбран из связи, -О-, -S-, -SO-, -SO2-, -NH-, -CO-, -CH=CH- и транс-циклопропилена. Предпочтительно, X выбран из связи, -О-, -S-, -SO-, -SO2-, -NH- и -CO-. В предпочтительных вариантах воплощения группа -Y-(Cn-алкилен)-X- выбрана из -CH2-O-, -CH2-S- и -CH=CH- и, в частности, представляет собой -CH2-O-.
В некоторых вариантах воплощения настоящего изобретения R1 представляет собой (1-4C)алкил, и Y представляет собой связь, n представляет собой целое число, выбранное из 1-6, и X представляет собой -O- или связь. В других вариантах воплощения R1 и -(CH2)n- вместе представляют собой линейную гексильную, гептильную или октильную группу.
В других вариантах воплощения настоящего изобретения R1 выбран из (1-4C)алкила, циклогексила, циклогексенила, бифенила, необязательно замещенного галогеном,
фенила, необязательно замещенного одним, двумя или тремя заместителями, независимо выбранными из галогена, (1-4C)алкила, (1-4C)алкокси, трифторметила, трифторметокси и циклопропила, необязательно замещенного фенилом,
тиенила, пиридила, тетрагидропиранила, каждый из которых необязательно замещен галогеном, (1-4C)алкилом, циклопропилом или фенилом, необязательно замещенным галогеном, и
индолила, дигидробензофуранила и бенздиоксанила, каждый из которых необязательно замещен галогеном или (1-4C)алкилом. В предпочтительных вариантах воплощения настоящего изобретения R1 выбран из фенила, необязательно замещенного одним или несколькими заместителями, независимо выбранными из галогена, (1-4C)алкила, циклопропила и трифторметила. Более предпочтительно, R1 представляет собой 2,6-дихлорфенил.
В других вариантах воплощения настоящего изобретения R5 представляет собой H.
В предпочтительных вариантах воплощения настоящего изобретения A представляет собой пиперидиновую структуру.
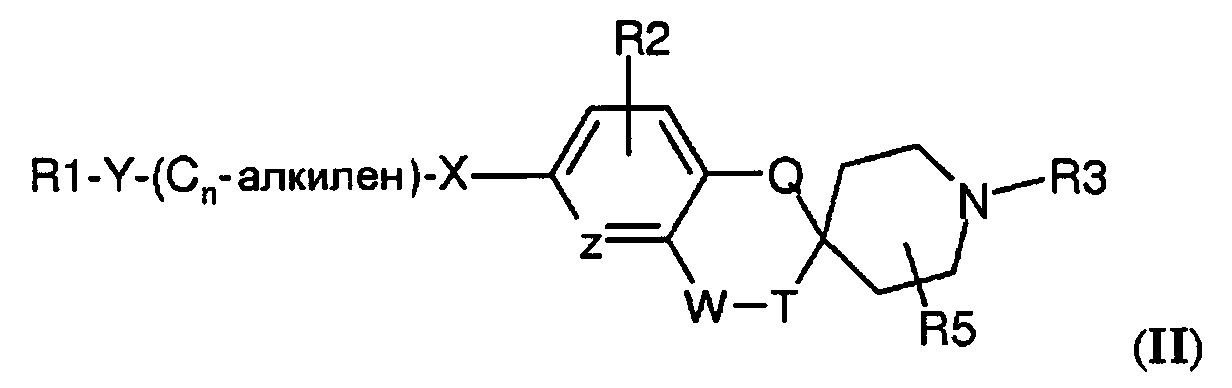
В другом варианте воплощения соединения по настоящему изобретению имеют структуру (II)
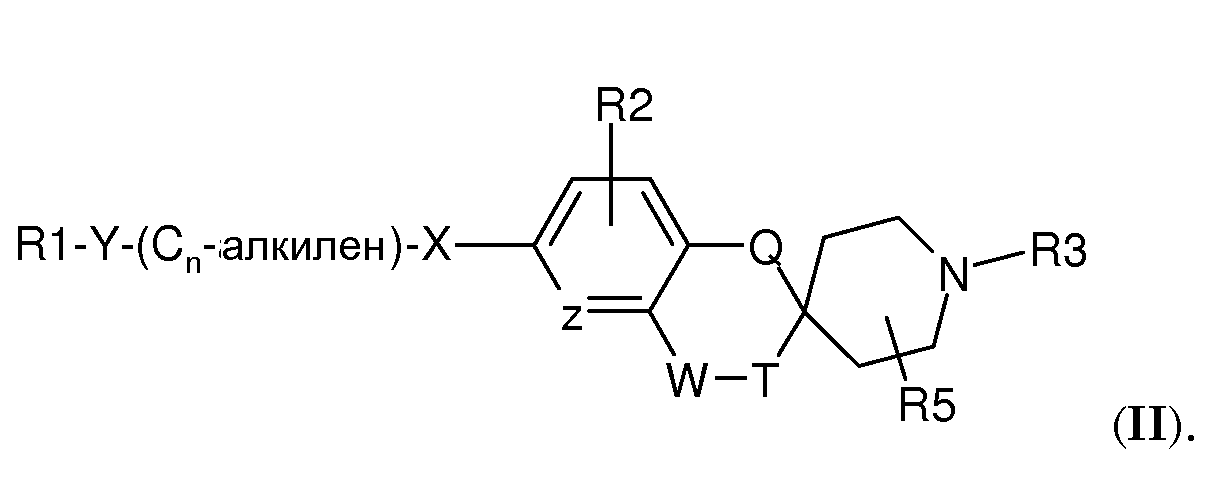
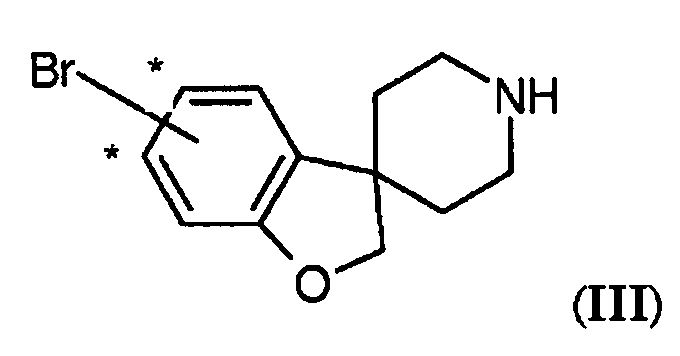
Соединения по настоящему изобретению подходящим образом можно получить способами, известными из уровня техники, и как проиллюстрировано в экспериментальном разделе настоящего описания. Были обнаружены некоторые новые и полезные промежуточные соединения для получения соединений по настоящему изобретению. Они представляют собой дополнительные варианты воплощения настоящего изобретения. Таким образом, еще один вариант воплощения настоящего изобретения представляет собой соединение формулы (III)
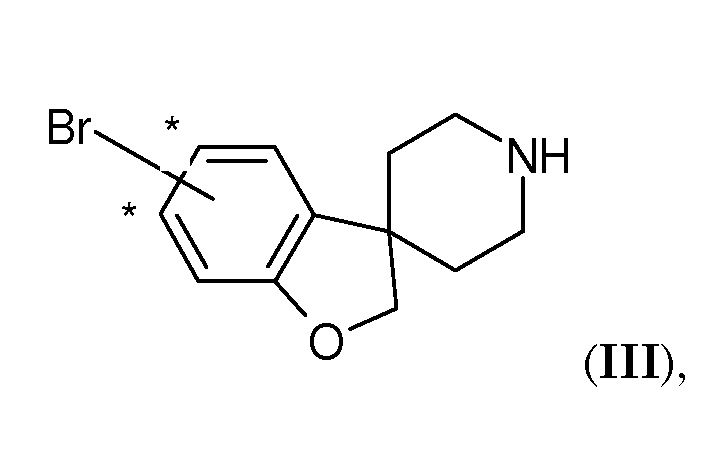
где Br присоединен на одном из участков, отмеченных звездочкой.
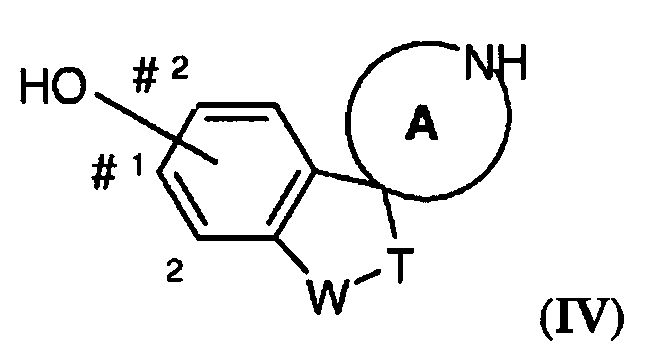
Также, один вариант воплощения настоящего изобретения представляет собой соединение формулы (IV)
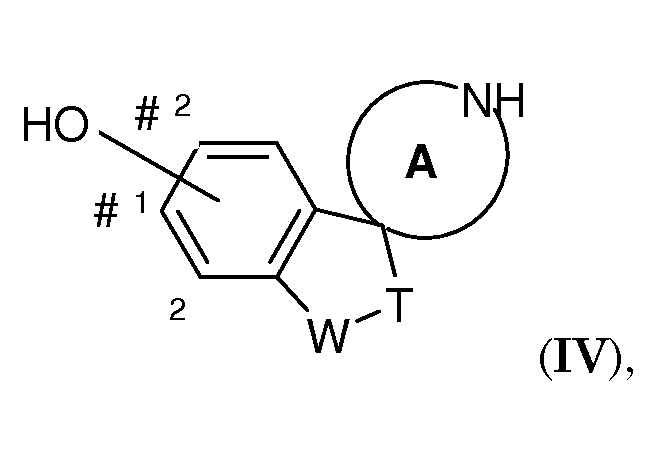
где OH присоединен на одном из участков, отмеченных знаком #, и где, если OH находится в положении, обозначенном цифрой 1, соединение может быть независимо замещено (1-4C)алкилом или галогеном, выбранным из F или Cl, в одном или обоих положениях, обозначенных цифрой 2; и W-T представляет собой -O-CH2- или -CH2-CH2-; и A представляет собой морфолиновую кольцевую структуру или 5- или 6-членный циклический амин. Соединения формулы (III) являются полезными для получения соединений формулы (I), где -W-T- представляет собой -O-CH2-, а соединения формулы (IV) для получения соединений формулы (I), где -W-T- представляет собой -O-CH2- или -CH2-CH2-.
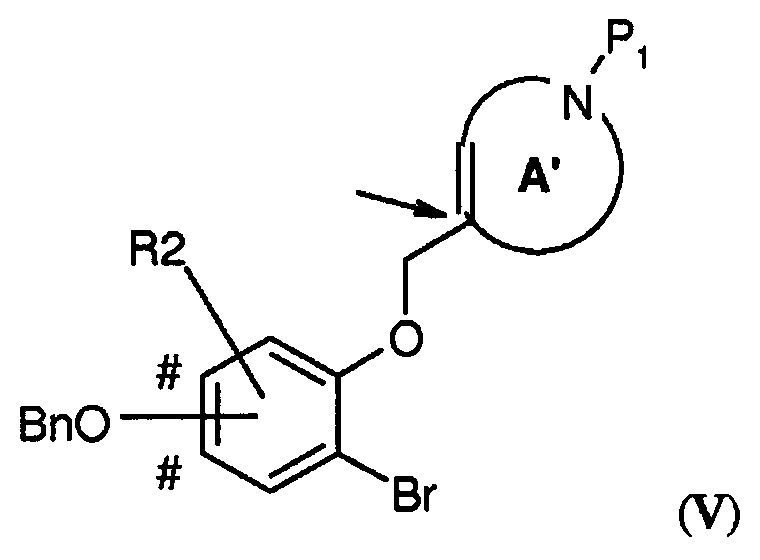
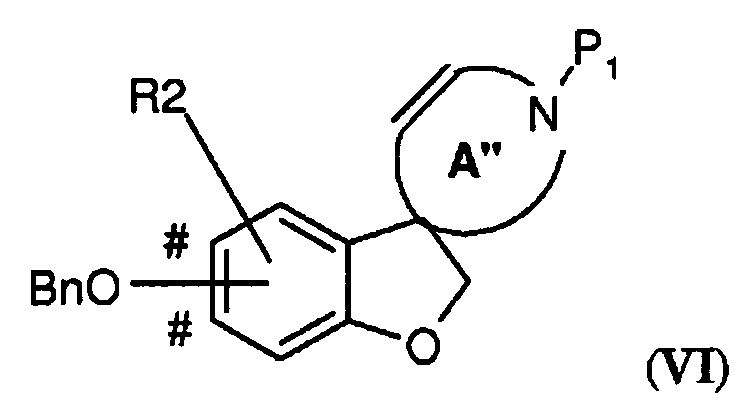
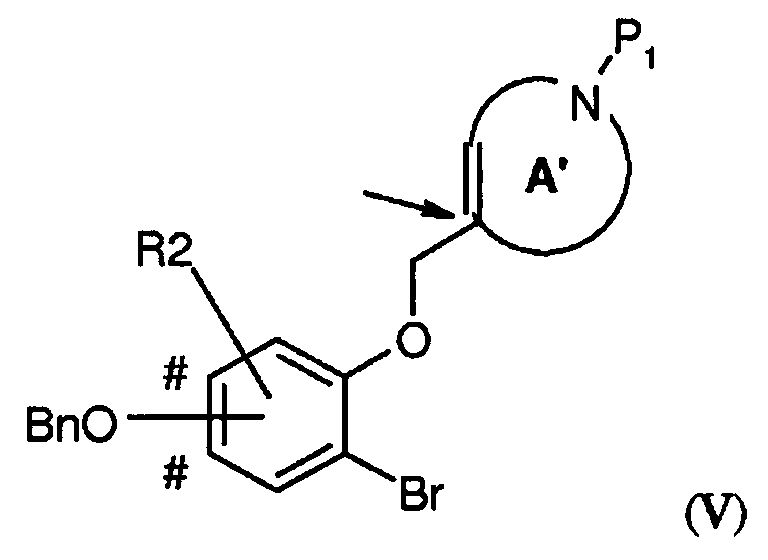
В соответствии с еще одним вариантом воплощения настоящего изобретения, очень эффективным способом получения соединения формулы (I), где R2 представляет собой H или один или два заместителя, выбранных из фтора, (1-4C)алкила и (1-4C)алкокси; -W-T- представляет собой -O-CH2-, и Z представляет собой CH или CR2, является способ, включающий стадию внутримолекулярной циклизации по методу Гека, где соединение формулы (V),
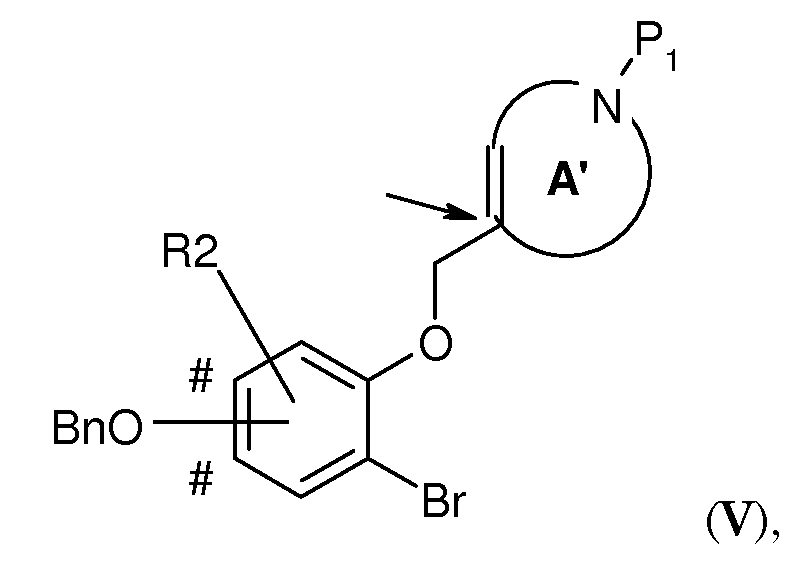
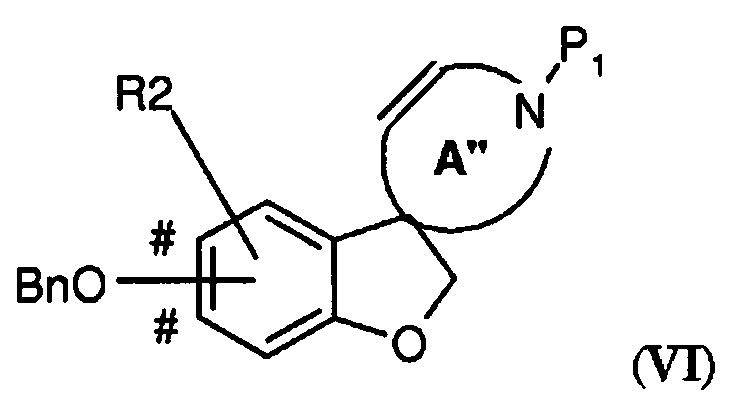
где A' представляет собой 5-, 6- или 7-членный циклический амин с двойной связью по атому углерода, указанному стрелкой, P1 представляет собой защитную группу, выбранную из -CO2-бензила и -CO2-(1-4C)алкила (предпочтительно -CO2-бензила), Bn представляет собой бензил, и BnO-группа может быть присоединена на одном из участков, отмеченных знаком #, преобразовывают в подходящем растворителе при повышенной температуре (например, в N-метил-2-пирролидоне (NMP) при 140°C), в присутствии карбоната серебра (предпочтительно в 1-2 молярных количествах в расчете на количество соединения V) и катализатора Германна-Беллера (1-10% моль., предпочтительно 3-6% моль.) в соединение формулы (VI)
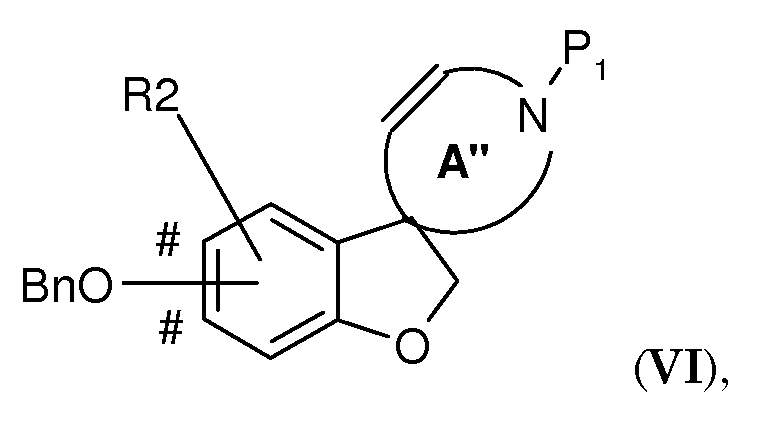
где A" представляет собой 5-, 6- или 7-членный циклический амин с двойной связью в положении, смещенном на одно или (временно) два положения - в зависимости от положения атома азота в кольце - относительно кольца A', с последующим осуществлением следующих стадий способа (таких как первая процедура удаления защиты и восстановление с получением соединения в соответствии с формулой (IV)) с получением соединения формулы (I).
Термин галоген относится к фтору, хлору, брому или иоду. Предпочтительные галогены представляют собой фтор и хлор и, в частности, хлор.
Термины (1-6C) и (1-4C)алкил означают разветвленную или неразветвленную алкильную группу, содержащую 1-6 и 1-4 атомов углерода, соответственно, например, метил, этил, пропил, изопропил и бутил. Предпочтительная алкильная группа представляет собой метил.
Термин (1-4C)алкокси означает алкоксигруппу, содержащую 1-4 атома углерода, где алкильная группа имеет значение, определенное выше. Предпочтительная алкоксигруппа представляет собой метокси.
Термины (1-4C)алкилен и (Cn-алкилен) означают разветвленную или неразветвленную алкиленовую группу, содержащую 1-4 или n атомов углерода, соответственно, например, метилен, -CHCH3-, -C(CH3)2-, -CHCH3CH2- и подобные. В определении R3, который представляет собой (1-4C)алкилен-R4, один или несколько атомов углерода в алкиленовой группе может быть (среди прочих) независимо замещен группой (CH2)2 с образованием циклопропильной группы, т.е. с образованием R3 группы, такой как 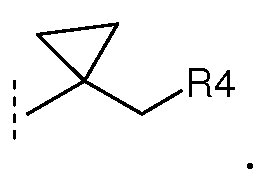
Термин (2-4C)алкинил означает разветвленную или неразветвленную алкинильную группу, содержащую 2-4 атома углерода, где тройная связь может присутствовать в разных положениях в группе, например, этинил, пропаргил, 1-бутинил, 2-бутинил и т.п.
Термины 5-, 6- или 7-членный циклический амин, используемые в определении формулы (I), относятся к пирролидинилу, пиперидинилу и гексаметилениминильным структурам, соответственно.
Термин (3-6C)циклоалкил означает циклическую алкильную группу, содержащую 3-6 атомов углерода, такую как циклопропил, циклобутил, циклопентил или циклогексил. Предпочтительными являются циклопентил и циклогексил.
Термин (4-6C)циклоалкенил означает циклическую алкенильную группу, содержащую 4-6 атомов углерода и включающую одну или две двойные связи, например, циклогексенил.
Термин (3-6C)циклоалкилен означает циклическую алкильную группу, имеющую две точки присоединения. Предпочтительным является 1,3-циклобутилен, имеющий структуру 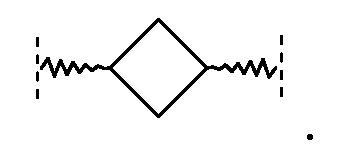
Термин (8-10C)бициклическая группа означает конденсированную кольцевую систему из двух групп, выбранных из ароматических и неароматических кольцевых структур, содержащих вместе 8-10 атомов углерода, например, - и в частности - индановая группа.
Термин моноциклический гетероцикл охватывает моноциклические гетероарильные группы и неароматические гетеромоноциклические группы, например фуранил, тиенил, пирролил, оксазолил, тиазолил, имидазолил, пиразолил, изоксазолил, изотиазолил, триазолил, оксадиазолил, пиридил, пиридазинил, пиримидинил, пиразинил, триазинил, тетрагидрофуранил, тетрагидропиранил, диоксанил, морфолинил и подобные.
Термин бициклический гетероцикл охватывает бициклические гетероарильные группы и неароматические гетеробициклические группы, например, индолил, индазолил, изоиндолил, индолизинил, бензимидазолил, имидазотиазолил, имидазопиридинил, бензофуранил, дигидробензофуранил, бенздиоксанил, хинолинил, изохинолинил, хинолизинил, тетрагидроизохинолинил и подобные.
Со ссылкой на заместители, термин "независимо" означает, что заместители в одной и той же молекуле могут быть одинаковыми или отличными друг от друга.
Соединения по настоящему изобретению могут содержать один или несколько асимметрических центров и, таким образом, могут существовать в виде рацематов и рацемических смесей, отдельных энантиомеров, диастереомерных смесей и индивидуальных диастереомеров.
Дополнительные асимметрические центры могут присутствовать в зависимости от природы различных заместителей в молекуле. Каждый такой асимметрический центр независимо будет образовывать два оптических изомера, и предполагается, что все из возможных оптических изомеров и диастереомеров в смесях и в виде чистых или частично очищенных соединений включены в объем настоящего изобретения. Настоящее изобретение охватывает все такие изомерные формы этих соединений. Независимый синтез этих диастереомеров или их хроматографические разделения можно осуществить, как это известно из уровня техники, путем соответствующей модификации методологии, раскрытой в настоящей заявке. Их абсолютную стереохимию можно определить при помощи рентгеновской кристаллографии кристаллических продуктов или кристаллических промежуточных соединений, которые подвергают дериватизации, если это необходимо, с использованием реагента, содержащего асимметрический центр известной абсолютной конфигурации. Если желательно, рацемические смеси соединений можно разделить с выделением, таким образом, индивидуальных энантиомеров. Разделение можно осуществить способами, хорошо известными из уровня техники, такими как объединение рацемической смеси соединений с энантиомерно чистым соединением с образованием диастереомерной смеси, с последующим разделением индивидуальных диастереомеров стандартными способами, такими как фракционированная кристаллизация или хроматография.
Соединения могут существовать в виде полиморфов, и в таком виде они включены в настоящее изобретение. Кроме того, соединения могут образовывать сольваты с водой (т.е. гидраты) или обычными органическими растворителями, и предполагается, что такие сольваты также охватываются объемом настоящего изобретения.
Изотопно-меченное соединение формулы (I) или его фармацевтически приемлемые соли, включая соединения формулы (I), изотопно-меченные для возможности их детекции PET или SPECT, также охватываются объемом настоящего изобретения. Это также относится к соединениям формулы (I), меченным [13C]-, [14C]-, [3H]-, [18F]-, [125I]- или другими изотопно обогащенными атомами, подходящих для исследований связывания с рецептором или метаболизма.
Термин "фармацевтически приемлемая соль" относится к таким солям, которые, согласно разумной медицинской оценке, являются подходящими для использования в контакте с тканями человека и низших животных без излишней токсичности, раздражения, аллергических реакций и т.п., и соответствуют разумному соотношению польза/риск. Фармацевтически приемлемые соли хорошо известны из уровня техники. Они могут быть получены in situ при выделении и очистке соединений по настоящему изобретению или отдельно путем взаимодействия с фармацевтически приемлемыми нетоксичными основаниями или кислотами, включая неорганические или органические основания и неорганические или органические кислоты.
Соединения по настоящему изобретению можно вводить энтерально или парентерально. Точная доза и режим введения этих соединений и содержащих их композиций зависят от биологической активности соединения per se, возраста, массы тела и пола пациента, потребностей конкретного субъекта, которому вводят лекарственное средство, степени заболевания или необходимости в лекарственном средстве и мнения лечащего врача. Как правило, парентеральное введение требует более низких доз по сравнению с другими способами введения, которые в большей степени зависят от адсорбции. Однако дозы для человека предпочтительно составляют 0,001-10 мг на кг массы тела. Как правило, энтеральные и парентеральные дозы должны находиться в пределах от 0,1 до 1000 мг в день общего количества активных ингредиентов.
После смешивания с фармацевтически подходящими вспомогательными веществами, например, как описано в справочнике "Remington, The Science and Practice of Pharmacy" (21st edition, Lippincott Williams & Wilkins, 2005, см., в частности, часть 5: Pharmaceutical Manufacturing), соединения можно подвергнуть прессованию с получением твердой лекарственной формы, такой как пилюли или таблетки, или подвергнуть переработке с получением капсул или суппозиториев. С использованием фармацевтически подходящих жидкостей соединения также можно применять в форме раствора, суспензии или эмульсии.
Для получения отдельных дозируемых единиц, например, таблеток, предусматривается использование традиционных добавок, таких как наполнители, красители, полимерные связующие и подобные. Как правило, можно использовать любую фармацевтически подходящую добавку, которая не оказывает негативного влияния на функцию активных соединений.
Подходящие носители, с которыми можно вводить соединения по настоящему изобретению, включают, например, лактозу, крахмал, производные целлюлозы и т.п. или смеси таких веществ, используемые в подходящих количествах. Композиции для внутривенного введения могут представлять собой, например, растворы соединений по настоящему изобретению в стерильном изотоническом водном буфере. Если необходимо, внутривенные композиции могут включать, например, солюбилизирующие вещества, стабилизаторы и/или местный анестетик для облегчения боли в месте инъекции.
Фармацевтические композиции по настоящему изобретению могут быть сформулированы для любого пути введения и включать по меньшей мере одно соединение по настоящему изобретению или его фармацевтически приемлемую соль с любым фармацевтически подходящим ингредиентом, эксципиентом, носителем, адъювантом или наполнителем.
Под "фармацевтически подходящим" подразумевается, что носитель, разбавитель или эксципиент должен быть совместимым с другими ингредиентами композиции и не должен быть вредным для его реципиента.
В одном варианте воплощения настоящего изобретения обеспечивается фармацевтическая упаковка или набор, включающий один или несколько контейнеров, заполненных одной или несколькими фармацевтическими композициями по настоящему изобретению. К такому контейнеру(контейнерам) могут прилагаться различные текстовые материалы, такие как инструкции по применению или уведомление в форме, установленной правительственным органом, регулирующим производство, применение или продажу фармацевтических продуктов, где такое уведомление отражает одобрение этим органом производства, применения или продажи для введения человеку или применения в ветеринарии.
Если не определено иное, все технические и научные термины, используемые в настоящей заявке, имеют такое же значение, которое известно специалистам из уровня техники, к которому относится настоящее изобретение. Хотя способы и вещества, подобные или эквивалентные тем, которые описаны в настоящей заявке, можно использовать для практического осуществления или испытания настоящего изобретения, подходящие способы и вещества описаны в настоящем документе.
Подписи к рисунку
Фиг. 1 Процент изменения у молодых и старых самцов мышей C57BL/6J в Т-образном лабиринте с использованием либо носителя (контрольные группы), либо соединения по настоящему изобретению (доза в мг/кг; п.о.)
Следующие примеры предназначены для дальнейшей более подробной иллюстрации настоящего изобретения.
Любое новое промежуточное соединение, раскрытое в настоящей заявке, представляет собой еще один вариант воплощения настоящего изобретения.
ПРИМЕРЫ
§1. (АНАЛИТИЧЕСКИЕ) СПОСОБЫ
Спектры ядерного магнитного резонанса (1Н ЯМР) определяли в указанном растворителе с использованием Bruker Avance-I 400 с 9,4T магнита (1Н: 400 МГц, 13C: 100 МГц), снабженного BBI инверсивной широкополосной измерительной головкой с Z-градиентом и ATM, или Bruker Avance-DRX 600 с 14.1T магнитом, снабженного TXI инверсивным тройным резонансным криозондом с Z-градиентом и ATM, при 300 K, если не указано иное. Спектры определяли в дейтерированном хлороформе (CDCl3) с 99,8% атом. D; или в диметилсульфоксиде-d6 (ДМСО-d6), содержащем 0,03% об./об. тетраметилсилана; оба от компании Aldric. Химические сдвиги (δ) указаны в миллионных долях (м.д.) ниже от области тетраметилсилана. Константы взаимодействия J указаны в Гц. Конфигурации пиков в спектрах ЯМР указаны символами 'кв.' (квартет), 'д.кв.' (двойной квартет), 'т' (триплет), 'дт' (двойной триплет), 'д' (дублет), 'дд' (двойной дублет), 'с' (синглет), 'шир.с' (широкий синглет) и 'м' (мультиплет). NH и OH сигналы определяли после смешивания образца с каплей D2O.
Температуры плавления записывали на устройстве для определения температур плавления Bϋchi B-545.
Все реакции с участием влагочувствительных соединений или условий осуществляли в безводной атмосфере азота.
Реакции отслеживали с использованием тонкослойной хроматографии (ТСХ) на покрытых диоксидом кремния пластиковых пластинах (Merck с предварительным покрытием силикагелем 60 F254) с использованием указанного элюента. Визуализацию пятен осуществляли при помощи УФ освещения (254 нм) или I2.
Жидкостная хроматография - Масс-спектрометрия (ЖХ-МС)
Система A: Колонка: Acquity UPLC BEH C18 1,7 мкм, 50×2,1 мм с 1,7 мкм частицами. Колонку терморегулируют в колоночной печи при 45°C.
Детекция: Диодная матрица, от 210 до 260 нм
|
A=99,9% Вода с 0,1% CH3COOH
B=99,9% CH3CN с 0,1% CH3COOH
Система B: Колонка: Waters Sunfire C18, 30×4,6 мм с 2,5 мкм частицами. Колонку терморегулируют в колоночной печи при 23°C.
Детекция: УФ/VIS измерительное устройство с длиной волны установленной на 254 нм + испарительный светорассеивающий детектор, работающий при 70° Цельсия и давлении N2 1,7 бар.
|
A=99,9% Вода с 0,1% HCOOH
B=99,9% CH3CN с 0,1% HCOOH
Указанное время удерживания (Rt), для Системы B, указано для пика на хроматограмме Общего Ионного Тока (TIC), который показывает массу для [M+H]+ в пределах погрешности 0,5 amu (атомные единицы массы) рассчитанного точного значения MW и имеет ассоциированный пик на хроматограмме Испарительного Светорассеивания (ELS) с относительным % площади (чистота) >85%.
§2. ОБЩИЕ АСПЕКТЫ СИНТЕЗА
Аббревиатуры
ACE-Cl 1-Хлорэтилхлорформиат
9-BBN 9-борабицикло[3.3.1]нонановый димер
CHC13 Хлороформ
CH2C12 Дихлорметан
CH3CN Ацетонитрил
CuBr2 Бромид меди(II)
DBU 1,8-Диазабицикло[5.4.0]ундец-7-ен
DIAD Диизопропилазодикарбоксилат
DIPEA N,N-Диизопропилэтиламин
DMF N,N-диметилформамид
DMSO Диметилсульфоксид
Et3N Триэтиламин
Et2O Диэтиловый эфир
EtOH Этанол
EtOAc Этилацетат
HC1 Хлористый водород
K2CO3 Карбонат калия
KHCO3 Бикарбонат калия
KI Иодид калия
KOH Гидроксид калия
KOtBu трет-бутоксид калия
MeOH Метанол
NaBH4 Боргидрид натрия
NaHCO3 Бикарбонат натрия
NaI Иодид натрия
NaOH Гидроксид натрия
NaOtBu трет-бутоксид натрия
Na2SO4 Сульфат натрия
NBS N-Бромсукцинимид
iPr2O Диизопропиловый эфир
КТ Комнатная температура
SiO2 Силикагель
TFA Трифторуксусная кислота
ТГФ Тетрагидрофуран
TMSCl Хлортриметилсилан
TMSOTf Триметилсилилтрифторметансульфонат
Подходящий синтез заявленных соединений и промежуточных соединений, содержащих пиперидиновые группы, осуществляли способами, описанными ниже; см. схему 1.
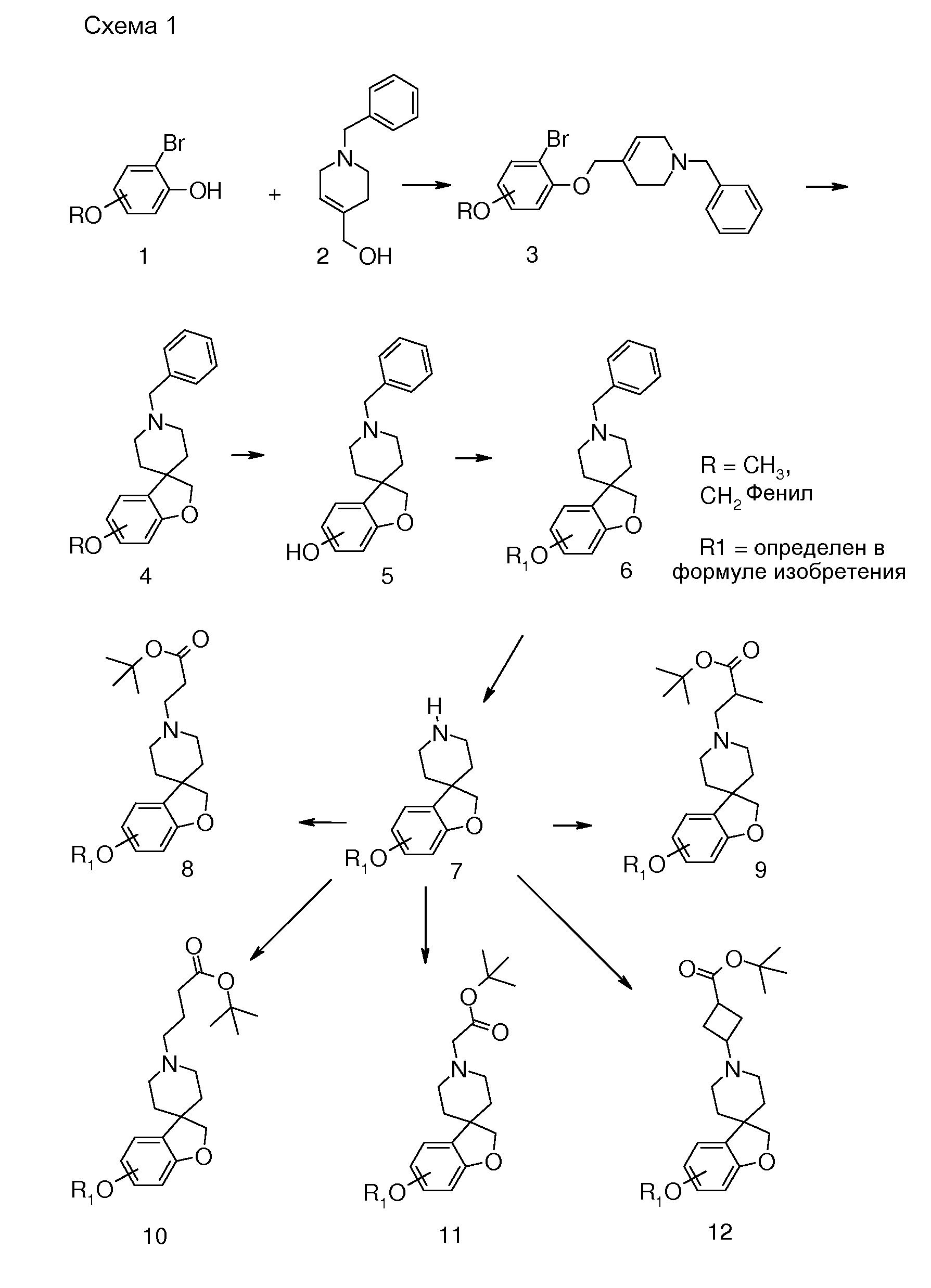
Синтез начинается с подходящим образом замещенного 2-бромфенола. Подходяще замещенные 2-бромфенолы являются коммерчески доступными, или их можно получить из других коммерчески доступных 2-бромфенолов. Соединение типа 1 можно преобразовать в соединение 3 путем взаимодействия с (1-бензил-1,2,3,6-тетрагидропиридин-4-ил)метанолом в присутствии трифенилфосфина и подходящего азо-реагента, такого как диизопропилазодикарбоксилат, в растворителе, таком как тетрагидрофуран или дихлорметан. Последующее преобразование соединения 3 в соединение 4 осуществляют Bu3SnH-опосредованным способом в присутствии AIBN и в растворителе, таком как бензол или толуол, в условиях нагревания до температуры кипения с обратным холодильником и/или в условиях микроволнового облучения. Удаление защиты у метокси-замещенного производного (соединение 4) можно осуществить с использованием HBr в уксусной кислоте, в условиях нагревания до температуры кипения с обратным холодильником, с получением 1'-бензил-2H-спиро[1-бензофуран-3,4'-пиперидин]-6-ола и/или соответствующего -5-ол аналога (5). Последующее O-алкилирование можно осуществить с использованием подходящего алкилирующего агента, такого 1-бромоктан или бензилбромид, в растворителях, таких как диметилсульфоксид (DMSO), ацетон, метанол или ацетонитрил, в присутствии основания, такого как гидроксид калия или карбонат калия, при температурах в пределах от 0°C до 60°C. Удаление N-бензильной группы в (например) соединении 1'-бензил-6-(октилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин] (6) можно осуществить путем взаимодействия с ACE-Cl в растворителе, таком как 1,2-дихлорэтан, с последующим взаимодействием промежуточного карбамата с метанолом.
Полученные спиропиперидины (7) можно подвергнуть взаимодействию с эфиром (мет)акриловой кислоты в так называемой реакции присоединения по Михаэлю, в растворителе, таком как ацетонитрил, метанол или N,N-диметилформамид, при температурах в пределах от комнатной температуры до 85°C и с добавлением в конце некоторого количестве основания, такого как триэтиламин или 1,8-диазабицикло[5.4.0]ундец-7-ен, с получением соответствующих трет-бутил спиропиперидин пропаноатов (8) и -2-метилпропаноатов (9). Спиропиперидины также можно подвергнуть взаимодействию с подходящим алкилирующим реагентом, таким как трет-бутилбромацетат или трет-бутиловый эфир 4-броммасляной кислоты, в присутствии основания, такого как карбонат калия или карбонат цезия, в растворителе, таком как ацетонитрил и/или тетрагидрофуран, при комнатной температуре, с получением соединений типа 10 и 11. Соединения типа 12 можно получить через восстановительное аминирование с использованием 3-оксоциклобутан-1-карбоксилата в растворителе, таком как дихлорэтан или ТГФ, в присутствии триацетоксиборгидрида натрия.
Соединения типа 7-12 можно преобразовать в конечные соединения (I) путем щелочного или кислотного гидролиза сложного эфира, в зависимости от природы группы R1. В качестве примера, трет-бутиловые сложные эфиры можно обработать кислотой, такой как трифторуксусная кислота или хлористый водород, в растворителе, таком как CH2Cl2 или 1,4-диоксан, при комнатной температуре. В качестве еще одного примера, эти сложные эфиры можно обработать основанием, таким как гидроксид натрия или гидроксид лития, в растворителях, таких как этанол, ТГФ и/или вода, при температурах в пределах от комнатной температуры до 70°C.
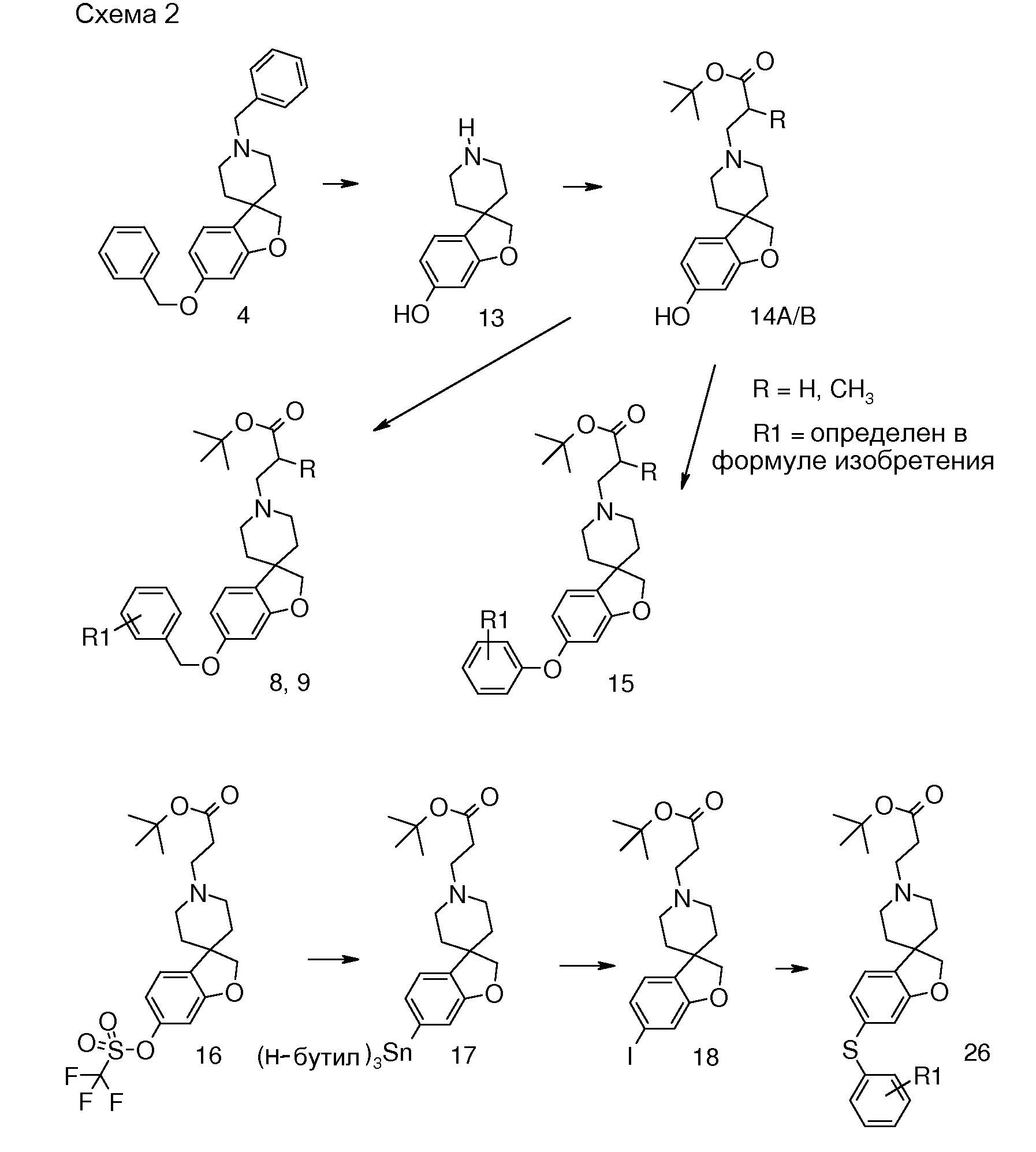
В качестве еще одного примера, удаление обеих бензильных групп в соединении 1'-бензил-6-(бензилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин] (4) (схема 2) можно осуществить путем гидрирования в растворителе, таком как этанол, и с использованием катализатора, такого как гидроксид палладия. Полученный спиропиперидин (13) можно подвергнуть взаимодействию с эфиром (мет)акриловой кислоты с получением трет-бутил 3-{6-гидрокси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата (14A) и трет-бутил 3-{6-гидрокси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропаноата (14B). Эти соединения могут быть модифицированы следующим образом: Путем взаимодействия с подходящим алкилирующим реагентом, таким как алкилбромид или алкилхлорид, в присутствии основания, такого как карбонат калия или карбонат цезия, в растворителе, таком как ацетонитрил и/или тетрагидрофуран, при комнатной температуре, с получением соединений типа 8 и 9. Альтернативно, 14A/B можно преобразовать в соединение типа 8 и 9 путем взаимодействия с подходящим спиртом, в присутствии трифенилфосфина и подходящего азо-реагента, такого как диизопропилазодикарбоксилат, в растворителе, таком как тетрагидрофуран или дихлорметан. Кроме того, 3-{6-гидрокси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат можно преобразовать в трет-бутил 3-{6-(6-фенокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат (соединение типа 15) с использованием бромбензола и смеси ацетата палладия(II), моногидрата трехосновного фосфата калия, 2-ди-трет-бутилфосфино-2',4',6'-триизопропилбифенила и фенилбороновой кислоты при 100°C, предпочтительно в течение ночи.
В другом примере и, например, из соединения 14A, соответствующий трет-бутил 3-{6-[(трифторметан)-сульфонилокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат (16) можно получить с использованием трифторметансульфонимида и основания, такого как триэтиламин, в растворителе, таком как хлороформ, которое можно преобразовать в трет-бутил 3-[6-(ацетилсульфанил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат (20, схема 3) (van den Hoogenband A.Tetrahedron Letters 2010, 51, 6877), с использованием (R)-1-[(1SP)-2-(дициклогексилфосфино)-ферроценил]этилди-трет-бутилфосфина, (CyPF-t-Bu) и трис-(дибензилиден-ацетон)-дипалладия(0) в присутствии тиоацетата калия. Это осуществляют в растворителе, таком как толуол, при повышенной температуре. S-ацетил-защищенное производное (20) может быть гидролизовано, например, с использованием гидроксида натрия в этаноле и затем обработано in situ бензилгалогенидом, например, 1,3-дихлор-2-(хлорметил)-4-метоксибензолом с получением 3-(6-{[2,6-дихлор-3-метокси)-фенил]метилсульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата (21, схема 3), который может быть гидролизован с получением соединения формулы (I). Альтернативно, соединение типа 21, щелочной амин, защищенный в виде его хлористоводородной кислоты, можно преобразовать в соответствующий сульфоновый аналог (22) с использованием пероксимоносульфата калия в растворителе, таком как вода, при комнатной температуре. Соединение типа 16 (схема 2) можно преобразовать в его станнил-производное (17) с использованием гекса-N-бутилдиолова в растворителе, таком как 1,4-диоксан, в присутствии хлорида лития и тетракис(трифенилфосфин)-палладия(0) при повышенных температурах. Этот трет-бутил 3-[6-(трибутилстаннил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат можно преобразовать в трет-бутил 3-{6-иод-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат (18) с использованием N-иодсукцинимида в растворителе, таком как ТГФ, предпочтительно при низкой температуре. Можно соответственно получить бром-аналог (19, схема 3) с использованием N-бромсукцинимида. В другом примере, соединения типа 23 можно получить с использованием станнил-аналога 17 и подходящего хлорангидрида кислоты в растворителе, таком как дихлорэтан, при повышенных температурах.
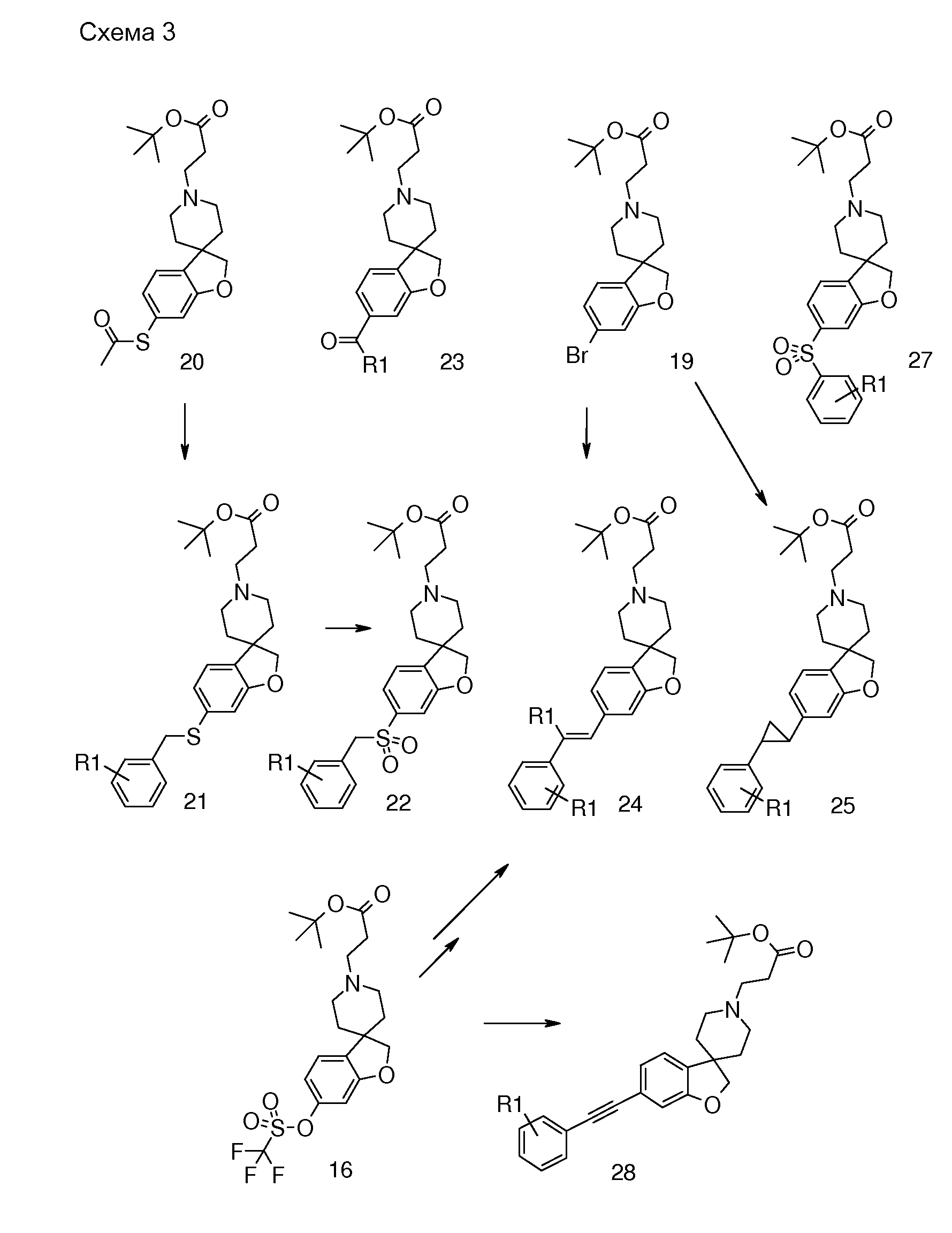
Трет-бутил 3-{6-иод-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат (18) можно использовать для катализируемой иодидом меди(I) реакции, например, с 2-метил-бензол-1-тиолом в растворителе, таком как 1,2-диметоксиэтан, и в присутствии карбоната калия при повышенных температурах, с получением примера соединения типа 26 (схема 2), которое может быть окислено (в примерах типа 27, схема 3) с использованием условий для преобразования соединения типа 21 в соединение типа 22. Трет-бутил 3-{6-бром-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат (19) является подходящим предшественником для реакции Сузуки. В конкретном примере 2-[(E)-2-(2,6-дихлорфенил)-этенил]трифторборонат калия, карбонат цезия и комплекс 1',1'-бис(дифенилфосфино)-ферроценпалладий(II)дихлорида с дихлорметаном подвергают взаимодействию в смеси толуола и воды при температуре кипения с обратным холодильником в течение ночи с получением трет-бутил 3-{6-[(E)-2-(2,6-дихлорфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата в качестве примера соединения типа 24 (схема 3). В другом примере, соединения типа 24 можно получить с использованием соединения типа 16 (схема 2), которое можно преобразовать в его винил-производное, с использованием трибутил(этенил)станнана в растворителе, таком как 1,4-диоксан, в присутствии хлорида лития и тетракис(трифенилфосфин)-палладия(0) при повышенных температурах. Этот трет-бутил 3-{6-(этенил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат можно преобразовать в соединения типа 24 с использованием подходяще замещенной фенилбороновой кислоты в растворителе, таком как N,N-диметилформамид, при повышенных температурах (Karimi B, Synthesis 2010, 1399). В другом варианте воплощения настоящего изобретения соединения типа 28 (схема 3) можно получить из трет-бутил 3-{-{6-[(трифтор-метан)сульфонилокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноата (соединение 16) и подходяще замещенного фенилацетиленового производного в растворителе, таком как диметилсульфоксид, с использованием основания, такого как трехосновной фосфат калия моногидрат, в присутствии ацетата палладия(II) и трифенилфосфина при повышенных температурах.
С использованием методики, описанной для преобразования соединения 19 в примеры соединения типа 24, трет-бутил 4-{6-[2-(2,6-дихлорфенил)циклопропил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-пропаноат (в качестве примера соединения типа 25) можно получить из соединения 19 и калиевой соли [2-(2,6-дихлорфенил)-циклопропил]-трифторбороната.
В другом варианте воплощения настоящего изобретения соединения типа 35 (схема 4) можно получить следующим образом: 1-(бензилокси)-4-бром-2,3-дифторбензол (29) и 4-пиридинметанол (30) подвергают взаимодействию в растворителе, таком как NMP, при 100°C в течение 0,5 часа (Stephane G. Tetrahedron Letters 2009, 50, 3776), с последующей кватернизацией с использованием бензилбромида и восстановлением промежуточного пиридин-1-ийбромида при помощи боргидрида натрия с получением соединения 32. Циклизацию (Bu3SnH, в присутствии AIBN) в растворителе, таком как бензол или толуол, можно осуществить в условиях нагревания до температуры кипения с обратным холодильником и/или в условия микроволнового облучения. Удаление обеих бензильных групп в соединении 1'-бензил-6-(бензилокси)-7-фтор-2H-спиро[1-бензофуран-3,4'-пиперидин] (33) можно осуществить путем гидрирования в растворителе, таком как этанол, и с использованием катализатора, такого как гидроксид палладия. Соединение 34 можно преобразовать в соединение типа 35, как описано выше, с последующим гидролизом с получением соединений формулы (I).
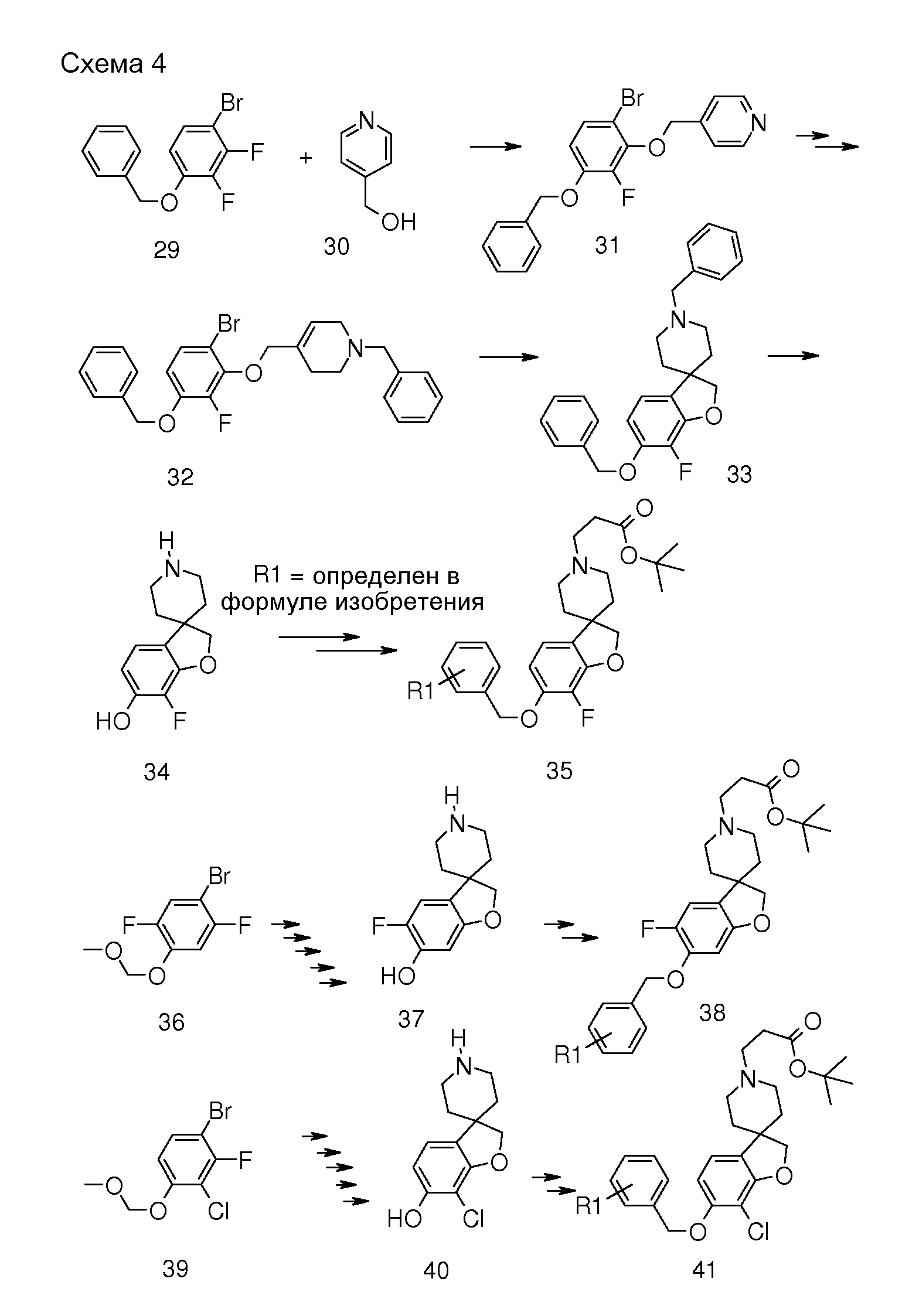
С использованием этой методики (Tetrahedron Letters 2009) подходящие (защищенные) фторированные бензольные производные можно преобразовать в соединения типа 38 и 41.
6-Бром-2H[1-бензофуран-3,4'-пиперидин] (46, схема 5) можно получить аналогичным способом. Удаление N-бензила можно осуществить путем взаимодействия с ACE-Cl в растворителе, таком как 1,2-дихлорэтан, с последующим взаимодействием промежуточного карбамата с метанолом. Преобразование соединения 46 в соединение типа 47, 48 и 49 осуществляют аналогичным способом, как описано на схеме 1 и 2.
Кроме того, обработка соединения 45 н-бутиллитием при -75°C в растворителе, таком как тетрагидрофуран или диэтиловый эфир, с последующим гашением подходящим изоцианатом дает соответствующий амид, который можно подвергнуть дебензилированию при помощи ACE-Cl и преобразовать в соединения типа 50. Гидролиз даст соединения формулы (I).
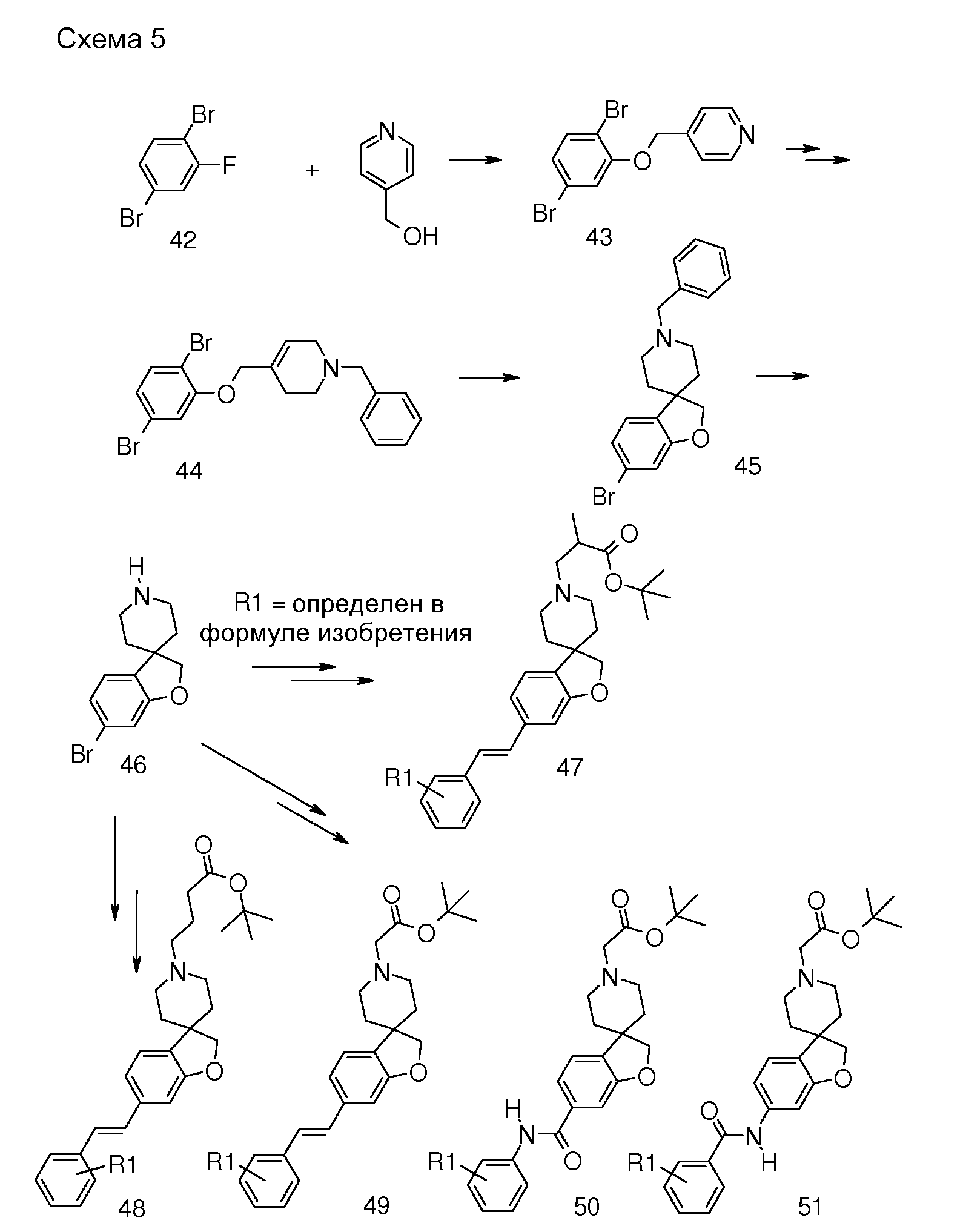
Амиды соединения типа 51 (схема 5) можно получить с использованием подходящего замещенного бензамида, например, 2,6-дихлорбензамида и трет-бутил 3-{-{6-[(трифторметан)сульфонилокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]-пропаноата (соединение 16) в растворителе, таком как трет-бутиловый спирт, и с использованием основания, такого как трехосновной фосфат калия, в присутствии трис-(дибензилиденацетон)-дипалладия(0) и 2-ди-трет-бутилфосфино-3,4,5,6-тетраметил-2',4',6'-три-изопропилбифенила при повышенных температурах. Гидролиз даст соединения формулы (I).
В качестве еще одного примера, соединение 13 (схема 2) можно защитить (соединение 52, схема 6) по азоту подходящей защитной группой (P.G.M. Wuts, T.W. Greene Protective Groups in Organic Synthesis, 4th ed., John Wiley & Sons, 2006), такой как трет-бутилоксикарбонил (BOC), путем взаимодействия с ди-трет-бутилдикарбонатом в растворителе, таком как ацетонитрил, при комнатной температуре. Затем фенольную группу можно подвергнуть взаимодействию с подходящим алкилирующим реагентом в растворителе, таком как ацетонитрил, в присутствии основания, такого как карбонат калия, при комнатной температуре, или с использованием условий Мицунобу и подходящего спирта. После этого трет-бутилоксикарбонильная (BOC) группа может быть удалена путем обработки кислотой, такой как хлористый водород, в растворителе, таком как этанол, при температурах в пределах от комнатной температуры до 60°C, с получением (альтернативным образом) уже указанного спиропиперидина типа 7.
Соединения типа 7 также могут быть модифицированы по азоту при помощи группы сложного эфира 2,2-дифтор-пропионовой кислоты (54) с использованием следующей последовательности стадий (Cheguillaume A., Lacroix S., Marchand-Brynaert J. Tetrahedron Letters 2003, 44, 2375): Первое взаимодействие с 1H-бензотриазол-1-метанолом в растворителе, таком как этанол, при температурах около 50°C; с последующим взаимодействием с цинковым реагентом, полученным из цинковой пыли, триметилсилилхлоридом и бромдифторацетатом в растворителе, таком как тетрагидрофуран, при температурах около 70°C.
Соединения формулы (I), где R3=(CH2)2OPO3H2 можно синтезировать, как показано на схеме 6. Так, соединение 7 подвергают взаимодействию с 2-(2-хлор-этокси)тетрагидро-2H-пираном в присутствии основания, такого как карбонат калия и иодид натрия, в растворителе, таком как DMF, при температуре около 100°C. Тетрагидро-2H-пирановую группу (в соединении 55) удаляют путем обработки кислотой, такой как п-толуолсульфоновая кислота, в растворителе, таком как метанол, при комнатной температуре. Образовавшийся спирт (соединение 56) затем обрабатывают фосфорамидитным реагентом, таким как ди-трет-бутил N,N-диизопропил-фосфорамидит, в присутствии тетразола, в смеси растворителей, таких как ТГФ, CH2Cl2 и CH3CN, при комнатной температуре и затем окисляют с использованием окислителя, такого как пероксид водорода или трет-бутилгидропероксид, в тех же растворителях при комнатной температуре, с получением соединений типа 57. Гидролиз фосфатных сложных эфиров можно осуществить путем обработки кислотой, такой как TFA, в растворителе, таком как CH2Cl2, при комнатной температуре.
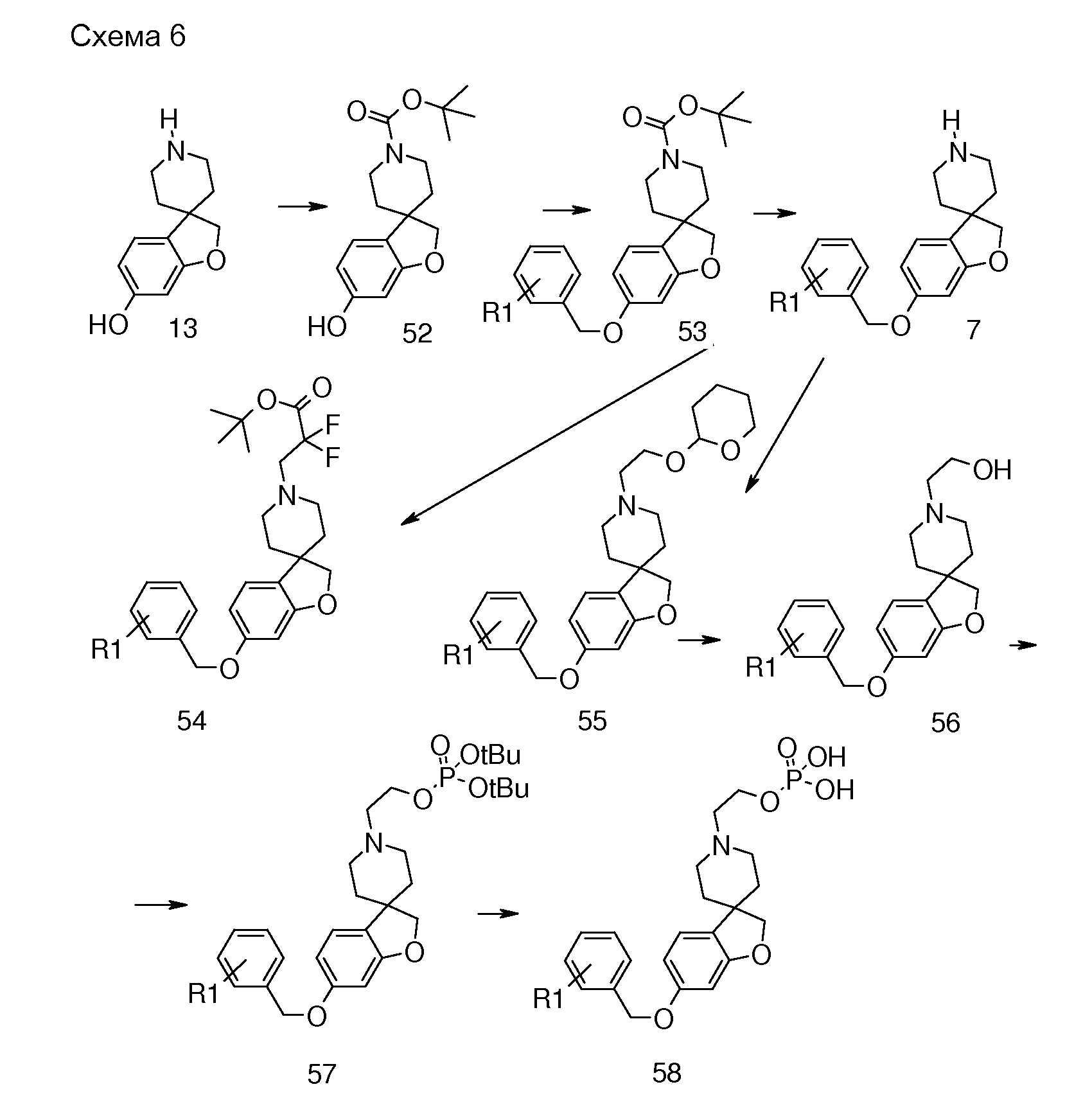
В другом варианте воплощения настоящего изобретения соединения типа 64 (схема 7) можно получить следующим образом: 4-(бензилокси)-1-бром-2-фтор-бензол и 3-пиридинметанол (59) подвергают взаимодействию в растворителе, таком как NMP, при 100°C в течение 0,5 часа, с последующей кватернизацией при помощи бензилбромида и восстановлением промежуточного пиридин-1-ийбромида при помощи боргидрида натрия с получением 1-бензил-5-[5-(бензилокси)-2-бромфеноксиметил]-1,2,3,6-тетра-гидропиридина. Это соединение можно преобразовать в бензил 5-[5-бензилокси)-2-бромфеноксиметил]-1,2,3,6-тетрагидропиридин-1-карбоксилат (61) с использованием основания, такого как бикарбонат калия, в дихлорметане в присутствии бензилхлорформиата при температуре окружающей среды. Циклизацию соединения 61 можно осуществить в растворителе, таком как NMP, и в присутствии карбоната серебра и палладацикла Германна-Беллера (Lauren R. Tetrahedron, 2008, 64, 4468), предпочтительно при 140°C. Удаление обоих защитных групп и восстановление двойной связи в соединении 6-(бензилокси)-2',6'-дигидро-1'H,2H-спиро[1-бензофуран-3,3'-пиридин] (62) можно осуществить путем гидрирования в смеси растворителей, таких как метанол и этилацетат, с использованием катализатора, такого как гидроксид палладия. Соединение 63 можно преобразовать в соединения типа 64 и другие структурные аналоги (например, аналоги соединений типа 24 и 28), как описано выше. Гидролиз даст соединения формулы (I).
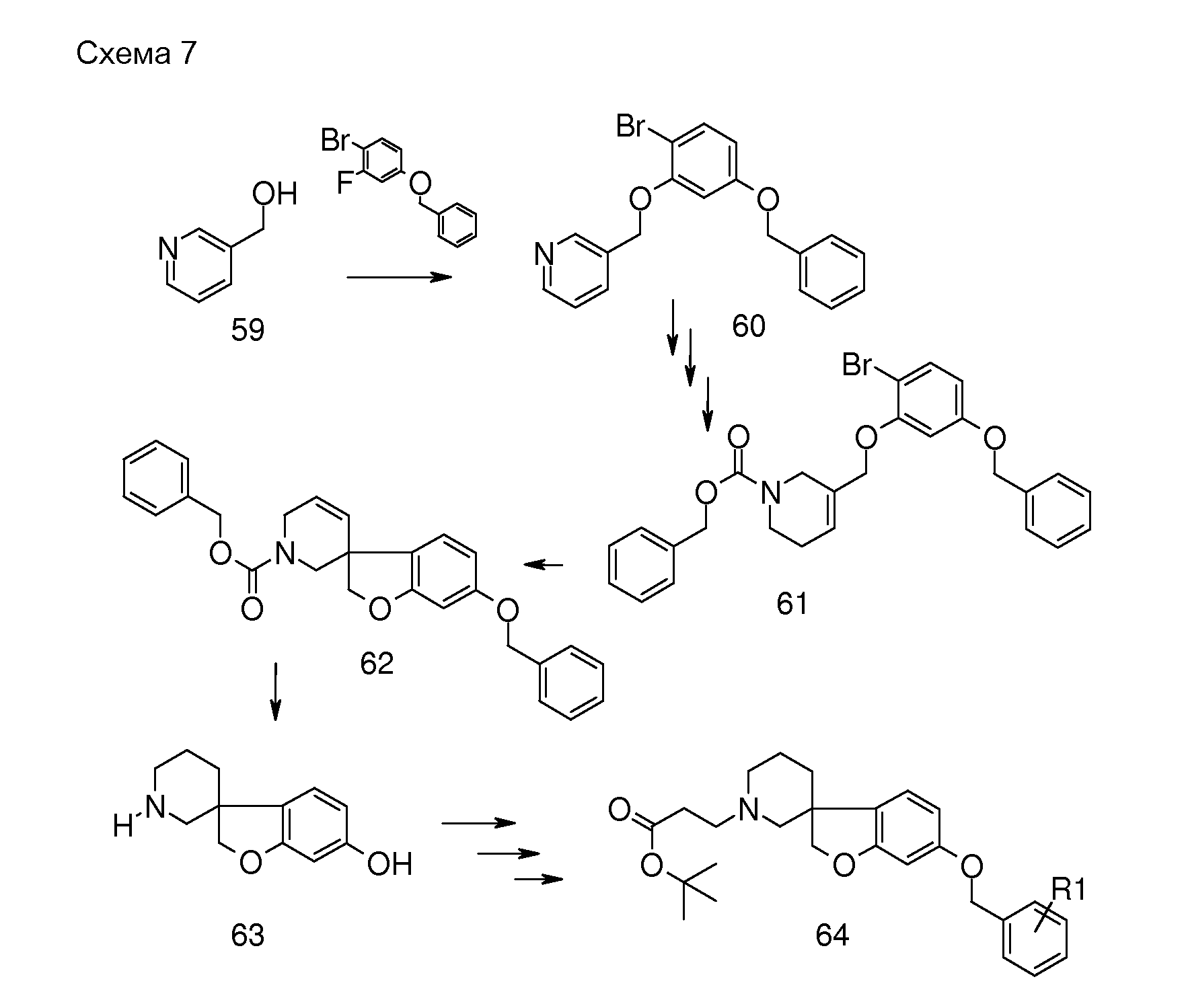
В другом примере настоящего изобретения соединения типа 69 (схема 8) можно получить следующим образом: (1-бензил-2,5-дигидро-1H-пиррол-3-ил)метанол (US2010-0069351) и 4-(бензилокси)-1-бром-2-фторбензол подвергают взаимодействию в растворителе, таком как NMP, при 100°C в течение 30 минут с получением 1-бензил-3-[5-бензилокси]-2-бромфенокси-метил]-2,5-дигидро-1H-пиррола (66). Циклизацию (Bu3SnH, в присутствии AIBN) в растворителе, таком как бензол или толуол, можно осуществить в условиях микроволнового облучения (предпочтительно при 200°C). Удаление обоих защитных групп можно осуществить при помощи формиата аммония в растворителе, таком как метанол, с использованием катализатора, такого как гидроксид палладия. Соединение 68 можно преобразовать в соединения типа 69 (и аналоги), как описано выше, с последующим гидролизом с получением соединений формулы (I).
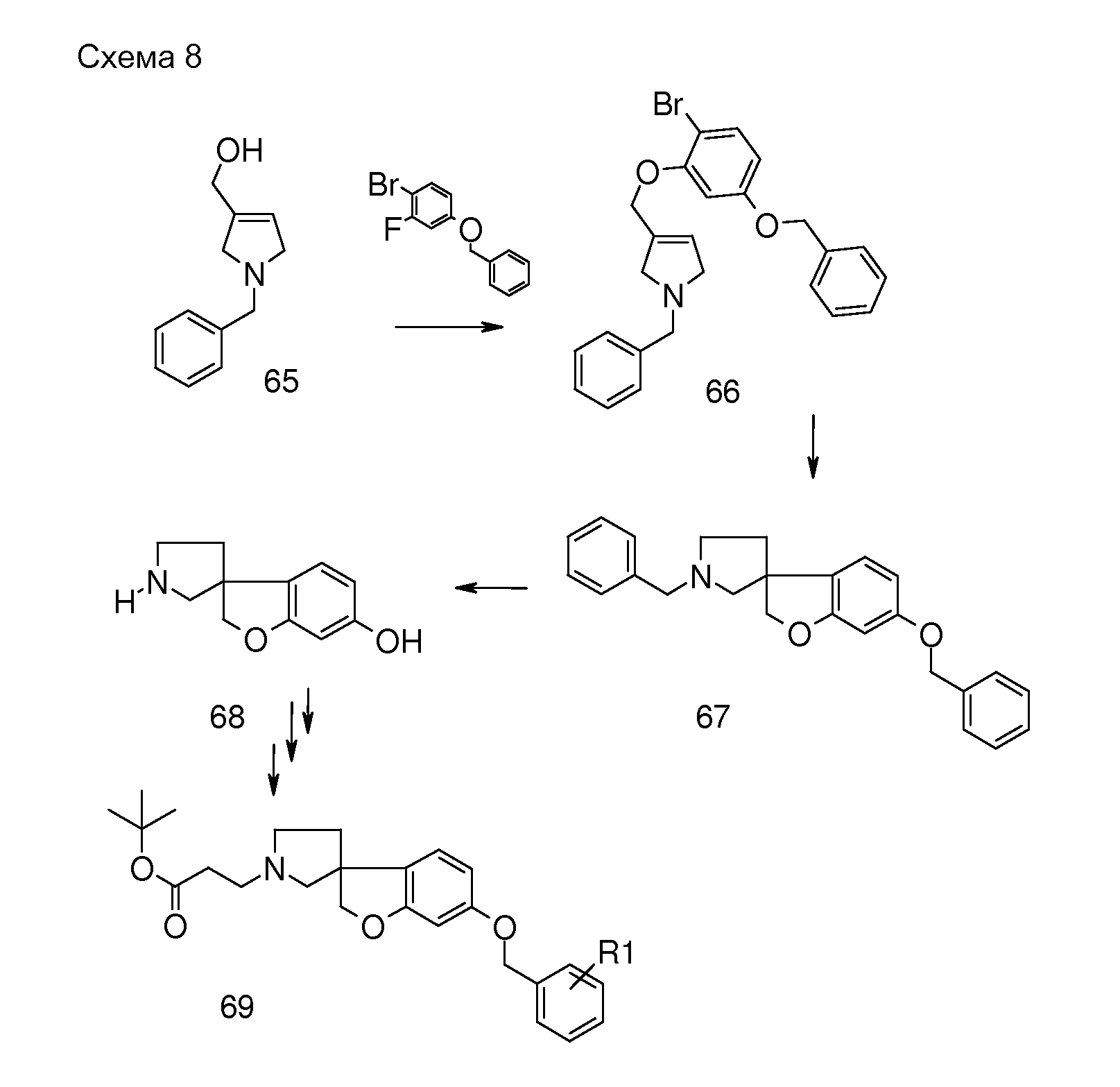
Еще в одном примере настоящего изобретения соединения типа 75 (схема 9) можно получить следующим образом: аминоспирт 71 можно получить путем взаимодействия 5-(бензилокси)-2,3-дигидро-1H-инден-1-она (70) и триметилсилилцианида в присутствии кислоты Льюиса, такой как иодид цинка, при комнатной температуре, в чистом виде без разбавителя. Затем осуществляют восстановление промежуточного цианогидрина с использованием восстановителя, такого алюмогидрид лития, в растворителе, таком как тетрагидрофуран. Аминоспирт (71) можно подвергнуть взаимодействию с активированной хлоруксусной кислотой или бромуксусной кислотой в растворителе, таком как дихлорметан, с использованием основания, такого как триэтиламин, и затем осуществить циклизацию в растворителе, таком как 2-пропанол, с использованием основания, такого как гидроксид калия, с получением 5-(бензилокси)-2,3-дигидроспиро[инден-1,2'-морфолин]-5'-она (72). Этот продукт может быть восстановлен с использованием восстановителя, такого как боран, в растворителе, таком как тетрагидрофуран, при температурах в пределах от 0°C до комнатной температуры с получением соединения (73) 5-(бензилокси)-2,3-дигидроспиро[инден-1,2'-морфолин]. Можно осуществить гидрирование этого продукта в растворителе, таком как MeOH, и с использованием катализатора, такого как гидроксид палладия, с получением соединения 74. Соединение 74 можно преобразовать в соединения типа 75 (и аналоги), как описано выше, с последующим гидролизом с получением соединений формулы (I).
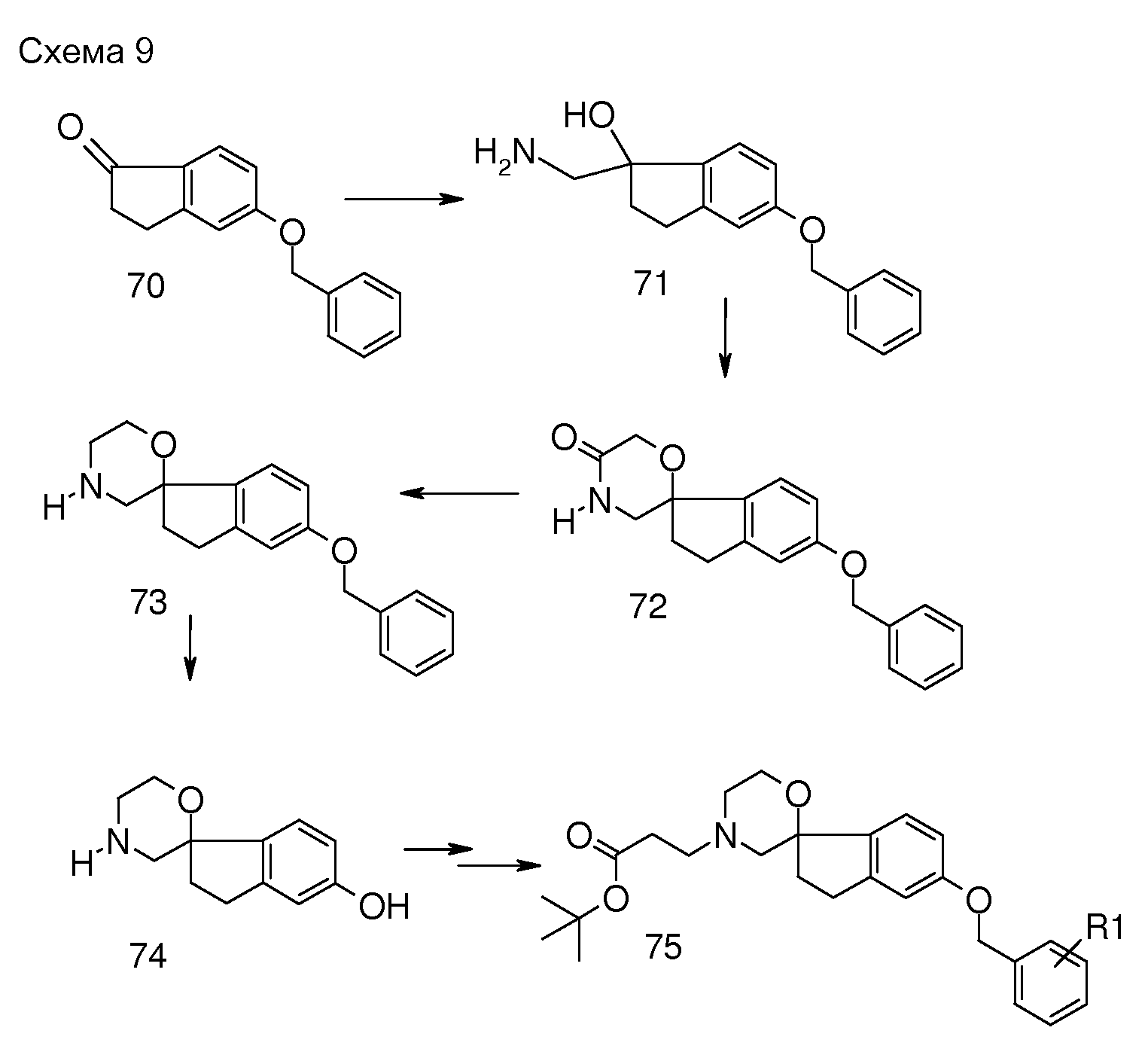
В другом варианте воплощения настоящего изобретения соединения типа 82 (схема 10) можно получить следующим образом: 6-метокси-2,3-дигидро-1H-инден-1-он (76) и боргидрид натрия подвергают взаимодействию в растворителе, таком как MeOH, при комнатной температуре, с последующей дегидратацией с использованием кислотного катализатора, такого как гидрат п-толуолсульфоновой кислоты, в присутствии гидрохинона в растворителе, таком как толуол. Этот продукт: 5-метокси-1H-инден (77) можно обработать бис(триметилсилил)амидом лития (LiHMDS) в растворителе, таком как тетрагидрофуран (0°C). Промежуточное соединение можно подвергнуть взаимодействию с подходящим алкилирующим реагентом, например трет-бутил N,N-бис(2-хлорэтил)карбаматом, в растворителе, таком как тетрагидрофуран или диэтиловый эфир, предпочтительно при температуре в пределах от 0°C до комнатной температуры. Можно осуществить гидрирование этого продукта (78) в растворителе, таком как MeOH, и с использованием катализатора, такого как гидроксид палладия, с получением соединения 79, которое можно подвергнуть взаимодействию с этантиолатом натрия в растворителе, таком как Ν,Ν-диметилформамид, при 130°C в течение 60 часов. Удаление защиты можно осуществить с использованием, например, 4н раствора HCl в растворителе, таком как диоксан, с получением HCl соли 2,3-дигидро-спиро[инден-1,4'-пиперидин]-5-ола (81), которую можно преобразовать в соединения типа 82 (и аналоги), как описано выше. Гидролиз даст соединения формулы (I).
§3.КОНКРЕТНЫЕ ПРИМЕРЫ СИНТЕЗА
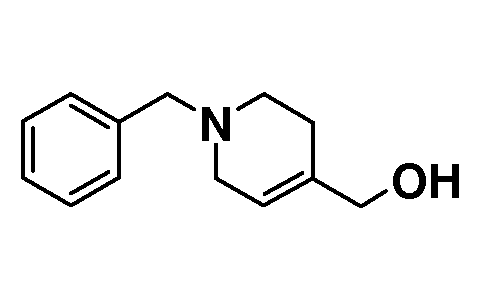
(1-Бензил-1,2,3,6-тетрагидропиридин-4-ил)метанол. 4-Гидроксиметилпиридин (20 г, 183 ммоль, 1,0 экв.) растворяли в DMF (80 мл) и добавляли бензилбромид (24,2 мл; 202 ммоль) и раствор перемешивали при 100°C в течение 2 часов. Раствору давали охладиться до комнатной температуры и разбавляли EtOH (этанолом) (300 мл) и обрабатывали порциями NaBH4 (8,7 г; 230 ммоль) и перемешивали при температуре кипения с обратным холодильником в течение 3 часов. Раствору давали охладиться до комнатной температуры и концентрировали в значительной степени. Остаток брали для поглощения в EtOAc и воду и органическую фазу сушили (Na2SO4), фильтровали и концентрировали с получением 35 г неочищенного масла. Это вещество очищали с использованием короткой пробки (10 см) из диоксида кремния, элюируя EtOAc, с получением продукта (23,9 г; 64%), который выделяли в виде масла.
1Н ЯМР (300 МГц, CDCl3) δ м.д. 7,39-7,2 (м, 5H), 5,69-5,63 (м, 1H), 4,03 (с, 2H), 3,58 (с, 2H), 3,0 (м, 2H), 2,6 (т, J=6 Гц, 2H), 2,21-2,11 (м, 2H).
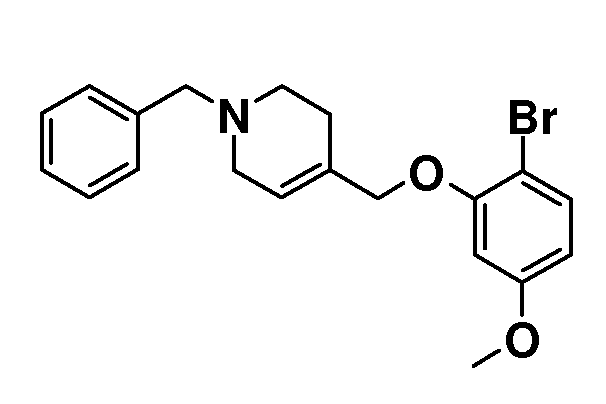
1-Бензил-4-((2-бром-5-метоксифенокси)метил)-1,2,3,6-тетрагидро-пиридин. (1-бензил-1,2,3,6-тетрагидропиридин-4-ил)метанол (20,7 г; 102 ммоль) растворяли в ТГФ (150 мл) и добавляли 2-бром-5-метоксифенол (20,7 г, 102 ммоль) с последующим добавлением PPh3 (29,4 г; 112 ммоль). Раствор охлаждали на льду и добавляли по каплям диизопропилазодикарбоксилат (22,2 мл; 112 ммоль), поддерживая температуру <10°C (в течение ~2 часов), и перемешивали при комнатной температуре в течение ночи. Смесь концентрировали и остаток перемешивали в гептане (200-300 мл) в течение 20 минут. Осадок отфильтровывали и промывали гептаном. Фильтрат концентрировали с получением 36 г желтого масла. Добавляли гептан (150 мл) и смесь перемешивали в течение 5 минут и оставляли выстаиваться в течение 2 минут (отделение масла), гептановую фазу декантировали от масла и концентрировали с получением продукта (25 г; 63%), который выделяли в виде желтого масла.
1H ЯМР (300 МГц, CDCl3) δ м.д. 7,42-7,2 (м, 6H), 6,48 (д, J=2 Гц, 1H), 6,39 (дд, J=9 и 2 Гц, 1H), 5,85-5,8 (м, 1H), 4,44 (с, 2H), 3,78 (с, 3H), 3,6 (с, 2H), 3,07-3,01 (м, 2H), 2,64 (т, J=6 Гц, 2H), 2,31-2,23 (м, 2H).
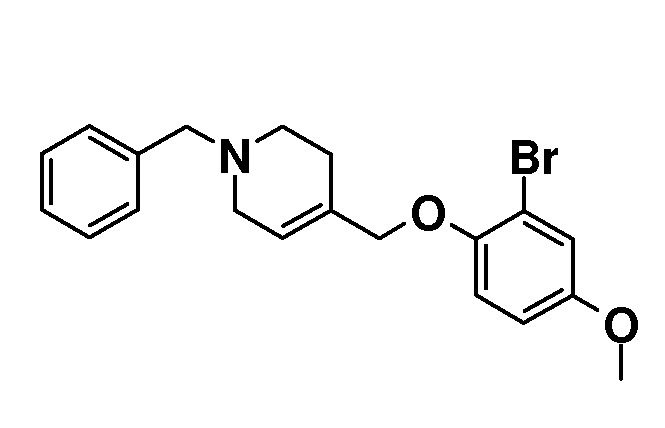
1-Бензил-4-((2-бром-4-метоксифенокси)метил)-1,2,3,6-тетрагидро-пиридин. (1-бензил-1,2,3,6-тетрагидропиридин-4-ил)метанол (18,9 г; 93 ммоль) растворяли в ТГФ (150 мл) и добавляли 2-бром-4-метоксифенол (18,9 г; 93 ммоль) с последующим добавлением PPh3 (26,8 г, 102 ммоль). Раствор охлаждали на льду и добавляли по каплям диизопропилазодикарбоксилат (20,3 мл, 102 ммоль), поддерживая температуру <10°C (в течение ~2 часов) и перемешивали при комнатной температуре в течение 2 дней. Смесь концентрировали. Остаток брали для поглощения в EtOAc и насыщенный раствор NaHCO3 и органическую фазу сушили (Na2SO4), фильтровали и концентрировали с получением 50 г неочищенного масла. Это вещество перемешивали в гептане (200-300 мл) в течение 20 минут. Осадок отфильтровывали и промывали гептаном. Фильтрат концентрировали с получением 29 г желтого масла. Это вещество очищали с использованием короткой пробки (10 см) из диоксида кремния, элюируя смесью гептан/EtOAc 6/1 с получением продукта (18,5 г; 51%), который выделяли в виде желтого масла.
1H ЯМР (300 МГц, CDCl3) δ м.д. 7,38-7,2 (м, 5H), 7,12 (д, J=2 Гц, 1H), 6,83 (м, 2H), 5,78 (м, 1H), 4,42 (с, 2H), 3,76 (с, 3H), 3,59 (с, 2H), 3,02 (м, 2H), 2,63 (т, J=6 Гц, 2H), 2,33-2,23 (м, 2H).
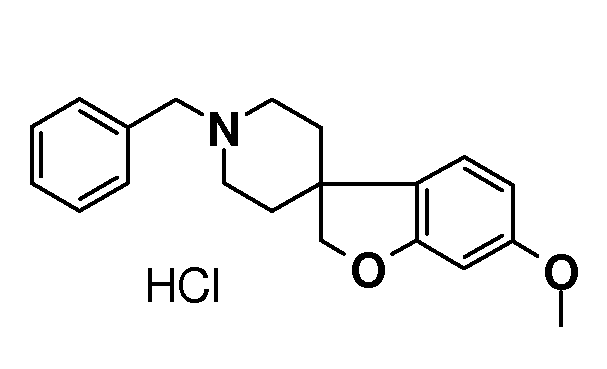
1'-Бензил-6-метокси-2H-спиро[бензофуран-3,4'-пиперидин] гидрохлорид. 1-бензил-4-((2-бром-5-метоксифенокси)метил)-1,2,3, 6-тетрагидро-пиридин (25 г; 64,4 ммоль) растворяли в бензоле (500 мл) и раствор продували азотом в течение 30 минут. Добавляли Bu3SnH (24,97 г; 85,8 ммоль) с последующим добавлением AIBN (0,6 г) и раствор перемешивали при температуре кипения с обратным холодильником в течение ночи. Реакционную смесь концентрировали и осуществляли ее поглощение в EtOAc и насыщенный раствор NaHCO3. Органическую фазу сушили (Na2SO4), фильтровали и концентрировали с получением 46 г неочищенного масла. Раствор 5-6н HCl в i-PrOH (40 мл) разбавляли i-PrOH (200 мл) и добавляли к маслу и перемешивали в течение 1 часа. Осадок отфильтровывали и промывали TBME и сушили в вакууме с получением продукта (15,1 г; 68%), который выделяли в виде белого твердого вещества.
1Н ЯМР (свободное основание, 300 МГц, CDCl3) δ м.д. 7,38-7,22 (м, 5H), 7,03 (д, J=9 Гц, 1H), 6,43 (дд, J=9 и 2 Гц, 1H), 6,39 (д, J=2 Гц, 1H), 4,37 (с, 2H), 3,77 (с, 3H), 3,53 (с, 2H), 2,94-2,83 (м, 2H), 2,1-1,88 (м, 4H), 1,74-1,67 (м, 2H).
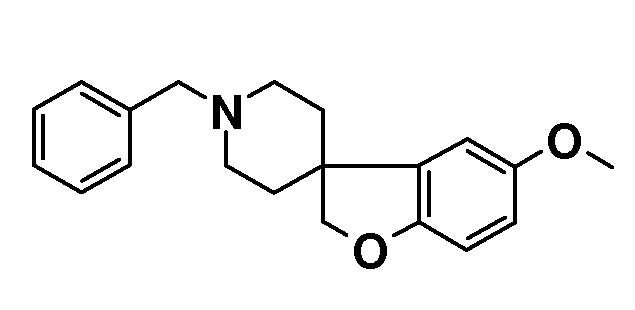
1'-Бензил-5-метокси-2H-спиро[1-бензофуран-3,4'-пиперидин]. 1-бензил-4-((2-бром-4-метоксифенокси)метил)-1,2,3,6-тетрагидро-пиридин (20 г; 51,5 ммоль) растворяли в бензоле (400 мл) и раствор продували азотом в течение 30 минут. Добавляли Bu3SnH (23,6 мл; 87 ммоль) с последующим добавлением AIBN (0,5 г) и раствор перемешивали при температуре кипения с обратным холодильником в течение ночи. Реакционную смесь концентрировали и осуществляли ее поглощение в EtOAc и насыщенный раствор NaHCO3. Органическую фазу сушили (Na2SO4), фильтровали и концентрировали с получением 40 г неочищенного масла. Это вещество очищали с использованием короткой пробки (10 см) из диоксида кремния, элюируя смесью гептан/EtOAc 4/1, с получением продукта (16,2 г; 91%), который выделяли в виде светло-желтого твердого вещества.
1H ЯМР (300 МГц, CDCl3) δ м.д. 7,38-7,22 (м, 5H), 6,74-6,63 (м, 3H), 4,37 (с, 2H), 3,77 (с, 3H), 3,53 (с, 2H), 2,93-2,84 (м, 2H), 2,1-1,88 (м, 4H), 1,76-1,67 (м, 2H).
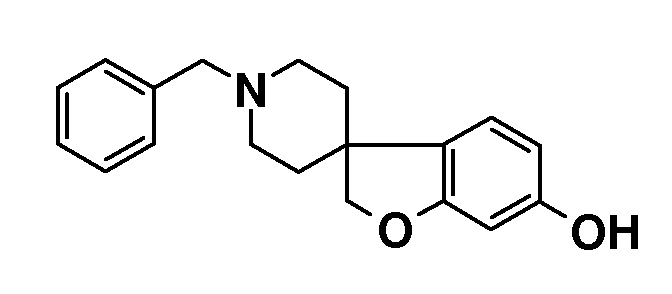
1'-Бензил-2H-спиро[1-бензофуран-3,4'-пиперидин]-6-ол. 1'-бензил-6-метокси-2H-спиро[бензофуран-3,4'-пиперидин] гидрохлорид (15 г; 0,58 ммоль) суспендировали в HOAc (160 мл) и добавляли 48% HBr (20 мл) и раствор перемешивали при температуре кипения с обратным холодильником в течение 24 часов. Смесь концентрировали и остаток брали для поглощения в EtOAc и насыщенный раствор NaHCO3. Органическую фазу сушили (Na2SO4), фильтровали и концентрировали с получением продукта (14 г).
1H ЯМР (300 МГц, CDCl3) δ м.д. 7,38-7,23 (м, 5H), 6,94 (д, J=8 Гц, 1H), 6,37-6,26 (м, 2H), 4,36 (с, 2H), 3,55 (с, 2H), 2,94-2,85 (м, 2H), 2,11-1,88 (м, 4H), 1,75-1,65 (м, 2H).
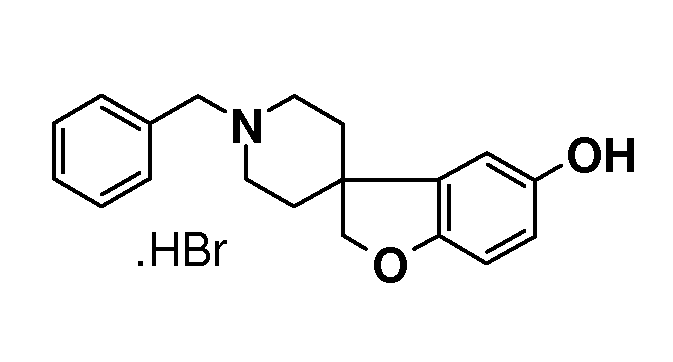
Гидробромид 1'-бензил-2H-спиро[1-бензофуран-3,4'-пиперидин]-5-ола. 1'-бензил-5-метокси-2H-спиро[бензофуран-3,4'-пиперидин] (16,2 г; 46,8 ммоль) суспендировали в HOAc (160 мл) и добавляли 48% HBr (20 мл) и раствор перемешивали при температуре кипения с обратным холодильником в течение 20 часов. Смеси давали охладиться и частично концентрировали. Осадок собирали фильтрованием и сушили в вакууме с получением продукта (14,7 г; 84%).
1H ЯМР (300 МГц, CD3OD) δ м.д. 7,6-7,46 (м, 5H), 6,64-6,57 (м, 3H), 4,43 (с, 2H), 4,35 (с, 2H), 3,48 (с, 2H), 3,21-3,04 (м, 2H), 2,23-2,08 (м, 2H), 2,02-1,92 (м, 2H).
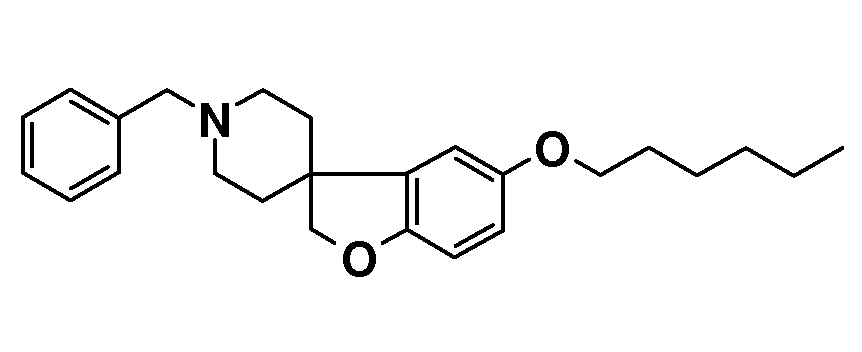
1'-Бензил-5-(гексилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]. Гидробромид 1'-бензил-2H-спиро[1-бензофуран-3,4'-пиперидин]-5-ола (170 мг; 0,58 ммоль) растворяли в MeOH (3 мл) и добавляли NaOH (48 мг; 1,2 ммоль) и раствор перемешивали в течение 5 минут. Добавляли 1-бромгексан (0,1 мл; 0,7 ммоль) и раствор перемешивали при температуре кипения с обратным холодильником в течение ночи. Смеси давали охладиться до комнатной температуры и концентрировали. Остаток брали для поглощения в EtOAc и H2O, органическую фазу сушили (Na2SO4), фильтровали и концентрировали с получением 160 мг масла. Это вещество подвергали колоночной хроматографии с использованием гептан/EtOAc 4/1 с получением продукта (102 мг; 60%), который выделяли в виде масла.
1H-ЯМР (300 МГц, CDCl3) δ м.д. 7,38-7,22 (м, 5H), 6,74-6,66 (м, 3H), 4,36 (с, 2H), 3,87 (т, J=7 Гц, 2H), 3,55 (с, 2H), 2,95-2,85 (м, 2H), 2,11-1,9 (м, 4H), 1,8-1,68 (м, 2H), 1,5-1,4 (м, 2H), 1,4-1,22 (м, 6H), 0,89 (т, J=7,5 Гц, 3H).
Следующие соединения были получены аналогичным способом:
1'-Бензил-5-(гептилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин].
1'-Бензил-5-(октилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин].
Аналогичным способом и исходя из 1'-бензил-2H-спиро[1-бензофуран-3,4'-пиперидин]-6-ол) были получены следующие соединения:
1'-Бензил-6-(гексилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин].
1'-Бензил-6-(гептилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин].
1'-Бензил-6-(октилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин].
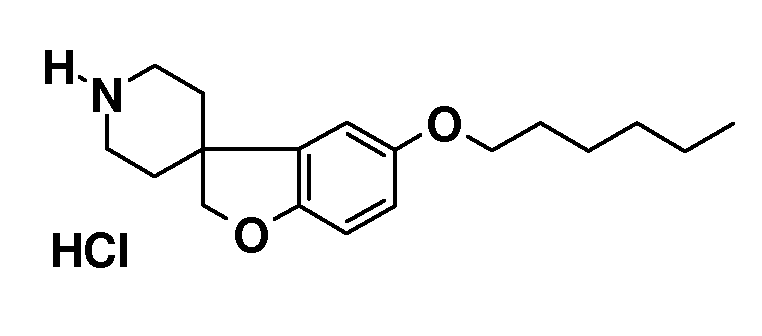
5-(Гексилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин] гидрохлорид. 1'-бензил-5-(гексилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин] (2,7 г; 7,1 ммоль) растворяли в 1,2-DCE (20 мл) и раствор перемешивали при 0°C. 1-Хлорэтилхлорформиат (3,07 мл; 28,4 ммоль) добавляли по каплям и раствор перемешивали в течение 10 минут при 0°C и при температуре кипения с обратным холодильником в течение 6 часов. Раствору давали охладиться до комнатной температуры в течение ночи и разбавляли DCM и промывали насыщенным солевым раствором. Органическую фазу сушили (Na2SO4), фильтровали и основательно концентрировали с получением неочищенного масла.
Масло растворяли в MeOH (20 мл) и перемешивали при температуре кипения с обратным холодильником в течение 1,5 часов. Смесь концентрировали в значительной степени и обрабатывали TBME. Из этого вещества отделяли масло, и раствор декартировали, и масло сушили в вакууме с получением 0,5 г продукта. Слитый раствор концентрировали и остаток растворяли в небольшом количестве MeOH. Добавляли 1н раствор HCl в i-PrOH (20 мл) и раствор перемешивали в течение 30 минут. Смесь концентрировали до ½ объема и осадок отфильтровывали и сушили в вакууме с получением еще 1,2 г. Объединение полученных фракций дало продукт (1,7 г; 74%), который получали в виде белого твердого вещества.
1H ЯМР (300 МГц, CDCl3) δ м.д. 9,78 (с, 2H), 6,81-6,66 (м, 3H), 4,36 (с, 2H), 3,9 (т, J=7 Гц, 2H), 3,62-3,49 (м, 2H), 3,14-2,93 (м, 2H), 2,43-2,27 (м, 2H), 2,07-1,95 (м, 2H), 1,81-1,7 (м, 2H), 1,51-1,3 (м, 6H), 0,9 (т, J=7,5 Гц, 3H).
Следующие соединения были получены аналогичным способом:
5-(Гептилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин] гидрохлорид.
5-(Октилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин] гидрохлорид.
6-(Гексилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин] гидрохлорид.
6-(Гептилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин] гидрохлорид.
6-(Октилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин] гидрохлорид.
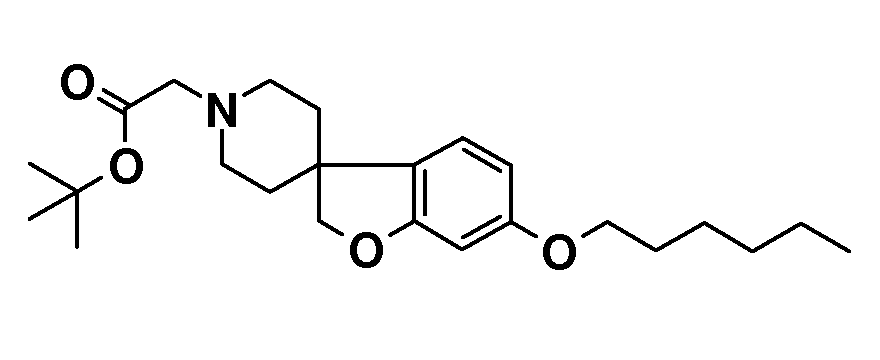
Трет-бутил 2-(6-(гексилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)ацетат. 6-(гексилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин] гидрохлорид (700 мг; 2,15 ммоль) суспендировали в CH3CN (15 мл) и добавляли трет-бутилхлорацетат (0,37 мл; 2,58 ммоль) с последующим добавлением K2CO3 (714 мг; 4,3 ммоль) и раствор перемешивали при 55°C в течение ночи. Раствору давали охладиться до комнатной температуры и концентрировали. Остаток брали для поглощения в EtOAc и H2O. Органическую фазу сушили (Na2SO4), фильтровали и концентрировали с получением продукта (850 мг; 98%).
1H ЯМР (300 МГц, CDCl3) δ м.д. 7,0 (д, J=9 Гц, 1H), 6,42 (дд, J=9 Гц, 2 Гц, 1H), 6,37 (д, J=2 Гц, 1H), 4,37 (с, 2H), 3,9 (т, J=7,5 Гц, 2H), 3,17 (с, 2H), 2,99-2,9 (м, 2H), 2,34-2,2 (м, 2H), 2,09-1,95 (м, 2H), 1,8-1,65 (м, 4H), 1,48 (с, 9H), 1,34-1,26 (м, 6H), 0,9 (т, J=7,5 Гц, 3H).
Следующие соединения были получены аналогичным способом:
Трет-бутил 2-(6-(гептилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)ацетат.
Трет-бутил 2-(6-(октилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)ацетат.
Трет-бутил 2-(5-(гексилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)ацетат.
Трет-бутил 2-(5-(гептилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)ацетат.
Трет-бутил 2-(5-(октилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)ацетат.
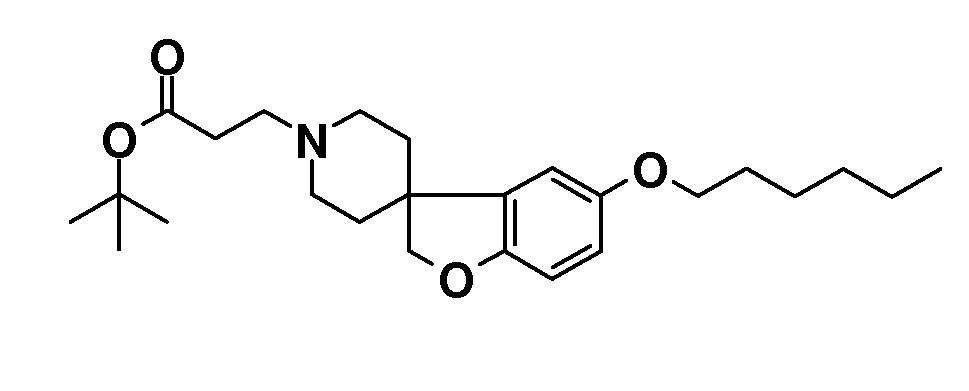
Трет-бутил 3-(5-(гексилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропаноат. 6-(Гексилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]гидрохлорид (600 мг; 1,84 ммоль) суспендировали в ТГФ (8 мл) и добавляли трет-бутилакрилат (0,32 мл; 2,2 ммоль), затем Et3N (0,36 мл; 2,58 ммоль). Раствор перемешивали при 70°C в течение ночи. Раствору давали охладиться до комнатной температуры и выливали в EtOAc и насыщенный раствор NaHCO3. Органическую фазу сушили (Na2SO4), фильтровали и концентрировали с получением продукта (770 мг; 100%), который получали в виде масла.
1H ЯМР (300 МГц, CDCl3) δ м.д. 7,19 (м, 1H), 6,73-6,66 (м, 2H), 4,34 (с, 2H), 3,87 (т, J=7,5 Гц, 2H), 2,94-2,84 (м, 2H), 2,69 (т, J=7,5 Гц, 2H), 2,44 (т, J=7,5 Гц, 2H), 2,16-1,87 (м, 4H), 1,8-1,64 (м, 4H), 1,46 (с, 9H), 1,52-1,29 (м, 6H), 0,9 (т, J=7,5 Гц, 3H).
Следующие соединения были получены аналогичным способом:
Трет-бутил 2-(5-(гептилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропаноат.
Трет-бутил 2-(5-(октилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропаноат.
Трет-бутил 2-(6-(гексилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропаноат.
Трет-бутил 2-(6-(гептилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропаноат.
Трет-бутил 2-(6-(октилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропаноат.
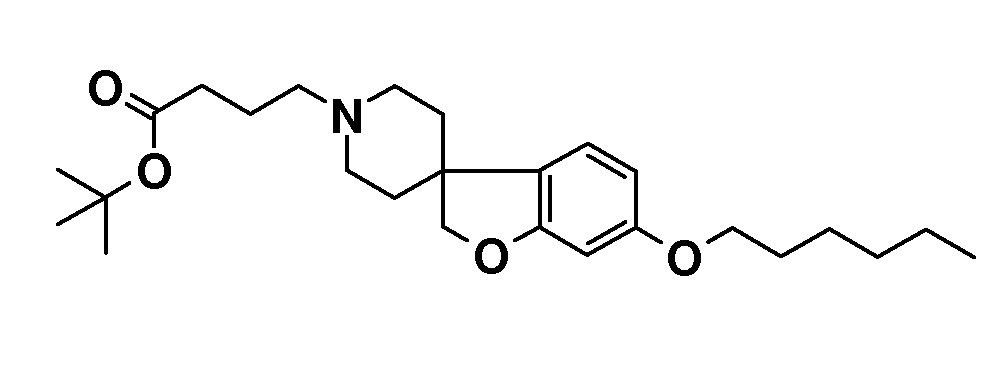
Трет-бутил 4-(6-(гептилокси)-2H-спиро[бензофуран-3,4'-пиперидин]-1'-ил)бутаноат. 6-(Гексилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]гидрохлорид (700 мг; 2,06 ммоль) суспендировали в CH3CN (15 мл) и добавляли трет-бутил-4-бромбутират (551 мг; 2,47 ммоль) с последующим добавлением K2CO3 (684 мг; 4,12 ммоль) и KI (342 мг; 2,47 ммоль) и раствор перемешивали при 75°C в течение ночи. Раствору давали охладиться до комнатной температуры и концентрировали. Остаток брали для поглощения в EtOAc и H2O. Органическую фазу сушили (Na2SO4), фильтровали и концентрировали с получением продукта (890 мг, 97%).
1H ЯМР (300 МГц, CDCl3) δ м.д. 6,96 (д, J=9 Гц, 1H), 6,42 (дд, J=9 Гц, 2 Гц, 1H), 6,37 (д, J=2 Гц, 1H), 4,36 (с, 2H), 3,9 (т, J=7,5 Гц, 2H), 2,95-2,85 (м, 2H), 2,4-2,3 (м, 2H), 2,24 (т, J=8 Гц, 2H), 2,12-1,87 (м, 4H), 1,87-1,63 (м, 6H), 1,45 (с, 9H), 1,5-1,22 (м, 8H), 0,89 (т, J=7,5 Гц, 3H).
Следующие соединения были получены аналогичным способом:
Трет-бутил 2-(6-(гептилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)бутаноат.
Трет-бутил 2-(6-(октилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)бутаноат.
Трет-бутил 2-(5-(гексилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)бутаноат.
Трет-бутил 2-(5-(гептилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)бутаноат.
Трет-бутил 2-(5-(октилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)бутаноат.
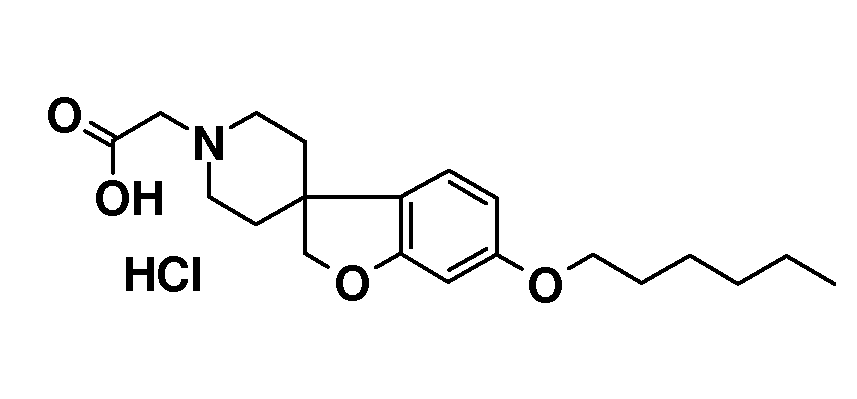
Соединение 1. Гидрохлорид 2-(6-(гексилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)уксусной кислоты. Трет-бутил 2-(6-(гексилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)ацетат (850 мг; 2,1 ммоль) перемешивали в растворе 4н HCl в диоксане (10 мл) и перемешивали в течение ночи. Осадок отфильтровывали и промывали TBME. Твердое вещество сушили в вакууме с получением продукта (590 мг; 73%).
1H ЯМР (300 МГц, CD3OD) δ м.д. 7,04 (с, 1H), 6,48-6,44 (дд, J=8 и 2 Гц, 1H), 6,37 (д, J=2 Гц, 1H), 4,47 (с, 2H), 4,11 (с, 2H), 3,91 (т, J=6,5 Гц, 2H), 3,75-3,6 (м, 2H), 3,4-3,1 (уш.c, 4H), 2,22 (с, 2H), 2,03-1,94 (м, 2H), 1,79-1,68 (м, 2H), 1,51-1,32 (м, 6H), 0,92 (т, J=7 Гц, 3H), DSC пик при 250°C.
Следующие соединения были получены аналогичным способом:
Соединение 2. Гидрохлорид 2-(6-(гексилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропановой кислоты
1H ЯМР (300 МГц, CD3OD) δ м.д. 7,07 (с, 1H), 6,48-6,44 (дд, J=8 Гц и 2 Гц, 1H), 6,37 (д, J=2 Гц, 1H), 4,47 (с, 2H), 3,92 (т, J=6,5 Гц, 2H), 3,67-3,56 (м, 2H), 3,47 (т, J=7 Гц, 2H), 3,3-3,1 (уш.с, 2H), 2,85 (т, J=7 Гц, 2H), 2,22-2,08 (м, 2H), 2,04-1,93 (м, 2H), 1,79-1,66 (м, 2H), 1,51-1,3 (м, 6H), 0,92 (т, J=7 Гц, 3H), DSC пик при 245,4°C.
Соединение 3. Гидрохлорид 2-(6-(гексилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)бутановой кислоты
1Н ЯМР (300 МГц, CD3OD) δ м.д. 7,04 (с, 1H), 6,48-6,44 (дд, J=8 Гц, 2 Гц, 1H), 6,37 (д, J=2 Гц, 1H), 4,47 (с, 2H), 3,91 (т, J=6,5 Гц, 2H), 3,69-3,53 (м, 2H), 3,27-3,18 (м, 2H), 3,1 (с, 2H), 2,49 (т, J=7 Гц, 2H), 2,14-1,96 (м, 6H), 1,76-1,7 (м, 2H), 1,48-1,32 (м, 6H), 0,92 (т, J=1 Гц, 3H), DSC пик при 232,6°C.
Соединение 4. Гидрохлорид 2-(6-(гептилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)уксусной кислоты
1Н ЯМР (300 МГц, CD3OD) δ м.д. 7,03 (с, 1H), 6,48-6,44 (дд, J=8 Гц, 2 Гц, 1H), 6,37 (д, J=2 Гц, 1H), 4,47 (с, 2H), 4,14 (с, 2H), 3,91 (т, J=6,5 Гц, 2H), 3,76-3,6 (м, 2H), 3,4-3,1 (уш.с, 2H), 2,22 (т, 2H), 2,03-1,94 (м, 2H), 1,79-1,68 (м, 2H), 1,52-1,27 (м, 8H), 0,9 (т, J=7 Гц, 3H), DSC пик при 251,6°C.
Соединение 5. Гидрохлорид 2-(6-(гептилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропановой кислоты
1Н ЯМР (300 МГц, CD3OD) δ м.д. 7,07 (с, 1H), 6,48-6,44 (дд, J=8 Гц, 2 Гц, 1H), 6,37 (д, J=2 Гц, 1H), 4,47 (с, 2H), 3,92 (т, J=6,5 Гц, 2H), 3,67-3,56 (м, 2H), 3,46 (т, J=7 Гц, 2H), 3,3-3,1 (м, 2H), 2,85 (т, J=7 Гц, 2H), 2,22-2,07 (м, 2H), 2,04-1,93 (м, 2H), 1,78-1,66 (м, 2H), 1,52-1,28 (м, 8H), 0,91 (т, J=7 Гц, 3H), DSC пик при 240,2°C.
Соединение 6. Гидрохлорид 2-(6-(гептилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)бутановой кислоты
1Н ЯМР (300 МГц, CD3OD) δ м.д. 7,04 (с, 1H), 6,48-6,44 (дд, J=8 Гц, 2 Гц, 1H), 6,37 (д, J=2 Гц, 1H), 4,47 (с, 2H), 3,91 (т, J=6,5 Гц, 2H), 3,68-3,55 (м, 2H), 3,27-3,18 (м, 2H), 3,1 (с, 2H), 2,49 (т, J=7 Гц, 2H), 2,22-1,94 (м, 6H), 1,8-1,68 (м, 2H), 1,51-1,32 (м, 8H), 0,91 (т, J=7 Гц, 3H), DSC пик при 229,1°C.
Соединение 7. Гидрохлорид 2-(6-(октилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)уксусной кислоты
1Н ЯМР (300 МГц, CD3OD) δ м.д. 7,03 (с, 1H), 6,48-6,44 (дд, J=8 и 2 Гц, 1H), 6,37 (д, J=2 Гц, 1H), 4,47 (с, 2H), 4,14 (с, 2H), 3,91 (т, J=6,5 Гц, 2H), 3,76-3,6 (м, 2H), 3,4-3,1 (уш.с, 2H), 2,22 (т, J=7 Гц, 2H), 2,03-1,94 (м, 2H), 1,79-1,67 (м, 2H), 1,51-1,26 (м, 10H), 0,9 (т, J=7 Гц, 3H), DSC пик при 247,6°C.
Соединение 8. Гидрохлорид 2-(6-(октилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропановой кислоты
1Н ЯМР (300 МГц, CD3OD) δ м.д. 7,07 (с, 1H), 6,48-6,44 (дд, J=8 и 2 Гц, 1H), 6,37 (д, J=2 Гц, 1H), 4,47 (с, 2H), 3,92 (т, J=6,5 Гц, 2H), 3,67-3,56 (м, 2H), 3,46 (т, J=7 Гц, 2H), 3,3-3,1 (м, 2H), 2,85 (т, J=7 Гц, 2H), 2,22-2,07 (м, 2H), 2,04-1,93 (м, 2H), 1,78-1,66 (м, 2H), 1,51-1,28 (м, 10H), 0,91 (т, J=7 Гц 3H), DSC пик при 235,9°C.
Соединение 9. Гидрохлорид 2-(6-(октилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)бутановой кислоты
1Н ЯМР (300 МГц, CD3OD) δ м.д. 7,04 (с, 1H), 6,48-6,44 (дд, J=8 и 2 Гц, 1H), 6,37 (д, J=2 Гц, 1H), 4,47 (с, 2H), 3,91 (т, J=6,5 Гц, 2H), 3,69-3,54 (м, 2H), 3,27-3,18 (м, 2H), 3,1 (с, 2H), 2,49 (т, J=7 Гц, 2H), 2,21-1,94 (м, 6H), 1,79-1,68 (м, 2H), 1,51-1,27 (м, 10H), 0,9 (т, J=7 Гц, 3H), DSC пик при 232°C.
Соединение 10. Гидрохлорид 2-(5-(гексилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)уксусной кислоты.
1Н ЯМР (300 МГц, CD3OD) δ м.д. 6,82-6,67 (м, 3Н), 4,47 (с, 2H), 4,14 (с, 2H), 3,91 (т, J=6,5 Гц, 2H), 3,78-3,63 (м, 2H), 3,3-3,1 (м, 2H), 2,33-2,18 (м, 2H), 2,07-1,96 (м, 2H), 1,8-1,67 (м, 2H), 1,53-1,42 (м, 2H), 1,42-1,3 (м, 4H), 0,92 (т, J=7 Гц, 3H).
Соединение 11. Гидрохлорид 2-(5-(гексилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропановой кислоты
1Н ЯМР (300 МГц, CD3OD) δ м.д. 6,82-6,67 (м, 3Н), 4,47 (с, 2H), 3,91 (т, J=6,5 Гц, 2H), 3,68-3,58 (м, 2H), 3,48 (т, J=7 Гц, 2H), 3,3-3,09 (м, 2H), 2,89 (т, J=7 Гц, 2H), 2,28-2,14 (м, 2H), 2,07-1,95 (м, 2H), 1,8-1,67 (м, 2H), 1,53-1,27 (м, 6H), 0,92 (т, J=7 Гц, 3H).
Соединение 12. Гидрохлорид 2-(5-(гексилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)бутановой кислоты
1Н ЯМР (300 МГц, CD3OD) δ м.д. 6,82-6,67 (м, 3Н), 4,47 (с, 2H), 3,92 (т, J=6,5 Гц, 2H), 3,7-3,58 (м, 2H), 3,25 (м, 2H), 3,1 (м, 2H), 2,5 (т, 7 Гц, 2H), 2,28-1,92 (м, 6H), 1,8-1,68 (м, 2H), 1,53-1,4 (м, 2H), 1,42-1,27 (м, 6H), 0,92 (т, J=7 Гц, 3H), DSC пик при 235,4°C.
Соединение 13. Гидрохлорид 2-(5-(гептилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)уксусной кислоты
1Н ЯМР (300 МГц, CD3OD) δ м.д. 6,82-6,67 (м, 3H), 4,47 (с, 2H), 4,14 (с, 2H), 3,91 (т, J=6,5 Гц, 2H), 3,75-3,63 (м, 2H), 3,3-3,12 (м, 2H), 2,33-2,18 (м, 2H), 2,07-1,96 (м, 2H), 1,8-1,67 (м, 2H), 1,53-1,27 (м, 8H), 0,92 (т, J=7 Гц, 3H).
Соединение 14. Гидрохлорид 2-(5-(гептилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропановой кислоты
1Н ЯМР (300 МГц, CD3OD) δ м.д. 6,82-6,67 (м, 3H), 4,47 (с, 2H), 3,91 (т, J=6,5 Гц, 2H), 3,68-3,58 (м, 2H), 3,47 (т, J=7 Гц, 2H), 3,3-3,1 (м, 2H), 2,87 (т, J=7 Гц, 2H), 2,25-2,14 (м, 2H), 2,07-1,96 (м, 2H), 1,8-1,67 (м, 2H), 1,53-1,27 (м, 10H), 0,92 (т, J=1 Гц, 3H).
Соединение 15. Гидрохлорид 2-(5-(гептилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)бутановой кислоты
1Н ЯМР (300 МГц, CD3OD) δ м.д. 6,82-6,67 (м, 3H), 4,47 (с, 2H), 3,91 (т, J=6,5 Гц, 2H), 3,68-3,57 (м, 2H), 3,4-3,06 (м, 4H), 2,5 (т, J=7 Гц, 2H), 2,25-1,94 (м, 6H), 1,79-1,68 (м, 2H), 1,51-1,27 (м, 10H), 0,92 (т, J=7 Гц, 3H), DSC пик при 240°C.
Соединение 16. Гидрохлорид 2-(5-(октилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)уксусной кислоты
1Н ЯМР (300 МГц, CD3OD) δ м.д. 6,82-6,67 (м, 3H), 4,47 (с, 2Н), 4,14 (с, 2Н), 3,91 (т, J=6,5 Гц, 2H), 3,75-3,62 (м, 2Н), 3,3-3,12 (м, 2Н), 2,32-2,18 (м, 2Н), 2,07-1,95 (м, 2Н), 1,8-1,67 (м, 2Н), 1,54-1,27 (м, 10Н), 0,9 (т, J=7 Гц, 3H).
Соединение 17. Гидрохлорид 2-(5-(октилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропановой кислоты
1Н ЯМР (300 МГц, CD3OD) δ м.д. 6,82-6,67 (м, 3H), 4,47 (с, 2Н), 3,91 (т, J=6,5 Гц, 2H), 3,68-3,58 (м, 2Н), 3,47 (т, J=7 Гц, 2H), 3,3-3,1 (м, 2Н), 2,87 (т, J=7 Гц, 2H), 2,26-2,14 (м, 2Н), 2,07-1,96 (м, 2Н), 1,8-1,67 (м, 2Н), 1,53-1,27 (м, 10Н), 0,92 (т, J=7 Гц, 3H).
Соединение 18. Гидрохлорид 2-(5-(октилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)бутановой кислоты
1Н ЯМР (300 МГц, CD3OD) δ м.д. 6,82-6,67 (м, 3H), 4,47 (с, 2H), 3,91 (т, J=6,5 Гц, 2H), 3,7-3,57 (м, 2H), 3,36-3,03 (м, 4H), 2,49 (т, J=7 Гц, 2H), 2,26-1,96 (м, 6H), 1,79-1,68 (м, 2H), 1,53-1,27 (м, 12H), 0,92 (т, J=7 Гц, 3H), DSC пик при 241,1°C.
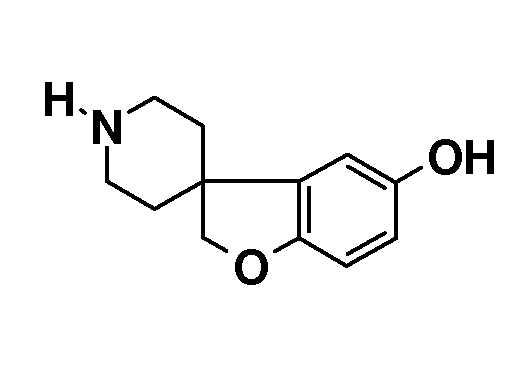
2H-спиро[1-Бензофуран-3,4'-пиперидин]-5-ол. К смеси гидробромида 1'-бензил-2H-спиро[1-бензофуран-3,4'-пиперидин]-5-ола (6 г, 15,9 ммоль) в 120 мл MeOH добавляли 0,6 г гидроксида палладия. Смесь обрабатывали при помощи H2 при нормальном давлении в течение ночи. Неочищенную реакционную смесь концентрировали до объема около 20 мл и фильтровали через содержащую паратолуолсульфокислоту твердофазную экстракционную гильзу, промывая MeOH и элюируя раствором 2н NH3/MeOH. Продукт концентрировали с получением 2,6 г (80%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,8 (с, 1H), 6,57-6,51 (м, 2H), 6,47 (дд, J=8 и 2 Гц, 1H), 4,29 (с, 2H), 2,9-2,84 (м, 2H), 2,55-2,47 (м, 2H), 1,68-1,59 (м, 2H), 1,54-1,47 (м, 2H).
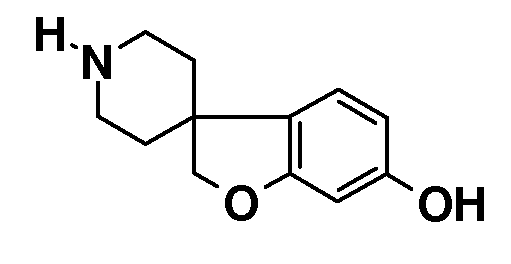
2H-спиро[1-Бензофуран-3,4'-пиперидин]-6-ол. К смеси 1'-бензил-2H-спиро[1-бензофуран-3,4'-пиперидин]-6-ола (2 г, 5,3 ммоль) в 60 мл MeOH (содержащем 5 мл 4н раствора HCl в MeOH) добавляли 0,2 г гидроксида палладия. Смесь обрабатывали при помощи Н2 при нормальном давлении в течение 48 часов. Неочищенную реакционную смесь концентрировали до объема около 20 мл и фильтровали через содержащую паратолуолсульфокислоту твердофазную экстракционную гильзу, промывая MeOH и элюируя раствором 2н NH3/MeOH. Продукт концентрировали с получением 950 мг (90%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,3 (уш.с, 1H), 6,91 (д, J=8 Гц, 1H), 6,50 (д, J=2 Гц, 1H), 4,31 (с, 2H), 2,9-2,84 (м, 2H), 2,54-2,45 (м, 2H), 1,68-1,59 (м, 2H), 1,52-1,44 (м, 2H).
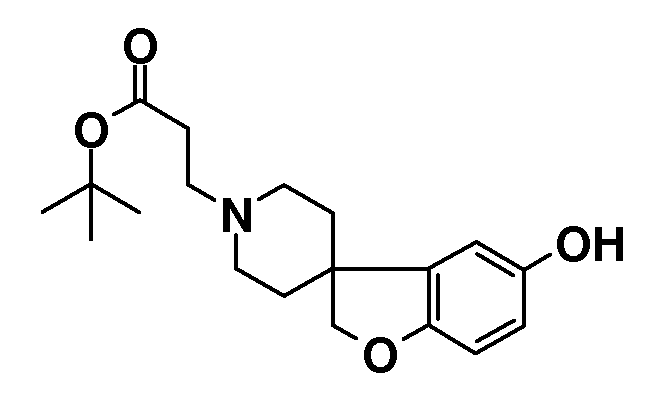
Трет-бутил 3-{5-гидрокси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. Смесь 2H-спиро[1-бензофуран-3,4'-пиперидин]-5-ола (3,85 г; 18,76 ммоль), трет-бутилакрилата (3,28 мл; 22,51 ммоль) и N,N-диизопропиламина в MeOH (175 мл) нагревали при температуре кипения с обратным холодильником в течение ночи. После охлаждения до комнатной температуры смесь концентрировали в вакууме и остаток распределяли между EtOAc и 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали, концентрировали в вакууме и очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1, затем Et2O) с получением продукта (4 г). Rt 1,02 мин (Система B), [M+H]+ 334,2
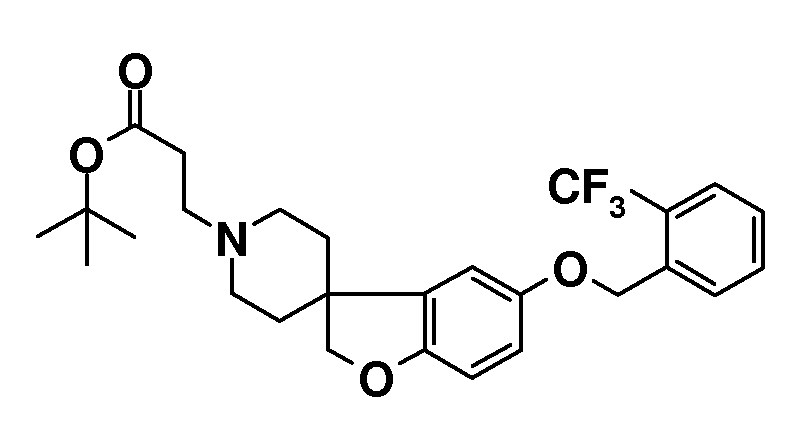
Трет-бутил 3-(5-{[2-(трифторметил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. К раствору трет-бутил 3-{5-гидрокси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата (0,51 г; 1,53 ммоль) в ТГФ (10 мл) добавляли 2-(трифторметил)бензиловый спирт (0,3 мл; 2,29 ммоль), с последующим добавлением DIAD (0,43 мл; 2,2 ммоль) и трифенилфосфина (0,58 г; 2,2 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 3 дней. Затем реакционную смесь концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 2:1) с получением продукта (0,38 г). Rt 1,42 мин (Система B), [M+H]+ 492,2
Следующие соединения были получены аналогичным способом:
Трет-бутил 3-[5-(циклогексилметокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат. Rt 1,49 мин (Система B), [M+H]+ 430,3
Трет-бутил 3-(5-{[3-(трифторметил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. Rt 1,48 мин (Система B), [M+H]+ 492,1
Трет-бутил 3-{5-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. Rt 1,45 мин (Система B), [M+H]+ 492,1
Трет-бутил 3-{5-[(3,5-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. Rt 1,50 мин (Система B), [M+H]+ 492,1
Трет-бутил 3-{5-[(2,6-дифторфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{5-[(2-хлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{5-[(2,4,6-трихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. Rt 1,53 мин (Система B), [M+H]+ 528,0
Трет-бутил 3-{5-[(2-хлор-6-метилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. Rt 1,50 мин (Система B), [M+H]+ 472,1
Соединение 19. Гидрохлорид 3-(5-{[2-(трифторметил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты. Трет-бутил 3-(5-{[2-(трифторметил)фенил]-метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат (0,21 г; 0,43 ммоль) растворяли в 4M растворе HCl в 1,4-диоксане (3,2 мл; 12,82 ммоль) и перемешивали в течение ночи при комнатной температуре. Затем растворитель удаляли в вакууме и остаток обрабатывали iPr2O, осадок собирали фильтрованием и сушили в течение ночи при пониженном давлении с получением продукта (0,17 г).
1H ЯМР (400 МГц, ДМСО/TFA-d6) δ м.д. 9,5 (уш.с, 1H), 7,75 (д, J=8,2 Гц, 2H), 7,68 (т, J=8,2 Гц, 1H), 7,53 (т, J=7,7 Гц, 1H), 6,69-6,82 (м, 3H), 5,15 (с, 2H), 4,42 (уш.с, 2H), 3,45-3,60 (м, 2H), 3,29-3,41 (м, 2H), 2,98-3,18 (м, 2H), 2,78 (т, J=7,4 Гц, 2H), 2,02-2,18 (м, 2H), 1,80-1,91 (м, 2H). Rt 1,36 мин (Система В), [M+H]+ 436,1.
Следующие соединения были получены аналогичным способом:
Соединение 20. Гидрохлорид 3-[5-(циклогексилметокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановой кислоты. Rt 1,40 мин (Система B), [M+H]+ 374,2
Соединение 21. Гидрохлорид 3-(5-{[3-(трифторметил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты. Rt 1,77 мин (Система B), [M+H]+ 436,1
Соединение 22. Гидрохлорид 3-{5-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты. Rt 1,49 мин (Система B), [M+H]+ 436,2
Соединение 23. Гидрохлорид 3-{5-[(3,5-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты. Rt 1,42 мин (Система B), [M+H]+ 436,0
Соединение 24. Гидрохлорид 3-{5-[(2,6-дифторфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты. Rt 1,27 мин (Система B), [M+H]+ 404,1
Соединение 25. Гидрохлорид 3-{5-[(2-хлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты. Rt 1,33 мин (Система B), [M+H]+ 402,1
Соединение 26. Гидрохлорид 3-{5-[(2,4,6-трихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,63 (уш.с, 1H), 10,36 (уш.с, 1H), 7,79 (с, 2H), 6,98 (дд, J=8 и 2 Гц, 1H), 6,76 (дд, J=8 и 2 Гц, 2H), 5,14 (с, 2H), 4,46 (уш.с, 2H), 3,24-3,56 (м, 4H), 2,99-3,17 (м, 2H), 2,87 (т, J=8 Гц, 2H,) 2,12-2,29 (м, 2H), 1,84-1,94 (м, 2H).
Rt 1,47 мин (Система B), [M+H]+ 472,0
Соединение 27. Гидрохлорид 3-{5-[(2-хлор-6-метилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,77 мин (Система B), [M+H]+ 416,1
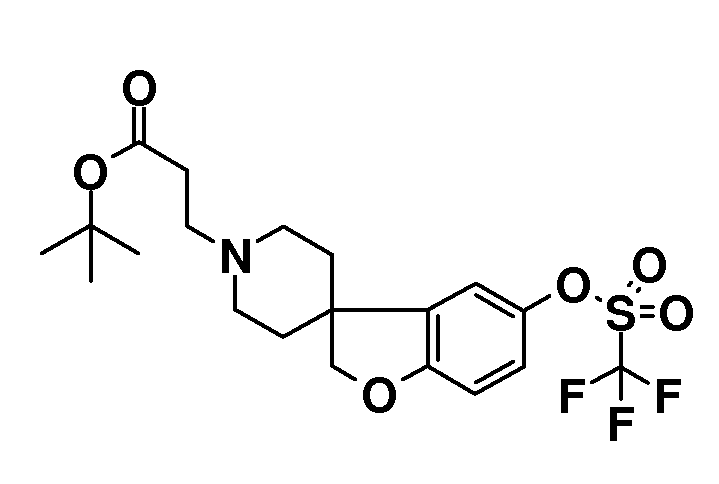
Трет-бутил 3-{5-[(трифторметан)сульфонилокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат. К раствору трет-бутил 3-{5-гидрокси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата (333 мг; 1,0 ммоль) в 15 мл дихлорметана и пиридине (90 мг; 1,1 экв.) добавляли по каплям раствор трифторметансульфонового ангидрида (310 мг; 1,1 экв.), растворенного в 5 мл дихлорметана, при -10°C. Полученной реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение ночи. Реакцию гасили путем добавления 5% водного раствора NH4Cl. Полученную смесь экстрагировали дихлорметаном. Органические слои сушили (Na2SO4), фильтровали и концентрировали в вакууме с получением продукта (390 мг), который использовали как таковой на следующей стадии. Rt 1,34 мин (Система B), [M+H]+ 466,1
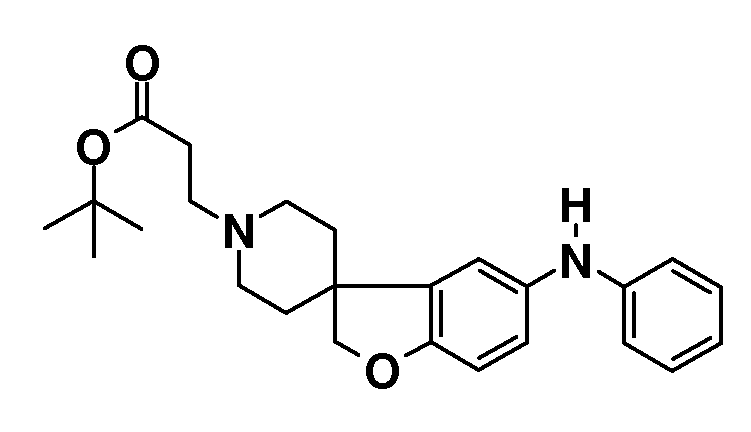
Трет-бутил 3-[5-(фениламино)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат. К дегазированному раствору трет-бутил 3-{5-[(трифторметан)сульфонилокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноата (380 мг; 0,82 ммоль) в толуоле (20 мл) добавляли анилин (91,23 мг; 0,98 ммоль), карбонат цезия (372 мг, 1,14 ммоль), ацетат палладия(II) (9 мг, 0,04 ммоль), 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил (39 мг; 0,08 ммоль) и 5 мг фенилбороновой кислоты. Полученную смесь нагревали до 100°C в течение ночи. После охлаждения до комнатной температуры добавляли 5% водный раствор NaHCO3 и продукт экстрагировали EtOAc. Объединенные органические слои сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, дихлорметан/MeOH 95:5) с получением продукта (270 мг), который использовали как таковой на следующей стадии.
Соединение 28. Гидрохлорид 3-[5-(фениламино)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановой кислоты. Трет-бутил 3-[5-(фениламино)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат (0,27 г; 0,66 ммоль) растворяли в 4M растворе HCl в 1,4-диоксане (10 мл, 40 ммоль) и перемешивали в течение ночи при комнатной температуре. Затем растворитель удаляли в вакууме и остаток обрабатывали iPr2O, осадок собирали фильтрованием и сушили в течение ночи при пониженном давлении с получением продукта (0,2 г). Rt 1,21 мин (Система B), [M+H]+ 353,1
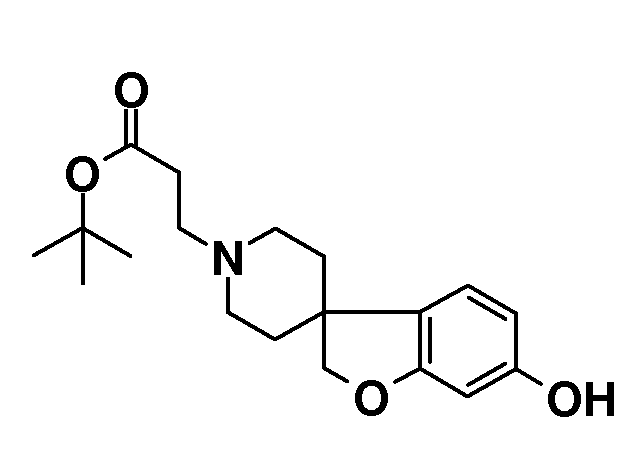
Трет-бутил 3-{6-гидрокси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. Смесь 2H-спиро[1-бензофуран-3,4'-пиперидин]-6-ола (5,09 г; 18,76 ммоль), трет-бутилакрилата (4 мл; 27,28 ммоль) и N,N-диизопропиламина (5,31 мл, 31 ммоль) в MeOH (100 мл) нагревали при температуре кипения с обратным холодильником в течение ночи. После охлаждения до комнатной температуры смесь концентрировали в вакууме и остаток распределяли между EtOAc и 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме с получением продукта (7,54 г).
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 6,92 (д, J=7,9 Гц, 1H), 6,28-6,35 (м, 2H), 5,40 (уш.с, 1H), 4,35 (с, 2H), 2,85-2,93 (м, 2H), 2,70 (т, J=7,4 Гц, 2H), 2,45 (т, J=7,4 Гц, 2H), 2,02-2,12 (м, 2H), 1,86-1,97 (м, 2H), 1,67-1,75 (м, 2H), 1,46 (с, 9H). Rt 0,97 мин (Система B), [M+H]+ 334,2.
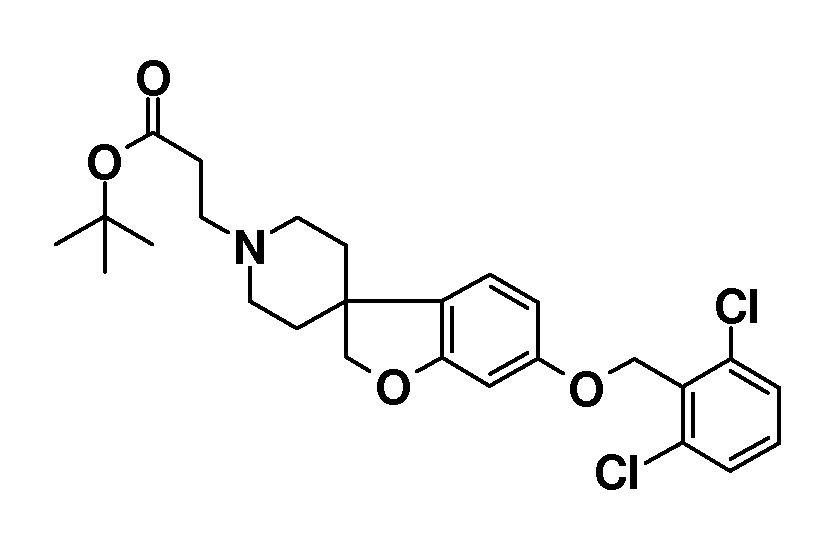
Трет-бутил 3-{6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. К раствору (2,6-дихлорфенил)метанола (0,79 г; 4,45 ммоль) и трет-бутил 3-{6-гидрокси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата (1 г, 2,97 ммоль) в дихлорметане (60 мл) добавляли трифенилфосфин (1,95 г; 7,42 ммоль), затем через 30 минут добавляли DIAD (1,46 мл; 7,42 ммоль). Затем полученную смесь перемешивали при комнатной температуре в течение ночи и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, дихлорметан/ацетон 95:5) с получением неочищенного продукта (2 г). Этот продукт растворяли в Et2O (60 мл) и добавляли 4 мл 1 M HCl/этанол. Образовавшееся белое твердое вещество выделяли фильтрованием и промывали Et2O и EtOAc, и затем распределяли между 5% водным раствором NaHCO3 и дихлорметаном. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме с получением продукта (1,10 г, 75%).
1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 7,36 (д, J=8 Гц, 2H), 7,23 (д, J=8 Гц, 1H), 7,03 (д, J=8 Гц, 1H), 6,56 (дд, J=8 и 2 Гц, 1H), 6,51 (д, J=2 Гц, 1H), 5,22 (с, 2H), 4,37 (с, 2H), 2,85-2,92 (м, 2H), 2,70 (т, J=8 Гц, 2H), 2,45 (дт, J=8 и 2 Гц, 2H), 2,03-2,11 (м, 2H), 1,89-1,98 (м, 2H), 1,69-1,77 (м, 2H), 1,46 (с, 9H). Rt 1,45 мин (Система B), [M+H]+ 492,1.
Следующие соединения были получены аналогичным способом:
Трет-бутил 3-{6-[(4-фенилпентил)окси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[(3-хлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-[6-(циклогексилметокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат.
Трет-бутил 3-[6-(оксан-2-илметокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат.
Трет-бутил 3-{6-[(2,5-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-(6-{[3-(трифторметил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-(6-{[2-(трифторметил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[(2,3-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[(2-хлор-6-фторфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-[6-(бензилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[(2,4-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-(6-{[2-хлор-6-(трифторметил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-[6-(циклогекс-3-ен-илметокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат.
Трет-бутил 3-{6-[(3,5-дихлорпиридин-4-ил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. Необходимый (3,5-дихлор-пиридин-4-ил)-метанол получали следующим образом: К раствору 3,5-дихлор-4-пиридинкарбоксальдегида (4,68 мл; 26,59 ммоль) в MeOH (50 мл) добавляли NaBH4 (1,01 г, 26,59 ммоль) небольшими порциями при 0°C. После завершения добавления смеси давали нагреться до комнатной температуры и перемешивали в течение одного часа. Затем смесь охлаждали до 0°C, добавляли воду и MeOH выпаривали в вакууме. К водному раствору добавляли 5% водный раствор NaHCO3 и EtOAc. Слои разделяли и органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме с получением продукта в виде аморфного твердого вещества (4,04 г, 85%).
Трет-бутил 3-{6-[(2,4-дихлорпиридин-3-ил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. Необходимый (2,4-дихлор-пиридин-3-ил)-метанол получали следующим образом: К раствору 2,4-дихлорпиридина (3,00 мл; 27,8 ммоль) в ТГФ (25 мл) добавляли по каплям раствор LDA (15,3 мл; 2,00 моль/л в ТГФ/гептане/этилбензоле; 30,6 ммоль) при -78°C. Полученную смесь перемешивали при -78°C в течение 1 часа. Затем добавляли по каплям раствор этилхлорформиата (3,2 мл; 33,33 ммоль) в ТГФ (5 мл) при -78°C и смесь перемешивали еще в течение 1 часа при такой же температуре. К полученной смеси добавляли 5% водный раствор NaHCO3 по каплям при -78°C. Смеси давали нагреться до комнатной температуры и экстрагировали EtOAc. Органический слой сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:3) с получением этилового эфира 2,4-дихлорникотиновой кислоты (2,45 г). К раствору этилового эфира 2,4-дихлорникотиновой кислоты (2,35 г; 10,68 ммоль) в ТГФ (50 мл) добавляли по каплям диизобутилалюминийгидрид (32,0 мл; 1,00 моль/л в ТГФ, 32,0 ммоль) при 4°C. Через 15 минут ледяную баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем полученную смесь концентрировали в вакууме и распределяли между 5% водным раствором NaHCO3 и EtOAc. Слои разделяли и органический слой сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали колоночной хроматографией (Et2O:гексан 1:1) с получением (2,4-дихлорпиридин-3-ил)метанола (0,40 г).
Трет-бутил 3-{6-[(2,4,6-трихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[(2,6-дихлор-4-иодфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. Необходимый (2,6-дихлор-4-иодфенил)метанол получали следующим образом: К раствору 3,5-дихлориодбензола (2,72 г; 9,97 ммоль) в ТГФ (25 мл) добавляли диизопропиламид лития (5,48 мл; 2,00 моль/л; 10,98 ммоль) при -78°C. Полученную смесь перемешивали в течение 4,5 часа и затем добавляли по каплям раствор N,N-диметилформамида (1,16 мл, 14,95 ммоль) в ТГФ (5 мл) при -78°C. Полученную реакционную смесь перемешивали в течение 2 часов при -40°C. Затем реакцию гасили путем добавления 5% водного раствора NH4Cl при -20°C. Полученную смесь экстрагировали Et2O. Объединенные органические слои сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:3) с получением 2,6-дихлор-4-бензальдегида (0,7 г, 23%). К раствору 2,6-дихлор-4-бензальдегида (450 мг, 1,27 ммоль) в MeOH (15 мл) добавляли NaBH4 (72,14 мг; 1,91 ммоль) небольшими порциями при 0°C. После завершения добавления смеси давали нагреться до комнатной температуры и перемешивали в течение одного часа. Затем смесь охлаждали до 0°C, добавляли воду и MeOH выпаривали в вакууме. К водному раствору добавляли 5% водный раствор NaHCO3 и EtOAc. Слои разделяли и органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (дихлорметан/ацетон 95:5) с получением (2,6-дихлор-4-иодфенил)метанола (0,42 г), который использовали как таковой.
Трет-бутил 3-{6-[(2,6-дифторфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[2-(2,6-дихлорфенил)этокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[2-(2-фторфенил)этокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[(2-хлор-5-метилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. Необходимый (2-хлор-5-метилфенил)метанол получали следующим образом: К раствору 2-хлор-5-метилбензойной кислоты (2,05 г; 12,2 ммоль) в ТГФ (20 мл) добавляли комплекс боран-ТГФ (1M, 24,03 мл; 24,3 ммоль) по каплям и затем перемешивали в течение 2 часов при 60°C. К реакционной смеси добавляли 1 M HCl (30 мл) при 0°C и полученную смесь перемешивали при комнатной температуре в течение 10 минут. Полученную смесь концентрировали в вакууме и остаток распределяли между EtOAc и 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме с получением продукта (1,8 г, 95%), который использовали как таковой на следующей стадии.
Трет-бутил 3-{6-[(2-хлор-5-этилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. Необходимый (2-хлор-5-этилфенил)метанол получали следующим образом: При продувке азотом к раствору этил 5-бром-2-хлорбензоата (4,26 мл, 25,05 ммоль) в ТГФ (100 мл) добавляли хлорид лития (2,12 г, 50,09 ммоль) и [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (0,82 г, 1 ммоль). Затем смесь охлаждали до -78°C и добавляли по каплям раствор диэтилцинка (37,57 мл; 1 моль/л; 37,57 ммоль) в гептане. Реакционной смеси давали нагреться до комнатной температуры в течение ночи. Полученную реакционную смесь охлаждали до -10°C и разбавляли 300 мл Et2O. Затем осторожно добавляли раствор 1 M HCl (150 мл). Органический слой отделяли, сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 5:95) с получением этил 2-хлор-5-этилбензоата (4,61 г, 86%). При продувке азотом к раствору этил 2-хлор-5-этил-бензоата (1 г, 4,70 ммоль) в ТГФ (25 мл), охлажденному до -5°C, добавляли диизобутилалюминийгидрид (14,11 мл; 14,11 ммоль) в толуоле. Реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение ночи. Полученную реакционную смесь охлаждали до -10°C и добавляли 5% водный раствор NaHCO3 (10 мл). Органический слой отделяли, сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:3, затем Et2O:гексан 1:1) с получением (2-хлор-6-этилфенил)метанола (0,59 г, 75%), который использовали как таковой.
Трет-бутил 3-{6-[(2-хлор-5-пропилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. Необходимый (2-хлор-5-пропилфенил)метанол получали следующим образом: При продувке азотом к раствору этил 5-бром-2-хлорбензоата (2 г, 7,59 ммоль) в ТГФ (14 мл) добавляли раствор 0,5 M хлорид лития в ТГФ (30 мл) и [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (0,22 г, 0,3 ммоль). Затем смесь охлаждали до -78°C и добавляли по каплям раствор N-пропилцинкбромида (30,36 мл; 0,5 моль/л; 15,18 ммоль). Реакционной смеси давали нагреться до комнатной температуры в течение ночи. Полученную реакционную смесь охлаждали до -10°C и разбавляли 300 мл Et2O. Затем осторожно добавляли раствор 1 M HCl (150 мл). Органический слой отделяли, сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 5:95, затем Et2O:гексан 1:0) с получением этил 2-хлор-5-пропилбензоата (1,1 г, 63%). При продувке азотом к раствору этил 2-хлор-5-пропил-бензоата (1,12 г, 4,94 ммоль) в ТГФ (28 мл), охлажденному до -5°C, добавляли диизобутилалюминийгидрид (14,82 мл; 14,82 ммоль) в толуоле. Реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение ночи. Полученную реакционную смесь охлаждали до -10°C и добавляли 5% водный раствор NaHCO3 (10 мл). Органический слой отделяли, сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:3, затем Et2O:гексан 1:1) с получением (2-хлор-6-пропилфенил)метанола (0,76 г, 83%), который использовали как таковой.
Трет-бутил 3-{6-[3-(2-фторфенил)пропокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[3-(2-хлорфенил)пропокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[(5,7-дифтор-2,3-дигидро-1H-инден-1-ил)окси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. Необходимый 5,7-дифтор-2,3-дигидро-1H-инден-1-ол получали следующим образом: К раствору 5,7-дифтор-1-инданона (1,20 г, 7,14 ммоль) в EtOH (50 мл) добавляли NaBH4 (283,5 мг; 7,49 ммоль) небольшими порциями при 0°C. После завершения добавления смеси давали нагреться до комнатной температуры и перемешивали в течение одного часа. Затем смесь охлаждали до 0°C, добавляли воду и MeOH выпаривали в вакууме. К водному раствору добавляли 5% водный раствор NaHCO3 и EtOAc. Слои разделяли и органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Продукт: 5,7-дифтор-2,3-дигидро-1H-инден-1-ол (1,2 г; 99%) использовали как таковой.
Трет-бутил 3-{6-[(5,7-дихлор-2,3-дигидро-1H-инден-1-ил)окси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. Необходимый 5,7-хлор-2,3-дигидро-1H-инден-1-ол получали из 5,7-дихлор-1-инданона с использованием условий, описанных для 5,7-дифтор-2,3-дигидро-1H-инден-1-ола.
Трет-бутил 3-{6-[(1R)-(2,3-дигидро-1H-инден-1-ил)окси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[(1S)-(2,3-дигидро-1H-инден-1-ил)окси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-[6-(3-фенилпропокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат.
Трет-бутил 3-{6-[2-(2,4-дихлорфенил)этокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[2-(2-хлорфенил)этокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-(6-{[2,6-дихлор-4-(трифторметил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропаноат. Необходимый [2,6-дихлор-4-(трифторметил)фенил]метанол получали следующим образом: К раствору 1,3-дихлор-5-(трифторметил)бензола (4,73 г; 22 ммоль) в ТГФ (40 мл) добавляли N-бутиллитий (8 мл; 2,50 моль/л; 20 ммоль) при -78°C. Полученную смесь перемешивали в течение 15 минут и добавляли на сухой лед в ТГФ. Реакционную смесь подкисляли до pH=3 (раствором 5 M HCl) и экстрагировали EtOAc. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, дихлорметан/MeOH 8:2) с получением 2,6-дихлор-4-(трифторметил)бензойной кислоты (1,2 г). К раствору этой 2,6-дихлор-4-(трифторметил)-бензойной кислоты (1,7 г; 6,56 ммоль) в ТГФ (20 мл) добавляли комплекс боран-ТГФ (1M, 13,13 мл; 13,3 ммоль) по каплям и затем перемешивали в течение ночи при 60°C. К реакционной смеси добавляли 1 M HCl (30 мл) при 0°C и полученную смесь перемешивали при комнатной температуре в течение 10 минут. Полученную смесь концентрировали в вакууме и остаток распределяли между EtOAc и 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:3, затем Et2O:гексан 1:1) с получением [2,6-дихлор-4-(трифторметил)фенил]метанола (1,3 г; 80%), который использовали как таковой на следующей стадии.
Трет-бутил 3-{6-[(2,6-дихлор-4-метилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропаноат. Необходимый (2,6-дихлор-4-метилфенил)-метанол получали следующим образом: При продувке азотом к раствору этил 1-бром-3,5-дихлорбензола (2,5 г, 11,07 ммоль) в ТГФ (14 мл) добавляли раствор 0,5 M хлорида лития в ТГФ (44,27 мл; 22,13 ммоль) и [1,1'-бис(дифенилфосфино)-ферроцен]дихлорпалладий(II) (0,32 г, 0,44 ммоль). Затем смесь охлаждали до -78°C и добавляли по каплям раствор метилцинкбромида (30,36 мл; 0,5 моль/л; 15,18 ммоль) в ТГФ. Реакционной смеси давали нагреться до комнатной температуры и затем нагревали в течение ночи (при 60°C). Полученную реакционную смесь охлаждали до -10°C и разбавляли 300 мл Et2O. Затем осторожно добавляли раствор 1 M HCl (150 мл). Органический слой отделяли, сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, гексан, затем дихлорметан/гексан 1:9) с получением 1,3-дихлор-5-метилбензола (1,0 г; 56%), который подвергали взаимодействию в ТГФ с N-бутиллитием, с последующим добавлением в сухой лед (как описано для 1,3-дихлор-5-(трифторметил)бензола). Полученный продукт 2,6-дихлор-4-метилбензойную кислоту восстанавливали с использованием комплекса боран-ТГФ (как описано для 2,6-дихлор-4-(трифторметил)бензойной кислоты) с получением (2,6-дихлор-4-метилфенил)метанола с выходом 71% за две стадии, который использовали как таковой.
Трет-бутил 3-{6-[(5-бром-2-хлорфенилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[(2-хлор-5-фенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. К дегазированной смеси трет-бутил 3-{6-[(5-бром-2-хлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата (100 мг; 0,56 ммоль) в 3 мл 1,2-диметоксиэтана добавляли бикарбонат натрия (1,5 мл), фенилбороновую кислоту (80 мг; 0,67 ммоль) и тетракис(трифенилфосфин)палладий(0) (6 мг; 0,06 ммоль). Полученную смесь нагревали при температуре кипения с обратным холодильником в течение ночи. После охлаждения до комнатной температуры смесь распределяли между EtOAc и 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:3, затем 1:1) с получением продукта (180 мг; 60%).
Трет-бутил 3-{6-[(2-хлор-5-циклопропилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. К дегазированной смеси трет-бутил 3-{6-[(5-бром-2-хлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата (0,28 г; 0,52 ммоль) в 9 мл толуола и 3 мл H2O добавляли циклопропилтрифторборонат калия (0,9 г; 0,63 ммоль), карбонат цезия (0,51 г; 1,56 ммоль) и комплекс 1',1'-бис(дифенилфосфино)ферферроценпалладий(II)дихлорида с дихлорметаном (20 мг; 0,03 ммоль). Полученную смесь нагревали в течение ночи (90°C). После охлаждения до комнатной температуры реакционную смесь разбавляли EtOAc, фильтровали и промывали 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1) с получением продукта (0,23 г; 88%).
Трет-бутил 3-[6-({2-хлор-5-[2-фенилциклопропил]фенил}метокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат. К дегазированной смеси трет-бутил 3-{6-[(5-бром-2-хлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата (0,3 г; 0,56 ммоль) в 9 мл толуола и 3 мл H2O добавляли трифтор(2-фенилциклопропил)боронат калия (0,9 г; 0,63 ммоль), карбонат цезия (0,55 г; 1,68 ммоль) и комплекс 1',1'-бис(дифенилфосфино)ферферроценпалладий(II)дихлорида с дихлорметаном (20 мг; 0,03 ммоль). Полученную смесь нагревали в течение ночи (90°C). После охлаждения до комнатной температуры реакционную смесь разбавляли EtOAc, фильтровали и промывали 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1) с получением продукта (0,23 г; 71%). Необходимый трифтор(2-фенилциклопропил)боронат калия получали из транс-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)стирола с использованием условий Симмонса-Смита (J. Org. Chem, 2004, 69, 327 и J. Am. Chem. Soc, 2009, 131, 6516) с получением 4,4,5,5-тетраметил-2-(2-фенилциклопропил)-1,3,2-диоксаборолана, который преобразовывали в трифтор(2-фенилциклопропил)боронат калия с использованием условий, аналогичных тем, которые описаны для синтеза бутилтрифторбороната калия (см. также: J. Org. Chem, 2004, 69, 357).
Трет-бутил 3-{6-[(2-хлор-6-метилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-(6-{[(2E)-3-(4-хлорфенил)проп-2-ен-1-ил]окси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. Необходимый (2E)-3-(4-хлорфенил)проп-2-ен-1-ол (J.O.C., 2006, 71, 1969-76) получали следующим образом: При продувке азотом к раствору этил (2E)-3-(4-хлорфенил)проп-2-еноата (3,32 г; 16,88 ммоль) в дихлорметане (60 мл), охлажденному до -78°C, добавляли диизобутилалюминийгидрид (49 мл; 49 ммоль) в толуоле по каплям в течение 30 минут. Реакционной смеси давали нагреться до 0°C (в течение 1 часа). Добавляли по каплям MeOH (15 мл), поддерживая установившийся режим выделения газа. Полученную реакционную смесь перемешивали еще в течение 30 минут при комнатной температуре, затем с последующим добавлением насыщенного водного раствора калий-натрий тартрата. Органический слой отделяли и водную фазу экстрагировали 2 раза дихлорметаном. Органические слои сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1) с получением продукта (2,5 г; 87,8%), который использовали как таковой.
Трет-бутил 3-{6-[(3-фенил)проп-2-ин-1-ил]окси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-[6-(2,3-дигидро-1-бензофуран-3-илокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат. Необходимый 2,3-дигидро-1-бензофуран-3-ол получали следующим образом: К раствору 3-кумаранона (2,82 г, 21 ммоль) в EtOH (50 мл) добавляли NaBH4 (2,39 г; 63 ммоль) небольшими порциями при 0°C. После завершения добавления смеси давали нагреться до комнатной температуры и перемешивали в течение одного часа. Затем смесь охлаждали до 0°C, добавляли воду и MeOH выпаривали в вакууме. К водному раствору добавляли 5% водный раствор NaHCO3 и EtOAc. Слои разделяли и органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Продукт: 2,3-дигидро-1-бензофуран-3-ол (2,59 г, 90%) использовали как таковой.
Трет-бутил 3-(6-{[(2E)-3-(2,6-дихлорфенил)проп-2-ен-1-ил]окси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропаноат. Необходимый (2E)-3-(2,6-дихлорфенил)проп-2-ен-1-ол получали (с выходом 91%), как описано для получения (2E)-3-(4-хлорфенил)проп-2-ен-1-ола.
Трет-бутил 3-(6-{3-[2-(трифторметил)фенил]пропокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропаноат.
Трет-бутил 3-(6-{[(2E)-3-фенилпроп-2-ен-1-ил]окси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропаноат.
Трет-бутил 3-{6-[3-(2,3-дифторфенил)пропокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[(7-хлор-2,3-дигидро-1H-инден-1-ил)окси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[3-(2-хлор-6-фторфенил)пропокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[3-(2,6-дихлорфенил)пропокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[3-(4-хлорфенил)пропокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-(6-{[(3-4-хлорфенил)проп-2-ин-1-ил]окси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропаноат.
Трет-бутил 3-(6-{[(2E)-3-(2-фторфенил)проп-2-ен-1-ил]окси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропаноат. Необходимый (2E)-3-(2-фторфенил)проп-2-ен-1-ол получали (с выходом 66%), как описано для получения (2E)-3-(4-хлорфенил)проп-2-ен-1-ола.
Трет-бутил 3-{6-[(4-бромтиофен-2-ил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. Необходимый (4-бромтиофен-2-ил)метанол получали следующим образом: К раствору 4-бром-тиофенкарбоксиальдегида (2,5 г; 13,09 ммоль) в EtOH (50 мл) добавляли NaBH4 (0,74 г; 19,63 ммоль) небольшими порциями при 0°C. После завершения добавления смеси давали нагреться до комнатной температуры и перемешивали в течение одного часа. Затем смесь охлаждали до 0°C, добавляли воду и MeOH выпаривали в вакууме. К водному раствору добавляли 5% водный раствор NaHCO3 и EtOAc. Слои разделяли и органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме с получением продукта: (2,12 г, 83%), который использовали как таковой.
Трет-бутил 3-{6-[(4-бутилтиофен-2-ил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. N-бутилбороновую кислоту преобразовывали в ее бутилтрифторборонат калия с использованием протокола от Org. Biomol. Chem., 2005, 941. Смесь н-бутилбороновой кислоты в ТГФ (40 мл), воде (10 мл) и бифториде калия (4,6 г; 58,9 ммоль) перемешивали при комнатной температуре в течение 4 часов. Затем растворители удаляли в вакууме и остаток обрабатывали толуолом и концентрировали в вакууме. Последние стадии повторяли три раза, чтобы полностью удалить воду. Полученное твердое вещество обрабатывали горячим ацетоном (20 мл) и ацетон декантировали. Это повторяли с другими 20 мл ацетона. Объединенные ацетоновые слои концентрировали в вакууме и остаток обрабатывали Et2O. Образовавшийся осадок собирали фильтрованием и сушили в вакууме с получением бутилтрифторбороната калия (1,4 г, 87%), который использовали как таковой.
К дегазированной смеси трет-бутил 3-{6-[(4-бромтиофен-2-ил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата (100 мг; 0,2 ммоль) в 20 мл толуола добавляли затем бутилтрифторборонат калия (35,2 мг; 0,22 ммоль), ацетат палладия(II) (2,2 мг; 0,01 ммоль), трехосновной фосфат калия моногидрат (158,5 мг; 0,69 ммоль) и 2-дициклогексилфосфино-2',6'-диизопропокси-1',1'-бифенил (9,2 мг; 0,02 ммоль). Полученную смесь нагревали при температуре кипения с обратным холодильником в течение ночи (бутыль из пирекса)). После охлаждения до комнатной температуры смесь концентрировали в вакууме и распределяли между EtOAc и 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1) с получением продукта (65 мг; 68%).
Трет-бутил 3-{6-[(4-циклопропилметилтиофен-2-ил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. К дегазированной смеси трет-бутил 3-{6-[(4-бромтиофен-2-ил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата (350 мг; 0,69 ммоль) в 20 мл толуола добавляли затем циклопропилтрифторборонат калия (112 мг; 0,76 ммоль), ацетат палладия(II) (7,8 мг; 0,03 ммоль), порошкообразный трехосновной фосфат калия моногидрат (554,7 мг; 2,41 ммоль) и 2-дициклогексилфосфино-2',6'-диизопропокси-1',1'-бифенил (32 мг; 0,07 ммоль). Полученную смесь нагревали при температуре кипения с обратным холодильником в течение ночи (бутыль из пирекса). После охлаждения до комнатной температуры смесь концентрировали в вакууме и распределяли между EtOAc и 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1) с получением продукта (230 мг; 74%).
Трет-бутил 3-(6-{[4-(2-фторфенил)тиофен-2-ил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. К дегазированной смеси трет-бутил 3-{6-[(4-бромтиофен-2-ил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата (100 мг; 0,2 ммоль) в 20 мл толуола добавляли последовательно 2-фтор-фенилбороновую кислоту (30,2 мг; 0,22 ммоль), ацетат палладия(II) (2,2 мг; 0,01 ммоль), трехосновной фосфат калия моногидрат (158,5 мг; 0,69 ммоль) и дициклогексилфосфино-2',6'-диизопропокси-1',1'-бифенил (9,2 мг; 0,02 ммоль). Полученную смесь нагревали при температуре кипения с обратным холодильником в течение ночи (бутыль из пирекса)). После охлаждения до комнатной температуры смесь концентрировали в вакууме и распределяли между EtOAc и 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 2:1) с получением продукта (98 мг; 95%).
Следующее соединение было получено аналогичным способом:
Трет-бутил 3-{6-[(4-фенилтиофен-2-ил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[(4-бром-3-метилтиофен-2-ил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. Необходимый (4-бром-3-метилтиофен-2-ил)метанол получали следующим образом: К раствору 4-бром-3-метилтиофенкарбоновой кислоты (2 г; 0,95 ммоль) в ТГФ (20 мл) добавляли комплекс боран-ТГФ (1M, 18,19 мл; 18,19 ммоль) по каплям при 0°C. Затем реакционную смесь перемешивали в течение 1 часа при 60°C. К этой реакционной смеси добавляли 1 M HCl (30 мл) при 0°C и полученную смесь перемешивали при комнатной температуре в течение 10 минут. Полученную смесь концентрировали в вакууме и остаток распределяли между EtOAc и 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме с получением продукта (2,2 г; 100%), который использовали как таковой.
Описанное выше промежуточное соединение: трет-бутил 3-{6-[(4-бром-3-метилтиофен-2-ил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат использовали для синтеза следующих 2 соединений:
Трет-бутил 3-{6-[(3-метил-4-фенилтиофен-2-ил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. К дегазированной смеси трет-бутил 3-{6-[(4-бром-3-метилтиофен-2-ил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата (200 мг; 0,38 ммоль) в 10 мл толуола добавляли последовательно фенилбороновую кислоту (56 мг; 0,46 ммоль), ацетат палладия(II) (4,3 мг; 0,02 ммоль), трехосновной фосфат калия моногидрат (308,5 мг; 1,34 ммоль) и 2-дициклогексилфосфино-2',6'-диизопропокси-1',1'-бифенил (15,7 мг; 0,04 ммоль). Полученную смесь нагревали при температуре кипения с обратным холодильником в течение ночи (бутыль из пирекса)). После охлаждения до комнатной температуры смесь концентрировали в вакууме и распределяли между EtOAc и 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 2:1) с получением продукта (200 мг; 100%).
Трет-бутил 3-{6-[(4-бутил-3-метилтиофен-2-ил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. К дегазированной смеси трет-бутил 3-{6-[(4-бром-3-метилтиофен-2-ил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата (200 мг; 0,38 ммоль) в 10 мл толуола добавляли последовательно бутилтрифторборонат калия (68,6 мг; 0,42 ммоль), ацетат палладия(II) (4,3 мг; 0,02 ммоль), трехосновной фосфата калия моногидрат (308,5 мг; 1,34 ммоль) и 2-дициклогексилфосфино-2',6'-диизопропокси-1',1'-бифенил (15,7 мг; 0,04 ммоль). Полученную смесь нагревали при температуре кипения с обратным холодильником в течение ночи (бутыль из пирекса)). После охлаждения до комнатной температуры смесь концентрировали в вакууме и распределяли между EtOAc и 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1) с получением продукта (126 мг; 65%).
Трет-бутил 3-{6-[(2,6-дихлор-3-этилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. Необходимый (2,6-дихлор-3-этилфенил)-метанол получали следующим образом: К смеси 2',4'-дихлорацетофенона (4,85 г; 25,66 ммоль), суспендированного в диэтиленгликоле (20 мл), добавляли гидроксид калия (2,37 г; 35,92 ммоль) и гидразингидрат (2,93 мл). Полученную смесь нагревали при 100°C (в течение 1 часа) и затем в течение ночи (при 200°C). После охлаждения до комнатной температуры смесь распределяли между Et2O и H2O. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, гексан) с получением продукта: 2,4-дихлор-1-этилбензола (2,24 г; 50%). К раствору 2,2,6,6-тетраметилпиперидина (2,36 мл; 14 ммоль), растворенного в ТГФ (40 мл), добавляли н-бутиллитий (5,61 мл; 2,50 моль/л; 14 ммоль) при -78°C. Реакционную смесь перемешивали в течение 90 минут, давая температуре повыситься до 0°C. Затем добавляли раствор 2,4-дихлор-1-этилбензола (2,23 г; 12,74 ммоль), растворенного в ТГФ (5 мл), при -78°C. Полученную смесь перемешивали в течение 2,5 часов. Затем добавляли по каплям раствор N,N-диметилформамида (1,48 мл; 19,11 ммоль) и полученную реакционную смесь перемешивали в течение 30 минут. Реакцию гасили путем добавления насыщенного водного раствора NaH4Cl при -50°C. Полученную смесь экстрагировали Et2O. Объединенные органические слои сушили (Na2SO4), фильтровали и концентрировали в вакууме с получением неочищенного 2,6-дихлор-3-этилбензальдегида, который снова растворяли в MeOH (100 мл). Затем добавляли NaBH4 (1,45 г; 38,22 ммоль) небольшими порциями при 0°C. После завершения добавления смеси давали нагреться до комнатной температуры и перемешивали в течение одного часа. Затем смесь охлаждали до 0°C, добавляли воду и MeOH выпаривали в вакууме. К водному раствору добавляли 5% водный раствор NaHCO3 и Et2O. Слои разделяли и органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:7, затем 1:1) с получением продукта: (2,6-дихлор-3-этилфенил)метанола (2,11 г; 80%).
Трет-бутил 3-{6-[(4-бутил-2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. Необходимый (4-бутил-2,6-дихлорфенил)-метанол получали следующим образом: К дегазированной смеси 1-бром-3,5-дихлорбензола (4,42 г; 19,57 ммоль) в 90 мл толуола и 30 мл H2O добавляли последовательно бутилтрифторборонат калия (4,01 г; 24,45 ммоль), карбонат цезия (19,13 г; 58,7 ммоль) и комплекс 1',1'-бис(дифенилфосфино)ферферроценпалладий(II)дихлорида с дихлорметаном (0,8 г; 0,98 ммоль). Полученную смесь нагревали в течение 48 часов (90°C). После охлаждения до комнатной температуры реакционную смесь разбавляли EtOAc, фильтровали и промывали H2O. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1) с получением 1-бутил-3,5-дихлорбензола (3,39 г; 85%). Этот продукт преобразовывали в (4-бутил-2,6-дихлорфенил)метанол (общий выход: 71%) с использованием последовательности, описанной для преобразования 2,4-дихлор-1-этилбензола в (2,6-дихлор-3-этилфенил)метанол.
Трет-бутил 3-{6-[(2,6-дихлор-4-циклопропилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. Необходимый (2,6-дихлор-4-циклопропилфенил)метанол получали следующим образом: К раствору 2,2,6,6-тетраметилпиперидина (2,36 мл; 14 ммоль), растворенного в ТГФ (40 мл), добавляли н-бутиллитий (5,61 мл; 2,50 моль/л; 14 ммоль) при -78°C. Реакционную смесь перемешивали в течение 90 минут, давая температуре повыситься до 0°C. Затем добавляли раствор 3,5-дихлориодбензола (6,82 г; 25 ммоль), растворенного в ТГФ (10 мл), при -78°C. Полученную смесь перемешивали в течение 2,5 часов. Затем добавляли по каплям раствор N,N-диметилформамида (2,9 мл; 37,5 ммоль) и полученную реакционную смесь перемешивали в течение 30 минут. Реакцию гасили путем добавления насыщенного водного раствора NaH4Cl при -50°C. Полученную смесь экстрагировали Et2O. Объединенные органические слои сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, дихлорметан:гексан 1:1) с получением продукта: 2,6-дихлор-4-иод-бензальдегида (5,11 г; 64). Затем 2,7 г; 8,52 ммоль этого альдегида снова растворяли в MeOH (100 мл) и добавляли NaBH4 (0,45 г; 12,79 ммоль) небольшими порциями при 0°C. После завершения добавления смеси давали нагреться до комнатной температуры и перемешивали в течение одного часа. Затем смесь охлаждали до 0°C, добавляли воду и MeOH выпаривали в вакууме. К водному раствору добавляли 5% водный раствор NaHCO3 и Et2O. Слои разделяли и органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, дихлорметан:ацетон 95:5) с получением продукта: (2,6-дихлор-4-иодфенил)метанола (2,2 г; 81%). К дегазированной смеси (2,6-дихлор-4-иодфенил)метанола (303 мг; 1 ммоль) в 9 мл толуола и 3 мл H2O добавляли последовательно бутилтрифторборонат калия (117 мг; 1,2 ммоль), карбонат цезия (977 мг; 3 ммоль) и комплекс 1',1'-бис(дифенилфосфино)-ферроценпалладий(II)дихлорида с дихлорметаном (0,037 г; 0,05 ммоль). Полученную смесь нагревали в течение 72 часов (90°C). После охлаждения до комнатной температуры реакционную смесь разбавляли EtOAc, фильтровали и промывали H2O. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, дихлорметан:ацетон 95:5) с получением (2,6-дихлор-4-циклопропилфенил)метанола (130 мг; 59%).
Трет-бутил 3-{6-[(2-хлор-6-этилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. Необходимый (2-хлор-6-этилфенил)метанол получали следующим образом: К раствору 2-хлор-6-этилбензальдегида (1,8 г, 10,67 ммоль), полученного в соответствии с US2007/197621 (см. также WO2007/85556 и US6380387), в MeOH (50 мл) добавляли NaBH4 (1,21 г; 32,02 ммоль) небольшими порциями при 0°C. После завершения добавления смеси давали нагреться до комнатной температуры и перемешивали в течение одного часа. Затем смесь охлаждали до 0°C, добавляли воду и MeOH выпаривали в вакууме. К водному раствору добавляли 5% водный раствор NaHCO3 и EtOAc. Слои разделяли и органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:7, затем Et2O:гексан 3:1) с получением (2-хлор-6-этилфенил)метанола (1,2 г; 66%).
Трет-бутил 3-(6-{[2-хлор-6-(пропан-2-ил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропаноат. Необходимый [2-хлор-6-(пропан-2-ил)фенил]метанол получали путем NaBH4 восстановления 2-хлор-6-(пропан-2-ил)бензальдегида в MeOH, который был получен способом, аналогичным получению 2-хлор-6-этилбензальдегида.
Трет-бутил 3-{6-[(2-хлор-6-циклопропил)фенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. Необходимый (2-хлор-6-циклопропилфенил)метанол получали путем NaBH4 восстановления 2-хлор-6-циклопропилбензальдегида в MeOH, который был получен способом, аналогичным получению 2-хлор-6-этилбензальдегида.
Трет-бутил 3-(6-{[2-хлор-6-(2-метилпропил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропаноат. Необходимый [2-хлор-6-(2-метилпропил)фенил)метанол получали путем NaBH4 восстановления 2-хлор-6-(2-метилпропил)бензальдегида в MeOH, который был получен способом, аналогичным получению 2-хлор-6-этилбензальдегида.
Трет-бутил 3-{6-[(2,6-дихлор-3-метоксифенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. Необходимый (2,6-дихлор-3-метокси-фенил)метанол получали следующим образом: смесь 2,4-дихлорфенола (4,8 г; 29,45 ммоль), карбоната калия (5,09 г; 36,8 ммоль) и иодметана в ацетоне (75 мл) нагревали при температуре кипения с обратным холодильником в течение 3,5 часов. После охлаждения до комнатной температуры смесь концентрировали в вакууме и остаток распределяли между Et2O и H2O. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме с получением 2,4-дихлор-1-метоксибензола (4,88 г; 93%). К раствору 2,2,6,6-тетраметилпиперидина (3,73 мл; 9,32 ммоль), растворенного в ТГФ (50 мл), добавляли н-бутиллитий (5,61 мл; 2,50 моль/л; 14 ммоль) при -78°C. Реакционную смесь перемешивали в течение 90 минут, давая температуре повыситься до 0°C. Затем добавляли раствор 2,4-дихлор-1-метоксибензола (1,5 г; 8,47 ммоль), растворенного в ТГФ (5 мл), при -78°C. Полученную смесь перемешивали в течение 2,5 часов. Затем добавляли по каплям раствор N,N-диметилформамида (0,99 мл; 12,71 ммоль) и полученную реакционную смесь перемешивали в течение 30 минут. Реакцию гасили путем добавления насыщенного водного раствора NaH4Cl при -50°C. Полученную смесь экстрагировали Et2O. Объединенные органические слои сушили (Na2SO4), фильтровали и концентрировали в вакууме. Неочищенный 2,6-дихлор-3-метоксибензальдегид растворяли в MeOH (50 мл) и добавляли NaBH4 (0,96 г; 25,4 ммоль) небольшими порциями при 0°C. После завершения добавления смеси давали нагреться до комнатной температуры и перемешивали в течение одного часа. Затем смесь охлаждали до 0°C, добавляли воду и MeOH выпаривали в вакууме. К водному раствору добавляли 5% водный раствор NaHCO3 и Et2O. Слои разделяли и органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1) с получением продукта: (2,6-дихлор-3-метоксифенил)метанола (1,35 г; 77%).
Трет-бутил 3-(6-{[2-хлор-6-(трифторметокси)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропаноат. Необходимый [2-хлор-6-(трифторметокси)фенил]метанол получали из 1-хлор-3-(трифторметокси)бензола с использованием последовательности LiTMP/N,N-диметилформамид, затем NaBH4/MeOH, общий выход 71% (аналогично (2,6-дихлор-3-метоксифенил)метанолу)).
Трет-бутил 3-(6-{[2-фтор-6-(пропан-2-ил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропаноат. Необходимый [2-фтор-6-(пропан-2-ил)-фенил]метанол получали аналогично последовательности, описанной для соединения 273.
Трет-бутил 3-{6-[(2-циклопропил-6-фторфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. Необходимый (2-циклопропил-6-фторфенил)-метанол получали, как описано для соединения 273.
Трет-бутил 3-{6-[(2-этил-6-фторфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. Необходимый (2-этил-6-фторфенил)метанол получали аналогично последовательности, описанной для соединения 273.
Трет-бутил 3-(6-{[2-фтор-6-(трифторметил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропаноат.
Трет-бутил 3-{6-[(4-хлор-2,6-дифторфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[1-(2,6-дихлорфенил)этокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[(2,6-диэтилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. Необходимый (2,6-диэтилфенил)метанол получали следующим образом: К охлажденному раствору (0°C) (E)-бутил[(2,6-дифторфенил)метилиден]амина (1,97 г; 9,99 ммоль), полученного в соответствии с US2007/197621, (см. также WO2007/85556 и US6380387), растворенного в ТГФ (35 мл), добавляли по каплям этилмагнийбромид (3M, 7,32 мл; 21,97 ммоль). Затем реакционную смесь перемешивали в течение 2 часов при комнатной температуре. К этой реакционной смеси добавляли 3 мл H2O и полученную смесь распределяли между EtOAc и 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:7) с получением (E)-бутил[(2,6-диэтилфенил)-метилиден]амина (1,18 г; 54%). Этот продукт (1,70 г; 7,82 ммоль) растворяли в 20 мл H2O и серной кислоте (5 мл; 93,90 ммоль) и нагревали до температуры кипения с обратным холодильником в течение 2 часов. После охлаждения до комнатной температуры полученную смесь распределяли между EtOAc и 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:7, затем Et2O:гексан 1:7) с получением (2,6-диэтилбензальдегида (1,27 г; 95%).
Этот продукт восстанавливали в MeOH (50 мл) при помощи NaBH4 (0,71 г; 18,8 ммоль) при 0°C. После завершения добавления смеси давали нагреться до комнатной температуры и перемешивали в течение одного часа. Затем смесь охлаждали до 0°C, добавляли воду и MeOH выпаривали в вакууме. К водному раствору добавляли 5% водный раствор NaHCO3 и EtOAc. Слои разделяли и органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1) с получением (2,6-диэтилфенил)-метанола (0,68 г; 55%).
Трет-бутил 3-(6-{[2-(пропан-2-ил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропаноат.
Трет-бутил 3-(6-{[2-этил-6-(трифторметил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропаноат. Необходимый (2-этил-6-(трифторфенил)-метанол получали, как описано для соединения 273 (исходя из 2-фтор-6-(трифторметил)бензальдегида).
Трет-бутил 3-(6-{[2-хлор-6-(дифторметокси)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропаноат. Необходимый (2-хлор-6-дифторметоксифенил)метанол получали следующим образом: К раствору 2-хлор-6-гидроксибензальдегида (1,00 г; 6,39 ммоль) и KOH (7,17 г; 127,7 ммоль) в CH3CN (20 мл) и воде (20 мл) добавляли бромдифторметилдиэтилфосфонат (1,25 мл; 7,03 ммоль) при -15°C. Через 30 минут смеси давали нагреться до комнатной температуры, перемешивали еще в течение 30 минут и затем обрабатывали 1M водным раствором HCl и экстрагировали Et2O. Объединенные органические слои сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O/гексан 1:3) с получением 2-хлор-6-дифторметокси-бензальдегида (0,68 г).
К раствору 2-хлор-6-дифторметоксибензальдегида (0,65 г; 3,15 ммоль) в MeOH (10 мл) добавляли NaBH4 (357,13 мг; 9,44 ммоль) при -15°C. После завершения добавления смеси давали нагреться до комнатной температуры и перемешивали в течение 30 минут. Затем добавляли воду (5 мл) и летучие вещества удаляли в вакууме. Остаток распределяли между Et2O и 5% водным раствором NaHCO3. Слои разделяли и органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме с получением (2-хлор-6-дифторметокси-фенил)-метанола (0,52 г), который использовали как таковой.
Трет-бутил 3-{6-[(2-фтор-6-метоксифенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
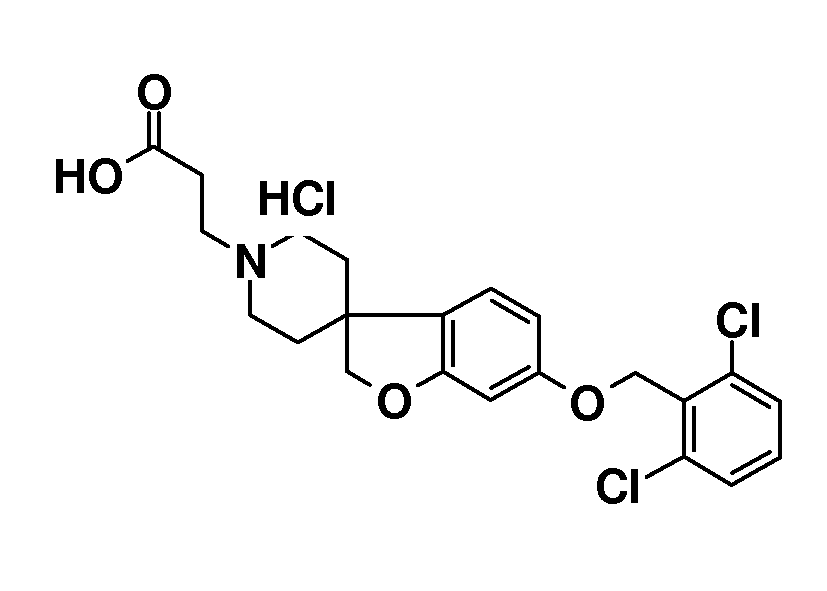
Соединение 29. Гидрохлорид 3-{6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты. Трет-бутил 3-{6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат (1,10 г, 2,23 ммоль) растворяли в 4M растворе HCl в 1,4-диоксане (20 мл; 4 моль/л; 80 ммоль) и перемешивали в течение ночи при 50°C. Затем растворитель удаляли в вакууме и остаток обрабатывали iPr2O, осадок собирали фильтрованием и сушили в течение ночи при пониженном давлении с получением продукта (1,0 г, 89%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,9 (уш.с, 1H), 10,5 (уш.с, 1H), 7,54-7,58 (м, 2H), 7,44-7,50 (м, 1H), 7,04-6,95 (м, 1H), 6,56-6,62 (м, 2H), 5,18 (с, 2Н), 4,48 (уш.с, 2H), 3,42-3,56 (м, 2H), 3,24-3,41 (м, 2H), 2,96-3,18 (м, 2H), 2,86 (т, J=8,0 Гц, 2H), 2,10-2,30 (м, 2H), 1,80-1,91 (м, 2H). Rt 1,57 мин (Система B), [M+H]+ 436,0.
Следующие соединения были получены аналогичным способом:
Соединение 30. Гидрохлорид 3-{6-[(4-фенилпентил)окси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,46 мин (Система B), [M+H]+ 424,1
Соединение 31. Гидрохлорид 3-{6-[(3-хлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,20 (уш.с, 1H), 11,30 (уш.с, 1H), 7,37-7,51 (м, 4H), 6,94-7,08 (м, 1H), 6,50-6,58 (м, 2H), 5,09 (с, 2H), 4,46 (с, 2H), 3,24-3,49 (м, 4H), 2,97-3,13 (м, 2H), 2,87 (т, J=7,8 Гц, 2H), 2,13-2,26 (м, 2H), 1,79-1,89 (м, 2H).
Соединение 32. Гидрохлорид 3-[6-(циклогексилметокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановой кислоты.
Rt 1,42 мин (Система B), [M+H]+ 374,2
Соединение 33. Гидрохлорид 3-[6-(оксан-2-илметокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановой кислоты.
Rt 1,13 мин (Система B), [M+H]+ 376,2
Соединение 34. Гидрохлорид 3-{6-[(2,5-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,40 мин (Система B), [M+H]+ 436,1
Соединение 35. Гидрохлорид 3-(6-{[3-(трифторметил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО/TFA-d6) δ м.д. 10,0 (уш.с, 1H), 7,69-7,78 (м, 2H), 7,56-7,66 (м, 2H), 7,00 (д, J=8,4 Гц, 1H), 6,49-6,58 (м, 2H), 5,15 (с, 2H), 4,50 (уш.с, 2H), 3,45-3,60 (м, 2H), 3,29-3,41 (м, 2H), 2,95-3,18 (м, 2H), 2,86 (т, J=7,4 Гц, 2H), 2,18-2,33 (м, 2H), 1,85-1,94 (м, 2H). Rt 1,38 мин (Система B), [M+H]+ 436,1.
Соединение 36. Гидрохлорид 3-(6-{[2-(трифторметил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,37 мин (Система B), [M+H]+ 436,1
Соединение 37. Гидрохлорид 3-{6-[(2,3-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,40 мин (Система B), [M+H]+ 436,0
Соединение 38. Гидрохлорид 3-{6-[(2-хлор-6-фторфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО/TFA-d6) δ м.д. 9,80 (уш.с, 1H), 7,40-7,48 (м, 1H), 7,34 (д, J=8,9 Гц, 1H), 7,20 (т, J=8,9 Гц, 1H), 7,01 (д, J=8 Гц, 1H), 6,52-6,58 (м, 2H), 5,15 (с, 2H), 4,51 (уш.с, 1H), 3,35-3,63 (м, 4H), 3,06-3,20 (м, 2H), 2,84 (т, J=7,5 Гц, 2H), 2,18-2,28 (м, 2H), 1,85-1,93 (м, 2H). Rt 1,31 мин (Система B), [M+H]+ 420,1.
Соединение 39. Гидрохлорид 3-[6-(бензилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-пропановой кислоты.
Rt 1,57 мин (Система B), [M+H]+ 368,1
Соединение 40. Гидрохлорид 3-{6-[(2,4-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,42 мин (Система B), [M+H]+ 436,1
Соединение 41. Гидрохлорид 3-(6-{[2-хлор-6-(трифторметил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,37 мин (Система B), [M+H]+ 470,1
Соединение 42. Гидрохлорид 3-[6-(циклогекс-3-ен-илметокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановой кислоты.
Rt 1,38 мин (Система B), [M+H]+ 372,2
Соединение 43. Гидрохлорид 3-{6-[(3,5-дихлорпиридин-4-ил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,23 мин (Система B), [M+H]+ 437,0
Соединение 44. Гидрохлорид 3-{6-[(2,4-дихлорпиридин-3-ил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,19 мин (Система B), [M+H]+ 437,0
Соединение 45. Гидрохлорид 3-{6-[(2,4,6-трихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,64 (уш.с, 1H), 10,09 (уш.с, 1H), 7,78 (с, 2H), 7,02 (уш.с, 1H), 6,54-6,59 (м, 2H), 5,13 (с, 2H), 4,46 (с, 2H), 3,21-3,50 (м, 4H), 2,92-3,11 (м, 2H), 2,80 (т, J=8 Гц, 2H), 2,04-2,15 (м, 2H), 1,81-1,89 (м, 2H). Rt 1,45 мин (Система B), [M+H]+ 471,9.
Соединение 46. Гидрохлорид 3-{6-[(2,6-дихлор-4-иодфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,82 (уш.с, 1H), 10,18 (уш.с, 1H), 7,98 (с, 2H), 7,00 (уш.с, 1H), 6,55-6,60 (м, 2H), 5,12 (с, 2H), 4,47 (уш.с, 2H), 3,26-3,51 (м, 4H), 3,10-3,19 (м, 2H), 2,83 (т, J=8 Гц, 2H), 2,08-2,19 (м, 2H), 1,82-1,90 (м, 2H). Rt 1,47 мин (Система B), [M+H]+ 561,8.
Соединение 47. Гидрохлорид 3-{6-[(2,6-дифторфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты. Rt 1,28 мин (Система B), [M+H]+ 404,0.
Соединение 48. Гидрохлорид 3-{6-[2-(2,6-дихлорфенил)этокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,80 (уш.с, H), 10,70 (уш., 1H), 7,49 (д, J=8,1 Гц, 2H), 7,28-7,39 (м, 1H), 6,88-7,08 (м, 1H), 6,41-6,51 (м, 2H), 4,41-4,49 (м, 2H), 4,08-4,18 (м, 2H), 3,25-3,48 (м, 6H), 3,06 (уш.с, 2H), 2,82-2,92 (м, 2H), 2,1-2,3 (м, 2H), 1,78-1,83 (м, 2H). Rt 1,41 мин (Система B), [M+H]+ 450,0.
Соединение 49. Гидрохлорид 3-{6-[2-(2-фторфенил)этокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,32 мин (Система B), [M+H]+ 400,0
Соединение 50. Гидрохлорид 3-{6-[(2-хлор-5-метилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,40 мин (Система B), [M+H]+ 416,1
Соединение 51. Гидрохлорид 3-{6-[(2-хлор-5-этилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,70 (уш.с, 1H), 10,55 (уш.с, 1H), 7,43 (д, J=2,2 Гц, 1H), 7,40 (д, J=8,2 Гц, 1H), 7,24 (дд, J=8,2 и 2,2 Гц, 1H), 6,94-7,03 (м, 1H), 6,51-6,61 (м, 2H), 5,06 (с, 2H), 4,47 (уш.с, 2H), 3,22-3,55 (м, 4H), 2,95-3,15 (м, 2H), 2,86 (т, J=7,6 Гц, 2H), 2,61 (кв., J=7,6 Гц, 2H), 2,10-2,30 (м, 2H), 1,79-1,91 (м, 2H), 1,16 (т, J=7,6 Гц, 3H). Rt 1,45 мин (Система B), [M+H]+ 430,1.
Соединение 52. Гидрохлорид 3-{6-[(2-хлор-5-пропилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,52 мин (Система B), [M+H]+ 444,1
Соединение 53. Гидрохлорид 3-{6-[3-(2-фторфенил)пропокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,80 (уш.с, 1H), 10,70 (уш.с, 1H), 7,27-7,32 (м, 1H), 7,20-7,27 (м, 1H), 7,09-7,15 (м, 2H), 6,88-6,98 (м, 1H), 6,44 (д, J=7,6 Гц, 1H), 6,38 (д, J=2,2 Гц, 1H), 4,45 (уш.с, 2H), 3,91 (т, J=6,2 Гц, 2H), 3,19-3,52 (м, H), 3,01 (м, 2H), 2,85 (т, J=7,7 Гц, 2H), 2,74 (т, J=7,6 Гц, 2H), 2,14-2,28 (м, 2H), 1,91-1,99 (м, 2H), 1,73-1,88 (м, 2H).
Соединение 54. Гидрохлорид 3-{6-[3-(2-хлорфенил)пропокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,44 мин (Система B), [M+H]+ 430,1
Соединение 55. Гидрохлорид 3-[6-(3-фенилпропокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановой кислоты.
Rt 1,45 мин (Система B), [M+H]+ 396,2
Соединение 56. Гидрохлорид 3-{6-[2-(2,4-дихлорфенил)этокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,47 мин (Система B), [M+H]+ 450,0
Соединение 57. Гидрохлорид 3-{6-[2-(2-хлорфенил)этокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,39 мин (Система B), [M+H]+ 416,0
Соединение 58. Гидрохлорид 3-(6-{[2,6-дихлор-4-(трифторметил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропановой кислоты. Rt 1,49 мин (Система B), [M+H]+ 504,0
Соединение 59. Гидрохлорид 3-{6-[(2,6-дихлор-4-метилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,64 (уш.с, 1H), 9,90 (уш.с, 1H), 7,42 (с, 2H), 7,01 (уш.с, 1H), 6,56-6,61 (м, 2H), 5,14 (с, 2H), 4,49 (уш.с, 2H), 3,31-3,53 (м, 4H), 3,01-3,11 (м, 2H), 2,81-2,87 (м, 2H), 2,35 (с, 3H), 2,09-2,19 (м, 2H), 1,84-1,92 (м, 2H). Rt 1,43 мин (Система B), [M+H]+ 450,0.
Соединение 60. Гидрохлорид 3-{6-[(5-бром-2-хлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,52 мин (Система B), [M+H]+ 480,0
Соединение 61. Гидрохлорид 3-{6-[(2-хлор-6-метилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,42 мин (Система B), [M+H]+ 416,1
Соединение 62. Гидрохлорид 3-(6-{3-[2-(трифторметил)фенил]пропокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропановой кислоты.
Rt 1,48 мин (Система B), [M+H]+ 464,1
Соединение 63. Гидрохлорид 3-{6-[3-(2,3-дифторфенил)пропокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,42 мин (Система B), [M+H]+ 432,1
Соединение 64. Гидрохлорид 3-{6-[3-(2-хлор-6-фторфенил)пропокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,42 мин (Система B), [M+H]+ 432,1
Соединение 65. Гидрохлорид 3-{6-[3-(2,6-дихлорфенил)пропокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,70 (уш.с, 1H), 10,70 (уш.с, 1H), 7,46 (д, J=8,3 Гц, 2H), 7,27 (дд, J=8,3 и 7,6 Гц, 1H), 6,95 (д, J=8,0 Гц, 1H), 6,46 (дд, J=8,0 и 2,0 Гц, 1H), 6,40 (д, J=2,0 Гц, 1H), 4,47 (уш.с, 2H), 3,99 (т, J=6,1 Гц, 2H), 3,46 (м, 2H), 3,29 (м, 2H), 2,98-3,10 (м, 4H), 2,87 (т, J=7,7 Гц, 2H), 2,15-2,30 (м, 2H), 1,90-1,99 (м, 2H), 1,78-1,88 (м, 2H). Rt 1,49 мин (Система B), [M+H]+ 464,0.
Соединение 66. Гидрохлорид 3-{6-[3-(4-хлорфенил)пропокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,46 мин (Система B), [M+H]+ 430,1
Соединение 67. Гидрохлорид 3-{6-[(2-хлор-5-фенилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,90 мин (Система B), [M+H]+ 478,0
Соединение 68. Гидрохлорид 3-{6-[(2,6-дихлор-3-этилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,80 (уш.с, 1H), 10,30 (уш.с, 1H), 7,50 (д, J=8,1 Гц, 1H), 7,45 (д, J=8,1 Гц, 1H), 6,95-7,07 (м, 1H), 6,58-6,62 (м, 2H), 5,19 (с, 2H), 4,48 (уш.с, 2H), 3,20-3,52 (м, 4H), 2,95-3,20 (м, 2H), 2,85 (т, J=7,7 Гц, 2H), 2,75 (кв., J=7,6 Гц, 2H), 2,10-2,28 (м, 2H), 1,80-1,90 (м, 2H), 1,18 (т, J=7,6 Гц, 3H).
Соединение 69. Гидрохлорид 3-{6-[(4-бутил-2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,55 (уш.с, 1H), 10,27 (уш.с, 1H), 7,37 (с, 2H), 6,95 (уш.с, 1H), 6,51-6,58 (м, 2H), 5,09 (с, 2H), 4,44 (уш.с, 2H), 3,22-3,50 (м, 4H), 2,94-3,18 (м, 2H), 2,81 (т, J=8 и 2 Гц, 2H), 2,57 (т, J=8 Гц, 2H), 2,07-2,19 (м, 2H), 1,78-1,86 (м, 2H), 1,48-1,56 (м, 2H), 1,21-1,30 (м, 2H), 0,84-0,89 (т, J=8 Гц, 3H). Rt 1,92 мин (Система B), [M+H]+ 492,0.
Соединение 70. Гидрохлорид 3-{6-[(2,6-дихлор-4-циклопропилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,55 (уш.с, 1H), 10,09 (уш.с, 1H), 7,27 (с, 2H), 7,00 (уш.с, 1H), 6,55-6,60 (м, 2H), 5,11 (с, 2H), 4,49 (уш.с, 2H), 3,26-3,52 (м, 4H), 2,97-3,12 (м, 2H), 2,84 (т, J=8 Гц, 2H), 2,08-2,22 (м, 2H), 1,97-2,02 (м, 1H), 1,83-1,91 (м, 2H), 0,99-1,06 (м, 2H), 0,78-0,82 (м, 2H). Rt 1,65 мин (Система B), [M+H]+ 476,0.
Соединение 71. Гидрохлорид 3-{6-[(2-хлор-5-циклопропилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,68 мин (Система B), [M+H]+ 442,1
Соединение 72. Гидрохлорид 3-[6-({2-хлор-5-[2-фенилциклопропил]фенил}метокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановой кислоты.
Rt 1,72 мин (Система B), [M+H]+ 518,0
Соединение 73. Гидрохлорид 3-{6-[(2-хлор-6-этилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,80 (уш.с, 1H), 10,30 (уш.с, 1H), 7,35-7,37 (м, 2H), 7,26-7,30 (м, 1H), 6,95-7,40 (м, 1H), 6,56-6,63 (м, 2H), 5,10 (с, 2H), 4,49 (уш.с, 2H), 3,24-3,54 (м, 4H), 2,96-3,14 (м, 2H), 2,87 (т, J=8,2 Гц, 2H), 2,71 (кв., J=7,6 Гц, 2H), 2,18-2,33 (м, 2H), 1,80-1,90 (м, 2H), 1,17 (т, J=7,6 Гц, 3H). Rt 1,40 мин (Система B), [M+H]+ 430,0.
Соединение 74. Гидрохлорид 3-(6-{[2-хлор-6-(пропан-2-ил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,80 (уш.с, 1H), 10,90 (уш.с, 1H), 7,33-7,41 (м, 3H), 6,94-7,04 (м, 1H), 6,56-6,63 (м, 2H), 5,15 (с, 2H), 4,49 (уш.с, 2H), 3,24-3,54 (м, 4H), 3,14-3,22 (м, 1H), 2,95-3,14 (м, 2H), 2,88 (т, J=8,0 Гц, 2H), 2,14-2,33 (м, 2H), 1,80-1,90 (м, 2H), 1,19 (д, J=6,7 Гц, 6H). Rt 1,40 мин (Система B), [M+H]+ 430,0.
Соединение 75. Гидрохлорид 3-{6-[(2-хлор-6-циклопропил)фенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,90 (уш.с, 1H), 10,10 (уш.с, 1H), 7,29-7,37 (м, 2H), 6,94-7,09 (м, 2H), 6,56-6,62 (м, 2H), 5,26 (с, 2H), 4,49 (уш.с, 2H), 3,42-3,56 (м, 2H), 3,24-3,41 (м, 2H), 2,96-3,18 (м, 2H), 2,84 (т, J=7,7 Гц, 2H), 2,00-2,23 (м, 3H), 1,80-1,91 (м, 2H), 0,88-0,96 (м, 2H), 0,73-0,65 (м, 2H). Rt 1,43 мин (Система B), [M+H]+ 442,0.
Соединение 76. Гидрохлорид 3-{6-[(2,6-дихлор-3-метоксифенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,35 мин (Система B), [M+H]+ 465,9
Соединение 77. Гидрохлорид 3-(6-{[2-хлор-6-(трифторметокси)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,90 (уш.с, 1H), 10,50 (уш.с, 1H), 7,58-7,65 (м, 2H), 7,46-7,51 (м, 1H), 6,95-7,03 (м, 1H), 6,56-6,62 (м, 2H), 5,10 (с, 2H), 4,49 (уш.с, 2H), 3,42-3,56 (м, 2H), 3,24-3,41 (м, 2H), 2,96-3,18 (м, 2H), 2,84 (т, J=7,7 Гц, 2H), 2,13-2,28 (м, 2H), 1,83-1,91 (м, 2H). Rt 1,41 мин (Система B), [M+H]+ 486,0.
Соединение 78. Гидрохлорид 3-(6-{[2-хлор-6-(2-метилпропил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,9 (уш.с, 1H), 10,1 (уш.с, 1H), 7,31-7,42 (м, 2H), 7,20-7,24 (м, 1H), 6,96-7,03 (м, 1H), 6,56-6,62 (м, 2H), 5,08 (с, 2H), 4,49 (уш.с, 2H), 3,45-3,56 (м, 2H), 3,24-3,41 (м, 2H), 2,96-3,18 (м, 2H), 2,84 (т, J=7,7 Гц, 2H), 2,58 (д, J=7,4 Гц, 2H), 2,00-2,23 (м, 3H), 1,80-1,91 (м, 2H), 0,85 (д, J=6,8 Гц, 6H).
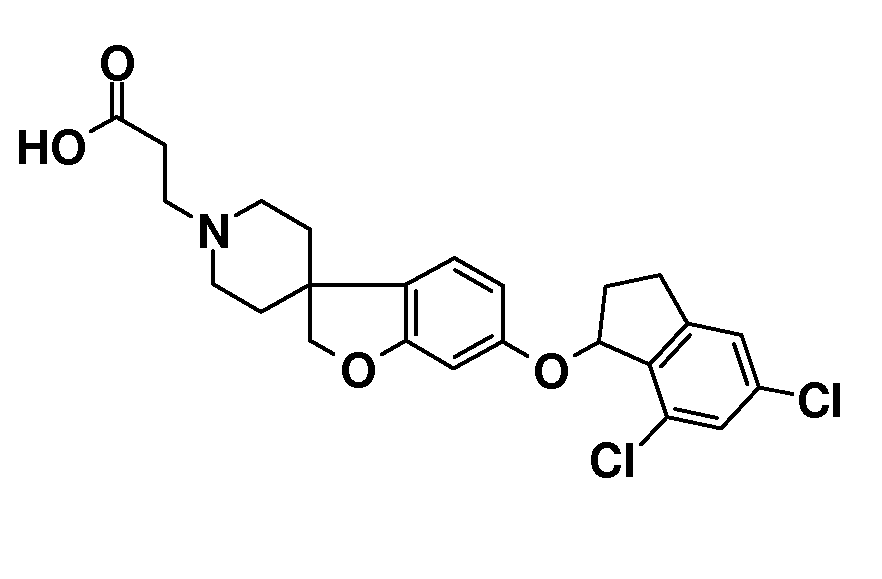
Соединение 79. 3-{6-[(5,7-Дихлор-2,3-дигидро-1H-инден-1-ил)окси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота. Смесь 3-{6-[(5,7-дихлор-2,3-дигидро-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата (0,27 г; 0,52 ммоль), 2M водного раствора NaOH (5 мл; 10 ммоль) и этанола (40 мл) перемешивали в течение 3 часов при 50°C и затем охлаждали до 0°C. К этой реакционной смеси добавляли по каплям водный раствор HCl (10 мл; 1 моль/л), после чего смесь концентрировали в вакууме. Остаток обрабатывали насыщенным солевым раствором и дихлорметаном. Водный слой промывали дихлорметаном (два раза). Затем органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме, с последующей обработкой iPr2O. Образовавшийся осадок собирали фильтрованием, промывали iPr2O и сушили в вакууме с получением продукта (209 мг; 81,8%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,25 (с, 1H), 7,19 (с, 1H), 7,06 (д, J=8,2 Гц, 1H), 6,53 (дд, J=8,2 и 2,1 Гц, 1H), 6,47 (д, J=2,1 Гц, 1H), 5,70 (д, J=5,1 Гц, 1H), 4,40 (с, 2H), 3,14-3,28 (м, 3H), 2,84-2,98 (м, 3H), 2,60 (т, J=5,9 Гц, 2H), 2,27-2,46 (м, 4H), 2,09 (т, J=11,4 Гц, 2H), 1,89 (уш.д, J=13,8 Гц, 2H). Rt 1,47 мин (Система В), [M+H]+ 462,0.
Следующие соединения были получены аналогичным способом:
Соединение 80. 3-{6-[(5,7-Дифтор-2,3-дигидро-1H-инден-1-ил)окси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота.
Rt 1,39 мин (Система B), [M+H]+ 430,1
Соединение 81. 3-{6-[(1R)-(2,3-дигидро-1H-инден-1-ил)окси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота.
Rt 1,34 мин (Система B), [M+H]+ 394,1
Соединение 82. 3-{6-[(1S)-(2,3-дигидро-1H-инден-1-ил)окси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота.
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,42 (д, J=7,3 Гц, 1H), 7,21-7,34 (м, 3H), 7,05 (д, J=8,2 Гц, 1H), 6,57 (дд, J=8,2 и 2,0 Гц, 1H), 6,51 (д, J=2,0 Гц, 1H), 5,71 (дд, J=6,5 и 4,4 Гц, 1H), 4,40 (с, 2H), 3,08-3,19 (м, 3H), 2,87-2,97 (м, 1H), 2,84 (т, J=6,1 Гц, 2H), 2,50-2,62 (м, 3H), 2,30-2,46 (м, 2H), 2,15-2,25 (м, 1H), 2,00-2,11 (м, 2H), 1,84-1,93 (м, 2H). Rt 1,34 мин (Система В), [M+H]+ 394,1.
Соединение 83. 3-(6-{[(2E)-3-(4-Хлорфенил)проп-2-ен-1-ил]окси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота.
Rt 1,48 мин (Система B), [M+H]+ 428,0
Соединение 84. 3-{6-[(3-Фенил)проп-2-ин-1-ил]окси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота.
Rt 1,37 мин (Система B), [M+H]+ 392,1
Соединение 85. 3-[6-(2,3-Дигидро-1-бензофуран-3-илокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановая кислота.
Rt 1,95 мин (Система B), [M+H]+ 396,1
Соединение 86. 3-(6-{[(2E)-3-(2,6-дихлорфенил)проп-2-ен-1-ил]окси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропановая кислота.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,48-7,52 (м, 2H), 7,32 (т, J=8,1 Гц, 1H), 7,10 (д, J=8,1 Гц, 1H), 6,72-6,60 (м, 1H), 6,53-6,46 (м, 2H), 6,31-6,39 (м, 1H), 4,75 (дд, J=5,1 и 2,0 Гц, 2H), 4,37 (с, 2H), 2,87-2,95 (м, 2H), 2,64-2,71 (м, 2H), 2,40-2,46 (м, 2H), 2,12-2,22 (м, 2H), 1,78-1,88 (м, 2H), 1,59-1,67 (м, 2H). Rt 1,51 мин (Система B), [M+H]+ 462,1.
Соединение 87. 3-(6-{[(2E)-3-фенилпроп-2-ен-1-ил]окси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропановая кислота.
Rt 1,37 мин (Система B), [M+H]+ 394,1
Соединение 88. 3-{6-[(7-Хлор-2,3-дигидро-1H-инден-1-ил)окси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота.
Rt 1,37 мин (Система B), [M+H]+ 428,0
Соединение 89. 3-(6-{[(3-(4-Хлорфенил)проп-2-ин-1-ил]окси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропановая кислота.
Rt 1,43 мин (Система B), [M+H]+ 426,0
Соединение 90. 3-(6-{[(2E)-3-(2-фторфенил)проп-2-ен-1-ил]окси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропановая кислота.
Rt 1,41 мин (Система B), [M+H]+ 412,1
Соединение 91. 3-{6-[(4-Бромтиофен-2-ил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота.
Rt 1,57 мин (Система B), [M+H]+ 452,0
Соединение 92. 3-{6-[(4-Бутилтиофен-2-ил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота.
Rt 1,67 мин (Система B), [M+H]+ 430,1
Соединение 93. 3-(6-{[4-(2-Фторфенил)тиофен-2-ил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота.
Rt 1,68 мин (Система B), [M+H]+ 468,0
Соединение 94. 3-{6-[(4-Фенилтиофен-2-ил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота.
Rt 1,99 мин (Система B), [M+H]+ 450,0
Соединение 95. 3-{6-[(4-Бром-3-метилтиофен-2-ил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,60 (уш.с, 1H), 7,68 (с, 1H), 7,08-7,13 (м, 1H), 6,45-6,51 (м, 2H), 5,18 (с, 2H), 4,36 (с, 2H), 2,81-2,89 (м, 2H), 2,61 (т, J=7,2 Гц, 2H), 2,39 (т, J=7,2 Гц, 2H), 2,17 (с, 3H), 2,02-2,12 (м, 2H), 1,74-1,86 (м, 2H), 1,56-1,64 (м, 2H). Rt 1,72 мин (Система B), [M+H]+ 467,9.
Соединение 96. 3-{6-[(4-Циклопропилметилтиофен-2-ил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,06-7,10 (м, 2H), 6,91 (д, J=1,2 Гц, 1H), 6,44-6,49 (м, 2H), 5,12 (с, 2H), 4,35 (с, 2H), 2,89-2,83 (м, 2H), 2,63 (т, J=7,0 Гц, 2H), 2,40 (т, J=7,0 Гц, 2H), 2,04-2,14 (м, 2H), 1,90 (дт, J=8,4, 5,0 Гц, 1H), 1,74-1,85 (м, 2H), 1,57-1,64 (м, 2H), 0,82-0,89 (м, 2H), 0,56-0,61 (м, 2H). Rt 1,69 мин (Система B), [M+H]+ 414,1.
Соединение 97. 3-{6-[(3-Метил-4-фенилтиофен-2-ил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота.
Rt 1,69 мин (Система B), [M+H]+ 464,0
Соединение 98. 3-{6-[(4-Бутил-3-метилтиофен-2-ил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота.
Rt 1,82 мин (Система B), [M+H]+ 444,1
Соединение 252. 3-(6-{[2-фтор-6-(пропан-2-ил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропановая кислота.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,37-7,46 (м, 1H), 7,23 (д, J=7,8 Гц, 1H), 7,03-7,14 (м, 2H), 6,47-6,54 (м, 2H), 5,05 (с, 2H), 4,37 (с, 2H), 3,12-3,22 (д, 1H), 2,82-2,91 (м, 2H), 2,63 (т, J=7,1 Гц, 2H), 2,40 (т, J=7,1 Гц, 2H), 2,10 (т, J=11,1 Гц, IH), 1,76-1,88 (м, 2H), 1,62 (д, J=13,1 Гц, 2H), 1,20 (д, J=6,8 Гц, 6H). Rt 1,45 мин (Система B), [M+H]+ 429,3.
Соединение 253. 3-{6-[(2-циклопропил-6-фторфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,29-7,37 (м, 1H), 7,02-7,14 (м, 2H), 6,85 (д, J=7,8 Гц, 1H), 6,50-6,56 (м, 2H), 5,16 (с, 2H), 4,37 (с, 2H), 2,86-2,92 (м, 2H), 2,64 (т, J=7,2 Гц, 2H), 2,41 (т, J=7,2 Гц, 2H), 2,00-2,18 (м, 3H), 1,77-1,88 (м, 2H), 1,62 (д, J=12,6 Гц, 2H), 0,89-0,98 (м, 2H), 0,66-0,72 (м, 2H). Rt 1,40 мин (Система B), [M+H]+ 426,2.
Соединение 254. 3-{6-[(2-этил-6-фторфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,33-7,42 (м, 1H), 7,04-7,17 (м, 3H), 6,48-6,56 (м, 2H), 5,02 (с, 2H), 4,37 (с, 2H), 2,87-2,97 (м, 2H), 2,62-2,74 (м, 5H), 2,45 (т, J=7,2 Гц, 2H), 2,11-2,23 (м, 2H), 1,80-1,92 (м, 2H), 1,64 (д, J=12,4 Гц, 2H), 1,16 (т, J=7,5 Гц, 3H). Rt 1,41 мин (Система B), [M+H]+ 414,3.
Соединение 255. 3-(6-{[2-фтор-6-(трифторметил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропановая кислота.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,63-7,75 (м, 3H), 7,12 (д, J=8,0 Гц, 1H), 6,47-6,53 (м, 2H), 5,09 (с, 2H), 4,37 (с, 2H), 2,86 (д, J=11,7 Гц, 2H), 2,62 (т, J=7,2 Гц, 2H), 2,40 (т, J=7,2 Гц, 2H), 2,04-2,13 (м, 2H), 1,77-1,86 (м, 2H), 1,62 (д, J=13,1 Гц, 2H). Rt 1,50 мин (Система B), [M+H]+ 454,2.
Соединение 256. 3-{6-[(4-хлор-2,6-дифторфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,43-7,49 (м, 2H), 7,07-7,12 (м, 1H), 6,47 (с, 2H), 5,01 (с, 2H), 4,34 (с, 2H), 2,73-2,79 (м, 2H), 2,40-2,47 (м, 2H), 1,85-1,98 (м, 4H), 1,74-1,84 (м, 2H), 1,51-1,58 (м, 2H). Rt 1,36 мин (Система B), [M+H]+ 439,2.
Соединение 257. 3-{6-[1-(2,6-дихлорфенил)этокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота.
1Н ЯМР (400 МГц, ДМСО-d6) δ 7,45 (д, J=8,1 Гц, 2H), 7,28-7,34 (м, 1H), 7,02 (д, J=8,1 Гц, 1H), 6,29 (дд, J=8,1, 2,1 Гц, 1H), 6,21 (д, J=2,1 Гц, 1H), 5,93 (кв., J=6,6 Гц, 1H), 4,30 (с, 2H), 2,81 (д, J=11,9 Гц, 2H), 2,57 (т, J=7,2 Гц, 2H), 2,37 (т, J=7,2 Гц, 2H), 2,02 (т, J=11,2 Гц, 2H), 1,69-1,78 (м, 2H), 1,67 (д, J=6,6 Гц, 3H), 1,55 (д, J=11,9 Гц, 2H). Rt 1,41 мин (Система B), [M+H]+ 450,1.
Соединение 258. 3-{6-[(2,6-диэтилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота.
1Н ЯМР (400 МГц, ДМСО-d6) δ 7,22-7,27 (м, 1H), 7,07-7,15 (м, 3H), 6,49-6,55 (м, 2H), 4,96 (с, 2H), 4,37 (с, 2H), 2,85 (д, J=11,7 Гц, 2H), 2,56-2,69 (м, 6H), 2,36 (т, J=7,0 Гц, 2H), 2,01-2,10 (м, 2H), 1,77-1,86 (м, 2H), 1,62 (д, J=12,9 Гц, 2H), 1,14 (т, J=7,5 Гц, 6H). Rt 1,47 мин (Система B), [M+H]+ 424,2.
Соединение 259. 3-(6-{[2-(пропан-2-ил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропановая кислота.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,30-7,40 (м, 3H), 7,15-7,22 (м, 1H), 7,08 (д, J=8,0 Гц, 1H), 6,47-6,54 (м, 2H), 5,04 (с, 2H), 4,39 (с, 2H), 3,10-3,19 (м, 1H), 3,02 (д, J=11,9 Гц, 2H), 2,81 (т, J=7,0 Гц, 2H), 2,54 (т, J=7,0 Гц, 2H), 2,32-2,43 (м, 2H), 1,89-2,00 (м, 2H), 1,68 (д, J=13,3 Гц, 2H), 1,16-1,22 (м, 6H). Rt 1,45 мин (Система B), [M+H]+ 410,7.
Соединение 260. 3-(6-{[2-этил-6-(трифторметил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропановая кислота.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,61-7,67 (м, 2H), 7,53-7,60 (м, 1H), 7,12 (д, J=7,8 Гц, 1H), 6,48-6,55 (м, 2H), 5,04 (с, 2H), 4,35 (с, 2H), 2,79 (д, J=11,2 Гц, 2H), 2,73 (кв., J=7,5 Гц, 2H), 2,45-2,5 (м, 2H), 2,05 (т, J=7,6 Гц, 2H), 1,87-1,97 (м, 2H), 1,77-1,86 (м, 2H), 1,58 (д, J=12,1 Гц, 2H), 1,17-1,23 (м, 3H). Rt 1,47 мин (Система B), [M+H]+ 464,2.
Соединение 261. 3-(6-{[2-Хлор-6-(дифторметокси)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропановая кислота.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,43-7,56 (м, 2H), 7,27-7,32 (м, 1H), 7,06-7,13 (м, 1H), 6,49-6,57 (м, 2H), 5,06 (с, 2H), 4,40 (с, 2H), 3,04 (д, J=11,7 Гц, 2H), 2,83 (т, J=7,1 Гц, 2H), 2,56 (т, J=7,1 Гц, 2H), 2,40 (м, 3H), 1,89-2,02 (м, 2H), 1,69 (д, J=13,5 Гц, 2H).
Соединение 262. 3-{6-[(2-Фтор-6-метоксифенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,37-7,47 (м, 1H), 7,09 (д, J=7,9 Гц, 1H), 6,93 (д, J=8,4 Гц, 1H), 6,85 (т, J=8,8 Гц, 1H), 6,42-6,52 (м, 2H), 4,95 (с, 2H), 4,35 (с, 2H), 3,83 (с, 3H), 2,86 (д, J=11,7 Гц, 2H), 2,61 (т, J=7,1 Гц, 2H), 2,38 (т, J=7,1 Гц, 2H), 2,08 (т, J=11,2 Гц, 2H), 1,81 (дт, J=12,8, 3,5 Гц, 2H), 1,61 (д, J=12,8 Гц, 2H). Rt 1,27 мин (Система B), [M+H]+ 416,7.
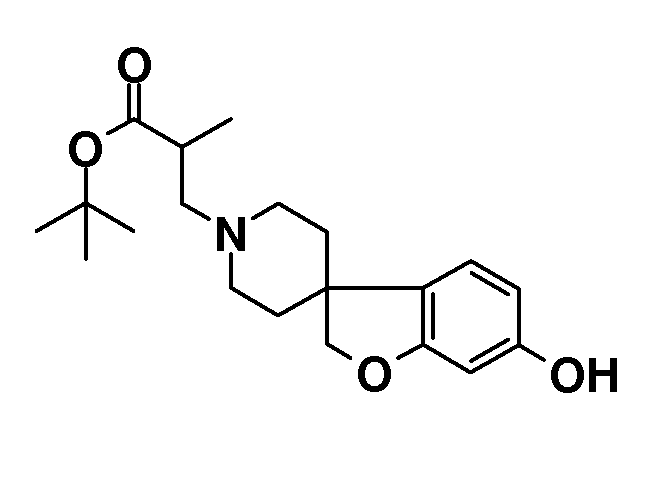
Трет-бутил 3-{6-гидрокси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метил-пропаноат. К раствору 2H-спиро[1-бензофуран-3,4'-пиперидин]-6-ола (565 мг; 2,76 ммоль) в N,N-диметилформамиде (5,00 мл) добавляли трет-бутилметакрилат (0,9 мл; 5,52 ммоль) и DBU (1,24 мл; 8,28 ммоль). Полученную смесь нагревали при 140°C в герметично закрытой колбе в течение ночи. После охлаждения до комнатной температуры реакционную смесь распределяли между 5% водным раствором NaHCO3 и EtOAc. Слои разделяли и органический слой сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1) с получением продукта (0,45 г, 47%).
1Н ЯМР (400 МГц, CDCl3-d) δ м.д. 6,91 (д, J=8,0 Гц, 1H), 6,29-6,36 (м, 2H), 5,80 (уш.с, 1H), 4,34 (с, 2H), 2,88-2,96 (м, 1H), 2,75-2,84 (м, 1H), 2,51-2,66 (м, 2H), 2,26-2,35 (м, 1H), 1,96-2,10 (м, 2H), 1,83-1,93 (м, 2H), 1,65-1,69 (м, 2H), 1,48 (с, 9H), 1,11 (д, J=8,5 Гц, 3H). Rt 1,13 мин (Система B), [M+H]+ 348,1.
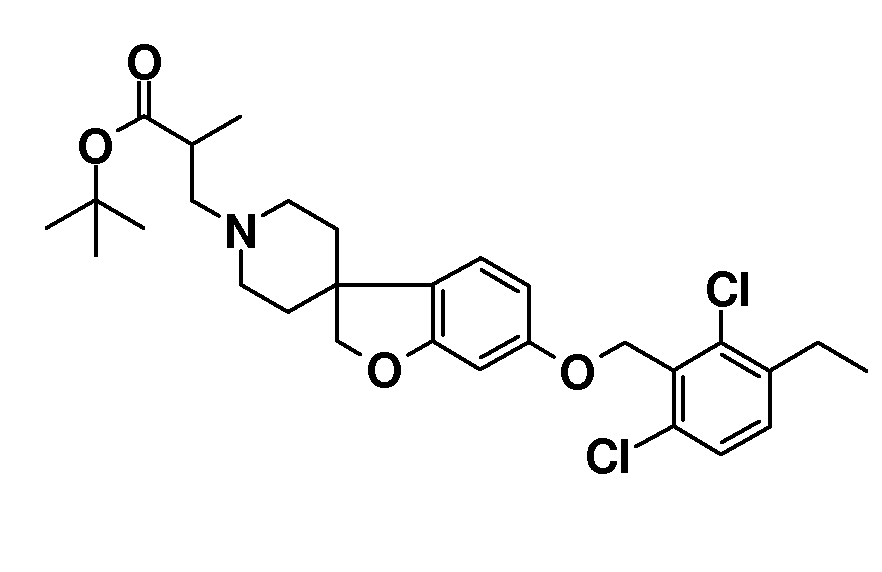
Трет-бутил 3-{6-[(2,6-дихлор-3-этилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропаноат. К раствору (2,6-дихлор-3-этилфенил)метанола (324 мг; 1,58 ммоль) и трет-бутил 3-{6-гидрокси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропаноата (0,44 г, 1,27 ммоль) в дихлорметане (20 мл) добавляли трифенилфосфин (415 мг; 1,58 ммоль), затем через 30 минут добавляли DIAD (0,31 мл; 1,58 ммоль). Затем полученную смесь перемешивали при комнатной температуре в течение ночи и концентрировали в вакууме.
Затем реакционную смесь распределяли между 5% водным раствором NaHCO3 и EtOAc. Слои разделяли и органический слой сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1) с получением продукта (670 мг, 98%). Rt 1,62 мин (Система B), [M+H]+ 534,0.
Следующие соединения были получены аналогичным способом:
Трет-бутил 3-{6-[(2,6-дихлор-3-этилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропаноат.
Трет-бутил 3-{6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропаноат.
Трет-бутил 3-{6-[(2-хлор-6-этилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропаноат.
Трет-бутил 2-метил-3-{6-[(2,4,6-трихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[(2,6-дихлор-4-метилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропаноат.
Трет-бутил 3-{6-[(2,6-дихлор-3-метоксифенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропаноат.
Трет-бутил 3-{6-[(4-бутил-2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропаноат.
Трет-бутил 3-{6-[(2-хлор-6-циклопропилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропаноат.
Трет-бутил 3-(6-{[2-хлор-6-(2-метилпропил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)-2-метилпропаноат.
Трет-бутил 3-(6-{[2-хлор-6-(2-трифторметокси)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)-2-метилпропаноат.
Трет-бутил 3-{6-[(2-хлор-5-этилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропаноат.
Трет-бутил 3-{6-[(2-этил-6-фторфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропаноат. Необходимый [2-этил-6-фторфенил]-метанол получали аналогично последовательности, описанной для соединения 273.
Трет-бутил 3-{6-[(2-циклопропил-6-фторфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропаноат.
Трет-бутил 3-(6-{[2-фтор-6-(пропан-2-ил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)-2-метилпропаноат.
Трет-бутил 2-метил-3-(6-{[2-(трифторметил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)-2-метилпропаноат.
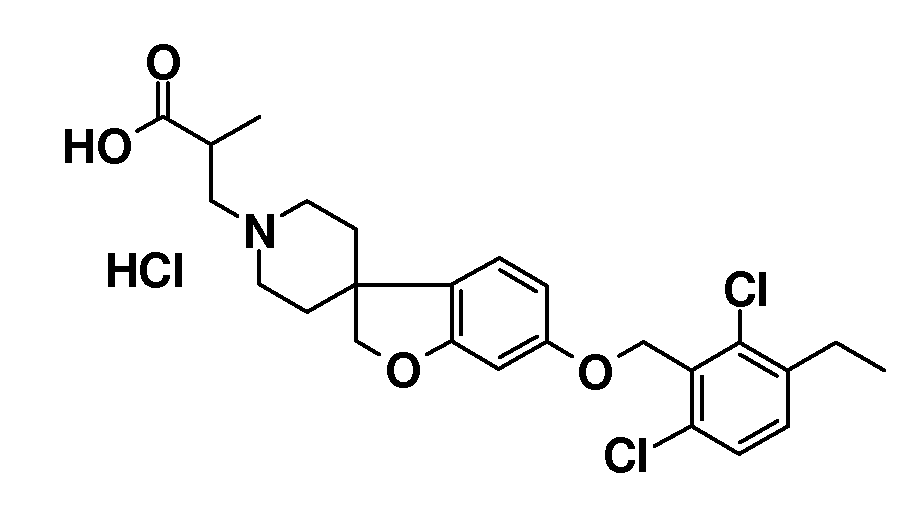
Соединение 99. Гидрохлорид 3-{6-[(2,6-дихлор-3-этилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропановой кислоты. Трет-бутил 3-{6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропаноат (0,62 г, 1,16 ммоль) растворяли в 4M растворе HCl в 1,4-диоксане (10 мл; 4 моль/л; 40 ммоль) и перемешивали в течение 48 часов при комнатной температуре. Затем растворитель удаляли в вакууме и остаток обрабатывали iPr2O, осадок собирали фильтрованием и сушили в течение ночи при пониженном давлении с получением продукта (0,44 г, 66%).
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,90 (уш.с, 1H), 10,00 (уш.с, 1H), 7,50 (д, J=8,4 Гц, 1H), 7,44 (д, J=8,4 Гц, 1H), 6,96-7,04 (м, 1H), 6,56-6,62 (м, 2H), 5,19 (с, 2H), 4,48 (уш.с, 2H), 3,30-3,55 (м, 4H), 2,94-3,18 (м, 3H), 2,75 (кв., J=7,4 Гц, 2H), 2,17-2,37 (м, 2H), 1,80-1,91 (м, 2H), 1,24 (д, J=7,0 Гц, 3H), 1,18 (т, J=7,4 Гц, 3H). Rt 1,60 мин (Система B), [M+H]+ 478,0.
Следующие соединения были получены аналогичным способом:
Соединение 100. Гидрохлорид 3-{6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропановой кислоты.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,90 (уш.с, 1H), 9,80 (уш.с, 1H), 7,54-7,58 (м, 2H), 7,46 (дд, J=8,1 и 6,2 Гц, 1H), 7,10 (уш.с, 1H), 6,58-6,62 (м, 2H), 5,17 (с, 2H), 4,48 (уш.с, 2H), 3,44-3,53 (м, 4H), 2,95-3,20 (м, 3H), 2,10-2,29 (м, 2H), 1,80-1,91 (м, 2H), 1,24 (д, J=7,8 Гц, 3H). Rt 1,42 мин (Система B), [M+H]+ 450,0.
Соединение 101. Гидрохлорид 3-{6-[(2-хлор-6-этилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропановой кислоты.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,90 (уш.с, 1H), 10,0 (уш.с, 1H), 7,32-7,39 (м, 2H), 7,25-7,29 (м, 1H), 6,96-7,04 (м, 1H), 6,56-6,62 (м, 2H), 5,10 (с, 2H), 4,48 (уш.с, 2H), 3,30-3,54 (м, 4H), 2,95-3,17 (м, 3H), 2,71 (кв., J=7,4 Гц, 2H), 2,17-2,37 (м, 2H), 1,80-1,91 (м, 2H), 1,24 (д, J=7,0 Гц, 3H), 1,16 (т, J=7,4 Гц, 3H). Rt 1,49 мин (Система B), [M+H]+ 444,0.
Соединение 102. Гидрохлорид 2-метил-3-{6-[(2,4,6-трихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,90 (уш.с, 1H), 10,10 (уш.с, 1H), 7,80 (с, 2H), 6,96-7,06 (м, 1H), 6,56-6,62 (м, 2H), 5,14 (с, 2H), 4,48 (уш.с, 2H), 2,98-3,55 (м, 7H), 2,20-2,37 (м, 2H), 1,80-1,91 (м, 2H), 1,24 (д, J=7 Гц, 3H). Rt 1,55 мин (Система B), [M+H]+ 485,9.
Соединение 103. Гидрохлорид 3-{6-[(2,6-дихлор-4-метилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропановой кислоты.
Rt 1,50 мин (Система B), [M+H]+ 463,9
Соединение 104. Гидрохлорид 3-{6-[(2,6-дихлор-3-метоксифенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропановой кислоты.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,90 (уш.с, 1H), 10,10 (уш.с, 1H), 7,52 (д, J=9,1 Гц, 1, 1H), 7,25 (д, J=9,1 Гц, 1H), 6,95-7,09 (м, 1H), 6,56-6,62 (м, 2H), 5,17 (с, 2H), 4,48 (уш.с, 2H), 3,90 (с, 3H), 3,35-3,54 (м, 3H), 2,94-3,19 (м, 4H), 2,14-2,32 (м, 2H), 1,80-1,90 (м, 2H), 1,24 (т, J=7,0 Гц, 3H). Rt 1,41 мин (Система B), [M+H]+ 480,0.
Соединение 105. Гидрохлорид 3-{6-[(4-бутил-2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропановой кислоты.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,90 (уш.с, 1H), 9,80 (уш.с, 1H), 7,41 (с, 2H), 6,95-7,05 (м, 1H), 6,56-6,62 (м, 2H), 5,12 (с, 2H), 4,48 (уш.с, 2H), 3,35-3,54 (м, 3H), 2,98-3,19 (м, 4H), 2,62 (т, J=7,7 Гц, 2H), 2,12-2,31 (м, 2H), 1,80-1,90 (м, 2H), 1,50-1,62 (м, 2H), 1,20-1,35 (м, 5H), 0,90 (т, J=7,6 Гц, 3H). Rt 1,76 мин (Система B), [M+H]+ 506,0.
Соединение 106. Гидрохлорид 3-(6-{[2-хлор-6-(2-метилпропил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)-2-метилпропановой кислоты.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,90 (уш.с, 1H), 9,90 (уш.с, 1H), 7,31-7,39 (м, 2H), 7,25-7,20 (м, 1H), 6,97-7,06 (м, 1H), 6,56-6,62 (м, 2H), 5,08 (с, 2H), 4,47 (уш.с, 2H), 3,24-3,58 (м, 3H), 2,88-3,18 (м, 4H), 2,58 (д, J=7,6 Гц, 2H), 2,11-2,38 (м, 2H), 1,80-1,91 (м, 3H), 1,25 (д, J=7,6 Гц, 3H), 0,85 (д, J=7,6 Гц, 6H). Rt 1,60 мин (Система B), [M+H]+ 472,1.
Соединение 107. Гидрохлорид 3-(6-{[2-хлор-6-(2-трифторметокси)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)-2-метилпропановой кислоты.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,9 (уш.с, 1H), 9,8 (уш.с, 1H), 7,58-7,65 (м, 2H), 7,47-7,52 (м, 1H), 7,06-6,97 (м, 1H), 6,56-6,62 (м, 2H), 5,10 (с, 2H), 4,47 (уш.с, 2H), 3,28-3,54 (м, 4H), 2,95-3,18 (м, 3H), 2,11-2,25 (м, 2H), 1,80-1,91 (м, 2H), 1,22 (д, J=7,6 Гц, 3H).
Соединение 108. Гидрохлорид 3-{6-[(2-хлор-5-этилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропановой кислоты.
Rt 1,54 мин (Система B), [M+H]+ 444,1.
Соединение 263. Гидрохлорид 3-{6-[(2-этил-6-фторфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропановой кислоты. Необходимый [2-этил-6-фторфенил]-метанол получали аналогично последовательности, описанной для соединения 273.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,88 (уш. с, 1H), 10,29 (уш.с, 1H), 7,34-7,42 (м, 1H), 6,98-7,16 (м, 3H), 6,53-6,60 (м, 2H), 5,04 (с, 2H), 4,47 (уш.с, 2H), 3,29-3,54 (м, 4H), 2,95-3,22 (м, 3H), 2,70 (кв., J=7,5 Гц, 2H), 2,24-2,38 (м, 2H), 1,80-1,89 (м, 2H), 1,26 (д, J=7,1 Гц, 3H), 1,17 (т, J=7,5 Гц, 3H). Rt 1,44 мин (Система В), [M+H]+ 428,8.
Соединение 264. Гидрохлорид 3-{6-[(2-циклопропил-6-фторфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропановой кислоты.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,92 (уш.с, 1H), 10,07 (уш.с, 1H), 7,30-7,37 (м, 1H), 6,95-7,09 (м, 2H), 6,86 (д, J=7,8 Гц, 1H), 6,55-6,62 (м, 2H), 5,17 (с, 2H), 4,47 (уш.с, 2H), 3,39-3,49 (м, 4H), 2,98-3,18 (м, 3H), 2,18-2,34 (м, 2H), 2,00-2,09 (м, 1H), 1,78-1,88 (м, 2H), 1,25 (д, J=7,1 Гц, 3H), 0,90-0,98 (м, 2H), 0,64-0,73 (м, 2H). Rt 1,42 мин (Система В), [M+H]+ 440,7.
Соединение 265. Гидрохлорид 3-(6-{[2-фтор-6-(пропан-2-ил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)-2-метилпропановой кислоты.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,91 (уш.с, 1H), 10,03 (уш.с, 1H), 7,38-7,46 (м, 1H), 7,24 (д, J=7,8 Гц, 1H), 6,97-7,10 (м, 2H), 6,53-6,60 (м, 2H), 5,06 (с, 2H), 4,47 (уш.с, 2H), 3,31-3,48 (м, 4H), 2,96-3,23 (м, 4H), 2,18-2,35 (м, 2H), 1,80-1,91 (м, 2H), 1,24 (д, J=7,1 Гц, 3H), 1,20 (д, J=6,8 Гц, 6H). Rt 1,49 мин (Система B), [M+H]+ 442,7.
Соединение 266. Гидрохлорид 2-метил-3-(6-{[2-(трифторметил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропановой кислоты.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,91 (уш.с, 1H), 10,23 (уш.с, 1H), 7,80 (д, J=7,8 Гц, 1H), 7,69-7,76 (м, 2H), 7,56-7,62 (м, 1H), 7,00 (уш.с, 1H), 6,54 (д, J=8,1 Гц, 1H), 6,49 (д, J=2,0 Гц, 1H), 5,19 (с, 2H), 4,47 (уш.с, 2H), 3,31-3,54 (м, 4H), 2,96-3,17 (м, 3H), 2,21-2,40 (м, 2H), 1,77-1,89 (м, 2H), 1,25 (д, J=7,1 Гц, 3H). Rt 1,43 мин (Система В), [M+H]+ 450,6.
Соединение 109. 3-{6-[(2-Хлор-6-циклопропилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропановая кислота 2,2,2-трифторуксусная кислота. Трет-бутил 3-{6-[(2-хлор-6-циклопропилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропаноат (350 мг; 0,68 ммоль) растворяли в дихлорметане (10 мл). Добавляли трифторуксусную кислоту (2 мл; 25,9 ммоль) и реакционную смесь перемешивали в течение 18 часов при комнатной температуре. Затем растворитель удаляли в вакууме и остаток обрабатывали iPr2O, осадок собирали фильтрованием и сушили в течение ночи при пониженном давлении с получением продукта (0,15 г, 35,8%).
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,90 (уш.с, 1H), 9,50 (уш.с, 1H), 7,29-7,37 (м, 2H), 7,01-7,20 (м, 2H), 6,56-6,62 (м, 2H), 5,26 (с, 2H), 4,47 (уш.с, 2H), 3,24-3,54 (м, 3H), 2,88-3,18 (м, 4H), 2,01-2,18 (м, 3H), 1,80-1,91 (м, 2H), 1,20 (д, J=7,6 Гц, 3H), 0,88-0,96 (м, 2H), 0,73-0,65 (м, 2H). Rt 1,50 мин (Система B), [M+H]+ 456,0.
Трет-бутил 2-{6-гидрокси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}ацетат. К раствору 2H-спиро[1-бензофуран-3,4'-пиперидин]-6-ола (1,05 г; 5,12 ммоль) в CH3CN (15 мл) и N-этилдиизопропиламине (2,19 мл) добавляли трет-бутилбромацетат (0,79 мл; 5,37 ммоль). Полученную смесь нагревали при 65°C в течение ночи.
После охлаждения до комнатной температуры реакционную смесь распределяли между 5% водным раствором NaHCO3 и EtOAc. Слои разделяли и органический слой сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали колоночной хроматографией (SiO2, Et2O) с получением продукта (1,45 г, 88,7%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 6,94 (д, J=7,9 Гц, 1H), 6,34 (дд, 7,9 и 2,2 Гц, 1H), 6,31 (д, J=2,2 Гц, 1H), 5,05-5,28 (м, 1H), 4,36 (с, 2H), 3,17 (с, 2H), 2,92-3,01 (м, 2H), 2,22-2,32 (м, 2H), 1,97-2,07 (м, 2H), 1,62-1,74 (м, 2H), 1,48 (с, 9H). Rt 0,95 мин (Система B), [M+H]+ 320,1.
Трет-бутил 2-{6-[(2,4,6-трихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}ацетат. К раствору (2,4,6-трихлорфенил)метанола (248 мг; 1,17 ммоль) и трет-бутил 3-{6-гидрокси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}ацетата (300 мг; 0,94 ммоль) в дихлорметане (20 мл) добавляли трифенилфосфин (308 мг; 1,17 ммоль), затем через 30 минут добавляли DIAD (0,23 мл; 1,17 ммоль). Затем полученную смесь перемешивали при комнатной температуре в течение ночи и концентрировали в вакууме. Затем реакционную смесь распределяли между 5% водным раствором NaHCO3 и EtOAc. Слои разделяли и органический слой сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1) с получением продукта (410 мг, 85%). Rt 1,63 мин (Система B), [M+H]+ 514,0.
Следующие соединения были получены аналогичным способом:
Трет-бутил 2-{6-[(2-хлор-6-этилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}ацетат.
Трет-бутил 2-{6-[(2-хлор-6-циклопропилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}ацетат.
Трет-бутил 2-{6-[(4-бутил-2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}ацетат.
Трет-бутил 2-{6-[(2-хлор-5-этилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}ацетат.
Трет-бутил 2-(6-{[2-хлор-6-(пропан-2-ил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)ацетат.
Трет-бутил 2-{6-[(2,6-дихлор-3-этилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}ацетат.
Трет-бутил 2-(6-{[2-хлор-6-(трифторметокси)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)ацетат.
Трет-бутил 2-{6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}ацетат.
Трет-бутил 2-{6-[(2,6-дихлор-3-метоксифенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}ацетат.
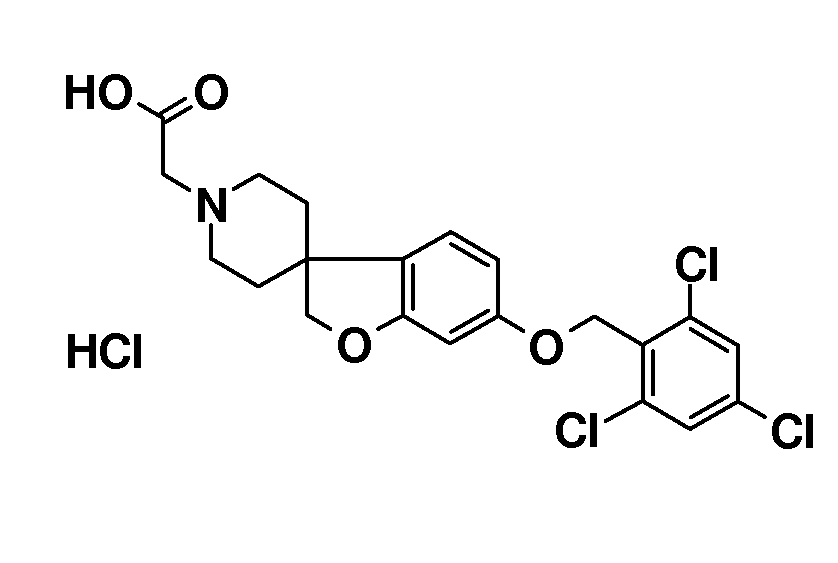
Соединение 110. Гидрохлорид 2-{6-[(2,4,6-трихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}уксусной кислоты. Трет-бутил 2-{6-[(2,4,6-трихлор-фенил)метокси-]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}ацетат (0,41 г, 0,8 ммоль) растворяли в 4M растворе HCl в 1,4-диоксане (20 мл; 4 моль/л; 80 ммоль) и перемешивали в течение 48 часов при комнатной температуре.
Затем растворитель удаляли в вакууме и остаток обрабатывали iPr2O, осадок собирали фильтрованием и сушили в течение ночи при пониженном давлении с получением продукта (0,29 г, 70%).
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 13,90 (уш.с, 1H), 10,30 (уш.с, 1H), 7,79 (с, 2H), 7,03-7,19 (м, 1H), 6,56-6,62 (м, 2H), 5,15 (с, 2H), 4,47 (уш.с, 2H), 4,17 (уш.с, 2H), 3,46-3,56 (м, 2H), 3,15-3,28 (м, 2H), 2,13-2,28 (м, 2H), 1,83-1,91 (м, 2H). Rt 1,73 мин (Система В), [M+H]+ 457,9.
Следующие соединения были получены аналогичным способом:
Соединение 111. Гидрохлорид 2-{6-[(2-хлор-6-этилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}уксусной кислоты.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 13,9 (уш.с, 1H), 10,90 (уш.с, 1H), 7,34-7,39 (м, 2H), 7,25-7,31 (м, 1H), 7,17-7,20 (м, 1H), 6,56-6,62 (м, 2H), 5,10 (с, 2H), 4,47 (уш.с, 2H), 4,17 (уш.с, 2H), 3,46-3,58 (м, 2H), 3,15-3,28 (м, 2H), 2,71 (кв., J=7,4 Гц, 2H), 2,13-2,28 (м, 2H), 1,83-1,91 (м, 2H), 1,16 (т, J=7,4 Гц, 3H). Rt 1,65 5 мин (Система B), [M+H]+ 416,0.
Соединение 112. Гидрохлорид 2-{6-[(2-хлор-6-циклопропилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}уксусной кислоты.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 13,80 (уш.с, 1H), 10,40 (уш.с, 1H), 7,28-7,38 (м, 2H), 7,08-7,23 (м, 1H), 7,04 (дд, J=7,0 и 2,0 Гц, 1H), 6,56-6,62 (м, 2H), 5,27 (с, 2H), 4,47 (уш.с, 2H), 4,13 (уш.с, 2H), 3,06-3,56 (м, 4H), 2,13-2,28 (м, 2H), 2,00-2,10 (м, 1H), 1,83-1,91 (м, 2H), 0,95-0,87 (м, 2H), 0,73-0,65 (м, 2H). Rt 1,67 мин (Система B), [M+H]+ 428,0.
Соединение 113. Гидрохлорид 2-{6-[(4-бутил-2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}уксусной кислоты.
Rt 1,99 мин (Система B), [M+H]+ 478,0
Соединение 114. Гидрохлорид 2-{6-[(2-хлор-5-этилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}уксусной кислоты.
Rt 1,71 мин (Система B), [M+H]+ 416,1
Соединение 115. Гидрохлорид 2-(6-{[2-хлор-6-(пропан-2-ил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)уксусной кислоты.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 14,0 (уш.с, 1H), 10,30 (уш.с, 1H), 7,31-7,42 (м, 3H), 7,18-7,05 (м, 1H), 6,56-6,62 (м, 2H), 5,15 (с, 2H), 4,45 (уш.с, 2H), 4,15 (уш.с, 2H), 3,45-3,56 (м, 2H), 3,12-3,27 (м, 3H), 2,15-2,27 (м, 2H), 1,80-1,91 (м, 2H), 1,20 (д, J=7,2 Гц, 6H). Rt 1,72 мин (Система B), [M+H]+ 430,1.
Соединение 116. Гидрохлорид 2-{6-[(2,6-дихлор-3-этилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}уксусной кислоты.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 13,9 (уш.с, 1H), 10,40 (уш.с, 1H), 7,50 (д, J=8,4 Гц, 1H), 7,45 (д, J=8,4 Гц, 1H), 7,19-7,03 (м, 1H), 6,56-6,62 (м, 2H), 5,20 (с, 2H), 4,47 (уш.с, 2H), 4,17 (уш.с, 2H), 3,08-3,56 (м, 4H), 2,75 (кв., J=7,2 Гц, 2H), 2,13-2,28 (м, 2H), 1,83-1,91 (м, 2Н), 1,18 (т, J=7,2 Гц, 3H). Rt 1,75 мин (Система B), [M+H]+ 450,1.
Соединение 117. Гидрохлорид 2-(6-{[2-хлор-6-(трифторметокси)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)уксусной кислоты.
Rt 1,64 мин (Система B), [M+H]+ 472,0.
Соединение 118. Гидрохлорид 2-{6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}уксусной кислоты.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 14,10 (уш.с, 1H), 10,10 (уш.с, 1H), 7,54-7,60 (м, 2H), 7,46 (дд, J=8,1 и 6,2 Гц, 1H), 7,08 (уш.с, 1H), 6,58-6,62 (м, 2H), 5,18 (с, 2H), 4,48 (уш.с, 2H), 4,18 (уш.с, 2H), 3,48-3,55 (м, 2H), 3,15-3,30 (м, 2H), 2,13-2,30 (м, 2H), 1,82-1,92 (м, 2H). Rt 2,02 мин (Система B), [M+H]+ 422,0.
Соединение 267. Гидрохлорид 2-{6-[(2,6-дихлор-3-метоксифенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}уксусной кислоты.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 13,90 (уш.с, 1H), 10,20 (уш.с, 1H), 7,52 (д, J=9,0 Гц, 1H), 7,26 (д, J=9,0 Гц, 1H), 6,55-6,62 (м, 2H), 5,17 (с, 2H), 4,47 (уш.с, 1H), 4,17 (уш.с, 1H), 3,90 (с, 3H), 3,12-3,60 (м, 6H), 2,10-2,32 (м, 2H), 1,82-1,93 (м, 2H). Rt 1,53 мин (Система B), [M+H]+ 452,1.
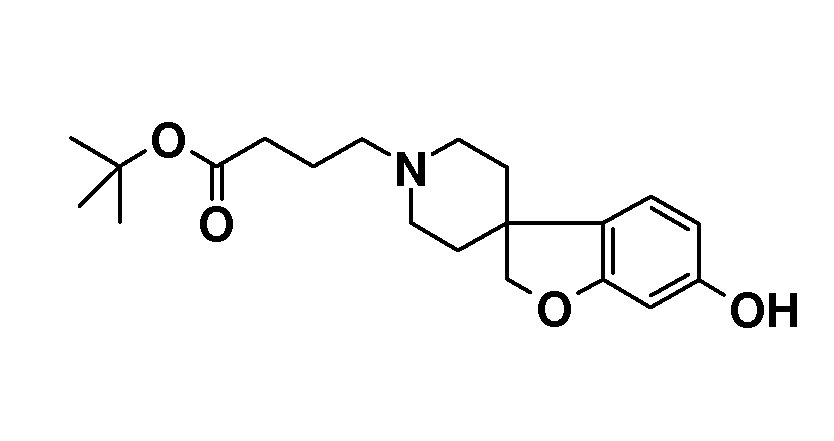
Трет-бутил 4-{6-гидрокси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутаноат. К суспензии 2H-спиро[1-бензофуран-3,4'-пиперидин]-6-ола (2 г; 9,74 ммоль) в CH3CN (50 мл) добавляли карбонат калия (4,04 г; 29,23 ммоль) с последующим добавлением трет-бутилового эфира 4-броммасляной кислоты (2,39 г; 10,72 ммоль) (получен в соответствии с Tetrahedron, 1992, 48 (42), 9277). Полученную смесь нагревали при 65°C в течение ночи.
После охлаждения до комнатной температуры реакционную смесь распределяли между 5% водным раствором NaHCO3 и EtOAc. Слои разделяли и органический слой сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали колоночной хроматографией (SiO2, Et2O) с получением продукта (2,95 г, 75%).
1Н ЯМР (400 МГц, CDCl3-d) δ м.д. 6,93 (д, J=8,0 Гц, 1H), 6,33 (дд, J=8,0, 2,1 Гц, 1H), 6,30 (д, J=2,1 Гц, 1H), 5,80 (уш.с, 1H), 4,35 (с, 2H), 2,89-2,94 (м, 2H), 2,35-2,41 (м, 2H), 2,26 (т, J=7,4 Гц, 2H), 1,89-2,07 (м, 4H), 1,77-1,86 (м, 2H), 1,67-1,74 (м, 2H), 1,45 (с, 9H). Rt 1,08 мин (Система B), [M+H]+ 348,1.
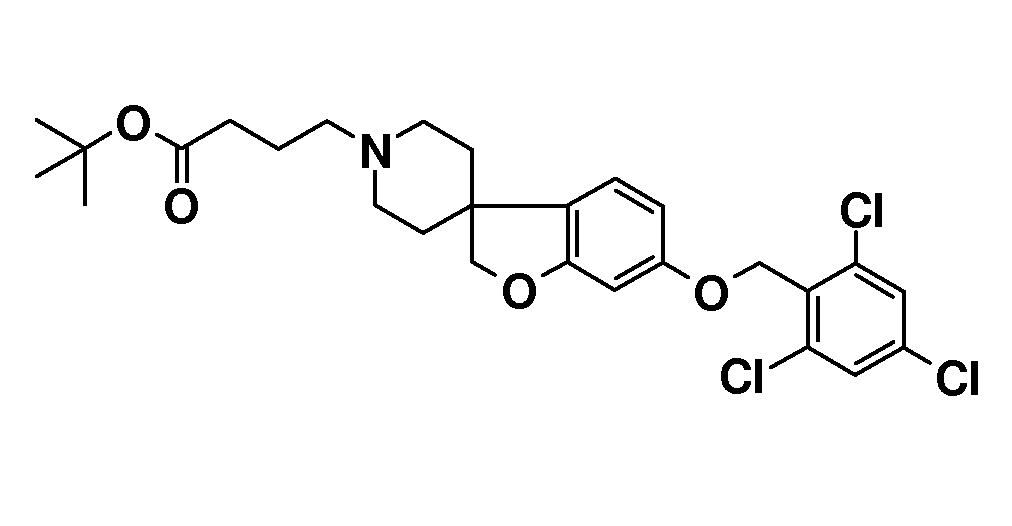
Трет-бутил 4-{6-[(2,4,6-трихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутаноат. К раствору (2,4,6-трихлорфенил)метанола (164,5 мг; 0,78 ммоль) и трет-бутил 4-{6-гидрокси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутаноата (250 мг; 0,62 ммоль) в дихлорметане (20 мл) добавляли трифенилфосфин (204 мг; 0,78 ммоль), затем через 30 минут добавляли DIAD (0,15 мл; 0,78 ммоль). Затем полученную смесь перемешивали при комнатной температуре в течение ночи и концентрировали в вакууме. Затем реакционную смесь распределяли между 5% водным раствором NaHCO3 и EtOAc. Слои разделяли и органический слой сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:2) с получением продукта (174 мг, 52%). Rt 1,59 мин (Система B), [M+H]+ 542,0.
Следующие соединения были получены аналогичным способом:
Трет-бутил 4-{6-[(2-хлор-6-этилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутаноат.
Трет-бутил 4-{6-[(2-хлор-6-циклопропилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутаноат.
Трет-бутил 4-{6-[(2,6-дихлор-3-этилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутаноат.
Трет-бутил 4-{6-[(2-хлор-5-этилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутаноат.
Трет-бутил 4-{6-[(2,6-дихлор-3-метоксифенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутаноат.
Трет-бутил 4-{6-[(4-бутил-2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутаноат.
Трет-бутил 4-(6-{[2-хлор-6-(трифторметокси)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)}бутаноат.
Трет-бутил 4-(6-{[2-хлор-6-(пропан-2-ил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)бутаноат.
Трет-бутил 4-{6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутаноат.
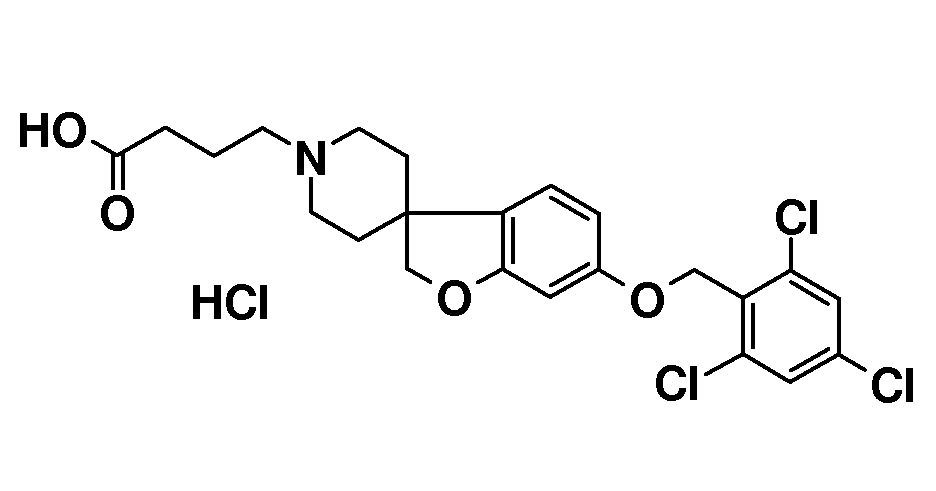
Соединение 119. Гидрохлорид 4-{6-[(2,4,6-трихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутановой кислоты. Трет-бутил 4-{6-[(2,4,6-трихлорфенил)метокси-]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутаноат (172 мг, 0,32 ммоль) растворяли в 4M растворе HCl в 1,4-диоксане (10 мл; 4 моль/л; 40 ммоль) и перемешивали в течение 48 часов при комнатной температуре. Затем растворитель удаляли в вакууме и остаток обрабатывали iPr2O, осадок собирали фильтрованием и сушили в течение ночи при пониженном давлении с получением продукта (144 мг, 82%).
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 14,10 (уш.с, 1H), 10,30 (уш.с, 1H), 7,54 (д, J=8,0 Гц, 2H), 7,33 (т, J=8,0 Гц, 1H), 7,00-7,25 (м, 5H), 4,50 (с, 2H), 4,19 (уш.с, 2H), 3,50-3,58 (м, 2H), 3,19-3,31 (м, 2H), 2,20-2,31 (м, 2H), 1,87-1,95 (м, 2H). Rt 1,46 мин (Система B), [M+H]+ 485,9.
Следующие соединения были получены аналогичным способом:
Соединение 120. Гидрохлорид 4-{6-[(2-хлор-6-этилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутановой кислоты.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,20 (уш.с, 1H), 10,30 (уш.с, 1H), 7,34-7,38 (м, 2H), 7,25-7,31 (м, 1H), 7,00 (д, J=8,1 Гц, 1H), 6,55-6,62 (м, 2H), 5,10 (с, 2H), 4,50 (с, 2H), 3,49 (м, 2H), 2,95-3,12 (м, 4H), 2,71 (кв., J=7,5 Гц, 2H), 2,37 (т, J=7,2 Гц, 2H), 2,20-2,30 (м, 2H), 1,81-2,00 (м, 4H), 1,16 (т, J=7,5 Гц, 3H). Rt 1,38 мин (Система B), [M+H]+ 444,0.
Соединение 268. 1'-(3-Карбоксипропил)-6-[(2-хлор-6-этилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ий-1'-олат. Гидрохлорид 4-{6-[(2-хлор-6-этилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутановой кислоты (210 мг; 0,38 ммоль) фильтровали через содержащую паратолуолсульфокислоту твердофазную экстракционную гильзу, промывая диоксаном и элюируя раствором 2н NH3/MeOH. Продукт концентрировали и растворяли в DCM (10 мл). Затем добавляли m-CPBA (95 мг; 0,38 ммоль) и полученную смесь перемешивали в течение ночи при комнатной температуре. Остаток (после выпаривания растворителя) очищали колоночной хроматографией (Inertsil ODS-3 (25×5), H2O:CH3CN 4:6 до чистого CH3CN) с получением продукта (40 мг; 22%).
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,56-7,65 (м, 1H), 7,48 (м, 1H), 7,28 (д, J=5,1 Гц, 1H), 7,16 (д, J=8,2 Гц, 1H), 6,51-6,63 (м, 2H), 5,10 (с, 2H), 4,48 (с, 2H), 3,63 (с, 2H), 3,35-3,56 (м, 4H), 2,71 (кв., J=7,5 Гц, 2H), 2,36-2,56 (м, 4H), 1,97-2,09 (м, 2H), 1,71 (д, J=13,8 Гц, 2H), 1,16 (т, J=7,5 Гц, 3H). Rt 1,41 мин (Система B), [M+H]+ 460,6.
Соединение 121. Гидрохлорид 4-{6-[(2-хлор-6-циклопропилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутановой кислоты.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,30 (уш.с, 1H), 10,30 (уш.с, 1H), 7,29-7,37 (м, 2H), 7,04 (дд, J=7,0, 2,0 Гц, 1H), 7,00 (м, 1H), 6,56-6,64 (м, 2H), 5,27 (с, 2H), 4,49 (уш.с, 2H), 3,48 (м, 2H), 3,04 (м, 4H), 2,37 (т, J=7,1 Гц, 2H), 2,20-2,30 (м, 2H), 2,06 (дт, J=8,4, 5,3 Гц, 1H), 1,90-2,00 (м, 2H), 1,80-1,90 (м, 2H), 0,89-0,96 (м, 2H), 0,66-0,73 (м, 2H). Rt 1,43 мин (Система B), [M+H]+ 456,0.
Соединение 122. Гидрохлорид 4-{6-[(2,6-дихлор-3-этилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутановой кислоты. Rt 1,57 мин (Система B), [M+H]+ 478,0.
Соединение 123. Гидрохлорид 4-{6-[(2-хлор-5-этилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутановой кислоты.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,30 (уш.с, 1H), 10,40 (уш.с, 1H), 7,38-7,44 (м, 2H), 7,24 (дд, J=8,2, 2,2 Гц, 1H), 6,96-7,02 (м, 1H), 6,51-6,60 (м, 2H), 5,06 (с, 2H), 4,48 (уш.с, 2H), 3,42-3,52 (м, 2H), 2,95-3,12 (м, 4H), 2,61 (кв., J=7,6 Гц, 2H), 2,36 (т, J=7,2 Гц, 2H), 2,22-2,30 (м, 2H), 1,79-2,00 (м, 4H), 1,17 (т, J=7,6 Гц, 3H). Rt 1,45 мин (Система B), [M+H]+ 444,0.
Соединение 124. Гидрохлорид 4-{6-[(2,6-дихлор-3-метоксифенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутановой кислоты.
Rt 1,34 мин (Система B), [M+H]+ 480,0
Соединение 125. Гидрохлорид 4-{6-[(4-бутил-2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутановой кислоты.
Rt 1,62 мин (Система B), [M+H]+ 506,0
Соединение 126. Гидрохлорид 4-(6-{[2-хлор-6-(трифторметокси)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)бутановой кислоты.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,30 (уш.с, 1H), 10,45 (уш.с, 1H), 7,57-7,66 (м, 2H), 7,48 (дт, J=7,6, 1,6 Гц, 1H), 7,00 (д, J=8,0 Гц, 1H), 6,53-6,62 (м, 2H), 5,10 (с, 2H), 4,50 (с, 2H), 3,43-3,52 (м, 2H), 2,96-3,11 (м, 4H), 2,37 (т, J=7,1 Гц, 2H), 2,21-2,32 (м, 2H), 1,95 (кв., J=7,6 Гц, 2H), 1,81-1,89 (м, 2H). Rt 1,41 мин (Система B), [M+H]+ 500,0.
Соединение 127. Гидрохлорид 4-(6-{[2-хлор-6-(пропан-2-ил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)бутановой кислоты.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,30 (уш.с, 1H), 10,60 (уш.с, 1H), 7,33-7,41 (м, 3H), 6,99 (д, J=7,4 Гц, 1H), 6,55-6,63 (м, 2H), 5,15 (с, 2H), 4,49 (уш.с, 2H), 3,44-3,52 (м, 2H), 3,14-3,22 (м, 1H), 2,95-3,11 (м, 4H), 2,23-2,40 (м, 4H), 1,96 (кв., J=7,6 Гц, 2H), 1,81-1,88 (м, 2H), 1,20 (д, J=6,8 Гц, 6H).
Соединение 128. Гидрохлорид 4-{6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутановой кислоты.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,10 (уш.с, 1H), 10,50 (уш.с, 1H), 7,54-7,58 (м, 2H), 7,45-7,51 (м, 1H), 6,97-7,12 (м, 1H), 6,56-6,62 (м, 2H), 5,21 (с, 2H), 4,48 (уш.с, 2H), 3,38-3,54 (м, 2H), 2,94-3,35 (м, 4H), 2,38 (т, J=7,5 Гц, 2H), 2,20-2,37 (м, 2H), 1,94-2,03 (м, 2H), 1,82-1,93 (м, 2H). Rt 1,37 мин (Система B), [M+H]+ 450,0.
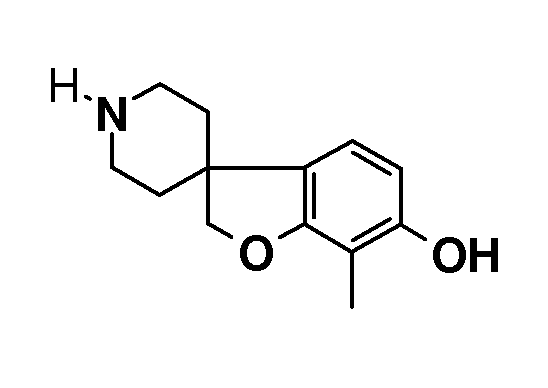
7-Метил-2H-спиро[1-бензофуран-3,4'-пиперидин]-6-ол. Смесь 2H-спиро[1-бензофуран-3,4'-пиперидин]-6-ола (0,78 г; 5,24 ммоль), триацетоксиборгидрида натрия (2,22 г; 10,48 ммоль) и бензальдегида (0,76 мл; 7,49 ммоль) в 1,2-дихлорэтане (25 мл) перемешивали в течение ночи при комнатной температуре. Затем реакционную смесь разбавляли дихлорметаном и экстрагировали 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали, концентрировали в вакууме и очищали колоночной хроматографией (SiO2, Et2O/гексан 1:1) с получением 1'-бензил-2H-спиро[1-бензофуран-3,4'-пиперидин]-6-ола (1,03 г; 93,1%). Rt 1,00 мин (Система B), [M+H]+ 296,1. К суспензии NaH (60% в масле) (179 мг; 4,47 ммоль) в 5 мл ТГФ добавляли 1'-бензил-2H-спиро[1-бензофуран-3,4'-пиперидин]-6-ол (660 мг; 2,23 ммоль), растворенный в 5 мл ТГФ, по каплям при 0°C. Полученную смесь перемешивали при 15°C (в течение 15 минут) и охлаждали снова. Затем добавляли хлорметилметиловый эфир (0,24 мл; 3,35 ммоль), растворяли в 5 мл ТГФ и полученную смесь перемешивали в течение ночи. К этой реакционной смеси добавляли H2O и Et2O. Слои разделяли и водный слой экстрагировали снова Et2O. Органический слой сушили (Na2SO4), фильтровали, концентрировали в вакууме и очищали колоночной хроматографией (SiO2, Et2O/гексан 1:1) с получением 1'-бензил-6-(метоксиметокси)-2H-спиро[1-бензофуран-3,4'-пиперидина (0,54 г; 71,2%). Rt 1,16 мин (Система B), [M+H]+ 340,1.
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,23-7,36 (м, 5H), 7,02 (д, J=8,2 Гц, 1H), 6,51-6,57 (м, 2H), 5,12 (с, 2H), 4,36 (с, 2H), 3,53 (с, 2H), 3,46 (с, 3H), 2,85-2,91 (м, 2H), 1,91-2,07 (м, H), 1,67-1,73 (м, 2H).
К раствору 1'-бензил-6-(метоксиметокси)-2H-спиро[1-бензофуран-3,4'-пиперидина (0,6 г; 1,77 ммоль) в Et2O (25 мл) добавляли н-бутиллитий (1,56 мл; 2,50 моль/л; 3,89 ммоль) при 0°C. Реакционную смесь нагревали при кипячении с обратным холодильником в течение 90 минут. Затем смесь охлаждали до 0°C и добавляли раствор 1,2-дибромтетрахлорэтана (1,27 г; 3,89 ммоль). Полученную смесь перемешивали в течение 15 минут и разбавляли EtOAc и H2O. Слои разделяли и водный слой экстрагировали снова EtOAc. Органический слой сушили (Na2SO4), фильтровали, концентрировали в вакууме и очищали колоночной хроматографией (SiO2, Et2O/гексан 1:1) с получением 1'-бензил-7-бром-6-(метоксиметокси)-2H-спиро[1-бензофуран-3,4'-пиперидина (0,36 г; 49,2%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,24-7,36 (м, 5H), 6,97 (д, J=8,2 Гц, 1H), 6,67 (д, J=8,2 Гц, 1H), 5,21 (с, 2H), 4,48 (с, 2H), 3,50-3,55 (м, 5H), 2,85-2,92 (м, 2H), 1,89-2,07 (м, 4H), 1,70-1,77 (м, 2H).
При продувке азотом к смеси 1'-бензил-7-бром-6-(метоксиметокси)-2H-спиро[1-бензофуран-3,4'-пиперидин] (0,33 г; 0,81 ммоль) в 9 мл безводного 1,4-диоксана добавляли последовательно карбонат калия (336 мг; 2,43 ммоль), триметилбороксин (0,11 мл; 0,81 ммоль) и тетракис(трифенилфосфин)палладий(0) (93 мг; 0,08 ммоль). Полученную смесь нагревали в течение 28 часов при 115°C (в бутыли из пирекса). После охлаждения до комнатной температуры реакционную смесь разбавляли EtOAc, фильтровали и промывали 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1) с получением 1'-бензил-6-(метоксиметокси)-7-метил-2H-спиро[1-бензофуран-3,4'-пиперидин] (0,25 г; 87%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,24-7,36 (м, 5H), 6,89 (д, J=8,2 Гц, 1H), 6,60 (д, J=8,2 Гц, 1H), 5,15 (с, 2H), 4,36 (с, 2H), 3,53 (с, 2H), 3,48 (с, 3H), 2,85-2,91 (м, 2H), 2,10 (с, 3H), 1,90-2,08 (м, 4H), 1,67-1,73 (м, 2H). Rt 1,25 мин (Система B), [M+H]+ 354,1.
Соединение растворяли в 1M растворе HCl в EtOH и перемешивали в течение 90 минут при 50°C. Затем растворитель удаляли в вакууме и остаток обрабатывали iPr2O. Осадок собирали фильтрованием и сушили в течение ночи с получением гидрохлорида 1'-бензил-7-метил-2H-спиро[1-бензофуран-3,4'-пиперидин]-6-ола (220 мг; 97%) Rt 1,07 мин (Система B), [M+H]+ 310,1
К смеси гидрохлорида 1'-бензил-7-метил-2H-спиро[1-бензофуран-3,4'-пиперидин]-6-ола (0,22 г;, 0,64 ммоль) в 10 мл MeOH добавляли гидроксид палладия (44 мг; 0,06 ммоль). Смесь обрабатывали при помощи Н2 в течение 72 часов. Неочищенную реакционную смесь концентрировали до объема около 5 мл и фильтровали через содержащую паратолуолсульфокислоту твердофазную экстракционную гильзу, промывая MeOH и элюируя раствором 2н NH3/MeOH. Продукт концентрировали с получением 7-метил-2H-спиро[1-бензофуран-3,4'-пиперидин]-6-ола (137 мг; 98%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 6,81 (д, J=8,0 Гц, 1H), 6,32 (д, J=8,0 Гц, 1H), 4,41 (с, 2H), 3,11 (дт, J=12,7, 3,6 Гц, 2H), 2,64-2,73 (м, 2H), 2,11 (с, 3H), 1,78-1,87 (м, 2H), 1,66-1,73 (м, 2H). Rt 0,88 мин (Система B), [M+H]+ 220,1.
7-метил-2H-спиро[1-бензофуран-3,4'-пиперидин]-6-ол преобразовывали в:
Соединение 129. Гидрохлорид 3-{6-[(2,6-дихлорфенил)метокси]-7-метил-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты
способом, аналогичным описанному для соединения 29.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,60 (уш.с, 1H), 10,70 (уш.с, 1H), 7,54-7,60 (м, 2H), 7,44-7,50 (м, 1H), 6,90 (уш.с, 1H), 6,75 (д, J=8,2 Гц, 1H), 5,19 (с, 2H), 4,46 (уш.с, 2H), 3,40-3,52 (м, 2H), 3,24-3,39 (м, 2H), 2,98-3,14 (м, 2H), 2,87 (т, J=7,5 Гц, 2H), 2,14-2,28 (м, 2H), 1,91 (с, 3H), 1,88 (уш.с, 2H). Rt 1,41 мин (Система B), [M+H]+ 450,0.
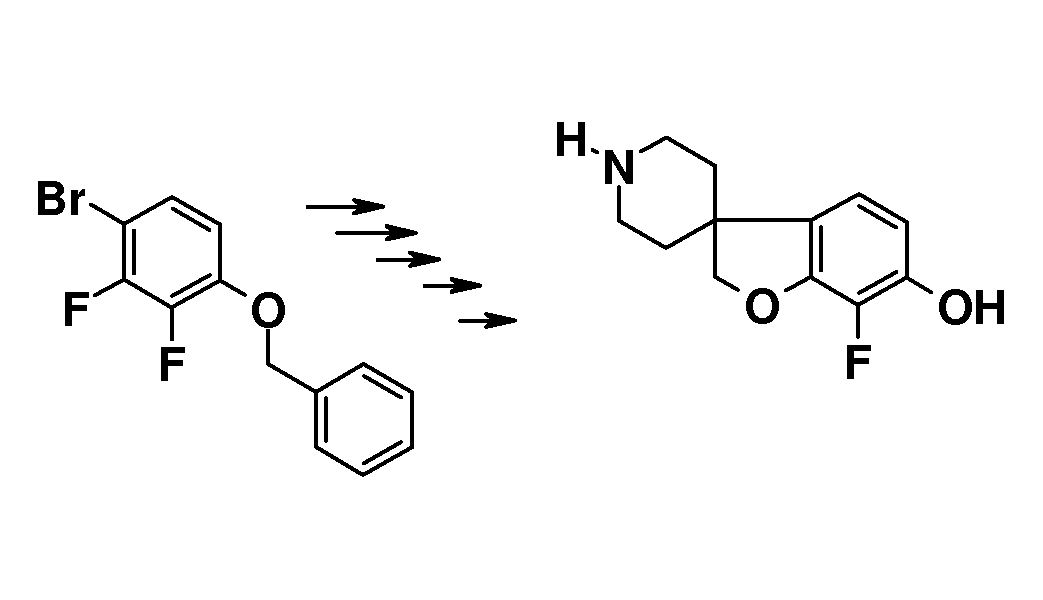
7-Фтор-2H-спиро[1-бензофуран-3,4'-пиперидин]-6-ол. 4-Пиридинметанол (1,7 г; 15,62 ммоль) растворяли в 1-метил-2-пирролидиноне (50 мл) и добавляли гидрид натрия (60% в минеральном масле; 0,62 г; 15,62 ммоль). Смесь перемешивали в течение 30 минут при температуре окружающей среды. Затем добавляли 1-(бензилокси)-4-бром-2,3-дифторбензол (4,45 г; 14,88 ммоль), растворенный в 1-метил-2-пирролидиноне (30 мл), и реакционную смесь нагревали до 100°C. ТСХ анализ показал полное преобразование в течение 15 минут. После охлаждения до комнатной температуры реакционную смесь разбавляли EtOAc и промывали 5% водным раствором NaHCO3. Органический слой промывали несколько раз H2O, сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 2:1 до чистого Et2O) с получением 4-[3-(бензилокси)-6-бром-2-фторфеноксиметил]пиридина (4,81 г; 83%),
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 8,62-8,66 (м, 2H), 7,32-7,48 (м, 7H), 7,21 (дд, J=9,0, 2,4 Гц, 1H), 6,69 (дд, J=9,0, 8,0 Гц, 1H), 5,17 (с, 2H), 5,13 (с, 2H),
который растворяли в ацетоне (72 мл). К этой реакционной смеси добавляли бензилбромид (1,85 мл; 15,45 ммоль) и перемешивали в течение ночи при 40°C. Затем смесь концентрировали в вакууме с получением 1-бензил-4-[3-(бензилокси)-6-бром-2-фторфеноксиметил]пиридин-1-ийбромида (7,55 г; 99%), который растворяли в MeOH (100 мл). К этой охлажденной (-10°C) реакционной смеси добавляли боргидрид натрия (1,16 г; 30,71 ммоль). После завершения добавления смеси давали нагреться до комнатной температуры и перемешивали в течение 4 часов. Затем смесь охлаждали до 0°C, добавляли воду и MeOH выпаривали в вакууме. К водному раствору добавляли 5% водный раствор NaHCO3 и Et2O. Слои разделяли и органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1) с получением продукта: 1-бензил-4-[3-(бензилокси)-6-бром-2-фторфеноксиметил]-1,2,3,6-тетрагидропиридина (3,73 г; 63%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,23-7,44 (м, 10H), 7,16 (дд, J=9,0, 2,3 Гц, H), 6,63 (дд, J=9,0, 7,9 Гц, 1H), 5,78-5,82 (м, 1H), 5,11 (с, 2H), 4,51 (с, 2H), 3,60 (с, 2H), 3,00-3,04 (м, 2H), 2,64 (т, J=5,7 Гц, 2H), 2,36-2,42 (м, 2H). Rt 1,48 мин (Система B), [M+H]+ 483,9.
К интенсивно дегазируемой смеси 1-бензил-4-[3-(бензилокси)-6-бром-2-фторфеноксиметил]-1,2,3,6-тетрагидропиридина (3,73 г; 7,73 ммоль) в 45 мл бензола добавляли последовательно 2,2'-азобис(2-метилпропионитрил) (0,05 г; 0,31 ммоль) и гидрид три-н-бутилолова (3,13 мл; 11,60 ммоль). Реакционную смесь нагревали в условиях микроволнового облучения (с использованием карбида кремния) в течение 1 часа при 175°C. После охлаждения до комнатной температуры смесь концентрировали в вакууме, при этом происходило осаждение продукта. Осадок собирали фильтрованием и очищали колоночной хроматографией (SiO2, Et2O:гексан 2:1) с получением продукта: 1'-бензил-6-(бензилокси)-7-фтор-2H-спиро[1-бензофуран-3,4'-пиперидин] (2,34 г; 72%),
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,24-7,46 (м, 10Н), 6,75 (дд, J=8,2, 1,4 Гц, 1H), 6,51 (дд, J=8,2, 6,9 Гц, 1H), 5,10 (с, 2H), 4,46 (с, 2H), 3,53 (с, 2H), 2,84-2,92 (м, 2H), 1,88-2,07 (м, 4H), 1,69-1,75 (м, 2H),
который растворяли в MeOH (50 мл). Затем добавляли формиат аммония (1,44 г; 22,8 ммоль) и гидроксид палладия (0,04 г; 0,29 ммоль). Реакционную смесь перемешивали в течение ночи (при 60°C). Неочищенную реакционную смесь концентрировали до объема около 5 мл и фильтровали через содержащую паратолуолсульфокислоту твердофазную экстракционную гильзу, промывая MeOH и элюируя раствором 2н NH3/MeOH. Продукт концентрировали с получением 7-фтор-2H-спиро[1-бензофуран-3,4'-пиперидин]-6-ола (1,23 г; 96%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,73 (дд, J=8,1, 1,2 Гц, 1H), 6,39-6,44 (м, 1H), 4,45 (с, 2H), 2,87 (дт, J=12,6, 3,5 Гц, 2H), 2,44-2,55 (м, 2H), 1,59-1,70 (м, 2H), 1,48-1,57 (м, 2H). Rt 0,40 мин (Система В), [M+H]+ 224,1.
Аналогичным способом и как описано для соединения 29, 7-фтор-2H-спиро[1-бензофуран-3,4'-пиперидин]-6-ол преобразовывали в трет-бутил 3-{7-фтор-6-гидрокси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат,
1H ЯМР (400 МГц, CDC13-d) δ м.д. 6,70 (дд, J=8,1, 1,2 Гц, 1H), 6,47 (дд, J=8,1, 7,3 Гц, 1H), 4,45 (с, 2H), 2,91 (д, J=12,0 Гц, 2H), 2,71 (т, J=7,2 Гц, 2H), 2,46 (т, J=7,2 Гц, 2H), 2,03-2,12 (м, 2H), 1,89-1,98 (м, 2H), 1,70-1,77 (м, 2H), 1,45 (с, 9H),
с последующим использованием реакции Мицунобу и кислотного гидролиза с получением следующих соединений:
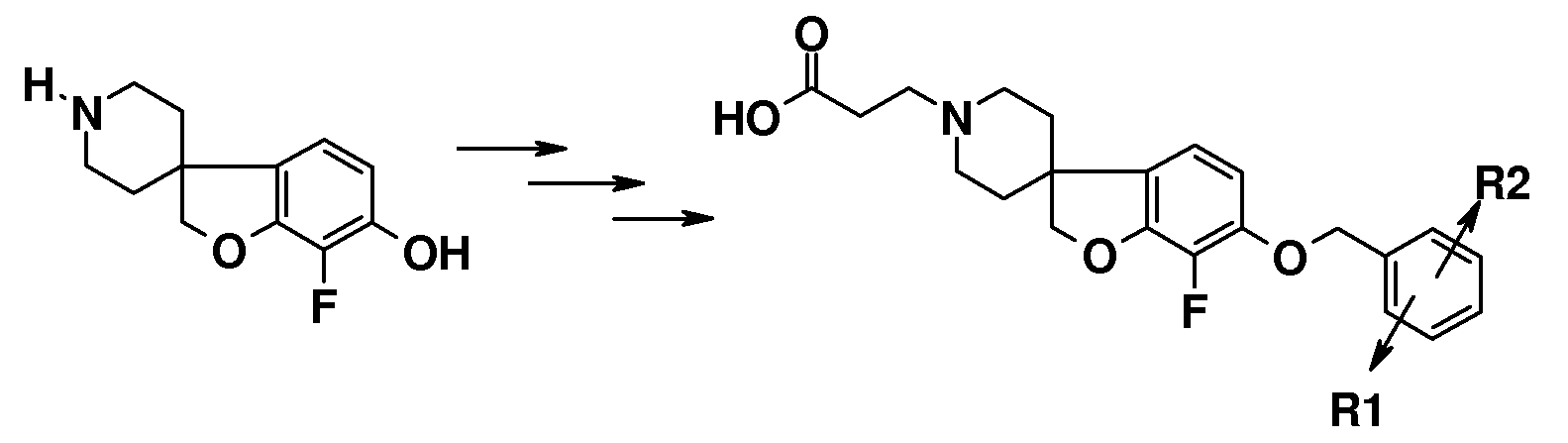
Соединение 130. Гидрохлорид 3-{6-[(2,6-дихлорфенил)метокси]-7-фтор-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,70 (уш.с, 1H), 10,50 (уш.с, 1H), 7,56-7,61 (м, 2H), 7,46-7,52 (м, 1H), 6,81-6,94 (м, 2H), 5,26 (с, 2H), 4,60 (уш.с, 2H), 3,43-3,53 (м, 2H), 3,25-3,37 (м, 2H), 3,00-3,11 (м, 2H), 2,86 (т, J=7,5 Гц, 2H), 2,13-2,29 (м, 2H), 1,89-2,96 (м, 2H). Rt 1,37 мин (Система B), [M+H]+ 454,0.
Соединение 131. Гидрохлорид 3-{6-[(2,6-дихлор-4-метилфенил)метокси]-7-фтор-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,50 (уш.с, 1H), 10,90 (уш.с, 1H), 7,42 (с, 2H), 6,85-6,93 (м, 2H), 5,21 (с, 2H), 4,59 (с, 2H), 3,41-3,52 (м, 2H), 3,37-3,26 (м, 2H), 3,00-3,15 (м, 2H), 2,86 (т, J=7,6 Гц, 2H), 2,34 (с, 3H), 2,16-2,29 (м, 2H), 1,88-1,96 (м, 2H). Rt 1,44 мин (Система B), [M+H]+ 468,1.
Соединение 132. Гидрохлорид 3-{7-фтор-6-[(2,4,6-трихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,90 (уш.с, 1H), 10,40 (уш.с, 1H), 7,81 (с, 2H), 6,85-6,93 (м, 2H), 5,23 (с, 2H), 4,60 (уш.с, 2H), 3,40-3,55 (м, 2H), 3,25-3,37 (м, 2H), 2,96-3,15 (м, 2H), 2,85 (т, J=7,3 Гц, 2H), 2,12-2,25 (м, 2H), 1,88-1,97 (м, 2H). Rt 1,44 мин (Система B), [M+H]+ 490,0.
Соединение 133. Гидрохлорид 3-{6-[(2,6-дихлор-3-метоксифенил)метокси]-7-фтор-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,80 (уш.с, 1H), 10,50 (уш.с, 1H), 7,54 (д, J=9,0 Гц, 1H), 7,28 (д, J=9,0 Гц, 1H), 6,84-6,94 (м, 2H), 5,25 (с, 2H), 4,60 (уш.с, 2Н), 3,90 (с, 3H), 3,41-3,54 (м, 2Н), 3,25-3,35 (м, 2Н), 2,97-3,16 (м, 2Н), 2,86 (т, J=1,6 Гц, 2Н), 2,13-2,28 (м, 2Н), 1,94 (м, 2Н). Rt 1,36 мин (Система В), [М+Н]+ 484,1.
Соединение 134. Гидрохлорид 3-{6-[(4-бутил-2,6-дихлорфенил)метокси]-7-фтор-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,80 (уш.с, 1H), 10,70 (уш.с, 1H), 7,43 (с, 2H), 6,81-6,93 (м, 2H), 5,21 (с, 2H), 4,60 (уш.с, H), 3,42-3,54 (м, 2H), 3,26-3,35 (м, 2H), 2,98-3,12 (м, 2H), 2,87 (т, J=7,6 Гц, 2H), 2,62 (т, J=7,6 Гц, 2H), 2,18-2,30 (м, 2H), 1,92 (д, J=13,7 Гц, 2H), 1,51-1,62 (м, 2H), 1,24-1,35 (м, 2H), 0,90 (т, J=7,4 Гц, 3H). Rt 1,67 мин (Система B), [M+H]+ 510,1. Rt 0,97 мин (Система B), [M+H]+ 448,0.
Соединение 135. Гидрохлорид 3-{6-[(2-хлор-5-этилфенил)метокси]-7-фтор-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Соединение 136. Гидрохлорид 3-{6-[(2-хлор-6-этилфенил)метокси]-7-фтор-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,80 (уш.с, 1H), 11,80 (уш.с, 1H), 7,35-7,40 (м, 2H), 7,29-7,32 (м, 1H), 6,82-6,96 (м, 2H), 5,19 (с, 2H), 4,60 (уш.с, 2H), 3,43-3,54 (м, 2H), 3,24-3,34 (м, 2H), 2,98-3,12 (м, 2H), 2,87 (т, J=7,6 Гц, 2H), 2,73 (кв., J=7,8 Гц, 2H), 2,15-2,30 (м, 2H), 1,88-1,97 (м, 2H), 1,17 (т, J=7,8 Гц, 3H). Rt 1,47 мин (Система B), [M+H]+ 448,1.
Соединение 137. Гидрохлорид 3-(6-{[2-хлор-6-(трифторметокси)фенил]метокси]-7-фтор-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,44 мин (Система B), [M+H]+ 504,0.
Соединение 269. Гидрохлорид 3-{6-[(2-хлор-6-этилфенил)метокси]-7-фтор-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,70 (уш.с, 1H), 10,60 (уш.с, 1H), 7,35-7,41 (м, 2H), 7,27-7,33 (м, 1H), 6,80-6,97 (м, 2H), 5,19 (с, 2H), 4,60 (уш.с, 2H), 3,25-3,55 (м, 4H), 3,00-3,12 (м, 2H), 2,87 (т, J=7,5 Гц, 2H), 2,73 (кв., J=7,5 Гц, 2H), 2,18-2,30 (м, 2H), 1,88-1,97 (м, 2H), 1,17 (т, J=7,5 Гц, 3H). Rt 1,47 мин (Система B), [M+H]+ 448,1.
Соединение 270. 3-{6-[(2-Хлор-6-фторфенил)метокси]-7-фтор-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота. Смесь трет-бутил 3-{6-[(2-Хлор-6-фторфенил)метокси]-7-фтор-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата (178 мг; 0,36 ммоль), 2M водного раствора NaOH (5 мл; 10 ммоль) и этанола (40 мл) перемешивали в течение 3 часов при 50°C и затем охлаждали до 0°C. К этой реакционной смеси добавляли по каплям водный раствор HCl (10 мл; 1 моль/л), затем смесь концентрировали в вакууме. Остаток обрабатывали насыщенным солевым раствором и дихлорметаном. Водный слой промывали дихлорметаном (два раза). Затем органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме, с последующей обработкой iPr2O. Образовавшийся осадок собирали фильтрованием, промывали iPr2O и сушили в вакууме с получением продукта (142 мг; 85,5%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,49-7,56 (м, 1H), 7,43 (д, J=8,0 Гц, 1H), 7,33 (т, J=8,8 Гц, 1H), 7,00 (д, J=8,0 Гц, 1H), 6,80 (т, J=7,6 Гц, 1H), 5,16 (д, J=1,4 Гц, 2H), 4,48 (с, 2H), 2,86 (д, J=11,7 Гц, 2H), 2,61 (т, J=7,0 Гц, 2H), 2,41 (т, J=7,0 Гц, 2H), 2,06 (т, J=11,7 Гц, 2H), 1,78-1,88 (м, 2H), 1,67 (д, J=12,5 Гц, 2H). Rt 1,34 мин (Система B), [M+H]+ 438,1.
Следующие соединения были получены аналогичным способом:
Соединение 271. 3-{6-[(2-Хлор-6-(пропан-2-ил)фенил]метокси}-7-фтор-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,35-7,45 (м, 3H), 7,01 (д, J=8,5 Гц, 1H), 6,84 (т, J=7,4 Гц, 1H), 5,22 (с, 2H), 4,48 (с, 2H), 3,16-3,25 (м, 1H), 2,84-2,89 (м, 2H), 2,61 (т, J=7,0 Гц, 2H), 2,40 (т, J=7,0 Гц, 2H), 2,02-2,11 (м, 2H), 1,80-1,89 (м, 2H), 1,67 (д, J=12,9 Гц, 2H), 1,20 (д, J=6,8 Гц, 6H). Rt 1,49 мин (Система B), [M+H]+ 462,2.
Соединение 272. 3-{6-[(2-Хлор-6-циклопропилфенил)метокси]-7-фтор-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,30-7,38 (м, 2H), 7,06 (дд, J=6,9, 1,9 Гц, 1H), 7,01 (д, J=8,0 Гц, 1H), 6,86 (т, J=7,3 Гц, 1H), 5,34 (с, 2H), 4,49 (с, 2H), 2,87-2,94 (м, 2H), 2,65 (т, J=7,0 Гц, 2H), 2,42 (т, J=7,0 Гц, 2H), 2,04-2,16 (м, 3H), 1,80-1,90 (м, 2H), 1,68 (д, J=12,8 Гц, 2H), 0,89-0,96 (м, 2H), 0,66-0,72 (м, 2H). Rt 1,44 мин (Система B), [M+H]+ 460,2.
Соединение 273. 3-{6-[(2-Циклопропил-6-фторфенил)метокси]-7-фтор-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,31-7,38 (м, 1H), 7,07 (т, J=9,1 Гц, 1H), 6,99 (д, J=8,2 Гц, 1H), 6,80-6,90 (м, 2H), 5,25 (с, 2H), 4,48 (с, 2H), 2,87 (д, J=12,1 Гц, 2H), 2,62 (т, J=7,2 Гц, 2H), 2,40 (т, J=7,2 Гц, 2H), 2,03-2,12 (м, 3H), 1,78-1,89 (м, 2H), 1,66 (д, J=12,6 Гц, 2H), 0,90-0,98 (м, 2H), 0,66-0,72 (м, 2H). Rt 1,42 мин (Система B), [M+H]+ 444,2.
Необходимый (2-циклопропил-6-фторфенил)метанол получали следующим образом: К охлажденному раствору (0°C) (E)-бутил[(2,6-дифторфенил)метилиден]амина (4,45 г; 22,56 ммоль), полученному в соответствии с US2007/197621 (см. также WO2007/85556 и US6380387), растворенного в ТГФ (100 мл), добавляли циклопропилмагнийбромид (0,5M, 51,9 мл; 25,95 ммоль) по каплям. Затем реакционную смесь перемешивали в течение 2 часов при комнатной температуре. К этой реакционной смеси добавляли 3 мл H2O и полученную смесь распределяли между EtOAc и 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме, с получением (E)-бутил[(2-циклопропил-6-фторфенил)метилиден]амина (5,07 г; 100%), который растворяли в 24 мл H2O и серной кислоте (8 мл) и нагревали до температуры кипения с обратным холодильником в течение 2 часов. После охлаждения до комнатной температуры полученную смесь распределяли между EtOAc и 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:7, затем Et2O:гексан 1:7) с получением (2-циклопропил-6-фторбензальдегида (2,37 г; 66%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 10,64 (с, 1H), 7,39-7,45 (м, 1H), 6,92-6,99 (м, 1H), 6,83 (д, J=7,9 Гц, 1H), 2,81-2,90 (м, 1H), 1,04-1,11 (м, 2H), 0,70-0,77 (м, 2H).
К 2-циклопропил-6-фторбензальдегиду (2,37 г; 14,44 ммоль) в MeOH (50 мл) добавляли NaBH4 (1,21 г; 32,02 ммоль) небольшими порциями при 0°C. После завершения добавления смеси давали нагреться до комнатной температуры и перемешивали в течение одного часа. Затем смесь охлаждали до 0°C, добавляли воду и MeOH выпаривали в вакууме. К водному раствору добавляли 5% водный раствор NaHCO3 и EtOAc. Слои разделяли и органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:7, затем Et2O:гексан 1;3) с получением (2-циклопропил-6-фторфенил)метанола (2,02 г; 84%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,13-7,22 (м, 1H), 6,86-6,94 (м, 1H), 6,79 (д, J=7,8 Гц, 1H), 4,95 (д, J=3,9 Гц, 2H), 2,15 (м, 1H), 1,74 (т, J=5,5 Гц, 1H), 0,97-1,04 (м, 2H), 0,68-0,75 (м, 2H).
Соединение 274. 3-(7-фтор-6{[2-фтор-6-(пропан-2-ил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропановая кислота.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,43 (м, 1H), 7,25 (д, J=7,9 Гц, 1H), 7,08 (т, J=9,0 Гц, 1H), 7,00 (д, J=7,5 Гц, 1H), 6,82 (т, J=7,5 Гц, 1H), 5,13 (д, J=1,1 Гц, 2H), 4,48 (с, 2H), 3,14-3,24 (м, 1H), 2,87 (д, J=11,9 Гц, 2H), 2,61 (т, J=7,0 Гц, 2H), 2,40 (т, J=7,0 Гц, 2H), 2,07 (т, J=11,4 Гц, 2H), 1,78-1,88 (м, 2H), 1,66 (д, J=12,7 Гц, 2H), 1,20 (д, J=6,8 Гц, 6H). Rt 1,46 мин (Система B), [M+H]+ 446,3
Соединение 275. 3-[7-фтор-6-(гексилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановая кислота. К смеси трет-бутил 3-{7-фтор-6-гидрокси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноата, CH3CN (10 мл) добавляли 1-бромгексан (0,123 мл; 0,88 ммоль) с последующим добавлением K2CO3 (400 мг; 2,92 ммоль) и раствор перемешивали при 75°C в течение ночи. Раствору давали охладиться до комнатной температуры и концентрировали. Остаток брали для поглощения в EtOAc и H2O. Органическую фазу сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1) с получением трет-бутил 3-{7-фтор-6-(гексилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноата (100 мг; 100%), который растворяли в 2M водном растворе NaOH (2 мл; 4 ммоль) и этаноле (10 мл). Реакционную смесь перемешивали в течение 3 часов при 50°C и затем охлаждали до 0°C. К этой реакционной смеси добавляли по каплям водный раствор HCl (4 мл; 1 моль/л), затем смесь концентрировали в вакууме. Остаток обрабатывали насыщенным солевым раствором и дихлорметаном. Водный слой промывали дихлорметаном (два раза). Затем органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме, с последующей обработкой iPr2O. Образовавшийся осадок собирали фильтрованием, промывали iPr2O и сушили в вакууме с получением продукта (150 мг; 67,1%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,93 (д, J=8,3 Гц, 1H), 6,57-6,62 (м, 1H), 4,46 (с, 2H), 3,97 (т, J=6,5 Гц, 2H), 2,85 (д, J=11,9 Гц, 2H), 2,60 (т, J=7,2 Гц, 2H), 2,39 (т, J=7,2 Гц, 2H), 2,06 (т, J=11,3 Гц, 2H), 1,76-1,86 (м, 2H), 1,61-1,73 (м, 4H), 1,35-1,44 (м, 2H), 1,25-1,33 (м, 4H), 0,84-0,90 (м, 3H). Rt 1,45 мин (Система B), [M+H]+ 380,3.
Следующие соединения были получены аналогичным способом:
Соединение 276. 3-[7-фтор-6-(гептилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановая кислота.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,93 (д, J=8,3 Гц, 1H), 6,57-6,63 (м, 1H), 4,47 (с, 2H), 3,97 (т, J=6,5 Гц, 2H), 2,86 (д, J=11,9 Гц, 2H), 2,61 (т, J=6,9 Гц, 2H), 2,40 (т, J=6,9 Гц, 2H), 2,08 (т, J=11,2 Гц, 2H), 1,81 (тд, J=12,6, 3,4 Гц, 2H), 1,61-1,73 (м, 4H), 1,20-1,43 (м, 8H), 0,86 (т, J=6,7 Гц, 3H). Rt 1,56 мин (Система B), [M+H]+ 394,3.
Соединение 277. 3-[7-фтор-6-(октилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановая кислота.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,92 (дд, J=8,3, 1,2 Гц, 1H), 6,55-6,63 (м, 1H), 4,46 (с, 2H), 3,97 (т, J=6,5 Гц, 2H), 2,85 (д, J=12,0 Гц, 2H), 2,60 (т, J=7,2 Гц, 2H), 2,39 (т, J=7,2 Гц, 2H), 2,00-2,11 (м, 2H), 1,81 (тд, J=12,6, 3,8 Гц, 2H), 1,60-1,73 (м, 4H), 1,18-1,43 (м, 10H), 0,86 (т, J=6,8 Гц, 3H). Rt 1,64 мин (Система B), [M+H]+ 408,3.
Соединение 278. 3-[7-фтор-6-(гекс-5-ен-1-илокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановая кислота.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,92 (дд, J=8,3, 1,3 Гц, 1H), 6,57-6,63 (м, 1H), 5,82 (ддт, J=17,2, 10,2, 6,6, 6,6 Гц, 1H), 4,94-5,06 (м, 2H), 4,46 (с, 2H), 3,99 (т, J=6,6 Гц, 2H), 2,85 (д, J=12,0 Гц, 2H), 2,61 (т, J=7,1 Гц, 2H), 2,39 (т, J=7,1 Гц, 2H), 2,02-2,12 (м, 4H), 1,81 (тд, J=12,6, 3,8 Гц, 2H), 1,61-1,75 (м, 4H), 1,44-1,54 (м, 2H). Rt 1,45 мин (Система B), [M+H]+ 378,3.
Соединение 279. 3-[7-фтор-6-(окт-7-ен-1-илокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановая кислота.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,92 (дд, J=8,2, 1,2 Гц, 1H), 6,56-6,62 (м, 1H), 5,80 (ддт, J=17,1, 10,3, 6,7, 6,7 Гц, 1H), 4,91-5,04 (м, 2H), 4,46 (с, 2H), 3,97 (т, J=6,6 Гц, 2H), 2,81-2,88 (м, 2H), 2,60 (т, J=7,0 Гц, 2H), 2,38 (т, J=7,0 Гц, 2H), 1,98-2,11 (м, 4H), 1,76-1,86 (м, 2H),1,60-1,73 (м, 4H), 1,27-1,44 (м, 6H). Rt 1,59 мин (Система B), [M+H]+ 406,3.
Соединение 280. 3-[7-фтор-6-(гепт-6-ен-1-илокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановая кислота.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,92 (д, J=8,2 Гц, 1H), 6,57-6,63 (м, 1H), 5,74-5,86 (м, 1H), 4,92-5,05 (м, 2H), 4,46 (с, 2H), 3,97 (т, J=6,3 Гц, 2H), 2,85 (д, J=11,9 Гц, 2H), 2,60 (т, J=7,0 Гц, 2H), 2,39 (т, J=7,0 Гц, 2H), 2,00-2,11 (м, 4H), 1,76-1,86 (м, 2H), 1,61-1,74 (м, 4H), 1,40 (дт, J=6,6, 3,5 Гц, 4H). Rt 1,29 мин (Система B), [M+H]+ 392,3.
Соединение 281. 3-{7-фтор-6-[(5,6,6-трифторгекс-5-ен-1-ил)окси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,92 (д, J=8,2 Гц, 1H), 6,57-6,63 (м, 1H), 5,74-5,86 (м, 1H), 4,92-5,05 (м, 2H), 4,46 (с, 2H), 3,97 (т, J=6,3 Гц, 2H), 2,85 (д, J=11,9 Гц, 2H), 2,60 (т, J=7,0 Гц, 2H), 2,39 (т, J=7,0 Гц, 2H), 2,00-2,11 (м, 4H), 1,76-1,86 (м, 2H), 1,61-1,74 (м, 4H), 1,40 (дт, J=6,6, 3,5 Гц, 4H). Rt 1,39 мин (Система B), [M+H]+ 432,3.
Соединение 282. 3-{7-фтор-6-[(4,4,5,5,5-пентафторпентил)окси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота.
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 6,79 (д, J=8,2 Гц, 1H), 6,50 (дд, J=8,2, 7,0 Гц, 1H), 4,49 (с, 2H), 4,08 (т, J=5,9 Гц, 2H), 3,16 (д, J=12,0 Гц, 2H), 2,83 (т, J=6,2 Гц, 2H), 2,58 (т, J=6,2 Гц, 2H), 2,20-2,41 (м, 4H), 1,99-2,15 (м, 4H), 1,85-1,94 (м, 2H). Rt 1,38 мин (Система B), [M+H]+ 456,2.
Соединение 283. 3-{7-фтор-6-[(5,5,6,6,6-пентафторгексил)окси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,94 (д, J=8,2 Гц, 1H), 6,59-6,64 (м, 1H), 4,47 (с, 2H), 4,03 (т, J=6,2 Гц, 2H), 2,86 (д, J=11,8 Гц, 2H), 2,60 (т, J=7,1 Гц, 2H), 2,21-2,43 (м, 4H), 2,06 (т, J=11,2 Гц, 2H), 1,76-1,87 (м, 4H), 1,60-1,72 (м, 4H). Rt 1,44 мин (Система B), [M+H]+ 470,2.
Соединение 284. 3-[7-фтор-6-(4,4,4-трифторбутокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановая кислота.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,95 (дд, J=8,3, 1,1 Гц, 1H), 6,58-6,65 (м, 1H), 4,48 (с, 2H), 4,06 (т, J=6,2 Гц, 2H), 2,85 (д, J=11,9 Гц, 2H), 2,60 (т, J=7,1 Гц, 2H), 2,34-2,48 (м, 4H), 2,05 (т, J=11,0 Гц, 2H), 1,88-1,98 (м, 2H), 1,81 (тд, J=12,6, 3,6 Гц, 2H), 1,65 (д, J=12,8 Гц, 2H). Rt 1,28 мин (Система B), [M+H]+ 406,2.
Соединение 285. 3-[6-(Циклогексилэтокси)-7-фтор-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановая кислота.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,93 (д, J=8,1 Гц, 1H), 6,90-6,94 (м, 1H), 4,46 (с, 2H), 4,01 (т, J=6,6 Гц, 2H), 2,85 (д, J=11,4 Гц, 2H), 2,60 (т, J=7,0 Гц, 2H), 2,38 (т, J=7,0 Гц, 2H), 2,05 (т, J=11,4 Гц, 2H), 1,55-1,86 (м, 12H), 1,38-1,50 (м, 1H), 1,07-1,27 (м, 2H), 0,87-1,00 (м, 2H). Rt 1,51 мин (Система B), [M+H]+ 406,7.
Соединение 286. 3-{6-[(2-Этилгексил)окси]-7-фтор-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановая кислота.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,93 (д, J=8,2 Гц, 1H), 6,58-6,64 (м, 1H), 4,46 (с, 2H), 3,87 (д, J=5,7 Гц, 2H), 2,85 (д, J=11,7 Гц, 2H), 2,60 (т, J=7,0 Гц, 2H), 2,39 (т, J=7,0 Гц, 2H), 2,06 (т, J=11,7 Гц, 2H), 1,75-1,87 (м, 2H), 1,59-1,71 (м, 3H), 1,22-1,49 (м, 8H), 0,82-0,92 (м, 6H). Rt 1,57 мин (Система B), [M+H]+ 408,7.
Соединение 287. 3-{7-Фтор-6-[(3,5,5-триметилгексил)окси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,93 (д, J=8,2 Гц, 1H), 6,61 (т, J=7,7 Гц, 1H), 4,46 (с, 2H), 4,00 (т, J=6,1 Гц, 2H), 2,85 (д, J=11,9 Гц, 2H), 2,60 (т, J=7,0 Гц, 2H), 2,39 (т, J=7,0 Гц, 2H), 2,01-2,11 (м, 2H), 1,75-1,86 (м, 2H), 1,60-1,74 (м, 3H), 1,55 (с, 1H), 1,27 (дд, J=14,0, 3,2 Гц, 1H), 1,02-1,09 (м, 1H), 0,94 (д, J=6,3 Гц, 3H), 0,87 (с, 9H). Rt 1,59 мин (Система B), [M+H]+ 422,8.
Соединение 288. 3-[6-(3-Циклогексилпропокси)-7-фтор-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановая кислота.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,92 (д, J=8,2 Гц, 1H), 6,59 (т, J=7,7 Гц, 1H), 4,46 (с, 2H), 3,95 (т, J=6,5 Гц, 2H), 2,85 (д, J=11,7 Гц, 2H), 2,60 (т, J=7,0 Гц, 2H), 2,39 (т, J=7,0 Гц, 2H), 2,06 (т, J=11,2 Гц, 2H), 1,81 (тд, J=12,5, 3,4 Гц, 2H), 1,57-1,75 (м, 9H), 1,05-1,32 (м, 6H), 0,80-0,93 (м, 2H).
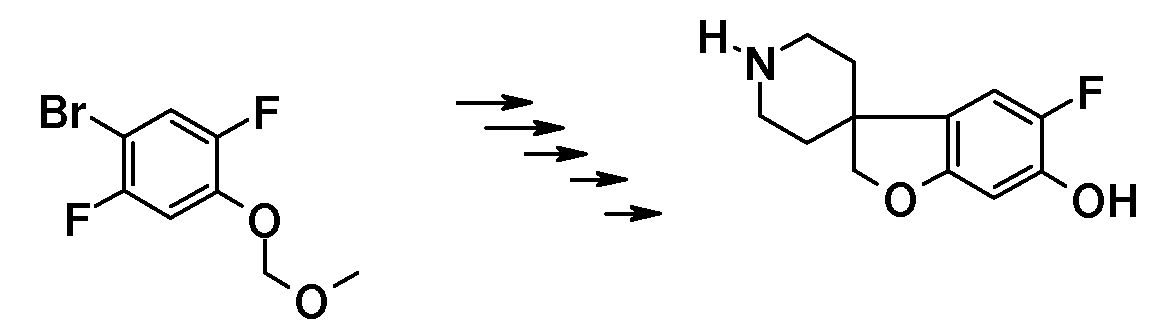
5-Фтор-2H-спиро[1-бензофуран-3,4'-пиперидин]-6-ол. 4-Пиридинметанол (7,9 г; 32,37 ммоль) растворяли в 1-метил-2-пирролидиноне (200 мл) и добавляли гидрид натрия (60% в минеральном масле; 2,89 г; 72,37 ммоль). Смесь перемешивали в течение 30 минут при температуре окружающей среды. Затем добавляли 1-бром-2,5-дифтор-4-(метокси-метокси)бензол (17,44 г; 68,92 ммоль), растворенный в 1-метил-2-пирролидиноне (150 мл), и реакционную смесь нагревали до 100°C. ТСХ анализ показал полное преобразование в течение 15 минут. После охлаждения до комнатной температуры реакционную смесь разбавляли EtOAc и промывали 5% водным раствором NaHCO3. Органический слой промывали несколько раз H2O, сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 2:1 до чистого Et2O) с получением 4-[2-бром-4-фтор-5-(метоксиметокси)феноксиметил]-пиридина (10,23 г; 29,81 ммоль; 43,38%),
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 8,61-8,66 (м, 2H), 7,39-7,43 (м, 2H), 7,33 (д, J=10,1 Гц, 1H), 6,84 (д, J=7,2 Гц, 1H), 5,16 (с, 2H), 5,10 (с, 2H), 3,49 (с, 3H),
который растворяли в ацетоне (153 мл). К этой реакционной смеси добавляли бензилбромид (4,46 мл; 37,26 ммоль) и смесь перемешивали в течение ночи при 40°C. Затем смесь концентрировали в вакууме с получением 1-бензил-4-[2-бром-4-фтор-5-(метоксиметокси)фенокси)-метил)пиридин-1-ийбромида (17,29 г; 99%), который растворяли в MeOH (200 мл). К этой охлажденной (-10°C) реакционной смеси добавляли боргидрид натрия (2,8 г; 74,12 ммоль). После завершения добавления смеси давали нагреться до комнатной температуры и перемешивали в течение 4 часов. Затем смесь охлаждали до 0°C, добавляли воду и MeOH выпаривали в вакууме. К водному раствору добавляли 5% водный раствор NaHCO3 и Et2O. Слои разделяли и органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O) с получением продукта: 1-бензил-4-[2-бром-4-фтор-5-(метоксиметокси)феноксиметил]-1,2,3,6-тетра-гидропиридина (8,47 г; 67,8%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,23-7,37 (м, 6H), 6,83 (д, J=7,3 Гц, 1H), 5,80-5,83 (м, 1H), 5,18 (с, 2H), 4,43 (с, 2H), 3,60 (с, 2H), 3,51 (с, 3H), 3,03 (уш.с, 2H), 2,63 (т, J=5,7 Гц, 2H), 2,24-2,29 (м, 2H). Rt 1,49 мин (Система B), [M+H]+ 438,1.
К интенсивно дегазируемой смеси 1-бензил-4-[2-бром-4-фтор-5-(метокси-метокси)феноксиметил]-1,2,3,6-тетрагидропиридина (5,78 г; 13,25 ммоль) в бензоле (75 мл) добавляли последовательно 2,2'-азобис(2-метилпропионитрил) (0,09 г; 0,53 ммоль) и гидрид три-н-бутилолова (5,36 мл; 19,87 ммоль; 1,5 экв.). Реакционную смесь (разделенную на 5 партий) нагревали в условиях микроволнового облучения (с использованием карбида кремния) в течение 1 часа при 175°C. После охлаждения до комнатной температуры смесь концентрировали в вакууме и очищали колоночной хроматографией (SiO2, Et2O:гексан 2:1). Остаток растворяли в Et2O (150 мл) и промывали 25 мл 10% водного раствора KF, сушили и концентрировали с получением продукта: 1'-бензил-5-фтор-6-(метоксиметокси)-2H-спиро[1-бензофуран-3,4'-пиперидин] (3,80 г; 80,26%),
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,24-7,36 (м, 5H), 6,86 (д, J=10,3 Гц, 1H), 6,66 (д, J=6,6 Гц, 1H), 5,14-5,17 (м, 2H), 4,35 (с, 2H), 3,53 (с, 2H), 3,51 (с, 3H), 2,83-2,91 (м, 2H), 1,98-2,07 (м, 2H), 1,91 (тд, J=12,6, 3,8 Гц, 2H), 1,67-1,73 (м, 2H). Rt 1,13 мин (Система В), [M+H]+ 358,2,
который растворяли в 1,2-дихлорэтане (20 мл) при 0°C. Затем добавляли 1-хлорэтилхлорформиат (0,82 мл; 7,55 ммоль) и реакционную смесь перемешивали в течение 1 часа (при комнатной температуре). Добавляли метанол (20 мл) и реакционную смесь перемешивали в течение ночи и концентрировали в вакууме с получением 5-фтор-6-(метоксиметокси)-2H-спиро[1-бензофуран-3,4'-пиперидин] (0,83 г; 90%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,20 (уш.с, 1H), 9,00 (уш.с, 1H), 7,02 (д, J=10,3 Гц, 1H), 6,75 (д, J=6,7 Гц, 1H), 5,19 (с, 2H), 4,48 (с, 2H), 3,22-3,42 (м, 5H), 2,89-3,03 (м, 2H), 1,99-2,10 (м, 2H), 1,80 (д, J=14,1 Гц, 2H),
который суспендировали в хлористоводородной кислоте (25 мл, 1M) и 25 мл этанола. Реакционную смесь перемешивали при температуре кипения с обратным холодильником в течение 1 часа. Остаток концентрировали в вакууме с получением гидрохлоридной соли 5-фтор-2H-спиро[1-бензофуран-3,4'-пиперидин]-6-ола (0,68 г),
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,90 (с, 1H), 9,05 (уш.с, 1H), 8,85 (уш.с, 1H), 6,91 (д, J=10,4 Гц, 1H), 6,41 (д, J=7,0 Гц, 1H), 4,42 (с, 2H), 3,26 (д, J=13,0 Гц, 2H), 2,87-3,02 (м, 2H), 1,92-2,05 (м, 2H), 1,77 (д, J=14,2 Гц, 2H),
которую фильтровали через содержащую паратолуолсульфокислоту твердофазную экстракционную гильзу, промывая MeOH и элюируя раствором 2н NH3/MeOH. Продукт концентрировали с получением 5-фтор-2H-спиро[1-бензофуран-3,4'-пиперидин]-6-ола (0,57 г; 97%). Rt 0,41 мин (Система B), [M+H]+ 224,2
Аналогичным способом и как описано для соединения 29, 5-фтор-2H-спиро[1-бензофуран-3,4'-пиперидин]-6-ол преобразовывали в трет-бутил 3-{5-фтор-6-гидрокси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат,
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 6,79 (д, J=9,7 Гц, 1H), 6,44 (д, J=7,0 Гц, 1H), 4,34 (с, 2H), 2,88 (д, J=12,0 Гц, 2H), 2,69 (т, J=7,3 Гц, 2H), 2,45 (т, J=7,3 Гц, 2H), 2,02-2,10 (м, 2H), 1,83-1,92 (м, 2H), 1,68-1,75 (м, 2H), 1,46 (с, 9H).
Затем осуществляли реакцию Мицунобу и гидролиз (как описано для соединения 270) с получением следующих соединений:
Соединение 289. 3-{6-[(2,6-Дихлорфенил)метокси]-5-фтор-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,54-7,60 (м, 2H), 7,46-7,51 (м, 1H), 7,17 (д, J=10,7 Гц, 1H), 6,88 (д, J=6,9 Гц, 1H), 5,23 (с, 2H), 4,38 (с, 2H), 2,86 (д, J=11,8 Гц, 2H), 2,60 (т, J=7,1 Гц, 2H), 2,39 (т, J=7,1 Гц, 2H), 2,06 (т, J=11,8 Гц, 2H), 1,83 (тд, J=12,7, 3,6 Гц, 2H), 1,62 (д, J=12,7 Гц, 2H). Rt 1,36 мин (Система B), [M+H]+ 454,1.
Соединение 290. 3-{6-[(2-Хлор-6-этилфенил)метокси]-5-фтор-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,37 (д, J=4,4 Гц, 2H), 7,26-7,31 (м, 1H), 7,16 (д, J=10,7 Гц, 1H), 6,89 (д, J=6,9 Гц, 1H), 5,16 (с, 2H), 4,38 (с, 2H), 2,85 (д, J=11,7 Гц, 2H), 2,72 (кв., J=7,5 Гц, 2H), 2,59 (т, J=7,0 Гц, 2H), 2,36 (т, J=7,0 Гц, 2H), 2,04 (т, J=11,7 Гц, 2H), 1,83 (тд, J=12,6, 3,3 Гц, 2H), 1,61 (д, J=12,6 Гц, 2H), 1,16 (т, J=7,5 Гц, 3H). Rt 1,39 мин (Система B), [M+H]+ 448,6.
Соединение 336. 3-[5-Фтор-6-(гексилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановая кислота.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,78-7,03 (м, 1H), 6,69 (д, J=6,9 Гц, 1H), 4,45 (уш.с, 2H), 3,98 (т, J=6,4 Гц, 2H), 3,20-3,61 (м, 4H), 2,96-3,19 (м, 2H), 2,89 (т, J=7,7 Гц, H), 2,23 (м, 2H), 1,86 (д, J=13,1 Гц, 2H), 1,62-1,74 (м, 2H), 1,21-1,46 (м, 6H), 0,87 (т, J=6,4 Гц, 3H).
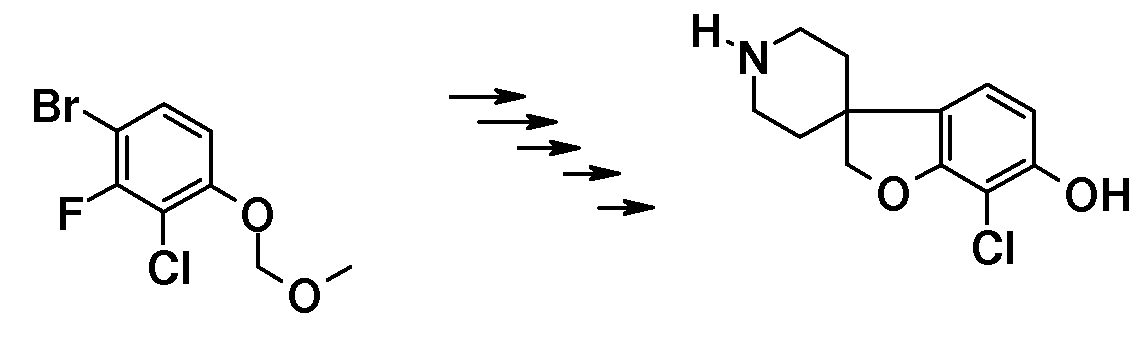
7-Хлор-2H-спиро[1-бензофуран-3,4'-пиперидин]-6-ол. Это соединение синтезировали в соответствии с процедурой синтеза 5-фтор-2H-спиро[1-бензофуран-3,4'-пиперидин]-6-ола (см. соединение 289), исходя из 1-бром-3-хлор-2-фтор-4-(метокси-метокси)бензола, с сопоставимыми или лучшими выходами. Некоторые иллюстрирующие это примеры представлены ниже:
4-[6-бром-2-хлор-3-(метоксиметокси)феноксиметил]пиридин (76%),
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 8,62-8,68 (м, 2H), 7,50 (д, J=5,4 Гц, 2H), 7,42 (д, J=9,0 Гц, 1H), 6,95 (д, J=9,0 Гц, 1H), 5,25 (с, 2H), 5,06 (с, 2H), 3,52 (с, 3H).
1-бензил-4-[6-бром-2-хлор-3-(метоксиметокси)феноксиметил]-1,2,3,6-тетра-гидропиридин (74%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,23-7,39 (м, 6H), 6,88 (д, J=9,0 Гц, 1H), 5,85-5,88 (м, 1H), 5,23 (с, 2H), 4,40 (с, 2H), 3,62 (с, 2H), 3,51 (с, 3H), 3,04-3,08 (м, 2H), 2,67 (т, J=5,7 Гц, 2H), 2,42-2,48 (м, 2H).
7-хлор-6-(метоксиметокси)-2H-спиро[1-бензофуран-3,4'-пиперидин] (100%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,20 (уш.с, 1H), 9,00 (уш.с, 1H), 7,01 (д, J=8,3 Гц, 1H), 6,78 (д, J=8,3 Гц, 1H), 5,24 (с, 2H), 4,60 (с, 2H), 3,40 (с, 3H), 3,28 (д, J=13,1 Гц, 2H), 2,90-3,03 (м, 2H), 2,07 (тд, J=13,1, 4,2 Гц, 2H), 1,84 (д, J=14,3 Гц, 2H).
7-Хлор-2H-спиро[1-бензофуран-3,4'-пиперидин]-6-ол,
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,88 (д, J=8,2 Гц, 1H), 6,45 (д, J=8,2 Гц, 1H), 4,43 (с, 2H), 2,86-2,92 (м, 2H), 2,48-2,55 (м, 2H), 1,66 (дт, J=11,6, 4,2 Гц, 2H), 1,84 (д, J=13,0 Гц, 2H). Rt 0,60 мин (Система B), [M+H]+ 240,1.
Аналогичным способом и как описано для соединения 29, 7-хлор-2H-спиро[1-бензофуран-3,4'-пиперидин]-6-ол преобразовывали в трет-бутил 3-{7-хлор-6-гидрокси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат.
Затем осуществляли реакцию Мицунобу и гидролиз (как описано для соединения 270) с получением следующих соединений:
Соединение 291. 3-{7-Хлор-6-[(2-хлор-6-циклопропилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,31-7,38 (м, 2H), 7,17 (д, J=8,2 Гц, 1H), 7,06 (дд, J=7,0, 1,8 Гц, 1H), 6,88 (д, J=8,2 Гц, 1H), 5,34 (с, 2H), 4,48 (с, 2H), 2,84-2,91 (м, 2H), 2,62 (т, J=7,0 Гц, 2H), 2,40 (т, J=7,0 Гц, 2H), 2,03-2,13 (м, 3H), 1,85 (т, J=11,5 Гц, 2H), 1,68 (д, J=12,8 Гц, 2H), 0,88-0,95 (м, 2H), 0,67-0,73 (м, 2H). Rt 1,48 мин (Система B), [M+H]+ 476,2.
Соединение 292. 3-(7-Хлор-6-{[2-фтор-6-(пропан-2-ил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропановая кислота.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,36-7,43 (м, 1H), 7,07-7,19 (м, 3H), 6,84 (д, J=8,3 Гц, 1H), 5,12 (с, 2H), 4,48 (с, 2H), 2,87 (д, J=11,7 Гц, 2H), 2,72 (кв., J=7,5 Гц, 2H), 2,61 (т, J=7,0 Гц, 2H), 2,40 (т, J=7,0 Гц, 2H), 2,07 (т, J=11,4 Гц, 2H), 1,79-1,89 (м, 2H), 1,67 (д, J=12,8 Гц, 2H), 1,18 (т, J=7,5 Гц, 3H). Rt 1,43 мин (Система B), [M+H]+ 448,2.
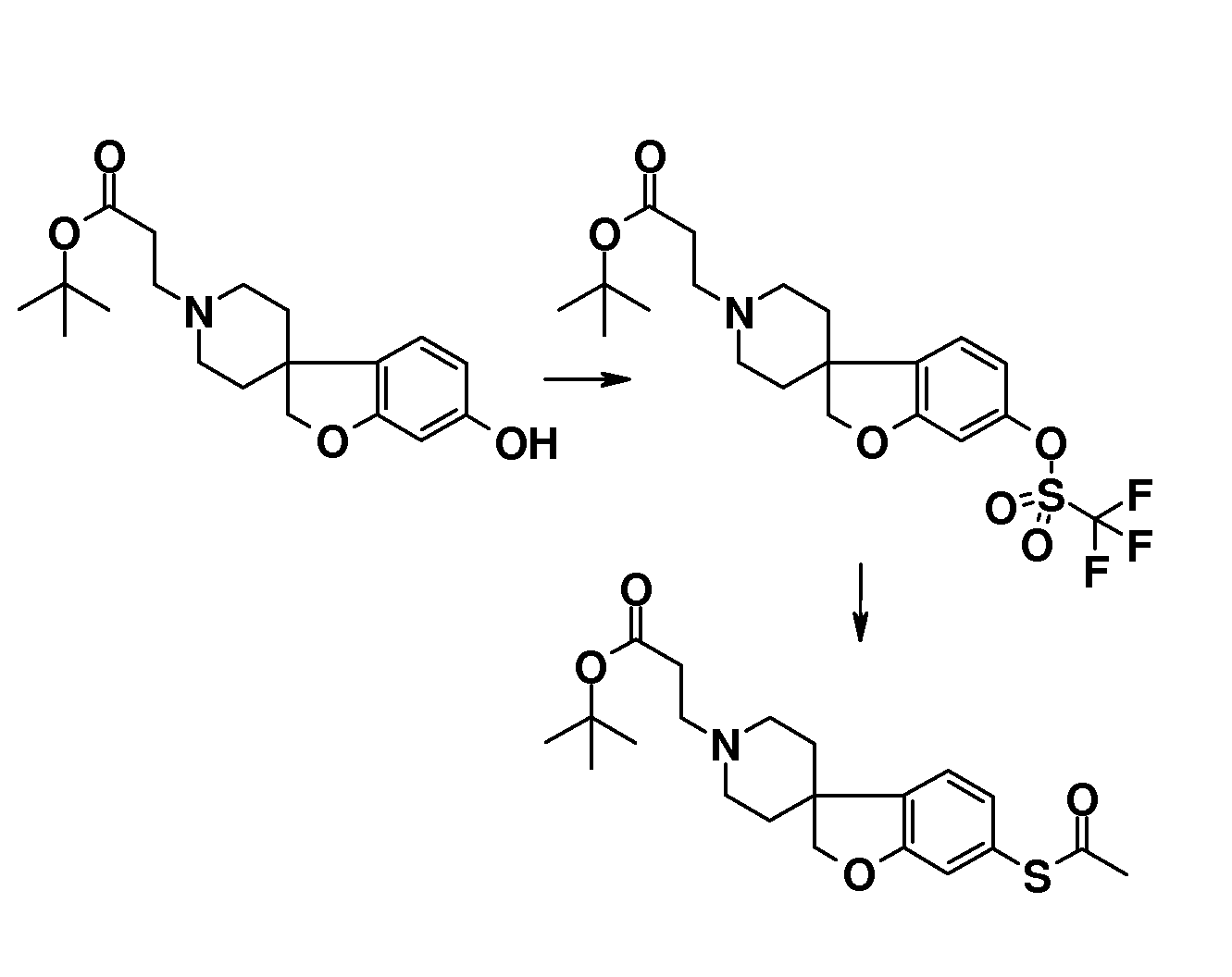
Трет-бутил 3-[6-(ацетилсульфанил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат. К раствору трет-бутил 3-{6-гидрокси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата (7,9 г, 23,7 ммоль) в 15 мл хлороформа добавляли триэтиламин (4,93 мл; 35,54 ммоль), 4-диметиламинопиридин (290 мг, 2,37 ммоль) и раствор трифторметансульфонимида (10,16 г, 28,43 ммоль), растворенного в 5 мл хлороформа. Полученную реакционную смесь нагревали при 60°C и перемешивали в течение ночи. Затем смесь охлаждали до 0°C, добавляли воду с последующим добавлением 5% NaHCO3 и смесь экстрагировали хлороформом. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, дихлорметан:ацетон 9:1) с получением трет-бутил 3-{6-[(трифторметан)сульфонилокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноата (9,5 г; 86%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,11 (д, J=8,2 Гц, 1H), 6,77 (дд, J=8,2 и 2,3 Гц, 1H), 6,68 (д, J=2,3 Гц, 1H), 4,34 (с, 2H), 2,85-2,94 (м, 2H), 2,69 (т, J=7,6 Гц, 2H), 2,45 (т, J=7,6 Гц, 2H), 2,02-2,10 (м, 2H), 1,86-1,97 (м, 2H), 1,72-1,75 (м, 2H), 1,46 (с, 9H).
При продувке азотом к раствору трет-бутил 3-{-{6-[(трифторметан)сульфонилокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноата (1,4 г, 3,01 ммоль) в толуоле (30 мл) добавляли (R)-1-[(1Sp)-2-(дициклогексилфосфино)ферроценил]этилди-трет-бутилфосфин (Strem chemicals; cataloque number 88733), (CyPF-t-Bu) (83,4 мг; 0,15 ммоль), с последующим добавлением трис-(дибензилиденацетон)-дипалладия(0) (68,85 мг; 0,08 ммоль). Эту смесь перемешивали в течение 5 минут. Затем добавляли тиоацетат калия (0,69 г; 6,02 ммоль) и полученную смесь нагревали при 110°C в течение 24 часов. Затем реакционную смесь охлаждали, разбавляли Et2O и фильтровали. Оставшийся органический слой сушили и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, дихлорметан:ацетон 9:1) с получением трет-бутил 3-[6-(ацетилсульфанил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноата (0,95 г; 80%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,14 (д, J=8 Гц, 1H), 6,93 (дд, J=8 и 2 Гц, 1H), 6,84 (д, J=2 Гц, 1H), 4,39 (с, 2H), 2,86-2,94 (м, 2H), 2,69 (т, J=8 Гц, 2H), 2,44 (т, J=8 Гц, 2H), 2,40 (с, 3H), 2,02-2,11 (м, 2H), 1,90-1,99 (м, 2H), 1,72-1,79 (м, 2H), 1,46 (с, 9H). Rt 1,53 мин (Система B), [M+H]+ 538,0.
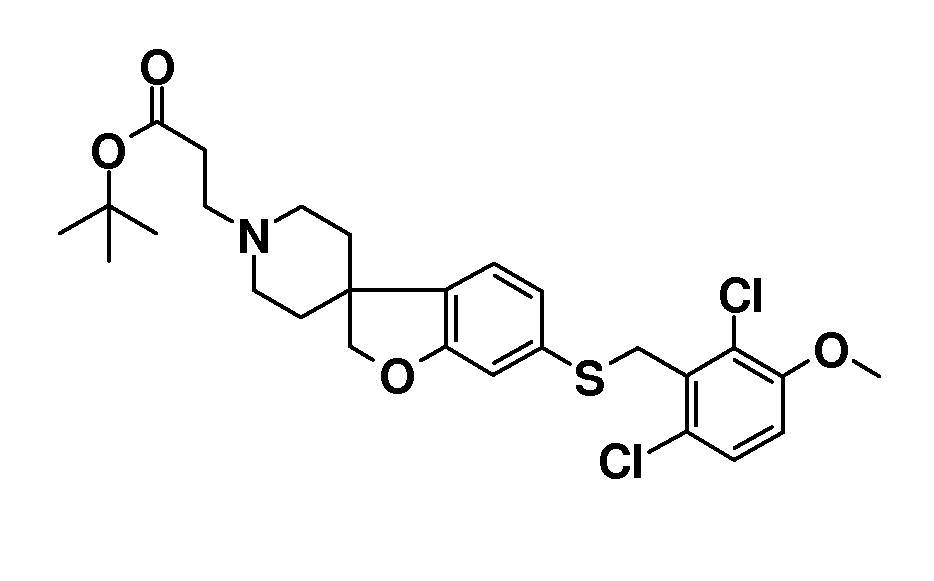
Трет-бутил 3-(6-{[(2,6-дихлор-3-метокси)фенил)метил]сульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. При охлаждении на ледяной бане раствор NaOH (22 мг; 0,55 ммоль) в 5 EtOH (5 мл) добавляли к трет-бутил 3-[6-(ацетил-сульфанил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноату (0,18 г; 0,46 ммоль), растворенному в EtOH (5 мл), и перемешивание продолжали в течение 30 минут, в это время LCMS анализ показал полное удаление защиты S-ацетила. К этой реакционной смеси добавляли 1,3-дихлор-2-(хлорметил)-4-метоксибензол (160 мг; 0,53 ммоль), растворенный в EtOH (2 мл), и перемешивали еще в течение 20 минут при 0°C. Затем реакционную смесь разбавляли EtOAc и промывали насыщенным солевым раствором. Оставшийся органический слой сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, дихлорметан:ацетон 9:1) с получением 3-(6-{[2,6-дихлор-3-метокси)фенил]метилсульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата 220 мг; 80%.
Необходимый 1,3-дихлор-2-(хлорметил)-4-метоксибензол получали из (уже описанного) (2,6-дихлор-3-метоксифенил)метанола с использованием тионилхлорида (14 экв.) в бензоле (75%).
Следующие соединения были получены аналогичным способом. Соответствующие бензилхлориды получали из указанных выше бензиловых спиртов:
Трет-бутил 3-(6-{[(4-бутил-2,6-дихлорфенил)метил]сульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-(6-{[(2-хлор-6-этилфенил)метил]сульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-(6-{[(2-хлор-6-циклопропилфенил)метил]сульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-(6-{[(2,6-дихлор-3-этилфенил)метил]сульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-(6-{[(2,4,6-трихлорфенил)метил]сульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-(6-{[(2,6-дихлорфенил)метил]сульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-(6-{[(2-хлорфенил)метил]сульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-(6-{[(2-метилфенил)метил]сульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-[6-(бензилсульфанил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-(6-{[(2-циклопропил-6-фторфенил)метил]сульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-[6-({[2-фтор-6-(пропан-2-ил)фенил]метил}сульфанил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат.
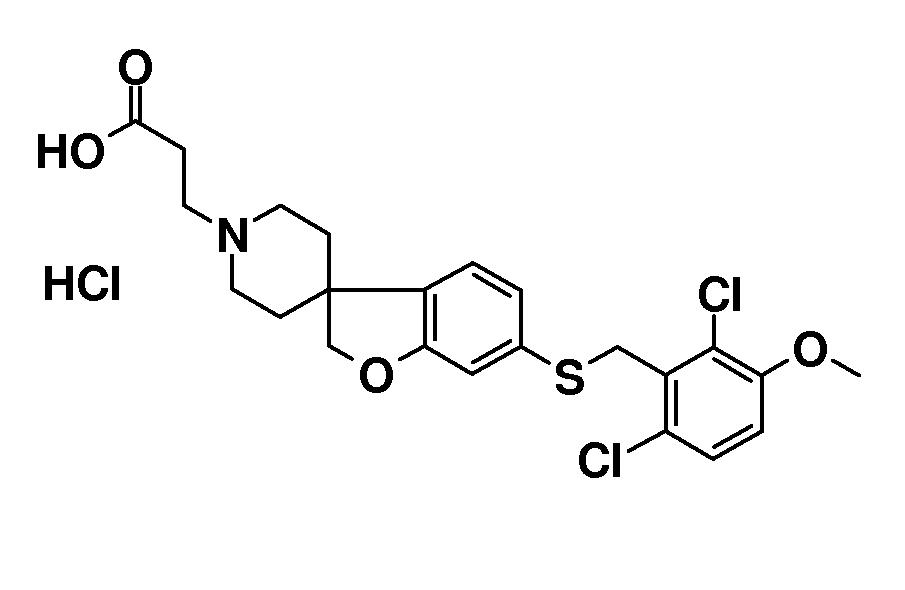
Соединение 138. Гидрохлорид 3-(6-{[(2,6-дихлор-3-метокси)фенил)метил]сульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты. Трет-бутил 3-(6-{[(2,6-дихлор-3-метокси)фенил)метил]сульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат (190 мг, 0,35 ммоль) растворяли в 4M растворе HCl в 1,4-диоксане (10 мл; 4 моль/л; 40 ммоль) и перемешивали в течение 48 часов при комнатной температуре. Затем растворитель удаляли в вакууме и остаток обрабатывали iPr2O, осадок собирали фильтрованием и сушили в течение ночи при пониженном давлении с получением продукта (144 мг, 82%). Rt 1,45 мин (Система B), [M+H]+ 482,0
Следующие соединения были получены аналогичным способом:
Соединение 139. Гидрохлорид 3-(6-{[(4-бутил-2,6-дихлорфенил)метил]сульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,75 мин (Система B), [M+H]+ 508,0
Соединение 140. Гидрохлорид 3-(6-{[(2-хлор-6-этилфенил)метил]сульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,73 (уш.с, 1H), 10,27 (уш.с, 1H), 7,19-7,35 (м, 3H), 7,06 (уш.с, 1H), 6,94 (д, J=8 Гц, 1H), 6,88 (с, 1H), 4,50 (уш.с, 2H), 4,31 (с, 2H), 3,27-3,54 (м, 4H), 2,99-3,15 (м, 2H), 2,85 (т, J=8 Гц, 2H), 2,66-2,74 (м, 2H), 2,12-2,26 (м, 2H), 1,84-1,94 (м, 2H), 1,18 (т, J=8 Гц, 3H).
Соединение 141. Гидрохлорид 3-(6-{[(2-хлор-6-циклопропилфенил)метил]сульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,82 (уш.с, 1H), 9,91 (уш.с, 1H), 7,36 (д, J=8 Гц, 1H), 7,28 (т, J=8 Гц, 1H), 7,13 (уш.с, 1H), 7,03 (т, J=8 Гц, 2H), 6,96 (д, J=2 Гц, 1H), 4,56 (уш.с, 4H), 3,37-3,59 (м, 4H), 3,19-3,25 (м, 2H), 2,88 (т, J=8 Гц, 2H), 2,17-2,23 (м, 2H), 2,09-2,13 (м, 1H), 1,92-1,99 (м, 2H), 0,96-1,12 (м, 2H), 0,64-0,80 (м, 2H). Rt 1,52 мин (Система В), [M+H]+ 458,0
Соединение 142. Гидрохлорид 3-(6-{[(2,6-дихлор-3-этилфенил)метил]сульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,57 мин (Система B), [M+H]+ 480,0
Соединение 143. Гидрохлорид 3-(6-{[(2,4,6-трихлорфенил)метил]сульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,82 (уш.с, 1H), 10,09 (уш.с, 1H), 7,71 (с, 2H), 7,05 (уш.с, 1H), 6,94 (д, J=8 Гц, 1H), 6,88 (д, J=2 Гц, 1H), 4,50 (уш.с, 2H), 4,34 (с, 2H), 3,26-3,54 (м, 4H), 2,99-3,12 (м, 2H), 2,83 (т, J=8 Гц, 2H), 2,10-2,22 (м, 2H), 1,85-1,92 (м, 2H). Rt 1,55 мин (Система B), [M+H]+ 487,9
Соединение 144. Гидрохлорид 3-(6-{[(2,6-дихлорфенил)метил]сульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,55 (уш.с, 1H), 10,18 (уш.с, 1H), 7,50 (д, J=8 Гц, 2H), 7,35 (т, J=8 Гц, 1H), 7,06 (уш.с, 1H), 6,95 (уш. д, J=8 Гц, 1H), 6,89 (с, 1H), 4,50 (уш.с, 2H), 4,39 (с, 2H), 3,27-3,54 (м, 4H), 2,99-3,12 (м, 2H), 2,84 (т, J=8 Гц, 2H), 2,09-2,24 (м, 2H), 1,85-1,92 (м, 2H). Rt 1,44 мин (Система B), [M+H]+ 451,9.
Соединение 145. Гидрохлорид 3-(6-{[(2-хлорфенил)метил]сульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,82 (уш.с, 1H), 10,00 (уш.с, 1H), 7,41-7,48 (м, 2H), 7,25-7,33 (м, 2H), 7,03 (уш.с, 1H), 6,88 (д, J=8 Гц, 1H), 6,84 (с, 1H), 4,47 (уш.с, 2H), 4,28 (с, 2H), 3,18-3,55 (м, 4H), 2,97-3,12 (м, 2H), 2,83 (т, J=8 Гц, 2H), 2,06-2,21 (м, 2H), 1,81-1,91 (м, 2H). Rt 2,31 мин (Система B), [M+H]+ 418,0.
Соединение 146. Гидрохлорид 3-(6-{[(2-метилфенил)метил]сульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,72 мин (Система B), [M+H]+ 398,1
Соединение 147. Гидрохлорид 3-[6-(бензилсульфанил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д.
Rt 1,35 мин (Система В), [M+H]+ 384,1
Соединение 293. Гидрохлорид 3-(6-{[(2-циклопропил-6-фторфенил)метил]сульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,73 (уш.с, 1H), 10,27 (уш.с, 1H), 7,20-7,25 (м, 1H), 6,97-7,06 (м, 2H), 6,93 (д, J=8 Гц, 1H), 6,88 (с, 1H), 6,80 (д, J=8 Гц, 1H), 4,49 (уш.с, 2H), 4,35 (с, 2H), 3,25-3,53 (м, 4H), 3,01-3,13 (м, 2H), 2,83 (т, J=8 Гц, 2H), 2,11-2,22 (м, 2H), 2,01-2,08 (м, 1H), 1,87 (д, J=8 Гц, 2H), 0,91-0,98 (м, 2H), 0,64-0,68 (м, 2H). Rt 1,47 мин (Система B), [M+H]+ 442,2.
Соединение 294. Гидрохлорид 3-[6-({[2-фтор-6-(пропан-2-ил)фенил]метил}сульфанил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,27-7,46 (м, 1H), 6,93-7,14 (м, 5H), 4,50 (уш.с, 2H), 4,22 (уш.с, 2H), 3,32-3,53 (м, 4H), 3,12-3,17 (м, 2H), 2,81-2,86 (м, 3H), 2,13-2,18 (м, 2H), 1,85-1,91 (м, 2H), 1,16 (д, J=8 Гц, 6H). Rt 1,48 мин (Система B), [M+H]+ 444,3.
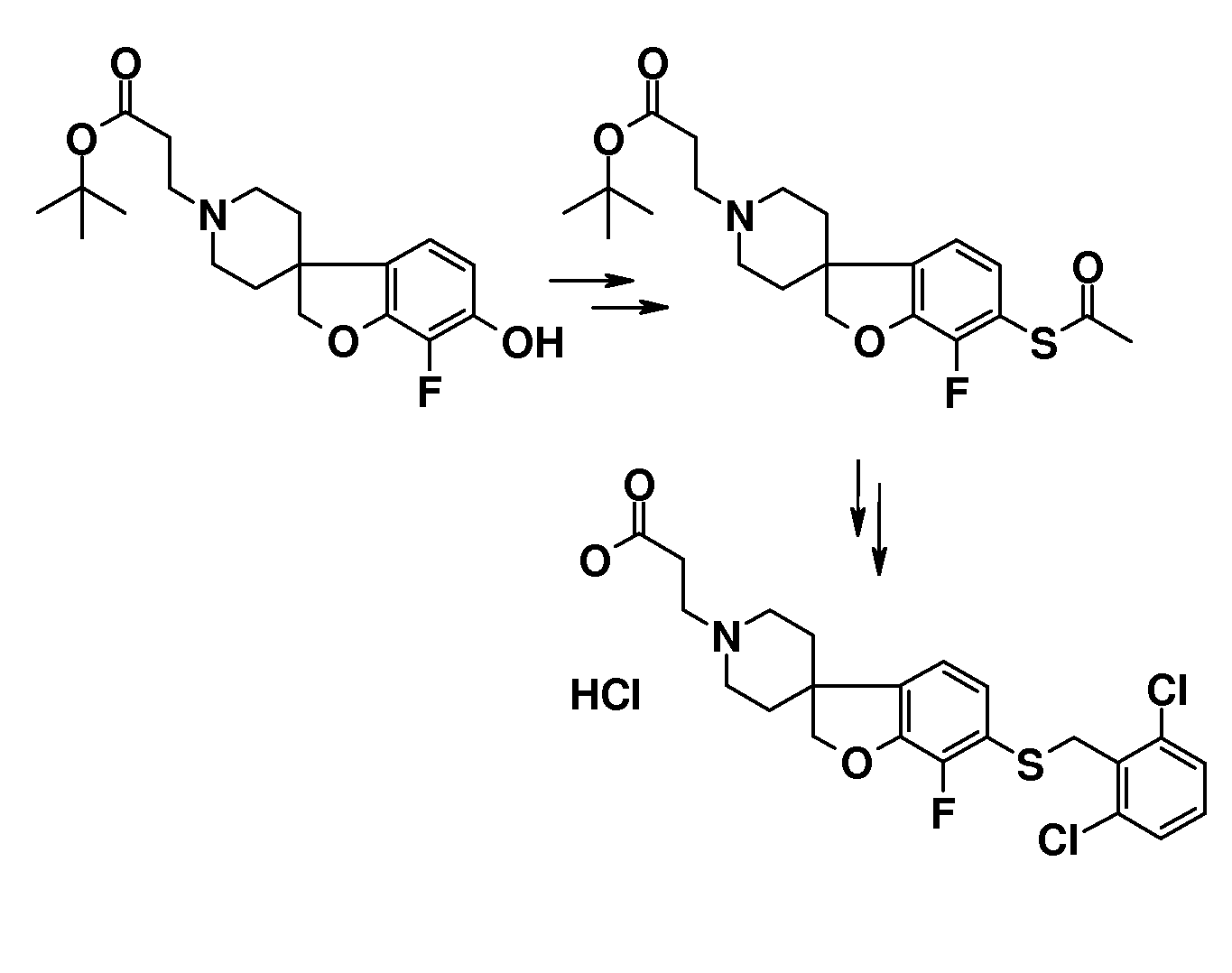
Трет-бутил 3-{7-фтор-6-гидрокси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-пропаноат преобразовывали в трет-бутил 3-[6-(ацетилсульфанил)-7-фтор-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат,
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 6,86-6,94 (м, 3H), 4,50 (с, 2H), 2,88-2,94 (м, 2H), 2,67-2,72 (т, J=8 Гц, 2H), 2,44 (т, J=8 Гц, 5H), 2,01-2,10 (м, 2H), 1,91-1,99 (м, 2H), 1,78-1,82 (м, 2H), 1,46 (с, 9H)
и преобразовывали в следующие соединения (аналогичным способом и как описано для соединения 138):
Соединение 295. Гидрохлорид 3-(6-{[(2,6-дихлорфенил)метил]сульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,64 (уш.с, 1H), 9,82 (уш.с, 1H), 7,47 (д, J=8 Гц, 2H), 7,31-7,36 (м, 1H), 6,95-6,99 (м, 1H), 6,88-6,91 (м, 1H), 4,64 (уш.с, 2H), 4,33 (с, 2H), 3,31-3,52 (м, 4H), 3,03-3,12 (м, 2H), 2,82 (т, J=8 Гц, 2H), 2,11-2,19 (м, 2H), 1,92-1,98 (м, 2H). Rt 1,49 мин (Система B), [M+H]+ 470,1.
Соединение 296. Гидрохлорид 3-(6-{[(2-хлор-6-этилфенил)метил]сульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,64 (уш.с, 1H), 9,90 (уш.с, 1H), 7,18-7,32 (м, 3H), 7,00-7,05 (м, 1H), 6,87-6,94 (м, 1H), 4,63 (уш.с, 2H), 4,27 (с, 2H), 3,25-3,54 (м, 4H), 2,96-3,13 (м, 2H), 2,83 (т, J=8 Гц, 2H), 2,63-2,72 (м, 2H), 2,11-2,20 (м, 2H), 1,89-2,00 (м, 2H), 1,15 (т, J=8 Гц, 3H). Rt 1,67 мин (Система B), [M+H]+ 464,1.
Соединение 297. Гидрохлорид 3-[7-Фтор-6-(пентилсульфанил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,63 (уш.с, 1H), 10,27 (уш.с, 1H), 6,94-6,99 (м, 2H), 6,89-6,92 (м, 1H), 4,63 (уш.с, 2H), 3,26-3,54 (м, 4H), 2,91 (т, J=8 Гц, 2H), 2,85 (т, J=8 Гц, 2H), 2,14-2,25 (м, 2H), 1,89-1,97 (м, 2H), 1,50-1,59 (м, 2H), 1,23-1,40 (м, 6H), 0,91 (т, J=8 Гц, 3H). Rt 1,43 мин (Система B), [M+H]+ 382,7.
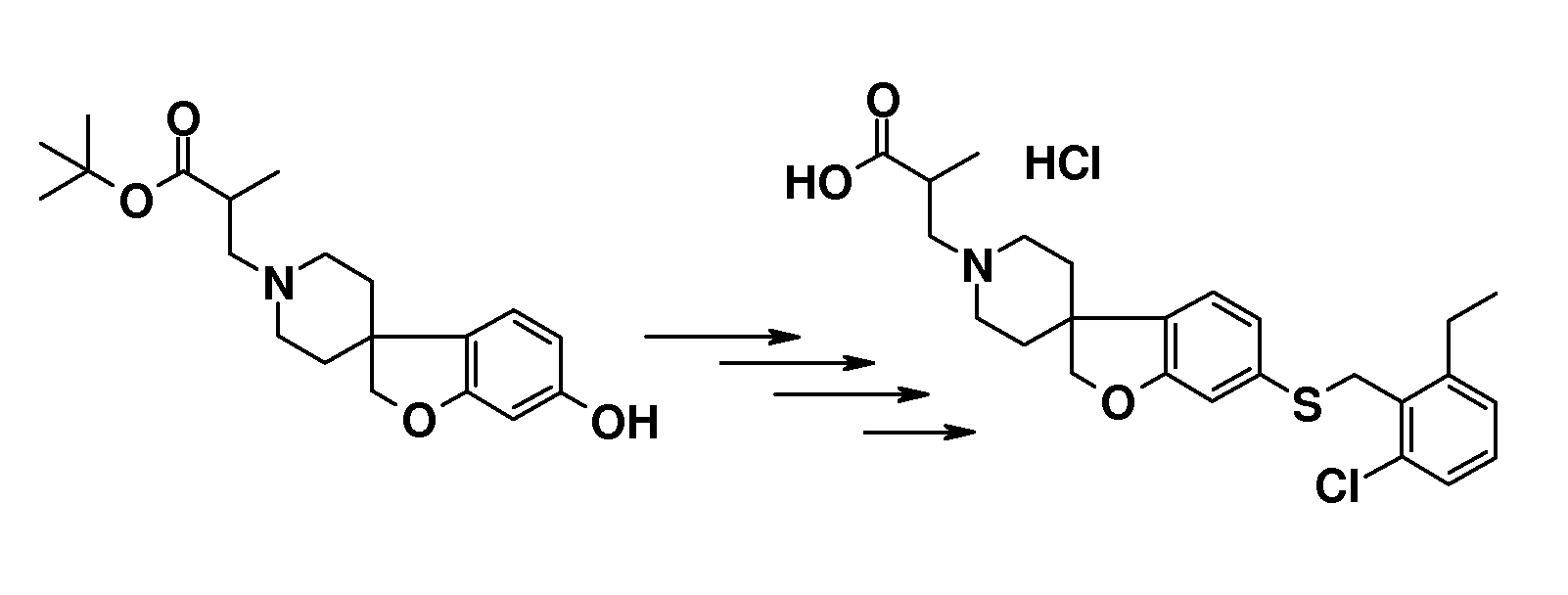
Следующие соединения, исходя из трет-бутил 3-{6-гидрокси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропаноата, были получены в соответствии с процедурой, описанной для соединения 138.
Соответствующие бензилхлориды были получены из уже описанных бензиловых спиртов:
Соединение 148. Гидрохлорид 2-метил-3-(6-{[(2,4,6-трихлорфенил)метил]сульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 13,00 (уш.с, 1H), 9,64 (уш.с, 1H), 7,82 (с, 2H), 7,06 (д, J=8 Гц, 1H), 7,18 (уш.с, 1H), 7,01 (д, J=2 Гц, 1H), 4,61 (уш.с, 2H), 4,46 (с, 2H), 3,41-3,65 (м, 4H), 3,16-3,27 (м, 2H), 3,07-3,14 (м, 1H), 2,25-2,39 (м, 2H), 1,95-2,05 (м, 2H), 1,35 (д, J=8 Гц, 3H). Rt 1,65 мин (Система B), [M+H]+ 502,0.
Соединение 149. Гидрохлорид 3-(6-{[(2,6-дихлор-3-метоксифенил)метил]сульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,91 (уш.с, 1H), 9,82 (уш.с, 1H), 7,45 (д, J=8 Гц, 1H), 7,14 (д, J=8 Гц, 1H), 7,05 (уш.с, 1H), 6,95 (д, J=8 Гц, 1H), 6,89 (д, J=2 Гц, 1H), 4,49 (уш.с, 2H), 4,37 (с, 2H), 3,86 (с, 3H), 3,42-3,55 (м, 3H), 2,98 (м, 4H), 2,18-2,29 (м, 2H), 1,83-1,91 (м, 2H), 1,24 (д, J=8 Гц, 3Н).
Соединение 150. Гидрохлорид 3-(6-{[(2,6-дихлор-4-метилфенил)метил]сульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропановой кислоты. Rt 1,55 мин (Система B), [M+H]+ 487,9
Соединение 151. Гидрохлорид 3-(6-{[(2-хлор-6-этилфенил)метил]сульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропановой кислоты. Rt 1,57 мин (Система B), [M+H]+ 460,1
Соединение 152. Гидрохлорид 3-[6-({[2-хлор-6-(пропан-2-ил)фенил]метил}сульфанил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,82 (уш.с, 1H), 9,82 (уш.с, 1H), 7,27-7,33 (м, 3H), 7,01-7,09 (уш.с, 1Н), 6,94 (д, J=8 Гц, 1H), 6,88 (с, 1H), 4,49 (уш.с, 2H), 4,34 (с, 2H), 3,31-3,52 (м, 4H), 2,99-3,21 (м, 4H), 2,19-2,33 (м, 2H), 1,82-1,92 (м, 2H), 1,24 (д, J=8 Гц, 3H), 1,16 (д, J=8 Гц, 6H).
Соединение 153. Гидрохлорид 3-(6-{[(2,6-дихлорфенил)метил]сульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,82 (уш.с, 1H), 9,82 (уш.с, 1H), 7,49 (д, J=8 Гц, 2H), 7,38 (т, J=8 Гц, 1H), 7,06 (уш.с, 1H), 6,95 (д, J=8 Гц, 1H), 6,88 (с, 1H), 4,49 (уш.с, 2H), 4,38 (с, 2H), 3,30-3,53 (м, 4H), 2,98-3,17 (м, 3H), 2,18-2,35 (м, 2H), 1,82-1,93 (м, 2H), 1,24 (д, J=8 Гц, 3H).
Соединение 298. Гидрохлорид 3-(6-{[(2-хлор-6-циклопропилфенил)метил]сульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,87 (уш.с, 1H), 9,80 (уш.с, 1H), 7,31 (д, J=4 Гц, 1H), 7,23 (т, J=4 Гц, 1H), 7,04 (уш.с, 1H), 6,98 (т, J=4 Гц, 2H), 6,90 (с, 1H), 4,46 (с, 4H), 3,30-3,55 (м, 4H), 3,00-3,15 (м, 3H), 2,20-2,30 (м, 2H), 2,02-2,10 (м, 1H), 1,84-1,91 (м, 2H), 1,23 (д, J=4 Гц, 3H), 0,91-0,95 (м, 2H), 0,66-0,70 (м, 2H). Rt 1,58 мин (Система B), [M+H]+ 472,1.
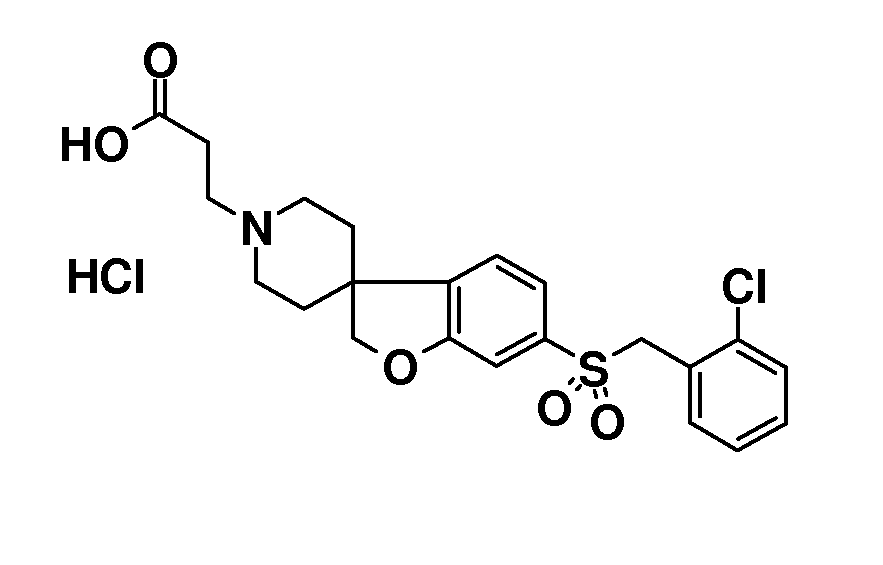
Соединение 154. Гидрохлорид 3-(6-{[(2-хлорфенил)метан]сульфонил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты. Трет-бутил 3-(6-{[(2-хлорфенил)метил]сульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат (237 мг, 0,50 ммоль) растворяли в 4M растворе HCl в 1,4-диоксане (10 мл; 4 моль/л; 40 ммоль) и перемешивали в течение 5 минут при комнатной температуре. Затем растворитель удаляли в вакууме и остаток обрабатывали iPr2O, осадок собирали фильтрованием. К этой HCl соли, растворенной в MeOH (7,50 мл) при 0°C, добавляли пероксимоносульфат калия (922 мг; 1,50 ммоль) в H2O (7,50 мл) и реакционную смесь перемешивали в течение 2 часов. Затем реакционную смесь разбавляли дихлорметаном и промывали 5% водным раствором NaHCO3 и насыщенным солевым раствором. Оставшийся органический слой сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, дихлорметан:ацетон 9:1) с получением трет-бутил 3-(6-{[(2-хлорфенил)метан]сульфонил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата (220 мг; 72,5%), который растворяли в 4M растворе HCl в 1,4-диоксане (10 мл; 4 моль/л; 40 ммоль) и перемешивали в течение 48 часов при комнатной температуре. Затем растворитель удаляли в вакууме и остаток обрабатывали iPr2O, осадок собирали фильтрованием и сушили в течение ночи при пониженном давлении с получением продукта (150 мг, 70%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,55 (уш.с, 1H), 10,27 (уш.с, 1H), 7,24-7,44 (м, 6H), 7,08 (с, 1H), 4,74 (с, 2H), 4,59 (уш.с, 2H), 3,24-3,54 (м, 4H), 3,01-3,14 (м, 2H), 2,81-2,89 (т, J=8 Гц, 2H), 2,15-2,28 (м, 2H), 1,89-1,96 (м, 2Н). Rt 1,36 мин (Система В), [M+H]+ 450,0.
Следующее соединение было получено аналогичным способом:,
Соединение 299. Гидрохлорид 3-(6-{[(2,6-дихлорфенил)метан]сульфонил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,64 (уш.с, 1H), 10,27 (уш.с, 1H), 7,52 (д, J=8 Гц, 2H), 7,40-7,45 (м, 2H), 7,32-7,39 (м, 2H), 4,87 (с, 2H), 4,63 (с, 2H), 3,26-3,56 (м, 4H), 3,01-3,16 (м, 2H), 2,84 (т, J=8 Гц, 2H), 2,17-2,28 (м, 2H), 1,91-1,99 (м, 2H). Rt 1,24 мин (Система B), [M+H]+ 484,1.
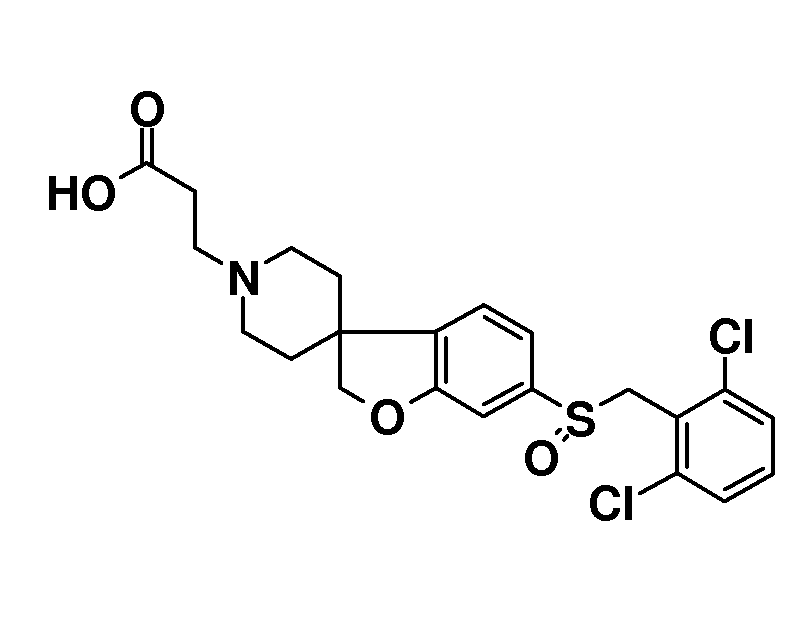
Соединение 300. Гидрохлорид 3-(6-{[(2,6-дихлорфенил)метан]сульфинил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты. К гидрохлориду трет-бутил 3-(6-{[(2,6-дихлорфенил)-метил]сульфанил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-пропаноата (210 мг, 0,41 ммоль), растворенному в MeOH (7,50 мл) при 0°C, добавляли пероксимоносульфат калия (254 мг; 0,41 ммоль) в H2O (7,50 мл) и реакционную смесь перемешивали в течение 2 часов. Затем реакционную смесь разбавляли EtOAc и промывали 5% водным раствором NaHCO3 и насыщенным солевым раствором. Оставшийся органический слой сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, дихлорметан:ацетон 95:5) с получением трет-бутил 3-(6-{[(2,6-дихлорфенил)метан]сульфинил}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата (130 мг), который растворяли в 2M водном растворе NaOH (1 мл; 2 ммоль) и этаноле (10 мл). Реакционную смесь перемешивали в течение 3 часов при 60°C и затем охлаждали до 0°C. К этой реакционной смеси добавляли по каплям водный раствор HCl (2 мл; 1 моль/л), затем смесь концентрировали в вакууме. Остаток обрабатывали насыщенным солевым раствором и дихлорметаном. Водный слой промывали дихлорметаном (два раза). Затем органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме, с последующей обработкой iPr2O. Образовавшийся осадок собирали фильтрованием, промывали iPr2O и сушили в вакууме с получением продукта (100 мг; 70%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,57 (д, J=8 Гц, 2H), 7,44-7,49 (м, 2H), 7,03-7,09 (м, 2H), 4,56 (д, J=12 Гц, 3H), 4,39 (д, J=12 Гц, 1H), 2,92-3,01 (м, 2H), 2,71 (т, J=8 Гц, 2H), 2,48 (т, J=8 Гц, 2H), 2,15-2,23 (м, 2H), 1,89-1,99 (м, 2H), 1,71-1,79 (м, 2H). Rt 1,35 мин (Система B), [M+H]+ 468,1.
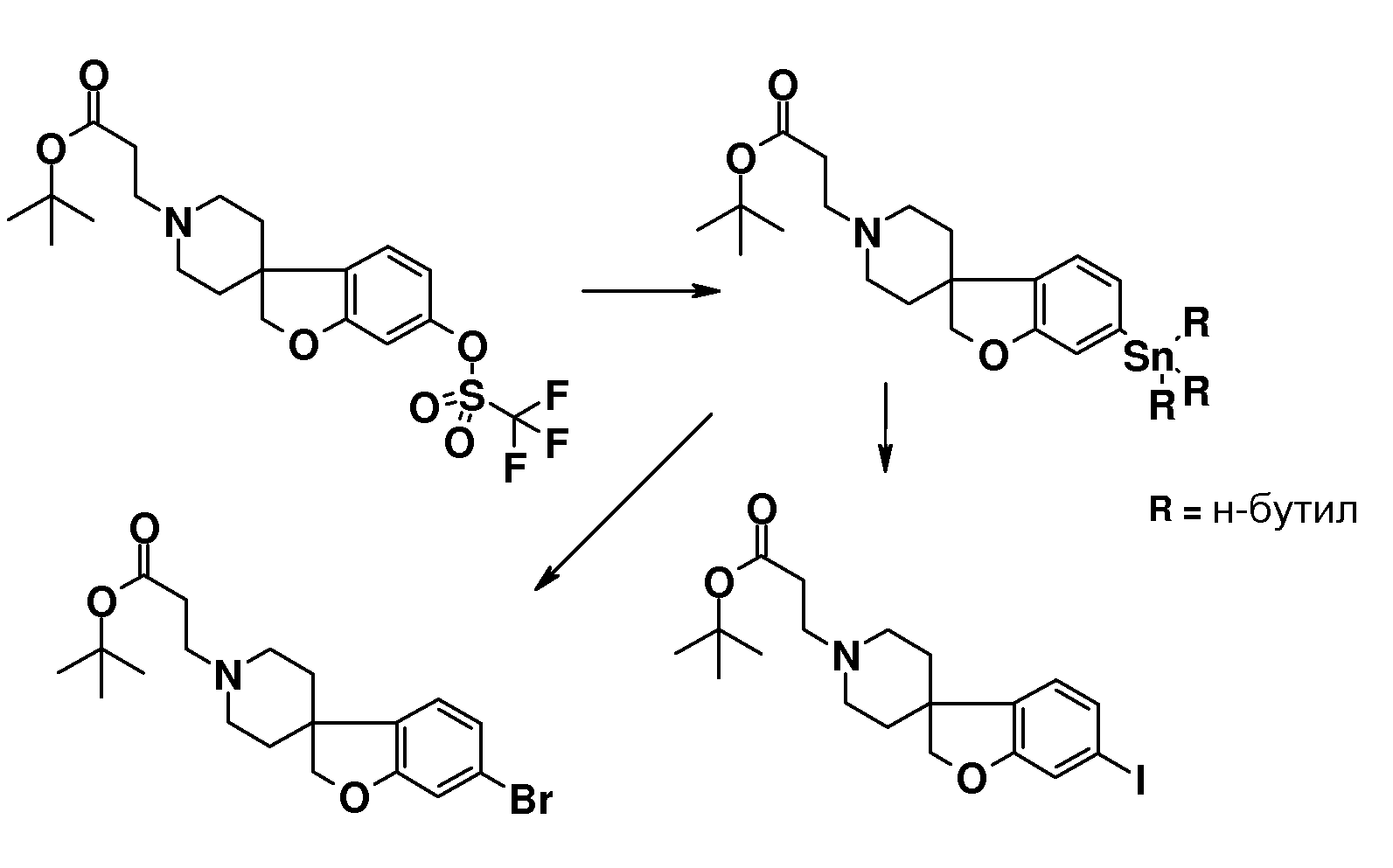
Трет-бутил 3-{6-иод-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
При продувке азотом к раствору трет-бутил 3-{-{6-[(трифторметан)сульфонилокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноата (5 г, 10,74 ммоль) и гекса-N-бутилдиолова (12,46 г; 21,48 ммоль) в 1,4-диоксане (25 мл) добавляли хлорид лития (2,28 г; 53,7 ммоль) и тетракис(трифенилфосфин)палладий(0). Эту смесь перемешивали в течение 72 часов при 108°C. Затем реакционную смесь охлаждали, разбавляли Et2O и экстрагировали раствором KF в H2O (5 моль/л). Органический слой сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:3) с получением трет-бутил 3-[6-(трибутилстаннил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноата (4,29 г; 66%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,11 (д, J=8,2 Гц, 1H), 6,96 (д, J=8,2 Гц, 1H), 6,91 (с, 1H), 4,34 (с, 2H), 2,85-2,94 (м, 2H), 2,69 (т, 7,8 Гц, 2H), 2,45 (т, J=7,8 Гц, 2H), 2,02-2,12 (м, 2H), 1,93-2,01 (м, 2H), 1,72-1,77 (м, 2H), 1,47-1,68 (м, 6H), 1,46 (с, 9H), 1,26-1,39 (м, 6H), 0,99-1,04 (м, 6H), 0,89 (т, J=7,2 Гц, 9H).
К охлажденному на ледяной бане раствору трет-бутил 3-[6-(трибутилстаннил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноата (3 г; 4,95 ммоль), растворенного в ТГФ (50 мл), добавляли N-иодсукцинимид (1,67 г; 7,42 ммоль) (порциями). Полученную реакционную смесь перемешивали в течение 75 минут (при 0°C). Затем реакционную смесь разбавляли EtOAc и Na2S2O3. Органический слой промывали насыщенным солевым раствором, сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, дихлорметан:ацетон 9:1) с получением трет-бутил 3-{6-иод-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата (1,55 г; 70%). Rt 1,32 мин (Система B), [M+H]+ 444,0
Трет-бутил 3-{6-бром-2H-спиро[1-бензофуран-3,4'-пиперидин]- 1'-ил}пропаноат получали из 3-[6-(трибутилстаннил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноата аналогичным способом с использованием N-бромсукцинимида (57%).
Трет-бутил 3-{6-[(2-метилфенил)сульфанил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. При продувке азотом к раствору трет-бутил 3-{6-иод-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата (0,2 г, 0,43 ммоль) в 1,2-диметоксиэтане (5 мл) добавляли 2-метилбензол-1-тиол (0,05 мл; 0,43 ммоль) и карбонат калия (118 мг; 0,86 ммоль) и в конце иодид меди(I) (9 мг; 0,045 ммоль). Эту смесь перемешивали в течение 24 часов при 93°C. Добавляли дополнительное количество 2-метилбензол-1-тиола (0,01 мл) и иодида меди(I) (10 мг) и реакционную смесь перемешивали еще в течение 4 часов. Затем реакционную смесь охлаждали, разбавляли EtOAc и экстрагировали насыщенным раствором NH4Cl и насыщенным солевым раствором. Органический слой сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, дихлорметан:ацетон 9:1) с получением трет-бутил 3-{6-[(2-метилфенил)сульфанил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата (0,14 г; 74%). Rt 1,47 мин (Система B), [M+H]+ 444,1
Следующее соединение было получено аналогичным способом:
Трет-бутил 3-{6-[(2,6-дихлорфенил)сульфанил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[(2-метилбензол)сульфонил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. Это соединение получали из трет-бутил 3-{6-[(2-метилфенил)сульфанил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата с использованием процедуры получения соединения 154.
Трет-бутил 3-{6-[(2,6-дихлорбензол)сульфонил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. К раствору трет-бутил 3-[6-(трибутилстаннил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноата (450 мг; 0,74 ммоль), растворенного в ТГФ (15 мл), добавляли н-бутиллитий (0,45 мл; 2,50 моль/л; 1,11 ммоль) при -78°C. Реакционную смесь перемешивали в течение 30 минут. Затем добавляли раствор 2,6-дихлорбензол-1-сульфонилфторида (0,2 г; 0,87 ммоль), растворенного в ТГФ (7 мл), при -78°C. Полученную смесь перемешивали и давали нагреться до комнатной температуры в течение ночи. Реакцию гасили путем добавления насыщенного водного раствора NaH4Cl. Полученную смесь экстрагировали Et2O и промывали 10 мл KF (10% в H2O). Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, дихлорметан:ацетон 9:1) с получением продукта (75 мг; 19%) Rt 1,35 мин (Система B), [M+H]+ 525,9
Следующее соединение было получено аналогичным способом:
Трет-бутил 3-[6-(бензолсульфонил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Соединение 155. Гидрохлорид 3-{6-[(2-метилфенил)сульфанил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты. Трет-бутил 3-{6-[(2-метилфенил)сульфанил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат (120 мг, 0,25 ммоль) растворяли в 4M растворе HCl в 1,4-диоксане (10 мл; 4 моль/л; 40 ммоль) и перемешивали в течение 48 часов при комнатной температуре. Затем растворитель удаляли в вакууме и остаток обрабатывали iPr2O, осадок собирали фильтрованием и сушили в течение ночи при пониженном давлении с получением продукта (90 мг, 82%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,73 (уш.с, 1H), 10,27 (уш.с, 1H), 7,18-7,38 (м, 4H), 7,08 (уш.с, 1H), 6,74 (д, J=8 Гц, 1H), 6,55 (с, 1H), 4,48 (уш.с, 2H), 3,23-3,55 (м, 4H), 2,95-3,15 (м, 2H), 2,80-2,88 (м, 2H), 2,32 (с, 3H), 2,08-2,23 (м, 2H), 1,84-1,93 (м, 2H). Rt 1,40 мин (Система B), [M+H]+ 384,1.
Следующее соединение было получено аналогичным способом:
Соединение 156. Гидрохлорид 3-{6-[(2,6-Дихлорфенил)сульфанил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,73 (уш.с, 1H), 10,18 (уш.с, 1H), 7,70 (д, J=8 Гц, 2H), 7,56 (т, J=8 Гц, 1H), 7,04 (уш.с, 1H), 6,59 (дд, J=8 и 2 Гц, 1H), 6,44 (с, 1H), 4,47 (уш.с, 2H), 3,25-3,53 (м, 4H), 2,96-3,11 (м, 2H), 2,82 (т, J=8 Гц, 2H), 2,06-2,18 (м, 2H), 1,83-1,92 (м, 2H). Rt 1,39 мин (Система B), [M+H]+ 437,9.
Соединение 157. Гидрохлорид 3-{6-[(2-метилбензол)сульфонил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты. Rt 1,21 мин (Система B), [M+H]+ 416,0
Соединение 158. Гидрохлорид 3-{6-[(2,6-дихлорбензол)сульфонил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,63 мин (Система B), [M+H]+ 469,9
Соединение 159. Гидрохлорид 3-[6-(бензолсульфонил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты. Rt 1,40 мин (Система [M+H]+ 384,1
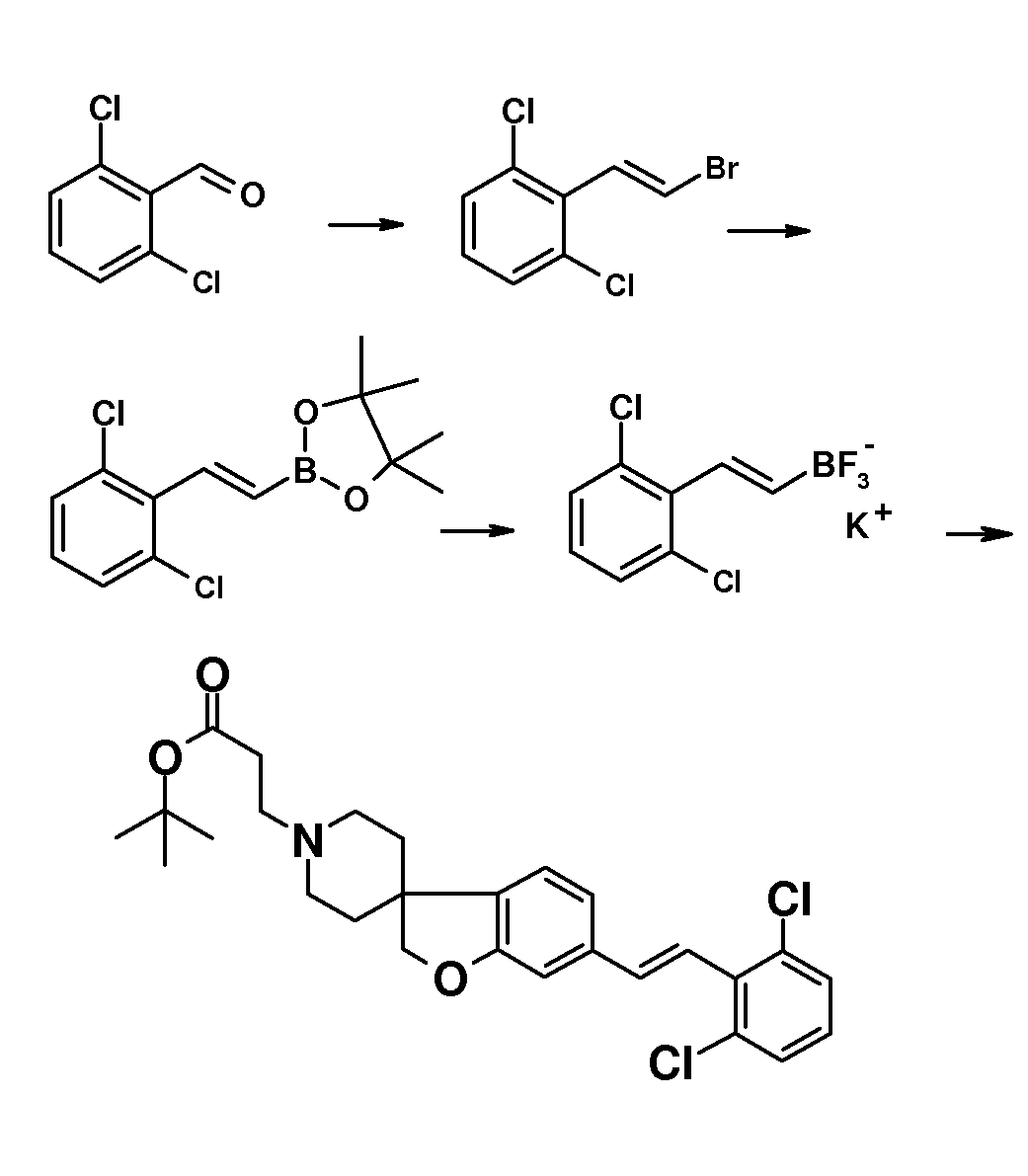
Трет-бутил 3-{6-[(E)-2-(2,6-дихлорфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
К раствору (бромметил)трифенилфосфонийбромида (23,92 г; 54,85 ммоль), растворенного в ТГФ (150 мл), добавляли суспензию трет-бутоксида калия (6,16 г; 54,85 ммоль) в ТГФ (50 мл), при -78°C (Adv. Synth. Catal., 2006, 348, 851). Реакционную смесь перемешивали в течение 2 часов. Затем добавляли по каплям раствор 2,6-дихлорбензальдегида (8 г; 45,71 ммоль), растворенного в ТГФ (50 мл), при -78°C. Полученную смесь перемешивали и давали нагреться до комнатной температуры в течение ночи. Реакцию гасили путем добавления насыщенного водного раствора NaH4Cl. Полученную смесь экстрагировали Et2O и промывали насыщенным солевым раствором. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, гексан) с получением 2-[(E)-2-бромэтенил]-1,3-дихлорбензола (7,22 г; 62%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,32 (д, J=8,0 Гц, 2H), 7,12-7,20 (м, 2H), 6,97 (д, J=14,2 Гц, 1H).
При продувке азотом к смеси 2-[(E)-2-бромэтенил]-1,3-дихлорбензола (7,22 г; 28,66 ммоль) в 1,4-диоксане (200 мл), добавляли последовательно бис(пинаколато)дибор (8,01 г; 31,52 ммоль), ацетат калия (8,44 г; 85,97 ммоль), комплекс 1',1'-бис(дифенилфосфино)-ферферроценпалладий(II)дихлорида с дихлорметаном (0,7 г; 0,86 ммоль) и (дополнительно количество) 1',Ι'-бис(дифенилфосфино)-ферферроцен (0,48 г; 0,86 ммоль). Полученную смесь нагревали в течение ночи (85°C). После охлаждения до комнатной температуры реакционную смесь разбавляли EtOAc, фильтровали и промывали H2O. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:7) с получением 2-[(E)-2-(2,6-дихлорфенил)этенил]-4,4,5,5-тетраметил-1,3,2-диоксаборолана (6,24 г; 72%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,39 (д, J=18,8 Гц, 1H), 7,31 (д, J=8,0 Гц, 2H), 7,11 (д, J=8,0 Гц, 1H), 6,24 (д, J=18,8 Гц, H), 1,33 (с, 12H).
К смеси 2-[(E)-2-(2,6-дихлорфенил)этенил]-4,4,5,5-тетраметил-1,3,2-диоксаборолана (2,5 г; 8,36 ммоль) в MeOH (60 мл) и воде (15 мл) добавляли бифторид калия (4,57 г; 58,3 ммоль) и перемешивали при комнатной температуре в течение ночи. Затем растворители удаляли в вакууме и остаток обрабатывали толуолом и концентрировали в вакууме. Последние стадии повторяли три раза, чтобы полностью удалить воду. Полученное твердое вещество обрабатывали горячим ацетонитрилом (20 мл) и ацетонитрил декантировали. Это повторяли 3 раза. Объединенные ацетонитрильные слои концентрировали в вакууме и остаток обрабатывали Et2O. Образовавшийся осадок собирали фильтрованием и сушили в вакууме с получением 2-[(E)-2-(2,6-дихлорфенил)этенил]-трифторбороната калия (2,31 г, 99%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,39 (д, J=8,0 Гц, 2H), 7,16 (т, J=8,0 Гц, 1H), 6,42 (д, J=18,6 Гц, 1H), 6,08-6,17 (м, 1H).
К дегазированной смеси трет-бутил 3-{6-бром-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата (1,26 г; 3,18 ммоль) и 2-[(E)-2-(2,6-дихлорфенил)этенил]-трифторбороната калия (1,06 г, 3,82 ммоль) в толуоле (45 мл) и воде (15 мл) последовательно добавляли карбонат цезия (3,54 г; 10,87 ммоль) и комплекс 1',1'-бис(дифенилфосфино)-ферферроценпалладий(II)дихлорида с дихлорметаном (0,13 г; 0,16 ммоль). Полученную смесь нагревали в течение ночи (100°C). После охлаждения до комнатной температуры реакционную смесь разбавляли EtOAc, фильтровали и промывали 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1, затем 2:1) с получением трет-бутил 3-{6-[(E)-2-(2,6-дихлорфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата (1,04 г; 67%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,34 (д, J=8,0 Гц, 2H), 7,01-7,15 (м, 6H), 4,40 (с, 2H), 2,88-2,94 (м, 2H), 2,67-2,74 (м, 2H), 2,42-2,48 (м, 2H), 2,04-2,13 (м, 2H), 1,92-2,20 (м, 2H), 1,72-1,88 (м, 2H), 1,47 (с, 9H). Rt, 1,58 мин (Система B), [M+H]+ 488,1.
Следующие соединения были получены аналогичным способом. Альдегиды являются коммерчески доступными и/или были описаны ранее:
Трет-бутил 3-{6-[(E)-2-(2-хлорфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[(E)-2-фенилэтенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[(E)-2-(4-фторфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[(E)-2-(2,6-дихлор-3-этилфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[(E)-2-(2,6-дихлор-4-циклопропилфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[(E)-2-(4-бутил-2,6-дихлорфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[(1Z)-3,3,3-трифтор-2-фенилпроп-1-ен-1-ил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. Необходимый трифтор[(1Z)-3,3,3-трифтор-2-фенилпроп-1-ен-1-ил]боронат калия получали следующим образом: 2,2,2-трифтор-1-фенилэтан-1-он преобразовывали в [(1E)-1-бром-3,3,3-трифторпроп-1-ен-2-ил]бензол и [(1Z)-1-бром-3,3,3-трифторпроп-1-ен-2-ил]бензол (4:1) и аналогичным способом, как для 2-[(E)-2-бромэтенил]-1,3-дихлорбензола. Эту смесь преобразовывали в смесь трифтор[(1E и Z)-3,3,3-трифтор-2-фенилпроп-1-ен-1-ил]боронатов калия, которую подвергают взаимодействию с трет-бутил 3-{6-бром-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноатом с получением смеси, которую очищали (ВЭЖХ) с получением указанного в заголовке соединения.
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,37-7,43 (м, 3H), 7,27-7,31 (м, 2H), 7,12-7,15 (м, 1H), 6,93 (д, J=7,8 Гц, 1H), 6,62 (дд, J=7,8, 1,2 Гц, 1H), 6,33 (д, J=1,2 Гц, 1H), 4,28 (с, 2H), 2,82-2,89 (м, 2H), 2,67 (т, J=7,4 Гц, 2H), 2,42 (т, J=7,4 Гц, 2H), 1,97-2,07 (м, 2H), 1,83-1,92 (м, 2H), 1,63-1,69 (м, 2H), 1,45 (с, 9H).
Использовали следующие условия ВЭЖХ: Chiralpak AD 20 мкм, 60 мл/мин. Элюенты гептан:EtOH (8:2).
Соединение 160. Гидрохлорид 3-{6-[(E)-2-(2,6-дихлорфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты. Трет-бутил 3-{6-[(E)-2-(2,6-дихлорфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат (1,04 г, 2,13 ммоль) растворяли в 4M растворе HCl в 1,4-диоксане (20 мл; 4 моль/л; 80 ммоль) и перемешивали в течение 48 часов при комнатной температуре. Затем растворитель удаляли в вакууме и остаток обрабатывали iPr2O, осадок собирали фильтрованием и сушили в течение ночи при пониженном давлении с получением продукта (0,93 г, 89,4%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,70 (уш.с, 1H), 10,30 (уш.с, 1H), 7,53 (д, J=8,1 Гц, 2H), 7,30-7,35 (м, 1H), 6,99-7,25 (м, 5H), 4,51 (с, 2H), 3,41-3,55 (м, 2H), 3,30-3,39 (м, 2H), 3,01-3,19 (м, 2H), 2,85 (т, J=7,5 Гц, 2H), 2,13-2,25 (м, 2H), 1,86-1,95 (м, 2H). Rt 1,49 мин (Система B), [M+H]+ 432,1.
Следующие соединения были получены аналогичным способом.
Соединение 161. Гидрохлорид 3-{6-[(E)-2-(2-хлорфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,42 мин (Система B), [M+H]+ 398,0
Соединение 162. Гидрохлорид 3-{6-[(E)-2-фенилэтенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,64 (уш.с, 1H), 10,55 (уш.с, 1H), 7,59 (д, J=8 Гц, 2H), 7,38 (т, J=8 Гц, 2H), 7,27 (т, J=8 Гц, 1H), 7,22 (с, 2H), 7,10-7,17 (м, 3H), 4,50 (уш.с, 2H), 3,28-3,52 (м, 4H), 3,01-3,18 (м, 2H), 2,86 (т, J=8 Гц, 2H), 2,16-2,28 (м, 2H), 1,87-1,95 (м, 2H).
Соединение 163. Гидрохлорид 3-{6-[(E)-2-(4-фторфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,70 (уш.с, 1H), 10,10 (уш.с, 1H), 7,63 (дд, J=8,6, 5,5 Гц, 2H), 7,04-7,28 (м, 7H), 4,49 (уш.с, 2H), 3,42-3,54 (м, 2H), 3,30-3,38 (м, 2H), 3,01-3,15 (м, 2H), 2,83 (т, J=7,6 Гц, 2H), 2,12-2,22 (м, 2H), 1,86-1,94 (м, 2H).
Соединение 164. Гидрохлорид 3-{6-[(E)-2-(2,6-дихлор-3-этилфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,54 мин (Система B), [M+H]+ 460,0
Соединение 165. Гидрохлорид 3-{6-[(E)-2-(2,6-дихлор-4-циклопропилфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,56 мин (Система B), [M+H]+ 472,0
Соединение 166. Гидрохлорид 3-{6-[(E)-2-(4-бутил-2,6-дихлорфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,70 мин (Система B), [M+H]+ 488,0
Соединение 167. Гидрохлорид 3-{6-[(1Z)-3,3,3-трифтор-2-фенилпроп-1-ен-1-ил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,70 (уш.с, 1H), 9,60 (уш.с, 1H), 7,41-7,52 (м, 5H), 7,30 (с, 1H), 7,15-7,25 (м, 1H), 7,01 (д, J=7,7 Гц, 1H), 6,90 (с, 1H), 4,53 (с, 2H), 3,48-3,56 (м, 2H), 3,30-3,41 (м, 2H), 3,02-3,20 (м, 2H), 2,80 (т, J=7,4 Гц, 3H), 2,06-2,17 (м, 2H), 1,94 (уш.д, J=14,1 Гц, 2H). Rt 1,55 мин (Система B), [M+H]+ 432,0.
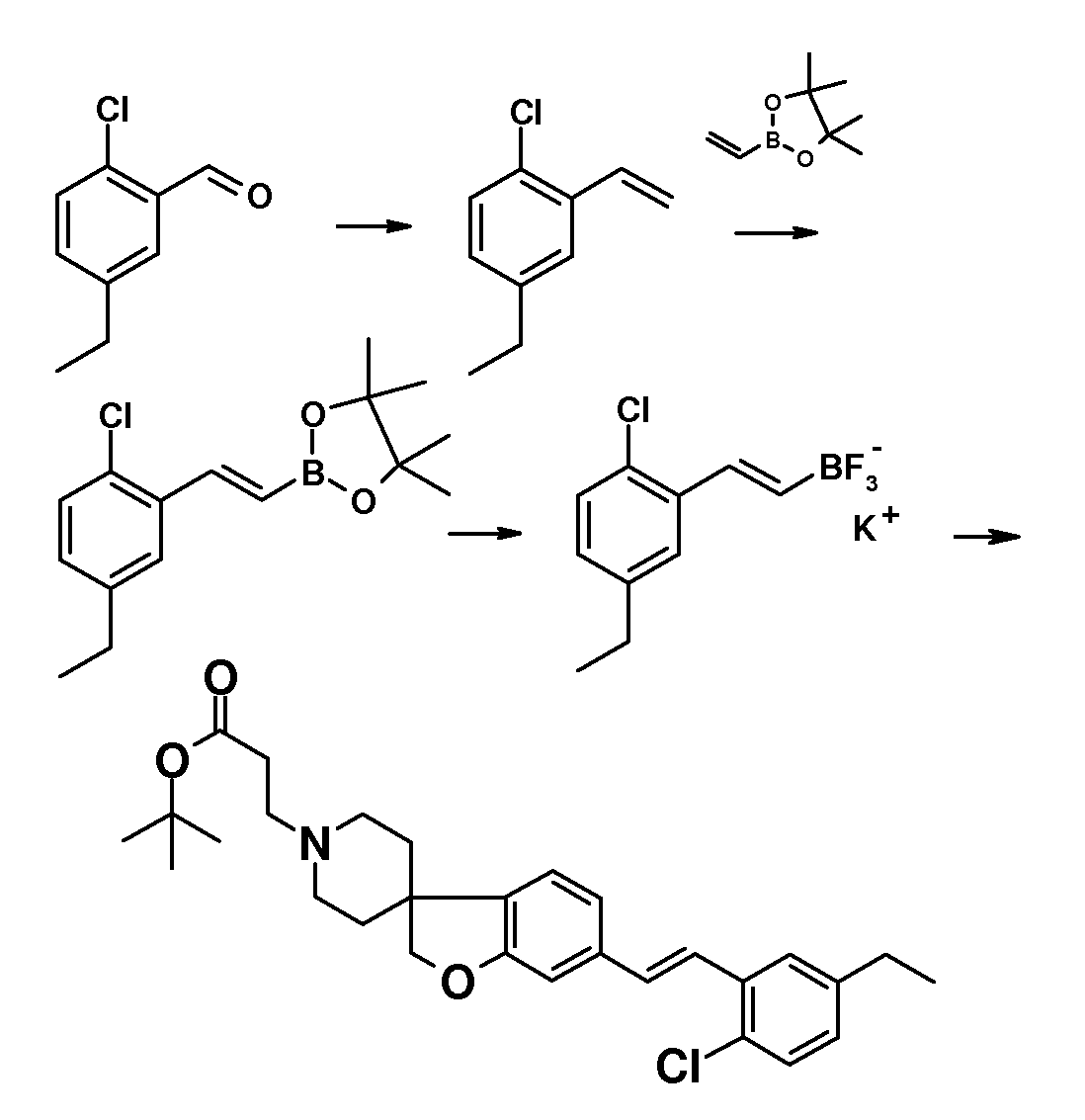
Трет-бутил 3-{6-[(E)-2-(2-хлор-5-этилфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
К раствору метилтрифенилфосфонийбромида (5,77 г; 16,15 ммоль), растворенного в ТГФ (25 мл), добавляли трет-бутоксид калия (1,81 г; 16,15 ммоль) в ТГФ (50 мл) при -78°C (Adv. Synth. Catal., 2006, 348, 851). Реакционную смесь перемешивали в течение 1,5 часа. Затем добавляли по каплям раствор 2-хлор-5-этилбензальдегида (2,27 г; 13,45 ммоль) (получен из уже описанного 2-хлор-5-этилбензальдегида путем окисления (диоксид марганца в ацетонитриле (69%)), растворенного в ТГФ (30 мл), при -78°C. Полученную смесь перемешивали и давали нагреться до комнатной температуры в течение ночи. Реакцию гасили путем добавления насыщенного водного раствора NaH4Cl. Полученную смесь экстрагировали Et2O и промывали насыщенным солевым раствором. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, гексан) с получением 1-хлор-2-этенил-4-этилбензола (2,11 г; 94%).
К дегазированной смеси 1-хлор-2-этенил-4-этилбензола (2,1 г; 12,6 ммоль) в дихлорметане (50 мл) добавляли последовательно пинаколовый эфир винилбороновой кислоты (1,94 мл; 11,46 ммоль) и катализатор Hoveyda-Grubbs 2го поколения (0,36 г; 0,57 ммоль) (Tetrahedron, (65), 2009, 3130). Полученную смесь нагревали в течение ночи (40°C). После охлаждения до комнатной температуры реакционную смесь разбавляли EtOAc и промывали H2O. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, гексан) с получением 2-[(E)-2-(2-хлор-5-этилфенил)этенил]-4,4,5,5-тетраметил-1,3,2-диоксаборолана (2,32 г; 69%), который использовали как таковой для преобразования в трет-бутил 3-{6-[(E)-2-(2-хлор-5-этилфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат с использованием таких же условий, как описано для предшественника соединения 160.
Следующие соединения были получены аналогичным способом.
Трет-бутил 3-{6-[(E)-2-(2,5-дихлорфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[(E)-2-(3-метилфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[(E)-2-(2-фторфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
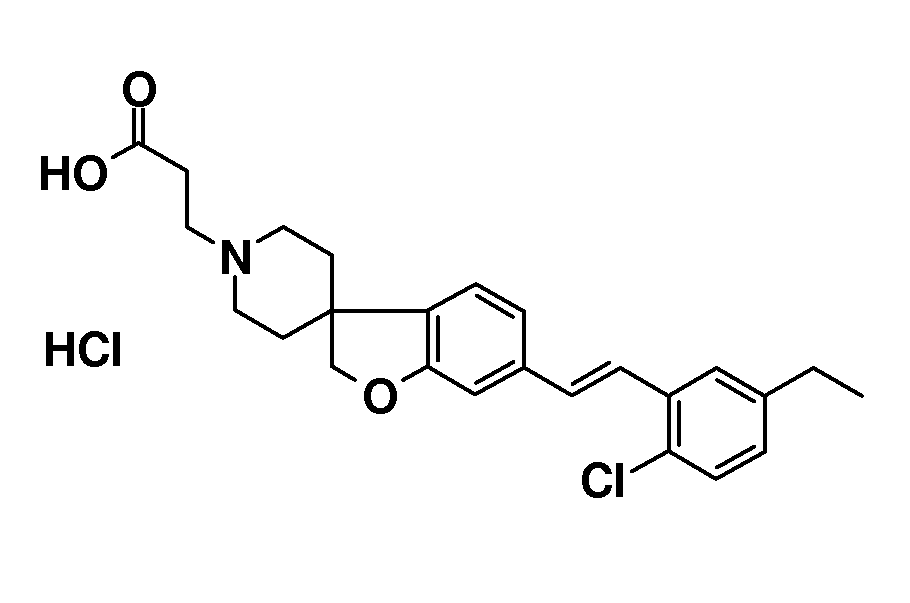
Соединение 168. Гидрохлорид 3-{6-[(E)-2-(2-хлор-5-этилфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Трет-бутил 3-{6-[(E)-2-(2,6-дихлорфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат (1,04 г, 2,13 ммоль) растворяли в 4M растворе HCl в 1,4-диоксане (20 мл; 4 моль/л; 80 ммоль) и перемешивали в течение 48 часов при комнатной температуре. Затем растворитель удаляли в вакууме и остаток обрабатывали iPr2O, осадок собирали фильтрованием и сушили в течение ночи при пониженном давлении с получением продукта (0,93 г, 89,4%). Rt 1,53 мин (Система B), [M+H]+ 426,0.
Следующие соединения были получены аналогичным способом.
Соединение 169. Гидрохлорид 3-{6-[(E)-2-(2,5-дихлорфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,90 (уш.с, 1H), 10,20 (уш.с, 1H), 7,94 (д, J=3,0 Гц, 1H), 7,52 (д, J=8,1 Гц, 1H), 7,27-7,46 (м, 3H), 7,09-7,23 (м, 3H), 4,52 (уш.с, 2H), 3,46-3,56 (м, 2H), 3,26-3,35 (м, 2H), 3,00-3,14 (м, 2H), 2,86 (т, J=7,7 Гц, 2H), 2,16-2,30 (м, 2H), 1,85-1,95 (м, 2H). Rt 1,50 мин (Система B), [M+H]+ 432,0
Соединение 170. Гидрохлорид 3-{6-[(E)-2-(3-метилфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты. Rt 1,37 мин (Система B), [M+H]+ 378,1
Соединение 171. Гидрохлорид 3-{6-[(E)-2-(2-фторфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,90 (уш.с, 1H), 10,50 (уш.с, 1H), 7,78 (т, J=7,7 Гц, 1H), 7,01-7,40 (м, 8H), 4,50 (уш.с, 2H), 3,42-3,56 (м, 2H), 3,26-3,39 (м, 2H), 3,00-3,14 (м, 2H), 2,87 (т, J=7,7 Гц, 2H), 2,16-2,32 (м, 2H), 1,83-1,95 (м, 2H). Rt 1,34 мин (Система B), [M+H]+ 382,1.
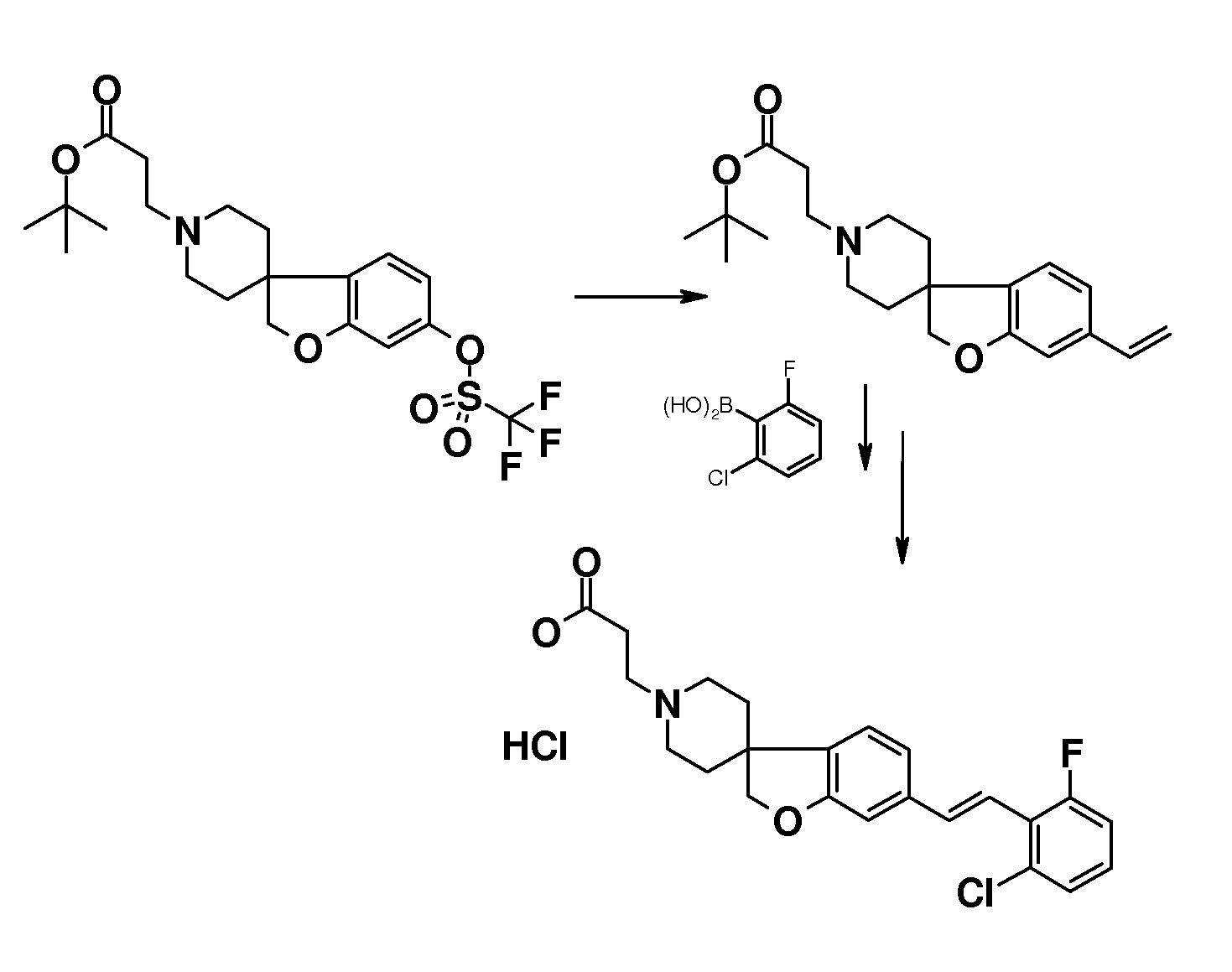
Соединение 301. Гидрохлорид 3-{6-[(E)-2-(2-хлор-6-фторфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты. При продувке азотом к раствору трет-бутил 3-{-{6-[(трифторметан)сульфонилокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноата (600 мг, 1,29 ммоль) и трибутил-(этенил)станнана (0,37 мл; 1,29 ммоль) в 1,4-диоксане (25 мл) добавляли хлорид лития (164 мг; 3,87 ммоль) с последующим добавлением тетракис(трифенилфосфин)палладия(0) (149 мг; 0,13 ммоль) (Tetrahedron Letters, 48 (2007), 323-326). Эту смесь перемешивали в предварительно нагретой масляной бане (110°C) в течение 70 минут. Затем реакционную смесь охлаждали, разбавляли Et2O и фильтровали. Органический слой промывали 5% водным раствором KF, сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, дихлорметан:ацетон 9:1) с получением трет-бутил 3-{6-(этенил-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата (330 мг; 74,5%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,07 (д, J=8 Гц, 1H), 6,91 (дд, J=8 и 2 Гц, 1H), 6,87 (д, J=2 Гц, 1H), 6,66 (дд, J=10 и 10 Гц, 1H), 5,68 (д, J=18 Гц, 1H), 5,19 (д, J=10 Гц, 1H), 4,36 (с, 2H), 2,86-2,93 (м, 2H), 2,69 (т, J=8 Гц, 2H), 2,45 (т, J=8 Гц, 2H), 2,03-2,11 (м, 2H), 1,91-1,99 (м, 2H), 1,69-1,76 (м, 2Н), 1,46 (с, 9Н).
Для реакции окислительного перекрестного связывания по методу Гека (Synthesis (2010), 1399-1427), смесь трет-бутил 3-{6-(этенил-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата (100 мг; 0,29 ммоль), ацетата палладия (10 мг; 0,04 ммоль), BIAN (бис(арил)ацетнафтехинодиимин) (J. Org. Chemistry, в печати (2011) (24 мг; 0,06 ммоль) и 2-хлор-6-фторфенилбороновой кислоты (76 мг; 0,44 ммоль) растворяли в 5 мл Ν,Ν-диметилформамида. Реакционную смесь (открытый сосуд) перемешивали в течение ночи (90°C). Добавляли дополнительное количество ацетата палладия (5 мг), BIAN (бис(арил)ацетнафтехинодиимин) (12 мг) и 2-хлор-6-фторфенилбороновой кислоты (50 мг) и реакционную смесь перемешивали еще в течение 24 часов (90°C). Затем реакционную смесь охлаждали, разбавляли EtOAc и промывали 5% водным раствором NaHCO3, сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, дихлорметан:ацетон 9:1) с получением трет-бутил 3-{6-[(E)-2-(2-хлор-6-фторфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата (70 мг; 43,3%). Rt 1,50 мин (Система B), [M+H]+ 472,2, который преобразовывали в гидрохлорид 3-{6-[(E)-2-(2-хлор-6-фторфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-пропановой кислоты (69%) (как описано для соединения 168).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,73 (уш.с, 1H), 10,91 (уш.с, 1H), 7,10-7,41 (м, 8H), 4,51 (уш.с, 2H), 3,29-3,52 (м, 4H), 3,02-3,13 (м, 2H), 2,83 (т, J=8 Гц, 2H), 2,12-2,22 (м, 2H), 1,87-1,95 (м, 2H). Rt 1,42 мин (Система B), [M+H]+ 416,2.
Соединение 302. Гидрохлорид 3-{6-[(E)-2-(2-циклопропил-6-фторфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты. Трет-бутил 3-{6-[(E)-2-(2-бром-6-фторфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-пропаноат (получали в соответствии со способом синтеза соединения 301). Rt 1,42 мин (Система B), [M+H]+ 518,5, подвергали взаимодействию с циклопропилтрифторборонатом калия (Tetrahedron Letters, 2008, 4122-4124) с использованием условий, описанных для соединения 71 (53%), с получением трет-бутил 3-{6-[(E)-2-(2-циклопропил-6-фторфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата. Rt 1,53 мин (Система B), [M+H]+ 478,7, который преобразовывали в гидрохлорид 3-{6-[(E)-2-(2-циклопропил-6-фторфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты (69%) (как описано для соединения 168).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,73 (уш.с, 1H), 10,09 (уш.с, 1H), 7,39 (д, J=16 Гц, 1H), 7,04-7,22 (м, 6H), 6,91 (д, J=8 Гц, 1H), 4,52 (уш.с, 2H), 3,48-3,58 (м, 2H), 3,03-3,13 (м, 2H), 2,85 (т, J=8 Гц, 2H), 2,09-2,25 (м, 5H), 1,87-1,95 (м, 2H), 0,97-1,02 (м, 2H), 0,70-0,74 (м, 2H). Rt 1,46 мин (Система B), [M+H]+ 422,7.
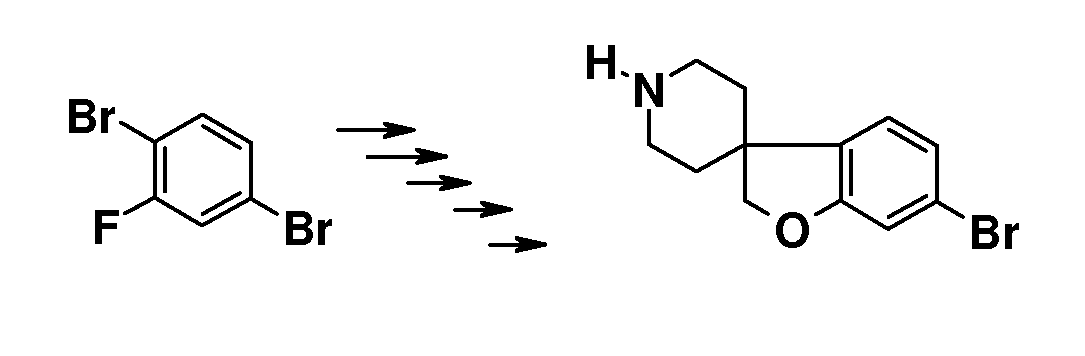
6-Бром-2H-спиро[1-бензофуран-3,4'-пиперидин]. 4-Пиридинметанол (17,56 г; 160,9 ммоль) растворяли в 1-метил-2-пирролидиноне (150 мл) и добавляли гидрид натрия (60% в минеральном масле; 6,44 г; 160,9 ммоль). Смесь перемешивали в течение 10 минут при температуре окружающей среды. Эту смесь затем добавляли к 1,4-дибром-2-фторбензолу (20,43 г; 80,47 ммоль), растворенному в 1-метил-2-пирролидиноне (250 мл). Полученную реакционную смесь нагревали до 100°C. ТСХ анализ показал полное преобразование в течение 5 минут. После охлаждения до комнатной температуры реакционную смесь разбавляли EtOAc и промывали 5% водным раствором NaHCO3. Органический слой промывали несколько раз H2O, сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 2:1 до чистого Et2O) с получением 4-(2,5-дибромфеноксиметил)пиридина (17,4 г; 63%), который растворяли в ацетоне (260 мл). К этой реакционной смеси добавляли бензилбромид (6,37 мл; 53,26 ммоль) и смесь перемешивали в течение ночи при 40°C. Затем смесь концентрировали в вакууме с получением 1-бензил-4-(2,5-дибромфеноксиметил)пиридин-1-ийбромида (24,9 г; 95%), который растворяли в MeOH (225 мл). К этой охлажденной (-10°C) реакционной смеси добавляли боргидрид натрия (4,51 г; 119,50 ммоль). После завершения добавления смеси давали нагреться до комнатной температуры и перемешивали в течение 4 часов. Затем смесь охлаждали до 0°C, добавляли воду и MeOH выпаривали в вакууме. К водному раствору добавляли 5% водный раствор NaHCO3 и Et2O. Слои разделяли и органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1) с получением продукта: 1-бензил-4-(2,5-дибромфеноксиметил]-1,2,3,6-тетрагидропиридина (19,78 г; 94%). Rt 1,37 мин (Система B), [M+H]+ 437,8.
К интенсивно дегазируемой смеси 1-бензил-4-(2,5-дибромфеноксиметил]-1,2,3,6-тетрагидропиридина (8 г; 18,3 ммоль) в 75 мл бензола добавляли последовательно 2,2'-азобис(2-метилпропионитрил) (0,12 г; 0,73 ммоль) и гидрид три-н-бутилолова (7,4 мл; 27,45 ммоль). Реакционную смесь нагревали в течение 72 часов при 115°C. После охлаждения до комнатной температуры смесь разбавляли Et2O и промывали 10% водным раствором KF. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали повторной колоночной хроматографией (SiO2, Et2O:гексан 1:1) с получением продукта: 1'-бензил-6-бром-2H-спиро[1-бензофуран-3,4'-пиперидин] (1,3 г; 20%),
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,24-7,35 (м, 5H), 6,97-7,02 (м, 2H), 6,91-6,94 (м, 1H), 4,38 (с, 2H), 3,53 (с, 2H), 2,85-2,92 (м, 2H), 1,90-2,07 (м, 4H), 1,67-1,74 (м, 2H).
Этот продукт растворяли в 1,2-дихлорэтане (20 мл) при 0°C. Затем добавляли 1-хлорэтилхлорформиат (0,98 мл; 9,07 ммоль) и реакционную смесь перемешивали в течение 15 минут. Неочищенную реакционную смесь концентрировали в вакууме. Добавляли толуол (100 мл) и смесь концентрировали. Эту последнюю стадию повторяли два раза. Добавляли MeOH (20 мл) и смесь перемешивали в течение ночи. Реакционную смесь концентрировали в вакууме с получением 6-бром-2H-спиро[1-бензофуран-3,4'-пиперидин]гидрохлорида (1,1 г; 99%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,80-9,15 (м, 2H), 7,05-7,11 (м, 3H), 4,53 (с, 2Н), 3,25-3,32 (м, 2Н), 2,92-3,03 (м, 2Н), 2,05 (дт, J=13,6, 4,2 Гц, 2H), 1,78-1,85 (м, 2Н).
Продукт растворяли в MeOH (5 мл) и фильтровали через содержащую паратолуолсульфокислоту твердофазную экстракционную гильзу, промывая MeOH и элюируя раствором 2н NH3/MeOH. Продукт концентрировали с получением 6-бром-2H-спиро[1-бензофуран-3,4'-пиперидин] (0,8 г). Rt 1,05 мин (Система B), [M+H]+ 270,0
Трет-бутил 4-{6-бром-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутаноат. К суспензии 6-бром-2H-спиро[1-бензофуран-3,4'-пиперидин]гидрохлорида (0,55 г; 1,81 ммоль) в CH3CN (35 мл) добавляли карбонат калия (0,75 г; 5,42 ммоль), иодид калия (0,36 г; 2,17 ммоль), с последующим добавлением трет-бутилового эфира 4-броммасляной кислоты (0,48 г; 2,17 ммоль). Полученную смесь нагревали при 65°C в течение ночи.
После охлаждения до комнатной температуры реакционную смесь распределяли между 5% водным раствором NaHCO3 и EtOAc. Слои разделяли и органический слой сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 2:1) с получением продукта (0,54 г, 72%).
1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 7,00 (дд, J=7,8, 1,5 Гц, 1H), 6,97 (д, J=7,8 Гц, 1H), 6,93 (д, J=1,5 Гц, 1H), 4,37 (с, 2H), 2,88-2,94 (м, 2H), 2,34-2,40 (м, 2H), 2,27 (т, J=7,4 Гц, 2H), 1,89-2,03 (м, 4H), 1,69-1,85 (м, 4H), 1,45 (с, 9H). Rt 1,30 мин (Система B), [M+H]+ 412,0.
Трет-бутил 2-{6-бром-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}ацетат. К суспензии 6-бром-2H-спиро[1-бензофуран-3,4'-пиперидин]гидрохлорида (0,55 г; 1,81 ммоль) в CH3CN (35 мл) и карбоната калия (0,75 г; 5,42 моль) добавляли трет-бутилбромацетат (0,42 г; 2,17 ммоль). Полученную смесь нагревали при 65°C в течение ночи.
После охлаждения до комнатной температуры реакционную смесь распределяли между 5% водным раствором NaHCO3 и EtOAc. Слои разделяли и органический слой сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1) с получением продукта (0,46 г, 66,7%). Rt 2,59 мин (Система B), [M+H]+ 383,9
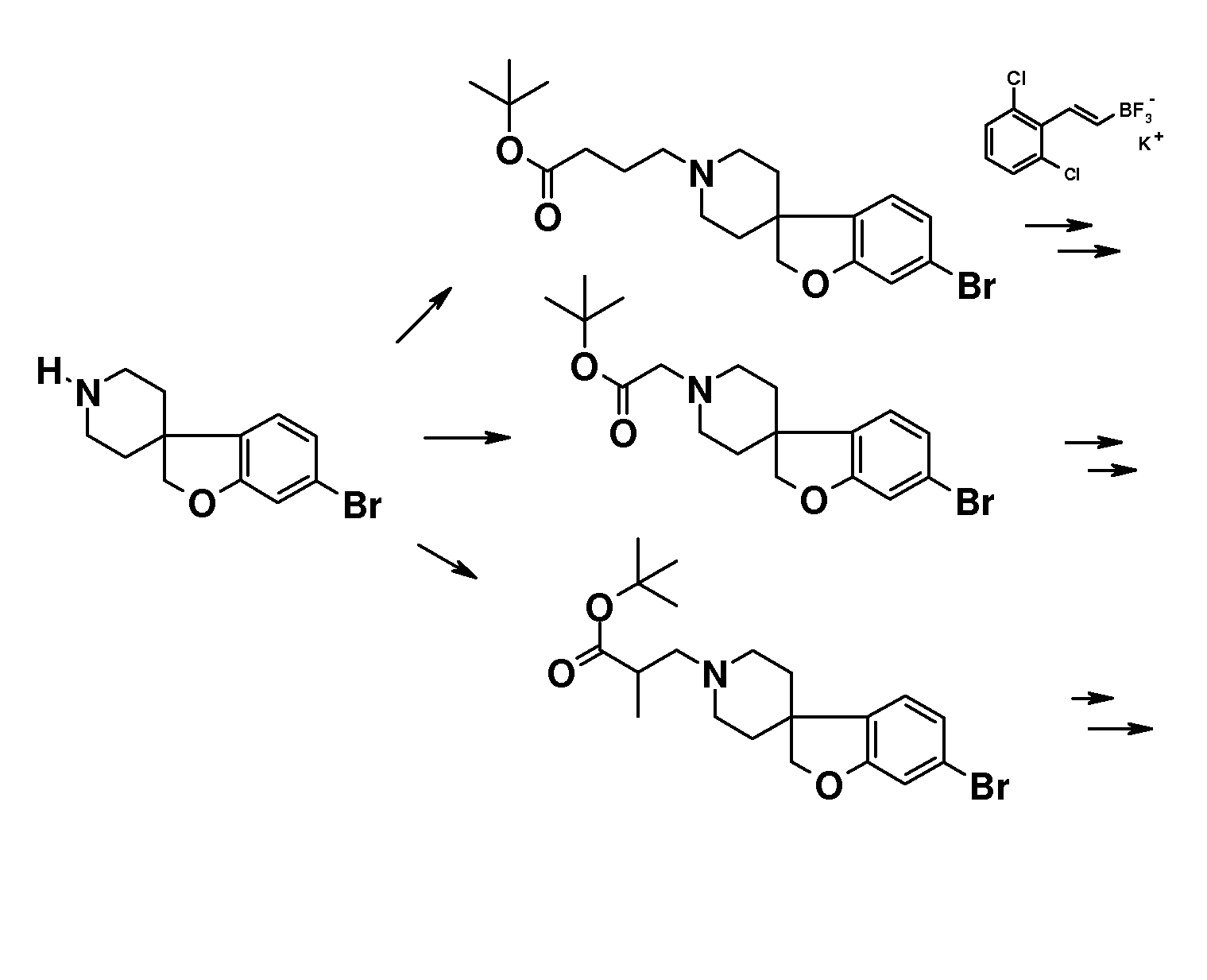
Трет-бутил 3-{6-бром-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропаноат. К суспензии 6-бром-2H-спиро[1-бензофуран-3,4'-пиперидин]гидрохлорида (0,53 г; 1,74 ммоль) в N,N-диметилформамиде (7 мл) добавляли трет-бутилметакрилат (0,57 мл; 3,48 ммоль) и DBU (0,78 мл; 5,22 ммоль). Полученную смесь нагревали при 140°C в герметично закрытой колбе в течение ночи.
После охлаждения до комнатной температуры реакционную смесь распределяли между 5% водным раствором NaHCO3 и EtOAc. Слои разделяли и органический слой сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1) с получением продукта (436 мг, 61%).
Rt 1,36 мин (Система B), [M+H]+ 412,0.
Трет-бутил 4-{6-[(E)-2-(2,6-дихлорфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутаноат. К дегазированной смеси трет-бутил 3-{6-бром-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутаноата (0,26 г; 0,63 ммоль) и 2-[(E)-2-(2,6-дихлорфенил)этенил]-трифторбороната калия (0,21 г, 0,76 ммоль) в толуоле (9 мл) и воде (3 мл) добавляли последовательно карбонат цезия (0,71 г; 2,17 ммоль) и комплекс 1',1'-бис(дифенилфосфино)-ферферроценпалладий(II)дихлорида с дихлорметаном (26 мг; 0,03 ммоль). Полученную смесь нагревали в течение ночи (100°C). После охлаждения до комнатной температуры реакционную смесь разбавляли EtOAc, фильтровали и промывали 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1, затем 3:1) с получением трет-бутил 3-{6-[(E)-2-(2,6-дихлорфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутаноата (257 мг; 80%). Rt 1,57 мин (Система B), [M+H]+ 502,2.
Трет-бутил 2-{6-[(E)-2-(2,6-дихлорфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}ацетат. К дегазированной смеси трет-бутил 3-{6-бром-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}ацетата (244 мг; 0,59 ммоль) и 2-[(E)-2-(2,6-дихлорфенил)этенил]-трифторбороната калия (196 мг, 0,76 ммоль) в толуоле (9 мл) и воде (3 мл) добавляли последовательно карбонат цезия (0,65 г; 2 ммоль) и комплекс 1',1'-бис(дифенилфосфино)-ферферроценпалладий(II)дихлорида с дихлорметаном (24 мг; 0,03 ммоль). Полученную смесь нагревали в течение ночи (100°C). После охлаждения до комнатной температуры реакционную смесь разбавляли EtOAc, фильтровали и промывали 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1, затем 3:1) с получением трет-бутил 3-{6-[(E)-2-(2,6-дихлорфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]- 1'-ил}бутаноата (187 мг; 67%).
1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 6,96-7,02 (м, 2H), 6,93 (д, J=1,1 Гц, 1H), 4,38 (с, 2H), 3,17 (с, 2H), 2,93-2,99 (м, 2H), 2,27 (дт, J=12,5 и 2,5 Гц, 2H), 2,03 (дт, J=12,5, 4,0 Гц, 2H), 1,68-1,76 (м, 2H), 1,48 (с, 9H). Rt 1,62 мин (Система B), [M+H]+ 474,2.
Трет-бутил 3-{6-[(E)-2-(2,6-дихлорфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропаноат. К дегазированной смеси трет-бутил 3-{6-бром-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропаноата (218 мг; 0,53 ммоль) и 2-[(E)-2-(2,6-дихлорфенил)этенил]-трифторбороната калия (178 мг, 0,64 ммоль) в толуоле (9 мл) и воде (3 мл) добавляли последовательно карбонат цезия (520 мг; 1,59 ммоль) и комплекс 1',1'-бис(дифенилфосфино)-ферферроценпалладий(II)дихлорида с дихлорметаном (22 мг; 0,03 ммоль). Полученную смесь нагревали в течение ночи (100°C). После охлаждения до комнатной температуры реакционную смесь разбавляли EtOAc, фильтровали и промывали 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:2) с получением трет-бутил 3-{6-[(E)-2-(2,6-дихлорфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропаноата (197 мг; 31,6%). Rt 1,63 мин (Система B), [M+H]+ 502,0.
Соединение 172. Гидрохлорид 4-{6-[(E)-2-(2,6-дихлорфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутановой кислоты. Трет-бутил 3-{6-[(E)-2-(2,6-дихлорфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутаноат (257 мг, 0,51 ммоль) растворяли в 4M растворе HCl в 1,4-диоксане (10 мл; 4 моль/л; 40 ммоль) и перемешивали в течение 48 часов при комнатной температуре. Затем растворитель удаляли в вакууме и остаток обрабатывали iPr2O, осадок собирали фильтрованием и сушили в течение ночи при пониженном давлении с получением продукта (233 мг, 89,6%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,85 (уш.с, 1H), 9,90 (уш.с, 1H), 7,54 (д, J=8,1 Гц, 2H), 7,33 (т, J=8,1 Гц, 1H), 6,99-7,18 (м, 5H), 4,52 (уш.с, 2H), 3,41-3,55 (м, 2H), 3,00-3,17 (м, 4H), 2,24-2,40 (м, 4H), 1,84-2,01 (м, 4H). Rt 1,44 мин (Система B), [M+H]+ 446,0.
Следующие соединения были получены аналогичным способом.
Соединение 173. Гидрохлорид 2-{6-[(E)-2-(2,6-дихлорфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}уксусной кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 14,10 (уш.с, 1H), 10,30 (уш.с, 1H), 7,54 (д, J=8,0 Гц, 2H), 7,33 (т, J=8,0 Гц, 1H), 7,00-7,25 (м, 5H), 4,50 (с, 2H), 4,19 (уш.с, 2H), 3,50-3,58 (м, 2H), 3,19-3,31 (м, 2H), 2,20-2,31 (м, 2H), 1,87-1,95 (м, 2H). Rt 1,67 мин (Система B), [M+H]+ 418,0.
Соединение 174. Гидрохлорид 3-{6-[(E)-2-(2,6-дихлорфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропановой кислоты.
Rt 1,53 мин (Система B), [M+H]+ 446,0.
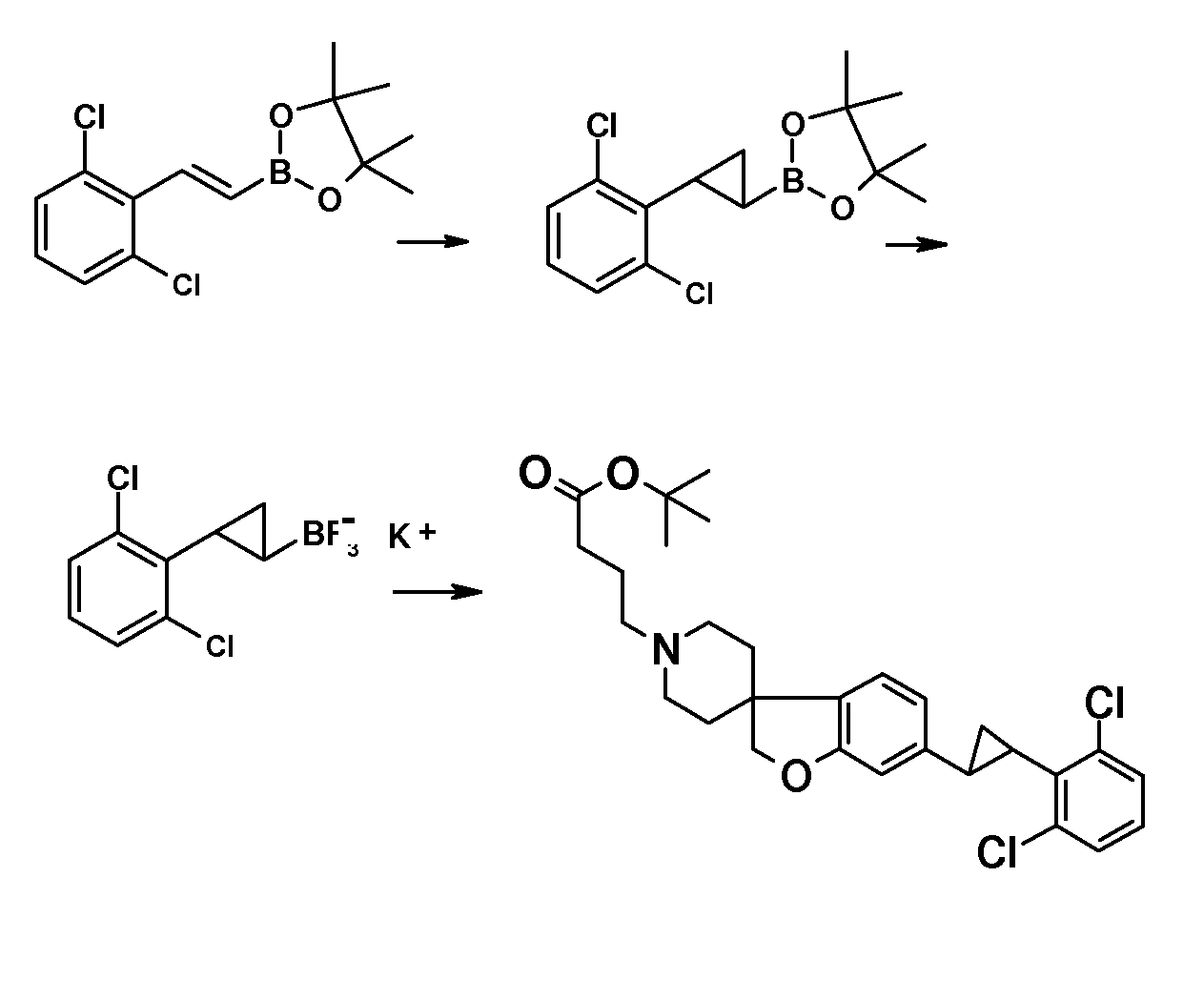
Трет-бутил 4-{6-[2-(2,6-дихлорфенил)циклопропил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутаноат. Необходимый [2-(2,6-дихлорфенил)-циклопропил]-трифторборонат калия получали следующим образом: К свежедистиллированному дихлорметану (10 мл) добавляли Et2Zn (6,02 мл; 1 м/л в гексане; 6,02 ммоль) при 0°C (J.Org. Chem., 69, (2), 2004, 327). К этому раствору добавляли (очень медленно) трифторуксусную кислоту (0,46 мл; 6,02 ммоль), растворенную в дихлорметане (20 мл). После завершения добавления (75 минут) реакционную смесь перемешивали в течение 30 минут при 0°C. Затем добавляли раствор диодметана (0,48 мл; 6,02 ммоль), растворенного в дихлорметане (10 мл), и полученную реакционную смесь перемешивали еще в течение 20 минут при 0°C. К этой реакционной смеси добавляли 2-[(E)-2-(2,6-дихлорфенил)этенил]-4,4,5,5-тетраметил-1,3,2-диоксаборолан (0,9 г; 3,01 ммоль) в дихлорметане (10 мл) и давали нагреться до комнатной температуры и перемешивали в течение ночи. Реакционную смесь гасили насыщенным раствором водного NH4Cl и разбавляли EtOAc, фильтровали и промывали 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:7) с получением 2-[2-(2,6-дихлор-фенил)циклопропил]-4,4,5,5-тетраметил-1,3,2-диоксаборолан калия (0,7 г; 74%), который растворяли в MeOH (8 мл) и воде (2 мл). Затем добавляли бифторид калия (1,19 г; 15,21 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем растворители удаляли в вакууме и остаток обрабатывали толуолом и концентрировали в вакууме. Последние стадии повторяли три раза, чтобы полностью удалить воду. Полученное твердое вещество обрабатывали горячим ацетонитрилом (20 мл) и ацетонитрил декантировали. Это повторяли 3 раза. Объединенные ацетонитрильные слои концентрировали в вакууме и остаток обрабатывали Et2O. Образовавшийся осадок собирали фильтрованием и сушили в вакууме с получением [2-(2,6-дихлорфенил)циклопропил]-трифторбороната калия (0,41 г; 64%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,3 (д, J=8,0 Гц, 2H), 7,13 (т, J=8,0 Гц, 1H), 1,37-1,44 (м, 1H), 0,65-0,71 (м, 1H), 0,36-0,43 (м, 1H),-0,09-0,01 (м, 1H).
При продувке азотом к смеси трет-бутил 3-{6-бром-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутаноата (0,26 г; 0,63 ммоль) и [2-(2,6-дихлорфенил)циклопропил]-трифторбороната калия (0,22 г, 0,76 ммоль) в толуоле (9 мл) и воде (3 мл) добавляли последовательно карбонат цезия (0,71 г; 2,17 ммоль) и комплекс 1',1'-бис(дифенилфосфино)-ферферроценпалладий(II)дихлорида с дихлорметаном (26 г; 0,03 ммоль) (Org. Lett., Vol 6, No 3, 2004, 357). Полученную смесь нагревали в течение ночи (100°C). После охлаждения до комнатной температуры реакционную смесь разбавляли EtOAc, фильтровали и промывали 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O) с получением трет-бутил 4-{6-[2-(2,6-дихлорфенил)-циклопропил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутаноата (268 мг; 82%). Rt 1,61 мин (Система B), [M+H]+ 516,0.
Следующие соединения были получены аналогичным способом.
Трет-бутил 2-{6-[2-(2,6-дихлорфенил)циклопропил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}ацетат.
Трет-бутил 3-{6-[2-(2,6-дихлорфенил)циклопропил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропаноат.
Трет-бутил 3-{6-[2-(2,6-дихлорфенил)циклопропил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Для следующих соединений необходимые калиевые аналоги [2-(замещенный фенил)циклопропил]-трифторборонатов были получены через последовательность, описанную выше, из соответствующих 2-[(E)-2-(замещенный фенил)этенил]-4,4,5,5-тетраметил-1,3,2-диоксаборолановых аналогов;
Трет-бутил 3-[6-(2-фенилциклопропил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[2-(2-фторфенил)циклопропил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[2-(2-хлорфенил)циклопропил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,30-7,26 (м, 2H), 7,04-7,13 (м, 2H), 6,79 (дд, J=7,7 и 1,6 Гц, 1H), 6,66 (д, J=1,6 Гц, 1H), 4,36 (с, 2H), 2,87-2,94 (м, 2H), 2,71 (т, J=7,6 Гц, 2H), 2,46 (т, J=7,6 Гц, 2H), 2,19-2,24 (м, 1H), 1,92-2,16 (м, 5H), 1,72-1,79 (м, 2H), 1,54-1,61 (м, 1H), 1,46 (с, 9H), 1,37-1,41 (м, 1H).
Трет-бутил 3-{6-[2-(2-хлор-5-этилфенил)циклопропил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
В качестве примера ЯМР данные представлены для А и B:
А: 1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,76 (д, J=18,4 Гц, 1H), 7,46 (д, J=2,1 Гц, 1H), 7,26 (д, J=8,2 Гц, 1H), 7,06 (дд, J=8,2, 2,1 Гц, 1H), 6,17 (д, J=18,4 Гц, 1H), 2,62 (кв., J=7,6 Гц, 2H), 1,32 (с, 12H), 1,22 (т, J=7,6 Гц, 3H),
В: 1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,23 (д, J=8,1 Гц, 1H), 6,93 (дд, J=8,1 и 2,0 Гц, 1H), 6,80 (д, J=2,0 Гц, 1H), 2,55 (кв., J=7,6 Гц, 2H), 2,34 (дт, J=8,1 и 5,7 Гц, 1H), 1,26 (с, 12H), 1,15-1,23 (м, 4H), 1,00-1,06 (м, 1H), 0,15-0,23 (м, 1H).
Трет-бутил 3-{6-[2-(4-бутил-2,6-дихлорфенил)циклопропил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Соединение 175. Гидрохлорид 4-{6-[2-(2,6-дихлорфенил)циклопропил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутановой кислоты. Трет-бутил 4-{6-[2-(2,6-дихлорфенил)циклопропил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутаноат (268 мг, 0,52 ммоль) растворяли в 4M растворе HCl в 1,4-диоксане (10 мл; 4 моль/л; 40 ммоль) и перемешивали в течение 48 часов при комнатной температуре. Затем растворитель удаляли в вакууме и остаток обрабатывали iPr2O, осадок собирали фильтрованием и сушили в течение ночи при пониженном давлении с получением продукта (239 мг, 92,7%). Rt 1,44 мин (Система B), [M+H]+ 460,0.
Следующие соединения были получены аналогичным способом:
Соединение 176. Гидрохлорид 2-{6-[2-(2,6-дихлорфенил)циклопропил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}уксусной кислоты.
Rt 1,70 мин (Система B), [M+H]+ 431,9
Соединение 177. Гидрохлорид 3-{6-[2-(2,6-дихлорфенил)циклопропил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропановой кислоты.
Rt 1,53 мин (Система B), [M+H]+ 460,0.
Соединение 178. Гидрохлорид 3-{6-[2-(2,6-дихлорфенил)циклопропил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,80 (уш.с, 1H), 10,20 (уш.с, 1H), 7,45 (д, J=8,1 Гц, 2H), 7,30 (т, J=8,1 Гц, 1, 1H), 6,67-7,30 (м, 1H), 6,82 (д, J=8,4 Гц, 1, 1H), 6,68 (с, 1H), 4,47 (уш.с, 2H), 3,42-3,55 (м, 2H), 3,21-3,42 (м, 2H), 2,95-3,14 (м, 2H), 2,86 (т, J=8,3 Гц, 2H), 2,08-2,28 (м, 4H), 1,82-1,95 (м, 2H), 1,54-1,62 (м, 1H), 1,32-1,41 (м, 1H). Rt 1,45 мин (Система B), [M+H]+ 446,0.
Соединение 179. Гидрохлорид 3-[6-(2-фенилциклопропил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,33 мин (Система B), [M+H]+ 378,2.
Соединение 180. Гидрохлорид 3-{6-[2-(2-фторфенил)циклопропил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,70 (уш.с, 1H), 10,90 (уш.с, 1H), 7,09-7,29 (м, 4H), 6,95-7,05 (м, 1H), 6,78 (д, J=7,8 Гц, 1H), 6,65 (с, 1H), 4,45 (уш.с, 2H), 3,38-3,56 (м, 2H), 3,24-3,39 (м, 2H), 2,96-3,20 (м, 2H), 2,88 (т, J=7,8 Гц, 2H), 2,12-2,40 (м, 4H), 1,78-1,95 (м, 2H), 1,41-1,55 (м, 2H). Rt 1,35 мин (Система B), [M+H]+ 396,0.
Соединение 181. Гидрохлорид 3-{6-[2-(2-хлорфенил)циклопропил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,90 (уш.с, 1H), 10,50 (уш.с, 1H), 7,46 (д, J=4,1 Гц, 1H), 7,40-7,44 (м, 1H), 7,12-7,34 (м, 3H), 6,93-7,08 (м, 1H), 6,82 (д, J=6,2 Гц, 1H), 6,70 (с, 1H), 4,48 (уш.с, 2H), 3,42-3,56 (м, 2H), 3,26-3,39 (м, 2H), 3,00-3,14 (м, 2H), 2,86 (т, J=7,7 Гц, 2H), 2,32-2,42 (м, 1H), 2,08-2,32 (м, 3H), 1,81-1,95 (м, 2H), 1,49-1,56 (м, 1H), 1,39-1,49 (м, 1H). Rt 1,40 мин (Система B), [M+H]+ 412,0.
Соединение 182. Гидрохлорид 3-{6-[2-(2-хлор-5-этилфенил)циклопропил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,70 (уш.с, 1H), 10,70 (уш.с, 1H), 7,31 (д, J=8,1 Гц, 1H), 7,06 (дд, J=8,1, 2,0 Гц, 1H), 6,95-7,10 (м, 2H), 6,79 (дд, J=8,1 и 1,2 Гц, 1H), 6,67 (д, J=1,2 Гц, 1H), 4,47 (уш.с, 2H), 3,43-3,52 (м, 2H), 3,25-3,30 (м, 2H), 2,99-3,11 (м, 2H), 2,88 (т, J=7,6 Гц, 2H), 2,58 (кв., J=7,6 Гц, 2H), 2,34 (дт, J=8,8 и 5,4 Гц, 1H), 2,20-2,30 (м, 2H), 2,11 (дт, J=8,8 и 5,4 Гц, 1H), 1,82-1,90 (м, 2H), 1,54 (дт, J=8,8 и 5,4 Гц, 1H), 1,43 (дт, J=8,8 и 5,4 Гц, 1H), 1,16 (т, J=7,6 Гц, 3H). Rt 1,40 мин (Система B), [M+H]+ 440,1
Соединение 183. Гидрохлорид 3-{6-[2-(4-бутил-2,6-дихлорфенил)циклопропил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,77 мин (Система B), [M+H]+ 502,0.
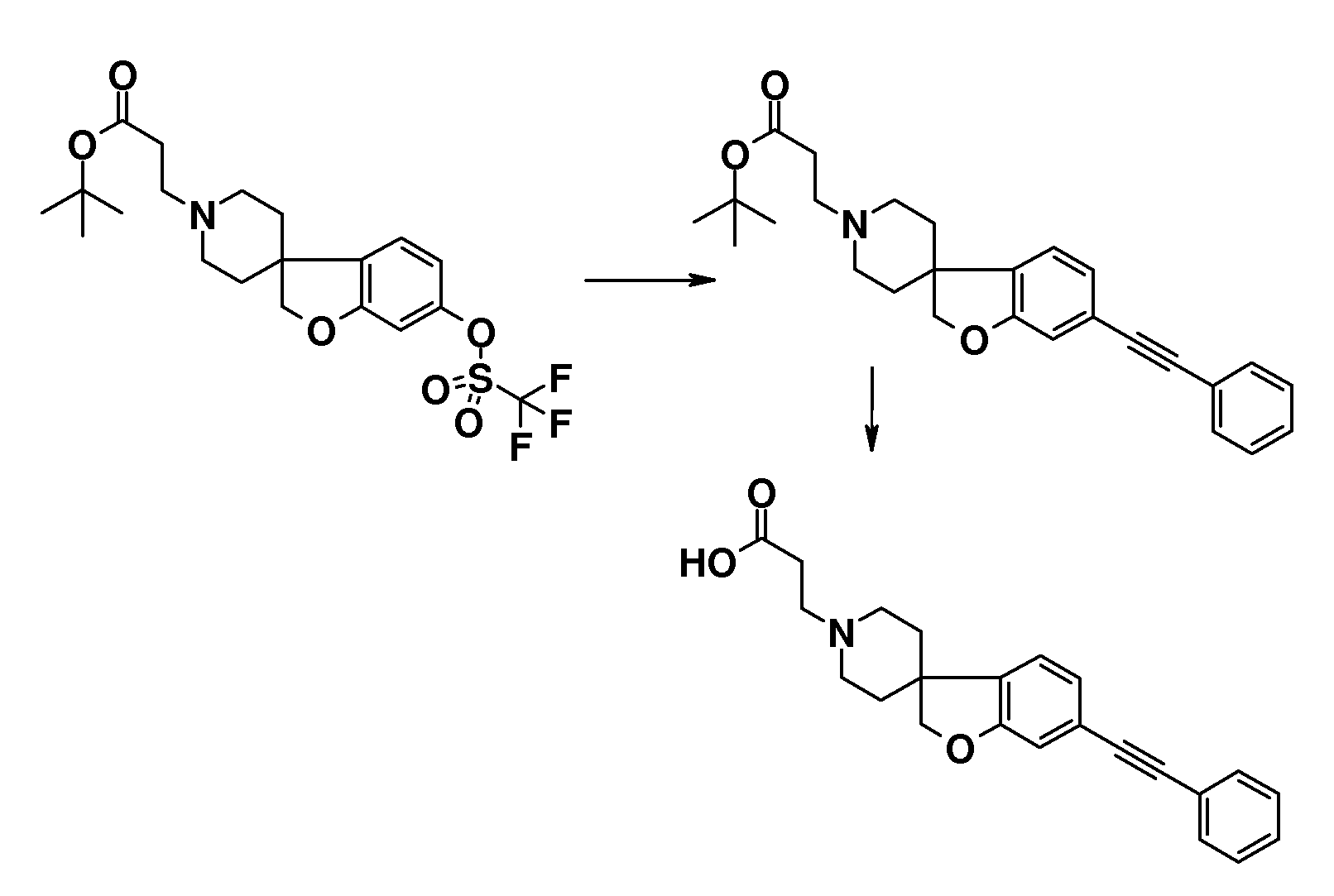
Соединение 303. Гидрохлорид 3-[6-(2-фенилэтинил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановой кислоты. К дегазированной смеси трет-бутил 3-{-{6-[(трифтор-метан)сульфонилокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноата (235 мг, 0,5 ммоль) и фенилацетилена (0,08 мл; 0,76 ммоль) в диметилсульфоксиде (5 мл) добавляли трехосновной фосфат калия моногидрат (128 мг; 0,61 ммоль). Затем добавляли ацетат палладия(II) (6 мг; 0,03 ммоль) и трифенилфосфин (26,5 мг; 0,1 ммоль). Полученную смесь нагревали в течение 1 часа на масляной бане (80°C). После охлаждения до комнатной температуры смесь разбавляли EtOAc. Реакционную смесь распределяли между EtOAc и 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, дихлорметан:MeOH 95:5 до 9:1) с получением трет-бутил 3-[6-(2-фенилэтинил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноата (190 мг; 90%). Rt 1,44 мин (Система B), [M+H]+ 418,3. Этот продукт (170 мг; 0,41 ммоль) растворяли в 4M растворе HCl в 1,4-диоксане (10 мл; 4 моль/л; 40 ммоль) и нагревали в течение 1,5 часа на масляной бане (50°C). Затем растворитель удаляли в вакууме и остаток обрабатывали iPr2O, осадок собирали фильтрованием и сушили в течение ночи при пониженном давлении с получением продукта (120 мг, 70%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,55 (уш.с, 1H), 10,18 (уш.с, 1H), 7,39-7,45 (м, 2H), 7,28-7,33 (м, 3H), 7,02 (с, 2H), 6,87 (с, 1H), 4,42 (с, 2H), 3,14-3,44 (м, 4H), 2,89-3,01 (м, 2H), 2,73 (т, J=8 Гц, 2H), 2,05-2,17 (м, 2H), 1,75-1,84 (м, 2H). Rt 1,37 мин (Система B), [M+H]+ 363,2.
Следующее соединение было получено аналогичным способом:
Соединение 304. Гидрохлорид 3-{6-[2-(2-хлорфенил)этинил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,52-7,56 (м, 1H), 7,40-7,44 (м, 1H), 7,22-7,26 (м, 2H), 7,07-7,14 (м, 2H), 6,97 (с, 1H), 4,39 (с, 2H), 2,88-2,95 (м, 2H), 2,70 (т, J=8 Гц, 2H), 2,45 (т, J=8 Гц, 2H), 2,03-2,12 (м, 2H), 1,91-2,01 (м, 2H), 1,71-1,78 (м, 2H), 1,46 (с, 9H). Rt 1,39 мин (Система B), [M+H]+ 396,2.
Трет-бутил 3-{6-бензил-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
К дегазированной смеси B-бензил-9-BBN (279,3 мг; 1,32 ммоль) (0,5 м/л в ТГФ (15 мл) добавляли трехосновной фосфат калия моногидрат (420 мг; 1,98 ммоль) и реакционную смесь перемешивали в течение 15 минут. Затем добавляли трет-бутил 3-{-{6-[(трифторметан)сульфонилокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат (307 мг, 0,66 ммоль), ацетат палладия(II) (6 мг; 0,03 ммоль) и 2-дициклогексилфосфино-2',6'-диметокси-1',1'-бифенил (22 мг; 0,05 ммоль). Полученную смесь нагревали в течение 1 часа при температуре кипения с обратным холодильником. После охлаждения до комнатной температуры смесь разбавляли EtOAc. Реакционную смесь распределяли между EtOAc и 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, дихлорметан:MeOH 95:1) с получением продукта (200 мг; 74,4%). Rt 1,40 мин (Система B), [M+H]+ 408,2.
Трет-бутил 3-[6-(2-фенилэтил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат. К дегазированной смеси фенетилтрифторбороната калия (209 мг; 0,99 ммоль) в толуоле (15 мл) и H2O (1,5 мл) добавляли трехосновной фосфат калия моногидрат (630 мг; 3 ммоль) и полученную реакционную смесь перемешивали в течение 15 минут. Затем добавляли трет-бутил 3-{-{6-[(трифторметан)сульфонилокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат (307 мг, 0,66 ммоль), ацетат палладия(II) (7 мг; 0,03 ммоль) и 2-дициклогексилфосфино-2',6'-диизопропокси-1',1'-бифенил (30 мг; 0,07 ммоль). Полученную смесь нагревали в течение 1 часа в предварительно нагретой масляной бане (100°C). После охлаждения до комнатной температуры смесь разбавляли EtOAc. Реакционную смесь распределяли между EtOAc и 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали повторной колоночной хроматографией (SiO2, дихлорметан:MeOH 95:5) с получением продукта (190 мг; 68,4%). Rt 1,43 мин (Система B), [M+H]+ 422,2.
Трет-бутил 3-{6-[(2-(2,дихлорфенил)этил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. К дегазированному раствору [2-(2,6-дихлорфенил)этил]трифторбората калия (0,3 г; 1,07 ммоль) в толуоле (10 мл) и воде (1 мл) добавляли трехосновной фосфат калия (0,68 г; 3,2 ммоль) и реакционную смесь перемешивали в течение 10 минут. Затем добавляли трет-бутил 3-{-{6-[(трифторметан)сульфонилокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат (382 мг, 0,82 ммоль), ацетат палладия(II) (7,3 мг; 0,03 ммоль) и 2-дициклогексилфосфино-2',6'-диизопропокси-1,1'-бифенил (30 мг; 0,07 ммоль). Полученную смесь нагревали при температуре кипения с обратным холодильником в течение ночи. После охлаждения до комнатной температуры смесь концентрировали в вакууме и распределяли между EtOAc и 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1) с получением продукта (0,21 г; 52,1%). Rt 1,52 мин (Система B), [M+H]+ 490,0
Необходимый [2-(2,6-дихлорфенил)этил]трифторборат калия получали следующим образом: К раствору 2,6-дихлорстирола (1,58 мл; 11,6 ммоль) в ТГФ (15 мл) добавляли димер хлор(1,5-циклооктадиен)иридия(I) (38,8 мг; 0,06 ммоль), 1,2-бис(дифенилфосфино)этан (46,1 мг; 0,12 ммоль) и пинаколборан (11,6 мл; 1M в ТГФ; 11,6 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи, затем концентрировали в вакууме и очищали колоночной хроматографией (SiO2, Et2O:гексан 1:3). Полученный продукт обрабатывали MeOH (56 мл), водой (14 мл) и бифторидом калия (3,43 г; 43,9 ммоль) и перемешивали при комнатной температуре в течение ночи. Затем растворители удаляли в вакууме и остаток обрабатывали толуолом и концентрировали в вакууме. Последние стадии повторяли три раза, чтобы полностью удалить воду. Полученное твердое вещество обрабатывали CH3CN и нагревали при 50°C. Осадок удаляли фильтрованием и промывали CH3CN. Объединенные CH3CN слои концентрировали в вакууме и остаток обрабатывали Et2O. Образовавшийся осадок собирали фильтрованием и сушили в вакууме с получением [2-(2,6-дихлорфенил)этил]трифторбората калия (1,12 г), который использовали как таковой.
Трет-бутил 3-{6-[(2-(2-фторфенил)этил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. К трет-бутил 3-{6-[(E)-(2-(2-фторфенил)этенил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноату (соединение 171) (80 мг; 0,18 ммоль) в 10 мл MeOH добавляли гидроксид палладия (3 мг; 0,02 ммоль). Смесь обрабатывали Н2 в течение ночи. Неочищенную реакционную смесь фильтровали через Целит с получением продукта (80 мг; 99%). Rt 1,39 мин (Система B), [M+H]+ 440,1.
Трет-бутил 3-[6-(феноксиметил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат. К дегазированному раствору трифтор(феноксиметил)]-борана калия (0,3 г; 1,07 ммоль) (Org. Lett., 2008, Vol 10, No 11, 2135) в толуоле (20 мл) и воде (2 мл) добавляли трехосновной фосфат калия (0,64 г; 3 ммоль) и реакционную смесь перемешивали в течение 10 минут. Затем добавляли трет-бутил 3-{-{6-[(трифторметан)сульфонилокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат (325 мг, 0,7 ммоль), ацетат палладия(II) (15,6 мг; 0,07 ммоль) и 2-дициклогексилфосфино-2',6'-диизопропокси-1,1'-бифенил (65 мг; 0,14 ммоль). Полученную смесь нагревали при температуре кипения с обратным холодильником в течение 70 часов. После охлаждения до комнатной температуры смесь концентрировали в вакууме и распределяли между EtOAc и 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, дихлорметан:ацетон 9:1) с получением продукта (0,25 г; 84,1%). Rt 1,29 мин (Система B), [M+H]+ 424,4.
Трет-бутил 3-[6-(фениламино)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат. К дегазированному раствору анилина (84 мг: 0,9 ммоль) в толуоле (15 мл) добавляли карбонат цезия (342 мг; 1,05 ммоль), трет-бутил 3-{-{6-[(трифторметан)сульфонилокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат (350 мг, 0,75 ммоль), ацетат палладия(II) (8,44 мг; 0,04 ммоль), фенилбороновую кислоту (4,5 мг; 0,04 ммоль) и 2-дициклогексилфосфино-2',6'-диизопропокси-1,1'-бифенил (35 мг; 0,08 ммоль). Полученную смесь нагревали при 100°C в течение ночи. После охлаждения до комнатной температуры смесь концентрировали в вакууме и распределяли между EtOAc и 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, дихлорметан:ацетон 97:3) с получением продукта (0,27 г; 87,9%). Rt 1,33 мин (Система В) [M+H]+ 409,2.
Соединение 184. Гидрохлорид 3-{6-бензил-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты. Трет-бутил 3-{6-бензил-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат (180 мг, 0,44 ммоль) растворяли в 4M растворе HCl в 1,4-диоксане (10 мл; 4 моль/л; 40 ммоль) и перемешивали в течение 48 часов при комнатной температуре. Затем растворитель удаляли в вакууме и остаток обрабатывали iPr2O, осадок собирали фильтрованием и сушили в течение ночи при пониженном давлении с получением продукта (120 мг, 66,5%). Rt 1,29 мин (Система B), [M+H]+ 352,2.
Следующие соединения были получены аналогичным способом:
Соединение 185. Гидрохлорид 3-[6-(2-фенилэтил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановой кислоты,
Rt 1,37 мин (Система B), [M+H]+ 366,2.
Соединение 186. Гидрохлорид 3-{6-[(2-(2,дихлорфенил)этил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты. Rt 1,36 мин (Система B). [M+H]+ 384,1.
Соединение 187. Гидрохлорид 3-{6-[(2-(2-фторфенил)этил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты,
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,90 (уш.с, 1H), 10,20 (уш.с, 1H), 7,42-7,48 (м, 2H), 7,27-7,32 (м, 1H), 7,04 (уш.с, 1H), 6,82 (д, J=6,2 Гц, 1H), 6,69 (с, 1H), 4,48 (уш.с, 2H), 3,42-3,56 (м, 2H), 3,26-3,39 (м, 2H), 3,00-3,14 (м, 4H), 2,86 (т, J=7,7 Гц, 2H), 2,68-2,75 (м, 2H), 2,16-2,30 (м, 2H), 1,85-1,95 (м, 2H). Rt 1,42 мин (Система B), [M+H]+ 433,9.
Соединение 188. Гидрохлорид 3-[6-(феноксиметил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановой кислоты,
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,64 (уш.с, 1H), 10,18 (уш.с, 1H), 7,29 (т, J=8 Гц, 2H), 7,12 (уш.с, 1H), 6,88-7,03 (м, 5H), 5,05 (с, 2H), 4,49 (с, 2H), 3,27-3,54 (м, 4H), 3,00-3,16 (м, 2H), 2,84 (т, J=8 Гц, 2H), 2,12-2,27 (м, 2H), 1,85-1,94 (м, 2H). Rt 1,32 мин (Система B), [M+H]+ 368,2.
Соединение 189. Гидрохлорид 3-[6-(фениламино)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановой кислоты. Rt 1,24 мин (Система B), [M+H]+ 353,2
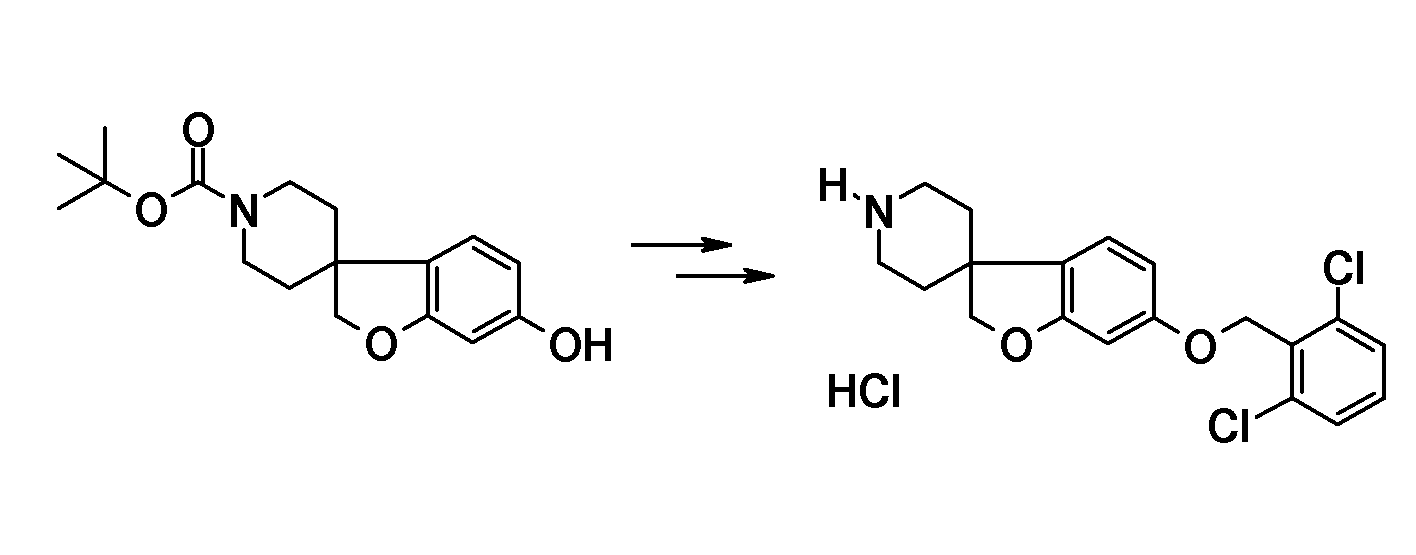
Соединение 190. 6-[(2,6-Дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]гидрохлорид. Смесь 2H-спиро[1-бензофуран-3,4'-пиперидин]-6-ола (2,6 г; 12,7 ммоль) и ди-трет-бутилдикарбоната (3,04 г; 13,9 ммоль) в дихлорметане (50 мл) перемешивали при комнатной температуре в течение ночи. Затем полученную смесь концентрировали в вакууме и остаток очищали колоночной хроматографией (SiO2, Et2O; гексан) с получением трет-бутил 6-гидрокси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-карбоксилата (2,5 г; 81%). Rt 1,89 мин (Система B), [M+H]+ 306,1. К раствору (2,6-дихлорфенил)метанола (0,24 г; 1,38 ммоль) и трет-бутил 6-гидрокси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-карбоксилата (0,28 г, 0,92 ммоль) в дихлорметане (10 мл) добавляли трифенилфосфин (0,36 г; 1,38 ммоль), затем через 30 минут добавляли DIAD (0,27 мл; 1,38 ммоль). Затем полученную смесь перемешивали при комнатной температуре в течение ночи и разбавляли дихлорметаном, промывали 5% водным раствором NaHCO3, сушили (Na2SO4) и фильтровали. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1) с получением трет-бутил 6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-карбоксилата (430 мг; 100%).
Трет-бутил 3-{6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-карбоксилат (3,68 г, 7,92 ммоль) растворяли в 1M растворе HCl в EtOH (30 мл) и перемешивали в течение 2 часов при 50°C. Затем растворитель удаляли в вакууме и остаток обрабатывали iPr2O, осадок собирали фильтрованием и сушили в течение ночи при пониженном давлении с получением 6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]гидрохлорида (1,89 г, 59% ).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,55-7,58 (м, 2H), 7,46 (дд, J=8,1 и 6,2 Гц, 1H), 7,05 (д, J=8,1 Гц, 1H), 6,57-6,61 (м, 2H), 5,18 (с, 2H), 4,49 (уш.с, 2H), 3,23-3,32 (м, 2H), 2,91-3,03 (м, 2H), 1,98-2,10 (м, 2H), 1,77-1,82 (м, 2H).
Соединение 191. 6-[(2,6-Дихлорфенил)метокси]-1'-метил-2H-спиро[1-бензофуран-3,4'-пиперидин]. К раствору 6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин] (220 мг; 0,55 ммоль) и N-этилдиизопропиламина (0,19 мл; 1,10 ммоль) в MeOH (20 мл) добавляли формальдегид (0,08 мл; 1,1 ммоль; 37% в H2O) и триацетоксиборгидрид натрия (232 мг; 1,1 ммоль). Затем полученную смесь перемешивали при комнатной температуре в течение ночи. Затем смесь разбавляли EtOAc, промывали 5% водным раствором NaHCO3, сушили (Na2SO4) и фильтровали. Остаток очищали колоночной хроматографией (SiO2, MeOH) с получением продукта (160 мг; 67,5%). Rt 1,36 мин (Система B), [M+H]+ 378,0.
Соединение 192. Гидрохлорид 3-{6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутановой кислоты. К смеси 6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин] (0,6 г; 1,5 ммоль) в дихлорэтане (12 мл), добавляли трет-бутил ацетоацетат (1 мл; 6 ммоль), триацетоксиборгидрид натрия (232 мг; 1,1 ммоль) и каплю уксусной кислоты. Затем полученную смесь перемешивали при комнатной температуре в течение ночи. Затем смесь разбавляли EtOAc, промывали 5% водным раствором NaHCO3, сушили (Na2SO4) и фильтровали. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:3) с получением трет-бутил 3-{6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутаноата (0,76 г; 72,5%). Rt 1,70 мин (Система B), [M+H]+ 506,0, который гидролизовали с использованием 4M раствора HCl в 1,4-диоксане, с получением продукта (90%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,80 (уш.с, 1H), 10,70 (уш.с, 1H), 7,55-7,59 (м, 2H), 7,46 (дд, J=8,1 и 6,2 Гц, 1, 1H), 7,05 (уш.с, 1H), 6,55-6,62 (м, 2H), 5,18 (с, 2H), 4,52 (уш.с, 2H), 3,62-3,72 (м, 1H), 3,30-3,48 (м, 2H), 2,98-3,20 (м, 3H), 2,52-2,63 (м, 1H), 2,30-2,48 (м, 2H), 1,80-1,90 (м, 2H), 1,33 (д, J=7,8 Гц, 3H). Rt 1,70 мин (Система B), [M+H]+ 450,0.
Соединение 193. 3-{6-[(2,6-Дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2,2-дифторпропановая кислота. К раствору 6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин] (1 г; 2,5 ммоль) в EtOH (10 мл) добавляли 1H-бензотриазол-1-метанол (0,37 г; 2,5 ммоль) и реакционную смесь нагревали при 50°C в течение 20 минут. После охлаждения до комнатной температуры растворитель удаляли в вакууме с получением 6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1H-бензотриазола, который использовали как таковой.
К суспензии цинковой пыли (0,33 г; 4,99 ммоль) в безводном ТГФ (10 мл) добавляли хлортриметилсилан (0,32 мл; 2,5 ммоль) и этилбромдифторацетат (0,48 мл; 3,74 ммоль). Эту смесь нагревали при температуре кипения с обратным холодильником в течение 10 минут и затем охлаждали до комнатной температуры. К полученной смеси добавляли по каплям раствор 6-[(2,6-дихлорфенил)-метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1Н-бензотриазола в ТГФ (5 мл). После завершения добавления полученную смесь нагревали при температуре кипения с обратным холодильником в течение 2 часов. После охлаждения до комнатной температуры реакционную смесь фильтровали через кизельгур и фильтровальную лепешку промывали этанолом. Растворители удаляли в вакууме и остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1) с получением трет-бутил 3-{6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2,2-дифторпропаноата (0,21 г; 16,8%). Rt 2,61 мин (Система B), [M+H]+ 500,0, который растворяли в EtOH (15 мл). Добавляли гидроксид натрия (3,0 мл; 2 моль/л; 6 ммоль; 14,3 экв.) и реакционную смесь перемешивали в течение 3 часов при 50°C и затем охлаждали до 0°C. К этой реакционной смеси добавляли по каплям водный раствор HCl (6 мл; 1 моль/л), затем смесь концентрировали в вакууме. Остаток обрабатывали насыщенным солевым раствором и дихлорметаном. Водный слой промывали дихлорметаном (два раза). Затем органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме, с последующей обработкой iPr2O. Образовавшийся осадок собирали фильтрованием, промывали iPr2O и сушили в вакууме с получением продукта (100 мг; 50,4%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,56-7,59 (м, 2H), 7,47 (дд, J=8,1 и 6,2 Гц, 1H), 7,12 (д, J=8,0 Гц, 1H), 6,58-6,62 (м, 2H), 5,17 (с, 2H), 4,45 (уш.с, 2H), 3,87 (т, J=15,1 Гц, 2H), 3,35-3,42 (м, 2H), 3,03-3,18 (м, 2H), 2,08-2,19 (м, 2H), 1,79-1,85 (м, 2H). Rt 1,77 мин (Система B), [M+H]+ 472,0.
Соединение 194. 3-{6-[(2,6-Дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2,2-метилпропановая кислота. К смеси 6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин] (0,42 г; 1,05 ммоль) в дихлорэтане (10 мл) добавляли трет-бутил 2,2-диметил-3-оксопропаноат (0,35 г; 2,1 ммоль), триацетоксиборгидрид натрия (0,6 г; 3 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 72 часов. Затем смесь разбавляли EtOAc, промывали 5% водным раствором NaHCO3, сушили (Na2SO4) и фильтровали. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1) с получением трет-бутил 3-{6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил-2,2-метилпропаноата (0,54 г). Rt 1,70 мин (Система B), [M+H]+ 506,0, который суспендировали в ТГФ (11 мл). К этой суспензии добавляли гидроксид лития (82 мг; 3,39 ммоль) и смесь перемешивали при 50°C в течение 48 часов. К этой смеси (при комнатной температуре) добавляли 3 мл 1M раствора HCl, 50 мл H2O и 25 мл фосфатного буфера (pH 7). Эту смесь промывали дихлорметаном (3 раза). Затем органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме с получением продукта (490 мг; 93%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,36-7,39 (м, 2H), 7,25 (дд, J=8,1 и 6,2 Гц, 1H), 7,08 (д, J=8,3 Гц, 1H), 6,60 (дд, J=8,2 и 2,3 Гц, 1H), 6,53 (д, J=2,2 Гц, 1H), 5,23 (с, 2H), 4,39 (с, 2H), 3,08-3,18 (м, 2H), 2,45-2,62 (м, 4H), 2,01-2,11 (м, 2H), 1,80-1,88 (м, 2H), 1,27 (с, 6H). Rt 1,64 мин (Система 25 B), [M+H]+ 464,0.
Соединение 305. 4-{6-[(2,6-Дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-3-метилбутановая кислота. Смесь 6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин] (0,45 г; 1,12 ммоль), К2СО3 (0,47 г; 3,37 ммоль), метил 4-хлор-3-метилбутаноата и иодида калия (0,22 г; 1,35 ммоль) в CH3CN (20 мл) нагревали при кипячении с обратным холодильником в течение 72 часов. После охлаждения до комнатной температуры реакционную смесь распределяли между 5% водным раствором NaHCO3 и Et2O. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O) с получением трет-бутил 4-{6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-3-метилбутаноата (0,16 г; 30%). Rt 1,36 мин (Система B), [M+H]+ 478,6. Смесь этого продукта (150 мг; 0,31 ммоль), 2M водного раствора NaOH (2 мл; 4 ммоль) и этанола (10 мл) перемешивали в течение 3 часов при 50°C и затем охлаждали до 0°C. К этой реакционной смеси добавляли по каплям водный раствор HCl (4 мл; 1 моль/л), затем смесь концентрировали в вакууме. Остаток обрабатывали насыщенным солевым раствором и дихлорметаном. Водный слой промывали дихлорметаном (два раза). Затем органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме, с последующей обработкой iPr2O. Образовавшийся осадок собирали фильтрованием, промывали iPr2O и сушили в вакууме с получением 4-{6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-3-метилбутановой кислоты (50 мг; 32,6%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,53-7,58 (м, 2H), 7,43-7,50 (м, 1H), 7,12 (д, J=8,1 Гц, 1H), 6,51-6,57 (м, 2H), 5,16 (с, 2H), 4,37 (с, 2H), 2,76-2,92 (м, 2H), 2,37 (дд, J=15,1, 6,0 Гц, 1H), 2,18-2,24 (м, 2H), 2,07-2,17 (м, 2H), 1,98-2,06 (м, 2H), 1,78-1,89 (м, 2H), 1,62 (д, J=12,9 Гц, 2H), 0,89 (д, J=6,4 Гц, 3H). Rt 1,39 мин (Система B), [M+H]+ 464,6.
Соединение 306. 4-{6-[(2,6-Дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пентановая кислота. К смеси 6-[(2,6-дихлорфенил)-метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин] (0,63 г; 1,57 ммоль) в дихлорэтане (12 мл) добавляли этиллевулинат (0,67 мл; 4,72 ммоль), триацетоксиборгидрид натрия (0,93 г; 4,4 ммоль) и несколько капель уксусной кислоты. Полученную смесь перемешивали при комнатной температуре в течение 72 часов. Затем смесь разбавляли EtOAc, промывали 5% водным раствором NaHCO3, сушили (Na2SO4) и фильтровали. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1) с получением этил 4-{6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пентаноата (0,14 г; 18,8%). Rt 1,40 мин (Система B), [M+H]+ 492,6, который гидролизовали до кислоты, как описано для соединения 305 (100 мг; 70%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,54-7,59 (м, 2H), 7,44-7,50 (м, 1H), 7,07 (д, J=8,1 Гц, 1H), 6,53-6,60 (м, 2H), 5,17 (с, 2H), 4,41-4,48 (м, 2H), 2,97-3,10 (м, 2H), 2,72-2,82 (м, 1H), 2,58-2,69 (м, 1H), 2,25-2,41 (м, 2H), 1,91-2,13 (м, 4H), 1,75 (д, J=12,9 Гц, 2H), 1,52-1,63 (м, 1H), 1,12 (д, J=6,4 Гц, 3H). Rt 1,35 мин (Система B), [M+H]+ 464,6.
Соединение 195. Гидрохлорид 3-{6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}этан-1-ола. Смесь 6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин] (1,61 г; 4,02 ммоль), 2-(2-хлорэтокси)тетрагидро-2H-пирана (0,71 мл; 4,82 ммоль), K2CO3 (1,67 г; 12,05 ммоль) и NaI (0,12 г; 0,8 ммоль) в DMF (215 мл) нагревали до 100°C в течение ночи. После охлаждения до комнатной температуры реакционную смесь распределяли между 5% водным раствором NaHCO3 и Et2O. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O) с получением 6-[(2,6-дихлорфенил)метокси]-1'-[2-(оксан-3-илокси)этил-2H-спиро[1-бензофуран-3,4'-пиперидин] (1 г; 50%), который растворяли в MeOH (20 мл). К этой реакционной смеси добавляли моногидрат п-толуолсульфоновой кислоты (0,39 г; 2 ммоль) и полученную смесь перемешивали при 50°C в течение 1 часа. Реакционную смесь распределяли между 5% водным раствором NaHCO3 и EtOAc. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, MeOH) с получением продукта (0,46 г), который преобразовывали в его HCl соль путем обработки продукта в 1 M растворе HCl в EtOH с последующим концентрированием в вакууме (70 мг; 7,7%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,70 (уш.с, 1H), 7,54-7,80 (м, 2H), 7,44-7,50 (м, 1H), 7,0 (д, J=7,9 Гц, 1H), 6,55-6,62 (м, 2H), 5,37 (м, 1H), 5,17 (с, 2H), 4,50 (с, 2H), 3,74-3,82 (м, 2H), 3,49-3,57 (м, 2Н), 3,14-3,20 (м, 2H), 3,00-3,12 (м, 2H), 2,13-2,27 (м, 2H), 1,81-1,89 (м, 2H).
Соединение 196. (2-{6-[(2,6-Дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}этокси)фосфоновая кислота. К раствору 3-{6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}этан-1-ола (0,36 г; 0,88 ммоль) в N,N-диметилформамиде (3 мл) добавляли раствор тетразола в CH3CN ((7,84 мл; 0,45 ммоль) при комнатной температуре. Полученную смесь перемешивали в течение 30 минут и затем добавляли ди-трет-бутил N,N-диизопропилфосфорамидит (0,56 мл; 1,76 ммоль) и реакционную смесь перемешивали в течение 1,5 часа. Затем смесь охлаждали до 0°C и добавляли раствор трет-бутилгидропероксида в нонане (0,24 мл; ~5,5 моль/л, 1,32 ммоль). Затем смесь перемешивали при комнатной температуре еще в течение 30 минут. Реакцию гасили путем добавления 5% водного раствора NaHCO3 и экстрагировали EtOAc. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, EtOAc, затем MeOH) с получением ди-трет-бутил (2-{6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}этил)фосфоната (0,30 г; 62,5%). Rt 2,03 мин (Система B), [M+H]+ 544,0, который растворяли в хлористоводородной кислоте (5 мл; 4 моль/л; 20 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем растворитель удаляли в вакууме и остаток обрабатывали iPr2O, осадок собирали фильтрованием и сушили в течение ночи при пониженном давлении с получением продукта (0,23 г, 81%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,30 (уш.с, 1H), 7,55-7,59 (м, 2H), 7,46 (дд, J=8,1 и 6,2 Гц, 1H), 7,10 (уш.с, 1H), 6,55-6,62 (м, 2H), 5,18 (с, 2H), 4,48 (уш.с, 2H), 4,18-4,24 (м, 2H), 3,30-3,48 (м, 2H), 3,44-3,53 (м, 2H), 3,35-3,43 (м, 2H), 3,09-3,2 (м, 2H), 2,13-2,24 (м, 2H), 1,84-1,91 (м, 2H). Rt 2,03 мин (Система B), [M+H]+ 487,9.
Соединение 197. 6-[(2,6-Дихлорфенил)метокси]-1'-[2-(1H-1,2,3,4-тетразол-5-ил)этил-2H-спиро[1-бензофуран-3,4'-пиперидин]. К смеси 6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин] (0,51 г; 1,27 ммоль) в МеОН (10 мл) добавляли N-этилдиизопропиламин (0,27 мл; 1,59 ммоль) и акрилонитрил (0,11 мл; 2,8 ммоль) и полученную смесь перемешивали при 80°C в течение 4 часов (в закрытой бутыли из пирекса). Затем смесь концентрировали в вакууме и остаток очищали колоночной хроматографией (SiO2, Et2O) с получением 3-{6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаннитрила (0,31 г; 58%). Rt 1,80 мин (Система B), [M+H]+ 417,0, который растворяли в толуоле (10 мл). Затем добавляли азидотриметилолово (0,39 г; 1,8 ммоль) и реакционную смесь нагревали в течение 72 часов при 100°C. Затем смесь концентрировали в вакууме и остаток очищали колоночной хроматографией (SiO2, EtOAc:MeOH 9:1, затем MeOH) с получением продукта (0,09 г; 29,3%). Rt 1,54 мин (Система B), [M+H]+ 460,0.
Соединение 198. (3-{6-[(2,6-Дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропил)фосфоновая кислота. Смесь 6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин] (0,59 г; 1,47 ммоль), диэтил (3-бромпропил)фосфоната (0,34 мл; 1,77 ммоль), NaI (0,04 г; 0,29 ммоль) и K2CO3 (0,61 г; 4,42 ммоль) в CH3CN (10 мл) нагревали при температуре кипения с обратным холодильником в течение 2 часов. После охлаждения до комнатной температуры смесь распределяли между 5% водным раствором NaHCO3 и Et2O. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, EtOAc:MeOH 90:10) с получением диэтил (3-{6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропил)фосфоната (0,8 г; 85,1%). Rt 1,62 мин (Система B), [M+H]+ 542,0. К раствору диэтил (3-{6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропил)фосфоната (0,68 г; 1,25 ммоль) в CH2Cl2 (15 мл) добавляли бромтриметилсилан (1,32 мл; 10 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем смесь концентрировали в вакууме, снова растворяли в MeOH (10 мл) и перемешивали в течение 2 часов при комнатной температуре. Полученную смесь концентрировали в вакууме и обрабатывали iPr2O. Осадок собирали фильтрованием и сушили в вакууме с получением продукта (0,65 г; 86,8%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,10-11,10 (м, 2H), 7,54-7,59 (м, 2H), 7,46 (дд, J=8,1 и 6,2 Гц, 1H), 7,10 (уш.с, 1H), 6,55-6,62 (м, 2H), 5,18 (с, 2H), 4,52 (уш.с, 2H), 3,40-3,58 (м, 2H), 3,12-3,24 (м, 2H), 2,97-3,12 (м, 2H), 2,02-2,13 (м, 2H), 1,83-1,97 (м, 4H), 1,59-1,70 (м, 2H). Rt 1,61 мин (Система B), [M+H]+ 485,9.
Соединение 199. 3-{6-[(2,6-Дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-3-оксопропановая кислота. К суспензии 6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин] 0,62 г; 1,55 ммоль) и N-этилдиизопропиламина (0,79 мл; 4,64 ммоль) в дихлорметане (15 мл) добавляли по каплям этилмалонилхлорид (0,3 мл; 2,32 ммоль) при 0°C. Полученную смесь перемешивали при комнатной температуре в течение ночи. Затем реакционную смесь распределяли между 5% водным раствором NaHCO3 и дихлорметаном. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O) с получением этил 3-{6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-3-оксопропаноата (0,46 г; 62,1%). Rt 2,44 мин (Система B), [M+H]+ 478,0, который растворяли в EtOH (15 мл) и гидроксиде натрия (3 мл; 2 моль/л; 6 ммоль) и смесь перемешивали при 50°C в течение ночи. После охлаждения до комнатной температуры полученную смесь загружали в РЕ-AX колонку [ISOLUTE (Biotage AB); 0,58 ммоль/г, 10 г]. Колонку промывали CH3CN и затем необходимое соединение элюировали 20% об./об. TFA в CH3CN. Содержащие соединение фракции концентрировали в вакууме с получением продукта (60 мг; 14,8%). Rt 2,62 мин (Система B), [M+H]+ 450,0.
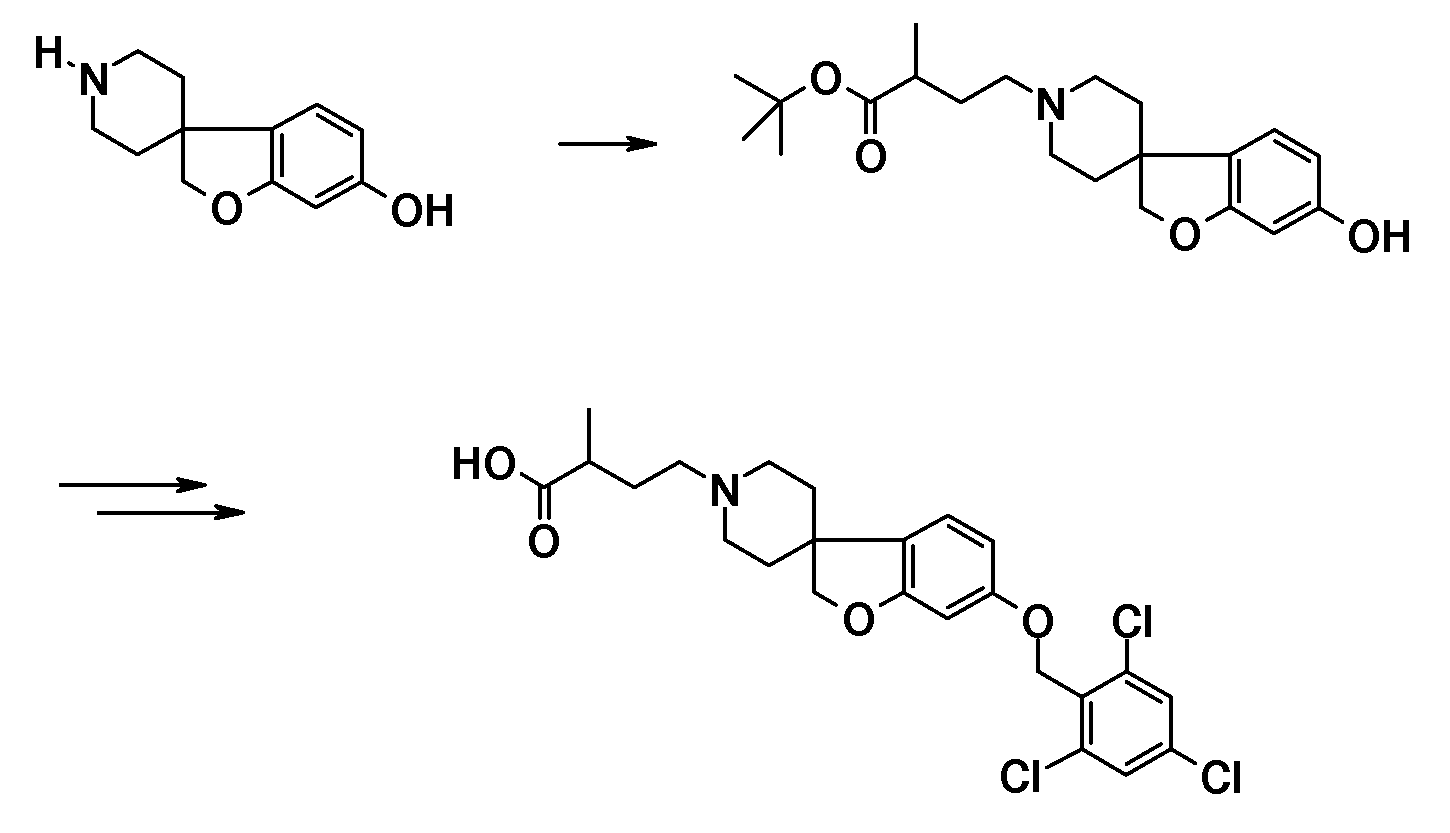
Соединение 307. 2-Метил-4-{6-[(2,4,6-трихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}бутановая кислота. Смесь 2H-спиро[1-бензофуран-3,4'-пиперидин]-6-ола (1,06 г; 5,16 ммоль), N-этилдиизопропиламина (2,65 мл; 15,49 ммоль), иодида калия (0,86 г; 5,16 ммоль) и метилового эфира 4-хлор-2-метилмасляной кислоты в CH3CN (50 мл) нагревали при кипячении с обратным холодильником в течение 72 часов. После охлаждения до комнатной температуры реакционную смесь распределяли между 5% водным раствором NaHCO3 и Et2O. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O) с получением трет-бутил 4-{6-гидрокси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилбутаноата (0,82 г; 50%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 6,93 (д, J=8,3 Гц, 1H), 6,28-6,36 (м, 2H), 4,35 (с, 2H), 3,69 (с, 3H), 2,88-2,94 (м, 2H), 2,47-2,55 (м, 1H), 2,32-2,41 (м, 2H), 1,86-2,06 (м, 5H), 1,57-1,75 (м, 3H), 1,18 (д, J=7,6 Гц, 3H).
К раствору (2,4,6-трихлорфенил)метанола (0,24 г; 1,13 ммоль) и трет-бутил 4-{6-гидрокси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилбутаноата (0,29 г, 0,91 ммоль) в дихлорметане (20 мл) добавляли трифенилфосфин (0,3 г; 1,13 ммоль), затем через 30 минут добавляли DIAD (0,22 мл; 1,13 ммоль). Затем полученную смесь перемешивали при комнатной температуре в течение ночи и разбавляли дихлорметаном, промывали 5% водным раствором NaHCO3, сушили (Na2SO4) и фильтровали. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1) с получением трет-бутил 2-метил-4-{6-[(2,4,6-трихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'пиперидин]-1'-ил}бутаноат кислоты (280 мг; 60%). Rt 1,51 мин (Система B), [M+H]+ 514,1. Смесь этого продукта (270 мг; 0,53 ммоль), 2M водного раствора NaOH (2 мл; 4 ммоль) и этанола (10 мл) перемешивали в течение 3 часов при 50°C и затем охлаждали до 0°C. К этой реакционной смеси добавляли по каплям водный раствор HCl (4 мл; 1 моль/л), затем смесь концентрировали в вакууме. Остаток обрабатывали насыщенным солевым раствором и дихлорметаном. Водный слой промывали дихлорметаном (два раза). Затем органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме, с последующей обработкой iPr2O. Образовавшийся осадок собирали фильтрованием, промывали iPr2O и сушили в вакууме с получением продукта (160 мг: 60%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,79 (с, 2H), 7,11 (д, J=8,0 Гц, 1H), 6,49-6,55 (м, 2H), 5,13 (с, 2H), 4,36 (с, 2H), 2,80-2,88 (м, 2H), 2,31-2,42 (м, 3H), 1,96-2,10 (м, 2H), 1,72-1,87 (м, 3H), 1,61 (д, J=12,4 Гц, 2H), 1,45-1,55 (м, 1H), 1,07 (д, J=7,0 Гц, 3H). Rt 1,49 мин (Система В), [M+H]+ 500,1.
Следующие соединения были получены аналогичным способом:
Соединение 308. 4-{6-[(2,6-Дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилбутановая кислота.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,54-7,59 (м, J=7,6 Гц, 2H), 7,44-7,50 (м, 1H), 6,92-7,18 (м, 1H), 6,56-6,62 (м, 2H), 5,17 (с, 2H), 4,47 (с, 2H), 3,25-3,54 (м, 3H), 2,91-3,19 (м, 3H), 2,42-2,49 (м, 1H), 2,12-2,29 (м, 2H), 1,94-2,09 (м, 1H), 1,75-1,91 (м, 3H), 1,13 (д, J=8,5 Гц, 3H). Rt 1,34 мин (Система B), [M+H]+ 464,1.
Соединение 309. 4-{6-[(2-Хлор-6-этилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилбутановая кислота.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,33-7,38 (м, 2H), 7,24-7,30 (м, 1H), 7,11 (д, J=7,5 Гц, 1H), 6,50-6,57 (м, 2H), 5,09 (с, 2H), 4,38 (с, 2H), 2,88-2,99 (м, 2H), 2,71 (кв., J=8,1 Гц, 2H), 2,36-2,44 (м, 1H), 2,15-2,23 (м, 1H), 1,74-1,93 (м, 3H), 1,65 (д, J=12,9 Гц, 2H), 1,49-1,60 (м, 1H), 1,16 (т, J=8,1 Гц, 3H), 1,09 (д, J=7,1 Гц, 3H). Rt 1,39 мин (Система B), [M+H]+ 458,2.
Соединение 310. 4-{6-[(2-Хлор-6-фторфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилбутановая кислота.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,47-7,54 (м, 1H), 7,39-7,45 (д, J=8,4 Гц, 1H), 7,28-7,35 (т, 1H), 7,11 (д, J=7,8 Гц, 1H), 6,48-6,56 (м, 2H), 5,08 (д, J=1,6 Гц, 2H), 4,36 (с, 2H), 2,79-2,89 (м, 2H), 2,31-2,43 (м, 3H), 1,96-2,10 (м, 2H), 1,72-1,88 (м, 3H), 1,61 (д, J=12,7 Гц, 2H), 1,45-1,54 (м, 1H), 1,07 (д, J=7,6 Гц, 3H). Rt 1,31 мин (Система B), [M+H]+ 448,2.
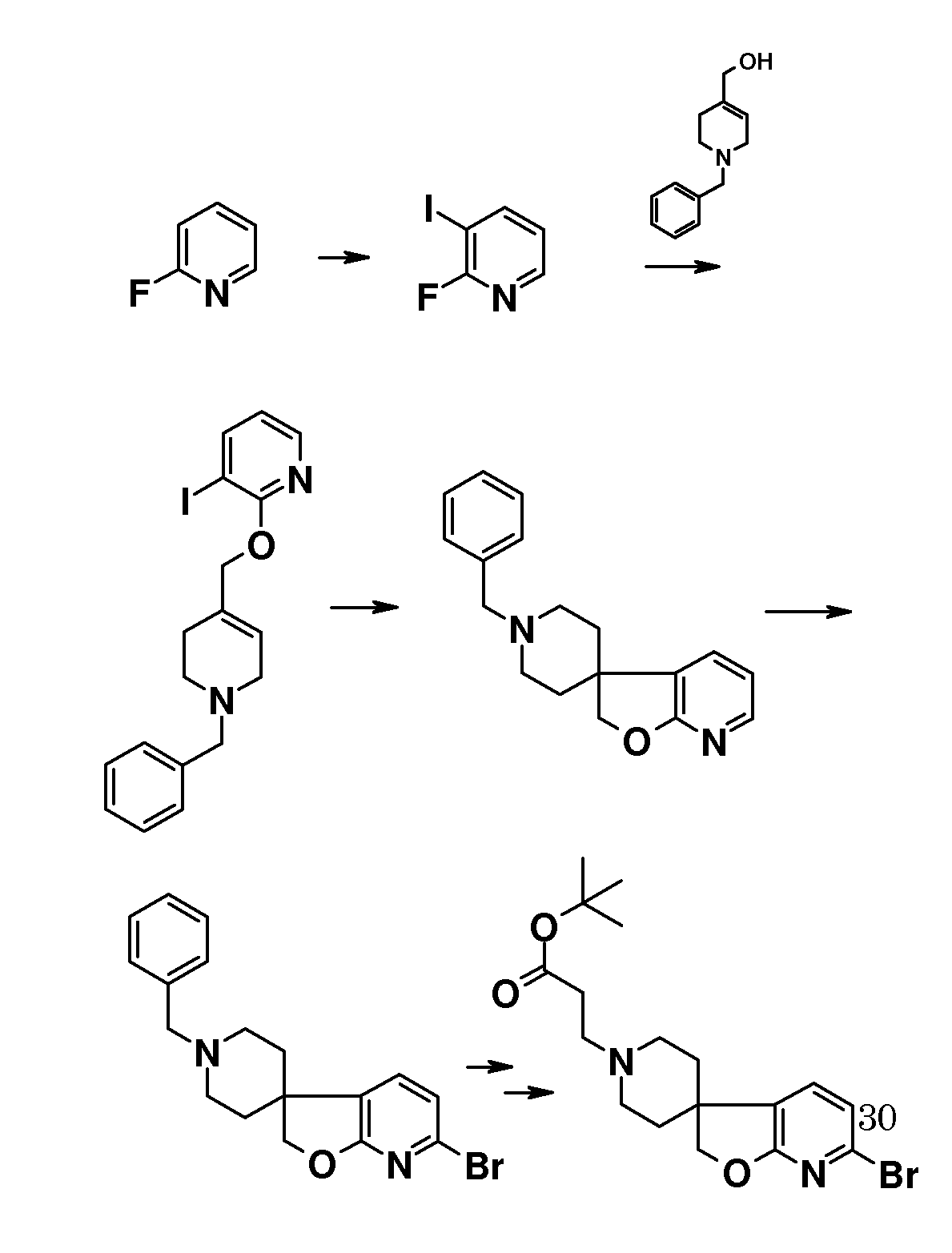
Трет-бутил 3-{5-бром-2H-спиро[фуро[2,3-b]пиридин-1,4'-пиперидин]-1'-ил}пропаноат. К раствору 2,2,6,6-тетраметилпиперидина (16,1 мл; 95,5 ммоль) в тетрагидрофуране (370 мл) (-78°C) добавляли н-бутиллитий (38,19 мл, 2,5 моль/л в гексане, 95,5 ммоль). Реакционную смесь перемешивали в течение 90 минут, давая температуре повыситься до 0°C. Затем (при -70°C) добавляли по каплям раствор 2-фторпиридина (8,2 мл; 95,5 ммоль), растворенного в ТГФ (10 мл). В процессе добавления температуру реакционной смеси поддерживали ниже -60°C. Реакционную смесь перемешивали при -70°С в течение одного часа, затем добавляли по каплям раствор иода (29 г; 114,6 ммоль) в тетрагидрофуране (50 мл). Полученную реакционную смесь перемешивали при -70°C в течение 2 часов. Реакционной смеси давали нагреться до 0°C и затем гасили путем добавления насыщенного водного раствора NH4Cl, затем Et2O. Органическую фазу отделяли и экстрагировали раствором бисульфита натрия, затем водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 5:95) с получением 2-фтор-3-иодпиридина (15,59 г; 73%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 8,21-8,13 (м, 2H), 7,01-6,95 (м, 1H). Rt 1,55 мин (Система B), [M+H]+ 224,0.
К перемешиваемому раствору (1-бензил-1,2,3,6-тетрагидропиридин-4-ил)метанола (WO2007/057775) (11,73 г; 57,7 ммоль) в N,N-диметилформамиде (114 мл) добавляли дисперсию гидрида натрия в минеральном масле (2,32 г) (порциями). Реакционную смесь перемешивали в течение 1 часа при температуре окружающей среды и добавляли к раствору 2-фтор-3-иодпиридина (11,39 г; 51 ммоль), растворенного в N,N-диметилформамиде (100 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в 5% раствор бикарбоната натрия и экстрагировали диэтиловым эфиром. Органический слой промывали водой (3 раза) и насыщенным солевым раствором. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1) с получением 2-[(1-бензил-1,2,3,6-тетрагидропиридин-4-ил)метокси]-3-иодпиридина (17,5 г; 84,31%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д.: 8,07 (д, J=5,8 Гц, 1H), 8,00 (д, J=3,0 Гц, 1H), 7,36-7,23 (м, 5H), 6,63 (т, J=4,8 Гц, 1H), 5,87-5,80 (м, 1H), 4,76 (с, 2H), 3,07-3,00 (с, 2H), 3,03 (с, 2H), 2,64 (т, J=5,8 Гц, 2H), 2,32-2,24 (м, 2H). Rt 1,19 мин (Система B), [M+H]+ 407,1.
К интенсивно дегазируемому раствору 2-[(1-бензил-1,2,3,6-тетрагидропиридин-4-ил)метокси]-3-иодпиридина (3,5 г; 8,62 ммоль) в толуоле (500 мл) добавляли последовательно 2,2'-азобис(2-метилпропионитрил) (0,28 г; 1,72 ммоль) и гидрид три-н-бутилолова (6,95 мл; 28,85 ммоль). Реакционную смесь нагревали в течение 24 часов при 110°C. После охлаждения до комнатной температуры смесь разбавляли Et2O и промывали 10% водным раствором KF. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O) с получением 1'-бензил-2H-спиро[фуро[2,3-b]пиридин-1,4'-пиперидин] (2,42 г; 70%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д.: 8,01 (д, J=3,5 Гц, 1H), 7,42 (д, J=5,5 Гц, 1H), 7,35-7,25 (м, 5H), 6,81 (т, J=5,3 Гц, 1H), 4,39 (с, 2H), 3,54 (с, 2H), 2,91-2,83 (м, 2H), 2,13-2,03 (м, 2H), 2,01-1,91 (м, 2H), 1,80-1,71 (м, 2H). Rt 0,89 мин (Система B), [M+H]+ 281,1.
Раствор N,N-диметилэтаноламина (1,64 мл; 16,26 ммоль) в ТГФ (10 мл) охлаждали до -5°C, затем добавляли по каплям н-бутиллитий (13 мл, 2,5 M в гексане; 32,52 ммоль) (Chem. Rev., 1993, 93, 2317). Полученную желтую смесь перемешивали при 0°C в течение 30 минут. Затем реакционную смесь охлаждали до -78°C и добавляли раствор 1'-бензил-2H-спиро[фуро[2,3-b]пиридин-1,4'-пиперидин] (1,52 г; 5,42 ммоль) в ТГФ (10 мл). Полученную реакционную смесь перемешивали в течение 1 часа. Затем к этой реакционной смеси добавляли раствор 1,2-дибромтетрафторэтана (2,58 мл; 21,7 ммоль), растворенного в ТГФ (40 мл). После завершения добавления реакционной смеси давали медленно нагреться и перемешивали в течение ночи при комнатной температуре. Реакционную смесь гасили путем добавления насыщенного водного раствора NH4Cl, затем Et2O. Органическую фазу отделяли и экстрагировали водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан:триэтиламин 35:60:5) с получением 1'-бензил-5-бром-2H-спиро[фуро[2,3-b]пиридин-1,4'-пиперидин] (0,65 г; 33,3%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д.: 7,36-7,25 (м, 6H), 7,00 (д, J=7,3 Гц, 1H), 4,43 (с, 2H), 3,55 (с, 2Н), 2,90-2,82 (м, 2H), 1,98-1,87 (м, 2H), 1,78-1,71 (м, 2H). Rt 1,09 мин (Система B), [M+H]+ 361,1.
К раствору 1'-бензил-5-бром-2H-спиро[фуро[2,3-b]пиридин-1,4'-пиперидин] (0,9 г; 2,56 ммоль) в 1,2-дихлорэтане (20 мл) при 0°C добавляли 1-хлорэтилхлорформиат (0,3 мл; 2,74 ммоль). Реакционную смесь перемешивали в течение 3 часов при 60°C. Неочищенную реакционную смесь концентрировали в вакууме. Добавляли толуол (100 мл) и смесь концентрировали. Эту последнюю стадию повторяли два раза. Добавляли MeOH (20 мл) и смесь перемешивали в течение ночи. Реакционную смесь концентрировали в вакууме с получением 5-бром-2H-спиро[фуро[2,3-b]пиридин-1,4'-пиперидин]гидрохлорида (0,85 г; >100%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д.: 9,17-9,03 (м, 1H), 7,55 (д, J=7,5 Гц, 1H), 7,18 (д, J=7,5 Гц, 1H), 4,58 (с, 2H), 3,65-3,25 (м, 3H), 3,07-2,92 (м, 2H), 2,15-2,03 (м, 2H), 1,93-1,84 (м, 2H). Rt 0,85 мин (Система B), [M+H]+ 269,0,
К суспензии 5-бром-2H-спиро[фуро[2,3-b]пиридин-1,4'-пиперидин]гидрохлорида (0,85 г; 2,78 ммоль) в MeOH (20 мл) добавляли трет-бутилметакрилат (0,48 мл; 3,34 ммоль) и N,N-диизопропилэтиламин (1 мл; 5,84 ммоль). Полученную смесь нагревали при 140°C в герметично закрытой колбе в течение ночи. После охлаждения до комнатной температуры реакционную смесь распределяли между 5% водным раствором NaHCO3 и EtOAc. Слои разделяли и органический слой сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали колоночной хроматографией (SiO2, Et2O) с получением трет-бутил 3-{5-бром-2H-спиро[фуро[2,3-b]пиридин-1,4'-пиперидин]-1'-ил}пропаноата (630 мг; 57%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д.: 7,26 (д, J=7,5 Гц, 1H), 7,01 (д, J=7,5 Гц, 1H), 4,42 (с, 2H), 2,90-2,82 (м, 2H), 2,69 (т, J=7,3 Гц, 2H), 2,43 (т, J=7,3 Гц, 2H), 2,15-2,05 (м, 2H), 1,95-1,85 (м, 2H), 1,46 (с, 9H). Rt 1,15 мин (Система B), [M+H]+ 399,0.
Трет-бутил 3-{5-[(2-хлорфенил)метокси-2H-спиро[фуро[2,3-b]пиридин-1,4'-пиперидин]-1'-ил)пропаноат.
К дегазированному раствору трет-бутил 3-{5-бром-2H-спиро[фуро[2,3-b]пиридин-1,4'-пиперидин]-1'-ил}пропаноата (300 мг, 0,76 ммоль) и (2-хлорфенил)метанола (215,32 мг; 1,51 ммоль) в толуоле (2,67 мл) добавляли карбонат цезия (0,37 г, 1,13 ммоль), ацетат палладия(II) (3,39 мг, 0,02 ммоль) и 2-ди-трет-бутилфосфино-3,4,5,6-тетраметил-2',4',6'-триизопропил-1,1'-бифенил (7,26 мг, 0,02 ммоль). Реакционную смесь перемешивали при 70°C в течение ночи. По прошествии ночи к реакционной смеси добавляли дополнительное количество ацетата палладия(II) (3,39 мг, 0,02 ммоль) и 2-ди-трет-бутилфосфино-3,4,5,6-тетраметил-2',4',6'-триизопропил-1,1'-бифенила (7,26 мг; 0,02 ммоль). Полученную смесь перемешивали еще в течение 3 часов. После охлаждения до комнатной температуры реакционную смесь разбавляли EtOAc, фильтровали и промывали 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан:триэтиламин 50:49:1) с получением трет-бутил 3-{5-[(2-хлорфенил)-метокси-2H-спиро[фуро[2,3-b]пиридин-1,4'-пиперидин]-1'-ил)пропаноата (220 мг; 63%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д.: 7,54-7,52 (м, 1H), 7,39-7,36 (м, 2H), 7,28-7,24 (м, 2H), 6,36 (д, J=7,8 Гц, 1H), 5,42 (с, 2H), 4,40 (с, 2H), 2,90-2,81 (м, 2H), 2,68 (т, J=7,5 Гц, 2H), 2,44 (т, J=7,5 Гц, 2H), 2,15-2,05 (м, 2H), 1,96-1,86 (м, 2Н), 1,70-1,78 (м, 2Н), 1,46 (с, 9Н). Rt 1,38 мин (Система В), [M+H]+ 459,0.
Следующее соединение было получено аналогичным способом:
Трет-бутил 3-{5-[(2,6-дихлорфенил)метокси-2H-спиро[фуро[2,3-b]пиридин-1,4'-пиперидин]-1'-ил]пропаноат.
1H ЯМР (400 МГц, CDCl3-d) δ м.д.: 7,21-7,37 (м, 4H), 6,31 (д, J=7,8 Гц, 1H), 5,54 (с, 2H), 4,42 (с, 2H), 2,90-2,82 (м, 2H), 2,70 (т, J=7,5 Гц, 2H), 2,44 (т, J=7,5 Гц, 2H), 2,17-2,06 (м, 2H), 1,97-1,87 (м, 2H), 1,79-1,69 (м, 2H), 1,46 (с, 9H). Rt 1,40 мин (Система B), [M+H]+ 493,0.
Трет-бутил 3-[5-(2,6-диметилфенокси)-2H-спиро[фуро[2,3-b]пиридин-1,4'-пиперидин]-1'-ил]пропаноат. К дегазированному раствору трет-бутил 3-{5-бром-2H-спиро[фуро[2,3-b]пиридин-1,4'-пиперидин]-1'-ил}пропаноата (250 мг; 0,63 ммоль) в ксилоле (3 мл) добавляли последовательно 2,6-диметилфенол (76,78 мг; 0,63 ммоль), карбонат калия (173,92 мг; 1,26 ммоль), 1-бутилимидазол (0,50 мл; 3,8 ммоль) и иодид меди(I) (23,97 мг; 0,13 ммоль). Реакционную смесь нагревали при 140°C и перемешивали в течение ночи. После охлаждения до комнатной температуры реакционную смесь разбавляли EtOAc, фильтровали и промывали 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан:триэтиламин 50:49:1) с получением продукта (70 мг, 25%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д.: 7,33 (д, J=7,8 Гц, 1H), 7,07-7,02 (м, 3H), 6,09 (д, J=7,8 Гц, 1H), 4,38 (с, 2H), 2,89-2,81 (м, 2H), 2,69 (т, J=7,5 Гц, 1H), 2,43 (т, J=7,5 Гц, 2H), 2,13 (с, 6H), 2,10-2,03 (м, 2H), 1,95-1,85 (м, 2H), 1,78-1,71 (м, 2H), 1,45 (с, 9H). Rt 1,35 мин (Система B), [M+H]+ 493,1.
Соединение 200. Гидрохлорид 3-{5-[(2-хлорфенил)метокси-2H-спиро[фуро[2,3-b]пиридин-1,4'-пиперидин]-1'-ил}пропановой кислоты.
Трет-бутил 3-{5-[(2-хлорфенил)метокси-2H-спиро[фуро[2,3-b]пиридин-1,4'-пиперидин]-1'-ил)пропаноат (200 мг, 0,44 ммоль) растворяли в 4M растворе HCl в 1,4-диоксане (10 мл; 4 моль/л; 40 ммоль) и перемешивали в течение 48 часов при комнатной температуре. Затем растворитель удаляли в вакууме и остаток обрабатывали iPr2O, осадок собирали фильтрованием и сушили в течение ночи при пониженном давлении с получением продукта (170 мг, 88%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,08 (уш.с, 1H), 10,9 (уш.с, 1H), 7,56-7,48 (м, 3H), 7,41-7,36 (м, 2H), 6,45 (д, 1H), 5,32 (с, 2H), 4,56-4,55 (м, 2H), 3,5-3,4 (м, 2H), 3,37-3,27 (м, 2H), 3,20-3,01 (м, 2H), 2,87 (т, J=7,4 Гц, 2H), 2,30-2,10 (м, 2H), 1,96-1,87 (м, 2H). Rt 1,30 мин (Система B), [M+H]+ 403,0.
Аналогичным способом получали:
Соединение 201. Гидрохлорид 3-{5-[(2,6-дихлорфенил)метокси-2H-спиро[фуро[2,3-b]пиридин-1,4'-пиперидин]-1'-ил)пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д.: 12,08 (уш.с, 1H), 10,03 (уш.с, 1H), 7,58-7,41 (м, 4H), 6,40-6,36 (м, 2H), 5,39 (с, 2H), 4,59-4,53 (м, 2H), 3,55-3,4 (м, 2H), 3,34-3,22 (м, 2H), 3,15-2,99 (м, 2H), 2,85 (т, J=7,3 Гц, 2H), 2,28-2,13 (м, 2H), 1,96-1,87 (м, 2H). Rt 1,32 мин (Система B), [M+H]+ 436,9.
Соединение 202. Гидрохлорид 3-[5-(2,6-диметилфенокси)-2H-спиро[фуро[2,3-b]пиридин-1,4'-пиперидин]-1'-ил]пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д.: 12,08 (уш.с, 1H), 10,03 (уш.с, 1H), 7,52 (с, 1H), 7,15-7,04 (м, 3H), 6,40-6,36 (м, 2H), 4,53-4,40 (м, 2H), 3,52-3,40 (м, 2H), 3,39-3,25 (м, 2H), 3,13-2,93 (м, 2H), 2,84 (т, J=7,3 Гц, 2H), 2,20-2,08 (м, 2H), 2,03 (с, 6H), 1,97-1,87 (м, 2H). Rt 1,24 мин (Система B), [M+H]+ 383,1.
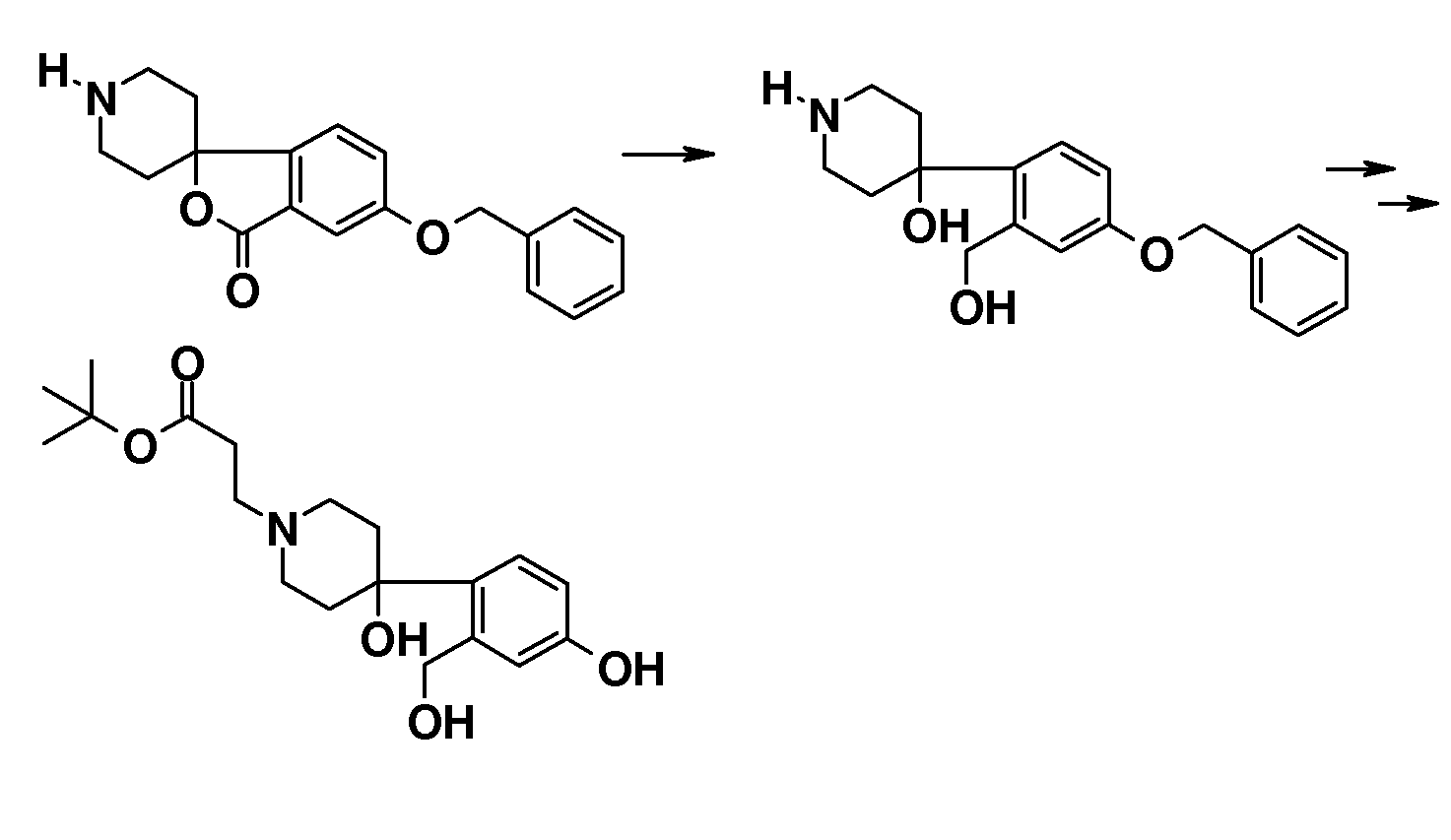
Трет-бутил 3-{4-гидрокси-4-[4-гидрокси-2-(гидроксиметил)фенил}пиперидин-1-ил}-пропаноат. 5-(Бензилокси)-3H-спиро[2-бензофуран-1,4'-пиперидин]-3-он (5 г, т.пл. 138-142°C), полученный в соответствии с J. Org. Chem., 40, 10, 1975, 1427, восстанавливали до 4-[4-(бензилокси)-2-(гидроксиметил)фенил]пиперидин-4-ола (US3962259) (4,3 г, т.пл. 198-202°C), который преобразовывали в трет-бутил 3-{4-[4-(бензилокси)-2-(гидроксиметил)-фенил]-4-гидроксипиперидин-1-ил}пропаноат (2,3 г) с использованием условий, описанных выше (трет-бутилакрилат, N,N-диизопропиламин в MeOH). Это промежуточное соединение дебензилировали с использованием следующих условий: (Pd(OH)2/H2/MeOH (в течение ночи при комнатной температуре) с получением указанного в заголовке соединения (1,6 г, т.пл. 68-70°C).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,1 (уш.с, 1H), 7,09 (уш.д, J=8 Гц, 1H), 6,97 (уш.с, 1H), 6,54 (уш.д, J=8 Гц, 1H), 5,69 (уш.с, 1H), 4,99 (уш.с, 1H), 4,74 (уш.с, 2H), 2,66-2,31 (м, 8H), 1,92-1,73 (м, 4H), 1,41 (с, 9H).
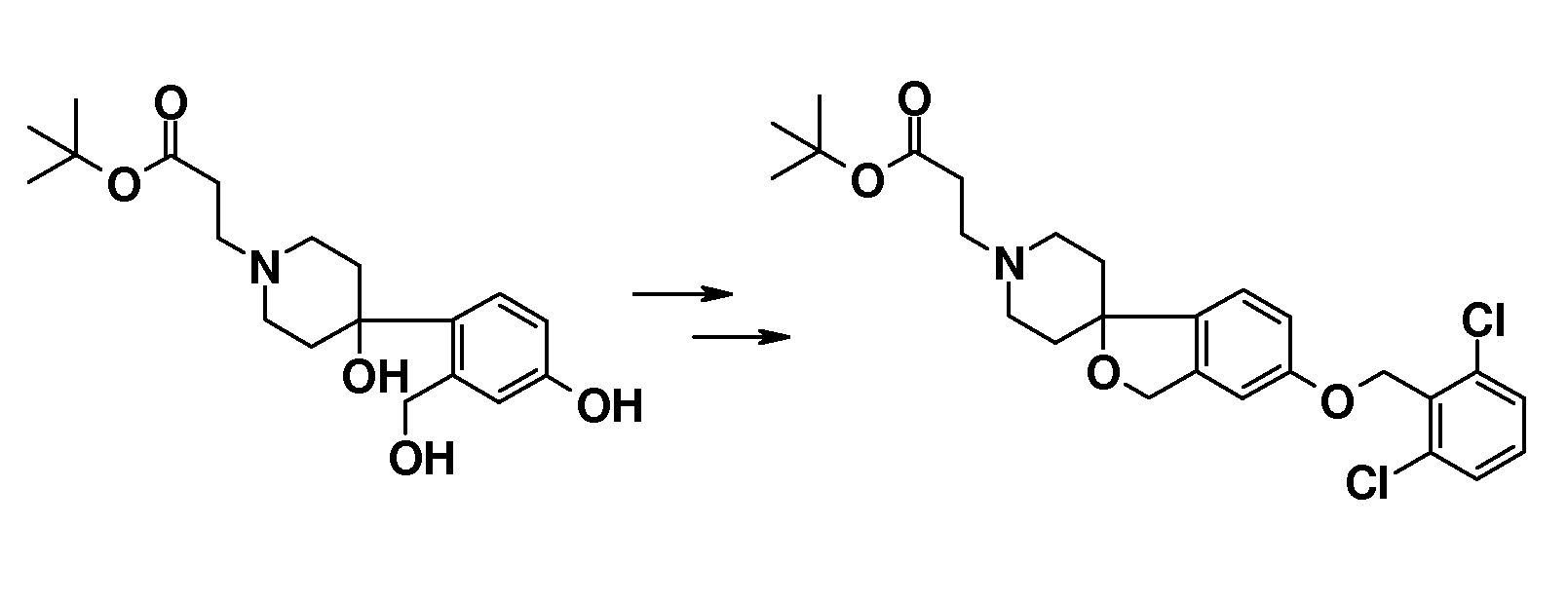
Трет-бутил 3-{5-[(2,6-дихлорфенил)метокси]-3-H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил}пропаноат. Смесь трет-бутил 3-{4-гидрокси-4-[4-гидрокси-2-(гидроксиметил)фенил}пиперидин-1-ил}пропаноата (0,41 г; 1,17 ммоль), K2CO3 (1,61 г; 11,67 ммоль) и 2-(бромэтил)-1,3-дихлорбензола (0,28 г; 1,17 ммоль) в ацетоне (50 мл) нагревали при 35°C в течение ночи. После охлаждения до комнатной температуры реакционную смесь распределяли между водным NaHCO3 и DCM. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, DCM, затем EtOAc) с получением трет-бутил 3-(4-{4-[(2,6-дихлорфенил)-метокси]-2-(гидроксиметил)фенил}-4-гидроксипиперидин-1-ил)пропаноата (0,49 г; 84,8%), Rt 1,32 мин (Система B), [M+H]+ 510,1, который растворяли в DCM (100 мл). Затем добавляли триэтиламин (0,54 мл; 4 ммоль) и метансульфонилхлорид (0,16 мл; 2,06 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 72 часов. Реакционную смесь распределяли между водным раствором NaHCO3 и DCM. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, DCM:EtOAc 3:1, затем 1:1) с получением трет-бутил 3-{5-[(2,6-дихлорфенил)-метокси]-3-H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил}пропаноата (0,26 г; 56,1%). Rt 1,45 мин (Система B), [M+H]+ 492,1.
Следующие соединения были получены аналогичным способом:
Трет-бутил 3-[5-(циклогексилметокси)-3-H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{5-[(2-хлорфенил)метокси]-3-H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{5-{[2-трифторметил)фенил]метокси}-3-Н-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-[5-(оксан-2-илметокси)-3-H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{5-[(3-хлорфенил)метокси]-3-H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{5-[(2,3-дихлорфенил)метокси]-3-H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-(5-{[3-(трифторметил)фенил]метокси}-3-H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{5-[(2,5-дихлорфенил)метокси]-3-H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{5-[(3,5-дихлорфенил)метокси]-3-H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил}пропаноат.
Соединение 203. Гидрохлорид 3-{5-[(2,6-дихлорфенил)метокси]-3-H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил}пропановой кислоты. Трет-бутил 3-{5-[(2,6-дихлорфенил)метокси]-3-H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил}пропаноат (260 мг, 0,53 ммоль) растворяли в 4M растворе HCl в 1,4-диоксане (8 мл; 4 моль/л; 32 ммоль) и перемешивали в течение 72 часов при комнатной температуре. Затем растворитель удаляли в вакууме и остаток обрабатывали iPr2O, осадок собирали фильтрованием и сушили в течение ночи при пониженном давлении с получением продукта (220 мг, 95,5%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,70 (уш.с, 1H), 10,40 (уш.с, 1H), 7,56-7,60 (м, 2H), 7,46-7,51 (м, 1H), 7,00-7,18 (м, 3H), 5,22 (с, 2H), 5,02 (с, 2H), 3,42-3,49 (м, 2H), 3,30-3,39 (м, 2H), 3,11-3,21 (м, 2H), 2,84 (т, J=7,6 Гц, 2H), 2,21-2,31 (м, 2H), 1,78-1,86 (м, 2H). Rt 1,35 мин (Система B), [M+H]+ 436,1.
Следующие соединения были получены аналогичным способом:
Соединение 204. Гидрохлорид 3-[5-(циклогексилметокси)-3-H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,41 мин (Система B), [M+H]+ 374,2.
Соединение 205. Гидрохлорид 3-{5-[(2-хлорфенил)метокси]-3-H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,35 мин (Система B), [M+H]+ 402,1.
Соединение 206. Гидрохлорид 3-(5-{[2-{трифторметил)фенил]метокси}-3-H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,36 мин (Система В), [M+H]+ 436,1.
Соединение 207. Гидрохлорид 3-[5-(оксан-2-илметокси)-3-H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,17 мин (Система B), [M+H]+ 376,2.
Соединение 208. Гидрохлорид 3-{5-[(3-хлорфенил)метокси]-3-H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,34 мин (Система B), [M+H]+ 402,1.
Соединение 209. Гидрохлорид 3-{5-[(2,3-дихлорфенил)метокси]-3-H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,70 (уш.с, 1H), 10,40 (уш.с, 1H), 7,65-7,79 (м, 1H), 7,56-7,60 (м, 1H), 7,43 (т, J=7,5 Гц, 1H), 6,98-7,13 (м, 3H), 5,20 (с, 2H), 5,01 (с, 2H), 3,43-3,51 (м, 2H), 3,31-3,39 (м, 2H), 3,12-3,23 (м, 2H), 2,85 (т, J=7,6 Гц, 2H), 2,21-2,31 (м, 2H), 1,78-1,86 (м, 2H).
Rt 1,40 мин (Система B), [M+H]+ 436,1.
Соединение 210. Гидрохлорид 3-(5-{[3-(трифторметил)фенил]метокси}-3-H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил}пропановой кислоты. Rt 1,40 мин (Система B), [M+H]+ 436,1.
Соединение 211. Гидрохлорид 3-{5-[(2,5-дихлорфенил)метокси]-3-H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил}пропановой кислоты.
Rt 1,43 мин (Система В), [М+Н]+ 436,1.
Соединение 212. Гидрохлорид 3-{5-[(3,5-дихлорфенил)метокси]-3-H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,80 (уш.с, 1H), 10,50 (уш.с, 1H), 7,58-7,61 (м, 1H), 7,50-7,53 (м, 2H), 6,96-7,10 (м, 3H), 5,13 (с, 2H), 4,99 (с, 2H), 3,44-3,53 (м, 2H), 3,30-3,39 (м, 2H), 3,11-3,22 (м, 2H), 2,86 (т, J=7,6 Гц, 2H), 2,21-2,32 (м, 2H), 1,76-1,85 (м, 2H).
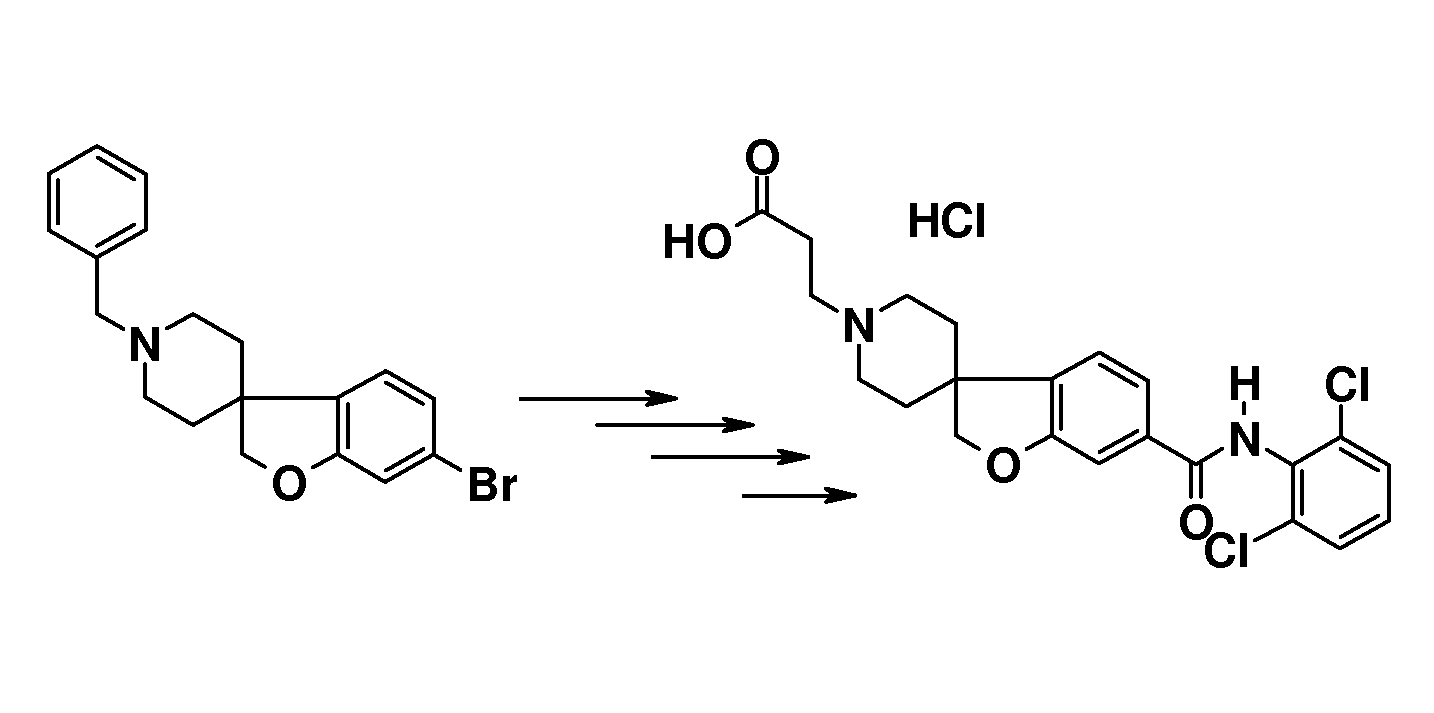
Соединение 213. Гидрохлорид 3-{6-[((2,6-дихлорфенил)карбамоил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты
Раствор 1'-бензил-6-бром-2H-спиро[1-бензофуран-3,4'-пиперидин] (0,51 г; 0,87 ммоль) в тетрагидрофуране (50 мл) охлаждали до -78°C и добавляли н-бутиллитий (0,35 мл, 2,5 моль/л в гексане, 0,87 ммоль). Затем (при -78°C) добавляли по каплям раствор 1,3-дихлор-2-изоцианатобензола (0,18 г; 0,96 ммоль), растворенного в ТГФ (10 мл). Реакционную смесь перемешивали при -70°C в течение 30 минут. Реакционной смеси давали нагреться до 0°C и затем гасили путем добавления насыщенного водного раствора NH4Cl, затем Et2O. Органическую фазу отделяли и экстрагировали водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:2) с получением 1'-бензил-N-(2,6-дихлорфенил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-6-карбоксамида (0,17 г; 41,8%). Rt 1,22 мин (Система B), [M+H]+ 467,1. К раствору 1'-бензил-N-(2,6-дихлорфенил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-6-карбоксамида (0,17 г; 0,36 ммоль) в 1,2-дихлорэтане (10 мл) при 0°C добавляли 1-хлорэтилхлорформиат (0,08 мл; 0,76 ммоль) и несколько капель триэтиламина. Реакционную смесь перемешивали в течение 3 часов при комнатной температуре. Неочищенную реакционную смесь концентрировали в вакууме. Добавляли толуол (100 мл) и смесь концентрировали. Эту последнюю стадию повторяли два раза. Добавляли MeOH (20 мл) и смесь перемешивали в течение ночи. Реакционную смесь концентрировали в вакууме и фильтровали через содержащую паратолуолсульфокислоту твердофазную экстракционную гильзу, промывая MeOH и элюируя раствором 2н NH3/MeOH. Продукт концентрировали с получением N-(2,6-дихлорфенил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-6-карбоксамида (0,14 г; 100%), Rt 1,05 мин (Система B), [M+H]+ 377,1, который растворяли в MeOH (10 мл). Затем добавляли трет-бутилакрилат (0,06 мл; 0,44 ммоль) и N,N-диизопропилэтиламин (0,09 мл; 0,50 ммоль). Полученную смесь нагревали при 140°C в герметично закрытой колбе в течение ночи. После охлаждения до комнатной температуры реакционную смесь распределяли между 5% водным раствором NaHCO3 и EtOAc. Слои разделяли и органический слой сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали колоночной хроматографией (SiO2, Et2O) с получением трет-бутил 3-{6-[((2,6-дихлорфенил)карбамоил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата (160 мг, 79%). Rt 1,25 мин (Система B), [M+H]+ 505,1, который растворяли в 4M растворе HCl в 1,4-диоксане (10 мл; 4 моль/л; 40 ммоль) и перемешивали в течение 48 часов при комнатной температуре. Затем растворитель удаляли в вакууме и остаток обрабатывали iPr2O, осадок собирали фильтрованием и сушили в течение ночи при пониженном давлении с получением указанного в заголовке соединения (140 мг, 80,9%). Rt 1,09 мин (Система B), [M+H]+ 449,1.
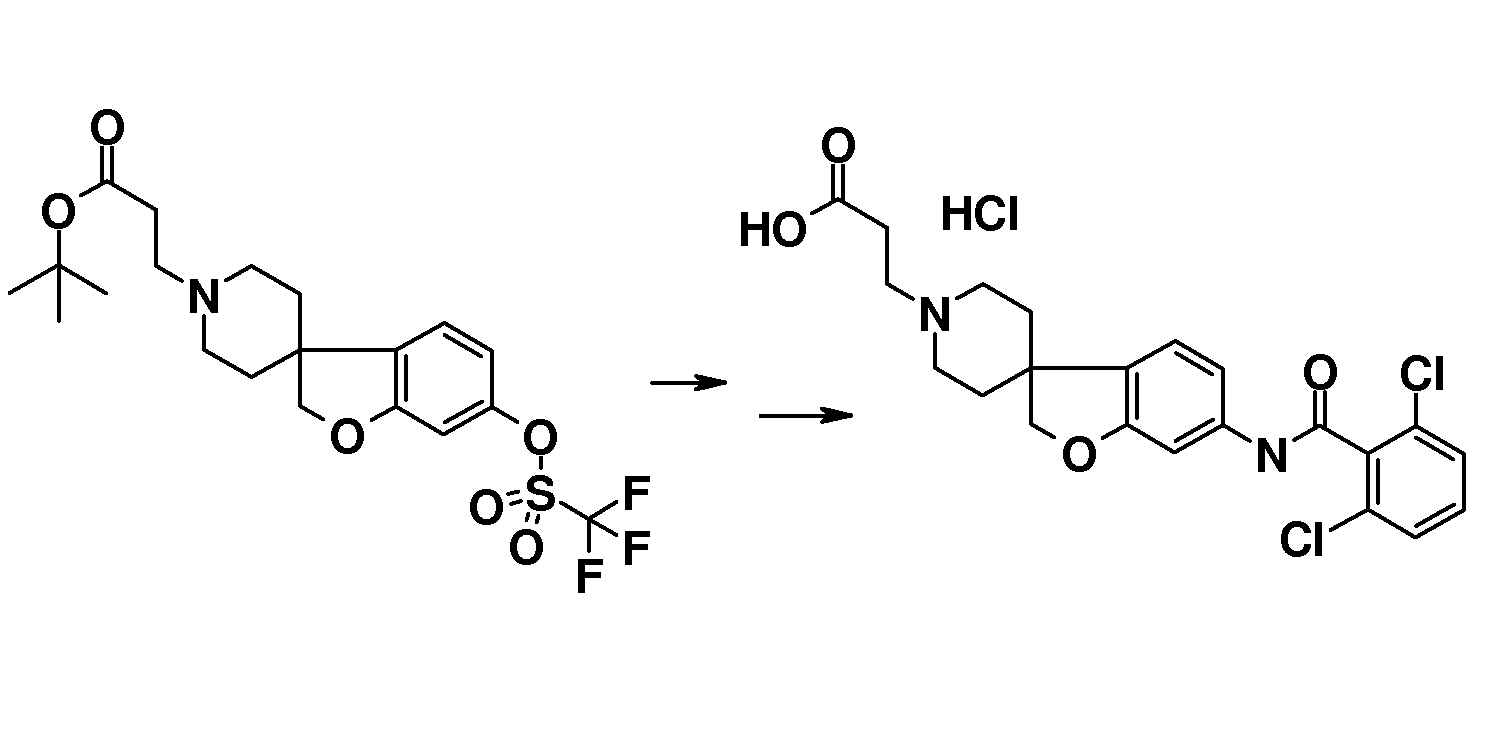
Соединение 311. Гидрохлорид 3-{6-[((2,6-дихлорбензол)амидо]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
К дегазированному раствору 2,6-дихлорбензамида (113 мг; 0,6 ммоль) и трет-бутил 3-{-{6-[трифторметан)сульфонилокси]-2Н-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]-пропаноата (232 мг, 0,5 ммоль) в трет-бутиловом спирте (7,5 мл) добавляли трехосновной фосфат калия (0,16 г; 0,75 ммоль). Затем добавляли трис-(дибензилиденацетон)-дипалладий(0) (9,1 мг; 0,01 ммоль) и 2-ди-трет-бутилфосфино-3,4,5,6-тетраметил-2',4',6'-триизопропилбифенил (24 мг; 0,05 ммоль). Полученную смесь нагревали при температуре кипения с обратным холодильником в течение ночи. После охлаждения до комнатной температуры смесь концентрировали в вакууме и распределяли между EtOAc и 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, дихлорметан:ацетон 9:1) с получением продукта (0,18 г; 71%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,56 (уш.с, 1H), 7,38-7,45 (м, 1H), 7,22 (д, J=2 Гц, 1H), 6,96-7,10 (м, 3H), 5,90 (уш.с, 1H), 4,39 (с, 2H), 2,87-2,94 (м, 2Н), 2,70 (т, J=8 Гц, 2Н), 2,45 (т, J=8 Гц, 2Н), 2,03-2,12 (м, 2Н), 1,90-1,99 (м, 2Н), 1,71-1,77 (м, 2Н), 1,48 (с, 9Н). Rt 1,31 мин (Система В), [М+Н]+ 505,2,
который растворяли в 4М растворе HCl в 1,4-диоксане (20 мл; 4 моль/л; 80 ммоль) и перемешивали в течение 3 часов при 65°C. Затем растворитель удаляли в вакууме и остаток обрабатывали iPr2O, осадок собирали фильтрованием и сушили в течение ночи при пониженном давлении с получением продукта (80 мг, 49%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,73 (с, 1H), 7,46-7,62 (м, 3H), 7,28 (уш.с, 1H), 7,13-7,18 (м, 2H), 4,49 (уш.с, 2H), 3,30-3,51 (м, 4H), 3,00-3,20 (м, 2H), 2,81-2,87 (м, 2Н), 2,12-2,19 (м, 2Н), 1,86-1,92 (м, 2Н). Rt 1,25 мин (Система В), [M+H]+ 449,2.
Соединение 312. Гидрохлорид 3-{6-[((2,6-дифторбензол)амидо]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,64 (уш.с, 1H), 10,82 (с, 1H), 10,27 (уш.с, 1H), 7,56-7,63 (м, 1H), 7,04-7,29 (м, 5H), 4,51 (уш.с, 2H), 3,29-3,55 (м, 4H), 3,05-3,12 (м, 2H), 2,82-2,89 (м, 2H), 2,15-2,24 (м, 2H), 1,84-1,93 (м, 2H).
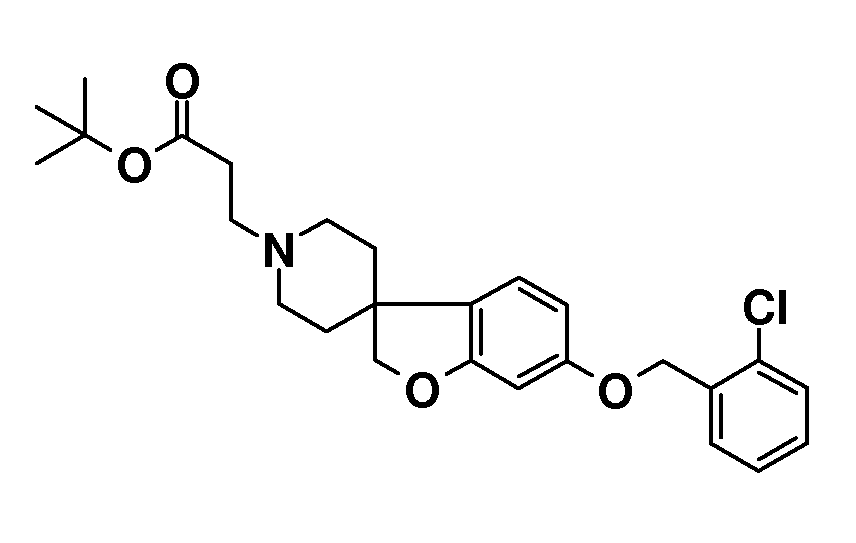
Трет-бутил 3-{6-[(2-хлорфенил)метокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. Cs2CO3 (240 мг; 0,735 ммоль) и NaI (4 мг; 0,025 ммоль) помещали в твердом виде в 16×100 мм стеклянный трубчатый реактор, снабженный магнитной мешалкой. Добавляли раствор трет-бутил 3-{6-гидрокси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата (81 мг; 0,245 ммоль) в CH3CN/ТГФ/DMF 1,5:1:1,5 (0,061 M) и смесь перемешивали при комнатной температуре в течение 2 часов. К этой реакционной смеси добавляли 1-(бромэтил)-2-хлорбензол (61,77 мг; 0,3 ммоль) в 0,5 мл DMF (0,6M) и полученную смесь нагревали при 80°C в течение 20 часов. Реакционную смесь охлаждали и растворители удаляли с использованием системы Genevac HT4 при 40°C в течение 14 часов (полный вакуум). Завершающая обработка включала добавление 2 мл K2CO3 1M и 4 мл DCM/MeOH 95:5 с последующим перемешиванием в течение 15 минут. Фазы разделяли через фазо-разделительный картридж 1PS. Водный слой снова экстрагировали 2 мл DCM/MeOH 95:5 и органические слои объединяли и сушили через фазо-разделительный картридж 1PS. Неочищенные соединения получали через удаление растворителей в условиях полного вакуума с использованием Genevac HT4 при 40°C в течение 14 часов и использовали как таковые на следующей стадии.
Следующие соединения были получены аналогичным способом:
Трет-бутил 3-[6-(бензилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат.
Трет-бутил 3-{6-[(4-хлорфенил)метокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[(6-цианогексил)окси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-[6-(4-фенилбутокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]-пропаноат.
Трет-бутил 3-[6-(2,3-дигидро-1-бензофуран-2-илметокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат.
Трет-бутил 3-[6-(2-феноксиэтокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]-пропаноат.
Трет-бутил 3-[6-(2-феноксипропокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат.
Трет-бутил 3-[6-(2-феноксибутокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]-пропаноат.
Трет-бутил 3-{6-[3-(бензилокси)пропокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-[6-(2-,3-дигидро-1,4-бензодиоксин-2-илметокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат.
Трет-бутил 3-(8-{[3-(4-трет-бутилфенил)-1,2,4-оксадиазол-5-ил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропаноат.
Трет-бутил 3-(6-{[4-(5-метил-1,2,4-оксадиазол-3-ил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропаноат.
Трет-бутил 3-(6-{[4-(1H-пиразол-1-ил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропаноат.
Трет-бутил 3-(6{[4-(1H-1,2,4-триазол-1-ил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропаноат.
Трет-бутил 3-{6-[(2-метил-1,3-тиазол-4-ил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[(1-метил-1H-пиразол-3-ил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-[6-({6-метилимидазол[1,2-a]пиридин-2-ил}метокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат.
Трет-бутил 3-[6-(гекс-5-ин-1-илокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]-пропаноат.
Трет-бутил 3-{6-[(5-оксогексил)окси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-пропаноат.
Трет-бутил 3-{6-[2-(нафталин-2-илокси)этокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-(6-{3-[(2-пропил-1,3-тиазол-5-ил)окси]пропокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропаноат.
Трет-бутил 3-{6-[(7-метоксигептил)окси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[(фенилкарбамоил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[2-(бензилокси)этокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[(4-метансульфонилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Соединение 214. 3-{6-[(2-Хлорфенил)метокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота трифторуксусная кислота.
Неочищенный трет-бутил 3-{6-[(2-хлорфенил)метокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат обрабатывали смесью TFA/DCM 2:1 и перемешивали при комнатной температуре в течение 2 часов. Затем летучие вещества удаляли с использованием потока азота и затем системы Genevac HT4 полного вакуума при 40°C в течение 14 часов. Неочищенный продукт очищали препаративной ВЭЖХ с получением указанного в заголовке соединения; Rt=1,38 мин (Система A), [M+H]+ Найдено: 403,21; Рассчитано: 402,14. Условия для препаративной ЖХ-МС: Ввод пробы неочищенного продукта, растворенного в 600 мкл DMSO/CH3CN 1:2; колонка ACQUITY UPLC ВЕН С18 1,7 мкм (50×2,1 мм × 1,7 мкм) при 45°C. Подвижная фаза А = вода + 0,1% CH3COOH и В = CH3CN + 0,1% СН3СООН, от 5% В до 90% В в течение 5 минут. C18 скорость потока 0,8 мл/мин, детекция при УФ 210-260 нм.
Следующие соединения были получены аналогичным способом:
Соединение 215. 3-[6-(Бензилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановая кислота трифторуксусная кислота. Rt=1-28 мин (Система A), [M+H]+ Найдено: 368,23; Рассчитано: 368,18.
Соединение 216. 3-{6-[(4-Хлорфенил)метокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота трифторуксусная кислота. Rt=1-42 мин (Система A), [M+H]+ Найдено: 403,21; Рассчитано: 402,14.
Соединение 217. 3-{6-[(6-Цианогексил)окси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота трифторуксусная кислота. R,=1,18 мин (Система A), [M+H]+ Найдено: 387,28; Рассчитано: 387,22.
Соединение 218. 3-[6-(4-Фенилбутокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановая кислота трифторуксусная кислота. Rt=1,54 мин (Система A), [M+H]+ Найдено: 410,30; Рассчитано: 410,23.
Соединение 219. 3-[6-(2,3-Дигидро-1-бензофуран-2-илметокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановая кислота трифторуксусная кислота. Rt=1,32 мин (Система A), [M+H]+ Найдено: 410,25; Рассчитано: 410,19.
Соединение 220. 3-[6-(2-Феноксиэтокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановая кислота трифторуксусная кислота. Rt=1,38 мин (Система A), [M+H]+ Найдено: 398,27; Рассчитано: 398,19.
Соединение 221. 3-[6-(2-Феноксипропокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановая кислота трифторуксусная кислота. Rt=1,49 мин (Система A), [M+H]+ Найдено: 412,28; Рассчитано: 412,21.
Соединение 222. 3-[6-(2-Феноксибутокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановая кислота трифторуксусная кислота. Rt=1,62 мин (Система A), [M+H]+ Найдено: 426,30; Рассчитано: 426,22.
Соединение 223. Трет-бутил 3-{6-[3-(Бензилокси)пропокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота трифторуксусная кислота. Rt=1,51 мин (Система A), [M+H]+ Найдено: 426,31; Рассчитано: 426,22.
Соединение 224. 3-[6-(2-,3-Дигидро-i,4-бензодиоксин-2-илметокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановая кислота трифторуксусная кислота. Rt=1,44 мин (Система A), [M+H]+ Найдено: 426,27; Рассчитано: 426,19.
Соединение 225. 3-(6-{[3-(4-Трет-бутилфенил)-1,2,4-оксадиазол-5-ил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропановая кислота трифторуксусная кислота. Rt=1,89 мин (Система A), [M+H]+ Найдено: 492,32; Рассчитано: 492,24.
Соединение 226. 3-(6-{[4-(5-Метил-1,2,4-оксадиазол-3-ил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропановая кислота трифторуксусная кислота. Rt=1,33 мин (Система A), [M+H]+ Найдено: 450,29; Рассчитано: 450,20.
Соединение 227. 3-(6-{[4-(1H-Пиразол-1-ил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропановая кислота трифторуксусная кислота. Rt=1,33 мин (Система A), [M+H]+ Найдено: 434,28; Рассчитано: 434,20.
Соединение 228. 3-(6-{[4-(1H-1,2,4-Триазол-1-ил)фенил]метокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропановая кислота трифторуксусная кислота. Rt=1,09 мин (Система A): [M+H]+ Найдено: 435,29; Рассчитано: 435,20.
Соединение 229. 3-{6-[(2-Метил-1,3-тиазол-4-ил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота трифторуксусная кислота. Rt=1,05 мин (Система A), [M+H]+ Найдено: 389,21; Рассчитано: 389,15.
Соединение 230. 3-{6-[(1-Метил-1H-пиразол-3-ил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота трифторуксусная кислота. Rt=0,92 мин (Система A), [M+H]+ Найдено: 372,25; Рассчитано: 372,19.
Соединение 231. 3-[6-({6-Метилимидазол[1,2-a]пиридин-2-ил}метокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановая кислота трифторуксусная кислота. Rt=0,77 мин (Система A), [M+H]+ Найдено: 421,28; Рассчитано: 422,20.
Соединение 232. 3-[6-(Гекс-5-ин-1-илокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановая кислота трифторуксусная кислота. Rt=1,3 мин (Система A), [M+H]+ Найдено: 358,26; Рассчитано: 358,20.
Соединение 233. 3-{6-[(5-Оксогексил)окси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота трифторуксусная кислота. Rt=1,06 мин (Система A), [M+H]+ Найдено: 376,27; Рассчитано: 376,21.
Соединение 234. 3-{6-[2-(Нафталин-2-илокси)этокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота трифторуксусная кислота. Rt=1,65 мин (Система A), [M+H]+ Найдено: 448,29; Рассчитано: 448,21.
Соединение 235. 3-(6-{3-[(2-Пропил-1,3-тиазол-5-ил)окси]пропокси}-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пропановая кислота трифторуксусная кислота. Rt=1,48 мин (Система A), [M+H]+ Найдено: 461,29; Рассчитано: 461,21.
Соединение 236. 3-{6-[(7-Мтоксигептил)окси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота трифторуксусная кислота. Rt=1,49 мин (Система A), [M+H]+ Найдено: 406,33; Рассчитано: 406,25.
Соединение 237. 3-{6-[(Фенилкарбамоил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота трифторуксусная кислота. Rt=1,12 мин (Система A), [M+H]+ Найдено: 411,27; Рассчитано: 411,19.
Соединение 238. 3-{6-[2-(Бензилокси)этокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота трифторуксусная кислота. Rt=1,38 мин (Система A), [M+H]+ Найдено: 412,28; Рассчитано: 412,21.
Соединение 239. 3-{6-[(4-Метансульфонилфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота трифторуксусная кислота. Rt=1,06 мин (Система A), [M+H]+ Найдено: 446,26; Рассчитано: 446,16.
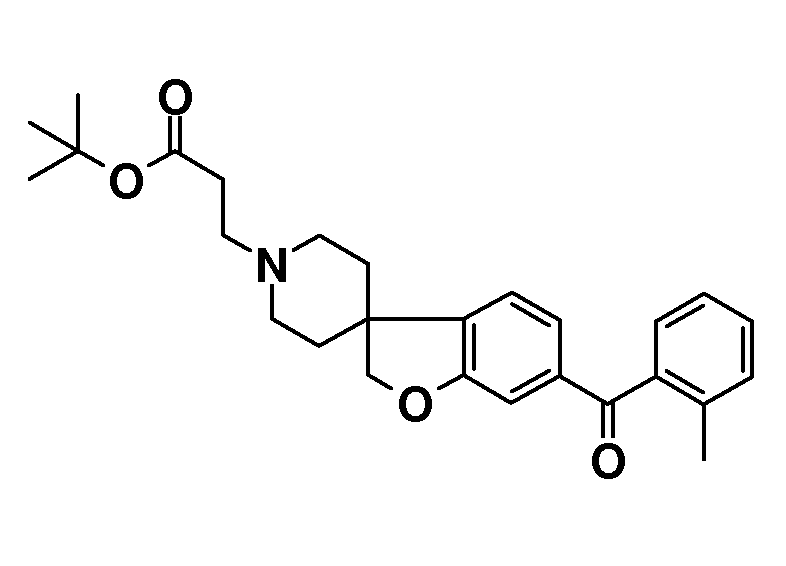
Трет-бутил 3-{6-[(2-Метилфенил)карбонил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
При продувке азотом к раствору трет-бутил 3-[6-(трибутилстаннил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноата (0,3 г; 0,49 ммоль), растворенного в дихлорэтане (5 мл), добавляли 2-метилбензоилхлорид (0,1 мл; 0,74 ммоль). Полученную реакционную смесь перемешивали в течение 72 часов при 70°C. Затем реакционную смесь охлаждали и разбавляли EtOAc и насыщенным солевым раствором. Органический слой промывали раствором KF H2O (5 моль/л), сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, дихлорметан:ацетон 9:1) с получением продукта (120 мг; 55,7%). Rt 1,47 мин (Система В), [M+H]+ 436,2.
Следующие соединения были получены аналогичным способом:
Трет-бутил 3-{6-бензоил-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[(2-хлорфенил)карбонил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[(2E)-3-фенилпроп-2-еноил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[(2E)-3-(2-хлорфенил)проп-2-еноил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[(1-бензофуран-2-ил)карбонил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-{6-[(2-фенилциклопропил)карбонил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат.
Трет-бутил 3-[6-(3-фенилпропаноил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат.
Соединение 240. Гидрохлорид 3-{6-[(2-метилфенил)карбонил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты. Трет-бутил 3-{6-[(2-хлорфенил)карбонил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат (100 мг, 0,23 ммоль) растворяли в 4M растворе HCl в 1,4-диоксане (20 мл; 4 моль/л; 80 ммоль) и перемешивали в течение 48 часов при комнатной температуре. Затем растворитель удаляли в вакууме и остаток обрабатывали iPr2O, осадок собирали фильтрованием и сушили в течение ночи при пониженном давлении с получением продукта (0,7 г, 73%). Rt 1,36 мин (Система B), [M+H]+ 380,1.
Следующие соединения были получены получали аналогичным способом:
Соединение 241. Гидрохлорид 3-{6-бензоил-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты. Rt 1,45 мин (Система B), [M+H]+ 366,2.
Соединение 242. Гидрохлорид 3-{6-[(2-хлорфенил)карбонил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,72 (уш.с, 1H), 10,20 (уш.с, 1H), 7,58-7,63 (м, 2H), 7,46-7,52 (м, 2H), 7,39-7,42 (м, 1H), 7,22-7,26 (м, 1H), 7,15 (уш.с, 1H), 4,59 (уш.с, 2H), 3,29-3,56 (м, 4H), 3,04-3,13 (м, 2H), 2,81-2,88 (м, 2H), 2,15-2,25 (м, 2H), 1,92-2,01 (м, 2H). Rt 1,55 мин (Система B), [M+H]+ 400,0.
Соединение 243. 3-{6-[(2E)-3-Фенилпроп-2-еноил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота трифторуксусная кислота. Трет-бутил 3-{6-[(2E)-3-фенилпроп-2-еноил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат (200 мг, 0,45 ммоль) растворяли DCM (6 мл) и добавляли трифторуксусную кислоту (2 мл; 25,96 ммоль) и перемешивали при комнатной температуре в течение ночи. Затем растворитель удаляли в вакууме и остаток обрабатывали iPr2O, осадок собирали фильтрованием и сушили в течение ночи при пониженном давлении с получением продукта (0,21 г; 88,3%). Rt 1,35 мин (Система B), [M+H]+ 392,1.
Следующие соединения были получены аналогичным способом:
Соединение 244. 3-{6-[(2E)-3-(2-Хлорфенил)проп-2-еноил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота трифторуксусная кислота. Rt 1,38 мин (Система B), [M+H]+ 426,0.
Соединение 245. 3-{6-[(1-Бензофуран-2-ил)карбонил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота трифторуксусная кислота. Rt 1,26 мин (Система B), [M+H]+ 406,1.
Соединение 246. 3-{6-[(2-Фенилциклопропил)карбонил]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановая кислота трифторуксусная кислота. Rt 1,31 мин (Система B), [M+H]+406,1.
Соединение 247. 3-[6-(3-фенилпропаноил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановая кислота трифторуксусная кислота. Rt 1,30 мин (Система B), [M+H]+ 394,1
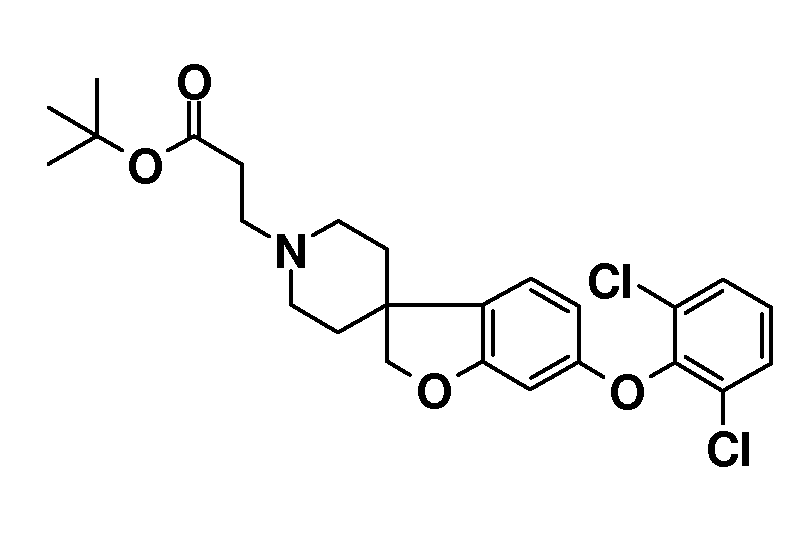
Трет-бутил 3-[6-(2,6-дихлорфенокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат. К раствору 3-{6-гидрокси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата (250 мг; 0,75 ммоль) и 2,6-дихлорфторбензола (123,7 мг; 075 ммоль), растворенных в DMF (5 мл), добавляли K2CO3 (155 мг; 1,2 ммоль). Полученную реакционную смесь перемешивали в течение 48 часов минут при 100°C. Затем реакционную смесь охлаждали и разбавляли EtOAc и насыщенным солевым раствором. Органический слой промывали водным раствором раствор NaHCO3, сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, DCM:MeOH 95:1) с получением продукта (130 мг; 36,2%). Rt 1,44 мин (Система В), [M+H]+ 478,1.
Трет-бутил 3-{6-(6-фенокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат. При продувке азотом к раствору 3-{6-гидрокси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата (237 мг; 0,71 ммоль) в 20 мл толуола добавляли последовательно бромбензол (111,6 мг; 0,71 ммоль), ацетат палладия(II) (8 мг; 0,04 ммоль), трехосновной фосфат калия моногидрат (302 мг; 1,42 ммоль), 2-ди-трет-бутилфосфино-2',4',6'-триизопропилбифенил (23 мг; 0,05 ммоль) и фенилбороновую кислоту (4,3 мг; 0,04 ммоль). Полученную смесь нагревали при 100°C в течение ночи. После охлаждения до комнатной температуры смесь концентрировали в вакууме и распределяли между EtOAc и 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали, и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, DCM:MeOH 97:3) с получением продукта (150 мг; 51%). Rt 1,38 мин (Система B), [M+H]+ 410,2.
Следующее соединение было получено аналогичным способом:
Трет-бутил 3-[6-(2,6-диметилфенокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат.
Соединение 248. Гидрохлорид 3-[6-(2,6-дихлорфенокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановой кислоты. Трет-бутил 3-[6-(2,6-дихлорфенокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат (120 мг, 0,25 ммоль) растворяли в 4M растворе HCl в 1,4-диоксане (10 мл; 4 моль/л; 40 ммоль) и перемешивали в течение 2 часов при 50°C. Затем растворитель удаляли в вакууме и остаток обрабатывали iPr2O, осадок собирали фильтрованием и сушили в течение ночи при пониженном давлении с получением продукта (0,1 г, 86,9%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,70 (уш.с, 1H), 10,10 (уш.с, 1H), 7,64 (д, J=8,2 Гц, 2H), 7,38 (т, J=8,2 Гц, 1H), 6,97-7,06 (м, 1H), 6,24-6,33 (м, 2H), 4,51 (уш.с, 2H), 3,43-3,52 (м, 2H), 3,26-3,37 (м, 2H), 2,96-3,09 (м, 2H), 2,83 (т, J=7,5 Гц, 2H), 2,07-2,18 (м, 2H), 1,86-1,93 (м, 2H). Rt 1,33 мин (Система B), [M+H]+ 422,0.
Следующие соединения были получены аналогичным способом:
Соединение 249. Гидрохлорид 3-{6-(6-фенокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропановой кислоты. Rt 1,27 мин (Система B), [M+H]+ 354,1.
Соединение 250. Гидрохлорид 3-[6-(2,6-диметилфенокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропановой кислоты. Rt 1,36 мин (Система B), [M+H]+ 382,2
Соединение 251. Гидрохлорид 3-{6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}циклобутан-1-карбоновой кислоты.
К смеси 6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин] (0,5 г; 1,25 ммоль) в дихлорэтане (30 мл), добавляли трет-бутил 3-оксоциклобутан-1-карбоксилат (276 мг; 1,62 ммоль), триацетоксиборгидрид натрия (423 мг; 2 ммоль) и полученную смесь перемешивали при комнатной температуре в течение ночи. Затем смесь разбавляли EtOAc, промывали 5% водным раствором NaHCO3, сушили (Na2SO4) и фильтровали. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1) с получением трет-бутил 3-{6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}циклобутан-1-карбоксилата (0,42 г; 65%). Rt 1,50 мин (Система B), [M+H]+ 518,0, который гидролизовали с использованием 4M раствора HCl в 1,4-диоксане, с получением продукта (340 мг; 80%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,5 (уш.с, 1H), 10,10 (уш.с, 1H), 7,55-7,58 (м, 2H), 7,47 (дд, J=8,1 и 6,2 Гц, 1H), 6,98-7,02 (м, 1H), 6,56-6,62 (м, 2H), 5,18 (с, 2H), 4,48 (уш.с, 2H), 3,57-3,62 (м, 1H), 3,26-3,44 (м, 2H), 2,78-2,93 (м, 3H), 2,35-2,53 (м, 2H), 1,78-2,18 (м, 4H). Rt 1,33 мин (Система B), [M+H]+ 461,9.
Соединение 313. 2-{6-[(2,6-Дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}циклопентан-1-карбоновая кислота. Этил 2-{6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}циклопентан-1-карбоксилат получали из 6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,4'-пиперидин] и этил 2-оксоциклопентан-1-карбоксилата (аналогично получению соединения 251).
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,33-7,40 (м, 2H), 7,20-7,28 (м, 1H), 7,00 (д, J=8,2 Гц, 1H), 6,47-6,59 (м, 2H), 5,22 (с, 2H), 4,31-4,42 (м, 2H), 4,17 (кв.д, J=7,1, 1,1 Гц, 2H), 3,23 (д, J=11,1 Гц, 1H), 3,01-3,10 (м, 1H), 2,93 (д, J=11,1 Гц, 1H), 2,58-2,72 (м, 1H), 1,76-2,13 (м, 9H), 1,54-1,73 (м, 3H), 1,29 (т, J=7,0 Гц, 3H).
Этот продукт преобразовывали в соединение 313 с использованием условий, описанных для соединения 79.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,53-7,59 (м, 2H), 7,44-7,50 (м, 1H), 7,15 (д, J=7,9 Гц, 1H), 6,50-6,58 (м, 2H), 5,17 (с, 2H), 4,41 (с, 2H), 3,14-3,58 (м, 3H), 3,03 (д, J=11,9 Гц, 1H), 2,85-2,95 (м, 2H), 2,31-2,49 (м, 2H), 2,00-2,11 (м, 1H), 1,63-1,94 (м, 7H), 1,47-1,62 (м, 2H). Rt 1,33 мин (Система B), [M+H]+ 476,6.
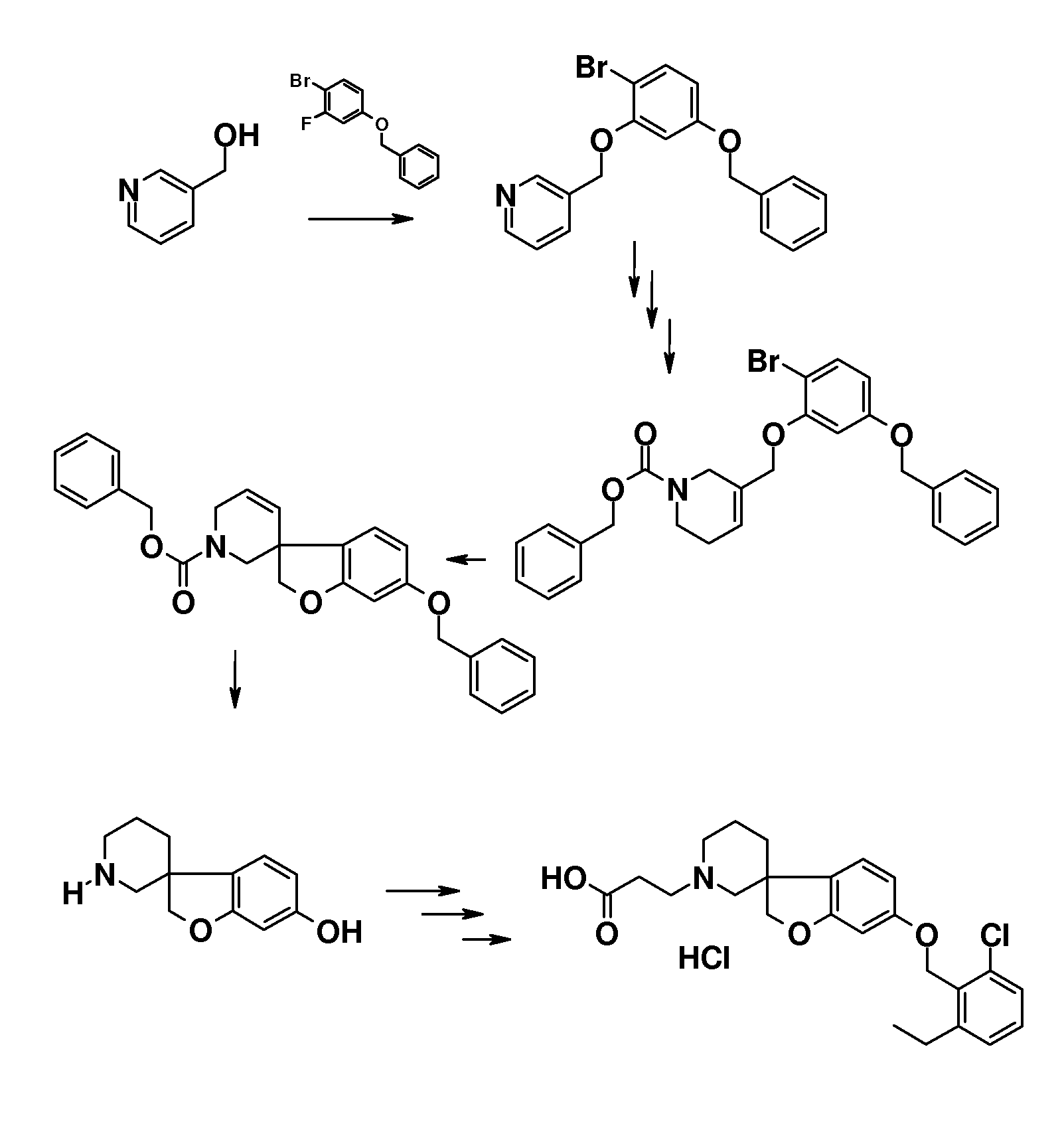
Соединение 314. Гидрохлорид 3-{6-[(2-хлор-6-этилфенил)метокси]-2H-спиро[1-бензофуран-3,3'-пиперидин]-1'-ил}пропановой кислоты. 3-Пиридинметанол (7,22 мл; 74,34 ммоль) растворяли в 1-метил-2-пирролидиноне (25 мл) и добавляли гидрид натрия (60% в минеральном масле; 2,97 г; 74,34 ммоль). Смесь перемешивали в течение 30 минут при температуре окружающей среды. Затем добавляли 4-(бензилокси)-1-бром-2-фторбензол (10,45 г; 37,17 ммоль), растворенный в 1-метил-2-пирролидиноне (20 мл), и реакционную смесь нагревали до 100°C. ТСХ анализ показал полное преобразование в течение 30 минут. После охлаждения до комнатной температуры реакционную смесь разбавляли EtOAc и промывали 5% водным раствором NaHCO3. Органический слой промывали несколько раз H2O, сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1) с получением 3-[5-(бензилокси)-2-бромфеноксиметил]пиридина (13,71 г; 99%),
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 8,70 (д, J=2,0 Гц, 1H), 8,59 (дд, J=4,9, 2,0 Гц, 1H), 7,81-7,87 (м, 1H), 7,30-7,46 (м, 6H), 6,62 (д, J=2,8 Гц, 1H), 6,52 (дд, J=8,7, 2,8 Гц, 1H), 5,11 (с, 2H), 5,03 (с, 2H),
который растворяли в ацетоне (200 мл). К этой реакционной смеси добавляли бензилбромид (4,64 мл; 38,82 ммоль) и перемешивали в течение ночи при 40°C. Затем смесь концентрировали в вакууме с получением 1-бензил-3-[5-(бензилокси)-2-бромфенокси)метил)пиридин-1-ийбромида (19,7 г; 98%). 14,68 г (27,12 ммоль) этого продукта растворяли в MeOH/ТГФ (1:1; 400 мл). К этой охлажденной (-60°C) реакционной смеси добавляли боргидрид натрия (2,57 г; 67,80 ммоль). После завершения добавления смеси давали нагреться до комнатной температуры и перемешивали еще в течение часа. Затем смесь охлаждали до 0°C, добавляли воду и MeOH выпаривали в вакууме. К водному раствору добавляли 5% водный раствор NaHCO3 и Et2O. Слои разделяли и органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1) с получением продукта: 1-бензил-5-[5-(бензилокси)-2-бромфеноксиметил]-1,2,3,6-тетрагидропиридина (10,54 г; 83%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,23-7,43 (м, 11H), 6,54 (д, J=2,7 Гц, 1H), 6,46 (дд, J=8,7, 2,7 Гц, 1H), 5,88 (м, 1H), 5,02 (с, 2H), 4,40 (с, 2H), 3,63 30 (с, 2H), 3,09 (д, J=1,9 Гц, 2H), 2,58 (т, J=5,7 Гц, 2H), 2,18-2,25 (м, 2H).
К смеси 1-бензил-5-[5-(бензилокси)-2-бромфеноксиметил]-1,2,3,6-тетрагидропиридина (1,40 г; 3,01 ммоль) и бикарбоната калия (0,30 г; 3,01 ммоль) в 10 мл дихлорметана добавляли бензилхлорформиат (2,04 мл; 13,57 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Затем добавляли ледяную воду и 5% водный раствор NaHCO3 с последующим добавлением дихлорметана. Слои разделяли и органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Осадок собирали фильтрованием и очищали колоночной хроматографией (SiO2, Et2O:гексан 1:3) с получением продукта: бензил 5-[5-бензилокси)-2-бромфеноксиметил]-1,2,3,6-тетрагидропиридин-1-карбоксилата (1,33 г; 86,78%),
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,30-7,43 (м, 11H), 6,54 (д, J=2,6 Гц, 1H), 6,48 (дд, J=8,7, 2,6 Гц, 1H), 5,94-5,99 (м, 1H), 5,16 (с, 2H), 5,03 (с, 2H), 4,44 (с, 2H), 4,11 (уш.с, 2H), 3,58 (т, J=5,7 Гц, 2H), 2,16-2,28 (м, 2H).
К интенсивно дегазируемой смеси указанного выше продукта (0,66 г; 1,30 ммоль) и карбоната серебра (0,45 г; 1,62 ммоль) в 1-метил-2-пирролидиноне (6 мл) добавляли палладацикл Германна-Беллера (0,06 г; 0,06 ммоль) (Tetrahedron, 64 (2008), 4468). Реакционную смесь нагревали в течение 18 часов при 140°C. После охлаждения до комнатной температуры смесь разбавляли водой и EtOAc. Слои разделяли и органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме с получением бензил 6-(бензилокси)-2',6'-дигидро-1'H,2H-спиро[1-бензофуран-3,3'-пиридин]-1'-карбоксилата (0,50 г; 90%), который растворяли в MeOH (10 мл) и EtOAc (20 мл). Добавляли гидроксид палладия (20 мг; 0,12 ммоль) и смесь обрабатывали при помощи H2 при 50 фунт/дюйм2 (3,515 кг/см2) в течение ночи. Неочищенную реакционную смесь концентрировали до объема около 5 мл и фильтровали через содержащую паратолуолсульфокислоту твердофазную экстракционную гильзу, промывая MeOH и элюируя раствором 2н NH3/МеОН. Продукт концентрировали с получением 2H-спиро[1-бензофуран-3,3'-пиперидин]-6-ола (220 мг; 91%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,20 (уш.с, 1H), 6,92 (д, J=8,0 Гц, 1H), 6,11-6,26 (м, 2H), 4,55 (д, J=8,8 Гц, 1H), 4,18 (д, J=8,8 Гц, 1H), 2,78-2,88 (м, 1H), 2,43-2,65 (м, 3H), 1,48-1,74 (м, 3H), 1,23-1,39 (м, 1H).
Аналогичным способом и как описано для соединения 29, 2H-спиро[1-бензофуран-3,3'-пиперидин]-6-ол преобразовывали в трет-бутил 3-{6-гидрокси-2H-спиро[1-бензофуран-3,3'-пиперидин]-1'-ил}пропаноат (59%),
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 6,90-6,96 (д, J=9,7 Гц, 1H), 6,28-6,34 (м, 2H), 4,60 (д, J=8,8 Гц, 1H), 4,25 (дд, J=8,8, 1,2 Гц, 1H), 2,77-2,86 (м, 1H), 2,62-2,71 (м, 2H), 2,55-2,61 (м, 1H), 2,32-2,40 (т, J=8,8 Гц, 2H), 2,05-2,14 (м, 2H), 1,46-1,75 (м, 4H), 1,44 (с, 9H).
с последующим осуществлением реакции Мицунобу с получением трет-бутил 3-{6-[(2-хлор-6-этилфенил)метокси]-2H-спиро[1-бензофуран-3,3'-пиперидин]-1'-ил]пропаноата. Этот продукт (340 мг; 0,7 ммоль) растворяли в 4M растворе HCl в 1,4-диоксане (20 мл; 4 моль/л; 40 ммоль) и перемешивали в течение 2 часов при 50°C. Затем растворитель удаляли в вакууме и остаток обрабатывали iPr2O, осадок собирали фильтрованием и сушили в течение ночи при пониженном давлении с получением продукта (0,25 г, 72,8%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,70 (уш.с, 1H), 10,55 (уш.с, 1H), 7,33-7,41 (м, 2H), 7,25-7,32 (м, 1H), 7,17 (д, J=8,3 Гц, 1H), 6,57-6,64 (м, 2H), 5,11 (с, 2H), 4,93 (д, J=9,6 Гц, 1H), 4,34 (д, J=9,6 Гц, 1H), 3,17-3,47 (м, 6H), 2,83-2,97 (м, 2H), 2,71 (кв., J=7,2 Гц, 2H), 1,74-1,94 (м, 4H), 1,15 (т, J=7,2 Гц, 3H). Rt 1,48 мин (Система B), [M+H]+ 430,0.
Следующие соединения были получены аналогичным способом:
Соединение 315. Гидрохлорид 3-{6-[(2-циклопропил-6-фторфенил)метокси]-2H-спиро[1-бензофуран-3,3'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,80 (уш.с, 1H), 10,60 (уш.с, 1H), 7,33 (тд, J=8,0, 6,2 Гц, 1H), 7,16 (д, J=8,0 Гц, 1H), 7,06 (т, J=8,0 Гц, 1H), 6,86 (д, J=7,7 Гц, 1H), 6,58-6,64 (м, 2H), 5,18 (д, J=1,2 Гц, 2H), 4,99 (д, J=9,9 Гц, 1H), 4,32 (д, J=9,7 Гц, 1H), 3,15-3,52 (м, 6H), 2,86-2,98 (м, 2H), 1,99-2,10 (м, 1H), 1,71-1,90 (м, 4H), 0,89-0,98 (м, 2H), 0,66-0,74 (м, 2H). Rt 1,42 мин (Система B), [M+H]+ 426,2.
Соединение 316. Гидрохлорид 3-(6-{[2-хлор-6-(пропан-2-ил)фенил]метокси}-2H-спиро[1-бензофуран-3,3'-пиперидин]-1'-ил)пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,80 (уш.с, 1H), 10,60 (уш.с, 1H), 7,32-7,45 (м, 3H), 7,17 (д, J=8,0 Гц, 1H), 6,56-6,65 (м, 2H), 5,15 (с, 2H), 4,99 (д, J=9,5 Гц, 1H), 4,33 (д, J=9,5 Гц, 1H), 3,11-3,47 (м, 6H), 2,86-2,99 (м, 3H), 1,74-1,93 (м, 5H), 1,20 (д, J=6,7 Гц, 6H). Rt 1,53 мин (Система B), [M+H]+ 444,0.
Соединение 317. Гидрохлорид 3-{6-[(2-хлор-6-циклопропилфенил)метокси]-2H-спиро[1-бензофуран-3,3'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,80 (уш.с, 1H), 10,20 (уш.с, 1H), 7,28-7,37 (м, 2H), 7,12-7,21 (м, 1H), 7,04-7,09 (м, 1H), 6,58-6,66 (м, 2H), 5,28 (с, 2H), 4,87 (д, J=9,6 Гц, 1H), 4,34 (д, J=9,6 Гц, 2H), 3,18-3,46 (м, 6H), 2,79-3,09 (м, 2H), 2,01-2,11 (м, 1H), 1,73-1,93 (м, 4H), 0,88-0,96 (м, 2H), 0,64-0,73 (м, 2H). Rt 1,49 мин (Система B), [M+H]+ 442,0.
Соединение 318. Гидрохлорид 3-{6-[(2-хлор-6-фторфенил)метокси]-2H-спиро[1-бензофуран-3,3'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,80 (уш.с, 1H), 10,40 (уш.с, 1H), 7,48-7,56 (м, 1H), 7,40-7,45 (м, 1H), 7,29-7,36 (м, 1H), 7,17 (д, J=7,9 Гц, 1H), 6,57-6,63 (м, 2H), 5,10 (с, 2H), 4,93 (д, J=9,5 Гц, 1H), 4,34 (д, J=9,5 Гц, 1H), 3,16-3,46 (м, 6H), 2,84-2,95 (м, 2H), 1,71-1,95 (м, 4H). Rt 1,35 мин (Система B), [M+H]+ 420,2.
Соединение 319. Гидрохлорид 3-{6-[(2,6-дихлор-3-этилфенил)метокси]-2H-спиро[1-бензофуран-3,3'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,80 (уш.с, 1H), 10,50 (уш.с, 1H), 7,46 (дд, J=7,5 Гц, 2H), 7,18 (д, J=7,8 Гц, 1H), 6,57-6,65 (м, 2H), 5,20 (с, 2H), 4,96 (д, J=9,6 Гц, 1H), 4,34 (д, J=9,6 Гц, 1H), 3,16-3,47 (м, 6H), 2,83-2,98 (м, 2H), 2,75 (кв., J=7,5 Гц, 2H), 1,75-1,92 (м, 4H), 1,18 (т, J=7,5 Гц, 3H). Rt 1,55 мин (Система B), [M+H]+ 464,0.
Соединение 320. Гидрохлорид 3-{6-[(4-бутил-2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,3'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,80 (уш.с, 1H), 10,40 (уш.с, 1H), 7,42 (с, 2H), 7,17 (д, J=7,9 Гц, 1H), 6,57-6,64 (м, 2H), 5,13 (с, 2H), 4,98 (д, J=9,5 Гц, 1H), 4,33 (д, J=9,5 Гц, 1H), 3,33-3,47 (м, 2H), 3,16-3,32 (м, 2H), 2,82-2,99 (м, 2H), 2,61 (т, J=7,6 Гц, 2H), 1,74-1,94 (м, 4H), 1,56 (м, 2H), 1,29 (м, 2H), 0,90 (т, J=7,6 Гц, 3H). Rt 1,72 мин (Система B), [M+H]+ 492,0.
Соединение 321. Гидрохлорид 3-{6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,3'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,80 (уш.с, 1H), 10,10 (уш.с, 1H), 7,57 (д, J=8,1 Гц, 2H), 7,44-7,52 (м, 1H), 7,17 (д, J=8,4 Гц, 1H), 6,58-6,65 (м, 2H), 5,18 (с, 2H), 4,91 (д, J=9,9 Гц, 1H), 4,34 (д, J=9,9 Гц, 1H), 3,32-3,47 (м, 4H), 3,18-3,32 (м, 2H), 2,82-3,00 (м, 2H), 1,74-1,92 (м, 4H). Rt 1,41 мин (Система B), [M+H]+ 435,9.
Соединение 322. Гидрохлорид 3-{6-[(2,4,6-трихлорфенил)метокси]-2H-спиро[1-бензофуран-3,3'-пиперидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,80 (уш.с, 1H), 10,30 (уш.с, 1H), 7,80 (с, 2H), 7,17 (д, J=8,5 Гц, 1H), 6,57-6,64 (м, 2H), 5,15 (с, 2H), 4,94 (д, J=9,6 Гц, 1H), 4,34 (д, J=9,6 Гц, 1H), 3,34-3,48 (м, 4H), 3,16-3,32 (м, 2H), 2,83-2,97 (м, 2H), 1,74-1,94 (м, 4H). Rt 1,54 мин (Система B), [M+H]+ 471,9.
Соединение 323. 3-{6-[(3,5-Дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,3'-пиперидин]-1'-ил}пропановая кислота. Трет-бутил 3-{6-[(3,5-дихлорфенил)-метокси]-2H-спиро[1-бензофуран-3,3'-пиперидин]-1'-ил}пропаноат (270 мг; 0,55 ммоль), 2M водный раствор NaOH (2 мл; 10 ммоль) и этанол (10 мл) перемешивали в течение 3 часов при 50°C и затем охлаждали до 0°C. К этой реакционной смеси добавляли по каплям водный раствор HCl (10 мл; 1 моль/л), затем смесь концентрировали в вакууме. Остаток обрабатывали насыщенным солевым раствором и дихлорметаном. Водный слой промывали дихлорметаном (два раза). Затем органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме с последующей обработкой iPr2O. Образовавшийся осадок собирали фильтрованием, промывали iPr2O и сушили в вакууме с получением продукта (40 мг; 15,4%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,57 (с, 1H), 7,48 (с, 2H), 7,08 (д, J=8,7 Гц, 1H), 6,43-6,50 (м, 2H), 5,07 (c, 2H), 4,46 (д, J=8,8 Гц, 1H), 4,24 (д, J=8,8 Гц, 1H), 2,68-2,79 (м, 1H), 2,43-2,65 (м, 3H), 2,21 (т, J=7,2 Гц, 2H), 2,00-2,16 (м, 2H), 1,52-1,66 (м, 3H), 1,36-1,53 (с, 1H).
Следующие соединения были получены аналогичным способом:
Соединение 324. 3-{6-[(2,5-Дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,3'-пиперидин]-1'-ил}пропановая кислота.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,64 (с, 1H), 7,55 (д, J=1,5 Гц, 1H), 7,45 (м, 1H), 7,08 (д, J=8,7 Гц, 1H), 6,43-6,50 (м, 2H), 5,07 (с, 2H), 4,46 (д, J=9,0 Гц, 1H), 4,24 (д, J=9,0 Гц, 1H), 2,68-2,79 (м, 1H), 2,43-2,67 (м, 3H), 2,35 (т, J=7,2 Гц, 2H), 2,00-2,18 (м, 2H), 1,52-1,66 (м, 3H), 1,36-1,51 (м, 1H). Rt 1,46 мин (Система B), [M+H]+ 436,1.
Соединение 325. 3-{6-[(2-Хлор-6-метилфенил)метокси]-2H-спиро[1-бензофуран-3,3'-пиперидин]-1'-ил}пропановая кислота.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,10 (уш.с, 1H), 7,06-7,38 (м, 4H), 6,47-6,54 (м, 2H), 5,10 (с, 2H), 4,48 (д, J=8,8 Гц, 1H), 4,25 (д, J=8,8 Гц, 1H), 2,71-2,80 (м, 1H), 2,47-2,67 (м, 3H), 2,30-2,44 (м, 5H), 2,02-2,18 (м, 2H), 1,55-1,69 (м, 3H), 1,37-1,53 (м, 1H). Rt 1,42 мин (Система B), [M+H]+ 416,2.
Соединение 326. 3-(6-{[2-Хлор-6-(трифторметил)фенил]метокси}-2H-спиро[1-бензофуран-3,3'-пиперидин]-1'-ил)пропановая кислота.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,29 (уш.с, 1H), 7,92 (д, J=8,1 Гц, 1H), 7,83 (д, J=8,1 Гц, 1H), 7,64-7,71 (м, 1H), 7,09-7,13 (м, 1H), 6,48-6,54 (м, 2H), 5,13 (с, 2H), 4,48 (д, J=8,8 Гц, 1H), 4,26 (д, J=8,8 Гц, 1H), 2,74-2,80 (м, 1H), 2,52-2,66 (м, 3H), 2,31-2,39 (м, 2H), 2,05-2,27 (м, 2H), 1,56-1,69 (м, 3H), 1,40-1,51 (м, 1H). Rt 1,42 мин (Система B), [M+H]+ 416,2.
Соединение 327. 3-{6-[1-(2,6-Дихлорфенил)этокси]-2H-спиро[1-бензофуран-3,3'-пиперидин]-1'-ил}пропановая кислота.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,19 (уш.с, 1H), 7,45 (д, J=8,0 Гц, 2H), 7,28-7,34 (м, 1H), 7,00 (д, J=8,0 Гц, 1H), 6,29 (дд, J=8,2, 2,1 Гц, 1H), 6,21 (д, J=2,1 Гц, 1H), 5,93 (кв., J=6,6 Гц, 1H), 4,41 (д, J=8,8 Гц, 1H), 4,18 (д, J=8,8 Гц, 1H), 2,69-2,77 (м, 2H), 2,44-2,62 (м, 4H), 2,28-2,35 (м, 2H), 1,99-2,09 (м, 3H), 1,67 (д, J=6,6 Гц, 3H), 1,48-1,63 (м, 3H), 1,34-1,48 (м, 1H). Rt 1,42 мин (Система B), [M+H]+ 416,2.
Соединение 328. 3-(6-{[2-Фтор-6-(трифторметил)фенил]метокси}-2H-спиро[1-бензофуран-3,3'-пиперидин]-1'-ил)пропановая кислота.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,62-7,77 (м, 3H), 7,11 (д, J=8,8 Гц, 1H), 6,45-6,53 (м, 2H), 5,09 (с, 2H), 4,48 (д, J=9,0 Гц, 1H), 4,25 (д, J=9,0 Гц, 1H), 2,71-2,81 (м, 1H), 2,52-2,66 (м, 3H), 2,35 (т, J=6,9 Гц, 2H), 2,05-2,18 (м, 2H), 1,53-1,70 (м, 3H), 1,37-1,52 (м, 1H). Rt 1,45 мин (Система B), [M+H]+ 454,2.
Соединение 329. 3-[6-(Окт-7-ен-1-илокси)-2H-спиро[1-бензофуран-3,3'-пиперидин]-1'-ил)пропановая кислота, которая была получена из трет-бутил 3-{6-гидрокси-2H-спиро[1-бензофуран-3,3'-пиперидин]-1'-ил}пропаноата с использованием способа, описанного для соединения 275.
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 12,10 (уш.с, 1H), 7,04 (д, J=8,1 Гц, 1H), 6,32-6,41 (м, 2H), 5,73-5,84 (м, 1H), 4,95 (м, 2H), 4,46 (д, J=8,8 Гц, 1H), 4,22 (д, J=8,8 Гц, 1H), 3,88 (т, J=6,5 Гц, 2H), 2,72-2,80 (м, 1H), 2,51-2,67 (м, 3H), 2,31-2,40 (т, J=6,9 Гц, 2H), 1,97-2,18 (м, 3H), 1,53-1,71 (м, 6H), 1,26-1,50 (м, 7H). Rt 1,37 мин (Система B), [M+H]+ 388,3.
Следующие соединения были получены аналогичным способом:
Соединение 330. 3-[6-(Гепт-6-ен-1-илокси)-2H-спиро[1-бензофуран-3,3'-пиперидин]-1'-ил)пропановая кислота.
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 12,10 (уш.с, 1H), 7,04 (д, J=8,1 Гц, 1H), 6,32-6,40 (м, 2H), 5,80 (ддт, J=17,0, 10,3, 6,7, 6,7 Гц, 1H), 4,90-5,06 (м, 2H), 4,45 (д, J=8,8 Гц, 1H), 4,22 (д, J=8,9 Гц, 1H), 3,88 (т, J=6,5 Гц, 2H), 2,69-2,80 (м, 1H), 2,51-2,65 (м, 3H), 2,29-2,39 (м, 2H), 1,98-2,16 (м, 4H), 1,52-1,73 (м, 5H), 1,33-1,48 (м, 5H). Rt 1,53 мин (Система B), [M+H]+ 374,3.
Соединение 331. 3-[6-(Гекс-5-ен-1-илокси)-2H-спиро[1-бензофуран-3,3'-пиперидин]-1'-ил)пропановая кислота.
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 12,10 (уш.с, 1H), 7,04 (д, J=8,1 Гц, 1H), 6,29-6,42 (м, 2H), 5,69-5,91 (м, 1H), 4,90-5,10 (м, 2H), 4,45 (д, J=9,4 Гц, 1H), 4,22 (д, J=9,4 Гц, 1H), 3,84-3,94 (м, 2H), 2,69-2,83 (м, 1H), 2,60-2,68 (с, 3H), 2,28-2,41 (м, 2H), 2,00-2,18 (м, 3H), 1,33-1,77 (м, 9H). Rt 1,53 мин (Система B), [M+H]+ 360,3.
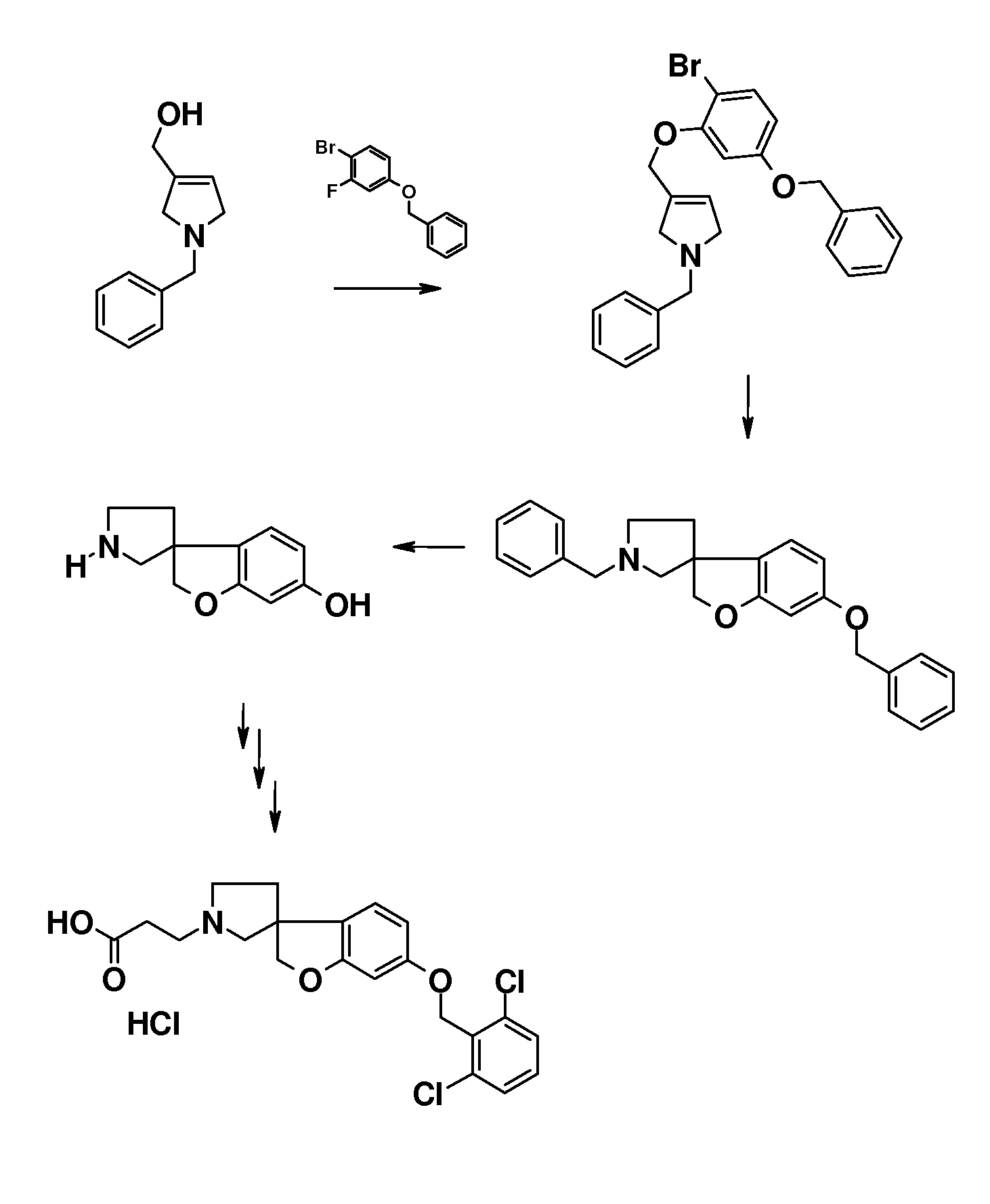
Соединение 332. Гидрохлорид 3-{6-[(2,6-дихлорфенил)метокси]- 2H-спиро[1-бензофуран-3,3'-пирролидин]-1'-ил}пропановой кислоты. (1-Бензил-2,5-дигидро-1H-пиррол-3-ил)метанол (US2010/0069351) (0,47 г; 2,49 ммоль) растворяли в 1-метил-2-пирролидиноне (5 мл) и добавляли гидрид натрия (60% в минеральном масле; 0,1 г; 2,49 ммоль). Смесь перемешивали в течение 30 минут при температуре окружающей среды. Затем добавляли 4-(бензилокси)-1-бром-2-фторбензол (0,35 г; 1,25 ммоль), растворенный в 1-метил-2-пирролидиноне (3 мл), и реакционную смесь нагревали до 100°C в течение 30 минут. После охлаждения до комнатной температуры реакционную смесь разбавляли EtOAc и промывали 5% водным раствором NaHCO3. Органический слой промывали несколько раз H2O, сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1 до чистого Et2O) с получением 1-бензил-3-[5-бензилокси]-2-бромфеноксиметил]-2,5-дигидро-1H-пиррола (0,48 г; 85%). Rt 1,45 мин (Система B), [M+H]+ 452,5.
К интенсивно дегазируемой смеси 1-бензил-3-[5-бензилокси]-2-бромфенокси-метил]-2,5-дигидро-1H-пиррола (0,46 г; 7,73 ммоль) в 5 мл бензола добавляли последовательно 2,2'-азобис(2-метилпропионитрил) (17 мг; 0,1 ммоль) и гидрид три-н-бутилолова (0,41 мл; 1,53 ммоль). Реакционную смесь нагревали в условиях микроволнового облучения в течение 2 часов при 200°C. После охлаждения до комнатной температуры реакционную смесь разбавляли EtOAc и промывали 5% водным раствором NaHCO3, сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 1:1) с получением 1'-бензил-6-(бензилокси]-2H-спиро[1-бензофуран-3,3'-пирролидин] (0,26 г; 68%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,20-7,45 (м, 10H), 7,10 (д, J=8,2 Гц, 1H), 6,52 (дд, J=8,2, 2,2 Гц, 1H), 6,43 (д, J=2,2 Гц, 1H), 5,01 (с, 2H), 4,51 (д, J=8,8 Гц, 1H), 4,34 (д, J=8,8 Гц, 1H), 3,68 (д, J=13,1 Гц, 1H), 3,59 (д, J=13,1 Гц, 1H), 2,87 (дт, J=8,7, 5,0 Гц, 1H), 2,79 (д, J=9,2 Гц, 1H), 2,61 (дт, J=8,9, 6,9 Гц, 1H), 2,48 (д, J=9,2 Гц, 1H), 2,20 (ддд, J=13,4, 8,9, 5,0 Гц, 1H), 1,95-2,07 (м, 1H). Rt 1,35 мин (Система В), [M+H]+ 372,6.
Смесь этого продукта (260 мг; 0,7 ммоль), формиата аммония (0,18 г; 2,8 ммоль) и гидроксида палладия (5 мг; 0,03 ммоль) в метаноле (25 мл) перемешивали в течение ночи (при 60°C). Неочищенную реакционную смесь концентрировали до объема около 5 мл и фильтровали через содержащую паратолуолсульфокислоту твердофазную экстракционную гильзу, промывая MeOH и элюируя раствором 2н NH3/МеОН. Продукт концентрировали с получением 2H-спиро[1-бензофуран-3,3'-пирролидин]-6-ола (0,13 г; 97%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,08 (д, J=8,1 Гц, 1H), 6,31 (дд, J=8,1, 2,1 Гц, 1H), 6,21 (д, J=2,1 Гц, 1H), 4,46 (д, J=9,0 Гц, 1H), 4,32 (д, J=9,0 Гц, 1H), 3,04-3,30 (м, 3H), 3,01 (д, J=11,4 Гц, 1H), 1,95-2,11 (м, 2H).
Аналогичным способом и как описано для соединения 29, 2H-спиро[1-бензофуран-3,3'-пирролидин]-6-ол преобразовывали в трет-бутил 3-{6-гидрокси-2H-спиро[1-бензофуран-3,3'-пирролидин]-1'-ил]пропаноат.
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 6,99 (д, J=8,1 Гц, 1H), 6,34 (дд, J=8,1, 2,2 Гц, 1H), 6,28 (д, J=2,2 Гц, 1H), 4,47 (д, J=8,8 Гц, 1H), 4,30 (д, J=8,8 Гц, 1H), 2,84-2,94 (м, 2H), 2,79 (т, J=7,4 Гц, 2H), 2,55-2,63 (м, 2H), 2,46 (т, J=7,4 Гц, 2H), 2,10-2,21 (м, 1H), 1,94-2,05 (м, 1H), 1,45 (с, 9H),
затем осуществляли реакцию Мицунобу и кислотный гидролиз с получением продукта: гидрохлорида 3-{6-[(2,6-дихлорфенил)метокси]-2H-спиро[1-бензофуран-3,3'-пирролидин]-1'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,70 (уш. с, 1H), 11,55 (уш.с, 1H), 7,57 (д, J=7,4 Гц, 2H), 7,36-7,52 (м, 2H), 6,65 (дд, J=8,3, 2,2 Гц, 1H), 6,60 (д, J=2,2 Гц, 1H), 5,19 (с, 2H), 4,23-4,81 (м, 2H), 3,14-3,91 (м, 6H), 2,84 (т, J=7,7 Гц, 2H), 2,10-2,40 (м, 2H).
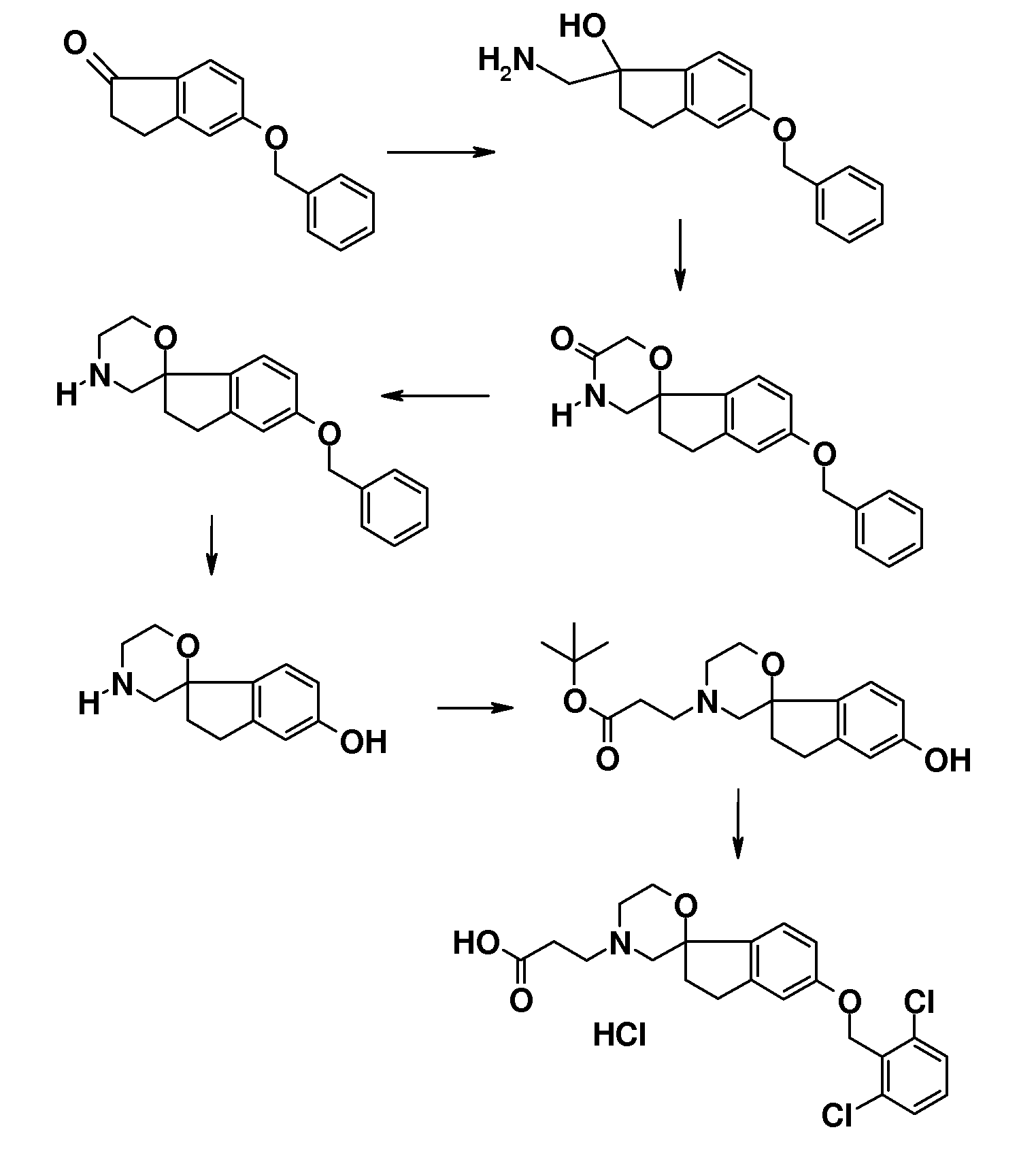
Соединение 333. Гидрохлорид 3-{5-[(2,6-дихлорфенил)метокси]-2,3-дигидроспиро[инден-1,2'-морфолин]-4'-ил}пропановой кислоты. Смесь 5-(бензилокси)-2,3-дигидро-1H-инден-1-она (13,11 г; 55,02 ммоль), иодида цинка (0,35 г; 1,1 ммоль) и триметилсилилцианида (22,71 мл; 181,5 ммоль) перемешивали в течение ночи при комнатной температуре. Затем избыток триметилсилилцианида удаляли в вакууме и остаток растворяли в ТГФ (250 мл). Полученный раствор добавляли по каплям к смеси литийалюминийгидрида (8,56 г; 225,57 ммоль) в ТГФ (200 мл). Полученную смесь нагревали при температуре кипения с обратным холодильником в течение 2 часов. Затем смесь охлаждали до 0°C и обрабатывали последовательно водой (10 мл), 2M водным раствором NaOH (20 мл) и водой (10 мл). Затем смесь нагревали при температуре кипения с обратным холодильником в течение 15 минут, снова охлаждали до комнатной температуры, фильтровали через кизельгур и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, MeOH) с получением 1-(аминометил)-5-(бензилокси)-2,3-дигидро-1H-инден-1-ола (10,7 г; 72%). К раствору 1-(аминометил)-5-(бензилокси)-2,3-дигидро-1H-инден-1-ола (10,50 г; 40 ммоль) и Et3N (6,52 мл; 46,78 ммоль) в смеси CH2Cl2 (100 мл) и MeOH (16 мл) добавляли по каплям раствор хлорацетилхлорида (3,42 мл; 42,9 ммоль) в CH2Cl2 (10 мл), при 0°C. Через 1 час при 0°C реакционную смесь гасили 1M водным раствором HCl (200 мл). Слои разделяли и органический слой промывали 5% водным раствором NaHCO3, сушили (Na2SO4) и концентрировали с получением N-{[5-(бензилокси)-1-гидрокси-2,3-дигидро-1H-инден-1-ил]метил}-2-хлорацетамида (10,5 г; 78%). Остаток растворяли в 2-пропаноле (100 мл) и добавляли трет-бутоксид калия (3,71 г; 33 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 1 часа и затем концентрировали в вакууме. Неочищенный продукт распределяли между EtOAc и 0,5 M водным раствором HCl. Слои разделяли и органический слой промывали 5% водным раствором NaHCO3, сушили (Na2SO4) и упаривали в вакууме. Остаток очищали колоночной хроматографией (SiO2, EtOAc:MeOH 9:1) с получением 5-(бензилокси)-2,3-дигидроспиро[инден-1,2'-морфолин]-5'-она (5,1 г; 54,8%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,29-7,45 (м, 6H), 7,05 (уш.с, 1H), 6,83-6,91 (м, 2H), 5,06 (с, 2H), 4,15-4,30 (м, 2H), 3,61 (дд, J=12,2, 1,9 Гц, 1H), 3,46 (дд, J=12,2, 2,9 Гц, 1H), 3,05-3,15 (м, 1H), 2,84 (дт, J=16,1, 6,7 Гц, 1H), 2,30 (т, J=6,7 Гц, 2H).
К раствору указанного выше продукта (0,7 г; 2,26 ммоль) в ТГФ (10 мл) добавляли по каплям комплекс боран-ТГФ (1M, 11,3 мл; 11,3 ммоль) при 0°C. Через 1 час смеси давали нагреться до комнатной температуры и перемешивали в течение ночи. К реакционной смеси добавляли MeOH (10 мл) при 0°C и полученную смесь перемешивали при комнатной температуре в течение 30 минут и затем концентрировали в вакууме. Остаток суспендировали в MeOH (10 мл) и добавляли 1 M водный раствор NaOH (25 мл) и нагревали при температуре кипения с обратным холодильником в течение 1 часа. Полученную смесь концентрировали в вакууме и остаток распределяли между EtOAc и 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, EtOAc:MeOH 9:1 до 1:9) с получением 5-(бензилокси)-2,3-дигидроспиро[инден-1,2'-морфолин] (0,47 г; 70,3%).
1H ЯМР (300 МГц, CDCl3-d) δ м.д. 7,29-7,45 (м, 6H), 6,82-6,88 (м, 2H), 5,05 (с, 2H), 3,78 (дд, J=7,0, 2,8 Гц, 2H), 2,95-3,05 (м, 3H), 2,86-2,93 (м, 1H), 2,74-2,84 (м, 2H), 2,48 (ддд, J=13,0, 8,4, 4,4 Гц, 1H), 2,23 (дддд, J=13,0, 8,4, 7,0, 1,2 Гц, 1H). Rt 1,19 мин (Система B), [M+H]+ 296,1.
5-(Бензилокси)-2,3-дигидроспиро[инден-1,2'-морфолин] (0,46 г; 1,56 ммоль) растворяли в MeOH (20 мл). Добавляли гидроксид палладия (11 мг; 0,16 ммоль) и смесь обрабатывали при помощи H2 в течение ночи. Реакционную смесь концентрировали с получением 2,3-дигидроспиро[инден-1,2'-морфолин]-5-ола (310 мг; 97%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,30 (уш.с, 1H), 7,22 (д, J=8,0 Гц, 1H), 6,54-6,59 (м, 2H), 3,56 (дд, J=5,8, 3,7 Гц, 2H), 2,55-2,85 (м, 6H), 2,41 (ддд, J=13,0, 8,0, 4,5 Гц, 1H), 1,91-2,00 (м, 1H). Rt 0,30 мин (Система B), [M+H]+ 206,1.
Смесь 2,3-дигидроспиро[инден-1,2'-морфолин]-5-ола (0,3 г; 1,46 ммоль), трет-бутилакрилата (0,64 мл; 4,38 ммоль) и N,N-диизопропиламина (0,76 мл, 4,46 ммоль) в MeOH (20 мл) нагревали при температуре кипения с обратным холодильником в течение ночи (закрытая бутыль из пирекса). После охлаждения до комнатной температуры смесь концентрировали в вакууме и остаток распределяли между EtOAc и 5% водным раствором NaHCO3. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O) с получением трет-бутил 3-{5-гидрокси-2,3-дигидроспиро[инден-1,2'-морфолин]-4'-ил}пропаноата (0,32 г; 65,5%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,46 (д, J=8,1 Гц, 1H), 6,60-6,68 (м, 2H), 4,97 (с, 1H), 3,69-3,81 (м, 2H), 2,93-3,03 (м, 1H), 2,33-2,79 (м, 10Н), 2,08-2,17 (м, 1H), 1,46 (с, 9H). Rt 1,04 мин (Система B), [M+H]+ 334,1.
Смесь трет-бутил 3-{5-гидрокси-2,3-дигидроспиро[инден-1,2'-морфолин]-4'-ил}пропаноата (315 мг; 0,94 ммоль), K2CO3 (0,39 г; 2,83 ммоль) и 2,6-дихлорбензилбромида (250 мг; 1,04 ммоль) в CH3CN (10 мл) перемешивали в течение ночи (при комнатной температуре). Реакционную смесь распределяли между 5% водным раствором NaHCO3 и Et2O. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, Et2O:гексан 4:6) с получением трет-бутил 3-{5-[(2,6-Дихлорфенил)метокси]-2,3-дигидроспиро[инден-1,2'-морфолин]-4'-ил}пропаноата (0,387 г; 83%). Rt 1,68 мин (Система B), [M+H]+ 492,0, который растворяли в 1M растворе HCl в 1,4-диоксане (10 мл) и перемешивали в течение 2 часов при 70°C. Затем растворитель удаляли в вакууме и остаток обрабатывали iPr2O, осадок собирали фильтрованием и сушили в течение ночи при пониженном давлении с получением гидрохлорида 3-{5-[(2,6-дихлорфенил)метокси]-2,3-дигидроспиро[инден-1,2'-морфолин]-4'-ил}пропановой кислоты (300 мг, 83%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,80 (уш.с, 1H), 11,20 (уш.с, 1H), 7,58 (д, J=8,0 Гц, 2H), 7,47 (т, J=8,0 Гц, 1H), 7,29 (д, J=8,8 Гц, 1H), 7,02 (с, 1H), 6,95 (д, J=8,8 Гц, 1H), 5,22 (с, 2H), 3,98 (д, J=7,5 Гц, 2H), 2,88-3,54 (м, 11H), 2,08-2,18 (м, 1H). Rt 1,45 мин (Система B), [M+H]+ 435,9.
Следующие соединения были получены аналогичным способом:
Соединение 334. Гидрохлорид 3-[5-{октилокси)-2,3-дигидроспиро[инден-1,2'-морфолин]-4'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,80 (уш.с, 1H), 11,20 (уш.с, 1H), 7,23 (д, J=8,8 Гц, 1H), 6,78-6,86 (м, 2H), 3,85-4,03 (м, 4H), 3,24-3,50 (м, 4H), 3,05-3,23 (м, 2H), 2,80-3,03 (м, 5H), 2,04-2,18 (м, 1H), 1,62-1,75 (м, 2H), 1,18-1,45 (м, 10H), 0,85-0,95 (м, 3H).
Соединение 335. Гидрохлорид 3-[5-(2,6-дихлорфенокси)-2,3-дигидроспиро[инден-1,2'-морфолин]-4'-ил}пропановой кислоты.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,80 (уш.с, 1H), 10,60 (уш.с, 1H), 7,66 (д, J=8,0 Гц, 2H), 7,38 (т, J=8,0 Гц, 1H), 7,32 (д, J=8,8 Гц, 1H), 6,69-6,75 (м, 2H), 3,87-3,99 (м, 2H), 3,05-3,53 (м, 8H), 2,82-2,92 (м, 3H), 2,08-2,18 (м, 1H).
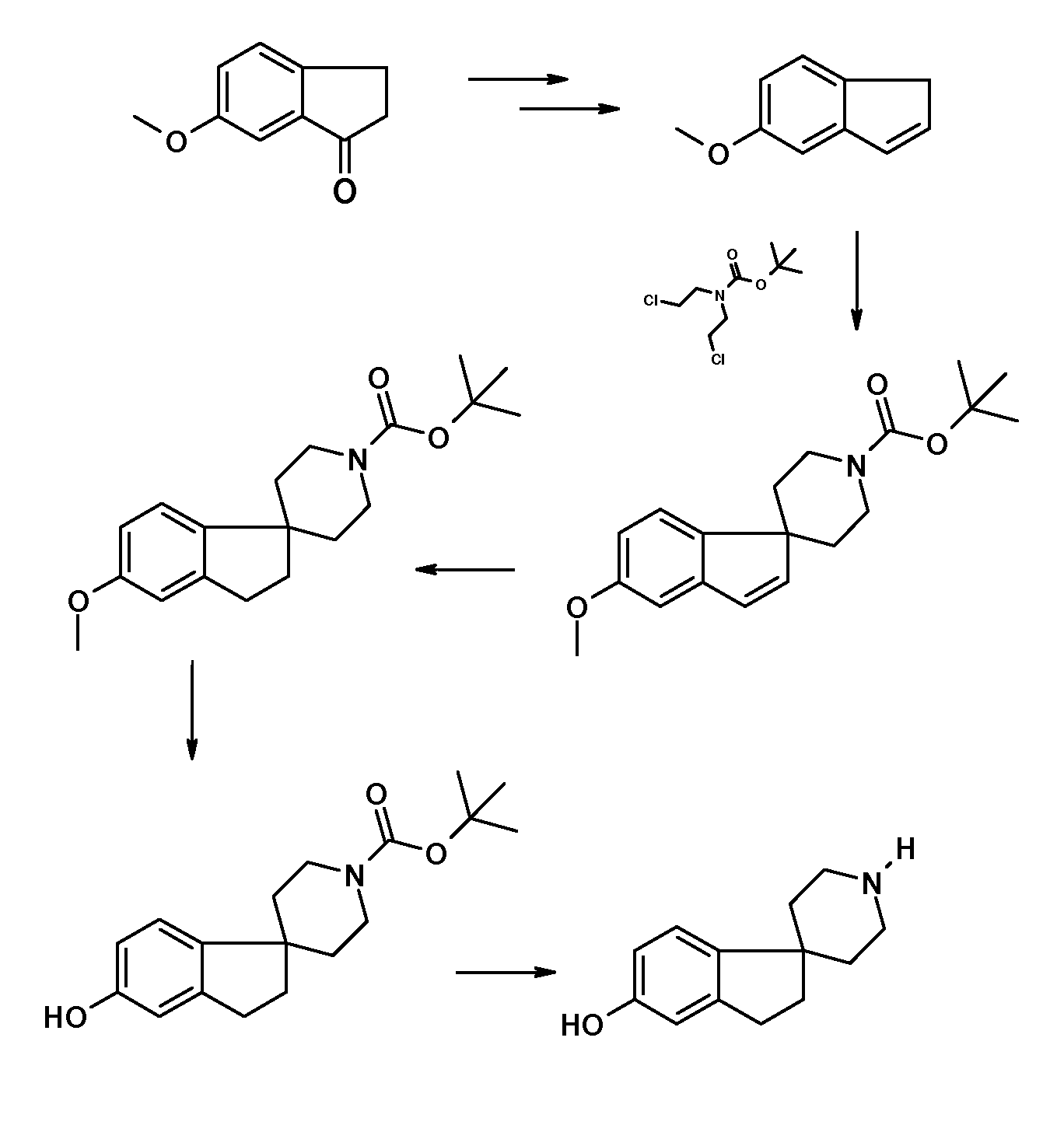
2,3-Дигидроспиро[инден-1,4'-пиперидин]-5-ол. К раствору 6-метокси-2,3-дигидро-1H-инден-1-она (25 г; 154 ммоль) в MeOH (400 мл) добавляли NaBH4 (7,0 г; 185 ммоль) порциями при комнатной температуре. Смесь перемешивали в течение 1 часа при комнатной температуре. Затем добавляли воду (100 мл) с последующим добавлением 2н раствора хлористоводородной кислоты (150 мл). Смесь перемешивали в течение 1,5 часа при комнатной температуре и затем экстрагировали MTBE (2-метокси-2-метилпропан). Объединенные органические слои промывали насыщенным солевым раствором, сушили (Na2SO4) и концентрировали в вакууме с получением 6-метокси-2,3-дигидро-1H-инден-1-ола в виде масла, 25 г (99%).
1H ЯМР (300 МГц, CDCl3-d) δ м.д. 7,15 (д, J=8 Гц, 1H), 6,95 (д, J=2 Гц, 1H), 6,80 (д, J=8 Гц, 1H), 4,82-4,78 (м, 1H), 3,80 (с, 3H), 3,05-2,95 (м, 1H), 2,80-2,70 (м, 1H), 2,40-2,30 (м, 1H), 2,15-2,05 (м, 1H).
Смесь 6-метокси-2,3-дигидро-1H-инден-1-ола (18,5 г; 113 ммоль), гидрата п-толуолсульфоновой кислоты (0,1 г; 0,5 ммоль), гидрохинона (0,1 г; 1 ммоль) и толуола (150 мл) нагревали до температуры кипения с обратным холодильником в течение 1 часа. После охлаждения до комнатной температуры смесь разбавляли MTBE (50 мл), промывали насыщенным раствором бикарбоната натрия, затем насыщенным солевым раствором, сушили (Na2SO4) и концентрировали с получением 5-метокси-1H-индена (15,5 г; чистота 75%),
1H ЯМР (300 МГц, CDCl3-d) δ м.д. 7,43 (д, J=8 Гц, 1H), 7,06 (д, J=2 Гц, 1H), 6,92 (д, J=6 Гц, 1H), 6,85 (дд, J=8, 2 Гц, 1H), 6,66 (д, J=6 Гц, 1H), 3,90 (с, 3H), 3,42 (с, 2H).
К раствору этого неочищенного 5-метокси-1H-индена (15,0 г; чистота 75%, 60 ммоль) в ТГФ (50 мл при 0°C) добавляли бис(триметилсилил)амид лития (LiHMDS, 1M раствор в ТГФ/этилбензоле, 200 мл; 200 ммоль). Полученный коричневый раствор добавляли по каплям в течение 20 минут к раствору трет-бутил N,N-бис(2-хлорэтил)карбамата (23 г; 95 ммоль) в ТГФ (100 мл). Смесь перемешивали в течение 1 часа при 0°C и затем в течение 1 часа при температуре окружающей среды. Смесь концентрировали в вакууме и очищали колоночной хроматографией (SiO2, EtOAc:гексан 1:9) с получением масла, 23 г. Кристаллизация из пентана давала трет-бутил 5-метоксиспиро[инден-1,4'-пиперидин]-1'-карбоксилат (9,4 г; (50%).
1H ЯМР (300 МГц, CDCl3-d) δ м.д. 7,22 (д, J=8 Гц, 1H), 6,88 (д, J=2 Гц, 1H), 6,78 (дд, J=8, 2 Гц, 1H), 6,72 (с, 2H), 4,30-4,10 (м, 2H), 3,80 (с, 3H), 3,10 (т, J=12 Гц, 2H), 1,98 (дт, J=12, 4 Гц, 2H), 1,50 (с, 9H), 1,30 (д, J=12 Гц, 2H).
Смесь трет-бутил 5-метоксиспиро[инден-1,4'-пиперидин]-1'-карбоксилата (3,15 г; 10 ммоль), 10% Pd/C (0,6 г; 0,6 ммоль) и этанола (50 мл) гидрировали при 5 бар в течение 4 часов. Катализатор удаляли фильтрованием через Целит и фильтрат концентрировали в вакууме с получением трет-бутил 5-метокси-2,3-дигидроспиро[инден-1,4'-пиперидин]-1'карбоксилата (2,8 г; 88%).
1H ЯМР (400 МГц, CDCl3-d) δ м.д. 7,13 (д, J=8 Гц, 1H), 6,75 (дд, J=8, 2 Гц, 1H), 6,70 (д, J=2 Гц, 1H), 4,15-4,05 (м, 2H), 3,80 (с, 3H), 2,95 (т, J=12 Гц, 2H), 2,85 (т, J=7 Гц, 2H), 2,05 (т, J=7 Гц, 2H), 1,80 (дт, J=12, 4 Гц, 2H), 1,55 (д, J=12 Гц, 2H), 1,50 (с, 9H).
К раствору трет-бутил 5-метокси-2,3-дигидроспиро[инден-1,4'-пиперидин]-1'-карбоксилата (320 мг; 1,0 ммоль) в N,N-диметилформамиде (15 мл) добавляли этантиолат натрия (360 мг; 4,0 ммоль). Смесь нагревали при 130°C в течение 60 часов. Смесь охлаждали до комнатной температуры и добавляли насыщенный раствор хлорида аммония (50 мл). Полученную смесь экстрагировали дихлорметаном. Объединенные экстракты промывали насыщенным солевым раствором, сушили (NaSO4) и концентрировали. Остаток очищали колоночной хроматографией (SiO2, EtOAc:гексан 1:2) с получением трет-бутил 5-гидрокси-2,3-дигидроспиро[инден-1,4'-пиперидин]-1'-карбоксилата (110 мг (37%),
1H ЯМР (300 МГц, CDCl3-d) δ м.д. 7,07 (д, J=8 Гц, 1H), 6,67 (дд, J=8, 2 Гц, 1H), 6,63 (д, J=2 Гц, 1H), 4,15-4,05 (м, 2H), 2,95 (т, J=12 Гц, 2H), 2,85 (т, J=7 Гц, 2H), 2,07 (т, J=7 Гц, 2H), 1,75 (дт, J=12 Гц, 2 Гц, 2H), 1,55 (д, J=12 Гц, 2H), 1,52 (с, 9H),
который растворяли в 4н растворе HCl в диоксане (4 мл). Осадок (образовавшийся через 1 час) собирали фильтрованием, промывали Et2O и сушили с получением HCl соли 2,3-дигидроспиро[инден-1,4'-пиперидин]-5-ола (65 мг; 75%).
1Н ЯМР (300 МГц, D2O) δ м.д. 7,20 (д, J=8 Гц, 1H), 6,82-6,78 (м, 2H), 3,46 (д, J=12 Гц, 2H), 3,23 (т, J=12 Гц, 2H), 2,88 (т, J=7 Гц, 2H), 2,14 (т, J=7 Гц, 2H), 2,02 (дт, J=12, 4 Гц, 2H), 1,78 (д, J=12 Гц, 2H).
В таблице ниже представлены структуры соединений 1-336 в соответствии с настоящим изобретением.
В этих структурах структурный элемент  представляет собой группу COOH.
представляет собой группу COOH.
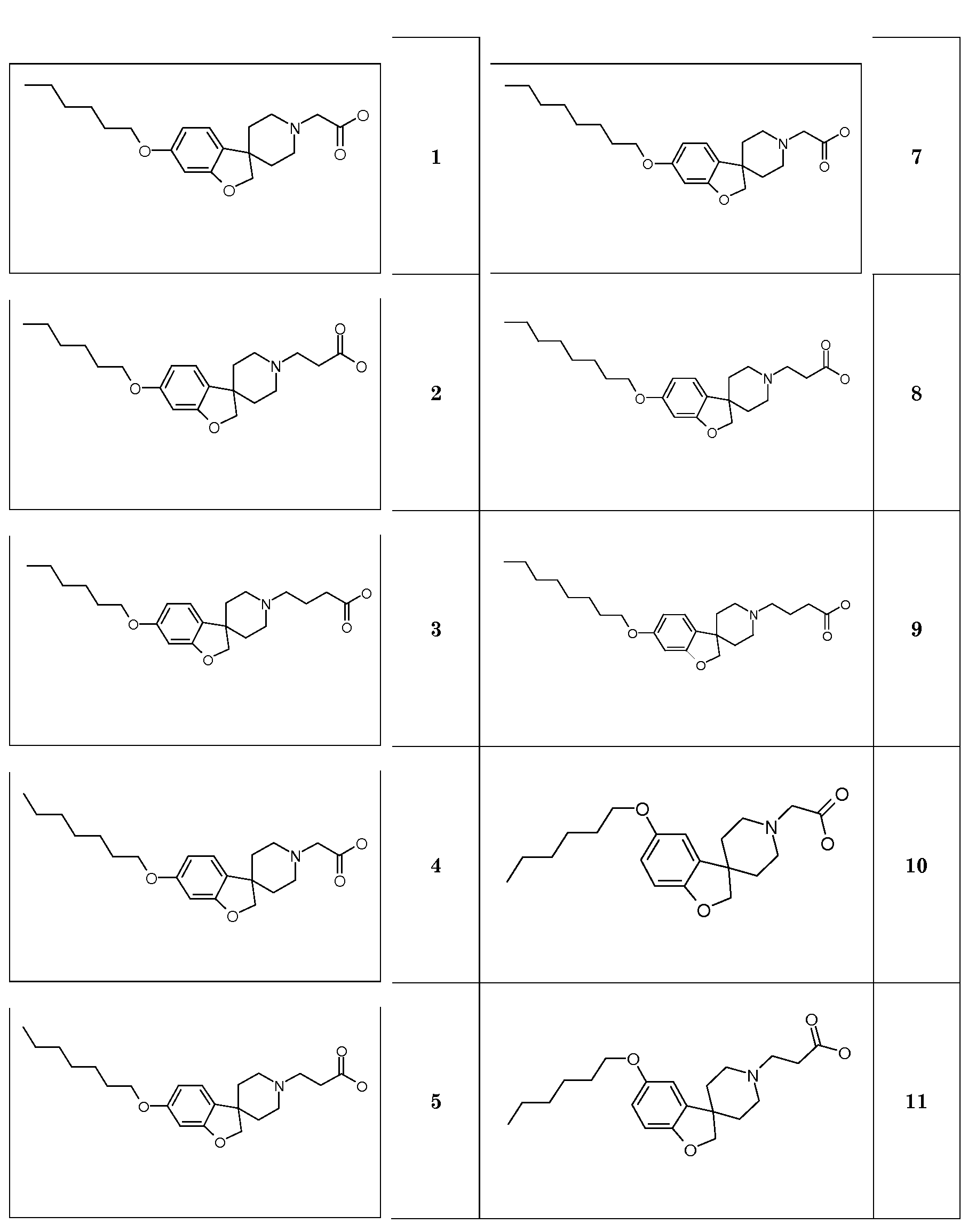
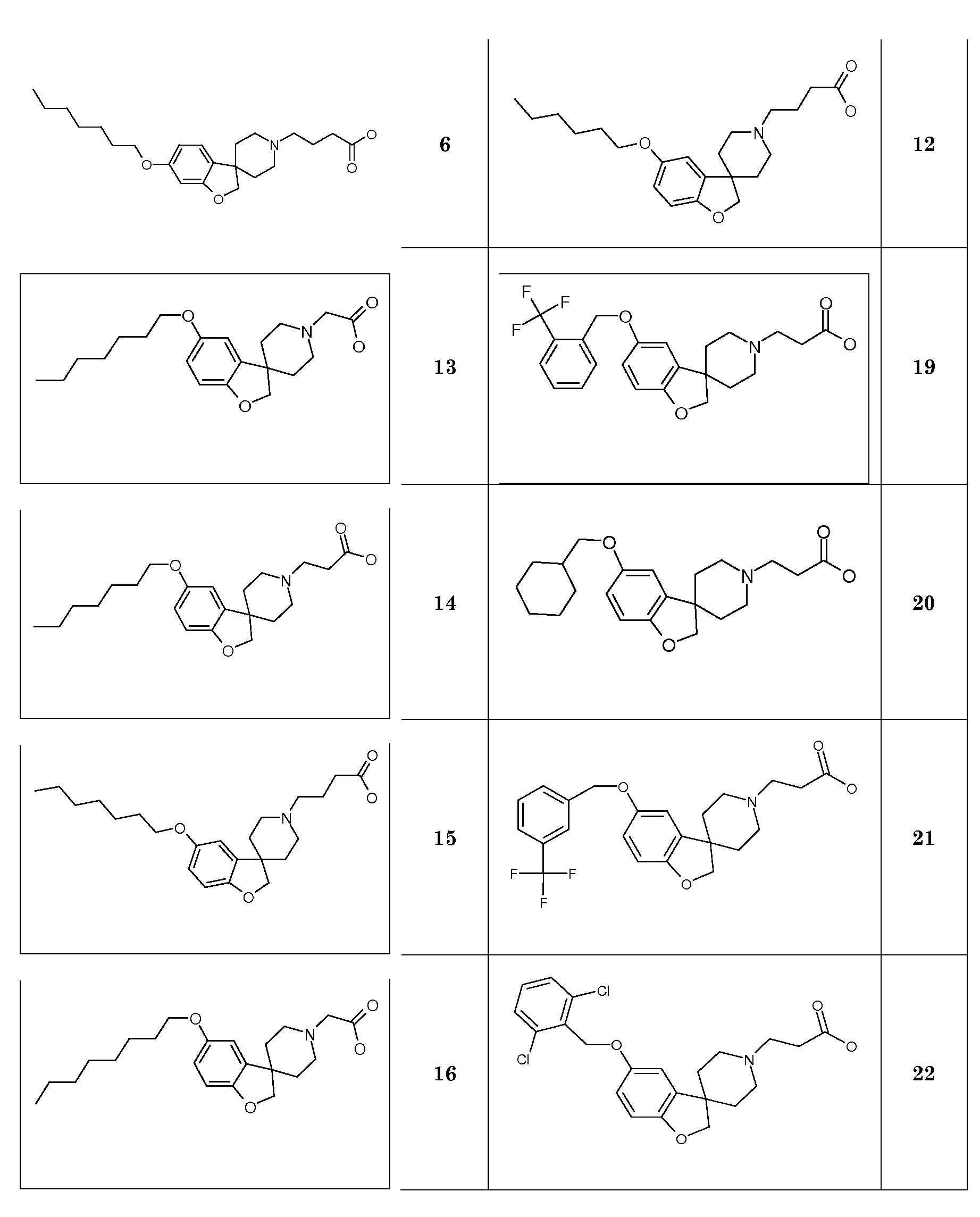
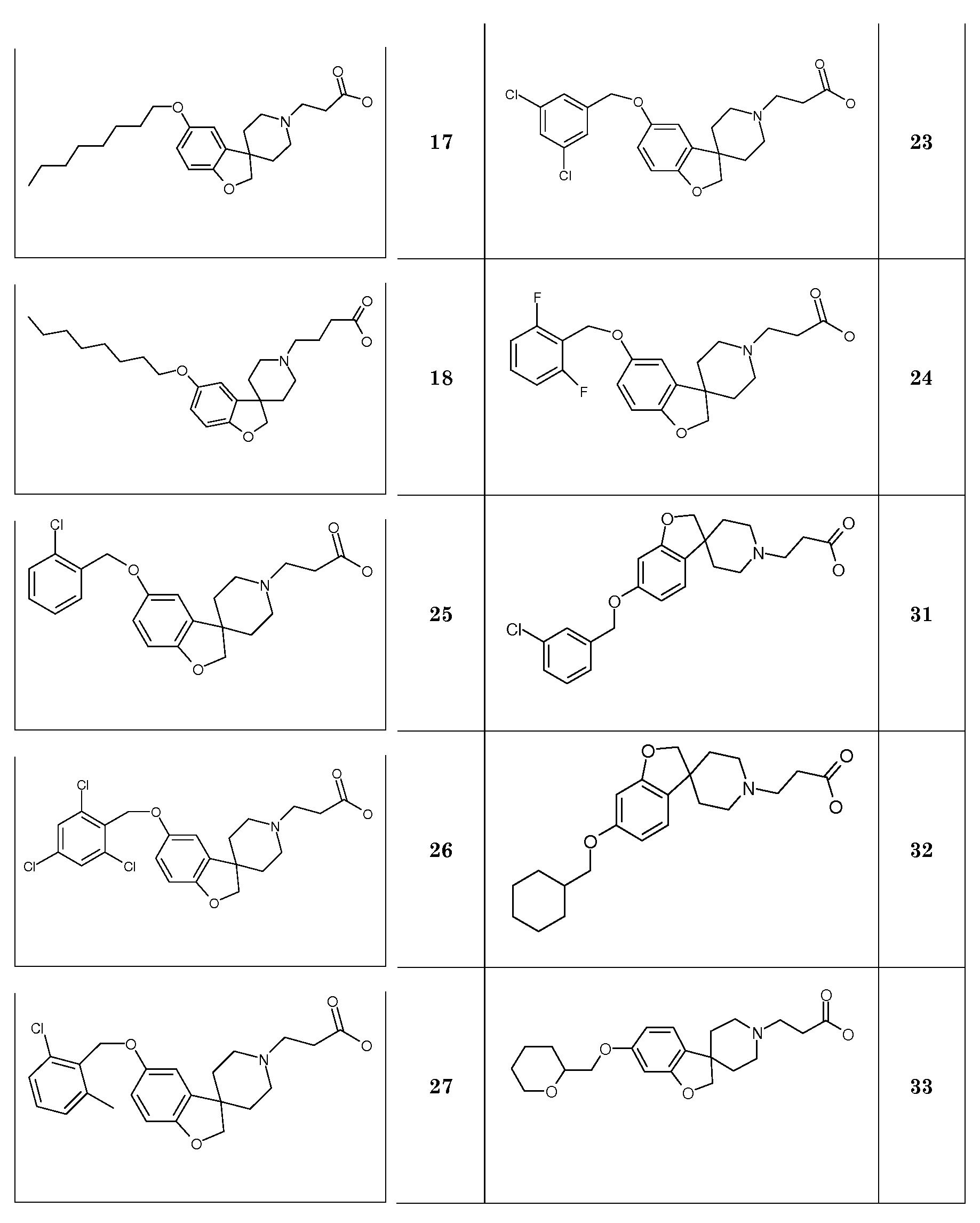
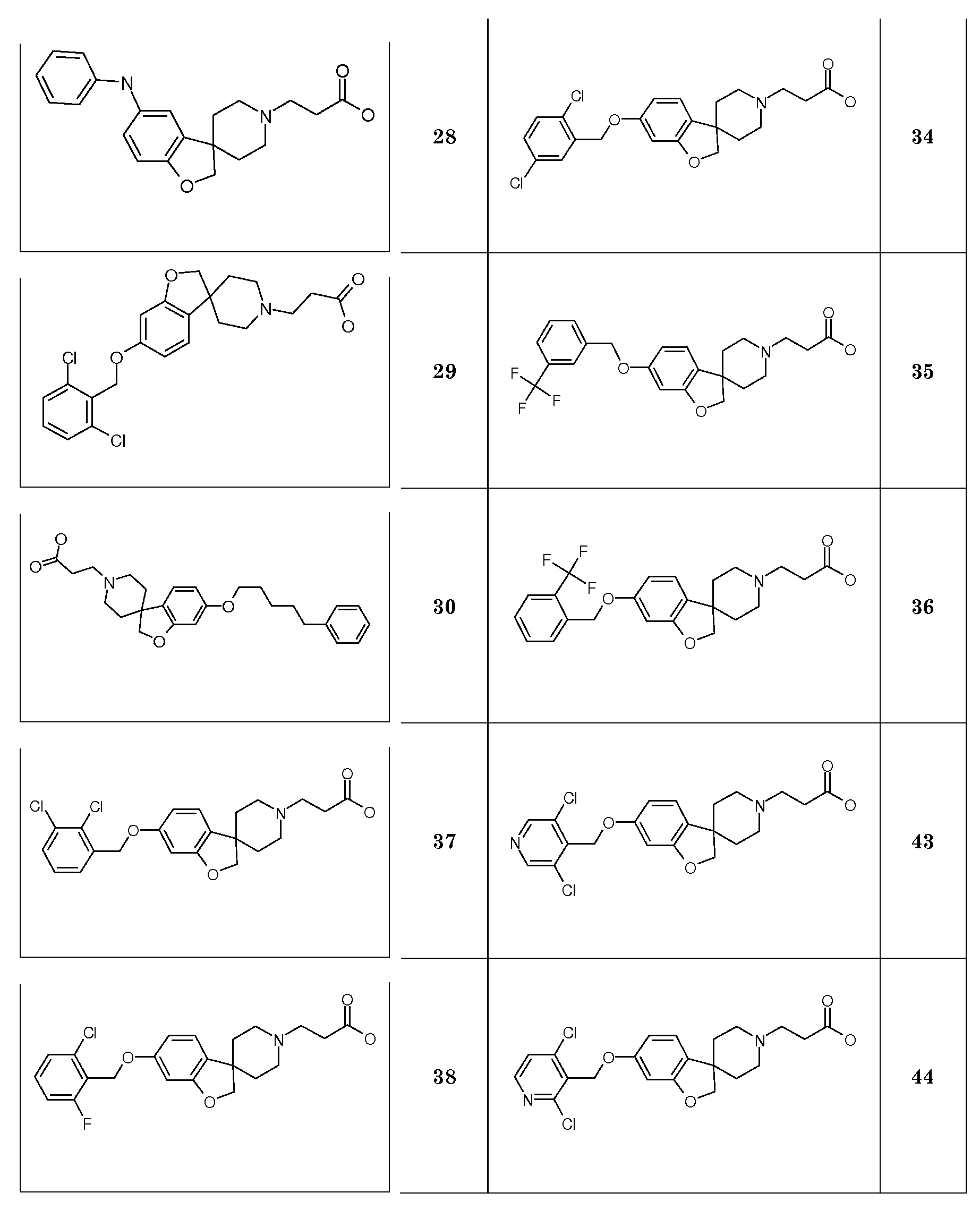
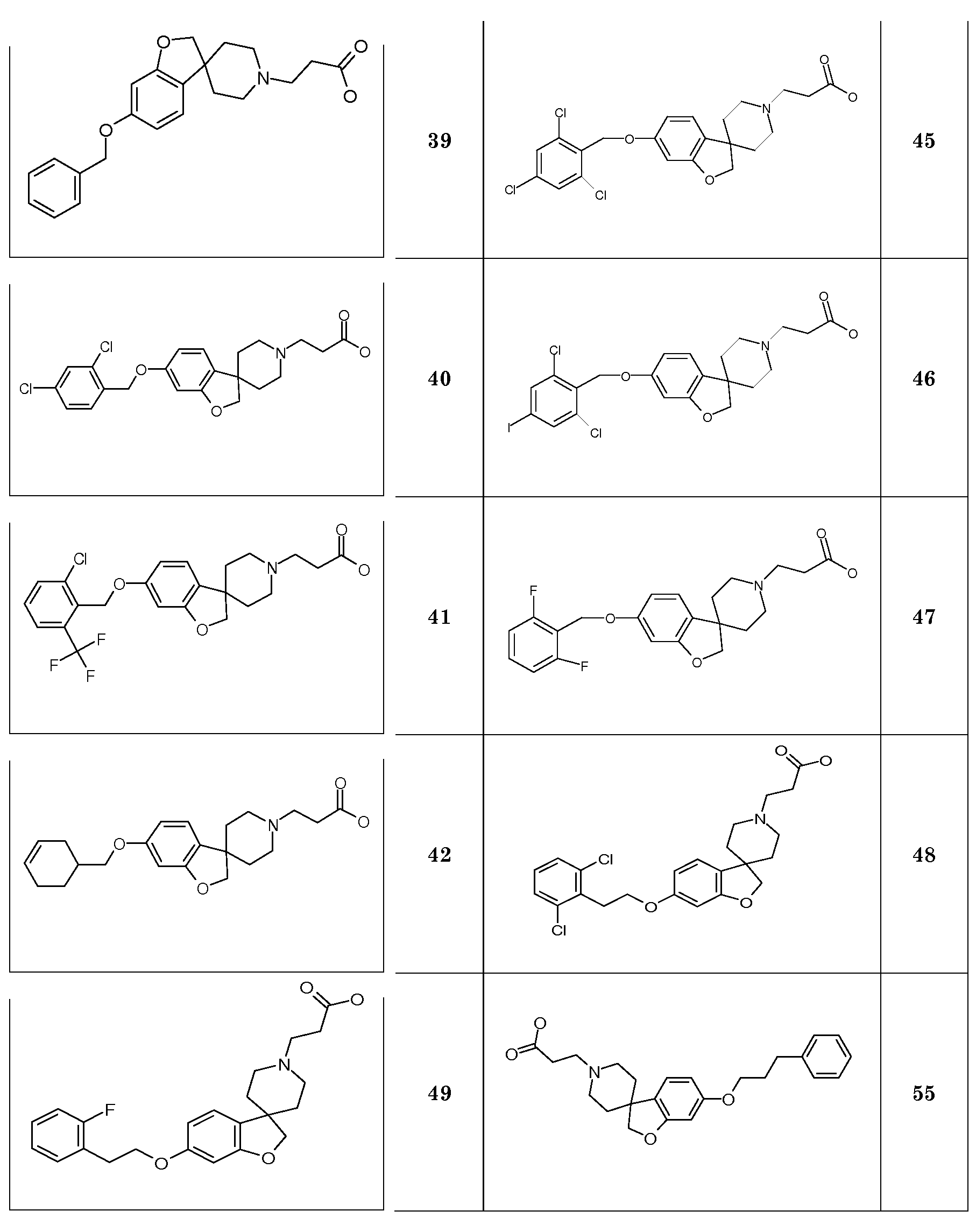
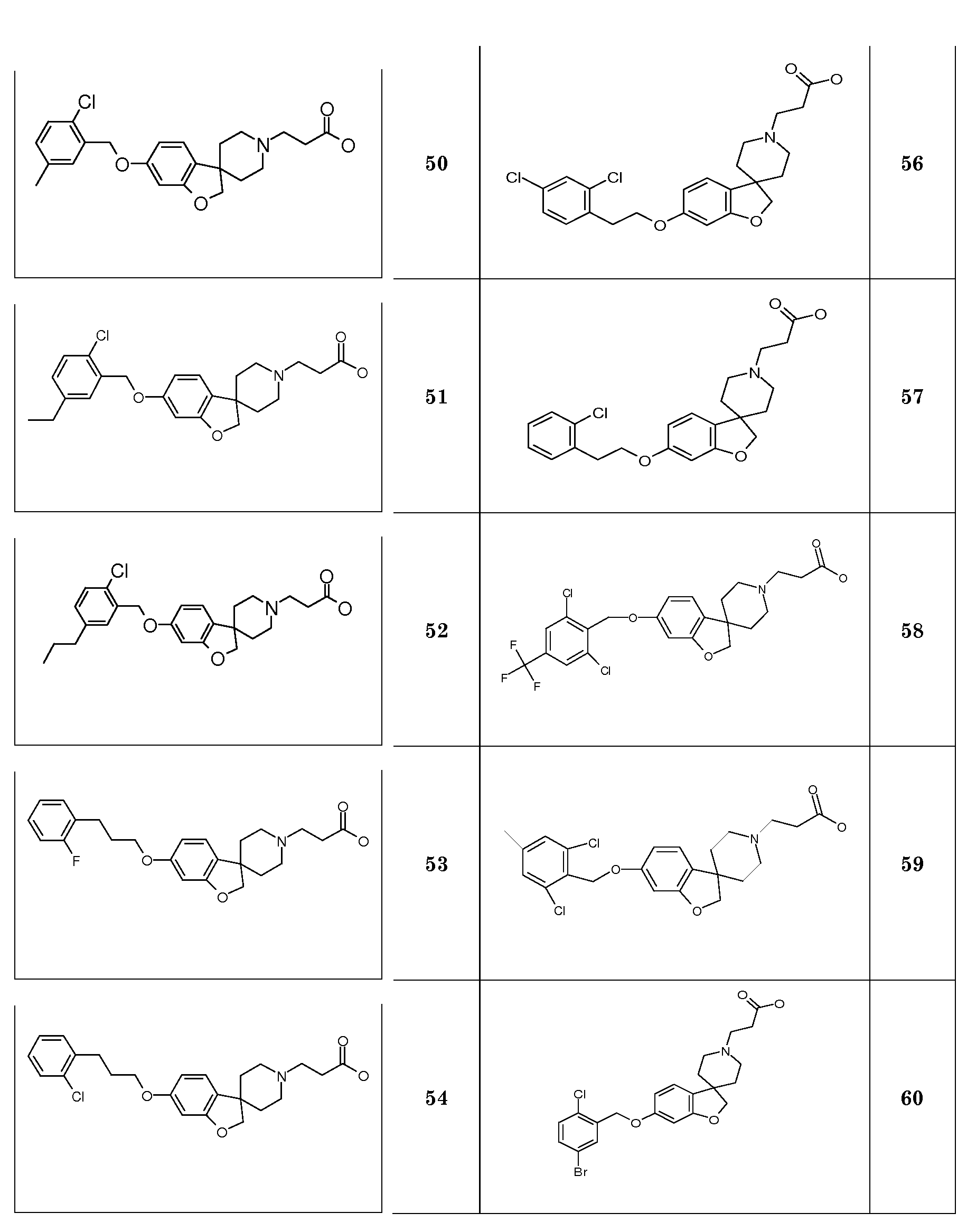
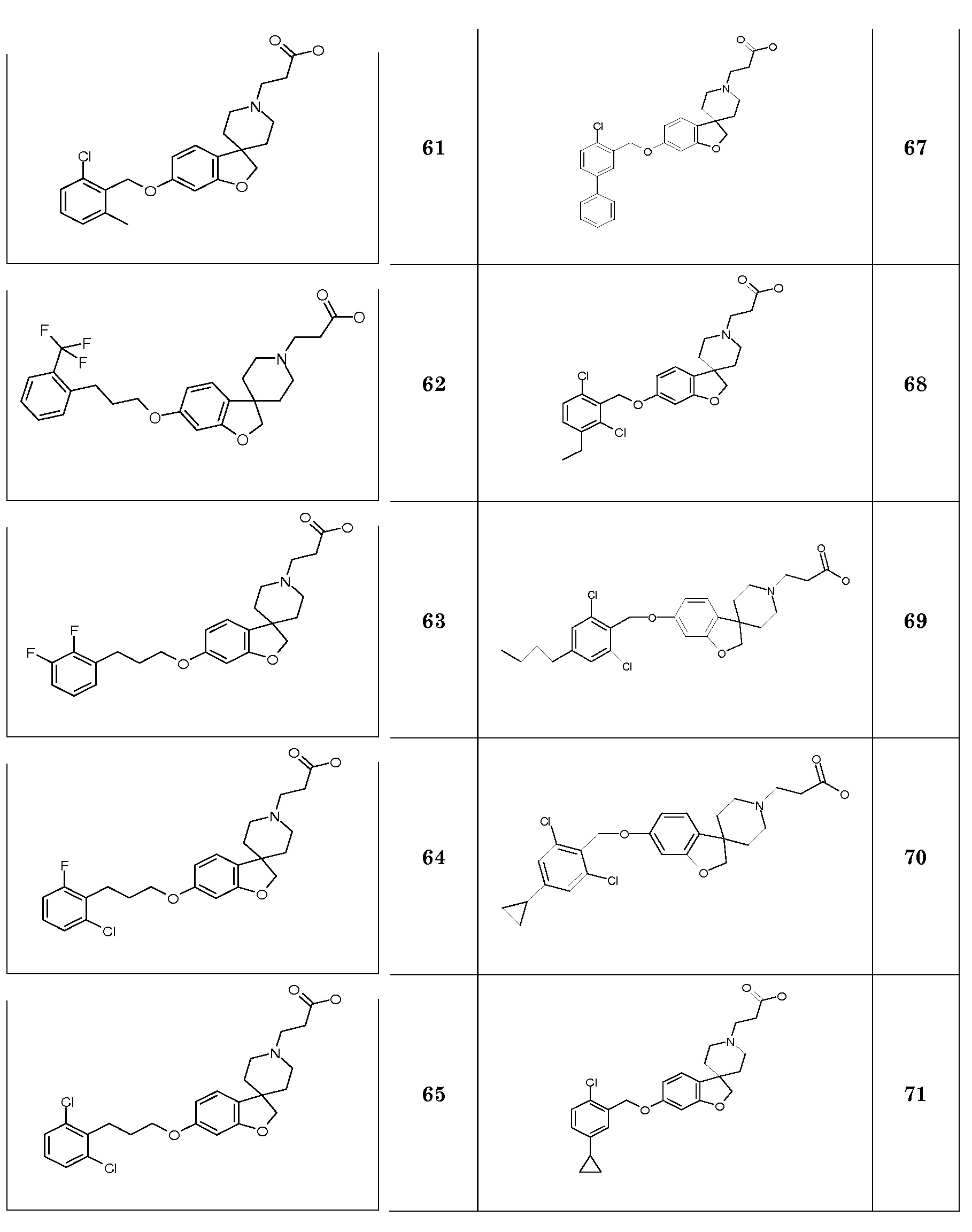
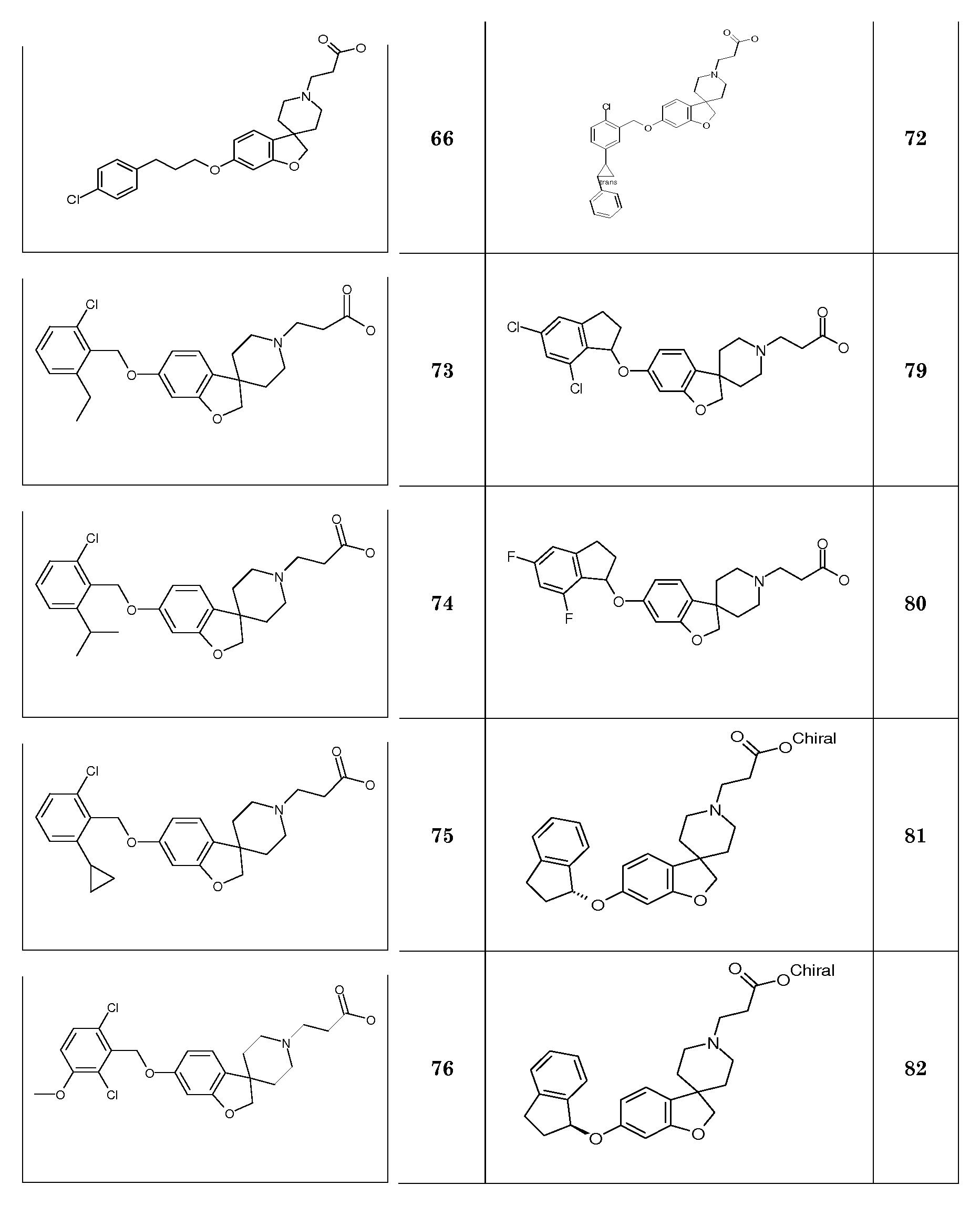
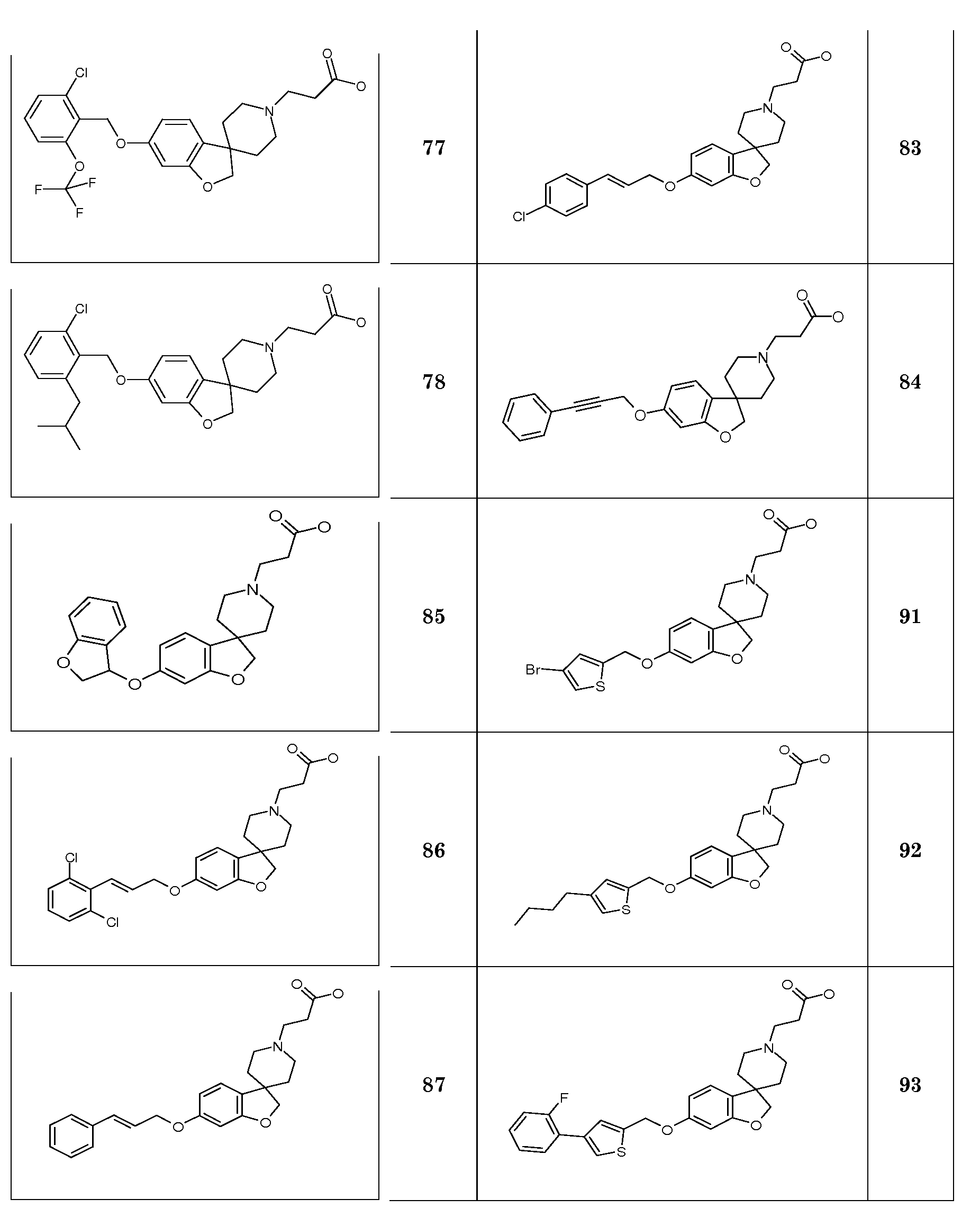
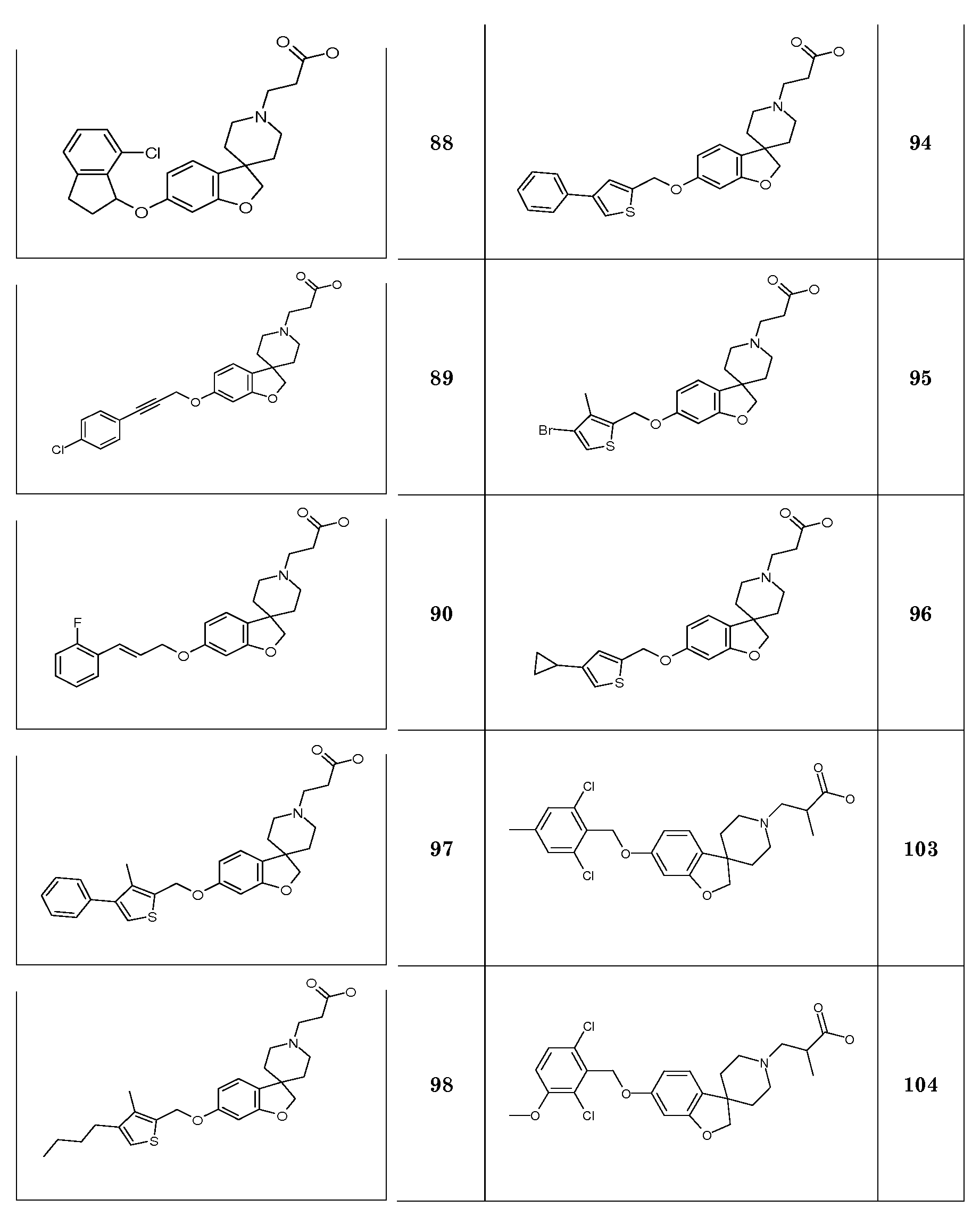
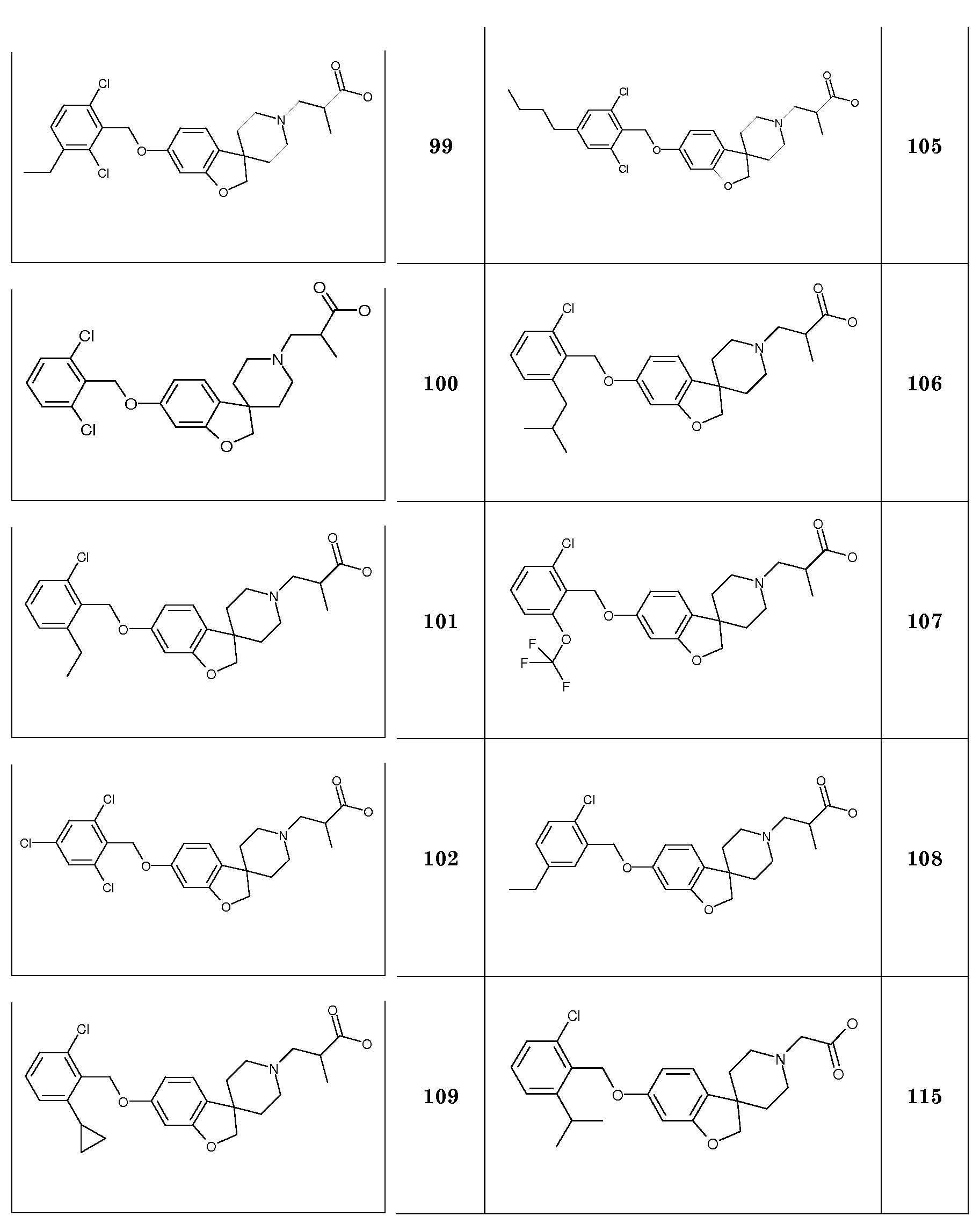
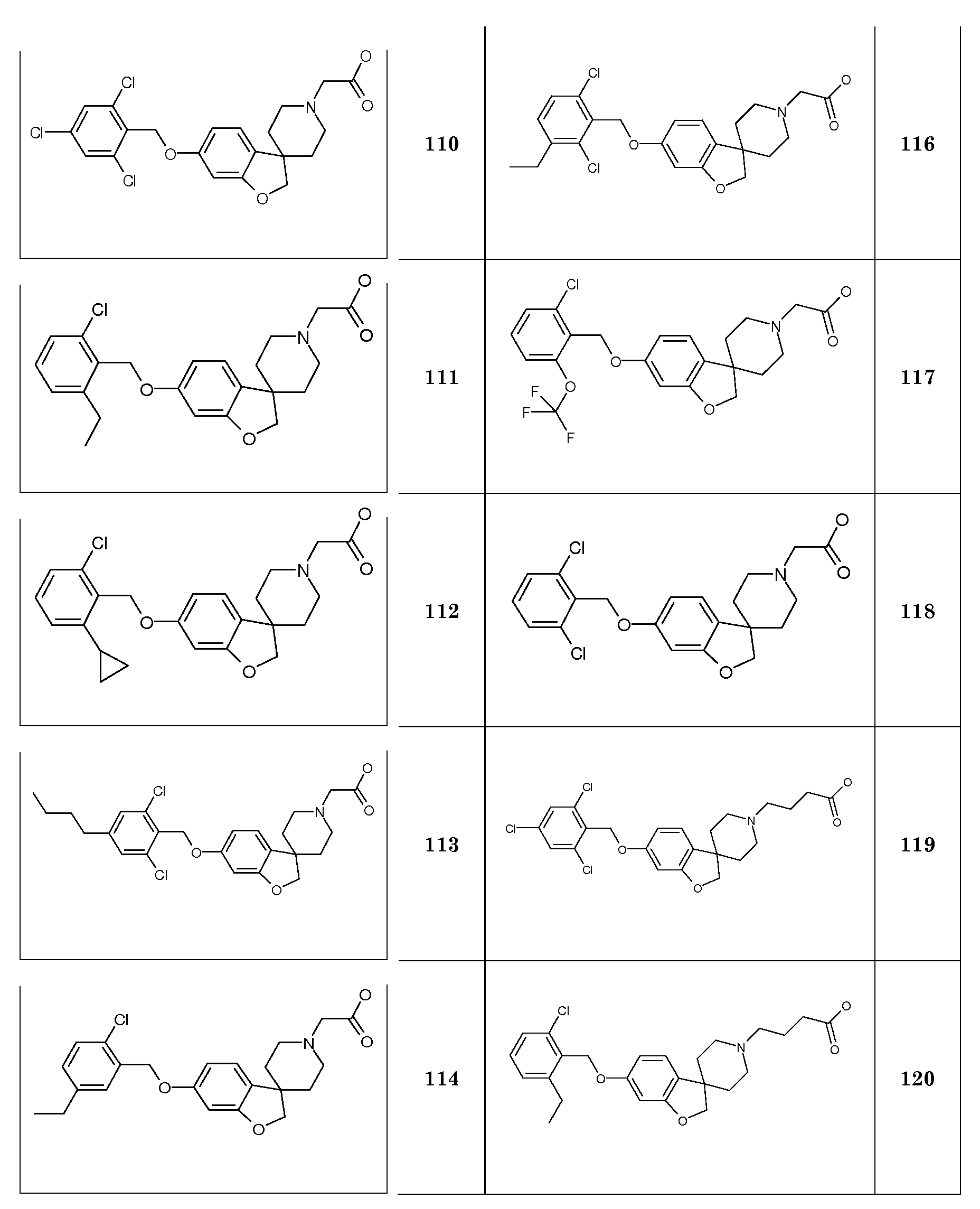
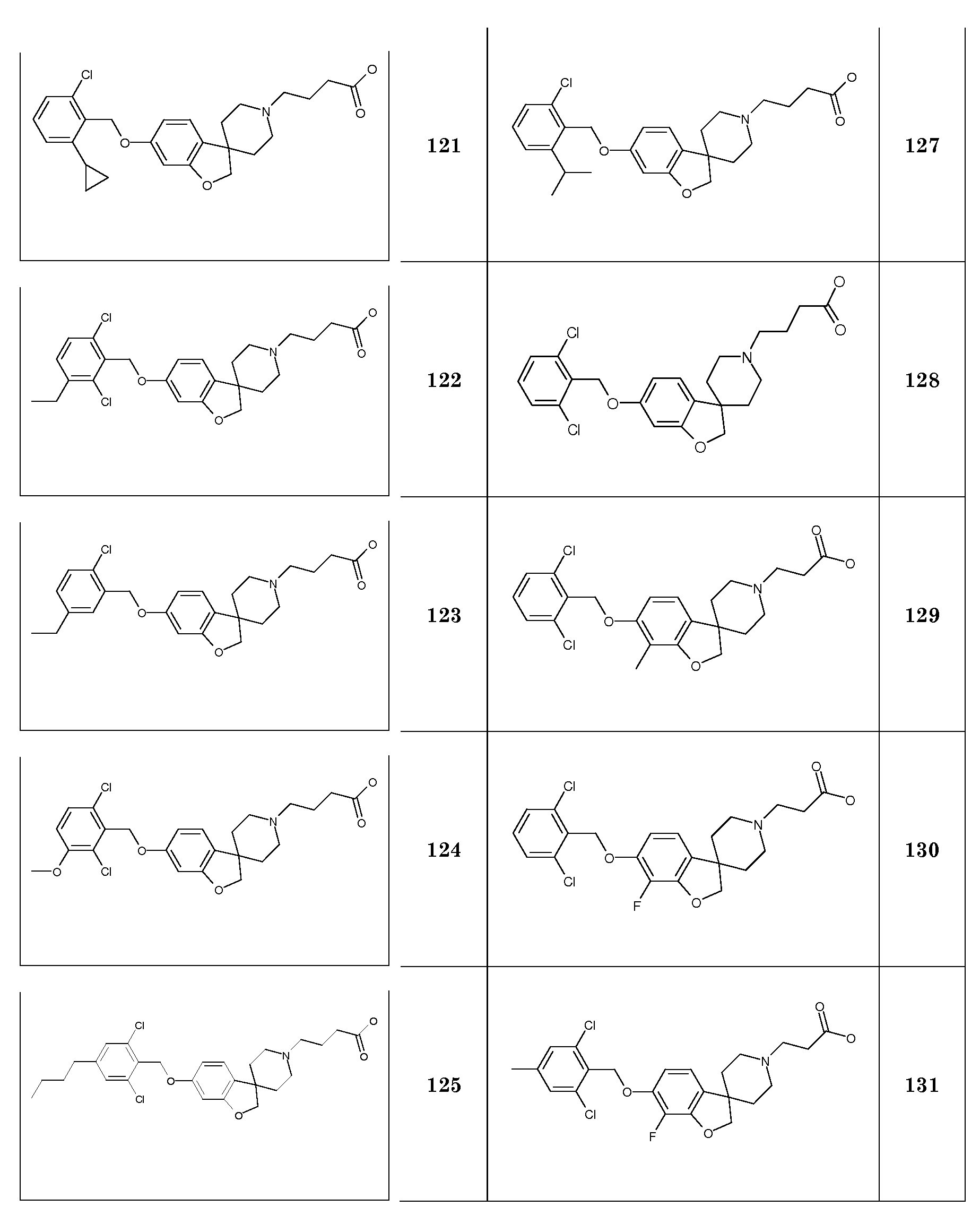
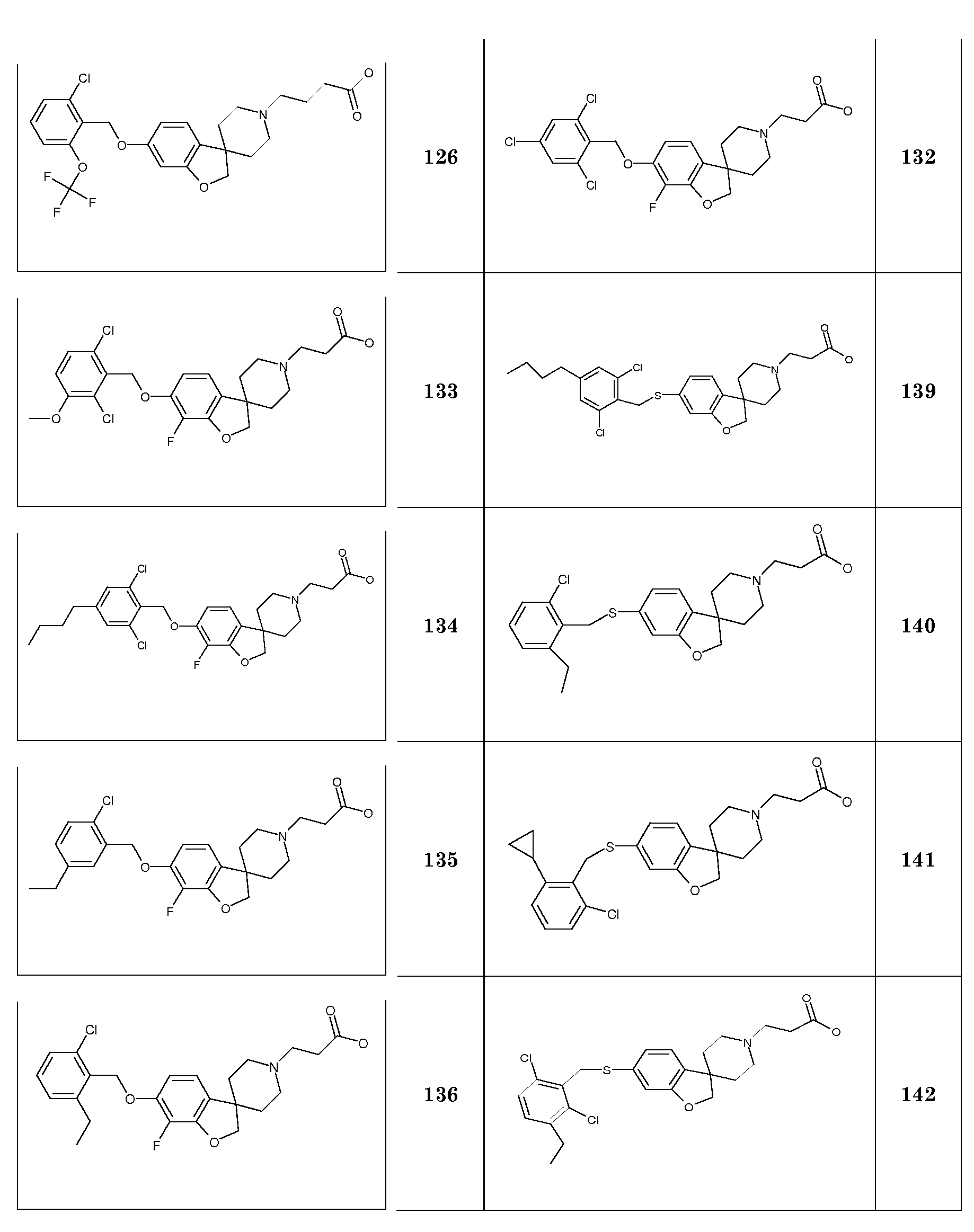
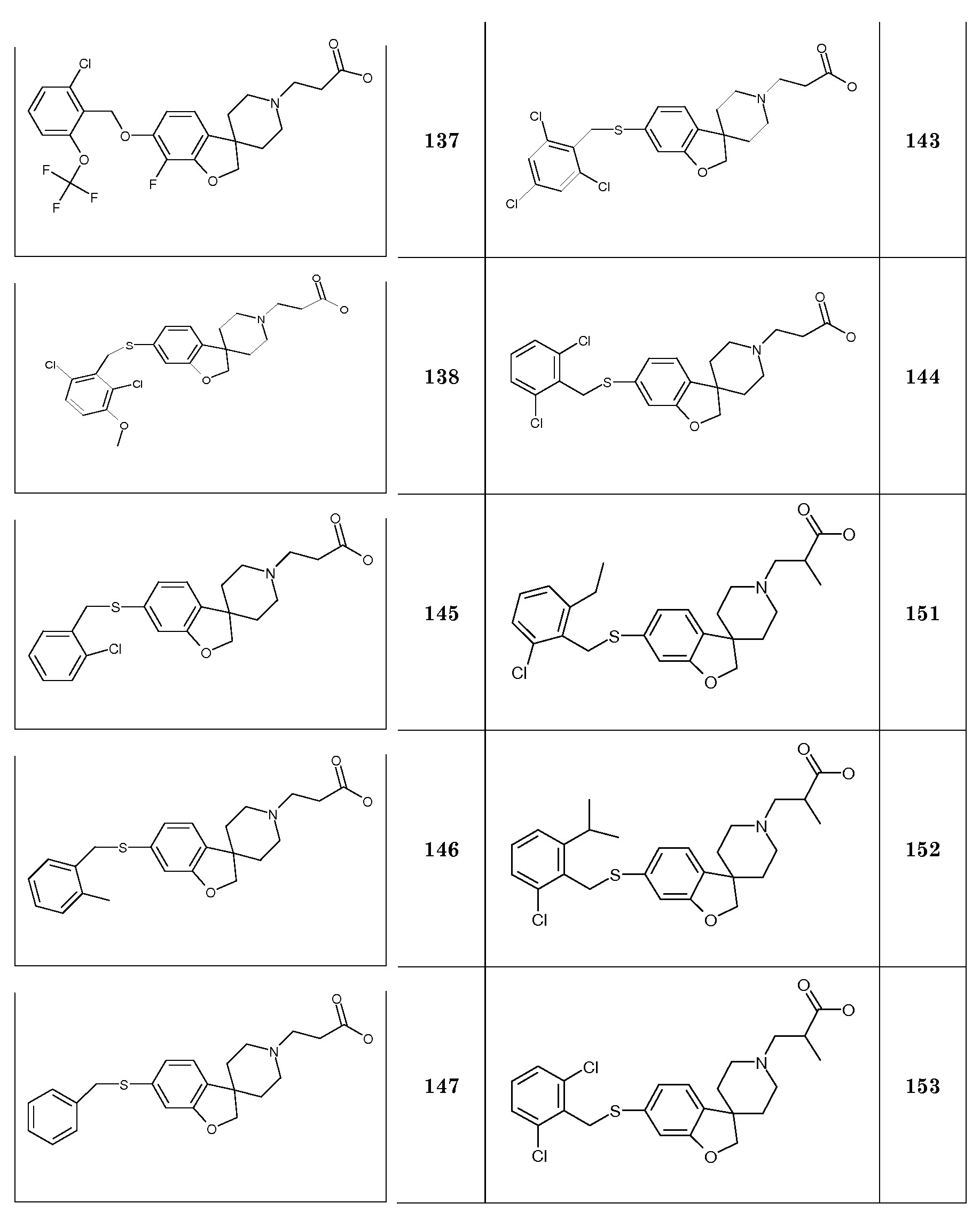
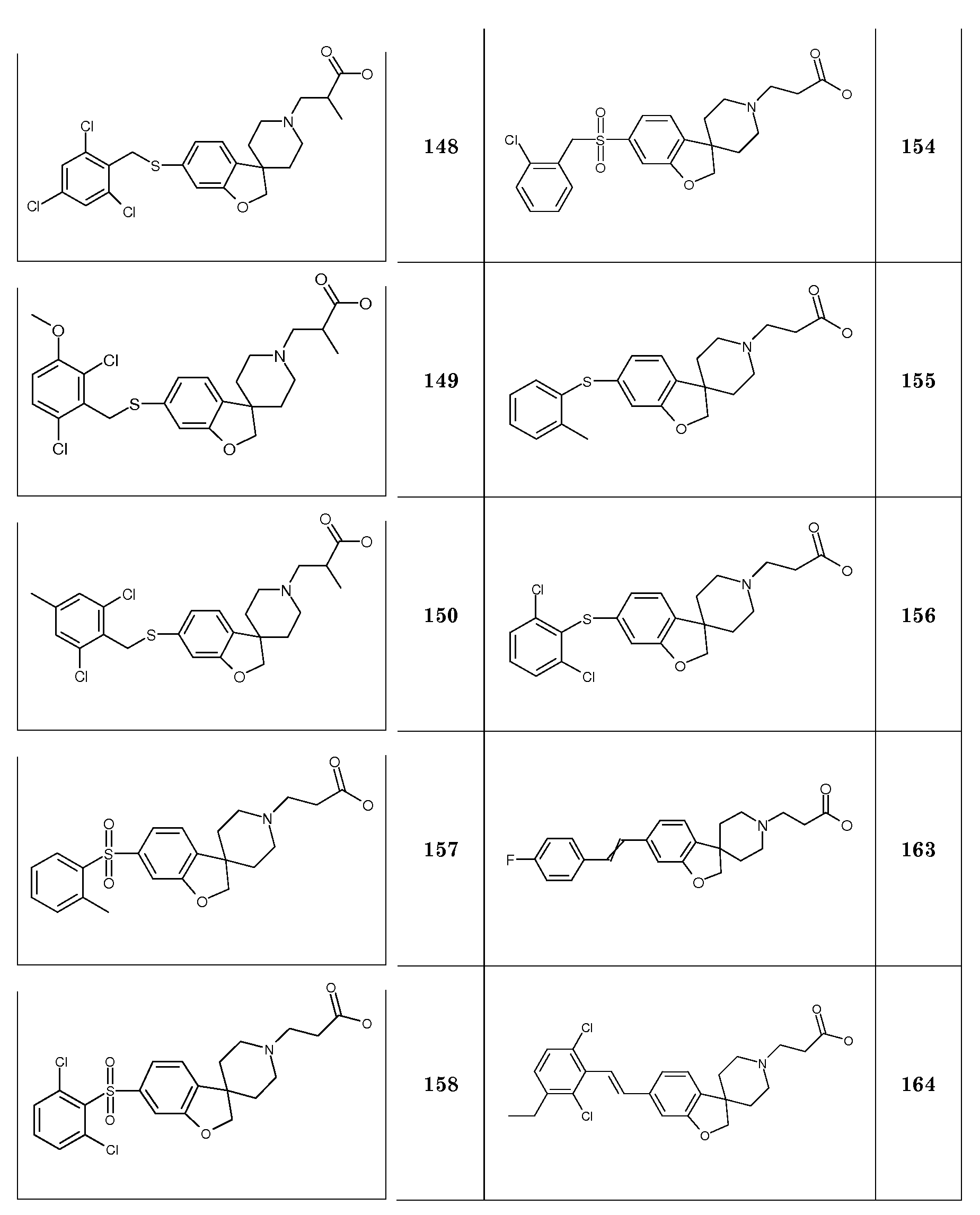
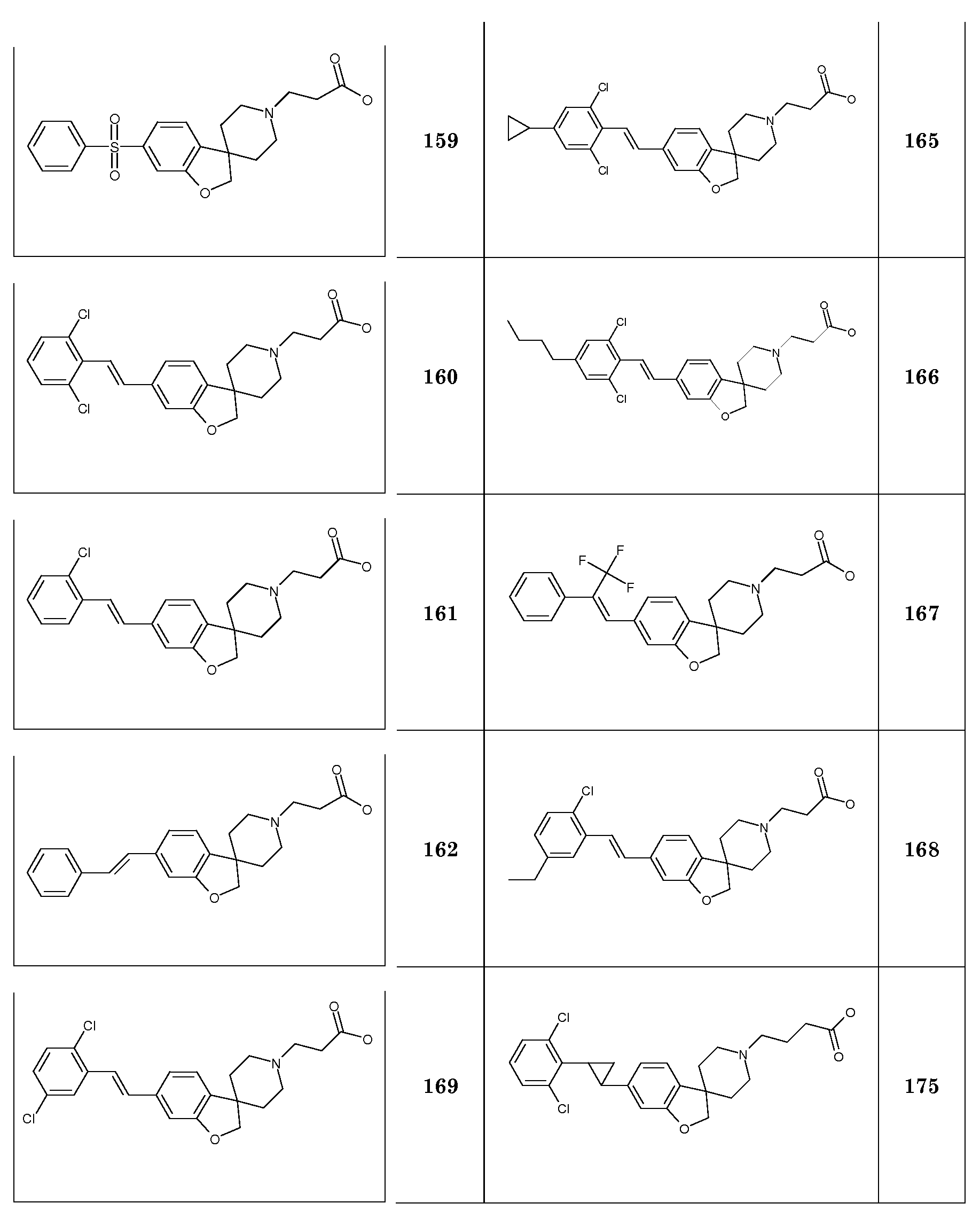
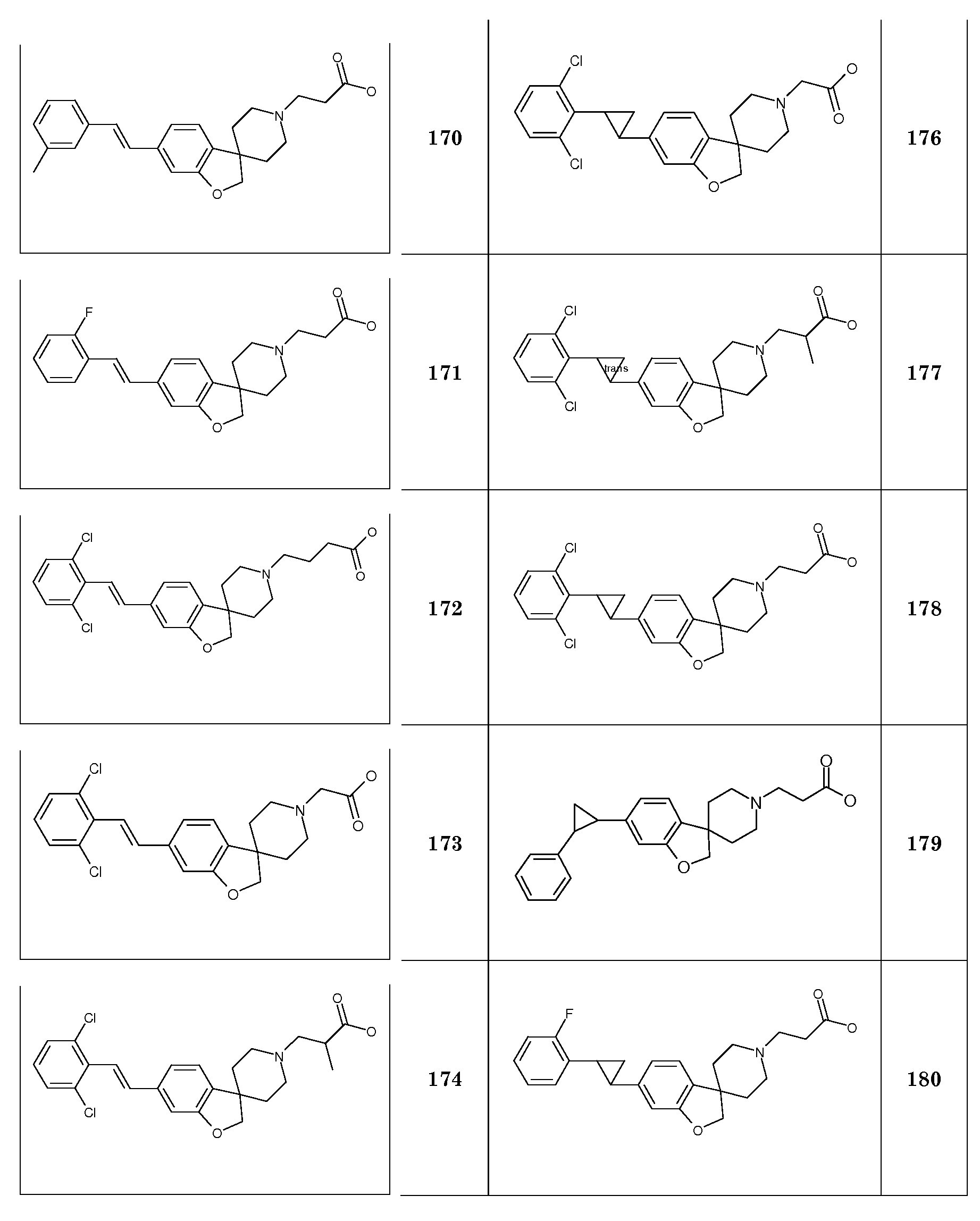
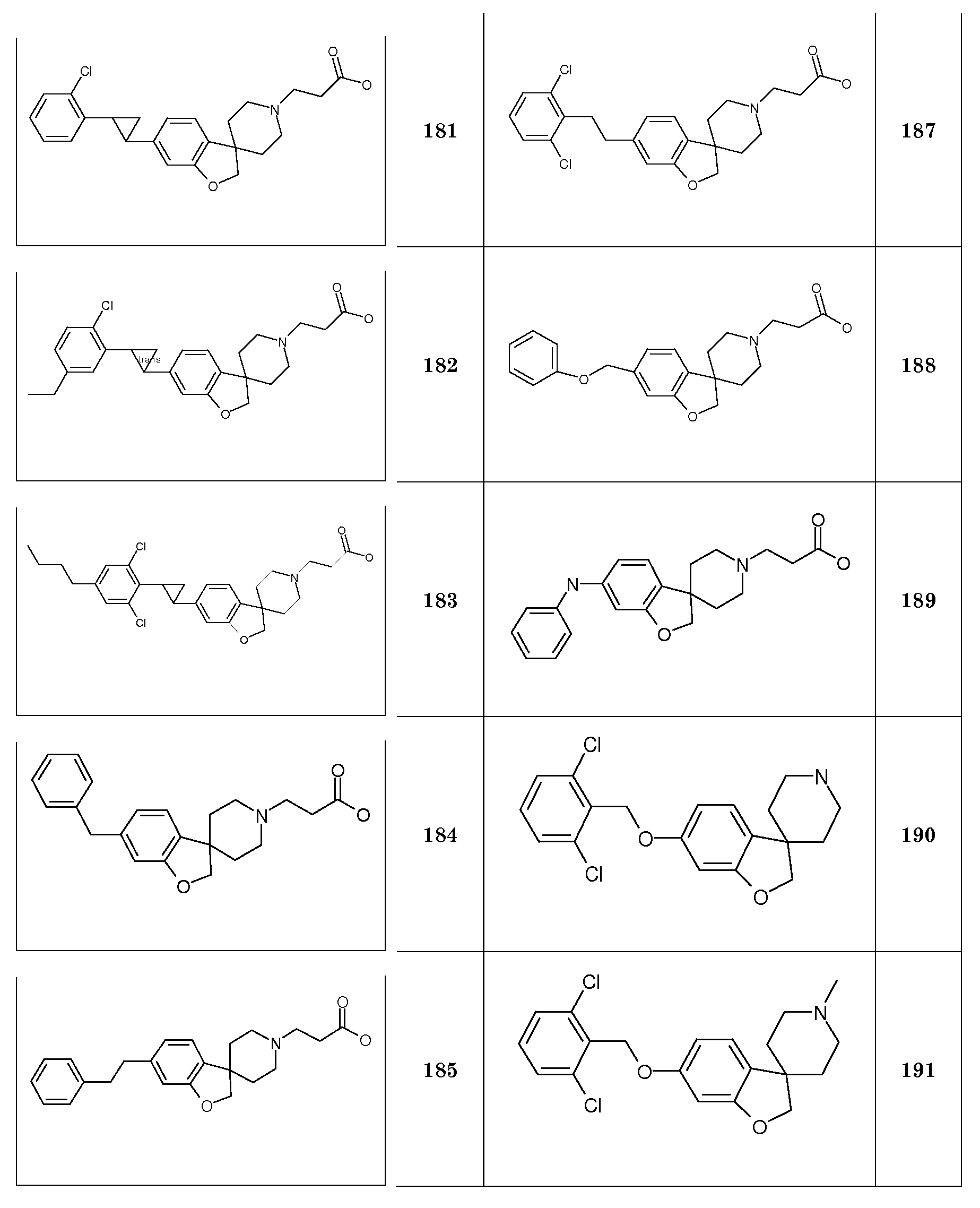
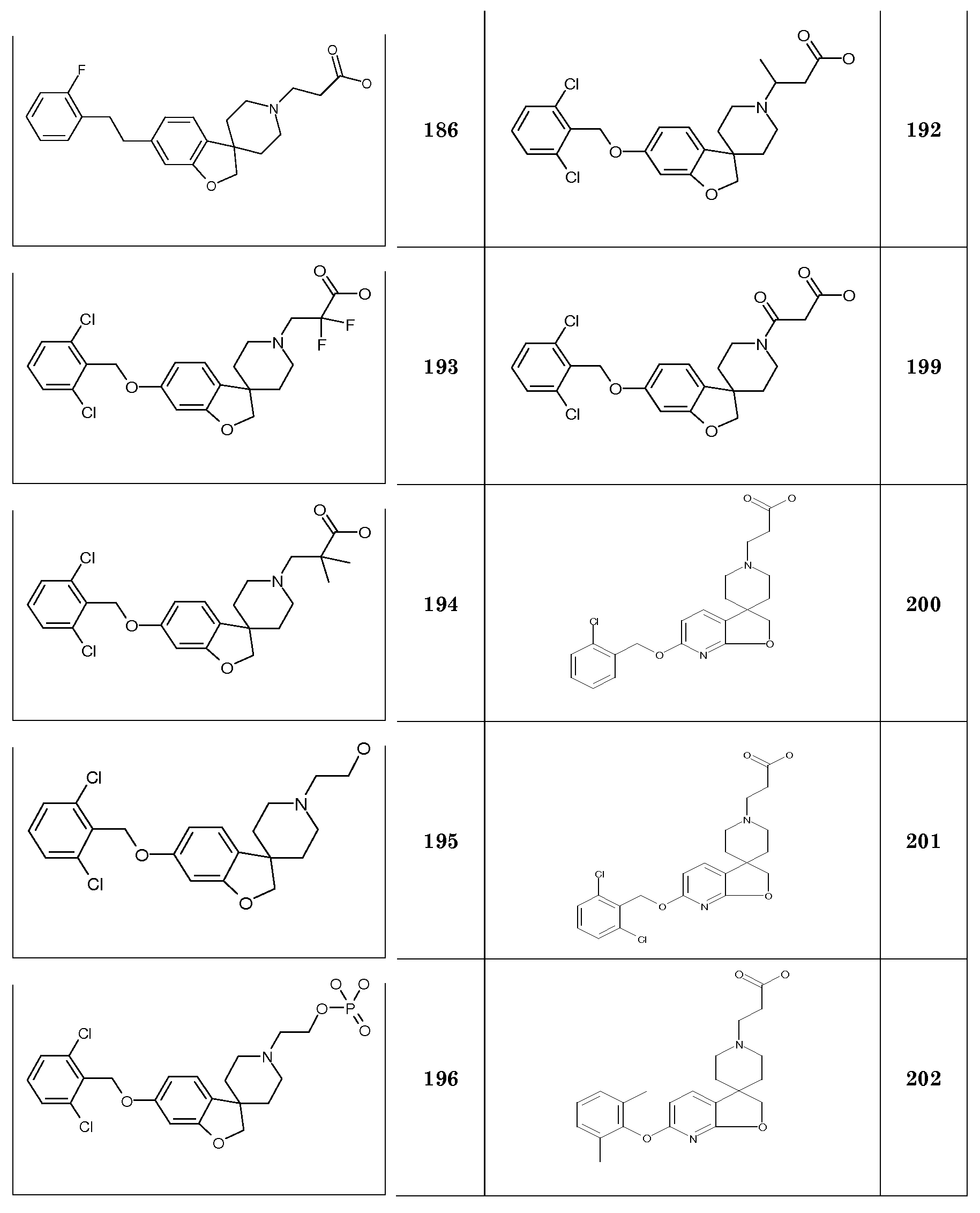
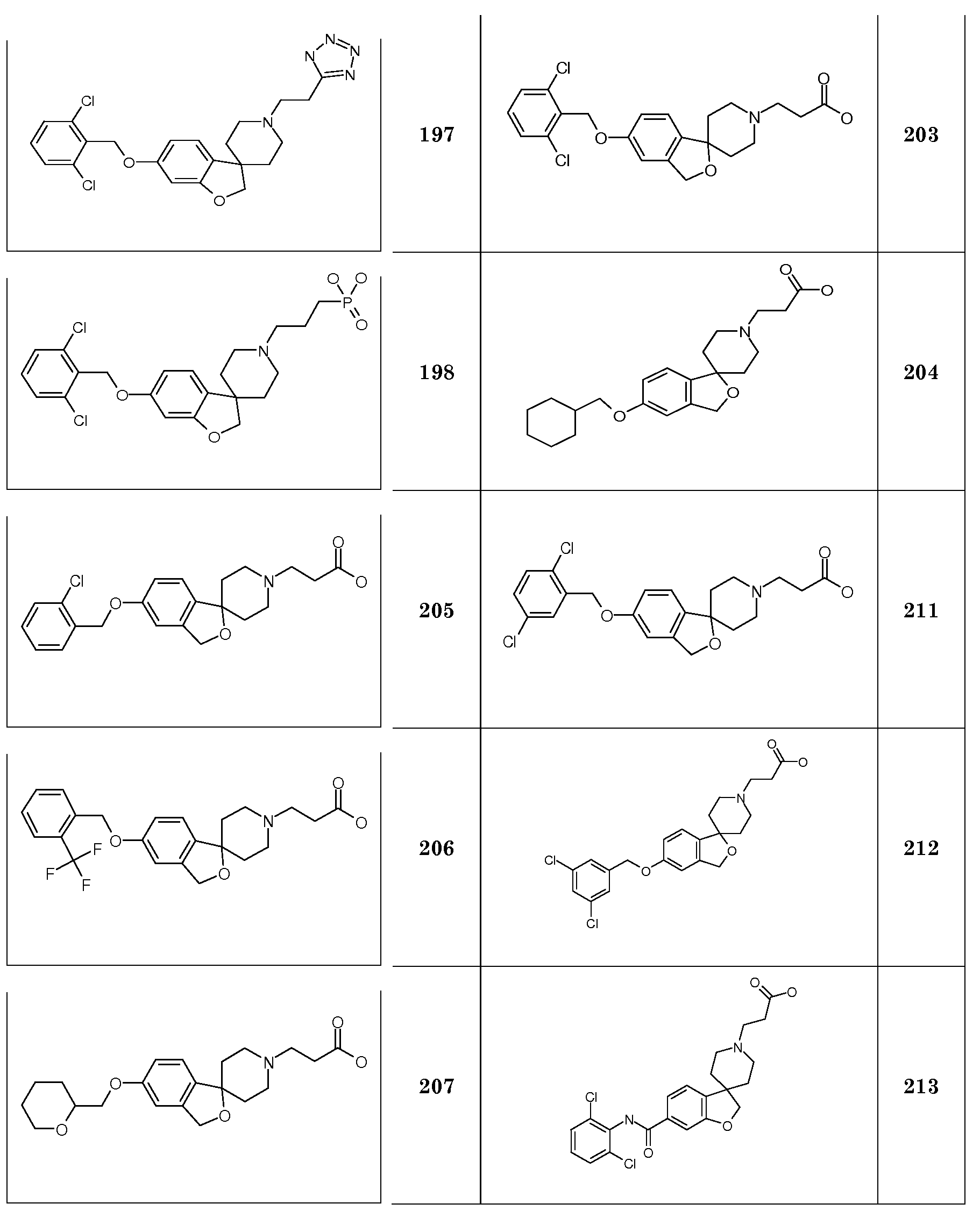
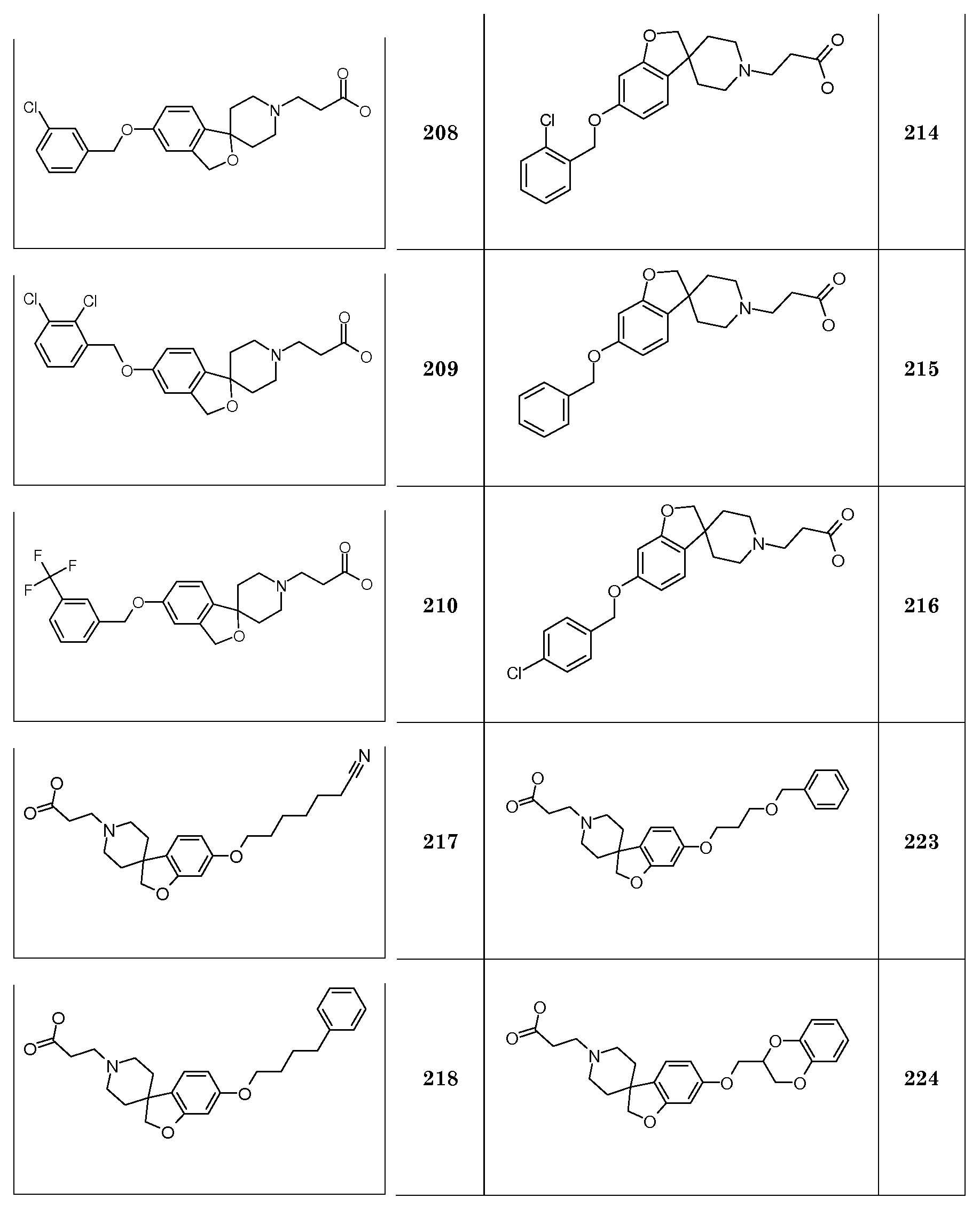
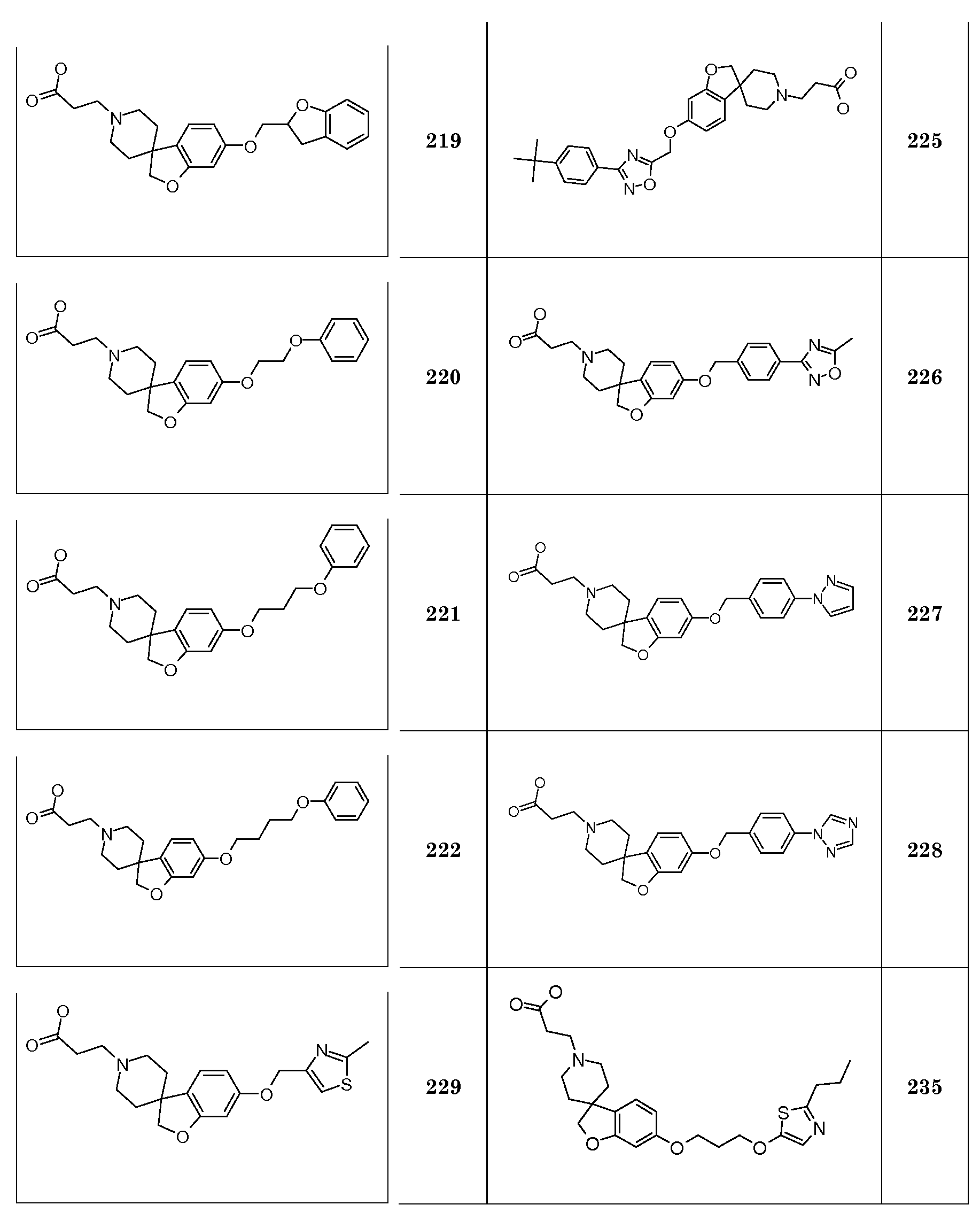
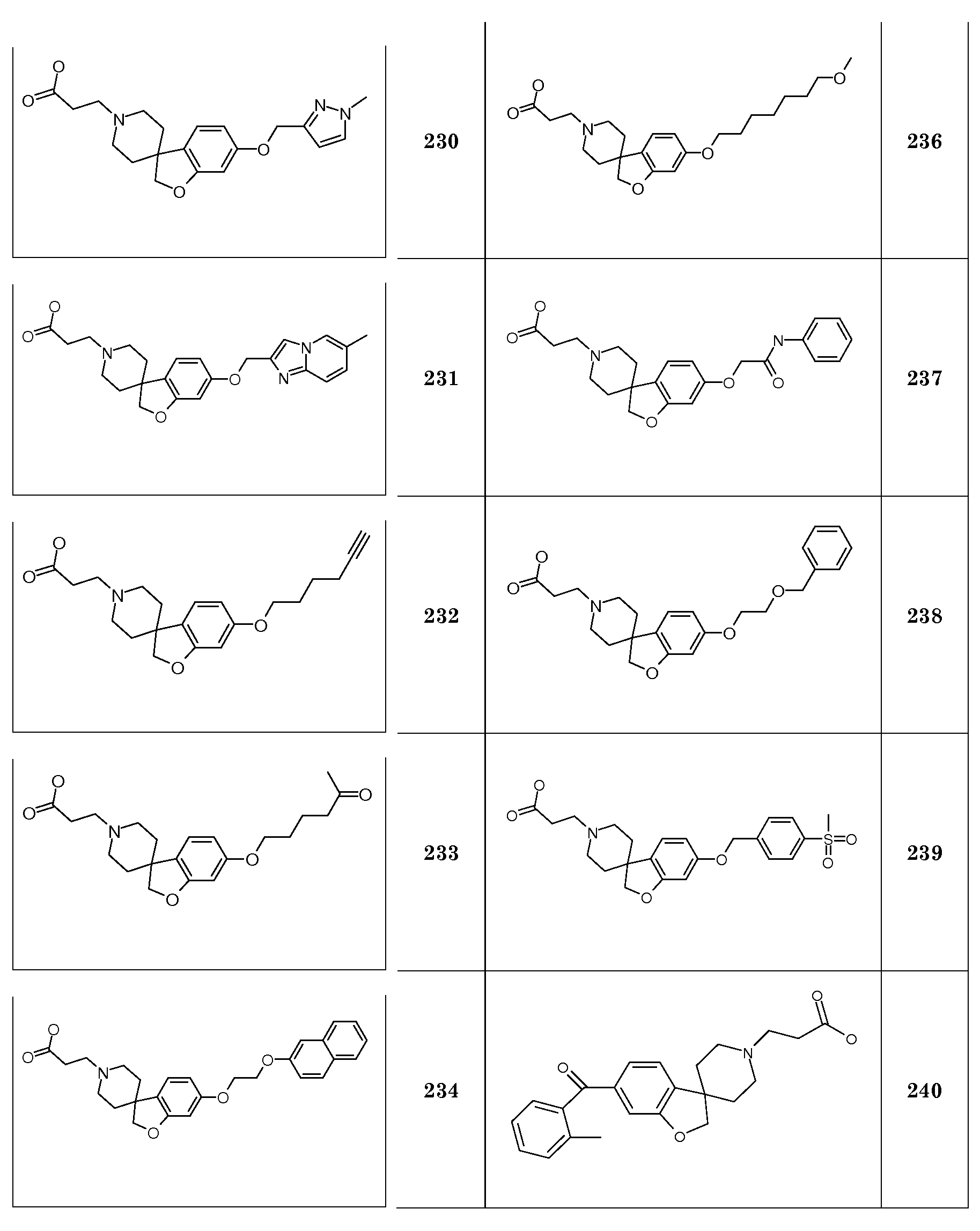
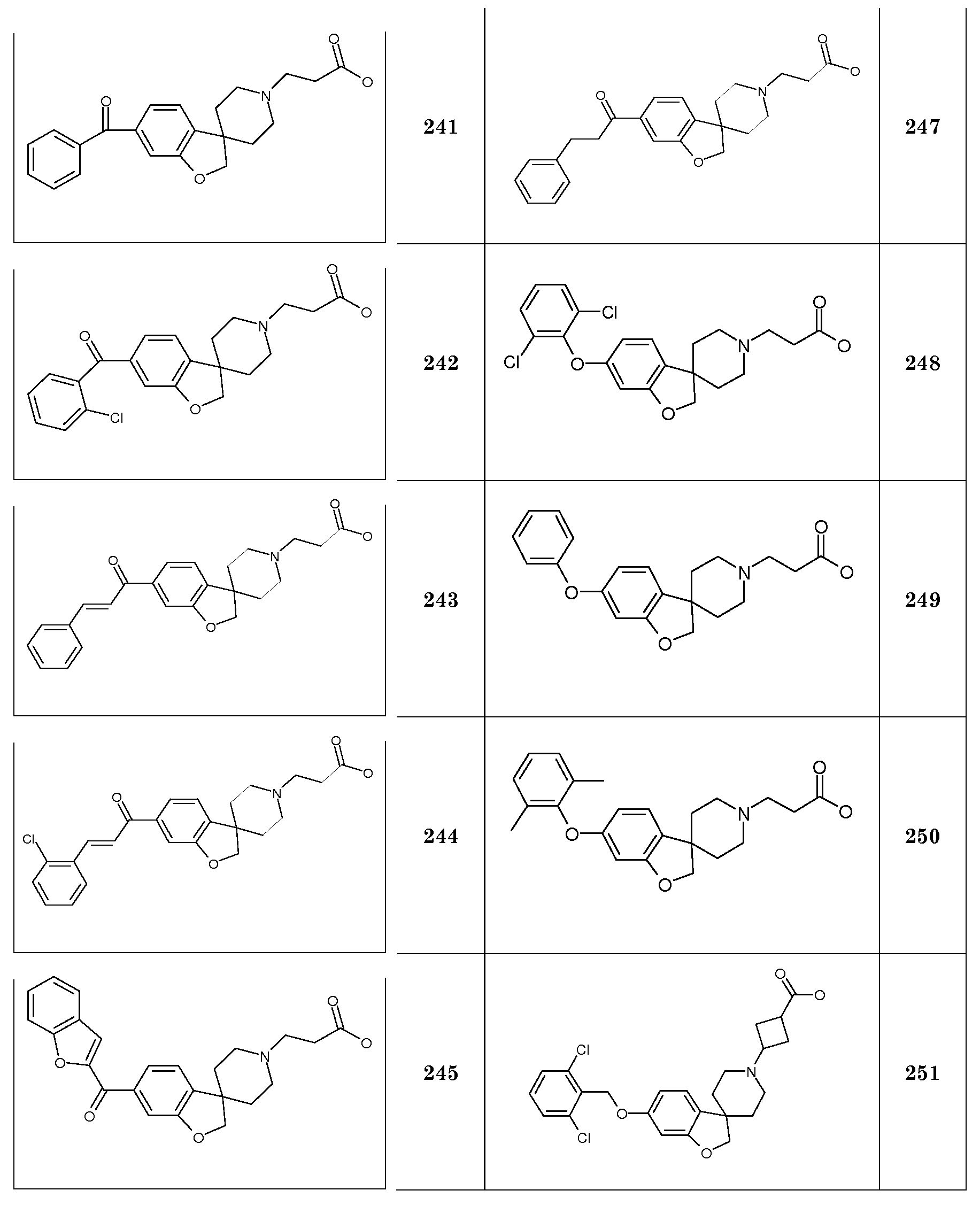
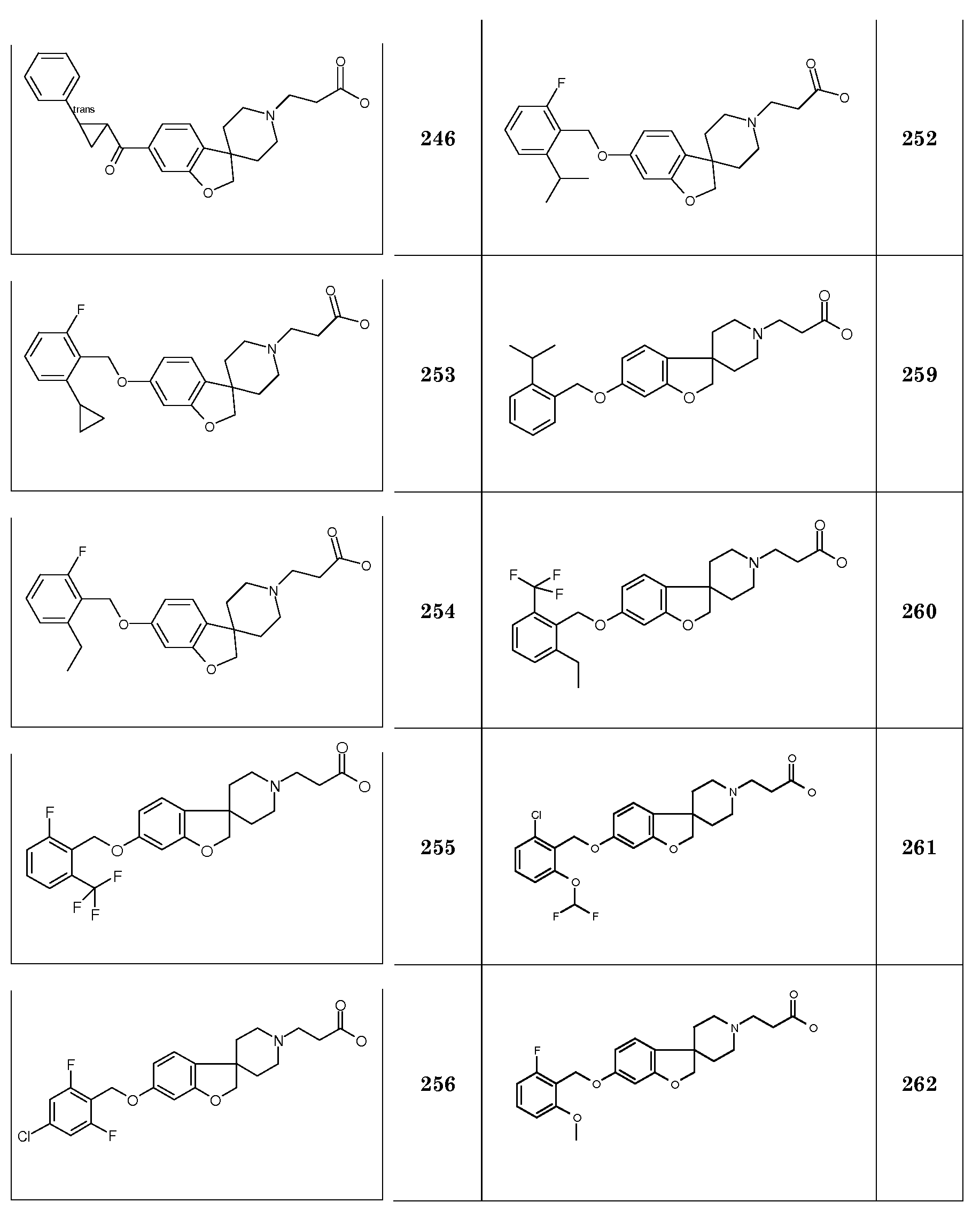
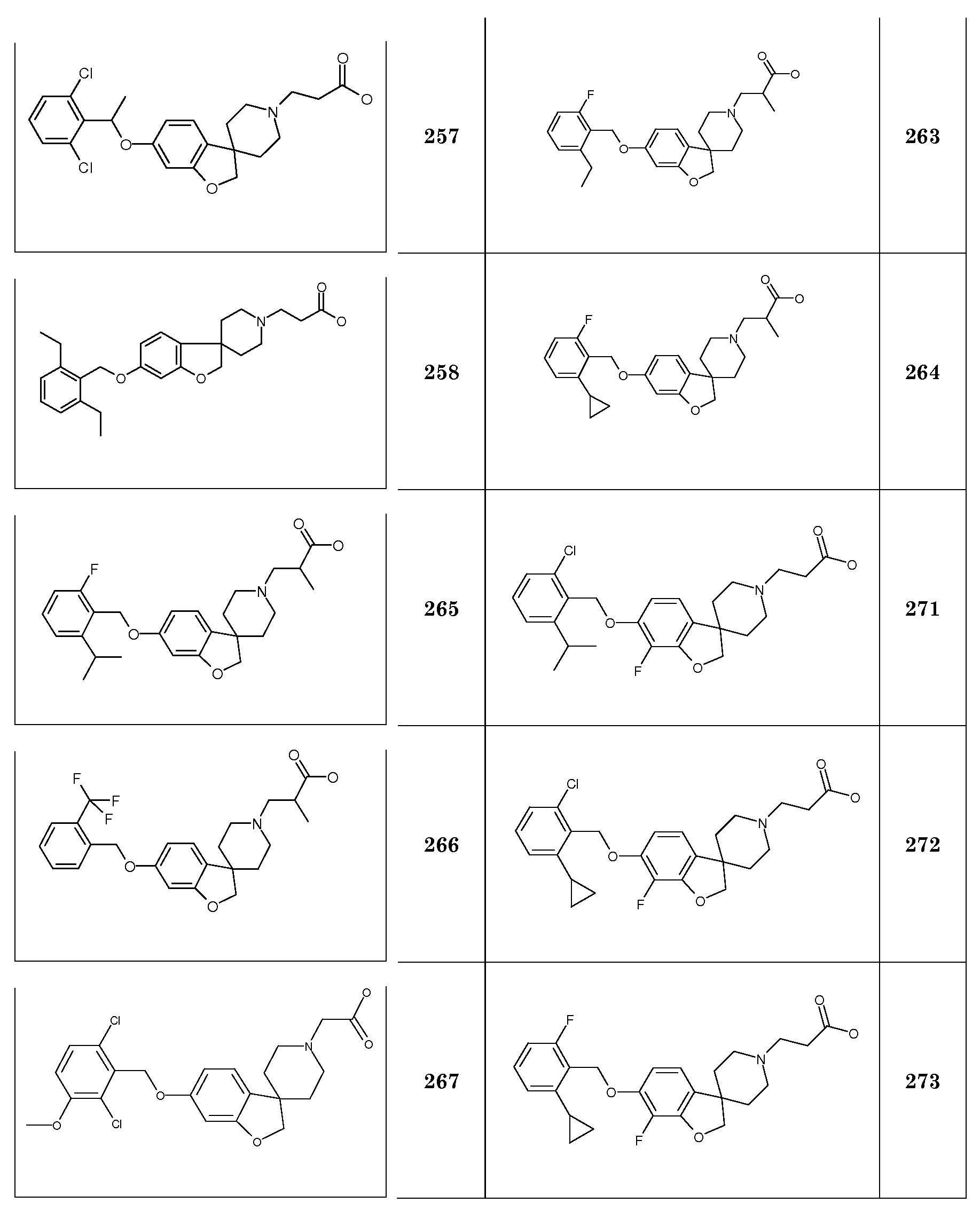
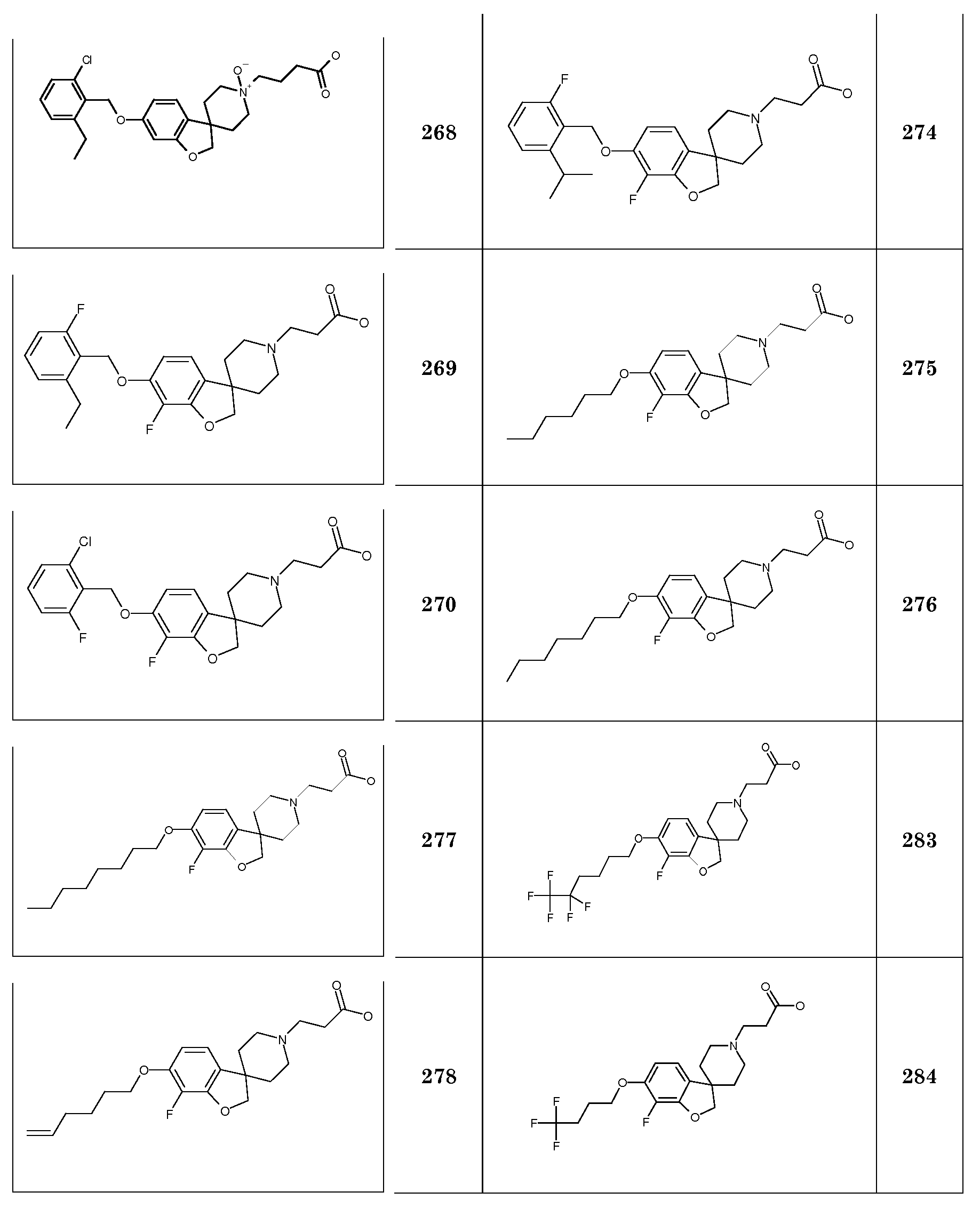
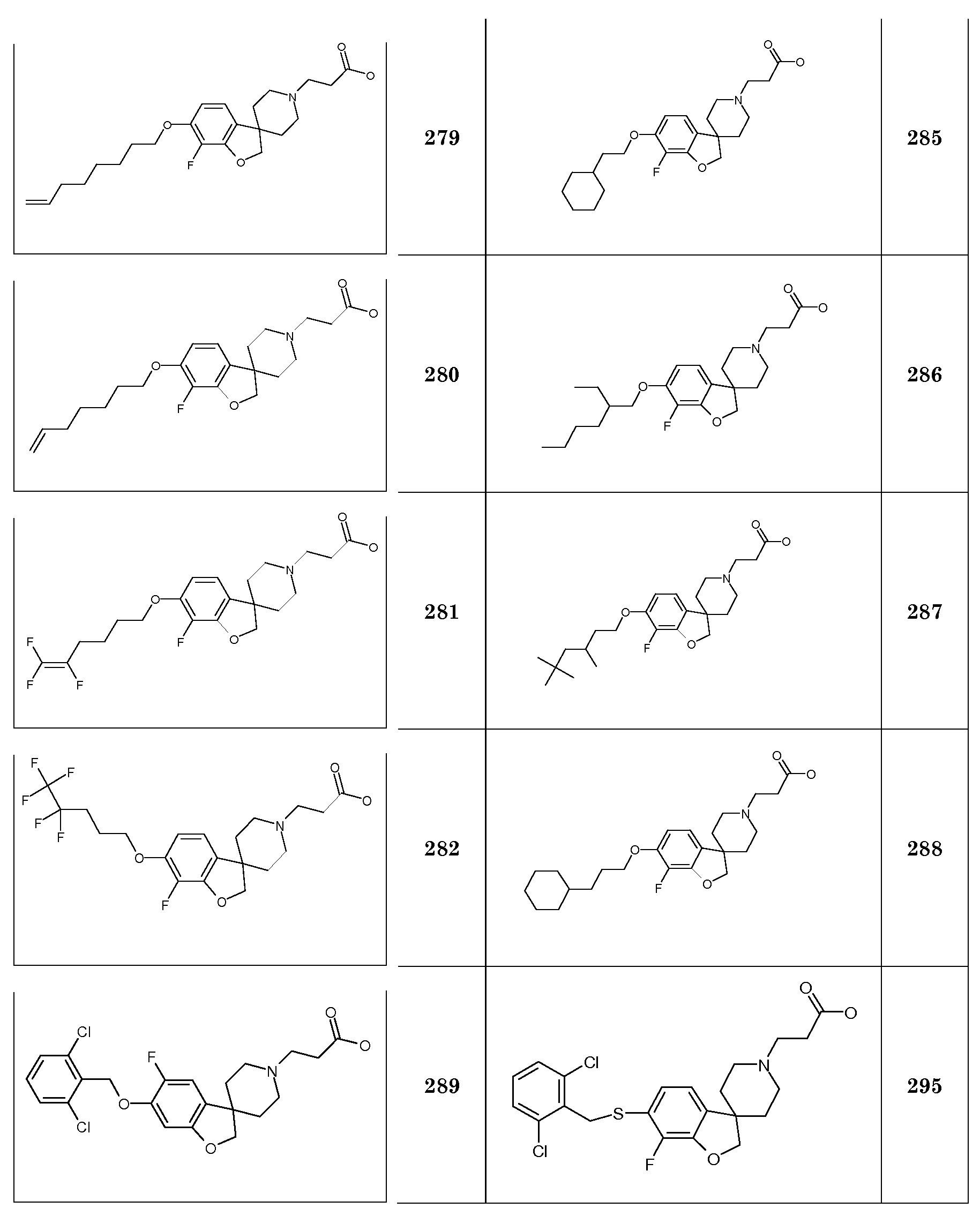
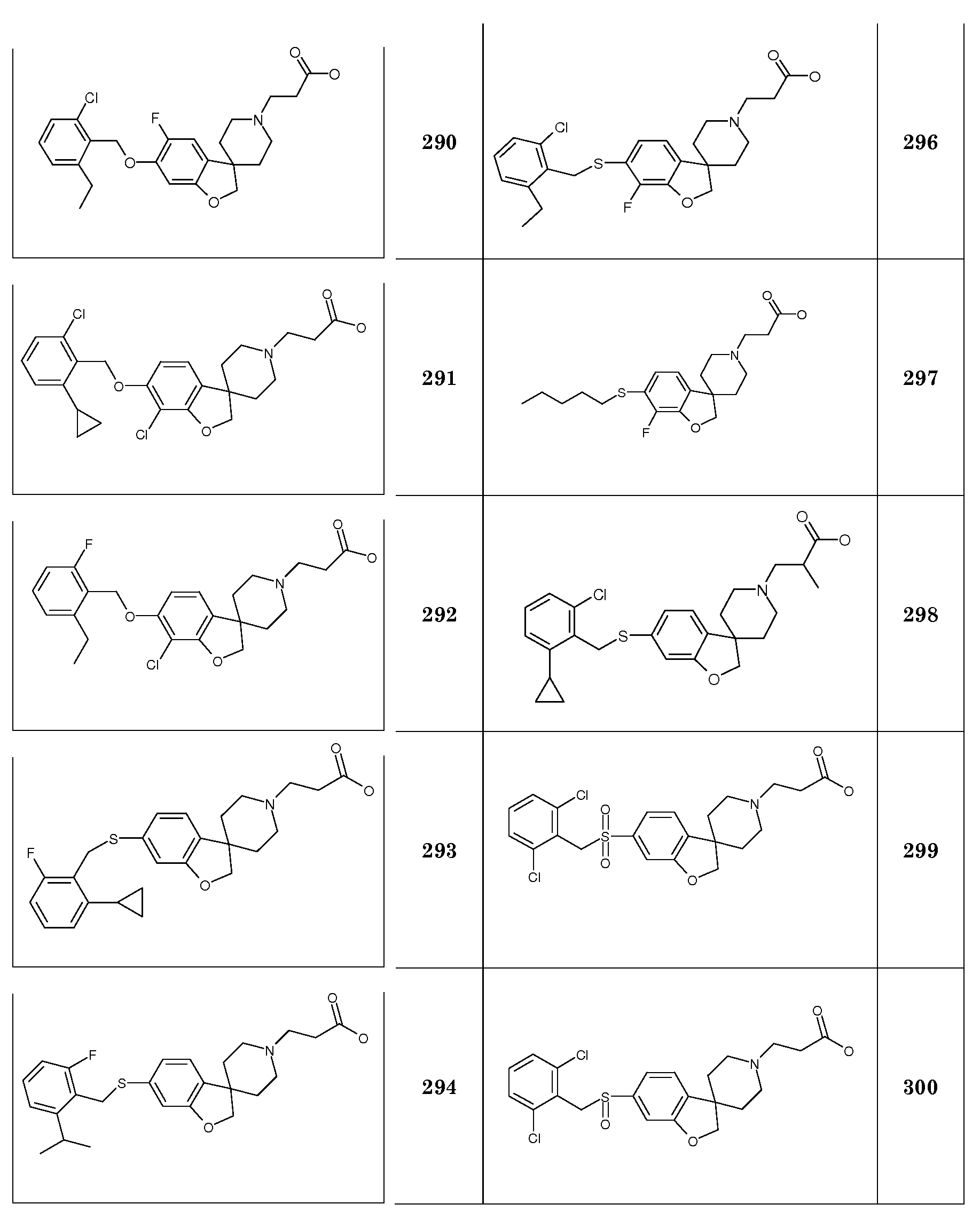
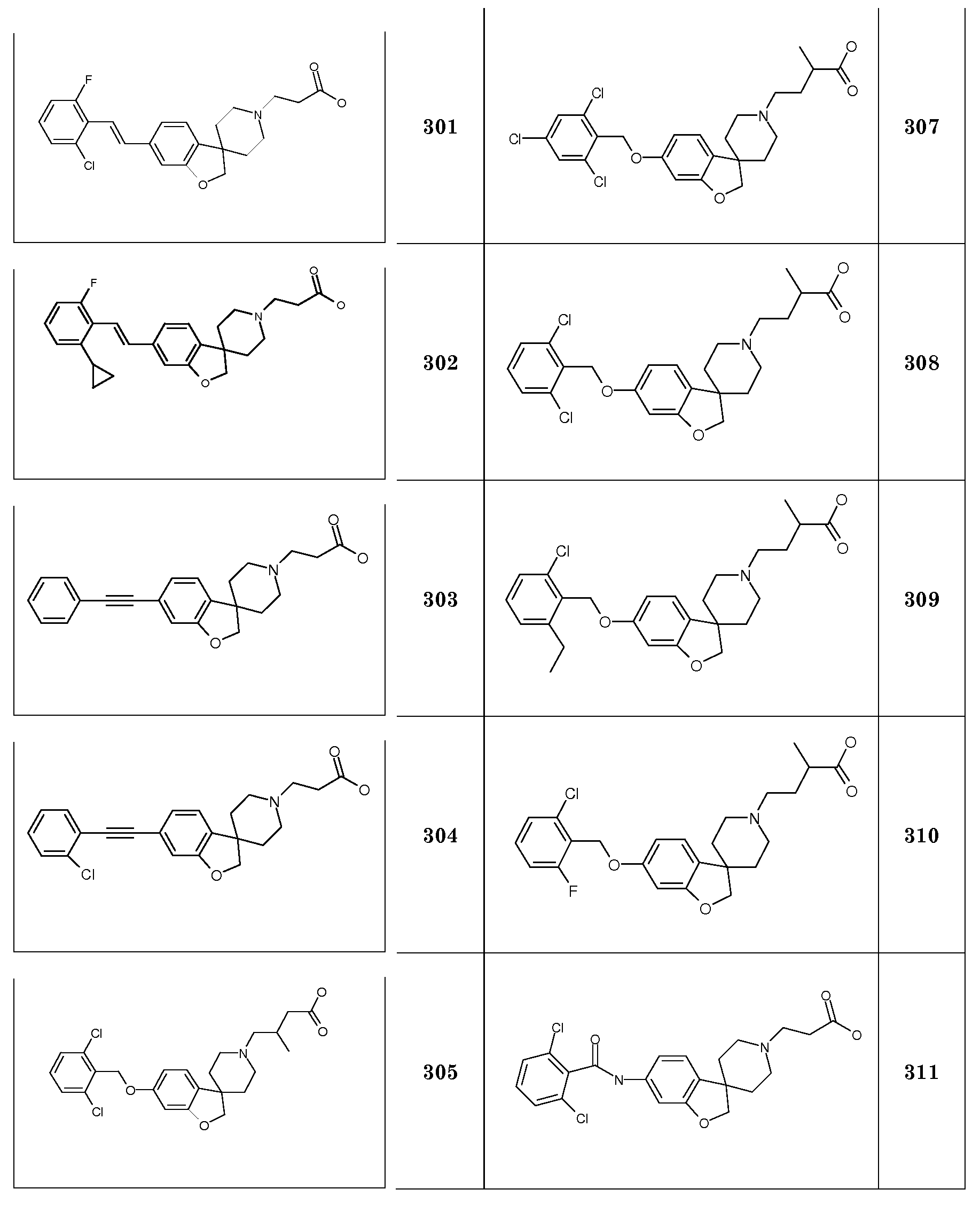
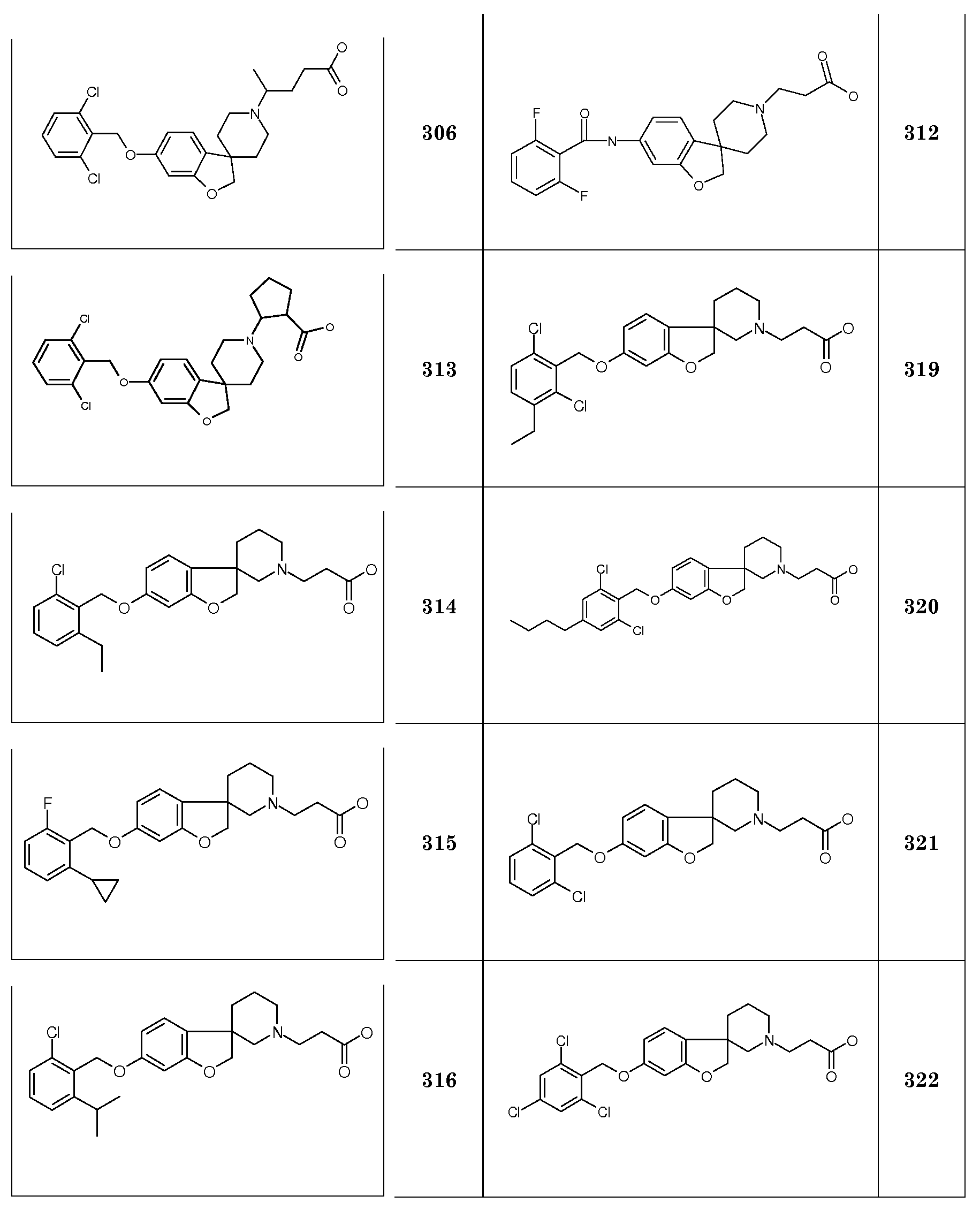
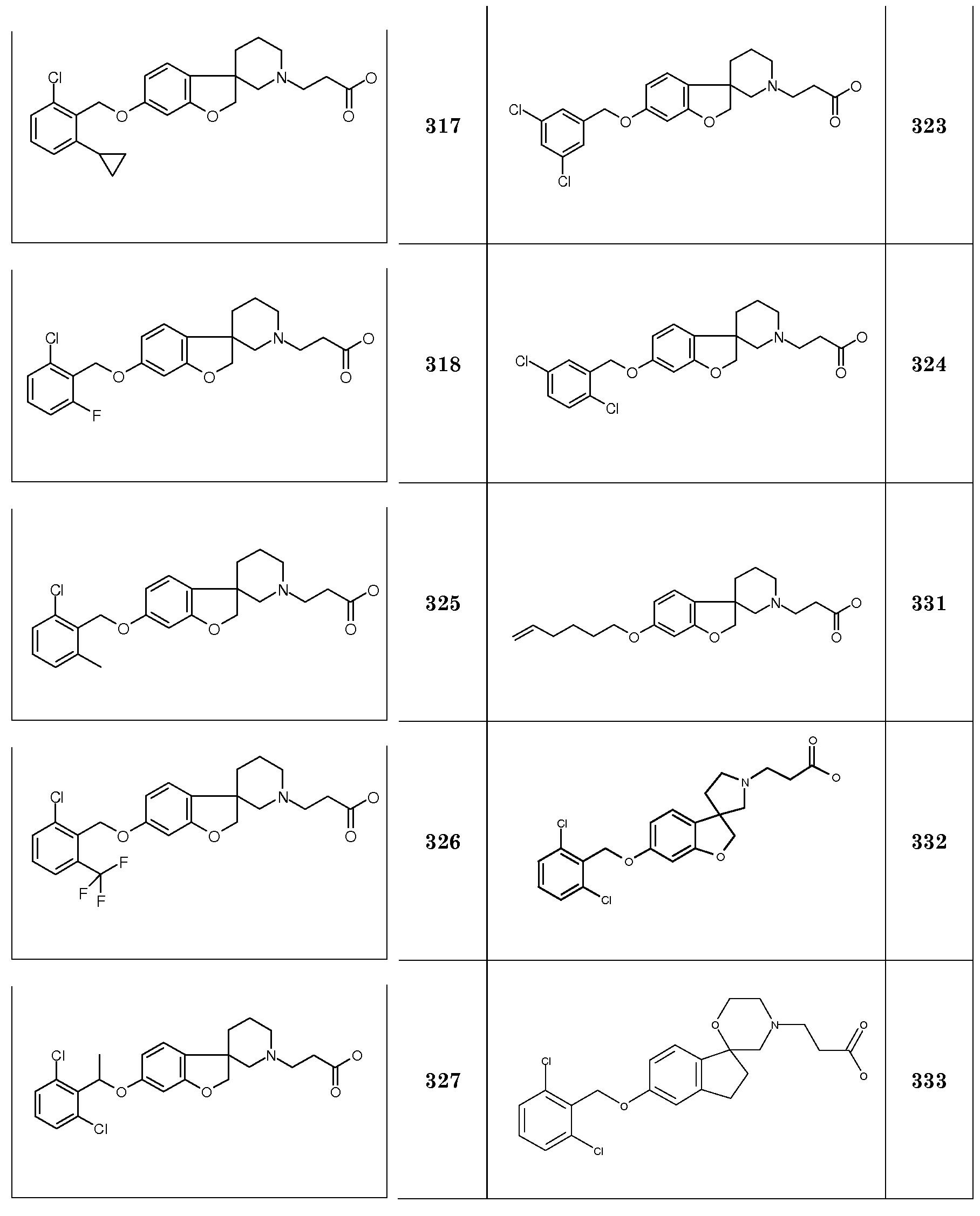
§5. ФАРМАКОЛОГИЧЕСКИЕ ИСПЫТАНИЯ И ДАННЫЕ
In vitro функциональная активность (агонизм) на человеческих S1P5 рецепторах
CHO-человеческий-S1P5-Aeqorin анализ закупали у компании Euroscreen, Брюссель (Euroscreen, технические документы, человеческий лизофосфолипидный S1P5 (Edg8) рецептор, ДНК клон и CHO AequoScreen™ рекомбинантная клеточная линия, каталожный №: ES-593-A, сентябрь 2006). Клетки, содержащие человеческий-S1P5-Aequorin, экспрессируют митохондриальный таргетируемый apo-Aequorin. Клетки необходимо нагрузить коелантеразином, чтобы восстановить активный Aequorin. После связывания агонистов с человеческим S1P5 рецептором концентрация внутриклеточного кальция повышается, и связывание кальция с комплексом apo-Aequorin/коелентеразин приводит к окислительной реакции коелентеразина, что в результате приводит к продукции apo-Aequorin, коелентерамида, CO2 и светового излучения (□max 469 нм). Этот люминесцентный ответ зависит от концентрации агониста. Люминесценцию измеряют с использованием MicroBeta Jet (Perkin Elmer). Агонистические эффекты соединений выражают как рЕС50. Соединения были испытаны по 10 точкам в пределах полулогарифмической концентрации, и осуществляли 3 независимых эксперимента с измерениями в отдельных точках.
In vitro функциональная активность (агонизм) на человеческих S1P3 рецепторах
CHO-человеческий-S1P3-Aeqorin анализ (CHO/Gα16/AEQ/h-S1P3) был учрежден компанией Solvay Pharmaceuticals. Плазмидную ДНК, кодирующую S1P3 рецептор (номер доступа в GenBank NM_005226), закупали в исследовательском центре UMR cDNA resource Centre (Rolla, MO). рсДНК3.1/hS1P3 конструкцию, содержащую митохондриально таргетируемый apo-Aeqorin и Gα16 белок, трансфицировали в клеточную линию CHO K1.
Клетки, содержащие человеческий-S1P3-Aequorin, экспрессируют митохондриальный таргетируемый apo-Aequorin. Клетки необходимо нагрузить коелантеразином, чтобы восстановить активный Aequorin. После связывания агонистов с человеческим S1P3 рецептором концентрация внутриклеточного кальция повышается, и связывания кальция с комплексом apo-Aequorin/коелентеразин приводит к окислительной реакции коелентеразина, что в результате приводит к продукции apo-Aequorin, коелентерамида, CO2 и светового излучения (λmax 469 нм). Этот люминесцентный ответ зависит от концентрации агониста. Люминесценцию измеряют с использованием MicroBeta Jet (Perkin Elmer). Агонистические эффекты соединений выражают как рЕС50. Соединения были испытаны по 10 точкам в пределах полулогарифмической концентрации, и осуществляли 3 независимых эксперимента с измерениями в отдельных точках.
In vitro функциональная активность (агонизм) на человеческих S1P1 рецепторах (метод A)
CHO-К1-человеческий-S1P1-Aeqorin анализ закупали у компании Euroscreenfast, Брюссель (Euroscreen, технические документы, человеческий S1P1 (Edg1) рецептор, ДНК клон и CHO-K1 AequoScreen™ рекомбинантная клеточная линия, каталожный №: FAST-0197L, февраль 2010). Клетки, содержащие человеческий-S1P1-Aequorin, экспрессируют митохондриальный таргетируемый apo-Aequorin. Клетки необходимо нагрузить коелантеразином, чтобы восстановить активный Aequorin. После связывания агонистов с человеческим S1P1 рецептором концентрация внутриклеточного кальция повышается, и связывания кальция с комплексом apo-Aequorin/коелентеразин приводит к окислительной реакции коелентеразина, что в результате приводит к продукции apo-Aequorin, коелентерамида, CO2 и светового излучения (λmax 469 нм). Этот люминесцентный ответ зависит от концентрации агониста. Люминесценцию измеряют с использованием MicroBeta Jet (Perkin Elmer). Агонистические эффекты соединений выражают как рЕС50. Соединения были испытаны по 10 точкам в пределах полулогарифмической концентрации, и осуществляли 2 независимых эксперимента с измерениями в отдельных точках.
In vitro функциональная активность (агонизм) на человеческих S1P1 рецепторах (метод B)
CHO-K1-человеческий-S1P1-C-AMP анализ осуществляли в Euroscreenfast, Брюссель (Euroscreen, человеческий S1P1 связывающийся Gi/0, (Edg1) рецептор, каталожный №: FAST-0197C, декабрь 2009).
Рекомбинантные CHO-K1 клетки, экспрессирующие человеческий S1P1, выращивали до середины логарифмического роста в культуральной среде без антибиотиков, отделяли, центрифугировали и ресуспендировали. Для испытания агониста клетки смешивали с соединением и Форсколином и инкубировали при комнатной температуре. Клетки лизировали и определяли концентрацию cAMP, в соответствии с указаниями изготовителя, с использованием HTRF набора от CIS-BIO International (каталожный № 62AM2PEB).
Агонистические эффекты соединений выражали как процент от активности сравнительного соединения при его ЕС50 концентрации. Рассчитывали значение EC50 и результаты представляли как pEC50. Соединения были испытаны по 10 точкам в пределах полулогарифмической концентрации с двумя повторами в 1 эксперименте.
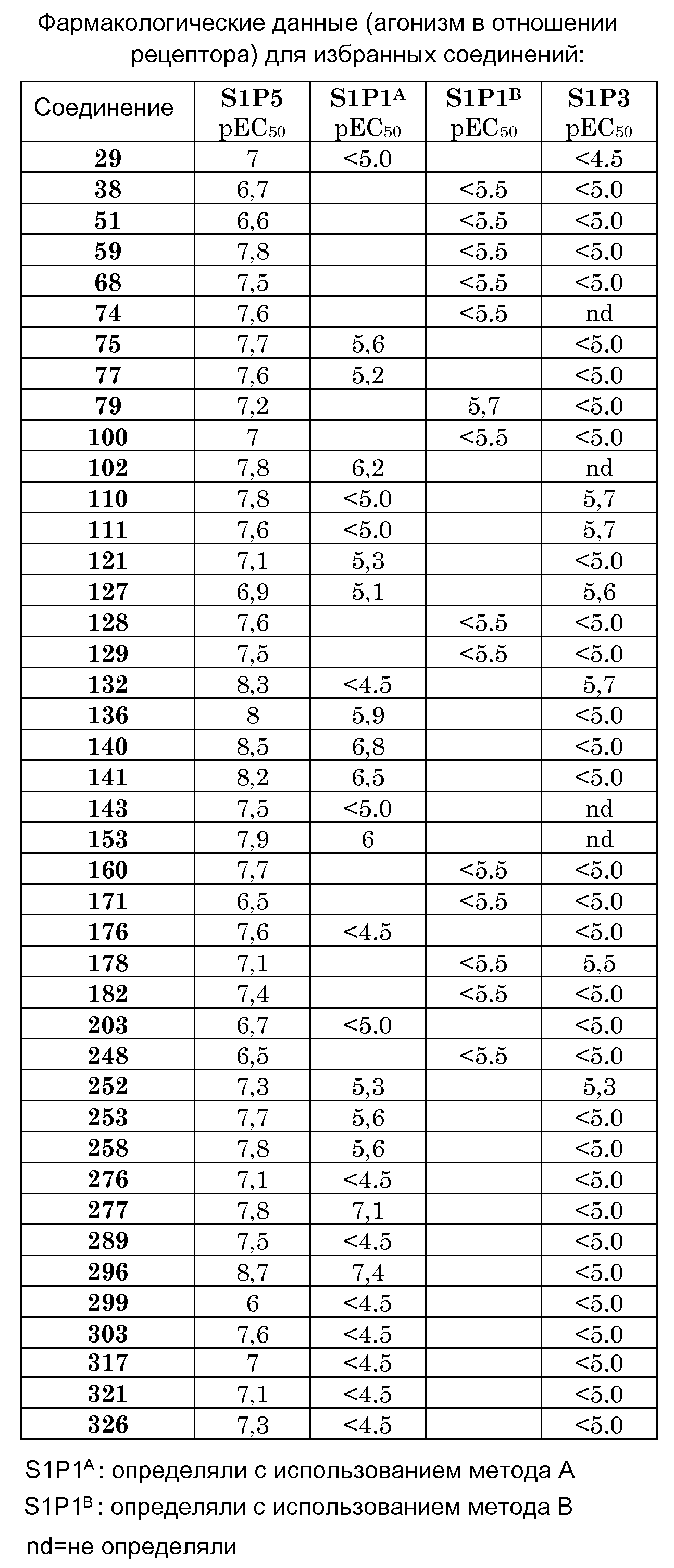
In vivo терапевтическая модель; Т-образный лабиринт
Связанное с возрастом нарушение памяти возникает у человека и грызунов. Спонтанное изменение является присущей грызунам тенденцией к чередующемуся свободному выбору в Т-образном лабиринте в серии последовательных испытаний. Эта последовательная процедура рассчитана на рабочую память и является чувствительной к различным фармакологическим манипуляциям, влияющим на процессы памяти (Aging and the physiology of spatial memory. Barnes C.A. Neurobiol. Aging 1988:563-8; Dember WN, Fowler H. Spontaneous alternation behavior. Psychol. Bull. 1958, 55(6):412-427; Gerlai R. new continuous alternation task in t-maze detects hippocampal dysfunction in mice. A strain comparison and lesion study. Behav Brain Res 1998 95(1):91-101).
Для этого испытания использовали самцов мышей C57BL/6J возраста 2 месяца или 12 месяцев с задачей спонтанного изменения направления в Т-образном лабиринте. Вкратце, для испытания мышей использовали 1 цикл, состоящий из 15 испытаний, которые включали 1 испытание "принудительного выбора", с последующими 14 испытаниями "свободного выбора". Животных рассматривали как попадающих в одно из ответвлений лабиринта, когда все четыре лапы находятся в этом ответвлении. Цикл испытаний завершали и животное извлекали из лабиринта сразу после осуществления 14 испытаний свободного выбора или по прошествии 15 минут, в зависимости от того, что завершалось первым. Процент изменений направления за 14 испытаний свободного выбора определяли для каждой мыши и использовали в качестве показателя действия рабочей памяти. Соединение по настоящему изобретению вводили перорально в течение 21 дня перед осуществлением анализа с использованием Т-образного лабиринта и в день осуществления анализа при t=-30 минут. Было обнаружено, что соединения по настоящему изобретению при дозах в пределах 0,01-15 мг/кг/день обеспечивали обратное развитие возрастного ухудшения познавательной способности у C57BL6J мышей возраста 12 месяцев вплоть до 100%. Таким образом, обработанные мыши возраста 12 месяцев были идентичны по поведению 2-месячным мышам, которых обрабатывали носителем. (см. фиг. 1)
Выводы: соединения по настоящему изобретению имеют положительный эффект на возрастное ухудшение познавательной способности.