Результат интеллектуальной деятельности: КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 5-ХЛОР-N2-(2-ИЗОПРОПОКСИ-5-МЕТИЛ-4-ПИПЕРИДИН-4-ИЛ-ФЕНИЛ)-N4-[2-(ПРОПАН-2-СУЛЬФОНИЛ)-ФЕНИЛ]-ПИРИМИДИН-2,4-ДИАМИНА
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к кристаллическим формам 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина, способам их получения, фармацевтическим композициям, содержащие их, и способам лечения с их применением.
УРОВЕНЬ ТЕХНИКИ
Полиформизм означает существование более чем одной кристаллической формы вещества. Данная способность химического вещества кристаллизоваться в более чем одну кристаллическую форму может иметь огромное влияние на срок хранения, растворимость, свойства состава и технологические свойства лекарства. Кроме того, действие лекарства может зависеть от полиморфизма молекулы лекарства. Разные полиморфы могут иметь разные скорости поглощения в организме, приводящие к более низкой или более высокой биологической активности, чем хотелось бы. В крайних случаях, нежелательный полиморф может даже демонстрировать токсичность. Появление неизвестной кристаллической формы в процессе производства может иметь значительное воздействие.
Понимание и управление полиформизмом, в таком случае, дает определенное преимущество в привлечении новых лекарств на рынок. Прежде всего, предсказание любых возможных полиморфов для лекарственного средства может быть использовано для уменьшения возможности загрязнения в процессе производства лекарства или хранения рядом с другими полиморфными формами. В некоторых случаях неспособность поймать загрязнение может иметь опасные для жизни последствия. Кристаллизация нежелательного полиморфа в процессе производства может означать недели или даже месяцы простоя производства, пока ученые найдут и исправят причину новой кристаллической формы или пройти через еще один цикл испытаний, чтобы получить одобрение для новой кристаллической формы.
Во-вторых, понимание, какие кристаллические формы лекарства возможны в некоторых случаях, позволяет исследователям максимизировать желаемые свойства соединения, такие как растворимость, свойства состава, технологические свойства и срок хранения. Понимание данных факторов в начале разработки нового лекарства может означать более активное, более стабильное или более дешевое промышленное лекарство.
Соединение 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамин, в форме свободного основания, формулы
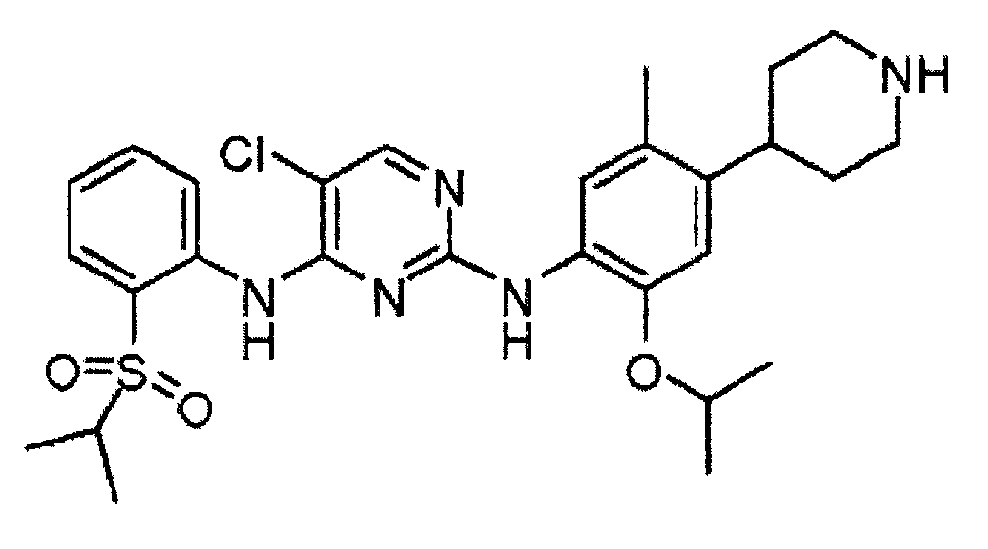
(I)
является ингибитором киназы анапластической лимфомы (ALK), членом инсулинового рецептора суперсемейства рецепторных тирозинкиназ. Соединение (I) было первоначально описано в WO 2008/073687 Al в качестве примера 7, соединение 66.
Однако, WO 2008/073687 Al, не предоставляет информации о кристаллических формах 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина или его соответствующих солей. Были раскрыты кристаллические формы 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина, которые являются полезными в лечение заболеваний, которые отвечают на ингибирование активности киназы анапластической лимфомы, очагово-адгезивной киназы (FAK), дзета-цепь-ассоциированной протеинкиназы 70 (ZAP-70), инсулин-подобного фактора роста (IGF-1R) или их комбинаций. Кристаллические формы проявляют новые физические свойства, которые могут быть использованы для того чтобы получить новые фармакологические свойства, и которые могут быть использованы в разработке лекарственного средства 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение предлагает по существу чистые кристаллические формы 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина.
Настоящее изобретение также предлагает фармацевтическую композицию, содержащую: (а) терапевтически эффективное количество по существу чистой кристаллической формы 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина; и (б) по меньшей мере один фармацевтически приемлемый носитель.
Настоящее изобретение также предлагает способ получения по существу чистой кристаллической формы 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина, который содержит этап взаимодействия 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина гидрохлорида в растворителе по меньшей мере с двумя эквивалентами водного гидроксида натрия.
Настоящее изобретение также предлагает способ получения по существу чистой кристаллической формы 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина, который содержит этап нагревания смеси двух кристаллических форм 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина в растворителе.
Настоящее изобретение также предлагает способ лечения расстройств, опосредованных киназой анапластической лимфомы, содержащий введение пациенту, нуждающемуся в таком лечении, эффективного количества по существу чистой кристаллической формы 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина.
Настоящее изобретение также предлагает применение по существу чистой кристаллической формы 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина для получения медикамента для лечения расстройств, опосредованных киназой анапластической лимфомы.
Настоящее изобретение также предлагает способ лечения расстройств, выбранных из доброкачественной или злокачественной опухоли; рака, выбранного из анапластической крупноклеточной лимфомы; не-ходжкинской лимфомы; воспалительной миофиброластичной опухоли; нейробластомы; саркомы; легких, немелкоклеточного рака легких; бронхов; простаты; молочной железы (включая случайный рак молочной железы и страдающих болезнью Каудена); поджелудочной железы, рака желудочно-кишечного тракта; толстой кишки; прямой кишки; карциномы толстой кишки; колоректальной аденомы; щитовидной железы; печени; внутрипеченочных желчных проток; гепатоцеллюлярного; надпочечника; желудка; желудочного; глиомы; глиобластомы; эндометрия; меланомы; почек; почечной лоханки; мочевого пузыря; тела матки; шейки матки; влагалища; яичника; множественной миеломы; пищевода; лейкемии; острого миелолейкоза; хронического миелолейкоза; лимфолейкоза; миелоидного лейкоза; мозга; карциномы мозга; полости рта и глотки, гортани; тонкой кишки; и меланомы, содержащий введение пациенту, нуждающемуся в таком лечении, эффективного количества кристаллической формы 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фиг.1 изображена порошковая рентгенограмма для кристаллической формы А 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина.
На Фиг.2 изображена дифференциальная сканирующая калориметрическая кривая для кристаллической формы А 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина.
На Фиг.3 изображена термогравиметрическая диаграмма для кристаллической формы А 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина.
На Фиг.4 изображена порошковая рентгенограмма для кристаллической формы В 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина.
На Фиг.5 изображена дифференциальная сканирующая калориметрическая кривая для кристаллической формы В 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина.
На Фиг.6 изображена термогравиметрическая диаграмма для кристаллической формы В 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Соединение 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина получено в индивидуальных кристаллических формах. Данные «кристаллическая(ие) форма(ы)» (или «кристаллическая(ие) модификация(и)» или «полиморфная(ые) форма(ы)» или «полиморф(ы)» в качестве терминов будут использоваться взаимозаменяемо) различаются по отношению к термодинамической стабильности, физическим параметрам, рентгеновской структуре и способам получения. Кроме того, «аморфный» относится к неупорядоченному твердому состоянию. Следует отметить, что разные образцы особой кристаллической формы будут иметь одни и те же основные пики порошковой рентгеновской дифракции (XRPD), но могут быть различия в порошковых образцах по отношению к незначительным пикам. Кроме того, термин «около» по отношению к максимальным значениям (в градусах) XRPD, как правило, означает в пределах 0,3°, более предпочтительно в пределах 0,2° и наиболее предпочтительно в пределах 0,1° от заданного значения. Альтернативно термин «около» означает (в данном и во всех контекстах) предел общепринятого стандарта ошибки среднего, при рассмотрении любым специалистом в данной области техники. В данном контексте термин «по существу чистый» означает, что более 80% одной кристаллической формы 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина или его соли присутствует или выделено, предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90% и наиболее предпочтительно по меньшей мере 95% одной из кристаллической форм, описанных здесь, присутствует.
В одном варианте осуществления выделена по существу чистая кристаллическая форма 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина, которую называют кристаллической формой А. Форма А свободного основания относительно не гигроскопична при 84%-ной относительной влажности (RH) и проявляет незначительное увеличение в поглощении влаги при 93% RH. Она имеет хорошую растворимость при рН 1, прекрасную растворимость в воде и хорошую растворимость в органических растворителях (11 мг/мл при РН 1, 0.21 мг/мл в воде и 40 мг/мл в метаноле соответственно). Она превращается в гидрохлоридную соль (нестехиометрически) в (0.1 N HCl) растворе при рН 1 в течение 72 часов. рН 1%-ной суспензии в воде составляет 6,86.
XRPD кристаллической формы А 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина проявляет дифракционные пики, имеющие максимумы при углах дифракции 7,2°, 8,1°, 10,8°, 12,0°, 12,4°, 13,4°, 14,4°, 14,8°, 15,7°, 16,9°, 17,7°, 18,5°, 19,0°, 19,5°, 20,0°, 20,3°, 21,1°, 21,6°, 22,4°, 22,6°, 23,0°, 24,1°, 24,5°, 25,5°, 26,0°, 26,2°, 27,0°, 27,3°, 28,3°, 29,0°, 29,1°, 30,6°, 31,3°, 32,8°, 33,5°, 34,2° и 36,4° (2θ градусов) как представлено образцом XRPD на Фиг.1.
Кристаллическая форма А 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина проявляет следующие термические параметры: температура плавления, Тп (начало) 174°C, как установлено дифференциальной сканирующей калориметрией при скорости сканирования 10°С/мин.(Фиг.2), точка разложения, Т>250°С и потеря веса при сушке равная 0,1% при 200°С, как установлено термогравиметрическим анализом и представлено на Фиг.3.
Инфракрасный спектр преобразования Фурье (FT-IR) кристаллической формы А 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина проявляет основные полосы (в единицах волновых чисел, см-1) при 3440,4, 3318,9, 2973,7, 2931,3, 2921,7, 1596,8, 1562,1, 1498,4, 1442,5, 1409,7, 1382,7, 1311,4, 1284,4, 1270,9, 1251,6, 1224,6, 1139,7, 1126,2, 1139,7, 1126,2, 1105,0, 1081,9, 1049,1, 1020,2, 1012,5, 952,7, 937,3, 894,8, 877,5, 860,1, 848,5, 817,7, 798,4, 781,0, 763,7, 756,0, 732,8, 686,6, 665,3, 644,1, 586,3 и 543,8.
В другом варианте осуществления, выделена по существу чистая кристаллическая форма 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина, которую называют кристаллической формой В.
XRPD кристаллической формы В 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина проявляет дифракционные пики, имеющие максимумы при углах дифракции 5,1°, 5,5°, 5,6°, 9,5°, 9,6°, 10,1°, 11,0°, 11,8°, 12,1°, 12,6°, 13,7°, 14,5°, 14,9°, 15,2°, 16,1°, 16,6°, 16,7°, 17,0°, 17,1°, 17,5°, 17,7°, 18,0°, 18,8°, 19,0°, 19,3°, 19,5°, 20,5°, 20,9°, 21,5°, 21,9°, 22,1°, 22,4°, 22,8°, 23,2°, 23,7°, 23,9°, 24,3°, 24,5°, 24,8°, 25,1°, 25,4°, 25,9°, 26,4°, 26,8°, 27,8°, 28,1°, 28,6°, 29,1°, 29,6°, 29,8°, 30,6°, 31,6°, 32,7°, 33,5°, 34,2°, 35,4°, 35,6° и 36,8° (2θ градусов) как представлено образцом XRPD на Фиг.4.
Кристаллическая форма В 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина проявляет следующие термические параметры: температура плавления, Тп (начало) 162°C, как установлено дифференциальной сканирующей калориметрией при скорости сканирования 10°С/мин.(Фиг.5), точка разложения, Т>250°С и потеря веса при сушке равная 0,05% при 200°С, как установлено термогравиметрическим анализом и представлено на Фиг.6.
Инфракрасный спектр преобразования Фурье (FT-IR) кристаллической формы В 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина проявляет основные полосы (волновые числа, см-1) при 3418,7, 3309,5, 3202,3, 2976,2, 2936,3, 2806,9, 2731,8, 1683,9, 1652,8, 1598,4, 1568,9, 1507,0, 1483,5, 1447,1, 1411,0, 1314,9, 1288,1, 1261,1, 1220,8, 1195,7, 1170,8, 1140,1, 1124,6, 1083,2, 1053,3, 1010,1, 947,1, 874,5, 776,0, 758,7, 734,5, 706,5, 678,5, 652,1, 586,3, 544,7, 519,1, 472,6 и 456,8.
В примерном варианте осуществления настоящее изобретение предлагает способ получения по существу чистых кристаллических форм 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина. Кристаллические формы получены из растворителя или смешанных растворителей, содержащих хороший растворитель, в котором соединение легко растворимо и плохой растворитель, в котором оно более труднорастворимо, может быть также применен при условии, что кристаллизация из смеси возможна, используя выбранную смесь растворителей. Примеры хороших растворителей включают метанол, этанол и изопропанол, муравьиную кислоту, уксусную кислоту, этилацетат, тетрагидрофуран и ацетон. Примером плохого растворителя является, например, вода.
В одном варианте осуществления кристаллическая форма А 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина получена взаимодействием 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамин гидрохлорида в водном ацетоне с по меньшей мере двумя эквивалентами водного гидроксида натрия. Отношение ацетон:вода успешно примененное в соответствии с изобретением составляет от 1:1 до 5:1 и 1:1 до 1:5 (объем/объем, об./об.), включая 1:1 и 3:1.Температура реакции составляет от 20°С до 70°C, включая 55°С.
В одном варианте осуществления кристаллическая форма А 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина содержит менее 1% по массе общих примесей. В другом варианте осуществления полиморфная форма А содержит менее 0,5% по массе общих примесей. В еще одном варианте осуществления полиморфная форма А содержит менее 0,1% по массе общих примесей.
В другом варианте осуществления кристаллическая форма В 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина приготовлена взаимодействием 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина с водной хлороводородной кислотой и последующим добавлением гидроксида натрия. Температура реакции составляет от 20°С до 70°C.
В другом варианте осуществления кристаллическая форма В 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина превращена в кристаллическую форму А 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина добавлением небольшого количества кристаллической формы А (1% по массе или менее, называемое затравкой) к суспензии или раствору формы В 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина в водном ацетоне. Температура, успешно примененная для затравки, составляет 20-40°С.
В данном контексте термин «затравка», может быть использован как существительное для описания одного или более кристаллов кристаллического соединения формулой (I). Термин «внеси затравку» также может быть использован как глагол для описания акта введения упомянутых одного или более кристаллов кристаллического соединения формулой (I) в окружающую среду (включая, но, не ограничиваясь ими, например, раствор, смесь, суспензию или дисперсию) что приводит к образованию большего количества кристаллов кристаллического соединения формулой (I).
В другом варианте осуществления кристаллическая форма В 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина превращена в кристаллическую форму А 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина нагреванием суспензии или раствора, содержащего кристаллическую форму В 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина в водном ацетоне. Смешанные растворители, успешно примененные, включают, например, ацетон/вода и этанол/вода. В предпочтительном варианте осуществления отношение ацетон:вода, успешно примененное, составляет от 1:1 до 5:1 (объем/объем, об./об.), включая 1:1 и 3:1. Температура реакции составляет от 30°С до 70°C, включая 50°С.
В примерном варианте осуществления предложена фармацевтическая композиция, содержащая: (а) терапевтически эффективное количество по существу чистой кристаллической формы 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина; и (b) по меньшей мере один фармацевтически приемлемый носитель. В предпочтительном варианте осуществления фармацевтическая композиция содержит: (а) терапевтически эффективное количество по существу чистой кристаллической формы А 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина; и (b) по меньшей мере один фармацевтически приемлемый носитель.
По меньшей мере, один фармацевтически приемлемый носитель существует в виде разбавителя, носителя средства или наполнителя и может быть легко выбран любым специалистом обычной квалификации в данной области техники и будет определен от желаемого способа введения. Иллюстративные примеры подходящих способов введения включают оральный, назальный, парентеральный, местный, трансдермальный и ректальный. Фармацевтические композиции по данному изобретению могут принимать любую фармацевтическую форму, признанную специалистом в данной области как подходящую. Подходящие фармацевтические формы включают твердые, полутвердые, жидкие или лиофилизированные составы, такие как таблетки, порошки, капсулы, суппозитории, суспензии, липосомы и аэрозоли.
В примерном варианте осуществления предлагается использование по существу чистой кристаллической формы 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина для получения лекарственного средства для лечения расстройств, опосредованных киназой анапластической лимфомы. В предпочтительном варианте осуществления медикамент содержит: (а) терапевтически эффективное количество по существу чистой кристаллической формы А 5-хлор-N2-(2-изопропокси-5-метил-4-пиперидин-4-ил-фенил)-N4-[2-(пропан-2-сульфонил)-фенил]-пиримидин-2,4-диамина. Медикамент полезен при лечении заболеваний, которые отвечают на ингибирование активности киназы анапластической лимфомы, очагово-адгезивной киназы (FAK), дзета-цепь-ассоциированной протеинкиназы 70 (ZAP-70), инсулин-подобного фактора роста (IGF-1R) или их комбинаций. Заболевания выбраны из доброкачественной или злокачественной опухоли; рака, выбранного из анапластической крупноклеточной лимфомы; не-ходжкинской лимфомы; воспалительной миофиброластичной опухоли; нейробластомы; саркомы; легких, немелкоклеточного рака легких; бронхов; простаты; молочной железы (включая случайный рак молочной железы и страдающих болезнью Каудена); поджелудочной железы, рака желудочно-кишечного тракта; толстой кишки; прямой кишки; карциномы толстой кишки; колоректальной аденомы; щитовидной железы; печени; внутрипеченочных желчных проток; гепатоцеллюлярного; надпочечника; желудка; желудочного; глиомы; глиобластомы; эндометрия; меланомы; почек; почечной лоханки; мочевого пузыря; тела матки; шейки матки; влагалища; яичника; множественной миеломы; пищевода; лейкемии; острого миелолейкоза; хронического миелолейкоза; лимфолейкоза; миелоидного лейкоза; мозга; карциномы мозга; полости рта и глотки, гортани; тонкой кишки; и меланомы. «Терапевтически эффективное количество» означает количество кристаллической формы, которое при введении субъекту, нуждающемуся в этом, является достаточным для осуществления лечения болезненных состояний, облегченных ингибированием активности протеин-киназы. Количество данного соединения по изобретению, которое будет терапевтически эффективным, будет варьироваться в зависимости от факторов, таких как болезненное состояние и его тяжесть, личность субъекта, нуждающегося в этом, и так далее, количество которого может быть запросто определено специалистами в данной области техники. Предпочтительно более 80%, более предпочтительно по меньшей мере 85%, еще более предпочтительно по меньшей мере 90% и наиболее предпочтительно по меньшей мере 95% введенной кристаллической формы является одной из форм изобретения. Как отмечалось выше, иллюстративные способы введения включают оральный, назальный, парентеральный, местный, трансдермальный и ректальный. Введение кристаллической формы может быть выполнено введением фармацевтической композиции данного изобретения или с помощью любых других эффективных средств.
Конкретные варианты осуществления настоящего изобретения будут продемонстрированы со ссылкой на следующие примеры. Следует понимать, что данные примеры раскрыты исключительно с целью иллюстрации изобретения и не должны восприниматься никоим образом, как ограничивающие объем настоящего изобретения.
Пример 1
Получение формы А 5-хлор-N-(2-изопропокси-5-метил-4-(пиперидин-4-ил-фенил)-N-2-(изопропилсульфонил)фенил)пиримидин-2,4-диамина.
5-Хлор-N-(2-изопропокси-5-метил-4-(пиперидин-4-илфенил)-N-2-(изопропилсульфонил)фенил)пиримидин-2,4-диамина дигидрохлоридная соль.
Соединение 2-изопропокси-5-метил-4-(пиперидин-4-ил) анилина дигидрохлорид (33,00 г, 85,25 ммоль) и 2,5-дихлор-N-(2-(изопропил сульфонил)фенил)пиримидин-4-амин (32,53 г) добавляли в 3-горлую 500 мл круглодонную колбу, снабженную механической мешалкой, термопарой, дефлегматором и N2 на входе и выходе. Добавляли растворитель, 2-пропанол (255,0 г, 325 мл) и смесь нагревали до кипячения при 82±2°С и перемешивали в течение по меньшей мере 14 часов. Смесь охлаждали до 22±3°С в течение 1 часа и перемешивали при 22±3°С в течение 3 часов. Полученное твердое вещество фильтровали и промывали 3×40 г (3×15 мл) 2-пропанолом. Твердое вещество сушили при 50±5°С/10 мбар в течение 16 часов с образованием 44,63 г 5-хлор-N-(2-изопропокси-5-метил-4-(пиперидин-4-ил-фенил)-N-2-(изопропилсульфонил)фенил)пиримидин-2,4-диамин дигидрохлоридной соли. Химическая чистота (как установлено ВЭЖХ): 97%. Скорректированный выход: 71,6%. LOD (пределы обнаружения) = 11,6%. Дигидрохлоридную соль перекристаллизовывали с использованием смеси ацетон:вода (10/1, об./об.). Химическая чистота (как установлено ВЭЖХ): 98,8%.
Форма А 5-Хлор-N-(2-изопропокси-5-метил-4-(пиперидин-4-илфенил)-N-2-(изопропилсульфонил)фенил)пиримидин-2,4-диамина.
7,00 г 5-хлор-N-(2-изопропокси-5-метил-4-(пиперидин-4-ил)фенил)-N-(2-(изопропилсульфонил)фенил)пиримидин-2,4-диамина дигидрохлорида и 21,0 г смеси ацетон:вода (3:1, об./об.) добавляли в сухой и чистый кристаллизатор при температуре окружающей среды. Смесь нагревали до 55±3°С в течение около 20 минут, чтобы получить прозрачный раствор. Горячий раствор фильтровали и 2,6 г ацетона и воды добавляли к смеси. Поддерживая нагревание 14,69 г (около 58% по весу) водного раствора NaOH добавляли в течение периода около 0,5 часа. Реакционную смесь выдерживали при 55±3°С в течение дополнительных 2 часов с получением не совсем белой суспензии. Дополнительные 10,82 г (около 58% по весу) водного раствора NaOH добавляли к горячему раствору в течение периода около 1,5 часа с получением густой не совсем белой суспензии. Суспензию охлаждали до 20±3°С в течение периода около 45 минут и 47,0 г деионизированной (DI) воды добавляли в течение около 30 минут и не совсем белую суспензию перемешивали при 20±3°С в течение 1 часа. Суспензию фильтровали и промывали 2×25,0 г деионизированной (DI) водой. Влажный осадок сушили около 17 часов в вакуумной печи при 50±3°С и 10 мбар при продувке N2 с получением 6,06 г не совсем белого или желтовато-коричневого твердого вещества, 5,30 г 5-хлор-N-(2-изопропокси-5-метил-4-(пиперидин-4-ил)фенил)-N-(2-(изопропилсульфонил)фенил)пиримидин-2,4-диамина. Выход: 87,5%. Форма А была идентифицирована и подтверждена его соответствующими образцом XRPD (порошковой рентгенограммы), FT-IR (инфракрасным спектром преобразования Фурье) и термическими параметрами.
Пример 2
Получение формы В 5-Хлор-N-(2-изопропокси-5-метил-4-(пиперидин-4-илфенил)-N-2-(изопропилсульфонил)фенил)пиримидин-2,4-диамина.
5,58 г 5-хлор-N-(2-изопропокси-5-метил-4-(пиперидин-4-ил)фенил)-N-(2-(изопропилсульфонил)фенил)пиримидин-2,4-диамина растворили в 50 мл 1,0 N HC1 при 30-40°С с получением прозрачного раствора. 200 мл 0,3 N раствора NaOH добавляли к этому прозрачному раствору по каплям в течение 20 минут при 20-23°С. Была получена мутная смесь, которую нагревали при перемешивании при 40-42°C в течение 2 часов и затем нагревали до 50-55°С в течение 2 часов. Полученную суспензию охлаждали до комнатной температуры и суспензию фильтровали. Влажный осадок промывали 3×20 мл воды и сушили под вакуумом с получением 5,30 г белого твердого вещества. Выход: 95%. Форма B была идентифицирована и подтверждена его соответствующими образцом XRPD (порошковой рентгенограммы), FT-IR (инфракрасным спектром преобразования Фурье) и термическими параметрами.
Пример 3
Получение формы А 5-хлор-N-(2-изопропокси-5-метил-4-(пиперидин-4-илфенил)-N-2-(изопропилсульфонил)фенил)пиримидин-2,4-диамина затравкой суспензии формы В 5-хлор-N-(2-изопропокси-5-метил-4-(пиперидин-4-илфенил)-N-2-(изопропилсульфонил)фенил)пиримидин-2,4-диамина с формой А.
Небольшое количество кристаллической формы А 5-хлор-N-(2-изопропокси-5-метил-4-(пиперидин-4-илфенил)-N-2-(изопропилсульфонил)фенил)пиримидин-2,4-диамина (0,1-1,0% по массе) добавляли к суспензии кристаллической формы В 5-хлор-N-(2-изопропокси-5-метил-4-(пиперидин-4-илфенил)-N-2-(изопропилсульфонил)фенил)пиримидин-2,4-диамина в водном ацетоне при перемешивании при комнатной температуре. Кристаллическую форму анализировали с помощью ее соответствующего профиля мутности или XRPD (порошковой рентгенограммы). Количество полученной по существу чистой формы А, зависит от растворителя, отношения ацетона к воде по объему и количества использованной «затравки» А, как представлено в таблице 1.
|
Пример 4
Превращение формы В 5-хлор-N-(2-изопропокси-5-метил-4-(пиперидин-4-илфенил)-N-2-(изопропилсульфонил)фенил)пиримидин-2,4-диамина в форму А 5-хлор-N-(2-изопропокси-5-метил-4-(пиперидин-4-илфенил)-N-2-(изопропилсульфонил)фенил)пиримидин-2,4-диамина нагреванием в водном растворителе.
Суспензию кристаллической формы В 5-хлор-N-(2-изопропокси-5-метил-4-(пиперидин-4-илфенил)-N-2-(изопропилсульфонил)фенил)пиримидин-2,4-диамина нагревали в водном растворителе при перемешивании. Превращение кристаллической формы В в кристаллическую форму А анализировали с помощью ее соответствующего профиля мутности или XRPD (порошковой рентгенограммы). Количество полученной по существу чистой формы А и ее соответствующее время конверсии зависит от системы растворителя и температуры, как представлено в таблице 2.
|
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 5-ХЛОР-N2-(2-ИЗОПРОПОКСИ-5-МЕТИЛ-4-ПИПЕРИДИН-4-ИЛ-ФЕНИЛ)-N4-[2-(ПРОПАН-2-СУЛЬФОНИЛ)-ФЕНИЛ]-ПИРИМИДИН-2,4-ДИАМИНА](https://fips.edrid.ru/images/rid/39/6b/10/16845044a314a5d6c4b4dafc4ad5e312.png)
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 5-ХЛОР-N2-(2-ИЗОПРОПОКСИ-5-МЕТИЛ-4-ПИПЕРИДИН-4-ИЛ-ФЕНИЛ)-N4-[2-(ПРОПАН-2-СУЛЬФОНИЛ)-ФЕНИЛ]-ПИРИМИДИН-2,4-ДИАМИНА](https://fips.edrid.ru/images/rid/39/6b/10/d6479a5ee6c6693a4ea44594a932f304.png)
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 5-ХЛОР-N2-(2-ИЗОПРОПОКСИ-5-МЕТИЛ-4-ПИПЕРИДИН-4-ИЛ-ФЕНИЛ)-N4-[2-(ПРОПАН-2-СУЛЬФОНИЛ)-ФЕНИЛ]-ПИРИМИДИН-2,4-ДИАМИНА](https://fips.edrid.ru/images/rid/39/6b/10/06f12c377b29306e153c7b842b068284.png)
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 5-ХЛОР-N2-(2-ИЗОПРОПОКСИ-5-МЕТИЛ-4-ПИПЕРИДИН-4-ИЛ-ФЕНИЛ)-N4-[2-(ПРОПАН-2-СУЛЬФОНИЛ)-ФЕНИЛ]-ПИРИМИДИН-2,4-ДИАМИНА](https://fips.edrid.ru/images/rid/39/6b/10/1fa11cc71e3183f9e8d7f40a9260055f.png)
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 5-ХЛОР-N2-(2-ИЗОПРОПОКСИ-5-МЕТИЛ-4-ПИПЕРИДИН-4-ИЛ-ФЕНИЛ)-N4-[2-(ПРОПАН-2-СУЛЬФОНИЛ)-ФЕНИЛ]-ПИРИМИДИН-2,4-ДИАМИНА](https://fips.edrid.ru/images/rid/39/6b/10/f9f604a5ad793ec00512647615fb6513.png)
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 5-ХЛОР-N2-(2-ИЗОПРОПОКСИ-5-МЕТИЛ-4-ПИПЕРИДИН-4-ИЛ-ФЕНИЛ)-N4-[2-(ПРОПАН-2-СУЛЬФОНИЛ)-ФЕНИЛ]-ПИРИМИДИН-2,4-ДИАМИНА](https://fips.edrid.ru/images/rid/39/6b/10/cbab18a7fc6e2cb980499cae54dfc544.png)

