Результат интеллектуальной деятельности: СПОСОБ ФОРМИРОВАНИЯ БИОАКТИВНОГО ПОКРЫТИЯ НА ПОВЕРХНОСТИ ЭНДОПРОТЕЗОВ КРУПНЫХ СУСТАВОВ
Вид РИД
Изобретение
Способ относится к технологиям производства изделий медицинского назначения. Предлагаемый способ формирования покрытий предназначен для реализации в масштабах серийного производства эндопротезов крупных суставов с улучшенной биологической совместимостью, которые применяют в операциях по замене пораженного сустава на искусственный в случае неизбежности хирургического пути решения проблемы.
Цель формирования покрытий состоит в уменьшении риска отторжения протезов и снижении травматизма операций.
Использование бесцементной технологии имплантации эндопротезов в условиях здоровой кости позволяет сразу же получить первичную надежную фиксацию имплантата. Однако на примере многочисленных исследований было показано, что использование таких имплантатов без дополнительной модификации поверхности приводит к большому количеству ревизионного эндопротезирования вследствие возникновения асептического расшатывания, а также stress-shilding синдрома. Поэтому на сегодняшний день актуальной проблемой эндопротезирования является выбор оптимального вида модифицирования поверхности имплантата.
На данный момент наиболее перспективным направлением является создание пористой биосовместимой поверхности методом микродугового оксидирования (МДО), получившим в последние годы широкое распространение. Он имеет ряд преимуществ: является относительно недорогим, экологичным, позволяет получать модифицированную поверхность с развитым микрорельефом, разветвленной системой пор и довольно высокой адгезией в системе металлическая основа/функциональный слой. Важно, что такой способ обработки имплантатов не оказывает негативного влияния на механические свойства металлической подложки, т.к. в процессе формирования покрытия высокотемпературное воздействие является кратковременным и локализовано на поверхности имплантата, погруженного в водный электролит. Помимо этого метод позволяет повышать биоактивность модифицированной поверхности через изменение химического состава поверхности при использовании электролитов, содержащих кальций и фосфор.
Известен способ по патенту РФ № 2385740 (опубликовано10.04.2010) «Биоактивное покрытие на имплантате из титана и способ его получения», позволяющий формировать биоактивное покрытие на имплантате из титана, обладающее высокой адгезией к поверхности имплантата и развитой шероховатой поверхностью, достаточной для успешной остеоинтеграции костной ткани и способ его получения. Биоактивное покрытие на имплантате из титана содержит кальций-фосфатные соединения и имеет многоуровневую пористую структуру с шероховатой поверхностью. Покрытие имеет толщину 10-40 мкм, общую пористость 35-45% со средним размером пор 3-8 мкм, шероховатость 2,5-5 мкм, адгезионную прочность 30-35 МПа. Покрытие содержит фосфаты кальция в рентгеноаморфном состоянии. Пескоструйную обработку проводят с использованием порошка окиси алюминия Al2O3 или окиси кремния SiO2 фракции 250-380 мкм с получением шероховатости 1,5-5 мкм. Химическое травление проводят путем протравливания поверхности титанового имплантата в кислотном травителе, нагретом до температуры кипения, на основе соляной и серной кислот, следующего состава: 10 частей HCl (30%) и 80 частей H2SO4 (60%)) и 10 частей Н2О, с формированием пор размером 1-2 мкм.Микродуговое оксидирование проводят в анодном режиме при параметрах: напряжение 250-300 В, длительность импульса 50-100 мкс, и частота следования импульсов - 50-100 Гц, в течение 3-10 минут в водном растворе электролита на основе ортофосфорной кислоты, гидроксиапатита и карбоната кальция, следующего состава, мас.%: H3PO4 - 20, Са10(PO 4)6(ОН)2 - 6, СаСО3 - 9.
Недостатком указанного способа является наличие стадии кислотного травления в кипящей смеси кислот, что переводит технологический процесс в разряд опасных химических производств и налагает ряд соответствующих требований и ограничений. Также необходимо отметить высокие концентрации химических веществ в составе электролита. Так, для обработки габаритного изделия (например, ножка тазобедренного протеза), потребуется емкость ванны с электролитом не менее 3-х литров, а количество гидроксиапатита для электролита - около 180 г, что в соответствии с рыночными ценами на него составит не менее 5 тыс. руб. на ванну. Кроме этого, гидроксиапатит кальция активно реагирует с ортофосфорной кислотой с выделением более кислых фосфатов кальция, таких как трикальцийфосфат, брушит и другие. В этом случае непонятен выбор авторов в пользу дорогостоящего гидроксиапатита в качестве исходного компонента, если при получении электролита он преобразуется в другие более доступные компоненты.
Известен также патент РФ № 2444376 C1(опубликовано: 10.03.2012), в котором описан способ нанесения биоактивного покрытия на титан и его сплавы при постоянном или импульсном токе напряжением 80-250 вольт в условиях искрового разряда с частотой следования импульсов 0,3-15,0 Гц в течение 10-40 мин. Процесс ведут в растворе фосфорной кислоты концентрацией 5-25% и серной кислоты концентрацией 5-10%, пересыщенном СаО растворе, и 5-10% суспензии гидроксилапатита дисперсностью менее 70 мкм в этом пересыщенном растворе. Затем поверхность имплантата перед введением в организм в течение 30-60 минут при температуре 20-37°С обрабатывают специальной средой, обладающей остеогенной и противомикробной активностью. Способ обеспечивает нанесение биоактивного нано- и микроструктурированного кальцийфосфатного покрытия на титановые имплантаты, обладающего повышенными остеокондуктивными, остеоиндуктивными свойствами и противомикробной активностью.
Недостатком указанного способа является высокое содержание кислот в электролите, которые нейтрализуются негашеной известью (СаО), а также высокое содержание дорогостоящего гидроксиапатита (5-10%). Смешение электролита приводит к выделению большого количества теплоты при гашении извести и ее реакции с кислотами. Технологически данная операция должна реализовываться с помощью специальных реакторов и требует дополнительных мер безопасности, что приводит к удорожанию технологического процесса и усложняет его.
Известен способ из источника CN 103083099 A (опубл. 08.05.2013) «Матрица имплантата корня зуба, содержащая покрытие из кремния, кальция, фосфора и натрия, нанесенного с помощью микродугового оксидирования, и способ его получения».
Изобретение направлено на решение проблемы металлозов за счет покрытий, полученных на поверхности имплантатов путем микродугового оксидирования. Способ включает этап подготовки металлических заготовок, мойки и сушки, этап проведения микродугового оксидирования с целью получения микронанопористых биопокрытий для формирования имплантата корня зуба и заключительный этап отмывки от остатков электролита. Введение биологически активных элементов, таких как кремний, кальций, фосфор и натрий, являющихся основными компонентами биологического стекла, предназначено для сокращения сроков приживления.
Способ включает описание конструкции имплантата, состоящего из корневой части с покрытием, полученным методом микродугового оксидирования, и держателя, установленного в имплантате корня зуба посредством винта. Имплантат корня изготовлен из чистого титана марок ТА2, ТА4 или титанового сплава T2448.
Микродуговая обработка проводится в электролите, содержащем силикат натрия, дигидрофосфат кальция, ацетат кальция, Na2-ЭДТА и гидроксид натрия при подаче прямоугольных анодных импульсов напряжением 250×550 В, частотой 0,2-1 кГц и скважностью 4-20%, в течение 5-15 мин.
К недостаткам указанного объекта можно отнести следующее. Подтверждение биоактивных свойств получаемых покрытий дается лишь косвенное (приведен только результат трехдневного теста в SBF моделирующей жидкости без использования invivo или invitro экспериментов). Как в реферате, так и в примерах отсутствует информация и по таким важным параметрам получаемого покрытия, как толщина, состав, пористость, адгезия и другим физико-химическим свойствам, которые могли бы свидетельствовать в пользу потенциальной возможности использования таких покрытий для реальных имплантатов. Кроме того, его невозможно использовать для обработки крупных имплантатов.
Наиболее близким по своим признакам, принятым за прототип, является способ формирования биоактивного покрытия, раскрытый в источнике US 2011/0218643 A1 (опубл. 08.09.2011), предназначенный для формирования покрытия на внутрикостных имплантатах из титана и титановых сплавов, что способствует повышению их биологической активности.
Имплантат помещают в ванну в раствор электролита, содержащего ионы Ca и P, а затем подключают к источнику питания. Также к источнику питания подключают вспомогательный электрод. Для охлаждения электролита используют теплообменник. Для формирования биоактивного покрытия между имплантатом и электродом прикладывают последовательность импульсов напряжения с чередованием полярности импульсов. На внутрикостной части имплантата формируется покрытие с толщиной от 10 до 30 мкм, пористой структурой с размерами пор от 0,5 до 10 мкм и содержащее от 10 до 30 мас. % гидроксиапатита.
Авторы утверждают, что высокое содержание Ca, P и кристаллических биологически активных соединений обеспечивает повышенные биоактивные свойства. В покрытии присутствует диоксид титана в виде кристаллитов анатаза и рутила размером 30-50 нм. Кроме того, высокий уровень пористости обеспечивает хорошую остеокондуктивность, в результате чего повышается адгезия кость-имплантат. Утверждается, что равномерная структура покрытия и врастание в него кости должно приводить к постепенному изменению механических свойств системы кость-имплантат, тем самым исключая появление концентраторов напряжения и повышая сдвиговую прочность.
Длительность импульсов напряжения в процессе обработки составляет 0,5-20 миллисекунд. Пауза между импульсами составляет менее 10 микросекунд. Длительность пауз сокращена для увеличения количества кальция и фосфора в покрытии. Амплитуда напряжения импульсов увеличивается постепенно до своих пиковых значений в течение первых 5 ч 300 секунд, благодаря чему удается избежать высоких пиковых значений тока в начале процесса. Амплитуда положительных импульсов напряжения не должна превышать 500-550 В, а отрицательных - 100 В, так как перенапряжение вызывает протекание мощных разрядов в местах концентрации силовых линий электрического поля (краевые выступающие области). Электролит включает водный раствор ацетата кальция (0,05-0,2 моль/л) и фосфата натрия (0,025-0,1 моль/л).
Недостатком способа по прототипу является то, что он не может быть применен в производстве эндопротезов крупных суставов со значительной площадью поверхности, особенно в случае, когда проводится обработка партии образцов. Связано это с тем, что по предлагаемому способу используют жесткий импульсный режим формирования разряда при микродуговом оксидировании. При жестком режиме используют принудительное начало пробоя подачей напряжения, заведомо превышающего критическую величину, и принудительное окончание пробоя отключением напряжения. Ввиду этого средняя плотность тока через поверхность образца по предлагаемому способу может достигать 5 А/см2, для импульсов положительной (анодной) полярности, особенно на начальном этапе. Площадь обрабатываемой поверхности только для одного элемента протеза тазобедренного сустава (впадины) может достигать 0,6 дм2, а средний анодный ток соответственно для обработки такой детали 300 А. Для групповой обработки, допустим, четырех изделий этот параметр будет превышать уже 1000 А. Обеспечение надежного электрического контакта для протекания токов таких значений станет существенным препятствием при подключении к источнику тока элементов эндопротезов стандартной конструкции и потребует ее доработки. Также необходимо отметить, что высокочастотные токи такой силы наводят значительные магнитные поля и создают помехи для электросети. В качестве примера в прототипе приведен образец с площадью всего 2×2 см2, обработка которого по данным приведенной осциллограммы требует в среднем за период (анодный+катодный импульсы) более 2 кВт мощности.
Задачей предлагаемого изобретения является разработка способа формирования биоактивного покрытия на поверхности эндопротезов крупных суставов человека с высокими физико-химическими свойствами и биохимической активностью методом микродугового оксидирования для применения в условиях серийного производства.
Техническим результатом изобретения является снижение средней плотности тока и использование мягкого анодно-катодного режима формирования биоактивных покрытий, что обеспечивает возможность групповой обработки элементов эндопротезов крупных суставов человека с получением пористого биоактивного стеклокерамического покрытия на всей или заданной поверхности элементов эндопротезов, изготовленных из наиболее применяемых титановых сплавов ВТ1-0 (Grade 2,3,4), ВТ6 (Ti-6Al−4V) и Ti-6Al-7Nb.
Задачу решает предложенный способ получения покрытий на элементах эндопротезов крупных суставов человека, выполненных из титана и его сплавов, включающий помещение имплантата в ванну с раствором электролита, содержащего ионы Ca и P, подключение имплантата и вспомогательного электрода к источнику питания, охлаждение электролита теплообменником, отличающийся тем, что
- используют электролит на основе гидроксида кальция Са(ОН)2, метасиликата натрия пятиводного Na2SiO3×5H2O и натрия фосфорнокислого двузамещенного двенадцативодного Na2HPO4×12H2O;
- электролит готовят следующим образом: растворяют полностью гидроксид кальция, добавляют метасиликат натрия и перемешивают до образования белого дисперсного взвешенного осадка, добавляют натрия гидрофосфат Na2HPO4×12H2O и перемешивают до полного его растворения;
- для обработки титана марок ВТ1-0, Grade 2, 3, 4, электролит готовят из расчета массы сухого вещества в граммах на литр состава: Са(ОН)2 - 1,6; Na2SiO3×5H2O - 8,0; Na2HPO4×12H2O - 5,0;
- для обработки сплавов ВТ6 (Ti-6Al-4V) и Ti-6Al-7Nb исходный электролит, применяемый для титана марки ВТ1-0 (Grade 2, 3, 4), разбавляют дистиллированной водой в соотношении 2 части электролита и 1 часть воды;
- для защиты не предназначенных для обработки частей элементов эндопротезов используют маскирующую изолирующую оснастку на основе поливинилсилоксанового силикона аддитивного отверждения, применение которого позволяет избежать негативных краевых эффектов и снижения качества покрытия на границе с маскирующей оснасткой;
- микродуговое оксидирование проводят в течение 10-30 мин в мягком анодно-катодном режиме с синусоидальной формой тока плотностью 0,1±0,02 А/см2, за исключением начального этапа, когда на первой минуте используют анодный режим включения при соотношении анодного и катодного токов не менее 10:1.
Заявленный технический результат достигается сочетанием состава электролита и электрических параметров микродугового оксидирования. Предлагаемые компоненты электролита являются источниками таких элементов, как кальций, фосфор и кремний, которые в процессе окисления подложки с участием термического воздействия микродуговых разрядов формируют стеклокерамическое покрытие, отдельные области которого аналогичны биоактивному стеклу различного состава [Hench L.L., Splinter R.J., Allen W.C. and Greenlee T.K. (1971). Bonding Mechanism at the Interface of Ceramics Prosthetic Materials. J. Biomed. Mater. Res. Syrup., 2: 117-141]. Содержание в электролите дисперсного осадка из смеси фосфатов и силикатов кальция во многом определяет насыщенность кальцием, фосфором и кремнием получаемого покрытия. Толщина получаемого покрытия при средней плотности тока 0,1 А/см2 может варьироваться от 10 до 35 мкм при временах обработки от 10 до 30 минут. Адгезионная прочность составляет не менее 30 МПа. При времени обработки свыше 30 минут можно получать более толстые покрытия, но при этом происходит ухудшение адгезионных свойств. Шероховатость покрытий находится в диапазоне Ra 1÷6 мкм. При максимальном диаметре пор до 20 мкм основной вклад в пористость вносят поры от 1 до 10 мкм.
Для групповой обработки четырех изделий площадью по 0,6 дм2 каждое средний ток обработки будет составлять около 25 А, тогда как при обработке четырех изделий такой же площади по прототипу этот параметр будет превышать уже 1000 А.
Таким образом, заявленное изобретение соответствует условиям новизны, изобретательский уровень и промышленная применимость.
Изобретение характеризуют следующие графические материалы.
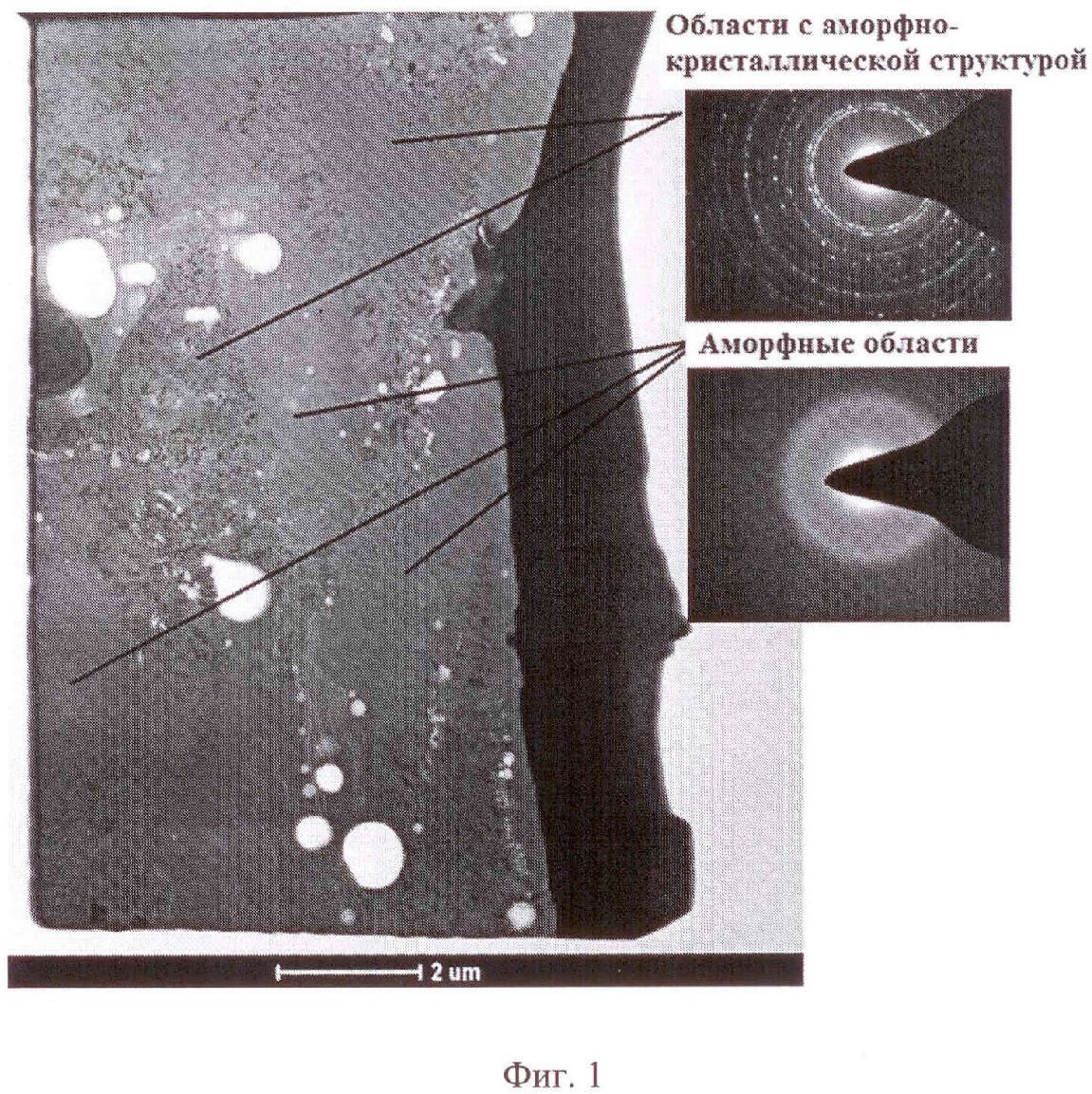
На фиг. 1 представлены результаты просвечивающей микроскопии, подтверждающие наличие аморфной стеклофазы в покрытии наряду с нанодисперсными кристаллитами оксида титана.
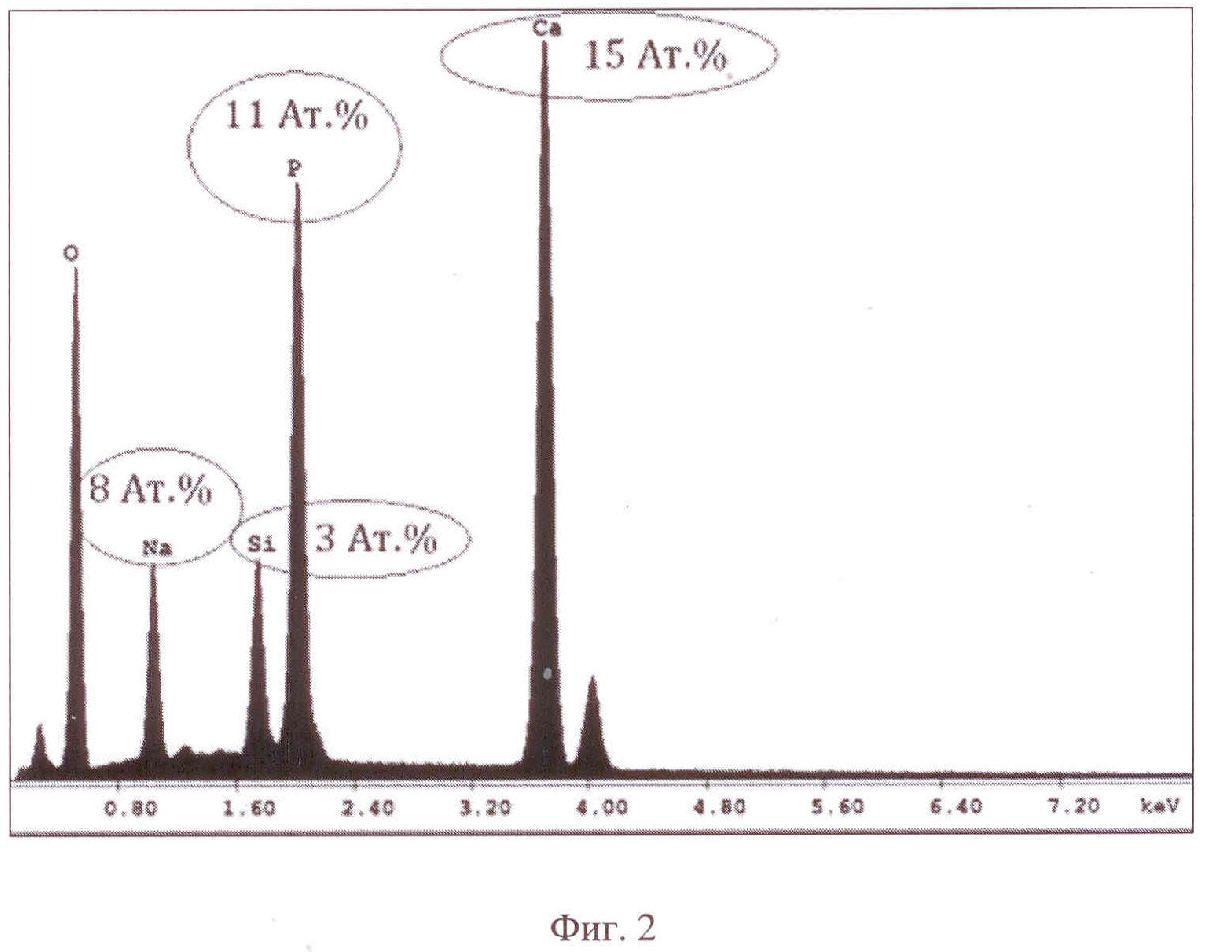
На фиг. 2 представлен элементный состав дисперсного осадка в электролите, который принимает участие в формировании покрытия, полученный методом энергодисперсионного анализа;
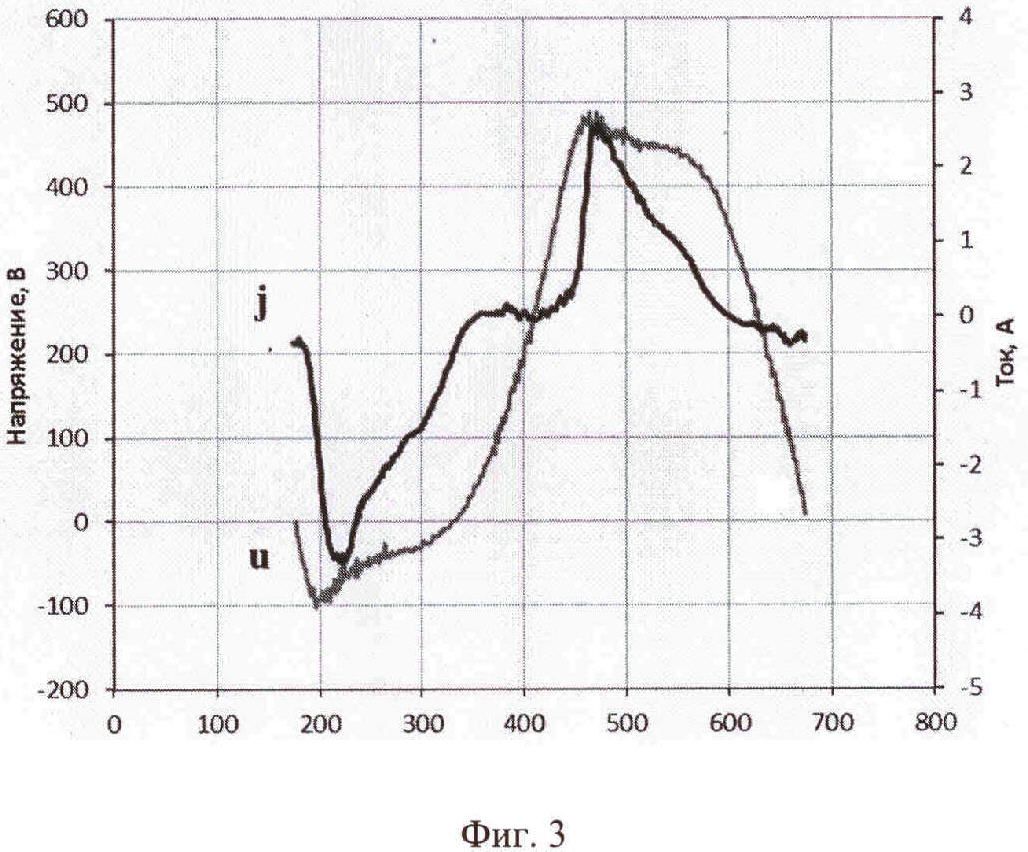
На фиг. 3 приведен график с изображением характерной для предлагаемого процесса осциллограммой напряжения и тока при длительности обработки 10 минут для образца площадью 10 см2. Как видно из графика, максимальный ток не превышает 4 А, а в прототипе - свыше 25 А для образца с площадью 4 см2. Средний же ток за период составляет около 1 А против 10 А по прототипу.
На фиг. 4 представлен внешний вид элемента протеза тазобедренного сустава - впадина бесцементной фиксации типоразмера 58С, изготовленная из технически чистого титана марки ВТ1-0 с покрытием, полученным по примеру 1.
На фиг. 5 представлен внешний вид элемента протеза тазобедренного сустава - ножка БЦФ-143, изготовленная из титанового сплава ВТ6 (Ti-6Al-4V) с покрытием, полученным по по примеру 2.
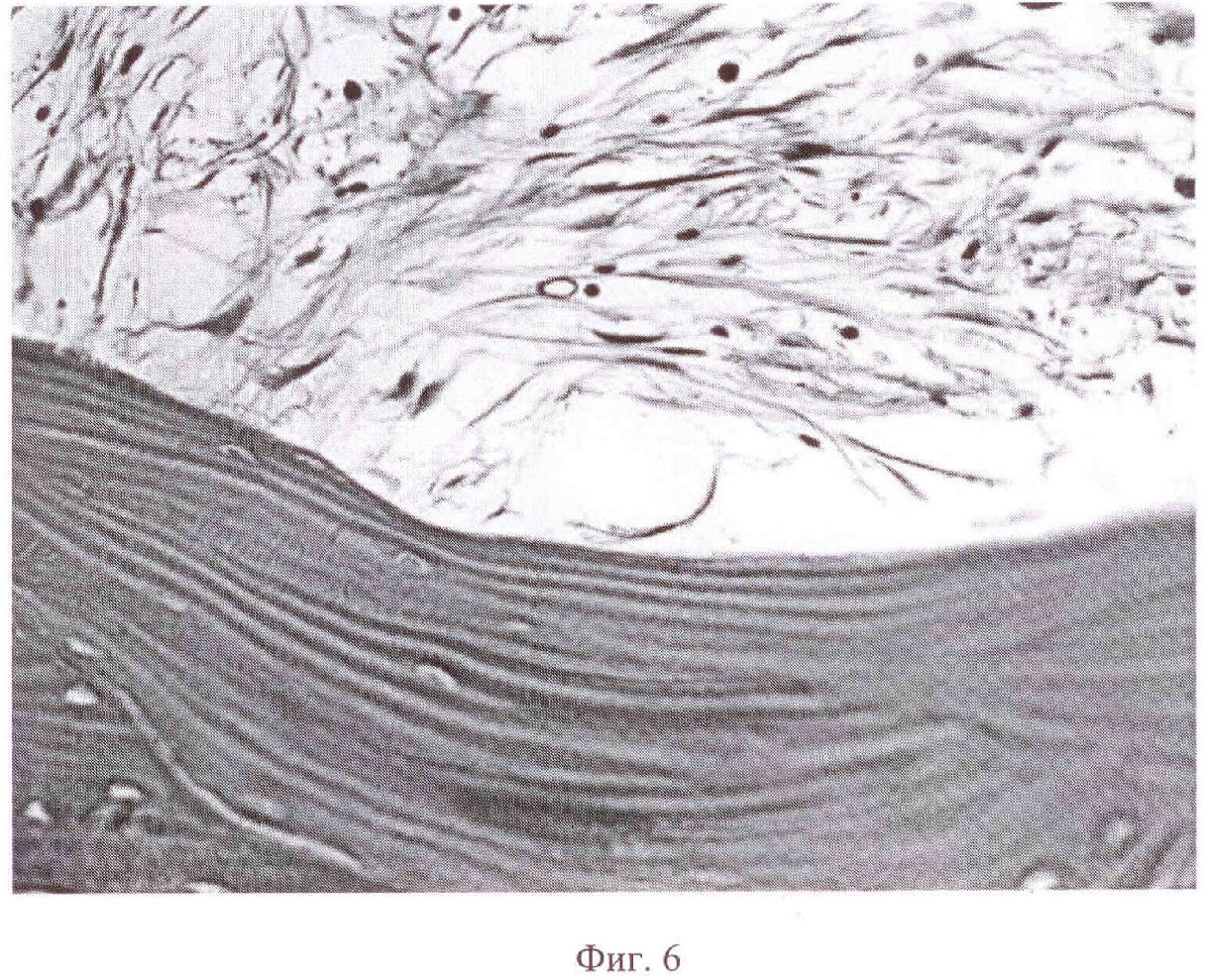
На фиг. 6 представлено изображение фрагмента остеоидной ткани (внизу) выросшей на поверхности имплантата ВТ6 с покрытием, окруженный волокнами рыхлой соединительной ткани(вверху). Анализ гистологических препаратов проводился стандартными методами световой микроскопии тонких срезов.
Примеры конкретного выполнения
Пример 1. В качестве изделия для обработки взят элемент протеза тазобедренного сустава - впадина бесцементной фиксации типоразмера 58С, изготовленная из технически чистого титана марки ВТ1-0. Для исходной поверхности проведена пескоструйная обработка белым электрокорундом зернистостью F16 по ГОСТ Р 52381-2005. Отмывка изделий перед оксидированием проводилась с использованием технического моющего средства ВЕГА-Р. С помощью силикона ElitDouble 22 фирмы Zhermack изготавливали изолирующую оснастку. Процесс проводили в электролите Са(ОН)2 - 1,6 г/л; Na2SiO3×5Н2О - 8,0 г/л; Na2HPO4×12H2O - 5,0 г/л в течение 30 минут. Средняя плотность тока составила 0,1 А/см2.
Характеристики полученного покрытия:
Объемная пористость: 12%±2%;
Толщина покрытия: 17,7 мкм±1,7 мкм;
Шероховатость Ra=2,4 мкм±0,5 мкм;
Элементный состав (вес.%): TiO2 - 52,2; CaO - 12,3; P2O5 - 3,9; SiO2 - 30,5; Na2O - 1,1.
Адгезионная прочность на сдвиг: 32 МРа
Пример 2. В качестве изделия для обработки взят элемент протеза тазобедренного сустава - ножка БЦФ-143, изготовленная титанового сплава ВТ6 (Ti-6Al-4V). Для исходной поверхности проведена пескоструйная обработка белым электрокорундом зернистостью F16. Отмывка изделий перед оксидированием проводилась с использованием технического моющего средства ВЕГА-Р. С помощью силикона ElitDouble 22 фирмы Zhermack изготавливали изолирующую оснастку. Для проведения процесса исходный электролит по примеру 1 разбавили дистиллированной водой в соотношении 2 части электролита и 1 часть воды, обработку проводили в течении 30 минут. Средняя плотность тока - 0,1 А/см2.
Характеристики полученного покрытия:
Объемная пористость: 13%±2%;
Толщина покрытия: 19,7 мкм±6,5 мкм;
Шероховатость Ra=3,5 мкм±0,5 мкм;
Элементный состав (вес.%): TiO2 - 32,0; CaO - 35,6; P2O5 - 8,6; SiO2 - 21,6; Al2O3 - 0,9; Na2O - 1,3.
Адгезионная прочность на сдвиг: 34 МРа.
Пример 3. В качестве объекта для обработки были взяты цилиндрические образцы диаметром 19,5 мм и длиной 40 мм, изготовленные из титанового сплава Ti-6Al-7Nb. Для исходной поверхности проведена пескоструйная обработка белым электрокорундом зернистостью F16. Отмывка заготовок перед оксидированием проводилась с использованием технического моющего средства ВЕГА-Р. Формирование покрытия проводили на всей площади образца. Для проведения процесса исходный электролит по примеру 1 разбавили дистиллированной водой в соотношении 2 части электролита и 1 часть воды, обработку проводили в течение 30 минут. Средняя плотность тока - 0,1 А/см2.
Характеристики полученного покрытия:
Объемная пористость: 11%±2%;
Толщина покрытия: 34,2 мкм±7,6 мкм;
Шероховатость Ra=5,8 мкм±0,5 мкм;
Элементный состав (вес.%): TiO2 - 35,7; CaO - 33,0; P2O5 - 9,4; SiO2 - 19,4; Al2O3 - 1,0; Na2O - 0,9;
Адгезионная прочность на сдвиг: 31 МРа.
Пример 4. В качестве объекта для обработки были взяты 3 образца в виде дисков диаметром 20 мм и высотой 5 мм с общей площадью всех образцов 28 см2, изготовленные из титана марки ВТ1-0. Поверхность образцов предварительно шлифована абразивной шкуркой зернистостью по шкале FEPA Р320. Отмывка заготовок перед оксидированием проводилась с использованием технического моющего средства ВЕГА-Р. Формирование покрытия проводили на всей площади образцов. Для проведения процесса использовали электролит по примеру 1, обработку проводили в течение 10 минут. Средняя плотность тока - 0,1 А/см2.
Характеристики полученного покрытия:
Объемная пористость: 15%±3%;
Толщина покрытия: 11 мкм±2 мкм;
Шероховатость Ra=1,7 мкм±0,4 мкм;
Элементный состав (вес.%): TiO2 - 68,5; CaO - 7,4; P2O5 - 5,3; SiO2 - 18,8.
Адгезионная прочность на сдвиг: 31 МРа.
Для оценки процессов остеокондуктивной и остеоиндуктивной активности биоактивного покрытия на титановом сплаве ВТ6, полученном по предлагаемому способу, проводился invivo эксперимент по методике «Эктопический остеогенез» [И.А. Хлусов, А.В. Карлов, И.В. Суходоло. Генез костной ткани на поверхности имплантатов для остеосинтеза. Гений ортопедии, 2003,-№3.-С.16-26]. Клетки сингенного костного мозга, взятого из бедренной кости подопытных животных, в стерильных условиях наносили на мини-имплантаты и культивировали в течение 45 мин в культуральной среде. В качестве контрольных были взяты имплантаты из аналогичного сплава без покрытия с шлифованной поверхностью. Затем производили инокуляцию имплантатов под кожу животных (крыс). В итоге 2-месячного периода подкожной имплантации признаков воспалительной реакции и инфекционного заражения тканей не наблюдалось. Высокая биосовместимость отмечалась как для имплантатов из сплава ВТ6 с покрытием, так и без покрытия. Однако имплантаты без покрытия подверглись большей инкапсуляции по сравнению с имплантатами с покрытиями, что свидетельствует о худшей реакции организма на внедрение первых. В ходе гистологического исследования тканевых образований, выросших из клеток костного мозга на имплантатах, было выявлено, что в подопытной группе на имплантатах с покрытиями четко определяется остеоидная ткань. Ее доля на поверхности образцов составила 30%, фиброзная соединительная ткань - 70% (фиг. 6). Образцы из сплава ВТ6 без покрытия содержали только фиброзную соединительную ткань. Данный in vivo эксперимент подтверждает остеогенные свойства покрытия, полученного по предлагаемому способу.
Способ получения покрытий на элементах эндопротезов крупных суставов человека, выполненных из титана и его сплавов, включающий помещение имплантата в ванну с раствором электролита, содержащего ионы Са и Р, подключение имплантата и вспомогательного электрода к источнику питания, охлаждение электролита теплообменником, отличающийся тем, что готовят электролит, для чего растворяют в дистиллированной воде гидроксид кальция Са(OH), затем добавляют метасиликат натрия пятиводного NaSiO×5HО и перемешивают до образования белого дисперсного взвешенного осадка, затем добавляют натрий фосфорнокислый двузамещенный двенадцативодный NaHPO×12HO и перемешивают до полного его растворения, причем для обработки титана марок ВТ1-0, Grade 2, 3, 4, электролит готовят из расчета массы сухого вещества в граммах на литр состава: Са(OH) - 1,6; NaSiO×5HO - 8,0; NaHPO×12HO - 5,0; а для обработки сплавов ВТ6 (Ti-6Al-4V) и Ti-6Al-7Nb исходный электролит, применяемый для титана марок ВТ1-0, Grade 2, 3, 4, разбавляют дистиллированной водой в соотношении 2 части электролита и 1 часть воды; для защиты не предназначенных для обработки частей элементов эндопротезов на них наносят маскирующую изолирующую оснастку на основе поливинилсилоксанового силикона аддитивного отверждения, далее проводят микродуговое оксидирование в течение 10-30 мин в мягком анодно-катодном режиме с синусоидальной формой тока плотностью 0,1±0,02 А/см, причем на первой минуте используют анодный режим включения при соотношении анодного и катодного токов не менее 10:1.