КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ГЛЮКАН
Вид РИД
Изобретение
Настоящее изобретение относится к новым композициям, включающим гелеобразующие агенты и глюканы, и к их применению в качестве лекарственного средства, в качестве изделия медицинского назначения, в качестве средства, входящего в состав изделия медицинского назначения, в качестве нутрицевтика, косметического продукта или тому подобное. В предпочтительном варианте, такие композиции также применяют в качестве первичной повязки на рану, которую можно непосредственно накладывать на поверхность раны или которая может быть представлена в виде подложки для образования композиционного материала. Также описаны способы применения композиций, содержащих глюкан, для лечения ран. Кроме того, в настоящей заявке предложены раневые повязки и наборы.
Глюканы представляют собой гетерогенную группу полимеров глюкозы, встречающихся, в частности, в клеточных стенках растений, бактерий, грибов и простейших. Глюканы имеют основную цепь, и в некоторых случаях боковые цепи, которые, в зависимости от происхождения глюкана, включают β(1,3), β(1,4) и/или β(1,6)-связанные группы глюкозы. В зависимости от источника и способа выделения, бета-глюканы имеют различную степень разветвленности и тип связи в основной цепи и боковых цепях. Частота и тип связи в боковой цепи в значительной степени соответствует биологической активности молекулы. Глюканы также значительно различаются по молекулярной массе, а также по тенденции к агрегации цепей, и обе эти характеристики существенны для профиля эффективности этих молекул. Многие глюканы, происходящие из грибов и дрожжей, в своем нативном состоянии нерастворимы в воде, но могут быть переведены в растворимую форму путем кислотного гидролиза или путем дериватизации с помощью введения чужеродных групп, таких как фосфат, сульфат, амин, карбоксиметилцеллюлоза и т.д.
В Европе, Азии и США бета-глюканы, в частности из пекарских дрожжей, уже давно используются в качестве кормовых добавок для животных, в косметике, в качестве пищевой добавки для человека, например, в качестве иммуномодуляторов при лечении ран и в качестве активного ингредиента в кремах для кожи. Глюканы применяют при лечении рака, как показано в международной публикации WO 02/058711. Бета-глюканы, в этом контексте, рассматриваются как иммуностимуляторы, повышающие активность лейкоцитов, отчасти за счет индукции хорошо регулируемых и локальных воспалительных реакций. Их применение в лечении воспалительных заболеваний кишечника также было описано в международной публикации WO 2009/063221. Применение глюканов в лечении ран описано в ЕР 815144 и в патенте США 6875754, а применение глюканов в лечении астмы и аллергии описано в патенте США 12/528, 215.
Глюканы злаковых обычно включают неразветвленные цепи из β(1,3) и значительную долю β(1,4)-связей, а дрожжевые глюканы состоят из преимущественно β(1,3)-связанных остатков глюкозы с β(1,6)-связями, выступающими в качестве точки ветвления для боковых цепей, которые могут включать как β(1,3), так и β(1,6)-связанные остатки глюкозы. Другие молекулы, которые относят к глюканам, включают курдлан, представляющий собой в основном линейную молекулу, состоящую из β(1,3)-связанных остатков глюкозы без боковых ветвей. Лентинан представляет собой глюкан с β(1,3)-связанной основной цепью, но включающей одиночные β(1,6)-связанные остатки глюкозы, присоединенные по существу регулярно к основной цепи, что создает подобную расческе структуру этой молекулы. Одиночные β(1,6)-связанные остатки глюкозы, присоединенные к основной цепи, аналогичны точке связывания β(1,3,6), но никакие другие молекулы к этой точке связывания не присоединяется, и, таким образом, глюканы, такие как лентинан не имеют боковых цепей. Другие примеры глюканов этой группы включают склероглюкан, ламинарин и шизофиллан.
Различные варианты ветвления и длины, а также структуры боковых цепей обуславливают различия во вторичной и третичной структуре и, следовательно, в биологической активности. Структура глюканов более высокого порядка значительно варьирует, и молекулярная масса, растворимость и размер частиц оказывают влияние на активность в целом непредсказуемым образом. Некоторые продукты являются чрезвычайно мощными индукторами провоспалительных цитокинов в клетках-мишенях, тогда как другие имеют противоположное действие, полностью ингибируя высвобождение цитокинов. Для многих нерастворимых бета-глюкановых продуктов характерна индукция целого ряда воспалительных реакций, так, например, показано, что инъекция композиции из нерастворимого бета-глюкана ассоциирована с формированием гранулемы, индукцией артрита и повышенной восприимчивостью к грамотрицательному сепсису. С другой стороны, не показано, что такие отрицательные побочные эффекты связаны с растворимыми бета-глюканами, но известно, что их эффективность в качестве иммуностимуляторов существенно варьирует.
Было показано (см. WO 95/30022), например, что глюкановый продукт, полученный из дрожжей, модифицированных путем обработки глюканазой для селективного удаления (1,6)-связанных боковых цепей, более эффективно стимулирует иммунную систему рыб, чем с продукт с интактными (1,6)-связанными боковыми цепями.
Глюканы имеют большой потенциал в качестве терапевтических средств и вспомогательных веществ, но широкий спектр структурной изменчивости, проблемы, связанные с анализом таких больших и сложных молекул и отсутствие понимания механизма действия и рецепторов этих молекул обуславливает по-прежнему существующую большую потребность в усовершенствованном глюкановом продукте, в частности, продукте, эффективном для лечения ран.
Бета-глюканы известны как компоненты так называемого патоген-ассоциированного молекулярного паттерна (ПАМП), поскольку они находятся на поверхности ряда патогенных (микро)организмов, в частности грибов. У высших организмов, соответственно, сформировался механизм распознавания таких типов структур для обнаружения и уничтожения вредителей, принадлежащих к данному классу организмов. У млекопитающих клетки так называемого врожденного иммунитета экспрессируют специфические рецепторы, распознающие бета-глюканы, и одним из таких наиболее известных рецепторов является Dectin-1, но другие рецепторы также участвуют в распознавании или в сигнальном каскаде, индуцируемом бета-глюканами, и среди них - рецепторы CD11b/CD18 (CR3) и toll-подобные рецепторы 2 и 4 (TLR2 и TLR4). Клетки, участвующие в распознавании бета-глюканов, включают типичные фагоциты врожденного иммунитета, т.е. моноциты, макрофаги, дендритные клетки и гранулоциты, а также клетки природных киллеров, а также ряд эндотелиальных клеток и клетки, специфичные для других тканей, способны экспрессировать рецепторы бета-глюканов.
Важным этапом в стимуляции биологического ответа в клетках-мишенях является первоначальное связывание с рецептором и, кроме того, по-видимому, способность препарата бета-глюкана опосредовать перекрестное связывание достаточного количества рецепторов для запуска соответствующего пути передачи сигнала в клетке. В настоящем изобретении предложен продукт, обладающий способностью индуцировать специфический тип биологической активности. Это отличает его от нерастворимых продуктов, которые могут индуцировать массовый ответ за счет образования перекрестных связей с большим количеством рецепторов с последующим их фагоцитированием, что вследствие нерастворимой (или «кристаллоподобной») природы глюкана приводит к лизосомальным разрывам внутри клетки, которые вызывают активацию инфламмасомы NLRP. Нерастворимые бета-глюканы также могут индуцировать образование АФК (активных форм кислорода), что также вызывает активацию инфламмасомы, приводящую к неблагоприятной воспалительной реакции. В настоящем изобретении предложены бета-глюкановые продукты, которые способны вызывать значительный воспалительный ответ, активирующий некоторые иммунные механизмы, но без активации инфламмасомы, характерной для ряда (агрегированных нерастворимых) бета-глюкановых продуктов.
Глюкановые продукты обычно представлены в форме частиц или, в некоторых случаях, полностью растворимы в водных растворах, которые в свою очередь, либо представляют собой прозрачную жидкость, как описано, например, в патенте США 5322841, или, в некоторых случаях, образуют вязкий раствор, как описано в Steiner et al (Prog Colloid Polymer Science 77, 1988). Растворимые бета-глюканы в форме истинного геля нетипичны, особенно среди глюканов дрожжей, но было установлено, что продукты в форме геля согласно настоящему изобретению обеспечивают высокую биологическую активность, в частности в заживлении ран, по сравнению с другими глюкановыми продуктами. В дополнение к прекрасному профилю эффективности фармацевтического или медицинского изделия, при заживлении ран чрезвычайно важно применять фармацевтические или медицинские изделия таким образом, чтобы обеспечить увлажнение раны. Кроме того, готовые продукты должны покрывать рану и предпочтительно прилипать к ней, чтобы избежать инфекции и обеспечить профиль введения, который врач считает целесообразным для конкретного типа раны. Как правило, глюканы в виде частиц в полурастворимой или в жидкой форме не отвечают этим основным требованиям либо по причине того, что они не являются эффективными, либо по причине того, что они находятся в состоянии, которое не применимо для заживления ран, или по обеим причинам. Композиция, содержащая глюкан, согласно настоящему изобретению совмещает эти необходимые характеристики, что делает ее применимой для всех случаев, в которых может найти соответствующее применение композиция глюкана в виде геля. В дополнение к локальному применению, другие варианты применения включают пероральное введение и/или введение через слизистую оболочку, например, в лечении заболеваний желудочно-кишечного тракта или полости рта. Превосходные адгезионные свойства композиции, содержащей глюкан, в соответствии с настоящим изобретением делают возможным покрытие слизистой оболочки в месте действия и, таким образом, ускоряют процесс заживления. Таким образом, композиция, содержащая глюкан, согласно изобретению также может найти особое применение при лечении воспаления слизистой оболочки рта.
Неожиданно авторы настоящего изобретения обнаружили, что комбинация бета-глюкана и гелеобразующего агента приводит к синергетическому эффекту и, следовательно, улучшает заживление раны. Вне связи с какой-либо конкретной теорией, возможное объяснение этого синергетического эффекта может быть связано с оптимизированной презентацией бета-глюкана паттерн-распознающим рецепторам (ПРР, англ. pattern recognition receptors, PRR) на поверхности иммунных клеток. Такие ПРР представляют собой белки, экспрессируемые на клеточной мембране клеток врожденного иммунитета. Такие ПРР распознают патоген-ассоциированные молекулярные паттерны (ПАМП), связанные с патогенными микроорганизмами и клеточным стрессом. ПАМП направляют фагоциты и антиген-презентирующие клетки на дальнейшее созревание и активируют дополнительную группу эффекторных функций. Таким образом, гранулоциты и макрофаги, которые не были стимулированы ПАМП, не будут в достаточной степени способными убивать и разрушать клетки-мишени и клетки микроорганизмов. ПАМП также играют основополагающую роль в иммунитете, обеспечивая возникновение реакций на соответствующие стимулы (например, микроорганизмы), а не на собственные антигены.
Тремя ключевыми рецепторами ПРР, которые, как известно, участвуют в распознавании ПАМП, являются рецептор комплемента 3 (CD11b/CD18), гетеродимер Toll-подобного рецептора 2 и 6, а также рецептор Dectin-1. Эффективная стимуляция этих рецепторов является важным этапом в активации иммунной системы и приводит к изменению состояния всех задействованных клеток. На основании положительных результатов для комбинации такого бета-глюкана и гелеобразующего агента представляется, что гелеобразующий агент может выступать в качестве средства для правильной ассоциации и поперечного связывания бета-глюканов с ПРР, расположенными на таких рецепторах, таким образом, улучшая эффективность каскада, опосредующего заживление ран.
Таким образом, в одном аспекте настоящее изобретение относится к композиции, содержащей глюкан и гелеобразующий агент, причем такая композиция имеет температуру плавления (гель в золь) выше 37°С. Гелеобразующий агент предпочтительно содержит, или состоит из, или по существу состоит из одного или более углеводов/полисахаридов (отличных от глюкана) и присутствует в концентрации, которая обеспечивает стабилизацию структуры геля. Глюкан присутствует в композиции в виде геля и, следовательно, является растворимым, в отличие от глюкана в форме частиц. В предпочтительном варианте глюкан сам по себе образует гель при растворении в воде в концентрации ≥1% (например, 1,5-6%) при 25°C и нейтральном pH.
В комбинации с гелеобразующим агентом концентрация бета-глюканового компонента может быть уменьшена до ≥0,1% и желаемые свойства геля могут быть получены путем добавления гелеобразующего агента. Верхний предел содержания бета-глюкана будет определяться концентрацией и природой добавляемого гелеобразующего агента, но обычно он составляет менее 4%. Конечный продукт, содержащий комбинацию бета-глюкана и гелеобразующего агента, готовят таким образом, чтобы обладал желаемыми свойствами заживления ран, как описано выше. Примеры включают 1 или 2% растворимого дрожжевого бета-глюкана в сочетании с 1 или 1,5% высокомолекулярной карбоксиметилцеллюлозы, которые образуют стабильный гель и обладают улучшенной способностью к заживлению ран, по сравнению с их применением в отдельности. При их смешивании с гелеобразующим агентом происходит упорядочивание молекулярной организации бета-глюкана с образованием оказывающего благоприятный эффект надмолекулярного типа организации. При фармацевтическом применении нового геля организация бета-глюкана в таком геле стабилизируется в форме, которая делает возможным перекрестное связывание рецепторов на поверхности популяции клеток-мишеней, что обуславливает желаемую иммуностимулирующую активность, лишенную негативных эффектов препарата агрегированного нерастворимого бета-глюкана. В предпочтительном варианте глюкан представляет собой дрожжевой глюкан и имеет усредненную молярную массу для одиночной цепи от 15000 до 50000 г/моль и усредненную молярную массу в водном растворе для агрегатов от 4 до 20×105 г/моль.
«Одиночная цепь» относится к отдельной молекуле глюкана, то есть такой, в которой гликозильные остатки ковалентно связаны. «Агрегаты» образуются в результате взаимодействий посредством водородных связей и определяют надмолекулярную или более высокого порядка структуру. Такие ассоциации менее постоянны, чем в случае образования ковалентной связи, но описанные в настоящей заявке способы обеспечивают образование агрегатов с опознаваемой структурой, средняя молярная масса которых может быть исследована с использованием способов, указанных в настоящей заявке. «Водный раствор», как правило, имеет pH 7.
Следует понимать, что водный раствор может иметь форму геля. Гели согласно настоящему изобретению предпочтительно представляют собой водные растворы, то есть гидрогели. Гелевые композиции предпочтительно представляют собой гидратированные гидроколлоиды. Гидратированные гидроколлоиды могут быть и эластичными, и вязкими. Гидроколлоиды обычно образуют гель, когда предпочтительнее образуются внутри- или межмолекулярные водородные, чем водородные связи с водой, в достаточной степени для преодоления энтропийных затрат.
Гелеобразующий агент предпочтительно представляет собой полимер, который сам способен образовывать гидрогель в водном растворе и в комбинации с глюканом может повышать гелеобразующие свойства глюканового компонента.
Примерами предпочтительных гелеобразующих агентов являются агенты, полученные из целлюлозы, бактериальные или водорослевые гидрогели, альгинаты, геллановая камедь, а также полимеры целлюлозы и их производные, такие как карбоксиметилцеллюлоза, метилцеллюлоза, гидроксипропилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилметилцеллюлоза и фталат гидроксипропилметилцеллюлозы. Некоторые из таких гелей также включают дополнительные компоненты, такие как серебро. Таким образом, гелеобразующие агенты предпочтительно представляют собой полисахариды, отличные от глюкана. Гелеобразующие агенты предпочтительно представляют собой гидроколлоиды и подходящие гидроколлоиды могут быть белковой природы, а не на основе Сахаров. Во всех случаях гелеобразующие агенты могут представлять собой природные агенты, агенты, полученные на их основе с помощью химических или других способов обработки или полностью синтетические агенты.
В качестве гелеобразующих агентов можно применять камеди, такие как трагакантавая и ксантановая камедь, альгинат натрия, желатин и геллановая камедь. Вещество из этой группы, геллановую камедь, продукт бактериального происхождения, также известную под торговыми названиями AppliedGel, Phytagel или Gelrite, часто применяют в качестве загустителя, эмульгатора и стабилизатора. Геллановая камедь представляет собой анионную деацетилированную внеклеточную полисахаридную камедь с высокой молекулярной массой, получаемую в виде продукта ферментации по чистой культуры Pseudomonas elodea с тетрасахаридным повторяющимся звеном из одной α-L-рамнозы, одной β-D-глюкуроновой кислоты и двух β-D-глюкозных остатков. Тетрасахаридный повтор имеет следующую структуру: D-Glc(β1→4)D-GlcA(β1→4)D-Glc(β1→4)L-Rha(α1→3)]n. Тетрасахаридные звенья соединены друг с другом с помощью (α1→3)-гликозидной связи. Точная молекулярная формула геллановой камеди может слегка варьировать (например, в зависимости от степени, в которой глюкуроновая кислота нейтрализована с помощью различных солей). Геллановая камедь обладает характерными свойствами температурозависимого зависимого и катион-индуцированного гелеобразования. Существуют три основные формы продукта на основе геллановой камеди, которые были охарактеризованы и которые отличаются по 1) содержанию полисахаридов, 2) проценту O-ацетильных заместителей у полисахарида и 3) содержанием белка (в том числе остатков нуклеиновых кислот и других органических источников азота). Она доступна в двух формах (с высоким или низким содержанием ацильных групп). Ацильные групп оказывают значительное влияние на характеристики геля. Формы с высоким содержанием ацильных групп образуют мягкие, очень эластичные и нехрупкие гели, в то время как формы с низким содержанием ацильных групп образуют прочные, неэластичные и хрупкие гели. Геллановая камедь практически не токсична для крыс при введении в виде единичной высокой дозы (5 г/кг массы тела) с пищей или через зонд.
Такие продукты как карбоксиметилцеллюлоза или метилцеллюлоза относятся к группе гелеобразующих агентов, полученных из целлюлозы, которая представляет собой полимер β-D-глюкозы, который ориентирован - CH2OH-группами с образованием длинной неразветвленной цепи. Целлюлоза является основным структурным материалом растений. Целлюлоза может быть модифицирована с замещением некоторых или всех гидроксильных групп на другие группы, такие как метоксидные группы (-OCH3) и карбоксиметильную (-CH2-COOH) группы. Метилцеллюлозу получают синтетическим способом путем нагревания целлюлозы с каустическим раствором (например, раствором гидроксида натрия) и обработкой хлористым метилом. Могут быть получены различные виды метилцеллюлозы, в зависимости от числа замещенных гидроксильных групп. Карбоксиметилцеллюлоза (КМЦ) образуется в результате реакции целлюлозы со щелочью и хлоруксусной кислотой. Различные препараты КМЦ могут иметь различную степень замещения, но обычно она составляет 0,6-0,95 производных на мономерное звено. Молекулы КМЦ несколько короче, в среднем, чем нативная целлюлоза с неравномерным распределением заместителей, образующим области с высокой и низкой степенью замещения. Большинство КМЦ быстро растворяются в холодной воде и в основном их применяют для регулирования вязкости без гелеобразования, поскольку КМЦ при обычных концентрациях не образует гель даже в присутствии ионов кальция. Способность КМЦ регулировать вязкость позволяет применять ее в качестве загустителя, стабилизатора фазы и эмульсии и суспендирующего агента. КМЦ также можно применять с учетом ее водоудерживающей способности, так как она остается высокой даже при низкой вязкости, особенно при использовании ее в форме соли Ca2+. Карбоксиметилцеллюлозу (КМЦ) или целлюлозную камедь часто применяют в виде ее натриевой соли, карбоксиметилцеллюлозы натрия.
Альгинат является самым распространенным морским биополимером и после целлюлозы самым распространенным биополимером в мире. Основной источник альгината находится в клеточных стенках и во внутриклеточном пространстве бурых водорослей, таких как гигантские ламинарии (Macrocystis pyrifera). Альгинаты также синтезируют некоторые бактерии (например, виды Pseudomonas и Azotobacter). Альгинаты представляют собой соли и сложные эфиры альгиновой кислоты. Химическими компонентами альгината являются случайные последовательности цепей из β-D-маннуроновой и α-L-гулуроновой кислот, соединенных 1→4 связями. Альгинаты нерастворимы в воде, но легко поглощают воду. Применение альгината в качестве иммобилизующего агента в большинстве вариантов применений основано на его способности образовывать термостабильные прочные гели, которые могут образовываться и затвердевать при комнатной температуре. В большинстве случае используют образование альгинатного геля с ионами кальция.
Другими гелеобразующими агентами, применяемыми в соответствии с настоящим изобретением, являются, но не ограничены ими, карбомеры; гидрофильные полимеры, такие как полиэтиленоксид, сополимеры полиоксиэтилена-полиоксипропилена и поливиниловый спирт.
Комбинацию согласно настоящему изобретению можно применять для получения эффективных содержащих глюкан композиций в форме геля с использованием в качестве исходного вещества любого растворимого глюкана. Наблюдаемый синергетический эффект означает, что при данной концентрации глюкана композиция в форме геля будет демонстрировать необходимую активность. Растворимые глюкановые продукты известны специалисту в данной области, и некоторые из них являются коммерчески доступными. Глюкан обычно получают из дрожжей, предпочтительно из Saccharomyces cerevisiae. Основная молекулярная структура глюкана представляет собой обычно β-1,3-основную цепь (каркас, то есть цепь из молекул глюкозы, соединенных β-1,3 связями), в дополнение к β-1,3-боковым цепям (то есть цепь из по меньшей двух молекул глюкозы, соединенных β-1,3-связями) и точки связывания β-1,3,6-связи, в которых боковые цепи присоединяется к основной цепи. Кроме того, глюканы из дрожжей включают β-1,6-связи, которые быть связаны с к боковыми цепями или непосредственно с основной цепью. Также встречаются и другие типы связи, но на сравнительно низком уровне. Другие виды дрожжей, которые могут служить источником для глюкана, включают пивные дрожжи, Candida sp., например, Candida albicans, Candida cloacae, Candida tropicalis, Candida utilis, Hansenula sp., например, Hansenula wingei, Hansenula arni, Hansenula henricii и Hansenula americana, Histoplasma sp., Kloeckera sp., Kluyveromyces sp., например, Kluyveromyces lactis, Kluyveromyces fragilis, Kluyveromyces polysporus, Pichia sp., Rhodotorula sp., Saccharomyces sp., например, Kluyveromyces Saccharomyces delbruekii, Saccharomyces rosei, Saccharomyces microellipsodes, Saccharomyces carlsbergensis или различные штаммы Saccharomyces, такие как Saccharomyces cerevisiae R4 (NRRL Y-15903) и R4 Ad (ATCC No. 74181), Schizophyllum sp., Schizosaccharomyces sp., например, Schizosaccharomyces pombe, Torula sp. И Torulopsis sp.
Однако глюканы могут быть получены и из других подходящих источников, например, глюканы бактерий, грибов или злаков. Отсутствие гелеобразующей способности у бета-глюкана как такового может быть компенсировано способностью к гелеобразованию таких агентов, как КМЦ, как описано выше, с получением продукта с желаемыми свойствами для заживления ран. Терапевтическая активность различных глюканов хорошо известна в данной области, и композицию согласно настоящему изобретению можно применять для повышения активности глюканов в целом, в частности в заживлении ран, при этом, как было показано авторами настоящего изобретения, физическая форма и межмолекулярная структура глюканового продукта имеет особенное значение. Вне связи с какой-либо теорией, эмпирическое правило заключается в том, что чем выше усредненная молярная масса основной цепи глюкана, применяемого в композициях настоящего изобретения, тем более эффективные гели могут быть получены.
Боковые цепи гелеобразующего глюкана согласно настоящему изобретению обычно содержат 2 или более β(1,3)-связанных звеньев глюкозы. Согласно настоящему изобретению, одиночные молекулы, присоединенные к основной цепи, не рассматриваются как «боковые цепи».
Гелеобразующие глюканы, предпочтительно, имеют боковые цепи, например, состоящие из или по существу состоящие из β(1,3)-связанных глюкозных звеньев (например, боковые цепи из по меньшей мере 2, 5, 10 или 20 связанных остатков глюкозы). В дополнение к β(1,3)-связанным боковым цепям глюканы могут также иметь одну или более β(1,6)-соединенные боковые цепи. Изменяя структуру цепи, можно изменить характеристики конечного продукта. Существует много различных способов изменения глюканов, в том числе путем ферментативной обработки, применения кислот, таких как муравьиная кислота или соляная кислота, или различных оснований, а также с использованием других способов. Предпочтительными являются глюканы, обработанные кислотой (например, муравьиной кислотой) или с использованием фермента или любым другим подходящим способом для того, чтобы значительно уменьшить или устранить число повторяющихся (1,6)-связанных молекул глюкозы в составе глюкана. Такие (1,6)-связанные глюкозильные группы, как правило, встречаются в боковых цепях бета-глюканов, полученных из дрожжей. Полученные в результате глюканы содержат β(1,3)-основные цепи и β(1,3)-боковые цепи, которые присоединены к ним одной β(1,6)-связью, которая не отщепляются при указанной обработке.
Предпочтительные глюканы по существу не содержат повторяющихся β(1,6)-связанных остатков глюкозы. Одиночные (1,6)-связи в точках ветвления β(1,3,6)-точки ветвления) не образуют «повторяющиеся» β(1,6)-связанные глюкозильные звенья. «По существу не содержит» означает менее 6%, предпочтительно менее 4% и наиболее предпочтительно менее 3% от общего глюкозных звеньев.
Некоторые варианты обработки, такие как ферментативная обработка, могут оставлять в боковых цепях нерасщепленными до 4 бета-1,6-связанных, но обычно 2 бета-1,6-связанных звеньев глюкозы. Такие молекулы также «по существу не содержат» повторяющиеся бета-1,6-связанные звенья глюкозы.
Распределение связей в составе предпочтительных глюканов можно представить следующим образом:
|
β(1,3,6) относится к остаткам точки ветвления, которые соединены (1,3)-связью с основной цепью и участвуют в (1,6)-присоединении боковой цепи.
Глюкан может быть представлен в форме одной экстрагированной фракции, двух или более различных фракций с различными средними молекулярными массами.
Глюканы предпочтительно не дериватизированы в терминах химических модифицирующих групп.
Молярная масса глюканов может быть определена различными способами. В случае растворимого глюкана молярную массу удобно оценивать с помощью анализа SEC-MALS-RI (эксклюзионная хроматография с детекцией многоуглового светорассеяния и показателя преломления), такой анализ позволяет определить усредненное значение молярной массы (MW) для образца, а также распределение различных молекулярных массы в образце. В настоящем изобретении усредненную молекулярную массу (Mw) определяли следующим образом:
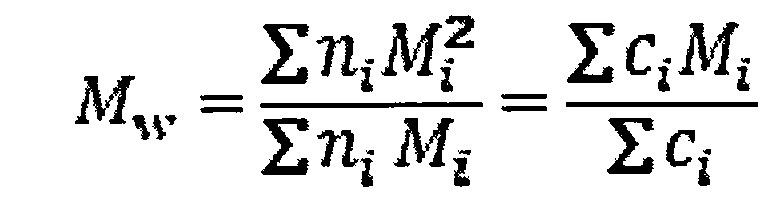 ,
,
где ni число молекул с молярной массой Mi. Концентрация по массе ci молекул с молярной массой Mi пропорциональна молярной массе Mi и числу молекул ni.
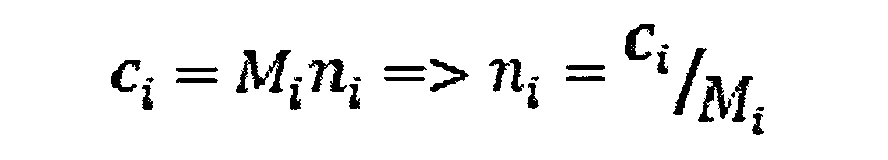
Концентрацию по массе для каждого отрезка на хроматограмме измеряют с помощью детектора показателя преломления, а молярную массу для каждого отрезка на хроматограмме измеряют с помощью детектора многоуглового светорассеяния в сочетании с детектором угла преломления. Расчеты основаны на теории светорассеяния.
В частности, средняя молекулярная масса (для одиночных цепей) определяют с помощью SEC-MALS-RI в DMAc с 0,5% LiCl (диметилацетамид с 0,5% хлоридом лития), предполагая, что значение dn/dc для глюкана в этом растворителе составляет 0,12. Растворитель DMAc/LiCl полностью растворяет указанный глюкан в форме одиночной цепи, и таким образом последующий анализ с помощью SEC-MALS-RI с применением DMAc с 0,5% LiCl в качестве элюента позволяет оценить распределение молекулярных масс на уровне одной цепи. В целом, анализ глюкана в DMAc/LiCl включает растворение сухого глюкана в растворителе в концентрации от примерно 3 мг/мл при перемешивании раствора при комнатной температуре в течение ночи и нагревании его при 100°C в течение 1 ч перед анализом с помощью SEC-MALS-RI с применением колонок PIgelPLgel Mixed-A LS и DMAc/c 0,5% LiCl в качестве элюента. Усредненная молярная масса для глюкана в форме одной цепи составляет предпочтительно от 15000 до 50000 г/моль, более предпочтительно от 25000 до 45000 г/моль, наиболее предпочтительно от 30000 до 40000 г/моль.
В водном растворе усредненная молекулярная масса для структур в основном более высокого порядка и агрегатов глюкана составляет предпочтительно 4-20×105 г/моль, более предпочтительно 5-15×105 г/моль и наиболее предпочтительно 6-12×105 г/моль. Такие средние значения предпочтительно рассчитывают, исключая очень большие агрегаты, то есть те, молекулярная масса которых выше 1,0×107 г/моль. Анализ глюкана в водном растворе включает разбавление гель-раствора до примерно 3 мг/мл в 0,1 M NaNO3/0,02% NaNa3, нагревание до 100°C в закрытой стеклянной пробирке в течение 30 мин, охлаждение до комнатной температуры, фильтрацию через 0,2 мкм шприцевой фильтр и последующий анализ методом SEC-MALS-RI с использованием колонок TSKgel G5000 PWXL + TSKgel G4000 PWXL и 0,1 M NaNO3/0,02% NaN3 в качестве элюента. Схожая схема с использованием, например, 0,05 M Na2SO4/0,01 M ЭДТА в качестве растворителя/элюента дает эквивалентные результаты. Сопоставление значений молярной массы для одиночных цепей и структур более высокого порядка/агрегатов в водном растворе дает хорошее представление о молекулярной и надмолекулярнрй структуре предпочтительных глюканов, применяемых в составах согласно настоящему изобретению.
Описанные выше глюкановые гели являются примерами глюканов в соответствии с настоящим изобретением. Такие глюкановые продукты характеризуются тем, что они существуют в форме геля при 25°C и при pH между 4 и 8. Такие глюкановые гели также характеризуются профилем вязкости, примером которого является температура плавления гелей (гель-золь) выше 30°C и примерно до 80°C, предпочтительно выше нормальной температуры тела.
Точку плавления геля глюканового продукта, т.е. температуру перехода гель→золь, удобно определять путем измерений небольших колебаний деформации с использованием реометра Stresstech HR или подобного прибора, и изучения изменений вязкоупругих свойств при охлаждении (70→10°) и нагреве (10→70°C) раствора глюкана. Другим способом определения приблизительной температуры плавления геля является измерение вязкости геля (например, с использованием ротационного вискозиметра) при последовательном увеличении температуры до момента по существу утраты вязкости и превращения геля в раствор.
Предпочтительные глюканы согласно настоящему изобретению вызывают экспрессию ФНОα и CXCL2/MIP2α в мышиных перитонеальных макрофагах. Слабая индукции ФНОα проявляется также в миелоидных дендритных клетках человека, полученные из моноцитов периферической крови.
Влияние предпочтительных бета-глюканов на высвобождение ФНОα является дозозависимым и, по-видимому, уменьшается при концентрации глюкана выше определенного порогового значения, например,. 2-4 мкг/мл, в случае клеточной линии RAW, сверхэкспрессирующей бета-рецептор глюкана Dectin-1. Продуктам настоящего изобретения свойственна индукция ФНОα и CXCI-2 от умеренной до низкой степени. Как ФНОα, так и CXCL-2 играют важную роль в заживлении ран. Мышиный хемокин CXCL2 стимулирует миграцию клеток и ангиогенез, и он может быть использован в качестве суррогатного маркера ангиогенной активности в воспалительной грануляционной ткани.
Предпочтительные глюканы согласно настоящему изобретению не вызывают значительного усиления экспрессии IP-10 (CXCI-10). IP-10 является членом семейства хемокинов альфа- или семейства хемотаксических цитокинов цистеин- аминокислота X -цистеин (CXC). Высокий уровень экспрессии IP-10 был обнаружен при ряде хронических воспалительных заболеваний у человека, в том числе при псориазе, распространенном воспалительном заболевании кожи. Пациенты в целом демонстрируют аномальный ответ, связанный с заживлением ран, характеризующийся более интенсивной воспалительной фазой и длительной и дезорганизованной грануляционной фазой с нарушением формирования кровеносных сосудов. Глюканы согласно настоящему изобретению не должны усиливать ЛПС-индуцированную экспрессию IP10 в дендритных клетках человека, и предпочтительно они ингибируют ЛПС-индуцированную экспрессию IP-10 в макрофагах, взятых у мышей db/db. Это означает, что предпочтительные глюканы в соответствии с настоящим изобретением запускают полезные элементы процесса заживления ран, и при этом они подавляют ингибиторы, тем самым удлиняя фазу заживления.
Кроме того, гелевые глюканы согласно настоящему изобретению предпочтительно активируют систему комплемента.
Композиции, содержащие глюкан, согласно настоящему изобретению высокоэффективны in vivo в качестве ранозаживляющих агентов, как показано в Примерах.
Глюкан, применяемый в композиции согласно настоящему изобретению, может представлять собой более эффективный вариант, в частности, растворимые бета-глюканы, обладающие способностью индуцировать дифференцировку миелоидных дендритных клеток человека по направлению к воспалительному фенотипу, значительно стимулировать секрецию ФНО-альфа, а также индуцировать продукцию G-CSF и IL-10 дендритными клетками. Во всех случаях секреция СХСl-10 должна сохраняться по существу на базовом уровне и на нее не оказывают влияние способы обработки, описанные в настоящей заявке, т.е. объединение с гелеобразующим агентом. Этот факт является важным, и он демонстрирует, что предпочтительный глюкан стимулирует секрецию специфического набора или комбинации цитокинов. Предпочтительный глюкан может также стимулировать макрофаги, взятые у мышей с диабетом (db/db) к секреции PGE 2 и GM-CSF.
Глюкановый гель, применяемый в Примерах в соответствии с настоящим изобретением, представляет собой гель на водной основе, и хотя гелевая форма может быть подтверждена путем визуального осмотра, профиль неньютоновской вязкости и псевдопластичная и тиксотропная природа глюканового геля может быть также определена путем измерения вязкости, например, с помощью ротационного вискозиметра. 2% глюкановый гель, используемый в Примерах, имеет вязкость по меньшей мере 1000 сПз, предпочтительно по меньшей мере 1500 сПз, измеренную при 25°C и скорости вращения 10 об./мин с использованием программируемого вискозиметра Brookfield DV-II+ Pro с малым адаптером для образцов и шпинделем SC4-31 (соответствует скорости сдвига 3,40 сек-1). Измерить вязкость такого псевдопластического и тиксотропного геля можно с помощью повышения/понижения скорости (англ. up-down rate ramp) например, начиная с 2 об/мин с увеличением до 10 об/мин с шагом 2 об/мин и с последующим понижением скорости до исходного значения с шагом 2 об/мин. Данные такого эксперимента могут показать как псевдопластические (снижение вязкости с увеличением скорости сдвига), так и тиксотропные (снижение вязкости в момент сдвига) характеристики геля, а также позволяют измерить, например, вязкость при 10 об/мин.
Глюканы с указанными выше предпочтительными свойствами для применения в композициях согласно настоящему изобретению могут быть получены любым из двух способов, описанных ниже и более подробно в Примерах. В каждом случае берут раствор молекул глюкана, а затем либо подвергают его нагреванию (или действию другого источника энергии), либо воздействуют на него химическим агентом, разрушающим существующие межмолекулярные водородные связи. Затем такой продукт быстро охлаждают до образования геля или добавляют агент, способствующий перестройки водородных связей между цепями глюкана. Как обсуждается ниже, гелеобразующий агент может быть добавлен до стадии обработки для диссоциации межцепочечных (и, возможно, внутрицепочечных) водородных связей. В альтернативном варианте гелеобразующий агент может быть добавлен после этой стадии, но до стадии обработки, который приводит к образованию водородных связей и, следовательно, образованию геля.
Соответственно в следующем аспекте настоящее изобретение относится к способу получения гелевой композиции, описанной в настоящей заявке, который включает:
а) обработку водного раствора молекул глюкана, возможно вместе с гелеобразующим агентом, с обеспечением диссоциации водородных связей молекул глюкана;
б) возможно добавление гелеобразующего агента к продукту, полученному на стадии а), и затем
в) обработку водного раствора для перестройки водородных связей молекул глюкана. В частности, водородные связи образуются между цепями/молекулами глюкан, эти связи «перестраиваются», поскольку после стадии (а) количество водородных связей значительно уменьшается и вновь увеличивается на стадии (в). Они не «перестраиваются» в том смысле, что структура водородных связей в исходном материале восстанавливается в первоначальном состоянии, вместо этого образуется другая система связей.
Согласно предпочтительному способу получения композиции, как определено выше, водный раствор молекул глюкана, нагревают до температуры 120-130°C, предпочтительно 120-125°C, и выдерживают при этой температуре в течение 10-30 минут, после этого раствор глюкана охлаждают до температуры 35-50°C, предпочтительно 35-40°C, в течение периода времени не более 80 минут, предпочтительно менее 60 минут, например, 50-60 минут. При меньших объемах (например, менее 100 литров) можно использовать более короткое время охлаждения (например, 25-50 минут); приведенные выше данные относятся к объему исходного продукта, равному 220 литров. Охлаждение в течение указанного выше периода времени считается быстрым, поскольку оно не основано на возвращении к комнатной температуре без постороннего дополнительного воздействия. Таким образом, в результате этого образуется гель с неупорядоченной (произвольной) структурой - «стог сена», в отличие от типичной тройной спиральной структуры «отожженных» цепей бета-глюкана. В соответствии с этим этапом нагревания и охлаждения, препарату растворенного бета-глюкана сообщают энергию (активизируют) для того, чтобы по существу солюбилизировать глюкановый гель, тем самым нарушить существующие структуры более высокого порядка, и вызвать случайную организацию с большой долей свободных одноцепочечных молекул.
При быстром охлаждении молекулы «замораживаются» в новой молекулярной конформации в результате быстро возникающих межмолекулярных взаимодействий, и при этом продукт не образует в основном тройные спиральные структуры. Молекулы, таким образом, фиксируются в более случайных положениях.
Нагревание предпочтительно осуществляют в изолированном резервуаре при перемешивании, при этом объем такого резервуара должен быть достаточно большим для хранения всей партии продукта, с кожухом или аналогичной структурой для обеспечения возможности нагревания резервуара снаружи. Объем партии, емкость системы нагревания, отношение поверхности к объему резервуара и эффект перемешивания должны быть подобраны таким образом, чтобы вся партия могла нагреваться до указанной температуры в течение допустимого периода времени, и при этом осуществлялся однородный нагрев всей партии. В альтернативном варианте этап активации происходить после того, как продукт перенесен в конечный резервуар, либо с помощью нагревания в автоклаве или с помощью альтернативных форм активации, например, с помощью ультразвука или микроволн.
Если этап активации осуществляют для всей партии в резервуаре, то активное охлаждение предпочтительно проводить в том же самом резервуаре, и для этого необходима возможность использовать кожух резервуара для охлаждения поверхности резервуара. В этом случае также объем партии, емкость системы нагревания, отношение поверхности к объему резервуара и эффект перемешивания должны быть подобраны таким образом, чтобы охлаждение происходило в течение заданного времени при однородном охлаждении всей партии. После такого начального охлаждения должно следовать заполнение продуктом конечных контейнеров и последующее охлаждение контейнеров до комнатной температуры. В предпочтительном варианте стадию охлаждения осуществляют непосредственно после стадии нагревания, то есть непосредственно (насколько это осуществимо с использованием соответствующего оборудования) после того, как глюкан был выдержан при повышенной температуре в течение 10-30 минут.
Подходящая методика проведения нагрева и охлаждения в процессе производства описана в Примере 1.
Если стадию активации осуществляли в конечных контейнерах, эти контейнеры должны быть охлаждены до комнатной температуры в течение периода времени, определенного выше.
Стадии нагревания и охлаждения, описанные выше, могут быть повторены, например, еще один раз.
Концентрация глюкана в водном растворе до стадии нагрева и быстрого охлаждения предпочтительно составляет 1,5-6%.
Описанная выше стадия нагрева и охлаждения может быть осуществлена для любого водного раствора молекул глюкана;
предпочтительные глюканы, в том числе глюканы с модифицированным ветвлением, описаны выше, и раствор глюкана предпочтительно представляет собой раствор глюкана дрожжей. Исходи вещество на стадии нагревания и охлаждения может быть само представлено в форме геля, при этом нагревание обеспечивает переход в золь, а охлаждение приводит к образованию другой структуры геля, отличной от исходного вещества.
Усредненная молярная масса (Mw) глюканов в исходном растворе, предпочтительно является высокой, предпочтительно, для одноцепочечной формы усредненная молярная масса глюкана в растворе составляет более 15000, более предпочтительно более 20000, наиболее предпочтительно более 25000 г/моль. Подходящие способы для определения значений массы приведены выше.
Глюканы обычно выделяют из их источника (например, грибов, дрожжей или злаков) в форме частиц, но способы производства растворимых форм из частиц глюкана известны в данной области и включают обработку кислотами или щелочами, например, этап формолиза, описанный в международной публикации WO 95/30022. Растворимые глюкановые продукты из злаков, таких как ячмень, можно приобрести в Sigma Chemical. Исходное вещество в форме частиц, например, такое как может быть получено в соответствии с протоколом в Примере 1 из международной публикации WO 95/30022, предпочтительно солюбилизируют путем нагревания в муравьиной кислоте в течение по меньшей мере двух часов. Формолиз, осуществленный с использованием в качестве исходного вещества глюкана в форме частиц, может привести к селективному удалению β(1,6)-связанных глюкозильных боковых цепей, а также к солюбилизации частиц глюкана.
Указанный выше способ изготовления может также включают предварительную стадию нагрева, до описанной выше стадии нагрева и быстрого охлаждения, стадию, на которой обработанный муравьиной кислотой продукт кипятят (>100°C) в течение по меньшей мере 30 минут. После охлаждения продукта, его предпочтительно обрабатывают для удаления твердых частиц с помощью стандартных способов, известных в данной области, например, центрифугированием или фильтрацией.
Частицы глюкана, которые обрабатывают с получением растворимой формы для дальнейшей обработки в соответствии с настоящим изобретением, в предпочтительном варианте получены из клеточных стенок, в частности дрожжевых клеточных стенок, содержащих также белковые компоненты и другие остатки, такие как маннан, хитин, которые удаляют, например, путем промывки.
Одним из примеров подходящего дрожжевого глюканового продукта в форме частиц является продукт производства Biotec Pharmacon ASA, получаемый из пекарских дрожжей (Saccharomyces cerevisiae) и известный как NBG Cos®. Другие примеры сырьевого продукта глюкана в форме частиц, представляют собой цельные частицы глюкана, как, например, продукт Imprime WGP™. NBG Cos® представляет собой природный недериватизированный (в смысле химических модифицирующих групп) β(1,3)/(1,6)-глюкан в форме частиц, который, как было показано с помощью ЯМР и химического анализа, состоит из полимеров, бета-1,3-связанной D-глюкозы, содержащей боковые цепи из бета-1,3 и бета-1,6-связанной D-глюкозы.
В качестве альтернативы описанному выше протоколу, такой же исходный раствор молекул глюкана можно обработать агентом, обеспечивающим диссоциацию водородных связей между глюкановыми цепями, с последующей обработкой агентом, обеспечивающим восстановление межцепочечных водородных связей.
Одним из таких агентов, способным растворить водородные связи между ОН-группами в цепи полиглюкозы, является гидроксид натрия (NaOH) в достаточной концентрации, который депротонирует многочисленные OH-группы в цепи. Это приводит к полной диссоциации всех межмолекулярных связей, характерных для таких глюканов с высокой молекулярной массой, в результате чего происходит случайная организация цепей в растворе. При нейтрализации раствора добавлением кислоты для нейтрализации щелочи OH-группы восстанавливаются, и между цепочками могут устанавливаться новые водородные связи.
При использовании NaOH в качестве агента обычно необходимо добавление, например, 2M раствора NaOH до конечной концентрации выше 50 мМ, или более предпочтительно приблизительно 150 мМ, к концентрации растворимого глюкана в водном растворе, равной 1-6%, более предпочтительно 1,5-4% и наиболее предпочтительно 2-4%. Для нейтрализации раствора можно добавить эквимолярное количество, например, 2М соляной кислоты (HCl) при перемешивании в течение короткого периода, достаточного для обеспечения эффективной нейтрализации, например, в течение менее минуты, при объеме, например, 1000 мл, после чего раствор оставляют для установления конформации геля, например, на 1-10 минут для объема 1000 мл. NaOH можно заменить на любой другой агент, способный осуществлять диссоциацию водородных связей, а HCl можно заменить на любой другой агент, способный быстро восстанавливать водородные связи с образованием геля со структурой типа «стог сена». Специалисту известны другие агенты, способные разрушать, а затем восстанавливать водородные связи, в этом отношении особенно подходящими являются основания и кислоты, поскольку их можно легко уравновесить друг с другом для нейтрализации воздействия агента, разрушающего водородные связи. Можно применять другие сильные кислоты, такие как муравьиная кислота или серная кислота. Кроме того, в качестве возможных агентов для депротонирования и разрушения водородных связей можно применять другие соли щелочных металлов, включающие, но не ограниченные перечисленными: гидроксид калия, гидроксид лития и гидроксид кальция, а также можно применять так называемые сверхоснования, такие как гидрид натрия или амид натрия. Для нейтрализации раствора с целью восстановления водородных связей можно применять любую кислоту с соответствующим качеством, включая, без ограничений, фосфорную кислоту, уксусную кислоту и лимонную кислоту. Мочевину или формамид также широко применяют для разрушения водородных связей, и их можно применять в этом процессе. Природа восстанавливающего агента должна соответствовать требованиям, установленным ниже в настоящей заявке, и в частности присутствию солей.
Следует иметь в виду, что в системе с участием крупных и сложных органических молекул, не является целесообразным или необходимым разрушение всех водородных связей или обеспечение участия всех молекулярных цепей в образовании водородных связей после обработки, обеспечивающей восстановление водородных связей. Однако условия обработки должны быть такими, чтобы они могли обеспечить радикальное изменение организации и степени водородных связей в растворе глюкана в целом. Специалисту в данной области известно о воздействии на раствор глюкана, например, 150 мМ NaOH, и соответствующим образом могут быть выбраны концентрации других агентов, разрушающих водородные связи. Задача второго этапа, условия которого делают возможным восстановление водородных связей, заключается в эффективной нейтрализации или обращении влияния на возможное образование межмолекулярных электростатических взаимодействий, вызванного добавлением агента, разрушающего водородный связи. Таким образом, природа и концентрация такого второго агента будет зависеть от выбора агента, разрушающего водородные связи.
В промышленном процессе отдельные стадии удобно проводить в резервуаре, достаточно большом для хранения всей партии продукта.
Стадии разрушения и последующего восстановления водородных связей, как описано выше, могут быть повторены, например, еще один раз.
Композиция предпочтительно содержит 0,1-6% глюкана в водном растворе, предпочтительно композиция содержит 0,2-2% глюкана в водном растворе. Использование различных концентраций, несомненно, зависит от целей и различных способов введения. Гелеобразующий агент или агент, обеспечивающий вязкость, или соответствующую смесь таких агентов обычно присутствует в количестве 0,2-3%, предпочтительно 0,25-2%, более предпочтительно 0,75-1,75%, наиболее предпочтительно 1-1,5% от массы композиции.
Для облегчения образования геля и повышения вязкости можно применять другие гелеобразующие агенты, такие как, но не ограничиваясь ими, аравийска камедь, агар, акриловая кислота и ее производные, полиакриловая кислота и ее производные, такие как полибутилметакрилат и полиметакриловая кислота, полиметакрилат, аскорбил пальмитат, карбомер, карнаубский воск, геллановый гель, альгиновая кислота и соответствующие соли, производные целлюлозы, такие как ацетатфталат целлюлозы, кроскармеллоза натрия, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, этилцеллюлоза и родственные соединения, карбоксиметилцеллюлоза и ее соли, фталат гидроксипропилметилцеллюлозы, фталат гипромеллозы, цетиловый спирт и его производные, микрокристаллический воск, полоксамер, полиэтиленгликоль, полиуретан, поливинилацетат, поливинилацетат фталат, поливиниловый спирт, силиконовый каучук и производные, шеллак, производные триглицеридов и их комбинации
Композиция может включать увлажнитель или смягчающий агент, такой как, но не ограничиваясь перечисленными, глицерин, пропиленгликоль, триацетин, циклометикон, полидекстроза и их комбинации.
Примерами гелевой комбинации в соответствии с настоящим изобретением являются 1 или 2% растворимого глюкана, смешанного с высокомолекулярной карбоксиметилцеллюлозой при конечной концентрации последней 1 или 1,5%. Композиция в форме геля может быть составлена путем добавления соответствующего количества КМЦ в 1 или 2% водный раствор глюкана. После полного растворения КМЦ композицию нагревают до температуры примерно 100°C или выше и быстро охлаждают с образованием геля с соответствующими свойствами.
Другим примером гелевого состава является 2% глюкан, смешанный с геллановым гелем в конечной концентрации 0,3%, при этом раствор глюкана нагревают до примерно 100°C или выше, и добавляют соответствующее количество сухого порошка геллановой камеди. Порошок оставляют для растворения и охлаждения до примерно 50°C, после чего добавляют CaCl2 до конечной концентрации приблизительно 5 мМ, чтобы вызвать гелеобразование. Затем раствор быстро охлаждают для стабилизации образовавшегося геля.
Третьим примером гелевой композиции является 0,5% глюкан, смешанный с геллановым гелем в конечной концентрации 0,5%, при это раствор глюкана нагревают до примерно 100°C или выше и добавляют соответствующее количество сухого порошка геллановой камеди. Порошок оставляют для растворения и охлаждения до примерно 50°C, после чего добавляют CaCl2 до конечной концентрации приблизительно 5 мМ, чтобы вызвать гелеобразование. Затем раствор быстро охлаждают для стабилизации образовавшегося геля.
В четвертом примере гелевая комбинация представляет собой 1% глюкан, смешанный с высокомолекулярной карбоксиметилцеллюлозой и глицерином, при конечной концентрации последних 1 и 1,5%, соответственно. Композиция в форме геля может быть составлена путем добавления соответствующего количества КМЦ в 1 водный раствор глюкана. После полного растворения КМЦ композицию нагревают до температуры выше или примерно 100°C и быстро охлаждают с образованием геля с соответствующими свойствами.
Композиции, содержащие глюкан, согласно настоящему изобретению являются эффективными терапевтическими агентами, и в еще одном аспекте настоящее изобретение относится к композициям, описанным в настоящей заявке, для применения в терапии, в частности, для лечения заболеваний, при которых субъект нуждается в системном или местном повышении иммунного ответа, например, в случаях, когда имеется повреждение тканей или инфекции. Настоящие композиции, в частности, полезны для облегчения заживления ран или язв и при лечении мукозита слизистой оболочки полости рта. Они также применимы для лечения рака или уменьшения размера опухоли.
Соответственно, в еще одном аспекте настоящее изобретение обеспечивает способ облегчения заживления ран или язв, или способствующий лечению мукозита или рака полости рта, или уменьшению размера опухоли у субъекта, нуждающегося в этом, причем указанный способ включает введение указанному субъекту композиции, содержащей глюкан, по настоящему изобретению, как описано в настоящей заявке.
Предпочтительно глюкан вводят перорально. Предпочтительно глюкан вводят в дозе от 5 до 200 мг/кг/день, более предпочтительно от 20 до 100 мг/кг/день.
Указано, что способ согласно настоящему изобретению «облегчает/способствует» заживлению ран или язв, так как некоторые раны или язвы излечиваются естественным способом, тогда как другие могут не излечиваться, но композиции настоящего изобретения, как было показано, ускоряют заживление ран и язвы. В некоторых случаях заживление может не произойти удовлетворительным образом без обработки. Примером такой раны, которая требует обработки для излечения, является диабетическая язва стопы. При таком симптоме у пациента развиваются раны, причиной которых является сахарный диабет. В связи тем, что первопричина часто не поддается лечению, и в связи с тем, что такие раны формируются на стопе пациентов, эти язвы не заживают сами по себе и вызывают значительные проблемы у пациентов, которые обычно заканчиваются ампутацией стопы.
Подходящие фармацевтические композиции могут содержать глюкан и гелеобразующий агент, как определено выше, и один или более фармацевтически приемлемых разбавителей или носителей, предпочтительно воду и также могут содержать один или более физиологически приемлемых стабилизаторов или других разбавителей или носителей. Композиции могут быть для удобства приготовлены в любой лекарственной форме для топического введения. Дозированные формы для локального введения могут представлять собой кремы, лосьоны, растворы, гели, мази, пасты, аэрозоли, пленки и т.п. В предпочтительном варианте гелевые композиции по настоящему изобретению подходят для хранения и введение из тюбика, например, пластикового тюбика.
В некоторых вариантах композиции, описанные в настоящей заявке, представлены в форме мази. Основа для мази может представлять собой масляную основу, эмульгируемую основу, эмульсионную основу или водорастворимую основу. В других вариантах композиции по настоящему изобретению представлены в форме крема. Кремы могут представлять собой вязкие жидкости или полутвердые эмульсии, либо типа «масло-в-воде», либо типа «вода-в-масле». Основа для крема может быть водовымываемой и может содержать содержат масляную фазу, эмульгатор и водную фазу. В других вариантах композиции по настоящему изобретению представлены в форме лосьона. Лосьоны могут быть приготовлены в виде суспензии твердых частиц и содержать суспендирующие агенты для повышения степени дисперсности. Композиции согласно настоящему изобретению могут быть также изготовлены в форме паст. Пасты представляют собой полутвердые лекарственные формы, в которых активное вещество суспендировано в подходящей основе. В зависимости от природы применяемой основы, пасты разделяют на жирные пасты или пасты, полученные на основе однофазных водных гелей.
В некоторых вариантах композиции образуют пленку на поверхности раны. Для облегчения образования пленки применяют пленкообразующие агенты, такие как, но не ограничиваясь перечисленными, акриловая кислота и ее производные, полиакриловая кислота и ее производные, такие как полибутилметакрилат и полиметакриловая кислота, полиметакрилат, аскорбил пальмитат, карбомер, карнаубский воск, производные целлюлозы, такие как ацетатфталат целлюлозы, кроскармеллоза натрия, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, этилцеллюлоза и родственные соединения, фталат гидроксипропилметилцеллюлозы, фталат гипромеллозы, цетиловый спирт и его производные, микрокристаллический воск, полоксамер, полиэтиленгликоль, полиуретан, поливинилацетат, поливинилацетат фталат, поливиниловый спирт, силиконовый каучук и производные, шеллак, производные триглицеридов и их комбинации.
Композиции могут также включать по меньшей мере один агент пластификатор-пленкообразователь, который может служить для размягчения полимерной пленки, образованной пленкообразующим агентом, таким образом, чтобы она была достаточно гибкой, чтобы двигаться вместе с участком тела, на который она нанесена, без растрескивания или отшелушивания.
В некоторых вариантах композиции придают форму пленки перед наложением на рану или они могут наноситься на непосредственно рану, где они полимеризуются на месте. «Наносимая» пленка полимеризуется при нанесении на кожу и она может наноситься в виде крема или мази из тюбика, шарикового аппликатора, в виде спрея и тому подобное. Пленка может образовываться за счет включения силиконового каучука во внешнюю фазу. При смешивании с внутренней фазой образующейся эмульсии дают высохнуть и она формирует «нанесенную» пленку, которая полимеризуется при нанесении на рану. Эмульсия может наноситься на подложку для достижения желаемой толщины.
В других случаях, композиции могут быть представлены в виде пластины или пластыря. Пластырь может иметь различную толщину. Пластырь может также быть вырезан по форме, в целом соответствующей краям раны.
В некоторых вариантах пластыри могут включать фармацевтически приемлемый адгезивный материал, который служит для прикрепления пластыря на рану или кожу. Пластырь может также содержать защитный слой.
Композиции можно наносить непосредственно на рану или на подложку (основу) для нанесения на рану. С композициями, описанными в настоящей заявке, можно применять любую подложку (носитель). Например, можно применять тканые, нетканые, трикотажные, пенопластовые и клейкие подложки. Также можно применять абсорбирующие или не абсорбирующие подложки. В некоторых вариантах композиции разбрызгивают или распределяют на подложке. В других вариантах подложку пропитывают композицией.
Раневые повязки можно применять в течение любого подходящего периода времени. Например, их можно применять в течение одного дня, в течение нескольких дней, в течение нескольких недель или нескольких месяцев и более. В целом раневые повязки наносят повторно до заживления раны. Продолжительность лечения раны с помощью повязок, описанных в настоящей заявке, может зависеть от таких факторов, как тип раны, подлежащей лечению, местоположение раны и форма применяемой композиции. В зависимости от используемой формы композиция может быть удалена с помощью воды, стерта, или снята с раны.
Композиции, описанные в настоящей заявке, можно применять для лечения ран любого происхождения. Например, раны могут быть вызваны ожогами, инфекцией, ишемией, лимфедемой, новообразованиями, невропатией, радиационным повреждением, хирургическими процедурами, венозной недостаточностью и травмами. Композиции согласно настоящему изобретению в особенности применимы для облегчения заживления раны или язвы.
Кроме того, изобретение обеспечивает физическую основу, например любое медицинское изделение или материал для медицинского применения, в котором содержится, например, которое пропитано композицией согласно настоящему изобретению, как определено в настоящей заявке.
Одной из важных характеристик глюканов таких композиций является их способность удерживать воду и способность к гелеобразованию даже в отсутствие таких условий, как отличное от нейтрального значения pH или присутствие катионов, которые могут способствовать образованию геля. Некоторые бета-глюканы образуют гели при таких низких концентрациях, как 1%, но в большинстве случаев при концентрации 2-4%. Растворимый бета-глюкан из дрожжей, как предпочтительный глюкан, описанный в настоящей заявке, образует тиксотропный и псевдопластический гель при растворении в водном растворе при концентрации 1-6% в диапазоне pH 3-7, независимо от присутствия катионов.
Термины «рана» и «язва» охватывают поверхностные раны, хирургические раны, ожоги, открытые переломы, язвы на ногах, афтозные язвы, диабетические язвы и пролежни. Раны могут образовываться в результате травмы, хирургического вмешательства или заболевания, но все они характеризуются потерей целостности кожи, при этом кожа может быть разорвана, срезана или проколота, и требуется возобновление роста кожи для восстановления целостности кожи. Композиции настоящего изобретения, как было показано, ускоряют заживление раны. Как показано в Примерах, эффективность может быть легко продемонстрирована путем измерения размера открытой раны.
Композиции предпочтительно применять локально, например, в виде геля, пластыря, лосьона, мази, крема для чрескожного введения и т.п. Композиции можно применять раз в день, чаще или реже, например, два раза в день или через день, и в течение времени, определенного врачом или в некоторых случаях самим пациентом, или другим лицом службы здравоохранения. Продолжительность лечения зависит от природы и тяжести раны или язвы, при этом улучшение состояния в целом может быть легко определено путем визуальной проверки.
Местное введение включает введение в полость рта, для доставки на слизистую оболочку полости рта можно применять подходящие гели, таблетки, пасты, аэрозоли и т.д., как известно в данной области.
Композиции настоящего изобретения находят применение в медицине для человека и в ветеринарии. При использовании в настоящей заявке термин «медицинский» включает применение в ветеринарии и другие аспекты, связанные с ветеринарией. Хотя люди являются предпочтительными субъектами лечения, другие животные, которых можно успешно лечить, включают сельскохозяйственных и домашних животных.
Композиции согласно настоящему изобретению можно наносить или включать в физический/твердый носитель, такой как пластырь, повязка, гипс, бандаж, пленка, марли и т.д., которые можно накладывать область раны или язвы, и такие продукты представляют собой дополнительный аспект настоящего изобретения.
Следует понимать, что предпочтительные характеристики, применимые к одному из аспектов или вариантов осуществления изобретения, применяются, с соответствующими изменениями, ко всем аспектам и вариантам осуществления.
В целом, рану промывают физиологическим раствором или стерильной водой, и очищают рану от некротических тканей и огрубевших участков. После этого на рану наносят композицию согласно настоящему изобретению. Форма композиции может зависеть от таких факторов, как площадь поверхности раны, которую необходимо охватить, тип раны, подлежащей лечению, и расположение раны. Например, композиция в форме геля, крема или мази можно применять для лечения язв и ожогов, тогда как марлю, пропитанную раствором композиции согласно настоящему изобретению, можно применять для хирургических или травматических ран.
Композиция согласно настоящему изобретению может быть представлена в составе наборов. Наборы, описанные в настоящей заявке, могут включать одну или более композицию согласно настоящему изобретению и инструкции по применению. Также в набор может входить одна или более подложек. В некоторых случаях также может быть предоставлен аппликатор для нанесения композиции. Композиции, включенных в наборы, могут иметь одинаковые топическую форму или различные топические формы. Можно применять одно и то же количество или различные количества композиции. Подложки могут быть одинакового или различного типа. Подложки также могут быть различной формы и толщины.
Ниже приведено дополнительное описание изобретения с помощью следующих неограничивающих Примеров и Фигур, где:
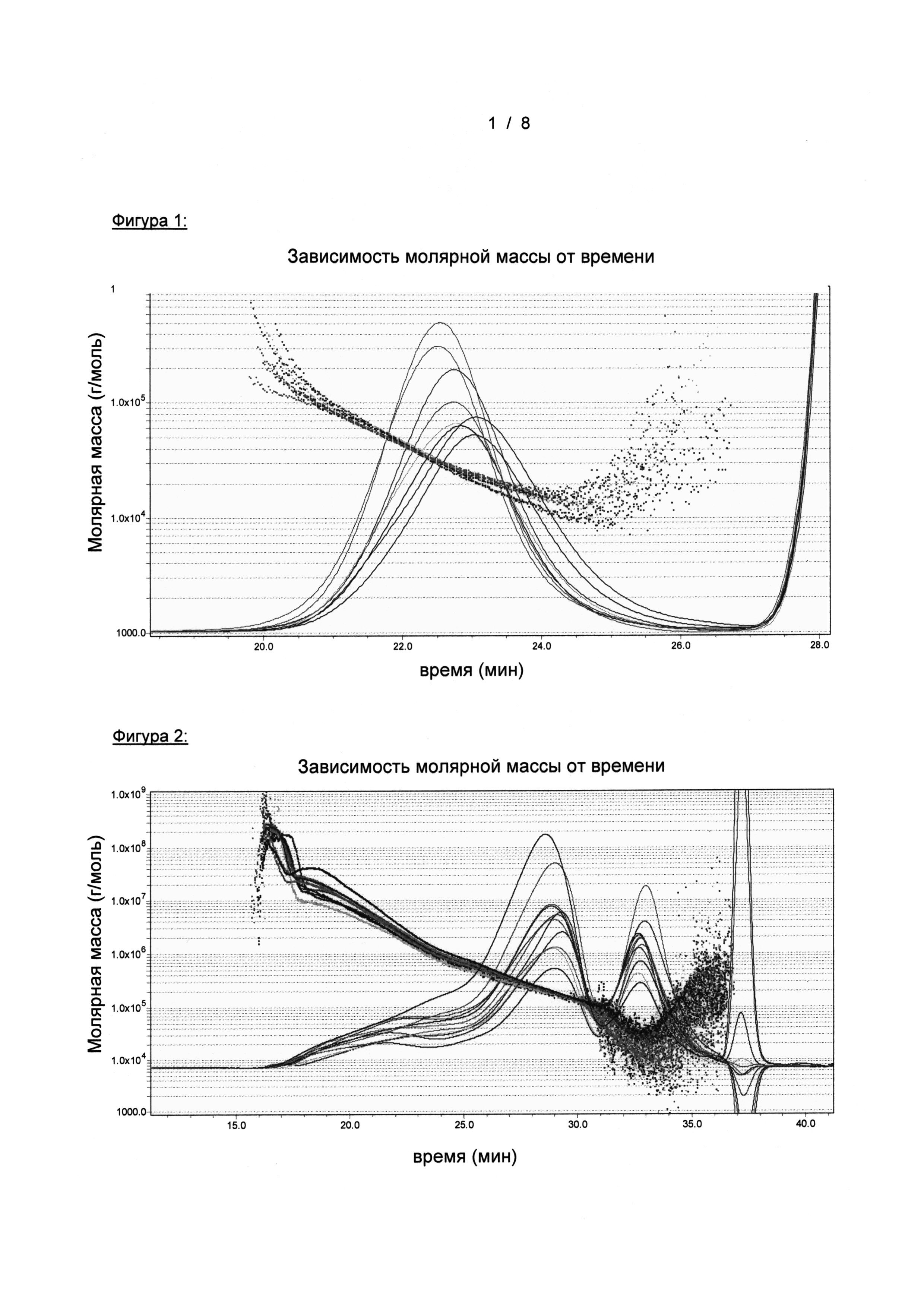
На Фигуре 1 показаны хроматограммы SEC-MALS-RI нескольких партий предпочтительных глюканов дрожжей, определенных как разветвленные β(1,3) глюканы c <2% повторяющихся β(1,6)-связанных глюкозильных единиц, проанализированных в DMAc/ с 0,5% LiCl, при условии, что dn/dc=0,12. Как видно, на уровне одной цепи распределение молекулярной массы находится в диапазоне от приблизительно 10,000 г/моль до приблизительно 200,000 г/моль.
На Фигуре 2 показаны хроматограммы SEC-MALS-RI нескольких партий предпочтительных глюканов дрожжей, определяемых как разветвленные β(1,3) глюканы c <2% повторяющихся β(1,6)-связанных глюкозильных единиц, проанализированных в водном буфере (0,1M NaNO3), при условии, что dn/dc=0,15. Как видно, на уровне одной цепи распределение молекулярной массы находится в диапазоне от приблизительно 10000 г/моль до более чем 10000000 г/моль. Результаты водной SEC-MALS-RI в сочетании с результатами в DMAc/LiCl показывают, что предпочтительные глюканы дрожжей существуют в виде агрегатов/надмолекулярных структур в водном растворе.
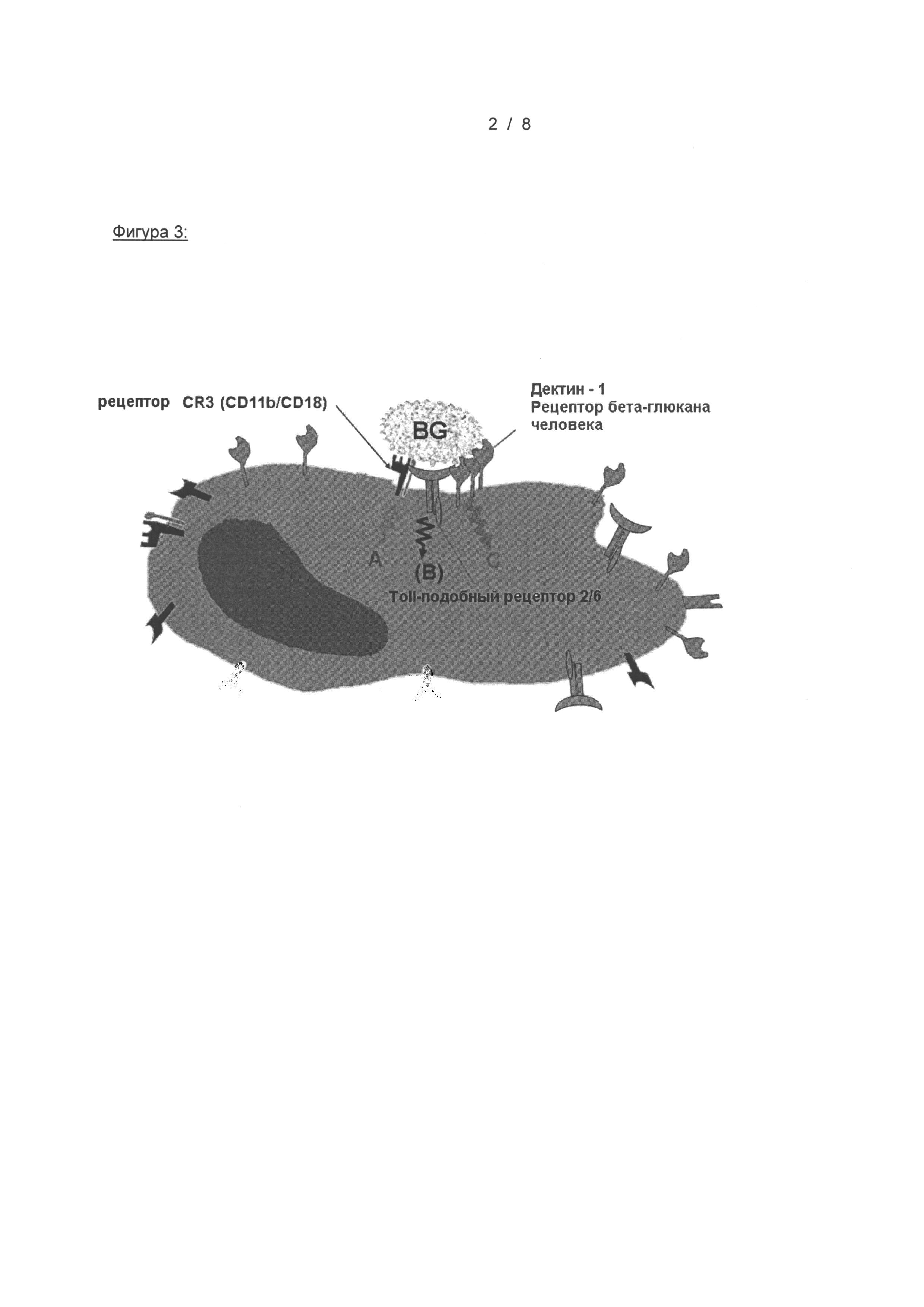
На Фигуре 3 показан предполагаемый механизм действия растворимых бета-глюканов, используемых в настоящем изобретении. На фигуре показано, что цепи бета-глюкана (BG) одновременно связываются с рецепторами, например, макрофагов, и, таким образом, активируют врожденную иммунную систему.
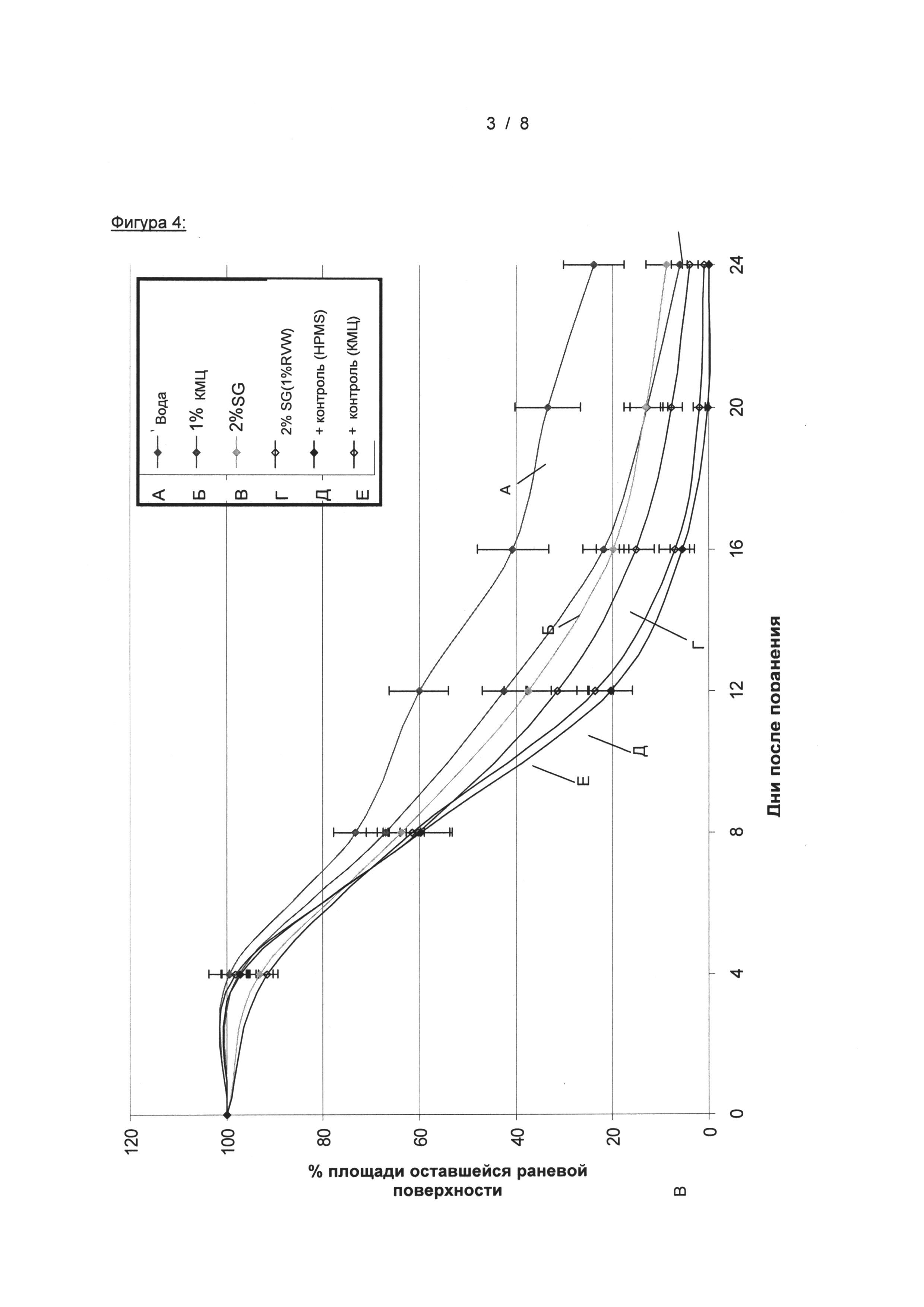
На Фигуре 4 показано заживление глубоких ран на модели мышей db/db, стимулированное местным введением только SG (2%), только карбоксиметилцеллюлозы (1% КМЦ), комбинацией этих веществ (2% SG, 1% КМЦ), по сравнению с носителем (водой) и положительным контролем (rh-PDGF-BB (10 мкг) + rh-TGF-α (1 мкг) в 0,5% НРМС и 1% КМЦ)
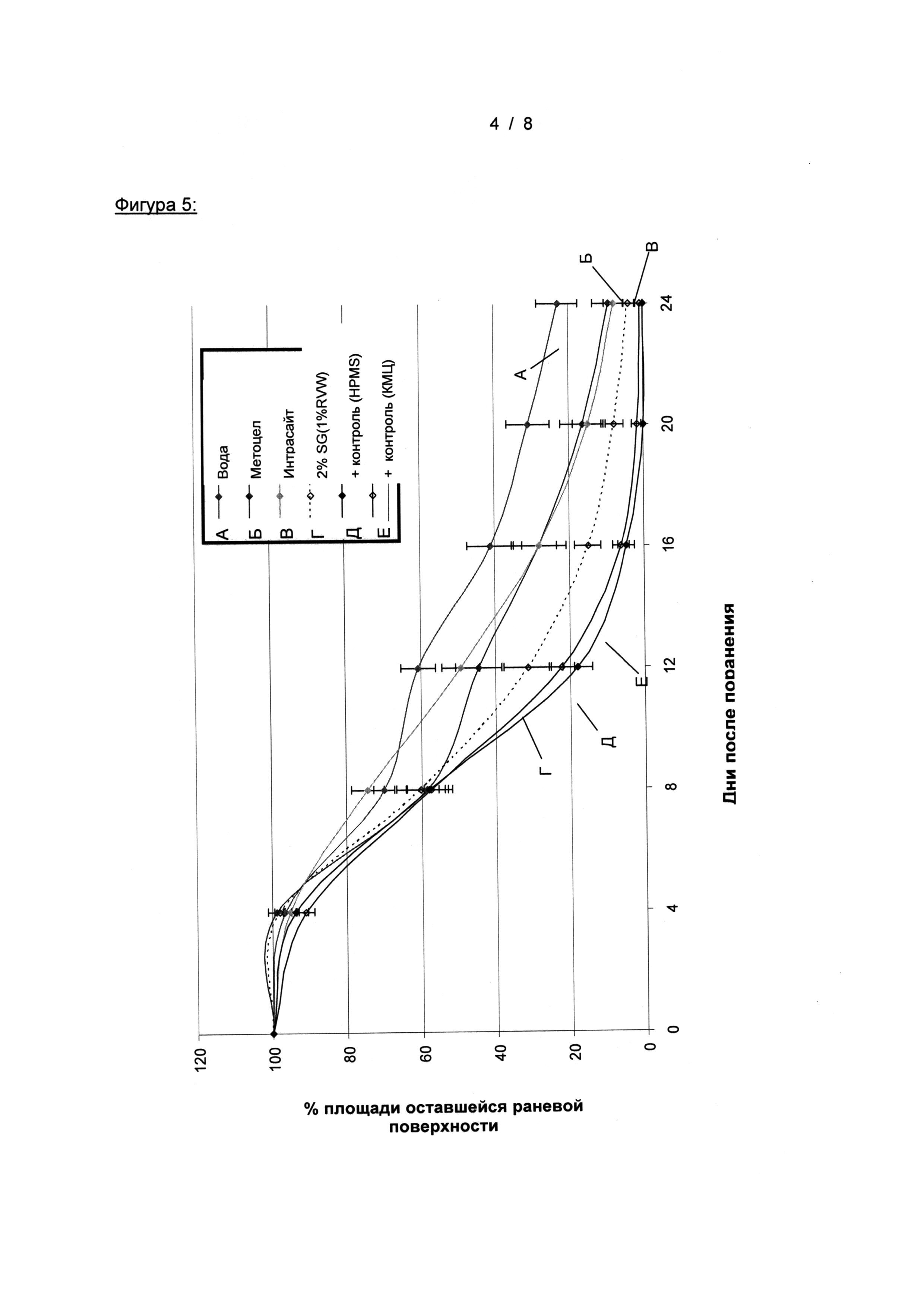
На Фигуре 5 показано изменение средней площади оставшейся раневой поверхности в % зависимости от времени (± СОС) - Группы: (1) Контроль с растворителем, (4) Метоцел, (5) Интрасайт, (9) 2% SG (1% КМЦ), (12) положительный контроль (НРМС), и (13) положительный контроль (КМЦ)
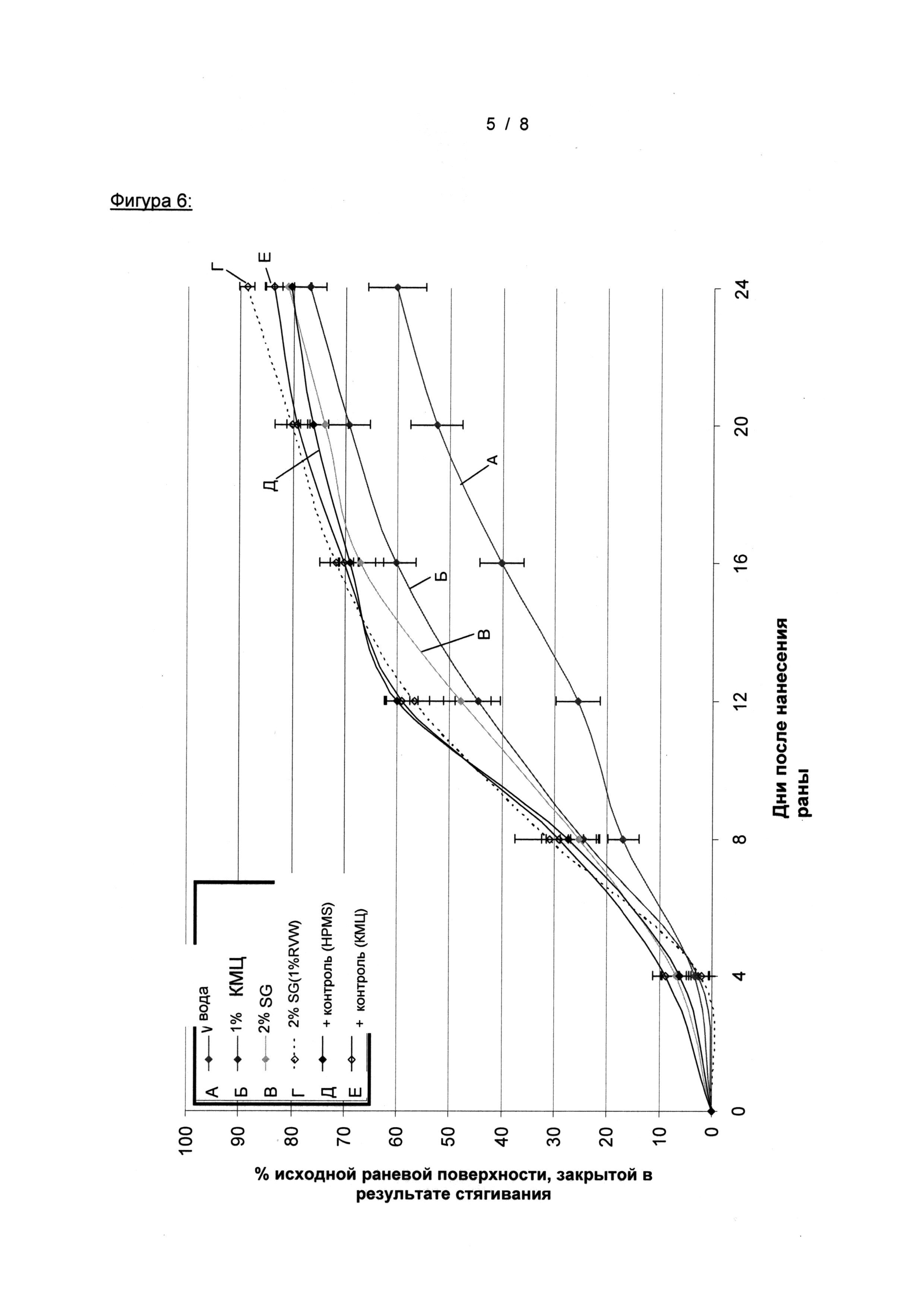
На Фигуре 6 показано изменение средней исходной площади раны в %, закрытой в результате стягивания, в зависимости от времени (± СОС) - Группы: (1) Контроль с растворителем, (2) 1% КМЦ, (6) 2% SG, (9)% 2 SG (1% CMC), (12) положительный контроль (НРМС), и (13) положительный контроль (CMC)
На Фигуре 7 показано изменение средней исходной площади раны в %, закрытой путем стягивания, в зависимости от времени (± СОС) - Группы: (1) Контроль с растворителем, (4) Метоцел, (5) Интрасайт, (9) 2% SG (КМЦ), (12) положительный контроль (НРМС), и (13) положительный контроль (КМЦ)
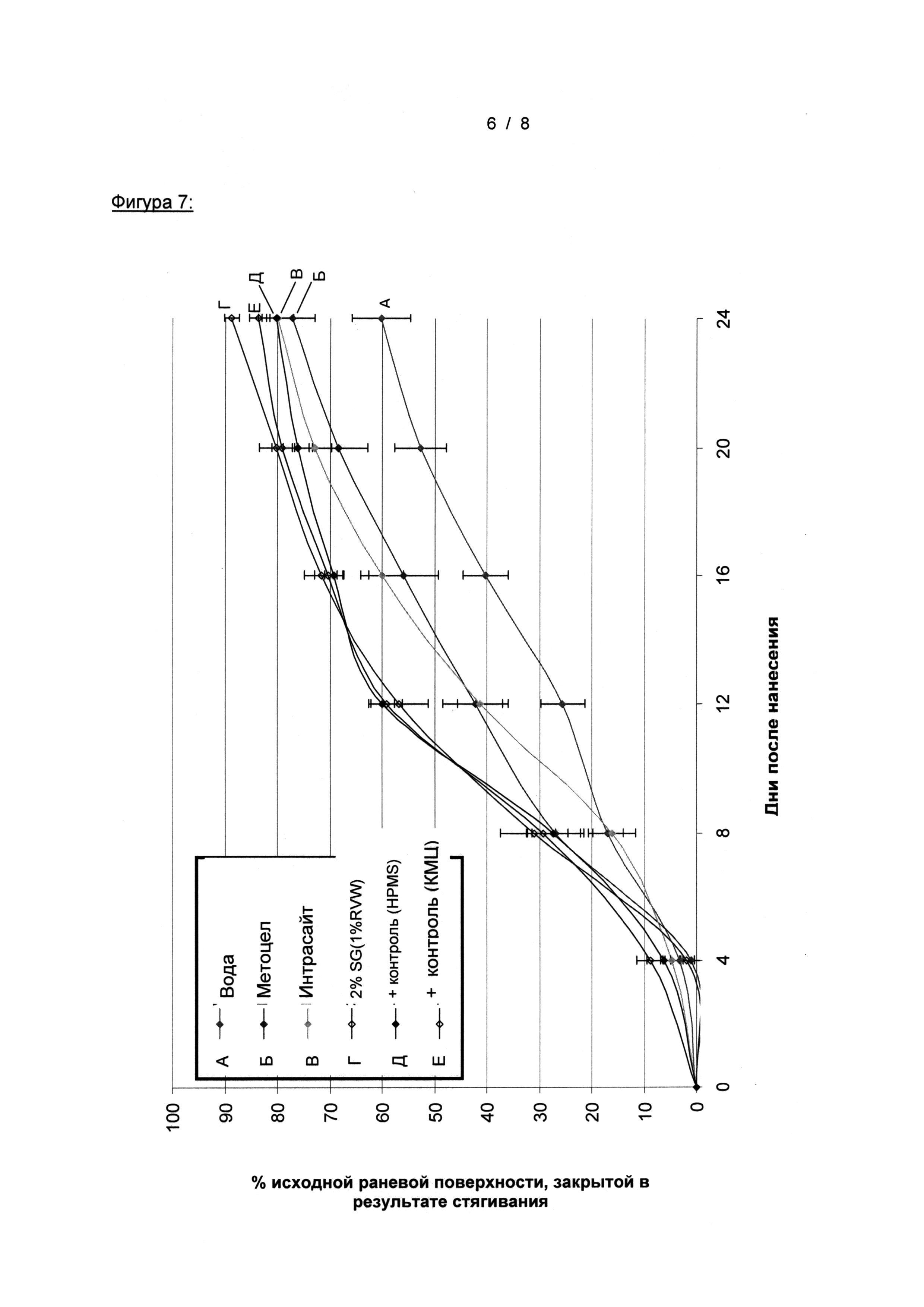
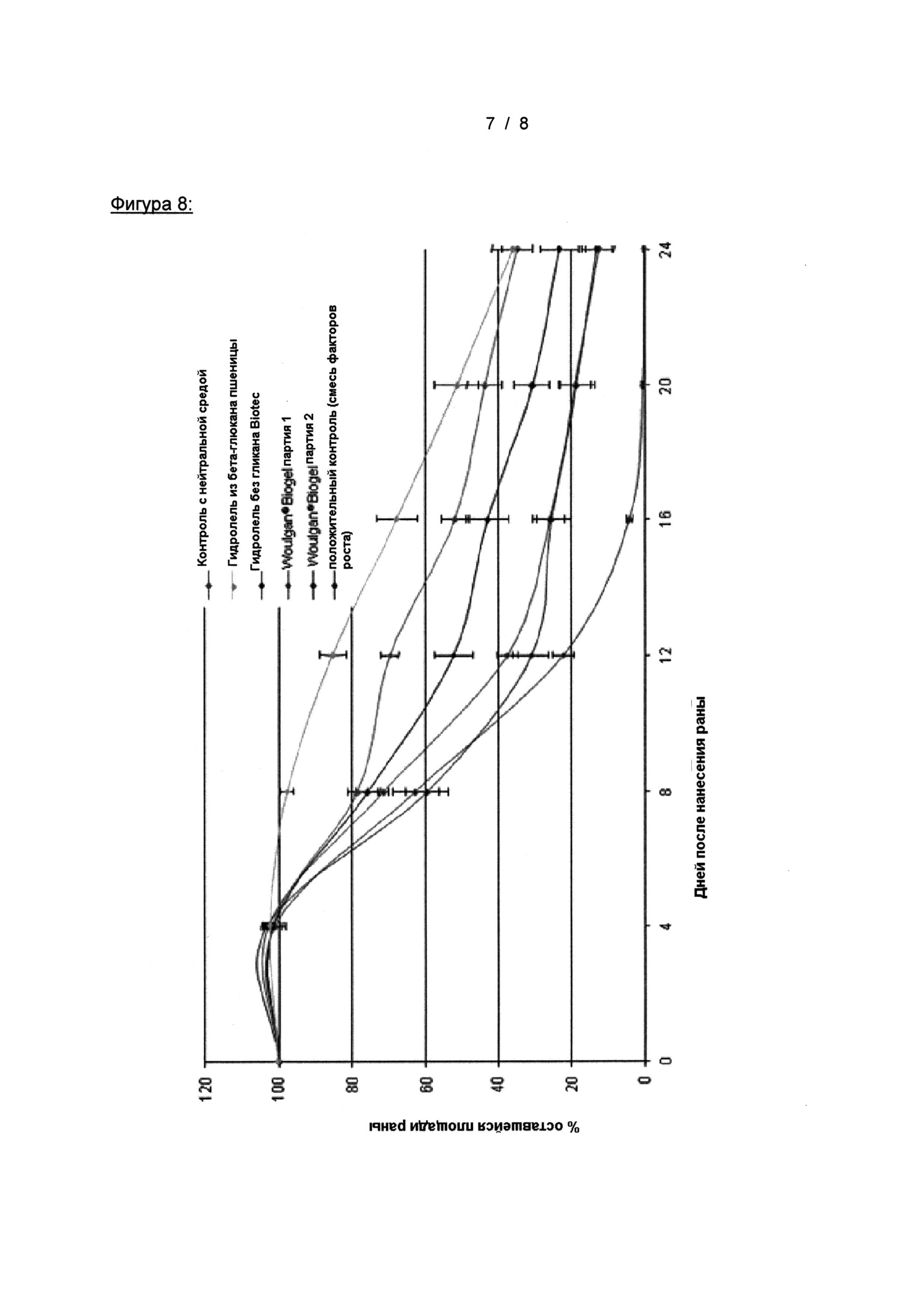
На Фигуре 8 показано заживление глубоких ран на модели мышей db/db, стимулированное местным введением двух различных составов биогеля Woulgan Biotec Pharmacon, только гидрогеля, продукта бета-глюкана овса, по сравнению с растворителем (водой) и положительным контролем (rh-PDGF-ВВ (10 мкг) + rh-TGF-α (1 мкг) в гидрогеле)
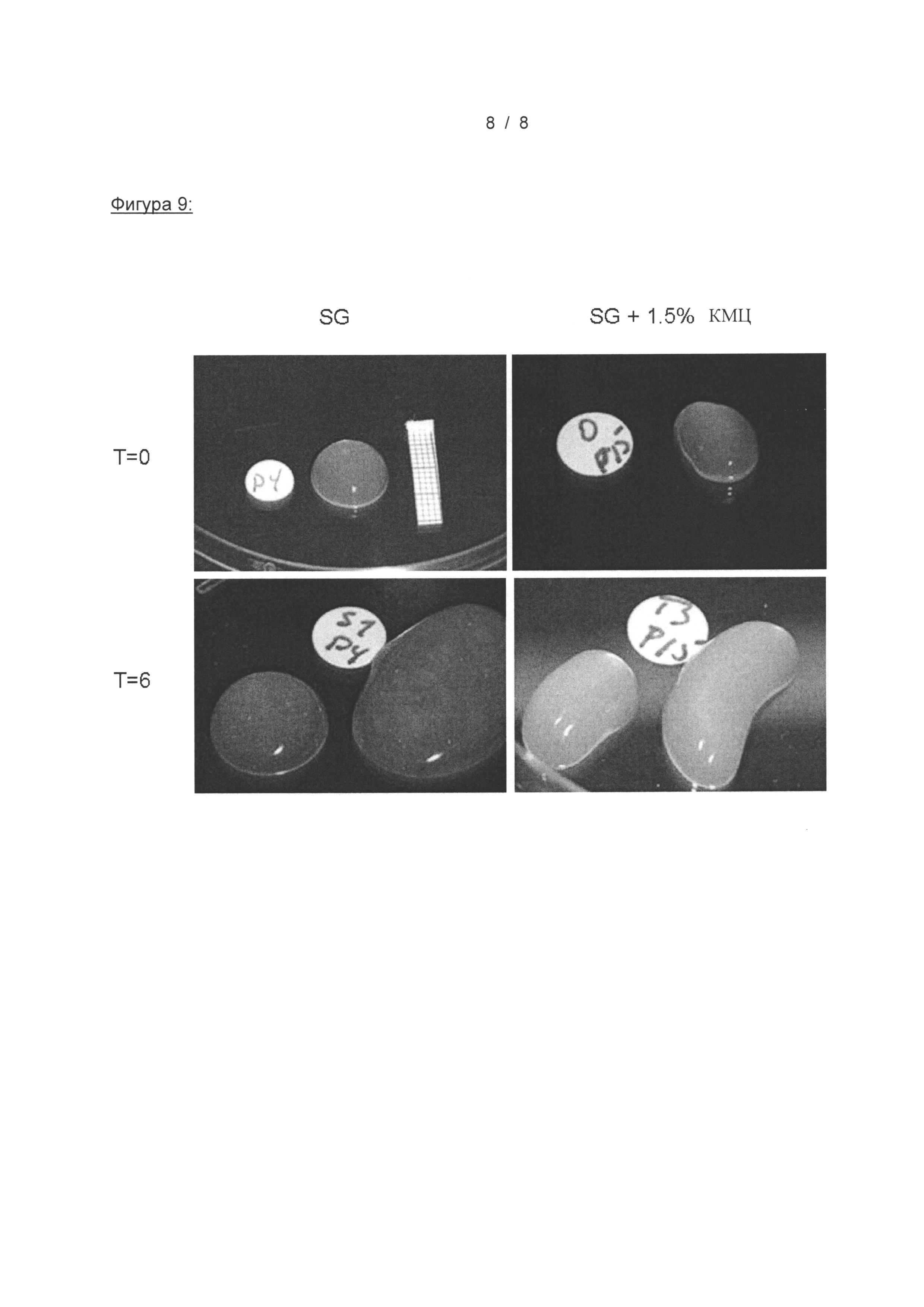
На Фигуре 9 показаны SG и SG, смешанные с 1,5% карбоксиметилцеллюлозой, хранящиеся в алюминиевых контейнерах. T=0 представляет начало исследования, а T=6 показывает образцы, хранящиеся 6 месяцев при колеблющейся температуре, меняющейся каждую неделю от 4 до 37°C.
Примеры
Пример 1: Получение гелевого глюканового продукта (SG)
Водный 1,5-2% раствор молекул глюкана дрожжей обрабатывали, как описано ниже. Этот водный раствор готовили из порошкового препарата глюкана путем формолиза для селективного удаления β-1,6 боковых цепей и последующей очистки и диафильтрации для удаления твердых частиц и низкомолекулярных компонентов из формолизного раствора. Подходящая стадия формолиза описана в Примере 3 в EP 0759089 B1. Порошковый глюкан был получены из клеточных стенок пекарских дрожжей (S.cereivisiae) путем отдельных экстракций щелочью, этиловым спиртом и водой, после каждой экстракции осуществляли сушку (распылительная сушка и вакуумное высушивание).
а. Термическая обработка:
Термическую обработку осуществляли после подведения концентрации раствора глюкана, обычно получали объем продукта приблизительно 220 литров при температуре примерно 60°C, в закрытом резервуаре объемом 800 литров при перемешивании, который нагревали путем введения пара в кожух, окружающий резервуар.
Продукт медленно нагревали до примерно 105°C, чтобы обеспечить равномерное нагревание всего объема, а затем нагревали в течение более короткого временного интервала до 123°C. Обычное время нагрева от 60°C до 123°C составляло 40-50 минут. Продукт затем выдерживали при 123°C - 125°C в течение 20 минут.
б. Активное охлаждение:
Затем начинали активное охлаждение. Охлаждением управляли вручную путем прямого открытия и закрытия клапанов с ручным управлением. Сначала аккуратно выпускали весь пар из кожуха и оставляли открытыми сливные клапаны. Затем в кожух осторожно подавали охлаждающую воду, сначала медленно, чтобы избежать чрезмерной тепловой нагрузки на стальные части резервуара. При понижении температуры увеличивали напор потока воды. Обычно охлаждение продолжали до тех пор, пока температура продукта не достигала 35°C - 40°C. Обычное время охлаждения от 123°C до 40°C составляло 50-60 минут.
Пример 2: Получение гелевого глюканового продукта
Водный 1,5-2% раствор молекул глюкана дрожжей обрабатывали, как описано ниже. Этот водный раствор готовили из порошкового препарата глюкана путем формолиза для селективного удаления β-1,6 боковых цепей, как описано в Примере 1.
а. Разрушение водородных связей путем добавления гидроксида натрия:
Добавление гидроксида натрия осуществляли после подведения концентрации раствора глюкана, обычно получали объем продукта приблизительно 185 литров в закрытом резервуаре объемом 800 литров при перемешивании, который нагревали или охлаждали путем введения пара или воды в кожух, окружающий резервуар.
Продукт охлаждали до 18°C, и затем медленно (со скоростью приблизительно 1 литр в минуту) добавляли 24 моля (960 г) NaOH, растворенного в приблизительно 10 литрах очищенной воды, через клапан в резервуаре.
б. Восстановление водородных связей путем добавления соляной кислоты:
Процесс восстановления начинали сразу же после добавления в резервуар последней порции раствора NaOH.
Чуть менее 24 молей HCl, приблизительно 9 литров 2,4M раствора HCl в очищенной воде, вносили в резервуар относительно быстро (примерно за 2 минуты), измеряли pH продукта и добавляли кислоту небольшими порциями, пока pH не достигал значения примерно 4. Общий объем добавленной HCl составил 23,4 моля.
в. Удаление соли
Для удаления ионов (Na+ и Cl-), внесенных на стадиях а и б, продукт подвергали диафильтрации через тангенциальный фильтр с 4 объемами очищенной воды.
Пример 3: Композиция, заживляющая раны in vivo
Изучали воздействие только гелевого глюкана (SG), полученного в соответствии с Примером 1, только растворителя (карбоксиметилцеллюлоза или геллановая камедь) или комбинации SG и растворителя на заживление ран путем анализа восстановления глубоких (на всю толщину) иссеченных ран кожи на модельных мышей с диабетом (db/db) (т.е. линии мышей BKS.Cg-m Dock7m +/+ Leprdb /J). Комбинированный продукт согласно настоящему изобретению также получали в соответствии с описанным здесь и приведенным в Примере 1 способом нагрева и быстрого охлаждения; вкратце, глюкан и растворитель растворяли в водном растворе и затем нагревали в автоклаве до примерно 120°C в течение примерно 18 минут. Продукт затем быстро охлаждали, чтобы дать возможность образоваться гелю, как описано в Примере 1.
После акклиматизации (5-7 дней без нарушения нормального режима) животных содержали в группах по 5 животных в соответствии с правилами Министерством внутренних дел Великобритании и специфическими требованиями по содержанию животных с диабетом. После нанесения экспериментального ранения животных содержали в отдельных клетках (размеры клетки 35×15×15 см с опилками в качестве подстилки с заменой два раза в неделю) при температуре воздуха 23°C и 12-часовом режиме свет/темнота. Мышей обеспечивали питанием (стандартная диета грызунов) и водой без ограничений. После анестезии животных помещали в теплую среду и наблюдали до полного восстановления после процедуры. Всем животным давали соответствующее обезболивание (бупренорфин) после операции и дополнительные анальгетики по мере надобности. Все процедуры с животными осуществляли в учреждении, лицензированном Министерством внутренних дел Великобритании, согласно лицензиям Министерства внутренних дел (PCD: 50/2505; PPL: 40/3300; PIL: 50/3482; PIL: 70/4934). Контроль здоровья животных осуществляли ежедневно в течение всего исследования.
В день 0 животных подвергали анестезии (изофлуоран и воздух), спину брили и очищали марлей, пропитанной физиологическим раствором. С левой стороны спины на коже каждого экспериментального животного наносили одну стандартизованную глубокую рану на всю толщину кожи (10,0 мм × 10,0 мм). Раны во всех экспериментальных группах затем покрывали кольцевой полосой прозрачной пленки Bioclusiv™ (Systagenix Wound Management, Великобритания), после чего животные получали либо SG, либо растворитель, либо комбинацию SG и растворителя путем инъекции 50 мкл материала, растворенного в очищенной воде, через пленку Bioclusive с использованием иглы номер 29. Животных с диабетом случайным образом распределяли по режимам воздействия с помощью соответствующего программного обеспечения.
Введение веществ повторяли в 2, 4 и 6 дни после нанесения раны. Тщательно следили за тем, чтобы раневые участки не были перенасыщены изучаемыми веществами или чрезмерно увлажнены; если обнаруживали чрезмерное накопление применяемого вещества/влаги, ранее нанесенный материал отсасывали перед повторным применением.
На 4, 8, 12, 16, 20 и 24 дни после ранения всех животных повторно анестезировали, удаляли пленку и все свободные остатки, и промывали раны стерильной марлей, пропитанной физиологическим раствором. На 4, 8, 12, 16, 20 и 24 дни раны фотографировали и снова покрывали пленкой Bioclusive. Заживление ран оценивали (не количественно) в соответствии с присутствием фибрина, грануляционной ткани, ангиогенеза и повторной эпителизации. На основе появления вышеуказанных признаков, формирование новой кожной ткани (заживление) оценивали как: очень хорошее, хорошее, умеренное, отсутствует.
Данные по закрытию ран дополнительно определяли по масштабированным изображениям ран, полученным во время каждого обследования. Площадь определенной раны, в данный момент времени, выражали как процент площади от раны этой же сразу же после операции (то есть в день 0). Средний процент оставшейся площади раны (и стандартную ошибку среднего) рассчитывали для каждой группы и отображали в виде графика. Воздействие каждого препарата, содержащего глюкан, сравнивали с ранами, обработанными: а), растворителем; и б) ТФР-ВВ + трансформирующий фактор роста-α (положительный контроль).
|
Результаты, представленные в Таблице 1, показывают, что частота заживления ран в случае воздействия только глюкана была выше по сравнению с ранами, обработанными только растворителем. Это позволяет предположить, что глюкан сам по себе является лучшим стимулятором формирования новой кожной ткани, чем гелеобразующий агент (растворител). Кроме того, существует четкий сдвиг в зависимости от концентрации раствора глюкана от 2% до 4%, который показывает увеличение заживления ран (от хорошего до очень хорошего). Тем не менее, комбинация глюкана и обоих растворителей превосходила индивидуальное использование каждого агента (существенный сдвиг от умеренного до хорошего и очень хорошего), что указывает на синергетический эффект продуктов в комбинации.
Пример 4: Влияние препаратов глюкана в соответствии с изобретением на заживление ран
Провели исследование для оценки способности препаратов на основе глюканов согласно настоящему изобретению облегчать восстановление тканей на известной модели замедленного заживления ран in vivo. Пациенты с сахарным диабетом склонны к медленному заживлению ран, причем особенно распространены язвы на стопах. Задержка в заживлении ран также распространяется на животных с диабетом, включая спонтанный диабет у (db/db) мышей (то есть у линии мышей BKS.Cg-м Dock7m +/+ Leprdb / J).
В этом исследовании заживление ран у мышей с диабетом, получающих препарат глюкана SG 131-9 Biotec (в различных концентрациях, с различными растворителями или без них), сравнивали с подобными ранами, обработанными растворители: (I) очищенная вода [вода для инъекций], (ii) 1,0% карбокси-метил-целлюлоза и (iii) 0,3% Фитагель. Заживление диабетических ран, обрабатываемых глюканом SG 131-9 Biotech, также сравнивали с компараторами: (i) Метоцел - материал сравнения, содержащий полисахарид, и (ii) Интрасайт Гель - лидирующий на рынке лечения ран препарат гидрогеля. Рекомбинантный человеческий тромбоцитарный фактор роста-ВВ (rh-PDGF-BB) в сочетании с рекомбинантным человеческим трансформирующим фактором роста-альфа (rh-TGF-α) использовали в качестве “положительного контроля” в данном исследовании. Этот положительный контроль применяли с двумя растворителями - 0,5% гидроксипропилметилцеллюлозой (НРМС) и 1,0% карбоксиметилцеллюлозой (КМЦ).
Материалы и методы
Материалы, используемые в тесте
1. Вода для инъекций
2. 1,0% карбоксиметилцеллюлоза (КМЦ, Sigma C5013, натриевая соль) в очищенной воде
3. 0,3% Фитагель + 4 мМ CaCl2
4. 2,0% Метоцел
5. Интрасайт
6. 2,0% SG
7. 4,0% SG
8. 1,0%КМЦ + 1,0% SG
9. 1,0% КМЦ + 2,0% SG
10. 1,0% КМЦ + 4,0% SG
11. 0,3% Фитагель + 2,0% SG
12. rh-PDGF-BB [10%] + rh-TGF-α [1%] - в 0,5% НРМС
13.. rh-PDGF-BB [10%] + rh-TGF-α [1%] - в 1,0% КМЦ
Вышеуказанные материалы подготавливали в соответствии со способами, описанными в Примерах 1 и 3. Фитагель всегда использовали с CaCl2.
Мыши модели диабета BKS.Cg-m Dock7m +/+ Lepdb / J мышей доставляли в Великобританию в возрасте приблизительно 5-6 недель и содержали «на месте» до достижения ими возраста 12 недель (± 1 неделя) - в соответствии с правилами Министерства внутренних дел и специфических требований по содержанию диабетических животных.
Вкратце, в день 0 мышей подвергали анестезии с использованием изофлуорана и воздуха, кожу спины сбоку брили и очищали в соответствии с протоколом. Слева от позвоночника на коже делали одну стандартизированную глубокую рану на полную толщину слоя кожи (10 мм × 10 мм). Диабетические животные были случайным образом распределены в одну из 13 экспериментальных групп (как описано в таблице ниже). Раны во всех группах покрывали кольцевой полосой полупроницаемой пленки Bioclusiv™ (Systagenix Wound Management, Великобритания), введение (в объеме 50 мкл [группы 1-11] и 100 мкл [12 и 13 группы]) осуществляли путем подкожных инъекций через пленку Bioclusive. Состояние перевязочных материалов проверяли ежедневно на протяжении всего исследования и при необходимости заменяли.
Животных в группах с 1 по 11 обездвиживали и осуществляли повторяющиеся введения путем подкожной инъекции через пленку Bioclusive в дни 2, 4 и 6 после нанесения ранения. Избыток влаги/ранее нанесенного вещества удаляли путем отсасывания перед очередным нанесением. Для экспериментальных групп 12 и 13 (положительный контроль) лечение повторяли ежедневно до 6 дня после ранения.
В 4 день всех животных повторно анестезировали, раны фотографировали, животных помещали в теплые условия (34°C) для восстановления. После того как границы ран стали хорошо видны через повязку Bioclusiv™ и для того, чтобы свести к минимуму повреждение области вокруг ран из-за повторяемых смен повязки, было принято решение о прекращении смены повязки из пленки с этого момента.
В дни 8, 12, 16, 20 всех животных повторно анестезировали, удаляли повязки и все свободные остатки, раны очищали стерильной марлей, пропитанной стерильным физиологическим раствором. Затем раны фотографировали, повторно накладывали повязки (см. выше) с пленкой Bioclusiv™, после чего животных помещали в теплые условия (34°C) для восстановления.
Сразу после ранения, а затем в дни 4, 8, 12, 16, 20 и 24 все раны фотографировали на цифровую фотокамеру вместе с калибровочной/идентификационной пластиной (последующее удаление повязки и промывка ран - там, где это было необходимо).
|
Анализ изображений закрытия раны:
Для расчета закрытия ран по масштабированным изображениям ран, снятых в каждой точке оценки, использовали программное обеспечение для анализа изображений Image Pro Plus (версия 4.1,0.0, Media Cybernetics, США) Поскольку процесс заживления раны включает в себя сжатие раны (движение внутрь краевой ткани), этот эффект также учитывали.
Были проведены следующие оценки:
1. Процент площади раны, оставшейся со временем, то есть отношение открытой площади раны, оставшейся в данный момент времени, к площади той же раны сразу же после ранения в день 0.
2. Процент сжатия раны со временем, то есть разница между площадью сжавшейся раны в данный момент времени и исходной площадью раны [в процентах от исходной площади раны].
Оценка инициации заживления ран (образования новой кожной ткани):
Все раны в исследовании визуально оценивали ежедневно до 8 дня, а затем в дни 10, 12, 14, 16, 20 и 24, чтобы установить состояние их «заживления». Каждую рану оценивали по тому, демонстрирует ли она «признаки образования новой кожной ткани» или нет (то есть, начался ли процесс заживления раны или нет). Каждую рану оценивали два независимых исследователя, средний процент ран, демонстрирующих «признаки образования новой кожной ткани» сравнивали между группами с разной обработкой в каждой точке оценки.
Считали, что формирование новой кожной ткани началось, если кровеносные сосуды внутри фасции на дне раны покрыты лежащим выше «материалом». Этот покрывающий материал мог формироваться от образования непрозрачного экссудата, полимеризованного/полуполимеризованного фибрина или грануляционной ткани. Неизменно, первым признаком начала образования новой кожной ткани было формирование красноватого экссудата в полости раны.
Результаты
Закрытие раны:
Для каждой отдельной раны в данный момент времени закрытие раны) выражали как процент оставшейся площади раны по отношению к исходной площади раны сразу после ранения (то есть в день 0). Данные по среднему проценту оставшейся площади раны для всех экспериментальных групп приведены ниже, в Таблице 3.
|
Как показано в Таблице 3 и на Фигурах 4 и 5, профили закрытия ран по данным “% оставшейся со временем площади раны” значительно различались между различными группами лечения. Раны, обрабатываемые только водой, показали самое медленное закрытие; раны в положительном контроле продемонстрировали самое быстрое закрытие; данные по другим группам терапии располагались между этим крайними значениями. Раны, обрабатываемые 2% SG (в КМЦ) закрывались быстрее, чем в любой другой экспериментальной группе лечения (за исключением положительного контроля).
Оба компаратора (Метоцел и Интрасайт) проявляли тенденцию к ускорению закрытия ран по сравнению с обработкой водой. Окончательные уровни закрытия ран, достигнутые на 24 день, составили ~ 91% для Метоцела и ~ 92% для Интрасайта.
Применение SG 131-9 (1, 2 или 4%) в КМЦ демонстрировало тенденцию к ускорению закрытия раны по сравнению с обработкой водой. Терапия 1% 131-9 (в КМЦ) приводила к значительному повышению закрытия с 12 по 20 дни после ранения. Обработка 2% SG 131-9 (в КМЦ), по-видимому, приводила к более существенному и устойчивому эффекту; вследствие такой обработки отмечали значительное ускорение в закрытии ран, начиная с 12 дня и далее. Обработка 4%ым SG 131-9 (в КМЦ), хотя и была более эффективной по сравнению с водой, оказалась менее эффективной по сравнению с обработкой 1% и 2% SG 131-9 (в КМЦ). Окончательные уровни закрытия ран, достигнутые на 24 день, составили: 90% для 1% SG 131-9 (в КМЦ), 96% для 2% SG 131-9 (в КМЦ) и 89% для 4% SG 131-9 (в КМЦ).
Применение 2% SG 131-9, наносимого в 1% КМЦ, демонстрировало тенденцию к ускорению закрытие ран в большей степени, чем 2% SG 131-9, наносимый в воде. При сравнении трех режимов обработки 2% SG 131-9 можно отметить, что все три воздействия способствовали закрытию раны в большей мере, чем соответствующие растворители (то есть вода, 1% карбоксиметилцеллюлоза и 0,3% Фитагель). В абсолютном выражении, 2% SG в КМЦ обычно приводил к самым высоким уровням закрытия. Уровни закрытия ран в группах терапии 2% SG в воде и 2% SG в Фитагеле были сходными, но при этом ниже, чем уровни закрытия ран, обработанных 2% SG 131-9 в КМЦ.
Из всех изученных препаратов SG 131-9, 2% SG 131-9 в 1% КМЦ оказался наиболее эффективным. Для 2% SG 131-9 (в КМЦ) было показано стимулирование закрытия раны в большей степени, чем для Интрасайта, компаратора на основе полисахаридов, и Метоцела, лидирующего на рынке препарата по обработке ран на основе гидрогеля.
Сжатие раны
Сжатием является центростремительное движение краев раны - за счет уплотнения грануляционной ткани в «теле» раны. Полагают, что “уплотняющие” силы, которые направляют этот процесс, находятся в клетках фибробластной линии. В этом исследовании, % сжатия рассчитывали как:

Результаты сжатия раны приведены в Таблице 4, ниже, и на Фигурах 6 и 7.
|
Значительно менее выраженное сжатие было отмечено только при обработке водой по сравнению со всеми другими группами терапии. Самые высокие уровни сжатия наблюдали с обоими видами положительных контролей, 2% SG (в КМЦ) и в более поздние моменты времени (дни 20 и 24) с 2%-ным SG (в Фитагеле).
Оба компаратора, Метоцел и Интрасайт способствовали сжатию раны по сравнению с обработкой водой. Сжатие ран, обработанных Метоцелом, было значительно сильнее, чем у ран, обрабатываемых водой воду, в дни 8, 20 и 24, в то время как при обработке Интрасайтом сжатие ран усиливалось, начиная с 12 дня и далее. Обе группы терапии компараторами в целом показали меньшее сжатие ран по сравнению с ранами в положительном контроле.
Обработка SG 131-9 (1%, 2% или 4%), растворенным в 1% КМЦ, способствовало сжатию раны по сравнению с обработкой водой. Обработка каждой из концентраций приводила к значительно большему сокращению, чем обработка водой, начиная с 12 дня и далее. Было обнаружено, что 2% SG 131-9 (в КМЦ) способствует сокращению раны по сравнению с только КМЦ, наиболее значительное сокращение наблюдалось в 16 и 24 дни. Было установлено, что 2% SG (в КМЦ) более эффективно стимулирует сжатие по сравнению с 1% и 4% SG 131-9 (в КМЦ). Обработка 2% SG (в КМЦ) приводила к уровням сжатия, сопоставимым с положительным контролем, вплоть до 20 дня включительно, в то время как, согласно приведенным ранее данным, КМЦ отдельно приводит к меньшему уровню сжатия, чем обработка положительными контролями. Интересно, что в конечной точке оценки (день 24) раны, обработанные 2% SG 131-9 (в КМЦ), сжимались в большей степени, чем раны, обработанные обоими видами положительных контролей.
2% SG 131-9, наносимый в 1% КМЦ, в целом усиливал сжатие раны в большей степени, чем 2% SG 131-9, растворенный в воде. В абсолютном выражении, 2% SG в КМЦ как правило, приводил к самым высоким уровням сжатия. Для 2% SG 131-9 (в Фитагеле) также было обнаружено стимулирование сокращения раны по сравнению с терапией водой и по сравнению с только Фитагелем.
Из всех изученных препаратов SG 131-9, 2% SG 131-9 в 1% КМЦ оказался наиболее эффективным для обеспечения сжатия раны. Было обнаружено, что 2% SG 131-9 (в КМЦ) ускоряет сокращение раны в большей степени, чем Интрасайт и Метоцел.
Инициация заживления раны (формирование новой кожной ткани)
Все раны в исследовании визуально оценивали ежедневно до 8 дня, а затем на 10, 12, 14, 16, 20 и 24 дни, чтобы установить состояние их “заживления”. Для каждой раны оценивали, демонстрирует ли она «признаки образования новой кожной ткани» или нет (то есть, начался ли процесс заживления раны или нет). Каждую рану оценивали два независимых исследователя, средний процент ран, демонстрирующих «признаки образования новой кожной ткани», сравнивали между группами с разной терапией в каждой точке оценки.
Было установлено, что раны в разных группах обработки, демонстрируют первые признаки заживления в разное время после ранения. Согласно этим данным, приведен порядок, в котором различные группы начинают 15 заживление, от самых быстрых к медленным:
|
На основании исследования было установлено, что семь из десяти (70%) случайным образом взятых ран, обрабатываемых водой, начинали формирование новой кожной ткани на 24 день. Также было установлено, что все раны во всех других группах к этому моменту также инициировали формирование новой кожной ткани.
При изучении SG, растворенного в 1% КМЦ, раны, получавшие 2% и 4% SG, обычно первыми начинали формирование новой кожной ткани; раны, получавшие 1% SG, были вторыми по признаку инициирования новой кожной ткани. По сравнению с обработкой водой, значительно большее число ран, обработанных 1% SG 131-9, начало процесс формирования новой кожной ткани с 6 по 14 день; значительно большее число ран, обработанных 2% SG 131-9, начало процесс формирования новой кожной ткани с 3 по 14 день; и значительно большее число ран, обработанных 4% SG 131-9, начало процесс формирования новой кожной ткани с 4 по 14 день. После 4 дня не было отмечено существенных различий между этими тремя группами терапии и двумя положительными контролями. По отношению к среднему числу дней, необходимых для начала заживления раны, все три концентрации SG привели к значительно более раннему началу формирования новой кожной ткани по сравнению с водой.
Было обнаружено, что раны, обрабатываемые 2% SG, приготовленным в Фитагеле, начинают заживление раньше, чем раны, получавшие только Фитагель. По сравнению с контрольными группами, значительно больше ран, получавших 2% SG (в Фитагеле), начали заживление с 4 по 14 дни, относительно ран, обработанных водой. По отношению к среднему числу дней, необходимых для начала заживления раны, раны, получавшие 2% SG (в Фитагеле) начинали заживление значительно раньше, чем раны, обработанные только водой или только Фитагелем.
Пример 5: Стабильность гелевого глюкана
Woulgan® готовили следующим образом:
- 2,7% SBG (растворимый бета-глюкан дрожжей Biotec в очищенной воде)
- Добавляли при перемешивании Blanose TM (7H4XF РН, Kirsch Pharma Gmbh, карбоксиметилцеллюлоза фармацевтического класса чистоты) до конечной концентрации 1,5% (вес/объем).
- Перемешивали до растворения КМЦ
- Добавляли глицерин (99,7%) до конечной концентрации 20%.
- Стерилизовали в автоклаве при 120°C в течение 18 минут
- Быстро охлаждали и давали гелю застыть, как описано в Примере 1.
и хранили в алюминиевых тубах при условиях, ускоряющих деградацию (при температуре, меняющейся от 4°C до 37°C) в течение срока до шести месяцев. SG Отдельно, то есть без карбоксиметилцеллюлозы, готовили в соответствии с Примером 1 и хранили в таких же условиях. В качестве исходного материала, SBG, использовали такой же материал, как в Примере 1.
Как показано на Фигуре 9, деградация геля SG усиливается при таких условиях хранения. Признаки деградации, то есть синерезис, становились заметными в таких условиях, начиная со срока хранения 1 месяц. После 6 месяцев хранения, гель SG показывал явные признаки синерезиса и был очень мягким, тонким, гетерогенным, шероховатым, с трещинами, гранулированным гелем, а гель, состоящий из SG с добавлением карбоксиметилцеллюлозы, не изменял своего состояния по сравнению с началом исследования и сохранялся в состоянии однородного и липкого геля в течение всего срока исследования, по крайней мере, до 6 месяцев. Комбинированные продукты показали повышенную стабильность по сравнению с SG без добавок.