ЗАМЕЩЕННЫЕ 4-(СЕЛЕНОФЕН-2(ИЛИ 3)-ИЛАМИНО)ПИРИМИДИНОВЫЕ СОЕДИНЕНИЯ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к замещенным 4-(селенофен-2(или 3)-иламино)пиримидиновым соединениям; способам их получения; способам лечения рака и способам изготовления фармацевтических композиций для лечения или ингибирования, или контроля рака.
Уровень техники изобретения
Рак представляет собой заболевание, возникающее вследствие патологического роста ткани. Определенные типы рака обладают способностью ограниченного распространения в тканях и также метастазирования в удаленные органы. Это заболевание может проявляться в широком выборе различных органов, тканей и клеточных типов. В силу вышесказанного, термин "рак" обозначает совокупность более чем тысячи различных заболеваний. У более чем 4,4 миллиона человек во всем мире выявлен диагноз рак молочной железы, рак толстой кишки, рак яичников, рак легких или рак предстательной железы, и свыше 2,5 миллионов человек умерли от этих тяжких заболеваний. В одних только Соединенных Штатах Америки свыше 1,25 миллионов новых случаев и свыше 500 000 смертей от рака было зафиксировано в 2005 г. Абсолютное большинство новых случаев этого заболевания будет представлено раком толстой кишки (-100 000), легких (-170 000), молочной железы (-210 000) и предстательной железы (-230 000). Как частота встречаемости, так и широта распространения рака прогнозируются возрастающими, приблизительно, на 15% в течение следующих десяти лет, показывающих среднюю скорость роста 1,4% (American Cancer Society, Cancer Facts and Figures 2005; http://www.cancer.org).
Лечение рака представлено двумя основными типами, либо радикальное, либо паллиативное. Главные радикальные типы лечения рака представляют собой хирургическое вмешательство и облучение. Эти варианты лечения, как правило, являются успешными только тогда, когда рак обнаружен на стадии ранней локализации. Если заболевание развилось до местнораспространенного рака или метастатического рака, эти типы лечения являются менее эффективными и лечение нацелено на временное ослабление симптома и поддерживание хорошего качества жизни. Большинство общепринятых лечебных протоколов в любом методе лечения включают комбинацию хирургического вмешательства, лучевую терапию и/или химиотерапию.
Цитотоксические лекарственные препараты (также известные как циторедуктивные агенты) применяют при лечении рака либо в качестве радикального лечения, либо с целью продления жизни или временного ослабления симптомов. Цитотоксические препараты могут быть скомбинированы с лучевой терапией и/или хирургическим вмешательством, как в случае неоадьювантного лечения (первоначальная химиотерапия нацелена на сокращение опухоли, благодаря чему оказание помощи посредством местной терапии, такой как хирургическое вмешательство и облучение, более эффективно) или как в случае адьювантной химиотерапии (применяется в сопряжении или после хирургического вмешательства и/или местной терапии). Комбинации различных лекарственных препаратов зачастую более эффективны, чем индивидуальные лекарственные препараты: они могут обеспечивать преимущество усиленного отклика в определенных опухолях, уменьшать развитие устойчивости к лекарственным препаратам и/или увеличивать выживаемость. По этим причинам применение комбинированных схем приема цитотоксических лекарств при лечении многих типов рака является широко распространенным. Цитотоксические вещества, принятые к применению в настоящее время, реализуют различные механизмы блокировки быстрого роста и вызывают клеточную гибель. Вообще, их можно подразделить на следующие группы, основываясь на механизме их действия: микротрубочковые модуляторы, которые препятствуют полимеризации или деполимеризации микротрубочек (например, доцетаксел, паклитаксел, винбластин, винорелбин); антиметаболиты, включая нуклеозидные аналоги и другие ингибиторы ключевых клеточных метаболических путей (например, капецитабин, гемцитабин, метотрексат); вещества, которые непосредственно взаимодействуют с ДНК (например, карбоплатин, циклофосфамид); антрациклиновые ДНК-интеркаляторы, которые препятствуют функционированию ДНК-полимеразы и Топо-изомеразы II (например, доксорубицин, эпирубицин); и неантрациклиновые ингибиторы активности Топо-изомеразы (например, топотекан, иринотекан и этопозид). Даже если различные цитотоксические лекарственные препараты воздействуют посредством различных механизмов действия, каждый, как правило приводит, по меньшей мере, к временному сокращению опухоли. Цитотоксические вещества продолжают выполнять роль важного компонента в онкологическом арсенале вооружения, предназначенного для использования в борьбе с раком. Большинство лекарственных препаратов, в настоящее время проходящих последний этап Фазы II и Фазу III клинических испытаний, сфокусированы на известных механизмах действия (тубулинсвязывающие вещества, антиметаболиты, взаимодействующие с ДНК при процессах ее функционирования), и на поэтапно возрастающих улучшениях известных классов лекарственных препаратов (например, таксаны или камптотецины). Небольшое количество цитотоксических лекарственных препаратов, основанных на новых механизмах действия, появилось в последнее время. Принципы действия этих цитотоксических препаратов включают ингибирование ферментов, задействованных в модификации ДНК (например, гистондеацетилаза (HDAC)), ингибирование белков, вовлеченных в движение микротрубочек и развитие клеточного цикла (например, кинезины, aurora киназа (серин/треонин-протеинкиназа)), и новые индукторы метаболического пути апоптоза (например, ингибиторы bcl-2).
Даже если цитотоксические вещества продолжают оставаться на передовой важной позиции в подходах лечения пациентов с сильно развившимися солидными опухолями, их ограниченная эффективность и узкоограниченные терапевтические свойства в результате проявляются в существенных побочных эффектах. Кроме того, фундаментальное научное исследование рака привело к изучению менее токсичных методов лечения, основанных на специфических механизмах, являющихся главными в развитии опухоли. Такие исследования могут привести к эффективной терапии, сопровождающейся улучшением качества жизни онкологических пациентов. Таким образом, появился новый класс терапевтических веществ, относящихся к цитостатикам. Цитостатики направляют свое воздействие на стабилизацию опухоли и, как правило, ассоциируются с более ограниченным и менее отягощающим профилем побочного эффекта. Их усовершенствование осуществляется в результате идентификации специфических генетических изменений, вовлеченных в развитие рака и на основе понимания, какие белки активируются при раке, такие как тирозин-киназа и серин/треонин-киназа.
Сверхэкспрессия EGFR встречается с высокой частотой в человеческих эпителиальных злокачественных новообразованиях, и его активация играет существенную роль в проявлении и развитии злокачественных новообразований человека, поскольку сигнальные метаболические пути EGFR связаны с клеточной пролиферацией, повышением выживаемости и ингибированием апоптоза. Вследствие этого, EGFR представляет собой очень привлекательную молекулярную мишень для терапии рака. В течение последних 20 лет многочисленные низкомолекулярные ингибиторы и моноклональные антитела, нацеленные на EGFR, успешно разрабатывались. Производные 4-анилинохиназолинов, Iressa (Гефитиниб) и Tarceva (Эрлотиниб) (Фиг. 1), представляют собой два селективных ингибитора EGFR, одобренных FDA в 2003 и 2004 гг., для лечения местнораспространенного или метастатического немелкоклеточного рака легких (NSCLC). Клинические данные показывают, что 10-20% от всех пациентов с NSCLC частично реагируют на эти два ингибитора EGFR, но только Эрлотиниб продлевал жизнь пациентов с рецидивным NSCLC. Кроме того, у большинства пациентов, которые реагировали на первичное лечение, со временем развивалась устойчивость к ингибиторам EGFR. Таким образом, существует крайне необходимая медицинская потребность в разработке и обнаружении новых, с широким терапевтическим индексом и более сильнодействующих соединений с противоопухолевой активностью.
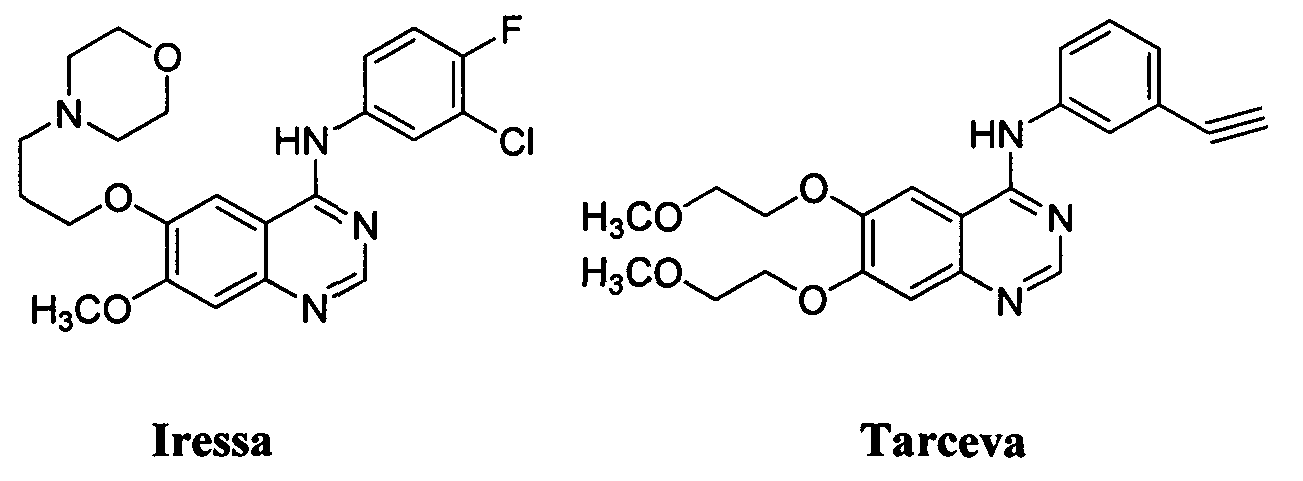
Фигура 1: Химические структуры Iressa и Tarceva
Техническая проблема, которую надо решить, в соответствии с настоящим изобретением, следовательно, может быть представлена как предоставление новых соединений, обладающих достаточно хорошей противораковой активностью или ингибиторной активностью в отношении EGFR тирозин-киназ или других киназ, таким образом предоставляя новые терапевтические возможности для лечения заболеваний, в частности, рака и других пролиферативных нарушений.
Сущность изобретения
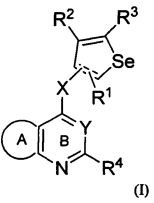
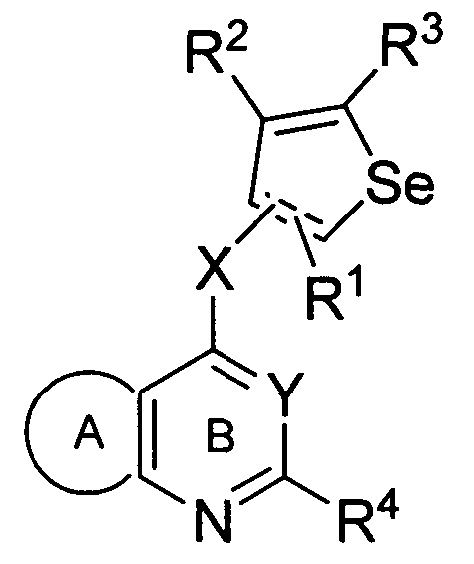
Настоящее изобретение предоставляет замещенные 4-(селенофен-2(или 3)-иламино)пиримидиновые соединения формулы (I) и их фармацевтически приемлемые соли.
В другом аспекте, изобретение предоставляет геометрические изомеры/оптические изомеры/диастереомеры, гидраты соединений формулы (I).
В другом аспекте, изобретение предоставляет способ получения соединений формулы (I).
В другом аспекте, изобретение предоставляет фармацевтические композиции, включающие, по меньшей мере, одно 4-(селенофен-2(или 3)-иламино)пиримидиновое соединение, выбираемое из вышеуказанных формулы (I) и его производных, в комбинации, по меньшей мере, с одним фармацевтически приемлемым эксципиентом/носителем/разбавителями.
В другом аспекте, изобретение предоставляет фармацевтические композиции, включающие, по меньшей мере, одно 4-(селенофен-2(или 3)-иламино)пиримидиновое соединение, выбираемое из вышеуказанных формулы (I) и его производных, в комбинации, по меньшей мере, с одним фармацевтически приемлемым эксципиентом/носителем/разбавителями и, по меньшей мере, с одним противоопухолевым веществом.
В другом аспекте, настоящее изобретение предоставляет способ лечения или ингибирования, или контролирования клеточного пролиферативного нарушения, в частности, рака у пациента, нуждающегося в таком лечении, включающий введение пациенту эффективного количества соединения формулы (I) или его композиций, как определено выше.
В другом аспекте, настоящее изобретение предоставляет способ лечения или контролирования роста опухоли или злокачественного новообразования посредством блокирования развития кровеносных сосудов или посредством ингибирования формирования сосудистых капилляров при введении, по меньшей мере, одного селенофенового соединения формулы (I) или его солей, или его композиций, как определено выше.
Описание чертежей
Фигура 1: Соединение 27 ингибирует формирование капилляроподобных эндотелиальных трубочек in vitro. Эндотелиальные клетки умбиликальной вены человека (Human umbilical vein endothelial cells (HUVECs)) наносили ровным слоем на поверхность чашки Петри, покрытую Cultrex, в присутствии либо только 10 нг/мл человеческого рекомбинантного фактора роста фибробласт (human recombinant Fibroblast Growth Factor (FGF)) (B), либо совместно с соединением 27 в количестве 0,5, 1,0, 2,5 и 5 мкг/мл C, D, E и F, соответственно. Клетки при наличии лечебной обработки оставляли для образования эндотелиальных капиллярных микротрубочек на 16 ч при 37°С. Панель A представляет формирование капилляроподобных эндотелиальных трубочек в ячейках с контрольной средой, обработанной 0,1% ДМСО.
Подробное описание изобретения
Изобретение сейчас будет подробно описано в связи с некоторыми предпочтительными и необязательными вариантами осуществления изобретения, таким образом эти различные его аспекты могут быть полнее поняты и приняты во внимание.
В настоящем изобретении используется селенофен в качестве основы структуры вместо бензольного кольца в 4-фениламинохиназолине для существенного увеличения его активности для возможного лечения на стадии ранней диагностики и для существенного увеличения эффективности при лечении на поздней стадии рака. Причина, по которой селенофеновая кольцевая система была выбрана вместо ароматической фениловой кольцевой системы заключается в том, что селен, будучи наиболее большим атомом в пятичленном кольце, может иметь сходство с фениловым кольцом по форме и размеру, и может приобретать структуру фенилового кольца в пространстве. Рецепторы, задействованные в распознавании 4-фениламинохиназолина, например, в гефитинибе, также могут распознаваться 4-селенофениламинохиназолином для биологического отклика. К тому же, селен в виде металлоорганического соединения может обладать противораковыми свойствами. Селен представляет собой хорошо идентифицируемый эссенциальный, присутствующий в следовых количествах рассеянный элемент в организме человека, в дозах 55-90 мкг, необходимых для поддержания полезного для здоровья режима питания людей (K.M. Aumann et. al., Org. Biomol. Chem., 2007, 5, 1276-1281). Вследствие этого селен может быть включен в виде металлоорганического соединения посредством того, что ароматическая селенофеновая кольцевая система замещает ароматическую фениловую систему, с существенным возрастанием эффективности.
Предложенные новые аналоги с заместителями в селенофеновой кольцевой системе будут приобретать конформацию, которая соответствует рецепторам мембраны опухолевой клетки, при специфических конформационных перестройках (Specific Conformational Perturbation (SCP)), предоставляя возможность физиологической реакции. С этим новым дизайном все молекулы в предварительно организованной специфической конформации в процессе действия связываются с рецепторами на сто процентов синхронизированно.
Это обернется предоставлением возможности высокой специфичности с большим диапазоном Терапевтического Индекса (TI). Обычно, для лечения онкологических пациентов большее значение терапевтического индекса является предпочтительным. Это объясняется тем, что в одном случае надо бы начать схему лечения с очень высокой максимальной переносимой дозы (Maximum Tolerated Dose (MTD)), такой, чтобы именно сами раковые клетки поражались бы сильно при первом химиотерапевтическом лечении. В противном случае, выжившие раковые клетки будут устранять повреждения ДНК и впоследствии метастазировать в другие ткани или органы. Кроме того, раковые клетки, выжившие после первого лечения, станут устойчивыми ко второму или последующим повторениям химиотерапии в случае таковой необходимости. И кроме того, из-за ослабления иммунной системы после первой химиотерапии субоптимальная доза, которая должна быть введена при втором лечебном воздействии, внесет вклад в токсичность больше, чем в лечебный эффект.
В качестве составной части работы по разработке новых противораковых соединений двадцать девять 4-селенофен-2(или 3)-иламинопиримидиновых соединений формулы (I) были получены и протестированы на их эффективность против трех раковых клеточных линий. Было установлено, что эти 4-селенофен-2(или 3)-иламинохиназолиновые соединения формулы (I) показали хорошее ингибирующее действие по отношению к A549 (легкое), DU145 (предстательная железа) и HT29 (толстая кишка) раковым клеточным линиям in vitro. Изобретатели сделали поразительное открытие, что аналог 4-селенофен-2(или 3)-иламинохиназолина (соединение 5) формулы (I) демонстрирует примерно в четыре раза большую активность in vitro по сравнению с гефитинибом (Iressa) при ингибировании клеточной линии A549 рака легких. Подобным образом аналог 4-селенофен-2(или 3)-иламинохиназолина (соединение 5) показал на клеточной линии A549 величину IC50, равную 4,6 мкΜ, в сравнении с 16,6 мкΜ, которую проявил гефитиниб. Также было установлено, что аналог 4-селенофен-2(или 3)-иламинохиназолина (соединение 1) формулы (I) демонстрирует примерно в два раза большую активность in vitro по сравнению с гефитинибом (Iressa) при ингибировании клеточной пролиферации клеточной линии A549 рака легких. Этот аналог (соединение 1) показал на той же клеточной линии рака легких величину IC50, равную 9,08 мкΜ, в сравнении с 16,6 мкΜ, которую проявил гефитиниб. Следовательно, новые аналоги (соединение 1 и соединение 5) являются значительно более лучшими, чем реализуемый на рынке лекарственный препарат гефитиниб (Iressa), по показателю эффективности в условиях in vitro. Итак, более поразительно, что эти два аналога (соединение 1 и соединение 5) аналогичным образом демонстрируют в несколько раз большую активность in vitro по сравнению с гефитинибом (Iressa) при ингибировании раковых клеточных линий DU145 (предстательная железа) и HT29 (толстая кишка), и эти результаты в итоге суммированы в Таблице 1.
Как можно видеть из Таблицы 2, соединение 21 было в шестнадцать, пятнадцать и в семнадцать раз активнее, чем Iressa в отношении клеток карциномы молочной железы (MDA-MB-231), гепатоцеллюлярных (HepG2) и цервикальных (HeLa) клеток карциномы, соответственно. Таким же образом, соединение 27 в равной мере более активно, чем Iressa в тех же самых трех карциномных клеточных линиях, тестированных in vitro.
На основании показанного на Фигуре 1, очевидно, что соединение 27 действует как препятствующее развитию кровеносных сосудов путем существенного ингибирования формирования эндотелиальных капилляров дозазависимым образом.
Даже если выбранные соединения использовали для наглядного доказательства настоящего изобретения, изобретение охватывает все соединения формулы (I) и их производные.
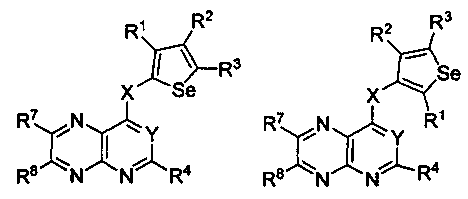
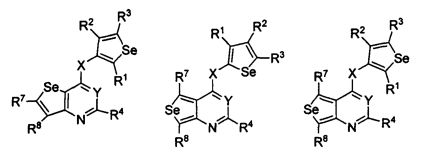
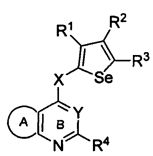
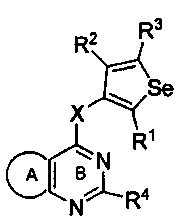
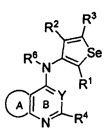
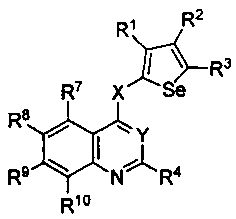
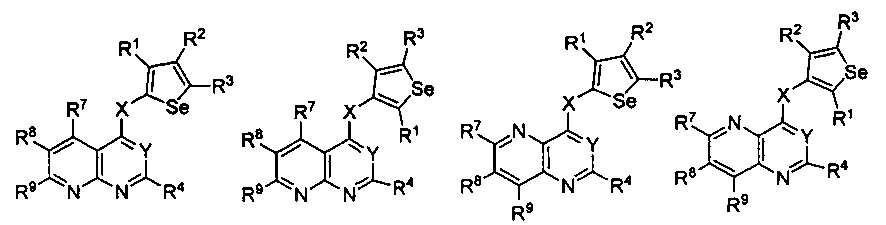
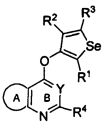
Таким образом, изобретение предоставляет замещенные 4-(селенофен-2(или 3)-иламино)пиримидиновые соединения, представленные нижеследующей формулой (I) и их фармацевтически приемлемые соли.
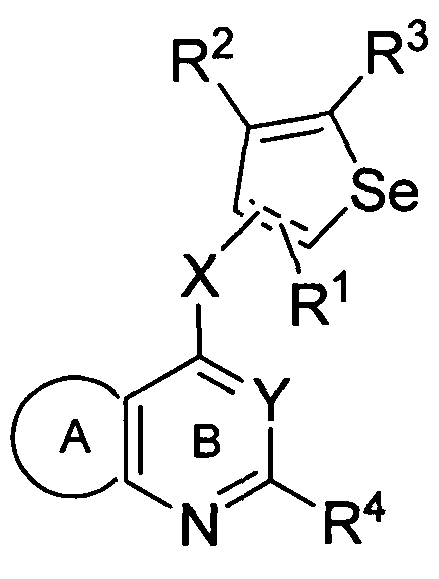
формула (I)
в которой:
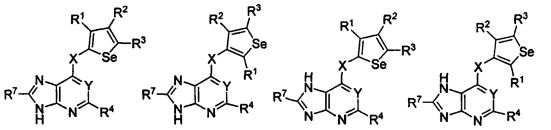
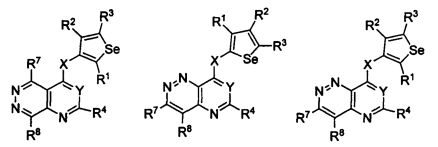
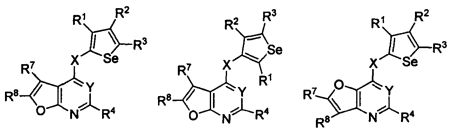
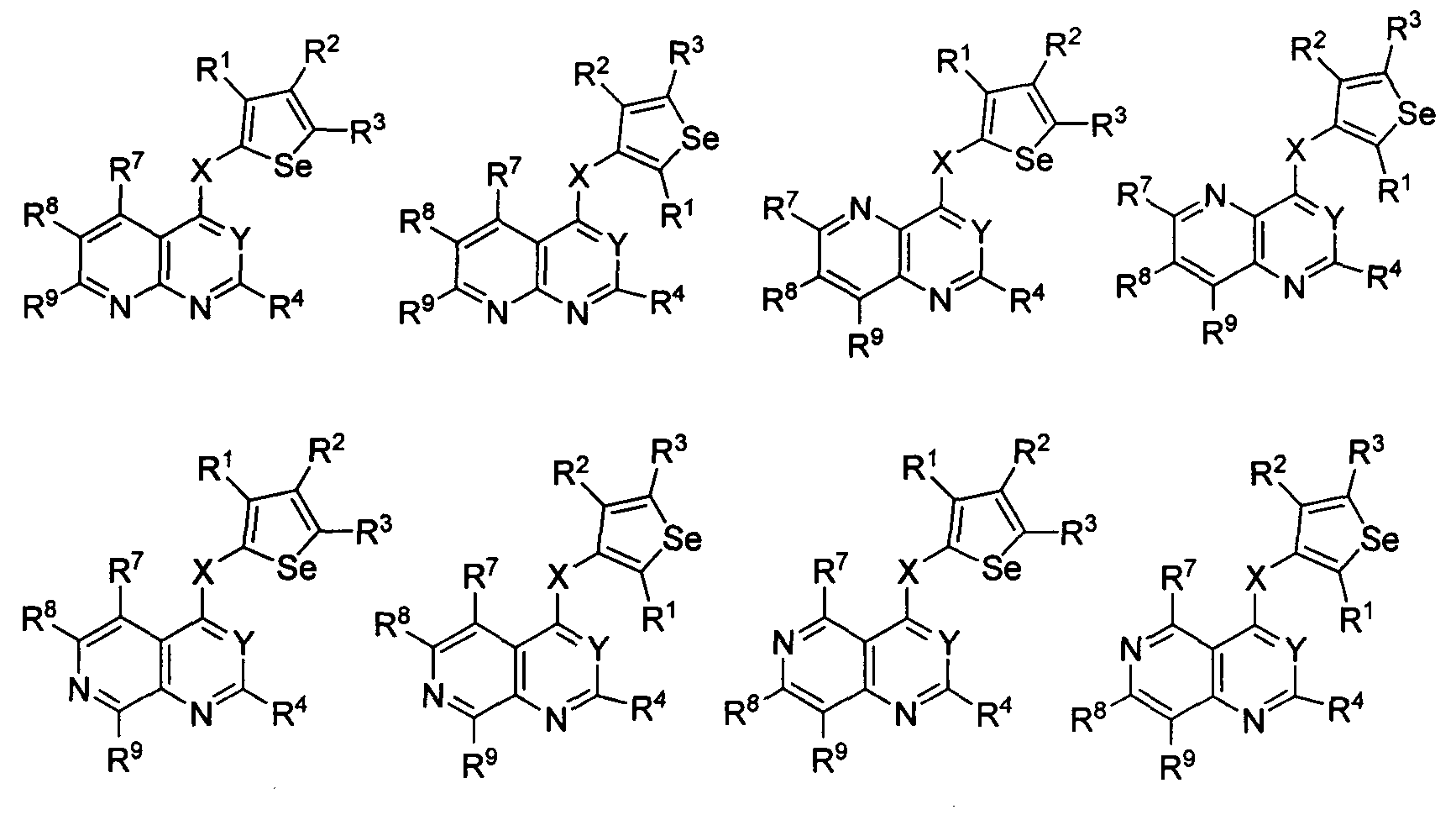
кольцо А представляет собой арил или гетероарил, или гетероциклоалкил; арил представляет собой сопряженное бензольное кольцо и гетероарил представляет собой 6-членное ароматическое сопряженное кольцо, содержащее один, два или три атома азота; или гетероарил представляет собой 5-членное ароматическое сопряженное кольцо, содержащее один или несколько гетероатомов, выбираемых из серы, кислорода, азота и селена, при условии, что присутствует не более одного атома кислорода, или серы, или селена; такие кольца включают пиридин, пиридазин, пиразин, пиримидин, тиофен, фуран, пиррол, селенофен, пиразол, имидазол, оксазол, изоксазол, тиазол и изотиазол; обычно, гетероциклоалкил представляет собой моно- или бициклический, насыщенный гетероциклический радикал, имеющий общее количество атомов углерода 3-10 и вплоть до 2 гетероатомов и/или гетерогрупп, независимо друг от друга выбираемых из группы, состоящей из N, O, S, SO и SO2;
кольцо А представляет собой, необязательно, замещенное одной, двумя или более группами, независимо друг от друга выбираемыми из водорода, галогена, гидрокси, формила, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалогенометила, сульфаниламида, С1-6 алкила, С1-6 вторичного алкила, С1-6 третичного алкила, С2-6 алкенила, С2-6 алкинила, С1-4 алкилкарбонила, С1-4 алкоксикарбонила, аминокарбонила, С1-6 алкиламинокарбонила, ди(С1-6 алкил)аминокарбонила, галогеноС1-6 алкила, гидроксиС1-6 алкила, С1-6 алкокси, галогеноС1-6 алкокси, гидроксиС1-6 алкокси, С3-7 циклоалкила, С3-7 циклоалкокси, С1-6 алкиламино, ди(С1-6 алкил)амино, аминоС1-6 алкила, аминоС1-6 алкокси, С1-6 алкиламиноС1-6 алкила, ди(С1-6 алкил)аминоС1-6 алкила, С1-6 алкилсульфинила, С1-6 алкилсульфонила, и кольца арила, гетероарила и гетероциклоалкила; кольца арила, гетероарила и гетероциклоалкила, необязательно, замещенного галогеном, гидроксилом, формилом, карбоновой кислотой, амино, нитро, циано, сульфоновой кислотой, тиолом, тригалогенометилом, сульфаниламидом, С1-6 алкилом, С2-6 алкенилом, С2-6 алкинилом, С1-4 алкилкарбонилом, С1-4 алкоксикарбонилом, аминокарбонилом, С1-6 алкиламинокарбонилом, ди(С1-6 алкил)аминокарбонилом, галогеноС1-6 алкилом, гидроксиС1-6 алкилом, С1-6 алкокси, галогеноС1-6 алкокси, гидроксиС1-6 алкокси, С3-7 циклоалкилом, С3-7 циклоалкокси, С1-6 алкиламино, ди(С1-6 алкил)амино, аминоС1-6 алкилом, аминоС1-6 алкокси, С1-6 алкиламиноС1-6 алкилом, ди(С1-6 алкил)аминоС1-6 алкилом, С1-6 алкилсульфинилом, С1-6 алкилсульфонилом;
Y представляет собой N или C-R5, в котором R5 выбирают из водорода, галогена, гидрокси, формила, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалогенометила, сульфаниламида, С1-6 алкила, С1-6 вторичного алкила, С1-6 третичного алкила, С2-6 алкенила, С2-6 алкинила, С1-4 алкилкарбонила, С1-4 алкоксикарбонила, аминокарбонила, С1-6 алкиламинокарбонила, ди(С1-6 алкил)аминокарбонила, галогеноС1-6 алкила, гидроксиС1-6 алкила, С1-6 алкокси, галогеноС1-6 алкокси, гидроксиС1-6 алкокси, С3-7 циклоалкила, С3-7 циклоалкокси, С1-6 алкиламино, ди(С1-6 алкил)амино, аминоС1-6 алкила, аминоС1-6 алкокси, С1-6 алкиламиноС1-6 алкила, ди(С1-6 алкил)аминоС1-6 алкила, С1-6 алкилсульфинила, С1-6 алкилсульфонила;
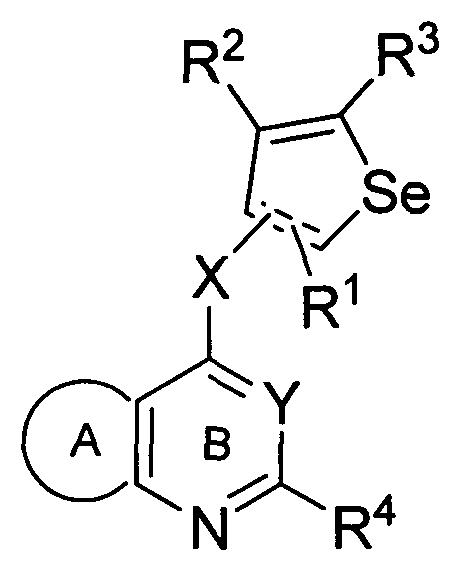
X может быть присоединен либо во 2-м, либо в 3-м положении селенофенового кольца;
X выбирают из NR6, O, S, S(O), S(О2); в котором R6 выбирают из водорода, амино, С1-6 алкила, галогеноС1-6 алкила;
R1, R2, R3 и R4
выбирают из водорода, галогена, гидрокси, формила, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалогенометила, сульфаниламида, С1-6 алкила, С1-6 вторичного алкила, С1-6 третичного алкила, С2-6 алкенила, С2-6 алкинила, С1-4 алкилкарбонила, С1-4 алкоксикарбонила, аминокарбонила, С1-6 алкиламинокарбонила, ди(С1-6 алкил)аминокарбонила, галогеноС1-6 алкила, гидроксиС1-6 алкила, С1-6 алкокси, галогеноС1-6 алкокси, гидроксиС1-6 алкокси, С3-7 циклоалкила, С3-7 циклоалкокси, С1-6 алкиламино, ди(С1-6 алкил)амино, аминоС1-6 алкила, аминоС1-6 алкокси, С1-6 алкиламиноС1-6 алкила, ди(С1-6 алкил)аминоС1-6 алкила, С1-6 алкилсульфинила, С1-6 алкилсульфонила; и кольца арила, гетероарила и гетероциклоалкила; кольца арила, гетероарила и гетероциклоалкила, необязательно, замещенного галогеном, гидроксилом, формилом, карбоновой кислотой, амино, нитро, циано, сульфоновой кислотой, тиолом, тригалогенометилом, сульфаниламидом, С1-6 алкилом, С2-6 алкенилом, С2-6 алкинилом, С1-4 алкилкарбонилом, С1-4 алкоксикарбонилом, аминокарбонилом, С1-6 алкиламинокарбонилом, ди(С1-6 алкил)аминокарбонилом, галогеноС1-6 алкилом, гидроксиС1-6 алкилом, С1-6 алкокси, галогеноС1-6 алкокси, гидроксиС1-6 алкокси, С3-7 циклоалкилом, С3-7 циклоалкокси, С1-6 алкиламино, ди(С1-6 алкил)амино, аминоС1-6 алкилом, аминоС1-6 алкокси, С1-6 алкиламиноС1-6 алкилом, ди(С1-6 алкил)аминоС1-6 алкилом, С1-6 алкилсульфинилом, С1-6 алкилсульфонилом.
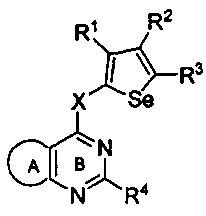
В предпочтительном варианте осуществления, изобретение предоставляет замещенные 4-(селенофен-2(или 3) иламино)пиримидиновые соединения, представленные нижеследующей формулой (I),
формула (I)
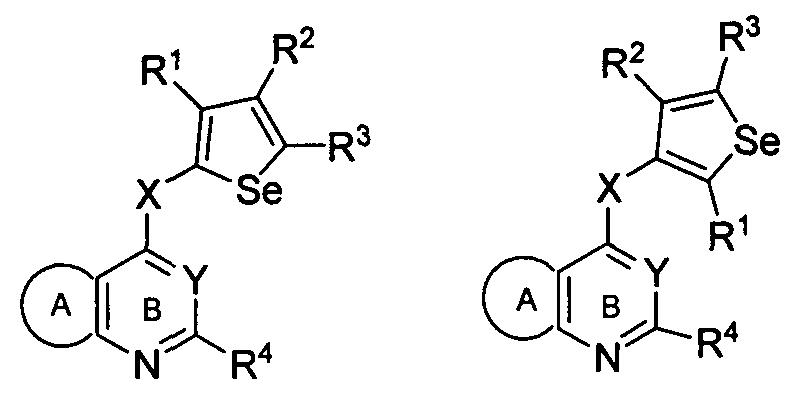
в которой X может быть присоединен либо во 2-м, либо в 3-м положении селенофенового кольца и выбирается из нижеследующих;
В другом варианте осуществления, изобретение предоставляет селенофеновые соединения формулы (I), в которых X представляет собой NR6;
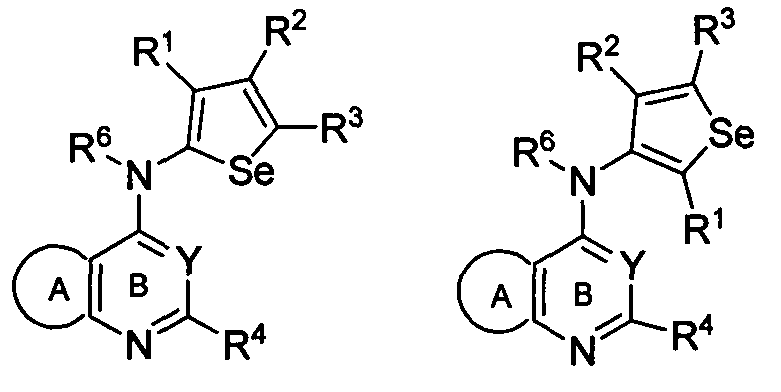
в которых R6 выбирают из водорода, амино, С1-6 алкила, галогеноС1-6 алкила.
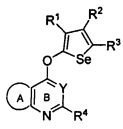
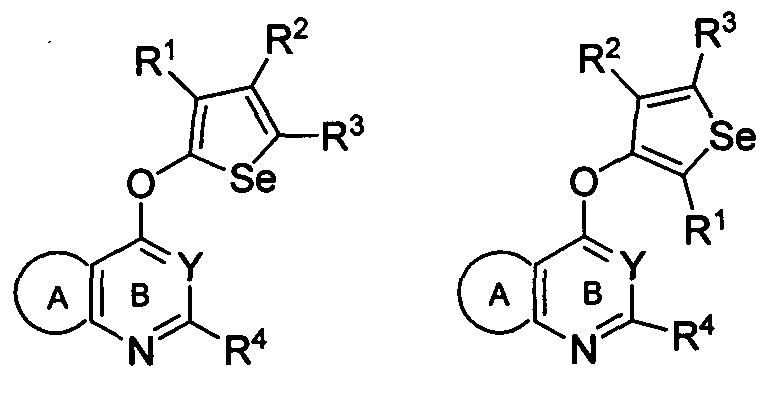
В другом варианте осуществления, изобретение предоставляет селенофеновые соединения формулы (I), в которых X представляет собой O;
В другом варианте осуществления, изобретение предоставляет селенофеновые соединения формулы (I), в которых Y представляет собой N;
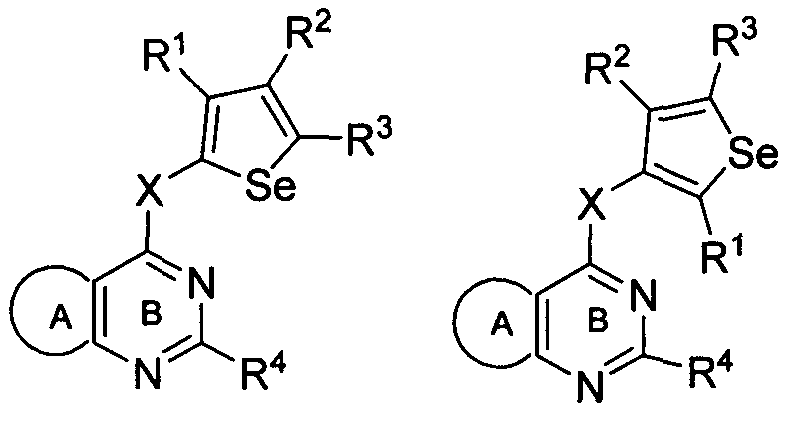
В другом варианте осуществления, изобретение предоставляет селенофеновые соединения формулы (I), в которых Y представляет собой C-R5;
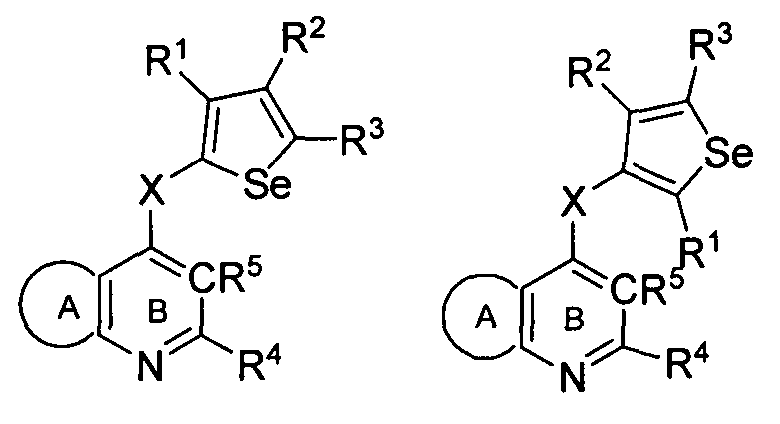
в которых R5 представляет собой
выбираемый из водорода, галогена, гидрокси, формила, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалогенометила, сульфаниламида, С1-6 алкила, С1-6 вторичного алкила, С1-6 третичного алкила, С2-6 алкенила, С2-6 алкинила, С1-4 алкилкарбонила, С1-4 алкоксикарбонила, аминокарбонила, С1-6 алкиламинокарбонила, ди(С1-6 алкил)аминокарбонила, галогеноС1-6 алкила, гидроксиС1-6 алкила, С1-6 алкокси, галогеноС1-6 алкокси, гидроксиС1-6 алкокси, С3-7 циклоалкила, С3-7 циклоалкокси, С1-6 алкиламино, ди(С1-6 алкил)амино, аминоС1-6 алкила, аминоС1-6 алкокси, С1-6 алкиламиноС1-6 алкила, ди(С1-6 алкил)аминоС1-6 алкила, С1-6 алкилсульфинила, С1-6 алкилсульфонила.
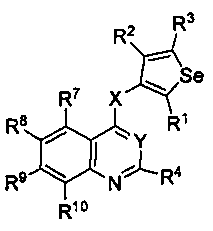
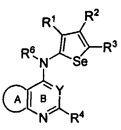
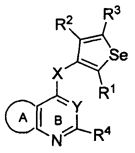
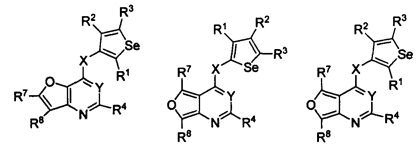
В другом варианте осуществления, изобретение предоставляет замещенные 4-(селенофен-2(или 3)-иламино)пиримидиновые соединения, представленные нижеследующей формулой (I), в которой кольцо A представляет собой, необязательно, замещенный арил или, необязательно замещенный гетероарил; необязательно замещенная арильная группа представляет собой 6-членное ароматическое кольцо, и полученная в результате сопряженная система представляет собой замещенный или незамещенный 4-селенофен-2(или 3)-иламинохиназолин. Например, 6-членное ароматическое кольцо является замещенным или незамещенным бензолом. 6-членное ароматическое кольцо выбирают из замещенного или незамещенного бензольного кольца, имеющего нижеследующую структуру;
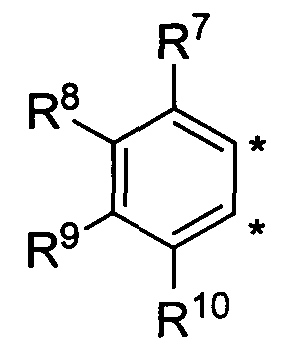
в которой * указывает место присоединения к кольцу B формулы I и выбирается из нижеследующих:
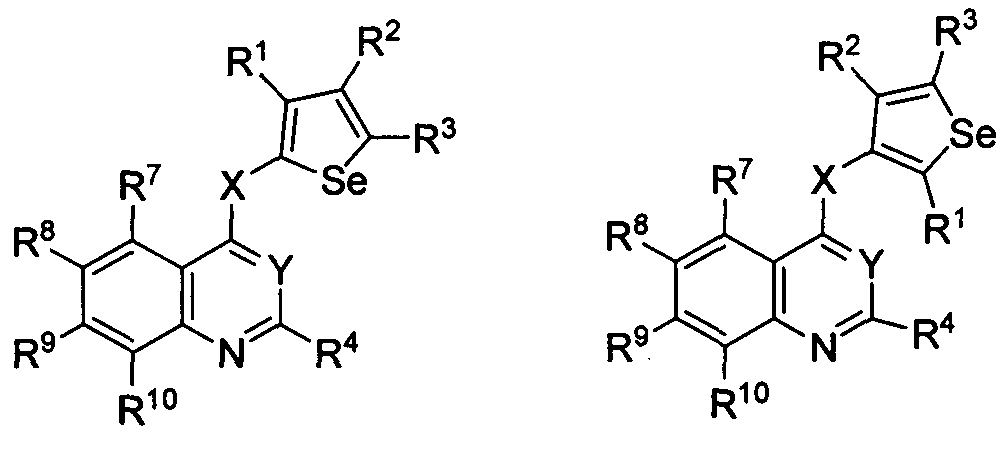
в которой:
R7, R8, R9 и R10
независимо друг от друга выбирают из водорода, галогена, гидрокси, формила, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалогенометила, сульфаниламида, С1-6 алкила, С1-6 вторичного алкила, С1-6 третичного алкила, С2-6 алкенила, С2-6 алкинила, С1-4 алкилкарбонила, С1-4 алкоксикарбонила, аминокарбонила, С1-6 алкиламинокарбонила, ди(С1-6 алкил)аминокарбонила, галогеноС1-6 алкила, гидроксиС1-6 алкила, С1-6 алкокси, галогеноС1-6 алкокси, гидроксиС1-6 алкокси, С3-7 циклоалкила, С3-7 циклоалкокси, С1-6 алкиламино, ди(С1-6 алкил)амино, аминоС1-6 алкила, аминоС1-6 алкокси, С1-6 алкиламиноС1-6 алкила, ди(С1-6 алкил)аминоС1-6 алкила, С1-6 алкилсульфинила, С1-6 алкилсульфонила и фенила, бензила, пятичленного гетероароматического кольца, содержащего один или несколько гетероатомов, выбираемых из серы, кислорода, азота и селена, при условии, что присутствует не более одного атома кислорода или серы, или селена; фенил или 5-членное гетероароматическое кольцо, необязательно, замещены галогеном, гидрокси, формилом, карбоновой кислотой, амино, нитро, циано, сульфоновой кислотой, тиолом, тригалогенометилом, сульфаниламидом, С1-6 алкилом, С1-6 вторичным алкилом, С1-6 третичным алкилом, С2-6 алкенилом, С2-6 алкинилом, С1-4 алкилкарбонилом, С1-4 алкоксикарбонилом, аминокарбонилом, С1-6 алкиламинокарбонилом, ди(С1-6 алкил)аминокарбонилом, галогеноС1-6 алкилом, гидроксиС1-6 алкилом, С1-6 алкокси, галогеноС1-6 алкокси, гидроксиС1-6 алкокси, С3-7 циклоалкилом, С3-7 циклоалкокси, С1-6 алкиламино, ди(С1-6 алкил)амино, аминоС1-6 алкилом, аминоС1-6 алкокси, С1-6 алкиламиноС1-6 алкилом, ди(С1-6 алкил)аминоС1-6 алкилом, С1-6 алкилсульфинилом, С1-6 алкилсульфонилом;
необязательно,
по меньшей мере, один из R7, R8, R9 и R10 может быть выбран из нижеследующей формулы;
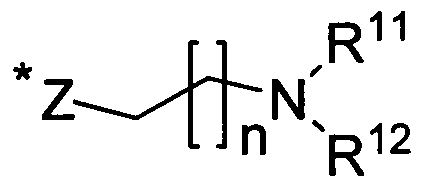
в которой:
n представляет собой целое число, выбираемое из 0, 1-5; предпочтительно, 2;
* указывает место присоединения к бензольному кольцу;
Z выбирают из CH2, O, S, или NH;
R11 и R12
независимо друг от друга выбирают из водорода, С1-6 алкила, галогеноС1-6 алкила, галогеноС1-6 алкокси, С3-7 циклоалкила;
необязательно, R11 и R12
присоединены и взятые вместе с атомами, к которым они присоединены, формируют 5-7-членное гетероциклоалкильное кольцо.
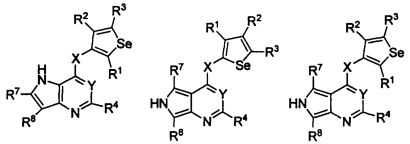
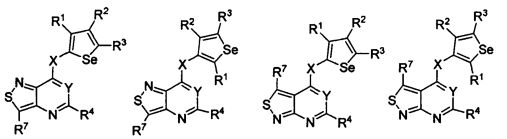
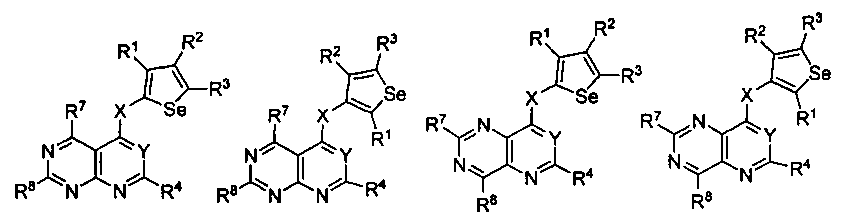
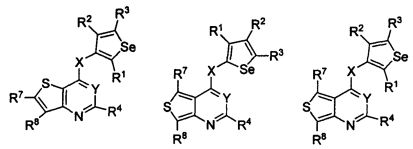
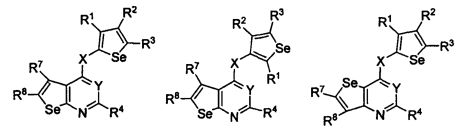
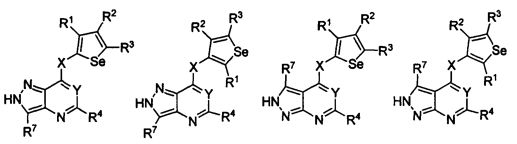
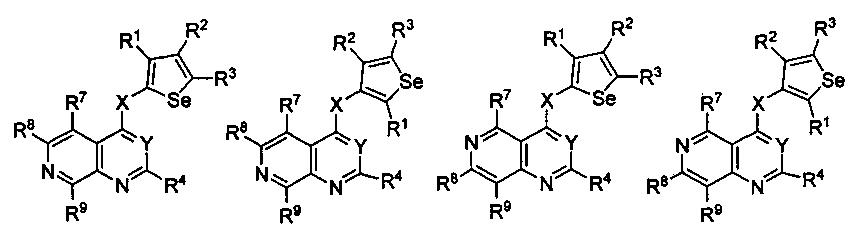
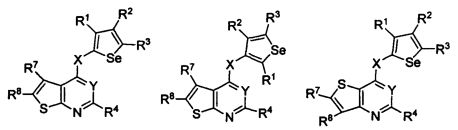
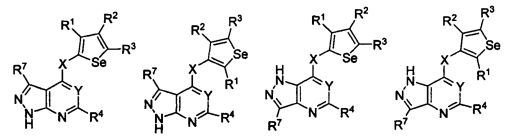
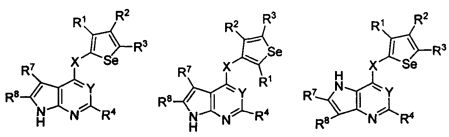
В другом варианте осуществления, изобретение предоставляет замещенные 4-(селенофен-2(или 3)-иламино)пиримидиновые соединения, представленные формулой (I), в которой кольцо A выбирают из пиридина и полученная в результате сопряженная система представляет собой замещенный или незамещенный 4-(селенофен-2(или 3)-иламинопиридино)пиримидин. Пиридиновое кольцо выбирают из нижеследующих;
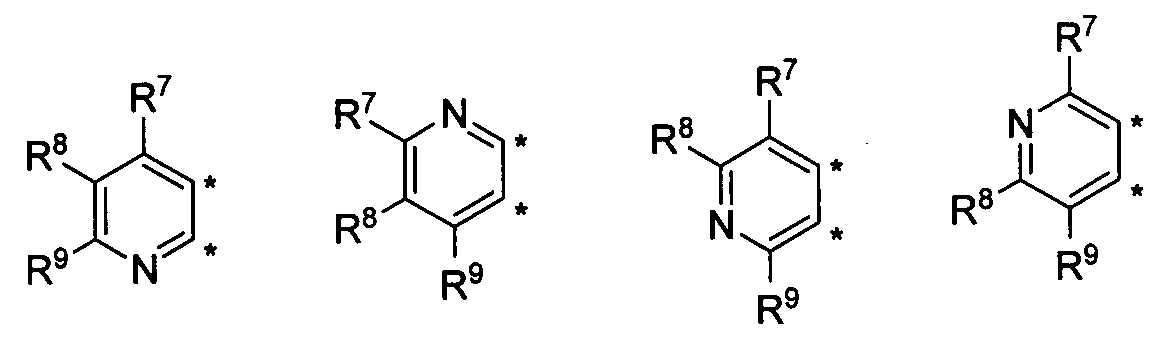
в которых:
* указывает место присоединения к кольцу B формулы I; связь, которая сопряжена с кольцом B, представляет собой либо 2,3, либо 3,2, либо 3,4, либо 4,3 пиридина, и выбирают из нижеследующих;
R7, R8 и R9
независимо друг от друга выбирают из групп, указанных выше.
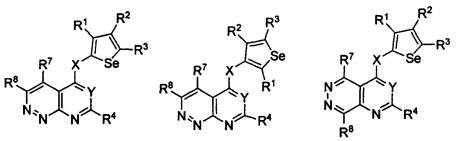
В другом варианте осуществления, изобретение предоставляет замещенные 4-(селенофен-2(или 3)-иламино)пиримидиновые соединения, представленные формулой (I), в которой кольцо A выбирают из пиразина и полученная в результате сопряженная система представляет собой замещенный или незамещенный 4-(селенофен-2(или 3)-иламинопиразино)пиримидин. Пиразиновое кольцо выбирают из нижеследующих;
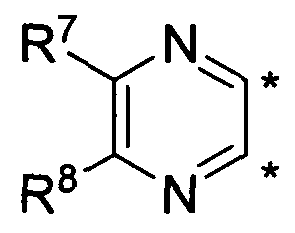
в которой:
* указывает место присоединения к кольцу B формулы I и выбирают из нижеследующих;
R7 и R8 независимо друг от друга выбирают из групп, указанных выше.
В другом варианте осуществления, изобретение предоставляет замещенные 4-(селенофен-2(или 3)-иламино)пиримидиновые соединения, представленные формулой (I), в которой кольцо A выбирают из пиримидина и полученная в результате сопряженная система представляет собой замещенный или незамещенный 4-(селенофен-2(или 3)-иламинопиримидино)пиримидин. Пиримидиновое кольцо выбирают из нижеследующих;
в которых:
* указывает место присоединения к кольцу B формулы I; связь, которая сопряжена с кольцом B, представляет собой либо 4,5, либо 5,4 пиримидина, и выбирают из нижеследующих;
R7 и R8
независимо друг от друга выбирают из групп, указанных выше.
В другом варианте осуществления, изобретение предоставляет замещенные 4-(селенофен-2(или 3)-иламино)пиримидиновые соединения, представленные формулой (I), в которой кольцо А выбирают из пиридазина и полученная в результате сопряженная система представляет собой замещенный или незамещенный 4-(селенофен-2(или 3)-иламинопиридазино)пиримидин. Пиридазиновое кольцо выбирают из нижеследующих;
в которой:
* указывает место присоединения к кольцу B формулы I; связь, которая сопряжена с кольцом B, представляет собой либо 3,4, либо 4,5, либо 4,3 пиридазина, и выбирают из нижеследующих;
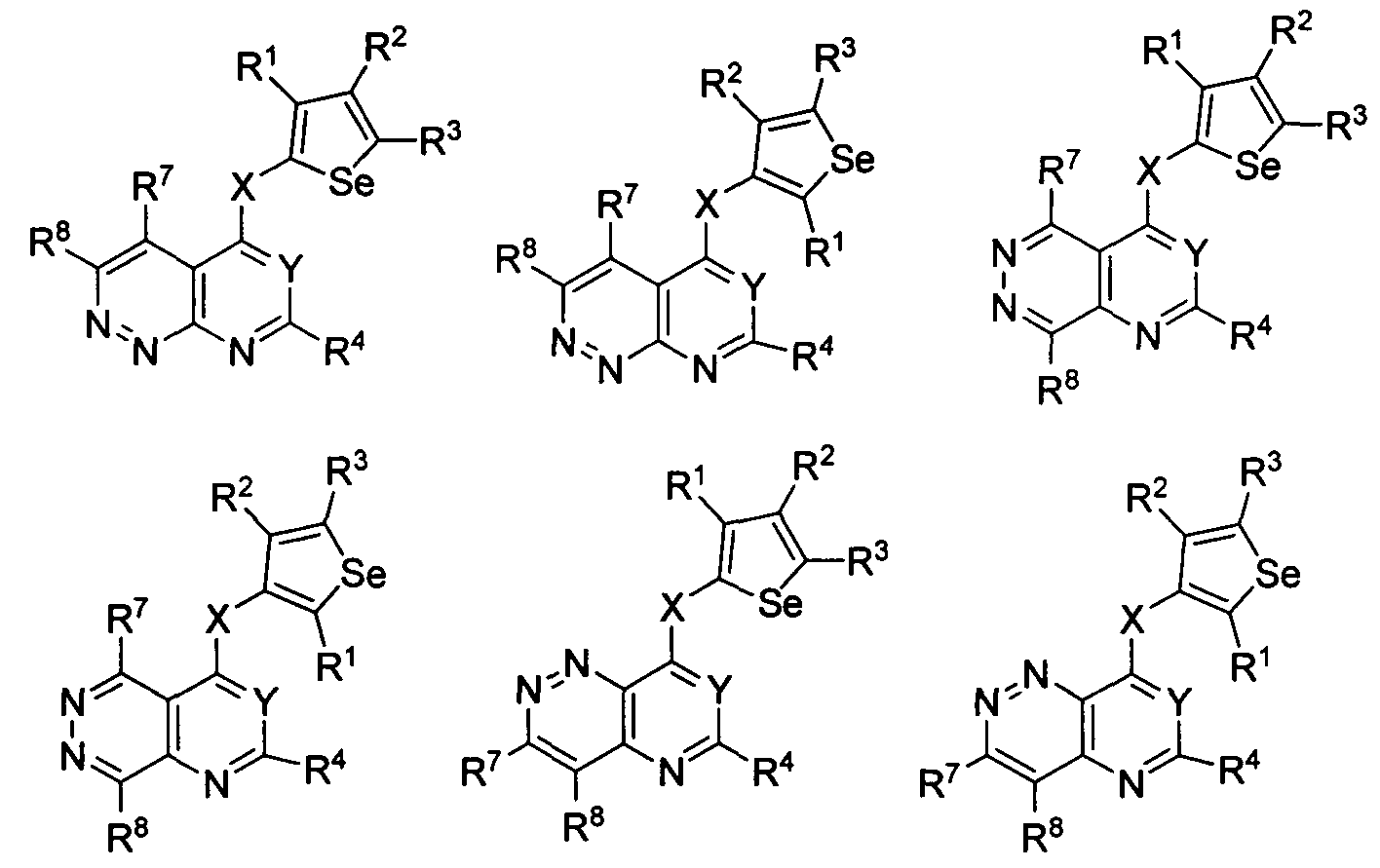
R7 и R8
независимо друг от друга выбирают из групп, указанных выше.
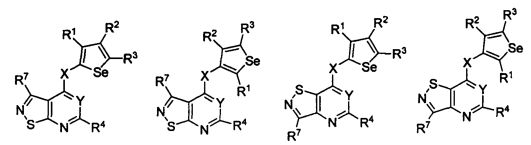
В другом варианте осуществления, изобретение предоставляет замещенные 4-(селенофен-2(или 3)-иламино)пиримидиновые соединения, представленные формулой (I), в которой кольцо А выбирают из тиофена, и полученная в результате сопряженная система представляет собой замещенный или незамещенный 4-(селенофен-2(или 3)-иламинотиено)пиримидин. Тиофеновое кольцо выбирают из нижеследующих;
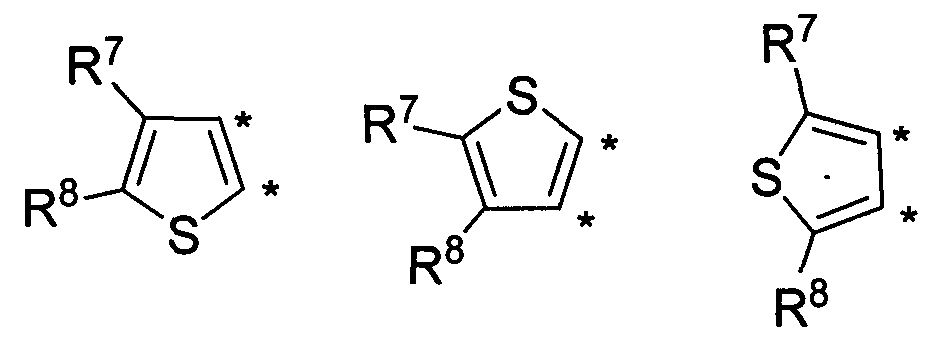
в которых:
* указывает место присоединения к кольцу B формулы I; связь, которая сопряжена с кольцом B, представляет собой либо 2,3, либо 3,2, либо 3,4 тиофена, и выбирают из нижеследующих;
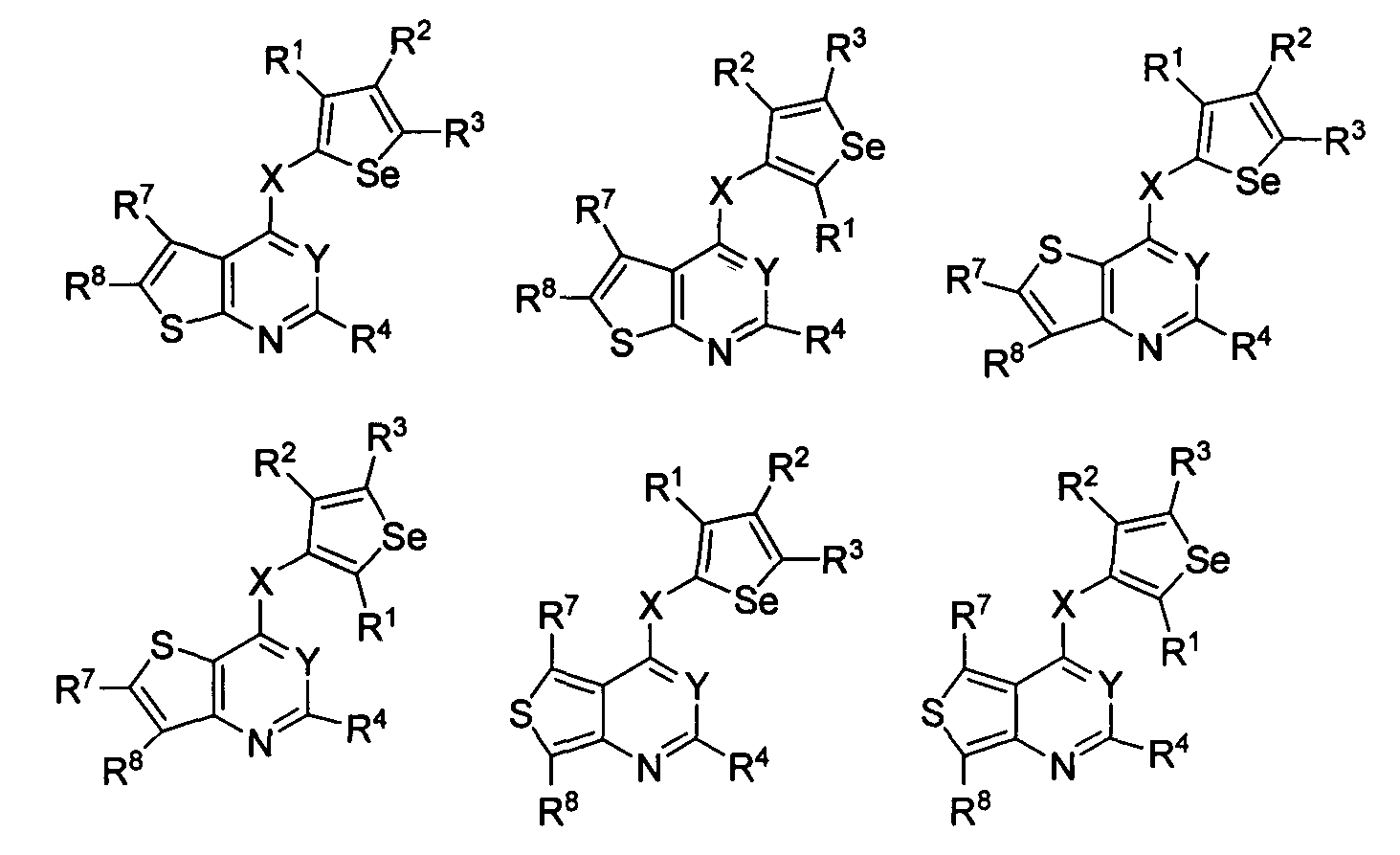
R7 и R8
независимо друг от друга выбирают из групп, указанных выше.
В другом варианте осуществления, изобретение предоставляет замещенные 4-(селенофен-2(или 3)-иламино)пиримидиновые соединения, представленные формулой (I), в которой кольцо А выбирают из фурана, и полученная в результате сопряженная система представляет собой замещенный или незамещенный 4-(селенофен-2(или 3)-иламинофурано)пиримидин. Фурановое кольцо выбирают из нижеследующих;
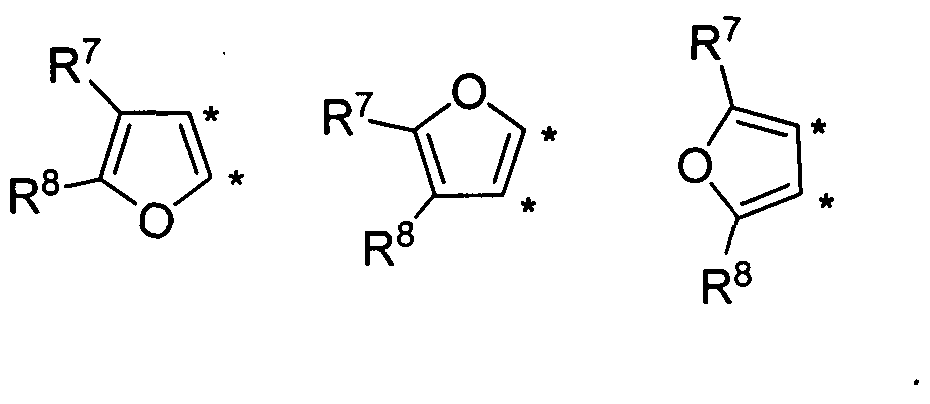
в которых:
* указывает место присоединения к кольцу B формулы I; связь, которая сопряжена с кольцом B, представляет собой либо 2,3, либо 3,2, либо 3,4 фурана, и выбирают из нижеследующих;
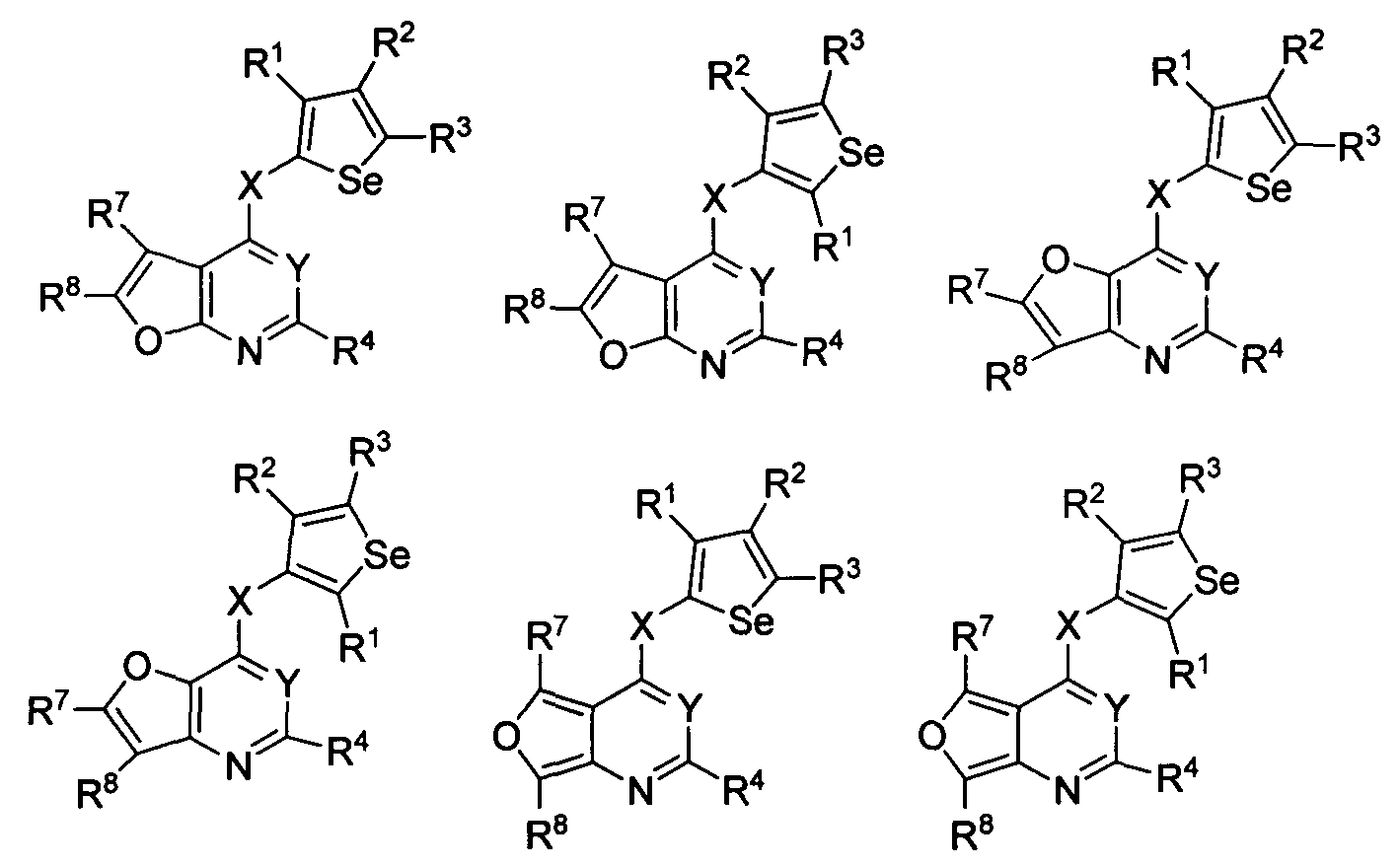
R7 и R8
независимо друг от друга выбирают из групп, указанных выше.
В другом варианте осуществления, изобретение предоставляет замещенные 4-(селенофен-2(или 3)-иламино)пиримидиновые соединения, представленные формулой (I), в которой кольцо А выбирают из пиррола и полученная в результате сопряженная система представляет собой замещенный или незамещенный 4-(селенофен-2(или 3)-иламинопирроло)пиримидин. Пиррольное кольцо выбирают из нижеследующих;
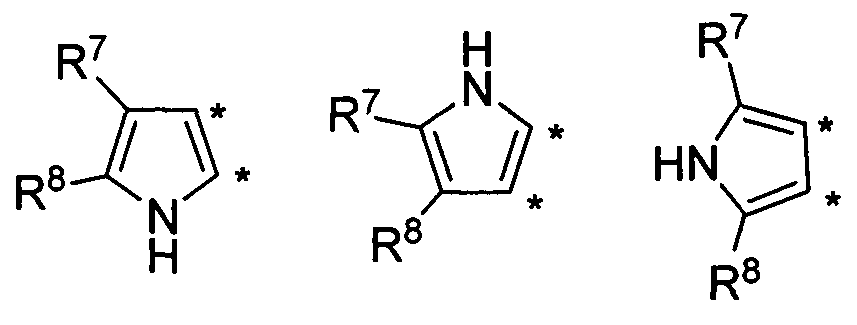
в которых:
* указывает место присоединения к кольцу B формулы I; связь, которая сопряжена с кольцом B, представляет собой либо 2,3, либо 3,2, либо 3,4 пиррола, и выбирают из нижеследующих;
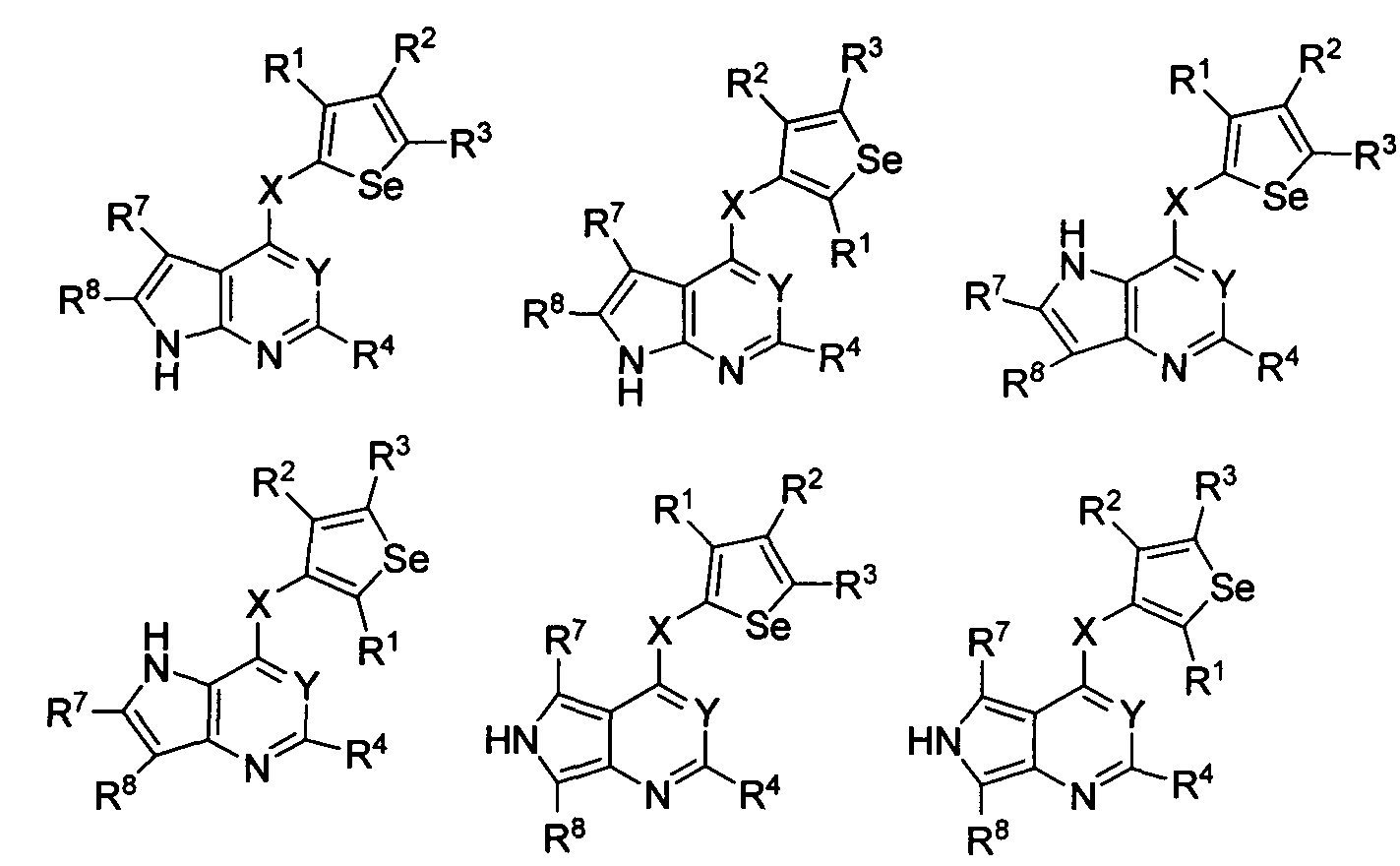
R7 и R8
независимо друг от друга выбирают из групп, указанных выше.
В другом варианте осуществления, изобретение предоставляет замещенные 4-(селенофен-2(или 3)-иламино)пиримидиновые соединения, представленные формулой (I), в которой кольцо А выбирают из селенофен и полученная в результате сопряженная система представляет собой замещенный или незамещенный 4-(селенофен-2(или 3)-иламиноселенофено)пиримидин. Селенофеновое кольцо выбирают из нижеследующих;
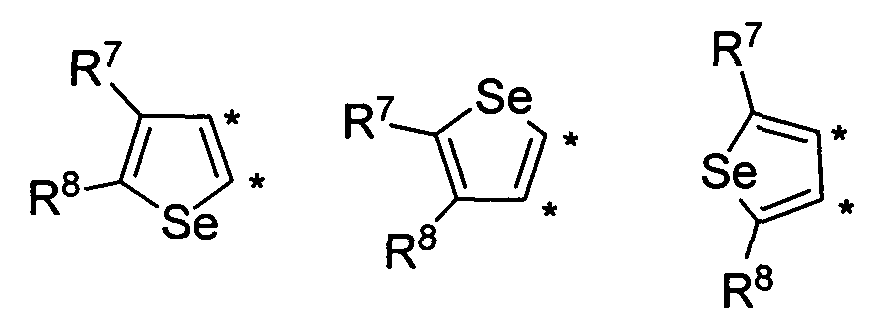
в которых:
* указывает место присоединения к кольцу B формулы I; связь, которая сопряжена с кольцом B, представляет собой либо 2,3, либо 3,2, либо 3,4 селенофена, и выбирают из нижеследующих;
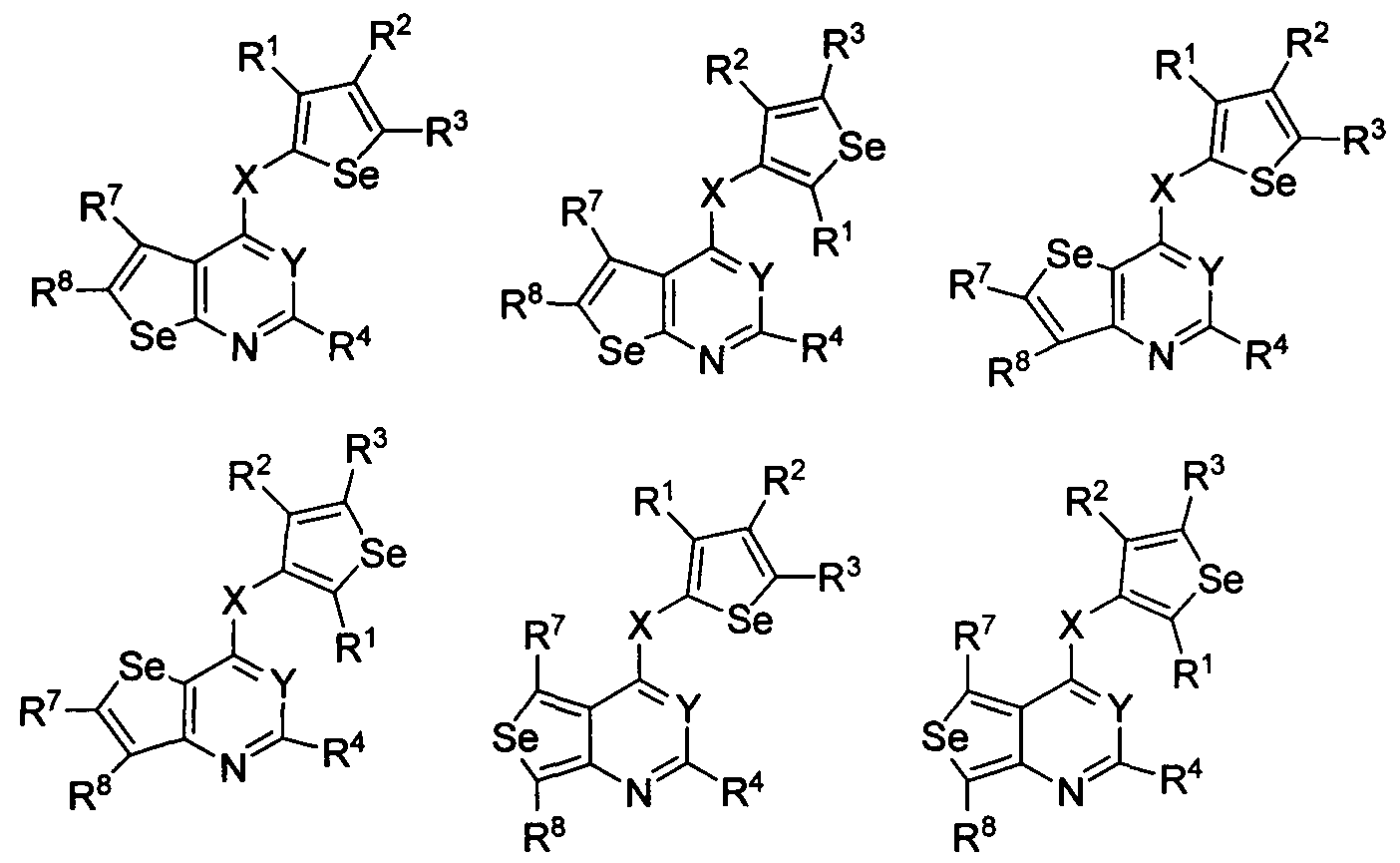
R7 и R8
независимо друг от друга выбирают из групп, указанных выше.
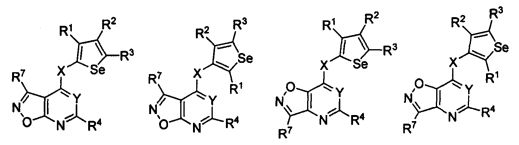
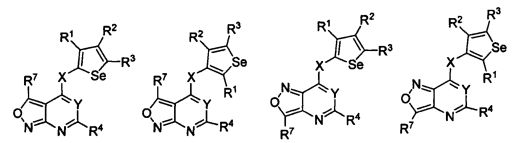
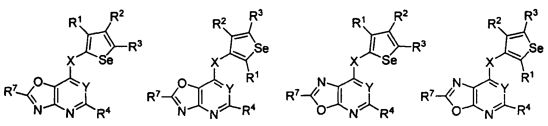
В другом варианте осуществления, изобретение предоставляет замещенные 4-(селенофен-2(или 3)-иламино)пиримидиновые соединения, представленные формулой (I), в которой кольцо А выбирают из оксазола и полученная в результате сопряженная система представляет собой замещенный или незамещенный 4-(селенофен-2(или 3)-иламинооксазоло)пиримидин. Оксазольное кольцо выбирают из нижеследующих;
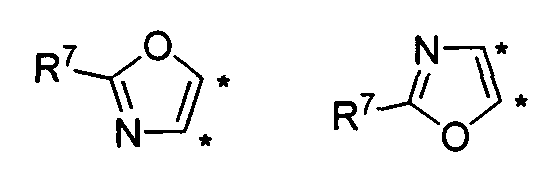
в которых:
* указывает место присоединения к кольцу B формулы I; связь, которая сопряжена с кольцом B, представляет собой либо 4,5, либо 5,4 оксазола, и выбирают из нижеследующих;
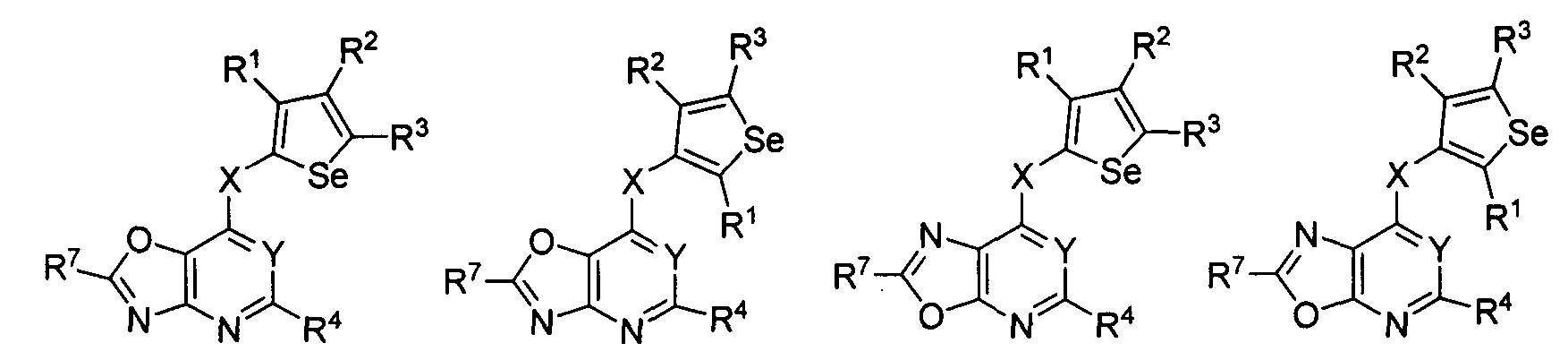
R7
независимо выбирают из групп, указанных выше.
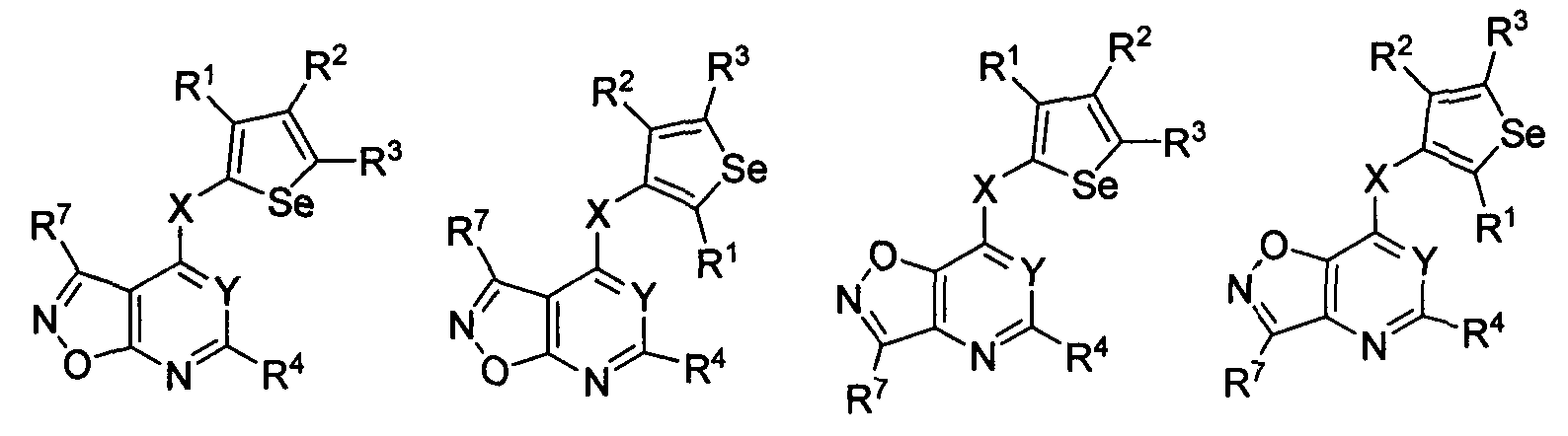
В другом варианте осуществления, изобретение предоставляет замещенные 4-(селенофен-2(или 3)-иламино)пиримидиновые соединения, представленные формулой (I), в которой кольцо А выбирают из изоксазола и полученная в результате сопряженная система представляет собой замещенный или незамещенный 4-(селенофен-2(или 3)-иламиноизоксазоло)пиримидин. Изоксазольное кольцо выбирают из нижеследующих;
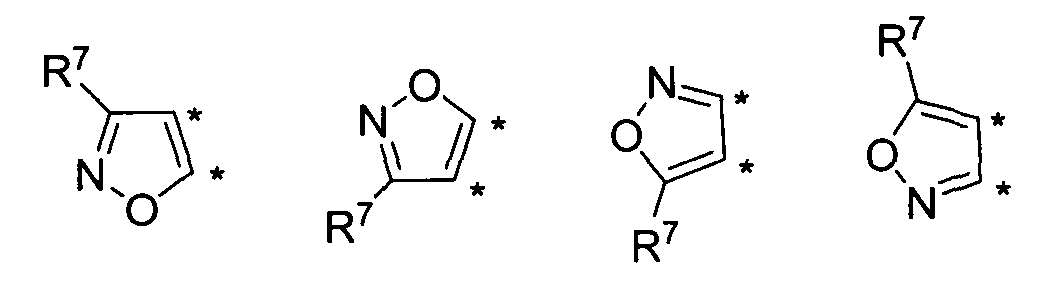
в которых:
* указывает место присоединения к кольцу B формулы I; связь, которая сопряжена с кольцом B, представляет собой либо 5,4, либо 4,5, либо 4,3, либо 3,4 изоксазола, и выбирают из нижеследующих;
R7
независимо выбирают из групп, указанных выше.
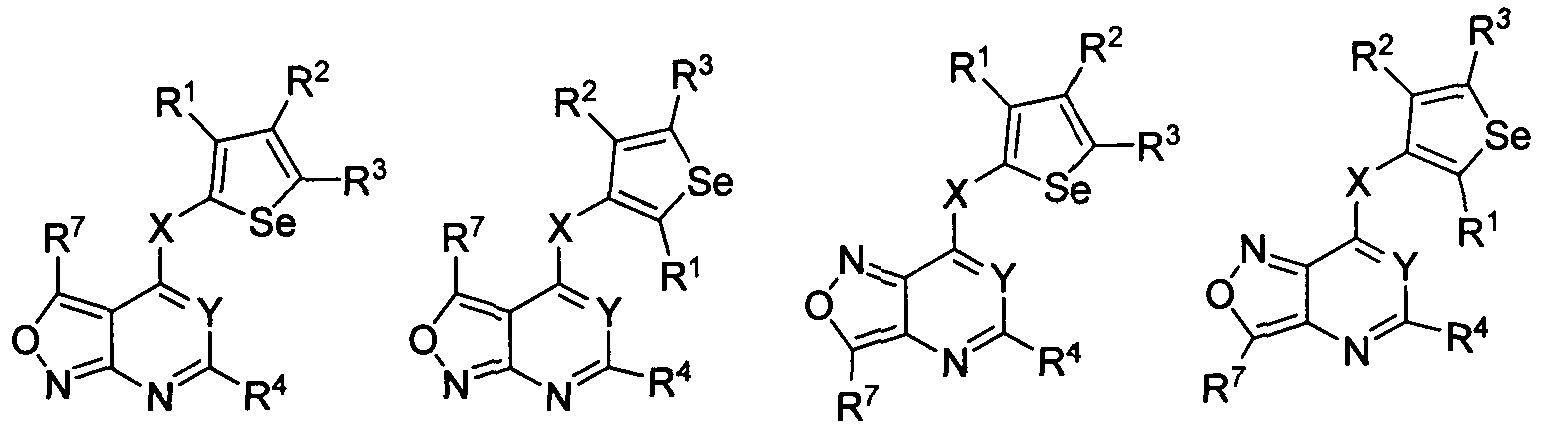
В другом варианте осуществления, изобретение предоставляет замещенные 4-(селенофен-2(или 3)-иламино)пиримидиновые соединения, представленные формулой (I), в которой кольцо А выбирают из имидазола и полученная в результате сопряженная система представляет собой замещенный или незамещенный 4-(селенофен-2(или 3)-иламиноимидазоло)пиримидин. Имидазольное кольцо выбирают из нижеследующих;
в которых:
* указывает место присоединения к кольце B формулы I; связь, которая сопряжена с кольцом B, представляет собой либо 5,4, либо 4,5 имидазола, и выбирают из нижеследующих;
R7
независимо выбирают из групп, указанных выше.
В другом варианте осуществления, изобретение предоставляет замещенные 4-(селенофен-2(или 3)-иламино)пиримидиновые соединения, представленные формулой (I), в которой кольцо А выбирают из пиразола и полученная в результате сопряженная система представляет собой замещенный или незамещенный 4-(селенофен-2(или 3)-иламинопиразоло)пиримидин. Пиразольное кольцо выбирают из нижеследующих;
в которых:
* указывает место присоединения к кольцу B формулы I; связь, которая сопряжена с кольцом B, представляет собой либо 5,4, либо 4,5, либо 4,3, либо 3,4 пиразола, и выбирают из нижеследующих;
R7
независимо выбирают из групп, указанных выше.
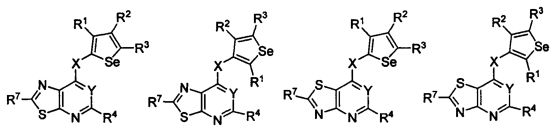
В другом варианте осуществления, изобретение предоставляет замещенные 4-(селенофен-2(или 3)-иламино)пиримидиновые соединения, представленные формулой (I), в которой кольцо А выбирают из тиазола и полученная в результате сопряженная система представляет собой замещенный или незамещенный 4-(селенофен-2(или 3)-иламинотиазоло)пиримидин. Тиазольное кольцо выбирают из нижеследующих;
в которых:
* указывает место присоединения к кольцу B формулы I; связь, которая сопряжена с кольцом B, представляет собой либо 5,4, либо 4,5 тиазола, и выбирают из нижеследующих;
R7
независимо выбирают из групп, указанных выше.
В другом варианте осуществления, изобретение предоставляет замещенные 4-(селенофен-2(или 3)-иламино)пиримидиновые соединения, представленные формулой (I), в которой кольцо А выбирают из изотиазола и полученная в результате сопряженная система представляет собой замещенный или незамещенный 4-(селенофен-2(или 3)-иламиноизотиазоло)пиримидин. Изотиазольное кольцо выбирают из нижеследующих;
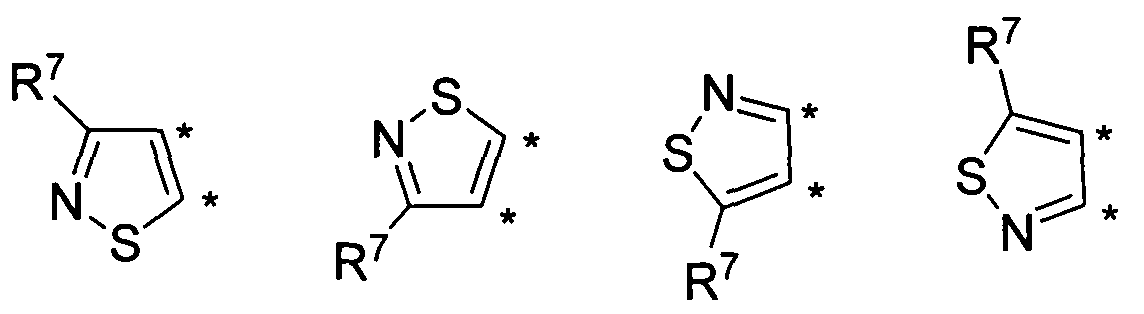
в которых:
* указывает место присоединения к кольцу B формулы I; связь, которая сопряжена с кольцом B, представляет собой либо 5,4, либо 4,5, либо 4,3, либо 3,4 изотиазола;
R7
независимо выбирают из групп, указанных выше.
Если не оговаривается иное, нижеследующие определения, применяемые для заместителей и остатков, используются на всем протяжении этого описания и формулы изобретения:
Алкил, как правило, представляет собой нормальный алкил, вторичный алкил или третичный алкил, имеющий 1-6 углеродных атомов. Не имеющие ограничительного характера примеры включают метил, этил, н-пропил, изо-пропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, гексил, изогексил. То же самое применимо к радикалам, таким как алкилкарбонил, алкокси, алкиламино, диалкиламино, алкилсульфонил, галогеноалкил и им подобные.
Алкенил, как правило, представляет собой прямоцепной или разветвленный ненасыщенный углеводородный радикал, имеющий 2-6 углеродных атомов и одну углерод-углеродную двойную связь. Не имеющие ограничительного характера примеры включают -CH=CH2, -CH=CHCH3, -C(CH3)=CH2, -CH2CH=CH2, CH=C(CH3)2, -C(CH3)=CHCH3, -CH2CH=CHCH3, -CH2C(CH3)=CH2, CH2CH2CH=CH2, -CH2CH=CHCH2CH3, -CH2CH2CH=CHCH3, -CH2CH=C(CH3)2, -CH2CH2C(CH3)=CH2, -CH=CHCH2CH2CH3 и т.п.
Алкинил, как правило, представляет собой прямоцепной или разветвленный ненасыщенный углеводородный радикал, имеющий 2-6 углеродных атомов и одну углерод-углеродную тройную связь. Не имеющие ограничительного характера примеры включают -C≡CH, -C≡CCH3, -CH2C≡CH, -C≡CCH2CH3, -CH2CH2C≡CH, -CH2C≡CCH3 и т.п.
Алкокси, в качестве иллюстрации и предпочтительно, представляет собой метокси, этокси, н-пропокси, изопропокси, н-бутокси и трет-бутокси, и т.п.
Алкилкарбонил, как правило, представляет собой прямоцепной или разветвленный алкильный радикал, имеющий 1-6 углеродных атомов, который связан через карбонильную группу с остальной частью молекулы. Не имеющие ограничительного характера примеры включают ацетил, н-пропионил, н-бутирил, изобутирил, пивалоил.
Алкоксикарбонил, в качестве иллюстрации и предпочтительно, представляет собой метоксикарбонил, этоксикарбонил, н-пропоксикарбонил, изопропоксикарбонил, н-бутоксикарбонил и трет-бутоксикарбонил, и т.п.
Алкилсульфонил, как правило, представляет собой прямоцепной или разветвленный алкильный радикал, имеющий 1-6 углеродных атомов, который связан через сульфонильную (-SO2-) группу с остальной частью молекулы. Не имеющие ограничительного характера примеры включают метилсульфонил, этилсульфонил, н-пропилсульфонил, изопропилсульфонил, н-бутилсульфонил, трет-бутилсульфонил и т.п.
Моноалкиламино, как правило, представляет собой амино-радикал, имеющий один алкильный остаток, присоединенный к атому азота. Не имеющие ограничительного характера примеры включают метиламино, этиламино, н-пропиламино, изопропиламино, н-бутиламино, трет-бутиламино. То же самое применимо к радикалам, таким как моноалкиламинокарбонил и т.п.
Диалкиламино, как правило, представляет собой амино-радикал, имеющий два независимо выбираемых алкильных остатка, присоединенных к атому азота. Не имеющие ограничительного характера примеры включают N,N-диметиламино, N,N-диэтиламино, N,N-диизопропиламино, N-этил-N-метиламино, N-метил-N-н-пропиламино, N-изо-пропил-N-н-пропиламино, N-трет-бутил-N-метиламино.
Моноалкиламинокарбонил, в качестве иллюстрации и предпочтительно, представляет собой метиламинокарбонил, этиламинокарбонил, н-пропиламинокарбонил, изопропиламинокарбонил, н-бутиламинокарбонил и трет-бутиламинокарбонил и т.п.
Диалкиламинокарбонил, в качестве иллюстрации и предпочтительно, представляет собой N,N-диметиламинокарбонил, N,N-диэтиламинокарбонил, Ν,Ν-диизопропиламинокарбонил, N-этил-N-метиламинокарбонил, N-метил-N-н-пропиламинокарбонил, N-изопропил-N-н-пропиламинокарбонил и N-трет-бутил-N-метиламинокарбонил, и т.п.
Алкилкарбониламино, как правило, представляет собой прямоцепной или разветвленный алкильный радикал, имеющий 1-6 углеродных атомов, который связан через карбониламино (-CO-NH-) группу с остальной частью молекулы и который присоединен к атому углерода этой группы. Не имеющие ограничительного характера примеры включают ацетиламино, н-пропиониламино, н-бутириламино, изобутириламино, пивалоиламино и т.п.
Алкоксикарбониламино, в качестве иллюстрации и предпочтительно, представляет собой метоксикарбониламино, этоксикарбониламино, н-пропоксикарбониламино, изопропоксикарбониламино, н-бутоксикарбониламино и трет-бутоксикарбониламино, и т.п.
Циклоалкил, как правило, представляет собой моно-, би- или трициклический насыщенный углеводородный радикал, имеющий 3-7 углеродных атомов. Предпочтение отдается моноциклическим циклоалкильным радикалам, имеющим 3-7 углеродных атомов. Не имеющие ограничительного характера примеры включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, бицикло[2,2,1]гептил, адамантил и т.п.
Гетероциклоалкил, как правило, представляет собой моно- или бициклический насыщенный гетероциклический радикал, имеющий общее количество от 3 до 10 углеродных атомов и вплоть до 2 гетероатомов и/или гетерогрупп, независимо выбираемых из группы, состоящей из N, O, S, SO и SO2, у которых кольцевая система может быть связана через кольцевой атом углерода или, если это возможно, через кольцевой атом азота. Не имеющие ограничительного характера примеры включают азиридинил, азетидинил, оксетанил, тиетанил, пирролидинил, пиразолидинил, тетрагидрофуранил, тиоланил, сульфоланил, 1,3-диоксоланил, 1,3-оксазолидинил, 1,3-триазолидинил, пиперидинил, пиперазинил, тетрагидропиранил, тетрагидротиопиранил, 1,3-диоксанил, 1,4-диоксанил, морфолинил, тиоморфолинил, 1,1-диоксидотиомо[фи]холинил, пергидроазепинил, пергидро-1,4-диазепинил, пергидро-1,4-оксазепинил, пергидроазоцинил, октагидропирроло[3,4-b]пирролил, октагидроизоиндолил, октагидропирроло[3,4-b]пиридил, октагидропирроло[1,2-a]пиразинил, декагидроизохинолинил, 7-азабицикло[2,2,1]гептил, 3-азабицикло[3,2,0]гептил, 7-азабицикло-[4,1,0]гептил, 2,5-диазабицикло[2,2,1]гептил, 2-окса-5-азабицикло[2,2,1]гептил, 2-азабицикло[2,2,2]октил, 3-азабицикло[3,2,1]октил, 8-азабицикло[3,2,1]октил, 8-окса-3-азабицикло[3,2,1]октил, 3-окса-9-азабицикло[3,3,1]нонил. Особое предпочтение отдается 5-7-членным моноциклическим гетероциклоалкильным радикалам, имеющим вплоть до 2 гетероатомов, выбираемых из группы, состоящей из N, O и S, таким как, в качестве иллюстрации и предпочтительно, тетрагидрофуранил, 1,3-диоксоланил, пирролидинил, тетрагидропиранил, 1,4-диоксанил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил, пергидроазепинил, пергидро-1,4-диазепинил и пергидро-1,4-оксазепинил.
Гетероарил, как правило, представляет собой моноциклический ароматический гетероциклический радикал, имеющий 5 или 6 кольцевых атомов, включающих вплоть до 3 гетероатомов, независимо выбираемых из группы, состоящей из N, O, S и Se, кольцевая система которого может быть связана через кольцевой атом углерода или, если это возможно, через кольцевой атом азота. Предпочтение отдается 6-членным гетероарильным радикалам, имеющим вплоть до 2 атомов азота, таким как пиридил, пиримидил, пиридазинил и пиразинил, и 5-членным гетероарильным радикалам, имеющим вплоть до 3 гетероатомов, выбираемых из группы, состоящей из N, O, S и Se, таким как, в качестве иллюстрации и предпочтительно, тиенил, фурил, пирролил, селенофенил, тиазолил, оксазолил, изотиазолил, изоксазолил, пиразолил, имидазолил, оксадиазолил, тиадиазолил, триазолил.
Галоген представляет собой фтор, хлор, бром и йод.
Соединения, в соответствии с этим изобретением, также могут быть представлены в форме их солей, гидратов и/или сольватов.
Соли для целей настоящего изобретения представляют собой, предпочтительно, фармацевтически приемлемые соли соединений, в соответствии с изобретением.
Фармацевтически приемлемые соли включают, образованные посредством присоединения кислоты, соли минеральных кислот, карбоновых кислот и сульфоновых кислот, например, соли хлористоводородной кислоты, бромистоводородной кислоты, азотной кислоты, серной кислоты, фосфорной кислоты, метансульфоновой кислоты, этансульфоновой кислоты, толуолсульфоновой кислоты, бензолсульфоновой кислоты, формамидинсульфоновой кислоты, нафталиндисульфоновой кислоты, муравьиной кислоты, уксусной кислоты, пропионовой кислоты, молочной кислоты, виноградной кислоты, яблочной кислоты, лимонной кислоты, фумаровой кислоты, малеиновой кислоты и бензойной кислоты.
Фармацевтически приемлемые соли также включают соли обычно применяемых оснований, таких как, в качестве примера и предпочтительно, соли щелочных металлов (например, соли натрия и калия), соли щелочноземельных металлов (например, соли кальция и магния), и соли аммония, полученные из аммиака или органических аминов, таких как, в качестве иллюстрации и предпочтительно, этиламин, диэтиламин, триэтиламин, этилдиизопропиламин, моноэтаноламин, диэтаноламин, триэтаноламин, дициклогексиламин, диметиламиноэтанол, дибензиламин, N-метилморфолин, N-метилпиперидин, дигидроабиэтиламин, аргинин, лизин, этилендиамин, и полиамины, такие как путресцин и кадаверин.
Гидраты соединений изобретения или их соли представляют собой стехиометрические композиции соединений с водой, такие как, например, геми-, моно-, или дигидраты.
Сольваты соединений изобретения или их соли представляют собой стехиометрические композиции соединений с органическими растворителями.
Соединения этого изобретения, как из-за характерных для них ассиметрических центров, так и за счет ограниченного вращения, могут быть представлены в форме изомеров (энантиомеров, диастереомеров). Любой изомер, в котором есть ассиметрический центр, может быть представлен в виде (R)-, (S)- или (R,S) конфигурации.
Также следует принять во внимание, что в случае присутствия двух и более ассиметрических центров в соединениях изобретения часто будет возможным воплощение структур нескольких диастереомеров и энантиомеров, и эти чистые диастереомеры и чистые энантиомеры представляют предпочтительные варианты осуществления изобретения. Подразумевается, что эти чистые стереоизомеры, чистые диастереомеры, чистые энантиомеры и их смеси охватываются сферой действия изобретения.
Геометрические изомеры из-за характерных для них заместителей при двойной связи или у кольца могут быть представлены в цис-(=Z-) или транс-(=E-) форме, и обе изомерные формы охвачены сферой действия изобретения.
Все изомеры, будь то разделенные, чистые, частично чистые, или в виде рацемической смеси, соединений этого изобретения охвачены сферой действия этого изобретения. Очистка указанных изомеров и разделение указанных изомерных смесей могут осуществляться с помощью стандартных методик, известных из уровня техники в данной области. Например, диастереомерные смеси могут быть разделены на индивидуальные изомеры посредством хроматографического процесса или кристаллизации, и рацематы могут быть разделены на соответствующие энантиомеры либо с помощью хроматографических процессов на хиральных фазах, либо с помощью оптического расщепления.
Кроме того, все возможные таутомерные формы соединений, описанных выше, соответственно включаются в настоящее изобретение.
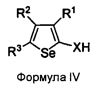
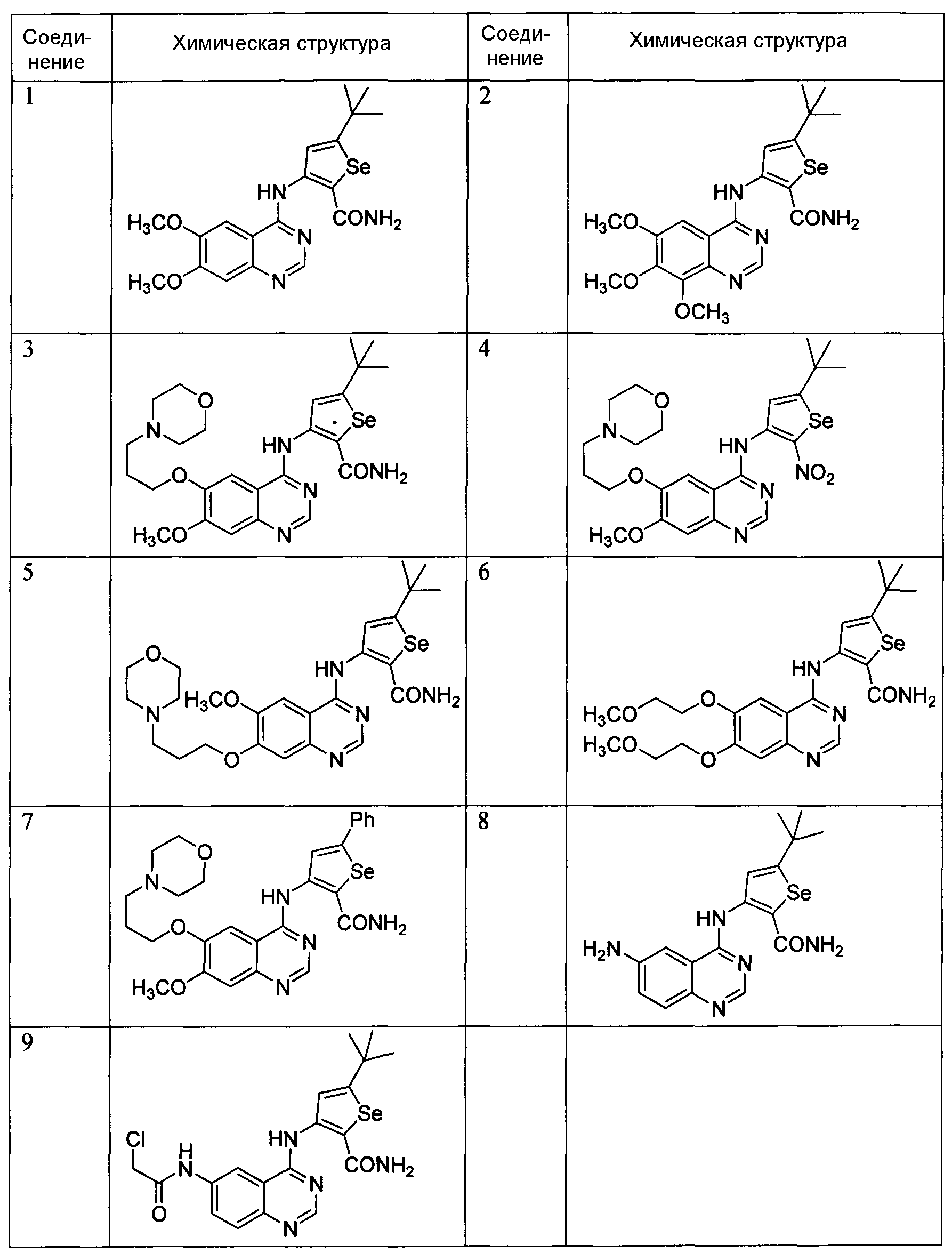
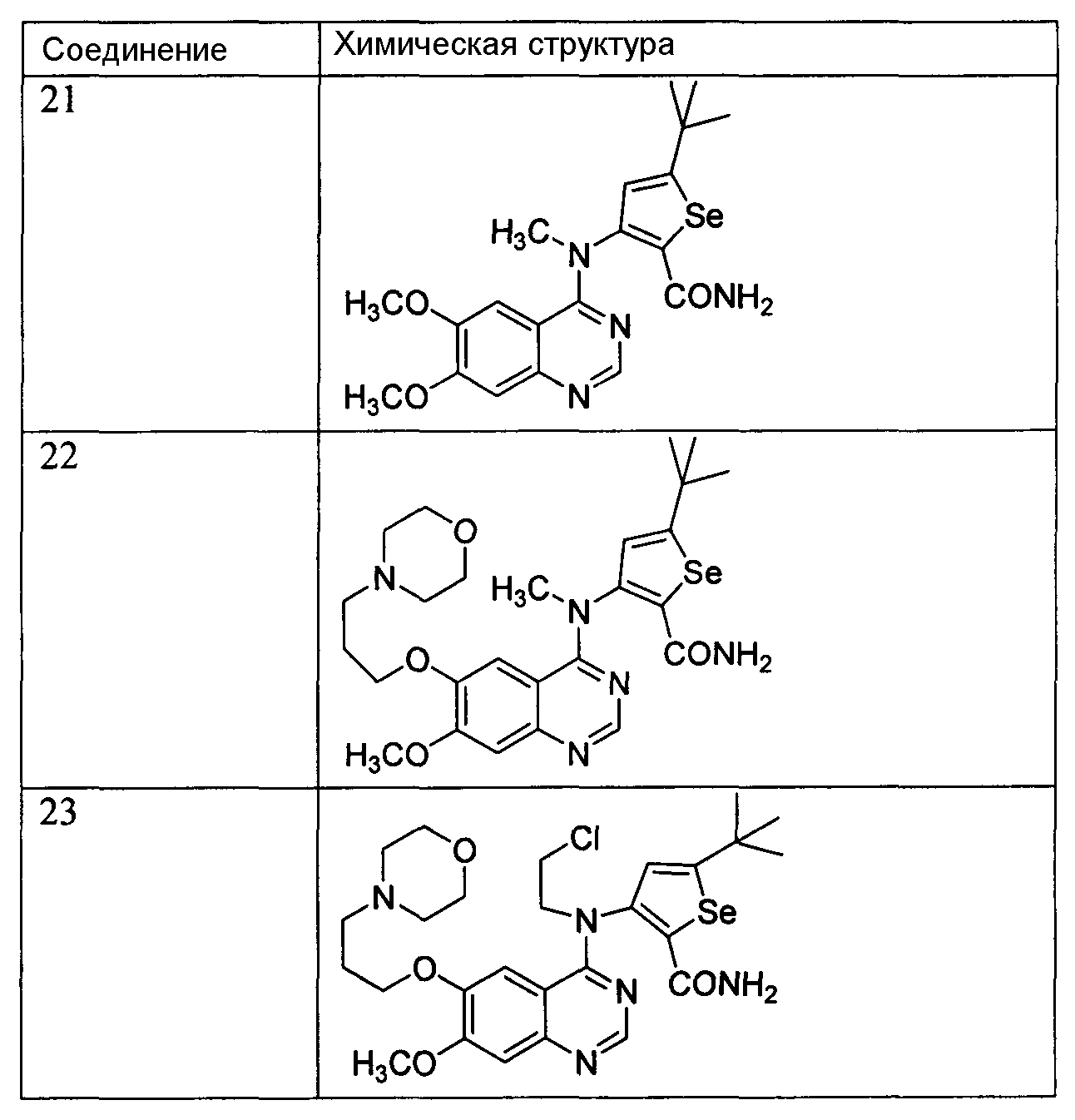
Некоторые примеры соединений формулы (I) для лечения или профилактики клеточных пролиферативных нарушений, таких как рак, показаны ниже, и их получение описано в примерах 1-29:
3-(6,7-Диметоксихиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид;
3-(6,7,8-Триметоксихиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид;
3-(6-(3-Морфолинопропокси)-7-метоксихиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид;
[5-(трет-Бутил)-2-нитроселенофен-3-ил][7-метокси-6-(3-морфолинопропокси)хиназолин-4-ил]амин;
3-(7-(3-Морфолинопропокси)-6-метоксихиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид;
3-(6,7-Бис(2-метоксиэтокси)хиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид;
3-(6-(3-Морфолинопропокси)-7-метоксихиназолин-4-иламино)-5-фенилселенофен-2-карбоксамид;
3-(6-Аминохиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид;
3-(6-(2-Хлорацетамидо)хиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид;
Метил-4-(6-(3-морфолинопропокси)-7-метоксихиназолин-4-иламино)-5-метилселенофен-2-карбоксилат;
4-(6-(3-Морфолинопропокси)-7-метоксихиназолин-4-иламино)-5-метилселенофен-2-карбоксамид;
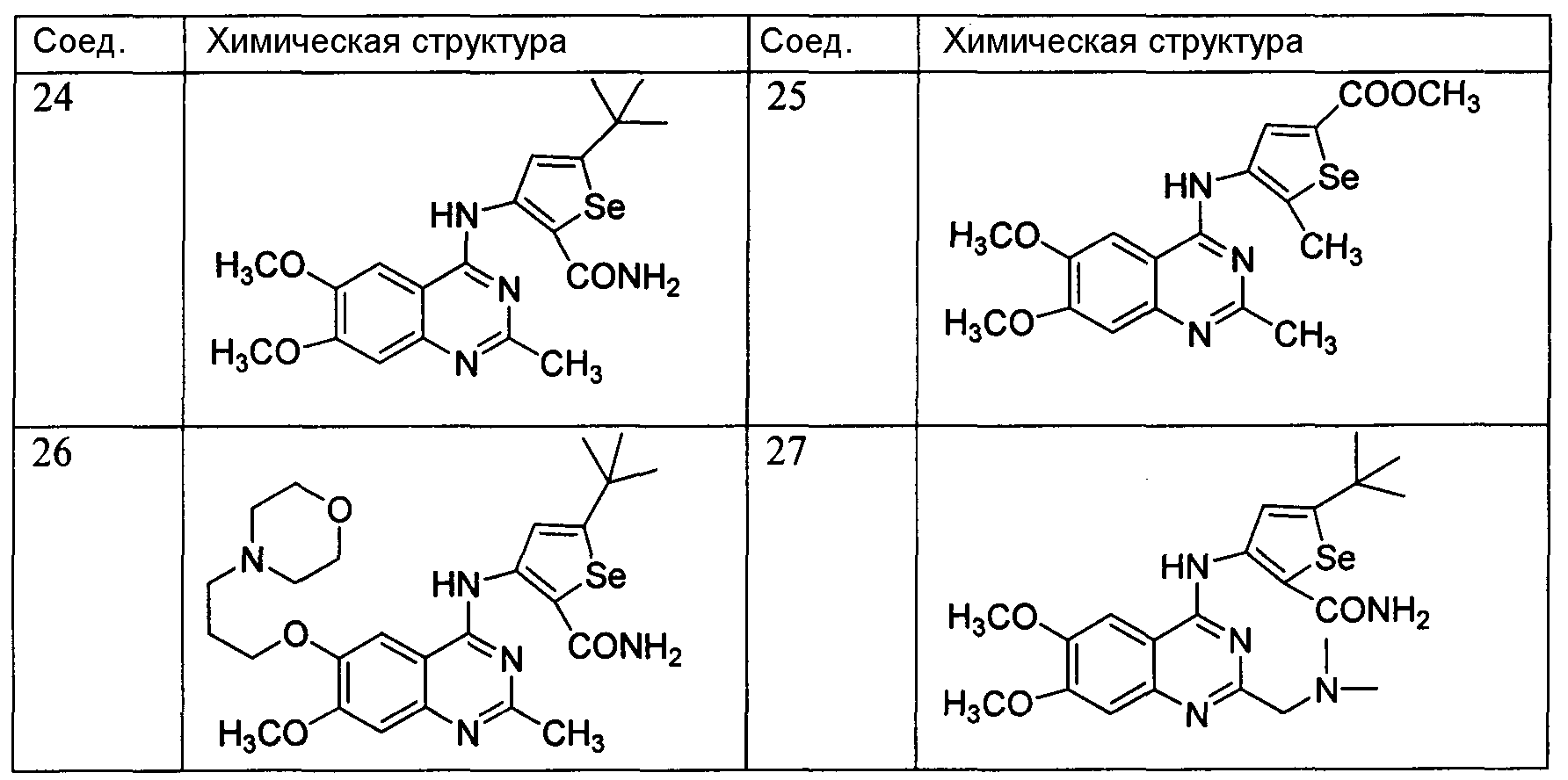
5-трет-Бутил-3-(пиридино[2,3-d]пиримидин-4-иламино)селенофен-2-карбоксамид;
3-(5-Этил-6-метилтиофено[2,3-d]пиримидин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид;
3-(6-(Метилтио)тиофено[3,2-d]пиримидин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид;
3-(6-Фенилфуро[2,3-d]пиримидин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид;
3-(6-трет-Бутилфуро[2,3-d]пиримидин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид;
Метил-4-(5,6-диметил-7Н-пирроло[2,3-d]пиримидин-4-иламино)-5-метилселенофен-2-карбоксилат;
3-(6-трет-Бутилселенофено[3,2-d]пиримидин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид;
3-(5-Этил-6-метилселенофено[2,3-d]пиримидин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид;
3-(2-(Метилтио)тиазоло(4,5-d]пиримидин-7-иламино)-5-трет-бутилселенофен-2-карбоксамид;
3-(N-(6,7-Диметоксихиназолин-4-ил)-N-метиламино)-5-трет-бутилселенофен-2-карбоксамид;
3-(N-(6-(3-Морфолинопропокси)-7-метоксихиназолин-4-ил)-N-метиламино)-5-трет-бутилселенофен-2-карбоксамид;
3-(N-(6-(3-Морфолинопропокси)-7-метоксихиназолин-4-ил)-N-(2-хлорэтил)амино)-5-трет-бутилселенофен-2-карбоксамид;
3-(6,7-Диметокси-2-метилхиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид;
Метил-4-(6,7-диметокси-2-метилхиназолин-4-иламино)-5-метилселенофен-2-карбоксилат;
3-(6-(3-Морфолинопропокси)-7-метокси-2-метилхиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид;
3-(6,7-Диметокси-2-(N,N-диметиламинометил)-хиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид;
3-(2-(4-Хлорфенил)-6,7-диметоксихиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид;
3-(6,7-Диметоксихиназолин-4-илокси)-5-трет-бутилселенофен-2-карбоксамид.
Синтез селенофеновых соединений формулы (I)
Настоящее изобретение также относится к способу получения соединений формулы (I), в которой все группы определены ранее.
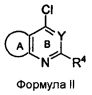
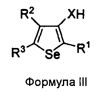
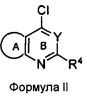
Соединения формулы (I) могут быть синтезированы посредством реакции соединения формулы II с 3-ХНселенофенильным соединением формулы III, как показано на схеме A:
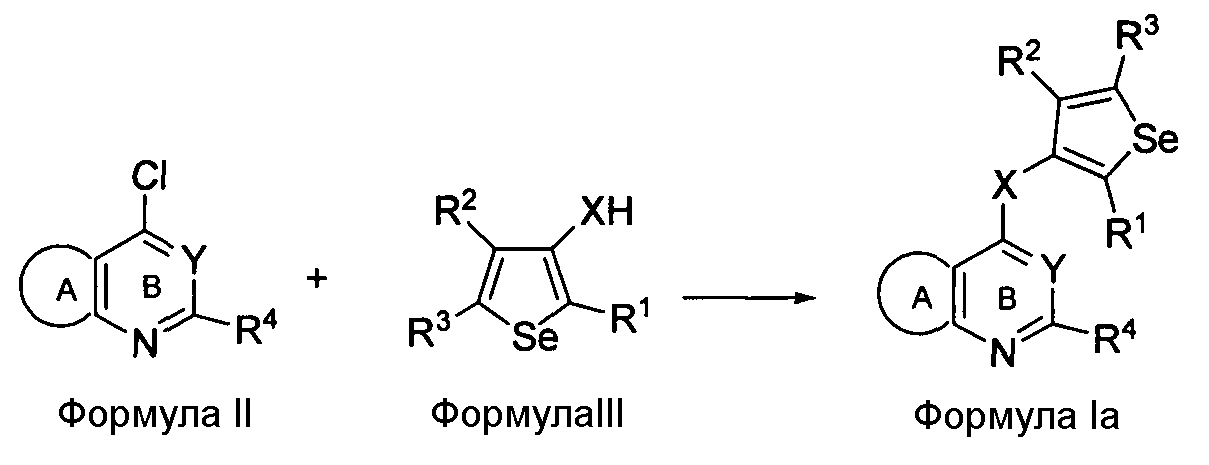
Схема A
Как показано на Схеме A, соединение формулы II, в котором кольцо A представляет собой ароматическое/гетероароматическое кольцо, вступает в реакцию с 3-ХНселенофенильным соединением формулы III в присутствии растворителя, такого как изопропиловый спирт, этанол, диметилформамид и, необязательно, в присутствии основания, с получением соединения формулы Ia. Основание может быть органическим или неорганическим, таким как пиридин, триэтиламин, гидроксид натрия или гидроксид калия.
Соединения формулы (I) могут быть синтезированы посредством проведения реакции соединения формулы II с 2-ХНселенофенильным соединением формулы IV, как показано на схеме B:
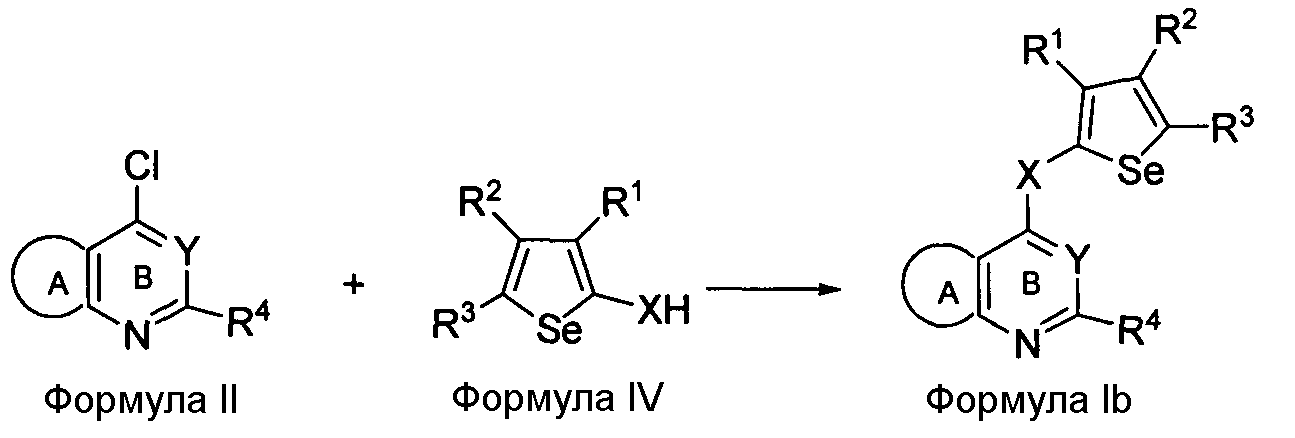
Схема B
Как показано на схеме B, соединение формулы II, вступает в реакцию с 2-ХНселенофенильным соединением формулы IV в присутствии растворителя, такого как изопропиловый спирт, этанол, диметилформамид и, необязательно, в присутствии основания, с получением соединения формулы Ib. Основание может быть органическим или неорганическим, таким как пиридин, триэтиламин, гидроксид натрия или гидроксид калия.
X в формуле III и в формуле IV выбирают из NH или O.
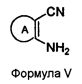
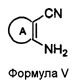
Альтернативно, соединения формулы (I), в которых X представляет собой NH; Y представляет собой N и R4 представляет собой H, могут быть получены при реакции соединения формулы V с 3-аминоселенофенильным соединением формулы III, как показано на схеме C:
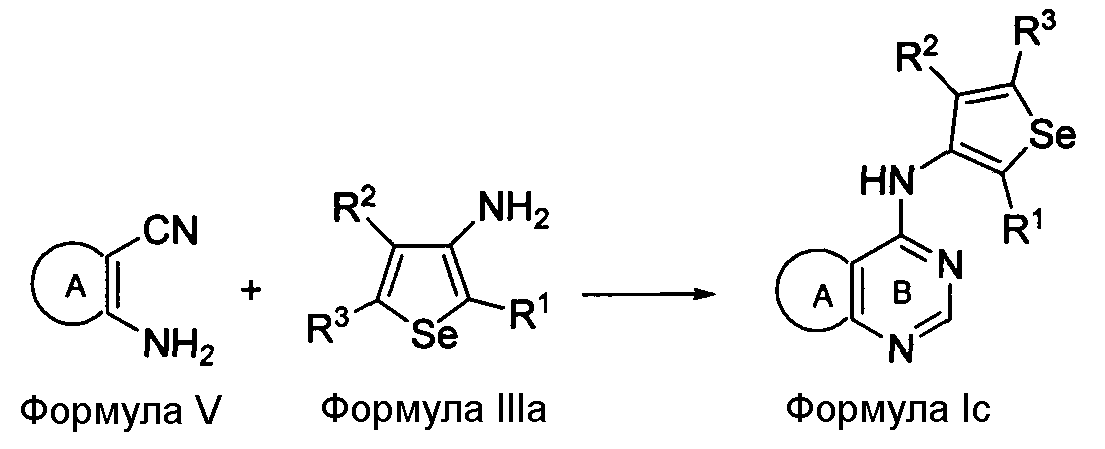
Схема C
В качестве альтернативы способу, изображенному на Схеме A, соединение формулы V, в котором кольцо A представляет собой ароматическое/гетероароматическое кольцо, вступает в реакцию с диметилформамид-диметилацеталем в присутствии растворителя, такого как толуол, ацетонитрил или уксусная кислота, или их смесь, с получением [(диметиламино)метилиден]амино-замещенного соединения, которое затем циклизуется с 3-селенофенильным соединением формулы IIIa в растворителе, таком как толуол, ацетонитрил, уксусная кислота или их смесь, с получением соединения формулы Ic, как показано на схеме C. Кроме того, соединение формулы V, в котором кольцо A представляет собой ароматическое/гетероароматическое кольцо, вступает в реакцию с триэтилортоформиатом или триметилортоформиатом в присутствии растворителя, такого, как толуол, ацетонитрил или уксусная кислота, или их смесь, с получением соединения, которое затем циклизуется с 3-селенофенильным соединением формулы IIIa в растворителе, таком как толуол, ацетонитрил, уксусная кислота или их смесь, с получением соединения формулы Ic.
Альтернативно, соединения формулы (I) в которых X представляет собой NH; Y представляет собой N и R4 представляет собой H, могут быть получены при реакции соединения формулы V с 2-аминоселенофенильным соединением формулы IVa, как показано на схеме D:
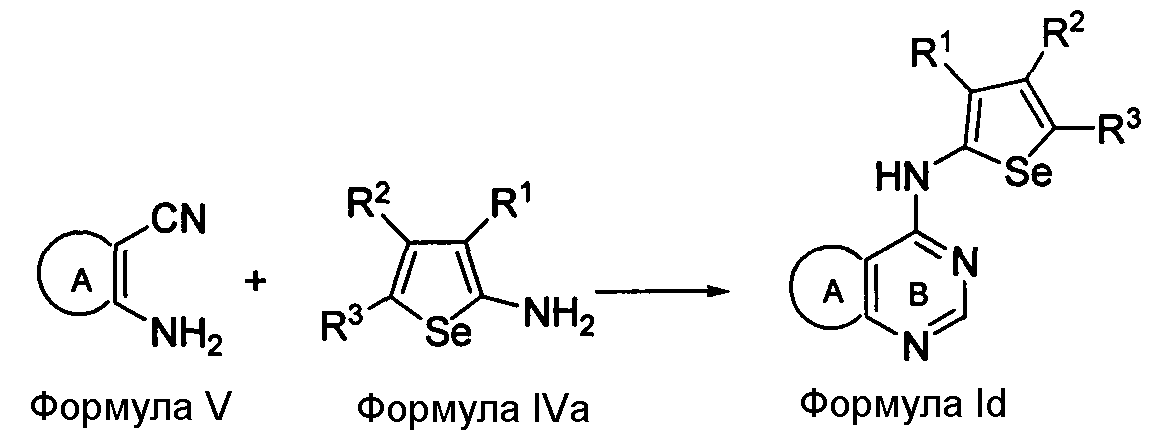
Схема D
В качестве альтернативы способу, изображенному на Схеме B, соединение формулы V, в котором кольцо A представляет собой бензольное (замещенное 2-аминобензонитрилом) или любое ароматическое/гетероароматическое кольцо, вступает в реакцию с диметилформамид-диметилацеталем в присутствии растворителя, такого как толуол, ацетонитрил или уксусная кислота, или их смесь, с получением [(диметиламино)метилиден]амино-замещенного соединения, которое затем циклизуется с 2-селенофенильным соединением (Aumann, K.M. et. al., Org. Biomol. Chem., 2007, 5, 1276-1281) формулы IVa в растворителе, таком как толуол, ацетонитрил, уксусная кислота или их смесь, с получением соединения формулы Id, как показано на Схеме D. Кроме того, соединение формулы V, вступает в реакцию с триэтилортоформиатом или триметилортоформиатом в присутствии растворителя, такого как толуол, ацетонитрил или уксусная кислота, или их смесь, с получением соединения, которое затем циклизуется с 2-селенофенильным соединением формулы IVa в растворителе, таком как толуол, ацетонитрил, уксусная кислота или их смесь, с получением соединения формулы Id.
Y в формуле II представляет собой N или CR5, и кольцо A в формуле II или в формуле V выбирают из бензола, пиридина, пиразина, пиримидина, пиридазина, тиофена, фурана, пиррола, селенофена, оксазола, изоксазола, имидазола, пиразола, тиазола, и изотиазола.
Способ синтеза некоторых соединений формулы (I) наглядно продемонстрирован, как показано ниже.
Синтез 4-(селенофен-3-иламино)хиназолинов: синтез селенофеновых соединений формулы (I), а именно, синтез 4-(селенофен-3-иламино)хиназолинов, достигается посредством стадий, показанных на схеме E.
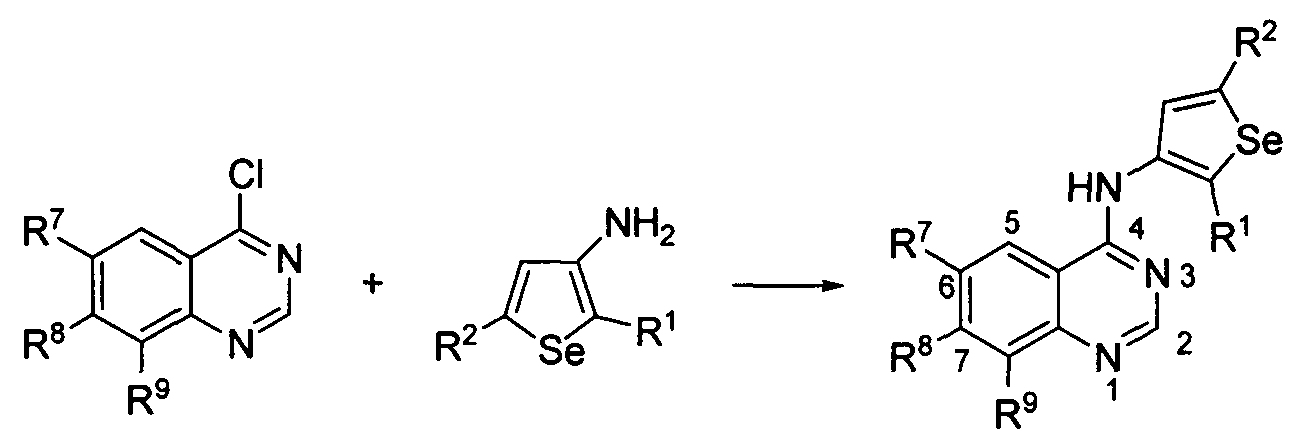
Схема E
Как показано на схеме E, 4-хлорхиназолины (Gazit, A. et. al., Bioorg. Med. Chem., 1996, 4, 1203-1207; Furuta, T. et al., J. Med. Chem., 2006, 49, 2186-2192; Liu, G. et. al., Bioorg. Med. Chem., 2007, 15, 6608-6617; Wang, J.-Q. et. al., Bioorg. Med. Chem. Lett., 2006, 16, 4102-1106; Ple, P.A. et. al., J. Med. Chem., 2004, 47, 871-887; Marzaro, G. et. al., Tetrahedron, 2010, 66, 962-968; Knesl, P. et. al., Molecules, 2006, 11, 286-297; Shaul, M. et. al., Bioorg. Med. Chem., 2004, 12, 3421-3429; Fernandes, C. et. al., Bioorg. Med. Chem., 2007, 15, 3974-3980) реагируют с 3-аминоселенофенами (Hesse, S. et. al., Synthesis, 2009, 1204-1208; Thomae, D. et al., Synthesis, 2008, 1600-1606) в протонном растворителе, таком как изопропиловый спирт, этанол, диметилформамид и, необязательно, в присутствии основания, с получением 4-селенофен-3-иламинохиназолинов. Основание может быть органическим или неорганическим, таким как пиридин, триэтиламин, гидроксид натрия и т.п. С использованием этого способа были синтезированы нижеприведенные 4-селенофен-3-иламинохиназолины.
Другой способ синтеза селенофеновых соединений формулы (I), а именно, синтеза 4-селенофен-3-иламинохиназолинов, достигается посредством стадий, показанных на схеме F.
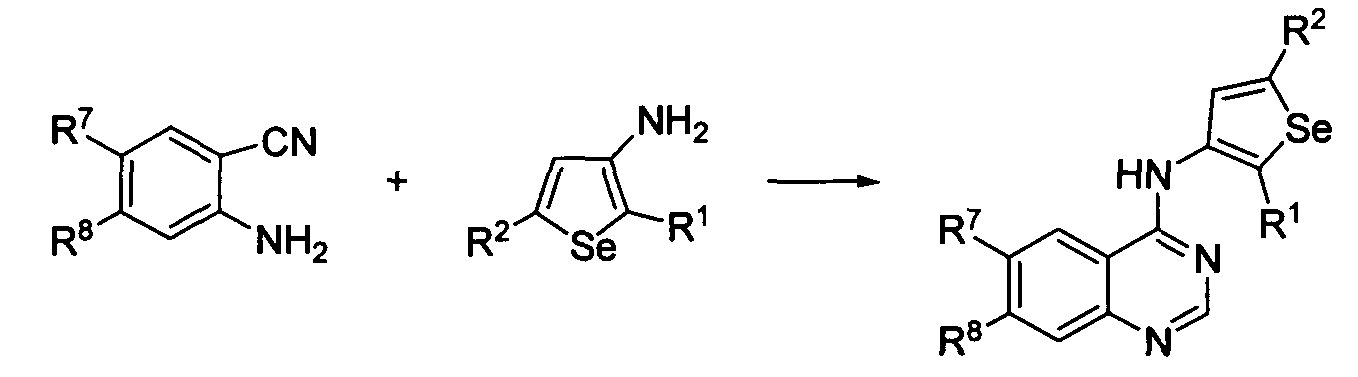
Схема F
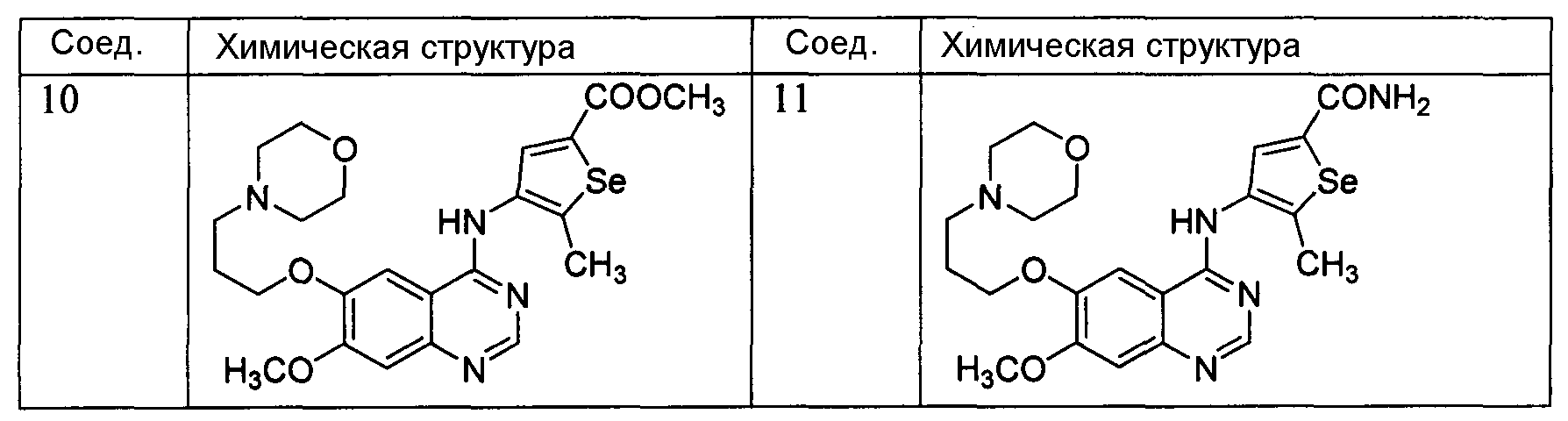
Как показано на схеме F, 2-аминобензонитрилы реагируют с N,N-диметилформамид-диметилацеталем или с триэтилортоформиатом, затем следует обработка 3-аминоселенофенами в толуол/уксусной кислоте с получением 4-селенофен-3-иламинохиназолинов. С использованием этого способа были синтезированы нижеприведенные 4-селенофениламинохиназолины.
Синтез 4-(селенофен-3-иламинопиридо)пиримидинов: Синтез селенофеновых соединений формулы (I), а именно, синтез 4-(селенофен-3-иламинопиридо)пиримидина достигается посредством стадий, показанных на схеме G.
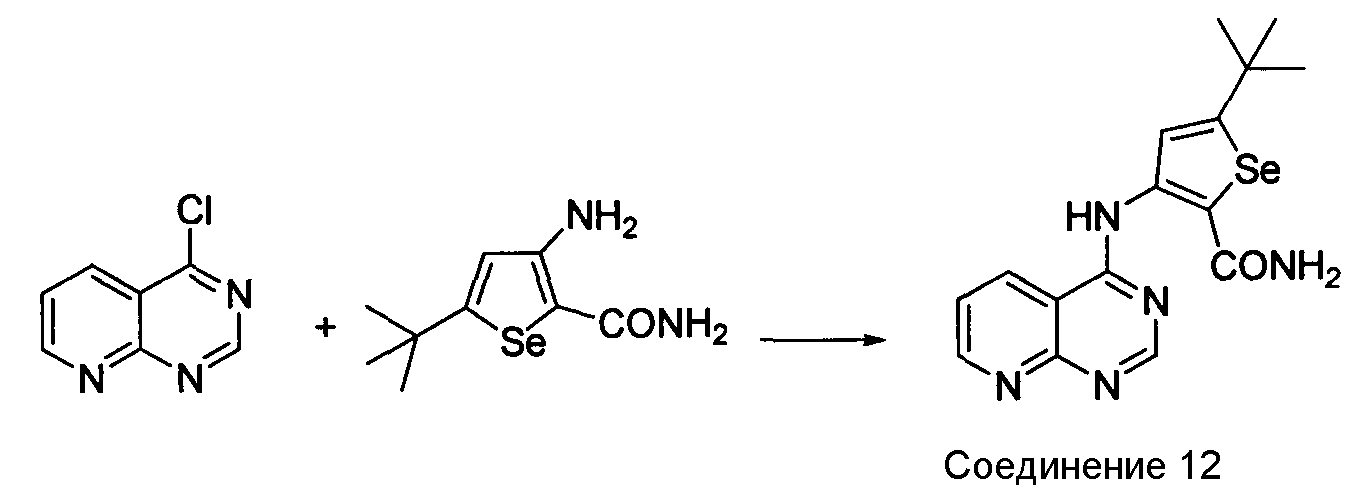
Схема G
Как показано на схеме G, 4-хлорпиридо[2,3-d]пиримидин (Robins, R.K. et. al., J. Am. Chem. Soc, 1955, 77, 2256-2260) вступает в реакцию с 5-трет-бутил-3-аминоселенофен-2- карбоксамидом в протонном растворителе, таком как изопропиловый спирт, с получением 5-(трет-бутил)-3-(пиридино[3,2-e]пиримидин-4-иламино)селенофен-2-карбоксамида.
Синтез 4-(селенофен-3-иламинотиофено)пиримидинов: синтез селенофеновых соединений формулы (I), а именно, синтез 4-(селенофен-3-иламинотиофено)пиримидина, достигается посредством стадий, показанных на схеме Н.
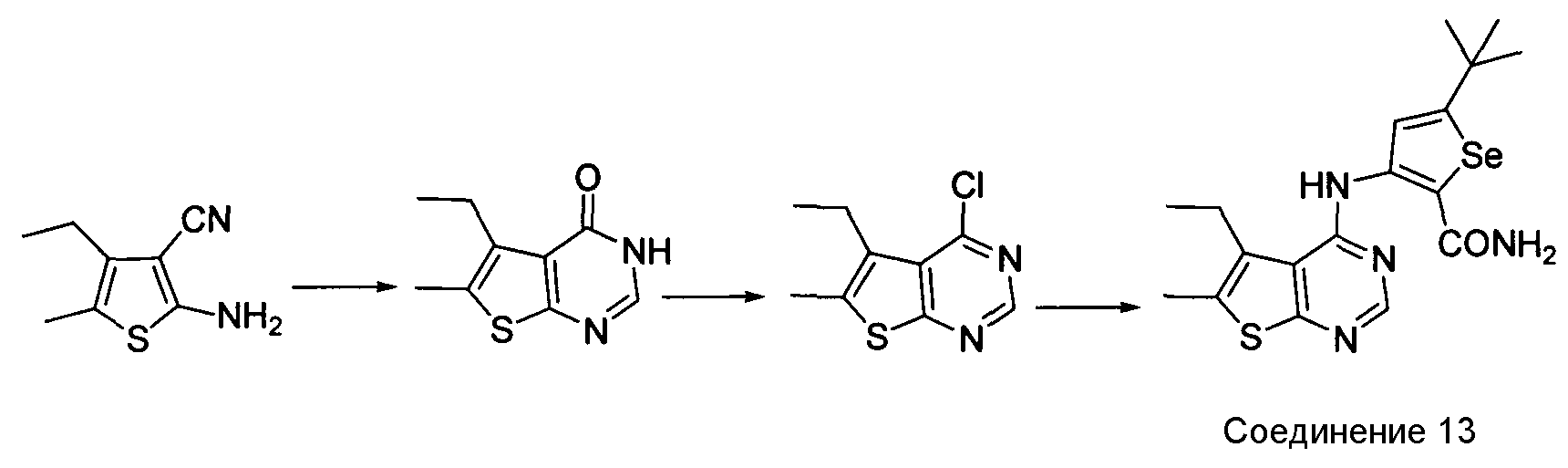
Схема H
Как показано на схеме H, циклизация 2-амино-4-этил-5-метилтиофен-3-карбонитрила с использованием муравьиной кислоты/серной кислоты и последующая обработка тионилхлоридом приводят к получению 4-хлор-5-этил-6-метилтиофено[2,3-d]пиримидина (Horiuchi, T. et. al., Bioorg. Med. Chem. Lett., 2009, 19, 305-308) с хорошим выходом. Обработка этого 4-хлор-соединения 3-амино-5-трет-бутилселенофен-2-карбоксамидом в присутствии ДМФА/NaOH приводит к получению 5-(трет-бутил)-3-[(5-этил-6-метилтиофено[3,2-e]пиримидин-4-ил)амино]селенофен-2-карбоксамида.
Синтез селенофеновых соединений формулы (I), а именно, синтез 4-(селенофен-3-иламинотиофено)пиримидина достигается посредством стадий, показанных на схеме I.
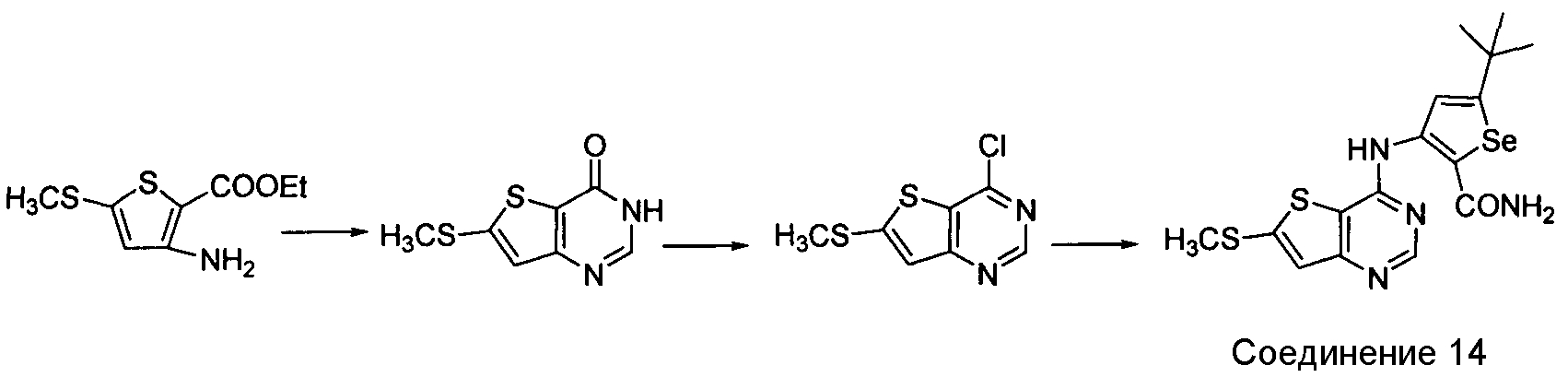
Схема I
Как показано на схеме I, циклизация этил-3-амино-5-(метилтио)тиофен-2-карбоксилата с использованием формамида и последующая обработка оксихлоридом фосфора приводят к получению 4-хлор-6-(метилтио)тиено[3,2-d]пиримидина с хорошим выходом. Обработка этого 4-хлор-соединения 3-амино-5-трет-бутилселенофен-2-карбоксамидом в присутствии ДМФА/NaOH приводит к получению 3-(6-(метилтио)тиено[3,2-d]пиримидин-4-иламино)-5-трет-бутилселенофен-2-карбоксамида.
Синтез 4-(селенофен-3-иламинофурано)пиримидинов: Синтез селенофеновых соединений формулы (I), а именно, синтез 4-(селенофен-3-иламинофурано)пиримидина достигается посредством стадий, показанных на схеме J.
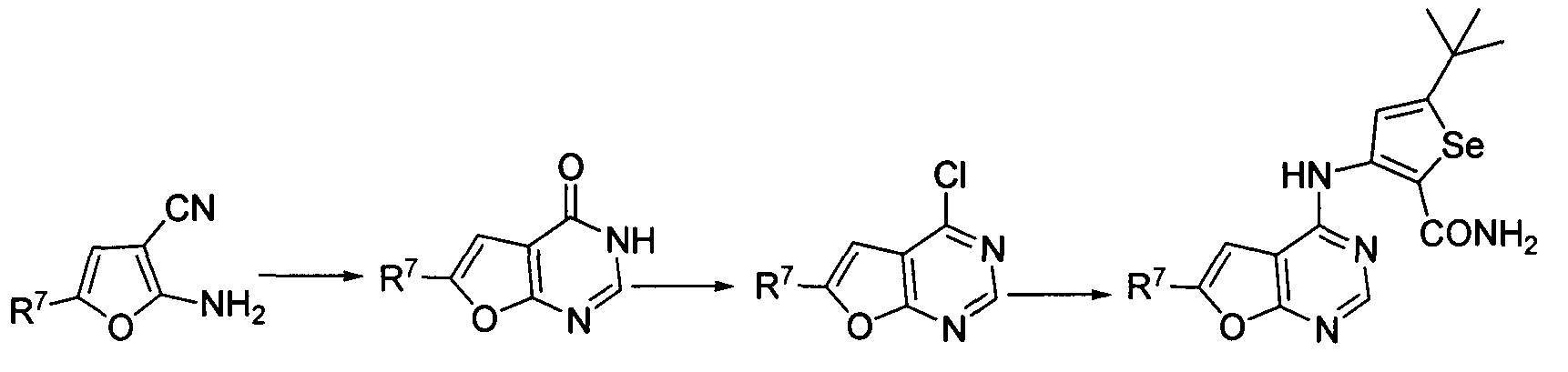
Схема J
Как показано на схеме J, циклизация 2-амино-5-замещенных-фуран-3-карбонитрилов (Foley, L.H. Tetrahedron Lett., 1994, 35, 5989-5992; Matsuda, T. et. al., Chem. Pharm. Bull, 1985, 33, 937-943) с использованием муравьиной кислоты/ацетангидрида и последующая обработка оксихлоридом фосфора приводят к получению 4-хлор-6-замещенных-фуро-[2,3-d]пиримидинов с хорошими выходами. Обработка этих 4-хлор-соединений 3-амино-5-трет-бутилселенофен-2-карбоксамидом в присутствии ДМФА/NaOH приводит к получению 4-селенофен-3-иламинофуранопиримидинов. С использованием этого способа были синтезированы нижеприведенные 4-селенофен-3- иламинофуранопиримидины.
Синтез 4-(селенофен-3-иламинопирроло)пиримидинов: Синтез селенофеновых соединений формулы (I), а именно, синтез 4-(селенофен-3-иламинопирроло)пиримидина достигается посредством стадий, показанных на схеме К.
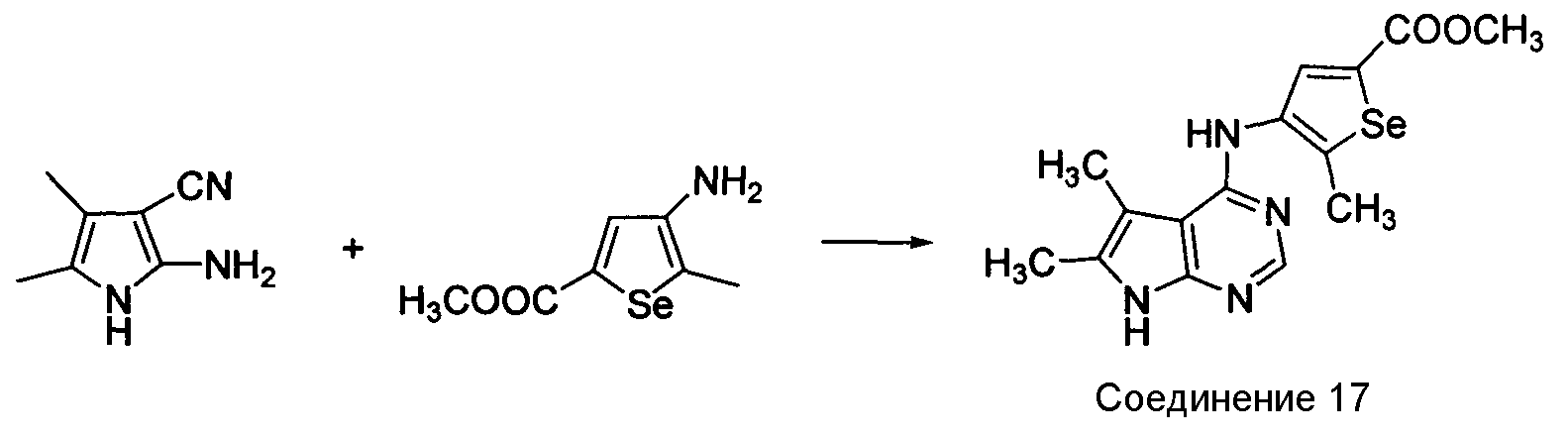
Схема K
Как показано на схеме K, 2-амино-4,5-диметил-1H-пиррол-3-карбонитрил (Fischer, R.W. et. al., Org. Proc. Res. Dev., 2001, 5, 581-586) вступает в реакцию с N,N-диметилформамид-диметилацеталем в присутствии толуола/уксусной кислоты, затем с метил-4-амино-5-метилселенофен-2-карбоксилатом в уксусной кислоте с получением метил-4-(5,6-диметил-7H-пирроло[2,3-d]пиримидин-4-иламино)-5-метилселенофен-2-карбоксилата.
Синтез 4-(селенофен-3-иламиноселенофено)пиримидинов: Синтез селенофеновых соединений формулы (I), а именно, синтез 4-(селенофен-3-иламиноселенофено)пиримидина, достигается посредством стадий, показанных на схеме L.
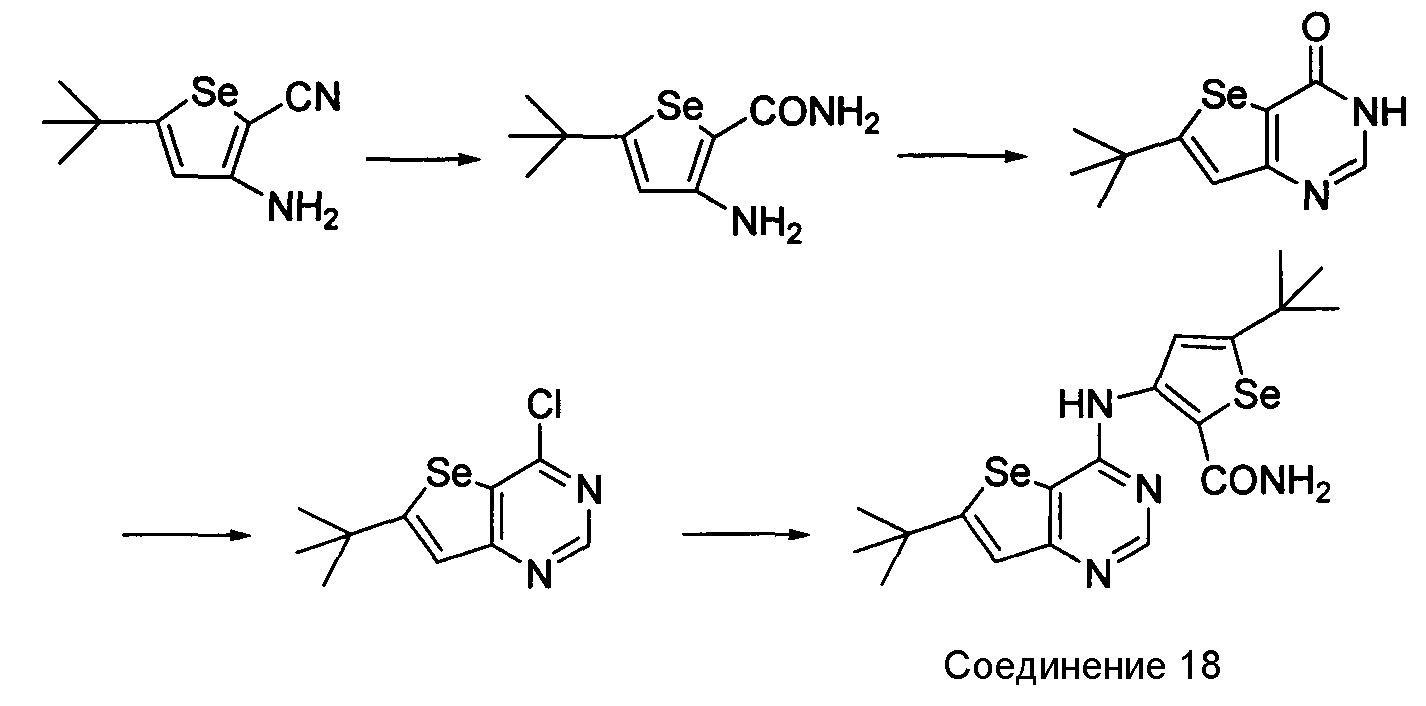
Схема L
Как показано на схеме L, 3-амино-5-(трет-бутил)селенофен-2-карбонитрил обрабатывают 10% водным раствором NaOH/этанол с получением 3-амино-5-(трет-бутил)селенофен-2-карбоксамида, который циклизуется с использованием муравьиной кислоты/серной кислоты с получением 6-(трет-бутил)-3-гидроселенофено[3,2-d]пиримидин-4-она и последующая обработка тионилхлоридом приводит к получению 6-(трет-бутил)-4-хлорселенофено[3,2-d]пиримидина (Hesse, S. et. al., Synthesis, 2009, 1204-1208) с хорошим выходом. Обработка этого 4-хлор-соединения 3-амино-5-трет-бутилселенофен-2-карбоксамидом в присутствии ДМФА/NaOH приводит к получению 5-(трет-бутил)-3-{[6-(трет-бутил)селенофено[2,3-e]пиримидин-4-ил]амино}селенофен-2-карбоксамида.
Синтез селенофеновых соединений формулы (I), а именно, синтез 4-(селенофен-3-иламиноселенофено)пиримидина достигается посредством стадий, показанных на схеме M.
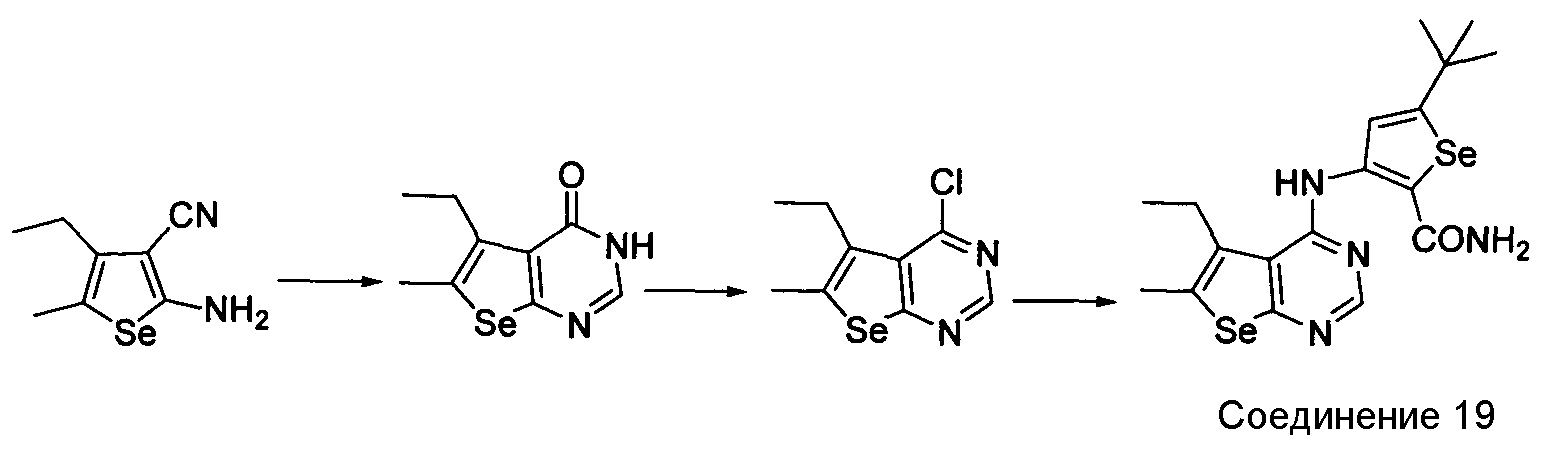
Схема M
Как показано на схеме M, циклизация 2-амино-4-этил-5-метилселенофен-3-карбонитрила с использованием муравьиной кислоты/серной кислоты и последующая обработка оксихлоридом фосфора приводит к получению 4-хлор-5-этил-6-метилселенофено[2,3-d]пиримидина с хорошим выходом. Обработка этого 4-хлор-соединения 3-амино-5-трет-бутилселенофен-2-карбоксамидом в присутствии ДМФА/NaOH приводит к получению 3-(5-этил-6-метилселенофено[2,3-d]пиримидин-4-иламино)-5-трет-бутилселенофен-2-карбоксамида.
Синтез 4-(селенофен-3-иламинотиазоло)пиримидинов: Синтез селенофеновых соединений формулы (I), а именно, синтез 4-(селенофен-3-иламинотиазоло)пиримидина достигается посредством стадий, показанных на схеме N.
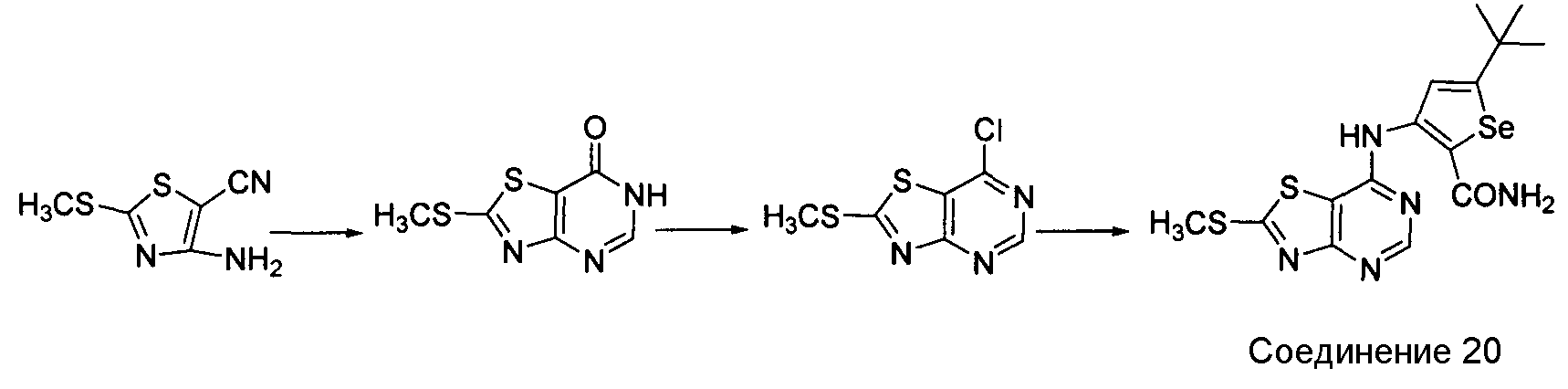
Схема N
Как показано на схеме N, циклизация 4-амино-2-(метилтио)тиазол-5-карбонитрила (Thomae, D. et. al., Tetrahedron, 2008, 64, 9309-9314) с использованием муравьиной кислоты/серной кислоты и последующая обработка оксихлоридом фосфора приводит к получению 7-хлор-2-(метилтио)тиазоло[4,5-d]пиримидина (Lin, R. et. al., Bioorg. Med. Chem. Lett., 2009, 19, 2333-2337) с хорошим выходом. Обработка этого хлор-соединения 3-амино-5-трет-бутилселенофен-2-карбоксамидом в присутствии ДМФА/NaOH приводит к получению 3-(2-(метилтио)тиазоло(4,5-d]пиримидин-7-иламино)-5-трет-бутилселенофен-2-карбоксамида.
Синтез N-замещенных соединений: Синтезы селенофеновых соединений формула (I), а именно, синтезы N-замещенных аналогов достигаются посредством стадий, показанных на схеме O.
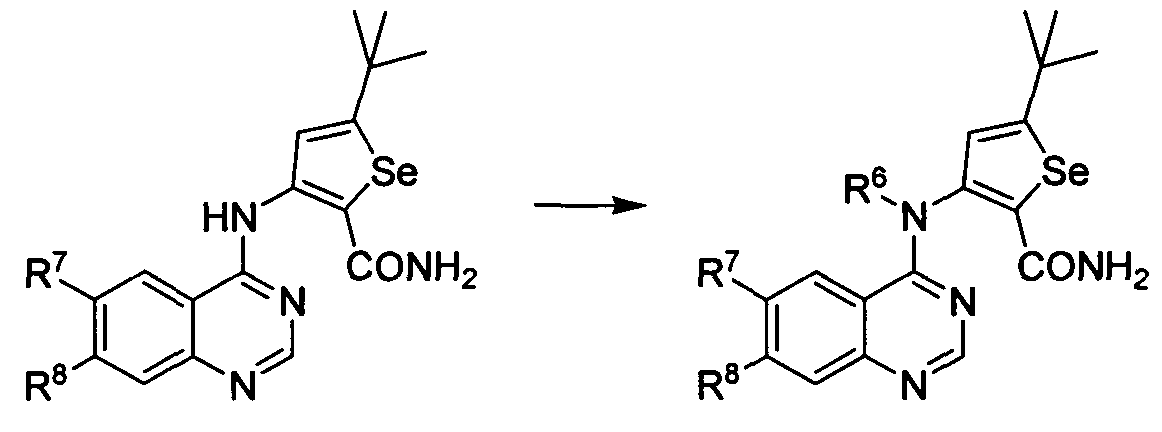
Схема O
Как показано на схеме O, обработка NH-соединения йодметаном или диметилсульфатом, или 1-бром-2-хлорэтаном в присутствии основания обеспечивает получение N-замещенных аналогов. С использованием этого способа были синтезированы нижеприведенные соединения.
Синтез 2-замещенных соединений: Синтезы селенофеновых соединений формулы (I), а именно, синтезы 2-замещенных аналогов достигаются посредством стадий, показанных на схеме P.
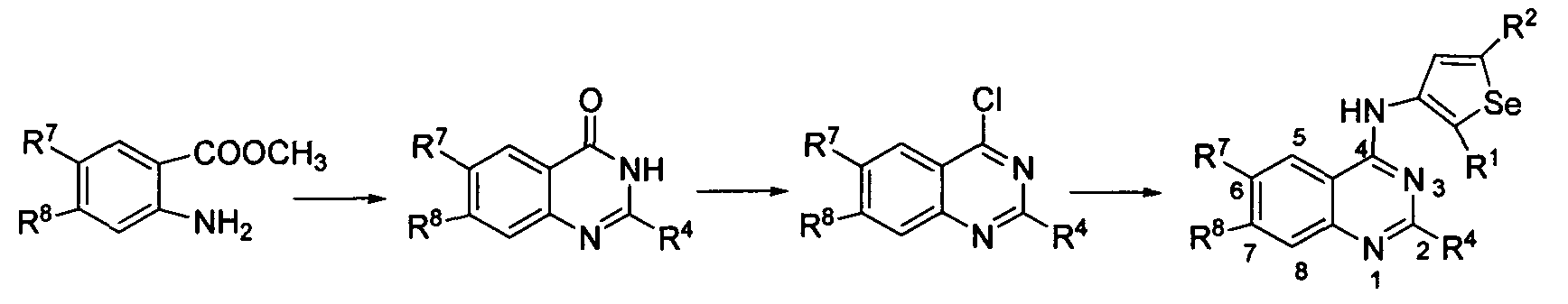
Схема P
Как показано на схеме P, замещенный метил 2-аминобензоат вступает в реакцию с ацетонитрилом или хлорацетонитрилом в присутствии HCl с получением циклизованного продукта (Zhang, X. et. al., Green Chem., 2009, 11, 1881-1888; Walker, G. J. Am. Chem. Soc, 1955, 77, 6698-6699; Li, Н.-Z. et. al., Molecules, 2010, 15, 9473-9485), который далее обрабатывают либо оксихлоридом фосфора, либо тионилхлоридом с получением 4-хлор-соединения. 4-хлор-соединение вступает в реакцию с 3-аминоселенофеновым соединением в присутствии ДМФА/NaOH с получением 2-замещенных аналогов. С использованием этих способов были синтезированы нижеприведенные соединения.
Синтез селенофеновых соединений формулы (1), а именно, синтез 2-замещенных аналогов достигается посредством стадий, показанных на схеме Q.
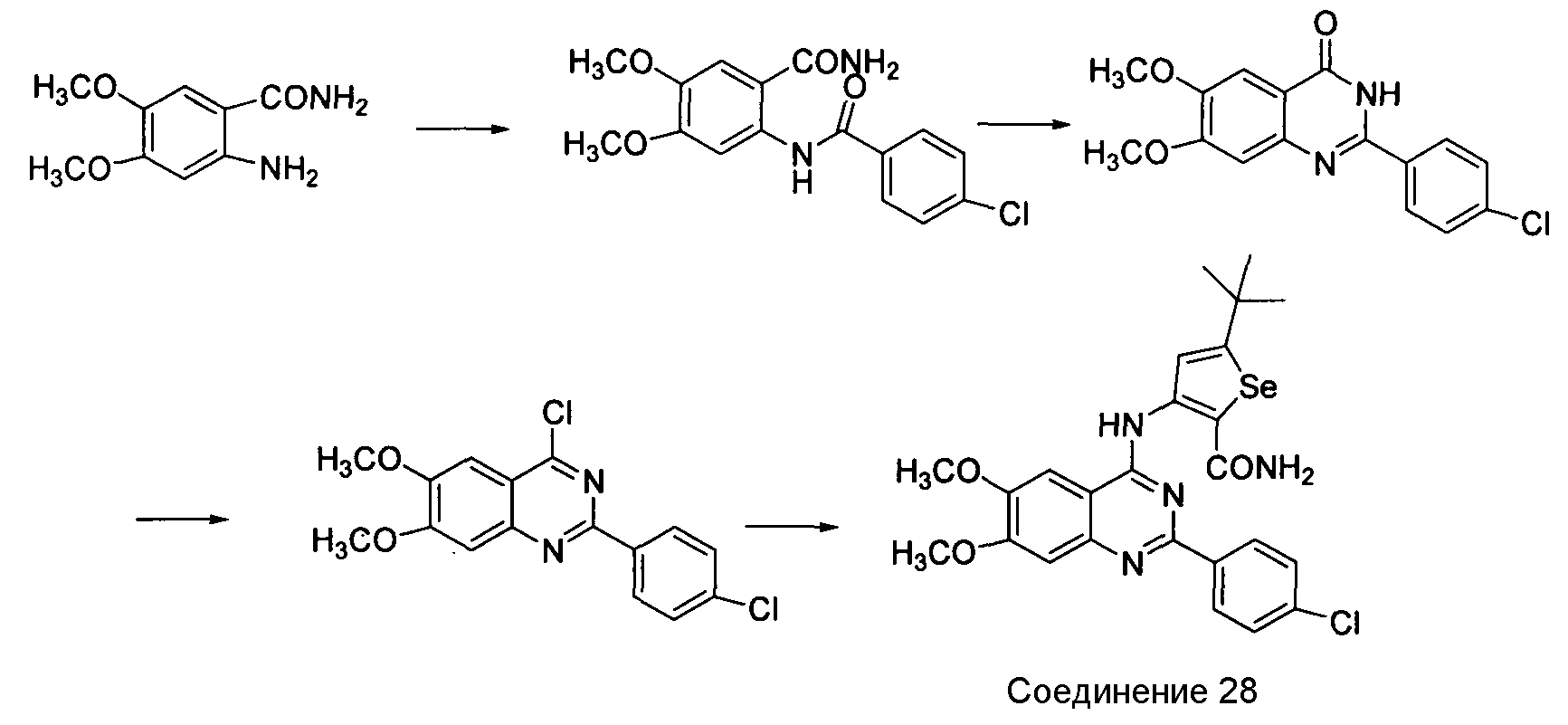
Схема Q
Как показано на схеме Q, 2-амино-4,5-диметоксибензамид вступает в реакцию с 4-хлорбензоилхлоридом в присутствии триэтиламина и ТГФ с получением 2-((4-хлорфенил)карбониламино)-4,5-диметоксибензамида, который циклизуют с использованием NaOH и затем обрабатывают тионилхлоридом с получением 4-хлор-2-(4-хлорфенил)-6,7-диметоксихиназолина (McKee, R.L. et. al., J. Am. Chem. Soc, 1946, 68, 1902-1903). 4-Хлор-соединение обрабатывают 5-(трет-бутил)селенофен-2-карбоксамидом в присутствии NaOH/ДМФ с получением 3-(2-(4-хлорфенил)-6,7-диметоксихиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамида.
Синтез эфира (X=O) аналогов: Синтез селенофеновых соединений формулы (I), а именно, синтез эфирных аналогов достигается посредством стадий, показанных на схеме R.
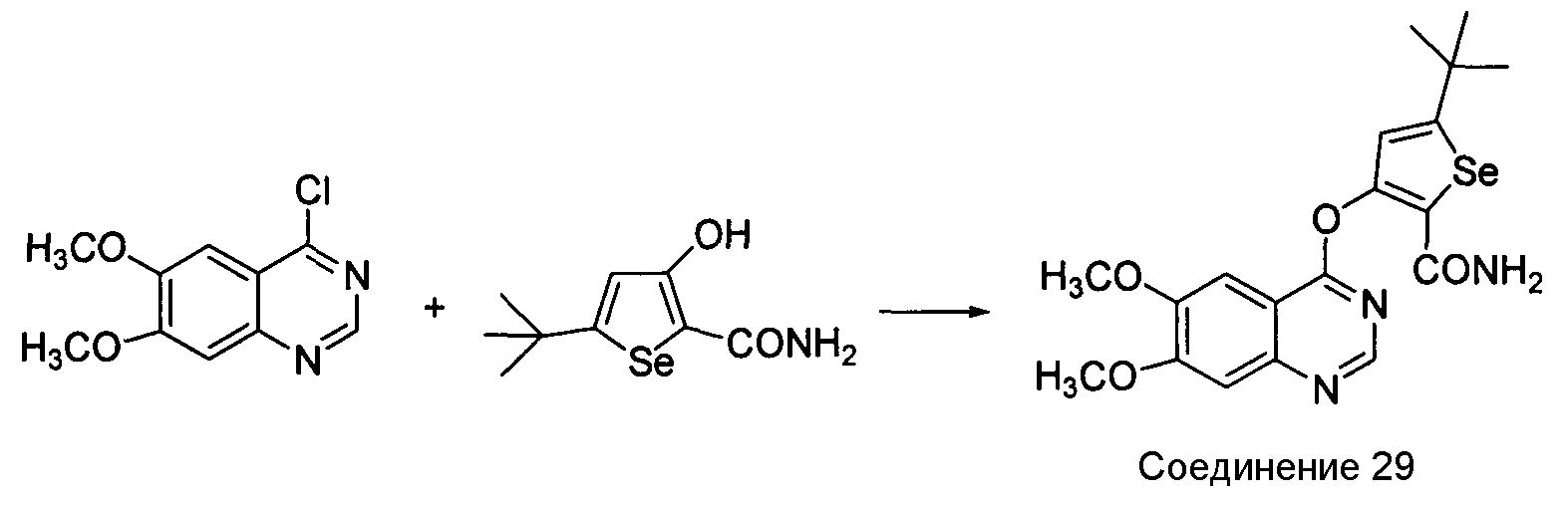
Схема R
Как показано на схеме R, 4-хлор-6,7-диметоксихиназолин вступает в реакцию с 5-трет-бутил-3-гидроксиселенофен-2-карбоксамидом в присутствии NaOH и ДМФА с получением 3-(6,7-диметоксихиназолин-4-илокси)-5-трет-бутилселенофен-2-карбоксамида. 5-трет-бутил-3-гидроксиселенофен-2-карбоксамид получают посредством осуществления пяти стадий из пинаколина, и это описано в примерах.
Синтез аминоселенофенов
Синтез аминоселенофенов формулы (III), а именно, 3-амино-5-трет-бутилселенофен-2-карбоксамида и 3-амино-5-фенилселенофен-2-карбоксамида достигается посредством стадий, показанных на схеме S.
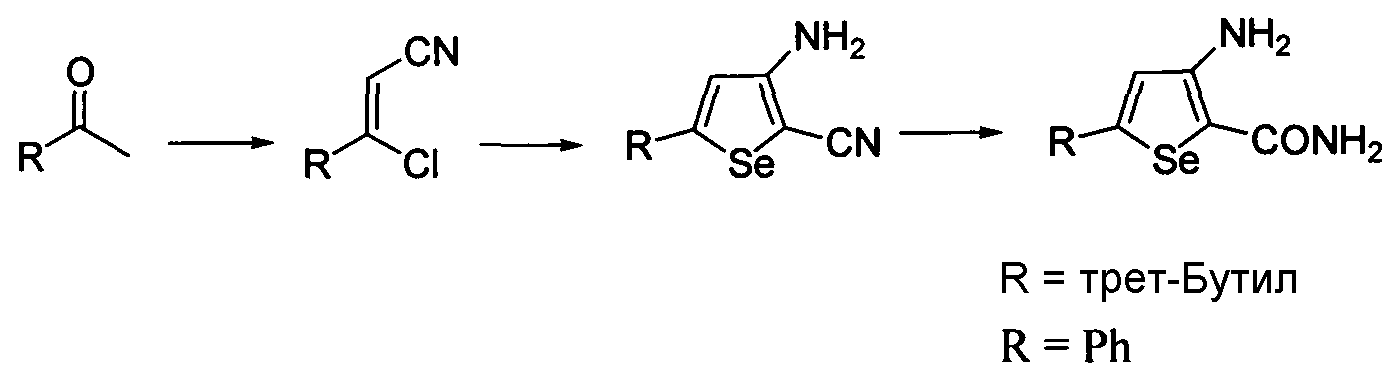
Схема S
3-хлор-3-замещенный проп-2-ен-нитрил получают исходя из соответствующего кетона с использованием ДМФА - оксихлорида фосфора, с последующим использованием гидроксиламина гидрохлорида. Полученные продукты реагируют с селенидом натрия, хлорацетонитрилом в присутствии основания, обеспечивая получение 5-замещенных 3-аминоселенофен-2-карбонитрилов с хорошими выходами. В конечном итоге, нитрильную группу гидролизуют с использованием водного раствора гидроксида натрия, обеспечивая получение 3-амино-5-трет-бутилселенофен-2-карбоксамида и 3-амино-5-фенилселенофен-2-карбоксамида.
Синтез аминоселенофенов формулы (III), а именно, 3-амино-5-трет-бутил-2-нитроселенофена достигается посредством стадий, показанных на схеме T.
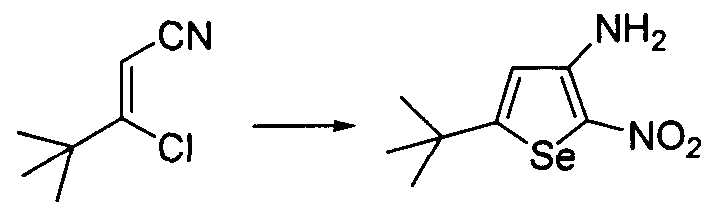
Схема T
3-хлор-3-трет-бутилпроп-2-ен-нитрил вступает в реакцию с селенидом натрия, бромнитрометаном в присутствии основания, обеспечивая получение 3-амино-5-трет-бутил-2-нитроселенофена.
Синтез аминоселенофенов формулы (III), а именно, метил-4-амино-5-метилселенофен-2-карбоксилата достигается посредством стадий, показанных на схеме U.
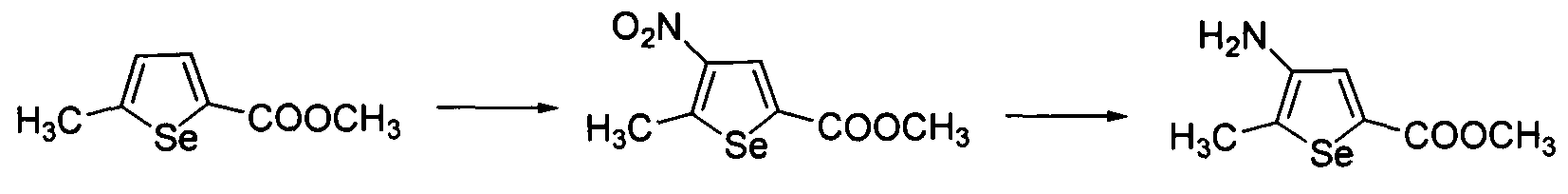
Схема U
Нитрование метил 5-метилселенофен-2-карбоксилата (Tsuboni, S. et. al., Tetrahedron Lett., 1986, 27, 2643-2644) обеспечивает получение метил-5-метил-4-нитроселенофен-2-карбоксилата. Функциональную нитрогруппу восстанавливают до аминов с использованием подходящих восстанавливающих агентов, например, железного порошка, или любых других восстанавливающих нитрогруппу агентов с хорошим выходом.
Везде в этом документе, для упрощения, отдается предпочтение использованию единственного смысла изложенного текста по сравнению с многообразным смыслом изложенного текста, но обычно подразумевается включение многообразного смысла изложенного текста, если не оговорено иное. Например, выражение "Способ лечения заболевания у пациента, включающий введение пациенту эффективного количества соединения формулы (I)" подразумевает включение одновременного лечения более чем одного заболевания, а также и введение более чем одного соединения формулы (I).
Композиции
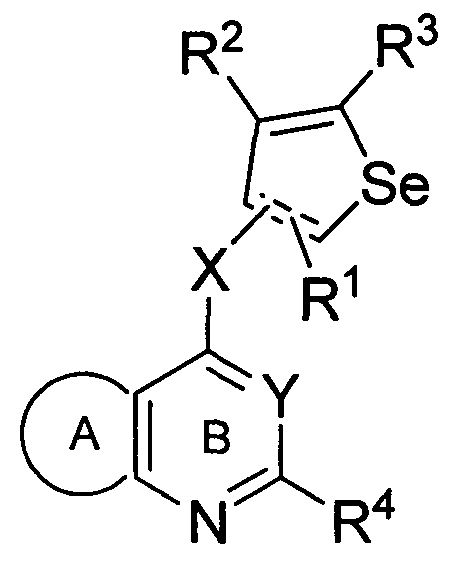
В другом аспекте, изобретение предоставляет фармацевтические композиции, включающие соединение формулы (I) или его фармацевтически приемлемую соль, или сольваты, или гидраты, или стереоизомеры в комбинации с фармацевтически приемлемыми эксципиентом(ами) или носителем(ями), или разбавителем(ями);
Формула (I)
в которой все группы представляют собой такие, как определены ранее.
Фармацевтические композиции, включающие соединение формулы (I) или его фармацевтически приемлемую соль, или сольваты, или гидрат, или стереоизомеры в комбинации с фармацевтически приемлемыми эксципиентом(ами), или носителем(ями), или разбавителем(ями); и концентрация указанного соединения формулы (I) находится в диапазоне от 0,01% до 99%.
Фармацевтические композиции, включающие соединение формулы (I) или его фармацевтически приемлемую соль, или сольваты, или гидраты, или стереоизомеры в комбинации с фармацевтически приемлемыми эксципиентом(ами), или носителем(ями), или разбавителем(ями); указанный носитель или разбавитель, или эксципиент выбирают из группы, состоящей из глюкозы, фруктозы, сахарозы, мальтозы, желтого декстрина, белого декстрина, аэрозоля, микрокристаллической целлюлозы, стеарата кальция, стеарата магния, сорбита, стевиозида, кукурузного сиропа, лактозы, лимонной кислоты, виноградной кислоты, яблочной кислоты, янтарной кислоты, молочной кислоты, L-аскорбиновой кислоты, dl-альфа-токоферола, глицерина, пропиленгликоля, сложного эфира глицерина и жирной кислоты, сложного эфира полиглицерина и жирной кислоты, сложного эфира сахарозы и жирной кислоты, сложного эфира сорбитана и жирной кислоты, сложного эфира пропиленгликоля и жирной кислоты, аравийской камеди, каррагенана, казеина, желатина, пектина, агара, витамина группы В, никотинамида, пантотената кальция, аминокислот, солей кальция, пигментов, вкусоароматических добавок и консервирующих добавок, дистиллированной воды, солевого физиологического раствора, водного раствора глюкозы, спирта (например, этанол), пропиленгликоля и полиэтиленгликоля, различных животных и растительных масел, парафина белого мягкого, парафина и воска.
Когда соединения настоящего изобретения вводят в качестве лекарственных препаратов людям и животным, они могут даваться в чистом виде или в виде фармацевтической композиции, содержащей, например, 0,01-99,5% соединения формулы (I) в комбинации с фармацевтически приемлемым носителем или разбавителем.
И еще в другом аспекте, изобретение предоставляет способ получения фармацевтической композиции. Способ включает стадию смешивания, по меньшей мере, одного соединения формулы (I), как определено выше, по меньшей мере, с одним фармацевтически приемлемым носителем или разбавителем, и приведение полученной в результате комбинации в удобную для введения форму.
В другом аспекте, фармацевтические композиции настоящего изобретения могут быть в любой форме, которая позволяет вводить композицию пациенту. Например, композиция может быть в форме твердого вещества, жидкости или газа (аэрозоль). Типичные способы введения включают, без исключения, топический, парентеральный, сублингвальный, интраперитонеальный (IP), внутривенный (IV), пероральный (PO), внутримышечный (IM), внутрикожный (IC), интрадермальный (ID), внутриматочный и интраректальный. Термин «парентеральный» для использования в данном описании включает подкожные инъекции, внутривенные, внутримышечные, интрастернальные процедуры инъекции или инфузии. Фармацевтические композиции изобретения по составу подобраны так, чтобы позволить активным ингредиентам, содержащимся в них, быть биодоступными непосредственно после введения композиции пациенту. Композиции, которые будут вводиться, имеют форму с одной или с несколькими дозированными единицами, например, таблетка может быть с дозированной единицей для однократного приема, и упаковка для соединения формулы (I) в топической форме может вмещать множество дозированных единиц и также в форме наночастиц различных размеров в эмульсии для теплокровных животных, нуждающихся в этом.
Для среднего специалиста в данной области техники будет очевидным, что оптимальная доза активного ингредиента(ов) в фармацевтической композиции будет зависеть от множества факторов. Важные факторы включают, без исключения, тип пациента (например, человек), конкретную форму активного ингредиента, способ введения и применяемую композицию.
В другом аспекте, изобретение предоставляет фармацевтические композиции, включающие, по меньшей мере, одно соединение формулы (I) или его фармацевтически приемлемую соль, или сольваты, или гидраты, или стереоизомеры и, по меньшей мере, один компонент, выбранный из фармацевтически приемлемого эксципиента, фармацевтически приемлемого разбавителя и фармацевтически приемлемого носителя, и, необязательно, дополнительно включающие, по меньшей мере, одно противоопухолевое вещество,
Формула (I)
в которой все группы представляют собой такие, как определено ранее.
Противоопухолевое вещество выбирают из алкилирующих агентов, антиметаболитов, гормональных терапевтических средств, ингибирующих топоизомеразу цитотоксических веществ, антиангиогенных соединений, антител, ингибиторов VEGF, ингибиторов EGFR (HER1), ингибиторов HER2, ингибиторов CDK, ингибиторов протеасомы, ингибиторов серин/треонин-киназы (Raf ингибиторы), ингибиторов тирозин-киназы, антагонистов андрогенового рецептора и ингибиторов ароматазы. В связи с этим, ниже приведен, не имеющий ограничительного характера, перечень примеров вторичных агентов, которые могут использоваться в комбинации с соединениями настоящего изобретения:
Алкилирующие агенты включают, но не ограничиваются только приведенными, метил-бис-(2-хлорэтил)амин-N-оксид, циклофосфамид, ифосфамид, тиотепа, ранимустин, нимустин, темозоломод, альтретамин, апазиквон, бросталлицин, бендамустин, кармустин, эстрамустин, фотемустин, глюфосфамид, мафосфамид, бендамустин, митолактол, цисплатин, карбоплатин, эптаплатин, лобаплатин, недаплатин, оксалиплатин и сатраплатин.
Антиметаболиты включают, но не ограничиваются только приведенными, метотрексат, 6-меркаптопуринрибозид, меркаптопурин, 5-фторурацил, тегафур, доксифлуридин, кармофур, цитарабин, цитарабин окфосфат, эноцитабин, гемцитабин, флударабин, 5-азацитидин, капецитабин, кладрибин, клофарабин, децитабин, эфлорнитин, этинилцитидин, цитозин арабинозид, гидроксимочевина, мелфалан, неларабин, нолатрексед, окфосфат, динатрий преметрексед, пентостатин, пелитрексол, ралтитрексед, триапин, триметрексат, видарабин, винкристин и винорелбин.
Гормональные терапевтические средства включают, но не ограничиваются только приведенными, экземестан, Lupron, анастрозол, доксеркальциферол, фадрозол, форместан, абиратерон ацетат, финастерид, эпристерид, тамоксифен цитрат, фулвестрант, Trelstar, торемифен, ралоксифен, лазофоксифен, летрозол, сагопилон, иксабепилон, эпотилон B, винбластин, винфлунин, доцетаксел и паклитаксел.
Ингибирующие топоизомеразу цитотоксические вещества включают, но не ограничиваются только приведенными, акларубицин, доксорубицин, амонафид, белотекан, камптотецин, 10-гидроксикамптотецин, 9-аминокамптотецин, дифломотекан, иринотекан, топотекан, эдотекарин, эпимбицин, этопозид, эксатекан, гиматекан, луртотекан, митоксантрон, пирамбицин, пиксантрон, рубитекан, собузоксан, тафлупозид.
Антиангиогенные соединения включают, но не ограничиваются только приведенными, ацитретин, афлиберсепт, ангиостатин, аплидин, асентар, акситиниб, рецентин, бевацизумаб, бриваниб аланинат, циленгтид, комбретастатин, DAST, эндостатин, фенретинид, галофугинон, пазопаниб, ранибизумаб, ребимастат, ремоваб, ревлимид, сорафениб, ваталаниб, скваламин, сунитиниб, телатиниб, талидомид, украин и витаксин.
Антитела включают, но не ограничиваются только приведенными, трастузумаб, цетуксимаб, бевацизумаб, ритуксимаб, тицилимумаб, ипилимумаб, люмиликсимаб, катумаксомаб, атацисепт, ореговомаб и алемтузумаб.
Ингибитор VEGF выбирают из сорафениба, DAST, бевацизумаба, сунитиниба, рецентина, акситиниба, афлиберсепта, телатиниба, бриваниб аланината, ваталаниба, пазопаниба и ранибизумаба.
Ингибитор EGFR (HER1) выбирают из цетуксимаба, панитумумаба, вектибикса, гефитиниба, эрлотиниба и Зактимы.
Ингибитор HER2 выбирают из лапатиниба, тратузумаба и пертузумаба.
Ингибитор CDK выбирают из росковитина и флавопиридола.
Ингибитор протеасомы выбирают из бортезомиба и карфилзомиба.
Ингибиторы серин/треонин-киназы включают ингибиторы MEK и ингибиторы Raf, такие как сорафениб.
Ингибитор тирозин-киназы выбирают из дазатиниба, нилотиниба, DAST, бозутиниба, сорафениба, бевацизумаба, сунитиниба, AZD2171, акситиниба, афлиберсепта, телатиниба, иматиниб мезилата, бриваниб аланината, пазопаниба, ранибизумаба, ваталаниба, цетуксимаба, панитумумаба, вектибикса, гефитиниба, эрлотиниба, лапатиниба, тратузумаба и пертузумаба.
Антагонист андрогенового рецептора выбирают из нандролона деканоата, флуоксиместерона, Android, Prostaid, андромустина, бикалутамида, флутамида, апоципротерона, апофлутамида, хлормадинон ацетата, Androcur, Tabi, ципротерон ацетата и нилутамида.
Ингибитор ароматазы выбирают из анастрозола, летрозола, тестолактона, экземестана, аминоглутетимида и форместана.
Другие противораковые агенты включают, например, алитретиноин, амплиген, атразентан, бексаротен, бортезомиб, бозентан, кальцитриол, эксизулинд, фотемустин, ибандроновая кислота, мильтефозин, митоксантрон, I-аспарагиназа, прокарбазин, дакарбазин, гидроксикарбамид, пегаспаргаза, пентостатин, тазаротен, велкейд, нитрат галлия, канфосфамид, даринапарсин и третиноин. В предпочтительном варианте осуществления изобретения, соединения настоящего изобретения могут применяться в комбинации с химиотерапией (т.e. с цитотоксическими веществами), анти-гормональной и/или таргетной терапией, так же, как другие ингибиторы киназ, ингибиторы mTOR и ингибиторы ангиогенеза.
Соединения настоящего изобретения также могут применяться при лечении рака в сочетании с лучевой терапией и/или хирургическим вмешательством. Кроме того, соединения формулы (I) могут использоваться, сами по себе или в композициях, в исследовании и диагностике, или в качестве аналитических стандартных образцов, и другим подобным образом, хорошо известным в данной области из уровня техники.
И еще в другом аспекте, изобретение предоставляет применение соединения формулы (I), как определено выше для промышленного производства фармацевтической композиции для лечения или предотвращения клеточного пролиферативного нарушения. В конкретных вариантах осуществления изобретения клеточное пролиферативное нарушение представляет собой рак.
Независимо от выбранного способа введения, соединения изобретения, которые могут использоваться в подходящей гидратированной форме, и/или фармацевтические композиции настоящего изобретения, вырабатываются в составе фармацевтически приемлемых дозированных форм с помощью стандартных методов, известных специалисту в данной области.
Фактические уровни дозирования и период времени введения активных ингредиентов фармацевтических композиций изобретения может изменяться для того, чтобы получить количество активного ингредиента, которое является эффективным для достижения требуемого терапевтического ответа для случая конкретного пациента, композиции, способа введения, без токсичности для пациента. Типичный диапазон дозировки составляет от 0,01 до 100 мг/кг в день или 0,1-150 мг/кг в день.
В конкретных вариантах осуществления изобретения, соединение изобретения может применяться при комбинированной терапии, совместно со стандартной химиотерапией рака. Стандартные схемы лечения лейкемии и других опухолей включают облучение, лекарственные препараты или их комбинацию.
Способы применения
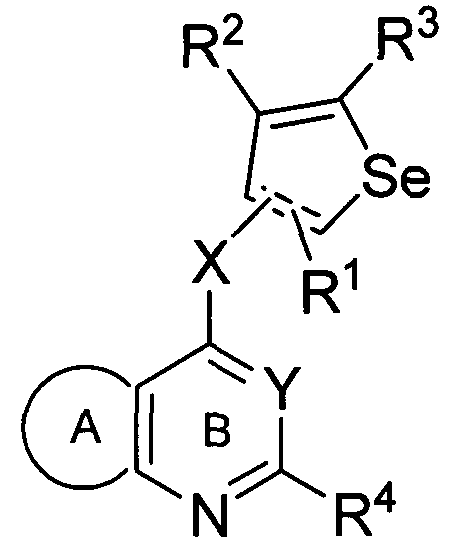
Соединения настоящего изобретения могут применяться для ингибирования активности тирозин-киназ, в частности, включая HER1 (EGFR), HER2 и VEGF, или для уничтожения раковых клеток. Следовательно, ожидается, что соединения формулы (I) представляют собой ценные терапевтические агенты. Таким образом, настоящее изобретение предоставляет способ лечения или ингибирования, или контролирования клеточного пролиферативного нарушения у пациента, нуждающегося в таком лечении, включающий введение пациенту эффективного количества соединения формулы (I) или его фармацевтической соли; или его изомеров, или его гидратов, или его сольватов;
Формула (I)
в которой:
кольцо A представляет собой арил или гетероарил, или гетероциклоалкил; арил представляет собой сопряженное бензольное кольцо и гетероарил представляет собой 6-членное ароматическое сопряженное кольцо, содержащее один, два или три атома азота; или гетероарил представляет собой 5-членное ароматическое сопряженное кольцо, содержащее один или несколько гетероатомов, выбираемых из серы, кислорода, азота и селена, при условии, что присутствует не более одного атома кислорода или серы, или селена; такие кольца включают пиридин, пиридазин, пиразин, пиримидин, тиофен, фуран, пиррол, селенофен, пиразол, имидазол, оксазол, изоксазол, тиазол и изотиазол; гетероциклоалкил, как правило, представляет собой моно- или бициклический, насыщенный гетероциклический радикал, имеющий общее число углеродных атомов от 3 до 10, и вплоть до 2 гетероатомов и/или гетерогрупп, независимо друг от друга выбираемых из группы, состоящей из N, O, S, SO и SO2.
Кольцо A представляет собой, необязательно, замещенное одной, двумя или несколькими группами, независимо друг от друга выбираемыми из водорода, галогена, гидрокси, формила, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалогенометила, сульфаниламида, С1-6 алкила, С1-6 вторичного алкила, С1-6 третичного алкила, С2-6 алкенила, С2-6 алкинила, С1-4 алкилкарбонила, С1-4 алкоксикарбонила, аминокарбонила, С1-6 алкиламинокарбонила, ди(С1-6 алкил)аминокарбонила, галогеноС1-6 алкила, гидроксиС1-6 алкила, С1-6 алкокси, галогеноС1-6 алкокси, гидроксиС1-6 алкокси, С3-7 циклоалкила, С3-7 циклоалкокси, С1-6 алкиламино, ди(С1-6 алкил)амино, аминоС1-6 алкила, аминоС1-6 алкокси, С1-6 алкиламиноС1-6 алкила, ди(С1-6 алкил)аминоС1-6 алкила, С1-6 алкилсульфинила, С1-6 алкилсульфонила, и кольца арила, гетероарила и гетероциклоалкила; кольца арила, гетероарила и гетероциклоалкила, необязательно, замещенного галогеном, гидроксилом, формилом, карбоновой кислотой, амино, нитро, циано, сульфоновой кислотой, тиолом, тригалогенометилом, сульфаниламидом, С1-6 алкилом, С2-6 алкенилом, С2-6 алкинилом, С1-4 алкилкарбонилом, С1-4 алкоксикарбонилом, аминокарбонилом, С1-6 алкиламинокарбонилом, ди(С1-6 алкил)аминокарбонилом, галогеноС1-6 алкилом, гидроксиС1-6 алкилом, С1-6 алкокси, галогеноС1-6 алкокси, гидроксиС1-6 алкокси, С3-7 циклоалкилом, С3-7 циклоалкокси, С1-6 алкиламино, ди(С1-6 алкил)амино, аминоС1-6 алкилом, аминоС1-6 алкокси, С1-6 алкиламиноС1-6 алкилом, ди(С1-6 алкил)аминоС1-6 алкилом, С1-6 алкилсульфинилом, С1-6 алкилсульфонилом;
Y представляет собой N или C-R5, в котором R5 выбирают из водорода, галогена, гидрокси, формила, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалогенометила, сульфаниламида, С1-6 алкила, С1-6 вторичного алкила, С1-6 третичного алкила, С2-6 алкенила, С2-6 алкинила, С1-4 алкилкарбонила, С1-4 алкоксикарбонила, аминокарбонила, С1-6 алкиламинокарбонила, ди(С1-6 алкил)аминокарбонила, галогеноС1-6 алкила, гидроксиС1-6 алкила, С1-6 алкокси, галогеноС1-6 алкокси, гидроксиС1-6 алкокси, С3-7 циклоалкила, С3-7 циклоалкокси, С1-6 алкиламино, ди(С1-6 алкил)амино, аминоС1-6 алкила, аминоС1-6 алкокси, С1-6 алкиламиноС1-6 алкила, ди(С1-6 алкил)аминоС1-6 алкила, С1-6 алкилсульфинила, С1-6 алкилсульфонила;
X может быть присоединен либо во 2-м, либо в 3-м положении селенофенового кольца;
X выбирают из NR6, O, S, S(O), S(О2); в котором R6 выбирают из водорода, амино, С1-6 алкила, галогеноС1-6 алкила;
R1, R2, R3 и R4
выбирают из водорода, галогена, гидрокси, формила, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалогенометила, сульфаниламида, С1-6 алкила, С1-6 вторичного алкила, С1-6 третичного алкила, С2-6 алкенила, С2-6 алкинила, С1-4 алкилкарбонила, С1-4 алкоксикарбонила, аминокарбонила, С1-6 алкиламинокарбонила, ди(С1-6 алкил)аминокарбонила, галогеноС1-6 алкила, гидроксиС1-6 алкила, С1-6 алкокси, галогеноС1-6 алкокси, гидроксиС1-6 алкокси, С3-7 циклоалкила, С3-7 циклоалкокси, С1-6 алкиламино, ди(С1-6 алкил)амино, аминоС1-6 алкила, аминоС1-6 алкокси, С1-6 алкиламиноС1-6 алкила, ди(С1-6 алкил)аминоС1-6 алкила, С1-6 алкилсульфинила, С1-6 алкилсульфонила; и кольца арила, гетероарила и гетероциклоалкила; кольца арила, гетероарила и гетероциклоалкила, необязательно, замещенного галогеном, гидроксилом, формилом, карбоновой кислотой, амино, нитро, циано, сульфоновой кислотой, тиолом, тригалогенометилом, сульфаниламидом, С1-6 алкилом, С2-6 алкенилом, С2-6 алкинилом, С1-4 алкилкарбонилом, С1-4 алкоксикарбонилом, аминокарбонилом, С1-6 алкиламинокарбонилом, ди(С1-6 алкил)аминокарбонилом, галогеноС1-6 алкилом, гидроксиС1-6 алкилом, С1-6 алкокси, галогеноС1-6 алкокси, гидроксиС1-6 алкокси, С3-7 циклоалкилом, С3-7 циклоалкокси, С1-6 алкиламино, ди(С1-6 алкил)амино, аминоС1-6 алкилом, аминоС1-6 алкокси, С1-6 алкиламиноС1-6 алкилом, ди(С1-6 алкил)аминоС1-6 алкилом, С1-6 алкилсульфинилом, С1-6 алкилсульфонилом.
Другой аспект изобретения предоставляет способ лечения или ингибирования, или контролирования клеточного пролиферативного нарушения у пациента, нуждающегося в таком лечении, включающий введение пациенту эффективного количества композиции, включающей в себя, по меньшей мере, одно селенофеновое соединение формулы (I), или его фармацевтическую соль; или его изомеры, или его гидраты, или его сольваты; и, по меньшей мере, один компонент, выбранный из фармацевтически приемлемого эксципиента, фармацевтически приемлемого разбавителя и фармацевтически приемлемого носителя; и, необязательно, дополнительно включающей в себя, по меньшей мере, одно противоопухолевое вещество, выбираемое из алкилирующих агентов, антиметаболитов, гормональных терапевтических средств, ингибирующих топоизомеразу цитотоксических веществ, антиангиогенных соединений, антител, ингибиторов VEGF, ингибиторов EGFR (HER1), ингибиторов HER2, ингибиторов CDK, ингибиторов протеасомы, ингибиторов серин/треонин-киназы (Raf ингибиторы), ингибиторов тирозин-киназы, антагонистов андрогенового рецептора и ингибиторов ароматазы.
Другой аспект настоящего изобретения предоставляет способ лечения или контролирования роста опухоли или злокачественного новообразования посредством блокирования развития кровеносных сосудов или посредством ингибирования формирования сосудистых капилляров при введении, по меньшей мере, одного селенофенового соединения формулы (I) или его солей, или его композиций, как определено выше.
Способ лечения или ингибирования, или контролирования клеточного пролиферативного нарушения, в котором указанное введение включает способ применения, выбираемый из группы, состоящей из интраперитонеального (IP), внутривенного (IV), перорального (PO), внутримышечного (IM), внутрикожного (IC), интрадермального (ID), внутриматочного, внутриопухолевого и интраректального.
В некоторых конкретных вариантах осуществления изобретения, клеточное пролиферативное нарушение представляет собой рак. Термин "проведение лечения" или "лечение", как принято на протяжении всего этого документа, применяется обычным образом, например, тактика ведения лечения или наблюдения пациента с целью противодействия, облегчения, уменьшения, ослабления, улучшения при состоянии заболевания или нарушения, такого как карцинома или любая злокачественная опухоль.
Термин "субъект клинического исследования" или "пациент" включает организмы, которые способны подвергаться клеточному пролиферативному нарушению или которые в ином случае могут получить полезный эффект от введения соединения изобретения, такие как человек и другие животные. Предпочтительные человеческие организмы включают пациентов из числа людей, страдающих от клеточного пролиферативного нарушения или предрасположенных к клеточному пролиферативному нарушению или связанных с ним состояний, как описано в этом документе. Термин "и другие животные" включает позвоночных, например, млекопитающих животных, таких как обезьяны, овца, корова, собака, кошка, и грызунов, например, мышь, и не относящихся к млекопитающим, таких как куры, земноводные, пресмыкающиеся и др.
Термин "клеточное пролиферативное нарушение" включает нарушения, включающие нежелательную или неконтролируемую пролиферацию клетки. Соединения настоящего изобретения могут использоваться для предотвращения, ингибирования, блокирования, снижения, уменьшения, контроля и др., клеточной пролиферации и/или клеточного деления, и/или порождения апоптоза. Этот способ включает введение нуждающемуся в этом пациенту, включая млекопитающих, включая человека, некоего количества соединения этого изобретения или его фармацевтически приемлемой соли, изомера, полиморфной смеси, метаболита, гидрата или сольвата, которое эффективно при лечении или предотвращении нарушения. Клеточные пролиферативные или гиперпролиферативные нарушения в контексте этого изобретения включают, но не ограничиваются только приведенными, например, псориаз, келоиды и другие гиперплазии, затрагивающие кожу, эндометриозы, костные нарушения, ангиогенные или затрагивающие кровеносные сосуды пролиферативные нарушения, легочную гипертензию, фиброзные нарушения, мезангиальные клеточные пролиферативные нарушения, полипы толстой кишки, поликистозное заболевание почек, доброкачественную гиперплазию простаты (BPH) и солидные опухоли, такие как злокачественные новообразования молочной железы, дыхательных путей, головного мозга, репродуктивных органов, желудочно-кишечного тракта, мочевыводящих путей, глаз, печени, кожи, головы и шеи, щитовидной железы, паращитовидной железы, и их отдаленные метастазы. Эти нарушения также включают лимфомы, саркомы и лейкемии.
Примеры злокачественных новообразований молочной железы включают, но не ограничиваются только приведенными, инфильтративно-протоковую карциному, инвазивную дольковую карциному, протоковую карциному in situ и лобулярную карциному in situ. Примеры злокачественных новообразований дыхательных путей включают, но не ограничиваются только приведенными, мелкоклеточную и немелкоклеточную карциному легкого, а также и аденому бронха и плевролегочную бластому.
Примеры злокачественных новообразований головного мозга включают, но не ограничиваются только приведенными, глиому ствола головного мозга и гипоталамуса, церебеллярную и церебральную астроцитому, глиобластому, медуллобластому, эпендимому, а также и нейроэктодермальную и пинеальную опухоль. Опухоли мужских репродуктивных органов включают, но не ограничиваются только приведенными, рак предстательной железы и рак яичка. Опухоли женских репродуктивных органов включают, но не ограничиваются только приведенными, эндометриальное, цервикальное, овариальное, вагинальное и влагалищное злокачественное новообразование, а также и саркому матки. Опухоли желудочно-кишечного тракта включают, но не ограничиваются только приведенными, анальные, относящиеся к толстой кишке, колоректальные, относящиеся к пищеводу, относящиеся к желчному пузырю, желудочные, панкреатические, ректальные, относящиеся к тонкому кишечнику и относящиеся к слюнной железе злокачественные новообразования.
Опухоли мочевыводящих путей включают, но не ограничиваются только приведенными, относящиеся к мочевому пузырю, пенильные, почечные, относящиеся к почечной лоханке, относящиеся к мочеточнику, уретральные и человеческие папиллярные ренальные злокачественные новообразования. Глазные злокачественные новообразования включают, но не ограничиваются только приведенными, интраокулярную меланому и ретинобластому. Примеры злокачественных новообразований печени включают, но не ограничиваются только приведенными, гепатоклеточную карциному (карциному клеток печени с или без фиброламеллярной разновидностью), холангиокарциному (карциному внутрипеченочных желчных протоков) и смешанную гепатоцеллюлярную холангиокарциному.
Кожные злокачественные новообразования включают, но не ограничиваются только приведенными, плоскоклеточную карциному, саркому Капоши, злокачественная меланома, рак кожных клеток Меркеля и немеланомный рак кожи. Злокачественные новообразования головы и шеи включают, но не ограничиваются только приведенными, ларингеальный, гипофарингеальный, назофарингеальный, орофарингеальный рак, рак губы и ротовой полости, и плоскоклеточный рак.
Лимфомы включают, но не ограничиваются только приведенными, СПИД-ассоциированную лимфому, не-ходжкинскую лимфому, кожную Т-клеточную лимфому, лимфому Беркитта, болезнь Ходжкина и лимфому центральной нервной системы.
Саркомы включают, но не ограничиваются только приведенными, саркому мягких тканей, остеосаркому, злокачественную фиброзную гистиоцитоксантому, лимфосаркому и рабдомиосаркому. Лейкемии включают, но не ограничиваются только приведенными, острую гранулоцитарную лейкемию, острую лимфобластную лейкемию, хроническую лимфоцитарную лейкемию, хроническую гранулоцитную лейкемию и лейкемию ворсистых клеток.
Фиброзные пролиферативные нарушения, т.e. аномальное образование внеклеточного матрикса, которые можно лечить соединениями и способами настоящего изобретения, включают атеросклероз, рестеноз, цирроз печени и мезангиальные клеточные пролиферативные нарушения, включая заболевания почек, такие как гломерулонефрит, диабетическая нефропатия, злокачественный нефросклероз, синдромы тромботической микроангиопатии, отторжение трансплантата и гломерулопатии.
Другие патологические состояния у людей и других млекопитающих, которые можно лечить путем введения соединения настоящего изобретения, включают опухолевый рост, ретинопатию, включая диабетическую ретинопатию, ишемическую окклюзию вены сетчатки, ретинопатию недоношенных и возрастную макулярную дегенерацию, ревматоидный артрит, псориаз и буллезные нарушения, связанные с образованием субэпидермальных волдырей, включая буллезный пемфигоид, полиморфную эритему и герпетиформный дерматит.
Соединения настоящего изобретения также могут применяться для предотвращения и лечения заболеваний верхних дыхательных путей и легких, заболеваний желудочно-кишечного тракта, а также и заболеваний мочевого пузыря и желчных протоков.
Заболевания, упомянутые выше, хорошо охарактеризованы у людей, но также они существуют с похожей этиологией и у других животных, включая млекопитающих, и их можно лечить посредством введения соединения формулы (I) или его фармацевтических композиций настоящего изобретения.
Настоящее изобретение предоставляет примеры, приведенные ниже, которые даны только как иллюстративный путь, и они не должны рассматриваться как ограничивающие объем изобретения. Вариации и изменения, которые очевидны для специалиста в данной области, предполагаются как охватываемые объемом и сущностью изобретения, которые определены в прилагаемой формуле изобретения.
Примеры
Синтез промежуточных соединений:
1. 3-Амино-5-трет-бутилселенофен-2-карбоксамид
Стадия a:
3-Хлор-4,4-диметилпент-2-ен-нитрил: К охлажденному льдом (0-5°C) диметилформамиду (6,2 мл, 80 ммоль) добавляли оксихлорид фосфора (3,75 мл, 40 ммоль) по каплям при перемешивании в течение 15 мин. К этой холодной смеси трет-бутилметилкетон (2,0 г, 20 ммоль) добавляли по каплям, поддерживая температуру реакционной смеси в интервале между 45-55°C в течение 10 мин. Реакционную смесь медленно доводили до комнатной температуры (комн.темп.) и выдерживали 30 мин. К реакционной смеси добавляли 1 мл от общего количества раствора гидроксиламина гидрохлорида (5,56 г, 80 ммоль) в сухом ДМФА (8 мл) и смесь перемешивали при 70-80°C в течение 5 мин. Затем оставшийся раствор гидроксиламина гидрохлорида в ДМФА добавляли туда же с такой скоростью, что температура реакционной смеси поднялась выше 145-155°C. После завершения добавления реакционную смесь оставляли доходить до комн.темп. в течение 30 мин и разбавляли холодной водой (200 мл). Раствор экстрагировали хлороформом (3×100 мл) и объединенный хлороформный слой промывали водой, солевым раствором и сушили над сульфатом натрия. Раствор фильтровали и растворитель упаривали. Остаток хроматографировали на силикагеле, используя гексан-этилацетат (98:2) в качестве элюента, получая продукт в виде масла светло-зеленого цвета (1,0 г, 35%).1Н ЯМР (400 МГц, CDCl3): δ 5,56 (1H, с), 1,24 (9H, с).
Стадия b:
Получение селенида натрия: Селен (0,83 г) добавляли к раствору гидроксида натрия (2,32 г) и формальдегидсульфоксилата натрия (3,84 г) в воде (11 мл). После перемешивания в течение 1 ч при 50°C белый осадок отфильтровывали в атмосфере азота и быстро использовали на следующей Стадии.
3-Амино-5-трет-бутилселенофен-2-карбонитрил: К суспензии селенида натрия (3,51 г, 27,87 ммоль) в ДМФА (28 мл) добавляли раствор 3-хлор-4,4-диметилпент-2-ен-нитрила (4,0 г, 27,87 ммоль) в ДМФА (10 мл) при комн.темп. в течение 5 мин и перемешивали смесь при 60-70°C в течение 2 ч. Затем хлорацетонитрил (1,76 мл, 27,87 ммоль) добавляли по каплям к реакционной смеси и снова перемешивали при той же самой температуре в течение 2 ч. Затем раствор метоксида натрия (1,5 г, 27,87 ммоль) в сухом метаноле (18 мл) добавляли по каплям и перемешивание продолжали в течение 1 ч. Смесь оставляли доходить до комн.темп. и выливали в холодную воду, и перемешивали в течение 30 мин. Выпавшее твердое вещество отфильтровывали и промывали водой. Твердое вещество перекристаллизовывали из хлороформ-гексана, получая продукт в виде твердого вещества коричневого цвета (5,06 г, 80%), Т.пл 110-112°C. 1Н ЯМР (400 МГц, CDCl3): δ 6,59 (1H, с), 4,46 (2H, ушир.с), 1,33 (9H, с); ЖХ-МС (режим определения отрицательных ионов): m/z 225, 227 (M-H)-.
Стадия c:
3-Амино-5-(трет-бутил)селенофен-2-карбоксамид: К суспензии 3-амино-5-(трет-бутил)селенофен-2-карбонитрила (2,0 г) в водном растворе гидроксида натрия (50 мл, 10%) добавляли этанол (50 мл) и смесь кипятили в течение 1 ч. Этанол отгоняли под вакуумом (прибл. 25 мл) и смесь оставляли охлаждаться до 5-10°C. Выделившиеся кристаллы отфильтровывали, промывали холодной водой и сушили, получая продукт в виде твердого вещества белого цвета с желтоватым оттенком (1,8 г, 83%), Т.пл. 160-162°C. 1Н ЯМР (400 МГц, CDCl3): δ 6,58 (1H, с), 5,75 (2H, ушир.с), 5,13 (2H, ушир.с), 1,34 (9H, с).
2. 3-Амино-5-фенилселенофен-2-карбоксамид
Стадия a:
3-Хлор-3-фенилпроп-2-ен-нитрил: Реакция с участием диметилформамида, оксихлорида фосфора и ацетофенона, как описано ранее, давала возможность получить продукт в виде масла (0,72 г, 53%). 1Н ЯМР (400 МГц, CDCl3): δ 7,64-7,67 (2H, м), 7,43-7,53 (3H, м), 6,02 (1H, с).
Стадия b:
3-Амино-5-фенилселенофен-2-карбонитрил: Реакция с участием 3-хлор-3-фенилпроп-2-ен-нитрила, селенида натрия и хлорацетонитрила, как описано ранее, давала возможность получить продукт в виде твердого вещества коричневого цвета (4,8 г, 53%), Т.пл. 162-164°C (с разл.). 1Н ЯМР (400 МГц, CDCl3): δ 7,46-7,49 (2H, м), 7,37-7,39 (3H, м), 7,01 (1H, с), 4,55 (2H, ушир.с).
Стадия c:
3-Амино-5-фенилселенофен-2-карбоксамид: Гидролиз 3-амино-5-фенилселенофен-2-карбонитрила при использовании водного раствора гидроксида натрия, как описано ранее, давал возможность получить продукт в виде твердого вещества золотисто-желтого цвета (2,8 г, 67%), Т.пл. 184-186°C. 1Н ЯМР (400 МГц, CDCl3): δ 7,50-7,53 (2H, м), 7,36-7,38 (3H, м), 7,04 (1H, с), 5,84 (2H, ушир.с), 5,12 (2H, ушир.с).
3. 3-Амино-5-трет-бутил-2-нитроселенофен
Реакция с участием 3-хлор-4,4-диметилпент-2-ен-нитрила, селенида натрия и бромнитрометана, как описано ранее, давала возможность получить продукт в виде твердого вещества желтого цвета, Т.пл. 112-114°C. 1Н ЯМР (400 МГц, ДМСО-d6): δ 8,28 (2H, ушир.с), 6,76 (1H, с), 1,28 (9H, с).
4. Метил-4-амино-5-метилселенофен-2-карбоксилат
Стадия a:
Метил-5-метил-4-нитроселенофен-2-карбоксилат: К охлажденному льдом (0-10°C) раствору метил-5-метилселенофен-2-карбоксилата (5,4 г, 26,6 ммоль) в уксусном ангидриде (15 мл) добавляли охлажденную льдом смесь азотной кислоты (5,5 мл, 61,1 ммоль, 70%) и уксусного ангидрида (10 мл) в течение 10 мин. Реакционную смесь оставляли медленно доходить до комн.темп. в течение 1 ч и перемешивали при комнатной температуре (комн.темп.) в течение 16 ч. Смесь выливали в ледяную воду и перемешивали в течение 10 мин. Раствор экстрагировали хлороформом (3×100 мл) и объединенный органический слой промывали водой, солевым раствором и сушили над сульфатом натрия. Раствор фильтровали и растворитель упаривали. Остаток хроматографировали на силикагелевой колонке, используя гексан-этилацетат (90:10) в качестве элюентов, получали продукт в виде твердого вещества бледно-желтого цвета (2,3 г, 35%), Т.пл. 90-92°C. 1H ЯМР (400 МГц, CDCl3): δ 8,54 (1H, с), 3,90 (3H, с), 2,90 (3H, с).
Стадия b:
Метил 4-амино-5-метилселенофен-2-карбоксилат: К раствору метил-5-метил-4-нитроселенофен-2-карбоксилата (2,3 г, 9,28 ммоль) в смеси воды (5 мл) и метанола (40 мл) добавляли конц. хлористоводородную кислоту (1,0 мл). К вышеуказанному раствору добавляли железный порошок (2,6 г, 46,4 ммоль), затем хлорид аммония (2,5 г, 46,4 ммоль) при комн.темп. Реакционную смесь кипятили в течение 1 ч и затем оставляли охлаждаться до комн.темп. Раствор фильтровали и подщелачивали с помощью насыщенного раствора бикарбоната натрия. Раствор экстрагировали этилацетатом (4×100 мл) и объединенный органический слой сушили над сульфатом натрия и фильтровали. Растворитель упаривали и остаток хроматографировали на силикагелевой колонке, используя гексан-этилацетат (80:20) в качестве элюента, получали метил-4-амино-5-метилселенофен-2-карбоксилат (1,6 г, 79%), Т.пл. 66-68°C. 1Н ЯМР (400 МГц, ДМСО-d6): δ 7,57 (1H, с), 4,72 (2H, ушир.с), 3,73 (3H, с), 2,24 (3H, с).
5. 3-Гидрокси-5-трет-бутилселенофен-2-карбоксамид
Стадия a:
3-Хлор-4,4-диметилпент-2-еналь: Оксихлорид фосфора (18,77 мл, 200 ммоль) добавляли по каплям к ДМФА (30,8 мл, 400 ммоль) при 0-5°C в течение 30 мин. Пинаколин (10 г, 100 ммоль) добавляли по каплям к реакционной смеси при той же самой температуре в течение 30 мин. Смесь оставляли доходить до комн.темп. и перемешивали в течение 2 ч. Реакционную смесь выливали в ледяную воду и подщелачивали с помощью аммиачного раствора. Раствор экстрагировали хлороформом (3×200 мл) и объединенный хлороформный слой промывали водой, солевым раствором и сушили над сульфатом натрия. Раствор фильтровали и растворитель упаривали.
Остаток хроматографировали на силикагелевой колонке, используя гексан-EtOAc (97:3) в качестве элюентов, получая продукт в виде масла светло-зеленого цвета (11,7 г, 80%).
Стадия b:
3-Хлор-4,4-диметилпент-2-еноевая кислота: Раствор гидроксида натрия (1,09 г, 27,3 ммоль) в воде (10 мл) добавляли к раствору нитрата серебра (2,32 г, 13,65 ммоль) в воде (15 мл) при температуре, соответствующей охлаждению льдом, в течение 15 мин. 3-Хлор-4,4-диметилпент-2-еналь (1,0 г, 6,825 ммоль) добавляли по каплям при той же самой температуре в течение 15 мин. Реакционную смесь оставляли доходить до комн.темп. и перемешивали в течение 1 ч. Реакционную смесь выливали в ледяную воду и фильтровали через гель hyflowgel для удаления черных частичек. Слой геля hyflowgel промывали горячей водой и охлаждали. Раствор подкисляли с помощью разбавленного HCl и раствор экстрагировали хлороформом (3×100 мл), и объединенный органический слой промывали солевым раствором и сушили над сульфатом натрия. Раствор фильтровали и растворитель упаривали, получая продукт в виде твердого вещества белого цвета (1,0 г, 91%), Т.пл. 146-148°C. 1Н ЯМР (400 МГц, CDCl3): δ 8,02 (1H, ушир.с), 6,11 (1H, с), 1,24 (9H, с); ЖХ-МС (режим определения отрицательных ионов): m/z 161, 163 (M-H)-.
Стадия c:
Метил-3-хлор-4,4-диметилпент-2-еноат: К раствору 3-Хлор-4,4-диметилпент-2-еноевой кислоты (0,8 г, 4,92 ммоль) в метаноле (20 мл) добавляли тионилхлорид (0,714 мл, 9,846 ммоль) по каплям при перемешивании при температуре, соответствующей охлаждению льдом. Реакционную смесь кипятили в течение 2 ч и доводили до комн.темп. Смесь выливали в холодную воду и перемешивали в течение 15 мин. Раствор экстрагировали хлороформом (3×100 мл) и объединенный органический слой промывали водой, солевым раствором, сушили над сульфатом натрия и фильтровали. Растворитель упаривали и остаток хроматографировали на силикагелевой колонке, используя гексан-этилацетат (95:5) в качестве элюентов, получая продукт в виде масла светло-зеленого цвета (750 мг, 87%). 1Н ЯМР (400 МГц, CDCl3): δ 6,08 (1H, с), 3,75 (3H, с), 1,24 (9H, с).
Стадия d:
5-трет-Бутил-3-гидроксиселенофен-2-карбонитрил: К суспензии селенида натрия (5,35 г, 42,49 ммоль) в ДМФА (43 мл) добавляли раствор метил-3-хлор-4,4-диметилпент-2-еноата (7,5 г, 42,49 ммоль) в ДМФА (10 мл) при комн.темп. в течение 5 мин и перемешивали смесь при 60-70°C в течение 2 ч. Затем хлорацетонитрил (2,785 мл, 42,49 ммоль) добавляли по каплям к реакционной смеси и снова перемешивали при 60-70°C в течение 2 ч. Затем раствор метоксида натрия (2,29 г, 42,49 ммоль) в сухом метаноле (26 мл) добавляли по каплям и перемешивание продолжали в течение 1 ч при той же самой температуре. Реакционную смесь выливали в ледяную воду и подкисляли с помощью разбавленного HCl. Раствор экстрагировали хлороформом (3×200 мл) и объединенный хлороформный слой промывали водой, солевым раствором и сушили над сульфатом натрия. Раствор фильтровали и растворитель упаривали. Остаток хроматографировали на силикагелевой колонке, используя гексан-EtOAc (80:20) в качестве элюентов, получая продукт в виде масла красного цвета (7,5 г, 77%). 1Н ЯМР (400 МГц, CDCl3): δ 6,76 (1H, с), 1,35 (9H, с); ЖХ-МС (режим определения отрицательных ионов): m/z 226, 228 (M-H)-.
Стадия e:
5-трет-Бутил-3-гидроксиселенофен-2-карбоксамид: К охлажденному льдом раствору 5-трет-бутил-3-гидроксиселенофен-2-карбонитрила (0,5 г) в трифторуксусной кислоте (2 мл) добавляли H2SO4 (0,5 мл) по каплям в течение 15 мин. Реакционную смесь оставляли доходить до комн.темп. и перемешивали в течение 6 ч. Реакционную смесь выливали в ледяную воду, экстрагировали хлороформом (3×50 мл). Объединенный хлороформный слой промывали водой, солевым раствором и сушили над сульфатом натрия. Раствор фильтровали и растворитель упаривали. Остаток хроматографировали на силикагелевой колонке, используя гексан-EtOAc (75:25) в качестве элюентов, получая продукт в виде твердого вещества коричневого цвета (460 мг, 86%), Т.пл. 164-168°C. 1Н ЯМР (400 МГц, CDCl3): δ 11,53 (1H, ушир.с), 6,81 (1H, с), 5,35 (2H, с), 1,35 (9H, с); ЖХ-МС (режим определения отрицательных ионов): m/z 244, 246 (M-H)-.
Пример 1
Синтез 3-(6,7-диметоксихиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамида (соединение 1)
Стадия a:
3-(6,7-Диметоксихиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид: К раствору 4-хлор-6,7-диметоксихиназолина (500 мг, 2,23 ммоль) в ДМФА (20 мл) добавляли последовательно 3-амино-5-трет-бутилселенофен-2-карбоксамид (820 мг, 3,34 ммоль), порошкообразный NaOH (270 мг, 6,69 ммоль) и каталитическое количество KI при комн.темп., и смесь перемешивали при комн.темп. в течение 16 ч. Смесь выливали в ледяную воду и перемешивали в течение 10 мин. Выделившееся твердое вещество отфильтровывали, промывали водой и сушили (730 мг, 76%). Неочищенный продукт далее хроматографировали и перекристаллизовывали из смеси хлороформ-метанол, получая продукт в виде твердого вещества бледно-желтого цвета, Т.пл. 248-252°C. ИК-спектр (KBr) νmax 3470, 3134, 2960, 1626, 1577, 1469, 1385, 1238, 1211, 1133, 1010, 856, 750 см-1; 1Н ЯМР (400 МГц, ДМСО-d6): δ 12,65 (1H, с, обмениваемый с D2O), 8,74 (1H, с), 8,62 (1H, с), 7,64 (2H, ушир.с, обмениваемый с D2O), 7,36 (1H, с), 7,25 (1H, с), 3,96 (3H, с), 3,95 (3H, с), 1,42 (9H, с); 13C ЯМР (100 МГц, ДМСО-d6): δ 168,3, 167,5, 154,5, 153,8, 152,9, 149,4, 146,9, 146,1, 120,7, 111,8, 108,7, 107,5, 99,8, 55,9, 55,5, 36,5, 32,2; ЖХ-МС (режим определения положительных ионов): m/z 433, 435 (M+H)+.
Стадия b:
HCl соль: К раствору 3-(6,7-диметоксихиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамида (100 мг) в диоксане (10 мл) добавляли HCl в диоксане до тех пор, пока рН-индикаторная бумага окрасится в красный цвет (1 мл) при комн.темп. Раствор перемешивали в течение 30 мин и выделившуюся соль отфильтровывали, промывали диоксаном и сушили, получая продукт в виде твердого вещества желтого цвета (80 мг), Т.пл. 234-238°C. ЖХ-МС (режим определения положительных ионов): m/z 433, 435 (M-HCl+H)+.
Пример 2
Синтез 3-(6,7,8-триметоксихиназолин-4-иламино-5-трет-бутилселенофен-2-карбоксамида (соединение 2)
Стадия a:
3-(6,7,8-Триметоксихиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид: Реакция 4-хлор-6,7,8-триметоксихиназолина с 3-амино-5-трет-бутилселенофен-2-карбоксамидом в присутствии ДМФА/NaOH, как описано в Примере 1, давала возможность получить титульное соединение в виде твердого вещества белого цвета с желтоватым оттенком, Т.пл. 218-220°C. 1Н ЯМР (400 МГц, CDCl3): δ 12,08 (1H, ушир.с, обмениваемый с D2O), 8,87 (1H, с), 8,78 (1H, с), 7,20 (1H, с), 5,49 (2H, ушир.с, обмениваемый с D2O), 4,15 (3H, с), 4,07 (3H, с), 4,06 (3H, с), 1,47 (9H, с); 13C ЯМР (100 МГц, CDCl3): δ 169,0, 168,6, 154,7, 153,1, 152,6, 147,9, 147,6, 146,6, 142,0, 121,7, 112,0, 109,4, 95,9, 62,1, 61,3, 56,1, 37,2, 32,6; ЖХ-МС (режим определения положительных ионов): m/z 463, 465 (M+H)+.
Стадия b:
HCl соль: 3-(6,7,8-Триметоксихиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид обрабатывали HCl в диоксане, как описано в Примере 1, что давало возможность получить HCl соль в виде твердого вещества светло-желтого цвета, Т.пл. 184-186°C.
Пример 3
Синтез 3-(6-(3-морфолинопропокси)-7-метоксихиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамида (соединение 3)
Стадия a:
3-(6-(3-морфолинопропокси)-7-метоксихиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид: Реакция 4-хлор-7-метокси-6-(3-морфолинопропокси)хиназолина с 3-амино-5-трет-бутилселенофен-2-карбоксамидом в присутствии ДМФА/NaOH, как описано в Примере 1, давала возможность получить титульное соединение в виде твердого вещества светло-желтого цвета, Т.пл. 208-212°C. ИК-спектр (KBr) νmax 3438, 3158, 2949, 1618, 1570, 1385, 1228, 1127, 1027, 859 см-1; 1H ЯМР (400 МГц, CDCl3): δ 12,01 (1H, с, обмениваемый с D2O), 8,86 (1H, с), 8,72 (1H, с), 7,38 (1H, с), 7,23 (1H, с), 5,37 (2H, ушир.с), 4,32 (2H, т, J=6,4 Гц), 4,01 (3H, с), 3,73 (4H, т, J=4,6 Гц), 2,65 (2H, т, J=7,2 Гц), 2,51-2,52 (4H, м), 2,14 (2H, пентет, J=7,0 Гц), 1,47 (9H, с); 13C ЯМР (100 МГц, CDCl3): δ 168,9, 168,7, 155,2, 154,5, 153,4, 149,3, 148,2, 147,6, 121,8, 109,8, 109,2, 107,7, 101,4, 67,5, 67,0, 56,2, 55,5, 53,7, 37,2, 32,6, 26,2; ЖХ-МС (режим определения отрицательных ионов): m/z 544, 546 (M-H)-.
Стадия b:
HCl соль: 3-(6-(3-Морфолинопропокси)-7-метоксихиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид обрабатывали HCl в диоксане, как описано в Примере 1, получая HCl соль в виде твердого вещества желтого цвета, Т.пл. 262-264°C. ЖХ-МС (режим определения отрицательных ионов): m/z 544, 546 (M-HCl-H)-.
Пример 4
Синтез [5-(трет-бутил)-2-нитроселенофен-3-ил][7-метокси-6-(3-морфолинопропокси)хиназолин-4-ил]амина (соединение 4)
Стадия a:
[5-(трет-Бутил)-2-нитроселенофен-3-ил][7-метокси-6-(3-морфолинопропокси)хиназолин-4-ил]амин: Реакция 4-хлор-7-метокси-6-(3-морфолинопропокси)хиназолина с 5-(трет-бутил)-2-нитроселенофен-3-иламином в присутствии ДМФА/NaOH, как описано в Примере 1, давала возможность получить титульное соединение в виде твердого вещества желтого цвета, Т.пл. 172-174°C. ИК-спектр (KBr) νmax 3431, 2942, 2860, 1616, 1436, 1309, 1281, 1 197, 1 121, 1025, 863 см-1; 1Н ЯМР (400 МГц, CDCl3): δ 11,67 (1H, с, обмениваемый с D2O), 8,90 (1H, с), 8,83 (1H, с), 7,30 (1H, с), 7,25 (1H, с), 4,30 (2H, т, J=6,2 Гц), 4,03 (3H, с), 3,73 (4H, т, J=4,4 Гц), 2,61 (2H, т, J=7,2 Гц), 2,51 (4H, ушир.с), 2,14 (2H, пентет, J=6,6 Гц), 1,47 (9H, с); 13C ЯМР (100 МГц, CDCl3): δ 176,6, 156,0, 153,4, 152,8, 150,3, 148,4, 144,9, 130,1, 120,1, 109,9, 107,8, 99,8, 67,5, 67,0, 56,3, 55,4, 53,8, 37,9, 32,0, 26,1; ЖХ-МС (режим определения положительных ионов): m/z 548, 550 (M+H)+.
Стадия b:
HCl соль: [5-(трет-Бутил)-2-нитроселенофен-3-ил][7-метокси-6-(3-морфолинопропокси)хиназолин-4-ил]амин обрабатывали HCl в диоксане, как описано в Примере 1, получая HCl соль в виде твердого вещества желтого цвета, Т.пл. 240-242°C; ЖХ-МС (режим определения положительных ионов): m/z 548, 550 (M-HCl+H)+.
Пример 5
Синтез 3-(7-(3-морфолинопропокси)-6-метоксихиназолин-4-иламино-5-трет-бутилселенофен-2-карбоксамида (соединение 5)
Стадия a:
3-(7-(3-Морфолинопропокси)-6-метоксихиназолин-4-иламино-5-трет-бутилселенофен-2-карбоксамид: Реакция 4-хлор-7-(3-морфолинопропокси)-6-метоксихиназолина с 3-амино-5-трет-бутилселенофен-2-карбоксамидом в присутствии ДМФА/NaOH, как описано в Примере 1, давала возможность получить титульное соединение в виде твердого вещества светло-желтого цвета, Т.пл. 216-220°C. ИК-спектр (KBr) νmax 3342, 3120, 2957, 2853, 1633, 1572, 1497, 1457, 1393, 1315, 1234, 1141, 1113, 1021, 903, 854, 798 см-1; 1Н ЯМР (400 МГц, CDCl3): δ 12,06 (1H, с, обмениваемый с D2O), 8,86 (1H, с), 8,71 (1H, с), 7,34 (1H, с), 7,25 (1H, с), 5,57 (2H, с, обмениваемый с D2O), 4,25 (2H, т, J=6,6 Гц), 4,06 (3H, с), 3,74 (4H, т, J=4,4 Гц), 2,59 (2H, т, J=7,2 Гц), 2,51 (4H, ушир.с), 2,10-2,16 (2H, м), 1,46 (9H, с); 13C ЯМР (100 МГц, CDCl3): δ 168,9, 168,6, 154,4, 154,3, 153,3, 150,1, 148,1, 147,4, 121,7, 109,6, 109,2, 108,3, 100,3, 67,3, 66,8, 56,2, 55,3, 53,7, 37,2, 32,6, 25,9; ЖХ-МС (режим определения положительных ионов): m/z 546, 548 (M+H)+.
Стадия b:
HCl соль: 3-(7-(3-Морфолинопропокси)-6-метоксихиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид обрабатывали HCl в диоксане, как описано в Примере 1, получая HCl соль в виде твердого вещества светло-желтого цвета, Т.пл. 262-264°C. ЖХ-МС (режим определения положительных ионов): m/z 546, 548 (M-HCl+H)+.
Пример 6
Синтез 3-(6,7-бис(2-метоксиэтокси)хиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамида (соединение 6)
Стадия a:
3-(6,7-Бис(2-метоксиэтокси)хиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид: Реакция 4-хлор-6,7-бис(2-метоксиэтокси)хиназолина с 3-амино-5-трет-бутилселенофен-2-карбоксамидом в присутствии ДМФА/NaOH, как описано в Примере 1, давала возможность получить титульное соединение в виде твердого вещества светло-желтого цвета, Т.пл. 198-204°C. ИК-спектр (KBr) νmax 3430, 3162, 2961, 1627, 1576, 1474, 1463, 1386, 1321, 1242, 1131, 1092, 937, 859 см-1; 1H ЯМР (400 МГц, CDCl3): δ 12,63 (1H, с, обмениваемый с D2O), 8,67 (1H, с), 8,64 (1H, с), 7,66 (2H, ушир.с, обмениваемый с D2O), 7,40 (1H, с), 7,28 (1H, с), 4,25-1,33 (4H, м), 3,75-3,80 (4H, м), 3,37 (3H, с), 3,36 (3H, с), 1,41 (9H, с); 13C ЯМР (100 МГц, CDCl3): δ 168,2, 167,4, 153,9, 153,8, 153,0, 148,6, 147,0, 146,0, 120,8, 112,1, 108,7, 108,6, 101,5, 70,0 (2C), 68,2, 68,0, 58,4, 58,3, 36,5, 32,2; ЖХ-МС (режим определения положительных ионов): m/z 521, 523 (M+H)+.
Стадия b:
HCl соль: 3-(6,7-бис(2-метоксиэтокси)хиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид обрабатывали HCl в диоксане, как описано в Примере 1, получая HCl соль в виде твердого вещества желтого цвета, Т.пл. 224-226°C. ЖХ-МС (режим определения положительных ионов): m/z 521, 523 (M-HCl+H)+.
Пример 7
Синтез 3-(6-(3-морфолинопропокси)-7-метоксихиназолин-4-иламино)-5-фенилселенофен-2-карбоксамида (соединение 7)
Стадия a:
3-(6-(3-Морфолинопропокси)-7-метоксихиназолин-4-иламино)-5-фенилселенофен-2-карбоксамид: Реакция 4-хлор-7-метокси-6-(3-морфолинопропокси)хиназолина с 3-амино-5-фенилселенофен-2-карбоксамидом в присутствии ДМФА/NaOH, как описано в Примере 1, давала возможность получить титульное соединение в виде твердого вещества желтого цвета, Т.пл. 236-240°C. ИК-спектр (KBr) νmax 34369, 3158, 2935, 1635, 1579, 1387, 1321, 1238, 1216, 1145, 1113, 902, 846 см-1; 1Н ЯМР (400 МГц, ДМСО-d6): δ 12,50 (1H, с), 9,16 (1H, с), 8,65 (1H, с), 7,77 (2H, ушир.с), 7,68-7,70 (2H, м), 7,44-7,52 (3H, м), 7,39 (1H, с), 7,26 (1H, с), 4,20 (2H, ушир.с), 3,96 (3H, с), 3,58 (4H, ушир.с), 2,50 (2H, ушир.с), 2,40 (4H, ушир.с), 2,00 (2H, пентет, J=6,5 Гц); ЖХ-МС (режим определения положительных ионов): m/z 566, 568 (M+H)+.
Стадия b:
HCl соль: 3-(6-(3-Морфолинопропокси)-7-метоксихиназолин-4-иламино)-5-фенилселенофен-2-карбоксамид обрабатывали HCl в диоксане, как описано в Примере 1, получая HCl соль в виде твердого вещества желтого цвета, Т.пл. 266-270°C. ЖХ-МС (режим определения отрицательных ионов): m/z 564, 566 (M-HCl-H)-.
Пример 8
Синтез 3-(6-аминохиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид (соединение 8)
Стадия a:
3-(6-Нитрохиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид: К раствору 4-хлор-6-нитрохиназолин (1,1 г, 5,2 ммоль) в изопропаноле (10 мл) добавляли 5-трет-бутил-3-аминоселенофен-2-карбоксамид (2,58 г, 10,50 ммоль) при комн.темп. и смесь перемешивали в течение 30 мин. Смесь выливали в ледяную воду и перемешивали в течение 15 мин. Выпавшее в осадок твердое вещество отфильтровывали, промывали водой и сушили, получая продукт в виде твердого вещества светло-желтого цвета (2,1 г, 95%), Т.пл. 280-282°C. 1Н ЯМР (400 МГц, ДМСО-d6): δ 13,23 (1H, ушир.с), 9,05 (1H, ушир.с), 8,85 (1H, с), 8,56-8,60 (2H, м), 7,98 (1H, д, J=9,2 Гц), 7,80 (2H, ушир.с), 1,43 (9H, с); ЖХ-МС (режим определения отрицательных ионов): m/z 416, 418 (M-H)-.
Стадия b:
3-(6-Аминохиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид: К суспензии 3-(6-нитрохиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид (1,0 г, 2,38 ммоль) в метаноле (18 мл) добавляли концентрированную HCl (0,24 мл, 2,39 ммоль) при комн.темп. Железный порошок (668 мг, 11,93 ммоль) добавляли медленно в течение 10 мин, затем добавляли хлорид аммония (638 мг, 11,93 ммоль). Воду (5 мл) добавляли к реакционной смеси и перемешивали при температуре кипения в течение 1 ч. Реакционную смесь оставляли доходить до комн.темп. и фильтровали для удаления железа. Раствор выливали в ледяную воду и перемешивали в течение 15 мин. Раствор экстрагировали этилацетатом (3×100 мл) и объединенный органический слой промывали водой, солевым раствором и сушили над сульфатом натрия. Раствор фильтровали и растворитель упаривали. Остаток хроматографировали на силикагелевой колонке, используя гексан-этилацетат (80:20) в качестве элюентов, получая продукт в виде твердого вещества желтого цвета (752 мг, 81%), Т.пл. 160-162°C. ИК-спектр (KBr) νmax 3430, 3340, 3222, 2961, 1631, 1598, 1569, 1390, 1314, 1262, 1185, 1130, 836 см-1; 1Н ЯМР (400 МГц, ДМСО-d6): δ 12,29 (1H, ушир.с, обмениваемый с D2O), 8,76 (1H, с), 8,44 (1H, с), 7,48-7,55 (3H, м), 7,26 (1H, ушир.с), 6,96 (1H, ушир.с), 5,85 (2H, ушир.с, обмениваемый с D2O), 1,40 (9H, с); 13C ЯМР (100 МГц, ДМСО-d6): δ 166,4, 165,5, 151,9, 148,1, 146,6, 144,8, 141,2, 127,6, 122,5, 119,6, 115,0, 110,0, 97,3, 34,9, 30,7; ЖХ-МС (режим определения положительных ионов): m/z 388, 390 (M+H)+.
Стадия c:
HCl соль: 3-(6-Аминохиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид обрабатывали HCl в диоксане, как описано в Примере 1, получая HCl соль в виде твердого вещества желтого цвета, Т.пл. 170-172°C. ЖХ-МС (режим определения положительных ионов): m/z 388, 390 (M-HCl+H)+.
Пример 9
Синтез 3-(6-(2-хлорацетамидо)хиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид (соединение 9)
Стадия a:
3-(6-(2-хлорацетамидо)хиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид: К раствору 3-(6-аминохиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамида (510 мг, 1,31 ммоль) в ТГФ (10 мл) добавляли раствор хлорацетил хлорида (0,105 мл, 1,31 ммоль) в ТГФ (1,0 мл) при комн.темп. Смесь перемешивали при комн.темп. в течение 30 мин (выделялось твердое вещество). Раствор выливали в ледяную воду и перемешивали в течение 15 мин. Выделившееся твердое вещество отфильтровывали, промывали водой и сушили, получая продукт в виде твердого вещества желтого цвета (540 мг, 80%). Этот неочищенный продукт далее хроматографировали и перекристаллизовывали из смеси хлороформ-метанол. Т.пл. 262-264°C; ИК-спектр (KBr) νmax 3437, 3109, 2961, 1706, 1652, 1608, 1575, 1541, 1464, 1386, 1355, 1311, 1241, 1137, 1086, 858, 834, 790 см-1; 1Н ЯМР (400 МГц, ДМСО-d6): δ 12,79 (1H, с, обмениваемый с D2O), 10,83 (1H, с, обмениваемый с D2O), 8,83 (1H, с), 8,73 (1H, с), 8,60 (1H, ушир.с), 8,01-8,03 (1H, м), 7,89 (1H, д, J=8,8 Гц), 7,68 (2H, ушир.с), 4,41 (2H, с), 1,47 (9H, с); 13C ЯМР (100 МГц, ДМСО-d6): δ 167,9, 167,2, 164,9, 154,9, 153,2, 146,3, 145,5, 137,2, 128,7, 126,7, 121,1, 115,2, 113,1, 110,0, 43,3, 36,5, 32,2; ЖХ-МС (режим определения отрицательных ионов): m/z 462, 464, 466 (M-H)-.
Стадия b:
HCl соль: 3-(6-(2-хлорацетамидо)хиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид обрабатывали HCl в диоксане, как описано в Примере 1, получая HCl соль в виде твердого вещества желтого цвета, Т.пл. 276-278°C. ЖХ-МС (режим определения отрицательных ионов): m/z 462, 464, 466 (M-HCl-H)-.
Пример 10
Синтез метил 4-(6-(3-морфолинопропокси)-7-метоксихиназолин-4-иламино)-5-метилселенофен-2-карбоксилата (соединение 10)
Стадия a:
Метил-4-(6-(3-морфолинопропокси)-7-метоксихиназолин-4-иламино)-5-метилселенофен-2-карбоксилат: К раствору 2-амино-4-метокси-5-(3-морфолин-4-илпропокси)бензонитрила (1,0 г, 3,436 ммоль) в толуоле (15 мл) добавляли последовательно уксусную кислоту (0,2 мл) и диметилформамид-диметилацеталь (1,03 мл, 7,216 моль). Реакционную смесь перемешивали при 105°C в течение 3 ч. Во время перемешивания метанол собирали с использованием в оборудовании насадки Дина-Старка. Толуол упаривали под вакуумом, получая полутвердое вещество желтого цвета. Остаток растворяли в уксусной кислоте (20 мл) и добавляли метил-4-амино-5-метилселенофен-2-карбоксилат (750 мг, 4,12 ммоль). Реакционную смесь перемешивали при 125-130°C в течение 3 ч. Реакционную смесь доводили до комн.темп. и выливали в холодную воду, и экстрагировали хлороформом (для удаления примесей). Водный раствор подщелачивали с помощью аммиачного раствора и экстрагировали хлороформом (3×100 мл), и объединенный органический слой промывали водой, солевым раствором и сушили над сульфатом натрия. Раствор фильтровали и растворитель упаривали. Остаток хроматографировали на силикагелевой колонке, используя смесь хлороформ-метанол (95:5) в качестве элюентов, получая неочищенный продукт (1,13 г, 68%). Неочищенный продукт далее перекристаллизовывали из смеси гексан-этилацетат, получая продукт в виде твердого вещества белого цвета с желтоватым оттенком, Т.пл. 172-174°C. ИК-спектр (KBr) νmax 3429, 2949, 1705, 1622, 1586, 1507, 1470, 1430, 1386, 1280, 1237, 1143, 1112, 1069, 1044, 850 см-1; 1Н ЯМР (400 МГц, CDCl3): δ 8,58 (1H, с), 8,11 (1H, с), 7,29 (1H, ушир.с, обмениваемый с D2O), 7,22 (1H, с), 7,18 (1H, с), 4,12 (2H, т, J=6,6 Гц), 3,97 (3H, с), 3,84 (3H, с), 3,71 (4H, т, J=4,4 Гц), 2,54 (2H, т, J=7,0 Гц), 2,46 (7H, ушир.с), 2,07 (2H, пентет, J=6,7 Гц); 13C ЯМР (100 МГц, CDCl3): δ 163,4, 157,2, 155,3, 153,9, 148,9, 147,5, 145,3, 135,4, 134,7, 132,2, 108,6, 107,9, 101,3, 67,6, 66,9, 56,1, 55,3, 53,7, 52,2, 26,1, 15,5; ЖХ-МС (режим определения положительных ионов): m/z 519, 520 (M+H)+.
Стадия b:
HCl соль: Метил 4-(6-(3-морфолинопропокси)-7-метоксихиназолин-4-иламино)-5-метилселенофен-2-карбоксилат обрабатывали HCl в диоксане, как описано в Примере 1, получая HCl соль в виде твердого вещества белого цвета с желтоватым оттенком, Т.пл. 198-200°C. ЖХ-МС (режим определения положительных ионов): m/z 519, 520 (M-HCl+H)+.
Пример 11
Синтез 4-(6-(3-морфолинопропокси)-7-метоксихиназолин-4-иламино)-5-метилселенофен-2-карбоксамида (соединение 11)
Стадия a:
4-(6-(3-Морфолинопропокси)-7-метоксихиназолин-4-иламино)-5-метилселенофен-2-карбоксамид: Раствор соединения 10 (1,0 г) в ТГФ (20 мл) добавляли к охлажденному раствору аммиака (100 мл) и перемешивали при комн.темп. в течение 5 дней. Раствор выливали в ледяную воду и экстрагировали хлороформом (3×100 мл). Объединенный органический слой промывали водой, солевым раствором и сушили над сульфатом натрия. Раствор фильтровали и растворитель упаривали. Остаток хроматографировали на силикагелевой колонке, используя смесь хлороформ-метанол (90:10) в качестве элюентов, получая продукт в виде твердого вещества белого цвета с желтоватым оттенком (690 мг, 71%), который перекристаллизовывали из смеси хлороформ-метанол, Т.пл. 90-92°C. ИК-спектр (KBr) νmax 3342, 2954, 1655, 1588, 1506, 1473, 1391, 1330, 1221, 1115, 1066, 999, 857 см-1; 1Н ЯМР (400 МГц, CDCl3): δ 9,34 (1H, с, обмениваемый с D2O), 8,35 (1H, с), 7,97 (1H, с), 7,81 (1H, ушир.с), 7,82 (1H, с), 7,29 (1H, ушир.с), 7,17 (1H, с), 4,17 (2H, т, J=6,2 Гц), 3,94 (3H, с), 3,58-3,60 (4H, м), 2,52 (2H, ушир.с), 2,38-2,42 (7H, ушир.с), 1,98-2,02 (2H, м); 13C ЯМР (100 МГц, CDCl3): δ 163,7, 157,6, 154,4, 153,3, 148,1, 146,6, 142,5, 139,2, 135,1, 131,5, 108,5, 107,2, 102,9, 67,1, 66,1, 55,8, 54,9, 53,4, 25,8, 15,0; ЖХ-МС (режим определения отрицательных ионов): m/z 502, 504 (M-H)-.
Стадия b:
HCl соль: 4-(6-(3-Морфолинопропокси)-7-метоксихиназолин-4-иламино)-5-метилселенофен-2-карбоксамид обрабатывали HCl в диоксане, как описано в Примере 1, получая HCl соль в виде твердого вещества светло-желтого цвета, Т.пл. 252-254°C. ЖХ-МС (режим определения отрицательных ионов): m/z 502, 504 (M-HCl-H)-.
Пример 12
Синтез 5-трет-бутил-3-(пиридино[2,3-d]пиримидин-4-иламино)селенофен-2-карбоксамида (соединение 12)
Стадия a:
5-трет-Бутил-3-(пиридино-[2,3-d]пиримидин-4-иламино)селенофен-2-карбоксамид: Реакция 4-хлорпиридино[2,3-d]пиримидина с 3-амино-5-трет-бутилселенофен-2-карбоксамид в присутствии ДМФА/NaOH, как описано в Примере 1, давала возможность получить титульное соединение в виде твердого вещества желтого цвета, Т.пл. 222-224°C. ИК-спектр (KBr) νmax 3310, 3180, 2961, 1616, 1572, 1383, 1332, 1316, 1280, 1245, 1226, 1090 см-1; 1Н ЯМР (400 МГц, CDCl3 + ДМСО-d6): δ 9,10 (1H, дд, J=4,4, 1,6 Гц), 8,96 (1H, с), 8,81 (1H, с), 8,55 (1H, дд, J=8,4, 1,6 Гц), 7,54 (1H, дд, J=8,4, 4,4 Гц), 6,50 (2H, ушир.с), 1,48 (9H, с); 13C ЯМР (100 МГц, CDCl3+ДМСО-d6): 168,6, 168,3, 158,6, 157,9, 156,5, 155,8, 146,1, 131,3, 121,9, 121,1, 111,7, 110,3, 36,8, 32,2; ЖХ-МС (режим определения отрицательных ионов): m/z 372, 374 (M-H)-.
Стадия b:
HCl соль: 5-трет-Бутил-3-(пиридино[2,3-d]пиримидин-4-иламино)селенофен-2-карбоксамид обрабатывали HCl в диоксане, как описано в Примере 1, получая HCl соль в виде твердого вещества желтого цвета, Т.пл. 242-244°C. ЖХ-МС (режим определения отрицательных ионов): m/z 372, 374 (M-HCl-H)-.
Пример 13
Синтез 3-(5-этил-6-метилтиофено[2,3-d]пиримидин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид (соединение 13)
Стадия a:
2-Амино-4-этил-5-метилтиофен-3-карбонитрил: К раствору диэтилкетона (3 г, 34,88 ммоль) в этаноле (30 мл) добавляли последовательно малононитрил (2,3 г, 34,88 ммоль), порошкообразную серу (1,1 г, 34,88 ммоль) и триэтиламин (36,4 мл, 348,8 ммоль) при комн.темп. Реакционную смесь кипятили в течение 1 ч. Реакционную смесь оставляли при комнатной температуре и выливали в ледяную холодную воду. Раствор перемешивали в течение 15 мин и экстрагировали этилацетатом (3×100 мл). Объединенный слой EtOAc промывали водой, солевым раствором и сушили над сульфатом натрия. Остаток хроматографировали на силикагелевой колонке, используя гексан-этилацетат (95:5) в качестве элюентов, получая продукт в виде твердого вещества белого цвета с желтоватым оттенком (700 мг, 12%), Т.пл. 100-105°C. 1Н ЯМР (400 МГц, CDCl3): δ 4,54 (2H, ушир.с), 2,48 (2H, кв. J=6,8 Гц), 2,17 (3H, с), 1,15 (3H, т, J=7,6 Гц); ЖХ-МС (режим определения отрицательных ионов): m/z 165 (M-H)-.
Стадия b:
5-Этил-6-(метил-3-гидротиофено[2,3-d]пиримидин-4-он: К охлажденному льдом раствору 2-амино-4-этил-5-метилтиофен-3-карбонитрила (0,5 г) в муравьиной кислоте (5 мл) медленно добавляли концентрированную серную кислоту (2 мл) в течение 10 мин. Смесь перемешивали при 90-100°C в течение 2 ч и оставляли для доведения до комн.темп. Смесь выливали в ледяную воду и перемешивали в течение 15 мин. Выпавшее в осадок твердое вещество отфильтровывали, промывали ледяной холодной водой и сушили. Продукт хроматографировали на силикагелевой колонке, используя гексан-этилацетат (70:30) в качестве элюентов, получая продукт в виде твердого вещества белого цвета с желтоватым оттенком (400 мг, 68%), Т.пл. 182-184°C. 1Н ЯМР (400 МГц, CDCl3): δ 11,97 (1H, ушир.с), 7,96 (1H, с), 2,98 (2H, кв. J=7,5 Гц), 2,44 (3H, с), 1,20 (3H, т, J=7,4 Гц); ЖХ-МС (режим определения отрицательных ионов): m/z 193 (M-H)-.
Стадия c:
4-Хлор-5-этил-6-метилтиофено[2,3-d]пиримидин: Смесь 5-этил-6-метил-3-гидротиофено[2,3-d]пиримидин-4-она (0,5 г), тионилхлорида (5 мл) и каталитического количества ДМФА (0,2 мл) кипятили в течение 1 ч. Растворители удаляли под вакуумом и смесь разбавляли холодной ледяной водой, и перемешивали в течение 10 мин. Раствор экстрагировали хлороформом (3×100 мл) и объединенный хлороформный слой промывали водой, солевым раствором и сушили над сульфатом натрия. Раствор фильтровали и растворитель упаривали. Остаток затирали в гексане, получая продукт в виде твердого вещества темно коричневого цвета (400 мг, 73%), Т.пл. 52-56°C. 1Н ЯМР (400 МГц, CDCl3): δ 8,73 (1H, с), 3,05 (2H, кв. J=7,5 Гц), 2,55 (3H, с), 1,24 (3H, т, J=7,6).
Стадия d:
3-(5-Этил-6-метилтиофено[2,3-d]пиримидин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид: Реакция 4-хлор-5-этил-6-метилтиено[2,3-d]пиримидина с 3-амино-5-трет-бутилселенофен-2-карбоксамидом в присутствии ДМФА/NaOH, как описано в Примере 1, давала возможность получить титульное соединение в виде твердого вещества белого цвета с желтоватым оттенком, Т.пл. 234-236°C. ИК-спектр (KBr) νmax 3332, 3154, 2962, 1665, 1585, 1362, 1221, 1048, 927, 838, 778 см-1; 1Н ЯМР (400 МГц, CDCl3): δ 11,04 (1H, с, обмениваемый с D2O), 8,64 (1H, с), 8,56 (1H, с), 5,34 (2H, ушир.с, обмениваемый с D2O), 3,15 (2H, кв. J=7,5 Гц), 2,49 (3H, с), 1,45 (9H, с), 1,25 (3H, т, J=7,6 Гц); 13C ЯМР (100 МГц, CDCl3): δ 168,0, 167,3, 167,0, 152,7, 151,7, 146,9, 131,0, 130,9, 122,8, 117,7, 110,6, 37,1, 32,5, 20,8, 15,6, 13,4; ЖХ-МС (режим определения отрицательных ионов): m/z 419, 421 (M-H)-.
Стадия e:
HCl соль: 3-(5-Этил-6-метилтиофено[2,3-d]пиримидин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид обрабатывали HCl в диоксане, как описано в Примере 1, получая HCl соль в виде твердого вещества светло-желтого цвета, Т.пл. 258-260°C. ЖХ-МС (режим определения положительных ионов): m/z 421, 423 (M-HCl+H)+.
Пример 14
Синтез 3-(6-(метилтио)тиофено[3,2-d]пиримидин-4-иламино)-5-трет-бутилселенофен-2-карбоксамида (соединение 14)
Стадия a:
6-(Метилтио)тиено[3,2-d]пиримидин-4(3H)-он: Смесь этил-3-амино-5-(метилтио)тиофен-2-карбоксилата (2 г) и формамида (20 мл) перемешивали при 150-160°C в течение 6 ч. Реакционную смесь оставляли доходить до комн.темп. и выливали в ледяную холодную воду. Раствор перемешивали в течение 15 мин. и выпавшее в осадок твердое вещество отфильтровывали, промывали ледяной холодной водой и сушили, получая продукт в виде твердого вещества светло-коричневого цвета (1,2 г, 61%), Т.пл. 216-218°C. 1Н ЯМР (400 МГц, ДМСО-d6): δ 12,45 (1H, с), 8,11 (1H, с), 7,26 (1H, с), 2,68 (3H, с); ЖХ-МС (режим определения отрицательных ионов): m/z 197 (M-H)-.
Стадия b:
4-Хлор-6-(метилтио)тиено[3,2-d]пиримидин: Смесь 6-(метилтио)тиено[3,2-d]пиримидин-4(3H)-она (900 мг) и оксихлорида фосфора (10 мл) кипятили в течение 3 ч. Реакционную смесь доводили до комн.темп. и выливали в ледяную холодную воду, и перемешивали в течение 10 мин. Выпавшее в осадок твердое вещество отфильтровывали, промывали водой и сушили, получая продукт в виде твердого вещества белого цвета с желтоватым оттенком (800 мг, 81%), Т.пл. 138-140°C. 1Н ЯМР (400 МГц, CDCl3): δ 8,87 (1H, с), 7,25 (1H, с), 2,72 (3H, с).
Стадия c:
3-(6-(Метилтио)тиофено[3,2-d]пиримидин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид: Реакция 4-Хлор-6-(метилтио)тиено[3,2-d]пиримидина с 3-амино-5-трет-бутилселенофен-2-карбоксамидом в присутствии ДМФА/NaOH, как описано в Примере 1, давала возможность получить титульное соединение в виде твердого вещества белого цвета с желтоватым оттенком, Т.пл. 260-262°C. ИК-спектр (KBr) νmax 3333, 3110, 2956, 1658, 1603, 1387, 1274, 1089, 849, 788 см-1; 1Н ЯМР (400 МГц, CDCl3): δ 11,38 (1H, с, обмениваемый с D2O), 8,72 (1H, с), 8,71 (1H, с), 7,21 (1H, с), 5,50 (2H, ушир.с, обмениваемый с D2O), 2,67 (3H, с), 1,45 (9H, с); 13C ЯМР (100 МГц, CDCl3): δ 168,9, 168,4, 161,1, 154,8, 152,0, 149,5, 147,5, 122,6, 121,8, 117,0, 109,4, 37,2, 32,6, 18,8; ЖХ-МС (режим определения отрицательных ионов): m/z 423, 425 (M-H)-.
Пример 15
Синтез 3-(6-фенилфуро[2,3-d]пиримидин-4-иламино)-5-трет-бутилселенофен-2-карбоксамида (соединение 15)
Стадия a:
6-Фенилфуро[2,3-d]пиримидин-4(3H)-он: К охлажденному льдом раствору 2-амино-5-фенилфуран-3-карбонитрила (2,0 г) в муравьиной кислоте (20 мл) медленно добавляли уксусный ангидрид (20 мл) в течение 10 мин. Реакционную смесь перемешивали при 0-10°C в течение 1 ч и обеспечивали подъем температуры до 100°C. При этой температуре смесь перемешивали в течение 16 ч и оставляли доходить до комн.темп. Смесь выливали в ледяную воду и перемешивали в течение 15 мин. Выпавшее в осадок твердое вещество отфильтровывали, промывали ледяной холодной водой и сушили, получая продукт в виде твердого вещества коричневого цвета (1,6 г, 69%), Т.пл. 320-322°C. 1Н ЯМР (400 МГц, ДМСО-d6): δ 12,64 (1H, ушир.с), 8,14 (1H, с), 7,86 (2H, д, J=6,4 Гц), 7,30-7,59 (4H, м); ЖХ-МС (режим определения отрицательных ионов): m/z 211 (M-H)-.
Стадия b:
4-Хлор-6-фенилфуро[2,3-d]пиримидин: Смесь 6-фенилфуро[2,3-d]пиримидин-4(3H)-она (1,0 г) и POCl3 (10 мл) перемешивали при 55-65°C в течение 3 ч. Реакционную смесь выливали в ледяную воду и перемешивали в течение 10 мин. Раствор экстрагировали хлороформом (3×100 мл) и объединенный хлороформный слой промывали водным раствором NaHCO3, водой, солевым раствором и сушили над сульфатом натрия. Остаток хроматографировали на силикагелевой колонке, используя гексан-EtOAc (95:5) в качестве элюентов, получая продукт в виде твердого вещества белого цвета (800 мг, 74%), Т.пл. 136-138°C. 1Н ЯМР (400 МГц, CDCl3): δ 8,74 (1H, с), 7,90-7,93 (2H, м), 7,45-7,54 (3H, м), 7,08 (1H, с).
Стадия c:
3-(6-фенилфуро[2,3-d]пиримидин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид: Реакция 4-хлор-6-фенилфуро[2,3-d]пиримидина с 3-амино-5-трет-бутилселенофен-2-карбоксамидом в присутствии ДМФА/NaOH, как описано в Примере 1, давала возможность получить титульное соединение в виде твердого вещества светло-желтого цвета, Т.пл. 280-282°C. ИК-спектр (KBr) νmax 3326, 3188, 2953, 1624, 1386, 1358, 1324, 1283, 1150, 1089, 1016, 921, 822, 778, 755 см-1; 1Н ЯМР (400 МГц, ДМСО-d6): δ 11,94 (1H, с, обмениваемый с D2O), 8,53 (1H, с), 8,50 (1H, с), 7,96 (2H, д, J=7,2 Гц), 7,43-7,55 (5H, м), 7,32 (1H, с), 1,40 (9H, с); 13C ЯМР (100 МГц, ДМСО-d6): δ 167,4, 167,1, 166,2, 153,3, 152,5, 152,3, 144,7, 129,3, 129,1, 128,6, 124,7, 121,1, 113,3, 104,4, 97,4, 36,4, 32,2; ЖХ-МС (режим определения отрицательных ионов): m/z 437, 439 (M-H)-.
Пример 16
Синтез 3-(6-трет-бутилфуро[2,3-d]пиримидин-4-иламино)-5-трет-бутилселенофен-2-карбоксамида (соединение 16)
Стадия a:
6-трет-Бутилфуро[2,3-d]пиримидин-4(3H)-он: К охлажденному льдом раствору 5-трет-бутил-2-аминофуран-3-карбонитрила (2,0 г) в муравьиной кислоте (20 мл) медленно добавляли уксусный ангидрид (20 мл) в течение 10 мин. Реакционную смесь перемешивали при 0-10°C в течение 1 ч и обеспечивали подъем температуры до 100°C. При этой температуре смесь перемешивали в течение 16 ч и оставляли доходить до комн.темп. Смесь выливали в ледяную воду и перемешивали в течение 15 мин. Раствор экстрагировали этилацетатом (3×100 мл) и объединенный органический слой промывали водой, солевым раствором и сушили над сульфатом натрия. Раствор фильтровали и растворитель упаривали. Остаток затирали в гексане и твердое вещество фильтровали, и сушили, получая продукт в виде твердого вещества коричневого цвета (1,1 г, 47%), Т.пл. 198-200°C. 1Н ЯМР (400 МГц, ДМСО-d6): δ 12,46 (1H, ушир.с), 8,31 (1H, с), 6,53 (1H, с), 1,30 (9H, с); ЖХ-МС (режим определения отрицательных ионов): m/z 191 (M-H)-.
Стадия b:
6-трет-Бутил-4-Хлорфуро[2,3-d]пиримидин: Смесь 6-трет-бутилфуро[2,3-d]пиримидин-4(3H)-она (1,0 г) и POCl3 (10 мл) перемешивали при 55-65°C в течение 3 ч. Реакционную смесь выливали в ледяную воду и перемешивали в течение 10 мин. Раствор экстрагировали хлороформом (3×100 мл) и объединенный хлороформный слой промывали водным раствором NaHCO3, водой, солевым раствором и сушили над сульфатом натрия. Раствор фильтровали и растворитель упаривали. Остаток хроматографировали на силикагелевой колонке, используя гексан-EtOAc (90:10) в качестве элюентов, получая продукт в виде твердого вещества белого цвета (800 мг, 73%), Т.пл. 72-74°C. 1Н ЯМР (400 МГц, CDCl3): δ 8,69 (1H, с), 6,48 (1H, с), 1,42 (9H, с).
Стадия c:
3-(6-трет-Бутилфуро[2,3-d]пиримидин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид: Реакция 4-хлор-6-трет-бутилфуро[2,3-d]пиримидина с 3-амино-5-трет-бутилселенофен-2-карбоксамидом в присутствии ДМФА/NaOH, как описано в Примере 1, давала возможность получить титульное соединение в виде твердого вещества белого цвета с желтоватым оттенком, Т.пл. 288-290°C. ИК-спектр (KBr) νmax 3491, 3325 2964, 1593, 1388, 1354, 1314, 1287, 1149, 1119, 1089, 936, 806, 773 см-1; 1Н ЯМР (400 МГц, ДМСО-d6): δ 10,80 (1H, с, обмениваемый с D2O), 8,46 (2H, с), 7,48 (2H, ушир.с, обмениваемый с D2O), 6,41 (1H, с), 1,39 (9H, с), 1,36 (9H, с); 13C ЯМР (100 МГц, ДМСО-d6): δ 167,4, 167,1, 166,0, 164,1, 152,6, 152,3, 144,9, 121,0, 113,1, 103,3, 94,8, 36,4, 32,7, 32,2, 28,23; ЖХ-МС (режим определения отрицательных ионов): m/z 417, 419 (M-H)-.
Пример 17
Синтез метил 4-(5,6-диметил-7H-пирроло[2,3-d]пиримидин-4-иламино)-5-метилселенофен-2-карбоксилата (соединение 17)
Реакция 2-амино-4,5-диметил-1H-пиррол-3-карбонитрила с диметилформамид-диметилацеталем и метил-4-амино-5-метилселенофен-2-карбоксилатом, как описано в Примере 10, давала возможность получить титульное соединение в виде твердого вещества светло-коричневого цвета, Т.пл. 238-240°C. 1Н ЯМР (400 МГц, CDCl3): δ 8,74 (1H, ушир.с, обмениваемый с D2O), 7,95 (1H, с), 7,37 (1H, с), 3,86 (3H, с), 2,43 (3H, с), 2,32 (3H, с), 2,25 (3H, с); ЖХ-МС (режим определения положительных ионов): m/z 363, 365 (M+H)+.
Пример 18
Синтез 3-(6-трет-бутилселенофено[3,2-d]пиримидин-4-иламино)-5-трет-бутилселенофен-2-карбоксамида (соединение 18)
Стадия a:
6-трет-Бутилселенофено[3,2-d]пиримидин-4(3H)-он: К раствору 3-амино-5-(трет-бутил)селенофен-2-карбоксамида (1 г) в муравьиной кислоте (10 мл) медленно добавляли концентрированную серную кислоту (5 мл) в течение 10 мин при комн.темп. Смесь кипятили в течение 1,5 ч и оставляли доходить до комн.темп. Смесь выливали в ледяную воду и подщелачивали аммиачным раствором. Раствор экстрагировали хлороформом (3×200 мл) и объединенный хлороформный слой промывали водой, солевым раствором и сушили над сульфатом натрия. Раствор фильтровали и растворитель упаривали, получая продукт в виде твердого вещества желтого цвета (900 мг, 80%), Т.пл. 240-242°C. 1Н ЯМР (400 МГц, CDCl3): δ 12,61 (1H, ушир.с), 8,16 (1H, с), 7,34 (1H, с), 1,46 (9H, с); ЖХ-МС (режим определения отрицательных ионов): m/z 253, 255 (M-H)-.
Стадия b:
4-Хлор-6-трет-бутилселенофено[3,2-d]пиримидин: Смесь 6-(трет-бутил)-3-гидроселенофено[3,2-d]пиримидин-4-она (550 мг), тионилхлорида (6 мл) и каталитического количества ДМФА (0,5 мл) кипятили в течение 2 ч. Растворители удаляли под вакуумом и смесь разбавляли хлороформом. Снова растворители удаляли под вакуумом и эту процедуру повторяли дважды (твердое вещество желтого цвета). Остаток разбавляли ледяной холодной водой и подщелачивали с помощью 10% водного раствора бикарбоната натрия. Раствор экстрагировали хлороформом (3×100 мл) и объединенный хлороформный слой промывали водой, солевым раствором и сушили над сульфатом натрия. Раствор фильтровали, и растворитель упаривали, получая продукт в виде твердого вещества светло-желтого цвета (520 мг, 88%), Т.пл. 78-80°C. 1Н ЯМР (400 МГц, CDCl3): δ 8,91 (1H, с), 7,51 (1H, с), 1,49 (9H, с).
Стадия c:
3-(6-трет-Бутилселенофено[3,2-d]пиримидин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид: Реакция 4-хлор-6-(трет-бутил)селенофено[3,2-d]пиримидина с 3-амино-5-трет-бутилселенофен-2-карбоксамидом в присутствии ДМФА/NaOH, как описано в Примере 1, давала возможность получить титульное соединение в виде твердого вещества белого цвета, Т.пл. 260-262°C. ИК-спектр (KBr) νmax 3439, 3173, 2960, 1666, 1605, 1564, 1503, 1458, 1381, 1330, 1244, 1086, 1038, 848, 773 см-1; 1Н ЯМР (400 МГц, CDCl3): δ 11,32 (1H, с, обмениваемый с D2O), 8,75 (1H, с), 8,73 (1H, с), 7,37 (1H, с), 5,34 (2H, ушир.с, обмениваемый с D2O), 1,47 (9H, с), 1,46 (9H, с); 13C ЯМР (100 МГц, CDCl3): δ 171,9, 168,8, 168,5, 164,4, 154,8, 147,8, 122,7, 121,6, 118,4, 108,9, 37,3, 37,1, 32,5, 32,4; ЖХ-МС (режим определения положительных ионов): m/z 481, 483, 485 (M+H)+.
Стадия d:
HCl соль: 3-(6-трет-Бутилселенофено[3,2-d]пиримидин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид обрабатывали HCl в диоксане, как описано в Примере 1, получая HCl соль в виде твердого вещества желтого цвета, Т.пл. 212-214°C. ЖХ-МС (режим определения положительных ионов): m/z 481, 483, 485 (M-HCl+H)+.
Пример 19
Синтез 3-(5-этил-6-метилселенофено[2,3-d]пиримидин-4-иламино)-5-трет-бутилселенофен-2-карбоксамида (соединение 19)
Стадия a:
2-Амино-4-этил-5-метилселенофен-3-карбонитрил: К раствору диэтилкетона (2 г, 23,24 ммоль) в этаноле (20 мл) добавляли последовательно малононитрил (1,53 г, 23,24 ммоль), селен порошкообразный (1,86 г, 23,24 ммоль) и триэтиламин (24,24 мл, 232,5 ммоль) при комн.темп. Реакционную смесь кипятили в течение 2 ч. Реакционную смесь оставляли при комнатной температуре и выливали в ледяную холодную воду. Раствор перемешивали в течение 15 мин и экстрагировали этилацетатом (3×100 мл). Объединенный слой EtOAc промывали водой, солевым раствором и сушили над сульфатом натрия. Остаток хроматографировали на силикагелевой колонке, используя гексан-этилацетат (95:5) в качестве элюентов, получая продукт в виде твердого вещества белого цвета с желтоватым оттенком (3,0 г, 60%), Т.пл. 126-128°C. 1Н ЯМР (400 МГц, CDCl3): δ 4,95 (2H, ушир.с), 2,45 (2H, кв. J=7,6 Гц), 2,26 (3H, с), 1,14 (3H, т, J=7,6 Гц); 13C ЯМР (100 МГц, CDCl3): δ 164,2, 137,2, 121,5, 116,6, 91,7, 22,0, 14,3, 14,2; ЖХ-МС (режим определения отрицательных ионов): m/z 211, 213 (M-H)-.
Стадия b:
5-Этил-6-метилселенофено[2,3-d]пиримидин-4(3H)-он: К охлажденному льдом раствору 2-амино-4-этил-5-метилселенофен-3-карбонитрила (0,4 г) в муравьиной кислоте (5 мл) медленно добавляли концентрированную серную кислоту (2 мл) в течение 10 мин. Смесь перемешивали при 90-100°C в течение 1 ч и оставляли доходить до комн.темп. Смесь выливали в ледяную воду и перемешивали в течение 15 мин. Выпавшее в осадок твердое вещество отфильтровывали, промывали ледяной холодной водой и сушили, получая продукт в виде твердого вещества коричневого цвета (320 мг, 71%), Т.пл. 180-182°C. 1Н ЯМР (400 МГц, CDCl3): δ 12,14 (1H, ушир.с), 7,94 (11H, с), 2,98 (2H, кв. J=7,4 Гц), 2,52 (3H, с), 1,18 (3H, т, J=7,4 Гц); ЖХ-МС (режим определения отрицательных ионов): m/z 239, 241 (M-H)-.
Стадия c:
4-Хлор-5-этил-6-метилселенофено[2,3-d]пиримидин: Смесь 5-этил-6-метилселенофено[2,3-d]пиримидин-4(3H)-она (300 мг) и оксихлорида фосфора (5 мл) кипятили в течение 1 ч. Реакционную смесь доводили до комн.темп. и выливали в ледяную холодную воду, и перемешивали в течение 10 мин. Выпавшее в осадок твердое вещество отфильтровывали, промывали водой и сушили, получая продукт в виде твердого вещества коричневого цвета (260 мг, 81%), Т.пл. 58-60°C, 1Н ЯМР (400 МГц, CDCl3): δ 8,68 (1H, с), 3,06 (2H, кв. J=7,5 Гц), 2,62 (3H, с), 1,23 (3H, т, J=7,4 Гц).
Стадия d:
3-(5-Этил-6-метилселенофено[2,3-d]пиримидин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид: Реакция 4-хлор-5-этил-6-метилселенофено[2,3-d]пиримидина с 3-амино-5-трет-бутилселенофен-2-карбоксамидом в присутствии ДМФА/NaOH, как описано в Примере 1, давала возможность получить титульное соединение в виде твердого вещества светло-желтого цвета, Т.пл. 258-260°C. ИК-спектр (KBr) νmax 3321, 3149, 2960, 1666, 1582, 1384, 1356, 1224, 1187, 1129, 1042, 1020, 925, 838, 810 см-1; 1Н ЯМР (400 МГц, CDCl3): δ 10,96 (1H, с, обмениваемый с D2O), 8,51 (1H, с), 8,49 (1H, с), 5,44 (2H, ушир.с, обмениваемый с D2O), 3,13 (2H, кв. J=7,6 Гц), 2,57 (3H, с), 1,44 (9H, с), 1,24 (3H, т, J=7,6 Гц); 13C ЯМР (100 МГц, CDCl3): δ 172,1, 167,9, 167,1, 153,4, 151,2, 146,9, 135,6, 133,4, 122,8, 120,8, 1 10,6, 37,0, 32,6, 21,8, 15,8, 15,3; ЖХ-МС (режим определения отрицательных ионов): m/z 465, 467, 469 (M-H)-.
Стадия e:
HCl соль: 3-(5-Этил-6-метилселенофено[2,3-d]пиримидин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид обрабатывали HCl в диоксане, как описано в Примере 1, получая HCl соль в виде твердого вещества светло-желтого цвета, Т.пл. 278-280°C. ЖХ-МС (режим определения положительных ионов): m/z 467, 469, 471 (M-HCl+H)+.
Пример 20
Синтез 3-(2-(метилтио)тиазоло[4,5-d]пиримидин-7-иламино)-5-трет-бутилселенофен-2-карбоксамида (соединение 20)
Стадия a:
2-(Метилтио)тиазоло[4,5-d]пиримидин-7-(6H)-он: К раствору 4-амино-2-(метилтио)тиазол-5-карбонитрила (800 мг) в муравьиной кислоте (8 мл) добавляли концентрированную серную кислоту (3,2 мл) по каплям в течение 15 мин. Реакционную смесь перемешивали при 90-100°C в течение 1 ч и оставляли доходить до комн.темп. Реакционную смесь выливали в ледяную воду и перемешивали в течение 15 мин. Выпавшее в осадок твердое вещество отфильтровывали, промывали водой и сушили, получая продукт в виде твердого вещества белого цвета (820 мг, 88%), Т.пл. 260-262°C. 1Н ЯМР (400 МГц, ДМСО-d6): δ 12,83 (1H, ушир.с), 8,25 (1H, с), 2,80 (3H, с); ЖХ-МС (режим определения отрицательных ионов): m/z 198 (M-H)-.
Стадия b:
7-Хлор-2-(метилтио)тиазоло[4,5-d]пиримидин: Смесь 2-(метилтио)тиазоло[4,5-d]пиримидин-7-(6H)-она (800 мг) и оксихлорида фосфора (8 мл) кипятили в течение 2 ч. Растворители удаляли под вакуумом и смесь разбавляли хлороформом. Снова растворители удаляли под вакуумом и эту процедуру повторяли дважды (твердое вещество желтого цвета). Остаток разбавляли ледяной холодной водой и подщелачивали с помощью 10% водного раствора бикарбоната натрия. Раствор экстрагировали хлороформом (3×100 мл) и объединенный хлороформный слой промывали водой, солевым раствором и сушили над сульфатом натрия. Раствор фильтровали и растворитель упаривали. Остаток хроматографировали на силикагелевой колонке, используя гексан-этилацетат (95:5) в качестве элюентов, получая продукт в виде твердого вещества белого цвета (750 мг, 86%), Т.пл. 148-150°C. 1Н ЯМР (400 МГц, CDCl3): δ 8,95 (1H, с), 2,90 (3H, с); ЖХ-МС (режим определения положительных ионов): m/z 218, 220 (M+H)+.
Стадия c:
3-(2-(Метилтио)тиазоло[4,5-d]пиримидин-7-иламино)-5-трет-бутилселенофен-2-карбоксамид: Реакция 7-хлор-2-(метилтио)тиазоло[4,5-d]пиримидина с 3-амино-5-трет-бутилселенофен-2-карбоксамидом в присутствии ДМФА/NaOH, как описано в Примере 1, давала возможность получить титульное соединение в виде слегка окрашенного твердого вещества, Т.пл. 280-282°C. 1Н ЯМР (400 МГц, ДМСО-d6): δ 12,16 (1H, ушир.с, обмениваемый с D2O), 8,77 (1H, с), 8,15 (1H, с), 7,61 (2H, ушир.с, обмениваемый с D2O), 2,69 (3H, с), 1,39 (9H, с); ЖХ-МС (режим определения положительных ионов): m/z 426, 428 (M+H)+.
Пример 21
Синтез 3-(N-(6,7-диметоксихиназолин-4-ил)-N-метиламино)-5-трет-бутилселенофен-2-карбоксамида (соединение 21)
К охлажденному льдом раствору соединения 1 (1,0 г, 2,30 ммоль) в ДМФА (15 мл) добавляли последовательно йодметан (0,144 мл, 2,30 ммоль) и K2CO3 (0,63 г, 4,61 ммоль). Реакционную смесь перемешивали при комн.темп. в течение 6 ч, выливали в ледяную холодную воду и перемешивали в течение 10 мин. Раствор экстрагировали EtOAc (3×100 мл) и объединенный слой EtOAc промывали водой, солевым раствором и сушили над сульфатом натрия. Раствор фильтровали и растворитель упаривали. Остаток хроматографировали на силикагелевой колонке, используя хлороформ-метанол (99:1) в качестве элюентов, получая продукт (750 мг, 72%), который перекристаллизовывали из смеси хлороформ-метанол, в виде твердого вещества желтого цвета, Т.пл. 256-258°C. ИК-спектр (KBr) νmax 3210, 2958, 1616, 1528, 1277, 1209, 1057, 1034, 1010, 961, 847, 812, 765 см-1; 1Н ЯМР (400 МГц, ДМСО-d6): δ 8,39 (1H, ушир.с), 8,17 (1H, с), 7,57 (1H, с), 7,52 (1H, с), 7,20 (1H, ушир.с), 6,98 (1H, с), 3,97 (3H, с), 3,86 (3H, с), 3,71 (3H, с), 1,32 (9H, с); 13C ЯМР (100 МГц, ДМСО-d6): δ 165,3, 162,8, 153,7, 153,4, 150,4, 150,2, 148,2, 134,1, 126,1, 123,9, 112,7, 105,7, 98,4, 56,2, 55,7, 36,8, 36,0, 32,2; ЖХ-МС (режим определения положительных ионов): m/z 447, 449 (M+H)+.
Пример 22
Синтез 3-(N-(6-(3-морфолинопропокси)-7-метоксихиназолин-4-ил)-N-метиламино)-5-трет-бутилселенофен-2-карбоксамида (соединение 22)
Стадия a:
3-(N-(6-(3-морфолинопропокси)-7-метоксихиназолин-4-ил)-N-метиламино)-5-трет-бутилселенофен-2-карбоксамид: К охлажденному льдом раствору соединения 3 (800 мг, 1,46 ммоль) в ацетоне (20 мл) добавляли диметилсульфат (0,14 мл, 1,46 ммоль). Реакционную смесь перемешивали при комн.темп. в течение 16 ч, выливали в ледяную холодную воду и перемешивали в течение 10 мин. Раствор экстрагировали EtOAc (3×100 мл) и объединенный слой EtOAc промывали водой, солевым раствором и сушили над сульфатом натрия. Раствор фильтровали и растворитель упаривали. Остаток хроматографировали на силикагелевой колонке, используя хлороформ-метанол (99:1) в качестве элюентов, получая продукт (420 мг, 51%), который перекристаллизовывали из смеси хлороформ-метанол, в виде твердого вещества желтого цвета, Т.пл. 228-230°C. ИК-спектр (KBr) νmax 3424, 2955, 2851, 1616, 1277, 1116, 1055, 1013, 860, 763 см-1; 1Н ЯМР (400 МГц, ДМСО-d6): δ 8,31 (1H, с), 8,17 (1H, с), 7,59 (1H, с), 7,48 (1H, с), 7,24 (1H, ушир.с), 6,70 (1H, ушир.с), 4,08 (2H, т, J=6,2 Гц), 3,97 (3H, с), 3,71 (3H, с), 3,57 (4H, ушир.с), 2,45 (2H, ушир.с), 2,38 (4H, ушир.с), 1,91-1,96 (2H, м), 1,32 (9H, с); ЖХ-МС (режим определения положительных ионов): m/z 560, 562 (M+H)+.
Стадия b:
HCl соль: 3-(N-(6-(3-Морфолинопропокси)-7-метоксихиназолин-4-ил)-N-метиламино)-5-трет-бутилселенофен-2-карбоксамид обрабатывали HCl в диоксане, как описано в Примере 1, получая HCl соль в виде твердого вещества светло-желтого цвета, Т.пл. 254-256°C. ЖХ-МС (режим определения положительных ионов): m/z 560, 562 (M+H-HCl)+.
Пример 23
Синтез 3-(N-(6-(3-морфолинопропокси)-7-метоксихиназолин-4-ил)-N-(2-хлорэтил)амино)-5-трет-бутилселенофен-2-карбоксамида (соединение 23)
Стадия a:
3-(N-(6-(3-Морфолинопропокси)-7-метоксихиназолин-4-ил)-N-(2-хлорэтил)амино)-5-трет-бутилселенофен-2-карбоксамид: К раствору соединения 3 (800 мг, 1,46 ммоль) в ДМФА (15 мл) добавляли карбонат калия (400 нг, 2,92 ммоль), затем по каплям прибавляли бромхлорэтан (0,122 г, 1,46 ммоль) в течение 5 мин при комн.темп. Реакционную смесь перемешивали в течение 16 ч, выливали в ледяную холодную воду и перемешивали в течение 10 мин. Раствор экстрагировали хлороформом (3×100 мл) и объединенный хлороформный слой промывали водой, солевым раствором и сушили над сульфатом натрия. Раствор фильтровали и растворитель упаривали. Остаток хроматографировали на силикагелевой колонке, используя хлороформ-метанол (96:4) в качестве элюентов, получая продукт в виде твердого вещества желтого цвета, который перекристаллизовывали из смеси хлороформ-гексан (450 мг, 51%), Т.пл. 198-200°C. 1Н ЯМР (400 МГц, CDCl3): δ 8,38 (1H, ушир.с), 7,82 (1H, с), 7,77 (1H, с), 7,39 (1H, с), 6,55 (1H, с), 5,66 (1H, ушир.с), 4,30 (2H, ушир.с), 4,17 (2H, т, J=6,4 Гц), 3,98 (3H, с), 3,86 (2H, т, J=5,6 Гц), 3,72 (4H, ушир.с), 2,52 (2H, т, J=6,6 Гц), 2,47 (4H, ушир.с), 2,04-2,07 (2H, м), 1,38 (9H, с); 13C ЯМР (100 МГц, ДМСО-d6): δ 164,4, 162,3, 153,0, 152,5, 149,8, 149,4, 146,8, 131,8, 125,6, 123,0, 112,0, 106,4, 97,7, 66,1, 65,4, 55,7, 54,0, 52,6, 49,1, 41,7, 35,3, 31,4, 24,9; ЖХ-МС (режим определения положительных ионов): m/z 608, 610, 612 (M+H)+.
Стадия b:
HCl соль: 3-(N-(6-(3-Морфолинопропокси)-7-метоксихиназолин-4-ил)-N-(2-хлорэтил)амино)-5-трет-бутилселенофен-2-карбоксамид обрабатывали HCl в диоксане, как описано в Примере 1, получая HCl соль в виде твердого вещества светло-желтого цвета, Т.пл. 190-192°C; ЖХ-МС (режим определения положительных ионов): m/z 608, 610, 612 (M-HCl+H)+.
Пример 24
Синтез 3-(6,7-диметокси-2-метилхиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамида (соединение 24)
Стадия a:
6,7-Диметокси-2-метилхиназолин-4(3H)-он: Сухой газообразный HCl пропускали (до того момента, как будет наблюдаться прозрачный раствор) через раствор метил-2-амино-4,5-диметоксибензоата (3,0 г, 14,21 ммоль) в ацетонитриле (72 мл) в течение 30 мин при комн.темп. Реакционную смесь кипятили 3 ч и доводили до комн.темп. Выпавшее в осадок твердое вещество отфильтровывали, и твердое вещество растворяли в воде. Раствор нейтрализовали с помощью 10% водного раствора NaHCO3 и выпавшее в осадок твердое вещество отфильтровывали, промывали ледяной холодной водой и сушили, получая продукт в виде твердого вещества белого цвета с желтоватым оттенком (2,5 г, 80%), Т.пл. 310-312°C. 1Н ЯМР (400 МГц, ДМСО-d6): δ 7,40 (1H, с), 7,06 (1H, с), 3,88 (3H, с), 3,85 (3H, с), 2,31 (3H, с); ЖХ-МС (режим определения положительных ионов): m/z 221 (M+H)+.
Стадия b:
4-Хлор-6,7-диметокси-2-метилхиназолин: Смесь 6,7-диметокси-2-метилхиназолин-4(3H)-она (1,0 мг) и оксихлорида фосфора (20 мл) кипятили в течение 3 ч. Реакционную смесь доводили до комн.темп. и выливали в ледяную холодную воду, и перемешивали в течение 10 мин. Раствор экстрагировали хлороформом (3×100 мл) и объединенный слой CHCl3 промывали водой, солевым раствором и сушили над сульфатом натрия. Раствор фильтровали, и растворитель упаривали, получая продукт в виде твердого вещества желтого цвета (1,0 г, 92%). Т.пл. 182-184°C. 1Н ЯМР (400 МГц, CDCl3): δ 7,36 (1H, с), 7,30 (1H, с), 4,06 (6H, с), 2,81 (3H, с); ЖХ-МС (режим определения положительных ионов): m/z 239, 241 (M+H)+.
Стадия c:
3-(6,7-Диметокси-2-метилхиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид: Реакция 4-хлор-6,7-диметокси-2-метилхиназолина с 3-амино-5-трет-бутилселенофен-2-карбоксамида в присутствии ДМФА/NaOH, как описано в Примере 1, давала возможность получить титульное соединение в виде твердого вещества белого цвета с желтоватым оттенком, Т.пл. 266-268°C. 1Н ЯМР (400 МГц, CDCl3): δ 11,95 (1H, ушир.с, обмениваемый с D2O), 8,97 (1H, с), 7,32 (1H, с), 7,19 (1H, с), 5,38 (2H, ушир.с, обмениваемый с D2O), 4,08 (3H, с), 4,01 (3H, с), 2,70 (3H, с), 1,47 (9H, с); 13C ЯМР (100 МГц, CDCl3): δ 168,63, 168,60, 162,1, 154,8, 154,5, 149,2, 148,2, 148,1, 121,9, 109,0, 107,4, 107,1, 100,1, 56,2, 56,1, 37,1, 32,5, 26,3; ЖХ-МС (режим определения отрицательных ионов): m/z 445, 447 (M-H)-.
Стадия d:
HCl соль: 3-(6,7-Диметокси-2-метилхиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид обрабатывали HCl в диоксане, как описано в Примере 1, получая HCl соль в виде твердого вещества светло-желтого цвета, Т.пл. 282-284°C. ЖХ-МС (режим определения отрицательных ионов): m/z 445, 447 (M-HCl-H)-.
Пример 25
Синтез метил-4-(6,7-диметокси-2-метилхиназолин-4-иламино)-5-метилселенофен-2-карбоксилата (соединение 25)
Стадия a:
Метил-4-(6,7-диметокси-2-метилхиназолин-4-иламино)-5-метилселенофен-2-карбоксилат: К раствору 4-хлор-6,7-диметокси-2-метилхиназолин (из Примера 24; 700 мг, 2,93 ммоль) в изопропаноле (20 мл) добавляли 4-амино-5-метилселенофен-2-карбоксилат (1,3 г, 5,8 ммоль) при комн.темп. и смесь перемешивали при комн.темп. в течение 16 ч. Смесь выливали в ледяную воду и перемешивали в течение 10 мин. Раствор экстрагировали EtOAc (3×100 мл) и объединенный слой промывали водой, солевым раствором и сушили над сульфатом натрия. Раствор фильтровали и растворитель упаривали. Остаток хроматографировали на силикагелевой колонке, используя смесь хлороформ-метанол (98:2) в качестве элюентов, получая продукт (700 мг, 57%) в виде твердого вещества коричневого цвета, Т.пл. 200-204°C. 1Н ЯМР (400 МГц, CDCl3): δ 8,18 (1H, с), 7,19 (1H, с), 7,00 (1H, с), 3,98 (3H, с), 3,92 (3H, с), 3,85 (3H, с), 2,58 (3H, с), 2,46 (3H, с); 13C ЯМР (100 МГц, CDCl3): δ 163,5, 162,8, 156,9, 154,8, 148,7, 148,2, 144,0, 135,3, 135,1, 131,8, 107,3, 106,4, 99,8, 56,2, 56,1, 52,2, 26,2, 15,5; ЖХ-МС (режим определения положительных ионов): m/z 420, 422 (M+H)+.
Стадия b:
HCl соль: Метил 4-(6,7-диметокси-2-метилхиназолин-4-иламино)-5-метилселенофен-2-карбоксилат обрабатывали HCl в диоксане, как описано в Примере 1, получая HCl соль в виде твердого вещества светло-желтого цвета, Т.пл. 276-280°C. ЖХ-МС (режим определения положительных ионов): m/z 420, 422 (M-HCl+H)+.
Пример 26
Синтез 3-(6-(3-морфолинопропокси)-7-метокси-2-метилхиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамида (соединение 26)
Стадия a:
6-(3-Морфолинопропокси)-7-метокси-2-метилхиназолин-4(3H)-он: Сухой газообразный HCl пропускали (до момента наблюдения прозрачного раствора) через раствор метил-5-(3-морфолинопропокси)-2-амино-4-метоксибензоата (1,0 г, 3,0 ммоль) в ацетонитриле (16 мл) в течение 30 мин при комн.темп. Реакционную смесь кипятили в течение 3 ч и доводили до комн.темп. Раствор выливали в ледяную воду и подщелачивали с помощью аммиачного раствора. Раствор экстрагировали EtOAc (3×100 мл) и объединенный слой EtOAc промывали водой, солевым раствором и сушили над сульфатом натрия. Раствор фильтровали и растворитель упаривали, получая продукт в виде твердого вещества белого цвета с желтоватым оттенком (1,0 г, 98%), Т.пл. 236-238°C. 1Н ЯМР (400 МГц, CDCl3): δ 11,60 (1H, ушир.с), 7,59 (1H, с), 7,08 (1H, с), 4,23 (2H, т, J=6,6 Гц), 3,97 (3H, с), 3,73 (4H, т, J=4,6 Гц), 2,56 (2H, т, J=7,0 Гц), 2,56 (3H, с), 2,48 (4H, т, J=4,4 Гц), 2,09 (2H, пентет, J=6,8 Гц); ЖХ-МС (режим определения положительных ионов): m/z 334 (M+H)+.
Стадия b:
6-(3-Морфолинопропокси)-4-хлор-7-метокси-2-метилхиназолин: Смесь 6-(3-морфолинопропокси)-7-метокси-2-метилхиназолин-4(3H)-она (600 мг), тионилхлорида (20 мл) и ДМФА (0,5 мл) кипятили в течение 3 ч. Реакционную смесь доводили до комн.темп. и выливали в ледяную холодную воду, и перемешивали в течение 10 мин. Раствор подщелачивали аммиачным раствором и экстрагировали хлороформом (3×100 мл). Объединенный слой CHCl3 промывали водой, солевым раствором и сушили над сульфатом натрия. Раствор фильтровали и растворитель упаривали, получая продукт в виде твердого вещества желтого цвета (500 мг, 79%), Т.пл. 116-118°C. 1Н ЯМР (400 МГц, CDCl3): δ 7,36 (1H, с), 7,25 (1H, с), 4,25 (2H, т, J=6,6 Гц), 4,03 (3H, с), 3,73 (4H, т, J=4,6 Гц), 2,79 (3H, с), 2,58 (2H, т, J=7,2 Гц), 2,49 (4H, т, J=4,4 Гц), 2,12 (2H, пентет, J=6,8 Гц); ЖХ-МС (режим определения положительных ионов): m/z 352, 354 (M+H).
Стадия c:
3-(6-(3-Морфолинопропокси)-7-метокси-2-метилхиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид: Реакция 6-(3-морфолинопропокси)-4-Хлор-7-метокси-2-метилхиназолина с 3-амино-5-трет-бутилселенофен-2-карбоксамидом в присутствии ДМФА/NaOH, как описано в Примере 1, давала возможность получить титульное соединение в виде твердого вещества коричневого цвета, Т.пл. 204-206°C. 1Н ЯМР (400 МГц, CDCl3): δ 11,92 (1H, ушир.с), 8,95 (1H, с), 7,34 (1H, с), 7,18 (1H, с), 5,37 (2H, ушир.с), 4,29 (2H, т, J=6,0 Гц), 3,98 (3H, с), 3,73 (4H, т, J=4,4 Гц), 2,70 (3H, с), 2,61 (2H, т, J=7,2 Гц), 2,50 (4H, ушир.с), 2,11-2,14 (2H, м), 1,47 (9H, с); ЖХ-МС (режим определения положительных ионов): m/z 560, 562 (M+H)+.
Стадия d:
HCl соль: 3-(6-(3-Морфолинопропокси)-7-метокси-2-метилхиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид обрабатывали HCl в диоксане, как описано в Примере 1, получая HCl соль в виде твердого вещества светло-желтого цвета, Т. пл. 236-238°C.
Пример 27
Синтез 3-(6,7-Диметокси-2-(N,N-диметиламинометил)-хиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамида (соединение 27)
Стадия а:
2-(Хлорметил)-6,7-диметоксихиназолин-4-(3Н)-он: Сухой газообразный HCl пропускали (до момента наблюдения прозрачного раствора) через раствор метил-2-амино-4,5-диметоксибензоата (1,0 г, 4,73 ммоль) в хлорацетонитриле (34 мл) в течение 30 мин при комн.темп. Реакционную смесь кипятили в течение 1 ч и доводили до комн.темп. Выпавшее в осадок твердое вещество отфильтровывали, и твердое вещество растворяли в воде. Раствор нейтрализовали с помощью 10% водного раствора NaHCO3 и выпавшее в осадок твердое вещество отфильтровывали, промывали ледяной холодной водой и сушили, получая продукт в виде твердого вещества белого цвета с желтоватым оттенком (950 мг, 79%). Т.пл. 268-272°C. 1Н ЯМР (400 МГц, CDCl3): δ 12,41 (1Н, с), 7,45 (1Н, с), 7,17 (1Н, с), 4,52 (2Н, с), 3,91 (3Н, с), 3,88 (3Н, с); ЖХ-МС (режим определения положительных ионов): m/z 277, 279 (M+Na)+.
Стадия b:
2-((Диметиламино)метил)-6,7-диметоксихиназолин-4-(3Н)-он: К раствору 2-(хлорметил)-6,7-диметоксихиназолин-4-(3Н)-она (100 мг, 0,392 ммоль) в ДМФА (5 мл) добавляли диметиламин (0,13 мл, 1,176 ммоль) при комн.темп. Реакционную смесь перемешивали при 70-80°C в течение 2 ч и оставляли доходить до комн.темп. Реакционную смесь выливали в ледяную воду и экстрагировали хлороформом (3×200 мл). Объединенный органический слой промывали водой, солевым раствором и сушили над сульфатом натрия. Раствор фильтровали и растворитель упаривали, получая продукт в виде твердого вещества белого цвета с желтоватым оттенком (80 мг, 78%), Т.пл. 210-212°C. 1Н ЯМР (400 МГц, CDCl3): δ 7,61 (1Н, с), 7,08 (1Н, с), 4,00 (3Н, с), 3,99 (3Н, с), 3,50 (2Н, с), 2,37 (6Н, с); ЖХ-МС (режим определения положительных ионов): m/z 264 (М+Н)+.
Стадия с:
(4-Хлор-6,7-диметоксихиназолин-2-ил)-N,N-диметилметанамин:
Смесь 2-((диметиламино)метил)-6,7-диметоксихиназолин-4-(3Н)-она (100 мг) и оксихлорида фосфора (10 мл) кипятили в течение 2 ч. Избыток POCl3 упаривали под вакуумом и реакционную смесь доводили до комн.темп. Смесь выливали в ледяную воду и подщелачивали с помощью водного аммиачного раствора. Раствор экстрагировали хлороформом (3×100 мл) и объединенный слой СНС13 промывали водой, солевым раствором и сушили над сульфатом натрия. Раствор фильтровали и растворитель упаривали, получая продукт в виде твердого вещества белого цвета с желтоватым оттенком (100 мг, 93%), Т.пл. 78-80°C. 1Н ЯМР (400 МГц, CDCl3): δ 7,41 (1Н, с), 7,38 (1Н, с), 4,05 (6Н, с), 3,82 (2Н, с), 2,42 (6Н, с); ЖХ-МС (режим определения положительных ионов): m/z 282, 284 (М+Н)+.
Стадия d:
3-(6,7-Диметокси-2-(N,N-диметиламинометил)-хиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид: Реакция (4-хлор-6,7-диметоксихиназолин-2-ил)-N,N-диметилметанамина с 3-амино-5-трет-бутилселенофен-2-карбоксамидом в присутствии ДМФА/NaOH, как описано в Примере 1, давала возможность получить титульное соединение в виде твердого вещества белого цвета с желтоватым оттенком, Т.пл. 186-190°C. 1Н ЯМР (400 МГц, CDCl3): δ 12,02 (1Н, с, обмениваемый с D2O), 9,03 (1Н, с), 7,32 (1Н, с), 7,31 (1Н, с), 5,60 (2Н, с, обмениваемый с D2O), 4,07 (3Н, с), 4,01 (3Н, с), 3,73 (2Н, с), 2,44 (6Н, с), 1,46 (9Н, с); 13С ЯМР (100 МГц, CDCl3): δ 168,7, 168,6, 161,8, 154,7, 154,5, 149,5, 148,2, 148,1, 122,1, 109,0, 108,0, 107,7, 100,0, 66,6, 56,2, 56,1, 45,9, 37,1, 32,5; ЖХ-МС (режим определения положительных ионов): m/z 490, 492 (М+Н)+.
Стадия е:
HCl соль: 3-(6,7-Диметокси-2-(N,N-диметиламинометил)-хиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид обрабатывали HCl в диоксане, как описано в Примере 1, получая НС1 соль в виде твердого вещества светло-желтого цвета, Т. пл. 226-228°C. ЖХ-МС (режим определения положительных ионов): m/z 490, 492 (М-HCl+Н)+.
Пример 28
Синтез 3-(2-(4-хлорфенил)-6,7-диметоксихиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид (соединение 28)
Стадия а:
2-((4-Хлорфенилкарбониламино)-4,5-диметоксибензамид: К раствору 2-амино-4,5-диметоксибензамида (2,0 г, 10,47 ммоль) в ТГФ (15 мл) и триэтиламине (3 мл, 20,91 моль) добавляли раствор
4-хлорбензоилхлорида (2,2 г, 12,57 моль) в ТГФ (5,0 мл) при комн.темп. в течение 10 мин. Реакционную смесь перемешивали при комн.темп. 16 ч. Раствор выливали в ледяную воду и перемешивали в течение 10 мин. Выделившееся твердое вещество отфильтровывали, промывали ледяной холодной водой и сушили до получения продукта в виде твердого вещества светло-желтого цвета (2,9 г, 85%), Т.пл. 120-122°C, 1Н ЯМР (400 МГц, ДМСО-d6): δ 13,38 (1H, с), 8,48 (1H, ушир.с), 8,33 (1H, ушир.с), 7,94 (2H, д, J=8,0 Гц), 7,66 (1H, с), 7,65 (2H, д, J=8,0 Гц), 7,46 (1H, с), 3,84 (3H, с), 3,81 (3H, с); ЖХ-МС (режим определения отрицательных ионов): m/z 333, 335 (M-H)-.
Стадия b:
2-(4-Хлорфенил)-6,7-диметоксихиназолин-4(3H)-он: К раствору 2-((4-хлорфенил)карбониламино)-4,5-диметоксибензамида (1,0 г, 2,99 ммоль) в этаноле (10 мл) добавляли водный раствор NaOH (15 мл) при комн.темп. в течение 10 мин. Реакционную смесь кипятили в течение 10 мин и оставляли доходить до комн.темп. Смесь выливали в ледяную воду и перемешивали в течение 10 мин. EtOAc (20 мл) добавляли к раствору и перемешивали в течение 5 мин. Выделившееся твердое вещество отфильтровывали, промывали ледяной холодной водой и сушили до получения продукта в виде твердого вещества белого цвета (900 мг, 95%), Т.пл. >360°C. 1Н ЯМР (400 МГц, ДМСО-d6): δ 12,47 (1H, с), 8,19 (2H, д, J=8,6 Гц), 7,62 (2H, д, J=8,6 Гц), 7,50 (1H, с), 7,23 (1H, с), 3,94 (3H, с), 3,90 (3H, с); ЖХ-МС (режим определения положительных ионов): m/z 317, 319 (M+H)+.
Стадия c:
4-Хлор-2-(4-Хлорфенил)-6,7-диметоксихиназолин: Смесь 2-(4-хлорфенил)-6,7-диметоксихиназолин-4(3H)-она (200 мг), тионилхлорида (10 мл) и ДМФА (0,3 мл) кипятили в течение 2 ч. Растворители удаляли под вакуумом. Смесь выливали в ледяную воду и перемешивали в течение 10 мин. Раствор подщелачивали аммиаком и перемешивали в течение 5 мин. Раствор экстрагировали хлороформом (3×100 мл) и объединенный хлороформный слой промывали водой, солевым раствором и сушили над сульфатом натрия. Раствор фильтровали и растворитель упаривали, получая продукт в виде твердого вещества желтого цвета (180 мг, 86%), Т.пл. 204-206°C. 1H ЯМР (400 МГц, ДМСО-d6): δ 8,47 (2H, д, J=8,4 Гц), 7,66 (2H, д, J=8,4 Гц), 7,52 (1H, с), 7,44 (1H, с), 4,08 (3H, с), 4,05 (3H, с).
Стадия d:
3-(2-(4-Хлорфенил)-6,7-диметоксихиназолин-4-иламино)-5-трет-бутилселенофен-2-карбоксамид: Реакция 4-хлор-2-(4-хлорфенил)-6,7-диметоксихиназолина с 3-амино-5-трет-бутилселенофен-2-карбоксамидом в присутствии ДМФА/NaOH, как описано в Примере 1, давала возможность получить титульное соединение в виде твердого вещества белого цвета, Т.пл. 268-270°C. 1Н ЯМР (400 МГц, CDCl3): δ 12,03 (1H, с, обмениваемый с D2O), 9,05 (1H, с), 8,49 (2H, д, J=8,4 Гц), 7,45 (2H, д, 7=8,4 Гц), 7,37 (1H, с), 7,32 (1H, с), 5,37 (2H, с, обмениваемый с D2O), 4,11 (3H, с), 4,06 (3H, с), 1,52 (9H, с); 13C ЯМР (100 МГц, CDCl3): δ 168,6, 168,5, 158,1, 155,0, 154,8, 149,9, 148,5, 148,1, 137,7, 136,0, 129,4, 128,5, 122,0, 109,3, 108,4, 108,0, 100,3, 56,3, 56,2, 37,3, 32,7; ЖХ-МС (режим определения отрицательных ионов): m/z 541, 543, 545 (M-H)-.
Пример 29
Синтез 3-(6,7-диметоксихиназолин-4-илокси)-5-трет-бутилселенофен-2-карбоксамид (соединение 29)
К раствору 4-хлор-6,7-диметоксихиназолина (200 мг, 0,89 ммоль) в ДМФА (5 мл) добавляли последовательно 5-трет-бутил-3-гидроксиселенофен-2-карбоксамид (220 мг, 0,89 ммоль), порошкообразный NaOH (147 мг, 3,568 ммоль) и каталитическое количество KI при комн.темп., и смесь перемешивали при комн.темп. в течение 3 ч. Смесь выливали в ледяную воду, нейтрализовали с помощью разбавленного HCl и перемешивали в течение 15 мин. Выпавшее в осадок твердое вещество отфильтровывали, промывали водой и сушили. Неочищенный продукт хроматографировали на силикагелевой колонке, используя хлороформ-метанол (95:5) в качестве элюентов, получая продукт в виде твердого вещества желтого цвета (245 мг, 63%), Т.пл. 220-224°C. 1Н ЯМР (400 МГц, CDCl3): δ 15,16 (1H, ушир.с, обмениваемый с D2O), 13,63 (1H, ушир.с, обмениваемый с D2O), 8,17 (1H, с), 7,51 (1H, с), 7,21 (1H, с), 6,87 (1H, с), 4,05 (6H, с), 1,38 (9H, с); 13C ЯМР (100 МГц, CDCl3): δ 175,5, 172,0, 164,8, 156,6, 155,1, 150,7, 145,9, 139,9, 118,7, 113,1, 112,7, 108,4, 103,3, 56,5, 56,3, 37,1, 32,2; ЖХ-МС (режим определения положительных ионов): m/z 434, 436 (M+H)+.
Противораковая активность
Пример 30
Анализ клеточной пролиферации на основе использования MTT-теста: анализ клеточной пролиферации на основе включения MTT [3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолий бромид] осуществляли с использованием стандартной методики. Цитотоксическую активность тестируемых соединений (соединение №№ 1-29) определяли как в клетках A549 карциномы легкого человека, так и в клетках HT29 карциномы толстой и прямой кишки человека, так и в клетках DU145 карциномы предстательной железы человека, так и в клетках MDA-MB-231 карциномы молочной железы человека (отрицательный результат на экстрогеновый рецептор), так и в клетках HeLa карциномы шейки матки человека посредством использования комплекта МТТ тестирования клеточной пролиферации MTT cell proliferation assay kit (Roche Applied Sciences, Germany). Тестирование осуществляли в соответствии с инструкциями, предоставленными производителем. В кратком изложении, одинаковое число клеток высевали в 96-луночные плоскодонные планшеты и инкубировали с 4-селенофениламинопиримидиновыми соединениями формулы (I) или с гефитинибом (Iressa) в разных концентрациях в течение трехдневного периода времени. В заполненные контрольной культурой лунки помещали только максимум 0,5% ДМСО. После этого 0,5 мг/мл MTT реагента добавляли в каждую лунку и микропланшет инкубировали еще в течение 4 ч при 37°C в присутствии 5% CO2. На конечной стадии клетки солюбилизировали посредством добавления солюбилизирующего раствора и оставляли для инкубации при 37°C на ночь. После полной солюбилизации кристаллов формазана снимали показания абсорбции при 540 нм в считывающем устройстве для микропланшетов (BioRad, USA). Результаты (средняя величина OD ± SD), полученные с учетом данных для четырех одинаковых лунок, использовали для расчетов по определению ингибирования клеточной пролиферации (50% от ингибирующей концентрации, IC50) тестируемыми соединениями.
Определение активности ингибирования клеточной пролиферации для соединений осуществляли двумя этапами - (1) Скрининг, и (2) Определение половины максимальной ингибирующей концентрации (IC50). На этапе скрининга клетки обрабатывали соединениями в трех различных концентрациях, например, 1, 5 и 10 мкг/мл. После этого лучшие по активности тестируемые соединения отбирали для определения IC50. Способности к ингибированию клеточной пролиферации для тестируемых соединений (1-29) при 10 мкг/мл (наивысшая дозировка, протестированная при скрининговых испытаниях) и значения IC50 для различных клеточных линий суммированы в Таблице 1. Результаты представлены в микромолярных концентрациях тестированных соединений. Активности ингибирования клеточной пролиферации для Гефитиниба (Iressa) представлены для сравнения.
|
Далее, логически основываясь на том, что наивысшие антиклеточнопролиферативные активности в отношении клеток A549, DU145 и HT-29 показали два соединения, а именно, соединение 21 и соединение 27, они были выбраны для дальнейших исследований их ингибирующей активности клеточной пролиферации некоторых других раковых клеток, таких как клетки DU145 рака предстательной железы человека или клетки MDA-MB-231 карциномы молочной железы человека (отрицательный результат на экстрогеновый рецептор), или клетки HeLa карциномы шейки матки человека (Таблица 2).
Активности ингибирования клеточной пролиферации для Гефитиниба (Iressa) представлены для сравнения.
|
Пример 31
Тестирование формирования эндотелиальных капилляров in vitro
Исследования формирования капилляров in vitro проводили на эндотелиальных клетках пупочной вены человека (Human umbilical vein endothelial cells (HUVEC)), культивируемых на 10 мг/мл экстракте базальной мембраны (BME-Cultrex®, R&D Systems, USA) в чашке Петри. Четыреста микролитров Cultrex наносили как покрытие при 4°C в каждую лунку 24-луночного культурального планшета и оставляли для гелеобразования при 37°C в течение 1 ч. HUVECs высевали на планшет с плотностью 1×105 клеток на лунку с 400 мкл среды EGM-2 (Lonza Walkersville Inc. Walkersville, MD). Клетки затем обрабатывали либо 10 нг/мл только одним рекомбинантным человеческим фактором роста фибробластов (Human recombinant Fibroblast Growth Factor (FGF, R&D Systems, Minneapolis, MN)), либо одновременно с ним соединением 27 в различных концентрациях в течение 16 часов. В заполненные контрольной культурой лунки помещали только 0,1% ДМСО. Изображения были получены с помощью микроскопа Nikon Eclipse TS 100 microscope, оснащенного фотоаппаратом Nikon Coolpix camera. Соединение 27 ингибировало FGF-индуцированное формирование капилляров доза-зависимым образом. В качестве сравнения приведено вызванное FGF формирование человеческих эндотелиальных капилляров in vitro (Фигура 1).