СОЕДИНЕНИЯ И СПОСОБЫ ЛЕЧЕНИЯ БОЛИ И ДРУГИХ РАССТРОЙСТВ
Вид РИД
Изобретение
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится по существу к соединениям, ингибирующим металлопротеазы, и, более конкретно, к соединениям, ингибирующим ММП-2 и/или ММП-9 и их применению для лечения боли, лекарственной зависимости и синдрома абстиненции, а также других заболеваний.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Воспаление определяется как комплексная биологическая реакция сосудистых тканей на вредные стимулы, такие как патогены, поврежденные клетки или раздражители. Это защитная попытка организма удалить вредные раздражители, а также начать процесс исцеления ткани. Воспаление может быть острым (ранняя стадия реакции) или хроническим (развивающимся на протяжении длительного времени). В остром воспалении принимают участие полиморфноядерные нейтрофильные лейкоциты, тогда как в хроническом воспалении задействуются моноциты, макрофаги, лимфоциты и плазматические клетки (обобщенно моноядерные лейкоциты). Одним из проявлений как острого, так и хронического воспаления является ощущение боли, которая может носить невропатический либо ноцицептивный характер. Типичными заболеваниями, для которых характерна невропатическая боль, являются боль в нижней части спины, невралгия/ фибромиалгия, диабетическая невропатическая боль и боль, связанная с рассеянным склерозом. Типичными заболеваниями, для которых характерна ноцицептивная боль, являются артритическая боль, в частности, остеоартрит или ревматоидный артрит, послеоперационная боль, боль, вызванная раком и ВИЧ.
В 1997 г. исследовательская группа Соммера и коллег (Соммер К., Шмидт К., Джордж А., Тойка К.В., Неврологический бюллетень, 1997; 237: 45-48) продемонстрировала, что эпиневральная инъекция потенциального ингибитора матричной металлопротеиназы (TAPI-0) в модели на мышах с хронической компрессией (ХК) обеспечивала блокирование как механической аллодинии, так и термической гипералгезии на третий день ежедневных инъекций. На тот момент авторы пришли к заключению, что механизм данного действия представляет собой ингибирование ФНО альфа, поскольку ингибитор (TAPI-0) являлся известным ингибитором ФНО-альфа (IC50 ~ 100 нМ). Однако впоследствии было продемонстрировано, что TABI-0 обладает значением IC50 для ММП-9, составляющим 0,5 нМ.
Чжи и коллеги (журнал Натуральная медицина 14 (13) (2008), 331-336) недавно установили, что матричная металлопротеаза-9
(ММП-9) повышенно регулировалась в поврежденных первичных сенсорных нейронах узла заднего корешка (УЗК) на ранней стадии лигирования спинномозгового нерва (ЛСН) на уровне L5 в модели невропатической боли (в первые сутки со снижением после 3-х суток) и что матричная металлопротеазу-2 (ММП-2) проявляла замедленную реакцию в модели (начало повышенной регуляции с 7-х суток и ее присутствие до 21-х суток). Они также установили, что ММП-2 индуцирует невропатическую боль посредством расщепления IL-1β и активации астроцитарной внеклеточной сигнал-регулируемой киназы (ERK). Кроме того, ими было установлено, что эндогенные ингибиторы матричных металлопротеиназ (TIMP-1 и TIMP-2) также подавляли невропатическую боль в модели. Кобаяши и коллеги («Молекулярная и клеточная неврология», 39 (2008), 619-627) совсем недавно продемонстрировали, что ММП расщепляют периферический основной миелиновый белок (ОМБ) и что ингибитор широкого спектра, содержащий гидроксамовую кислоту (GM6001), снижает механическую ноцицепцию. Также другими группами были выполнены другие исследования с использованием нокаутных мышей (Комори К. и соавт., бюллетень Федерации европейских биохимических обществ, 557: 125-128 (2004) и Фольгуэра А. и соавт., Труды национальной академии наук США, 106 (38), 16451-16456 (2009)), демонстрирующие, что ММП-2 имеет ключевое значение в индуцировании хронической невропатической боли.
Было выдвинуто предположение, что лекарственная зависимость является результатом индуцированного лекарственными средствами обучения и формирования долговременной памяти. С каждым применением лекарственного средства возможна повторная активация и закрепление памяти о лекарственном средстве для поддержания первоначальной памяти (Химен С.Э.; Маленка Р.К.; Нестлер Э.Дж.; «Нейронные механизмы зависимости: роль обучения и памяти за вознаграждение», Годовой неврологический обзор, 29, 565-598 (2006)). Было установлено, что к эндогенным белкам, играющим ключевую роль в синаптической пластичности, относятся матричные металлопротеазы (ММП) и, в частности, ММП-2 и ММП-9. Было определено, что ММП-2 и ММП-9 принимают участие в удлинении аксонов, аксональном наведении рецепторов, миелинизации аксонов, а также расчистке пути через внеклеточную матрицу (Райт Дж.У.; Хардинг Дж.У.; «Вклад матричных металлопротеаз в нейронную пластичность, привыкание, ассоциативное обучение и лекарственную зависимость», Нейронная пластичность, том 2009, 12 страниц (2009)). Также было установлено, что ММП-2 и ММП-9 непосредственно связаны с метамфетаминовой (Мизогучи X.; Ямада К.; Нива М; Моури А.; Мизуно Т.; Нода И.; Нитта А.; Итохеара С; Банно И. и Набешима Т.; «Снижение метамфетамин-индуцированной сенсибилизации и подкрепления у мышей с дефицитом матричной металлопротеазы-2 и -9», Журнал нейрохимии, 100, 1579-1588 (2007) и кокаин-индуцированной (Браун Т.Э.; Форкер М.Р.; Кокинг Д.Л.; Янсен Х.Т.; Хардинг Дж.У. и Сорг Б.А.; «Роль матричных металлопротеиназ в приобретении и закреплении кокаин-индуцированного предпочтения мест введения психоактивного вещества», Обучение и память, 14, 214-223 (2007)) поведенческой сенсибилизацией и подкреплением. Например, Набешима и коллеги (Мизогучи X.; Ямада К.; Нива М.; Моури А.; Мизуно Т.; Нода И.; Нитта А.; Итохеара С; Банно И. и Набешима Т.; «Роль матричной металлопротеиназы и тканевого ингибитора ММП в метамфетамин-индуцированной сенсибилизации и подкреплении: последствия понижающей регуляции дофаминовых рецепторов и выделения дофамина», Журнал нейрохимии, 102, 1548-1560 (2007) установили, что при вливании ингибитора ММП-2/-9 (с применением осмотического мининасоса) в правый желудочек или лобную долю крыс происходит блокирование метамфетамин-индуцированной сенсибилизации и предпочтения мест введения психоактивного вещества, а также снижение выделения дофамина в центре удовольствия.
У лиц с хроническим употреблением опиоидов часто развивается толерантность и гипералгезия. Толерантность является состоянием адаптации, при котором воздействие опиоидов вызывает изменения, которые приводят к снижению эффективности подавления боли лекарственным средством. Результат толерантности заключается в необходимости приема пациентом повышенных доз опиоидов для сохранения терапевтического эффекта. Гипералгезия представляет собой состояние, при котором введение опиоидов вызывает сенсибилизацию к боли. Пациенты с хроническим употреблением опиоидов, таких как морфин, не только становятся более восприимчивыми к первоначальной боли, но и в ряде случаев испытывают боли нового типа при введении самого опиоида. Как толерантность, так и гипералгезия являются факторами, которые позволяют объяснить возникновение зависимости от опиоидов у лиц с хроническим употреблением. Недавно Сонг и коллеги (Неврологический журнал, 30 (22) (2010), 7613-7623) обнаружили сильную связь между физической зависимостью, связанной с опиоидной абстиненцией, и повышенной активностью ММП-9 в заднем роге. Эти исследователи установили, что вследствие введения экзогенной ММП-9 в спинной мозг возможно индуцирование морфиноподобного абстинентного поведения, а также механической аллодинии у нормальных мышей. При интратекальном введении исследователями ингибитора ММП-9 (2-[бензил-(4-метоксибензолсульфонил)амино]-5-дииэтиламино-N-гидрокси-3-метил-бензамид) мышам с наблюдающейся морфиновой абстиненцией было достигнуто устранение абстинентного поведения. При совместном введении ингибитора ММП-2 или ММП-9 было достигнуто снижение морфиновой толерантности у мышей. Соединения, использованные во всех вышеуказанных исследованиях для подавления активности ММП-2 и/или ММП-9, представляли собой ингибиторы ММП, содержащие гидроксамовую кислоту, которые обладают известными токсичными побочными эффектами.
Матричные металлопротеазы (ММП) представляют семейство структурно родственных цинксодержащих ферментов, для которых было зарегистрировано стимулирование разрушения соединительной ткани в нормальных физиологических процессах, таких как эмбриональное развитие, воспроизведение и ремоделирование тканей. Повышенная экспрессия ММП или нарушение равновесия между ММП рассматривались как факторы воспалительных, злокачественных и дегенеративных патологических процессов, характеризующихся нарушением ткани внеклеточной матрицы или соединительной ткани. В связи с этим ММП являются мишенями терапевтических ингибиторов в случае некоторых воспалительных, злокачественных и дегенеративных заболеваний, таких как ревматоидный артрит, остеоартрит, остеопороз, периодонтит, рассеянный склероз, гингивит, роговичное, эпидермальное и желудочное изъязвление, атеросклероз, пролиферация неоинтимы (которая приводит к рестенозу и ишемической сердечной недостаточности) и метастаз опухоли, но не в случае боли. ММП-2 (72 кДа желатиназа/желатиназа A) и ММП-9 (92 кДа желатиназа/желатиназа B) расщепляет компоненты внеклеточной матрицы базальной мембраны. Их субстраты включают коллаген IV и V типов, фибронектин, эластин и денатурированные интерстициальные коллагены. Было продемонстрировано, что расщепление матрицы, связанное с данной протеиназой, играет важную роль в развитии таких заболеваний, как атеросклероз, воспаление, инсульт, а также рост и метастаз опухолей. Однако до недавнего времени было опубликовано мало научной литературы, посвященной использованию ингибиторов ММП-2 и/или ММП-9 для лечения боли и/или зависимости.
Клинические исследования матричных металлопротеиназ были выполнены лишь для некоторых показаний. В подавляющем большинстве случаев для артрита и рака. В число ингибиторов, для которых были выполнены клинические исследования, в особенности по онкологическим показаниям, входят приномастат (AG3340; Agouron/Pfizer (Агурон/Пфайзер)), BAY 12-9566 (Bayer Corp. (корпорация «Байер»)), батимистат (BB-94; British Biotech, Ltd (Бритиш Битех Лтд.)), BMS-275291 (бывший D2163; Celltech/Bristol-Myers Squibb («Селлтек»/ «Бристол-Майерс Сквибб»)), маримастат (BB 2516; British Biotech, Ltd/ Schering-Plough («Шеринг-Плау»)), MMI270(B) (бывший CGS-27023A; Novartis («Новартис»)) и метастат (COL-3; CollaGenex («КоллаГенекс»)). Ряд ингибиторов, содержащих гидроксамовую кислоту, проявляют обширную токсичность для человека. Например, маримастат, который содержит гидроксаматную группу, проявляет зависимую от времени и дозировки мышечно-скелетную токсичность (артралгия, миалгия, тендинит) для человека. Другие токсичности маримастата включают асцит, диссеминированную злокачественную опухоль, озноб, холангит, головокружение, одышку, отек, усталость, лихорадку, желудочно-кишечные нарушения (потеря аппетита, тошнота, рвота, диарея, запор), желудочно-кишечные кровотечения, головную боль, изжогу, печеночную токсичность, гиперкальцемию, гипергликемию, высыпания и затруднение дыхания. Неизвестно, связана ли токсичность, проявляемая многими ингибиторами ММП, с гидроксамовой кислотой, однако очевидно, что получение ингибитора ММП, который не содержит группу гидроксамовой кислоты, может снизить некоторые потенциальные метаболические последствия.
Кушнер и коллеги (Кушнер Д.Дж.; Бейкер А.; Данстолл Т.Дж. Кан. Журнал физиологии и фармакологии, 77 (2) (1999), стр.79-88) представили примеры того, каким образом включение дейтерия в лекарственный препарат зачастую способно снизить уровень метаболически индуцированных преобразований, в частности, стимулированных цитохромом P450. Этот сниженный уровень индукции метаболизма цитохромом P450 иногда может быть непосредственно выражен в повышении биологической доступности. Причина этого связана с тем фактом, что атомное замещение водорода дейтерием в лекарственном препарате изменяет силу связи углерод-дейтерий, обеспечивая при этом сохранение очень высокой схожести его трехмерной поверхности с недейтерированной версией. Замещение дейтерия водородом может повлечь за собой возникновение изотопного эффекта, который способен изменить фармакокинетику лекарственного препарата. В реакции, в которой происходит расщепление связи C-H, скорость аналогичной реакции для связи C-D будет снижена. Например, Шнайдер и коллеги (Шнайдер Ф. и соавт., BiRDS Pharma GmbH (Бердс Фарма ГмбХ), исследование лекарственного препарата (2006), 56 (4), стр.295-300) продемонстрировали, что замещение нескольких атомов водорода в одном из ароматических колец ингибитора COX-2 рефекоксиба (4-(4-метилсульфонилфенил)-3-фенил-5H-фуран-2-один) дейтерием (в положениях 2′, 3′, 4′ 5′ и 6′) повышало пероральную биологическую доступность лекарственного препарата, не оказывая воздействия на избирательность COX-2. При применении этой стратегии к кислоте на основе триптофана S-3304 возможно снижение ее восприимчивости к гидроксилированию цитохромом P450 и повышение, в конечном счете, ее общей биологической доступности и, возможно, концентрации целевого соединения в ткани.
Другим возможным следствием включения дейтерия в лекарственный препарат являются его полиморфные свойства (т.е. различные кристаллические формы). Например, Хирота и Урушибара (Бюллетень химического общества Японии, 32 (7) (1959), 703-706) продемонстрировали, что замещение одного винилового водорода на дейтерий в аллокоричной кислоте способно изменить как температуру плавления, так и интенсивность рентгеновской дифракционной картины молекулы. Лин и Гиллори (журнал фармацевтической науки, том 59 (7) (2006), 972-979) продемонстрировали, что сульфаниламид-d4 проявлял сниженные показатели теплоты перехода и теплоты плавления в различных кристаллических состояниях по сравнению с соответствующими недейтерированными формами. И наконец, Кроуфорд и коллеги (Кроуфорд С.и соавт., международное издание «Прикладная химия», 48 (4) (2009), 755-757) недавно продемонстрировали, что кристаллическая форма полностью дейтерированного пиридина принимает уникальную конфигурацию, которая может быть достигнута только при оказании высокого давления на недейтерированную исходную версию. В их работе явно продемонстрировано, что замещение водорода на дейтерий изменяет силу взаимодействия между различными атомами в соседних молекулах, вызывая переход кристаллической структуры в более энергетически выгодную форму. Это изменение кристаллической структуры, или полиморфная модификация, может обеспечить повышение свойств растворимости и улучшение биологической доступности.
Сухолейки (WO/2010/075287) продемонстрировал, что частичное дейтерирование ингибитора матричной металлопротеиназы (ММП) может повысить биологическую доступность этого ингибитора по сравнению с недейтерированной исходной версией. Известно, что в крови человека ингибитор ММП S3304 образует несколько гидроксилированных метаболитов (Чиаппори А.А. и соавт., Клиническое исследование рака 2007, 13 (7), 2091-2099). В двух из основных метаболитов гидроксилирование осуществляется по индоловому кольцу группы триптофана, а в третьем происходит гидроксилирование метиловой группы толуола молекулы S3304. При дейтерировании концевой метиловой группы толуола S3304 наблюдалось повышение биологической активности соединения in vivo в модели на мышах лигирования спинномозгового нерва (ЛСН) для механической аллодинии по сравнению с контролем растворителем и недейтерированной исходной версией (S3304).
В литературе отражены несколько не содержащих гидроксамовую кислоту ингибиторов ММП, лишь для некоторых из которых были выполнены клинические исследования для применения при раке и/или воспалении. Однако ни для одного из них не были выполнены исследования в отношении боли, зависимости от лекарственных средств или снижения толерантности и абстиненции, связанных с применением опиоидов, на модельных животных или человеке. В настоящей заявке предлагается ряд соединений, ингибирующих ММП-2 и/или ММП-9, и способ их применения для ингибирования боли и других расстройств.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединениям и фармацевтическим композициям для применения в качестве лекарственного препарата для лечения обусловленных ММП состояний или заболеваний.
Один вариант осуществления настоящего изобретения относится к новому способу лечения боли, зависимости от лекарственных средств и/или снижения побочных эффектов толерантности и абстиненции, связанных со злоупотреблением психоактивными веществами, с применением ингибитора ММП-2 и/или ММП-9.
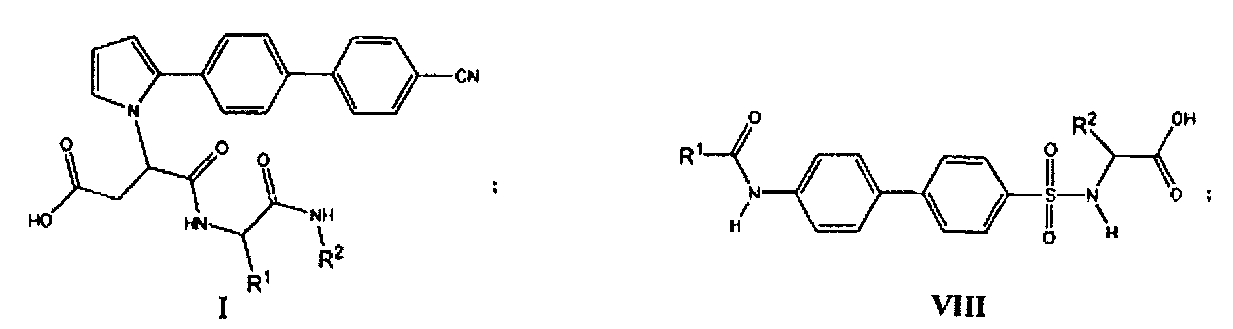
Ингибитор ММП-2 и/или ММП-9 представлен общими формулами (I-XIII):
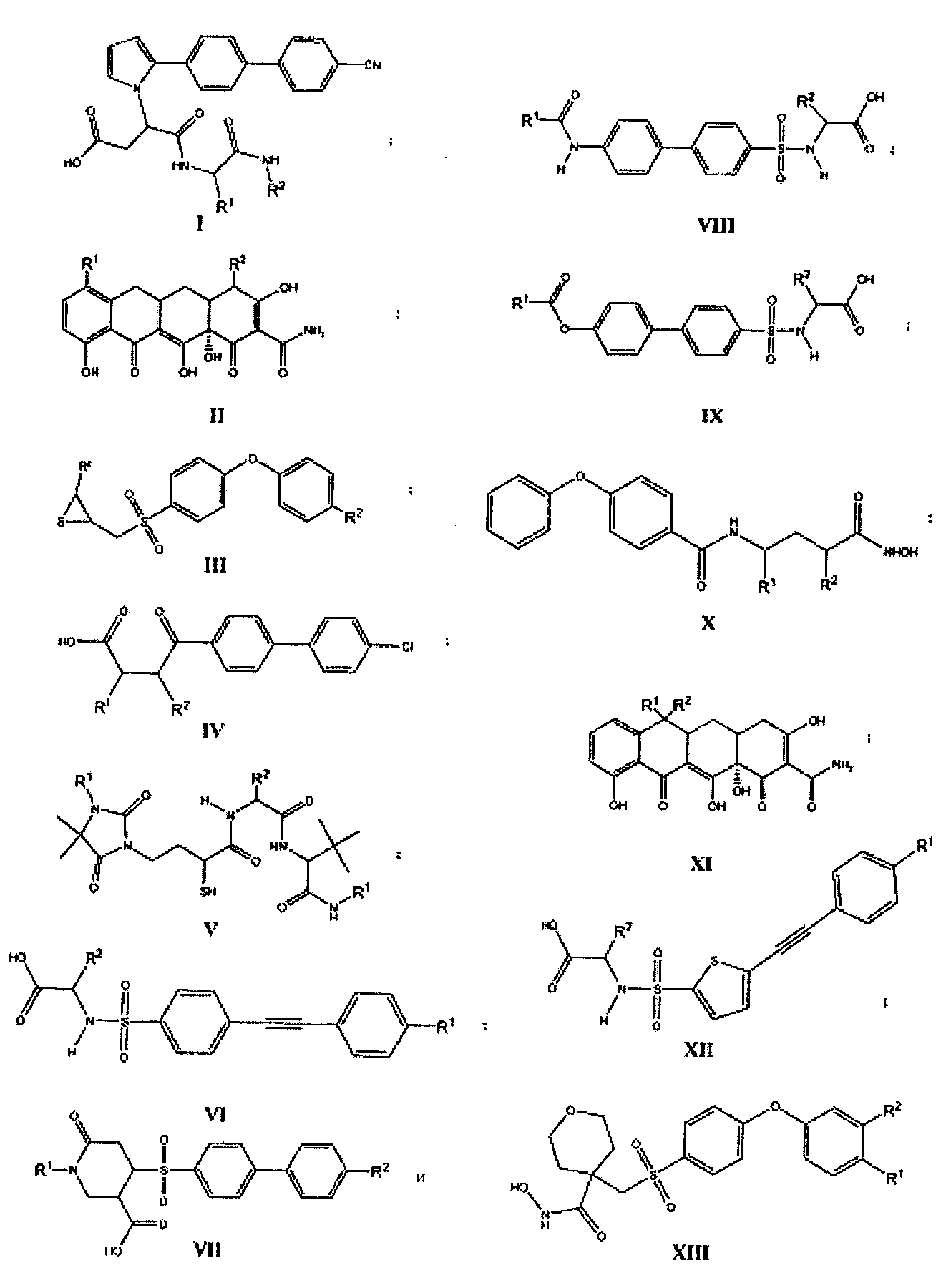
где все переменные в предыдущих формулах (I-XIII) определены ниже в настоящем описании.
R1, R2 независимо выбраны из группы, состоящей из водорода, галогена, алкила, циклоалкила, гетероциклоалкила, бициклоалкила, гетеробициклоалкила, спироалкила, спирогетероалкила, арила, гетероарила, циклоалкила, конденсированного с арилом, гетероциклоалкила, конденсированного с арилом, циклоалкила, конденсированного с гетероарилом, гетероциклоалкила, конденсированного с гетероарилом, циклоалкилалкила, гетероциклоалкилалкила, бициклоалкилалкила, гетеробициклоалкилалкила, спироалкилалкила, спирогетероалкилалкила, арилалкила, гетероарилалкила, циклоалкила, конденсированного с арилалкилом, гетероциклоалкила, конденсированного с арилалкилом, циклоалкила, конденсированного с гетероарилалкилом, гетероциклоалкила, конденсированного с гетероарилалкилом, гетероциклоалкила, бициклоалкила, гетеробициклоалкила, спироалкила, спирогетероалкила, арила, гетероарила, циклоалкила, конденсированного с арилом, гетероциклоалкила, конденсированного с арилом, циклоалкила, конденсированного с гетероарилом, гетероциклоалкила, конденсированного с гетероарилом, циклоалкилалкила, гетероциклоалкилалкила, бициклоалкилалкила, гетеробициклоалкилалкила, спироалкилалкила, спирогетероалкилалкила, арилалкила, гетероарилалкила, циклоалкила, конденсированного с арилалкилом, гетероциклоалкила, конденсированного с арилалкилом, циклоалкила, конденсированного с гетероарилалкилом, гидроксигруппы, алкоксигруппы, арила, гетероарила, арилалкила, гетероарилалкила, алкенила, алкинила, NO2, NR9R9, NR9NR9R9, NR9N=CR9R9, NR9SO2R9, CN, C(O)OR9 и фторалкила, где алкил, циклоалкил, алкоксигруппа, алкенил, алкинил и фторалкил являются необязательно замещенными один или большее количество раз, а гетероциклоалкил, конденсированный с гетероарилалкилом является необязательно замещенным один или большее количество раз;
его N-оксиды, дейтерированные аналоги, фармацевтически приемлемые соли, пролекарства, лекарственные формы, полиморфы, таутомеры, рацемические смеси и стереоизомеры.
Соединения настоящего изобретения, ингибирующие ММП-2 и/или ММП-9, также могут быть применены для лечения других заболеваний, обусловленных активностью металлопротеаз, таких как ревматоидный артрит, остеоартрит, аневризма брюшной аорты, рак, воспаление, атеросклероз, рассеянный склероз, хроническая обструктивная болезнь легких, глазные болезни, неврологические заболевания, психиатрические заболевания, тромбоз, бактериальное заражение, болезнь Паркинсона, усталость, тремор, диабетическая ретинопатия, сосудистые заболевания сетчатки глаза, старение, слабоумие, кардиомиопатия, почечная тубулярная недостаточность, диабет, психоз, дискинезия, пигментные нарушения, глухота, воспалительный и фиброзный синдромы, раздражающий кишечный синдром, аллергии, болезнь Альцгеймера, артериальное распространение бактерий, пародонтоз, вирусное заражение, инсульт, сердечнососудистое заболевание, реперфузионное повреждение, травмы, химическое или окислительное повреждение тканей, заживление ран, геморрой, процедура омоложения кожи и боль.
В частности, соединения настоящего изобретения, ингибирующие ММП-2 и/или ММП-9, также могут быть применены для лечения боли, снижения побочных эффектов зависимости от и/или отмены лекарственных средств, связанных со злоупотреблением пациентом психоактивными веществами, указанный способ, включающий этап введения пациенту эффективного количества настоящего соединения в сочетании с носителем, отличающийся тем, что пациент страдает от повышенной или гипертрофированной чувствительности к боли, такой как гипералгезия, каузалгия и аллодиния; острая боль, жгучая боль; атипичная лицевая боль; невропатическая боль; боль в спине; комплексные региональные болевые синдромы I и II; артритическая боль; боль от спортивных травм; боль, связанная с вирусным заражением, напр., ВИЧ, постполиомиелитным синдромом и постгерпетической невралгией; фантомная боль конечностей; родовые схватки; раковая боль; боль после химиотерапии; постинсультная боль; послеоперационная боль; физиологическая боль; воспалительная боль; боль острых воспалительных состояний/боль во внутренних органах, напр., стенокардия, раздражающий кишечный синдром и воспалительные заболевания кишечника; невропатическая боль; невралгия; болевая диабетическая невропатия; травматическое повреждение нервов; повреждение спинного мозга; зависимость от лекарственных средств и/или толерантность или абстиненция от опиоидов или других вызывающих зависимость лекарственных средств.
Настоящее изобретение также предлагает соединения, ингибирующие ММП-2, ММП-9 и/или другие металлопротеазы, которые используются в качестве действующих веществ в фармацевтических композициях для лечения или профилактики активности металлопротеаз, в частности, заболеваний, обусловленных активностью ММП-2 и/или ММП-9. Настоящее изобретение также предполагает использование таких соединений в фармацевтических композициях для перорального или парентерального введения, включающих одно или более соединений, ингибирующих ММП-2 и/или ММП-9, представленных в настоящем описании.
Настоящее изобретение далее предлагает способы ингибирования ММП-2, ММП-9 и/или других металлопротеаз посредством введения лекарственных форм, включая, но не ограничиваясь, пероральные, ректальные, местные, интратекальные, внутривенные, парентеральные (включая, но не ограничиваясь, внутримышечные, внутривенные), инъекции склеры (офтальмические) чрескожные, ингаляционные (включая, но не ограничиваясь, легочную, аэрозольную ингаляцию), назальные, сублингвальные, подкожные или внутрисуставные лекарственные формы, включающие соединения, ингибирующие гетеробициклические металлопротеазы, стандартными способами, известными в медицинской практике, для лечения заболеваний или симптомов, обусловленных или связанных с металлопротеазой, в частности с ММП-2, в том числе профилактическое и терапевтическое лечение. Хотя наиболее подходящие пути введения зависят от характера и степени тяжести состояний, подвергаемых лечению, и характера действующего вещества. Соединения настоящего изобретения для удобства представлены в единичной дозированной форме и могут быть получены с помощью любых способов, хорошо известных в области фармацевтики.
Соединения настоящего изобретения, ингибирующие ММП-2 и/или ММП-9, могут быть использованы в сочетании с болезнь-модифицирующими противоревматическими препаратами, нестероидными противовоспалительными препаратами, избирательным ингибитором СОХ-2, ингибитором СОХ-1, иммунодепрессивными, стероидными препаратами, модификатором биологической реакции или другими противовоспалительными препаратами.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
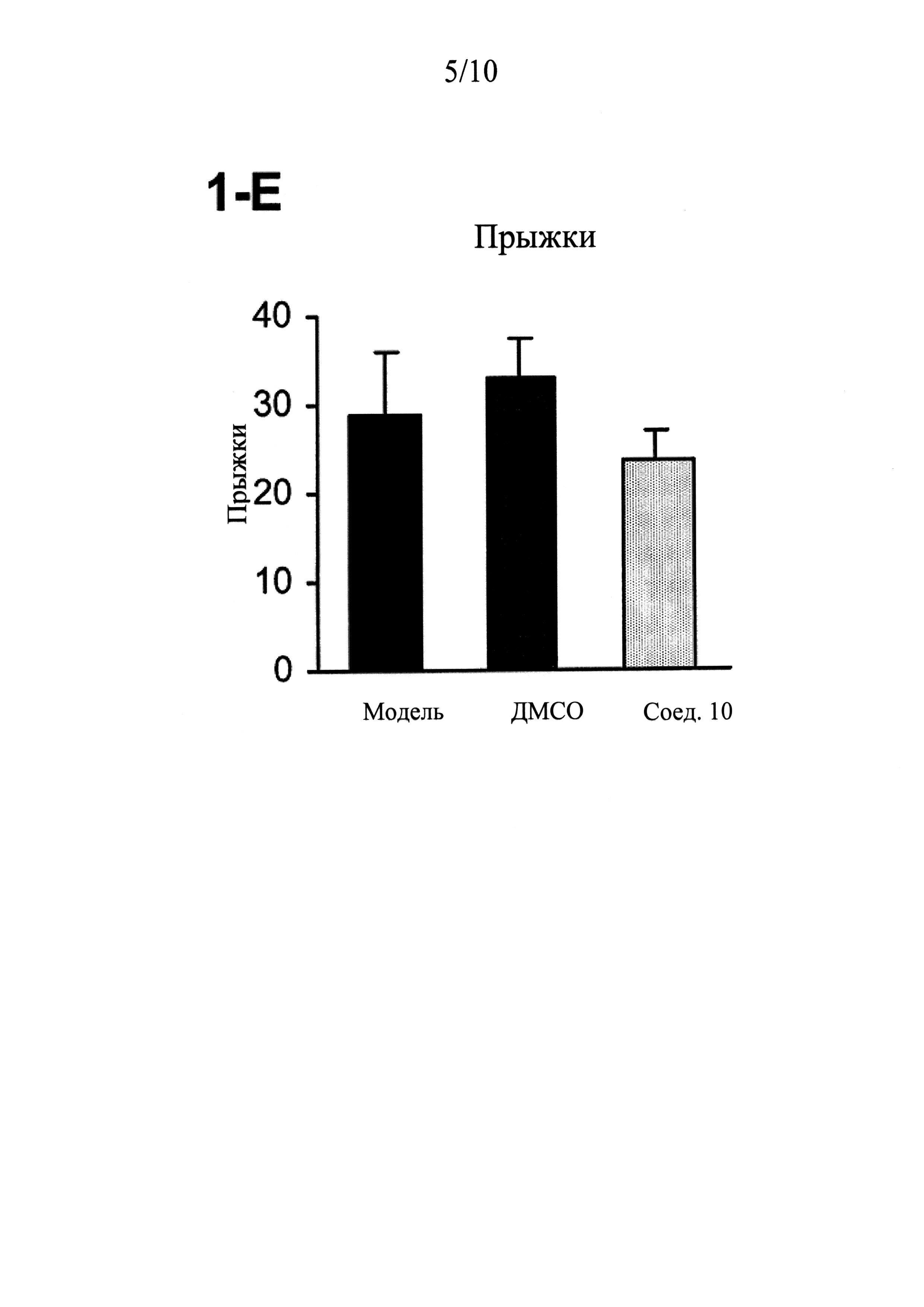
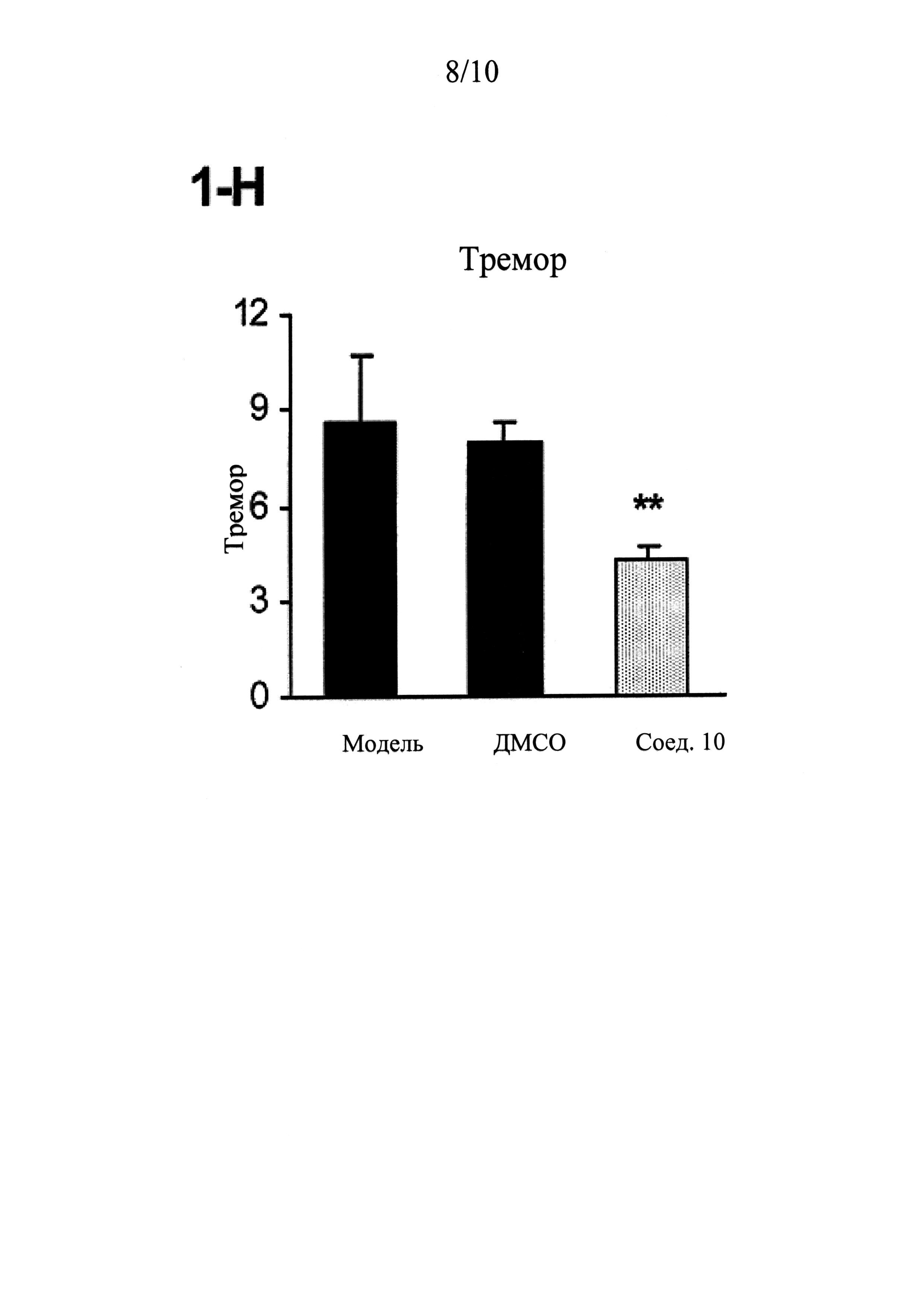
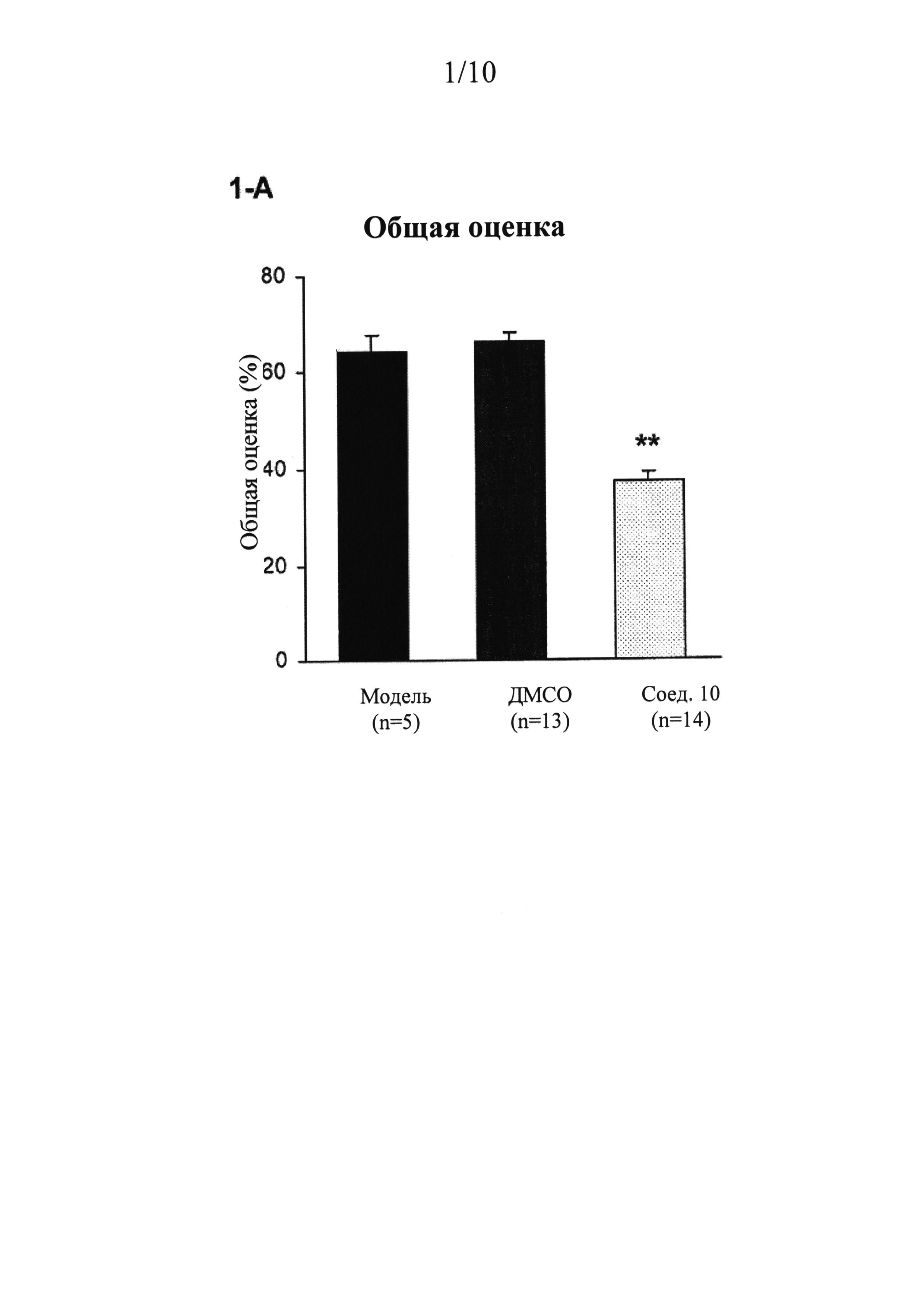
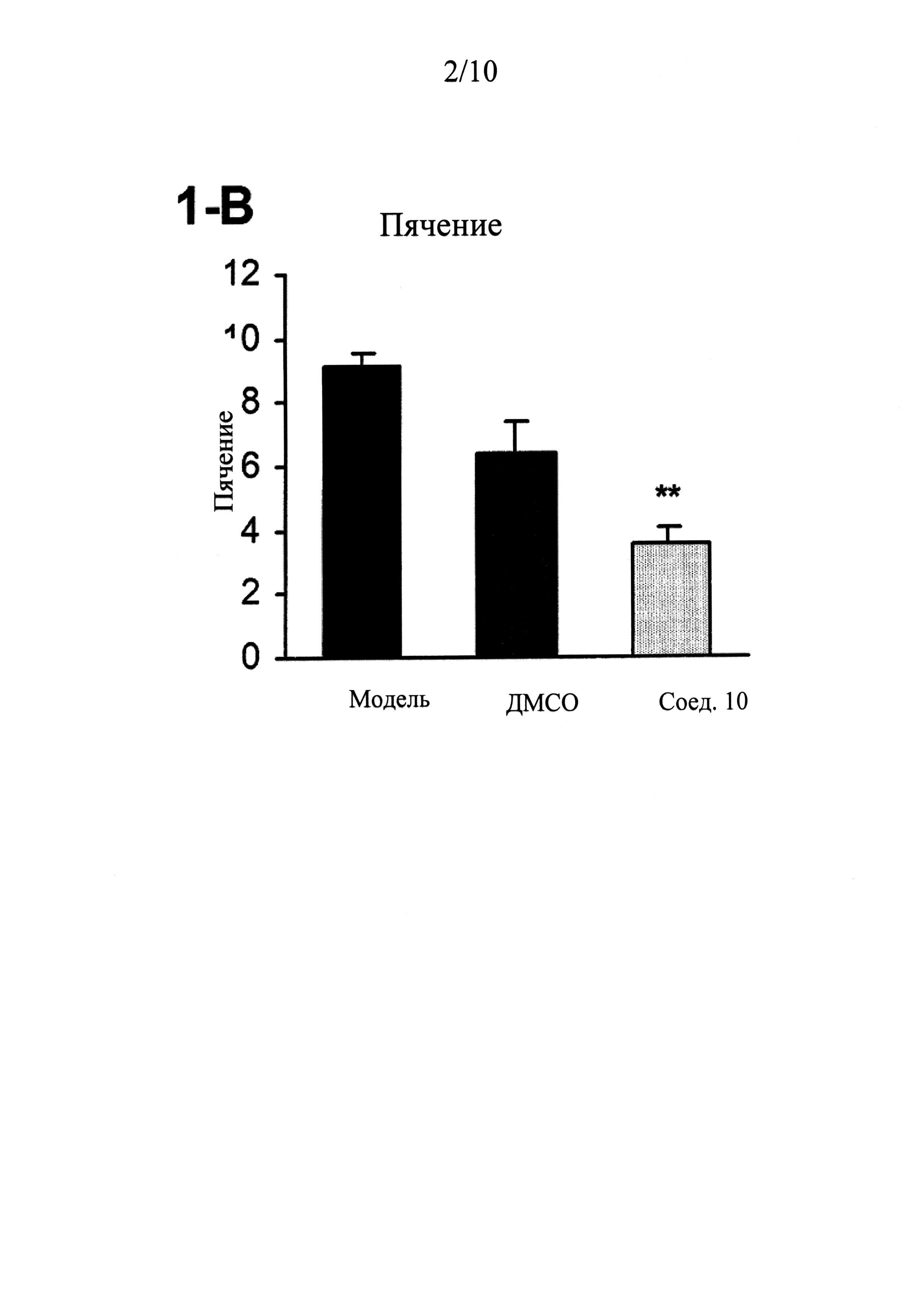
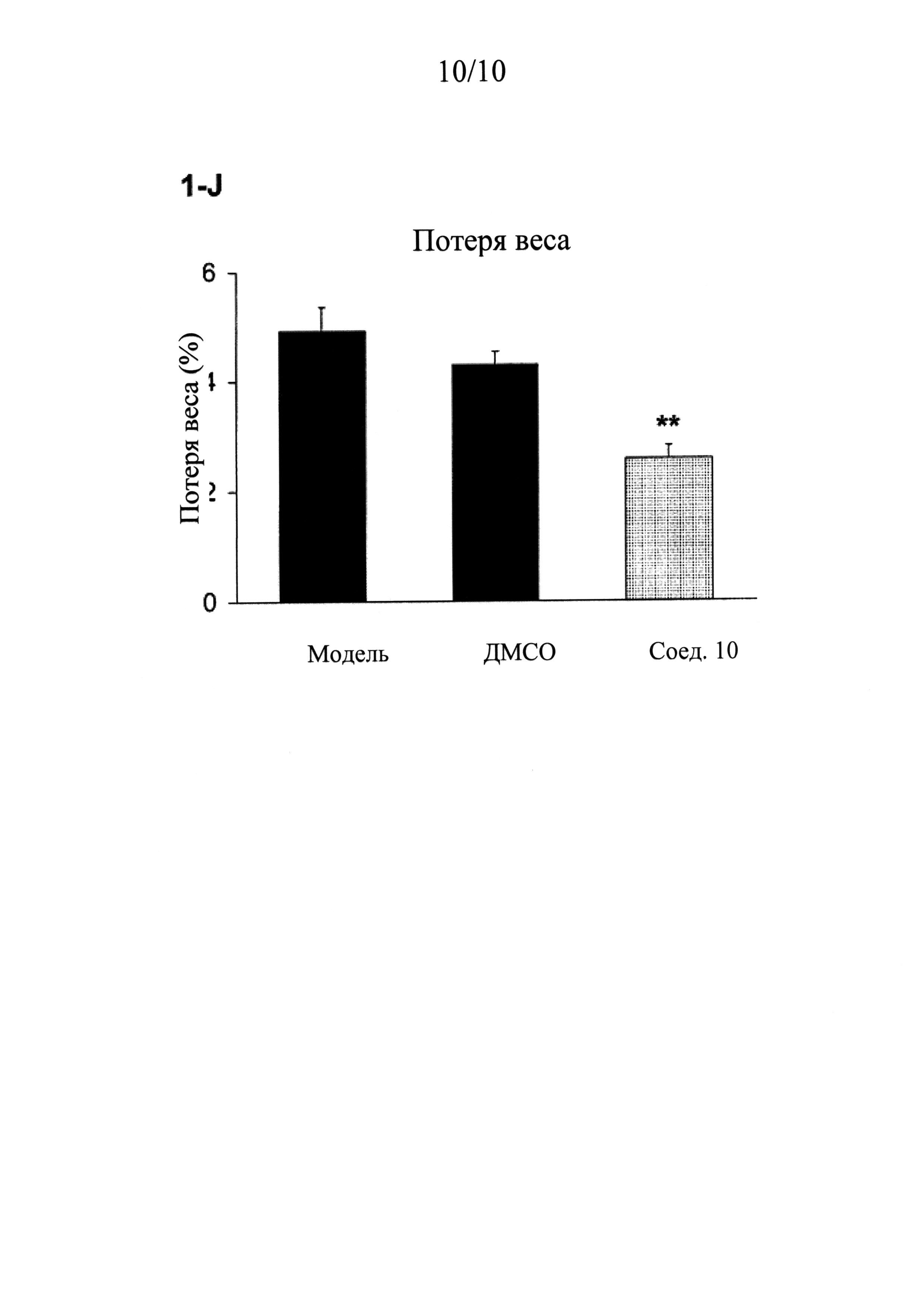
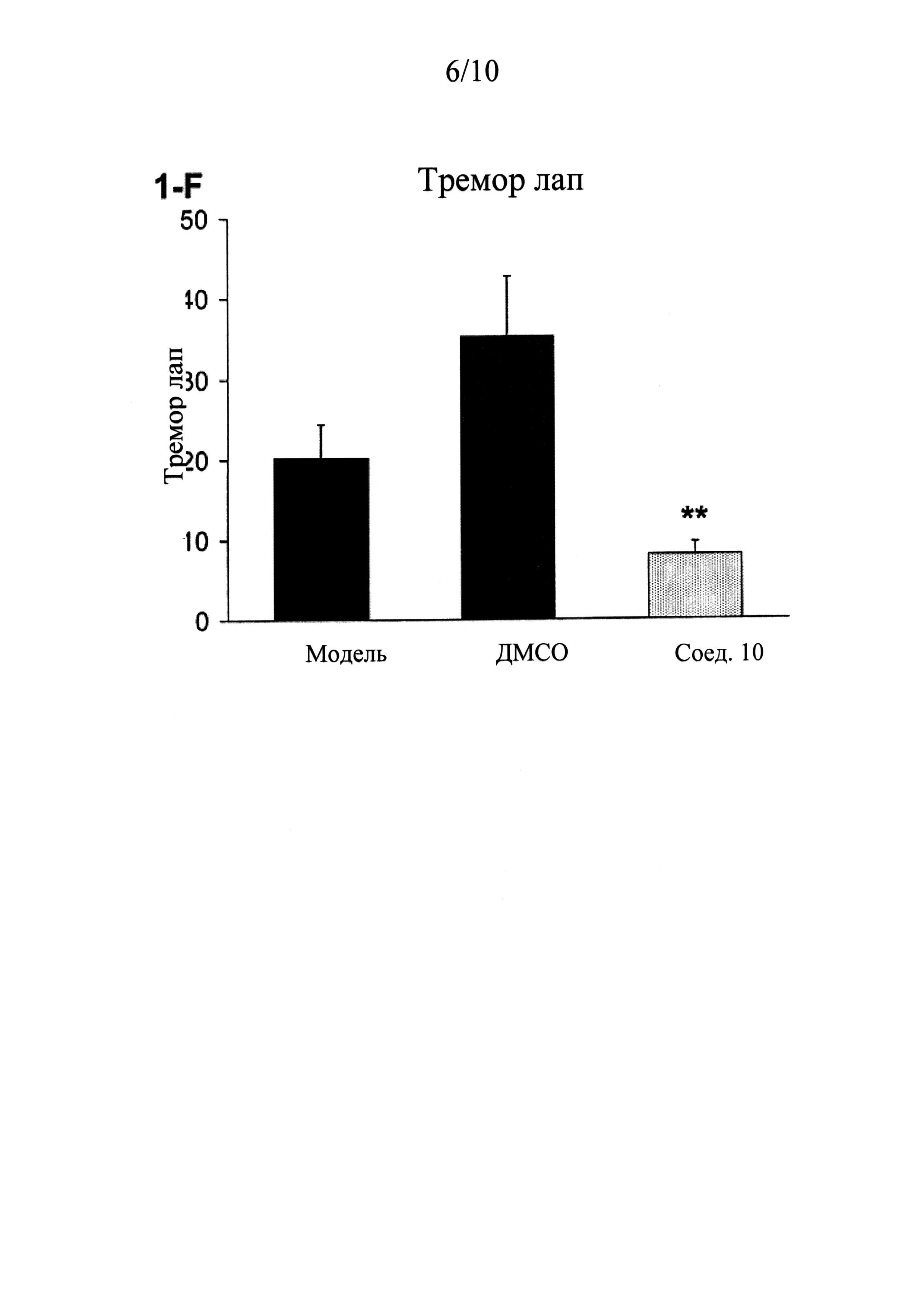
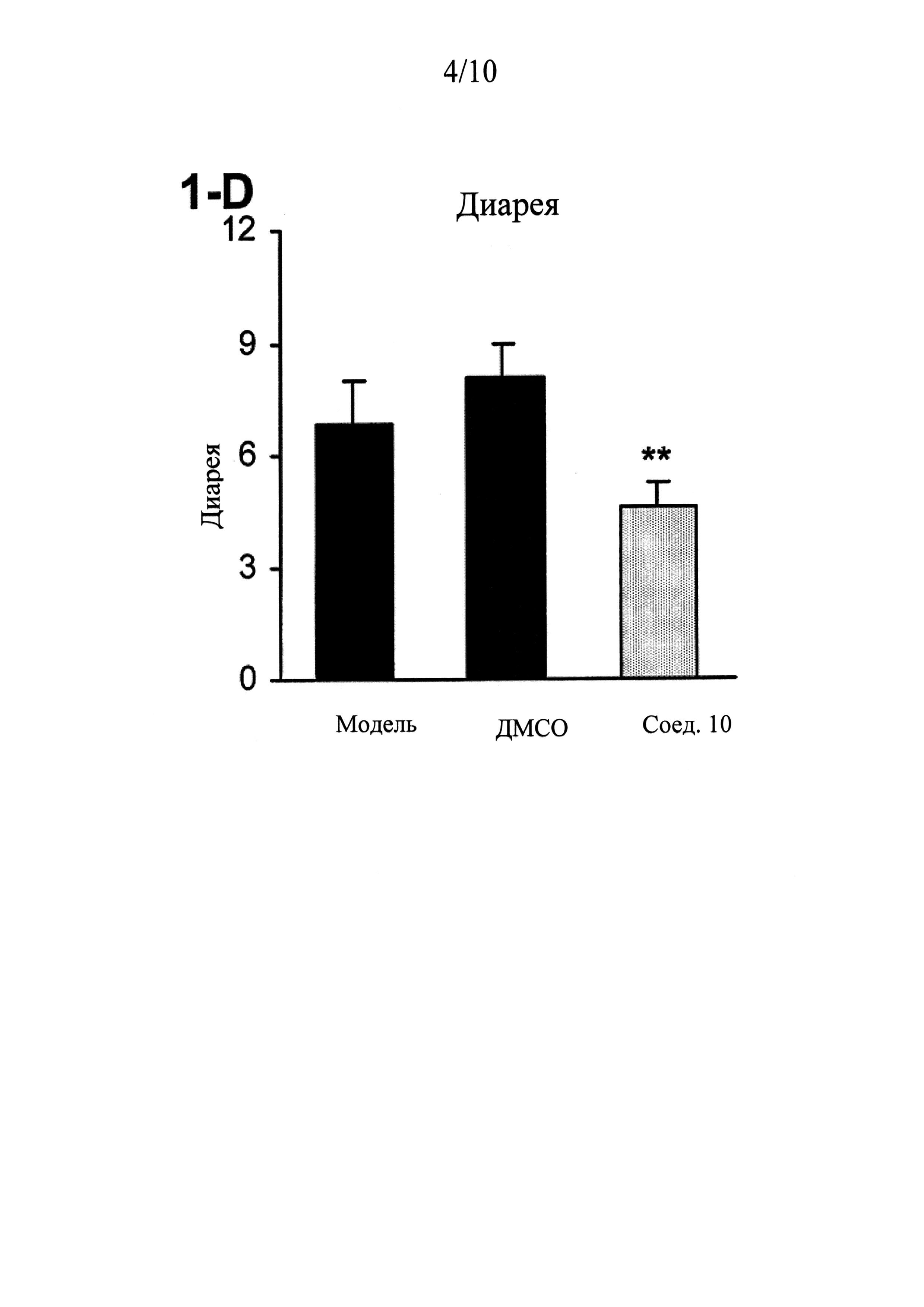
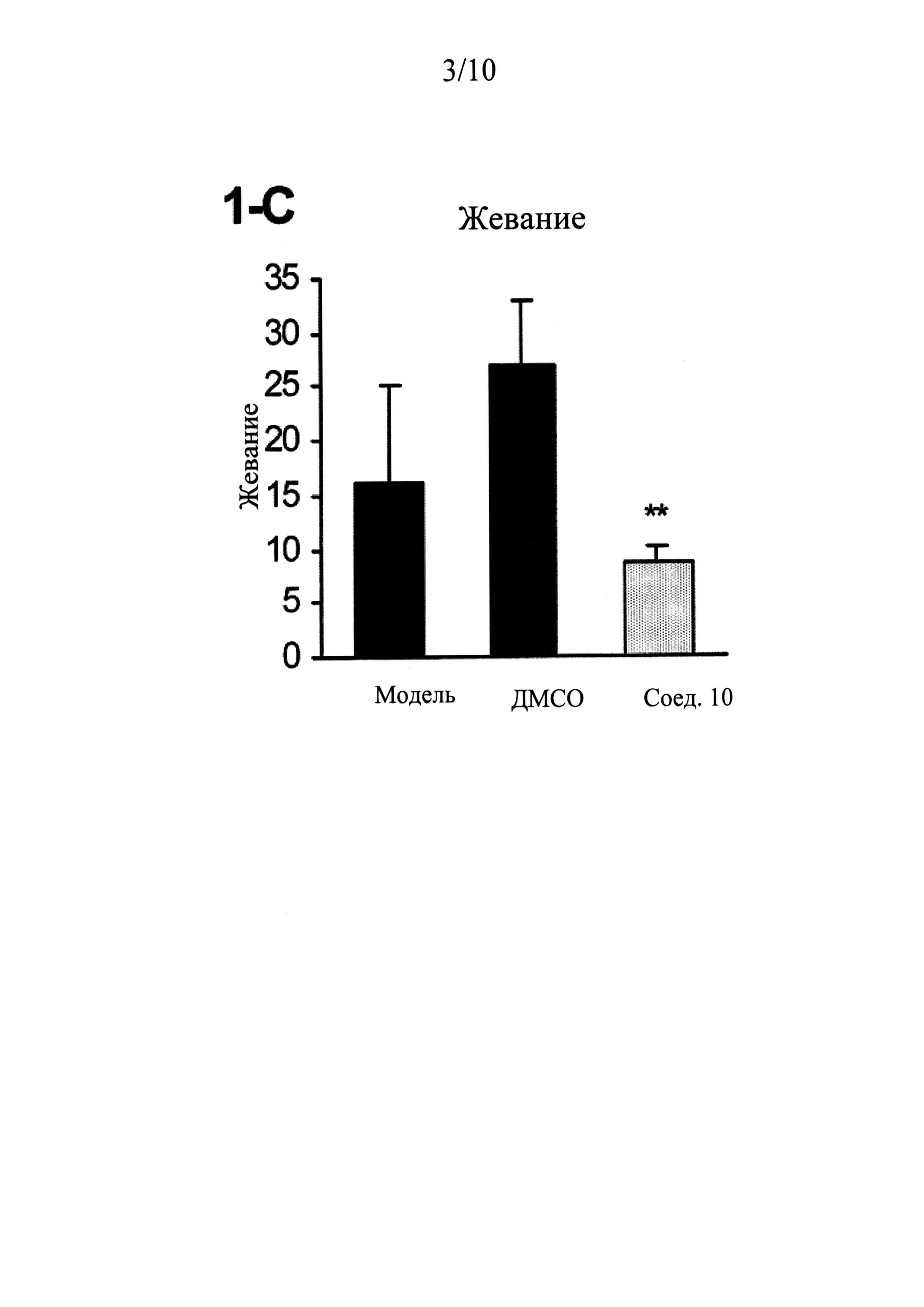
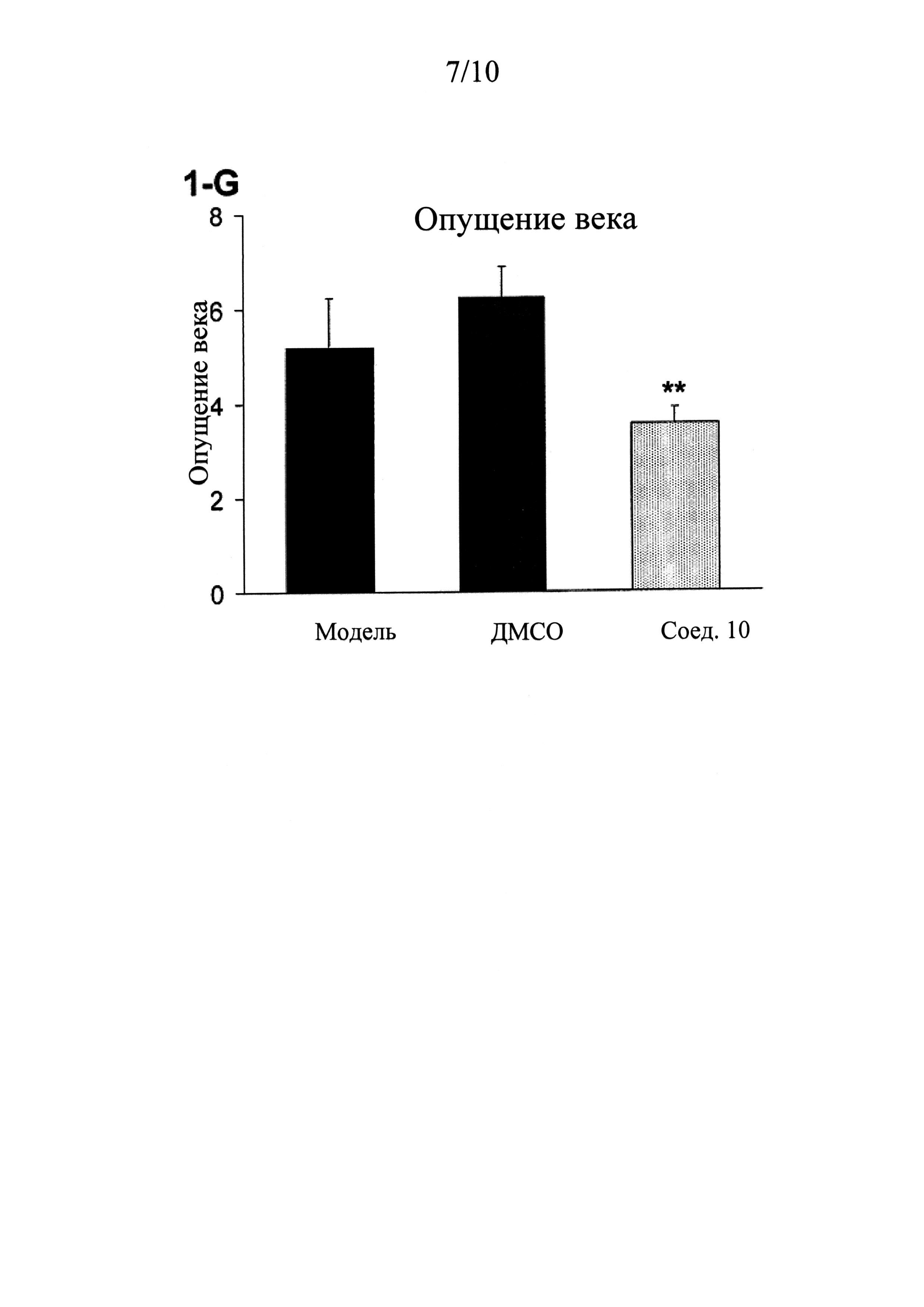
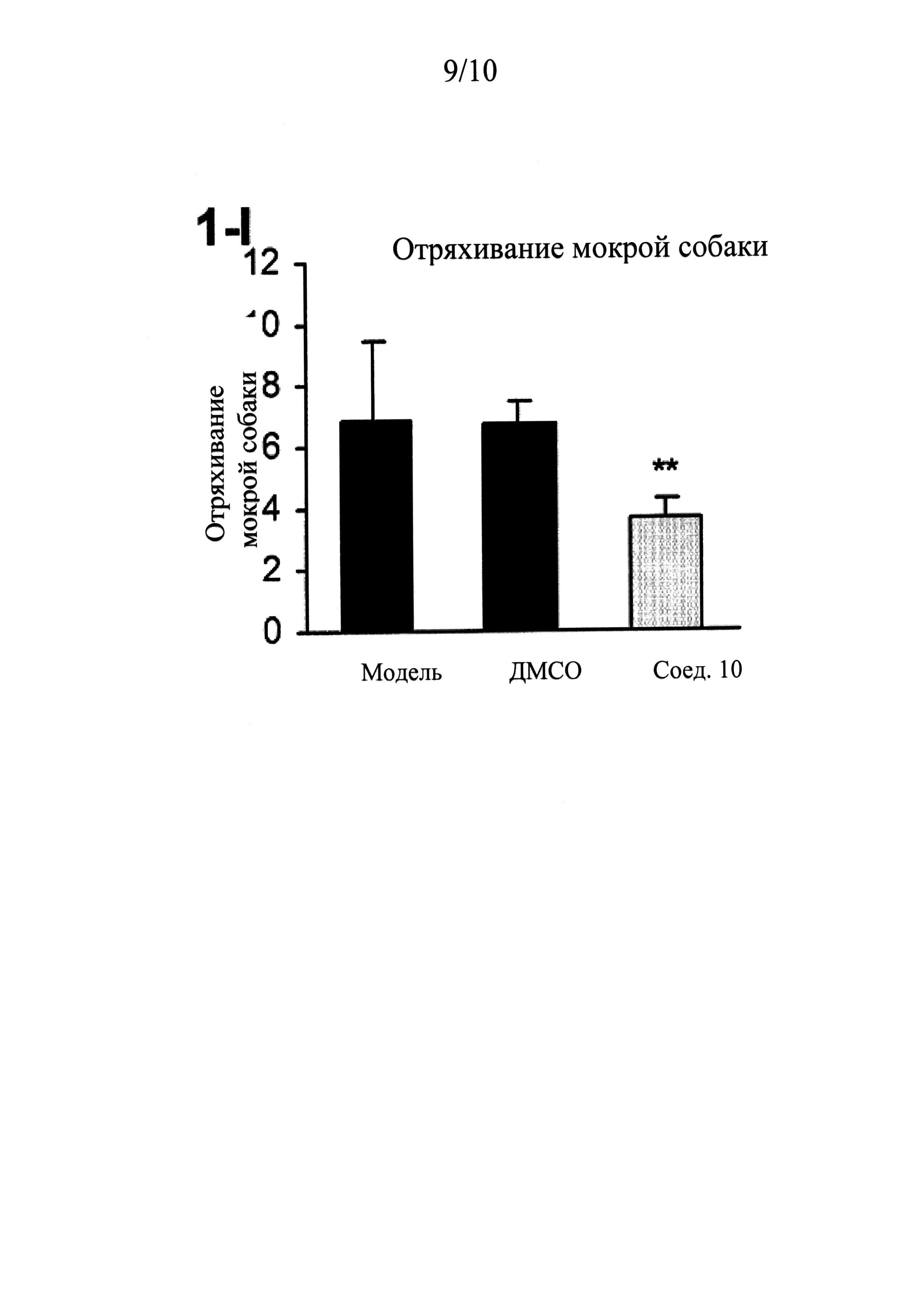
ФИГУРЫ 1 (A-J) представляют собой графики, демонстрирующие, что интратекальное введение соединения 10 значительно смягчает поведенческие признаки симптомов абстиненции, связанной с отменой морфина, которая спровоцирована налоксоном, у мышей линии CD-1 по сравнению с контрольным препаратом и растворителем (n=5 мышей для контрольного препарата; n=13 мышей для контроля растворителем ДМСО и n=14 мышей для введения соединения 10).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Термин «D», используемый в настоящем описании сам по себе или в составе химической структуры или группы, обозначает дейтерий.
Термин «дейтерий», используемый в настоящем описании сам по себе или в составе другой группы, обозначает стабильный изотоп водорода с массовым числом 2.
Термин «дейтерированный», используемый в настоящем описании сам по себе или в составе группы, обозначает необязательно замещенные атомы дейтерия.
Термин «дейтерированный аналог», используемый в настоящем описании сам по себе или в составе группы, обозначает необязательно замещенные атомы дейтерия в выбранных положениях внутри и вокруг молекулы.
Термин «алкил», используемый в настоящем описании сам по себе или в составе другой группы, обозначает необязательно замещенные насыщенные углеводородные группы с прямой или разветвленной цепочкой, предпочтительно имеющие от 1 до 10 атомов углерода в нормальной цепочке, более предпочтительно низшие алкильные группы. Типичные незамещенные группы включают метил, этил, пропил, изопропил, н-бутил, трет-бутил, изобутил, пентил, гексил, изогексил, гептил, 4,4-диметилпентил, октил, 2,2,4-триметилпентил, нонил, децил, ундецил, додецил и им подобные. Типичные заместители могут включать, но не ограничиваются, одну или большее количество следующих групп: галоген, алкоксигруппа, алкилтиогруппа, алкенил, алкинил, арил (напр., для образования бензильной группы), циклоалкил, циклоалкенил, гидроксигруппа или защищенная гидроксигруппа, карбоксильная группа (--COOH), алкилоксикарбонил, алкилкарбонилоксигруппа, алкилкарбонил, карбамоил (NH2--CO--), замещенный карбамоил ((R10)(R11)N--CO--, где R10 или R11 являются такими, как определено ниже, за исключением того, что как минимум один из R10 или R11 не является водородом), аминогруппа, гетероциклогруппа, моно- или диалкиламиногруппа, или тиол (--SH).
Термин «гетероалкил», который может быть взаимозаменяемо использован с термином «алкил», обозначает необязательно замещенные насыщенные углеводородные группы с прямой или разветвленной цепочкой, предпочтительно имеющие от 1 до 10 атомов углерода в нормальной цепочке, более предпочтительно низшие алкильные группы. Типичные незамещенные группы включают метил, этил, пропил, изопропил, н-бутил, трет-бутил, изобутил, пентил, гексил, изогексил, гептил, 4,4-диметилпентил, октил, 2,2,4-триметилпентил, нонил, децил, ундецил, додецил и им подобные. Типичные заместители могут включать, но не ограничиваются, одну или большее количество следующих групп: галоген, алкоксигруппа, алкилтиогруппа, алкенил, алкинил, арил (напр., для образования бензильной группы), циклоалкил, циклоалкенил, гидроксигруппа или защищенная гидроксигруппа, карбоксильная группа (--COOH), алкилоксикарбонил, алкилкарбонилоксигруппа, алкилкарбонил, карбамоил (NH2--CO--).
Термин «низший алкил», используемый в настоящем описании, обозначает необязательно замещенные группы, как описано выше для алкила, имеющие от 1 до 4 атомов углерода в нормальной цепочке.
Термин «алкоксигруппа» обозначает алкильную группу, как описано выше, связанную через кислородную связь (--O--).
Термин «алкенил», используемый в настоящем описании сам по себе или в составе другой группы, обозначает необязательно замещенные углеводородные группы с прямой или разветвленной цепочкой, содержащие в цепочке, по крайней мере, одну двойную связь углерод-углерод и предпочтительно имеющие от 2 до 10 атомов углерода в нормальной цепочке. Типичные незамещенные группы включают этенил, пропенил, изобутенил, бутенил, пентенил, гексенил, гептенил, октенил, ноненил, деценил и им подобные. Типичные заместители могут включать, но не ограничиваются, одну или большее количество следующих групп: галоген, алкоксигруппа, алкилтиогруппа, алкил, алкинил, арил, циклоалкил, циклоалкенил, гидроксигруппа или защищенная гидроксигруппа, карбоксильная группа (--COOH), алкилоксикарбонил, алкилкарбонилоксигруппа, алкилкарбонил, карбамоил (NH2--CO-), замещенный карбамоил.
Термин «алкинил», используемый в настоящем описании сам по себе или в составе другой группы, обозначает необязательно замещенные углеводородные группы с прямой или разветвленной цепочкой, содержащие в цепочке как минимум одну тройную связь углерод-углерод и предпочтительно имеющие от 2 до 10 атомов углерода в нормальной цепочке. Типичные незамещенные группы включают, но не ограничиваются, этинил, пропинил, бутинил, пентинил, гексинил, гептинил, октинил, нонинил, децинил, и им подобные. Типичные заместители могут включать, но не ограничиваются, одну или большее количество следующих групп: галоген, алкоксигруппа, алкилтиогруппа, алкил, алкенил, арил, циклоалкил, циклоалкенил, гидроксигруппа или защищенная гидроксигруппа, карбоксильная группа (--COOH), алкилоксикарбонил, алкилкарбонилоксигруппа, алкилкарбонил, карбамоил (NH2--CO--), замещенный карбамоил.
Термин «циклоалкил», используемый в настоящем описании сам по себе или в составе другой группы, обозначает необязательно замещенные насыщенные циклические углеводородные кольцевые системы, в том числе системы колец с внутренним мостиком, предпочтительно содержащие от 1 до 3 колец и от 3 до 9 атомов углерода. Типичные незамещенные группы включают, но не ограничиваются, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклодецил и циклододецил и адамантил. Типичные заместители включают, но не ограничиваются, одну или большее количество алкильных групп, как описано выше, или одну или большее количество групп, описанных выше в качестве алкильных заместителей.
Термин «арил», используемый в настоящем описании сам по себе или в составе другой группы, обозначает необязательно замещенные гомоциклические ароматические группы, предпочтительно содержащие 1 или 2 кольца и от 6 до 12 атомов углерода на каждое кольцо. Типичные незамещенные группы включают, но не ограничиваются, фенил, бифенил и нафтил. Типичные заместители включают, но не ограничиваются, одну или большее количество нитрогрупп, алкильных групп, как описано выше, или групп, описанных выше в качестве алкильных заместителей.
Термин «гетероцикл» или «гетероциклическая система» обозначает гетероциклил, гетероцикленил или гетероарильную группу, как описано в настоящем изобретении, которые содержат атомы углерода и от 1 до 4 гетероатомов, независимо выбранных из N, O и S и включающих любую бициклическую или трициклическую группу, в которой любое из определенных выше гетероциклических колец является конденсированным с одним или большим количеством гетероциклических, арильных или циклоалкильных групп. Гетероатомы азота и серы могут быть необязательно окислены. Гетероциклическое кольцо может быть присоединено к его подвешенной группе по любому гетероатому или атому углерода, что обеспечивает стабильную структуру. Гетероциклические кольца, описанные в настоящем изобретении, могут быть замещены по атому углерода или по атому азота.
Примеры гетероциклов включают, но не ограничиваются, 1H-индазол, 2-пирролидонил, 2H,6H-1,5,2-дитиазинил, 2H-пирролил, 3H-индолил, 4-пиперидонил, 4аH-карбазол, 4H-хинолизинил, 6H-1,2,5-тиадиазинил, акридинил, азоцинил, бензимидазолил, бензофуранил, бензотиофуранил, бензотиофенил, бензоксазолинил, бензоксазолил, бензтиазолил, бензтриазолил, бензтетразолил, бензизоксазолил, бензизотиазолил, бензимидазалонил, карбазолил, 4aH-карбазолил, b-карболинил, хроманил, хроменил, циннолинил, декагидрохинолинил, 2H,6H-1,5,2-дитиазинил, дигидрофуро[2,3-b]тетрагидрофуран, фуранил, фуразанил, имидазолидинил, имидазолинил, имидазолил, 1Н-индазолил, индоленил, индолинил, индолизинил, индолил, изатиноил, изобензофуранил, изохроманил, изоиндазолил, изоиндолинил, изоиндолил, изохинолинил, изотиазолил, изоксазолил, морфолинил, нафтиридинил, октагидроизохинолинил, оксадиазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, оксазолидинил, оксазолил, оксазолидинилперимидинил, оксиндолил, фенантридинил, фенантролинил, фенарсазинил, феназинил, фенотиазинил, феноксатиинил, феноксазинил, фталазинил, пиперазинил, пиперидинил, птеридинил, пиперидонил, 4-пиперидонил, птеридинил, пуринил, пиранил, пиразинил, пиразолидинил, пиразолинил, пиразолил, пиридазинил, пиридооксазол, пиридоимидазол, пиридотиазол, пиридинил, пиридил, пиримидинил, пирролидинил, пирролинил, пирролил, хиназолинил, хмнолинил, 4Н-хинолизинил, хиноксалинил, хинуклидинил, карболинил, тетрагидрофуранил, тетрагидроизохинолинил, тетрагидрохинолинил, тетразолил, 6H-1,2,5-тиадиазинил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, тиантренил, тиазолил, тиенил, тиенотиазолил, тиенооксазолил, тиеноимидазолил, тиофенил, триазинил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,5-триазолил, 1,3,4-триазолил, ксантенил.
Термин «гетероцикленил» обозначает неароматическую моноциклическую или полициклическую углеводородную кольцевую систему, содержащую приблизительно от 3 до 10 атомов, желательно содержащую приблизительно от 4 до 8 атомов, в которой один или большее количество атомов углерода в кольцевой системе являются гетероэлементами, отличными от углерода, например, атомами азота, кислорода или серы, и которая содержит как минимум одну двойную связь углерод-углерод или двойную связь углерод-азот. Размеры колец кольцевой системы могут включать от 5 до 6 атомов в кольце. Обозначение аза-, окса- или тиа- в качестве приставки перед гетероцикленилом, говорит о том, что как минимум один атом азота, кислорода или серы присутствует соответственно как атом кольца. Гетероцикленил может быть необязательно замещен одним или большим количеством заместителей, как определено в настоящем описании. Атом азота или серы гетероцикленил а также может быть необязательно окислен до соответствующего N-оксида, S-оксида или S,S-диоксида. Термин «гетероцикленил», используемый в настоящем описании, включает в качестве примера и не ограничиваясь соединения, описанные в следующих работах: Пакетт Лео А.; «Основы современной гетероциклической химии» (У.А. Бенджамин, Нью-Йорк, 1968), в частности, в главах 1, 3, 4, 6, 7 и 9; «Химия гетероциклических соединений». Серия монографий (Джон Уайли и сыновья, Нью-Йорк, от 1950 г. по настоящее время), в частности тома 13, 14, 16, 19 и 28; Журнал американского химического общества, 82: 5566 (1960) - все содержания которых включены в качестве ссылки в настоящее описание. Типичные моноциклические азагетероцикленильные группы включают, но не ограничиваются, 1,2,3,4-тетрагидрогидропиридин, 1,2-дигидропиридил, 1,4-дигидропиридил, 1,2,3,6-тетрагидропиридин, 1,4,5,6-тетрагидропиримидин, 2-пирролинил, 3-пирролинил, 2-имидазолинил, 2-пиразолинил, и им подобные. Типичные оксагетероцикленильные группы включают, но не ограничиваются, 3,4-дигидро-2Н-пиран, дигидрофуранил и фтордигидрофуранил. Типичной полициклической оксагетероцикленильной группой является 7-оксабицикло[2.2.1]гептенил.
Термин «гетероциклил» обозначает неароматическую насыщенную моноциклическую или полициклическую кольцевую систему, содержащую приблизительно от 3 до 10 атомов углерода, желательно содержащую от 4 до 8 атомов углерода, в которой один или большее количество атомов углерода в кольцевой системе являются гетероэлементами, отличными от углерода, например, атомами азота, кислорода или серы. Размеры колец кольцевой системы могут включать от 5 до 6 атомов в кольце. Обозначение аза-, окса- или тиа- в качестве приставки перед гетероциклилом, говорит о том, что как минимум один атом азота, кислорода или серы присутствует соответственно как атом кольца. Гетероциклил может быть необязательно замещен одним или большим количеством заместителей, которые могут быть одинаковыми или различными, как определено в настоящем описании. Атом азота или серы гетероциклила также может быть необязательно окислен до соответствующего N-оксида, S-оксида или S,S-диоксида.
Термин «гетероциклил», используемый в настоящем описании, включает в качестве примера и не ограничиваясь соединения, описанные в следующих работах: Пакетт Лео А.; «Основы современной гетероциклической химии» (У.А. Бенджамин, Нью-Йорк, 1968), в частности, в главах 1, 3, 4, 6, 7 и 9; «Химия гетероциклических соединений». Серия монографий (Джон Уайли и сыновья, Нью-Йорк, от 1950 г. по настоящее время), в частности тома 13, 14, 16, 19 и 28; Журнал американского химического общества, 82: 5566 (1960). Типичные моноциклические гетероциклильные кольца включают, но не ограничиваются, пиперидил, пирролидинил, пиперазинил, морфолинил, тиоморфолинил, тиазолидинил, 1,3-диоксоланил, 1,4-диоксанил, тетрагидрофуранил, тетрагидротиофенил, тетрагидротиопиранил и им подобные.
Термин «гетероарил» обозначает ароматическую моноциклическую или полициклическую кольцевую систему, содержащую приблизительно от 5 до 10 атомов, в которой один или большее количество атомов в кольцевой системе являются гетероэлементами, отличными от углерода, например, атомами азота, кислорода или серы. Размеры колец кольцевой системы включают от 5 до 6 атомов в кольце. «Гетероарил» может быть необязательно замещен одним или большим количеством заместителей, которые могут быть одинаковыми или различными, и определены в настоящем описании. Обозначение аза-, окса- или тиа- в качестве приставки перед гетероарилом, говорит о том, что как минимум один атом азота, кислорода или серы присутствует соответственно как атом кольца. Атом азота гетероарила может быть необязательно окислен до соответствующего N-оксида. Гетероарил, используемый в настоящем описании, включает в качестве примера и не ограничиваясь соединения, описанные в следующих работах: Пакетт Лео А.; «Основы современной гетероциклической химии» (У.А. Бенджамин, Нью-Йорк, 1968), в частности, в главах 1, 3, 4, 6, 7 и 9; «Химия гетероциклических соединений». Серия монографий (Джон Уайли и сыновья, Нью-Йорк, от 1950 г. по настоящее время), в частности тома 13, 14, 16, 19 и 28; Журнал американского химического общества, 82: 5566 (1960). Типичные гетероарильные и замещенные гетероарильные группы включают, но не ограничиваются, пиразинил, тиенил, изотиазолил, оксазолил, пиразолил, фуразанил, пирролил, 1,2,4-тиадиазолил, пиридазинил, хиноксалинил, фталазинил, имидазо[1,2]пиридин, имидазо[2,1-b]тиазолил, бензофуразанил, азаиндолил, бензимидазолил, бензотиенил, тиенопиридил, тиенопиримидил, пирролопиридил, имидазопиридил, бензоазаиндол, 1,2,3-триазинил, 1,2,4-триазинил, 1,3,5-триазинил, бензтиазолил, диоксолил, фуранил, имидазолил, индолил, индолизинил, изоксазолил, изохинолинил, изотиазолил, оксадиазолил, оксазинил, оксиранил, пиперазинил, пиперидинил, пиранил, пиразинил, пиридазинил, пиразолил, пиридил, пиримидинил, пирролил, пирролидинил, хиназолинил, хинолинил, тетразинил, тетразолил, 1,3,4-тиадиазолил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, тиатриазолил, тиазинил, тиазолил, тиенил, 5-тиоксо-1,2,4-диазолил, тиоморфолиногруппу, тиофенил, тиопиранил, триазолил и триазолонил.
Термин «амино» обозначает радикал -NH2, где один или оба атома водорода могут быть замещены необязательно замещенной углеводородной группой. Типичные аминогруппы включают, но не ограничиваются, н-бутиламиногруппу, трет-бутиламиногруппу, метилпропиламиногруппу и этилдиметиламиногруппу.
Термин «циклоалкилалкил» обозначает циклоалкилалкильную группу, в которой циклоалкил, как описано выше, связан через алкил, как определено выше. Циклоалкилалкильные группы могут содержать низшую алкильную группу. Типичные циклоалкилалкильные группы включают, но не ограничиваются, циклопропилметил, циклопентилметил, циклогексилметил, циклопропилэтил, циклопентилэтил, циклогексилпропил, циклопропилпропил, циклопентилпропил и циклогексилпропил.
Термин «арилалкил» обозначает арильную группу, как описано выше, связанную через алкил, как определено выше.
Термин «гетероарилалкил» обозначает гетероарильную группу, как описано выше, связанную через алкил, как определено выше.
Термин «гетероциклилалкил» или «гетероциклоалкилалкил» обозначает гетероциклильную группу, как описано выше, связанную через алкил, как определено выше.
Термин «галоген», используемый в настоящем описании сам по себе или в составе другой группы, означает хлор, бром, фтор и йод.
Термин «галогеналкил» обозначает галогеновую группу, как описано выше, связанную через алкил, как определено выше. Типичной группой является фторалкил.
Термин «аминоалкил» обозначает аминогруппу, как определено выше, связанную через алкил, как определено выше.
Выражение «бициклическая конденсированная кольцевая система, в которой как минимум одно кольцо является частично насыщенным» обозначает конденсированную бициклическую кольцевую группу, включающую от 8 до 13 членов, в которой как минимум одно из колец является неароматическим. Кольцевая группа содержит атомы углерода и необязательно 1-4 гетероатома, независимо выбранных из N, O и S. Иллюстративные примеры включают, но не ограничиваются, инданил, тетрагидронафтил, тетрагидрохинолил и бензоциклогептил.
Выражение «трициклическая конденсированная кольцевая система, в которой как минимум одно кольцо является частично насыщенным» обозначает конденсированную трициклическую кольцевую группу, включающую от 9 до 18 членов, в которой как минимум одно из колец является неароматическим. Кольцевая группа содержит атомы углерода и необязательно 1-7 гетероатомов, независимо выбранных из N, O и S. Иллюстративные примеры включают, но не ограничиваются, флуорен, 10,11-дигидро-5Н-дибензо[a,d]циклогептен и 2,2a,7,7a-тетрагидро-1Н-циклобута[a]инден.
Термин «изотопное обогащение» относится к процессу, в котором осуществляется изменение относительной распространенности изотопа указанного элемента с получением формы элемента, обогащенной одним конкретным изотопом и обедненной другими его изотопными формами.
Термин «фармацевтически приемлемые соли» относится к производным описанных соединений, в которых исходное соединение модифицируется за счет получения солей кислоты или основания. Примеры фармацевтически приемлемых солей включают, но не ограничиваются, соли неорганических или органических кислот основных остатков, таких как амины; щелочные или органические соли кислотных остатков, таких как карбоновые кислоты и им подобные. Фармацевтически приемлемые соли включают приемлемые нетоксичные соли или четвертичные аммонийные соли исходного соединения, образованные, например, из нетоксичных неорганических или органических кислот. Например, такие приемлемые нетоксичные соли включают производные от неорганических кислот, таких как, но не ограничиваясь, соляная, бромистоводородная, серная, сульфаминовая, фосфорная, азотная и им подобные; и соли, полученные из органических кислот, такие как, но не ограничиваясь, уксусная, пропионовая, янтарная, гликолевая, стеариновая, молочная, яблочная, винная, лимонная, аскорбиновая, памовая, малеиновая, гидроксималеиновая, фенилуксусная, глутаминовая, бензойная, салициловая, сульфаниловая, 2-ацетоксибензойная, фумаровая, толуолсульфоновая, метансульфоновая, этандисульфоновая, щавелевая, изетионовая и им подобные.
Термин «полиморф» обозначает форму химического соединения, в частности, форму кристаллической структуры. Определенные полиморфы могут демонстрировать повышенную термодинамическую стабильность и могут быть более подходящими, чем другие полиморфные формы, для включения в фармацевтические составы. Соединения, содержащие атомы водорода, замещенные дейтерием, могут образовывать полиморфы, которые способны обеспечивать повышение их свойства растворимости и/или биологической доступности.
Термин «дейтерированные аналоги», используемый в настоящем описании сам по себе или в составе группы, обозначает необязательно замещенные дейтерием атомы водорода.
Кушнер и коллеги (Кушнер Д.Дж.; Бейкер А.; Данстолл Т.Дж. Кан. Журнал физиологии и фармакологии, 77(2) (1999), стр.79-88) представили примеры того, каким образом включение дейтерия в лекарственный препарат зачастую способно снизить уровень метаболически индуцированных преобразований, в частности, стимулированных цитохромом P450. Этот сниженный уровень индукции метаболизма цитохромом P450 иногда может быть непосредственно выражен в повышении биологической доступности. Причина этого связана с тем фактом, что атомное замещение водорода дейтерием в лекарственном препарате изменяет силу связи углерод-дейтерий, обеспечивая при этом сохранение очень высокой схожести его трехмерной поверхности с недейтерированной версией. Замещение дейтерия водородом может повлечь за собой возникновение изотопного эффекта, который способен изменить фармакокинетику лекарственного препарата. В реакции, в которой происходит расщепление связи С-Н, скорость аналогичной реакции для связи C-D будет снижена. Например, Шнайдер и коллеги (Шнайдер Ф. и соавт, BiRDS Pharma GmbH, Исследование лекарственного препарата (2006), 56(4), стр.295-300) продемонстрировали, что замещение нескольких атомов водорода в одном из ароматических колец ингибитора СОХ-2 рефекоксиба (4-(4-метилсульфонилфенил)-3-фенил-5Н-фуран-2-один) дейтерием (в положениях 2′, 3′, 4′ 5′ и 6′) повышало пероральную биологическую доступность лекарственного препарата, не оказывая воздействия на избирательность СОХ-2.
Фармацевтически приемлемые соли настоящего изобретения могут быть синтезированы из исходного соединения, которое содержит основной или кислотный остаток, с помощью обычных химических способов. В целом такие соли могут быть получены путем взаимодействия свободных кислотных или основных форм указанных соединений со стехиометрическим количеством подходящего основания или кислоты в воде или в органическом растворителе, или в их смеси. Органические растворители включают, но не ограничиваясь, безводную среду, такую как эфиры, этилацетат, этанол, изопропанол или ацетонитрил. Перечни подходящих солей можно найти в работе Фармацевтические науки Ремингтона, 18-е изд., Mack Publishing Company («Мак Паблишинг Компани»), Истон, Пенсильвания, 1990, стр.1445, описание которых включено в настоящее изобретение в качестве ссылки.
Выражение «фармацевтически приемлемый» обозначает те соединения, продукты, композиции и/или дозированные формы, которые находятся в рамках озвученного медицинского определения, подходящие для применения в контакте с тканями человека и животных без чрезмерной токсичности, раздражения, аллергии или другой проблемы либо с осложнением в соответствии с приемлемым соотношением польза/риск.
Термин «N-оксид» обозначает соединения, которые могут быть получены с помощью известной методики путем взаимодействия соединения настоящего изобретения, включающего атом азота (такой как в пиридильной группе) с пероксидом водорода или перкислотой, такой как 3-хлорпероксибензойная кислота, в инертном растворителе, таком как дихлорметан, в диапазоне температур приблизительно от -10 до +80°C, желательно около 0°C.
Термин «замещенный» предназначен для того, чтобы показать, что один или большее количество атомов водорода у атома, указанного в используемом выражении как «замещенный», замещены с выбором из указанной группы при условии, что указанная нормальная валентность атома не превышена и что замещение приведет к образованию стабильного соединения. Когда заместитель представляет собой кетогруппу (то есть =O), в этом случае замещенными являются 2 атома водорода у заданного атома.
Если функциональные группы соединения настоящего изобретения не были определены как незамещенные, функциональные группы соединения могут быть замещены. В дополнение к любым заместителям, описанным выше, функциональные группы соединений настоящего изобретения могут быть необязательно замещены одной или большим количеством групп, независимо выбранных из следующего перечня:
C1-C4 алкил;
C2-C4 алкенил;
C2-C4 алкинил;
CF3;
галоген;
OH;
O-(C1-C4 алкил);
OCH2F;
OCHF2;
OCF3;
OC(O)-(C1-C4 алкил);
OC(O)-(C1-C4 алкил);
OC(O)NH-(C1-C4 алкил);
OC(O)N-(C1-C4 алкил)2;
OC(S)NH-(C1-C4 алкил);
OC(S)N(C1-C4 алкил)2;
SH;
S-(C1-C4 алкил);
S(O)-(C1-C4 алкил);
SC(O)2-(C1-C4 алкил);
SC(O)-(C1-C4 алкил);
SC(O)O-(C1-C4 алкил);
NH2;
N(H)-(C1-C4 алкил);
N(C1-C4 алкил)2;
N(H)C(O)-(C1-C4 алкил);
N(CH3)C(O)-(C1-C4 алкил);
N(H)C(O)-CF3;
N(CH3)C(O)-CF3;
N(H)C(S)-(C1-C4 алкил);
N(CH3)C(S)-(C1-C4 алкил);
N(H)S(O)2-(C1-C4 алкил);
N(H)C(O)NH2;
N(H)C(O)NH-(C1-C4 алкил);
N(CH3)C(O)NH-(C1-C4 алкил);
N(H)C(O)N(C1-C4 алкил)2;
N(CH3)C(O)N(C1-C4 алкил)2;
N(H)S(O)2NH2;
N(H)S(O)2NH-(C1-C4 алкил);
N(CH3)S(O)2NH-(C1-C4 алкил);
N(H)S(O)2N(C1-C4 алкил)2;
N(CH3)S(O)2N(C1-C4 алкил)2;
N(H)C(O)O-(C1-C4 алкил);
N(CH3)C(O)O-(C1-C4 алкил);
N(H)S(O)2O-(C1-C4 алкил);
N(CH3)S(O)2O-(C1-C4 алкил);
N(CH3)C(S)NH-(C1-C4 алкил);
N(CH3)C(S)N(C1-C4 алкил)2;
N(CH3)C(S)O-(C1-C4 алкил);
N(H)C(S)NH2;
NO2;
CO2H;
CO2-(C1-C4 алкил);
C(O)N(H)OH;
C(O)N(CH3)OH;
C(O)N(CH3)OH;
C(O)N(CH3)O-(C1-C4 алкил);
C(O)N(H)-(C1-C4 алкил);
C(O)N(C1-C4 алкил)2;
C(S)N(H)-(C1-C4 алкил);
C(S)N(C1-C4 алкил)2;
C(NH)N(H)-(C1-C4 алкил);
C(NH)N(C1-C4 алкил)2;
C(NCH3)N(H)-(C1-C4 алкил);
C(NCH3)N(C1-C4 алкил)2;
C(O)-(C1-C4 алкил);
C(NH)-(C1-C4 алкил);
C(NCH3)-(C1-C4 алкил);
C(NOH)-(C1-C4 алкил);
C(NOCH3)-(C1-C4 алкил);
CN;
CHO;
CH2OH;
CH2O-(C1-C4 алкил);
CH2NH2;
CH2N(H)-(C1-C4 алкил);
CH2N(C1-C4 алкил)2;
арил;
гетероарил;
циклоалкил;
гетероциклил.
В одном варианте осуществления настоящего изобретения соединения, ингибирующие металлопротеазы, могут быть представлены общей формулой (I-XIII):
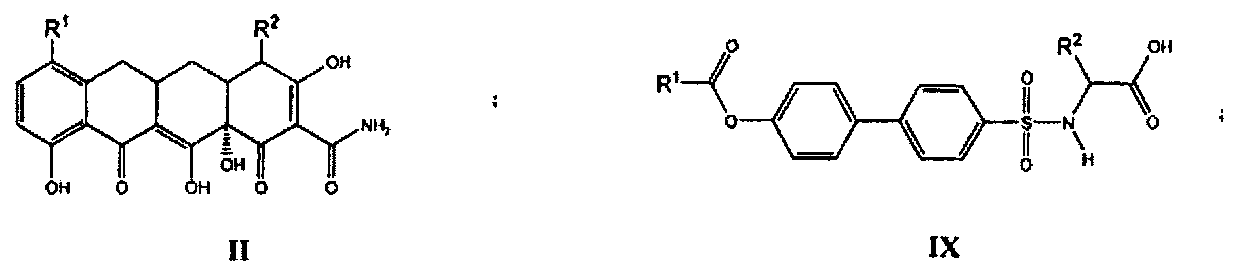
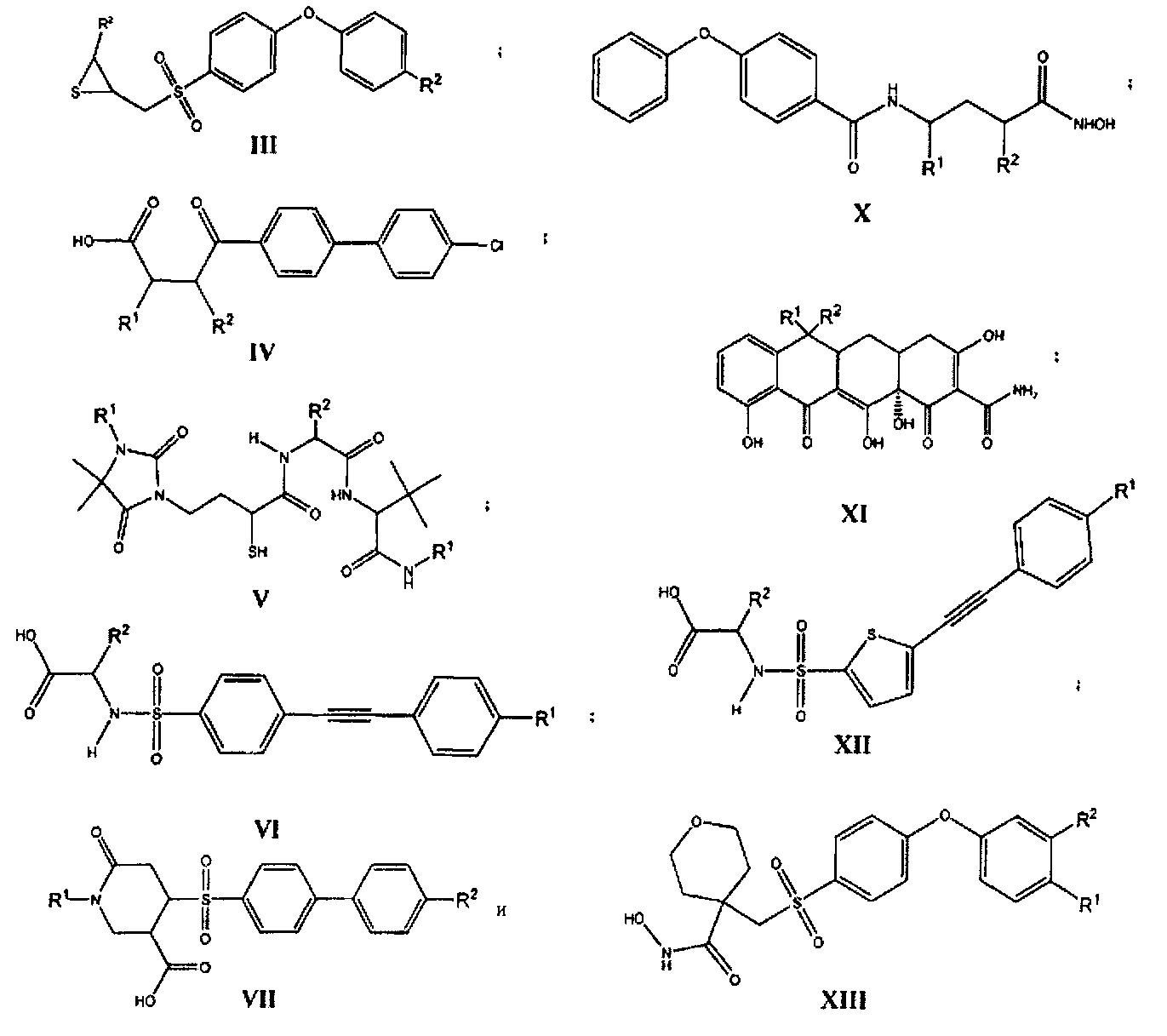
где все переменные в предыдущих формулах (I-XIII) определены ниже в настоящем описании.
R1, R2 независимо выбраны из группы, состоящей из водорода, галогена, алкила, циклоалкила, гетероциклоалкила, бициклоалкила, гетеробициклоалкила, спироалкила, спирогетероалкила, арила, гетероарила, циклоалкила, конденсированного с арилом, гетероциклоалкила, конденсированного с арилом, циклоалкила, конденсированного с гетероарилом, гетероциклоалкила, конденсированного с гетероарилом, циклоалкилалкила, гетероциклоалкилалкила, бициклоалкилалкила, гетеробициклоалкилалкила, спироалкилалкила, спирогетероалкилалкила, арилалкила, гетероарилалкила, циклоалкила, конденсированного с арилалкилом, гетероциклоалкила, конденсированного с арилалкилом, циклоалкила, конденсированного с гетероарилалкилом, гетероциклоалкила, конденсированного с гетероарилалкилом, гетероциклоалкила, бициклоалкила, гетеробициклоалкила, спироалкила, спирогетероалкила, арила, гетероарила, циклоалкила, конденсированного с арилом, гетероциклоалкила, конденсированного с арилом, циклоалкила, конденсированного с гетероарилом, гетероциклоалкила, конденсированного с гетероарилом, циклоалкилалкила, гетероциклоалкилалкила, бициклоалкилалкила, гетеробициклоалкилалкила, спироалкилалкила, спирогетероалкилалкила, арилалкила, гетероарилалкила, циклоалкила, конденсированного с арилалкилом, гетероциклоалкила, конденсированного с арилалкилом, циклоалкила, конденсированного с гетероарилалкилом, гидроксигруппы, алкоксигруппы, арила, гетероарила, арилалкила, гетероарилалкила, алкенила, алкинила, NO2, NR9R9, NR9NR9R9, NR9N=CR9R9, NR9SO2R9, CN, C(O)OR9 и фторалкила, где алкил, циклоалкил, алкоксигруппа, алкенил, алкинил и фторалкил являются необязательно замещенными один или большее количество раз, гетероциклоалкил конденсированный с гетероарилалкилом являются необязательно замещенными один или большее количество раз;
его N-оксиды, дейтерированные аналоги, фармацевтически приемлемые соли, пролекарства, лекарственные формы, полиморфы, таутомеры, рацемические смеси и стереоизомеры.
Предусматривается, что соединения настоящего изобретения, представленные описанными выше формулами, включают все диастереомеры и энантиомеры, а также рацемические смеси. Рацемические смеси могут быть разделены с применением разделения хиральных солей или высокоэффективной жидкостной хроматографии на хиральной колонке. Как было указано выше, соединения настоящего изобретения, представленные описанными выше формулами, включают дейтерированные аналоги, в молекулах которых один или более атомов водорода замещены атомами дейтерия.
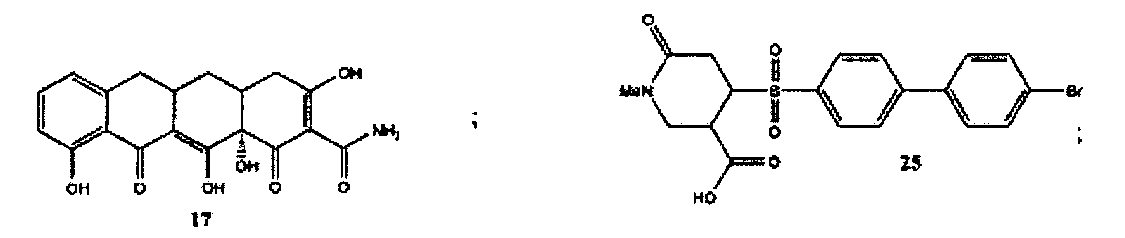
Более конкретно, соединения формулы (I-XIII) могут быть выбраны, но не ограничиваясь, из следующей группы:
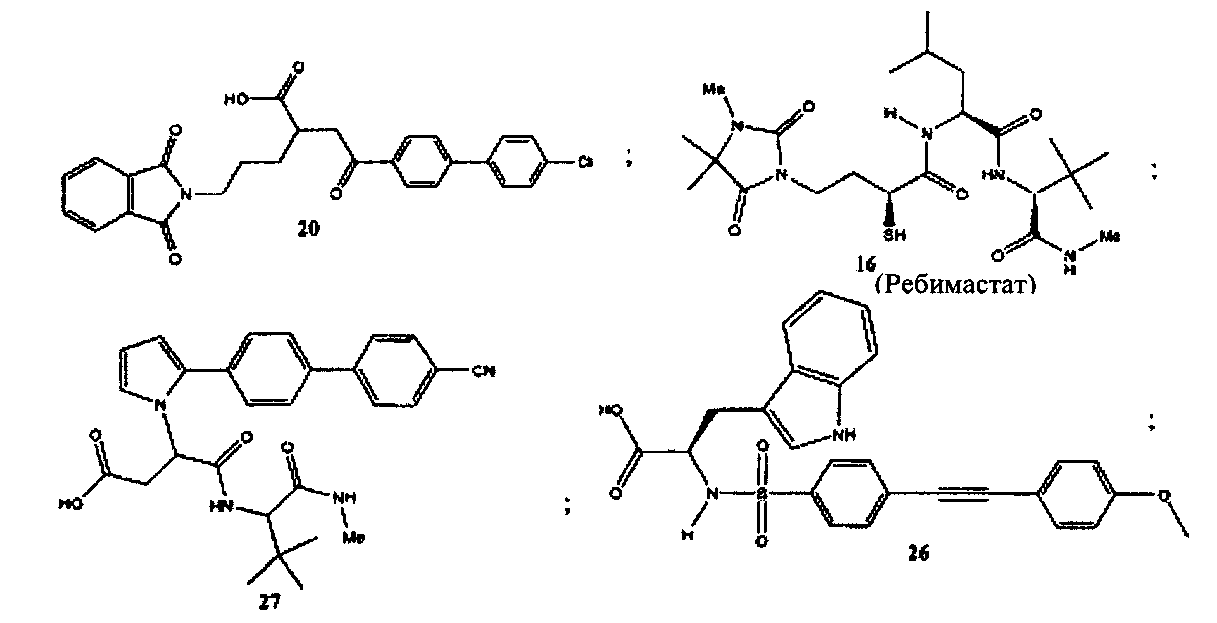
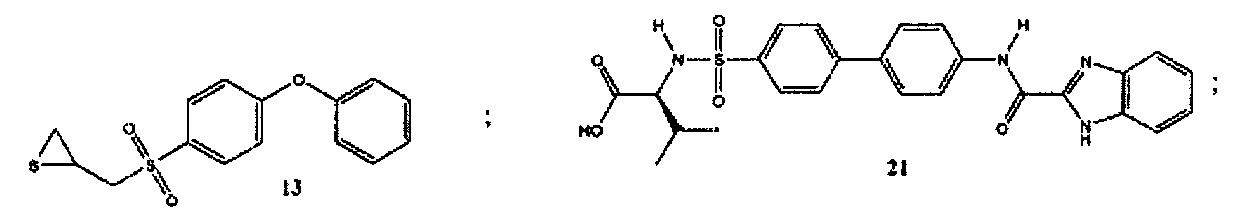
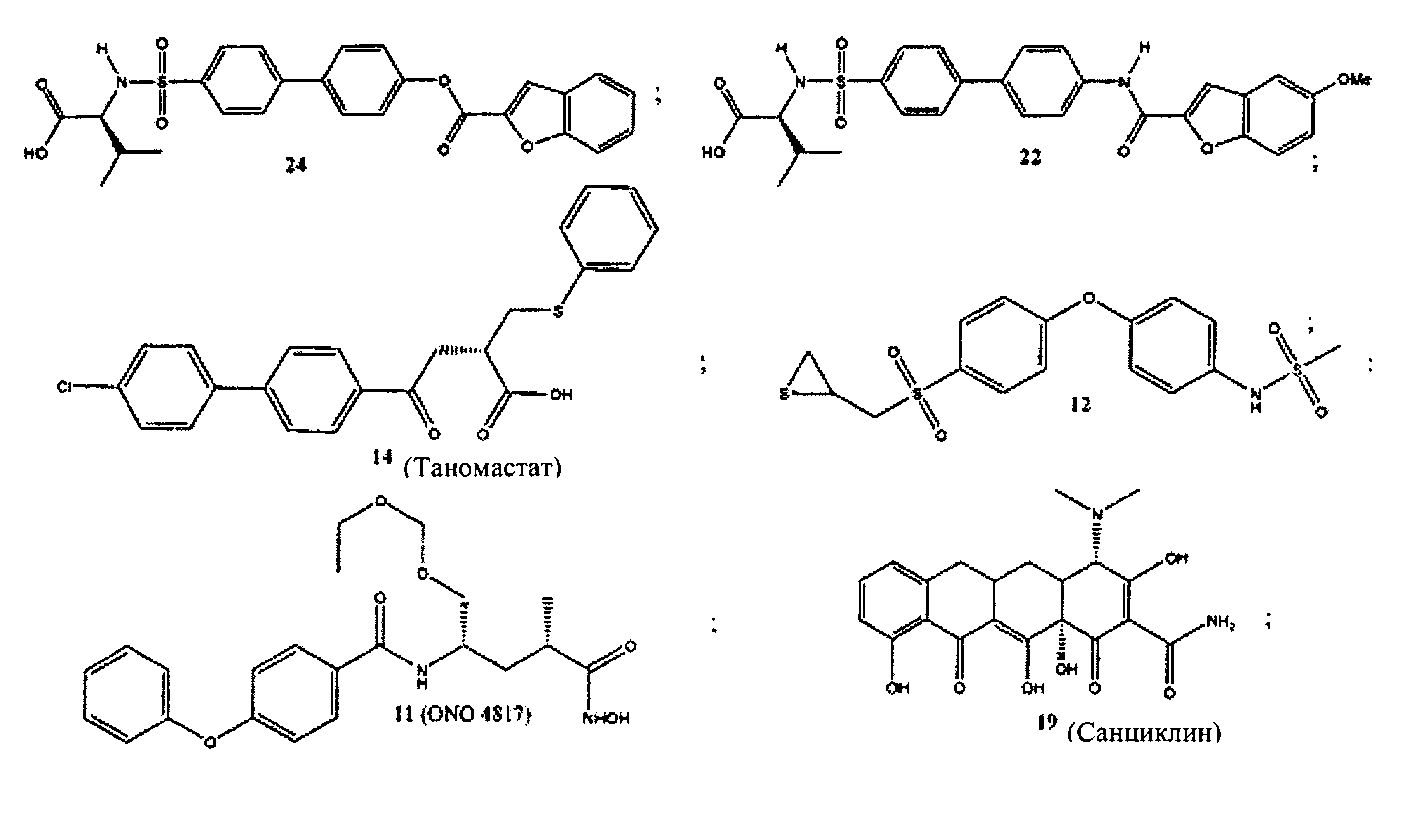
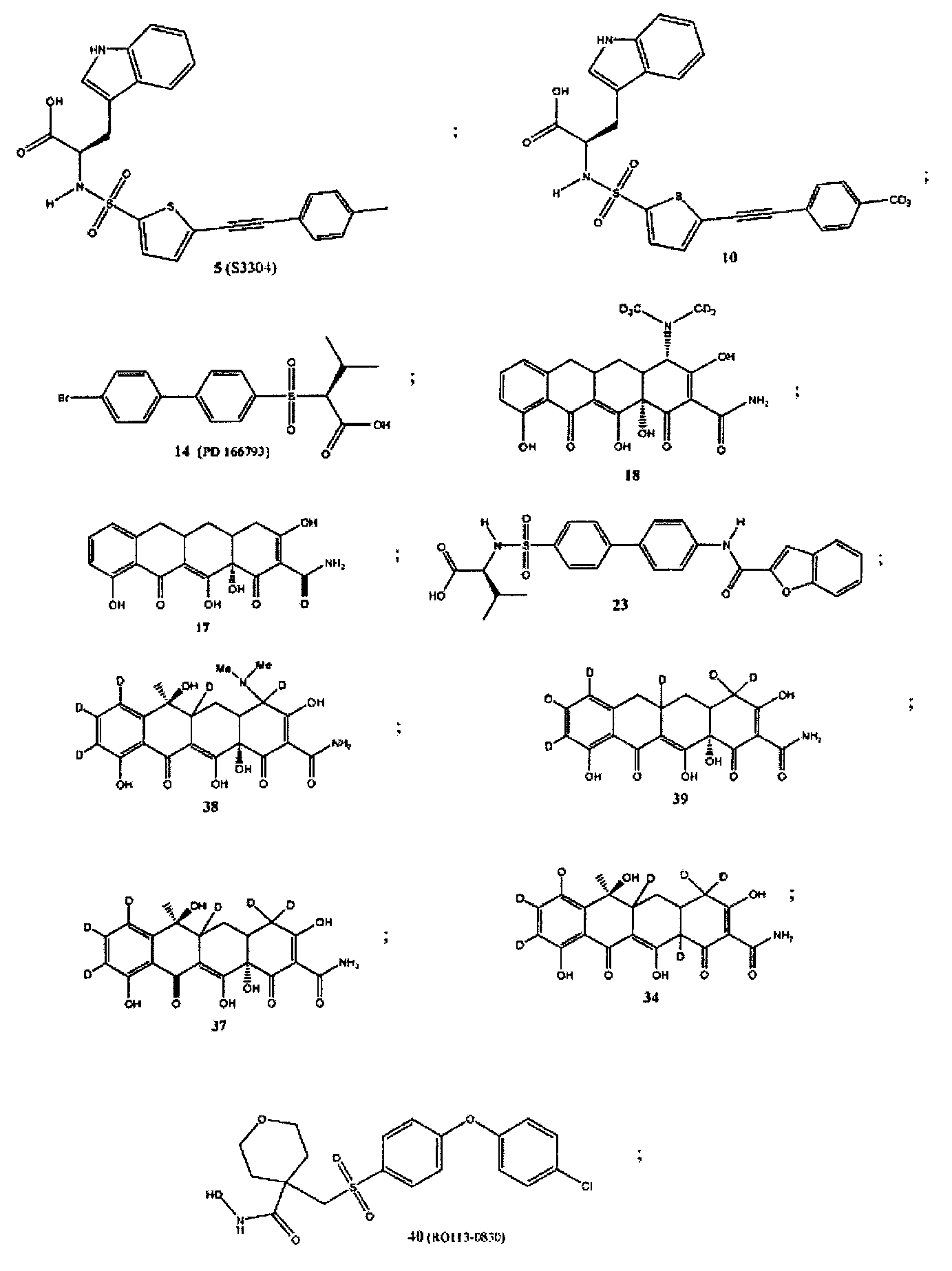
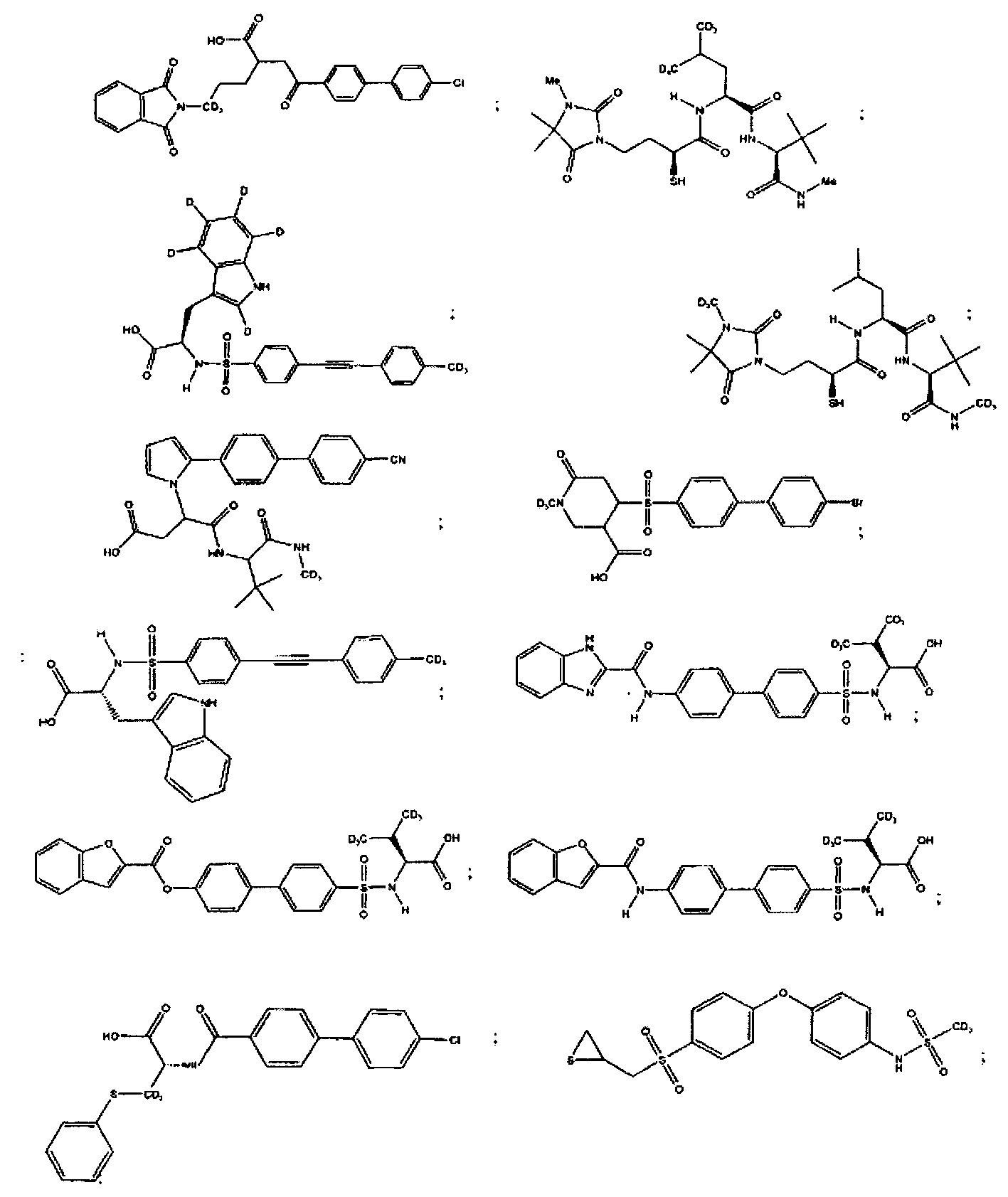
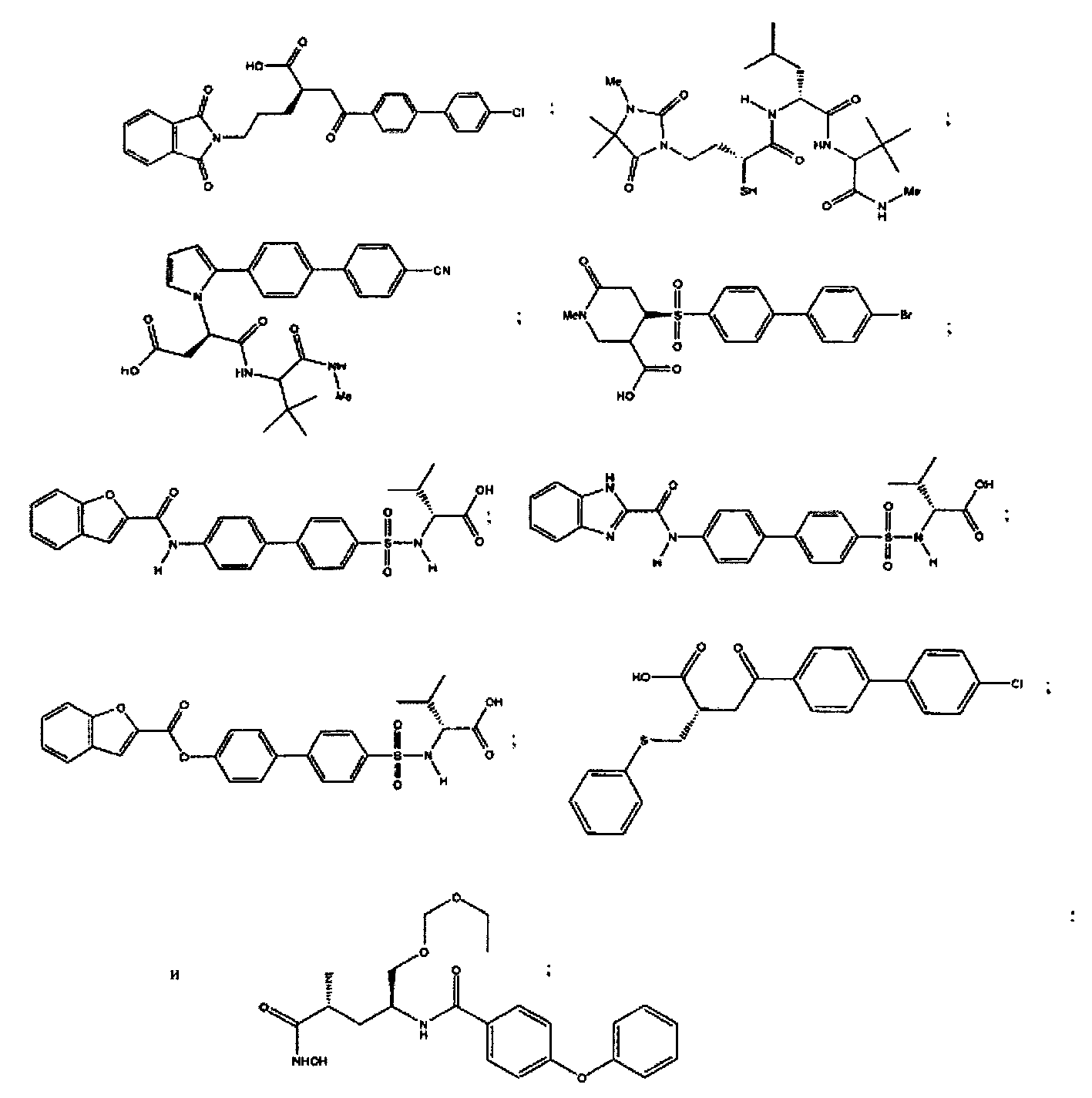
Настоящее изобретение также относится к фармацевтическим композициям, включающим любое из соединений настоящего изобретения, ингибирующих ММП-2 и/или ММП-9, описанных выше. В соответствии с этим в некоторых вариантах осуществления настоящего изобретения предлагается фармацевтическая композиция, которая может включать эффективное количество соединения настоящего изобретения, ингибирующего ММП-2 и/или ММП-9, и фармацевтически приемлемый носитель.
Настоящее изобретение также относится к способам ингибирования ММП-2 и/или ММП-9 и способам лечения заболеваний или симптомов, обусловленных активностью ферментов ММП-2 и/или ММП-9. Такие способы включают введение соединения настоящего изобретения, ингибирующего ММП-2 и/или ММП-9, такого как соединение с формулой (I-XIII), как определено выше, его дейтерированного аналога или N-оксида, фармацевтически приемлемой соли, полиморфа или стереоизомера. Примеры заболеваний или симптомов, обусловленных активностью ферментов ММП-2 и/или ММП-9, включают, но не ограничиваются, гипертрофированную чувствительность к боли, такую как гипералгезия, каузалгия и аллодиния; острую боль, жгучую боль; боль, вызванную механическим путем, атипичную лицевую боль; невропатическую боль; боль в спине; комплексные региональные болевые синдромы I и II; артритическую боль; боль от спортивных травм; боль, связанную с вирусным заражением и постгерпетической невралгией; фантомную боль конечностей; родовые схватки; раковую боль; боль после химиотерапии; постинсультную боль; послеоперационную боль; физиологическую боль; воспалительную боль; боль острых воспалительных состояний/боль во внутренних органах, стенокардию, раздражающий кишечный синдром и воспалительные заболевания кишечника; невропатическую боль; невралгию; болевую диабетическую невропатию; травматическое повреждение нервов; повреждение спинного мозга; зависимость от лекарственных средств и/или толерантность или абстиненцию от опиоидов или других вызывающих зависимость лекарственных средств.
В некоторых вариантах осуществления настоящего изобретения соединения, ингибирующие ММП-2 и/или ММП-9, определенные выше, применяются в производстве лекарственного средства для лечения заболевания, обусловленного активностью ММП-2 и/или ММП-9.
В некоторых вариантах осуществления изобретения соединения, ингибирующие ММП-2 и/или ММП-9, могут быть использованы в сочетании с препаратом, активным или терапевтическим средством, таким как, но не ограничиваясь: (a) болезнь-модифицирующий противоревматический препарат; (b) нестероидный противовоспалительный препарат; (c) избирательный ингибитор СОХ-2; (d) ингибитор СОХ-1; (e) иммунодепрессивный препарат; (f) стероид; (g) модификатор биологической реакции; (h) опиоид или (i) другие противовоспалительные препараты или терапевтические средства, используемые для лечения опосредуемых хемокинами заболеваний.
Примеры болезнь-модифицирующих противоревматических препаратов включают, но не ограничиваются, метотрексат, азатиопринлуфлунамид, пеницилламин, соли золота, микофенолат, мофетил и циклофосфамид.
Примеры нестероидных противовоспалительных препаратов включают, но не ограничиваются, пироксикам, кетопрофен, напроксен, индометацин и ибупрофен.
Примеры избирательных ингибиторов СОХ-2 включают, но не ограничиваются, рофекоксиб, целекоксиб и вальдекоксиб.
Пример ингибитора СОХ-1 включает, но не ограничивается, пироксикам.
Примеры иммунодепрессивных препаратов включают, но не ограничиваются, метотрексат, циклоспорин, лефлунимид, такролимус, рапамицин и сульфасалазин.
Примеры стероидов включают, но не ограничиваются, p-метазон, преднизон, кортизон, преднизолон и дексаметазон.
Примеры модификаторов биологической реакции включают, но не ограничиваются, антитела анти-ФНО, антагонисты ФНО-α, антагонисты IL-1, анти-CD40, анти-CD28, IL-10 и антиадгезивные молекулы.
Примеры противовоспалительных препаратов или терапевтических средств включают, но не ограничиваются, ингибиторы киназы p38, ингибиторы PDE4, ингибиторы TACE, антагонисты хемокиновых рецепторов, талидомид, ингибиторы лейкотриенов и другие низкомолекулярные ингибиторы продуцирования провоспалительных цитокинов.
В соответствии с другим вариантом осуществления настоящего изобретения фармацевтическая композиция может включать эффективное количество соединения настоящего изобретения, фармацевтически приемлемый носитель и препарат, активное или терапевтическое средство, выбранное из группы, включающей: (a) болезнь-модифицирующий противоревматический препарат; (b) нестероидный противовоспалительный препарат; (c) избирательный ингибитор СОХ-2; (d) ингибитор СОХ-1; (e) иммунодепрессивный препарат; (f) стероид; (g) модификатор биологической реакции; (h) опиоид; (i) другие противовоспалительные препараты или терапевтические средства, используемые для лечения опосредуемых хемокинами заболеваний.
Ингибирующая ММП активность соединений настоящего изобретения, ингибирующих ММП, может быть измерена с помощью любого подходящего исследования, известного в данной области. Стандартные исследования in vitro для измерения ингибирующей активности в отношении ММП-2 описаны в примере 130, а в отношении ММП-9 - в примере 131. Кроме того, стандартные исследования in vitro для измерения ингибирующей активности в отношении ММП-1, ММП-7, ММП-12 и ММП-13 описаны в примерах 132-136. Стандартные исследования in vitro для измерения микросомальной стабильности у мышей и человека представлены в примере 105. Свойства ингибирования боли in vivo соединений настоящего изобретения, ингибирующих ММП, могут быть измерены с применением любой подходящей животной модели, известной в данной области. Стандартные испытания in vivo для измерения ингибирования невропатической боли описаны в примерах 110 и 111, а испытания для измерения воспалительной боли описаны в примере 120. Наконец стандартные испытания in vivo для измерения морфиновой толерантности и абстиненции, которая спровоцирована налоксоном, описаны в примере 125, а стандартные испытания in vivo для измерения обусловленного стимулами рецидива, описаны в примере 126.
Соединения изобретения, ингибирующие ММП, обладают ингибирующей активностью (IC50 ММП-2 и/или ММП-9) в пределах от около 0,2 нМ до около 20 мкМ и, как правило, от около 1 нМ до около 2 мкМ. Синтез соединений настоящего изобретения, ингибирующих ММП, и их биологический анализ описаны в последующих примерах, которые не должны каким-либо образом ограничивать изобретение.
ПРИМЕРЫ И СПОСОБЫ
Все реагенты и растворители получают из коммерческих источников и используют без дополнительной очистки. Протонный спектр (1H) регистрируют на ЯМР спектрометре в дейтерированных растворителях. Флэш-хроматографию выполняют с использованием силикагеля «Мерк», градиент 60, 70-230 меш и подходящих органических растворителей, как показано в конкретных примерах. Тонкослойную хроматографию (ТСХ) проводят на силикагельных пластинках с УФ определением.
Пример 1
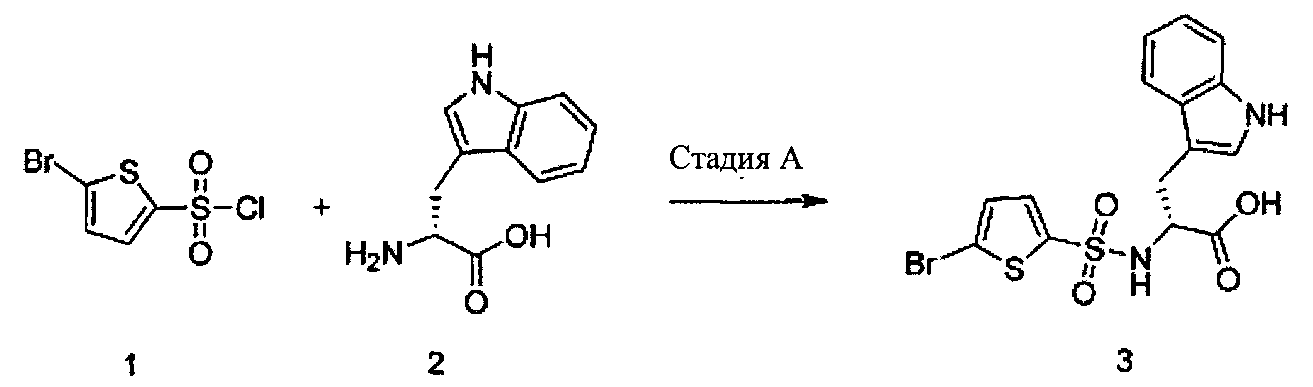
Стадия A
К суспензии (R)-2-амино-3-(1Н-индол-3-ил)-пропионовой кислоты 2 (0,23 г, 1,12 ммоль) (Alfa-Aesar («Альфа Аэсар»), A-18426) в ацетоне (3 мл) добавили 2М карбоната натрия (1 мл) с перемешиванием при комнатной температуре в течение 30 минут. К этой смеси добавили бромсульфонилхлорид 1 (0,13 г, 0,5 ммоль) (Alfa-Aesar А-14677) с перемешиванием при 0°C в течение 15 минут. Далее реакционную смесь перемешивали на протяжении 1 часа при комнатной температуре. После выливания в воду (20 мл) раствор промыли эфиром (x3). Водный слой окислили 1М HCl с последующим экстрагированием этилацетатом (x3). Далее комбинированные органические экстракты промыли рассолом и высушили (Na2SO4) с получением сырого продукта (R)-2-(5-бромтиофен-2-сульфониламино)-3-(1Н-индол-3-ил)-пропионовой кислоты (3) (0,16 г, 74%). ЖХ-МС (ЭС+) 429, 431; (ЭС-) 427, 429.
Часть сырого продукта (R)-2-(5-бромтиофен-2-сульфониламино)-3-(1Н-индол-3-ил)-пропионовой кислоты (3) была направлена на следующую стадию без дальнейшей очистки.
Пример 2
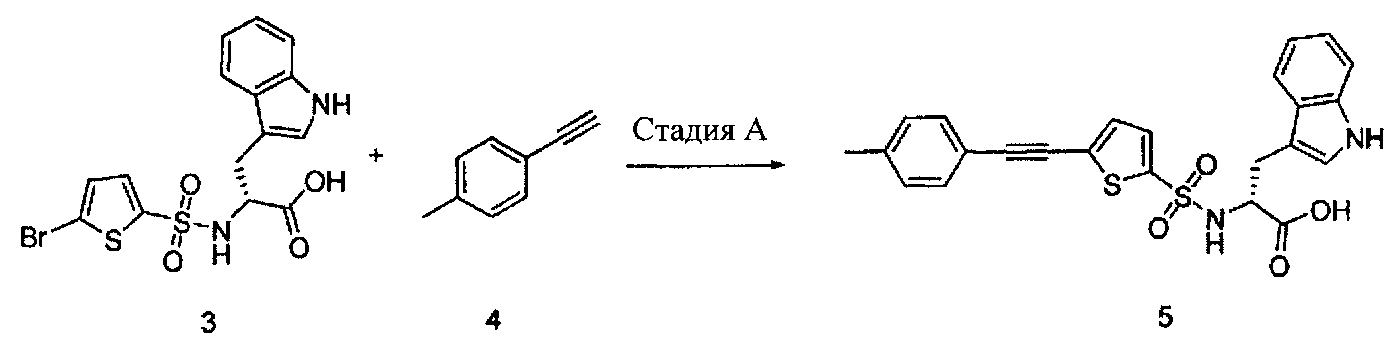
Стадия A
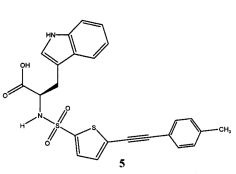
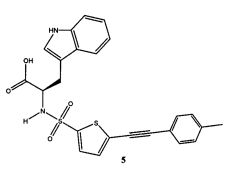
В круглодонную колбу была добавлена сырая (R)-2-(5-бромтиофен-2-сульфониламино)-3-(1Н-индол-3-ил)-пропионовая кислота (3) (60 мг, 0,14 ммоль), п-толилацетилен 4 (480 мг, 0,41 ммоль), PdCl2P(PPh3)2 (10 мг, 0,015 ммоль), йодид меди (I) (2 мг, 0,01 ммоль) и триэтиламин (0,025 г, 0,25 ммоль), после чего выполнено растворение в сухом ДМФА (2 мл) в атмосфере азота. Далее был выполнен нагрев реакционной смеси при 50°C в атмосфере азота в течение 2 часов. Затем реакционная смесь была охлаждена до комнатной температуры, разбавлена этилацетатом и промыта раствором, содержащим NaCl/NaHCO3/(NH4)2CO3/воду (1:1:1:1) (x3), водой, после чего высушена над сульфатом натрия (Na2SO4). Сырой продукт был очищен с применением колонки SAX с получением желаемой (R)-3-(1Н-индол-3-ил)-2-(5-п-толилэтинил-тиофен-2-сульфониламино)-пропионовой кислоты 5 (0,036 г, 55%).
Пример 2 реакция A была повторена в том же масштабе, как указано выше, после чего продукт реакции был объединен с предыдущей партией. Объединенные продукты далее были очищены с использованием препаративной обращенно-фазовой ВЭЖХ с получением (R)-3-(1H-индол-3-ил)-2-(5-п-толилэтинил-тиофен-2-сульфониламино)-пропионовой кислоты 5 с чистотой >95% (контроль методом ВЭЖХ). ЖХ-МС (ЭС+) 465; (ЭС-) 463; 1Н ЯМР (300 МГц, ДМСО-d6) δ 2,35 (с, 3Н), 2,86-2,94 (м, 1Н), 3,08-3,16 (м, 1Н), 3,96-4,40 (м, 1Н), 6,93-7,50 (м, 11Н), 8,67 (д, 1Н, J=8,7 Гц), 10,83 (с, 1Н).
Пример 3: синтез исходного материала 4-йодтолуола (D3, 98%)
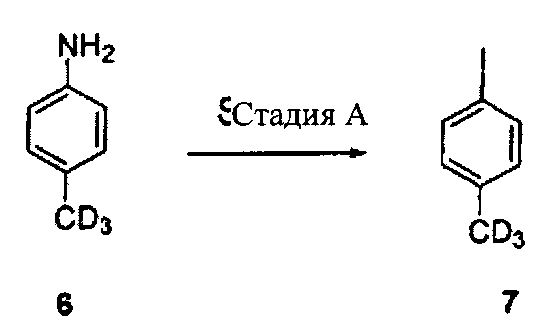
Стадия A
В соответствии с классическим методом Грисса («Практическая органическая химия», Ричард Клэй и сыновья, страница 144, препарат №60 (1900)), в котором к 0,2 грамма (1,8 ммоль) толуидина (D3, 98%), коммерчески полученного из изотопов C/D/N (Квебек, Канада) (6), добавили 0,4 мл D2SO4 (коммерчески полученной от компании Cambridge Isotope Laboratories (Кембридж Изотоп Лабораториз), Андовер, Массачусетс), и охладили полученную смесь до снижения температуры перемешиваемой смеси до 0°C, после чего медленно добавили 160 мг (2,32 ммоль) нитрита натрия тремя частями на протяжении 10 минут, контролируя, чтобы температура не поднималась выше 10°C. После добавления нитрита натрия добавили раствор, содержащий 48 мг (2,9 ммоль) KI в 1 мл D2O (коммерчески полученной от компании Cambridge Isotope Laboratories), и реакционную смесь оставили для нагрева до комнатной температуры и перемешивали в течение 1 часа. Далее реакционную смесь разбавили D2O (10 мл) и экстрагировали эфиром (x2). После этого слой эфира промыли 10% Na2S2O3 в D2O (x2) и высушили над безводным сульфатом натрия. Далее сырой продукт (7) очистил с помощью колоночной хроматографии с использованием гексана в качестве элюента для получения желаемого чистого продукта 4-йодтолуола (D3, 98%) (7) (0,16 г, 40%). 1Н ЯМР (300 МГц, CDCl3): δ, 6,93 (д, 2Н, J=7,8 Гц), 7,56 (д, 2Н, J=7,8 Гц).
При замещении D2SO4 на DCl (коммерчески полученную от компании Cambridge Isotope Laboratories, Андовер, Массачусетс) был достигнут всего 20% выход 7.
Пример 4
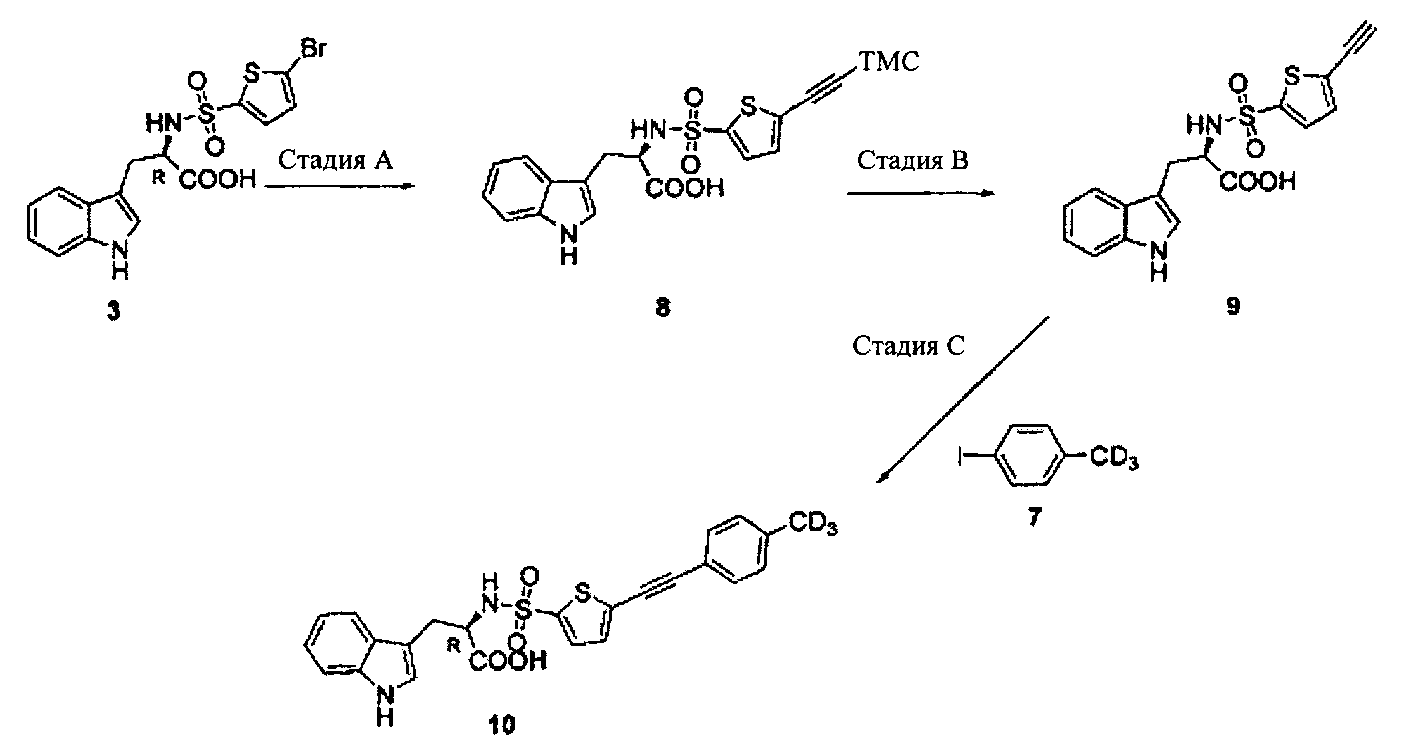
Стадия A
В круглодонную колбу была добавлена сырая смесь продукта (R)-2-(5-бромтиофен-2-сульфониламино)-3-(1Н-индол-3-ил)-пропионовой кислоты (3) (0,25 г, 0,584 ммоль) (синтезированного на стадии A примера 1), коммерчески доступного этинилтриметилсилана (0,17 г, 1,73 ммоль), PdCl2P(PPh3)2 (0,041 г, 0,061 ммоль), йодида меди (I) (0,006 г, 0,0315 ммоль) и триэтиламина (0,177 г, 1,75 ммоль), после чего выполнено растворение в сухом ДМФА (3 мл) в атмосфере азота и выполнен нагрев смеси при 50°C в течение двух часов. Затем реакционная смесь была разбавлена этилацетатом и промыта раствором, содержащим NaCl/NaHCO3/(NH4)2CO3/воду (1:1:1:1) (x3), водой, рассолом и высушена (Na2SO4) с получением желаемой сырой (R)-3-(1H-индол-3-ил)-2-(5-триметилсиланилэтинил-тиофен-2-сульфониламино)-пропионовой кислоты 8 (185 мг, 71%). ЖХ-МС (ЭС+) 447; (ЭС-) 445.
Стадия B
К раствору сырой (R)-3-(1Н-индол-3-ил)-2-(5-триметилсиланилэтинил-тиофен-2-сульфониламино)-пропионовой кислоты 8 (0,126 г, 0,282 ммоль) в смеси дихлорметан/метанол (1:1, 10 мл) был добавлен K2CO3 (0,047 г, 0,34 ммоль) и выполнено перемешивание в течение 60 минут. Далее реакционная смесь была отфильтрована, а концентрат промыт смесью дихлорметан-метанол. Объединенный фильтрат был концентрирован при сниженном давлении, а затем очищен с применением колонки SAX для получения (R)-2-(5-этинилтиофен-2-сульфониламино)-3-(1Н-индол-3-ил)-пропионовой кислоты 9 (52 мг, 49%). ЖХ-МС (ЭС+) 375; (ЭС-) 373.
Стадия C
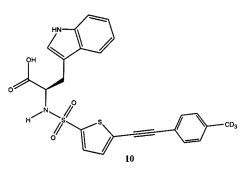
В круглодонную колбу были добавлены (R)-2-(5-этинилтиофен-2-сульфониламино)-3-(1Н-индол-3-ил)-пропионовая кислота 9 (0,052 г, 0,139 ммоль), йодтолуол (D3, 98%) 7 (0,061 г, 0,28 ммоль) (полученный из коммерчески доступного 4-аминотолуола (D3, 98%) с применением реакции Зандмейера, представленной в примере 3), PdCl2P[(PPh3)]2 (0,01 г, 0,015 ммоль), йодид меди (I) (0,002 г, 0,0105 ммоль) и триэтиламин (0,025 г, 0,247 ммоль), после чего выполнено растворение в сухом ДМФА (3 мл) в атмосфере азота и выполнен нагрев смеси при 50°C в течение двух часов. Затем реакционная смесь была охлаждена, разбавлена этилацетатом и промыта раствором, содержащим NaCl/NaHCO3/(NH4)2CO3/воду (1:1:1:1) (x3), водой, рассолом и высушена над сульфатом натрия (Na2SO4). Смесь была отфильтрована, и фильтрат был выпарен при пониженном давлении с получением сырого 10, который был очищен с применением колоночной хроматографии SAX с получением очищенного 10 (0,025 г, 38%). Продукт был подвергнут дальнейшей очистке с применением препаративной обращенно-фазовой ВЭЖХ для получения желаемого продукта 10 (R)-3-(1Н-индол-3-ил)-2-[5-4-тридейтерометил-фенилэтинил)-тиофен-2-сульфониламино]-пропионовой кислоты (D3, 98%) с чистотой >95% (контроль методом ВЭЖХ). ЖХ-МС (ЭС+) 468; (ЭС-) 466. 1Н ЯМР (300 МГц, МеОН-d4) δ 3,17-3,25 (м), 4,32-4,35 (м), 5,60-5,66 (м), 7,05-7,68 (м), 10,4 (уш с).
Пример 5
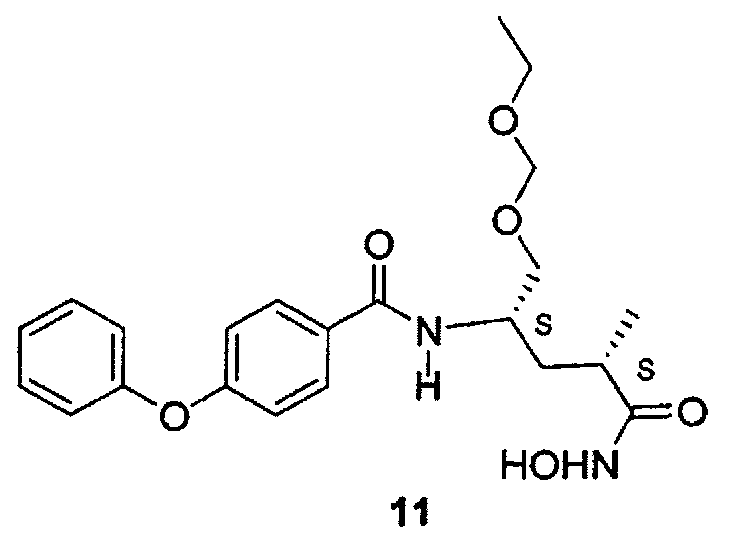
N-(1-этоксиметоксиметил-3-гидроксикарбамоил-бутил)-4-феноксибензамид (11) (ONO 4817) может быть получен коммерчески от компании Tocris Biosciences (Эллисвилль, Миссури).
Пример 6
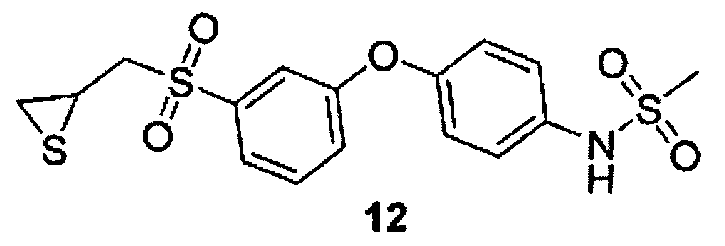
N-[4-(3-тииранилметансулфонил-фенокси)-фенил]-метансульфонамид (12) (Липтон и соавт., WO 2006/036928, и Икеджири М. и соавт., Журнал биологической химии, 280, 33992 (2005)) может быть получен коммерчески от компании EMD Biosciences («ЕМД Биосайнсиз») (Гиббстаун, Нью-Джерси).
Пример 7
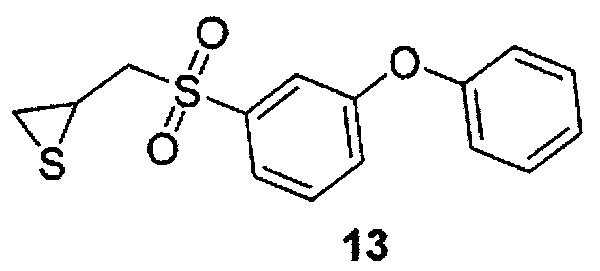
2-(3-фенокси-бензолсульфонилметил)-тииран (13) (Липтон и соавт., WO 2006/036928, и Клейфилд О. и соавт., Журнал биологической химии, 276, 17126 (2001)) может быть получен коммерчески от компании EMD Biosciences (Гиббстаун, Нью-Джерси) или от компании Biomol («Биомоль») (Плимут-Митинг, Пенсильвания).
Пример 8
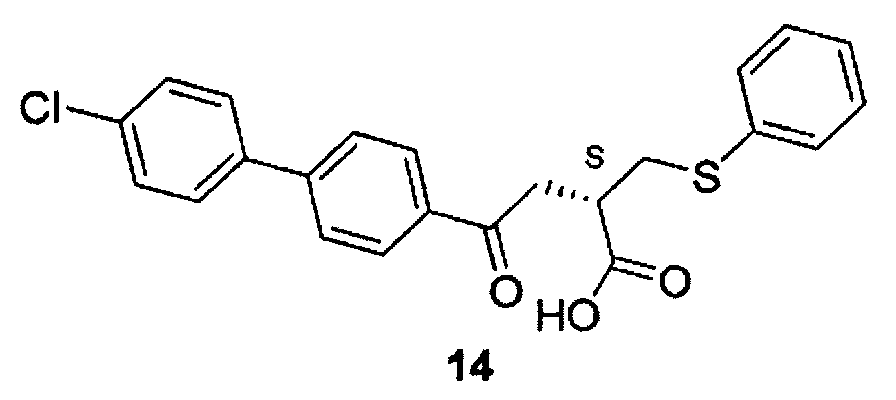
4-(4′-хлорбифенил-4-ил)-4-оксо-2-фенилсульфанилметилмасляная кислота (14) [таномастат] может быть получен коммерчески от компании Toronto Research Chemicals («Торонто Рисеч Кемикалс») (Онтарио, Канада) или от компании Texas Biochemicals («Тексас Биокемикалс») (Колледж-Стейшен, Техас) или может быть синтезирован в соответствии с процедурой, описанной в литературе (Клюндер X. и соавт., US 5886022 (1999)).
Пример 9
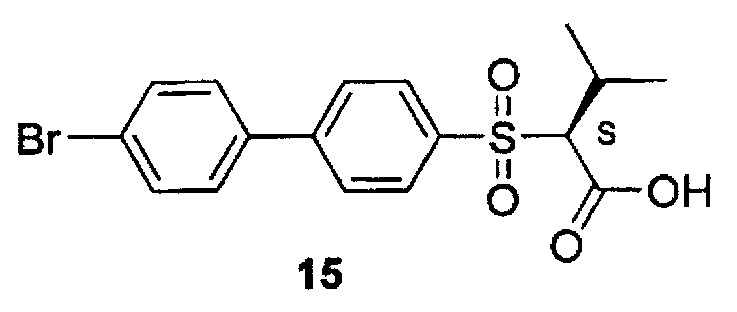
2-(4′-бромбифенил-4-сульфонил)-3-метилмасляная кислота (15) (PD 166793) может быть получен коммерчески от компании Tocris Biosciences (Токрис Биосайнсиз) (Эллисвилль, Миссури).
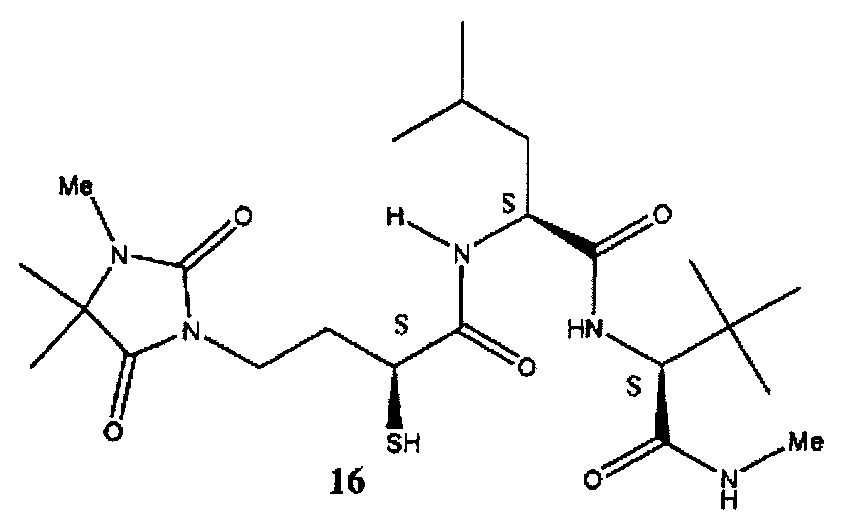
2-[2-меркапто-4-(3,4,4-триметил-2,5-диоксоимидазолин-1-ил)-бутириламино]-4-метилпентановая кислота (2,2-диметил-1-метилкарбамоил-пропил)-амид (16) [ребимастат или BMS-2752991] (Франс С, Органический дайджест, 2005 (7 (14), 3009 (2005)) может быть коммерчески получена от компании Finechemie & Pharma Co., Ltd. («Файнкеми энд Фарма Ко Лтд») (Чунцин, Китай) или китайской фармацевтической группы CSPC (Шицзячжуан, Китай) либо синтезирован в соответствии с процедурой, описанной в литературе (Франс С, Органический дайджест, 2005 (7 (14), 3009 (2005)).
Пример 11
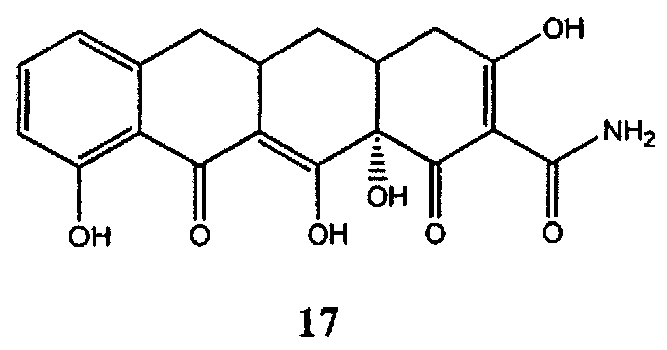
Амид 3,10,12,12a-тетрагидрокси-1,11-диоксо-1,4,4a,5,5a,6,11,12a-октагидронафтацен-2-карбоновой кислоты (17) (Рудек М. и соавт., Журнал клинической онкологии, 19, 584-592 (2001)) может быть коммерчески получен от компании Sigma-Aldrich («Сигма-Алдрич») (Милуоки, Висконсин).
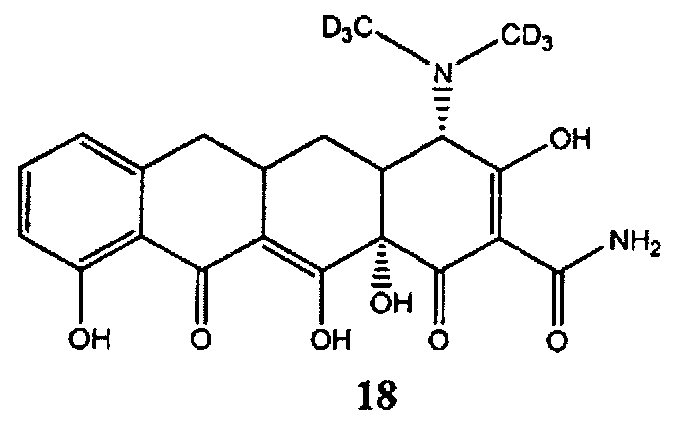
Амид 4-диметил-(D6, 98%)-3,10,12,12a-тетрагидрокси-1,11-диоксо-1,4,4a,5,5a,6,11,12a-октагидронафтацен-2-карбоновой кислоты (18) может быть получен коммерчески от компании Toronto Research Chemicals («Торонто Рисеч Кемикалс») (Онтарио, Канада).
Пример 13
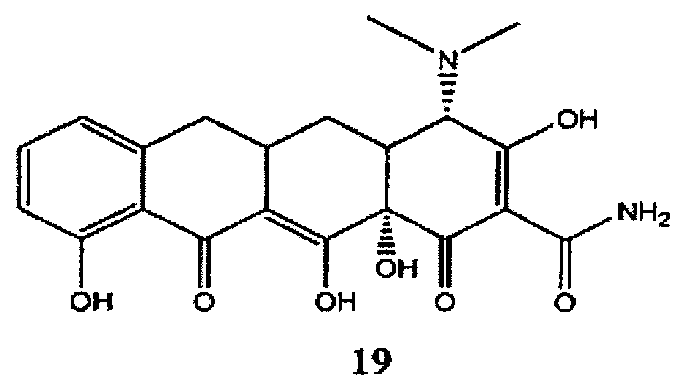
Амид 4-диметиламино-3,10,12,12a-тетрагидрокси-1,11-диоксо-1,4,4a,5,5a,6,11,12a-октагидронафтацен-2-карбоновой кислоты (19) (санциклин) может быть получен коммерчески от компании Toronto Research Chemicals (Онтарио, Канада).
Пример 14
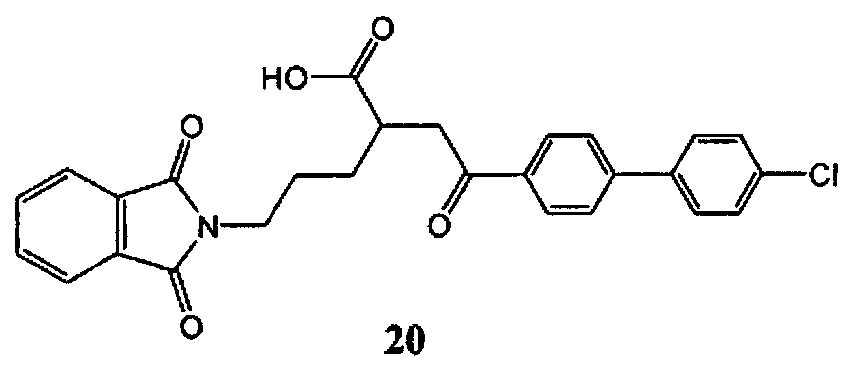
2-[2-(4′-хлорбифенил-4-ил)-2-оксоэтил]-5-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)-пентановая кислота (20) (санциклин) может быть синтезирована в соответствии с процедурой, описанной в литературе (Клюндер X. и соавт., US 5886022 (1999); пример 189).
Пример 15
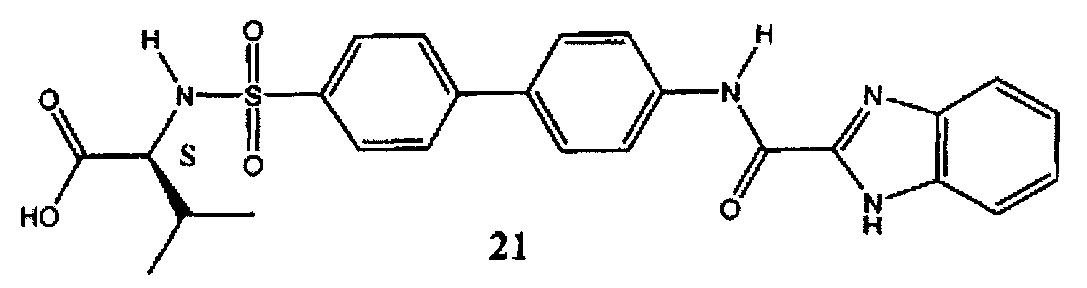
2-{4′-[(1Н-бензоимидазол-2-карбонил)-амино]-бифенил-4-сульфониламино}-3-метилмасляная кислота (21) может быть синтезирована в соответствии с процедурой, описанной в литературе (Левин Дж.И. и соавт., US 7420001 B2 (2008)).
Пример 16
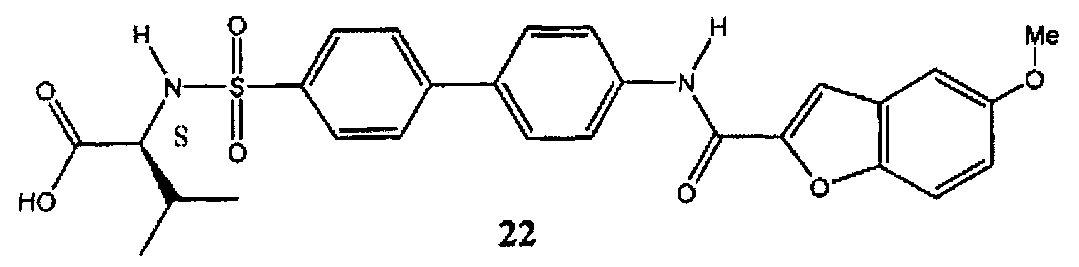
2-{4′-[(5-метоксибензофуран-2-карбонил)-амино]-бифенил-4-сульфониламино}-3-метилмасляная кислота (22) может быть синтезирована в соответствии с процедурой, описанной в литературе (Левин Дж.И. и соавт., US 7420001 B2 (2008)).
Пример 17
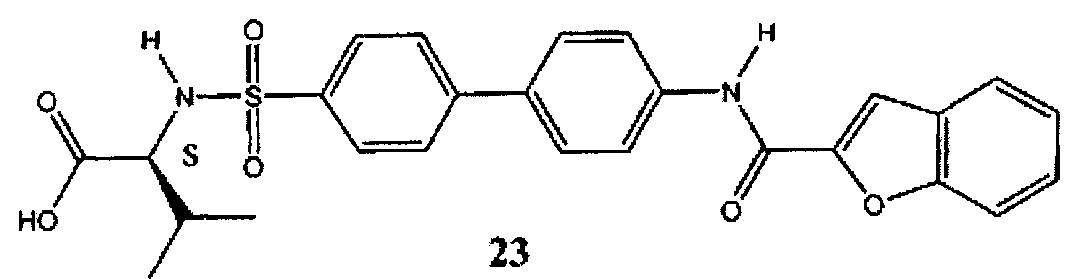
2-{4′-[(бензофуран-2-карбонил)-амино]-бифенил-4-сульфониламино}-3-метилмасляная кислота (23) может быть синтезирована в соответствии с процедурой, описанной в литературе (Левин Дж.И. и соавт., US 7420001 B2 (2008)).
Пример 18
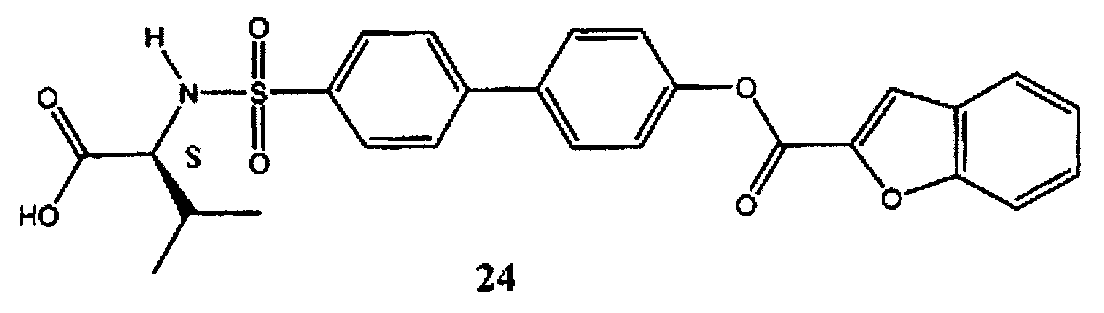
Сложный 4′-(1-карбокси-2-метилпропилсульфамоил)-бифенил-4-иловый эфир бензофуран-2-карбоновой кислоты (24) может быть синтезирован в соответствии с процедурой, описанной в литературе (Левин Дж.И. и соавт., US 7420001 B2 (2008)).
Пример 19
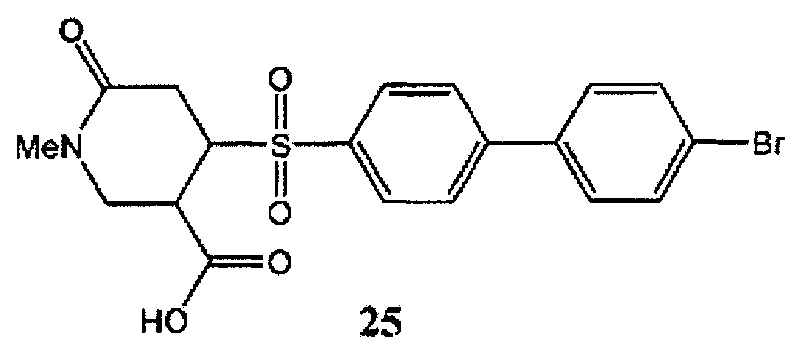
4-(4′-бромфенил-4-сульфонил)-1-метил-6-оксопиперидин-3-карбоновая кислота (25) может быть синтезирована в соответствии с процедурой, описанной в литературе (Чанг И.Чж. и соавт., Бюллетень корейского химического общества, 29 (6), 1103-1104 (2008)).
Пример 20
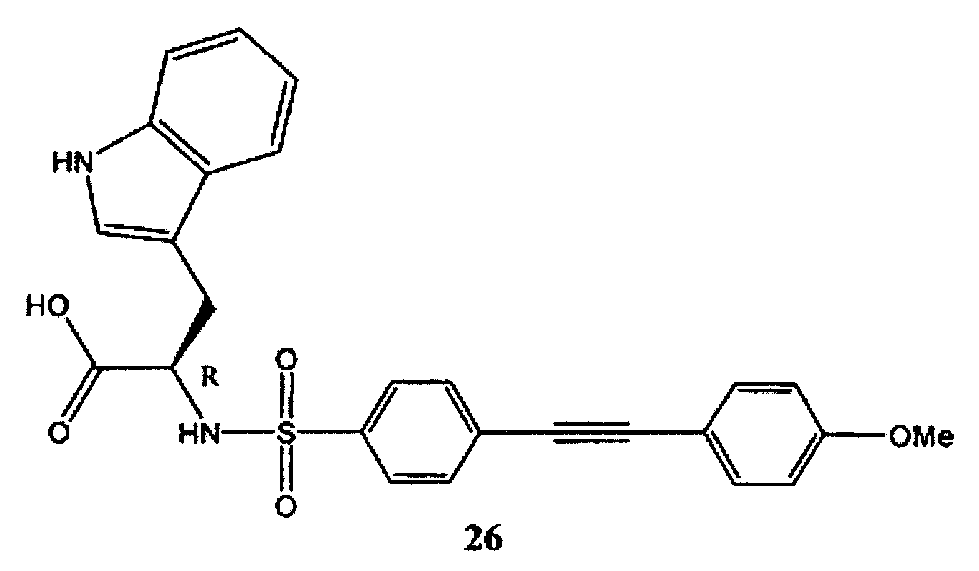
3-(1Н-индол-3-ил)-2-[4-(4-метоксифенилэтинил)-бензолсульфониламино]-пропионовая кислота (26) может быть синтезирована в соответствии с процедурой, описанной в литературе (Тамура И. и соавт., Журнал медицинской химии, 41, 640-649 (1998)).
Пример 21
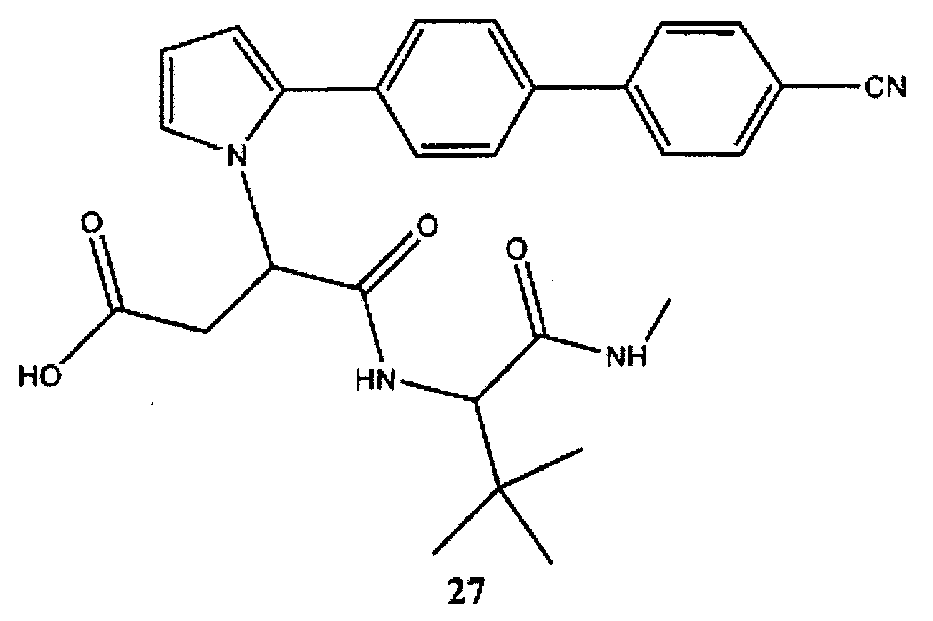
3-[2-(4′-цианобифенил-4-ил)-пиррол-1-ил]-N-(2,2-диметил-1-метилкарбамоилпропил)-янтарная кислота (27) может быть синтезирована в соответствии с процедурой, описанной в литературе (Уиттакер М. и соавт., Химический обзор, 99, 2735-2776 (1999) и представленные в нем источники).
Пример 22
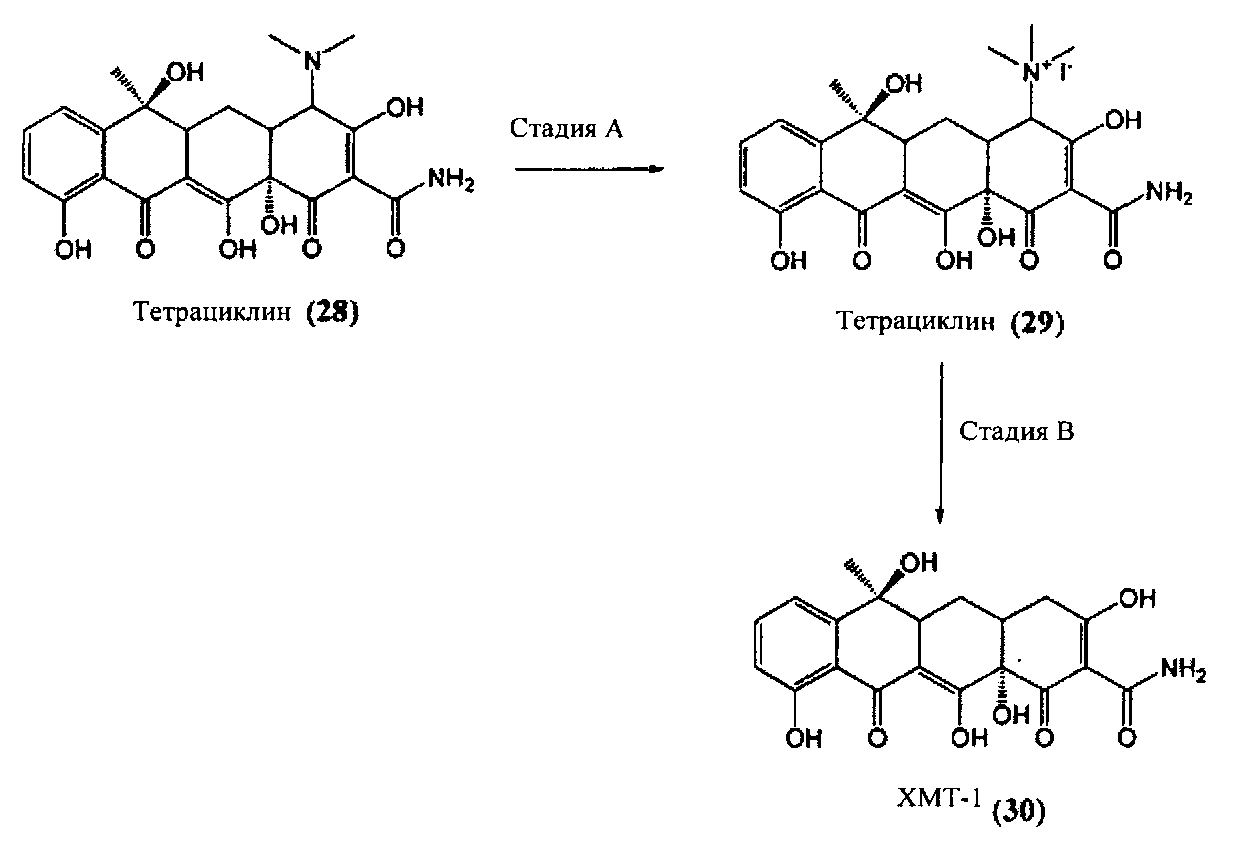
Стадия A
Голуб и коллеги (Голуб Л.М. и соавт., Журнал стоматологических исследований, 66 (8), 1310-1314, 1987) установили, что химическое удаление N,N-диметиламиновой группы тетрациклина приводит к удалению всей бактерицидной активности молекулы. При использовании коммерчески полученного (Sigma-Aldrich, Милуоки, Вайоминг) тетрациклина (28) в реакции с добавлением йодистого метила происходит образование промежуточного продукта триалкилйодида (29).
Стадия B
Промежуточный продукт 29 может быть далее обработан цинком и уксусной кислотой в воде с получением химически модифицированного тетрациклина (ХМТ)-1 (30).
Пример 23
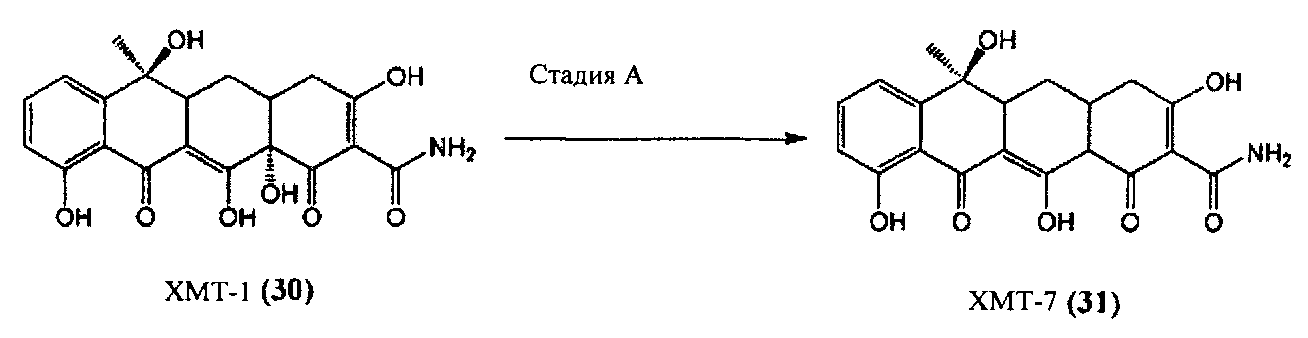
Стадия A
В соответствии с методом Грина и Бута (Грин А., Бут Дж.Х., Журнал американского химического общества, 82 (15), 3950-3953, 1960) аналог дедиметил-тетрациклина ХМТ-1 (30) далее может быть подвергнут восстановительному элиминированию 12α-гидроксильной группы цинком и гидроксидом аммония в воде с получением химически модифицированного тетрациклина (ХМТ-7) (31).
Пример 24
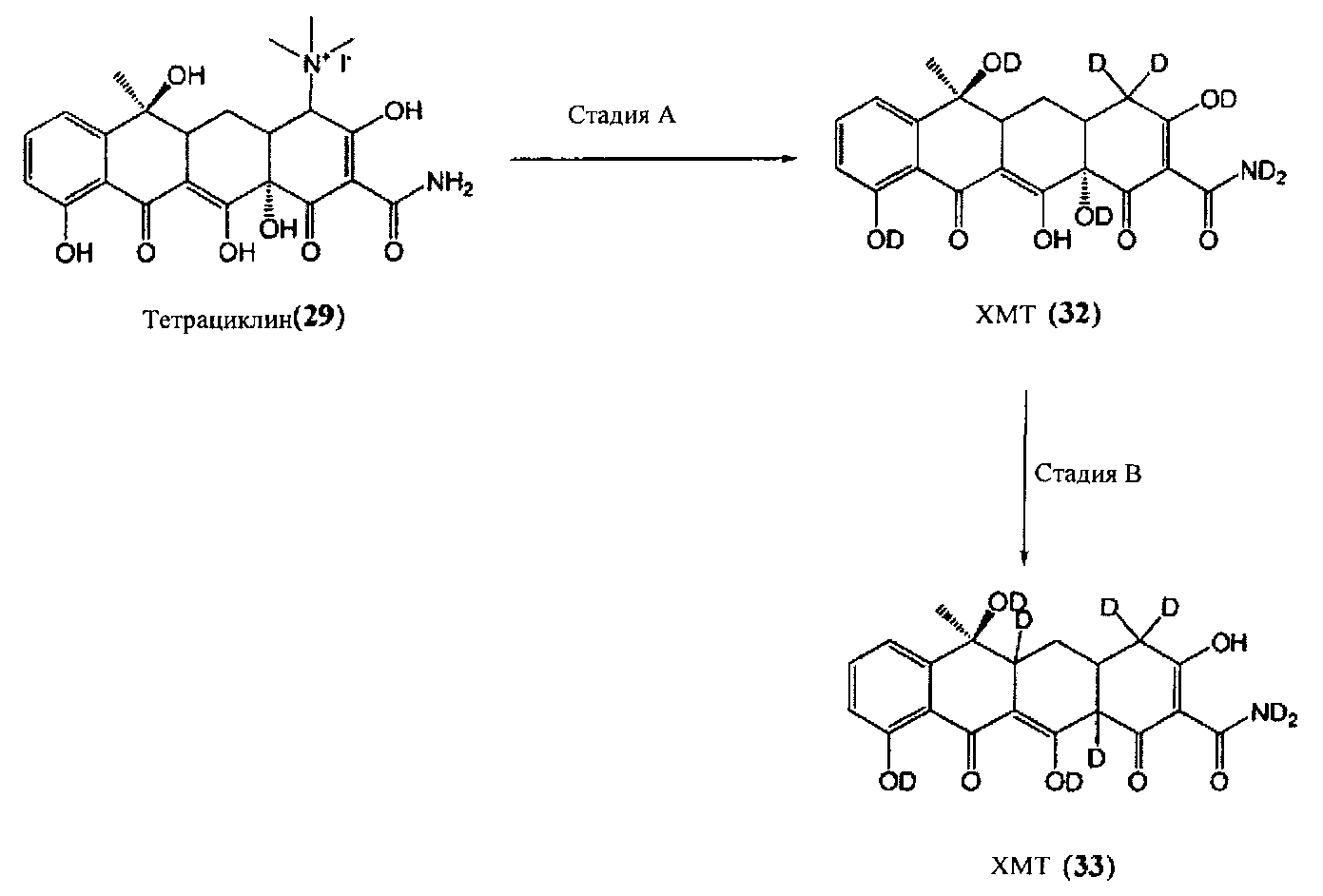
Стадия A
Помимо удаления триалкиламмониевой группы, метод Голуба и коллег (Голуб Л.М. и соавт., Журнал стоматологических исследований, 66 (8), 1310-1314, 1987) также может быть использован для включения дейтерия региоселективным образом в положении C4 кольца «A» молекулы тетрациклина. Промежуточный продукт триалкилйодид (29) может быть обработан цинком и дейтерированной уксусной кислотой в D2O с получением дедиметиламина, дейтерированного аналога тетрациклина 32.
Стадия B
В соответствии с методом Грина и Бута (Грин А., Бут Дж.Х., Журнал американского химического общества, 82 (15), 3950-3953, 1960), помимо применения дейтерированных растворителей, аналог дедиметил-тетрациклина 32 может быть подвергнут восстановительному элиминированию 12α-гидроксильной группы цинком и гидроксидом аммония в D2O с получением дейтерированного ХМТ (33).
Пример 25
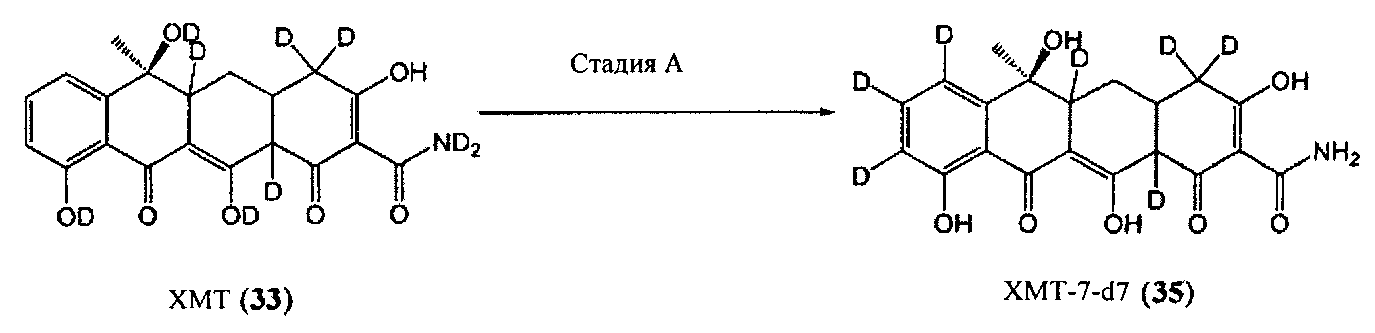
Стадия A
В соответствии с работой Саджики и коллег (Саджики X. и соавт., Синтетический дайджест №9, 1385-1388, 2005) ХМТ (33) может быть обработан палладием на углероде в присутствии водорода и дейтерированной воды с получением XMT-7-d13, который может быть далее обработан H2O с обратным замещением водорода амидной и гидроксильной групп с получением желаемого XMT-7-d7 (35).
Пример 26
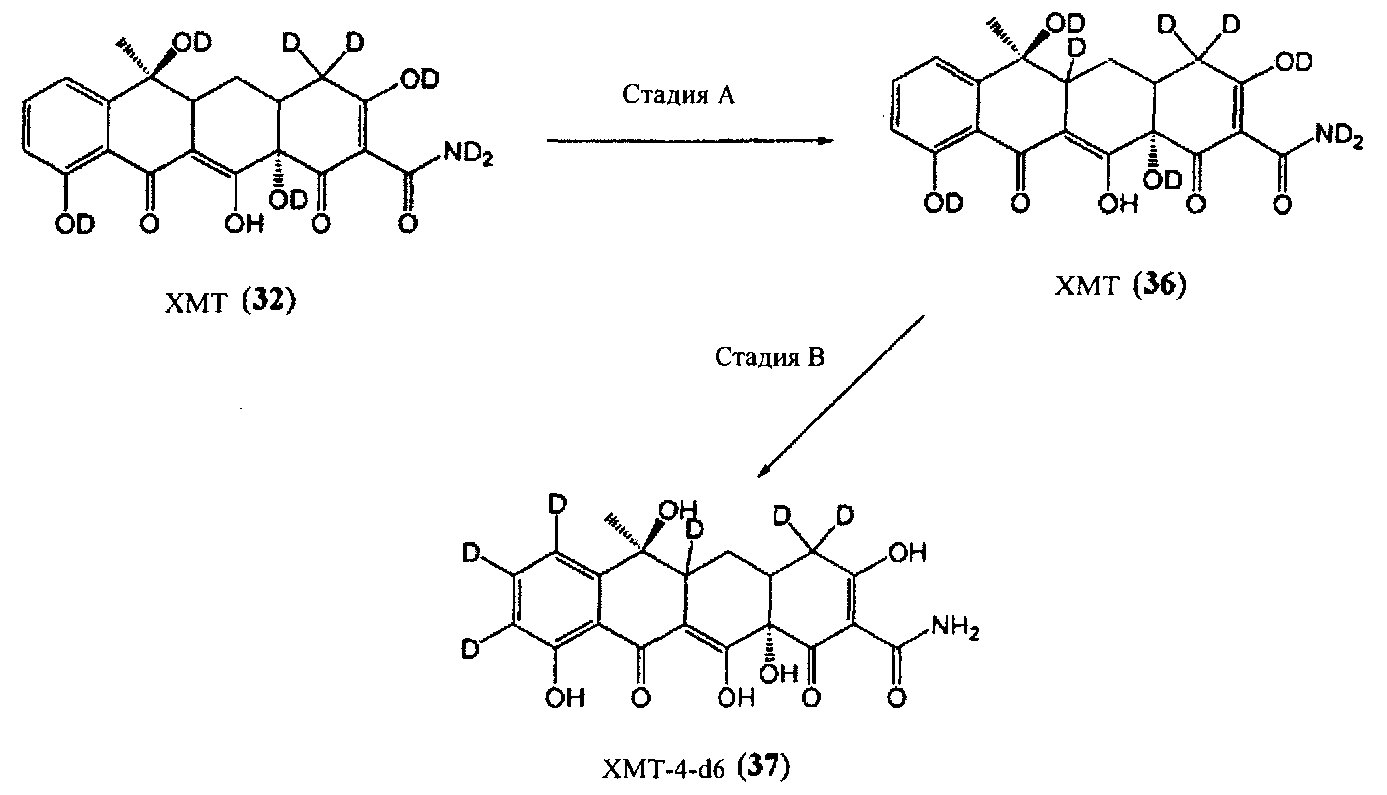
Стадия A
В соответствии со следующим методом Йошиды и коллег (Йошида Т. и соавт., Журнал американского химического общества, 101 (8), 2027-2038, 1979) XMT-d8 (32) может быть обработан трис-триэтилфосфином палладия в дейтерированной воде с получением дейтерированного ХМТ (36).
Стадия B
ХМТ (36) может быть обработан палладием на углероде в присутствии водорода и дейтерированной воды с получением XMT-4-d13, который может быть далее обработан H2O с обратным замещением водорода амидной и гидроксильной групп с получением желаемого XMT-4-d6 (37).
Пример 27
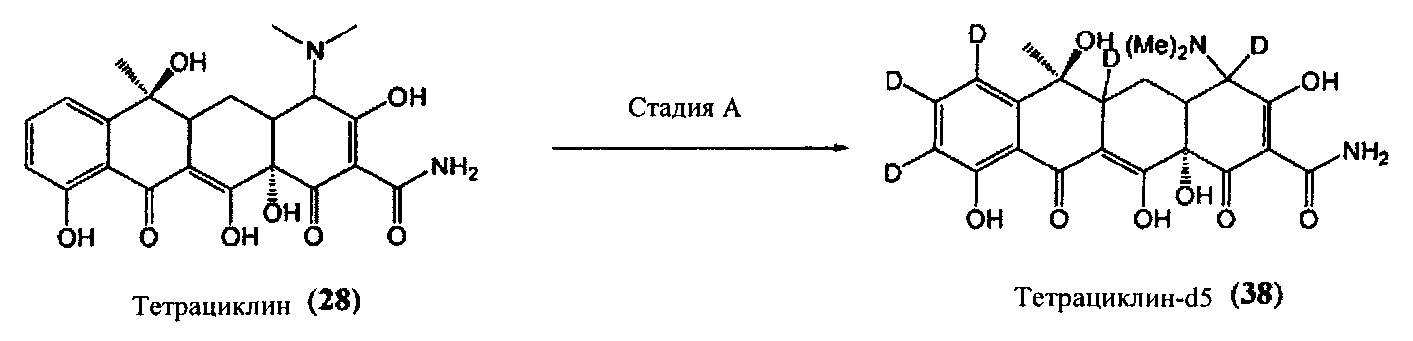
Стадия A
В соответствии с методом Йошиды и коллег (Йошида Т. и соавт., Журнал американского химического общества, 101 (8), 2027-2038, 1979) тетрациклин (28) может быть обработан палладием на углероде в присутствии водорода и дейтерированной воды и подвергнут нагреву с получением дейтерированного тетрациклина-d12. Далее тетрациклин-d12 может быть обработан H2O с обратным замещением водорода амидной и гидроксильных групп с получением желаемого тетрациклина-d5 (38).
Пример 28

Стадия A
В соответствии с методом Йошиды и коллег (Йошида Т. и соавт., Журнал американского химического общества, 101 (8), 2027-2038, 1979) соединение (17) может быть обработано палладием на углероде в присутствии водорода и дейтерированной воды и подвергнуто нагреву с получением дейтерированного тетрациклина-d12. Далее тетрациклин-d12 может быть обработан H2O с обратным замещением водорода амидной и гидроксильной групп с получением желаемого тетрациклина-d6 (39).
Пример 29
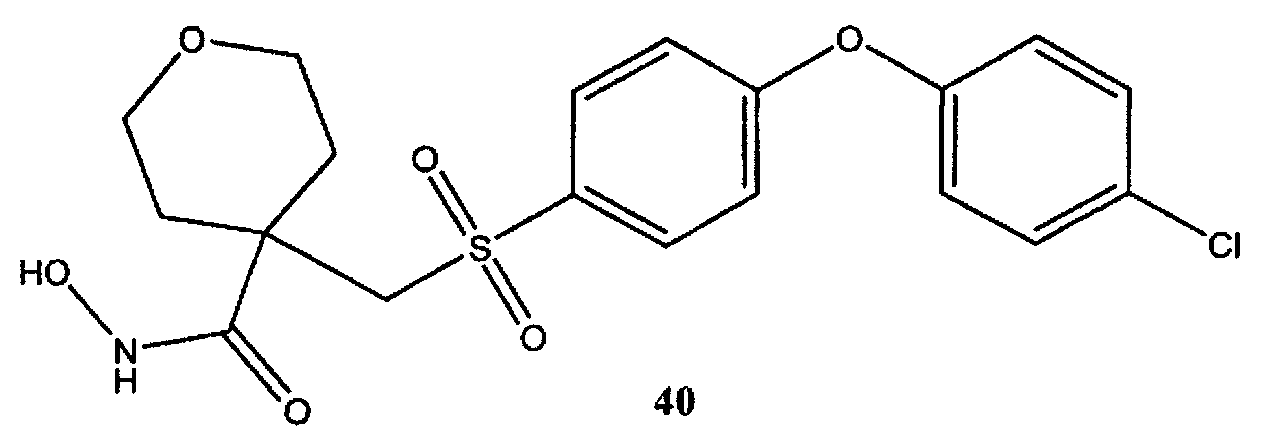
N-гидрокси-4-([4-[4-хлорфенокси]бензолсульфонил]метил)-2,3,5,6-тетрагидропиран-4-карбоксамид (40) (также обозначенный как RO113-0830 или CTS-1027) может быть синтезирован в соответствии с процедурами, описанными в литературе (Лоуренс Э. Фишер; Чарльз Дворак; Кина Грин; Саманта Дженис; Энтони Принс; Кешаб Сарма; Пол Макгрейн; Дэвид Мур; Джеффри Кэмпбелл; Джанель Баптиста; Крис Брока; Тан Хендрикс; Кит Уокер; Кэлвин Йи, От лабораторных к полупромышленным испытаниям. Серия - симпозиумы ACS (Американское химическое общество), том 817, глава 6 (19 апреля 2002 г.) страницы 89-100 и процитированные источники литературы).
Пример 105
Анализ in vitro для определения микросомальной стабильности выбранных соединений в микросомах человека и мыши
Микросомальная стабильность была определена для выбранных соединений в соответствии с методом Хьюстона (Хьюстон Дж.Б.; Биохимическая фармакология 47 (1994), 1469).
В анализе in vitro была использована концентрация соединения 1 мкМ и отдельные микросомы человека и мыши (0,3 мг/мл, BD Bioscience). Для обеспечения надлежащей подачи энергии для микросомального расщепления соединения в каждую пробу была добавлена система регенерации энергии, включающая 100 мМ фосфата калия, 2 мМ НАДФН, 3 мМ MgCl2, pH=7,4 и микросомальный белок, и полученная суспензия далее инкубировалась в двух повторностях в течение 60 мин при 37°C в ротационном шейкере. Контрольная проба подвергается воздействию испытываемого средства в двух повторностях без НАДФН для определения расщепления без участия НАДФН. При T=0 и T=60 мин аликвотная проба отбирается из каждой экспериментальной и контрольной реакции, после чего смешивается с равным объемом ледяного стоп-реагента (включающего 0,3% уксусной кислоты в ацетонитриле, содержащем галоперидол и диклофенак в качестве внутренних эталонов). Остановленные реакции далее инкубируются в течение как минимум десяти минут при температуре -20°C, после чего добавляется дополнительный объем воды. Затем пробы центрифугируются для удаления осажденного белка, и надосадочные жидкости далее анализируются с помощью ЖХ-МС/МС для определения процентного содержания оставшегося соединения. В качестве системы ЖХ-МС/МС был использован масс-спектрометр Agilent (Аджилент) 6410 в сочетании с жидкостным хроматографом ВЭЖХ Agilent 1200 и охлаждающим автодозатором CTC PAL под контролем программного обеспечения MassHunter (МассХантер) (Agilent) или масс-спектрометр ABI2000 в сочетании с жидкостным хроматографом ВЭЖХ Agilent 1100 и охлаждающим автодозатором CTC PAL под контролем программного обеспечения Analyst (ABI). После сепарирования на колонке для обращенно-фазовой ВЭЖХ C18 (Agilent, Waters или эквивалентная) с использованием градиентной системы ацетонитрил-вода был выполнен анализ пиков с применением масс-спектрометрии (МС) с ионизацией электрораспылением (ИЭС) в режиме мониторинга множественных реакций (ММП).
В таблицах 1 и 2 ниже приведена микросомальная стабильность выбранных соединений в микросомах человека и мыши.
|
|
Измерение ингибирования невропатической боли - животная модель ЛСН на мышах;
Предпосылки и описание животной модели
Для измерения эффектов ингибирования невропатической боли ингибиторов ММП настоящего изобретения для избранного количества соединений была использована модель на мышах лигирования спинномозгового нерва (ЛСН). Эта модель, впервые примененная в работе Беннета и коллег (Беннет Дж.Дж. и соавт., «Боль», 33 (1988), 87-107) и оптимизированная Кимом и Чангом (Ким С.Х.; Чанг Чж.М., «Боль», 50 (1992), 355-363), включает удаление при увеличении трети поперечного отростка с последующим установлением и произвольным отсечением спинномозгового нерва L5 от прилегающего спинномозгового нерва L4 у мыши. Затем спинномозговой нерв L5 туго лигируется с применением шелковой хирургической нити 6.0. Повреждение нерва приводит к гипералгезии, которая проявляется в усиленных реакциях на механические, тепловые и/или холодовые стимулы. В этом случае выполняется исследование механической гипералгезии с применением мононитей фон Фрея, в котором нити различной толщины и изгибающего усилия по отдельности наносятся на подошвенную поверхность стопы мыши. Пороговое усилие отдергивания лап после операции нерва существенно снижается. Сильные ингибиторы боли компенсируют это явление, обусловливая повышение усилия, которое необходимо применить для того, чтобы вызвать отдергивание лапы грызуна.
Пример 110: интратекальное (ИТ) введение ингибиторов ММП в модели боли на ЛСН-мышах
После предоперационного измерения (сутки -2) исходного порогового значения отдергивания лап, мыши мужского пола линии FVB были подвергнуты повреждению ЛСН (сутки -1). На следующие сутки (сутки 0) после операции ЛСН были выполнены исследования послеоперационного исходного порогового значения механической аллодинии животных; далее животные были случайным образом распределены в одну из 3 экспериментальных групп (см. таблицу 3). В ходе исследования для этих животных выполнялось измерение порогового значения отдергивания лап в ответ на механическую стимуляцию с использованием мононитей фон Фрея.
Во избежание системного действия ингибиторов ММП введение ингибиторов ММП настоящего изобретения осуществлялось в пространство спинномозговой жидкости (СМЖ) в районе пояснично-крестцового отдела спинного мозга с применением интратекального (ИТ) введения с целью воздействия на ММП в УЗК, спинном мозге и СМЖ. Интратекальное введение ингибитора ММП способно обеспечить воздействие не только на клетки спинного мозга, но и клетки УЗК. Каждая интратекальная (ИТ) инъекция выполнялась в соответствии с методикой Хильдена и Уилкокса (Хильден Дж.Л., Уилкокс Дж.Л., Европейский журнал фармакологии, 67 (1980), 313-6): 5,2 мг каждого из ингибиторов ММП были первоначально растворены в 140 миллилитрах ДМСО, после чего добавлены в 1260 миллилитров 0,5% раствора гидроксипропилцеллюлозы (ГПЦ) в воде с образованием высокодисперсной суспензии, содержащей соединение в 10% ДМСО и 0,5% гидроксипропилцеллюлозы. Была выполнена инъекция 10 микролитров смеси в интратекальное пространство самца мыши линии FVB (каждая особь весом 22-25 граммов, получены от Лаборатории Джексона, Бар Харбор, Мэн) с применением поясничной пункции в объеме 10 мкл/мышь с использованием микрошприцов «Гамильтон» посредством введения иглы калибра 30 между поясничными позвонками 5 и 6. Если вкратце, каждое животное крепко удерживалось за тазовый пояс в одной руке при введении иглы в ткань с правой стороны от остистого отростка L5 или L6. Выполнялось введение иглы в канавку между остистым отростком и поперечным отростком и осторожное продвижение по направлению к межпозвоночному промежутку под углом ~10°. После введения иглы (~0,5 см) в позвоночный столб наблюдалось подергивание хвостом, после чего осуществлялось введение раствора. В таблице 3 представлены сводные данные в отношении различных экспериментальных групп и частоты введения.
|
Исследования тактильной аллодинии. Измерение механической аллодинии было осуществлено с применением калиброванных нитей фон Фрея (моноволокна Семза-Вайнштейна; Stoelting («Стоэлтинг»), Вуд-Дейл, Иллинойс, США). Исследование выполнялось для подошвенной поверхности левой поврежденной лапы каждого животного в соответствии с описанием Каплана и соавт. (Журнал неврологических методов, 53 (1994), 55-63). Было выполнено определение пятидесятипроцентной пороговой реакции отдергивания лапы посредством последовательного повышения или снижения силы стимула в соответствии с методом «вверх-вниз» Диксона (ежегодный обзор фармакологической токсикологии, 20 (1980). 441-462). Для мышей были использованы восемь нитей фон Фрея с изгибающими усилиями приблизительно равного логарифмического приращения (число фон Фрея: 1,65, 2,36, 2,44, 2,83, 3,22, 3,61, 3,84, 4,08 и 4,17; эквивалентно усилию 0,005, 0,02, 0,03, 0,07, 0,17, 0,41, 0,69, 1,20 и 1,48 g соответственно).
Перед исследованиями каждая мышь была помещена в подвешенную чистую пластмассовую камеру с дном из проволочной сетки для акклиматизации в течение 15 минут. Исследования были начаты с усилия 0,07 g (отметка на рукоятке 2,83), прилагаемого в перпендикулярном направлении к подошвенной поверхности поврежденной задней лапы; к каждой нити было приложено достаточное давление для проявления изгибания. Отсутствие реакции подъема/отдергивания лапы спустя 6 с влекло за собой применение следующей нити с большим весом. Отдергивание лапы, указывающее на положительную реакцию, влекло за собой применение более слабой нити. После первоначальной положительной реакции (т.е. отдергивания лапы) исследование продолжалось для регистрации четырех дополнительных измерений, которые использовались для расчета пороговой реакции. Четыре последовательных положительных реакции получили оценку 0,001 g, и пять последовательных отрицательных реакций (т.е. отсутствие отдергивания лапы) получили оценку 1,5 g.
Анализ исследований тактильной аллодинии. 50% пороговое значение отдергивания лапы было рассчитано (PWT: Луо и Калькутт, Журнал фармакологии и экспериментальной терапии, 303 (3) (2002), 1199-1205; Каплан и соавт., Журнал неврологических методов, 53 (1994), 55-63) с применением формулы:
10(Xf+κδ)/10000
где Xf - последняя использованная нить фон Фрея (логарифмические единицы), κ - значение, определяющее характер реакции (взятое из таблицы, опубликованной Капланом и соавт., 1994), а δ - средняя разность между стимулами (логарифмические единицы).
Контроль пристрастности. Для предотвращения пристрастности в результатах исследования технический персонал не был осведомлен об экспериментальной принадлежности каждого животного при выполнении оценки поведенческих реакций животных.
Результаты исследования поведения, которые представлены в таблице 4, наглядно показывают почти полную компенсацию аллодинии соединением №10 по сравнению с растворителем и соединением №5.
|
Пример 111: внутрибрюшинное (ВБ) введение ингибиторов ММП в модели боли на ЛСН-мышах
Чтобы обеспечить повышение биологической доступности соединений ММП настоящего изобретения при введении соединения с наружной части спинного мозга, для модельных ЛСН-мышей было выполнено повторное внутрибрюшинное введение соединений №5 и №10. За исключением режима введения, количества мышей в группах, а также количества инъекций и дозировки указанного соединения на инъекцию, остальная часть исследования осуществлялась аналогичным образом (в отношении хирургической операции и исследований и анализа тактильной аллодинии), как в эксперименте 110. 3,2 мг каждого из ингибиторов ММП №5 и №10 были растворены в 320 микролитрах ДМСО. Далее к раствору были добавлены 32 микролитра твин 80 с последующим добавлением 2850 микролитров фосфатно-буферного солевого раствора (ФБСР). Это обеспечило окончательную концентрацию 10% ДМСО, 1% твин и 1 мг/мл соединения. Далее данный раствор вводился путем инъекции из расчета 0,1 мл на мышь в сутки (в течение пяти последовательных суток) для достижения приблизительной дозы 3,3 мг/кг. Экспериментальные группы представлены в таблице 5. Результаты исследований поведения представлены в таблице 6. Очевидно, что соединение №10 демонстрирует полную компенсацию механической аллодинии к суткам 5. Примечательным является факт продолжительного эффекта, вызываемого соединением №10 спустя даже 48 часов (сутки 6) с момента последней инъекции (сутки 4).
|
|
Пример 120
Измерение ингибирования воспалительной боли: индуцированное каррагинаном (КАРР) воспаление у крыс
Для измерения эффектов ингибирования воспалительной боли ингибиторов ММП настоящего изобретения возможно применение каррагинановой модели для измерения невропатической боли, как показано в работе Лабуда К.Дж и Фукса П.Н., Дайджест неврологии, 304 (2001), 137-140.
Острая модель: подкожная инъекция в заднюю лапу крысы. Острое воспалительное состояние достигается посредством подкожной инъекции 3% лямбда-каррагинана (0,12 мл) в подошвенную поверхность одной задней лапы под легким изофлурановым наркозом. Как правило, используется дополнительная контрольная группа, которая получает равный объем физиологического раствора. Далее животным вводятся ингибиторы ММП настоящего изобретения спустя 3,5 часа после инъекции КАРР. Количественное определение болевого поведения может быть выполнено с применением животной модели отдергивания лапы с использованием процедур, аналогичных описанным в эксперименте 110 и 111.
Хроническая модель: внутрисуставная инъекция. Более продолжительное состояние воспаления достигается посредством внутрисуставной инъекции КАРР (0,1 мл, 3%) в большеберцовый сустав под изофлурановым наркозом. Этот путь введения вызывает воспалительное состояние, которое может продолжаться до 7 суток после инъекции и является достоверной моделью артритической воспалительной боли. Далее может быть выполнено количественное определение болевого поведения с помощью процедур, аналогичных описанным в эксперименте 110 и 111.
Пример 125
Исследований морфиновой толерантности и спровоцированной налоксоном морфиновой абстиненции у мышей Измерение эффектов интратекального (ИТ) или внутрибрюшинного (ВБ) введения ингибитора матричной металлопротеиназы (ММП) в модели на мышах морфиновой анальгезии, толерантности и абстиненции. Она предназначена для измерения эффектов ингибитора ММП в отношении: 1) ослабления морфиновой толерантности у мышей и 2) абстинентного поведения при спровоцированной налоксоном морфиновой абстиненции у мышей. В животной модели, которая была разработана в 1960-х гг. и модернизирована в начале 1970-х гг., используется опиоидный антагонист налоксон для быстрого подавления µ-опиоидного рецептора, чтобы «спровоцировать» абстинентное поведение у грызунов (Захариу В. и соавт.; «Ключевая роль RGS9 в действии опиатов», PNAS, 100 (23), стр.13656-13661 (2003)). На основании работы Сонга и коллег (Журнал неврологии, 30 (22) (2010), 7613-7623) были использованы взрослые мыши мужского и женского пола линии CD-1 (Лаборатория Чарльза Ривера) и мыши дикого типа (ДТ) линии FVB (Лаборатория Джексона) весом 24-28 г и возрастом 8-10 недель. В соответствии с работой Сонга и коллег для определения порога болевой чувствительности и морфиновой анальгезии/толерантности использовали устройство с горячей пластиной. Было установлено время отключения 30 с во избежание повреждения тканей. Также для дополнительного подтверждения поведенческих эффектов от введения ингибитора матричной металлопротеиназы-2 и -9 другим линиям мышей были использованы взрослые мыши линии Kunming (Куньмин) (КМ).
Введение препарата и исследования морфиновой абстиненции: ингибиторы матричных металлопротеиназ (ММП) были растворены в фосфатно-буферном солевом растворе (ФБСР) и диметилсульфоксиде (ДМСО) и разбавлены ФБСР (окончательная концентрация ДМСО для интратекального введения составила 10%). Оптимально ингибитор ММП был сначала растворен в ДМСО, а затем разбавлен ФБСР и 1% твин для достижения окончательной концентрации 10% ДМСО, 1% твин в буферном растворе ФБСР. Введение ингибиторов ММП (5-10 мкг) и растворителя ФБСР и ДМСО было осуществлено посредством их интратекального введения (ИТ) (с дозировкой каждого 10 мкл) соответственно под кратковременным ингаляционным наркозом ~5 мин после каждой инъекции морфина с применением поясничной пункции в межпозвоночный промежуток L4-5 и L5-6 для серии инъекций с использованием иглы из нержавеющей стали (калибр 30), закрепленной на шприце «Гамильтон» объемом 25 мкл. На основании работы Захариу и коллег (Захариу В., Георгеску Д., Санчес Н., Рахман 3., Дилеоне Р., Бертон О, Нев Р.Л., Сим-Селли Л.Дж., Селли Д.Э., Голд С.Дж., Нестлер Э.Дж., Труды национальной академии наук США, том 100 (1003). стр.13656-13661), а также работы Лю и коллег (Лю В.Т., Ли Х.К., Сонг Ц.С., Хуанг Ц.Чж., Сонг Ц.Чж., журнал FASEB 23 (2009), стр.90-98) мыши были инъецированы внутрибрюшинно увеличивающимися дозами морфина (20, 40, 60, 80, 100 и 100 мг/кг) каждые 8 ч на протяжении 2,5 суток (см. протокол исследования в таблице 7). Спустя два часа после последней инъекции морфина был подкожно введен налоксон (1 мг/кг). Далее по прошествии 1 часа после введения налоксона на протяжении 30 мин осуществлялся контроль абстинентного поведения. Налоксон является конкурентным антагонистом µ-опиоидных рецепторов, который может быть использован для противодействия эффектам морфина у мышей и для проявления симптомов морфиновой абстиненции.
|
|
Влияние ингибиторов ММП на морфиновую абстиненцию. Для исследования поведенческих признаков, подобных морфиновой абстиненции после интратекального введения ингибитора ММП, спустя 1-2 часа после введения налоксона на протяжении 30 минут осуществлялся контроль симптомов абстиненции. Помимо измерения отдельных признаков абстиненции, был выполнен расчет общей оценки опиатной абстиненции, заимствованный из работы Сонга и коллег (Журнал неврологии, 30 (22) (2010), 7613-7623), а также других работ (Захариу и соавт., 2003; Лю и соавт., 2009a) (кол-во шагов назад X 0,1) + (диарея X 2) + (кол-во прыжков X 0,1) + (тремор лап X 0,1) + опущение века + тремор + (% потери веса X 5) + кол-во отряхиваний мокрой собаки. Результаты показали, что соединение 10 обеспечивало снижение общего поведения морфиновой абстиненции по сравнению с контролем и растворителем (см. фигуру 1 A-J).
Желатиновая зимография для измерения синдромов отмены ММП-2 и/или ММП-9.
Желатиновая зимография выполнялась в соответствии с методом Сонга и коллег (Журнал неврологии, 30 (22) (2010), 7613-7623) для определения уровней ММП-2 и ММП-9 в спинном мозге мышей (включая сегменты L1-L6) до, во время и после введения соединения 10. Цель этого исследования заключалась в определении проявления синдромов отмены ММП-2 и/или ММП-9 в связи с абстиненцией при отмене соединения 10 в животной модели спровоцированной налоксоном абстиненции. Исследование выполнялось в трех группах, включающих по шесть мышей в каждой («наивная» группа, контрольная группа и группа соединения 10). Результаты показали, что по прошествии 0,5 и 2 часов после спровоцированной налоксоном абстиненции и прекращения введения соединения 10 сохранялись одинаковые или несколько сниженные уровни ММП-2 и ММП-9 по сравнению с контрольной группой (мыши, которые не получали соединение 10, но подвергнутые абстиненции). Проявления синдрома отмены ММП-2 и/или ММП-9, связанные с прекращением введения соединения 10 не наблюдались.
Влияние ингибиторов ММП на снижение морфинового подавления боли. Для исследования влияния ингибиторов ММП на порог болевой чувствительности и начальную болеутоляющую реакцию на морфин возможно помещение мышей на устройство с горячей пластиной, нагреваемой до 55°C, и измерение времени задержки до вылизывания лапы. Данные могут быть рассчитаны в качестве процента максимально возможного эффекта (%МВЭ), расчет которого может быть произведен с применением формулы Сонга и коллег (Журнал неврологии, 30 (22) (2010), 7613-7623) (следующая формула: 100 X [(время реакции на препарат - базовое время реакции) / (30 с - базовое время реакции)] = %МВЭ. Морфин (10 мг/кг, подкожно), ингибитор ММП (5-10 мкг, ИТ) и контрольные растворы ФБСР и ДМСО (1%, ИТ) могут быть введены за 30 мин до испытаний. Протокол должен быть аналогичным использованному группами Сонга и соавт., Захариу и соавт. и Лю и соавт. Для оценки физической толерантности к морфину каждая мышь может быть помещена на устройство с горячей пластиной, нагретой до 55°C с измерением времени задержки до вылизывания лапы после подкожной инъекции морфина. Для исследований острой толерантности время задержки до вылизывания лапы может быть измерено спустя 0,5, 1, 1,5 и 2 ч после введения однократной дозы морфина из расчета 10 мг/кг, введенной через 24 ч после введения морфина с дозировкой 100 мг/кг. Исследования хронической толерантности могут быть выполнены после повторного режима введения морфина из расчета 10 мг/кг на протяжении 7 суток с измерением болеутоляющего эффекта через 30 мин после каждой инъекции.
Пример 126
Модель самовведения на грызунах для определения зависимости
Исследование обусловленного стимулами рецидива. Оценка ингибиторов ММП-2 и ММП-9 в отношении обусловленного стимулами рецидива, связанного с самовведением веществ, вызывающих привыкание, таких как опиоиды, амфетамины, алкоголь, никотин или кокаин. Эта животная модель основана на том представлении, что воздействие стимулов, ранее связанных с введением вызывающих привыкание препаратов, таких как опиоиды, амфетамины, алкоголь, никотин или кокаин, может вызвать рецидив поведения, в основе которого лежит стремление к вызывающему привыкание препарату у абстинентных крыс, для которых уже наблюдалось ранее самовведение препаратов, вызывающих привыкание (Шелтон К.Л.; Бердсли П.М; «Эффекты воздействия ассоциированных с препаратами экстероцептивных стимулов на восстановление зависимости от метамфетамина у крыс», Фармакология, биохимия и поведение, 90 (3), 434-440 (2008)). Этот эффект считается аналогичным клиническим случаям, в которых возврат в условия и к сопутствующим элементам препаратов вызывает рецидив стремления к вызывающему привыкание препарату. Химические препараты, которые снижают эффективность выражения стремления к вызывающему привыкание препарату, рассматриваются как подающие надежды в качестве потенциальных лекарственных средств для предотвращения рецидива у злоупотребляющих психоактивными веществами. Двенадцать самцов крыс (Лонг-Эванс) могут быть использованы для оценки каждой дозировки ингибитора ММП-2 и/или ММП-9 или растворителя, которые могут быть введены пероральным путем. После акклиматизации в виварии возможна имплантация постоянных венозных катетеров в правую яремную вену. Затем крысам дается время на восстановление после операции на протяжении 5 суток до начала обучения самовведению. Сеансы обучения самовведению, на протяжении которых выполняется вливание с дозировкой 0,1 мг/кг вызывающего привыкание вещества, осуществляются на протяжении 2 часов каждый день. В начале сеансов самовведения вызывающего привыкание препарата выдвигаются рычаги и включается освещение. Во время обучения каждое нажатие на правый рычаг вызывает вливание вызывающего привыкание препарата в течение 6 с, после чего следует 14 с перерыв. В начале вливания освещение гаснет, включается звуковая сигнализация, и световые сигналы над каждым рычагом мигают с частотой 3 Гц. Звуковая сигнализация и световые сигналы остаются включенными в течение 6 с вливания. Через двадцать секунд после начала вливания освещение включается снова и возможность повторного самовведения вызывающего привыкание препарата становится доступной (т.е. каждое вливание вызывающего привыкание препарата может запустить 20 с период, на протяжении которого нажатие рычага может быть зарегистрировано, но не повлечет за собой последствия в виде дальнейших вливаний). Двенадцать крыс могут быть использованы для оценки каждой пероральной дозы ингибитора ММП-2 и/или ММП-9 или растворителя.
Другие модели на грызунах, включающие самовведение вызывающих привыкание веществ. Каждую крысу обучают в равной степени нажимать два рычага в экспериментальной камере. После обучения один рычаг может быть случайным образом назначен в качестве активного рычага; другой остается отключенным. Исследования самовведения вызывающего привыкание вещества, такого как никотин или метамфетамин, могут быть начаты спустя 7 суток после имплантации яремного катетера.
В исследованиях способствующих укреплению зависимости эффектов никотина животные могут реагировать на укрепляющий безусловный безмедикаментозный стимул (напр., свет или звук) в присутствии или отсутствии никотина, который вводится посредством подкожной инъекции. Другие поведенческие парадигмы могут включать параллельные процедуры выбора, в которых животные могут получать никотин (т.е. кокаин, метиламфетамин, опиоид и т.д.) и безмедикаментозные укрепляющие стимулы одновременно в рамках одного сеанса (Палматье М.И., Ф.Ф. Эванс-Мартин и соавт. (2006). «Диссоциация первичных укрепляющих и способствующих укреплению зависимости эффектов никотина или некоторых других вызывающих привыкание веществ с применением парадигмы самовведения у крыс с одновременной доступностью медикаментозных и внешних укрепляющих стимулов». Психофармакология (Берлин) 184 (3-4): 391-400). Предпочтение мест введения также может быть использовано для дополнения исследований самовведения и для определения, оказывает ли ингибитор ММП-2 и/или ММП-9 воздействие на аппетентные свойства контекстных стимулов, связанных с вызывающими привыкание веществами (т.е. никотин, амфетамины, кокаин и опиоиды). Наконец в камерах «открытое поле» может быть измерена двигательная активация. Для всех рекомендуемых экспериментов предполагается использование множественных доз ингибитора ММП-2 и/или ММП-9, контроля физиологическим раствором и положительного контроля (например, в качестве положительного контроля для измерения никотиновой зависимости следует использовать варениклин или бупропион) при суммарном количестве 15 крыс в каждой экспериментальной группе.
Пример 130
Анализ для определения ингибирования ММП-2
Определение активности ингибирования ММП-2 было осуществлено по методу Найта (Найт К.Дж. и соавт., БЮЛЛ. FEBS (Федерация европейских биохимических обществ) 296 (3) (1992), 263-266) с использованием буфера исследования, содержащего 50 мМ трис-HCl, pH 7,6, 200 мМ NaCl, 5 мМ CaCl2 и 1 мкМ ZnSO4. Исследования ингибитора ММП настоящего изобретения были выполнены для установленной концентрации (1 мкМ) в двух повторностях. В раствор соединения был добавлен каталитический домен фермента ММП-2 (рекомбинантного белка человека, 10 нМ). Смесь фермента и соединения в буфере исследования далее тщательно перемешали и инкубировали в течение 60 минут при температуре 37°C. По завершении инкубирования был выполнен анализ с добавлением 10 мкМ флуоресцентного субстрата Mca-P-L-G-L-Dpa-A-R-NH2 (кД ~ 8 мкМ). Далее было выполнено измерение флуоресцентного продукта McaPLG при длине волны возбуждения 355 нм и эмиссии 405 нм с помощью автоматического планшетного считывающего устройства при 37°C. Для положительного контроля была выполнена отдельная процедура с применением ингибитора ММП широкого спектра GM6001 в качестве контрольного соединения (IC50 ММП-2=0,5 нМ). В таблице 7 представлены результаты исследования ингибирования.
|
Пример 131
Анализ для определения ингибирования ММП-9
Определение активности ингибирования ММП-9 осуществлялось по методу Бикетта (Бикетт Д.М. и соавт., Аналитическая биохимия 212 (1993), 58-64) с использованием буфера исследования, содержащего 50 мМ трис-HCl, pH 7,6, 200 мМ NaCl, 5 мМ CaCl2 и 1 мкМ ZnSO4. Исследования ингибитора ММП настоящего изобретения были выполнены для установленной концентрации (1 мкМ) в двух повторностях. В раствор соединения был добавлен каталитический домен фермента ММП-2 (рекомбинантного белка человека, 10 нМ). Смесь фермента и соединения в буфере исследования далее была тщательно перемешана и инкубировалась в течение 60 минут при температуре 37°C. По завершении инкубирования был выполнен анализ с добавлением 10 мкМ флуоресцентного субстрата DNP-Pro-Cha-Gly-Cys(Me)-His-Ala-Lys(N-Me-Abz)-NH2 [Cha-β-циклогексилаланил; Abz - 2-аминобензол (антранилоил)] (Kd ~ 7 мкМ). Далее было выполнено измерение флуоресцентного продукта DnpPChaG при длине волны возбуждения 365 нм и эмиссии 450 нм с помощью автоматического планшетного считывающего устройства при 37°C. Для положительного контроля была выполнена отдельная процедура с применением ингибитора ММП широкого спектра GM6001 в качестве контрольного соединения (IC50 ММП-9=0,2 нМ). В таблице 8 представлены результаты исследования ингибирования.
|
Пример 132
Анализ для определения ингибирования ММП-1
При возникновении необходимости в определении активности ингибирования ММП-1 для ингибиторов ММП настоящего изобретения можно применить метод Найта (Найт К.Дж. и соавт., БЮЛЛ. FEBS 296(3) (1992), 263-266) с использованием буфера исследования, содержащего 50 мМ трис-HCl, pH 7,6, 200 мМ NaCl, 5 мМ CaCl2 и 1 мкМ ZnSO4. Исследования выполняются для установленной концентрации (1 мкМ) в двух повторностях. В раствор соединения добавляется каталитический домен фермента ММП-1 (рекомбинантного белка человека). Смесь фермента и соединения в буфере исследования далее тщательно перемешивается и инкубируется в течение 60 минут при температуре 37°C. По завершении инкубирования выполняется анализ с добавлением 10 мкМ флуоресцентного субстрата DNP-Pro-Cha-Gly-Cys(Me)-His-Ala-Lys(N-Me-Abz)-NH2 [Cha - β-циклогексилаланил; Abz - 2-аминобензол (антранилоил)] (10 мкМ). Далее выполняется измерение флуоресцентного продукта DnpPChaG при длине волны возбуждения 365 нм и эмиссии 450 нм с помощью автоматического планшетного считывающего устройства при 37°C. Для положительного контроля также может быть выполнена отдельная процедура с применением ингибитора ММП широкого спектра Тир-гидроксамовой кислоты в качестве контрольного соединения.
Пример 133
Анализ для определения ингибирования ММП-7
При возникновении необходимости в определении активности ингибирования ММП-7 для ингибиторов ММП настоящего изобретения возможно применение метода Найта (Найт К.Дж. и соавт., БЮЛЛ. FEBS 296 (3) (1992), 263-266) с использованием буфера исследования, содержащего 50 мМ трис-HCl, pH 7,6, 200 мМ NaCl, 5 мМ CaCl2 и 1 мкМ ZnSO4. Исследования выполняются для установленной концентрации (1 мкМ) в двух повторностях. В раствор соединения добавляется каталитический домен фермента ММП-7 (рекомбинантного белка человека). Смесь фермента и соединения в буфере исследования далее тщательно перемешивается и инкубируется в течение 60 минут при температуре 37°C. По завершении инкубирования выполняется анализ с добавлением 10 мкМ флуоресцентного субстрата Mca-P-L-G-L-Dpa-A-R-NH2. Далее выполняется измерение флуоресцентного продукта McaPLG при длине волны возбуждения 355 нм и эмиссии 405 нм с помощью автоматического планшетного считывающего устройства при 37°C. Для положительного контроля также может быть выполнена отдельная процедура с применением ингибитора ММП широкого спектра Тир-гидроксамовой кислоты в качестве контрольного соединения.
Пример 134
Анализ для определения ингибирования ММП-3
При возникновении необходимости в определении активности ингибирования ММП-7 для ингибиторов ММП настоящего изобретения можно применить метод Найта (Найт К.Дж. и соавт., БЮЛЛ. FEBS 296 (3) (1992), 263-266) с использованием буфера исследования, содержащего 50 мМ трис-HCl, pH 7,6, 200 мМ NaCl, 5 мМ CaCl2 и 1 мкМ ZnSO4. Исследования выполняются для установленной концентрации (1 мкМ) в двух повторностях. В раствор соединения добавляется каталитический домен фермента ММП-3 (рекомбинантного белка человека). Смесь фермента и соединения в буфере исследования далее тщательно перемешивается и инкубируется в течение 60 минут при температуре 37°C. По завершении инкубирования выполняется анализ с добавлением 10 мкМ флуоресцентного субстрата McaRPKPVENvalWRK(Dnp)NH2. Далее выполняется измерение флуоресцентного продукта McaRPK при длине волны возбуждения 355 нм и эмиссии 405 нм с помощью автоматического планшетного считывающего устройства при 37°C. Для положительного контроля также может быть выполнена отдельная процедура с применением ингибитора ММП широкого спектра Тир-гидроксамовой кислоты в качестве контрольного соединения.
Пример 135
Анализ для определения ингибирования ММП-12
При определении активности ингибирования ММП-12 сначала выполняется сепарирование расщепленного и нерасщепленного субстрата с применением сдвига электрофоретической подвижности с последующим измерением флуоресценции сепарированных продуктов и сравнением с контрольными реакциями для определения ингибирования ферментной активности. Возможно выполнение анализа ММП-12 с использованием буфера исследования, содержащего 100 мМ HEPES, pH 7,5, 0,01% Brij-35, 1,5 мМ NaCl и 2 мМ CaCl2. Исследования выполняются для установленной концентрации (1 мкМ) в двух повторностях. Реакция может быть начата посредством добавления субстрата и инкубирования реакционной смеси в течение 1 часа при комнатной температуре. Реакция может быть остановлена посредством добавления останавливающего буфера, содержащего 100 мМ HEPES (pH 7,5), 30 мМ ЭДТК, 0,015% Brij-35 и 5% ДМСО. Для положительного контроля также может быть выполнена отдельная процедура с применением ингибитора ММП широкого спектра GM6001 в качестве контрольного соединения.
Пример 136
Анализ для определения ингибирования ММП-13
При возникновении необходимости в определении активности ингибирования ММП-13 для ингибиторов ММП настоящего изобретения можно применить метод Найта (Найт К.Дж. и соавт., БЮЛЛ. FEBS 296 (3) (1992), 263-266) с использованием буфера исследования, содержащего 50 мМ трис-HCl, pH 7,6, 200 мМ NaCl, 5 мМ CaCl2 и 1 мкМ ZnSO4. Исследования выполняются для установленной концентрации (1 мкМ) в двух повторностях. В раствор соединения добавляется каталитический домен фермента ММП-13 (рекомбинантного белка человека). Смесь фермента и соединения в буфере исследования далее тщательно перемешивается и инкубируется в течение 60 минут при температуре 37°C. По завершении инкубирования выполняется анализ с добавлением 10 мкМ флуоресцентного субстрата Mca-P-L-G-L-Dpa-A-R-NH2. Далее выполняется измерение флуоресцентного продукта McaPLG при длине волны возбуждения 355 нм и эмиссии 405 нм с помощью автоматического планшетного считывающего устройства при 37°C. Для положительного контроля также может быть выполнена отдельная процедура с применением ингибитора ММП широкого спектра Тир-гидроксамовой кислоты в качестве контрольного соединения.