СПОСОБ ПОЛУЧЕНИЯ ДИАГНОСТИЧЕСКОЙ СЫВОРОТКИ ДЛЯ ВЫЯВЛЕНИЯ ВИРУСА АЛЕУТСКОЙ БОЛЕЗНИ НОРОК
Вид РИД
Изобретение
Изобретение относится к ветеринарной вирусологии, а именно к получению диагностических препаратов, в частности высокоактивных сывороток при иммунизации животных-продуцентов различными антигенами, может быть использовано для определения вируса алеутской болезни норок (ВАБН) в звероводческих хозяйствах с целью защиты животных от болезни, а также для лабораторных исследований и производства диагностических тест-наборов ВАБН.
Алеутская болезнь норок (АБ) инфекционное вирусное заболевание, наносящее основной ущерб пушному звероводству. Особенностью АБ является неспособность нарабатывающихся антител нейтрализовать вирус. Вакцинация лишь усугубляет патологический процесс и единственным методом борьбы с АБ становится своевременная диагностика и выбраковка больных животных. Существующие в мире способы диагностики АБ технологичны, но обладают не очень высокой чувствительностью. Кроме того, высокочувствительные способы трудоемки, дороги, требуют для своего исполнения много времени, которое резко увеличивается при обследовании большого количества зверей.
Алеутскую болезнь норок, вызываемая патогеном из рода Parvovirus, трудно выявить иммуноферментным методом в связи с тем, что вирионы образуют сложный комплекс с железосодержащим белком ферритином (Ф) и антителами к этому вирусу. Ферритин и антитела препятствуют сорбции вируса на стирольном планшете и реакции с иммуноглобулинами. Ферритин также не дает возможности получить высокоочищенный антиген для получения антисыворотки. Сложность определения вируса из биологических жидкостей как отмечалось выше, связана с образованием очень стойких агрегатов ВАБН-Ф. Существующие методики определения требуют предварительного выделения и очистки вируса в лабораторных условиях с использованием дорогостоящей сложной аппаратуры и применения сильных поверхностно-активных веществ (ПАВ).
Необходим чувствительный и одновременно высокотехнологичный способ, позволяющий получить антисыворотку для проведения массового обследования норок на зверофермах.
Известен «Способ серологической диагностики алеутской болезни норок» (авторское свидетельство №1427651, А61К 39/00, 15.09.1990 г.). В указанном способе антиген, содержащий инактивированный вирус алеутской болезни норок, предварительно концентрируют, промывают буфером, повторно концентрируют ультрафильтрацией и йодируют изотопом с помощью NaJ в присутствии хлорамина T и метабисульфата натрия. После добавления указанного антигена к исследуемой сыворотке указанную смесь инкубируют в течение 1-1,5 ч, отделяют, осадок центрифугированием и измеряют его радиоактивность, которая и служит мерой содержания антител в исследуемой сыворотке.
Указанный способ является трудоемким и дорогим, т.к. для получения антигена используются изотопы и, кроме того, диагностическая антисыворотка имеет низкий титр.
Известен «Способ получения сыворотки для диагностики анаплазмоза крупного рогатого скота в реакции непрямой иммунофлуоресценции путем гипериммунизации кроликов» (патент РФ №2368393, А61К 39/395, 27.09.2009 г.). Способ состоит из введения кроликам антигена и иммуностимулятора левамизола. При этом в качестве антигена используют антиген, извлеченный путем попеременного замораживания и оттаивания выращенной на клетках Vero в питательной среде поддержки роста Игла MEM с добавлением эмбриональной сыворотки, аминокислот и антибиотиков живой культуры Anaplasma sp. Omsk после восьмисуточной инкубации.
Известный способ имеет следующие недостатки: невысокие титры образующихся в крови кроликов антител и низкая активность полученных антисывороток.
Известен также «Способ получения сыворотки против вирусного энтерита норок» (патент РФ №2049478, МПК А61К 39/23, приоритет с 16.04.1992 г.). В известном способе проводят гипериммунизацию животных антигеном с последующим забором крови и отделением целевого продукта. В качестве антигена используют очищенный и концентрированный штамм Virus enteritis lutreo larum "Родники". Из животных используют козу, а гипериммунизацию проводят введением по 5-12 см3 антигена последовательно с интервалом между инъекциями 7-10 суток внутривенно, внутримышечно, внутривенно, подкожно с полным адъювантом Фрейнда, а затем через 28-30 суток внутривенно.
В известном способе из животных используют козу, а не кроликов, что требует больших доз антигена.
Также известен «Способ получения антивирусной сыворотки» (см. Автореферат диссертации на соискание ученой степени кандидата биологических наук Мартыненко М.В. «Иммунохимические и молекулярно-генетические свойства вируса Алеутской болезни (Aleutian disease virus - ADV), циркулирующего на юге Приморского края, и разработка методов его диагностики» Владивосток 2006, стр. 5-8). Способ включает получение очищенного препарата вируса из органов норок с положительным ответом в серологических тестах на наличие ADV (название дальневосточного изолята вируса ADV-DV) путем дифференциального центрифугирования в трис-буферной системе, осуществления диссоциации иммунных комплексов HC1-глицериновым буфером, избавлением от примеси ферритина хроматографией на сефарозе 6B и иммунизацией кроликов препаратом с полным адъювантом Фрейнда по схеме M. Горвица и М. Шарффа в собственной модификации, осаждением IgG из крови норок сульфатом аммония и очисткой на колонке сефадекса G-200. Конъюгацию вирусных белков и IgG с 125I осуществляли методом окисления йодата хлорамином T. Полученная кроличья поликлональная антисыворотка против ADV-DV, которая содержала антитела к вирионным белкам, так как реагировала в РДД с препаратом вируса. ADV-DV показал себя при этом способе приготовления средним иммуногеном (титр специфических антител, по данным РДД, 1:512-1024).
Сыворотка, полученная по известному способу, характеризуется недостаточной степенью очистки антигенов от примесей ферритина и низким титром антисыворотки, полученной при иммунизации кроликов.
В основу заявленного технического решения поставлена задача получения диагностической сыворотки с высоким титром для определения вирусов АБН, которая может быть использована для диагностики АБН в полевых условиях при массовом обследовании норок.
Поставленная задача решается тем, что в способе получения сыворотки для диагностики АБН, включающем выделение и очистку вируса и иммунизацию животных, антиген получают путем гомогенизации органов инфицированных АБН норок с последующим трехкратным замораживанием/размораживанием гомогената, дезинтеграцией его трехкратной ультразвуковой обработкой, осаждением неразрушенных клеток двукратным низкоскоростным центрифугированием, осаждение иммунных комплексов, уплотнением осадка низкоскоростным центрифугированием, экстрагированием иммунных комплексов минимальными количествами путем трехкратной экстракции на холоду в течение 1-2 часов с последующим низкоскоростным центрифугированием, осаждением ИК высокоскоростным центрифугированием из объединенных экстрактов, извлечением иммунных комплексов из осадка минимальными количествами ТНЭ буфера путем трехкратного экстрагирования на холоду в течение 1-2 часов с последующим низкоскоростным центрифугированием, диссоциацией иммунных комплексов в кислой среде в течение 1 часа на холоду, отделением ВАБН-Ф от антител высокоскоростным ультрацентрифугированием, растворением осадка в минимальном количестве карбонатного буфера, отделением ферритина от вирусных частиц на колонке с сефарозой 6B в системе карбонатного буфера. Для более качественной очистки хроматографию проводят дважды. Контроль спектрофотометрией осуществляют в ультрафиолете диапазоне волн 220-310. После чего проводят вычисление ориентировочной концентрации вируса по формуле Калькара:
К=1,45×E280-0,74×E260
Затем для получения максимального титра антител к ВАБН проводят следующую схему иммунизации кроликов:
- первая иммунизация 200 мкг антигена + полный адъювант Фрейнда (США) проводилась подкожно в 9-12 точек;
- вторая иммунизация (через 7 дней после первой) - 200 мкг антигена + полный адъювант Фрейнда (США) внутримышечно и подкожно в 6-8 точек;
- третья иммунизация (через 7 дней после второй) - 300 мкг антигена + полный адъювант Фрейнда (США) внутримышечно и подкожно в 6-8 точек;
- четвертая иммунизация (через 14 дней после третьей) - 200 мкг антигена + полный адъювант Фрейнда (США) внутримышечно и подкожно в 6-8 точек;
- пятая иммунизация (через 7 дней после четвертой) - 200 мкг антигена внутривенно.
Титр антител составил 1/16384.
Кроме того, в качестве буферной системы используют 50 мМ трис-HC1, 0,15 M NaC1, pH 7,2, качестве детергентов используют 1% тритона X-100, 0,4 мМ фенилметилсульфонилфторида, 1% дезоксихолата натрия (Sigma США), качестве ТНЭ буфера используют 10 мМ трис-HC1, 0,1 M NaC1, 1 мМ ЭДТА-Na, 0,05% NP-40 (Sigma США), pH 7,4.
В заявленном способе общими признаками для него и для его прототипа являются:
- получение очищенного антигена;
- иммунизация животных антигеном.
Сопоставительный анализ заявляемого технического решения и прототипа показывает, что первое имеет в отличие от прототипа следующие существенные признаки:
- модифицированный способ получения высокоочищенного препарата вируса из сложного комплекса с железосодержащим белком ферритина и антителами к вирусу алеутской болезни норок;
- усовершенствованная пятиэтапная схема иммунизации кроликов для получения максимального титра антител к ВАБН.
Совокупность существенных признаков заявленного технического решения имеет причинно-следственную связь с достигаемым техническим результатом - получением диагностической сыворотки с высоким титром. На основании изложенного можно заключить, что заявленное техническое решение является новым, обладает техническим уровнем и пригодно для промышленного применения.
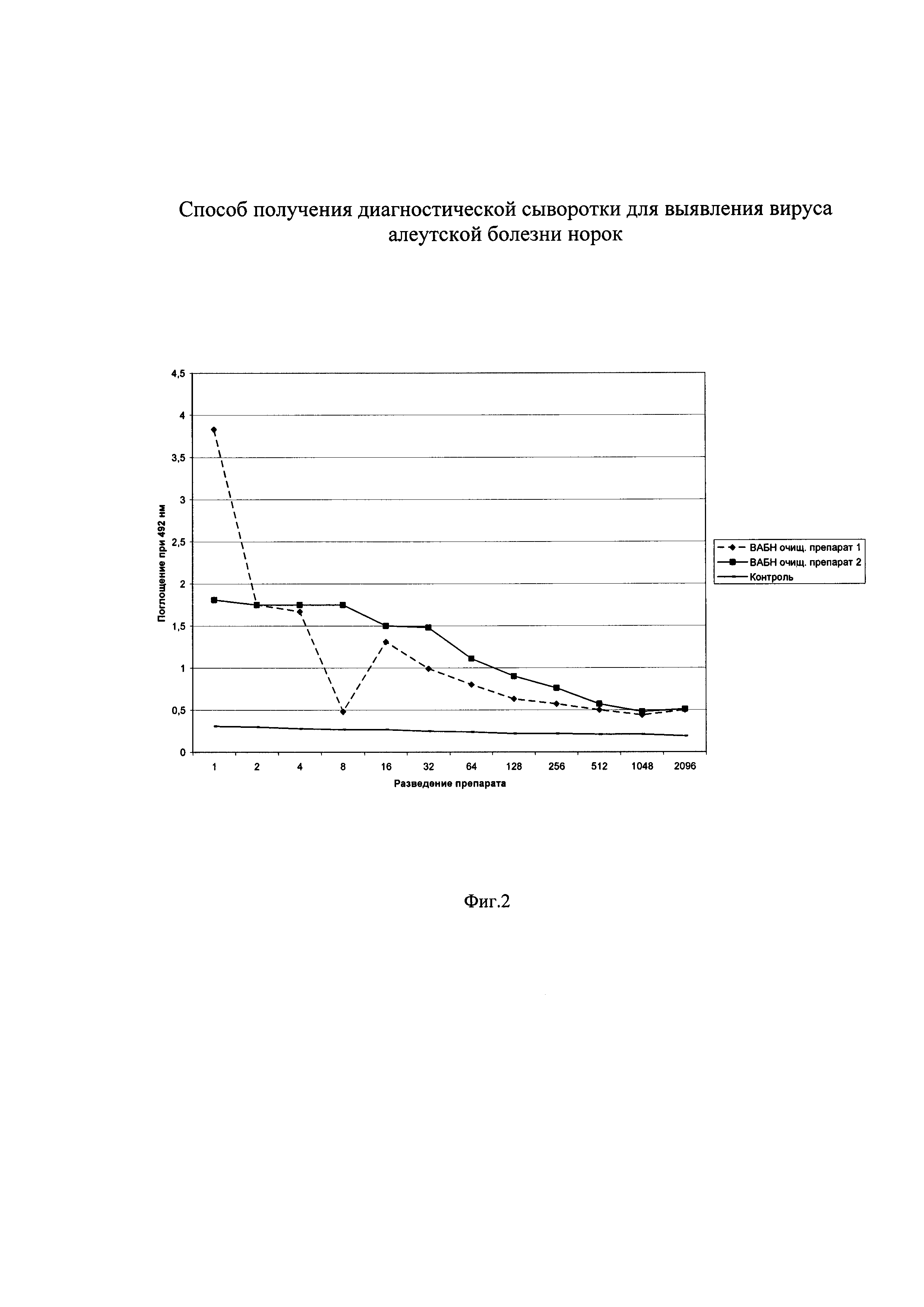
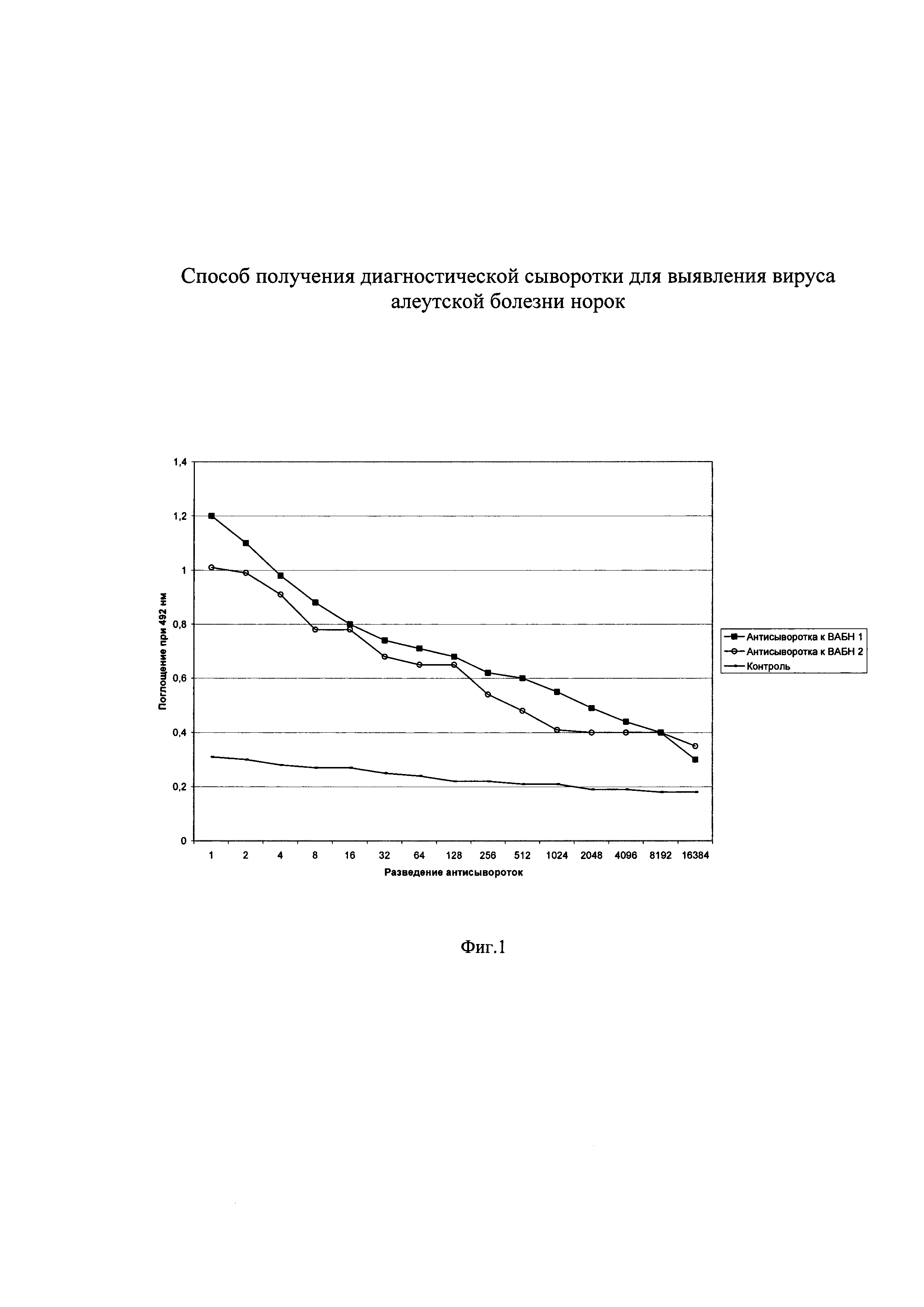
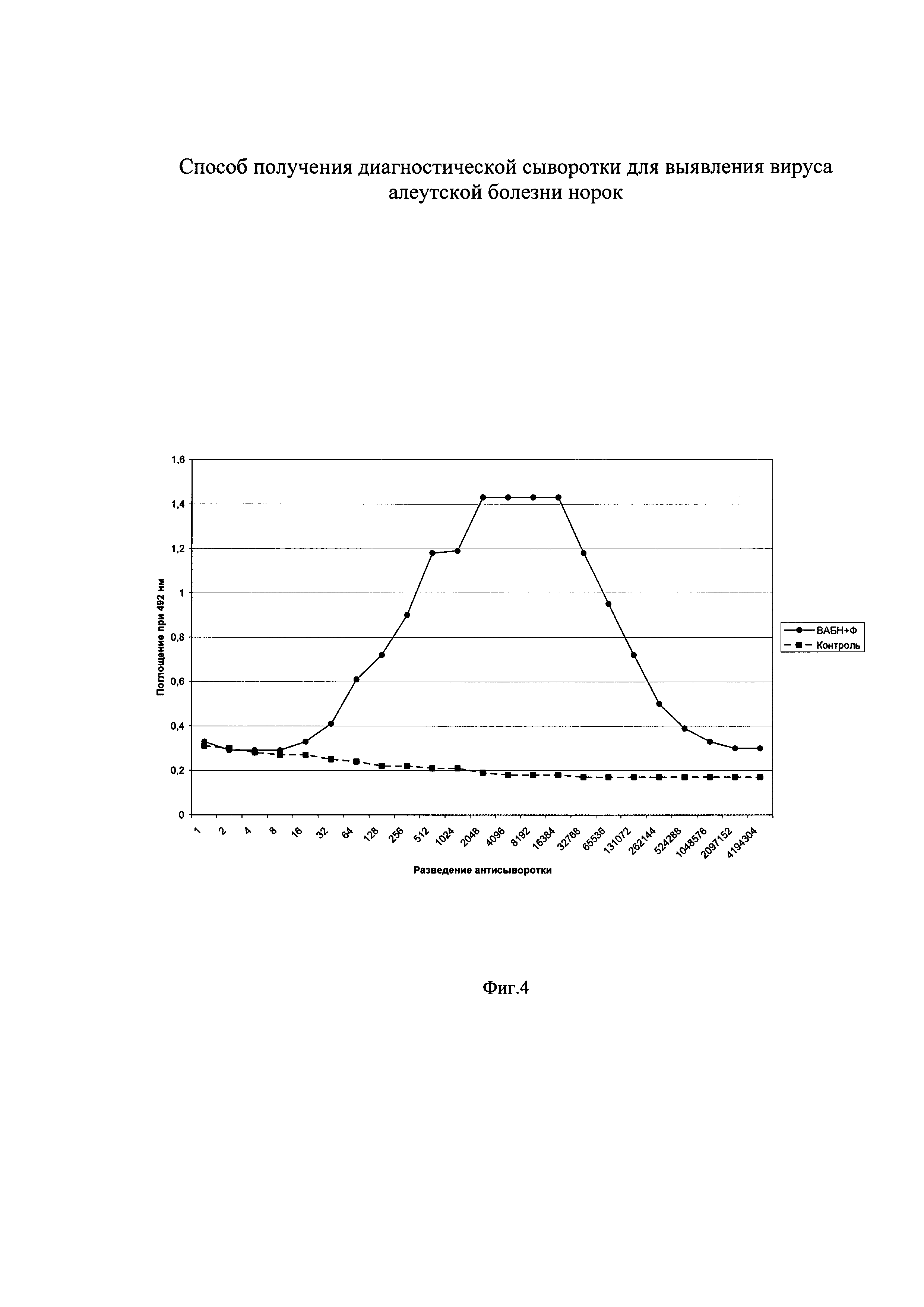
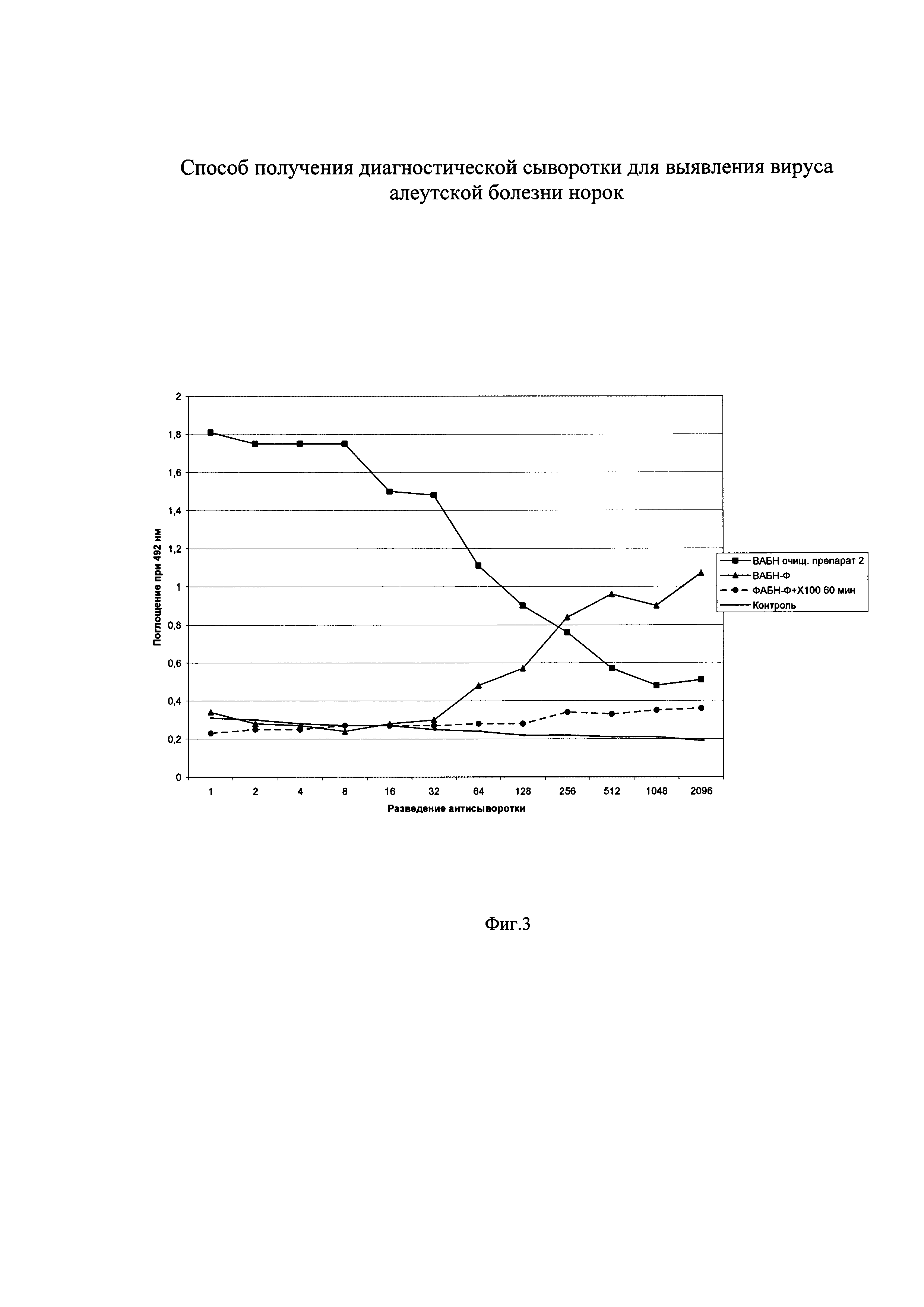
Изобретение поясняется чертежами, где на фиг. 1 показан титр кроличьих антисывороток к ВАБН в непрямом варианте ИФА, на фиг. 2 - антигенные взаимоотношения 2-х штаммов ВАБН, на фиг. 3 - действие ПАВ на комплекс ВАБН-Ф при определении вируса, на фиг. 4 - кривая титрования препарата ВАБН-Ф после воздействия ПАВ. На чертежах приняты следующие обозначения:
Фиг. 1
Антисыворотка к ВАБН 1 от кролика №1
Антисыворотка к ВАБН 2 от кролика №2
Контроль - нормальная кроличья антисыворотка
Разведение антивидового конъюгата 1/1000
Концентрация антигена 5 мкг/мл.
Фиг. 2.
ВАБН очищ. препарат 1 - изолят вируса из Подмосковья
ВАБН очищ. препарат 2 - изолят из местного зверосовхоза
Начальная концентрация вируса 50 мкг/мл
Разведение антивидового конъюгата 1/1000
Фиг. 3.
ВАБН очищ. препарат 2 - изолят из местного зверосовхоза
ВАБН-Ф - комплекс вируса с ферритином
ВАБН-Ф +Х100 60 мин - Комплекс ВАБН-Ф обработанный Тритоном X100 в течение 60 мин.
Контроль - плазма крови здоровой норки, разбавленная в 100 раз
Начальная концентрация вируса 50 мкг/мл
Разведение антивидового конъюгата 1/1000.
Фиг. 4.
ВАБН-Ф - комплекс вируса с ферритином
Контроль - плазма крови здоровой норки разбавленная в 100 раз.
Способ получения диагностической сыворотки реализуется следующим образом. Получение максимального титра антител. Для этого необходимо получение вирусного препарата наивысшей степени очистки. Антиген получают путем гомогенизации органов инфицированных АБН норок (например, селезенка, печень, почки) в буферной системе, содержащей детергенты в соотношении 1/3-1/5 от объема (в ступке с добавлением кварцевого песка и далее в гомогенизаторе), с последующим трехкратным замораживанием/размораживанием гомогената, дезинтеграции клеточного гомогената трехкратной ультразвуковой обработкой при частоте 22 кГц/сек на аппарате УЗДН-2 (по 20 сек с интервалом в несколько сек), осаждения неразрушенных клеток двукратным низкоскоростным центрифугированием (осветление гомогената (по 6000-8000 об/мин в течение 20 мин), осаждения иммунных комплексов (ИК) 10% полиэтиленгликолем (ПЭГ-6000) или 25% сульфатом аммония в течение 4-х часов или ночи, уплотнения осадка низкоскоростным центрифугированием (12000 об мин в течение 30 мин), экстрагирования иммунных комплексов минимальными количествами (1/10 от первоначального объема) ТНЭ буфером путем трехкратной экстракции на холоду в течение 1-2 часов с последующим низкоскоростным центрифугированием в режиме 12000 об/мин по 20 мин, осаждения ИК высокоскоростным центрифугированием из объединенных экстрактов при 30000 об/мин в течение 2,5 часов, извлечения иммунных комплексов из осадка минимальными количествами ТНЭ буфера путем трехкратного экстрагирования на холоду в течение 1-2 часов с последующим низкоскоростным центрифугированием в режиме 12000 об/мин по 20 мин, диссоциации иммунных комплексов в кислой среде (pH 2,4) HC1-глицинового буфера в соотношении 1V экстракта на 2V буфера в течение 1 часа на холоду, отделения ВАБН-Ф от антител высокоскоростным ультрацентрифугированием (30000 об/мин в течение 2,5 часов) с последующим растворением осадка в минимальном количестве (не более 2 мл) карбонатного буфера pH 9,6 и отделения ферритина от вирусных частиц на колонке с сефарозой 6B в системе карбонатного буфера, после чего дважды проводят хроматографию, при этом контроль проводят спектрофотометрией в ультрафиолете диапазоне волн 220-310, а вычисление ориентировочной концентрации вируса проводят по формуле Калькара:
К=1,45×E280-0,74×E260,
в качестве животных для иммунизации используют кроликов, а саму иммунизацию проводят в пять этапов:
- первая иммунизация 200 мкг антигена + полный адъювант Фрейнда (США) проводилась подкожно в 9-12 точек;
- вторая иммунизация (через 7 дней после первой) - 200 мкг антигена + полный адъювант Фрейнда (США) внутримышечно и подкожно в 6-8 точек;
- третья иммунизация (через 7 дней после второй) - 300 мкг антигена + полный адъювант Фрейнда (США) внутримышечно и подкожно в 6-8 точек;
- четвертая иммунизация (через 14 дней после третьей) - 200 мкг антигена + полный адъювант Фрейнда (США) внутримышечно и подкожно в 6-8 точек;
- пятая иммунизация (через 7 дней после четвертой) - 200 мкг антигена внутривенно.
Для подтверждения технического результата - получение сыворотки с высоким титром - было проведено тестирование полученной диагностической сыворотки. Тестирование сыворотки проводили с очищенным препаратом 2-х штаммов ВАБН (местным и из Подмосковья) (фиг. 2). Из чертежа видно, что антисывороткой к местному штамму ВАБН можно определять и гетерологичный штамм.
Пример №1 осуществления тестирования сыворотки.
В лунки полистирольного планшета вносится 20 мкл разбавленной биологической жидкости (плазма крови, моча, слюна) и добавляется 0,1 мл 10% раствора тритона Х-100 в бикарбонатном буфере (0,05 М, pH 9,6) для разрушения комплекса ВАБН-Ф. Далее проводится стандартное разведение и планшет инкубируется. Лунки трижды промываются буфером ПБС (0,01 М, pH 7,5) с добавлением Твин-20 (0,05%).
Конъюгат и антисыворотку наносили в 0,01 M фосфатном буфере (pH 7,5) с добавлением 0,1% бычьего сывороточного альбумина (Serva). При определенном разведении (фиг. 3) ферритин вместе с тритоном отмываются и не мешают определению вируса. Субстрат (ортофенилендиамин 0,05%) наносится в фосфат-цитратном буфере (0,05 М, pH 5,0) с 0,003% перекиси водорода. Ферментативную реакцию останавливали через 30 мин. 4 H серной кислоты и измеряли оптическую плотность при длине волны 492 нм.
Пример №2 осуществления тестирования сыворотки.
В лунки полистирольного планшета вносится 1 мл разбавленной антисыворотки и инкубируется для сорбции антител на планшет. Планшет отмывается и в лунки добавляется предварительно обработанный тритоном Х-100 биологический материал (кровь норок) в разведении от 2000 до 20000 раз (фиг. 4). Планшет инкубируется. Дальнейшая обработка проводится как в примере 1.
При сопоставлении со способом-прототипом выявлены следующие преимущества полученной диагностической сыворотки:
- возможность тестировать вирус алеутской болезни норок в различных биологических жидкостях;
- проводить тестирования без предварительной дорогостоящей очистки вируса в лабораторных условиях;
- снизить себестоимость анализов.
Использование изобретения в ветеринарной вирусологии позволит организовать массовый выпуск высокоактивной сыворотки для выявления вируса алеутской болезни норок.