МОДИФИЦИРОВАННЫЕ ВАЗОАКТИВНЫЕ ИНТЕСТИНАЛЬНЫЕ ПЕПТИДЫ
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА HA РОДСТВЕННЫЕ ЗАЯВКИ
[001] В соответствии с § 119(е) Капитула 35 Свода законов США данная заявка претендует на приоритет временной заявки США №61/234 151 от 14 августа 2009 года, содержание которой целиком включено сюда в качестве ссылок.
ОБЛАСТЬ ТЕХНИКИ
[002] Настоящее изобретение относится к вазоактивным интестинальным пептидам (ВИП) и содержащим их фармацевтическим композициям, включая ВИЛ, обладающие увеличенным периодом полувыведения из системы кровообращения, и ВИЛ, имеющие профили связывания с рецептором, которые отличаются от таковых немодифицированного зрелого пептида.
ОПИСАНИЕ ТЕКСТОВОГО ФАЙЛА, ПОДАННОГО В ЭЛЕКТРОННОМ ВИДЕ
[003] Содержание текстового файла, поданного совместно с данным документом в электронном виде, целиком включено сюда в качестве ссылок: Представленная в формате машиночитаемого носителя копия листинга последовательностей (название файла:
PHAS_019_01US_SeqList_ST25.txt, дата записи: 4 августа 2010 года, размер файла 44 килобайта).
УРОВЕНЬ ТЕХНИКИ
[004] Вазоактивный интестинальный пептид (ВИП) обладает рядом биологических эффектов, включая эффекты в отношении гемостаза, иммунной системы и нервной системы. См. Delgado et al., The Significance of Vasoactive Intestinal Peptide in Immunomodulation, Pharmacol. Reviews 56(2):249-290 (2004). Например, ВИП обладают благоприятным эффектом на кровяное давление и давление в легочной артерии и на широкий диапазон иммунологических и воспалительных состояний. ВИП обладает большим потенциалом в качестве активного агента для лечения легочной гипертензии, хронической обструктивной болезни легких (ХОБЛ), артрита, воспалительного заболевания кишечника (ВЗК) и астмы, и это лишь некоторые из заболеваний.
[005] Имеется, по меньшей мере, два рецептора для ВИЛ, включая VPAC1 и VPAC2. Эти рецепторы в той или иной степени связываются как с ВИП, так и с пептидом, активирующим аденилатциклазу гипофиза (РАСАР). Оба рецептора являются членами семейства рецепторов с 7 трансмембранными доменами, сопряженных с G-белком. VPAC1 распространен, например, в ЦНС, печени, легких, кишечнике и на Т-лимфоцитах. VPAC2 обнаруживают, например, в ЦНС, поджелудочной железе, скелетных мышцах, сердце, почках, жировой ткани, семенниках и в желудке.
[006] Короткий период полувыведения ВИП делает применение этих пептидов в качестве фармацевтического агента непрактичным. См. Pozo D, et al., Tuning immune tolerance with vasoactive intestinal peptide: A new therapeutic approach for immune disorders. Peptides 28(9): 1833-1846 (2007). И действительно, исследования показали, что период полувыведения ВИП из крови составляет менее 2 минут (Domschke et al., 1978, Gut 19: 1049-53; Burhol etal., 1978, Scand J Gastroent 13: 807-813).
Более того, множественность биологических эффектов ВИП может усложнять его разработку для какого-то конкретного показания. Таким образом, необходимы модифицированные версии ВИП для того, чтобы сделать агент применимым в терапевтической практике, например, путем увеличения периода полувыведения и/или приготовления молекул, обладающих требуемыми профилями связывания с рецептором.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[007] Настоящее изобретение направлено на создание модифицированных вазоактивных интестинальных пептидов (ВИП), а также кодирующих полинуклеотидов и векторов и фармацевтических композиций, содержащих модифицированные ВИП. Настоящее изобретение дополнительно направлено на создание способов приготовления модифицированных молекул ВИП и способов применения модифицированных агентов ВИП для лечения пациентов. В соответствии с изобретением, модифицированный ВИП демонстрирует увеличенный период полувыведения из системы кровообращения или сохраняемость в организме, и/или сопоставимые эффективность связывания с рецептором и/или биологическую активность, и/или измененный профиль связывания с рецептором, по сравнению с немодифицированным ВИП.
[008] Одной из особенностей изобретения является то, что оно направлено на создание модифицированных молекул ВИП и содержащих их фармацевтических композиций. Модифицированные молекулы ВИП модифицированы рекомбинантными или химическим способом по N-и/или С-концам путем добавления одной или нескольких аминокислот, и/или путем сшивки с гетерологичными аминокислотными последовательностями таким образом, чтобы обеспечить более длительный период полувыведения из системы кровообращения или сохраняемость в организме, сопоставимую биологическую активность и/или измененный профиль связывания с рецептором. Например, в некоторых вариантах воплощения зрелый ВИП из 28 аминокислот, у которого N-конец начинается с His, содержит дополнительные N-концевые аминокислоты, такие как единичная аминокислота на N-конце (например, Met). В данном или в других воплощениях модифицированный ВИП содержит на N- или С-конце сшивку с эластино-подобным пептидом (ЭПП), как описано в этом документе. Такие модифицированные молекулы ВИП могут демонстрировать повышенный период полувыведения из системы кровообращения или сохраняемость в организме и/или измененное предпочтение к связыванию с VPAC2, по сравнению с VPAC1.
[009] Например, ВИП может быть сшит (например, с помощью рекомбинантных методов) с N-концом пептида ЭПП. Гистидин природного зрелого ВИП может находиться на N-конце. Такие терапевтические агенты могут требовать существенно меньшей частоты введения дозы, чем несшитый аналог, в частности, введения дозы примерно 1-7 раз в неделю (например, введение дозы ежедневно или раз в неделю).
[010] В соответствии с другими вариантами воплощения, химера ВИП-ЭПП может содержать метионин на N-конце, при этом His природного зрелого продукта ВИП находится в положении 2. В других вариантах воплощения молекула ВИП-ЭПП начинается последовательностью метионин-аланин-аланин. При продукции в бактериях первый метионин отсутствует, и продукт содержит на N-конце Ala-Ala. Ala-Ala удаляется in vitro или in vivo под действием пептидазы ДПП-IV, при этом остается N-конец природного зрелого ВИП. Эти конструкции, содержащие дополнительные аминокислоты на N-конце, демонстрируют существенно отличную активность при испытании на активность связывания с рецепторами VPAC1 и VPAC2. Например, хотя обе конструкции могут активировать рецептор VPAC2 со схожей ЕС50, конструкция с метионином на N-конце (и His в положении 2), по меньшей мере, в 100 раз менее активна в отношении рецептора VPAC1.
[011] В различных вариантах воплощения модифицированный ВИП по изобретению, содержащий N-концевой Met, обладает тем преимуществом, что его получают с применением рекомбинантных методов, таких как продукция в Е.coli или иной экспрессионной системе, без дополнительного постэкспрессионного производственного процесса для экспонирования природного или требуемого N-конца.
[012] В других вариантах воплощения ВИП может быть модифицирован химически, например, путем добавления одного или нескольких ПЭГ или иных остатков (например, на N-конце или около него), как подробно описано в этом документе.
[013] Другими особенностями настоящего изобретения является то, что оно направлено на создание полинуклеотидов и векторов, кодирующих модифицированный ВИП по изобретению, а также содержащих их клеток-хозяев. Клетки-хозяева могут быть пригодны для рекомбинантной продукции модифицированного ВИП, например, бактериальные или дрожжевые клетки, пригодные для применения с известными экспрессионными системами.
[014] Другими особенностями настоящего изобретения является то, что оно направлено на создание способов лечения, уменьшения интенсивности симптомов или профилактики состояния у млекопитающего. Такие состояния включают разнообразные сердечнососудистые, иммунологические (например, аутоиммунные) и неврологические состояния. Например, модифицированный ВИП может применяться для регулировки баланса между провоспалительными и противовоспалительными эффекторами у пациента, в том числе у пациента, страдающего от аутоиммунного заболевания или воспалительного состояния. Примеры показаний для применения модифицированного ВИП включают, среди прочего, гипертонию, хроническую обструктивную болезнь легких (ХОБЛ), диабет, фиброз миокарда, сердечную недостаточность, кардиомиопатию, артрит, воспалительное заболевание кишечника (ВЗК) и астму.
ОПИСАНИЕ ФИГУР
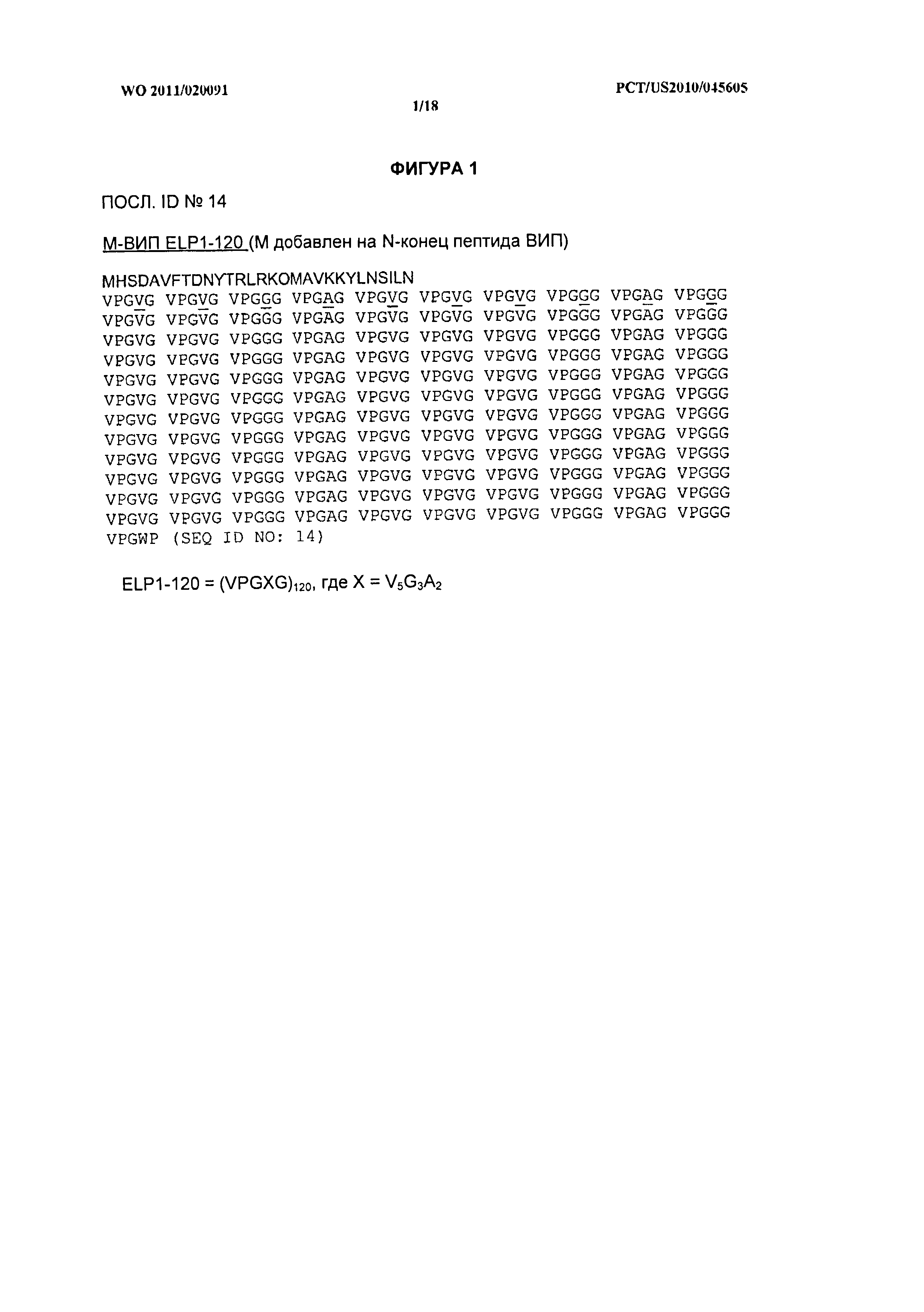
[015] На фиг.1 показана аминокислотная последовательность модифицированного химерного белка ВИП-ЭПП (М-ВИП-ЭПП1-120, ПОСЛ. ID №:14), содержащего Met на N-конце и 120 единиц ЭПП1 (VPGXG, ПОСЛ. ID №:3), сшитые с С-концом ВИП.
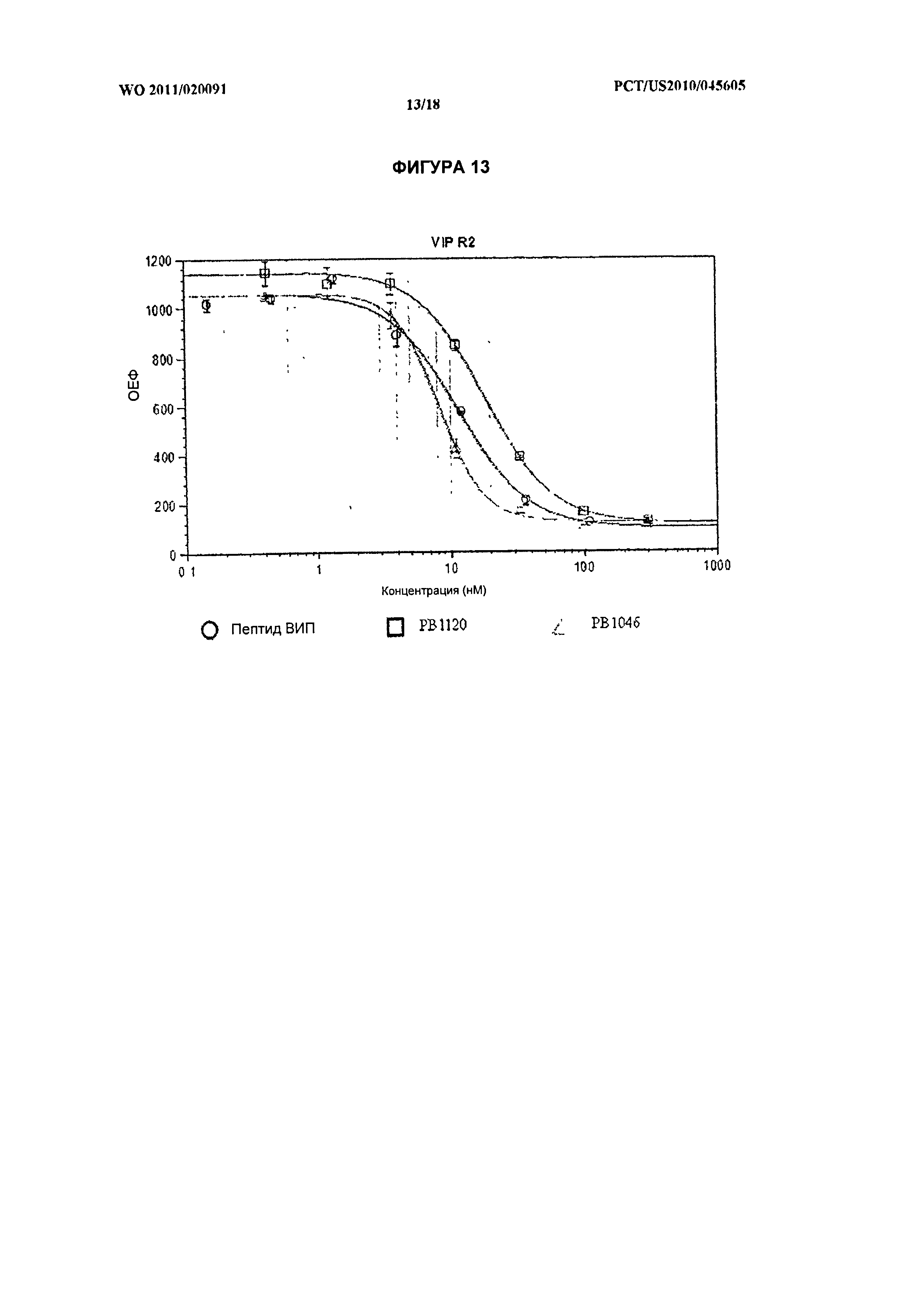
[016] На фиг.2 показана аминокислотная последовательность модифицированного химерного белка ВИП-ЭПП (МАА-ВИП-ЭПП1-120, ПОСЛ. ID №:15), содержащего Met-Ala-Ala на N-конце, который подвержен активации до природного зрелого пептида ВИП, и 120 единиц ЭПП1 (VPGXG, ПОСЛ. ID №:3), сшитые с С-концом ВИП.
[017] На фиг.3 представлена карта плазмиды рРВ1031, кодирующей ЭПП1-120 для стандартной продукции рекомбинантных химер.
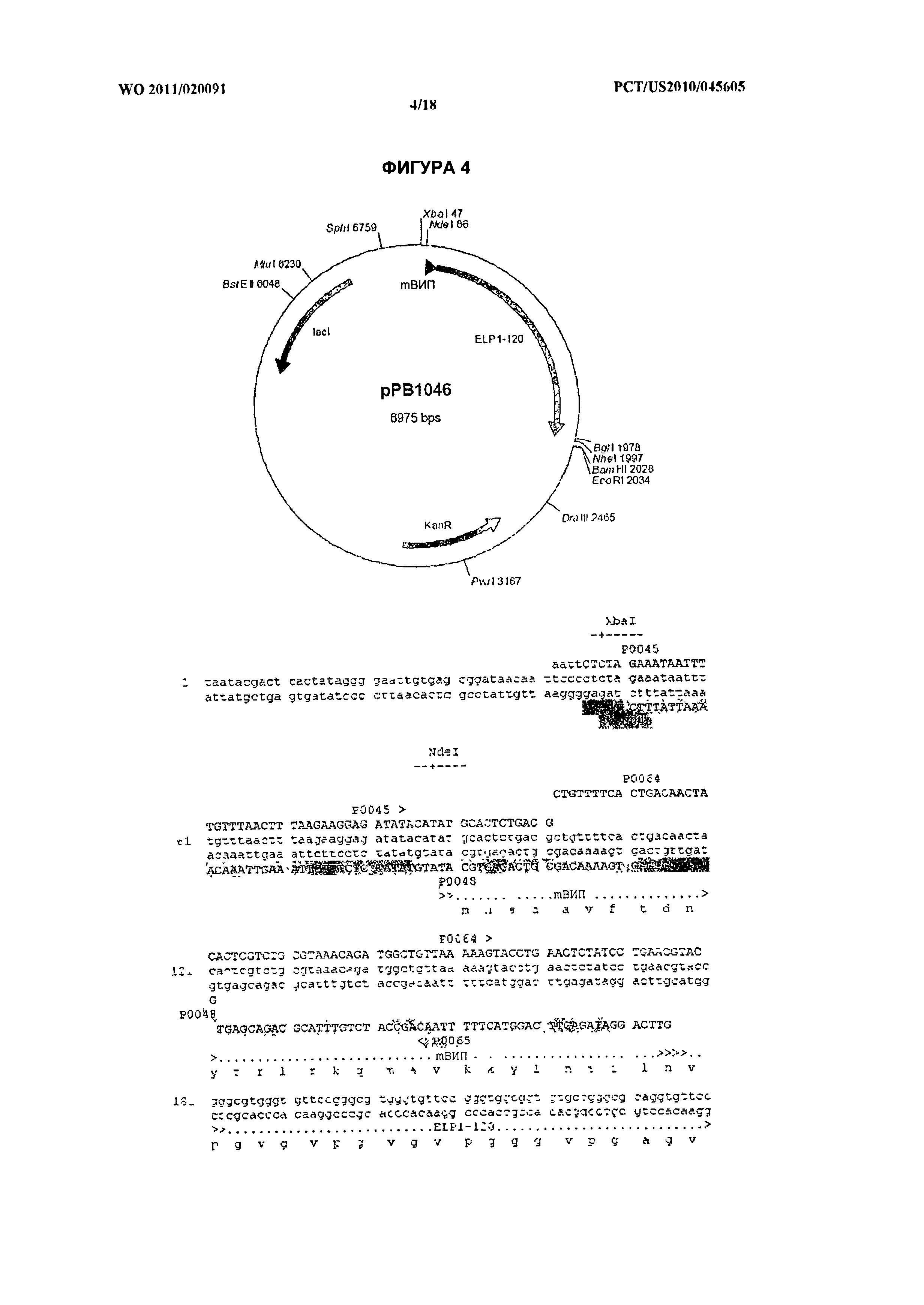
[018] На фиг.4 изображена плазмида рРВ1046, кодирующая химерный белок М-ВИП-ЭПП1-120 (ПОСЛ. ID №№:39 и 40). Указаны праймеры (Р0045, ПОСЛ. ID №:31, Р0048, ПОСЛ. ID №:32, и Р0065, ПОСЛ. ID №:34) для создания рекомбинантного гена.
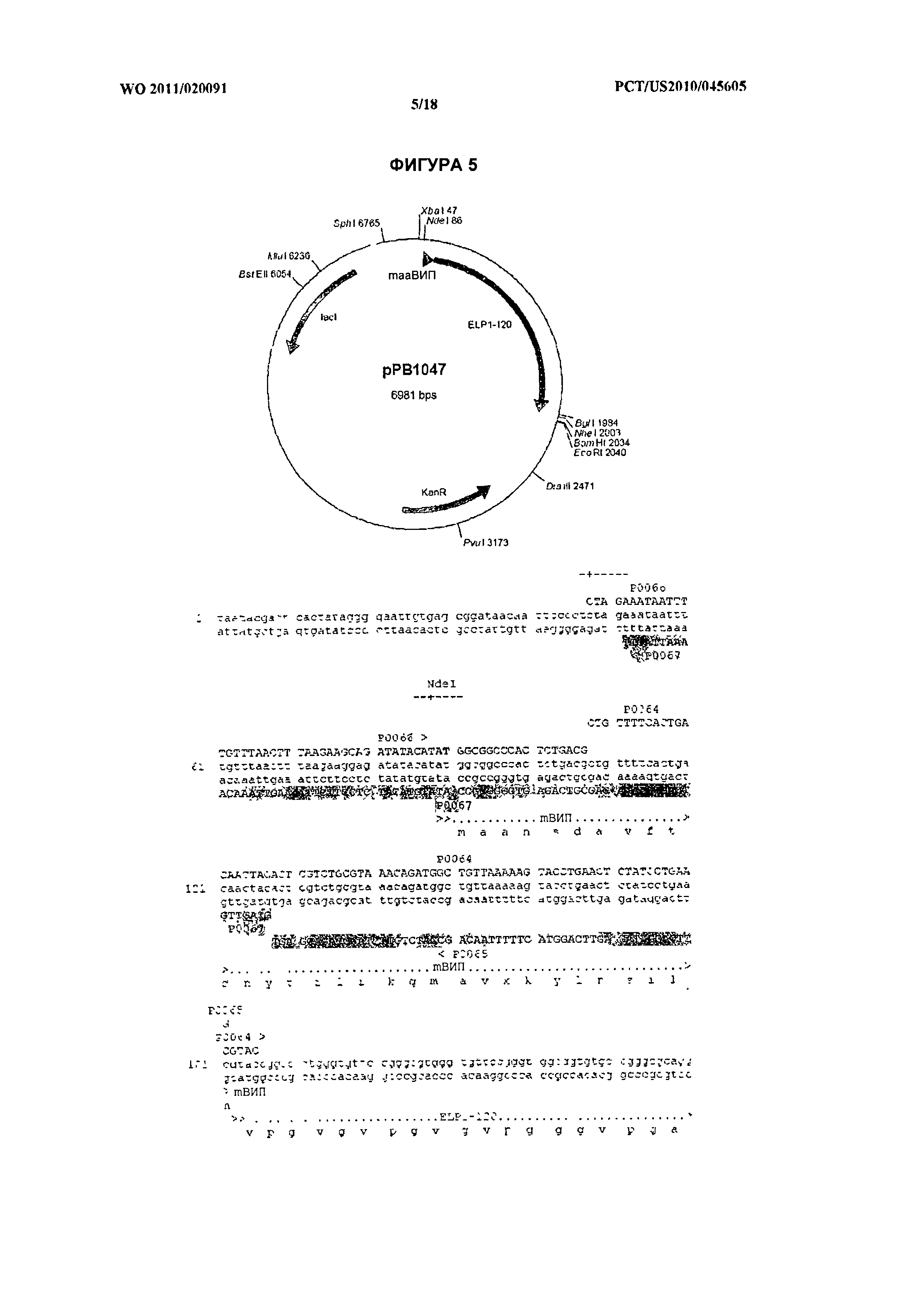
[019] На фиг.5 изображена плазмида рРВ1047, кодирующая химерный белок МАА-ВИП-ЭПП1-120 (ПОСЛ. ID №№:41 и 42). Указаны праймеры (Р0066, ПОСЛ. ID №:35, Р0064, ПОСЛ. ID №:33, P0067, ПОСЛ. ID №:36) для создания рекомбинантного гена.
[020] На фиг.6 изображена плазмида рРВ1048, кодирующая химерный белок ЭПП1-120-ВИП (ПОСЛ. ID №№:43 и 44). Указаны праймеры для создания рекомбинантного гена (Р0068, ПОСЛ. ID №:37, Р0069, ПОСЛ. ID №:38).
[021] На фиг.7 представлен анализ в 10% полиакриламидном геле NuPAGE с трис-ацетатным буфером очищенных химерных белков ВИП-ЭПП, с тепловой денатурацией и без нее.
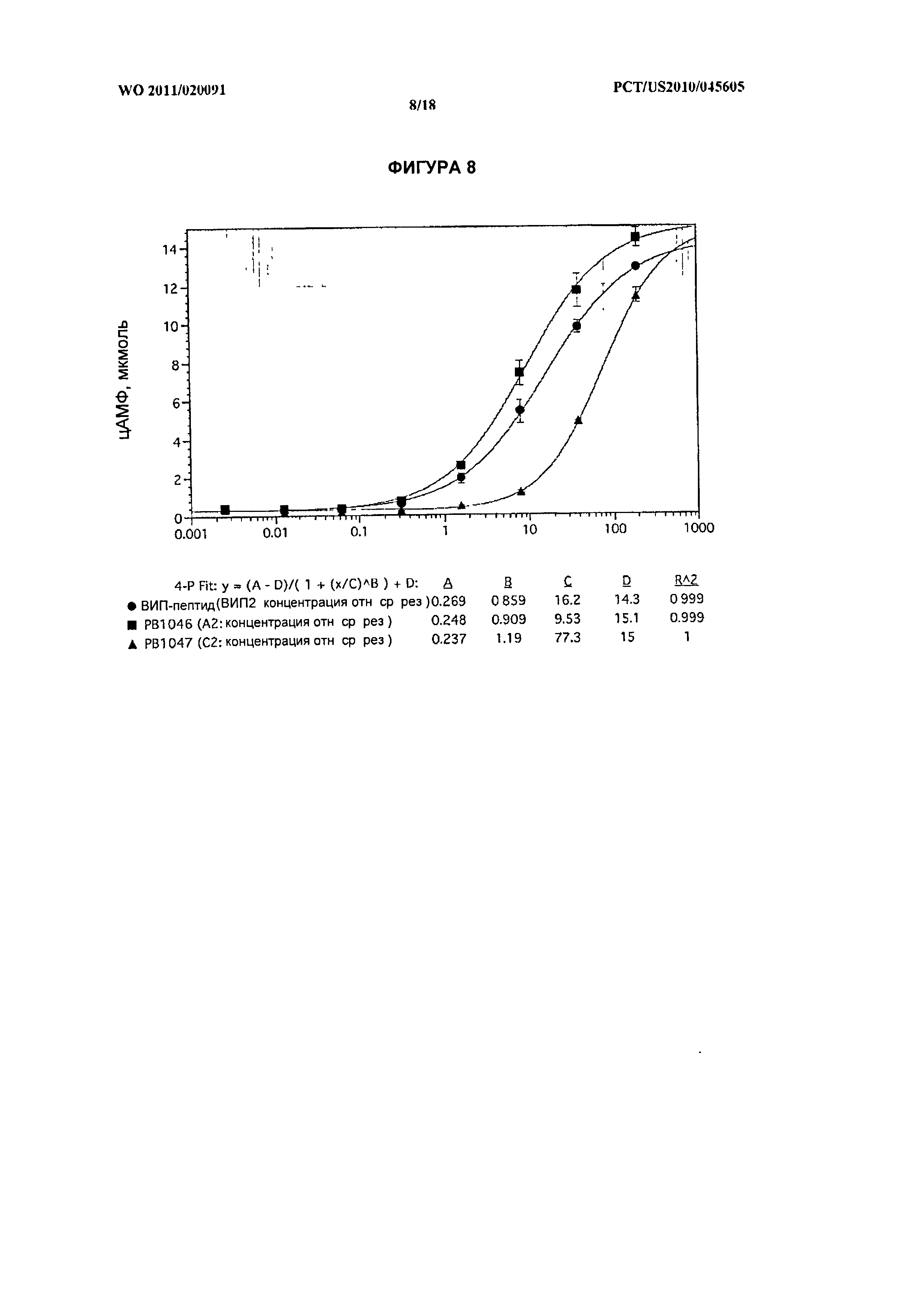
[022] На фиг.8 показана активность in vitro нативного ВИП и химерных белков ВИП-ЭПП РВ 1046 и РВ 1047 в отношении рецептора VPAC2.
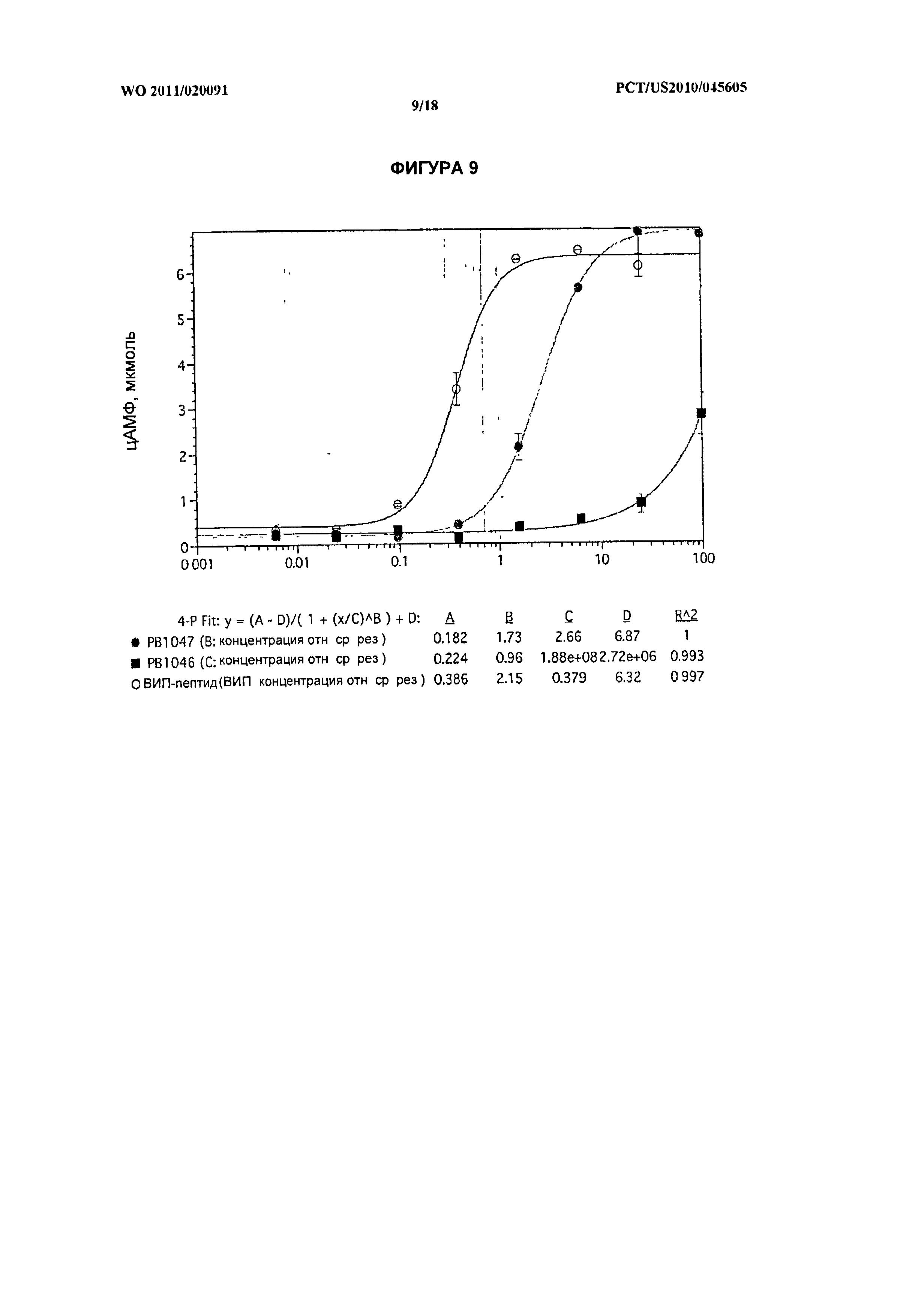
[023] На фиг.9 показана активность т vitro нативного ВИП и химерных белков ВИП-ЭПП РВ1046 и РВ1047 в отношении рецептора VPAC1.
[024] На фиг.10 показан эффект in vivo химерного белка ВИП-ЭПП на кровяное давление у крысы. На диаграмме слева показано систолическое артериальное давление. На диаграмме справа показано диастолическое артериальное давление. ВИП-ЭПП снижает кровяное давление в течение периода 12 ч.
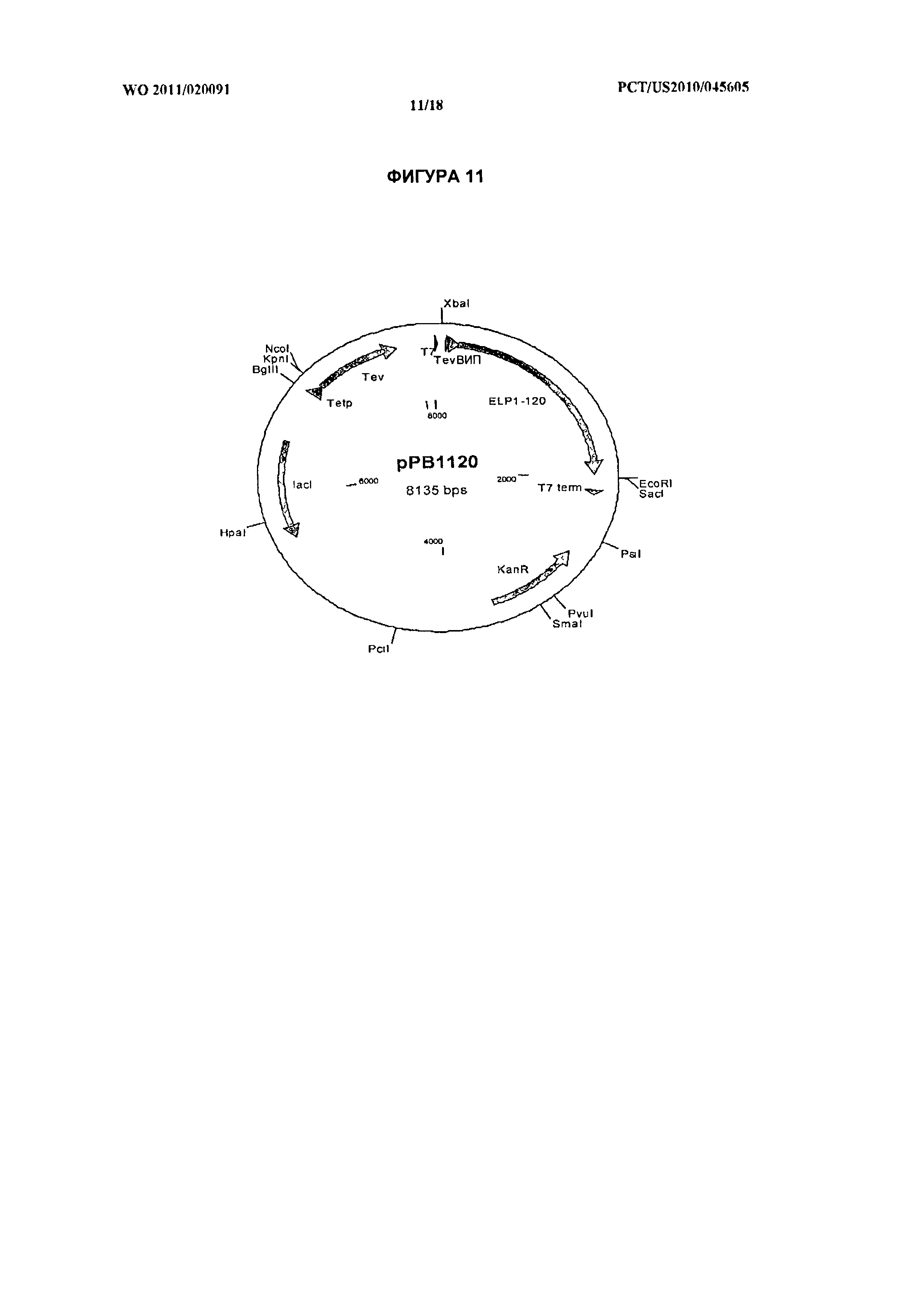
[025] На фиг.11 показана карта плазмиды рРВ1120 (ПОСЛ. ID №:48), кодирующей ВИП-ЭПП 1-120.
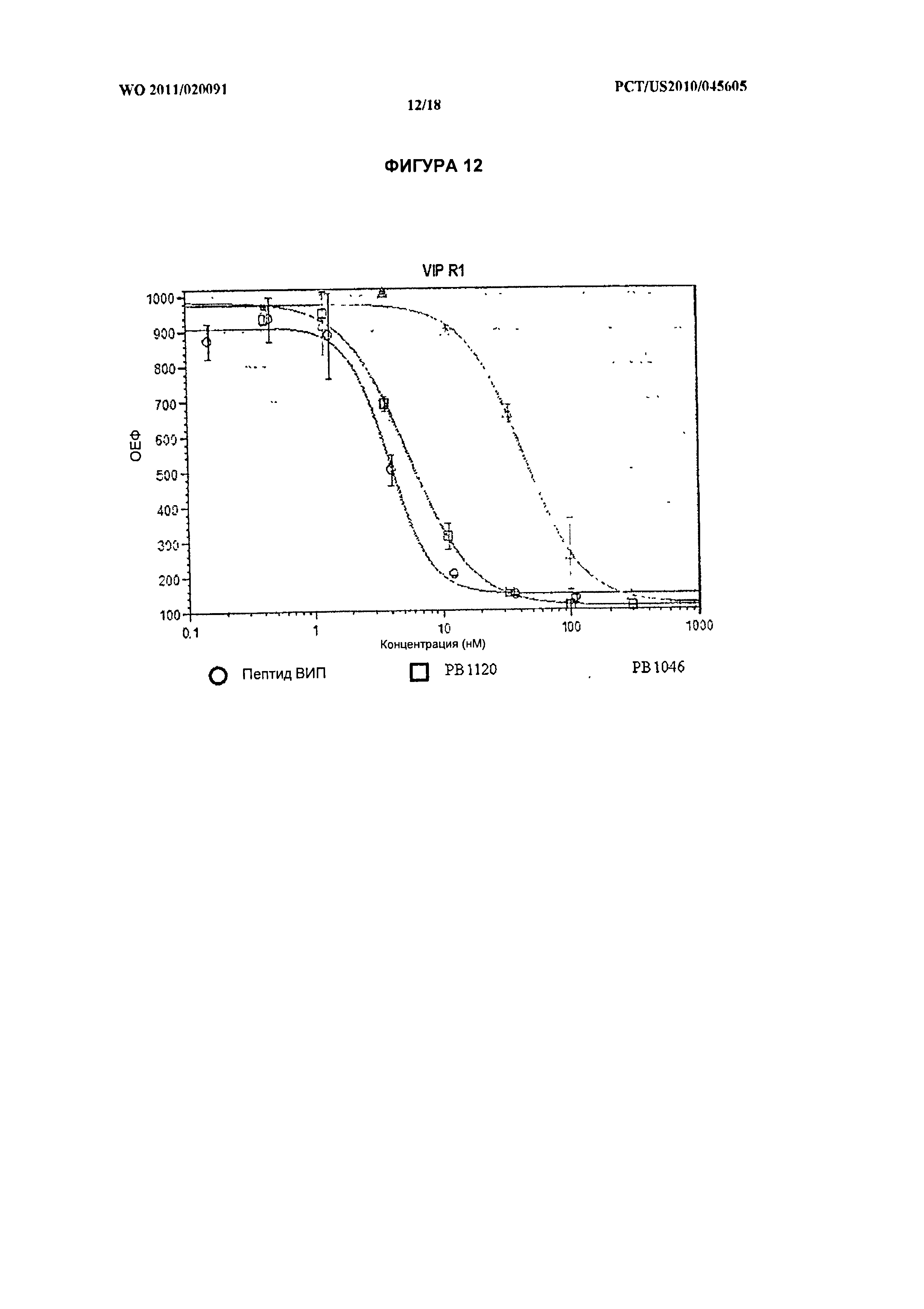
[026] На фиг.12 показана активность in vitro нативного ВИП и химерных белков ВИП-ЭПП РВ1120 и РВ1046 в отношении рецептора VPAC1.
[027] На фиг.13 показана активность in vitro нативного ВИП и химерных белков ВИП-ЭПП РВ1120 и РВ1046 в отношении рецептора VPAC2.
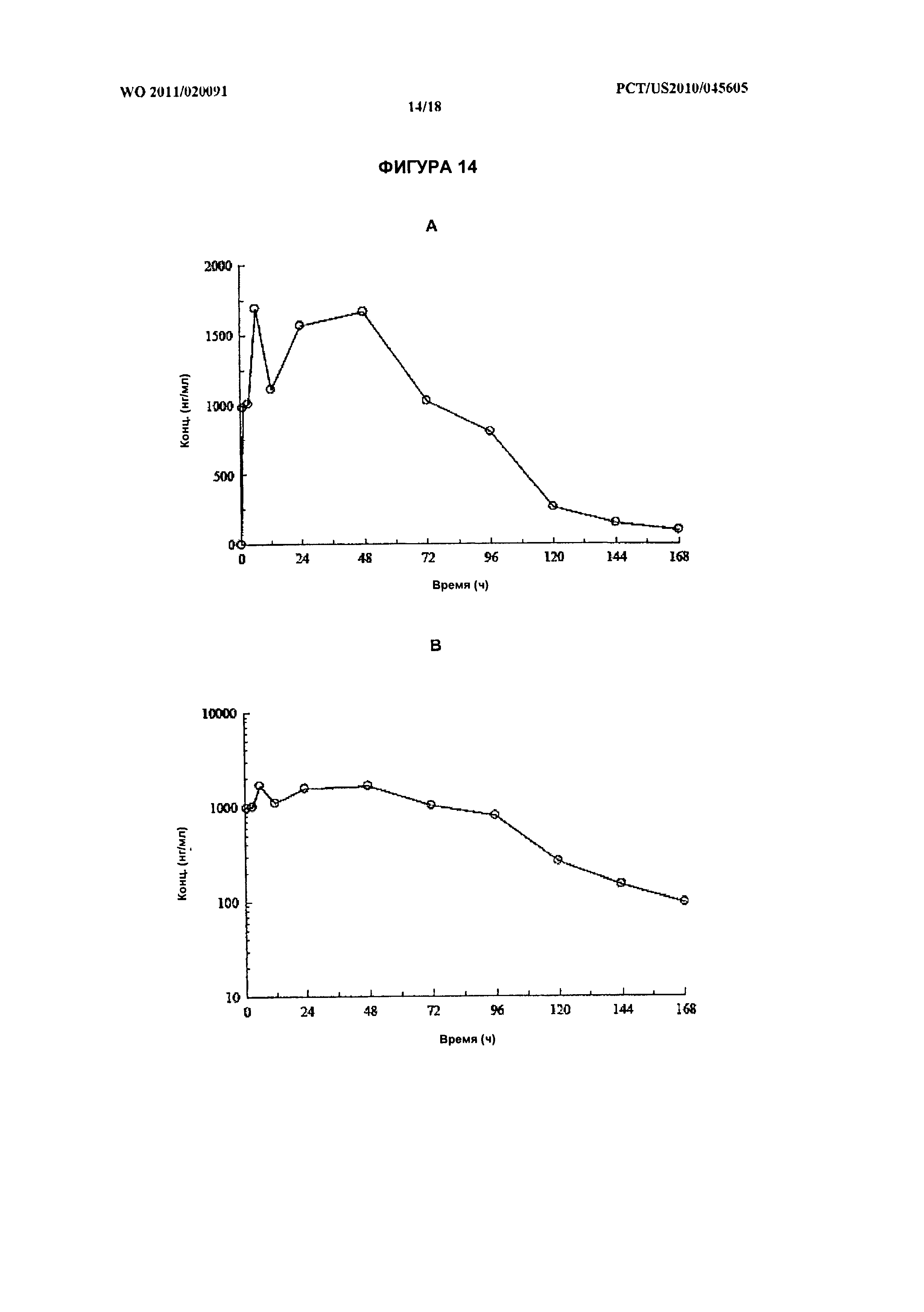
[028] На фиг.14А показан фармакокинетический профиль химерного белка ВИП-ЭПП РВ1120 у обезьян (n=3) после разовой подкожной инъекции в дозировке 3 мг/кг, с линейными осями. На фиг.14 В показан фармакокинетический профиль химерного белка ВИП-ЭПП РВ 1120 с полулогарифмическими осями.
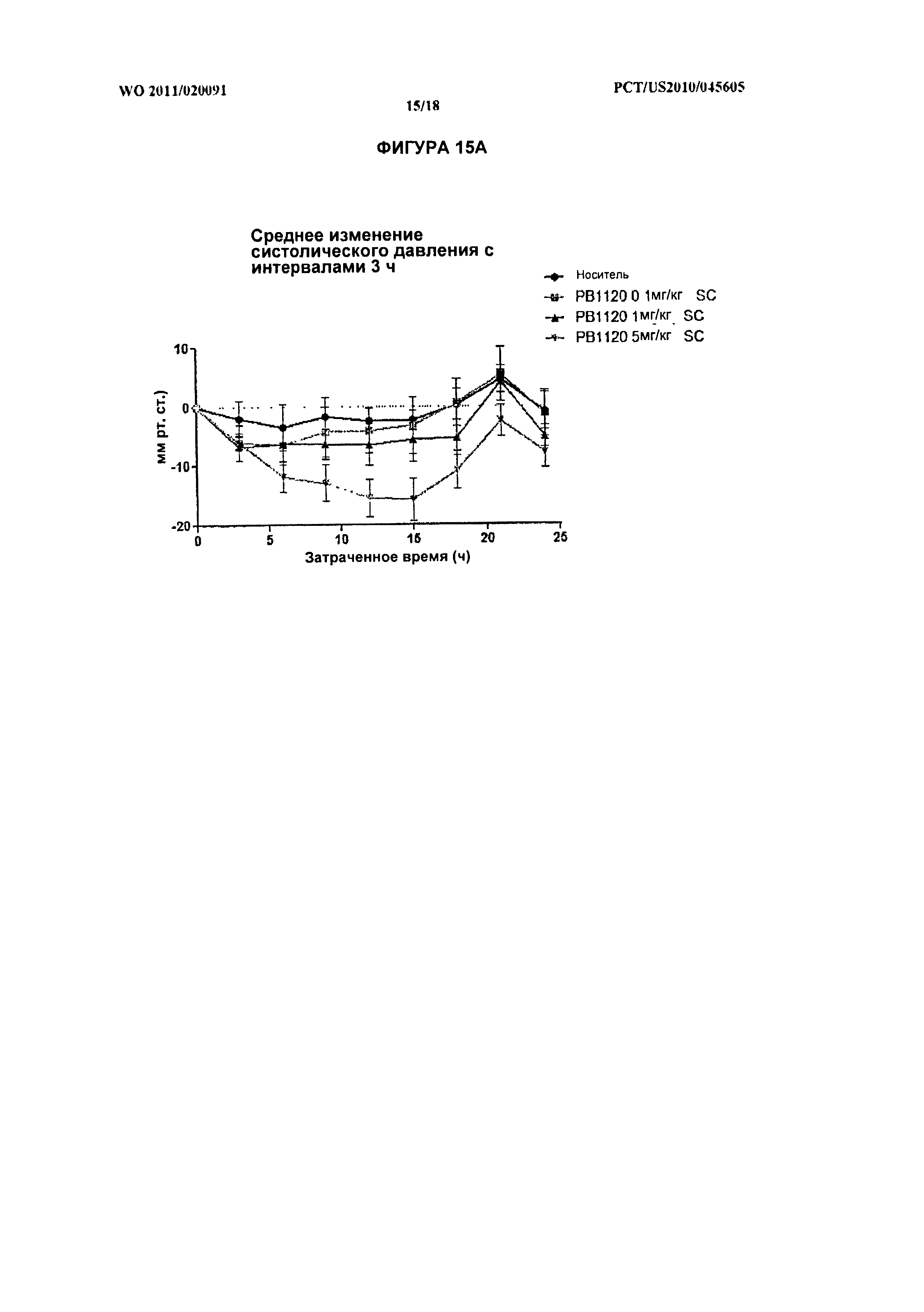
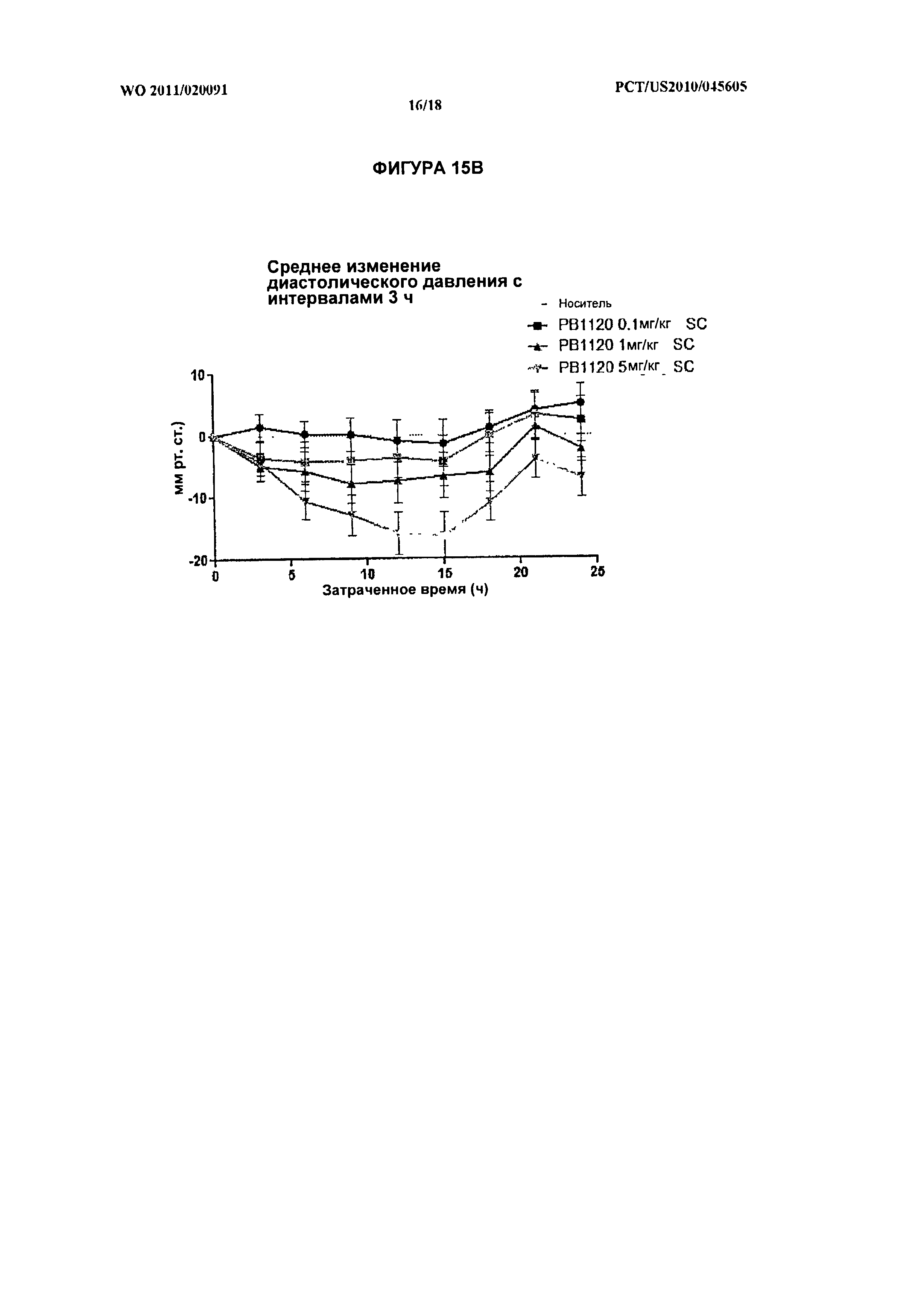
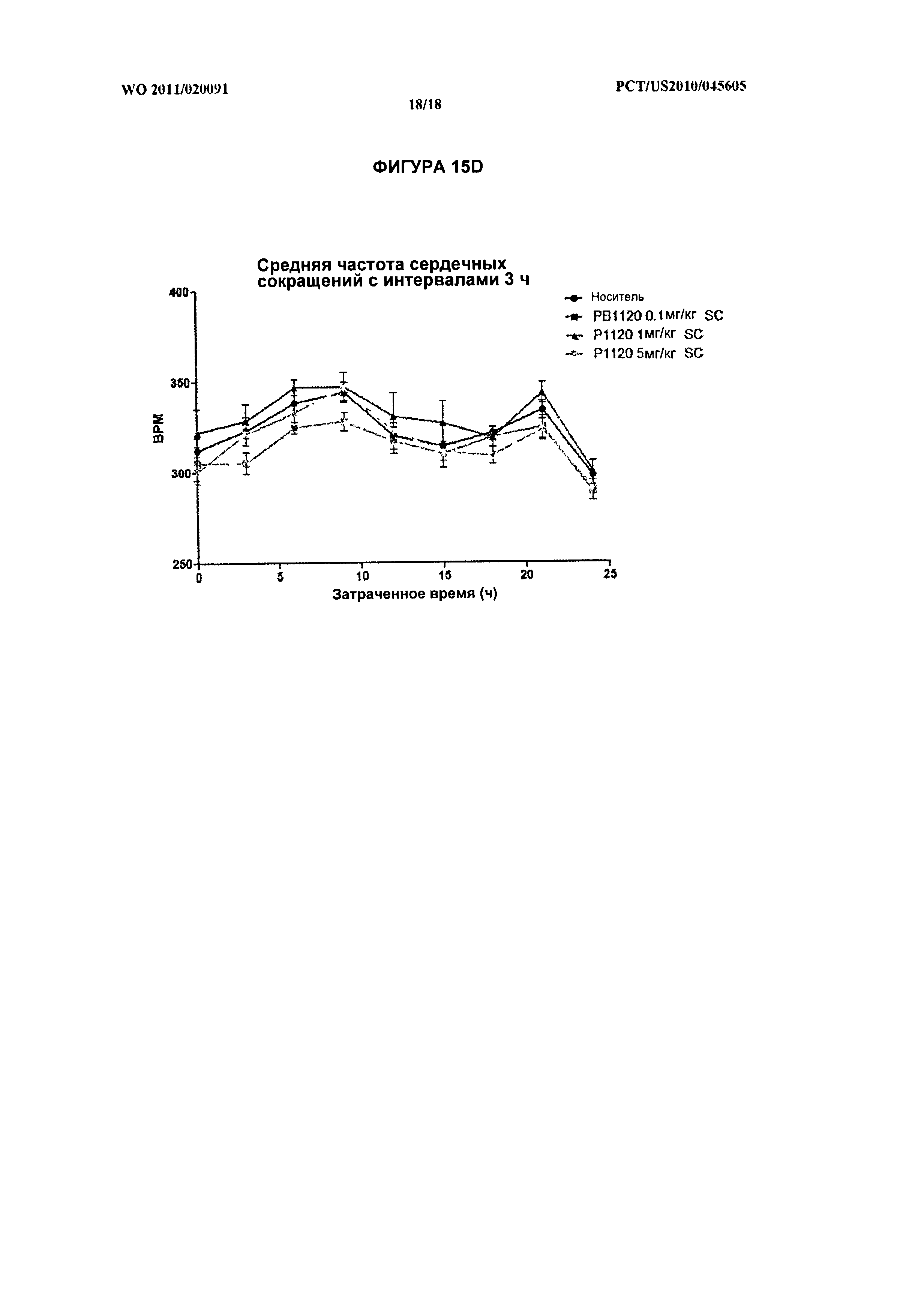
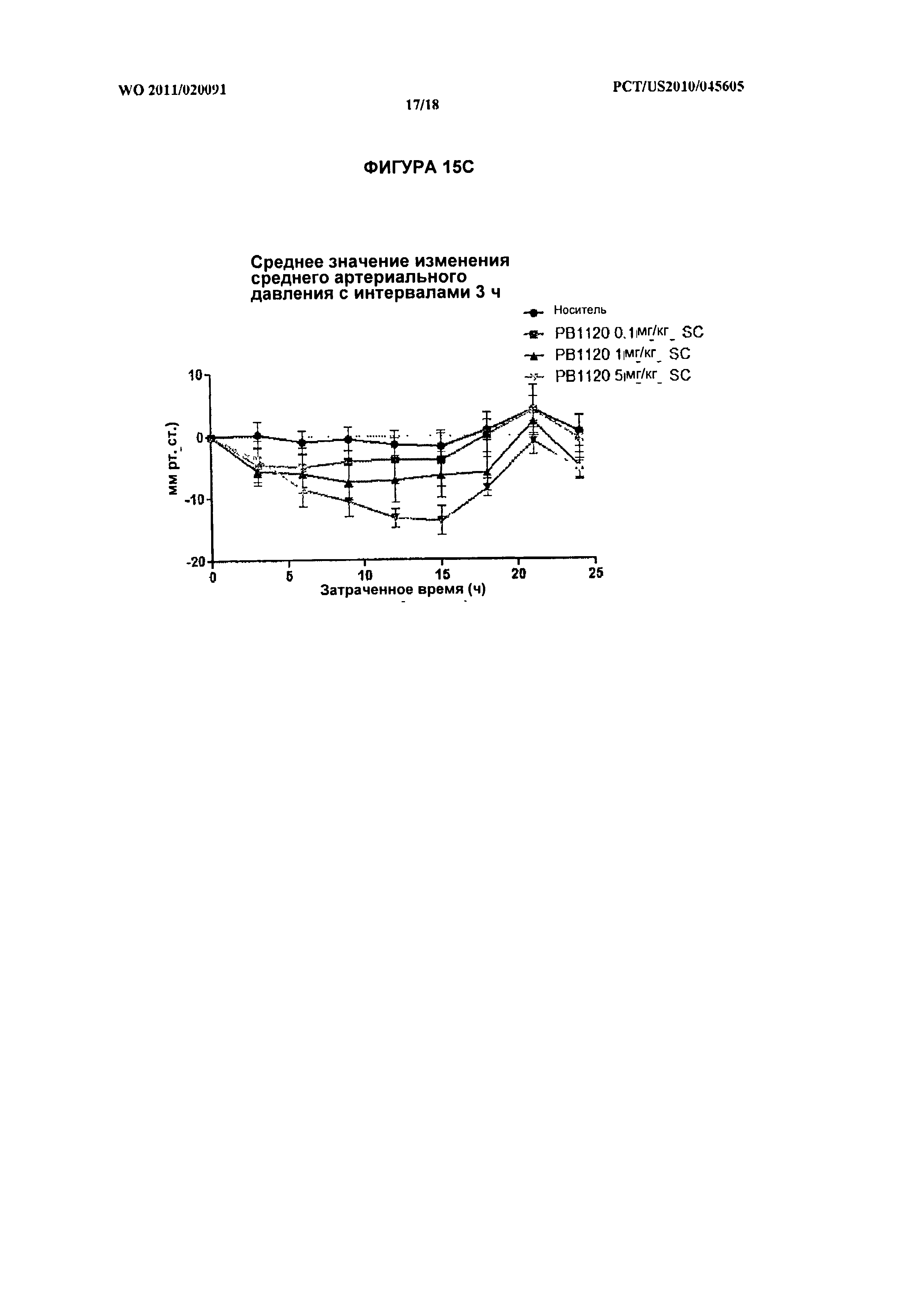
[029] На фиг.15А, 15В, и 15С показано среднее изменение систолического, диастолического и среднего кровяного давления, соответственно, с интервалами 3 ч, у крыс, получивших подкожную инъекцию РВ1120 в дозировках 0,1 мг/кг, 1 мг/кг или 5 мг/кг. На фиг.15D показана средняя частота сердечных сокращений подопытных крыс с интервалами 3 ч после введения РВ1120.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[030] Настоящее изобретение направлено на создание модифицированных вазоактивных интестинальных пептидов (ВИП), кодирующих полинуклеотидов и векторов, а также фармацевтических композиций, содержащих модифицированные ВИП. Настоящее изобретение дополнительно направлено на создание способов приготовления и применения модифицированных агентов ВИП для лечения пациентов. В соответствии с изобретением, ВИП может демонстрировать увеличенный период полувыведения из системы кровообращения или сохраняемость в организме, сопоставимые эффективность связывания с рецептором или биологическую активность, и/или измененный профиль связывания с рецептором, по сравнению с немодифицированным ВИП. В различных вариантах воплощения соединения по изобретению демонстрируют сниженную частоту приема, по сравнению с немодифицированными аналогами.
Вазоактивный интестинальный пептид
[031] Вазоактивный интестинальный пептид (ВИП) - это пептидный гормон, содержащий 28 аминокислотных остатков и продуцирующийся во многих частях тела человека, включая кишечник, поджелудочную железу и супрахиазматические ядра гипоталамуса в мозге. ВИП демонстрирует широкое разнообразие биологических активностей, включая системное расширение кровеносных сосудов, гипотензию, повышенный минутный сердечный выброс, стимуляцию дыхания, гипергликемию, расширение коронарных сосудов, бронходилатацию у животных и человека. ВИП также влияет на баланс иммунной системы.
[032] ВИП оказывает влияние на несколько частей тела. По отношению к пищеварительной системе ВИП может индуцировать расслабление гладкой мускулатуры (нижнего пищеводного сфинктера, желудка, желчного пузыря), стимулировать секрецию воды в сок поджелудочной железы и желчь и вызывать подавление секреции кислоты в желудке и всасывания из полости кишечника. Его роль в кишечнике состоит в стимуляции секреции воды и электролитов, а также в растяжении гладкой мускулатуры кишечника, расширении периферических кровеносных сосудов, стимулировании секреции бикарбоната поджелудочной железой и подавлении стимулируемой гастрином секреции кислоты в желудке. Эти эффекты действуют совместно для повышения подвижности. ВИП обладает функцией стимулирования секреции пепсиногена главными клетками.
[033] ВИП был обнаружен в сердце и оказывает существенные эффекты на сердечнососудистую систему. Он вызывает расширение коронарных сосудов, а также оказывает положительный инотропный и хронотропный эффект.
[034] ВИП является иммуномодулирующим пептидом, полезным для лечения воспаления и аутоиммунного заболевания TH1-типа (см. Delgado et al., The Significance of Vasoactive Intestinal Peptide in Immunomodulation. Pharmacol. Reviews 56(2):249-290 (2004)). ВИП полезен для лечения нейродегенеративных заболеваний (см. патент США №5 972 883, содержание которого целиком включено здесь в качестве ссылки). ВИП и структурно родственный ему пептид, полипептид, активирующий аденилатциклазу гипофиза (РАСАР), оказывают важные терапевтические эффекты при хроническом воспалительном ревматоидном заболевании, таком как остеоартрит (ОА) и ревматоидный артрит (RA), подавляя как воспалительный, так и аутоиммунный компоненты заболевания (Juarranz et al., Vasoactive intestinal peptide modulates proinflammatory mediator synthesis in osteoarthritic and rheumatoid synovial cells. Rheumatology, 2004, 43:416-422). Кроме того, ВИП участвует в поддержании иммунологической толерантности, регулируя баланс между провоспалительными и противовоспалительными эффекторами или индуцируя появление Т-клеток, обладающих супрессорной активностью относительно аутореактивных Т-клеток (Pozo et al., Tuning immune tolerance with vasoactive intestinal peptide: A new therapeutic approach for immune disorders, Peptide, 2007,28(9): 1833-1846).
[035] Зрелый ВИП содержит 28 аминокислотных остатков, расположенных в следующей последовательности: HSDAVFTDNYTRLRKQMAVKKYLNSILN (ПОСЛ. ID №:13). ВИП образуется в результате процессинга молекулы предшественника препро-ВИП, состоящей из 170 аминокислот. Структуры ВИП и примеры аналогов описаны в патентах США 4835252, 4939224, 5141924, 4734400, 4605641, 6080837, 6316593, 5677419, 5972883, 6489297, 7094755 и 6608174, содержание каждого из которых целиком включено сюда в качестве ссылки.
[036] Ряд мутаций для повышения устойчивости пептида против протеаз и т.д. подробно описаны в литературе (см. Onune et al Physicochemical and pharmacological characterization of novel vasoactive intestinal peptide derivatives with improved stability. Eur. J.Pharm. Biopharm. 2009, содержание которой целиком включено сюда в качестве ссылки). Эти модифицированные пептиды ВИП имеют последовательности ПОСЛ. ID №:21 (M17L, для предотвращения окисления Met), ПОСЛ. ID №:22 (K15R, K20R и K21R, для повышения устойчивости к протеолизу) и ПОСЛ. ID №:23 (N24A и S25A, для повышения протеолитической/термической устойчивости). Настоящее изобретение направлено на создание пептидов ВИП, которые содержат одну или несколько из этих модификаций, и имеют дополнительные модификации ВИП, описанные в этом документе. Примеры модифицированных молекул ВИП включают модифицированные пептиды ВИП с ПОСЛ. ID №№:14-15, 17-27, 40, 42, 44 и 50.
[037] В различных воплощениях, описанных в этом документе, описан модифицированный ВИП (например, содержащий ПОСЛ. ID №:13) (или функциональный аналог, как описано в этом документе). В общем случае функциональные аналоги ВИП включают функциональные фрагменты, укороченные по N- или С-концу на 1-10 аминокислот, включая 1, 2, 3 или вплоть до примерно 5 аминокислот (по сравнению с ПОСЛ. ID №:13). Такие функциональные аналоги могут содержать вставки, делеции и/или замены от 1 до 5 аминокислот (в целом), по сравнению с нативной последовательностью (например, ПОСЛ. ID №:13), в каждом случае сохраняя активность пептида (например, в отношении связывания с VPAC2 и/или VPAC1). Такая активность может быть подтверждена или количественно определена с применением любого доступного метода анализа, включая метод анализа, описанный в этом документе, и включая любой пригодный метод анализа для определения или количественной оценки активности, описанный в работе Delgado et al., The Significance of Vasoactive Intestinal Peptide in Immunomodulation, Pharmacol. Reviews 56(2): 249-290 (2004). В этих и других вариантах воплощения ВИП-компонент модифицированного ВИП по изобретению имеет, по меньшей мере, примерно 50%, 75%, 80%, 85%, 90%, 95% или 97% идентичности по отношению к нативной зрелой последовательности (ПОСЛ. ID №:13). Определение идентичности последовательностей между двумя последовательностями (например, между нативной последовательностью и функциональным аналогом) можно проводить с применением любой программы для выравнивания, включая Tatusova et al., Blast 2 sequences - a new tool for comparing protein and nucleotide seguences, FEMS Microbiol Lett. 174: 247-250 (1999).
[038] Одной из особенностей изобретения является то, что оно направлено на создание модифицированной молекулы ВИП, обладающей предпочтительным связыванием с рецептором VPAC2 или VPAC1, по сравнению с немодифицированным ВИП (например, пептидом, состоящим из аминокислотной последовательности ПОСЛ. ID №:13). Например, модифицированный ВИП может обладать относительным предпочтением к связыванию с VPAC2, а не с VPAC1, составляющим, по меньшей мере, примерно 2:1, примерно 5:1, примерно 10:1, примерно 25:1, примерно 50:1, примерно 100:1, примерно 500:1 или более. В других вариантах воплощения модифицированный ВИП может обладать относительным предпочтением к связыванию с VPAC1, а не с VPAC2, составляющим, по меньшей мере, примерно 2:1, примерно 5:1, примерно 10:1, примерно 25:1, примерно 50:1, примерно 100:1, примерно 500:1 или более. Например, в некоторых вариантах воплощения модифицированный ВИП активирует рецептор VPAC2 в существенной степени так же, как зрелый немодифицированный ВИП человека, т.е. с ЕС50, отличающейся в пределах 2 раз от таковой зрелого немодифицированного ВИП человека (ПОСЛ. ID №:13). Однако тот же самый модифицированный ВИП примерно в 50 или 100 или более раз менее эффективен, чем зрелый немодифицированный ВИП человека при активации рецептора VPAC.
[039] Такие модифицированные молекулы ВИП могут содержать модифицированные N-концевые области, такие как добавление от 1 до примерно 500 аминокислот к N-концевому гистидину пептида ВИП, которое может включать гетерологичные аминокислотные последовательности млекопитающих. Например, модифицированный ВИП может содержать единичный остаток метионина со стороны N-конца природного N-концевого гистидина зрелого ВИП. Эту молекулу также стандартно продуцируют в Е.coli или в другой бактериальной экспрессионной системе, так как в этом случае метионин не будет удален клеткой Е coli, если соседней аминокислотой является гистидин. В соответствии с другим вариантом, N-концевая аминокислота может являться любой из встречающихся в природе аминокислот, а именно, аланином, аргинином, аспарагином, аспарагиновой кислотой, цистеином, глутаминовой кислотой, глутамином, глицином, гистидином, изолейцином, лейцином, лизином, метионином, фенилаланином, серином, треонином, триптофаном, тирозином, валином и пролином.
[040] Дополнительная последовательность, добавленная к N-концу ВИП, может иметь любую последовательность, включая биологически активные и биологически инертные последовательности длиной от 1 до примерно 100, от 1 до примерно 50, от 1 до примерно 20, от 1 до примерно 10 и от 1 до примерно 5 аминокислот.
[041] N-конец модифицированного ВИП может иметь структуру М-N, где М - это метионин, а N - это N-конец молекулы ВИП (например, ПОСЛ. ID №:14, ФИГУРА 1). Этот метионин обеспечивает трансляцию белка в бактериальной или эукариотической клетке-хозяине. Таким образом, модифицированный ВИП может быть получен в биологической системе, включая бактериальные и дрожжевые экспрессионные системы (например, Е.coli). Хотя метионин может быть в некоторых случаях удален метионин-аминопептидазой (МА) в бактериальной экспрессионной системе, гистидин (Н) в положении 2 является одним из наименее предпочтительных остатков для МА.
[042] В других вариантах воплощения N-конец модифицируют путем сшивки с гетерологичным белком млекопитающих, таким как белком млекопитающих, который обеспечивает увеличение периода полувыведения терапевтических молекул. Такими последовательностями могут быть последовательности млекопитающих, такие как последовательности альбумина, трансферрина или фрагмента антител Fc. Такие последовательности описаны в патенте США №7238667 (в частности, в отношении конъюгатов альбумина), патенте США №7176278 (в частности, в отношении конъюгатов трансферрина) и патенте США №5766883, которые полностью включены сюда в качестве ссылок.
[043] В других вариантах воплощения ВИП может быть активирован пептидазой или протеазой, такой как эндогенная пептидаза или протеаза. Такие активируемые последовательности описаны в международной заявке на патент №PCT/US2009/068656, которая полностью включена сюда в качестве ссылки. При использовании в этом документе термины «пептидаза» и «протеаза» являются взаимозаменяемыми. Например, ВИП может быть сконструирован так, чтобы его могла активировать дипептидилпептидаза. Примеры дипептидилпептидаз включают дипептидилпептидазу-1 (ДПП-I), дипептидилпептидазу-3 (ДПП-III), дипептидилпептидазу-4 (ДПП-IV), дипептидилпептидазу-6 (ДПП-VI), дипептидилпептидазу-7 (ДПП-VII), дипептидилпептидазу-8 (ДПП-VIII), дипептидилпептидазу-9 (ДПП-IX), дипептидилпептидазу-10 (ДПП-Х). Последовательности субстратов для таких дипептидаз известны.
[044] N-конец активируемого ВИП может иметь структуру Z-N, где Z - это субстрат для дипептидазы (например, Z удаляется под воздействием дипептидазы), а N - это N-конец ВИП. Активируемый ВИП может иметь N-концевую последовательность формулы M-X-N, где М -это метионин, Х - это Pro, Ala или Ser, a N - это N-конец ВИП или аналога ВИП. В этом случае М и Х будут предрасположены к отщеплению и будут удалены клеткой-хозяином (например, Е.coli.) и/или, впоследствии, дипептидазой (например, ДПП-IV). В соответствии с другим вариантом, N-концевая последовательность активируемого ВИП может иметь структуру X1-X2-N, где X1 - это Gly, Ala, Ser, Cys, Thr, Val или Pro; X2 - это Pro, Ala или Ser; и N - это N-конец ВИП. X1-X2 является субстратом для дипептидазы (например, ДПП-IV), и в результате расщепления дипептидазой будет экспонирован N, требуемый N-конец ВИП или аналога ВИП (например, ПОСЛ. ID №:15, ФИГУРА 2). В таких вариантах воплощения белок может быть получен путем экспрессии конструкции, кодирующей M-X1-X2-N (где М - метионин) в клетке-хозяине (например, Е. coli.), так как Gly, Ala, Ser, Cys, Thr, Val или Pro во втором положении будут служить сигналом для удаления Met, что в результате приведет к последовательности X1-Х2 на N-конце, которая может быть активирована дипептидазой (например, ДПП-IV) in vivo. Такие активируемые молекулы ВИП, которые активируются для образования природного зрелого N-конца ВИП, не демонстрируют предпочтения в отношении рецепторов.
[045] В другом варианте воплощения настоящего изобретения N-конец модифицированного активируемого ВИП может иметь структуру M-Z-N, где М - это метионин, Z - это субстрат для дипептидазы (например, Z удаляется под воздействием дипептидазы), а N - это отличный от His N-конец ВИП (модифицированного ВИП). Например, модифицированный активируемый ВИП может иметь N-концевую последовательность формулы M-X-N, где М - это метионин, Х - это Pro, Ala или Ser, а N - это отличный от His N-конец активной формы ВИП. В этом случае М и Х будут предрасположены к отщеплению и будут удалены клеткой-хозяином (например, Е.coli.) и/или, впоследствии, дипептидазой (например, ДПП-IV). В соответствии с другим вариантом, N-концевая последовательность активируемого ВИП может иметь структуру X1-X2-N, где X1 - это Gly, Ala, Ser, Cys, Thr, Val или Pro; X2 - это Pro, Ala или Ser; и N - это отличный от His N-конец активной формы ВИП. X1-Х2 является субстратом для дипептидазы (например, ДПП-IV), и в результате расщепления дипептидазой будет экспонирован N, требуемый отличный от His N-конец ВИП.
[046] В другом варианте воплощения настоящего изобретения N-конец модифицированного активируемого ВИП может иметь структуру M-Z-S-N, где М - это метионин; Z - это субстрат для дипептидазы (например, Z удаляется под воздействием дипептидазы); N - это N-конец зрелого ВИП (His); и S - это одна или несколько аминокислот, которые будут экспонированы после расщепления дипептидазой и которые обеспечивают получение модифицированного ВИП, как описано ранее. Например, модифицированный активируемый ВИП может содержать N-концевую последовательность формулы M-X-S-N, где М - это метионин, Х - это Pro, Ala или Ser; N - это N-конец зрелого ВИП; и S - это одна или несколько аминокислот, которые будут экспонированы после расщепления дипептидазой и которые обеспечивают предпочтение в отношении рецептора. В соответствии с другим вариантом, N-концевая последовательность активируемого ВИП может иметь структуру X1-X2-S-N, где X1 - это Gly, Ala, Ser, Cys, Thr, Val или Pro; X2 - это Pro, Ala или Ser; N - это отличный от His N-конец ВИП; и S - это одна или несколько аминокислот, которые будут экспонированы после расщепления дипептидазой. X1-X2 является субстратом для дипептидазы (например, ДПП-IV), и расщепление дипептидазой приведет к экспонированию S.
[047] В этом и других воплощениях химические модификации N-конца, примененные в отношении N-конца ВИП, могут обеспечивать предпочтение в отношении рецептора. Химическая модификация белков и ее способы хорошо известны специалистам в данной области. Неограничивающими примерами химических модификаций являются пегилирование, метилглиоксилирование, восстановительное алкилирование, окисление надмуравьиной кислотой, сукцинилирование, аминоэтилирование и присоединение липидных компонентов (Clifton, New Protein Techniques, New Jersey: Humana Press, 1985. ISBX. 0-89603-126-8. Volume. 3 of Methods in Molecular Biology). Химические группы, такие как при пегилировании, которые могут быть присоединены в качестве модификаций цистеина, метионина, гистидина, лизина, аргинина, триптофана, тирозина, карбоксильных групп, были описаны ранее (см. Lundblad, Techniques in Protein Modification, CRC Press, 1995).
Сшивка биоэластичных полимеров
[048] В некоторых вариантах воплощения ВИП по изобретению содержит на N-конце и/или на С-конце компонент, являющийся биоэластичным полимером. «Биоэластичный полимер» может демонстрировать обратный температурный фазовый переход. Биоэластичные полимеры известны специалистам и описаны, например, в патенте США №:5520672, принадлежащем Urry et al. Биоэластичные полимеры могут являться полипептидами, содержащими эластомерные единицы пентапептидов, тетрапептидов и/или нонапептидов (например, «эластино-подобных пептидов»). Биоэластичные полимеры, которые можно применять для осуществления настоящего изобретения, изложены в патенте США №4474851, в котором описан ряд повторяющихся тетрапептидных и пентапептидных единиц, которые можно применять для образования биоэластичного полимера. Отдельные биоэластичные полимеры также описаны в патентах США №№4132746; 4187852; 4500700; 4589882 и 4870055. Другие примеры эластичных полимеров изложены в патенте США №6699294, патенте США №6753311 и патенте США №6063061. Структуры таких биоэластичных полимеров настоящим включены сюда в качестве ссылок.
[049] В одном из вариантов воплощения биоэластичные полимеры являются полипептидами общей формулы (VPGXG)m, где Х - это любая аминокислота (например, Ala, Leu, Phe) и m равно от примерно 20 до примерно 2000, или от примерно 50 до примерно 180. В примерах воплощений m равно 60, 90, 120, 150 или 180. Частота различных аминокислот в положении четвертой аминокислоты можно менять, так же как и идентичность X.
[050] Например, биоэластичные полимеры могут содержать повторяющиеся эластомерные единицы, выбранные из биоэластичных пентапептидов и тетрапептидов, при этом повторяющиеся единицы содержат аминокислотные остатки, выбранные из группы, состоящей из остатков гидрофобных аминокислот и глицина, и при этом повторяющиеся единицы существуют в конформации, имеющей бета-поворот формулы:
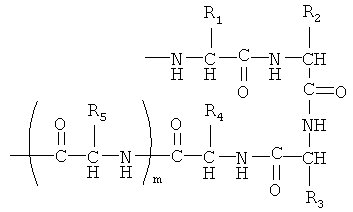
где R1-R5 представляют боковые цепи аминокислотных остатков 1-5, a m равно 0, если повторяющаяся единица - это тетрапептид, или 1, если повторяющаяся единица - это пентапептид. Нонапептидные повторяющиеся единицы обычно состоят из последовательно расположенных тетра- и пентапептидов. Гидрофобные аминокислотные остатки выбирают из аланина, валина, лейцина, изолейцина, пролина, фенилаланина, триптофана и метионина. Во многих случаях первый аминокислотный остаток повторяющейся единицы является остатком валина, лейцина, изолейцина или фенилаланина; второй аминокислотный остаток является остатком пролина; третий аминокислотный остаток является остатком глицина; и четвертый аминокислотный остаток является остатком глицина или сильно гидрофобным остатком, таким как триптофан, фенилаланин или тирозин. Частные примеры включают тетрапептид Val-Pro-Gly-Gly, тетрапептид GGVP, тетрапептид GGFP, тетрапептид GGAP, пентапептид Val-Pro-Gly-Val-Gly, пентапептид GVGVP, пентапептид GKGVP, пентапептид GVGFP, пентапептид GFGFP, пентапептид GEGVP, пентапептид GFGVP и пентапептид GVGIP. См., например, патент США №6699294.
[051] В некоторых примерах воплощений ВИП по изобретению содержит на N-конце и/или на С-конце компонент ЭПП (эластино-подобный пептид). ЭПП-компонент содержит или состоит из структурных пептидных единиц или последовательностей, которые родственны белку эластину или являются его производными. Такие последовательности полезны для улучшения свойств терапевтических белков в отношении одного или нескольких из следующего: биодоступности, терапевтически эффективной дозы и/или частоты введения, биологического действия, совместимости с готовой лекарственной формой, устойчивости к протеолизу, растворимости, периода полувыведения или другой меры сохраняемости в организме после введения и/или скорости клиренса из организма. См., например, WO 2008/030968 содержание которой целиком включено сюда в качестве ссылки.
[052] Когда ЭПП расположен на С-конце ВИП, могут быть произведены дополнительные модификации N-конца, такие как добавление одной или нескольких аминокислот, как описано выше. В соответствии с другим вариантом воплощения, на N-конце ВИП такие модификации отсутствуют.
[053] ЭПП-компонент сконструирован из структурных единиц длиной от трех до примерно двадцати аминокислот, или, в некоторых вариантах воплощения, от четырех до десяти аминокислот, например, из пяти или шести аминокислот. Длина индивидуальных структурных единиц в конкретном ЭПП-компоненте может варьироваться или может быть однородной. В некоторых воплощениях ЭПП-компонент сконструирован из политетра-, полипента-, полигекса-, полигепта-, полиокта- и полинонапептидного мотива повторяющихся структурных единиц. Примеры структурных единиц включают единицы, заданные ПОСЛ. ID №№:1-12 (см. ниже), которые могут применяться в качестве повторяющихся структурных единиц, включая тандемно повторяющиеся единицы, или могут применяться в каких-либо сочетаниях для создания ЭПП, эффективного для улучшения свойств терапевтического компонента. Таким образом, ЭПП-компонент может содержать или состоять в существенной степени из структурных(ой) единиц(ы), выбранных из ПОСЛ. ID №№:1-12, указанных ниже.
[054] ЭПП-компонент, содержащий такие структурные единицы, может иметь различные размеры. Например, ЭПП-компонент может содержать или состоять в существенной степени из от примерно 10 до примерно 500 структурных единиц, или в некоторых воплощениях, от примерно 20 до примерно 200 структурных единиц, или в некоторых воплощениях, от примерно 50 до примерно 150 структурных единиц, или от примерно 75 до примерно 130 структурных единиц, включая одну или комбинацию нескольких из единиц, заданных в ПОСЛ. ID №№:1-12. ЭПП-компонент может содержать примерно 120 структурных единиц, таких как повторы структурных единиц, определяемых ПОСЛ. ID №:3 (приведена ниже). Таким образом, ЭПП-компонент может иметь длину от примерно 50 до примерно 2000 аминокислотных остатков, или от примерно 100 до примерно 600 аминокислотных остатков, или от примерно 200 до примерно 500 аминокислотных остатков, или от примерно 200 до примерно 400 аминокислотных остатков.
[055] В некоторых вариантах воплощения ЭПП-компонент, или, в некоторых случаях, терапевтический агент, имеет размер менее чем примерно 150 кДа, или менее чем примерно 100 кДа, или менее чем примерно 55 кДа, или менее чем примерно 50 кДа, или менее чем примерно 40 кДа, или менее чем примерно 30 или 25 кДа.
[056] В некоторых вариантах воплощения ЭПП-компонент в состоянии дофазового перехода может иметь вытянутую, относительно неструктурированную и неглобулярную форму, такую, которая помогает избежать фильтрации в почках. В таких воплощениях терапевтические агенты по изобретению имеют молекулярную массу менее чем в типичном случае является пределом для фильтрации в почках, такую как менее чем 60 кДа, или, в некоторых воплощениях, менее чем примерно 55, 50, 45, 40, 30 или 25 кДа, и, тем не менее, сохраняются в организме по меньшей мере в 2, 3, 4, 5, 10, 20 или 100 раз дольше, чем несшитый (например, не входящий в состав химеры или конъюгата) терапевтический аналог.
[057] В этих и других вариантах воплощения ЭПП-компонент не вносит существенного или значимого вклада в биологическое действие терапевтического пептида. Таким образом, ВИП, сшитый с ЭПП, по настоящему изобретению может демонстрировать активность (биологическое действие), которая такая же или схожа с активностью его несшитого аналога. ВИП, сшитый с ЭПП, по настоящему изобретению может демонстрировать активность или уровень биологического действия (например, согласно испытанию in vitro или in vivo) от 10 до 100% от таковых, демонстрируемых несшитым аналогом при том же способе анализа. В различных вариантах воплощения, (активированный) ВИП, сшитый с ЭПП, по настоящему изобретению может демонстрировать активность или уровень биологического действия (например, согласно испытанию in vitro или in vivo), равные по меньшей мере 50%, 60%, 75%, 80%, 90%, 95% или более от таковых, демонстрируемых несшитым аналогом.
[058] В некоторых воплощениях ЭПП-компонент претерпевает обратимый обратный фазовый переход. Таким образом, ЭПП-компоненты не упорядочены структурно и имеют высокую растворимость в воде ниже температуры перехода (Tt), но демонстрируют быстрый (в диапазоне 2-3°С) фазовый переход из неупорядоченного к упорядоченному состоянию, когда температура повышается выше Tt, что ведет к десольватации и агрегации ЭПП-компонентов. Например, ЭПП образует нерастворимые полимеры по достижении достаточного размера, которые могут быть легко удалены и выделены из раствора путем центрифугирования. Такой фазовый переход является обратимым, и выделенные нерастворимые ЭПП можно полностью повторно растворить в буферном растворе, когда температура возвращается на уровень ниже значения Tt для этих ЭПП. Таким образом, терапевтические агенты по изобретению в некоторых вариантах воплощения могут быть отделены от других примесных белков с высокой степенью чистоты с применением методик циклических обратных фазовых переходов, например, с применением температуро-зависимой растворимости терапевтического агента, или добавления соли в среду. Последовательные циклы обратных фазовых переходов можно применять для достижения высокой степени чистоты. В дополнение к температуре и ионной силе, другие переменные параметры окружающей среды, полезные для модулирования обратного фазового перехода терапевтических агентов, включают рН, добавление неорганических и органических растворенных веществ или растворителей, ионизация боковых цепей или химическая модификация и давление.
[059] В некоторых воплощениях ЭПП-компонент не претерпевает обратимый обратный фазовый переход или не претерпевает такой переход при биологически допустимой Tt, и, таким образом, улучшения биологических и/или физиологических свойств молекулы (как описано в другом месте в этом документе) могут быть полностью или в существенной степени независимы от любых свойств фазового перехода. Тем не менее, такие свойства фазового перехода могут придавать дополнительные практические преимущества, например, с точки зрения извлечения и очистки таких молекул.
[060] При практическом применении настоящего изобретения ЭПП-компонент функционирует, стабилизируя или иным образом улучшая ВИП-компонент в терапевтической композиции. Вслед за введением объединенной конструкции ВИП-ЭПП пациенту, нуждающемуся в терапевтическом агенте ВИП, ВИП-компонент и ЭПП остаются объединенными друг с другом, пока ВИП терапевтически активен, например, в случае лечения или профилактики болезненного состояния или физиологического состояния, или при другом терапевтическом вмешательстве.
[061] В некоторых воплощениях ЭПП-компонент(ы) могут состоять из структурных единиц, включая в качестве неограничивающих примеров:
(a) тетрапептид Val-Pro-Gly-Gly, или VPGG (ПОСЛ. ID №:1);
(b) тетрапептид Ile-Pro-Gly-Gly, или IPGG (ПОСЛ. ID №:2);
(c) пентапептид Val-Pro-Gly-X-Gly (ПОСЛ. ID №: 3), или VPGXG, где X - это любой природный или неприродный аминокислотный остаток, и где Х необязательно варьируется для полимерных и олигомерных повторов;
(d) пентапептид Ala-Val-Gly-Val-Pro, или AVGVP (ПОСЛ. ID №:4);
(e) пентапептид Ile-Pro-Gly-X-Gly, или IPGXG (ПОСЛ. ID №:5), где Х - это любой природный или неприродный аминокислотный остаток, и где Х необязательно варьируется для полимерных и олигомерных повторов;
(е) пентапептид Ile-Pro-Gly-Val-Gly, или IPGVG (ПОСЛ. ID №:6);
(f) пентапептид Leu-Pro-Gly-X-Gly, или LPGXG (ПОСЛ. ID №:7), где X - это любой природный или неприродный аминокислотный остаток, и где Х необязательно варьируется для полимерных и олигомерных повторов;
(g) пентапептид Leu-Pro-Gly-Val-Gly, или LPGVG (ПОСЛ. ID №:8);
(h) гексапептид Val-Ala-Pro-Gly-Val-Gly, или VAPGVG (ПОСЛ. ID №:9);
(I) октапептид Gly-Val-Gly-Val-Pro-Gly-Val-Gly, или GVGVPGVG (ПОСЛ. ID №:10);
(J) нонапептид Val-Pro-Gly-Phe-Gly-Val-Gly-Ala-Gly, или VPGFGVGAG (ПОСЛ. ID №:11); и
(К) нонапептиды Val-Pro-Gly-Val-Gly-Val-Pro-Gly-Gly, или VPGVGVPGG (ПОСЛ. ID №:12).
[062] Такие структурные единицы, задаваемые ПОСЛ. ID №№:1-12, могут образовывать структурные повторяющиеся единицы, или могут применяться в сочетании для образования ЭПП-компонента в соответствии с изобретением. В некоторых вариантах воплощения ЭПП-компонент образован полностью (или почти полностью) из одной или из комбинации (например, 2, 3 или 4) структурных единиц, выбранных из ПОСЛ. ID №№:1-12. В других вариантах воплощения, по меньшей мере, 75%, или, по меньшей мере, 80%, или, по меньшей мере, 90% ЭПП-компонента образовано из одной или из комбинации структурных единиц, выбранных из ПОСЛ. ID №№:1-12, которые могут присутствовать в качестве повторяющихся единиц.
[063] В некоторых воплощениях, ЭПП-компонент(ы) содержат повторяющиеся единицы, включая тандемные повторяющиеся единицы, пентапептида Val-Pro-Gly-X-Gly (ПОСЛ. ID №:3), где X - как задано выше и где процентное отношение пентапептидных единиц Val-Pro-Gly-X-Gly (ПОСЛ. ID №:3), выраженное относительно целого ЭПП-компонента (который может содержать структурные единицы, отличные от VPGXG (ПОСЛ. ID №:3)), выше чем примерно 75%, или выше, чем примерно 85%, или выше, чем примерно 95% от ЭПП-компонента. ЭПП-компонент может содержать мотивы, включающие повтор от 5 до 15 единиц (например, повтор примерно 10 или примерно 12 единиц) пентапептида ПОСЛ. ID №:3, с переменным остатком X, варьирующимся у, по меньшей мере, 2 или, по меньшей мере, 3 из структурных единиц в составе повтора. Переменные остатки могут быть выбраны независимо, например, из аминокислот V, I, L, A, G и W (и могут быть выбраны таким образом, чтобы сохранять требуемое свойство обратного фазового перехода). Примеры мотивов включают VPGXG (ПОСЛ. ID №:3), где переменные остатки являются V (который может присутствовать в 40%-60% структурных единиц), G (который может присутствовать в 20%-40% структурных единиц) и А (который может присутствовать в 10%-30% структурных единиц). Мотив, состоящий из повторов, сам может повторяться, например, от приблизительно 5 до 20 раз, например, от приблизительно 8 до 15 раз (например, около 12 раз), для формирования примера ЭПП-компонента. ЭПП-компонент, подобный описанному в данном параграфе, конечно, может быть сконструирован из любой из структурных единиц, заданных в ПОСЛ. ID №№:1-12, или из их комбинации. Пример ЭПП-компонента, сшитого с С-концом ВИП, приведен на фиг.1.
[064] В некоторых вариантах воплощения единицы ЭПП могут образовывать структуру β-поворота, которая обеспечивает эластино-подобные свойства (например, обратный фазовый переход). Примеры пептидных последовательностей, пригодных для создания структуры β-поворота, описаны в международной заявке на патент PCT/US96/05186, содержание которой целиком включено сюда в качестве ссылки. Например, четвертый остаток (X) в последовательности пентапептида эластина VPGXG (ПОСЛ. ID №:3) может быть заменен без утраты способности формировать β-поворот.
[065] В некоторых воплощениях ЭПП-компоненты включают полимерные или олигомерные повторы пентапептида VPGXG (ПОСЛ. ID №:3), где переменный остаток Х может быть любой аминокислотой. Х может являться встречающейся в природе или не встречающейся в природе аминокислотой. В некоторых вариантах воплощения Х выбран из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутаминовой кислоты, глутамина, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина и валина. В некоторых вариантах воплощения Х является природной аминокислотной, отличной от пролина и цистеина.
[066] Переменный остаток Х (например, относительно ПОСЛ. ID №:3 или другой структурной единицы ЭПП) может являться неканонической (не кодируемой генетическим кодом) аминокислотой. Примеры неканонических аминокислот включают: D-изомеры канонических аминокислот, 2,4-диаминомасляную кислоту, α-аминоизомасляную кислоту, А-аминомасляную кислоту, Abu, 2-аминомасляную кислоту, γ-Abu, ε-Ahx, 6-аминокапроевую кислоту, Aib, 2-аминоизомасляную кислоту, 3-аминопропионовую кислоту, орнитин, норлейцин, норвалин, гидроксипролин, саркозин, цитруллин, гомоцитруллин, цистеиновую кислоту, трет-бутил глицин, трет-бутилаланин, фенилглицин, циклогексилаланин, β-аланин, фтор-аминокислоты, искусственно созданные аминокислоты, такие как β-метиламинокислоты, Сα-метиламинокислоты, Nα-метиламинокислоты и в целом аналоги аминокислот.
[067] Выбор Х может быть независимым для каждой структурной единицы ЭПП (например, для каждой структурной единицы, указанной в этом документе, имеющей переменный остаток X). Например, Х может быть независимо выбран для каждой структурной единицы как аминокислота, имеющая положительно заряженную боковую цепь, аминокислота, имеющая отрицательно заряженную боковую цепь или аминокислота, имеющая нейтральную боковую цепь, включая, в некоторых воплощениях, гидрофобную боковую цепь.
[068] В других вариантах воплощения ЭПП-компонент(ы) могут включать полимерные или олигомерные повторы пентапептидов VPGXG (ПОСЛ. ID №:3), IPGXG (ПОСЛ. ID №:5) или LPGXG (ПОСЛ. ID №:7) или их комбинацию, где Х - как указано выше.
[069] В каждом варианте воплощения структурные единицы или, в некоторых случаях, полимерные или олигомерные повторы последовательностей ЭПП могут быть разделены одним или несколькими аминокислотными остатками, что не отменяет общего эффекта на молекулу, то есть, эффекта по приданию определенных улучшенных свойств терапевтическому компоненту, как описано в этом документе. В некоторых воплощениях такие одна или несколько аминокислот также не отменяют или в существенной степени не влияют на свойства фазового перехода ЭПП-компонента (при сравнении с молекулой, где такие одна или несколько аминокислот делегированы).
[070] Структуру получающихся в результате ЭПП-компонентов можно описать с помощью нотации ЭППk [XiYj-n], где k обозначает конкретную повторяющуюся единицу ЭПП, заключенные в скобки заглавные буквы являются однобуквенным кодовым обозначением аминокислот, а соответствующие им нижние индексы обозначают относительную долю каждого переменного остатка Х в структурных единицах (если применимо), и n описывает общую длину ЭПП, выраженную в количестве структурных повторов. Например, ЭПП1 [V5A2G3-10] обозначает ЭПП-компонент, содержащий 10 повторяющихся единиц пентапептида VPGXG (ПОСЛ. ID №:3), где Х - это валин, аланин и глицин в относительных долях 5:2:3; ЭПП1 [K1V2F1-4] обозначает ЭПП-компонент, содержащий 4 повторяющиеся единицы пентапептида VPGXG (ПОСЛ. ID №:3), где Х - это лизин, валин и фенилаланин в относительных долях 1:2:1; ЭПП1 [K1V7F1-9] обозначает полипептид, содержащий 9 повторяющихся единиц пентапептида VPGXG (ПОСЛ. ID №:3), где Х - это лизин, валин и фенилаланин в относительных долях 1:7:1; ЭПП1 [V1A8G7-10] обозначает ЭПП-компонент, содержащий 10 повторяющихся единиц пентапептида VPGXG (ПОСЛ. ID №:3), где Х - это валин, аланин и глицин в относительных долях 1:8:7; ЭПП1 [V-5] обозначает полипептид, содержащий 5 повторяющихся единиц пентапептида VPGXG (ПОСЛ. ID №:3), где Х - это только валин; ЭПП1 [V-20] обозначает полипептид, содержащий 20 повторяющихся единиц пентапептида VPGXG (ПОСЛ. ID №:3), где Х - это только валин; ЭПП2 [5] обозначает полипептид, содержащий 5 повторяющихся единиц пентапептида AVGVP (ПОСЛ. ID №:4); ЭПП3 [V-5] обозначает полипептид, содержащий 5 повторяющихся единиц пентапептида IPGXG (ПОСЛ. ID №:5), где Х - это только валин; ЭПП4 [V-5] обозначает полипептид, содержащий 5 повторяющихся единиц пентапептида LPGXG (ПОСЛ. ID №:7), где Х - это только валин. Описанные в данном параграфе ЭПП-компоненты можно применять в связи с настоящим изобретением для повышения терапевтических свойств терапевтического компонента.
[071] Более того, Tt является функцией от гидрофобности переменного остатка. Таким образом, изменяя тип переменного(ых) остатка(ов) и их молярную долю (доли), можно синтезировать ЭПП, которые демонстрируют обратный фазовый переход в диапазоне 0-100°С. Таким образом, Tt при данной длине ЭПП может быть снижена путем внедрения более высокой доли гидрофобных переменных остатков в последовательность ЭПП. Примеры пригодных гидрофобных переменных остатков включают валин, лейцин, изолейцин, фенилаланин, триптофан и метионин. Тирозин, который умеренно гидрофобен, также может применяться. И наоборот, Tt можно повысить путем внедрения остатков, таких как остатки, выбранные из группы, состоящей из: глутаминовой кислоты, цистеина, лизина, аспартата, аланина, аспарагина, серина, треонина, глицина, аргинина и глутамина; предпочтительно, выбранные из аланина, серина, треонина и глутаминовой кислоты.
[072] ЭПП-компонент в некоторых воплощениях выбран или сконструирован так, чтобы обеспечить значение Tt (в физиологических условиях) в диапазоне от примерно 10 до примерно 80°С, например, от приблизительно 35 до приблизительно 60°С, или от примерно 38 до примерно 45°С. В некоторых вариантах воплощения Tt выше, чем примерно 40°С, или выше, чем примерно 42°С, или выше, чем примерно 45°С, или выше, чем примерно 50°С. Температура фазового перехода в некоторых воплощениях выше температуры тела субъекта или пациента (например, >37°С), и тем самым сохраняется растворимость in vivo, или в других воплощениях Tt ниже температуры тела (например, <37°С) для обеспечения дополнительных преимуществ, таких как формирование in vivo депонированного пула лекарственного препарата для длительного высвобождения терапевтического агента. См., например, US 2007/0009602, содержание которой целиком включено здесь в качестве ссылки.
[073] Значение Tt для ЭПП-компонента можно модифицировать путем варьирования длины цепочки ЭПП, так как Tt в целом возрастает при снижении молекулярной массы. Для полипептидов, имеющих молекулярную массу >100, 000, разработанная шкала гидрофобности Арри (Urry) с соавторами (PCT/US96/05186, содержание которой целиком включено сюда в качестве ссылки) обеспечивает один из способов прогнозирования примерного значения Tt для специфичной последовательности ЭПП. Однако в некоторых вариантах воплощения длина ЭПП-компонента может сохраняться относительно маленькой при сохранении целевого значения Tt путем внедрения большей доли гидрофобных переменных остатков (например, аминокислотных остатков, имеющих гидрофобные боковые цепи) в последовательность ЭПП. В случае полипептидов, имеющих молекулярную массу <100, 000, значение Tt можно прогнозировать или определять с помощью следующего квадратного уравнения: Tt=M0+M1X+М2Х2, где Х - это молекулярная масса химерного белка и М0=116,21; M1=-1,7499; М2=0,010349.
[074] Хотя тип и гидрофобность переменного остатка, X, влияют на значение Tt ЭПП-компонента и, следовательно, ЭПП-компонента, сшитого с терапевтическим компонентом, на дополнительные свойства молекулы также может быть оказано влияние. Такие свойства включают в качестве неограничивающих примеров, растворимость, биодоступность, сохраняемость, период полувыведения, активность и безопасность молекулы.
[075] В разделе примеров ниже видно, что сшитый с ЭПП ВИП-агент сохраняет существенную долю биологической активности нативного ВИП, по сравнению с несшитыми формами ВИП. Дополнительно, показано, что ЭПП демонстрируют длительный период полувыведения. Соответственно, ЭПП может применяться в соответствии с настоящим изобретением для существенного увеличения (например, более чем на 10%, 20%, 30%, 50%, 100%, 200% или выше, в конкретных примерах воплощения) периода полувыведения ВИП, конъюгированного с ЭПП, по сравнению с периодом полувыведения свободной (неконъюгированной) формы терапевтического агента. Модифицированный ВИП, имеющий увеличенный период полувыведения из системы кровообращения, можно вводить от 1 до примерно 10 раз в неделю, например, от 1 до примерно 5, или от 1 до примерно 3 раз в неделю. Модифицированный ВИП или содержащую его фармацевтическую композицию можно вводить примерно один раз в день, или примерно через день, или примерно на каждый третий день, или примерно один раз в неделю (т.е. дозирование один раз в неделю).
Конъюгация и сшивка
[076] Полученный рекомбинантными способами химерный белок с ВИП, в соответствии с некоторыми воплощениями настоящего изобретения, содержит присоединяемый компонент (например, ЭПП) и ВИП или аналог ВИП, соединенные друг с другом посредством генетической сшивки. Например, химерный белок может быть получен трансляцией полинуклеотида, кодирующего ВИП или аналог ВИП, клонированные в одной рамке считывания с ЭПП-компонентом.
[077] В некоторых воплощениях ЭПП-компонент и ВИП или аналог ВИП могут быть сшиты с применением линкерного пептида различной длины для обеспечения более существенного физического разделения и обеспечения большей подвижности сшитых белков в пространстве, и, таким образом, максимизации доступности ВИП или аналога ВИП, например, для связывания с соответствующим ему рецептором. Линкерный пептид может состоять из аминокислот, которые являются гибкими или более жесткими. Например, гибкий линкер может содержать аминокислоты, обладающие относительно небольшими боковыми цепями, которые могут быть гидрофильными. В частности, гибкий линкер может содержать остатки глицина и/или серина. Более жесткие линкеры могут содержать, например, создающие более существенные стерические препятствия боковые цепи аминокислот, таких как (в частности) тирозин или гистидин. Линкер может иметь длину менее чем примерно 50, 40, 30, 20, 10 или 5 аминокислотных остатков. Линкер может быть ковалентно присоединен в области между ВИП или аналогом ВИП и ЭПП-компонентом, например, посредством рекомбинантной сшивки.
[078] Линкер или пептидный спейсер могут быть подвержены или не подвержены расщеплению протеазами. В качестве примера, расщепляемые пептидные спейсеры включают, в частности, пептидную последовательность, узнаваемую протеазами (in vitro или т vivo) различных типов, такими как Tev, тромбин, фактор Ха, плазмин (протеазы крови), металлопротеазы, катепсины (например, GFLG, ПОСЛ. ID №:47 и т.д.), и протеазы, обнаруженные в других отделах тела. В некоторых вариантах воплощения, в которых применяют расщепляемые линкеры, химерный белок может быть неактивным, менее активным или менее эффективным в форме химеры, и потом активируется после расщепления спейсера in vivo. В соответствии с другим вариантом, когда терапевтический агент в существенной степени активен в форме химеры, могут применять нерасщепляемые спейсеры. Нерасщепляемый спейсер может быть любого пригодного типа, включая, например, фрагменты нерасщепляемого спейсера, имеющие формулу [(Gly)n-Ser]m, где n равно от 1 до 4, включительно, и m равно от 1 до 4, включительно. В соответствии с другим вариантом, короткая последовательность ЭПП, отличная от остова ЭПП, может применяться вместо линкера или спейсера, если она обеспечивает необходимый эффект.
[079] В других вариантах воплощения терапевтический агент является рекомбинантной химерой, у которой терапевтический компонент фланкирован на каждом конце ЭПП-компонентом. По меньшей мере, один из указанных ЭПП-компонентов может быть присоединен через расщепляемый спейсер таким образом, что терапевтический компонент неактивен, но активируется in vivo посредством протеолитического удаления одного ЭПП-компонента. Получающийся в результате химерный белок с одним ЭПП активен и обладает увеличенным периодом полувыведения (или другим свойством, описанным в этом документе) in vivo.
[080] В других вариантах воплощения настоящее изобретение направлено на создание химических конъюгатов ВИП или аналога ВИП и ЭПП-компонента. Конъюгаты могут быть приготовлены путем химического присоединения ЭПП-компонента к ВИП или аналогу ВИП посредством ряда способов, хорошо известных специалистам в данной области (см., например, Nilsson et al., 2005, Ann Rev Biophys Bio Structure 34:91-118). В некоторых вариантах воплощения химический конъюгат может быть образован путем ковалентного присоединения ВИП или аналога ВИП к ЭПП-компоненту напрямую или через короткий или длинный линкерный фрагмент, через одну или несколько функциональных групп на терапевтическом белковом компоненте, например, аминогруппу, карбоксильную группу, фенильную группу, тиольную группу или гидроксильную группу, с образованием ковалентного конъюгата. Могут быть применены различные стандартные линкеры, например, диизоцианаты, диизотиоцианаты, карбодиимиды, сложные эфиры бис-(гидроксисукцинимида), сложные эфиры малеимида и гидроксисукцинимида, глутаральдегид и т.п.
[081] Дополнительно, непептидные химические спейсеры могут быть любого пригодного типа, включая, например, функциональные линкеры, описанные в книге Bioconjugate Techniques, Greg T.Hermanson, опубликованной издательством Academic Press, Inc. в 1995 г., и таковые, указанные в руководстве Cross-Linking Reagents Technical Handbook, распространяемом компанией Pierce Biotechnology, Inc. (Рокфорд, Иллинойс, США), описание которых целиком включено сюда в качестве ссылок. Примеры химических спейсеров включают гомобифункциональные линкеры, которые могут присоединяться к аминогруппам лизинов, а также гетеробифункциональные группы, которые могут присоединяться к цистеинам одним концом и к лизинам другим концом.
[082] В некоторых воплощениях относительно небольшие ЭПП-компоненты (например, ЭПП-компоненты размером менее чем примерно 30 кДа, 25 кДа, 20 кДа, 15 кДа или 10 кДа), которые не совершают фазовый переход при комнатной температуре (или при температуре тела человека, например, Tt>37°C), химически соединены или поперечно сшиты. Например, два относительно небольших ЭПП-компонента, обладающих одинаковыми или разными свойствами, могут быть химически соединены. Такое соединение, в некоторых вариантах воплощения, может иметь место in vivo, путем добавления единичного остатка цистеина на С-конце или рядом с ним в составе компонента ЭПП. Каждый из таких ЭПП-компонентов может быть сшит с одним или несколькими терапевтическими компонентами, так, чтобы увеличить активность или авидность в отношении мишени.
Полинуклеотиды, векторы, клетки-хозяева и способы получения [083] Еще одной особенностью настоящего изобретения является то, что оно направлено на создание полинуклеотидов, содержащих нуклеотидную последовательность, кодирующую модифицированный ВИП по изобретению. Такие полинуклеотиды могут дополнительно содержать, в дополнение к последовательностям, кодирующим ВИП или аналог ВИП и химерные последовательности, один или несколько регулирующих экспрессию элементов. Например, полинуклеотид может содержать один или несколько промоторов или энхансеров транскрипции, сайтов связывания рибосомы, сигналов терминации транскрипции и сигналов полиаденилирования в виде регулирующих экспрессию элементов. Полинуклеотиды могут быть вставлены в любой пригодный вектор, который может находиться в любой пригодной для экспрессии клетке-хозяине, такой как Е.coli.
[084] В общем случае вектор, содержащий полинуклеотид, может быть внедрен в клетку для экспрессии терапевтического агента. Вектор может оставаться эписомальным или интегрироваться в хромосому, при условии, что вставка, кодирующая терапевтический агент, может транскрибироваться. Векторы могут быть сконструированы с применением стандартной технологии рекомбинантных ДНК. Векторы могут являться плазмидами, фагами, космидами, фагмидами, вирусами или принадлежать к любому другому типу, известному специалистам в данной области, которые применяют для репликации и экспрессии в прокариотических или эукариотических клетках. Специалисту в данной области понятно, что большое разнообразие компонентов, известных специалистам в данной области (таких как регулирующие экспрессию элементы), могут быть включены в такие векторы, в том числе большое разнообразие транскрипционных сигнальных последовательностей, таких как промоторы и другие последовательности, регулирующие связывание РНК-полимеразы с промотором. Любой промотор, о котором известно, что он эффективен в клетках, в которых будет экспрессирован вектор, может применяться для инициации экспрессии терапевтического агента. Пригодные промоторы могут быть индуцибельными или конститутивными.
[085] В некоторых воплощениях модифицированный ВИП экспрессируется в Е.coli или другой бактериальной экспрессионной системе. Е.coli в общем случае не будет удалять N-концевой метионин в ходе экспрессии, таким образом, что молекула модифицированного ВИП сохраняет специфичность в отношении рецептора. Другие экспрессионные системы могут применяться в соответствии с изобретением, включая дрожжевые экспрессионные системы, системы экспрессии в клетках млекопитающих и бакуловирусные системы.
[086] Терапевтический белок, если применяются химерные последовательности, сшитые с ЭПП, может быть извлечен с применением обратного температурного циклического изменения температуры. В частности, как описано ранее, ЭПП-компонент претерпевает обратимый обратный фазовый переход. То есть, ЭПП-компоненты не упорядочены структурно и имеют высокую растворимость в воде ниже температуры перехода (Tt), но демонстрируют быстрый (в диапазоне 2-3°С) фазовый переход из неупорядоченного к упорядоченному состоянию, когда температура повышается выше Tt, что ведет к десольватации и агрегации ЭПП-компонентов. Например, ЭПП образует нерастворимые полимеры по достижении достаточного размера, которые могут быть легко удалены и выделены из раствора путем центрифугирования. Такой фазовый переход является обратимым, и выделенные нерастворимые ЭПП можно полностью повторно растворить в буферном растворе, когда температура возвращается на уровень ниже значения Tt для этих ЭПП. Таким образом, терапевтические агенты по изобретению в некоторых вариантах воплощения могут быть отделены от других примесных белков с высокой степенью чистоты с применением методик циклических обратных фазовых переходов, например, с применением температуро-зависимой растворимости терапевтического агента, или добавления соли в среду. Последовательные циклы обратных фазовых переходов можно применять для достижения высокой степени чистоты. В дополнение к температуре и ионной силе, другие переменные параметры окружающей среды, полезные для модулирования обратного фазового перехода терапевтических агентов, включают рН, добавление неорганических и органических растворенных веществ или растворителей, ионизация боковых цепей или химическая модификация и давление.
Фармацевтические композиции и способы введения
[087] Настоящее изобретение дополнительно направлено на создание фармацевтических композиций, содержащих эффективное количество модифицированного ВИП по изобретению (как описано ранее) вместе с фармацевтически приемлемым носителем, разбавителем или вспомогательным веществом. Такие фармацевтические композиции эффективны для лечения или уменьшения интенсивности симптомов, например, аутоиммунного или воспалительного заболевания, как описано в этом документе.
[088] Терапевтические агенты по изобретению могут быть введены сами по себе, а также в различных формах, включая физиологически приемлемые сложные эфиры, соли и другие их физиологически функциональные производные. В таких фармацевтических готовых лекарственных формах терапевтические агенты могут применяться поодиночке или совместно (в том числе в единой рецептуре) с другими терапевтическими ингредиентами, такими как противовоспалительные агенты или иммуносупрессанты.
[089] Носитель(и) должен быть «фармацевтически приемлемым» в том смысле, что он должен быть совместим с другими ингредиентами готовой лекарственной формы и не должен быть чрезмерно вреден для того, кто будет ее принимать.
[090] Готовые лекарственные формы терапевтического агента включают таковые, пригодные для парентерального, а также непарентерального введения. Примеры способов введения включают, сред прочих, пероральное, буккальное, местное, назальное, подкожное, внутримышечное и внутривенное. Готовые лекарственные формы для парентерального введения являются предпочтительными.
[091] Готовые лекарственные формы, содержащие терапевтический агент по настоящему изобретению, могут еще в одном варианте быть представлены в виде унифицированных лекарственных форм и могут быть приготовлены любым способом, хорошо известным специалистам в области фармацевтического дела. Такие способы в общем случае включают этап внесения терапевтических агентов в смесь с носителем, который составлен из одного или нескольких вспомогательных ингредиентов. В типичном случае готовые лекарственные формы приготавливают путем однородного и тесного смешивания терапевтического агента с жидким носителем, тонко измельченным твердым носителем или с обоими, с последующим, если это необходимо, формовкой продукта в лекарственную форму, соответствующую требуемой готовой лекарственной форме.
[092] Готовые лекарственные формы, пригодные для парентерального введения, в одном варианте содержат стерильный водный препарат терапевтического агента, который предпочтительно является изотоничным по отношению к крови реципиента (например, физиологический солевой раствор). Такие готовые лекарственные формы могут включать суспендирующие агенты и агенты-загустители или другие системы микрогранул, которые созданы для нацеливания терапевтического агента на систему кровообращения или один или несколько органов. Готовые лекарственные формы могут быть представлены в однодозовой или мультидозовой форме.
[093] В дополнение к вышеупомянутым ингредиентам, готовые лекарственные формы по настоящему изобретению могут дополнительно включать один или несколько вспомогательных ингредиентов, выбранных из: разбавителей, буферных растворов, вкусовых агентов, разбавителей, поверхностно-активных агентов, загустителей, смазывающих веществ, консервантов (включая антиоксиданты) и т.п.
[094] Хотя специалист в данной области может определить необходимую дозу в каждом случае (включая унифицированную дозу для введения препарата пролонгированного действия), пригодная доза терапевтического агента для достижения терапевтической пользы может, например, находиться в диапазоне от примерно 1 микрограмма (мкг) до примерно 100 миллиграммов (мг) на килограмм массы тела реципиента, или в диапазоне от примерно 10 мкг до примерно 50 мг на килограмм массы тела, или в диапазоне от примерно 10 мкг до примерно 10 мг на килограмм массы тела. Требуемая доза может быть представлена в виде одной дозы или двух или нескольких суб-доз, вводимых с соответствующими интервалами в течение периода введения дозы (например, одной недели, двух недель и т.д.) Эти суб-дозы могут вводиться в виде унифицированных лекарственных форм, например, содержащих от примерно 10 мкг до примерно 500 мг, или от примерно 50 мкг до примерно 200 мг, или от примерно 50 мкг до примерно 100 мг активного вещества на унифицированную лекарственную форму. В соответствии с другим вариантом, если того требует состояние реципиента, дозы могут вводиться в виде непрерывной инфузии.
[095] Способ введения лекарственных форм, конечно же, будет влиять на терапевтическое количество пептидного активного терапевтического агента, которое требуется и является эффективным для данного лечебного применения. Например, вводимые перорально дозировки могут, по меньшей мере, дважды, например в 2-10 раз, превосходить уровни дозировок, применяемых при парентеральных способах введения. Готовые лекарственные формы с отложенным высвобождением также позволят осуществлять доставку существенно большего количества терапевтического агента, таким образом, что агент будет иметь пролонгированное высвобождение в течение некоторого периода времени.
[096] ВИП, который циркулирует в плазме здоровых индивидуумов, происходит из ВИП-содержащих нервных волокон в желудочно-кишечном тракте, а также отражает обильное выделение из нервов сосудов (Cugini et al., 1991, Reg Pept 34: 141-8). Подобно большинству вазоактивных белков, ВИП имеет относительно короткий период полувыведения. Период полувыведения ВИП из крови составляет менее 2 мин (Domschke et al., 1978, Gut 19: 1049-53; Burhol et al., 1978, Scand J Gastroent 13: 807813). Одним из преимуществ модифицированных ВИП, описанных в этом документе, является увеличенный период полувыведения или сохраняемость в организме. В соответствии с некоторыми вариантами воплощения настоящего изобретения ВИП можно вводить от 1 до примерно 10 раз в неделю, например, от 1 до примерно 5, или от 1 до примерно 3 раз в неделю. Модифицированный ВИП или содержащую его фармацевтическую композицию можно вводить примерно один раз в день, или примерно через день, или примерно на каждый третий день, или примерно один раз в неделю.
[097] В некоторых воплощениях модифицированный ВИП вводят парентерально, например, в виде подкожной или внутримышечной инъекции. Введение может быть в виде унифицированной дозы модифицированного ВИП, описанного в этом документе.
[098] Модифицированный ВИП, при парентеральном введении, можно вводить один раз в день, или один или два раза в неделю, или от одного до пяти раз в месяц. В этих воплощениях модифицированный ВИП можно вводить в виде растворимого инфузионного пептида, который сохраняется в системе кровообращения, как описано в этом документе, для обеспечения непрерывной активности при относительно редком введении. Модифицированный ВИП можно вводить в виде препарата пролонгированного действия, как также описано в этом документе, для обеспечения пролонгированного высвобождения химерного пептида в систему кровообращения в течение определенного периода времени. См. US 2007/0009602, содержание которой включено сюда в качестве ссылки.
Способы применения
[099] Другими особенностями настоящего изобретения является то, что оно направлено на создание способов лечения, уменьшения интенсивности симптомов или профилактики состояния у млекопитающего. Такие состояния включают разнообразные сердечнососудистые, иммунологические (например, аутоиммунные) и неврологические состояния. Например, модифицированный ВИП может применяться для регулировки баланса между провоспалительными и противовоспалительными эффекторами у пациента, в том числе, у пациента, страдающего от аутоиммунного заболевания или воспалительного состояния. Примерами показаний для применения модифицированного ВИП включают, среди прочего, гипертонию, фиброз миокарда, сердечную недостаточность, кардиомиопатию, диабет, хроническую обструктивную болезнь легких (ХОБЛ), артрит, воспалительное заболевание кишечника (ВЗК), болезнь Паркинсона, повреждения мозга и астму.
[0100] Таким образом, изобретение направлено на создание способа лечения различных состояний, включая состояния, характеризующиеся аутоиммунными и воспалительными процессами. Способ включает введение эффективного количества модифицированного ВИП по изобретению пациенту, нуждающемуся в этом.
Гипертония
[0101] В различных воплощениях, описанных в этом документе, настоящее изобретение направлено на создание способов лечения или профилактики гипертонии у нуждающегося в этом пациента, включающих введение эффективного количества модифицированного ВИП. Формы гипертонии, которые можно лечить с применением модифицированных ВИП по настоящему изобретению, включают легочную гипертонию, неконтролируемую первичную артериальную гипертензию и некупируемую гипертензию.
[0102] Легочная гипертензия - это относительно редкое, но сопровождающееся высокой смертностью заболевание, характеризующееся прогрессирующей легочной артериальной гипертензией и усиленным утолщением мелких легочных артерий и артериол, приводящее к правожелудочковой (RV) недостаточности (Said et al., 2007, Circulation 115: 1260-8). Были выявлены связи ВИП с малым и большим кругами кровообращения. В отношении сосудистого ложа легких и его изменений при легочной гипертензии, ВИП вызывает расслабление гладкой мускулатуры легочных сосудов, полученных от нескольких видов млекопитающих, in vitro, нейтрализует или ослабляет действие эндотелина и других сосудосуживающих агентов, снижает гипоксическое сужение легочных сосудов и ингибирует пролиферацию клеток гладкой мускулатуры легочных сосудов у пациентов с легочной гипертензией. Кроме того, ВИП является ко-трансмиттером физиологических неадренергических, нехолинергических систем расслабления гладкой мускулатуры легочных сосудов. Дополнительно сообщалось, что ВИП-содержащие нервы, в норме часто встречающиеся в легочной артерии, отсутствуют в легочных артериях пациентов с легочной гипертензией, и ингаляция пептида оказывала благоприятный терапевтический эффект на таких пациентов (Petkov et al., 2003, J.Clin Invest. 111: 1339-1346). Наконец, исследования показали, что ВИП-заместительная терапия у ВИП-/- мышей способна предотвратить или, по меньшей мере, замедлить прогрессирование ключевых патологических изменений при легочной гипертензии (Said et al., 2007, Circulation 115: 1260-8). Таким образом, можно ожидать, что применение ВИП для лечения пациентов с легочной гипертензией приведет к существенному улучшению гемодинамических и прогностических характеристик заболевания (Petkov et al., 2003, J.Clin Invest. 111:1339-1346).
[0103] Неконтролируемая первичная артериальная гипертензия - это кровяное давление, которое постоянно находится на уровне выше нормального, при этом причину такого высокого кровяного давления установить невозможно. Первичная артериальная гипертензия является наиболее преобладающим типом гипертонии, затрагивающим 90-95% пациентов с гипертонией (Carretero et al., 2000, Circulation 101: 329-35), и специалисты полагают, что она вызвана несколькими пока не выявленными факторами. Концентрации ВИП снижены у склонных к инсульту крыс с первичной артериальной гипертензией (Mori et al., 1993, Jpn Heart J. 34: 785-94), и применение ВИП человека со стерически стабилизированными липосомами способно нормализовать системное артериальное давление у хомяков со спонтанной гипертонией (Onyuksel et al., 2006, Peptides 27: 2271-5).
[0104] Некупируемая гипертензия - это форма высокого кровяного давления, которая не отвечает на лечение (т.е., кровяное давление остается высоким даже при введении комбинации лекарственных препаратов). Причины слабого контроля над кровяным давлением многочисленны. Наиболее вероятными причинами являются объемная перегрузка из-за избыточного поступления натрия, непереносимости лекарственных препаратов, несоблюдения режима лечения и вторичной гипертонии (Graves JW, 2000, Mayo Clin Prac 75: 278-84). Как сильное системное сосудорасширяющее средство, ВИП обладает полезностью для лечения и профилактики гипертонии у пациентов, у которых наблюдаются признаки некупируемой гипертензии.
Заболевание сердца
[0105] В дополнительных воплощениях настоящее изобретение направлено на создание способов лечения или профилактики заболеваний сердца у нуждающегося в этом пациента, включающих введение эффективного количества модифицированного ВИП. Формы заболевания сердца, которые можно лечить с применением модифицированных ВИП по настоящему изобретению, включают фиброз миокарда, сердечную недостаточность и кардиомиопатию.
[0106] Изменения синтеза и секреции ВИП в сердце, по-видимому, играет роль в патогенезе нескольких заболеваний, таких как сердечная недостаточность и фиброз миокарда (Dvorakova MC, 2005, Drug News Perspect. 18: 387-91). Например, концентрация ВИП существенно снижена как в ткани, полученной от пациентов с кардиомиопатией, так и в ткани сердца, полученной у животных с моделями сердечной недостаточности (Unverferth et al., 1986, J. Lab din Med 108: 11-16). Дополнительно, деградация ВИП повышена в сердце при фиброзе, и вследствие этого концентрация ВИП в миокарде снижается. Таким образом, сниженный уровень ВИП, по-видимому, является важным фактором при патогенезе заболевания (Ye et al., 2003, Acta Physiol Scand 179: 353-60), и пониженные концентрации ВИП связаны с прогрессивным ухудшением состояния при сердечной недостаточности. Применение ингибитора вазопептидазы омапатрилата, о котором известно, что он снижает скорость метаболического клиренса ВИП, приводило к снижению систолического артериального давления, а также к уменьшению степени тяжести фиброза миокарда, по сравнению с контролем (Ye et al., 2004, Eur J Pharmacol 485: 235-42). Защитный эффект ВИП также был отмечен для миокарда при ишемии и реперфузии (Kalfin et al., 1994, J Pharmacol Exp Ther 268: 952-8). Таким образом, можно ожидать, что применение модифицированных ВИП по настоящему изобретению будет оказывать полезное воздействие на различные патологические состояния, включая сердечную недостаточность, кардиомиопатию и фиброз миокарда.
Сахарный диабет 2 типа
(0107] В дополнительных воплощениях настоящее изобретение направлено на создание способов лечения или профилактики диабета у нуждающегося в этом пациента, включающих введение эффективного количества модифицированного ВИП. В частности, модифицированные ВИП по настоящему изобретению имеют полезность при лечении и профилактике сахарного диабета 2 типа.
[0108] Исследования показали, что содержание ВИП в желудке и двенадцатиперстной кишке крыс с диабетом существенно ниже, чем у нормальных крыс (Gozes et al., 2004, Best Pract Res din Endocrinol Metab 18: 623-640). Более низкие уровни ВИП в тканях желудочно-кишечного тракта могут частично вносить вклад в аномальную подвижность кишечника, наблюдаемую у пациентов с диабетом (Adeghate et al., 2001, Arch Phys Bioc 109: 246-51). ВИП стимулирует секрецию инсулина клетками инсулиномы, островками Лангерганса мыши и перфузируемой поджелудочной железой крысы. Показано участие активации VPAC1 в повышении выработки глюкозы (Gozes et al., 2004, Best Pract Res din Endocrinol Metab 18: 623-640), в то время как рецептор ВИП - VPAC2 -экспрессируется в β-клетках островков Лангерганса, и его активация вызывает повышение уровня циклического АМФ и стимуляцию секреции инсулина (DeSouza et al., 2009, Nature Reviews 8: 361-7). Дополнительно, ВИП стимулирует секрецию глюкагона у человека, приводя к высвобождению глюкозы из печени. При совместном рассмотрении, все эти исследования свидетельствуют о том, что ВИП оказывает обширное прямое воздействие на метаболизм глюкозы. Соответственно, можно ожидать, что ВИП и модифицированные формы ВИП, такие как химерные пептиды, описанные в этом документе, будут полезны в качестве терапии для лечения и профилактики диабета 2 типа.
Предпочтение к рецептору VPAC2
[0109] В некоторых вариантах воплощения, например, таких, где модифицированный ВИП обладает более высоким предпочтением в отношении VPAC2, по сравнению с немодифицированным ВИП, модифицированный ВИП может подавлять у пациента воспалительные ответы, такие как ответы гиперчувствительности замедленного типа. В некоторых таких вариантах воплощения модифицированный ВИП подавляет развитие аутореактивных Т-клеток. В этих воплощениях пациент может иметь одно или несколько состояний, определяемых воспалением TH1-типа или TH1-аутоиммунностью, таких как артрит (включая ревматоидный артрит), воспалительное заболевание кишечника (например, болезнь Крона), диабет 1 типа, множественный склероз, отторжение трансплантата, синдром Гужеро-Шегрена, панкреатит, увеоретинит, кератит и септический шок.
Предпочтение к рецептору VPAC1
[0110] В некоторых вариантах воплощения, например, таких, где модифицированный ВИП обладает более высоким предпочтением в отношении VPAC1, по сравнению с немодифицированным ВИП, модифицированный ВИП может способствовать развитию у пациентов ТН1-воспалительных ответов, таких как ответы гиперчувствительности замедленного типа. В этих вариантах воплощения пациент может иметь одно или несколько состояний, связанных с ТН2-иммунитетом, таких как астма или хроническая обструктивная болезнь легких (ХОБЛ).
[0111] ХОБЛ - это хроническое воспалительное заболевание дыхательных путей, которое затрагивает до 8% людей в индустриализированных странах. Наблюдается повышение количества женщин и мужчин, страдающих ХОБЛ. Легочная гипертензия - это общий симптом хронической обструкции дыхательных путей, но точные механизмы повышения устойчивости сосудов не ясны. Возможные причины легочной гипертензии при ХОБЛ включают эмфизематозную деструкцию капиллярного русла, ремоделирование легочных сосудов и гипоксическое сужение легочных сосудов.
[0112] ВИП - это одна из наиболее распространенных молекул, обнаруженных в дыхательных путях. Благодаря его противовоспалительным и бронхорасширяющим свойствам он был предложен в качестве нового лекарственного средства для лечения ХОБЛ и астмы. Хотя активация VPAC1 является преобладающей, как VPAC1, так и VPAC2 необходимы для оптимального противовоспалительного сигналлинга (Burian et al., 2010, Peptides 31: 603-8). Соответственно, можно ожидать, что лечение с применением ВИП и модифицированных форм ВИП, таких как химерные пептиды, описанные в этом документе, будут помогать снижать тяжесть хронического воспаления в легких пациентов с ХОБЛ и астмой.
[0113] Настоящее изобретение дополнительно проиллюстрировано следующими примерами, которые не должны истолковываться как ограничивающие. Содержание всех публикаций, патентов и опубликованных заявок на патенты, процитированных в настоящей заявке, а также фигуры включены сюда полностью в качестве ссылок.
ПРИМЕРЫ
Пример 1
Клонирование конструкций ВИП-ЭПП
(0114] Последовательность ДНК для пептида ВИП описана в работе Simoncsits et al. (Synthesis, cloning and expression in Escherichia coli of artificial genes coding for biologically active elongated precursors of the vasoactive intestinal polypeptide. Eur. J.Biochem. 1988, 178(2):343-350, которая включена сюда полностью в качестве ссылки), за исключением того, что остаток 17 был нативным метионином и не содержал ни одного из описанных С-концевых удлинений (см. ПОСЛ. ID №:16).
[0115] Были сделаны два начальных варианта, один с метионином на С-конце, из-за необходимости использовать ATG в качестве стартового кодона (РВ1046, ПОСЛ. ID №:17) и один с трипептидом МАА на N-конце (РВ1047, ПОСЛ. ID №:18). Метионин в РВ1046 в норме был бы удален метионинаминопептидазой (МА), но так как вторым остатком является гистидин, один из наименее предпочтительных аминокислотных остатков в этом положении для МА, метионин не отщепляется. Метионин в РВ1047 был отщеплен, и остался дипептид АА, который потом может быть удален in vitro или in vivo пептидазой ДППIV с оставлением гистидина в качестве N-концевого остатка. Последовательность ДНК для ВИП клонировали в вектор рРВ1031 (см. фиг.3), несущий последовательность ДНК ЭПП1-120, с получением экспрессионной кассеты под управлением Т7-промотора.
[0116] Синтетические олигонуклеотиды Р0045 (ПОСЛ. ID №:31), Р0048 (ПОСЛ. ID №:32), P0064 (ПОСЛ. ID №:33) и Р0065 (ПОСЛ. ID №:34) отожгли друг с другом, расщепили ферментом рестрикции XbaI и лигировали в плазмиду рРВ1031, которая была расщеплена ферментами рестрикции XbaI/KpnI, с получением экспрессионной плазмиды рРВ1046 (см. фиг.4).
[0117] Синтетические олигонуклеотиды Р0066 (ПОСЛ. ID №:35), P0064 (ПОСЛ. ID №:33), P0067 (ПОСЛ. ID №:36) и Р0065 (ПОСЛ. ID №:34) отожгли друг с другом, расщепили ферментом рестрикции Xbal и лигировали в плазмиду рРВ1031, которая была расщеплена ферментами рестрикции XbaI/KpnI с получением экспрессионной плазмиды рРВ1047 (см. фиг.5).
[0118] Кроме того, и предполагая, что N-конец не являлся абсолютно необходимым для активности, также произвели С-концевую сшивку, рРВ1048 (см. фиг.6). Синтетические олигонуклеотиды Р0068 (ПОСЛ. ID №:37) и Р0069 (ПОСЛ. ID №:38) отожгли друг с другом и лигировали в плазмиду рРВ1031 которая была расщеплена ферментами рестрикции BglI/Nhel, с получением экспрессионной плазмиды рРВ1048.
Пример 2 Экспрессия конструкций ВИП-ЭПП
[0119] Продуцирующий штамм E.coli BLR (Novogen) трансформировали плазмидами рВ1046, рРВ1047 и рРВ1048 и выращивали в обогащенной среде во встряхиваемых флаконах при 37°С в течение ночи. Осадок клеток ресуспендировали в буферном растворе ТЕ рН 8,0, лизировали при помощи микрофлюидайзера (Microfluidics), центрифугировали для удаления нерастворимого материала и очищали продукт из полученного растворимого лизата путем создания условий для «фазового перехода» (ссылка) добавлением NaCl до концентрации 3М. После этого пробы проходили еще два дополнительных раунда фазового перехода с получением окончательных очищенных проб. Эти пробы анализировали в ДСН-ПААГ и обнаружили, что РВ1046 и РВ1047 дают две полосы (см. фиг.7). Предположив, что это было результатом протеолиза, вырастили культуры еще раз, но в этом случае перед лизисом провели нагревание при 60°С в течение 15 мин. Анализ в 10% полиакриламидном геле NuPAGE с трис-ацетатным буфером показал, что протеолиз удалось ингибировать (см. фиг.7).
[0120] Протеолиз происходил, скорее всего, в пределах пептида и, вероятно, близко к месту соединения пептида с ЭПП, так как расщепление не наблюдали в случае С-концевой химеры РВ1048. Этот протеолиз может быть предотвращен тепловой денатурацией протеаз(ы) перед проведением лизиса клеток, что свидетельствует об участии в нем скорее периплазматических протеаз(ы), а не цитозольных протеаз, или цитозольных протеаз, которые активируются или меняют поведение после лизиса.
Пример 3
Активность химерного белка модифицированный ВИП-ЭПП in vitro
[0121] Для измерения биологической активности и эффективности in vitro ВИП или химерных белков ВИП-ЭПП применяли метод анализа, основанный на применении клеток. В ходе анализа измеряют повышение внутриклеточной концентрации циклического аденозинмонофосфата (цАМФ) в ответ на обработку ВИП или химерными белками ВИП-ЭПП в клетках яичника китайского хомячка (СНО), модифицированных генно-инженерными методами так, чтобы они экспрессировали либо рецептор 2 вазоактивного интестинального пептида человека (VPAC2), либо рецептор 1 вазоактивного интестинального пептида человека (VPAC1). Как ВИП, так и химерные белки ВИП-ЭПП способны стимулировать продукцию цАМФ в данных клетках, что свидетельствует о том, что химерные белки сохраняют способность связываться с рецептором и активировать его. Так как количество аккумулированного цАМФ в клетках после рецептор-опосредованного связывания лиганда и активации прямо пропорционально количеству присутствующего интактного пептида или химерного белка, метод анализа можно применять для определения биологической активности и относительной эффективности.
[0122] В данном примере проводили испытание активности химерных белков ВИП-ЭПП РВ1046 и РВ1047. Конструкция РВ1046 содержит ВИП с Met на N-конце и конструкция РВ1047 содержит ВИП с Ala-Ala на его N-конце. Обе конструкции имеют ЭПП(1-120) на их С-концах. В первом эксперименте активность конструкций испытывали с применением клеток СНО, экспрессирующих рецептор для ВИП VPAC2. После 30 мин инкубации различных концентраций химерных белков с клетками эти клетки лизировали и измеряли количество образовавшегося цАМФ с применением коммерчески доступного набора. РВ1047 обрабатывали ДПП-IV перед добавлением к клеткам. На фиг.8 показан результат.Как можно видеть, химерный белок с модифицированным ВИП РВ 1046 несколько более активен, чем нативный белок ВИП, тогда как РВ1047 менее активен.
[0123] Активность РВ1046 и РВ1047 также испытывали с применением клеток СНО, экспрессирующих рецептор для ВИП VPAC 1. После 30 минут инкубации различных концентраций химерных белков с клетками СНО эти клетки лизировали и измеряли количество образовавшегося цАМФ с применением коммерчески доступного набора. РВ1047 обрабатывали ДПП-IV перед добавлением к клеткам. На фиг.9 показан результат. В этом случае химерный белок с модифицированным ВИП РВ1046 намного менее активен, чем нативный белок ВИП, тогда как относительная активность РВ1047 в сравнении с нативным ВИП примерно такая же, как в случае испытания с рецептором VPAC2. Эти результаты предполагают, что РВ 1046 избирательно активирует рецептор VPAC2 в большей степени, чем рецептор VPAC1.
Пример 4
Влияние химерного белка ВИП-ЭПП на кровяное давление
[0124] Активность химерного белка модифицированного ВИП-ЭПП РВ1047 также испытывали in vivo. В частности, было исследовано влияние химерного белка ВИП-ЭПП на кровяное давление. Крысам со спонтанной гипертонией вводили подкожно РВ1047 (10 мг/кг) или буферный раствор (контроль) и измеряли их кровяное давление в нескольких временных точках после введения химерного белка. В каждой группе было пять животных, и диаграммы показывают среднее значение и стандартное отклонение. РВ1047 существенно снижал систолическое и диастолическое артериальное давление у этих животных в течение периода, по меньшей мере, 12 ч после введения (см. фиг.10), что указывает на то, что химерный белок ВИП-ЭПП активен и потенциально может применяться в качестве лекарственных препаратов для лечения связанных с ВИП заболеваний.
Пример 5
Дополнительные химерные белки ВИП-ЭПП
[0125] Обработка белка РВ1047 протеазой ДПП IV приводила к удалению как АА, так и HS с N-конца и инактивации пептида. Поэтому была сконструирована плазмида рРВ1064, в которой N-конец был заменен на MAAHG, ПОСЛ. ID №:45, вместо MAAHS, ПОСЛ. ID №:46, так как HG более устойчив к ДПП IV, чем HS.
[0126] Также была сконструирована плазмида рРВ1056, которая кодирует ВИП с противоположно заряженным линкером (ПОСЛ. ID №:20), в основе которого лежит повтор VPGXG, ПОСЛ. ID №:3, перед ЭПП.
Пример 6
Клонирование, экспрессия и анализ дополнительного химерного белка ВИП-ЭПП, РВ1120
[0127] Последовательность ДНК ВИП клонировали в вектор рРВ1120 (ПОСЛ. ID №:48) (см. фиг.11), несущий последовательность ДНК ЭПП1-120 DNA, с получением экспрессионной кассеты под контролем промотора Т7. Далее продуцирующий штамм Е.coli BLR трансформировали плазмидой рРВ1120 и выращивали в обогащенной среде, как описано выше. Пробы полученного в результате химерного пептида ВИП-ЭПП1-120, РВ1120, очистили и проанализировали в ДСН-ПААГ.
[0128] Активность химерного пептида РВ1120 также испытали in vitro. Активность испытывали с применением метода анализа на основе клеток СНО, экспрессирующих рецептор для ВИП (VPAC1), как описано выше в примере 3. Как показано на фиг.12, РВ1120 был примерно в 1,4 раза менее активен, чем нативный пептид ВИП, в отношении рецептора VPAC1. Для сравнения, конструкция РВ1046, которая содержит N-концевой остаток метионина, была примерно в 11 раз менее активна, чем нативный пептид ВИП. В ходе множества экспериментов РВ1120 был примерно от 1,4 до 6 раз менее активен, чем нативный пептид ВИП, в отношении рецептора VPAC1.
[0129] Фиг.13 демонстрирует активность РВ1120 в отношении рецептора VPAC2. Как и в случае результатов для рецептора VPAC1, РВ 1120 показывает немного меньшую активность (примерно в 1,5 раза ниже), чем нативный пептид ВИП, в отношении рецептора VPAC2. Однако, в противоположность результатам, наблюдаемым в случае VPAC1, РВ1046 проявлял равную активность в отношении VPAC2, при сравнении с нативным пептидом. В ходе множества экспериментов РВ 1120 был примерно от 1,5 до 7 раз менее активен, чем нативный пептид ВИП, в отношении рецептора VPAC2.
Пример 7
Фармакокинетический профиль химерного белка модифицированный ВИП-ЭПП, РВ1120
[0130] В дополнение к анализу биологической активности, описанному выше, также был исследован фармакокинетический профиль химерного белка ВИП-ЭПП, РВ1120. Обезьянам вводили единичную подкожную инъекцию (с дозировкой 3 мг/кг) белка РВ1120 и измеряли концентрацию лекарственного препарата в плазме ежедневно в течение одной недели. Было использовано три животных, и диаграммы показывают среднее значение и стандартное отклонение. Более половины начальной дозы РВ1120 сохранялось в кровеносной системе до 4 дней (см. фиг.14А и 14В, которые иллюстрируют средние концентрации в плазме РВ1120 после подкожного введения с применением линейных и полулогарифмических осей, соответственно).
[0131] На основании этих данных, можно предположить, что, по-видимому, происходит пролонгированная фаза всасывания после подкожного введения РВ1120, что согласуется с медленным всасыванием из места введения. Кажущийся период полувыведения (t1/2), на основании снижения концентрации в плазме, находится в диапазоне от 9,9 до 45,8 ч и, вероятно, отражает медленное всасывание, а не истинное выведение. Эти данные свидетельствуют, что химерный белок ВИП-ЭПП обладает значительно увеличенным периодом полувыведения, по сравнению с нативным ВИП, и потенциально его можно вводить с увеличенными интервалами (например, можно вводить примерно один раз в день, примерно раз в два дня, примерно раз в три дня или примерно один раз в неделю).
Пример 8
Влияние химерного белка модифицированный ВИП-ЭПП, РВ1120, на кровяное давление
[0132] Для измерения влияния химерного белка модифицированный ВИП-ЭПП, РВ1120, на систолическое, диастолическое и среднее артериальное давление крысам вводили разовую подкожную инъекцию в дозировках 0,1 мг/кг, 1 мг/кг или 5 мг/кг белка РВ1120 и проводили оценку с 3-часовыми интервалами. Фиг.15А, 15В и 15С демонстрируют среднее изменение систолического, диастолического и среднего артериального давления, соответственно. На фиг.15D показана средняя частота сердечных сокращений с интервалами 3 ч после введения РВ1120. Как демонстрируют фиг.15А-С, крысы, которым вводили инъекцию с дозировками 1 мг/кг или 5 мг/кг РВ1120, показывали существенное снижение систолического, диастолического и среднего артериального давления через 9 ч после инъекции, что свидетельствует о том, что химерный белок ВИП-ЭПП, РВ1120, потенциально можно вводить с целью лечения или профилактики гипертонии у подверженной ей индивидуумов.
[0133] Если не указано иначе, все технические и научные термины, использованные в этом документе, имеют те же значения, что являются общепринятыми в области, к которой относится настоящее изобретение. Хотя при практическом осуществлении для тестирования настоящего изобретения возможно применение любых способов и материалов, схожих или эквивалентных описываемым в этом документе, предпочтительные способы и материалы описаны здесь. Все цитируемые публикации, патенты и публикации патентов включены сюда полностью в качестве ссылок.
[0134] Публикации, обсуждаемые в этом документе, приведены исключительно из-за их раскрытия до даты подачи настоящей заявки. Ничто из изложенного в этом документе не следует толковать как допущение, что настоящее изобретение не имеет права датировать задним числом такую публикацию на основании предшествующего изобретения.
[0135] Хотя изобретение было описано в связи с конкретными примерами его воплощения, понятно, что возможны дополнительные изменения, и данная заявка охватывает любые вариации, применения или адаптации изобретения, следующие, в целом, принципам изобретения, и включая такие отклонения от настоящего раскрытия, которые соответствуют известной или обычной практике, принятой в данной области, к которой принадлежит изобретение, и которые могут быть применены к существенным особенностям, изложенным ранее в этом документе, и которые соответствуют объему прилагаемой формулы изобретения.