Результат интеллектуальной деятельности: ГЕН PDGF-Bopt ТРОМБОЦИТАРНОГО ФАКТОРА РОСТА ЧЕЛОВЕКА
Вид РИД
Изобретение
Изобретение относится к области биотехнологии, технологии получения генно-инженерных конструкций для экспрессии трансгенов в клетках млекопитающих in vitro и in vivo с целью их применения в клеточной инженерии и в генной терапии. Изобретение представляет собой модифицированную последовательность гена В-полипептидной цепи тромбоцитарного фактора роста (PDGF-B) человека, включаемого в состав генно-инженерных векторов в качестве одного из фрагментов.
Тромбоцитарные факторы роста представляют собой группу ростовых факторов, играющих важную роль в эмбриогенезе, а также в процессах репарации и регенерации поврежденных тканей. Они стимулируют пролиферативную и миграционную активность мезенхимальных клеток, являются кофактором других ростовых факторов, стимулируют секреторную активность клеток, продукцию ими белков внеклеточного матрикса, таких как фибронектин, коллаген, протеогликаны. Эти свойства делают тромбоцитарные факторы роста привлекательными для использования в различных биотехнологиях, в том числе генной и клеточной терапии, при производстве биотрансплантатов.
Тромбоцитарные факторы роста являются димерами, состоящими из полипептидных цепей, связанных дисульфидными связями. Существуют четыре гена PDGF, кодирующие PDGF-A, PDGF-B, PDGF-C и PDGF-D полипептидные цепи (Linda Fredriksson, Hong Li, Ulf Eriksson. Cytokine & Growth Factor Reviews 15 (2004) 197-204). PDGF-B экспрессируется в эндотелиальных клетках, мегакариоцитах и нейронах (Hellström M, Kalén M, Lindahl Ρ, Abramsson A, Betsholtz С. Development 1999; 126:3047-55). Он является одним из важнейших факторов ангиогенеза. PDGF-BB стимулирует миграцию перицитов и гладкомышечных клеток в места образования новых сосудов и тем самым способствует стабилизации вновь сформированных капилляров (Banfi A. von Degenfeld G. Gianni-Barrera R. Rednato S. Merchant MJ. McDonald DM. Blau HM. FASEB J. 2012 Jun; 26(6):2486-97; Gaengel K., Genové G., Armulik Α., Betsholtz С. (2009) Arterioscler. Thromb. Vase. Biol. 29, 630-638).
Перспективы генной терапии в лечении заболеваний, связанных с нарушением кровоснабжения, продемонстрированы как в экспериментальных, так и в клинических исследованиях (Ylä-Herttuala S., Rissanen Т.Т., Vajanto I., Hartikainen J.J. Am. Coll. Cardiol., 2007, vol. 49, pp. 1015-1026; Banfi A. von Degenfeld G. Gianni-Barrera R. Reeinato S. Merchant MJ, McDonald DM. Blau HM. FASEB J. 2012 Jun; 26(6):2486-97).
Технической задачей, решаемой авторами настоящего изобретения, является создание модифицированной последовательности гена PDGF-B, которая при ее включении в состав генно-инженерного вектора позволяла бы достичь более высокого уровня экспрессии соответствующего белка в клетках, трансфицированных данным вектором.
Технический результат достигался модификацией природной последовательности гена PDGF-B, в основе которой лежала вырожденность генетического кода. Последовательность модифицировали таким образом, чтобы триплеты нуклеотидов, кодирующие некоторые из аминокислот белковой последовательности тромбоцитарного фактора роста, встречались в генах человека наиболее часто. При этом использовали опубликованные в открытых источниках данные по частотам встречаемости кодонов (http://www.kazusa.or.jp/codon/).
На Фиг. 1 представлена последовательность нуклеотидов гена PDGF-Bopt (средние строки) в сравнении с последовательностью нуклеотидов природного гена PDGF-B (верхние строки). Показана также последовательность аминокислот кодируемого белкового продукта - тромбоцитарного фактора роста человека (нижние строки). Серым фоном в последовательности гена PDGF-Bopt выделены триплеты нуклеотидов, отличные от таковых в природной последовательности.
На Фиг. 2 приведена функциональная карта плазмиды pVAX1-PDGF-Bopt.
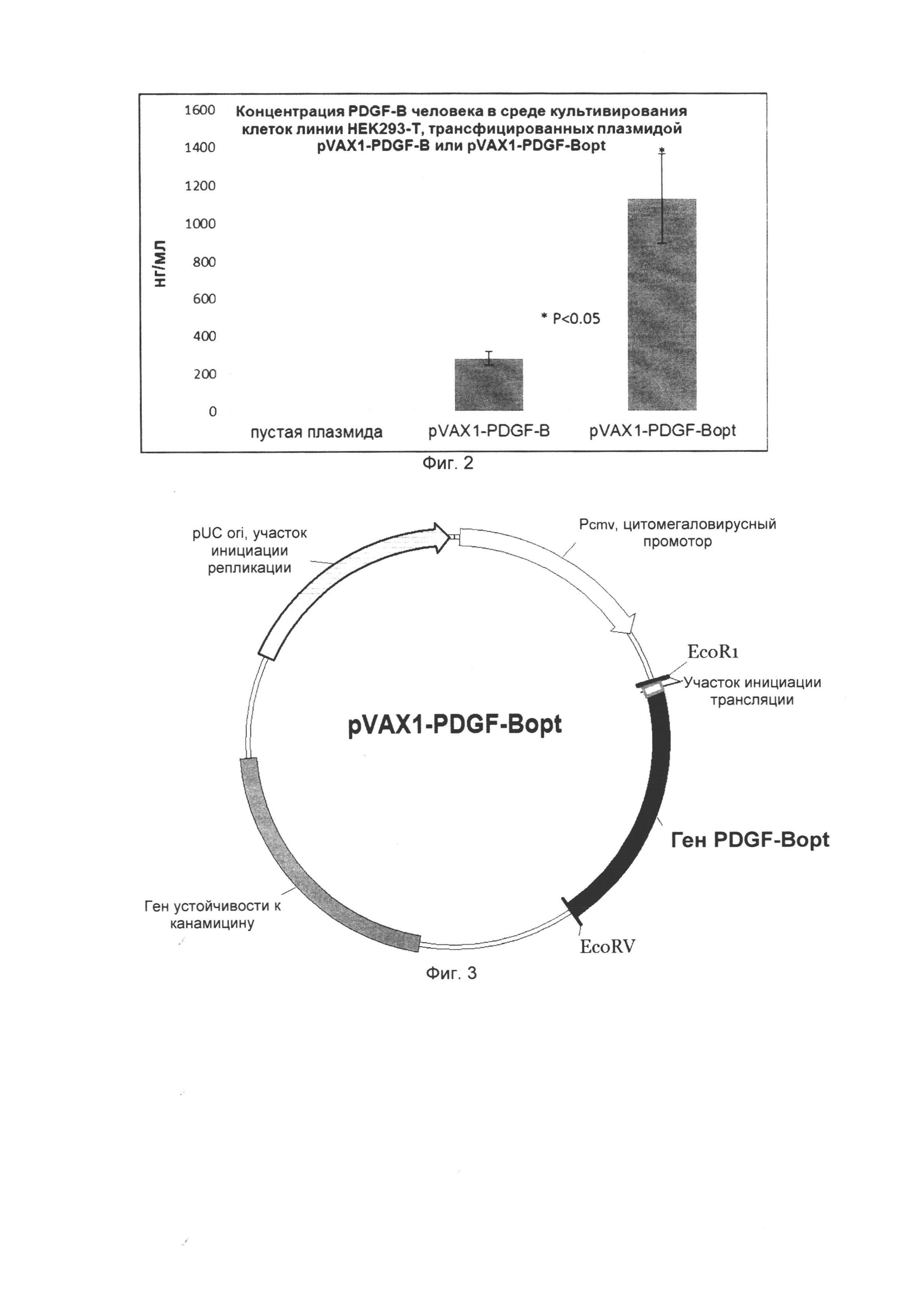
На Фиг. 3 представлены результаты количественного определения белка PDGF-BB человека в среде культивирования клеток линии НЕК293-Т, трансфицированных плазмидами pVAX1, pVAX1-PDGF-B, pVAX1-PDGF-Bopt.
Синтез оптимизированного гена PDGF-Bopt и конструирование плазмиды осуществляли с помощью стандартной технологии и оборудования, применяемых для решения подобных задач в генной инженерии (Watson J.D., Gilman M., Witkowski J., Zoller M. - Recombinant DNA, Scientific American Books, New York, 1992).
Дизайн оптимизированной последовательности нуклеотидов, кодирующей тромбоцитарный фактор роста человека, проводили на основе базы данных частоты встречаемости кодонов у разных организмов, доступной на вэб-сайте http://www.kazusa.or.jp/codon/. Среди триплетов нуклеотидов, кодирующих аминокислоты белковой последовательности природного гена PDGF-B, выявляли такие, которые редко встречаются в генах человека. Выявленные редкие триплеты, а также соседние с ними триплеты заменяли на триплеты, кодирующие ту же аминокислоту, но при этом встречающиеся в генах человека наиболее часто. Благодаря вырожденности генетического кода все аминокислоты природного гена тромбоцитарного фактора роста человека остались неизмененными. Полученная последовательность нуклеотидов представлена на Фиг. 1.
Плазмиду, несущую оптимизированный ген PDGF-Bopt, получали методом генно-инженерного конструирования, как описано ниже на примере плазмиды pVAX1-PDGF-Bopt.
Химически синтезировали следующие олигонуклеотиды:

Смешивали их (по 2 мкМ каждого) в лигазном буфере и кинировали. После инактивации киназы полученную смесь (смесь 1) смешивали с равным объемом смеси 2, представляющей собой следующие синтезированные олигонуклеотиды (также по 2 мкМ) в лигазном буфере:
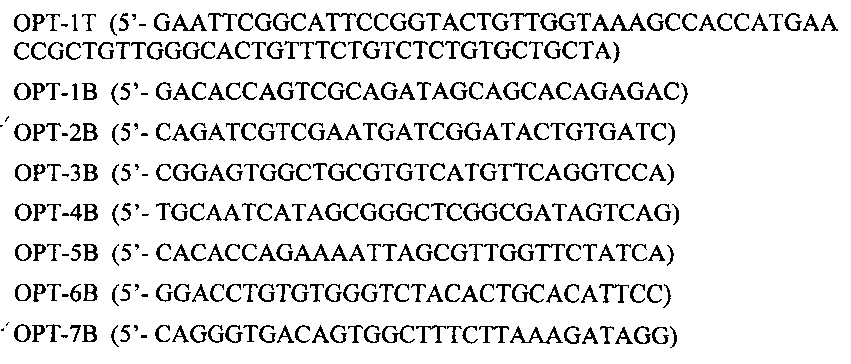

Прогревали на 95°С в течение 1 мин и давали медленно остыть до комнатной температуры для медленного отжига олигонуклеотидов. Далее полученную смесь разводили в 5 раз 1х лигазным буфером и ставили реакцию лигирования на ночь. На следующий день лигазную смесь разводили в 5 раз и подвергали ее ПЦР со следующими концевыми праймерами:
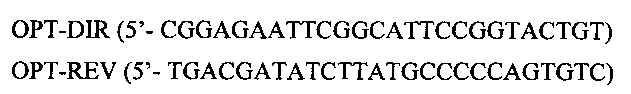
Разделение и идентификацию продуктов реакции осуществляли методом электрофореза в 1,5% агарозном геле. Далее вырезали из геля основную полосу, соответствующую целевому продукту реакции, проводили экстракцию ДНК и клонировали ее в коммерчески доступную плазмиду pVAX1, расщепленную рестриктазами EcoR1 и EcoRV, с получением плазмиды pVAX1-PDGF-Bopt. Встраивание последовательности оптимизированного PDGF-B и ее идентичность подтверждали рестриктным анализом и секвенированием.
Эффективность заявляемого изобретения иллюстрируется следующим примером.
Пример. Клетки НЕК293Т, культивируемые в 6-луночной плашке в среде DMEM, содержащей 10% эмбриональной телячьей сыворотки, трансфицировали плазмидой pVAX1-PDGF-Bopt, несущей оптимизированный ген тромбоцитарного фактора роста человека (PDGF-Bopt), или контрольными плазмидами pVAX1-PDGF-B (кодирует природный ген тромбоцитарного фактора роста человека) и pVAX1 (пустая плазмида). Для трансфекции клеток в одной лунке плашки брали 2,5 мкг ДНК и 7,5 мкл реагента Lipofectamine 2000 (Invitrogen), процедуру проводили в соответствии с протоколом производителя. Через 24 ч после трансфекции культуральную среду заменяли на свежую и инкубировали клетки в течение 48 часов. Концентрацию гомодимера тромбоцитарного фактора роста человека В (PDGF-BB) в среде культивирования клеток определяли методом иммуноферментного анализа с использованием набора реагентов Human PDGF-BB Quantikine ELISA Kit (R&D Systems) в соответствии с протоколом производителя.
Результаты измерений представлены на Фиг. 3, где отражена средняя концентрация гомодимера тромбоцитарного фактора роста ВВ (PDGF-BB) в среде культивирования клеток линии НЕК293Т, трансфицированных плазмидой pVAX1, pVAX1-PDGF-B или плазмидой pVAX1-PDGF-Bopt.
Иммуноферментный анализ показал, что в условиях эксперимента концентрация PDGF-BB в среде культивирования клеток, трансфицированных вектором с оптимизированной последовательностью гена PDGF, составляла 1129±233,3 нг/мл, что в 4,01 раза выше, чем в группе «pVAX1-PDGF-B» (281,4±34,8 нг/мл). Концентрация белка в группе «pVAX1» была ниже порога чувствительности метода.
Ген тромбоцитарного фактора роста человека, оптимизированный для экспрессии в клетках млекопитающих, который представлен последовательностью нуклеотидов, приведенной на Фиг. 1.