ПЕПТИДЫ И ИХ ПРИМЕНЕНИЕ
Вид РИД
Изобретение
Область изобретения
Настоящее изобретение относится к пептидам и их применению в лечении микробных инфекций, в частности бактериальных инфекций. Также предложен способ лечения.
Предшествующий уровень техники
Противомикробные пептиды представляют собой ключевые эффекторные молекулы врожденной иммунной системы и интегральные компоненты первой линии защиты против микробных инфекций всех эукариотических организмов. Ряд прокариотических организмов также использует Противомикробные пептиды в качестве средств для борьбы против заражения другими микроорганизмами. Многие Противомикробные пептиды характеризуются катионными свойствами, которые способствуют взаимодействиям с отрицательно заряженными фосфолипидами микробной мембраны, что затем приводит к микробному лизису и гибели после пермеабилизации мембраны. Например, было показано, что Противомикробные пептидные молекулы могут агрегировать и образовывать потенциалозависимые каналы в липидном бислое, приводя в результате к пермеабилизации как внутренней, так и внешней мембраны микроорганизма (Lehrer, R. I., J. Clin. Investigation, 84:553 (1989)). Амфифильная природа этих молекул также может способствовать включению гидрофобного остатка в липидный бислой посредством электростатического притяжения, в то время как полярные остатки вдаются внутрь и выше мембраны.
Устойчивые к лекарствам микроорганизмы, особенно бактерии, становятся все более проблематичными, так как степень инфицирования продолжает увеличиваться, и эффективные способы контроля становятся все более и более ограниченными. Интенсивное использование антибиотиков в последние 50 лет или около того, в сочетании с бессистемным назначением антибиотиков и несоблюдением пациентами режимов лечения, выделило микроорганизмы, которые развивались или приобрели средство противостоять эффектам антибиотиков. Передача инфекции и контроль за лекарственно-устойчивыми организмами становятся одной из наиболее значимых проблем здравоохранения.
Все грамположительные виды, включая Staphylococcus spp., Enterococcus spp., Listeria spp., Clostridium spp., Corynebacterium spp., Nocardia spp., Bacillus spp.и Streptococcus spp., в том числе те, которые развивались или получили варьирующие уровни устойчивости к антибиотикам, таким как метициллин (meticillin), представляют особый интерес, также как и грамотрицательные виды Eschehchia spp., Pseudomonas spp., Klebsiella spp.и Acetinobacter spp.Другие грамотрицательные патогены, представляющие интерес, включают Enterobacteriaceae (особенно те, которые продуцируют β-лактамазу (ESBL) или карбапенемазу расширенного спектра). Коагулазонегативные Staphylococci, такие как S. epidermidis, также появились как важные лекарственно-устойчивые внутрибольничные патогены. Возможности лечения инфекций, в которые вносят вклад или которые вызываются метициллин-устойчивыми бактериями или бактериями со множественной лекарственной устойчивостью, в настоящее время ограничены, и существует острая необходимость в разработке новых терапий, которые ингибируют или уничтожают такие организмы. Другие бактериальные патогены, представляющие особый интерес, включают Mycobacterium spp., например Mycobacterium tuberculosis; Enterobacter spp.; Campylobacter spp.; Salmonella spp.; Helicobacter spp., например Helicobacter pylori; Neisseria spp., например Neisseria gonorrhea, Neisseria meningitidis; Borrelia burgdorferi; Shigella spp., например Shigella flexnerii; Haemophilus spp., например Haemophilus influenzae; Chlamydia spp., например Chlamydia trachomatis, Chlamydia pneumoniae, Chlamydia psittaci; Francisella tularensis; Yersinia spp., например Yersinia pestis; Treponema spp.; Burkholderia spp.; например Burkholderia mallei и В. pseudomallei.
Pseudomonas aeruginosa представляет собой оппортунистический патоген, который вызывает инфекции дыхательных путей, инфекции мочевыводящей системы, дерматит, инфекции мягких тканей, бактериемию и ряд системных инфекций, особенно у пациентов с тяжелыми ожогами и пациентов, страдающих раком и СПИД, у которых иммунная система подавлена. Респираторные инфекции, вызываемые Pseudomonas aeruginosa, возникают почти исключительно у индивидуумов с нарушениями нижних дыхательных путей или нарушенным механизмом системной защиты (например, у пациентов с муковисцидозом или хронической обструктивной болезнью легких). Первичная пневмония возникает у пациентов с хроническим легочным заболеванием и застойной сердечной недостаточностью. Бактериемическая пневмония наиболее часто возникает у раковых пациентов с нейтропенией, подвергающихся химиотерапии. Колонизация нижних дыхательных путей пациентов с муковисцидозом мукоидными штаммами Pseudomonas aeruginosa является распространенной и трудно поддается лечению. Существует необходимость в разработке эффективного средства лечения инфекций Pseudomonas aeruginosa.
Staphylococcus aureus представляет собой оппортунистический патоген, который в обычных условиях встречается на коже и в носу многих здоровых людей, где он живет абсолютно безвредно. Однако, S. aureus может вызывать проблемы, когда он способен проникнуть в организм, вызывая абсцессы, нарывы, прыщи, импетиго и раневые инфекции, независимо от того получены ли они случайно или в результате хирургического вмешательства. Если инфекция попадает в кровоток и разносится в разные части тела, она может вызвать заражение крови (септицемию), костную инфекцию (остеомиелит), инфекцию сердечного клапана (эндокардит) и легочную инфекцию (пневмонию). Метициллин-устойчивый S.aureus (MRSA) представляет собой тип S. aureus, который является устойчивым ко многим распространенным прописываемым антибиотикам, включая метициллин (примерно 40% инфекций S. aureus в UK являются устойчивыми к метициллину и другим антибиотикам), и часто на него ссылаются в популярной прессе как на "сверхинфект". MRSA является одним из наиболее превалирующих микробов, вовлеченных в инфекции, связанные с здравоохранением. Инфекции обычно имеют место в госпиталях, и в частности у восприимчивых и/или ослабленных пациентов, включая пациентов в палатах интенсивной терапии, Ожеговых отделениях и ортопедических отделениях. MRSA тяжелее поддается лечению, так как многие антибиотики являются неэффективными, а те, которые эффективны, часто необходимо давать в более высоких дозах внутривенно в течение продолжительных периодов времени (несколько недель), тем самым подчеркивая необходимость в разработке альтернативных противомикробных терапий.
Поскольку микробные патогены не приобретают быстро устойчивость к катионным пептидам, вопреки эволюционному давлению миллионов лет совместного существования, они остаются привлекательными терапевтическими мишенями. В заявках авторов настоящего изобретения WO 2006/018652 и WO 2008/093058, находящихся на одновременном рассмотрении, описана идентификация пептидов, которые могут быть использованы для лечения микробных инфекций, включая бактериальные инфекции.
Микробная биопленка представляет сообщество микробных клеток, заключенных во внеклеточную матрицу полимерных веществ и прикрепленных к биологической или неживой поверхности. Ряд микроорганизмов (бактерии, грибы и/или простейшие, с ассоциированными бактериофагами и другими вирусами) может быть обнаружен в этих биопленках. Биопленки повсеместно распространены в природе и наиболее часто обнаруживаются в разнообразных окружениях. Биопленки все более признаются учеными и медицинским сообществом как вовлеченные во многие инфекции, и особенно их вклад в неподдаваемость противоинфекционному лечению.
Образование биопленки не ограничено только способностью микробов прикрепляться к поверхности. Микробы, растущие на биопленке, способны взаимодействовать друг с другом в большей степени, чем с фактическим физическим субстратом, на котором биопленка исходно развивалась. Например, этот феномен благоприятствует конъюгативному переносу генов, который возникает в большей степени между клетками в биопленке, чем между планктонными клетками. Это увеличивает возможность горизонтального переноса генов между бактериями и является важным, поскольку способствует переносу генов устойчивости к антибиотикам или генов, определяющих вирулентность, от устойчивых микробов к чувствительным. Бактерии могут взаимодействовать друг с другом посредством системы, известной как бактериальное чувство кворума, через которую молекулы передачи сигнала высвобождаются в среду, и их концентрация может быть детектирована окружающими микробами. Бактериальное чувство кворума дает возможность бактериям координировать свое поведение, таким образом усиливая их способность к выживанию. Реакции на бактериальное чувство кворума включают адаптацию к доступности питательных веществ, защиту от других микроорганизмов, которые могут конкурировать за те же питательные вещества, и избегание токсических соединений, потенциально опасных для бактерий. При инфицировании хозяина (например людей, других животных или растений) важным для патогенных бактерий является координирование их вирулентности, для того чтобы ускользать от иммунного ответа хозяина с целью обеспечения способности установления успешного инфицирования.
Образование биопленки играет ключевую роль во многих инфекционных заболеваниях, таких как муковисцидоз и периодонтит, в инфекциях крови и мочевыделительной системы, а также как следствие наличия постоянных медицинских устройств. Подтвержденные механизмы, с помощью которых ассоциированные с биопленкой микроорганизмы вызывают заболевания у их хозяина, включают следующие: (1) замедленное проникновение противомикробного агента через биопленочную матрицу, (2) открепление клеток или клеточных агрегатов от биопленок на постоянных медицинских устройствах, (3) продуцирование эндотоксинов, (4) устойчивость к иммунной системе хозяина, (5) предоставление ниши для генерирования устойчивых организмов через горизонтальный перенос генов противомикробной устойчивости и/или генов, определяющих вирулентность, и (6) изменение скорости роста (а именно, метаболический покой) (Donlan and Costerton, Clin Microbiol Rev 15: 167-193, 2002; Parsek and Singh, Annu Rev Microbiol 57: 677-701, 2003; Costerton JW, Resistance of biofilms to stress. In The biofilm primer'. (Springer Berlin Heidelberg), pp.56-64.2007).
Экспериментальные свидетельства последнего времени указывают на существование в биопленках небольшой субпопуляции специализированных неметаболизирующих персистирующих клеток (покоящиеся клетки). Считают, что эти клетки могут быть ответственными за высокую устойчивость/толерантность биопленки к противомикробным агентам. Персистирующие клетки с множественной устойчивостью к лекарствам и толерантностью присутствуют как в планктонных популяциях, так и в биопленках, и, по-видимому, дрожжи и бактерии проявляли аналогичные стратегии, которые направляют функцию выживания для этой субпопуляции. Защита, обеспечиваемая полимерной матрицей, дает возможность персистирующим клеткам избегать элиминации и служит в качестве источника репопуляции. Есть доказательство того, что персистеры могут быть в большой степени ответственными за множественную лекарственную устойчивость микробных биопленок (LaFleur et al., Antimicrob Agents Chemother. 50: 3839-46, 2006; Lewis, Nature Reviews Microbiology 5, 48-56 2007).
Таким образом, существует потребность в дополнительных агентах, которые могут быть использованы для лечения микробных инфекций. В частности, сохраняется острая необходимость в дополнительных противомикробных активных веществах, которые могут быть использованы в лечении бактериальных инфекций, таких как те, которые вызываются Staphylococci, Streptococci, Acinetobacter spp., Klebsiella spp., E. соli и Pseudomonas spp.Также имеется острая необходимость в лучших терапиях для предупреждения образования биопленки и лечения состояний, ассоциированных с микробными биопленками.
Авторы настоящего изобретения идентифицировали пептиды, которые неожиданно проявляли улучшенную противомикробную активность по сравнению с природными противомикробными пептидами, такими как дефензины, кателицидины и другие. Заявленные соединения имеют сильные противомикробные свойства, в то же время проявляя низкую токсичность in vitro и in vivo у животных и людей.
Краткое изложение сущности изобретения
Согласно первому аспекту настоящего изобретения предложен пептид, где по меньшей мере 75% аминокислот пептида представляют собой аминокислоты аргинин и фенилаланин, причем по меньшей мере 50% аминокислот представляют собой аминокислоту аргинин и по меньшей мере 15% аминокислот представляют собой аминокислоту фенилаланин.
Пептиды по изобретению полезны среди прочего в лечении или предупреждении микробных инфекций, в частности бактериальных инфекций, таких как инфекции, вызываемые Staphylococcus spp. и Pseudomonas spp., но не ограниченных ими. Пептиды по настоящему изобретению также полезны в предупреждении и лечении биопленочных инфекций, вызванных этими и другими бактериями.
В общем, по меньшей мере 80% аминокислот в пептиде представляют собой аминокислоты аргинин и фенилаланин, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, типично около 99% аминокислот в пептиде представляют собой аминокислоты аргинин и фенилаланин. Согласно одному из воплощений все аминокислоты в пептиде представляют собой аргинин и фенилаланин.
В общем, по меньшей мере 55% аминокислот в пептиде представляют собой аминокислоту аргинин, предпочтительно по меньшей мере 60% (например 61%), более предпочтительно по меньшей мере 65%, типично около 70% аминокислот в пептиде представляют собой аминокислоту аргинин.
В общем, по меньшей мере 20% аминокислот в пептиде представляют собой аминокислоту фенилаланин, предпочтительно по меньшей мере 25%, более предпочтительно по меньшей мере 30%, типично около 30-40% (например 38%) аминокислот в пептиде представляют собой аминокислоту фенилаланин.
Аминокислоты пептида по настоящему изобретению могут быть D- или L-аминокислотами. Аминокислоты могут быть оптическими изомерами катионных аминокислот, как определено здесь, например D- или L-аминокислот. Аминокислоты могут быть природными или синтетическими. Изобретение также включает известные изомеры (структурные, стерео-, конформационные и конфигурационные) и структурные аналоги вышеуказанных аминокислот, и те, которые модифицированы естественным путем (например посттрансляционной модификацией) или химическим путем, включая, но не исключительно, фосфорилирование, гликозилирование, сульфонилирование и/или гидроксилирование.
Согласно одному из воплощений настоящего изобретения пептид состоит из аминокислот аргинина и фенилаланина, возможно с неаргининовыми и нефенилаланиновыми заменами в количестве вплоть до пяти. В общем, пептид состоит из аминокислот аргинина и фенилаланина с неаргининовыми и нефенилаланиновыми заменами в количестве ноль, одна, две или три, типично ноль, одна или две замены, преимущественно ноль или одна замена.
Согласно одному из воплощений пептид состоит из аминокислот аргинина и фенилаланина.
Типично, пептид по настоящему изобретению может содержать 1-5 замен, предпочтительно 1-3 замены, как правило одну замену. Замена(ы) могут быть концевыми или неконцевыми.
Замены могут состоять из аминокислот или не являться аминокислотами. Замены могут быть заряженными или незаряженными. Типично, одна или более замен представляют собой незаряженные аминокислоты. Альтернативно или дополнительно, одна или более замен могут представлять собой заряженные аминокислоты, в частности катионные аминокислоты. Одна или более аминокислотных замен могут быть гидрофобными.
Когда одна или более замен являются аминокислотными заменами, они могут быть заряженными или незаряженными аминокислотами. Аминокислотные замены могут быть существующими в природе либо не существующими в природе, синтезированными аминокислотными заменами.
В общем, замены состоят из одной или более гидрофобной аминокислоты и/или одной или более катионной аминокислоты.
Термин "гидрофобный", как он использован здесь, относится к аминокислоте, имеющей боковую цепь, которая является незаряженной при физиологическом рН, которая является неполярной и которая в общем отталкивается водным раствором.
В общем, гидрофобный аминоостаток имеет гидрофобность не ниже -1,10 и заряд не выше 0.
Термин "катионный", как он использован здесь, относится к аминокислотам, имеющим суммарный заряд не ниже 0. В общем, термин "катионный" относится к аминокислотам, имеющим суммарный заряд выше нуля.
Типичные гидрофобные аминокислотные замены включают глицин, лейцин, пролин, аланин, триптофан, валин, изолейцин, метионин, тирозин и треонин.
Типичные катионные аминокислотные замены включают орнитин, гистидин и лизин.
Согласно одному из воплощений пептид содержит одну или более аминокислот цистеина, в частности один или два концевых остатка цистеина.
Согласно одному из воплощений пептид содержит одну или более замен, выбранных из группы лизин, пролин, глицин и гистидин.
Преимущественно, пептид состоит из аргинина, фенилаланина и одной из группы, состоящей из лизина, пролина, глицина и гистидина. Преимущественно, группа состоит из пролина и глицина.
В общем, пептид не содержит аминокислоты аспарагиновую кислоту, глутаминовую кислоту, аспарагины, глутамин или серин, но некоторые пептиды по изобретению могут иметь активность, даже если эти аминокислоты присутствуют.
В дополнение, аминокислотная последовательность пептида может быть модифицирована таким образом, чтобы привести в результате к варианту пептида, который включает замену по меньшей мере одного аминокислотного остатка в пептиде на другой аминокислотный остаток, включая замены, которые используют D-, а не L-форму.
Один или более остатков пептида могут быть заменены на другой для изменения, усиления или сохранения биологической активности пептида. Такой вариант может иметь, например, по меньшей мере приблизительно 10% биологической активности соответствующего невариантного пептида. Часто используют консервативные аминокислоты, то есть замены аминокислот с подобными химическими и физическими свойствами, как описано выше.
Так, например, консервативные аминокислотные замены могут включать замену одной катионной аминокислоты на другую, например аргинин на лизин, орнитин или гистидин. Альтернативно или дополнительно, фенилаланин может быть заменен на глицин, лейцин, пролин, аланин, триптофан, валин, изолейцин, метионин, тирозин или треонин. После введения замен варианты подвергают скринингу на биологическую активность.
Пептид по настоящему изобретению может содержать от 2 до 200 аминокислот, например от 3, 4, 5, 6 или 7 вплоть до 100 аминокислот, включая от 3, 4, 5, 6 или 7 вплоть до 10, 15, 20, 25, 30, 35, 40, 45 или 50 аминокислот.
Согласно одному из воплощений противомикробный пептид содержит от 3 или 4 до 50 аминокислот.
Пептид может содержать от 100 до 200 аминокислот, от 20 до 100, от 20 до 45 аминокислот, например 20, 25, 30, 35, 40, 42 или 45 аминокислот. Пептид может содержать от 3 до 15 аминокислот, например от 5 до 15 аминокислот, например 13-15 аминокислот.
Типично, пептид содержит от 5 до 20 аминокислот, предпочтительно от 5 до 15, более предпочтительно от 7 до 15, в общем от 10 до 15 аминокислот, включая от 11 до 13 аминокислот.
Согласно одному из воплощений пептид состоит из 10-15 аминокислот, в частности 11-13 аминокислот.
Пептид может типично содержать от 5 до 50 аминокислот аргинина, предпочтительно от 5 до 30, более предпочтительно от 5 до 20, в общем от 7 до 10 аминокислот аргинина.
Пептид может содержать от 1 до 20 аминокислот фенилаланина, типично от 1 до 15, предпочтительно от 2 до 10, более предпочтительно от 2 до 5 аминокислот фенилаланина.
В общем, пептид содержит аргининовый каркас, в котором присутствуют фенилаланиновые замены.
В общем, пептид содержит по меньшей мере один непрерывный участок из 3-20 аминокислот аргинина, типично по меньшей мере один непрерывный участок из 3-10 аминокислот аргинина, предпочтительно по меньшей мере один непрерывный участок из 3-5 аминокислот аргинина. Альтернативно или дополнительно, пептид может содержать по меньшей мере один непрерывный участок из 5-10 аминокислот аргинина.
В общем, пептид содержит по меньшей мере один непрерывный участок из 1-5 аминокислот фенилаланина, типично по меньшей мере один непрерывный участок из 3-5 аминокислот фенилаланина, предпочтительно пептид содержит по меньшей мере один непрерывный участок из 3 аминокислот фенилаланина.
Согласно одному из воплощений пептид содержит более одного фенилаланинового участка, каждый из которых содержит одну или более аминокислот фенилаланина. В общем, пептид содержит два или три фенилаланиновых участка.
Согласно одному из воплощений пептид не содержит концевую аминокислоту фенилаланин.
Согласно одному из воплощений пептид содержит одну концевую аминокислоту фенилаланин, только в качестве примера, М-концевой фенилаланин. Предпочтительно пептид не содержит концевую аминокислоту фенилаланин на обоих концах пептида.
Типично, пептид содержит аргининовые аминокислотные участки на одном или обоих концах, предпочтительно аргининовые аминокислотные участки, имеющие 1-5 аминокислот аргинина. Альтернативно, пептид может содержать одну или две концевые неаргининовые и нефенилаланиновые замены. Подходящие концевые замены включают описанные выше замены, в частности гистидин, цистеамин и лизин.
Пептид может содержать аминокислоту фенилаланин на С- или N-конце и аминокислоту аргинин на соответствующем N- или С-конце.
Согласно одному из воплощений пептид содержит С-концевую аминокислоту аргинин и N-концевую аминокислоту фенилаланин.
Согласно одному из воплощений пептид не содержит последовательность (например 2 или более) аминокислот фенилаланина на N-конце.
Пептид по настоящему изобретению может быть симметричным или несимметричным.
Предпочтительно пептид является ациклическим. Пептид может быть прямоцепочечным, то есть линейным, или разветвленным. Термин "пептид", как он использован здесь, означает в общем смысле множество аминокислотных остатков, соединенных вместе пептидными связями. Его используют взаимозаменяемо, и он означает то же самое, что и полипептид и белок.
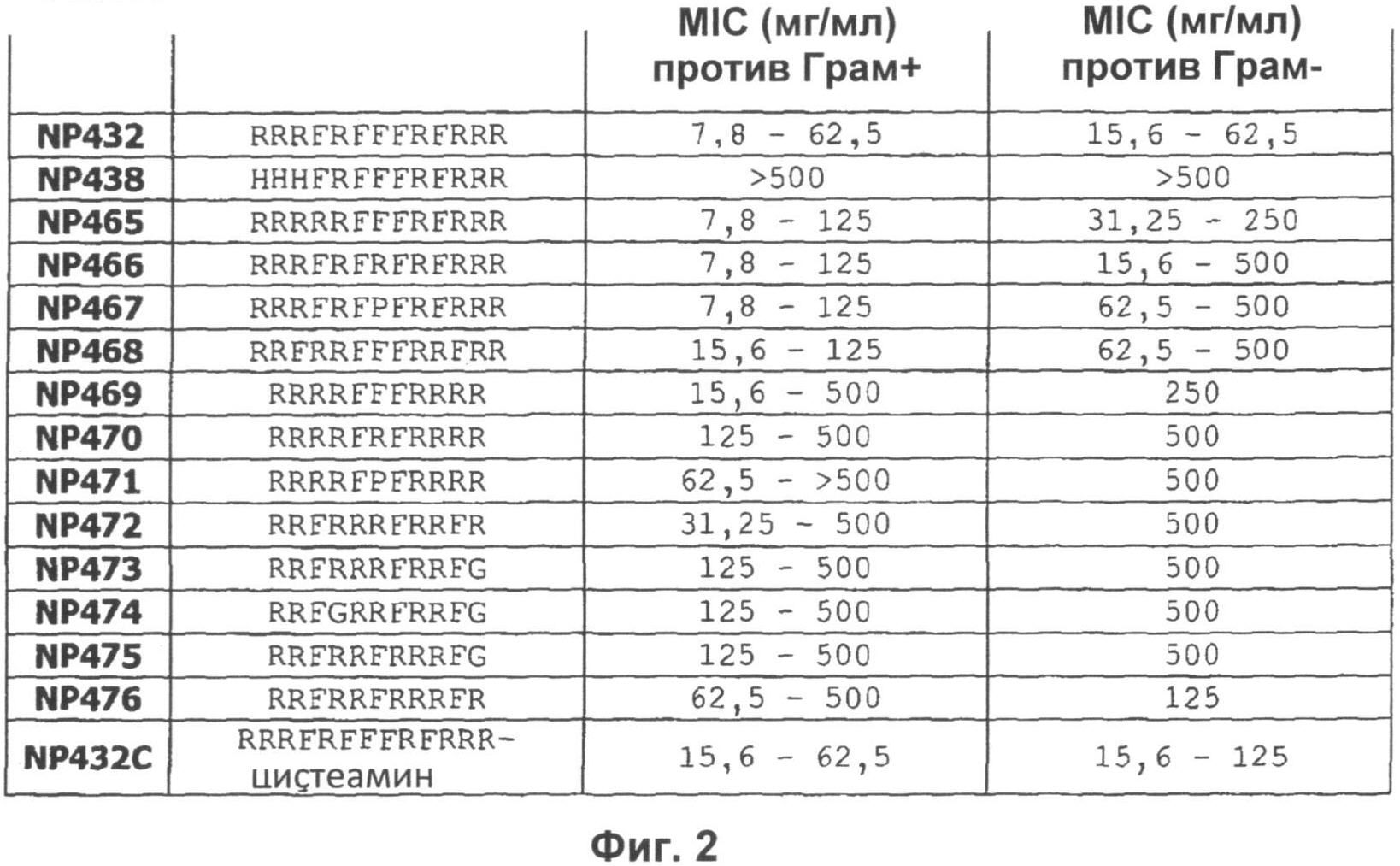
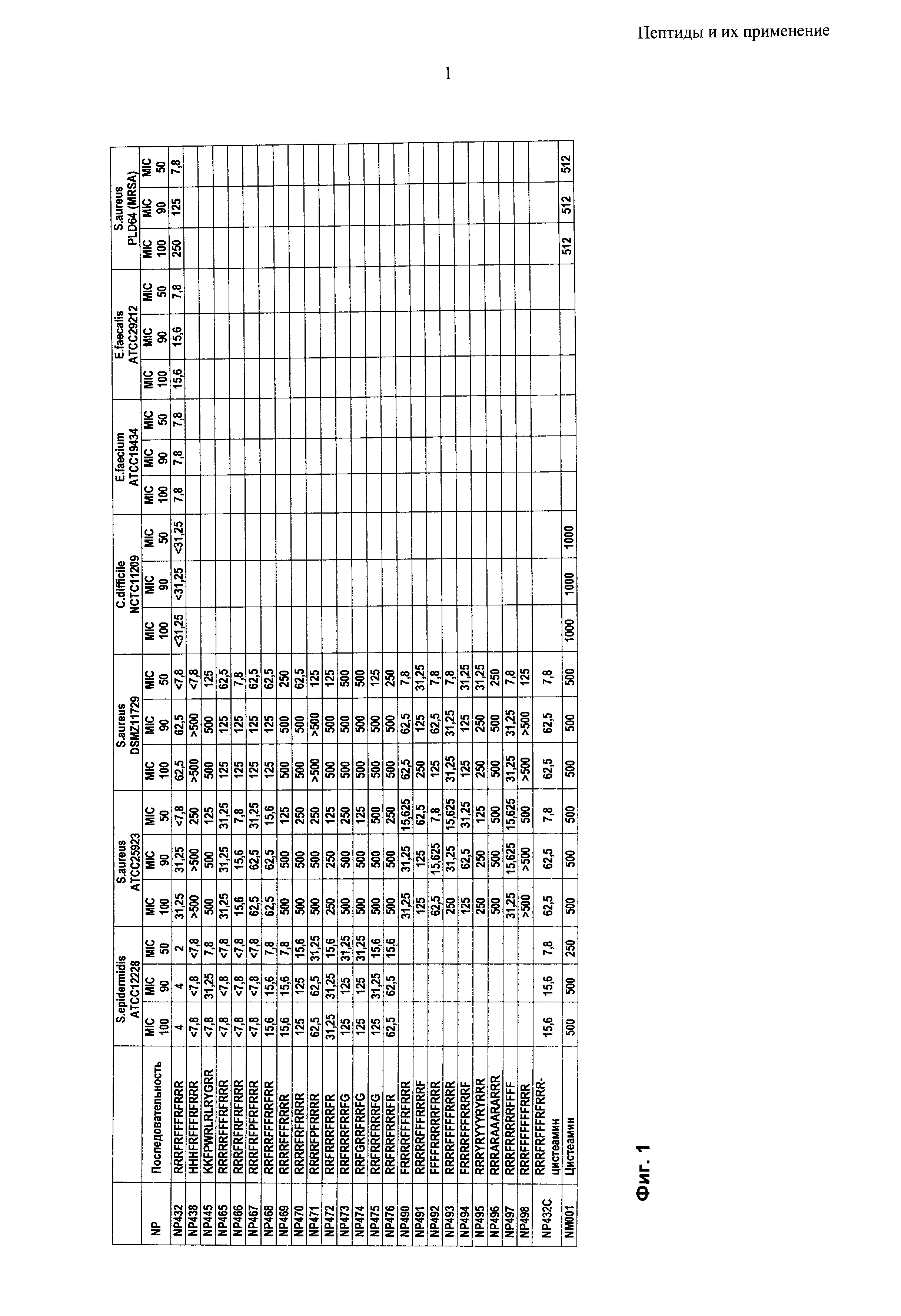
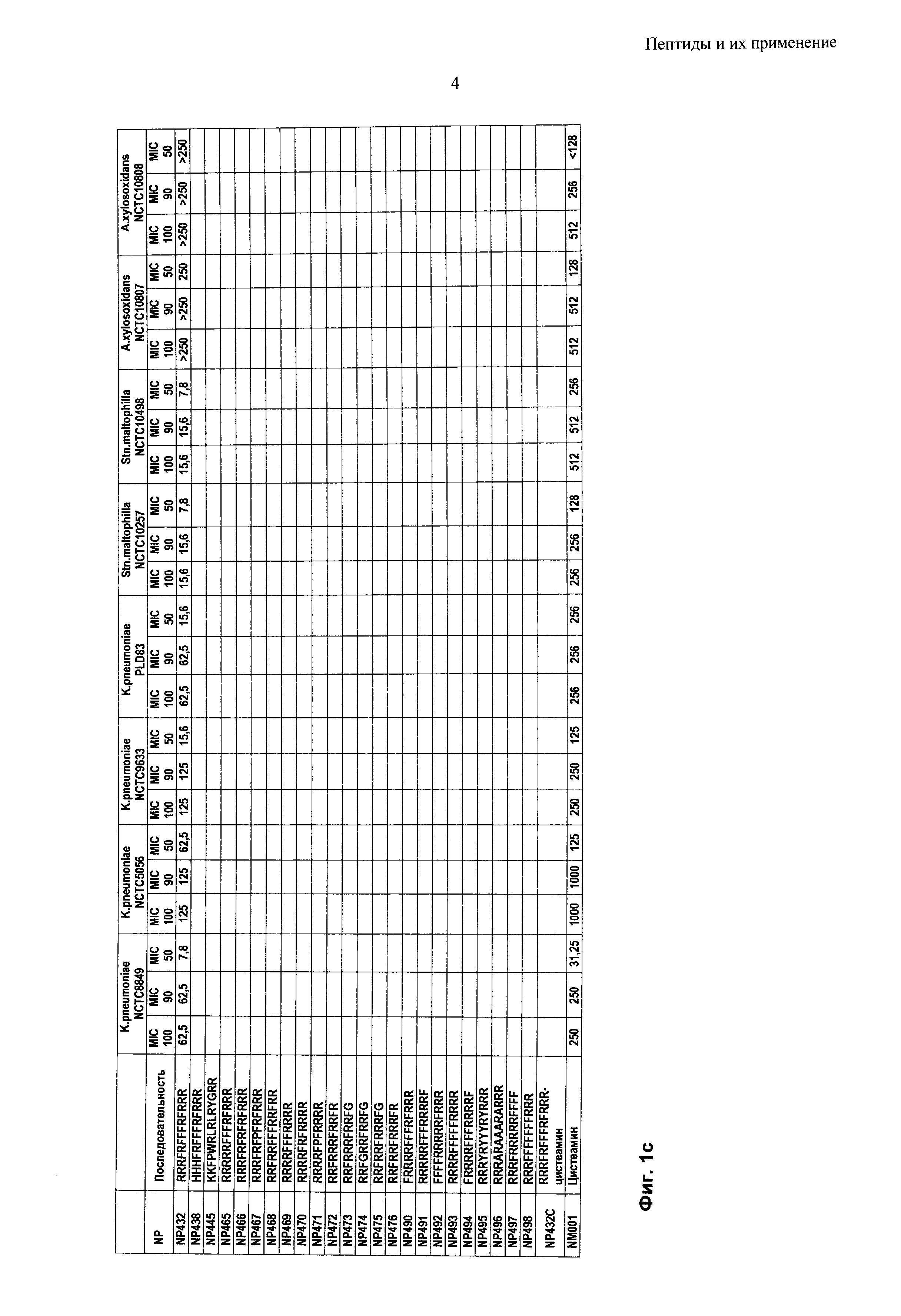
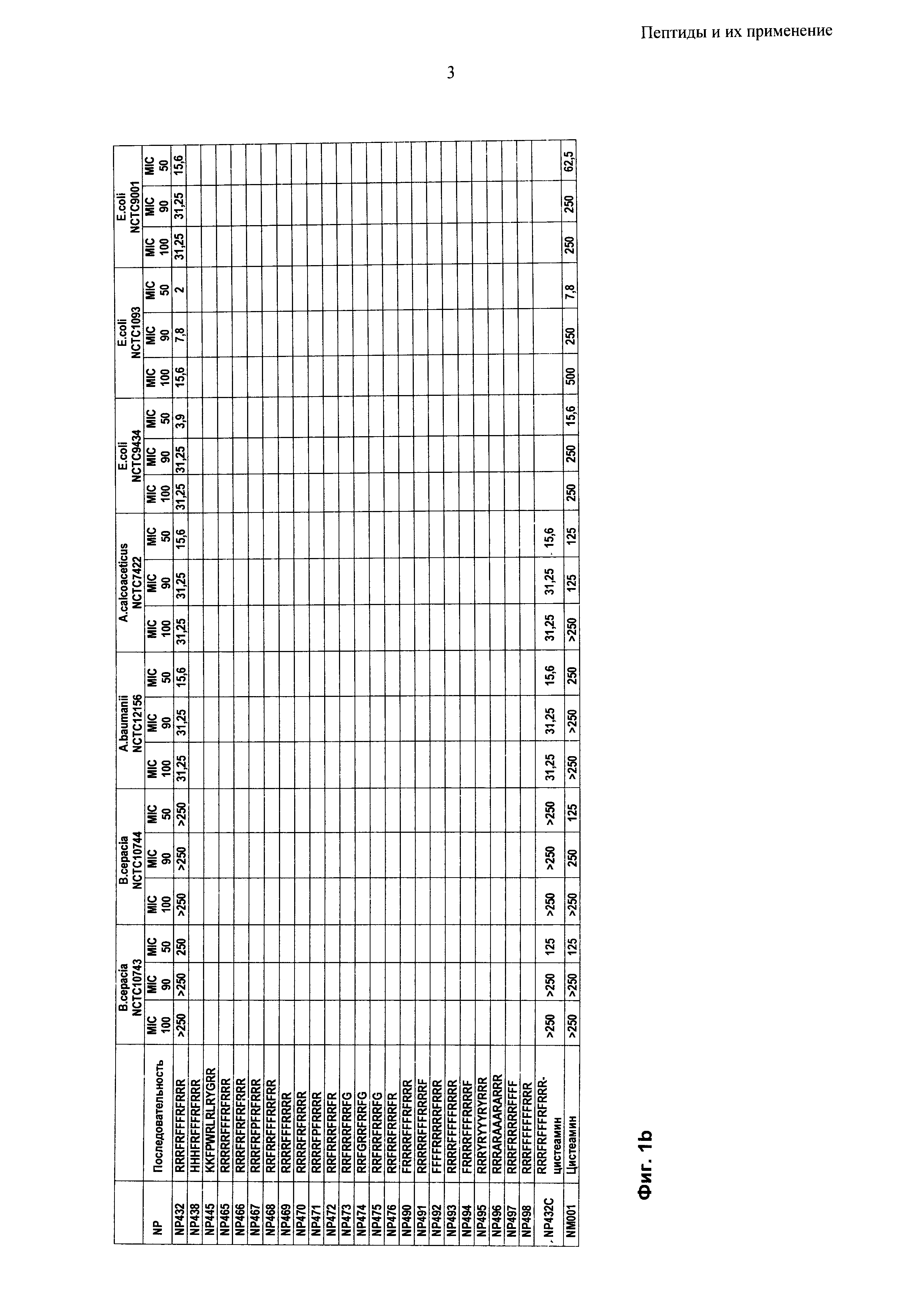
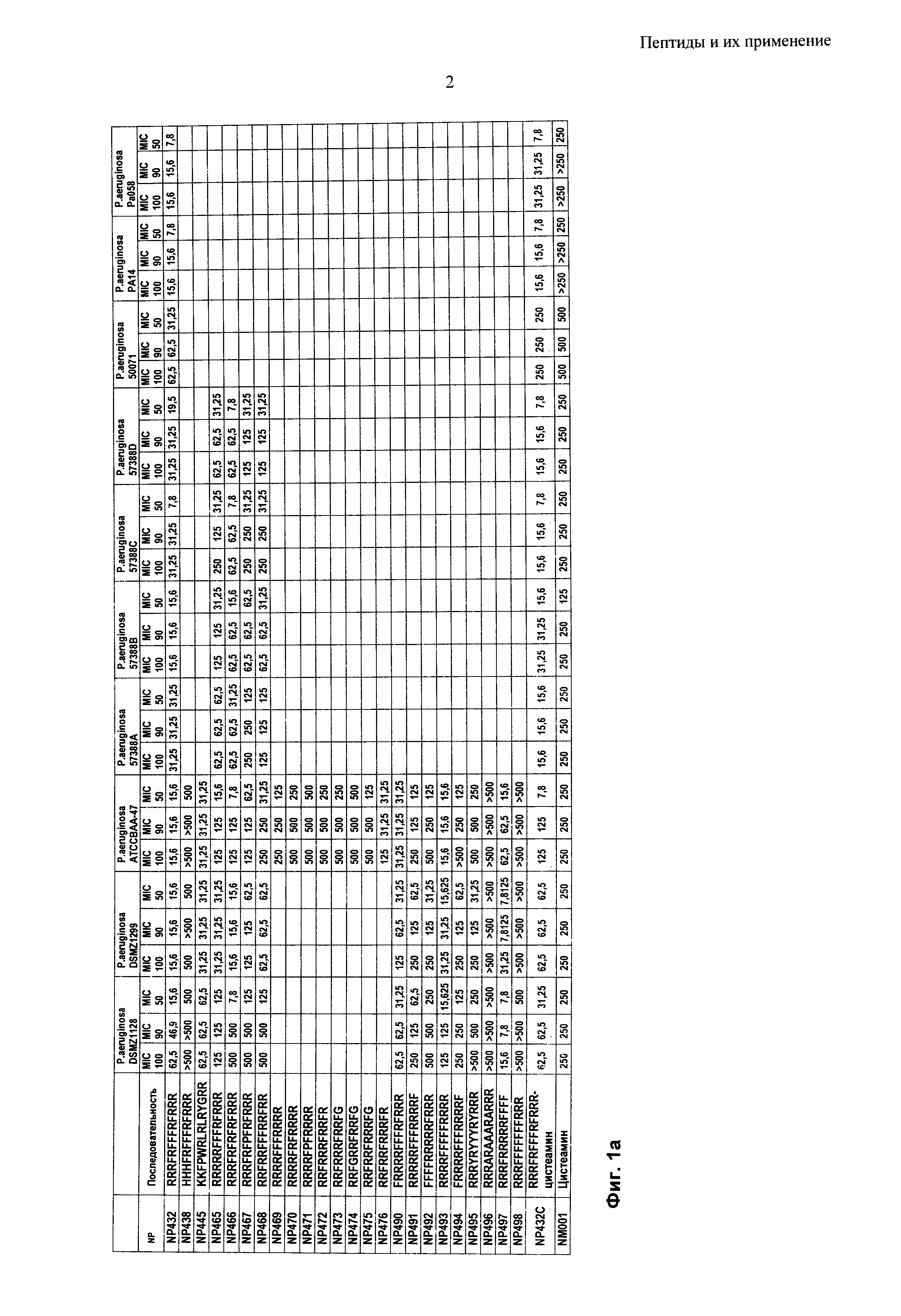
Согласно одному из воплощений настоящего изобретения пептид содержит аминокислотную последовательность, выбранную из группы RRRFRFFFRFRRR, HHHFRFFFRFRRR, KKFPWRLRLRYGRR, RRRRRFFFRFRRR, RRRFRFRFRFRRR, RRRFRFPFRFRRR, RRFRRFFFRRFRR, RRRRFFFRRRR, RRRRFRFRRRR, RRRRFPFRRRR, RRFRRRFRRFR RRFRRRFRRFG, RRFGRRFRRFG, RRFRRFRRRFG, RRFRRFRRRFR, FRRRRFFFRFRRR, RRRRRFFFRRRRF, FFFFRRRRRFRRR, RRRRFFFFFRRRR, FRRRRFFFRRRRF, RRRYRYYYRYRRR, RRRARAAARARRR, RRRFRRRRRFFFF, RRRFFFFFFFRRR и RRRFRFFFRFRRR-цистеамин. Пептиды могут состоять по существу из этих аминокислотных последовательностей.
Согласно одному из воплощений настоящего изобретения пептид содержит аминокислотную последовательность, выбранную из группы RRRFRFFFRFRRR (NP432), FRRRRFFFRFRRR (NP490), RRRRFFFFFRRRR (NP493) и RRRFRRRRRFFFF (NP497).
Согласно второму аспекту настоящего изобретения пептид содержит смесь гидрофобных и катионных аминокислот. В частности, гидрофобные аминокислоты выбраны из группы, состоящей из глицина, лейцина, фенилаланина, пролина, аланина, триптофана, валина, изолейцина, метионина,тирозина и треонина.
Пептид по этому воплощению в общем содержит аминокислоту аргинин, но не обязательно содержит аминокислоту фенилаланин.
Типично гидрофобные аминокислоты выбраны из группы, состоящей из фенилаланина, триптофана, тирозина и глицина.
В частности, катионные аминокислоты выбраны из группы, состоящей из орнитина, гистидина, аргинина и лизина. Типично катионные аминокислоты выбраны из группы, состоящей из аргинина и лизина.
Согласно одному из воплощений пептид содержит аминокислоты лизин, фенилаланин и аргинин.
Согласно дополнительному воплощению пептид содержит аминокислоты лизин, аргинин, фенилаланин, пролин, триптофан, тирозин и глицин. Хотя пептиды по настоящему изобретению не включают в общем аминокислоту глутамин, некоторые такие пептиды могут проявлять активность. Такой пептид может включать одну или две аминокислоты глутамин.
Согласно одному из воплощений описанные выше пептиды могут состоять из этих конкретных аминокислот с заменами в количестве ноль, одна или две. В общем пептиды по настоящему изобретению состоят из этих конкретных аминокислот. Альтернативно, пептиды по этому воплощению настоящего изобретения могут содержать замены, как подробно описано выше.
Пептиды по второму воплощению могут содержать аминокислотную последовательность, выбранную из группы, состоящей из KKPRRKPRRPKRKK (NP449) и KKFPWRLRLRYGRR (NP445).
Пептиды по изобретению являются в общем синтетическими пептидами. Пептиды могут быть выделенными, очищенными пептидами или их вариантами, которые могут быть синтезированы in vitro, например, способом твердофазного пептидного синтеза, катализируемого ферментами пептидного синтеза, или с помощью технологии рекомбинантной ДНК.
Для идентификации активных пептидов, которые имеют небольшую или не имеют нежелательной токсичности для клеток млекопитающих, индивидуальные пептиды или библиотеки пептидов могут быть получены, и эти индивидуальные пептиды или пептиды из этих библиотек могут быть подвергнуты скринингу на противомикробную активность и токсичность, включая противогрибковую, антибактериальную, противовирусную, противопротозойную, противопаразитарную активность и токсичность, но не ограничиваясь ими.
Пептиды по изобретению могут существовать в разных формах, таких как свободные кислоты, свободные основания, сложные эфиры и другие пролекарства, соли и таутомеры, например, и изобретение включает все вариантные формы соединений.
Таким образом, изобретение охватывает соль или пролекарство пептида или варианта пептида по изобретению.
Композиция
Согласно еще одному аспекту настоящего изобретения предложена композиция, содержащая один или более пептидов, как они описаны выше, вместе с одним или более адъювантами или эксципиентами.
Согласно одному из воплощений, композиция может содержать два или более пептидов по настоящему изобретению. Предпочтительно композиция содержит один, два или три пептида по настоящему изобретению.
Агенты по изобретению могут быть введены в форме фармацевтически приемлемых солей. Фармацевтически приемлемые соли по настоящему изобретению могут быть синтезированы из исходного соединения, которое содержит основную или кислотную группировку, традиционными химическими способами. В общем, такие соли могут быть получены путем взаимодействия этих соединений в форме свободной кислоты или свободного основания со стехиометрическим количеством подходящего основания или кислоты в воде или в органическом растворителе или в их смеси; как правило, предпочтительными являются неводные среды, такие как эфир, этилацетат, этанол, изопропанол или ацетонитрил. Перечни подходящих солей можно найти в Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, Pa., US, 1985, p.1418, описание которой включено в данное описание ссылкой; см. также Stahl et al, Eds, "Handbook of Pharmaceutical Salts Properties Selection and Use", Verlag Helvetica Chimica Acta and Wiley-VCH, 2002. Фраза "фармацевтически приемлемый" использована здесь для ссылки на те соединения, материалы, композиции и/или дозированные формы, которые, по результатам тщательной медицинской оценки, подходят для применения в контакте с тканями человека или животного, не вызывая излишней токсичности, раздражения, аллергической реакции или других проблем или осложнений, соизмеримо с обоснованным соотношением польза/риск.
Таким образом, изобретение включает фармацевтически приемлемые соли раскрытых соединений, где исходное соединение модифицировано путем получения их кислых или основных солей, например традиционных нетоксичных солей четвертичного аммония, которые образованы, например, из неорганических или органических кислот или оснований. Примеры таких солей присоединения кислоты включают ацетат, адипинат, альгинат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, фумарат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидроиодид, 2-гидроксиэтансульфонат, лактат, малеат, метансульфонат, 2-нафталинсульфонат, никотинат, оксалат, памоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, тозилат и ундеканоат. Основные соли включают соли аммония, соли щелочных металлов, такие как соли натрия и соли калия, соли щелочноземельных металлов, такие как соли кальция и соли магния, соли с органическими основаниями, такие как соли дициклогексиламина, N-метил-О-глюкамина, и соли с аминокислотами, такими как аргинин, лизин и так далее. Кроме того, основные азотсодержащие группы могут быть кватернизированы с такими агентами, как галогениды низших алкилов, такие как метил-, этил-, пропил- и бутилхлориды, -бромиды и -иодиды; диалкилсульфаты, такие как диметил-, диэтил-, дибутилсульфаты; и диамилсульфаты, длинноцепочечные галогениды, такие как децил-, лаурил-, миристил- и стеарилхлориды, -бромиды и -иодиды, аралкилгалогениды, такие как бензил- и фенетилбромиды, и другие.
Соли карбоксильных групп пептида или варианта пептида по изобретению могут быть получены традиционно путем взаимодействия пептида с одним или более эквивалентов желаемого основания, такого как, например, соль гидроксида металла, например гидроксид натрия; карбонат или бикарбонат металла, такие как, например, карбонат или бикарбонат натрия; или аминного основания, такого как, например, триэтиламин, триэтаноламин и тому подобное.
N-Ацилпроизводные аминогруппы пептида или варианта пептида по изобретению могут быть получены путем использования N-ацил-защищенной аминокислоты для конечной конденсации или путем ацилирования защищенной или незащищенной аминокислоты. O-Ацилпроизводные могут быть получены, например, путем ацилирования свободной гидроксигруппы пептида или пептидного полимера. Или ацилирование может быть осуществлено с использованием стандартных ацилирующих реагентов, таких как ацил галоген иды, ангидриды, ацилимидазолы и тому подобное.
Изобретение включает пролекарства для активных фармацевтических видов описанных пептидов, например, в которых одна или более функциональных групп защищены или дериватизированы, но могут превращаться in vivo в функциональную группу, как в случае сложных эфиров карбоновых кислот, превращаемых in vivo в свободную кислоту, или, в случае защищенных аминов, в свободную аминогруппу. Термин "пролекарство", как он использован здесь, представляет собой конкретные структуры, которые легко превращаются in vivo в родительскую структуру, например, путем гидролиза в крови. Подробное обсуждение предложено в Т. Higuchi and V. Stella, Pro-drugs as Novel Delivery Systems, Vol.14 of the A.C.S. Symposium Series, Edward B. Roche, ed, Bioreversible Carriers in Drug Design, American Pharmaceutical Association and Pergamon Press, 1987; H Bundgaard, ed, Design of Prodrugs, Elsevier, 1985; и Judkins, et al. Synthetic Communications, 26(23), 4351-4367 (1996), каждая из которых включена в данное описание посредством ссылки.
Таким образом, пролекарства включают лекарственные средства, имеющие функциональную группу, которая была преобразована в ее обратимое производное. Как правило, такие пролекарства превращаются в активное лекарственное средство путем гидролиза. Пролекарства также включают соединения, превращаемые в активное лекарственное средство путем окислительной или восстановительной реакции. В качестве примеров можно упомянуть следующие: окислительная активация, N- и O-деалкилирование, окислительное дезаминирование, N-окисление, эпоксилирование, восстановительная активация, азо-восстановление, восстановление сульфоксида, дисульфидное восстановление, биовосстановительное алкилирование и нитровосстановление.
Также следует упомянуть в качестве метаболических активации пролекарств нуклеотидную активацию, активацию фосфорилированием и активацию декарбоксилированием.
Использование защитных групп полностью описано в "Protective Groups in Organic Chemistry", под редакцией J W F McOmie, Plenum Press (1973), и "Protective Groups in Organic Synthesis", 2-е издание, Т W Greene & P и М Wutz, Wiley-lnterscience (1991).
Таким образом, специалистам в данной области техники понятно, что, хотя защищенные производные описанных пептидов сами по себе могут не обладать фармакологической активностью, они могут быть введены, например парентерально или перорально, и затем метаболизированы в организме с образованием соединений, которые являются фармакологически активными. Такие производные являются, таким образом, примерами "пролекарств". AU пролекарства описанных соединений включены в объем данного изобретения.
Композиция по настоящему изобретению также включает один или более фармацевтически приемлемых носителей, эксципиентов, адъювантов или разбавителей. Фразу "фармацевтически приемлемый" используют в данном описании для ссылки на те соединения, вещества, композиции и/или лекарственные формы, которые, по результатам тщательной медицинской оценки, подходят для использования в контакте с тканями человека, или возможно животного, не вызывая излишнюю токсичность, раздражение, аллергическую реакцию или другую проблему или осложнение, соизмеримо разумному соотношению польза/риск.
Когда терапевтические пептиды по изобретению изготавливают для перорального введения, их как правило объединяют с фармацевтически приемлемым носителем, разбавителем или эксципиентом с образованием фармацевтического препарата или стандартной лекарственной формы. Для перорального введения пептиды могут быть представлены в форме порошка, гранулярного образования, раствора, суспензии, эмульсии или в природном или синтетическом полимере или смоле для всасывания активных ингредиентов из жевательной резинки. Активные пептиды также могут быть представлены в виде болюса, электуария или пасты. Перорально вводимые терапевтические пептиды по изобретению также могут быть приготовлены в виде препарата с непрерывным высвобождением, например, пептиды могут быть покрыты оболочкой, инкапсулированы в микрокапсулы или иным образом помещены в устройство для непрерывной доставки. Суммарное содержание активных ингредиентов в таких препаратах составляет от 0,1 до 99,9% по массе препарата.
Таким образом, одна или более подходящих стандартных лекарственных форм, содержащих терапевтические пептиды по изобретению, могут быть введены различными путями, включая пероральный, парентеральный (в том числе подкожный, внутривенный, внутримышечный и внутрибрюшинный), ректальный, дермальный, трансдермальный, внутригрудинный, внутрилегочный, мукозальный, внутриглазной и интраназальный (респираторный) пути. Терапевтические пептиды также могут быть приготовлены в виде липидного препарата или для непрерывного высвобождения (например, с использованием микроинкапсулирования, см. WO 94/07529 и патент США 4962091, включенные в данное описание посредством ссылки). Когда подходит, препараты могут быть удобным образом представлены в дискретных стандартных лекарственных формах и могут быть изготовлены любым из способов, хорошо известных в области фармацевтики. Такие способы могут включать стадию смешивания терапевтического агента с жидкими носителями, твердыми матрицами, полутвердыми матрицами, тонкоизмельченными твердыми носителями или их комбинациями и затем, при необходимости, включения в форму или придания формы продукта в желаемую систему доставки.
Фармацевтические препараты, содержащие терапевтические пептиды по изобретению, могут быть изготовлены методиками, известными в данной области техники с использованием хорошо известных и легко доступных ингредиентов. Например, пептид может быть приготовлен в виде препарата с общепринятыми эксципиентами, разбавителями или носителями и преобразован в таблетки, капсулы, растворы, суспензии, порошки, аэрозоли и тому подобное. Примеры эксципиентов, разбавителей и носителей, которые являются подходящими для таких препаратов, включают буферы, а также наполнители и добавки, такие как крахмал, целлюлоза, сахара, маннит и кремниевые производные. Также могут быть включены связывающие агенты, например карбоксиметилцеллюлоза, гидроксиметилцеллюлоза, гидроксипропилметилцеллюлоза и другие производные целлюлозы, альгинаты, желатин и поливинилпирролидон. Могут быть включены увлажняющие агенты, например глицерин, разрыхлители, такие как карбонат кальция и бикарбонат натрия. Также могут быть добавлены агенты для пролонгированного растворения, например парафин. Усилители всасывания, такие как соединения четвертичного аммония, также могут быть включены. Поверхностно-активные агенты, такие как цетиловый спирт и глицеринмоностеарат, могут быть включены. Адсорбирующие носители, такие как каолин и бентонит, могут быть добавлены. Смазывающие вещества, такие как тальк, стеарат кальция и магния и твердые полиэтиленгликоли, также могут быть включены. Консерванты также могут быть добавлены. Композиции по изобретению также могут содержать загустители, такие как целлюлоза и/или производные целлюлозы. Они также могут содержать смолы, такие как ксантановая, гуаровая камедь или древесный уголь или аравийская камедь, или альтернативно, полиэтиленгликоли, бентониты и монтмориллониты и тому подобное.
Например, таблетки или каплеты, содержащие пептиды по изобретению, могут включать буферные агенты, такие как карбонат кальция, оксид магния и карбонат магния. Подходящие буферные агенты также могут включать уксусную кислоту в виде соли, лимонную кислоту в виде соли, борную кислоту в виде соли и фосфорную кислоту в виде соли. Каплеты и таблетки также могут включать неактивные ингредиенты, такие как целлюлоза, прежелатинизированный крахмал, диоксид кремния, гидроксипропилметилцеллюлоза, стеарат магния, микрокристаллическая целлюлоза, крахмал, тальк, диоксид титана, бензойная кислота, лимонная кислота, кукурузный крахмал, минеральное масло, полипропиленгликоль, фосфат натрия, стеарат цинка и тому подобное. Твердые и мягкие желатиновые капсулы, содержащие по меньшей мере один пептид по изобретению, могут содержать неактивные ингредиенты, такие как желатин, микрокристаллическая целлюлоза, лаурилсульфат натрия, крахмал, тальк и диоксид титана и тому подобное, а также жидкие носители, такие как полиэтиленгликоли (PEG) и растительное масло. Кроме того, каплеты или таблетки с энтеросолюбильным покрытием, содержащие один или более пептидов по изобретению, разрабатывают для придания устойчивости к разложению в желудке и растворения в более нейтральном и щелочном окружении дуоденальной кишки.
Терапевтические пептиды по изобретению также могут быть приготовлены в виде эликсиров или растворов для традиционного перорального введения или в виде растворов, подходящих для парентерального введения, например внутримышечным, подкожным, внутрибрюшинным или внутривенным путем. Фармацевтические препараты терапевтических пептидов по изобретению также могут приобретать форму водного или безводного раствора или дисперсии, или альтернативно, форму эмульсии или суспензии либо лечебной мази.
Таким образом, терапевтические пептиды могут быть изготовлены в виде препаратов для парентерального введения (например путем инъекции, например болюсной инъекции или непрерывной инфузии) и могут быть представлены в стандартной дозе в ампулах, предварительно заполненных шприцах, контейнерах для инфузии малого объема или в многодозовых контейнерах. Как упомянуто выше, консерванты могут быть добавлены для того, чтобы способствовать сохранению сроку годности лекарственной формы. Активные пептиды и другие ингредиенты могут образовывать суспензии, растворы или эмульсии в масляных или водных носителях и могут содержать агенты для приготовления препаратов, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активные пептиды и другие ингредиенты могут находиться в форме порошка, полученного асептическим выделением стерильного твердого вещества или лиофилизацией из раствора для разведения подходящим носителем, например стерильной апирогенной водой, перед использованием.
Возможно добавлять при необходимости адъювант, выбранный из антиоксидантов, поверхностно-активных веществ, других консервантов, пленкообразующих, кератолитических или комедолитических агентов, отдушек, корригентов и красителей. Могут быть добавлены антиоксиданты, такие как трет-бутилгидрохинон, бутилированный гидроксианизол, бутилированный гидрокситолуол и [альфа]-токоферол и его производные.
Эти препараты могут содержать фармацевтически приемлемые носители, наполнители и адъюванты, которые хорошо известны в данной области техники. Например, возможно приготовить растворы с использованием одного или более органических растворителей, которые приемлемы с физиологической точки зрения, выбранных, помимо воды, из растворителей, таких как ацетон, уксусная кислота, этанол, изопропиловый спирт, диметилсульфоксид, гликолевые эфиры, такие как продукты, продаваемые под маркой "Dowanol", полигликоли и полиэтиленгликоли, С1-С4алкиловые эфиры короткоцепочечных кислот, этил- и изопропиллактат, триглицериды жирных кислот, такие как продукты, продаваемые под маркой "Miglyol", изопропилмиристат, животные, минеральные и растительные масла и полисилоксаны.
Предпочтительно композиция находится в форме фармацевтического препарата терапевтических пептидов по изобретению и может также принимать форму растворителя или разбавителя, содержащего пептид. Растворители или разбавители могут включать кислые растворы, диметилсульфон, N-(2-меркаптопропионил)глицин, 2-н-нонил-1,3-диоксолан и этиловый спирт.
Предпочтительно растворитель/разбавитель представляет собой кислый растворитель, например уксусную кислоту, лимонную кислоту, борную кислоту, молочную кислоту, пропионовую кислоту, фосфорную кислоту, бензойную кислоту, масляную кислоту, малеиновую кислоту, малоновую кислоту, щавелевую кислоту, янтарную кислоту или винную кислоту.
Фармацевтические препараты по настоящему изобретению могут включать в качестве возможных ингредиентов фармацевтически приемлемые носители, разбавители, солюбилизаторы или эмульгаторы и соли доступного в данной области техники типа. Примеры таких веществ включают обычные солевые растворы, такие как физиологически забуференные солевые растворы и вода. Конкретные неограничивающие примеры носителей и/или разбавителей, которые являются полезными в фармацевтических препаратах по настоящему изобретению, включают воду и физиологически приемлемые забуференные солевые растворы, такие как забуференные фосфатом физиологические растворы с рН 7,0-8,0.
Более предпочтительно растворитель представляет собой раствор уксусной кислоты. Растворитель, например раствор уксусной кислоты, может присутствовать в композиции в концентрации менее 1%, 0,5%, 0,25%, 0,1%, 0,05% или 0,01% кислоты, например уксусной кислоты.
Композиция по настоящему изобретению может содержать один или более дополнительных противомикробных агентов. В частности, композиция по настоящему изобретению может содержать один или более дополнительных антибактериальных агентов.
Также предусмотрены комбинированные продукты, которые включают один или более пептидов по настоящему изобретению и один или более других противомикробных, в частности один или более других антибактериальных агентов. Композиция по настоящему изобретению может содержать один или более из цистеамина (NM001), полиаргинина и полилизина, например гидробромид поли-1-лизина 10-20 кДа (NP108), гидрохлорид поли-1-лизина 15-30 кДа (NP101) и гидрохлорид поли-1-аргинина 5-15 кДа (NP121).
Дополнительно, пептиды хорошо подходят для приготовления лекарственных форм с непрерывным высвобождением и тому подобного. Препараты могут быть составлены таким образом, чтобы высвобождать активный пептид, например, в конкретной части кишечника или дыхательных путей, возможно в течение какого-либо периода времени. Покрытия, оболочки и защитные матрицы могут быть изготовлены, например, из полимерных веществ, таких как полилактид-гликоляты, липосомы, микроэмульсии, микрочастицы, наночастицы или воски. Такие покрытия, оболочки и защитные матрицы полезны для покрытия медицинских устройств, например стентов, катетеров, аппаратов для перитонеального диализа, дренажных устройств и тому подобного.
Для местного введения активные агенты могут быть изготовлены как известно в данной области техники для непосредственного нанесения на область-мишень. Формы, удовлетворяющие требованиям для местного применения, принимают форму, например, кремов, молочка, гелей, порошков, дисперсии или микроэмульсий, лосьонов, имеющих большую или меньшую степень густоты, пропитанных тампонов, мазей или полосок, аэрозольных препаратов (например спреев или пенок), мыла, детергентов, лосьонов или кусков мыла. Другие традиционные формы для этой цели включают раневые повязки, бандажи с покрытием или другие полимерные оболочки, мази, кремы, лосьоны, пасты, гели, спреи и аэрозоли. Таким образом, терапевтические пептиды по изобретению могут быть доставлены посредством пластырей или бандажей для кожного введения. Альтернативно, пептид может быть изготовлен в виде препарата в виде части адгезивного полимера, такого как полиакрилата или сополимера акрилата/винилацетата. Для долговременного применения может быть желательным использование микропористых и/или воздухопроницаемых пластиковых основ, так чтобы набухание и мацерация кожи могли быть сведены к минимуму. Обратный слой может быть любой приемлемой толщины, которая будет давать желаемые защитные и поддерживающие свойства. Подходящая толщина в общем составляет от примерно 10 до примерно 200 микрон.
Фармацевтические препараты для местного введения могут содержать, например, физиологически приемлемый забуференный солевой раствор, содержащий от примерно 0,001 мкг/мл до примерно 100 мкг/мл, например от 0,1 мкг/мл до 10 мкг/мл, одного или более пептидов по настоящему изобретению, предназначенных для использования по показанию, которое подлежит лечению.
Мази и кремы могут, например, быть изготовлены с водной или масляной основой с добавлением подходящих загустителей и/или желирующих агентов. Лосьоны могут быть изготовлены с водной или масляной основой и в общем содержат также один или более эмульгаторов, стабилизаторов, диспергирующих агентов, суспендирующих агентов, загустителей или красителей. Активные пептиды могут также быть доставлены посредством ионофореза, например, как описано в патентах США 4140122, 4383529 или 4051842, которые включены в данное описание посредством ссылки. Процент по массе терапевтического агента по изобретению, присутствующего в препарате для местного введения, зависит от ряда факторов, но в общем составляет от 0,01% до 95% от общей массы препарата и типично 0,1-85% по массе.
Капли, такие как глазные капли или капли в нос, могут быть приготовлены с одним или более терапевтическими пептидами в водной или неводной основе, также содержащей один или более диспергирующих агентов, солюбилизирующих агентов или суспендирующих агентов. Жидкие спреи можно нагнетать или удобным образом доставлять из упаковок под давлением. Капли могут быть доставлены посредством простого флакона-капельницы с наконечником, посредством флакона, приготовленного с возможностью доставки жидкого содержимого капельным путем или посредством укупоренного контейнера специальной формы.
Терапевтический пептид также может быть изготовлен в виде препарата для местного введения в полость рта или горла. Например, активные ингредиенты могут быть изготовлены в виде лепешки, дополнительно содержащей вкусоароматическую основу, обычно сахарозу и аравийскую камедь или трагакант; пастилок, содержащих композицию в инертной основе, такой как желатин и глицерин или сахароза и аравийская камедь; и жидкостей для полоскания рта, содержащих композицию по настоящему изобретению в подходящем жидком носителе. Пептиды по изобретению также могут быть введены в дыхательные пути. Таким образом, в настоящем изобретении также предложены аэрозольные фармацевтические препараты и лекарственные формы для использования в способах по изобретению. В общем, такие лекарственные формы содержат количество по меньшей мере одного из агентов по изобретению, эффективное для лечения или предупреждения клинических симптомов конкретной инфекции, показания или заболевания. Любое статистически значимое ослабление одного или более симптомов инфекции, показания или заболевания, которое подвергали лечению согласно способу по настоящему изобретению, считается лечением такой инфекции, показания или заболевания в объеме данного изобретения.
Альтернативно, для введения путем ингаляции или инсуффляции, композиция может принимать форму сухого порошка, например, порошковую смесь терапевтического агента и подходящей порошковой основы, такой как лактоза или крахмал. Порошковая композиция может быть представлена в стандартной лекарственной форме, например, в капсулах или картриджах, или, например, желатиновых или блистерных упаковках, из которых порошок может быть введен с помощью ингалятора, инсуффлятора или дозирующего ингалятора (см., например, дозирующий ингалятор под давлением (MDI) и сухой порошковый ингалятор, раскрытые в Newinan, S. P. in Aerosols and the Lung, Clarke, S. W. and Davia, D. eds., pp.197-224, Butterworths, London, England, 1984).
Терапевтические пептиды по настоящему изобретению также могут быть введены в водном растворе при введении в форме аэрозоля или ингаляционной форме. Таким образом, другие аэрозольные фармацевтические препараты могут содержать, например, физиологически приемлемый забуференный физиологический раствор, содержащий от примерно 0,001 мкг/мл до примерно 100 мкг/мл одного или более пептидов по настоящему изобретению, специфичных для показания или заболевания, подлежащего лечению. Сухой аэрозоль в форме тонкоизмельченных твердых частиц пептида или нуклеиновой кислоты, которые не растворены или не суспендированы в жидкости, также являются полезными в практическом выполнении настоящего изобретения. Пептиды по настоящему изобретению могут быть изготовлены в виде присыпок и содержат тонкоизмельченные частицы, имеющие средний размер частиц от примерно 1 до 5 мкм, альтернативно от 2 до 3 мкм. Тонкоизмельченные частицы могут быть получены путем пульверизации и фракционирования с использованием методик, хорошо известных в данной области техники. Частицы могут быть введены путем ингаляции предварительно определенного количества тонкоизмельченного материала, который может находиться в форме порошка. Понятно, что единичное содержание активного ингредиента или ингредиентов, содержащихся в индивидуальной аэрозольной дозе каждой лекарственной формы, не обязательно само по себе составляет эффективное количество для лечения конкретной инфекции, показания или заболевания, поскольку необходимое эффективное количество может быть достигнуто путем введения множества единиц дозировки. Кроме того, эффективное количество может быть достигнуто с использованием меньшего количество, чем доза в лекарственной форме, либо индивидуально, либо в ряде введений.
Для введения в верхние дыхательные пути (назальная область) или нижние дыхательные пути посредством ингаляции терапевтические пептиды по изобретению удобным образом доставляют из небулайзера или упаковки под давлением или другими традиционными средствами доставки аэрозольного спрея. Упаковки по давлением могут содержать подходящий пропеллент, такой как дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, диоксид углерода или другой подходящий газ. В случае аэрозоля под давлением единица дозировки может быть определена путем предложения клапана для доставки отмеренного количества. Небулайзеры включают раскрытые в патентах США 4624251, 3703173, 3561444 и 4635627, которые включены в данное описание путем ссылки, но не ограничены ими. Системы аэрозольной доставки этого типа, раскрытого здесь, доступны от ряда коммерческих источников, включая Fisons Corporation (Bedford, Mass.), Schering Corp. (Kenilworth, NJ) и American Pharmoseal Co. (Valencia, CA). Для интраназального введения терапевтический агент также может быть введен посредством капель в нос, жидкого спрея, например посредством распылителя в пластиковом флаконе или дозирующего ингалятора. Типичные распылители представляют собой Mistometer (Wintrop) и Medihaler (Riker).
Кроме того, активные ингредиенты также могут быть использованы в комбинации с другими терапевтическими агентами, например, обезболивающими агентами, противовоспалительными агентами антигистаминными средствами, бронходилататорами и тому подобное, независимо от того, используют ли их для описанных состояний или какого-либо другого состояния.
Противомикробное применение
Согласно еще одному аспекту настоящего изобретения предложен пептид, как он описан выше, для применения в терапии или профилактике.
Согласно еще одному аспекту настоящего изобретения предложен пептид, как он описан выше, для применения в лечении или предупреждении микробной инфекции или состояния. Как правило, пептид по настоящему изобретению упакован и представлен для применения в лечении или предупреждении микробной инфекции или состояния.
Согласно еще одному аспекту настоящего изобретения предложен способ лечения или предупреждения микробной инфекции или состояния, включающий стадию введения пациенту, нуждающемуся в этом, пептида по настоящему изобретению.
Пептиды по изобретению полезны среди прочего в качестве противомикробных пептидов, например, против бактерий, грибов, дрожжей, простейших и вирусов. Термин "противомикробный пептид" может быть использован здесь для определения любого пептида, который обладает микробицидной и/или микробистатической активностью и охватывает, необязательно, любой пептид, описанный как обладающий антибактериальными, противогрибковыми, антимикотическими, противопаразитарными, противопротозойными, противовирусными, противоинфекционными, антиинфективными и/или обеззараживающими, альгицидными, амебецидными, микробицидными, бактерицидными, фунгицидными, паразитицидными, протозоацидными, антипротозойными свойствами.
Под "микробной инфекцией" понимают инфекцию, вызываемую бактериальным, паразитическим, протозойным, вирусным или грибковым патогеном. "Патоген" в общем определен как любой организм, вызывающий заболевание. В частности, пептиды по настоящему изобретению полезны в качестве антибактериальных пептидов.
Таким образом, в изобретении дополнительно предложен пептид согласно изобретению для применения в качестве лекарственного средства. Пептиды по изобретению могут применяться в качестве противомикробных агентов как in vivo, in vitro, так и ex vivo.
Бактериальный патоген может иметь происхождение из бактериальных видов, выбранных из группы, состоящей из: Staphylococcus spp., например Staphylococcus aureus, Staphylococcus epidermidis; Enterococcus spp., например Enterococcus faecalis, Enterococcus faecium; Streptococcus pyogenes; Listeria spp.; Pseudomonas spp., например Pseudomonas aeruginosa; Mycobacterium spp., например Mycobacterium tuberculosis; Enterobacter spp.; Klebsiella spp., например Klebsiella pneumonia; Campylobacter spp.; Salmonella spp.; Streptococcus spp., например Streptococcus Группы А или В, Streptococcus pneumoniae; Stenotrophomonas spp., Stenotrophomonas maltophilia; Helicobacter spp., например Helicobacter pylori; Neisseria spp., например Neisseha gonorrhea, Neisseria meningitidis; Borrelia burgdorferi; Shigella spp., например Shigella flexneri; Escherichia go//; Haemophilus spp., например Haemophilus influenzae; Chlamydia spp., например Chlamydia trachomatis, Chlamydia pneumoniae, Chlamydia psittaci; Francisella fularensis; Bacillus spp., например Bacillus anthracis; Clostridia spp., например Clostridium botulinum, Closthdium perfringens, Clostridium difficile; Yersinia spp., например Yersinia pestis; Treponema spp.; Burkholderia spp.; например Burkholderia mallei, B. cepacia, комплекс В. cepacia и б. pseudomallei, Acinetobacterspp., например A. baumanii и A. calcoaceticus; Achromobacter spp., Achromobacter xylosoxidans.
Бактериальный патоген может представлять собой грамотрицательную бактерию или грамположительную бактерию. Грамотрицательная бактерия может быть выбрана из группы, состоящей из Pseudomonas spp.(в частности Pseudomonas aeruginosa); Burkholderia spp (в частности Burkholderia cepacia); Acinetobacterspp., например A. baumanii and A. calcoaceticus; Streptococcus spp., например Streptococcus Группы А или В, Streptococcus pneumoniae; Stenotrophomonas spp., Stenotrophomonas maltophilia и Achromobacter spp., например Achromobacter xylosoxidans.
Грамположительная бактерия может быть выбрана из группы, состоящей из Staphylococcus spp.(в частности Staphylococcus aureus и Staphylococcus epidermidis); Escherichia соli; Closthdia spp., например Clostridium botulinum, Clostridium perfringens, Clostridium difficile; и Enterococcus spp., например Enterococcus faecalis, Enterococcus faecium.
Бактериальный патоген может быть выбран из группы, состоящей из Staphylococcus spp.(в частности Staphylococcus aureus и Staphylococcus epidermidis); Pseudomonas spp.(в частности Pseudomonas aeruginosa); Burkholderia spp (в частности Burkholderia cepacia), Escherichia coir, Acinetobacter spp., например A. baumanii и A. calcoaceticus; Clostridia spp., например Clostridium botulinum, Clostridium perfringens, Clostridium difficile; Enterococcus spp., например Enterococcus faecalis, Enterococcus faecium; Streptococcus spp., например Streptococcus Группы А или В, Streptococcus pneumoniae; Stenotrophomonas spp., Stenotrophomonas maltophilia и Achromobacter spp., Achromobacter xylosoxidans.
Бактериальный патоген может быть выбран из группы, состоящей из Staphylococcus spp.(в частности Staphylococcus aureus и Staphylococcus epidermidis) и Pseudomonas spp. (в частности Pseudomonas aeruginosa).
Микробное заболевание или состояние/инфекция могут быть выбраны из группы, состоящей из нарывов, фурункулов, целлюлита, импетиго, внутрибольничных инфекций, бактериемии, пневмонии, остеомиелита, эндокардита, менингита, абсцессов, муковисцидоза (в частности легочных инфекций у пациентов с муковисцидозом), желудочно-кишечных инфекций, инфекций мочеполовой системы, септицемии, фарингита, некротизирующего фасцита, острого гломерулонефрита, среднего отита, ран, сибирской язвы, энцефалита, дифтерии, газовой гангрены, ботулизма и столбняка.
Альтернативно, пептиды по настоящему изобретению могут быть использованы для лечения или облегчения заболевания или состояния, выбранного из группы, состоящей из гонореи, менингита, пневмонии, среднего отита, остеомиелита, муковисцидоза (в частности легочных инфекций у пациентов с муковисцидозом), инфекций мочеполовой системы, перитонита, конъюнктивита, септицемии, венерического. заболевания, бактериемии, внутрибольничных инфекций, дизентерии, желудочно-кишечных инфекций, брюшного тифа, чумной пневмонии, ран, холеры, инфекций почек, болезни Флетчера, конъюнктивита, кашля, туляремии, бруцеллеза, легионеллеза, язвенной болезни, тифа, фарингита.
Заболевание или состояние, подлежащее лечению, может обеспечиваться или вызываться оппортунистическим бактериальным инфицированием, включая заболевания или состояния, выбранные из группы, состоящей из инфекций мочевыводящей системы, инфекций дыхательных путей, дерматита, инфекций мягких тканей, бактериемии, инфекций костей и суставов, желудочно-кишечных инфекций и системных бактериальных инфекций у пациентов с тяжелыми ожогами, раком, муковисцидозом или СПИД.
Пептиды по настоящему изобретению могут иметь минимальную ингибирующую концентрацию (МIС) 32 мкг/мл или менее против грамположительных микробных патогенов, в частности бактериальных патогенов. В общем, пептиды имеют МIС 20 мкг/мл или менее, типично 16 мкг/мл или менее, предпочтительно 10 мкг/мл или менее против грамположительных микробных патогенов. Преимущественно, пептиды по настоящему изобретению имеют MIC около 8 мкг/мл против грамположительных микробных патогенов, в частности грамположительных бактериальных патогенов.
Пептиды по настоящему изобретению могут иметь минимальную ингибирующую концентрацию (MIC) 70 мкг/мл или менее против грамотрицательных микробных патогенов, в частности бактериальных патогенов. В общем, пептиды имеют MIC 50 мкг/мл или менее, типично 40 мкг/мл или менее, предпочтительно 30 мкг/мл или менее против грамотрицательных микробных патогенов. Преимущественно, пептиды по настоящему изобретению имеют MIC менее 30 мкг/мл против грамотрицательных микробных патогенов, в частности грамотрицательных бактериальных патогенов.
MIC как правило измеряют при рН около 7.
Пептиды по настоящему изобретению могут иметь минимальную бактерицидную концентрацию (МВС) 250 мкг/мл или менее против грамотрицательных и грамположительных бактериальных патогенов. В общем, пептиды имеют MIC 125 мкг/мл или менее, типично 100 мкг/мл или менее, предпочтительно 60 мкг/мл или менее против грамотрицательных и грамположительных бактериальных патогенов. Преимущественно, пептиды по настоящему изобретению имеют МIС менее 40 мкг/мл против грамотрицательных и грамположительных бактериальных патогенов.
Вирусный патоген может иметь происхождение из вируса, выбранного из группы, состоящей из: вируса иммунодефицита человека (HTV 1 и 2); вируса Т-клеточного лейкоза человека (HTLV 1 и 2); вируса Эбола; вируса папилломы человека (например HPV-2, HPV-5, HPV-8, HPV-16, HPV-18, HPV-31, HPV-33, HPV-52, HPV-54 и HPV-56); паповавируса; риновируса; вируса полиомиелита; вируса герпеса; аденовируса; вируса Эпштейн-Барра; вируса гриппа, вирусов гепатита В и С, вируса оспы, ротавируса или коронавируса атипичной пневмонии (SARS).
Патоген паразитов может иметь происхождение из группы, состоящей из Trypanosoma spp.(Trypanosoma cruzi, Trypansosoma brucei), Leishmania spp., Giardia spp., Trichomonas spp., Entamoeba spp., Naegleria spp., Acanthamoeba spp., Schistosoma spp., Plasmodium spp., Crytosporidium spp., Isospora spp., Balantidium spp., Loa Loa, Ascaris lumbricoides, Dirofilaria immitis, Toxoplasma ssp., например Toxoplasma gondii. Грибковый патоген может иметь происхождение из грибкового патогена, который является представителем рода Candida spp., (например С.albicans), Epidermophyton spp., Exophiala spp., Microsporum spp., Trichophyton spp., (например Г. rubrum и Т. interdigitale), Tinea spp., Aspergillus spp., Blastomyces spp., Blastoschizomyces spp., Coccidioides spp., Cryptococcus spp., Histoplasma spp., Paracoccidiomyces spp., Sporothrix spp., Absidia spp., Cladophialophora spp., Fonsecaea spp., Phialophora spp., Lacazia spp., Arthrographis spp., Acremonium spp., Actinomadura spp., Apophysomyces spp., Emmonsia spp., Basidiobolus spp., Beauveria spp., Chrysosporium spp., Conidiobolus spp., Cunninghamella spp., Fusarium spp., Geotrichum spp., Graphium spp., Leptosphaeria spp., Malassezia spp., Mucorspp., Neotestudina spp., Nocardia spp., Nocardiopsis spp., Paecilomyces spp., Phoma spp., Piedraia spp., Pneumocystis spp., Pseudallescheria spp., Pyrenochaeta spp., Rhizomucor spp., Rhizopus spp., Rhodotorula spp., Saccharomyces spp., Scedosporium spp., Scopulariopsis spp., Sporobolomyces spp., Syncephalastrum spp., Trichoderma spp., Trichosporon spp., Ulocladium spp., Ustilago spp., Verticillium spp., Wangiella spp.
Микробная инфекция может быть системной, местной, подкожной, кожной или грибковой инфекцией слизистых оболочек.
Грибковые инфекции могут быть классифицированы как системные, означая, что инфекция является глубокой и затрагивает внутренние органы или перенесена в кровь, или местные (дерматофитные), означая, что инфекция является поверхностной и существует на коже. Дополнительно, дрожжевые инфекции могут воздействовать на слизистые оболочки организма. Дрожжевые инфекции также могут быть системными (например, кандидемия и другие часто фатальные состояния). Грибковые инфекции на коже обычно лечат с использованием кремов или мазей (местные противогрибковые лекарственные средства). Однако, системные инфекции, дрожжевые инфекции или местные инфекции, которые не проходят после лечения кремами или мазями, могут требовать лечения системными противогрибковыми лекарственными средствами (перорально или внутривенно). Эти лекарственные средства используют, например, для лечения распространенных грибковых инфекций, таких как лишай (дерматомикоз), который возникает на коже, или кандидоз (дрожжевая инфекция, также известная как молочница), который возникает в горле, влагалище или других частях тела. Системные противогрибковые лекарственные средства также используют для лечения других глубоких грибковых инфекций, таких как гистоплазмоз, бластомикоз и аспергиллез, которые могут воздействовать на легкие и другие органы. Иногда их используют для предупреждения или лечения грибковых инфекций у людей с ослабленной иммунной системой, таких как пациенты с трансплантированными костным мозгом или органами и люди с ВИЧ-СПИД.
Местные или дерматофитные грибковые инфекции, хотя обычно и не являются причиной смерти или тяжелого заболевания, широко распространены и являются важными с экономической точки зрения, так как их лечение может быть дорогостоящим. Местные или поверхностные грибковые инфекции могут включать те, которые возникают на коже, пластинках, роговом слое эпидермиса, ногтях и волосах. Кожные инфекции являются инфекциями на коже, ногтях пальцев рук и ног.
В предпочтительном аспекте по изобретению грибковая инфекция представляет собой онихомикоз. Онихомикоз может быть вызван грибком из рода Trichophyton spp., но не ограничен им, например грибок может представлять собой Trichophyton interdigitale или Trichophyton rubrum.
Термин "онихомикоз" включает дистально-латеральную подногтевую, поверхностную белую, проксимальную белую подногтевую, вторичную дистрофическую, первичную дистрофическую формы, эндоникс-онихомикоз, кандидозную форму (например онихолизис и хроническое заболевание с поражением кожи и слизистых) онихомикоза, но не ограничен ими. Было показано, что онихомикоз представляет значительный фактор риска для более тяжелых клинических осложнений, таких как острый бактериальный целлюлит руки/ноги и другие вторичные бактериальные инфекции, поэтому изобретение охватывает лечение этих инфекций.
Термин "лечение" относится к эффектам описанных здесь пептидов, которые обеспечивают пользу пациентам, страдающим (инфекционным) заболеванием, включая улучшение состояния пациента или задержку прогрессирования заболевания.
Пептиды по изобретению, включая их соли, вводят таким образом, чтобы достичь ослабления по меньшей мере одного симптома, ассоциированного с инфекцией, показанием или заболеванием, или уменьшения количества антитела, ассоциированного с показанием или заболеванием.
Пептиды по изобретению также могут быть полезны в лечении или предупреждении, среди прочего, ран, язв и поражений, например, кожных ран, таких как порезы или ожоги, и ассоциированных с ними состояний.
Термин "лечение" относится к эффектам описанных здесь пептидов, которые обеспечивают пользу пациентам, страдающим (инфекционным) заболеванием, включая улучшение состояния пациента или задержку прогрессирования заболевания.
Как используют здесь, "лечение раны" может включать излечение раны и ассоциированных состояний и терапию, которая стимулирует, усиливает или ускоряет заживление тканей и включает послеоперационные рубцы, ожоги, псориаз, ускорение ремоделирования тканей, например, после косметической операции и трансплантации органов.
Таким образом, в дополнительном аспекте изобретения предложен субстрат, на который наносят пептид по изобретению или к которому его прикрепляют. Предпочтительно субстрат является подходящим для нанесения на раны или для доставки к раневым участкам. Предпочтительно субстрат обеспечивает перенос пептидов по изобретению с субстрата на раневое ложе для достижения их антибиотического эффекта. Субстрат может представлять собой повязку, например, повязку на рану. Повязка может содержать тканевой материал, или она может представлять собой материал на основе коллагена.
Пептиды по изобретению также могут найти применение в качестве или в виде дезинфицирующего средства, в данном контексте, пептид или фармацевтические композиции по изобретению можно наносить, отдельно или в комбинации с другими дезинфицирующими агентами, на подлежащую обработке поверхность. Как используют здесь, "подлежащая обработке поверхность" может представлять собой субстрат, как определено здесь, или медицинское устройство. В дополнительном аспекте изобретения предложен способ лечения или предупреждения микробной инфекции у субъекта, включающий введение указанному субъекту терапевтически эффективного количества пептида по изобретению.
Млекопитающие, птицы и другие животные могут быть обработаны пептидами, композициями или способами, описанными здесь. Такие млекопитающие и птицы включают людей, собак, кошек и сельскохозяйственных животных, таких как лошади, крупный рогатый скот, овцы, козы, куры и индейки и тому подобное. Кроме того, растения также могут быть обработаны пептидами, композициями или способами по изобретению.
Когда субъект представляет собой животное, пептиды по изобретению могут быть введены местно или системно. В частности, пептиды можно наносить на тело животного или ногтеподобные структуры, включая, но не ограничиваясь ими, копыта, когти и ноги.
Пептиды по настоящему изобретению в общем нетоксичны и, как правило, хорошо переносятся млекопитающими, птицами, животными и растениями. Как правило, пептиды по настоящему изобретению хорошо переносятся в дозах 2-10 мг/кг или более, предпочтительно 2-6 мг/кг. Например, было обнаружено, что пептид NP432 не является летальным для мышей в дозе около 5 мг/кг.
Для достижения желаемого(ых) эффекта(ов) пептид или его вариант или их комбинация могут быть введены в виде однократной или разделенных доз, например, от по меньшей мере примерно 0,01 мг/кг до примерно 500-750 мг/кг, от по меньшей мере примерно 0,01 мг/кг до примерно 300-500 мг/кг, от по меньшей мере примерно 0,1 мг/кг до примерно 100-300 мг/кг или от по меньшей мере примерно 1 мг/кг до примерно 50-100 мг/кг массы тела или от по меньшей мере примерно 1 мг/кг до примерно 20 мг/кг массы тела, хотя другие дозировки могут давать благоприятные результаты. Вводимое количество будет варьировать в зависимости от разных факторов, включая выбранный пептид и его клинические эффекты, заболевание, масса тела, физическое состояние, состояние здоровья, возраст млекопитающего, предупреждения или лечения следует достигнуть, и является ли пептид химически модифицированным, но не ограничиваясь этим. Такие факторы могут быть легко определены лечащим специалистом исходя из эмпирических данных клинических исследований и результатов, полученных на доклинических животных моделях или других тест-системах, которые доступны в данной области техники.
Введение терапевтических агентов в соответствии с настоящим изобретением может быть осуществлено в однократной дозе, в многократных дозах, непрерывным или прерывистым образом, в зависимости, например, от физиологического состояния реципиента, является ли цель лечения терапевтической или профилактической, и других факторов, известных лечащим врачам. Введение пептидов по изобретению может быть по существу непрерывным в течение предварительно выбранного периода времени или может быть осуществлено с интервалом между дозами. Подразумевают как местное, так и системное введение.
Для получения композиции пептиды синтезируют или иным образом получают, очищают при необходимости или желании, и затем как правило лиофилизируют и стабилизируют. Пептид может быть затем отрегулирован по концентрации и возможно объединен с другими агентами. Абсолютная масса данного пептида, включенного в стандартную форму, может широко варьировать. Например, от примерно 0,01 до примерно 2 г или от примерно 0,01 до примерно 500 мг по меньшей мере одного пептида по изобретению или множества пептидов, специфичных для конкретного клеточного типа, может быть введено. Альтернативно, стандартная дозировка может варьировать от примерно 0,01 г до примерно 50 г, от примерно 0,01 г до примерно 35 г, от примерно 0,1 г до примерно 25 г, от примерно 0,5 г до примерно 12 г, от примерно 0,5 г до примерно 8 г, от примерно 0,5 г до примерно 4 г, или от примерно 0,5 г до примерно 2 г.
Суточные дозы пептидов по изобретению также могут варьировать. Такие суточные дозы могут варьировать, например, от примерно 0,001 г/сутки до примерно 100 или 50 г/сутки, от примерно 0,1 г/сутки до примерно 25 г/сутки, от примерно 0,1 г/сутки до примерно 12 г/сутки, от примерно 0,1 г/сутки до примерно 5 г/сутки, от примерно 0,1 г/сутки до примерно 2,5 г/сутки, от примерно 0,1 г/сутки до примерно 2 г/сутки, от примерно 0,5 г/сутки до примерно 8 г/сутки, от примерно 0,5 г/сутки до примерно 4 г/сутки, от примерно 0,5 г/сутки до примерно 2 г/сутки, и от примерно 0,5 г/сутки до примерно 1 г/сутки.
Синергетический эффект
Предпочтительно композиция включает один или более противомикробных агентов, которые действуют синергетически с пептидами по настоящему изобретению. Типично, синергетический эффект приводит в результате к повышенному противомикробному эффекту. В общем объединенные агенты ассоциированы с противомикробными свойствами по меньшей мере на 10% больше чем сумма противомикробных свойств этих двух или более агентов; типично по меньшей мере на 20% больше; предпочтительно по меньшей мере на 30% больше; преимущественно по меньшей мере на 50% больше чем сумма противомикробных свойств этих двух или более агентов.
Как правило, противомикробный агент представляет собой антибактериальный агент, и композиция проявляет синергетически высокий антибактериальный эффект.
Синергетически высокий антибактериальный эффект может быть выраженным в отношении одного или более из группы, состоящей из:
Staphylococcus spp., например Staphylococcus aureus, Staphylococcus epidermidis; Enterococcus spp., например Enterococcus faecalis, Enterococcus faecium; Streptococcus pyogenes; Listeria spp.; Pseudomonas spp.например Pseudomonas aeruginosa; Mycobacterium spp., например Mycobacterium tuberculosis; Enterobacter spp.; Klebsiella spp., например Klebsiella pneumonia; Campylobacterspp.; Salmonella spp.; Streptococcus spp., например Streptococcus Группы А или В, Streptococcus pneumoniae; Stenotrophomonas spp., Stenotrophomonas maltophilia; Helicobacter spp., например Helicobacter pylori;
Neisseria spp., например Neisseria gonorrhea, Neisseria meningitidis; Borrelia burgdorferi; Shigella spp., например Shigella flexneri; Escherichia со//; Haemophilus spp., например Haemophilus influenzae; Chlamydia spp., например Chlamydia trachomatis, Chlamydia pneumoniae, Chlamydia psittaci; Francisella fularensis;
Bacillus spp., например Bacillus anthracis; Clostridia spp., например Clostridium botulinum, Clostridium perfringens, Clostridium difficile; Yersinia spp., например Yersinia pestis; Treponema spp.; Burkholderia spp.; например Burkholderia mallei, B. cepacia, комплекс б. cepacia и В. pseudomallei, Acinetobacter spp., например A. baumanii и A. calcoaceticus; Achromobacterspp., Achromobacter xylosoxidans.
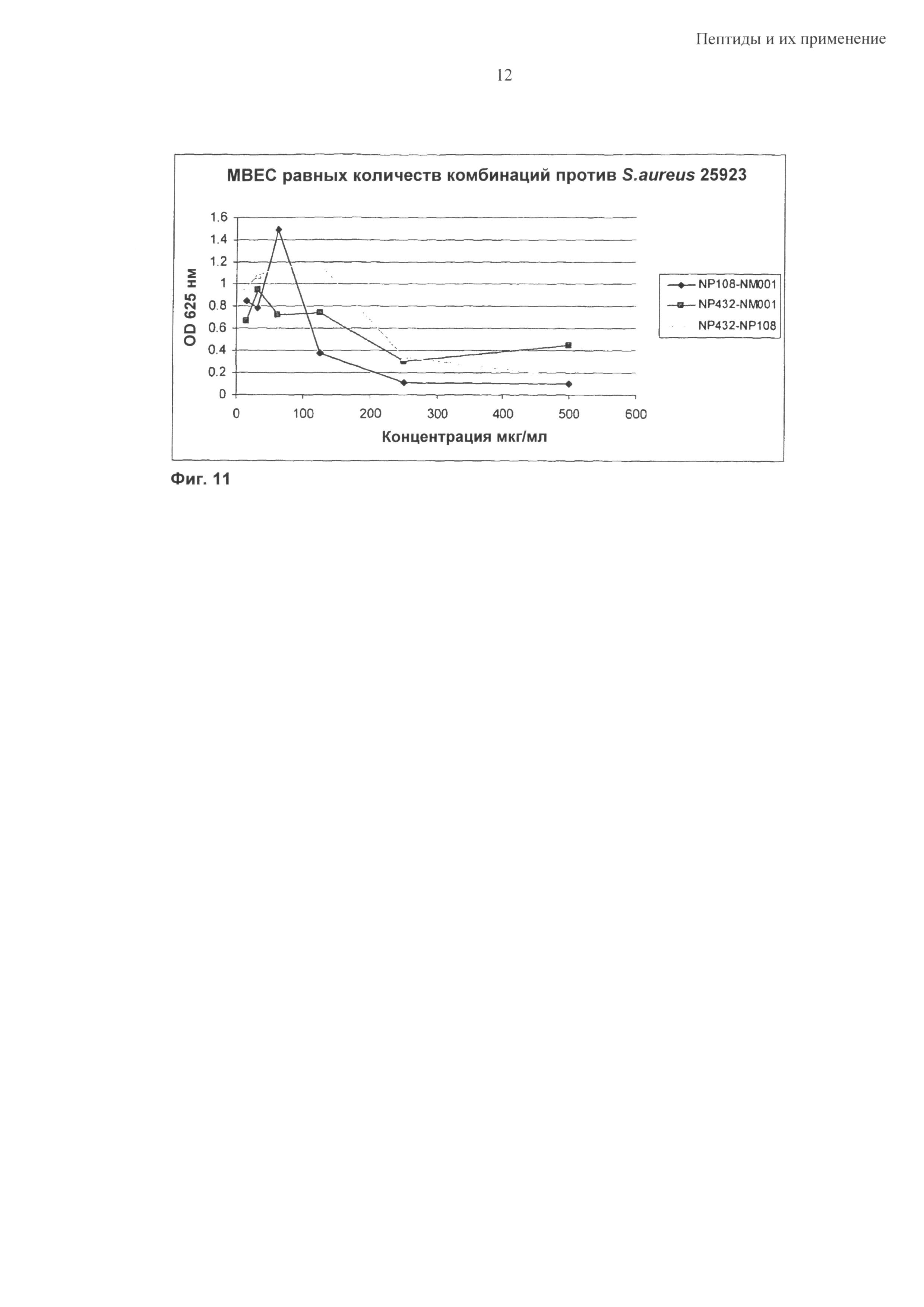
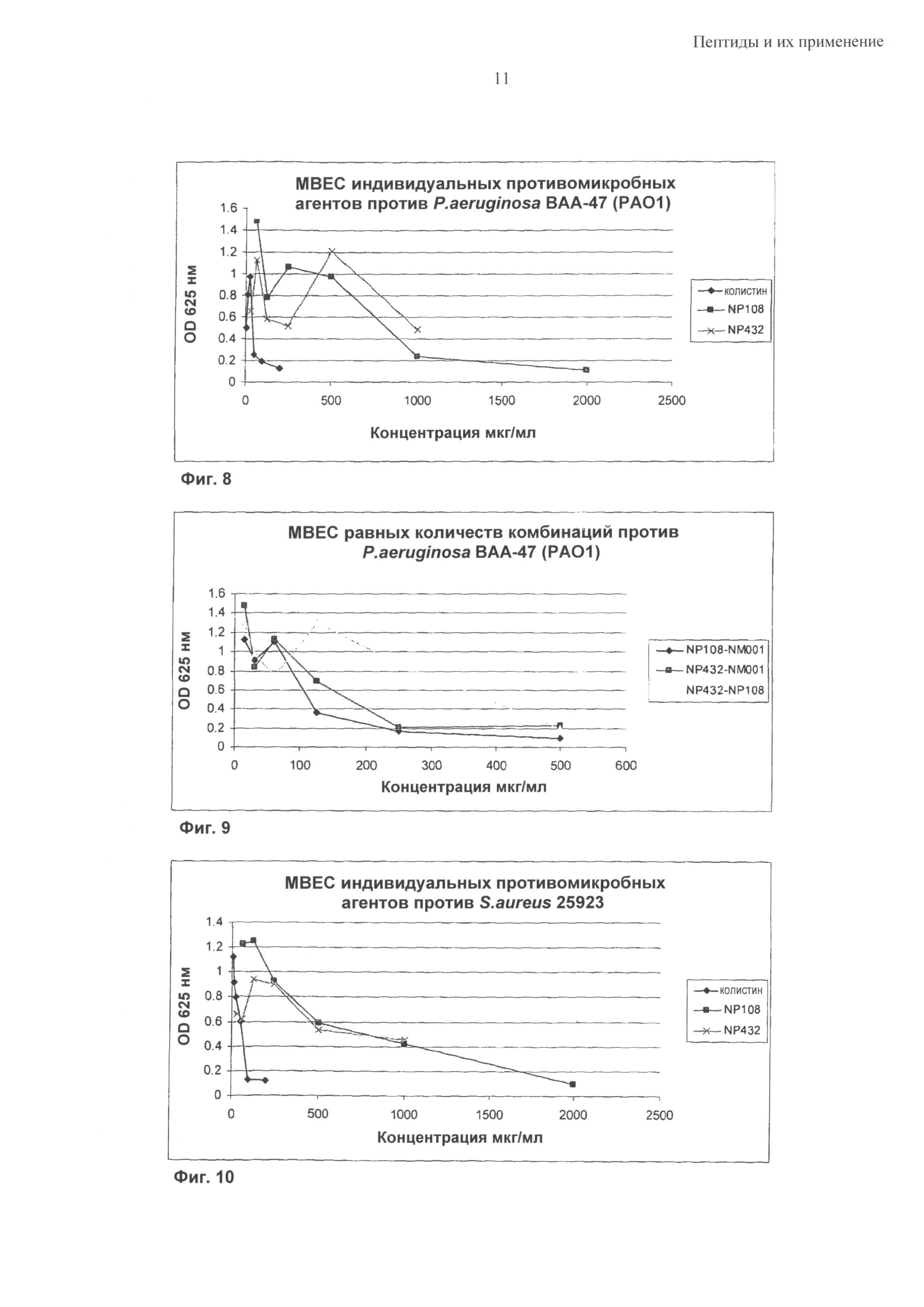
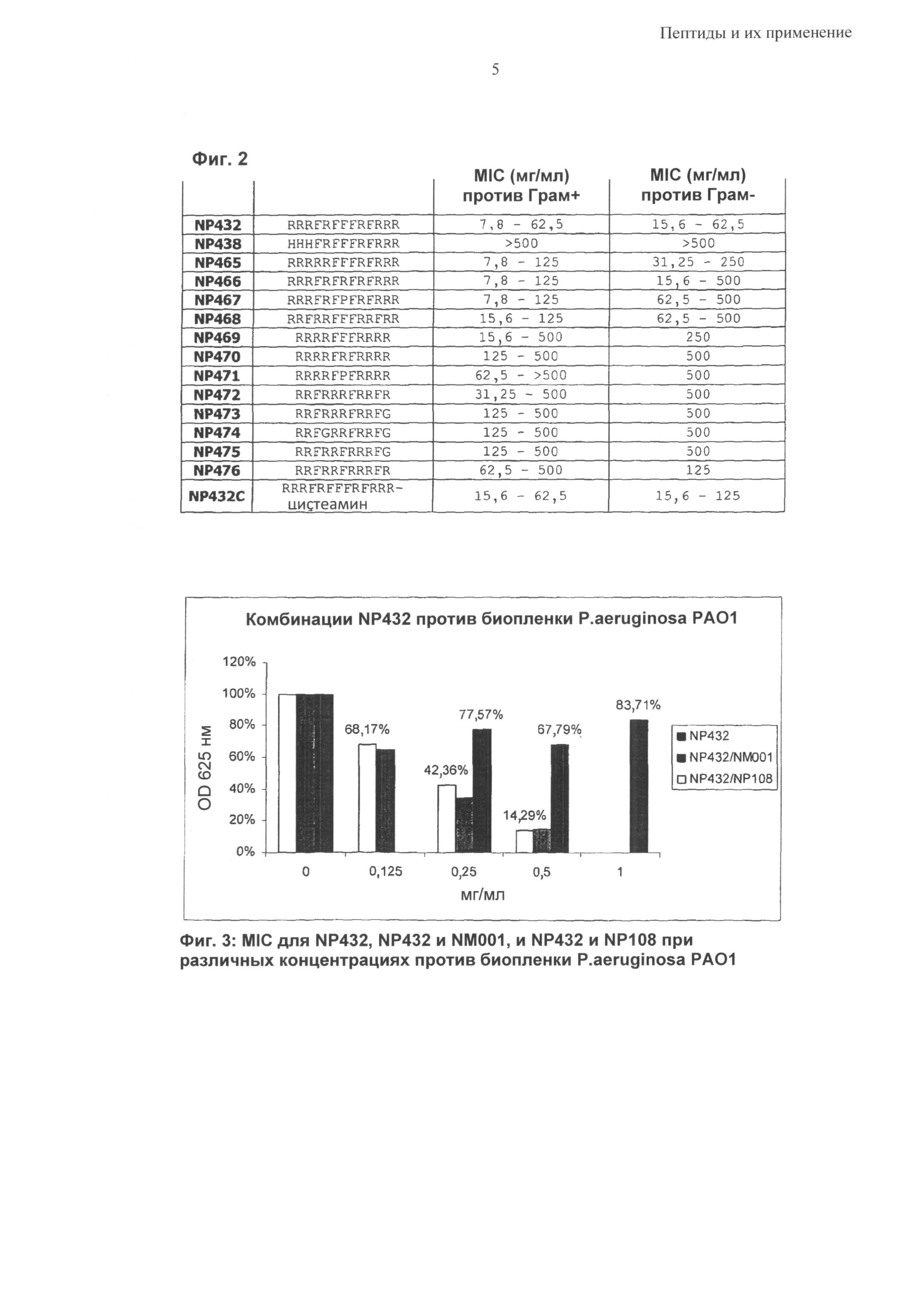
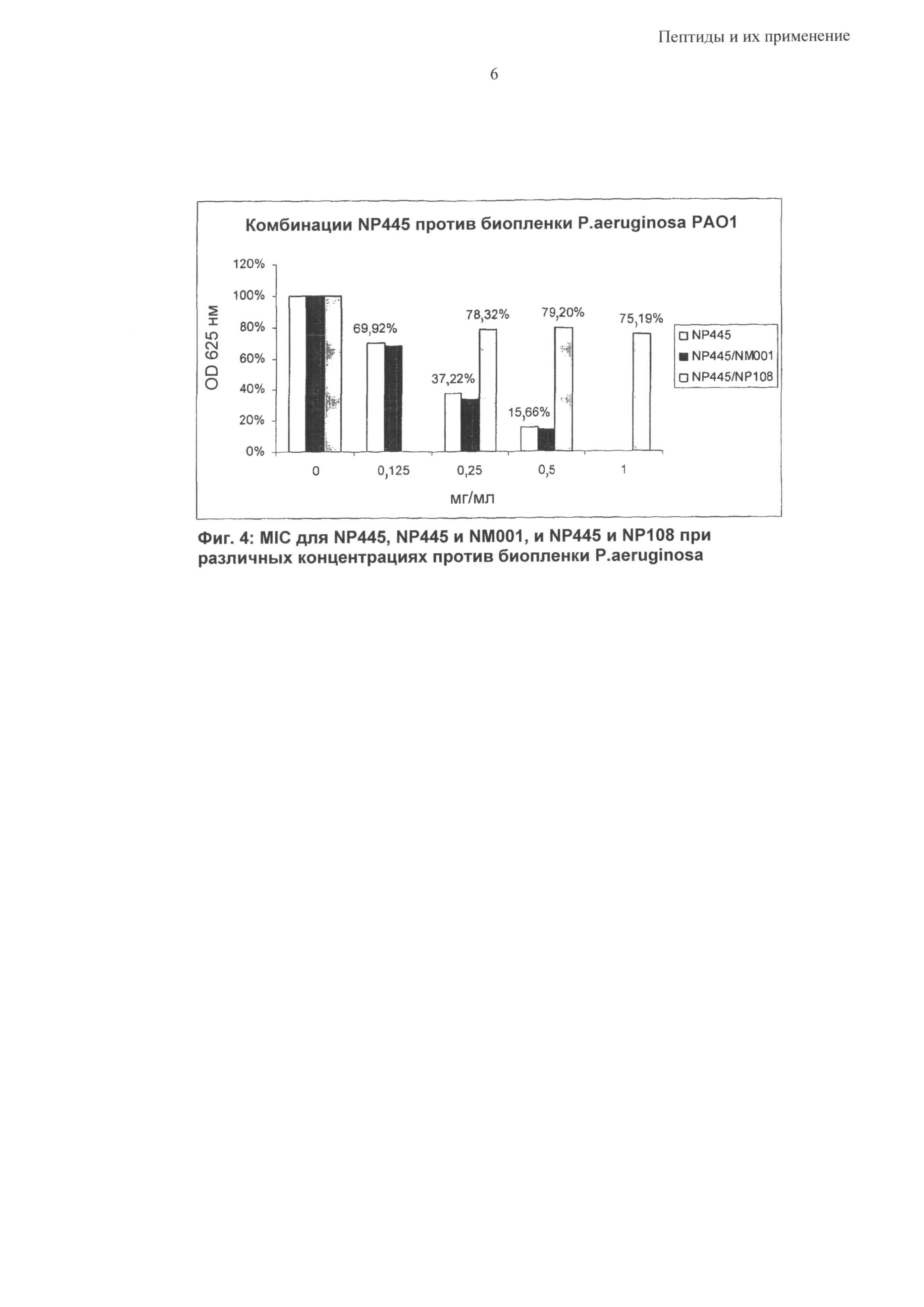
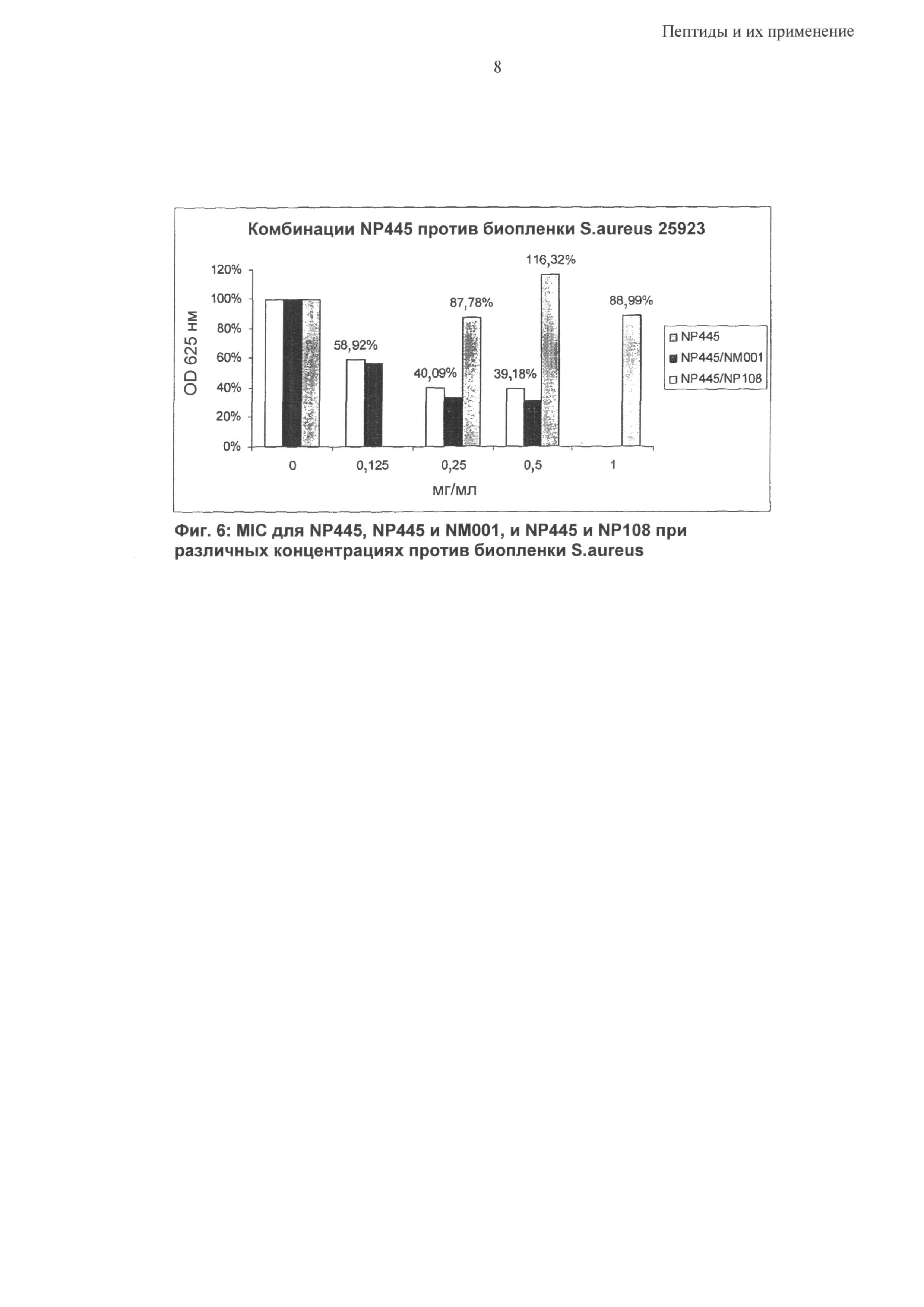
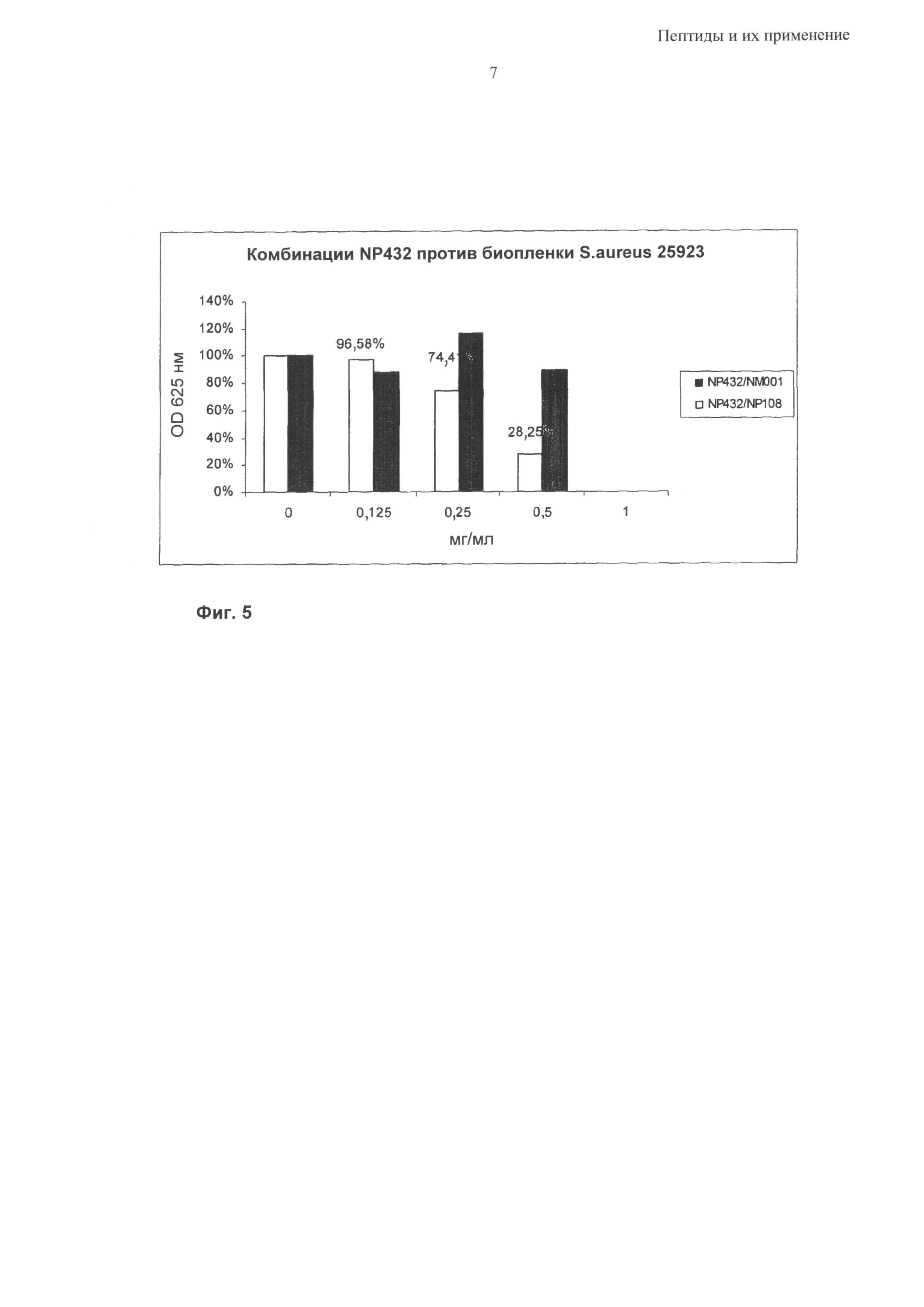
Синергетический эффект может быть особенно выраженным в отношении бактерий Р. aeruginosa, S. epidermidis и S. aureus; в том числе против бактериальных биопленок, содержащих такие бактериальные патогены.
Альтернативно, синергетический эффект может быть выраженным в виду неожиданно низкой токсичности, ассоциированной с объединяемыми агентами. В общем объединенные агенты ассоциированы с токсичностью по меньшей мере на 10% меньше суммы ассоциированных токсичностей данных двух или более агентов; типично по меньшей мере на 20% меньше; предпочтительно по меньшей мере на 30% меньше; преимущественно по меньшей мере на 50% меньше чем сумма ассоциированных токсичностей данных двух или более агентов.
Синергетический эффект может проявляться через комбинацию одного или более пептидов по настоящему изобретению и одного или более других антибактериальных пептидов.
Согласно одному из воплощений, антибактериальные пептиды могут быть представлены следующей формулой:
((X)I(Y)m)n,
где I и m представляют собой целые числа от 1 до 10, например от 0 до 5; n равен целому числу от 1 до 10; Х и Y, которые могут быть одинаковыми или разными, представляют собой аминокислоту, выбранную из группы, состоящей из гидрофобных аминокислот и/или катионных аминокислот. В предпочтительном аспекте по изобретению антибактериальный пептид содержит от 3 до 200 аминокислот, например от 3, 4, 5, 6 или 7 вплоть до 100 аминокислот, включая от 3, 4, 5, 6 или 7 вплоть до 20, 25, 30, 35, 40 или 42 аминокислот. Антибактериальный пептид может содержать от 100 до 200 аминокислот, от 27 до 100 аминокислот, от 28 до 86 аминокислот, от 7 до 27 аминокислот или от 3 до 14 аминокислот. Типично, антибактериальный пептид содержит от 3 до 15 аминокислот (например от 13 до 15), например от 3 до 7 аминокислот. Х и Y могут быть выбраны из фенилаланина и аргинина. Х может представлять собой аминокислоту фенилаланин, и Y может представлять собой аминокислоту аргинин.
Согласно одному из воплощений предложена синергетическая композиция, включающая пептид, содержащий аминокислотную последовательность, выбранную из группы RRRFRFFFRFRRR, HHHFRFFFRFRRR, KKFPWRLRLRYGRR, RRRRRFFFRFRRR, RRRFRFRFRFRRR, RRRFRFPFRFRRR, RRFRRFFFRRFRR, RRRRFFFRRRR, RRRRFRFRRRR, RRRRFPFRRRR, RRFRRRFRRFR, RRFRRRFRRFG, RRFGRRFRRFG, RRFRRFRRRFG, RRFRRFRRRFR, FRRRRFFFRFRRR, RRRRRFFFRRRRF, FFFFRRRRRFRRR, RRRRFFFFFRRRR, FRRRRFFFRRRRF, RRRYRYYYRYRRR, RRRARAAARARRR, RRRFRRRRRFFFF, RRRFFFFFFFRRR и RRRFRFFFRFRRR-цистеамин, вместе с одним или более из цистеамина (NM001), полиаргинина и полилизина, например гидробромид поли-L-лизина 10-20 кДа(МР 108).
Согласно одному из воплощений композиция содержит одну из RRRFRFFFRFRRR (NP432), RRRRRFFFRFRRR (NP 465), RRRFRFRFRFRRR (NP 466) и RRRFRFPFRFRRR (NP 467) и один из цистеамина и полилизина, например гидробромид поли-L-лизина 10-20 кДа (NP108).
Согласно одному из воплощений композиция содержит одну из RRRFRFFFRFRRR (NP432), FRRRRFFFRFRRR (NP490), RRRRFFFFFRRRR (NP493) и RRRFRRRRRFFFF (NP497) и один из цистеамина и полилизина, например гидробромид поли-L-лизина 10-20 кДа (NP108).
Во всем описании и формуле изобретения слова "содержать" и "содержит" и вариации этих слов, например "содержащий" и "содержат", означают "включающие, но не ограниченные" и не предназначены исключать (и не исключают) другие группировки, добавки, компоненты, целые числа или стадии.
Во всем описании и формуле изобретения формы единственного числа охватывают формы множественного числа, если контекст не требует иного. В частности, следует понимать, что когда используют неопределенный артикль, описание подразумевает как множественное, так и единственное число, если контекст не требует иного.
Следует понимать, что признаки, целые числа, характеристики, соединения, химические группировки или группы, описанные в контексте с конкретным аспектом, воплощением или примером по изобретению, применимы к любому другому аспекту, воплощению или примеру, описанному здесь, за исключением не совместимых с ними случаев.
Настоящее изобретение далее описывается примерами со ссылкой на прилагаемые графические материалы, на которых:
на Фиг.1 представлена таблица, подробно показывающая минимальную ингибирующую концентрацию (MIC) и минимальную бактерицидную концентрацию (МВС) пептидов по настоящему изобретению против различных грамположительных бактериальных видов (Фиг.1) и грамотрицательных бактериальных видов (Фиг.1а, 1b и 1с);
на Фиг.2 представлена таблица, подробно показывающая среднюю минимальную ингибирующую концентрацию (MIC) пептидов по настоящему изобретению против грамположительных и грамотрицательных микробных видов;
на Фиг.3 представлены значения MIC для NP432, NP432 и NM001 и NP432 и NP108 при варьирующих концентрациях против биопленки Р. aeruginosa;
на Фиг.4 представлены значения MIC для NP445, NP445 и NM001 и NP445 и NP108 при варьирующих концентрациях против биопленки Р. aeruginosa;
на Фиг.5 представлены значения MIC для NP432 и NM001 и NP432 и NP108 при варьирующих концентрациях против биопленки S. aureus;
на Фиг.6 представлены значения MIC для NP445, NP445 и NM001 и NP445 и NP108 при варьирующих концентрациях против биопленки S. aureus;
на Фиг.7 и Фиг.7а представлена таблица, подробно показывающая минимальную ингибирующую концентрацию (МIС) и минимальную бактерицидную концентрацию (МВС) пептидов по настоящему изобретению против различных микробных видов; ячейки таблицы, помеченные черным цветом, означают токсические эффекты; ячейки таблицы, помеченные серым цветом, означают активность <100 мкг/мл; ячейки таблицы, не помеченные цветом, означают активность при 100-500 мкг/мл, наиболее перспективные NP;
на Фиг.8 представлены значения МВЕС для колистина, NP108 и NP432 при концентрациях от 0 до 2500 мкг/мл против бактериальной пленки Р. aeruginosa;
на Фиг.9 представлены значения МВЕС для комбинаций NP108-NM001, NP432-NM001 и NP432-NP108 против биопленки Р. aeruginosa при концентрациях от 0 до 600 мкг/мл;
на Фиг.10 представлены значения МВЕС для колистина, NP108 и NP432 при концентрациях от 0 до 2500 мкг/мл против бактериальной биопленки S. aureus;
на Фиг.11 представлены значения МВЕС для комбинаций NP108-NM001, NP432-NM001 и NP432-NP108 против биопленки S. aureus при концентрациях от 0 до 600 мкг/мл.
Примеры
Пример 1
Бактериальные биопленки Р. aeruginosa и бактериальные пленки S. aureus выращивали в агаре Мюллера-Хинтона в отдельных 96-луночных микротитрационных планшетах в течение 21 часа при 37 градусах по Цельсию. Планктонные клетки и среду затем удаляли и бактериальные пленки трижды промывали фосфатным буферным раствором при рН около 7. Затем к этим бактериальным пленкам добавляли двукратные разведения трех разных противомикробных агентов в бульоне Мюллера-Хинтона. Микротитрационные планшеты инкубировали при 37 градусах по Цельсию в течение 24 часов. Затем среду переносили на свежий микротитрационный планшет и измеряли оптическую плотность бактериальной биопленки при 625 нм на планшет-ридере (BioTek Powerwave, XS, Winooski, USA).
Тестируемые противомикробные агенты представляли собой колистин, NP108 и NP432. Сначала тестировали активность противомикробных агентов при концентрациях от 0 до 2500 мкг/мл, затем тестировали активность противомикробных агентов при концентрациях от 0 до 600 мкг/мл. Результаты суммированы на Фиг.8-11. Эти графические материалы подтверждают противомикробное действие пептида по настоящему изобретению (NP432) против бактериальных пленок Р. aeruginosa и против бактериальной пленки S. aureus. Противомикробное действие сравнимо с известными противомикробными агентами.
Пример 2
Бактериальные биопленки Р. aeruginosa и бактериальные пленки S. aureus выращивали в агаре Мюллера-Хинтона в отдельных 96-луночных микротитрационных планшетах в течение 18 часов при 37 градусах по Цельсию. Планктонные клетки и среду затем удаляли и бактериальные пленки трижды промывали фосфатным буферным раствором при рН около 7. Затем к этим бактериальным пленкам добавляли двукратные разведения трех разных противомикробных агентов в бульоне Мюллера-Хинтона. Микротитрационные планшеты инкубировали при 37 градусах по Цельсию в течение 24 часов. Затем среду переносили на свежий микротитрационный планшет и измеряли оптическую плотность бактериальной биопленки при 625 нм на планшет-ридере (BioTek Powerwave, XS, Winooski, USA).
Тестируемые противомикробные агенты представляли собой NP432 отдельно, комбинацию NP432 и NM001 в равной концентрации, комбинацию NP432 и NP108 в равной концентрации, NP445 отдельно, комбинацию NP445 и NM001 в равной концентрации, комбинацию NP445 и NP108 в равной концентрации. Противомикробные агенты тестировали при концентрациях от 0 до 1 мг/мл против бактериальных пленок Р. aeruginosa и бактериальных пленок S. aureus. Результаты суммированы на Фиг.3-6. Эти графические материалы подтверждают противомикробное действие пептида по настоящему изобретению (NP432 и NP445) против бактериальных пленок Р. aeruginosa и против бактериальной пленки S. aureus, отдельно и в комбинации с NM001 и NP108.