Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ЗВЕЗДООБРАЗНЫХ ПОЛИМЕРОВ
Вид РИД
Изобретение
Область изобретения
Объектом изобретения является способ получения звездообразных полимеров на основе лактида и/или гликолида. Этот способ контролируем и является более эффективным, чем способы из уровня техники. Особый интерес представляет тот факт, что полученные полимеры являются функционализированными по всем лучам звезды, даже в случае олигомеров.
Уровень техники
В настоящее время растущее внимание уделяют синтетическим полимерам для разработки искусственных органов и лекарственных средств [Chem. Eng. News 2001, 79 (6), 30]. Полимеры, о которых идет речь, должны соответствовать ряду критериев, и, в частности, они должны быть биосовместимыми. Биоразлагаемость является дополнительным преимуществом, если полимер должен быть удален по истечении соответствующего периода после имплантации в организм. В этом отношении сополимеры на основе молочной и гликолевой кислоты (PLGA) представляют очень большой интерес, т.к. они чувствительны к гидролизу и разлагаются in vivo с высвобождением нетоксичных побочных продуктов. Область применения PLGA очень обширна (Adv. Master. 1996, 8, 305 et Chemosphere 2001, 43, 49). В области хирургии их используют для синтеза многоволоконных нитей, шовного материала, имплантатов, протезов… В фармакологии они обеспечивают капсулирование, перенос и контролированное высвобождение активных веществ. Для всех этих применений одним из ключевых факторов является скорость разложения PLGA, которая зависит от их структуры (длина цепи, дисперсность, соотношение мономеров, стереохимия в них и их соединение…).
Разветвленные полимеры, к которым относятся звездообразные полимеры, дендримеры и гиперразветвленные полимеры, являлись объектом многочисленных исследований в связи с их представляющими интерес реологическими и механическими свойствами.
В частности, звездообразные полимеры или полимеры звездообразной архитектуры могут применяться для введения активных веществ и имеют интересные профили высвобождения. Полимеры этого типа главным образом получают из инициаторов типа многоатомных спиртов, содержащих n спиртовых функциональных групп для получения звезд с n лучами.
Кроме того, звездообразные полимеры имеют температуру стеклования, а также вязкость в стеклообразном состоянии, отличающиеся от их линейных эквивалентов. То же относится к их кристалличности и, следовательно, их температуре плавления, которая также отличается от их линейных эквивалентов. В частности, описано, что полимеры с высокой молекулярной массой имеют температуру стеклования и температуру плавления, более низкие, чем их линейные эквиваленты. Тем не менее, природа кристаллической фазы остается одинаковой в обеих структурах.
Биоразлагаемый звездообразный полимер (например, PLGA) имеет существенно большую первоначальную скорость разложения, чем его линейный эквивалент той же массы. Действительно, было показано, что путем химического или ферментативного гидролиза первые разрывы эфирных связей происходят в ядре звезды, близкой к инициатору, высвобождая таким образом линейные полимеры с более низкими молекулярными массами. Таким образом, скорость высаливания и разложения следует соотносить со структурой полимерной матрицы.
Эти различия свойств, таким образом, дают доступ к новым матрицам, представляющим интерес. Например, капсулирование активных веществ в звездообразные полимеры PLGA было описано A. Breitenbach, Y. X. Li, T. Kissel, Journal of Controlled Release 2000, 64, 167.
Полимеризация путем открытия цикла с участием металлических комплексов для синтеза полимеров звездообразной архитектуры описывалась с начала 1990 годов. Их главным образом получали в растворе или в массе с использованием металлических катализаторов, таких как октаноат олова, даже если имелись ссылки на другие системы на основе Fe, Zn, Al… (H.R. Kricheldorf, Polymer for Advanced Technologies 2002, 13, 969; A.Finne, A-C. Albertsson, Biomacromolecules 2002, 3, 684; H.R. Kricheldorf, H.Hachmann-Thiessen, G. Schwarz, Biomacromolecules 2004, 5, 492; I. Arvanitoyannis, A. Nakayama, E. Psomiadou, N. Kawasaki, N. Yamamoto, Polymer 1996, 37, 651).
В литературе по синтезу звездообразных полимеров на основе молочной кислоты (PLA) описано очень мало примеров с применением неметаллических катализаторов. В 2007 году K. Numata, R.K. Srivastava, A. Finne-Wistrand, A.C. Albertsson, Y. Doi, H. Abe, Biomacromalecules 2007, 8, 3115, впервые описали ферментативную полимеризацию лактида в массе в присутствии многоатомных спиртов. 2-22-Лучевые звездообразные PLA получены с показателями полимолекулярности от 1,0 до 1,5 в присутствии липазы PS при 140°С через 5-7 дней полимеризации.
Примеры получения полиэфиров звездообразной архитектуры при помощи органических катализаторов относятся к мономерам, не являющимся лактидами, таким как δ-валеролактон или ε-капролактон (F. Sanda, H. Sanada, Y. Shibasaki, T. Endo, Macromolecules 2002, 35, 680; P. V. Persson, J. Casas, T. Iversen, A. Cordova, Macromolecules, 2006, 39, 2819, и F. Zeng, H. Lee, M. Chidiac, C. Allen, Biomacromolecules 2005, 6, 2140). С используемыми катализаторами (фумаровая и молочная кислоты) необходимые температуры реакции являются относительно высокими (порядка 90°С).
Описанные примеры открытия цикла лактида, катализируемого органическим катализатором, основаны на макроинициаторах. В настоящее время не существует эффективной каталитической системы для синтеза олигомеров с малыми молекулярными массами из многоатомных спиртов, обеспечивающей полную функционализацию лучей.
Заявителем разработан новый неметаллический способ, легко контролируемый и имеющий большую эффективность по сравнению со способами из уровня техники в случае олигомеров.
Краткое изложение изобретения
Объектом изобретения является способ получения звездообразных полимеров на основе лактидного мономера и гликолидного мономера или лактидного мономера путем размыкания цикла в присутствии катализатора, в котором:
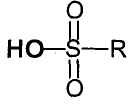
- катализатор соответствует формуле 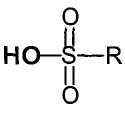 , в которой R обозначает (С1-С6)галоалкил;
, в которой R обозначает (С1-С6)галоалкил;
- инициатором является многоатомный спирт, содержащий от 3 до 6 гидроксильных функциональных групп.
Предпочтительно мономером является лактид.
Предпочтительно полимеры получают на основе лактидного мономера и гликолидного мономера.
Предпочтительно реакция протекает в органическом растворителе и более предпочтительно в галогенированном или ароматическом растворителе.
Предпочтительно растворителем является галогенированный растворитель, предпочтительно растворителем является дихлорметан.
Предпочтительно инициатором является многоатомный спирт, содержащий от 3 до 4 гидроксильных функциональных групп.
Предпочтительно инициатором является глицерин.
Предпочтительно катализатором является трифторметансульфоновая кислота.
Предпочтительно температура реакции составляет от 0 до 150°С, более предпочтительно от 20 до 45°С.
Предпочтительно исходное отношение концентрация мономера/концентрация функциональной группы ОН инициатора составляет от 200/1 до 1/1.
Предпочтительно исходное отношение концентрация мономера/концентрация функциональных групп ОН инициатора составляет от 100/1 до 2/1.
Предпочтительно исходное отношение концентрация мономера/концентрация функциональных групп ОН инициатора составляет от 20/1 до 4/1.
Предпочтительно исходное отношение концентрация катализатора/концентрация функциональной группы ОН инициатора составляет от 0,1 до 20.
Предпочтительно исходное отношение концентрация катализатора/концентрация функциональной группы ОН инициатора составляет от 0,2 до 10.
Предпочтительно исходное отношение концентрация катализатора/концентрация функциональной группы ОН инициатора составляет от 0,3 до 6.
Подробное описание способов осуществления изобретения
Объектом изобретения, таким образом, является способ получения звездообразных полимеров на основе лактида и/или гликолида. Под звездообразным полимером понимают полимер, имеющий одну точку разветвления, из которой выходит несколько линейных цепей.
Реакция полимеризации относится к реакции типа размыкания цикла. Полимеризация путем размыкания цикла является полимеризацией путем прибавления. Схематически ее можно изобразить следующим образом:  , где n обозначает число мономеров.
, где n обозначает число мономеров.
Реакцию проводят исходя из лактидного мономера и гликолидного мономера или из одного лактидного мономера. В варианте мономер является лактидом. В другом варианте реакция является реакцией сополимеризации и реакцию проводят с использованием лактида и гликолида.
Реакцию проводят в присутствии катализатора формулы 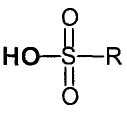 , в которой R обозначает галоалкил. Под галоалкиллом подразумевают алкильный радикал, замещенный одним или несколькими атомами галогена. Алкильный радикал содержит от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода. Атом галогена выбирают из F, Cl, Br и I. Например, C2F6 или CF3. Предпочтительно галоалкилом является CF3.
, в которой R обозначает галоалкил. Под галоалкиллом подразумевают алкильный радикал, замещенный одним или несколькими атомами галогена. Алкильный радикал содержит от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода. Атом галогена выбирают из F, Cl, Br и I. Например, C2F6 или CF3. Предпочтительно галоалкилом является CF3.
Инициатором реакции является многоатомный спирт, содержащий от 3 до 6 функциональных гидроксильных групп, т.е. инициатором является органическая молекула, содержащий от 3 до 6 функциональных групп -ОН. Многоатомный спирт, такой как определен в настоящем изобретении, может являться алифатической или циклической углеродной цепочкой. Многоатомный спирт может также содержать другие органические функциональные группы, такие как, например, одна или несколько альдегидных и/или кетоновых функциональных групп. Например, многоатомный спирт можно выбирать из глицерина, триметилолэтана, триметилолпропана, пентаэритрита, дипентаэритрита, инозита, ксилита, маннита, сорбитола, эритрозы, треозы, арабинозы, рибозы, гулозы, идозы, альтрозы алозы, талозы, сорбозы, маннозы, глюкозы, фруктозы, галактозы, сахарозы, лактозы. Предпочтительно инициатором является пентаэритрит, дипентаэритрит, глицерин, триметилолэтан, триметилолпропан или сорбитол. Более предпочтительно инициатором является глицерин.
Реакция протекает в растворителе. Термин «растворитель» обозначает здесь один растворитель или смесь растворителей. Предпочтительно растворитель выбирают так, чтобы полученный полимер растворялся в нем. Предпочтительно растворитель выбирают из галогенированных растворителей и ароматических растворителей. Например, растворитель выбирают из дихлорметана, дихлорэтана и толуола. Предпочтительно растворителем является дихлорметан.
Предпочтительно реакцию проводят при температуре от комнатной температуры, т.е. примерно 25°С, до температуры кипения выбранного растворителя. Температуру реакции выбирают так, чтобы она была ниже температуры разложения полученного полимера. Например, температура составляет от 0 до 150°С. Предпочтительно температура составляет от 10 до 90°С. Более предпочтительно температура составляет от 20 до 45°С, предпочтительно 20 до 30°С. Например, реакцию проводят при комнатной температуре.
Предпочтительно реакцию останавливают, когда целевая степень полимеризации получена. Например, реакцию останавливают, когда первоначально введенный мономер вступает в реакцию на 90-100%. Предпочтительно реакцию останавливают, когда первоначально введенный мономер вступает в реакцию более чем на 94%. Например, реакцию останавливают резким охлаждением. В качестве альтернативы реакцию останавливают путем введения основания. Например, реакцию полимеризации останавливают путем введения щелочной смолы, такой, например, как AmberlystTM А21.
Предпочтительно, исходное отношение концентрации мономера к концентрации функциональной группы ОН инициатора составляет от 200/1 к 1/1, более предпочтительно от 100/1 до 3/1, еще более предпочтительно от 20/1 до 4/1. Например, отношение составляет от 8/1 до 6/1.
Предпочтительно, исходное отношение концентрации катализатора к концентрации функциональной группы ОН инициатора составляет от 0,1 до 20, более предпочтительно от 0,2 до 10, еще более предпочтительно от 0,2 до 6.
Способ по изобретению имеет многочисленные преимущества. В частности, способ легко контролировать. Он более эффективен, чем способы из уровня техники. В частности, полученные полимеры функционализированы по всем лучам звезды. Это также относится к синтезу олигомеров. Под олигомером понимают небольшой полимер, предпочтительно имеющий молярную массу меньше 2000 г/моль.
При условии что не было дано другое определение, все технические и научные термины, использованные в настоящем изобретении, имеют смысловое значение, которое обычно понимает средний специалист в области техники, к которой относится изобретение.
Нижеследующие примеры иллюстрируют изобретение и ни в каком случае не могут рассматриваться как ограничивающие объем изобретения.
ПРИМЕРЫ
В нижеследующих примерах, если не указано иное, применяют следующие условия полимеризации: триметилолпропан (ТМР) используют после азеотропной перегонки в толуоле, пентаэритритол (РЕТ) сушат в вакууме в присутствии Р2О5 и перегоняют глицерин. Если не указано иное, лактид используют в его рацемической форме (D,L) в дихлорметане ([L]0=1 моль/L), в присутствии 0,1 эквивалента трифторметансульфоновой кислоты на одну спиртовую группу. Если не указано иное, полимеризацию проводят при комнатной температуре (Т=26°С) при интенсивном перемешивании. Полимеры получают во времена реакции, близкие временам реакции их линейных эквивалентов (примерно 5-7 часов).
В конце реакции катализатор нейтрализуют щелочной смолой AmberlystTM A21. Полимеры осаждают в смеси CH2Cl2/гептан, затем сушат в вакууме на вращающемся испарителе в течение 48 часов.
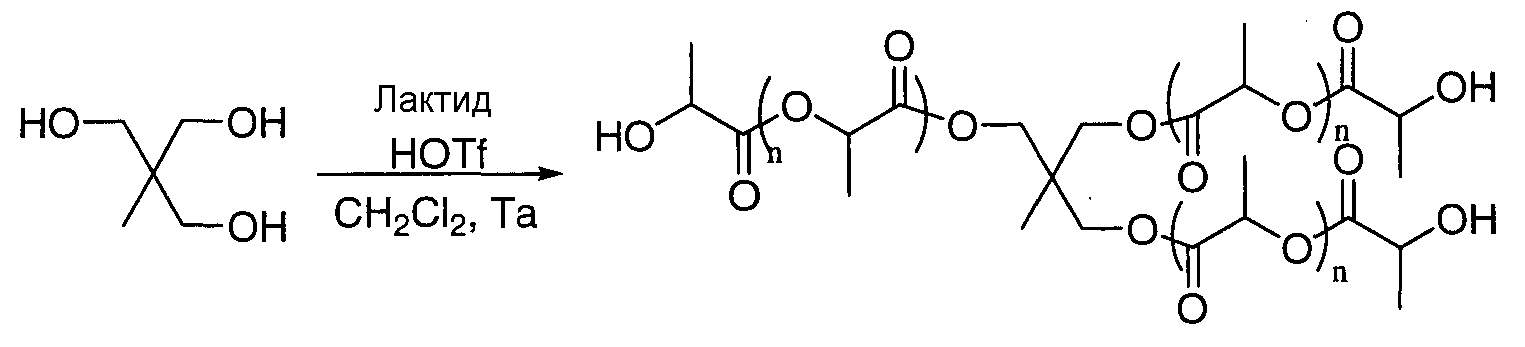
Примеры 1-4
|
При отношении лактид/инициатор (инициатор=триметилолпропан) 3/1 получают белый и твердый полимер (Tg=7°С).
При отношении 2/1 (или отношении лактид/[OH]0 6/1 при триметилолпропане) полимер, инициированный пентаэритриолом, является довольно твердым, тогда как инициированный глицерином является наиболее текучим из трех (температура стеклования Tg=3°С).
Даже при таком отношении мономер/инициатор получают хорошо контролируемые полимеры (DPямр (степень полимеризации, измеренная ЯМР) луча, близкая теоретической DP (степень полимеризации), равной 2, показатель полимолекулярности около 1,2) с хорошим инициированием по всем спиртам: при использовании трехатомных спиртов 2,9 СН2 из 3 инициировали. Это измерение определяется спектроскопией ЯМР 1Н по интегрированию CH2-O-PLA (и CH-O-PLA для глицерина) по отношению к сигналам, наблюдаемым около 3,5 м.д. (участок, характерный для CH2-СН и СН-ОН инициаторов). Исследование масс-спектрометрией путем электрораспыляющей ионизации в положительном режиме подтверждает исключительное инициирование исходным многоатомным спиртом для триметилолпропана и пентаэритриола.
Примеры 5-7 осуществляли в соответствии со следующей методикой.
Лактид (LA) и протонный инициатор (многоатомный спирт, 1 эквивалент) растворяют в только что перегнанном дихлорметане ([LA]0=1 моль/L). Затем вводят трифторметансульфоновую кислоту (acide triflique) (0,05 эквивалента на ОН) и реакционную среду интенсивно перемешивают при Т=26°С до полного вступления в реакцию лактида, контролируемого спектроскопией ЯМР 1Н.
Вводят 4 эквивалента (по отношению к трифторметансульфокислоте) смолы Amberlyst A21 (4,6 мэкв/г), предварительно высушенные на Р2О5. Реакционную среду перемешивают в течение 45 минут, затем фильтруют. Реакционный растворитель затем выпаривают в вакууме и полученный полимер осаждают смесью CH2Cl2/гептан 5/90. Супернатант удаляют и полимер сушат в вакууме при 60°С в течение 48 часов.
Пример 5: полимер, инициированный глицерином в присутствии 4,5 эквивалентов D,L-лактида
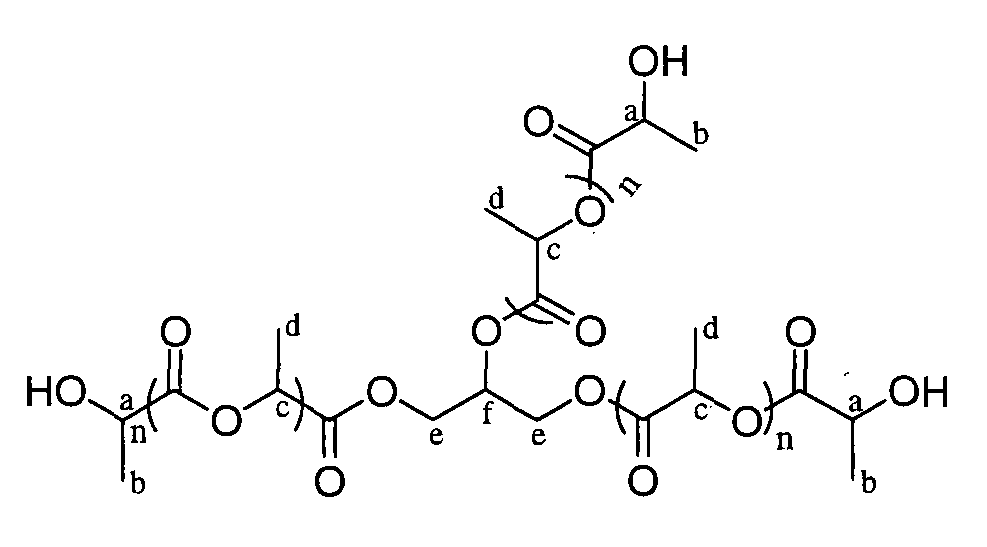
ЯМР 1H (δ, ДМСО-д6, 300,1 МГц): 5,48 (3H, м, OH), 5,30-5,05 (7,6H, м, CHC и CHf), 4,41-4,05 (7H, м, CH2e и CHa), 1,47 (19,7H, м, CH3d), 1,30 (9,1H, м, CH3b) м.д.
13C ЯМР (δ, ДМСО-д6, 75,5 МГц): 174,0 (CO), 169,6-169,1 (CO), 69,9-67,7 (CHpol), 65,7 (CHOH), 65,4 (CHOH), 62,6-62,3 (CH2O), 59,1 (CH2OH), 20,4-20,2 (CH3OH), 16,6-16,4 (CH3pol) м.д.
DPямр=4,5
% остаточного лактида (HPLC): 0,6%
SEC (THF): Mn=1055, MW/Mn=1,09
Пример 6: полимер, инициированный триметилолэтаном в присутствии 6 эквивалентов D,L-лактида
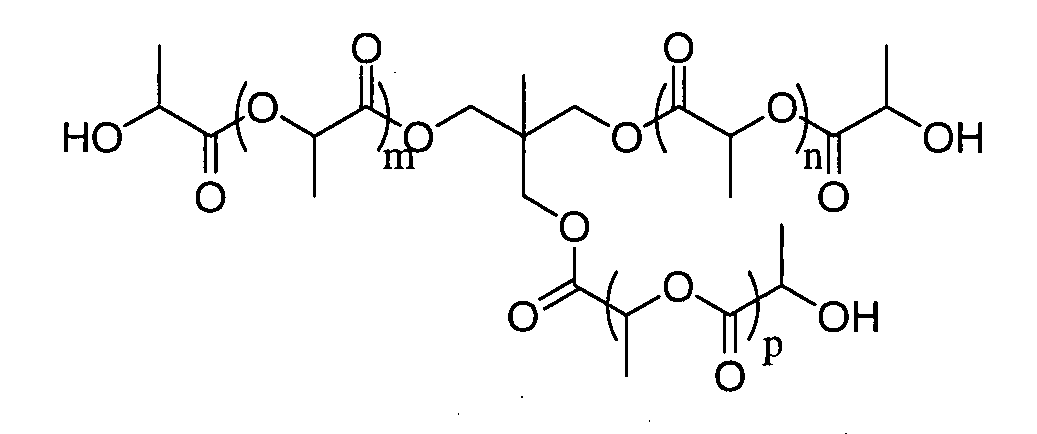
1H ЯМР (δ, CDCl3, 300,1 МГц): 5,25-5,11 (9H, м, CH), 5,05 (3H, шир.с, OH), 4,37 (3H, м, CH-OH), 4,11-4,05 (6H, м, CH2), 1,59-1,47 (35,2H, м, CH3), 1,02 (3H, м, CH3) м.д.
% остаточного лактида (HPLC): 0,6%
DPямр=5,9
SEC (THF): Mn=1258, MW/Mn=1,15
Пример 7: полимер, инициированный пентаэритриолом в присутствии 8 эквивалентов D,L-лактида
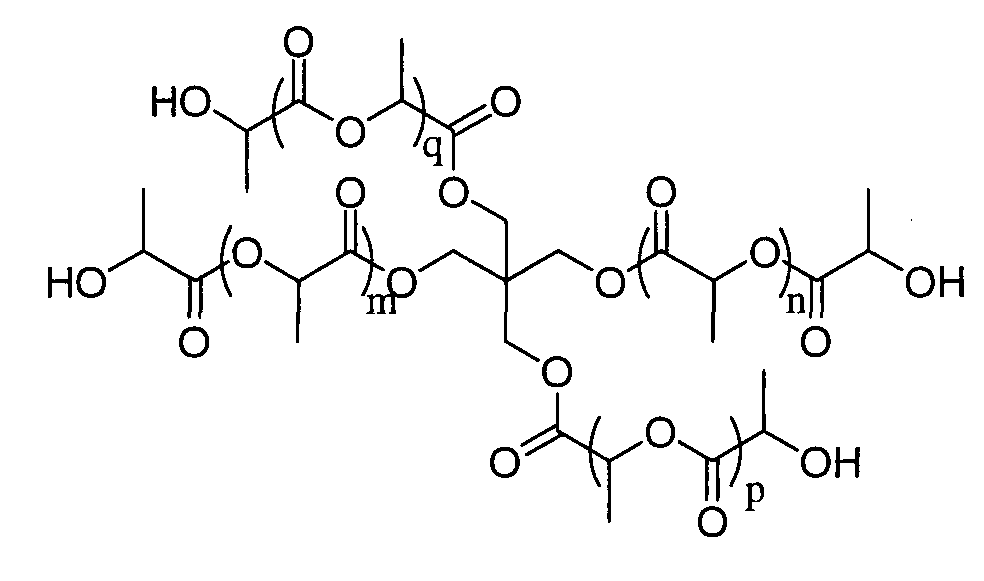
1H ЯМР (δ, CDCl3, 300,1 МГц): 5,23-5,09 (12H, м, CH), 4,35 (4H, м, CH-OH), 4,22-4,16 (8H, м, CH2), 1,58-1,47 (50,4H, м, CH3) м.д.
DPямр=8,4
SEC (THF): Mn=1576, MW/Mn=1,26
Примеры 8-10: Синтез PLA с разными массами
В нижеследующих примерах 8-10 триметилолэтан был выбран в качестве инициатора. Во всех реакциях полимеризации триметилолэтан используют после сублимации. Лактид используют или в рацемической форме (D,L), или в чисто энантиомерной форме (L).
Длина полимера зависит от исходного отношения (мономер М)0/инициатор I)0. Разные отношения [M]0/[I]0 устанавливают для каждой полимеризации в целях получения полимеров с разными массами.
|
Введение групп СН2ОН инициатора является полным (контролируется спектроскопией ЯМР 1Н) в каждом полимере.
Кроме того наблюдается, что чем это отношение больше, тем больше масса полимера.
Общий протокол синтеза
Лактид и многоатомный спирт (1 эквивалент) растворяют в только что перегнанном дихлорметане ([LA]0=1 моль.L-1). Затем вводят трифторметансульфоновую кислоту (1 эквивалент на ОН) и реакционную среду интенсивно перемешивают при Т=26°С до полного вступления в реакцию лактида, контролируемого спектроскопией ЯМР 1Н. В конце полимеризации вводят 4 эквивалента (по отношению к трифторметансульфокислоте) смолы Amberlyst A21 (4,6 мэкв/г), предварительно высушенной на Р2О5. Реакционную среду перемешивают в течение 45 минут, затем фильтруют. В два приема вводят 2 эквивалента смолы Amberlyst A21 в реакционную среду, которую перемешивают в течение 45 минут, затем фильтруют. Реакционный растворитель затем выпаривают в вакууме.
Пример 11: Синтез сополимера PLGA 80/20 звездообразной формы
Сополимер PLGA звездообразной формы, в котором отношение лактид/гликолид=80/20, синтезируют исходя из триметилолэтана.
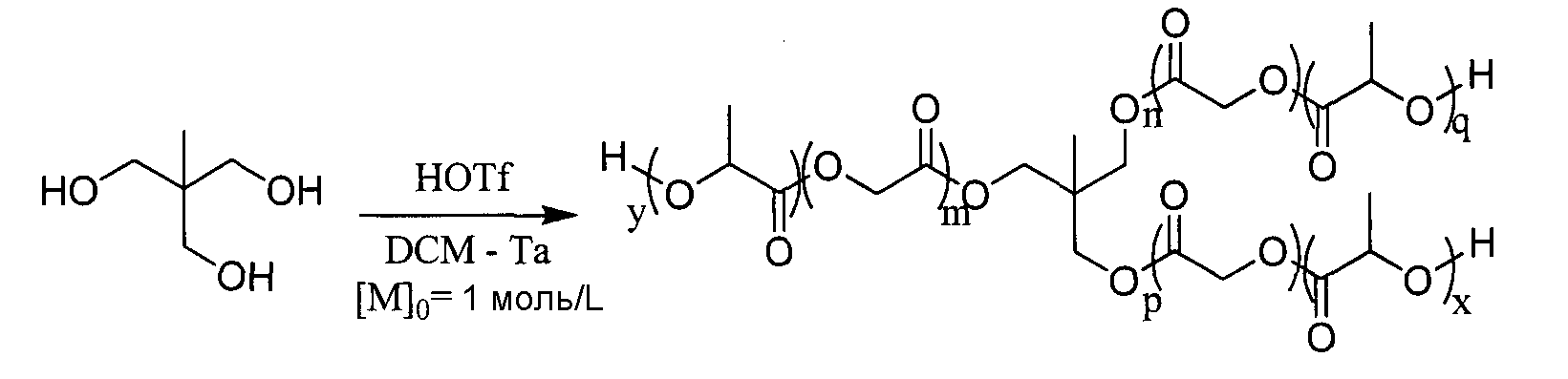
|
Через 5 часов с начала перемешивания гликолид полностью вступает в реакцию, и количество остаточного лактида незначительно. DPямр луча близко к теоретическому DP (равно 3), и спектроскопия ЯМР позволяет подтвердить, что инициирование имело место по всем спиртовым группам триметилолэтана.
Протокол синтеза
Лактид (7,8 эквивалента), гликолид (1,2 эквивалента) и мпогоатомный спирт (1 эквивалент) суспендируют в только что перегнанном дихлорметане ([LA]0=1 моль/L). Затем вводят трифторметансульфоновую кислоту (0,1 эквивалента на ОН) и реакционную среду интенсивно перемешивают при Т=26°С до полного вступления в реакцию лактида, контролируемого спектроскопией ЯМР 1Н. В конце полимеризации вводят 4 эквивалента (по отношению к трифторметансульфокислоте) смолы Amberlyst A21 (4,6 мэкв/г), предварительно высушенной на Р2О5. Реакционную среду перемешивают в течение 45 минут, затем фильтруют. Операцию повторяют один раз, затем реакционный растворитель выпаривают в вакууме.
1H ЯМР (δ, CDCl3, 300,1 МГц): 5,30-5,10 (11,4H, м, CH), 4,90-4,70 (7H, м, CH2), 4,36 (3H, м, CH), 4,07 (6H, м, CH2), 3,82 (3H, шир.с, OH), 1,60-1,48 (41,4H, м, CH3), 1,01 (3H, м, CH3) м.д.
DPямр=8,95
Отношение лактид/гликолид=80/20 (ЯМР 1Н)
SEC (THF): Mn=1898, MW/Mn=1,16
Пример 12: Синтез звездообразного PLA в толуоле при 80°С
В этом примере толуол используют в качестве растворителя после перегонки и реакционную смесь нагревают до 80°С.
|
Протокол синтеза
Лактид (LA) и лактид и протонный растворитель (многоатомный спирт, 1 эквивалент) суспендируют в только что перегнанном дихлорметане ([LA]0=1 моль/L) и реакционную среду нагревают до 80°С в атмосфере аргона. Затем вводят трифторметансульфоновую кислоту (0,1 эквивалента на ОН) и реакционную среду интенсивно перемешивают при Т=26°С в течение 30 минут (полное вступление в реакцию лактида контролируется спектроскопией ЯМР 1Н). Вводят 4 эквивалента (по отношению к трифторметансульфокислоте) смолы Amberlyst A21 (4,6 мэкв/г), предварительно высушенной на Р2О5. Реакционную среду перемешивают в течение 45 минут, затем фильтруют. Затем реакционный растворитель выпаривают в вакууме.
Аналитические данные полученного таким образом полимера сходны с полученными в примере 1.
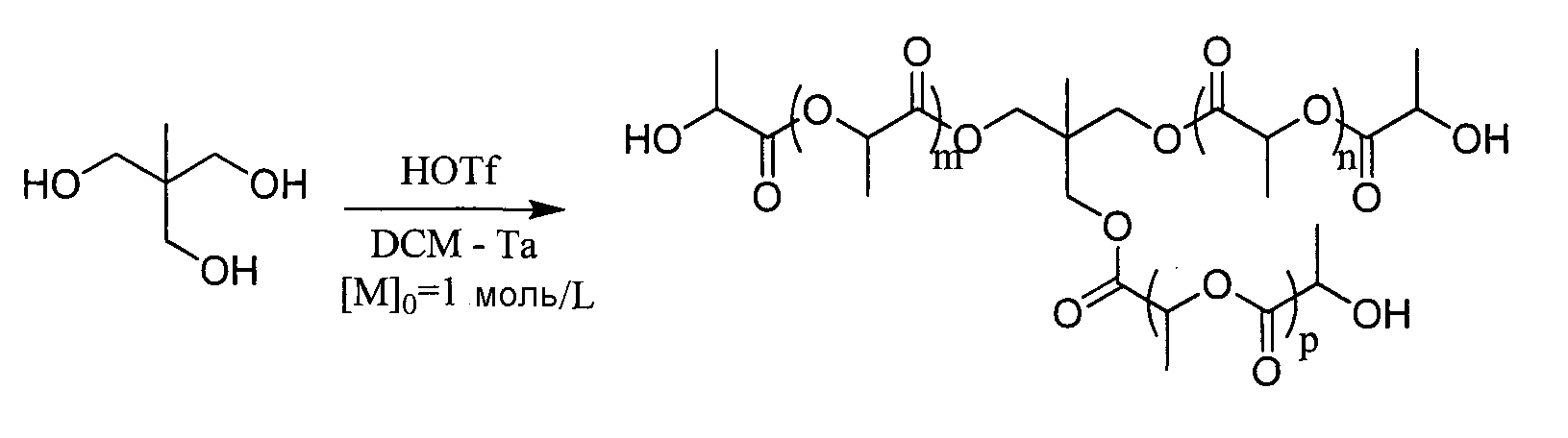
Пример 13: Синтез звездообразного 6-лучевого PLA
Дипентаэритриол предварительно сушат в вакууме в присутствии Р2О5. Лактид используют в чисто энантиомерной форме (L) в дихлорметане ([LA]0=1 моль/L) в присутствии 0,1 эквивалента трифторметансульфоновой кислоты на спиртовую группу. Реакции полимеризации проводят при комнатной температуре. В конце реакции катализатор нейтрализуют путем обработки щелочной смолой Amberlyst A21.
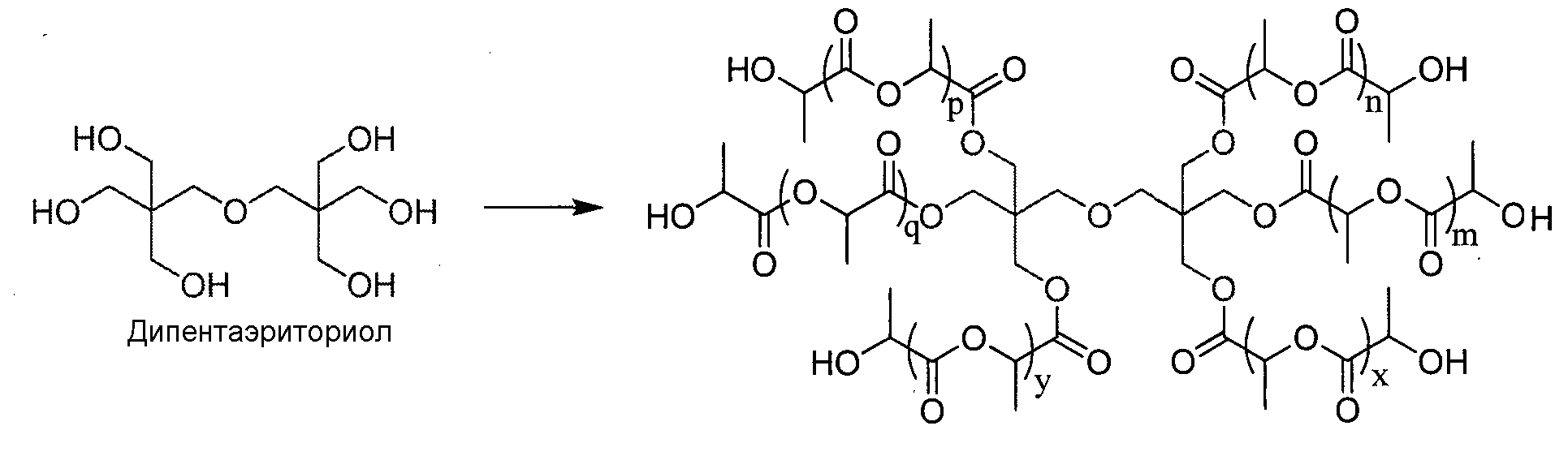
|
Даже при малой величине отношения мономер/инициатор полученный полимер хорошо контролируется: DPямр луча близко к теоретическому DP (равно 3) и спектроскопией ЯМР 1Н интегрирование 12Н CH2-O-PLA в сочетании с отсутствием сигнала, наблюдаемого около 3,5 м.д. (участок, характерный для CH2-СН инициатора), позволяет утверждать, что инициирование по всем спиртовым группам дипентаэритриола является полным.
Протокол синтеза
Лактид (LA,18 эквивалентов) и дипентаэритриол (1 эквивалент) суспендируют в только что перегнанном дихлорметане ([LA]0=1 моль/L). Затем вводят трифторметансульфоновую кислоту (0,05 эквивалента на ОН) и реакционную среду интенсивно перемешивают при Т=26°С до полного вступления в реакцию лактида, контролируемого спектроскопией ЯМР 1Н.
Вводят 4 эквивалента (по отношению к трифторметансульфокислоте) смолы Amberlyst A21 (4,6 мэкв/г), предварительно высушенной на Р2О5. Реакционную среду перемешивают в течение 45 минут, затем фильтруют.
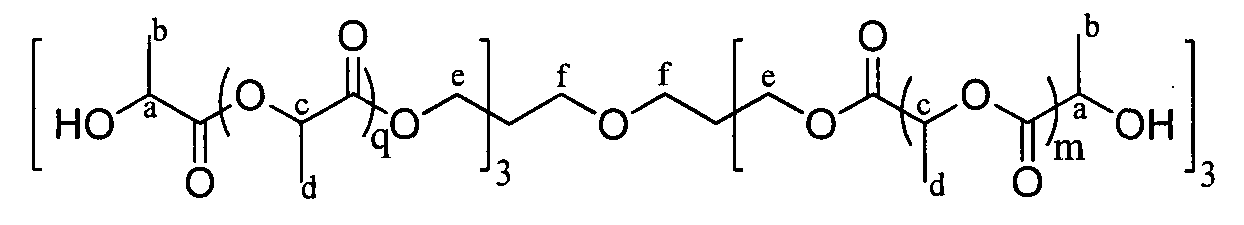
1H ЯМР (δ, CDCl3, 300,1 МГц): 5,22-5,07 (30Н, м, CHC), 4,35 (6H, кв., CHa), 4,14 (12Н, шир.с, CH2e), 3,35 (4H, шир.с, CH2f), 1,61-1,47 (111H, м, CH3) м.д.
13C ЯМРР (δ, CDCl3, 75,5 МГц): 175,1 (CO), 169,6 (CO), 69,9-67,7 (CHpoi+CH2), 66,7 (CHOH), 62,8-62,7 (CH2), 59,1 (CH2OH), 20,5-20,3 (CH3), 16,7-16,6 (CH3pol) м.д.
DPямр=18
SEC (THF): Mn=4320, MW/Mn=1,20.